Ссылка на перечень последовательностей, таблицу или компьютерную программу
Официальная копия Перечня Последовательностей представлена одновременно с описанием в виде текстового файла в формате ASCII при помощи EFS-Web, название файла “PAT055051_seql2.txt”, дата создания 22 марта 2013 года и размер 447 килобайт. Перечень последовательностей, представленный посредством EFS-Web, является частью описания и включен в полном объеме в качестве ссылки.
Предшествующий уровень техники:
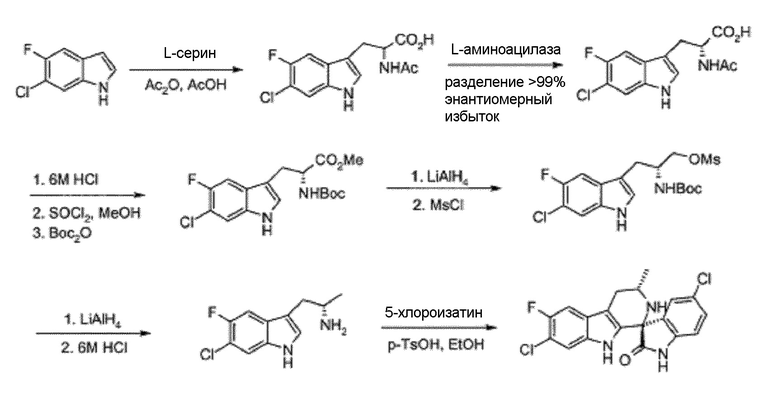
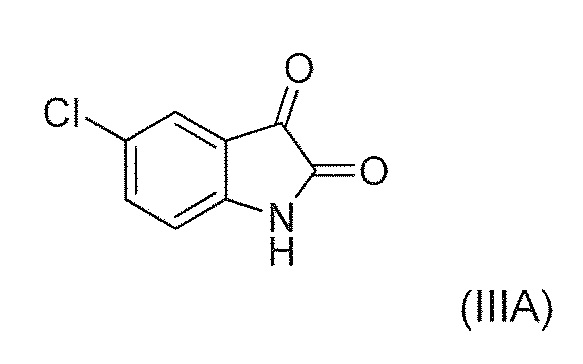
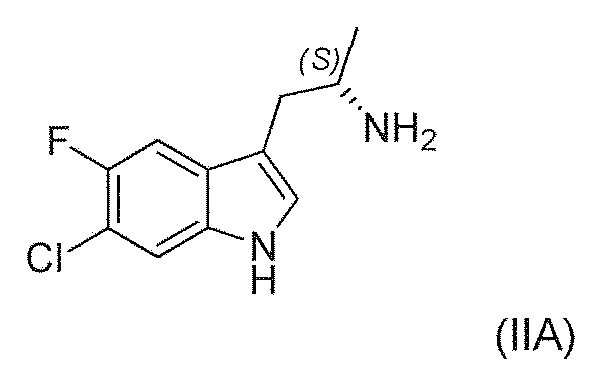
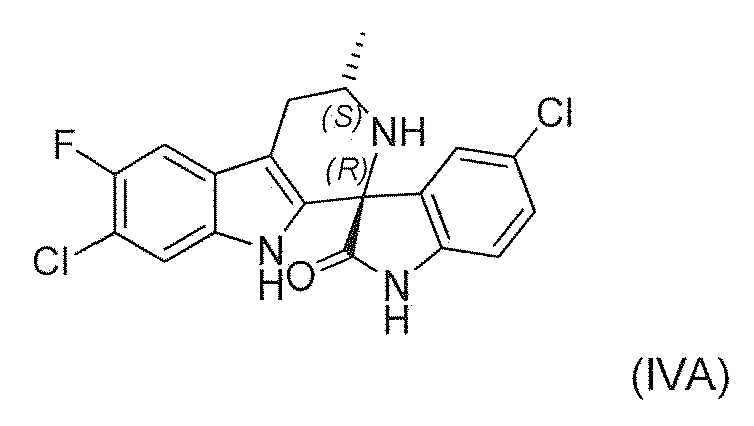
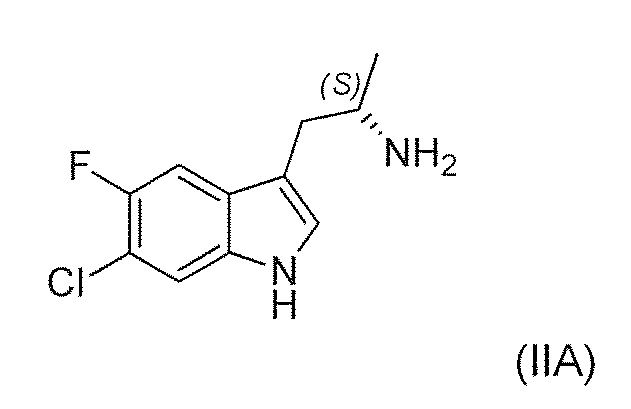
Известны (1'R,3'S)-5,7'-дихлор-6'-фтор-3'-метил-2',3',4',9'-тетрагидроспиро[индолин-3,1'-пиридо[3,4-b]индол]-2-он (например, соединение формулы (IV), которое включает спироиндолоновую группу) и 6-стадийный способ синтеза, включая известное хиральное аминовое промежуточное соединение (IIA) (WO 2009/132921):
Изобретение:
Настоящее изобретение относится к усовершенствованному способу синтеза спироиндолоновых соединений, в частности, (1'R,3'S)-5,7'-дихлор-6'-фтор-3'-метил-2',3',4',9'-тетрагидроспиро[индолин-3,1'-пиридо[3,4-b]индол]-2-она, и к промежуточным соединениям, используемым в усовершенствованном способе.
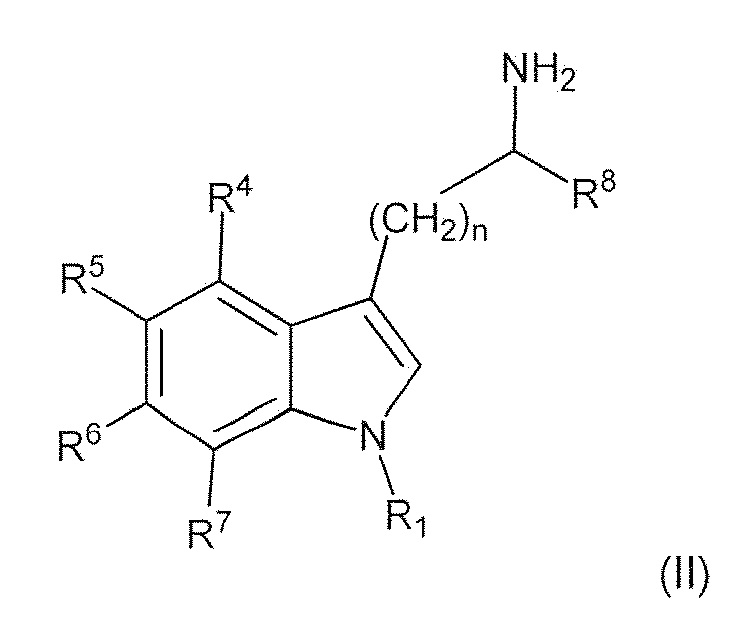
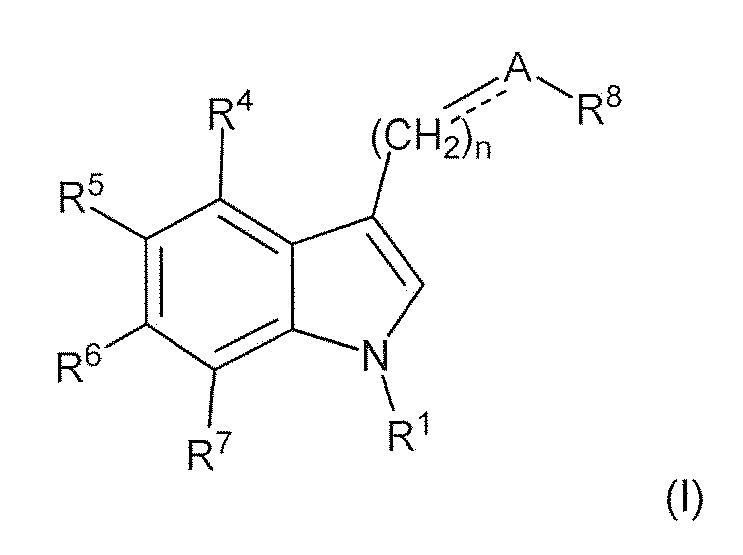
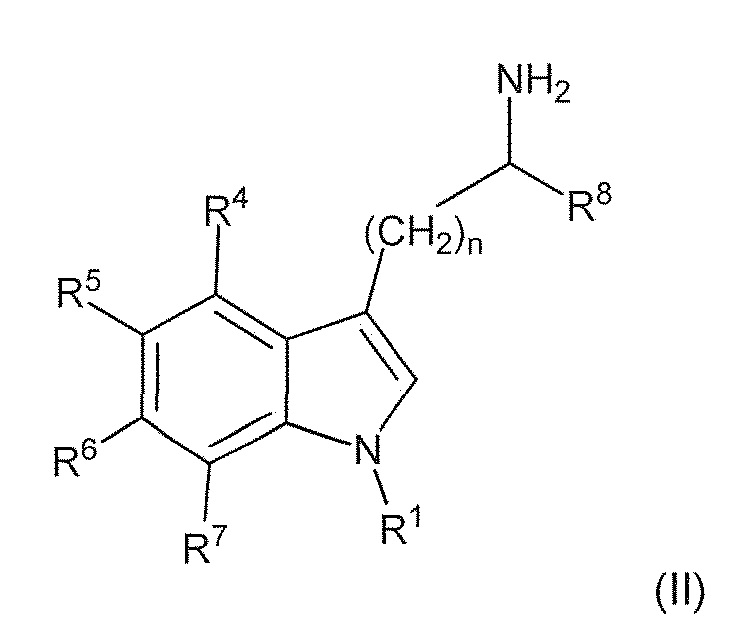
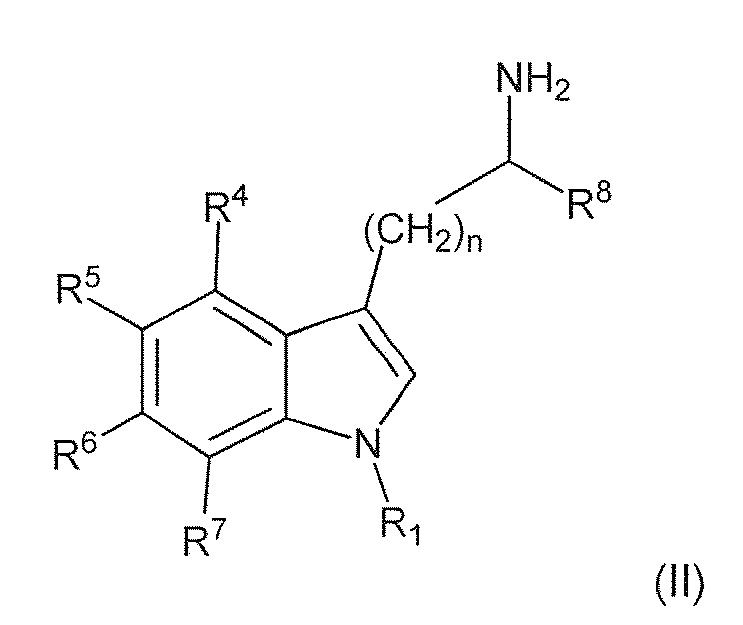
В первом варианте воплощения изобретение представляет способ получения соединения формулы (II) или его соли или сольвата или гидрата,

включающий преобразование соединения формулы (I) в соединение формулы (II) или его соль, сольват или гидрат,
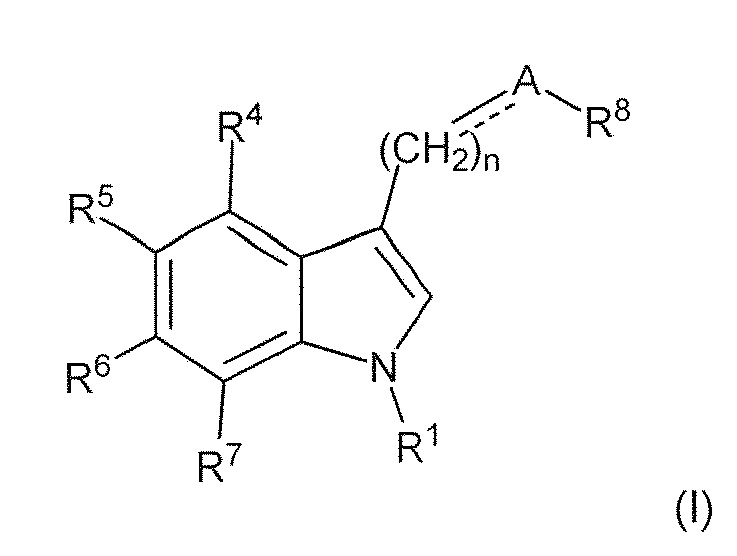
где: пунктирная линия представляет собой связь или отсутствует; A выбирают из C=O и C=NH; или когда пунктирная линия представляет собой двойную связь, A-R8 представляет собой:
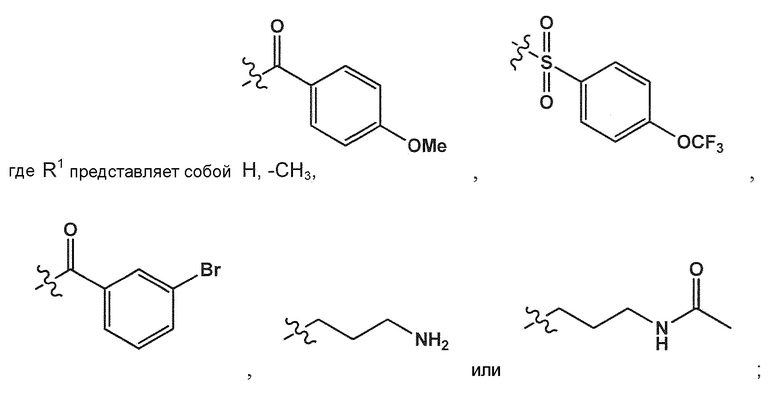
 ; Ra представляет собой C1-6 алкил; R1 представляет собой H, -CH3,
; Ra представляет собой C1-6 алкил; R1 представляет собой H, -CH3,  ,
,
R4 и R7 каждый, независимо друг от друга, представляют собой H или -Cl; R5 представляет собой H, -OH, -CH3, -OCH3, -F, -Cl, -CF3 или -CN; R6 представляет собой H, -OH, -OCH3, -F или -Cl; R8 представляет собой H, -CH3, -CH2CH3, -CH2OH, -CO2H, -CO2CH3, -CO2CH2CH3 или -CF3; и n имеет значение 1 или 2.
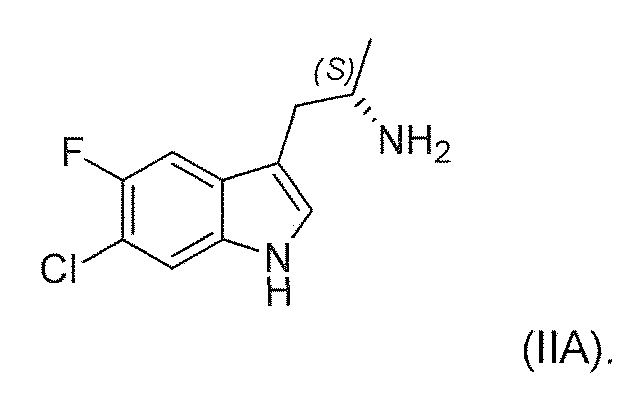
Во втором варианте воплощения изобретение представляет способ получения соединения формулы (IIA) или его соли или гидрата или сольвата,
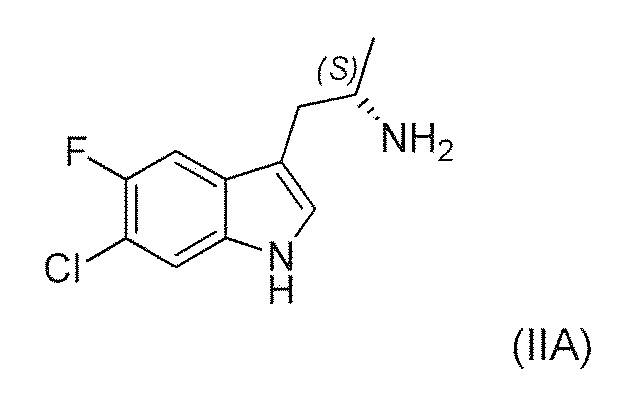 ,
,
включающий ферментативное трансаминирование соединения формулы (IA) или его соли или сольвата или гидрата,
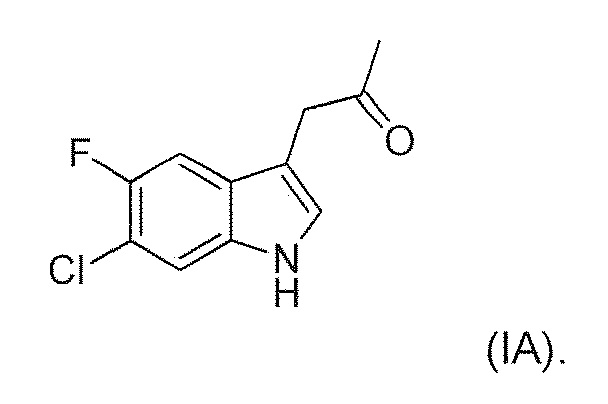
с получением соединения формулы (IIA).
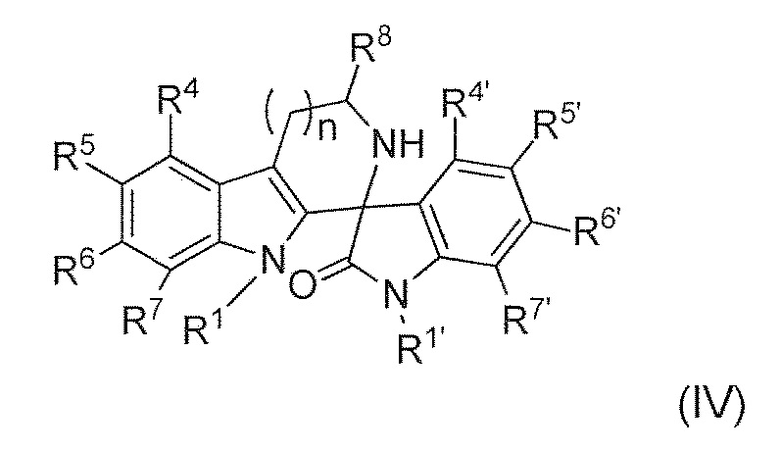
В третьем варианте воплощения изобретение представляет способ получения соединения формулы (IV) или его соли или гидрата или сольвата,
 ,
,
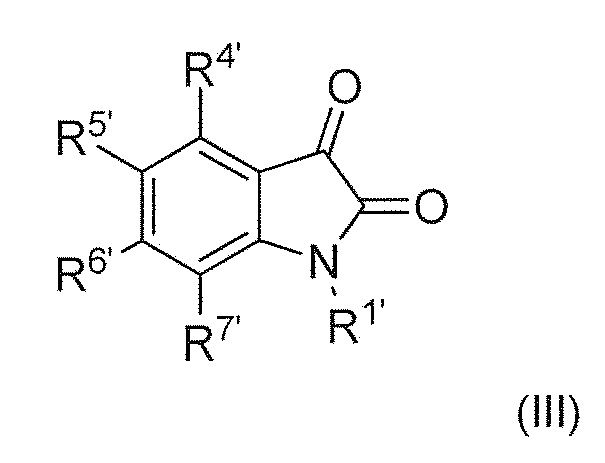
включающий, взаимодействие соединения формулы (III) или его соли или гидрата или сольвата,
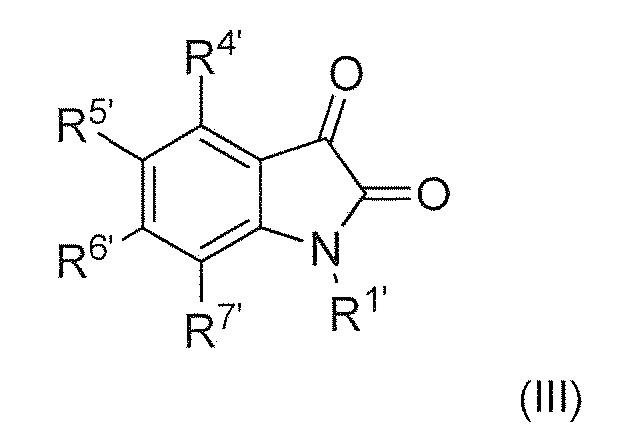
с соединением формулы (II), или его солью или гидратом или сольватом,
 ,
,
где соединение формулы (II) или его соль или гидрат или сольват получают из соединения формулы (I) или его соли или гидрата или сольвата,
 ,
,
где: пунктирная линия представляет собой связь или отсутствует; A выбирают из C=O и C=NH; или когда пунктирная линия представляет собой двойную связь, A-R8 представляет собой:
 ;
;
Ra представляет собой C1-6 алкил; R1 представляет собой (C1-C6)алкил, необязательно замещенный группой амино, (C1-C6) алкиламино, (C1-C6) алкил ди-алкиламино или (C1-C6)алкил C(O)NH (C1-6)алкил; R4 и R7 каждый, независимо друг от друга, представляют собой H или галоген; R5 и R6 каждый, независимо друг от друга, представляют собой водород, галоген, гидроксил, (C1-C6) алкил, тригалоген (C1) алкил, циано или (C1-C6) алкокси; R8 представляет собой (C1-C6) алкил, необязательно замещенный гидроксилом; n имеет значение 1 или 2; R1’ представляет собой водород или (C1-C6)алкил; и R4’, R5’, R6’ и R7’, каждый, независимо друг от друга, представляют собой водород, галоген, гидрокси, амино, алкиламино, диалкиламино, (C1-C6)алкил и (C1-C6)алкилокси.
В четвертом варианте воплощения изобретение представляет способ получения соединения формулы (IVA) или его соли или сольвата или гидрата,
 ,
,
включающий: взаимодействие соединения формулы (IIIA) или его соли или сольвата или гидрата
с соединением формулы (II) или его солью или сольватом или гидратом,
с получением соединения формулы (IVA) или его соли или сольвата или гидрата,
где соединение формулы (IIA) получают из соединения формулы (IA) или его соли или гидрата или сольвата,
 .
.
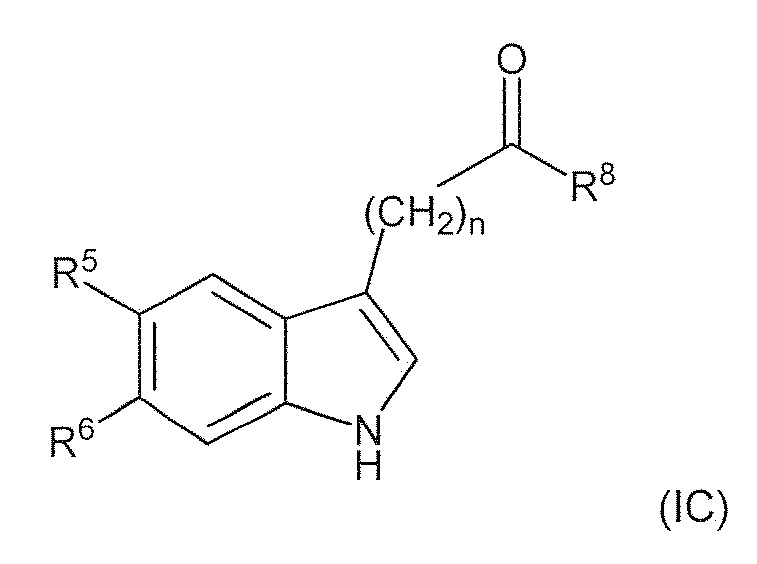
В пятом варианте воплощения изобретение представляет соединение формулы (IC):
 ,
,
где: R1 представляет собой (C1-C6) алкил, необязательно замещенный группой амино, (C1-C6) алкиламино, (C1-C6)алкил ди-алкиламино или (C1-C6)алкил C(O)NH (C1-6)алкил; R5 и R6 каждый, независимо друг от друга, представляют собой водород, галоген, гидроксил, (C1-C6) алкил, тригалоген (C1)алкил, циано или (C1-C6)алкокси; R8 представляет собой (C1-C6) алкил, необязательно замещенный гидроксилом; n имеет значение 1 или 2; или его фармацевтически приемлемую соль или гидрат или сольват.
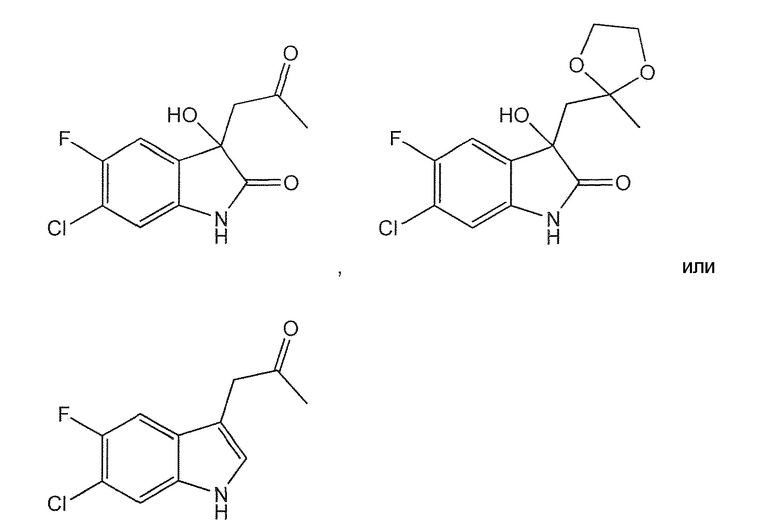
В шестом варианте воплощения изобретение представляет соединение, выбранное из:
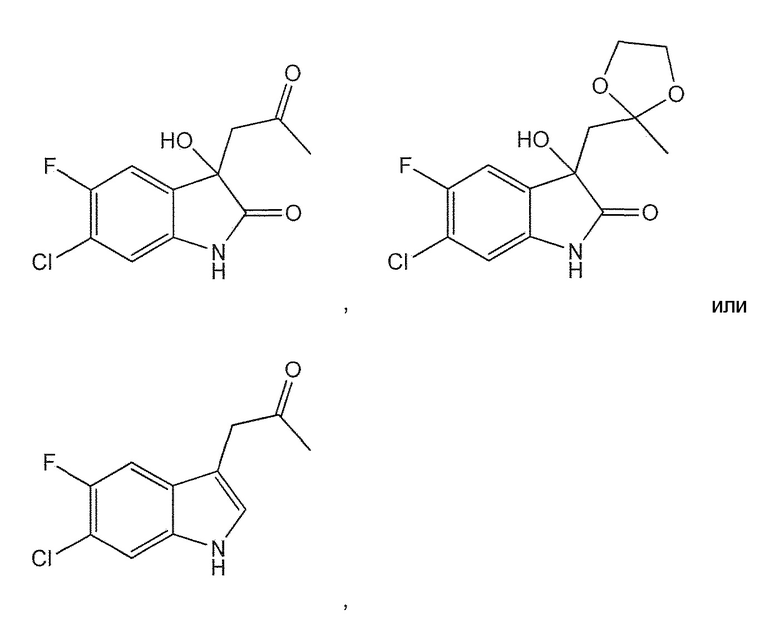
или его фармацевтически приемлемую соль, сольват или гидрат.
Область техники, к которой относится изобретение
Изобретение относится к новым способам, новой технологической стадии и новому промежуточному соединению, полезным для получения спироиндолоновых соединений, полезных для лечения паразитарных заболеваний, включающих, например, спироиндолоновую группу, таких как (1'R,3'S)-5,7'-дихлор-6'-фтор-3'-метил-2',3',4',9'-тетрагидроспиро[индолин-3,1'-пиридо[3,4-b]индол]-2-он.
Предпосылки изобретения
Настоящее изобретение относится к способам получения спироиндолоновых соединений, таких как (1'R,3'S)-5,7'-дихлор-6'-фтор-3'-метил-2',3',4',9'-тетрагидроспиро[индолин-3,1'-пиридо[3,4-b]индол]-2-он.
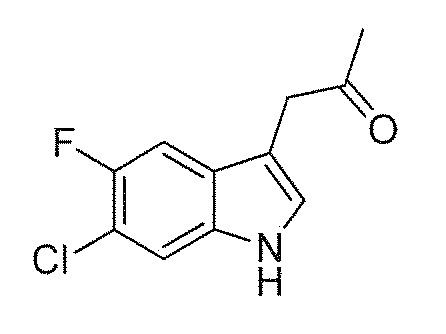
(1'R,3'S)-5,7'-дихлор-6'-фтор-3'-метил-2',3',4',9'-тетрагидроспиро[индолин-3,1'-пиридо[3,4-b]индол]-2-он является полезным для лечения и/или профилактики инфекций, таких как инфекции, вызываемые возбудителями Plasmodium falciparum, Plasmodium vivax, Plasmodium malariae, Plasmodium ovale, Trypanosoma cruzi и паразитами рода Leishmania, такими как, например, Leishmania donovani, и имеет следующую структуру:
(1'R,3'S)-5,7'-дихлор-6'-фтор-3'-метил-2',3',4',9'-тетрагидроспиро[индолин-3,1'-пиридо[3,4-b]индол]-2-он и его синтез описаны в WO 2009/132921 Al, в частности, в Примере 49 данной публикации.
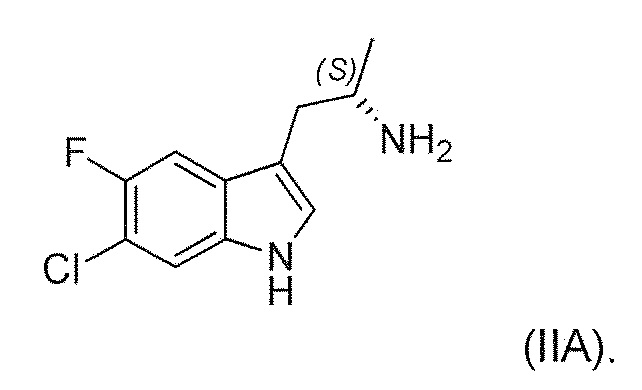
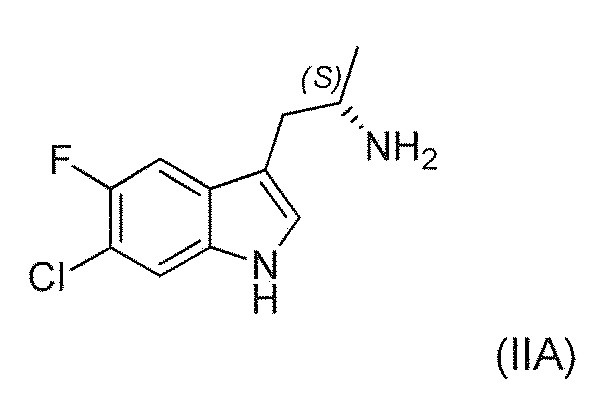
Существует потребность в обеспечении нового способа получения (1'R,3'S)-5,7'-дихлор-6'-фтор-3'-метил-2',3',4',9'-тетрагидроспиро[индолин-3,1'-пиридо[3,4-b]индол]-2-она в целях повышения общей эффективности синтеза, чтобы сделать его пригодным для промышленного производства. В частности, существует необходимость в повышении эффективности синтеза хирального аминового промежуточного соединения (IIA):

Подробное описание изобретения
Способ(ы) в соответствии с настоящим изобретением для получения спироиндолоновых соединений, таких как соединения в соответствии с формулой (IV) или их соли или гидраты или сольваты, и промежуточных соединений, определенных в настоящей заявке, обобщенно представлены на схеме 1.
Схема 1
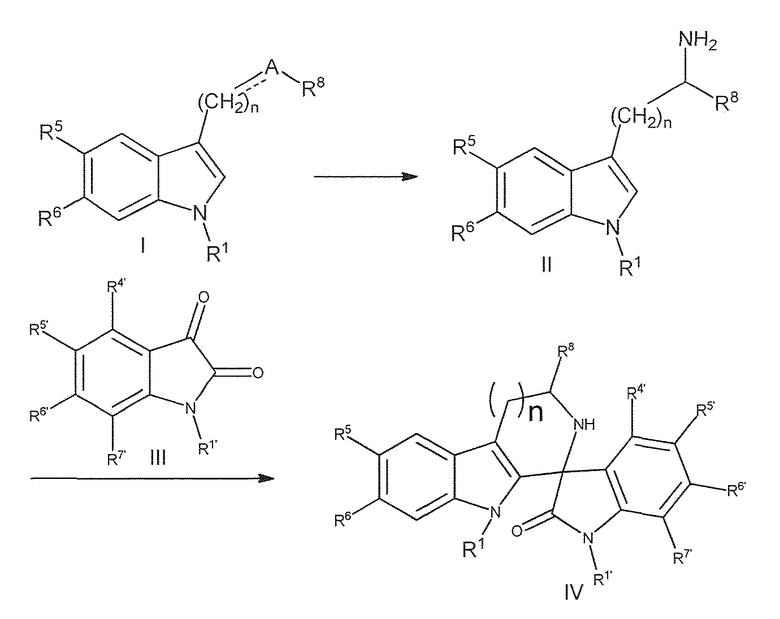
Конкретно, соединение формулы (I) или его соль или гидрат или сольват преобразуют в соединение формулы (II) или его соль или гидрат или сольват в соответствии со способами 1, 2, 3, 4, 5 или 6, где
- способ 1 включает
a) Ферментативное трансаминирование для преобразования соединения формулы (I) или его соли или гидрата или сольвата в соединение формулы (II) или его соль или гидрат или сольват
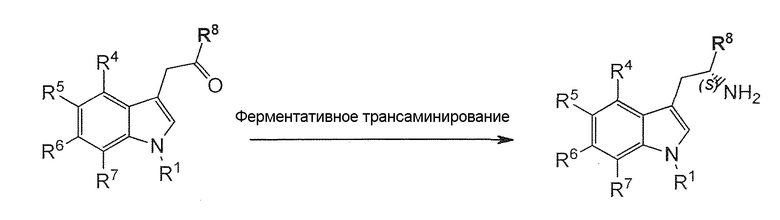
- способ 2 включает;
a) Химический асимметрический катализ для преобразования соединения формулы (I) или его соли или гидрата или сольвата в соединение формулы (II) или его соль;
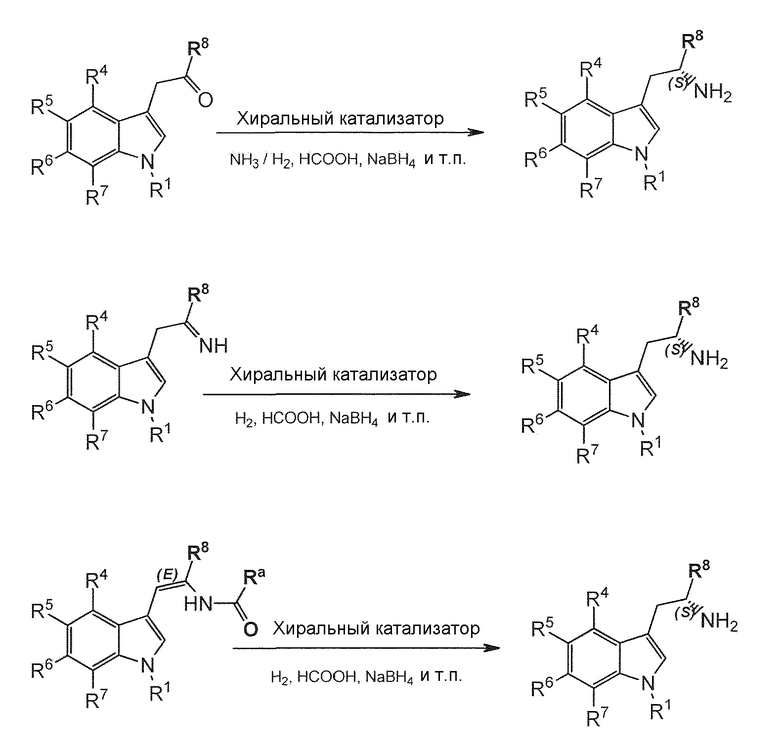
- способ 3 включает
a) Химическое асимметрическое восстановление для преобразования соединения формулы (I) или его соли или гидрата или сольвата в соединение формулы (II) или его соль или гидрат или сольват;
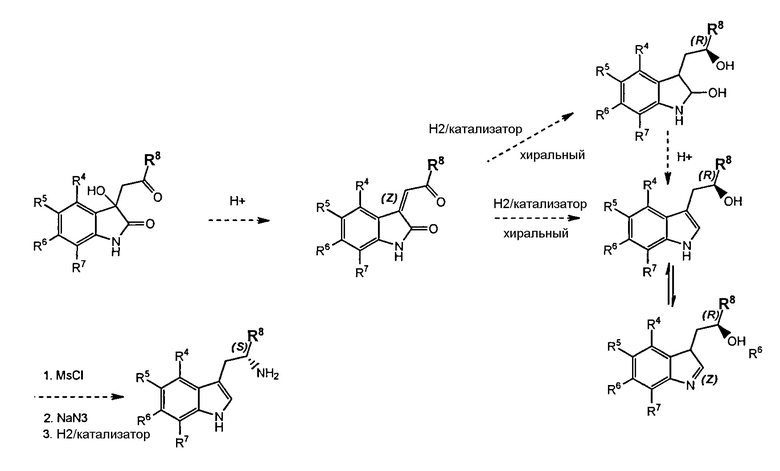
- способ 4 включает
a) Восстановление с последующим хиральным разделением для преобразования соединения формулы (I) или его соли или гидрата или сольвата в соединение формулы (II) или его соль или гидрат или сольват;

- способ 5 включает
a) Разделение с использованием липазы для преобразования рацемата соединения формулы (II) или его соли или гидрата или сольвата в отдельный энантиомер соединения формулы (II) или его соль или гидрат или сольват;
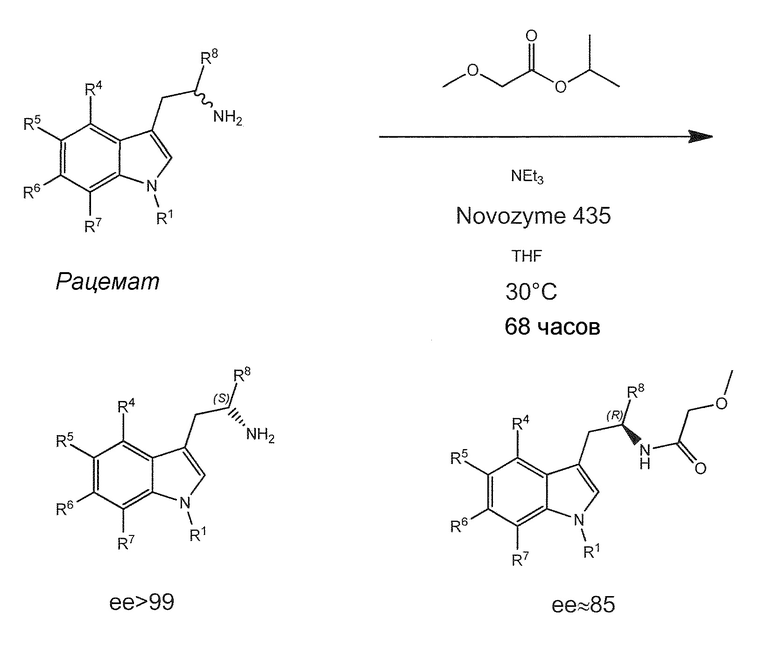
Novozym 435: Candida antarctica Липаза В, иммобилизованная на акриловой смоле
- способ 6 включает
a) Сочетание двух или нескольких из способов 1-5 для преобразования соединения формулы (I) или его соли или гидрата или сольвата в соединение формулы (II) или его соль или гидрат или сольват.
Соединение формулы (II) или его соль можно преобразовать в соединение формулы (IV) или его соль, например, как описано в WO 2009/132921, в частности, как описано в соответствующих пунктах формулы изобретения и примерах, которые включены в данную заявку посредством ссылки.
Изобретение конкретно относится к способам, описанным в каждом разделе. Изобретение также относится, независимо, к каждой отдельной стадии, описанной в последовательности технологических операций в соответствующем разделе. Таким образом, любая и каждая отдельная стадия любого способа, состоящего из последовательности стадий, описанных в настоящей заявке, сама по себе является предпочтительным вариантом воплощения настоящего изобретения. Таким образом, изобретение также относится к тем вариантам воплощения способа, в соответствии с которыми соединение, получаемое в качестве промежуточного соединения на любой стадии способа, используют в качестве исходного вещества.
Изобретение также относится к новым исходным веществам, которые были специально разработаны для получения соединения в соответствии с изобретением, к их использованию и к способам их получения.
Изобретение также относится к промежуточным соединениям, которые были специально разработаны для получения соединения в соответствии с изобретением, к их использованию и к способам их получения.
Следует отметить, что в настоящем изобретении, как правило, объяснения, представленные в одном разделе, также применимы для других разделов, если не указано иное. Например, определения для остатка R1 в формуле (I), представленные в Разделе A, также применимы, если формула (I) встречается в других разделах, таких как Раздел B, если не указано иное.
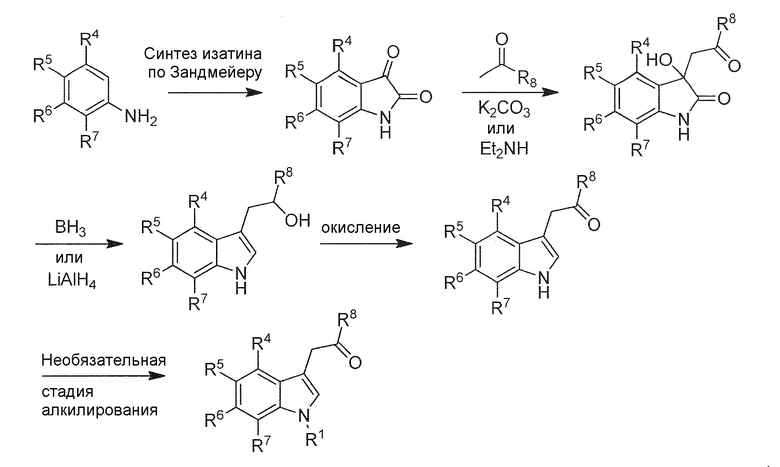
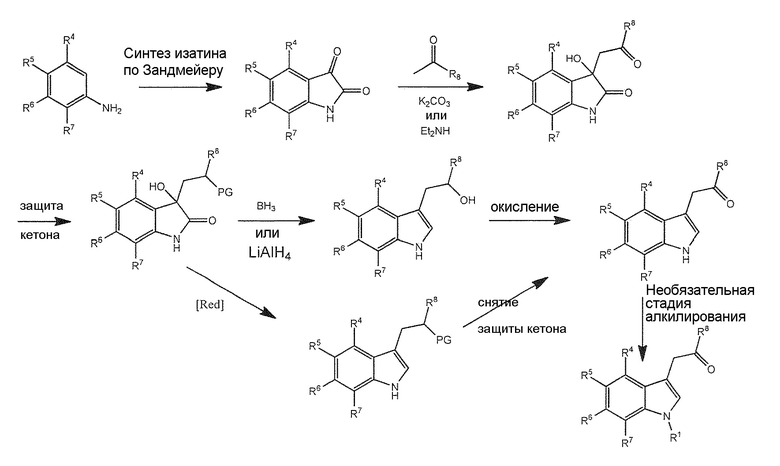
Раздел A: Получение соединения формулы (I)
Соединение формулы (I) или его соль или гидрат или сольват можно получить, как описано ниже и/или в соответствии с примерами 1-3 из настоящей заявки.
или
Раздел B: Преобразование соединения формулы (I) в соединение формулы (II).
В первом варианте воплощения изобретение представляет способ получения соединения формулы (II) или его соли или сольвата или гидрата,
 ,
,
включающий преобразование соединения формулы (I) в соединение формулы (II) или его соль, сольват или гидрат,
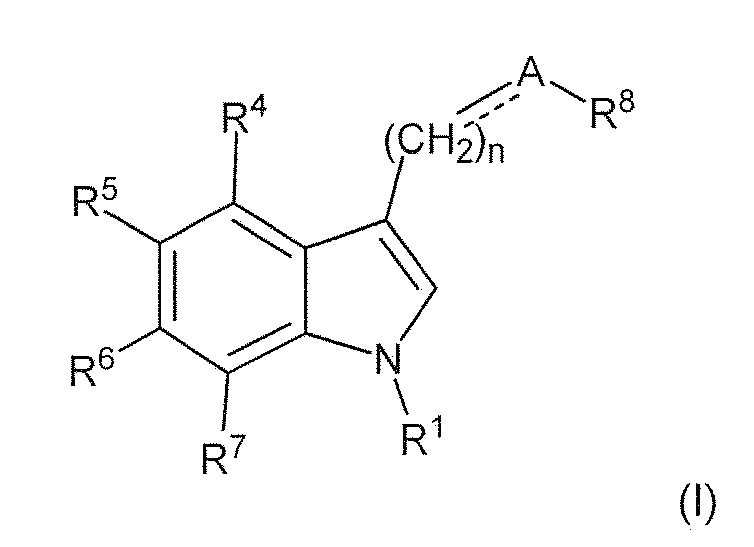 ,
,
где: пунктирная линия представляет собой связь или отсутствует; A выбирают из C=O и C=NH; или когда пунктирная линия представляет собой двойную связь, A-R8 представляет собой:

R4 и R7 каждый, независимо друг от друга, представляют собой, H или -Cl; R5 представляет собой H, -OH, -CH3, -OCH3, -F, -Cl, -CF3 или -CN; R6 представляет собой H, -OH, -OCH3, -F или -Cl; R8 представляет собой H, -CH3, -CH2CH3, -CH2OH, -CO2H, -CO2CH3, -CO2CH2CH3 или -CF3; и n имеет значение 1 или 2.
В первом альтернативном варианте воплощения изобретение представляет способ преобразования соединения формулы (I) в соединение формулы (II), где R5 и R6 представляют собой фтор, когда: R8 представляет собой -CH3, и n имеет значение 1.
Во втором альтернативном варианте воплощения изобретение представляет способ преобразования соединения формулы (I) в соединение формулы (II), где R5 и R6 представляют собой фтор и хлор, когда: R8 представляет собой -CH3, и n имеет значение 1.
В третьем альтернативном варианте воплощения изобретение представляет способ преобразования соединения формулы (I) в соединение формулы (II), где R5 и R6 представляют собой водород, когда: R8 представляет собой -CH3 и n имеет значение 1.
В четвертом альтернативном варианте воплощения изобретение представляет способ преобразования соединения формулы (I) в соединение формулы (II), где R5 представляет собой фтор, когда: n имеет значение 1, и R6 представляет собой водород.
В шестом альтернативном варианте воплощения изобретение представляет способ преобразования соединения формулы (I) в соединение формулы (II), где соединение формулы (II) представляет собой соединение формулы (IIA) или его соль или сольват или гидрат,
В седьмом альтернативном варианте воплощения изобретение представляет способ преобразования соединения формулы (I) в соединение формулы (II), где соединение формулы (II) преобразуют из соединения формулы (I) в условиях, выбранных из ферментативного трансаминирования, химического асимметрического катализа, асимметричного восстановления и хирального разделения, или комбинации двух или более условий.
В восьмом альтернативном варианте воплощения изобретение представляет способ преобразования соединения формулы (I) в соединение формулы (II), где A представляет собой C=O.
В девятом альтернативном варианте воплощения изобретение представляет способ преобразования соединения формулы (I) в соединение формулы (II), где соединение формулы (I) представляет собой соединение формулы (IA) или его соль или гидрат или сольват,
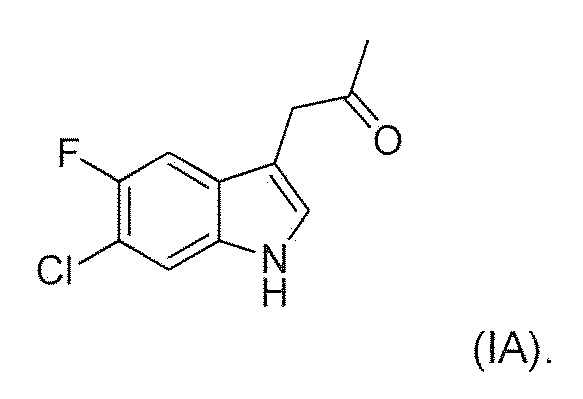
В иллюстративном варианте воплощения фермент представляет собой SEQ ID NO: 134.
Во втором варианте воплощения изобретение представляет способ получения соединения формулы (IIA) или его соли или гидрата или сольвата,
 ,
,
включающий ферментативное трансаминирование соединения формулы (IA) или его соли или сольвата или гидрата,
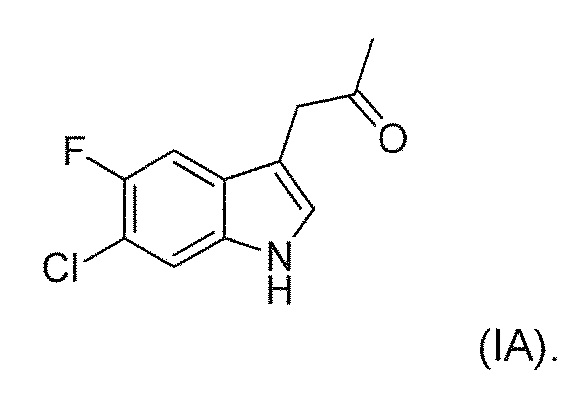
с получением соединения формулы (IIA).
Обычно кетон, соединение (I), растворяют в органическом растворителе, например, гликоле, и добавляют к водной смеси изопропиламина HCL и пиридоксалфосфата, с последующим добавлением TEA буфера. Уровень pH затем доводят до нейтрального при помощи соответствующего основания, например, NaOH, с последующим нагреванием и добавлением трансаминазы. Реакционную смесь оставляют перемешиваться при температуре в течение приблизительно 24 часов. Твердый хиральный аминовый продукт (соединение формулы (II)) выделяют способом, известным специалистам в данной области техники, и/или в соответствии с примерами 10-12.
В иллюстративном варианте воплощения фермент представляет собой SEQ ID NO: 134.
Раздел C: Преобразование соединения формулы (II) в соединение формулы (IV)
В третьем варианте воплощения изобретение представляет способ получения соединения формулы (IV) или его соли или гидрата или сольвата,
 ,
,
включающий взаимодействие соединения формулы (III) или его соли или гидрата или сольвата
с соединением формулы (II) или его солью или гидратом или сольватом,
 ,
,
где соединение формулы (II) или его соль или гидрат или сольват получают из соединения формулы (I) или его соли или гидрата или сольвата,
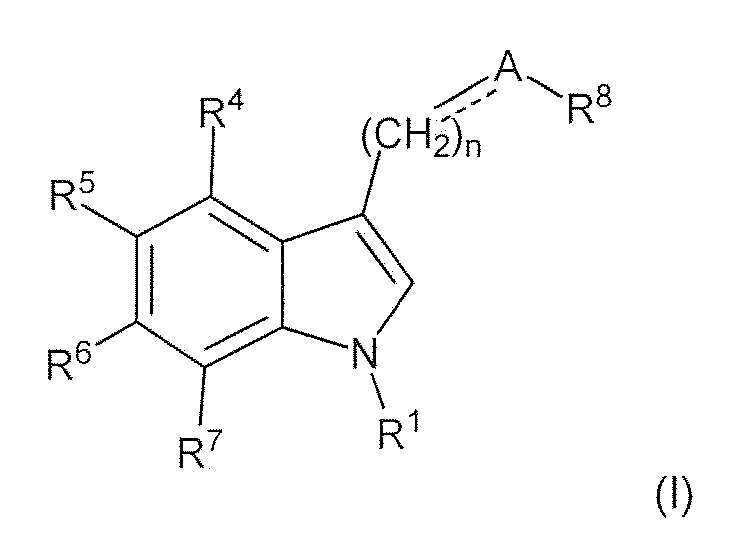
где: пунктирная линия представляет собой связь или отсутствует; A выбирают из C=O и C=NH; или когда пунктирная линия представляет собой двойную связь, A-R8 представляет собой:
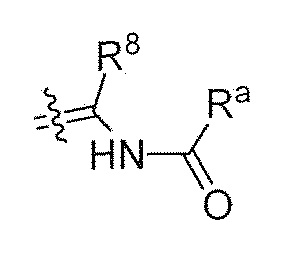 ;
;
Ra представляет собой C1-6 алкил; R1 представляет собой (C1-C6)алкил, необязательно замещенный группой амино, (C1-C6)алкиламино, (C1-C6)алкил ди-алкиламино или (C1-C6)алкил C(O)NH(C1-C6)алкил; R4 и R7 каждый, независимо друг от друга, представляют собой H или галоген; R5 и R6 каждый, независимо друг от друга, представляют собой водород, галоген, гидроксил, (C1-C6)алкил, тригалоген(C1)алкил, циано или (C1-C6)алкокси; R8 представляет собой (C1-C6) алкил, необязательно замещенный гидроксилом; n имеет значение 1 или 2, R1’ представляет собой водород или (C1-C6)алкил; и R4’, R5’, R6’ и R7’, каждый, независимо друг от друга, представляют собой водород, галоген, гидрокси, амино, алкиламино, диалкиламино, (C1-C6)алкил и (C1-C6)алкилокси.
В десятом альтернативном варианте воплощения изобретение представляет способ получения соединения формулы (IV), где R5 и R6 представляют собой фтор, когда: R8 представляет собой -CH3, и n имеет значение 1.
В одиннадцатом альтернативном варианте воплощения изобретение представляет способ получения соединения формулы (IV), где R5 и R6 представляют собой фтор и хлор, когда: R8 представляет собой -CH3, и n имеет значение 1.
В двенадцатом альтернативном варианте воплощения изобретение представляет способ получения соединения формулы (IV), где R5 и R6 представляют собой водород, когда: R8 представляет собой -CH3 и n имеет значение 1.
В четырнадцатом альтернативном варианте воплощения изобретение представляет способ получения соединения формулы (IV), где R5 представляет собой фтор, когда: n имеет значение 1, и R6 представляет собой водород.
R4 и R7 каждый, независимо друг от друга, представляют собой, H или -Cl; R5 представляет собой H, -OH, -CH3, -OCH3, -F, -Cl, -CF3 или -CN; R6 представляет собой H, -OH, -OCH3, -F или -Cl; R8 представляет собой H, -CH3, -CH2CH3, -CH2OH, -CO2H, -CO2CH3, -CO2CH2CH3 или -CF3; и n имеет значение 1 или 2.
В пятнадцатом альтернативном варианте воплощения изобретение представляет способ получения соединения формулы (IV), где соединение формулы (II) представляет собой соединение формулы (IIA) или его соль или сольват или гидрат,
В шестнадцатом альтернативном варианте воплощения изобретение представляет способ получения соединения формулы (IV), где R5’ представляет собой галоген.
В семнадцатом альтернативном варианте воплощения изобретение представляет способ получения соединения формулы (IV), где R5’ представляет собой хлор, и R1’, R4’, R6’ и R7’, каждый, представляют собой водород.
В восемнадцатом альтернативном варианте воплощения изобретение представляет способ получения соединения формулы (IV), где соединение формулы (III) представляет собой соединение формулы (IIIA) или его соль или гидрат или сольват,
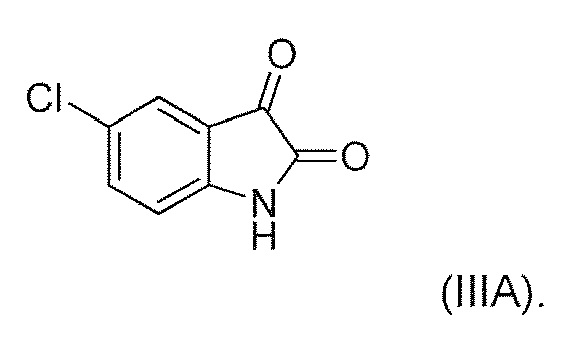
В иллюстративном варианте воплощения фермент представляет собой SEQ ID NO: 134.
В четвертом варианте воплощения изобретение представляет способ получения соединения формулы (IVA) или его соли или сольвата или гидрата,
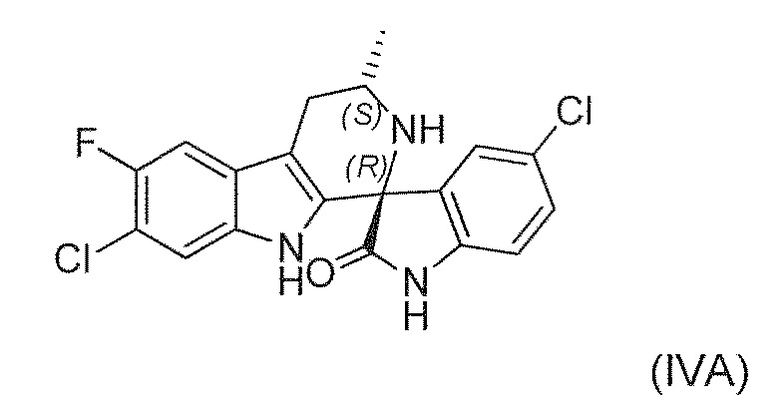 ,
,
включающий: взаимодействие соединения формулы (IIIA) или его соли или сольвата или гидрата

с соединением формулы (II) или его солью или сольватом или гидратом,
с получением соединения формулы (IVA) или его соли или сольвата или гидрата,
где соединение формулы (IIA) получают из соединения формулы (IA) или его соли или гидрата или сольвата,
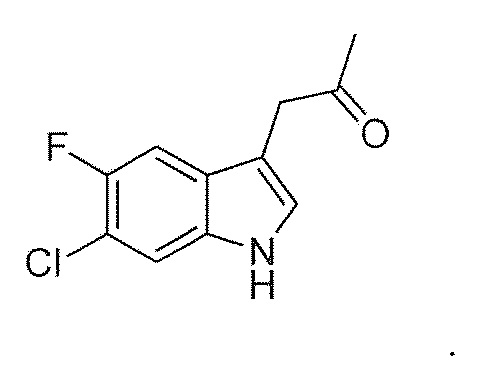
В девятнадцатом альтернативном варианте воплощения изобретение представляет способ получения соединения формулы (IVA), где соединение формулы (IIA) преобразуют в соль формулы (IIB):
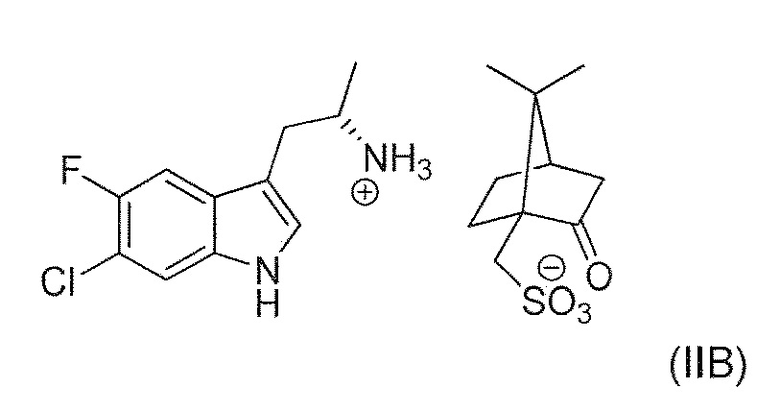
до реакции с соединением формулы (IIIA).
В иллюстративном варианте воплощения фермент представляет собой SEQ ID NO: 134.
В двадцатом альтернативном варианте воплощения изобретение представляет способ получения соединения формулы (IVA), где реакцию осуществляют в щелочных условиях.
В двадцать первом альтернативном варианте воплощения изобретение представляет способ получения соединения формулы (IVA), где реакцию осуществляют в присутствии триэтиламина.
В двадцать втором альтернативном варианте воплощения изобретение представляет способ получения соединения формулы (IVA), где соединение формулы (IVA) выделяют в виде соли формулы (IVB):
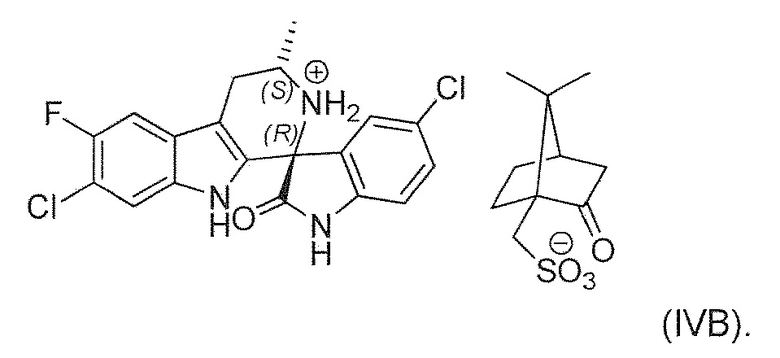
В двадцать третьем альтернативном варианте воплощения изобретение представляет способ получения соединения формулы (IVA), где соль формулы (IVB) преобразуют в соединение формулы (IVA) в форме свободного основания.
В двадцать четвертом альтернативном варианте воплощения изобретение представляет способ получения соединения формулы (IVA), где соль формулы (IVB) преобразуют в соединение формулы (IVA) в форме свободного основания при помощи карбоната натрия.
В двадцать пятом альтернативном варианте воплощения изобретение представляет способ получения соединения формулы (IVA), где соединение формулы (IVA) представляет собой гидрат.
В двадцать шестом альтернативном варианте воплощения изобретение представляет способ получения соединения формулы (IVA), где соединение формулы (IVA) представляет собой полугидрат.
В двадцать седьмом альтернативном варианте воплощения изобретение представляет способ получения соединения формулы полугидрата (IVA), где полугидрат соединения формулы (IVA) измельчают после выделения.
Раздел D: Использование новых соединений по настоящему изобретению формулы (IC).
В пятом варианте воплощения изобретение представляет соединение формулы (IC):
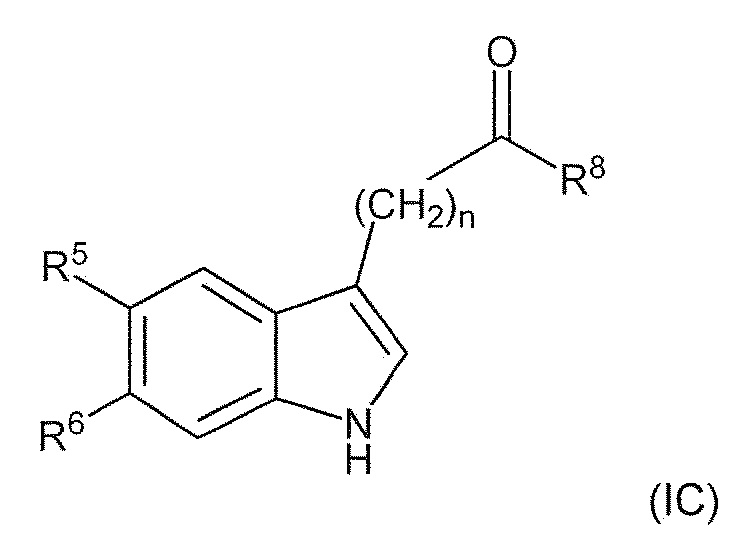 ,
,
где: R1 представляет собой (C1-C6) алкил, необязательно замещенный группой амино, (C1-C6) алкиламино, (C1-C6) алкилди-алкиламино или (C1-C6)алкил C(O)NH (C1-6)алкил; R5 и R6 каждый, независимо друг от друга, представляют собой водород, галоген, гидроксил, (C1-C6)алкил, тригалоген (C1)алкил, циано или (C1-C6)алкокси; R8 представляет собой (C1-C6) алкил, необязательно замещенный гидроксилом; n имеет значение 1 или 2; или его фармацевтически приемлемую соль или гидрат или сольват.
В двадцать восьмом альтернативном варианте воплощения изобретение представляет соединение формулы (IC), где R5 и R6 представляют собой фтор, когда: R8 представляет собой -CH3, и n имеет значение 1.
В двадцать девятом альтернативном варианте воплощения изобретение представляет соединение формулы (IC), где R5 и R6 представляют собой фтор и хлор, когда: R8 представляет собой -CH3, и n имеет значение 1.
В тридцатом альтернативном варианте воплощения изобретение представляет соединение формулы (IC), где R5 и R6 представляют собой водород, когда: R8 представляет собой -CH3 и n имеет значение 1.
В тридцать первом альтернативном варианте воплощения изобретение представляет соединение формулы (IC), где R5 представляет собой фтор, когда: n имеет значение 1, и R6 представляет собой водород.
В тридцать втором альтернативном варианте воплощения изобретение представляет соединение формулы (IC),
R5 представляет собой H, -OH, -CH3, -OCH3, -F, -Cl, -CF3 или -CN; R6 представляет собой H, -OH, -OCH3, -F или -Cl; R8 представляет собой H, -CH3, -CH2CH3, -CH2OH, -CO2H, -CO2CH3, -CO2CH2CH3 или -CF3; и n имеет значение 1 или 2.
В тридцать третьем альтернативном варианте воплощения изобретение представляет соединение формулы (I), где соединение представляет собой соединение формулы (IA):

или его фармацевтически приемлемую соль или гидрат или сольват.
В шестом варианте воплощения изобретение представляет соединение, выбранное из:
 ,
,
или его фармацевтически приемлемую соль, сольват или гидрат.
Раздел I: Общие термины
Ниже представлены определения различных терминов, используемых для описания новых промежуточных соединений и стадий синтеза настоящего изобретения. Эти определения, либо посредством замены одного, более чем одного или всех общих выражений или символов, используемых в настоящем описании, и, таким образом, обеспечивая варианты воплощения настоящего изобретения, в частности, применимы к терминам, как они используются в данном описании, если только они не определены иным образом в конкретных случаях либо отдельно либо как часть более крупной группы. Таким образом, общие определения, используемые выше и ниже, если не указано иное, имеют следующие значения:
Термин “C1-C20-“ определяет группу, содержащую до, и включительно, максимум 20, особенно до, и включительно, максимум 7 атомов углерода, при этом указанная группа является разветвленной (один или более раз) или линейной и связана через концевой или не-концевой атом углерода.
Алкил, являясь радикалом или частью радикала, представляет собой прямую или разветвленную (один или, если требуется и возможно, более раз) углеродную цепь, и конкретно представляет собой C1-C7-алкил, такой как C1-C4-алкил, в частности, разветвленный C1-C4-алкил, такой как изопропил. Термин “низший” или “C1-C7-“ определяет группу, содержащую до, и включительно, максимум 7, в особенности до, и включительно, максимум 4 атома углерода, при этом указанная группа является разветвленной (один или более раз) или с прямой цепью и связана через концевой или не-концевой атом углерода. Низший или C1-C7-алкил, например, представляет собой н-пентил, н-гексил или н-гептил или предпочтительно C1-C4-алкил, особенно, такой как метил, этил, н-пропил, изо-пропил, н-бутил, изобутил, втор-бутил, трет-бутил, в частности метил, этил, н-пропил, изо-пропил, н-бутил, изобутил, втор-бутил, трет-бутил; предпочтительно, метил.
Алкиламино и диалкиламино относятся к алкил-NH- и (алкил)2N-, соответственно, где алкил может быть линейным или разветвленным. Алкильная группа, например, включает от 1 до 7 и, в частности, от 1 до 4 C атомов. Некоторые примеры представляют собой метиламино, диметиламино, этиламино, и диэтиламино; предпочтительно метиламино.
Гало или галоген представляет собой, предпочтительно, фтор, хлор, бром или йод, предпочтительно, фтор или хлор; если галоген упоминается в качестве заместителя, где это возможно, могут присутствовать один или несколько (например, до трех или один) атомов галогена, например, в галоген-C1-C7-алкиле, таком как трифторметил, 2,2-дифторэтил или 2,2,2-трифторэтил.
Галоген-C1-C7-алкил может быть линейным или разветвленным и, в частности, включает от 1 до 4 C атомов, например, 1 или 2 C атома. Примеры представляют собой фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, 2-хлорэтил и 2,2,2-трифторэтил; предпочтительно, трифторметил.
Алкокси, являясь радикалом или частью радикала, относится к алкил-O-, где термин алкил имеет значение, определенное в настоящей заявке, и включает, например, C1-C20-алкокси (-O-C1-C20алкил), предпочтительно C1-C7-алкокси (-O-C1-C7алкил). В частности, алкокси включает, например, радикалы метокси, этокси, н-пропилокси, изопропилокси, н-бутилокси, изобутилокси, втор-бутилокси, трет-бутилокси, пентилокси, гексилокси и гептилокси; предпочтительно метокси.
Термин “ оптически активное основание” описывает, например, хиральные амины, предпочтительно, хиральные третичные амины, более предпочтительно алкалоиды хинного дерева, такие как хинидин и хинин, наиболее предпочтительно модифицированные алкалоиды хинного дерева. Примеры таких модифицированных алкалоидов хинного дерева подробно описаны, например, в Tian, S.-K.; Chen, Y.; Hang, J.; Tang, L.; McDiad, P.; Deng, L. Acc. Chem. Res. 2004, 37, 621-631 и приведенных в них ссылках.
Термин “катализатор фазового переноса”, как это используется в настоящей заявке, относится к каталитическому количеству химического реагента, который увеличивает скорость реакции между химическими веществами, находящимися в разных фазах (например, несмешивающиеся жидкости или твердые тела и жидкости) посредством экстрагирования одного из реагентов, чаще всего аниона, через межфазную границу в другую фазу. Эти катализаторы включают четвертичные аммониевые или фосфониевые соли (например, соли тетраалкиламмония, где алкил может быть одинаковым или разным), или агенты для образования комплексов неорганических катионов (например, краун-эфиры или другие криптанды). Катион катализатора не расходуются в ходе реакции, хотя анионный обмен имеет место. В частности, подходящие катализаторы фазового переноса, которые можно использовать в соответствии с настоящим изобретением, представляют собой четвертичные соли аммония, например, формулы RmRnRlRkNX, где RmRnRlRk представляют собой алкил, либо одинаковый либо отличный друг от друга, и X представляет собой галоген (например, хлорид, бромид, йодид) или гидроксид, например, тетра-н-бутиламмонийгидроксид.
"Гетерогенный" катализатор, как это используется в настоящей заявке, относится к катализатору, нанесенному на носитель, как правило, хотя и не обязательно, субстрат состоит из неорганического вещества, например, пористого вещества, такого как углерод, кремний и/или оксид алюминия.
"Гомогенный" катализатор, как это используется в настоящей заявке, относится к катализатору, который не нанесен на носитель.
Термин "хиральный" относится к молекулам, которые имеют свойство несовместимости при наложении на являющегося их зеркальным отображением партнера, в то время как термин "aхиральный" относится к молекулам, которые совмещаются с их зеркальным отражением.
Термин “катализатор” означает любое вещество, которое влияет на скорость химической реакции, снижая энергию активации для химической реакции.
Термин “порошкообразный катализатор” означает катализатор с содержанием воды от 0 до 30% масс.
Термин "отношение субстрата к катализатору" (S/C) относится к молярному отношению исходного соединения или его соли к "катализатору на основе переходного металла”.
Термин “выделение продукта реакции” означает работу по выделению и/или очистке, которые осуществляют сразу после завершения реакции.
При использовании в настоящей заявке, если не указано иное, термин “комнатная температура” или “температура окружающей среды” означает температуру от 15 до 30ºC, такую как температура от 20 до 30°C, например, от 20 до 25ºC.
Термин "инертный", как он используется в настоящей заявке, означает на вступающий во взаимодействие с любым из реагентов, растворителей или других компонентов реакционной смеси. Такие инертные условия, как правило, осуществляют при помощи инертного газа, такого как диоксид углерода, гелий, азот, аргон, среди прочих газов.
Связи со звездочкой (*) означают точку связывания с остальной частью молекулы.
Соединения по настоящему изобретению могут иметь один или несколько асимметричных центров. Предпочтительными абсолютными конфигурациями являются те, которые указаны отдельно в настоящей заявке. Тем не менее, любой возможный чистый энантиомер, чистый диастереоизомер, или их смеси, например, смеси энантиомеров, такие как рацематы, входят в объем настоящего изобретения.
В формулах, представленных в настоящей заявке, обозначение  ,
,  или
или  на C-sp3 представляет собой ковалентную связь, где стереохимия связи не определена. Это значит, что обозначение
на C-sp3 представляет собой ковалентную связь, где стереохимия связи не определена. Это значит, что обозначение  или
или  на C-sp3 включает (S) конфигурацию, а также (R) конфигурацию соответствующего хирального центра. Более того, также включены смеси, например, смеси энантиомеров, такие как рацематы, включены в объем настоящего изобретения.
на C-sp3 включает (S) конфигурацию, а также (R) конфигурацию соответствующего хирального центра. Более того, также включены смеси, например, смеси энантиомеров, такие как рацематы, включены в объем настоящего изобретения.
В формулах, представленных в настоящей заявке, обозначение  или
или  на C-sp2 представляет собой ковалентную связь, где стереохимия или геометрия связи не определена. Это значит, что обозначение "
на C-sp2 представляет собой ковалентную связь, где стереохимия или геометрия связи не определена. Это значит, что обозначение " " на C-sp2 включает цис (Z) конфигурацию, а также транс (Е) конфигурацию соответствующей двойной связи. Более того, также включены смеси, например, смеси изомеров с двойной связью включены в объем настоящего изобретения.
" на C-sp2 включает цис (Z) конфигурацию, а также транс (Е) конфигурацию соответствующей двойной связи. Более того, также включены смеси, например, смеси изомеров с двойной связью включены в объем настоящего изобретения.
В формулах, представленных в настоящей заявке, обозначение  указывает связь Csp3-Csp3 или связь Csp2-Csp2.
указывает связь Csp3-Csp3 или связь Csp2-Csp2.
Соединения по настоящему изобретению могут иметь один или несколько асимметричных центров. Предпочтительные абсолютные конфигурации представляют собой такие, которые специально указаны в настоящей заявке.
В формулах, представленных в настоящей заявке, обозначение  на C-sp3 указывает на абсолютную стереохимию, или (R) или (S).
на C-sp3 указывает на абсолютную стереохимию, или (R) или (S).
В формулах, представленных в настоящей заявке, обозначение  на C-sp3 указывает на абсолютную стереохимию, или (R) или (S).
на C-sp3 указывает на абсолютную стереохимию, или (R) или (S).
Термин “стереоизомерная чистота” с указанным процентом означает, что обозначенный стереоизомер преобладает при таком указанном процентном содержании в смеси стереоизомеров.
Термин “стереоизомер” означает одну из абсолютных конфигураций одной органической молекулы, имеющей, по меньшей мере, один асимметричный атом углерода. В определение стереоизомер включены энантиомеры и диастереомеры.
Термин "разделение" относится к отделению или концентрированию или обеднению одного из стереоизомеров молекулы.
Соли представляют собой главным образом фармацевтически приемлемые соли или, как правило, соли любого из промежуточных соединений, указанных в настоящей заявке, и специалист в данной области легко определит соли, которые не исключаются по химическим соображениям. Они могут быть образованы, когда присутствуют солеобразующие группы, такие как основные или кислотные группы, которые могут существовать в диссоциированной форме, по меньшей мере, частично, например, при pH от 4 до 10 в водных растворах, или могут быть выделены, главным образом, в твердой, особенно в кристаллической форме.
Такие соли образуются, например, в виде кислотно-аддитивных солей, предпочтительно с органическими или неорганическими кислотами, из соединений или любого из промежуточных соединений, указанных в настоящей заявке, с основным атомом азота (например, имино или амино), в частности, в виде фармацевтически приемлемых солей. Подходящие неорганические кислоты представляют собой, например, галогенированные кислоты, такие как хлористоводородная кислота, серную кислоту или фосфорную кислоту. Подходящие органические кислоты представляют собой, например, карбоновые, фосфоновые, сульфоновые или сульфаминовые кислоты, например, уксусную кислоту, пропионовую кислоту, молочную кислоту, фумаровую кислоту, янтарную кислоту, лимонную кислоту, аминокислоты, такие как глутаминовая кислота или аспарагиновая кислота, малеиновую кислоту, гидроксималеиновую кислоту, метилмалеиновую кислоту, бензойную кислоту, метан- или этан-сульфоновую кислоту, этан-1,2-дисульфоновую кислоту, бензолсульфоновую кислоту, 2-нафталинсульфоновую кислоту, 1,5-нафталин-дисульфоновую кислоту, N-циклогексилсульфаминовую кислоту, N-метил-, N-этил- или N-пропил-сульфаминовую кислоту, или другие органические протонные кислоты, такие как аскорбиновая кислота.
В присутствии отрицательно заряженных радикалов, таких как карбокси или сульфо, соли также могут быть образованы с основаниями, например, солями металлов или аммония, такими как соли щелочных металлов или щелочно-земельных металлов, например, соли натрия, калия, магния или кальция, или соли аммония с аммиаком или подходящими органическими аминами, например, такими как триэтиламин или три(2-гидроксиэтил)амин, N-этил-пиперидин, N,N'-диметилпиперазин, трет-бутиламин, н-бутиламин, фенилэтиламин, дициклогексиламин или циклогексиламин.
Когда основная группа и кислотная группа присутствуют в одной и той же молекуле, любое из указанных в настоящей заявке промежуточных соединений также может образовывать внутренние соли.
Для целей выделения или очистки любого из указанных в настоящей заявке промежуточных соединений также можно использовать не являющиеся фармацевтически приемлемыми соли, например, пикраты или перхлораты.
Предпочтительные соли включают, например, кислотно-аддитивные соли. Соединения, содержащие, по меньшей мере, одну кислотную группу (например, COOH или 5-тетразолил), также могут образовывать соли с основаниями. Подходящие соли с основаниями представляют собой, например, соли металлов, такие как соли щелочных металлов или соли щелочно-земельных металлов, например, соли натрия, калия, кальция или магния, или соли с аммиаком или органическим амином, таким как морфолин, тиоморфолин, пиперидин, пирролидин, моно-, ди- или три-низший алкиламин, например, этил-, трет-бутил-, диэтил-, диизопропил-, триэтил-, трибутил- или диметилпропиламин, или моно-, ди- или тригидрокси низший алкиламин, например, моно-, ди- или три-этаноламин. Кроме того, могут быть образованы соответствующие внутренние соли. Также включены соли, которые не подходят для фармацевтического применения, но которые могут быть использованы, например, для выделения или очистки свободных соединений I или их фармацевтически приемлемых солей. Наиболее предпочтительной солью формулы (IV) является соль камфорсульфоновой кислоты.
В частности, термин “соль соединения формулы (IV)” относится, например, к его соли с амином, его соли с щелочным металлом или его соли с щелочноземельным металлом (например, натриевой соли, калиевой соли, кальциевой соли, магниевой соли и т.д.). В частности, термин “амин” в выражении “его соль с амином”, например, в отношении аминовой соли соединения формулы (IV), означает третичный амин формулы NR9R10R11, вторичный амин формулы NHR9R10R или первичный амин формулы NH2R9, где R9, R10 и R11 представляют собой, независимо друг от друга, алкил, арил, циклоалкил или гетероциклил, определенные в настоящей заявке, предпочтительно, алкил или циклоалкил. Термин “амин” представляет собой, например, дифениламин, диизопропиламин, диметиламин, триэтиламин, диизопропилэтиламин, дициклогексиламин, трет-бутиламин, н-бутиламин или циклогексиламин, в частности, трет-бутиламин, н-бутиламин или циклогексиламин, более предпочтительно, н-бутиламин или циклогексиламин.
При использовании в настоящем описании и прилагаемой формуле изобретения формы единственного числа, обозначенные артиклями “a”, “an” и “the”, включают ссылки на множественное число, если из контекста явно не следует иное. Таким образом, например, ссылка на “полипептид” включает более чем один полипептид.
Аналогично, “содержат,” “содержит,” “содержащий” “включают,” “включает” и “включающий” являются взаимозаменяемыми и не предназначены для ограничения.
Необходимо также понимать, что там, где в описаниях различных вариантов воплощения используют термин “содержащий”, специалистам в данной области будет понятно, что в некоторых конкретных случаях вариант воплощения может быть альтернативно описан с использованием выражения “состоящий по существу из” или “состоящий из”.
Следует понимать, что как предшествующее общее описание, включая рисунки, и последующее подробное описание являются иллюстративными и пояснительными и не ограничивают настоящего раскрытия.
Заголовки разделов, используемые в настоящей заявке, представлены исключительно для организационных целей, и не должны быть истолкованы как ограничивающие указанный объект изобретения.
Аббревиатуры, используемые для генетически кодируемых аминокислот, являются обычными и представляют собой следующие:
Когда используют трехбуквенные аббревиатуры, если специально не предшествует "L" или в "D" или ясно из контекста, в котором используют аббревиатуру, аминокислота может быть или в L- или в D-конфигурации относительно α-углерода (Cα). Например, когда “Ala” обозначает аланин без указания конфигурации относительно α-углерода, “D-Ala” и “L-Ala” обозначают D-аланин и L-аланин, соответственно. Когда используют однобуквенные аббревиатуры, заглавные буквы обозначают аминокислоты в L-конфигурации относительно α-углерода, а строчные буквы обозначают аминокислоты в D-конфигурации относительно α-углерода. Например, “A” обозначает L-аланин и “a” обозначает D-аланин. Когда полипептидные последовательности представлены в виде строки из однобуквенных или трехбуквенных сокращений (или их комбинаций), последовательности представлены в направлении от амино (N) к карбокси (C) в соответствии с общепринятым правилом.
Аббревиатуры, используемые для генетически кодирующих нуклеозидов, являются общепринятыми и представляют собой следующие: аденозин (А); гуанозин (G); цитидин (С); тимидин (Т); и уридин (U). Если конкретно не определено, сокращенно указанные нуклеотиды могут представлять собой либо рибонуклеозиды либо 2’-дезоксирибонуклеозиды. Нуклеозиды могут быть указаны либо как рибонуклеозиды или 2’-дезоксирибонуклеозиды на индивидуальной основе или на совокупной основе. Когда последовательности нуклеиновых кислот представлены в виде строки из однобуквенных сокращений, последовательности представлены в направлении от 5’ к 3’ в соответствии с общепринятым правилом, и фосфаты не указаны.
В отношении настоящего изобретения, технические и научные термины, используемые в описаниях в настоящей заявке, будут иметь значения понятные обычному специалисту в данной области, если конкретным образом не определено иное. Соответственно, следующие термины будут иметь следующие значения:
“Белок”, “полипептид” и “пептид” используют взаимозаменяемо в настоящей заявке для обозначения полимера по меньшей мере из двух аминокислот, ковалентно связанных амидной связью, независимо от длины или посттрансляционной модификации (например, гликозилирование, фосфорилирование, липидирование, миристилирование, убиквитинирование и т.д.). Этим определением охватываются D- и L-аминокислоты, и смеси D- и L-аминокислот.
“Полинуклеотид” или “нуклеиновая кислота” относится к двум или нескольким нуклеозидам, которые ковалентно связаны друг с другом. Полинуклеотид может быть полностью состоящим из рибонуклеозидов (т.е., РНК), полностью состоящим из 2’ дезоксирибонуклеозидов (т.е., ДНК) или смеси рибо- и 2’ дезоксирибонуклеозидов. В то время как нуклеозиды, как правило, связаны вместе при помощи стандартных фосфодиэфирных связей, полинуклеотиды могут включать одну или несколько нестандартных связей. Полинуклеотид может быть одноцепочечным или двухцепочечным или может включать и одноцепочечные и двухцепочечные участки. Кроме того, в то время как полинуклеотид, как правило, состоит из встречающихся в природе кодирующих нуклеиновокислотных оснований (т.е., аденин, гуанин, урацил, тимин и цитозин), он может включать одно или несколько модифицированных и/или синтетических нуклеиновокислотных оснований, таких как, например, инозин, ксантин, гипоксантин и т.д. Предпочтительно, такие модифицированные и синтетические нуклеиновокислотыне основания будут кодирующими нуклеиновокислотными основаниями.
“Аминотрансфераза” и “трансаминаза” используются взаимозаменяемо в настоящей заявке в отношении полипептида, обладающего ферментативной способностью к переносу аминогруппы (NH2) от первичного амина к карбонильной группе (C=O) акцепторной молекулы. Трансаминазы, как этот термин используется в настоящей заявке, включают трансаминазу, встречающуюся в природе (дикого типа), а также не встречающиеся в природе генно-инженерные полипептиды.
“Аминоакцептор” и “аминовый акцептор”, “кетосубстрат”, “кето” и “кетон” используются взаимозаменяемо в настоящей заявке в отношении карбонильного (кето или кетонового) соединения, которое принимает аминогруппу от донорного амина. В некоторых вариантах воплощения аминоакцепторы представляют собой молекулы следующей общей формулы,
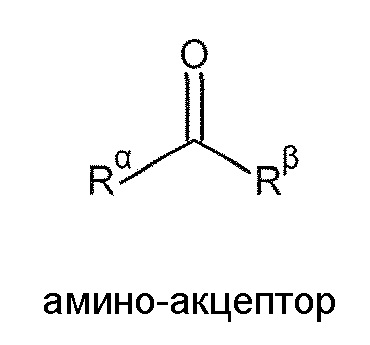 ,
,
в которой каждый из Rα и Rβ, независимо, представляет собой алкил, циклоалкил, гетероциклоалкил, арил или гетероарил, который может быть незамещенным или замещен одной или несколькими ферментативно приемлемыми группами. Rα может быть таким же или отличным от Rβ по структуре или хиральности. В некоторых вариантах воплощения, Rα и Rβ, вместе взятые, могут образовывать кольцо, которое является незамещенным, замещенным или конденсированным с другими кольцами. Аминоакцепторы включают кето-карбоновые кислоты и алканоны (кетоны). Типичные кето-карбоновые кислоты представляют собой α-кето-карбоновые кислоты, такие как глиоксалевая кислота, пировиноградная кислота, щавелевая кислота и подобные, а также соли этих кислот. Аминоакцепторы также включают вещества, которые преобразуются в аминоакцептор посредством других ферментов или клеточных процессов, такие как фумаровая кислота (которая может быть преобразована в щавелевоуксусную кислоту), глюкоза (которая может быть преобразована в пируват), лактат, малеиновая кислота и другие. Аминоакцепторы, которые могут быть использованы, включают, в качестве примера, а не ограничения, 3,4-дигидронафталин-1(2H)-он, 1-фенилбутан-2-он, 3,3-диметилбутан-2-он, октан-2-он, этил 3-оксобутаноат, 4-фенилбутан-2-он, 1-(4-бромфенил)этанон, 2-метил-циклогексанон, 7-метокси-2-тетралон, 1-гидроксибутан-2-он, пировиноградная кислота, ацетофенон, 3’-гидроксиацетофенон, 2-метокси-5-фторацетофенон, левулиновая кислота, 1-фенилпропан-1-он, 1-(4-бромфенил)пропан-1-он, 1-(4-нитрофенил)пропан-1-он, 1-фенилпропан-2-он, 2-оксо-3-метилбутанoвую кислоту, 1-(3-трифторметилфенил)пропан-1-он, гидроксипропанон, метоксиоксипропанон, 1-фенилбутан-1-он, 1-(2,5-диметокси-4-метилфенил)бутан-2-он, 1-(4-гидроксифенил)бутан-3-он, 2-ацетилнафталин, фенилпировиноградную кислоту, 2-кетоглутаровую кислоту и 2-кетоянтарную кислоту, включая и (R) и (S) отдельные изомеры, где это возможно.
“Аминодонор” или “донор амина” относится к аминосоединению, которое является донором аминогруппы для аминоакцептора, становясь, таким образом, карбонилом. В некоторых вариантах воплощения, аминодоноры представляют собой молекулы следующей общей формулы,
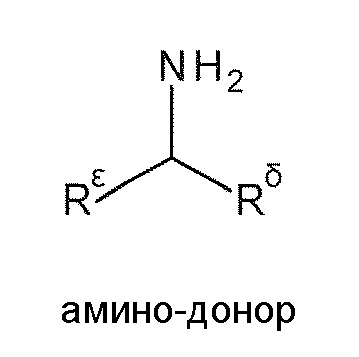
в которой каждый из Rε и Rδ, независимо, представляет собой алкил, циклоалкил, гетероциклоалкил, арил или гетероарил, который является незамещенным или замещен одной или несколькими ферментативно не-ингибирующими группами. Rε может быть таким же или отличным от Rδ по структуре или хиральности. В некоторых вариантах воплощения, Rε и Rδ, вместе взятые, могут образовывать кольцо, которое является незамещенным, замещенным или конденсированным с другими кольцами. Типичные аминодоноры, которые могут быть использованы, включают хиральные и ахиральные аминокислоты, и хиральные и ахиральные амины. Аминодоноры которые могут быть использованы, включают, в качестве примера, а не для ограничения, изопропиламин (также называемый как 2-аминопропан), α-фенэтиламин (также называемый 1-фенилэтанамин) и его энантиомеры (S)-1-фенилэтанамин и (R)-1-фенилэтанамин, 2-амино-4-фенилбутан, глицин, L-глутаминовую кислоту, L-глутамат, глутамат-мононатрий, L-аланин, D-аланин, D,L-аланин, L-аспарагиновую кислоту, L-лизин, D,L-орнитин, β-аланин, таурин, н-октиламин, циклогексиламин, 1,4-бутандиамин (также называемый как путресцин), 1,6-гександиамин, 6-аминокапроновая кислота, 4-аминомасляная кислота, тирамин и бензиламин, 2-аминобутан, 2-амино-1-бутанол, 1-амино-1-фенилэтан, 1-амино-1-(2-метокси-5- фторфенил)этан, 1-амино-1-фенилпропан, 1-амино-1-(4-гидроксифенил)пропан, 1-амино-1-(4-бромфенил)пропан, 1-амино-1-(4-нитрофенил)пропан, 1-фенил-2-аминопропан, 1-(3-трифторметилфенил)-2-аминопропан, 2-аминопропанол, 1-амино-l-фенилбутан, 1-фенил-2-аминобутан, 1-(2,5-диметокси-4-метилфенил)-2-аминобутан, 1-фенил-3-аминобутан, 1-(4-гидроксифенил)-3-аминобутан, 1-амино-2-метилциклопентан, 1-амино-3-метилциклопентан, 1-амино-2-метилциклогексан, 1-амино-1-(2-нафтил)этан, 3-метилциклопентиламин, 2-метилциклопентиламин, 2-этилциклопентиламин, 2-метилциклогексиламин, 3-метилциклогексиламин, 1-аминотетралин, 2-аминотетралин, 2-амино-5-метокситетралин и 1-аминоиндан, включая и (R) и (S) отдельные изомеры, где это возможно, и включая все возможные соли аминов.
“Хиральный амин” относится к аминам общей формулы R1-CH(NH2)- R1 и используется в настоящей заявке в самом широком смысле, включая большое разнообразие алифатических и алициклических соединений различных, и смешанных, функциональных типов, характеризующихся наличием первичной аминогруппы, связанной с вторичным атомом углерода, который, в дополнение к атому водорода, несет либо (i) двухвалентную группу, образующую хиральную циклическую структуру, либо (ii) два заместителя (отличных от водорода), отличающихся друг от друга по структуре или хиральности. Двухвалентные группы, образующие хиральную циклическую структуру, включают, например, 2-метилбутан-1,4-диил, пентан-1,4-диил, гексан-1,4-диил, гексан-1,5-диил, 2-метилпентан-1,5-диил. Два различных заместителя на вторичном атоме углерода (R1 и R2 выше) также могут широко варьироваться и включают алкил, аралкил, арил, галоген, гидрокси, низший алкил, низший алкокси, низший алкилтио, циклоалкил, карбокси, карбалкокси, карбамоил, моно- и ди-(низший алкил) замещенный карбамоил, трифторметил, фенил, нитро, амино, моно- и ди-(низший алкил) замещенный амино, алкилсульфонил, арилсульфонил, алкилкарбоксамидо, арилкарбоксамидо и т.д., а также алкил, аралкил или арил, замещенный вышеуказанными группами.
“Пиридоксал-фосфат,” “PLP,” “пиридоксал-5’-фосфат,” “PYP” и “P5P” используются взаимозаменяемо в настоящей заявке в отношении соединения, которое действует в качестве кофермента в трансаминазных реакциях. В некоторых вариантах воплощения пиридоксалфосфат определен структурой 1-(4'-формил-3'-гидрокси-2'-метил-5'-пиридил)метоксифосфоновой кислоты, CAS-номер [54-47-7]. Пиридоксал-5'-фосфат можно получить in vivo путем фосфорилирования и оксиления пиридоксола (также известного как витамин B6). В реакциях трансаминирования с использованием трансаминазных ферментов, происходит перенос группы амина аминодонора к коферменту с получением побочного кето-продукта, в то время как пиридоксал-5'-фосфат преобразуют в пиридоксаминфосфат. Пиридоксал-5'-фосфат восстанавливают путем взаимодействия с другим кетосоединением (аминоакцептор). Перенос группы амина от пиридоксаминфосфата к аминоакцептору приводит к получению хирального амина и восстановлению кофермента. В некоторых вариантах воплощения пиридоксал-5'-фосфат можно заменить другими членами семейства витамина B6, включая пиридоксин (PN), пиридоксал (PL), пиридоксамин (PM) и их фосфорилированные аналоги; пиридоксинфосфат (PNP) и пиридоксамин фосфат (PMP).
“Кодирующая последовательность” относится к той части нуклеиновой кислоты (например, гену), которая кодирует аминокислотную последовательность белка.
“Природного происхождения” или “дикого типа” относится к форме, обнаруженной в природе. Например, полипептидная или полинуклеотидная последовательность природного происхождения или дикого типа представляет собой последовательность, присутствующую в организме, которую можно выделить из природного источника и которая не была намеренно модифицирована человеком путем манипуляций.
“Рекомбинантный” или “генно-инженерный” или “не-природного происхождения” при использовании в отношении, например, клетки, нуклеиновой кислоты или полипептида, относится к веществу, или к веществу, соответствующему природной или нативной форме этого вещества, которое было модифицировано таким образом, что не могло бы существовать в природе в таком виде, или которое идентично ему, но было получено или имеет происхождение из синтетических веществ и/или манипуляцией с использованием рекомбинантных методов. Неограничивающие примеры включают, среди прочих, рекомбинантные клетки, экспрессирующие гены, которые не обнаружены в природной (не-рекомбинантной) форме клетки или экспрессируют нативные гены, которые в противном случае экспрессируются на другом уровне.
“Процент идентичности последовательностей” и “процент гомологии” используются взаимозаменяемо в настоящей заявке, и относятся к сравнениям между полинуклеотидами и полипептидами, и определяются путем сравнения двух оптимально выровненных последовательностей относительно окна сравнения, где часть полинуклеотидной или полипептидной последовательности в окне сравнения может включать дополнения или делеции (т.е., пробелы) по сравнению с контрольной последовательностью для оптимального выравнивания двух последовательностей. Процент может быть рассчитан путем определения количества положений, в которых идентичные основание нуклеиновой кислоты или аминокислотный остаток встречаются в обеих последовательностях, с получением ряда совпадающих положений, деления числа совпадающих положений на общее число положений в окне сравнения и умножения результата на 100, с получением процента идентичности последовательностей. В качестве альтернативы, процент можно рассчитать путем определения количества положений, в которых либо идентичное основание нуклеиновой кислоты или аминокислотный остаток встречаются в обеих последовательностях, либо основание нуклеиновой кислоты или аминокислотный остаток совпадают с пробелом, с получением ряда совпадающих положений, деления числа совпадающих положений на общее число положений в окне сравнения и умножая результат на 100, с получением процента идентичности последовательностей. Специалистам в данной области техники должно быть понятно, что существует много алгоритмов, доступных для выравнивания двух последовательностей. Оптимальное выравнивание последовательностей для сравнения можно осуществить, например, с использованием алгоритма локальной гомологии Смита и Уотермана, 1981, Adv. Appl. Math. 2: 482, с использованием алгоритма выравнивания для определения гомологии Нидлмана и Вунша, 1970, J. Mol. Biol. 48: 443, при помощи поиска метода подобия Пирсона и Липмана, 1988, Proc. Natl. Acad. Sci. USA 85: 2444, при помощи компьютеризированных реализаций этих алгоритмов (GAP, BESTFIT, FASTA, и TFASTA в пакете программного обеспечения GCG Wisconsin), или при визуальном осмотре (см.главным образом, Current Protocols in Molecular Biology, F. M. Ausubel et al., eds., Current Protocols, a joint venture between Greene Publishing Associates, Inc. и John Wiley & Sons, Inc., (1995 Supplement) (Ausubel)). Примеры алгоритмов, которые можно использовать для определения процента идентичности последовательностей и сходства последовательностей представляют собой BLAST и BLAST 2.0 алгоритмы, которые описаны в Altschul et al., 1990, J. Mol. Biol. 215: 403-410 и Altschul et al., 1977, Nucleic Acids Res. 3389-3402, соответственно. Программное обеспечение для осуществления BLAST анализов является общедоступным через веб-сайт Национального центра биотехнологической информации. Этот алгоритм включает в первую очередь выявление имеющих высокую оценку пар последовательностей (HSPs) путем выявления коротких слов длиной W в справочной последовательности, которые либо совпадают либо удовлетворяют некоторой положительно оцениваемой пороговой величине T при выравнивании со словом той же длины в последовательности из базы данных. T называют оценочным порогом соседнего слова (Altschul et al, выше). Эти исходные соседние слова-попадания действуют как семена для инициирования поисков для определения более длинных HSPs, содержащих их. Слова-попадания затем расширяют в обоих направлениях вдоль каждой последовательности вплоть до увеличения кумулятивной оценки выравнивания. Кумулятивные оценки рассчитывают с использованием, для нуклеотидной последовательности, параметров M (наградное очко для пары совпадающих остатков; всегда >0) и N (штрафное очко для несовпадающих остатков; всегда <0). Для аминокислотных последовательностей, используют оценочную матрицу для рассчета кумулятивной оценки. Расширение слов-попаданий в каждом направлении останавливают, когда: кумулятивная оценка выравнивания снижается на количество X от ее максимально достигаемого значения; кумулятивная оценка приближается к нулю или ниже из-за аккумуляции одного или нескольких отрицательно оцениваемых совмещений остатков; или достигается конец любой из последовательностей. Параметры BLAST алгоритма W, T и X определяют чувствительность и скорость выравнивания. BLASTN программа (для нуклеотидной последовательности) использует в качестве значений по умолчанию длину слова (W) 11, ожидание (E) 10, M=5, N=-4, и сравнение обеих цепочек. Для аминокислотной последовательности, BLASTP программа использует в качестве значений по умолчанию длину слова (W) 3, ожидание (E) 10 и BLOSUM62 оценочную матрицу (см. Henikoff and Henikoff, 1989, Proc Natl Acad Sci USA 89: 10915). В качестве примера определения совмещения последовательностей и % идентичности последовательностей, можно использовать BESTFIT или GAP программы в пакете программ GCG Wisconsin Software package (Accelrys, Madison WI), с использованием указанных параметров, принимающих значения по умолчанию.
“Эталонная последовательность” относится к определенной последовательности, используемой в качестве основы для сравнения последовательностей. Эталонная последовательность может быть подмножеством большей последовательности, например, сегментом полноразмерной последовательности гена или полипептида. Как правило, эталонная последовательность составляет по меньшей мере 20 нуклеотидных или аминокислотных остатков в длину, по меньшей мере 25 остатков в длину, по меньшей мере 50 остатков в длину, или полную длину нуклеиновой кислоты или полипептида. Поскольку два полинуклеотида или полипептида могут каждый (1) включать последовательность (т.е., часть полной последовательности), которая имеет схожесть между двумя последовательностями, и (2) могут дополнительно включать последовательность, которая имеет расхождение между двумя последовательностями, сравнения последовательностей между двумя (или более) полинуклеотидами или полипептидом, как правило, осуществляют путем сравнения последовательностей двух полинуклеотидов или полипептидов при помощи "окна сравнения" для выявления и сравнения локальных областей сходства последовательностей. В некоторых вариантах воплощения, “эталонная последовательность” может быть основана на первичной аминокислотной последовательности, где эталонная последовательность представляет собой последовательность, которая может иметь одно или несколько изменений в первичной последовательности. Например, “эталонная последовательность, основанная на SEQ ID NO: 4, которая содержит по остатку, соответствующему X14, валин или X14V, относится к эталонной последовательности, в которой соответствующий остаток по X14 в SEQ ID NO: 4, который представляет собой тирозин, был заменен на валин.
“Окно сравнения” относится к концептуальному сегменту, состоящему по меньшей мере из примерно 20 смежных нуклеотидных положений или аминокислотных остатков, где последовательность можно сравнить с эталонной последовательностью из по меньшей мере 20 смежных нуклеотидов или аминокислот, и где часть последовательности в окне сравнения может включать вставки или делеции (т.е. пробелы), составляющие 20 процентов или меньше по сравнению с эталонной последовательностью (которая не включает вставки или делеции), для оптимального выравнивания двух последовательностей. Окно сравнения может быть длиннее, чем 20 смежных остатков, и включает, опционально 30, 40, 50, 100 или более длинные окна.
“Существенная идентичность” относится к полинуклеотидной или полипептидной последовательности, которая имеет по меньшей мере 80 процентов идентичности последовательности, по меньшей мере 85 процентов идентичности последовательности, и 89-95 процентов идентичности последовательности, чаще всего, по меньшей мере 99 процентов идентичности последовательности по сравнению с эталонной последовательностью через окно сравнения, включающее по меньшей мере 20 положений остатков, часто через окно сравнения, включающее по меньшей мере 30-50 остатков, где процент идентичности последовательностей рассчитывают путем сравнения эталонной последовательности с последовательностью, которая включает делеции или вставки, которые в целом составляют 20 процентов или менее от эталонной последовательности в окне сравнения. В конкретных вариантах воплощения, относящихся к полипептидам, термин “существенная идентичность” означает, что две полипептидные последовательности, при оптимальном выравнивании, таком, как при использовании программ GAP или BESTFIT с использованием количества гэпов по умолчанию, имеют идентичность последовательностей по меньшей мере 80 процентов, предпочтительно имеют идентичность последовательностей по меньшей мере 89 процентов, идентичность последовательностей по меньшей мере 95 процентов или более (например, идентичность последовательностей 99 процентов). Предпочтительно, положения остатков, которые не являются идентичными, отличаются консервативными аминокислотными заменами.
“Соответствующий чему-либо”, “со ссылкой на” или “по отношению к”, при использовании в контексте нумерации данной аминокислотной или полинуклеотидной последовательности, относится к нумерации остатков определенной эталонной последовательности, когда данную аминокислотную или полинуклеотидную последовательность сравнивают с эталонной последовательностью. Другими словами, номер остатка или положение остатка данного полимера обозначено относительно эталонной последовательности, а не фактического численного положения остатка в данной аминокислотной или полинуклеотидной последовательности. Например, данная аминокислотная последовательность, такая как у генно-инженерной трансаминазы, может быть выровнена с эталонной последовательностью путем введения гэпов для оптимизации совпадений остатков между двумя последовательностями. В этих случаях, хотя гэпы присутствуют, нумерация остатка в данной аминокислотной или полинуклеотидной последовательности сделана относительно эталонной последовательности, с которой ее сравнивали.
“Аминокислотные несовпадения” или “несовпадения остатков” относится к изменению аминокислотного остатка в положении полипептидной последовательности относительно аминокислотного остатка в соответствующем положении в эталонной последовательности. Положения аминокислотных несовпадений, как правило, указаны в настоящей заявке как “Xn,” где n относится к соответствующему положению в эталонной последовательности, на которой основывается несовпадение остатков. Например, “несовпадение остатков в положении X14 по сравнению с SEQ ID NO: 4” относится к изменению аминокислотного остатка в положении полипептида, соответствующем положению 14 в SEQ ID NO: 4. Таким образом, если описываемый полипептид в SEQ ID NO: 4 содержит тирозин в положении 14, тогда “несовпадение остатков в положении X14 по сравнению с SEQ ID NO: 4” представляет собой аминокислотную замену любого остатка, отличного от тирозина в положении полипептида, соответствующем положению 14 в SEQ ID NO: 4. В большинстве случаев в настоящей заявке, конкретное несовпадение аминокислотных остатков в положении указывается как “XnY”, где “Xn” обозначает соответствующее положение, как описано выше, и “Y” представляет собой однобуквенный идентификатор аминокислоты, присутствующей в генно-инженерном полипептиде (т.е. остаток, отличный от того, который присутствует в эталонном полипептиде). В некоторых вариантах воплощения, более чем одна аминокислота может присутствовать в указанном положении остатка, альтернативные аминокислоты могут быть перечислены в виде XnY/Z, где Y и Z представляют собой альтернативные аминокислотные остатки. В некоторых случаях (например, в Таблице 2A и 2B), настоящее изобретение также обеспечивает специфические аминокислотные различия, указанные условными обозначениями “AnB”, где A представляет собой однобуквенный идентификатор остатка в эталонной последовательности, “n” представляет собой номер положения остатка в эталонной последовательности, и B представляет собой однобуквенный идентификатор замены остатка в последовательности генно-инженерного полипептида. Кроме того, в некоторых случаях, полипептид по настоящему изобретению может включать одно или несколько несовпадений аминокислотных остатков относительно эталонной последовательности, что указывается путем перечисления конкретных положений, где были внесены изменения по отношению к эталонной последовательности. Настоящее изобретение включает генно-инженерные полипептидные последовательности, содержащие одно или несколько аминокислотных несовпадений, которые включают либо консервативные либо не-консервативные аминокислотные замены, или и те и другие.
“Консервативные аминокислотные замены” относятся к заменам остатка другим остатком, имеющим подобную боковую цепь, и, таким образом, как правило, включают замены аминокислот в полипептиде аминокислотами в рамках одного и того же или подобного определенного класса аминокислот. В качестве примера, а не для ограничения, аминокислота с алифатической боковой цепью может быть заменена другой алифатической аминокислотой, например, аланином, валином, лейцином и изолейцином; аминокислота с гидроксильной боковой цепью заменена другой аминокислотой с гидроксильной боковой цепью, например, серином и треонином; аминокислота, имеющая ароматические боковые цепи, заменена другой аминокислотой, имеющей ароматическую боковую цепь, например, фенилаланином, тирозином, триптофаном и гистидином; аминокислота с основной боковой цепью заменена другой аминокислотой с основной боковой цепью, например, лизином и аргинином; аминокислота с кислотной боковой цепью заменена другой аминокислотой с кислотной боковой цепью, например, аспарагиновой кислотой или глутаминовой кислотой; и гидрофобная или гидрофильная аминокислота заменена на другую гидрофобную или гидрофильную аминокислоту, соответственно. Примеры консервативных замен представлены в Таблице 1 ниже.
Другой не-полярный (A, L, V, I, G, M)
“Не-консервативная замена” относится к замене аминокислоты в полипептиде аминокислотой с существенно отличающимися свойствами боковой цепи. Не-консервативные замены могут использовать аминокислоты между, а не внутри, определенными группами и влияют на (a) структуру пептидного скелета в области замены (например, пролин вместо глицина), (b) заряд или гидрофобность, или (c) основную часть боковой цепи. В качестве примера, а не для ограничения, примером не-консервативной замены может быть имеющая кислотную природу аминокислота, замещенная основной или алифатической аминокислотой; ароматическая аминокислота, замещенная малой аминокислотой; и гидрофильная аминокислота, замещенная гидрофобной аминокислотой.
“Делеция” относится к модификации для получения полипептида путем удаления одной или нескольких аминокислот из эталонного полипептида. Делеции могут включать удаление 1 или более аминокислот, 2 или более аминокислот, 5 или более аминокислот, 10 или более аминокислот, 15 или более аминокислот или 20 или более аминокислот, вплоть до 10% от общего количества аминокислот или до 20% от общего количества аминокислот, составляющих эталонный фермент, сохраняя ферментативную активность и/или сохраняя улучшенные свойства генно-инженерного трансаминазного фермента. Делеции могут быть направлены на внутренние части и/или концевые части полипептида. В различных вариантах воплощения, делеция может включать непрерывный сегмент или может быть прерывистой.
“Вставка” относится к модификации полипептида путем добавления одной или нескольких аминокислот из эталонного полипептида. В некоторых вариантах воплощения, улучшенные генно-инженерные трансаминазные ферменты включают вставки одной или нескольких аминокислот в трансаминазный полипептид природного происхождения, а также вставки одной или нескольких аминокислот в другие улучшенные трансаминазные полипептиды. Вставки могут быть во внутренних частях полипептида или по карбокси- или амино- концу. Вставки, как этот термин используется в настоящей заявке, включают гибридные белки, как известно в данной области техники. Вставка может представлять собой последовательный сегмент из аминокислот или разделенный одной или несколькими аминокислотами в полипептиде природного происхождения.
“Фрагмент”, как этот термин используется в настоящей заявке, относится к полипептиду, который содержит амино-концевую и/или карбокси-концевую делецию, но где остальная аминокислотная последовательность идентична соответствующим положениям в последовательности. Фрагменты могут составлять в длину по меньшей мере 14 аминокислот, по меньшей мере 20 аминокислот, по меньшей мере 50 аминокислот или больше, и до 70%, 80%, 90%, 95%, 98% и 99% от полноразмерного трансаминазного полипептида, например, полипептида SEQ ID NO: 2 или генно-инженерной трансаминазы SEQ ID NO: 34.
“Выделенный полипептид” относится к полипептиду, который, по существу отделен от других загрязняющих веществ, которые окружают его в естественных условиях, например, белков, липидов и полинуклеотидов. Термин охватывает полипептиды, которые были выделены или очищены из их природного окружения или системы экспрессии (например, клетка-хозяин или синтез in vitro). Улучшенные трансаминазные ферменты могут присутствовать внутри клетки, присутствовать в клеточной среде или могут быть получены в различных формах, таких как лизаты или выделенные препараты. Таким образом, в некоторых вариантах воплощения улучшенный трансаминазный фермент может представлять собой выделенный полипептид.
“По существу чистый полипептид” относится к композиции, в которой полипептид является преобладающим присутствующим видом (т.е. в расчете на молярную или массовую долю это более избыточный по сравнению с любыми другими отдельными макромолекулярными видами в композиции) и представляет собой по существу очищенную композицию, когда целевой вид включает по меньшей мере около 50 процентов присутствующих макромолекулярных видов, в молярном или массовом выражении. Как правило, по существу чистая трансаминазная композиция будет составлять около 60 % или более, около 70% или более, около 80% или более, около 90% или более, около 95% или более и около 98% или более от всех макромолекулярных видов, в молярном или массовом выражении, присутствующих в композиции. В некоторых вариантах воплощения целевой вид очищают по существу до гомогенного состояния (т.е., загрязняющие виды не могут быть обнаружены в композиции обычными способами детекции), где композиция состоит по существу из одного вида макромолекул. Молекулы растворителя, малые молекулы (<500 Дальтон) и элементарные ионы не считаются макромолекулярными видами. В некоторых вариантах воплощения, выделенный улучшенный трансаминазный полипептид представляет собой по существу чистую полипептидную композицию.
“Стереоселективность” относится к преимущественному образованию одного стереоизомера по сравнению с другим в химической или ферментативной реакции. Стереоселективность может быть частичной, когда образование одного стереоизомера является предпочтительным по сравнению с другим, или она может быть полной, когда образуется только один стереоизомер. Когда стереоизомеры представляют собой энантиомеры, стереоселективность указывают как энантиоселективность, доля (типично указывают как процент) одного энантиомера в общем количестве обоих. В данной области техники обычно альтернативно указывают (как правило, в виде процента) как энантиомерный избыток (э.и.), рассчитанный на основании этого в соответствии с формулой [основной энантиомер − минорный энантиомер]/[основной энантиомер + минорный энантиомер]. Когда стереоизомеры представляют собой диастереоизомеры, стереоселективность указывают как диастереоселективность, доля (типично указывают как процент) одного диастереомера в смеси двух диастереомеров, обычно альтернативно указывают как диастереомерный избыток (д.и.). Энантиомерный избыток и диастереомерный избыток представляют собой виды стереомерного избытка.
“Высоко стереоселективный” относится к химической или ферментативной реакции, в которой возможно преобразование субстрата, например, Соединения (IA), в его соответствующий хиральный аминный продукт, например, Соединение (IIA), с стереомерным избытком по меньшей мере около 85%.
“Улучшенное ферментное свойство” относится к трансаминазному полипептиду, который демонстрирует улучшение любого ферментного свойства по сравнению с эталонной трансаминазой. Для генно-инженерных трансаминазных полипептидов, описанных в настоящей заявке, сравнение, как правило, осуществляют с трансаминазным ферментом дикого типа, хотя в некоторых вариантах воплощения, эталонная трансаминаза может быть другой улучшенной генно-инженерной трансаминазой. Ферментные свойства, улучшение которых является желательным, включают, но не ограничиваются этим, ферментативную активность (которая может быть выражена как процент конверсии субстрата), термостабильность, стабильность в растворителе, профиль рН активности, требования к кофакторам, стойкость к действию ингибиторов (например, ингибирование субстратом или продуктом), стереоспецифичность и стереоселективность (включая энантиоселективность).
“Повышенная ферментативная активность” относится к улучшенному свойству генно-инженерных трансаминазных полипептидов, которое может быть представлено как увеличение удельной активности (например, полученный продукт/время/масса белка) или как увеличение процента конверсии субстрата в продукт (например, процент конверсии исходного количества субстрата в продукт в течение определенного периода времени с использованием определенного количества трансаминазы) по сравнению с эталонным трансаминазным ферментом. Примеры способов для определения ферментной активности представлены в Примерах. Можно влиять на любое свойство, относящееся к ферментной активности, включая классические ферментные свойства Km, Vmax или kcat, изменения которых могут привести к повышенной ферментативной активности. Ферментная активность может быть улучшена до уровня примерно в 1,2 раз выше ферментативной активности соответствующего трансаминазного фермента дикого типа, вплоть до уровня в 2 раза, 5 раз, 10 раз, 20 раз, 25 раз, 50 раз, 75 раз, 100 раз или более выше по сравнению с трансаминазой природного происхождения или другой генно-инженерной трансаминазой, из которой были получены трансаминазные полипептиды. Трансаминазная активность может быть измерена при помощи любого стандартного анализа, например, путем мониторинга изменений спектрофотометрических свойств реагентов или продуктов. В некоторых вариантах воплощения, количество полученных продуктов может быть измерено при помощи разделения методом высокоэффективной жидкостной хроматографии (ВЭЖХ), в сочетании с УФ-поглощением или люминесцентной детекцией после дериватизации, например, с использованием o-фтальдиальдегида (OPA). Сравнения ферментных активностей осуществляют с использованием определенного способа получения фермента, определенного анализа в определенных условиях, и одного или более определенных субстратов, как подробно описано в настоящей заявке далее. Как правило, когда сравнивают лизаты, определяют количество клеток и количество анализируемого белка, а также используют идентичные системы экспрессии и идентичные клетки хозяина, чтобы свести к минимуму изменения в количестве фермента, продуцируемого клетками хозяина и присутствующего в лизатах.
“Конверсия” относится к ферментативному преобразованию субстрата(субстратов) в соответствующий продукт(продукты). “Процент конверсии” относится к проценту субстрата, который преобразуется в продукт в течение определенного периода времени при определенных условиях. Таким образом, “ферментативная активность” или “активность” трансаминазного полипептида может быть выражена как “процент конверсии” субстрата в продукт.
“Термостабильный” относится к трансаминазному полипептиду, который поддерживает подобную активность (более чем 60%-80%, например) после воздействия высоких температур (например, 40-80°C) в течение периода времени (например, 0,5-24 часа), по сравнению с ферментом дикого типа.
“Стабильный к растворителю” относится к трансаминазному полипептиду, который поддерживает подобную активность (более чем, например, 60%-80%) после воздействия различных концентраций (например, 5-99%) растворителя (этанол, изопропиловый спирт, диметилсульфоксид (DMSO), тетрагидрофуран, 2-метилтетрагидрофуран, ацетон, толуол, бутилацетат, метил трет-бутиловый эфир и т.д.) в течение периода времени (например, 0,5-24 часа), по сравнению с ферментом дикого типа.
“Термо- и стабильный к растворителю” относится к трансаминазному полипептиду, который является и термостабильным и стабильным к растворителю.
“Жесткая гибридизация” используется в настоящей заявке по отношению к условиям, при которых нуклеиновокислотные гибриды являются стабильными. Как известно специалистам в данной области техники, стабильность гибридов отражается в температуре плавления (Tm) гибридов. В общем, стабильность гибрида является функцией ионной силы, температуры, содержания G/C и присутствия хаотропных агентов. Значения Tm для полинуклеотидов можно рассчитать с использованием известных способов для прогнозирования температуры плавления (см., например, Baldino et al., Methods Enzymology 168: 761-777; Bolton et al., 1962, Proc. Natl. Acad. Sci. USA 48: 1390; Bresslauer et al., 1986, Proc. Natl. Acad. Sci USA 83: 8893-8897; Freier et al., 1986, Proc. Natl. Acad. Sci USA 83: 9373-9377; Kierzek et al., Biochemistry 25: 7840-7846; Rychlik et al., 1990, Nucleic Acids Res 18: 6409-6412 (erratum, 1991, Nucleic Acids Res 19: 698); Sambrook et al., supra); Suggs et al., 1981, в Developmental Biology с использованием Purified Genes (Brown et al., eds.), pp. 683-693, Academic Press; and Wetmur, 1991, Crit Rev Biochem Mol Biol 26: 227-259. Все публикации включены в настоящую заявку посредством ссылки). В некоторых вариантах воплощения, полинуклеотид кодирует полипептид, раскрытый в настоящей заявке, и гибридизируется при определенных условиях, таких как умеренно жесткие или очень жесткие условия, в комплемент последовательности, кодирующей генно-инженерный трансаминазный фермент по настоящему изобретению.
“Жесткость гибридизации” относится к условиям гибридизации, таким как условия промывки, при гибридизации нуклеиновых кислот. Как правило, реакции гибридизации осуществляют в условиях низкой жесткости, с последующими промывками различной, но более сильной жесткости. Термин “умеренно жесткая гибридизация” относится к условиям, которые позволяют целевой ДНК связываться с комплементарной нуклеиновой кислотой, которая имеет около 60% идентичности, предпочтительно, около 75% идентичности, около 85% идентичности с целевой ДНК, с более чем около 90% идентичностью с целевым полинуклеотидом. Примеры умеренно жестких условий включают условия, эквивалентные гибридизации в 50% формамиде, 5× растворе Денхарта, 5×SSPE, 0,2% SDS при 42°C, с последующей промывкой в 0,2×SSPE, 0,2% SDS, при 42°C. “Высоко жесткая гибридизация” относится, как правило, к условиям, которые представляют собой около 10°С или меньше от температуры термического плавления Tm, как определено для состояния раствора для определенной полинуклеотидной последовательности. В некоторых вариантах воплощения, высокая жесткость гибридизации относится к условиям, которые позволяют осуществить гибридизацию только тех нуклеиновокислотных последовательностей, которые образуют стабильные гибриды в 0,018M растворе NaCl при 65°C (т.е., если гибрид не является стабильным в 0,018M растворе NaCl при 65°C, он не будет стабильным в условиях высокой жесткости, как это предусмотрено в настоящей заявке). Условия высокой жесткости могут быть обеспечены, например, путем гибридизации в условиях, эквивалентных 50% формамида, 5Х раствор Денхарта, 5ХSSPE, 0,2% SDS при 42°C, с последующей промывкой в 0,1ХSSPE и 0,1% SDS при 65°C. Другим условием высокой жесткости является гибридизация в условиях, эквивалентных гибридизации в 5XSSC, содержащем 0,1% (масс/об) SDS при 65°C и промывке в 0,1ХSSC, содержащем 0,1% SDS при 65°C. Другие условия гибридизации высокой жесткости, а также условия умеренной жесткости, описаны в ссылках, приведенных ранее.
“Гетерологичный” полинуклеотид относится к любому полинуклеотиду, который вводят в клетку хозяина лабораторными методами, и включает полинуклеотиды, которые выделяют из клетки хозяина, подвергают лабораторным манипуляциям и затем снова вводят в клетку хозяина.
“Кодон-оптимизированный” относится к изменениям в кодонах полинуклеотида, кодирующего белок, на те, уоторые предпочтительно используются в конкретном организме, так чтобы кодируемый белок эффективно экспрессировался в организме, представляющем интерес. Хотя генетический код вырождается, что выражается в том, что большинство аминокислот представлены несколькими кодонами, называемыми “синонимами” или “синонимичными” кодонами, хорошо известно, что используемость кодонов в конкретных организмах является неслучайной и смещается в направлении конкретных кодоновых триплетов. Это смещение в используемости кодонов может быть выше при ссылке на определенный ген, гены, имеющие общую функцию или наследственное происхождение, высоко экспрессирующиеся белки против имеющих низкое число копий белков и кодирующие области агрегированных белков генома организма. В некоторых вариантах воплощения полинуклеотиды, кодирующие трансаминазные ферменты, могут быть кодон-оптимизированными для оптимального продуцирования из организма хозяина, выбранного для экспрессии.
“Предпочтительные, оптимальные кодоны с высоким смещением используемости кодонов” относится взаимозаменяемо к кодонам, которые используются с большей частотой в кодирующих областях белков, по сравнению с другими кодонами, которые кодируют ту же самую аминокислоту. Предпочтительные кодоны можно определить в отношении используемости кодонов в отдельном гене, набора генов, имеющих общую функцию или происхождение, высоко экспрессирующихся генов, частоты кодонов в кодирующих областях агрегированных белков целого организма, частоты кодонов в кодирующих областях агрегированных белков родственных организмов, или сочетания вышеперечисленного. Кодоны, частота которых увеличивается с уровнем генной экспрессии, типично являются оптимальными кодонами для экспрессии. Известны различные способы для определения частоты кодонов (например, используемость кодонов, относительная используемость синонимичных кодонов) и предпочтительности кодонов в конкретных организмах, включая многомерный анализ, например, с использованием кластерного анализа или анализа соответствия, и эффективного количества кодонов, используемых в гене (см. GCG CodonPreference Computer Group Wisconsin Package; CodonW, John Peden, University of Nottingham; McInerney, J. O, 1998, Bioinformatics 14: 372-73; Stenico et al., 1994, Nucleic acids Res. 222437-46; Wright, F., 1990, Gene 87: 23-29). Таблицы используемости кодонов доступны для все большего числа организмов (см., например, Wada et al., 1992, Nucleic acids Res. 20: 2111-2118; Nakamura et al., 2000, Nucl. Acids Res. 28: 292; Duret, et al., supra; Henaut and Danchin, “Escherichia coli and Salmonella,” 1996, Neidhardt, et al. Eds., ASM Press, Washington D.C., p. 2047-2066. Источник данных для получения используемости кодонов может опираться на любую доступную нуклеотидную последовательность, способную кодировать белок. Эти наборы данных включают последовательности нуклеиновых кислот, действительно известные как кодирующие экспрессируемые белки (например, полные белок-кодирующие последовательности-CDS), экспрессируемые метки последовательностей (ESTS) или прогнозируемые кодирующие области геномных последовательностей (см., например, Mount, D., Bioinformatics: Sequence and Genome Analysis, Chapter 8, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 2001; Uberbacher, E. C., 1996, Methods Enzymol. 266: 259-281; Tiwari et al., 1997, Comput. Appl. Biosci. 13: 263-270).
“Контрольная последовательность” определяется в настоящей заявке как включающая все компоненты, которые являются необходимыми или предпочтительными для экспрессии полинуклеотида и/или полипептида по настоящему изобретению. Каждая контрольная последовательность может быть нативной или чужеродной для нуклеиновокислотной последовательности, кодирующей полипептид. Такие контрольные последовательности включают, но не ограничиваются этим, лидерную последовательность, последовательность полиаденилирования, пропептидную последовательность, промотор, сигнальную пептидную последовательность и терминатор транскрипции. Как минимум, контрольные последовательности включают промотор и транскрипционные и трансляционные стоп сигналы. Контрольные последовательности могут быть обеспечены линкерами в целях введения специфических сайтов рестрикции, способствующих лигированию контрольных последовательностей с кодирующей областью нуклеиновокислотной последовательности, кодирующей полипептид.
“Функционально связанный” определяется в настоящей заявке как конфигурация, в которой контрольная последовательность соответствующим образом размещена (т.е., в функциональной взаимосвязи) в положении по отношению к полинуклеотиду, представляющему интерес, таким образом, чтобы контрольная последовательность направляла или регулировала экспрессию полинуклеотида и/или полипептида, представляющего интерес.
“Промоторная последовательность” относится к нуклеиновокислотной последовательности, которая распознается клеткой хозяина для экспрессии полинуклеотида, представляющего интерес, такой как кодирующая последовательность. Промоторная последовательность содержит транскрипционные контрольные последовательности, которые опосредуют экспрессию полинуклеотида, представляющего интерес. Промотор может представлять собой любую нуклеиновокислотную последовательность, которая демонстрирует транскрипционную активность в выбранной клетке хозяина, включая мутантный, усеченный и гибридный промоторы, и может быть получен из генов, кодирующих внеклеточные или внутриклеточные полипептиды, гомологичные или гетерологичные к клетке хозяина.
“Подходящие реакционные условия” относятся к таким условиям в биокаталитическом реакционном растворе (например, пределы нагрузки фермента, нагрузки субстрата, нагрузки кофактора, температура, pH, буферы, со-растворители и т.д.), в которых трансаминазный полипептид по настоящему изобретению способен к преобразованию соединения субстрата в соединение, представляющее собой продукт (например, преобразование Соединения (IA) в Соединение (IIA)). Примеры “подходящих реакционных условий” представлены в настоящем изобретении и проиллюстрированы примерами.
“Нагрузка”, такая как “нагрузка соединения” или “нагрузка фермента ” или “нагрузка кофактора” относится к концентрации или количеству компонента в реакционной смеси в начале реакции.
“Субстрат”, в контексте биокатализатор-опосредованного способа, относится к соединению или молекуле, на которые оказывает действие биокатализатор. Например, примером субстрата для трансаминазного биокатализатора в способе, раскрытом в настоящей заявке, является соединение (IA).
“Продукт”, в контексте биокатализатор-опосредованного способа, относится к соединению или молекуле, которые образуются в результате действия биокатализатора. Например, примером продукта для трансаминазного биокатализатора в способе, раскрытом в настоящей заявке, является соединение (IIA).
Настоящее изобретение обеспечивает способы использования полипептидов, обладающих трансаминазной активностью, для синтеза (S)-1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амина с энантиомерным избытком (R)-1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амина. Когда описание относится к полипептидам, должно быть понятно, что оно также описывает полинуклеотиды, кодирующие полипептиды.
Аминотрансферазы, также известные как трансаминазы, катализируют перенос аминогруппы от первичного амина амино-донорного субстрата к карбонильной группе (например, кето или альдегидная группа) амино-акцепторной молекулы. Аминотрансферазы были идентифицированы из различных организмов, таких как Alcaligenes denitrificans, Bordetella bronchiseptica, Bordetella parapertussis, Brucella melitensis, Burkholderia malle, Burkholderia pseudomallei, Chromobacterium violaceum, Oceanicola granulosus HTCC2516, Oceanobacter sp. RED65, Oceanospirillum sp. MED92, Pseudomonas putida, Ralstonia solanacearum, Rhizobium meliloti, Rhizobium sp. (штамм NGR234), Vibrio fluvialis, Bacillus thuringensis, и Klebsiella pneumoniae (Shin et al., 2001, Biosci. Biotechnol, Biochem. 65: 1782-1788).
Трансаминазы являются полезными для хирального разделения рацемических аминов, используя способность трансаминаз осуществлять реакцию стереоспецифическим образом, т.е. путем предпочтительного преобразования одного энантиомера в соответствующий кетон, с получением, таким образом, смеси, обогащенной другим энантиомером (см. например, Koselewski et al., 2009, Org Lett. 11(21): 4810-2). Стереоселективность трансаминаз при преобразовании кетона в соответствующий амин также делает эти ферменты полезными для асимметричного синтеза оптически чистых аминов из соответствующих кето соединений (см. например, Höhne et al., “Biocatalytic Routes to Optically Active Amins,” Chem Cat Chem 1(1): 42-51; Zua and Hua, 2009, Biotechnol J. 4(10): 1420-31).
ω-Трансаминаза из Vibrio fluvialis ω-VfT) демонстрирует высокую энантиоселективность в отношении (S)-энантиомера хиральных аминов и обладает характерной субстрат-специфичностью в отношении хиральных ароматических аминов (Shin and Kim, 2001, J. Org. Chem. 67: 2848-2853). Высокую энантиоселективность ω-VfT используют для хирального разделения аминов (H. Yun, B.-K. Cho, B.-G. Kim, Biotechnol. Bioeng. 2004, 87, 772-778; J.-S. Shin, B.-G. Kim, Biotechnol. Bioeng. 1997, 55, 348-358; M. Hçhne, K. Robins, U. T. Bornscheuer, Adv. Synth. Catal. 2008, 350, 802-807). Фермент также используют в асимметричном синтезе оптически чистых аминов с использованием прохирального кетонового субстрата. Однако ограничением асимметричного синтеза является неблагоприятная равновесная обратная реакция (Shin and Kim, 1999, Biotechnol. Bioeng. 65, 206-211), ингибирование ω-VfT фермента аминовым продуктом (Shin et al., 2001, Biotechnol Bioeng 73: 179-187; Yun and Kim, 2008, Biosci. Biotechnol. Biochem. 72(11): 3030-3033); низкая активность на амино акцепторах, имеющих большие боковые цепи, такие как ароматические группы (Shin and Kim, 2002, J. Org. Chem. 67: 2848-2853); и низкая ферментная стабильность (Yun and Kim, supra).
Генно-инженерные трансаминазы, происходящие из трансаминазы Vibrio fluvialis, имеющие повышенную резистентность к алифатическим кетонам, описаны в Yun et al., 2005, Appl Environ Micriobiol., 71(8): 4220-4224), тогда как ω-VfTs с расширенной специфичностью в отношении амино-донорного субстрата описаны в Cho et al., 2008, Biotechnol Bioeng. 99(2): 275-84. Патентные публикации WO2010081053 и US20100209981, включенные в настоящую заявку посредством ссылки, описывают генно-инженерные ω-VfTs, имеющие повышенную стойкость к температуре и/или органическому растворителю и ферментативную активность в отношении структурно различных амино-акцепторных молекул.
Настоящее изобретение относится к способам применения генно-инженерных трансаминазных полипептидов, происходящих из V. fluvialis, которые эффективно опосредуют преобразование 1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-она в продукт, который представляет собой соединение (S)-1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амина, с энантиомерным избытком. Важно подчеркнуть, что, настоящее раскрытие идентифицирует положения аминокислотных остатков и соответствующие мутации в трансаминазном полипептиде, которые увеличивают ферментативную активность, энантиоселективность, стабильность и стойкость к ингибированию продуктом при преобразовании 1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-она в являющееся продуктом соединение (S)-1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амина.
Соответственно, в одном аспекте, настоящее изобретение относится к способам применения полипептидов, которые способны к преобразованию субстрата, т.е. соединения (IA) 1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-она в продукт, т.е. соединение (IIA) (S)-1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амин,
Схема 1
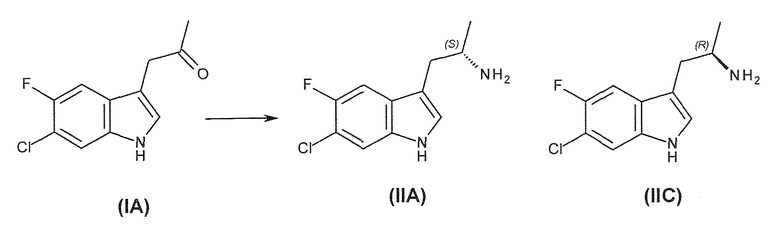
в присутствии амино донора, где (S)-1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амин получают с энантиомерным избытком соединения (IIC), (R)-1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амина.
В некоторых вариантах воплощения, полипептиды, используемые в способах, представляют собой трансаминазы не-природного происхождения, специально разработанные для получения улучшенных свойств по сравнению с дикого типа V. fluvialis полипептидом SEQ ID NO: 2 или другим генно-инженерным полипептидом, например, SEQ ID NO: 4. Эти генно-инженерные трансаминазные полипептиды, предназначенные для эффективного преобразования 1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-она в (S)-1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амин, имеют одно или более различий в остатках по сравнению с аминокислотной последовательностью SEQ ID NO: 2 или эталонным генно-инженерным трансаминазным полипептидом, таким как эталонный полипептид SEQ ID NO: 4. Различия, касающиеся остатков, связаны с усилениями ферментных свойств, включая ферментативную активность, ферментную стабильность и резистентность к ингибированию аминовым продуктом.
В некоторых вариантах воплощения, генно-инженерные трансаминазные полипептиды, используемые в настоящем раскрытии, демонстрируют повышенную активность в преобразовании субстрата 1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-она в продукт (S)-1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амин с энантиомерным избытком в течение определеного времени с таким же количеством фермента по сравнению с дикого типа или эталонным генно-инженерным ферментом. В некоторых вариантах воплощения, генно-инженерный трансаминазный полипептид имеет активность, выше по меньшей мере примерно в 1,2 раза, 1,5 раз, 2 раза, 3 раза, 4 раза, 5 раз, 10 раз, 20 раз, 30 раз, 40 раз или 50 раз или более, по сравнению с полипептидом, представленным SEQ ID NO: 4, в подходящих реакционных условиях.
В некоторых вариантах воплощения, генно-инженерные трансаминазные полипептиды, используемые в настоящем раскрытии, имеют повышенную стойкость к температуре и/или растворителям, используемым в реакции преобразования, по сравнению с дикого типа или эталонным генно-инженерным ферментом. В некоторых вариантах воплощения, генно-инженерный трансаминазный полипептид имеет стабильность, выше по меньшей мере в 1,2 раза, 1,5 раз, 2 раза, 3 раза, 4 раза, 5 раз, 10 раз или более, по сравнению с полипептидом SEQ ID NO: 4 в подходящих реакционных условиях.
В некоторых вариантах воплощения генно-инженерные трансаминазные полипептиды, используемые в настоящем раскрытии, имеют повышенную стойкость или резистентность к аминовому продукту (S)-1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амину по сравнению с дикого типа или эталонным генно-инженерным ферментом. В некоторых вариантах воплощения генно-инженерный трансаминазный полипептид имеет по меньшей мере в 1,2 раза, 1,5 раз, 2 раза, 3 раза, 4 раза, 5 или более раз большую резистентность к ингибированию 1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амином, в частности, (S)-1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амином, по сравнению с полипептидом, представленным SEQ ID NO: 4, в подходящих реакционных условиях, которые описаны ниже.
В некоторых вариантах воплощения генно-инженерные трансаминазные полипептиды, используемые в настоящем раскрытии, способны к преобразованию субстрата 1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-она в продукт (S)-1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амин с энантиомерным избытком больше чем 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5 или больше по сравнению с (R)-1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2- в подходящих реакционных условиях.
В некоторых вариантах воплощения генно-инженерные трансаминазные полипептиды, используемые в настоящем раскрытии, способны к преобразованию соединения (IA) в соединение (IIA) с повышенной стойкостью для присутствия субстрата по сравнению с эталонным полипептидом SEQ ID NO: 4 в подходящих реакционных условиях. Таким образом, в некоторых вариантах воплощения генно-инженерные трансаминазные полипептиды способны к преобразованию субстрата, представляющего собой соединение (IIA), в продукт, представляющий собой соединение (IA), в присутствии нагрузки субстрата при концентрации по меньшей мере около 1 г/л, около 5 г/л, около 10 г/л, около 20 г/л, около 30 г/л, около 40 г/л, около 50 г/л, около 70 г/л, около 100 г/л, около 125 г/л, около 150 г/л. около 175 г/л или около 200 г/л или более, с процентом конверсии по меньшей мере около 50%, по меньшей мере около 60%, по меньшей мере около 70%, по меньшей мере около 80%, по меньшей мере около 90%, по меньшей мере около 95%, по меньшей мере около 98%, или по меньшей мере около 99%, с временем реакции около 72 часов или меньше, около 48 часов или меньше, около 36 часов или меньше, или около 24 часов или меньше, в подходящих реакционных условиях.
Подходящие реакционные условия, в которых выше-описанные улучшенные свойства генно-инженерных полипептидов осуществляют преобразование, можно определить как относящиеся к концентрациям или количествам полипептида, субстрата, кофактора, буфера, со-растворителя, pH, и/или условия, включающие температуру и время реакциии, как описано ниже и в примерах.
Иллюстративные генно-инженерные полипептиды, используемые в настоящем раскрытии, ассоциируются с их улучшенными свойствами для преобразования соединения (IA) в соединение (IIA), и они включают одно или более расхождений остатков по сравнению с SEQ ID NO: 2 в следующих положениях остатков: X9; X14; X18; X21; X26; X31; X33; X41; X45; X47; X57; X70; X86; X88; X107; X113; X132; X133; X146; X147; X148; X153; X163; X168; X173; X177; X203; X211; X233T; X235; X244; X250; X284; X294; X314; X315; X318; X323; X324; X324; X346; X383; X391; X395; X398; X400; X417; X419; X420; X423; X424; X427; X448; и X451. Специфические аминокислотные различия в каждом из этих положений, которые ассоциируются с улучшенными свойствами иллюстративных полипептидов Таблицы 2A и 2B, включают: X9T; X14V; X18A; X21H; X26R; X31M; X31S; X33T; X41L; X45H; X47N; X57F; X57Y; X70A; X86D; X86Y; X88A; X88L; X107P; X113L; X113V; X132F; X133R; X146L; X147K; X148Q; X148R; X153S; X163F; X163I; X163L; X163R; X163V; X168K; X168S; X173A; X177L; X203S; X211K; X233T; X235P; X244T; X250A; X284A; X294V; X314N; X315G; X318D; X323T; X324G; X324H; X346L; X383V; X391A; X395P; X398L; X398V; X398W; X400G; X417M; X419S; X420N; X423I; X424V; X424A; X427Y; X448E; и X451D.
Расхождения остатков по сравнению с генно-инженерной трансаминазой, представленной SEQ ID NO: 4, включает такие, которые присутствуют в положениях остатков: X14; X26; X31; X33; X41; X47; X57; X70; X86; X88; X107; X113; X132; X148; X163; X168; X173; X203; X250; X284; X314; X315; X324; X346; X395; X398; X400; X417; X419; X420; X423; X424; X448; и X451. Специфические аминокислотные различия в этих положениях включают: X14V; X26R; X31S; X33T; X41L; X47N; X57F; X57Y; X70A; X86D; X88A; X88L; X107P; X113L; X113V; X132F; X148Q; X148R; X163I; X163L; X163R; X163V; X168K; X168S; X173A; X203S; X250A; X284A; X314N; X315G; X324H; X346L; X395P; X398L; X398V; X398W; X400G; X417M; X419S; X420N; X423I; X424V; X448E; и X451D. Хотя расхождения остатков по сравнению с SEQ ID NO: 4 также имеет место в положениях остатков X153 и X383, эти различия представляют собой реверсии к аминокислотному остатку, присутствующему в последовательности SEQ ID NO: 2 дикого типа, указывая на то, что взаимопреобразования между аминокислотами S и V в положении остатка X153 и между аминокислотами A и V в положении остатка X383 не оказывают какие-либо существенные неблагоприятные эффекты на свойства генно-инженерного фермента.
Данные, касающиеся структуры и функции иллюстративных имеющих не-природное происхождение (или генно-инженерных) трансаминазных полипептидов, используемых в способе по настоящему изобретению, представлены ниже в Таблице 2A и 2B. Идентификаторы последовательностей с нечетными номерами (т.е. SEQ ID NOs) относятся к нуклеотидной последовательности, кодирующей аминокислотную последовательность, представленную SEQ ID NOs с четными номерами, и последовательности представлены в электронном файле перечня последовательностей, прилагаемом к настоящему раскрытию, который включен в настоящую заявку посредством ссылки. Различия аминокислотных остатков основаны на сравнении с эталонной последовательностью SEQ ID NO: 4, которая представляет генно-инженерные трансаминазы, происходящие из ω-VfT полипептида дикого типа, имеющего следующие 24 отличия аминокислотных остатков A9T; G18A; D21H; V31M; N45H; F86Y; A133R; R146L; W147K; V153S; K163F; V177L; R211K; P233T; A235P; P244T; M294V; P318D; A323T; S324G; A383V; T391A; C424A; F427Y по сравнению с SEQ ID NO: 2. Активность каждого генно-инженерного полипептида по сравнению с эталонным полипептидом SEQ ID NO: 4 определяли как преобразование кетонового субстрата 1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-она в аминовый продукт, представляющий собой соединение (S)-1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амин, в течение заданного периода времени и температуры в высокопроизводительном (HTP) анализе, который использовали в качестве первичного скрининга. Данные HTP анализа, представленные в Таблице 2A, определяли с использованием E. coli. прозрачных клеточных лизатов в формате 96-луночного планшета с объемом ~200 мкл на лунку, используя для анализа реакционные условия, указанные в таблице и примерах. В некоторых случаях, порошковый анализ с использованием встряхиваемой колбы (SFP) и/или порошковый анализ полученного продукта последовательной обработки (DSP) использовали в качестве вторичного скрининга для оценки свойств генно-инженерных трансаминаз, результаты этих анализов представлены в Таблице 2B. SFP и DSP формы обеспечивают более очищенный порошковый препарат генно-инженерных полипептидов. Например, генно-инженерная трансаминаза в SFP препаратах составляет приблизительно 30% от общего содержания белка, в то время как DSP препараты могут содержать генно-инженерные трансаминазы, которые составляют приблизительно 80% от общего содержания белка.
Уровни активности (т.е., “+” “++”, и т.д.) определяются следующим образом: “+” указывает активность, выше в 1,2 раза или больше, по сравнению с SEQ ID NO: 4 для генно-инженерных трансаминазных полипептидов SEQ ID NO: 6-14, и в 1,2 раза или больше по сравнению с SEQ ID NO: 8 для генно-инженерного трансаминазного полипептида SEQ ID NO: 16-154; и a“++” указывает активность, выше в 5 раз или больше, по сравнению с SEQ ID NO: 4 для генно-инженерных трансаминазных полипептидов SEQ ID NO: 6-14, и активность, выше в 5 раз или больше, по сравнению с SEQ ID NO: 8 для генно-инженерных трансаминазных полипептидов SEQ ID NO: 16-154. Данные, касающиеся стабильности, получали путем включения в анализ следующих количеств продукта (S)-1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амина и сравнения активности с активностью эталонного фермента в таких же условиях: 14 г/л для анализа генно-инженерных трансаминазных полипептидов SEQ ID NO. 6-14, и 16 г/л для анализа генно-инженерных трансаминазных полипептидов SEQ ID NO. 16-154. Оценку стабильности осуществляли путем сравнения активностей при двух разных температурах 55°C и 50°C.
Генно-инженерные полипептиды и соответствующие улучшения фермента с использованием HTP препаратов
50°C в течение 24 часов.
bУсловия HTP анализа 2: Клетки, выращенные в 96-луночных планшетах, лизировали с использованием 400 мкл лизисного буфера (1 мг/мл лизозима, 0,5 мг/мл полимиксин B сульфата, 1 мМ PLP, 0,1 M триэтаноламина (TEA), pH 7,0. Реакционные условия включали: 10 г/л (44,4 мМ) Соединения (IA); 1 мМ пиридоксал-5-фосфата (PLP); 2 M изопропиламина (IPM), pH 7,0; 100 мМ триэтаноламин (TEA), pH 7,0; 5% PEG 200 об/об; 10 мкл Лизата; и
50°C в течение 24 часов.
c Условия анализа стабильности: 10 г/л (44,4 мМ) Соединения (IA); 1 мМ пиридоксал-5-фосфата (PLP); 2 M изопропиламин (IPM), pH 7,0; 100 мМ триэтаноламин (TEA), pH 7,0; 5% PEG 200 об/об; 10 мкл Лизата (полученного в соответствии с условиями HTP анализа 1 или 2); и 55°C в течение 24 часов. Лизаты получали в соответствии с условиями HTP анализа 1 (для SEQ ID NO: 4-90) или условиями HTP анализа 2 (для SEQ ID NO: 92-230).
d Условия анализа ингибирования продуктом 1: 10 г/л (44,4 мМ) Соединения (IA); 14 г/л Соединения (IIA); 1 мМ пиридоксал-5-фосфата (PLP); 2 M изопропиламина (IPM), pH 7,0; 100 мМ триэтаноламина (TEA), pH 7,0; 5% PEG 200 об/об; 10 мкл Лизата; и 50°C. Лизаты получали в соответствии с условиями HTP анализа 1.
e Условия анализа ингибирования продуктом 2: 10 г/л (44,4 мМ) Соединения (IA); 16 г/л Соединения (IIA); 1 мМ пиридоксал-5-фосфата (PLP); 2 M изопропиламина (IPM), pH 7,0; 100 мМ триэтаноламина (TEA), pH 7,0; 5% PEG 200 об/об; 10 мкл Лизата; и 50°C. Лизаты получали в соответствии с условиями HTP анализа 2.
nd: не определяли
Генно-инженерные полипептиды и соответствующие улучшения фермента с использованием препаратов во встряхиваемой колбе и DSP
а
b
b Условия анализа DSP =: 25 г/л (или 50 или 100 г/л) Соединения (IA); 1 мМ пиридоксал-5-фосфата (PLP); 2 M изопропиламина (IPM), pH 7; 5% об/об PEG200; 100 мМ триэтаноламина (TEA), pH 7; 2 г/л белка из трансаминаза-содержащего DSP препарата; и 50°C, время реакции 24 часа.
При рассмотрении иллюстративных полипептидов, полезных в способах по настоящему изобретению, улучшения свойств фермента ассоциируются с отличиями остатков по сравнению с SEQ ID NO: 4 в положениях остатков X14; X26; X31; X33; X41; X47; X57; X70; X86; X88; X107; X113; X132; X148; X163; X168; X173; X203; X250; X284; X314; X315; X324; X346; X395; X398; X400; X417; X419; X420; X423; X424; X448; и X451. Специфические отличия остатков в каждом из этих положениий, которые ассоциируются с улучшенными свойствами, включают: X14V; X26R; X31S; X33T; X41L; X47N; X57F; X57Y; X70A; X86D; X88A; X88L; X107P; X113L; X113V; X132F; X148Q; X148R; X163I; X163L; X163R; X163V; X168K; X168S; X173A; X203S; X250A; X284A; X314N; X315G; X324H; X346L; X395P; X398L; X398V; X398W; X400G; X417M; X419S; X420N; X423I; X424V; X448E; и X451D.
Соответственно, в некоторых вариантах воплощения, генно-инженерный трансаминазный полипептид, полезный в способах по настоящему изобретению, способен к преобразованию субстрата, представляющего собой Соединение (IA) 1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-он, в продукт, представляющий собой Соединение (IIA) (S)-1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амин, с улучшенными свойствами по сравнению с SEQ ID NO: 4, включает аминокислотную последовательность, имеющую по меньшей мере, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичности последовательности с эталонной последовательностью SEQ ID NO: 2 и одно или более отличий остатков по сравнению с SEQ ID NO: 4 в положениях остатков, выбранных из: X14; X26; X31; X33; X41; X47; X57; X70; X86; X88; X107; X132; X148; X163; X168; X173; X203; X250; X284; X314; X315; X324; X346; X395; X398; X400; X417; X419; X423; X448; и X451, где отличия остатков в положениях остатков X31; X57; X86; X163; X168; X314; X324; X398; и X417 выбраны из: X31S; X57Y; X86D; X163I; X163L; X163R; X163V; X168S; X314N; X324H; X398L; X398V; X398W; и X417M.
В некоторых вариантах воплощения, генно-инженерный трансаминазный полипептид, полезный в способах по настоящему изобретению, способен к преобразованию субстрата, представляющего собой Соединение (IA) в продукт, представляющий собой Соединение (IIA), с улучшенными свойствами по сравнению с SEQ ID NO: 4, включает аминокислотную последовательность, имеющую по меньшей мере 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичности последовательности с эталонной последовательностью SEQ ID NO: 4 и одно или более отличий остатков по сравнению с SEQ ID NO: 4 в положениях остатков, выбранных из: X14; X26; X31; X33; X41; X47; X57; X70; X86; X88; X107; X132; X148; X163; X168; X173; X203; X250; X284; X314; X315; X324; X346; X395; X398; X400; X417; X419; X423; X448; и X451, где отличия остатков в положениях остатков X31; X57; X86; X163; X168; X314; X324; X398; и X417 выбраны из: X31S; X57Y; X86D; X163I; X163L; X163R; X163V; X168S; X314N; X324H; X398L; X398V; X398W; и X417M. В некоторых вариантах воплощения, генно-инженерные трансаминазные полипептиды способны к осуществлению преобразования с энантиоселективностями, описанными выше, например, ≥90% э.и.
В некоторых вариантах воплощения, трансаминазный полипептид, полезный в способах по настоящему изобретению, способен к преобразованию субстрата, представляющего собой Соединение (IA), в продукт, представляющий собой Соединение (IIA), с улучшенными свойствами по сравнению с SEQ ID NO: 4, включает аминокислотную последовательность, имеющую по меньшей мере, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичности с эталонной последовательностью, выбранной из SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 112, 114, 116, 118, 120, 122, 124, 126, 128, 130, 132, 134, 136, 138, 140, 142, 144, 146, 148, 150, 152, и 154, и одно или более отличий остатков по сравнению с SEQ ID NO: 4 в положениях остатков, выбранных из: X14; X26; X31; X33; X41; X47; X57; X70; X86; X88; X107; X132; X148; X163; X168; X173; X203; X250; X284; X314; X315; X324; X346; X395; X398; X400; X417; X419; X423; X448; и X451, где отличия остатков в положениях остатков X31; X57; X86; X163; X168; X314; X324; X398; и X417 выбраны из: X31S; X57Y; X86D; X163I; X163L; X163R; X163V; X168S; X314N; X324H; X398L; X398V; X398W; и X417M. В некоторых вариантах воплощения, эталонную последовательность выбирают из SEQ ID NO: 4, 8, 14, 16, 132, 134, и 146. В некоторых вариантах воплощения, эталонная последовательность представляет собой SEQ ID NO: 4. В некоторых вариантах воплощения, эталонная последовательность представляет собой SEQ ID NO: 8. В некоторых вариантах воплощения, эталонная последовательность представляет собой SEQ ID NO: 134. В некоторых вариантах воплощения, эталонная последовательность представляет собой SEQ ID NO: 146.
В некоторых вариантах воплощения, трансаминазный полипептид, способный к преобразованию субстрата, представляющего собой Соединение (IA), в продукт, представляющий собой Соединение (IIA), с улучшенными свойствами по сравнению с SEQ ID NO: 4, включает аминокислотную последовательность, выбранную из SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 112, 114, 116, 118, 120, 122, 124, 126, 128, 130, 132, 134, 136, 138, 140, 142, 144, 146, 148, 150, 152, и 154, и имеющую одно или более отличий остатков по сравнению с SEQ ID NO: 4 в положениях остатков, выбранных из: X14; X26; X31; X33; X41; X47; X57; X70; X86; X88; X107; X132; X148; X163; X168; X173; X203; X250; X284; X314; X315; X324; X346; X395; X398; X400; X417; X419; X423; X448; и X451, где отличия остатков в положениях остатков X31; X57; X86; X163; X168; X314; X324; X398; и X417 выбраны из: X31S; X57Y; X86D; X163I; X163L; X163R; X163V; X168S; X314N; X324H; X398L; X398V; X398W; и X417M. В некоторых вариантах воплощения, аминокислотную последовательность выбирают из SEQ ID NO: 4, 8, 14, 16, 132, 134, и 146. В некоторых вариантах воплощения, аминокислотная последовательность представляет собой SEQ ID NO: 4. В некоторых вариантах воплощения, аминокислотная последовательность представляет собой SEQ ID NO: 8. В некоторых вариантах воплощения, аминокислотная последовательность представляет собой SEQ ID NO: 134. В некоторых вариантах воплощения, аминокислотная последовательность представляет собой SEQ ID NO: 146.
В некоторых вариантах воплощения, генно-инженерный трансаминазный полипептид способен к преобразованию субстрата, представляющего собой Соединение (IA), в продукт, представляющий собой Соединение (IIA) с по меньшей мере в 1,2 раза большей активностью по сравнению с SEQ ID NO: 4, и включает аминокислотную последовательность, выбранную из: SEQ ID NO: 6, 8, 10, 12, 14, 16, 22, 24, 28, 30, 32, 48, 52, 56, 62, 64, 66, 68, 86, 88, 90, 92, 98, 100, 104, 106, 108, 110, 112, 114, 116, 118, 124, 126, 128, 132, 134, 136, 142, 144, 148 и 154.
В некоторых вариантах воплощения, генно-инженерный трансаминазный полипептид способен к преобразованию субстрата, представляющего собой Соединение (IA), в продукт, представляющий собой Соединение (IIA), с по меньшей мере в 5 раз большей активностью по сравнению с SEQ ID NO: 4 и включает аминокислотную последовательность, имеющую одно или более отличий остатков, выбранных из: X14V, X26R; X33T; X88A/L; X163I/L; и X284A.
В некоторых вариантах воплощения, генно-инженерный трансаминазный полипептид, полезный в способах по настоящему изобретению, способен к преобразованию субстрата, представляющего собой Соединение (IA), в продукт, представляющий собой Соединение (IIA), с по меньшей мере в 5 раз большей активностью по сравнению с SEQ ID NO: 4, и включает аминокислотную последовательность, выбранную из: SEQ ID NO: 6, 8, 10, 14, 16, 22, 24, 28, 30, 32, 48, 52, 56, 62, 64, 86, 88, 90, 92, 98, 100, 104, 106, 108, 110, 112, 114, 116, 118, 124, 126, 128, 132, 134, 136, 142, 144, 148, и 154.
В некоторых вариантах воплощения, генно-инженерный трансаминазный полипептид имеет по меньшей мере в 1,2 раза, 1,5 раз, 2 раза, 3 раза, 4 раза, 5 или более раз бóльшую стойкость к ингибированию 1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амином, в частности, (S)-1-(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амином по сравнению с полипептидом, представленным SEQ ID NO: 4, при преобразовании Соединения (IA) в Соединение (IIA). Как правило, повышение стойкости или резистентности к ингибированию соединением, которое является продуктом, можно измерить в условиях HTP анализа в присутствии 14 г/л или 16 г/л соединения (IIA), как описано в Таблице 2A и 2B и примерах. В некоторых вариантах воплощения, генно-инженерный трансаминазный полипептид, имеющий более высокую, по меньшей мере в 1,2 раза или больше, стойкость к ингибированию -(1H-5-фтор-6-хлор-индол-3-ил)пропан-2-амином, включает аминокислотную последовательность, имеющую одно или более отличий остатков по сравнению с SEQ ID NO: 4, выбранных из: X26R; X70A; X86D; X88A/L; X132F; X163L; X315G; X395P; X398L; и X419S.
В некоторых вариантах воплощения, генно-инженерный трансаминазный полипептид с улучшенными свойствами для преобразования Соединения (IA) в Соединение (IIA) имеет аминокислотную последовательность, включающую последовательность, выбранную из SEQ ID NO: 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 112, 114, 116, 118, 120, 122, 124, 126, 128, 130, 132, 134, 136, 138, 140, 142, 144, 146, 148, 150, 152, и 154.
В некоторых вариантах воплощения, генно-инженерная трансаминаза, способная к преобразованию Соединения (IA) в Соединение (IIA) в подходящих реакционных условиях, включает аминокислотную последовательность, имеющую по меньшей мере 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичности с одной из SEQ ID NO: 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 112, 114, 116, 118, 120, 122, 124, 126, 128, 130, 132, 134, 136, 138, 140, 142, 144, 146, 148, 150, 152, и 154, и отличия аминокислотных остатков по сравнению с SEQ ID NO: 4, которые присутствуют в любой из SEQ ID NO: 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 112, 114, 116, 118, 120, 122, 124, 126, 128, 130, 132, 134, 136, 138, 140, 142, 144, 146, 148, 150, 152, и 154, как представлено в Таблицах 2A и 2B.
В некоторых вариантах воплощения, генно-инженерные полипептиды могут быть в различных формах, например, таких как выделенный препарат, как по существу очищенный фермент, целые клетки, трансформированные геном(генами), кодирующим фермент, и/или в виде клеточных экстрактов и/или лизатов таких клеток. Ферменты могут быть лиофилизированы, высушены распылением, могут быть осажденными или в форме неочищенной пасты, как обсуждается ниже.
В некоторых вариантах воплощения, трансаминазные полипептиды могут быть связаны на физическом субстрате. Трансаминазные полипептиды могут быть связаны нековалентно или ковалентно на физическом субстрате так, чтобы они сохраняли их улучшенную активность, стереоселективность, стойкость к продукту, стабильность и/или другие улучшенные свойства по сравнению с эталонным полипептидом SEQ ID NO: 4. В таких вариантах воплощения, иммобилизованные полипептиды могут способствовать биокаталитическому преобразованию подходящих кетоновых субстратов, например, Соединения (IA) или его структурных аналогов в соответствующий аминовый продукт, например, Соединение (IIA) или соответствующие структурные аналоги, и после завершения реакции легко удерживаются (например, путем удерживания шариков, на которых иммобилизован полипептид), и затем их снова используют или возвращают в повторный цикл в последующих реакциях. Такие способы с использованием иммобилизованных ферментов обеспечивают бóльшую эффективность и снижение затрат. Способы иммобилизации фермента хорошо известны из уровня техники. Различные способы для конъюгирования с субстратами, например, мембранами, шариками, стеклом и т.д. описаны, среди прочего, в Hermanson, G.T., Bioconjugate Techniques, Second Edition, Academic Press; (2008), and Bioconjugation Protocols: Strategies and Methods, в Methods in Molecular Biology, C.M. Niemeyer ed., Humana Press (2004); раскрытия которых включены в настоящую заявку посредством ссылки.
Полинуклеотиды, кодирующие генно-инженерные трансаминазы, векторы экспрессии и клетки хозяина
В другом аспекте, настоящее изобретение обеспечивает полинуклеотиды, кодирующие генно-инженерные трансаминазные полипептиды, описанные в настоящей заявке. Полинуклеотиды могут быть функционально связаны с одной или более гетерологичными регуляторными последовательностями, которые контролируют генную экспрессию, с созданием рекомбинантного полинуклеотида, способного экспрессировать полипептид. Конструкции экспрессии, содержащие гетерологичный полинуклеотид, кодирующий генно-инженерную трансаминазу, можно ввести в подходящие клетки хозяина для экспрессии соответствующего трансаминазного полипептида.
Как должно быть понятно специалистам в данной области, доступность последовательности белка и сведения о кодонах, соответствующих различным аминокислотам, обеспечивает описание всех полинуклеотидов, способных кодировать полипептиды в соответствии с изобретением. Вырождение генетического кода, где одни и те же аминокислоты кодируются альтернативными или синонимичными кодонами, позволяет получить чрезвычайно большое количество нуклеиновых кислот, которые все кодируют улучшенные трансаминазные ферменты. Таким образом, обладая знаниями о конкретной аминокислотной последовательности, специалисты в данной области могли бы получить ряд различных нуклеиновых кислот просто путем модификации последовательности одного или более кодонов таким образом, чтобы не изменять аминокислотную последовательность белка. В этой связи, настоящее изобретение специально предусматривает любой и каждый возможный вариант полинуклеотидов, которые могут кодировать полипептиды, описанные в настоящей заявке, путем выбора комбинаций, основанных на возможных выборах кодонов, и все такие варианты следует рассматривать как специально раскрытые для любого полипептида, описанного в настоящей заявке, включая аминокислотные последовательности, представленные в Таблицах 2A и 2B и раскрытые в перечне последовательностей, включенном в настоящую заявку посредством ссылки, как SEQ ID NO: 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 112, 114, 116, 118, 120, 122, 124, 126, 128, 130, 132, 134, 136, 138, 140, 142, 144, 146, 148, 150, 152 и 154.
В различных вариантах воплощения, кодоны предпочтительно выбирают для соответствия клетке хозяина, в которой продуцируется белок. Например, предпочтительные кодоны, используемые в бактериях, используют для экспресии гена в бактериях; предпочтительные кодоны, используемые в дрожжах, используют для экспресии в дрожжах; и кодоны, используемые в млекопитающих, используют для экспрессии в клетках млекопитающих. В некоторых вариантах воплощения, необязательно должны быть заменены все кодоны для оптимизации использования кодонов трансаминаз, поскольку природная последовательность будет включать предпочтительные кодоны, и поскольку предпочтительные кодоны могут не потребоваться для всех аминокислотных остатков. Следовательно, кодон-оптимизированные полинуклеотиды, кодирующие трансаминазные ферменты, могут содержать предпочтительные кодоны примерно в 40%, 50%, 60%, 70%, 80% или больше чем 90% положений кодонов полноразмерной кодирующей области.
Выделенный полинуклеотид, кодирующий улучшенный трансаминазный полипептид, можно подвергнуть различным манипуляциям для обеспечения экспрессии полипептида. В некоторых вариантах воплощения, полинуклеотиды, кодирующие полипептиды, могут быть обеспечены в виде векторов экспрессии, где присутствует одна или более контрольных последовательностей для рагуляции экспрессии полинуклеотидов и/или полипептидов. Манипуляции с выделенным полинуклеотидом до его вставки в вектор могут быть желательными или необходимыми, в зависимости от вектора экспрессии. Процедуры модификации полинуклеотидов и нуклеиновокислотных последовательностей с использованием методов рекомбинантной ДНК хорошо известны из уровня техники. Руководство представлено в Sambrook et al., 2001, Molecular Cloning: A Laboratory Manual, 3rd Ed., Cold Spring Harbor Laboratory Press; и Current Protocols in Molecular Biology, Ausubel. F. ed., Greene Pub. Associates, 1998, updates to 2006.
В вариантах воплощения, раскрытых в настоящей заявке, улучшенные полипептиды и соответствующие полинуклеотиды можно получить с использованием способов, используемых специалистами в данной области. Исходная полинуклеотидная последовательность, кодирующая полипептид дикого типа Vibrio fluvialis, описана в Shin et al., 2003, Appl. Microbiol. Biotechnol. 61(5-6): 463-471, и способы получения генно-инженерных трансаминазных полипептидов с улучшенной стабильностью и свойствами распознавания субстрата раскрыты в публикациях патентных заявок WO2010081053 и US20100209981, включенных в настоящую заявку посредством ссылки.
Когда последовательность генно-инженерного полипептида является известной, полинуклеотиды, кодирующие фермент, можно получить стандартными твердофазными способами в соответствии с известными способами синтеза. В некоторых вариантах воплощения, фрагменты из вплоть до около 100 оснований могут быть индивидуально синтезированы, затем объединены (например, способами ферментативного или химического лигирования, или полимераза-опосредованными способами) с образованием любой желательной непрерывной последовательности. Например, полинуклеотиды и олигонуклеотиды по настоящему изобретению можно получить путем химического синтеза с использованием, например, классического способа на основе фосфорамидита, описанного в Beaucage et al., 1981, Tet Lett 22: 1859-69, или способа, описанного в Matthes et al., 1984, EMBO J. 3: 801-05, например, как это типично осуществляют на практике в автоматизированных способах синтеза. В соответствии со способом на основе фосфорамидита, олигонуклеотиды синтезируют, например, в автоматическом ДНК синтезаторе, осуществляют очистку, отжиг, лигирование и клонирование в подходящие векторы. Кроме того, по существу любую нуклеиновую кислоту можно получить из любого из многочисленных коммерческих источников.
Соответственно, в некоторых вариантах воплощения, способ получения генно-инженерного трансаминазного полипептида может включать: (a) синтез полинуклеотида, кодирующего полипептид, включающий аминокислотную последовательность, выбранную из SEQ ID NO: 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 112, 114, 116, 118, 120, 122, 124, 126, 128, 130, 132, 134, 136, 138, 140, 142, 144, 146, 148, 150, 152 и 154, и имеющего одно или более отличий остатков по сравнению с SEQ ID NO: 4 в положениях остатков, выбранных из: X14; X26; X31; X33; X41; X47; X57; X70; X86; X88; X107; X132; X148; X163; X168; X173; X203; X250; X284; X314; X315; X324; X346; X395; X398; X400; X417; X419; X423; X448; и X451, где отличия остатков в положениях остатков X31; X57; X86; X163; X168; X314; X324; X398; и X417 выбраны из: X31S; X57Y; X86D; X163I; X163L; X163R; X163V; X168S; X314N; X324H; X398L; X398V; X398W; и X417M.; и (b) экспрессирование трансаминазного полипептида, кодируемого полинуклеотидом.
Экспрессированную генно-инженерную трансаминазу можно оценить на желаемое улучшенное свойство, например, активность, энантиоселективность, стабильность и стойкость к продукту, в преобразовании соединения (IA) в соединение (IIA) с использованием любого из условий анализа, описанных в настоящей заявке.
В некоторых вариантах воплощения, любой из генно-инженерных трансаминазных ферментов, экспрессируемых в клетке хозяина, можно выделить из клеток и/или культуральной среды с использованием любого одного или нескольких хорошо известных методов для очистки белка, включая, среди прочего, лизозимную обработку, обработку ультразвуком, фильтрацию, высаливание, ультра-центрифугирование, и хроматографию. Подходящие растворы для лизиса и высокоэффективной экстракции белков из бактерий, таких как E. coli, коммерчески доступны под торговым названием CelLytic BTM от компании Sigma-Aldrich of St. Louis MO.
Хроматографические методы для выделения трансаминазного полипептида включают, среди прочего, обращенно-фазовую хроматографию, высоко-эффективную жидкостную хроматографию, ионообменную хроматографию, гель-электрофорез и аффинную хроматографию. Условия для очистки конкретного фермента зависят, частью, от факторов, таких как общий заряд, гидрофобность, гидрофильность, молекулярная масса, форма молекулы и т.д., и должны быть известны специалистам в данной области.
В некоторых вариантах воплощения, аффинные методы можно использовать для выделения улучшенных трансаминазных ферментов. Для очистки методом аффинной хроматографии можно использовать любое антитело, которое специфическим образом связывается с трансаминазным полипептидом. Для продукции антител, различные животные-хозяева, в том числе, но не ограничиваясь этим, кролики, мыши, крысы и т.д., могут быть иммунизированы инъекции трансаминазного полипептида или его фрагмента. Трансаминазный полипептид или фрагмент могут быть присоединены к подходящему носителю, такому как BSA, посредством функциональной группы боковой цепи или линкеров, связанных с функциональной группой боковой цепи. Различные адъюванты можно использовать для усиления иммунологического ответа, в зависимости от вида хозяина, включая, но не ограничиваясь этим адъювант Фрейнда (полный и неполный), минеральные гели, такие как гидроксид алюминия, поверхностно-активные вещества, такие как лизолецитин, плюрониловые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианин моллюска морское блюдечко, динитрофенол, и потенциально полезные человеческие адъюванты, такие как BCG (bacilli Calmette Guerin) и Corynebacterium parvum.
Способы использования генно-инженерных трансаминазных ферментов
В другом аспекте, трансаминазы, описанные в настоящей заявке, можно использовать в способе осуществления трансаминазных реакций, в которых происходит перенос аминогруппы от амино-донора к амино-акцептору, например, кетоновому субстрату, с получением амина. Использование прохирального кетонового акцептора может привести к продукции хирального амина с энантиомерным избытком. Как правило, способ осуществления реакции трансаминирования включает контактирование или инкубацию амино-донора и амино-акцептора с генно-инженерным трансаминазным полипептидом по настоящему изобретению в реакционных условиях, подходящих для преобразования амино-акцептора в амин.
В некоторых вариантах воплощения, трансаминазы можно использовать для преобразования субстрата, представляющего собой соединение формулы (I), в продукт, представляющий собой соединение формулы (II). Соответственно, в некоторых вариантах воплощения, способ получения соединения формулы (II) с энантиомерным избытком включает контактирование соединения формулы (I) в присутствии амино-донора в подходящих реакционных условиях с генно-инженерным трансаминазным полипептидом, описанным в настоящей заявке. В некоторых вариантах воплощения способа, соединение формулы (II) может быть образовано с энантиомерным избытком по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более.
Для описанных выше способов можно использовать любую из генно-инженерных трансаминаз, описанных в настоящей заявке. В качестве примера и без ограничения, в некоторых вариантах воплощения в способе можно использовать генно-инженерный трансаминазный полипептид, включающий аминокислотную последовательность, имеющую по меньшей мере, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичности с эталонной последовательностью, выбранной из SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 112, 114, 116, 118, 120, 122, 124, 126, 128, 130, 132, 134, 136, 138, 140, 142, 144, 146, 148, 150, 152, и 154, и одно или более отличий остатков по сравнению с SEQ ID NO: 4 в положениях остатков, выбранных из: X14; X26; X31; X33; X41; X47; X57; X70; X86; X88; X107; X132; X148; X163; X168; X173; X203; X250; X284; X314; X315; X324; X346; X395; X398; X400; X417; X419; X423; X448; и X451, где отличия остатков в положениях остатков X31; X57; X86; X163; X168; X314; X324; X398; и X417 выбраны из: X31S; X57Y; X86D; X163I; X163L; X163R; X163V; X168S; X314N; X324H; X398L; X398V; X398W; и X417M. В некоторых вариантах воплощения, эталонную последовательность выбирают из SEQ ID NO: 4, 8, 14, 16, 132, 134, и 146. В некоторых вариантах воплощения, эталонная последовательность представляет собой SEQ ID NO: 4. В некоторых вариантах воплощения, эталонная последовательность представляет собой SEQ ID NO: 8. В некоторых вариантах воплощения, эталонная последовательность представляет собой SEQ ID NO: 134. В некоторых вариантах воплощения, эталонная последовательность представляет собой SEQ ID NO: 146.
В некоторых вариантах воплощения, иллюстративные трансаминазы, подходящие для осуществления способов, описанных в настоящей заявке, могут представлять собой полипептид, включающий аминокислотную последовательность, выбранную из SEQ ID NO: 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 112, 114, 116, 118, 120, 122, 124, 126, 128, 130, 132, 134, 136, 138, 140, 142, 144, 146, 148, 150, 152 и 154. Руководство по выбору и использованию генно-инженерных трансаминаз представлено в описаниях, содержащихся в настоящей заявке, например, в Таблице 2 и Примерах.
В вариантах воплощения, описанных в настоящей заявке и проиллюстрированных в Примерах, описаны различные пределы, касающиеся подходящих реакционных условий, которые могут быть использованы в способах, включая, но не ограничиваясь этим, пределы, касающиеся амино-донора, pH, температуры, буфера, системы растворителя, нагрузки субстрата, нагрузки полипептида, нагрузки кофактора, давления и времени реакции. Другие подходящие реакционные условия для осуществления способа биокаталитического преобразования соединения-субстрат в соединение-продукт с использованием генно-инженерного трансаминазного полипептида, описанного в настоящей заявке, могут быть легко оптимизированы в свете руководящих указаний, представленных в настоящей заявке, путем рутинного экспериментирования, которое включает, но не ограничивается этим, контактирование генно-инженерного трансаминазного полипептида и соединения-субстрат в экспериментальных реакционных условиях, таких как концентрация, pH, температура, растворители, и детекцию соединения-продукта.
В вариантах воплощения, описанных в настоящей заявке, трансаминазный полипептид использует амино-донор для образования соединений, представляющих собой продукт. В некоторых вариантах воплощения, амино-донор в реакционных условиях может быть выбран из изопропиламина (также указан в настоящей заявке как “IPM”), путресцина, L-лизина, α-фенэтиламина, D-аланина, L-аланина или D,L-аланина, или D,L-орнитина. В некоторых вариантах воплощения, амино-донор выбирают из группы, состоящей из IPM, путресцина, L-лизина, D- или L-аланина. В некоторых вариантах воплощения, амино-донор представляет собой IPM. В некоторых вариантах воплощения, подходящие реакционные условия включают амино-донор, в частности IPM, присутствующий в концентрации по меньшей мере от около 0,1 до около 3,0 M, от 0,2 до около 2,5 M, от около 0,5 до около 2 M или от около 1 до около 2 M. В некоторых вариантах воплощения, амино-донор присутствует в концентрации около 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 1, 1,5, 2, 2,5 или 3 M. Более высокие концентрации амино-донора, например, IPM, можно использовать для сдвига равновесия в сторону образования аминового продукта.
Подходящие реакционные условия с использованием генно-инженерных трансаминазных полипептидов также типично включают кофактор. Кофакторы, полезные в способах с использованием генно-инженерных трансаминазных ферментов, включают, но не ограничиваются этим, пиридоксал-5'-фосфат (также известный как пиридоксал-фосфат, PLP, P5P), пиридоксин (PN), пиридоксал (PL), пиридоксамин (PM), и их фосфорилированные аналоги; пиридоксинфосфат (PNP) и пиридоксаминфосфат (PMP). В некоторых вариантах воплощения, кофактор PLP присутствует естественным образом в клеточном экстракте, и его пополнение не требуется. В некоторых вариантах воплощения способов, подходящие реакционные условия включают добавление кофактора к содержащей фермент реакционной смеси, например, когда используют частично очищенный, или очищенный трансаминазный фермент. В некоторых вариантах воплощения, подходящие реакционные условия могут включать присутствие кофактора, выбранного из PLP, PN, PL, PM, PNP и PMP, в концентрации от около 0,1 г/л до около 10 г/л, от около 0,2 г/л до около 5 г/л, от около 0,5 г/л до около 2,5 г/л. В некоторых вариантах воплощения, реакционные условия включают концентрацию PLP около 0,1 г/л или меньше, 0,2 г/л или меньше, 0,5 г/л или меньше, 1 г/л или меньше, 2,5 г/л или меньше, 5 г/л или меньше, или 10 г/л или меньше. В некоторых вариантах воплощения, кофактор можно добавлять либо в начале реакции, и/или дополнительный кофактор добавляют в процессе реакции.
Соединение, представляющее собой субстрат, в реакционных смесях может варьироваться, принимая во внимание, например, желаемое количество соединения-продукта, эффект концентрации субстрата на ферментативную активность, стабильность фермента в реакционных условиях и процент преобразования субстрата в продукт. В некоторых вариантах воплощения, подходящие реакционные условия включают нагрузку соединения, представляющего собой субстрат, по меньшей мере от около 0,5 до около 200 г/л, от 1 до около 200 г/л, от 5 до около 150 г/л, от около 10 до около 100 г/л, от 20 до около 100 г/л или от около 50 до около 100 г/л. В некоторых вариантах воплощения, подходящие реакционные условия включают нагрузку соединения, представляющего собой субстрат, по меньшей мере около 0,5 г/л, по меньшей мере около 1 г/л, по меньшей мере около 5 г/л, по меньшей мере около 10 г/л, по меньшей мере около 15 г/л, по меньшей мере около 20 г/л, по меньшей мере около 30 г/л, по меньшей мере около 50 г/л, по меньшей мере около 75 г/л, по меньшей мере около 100 г/л, по меньшей мере около 150 г/л или по меньшей мере около 200 г/л, или даже больше.
Улучшенная активность и/или стереоселективность генно-инженерных трансаминазных полипептидов, раскрытых в настоящей заявке, обеспечивает способы, где более высокий процент конверсии можно получить с использованием более низких концентраций генно-инженерного полипептида. В некоторых вариантах воплощения способа, подходящие реакционные условия включают концентрацию генно-инженерного полипептида от около 0,01 до около 50 г/л; от около 0,05 до около 50 г/л; от около 0,1 до около 40 г/л; от около 1 до около 40 г/л; от около 2 до около 40 г/л; от около 5 до около 40 г/л; от около 5 до около 30 г/л; от около 0,1 до около 10 г/л; от около 0,5 до около 10 г/л; от около 1 до около 10 г/л; от около 0,1 до около 5 г/л; от около 0,5 до около 5 г/л; или от около 0,1 до около 2 г/л. В некоторых вариантах воплощения, трансаминазный полипептид присутствует в концентрации около 0,01, 0,05, 0,1, 0,2, 0,5, 1, 2, 5, 10, 15, 20, 25, 30, 35, 40 или 50 г/л.
В процессе реакций трансаминирования, pH реакционной смеси может изменяться. pH реакционной смеси можно поддерживать при желательном значении pH или в пределах желаемого диапазона pH. Это можно осуществить путем добавления кислоты или основания, до и/или в процессе реакции. Альтернативно, pH можно контролировать с использованием буфера. Соответственно, в некоторых вариантах воплощения, реакционные условия включают буфер. Подходящие буферы для поддержания желаемого диапазона pH известны из уровня техники и включают, в качестве примера, а не для ограничения, боратный, карбонатный, фосфатный, триэтаноламиновый буфер и подобные. В некоторых вариантах воплощения, буфер представляет собой борат. В некоторых вариантах воплощения способа, подходящие реакционные условия включают буферный раствор триэтаноламина, где концентрация триэтаноламина составляет от около 0,01 до около 0,4 M, от 0,05 до около 0,4 M, от 0,1 до около 0,3 M или от около 0,1 до около 0,2 M. В некоторых вариантах воплощения, реакционные условия включают концентрацию триэтаноламина около 0,01, 0,02, 0,03, 0,04, 0,05, 0,07, 0,1, 0,12, 0,14, 0,16, 0,18, 0,2, 0,3, или 0,4 M. В некоторых вариантах воплощения, реакционные условия включают воду в качестве подходящего растворителя, без присутствия какого-либо буфера.
В вариантах воплощения способа, реакционные условия могут включать подходящее значение pH. Желаемое значение pH или желаемый диапазон pH можно поддерживать путем использования кислоты или основания, подходящего буфера, или использование буфера в сочетании с добавлением кислоты или основания. pH реакционной смеси можно контролировать до и/или в процессе реакции. В некоторых вариантах воплощения, подходящие реакционные условия включают pH раствора при значении pH от около 6 до около 12, pH от около 6 до около 10, pH от около 6 до около 8, pH от около 7 до около 10, pH от около 7 до около 9 или pH от около 7 до около 8. В некоторых вариантах воплощения, реакционные условия включают pH раствора около 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5, 10, 10,5, 11, 11,5 или 12.
В вариантах воплощения способов, описанных в настоящей заявке, подходящую температуру можно использовать для реакционных условий, например, принимая во внимание повышение скорости реакции при более высоких температурах, и активность фермента в ходе осуществления реакции. Например, генно-инженерные полипептиды по настоящему изобретению имеют повышенную стабильность в отношении трансаминазного полипептида природного происхождения, например, полипептида дикого типа SEQ ID NO: 2, что позволяет использовать генно-инженерные полипептиды при более высоких температурах для повышения скорости конверсии и улучшенных характеристик растворимости субстрата для реакции. Соответственно, в некоторых вариантах воплощения, подходящие реакционные условия включают температуру от около 10°C до около 70°C, от около 10°C до около 65°C, от около 15°C до около 60°C, от около 20°C до около 60°C, от около 20°C до около 55°C, от около 30°C до около 55°C или от около 40°C до около 50°C. В некоторых вариантах воплощения, подходящие реакционные условия включают температуру около 10°C, 15°C, 20°C, 25°C, 30°C, 35°C, 40°C, 45°C, 50°C, 55°C, 60°C, 65°C или 70°C. В некоторых вариантах воплощения, температуру в процессе ферментативной реакции можно поддерживать при температуре на протяжении всего процесса реакции. В некоторых вариантах воплощения, температуру в процессе ферментативной реакции можно регулировать в соответствии с температурным профилем в ходе реакции.
Способы по настоящему изобретению, как правило, осуществляют в растворителе. Подходящие растворители включают воду, водные буферные растворы, органические растворители, полимерные растворители и/или системы со-растворителей, которые, как правило, включают водные растворители, органические растворители и/или полимерные растворители. Водный растворитель (вода или система водных со-растворителей) pH-буферизованным или небуферизованным. В некоторых вариантах воплощения, способы с использованием генно-инженерных трансаминазных полипептидов, как правило, осуществляют в системе водного со-растворителя, включающей органический растворитель (например, этанол, изопропанол (IPA), диметилсульфоксид (DMSO), этилацетат, бутилацетат, 1-октанол, гептан, октан, метил-трет-бутиловый эфир (MTBE), толуол и подобные), ионные или полярные растворители (например, 1 этил 4 метилимидазолий тетрафторборат, 1 бутил 3 метилимидазолий тетрафторборат, 1 бутил 3 метилимидазолий гексафторфосфат, глицерин, полиэтиленгликоль и подобные). В некоторых вариантах воплощения, со-растворитель может представлять собой полярный растворитель, такой как полиол, диметилсульфоксид, DMSO или низший спирт. Не-водный компонент со-растворителя водной системы со-растворителя может быть смешиваемым с водным компонентом, образуя одну жидкую фазу, или может быть частично смешиваемым или несмешиваемым с водным компонентом, образуя две жидких фазы. Примеры водных систем со-растворителей могут включать воду и один или несколько со-растворителей, выбранных из органического растворителя, полярного растворителя и полиола. Как правило, со-растворитель как компонент водной системы со-растворителя выбирают таким образом, чтобы не оказывал вредного дезактивирующего действия на трансаминазный фермент в реакционных условиях. Подходящие системы со-растворителей легко можно определить путем измерения ферментативной активности определенного генно-инженерного трансаминазного фермента с использованием определенного субстрата, представляющего интерес, в системе растворителя-кандидате, с использованием анализа ферментативной активности, такого как анализы, описанные в настоящей заявке.
В некоторых вариантах воплощения способа, подходящие реакционные условия включают водный со-растворитель, где со-растворитель включает полиольный растворитель, в частности, гликоли. Примеры подходящих полиольный растворителей включают, в качестве примера, а не для ограничения, полиэтиленгликоль, метиловый эфир полиэтиленгликоля, диметиловый эфир диэтиленгликоля, диметиловый эфир триэтиленгликоля и полипропиленгликоль. В некоторых вариантах воплощения, водный со-растворитель включает полиэтиленгликоль, который является доступным с разной молекулярной массой. В частности, полезными являются низкомолекулярные гликоли, такие как PEG200-PEG600. Соответственно, в некоторых вариантах воплощения, водный со-растворитель включает PEG200 от около 1% до около 40% об/об; от около 1% до около 40% об/об; от около 2% до около 40% об/об; от около 5% до около 40% об/об; от 2% до около 30% об/об; от 5% до около 30% об/об; от 1 до около 20% об/об; от около 2% до около 20% об/об; от около 5% до около 20% об/об; от около 1% до около 10% об/об; от около 2% до около 10% об/об. В некоторых вариантах воплощения, подходящие реакционные условия включает водный со-растворител, включающий PEG200 при около 1%, 2%, 5%, 10%, 15%, 20%; 25%; 30%; 35%; 35% или около 40% об/об.
В некоторых вариантах воплощения способа, подходящие реакционные условия включают водный со-растворитель, где со-растворитель включает DMSO при около 1% до около 80% (об/об), от около 1 до около 70% (об/об), от около 2% до около 60% (об/об), от около 5% до около 40% (об/об), от 10% до около 40% (об/об), от 10% до около 30% (об/об) или от около 10% до около 20% (об/об). В некоторых вариантах воплощения способа, подходящие реакционные условия включают водный со-растворитель включающий DMSO при по меньшей мере, около 1%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% или 80% (об/об).
Количества взаимодействующих веществ, используемые в реакции трансаминирования, как правило, варьируются в зависимости от желаемого количества продукта и одновременно от используемого количества трансаминазного субстрата. Специалистам в данной области должно быть понятно, как варьировать эти количества для их подгонки для получения желаемого уровня производительности и к масштабу производства.
В некоторых вариантах воплощения, порядок добавления взаимодействующих веществ не является критичным. Взаимодействующие вещества могут быть добавлены вместе одновременно с растворителем (например, однофазным растворителем, двухфазной системой водных со-растворителей и подобными), или альтернативно, некоторые из взаимодействующих веществ можно добавлять отдельно, а некоторые вместе, в разные точки времени. Например, кофактор, трансаминазу и трансаминазный субстрат можно добавлять сначала к растворителю.
Твердые взаимодействующие вещества (например, фермент, соли и т.д.) могут обеспечиваться для реакции в самых разнообразных формах, включая порошок (например, лиофилизированный, высушенный путем распыления и подобные), раствор, эмульсию, суспензию и т.п. Взаимодействующие вещества могут быть легко лиофилизированы или высушены путем распыления с использованием способов и оборудования, которые известны специалистам в данной области. Например, раствор белка можно заморозить при -80ºC небольшими аликвотами, затем добавлять предварительно охлажденную лиофилизационную камеру, с последующим приложением вакуума.
Для улучшения эффективности смешивания, когда используют водную систему со-растворителя, сначала можно добавить трансаминазу и кофактор и смешать в водной фазе. Затем можно добавить органическую фазу и смешать, с последующим добавлением трансаминазного субстраат. Альтернативно, трансаминазный субстрат можно предварительно смешать в органической фазе, перед добавлением к водной фазе.
Реакции трансаминирования, как правило, дают осуществиться до тех пор, пока дальнейшее преобразование кетонового субстрата в аминовый продукт не будет сушественно изменяться по мере осуществления реакции, например, когда происходит преобразование менее чем 10% субстрата, или когда происходит преобразование менее чем 5% субстрата). В некоторых вариантах воплощения, реакции дают осуществиться вплоть до полного или почти полного преобразования кетонового субстрата в аминовый продукт. Пребразование субстрата в продукт можно отслеживать с использованием известных методов детекции субстрата и/или продукта. Подходящие методы включают газовую хроматографию, ВЭЖХ, и подобные. В результате конверсии выходы хирального аминового продукта, образованного в реакционной смеси, как правило больше чем около 50%, также могут быть больше чем около 60%, также могут быть больше чем около 70%, также могут быть больше чем около 80%, также могут быть больше чем 90%, и часто больше чем около 97%. В некоторых вариантах воплощения, способы получения соединений формулы (II) с использованием генно-инженерного трансаминазного полипептида в подходящих реакционных условиях обеспечивают по меньшей мере, около 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более конверсии кетонового субстрата, например, соединения формулы (I), в аминовый продукт, например, соединение формулы (II), в течение около 48 часов или меньше, в течение около 36 часов или меньше, в течение около 24 часов или меньше, или даже в течение меньшего времени.
В некоторых вариантах воплощения способа, подходящие реакционные условия включают нагрузку субстрата, т.е. соединения, используемого в качестве субстрата, по меньшей мере около 20 г/л, 30 г/л, 40 г/л, 50 г/л, 60 г/л, 70 г/л, 100 г/л или более, и при этом способ обеспечивает по меньшей мере, около 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более конверсию соединения-субстрат в соединение-продукт, в течение около 48 часов или меньше, в течение около 36 часов или меньше или в течение около 24 часов или меньше.
Генно-инженерные трансаминазные полипептиды по настоящему изобретению при использовании в способе в подходящих реакционных условиях обеспечивают энантиомерный избыток хирального амина по меньшей мере, 97%, 98, 99%, 99,1%, 99,2%, 99,3%, 99,4%, 99,5%, 99,6%, 99,7%, 99,8% или 99,9%. э.и.
В следующем варианте воплощения способов преобразования соединения-субстрат в продукт, представляющий собой аминовое соединение, с использованием генно-инженерных трансаминазных полипептидов подходящие реакционные условия включают начальную загрузку субстрата в реакционный раствор, который затем контактирует с полипептидом. К этому реакционному раствору затем добавляют дополнительное количество субстрата в виде непрерывного добавления в течение некоторого времени при скорости по меньшей мере около 1 г/л/час, по меньшей мере около 2 г/л/час, по меньшей мере около 4 г/л/час, по меньшей мере около 6 г/л/час, или при более высокой скорости. Таким образом, в соответствии с этими подходящими реакционными условиями, полипептид добавляют к раствору, имеющему начальную нагрузку субстрата по меньшей мере около 20 г/л, 30 г/л или 40 г/л. После этого добавления полипептида следует непрерывное добавление дополнительного субстрата к раствору при скорости около 2 г/л/час, 4 г/л/час или 6 г/л/час вплоть до достижения намного более высокой конечной нагрузки субстрата по меньшей мере около 30 г/л, 40 г/л, 50 г/л, 60 г/л, 70 г/л, 100 г/л, 150 г/л, 200 г/л или более. Соответственно, в некоторых вариантах воплощения способа, подходящие реакционные условия включают добавление полипептида к раствору, имеющему начальную нагрузку субстрата по меньшей мере около 20 г/л, 30 г/л или 40 г/л, с последующим добавлением дополнительного субстрата к раствору при скорости около 2 г/л/час, 4 г/л/час или 6 г/л/час вплоть до достижения конечной нагрузки субстрата по меньшей мере около 30 г/л, 40 г/л, 50 г/л, 60 г/л, 70 г/л, 100 г/л или более. Это условие реакции, включающее добавление субстрата, делает возможным достижение более высоких нагрузок субстрата, поддерживая при этом высокие скорости конверсии кетонового субстрата в аминовый продукт по меньшей мере около 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или больше. В некоторых вариантах воплощения этого способа, добавляемый дополнительный субстрат находится в растворе, включающем изопропиламин или изопропиламинацетат в концентрации по меньшей мере около 0,5 M, по меньшей мере около 1,0 M, по меньшей мере около 2,5 M, по меньшей мере около 5,0 M, по меньшей мере около 7,5 M, по меньшей мере около 10,0 M.
В некоторых вариантах воплощения способов, реакция трансаминирования с использованием генно-инженерного трансаминазного полипептида может включать следующие подходящие реакционные условия: (a) нагрузка субстрата от около 5 г/л до 200 г/л; (b) от около 0,1 до 50 г/л трансаминазного полипептида; (c) от около 0,1 доo 4 M изопропиламина (IPM); (d) от около 0,1 до 10 г/л пиридоксалфосфатного (PLP) кофактора; (e) pH около 6-9; и (f) температура около 30-60°C.
В некоторых вариантах воплощения способов, реакция трансаминирования с использованием генно-инженерного трансаминазного полипептида может включать следующие подходящие реакционные условия: (a) нагрузка субстрата от около 5 до около 20 г/л; (b) от около 0,05 до 2 г/л трансаминазного полипептида; (c) от около 1 до 10% об/об PEG200; (d) от около 1 до 2 M изопропиламина (IPM); (e) от около 0,1 до 1 г/л пиридоксалфосфатного (PLP) кофактора; (f) от около 0,1 до около 0,5 M триэтаноламина (TEA); (g) pH около 6-8; и (h) температура около 45-55°C.
В некоторых вариантах воплощения способов, реакция трансаминирования с использованием генно-инженерного трансаминазного полипептида может включать следующие подходящие реакционные условия: (a) нагрузка субстрата от около 25 до около 100 г/л; (b) от около 0,5 до 10 г/л трансаминазного полипептида; (c) от около 1 до 10% об/об PEG200; (d) от около 1 до 2 M изопропиламина (IPM); (e) от около 0,1 до 1 г/л пиридоксалфосфатного (PLP) кофактора; (f) от около 0,1 до около 0,5 M триэтаноламина; (g) pH около 6-8; и (h) температура около 45-55°C.
В некоторых вариантах воплощения, используют дополнительные реакционные компоненты или осуществляют дополнительные процедуры, в дополнение к реакционным условиям. Это может включать принятие мер для стабилизации или предотвращения инактивации фермента, уменьшения ингибирования продуктом, сдвига реакционного равновесия к образованию аминового продукта.
Соответственно, в некоторых вариантах воплощения способа получения амина, такого как хиральный амин, можно добавить дополнительное количество амино-акцептора (вплоть до насыщения), и/или образующийся амино-акцептор (кетон) можно непрерывно удалять из реакционной смеси. Например, образующий мостик растворитель или двухфазную систему со-растворителей можно использовать для продвижения аминового продукта в экстракционный раствор и, таким образом, уменьшить ингибирование посредством аминового продукта, а также сдвинуть равновесие к образованию продукта (см. например, Yun и Kim, 2008, Biosci. Biotechnol. Biochem. 72(11): 3030-3033).
В некоторых вариантах воплощения способов, подходящие реакционные условия включают присутствие восстановленного кофактора, никотинамидадениндинуклеотида (NADH), который может действовать как ограничивающий инактивацию трансаминазного фермента (см., например, van Ophem et al., 1998, Biochemistry 37(9): 2879-88). В таких вариантах воплощения, где присутствует NADH, можно использовать систему восстановления кофактора, такую как глюкозодегидрогеназа (GDH) и глюкоза или формиатдегидрогеназа и формиат, для восстановления NADH в реакционной среде.
В некоторых вариантах воплощения, способ может дополнительно включать удаление карбонильного побочного продукта, образованного из донора аминогруппы, когда осуществляется перенос аминогруппы к акцептору аминогруппы. Такое удаление in situ может снизить скорость обратной реакции так, чтобы прямая реакция доминировала и больше субстрата затем преобразовывалось в продукт. Удаление карбонильного побочного продукта можно осуществлять различными способами. Когда донор аминогруппы представляет собой аминокислоту, такую как аланин, карбонильный побочный продукт, кетокислоту, можно удалить путем взаимодействия с пероксидом (см. например, US 2008/0213845, включенный в настоящую заявку посредством ссылки). Пероксиды, которые можно использовать, включают, среди прочего, перекись водорода; пероксикислоты (перкислоты), такие как перуксусная кислота (CH3CO3H), трифторперуксусная кислота и метахлорпероксибензойная кислота; органические пероксиды, такие как трет-бутилпероксид ((CH3)3COOH), или другие селективные окислители, такие как тетрапропиламмония перрутенат, MnO2, KMnO4, тетроксид рутения и родственные соединения. Альтернативно, удаление пирувата можно осуществить через его восстановление до лактата с использованием лактатдегидрогеназы для сдвига равновесия к аминовому продукту (см. например, Koszelewski et al., 2008, Adv. Syn. Catal,350: 2761-2766). Удаление пирувата также можно осуществить через его декарбоксилирование с использованием пируватдекарбоксилазы (см. например, Höhne et al., 2008, Chem BioChem 9: 363-365) или ацетолактатсинтазы (см. Yun and Kim, supra).
Альтернативно, в вариантах воплощения, где аминокислоту используют в качестве донора аминогруппы, кетокислотный карбонильный побочный продукт может быть рециклирован обратно в аминокислоту путем взаимодействия с аммиаком и NADH с использованием подходящего дегидрогеназного фермента, например, аминокислотной дегидрогеназы, в присутствии амино-донора, такого как аммиак, пополняя, таким образом, донор аминогруппы.
В некоторых вариантах воплощения, где выбор амино-донора приводит к карбонильному побочному продукту, который имеет давление паров выше, чем у воды (например, низкокипящий ко-продукт, такой как летучее органическое карбонильное соединение), карбонильный побочный продукт можно удалить путем барботирования реакционного раствора не-реактивным газом или путем приложения вакуума к низкому реакционному давлению и удаления карбонильного побочного продукта, присутствующего в газовой фазе. Не-реактивный газ представляет собой любой газ, который не взаимодействует с реакционными компонентами. Различные не-реактивные газы включают азот и благородные газы (например, инертные газы). В некоторых вариантах воплощения, не-реактивный газ представляет собой газообразный азот. В некоторых вариантах воплощения, амино-донор, используемый в способе, представляет собой изопропиламин (IPM), который образует карбонильный побочный продукт ацетон при переносе аминогруппы к акцептору аминогруппы. Ацетон можно удалить путем барботирования газообразным азотом или приложения вакуума к реакционному раствору и удаления ацетона из газовой фазы при помощи ловушки для ацетона, такой как холодильник или другая холодная ловушка. Альтернативно, ацетон можно удалить путем восстановления до изопропанола с использованием трансаминазы.
В некоторых вариантах воплощения способы, описанные выше, где удаляют карбонильный побочный продукт, можно добавить соответствующий донор аминогруппы в процессе реакции трансаминирования для пополнения донора аминогруппы и/или поддержания pH реакции. Пополнение донора аминогруппы также сдвигает равновесие к образованию продукта, таким образом увеличивая конверсию субстрата в продукт. Таким образом, в некоторых вариантах воплощения, где донор аминогруппы представляет собой изопропиламин, и ацетоновый продукт удаляют in situ, изопропиламин можно добавить к раствору для пополнения донора аминогруппы, утраченного в процессе удаления ацетона, и для поддержания pH реакции (например, при около 8,5).
В следующих вариантах воплощения, любой из описанных выше способов преобразования соединения-субстрат в соединение-продукт может дополнительно включать одну или несколько стадий, выбранных из следующих: экстракция; выделение; очистка; и кристаллизация соединения, являющегося продуктом. Способы, процедуры и протоколы для экстракции, выделения, очистки и/или кристаллизации аминового продукта из биокаталитических реакционных смесей, полученных раскрытыми выше способами, известны рядовым специалистам в данной области, и/или могут быть определены путем рутинного экспериментирования. Кроме того, иллюстративные способы представлены в примерах ниже.
Раздел J: Примеры
Следующие Примеры служат для иллюстрации настоящего изобретения, не ограничивая его объем, в то время как они, с другой стороны, представляют предпочтительные варианты воплощения реакционных стадий, промежуточных соединений и/или способа по настоящему изобретению.
Пример 1: Синтез кетонового промежуточного соединения
6-Хлор-5-фтор-3-гидрокси-3-(2-оксо-пропил)-1,3-дигидро-индол-2-он

К суспензии 6-хлор-5-фтор-изатина (25 г, 125 ммоль) в ацетоне (620 мл) добавляли Et2NH (0,9 г, 12,5 ммоль) и K2CO3 (1,7 г, 12,5 ммоль). Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь фильтровали и растворитель удаляли при пониженном давлении. Неочищенный продукт снова растворяли в MeOH (300 мл) при 50oC и добавляли воду (300 мл). При добавлении воды осаждалось твердое вещество. MeOH (250 мл) удаляли при пониженном давлении при 50oC; Смесь охлаждали до 0-5oC и перемешивали в течение 30 минут; Твердое вещество фильтровали и сушили с получением 6-хлор-5-фтор-3-гидрокси-3-(2-оксо-пропил)-1,3-дигидро-индол-2-она (27 г). 1H ЯМР (DMSO-d6): 2,00 (3H, с, CH3), 3,09 (1H, д, CH, J=16 Гц), 3,39 (1H, д, CH, J=16 Гц), 6,16 (1H, с, OH); 6,88 (1H, д, CH, J=8Гц), 7,36 (1H, д, CH, J=12 Гц), 10,37 (1H, с, NH). MS (ESI) m/z 258,0 (M+H)+. ВЭЖХ способ: Колонка: Agilent Extend-C18; 150×3,0 мм; 3,5 мкм. Подвижная фаза A (0,1% H3PO4) в воде; Подвижная фаза B (Ацетонитрил). Градиент: 0 мин (95% A); 0,5 мин (95% A), 14 мин (5% A), 19,5 мин (5% A). Скорость потока: 0,5 мл/мин-1. Длина волны: 210 нм. Температура: 40oC. Время удерживания: 7,52 мин.
6-Хлор-5-фтор-3-гидрокси-3-(2-метил-[1,3]диоксолан-2-илметил)-1,3-дигидро-индол-2-он

К суспензии 6-хлор-5-фтор-3-гидрокси-3-(2-оксопропил)индолин-2-она (25 г, 97 ммоль) в этиленгликоле (250 мл) добавляли триэтилортоформиат (43 г, 291 ммоль) и моногидрат толуол-4-сульфоновой кислоты (0,9 г, 4,8 ммоль). Реакционную смесь нагревали при 40-50oC в течение 2 часов. Последовательно добавляли MeТГФ (500 мл) и 10% водный раствор NaCl (500 мл). Органический слой отделяли и промывали водой два раза. После выпаривания растворителя в вакууме белое твердое вещество промывали при помощи TBME (400 мл) и сушили с получением 6-хлор-5-фтор-3-гидрокси-3-(2-метил-[1,3]диоксолан-2-илметил)-1,3-дигидро-индол-2-она (27,8 г). 1H ЯМР (DMSO-d6): 1,00 (3H, с, CH3), 2,37 (2H, д, CH2,), 3,13 (1H, кв., CHH,), 3,58 (1H, кв., CHH,), 3,59 (1H, кв., CHH,), 3,68 (1H, кв., CHH,), 6,00 (1H, с, OH); 6,85 (1H, д, CH, J=8 Гц), 7,31 (1H, д, CH, J=12 Гц), 10,24 (1H, с, NH). MS (ESI) m/z 302,0 (M+H)+. ВЭЖХ способ: Колонка: Agilent Extend-C18; 150×3,0 мм; 3,5 мкм. Подвижная фаза A (0,1% H3PO4) в воде; Подвижная фаза B (Ацетонитрил). Градиент: 0 мин (95% A); 0,5 мин (95% A), 14 мин (5% A), 19,5 мин (5% A). Скорость потока: 0,5 мл/мин-1. Длина волны: 210 нм. Температура: 40oC. Время удерживания: 7,94 мин.
1-(6-Хлор-5-фтор-1H-индол-3-ил)-пропан-2-он

К раствору 6-хлор-5-фтор-3-гидрокси-3-((2-метил-1,3-диоксолан-2-ил)метил)индолин-2-она (27,8 г, 92 ммоль) в ТГФ (250 мл) добавляли Red-Al (79,8 г, 276 ммоль) в ТГФ (100 мл) медленно при 60oC в атмосфере N2. После добавления смесь перемешивали при комнатной температуре в течение 3 часов. Добавляли 20% раствор HCl (400 мл) и смесь перемешивали в течение 20 минут. Добавляли этилацетат (500 мл) и перемешивали в течение 10 минут. Органический слой отделяли и промывали водой (100 мл ×2); После обработки при помощи Na2SO4 (50 г) и активированного угля (5 г) при комнатной температуре, смесь фильтровали и фильтрат концентрировали. Неочищенный продукт перекристаллизовывали при помощи MeOH (80 мл) и воды (60 мл) с получением 1-(6-хлор-5-фтор-1H-индол-3-ил)-пропан-2-она (15,5 г). 1H ЯМР (DMSO-d6): 2,21 (3H, с, CH3), 3,78 (2H, с, CH2,), 7,13 (1H, д, CH, J=4 Гц); 7,23 (1H, д, CH, J=8 Гц), 7,33 (1H, д, CH, J=8 Гц), 8,23 (1H, с, NH). MS (ESI) m/z 226,0 (M+H)+. ВЭЖХ способ: Колонка: Agilent Extend-C18; 150×3,0 мм; 3,5 мкм. Подвижная фаза A (0,1% H3PO4) в воде; Подвижная фаза B (Ацетонитрил). Градиент: 0 мин (95% A); 0,5 мин (95% A), 14 мин (5% A), 19,5 мин (5% A). Скорость потока: 0,5 мл/мин-1. Длина волны: 210 нм. Температура: 40ºC. Время удерживания: 10,75 мин.
Пример 2: Второй альтернативный синтез кетонового исходного вещества
1-(6-Хлор-5-фтор-1H-индол-3-ил)-пропан-2-он
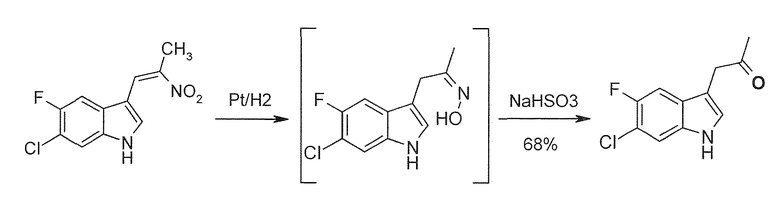
В атмосфере N2, Pt/C (10 г, 5% Pt на углероде) добавляли к суспензии 6-хлор-5-фтор-3-((Z)-2-нитро-пропенил)-1H-индола (100 г, 0,39 моль) в этилацетате (500 мл). Реакционную смесь вакуумировали и продували при помощи H2 три раза и перемешивали при комнатной температуре в течение ночи. Катализатор отфильтровывали и органический растворитель удаляли при пониженном давлении с получением коричневого масла. Масло снова растворяли в EtOH (500 мл) и добавляли бисульфит натрия (81,7 г, 0,79 моль) в H2O (). Суспензию нагревали до 80oC в течение ночи. Осадок отфильтровывали и этанол удаляли под давлением. Остаток разбавляли водой (500 мл) и экстрагировали этилацетатом (300 мл ×2). Объединенный органический слой сушили над Na2SO4 и конденсировали на роторном испарителе с получением коричневого масла (53 г, 60% выход).
Пример 3: Второй альтернативный синтез кетонового промежуточного соединения
1-(6-Хлор-5-фтор-1H-индол-3-ил)-пропан-2-он
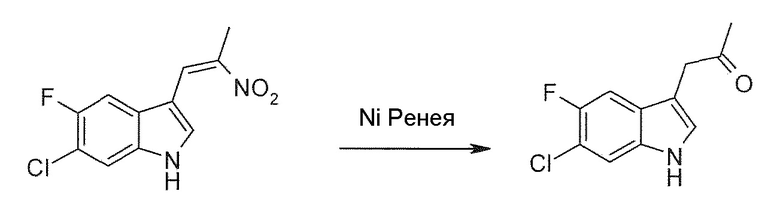
Ni Ренея (0,75 г) и уксусную кислоту (1,1 мл, 19,6 ммоль) добавляли к суспензии 6-хлор-5-фтор-3-((Z)-2-нитро-пропенил)-1H-индола (5 г, 19,6 ммоль) в смеси MeOH и H2O (2:1, 50 мл) при комнатной температуре. Реакционную смесь вакуумировали и продували при помощи H2 три раза и нагревали при 50oC в течение ночи. К реакционной смеси добавляли MeOH (50 мл) и катализатор отфильтровывали через целит. Растворитель концентрировали до 50 мл и добавляли H2O (300 мл). При добавлении H2O образовывалось не совсем белое твердое вещество. Твердое вещество фильтровали и промывали водой. После сушки в печи выделяли 2,53 г не совсем белого твердого вещества.
Пример 4: Синтез, оптимизация и скрининг генно-инженерных трансаминазных полипептидов
Синтез и оптимизация гена: Полинуклеотидную последовательность, кодирующую описанный дикого типа омега трансаминазный полипептид из Vibrio fluvialis SEQ ID NO: 2, кодон-оптимизировали и синтезировали в виде гена SEQ ID NO: 1. Синтетический ген SEQ ID NO: 1 клонировали в pCK110900 векторную систему (см., например, публикацию патентной заявки США 20060195947, которая включена в настоящую заявку посредством ссылки) и затем экспрессировали в E. coli W3110fhuA. E. coli W3110 экспрессирует трансаминазные полипептиды в виде внутриклеточного белка под контролем lac промотора. Полинуклеотид (SEQ ID NO: 3), кодирующий генно-инженерный трансаминазный полипептид SEQ ID NO: 4 получали путем направленной эволюции кодон-оптимизированного гена SEQ ID NO: 1. Полипептид SEQ ID NO: 4 имеет 24 отличия аминокислотных остатков (A9T; G18A; D21H; V31M; N45H; F86Y; A133R; R146L; W147K; V153S; K163F; V177L; R211K; P233T; A235P; P244T; M294V; P318D; A323T; S324G; A383V; T391A; C424A; F427Y) по сравнению с SEQ ID NO: 2. Этот синтетический ген SEQ ID NO: 3 (кодирующий полипептид SEQ ID NO: 4) использовали в качестве исходного скелета для дальнейшей оптимизации с использованием стандартных способов направленной эволюции через образование библиотеки повторяющихся вариантов путем синтеза гена, с последующим скринингом и секвенированием точных попаданий для генерирования генов, кодирующих генно-инженерные трансаминазы, способные к преобразованию соединения (IA) в соединение (IIA), с улучшенными ферментными свойствами по сравнению с полипептидами SEQ ID NOs: 2 и 4. Полученные последовательности генно-инженерного трансаминазного полипептида и специфические мутации и относительные активности представлены в Таблице 2A.
Пример 5: Продукция генно-инженерных трансаминаз
Генно-инженерные трансаминазные полипептиды получали в E. coli W3110 в виде внутриклеточного белка под контролем lac промотора. Полипептид аккумулируется преимущественно в виде растворимого цитозольного активного фермента. Процедуру с использованием встряхиваемой колбы используют для получения генно-инженерных полипептидов в виде порошков, которые могут быть использованы в анализах активности или биокаталитическом способе, раскрытом в настоящей заявке.
Высокопроизводительный рост & экспрессия. Клетки собирали и выращивали в течение ночи в LB среде, содержащей 1% глюкозы и 30 мкг/мл хлорамфеникола (CAM), 30°C, 200 об/мин, 85% влажности. 20 мкл культуры, выращенной в течение ночи, переносили в планшет с глубокими лунками, содержащий 380 мкл 2xYT питательной среды, содержащей 30 мкг/мл CAM, 1 мМ IPTG, 1 мМ MgSO4, и инкубировали в течение ~18 часов при 30°C, 200 об/мин, 85% влажности. Исходная культуральная TB среда состояла из TB среды (380 мкл/лунка), 30 мкг/мл CAM, 1 мМ MgSO4, и 1 мМ IPTG. Клеточные культуры центрифугировали при 4000 об/мин, 4°C в течение 10 мин., и среду сливали. Клеточные осадки после центрифугирования ресуспендировали в 200 или 400 мкл Лизисного Буфера (0,1 M триэтаноламиновый (TEA) буфер, pH 9,0, содержащий 1 мМ MgSO4, 400 мкг/мл PMBS и 500 мкг/мл Лизозима), как описано ниже.
Получение порошков (SFP) с использованием встряхиваемой колбы: Процедуру с использованием встряхиваемой колбы использовали для получения генно-инженерных трансаминазных полипептидов в форме порошков, используемых во вторичных скрининговых анализах или в биокаталитическом способе, раскрытом в настоящей заявке. Содержащийся во встряхиваемой колбе порошок (SFP) включает приблизительно 30% общего количества белка и, соответственно, обеспечивает более очищенный препарат генно-инженерного фермента по сравнению с клеточным лизатом, используемым в HTP анализах. Одну микробную колонию E. Coli, содержащую плазмиду, кодирующую генно-инженерную трансаминазу, представляющую интерес, инокулировали в 50 мл Luria Bertani бульона, содержащего 30 мкг/мл хлорамфеникола и 1% глюкозы. Клетки выращивали в течение ночи (по меньшей мере 16 часов) в инкубаторе при 30°C при встряхивании при 250 об/мин. Культуру разводили в 250 мл бульона Terrific Broth (12 г/л бакто-триптона, 24 г/л дрожжевого экстракта, 4 мл/л глицерина, 65 мМ фосфата калия, pH 7,0, 1 мМ MgSO4), содержащего 30 мкг/мл хлорамфеникола, в 1-л колбе до оптической плотности при 600 нм (OD600) 0,2 и давали расти при 30°C. Экспрессию трансаминазного гена индуцировали путем добавления изопропил-β-D-тиогалактозида (“IPTG”) до конечной концентрации 1 мМ, когда OD600 культуры было 0,6-0,8, и инкубацию затем продолжали в течение ночи (по меньшей мере 16 часов). Клетки собирали центрифугированием (5000 об/мин, 15 мин, 4°C) и супернатант сливали. Полученный в результате центрифугирования клеточный осадок ресуспендировали с равным объемом холодного (4°C) 100 мМ триэтаноламинового (хлоридного) буфера, pH 7,0 (необязательно включающего 2 мМ MgSO4) и собирали путем центрифугирования, как указано выше. Промытые клетки ресуспендировали в двух объемах холодного триэтаноламинового (хлоридного) буфера и пропускали через French Press два раза при 12000 ф/дюйм2, поддерживая при этом при при 4°C. Клеточный дебрис удаляли центрифугированием (9000 об/мин, 45 минут, 4°C). Прзрачный содержащий лизат супернатант собирали и хранили при -20°C. Лиофилизация замороженного прозрачного лизата обеспечивала полученный методом встряхиваемой колбы неочищенный трансаминазный полипептид в виде сухого порошка. Альтернативно, полученный в результате центрифугирования клеточный осадок (до или после промывки) хранили при 4°C или -80°C.
Получение порошков методом последовательной обработки (DSP): DSP порошки содержат приблизительно 80% общего количества белка и, соответственно, обеспечивают более очищенный препарат генно-инженерного фермента по сравнению с клеточным лизатом, используемым в высокопроизводительном анализе. Более крупномасштабную (~100-120 г) ферментацию генно-инженерной трансаминазы для получения DSP порошков можно осуществить с использованием способа короткого дозирования с последующей подпиткой, в соответствии со стандартными биотехнологическими способами. Вкратце, экспрессию трансаминазы индуцируют путем добавления IPTG до конечной концентрации 1 мМ. После ферментации клетки собирают и ресуспендируют в 100 мМ Триэтаноламин-H2SO4 буфера, затем механически разрывают путем гомогенизации. Флокуляцию клеточного дебриса и нуклеиновой кислоты осуществляют с использованием полиэтиленимина (PEI) и суспензию осветляют путем центрифугирования. Полученный прозрачный супернатант концентрируют с использованием тангенциальной поперечноточной ультрафильтровальной мембраны для удаления солей и воды. Концентрированный и частично очищенный концентрат фермента затем может быть высушен в лиофилизаторе и упакован (например, в полиэтиленовые контейнеры).
Пример 6: Аналитические процедуры
ВЭЖХ Анализ HTP реакций: Аликвоту гашеной реакционной смеси подвергали ВЭЖХ анализу при следующих условиях.
Субстратные примеси: 1,8 мин;
Кетоновый субстрат соединение (IA): 2,7 мин
Преобразование соединения (IA) в соединение (IIA) определяли из полученных хроматограмм следующим образом:
Конверсия (%) = Площадь продукта/(Площадь продукта + Площадь субстрата × 0,73) × 100%
ВЭЖХ Анализ реакций в масштабе 5 мл и 100 мл: Аликвоты гашеной реакционной смеси подвергали ВЭЖХ анализу при следующих условиях.
Кетоновый субстрат соединение (IA):7,6 мин
Преобразование соединения (IA) в соединение (IIA) определяли из хроматограмм следующим образом:
Конверсия (%) = Площадь продукта/(Площадь продукта + Площадь субстрата × 0,73) × 100%
Определение хиральной чистоты продукта (% э.и.): Хиральную чистоту или энантиомерный избыток соединения (IIA) оценивали при помощи ВЭЖХ с использованием следующих условий.
R-продукт: 17,9 мин;
S-продукт: 18,9 мин
Определение чистоты продукта: Чистоту продукта определяли при помощи ВЭЖХ с использованием следующих условий.
Пример 7: Высокопроизводительный (HTP) скрининг трансаминаз для преобразования соединения (IA) в соединение (IIA)
HTP Скрининговые анализы: Высокопроизводительный скрининг, используемый для ориентирования первичного выбора вариантов, осуществляли в 96-луночных планшетах с использованием клеточных лизатов в условиях анализа: 10 г/л соединения (IA); 1 мМ пиридоксалфосфата (PLP); 2 M изопропиламина (IPM), pH 7,0); 0,1 M триэтаноламина (TEA), pH 7; 5% об/об PEG200; 10 мкл лизата; и 50 или 55°C.
Клетки выращивали в 96-луночных планшетах, как описано выше, и лизаты получали путем распределения 200 мкл (для Цикла 1) или 400 мкл (для Цикла 2) лизисного буфера (1 мг/мл лизозима, 0,5 мг/мл полимиксин B сульфата, 1 мМ PLP, 0,1 M триэтаноламина (TEA), pH 7,0) в каждую лунку. Планшеты герметично закрывали, встряхивали в течение 2 часов, и затем центрифугировали в течение 20 мин при 4000 об/мин при 4°C для осаждения клеточного дебриса.
10 мкл исходного раствора субстрата (200 г/л соединения (IIA), растворенного в PEG200) добавляли в каждую лунку 96-луночного планшета с последующим добавлением 180 мкл исходного раствора изопропиламина (IPM)/пиридоксалфосфата (PLP) (2,2 M IPM и 1,06 мМ PLP в 100 мМ TEA, pH 7,0. Для оценки стойкости к ингибированию продуктом, представляющим собой Соединение (IIA), соединение (IIA) добавляли к реакционной смеси до конечной концентрации 14 г/л для Цикла 1 и 16 г/л для Цикла 2 анализов. Реакции инициировали путем добавления 10 мкл клеточного лизата/лунка. Планшеты герметично закрывали и инкубировали при встряхивании при 50 или 55°C в течение 24 часов. Реакции гасили при помощи 600 мкл ацетонитрила и образцы исследовали при помощи ВЭЖХ, как описано в примере 5.
Пример 8: Способ преобразования соединения (IA) в соединение (IIA) в масштабе 5 мл
Реакции в 5 мл масштабе осуществляли следующим образом. В 20-мл стеклянный сосуд, снабженный крестообразной магнитной мешалкой, добавляли 0,75 мл (или 0,5 мл в случае 10% об/об концентрации PEG 200) 100 мМ TEA буфера (pH 7,0). В сосуд добавляли 2 мл 5 M IPM⋅HCl исходного раствора с последующим добавлением 1 мл 5 мМ PLP исходного раствора. Смесь перемешивали при 500 об/мин (магнитная мешалка). pH смеси затем доводили до 7,0 с использованием раствора 1 M NaOH. В сосуд затем добавляли 125 мг (или 250 мг для 50 г/л или 500 мг для 100 г/л концентрации) субстрата (твердый). Затем к смеси добавляли 0,25 мл (или 0,5 мл для концентрации 10% об/об) PEG 200. Конечные концентрации компонентов были следующими: 25 г/л (или 50 или 100 г/л) соединения (IA); 1 мМ PLP; 2 M IPM; 5% об/об (или 10%) PEG 200; 2 г/л TA фермента; 100 мМ TEA, pH 7,0). Смесь затем перемешивали и нагревали до 50°C.
Реакции инициировали путем добавления 1 мл исходного раствора фермента (10 г/л). 20 мкл образцов отбирали в разные точки времени и разбавляли при помощи 750 мкл метанола и анализировали при помощи ВЭЖХ. Через 24 часа реакции гасили при помощи 5 мл ацетонитрила и образцы анализировали при помощи ВЭЖХ для получения конечного % конверсии.
Пример 9: Способ преобразования соединения (IA) в соединение (IIA) в 100 мл масштабе
Реакции в 100 мл м масштабе осуществляли следующим образом. В 250-мл круглодонную колбу, снабженную якорной мешалкой, добавляли 15 мл 100 мМ TEA буфера (pH 7). В круглодонную колбу добавляли 40 мл 5 M IPM⋅HCl исходного раствора, с последующим добавлением 20 мл 5 мМ PLP исходного раствора. Смесь перемешивали при 100 об/мин (при перемешивании сверху) и pH доводили до 7,0 с использованием 10 M NaOH. Затем в круглодонную колбу добавляли твердый субстрат-Соединение (IA) в течение ~5 мин при перемешивании. PEG 200 (5 мл) и смесь нагревали до 50°C. Затем добавляли 20 мл исходного раствора фермента (10 г/л) для запуска реакции. Реакционную смесь перемешивали при 200 об/мин (при перемешивании сверху). 20 мкл образцы отбирали в разные точки времени и разбавляли при помощи 750 мкл метанола и анализировали при помощи ВЭЖХ. В некоторых случаях, когда не осуществляли дальнейшую обработку, через 24 часа реакцию гасили при помощи 100 мл ацетонитрила и образцы анализировали при помощи ВЭЖХ для получения конечного % конверсии (Фиг. 9). Концентрации компонентов в реакции были следующими: кетон: 25 г/л (или 50 или 100 г/л); PLP: 1 мМ; IPM: 2 M; PEG200: 5% об/об; TA фермент: 2 г/л; буфер: 100 мМ TEA, pH 7,0. Преобразование субстрата в продукт анализировали при помощи ВЭЖХ, как описано в примере 3.
Обработка продукта: После 24 часов реакции в условиях, описанных выше (до точки 11), реакционную смесь охлаждали до комнатной температуры. Смесь фильтровали через стандартную G4 воронку из спеченного стекла с кусочком фильтровальной бумаги (Whatman 1, размер пор 11 мкм). Круглодонную колбу промывали при помощи 20 мл деионизированной воды, которую затем фильтровали через ту же самую воронку. Фильтровальную лепешку промывали два раза при помощи 20 мл деионизированной воды. pH фильтрата доводили от 6,8 до 3 с использованием раствора 5 M HCl. Фильтрат затем переносили в делительную воронку и экстрагировали при помощи 100 мл MTBE. Двухфазную смесь оставляли для разделения. MTBE слой, содержащий непрореагировавший субстрат и примеси, сливали. Водный слой переносили в химический стакан и добавляли 100 мл MTBE. pH водного слоя затем доводили от 3 до 10 с использованием раствора 10 M NaOH. Смесь переносили в делительную воронку и фазам давали разделиться. Водный слой затем экстрагировали при помощи 100 мл MTBE три раза (N.B.: повторяли до тех пор, пока не оставалось никакого продукта в водном слое). MTBE фазы от трех экстракций объединяли и упаривали досуха с использованием роторного испарителя. Неочищенный продукт затем сушили в вакууме в течение 48 часов.
Пример 10: Способ преобразования соединения (IA) в соединение (IIA) в 30 г масштабе
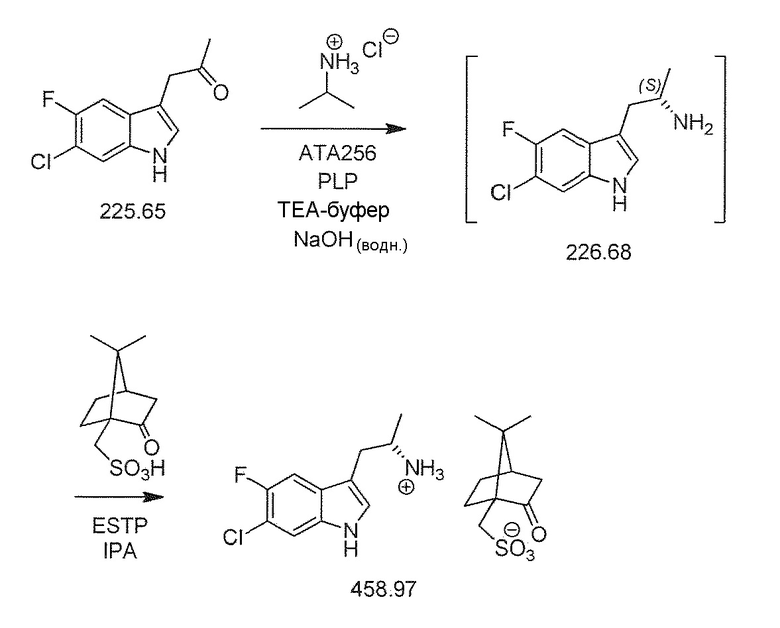
152,48 г гидрохлорида изопропиламина и 0,204 г пиридоксалфосфата моногидрата растворяли в 495 мл воды при перемешивании. К этому желтому прозрачному раствору добавляли раствор 30,0 г кетона в 85 мл полиэтиленгликоля (среднемассовая молекулярная масса 200) в течение 15 минут. При добавлении кетон осаждался в виде мелких частиц, которые равномерно распределялись в реакционной среде. К суспензии добавляли 180 мл триэтаноламинового буфера (0,1 моль/л, pH 7) и pH доводили до 7 путем добавления водного раствора гидроксида натрия (1 моль/л). Реакционную смесь нагревали до 50°C и добавляли раствор 1,62 г трансаминазы SEQ ID NO: 134, растворенной в 162 мл триэтаноламинового буфера (0,1 моль/л, pH 7). Реакционную смесь постоянно поддерживали при pH 7 путем добавления 1 моль/л водного раствора гидроксида натрия. Реакционную смесь перемешивали в течение 24 часов при 50°C и пропускали поток азота над поверхностью реакционной смеси для отгонки образовавшегося ацетона. Реакционную смесь затем охлаждали до 25°C и фильтровали через слой хлопьевидной целлюлозы. pH фильтрата доводили до ≈1 путем добавления концентрированной серной кислоты. Подкисленный фильтрат экстрагировали при помощи 250 мл изопропилацетата. Слои разделяли и pH водной фазы доводили до ≈10 путем добавления концентрированного водного раствора гидроксида натрия. Водно-щелочную фазу экстрагировали при помощи изопропилацетата. Слои разделяли и органическую фазу промывали при помощи 100 мл воды. Органическую фазу концентрировали путем дистилляции до 2/3 ее исходного объема. Во втором реакторе 33,98 г (+)-камфорсульфоновой кислоты растворяли в 225 мл изопропилацетата при нагревании до температуры кипения с обратным холодильником и добавляли концентрированную органическую фазу в течение 10 минут. После полного добавления образовавшуюся разбавленную суспензию охлаждали до 0°C в течение 2 часов и хранили при 0°C в течение 15 часов. Осажденную амин-(+)-камфорсульфонатную соль фильтровали, промывали при помощи 70 мл изопропилацетата и сушили при 40°C в вакууме с получением 51,57 г бесцветных кристаллов (84,5% выход продукта как такового).
Аналитические данные
ИК:
 (см-1)=3296, 3061, 2962, 2635, 2531, 2078, 1741, 1625, 1577, 1518, 1461, 1415,1392, 1375, 1324, 1302, 1280, 1256, 1226, 1170, 1126, 1096, 1041, 988, 966, 937, 868, 834, 814, 790, 766, 746, 719, 669, 615.
(см-1)=3296, 3061, 2962, 2635, 2531, 2078, 1741, 1625, 1577, 1518, 1461, 1415,1392, 1375, 1324, 1302, 1280, 1256, 1226, 1170, 1126, 1096, 1041, 988, 966, 937, 868, 834, 814, 790, 766, 746, 719, 669, 615.
ЖХ-МС (ESI +):
Аммониевый ион: m/z =227 ([M+H]), 268 ([M+H+CH3CN]), 453 ([2M+H]).
Камфорсульфонатный ион: m/z =250 ([M+NH4]), 482 ([2M+NH4]).
ЖХ-МС (ESI -):
Камфорсульфонатный ион: m/z=231 ([M-H]), 463 ([2M-H]).
1H-ЯМР (DMSO-d6, 400 MГц): 11,22 (шир.с, 1H), 7,75 (шир.с, 3H), 7,59 (д, J=10,3 Гц, 1H), 7,54 (д, J=6,5 Гц, 1H), 7,36 (д, J=2,3 Гц, 1H), 3,37-3,50 (м, 1H), 2,98 (дд, J=14,3, 5,8 Гц, 1H), 2,91 (д, J=14,8 Гц, 1H), 2,81 (дд, J=14,3, 8,0 Гц, 1H), 2,63-2,74 (м, 1H), 2,41 (д, J=14,6 Гц, 1H), 2,24 (дт, J=18,3, 3,8 Гц, 1H), 1,94 (т, J=4,4 Гц, 1H), 1,86 (дт, J=7,4, 3,6 Гц, 1H), 1,80 (д, J=18,1 Гц, 1H), 1,23-1,35 (м, 2H), 1,15 (д, J=6,3 Гц, 3H), 1,05 (с, 3H), 0,74 (с, 3H).
Свободный амин (получен путем упаривания изопропилацетатного слоя после экстракции водно-щелочного слоя):
1H ЯМР (400MГц, DMSO-d6): 11,04 (шир.с, 1H), 7,50 (д, J=10,5 Гц, 1H), 7,48 (д, J=6,5 Гц, 1H), 7,25 (с, 1H), 3,03 (секстет, J=6,3 Гц, 1H), 2,61 (дд, J=14,3, 6,5 Гц, 1H), 2,57 (дд, J=14,1, 6,5 Гц, 1H), 1,36 (шир.с, 2H), 0,96 (д, J=6,3 Гц, 3H).
Пример 11: Способ преобразования соединения (IIA) в соединение (IVB)

13,62 г 5-хлоризатина суспендировали в 35 мл изопропанола и добавляли 2,3 г триэтиламина. Суспензию нагревали до температуры кипения с обратным холодильником и добавляли раствор 34,42 г амин-(+)-камфорсульфонатной соли, растворенной в 300 мл изопропанола в течение 50 минут. Реакционную смесь перемешивали при температуре кипения с обратным холодильником в течение 17 часов. Реакционную смесь охлаждали до 75°C и к реакционной смеси добавляли 17,4 г (+)-камфорсульфоновой кислоты. Приблизительно 300 мл изопропанола удаляли путем вакуумной перегонки. Удаленный путем перегонки изопропанол заменяли изопропилацетатом и продолжали вакуумную перегонку. Эту перегонку повторяли снова. Для перегонки остатка добавляли 19 мл этанола и 265 мл этилацетата и смесь нагревали до температуры кипения с обратным холодильником. Смесь постепенно охлаждали до 0°C и хранили при 0°C в течение 24 часов. Кристаллы от бежевого до не совсем белого цвета отфильтровывали, промывали 3 порциями (каждая по 25 мл) предварительно охлажденного (0°C) этилацетата и сушили в вакууме с получением 40,3 г кристаллов от бежевого до не совсем белого цвета. (86,3% выход продукта как такового)
ИК:
 (см-1)= 3229, 3115, 3078, 3052, 2971, 2890, 2841, 2772, 2722, 2675, 2605, 2434, 1741, 1718, 1621, 1606, 1483, 1460, 1408, 1391, 1372, 1336, 1307, 1277, 1267, 1238, 1202, 1184, 1162, 1149, 1128, 1067, 1036, 987, 973, 939, 919, 896, 871, 857, 843, 785, 771, 756, 717, 690, 678, 613.
(см-1)= 3229, 3115, 3078, 3052, 2971, 2890, 2841, 2772, 2722, 2675, 2605, 2434, 1741, 1718, 1621, 1606, 1483, 1460, 1408, 1391, 1372, 1336, 1307, 1277, 1267, 1238, 1202, 1184, 1162, 1149, 1128, 1067, 1036, 987, 973, 939, 919, 896, 871, 857, 843, 785, 771, 756, 717, 690, 678, 613.
ЖХ-МС (ESI +):
Аммониевый ион: m/z =390 ([M+H]), 431 ([M+H+CH3CN])
Камфорсульфонатный ион: m/z =250 ([M+NH4]), 482 ([2M+NH4])
ЖХ-МС (ESI -):
Камфорсульфонатный ион: m/z=231 ([M-H]), 463 ([2M-H])
1H ЯМР (DMSO-d6, 600 MГц): 11,49 (с, 1H), 11,23 (с, 1H), 10,29-10,83 (м, 1H), 9,78-10,31 (м, 1H), 7,55-7,60 (м, 2H), 7,52 (с, 1H), 7,40 (д, J=6,2 Гц, 1H), 7,16 (д, J=8,8 Гц, 1H), 4,52-4,63 (м, 1H), 3,20 (дд, J=16,3, 4,2 Гц, 1H), 2,96 (дд, J=16,1, 11,3 Гц, 1H), 2,90 (д, J=15,0 Гц, 1H), 2,56-2,63 (м, 1H), 2,39 (д, J=14,6 Гц, 1H), 2,21 (дт, J=18,0, 3,8 Гц, 1H), 1,89-1,93 (м, 1H), 1,81 (ддд, J=15,3, 7,8, 3,7 Гц, 1H), 1,76 (д, J=18,3 Гц, 1H), 1,53 (д, J=6,6 Гц, 3H), 1,20-1,33 (м, 2H), 0,98 (с, 3H), 0,70 (с, 3H).
Пример 12: Способ получения Соединения формулы (IVA) ½ Гидрата
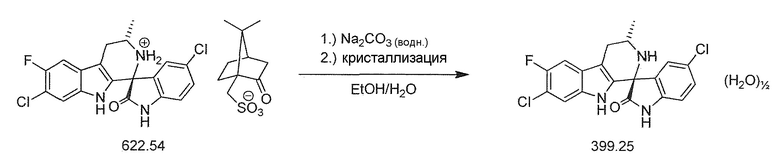
В 750-мл реакторе, снабженном лопастной мешалкой, 50 г соединения (IVB) в форме соли растворяли в 300 мл этанола (ALABD) и 100 мл деионизированной воды (WEM). Прозрачный желтоватый раствор нагревали до внутренней температуры 58°C. К раствору добавляли 85 г 10% водного раствора карбоната натрия в течение 10 минут. Прозрачный раствор фильтровали во второй реакционный сосуд. Сосуд и фильтр с частицами, каждый, промывали при помощи 25 мл смеси этанол:вода (3:1 об/об) во втором реакционном сосуде. Объединенный отфильтрованный от частиц раствор нагревали до внутренней температуры 58°C и добавляли 200 мл воды (WEM) по каплям в течение 15 минут. В конце добавления раствор становился мутным. Смесь перемешивали в течение 10 минут при внутренней температуре 58°C и затем медленно охлаждали до комнатной температуры в течение 4 часов 30 минут, с образованием густой, хорошо перемешиваемой белой суспензии. К суспензии добавляли 200 мл воды и смесь перемешивали еще в течение 15 часов 20 минут при комнатной температуре. Суспензию фильтровали и фильтровальную лепешку промывали два раза 25-мл порциями смеси этанол:вода 9:1 (об/об). Бесцветные кристаллы сушили при 60°C в вакууме с получением 26,23 г (=91,2% выход).
1H ЯМР (400 МГц, DMSO-d6) 10,70 (с, 1H), 10,52 (с, 1H), 7,44 (д, J=10,0 Гц, 1H), 7,33 (дд, J=8,4, 2,1 Гц, 1H), 7,26 (д, J=6,5 Гц, 1H), 7,05 (д, J=2,3 Гц, 1H), 6,93 (д, J=8,3 Гц, 1H), 3,83-4,00 (м, 1H), 3,13 (д, J=6,0 Гц, 1H), 2,77 (дд, J=15,1, 3,8 Гц, 1H), 2,38 (дд, J=15,1, 10,5 Гц, 1H), 1,17 (д, J=6,3 Гц, 3H).
| название | год | авторы | номер документа |
|---|---|---|---|
| Новые трансаминазы и способ дезаминирования аминосоединения с их применением | 2016 |
|
RU2718778C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2,4-ДИГИДРОКСИБУТИРАТА | 2013 |
|
RU2645260C2 |
| ПРОИЗВОДНЫЕ 3-(5-АМИНО-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОНА И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С БЕЛКОМ С "ЦИНКОВЫМИ ПАЛЬЦАМИ" 2 СЕМЕЙСТВА IKAROS (IKZF2) | 2019 |
|
RU2815714C2 |
| ПРОИЗВОДНЫЕ 3-(5-ГИДРОКСИ-1-ОКСОИЗОИНДОЛИН-2-ИЛ) ПИПЕРИДИН-2,6-ДИОНА И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С БЕЛКОМ С "ЦИНКОВЫМИ ПАЛЬЦАМИ" 2 (IKZF2) СЕМЕЙСТВА IKAROS | 2019 |
|
RU2797559C2 |
| ИНГИБИТОРЫ EZH2 ЧЕЛОВЕКА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2704445C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА | 2013 |
|
RU2677276C2 |
| ФЕРМЕНТАТИВНЫЙ СИНТЕЗ 4’-ЭТИНИЛНУКЛЕОЗИДНЫХ АНАЛОГОВ | 2019 |
|
RU2816846C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ И ДИАГНОСТИКИ РАКА ЛЕГКИХ | 2001 |
|
RU2311920C2 |
| АГОНИСТ ГЛЮКОКОРТИКОИДНОГО РЕЦЕПТОРА И ЕГО ИММУНОКОНЪЮГАТЫ | 2017 |
|
RU2745748C2 |
| ВАРИАНТЫ CTLA-4 | 2013 |
|
RU2671465C2 |




























































































































































































































Изобретение относится к способам и промежуточным соединениям для получения спироиндолоновых соединений, таких как (1'R,3'S)-5,7'-дихлор-6'-фтор-3'-метил-2',3',4',9'-тетрагидроспиро[индолин-3,1'-пиридо[3,4-b]индол]-2-он, и их солей, гидратов и сольватов. Способ включает ферментативное трансаминирование соединения формулы I в соединение формулы II, с использованием фермента, представленного SEQ ID NO:134. Способ позволяет повысить эффективность синтеза хирального аминового промежуточного соединения. 3 н. и 9 з.п. ф-лы, 12 пр.
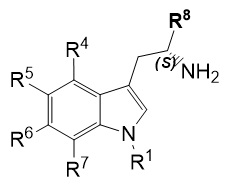 (II)
(II)  (I)
(I)
1. Способ получения соединения формулы (II), или его соли, или сольвата, или гидрата,
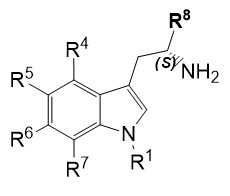 (II)
(II)
включающий ферментативное трансаминирование соединения формулы (I) в соединение формулы (II) или его соль, сольват или гидрат, где фермент представляет собой SEQ ID NO: 134,
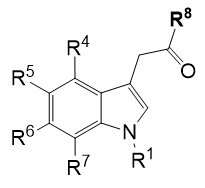 (I)
(I)
где:
R1 представляет собой H, -CH3,
R4 и R7 каждый, независимо друг от друга, представляют собой H или -Cl;
R5 представляет собой H, -OH, -CH3, -OCH3, -F, -Cl, -CF3 или -CN;
R6 представляет собой H, -OH, -OCH3, -F или -Cl;
R8 представляет собой H, -CH3, -CH2CH3, -CH2OH, -CO2H, -CO2CH3, -CO2CH2CH3 или -CF3.
2. Способ по п.1, где R5 и R6 представляют собой фтор, когда R8 представляет собой -CH3.
3. Способ по п.1, где R5 и R6 представляют собой фтор и хлор, когда R8 представляет собой -CH3.
4. Способ по п.1, где R5 и R6 представляют собой водород, когда R8 представляет собой -CH3.
5. Способ по п.1, где R5 представляет собой фтор, когда R6 представляет собой водород.
6. Способ по п.1, где соединение формулы (II) представляет собой соединение формулы (IIA), или его соль, или сольват, или гидрат,
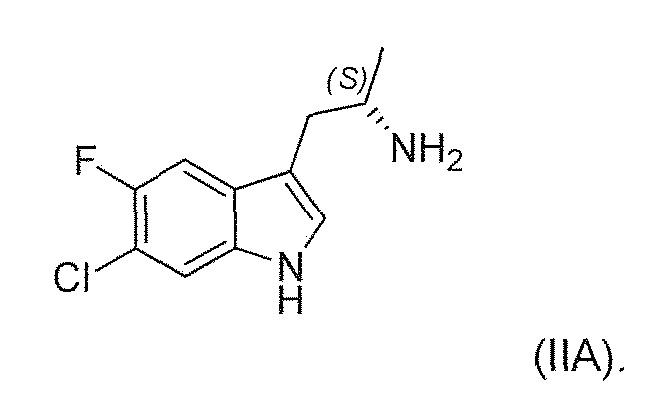
7. Способ по п.1, где соединение формулы (I) представляет собой соединение формулы (IA), или его соль, или гидрат, или сольват,

8. Способ получения соединения формулы (IVA), или его соли, или сольвата, или гидрата,
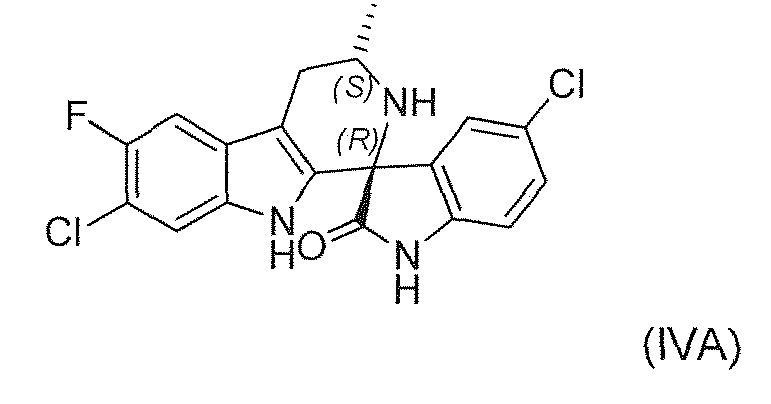
включающий взаимодействие соединения формулы (IIIA), или его соли, или сольвата, или гидрата,
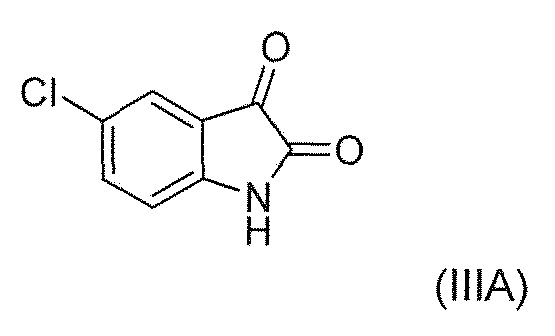
с соединением формулы (II), или его солью, или сольватом, или гидратом,
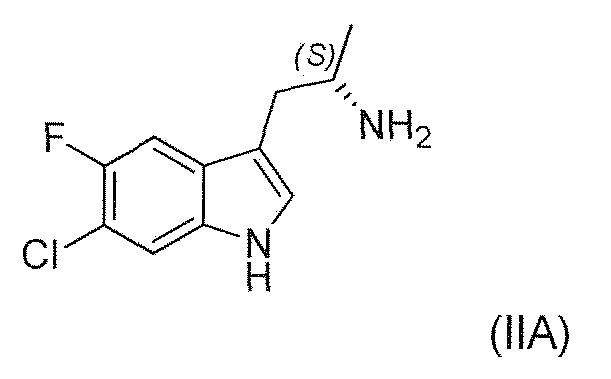
с получением соединения формулы (IVA), или его соли, или сольвата, или гидрата,
где соединение формулы (IIA) получают ферментативным трансаминированием соединения формулы (IA), или его соли, или гидрата, или сольвата,
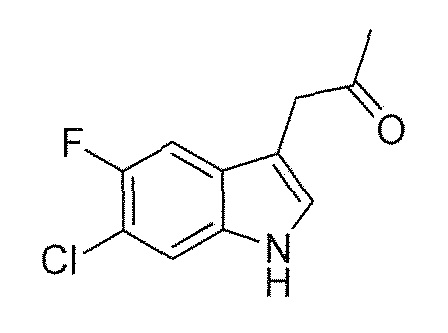
и где фермент представляет собой SEQ ID NO:134.
9. Способ по п.8, где соединение формулы (IIA) преобразуют в соль формулы (IIB):
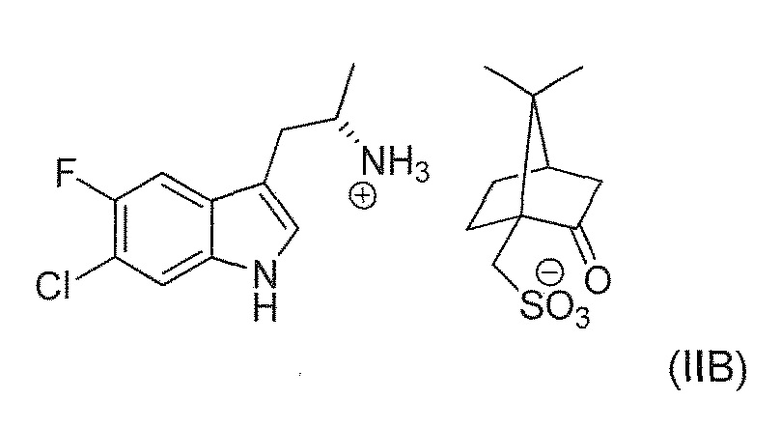
до реакции с соединением формулы (IIIA).
10. Способ по п.8, где соединение формулы (IVA) выделяют в виде соли формулы (IVB):
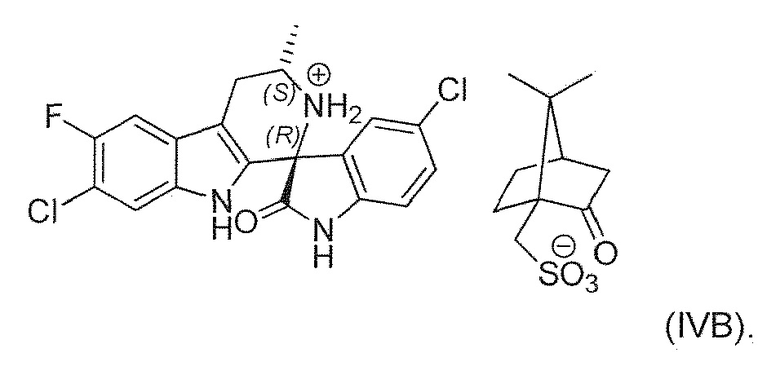
11. Способ по п.8, где соль формулы (IVB) преобразуют в соединение формулы (IVA) в форме свободного основания.
12. Соединение формулы (IA):
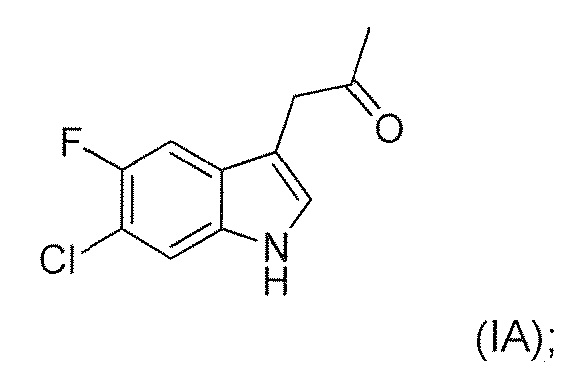
или его фармацевтически приемлемая соль, или гидрат, или сольват.
| WO 2009132921 A1, 05.11.2009 | |||
| GB 974895 А, 11.11.1964 | |||
| US 3282959 A1, 01.11.1966 | |||
| US 4073795 A1, 14.02.1978 | |||
| Отклонитель для бурения наклонных скважин | 1960 |
|
SU135846A1 |
| Машина для пропитки тканей в виде жгута в свободном состоянии | 1958 |
|
SU120208A1 |
| NICHOLS D E ET AL, "SYNTHESIS AND SEROTONIN RECEPTOR AFFINITIES OF A SERIES OF ENANTIOMERS OF ALPHA-METHYLTRYPTAMINES: EVIDENCE FOR THE BINDING CONFORMATION OF TRYPTAMINES AT SEROTONIN 5-HT1B RECEPTORS", JOURNAL OF MEDICINAL CHEMISTRY, AMERICAN CHEMICAL SOCIETY, 1988, vol | |||
| Способ очистки нефти и нефтяных продуктов и уничтожения их флюоресценции | 1921 |
|
SU31A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| IWAO TABUSHI ET AL, "A-(modified B6)-B-[omega-amino(ethylamino)]-beta-cyclodextrin as an artificial B6 enzyme for chiral aminotransfer reaction", JOURNAL OF THE AMERICAN CHEMICAL SOCIETY, 1985, vol | |||
| Счетный сектор | 1919 |
|
SU107A1 |
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| BALDWIN J E ET AL, "APPLICATION OF ESCHERICHIA-COLI ASPARTATE TRANSAMINASE TO AMINO ACID SYNTHESIS", TETRAHEDRON LETTERS, 1987, vol | |||
| Видоизменение прибора с двумя приемами для рассматривания проекционные увеличенных и удаленных от зрителя стереограмм | 1919 |
|
SU28A1 |
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| Способ запрессовки не выдержавших гидравлической пробы отливок | 1923 |
|
SU51A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| ASANO Y ET AL, "HIGH YIELD SYNTHESIS OF L-AMINO ACIDS BY PHENYLALANINE DEHYDROGENASE FROM SPOROSARCINA UREAE", AGRICULTURAL AND BIOLOGICAL CHEMISTRY, 1987, vol | |||
| Способ запрессовки не выдержавших гидравлической пробы отливок | 1923 |
|
SU51A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| RU 2007116971 A, 27.11.2008. | |||
Авторы
Даты
2018-07-31—Публикация
2013-03-22—Подача