ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет согласно предварительным заявкам на патенты США №№62/196558 и 62/196568, обе из которых поданы 24 июля 2015 года, обе из которых включены в данный документ посредством ссылки во всей своей полноте.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к доставке средств через кожу. В настоящем изобретении предусмотрены способы доставки средств, таких как биологически активные средства. Конкретно, описываются способы доставки средства в одну или более областей эпидермиса и, таким образом, в лимфатическую систему.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Доставка лекарственных средств в лимфатическую систему была реализована в качестве основного механизма лечения многочисленных заболеваний. Тем не менее, физиология и гидростатика лимфатических сосудов сделали настоящий методологический аппарат неэффективным в отношении нацеливания и прямой доставки лекарственных средств в лимфатическую систему. Многие используемые в настоящее время способы основаны на первоначальном нацеливании на кровеносную систему, которая обеспечивает передвижение при низких скоростях по кровеносным капиллярам в интерстициальные ткани и в лимфатическую систему. Эти подходы основаны на специфических химических модификациях лекарственных средств или липидных или наноносителях лекарственных средств.
Лимфатическая система представляет собой один из основных компонентов иммунной системы. Она играет важную роль в транспортировке иммуногенов, патогенов, жидкостей организма и материалов в виде частиц, в том числе белков и частиц жиров из интерстициальных тканей. Лимфатические сосуды также долго оценивали в качестве играющих важную роль в иммунитете и многочисленных состояниях заболевания. Лимфатические сосуды являются основным путем как для нахождения определенных видов рака, так и метастатического распространения первичных опухолей. Например, полагают, что лимфомы (например, лимфома Ходжкина и неоплазмы B-клеток) составляют по меньшей мере 5% всех случаев рака и более половины всех видов рака крови. Кроме того, наиболее распространенный путь метастазирования исходит из злокачественных клеток из первичной опухоли, попадающих в лимфатическую систему и рассеивающих вторичные опухоли в отдаленных местоположениях и других тканях органов. В случае немелкоклеточного рака легкого (NSCLC) выживаемость после хирургического вмешательства снижается приблизительно наполовину, если опухоль находится в лимфатических узлах в легком, и еще наполовину, если задействованы лимфатические узлы в непосредственной близости от легкого (средостение).
Также известно, что лимфатические сосуды играют важные роли во время случаев воспаления, возникающих в результате инфекции и хронического заболевания. Во время инфекции существует физиологическая необходимость в удалении отведенной интерстициальной жидкости и фильтровании вредных микробов, поврежденных клеток и токсичных побочных продуктов. В ответ локальные лимфатические сосуды претерпевают сильный индуцированный воспалением лимфо-ангиогенез (т.е., рост и распространение лимфатических капилляров). Часто наличие воспалительного состояния приводит к набуханию лимфатических узлов или лимфадениту. Кроме того, известно, что физиологические ответы лимфо-ангиогенеза и лимфаденита важны в нескольких классах хронических заболеваний, в том числе при ревматоидном артрите, диабете, воспалительном заболевании кишечника и хроническом отторжении при трансплантации.
Попытки ненацеленной доставки в лимфатическую сосудистую систему включали различные способы парентерального введения, внутривенные (i.v.), подкожные (s.c.), внутримышечные (i.m.) или внутрикожные (i.d.) инъекции или способы пероральной доставки. Каждый из этих способов столкнулся с различными уровнями лимфатической абсорбции, вероятно, зависящей от места инъекции, физиологии тестируемого животного и общей физиологии лимфатических сосудов, которые обладали сильно различающейся кинетикой абсорбции. Доставленные перорально или внутривенно лекарственные средства вначале попадают в кровеносную систему, в результате чего происходит системное распределение в различных органах, а перорально доставленные лекарственные средства часто претерпевают эффекты пресистемного метаболизма. Другие способы парентерального введения (s.c., i.m. и i.d.) для доставки в лимфатическую систему оказались непостоянными и невоспроизводимыми. В одном таком исследовании обнаружено, что высокие уровни рекомбинантного интерферонаα-2a локализованы в лимфе после инъекции или s.c., или i.d. в канюлированные ноги овцы, см., Supersaxo, A. et al., Pharm. Res., 5(8), 472-476 (1988). Однако, эти результаты невозможно было продублировать в других исследованиях на кроликах после введения s.c. (см. Yoshikawa, H. et al., J Pharmacobio-Dyn., 8(3), 206-210 (1985).
Различные попытки нацеленной доставки второго поколения были осуществлены с помощью систем, основанных на носителях для нацеливания на лимфатическую систему, которые включают транс-лимфатические системы доставки лекарственных средств (например, липосомы и основанные на липидах наносоставы), носители на основе микро- или наночастиц, макромолекулярные полимеры, мицеллы полимеров, виды активированного угля, силикон и наноэмульсии O/W или W/O, и нацеливание на лимфатическую систему на основе антител, см., например, Xie et al., Expert Opin. Drug Deliv., 6(8), 25 785-792 (2009) и Zhang and Wei-Yue., Cancer Biol Med., (11), 247-254 (2014).
Обычно эти системы носителей инъецируют в тело посредством традиционных путей i.v., s.c., i.d. или i.m. или дают перорально. Как обсуждалось выше, в результате i.v. и перорального путей введения происходит слабый захват лимфатической системой, так как эти введенные носители могут быть разбавлены в системном кровотоке, а также сначала должны покинуть кровеносную систему для попадания в лимфатические сосуды. Известные проблемы, связанные с липосомами и составами на основе наночастиц включают низкие уровни захвата лимфатической системой и непредсказуемые уровни высвобождения лекарственных средств, что требует разработки специфичных липосомных составов для каждого лекарственного средства, которое надлежит доставить. Кроме того, инъецированные носители на основе липосом часто задерживаются в интерстициальных тканях, неспособные попасть в лимфатическую систему, что требует вторичного механизма транспорта, опосредованного макрофагами, см., Oussoren et al., Adv. Drug Deliv. Rev., 50(1-2), 143-156 (2001).
Другие подходы, характеризующие имплантируемые устройства для высвобождения лекарственных средств локально в лимфатических сосудах, описаны в WO 2007/047539 и US 2010/0278725. Однако эти имплантируемые устройства для доставки в лимфатическую систему являются дорогостоящими и инвазивными, что может приводить усилению боли у пациента и сокращению степени соответствия и удовлетворения. Кроме того, эти подходы основаны на расположении таких устройств в подкожных слоях кожи, в которых кровеносная или лимфатическая сосудистые системы находятся в малом количестве или совсем отсутствуют. Подходы для доставки в лимфатические сосуды с помощью внутрикожных инъекций описаны в US 20050180952. В методиках, подобных этим, применяют болюсные инъекции, сконцентрированные на площади, что приводит к неконтролируемым уровням абсорбции лекарственных средств в зависимости от площади инъекции и излишнему расходу дорогих материалов для лекарственных средств. Кроме того, инъецирование лекарственного средства при однократном введении в глубину дермы может приводить к различиям от пациента к пациенту из-за того, что лекарственное средство доставлено в место с уменьшенным количеством лимфатических капилляров, или из-за диффузии или передвижения лекарственного средства глубже в подкожную ткань. Известно, что другие обычные методики внутрикожной инъекции, такие как туберкулиновая кожная проба Манту, являются неточными и сложными для воспроизводимого введения.
Таким образом, существует потребность в новых, воспроизводимых и эффективных способах доставки средств (например, биоактивных средств) в лимфатическую систему.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном описанном в данном документе варианте осуществления представлен способ доставки одного или более средств в одну или более лимфатических тканей субъекта, при этом способ предусматривает: (a) приведение в контакт одного или более слоев эпидермиса с одним или более усилителями обратимой проницаемости, где один или более усилителей обратимой проницаемости индуцируют обратимое повышение проницаемости одной или более клеток барьерного слоя эпидермиса для по меньшей мере одного или более средств; (b) введение общего количества жидкой лекарственной формы в 2-50000 частях дозы одного или более средств при контролируемой скорости потока при введении, где каждую часть дозы одного или более средств независимо вводят c применением множества независимых значений глубины в эпидермисе перед любыми дальнейшими диффузией или перемещением одного или более средств в эпидермисе; и где после введения проницаемость одной или более клеток барьерного слоя возвращается к нормальному состоянию перед приведением в контакт эпидермиса с одним или более усилителями проницаемости.
В другом описанном в данном документе варианте осуществления представлен способ лечения субъекта с заболеванием, предусматривающим одно или более мест локализации лимфаденита, путем введения одного или более биологически активных средств в один или более участков локализации лимфаденита, предусматривающий: (a) применение одного или более устройств для доставки, имеющих 2-50000 структур для доставки, по отношению к одному или более участкам кожи, содержащим лимфатическую сосудистую сеть, где устройство для доставки обеспечивает контакт одного или более слоев эпидермиса с одним или более усилителями обратимой проницаемости, которые индуцируют обратимое повышение проницаемости одной или более клеток барьерного слоя эпидермиса по меньшей мере для одного или более биологически активных средств; (b) введение общего количества жидкой лекарственной формы в 2–50000 частях дозы одного или более биологически активных средств при контролируемой скорости потока при введении посредством устройства для доставки, где каждую часть дозы одного или более биологически активных средств независимо вводят при множестве независимых значений глубины в эпидермисе перед любыми дальнейшими диффузией или перемещением одного или более биологически активных средств в эпидермисе; где после стадии введения одно или более биологически активных средств перемещаются или диффундируют через эпидермис, через базальный слой эпидермиса и по меньшей мере в часть нижележащей жизнеспособной дермы с обеспечением захвата части одного или более биологически активных средств с помощью одного или более восприимчивых сплетений лимфатических капилляров для достижения лучшей доставки одного или более биологически активных средств в лимфатическую сосудистую сеть по сравнению с внутривенной, внутрикожной или подкожной доставкой идентичного одного или более биологически активных средств; и где после введения и захвата одно или более биологически активных средств циркулируют через лимфатическую сосудистую сеть к одной или более вторичным лимфатическим тканям, содержащим один или более лимфатических узлов, за счет чего осуществляется введение одного или более биологически активных средств в один или более участков локализации лимфаденита.
В некоторых аспектах описанных в данном документе вариантов осуществления эпидермис содержит и нежизнеспособный эпидермис, и жизнеспособный эпидермис.
В некоторых аспектах описанных в данном документе вариантов осуществления множество независимых значений глубины характеризуется объединенным средним значением глубины введения в эпидермисе, где каждая часть дозы независимо вводится на глубину в эпидермисе, которая представляет собой большее значение глубины, меньшее значение глубины или одинаковое значение.
В некоторых аспектах описанных в данном документе вариантов осуществления общее количество жидкой лекарственной формы одного или более средств, вводимых при множестве значений глубины в эпидермисе, предусматривает введение на глубину по меньшей мере в части нежизнеспособного эпидермиса и/или по меньшей мере в части жизнеспособного эпидермиса.
В некоторых аспектах описанных в данном документе вариантов осуществления множество значений глубины в эпидермисе находится в диапазоне от приблизительно 1 μм до приблизительно 500 μм вглубь от наиболее наружного слоя поверхности эпидермиса у субъекта.
В некоторых аспектах описанных в данном документе вариантов осуществления множество значений глубины в жизнеспособном эпидермисе составляет от приблизительно 1 μм до приблизительно 250 μм вглубь от наиболее глубокого нежизнеспособного эпидермального слоя, но все еще в жизнеспособном эпидермисе.
В некоторых аспектах описанных в данном документе вариантов осуществления среднее значение независимого множества значений глубины характеризуется общим средним значением глубины для доставки части дозы в эпидермис, составляющим от приблизительно 70 μм до приблизительно 175 μм вглубь от наиболее наружного слоя поверхности эпидермиса.
В некоторых аспектах описанных в данном документе вариантов осуществления общее количество жидкой лекарственной формы одного или более средств вводят при множестве значений глубины в эпидермисе, состоящем только из одного или более слоев жизнеспособного эпидермиса и не содержащем слой нежизнеспособного эпидермиса.
В некоторых аспектах описанных в данном документе вариантов осуществления частота каждого из независимых значений глубины введения части дозы в жизнеспособный и/или нежизнеспособный эпидермис проявляет распределение Гаусса значений глубины.
В некоторых аспектах описанных в данном документе вариантов осуществления одно или более средств вводят с помощью применения одного или более устройств для доставки в один или более участков кожи.
В некоторых аспектах описанных в данном документе вариантов осуществления устройство для доставки содержит матрицу, содержащую 2–50000 структур для доставки, находящихся в жидкостной связи с одним или более средствами в жидкой среде-носителе, где устройство для доставки содержит механизм для контроля скорости потока при введении; при этом структуры для доставки содержат механизм для проникновения по меньшей мере через наиболее поверхностный слой эпидермиса; и при этом одно или более средств в жидкой-среде носителе доставляют c помощью структур для доставки при множестве значений глубины в жизнеспособном эпидермисе у субъекта, за счет чего осуществляется введение 2–50000 частей дозы одного или более средств.
В некоторых аспектах описанных в данном документе вариантов осуществления структуры для доставки характеризуются стандартной или нестандартной геометрической формой.
В некоторых аспектах описанных в данном документе вариантов осуществления структуры для доставки представляют собой иглы.
В некоторых аспектах описанных в данном документе вариантов осуществления одно или более средств вводят при контролируемой скорости потока при введении, составляющей от приблизительно 0,01 μл/ч. до приблизительно 100 μл/ч. на структуру для доставки.
В некоторых аспектах описанных в данном документе вариантов осуществления общая контролируемая скорость потока при введении одного или более средств при множестве значений глубины в эпидермисе составляет от приблизительно 0,02 μл/ч./см2 до приблизительно 50000 μл/ч./см2 в пересчете на общую площадь поверхности устройства для доставки, которое контактирует с кожей субъекта.
В некоторых аспектах описанных в данном документе вариантов осуществления одно или более средств доставляются в объем ткани эпидермиса, вмещающий одно или более средств, перед любыми дальнейшими диффузией или перемещением одного или более средств в эпидермисе, составляющий от приблизительно 0,7 мм3 до приблизительно 2500 мм3.
В некоторых аспектах описанных в данном документе вариантов осуществления одно или более средств непрерывно вводят субъекту в течение периода времени, составляющего от приблизительно 0,1 часа до приблизительно 96 часов.
В некоторых аспектах описанных в данном документе вариантов осуществления один или более усилителей проницаемости представляют собой один или более из усилителей химической, физической или электрической проницаемости.
В некоторых аспектах описанных в данном документе вариантов осуществления физические усилители проницаемости предусматривают наноструктурированную или нанотопографическую поверхность.
В некоторых аспектах описанных в данном документе вариантов осуществления нанотопографическая поверхность нанесена на поверхность структур для доставки, как описано в данном документе.
В некоторых аспектах описанных в данном документе вариантов осуществления одно или более средств, вводимое в кожу при множестве значений глубины, перемещаются или диффундируют глубже через эпидермис, через базальный слой эпидермиса и по меньшей мере в часть нижележащей жизнеспособной дермы.
В некоторых аспектах описанных в данном документе вариантов осуществления при введении одного или более средств достигается давление интерстициальной жидкости в нижележащей дерме, составляющее от приблизительно 1 мм рт. ст. до приблизительно 15 мм рт. ст.
В некоторых аспектах описанных в данном документе вариантов осуществления одно или более средств абсорбируются одним или более восприимчивыми сплетениями лимфатических капилляров после доставки в эпидермис.
В некоторых аспектах описанных в данном документе вариантов осуществления одно или более средств циркулируют через сплетение лимфатических капилляров и в лимфатическую сосудистую сеть к одной или более лимфатическим тканям.
В некоторых аспектах описанных в данном документе вариантов осуществления одна или более лимфатических тканей содержит один или более лимфатических узлов.
В некоторых аспектах описанных в данном документе вариантов осуществления концентрация одного или более средств в одном или более лимфатических узлов составляет от приблизительно 0,5% до приблизительно 30% от начальной дозы на грамм ткани лимфатических узлов.
В некоторых аспектах описанных в данном документе вариантов осуществления концентрация одного или более средств в одной или более лимфатических тканях является большей в от приблизительно 1,25 раза до приблизительно 50 раз, чем при внутривенной, внутрикожной или подкожной доставке идентичных одного или более средств.
В некоторых аспектах описанных в данном документе вариантов осуществления скорость абсорбции в сыворотку крови одного или более средств является эквивалентной внутрикожной доставке и подкожной доставке идентичных одного или более средств.
В некоторых аспектах описанных в данном документе вариантов осуществления соотношение начальной дозы одного или более средств, локализованных в грамме ткани лимфатического узла и ткани цельной крови, составляет от приблизительно 5:1 до приблизительно 15:1 через приблизительно 36 часов.
В некоторых аспектах описанных в данном документе вариантов осуществления соотношение начальной дозы одного или более средств, локализованных в грамме ткани лимфатического узла и ткани кожи, составляет от приблизительно 0,5:1 до приблизительно 1:1 через приблизительно 36 часов.
В некоторых аспектах описанных в данном документе вариантов осуществления одно или более средств представляют собой биологически активное средство.
В некоторых аспектах описанных в данном документе вариантов осуществления биологически активное средство является применимым для лечения, замедления прогрессирования, задержки возникновения, профилактики, облегчения или уменьшения тяжести симптомов заболевания у нуждающегося в лечении субъекта.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фигура 1. Представлено схематическое изображение кожи, в том числе эпидермиса и дермы, иллюстрирующее различные ткани кожи.
Фигура 2А и 2В. Представлено схематическое изображение эпидермиса, иллюстрирующее слои эпидермиса.
Фигура 3. Представлено схематическое изображение иллюстративной структуры для доставки для введения активного средства в жизнеспособную кожу.
Фигура 4. Представлено схематическое изображение иллюстративной структуры для доставки с нанотопографической поверхностью для введения активного средства в жизнеспособную кожу.
Фигура 5. Схематическое изображение способов доставки в жизнеспособную кожу, иллюстрирующее среднее значение глубины для доставки.
Фигура 6. Представлено изображение, полученное с помощью оптической когерентной томографии (OCT), кожи после прокалывания кожи с помощью матрицы игл.
Фигура 7А–С. Представлена модуляция белков плотных контактов с помощью нанотопографической поверхности, содержащей иглы, в эпителиальных клетках Caco-2.
Фигура 8. Представлено изображение флуоресцентно меченного этанерцепта (продаваемого как Enbrel®, противовоспалительное лекарственное средство), введенного в жизнеспособную кожу, на котором показана доставка непосредственно в лимфатическую сосудистую сеть и ткани лимфатических узлов.
Фигура 9. Представлено изображение флуоресцентно меченного этанерцепта, введенного в жизнеспособную кожу, на котором показана доставка в подмышечный и подчелюстной лимфатические узлы.
Фигура 10. Представлено биораспределение этанерцепта после доставки в жизнеспособную кожу c применением способов по настоящему изобретению, демонстрирующее повышенную доставку в лимфатические узлы по сравнению со способами традиционной доставки.
Фигура 11А и 11В. Представлена локализация этанерцепта после доставки в жизнеспособную кожу, что указывает на увеличенную концентрацию в областях воспаленных тканей по сравнению со способами подкожной инъекции.
Фигура 12. Представлена эффективность этанерцепта при сокращении воспаления у крыс с артритом после введения в жизнеспособную кожу по сравнению со способами подкожной инъекции.
Фигура 13. Представлена скорость абсорбции в сыворотку крови этанерцепта после доставки в жизнеспособную кожу, которая показывает, что скорость абсорбции в сыворотку крови является аналогичной таковой при использовании общепринятых эталонных способов доставки.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Существует потребность в способах контролируемой доставки биологически активных средств субъекту, где средство контролируемо и воспроизводимо абсорбируется лимфатическими тканями. Таким образом, в данном документе описаны способы контролируемой доставки одного или более средств в кожу. Способы контролируемой доставки, описанные в данном документе, обеспечивают захват одного или более средств лимфатическими тканями, в частности, одним или более восприимчивыми сплетениями лимфатических капилляров в жизнеспособной коже.
Термин «жизнеспособная кожа», используемый в данном документе, означает область кожи, расположенную непосредственно ниже рогового слоя эпидермиса, включая дерму, но выше cлоев подкожной основы. Данный термин охватывает и жизнеспособный эпидермис, и жизнеспособную дерму. Фактическая толщина жизнеспособной кожи будет варьироваться в зависимости места расположения кожи, возраста и физиологии определенного субъекта. Термин жизнеспособная кожа дополнительно конкретизирует, что данная часть кожи содержит ядросодержащие живые клетки, часто митотические. В некоторых аспектах, описанных в данном документе, жизнеспособная кожа также содержит по меньшей мере одно или более cплетений лимфатических капилляров и/или одно или более сплетений кровеносных капилляров.
Термин «жизнеспособная дерма», используемый в данном документе, означает область кожи, расположенную непосредственно ниже базального слоя эпидермиса, включая дерму, но над cлоем подкожной основы. Жизнеспособная дерма содержит и cосочковый и cетчатый слои дермы, дополнительно содержащие, например, кровеносные капилляры и лимфатические капилляры, помимо других типов тканей.
Термин «жизнеспособный эпидермис», используемый в данном документе, означает область кожи, расположенную непосредственно ниже рогового слоя. Жизнеспособный эпидермис содержит базальный слой или герминативный слой, cлой сквамозных клеток или шиповатый слой и слой гранулярных клеток или зернистый слой.
Термин «средство», используемый в данном документе, означает соединение, вещество, композицию или молекулу, подлежащие доставке. Иллюстративные и неограничивающие примеры включают биологически активные средства, нуклеиновые кислоты (например, микроРНК), пигменты (например, контрастные средства и флуоресцентные репортеры), вакцины и им подобные.
Термин «биологически активное средство», используемый в данном документе, означает любое биологически совместимое средство, которое вызывает клеточный ответ. Термин биологически активное средство предусматривает любые лекарственное средство, активный ингредиент, активное лекарственное вещество или вакцину. Например, биологически активное средство описанное в вариантах осуществления в данном документе, может предусматривать лекарственные средства, такие как низкомолекулярные лекарственные средства, биоэквивалентные лекарственные средства, биологические средства и т. д., наночастицы, липиды, липосомы, белки (например, рекомбинантные белки, антитела и т. д.) и им подобные.
Термины «лекарственное средство», «активный ингредиент», «активное лекарственное средство» или «активное фармацевтическое средство» используемые в данном документе, означают активный ингредиент, соединение или вещество, композиции или их смеси, которые обеспечивают лекарственный, а часто благоприятный эффект. Ссылка на конкретный активный ингредиент включает, если это необходимо, активный ингредиент и любые их фармацевтически приемлемые соли или сложные эфиры. Термины «дозировка» или «доза» означают любую форму состава активного ингредиента, которая содержит количество, достаточное для получения терапевтического эффекта при однократном введении.
Термин «подбор дозы», используемый в данном документе, означает нарастающее увеличение дозировки лекарственного средства или частоты введения до такого уровня, который обеспечивает оптимальный терапевтический эффект.
Термин «контролируемая доставка», используемый в данном документе, означает способ введения, результатом которого является контролируемая доставка одного или более средств за требуемый период времени.
«Контролируемая доставка» при использовании в данном документе охватывает термины «модифицированная доставка», «замедленная доставка» «длительная доставка» и «отсроченная доставка». В некоторых аспектах, описанных в данном документе, результатом способов контролируемой доставки является доставка одного или более средств или активных лекарственных веществ с достижением терапевтического порога за максимальный период времени.
Термин «отсроченная доставка», используемый в данном документе, относится к доставке одного или более средств в соответствии с требуемым профилем на протяжении длительного периода в физиологических условиях или в условиях теста in vitro. Под «длительным периодом» подразумевается непрерывный период времени, составляющий по меньшей мере приблизительно 20 минут, приблизительно 30 минут, приблизительно 1 час; приблизительно 2 часа; приблизительно 4 часа; приблизительно 6 часов; приблизительно 8 часов; приблизительно 10 часов; приблизительно 12 часов; приблизительно 14 часов; приблизительно 16 часов; приблизительно 18 часов; приблизительно 20 часов; приблизительно 24 часа или еще более длительный период.
Термин «модифицированная доставка», используемый в данном документе, означает доставку одного или более средств с более низкой скоростью, чем при немедленной доставке состава в физиологически условиях или в условиях теста in vitro.
Термин «замедленная доставка», используемый в данном документе, означает доставку одного или более средств за длительный период времени, например, составляющий минуты, часы сутки, с тем, чтобы исходно высвобождалась меньшая часть, а не весь активный ингредиент. Скорость с замедленным высвобождением может обеспечивать, например, доставку определенного указанного количества одного или более средств или активных лекарственных веществ за определенный период времени в физиологических условиях или в условиях теста in vitro.
Термин «длительная доставка», используемый в данном документе, означает доставку одного или более средств за длительный период, как, например, составляющий по меньшей мере приблизительно 20 минут, приблизительно 30 минут, приблизительно 1 час; приблизительно 2 часа; приблизительно 4 часа; приблизительно 6 часов; приблизительно 8 часов; приблизительно 10 часов; приблизительно 12 часов; приблизительно 14 часов; приблизительно 16 часов; приблизительно 18 часов; приблизительно 20 часов, приблизительно 24 часа, приблизительно 48 часов, приблизительно 72 часа или еще более длительный период.
Термин «первичная доставка» или «первично доставляемый» относится к месту расположения в ткани, где средство впервые вступает в контакт. В некоторых аспектах, описанных в данном документе, первичная доставка может относится к месту расположения в коже (например, в нежизнеспособном эпидермисе, жизнеспособном эпидермисе, или жизнеспособной дерме), где одно или более средств впервые вступают в контакт, будучи доставляемыми посредством устройства для доставки или одной или более структур для доставки в составе устройства для доставки.
Используемая в настоящем документе «стандартная доставка» означает любой способ, существующий до настоящего изобретения, который используют в области доставки одного или более материалов с биологическими кинетическими характеристиками или активностью, аналогичными внутривенной (i.v.), ионофоретической, подкожной (s.c.), внутримышечной (i.m.) или внутрикожной (i.d.) инъекциям, или составов для местного применения. Иллюстративные способы включают подкожный, ионофоретический и внутрикожный способы доставки, такие как те, что описаны в US 5800420, US 20050180952 и в Xie et al., Expert Opin. Drug Deliv., 6(8), 785-792 (2009) и Zhang and Wei-Yue., Cancer Biol. Med., (11), 247-254 (2014), каждый из которых включен в настоящий документ посредством ссылки по отношению к общему описанию способов стандартной доставки.
Термин «BCS класса I, II, II или IV» означает, характеризуется ли соединение или активное лекарственное вещество высокой или низкой проникающей способностью и высокой или низкой растворимостью (например, слаборастворимые). Лекарственные средства, представляющие собой BCS класса I, характеризуются высокой проникающей способностью и высокой растворимостью; лекарственные средства, представляющие собой BCS класса II, характеризуются высокой проникающей способностью и низкой растворимостью, лекарственные средства, представляющие собой BCS класса III, характеризуются низкой проникающей способностью и высокой растворимостью, и лекарственные средства, представляющие собой BCS класса IV, характеризуются низкой проникающей способностью и низкой растворимостью. Лекарственное вещество с немедленным высвобождением считается высокорастворимыми в том случае, когда наивысшая дозировка растворима в 250 мл или меньшем количестве водной среды в диапазоне показателя pH от 1 до 7,5 при 37±1°C. Соответствующие показатели условий pH необходимо установить для точного определения профиля pH-растворимости. При отсутствии доказательств, свидетельствующих о нестабильности в желудочно-кишечном тракте, считается, что лекарственное вещество с немедленным высвобождением обладает высокой проникающей способностью, если определяемая степень абсорбции у людей составляет 90% или больше от вводимой дозы, исходя из определения баланса веществ или по сравнению с внутривенной эталонной дозой. Проникающую способность можно определить с применением подходов баланса веществ, абсолютной биодоступности или кишечной перфузии. Когда один способ не позволяет окончательно дать представление о классе проникающей способности, рекомендуется применение двух разных способов. Готовая лекарственная форма считается быстро растворимой в том случае, когда не менее 85% от указанного на упаковке содержания лекарственного вещества растворяется в течение 30 минут при использовании аппарата I согласно USP при 100 об/мин (или аппарата II при 50 об/мин) в объеме 900 мл или меньше в каждой из следующих сред: (1) в 0,1 н. HCl или в искусственном желудочном соке без ферментов согласно USP; (2) буфере с pH 4,5; и (3) буфере с pH 6,8 или искусственном кишечном соке без ферментов согласно USP. См. FDA Guidance for Industry: Waiver of In Vivo Bioavailability and Bioequivalence Studies for Immediate-Release Solid Oral Dosage Forms Based on a Biopharmaceutics Classification System. (August 2000), которое включено в данный документ посредством ссылки в отношении таких данных.
Используемый в данном документе термин «биодоступность», означает общее количество указанной дозировки вводимого средства, которое достигает компартмента крови. Ее обычно измеряют в виде площади под кривой на графике зависимости концентрации от времени.
Используемая в данном документе «ткань» означает группу или слой клеток, которые вместе выполняют функцию, включая без ограничения ткань кожных покровов, лимфатическую ткань (например, лимфоузлы), ткань слизистой, ткань органов размножения, ткань шейки матки, ткань влагалища и любую часть организма, которая состоит из разных типов ткани и которая выполняет конкретную функцию, т. е. орган, включая без ограничения легкое, селезенку, толстый отдел кишечника, вилочковую железу. Используемый в данном документе термин ткань включает любую ткань, которая взаимодействует с окружающей средой или доступна для нее, например ткань слизистых оболочек или кожных покровов.
Используемый в данном документе термин «ткань-биодоступность» означает количество средства, доступное in vivo в конкретной ткани. Эти количества обычное измеряют в качестве показателей активности, которые могут относиться к связыванию, мечению, детекции, переносу, стабильности, биологическому воздействию или другим измеряемым свойствам, применимым для диагностики и/или терапии. Кроме того, понятно, что определение «биодоступность в ткани» также включает количество средства, доступное для применения в конкретной ткани. «Биодоступность в ткани» включает общее количество средства, накопленного в определенной ткани, количество средства, присутствующего в определенной ткани, количество средства, накопленного на единицу массы/объема определенной ткани, и количество средства, накопленного за единицу времени в определенной единице массы/объема определенной ткани. Биодоступность в ткани включает количество средства, которое доступно in vivo в определенной ткани или в совокупности тканей, как, например, в тех тканях, которые образуют сосудистую сеть и/или различные органы в организме, например, часть организма, которая состоит из разных типов ткани и которая выполняет определенную функцию, например, лимфатическая сосудистая сеть или кровь.
Термин «Cmax», используемый в данном документе, означает максимальную концентрацию в крови (плазме крови, сыворотке крови или цельной крови) или максимальную концентрацию в крови, рассчитанную по или выведенную из кривой зависимости концентрация-время, и ее выражают в единицах мг/л или нг/мл в зависимости от того, что применимо.
Термин «Cmax», используемый в данном документе, означает минимальную концентрацию в крови (плазме крови, сыворотке крови или цельной крови) или минимальную концентрацию в крови, рассчитанную по или выведенную из кривой зависимости концентрация-время, и ее выражают в единицах мг/л или нг/мл в зависимости от того, что применимо.
Термин «Cavg», используемый в данном документе, означает концентрацию в крови (плазме крови, сыворотке крови или цельной крови) лекарственного средства в пределах интервала дозирования, рассчитанную в виде AUC/интервал дозирования, и ее выражают в единицах мг/л или нг/мл в зависимости от того, что применимо.
Термин «Tmax», используемый в данном документе, означает время после введения, за которое достигается Cmax, и его выражают в единицах часы (ч.) или минуты (мин.) в зависимости от того, что применимо.
Термин «AUC0→τ», используемый в данном документе, означает площадь под кривой зависимости концентрации в крови (плазме крови, сыворотке крови или цельной крови) от начала исследования время ноль до определенного времени тау (τ) в пределах интервала дозирования в равновесном состоянии, где тау представляет собой протяженность интервала дозирования, и он выражается в единицах ч. мг/л или ч. нг/мл в зависимости от того, что применимо. Например, термин AUC0→12, используемый в данном документе, означает площадь под кривой зависимости концентрации от времени, равном 0-12 часов.
Термин «AUC0→∞», используемый в данном документе, означает площадь под кривой зависимости концентрации в крови (плазме крови, сыворотке крови или цельной крови) от времени 0 часов до бесконечности, и его выражают в единицах ч. мг/л или ч. нг/мл в зависимости от того, что применимо.
Термин «AUCобщая», используемый в данном документе, означает объединенную площадь под кривой зависимости концентрации в крови (плазме крови, сыворотке крови или цельной крови) от времени, и его выражают в единицах ч. мг/л (или ч. нг/мл) по меньшей мере для одной или более доз фармацевтических композиций, описанных в данном документе. В одном аспекте «AUCобщая» означает объединенную площадь под кривой зависимости концентрации в крови от времени по меньшей мере для двух доз фармацевтических композиций, описанных в данном документе.
Термин «лечение» означает введение терапевтического средства в количестве, посредством способа или режима, эффективных для улучшения состояния, симптома или параметра, ассоциированных с нарушением.
Термин «профилактика» означает предупреждение или сокращение прогрессирования нарушения, или до статистически значимой степени, или до такой степени, которая поддается выявлению специалистом в данной области.
Термин «практически», используемый в данном документе, означает в большой или значительной степени, но не в абсолютной. В некоторых аспектах практически означает от 90% до 99% или более в разных вариантах осуществления, описанных в данном документе, включая каждое целое число в пределах указанного диапазона.
Используемые в данном документе термины «субъект» и «пациент» используют взаимозаменяемо. Используемый в данном документе субъект представляет собой предпочтительно млекопитающего, такого как млекопитающее, не относящееся к приматам (например, коровы, свиньи, кони, кошки, собаки, крысы и т.д) и относящееся к приматам (например, обезьяну и человека), наиболее предпочтительно человека.
Используемые в данном документе термины «нарушение» и «заболевание» используют взаимозаменяемо для обозначения состояния у субъекта. Заболевания включают любые прекращение, приостановку или нарушение функций организма, систем или органов.
Используемые в данном документе выражения «лечить», «лечение» и «при лечении» относятся к устранению, снижению или уменьшению тяжести симптомов заболевания или нарушения. В некоторых вариантах осуществления лечение означает устранение, удаление, модификацию или контроль первичной, региональной или метастатической раковой ткани, что является результатом введения одного или более терапевтических средств. В определенных вариантах осуществления такие термины относятся к минимизации или задержке распространения рака, являющихся результатом введения одного или более терапевтических средств субъекту с таким заболеванием.
Используемые в данном документе термины «контролировать», «при контроле» и «контроль» относятся к положительным эффектам, которые субъект получает в результате введения профилактического или терапевтического средства, но которые не приводят к излечению заболевания. В определенных вариантах осуществления субъекту вводят одно или более профилактических или терапевтических средств для «контроля» заболевания c тем, чтобы предупредить прогрессирование или усугубление течения заболевания.
Используемые в данном документе термины «предупреждать», «при предупреждении» и «предупреждение» означают предупреждение повторного проявления или возникновения одного или более симптомов нарушения у субъекта, что является результатом введения профилактического или терапевтического средства.
Используемая в данном документе фраза «побочные эффекты» охватывает нежелательные и негативные эффекты, возникающие за счет применения профилактического или терапевтического средства. Негативные эффекты всегда являются нежелательными, но нежелательные эффекты необязательно являются побочными. Негативный эффект от профилактического или терапевтического средства может быть опасным, или неприятным, или сопряжен с риском. Побочные эффекты химиотерапии включают без ограничения гастроинтестинальную токсичность, как, например, без ограничения ранняя и поздно наступающая диарея и метеоризм, тошнота, рвота, анорексия, лейкопения, анемия, нейтропения, астения, спазмы в животе, лихорадочное состояние, боль, снижение массы тела, дегидратация, облысение, диспноэ, бессонница, головокружение, воспаление слизистых оболочек, ксеростомия и почечная недостаточность, а также запор, нервные и мышечные явления, обратимое или необратимое повреждение почек и желчного пузыря, гриппоподобные симптомы, задержка жидкости и обратимое или необратимое бесплодие. Побочные эффекты лучевой терапии включают без ограничения утомляемость, сухость во рту и потерю аппетита. Побочные эффекты применения биопрепаратов/иммунопрепаратов включают без ограничения высыпания или отеки в месте введения, гриппоподобные симптомы, такие как лихорадка, озноб и утомляемость, проблемы с пищеварительным трактом и аллергические реакции. Побочные эффектов разновидностей гормональной терапии включают без ограничения тошноту, нарушения детородной функции, депрессию, потерю аппетита, проблемы со зрением, головную боль и колебания массы тела. Из уровня техники известны многочисленные дополнительные нежелательные эффекты, которые, как правило, проявляются у пациентов, см., например, справочник the Physicians’ Desk Reference (69th ed., 2015), который включен в данный документ посредством ссылки в своем полном объеме.
Используемая в данном документе фраза «доставка в восприимчивую ткань» или «жизнеспособную ткань» означает доставку одного или более средств в живую ткань или структуру ткани, например, в кожу, кровеносную сосудистую сеть, лимфатическую сосудистую сеть и лимфатические узлы. В некоторых вариантах осуществления, описанных в данном документе, способы, композиции и устройства, дополнительно описанные в данном документе, могут модулировать структуру живой ткани или тканевую структуру с облегчением абсорбции одного или более средств. В некоторых аспектах живая ткань или тканевая структура включают кожу и отдельные жизнеспособные клетки, из которых состоит кожа. В некоторых аспектах, описанных в данном документе, способы доставки индуцируют определенные клетку или ткань (например, жизнеспособную кожа) таким образом, чтобы они стали восприимчивыми к доставке одного или более средств в данную конкретную ткань. В некоторых аспектах, описанных в данном документе, живая ткань или тканевая структура содержат один или более слоев жизнеспособной кожи, как, например, жизнеспособные слои эпидермиса и нижележащей дермы. В некоторых аспектах, описанных в данном документе, живая ткань или тканевая структура содержат лимфатические капилляры, например, питающие восприимчивые сплетения лимфатических капилляров.
В данном документе описаны способы и устройства для доставки средств в кожу. В определенных вариантах осуществления, описанных в данном документе, представлены способы доставки средств в лимфатическую сосудистую сеть.
В вариантах осуществления, описанных в данном документе, представлены способы доставки одного или более средств в кожу. В некоторых аспектах одно или более средств доставляют по меньшей мере в часть или область жизнеспособной или нежизнеспособной кожи. В некоторых аспектах одно или более средств доставляются по меньшей мере в часть или участок жизнеспособного эпидермиса. В некоторых аспектах одно или более средств доставляются по меньшей мере в часть или участок нежизнеспособного эпидермиса. Как далее описано в данном документе, одно или более средств способны проходить через жизнеспособный эпидермис и поступать в дерму, тем самым вступая в близкий контакт c одним или более кровеносными или лимфатическими капиллярами.
Доставка в кожу сопряжена с рядом трудностей, с учетом барьерной функции, обеспечиваемой кожей. В плане анатомического строения кожа в целом состоит из двух главных слоев тканей, наружного – эпидермиса и нижележащего – дермы, которые вместе образуют кожу. В общих чертах система покровов тела предусматривает кожу, волосы, ногти, экзокринные железы и подкожные ткани. Многие подходы для трансдермальной доставки или подходы с применением микроигл для доставки в кожу и через эпидермис и в жизнеспособную дерму являются неудачными из-за того, что данная барьерная функция обусловливает задержку доставляемых материалов в одном или более слоях эпидермиса.
Эпидермис подразделяется на четыре основных слоя или оболочки. В направлении снизу вверх расположены базальная мембрана, базальный слой или герминативный слой, слой сквамозных клеток или шиповатый слой, слой гранулярных клеток или гранулярный слой, и ороговевший слой или роговой слой. Среди этих трех слоев три нижних слоя (т. е., герминативный слой, шиповатый слой и гранулярный слой) составляют живые слои эпидермиса.
Данные живые слои эпидермиса являются важными из-за барьерной функции кожи, которая основывается на самообновлении и дифференциации расположенных в основании стволовых клеток для регенерации верхних слоев кожи и обеспечения безъядерными клетками барьерного слоя или рогового слоя. Барьерная функция эпидермиса главным образом обусловлена присутствием плотных контактов, которые препятствуют поступлению макромолекул (например, белков), микроорганизмов и других потенциально токсичных химических веществ. Таким образом, данные плотные контакты являются барьерными структурами, которые включают сеть трансмембранных белков, погруженных в прилегающие плазматические мембраны (например, клаудины, окклюдины и молекулы межклеточной адгезии), а также множество бляшечных белков (например, ZO-1, ZO-2, ZO-3, цингулин, симплекин). Плотные контакты расположены практически во всех типах барьеров тканей, в том числе во внутреннем эпителии (например, эпителии кишечника, гематоэнцефалическом барьере, кровеносных сосудах, лимфатических сосудах), а также по всему жизнеспособному эпидермису кожи.
Толщина кожа варьирует в зависимости от локализации и возраста. Например, глазное веко имеет один из наиболее тонких слоев эпидермиса, составляющий менее приблизительно 0,2 мм; ладони кистей и подошв стоп имеют одни из наиболее толстых слоев эпидермис, имеющий толщину почти 1,5 мм. Толщина дермы также варьирует в зависимости от места расположения ткани, при этом дерма с обратной стороны в 30-40 раз толще эпидермиса, см. справочник William D. James, Timothy Berger, and Dirk Elston., Clinical Dermatology (11th ed. 2011), который включен в данный документе посредством ссылки во всей своей полноте.
Под эпидермисом расположена дерма, которая содержит два слоя, самую наружную часть, называемую сосочковым слоем дермы, и более глубокий слой, называемый сетчатый слой дермы. Сосочковый слой дермы содержит большое количество крови в микроциркуляторном русле и лимфатических сплетениях. И для сравнения сетчатый слой дермы является относительно бесклеточным, состоящим из плотной коллагеновой и эластичной соединительной ткани. Под эпидермисом и дермой расположена подкожная ткань, также называемая гиподермой, которая состоит из соединительной ткани и жировой ткани. См. справочник Physiology, Biochemistry, and Molecular Biology of the Skin, Second Edition, (L.A. Goldsmith, Ed., 2nd ed. Oxford University Press, New York, 1991), который включен в данный документе посредством ссылки во всей своей полноте.
В некоторых вариантах осуществления предусмотрены способы, описанные в данном документе, для повышенной доставки одного или более средств в одну или более лимфатических тканей. В некоторых аспектах одно или более средств перемещаются через лимфатическую сосудистую сеть в один или более лимфатических узлов. Как дополнительно описано в данном документе, лимфатическая сосудистая сеть включает все лимфатические эндотелиальные клетки, образующие лимфатические капилляры, более крупные лимфатические сосуды и собирающие протоки. Жидкость в лимфатической сосудистой сети и все биологические материалы в данной жидкости в дальнейшем сливаются в один или более лимфоузлов и в конечном итоге в кровеносное русло с поступлением в системный кровоток. Полный обзор физиологии лимфатической системы см., William N. Charman and Valentino J. Stella, Lymphatic Transport of Drugs (1992), который включен в данный документе посредством ссылки во всем своем объеме.
Лимфатическая система представляет собой часть иммунной системы, защищающей организм от инфекции и инвазии чужеродными организмами. Лимфоциты и макрофаги осуществляют досмотр большинства тканей организма в отношении вторгающихся вирусов, бактерий, опухолевых клеток, чужеродных белков, токсинов, поврежденных и погибающих клеток, а также чужеродных клеток, в том числе чужеродных тканевых трансплантатов. Лимфатические сосуды сообщаются с большинством тканей, транспортируя лимфатическую жидкость, которая переносит иммунные клетки в лимфоузлы и органы иммунной системы, такие как селезенка и вилочковая железа. Лимфатические сосуды, также называемые лимфатическими протоками или лимфатической сосудистой сетью, представляют собой сеть из тонких непрозрачных трубчатых структур, которые разветвляются подобно кровеносным сосудах в тканях по всему организму. У млекопитающих, в том числе людей, большинство тканей и органов дренируются лимфатической системой.
В отличие от кровеносной системы лимфатический система не является замкнутой и не имеет главного качающего органа. Лимфатический система образует одностороннюю проточную систему по направлению к сердцу. Сложная разветвленная сеть лимфатических капилляров отводит интерстициальную жидкость из тканей, после чего эта жидкость называется лимфой. Некоторые типы соединительной ткани, такие как хрящевая ткань и роговица, не имеют кровеносных сосудов и также лишены лимфатических протоков. Лимфа передвигается медленно и при низком давлении за счет перистальтического сокращения.
Диаметр данных лимфатических капилляров составляет от десяти до пятидесяти микрометров в диаметре. Они начинаются слепо или от анастомозирующих сосудов. Эндотелий представляет собой отдельный слой с неполной базальной мембраной. Они обладают щелевыми контактами, которые являются высоко проницаемыми для белков плазмы крови и крупных частиц, включая, например, частицы углерода, патогенные организмы, такие как вирусы, бактериальные клетки и паразитические организмы, клетки, включая, например, иммунные клетки и опухолевые клетки, а также продукты клеточного распада. Лимфатические капилляры имеют одноходовые клапаны, которые обеспечивают возможность потока только в одном направлении. Когда давление интерстициальной жидкости снаружи лимфатического капилляра больше давления внутри капилляра, створки открываются, позволяя жидкости поступать. И наоборот, когда давление внутри капилляра больше, створка принудительно закрывается, препятствуя вытеканию лимфы из сосуда. Во время воспаления в капиллярах раскрываются дополнительные просвета, обеспечивающие возможность захвата еще более крупных молекул и продуктов клеточного распада.
Лимфа течет из капилляров в собирающие лимфатические протоки, где впервые встречаются первые из множестве лимфоузлов. Эти «афферентные» лимфатические сосуды приносят лимфу в лимфоузел, а «эфферентные» лимфатические сосуды выводят лимфу из лимфоузла. Лимфа представляет собой бесцветную, водянистую жидкость, возникающую из интерстициальной жидкости. Лимфа возникает в результате того, что происходит потеря плазмы крови в системе капилляров кровеносной системы, которая просачивается в окружающие ткани. Хотя капилляры кровеносной системы теряют лишь приблизительно 1% от объема жидкости, которая проходит через них в интерстициальную ткань; тем не менее, в системе циркулирует настолько много крови, что суммарная потеря жидкости в организме человека в среднем составляет приблизительно три литра в день. В лимфатической системе осуществляется повторный захват данной жидкости за счет диффузии в лимфатические капилляры, при этом происходит ее фильтрация через разные лимфоузлы и возврат в кровеносную систему через грудной лимфатический проток. В пределах лимфатической системы данная жидкость называется лимфой, и она характеризуется практически таким же самым составом, как и исходная интерстициальная жидкость.
Лимфатический капилляры распространены повсеместно во всем организме. Неограничивающе примеры таки мест расположения включают жизнеспособную кожу (дерму), сухожилия, поперечно-полосатые мышцы, влагалища мышц, надкостница кости, капсулы суставов, располагающаяся под мезотелием оболочка плевральной, перитонеальной и перикардиальной полостей, пищеварительный канал, слюнные железы, печень, селезенка, носовая полость, трахея, бронхи, щитовидная железа, вилочковая железа, надпочечник, почка, мочевой пузырь, мочеиспускательный канал, предстательная железы, семенник, матка, яичник и сердце.
В лимфатических узлах осуществляется фильтрация лимфы с помощью внутренней пористой соединительной ткани, заполненной лимфоцитами, которые улавливают и уничтожают бактерии и вирусы. В лимфоузлах также продуцируются лимфоциты и антитела. Когда организм борется с инфекцией, количество этих лимфоцитов быстро умножается, что в результате приводит к характерному опуханию лимфоузлов. Лимфа переносится в поступательно увеличивающиеся в размере лимфатические сосуды, достигающих правого лимфатического протока (для лимфы из верхней правой части тела) и грудного лимфатического протока (для остальной части тела). В этих протоках осуществляются дренирование в кровеносную систему в правой и левой подключичных венах, расположенных рядом с плечами. Наряду с сетью лимфатических сосудов существует ряд различных лимфатических тканей и органов, включая лимфатические узелки, Пейеровы бляшки, миндалины, лимфоузлы, вилочковую железу и селезенку.
Лимфатический узлы являются местами временного скопления лимфоцитов, которые образуются в местах возникновения инфекции, а затем исчезают. Узлы не отделены какими-либо капсулой или внешней оболочкой от окружающих клеток и жидких сред, которые проходят непосредственно в узлы. В плотную капсулу лимфоузлов заключено множество лимфатических узелков, и их питание осуществляется за счет кровеносных сосудов и лимфатических сосудов. В лимфоузлах происходит фильтрация лимфы, доставляемой к ним по лимфатическим сосудам. Таким образом, в лимфатических узлах фильтруется лимфа, дренируемая из системы лимфатических капилляров, в которой располагаются лимфоузлы. Пейеровы бляшки представляют собой крупные узловые скопления лимфоцитов, расположенные в стенках тонкого кишечника, а миндалины представляют собой скопления лимфоидной ткань, окруженных слизистой оболочкой глотки. Пейеровы бляшки и миндалины расположены в определенных участках с тем, чтобы перехватывать антигены в пищеварительном и респираторном трактах соответственно.
Селезенка, лимфоузлы и вспомогательная лимфоидная ткань (включая миндалины и червеобразный отросток) являются вторичными лимфоидными органами. Эти органы состоят из структурной соединительной ткани, которая обеспечивает поддержку циркулирующим B- и T-лимфоцитам и другим иммунным клеткам, включая, например, макрофаги, дендритные клетки и эозинофилы. Когда микроорганизмы вторгаются в тело или тело сталкиваются с другими антигенами, антигены, как правило, переносятся из ткани в лимфу. Лимфа поступает в лимфатических сосудах в региональные лимфоузлы. В лимфоузлах макрофаги и дендритные клетки фагоцитируют антигены, процессируют антигены и презентируют антигены лимфоцитам, которые затем начинают продуцировать антитела или служат в качестве клеток памяти для повторного распознавания антигенов в будущем. Лимфа и лимфоидная ткань, таким образом, содержат антитела и иммунные клетки.
Существует большой диапазон скорости лимфатической абсорбции жидкости из интерстициальных тканей. Например, было установлено, что процент воды, выводимый из тонкого кишечника посредством лимфатических сосудов варьирует в любом месте от 1% до около 85%, при этом другие показатели свидетельствуют о том, лимфатическая система ответственна за абсорбцию от 15 до 20% интерстициальной жидкости. Это расхождение, вероятно, связано с действительным физиологическим состоянием измеряемой лимфатической ткани.
Лимфатический капилляры широко распространены в коже у млекопитающих. В частности, было обнаружено, что определенные участки, такие как пальцы и ладони, и ладонные и подошвенные поверхности стоп и пальцев ног, а также мошонка имеют наивысший показатель распределения лимфатических сосудов. Лимфатические сосуды в коже состоят, по сути, из поверхностного лимфатического сплетения в дерме, простирающегося в вверх в наружные две трети части структуры дермы в сосочковый слой дермы. Более глубоко расположенные сплетения лежат в дерме около подкожной ткань на границе с участками сетчатого слоя дермы. Обычно незначительное количество лимфатической ткань обнаруживают в эпидермисе или слоях подкожной ткани, или она вообще отсутствует. Лимфатические сосуды являются, как правило, более однородными в тех участках кожи, в которых имеются более толстые слои дермы (например, ладонная поверхность кистей рук и подошвенная поверхность стоп). Аналогично тканям тонкого кишечника абсорбция интерстициальной жидкости и белков в коже является высоковариабельной, например, в моделях на животных ток лимфы в областях кожи составляет примерно 1 мл/ч./100 г ткани, который может увеличиваться более чем в 10 раз в зависимости от физиологии местной ткани, окружающей лимфатическую сосудистую сеть. Были установлены разные факторы, которые воздействуют на лимфатическую абсорбцию, включая венозное давление, сокращение окружающих тканей и кровеносных сосудов и показатели частоты дыхания. Например, уравнением Старлинга описывается образование интерстициальной жидкости за счет конкурентного взаимодействия гидростатических и онкотических сил вдоль полупроницаемых стенок капилляров. Таким образом, повышенное гидростатическое давление или сниженное онкотическое давление в кровеносном сосуде или повышенная проницаемость капилляра будут направлены на стимуляцию увеличения объема интерстициальной жидкости и дальнейшей абсорбции жидкости лимфатическими капиллярами или отеку.
Абсорбция белков и липидов также значительно варьируется и главным образом зависит от скоростей абсорбции, места расположения в коже и размера молекулы. В целом размер и липо- или гидрофильность молекулы играет существенную роль в ее относительной абсорбции. Например, и не ограничиваясь какой-либо теорией, полагают, что молекулы размером меньше 10 кДа абсорбируются кровеносными капиллярами и лимфатическими капиллярами с примерно одинаковой скоростью, тогда как молекулы размером более 20 кДа могут с большей вероятностью поступать в лимфатические сосуды в зависимости от физиологического состояния указанного местного лимфатического капилляра, как описано выше.
Таким образом, было широко признано, что доставка в лимфатическую систему была бы высоко востребованной из-за повсеместной распространенности лимфатических капилляров и их способности абсорбировать множество средств разных размеров. Упомянутое выше вовлечение лимфатической системы в воспаление, и возникновение, и распространение различных видов рака, и в течение воспаления, предоставляет важный альтернативный путь как для местного, так и для системного лечения воспаления и рака.
В некоторых вариантах осуществления описанных в данном документе, одно или более средств могут доставляться в жидком растворе носителя. В одном аспекте тоничность жидкого носителя может быть гипертонической по отношению к жидкостям в кровеносных капиллярах или лимфатических капиллярах. В другом аспекте тоничность раствора жидкого носителя может быть гипотонической по отношению к жидкостям в кровеносных капиллярах или лимфатических капиллярах. В другом аспекте тоничность раствора жидкого носителя может быть изотонической по отношению к жидкостям в кровеносных капиллярах или лимфатических капиллярах. Раствор жидкого носителя может дополнительно содержать по меньшей мере один или более фармацевтически приемлемых наполнителей, разбавителей, сорастворителей, материалов в форме частиц или коллоидов. Известны фармацевтически приемлемые наполнители для применения в растворах жидких носителей, см., например, справочник Pharmaceutics: Basic Principles and Application to Pharmacy Practice (Alekha Dash et al. eds., 1st ed. 2013), который для представления изложенных в нем идей включен в настоящий документ посредством ссылки.
В некоторых вариантах осуществления, описанных в данном документе, одно или более средств непосредственно доставляются в местоположение в эпидермисе. В некоторых аспектах одно или более средств диффундируют, перемещаются, поступают или переносятся в местоположение, расположенное в непосредственной близости с лимфатической сосудистой сетью. Как описано в данном документе, результатом такого размещения в эпидермисе после применения описанных в данном документе способов является диффузия или перемещение средства через эпидермис и в жизнеспособный эпидермис, что обеспечивает возможность непосредственного контакта средства с наиболее поверхностно расположенной системой лимфатических капилляров или также известной как лимфатическая дренажная система или сплетение лимфатических капилляров, физиологическая функция которой заключается в отведении интерстициальной жидкости из указанного местоположения в остальную часть лимфатической системы. Дополнительно результатом способов доставки одного или более средств в систему лимфатических капилляров, описанную в данном документе, может быть доставка средства в первые лимфоузлы, дренирующие систему лимфатических капилляров, также называемые «первичными» лимфоузлами. В некоторых аспектах результатом локализованной доставки одного или более средств также может быть доставка средства в дополнительные лимфоузлы, расположенные ниже первичных лимфоузлов, также называемых «вторичными» лимфоузлами. В некоторых аспектах средство может в дальнейшем поступать в ток крови и доставляться системно.
Некоторые варианты осуществления, описанные в данном документе, включают способы доставки одного или более средств в лимфатическую ткань, содержащую один или более лимфатических капилляров, лимфатических узелков, лимфатических узлов, Пейеровых бляшек и/или миндалин. В некоторых аспектах способы, описанные в данном документе, являются подходящими для доставки к одному или более лимфатическим узлам в любой ткани или в любом участке организма. Подходящие неограничивающие примеры предусматривают лимфоузлы, расположенные в кистях рук, стопах, бедрах (бедренные лимфоузлы), руках, ногах, подмышечных впадинах (подмышечные лимфоузлы), паховой области (паховые лимфоузлы), шее (шейные лимфоузлы), груди (грудные лимфоузлы), брюшной полости (подвздошные лимфоузлы), подколенные лимфоузлы, окологрудинные лимфоузлы, латеральные аортальные лимфоузлы, параортальные лимфоузлы, подподбородочные лимфоузлы, околоушные лимфоузлы, подчелюстные лимфоузлы, подключичные лимфоузлы, межреберные лимфоузлы, диафрагмальные лимфоузлы, панкреатические лимфоузлы, цистерну грудного протока, поясничные лимфоузлы, крестцовые лимфоузлы, запирательные лимфоузлы, брыжеечные лимфоузлы, брыжеечно-ободочные лимфоузлы, средостенные лимфоузлы, желудочные лимфоузлы, печеночные лимфоузлы и cелезеночные лимфоузлы.
В некоторых вариантах осуществления, описанных в данном документе, представлены способы доставки одного или более средств в одно или более сплетений лимфатических капилляров у субъекта в одной или более тканей, имеющих по меньшей мере одно сплетение лимфатических капилляров. В некоторых аспектах одно или более средств можно доставлять в одно или более сплетений лимфатических капилляров, расположенных в жизнеспособном слое кожи. В некоторых аспектах одно или более средств могут абсорбироваться одним или более сплетений лимфатических капилляров, расположенных в жизнеспособном слое кожи. В некоторых аспектах одно или более доставленных средств могут абсорбироваться одним или более сплетений лимфатических капилляров, расположенных в сосочковом слое дермы. В некоторых аспектах одно или более доставленных средств могут абсорбироваться одним или более сплетений лимфатических капилляров, расположенных в сетчатом слое дермы.
В некоторых вариантах осуществления, описанных в данном документе, представлены способы доставки одного или более средств в кожу с применением максимального значения глубины. В некоторых аспектах одно или более средств доставляются в эпидермис, который содержит и нежизнеспособный эпидермис (например, роговой слой), и жизнеспособный эпидермис, расположенный ниже нежизнеспособного эпидермиса. Значение глубины в жизнеспособной коже может варьировать в зависимости от места расположения, возраста и физиологии кожи конкретного субъекта, что описано в данном документе. Общее значение глубины в коже для доставки одного или более средств можно описать в виде распределения множества значений глубины, на которой могут располагаться одно или более средств после первичного введения одного или более средств с применением описанных в данном документе способов. Общее распределение значений глубины для доставки одного или более активных средств зависит от скорости введения, объема и значения глубины в коже, на которую проникает структура для доставки, что далее описано в данном документе. Следовательно, части общего доставляемого средства могут находится на более поверхностной глубине или на более значительной глубине, где общее доставляемое средство имеет среднее значение глубины для доставки и стандартным отклонением диапазона значений глубины для доставки. Следовательно, в некоторых аспектах доставка одного или более средств в кожу, как описано в данном документе, может происходить в соответствии с простым нормальным распределением (т. е. гауссовским распределением) в коже. В некоторых других аспектах доставка одного или более средств в жизнеспособную кожу может происходит в соответствии с мультимодальным распределением значений глубины в коже.
Доставка одного или более средств в эпидермис, где одно или более введенных средств проявляет распределение значений глубины в эпидермисе, обеспечивает ранее нереализованный аспект приведения в контакт всех уровней потенциальных дермальных лимфатических капилляров. Способы, описанные в данном документе, дополнительно предусматривают обратимое увеличение проницаемости барьерной функции кожи для активации нисходящей (сверху вниз) диффузии или перемещения средства через все слои эпидермиса и в жизнеспособную дерму. В некоторых аспектах, описанных в данном документе, доставка в эпидермис дает больший лимфатический захват по сравнению с альтернативными способами доставки парентеральным путем, такими как методики внутрикожной доставки, при которых могут быть упущены первичные лимфатические капилляры, находящиеся непосредственно ниже базальной мембраны эпидермиса, в результате чего понижается лимфатический захват. Не вдаваясь в какую-либо теорию, это может возникать из-за того, что средство может более свободно перемещаться вниз через сетчатый слой дермы и в подкожную ткань. Следовательно, за счет обеспечения способов, которые обеспечивают возможность диффузии или перемещения средства через эпидермис при множестве значений скорости потока, как описано в данном документе, поверхностные лимфатические протоки и глубоко расположенные лимфатические протоки в дерме могут вступать в контакт со средством, которое повышает скорость абсорбции или количество средства для одного или более восприимчивых лимфатических капилляров.
В некоторых вариантах осуществления, описанных в данном документе, по меньшей мере часть или все из одного или более средств могут быть непосредственно доставлены или введения на начальную глубину в коже, содержащей нежизнеспособный эпидермис и/или жизнеспособный эпидермис. В некоторых аспектах часть одного или более средств может также непосредственно доставляться в жизнеспособную дерму помимо эпидермиса. Диапазон значений глубины для доставки будет зависеть от заболевания, подлежащего лечению, и физиологии кожи конкретного субъекта. Исходная доставка может быть определена как место расположения в коже, где введенное средство сперва вступает в контакт, как это описано в данном документе. Не вдаваясь в какую-либо теорию, полагают, что при введении одного или более средств может происходить его перемещение (например, диффузия) от первичного сайта доставки (например, нежизнеспособного эпидермиса, жизнеспособного эпидермиса или жизнеспособной дермы) в более глубокое местоположение в жизнеспособной коже. Например, все вводимое средство или его часть могут доставляться в нежизнеспособный эпидермис, а затем они продолжают перемещение (например, диффузию) в жизнеспособный эпидермис и минуют базальный слой жизнеспособного эпидермиса и поступают в жизнеспособную дерму. Альтернативно все вводимое средств или его часть могут доставлять в жизнеспособный эпидермис (т. е. сразу под роговой слой), а затем продолжать перемещение (например, диффузию), минуя базальный слой жизнеспособного эпидермиса, и поступать в жизнеспособную дерму. И наконец, все вводимое средство или его часть могут доставлять в жизнеспособную дерму. Перемещение одного или более активных средств через кожу является многофакторным и, например, зависит от состава жидкого носителя (например, его вязкости), скорости введения, доставки структур и т. д. Данное перемещение через эпидермис и в дерму можно дополнительно определить как явление переноса и рассчитать количественно по скорости переноса массы(масс) и/или механики жидкостей (например, массовой скорости потока(потоков)).
Таким образом, в некоторых вариантах осуществления, описанных в данном документе, одного или более средств могут быть доставлены на глубину в эпидермисе, где одно или более средств перемещается, минуя базальный слой жизнеспособного эпидермиса, в жизнеспособную дерму. В некоторых аспектах, описанных в данном документе, одно или более средств затем абсорбируются одним или более восприимчивыми сплетениями лимфатических капилляров или кровеносных капилляров.
В некоторых вариантах осуществления, описанных в данном документе, распределение значений глубины в коже, куда первоначально доставляется по меньшей мере часть или все из одного или более средств, варьирует от приблизительно 5 μм до приблизительно 4500 μм, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах значение глубины в коже для доставки одного или более средств варьирует от приблизительно 5 μм до приблизительно 2000 μм, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах значение глубины в коже для доставки одного или более средств варьирует от приблизительно 5 μм до приблизительно 1000 μм, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах значение глубины в коже для доставки одного или более средств варьирует от приблизительно 5 μм до приблизительно 500 μм, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах значение глубины в коже для доставки одного или более средств варьирует от приблизительно 5 μм до приблизительно 250 μм, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах значение глубины в коже для доставки одного или более средств варьирует от приблизительно 5 μм до приблизительно 100 μм, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах среднее значение глубины в коже для доставляемых одного или более средств составляет приблизительно 5 μм, приблизительно 10 μм, приблизительно 20 μм, приблизительно 30 μм, приблизительно 40 μм, приблизительно 50 μм, приблизительно 70 μм, приблизительно 80 μм, приблизительно 90 μм, приблизительно 100 μм, приблизительно 125 μм, приблизительно 150 μм, приблизительно 175 μм, приблизительно 200 μм, приблизительно 225 μм, приблизительно 250 μм, приблизительно 275 μм, приблизительно 300 μм, приблизительно 350 μм, приблизительно 400 μм, приблизительно 450 μм, приблизительно 500 μм, приблизительно 550 μм, приблизительно 600 μм, приблизительно 650 μм, приблизительно 700 μм, приблизительно 750 μм, приблизительно 800 μм, приблизительно 850 μм, приблизительно 900 μм, приблизительно 950 μм, приблизительно 1000 μм, приблизительно 1100 μм, приблизительно 1200 μм, приблизительно 1300 μм, приблизительно 1400 μм, приблизительно 1500 μм, приблизительно 1600 μм, приблизительно 1700 μм, приблизительно 1800 μм, приблизительно 1900 μм, приблизительно 2000 μм, приблизительно 2250 μм, приблизительно 2500 μм, приблизительно 2750 μм, приблизительно 3000 μм, приблизительно 3250 μм, приблизительно 3500 μм, приблизительно 3750 μм или приблизительно 4000 μм.
В некоторых вариантах осуществления, описанных в данном документе, одно или более средств первоначально доставляют в жизнеспособную кожу, где распределение значений глубины в жизнеспособной коже для доставки одного или более средств сразу же минует роговой слой эпидермиса и располагается над подкожной тканью. В некоторых аспектах значение глубины в жизнеспособной коже для доставки одного или более средств варьирует от приблизительно 1 μм до приблизительно 4000 μм за пределами рогового слоя, но все еще в пределах жизнеспособной кожи над подкожной тканью. Будет ли данное средство находиться в эпидермисе или дерме, зависит от толщины эпидермиса, например, ожидается, что применяемые более неглубокие значения глубины для доставки, составляющие от приблизительно 1 μм до приблизительно 250 μм, минуя роговой слой, будут располагаться в жизнеспособном эпидермисе. Аналогично ожидается, что углубления со значением глубины более 400 μм, 500 μм или 700 μм будут располагаться по меньшей мере в наиболее поверхностной части жизнеспособной дермы (например, сосочковом слое дермы). В некоторых аспектах значение глубины в жизнеспособной коже для доставки одного или более средств варьирует от приблизительно 1 μм до приблизительно 5000 μм за пределами рогового слоя, но все еще в пределах жизнеспособной кожи над подкожной тканью, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах значение глубины в жизнеспособной коже для доставки одного или более средств варьирует от приблизительно 1 μм до приблизительно 3500 μм за пределами рогового слоя, но все еще в пределах жизнеспособной кожи над подкожной тканью, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах значение глубины в жизнеспособной коже для доставки одного или более средств варьирует от приблизительно 1 μм до приблизительно 2000 μм за пределами рогового слоя, но все еще в пределах жизнеспособной кожи над подкожной тканью, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах значение глубины в жизнеспособной коже для доставки одного или более средств варьирует от приблизительно 1 μм до приблизительно 1000 μм за пределами рогового слоя, но все еще в пределах жизнеспособной кожи над подкожной тканью, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах значение глубины в жизнеспособной коже для доставки одного или более средств варьирует от приблизительно 1 μм до приблизительно 500 μм за пределами рогового слоя, но все еще в пределах жизнеспособной кожи над подкожной тканью, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах значение глубины в жизнеспособной коже для доставки одного или более средств варьирует от приблизительно 1 μм до приблизительно 250 μм за пределами рогового слоя, но все еще в пределах жизнеспособной кожи над подкожной тканью, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах значение глубины в жизнеспособной коже для доставки одного или более средств варьирует от приблизительно 1 μм до приблизительно 100 μм за пределами рогового слоя, но все еще в пределах жизнеспособной кожи над подкожной тканью, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах значение глубины в жизнеспособной коже для доставки одного или более средств варьирует от приблизительно 1 μм до приблизительно 50 μм за пределами рогового слоя, но все еще в пределах жизнеспособной кожи над подкожной тканью, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах среднее значение глубины в жизнеспособной коже для доставки одного или более средств составляет приблизительно 1 μм, приблизительно 5 μм, приблизительно 10 μм, приблизительно 20 μм, приблизительно 30 μм, приблизительно 40 μм, приблизительно 50 μм, приблизительно 60 μм, 5 приблизительно 70 μм, приблизительно 80 μм, приблизительно 90 μм, приблизительно 100 μм, приблизительно 150 μм, приблизительно 250 μм, приблизительно 350 μм, приблизительно 450 μм, приблизительно 550 μм, приблизительно 650 μм, приблизительно 750 μм, приблизительно 850 μм, приблизительно 950 μм, приблизительно 1000 μм, приблизительно 1100 μм, приблизительно 1200 μм, приблизительно 1300 μм, приблизительно 1400 μм, приблизительно 1500 μм, приблизительно 1600 μм, приблизительно 1700 μм, приблизительно 1800 μм, приблизительно 1900 μм, приблизительно 2000 μм, приблизительно 2250 μм, приблизительно 2500 μм, приблизительно 2750 μм, приблизительно 3000 μм, приблизительно 3250 μм, приблизительно 3500 μм, приблизительно 3750 μм, приблизительно 4000 μм, приблизительно 4500 μм или приблизительно 5000 μм за пределами рогового слоя, но все еще в пределах жизнеспособной кожи над подкожной тканью.
Неограничивающий тесты для оценки глубины первичной доставки в коже могут быть инвазивными (например, биопсия) или неинвазивными (например, визуализация). Стандартные неинвазивные оптические методики исследования, которые можно использовать для оценки глубины для доставки средства в кожу, включают спектроскопию отражения, флуоресцентную спектроскопию, фототермическую спектроскопию или оптическую когерентную томографию (OCT). Визуализация с применением данных способов может быть проведена в режиме реального времени для оценки глубины первичной доставки. Альтернативно инвазионная биопсия кожи может быть проведена сразу же после введение средства, с последующим проведением стандартных гистологических методик и методик окрашивания для определения глубины для доставки средства. Например, для способов оптической визуализации, применимых для определения глубины проницаемости кожи вводимых средств, см. Sennhen, et al., Skin Pharmacol., 6(2), 152-160 (1993), Gotter, et al., Skin Pharmacol. Physiol., 21, 156-165 (2008) или Mogensen et al., Semin. Cutan. Med. Surg,. 28, 196-202 (2009), каждая из которых для представления изложенных в них идей включена посредством ссылки в данный документ.
В некоторых вариантах осуществления, описанных в данном документе, представлены способы опосредованной или непосредственной доставки по меньшей мере части одного или более средств в восприимчивое сплетение лимфатических капилляров у субъекта. В некоторых аспектах по меньшей мере часть одного или более средств первоначально доставляется в эпидермис, содержащий нежизнеспособный эпидермис и жизнеспособный эпидермис, где в результате доставки происходит опосредованная доставка одного или более средств в восприимчивое сплетение лимфатических капилляров после диффузии или перемещения одного или более средств в жизнеспособную дерму, как описано в данном документе. В некоторых других аспектах по меньшей мере часть одного или более средств непосредственно доставляется в участок жизнеспособной кожи (например, жизнеспособную дерму), имеющий восприимчивое сплетение лимфатических капилляров. В некоторых аспектах восприимчивое сплетение лимфатических капилляров расположено в участке жизнеспособной дермы, как описано в данном документе. В некоторых аспектах восприимчивое сплетение лимфатических капилляров легко абсорбирует одно или более средств из местной окружающей дермальной интерстициальной ткани. В некоторых аспектах восприимчивое сплетение лимфатических капилляров является восприимчивым к абсорбированию одного или более средств из местной окружающей дермальной интерстициальной ткани за счет местных физиологических окружающих условий. В некоторых аспектах местные физиологические окружающие условия являются чувствительными к абсорбированию одного или более средств за счет присутствия воспаления, более высокого давления дермальной интерстициальной жидкости по сравнению с внутрилимфатическим давлением, более высокими показателями транскапиллярного обмена жидкостей, сокращением тканей, вдохом и выдохом или комбинацией этих факторов. В одном аспекте восприимчивое сплетение лимфатических капилляров характеризуется пониженным давлением внутри лимфатического капилляра по сравнению с окружающей дермальной интерстициальной жидкостью, в которой находятся одно или более средств, за счет чего увеличивается скорость местной абсорбции сплетением лимфатических капилляров одного или более средств. В другом аспекте восприимчивое сплетение лимфатических капилляров и одно или более средств расположены в участке воспаления, где местное воспаление стимулирует увеличение пористости сплетения лимфатических капилляров, за счет чего увеличивается скорость местной абсорбции доставляемых в него одного или более средств. В некоторых других аспектах пористость сплетения лимфатических капилляров увеличивается одним или более усилителями проницаемости, как дополнительно описано в данном документе.
В некоторых вариантах осуществления, описанных в данном документе, представлены способы опосредованной доставки одного или более средств в область жизнеспособной кожи (например, жизнеспособной дермы), имеющую одно или более восприимчивых сплетений лимфатических капилляров. В некоторых аспектах способ доставки включает введение одного или более средств в подходящей среде в эпидермис кожи при контролируемой скорости, где в результате доставки одного или более средств происходит нисходящая диффузия через эпидермис и в жизнеспособную дерму, где средство окружает одно или более восприимчивых сплетений лимфатических капилляров. В некоторых аспектах одно или более средств доставляют в виде суспензии или раствора в жидком носителе. Не вдаваясь в какую-либо теорию, полагают, что введение одного или более средств в растворе жидкого носителя при контролируемой скорости, где одно или более сплетений лимфатических капилляров окружены раствором, содержащим одно или более средств, может усиливать его абсорбцию сплетением лимфатических капилляров. Опять же, не вдаваясь в какую-либо теорию, полагают, что абсорбция раствора, содержащего одно или более средств, может быть обусловлена повышением местного давления дермальной интерстициальной жидкости вокруг сплетения лимфатических капилляров.
В некоторых вариантах осуществления, описанных в данном документе, представлены способы определения соответствия физиологической скорости абсорбции одним или более восприимчивыми сплетениями лимфатических капилляров раствора жидкого носителя, содержащего одно или более средств. В некоторых аспектах, описанных в данном документе, способы определения соответствия скорости абсорбции тканями восприимчивого сплетения лимфатических капилляров предусматривает увеличение местного давления тканевой жидкости или гидростатического давления в ткани, окружающей одно или более сплетений лимфатических капилляров. Скорость абсорбции сплетением лимфатических капилляров будет зависеть от ряда факторов, которые дополнительно описаны в данном документе (например, скоростей капиллярного потока в сосудах и скоростей фильтрации, онкотического давления в ткани и гидростатического давления, а также эластичности тканей и т. д.). Не вдаваясь в какую-либо теорию, в целом относительно небольшое повышение местного гидростатического давления в дермальной интерстициальной ткани увеличивает скорость лимфатической абсорбции. При более низких скоростях абсорбции в интерстициальной ткани лимфатические протоки являются основным путем удаления жидкости. Разные белки и другие биологические частицы переносятся с интерстициальной жидкостью, поскольку она дренируется из жидкостей интерстициальных тканей в лимфатические капилляры. Возникающие в результате повышения гидростатического давления в ткани без существенного снижения онкотического давления в ткани предпочтительно принудительно направляет жидкость в лимфатические протоки, а не в кровеносные капилляры, из-за общего повышения гидравлической проводимости в лимфатических сосудах. В отличие от этого при относительно высоких скоростях абсорбции в интерстициальной ткани капилляры, как правило, являются основным путем удаления жидкости. Как правило, это происходит из-за того, что повышенный объем жидкости проталкивается в интерстициальные ткани, при этом онкотическое давление в ткани снижается, принудительно направляя жидкость в кровеносные капилляры из-за относительно высокого онкотического давления в кровеносных капиллярах. Кроме того, наличие от средних до высоких уровней жидкости в интрестициальной ткани повышает давление на внеклеточную матрицу, увеличивая эластичность ткани (например, растяжимость ткани) и общее снижение гидростатического давления. Результатом этого является лимфатический дренаж. Таким образом, интерстициальное гидростатическое и онкотическое давления воздействуют на стенки капилляров, тогда как только давление в ткани оказывает воздействие на лимфатический дренаж.
В некоторых вариантах осуществления, описанных в данном документе, скорость абсорбции одного или более средств восприимчивым сплетением лимфатических капилляров может составлять от приблизительно 10% до приблизительно 99% от физиологической скорости абсорбции дермальной интерстициальной жидкости тканями одного или более сплетений лимфатических капилляров, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах скорость абсорбции одного или более средств восприимчивым сплетением лимфатических капилляров может составлять от приблизительно 25% до приблизительно 99% от физиологической скорости абсорбции дермальной интерстициальной жидкости тканями, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах скорость абсорбции одного или более средств восприимчивым сплетением лимфатических капилляров может составлять от приблизительно 50% до приблизительно 99% от физиологической скорости абсорбции дермальной интерстициальной жидкости тканями, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах скорость абсорбции одного или более средств восприимчивым сплетением лимфатических капилляров может составлять от приблизительно 75% до приблизительно 99% от физиологической скорости абсорбции дермальной интерстициальной жидкости тканями, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах скорость абсорбции одного или более средств восприимчивым сплетением лимфатических капилляров может составлять приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% или даже приблизительно 99% от физиологической скорости абсорбции дермальной интерстициальной жидкости тканями.
В некоторых вариантах осуществления, описанных в данном документе, за счет введения жидкости, содержащей одно или более средств, достигают повышения местного давления дермальной интерстициальной жидкости с активацией лимфатического захвата одного или более средств. Без ограничения теорией полагают, что показатели давления интерстициальной жидкости, составляющие от более приблизительно 1 мм рт ст. до приблизительно 3 мм рт. ст., приводят в результате к лимфатическому дренажу интерстициальной жидкости (например, интерстициальной жидкости в дерме). Данное значение давления в результате приводит к открытию лимфатических клапанов, чувствительных к давлению, как описано в данном документе, что позволяет интерстициальной жидкости дренировать в лимфатические капилляры. В некоторых аспектах область дермы, в которой возникает повышенное давление дермальной интерстициальной жидкости из-за введения одного или более средств, описанных в данном документе, располагается ниже участка введения в эпидермисе. В некоторых аспектах определенные значения давления в дермальной интерстициальной ткани могут составлять от приблизительно 1 мм рт. ст. до приблизительно 15 мм рт. ст. В некоторых аспектах значения давления в дермальной интерстициальной ткани можно увеличить с помощью способов, описанных в данном документе, с тем, чтобы они составляли от приблизительно 1 мм рт. ст. до приблизительно 10 мм рт. ст. В некоторых аспектах определенные значения давления в дермальной интерстициальной ткани можно увеличить с помощью способов, описанных в данном документе, с тем, чтобы они составляли от приблизительно 1 мм рт. ст. до приблизительно 5 мм рт. ст. В некоторых аспектах определенные значения давления в дермальной интерстициальной ткани можно увеличить с помощью способов, описанных в данном документе, с тем, чтобы они составляли более приблизительно 1 мм рт. ст., более приблизительно 2 мм рт. ст., более приблизительно 3 мм рт. ст., более приблизительно 4 мм рт. ст., более приблизительно 5 мм рт. ст., более приблизительно 6 мм рт. ст., более приблизительно 7 мм рт. ст., более приблизительно 8 мм рт. ст., более приблизительно 9 мм рт. ст., более приблизительно 10 мм рт. ст., более приблизительно 11 мм рт. ст., более приблизительно 12 мм рт. ст., более приблизительно 13 мм рт. ст., более приблизительно 14 мм рт. ст., более приблизительно 15 мм рт. ст., более приблизительно 16 мм рт. ст., более приблизительно 17 мм рт. ст., более приблизительно 18 мм рт. ст., более приблизительно 19 мм рт. ст. или более приблизительно 20 мм рт. ст.
Можно использовать любой способ для оценки давления интерстициальной жидкости, известный из уровня техники. Например, микропипетка, методики тампон-в-игле или тампон с катетером продемонстрировали высокие уровни точности параллельных определений, и их можно использовать для оценки гидростатического давления вокруг части зонда, введенного в интерстициальное пространство субъекту (например, интерстициальное пространство в дерме) во время введения средства или после введения средства, используя способы, описанные в данном документе. См., например, публикацию Wiig and Swartz., Phsiol. Rev., 1005-1060, (2012), которая для представления изложенных в них идей включена в данный документ посредством ссылки.
В некоторых вариантах осуществления, описанных в данном документе, представлены способы для длительной доставки (или введения) одного или более средств, описанных в данном документе. В некоторых аспектах одно или более средств доставляют за период времени от приблизительно 0,1 часа до приблизительно 96 часов, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств доставляют за период времени от приблизительно 0,1 часа до приблизительно 72 часов, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств доставляют за период времени от приблизительно 0,5 часа до приблизительно 48 часов, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств доставляют за период времени от приблизительно 0,5 часа до приблизительно 24 часов, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств доставляют за период времени от приблизительно 0,5 часа до приблизительно 12 часов, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств доставляют за период времени от приблизительно 0,5 часа до приблизительно 6 часов, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств доставляют за период времени приблизительно 0,5 часа, приблизительно 1 час, приблизительно 1,5 часа, приблизительно 2 часа, приблизительно 2,5 часа, приблизительно 3 часа, приблизительно 3,5 часа, приблизительно 4 часа, приблизительно 4,5 часа, приблизительно 5 часов, приблизительно 6 часов, приблизительно 7 часов, приблизительно 8 часов, приблизительно 9 часов, приблизительно 10 часов, приблизительно 1,1 часов, приблизительно 12 часов, приблизительно 16 часов, приблизительно 20 часов, приблизительно 24 часа, приблизительно 28 часов, приблизительно 32 часа, приблизительно 36 часов, приблизительно 40 часов, приблизительно 44 часа, приблизительно 48 часов, приблизительно 52 часа, приблизительно 56 часов, приблизительно 60 часов, приблизительно 64 часа, приблизительно 68 часов или приблизительно 72 часа.
В некоторых вариантах осуществления, описанных в данном документе, одно или более средств в растворе жидкого носителя вводят первично в примерное пространство в коже. Одно или более средств в растворе жидкого носителя, первично доставляемые в кожу (например, перед любыми дальнейшими перемещением или диффузией), могут распределяться в примерно трехмерном объеме кожи или заключаться в ней. Таким образом, как дополнительно описано в данном документе, одно или более первично доставляемых средств проявляют гауссовское распределение значений глубины для доставки и также будут характеризоваться гауссовским распределением в трехмерном объеме кожной ткани. В некоторых аспектах одно или более средств в растворе жидкого носителя могут быть введены в кожу, где объем ткани, содержащий одно или более средств в растворе жидкого носителя, составляет от приблизительно 0,7 мм3 до приблизительно 2500 мм3, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств в растворе жидкого носителя могут быть введены в кожу, где общая площадь трехмерной поверхности для введенного жидкого раствора носителя, содержащего одно или более средств, составляет от приблизительно 18 мм2 до приблизительно 20000 мм2, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств в растворе жидкого носителя раствор могут быть введены в кожу, где соотношение объема и общей площади трехмерной поверхности для введенного жидкого раствора носителя, содержащего одно или более средств, составляет от приблизительно 35 мм-1 до приблизительно 5 мм-1, включая каждое целое число в пределах указанного диапазона. Иллюстративный объем, площадь поверхности и соотношения площади поверхности и объема могут варьироваться в зависимости от физиологического состояния локального участка для введения, размера устройства для доставки, глубины для доставки и подлежащего лечению заболевания.
Объем ткани, площадь поверхности и соотношение площади поверхности и объема доставляемого средства можно определить с применением стандартных геометрических расчетов после измерения общих размеров (ширины и длины) устройства для доставки, вступающего в контакт с кожей субъекта, и наибольшего значения глубины для доставки первично вводимого средства, используя стандартные способы и методики измерения глубины для доставки, как описано в данном документе.
В некоторых вариантах осуществления, описанных в данном документе, множество доз одного или более средств в растворе жидкого носителя, как описано в данном документе, одновременно вводят в кожу субъекта. В некоторых аспектах одно или более средств в растворе жидкого носителя вводят одновременно в 2-50000 частях дозы, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств в растворе жидкого носителя вводят одновременно в 2-25000 частях дозы. В некоторых аспектах одно или более средств в растворе жидкого носителя вводят одновременно в 2-15000 частях дозы, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств в растворе жидкого носителя вводят одновременно в 2-10000 частях дозы, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств в растворе жидкого носителя вводят одновременно в 2-5000 частях дозы, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств в растворе жидкого носителя вводят одновременно в 2-1000 частях дозы, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств в растворе жидкого носителя вводят одновременно в 2–500 частях дозы, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств в растворе жидкого носителя вводят одновременно в 2-250 частях дозы, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств в растворе жидкого носителя вводят одновременно в 2-150 частях дозы, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств в растворе жидкого носителя вводят одновременно в 2-100 частях дозы. В некоторых аспектах одно или более средств в растворе жидкого носителя вводят одновременно в 2-50 частях дозы, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств в растворе жидкого носителя вводят одновременно в 2-25 частях дозы, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств в растворе жидкого носителя вводят одновременно в 2-15 частях дозы, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах одно или более средств в растворе жидкого носителя вводят одновременно в 2-10 частях дозы. В некоторых аспектах одно или более средств в растворе жидкого носителя одновременно вводят в приблизительно 2 частях дозы, приблизительно 5 частях дозы, приблизительно 10 частях дозы, приблизительно 15 частях дозы, приблизительно 20 частях дозы, приблизительно 25 частях дозы, приблизительно 30 частях дозы, приблизительно 35 частях дозы, приблизительно 40 частях дозы, приблизительно 45 частях дозы, приблизительно 50 частях дозы, приблизительно 75 частях дозы, приблизительно 80 частях дозы, приблизительно 85 частях дозы, приблизительно 90 частях дозы, приблизительно 95 частях дозы, приблизительно 100 частях дозы, приблизительно 150 частях дозы, приблизительно 200 частях дозы, приблизительно 250 частях дозы, приблизительно 300 частях дозы, приблизительно 350 частях дозы, приблизительно 400 частях дозы, приблизительно 450 частях дозы, приблизительно 500 частях дозы, приблизительно 600 частях дозы, приблизительно 700 частях дозы, приблизительно 800 частях дозы, приблизительно 900 частях дозы, приблизительно 1000 частей дозы, приблизительно 2000 частей дозы, приблизительно 3000 частей дозы, приблизительно 4000 частей дозы, приблизительно 5000 частей дозы, приблизительно 6000 частей дозы, приблизительно 7000 частей дозы, приблизительно 8000 частей дозы, приблизительно 9000 частей дозы, приблизительно 10000 частей дозы, приблизительно 15000 частей дозы, приблизительно 20000 частей дозы, приблизительно 25000 частей дозы, приблизительно 30000 частей дозы, приблизительно 35000 частей дозы, приблизительно 40000 частей дозы, приблизительно 45000 частей дозы или приблизительно 50000 частей дозы. В некоторых аспектах, описанные выше части дозы можно вводить посредством подходящей структуры для доставки, как дополнительно описано в данном документе.
В некоторых вариантах осуществления, описанных в данном документе, независимые структуры для доставки, как дополнительно описано в данном документе, можно применять для введения каждой части дозы одного или более средств в кожу субъекта. В некоторых вариантах осуществления скорость потока одного или более вводимых средств на одну структуру для доставки, как описано в данном документе, может составлять от приблизительно 0,01 μл в час до приблизительно 500 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах контролируемая скорость потока одного или более вводимых средств на одну структуру для доставки, как описано в данном документе, может составлять от приблизительно 0,01 μл в час до приблизительно 250 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах контролируемая скорость потока одного или более вводимых средств на одну структуру для доставки, как описано в данном документе, может составлять от приблизительно 0,01 μл в час до приблизительно 150 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах контролируемая скорость потока одного или более вводимых средств на одну структуру для доставки, как описано в данном документе, может составлять от приблизительно 0,01 μл в час до приблизительно 100 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах контролируемая скорость потока одного или более вводимых средств на одну структуру для доставки, как описано в данном документе, может составлять от приблизительно 0,01 μл в час до приблизительно 50 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах контролируемая скорость потока одного или более вводимых средств на одну структуру для доставки, как описано в данном документе, может составлять от приблизительно 0,01 μл в час до приблизительно 25 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах контролируемая скорость потока одного или более вводимых средств на одну структуру для доставки, как описано в данном документе, может составлять от приблизительно 0,01 μл в час до приблизительно 10 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах контролируемая скорость потока одного или более вводимых средств на одну структуру для доставки, как описано в данном документе, может составлять приблизительно 0,01 μл в час, приблизительно 0,5 μл в час, приблизительно 1 μл в час, приблизительно 1,5 μл в час, приблизительно 2 μл в час, приблизительно 2,5 μл в час, приблизительно 3 μл в час, приблизительно 3,5 μл в час, приблизительно 4 μл в час, приблизительно 4,5 μл в час, приблизительно 5 μл в час, приблизительно 10 μл в час, приблизительно 15 μл в час, приблизительно 20 μл в час, приблизительно 25 μл в час, приблизительно 30 μл в час, приблизительно 35 μл в час, приблизительно 40 μл в час, приблизительно 45 μл в час, приблизительно 50 μл в час, приблизительно 60 μл в час, приблизительно 70 μл в час, приблизительно 80 μл в час, приблизительно 90 μл в час, приблизительно 100 μл в час, приблизительно 125 μл в час, приблизительно 150 μл в час, приблизительно 175 μл в час, приблизительно 200 μл в час, приблизительно 225 μл в час, приблизительно 250 μл в час, приблизительно 300 μл в час, приблизительно 350 μл в час, приблизительно 400 μл в час, приблизительно 450 μл в час или приблизительно 500 μл в час.
В некоторых вариантах осуществления, описанных в данном документе, объединенная общая контролируемая скорость потока одного или более введенных средств в кожу субъекта посредством структур для доставки, как описано в данном документе, может составлять от приблизительно 0,02 μл в час до приблизительно 50000 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более введенных средств, как описано в данном документе, может составлять от приблизительно 0,02 μл в час до приблизительно 25000 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более введенных средств, как описано в данном документе, может составлять от приблизительно 0,02 μл в час до приблизительно 15000 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более введенных средств, как описано в данном документе, может составлять от приблизительно 0,02 μл в час до приблизительно 10000 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более введенных средств, как описано в данном документе, может составлять от приблизительно 0,02 μл в час до приблизительно 5000 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более введенных средств, как описано в данном документе, может составлять от приблизительно 0,02 μл в час до приблизительно 2500 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более введенных средств, как описано в данном документе, может составлять от приблизительно 0,02 μл в час до приблизительно 1250 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более введенных средств, как описано в данном документе, может составлять от приблизительно 0,02 μл в час до приблизительно 500 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более введенных средств, как описано в данном документе, может составлять от приблизительно 0,02 μл в час до приблизительно 250 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более введенных средств, как описано в данном документе, может составлять от приблизительно 0,02 μл в час до приблизительно 125 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более введенных средств, как описано в данном документе, может составлять от приблизительно 0,02 μл в час до приблизительно 50 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более введенных средств, как описано в данном документе, может составлять от приблизительно 0,02 μл в час до приблизительно 25 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более введенных средств, как описано в данном документе, может составлять от приблизительно 0,02 μл в час до приблизительно 10 μл в час, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более средств, описанных в данном документе, может составлять приблизительно 0,02 μл в час, приблизительно 0,5 μл в час, приблизительно 1 μл в час, приблизительно 1,5 μл в час, приблизительно 2 μл в час, приблизительно 2,5 μл в час, приблизительно 3 μл в час, приблизительно 3,5 μл в час, приблизительно 4 μл в час, приблизительно 4,5 μл в час, приблизительно 30 5 μл в час, приблизительно 10 μл в час, приблизительно 15 μл в час, приблизительно 20 μл в час, приблизительно 25 μл в час, приблизительно 30 μл в час, приблизительно 35 μл в час, приблизительно 40 μл в час, приблизительно 45 μл в час, приблизительно 50 μл в час, приблизительно 60 μл в час, приблизительно 70 μл в час, приблизительно 80 μл в час, приблизительно 90 μл в час, приблизительно 100 μл в час, приблизительно 125 μл в час, приблизительно 150 μл в час, приблизительно 175 μл в час, приблизительно 200 μл в час, приблизительно 225 μл в час, приблизительно 250 μл в час, приблизительно 300 μл в час, приблизительно 350 μл в час, приблизительно 400 μл в час, приблизительно 450 μл в час, приблизительно 500 μл в час, приблизительно 550 μл в час, приблизительно 600 μл в час, приблизительно 650 μл в час, приблизительно 700 μл в час, приблизительно 750 μл в час, приблизительно 800 μл в час, приблизительно 850 μл в час, приблизительно 900 μл в час, приблизительно 950 μл в час, приблизительно 1000 μл в час, приблизительно l ,250 μл в час, приблизительно 1500 μл в час, приблизительно 1750 μл в час, приблизительно 2000 μл в час, приблизительно 2250 μл в час, приблизительно 2500 μл в час, приблизительно 2750 μл в час, приблизительно 3000 μл в час, приблизительно 3250 μл в час, приблизительно 3500 μл в час, приблизительно 3750 μл в час, приблизительно 4000 μл в час, приблизительно 4250 μл в час, приблизительно 4500 μл в час, приблизительно 4750 μл в час, приблизительно 5000 μл в час, приблизительно 5500 μл в час, приблизительно 6000 μл в час, приблизительно 6500 μл в час, приблизительно 7000 μл в час, приблизительно 7500 μл в час, приблизительно 8000 μл в час, приблизительно 8500 μл в час, приблизительно 9000 μл в час, приблизительно 9500 μл в час, приблизительно 10000 μл в час, приблизительно 20000 μл в час, приблизительно 30000 μл в час, приблизительно 40000 μл в час или приблизительно 50000 μл в час.
В некоторых вариантах осуществления, описанных в данном документе, объединенная общая контролируемая скорость потока одного или более средств, вводимых в кожу субъекта, как описано в данном документе, может варьировать от приблизительно 0,02 μл/ч./см2 до приблизительно 50000 μл/ч./см2, включая каждое целое число в пределах указанного диапазона в пересчете на общую площадь поверхности устройства для доставки, которое контактирует с кожей субъекта, как дополнительно описано в данном документе. В одном аспекте общая площадь поверхности устройства для доставки относится к площади двухмерной поверхности устройства поддерживающей подложки, которая вступает в контакт с кожей субъекта. В другом аспекте общая площадь поверхности устройства для доставки относится к сочетанию общих значений площади двухмерной поверхности в поперечном сечении каждой из независимых структур для доставки, которые вступают в контакт с кожей субъект. В некоторых аспектах общая контролируемая скорость потока одного или более вводимых средств, описанных в данном документе, может варьировать от приблизительно 0,02 μл/ч./см2 до приблизительно 50000 μл/ч./см2, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более вводимых средств, описанных в данном документе, может варьировать от приблизительно 0,02 μл/ч./см2 до приблизительно 15000 μл/ч./см2, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более вводимых средств, описанных в данном документе, может варьировать от приблизительно 0,02 μл/ч./см2 до приблизительно 10000 μл/ч./см2, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более вводимых средств, описанных в данном документе, может варьировать от приблизительно 0,02 μл/ч./см2 до приблизительно 5000 μл/ч./см2, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более вводимых средств, описанных в данном документе, может варьировать от приблизительно 0,02 μл/ч./см2 до приблизительно 2500 μл/ч./см2, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более вводимых средств, описанных в данном документе, может варьировать от приблизительно 0,02 μл/ч./см2 до приблизительно 1250 μл/ч./см2, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более вводимых средств, описанных в данном документе, может варьировать от приблизительно 0,02 μл/ч./см2 до приблизительно 500 μл/ч./см2, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более вводимых средств, описанных в данном документе, может варьировать от приблизительно 0,02 μл/ч./см2 до приблизительно 250 μл/ч./см2, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более вводимых средств, описанных в данном документе, может варьировать от приблизительно 0,02 μл/ч./см2 до приблизительно 125 μл/ч./см2, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более вводимых средств, описанных в данном документе, может варьировать от приблизительно 0,02 μл/ч./см2 до приблизительно 50 μл/ч./см2, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более вводимых средств, описанных в данном документе, может варьировать от приблизительно 0,02 μл/ч./см2 до приблизительно 25 μл/ч./см2, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более вводимых средств, описанных в данном документе, может 20 варьировать от приблизительно 0,02 μл/ч./см2 до приблизительно μл/ч./см2, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более вводимых средств, описанных в данном документе, может варьировать от приблизительно 0,02 μл/ч./см2 до приблизительно 10 μл/ч./см2, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая контролируемая скорость потока одного или более средств, описанных в данном документе, может составлять приблизительно 0,02 μл/ч./см2, приблизительно 0,5 μл/ч./см2, приблизительно 1 μл/ч./см2, приблизительно 1,5 μл/ч./см2, приблизительно 2 μл/ч./см2, приблизительно 2,5 μл/ч./см2, приблизительно 3 μл/ч./см2, приблизительно 3,5 μл/ч./см2, приблизительно 4 μл/ч./см2, приблизительно 4,5 μл/ч./см2, приблизительно 5 μл/ч./см2, приблизительно 10 μл/ч./см2, приблизительно 15 μл/ч./см2, приблизительно 20 μл/ч./см2, приблизительно 25 μл/ч./см2, приблизительно 30 μл/ч./см2, приблизительно 35 μл/ч./см2, приблизительно 40 μл/ч./см2, приблизительно 45 μл/ч./см2, приблизительно 50 μл/ч./см2, приблизительно 60 μл/ч./см2, приблизительно 70 μл/ч./см2, приблизительно 80 μл/ч./см2, приблизительно 90 μл/ч./см2, приблизительно 100 μл/ч./см2, приблизительно 125 μл/ч./см2, 30 приблизительно 150 μл/ч./см2, приблизительно 175 μл/ч./см2, приблизительно 200 μл/ч./см2, приблизительно 225 μл/ч./см2, приблизительно 250 μл/ч./см2, приблизительно 300 μл/ч./см2, приблизительно 350 μл/ч./см2, приблизительно 400 μл/ч./см2, приблизительно 450 μл/ч./см2, приблизительно 500 μл/ч./см2, приблизительно 550 μл/ч./см2, приблизительно 600 μл/ч./см2, приблизительно 650 μл/ч./см2, приблизительно 700 μл/ч./см2, приблизительно 750 μл/ч./см2, приблизительно 800 μл/ч./см2, приблизительно 850 μл/ч./см2, приблизительно 900 μл/ч./см2, приблизительно 950 μл/ч./см2, приблизительно 1000 μл/ч./см2, приблизительно 1250 μл/ч./см2, приблизительно 1500 μл/ч./см2, приблизительно 1750 μл/ч./см2, приблизительно 2000 μл/ч./см2, приблизительно 2250 μл/ч./см2, приблизительно 2500 μл/ч./см2, приблизительно 2750 μл/ч./см2, приблизительно 3000 μл/ч./см2, приблизительно 3250 μл/ч./см2, приблизительно 3500 μл/ч./см2, приблизительно 3750 μл/ч./см2, приблизительно 4000 μл/ч./см2, приблизительно 4250 μл/ч./см2, приблизительно 4500 μл/ч./см2, приблизительно 4750 μл/ч./см2, приблизительно 5000 μл/ч./см2, приблизительно 5500 μл/ч./см2, приблизительно 6000 μл/ч./см2, приблизительно 6500 μл/ч./см2, приблизительно 7000 μл/ч./см2, приблизительно 7500 μл/ч./см2, приблизительно 8000 μл/ч./см2, приблизительно 8500 μл/ч./см2, приблизительно 9000 μл/ч./см2, приблизительно 9500 μл/ч./см2, приблизительно 10000 μл/ч./см2, приблизительно 20000 μл/ч./см2, приблизительно 30000 μл/ч./см2, приблизительно 40000 μл/ч./см2 или приблизительно 50000 μл/ч./см2.
В некоторых вариантах осуществления, описанных в данном документе, представлены способы контролируемой доставки одного или более средств в растворе жидкого носителя, как описано в данном документе. В некоторых аспектах способы предусматривают проникновение по меньшей мере через наиболее поверхностный слой эпидермиса с помощью структуры для доставки, описанной в данном документе, приведение эпидермиса в контакт с одним или более усилителями проницаемости и введение одного или более средств в растворе жидкого носителя в приблизительно 2-50000 частях дозы, где части дозы вводят в кожу (например, нежизнеспособный эпидермис, и/или жизнеспособный эпидермис, и/или жизнеспособную дерму) на глубину, составляющую от приблизительно 10 μм до приблизительно 4500 μм или от приблизительно 1 μм до приблизительно 4000 μм, за пределами наиболее поверхностного слоя эпидермиса, но все еще в пределах жизнеспособной кожи над подкожной тканью; и где введение предусматривает одно или более из (a) скорости потока при введении, которая соответствует скорости лимфатического дренажа; (b) общей скорости введения, составляющей от приблизительно 0,02 μл/ч./см2 до приблизительно 50000 μл/ч./см2, исходя из площади поверхности устройства для доставки или структур для доставки; (c) давления интерстициальной жидкости, составляющего более приблизительно 2 мм рт. ст., вблизи одного или более чувствительных сплетений лимфатических капилляров; и (d) доставки одного или более средств в жидком носителе в кожу, где доставляемая жидкость заключена или контактирует с трехмерным объемом ткани, составляющим от приблизительно 0,7 мм3 до приблизительно 2500 мм3.
В некоторых вариантах осуществления, описанных в данном документе, представлены способы контролируемой доставки одного или более активных лекарственных веществ в восприимчивое сплетение лимфатических капилляров в жизнеспособной коже. В некоторых аспектах общую дозу одного или более активных лекарственных веществ в жидком носителе доставляют в эпидермис и впоследствии в одно или более восприимчивых сплетений лимфатических капилляров в жизнеспособной коже. Данная общая доза может содержать от 2 до 50000 частей дозы, как описано в данном документе. В некоторых аспектах общая доза одного или более активных лекарственных веществ может составлять от приблизительно 0,0001 мг/кг массы тела до приблизительно 100 мг/кг массы тела, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая доза одного или более активных лекарственных веществ может составлять от приблизительно 0,001 мг/кг массы тела до приблизительно 100 мг/кг массы тела, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая доза одного или более активных лекарственных веществ может составлять от приблизительно 0,01 мг/кг массы тела до приблизительно 100 мг/кг массы тела, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая доза одного или более активных лекарственных веществ может составлять от приблизительно 0,1 мг/кг массы тела до приблизительно 100 мг/кг массы тела, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая доза одного или более активных лекарственных веществ может составлять от приблизительно 0,1 мг/кг массы тела до приблизительно 50 мг/кг массы тела, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая доза одного или более активных лекарственных веществ может составлять от приблизительно 0,1 мг/кг массы тела до приблизительно 25 мг/кг массы тела, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая доза одного или более активных лекарственных веществ может составлять от приблизительно 0,1 мг/кг массы тела до приблизительно 25 мг/кг массы тела, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая доза одного или более активных лекарственных веществ может составлять от приблизительно 0,1 мг/кг массы тела до приблизительно 10 мг/кг массы тела, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая доза одного или более активных лекарственных веществ может составлять от приблизительно 0,1 мг/кг массы тела до приблизительно 5 мг/кг массы тела, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах общая доза одного или более активных лекарственных веществ может составлять приблизительно 0,0001 мг/кг, приблизительно 0,001 мг/кг, приблизительно 0,01 мг/кг, приблизительно 0,2 мг/кг, приблизительно 0,5 мг/кг, приблизительно 1 мг/кг, приблизительно 2 мг/кг, приблизительно 3 мг/кг, приблизительно 4 мг/кг, приблизительно 5 мг/кг, приблизительно 6 мг/кг, приблизительно 7 мг/кг, приблизительно 8 мг/кг, приблизительно 9 мг/кг, приблизительно 10 мг/кг, приблизительно 20 мг/кг, приблизительно 30 мг/кг, приблизительно 40 мг/кг, приблизительно 50 мг/кг, приблизительно 60 мг/кг, 25 приблизительно 70 мг/кг, приблизительно 80 мг/кг, приблизительно 90 мг/кг или приблизительно 100 мг/кг.
В некоторых вариантах осуществления, описанных в данном документе, результатом способов контролируемой доставки, описанных в данном документе, является то, что одно или более средств осаждаются в одном или более лимфатических узлах или лимфатических тканях. В некоторых аспектах концентрация одного или более активных лекарственных веществ составляет от приблизительно 0,5% до приблизительно 75% от начальной дозы на грамм ткани лимфоузла, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах концентрация одного или более активных лекарственных веществ составляет от приблизительно 0,5% до приблизительно 50% от начальной дозы на грамм ткани лимфоузла, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах концентрация одного или более активных лекарственных веществ составляет от приблизительно 0,5% до приблизительно 25% от начальной дозы на грамм ткани лимфоузла, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах концентрация одного или более активных лекарственных веществ составляет от приблизительно 0,5% до приблизительно 15% от начальной дозы на грамм ткани лимфоузла, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах концентрация одного или более активных лекарственных веществ составляет от приблизительно 0,5% до приблизительно 10% от начальной дозы на грамм ткани лимфоузла, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах концентрация одного или более активных лекарственных веществ составляет от приблизительно 0,5% до приблизительно 5% от начальной дозы на грамм ткани лимфоузла, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах концентрация одного или более активных лекарственных веществ составляет от приблизительно 10% до приблизительно 60% от начальной дозы на грамм ткани лимфоузла, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах концентрация одного или более активных лекарственных веществ составляет от приблизительно 30% до приблизительно 55% от начальной дозы на грамм ткани лимфоузла, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах концентрация одного или более активных лекарственных веществ составляет от приблизительно 40% до приблизительно 50% от начальной дозы на грамм ткани лимфоузла, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах концентрация одного или более активных лекарственных веществ составляет приблизительно 0,5%, приблизительно 3%, приблизительно 4%, приблизительно 5%, приблизительно 6%, приблизительно 7%, приблизительно 8%, приблизительно 9%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70% или приблизительно 75% от начальной дозы на грамм ткани лимфоузла.
В некоторых вариантах осуществления, описанных в данном документе, результатом способов контролируемой доставки, описанных в данном документе, является то, что одно или более активных лекарственных веществ осаждаются в одном или более лимфатических узлах, где соотношение начальной дозы одного или более средств, локализующихся в грамме ткани лимфатического узла и ткани цельной крови, составляет от приблизительно 2:1 до приблизительно 50:1 через приблизительно 36 часов, включая все соотношения в указанном диапазоне. В некоторых аспектах соотношение начальной дозы одного или более средств, локализованных в грамме ткани лимфоузла и ткани цельной крови, составляет от приблизительно 2:1 до приблизительно 25:1 через приблизительно 36 часов, включая все соотношения в указанном диапазоне. В некоторых аспектах соотношение начальной дозы одного или более средств, локализованных в грамме ткани лимфоузла и ткани цельной крови, составляет от приблизительно 2:1 до приблизительно 15:1 через приблизительно 36 часов, включая все соотношения в указанном диапазоне. В некоторых аспектах соотношение начальной дозы одного или более средств, локализованных в 25 граммах ткани лимфатического узла и ткани цельной крови, составляет от приблизительно 2:1 до приблизительно 10:1 через приблизительно 36 часов, включая все соотношения в указанном диапазоне. В некоторых аспектах соотношение начальной дозы одного или более средств, локализованных в грамме ткани лимфоузла и ткани цельной крови, составляет от приблизительно 2:1 до приблизительно 5:1 через приблизительно 36 часов, включая все соотношения в указанном диапазоне. В некоторых аспектах соотношение начальной дозы одного или более средств, локализованных в грамме ткани лимфоузла и ткани цельной крови, составляет приблизительно 2:1, приблизительно 3:1, приблизительно 4:1, приблизительно 5:1, приблизительно 6:1, приблизительно 7:1, приблизительно 8:1, приблизительно 9:1, приблизительно 10:1, приблизительно 12:1, приблизительно 14:1, приблизительно 16:1, приблизительно 18:1, приблизительно 20:1, приблизительно 25:1, приблизительно 30:1, приблизительно 35:1, приблизительно 40:1, приблизительно 45:1 или приблизительно 50:1.
В некоторых вариантах осуществления, описанных в данном документе, результатом способов контролируемой доставки, описанных в данном документе, является то, что одно или более активных лекарственных веществ осаждаются в одном или более лимфоузлах, где соотношение начальной дозы одного или более средств, локализующихся в грамме ткани лимфоузла и кожи, составляет от приблизительно 0,2:1 до приблизительно 3:1 через приблизительно 36 часов, включая все соотношения в указанном диапазоне. В некоторых аспектах соотношение начальной дозы одного или более средств, локализованных в грамме ткани лимфоузла и кожи, составляет от приблизительно 0,25:1 до приблизительно 3:1 через приблизительно 36 часов, включая все соотношения в указанном диапазоне. В некоторых аспектах соотношение начальной дозы одного или более средств, локализованных в грамме ткани лимфоузла и кожи, составляет от приблизительно 0,5:1 до приблизительно 3:1 через приблизительно 36 часов, включая все соотношения в указанном диапазоне. В некоторых аспектах соотношение начальной дозы одного или более средств, локализованных в грамме ткани лимфоузла и кожи, составляет от приблизительно 1:1 до приблизительно 3:1 через приблизительно 36 часов, включая все соотношения в указанном диапазоне. В некоторых аспектах соотношение начальной дозы одного или более средств, локализованных в 15 граммах ткани лимфатического узла и кожи, составляет приблизительно 0,2:1, приблизительно 0,2:1, приблизительно 0,4:1, приблизительно 0,6:1, приблизительно 0,8:1 или приблизительно 1:1, приблизительно 2:1 или приблизительно 3:1.
Неинвазионные способы количественного определения биораспределения лекарственного средства и фармакокинетики абсорбции тканями хорошо известны, и их используют для оценки процента абсорбировавшегося лекарственного средства от начальной дозы на грамм ткани. Процент начальной дозы одного или более средств, доставляемых на грамм ткани лимфоузла, как описано в данном документе, можно рассчитать количественно путем непосредственного мечения одного или более средств с помощью детектируемой радиоактивной метки с последующим введением средства, используя способы, описанные в данном документе. Визуализацию и количественный подсчет средства, меченного радиоактивной меткой, можно провести с использованием стандартной позитронно-эмиссионной томографии (PET) или однофотонной эмиссионной компьютерной томографии (SPECT), или комбинации данных методик с рентгеновской компьютерной томографией (CT) или магнитнорезонансной визуализацией (MRI), см., например, Ding and Wu., Theranostics, 2(11), 1040-1053 (2012), которая для представления изложенных в ней идей включена в данный документ посредством ссылки. Применимые радиоактивные метки могут предусматривать коротко- или долгоживущие радиоактивные изотопы, такие как 11C, 15O, 18F, 68Ga, 64Cu, 76Br, 89Zr, 124I. Выбор радиоактивной метки будет зависеть от средства, подлежащего тестированию, и от конкретных протоколов мечения, известных из уровня техники. Процент абсорбированной начальной дозы/грамм ткани лимфоузла, исходно измеренной с использованием или PET-, или SPECT-визуализации, может быть рассчитан с использованием стандартной радиофармацевтической дозиметрии и таблиц плотности тканей, см., Bolch, et al., J. Nucl. Med., 50(3), 477 (2009), которая для представления изложенных в ней идей включена в данный документ посредством ссылки.
Другие сравнительные методологии можно использовать для оценки количества лекарственного средства на грамм ткани, доставляемого в лимфатическую ткань. Подходящие сравнительные методологии предусматривают радиоактивное мечение одного или более средств с использованием любого из описанных выше коротко- или долгоживущих изотопов и введение меченных одного или более средств с использованием способов, описанных в данном документе, подходящему сопоставимому тестируемому субъекту. Субъект может представлять собой лабораторное животное, такое как крыса, морская свинка, мышь или обезьяна. Для определения биораспределения и процента от начальной дозы, доставляемой на грамм лимфатической ткани, лимфатическую ткань (например, один или более лимфоузлов), среди других связанных органов, можно получить от субъекта-животного, и определенные уровни радиоактивности в этой ткани можно измерить и рассчитать количественно с использованием стандартных, хорошо известных в данной области методик и сравнить с показателями радиоактивности для начальной дозировки.
В некоторых вариантах осуществления, описанных в данном документе, результатом способов контролируемой доставки, описанных в данном документе, является большая абсорбция начальной дозировки одного или более средств одним или более восприимчивыми сплетениями лимфатических капилляров относительно других общепринятых путей доставки, таких как внутривенный (i.v.), подкожный (s.c.), внутримышечный (i.m.) или внутрикожный (i.d.) инъекционные пути или общепринятые трансдермальные пластыри. В некоторых аспектах результатом способов контролируемой доставки, описанных в данном документе, является увеличение в от примерно 1,25 раза до приблизительно 50 раз лимфатической доставки одного или более средств по сравнению с i.v., s.c., i.m. или i.d. путями парентеральной доставки, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах результатом способов контролируемой доставки, описанных в данном документе, является увеличение в от примерно 1,25 раза до приблизительно 20 раз лимфатической доставки одного или более средств по сравнению с i.v., s.c., i.m. или i.d. путями парентеральной доставки, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах результатом способов контролируемой доставки, описанных в данном документе, является увеличение в от примерно 1,25 раза до приблизительно 10 раз лимфатической доставки одного или более средств по сравнению с i.v., s.c., i.m. или i.d. путями парентеральной доставки, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах результатом способов контролируемой доставки, описанных в данном документе, является увеличение в от примерно 1,25 раза до приблизительно 5 раз лимфатической доставки одного или более средств по сравнению с i.v., s.c., i.m. или i.d. путями парентеральной доставки, включая каждое целое число в пределах указанного диапазона.
Оценку захвата и сравнение средства, доставляемого с использованием способов, описанных в данном документе, одним или более сплетениями лимфатических капилляров можно определить с использованием одного или более средств для визуализации, присоединенных к средству или биологически активному средству, доставляемым с использованием способов, описанных в данном документе. Эти средства для визуализации можно использовать для визуальной оценки лимфатических капилляров и тканей, например одного или более сплетений лимфатических капилляров или тканей лимфоузлов. Подходящие средства для визуализации могут представлять собой любое средство, которое является биосовместимым и не обладает биологической активностью или побочными эффектами. Иллюстративные и неограничивающие средства для визуализации могут представлять собой одно или более средств, используемых для прямой или опосредованной рентгеновской визуализации, одно или более контрастных средств, используемых для магнитнорезонансной визуализации (MRI), одно или более флуоресцентных средств для визуализации для флуоресцентной микролимфоангиографии (FML) или одно или более средств для флуоресцентной визуализации, возбуждаемых проникающим в ткань светом ближней инфракрасной области спектра (NIR) для использования в ICG-лимфоангиографии. Методики и средства, используемые для визуализации лимфатической системы, известны из уровня техники, см., например, Sevick-Muraca, et al., J. Clin Invest., 124(3), 905-914 (2014), которая для представления изложенных в ней идей включена в данный документ посредством ссылки. Стандартные алгоритмы анализа изображений и программное обеспечение можно использовать для подсчета интенсивности свечения флуорофора в доставляемом средстве, которое мечено или маркировано средством для визуализации, как описано выше, и сравнить с общепринятыми i.v., s.c., i.m. или i.d. путями парентеральной доставки.
В некоторых вариантах осуществления результатом способов контролируемой доставки, описанных в данном документе, является эквивалентная скорость абсорбции в сыворотке крови одного или более средств, описанных в данном документе, по сравнению с i.v., s.c., i.m. или i.d. путями парентеральной доставки при сохранении относительно высоких скоростей лимфатической доставки, как описано в данном документе. Не вдаваясь в какую-либо теорию, скорость доставки может быть обусловлена лимфатической циркуляцией одного или более средств через грудной лимфатический проток и в кровообращение. Можно использовать стандартные высокоточные и прецизионные методологии для измерения концентрации в сыворотке крови и терапевтического мониторинга в необходимые точки времени, которые хорошо известны из уровня техники, такие как радиоиммунологические анализы, высокоэффективная жидкостная хроматография (HPLC), флуоресцентный поляризационный иммуноанализ (FPIA), иммуноферментный анализ (EMIT) или твердофазные иммуноферментные анализы (ELISA). Для расчета скорости абсорбции с использованием описанных выше способов концентрация лекарственного средства в разные точки времени должна быть измерена, начиная сразу же после введения, а затем шаг за шагом до установления значения Cmax и расчета ассоциированной скорости абсорбции.
В некоторых вариантах осуществления результатом способов контролируемой доставки, описанных в данном документе, являются физиологически пролонгированные уровни биологически активного средства (например, активного лекарственного вещества) выше эффективного терапевтического порога. В некоторых аспектах способы контролируемой доставки, описанные в данном документе, снижают количество или устраняют необходимость болюсного введения одного или более активных лекарственных веществ, описанных в данном документе. В некоторых аспектах результатом этого может быть улучшенный профиль безопасности одного или более биологически активных средств путем ограничения потенциально опасных скачков при системной циркуляции в плазме крови одного или более биологически активных средств. Кроме того, способы контролируемой доставки, описанные в данном документе, могут дополнительно увеличивать терапевтический индекс одного или более вводимых активных лекарственных веществ путем снижения дозы, требуемой для достижения терапевтического или благоприятного эффекта.
В некоторых вариантах осуществления результатом способов контролируемой доставки, описанных в данном документе, является удержание одного или более средств в очаге заболевания (например, в одном или более лимфатических узлах), при этом отсутствует их системное распространение, что приводит к снижению частоты возникновения известных побочных эффектов, вызываемых активным лекарственным веществом. Например, при заболеваниях, в которые вовлечено воспаление (например, рак, инфекция, артрит), одно или более средств могут абсорбироваться восприимчивыми сплетениями лимфатических капилляров и распределяться в очаги воспаления, но не распределяться в дальнейшем в большой круг кровообращения. Кроме того, в зависимости от заболевания, одно или более средств могут распределяться системно путем циркуляции через лимфатическую сосудистую сеть и лимфатические ткани через лимфатический грудной проток и в большой круг кровообращения.
В некоторых вариантах осуществления результатом способов контролируемой доставки, описанных в данном документе, является относительно короткое время достижения максимальной терапевтической эффективности или Tmax, сохраняя при этом физиологически пролонгированные уровни одного или более активных лекарственных веществ выше эффективного терапевтического порога. Tmax может представлять собой показатель, независимый от Cmax, или общую концентрацию в сыворотке крови активного лекарственного вещества, и ее можно измерить с помощью восприятия тяжести заболевания или состояния. В некоторых вариантах осуществления, описанных в данном документе, одно или более биологически активных средств, доставленных в кожу и в восприимчивое сплетение лимфатических капилляров с помощью способов, описанных в данном документе, может включать активное лекарственное вещество. Например, активное лекарственное вещество может представлять собой соединение (например, малую молекулу), которое оказывает воздействие на клеточный рецептор или поверхностный белок и функционирует в качестве агониста, антагониста, обратного агониста и т. д., результатом чего является модификация пути развития заболевания, зачастую и эффективного, и благоприятного исхода для субъекта, страдающего заболеванием или нарушением, описанным в данном документе. Активное лекарственное вещество может проявлять токсичность по отношению к раковым клеткам или характеризоваться бактерицидной или противовирусной активностью. Подходящие активные лекарственные вещества будут зависеть от заболевания или нарушения, подлежащих лечению, и от переносимости субъектом получаемого конкретного активного лекарственного вещества. Подходящие активные лекарственные вещества, описанные в данном документе, можно вводить независимо от того, является ли активное лекарственное вещество гидрофильным, липофильным или амфипатическим. Активные лекарственные вещества могут быть слабо или высокорастворимыми в водной среде или демонстрировать низкую или высокую системную проникающую способность (например, любое лекарственное средство BCS класса I, II, III или IV). Кроме того, активные лекарственные вещества, описанные в данном документе, могут также предусматривать любое лекарственное средство, представляющее собой белок, как, например, антитело (например, гуманизированное антитело).
Иллюстративные активные лекарственные вещества могут предусматривать малую молекулу. В некоторых аспектах малая молекула может иметь молекулярную массу, составляющую от приблизительно 50 г/моль до приблизительно 1000 г/моль (т. е., ≈50 Да – 1000 Да), включая каждое целое число в пределах указанного диапазона. В некоторых аспектах малая молекула может характеризоваться молекулярной массой, составляющей приблизительно 50 г/моль, приблизительно 100 г/моль, приблизительно 150 г/моль, приблизительно 200 г/моль, приблизительно 250 г/моль, приблизительно 300 г/моль, приблизительно 350 г/моль, приблизительно 400 г/моль, приблизительно 450 г/моль, приблизительно 500 г/моль, приблизительно 550 г/моль, приблизительно 600 г/моль, приблизительно 650 г/моль, приблизительно 700 г/моль, приблизительно 750 г/моль, приблизительно 800 г/моль, приблизительно 850 г/моль, приблизительно 900 г/моль, приблизительно 950 г/моль или приблизительно 1000 г/моль.
Другие подходящие активные лекарственные вещества могут предусматривать более крупные соединения или белок. В некоторых аспектах соединение или белок могут иметь атомный вес от приблизительно 1 кДа до приблизительно 250 кДа, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах соединение или белок могут иметь атомный вес, составляющий приблизительно 1 кДа, приблизительно 5 кДа, приблизительно 10 кДа, приблизительно 15 кДа, приблизительно 20 кДа, приблизительно 25 кДа, приблизительно 50 кДа, приблизительно 75 кДа, приблизительно 100 кДа, приблизительно 125 кДа, приблизительно 150 кДа, приблизительно 175 кДа, приблизительно 200 кДа, приблизительно 225 кДа или приблизительно 250 кДа.
В некоторых вариантах осуществления, описанных в данном документе, представлены способы введения одного или более биологически активных средств животному, предпочтительно млекопитающему и наиболее предпочтительно человеку, для предупреждения, лечения или облегчения тяжести одного или более симптомов, ассоциированных с заболеванием, нарушением или инфекцией, путем доставки одного или более биологически активных средств в кожу (например, эпидермис) субъекта с помощью способов, описанных в данном документе. Способы, описанные в данном документе, применимы для лечения или предупреждения заболевания или нарушения лимфатической системы, первичного или метастатического новообразования (т. е. рака), аутоиммунных расстройств и инфекционных заболеваний. Биологически активные средства могут быть предоставлены в фармацевтически приемлемых композициях или составах, известных из уровня техники или описанных в данном документе.
В некоторых вариантах осуществления, описанных в данном документе, одно или более биологически активных средств присутствуют в жидком носителе в виде фактически растворившегося раствора, суспензии или коллоидной суспензии. Можно использовать любой подходящий раствор жидкого носителя, который соответствует по меньшей мере спецификациям Фармакопее Соединенных Штатов Америки (USP), а тоничность таких растворов, как известно, можно модифицировать, см., например, Remington: The Science and Practice of Pharmacy (Lloyd V. Allen Jr. ed., 22nd ed. 2012). Иллюстративные неограничивающие растворы жидких носителей могут быть водными, эмульсиями или неводными в зависимости от биологически активного(активных) средства(средств), подлежащего(подлежащих) введению. Например, водный жидкий носитель может содержать воду и что-либо из или комбинацию из водорастворимого носителя, этилового спирта, жидкого (с низким молекулярным весом) полиэтиленгликоля и им подобных. Неводные носители могут предусматривать жидкие растительные масла, такие как кукурузное масло, масло из семян хлопчатника, арахисовое масло или кунжутное масло и им подобные. Подходящие растворы жидких носителей могут дополнительно предусматривать любое из консерванта, антиоксиданта, средства, усиливающего комплексообразование, буферного средства, подкисляющего средства, солевого раствора, электролита, средства, повышающего вязкость, средства, снижающего вязкость, ощелачивающего средства, противомикробного средства, противогрибкового средства, средства, повышающего растворимость, или их комбинации.
Некоторые варианты осуществления, описанные в данном документе, включают способы лечения, предупреждения, снижения вероятности возникновения, облегчения тяжести или осуществления контроля заболевания или нарушения у нуждающегося в этом субъекта, при этом способ предусматривает введение субъекту терапевтически эффективной дозы или профилактически эффективной дозы одного или более биологически активных средств (например, активного лекарственного вещества) в кожу (например, в эпидермис) нуждающегося в этом субъекта, где одно или более биологически активных средств абсорбируется восприимчивым сплетением лимфатических капилляров. В некоторых аспектах способы лечения или предупреждения заболевания у субъекта посредством доставки одного или более биологически активных средств в жизнеспособный или нежизнеспособный эпидермис субъекта являются более эффективными, чем стандартные пути доставки, например, инъекции i.v., s.c., i.m. или i.d.
Способы, описанные в данном документе, предусматривают непосредственное нацеливание в лимфатическую систему различных биологически активных средств посредством доставки в эпидермис (нежизнеспособный эпидермис и жизнеспособный эпидермис), результатом чего являются ранее недостижимые благоприятные терапевтические эффекты, включающие щадящие дозы, повышенную эффективность лекарственного средства, сниженную частоту возникновения побочных эффектов, сниженный метастатический потенциал, снижение воспаления и повышение выживаемости субъекта. Соответственно, способы, описанные в данном документе, предусматривают увеличенное системное и/или локализованное депонирование терапевтического средства по сравнению с инъекционными способами i.v., s.c., i.m. или i.d. Таким образом, любое подходящее заболевание или состояние можно лечить с помощью способов, описанных в данном документе.
В некоторых вариантах осуществления диффузия или перемещение вводимого средства через эпидермис может быть увеличена путем введения или приведения в контакт эпидермиса субъекта с одним или более усилителями проницаемости или проникающей способности. В некоторых аспектах проникающая способность или усилитель проницаемости могут быть химическими, физическими или электрическими. Функция усилителей проницаемости заключается в повышении перемещения или диффузии одного или более средств через роговой слой эпидермиса и в жизнеспособный эпидермис. Усилители проницаемости могут дополнительно стимулировать перемещение или диффузию одного или более вводимых средств через жизнеспособный эпидермис, в том числе базальную мембрану жизнеспособного эпидермиса, и в нижележащую жизнеспособную дерму. См., например, Prasunitz and Langer, Nature Biotechnol, 26(11), 1261-1268 (2008), которая для представления изложенных в ней идей применения усилителя эпидермальной проницаемости в лекарственных средствах для трансдермальной доставки включена в данный документ посредством ссылки.
В некоторых вариантах осуществления, описанных в данном документе, эффективное количество одного или более химических усилителей проницаемости могут доставляться в эпидермис. Не вдаваясь в какую либо теорию, полагают, что химические усилители проницаемости, описанные в данном документе, могут стимулировать проницаемость рогового слоя для вводимого средства путем денатурации внутриклеточного кератина, вызывая набухание вследствие гидратации, воздействия на десмосомы, поддерживающие адгезию корнеоцитов, или модифицирования барьера, продуцирующего липиды в липидном бислое. Неограничивающие примеры химического усилителя проницаемости могут включать сульфоксиды, такие как диметилсульфоксид и додецилметилсульфоксид; мочевины; спирты, такие как этанол, каприловый спирт и пропиленгликоль; пирролидоны и производные, такие как N-метил-2-пирролидон и 2-пирролидон; азон и производные, такие как 1-додецилазациклогептан-2-он; производные диоксолана; анионные, катионные, неионогенные или цвиттерионные поверхностно-активные вещества, такие как натрия лаурилсульфат, цетилтриметиаммония бромид, сорбитан монолаурат, полисорбат 80, додецилметил аммонийпропансульфат; терпены, такие как ментол или лимонен; жирные кислоты, такие как олеиновая кислоты или ундекановая кислота; или гидратирующие количества воды.
В некоторых вариантах осуществления, описанных в данном документе, физический усилитель проницаемости можно использовать для повышения проницаемости эпидермиса для вводимого средства. В некоторых аспектах физический усилитель проницаемости может быть основан на использовании звука, применения поля электрического тока или специфических структурных взаимодействий с эпидермисом для повышения проницаемости эпидермиса. Неограничивающие примеры включают сонофорез (например, ультразвук), ионофорез, электропорацию или наноструктурированные контактные поверхности (например, нанотопография).
В некоторых вариантах осуществления, описанных в данном документе, способы контролируемой доставки одного или более средств в восприимчивое сплетение лимфатических капилляров, описанные в данном документе, могут включать доставку одного или более средств с помощью устройства для доставки, содержащего 2-50000 структур для доставки, которые способны проникать через роговой слой и обеспечивать глубину доставки и объем в коже, а также контролируемую доставку одного или более средств при скоростях потока при введении, как описано в данном документе. Структуры для доставки могут быть присоединены к поддерживающей подложке устройства для доставки и расположены под одним или множеством разных углов для проникновения через роговой слой и доставки одного или более средств. В некоторых аспектах, описанных в данном документе, поддерживающая подложка, содержащая структуры для доставки, может вступать в контакт с кожей субъекта и может иметь цилиндрическую, прямоугольную или геометрическую неправильную форму. Поддерживающая подложка дополнительно содержит площадь двухмерной поверхности, которая в некоторых аспектах может составлять от приблизительно 1 мм2 до приблизительно 10000 мм2.
В некоторых аспектах структуры для доставки могут характеризоваться любой геометрической формой (например, цилиндрической, прямоугольной или геометрически неправильной формой). Кроме того, структуры для доставки могут предусматривать длину и площадь поверхности в поперечном сечении. В некоторых аспектах структуры для доставки могут характеризоваться общей длиной, которая больше диаметра поперечного сечения или ширины. В некоторых других аспектах структуры для доставки могут характеризоваться диаметром поперечного сечения или шириной, которые больше общей длины. В некоторых аспектах ширина поперечного сечения каждой структуры для доставки может составлять от приблизительно 5 μм до приблизительно 140 μм, и площадь поперечного сечения может составлять от приблизительно 25 μм2 до приблизительно 15000 μм2, включая каждое целое число в пределах указанного диапазона. В некоторых аспектах длина каждой структуры для доставки может составлять от приблизительно 10 μм до приблизительно 1000 μм, включая каждое целое число в пределах указанного диапазона. Площадь поверхности и площади поперечного сечения, описанные в данном документе, можно определить с использованием геометрических расчетов, известных из уровня техники.
Структуры для доставки, описанные в данном документе, необязательно должны быть идентичны друг другу. Устройство имеет множество структур для доставки, каждая из которых может характеризоваться разными значениями длины, значениями внешнего диаметра, значениями внутреннего диаметра, формами поперечного сечения, нанотопографическими поверхностями и/или промежутками между каждой из структур для доставки. Например, структуры для доставки могут быть разнесены друг от друга, например по прямоугольной или квадратной сетке или по концентрическим окружностям. Промежутки могут зависеть от ряда факторов, включая высоту и ширину структур для доставки, а также количество и тип средства, которое предназначено для структур для доставки. В некоторых аспектах промежутки между каждой из структур для доставки могут составлять от приблизительно 1 μм до приблизительно 800 μм, включая каждое целое число в пределах указанного диапазона.
В некоторые варианты осуществления структуры для доставки могут содержать матрицу игл в жидкостном соединении с жидкой средой-носителем, содержащей одно или более средств. В некоторых аспектах матрица игл может содержать множество игл со структурными механизмами для контроля проникновения в кожу и доставки жидкости в кожу (например, проникновения и доставки в кожу), см., например, US 20150367117, который включен в данный документе посредством ссылки во всей своей полноте. В некоторых вариантах осуществления матрица игл может содержать 2-50000 игл со структурными механизмами для контроля проникновения в кожу и доставки жидкости в кожу. В некоторых других аспектах матрица игл может дополнительно содержать изготовленную произвольно или нанотопографическую поверхность на каждой игле. Игла или матрица игл могут быть присоединены к более крупному аппарату для доставки лекарственного средства, предусматривающему средства контроля скорости доставки жидкости, адгезивные материалы для присоединения к коже, жидкостные насосы и им подобные. Если существует необходимость, скорость доставки средства можно постоянно контролировать с помощью создающих давление механизмов. Необходимые скорости доставки, описанные в данном документе, в эпидермис можно задействовать путем управления одним или более средствами, описанными в данном документе, с приложением давления или других средств управления, включая насосы, шприцы, шприцы-ручки, эластомерные мембраны, давление газа, пьезоэлектрический, электродвижущий, электромагнитный или осмотический насос, или применения мембран для контроля скорости или их комбинаций. Конкретные иллюстративные структуры и устройства, содержащие механизм для контролирования доставки одного или более средств в эпидермис, описаны в патентных документах US 20110270221, US 20120187814, US 20130144217, US 20130144257, US 20130150822, US 20130158505, US 20130165861, US 20140343532, US 20150360018, US 20150367117, US 20160106965, каждый из которых включен в данный документ посредством ссылки во всей своей полноте.
В некоторых вариантах осуществления, описанных в данном документе, устройство для доставки может содержать матрицу игл в виде пластыря. В некоторых аспектах матрица игл способна проникать через наиболее поверхностный слой рогового слоя и исходно доставлять одно или более средств, описанных в данном документе, в весь нежизнеспособный эпидермис или по меньшей мере его часть, в весь жизнеспособный эпидермис или по меньшей мере его часть и/или по меньшей мере в часть жизнеспособной дермы субъекта. Эти иглы могут дополнительно предусматривать нанотопографию на поверхности иглы в произвольном или упорядоченном узоре. В некоторых аспектах нанотопографический узор может демонстрировать фрактальную геометрическую структуру.
Иллюстративные и неограничивающие устройства и структуры для доставки одного или более средств в кожу показаны на фигурах 3 и 4. Например, как показано на фиг. 3, матрица игл может содержать подложку 42 с верхней поверхностью 44 и нижней поверхностью 46 и образовывать множество отверстий 50 между верхней и нижней поверхностями 44, 46. Кроме того, матрица игл может также содержать множество игл48, выдающихся наружу от нижней поверхности 46. Как описано выше, каждая микроигла 48 может определять один или более канал(каналов) 56, находящихся в жидкостной связи с отверстиями 50. Таким образом, активный состав в жидком носителе, описанный в данном документе, который содержится в подходящем резервуаре, может быть направлен от поверхности 44 подложки 42 через отверстия 50 и в иглы 48 для дальнейшей доставки в кожу пользователя. Способы, описанные в данном документе, предусмотрены для доставки одного или более средств в жизнеспособный слой кожи и в конечном итоге в восприимчивое сплетение лимфатических капилляров и/или сплетение кровеносных капилляров.
Иглы, описанные выше, могут дополнительно содержать нанотопографическую поверхность, как описано в данном документе. На фигуре 4 схематически изображены концы двух иллюстративных игл 22. В данном конкретном варианте осуществления иглы 22 соответствуют центральному выводному каналу в пластине24, которая может быть использована для доставки средства через каждую иглу 22 матрицы игл, как описано в данном документе. В некоторых других вариантах осуществления иглы могут иметь множество выводных каналов для доставки средства посредством иглы. Поверхность 25 иглы 22 может быть определена нанотопографической областью 26. В данном варианте осуществления нанотопография 26 определяет произвольный узор на поверхности 25 иглы 22; однако в некоторых других вариантах осуществления нанотопография может быть структурированной или иметь структурированный/неструктурированный характер.
В некоторых вариантах осуществления описанных в данном документе, устройство для доставки содержит матрицу игл с нанотопографией, как описано в данном документе, которая функционирует в качестве усилителя проницаемости и может повышать доставку одного или более средств через эпидермис. Как описано в данном документе, эта доставка может происходить за счет модуляции механизмов чресклеточного переноса (например, активных или пассивных механизмов) или посредством параклеточного проникновения. Не вдаваясь в какую-либо теорию, наноструктурированная или нанотопографическая поверхности могут повышать проницаемость одного или более слоев жизнеспособного эпидермиса, включая эпидермальную базальную мембрану, путем модифицирования плотных контактов клетка-клетка, что обеспечивает возможность модифицирования параклеточного или клеточного активного путей переноса (например, чресклеточного переноса), обеспечивая возможность диффузии или перемещения, и/или активного переноса вводимого средства через жизнеспособный эпидермис и в нижележащую жизнеспособную дерму. Данный эффект может возникать из-за модуляции экспрессии генов, кодирующих белки плотных контактов клетка/клетка. Как упомянуто ранее, плотные контакты обнаружены в жизнеспособной коже и, в частности, в жизнеспособном эпидермисе. Раскрытие плотных контактов может обеспечивать параклеточный путь для улучшенной доставки любого средства, как, например, тех средств, доставка которых через кожу ранее блокировалась.
В некоторых вариантах осуществления, описанных в данном документе, доставка устройства, содержащего матрицу игл с нанотопографией, модулирует экспрессию генов нуклеиновых кислот, кодирующих белки контактов клетка/клетка в одном или более типах клеток жизнеспособного эпителия (например, в жизнеспособных эпидермальных клетках, клетках дермального слоя кожи, клетках кровеносных капилляров или клетках лимфатических капилляров). В некоторых аспектах экспрессия генов нуклеиновых кислот, кодирующих один или более белков контакта клетка/клетка, является повышенной. В некоторых аспектах экспрессия генов нуклеиновых кислот, кодирующих один или более белков контакта клетка/клетка, является пониженной. Можно использовать любой способ измерения уровней экспрессии гена, включая без ограничения ПЦР, ПЦР с обратной транскрипцией, количественную ПЦР в режиме реального времени, микрочипы, нозерн-блоттинг, секвенирование РНК и им подобные.
Взаимодействие между отдельными клетками и структурами с нанотопографией может повышать проницаемость эпителиальной ткани (например, эпидермиса) и индуцировать прохождение средства через клетки барьерного слоя и способствовать чресклеточному переносу. К примеру, взаимодействие между керотиноцитами жизнеспособного эпидермиса может способствовать разделению средства в керотиноцитах (например, чресклеточному транспорту) с последующей диффузией через клетки и снова через липидный бислой. Кроме того, взаимодействие нанотопографической стуруктуры и корнеоцитов рогового слоя может индуцировать изменения в липидах барьерного слоя или корнеодесмосомах, что приводит в результате к диффузии средства через роговой слой в нижележащие жизнеспособные эпидермальные слои. Хотя средство может пересекать барьерный слой, что обусловлено параклеточным и чресклеточным путями, преобладающий путь переноса может варьировать в зависимости природы средства.
В некоторых вариантах осуществления, описанных в данном документе, устройство для доставки, содержащее матрицу игл с нанотопографией, модулирует экспрессию генов, кодирующих белки контактов клетка/клетка в одном или более типах клеток жизнеспособного эпителия (например, в жизнеспособных эпидермальных клетках, клетках дермального слоя кожи, клетках кровеносных капилляров или клетках лимфатических капилляров). В некоторых аспектах экспрессия одного или более белков контакта клетка/клетка является повышенной. В некоторых аспектах экспрессия одного или более белков контакта клетка/клетка является пониженной. Можно использовать любой способ измерения уровней экспрессии белков, включая без ограничения вестерн-блоттинг, визуализацию тканей (например, флуоресцентную или хемилюминесцентную визуализацию), масс-спектрометрию и им подобные.
В некоторых вариантах осуществления, описанных в данном документе, устройство может взаимодействовать с одним или более компонентами эпителиальной ткани с повышением пористости ткани, делая ее восприимчивой к параклеточному и/или чресклеточному механизмам переноса. Эпителиальная ткань представляет собой один из основных типов тканей тела. Эпителиальные ткани, которые могут приобретать большую пористость, могут включать и однослойный, и многослойный эпителий, включая кератинизированный эпителий и переходной эпителий. Кроме того, эпителиальная ткань, включенная в данный документ, может включать любые типы клеток эпителиального слоя, включая без ограничения кератиноциты, эндотелиальные клетки, лимфатические эндотелиальные клетки, сквамозные клетки, цилиндрические клетки, кубовидные клетки и псевдомногослойные клетки. Можно использовать любой способ измерения пористости, включая без ограничения анализ проницаемости эпителия. Например, анализ проницаемости тотального препарата можно использовать для измерения пористости (например, кожи) эпителия или барьерной функции in vivo. В одном варианте осуществления в анализе проницаемости тотального препарата используют 5-бромо-4-хлоро-3-индолил-β, D-галактопиранозид (X-Gal). Нефиксированные, необработанные образцы споласкивали фосфатно-буферным солевым раствором (PBS) и быстро высушивали. Образцы погружали в реакционную смесь X-Gal при pH, доведенном до 4,5. После инкубирования при 37°C в течение 8–10 ч, образцы промывали с использованием PBS в течение 1–2 минут и анализировали. В одном варианте осуществления в анализе проницаемости тотального препарата используют гистологический краситель, такой как без ограничения толуидиновый синий или гематоксилин. Нефиксированные, необработанные образцы инкубировали в течение 1–5 минут в метаноле и споласкивали в PBS. Образцы инкубировали в 0,5% гематоксилине или 0,1% толуидиновом синем, а затем заливали агарозой для проведения анализа. В одном варианте осуществления анализ образца проводили путем получения фотоснимков подготовленного образца и проводили оценку, исходя из степени проникновения красителя. Можно использовать другие способы, известные из уровня техники. См., например, Indra and Leid, Methods Mol Biol. (763) 73-81, которая для представления изложенных в ней идей включена в данный документ посредством ссылки.
В некоторых вариантах осуществления, описанных в данном документе, структурные изменения, индуцированные присутствием нанотопографической поверхности на клетках барьерного слоя, являются временными и обратимыми. Неожиданно было обнаружено, что применения наноструктурированной, нанотопографической поверхностей в результате приводят к временному и полностью обратимому повышению пористости эпителиальных тканей за счет изменения стабильности и динамических характеристик контактов, которые, если не вдаваться в какую-либо теорию, могут в результате приводить ко временному повышению параклеточного и чресклеточного переноса вводимого средства через эпидермис и в жизнеспособную дерму. Таким образом, в некоторых аспектах повышение проницаемости эпидермиса или эпителиальной ткани, полученное за счет нанотопографии, как, например, активация параклеточных или чресклеточных диффузии или перемещения одного или более средств, возвращается к нормальному физиологическому состоянию, которое присутствовало перед приведением эпителиальной ткани в контакт с нанотопографической поверхностью с последующим удалением нанотопографической поверхности. Таким образом, нормальная барьерная функция клетки(клеток) барьерного слоя (например, эпидермальной(эпидермальных) клетки(клеток)) сохраняется, и не происходит дальнейшей диффузии или перемещения молекул помимо нормальной физиологической диффузии или перемещения молекул в ткани субъекта.
Эти обратимые структурные изменения, индуцированные нанотопографией, могут функционировать с тем, чтобы ограничивать вторичные инфекции кожи, абсорбцию опасных токсинов, и ограничивают раздражение дермы. Также нарастающая обратимость эпидермальной проницаемости от верхнего слоя эпидермиса к базальному слою может активировать нисходящее перемещение одного или более средств через эпидермис и в дерму и препятствовать обратному току или обратной диффузии одного или более средств обратно в эпидермис.
В некоторых альтернативных вариантах осуществления способы доставки одного или более средств в кожу предусматривают не только иглу, микроиглу или механизмы для проведения инъекций с помощью наноиглы, но и также другие способы доставки, такие как средства для безыгольной или безыгольной баллистической инъекции жидкостей, методики ионофореза и непосредственное депонирование жидкости, твердых веществ или других дозируемых форм в эпидермисе кожи.
В некоторых вариантах осуществления, описанных в данном документе, предусмотрены способы применения устройства, имеющего по меньшей мере 2 или более структур для доставки, по отношению к поверхности кожи субъекта для лечения заболевания или нарушения, описанных в данном документе. В некоторых аспектах устройство применяют по отношению к области кожи субъекта, где место расположения на коже на теле характеризуется плотной сетью лимфатических капилляров. Множество устройств можно применять по отношению к одному или более участкам расположения на коже, имеющим плотную сеть лимфатических капилляров. В некоторых аспектах можно применять 1, 2, 3, 4, 5 или больше устройств. Данные устройства можно применять в пространственном отношении раздельно, или в непосредственной близости друг от друга, или рядом друг с другом. Иллюстративные и неограничивающие области с плотной сетью лимфатических протоков предусматривают ладонные поверхности кистей рук, мошонку, подошвенные поверхности стоп и нижнюю часть брюшной полости.
Для специалиста в данной области будет очевидно, что подходящие модификации и адаптации к композициям, способам и приложениям, описанным в данном документе, могут быть проведены без отклонения от объема любых вариантов осуществления или их аспектов. Представленные композиции и способы являются иллюстративными и не предназначены для ограничения объема указанных вариантов осуществления. Все различные варианты осуществления, аспекты и дополнительные возможности, раскрытые в данном документе, могут быть объединены во всех вариантах. Объем композиций, композиций, способов и процессов, описанных в данном документе, включает все фактические или потенциальные комбинации вариантов осуществления, аспектов, дополнительных возможностей, примеров и предпочтений, описанных в данном документе. Все патенты и публикации, цитируемые в данном документе, включены в данный документ посредством ссылки для представления изложенных в них конкретных идей.
Пример 1. Схематическое представление кожи
Общая структура кожи, в том числе дермы и эпидермиса, проиллюстрирована на фигуре 1. Дерма состоит из большого числа типов тканей и в целом характеризуется толщиной в диапазоне от приблизительно 500 μм до приблизительно 4000 μм. Лимфатические и кровеносные капилляры часто располагаются вместе, как показано на иллюстрации, или они могут присутствовать в виде отдельных элементов. Как проиллюстрировано, кровеносные и лимфатические капилляры часто располагаются в верхних частях дермы (например, рядом с эпидермальной или дермальной базальной мембраной) в части сосочкового слоя дермы. Более крупные сосуды обычно расположены в нижнем сетчатом слое дермы (например, как показано, в кровеносных сосудах). Другие типы ткани, являющиеся важными для функции кожи, включают крупные артерии, артериолы, протоки потовых желез, сальные железы, капсулированные нервные окончания, соединительные ткани и внеклеточную матрицу, гладкие мышцы и волосяные фолликулы. Ниже сетчатого слоя дермы расположен слой подкожной основы, который главным образом состоит из жировой ткани и в общем лишен какой-либо лимфатической или кровеносной сосудистой сети.
Как показано на фигуре 2A, эпителиальный слой кожи образован четырьмя основными слоями клеток, которые отсутствуют во многих других типах тканей дермы (например, кровеносные и лимфатические капилляры и т. д.) при общей толщине в диапазоне от приблизительно 20 μм до приблизительно 400 μм. Как показано на рисунке, в направлении снизу вверх расположена базальная мембрана с далее идущими за ней базальным слоем или герминативным слоем, слоем сквамозных клеток или шиповатым слоем (шиповатым слоем эпидермиса), слоем гранулярных клеток или гранулярным слоем и ороговевшим слоем или роговым слоем. Эпидермис главным образом не является митотическим, причем роговой слой содержит барьер из нежизнеспособных безъядерных клеток; однако, как показано на фигуре 2B, базальный слой состоит из симметрично делящихся стволовых клеток и других временно разрастающихся клеток для регенерации рогового слоя.
Пример 2. Глубина проникновения красителя в кожу
Матрицу игл выполняли на пленке и использовали для оценки среднего диапазона значений глубины для доставки средства в коже взрослых особей морских свинок. Как показано на фигуре 5, краситель метиленовый синий вводили при среднем значении глубины, составляющем приблизительно 92 μм, что демонстрирует диапазон распределения значений глубины от приблизительно 5 μм до приблизительно 200 μм. Как показано на фигуре 6, структуру и глубину в коже можно оценить с применением методик оптической когерентной томографии. Структуру кожи после нанесения матрицы игл можно оценить визуально по отдельным горизонтальным срезам кожи.
Пример 3. Модуляция эпидермальных белков плотных контактов
Матрицу игл с нанотопографической поверхностью выполняли на пластыре и проверяли in vitro в монослое эпителиальных клеток Caco-2. Как показано на фигуре 7A, белок плотных контактов ZO-1 демонстрирует картину нормального окрашивания. Однако, когда матрицу игл с нанотопографической поверхностью помещали вблизи клеток Caco-2, тогда также визуально отмечали картину неоднородного окрашивания. Данная нарушенная картина указывает на ремоделирование контактов в тех участках, в которых размещалась нанотопография (фигура 7B). Когда матрицу игл с нанотопографией удаляли, картина окрашивания возвращалась к нормальной, что свидетельствует о пространственном и временном воздействии на белки плотных контактов, такие как ZO-1 (фигура 7C).
Пример 4. Визуализация in vivo доставки в лимфатическую систему этанерцепта (продаваемого как Enbrel®, противовоспалительное лекарственное средство) в лимфатическую сосудистую сеть и биораспределение у крыс с артритом
Проверяли способность к доставке непосредственно в лимфатическую систему терапевтического белка этанерцепта посредством введения в кожу. Этанерцепт флуоресцентно метили для визуализации in vivo с применением излучения близкого к инфракрасному спектру, как описано ранее, см. Sevick-Muraca et al., J. Clin Invest., 124(3), 905-914 (2014), которая для представления изложенных в ней идей включена в данный документ посредством ссылки. Этанерцепт вводили в кожу крысам, размещая дорсально на крысе устройство для доставки, содержащее матрицу игл. Как показано на фигуре 8 и фигуре 9, результатом введения этанерцепта в кожу был его захват лимфатической сосудистой сетью и последующее распределение в тканях первичного и вторичного лимфатических узлов.
Исследовали биораспределение этанерцепта во множестве типов тканей после доставки. Таким образом, результатом доставки этанерцепта в кожу были более высокие уровни в подмышечных и паховых лимфатических узлах по сравнению с общепринятыми способами i.v., s.c. или i.d. (фигура 10).
Как дополнительно продемонстрировано на фигурах 11A и B, более высокие уровни этанерцепта были локализованы в воспаленных тканях в крысиных моделях с артритом задних конечностей при введении в кожу по сравнению с общепринятыми способами подкожной доставки. Кроме того, наблюдали 17% уменьшение набухания этих воспаленных тканей после введения той же дозировки этанерцепта 3 мг посредством измерения диаметра голеностопного сустава (фигура 12).
Пример 5. Скорость абсорбции этанерцепта в сыворотку крови после доставки в кожу
Как показано на фигуре 13, скорость абсорбции этанерцепта в сыворотку крови после введения в кожу является примерно такой же, как при способах (i.v.), (s.c.) или (i.d.).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ДОСТАВКИ АКТИВНЫХ СРЕДСТВ В ЛИМФАТИЧЕСКУЮ СИСТЕМУ | 2016 |
|
RU2719946C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ПРИМЕНЕНИЯ В КЛЕТОЧНОЙ ТЕРАПИИ | 2010 |
|
RU2610427C2 |
| ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ ЛЕКАРСТВЕННЫХ ФОРМ БЕРБЕРИНА | 2016 |
|
RU2733743C2 |
| КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ БОЛЕЗНЕННЫХ СОСТОЯНИЙ КОЖИ | 2011 |
|
RU2578979C2 |
| ФОРМИРОВАНИЕ МИКРОПОР В КОЖЕ ЧЕЛОВЕКА ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ И МОНИТОРИНГА | 1996 |
|
RU2209031C2 |
| ИНГИБИТОР ГЕПАРАНАЗНОЙ АКТИВНОСТИ | 2010 |
|
RU2503454C1 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ПЛОХО ЗАЖИВАЮЩИХ РАН | 2007 |
|
RU2521329C2 |
| КОМПОЗИЦИИ НАПРОКСЕНА ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ В ФОРМЕ ГЕЛЯ | 2020 |
|
RU2809702C2 |
| СРЕДСТВО ГИДРОСУЛЬФАТ УГЛЕРОДО-РТУТНЫЙ КОМПЛЕКС И СПОСОБ ЛЕЧЕНИЯ ИНФЕКЦИОННО-ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 2002 |
|
RU2196590C1 |
| ПЛАСТЫРЬ С МИКРОИГЛАМИ ДЛЯ ДОСТАВКИ АКТИВНОГО ИНГРЕДИЕНТА В КОЖУ | 2016 |
|
RU2803383C2 |
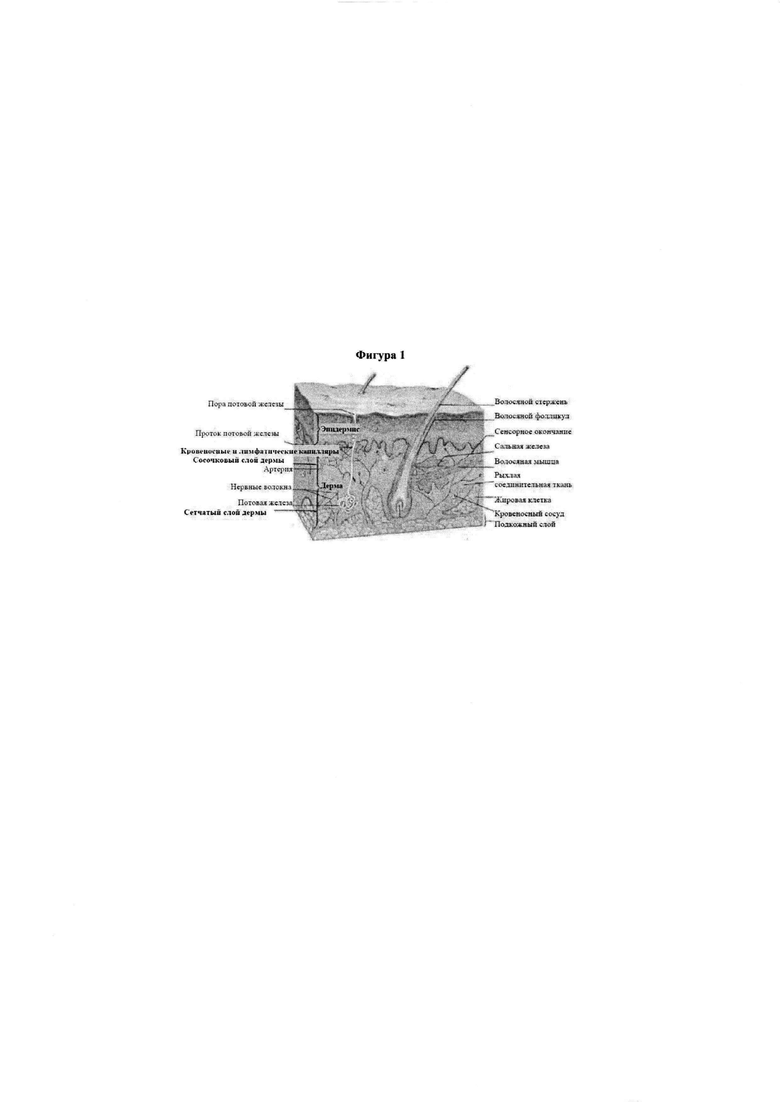
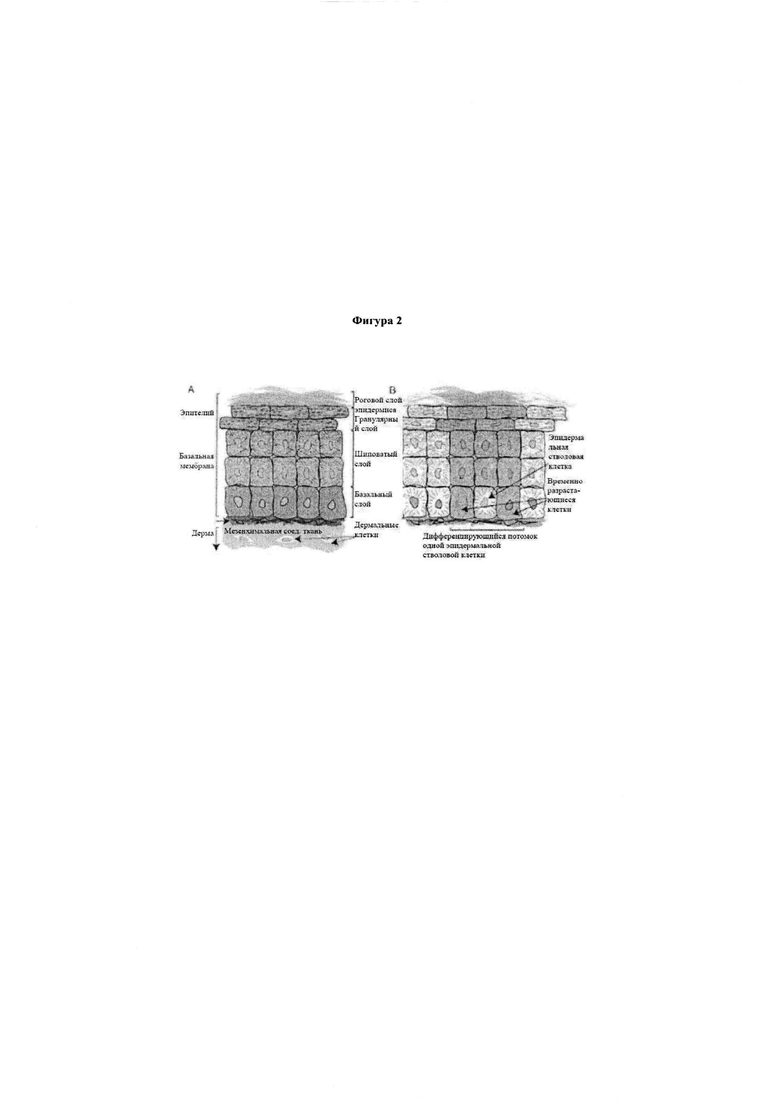





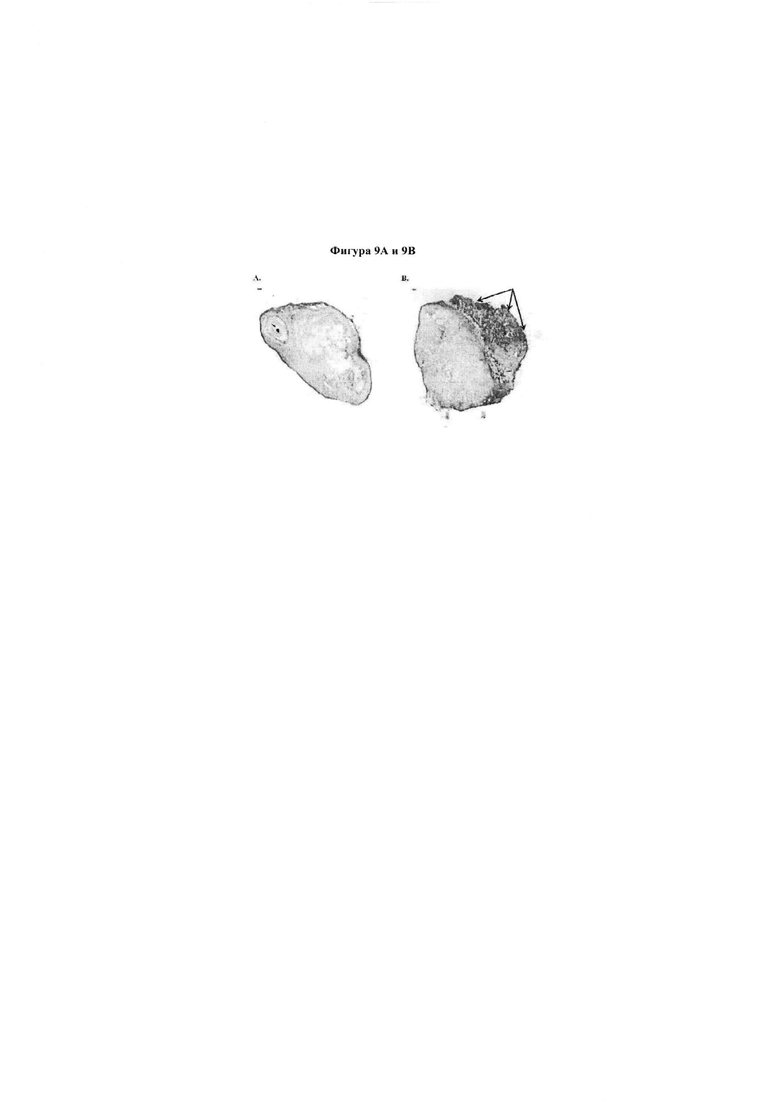


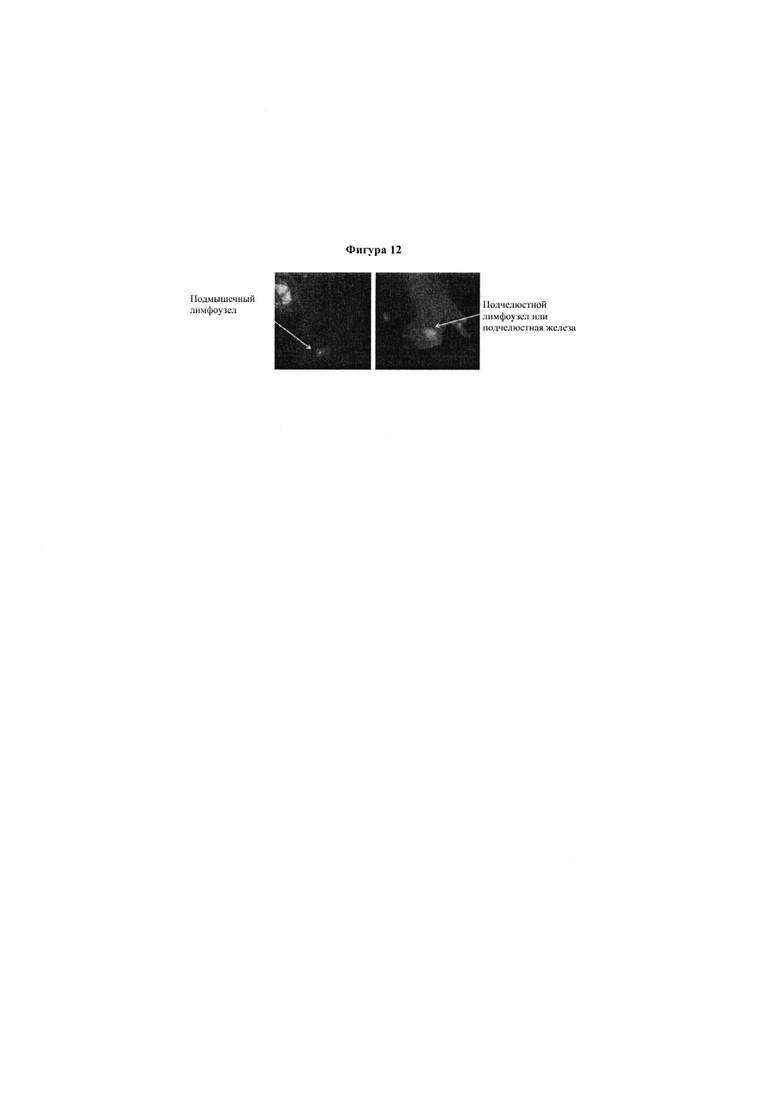

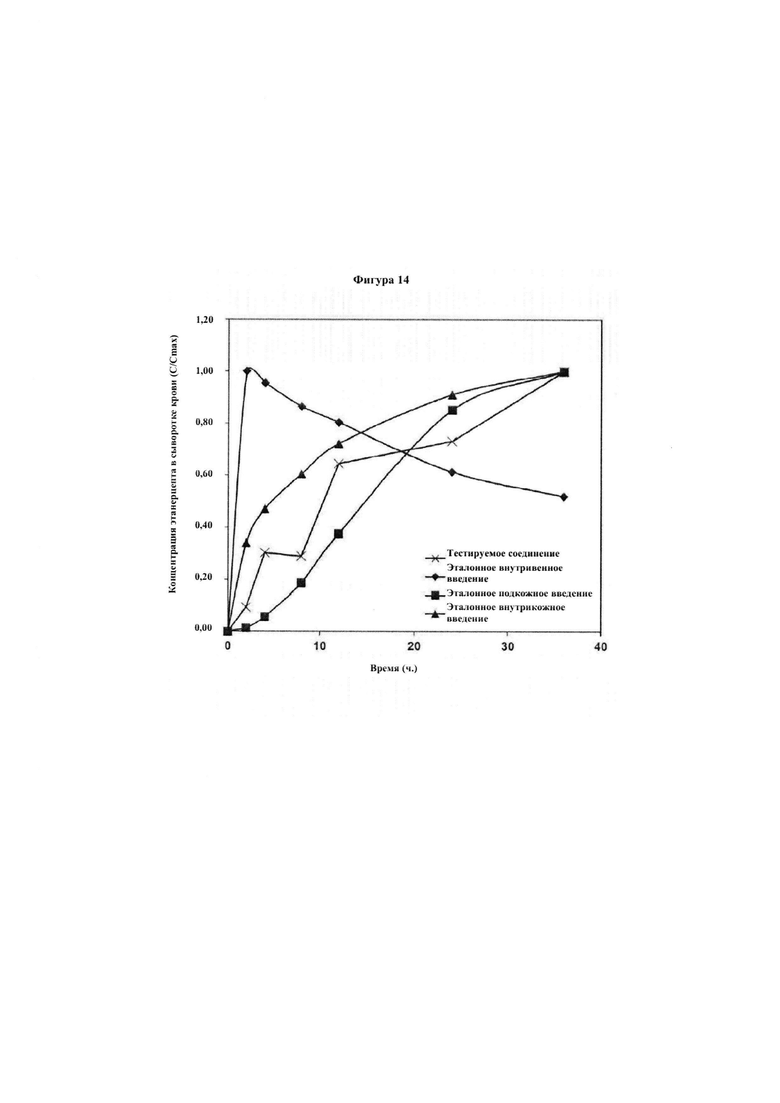
Группа изобретений относится к медицине, а именно к доставке средств через кожу, и может быть использована для доставки одного или более средств в одну или более восприимчивых опухолей у субъекта и лечения субъекта с заболеванием, предусматривающим одну или более опухолей, путем введения одного или более биологически активных средств в одну или более опухолей. Способ доставки одного или более средств в одну или более восприимчивых опухолей у субъекта предусматривает: (a) применение одной или более матриц игл, имеющих множество игл, по отношению к одному или более участкам кожи, содержащим кровеносную сосудистую сеть или лимфатическую сосудистую сеть, и (b) введение общего количества жидкой лекарственной формы в множественных частях дозы одного или более средств при контролируемой скорости потока при введении. При этом одна или более матриц игл обеспечивают контакт одного или более слоев эпидермиса с одним или более усилителями обратимой проницаемости. Усилители обратимой проницаемости могут быть химическими, физическими или электрическими. При этом индуцируется обратимое повышение проницаемости одной или более клеток барьерного слоя эпидермиса по меньшей мере для одного или более средств. Контролируемая скорость потока при введении составляет от 0,01 до 100 мкл/ч на каждую из игл. Общая объединенная контролируемая скорость потока при введении составляет от 0,02 до 50000 мкл/ч/см2 в пересчете на общую площадь поверхности одной или более матриц игл, которые контактируют с кожей субъекта. Каждую часть дозы одного или более средств независимо вводят при множестве независимых значений глубины, находящихся в диапазоне от 1 до 500 мкм, за пределами наиболее поверхностного слоя эпидермиса у субъекта, но все еще в пределах эпидермиса субъекта, которое характеризуется гауссовским распределением значений глубины в эпидермисе, перед любыми дальнейшими диффузией или перемещением одного или более средств в эпидермисе. После стадии введения одно или более средств перемещаются или диффундируют глубже через эпидермис, через базальный слой эпидермиса и в нижележащую часть жизнеспособной дермы с обеспечением захвата части одного или более биологически активных средств одним или более восприимчивыми сплетениями кровеносных капилляров или сплетениями лимфатических капилляров. После введения проницаемость одной или более клеток барьерного слоя возвращается к состоянию перед приведением эпидермиса в контакт с одним или более усилителями проницаемости. Способ лечения субъекта с заболеванием, предусматривающим одну или более опухолей, путем введения одного или более биологически активных средств в одну или более опухолей, предусматривает: (а) применение одной или более матриц игл, имеющих множество игл, по отношению к одному или более участкам кожи, содержащим кровеносную сосудистую сеть и лимфатическую сосудистую сеть, и (b) введение общего количества жидкой лекарственной формы в множественных частях дозы одного или более биологически активных средств при контролируемой скорости потока при введении посредством матрицы игл. При этом матрица игл обеспечивает контакт одного или более слоев эпидермиса с одним или более усилителями обратимой проницаемости, которые индуцируют обратимое повышение проницаемости одной или более клеток барьерного слоя эпидермиса по меньшей мере для одного или более биологически активных средств. Каждую часть дозы одного или более биологически активных средств независимо вводят при множестве независимых значений глубины в эпидермисе перед любыми дальнейшими диффузией или перемещением одного или более биологически активных средств в эпидермисе. После стадии введения одно или более биологически активных средств перемещаются или диффундируют глубже через эпидермис, через базальный слой эпидермиса и в нижележащую часть жизнеспособной дермы с обеспечением захвата части одного или более биологически активных средств одним или более восприимчивыми сплетениями кровеносных капилляров или сплетениями лимфатических капилляров. После введения и захвата одно или более биологически активных средств циркулируют по кровеносной сосудистой сети или лимфатической сосудистой сети к одной или более опухолям. Одно или более биологически активных средств доставляют в одну или более опухолей в более высокой концентрации по сравнению с внутривенной, внутрикожной или подкожной доставкой идентичных одного или более биологически активных средств. Группа изобретений обеспечивает захват одного или более средств лимфатическими тканями, в частности, одним или более восприимчивыми сплетениями лимфатических капилляров в жизнеспособной коже за счет введения средств матрицей игл в множественных частях дозы при контролируемой скорости потока при введении с усилением обратимой проницаемости. 2 н. и 41 з.п. ф-лы, 14 ил.
1. Способ доставки одного или более средств в одну или более восприимчивых опухолей у субъекта, при этом способ предусматривает:
(a) применение одной или более матриц игл, имеющих множество игл, по отношению к одному или более участкам кожи, содержащим кровеносную сосудистую сеть или лимфатическую сосудистую сеть, где одна или более матриц игл обеспечивают контакт одного или более слоев эпидермиса с одним или более усилителями обратимой проницаемости, предусматривающими химический, физический или электрический усилители проницаемости, которые индуцируют обратимое повышение проницаемости одной или более клеток барьерного слоя эпидермиса по меньшей мере для одного или более средств;
(b) введение общего количества жидкой лекарственной формы в множественных частях дозы одного или более средств при контролируемой скорости потока при введении, составляющей от 0,01 до 100 мкл/ч на каждую из игл, при общей объединенной контролируемой скорости потока при введении, составляющей от 0,02 до 50000 мкл/ч/см2 в пересчете на общую площадь поверхности одной или более матриц игл, которые контактируют с кожей субъекта,
где каждую часть дозы одного или более средств независимо вводят при множестве независимых значений глубины, находящихся в диапазоне от 1 до 500 мкм, за пределами наиболее поверхностного слоя эпидермиса у субъекта, но все еще в пределах эпидермиса субъекта, которое характеризуется гауссовским распределением значений глубины в эпидермисе, перед любыми дальнейшими диффузией или перемещением одного или более средств в эпидермисе; и
где после стадии введения одно или более средств перемещаются или диффундируют глубже через эпидермис, через базальный слой эпидермиса и в нижележащую часть жизнеспособной дермы с обеспечением захвата части одного или более биологически активных средств одним или более восприимчивыми сплетениями кровеносных капилляров или сплетениями лимфатических капилляров; и
где после введения проницаемость одной или более клеток барьерного слоя возвращается к состоянию перед приведением эпидермиса в контакт с одним или более усилителями проницаемости.
2. Способ по п. 1, где эпидермис предусматривает как нежизнеспособный эпидермис, так и жизнеспособный эпидермис.
3. Способ по п. 1, где общее количество жидкой лекарственной формы одного или более средств вводят при множестве значений глубины в эпидермисе, состоящем только из одного или более cлоев жизнеспособного эпидермиса и не содержащем слой нежизнеспособного эпидермиса.
4. Способ по п. 3, где множество значений глубины в жизнеспособном эпидермисе составляет от 1 до 250 мкм за пределами наиболее глубокого слоя нежизнеспособного эпидермиса, но все еще в пределах жизнеспособного эпидермиса.
5. Способ по п. 1, где среднее значение независимого множества значений глубины характеризуется общим средним значением глубины для доставки части дозы в эпидермисе, составляющим от 70 до 175 мкм, за пределами наиболее поверхностного слоя эпидермиса.
6. Способ по п. 1, где множество независимых значений глубины характеризуется общим средним значением глубины введения в эпидермисе, где каждую часть дозы независимо вводят при значении глубины в эпидермисе, которое является более глубоким, менее глубоким или одинаковым.
7. Способ по п. 1, где матрица игл содержит матрицу, содержащую множество игл, находящихся в жидкостной связи с одним или более средствами в жидкой среде-носителе,
где матрица игл содержит механизм для контроля скорости потока при введении;
где иглы содержат механизм для проникновения по меньшей мере через наиболее поверхностный слой эпидермиса; и
где одно или более средств в жидкой среде-носителе доставляют с помощью игл при множестве значений глубины в жизнеспособном эпидермисе у субъекта, за счет чего осуществляется введение множественных частей дозы одного или более средств.
8. Способ по п. 1, где иглы характеризуются стандартной или нестандартной геометрической формой.
9. Способ по п. 1, где одно или более средств доставляют в объем ткани эпидермиса, вмещающий одно или более средств, перед любыми дальнейшими диффузией или перемещением одного или более средств в эпидермисе, составляющий от 0,7 до 2500 мм3.
10. Способ по п. 1, где одно или более средств непрерывно вводят субъекту в течение периода времени, составляющего от 0,1 до 96 ч.
11. Способ по п. 1, где один или более усилителей проницаемости представляют собой один или более химических, физических или электрических усилителей проницаемости.
12. Способ по п. 11, где физические усилители проницаемости предусматривают наноструктурированную или нанотопографическую поверхность.
13. Способ по п. 12, где нанотопографическая поверхность получена на поверхности игл, определенных в п. 7.
14. Способ по п. 1, где при введении одного или более средств достигается давление дермальной интерстициальной жидкости в нижележащей дерме под участком введения, составляющее от 1 до 15 мм рт. ст.
15. Способ по п. 1, где одно или более средств абсорбируются одной или более тканями, содержащими одно или более восприимчивых сплетений лимфатических капилляров или одно или более сплетений кровеносных капилляров, после доставки в эпидермис.
16. Способ по п. 15, где одно или более средств циркулируют по одному или более сплетениям кровеносных капилляров и в одной или более восприимчивых опухолях или в непосредственной близости от них.
17. Способ по п. 15, где одно или более средств циркулируют по одному или более сплетениям лимфатических капилляров и в одной или более восприимчивых опухолях или в непосредственной близости от них.
18. Способ по п. 1, где концентрация одного или более средств в одной или более восприимчивых опухолях является большей в от 1,25 до 50 раз, чем при внутривенной, внутрикожной или подкожной доставке идентичных одного или более средств.
19. Способ по п. 1, где скорость абсорбции в сыворотку крови одного или более средств является эквивалентной внутрикожной доставке и подкожной доставке идентичных одного или более средств.
20. Способ по п. 1, где одно или более средств предусматривают биологически активное средство.
21. Способ по п. 20, где биологически активное средство является применимым для лечения, замедления прогрессирования, задержки возникновения, профилактики, облегчения или уменьшения тяжести симптомов заболевания у нуждающегося в лечении пациента.
22. Способ лечения субъекта с заболеванием, предусматривающим одну или более опухолей, путем введения одного или более биологически активных средств в одну или более опухолей, предусматривающий:
(а) применение одной или более матриц игл, имеющих множество игл, по отношению к одному или более участкам кожи, содержащим кровеносную сосудистую сеть и лимфатическую сосудистую сеть, где матрица игл обеспечивает контакт одного или более слоев эпидермиса с одним или более усилителями обратимой проницаемости, которые индуцируют обратимое повышение проницаемости одной или более клеток барьерного слоя эпидермиса по меньшей мере для одного или более биологически активных средств;
(b) введение общего количества жидкой лекарственной формы в множественных частях дозы одного или более биологически активных средств при контролируемой скорости потока при введении посредством матрицы игл;
где каждую часть дозы одного или более биологически активных средств независимо вводят при множестве независимых значений глубины в эпидермисе перед любыми дальнейшими диффузией или перемещением одного или более биологически активных средств в эпидермисе; и
где после стадии введения одно или более биологически активных средств перемещаются или диффундируют глубже через эпидермис, через базальный слой эпидермиса и в нижележащую часть жизнеспособной дермы с обеспечением захвата части одного или более биологически активных средств одним или более восприимчивыми сплетениями кровеносных капилляров или сплетениями лимфатических капилляров;
где после введения и захвата одно или более биологически активных средств циркулируют по кровеносной сосудистой сети или лимфатической сосудистой сети к одной или более опухолям; и
где одно или более биологически активных средств доставляют в одну или более опухолей в более высокой концентрации по сравнению с внутривенной, внутрикожной или подкожной доставкой идентичных одного или более биологически активных средств.
23. Способ по п. 22, где эпидермис предусматривает как нежизнеспособный эпидермис, так и жизнеспособный эпидермис.
24. Способ по п. 22, где общее количество жидкой лекарственной формы одного или более биологически активных средств, вводимых при множестве значений глубины в эпидермисе, предусматривает введение на глубину нежизнеспособного эпидермиса и/или жизнеспособного эпидермиса.
25. Способ по п. 22, где множество значений глубины в эпидермисе составляют от 1 до 500 мкм за пределами наиболее поверхностного слоя эпидермиса у субъекта.
26. Способ по п. 22, где общее количество жидкой лекарственной формы одного или более биологически активных средств вводят при множестве значений глубины в эпидермисе, состоящем только из одного или более cлоев жизнеспособного эпидермиса и не содержащем слой нежизнеспособного эпидермиса.
27. Способ по п. 26, где множество значений глубины в жизнеспособном эпидермисе составляет от 1 до 250 мкм за пределами наиболее глубокого слоя нежизнеспособного эпидермиса, но все еще в пределах жизнеспособного эпидермиса.
28. Способ по п. 22, где среднее значение независимого множества значений глубины характеризуется общим средним значением глубины для доставки части дозы в эпидермисе, составляющим от 70 до 175 мкм, за пределами наиболее поверхностного слоя эпидермиса.
29. Способ по п. 22, где множество независимых значений глубины характеризуется общим средним значением глубины введения в эпидермисе, где каждую часть дозы независимо вводят при значении глубины в эпидермисе, которое является более глубоким, менее глубоким или одинаковым.
30. Способ по п. 22, где частота применения значения глубины для введения каждой независимой части дозы в жизнеспособном и/или нежизнеспособном эпидермисе характеризуется гауссовским распределением значений глубины.
31. Способ по п. 22, где матрица игл содержит матрицу, содержащую множество игл, находящихся в жидкостной связи с одним или более биологически активными средствами в жидкой среде-носителе,
где матрица игл содержит механизм для контроля скорости потока при введении;
где иглы содержат механизм для проникновения по меньшей мере через наиболее поверхностный слой эпидермиса; и
где одно или более биологически активных средств в жидкой среде-носителе доставляют с помощью игл при множестве значений глубины в жизнеспособном эпидермисе у субъекта, за счет чего осуществляется введение множественных частей дозы одного или более биологически активных средств.
32. Способ по п. 31, где иглы характеризуются стандартной или нестандартной геометрической формой.
33. Способ по п. 31, где одно или более биологически активных средств вводят при контролируемой скорости потока при введении, составляющей от 0,01 до 100 мкл/ч на иглу.
34. Способ по п. 22, где общая контролируемая скорость потока при введении одного или более биологически активных средств при множестве значений глубины в эпидермисе составляет от 0,02 до 50000 мкл/ч/см2 в пересчете на общую площадь поверхности матрицы игл, которая контактирует с кожей субъекта.
35. Способ по п. 22, где одно или более биологически активных средств доставляют в объем ткани эпидермиса, вмещающий одно или более биологически активных средств, перед любыми дальнейшими диффузией или перемещением одного или более биологически активных средств в эпидермисе, составляющий от 0,7 до 2500 мм3.
36. Способ по п. 22, где одно или более биологически активных средств непрерывно вводят субъекту в течение периода времени, составляющего от 0,1 до 96 часов.
37. Способ по п. 22, где один или более усилителей проницаемости представляют собой один или более химических, физических или электрических усилителей проницаемости.
38. Способ по п. 37, где физические усилители проницаемости предусматривают наноструктурированную или нанотопографическую поверхность.
39. Способ по п. 38, где нанотопографическая поверхность получена на поверхности иглы, определенной в п. 32.
40. Способ по п. 22, где при введении одного или более биологически активных средств достигается давление дермальной интерстициальной жидкости в нижележащей дерме под участком введения, составляющее от 1 до 15 мм рт. ст.
41. Способ по п. 22, где более высокая концентрация одного или более средств в одной или более восприимчивых опухолях является большей в от 1,25 до 50 раз, чем при внутривенной, внутрикожной или подкожной доставке идентичных одного или более биологически активных средств.
42. Способ по п. 22, где скорость абсорбции в сыворотку крови одного или более биологически активных средств является эквивалентной внутрикожной доставке и подкожной доставке идентичных одного или более биологически активных средств.
43. Способ по п. 22, где биологически активное средство является применимым для лечения, замедления прогрессирования, задержки возникновения, профилактики, облегчения или уменьшения тяжести симптомов заболевания, предусматривающего одну или более опухолей.
| WO 2013059343 A1, 25.04.2013 | |||
| WO 2011139713 A2, 10.11.2011 | |||
| ТРАНСДЕРМАЛЬНАЯ ДОСТАВКА ЛАЗОФОКСИФЕНА | 2001 |
|
RU2328276C2 |
Авторы
Даты
2020-04-23—Публикация
2016-07-22—Подача