ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым антителам анти-IL-4, антителам анти-IL-13 и биспецифическим антителам анти-IL-4/анти-IL-13 и к их применению для улучшения состояния, лечения или профилактики заболеваний или расстройств у млекопитающих, включая человека, вызванных аномальной активностью или аномальным метаболизмом IL-4 и (или) IL-13. Рассматриваемое антитело может блокировать связывание и (или) передачу сигнала лиганда, например IL-4 или IL-13, с рецептором или комплексом рецептора, например IL-4Rα, IL-13Rα1 и IL-13Rα2. Раскрывается информация о профилактических, иммунотерапевтических и диагностических препаратах, содержащих рассматриваемые антитела, и их применение в рамках методов профилактики или лечения таких заболеваний млекопитающих, включая человека, которые вызваны аномальным метаболизмом и (или) активностью лимфоидных и нелимфоидных клеток, включая моноциты, фибробласты и эндотелиальные клетки. К таким заболеваниям относятся аутоиммунные болезни, а также болезни, вызванные или характеризующиеся воспалительными процессами, например аллергическая астма и дерматит.
УРОВЕНЬ ТЕХНИКИ
Интерлейкин-4 (IL-4) является плейотропным цитокином, который обладает широким спектром биологических воздействий на лимфоидные В- и Т-клетки, а также многие нелимфоидные клетки, в том числе моноциты, эндотелиальные клетки и фибробласты. Например, IL-4 стимулирует пролиферацию нескольких линий клеток, зависимых от IL-2 и IL-3, индуцирует экспрессию молекул II класса главного комплекса гистосовместимости в дремлющих В-клетках и усиливает секрецию IgG4 и IgE В-клетками человека. IL-4 связан с иммунным ответом Th2-типа и продуцируется Th2-клетками, а также стимулирует их дифференциацию. Предполагается, что IL-4 проявляется в ряде таких заболеваний, как аллергия и астма.
Недавно был идентифицирован цитокин IL-13 (Minty, A. et al., Nature, 1993, 362, 248-250, и McKenzie, A. N. et al., Proc. Natl. Acad. Sci. U.S.A, 1993, 90, 3735-3739), содержащий 112 аминокислот, который выделяется активированными Т-лимфоцитами, В-лимфоцитами, а также мастоцитами, после их активации.
На основании своих разнообразных биологических свойств, сходных с IL-4, IL-13 был отнесен к IL-4-подобным цитокинам. Его функции, действительно, похожи на функции IL-4 в отношении В-клеток (Defrance, T. et al., J. Exp. Med., 1994, 179, 135-143, Punnonen, J. et al., Proc. Natl. Acad. Sci. (USA), 1993, 90, 3730-3734, Fior, R. et al., Eur. Cytokine Network, 1994, 5, 593-600), моноцитов (Muzio, M. R. F. et al., Blood, 1994, 83, 1738-1743, De Waal Malefyt, R. et al., J. Immunol, 1993, 151, 6370-6381, Doyle, A. et al., Eur. J. Immunol. 1994, 24, 1441-1445, Montaner, L. J. et al., J. Exp. Med., 1993, 178, 743-747, Sozzani, P. et al., J. Biol. Chem., 1995, 270, 5084-5088) и других негематопоэтических клеток (Herbert, J. M. et al., Febs Lett., 1993, 328, 268-270, и Derocq, J. M. et al., Febs Lett. 1994, 343, 32-36). С другой стороны, в отличие от IL-4 он не оказывает специфического воздействия на дремлющие или активированные Т-клетки (Zurawuki, G. et al., Immunol. Today, 1994, 15, 19-26).
Различные проявления биологической активности IL-13 в отношении моноцитов/макрофагов, В-лимфоцитов и определенных гематопоэтических предшественников подробно описаны в работах A. J. Minty, а также в обзорах по IL-13. Кроме того, ряд данных свидетельствует о том, что данный цитокин оказывает плейотропный эффект на клетки других типов. К таким негематопоэтическим клеткам, на которые IL-13 оказывает прямое воздействие, относятся эндотелиальные и микроглиальные клетки, кератиноциты, а также клетки карциномы почек и толстой кишки.
Один из этапов анализа сигнала, передаваемого биологической молекулой внутри клетки, предусматривает идентификацию ее мембранного рецептора. Исследования, проведенные в этих целях для рецептора IL-13, показали, что IL-13 и IL-4 имеют общий рецептор или по крайней мере некоторые из компонентов общего рецепторного комплекса, а также общие элементы цепи передачи сигнала (Zurawski S. M. et al., Embo Journal, 1993, 12, 2663-2670, Aversa, G. et al., J. Exp. Med., 1993, 178, 2213-2218, Vita, N. et al., Biol. Chem., 1995, 270, 3512-3517, Lefort, S. et al., Febs Lett., 1995, 366, 122-126). Данный рецептор присутствует на поверхности различных видов клеток в различных количествах в зависимости от рассматриваемого типа клетки. Сравнительное распределение рецепторов IL-13 и IL-4 рассматривалось в работах A. J. Minty (Interleukin-13 for Cytokines in Health and Disease. Eds D. G. Remick and J. S. Frie, Marcel Decker, N.Y. 1996).
Рецепторы клеточной поверхности и рецепторные комплексы связывают IL-4 и/или IL-13 с различной аффинностью. К основным компонентам рецепторов и рецепторных комплексов, которые связывают IL-4 и/или IL-13, относятся IL-4Rα, IL-13Rα1 и IL-13Rα2. Эти цепи экспрессируются на поверхности клеток как мономеры или гетеродимеры IL-4Rα/IL-13Rα1 (II тип IL-4R) или IL-4Rα/γc (I тип IL-4R). Мономер IL-4Rα и гетеродимер IL-4Rα/γc связывают IL-4, но не связывают IL-13. Мономеры IL-13Rα1 и IL-13Rα2 связывают IL-13, но не связывают IL-4. Гетеродимер IL-4Rα/IL-13Rα1 связывает и IL-4, и IL-13 (Murata et al., Int. J. Hematol., 1999, 69, 13-20).
Иммунные ответы Th2-типа стимулируют продукцию антител и гуморальный иммунитет и развиваются для противодействия внеклеточным патогенам. Клетки Th2 являются медиаторами продукции Ig (гуморальный иммунитет) и продуцируют IL-4, IL-5, IL-6, IL-9, IL-10 и IL-13 (Tanaka, et, al., Cytokine Regulation of Humoral Immunity, 251- 272, Snapper, ed., John Wiley and Sons, New York (1996)). Иммунные ответы Th2-типа характеризуются генерацией определенных цитокинов (например, IL-4, IL-13) и специфичных типов антител (IgE, IgG4) и типичны для аллергических реакций, результатом которых могут стать слезящиеся глаза и астматические симптомы, например воспаление дыхательных путей и сокращение мышечных клеток дыхательных путей в легких.
И IL-4, и IL-13 являются терапевтически важными цитокинами, что определяется их биологическими функциями, и играют важную роль во многих заболеваниях, в том числе при астме (Curr Opin Allergy Clin Immunol 2005, Vo. 5, 161-166). Было показано, что IL-4 в состоянии ингибировать аутоиммунные заболевания, и продемонстрировано, что IL-4 и IL-13 обладают потенциалом усиливать противоопухолевый иммунный ответ. Поскольку оба цитокина задействованы в патогенезе аллергических заболеваний, ингибиторы таких цитокинов могут обладать положительным терапевтическим эффектом.
Поэтому существует потребность в усовершенствованных агентах, которые ингибируют IL-4, ингибируют IL-13, а также агентах, которые ингибируют и IL-4, и IL-13.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предлагаются новые гуманизированные моноклональные и биспецифические антитела, а также их фрагменты и производные, которые специфическим образом связываются с IL-4 и (или) IL-13. Некоторые из моно- или биспецифических антител анти-IL-4 и (или) IL-13 и их фрагменты могут быть изменены, с тем чтобы воспрепятствовать образованию внутрицепьевой дисульфидной связи, что приводит к образованию молекулы, которая сохраняет стабильность в процессе получения и использования in vivo. Антитела по настоящему изобретению нейтрализуют активность IL-4 и (или) IL-13 в биологических анализах, которые описаны в настоящем документе.
Изобретение включает аминокислотные последовательности вариабельной тяжелой и легкой цепи антител и соответствующие им последовательности нуклеиновых кислот.
Другой пример осуществления настоящего изобретения включает клеточные линии и векторы, содержащие последовательности антител настоящего изобретения.
Еще один пример осуществления настоящего изобретения предполагает использование антител для приготовления фармацевтического препарата для лечения заболеваний и нарушений, связанных с функцией и метаболизмом IL-4 и (или) IL-13. В частности, настоящее изобретение относится к лечению рака, аутоиммунных заболеваний и болезней, вызванных или характеризующихся воспалительными процессами, например аллергической астмы и дерматита.
Дополнительные особенности и преимущества описаны в настоящем документе и будут очевидны из приведенного ниже полного описания изобретения и фигур.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1 представлено схематическое изображение молекулы биспецифического антитела анти-IL-4/IL-13, содержащей четыре полипептидные цепи. Две более легкие цепи содержат N-VLhB-B13-линкер-VLh8D4-8-CL-C (CL, константная область легкой цепи), две более тяжелые цепи содержат N-VHhB-B13-линкер-VHh8D4-8-CH1-CH2-CH3-C. Линкерная последовательность (G4S)2 представлена GGGGSGGGGS (SEQ ID NO:6).
На фиг. 2 приводятся аминокислотные последовательности гуманизированных вариабельных доменов антитела B-B13 анти-IL-13 (SEQ ID NO:1 и 2) и гуманизированных вариабельных доменов антитела 8D4-8 анти-IL-4 (SEQ ID NO:3, 4 и 5). Подчеркиванием выделены внесенные изменения в аминокислотную последовательность. Полужирным шрифтом выделена CDR.
ПОДРОБНОЕ описание изобретения
Настоящее изобретение не ограничивается конкретной методологией, протоколами, клеточными линиями, векторами или реагентами, описанными в настоящем документе, поскольку их можно менять, не затрагивая при этом основной идеи и охвата изобретения. Далее, используемая в настоящем документе терминология предназначена исключительно для описания конкретных осуществлений и не подразумевает ограничения сферы охвата настоящего изобретения. Если не указано иное, все технические и научные термины и сокращения, используемые в настоящем документе, имеют такое же значение, которое общеизвестно рядовым специалистам в данной области, к которой относится настоящее изобретение. Любые методы и материалы, аналогичные или идентичные описанным в настоящем документе, могут использоваться в практическом применении настоящего изобретения, и ниже приводится описание только примеров методов, устройств и материалов.
Все публикации и патенты, упоминаемые в настоящем документе, включаются в настоящий документ в силу ссылки на них для целей описания и раскрытия приводимых в нем белков, ферментов, векторов, клеток-хозяев и методологий, которые могут использоваться в сочетании с настоящим изобретением и в нем. Вместе с тем, никакие положения настоящего документа не следует толковать как признание того, что настоящее изобретение не имеет права на более ранний приоритет на основании предшествующего изобретения.
Перед описанием формулировок и приложений способов, связанных с IL-4 и (или) IL-13, и рассматриваемых продуктов для сведения специалистов ниже приводятся определения некоторых терминов и словосочетаний.
Термин «интерлейкин-4» (IL-4) относится к существующим в природе или эндогенным белкам млекопитающих IL-4, а также к белкам, имеющим аминокислотную последовательность, которая совпадает с существующим в природе или соответствующим эндогенным белком млекопитающих IL-4 (например, рекомбинантные белки, синтетические белки (то есть полученные с использованием методов синтетической органической химии)). Соответственно, как указано в настоящем документе, термин включает зрелый белок IL-4, полиморфные или аллельные варианты, а также другие изоформы IL-4 и модифицированные или немодицифированные формы упомянутого выше (например, липидные, гликозилированные). Существующие в природе или эндогенные IL-4 включают зрелые белки, например нативный IL-4, полиморфные или аллельные варианты, а также другие изоформы и мутантные формы, которые присутствуют в естественных условиях в организме млекопитающих (например, человек, нечеловекообразные приматы). Такие белки могут извлекаться или выделяться из источника, который в естественных условиях продуцирует, например, IL-4. Такие белки и белки, имеющие аминокислотную последовательность, которая совпадает с существующим в природе или соответствующим эндогенным IL-4, определяют по названию соответствующего млекопитающего. Например, если соответствующим млекопитающим является человек, белок обозначают как IL-4 человека. Специалистам в данной области известны несколько мутантных белков IL-4, например, описанных в заявке WO 03/038041.
Термин «интерлейкин-13» (IL-13) относится к существующим в природе или эндогенным белкам млекопитающих IL-13, а также к белкам, имеющим аминокислотную последовательность, которая совпадает с существующим в природе или соответствующим эндогенным белком млекопитающих IL13 (например, рекомбинантные белки, синтетические белки (то есть полученные с использованием методов синтетической органической химии)). Соответственно, как определено в настоящем документе, термин включает зрелый белок IL-13, полиморфные или аллельные варианты, а также другие изоформы IL-13 (например, полученные методом альтернативного сплайсинга или при помощи других клеточных процессов) и модифицированные или немодицифированные формы упомянутого выше (например, липидные, гликозилированные). Существующие в природе или эндогенные IL-13 включают зрелые белки, например зрелый IL-13, полиморфные или аллельные варианты, а также другие изоформы и мутантные формы, которые присутствуют в естественных условиях в организме млекопитающих (например, человек, нечеловекообразные приматы). Например, используемый здесь IL-13 включает вариант IL-13 человека, в котором Arg в позиции 110 зрелого IL-13 человека замещается на Gin (позиция 110 зрелого IL-13 соответствует позиции 130 белка предшественника), который ассоциируется с астмой (атопической и неатопической астмой) и другими вариантами IL-13. (Heinzmann el al., Hum MoI Genet. 9:549-559 (2000).) Такие белки могут извлекаться или выделяться из источника, который в естественных условиях продуцирует, например, IL-13. Такие белки и белки, имеющие аминокислотную последовательность, которая совпадает с существующим в природе или соответствующим эндогенным IL-13, определяют по названию соответствующего млекопитающего. Например, если соответствующим млекопитающим является человек, белок обозначают как IL-13 человека. Специалистам в данной области известны несколько мутантных белков IL-13, например, описанных в заявке WO 03/035847.
Термин «по существу идентичны» по отношению к последовательности полипептидной цепи антитела может интерпретироваться как идентичность по крайней мере на 70%, 80%, 90%, 95% или больше последовательности цепи антитела и сопоставляемой полипептидной последовательности. Тот же термин в отношении последовательности нуклеиновой кислоты может интерпретироваться как последовательность нуклеотидов, проявляющая идентичность по крайней мере на 85%, 90%, 95%, 97% или больше последовательности по отношению к сопоставляемой последовательности нуклеиновой кислоты.
Термины «идентичность» или «гомология» могут означать процент оснований нуклеотидов или аминокислотных остатков в последовательности кандидата, которые идентичны остатку соответствующей последовательности, с которой она сравнивается, после сопоставления последовательностей и введения пропусков, если необходимо, для обеспечения максимального процента идентичности по всей последовательности и без учета любых консервативных замещений в рамках идентичности последовательности. Ни N-концевые или C-концевые удлиняющие сегменты, ни вставки не следует рассматривать как уменьшающие идентичность или гомологию. Методы и компьютерные программы для сопоставления доступны и известны специалистам в данной области. Идентичность последовательности может оцениваться с помощью программного обеспечения для анализа последовательностей.
Словосочетания и термины «функциональный фрагмент, вариант, производное или аналог» и им подобные, а также их формы, применяемые в отношении антитела или антигена, описывают соединение или молекулу, обладающую качественной биологической активностью, присущей рассматриваемому антителу или полноразмерному антигену. Например, функциональный фрагмент или аналог антитела анти-IL-4 может связываться с молекулой IL-4 или с молекулой, которая может препятствовать или существенно снижать способность лиганда или агониста или антагонистического антитела, связываться с IL-4.
«Субституционными» вариантами называют такие, где по крайней мере один аминокислотный остаток в нативной последовательности удален и заменен другой аминокислотой, введенной на его место в том же положении. Замещения могут быть одиночными, при которых заменяется только одна аминокислота в молекуле, или множественными, если в одной и той же молекуле замещаются две или более аминокислоты. Множественные замещения могут производиться в последовательных сайтах. Кроме того, одна аминокислота может замещаться несколькими остатками, такой вариант содержит как замещения, так и вставки. «Инсерционными» вариантами называют такие, где одна или несколько аминокислот были введены таким образом, что оказались непосредственно соседствующими с той или иной аминокислотой в конкретном положении нативной последовательности. Под непосредственно соседствующей с той или иной аминокислотой понимается аминокислота, связанная с α-карбоксильной или α-аминной функциональной группой аминокислоты. «Делеционными» вариантами называют такие, где удалена одна или несколько аминокислот из нативной аминокислотной последовательности. Обычно в делеционных вариантах удаляют одну или две аминокислоты в конкретной области молекулы.
Термин «антитело» используется в наиболее широком смысле и, в частности, включает моноклональные антитела (включая полноразмерное моноклональные антитела), поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), фрагменты антител или синтетические полипептиды, содержащие одну или более последовательностей CDR или производных от CDR, при условии, что полипептиды проявляют желательную биологическую активность. Антитела (Ab) и иммуноглобулины (Ig) относятся к гликопротеинам, обладающим одинаковыми структурными особенностями. Как правило, антитела рассматривают как Ig с определенной или распознаваемой специфичностью. Таким образом, антитела проявляют специфичность связывания с конкретной мишенью, тогда как к иммуноглобулинам относятся и антитела, и другие подобные антителам молекулы, которые не обладают специфичностью к мишени. Антитела по настоящему изобретению могут относиться к любому классу (например, IgG, IgE, IgM, IgD, IgA и т.п.) или подклассу (например, IgG1, IgG2, IgG2a, IgG3, IgG4, IgA1, IgA2 и т.п.) (термины «тип» и «класс», а также «подтип» и «подкласс» равнозначно используются в настоящем документе). Нативные или немутантные, то есть полученные от представителя популяции без искусственных манипуляций антитела и иммуноглобулины обычно представляют собой гетеротетрамерные гликопротеины с молекулярным весом примерно 150000 дальтон, состоящие из двух одинаковых легких цепей (L) и двух одинаковых тяжелых цепей (H). Каждая тяжелая цепь имеет на конце вариабельный домен (VH), за которым следует несколько константных доменов. Каждая легкая цепь имеет на конце вариабельный домен (VL), а на другом конце - константный домен. Под выражением «без искусственных манипуляций» понимают отсутствие обработки, после которой элементы содержат или экспрессируют чужеродную антиген-связывающую молекулу. Определение «нативный» может относиться к наиболее преобладающей аллели или видам, регистрируемым в популяции, или к антителу, полученному от животного без манипуляций, в сопоставлении с аллелью или полиморфизмом, или вариантом, или производным, полученным за счет той или иной формы манипуляций, например мутагенеза, применения рекомбинантных методик и т.п. для изменения аминокислоты антиген-связывающей молекулы.
Используемый в настоящем документе термин «антитело анти-IL-4» означает антитело или полипептид, полученный от него (производное), которые специфически связываются с IL-4 в соответствии с определением настоящего документа, в том числе, среди прочих, молекулы, которые ингибируют или существенно снижают уровень связывания IL-4 с его рецептором или ингибируют активность IL-4.
Используемый в настоящем документе термин «антитело анти-IL-13» означает антитело или полипептид, полученный от него (производное), которые специфически связываются с IL-13 в соответствии с определением настоящего документа, в том числе, среди прочих, молекулы, которые ингибируют или существенно снижают уровень связывания IL-13 с его рецептором или ингибируют активность IL-13.
Термин «вариабельный» в контексте вариабельного домена антител относится к определенным частям соответствующей молекулы, которые в значительной мере отличаются своей последовательностью от антител и используются для специфического распознавания и связывания конкретного антитела с его определенной мишенью. При этом вариабельность неравномерно распределяется по вариабельным доменам антител. Вариабельность сосредоточивается в трех сегментах, называемых определяющими комплементарность областями (CDR; то есть CDR1, CDR2 и CDR3), также известными как гипервариабельные участки, которые находятся в вариабельных доменах как легкой, так и тяжелой цепи. Области вариабельных доменов с более высокими уровнями сохранения называют остовными областями (FR) или последовательностями. Вариабельные домены нативных тяжелых и легких цепей содержат по четыре области FR, в значительной мере имеют конформацию β-листа и связаны тремя CDR, которые образуют петли, соединяющие, а в некоторых случаях и образующие, часть структуры β-листа. CDR в каждой цепи часто удерживаются поблизости друг от друга областями FR, и вместе с CDR другой цепи способствуют формированию искомого (эпитопа или детерминанта) сайта связывания антител (см., Kabat et al. Sequences of Proteins of Immunological Interest, National Institute of Health, Bethesda, MD (1987)). Если не указано иначе, используемая в настоящем документе нумерация аминокислотных остатков иммуноглобулина производится в соответствии с системой нумерации аминокислотных остатков иммуноглобулина из работы Kabat et al. Одна CDR может обладать способностью специфически связывать когнатный эпитоп.
Термин «шарнир», или «шарнирная область», используемый в настоящем изобретении, относится к гибкому полипептиду, содержащему аминокислоты между первым и вторым константными доменами антитела.
Определение «фрагмент антитела» относится к части интактной или полной цепи или антитела, как правило, области связывания мишени или вариабельной области. К примерам фрагментов антитела, среди прочих, относятся фрагменты Fab, Fab', F(ab')2 и Fv. «Функциональным фрагментом» или «аналогом антитела анти-IL-4 и (или) IL-13» называют такой фрагмент, который может препятствовать способности рецептора, или существенно снижать такую способность, связываться с лигандом или инициировать сигнал. Используемый в настоящем документе термин «функциональный фрагмент» является синонимом термина «фрагмент антитела» и при употреблении в отношении антител может касаться таких фрагментов, как Fv, Fab, F(ab')2 и т.п., которые в состоянии препятствовать способности рецептора, или существенно снижать такую способность, связываться с лигандом или инициировать сигнал. Фрагмент «Fv» состоит из димера вариабельного домена с одной тяжелой и одной легкой цепью, образованного посредством нековалентной ассоциации (димер VH-VL). В такой конфигурации три CDR каждого вариабельного домена взаимодействуют, формируя искомый сайт связывания на поверхности димера VH-VL, так же как в интактном антителе. В совокупности такие шесть CDR обеспечивают специфичность связывания мишени на интактном антителе. При этом даже единичный вариабельный домен (или половина Fv, содержащая всего три CDR, специфичных к мишени) может обладать способностью распознавать и связывать мишень.
«Одноцепочечные Fv», фрагменты антител «sFv» или «scAb» включают домены антитела VH и VL, причем эти домены присутствуют в единой полипептидной цепи. Как правило, полипептид Fv дополнительно содержит полипептидный линкер, часто гибкую молекулу, между доменами VH и VL, что позволяет sFv образовать нужную структуру для связывания мишени.
Термин «диатела» относится к фрагментам антител с двумя антиген-связывающими сайтами, каковые фрагменты могут включать вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в той же полипептидной цепи. За счет использования линкера, который слишком короткий, чтобы обеспечивать объединение двух вариабельных доменов одной и той же цепи, домены диател вынуждены объединяться с доменами связывания другой цепи для формирования двух антиген-связывающих сайтов.
Фрагмент Fab содержит вариабельные и константные домены легкой цепи и вариабельный и первый константный домен (CH1) тяжелой цепи. Фрагменты Fab' отличаются от фрагментов Fab добавлением нескольких остатков в карбоксильном концевом окончании домена CH1, так чтобы он содержал один или несколько цистеинов из шарнирной области антитела. Фрагменты Fab' могут быть получены расщеплением дисульфидной связи в цистеинах шарнирной области продукта разрушения пепсином F(ab')2. Дополнительная ферментативная и химическая обработка антител может приводить к образованию других представляющих интерес функциональных фрагментов.
Термин «линейный Fab» относится к четырехвалентному антителу, согласно описанию в Miller et al. (2003), J Immunol. 170: 4854-4861. «Линейный Fab» состоит из тандема одинаковых доменов CH1-VH, соединенных одинаковой легкой цепью в каждом положении CH1-VH. Подобные молекулы создавались с тем, чтобы повысить валентность антитела с целью улучшения его функциональной аффинности за счет эффекта авидности, но они являются моноспецифическими.
Термин «биспецифические антитела (BsAb)» относится к молекулам, которые объединяют антиген-связывающие сайты двух антител в одной молекуле. Так, биспецифическое антитело в состоянии связывать два различных антигена одновременно. Кроме диагностических приложений, BsAb открывают дорогу новым терапевтическим применениям за счет переориентации мощной эффекторной системы на пораженные болезнью области или за счет повышения нейтрализующей или стимулирующей функции антител.
В ходе первых попыток сочетания специфичности связывания двух полных антител против различных антигенов-мишеней в лечебных целях использовались химически слитые гетероконъюгированные молекулы (Staerz et al.(1985), Nature 314: 628-631).
Биспецифические антитела продуцировались из исходных гибридом с помощью гетерогибридомных методик, и in vitro были продемонстрированы свойства, подобные наблюдаемым для гетероконъюгатов (Milstein & Cuello (1983) Nature 305:537-540).
Несмотря на многообещающие результаты, полученные с помощью гетероконъюгатов или биспецифических антител, продуцируемых в результате, как упоминалось выше, слияния клеток, ряд факторов делает их неприменимыми для широкомасштабных терапевтических приложений. К таким факторам относятся: быстрое выведение гетероконъюгатов in vivo, трудоемкие методики, необходимые для получения любой из форм молекулы, потребность в тщательной очистке гетероконъюгатов от гомоконъюгатов или моноспецифических антител и характерные низкие выходы.
Генная инженерия все чаще использовалась для конструирования, модификации и продукции антител или производных антител с желательным набором свойств связывания и эффекторных функций.
Было разработано множество рекомбинантных методик для эффективной продукции BsAb, в обоих случаях как фрагментов антитела (Carter et al. (1995), J. Hematotherapy 4:463-470; Pluckthun et al. (1997) Immunotechology 3:83-105; Todorovska et al. (2001) J. Immunol. Methods 248:47-66) и полноразмерные форматы IgG (Carter (2001) J. Immunol. Methods 248: 7-15).
Объединение двух различных scFv приводит к форматам BsAb с минимальной молекулярной массой, которые называют sc-BsAb или Ta-scFv (Mack et al. (1995), Proc. Acad. Sci. USA. 92:7021-7025; Mallender et al. (1994) J. Biol. Chem. 269:199-206). BsAb конструировались посредством генетического слияния двух scFv за счет обеспечивающей димеризацию функциональности, например лейциновой застежки (Kostelny et al. (1992) J. Immunol. 148:1547-53; de Kruif et al. (1996) J. Biol. Chem. 271:7630-4).
Как упоминалось выше, диателами называют небольшие фрагменты бивалентных и биспецифических антител. Фрагменты включают VH, связанный с VL одной и той же полипептидной цепи за счет линкера, который имеет слишком малую длину (менее 12 аминокислот), чтобы обеспечивать возможность связывания между двумя доменами на одной и той же цепи. Домены вынуждены межмолекулярно объединяться с комплементарными доменами другой цепи для формирования двух антиген-связывающих сайтов. Такие димерные фрагменты антител, или «диатела», являются бивалентными и биспецифическими. (Holliger et al. (1993), Proc. Natl. Acad. Sci. USA. 90: 6444-6448). Диатела имеют размер, близкий к фрагменту Fab. Полипептидные цепи доменов VH и VL, связанные линкером между 3 и 12 аминокислотами, образуют в основном димеры (диатела), тогда как в случае линкера между 0 и 2 аминокислотными остатками предпочтительными оказываются тримеры (триатела) и тетрамеры (тетратела). Кроме длины линкера, точная модель олигомеризации очевидно зависит от состава, а также от ориентации V-доменов (Hudson et al. (1999), J Immunol Methods 231: 177-189). Предсказуемость конечной структуры молекул диател исключительно низкая.
Несмотря на то, что sc-BsAb и конструкции на основе диател обладают интересным клиническим потенциалом, было показано, что такие нековалентно ассоциированные молекулы недостаточно стабильны в физиологических условиях. Общая стабильность фрагмента scFv зависит от внутренней стабильности доменов VL и VH, а также от стабильности доменного интерфейса. Недостаточная стабильность интерфейса VH-VL фрагментов scFv часто указывалась среди основных причин необратимой инактивации scFv, поскольку промежуточное раскрытие интерфейса, которое допускает пептидный линкер, открывает доступ к гидрофобным участкам, способствующим агрегированию, а потому определяющим нестабильность и низкий выход продукции (Wörn and Plückthun (2001), J. Mol. Biol. 305: 989-1010).
Альтернативный метод приготовления биспецифических бивалентных антиген-связывающих белков из доменов VH и VL приводится в патенте US 5989830. Такие фрагменты антитела с двумя головками получают экспрессией двухцистронного вектора, кодирующего две полипептидные цепи, причем одна полипептидная цепь дважды содержит VH в последовательности с пептидным линкером (VH1-линкер-VH2), а другая полипептидная цепь содержит комплементарные домены VL, соединенные в последовательность пептидным линкером (VL1-линкер-VL2). В патенте US 5989830 было показано, что линкер должен состоять по крайней мере из 10 аминокислотных остатков.
Поливалентные белковые комплексы (PPC) с возрастающей валентностью описаны в патенте US 2005/0003403 A1. PPC содержат две полипептидные цепи, которые обычно располагаются латерально по отношению друг к другу. Каждая полипептидная цепь обычно включает 3 или 4 «v-области», содержащие аминокислотные последовательности, которые в состоянии образовать сайт связывания антигена при сопоставлении с соответствующей v-областью на противолежащей полипептидной цепи. На каждой полипептидной цепи может быть задействовано до примерно 6 «v-областей». V-области каждой полипептидной цепи связаны линейно друг с другом и могут соединяться перемежаемыми линкерными областями. При организации в форме PPC v-области на каждой полипептидной цепи образуют индивидуальные сайты связывания антигена. Комплекс может содержать одну или несколько связывающих специфичностей.
Вместе с тем при использовании таких молекул была продемонстрирована склонность к агрегированию, нестабильность и низкий выход экспрессии (Wu et al. (2001) Prot. Eng. 14: 1025-1033). Все это характерные проблемы стабильности, которые могут наблюдаться при экспрессии одноцепочечных антител. (Wörn and Plückthun (2001), J. Mol. Biol. 305: 989-1010).
Поэтому целью настоящего изобретения является получение биспецифического поливалентного антитела, с помощью которого можно избежать образования агрегатов. Кроме того, оно должно обладать стабильностью, которая определяет его пригодность для использования в лечебных целях.
Используемый в настоящем документе термин «моноклональное антитело» относится к антителу, полученному из популяции в значительной мере однородных антител, то есть отдельные антитела, образующие популяцию, идентичны, если не учитывать возможные природные мутации, которые могут присутствовать в незначительных количествах.
В данном случае к моноклональным антителам, в частности, относятся «химерные» антитела, в которых часть тяжелой и (или) легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных от конкретных видов или принадлежащих к определенному классу или подклассу (типу или подтипу) антител, при этом остальная цепь (цепи) идентична или гомологична соответствующим последовательностям в антителах, полученных от других видов или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител, при условии что они проявляют желаемую биологическую активность при связывании с IL-4 и (или) IL-13 или воздействии на активность или метаболизм IL-4 и (или) IL-13 (патент США № 4816567; и Morrison et al., Proc Natl Acad Sci USA 81:6851 (1984)). Поэтому CDR одного класса антител могут быть введены в FR антитела другого класса или подкласса.
Моноклональные антитела обладают высокой специфичностью, они ориентированы на единственный сайт-мишень, эпитоп или детерминант. Кроме того, в отличие от обычных (поликлональных) препаратов антител, которые, как правило, содержат различные антитела, ориентированные против различных детерминантов (эпитопов) антигена, каждое моноклональное антитело направлено против единственного детерминанта в мишени. В дополнение к специфичности, преимущество моноклональных антител состоит в том, что они продуцируются клеткой-хозяином без примесей других иммуноглобулинов, что обеспечивает клонирование соответствующего гена и мРНК, кодирующей антитело его цепей. Модификатор «моноклональное» указывает на характеристику антитела, которое было получено из в значительной мере однородной популяции антител, и не должен интерпретироваться как требующий продукции антитела любым конкретным методом. Например, моноклональные антитела для использования в настоящем изобретении могут быть выделены из фаг-библиотеки антител с помощью хорошо известных методик или же могут выделяться из поликлонального препарата. Исходные моноклональные антитела для использования в соответствии с настоящим изобретением могут быть приготовлены с помощью гибридомного метода, описанного в Kohler et al., Nature 256:495 (1975), или могут быть получены рекомбинантными методами, которые хорошо известны специалистам в данной области.
Термин «поливалентное антитело», используемый в настоящем изобретении, относится к антителу, содержащему два и более сайтов связывания антигена, и поэтому способному одновременно связывать два или более антигена, обладающих одинаковой или различной структурой. Термин «бивалентное» означает, что антитело содержит два антиген-связывающих сайта. Термин «тетравалентное» означает, что антитело содержит четыре антиген-связывающих сайта.
Термин «антиген-связывающий сайт», который используется в настоящем изобретении, относится к части антитела, содержащей область, специфически связывающую часть антигена или полный антиген и комплементарную части антигена или полному антигену. В случае большого по величине антигена антитело может связываться лишь с определенной его частью, и такую часть называют эпитопом. Антиген-связывающий домен может обеспечиваться одним или несколькими вариабельными доменами антитела. Предпочтительно, чтобы антиген-связывающий домен был образован за счет связывания вариабельного домена легкой цепи антитела (VL) и вариабельного домена тяжелой цепи антитела (VH).
Используемый в настоящем изобретении термин «антиген» относится к молекуле или части молекулы, которая в состоянии связываться с антителами настоящего изобретения. Антиген может содержать один или несколько эпитопов. К примерам антигенов, распознаваемых антителами настоящего изобретения, среди прочих, относятся белки сыворотки, например цитокины, такие как IL-4, IL5, IL9 и IL-13, биологически активные пептиды, молекулы клеточной поверхности, например рецепторы, переносчики, ионные каналы, вирусные и бактериальные белки.
Используемый в настоящем изобретении термин «моноспецифический» означает, что поливалентное антитело настоящего изобретения распознает только один антиген, причем все антиген-связывающие сайты являются идентичными.
Используемый в настоящем изобретении термин «биспецифический» означает, что поливалентное антитело настоящего изобретения распознает два различных эпитопа на одном и том же антигене или двух различных антигенах.
Используемый в настоящем изобретении термин «мультиспецифический» означает, что поливалентное антитело настоящего изобретения распознает множество различных эпитопов на одном и том же антигене или множестве различных антигенов.
Используемый в настоящем изобретении термин «линкер» означает пептид, приспособленный для соединения вариабельных доменов конструкций антител настоящего изобретения. Пептидный линкер может содержать любые аминокислоты, при этом предпочтение отдается аминокислотам глицину (G) и серину (S). Линкеры, соединяющие полипептид тяжелой цепи и полипептид легкой цепи и внутри этих цепей, могут быть одинаковыми или отличаться друг от друга. Кроме того, линкер может иметь длину 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислот. Предпочтительным пептидным линкером для доменов тяжелой цепи, а также для доменов легкой цепи является GGGGS. Число линкерных единиц в тяжелой цепи и в легкой цепи может быть одинаковым (симметричный порядок) или отличаться друг от друга (асимметричный порядок).
Пептидный линкер предпочтительно является достаточно длинным, чтобы обеспечивать надлежащую степень гибкости, исключающую влияние функциональных областей антитела на активность друг друга, например, из-за стерических затруднений, чтобы давать возможность для надлежащего сворачивания белка, а также, при необходимости, позволять молекулам антитела взаимодействовать с двумя или более, возможно, пространственно удаленными друг от друга рецепторами на поверхности одной и той же клетки; вместе с тем, он должен предпочтительно быть достаточно коротким, чтобы гарантировать стабильность функциональных областей антитела внутри клетки.
Поэтому длина, состав и/или конформация пептидных линкеров может с легкостью варьироваться специалистами в данной области, с тем чтобы оптимизировать желательные свойства поливалентного антитела.
По сравнению с антителом человека «гуманизированные» формы нечеловеческих (например, мышиных) антител представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (например, Fv, Fab, Fab', F(ab')2 или других связывающих мишень подпоследовательностей антител), которые содержат последовательности, производные от нечеловеческого иммуноглобулина. Как правило, гуманизированное антитело будет включать по существу всю последовательность одного, а обычно двух вариабельных доменов, в которых все или по существу все области CDR соответствуют областям нечеловеческого иммуноглобулина, и все или по существу все области FR представляют собой матричную последовательность иммуноглобулина человека. Гуманизированное антитело может также включать по крайней мере часть константной области иммуноглобулина (Fc), как правило, выбранной матричной последовательности иммуноглобулина человека. Как правило, основной целью является получение молекулы антитела, которая минимально иммуногенна для человека. Поэтому существует возможность также заменить одну или несколько аминокислот в одной или нескольких CDR на такие, которые будут менее иммуногенны для организма-хозяина человека, существенно не снижая специфическую функцию связывания одной или нескольких CDR с IL-4 и (или) IL-13. В качестве альтернативы можно использовать нечеловеческую FR, но в ней наиболее иммуногенные аминокислоты заменяются на менее иммуногенные. Вместе с тем обсуждавшееся выше встраивание в CDR не является единственным методом получения гуманизированного антитела. Например, модификации одних только областей CDR может быть недостаточно, поскольку довольно часто остовные остатки могут играть важную роль в определении трехмерной структуры петель CDR и общей аффинности антитела к своему лиганду. Поэтому могут применяться любые способы модификации молекулы нечеловеческого исходного антитела, так чтобы быть менее иммуногенной для человека, и полная идентичность с антителом человека не всегда является обязательной. Итак, гуманизация может также достигаться, например, простым замещением всего лишь нескольких остатков, в частности, тех, которые находятся на поверхности молекулы антитела и не скрыты внутри ее структуры, а потому не являются легко доступными для иммунной системы хозяина. Подобный способ предложен в настоящем документе в отношении замещения «мобильных» или «гибких» остатков молекулы антитела, при этом цель заключается в том, чтобы уменьшить или подавить иммуногенность получающейся молекулы, не влияя на специфичность антитела в отношении эпитопа или детерминанта. См., например, Studnicka et al., Prot Eng 7(6)805-814, 1994; Mol Imm 44:1986-1988, 2007; Sims et al., J Immunol 151:2296 (1993); Chothia et al., J Mol Biol 196:901 (1987); Carter et al., Proc Natl Acad Sci USA 89:4285 (1992); Presta et al., J Immunol 151:2623 (1993), WO 2006/042333 и патент США № 5869619.
Предлагаемый способ гуманизации основан на воздействии гибкости молекулы антитела в процессе и в момент иммунного распознавания. Гибкость белка связана с молекулярным движением его молекулы. Под гибкостью белка подразумевают способность всего белка, части белка или отдельно взятого аминокислотного остатки формировать ансамбль конформаций, которые в значительной мере отличаются друг от друга. Данные о гибкости белка можно получить по результатам экспериментов рентгеновской кристаллографии (см., например, Kundu et al. 2002, Biophys J 83:723–732.), ядерного магнитного резонанса (см., например, Freedberg et al., J Am Chem Soc 1998, 120(31):7916-7923) или по результатам моделирования молекулярной динамики (MD). Моделирование MD белка проводится на компьютере и позволяет выявить движения всех атомов белка за определенный период времени посредством расчета физических взаимодействий атомов друг с другом. Результатом моделирования MD является траектория для исследуемого белка за период времени моделирования. Траектория представляет собой ансамбль конформаций белка, также называемый статическими конфигурациями, которые периодически регистрируются за время моделирования, например каждую пикосекунду (псек). Именно посредством анализа ансамбля статических конфигураций можно определить гибкость аминокислотных остатков белка. Поэтому гибким остатком считается такой, который может иметь ансамбль различных конформаций в структуре полипептида, где такой остаток находится. Методы MD известны специалистам в данной области, см., например, Brooks et al. “Proteins: A Theoretical Perspective of Dynamics, Structure and Thermodynamics” (Wiley, New York, 1988). Некоторые программные продукты позволяют проводить моделирование MD, в том числе Amber (см. Case et al. (2005) J Comp Chem 26:1668-1688), Charmm (см. Brooks et al. (1983) J Comp Chem 4:187-217; и MacKerell et al. (1998) в “The Encyclopedia of Computational Chemistry” vol. 1:271-177, Schleyer et al., eds. Chichester: John Wiley & Sons) или Impact (см. Rizzo et al. J Am Chem Soc; 2000; 122(51):12898-12900.)
Большинство комплексов белков обладает сравнительно протяженными и планарными скрытыми поверхностями, и было показано, что гибкость связывающихся партнеров обеспечивает основу для их пластичности, что позволяет им конформационно адаптироваться друг к другу (Structure (2000) 8, R137-R142). Соответственно, было показано, что примеры «индуцированного соответствия» играют доминирующую роль во взаимодействии белок-белок. Кроме того, существует постоянно пополняющаяся совокупность данных, которые показывают, что белки на самом деле связывают лиганды различных форм, размеров и структуры (Protein Science (2002) 11:184-187) и что конформационное разнообразие, очевидно, является существенной составляющей способности распознавать различных партнеров (Science (2003) 299, 1362-1367). Гибкие остатки принимают участие в связывании партнеров в паре белок-белок (Structure (2006) 14, 683-693).
Гибкие остатки могут принимать самые разные конформации, формирующие ансамбль областей взаимодействия, которые, скорее всего, будут распознаваться В-клетками памяти и вызывать иммуногенный ответ. Таким образом, антитела могут быть гуманизированы посредством модификации ряда остатков остовной последовательности, так чтобы ансамбль конформаций и доступных областей распознавания в модифицированном антителе как можно более походил на существующие в антителе человека.
Это может достигаться модификацией ограниченного числа остатков посредством: (1) построения модели гомологии исходного моноклонального антитела (mAb) и проведения молекулярно-динамического моделирования (MD); (2) анализа гибких остатков и идентификации наиболее гибких остатков в молекуле нечеловеческого антитела, а также выявления остатков или мотивов, которые, скорее всего, будут источником гетерогенности или реакции распада; (3) идентификации антитела человека, которое демонстрирует наличие наиболее похожего ансамбля зон распознавания, в качестве исходного антитела; (4) выявления гибких остатков для мутации, остатков или мотивов, которые, скорее всего, будут источником гетерогенности и распада и также будут подвергаться мутации; и (5) проверки на наличие известных эпитопов Т- или В-клеток. Гибкие остатки могут выявляться на основе расчетов MD, которые предлагаются в настоящем документе, с использованием модели предполагаемого растворителя, которая учитывает взаимодействие водного растворителя с атомами белка за период времени моделирования. После выявления набора гибких остатков в вариабельных легких и тяжелых цепях определяют набор остовных последовательностей тяжелых и легких цепей вариабельных областей человека, которые обладают близким сходством с существующими в рассматриваемом антителе. Для этого, например, можно воспользоваться поиском BLAST для набора гибких остатков по базе данных для последовательностей антител зародышевой линии человека. Это также может достигаться посредством сопоставления динамики исходного mAb с динамикой библиотеки канонических структур зародышевой линии. Остатки и соседние остатки CDR исключаются из поиска, с тем чтобы обеспечить сохранение высокой аффинности для антигена.
Затем производилась замена гибких остатков. Когда несколько остатков человека проявляли сходную гомологию, выбор определялся также природой остатков, которые, скорее всего, оказывали бы влияние на поведение гуманизированного антитела в растворе. Например, предпочтение отдавалось полярным остаткам в доступных гибких петлях, в противоположность гидрофобным остаткам. Остатки, которые являются потенциальным источником нестабильности и гетерогенности, также подвергали мутации, даже если они обнаруживались в CDR. Сюда включаются доступные метионины, поскольку образование сульфоксида может быть следствием взаимодействия с кислородными радикалами, протеолитическое расщепление кислото-неустойчивых связей, например в дипептиде Asp-Pro (Drug Dev Res (2004) 61:137-154), сайты деамидирования, присутствующие в доступном остатке аспарагина, за которым следует небольшая по размерам аминокислота, например Gly, Ser, Ala, His, Asn или Cys (J Chromatog (2006) 837:35-43), а также сайты N-гликозилирования, например сайт Asn-X-Ser/Thr. Как правило, доступные метионины будут замещаться лейцинами, доступны аспарагины будут замещаться глутамином или аспартатом, или же будет замещаться следующий за ними остаток. В случае сайта гликозилирования (Asn-X-Ser/Thr) будет заменяться либо Asn, либо остаток Ser/Thr.
Результирующая композитная последовательность проверяется на предмет присутствия известных эпитопов В-клеток или линейных эпитопов Т-клеток. Поиск проводится, например, по общедоступной базе данных иммунных эпитопов (IEDB). Если внутри композитной последовательности обнаруживается известный эпитоп, ищется другой набор последовательностей человека, внутри которых производится замещение.
В отличие от предложенного в патенте США № 5639641 метода изменения поверхности (resurfacing), в предлагаемом способе учитываются также иммуногенные ответы, опосредованные В- и Т-клетками. Способ также позволяет обойти проблему потери активности, которая иногда наблюдается в случае вставок в CDR (патент США № 5530101). Кроме того, в процессе инженерии и селекции также учитываются аспекты стабильности и растворимости, что позволяет создать антитело, оптимизированное в плане низкой иммуногенности, высокой аффинности к антигену и более приемлемых биофизических характеристик.
Стратегии и способы изменения поверхности антител, а также другие методы снижения иммуногенности антител в различных организмах хозяина изложены, например, в патенте США № 5639641. В целом в рамках предпочтительного способа: (1) проводится сопоставление положений набора вариабельных областей тяжелых и легких цепей антитела, с тем чтобы определить доступные поверхностные положения тяжелой и легкой цепи вариабельной области остовной последовательности, при этом сопоставленные положения для всех вариабельных областей должны быть по крайней мере примерно на 98% идентичны; (2) определяется набор нечеловеческих доступных поверхностных аминокислотных остатков тяжелых и легких цепей вариабельной области остовной последовательности, например, для антитела грызунов (или его фрагмента); (3) определяется набор доступных поверхностных аминокислотных остатков тяжелых и легких цепей вариабельной области остовной последовательности, который наиболее близок набору доступных поверхностных аминокислотных остатков грызунов; и (4) набор доступных поверхностных аминокислотных остатков тяжелых и легких цепей вариабельной области остовной последовательности, идентифицированный на этапе (2), заменяется набором доступных поверхностных аминокислотных остатков тяжелых и легких цепей вариабельной области остовной последовательности, идентифицированным на этапе (3), за исключением тех аминокислотных остатков, которые размещаются в пределах 5Å от любого атома любого остатка CDR антитела грызунов, с тем чтобы получить гуманизированное антитело, например антитело грызунов, сохраняющее специфичность связывания.
Антитела могут гуманизироваться на основе множества других методик, в том числе вставки в CDR (EPO 0239400; WO 91/09967; а также патенты США №№ 5530101 и 5585089), изменения поверхности антител или восстановления поверхностного доступа (EPO 0592106; EPO 0519596; Padlan, 1991, Molec Imm 28(4/5):489-498; Studnicka et al., 1994, Prot Eng 7(6):805-814; и Roguska et al., 1994, PNAS 91:969-973) и перестановки в цепи (патент США № 5565332). Антитела человека могут приготовляться с применением различных методов, известных специалистам в данной области, в том числе, среди прочих, методов фаг-дисплея, см. патенты США №№ 4444887, 4716111, 5,545,806 и 5814318; и WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741, с использованием трансгенных животных, например грызунов, с использованием химерных клеток и т.п.
Термины «гомолог антитела» или «гомолог» относятся к любой молекуле, которая специфическим образом связывает IL-4 и (или) IL-13 в соответствии с содержанием настоящего документа. Таким образом, к гомологам антитела относятся нативное или рекомбинантное антитело, модифицированное или немодифицированное; части антитела, которые сохраняют представляющие интерес биологические свойства; например связывание IL-4 или IL-13; например молекулы Fab или Fv; одноцепочечное антитело; полипептид, содержащий одну или несколько областей CDR и т.п. Аминокислотная последовательность гомолога необязательно должна быть идентична последовательности существующего в природе антитела, но может быть изменена или модифицирована включением замещающих аминокислот, введенных аминокислот, удаленных аминокислот, аминокислот, не входящих в число двадцати, которые встречаются в белках, и т.п., с тем чтобы получить полипептид с улучшенными или иными полезными свойствами.
Антителами с гомологичными последовательностями называют антитела с аминокислотными последовательностями, которые обладают гомологией последовательности с аминокислотными последовательностями антитела IL-4, IL-13 или биспецифического антитела IL-4/IL-13 настоящего изобретения. Предпочтительно, гомология существует с аминокислотной последовательностью вариабельных областей антитела настоящего изобретения. «Гомология последовательности» относится к последовательности аминокислот настоящего документа, которая определяется как последовательность с гомологией примерно 90%, 91%, 92%, 93%, 94% или выше и, более предпочтительно, с гомологией по крайней мере около 95%, 96%, 97%, 98% или 99% по отношению к другой последовательности аминокислот, которая определяется, например, по методу поиска FASTA в соответствии с Pearson & Lipman, Proc Natl Acad Sci USA 85, 2444-2448 (1988).
Химерным антителом называют антитело, содержащее различные части антитела, полученного из различных источников, таких как различные антитела, различные классы антител, различные виды животных, например антитела, имеющие вариабельную область, полученную из мышиного моноклонального антитела, соединенные с константной областью иммуноглобулина человека и т.п. Таким образом, гуманизированное антитело представляет собой вид химерного антитела. Методы приготовления химерных антител известны специалистам в данной области, см., например, Morrison, 1985, Science 229:1202; Oi et al., 1986, BioTechniques 4:214; Gillies et al., 1989, J Immunol Methods 125:191-202; и патенты США №№ 5807715, 4816567 и 4816397.
К искусственным антителам относятся фрагменты scFv, химерные антитела, диатела, триатела, тетратела и mru (см. обзоры Winter & Milstein, 1991, Nature 349:293-299; и Hudson, 1999, Curr Opin Imm 11:548-557), каждое из них обладает способностью связывать антиген или эпитоп. В одноцепочечном фрагменте Fv (scFv), домены VH и VL антитела связаны гибким пептидом. Обычно линкер представляет собой пептид длиной около 15 аминокислот. Если линкер существенно меньше, например длиной в 5 аминокислот, образуются диатела. Наименьшей связывающей единицей антитела является CDR, как правило CDR2 тяжелой цепи, которая обладает достаточной способностью к распознаванию и связыванию. Такой фрагмент называют молекулярной областью распознавания, или mru. Несколько таких mru могут быть связаны вместе с короткими линкерными пептидами, тем самым, образуя искусственный связывающий белок с более высокой авидностью по сравнению с отдельным mru.
В сферу охвата настоящего изобретения также включаются функциональные эквиваленты рассматриваемого антитела. Термин «функциональные эквиваленты» включает, например, антитела с гомологичными последовательностями, гомологи антител, химерные антитела, искусственные антитела и модифицированные антитела, например те, в которых каждый функциональный эквивалент определяется способностью связываться с IL-4 и (или) IL-13, ингибируя способность или функцию IL-4 и (или) IL-13 передавать сигнал, или ингибируя связывание IL-4 и (или) IL-13 с его рецептором. Опытному специалисту в данной области будет очевидно частичное наложение терминов, обозначающих группы молекул, «фрагменты антител» и «функциональные эквиваленты». Методы приготовления функциональных эквивалентов, которые сохраняют способность к связыванию IL-4 и (или) IL-13, известны квалифицированным специалистам в данной области и изложены, например, в WO 93/21319, EPO Ser. No. 239400, WO 89/09622, EPO Ser. No. 338745 и EPO Ser. No. 332424.
К функциональным эквивалентам настоящей заявки также относятся модифицированные антитела, например антитела, модифицированные за счет ковалентной связи молекулы любого типа с антителом. Например, к модифицированным антителам относятся антитела, которые были модифицированы, например гликозилированием, ацетилированием, PEGилированием, деамидированием, фосфорилированием, амидированием, введением известных защитных/блокирующих групп, протеолитическим расщеплением, связью с клеточным лигандом, связью с токсином или цитотоксической группой или другим белком и т.п. Ковалентное связывание необязательно приводит к антителу, которое защищено от формирования анти-идиотипического отклика. Модификация может проводиться с использованием известных методик, в том числе, среди прочих, специфического химического расщепления, ацетилизирования, формилирования, метаболического синтеза и т.п. Кроме того, модифицированные антитела могут содержать одну или несколько неклассических аминокислот.
Рядовым специалистам в данной области известно множество методик, которые позволяют проводить оптимизацию аффинности связывания. Как правило, такие методики включают замещение различных аминокислотных остатков в рассматриваемом сайте с последующим скрининговым анализом аффинности связывания мутантного полипептида с когнатным антигеном или эпитопом.
После идентификации и выделения антитела часто бывает полезно получить вариант или мутант антитела, или мутеин, где изменены один или несколько аминокислотных остатков, например, в одной или нескольких гипервариабельных областей антитела. В альтернативном варианте или дополнительно в структуру антитела может быть внесено одно или несколько изменений (например, замещений) в остатках остовной последовательности, что приводит к улучшению аффинности связывания мутанта антитела с IL-4 и (или) IL-13. Примерами остатков остовной области, которые могут быть модифицированы, являются те, которые напрямую нековалентно связывают антиген (Amit et al., Science 233:747-753 (1986)); взаимодействуют с конформацией CDR или влияют на нее (Chothia et al., J Mol Biol 196:901-917 (1987)); и (или) входят в состав интерфейса VL-VH (EP 239 400). В некоторых примерах осуществления модификация одного или нескольких таких остатков остовной области приводит к улучшению аффинности связывания антитела с когнатным антигеном. Например, в настоящем примере осуществления изобретения могут меняться от одного до примерно пяти остатков остовной области. Иногда этого может быть достаточно, чтобы получить мутант антитела, пригодный для использования в доклинических испытаниях, даже если не вносились изменения ни в один из остатков гипервариабельной области. Однако, как правило, мутант антитела может включать одно или несколько изменений гипервариабельной области. Константные области также могут меняться, с тем, чтобы добиться желаемых или более желаемых эффекторных свойств.
Остатки гипервариабельной области, которые подвергаются замещению, могут изменяться случайным образом, особенно, если исходная аффинность связывания исходного антитела такова, что случайным образом получаемые мутанты антител могут легко анализироваться в процессе скрининга на изменение связывания по методике анализа, приведенной в настоящем документе.
Одним из методов получения мутантов антител, например мутантов CDR, является «мутагенез сканирования аланина» (Cunningham & Wells, Science 244:1081-1085 (1989); и Cunningham & Wells, Proc Nat Acad Sci USA 84:6434-6437 (1991)). Один или несколько остатков гипервариабельной области заменяются аланиновыми или полиаланиновыми остатками. Такой остаток (остатки) гипервариабельной области, который проявляет функциональную чувствительность к замещениям, затем модифицируют, вводя дальнейшие или другие мутации в сайтах замены. Таким образом, несмотря на то, что сайт для введения вариации последовательности аминокислоты предопределен, сам по себе характер мутации необязательно заранее задан. Можно попытаться ввести аналогичные замещения с другими аминокислотами, в зависимости от желательных свойств сканируемых остатков.
Более систематический метод идентификации аминокислотных остатков для модификации включает выбор остатков гипервариабельной области, задействованных в связывании IL-4 и (или) IL-13, а также тех остатков гипервариабельной области, которые слабо участвуют или не задействованы в связывании IL-4 и (или) IL-13. Проводится аланиновое сканирование остатков несвязывающей гипервариабельной области, причем каждый Ala мутант проходит тестирование на улучшение связывания с IL-4 и (или) IL-13. В другом примере осуществления для модификации выбирается тот остаток (остатки), которые существенным образом задействованы в связывании IL-4 и (или) IL-13. Модификация может предусматривать делецию остатка или введение одного или нескольких остатков в непосредственной близости от рассматриваемого остатка. Однако, как правило, модификация предусматривает замену остатка другой аминокислотой. Первая замена может быть консервативной. Если такая замена приводит к изменению биологической активности (например, аффинности связывания), тогда можно провести следующую консервативную замену, чтобы узнать, удалось ли добиться более существенных изменений.
Еще более значимое изменение в линии антител и проявлении биологических свойств может быть достигнуто при выборе аминокислоты, которая более заметно отличается по свойствам от той, которая обычно присутствует на этом сайте. Поэтому такое замещение может производиться при одновременном сохранении: (a) структуры полипептидного остова в зоне замены, например в виде листа или спиральной конформации; (б) заряда или гидрофобности молекулы в мишеневом сайте, или (в) объема боковой цепи.
Например, встречающиеся в природе аминокислоты могут быть подразделены на группы на основе общих свойств боковой цепи:
(1) гидрофобные: метионин (M или Met), аланин (A или Ala), валин (V или Val), лейцин (L или Leu) и изолейцин (I или Ile);
(2) нейтральные, гидрофильные: цистеин (C или Cys), серин (S или Ser), треонин (T или Thr), аспарагин (N или Asn) и глутамин (Q или Gln);
(3) кислые: аспарагиновая кислота (D или Asp) и глутаминовая кислота (E или Glu);
(4) основные: гистидин (H или His), лизин (K или Lys) и аргинин (R или Arg);
(5) остатки, которые влияют на ориентацию цепи: глицин (G или Gly) и пролин (P или Pro);
(6) ароматические: триптофан (W или Trp), тирозин (Y или Tyr) и фенилаланин (F или Phe).
Под неконсервативными замещениями может подразумеваться замена одной из аминокислот на аминокислоту из другой группы. Под консервативными замещениями может пониматься замена одной аминокислоты на другую внутри одной группы.
К предпочтительным замещениям аминокислот относятся такие, которые: (1) снижают подверженность протеолизу, (2) уменьшают склонность к окислению, (3) изменяют аффинность связывания и (4) обеспечивают или изменяют другие физико-химические или функциональные свойства таких аналогов. Среди аналогов могут присутствовать различные мутеины с последовательностью, отличающейся от существующей в природе пептидной последовательности. Например, единичные или множественные замены аминокислот (предпочтительно консервативные замены аминокислот) могут производиться в существующей в природе последовательности (предпочтительно в части полипептида за пределами домена (доменов), ответственного за межмолекулярные контакты). Консервативная замена аминокислот не должна существенно изменять структурные характеристики исходной последовательности (например, замена аминокислоты обычно не должна приводить к нарушению спиральной конформации, которая присутствовала в исходной последовательности, или же нарушать другие элементы вторичной структуры, которые характеризуют исходную последовательность), исключением являются изменения общего объема или изменения конформации R-группы или боковой цепи, Proteins, Structures and Molecular Principles (Creighton, ed., W. H. Freeman and Company, New York (1984)); Introduction to Protein Structure (Branden & Tooze, eds., Garland Publishing, New York, N. Y. (1991)); и Thornton et al. Nature 354:105 (1991).
Обычно мутант антитела с улучшенными биологическими свойствами будет иметь аминокислотную последовательность, которая по крайней мере на 75% идентична или подобна аминокислотной последовательности тяжелой или легкой цепи вариабельного домена исходного античеловеческого антитела IL-4 и (или) IL-13, или обладает по крайнем мере 80%-ной, по крайней мере 85%-ной, по крайней мере 90%-ной и часто по крайней мере 95%-ной идентичностью. Идентичность или подобие в отношении последовательности исходного антитела определяется в настоящем документе как процент аминокислотных остатков в последовательности кандидата, которые идентичны (то есть тот же остаток) или подобны (то есть аминокислотный остаток из той же группы, исходя из близких свойств боковой цепи, см. выше) остаткам исходного антитела после сопоставления последовательностей и введения пропусков, если необходимо, для обеспечения максимального процента идентичности последовательности.
В альтернативном варианте мутанты антитела могут быть получены систематической мутацией областей FR и CDR тяжелой и легкой цепей или же области Fc антитела анти-IL-4, анти-IL-13 или биспецифического антитела IL-4/IL-13. Другой метод получения мутантов антитела включает использование созревания аффинности с помощью фаг-дисплея (Hawkins et al., J Mol Biol 254:889-896 (1992) и Lowman et al., Biochemistry 30(45):10832-10838(1991)). Слитые белки оболочки бактериофага (Smith, Science 228:1315 (1985); Scott & Smith, Science 249:386 (1990); Cwirla et al. Proc Natl Acad Sci USA 8:309 (1990); Devlin et al. Science 249:404 (1990); Wells & Lowman, Curr Opin Struct Biol 2:597 (1992); и патент США № 5223409) известны как удобные объекты для связывания фенотипа белков или пептидов дисплея с генотипом частиц бактериофага, которые их кодируют. При использовании фаг-дисплея также отображаются домены Fab антител (McCafferty et al., Nature 348: 552 (1990); Barbas et al. Proc Natl Acad Sci USA 88:7978 (1991); и Garrard et al. Biotechnol 9:1373 (1991)).
Моновалентный фаг-дисплей предусматривает отображение набора вариантов белка в форме слитых белков с белком оболочки бактериофага на частицах фага (Bass et al., Proteins 8:309 (1990). Созревание аффинности, или улучшение равновесной аффинности связывания различных белков, ранее достигалось посредством последовательного применения мутагенеза, моновалентного фаг-дисплея и функционального анализа (Lowman & Wells, J Mol Biol 234:564 578 (1993); и патент США № 5534617), например, особое внимание уделялось областям CDR антител (Barbas et al., Proc Natl Acad Sci USA 91:3809 (1994); и Yang et al., J Mol Biol 254:392 (1995)).
Библиотеки множества (например, 106 или более) вариантов белков, которые отличаются в определенных положениях последовательности, можно построить на частицах бактериофагов, каждая из которых содержит ДНК, кодирующую определенный вариант белка. После циклов аффинной очистки с использованием иммобилизированного антигена, изолируют отдельные клоны бактериофагов и на основании ДНК определяют аминокислотную последовательность отображаемого белка.
После получения мутанта антитела можно определить биологическую активность данной молекулы по сравнению с исходным антителом, в соответствии со сведениями, изложенными в настоящем документе. Как отмечалось выше, для этого может потребоваться определить аффинность связывания и (или) иную биологическую активность или физические свойства антитела. В предпочтительном осуществлении настоящего изобретения готовится набор мутантов антитела с последующим скринингом аффинности связывания для антигена. Один или несколько мутантов антитела, выбираемых по результатам скрининга, могут дополнительно проверяться с использованием одного или нескольких других методов анализа биологической активности, с тем, чтобы подтвердить, что мутант (мутанты) антитела обладает новыми или улучшенными свойствами. В предпочтительных примерах осуществления мутант антитела сохраняет способность связывания IL-4 и (или) IL-13 с аффинностью связывания, близкой или лучшей/более высокой по сравнению с характеристиками исходного антитела.
Отобранный таким образом мутант (мутанты) антитела может подвергаться дальнейшим модификациям, которые часто зависят от предполагаемого использования антитела. Такие модификации могут включать дальнейшее изменение аминокислотной последовательности, слияние с гетерологическим полипептидом (полипептидами) и (или) ковалентные модификации. Например, остаток цистеина, который не задействован в сохранении надлежащей конформации мутанта антитела, может замещаться, как правило, на серин, с тем чтобы улучшить устойчивость молекулы к окислению и предупредить образование аберрантных сшивок. Напротив, цистеин может вводиться в структуру антитела, с тем, чтобы улучшить его стабильность (особенно, если в качестве антитела выбирается фрагмент антитела, например, фрагмент Fv).
Другой тип мутанта антитела имеет измененную структуру гликозилирования. С этой целью могут удаляться одна или несколько углеводных групп, присутствующих в антителе, и (или) добавляться один или несколько сайтов гликозилирования, которых нет в молекуле антитела. Гликозилирование антител, как правило, либо N-связано с Asn, либо O-связано с Ser или Thr. Трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X - любая аминокислота, кроме пролина, являются распространенными последовательностями распознавания для ферментативного связывания углеводной группы с боковой цепью аспарагина. N-ацетилгалактозамин, галактоза, фукоза или ксилоза, например, связываются с гидроксиаминокислотой, как правило с серином или треонином, хотя может использоваться и 5-гидроксипролин или 5-гидроксилизин. Добавление или замещение одного или нескольких остатков серина или треонина к последовательности исходного антитела может повысить вероятность O-связанного гликозилирования.
Возможно, будет желательно модифицировать антитело настоящего изобретения в плане эффекторной функции, с тем чтобы повысить эффективность антитела. Например, в область Fc может вводиться остаток (остатки) цистеина, что обеспечивает возможность образования межцепочечной дисульфидной связи в этой области. Полученное таким образом гомодимерное антитело может характеризоваться более высокой способностью к интернализации и (или) комплемент-зависимому лизису и антителозависимой клеточной цитотоксичности (ADCC), см. Caron et al., J Exp Med 176:1191-1195 (1992) и Shopes, Immunol 148:2918-2922 (1993). В альтернативном варианте может быть сконструировано антитело, которое имеет двойные области Fc и поэтому может обеспечивать повышенные комплемент-зависимый лизис и способность к ADCC, см. Stevenson et al., Anti-Cancer Drug Design 3: 219 230 (1989).
Ковалентные модификации антитела включаются в охват настоящего изобретения. Они могут проводиться посредством химического синтеза или, если возможно, ферментативного или химического расщепления антитела. Другие формы ковалентных модификаций антитела вводятся в молекулу посредством взаимодействия выбранных аминокислотных остатков антитела с органическим агентом, используемым для получения производных, который в состоянии реагировать с выбранными боковыми цепями или с N-концевым или C-концевым остатком.
Цистеинилиновые остатки могут реагировать с α-галоацетатами (и соответствующими аминами), например хлоруксусной кислотой или хлорацетамидом, с образованием карбоксиметильных или карбоксиамидометильных производных. Производные цистеинилиновых остатков также можно получать, например, путем реакции с бромтрифторацетоном, α-бром-β-(5-имидозоил)пропионовой кислотой, хлорацетилфосфатом, N-алкилмалеимидами, 3-нитро-2-пиридилдисульфидом, метил-2-пиридилдисульфидом, п-хлормеркурбензоатом, 2-хлормеркур-4-нитрофенолом или хлор-7-нитробензо-2-окса-1,3-диазолом.
Производные гистидинилиновых остатков могут быть получены по реакции с диэтилпирокарбонатом при pH 5,5-7,0. п-Бромфенацилбромид может также использоваться, реакцию предпочтительно проводить в 0,1 M растворе какодилата натрия при pH 6,0.
Лизинилиновые остатки и α-концевые остатки могут реагировать с янтарным ангидридом или с ангидридами других карбоновых кислот, с тем чтобы изменить заряд остатков. К другим удобным реагентам для получения производных α-аминосодержащих остатков относятся имидоэфиры, например метилпиколинимидат, пиридоксальфосфат, пиридоксаль, хлорборогидрид, тринитробензолсульфоновая кислота, O-метилизомочевина и 2,4-пентандион, и аминокислота может катализироваться трансаминазой в присутствии глиоксилата.
Остатки аргинина могут модифицироваться по реакции с одним или несколькими стандартными реагентами, например фенилглиоксалем, 2,3-бутандионом, 1,2-циклогександионом и нингидрином. Для получения производных в случае остатков аргинина часто требуется проводить реакцию в щелочной среде. Кроме того, реагенты могут взаимодействовать с лизином, а также с ε-аминогруппой аргинина.
Специфическая модификация остатков тирозина может производиться с помощью ароматических диазониевых соединений или тетранитрометана. Например, N-ацетилимидазол и тетранитрометан используются для образования O-ацетилтирозильных соединений и 3-нитропроизводных, соответственно. Остатки тирозина могут йодироваться с использованием 125I или 131I, чтобы получить меченые белки для применения в радиоиммунологическом анализе.
Карбоксильные боковые группы (аспартил или глутамил) могут быть модифицированы по реакции с карбодиимидами (R-N=C=C-R'), где R и R' могут быть различными алкильными группами, например 1-циклогексил-3-(2-морфолинил-4-этил)карбодиимид или 1-этил-3-(4-азоний-4,4-диметилпентил)карбодиимид. Кроме того, остатки аспартила и глутамила могут быть трансформированы в аспарагинилиновые и глутаминилиновые остатки по реакции с ионами аммония.
Глутаминилиновые и аспарагинилиновые остатки часто деамидируют до соответствующих глутамильных и аспартильных остатков, соответственно, в нейтральной или основной среде. Деамидированная форма таких остатков входит в сферу охвата настоящего изобретения.
К другим модификациям относится гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп остатков серинил или треонил, метилирование α-аминогрупп боковых цепей лизина, аргинина и гистидина (Creighton, Proteins: Structure and Molecular Properties, W.H. Freeman & Co., San Francisco, pp. 79-86 (1983)), ацетилирование N-концевого амина и амидирование любой C-концевой карбоксильной группы.
Другая форма ковалентной модификации представляет собой химическое или ферментативное связывание гликозидов с антителом. Такие процедуры не требуют продукции антител в клетке-хозяине, которая проявляет гликозилирующие свойства в N-связанном или O-связанном гликозилировании. В зависимости от использованного метода сочетания сахар (сахара) могут связываться с: (a) аргинином и гистидином; (б) свободными карбоксильными группами; (в) свободными сульфгидрильными группами, например цистеина; (г) свободными гидроксильными группами, например серина, треонина или гидроксипролина; (д) ароматическими остатками, например фенилаланина, тирозина или триптофана; или (е) амидной группой глутамина. Подобные методы описаны в WO 87/05330 и в Aplin & Wriston, CRC Crit Rev Biochem, pp. 259-306 (1981).
Удаление любой углеводной группы, присутствующей в структуре антитела, может осуществляться химическим или ферментативным способом. Например, для химического дегликозилирования может потребоваться подействовать на антитело таким реагентом, как трифторметансульфоновая кислота или равноценным соединением, что приводит к расщеплению большинства или всех сахаров, кроме связывающего сахара (N-ацетилглюкозамин или N-ацетилгалактозамин), при этом антитело остается интактным. Химическое дегликозилирование описано, например, в Hakimuddin et al. Arch Biochem Biophys 259:52 (1987) и в Edge et al., Anal Biochem 118:131 (1981). Ферментативное расщепление углеводных групп на антителах может осуществляться посредством любой из множества эндогликозидаз и экзогликозидаз, как это описано, например, в Thotakura et al., Meth Enzymol 138:350 (1987).
Другая форма ковалентной модификации антитела включает связывание антитела с одним из множества небелковых полимеров, например полиэтиленгликолем, полипропиленгликолем или полиоксиалкиленами, на основе метода, приведенного в патентах США №№ 4640835; 4496689; 4301144; 4670417; 4791192 или 4179337.
Другая предпочтительная методика получения мутантов или мутеинов представляет собой созревание аффинности с помощью фаг-дисплея (Hawkins et al., J Mol Biol 254:889-896 (1992) и Lowman et al., Biochemistry 30(45):10832-10838(1991)). Вкратце, проводится мутация нескольких сайтов гипервариабельной области (например, 6-7 сайтов), чтобы получить все возможные аминокислотные замещения на каждом сайте. Полученные таким образом мутанты антитела моновалентно проявляются на частицах фага как слитые с белком, находящимся на частицах. Фаг, экспрессирующий различные мутанты, может проходить цикл процедур селекции связывания с последующим выделением и секвенированием тех мутантов, которые демонстрируют высокую аффинность.
Метод селекции новых связывающих полипептидов может опираться на использование библиотеки структурно связанных полипептидов. Библиотека структурно связанных полипептидов, например слитых с белком оболочки фага, получается посредством мутагенеза и проявляется на поверхности частицы. Затем частицы вступают в контакт с молекулой-мишенью, и частицы с самой высокой аффинностью к мишени отделяются от обладающих более низкой аффинностью. Связывающиеся с высокой аффинностью частицы затем амплифицируются посредством инфицирования подходящего бактериального хозяина, и стадию конкурентного связывания повторяют. Процесс повторяют, до тех пор пока не будут получены полипептиды с желаемой аффинностью.
В альтернативном варианте мультивалентный фаг (McCafferty et al. (1990) Nature 348:552-554; и Clackson et al. (1991) Nature 352:624-628) может также использоваться для экспрессии случайных точечных мутаций (например, полученных в результате использования допускающей ошибки ДНК-полимеразы) для получения фаговой библиотеки фрагментов антител, которые затем могут подвергаться скринингу для проверки аффинности к IL-4 и (или) IL-13, Hawkins et al., (1992) J Mol Biol 254:889-896.
Предпочтительно, чтобы в процессе созревания аффинности реплицируемый вектор экспрессии оставался под строгим контролем управляющего элемента транскрипции, а условия культивирования корректировались таким образом, чтобы количество или число частиц, несущих более одной копии слитого белка, было менее примерно 1%. Кроме того, предпочтительно, чтобы количество частиц, несущих более одной копии слитого белка, было менее 10% от количества частиц, несущих единственную копию слитого белка. Предпочтительно, чтобы такое количество было менее 20%.
Функциональные эквиваленты могут получаться заменой различных CDR в различных цепях антител в остовной или композитной FR, полученной от многих антител. Так, например, возможно получить различные классы антител для заданного набора CDR посредством замещения различных тяжелых цепей, например IgG1-4, IgM, IgA1-2 или IgD, с тем чтобы получить различающиеся типы и изотипы антител IL-4 и (или) IL-13. Аналогичным образом, искусственные антитела, входящие в сферу охвата настоящего изобретения, могут быть получены посредством включения заданного набора CDR в полностью синтетическую остовную область.
К фрагментам антител и функциональным эквивалентам настоящего изобретения относятся такие молекулы, которые обладают регистрируемым уровнем связывания с IL-4 и (или) IL-13. Регистрируемый уровень связывания включает все значения в диапазоне по крайней мере 10-100%, предпочтительно по крайней мере 50%, 60% или 70%, более предпочтительно по крайней мере 75%, 80%, 85%, 90%, 95% или 99% способности связывания представляющего интерес антитела. В сферу охвата настоящего изобретения также включаются эквиваленты с аффинностью более 100% по сравнению с рассматриваемым антителом.
CDR обычно имеют большое значение для распознавания эпитопов и связывания антитела. При этом, однако, могут вноситься изменения в остатки, которые входят в состав CDR, с одновременным отсутствием воздействия на способность антитела распознавать когнатный эпитоп и связываться с ним. Например, могут вноситься изменения, которые не оказывают воздействия на распознавание эпитопов, но тем не менее повышают аффинность связывания антитела с эпитопом. В ряде исследований приводится обзор эффектов замены одной или нескольких аминокислот в различных положениях последовательности антитела, исходя из знаний о первичной последовательности антитела, на их свойства, например связывание и уровень экспрессии (Yang et al., 1995, J Mol Biol 254:392-403; Rader et al., 1998, Proc Natl Acad Sci USA 95:8910-8915; и Vaughan et al., 1998, Nature Biotechnology 16, 535-539).
Таким образом, эквиваленты рассматриваемого антитела могут быть получены изменением последовательностей генов тяжелой и легкой цепей в CDR1, CDR2 или CDR3, или в остовных областях с помощью таких методов, как олигонуклеотид-опосредованный сайт-направленный мутагенез, кассетный мутагенез, ПЦР пониженной точности, перестановка в ДНК или штаммы мутатора E. coli (Vaughan et al., 1998, Nat Biotech 16:535-539; и Adey et al., 1996, Chap. 16, pp. 277-291, в Phage Display of Peptides and Proteins, eds. Kay et al., Academic Press). Методы изменения последовательности нуклеиновой кислоты первичного антитела могут приводить к образованию антител с повышенной аффинностью (Gram et al., 1992, Proc Natl Acad Sci USA 89:3576-3580; Boder et al., 2000, Proc Natl Acad Sci USA 97:10701-10705; Davies & Riechmann, 1996, Immunotech 2:169-179; Thompson et al., 1996, J Mol Biol 256:77-88; Short et al., 2002, J Biol Chem 277:16365-16370; и Furukawa et al., 2001, J Biol Chem 276:27622-27628).
Повторяющиеся циклы «полипептидной селекции» могут применяться для отбора систем со все более высокой аффинностью связывания, например посредством селекции изменений нескольких аминокислот, которые отбираются в ходе множества циклов селекции. После первого цикла селекции, включающего первую область селекции аминокислот в лиганде или полипептиде антитела, проводятся дополнительные циклы селекции в других областях или аминокислотах лиганда. Циклы селекции повторяются до достижения желаемых характеристик аффинности.
К улучшенным антителам также относятся антитела, обладающие более совершенными характеристиками, приготовленные с использованием стандартных методик иммунизации животных, образования гибридом и селекции антител с определенными характеристиками.
Термин «антагонист» относится к молекуле, способной ингибировать одно или несколько проявлений биологической активности молекулы-мишени, например передачу сигнала IL-4 и (или) IL-13. Антагонист может препятствовать связыванию рецептора с лигандом и наоборот, выводя из строя или уничтожая клетки, активируемые лигандом, и (или) блокируя активацию рецептора или лиганда (например, активацию тирозинкиназы), или передачу сигнала после связывания лиганда с рецептором. Антагонист в состоянии полностью блокировать взаимодействие рецептор-лиганд или может существенно подавлять такие взаимодействия.
Термин «агонист» относится к соединению, включающему белок, полипептид, пептид, антитело, фрагмент антитела, конъюгат, большую молекулу, малую молекулу, которое активирует одно или несколько проявлений биологической активности IL-4 и (или) IL-13. Агонисты могут вмешиваться в связывание рецептора с лигандом и наоборот, действуя в качестве митогена клеток, активируемых лигандом, и (или) препятствуя инактивации клеток или ингибированию сигнала после связывания лиганда с рецептором. Для целей настоящего изобретения все подобные аспекты воздействия агониста считаются эквивалентными.
Используемые в настоящем документе термины «клетка», «линия клеток» и «клеточная культура» включают их потомство. Также подразумевается, что все потомство не может быть в точности идентичным, например по содержанию ДНК, вследствие намеренных или случайных мутаций. Сюда входит вариант потомства, который обладает такими же функциями или представляющей интерес биологической характеристикой, для которых проводится скрининг в исходных клетках.
Термин «вектор» означает конструкцию нуклеиновой кислоты, носитель, содержащий нуклеиновую кислоту, трансген, чужеродный ген или представляющий интерес ген, который может быть функционально связан с подходящими контрольными последовательностями для экспрессии трансгена в организме подходящего хозяина. К таким контрольным последовательностям, например, относятся промотор для проведения транскрипции, дополнительная операторная последовательность для контроля такой транскрипции, последовательность, кодирующая подходящие сайты связывания мРНК на рибосоме, а также последовательности, которые контролируют остановку транскрипции и трансляции. Вектором может быть плазмида, частица фага или просто потенциальная геномная вставка. После трансформации в подходящего хозяина вектор может реплицироваться и функционировать независимо от генома хозяина, или может в некоторых случаях интегрироваться в геном клетки-хозяина. В приведенном описании термины «плазмида» и «вектор» используются равнозначно, поскольку плазмида является широко применяемой формой вектора. Вместе с тем предполагается, что изобретение включает такие другие формы векторов, которые выполняют эквивалентные функции носителей, которые известны или становятся известны специалистам в данной области, например вирусы, синтетические молекулы, которые содержат нуклеиновые кислоты, липосомы и т.п.
Под «млекопитающим» для целей лечения понимается любое животное, классифицируемое как млекопитающее, в том числе человек, домашние и сельскохозяйственные животные, нечеловекообразные приматы, а также животные из зоопарков, спортивные или домашние животные, например собаки, лошади, кошки, коровы и т.п.
Представляющие интерес антитела могут подвергаться скринингу или могут использоваться в методах анализа, которые описаны в настоящем документе или известны специалистам в данной области. Часто для таких анализов требуется реагент, который может обнаруживаться доступными методами, например содержащий метку. Используемый в настоящем документе термин «метка» относится к детектируемому соединению или составу, который напрямую или косвенно может конъюгироваться с молекулой или белком, например антителом. Метка может быть сама по себе детектируемой (например, радиоизотопные метки или флуоресцентные метки) или, в случае ферментативной метки, может катализировать химические изменения субстрата или состава, которые поддаются детектированию.
Используемый в настоящем документе термин «твердая фаза» означает неводную матрицу, к которой может прикрепляться структура или молекула, например антитело настоящего изобретения. Примерами твердых фаз, входящих в сферу охвата настоящего изобретения, являются полностью или частично образованные из стекла (например, стекла с контролируемой пористостью), полисахариды (например, агароза), полиакриламиды, полистирол, поливиниловый спирт и силиконы. В некоторых примерах осуществления, в зависимости от контекста, твердая фаза может представлять собой лунку в аналитическом планшете; в иных случаях она может использоваться в колонке для очистки (например, в колонке для аффинной хроматографии). Таким образом, твердой фазой может быть бумага, гранулы, пластиковая поверхность, чип и т.п., она может быть изготовлена из самых различных материалов, например нитроцеллюлозы, агарозы, полистирола, полипропилена, силикона и т.п., а также может иметь самые различные конфигурации.
Как известно специалистам в данной области, ген или кДНК, кодирующие IL-4 и IL-13, могут клонироваться в плазмиду или другой вектор экспрессии и экспрессироваться в рамках любой из нескольких систем экспрессии в соответствии с методами, хорошо известными квалифицированным специалистам в данной области, см., например, ниже.
Молекулы нуклеиновых кислот, кодирующие аминокислотную последовательность мутантов, могут быть получены с помощью самых различных методов, известных специалистам в данной области. К таким методам, среди прочих, относятся олигонуклеотидный (или сайт-направленный) мутагенез, ПЦР-мутагенез и кассетный мутагенез ранее приготовленного мутированного или немутированного варианта рассматриваемой молекулы (см., например, Kunkel, Proc Natl Acad Sci USA 82:488 (1985)).
Рекомбинантная экспрессия антитела настоящего изобретения или его фрагмента, производного или аналога (например, тяжелой или легкой цепи антитела настоящего изобретения, одноцепочечного антитела настоящего изобретения или антитела мутеина настоящего изобретения) подразумевает конструирование вектора экспрессии, содержащего полинуклеотид, который кодирует антитело или фрагмент антитела, как описано в настоящем документе. После получения полинуклеотида, кодирующего молекулу антитела, можно приготовить вектор для продукции антитела, используя технологию рекомбинантной ДНК, известную специалистам в данной области. Конструируется вектор экспрессии, содержащий кодирующие антитело последовательности, а также соответствующие маркеры контроля транскрипции и трансляции. К таким методам относятся, например, методики рекомбинантной ДНК in vitro, синтетические методики и генетическая рекомбинация in vivo.
Вектор экспрессии переносится в клетку-хозяин с помощью стандартных методик, и трансфицированные клетки затем культивируют с помощью стандартных методик с целью получить антитело настоящего изобретения или его фрагмент. В одном из аспектов изобретения в клетке-хозяине может проводиться совместная экспрессия векторов, кодирующих тяжелую и легкую цепи, с тем чтобы обеспечить экспрессию всей молекулы иммуноглобулина, как это подробно описано в настоящем документе.
При экспрессии молекул антитела, представленных в настоящем изобретении, могут использоваться самые разнообразные системы хозяина/вектора экспрессии. Такие системы экспрессии представляют собой носители для получения и последующей очистки представляющих интерес кодирующих последовательностей, но также представляют собой клетки, которые при трансформации или трансфекции соответствующими кодирующими нуклеотидными последовательностями в состоянии экспрессировать молекулу антитела настоящего изобретения in situ. Бактериальные клетки, например E. coli, а также эукариотические клетки широко используются для экспрессии молекулы рекомбинантного антитела, особенно для экспрессии всей молекулы рекомбинантного антитела. Например, клетки млекопитающих, такие как клетки CHO, в сочетании с вектором, например, несущим основной элемент промежуточного раннего гена-промотера цитомегаловируса человека, являются эффективной системой экспрессии антител (Foecking et al., Gene 45:101 (1986); и Cockett et al., Bio/Technology 8:2 (1990)). Как известно специалистам в данной области, для приготовления представляющих интерес белков могут также использоваться растения и культуры растительных клеток, клетки насекомых и т.п.
Кроме того, может выбираться клетка-хозяин, которая модулирует экспрессию введенных последовательностей или модифицирует и обеспечивает процессинг генного продукта конкретным заданным образом. Подобные модификации (например, гликозилирование) и процессинг (например, расщепление) белковых продуктов могут иметь важное значение для функционирования белка. Различные клетки-хозяева обладают характерными и специфическими механизмами пост-трансляционного процессинга и модификации белков и генных продуктов. Подходящие линии клеток или системы хозяев могут выбираться для обеспечения необходимой модификации и процессинга экспрессированного представляющего интерес антитела. Следовательно, может использоваться эукариотическая клетка-хозяин, которая обладает клеточным аппаратом для надлежащего процессинга первичного транскрипта, гликозилирования и фосфорилирования генного продукта. К таким клеткам-хозяинам млекопитающих, среди прочих, относятся CHO, COS, 293, 3T3 или клетки миеломы.
Стабильная экспрессия является предпочтительной для долгосрочной высокопроизводительной продукции рекомбинантных белков. Например, могут быть сконструированы линии клеток, которые стабильно экспрессируют молекулу антитела. Вместо использования векторов экспрессии, которые содержат вирусные источники репликации, клетка-хозяин может быть трансформирована с помощью ДНК в условиях регулирования, которое обеспечивается соответствующими элементами контроля экспрессии (например, промотером, энхансером, последовательностями, терминаторами транскрипции, сайтами полиаденилирования и т.п.) и селектируемым маркером. После интродукции чужеродной ДНК сконструированным клеткам в течение одного или двух дней дают расти в обогащенной среде, затем их переносят в селективную среду. Селектируемый маркер в рекомбинантной плазмиде придает устойчивость по отношению к селекции и позволяет клетками стабильно интегрировать плазмиду в хромосому с последующим развитием в линию клеток. Такие сконструированные линии клеток удобны не только для продукции антител, но также пригодны для скрининга и оценки соединений, которые прямо или косвенно взаимодействуют с молекулой антитела.
Может использоваться ряд систем селекции, в том числе, среди прочих, тимидинкиназа вируса Herpes simplex (Wigler et al., Cell 11:223 (1977)), гипоксантин-гуанинфосфорибозилтрансфераза (Szybalska et al., Proc Natl Acad Sci USA 48:202 (1992)), селекция глутаматсинтазы в присутствии метионинсульфоксимида (Adv Drug Del Rev 58, 671, 2006, см. также веб-сайт или подборку литературы Lonza Group Ltd.), а также гены аденинфосфорибозилтрансферазы (Lowy et al., Cell 22:817 (1980)) в клетках tk, hgprt или aprt, соответственно. Также устойчивость к антиметаболитам может использоваться в качестве основы для селекции следующих генов: dhfr, который обеспечивает устойчивость к метотрексату (Wigler et al., Proc Natl Acad Sci USA 77:357 (1980); O'Hare et al., Proc Natl Acad Sci USA 78:1527 (1981)); gpt, который обеспечивает устойчивость к микофеноловой кислоте (Mulligan et al., Proc Natl Acad Sci USA 78:2072 (1981)); neo, который обеспечивает устойчивость к аминогликозиду, G-418 (Wu et al., Biotherapy 3:87 (1991)); hygro, который обеспечивает устойчивость к гигромицину (Santerre et al., Gene 30:147 (1984)). Методы, известные специалистам в данной области технологии рекомбинантной ДНК, могут стандартным образом применяться для селекции желаемого рекомбинантного клона, и такие методы описаны, например, в Ausubel et al., eds., Current Protocols in Molecular Biology, John Wiley & Sons (1993); Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press (1990); Dracopoli et al., eds., Current Protocols in Human Genetics, John Wiley & Sons (1994); и Colberre-Garapin et al., J Mol Biol 150:1 (1981).
Уровни экспрессии молекулы антитела могут быть повышены с помощью векторной амплификации (например, см. Bebbington et al., в DNA Cloning, Vol. 3. Academic Press (1987)). В случае возможности амплификации маркера в векторной системе, экспрессирующей антитело, увеличение уровня ингибитора, присутствующего в культуре, будет приводить к росту числа копий маркерного гена. Поскольку амплифицируемая область ассоциирована с геном антитела, продукция антитела будет также возрастать (Crouse et al., Mol Cell Biol 3:257 (1983)).
Клетка-хозяин может совместно трансфицироваться двумя или более векторами экспрессии настоящего изобретения, например первым вектором, кодирующим производный от тяжелой цепи полипептид, и вторым вектором, кодирующим производный от легкой цепи полипептид. Два вектора могут содержать идентичные селектируемые маркеры, которые обеспечивают равную экспрессию полипептидов тяжелой и легкой цепей. В качестве альтернативы может использоваться единичный вектор, который кодирует и в состоянии экспрессировать полипептиды как тяжелой, так и легкой цепей. В подобных случаях легкая цепь должна располагаться до тяжелой во избежание появления избытка токсичной свободной тяжелой цепи (Proudfoot, Nature 322:52 (1986); и Kohler, Proc Natl Acad Sci USA 77:2197 (1980)). Кодирующие последовательности для тяжелой и легкой цепей могут включать кДНК или геномную ДНК.
После того как молекула антитела настоящего изобретения получена в организме животного, синтезирована химическим путем или посредством рекомбинантной экспрессии, ее можно очистить с помощью любого метода, известного специалистам в данной области, применяемого для очистки молекулы иммуноглобулина, например хроматографии (например, ионообменной, аффинной, в частности, опирающейся на аффинность IL-4 и (или) IL-13 для белка A, а также гель-фильтрацией и т.п.), центрифугирования, дифференциальной растворимости или с помощью любой другой стандартной методики для очистки белков. Кроме того, для упрощения процесса очистки антитела настоящего изобретения или их фрагменты могут быть слиты в гетерологические полипептидные последовательности, описанные в настоящем документе или же известные специалистам в данной области.
Антитела настоящего изобретения могут быть получены любым удобным методом, известным специалистам в данной области. К антителам настоящего изобретения могут относиться поликлональные антитела, хотя по причине модификации антител для оптимизации применения на человеке, а также для оптимизации применения антител самих по себе, моноклональные антитела являются предпочтительными из-за простоты получения и обработки конкретных белков. Методы приготовления поликлональных антител известны квалифицированным специалистам в данной области (Harlow et al., Antibodies: a Laboratory Manual, Cold Spring Harbor Laboratory Press, 2nd ed. (1988)).
Антитела настоящего изобретения предпочтительно включают моноклональные антитела. Моноклональные антитела могут быть приготовлены с помощью гибридомных методик, например описанных в Kohler et al., Nature 256:495 (1975); патент США № 4,376,110; Harlow et al., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 2nd ed. (1988) и Hammerling et al., Monoclonal Antibodies and T-Cell Hybridomas, Elsevier (1981), методик рекомбинантной ДНК, например приготовление и использование трансфектом, или других методов, известных специалистам в данной области. Другие примеры методов, которые могут использоваться для продукции моноклональных антител, среди прочих, включают, гибридомные методики В-клеток человека (Kosbor et al., Immunology Today 4:72 (1983); и Cole et al., Proc Natl Acad Sci USA 80:2026 (1983)), и EBV-гибридомную методику (Cole et al., Monoclonal Antibodies and Cancer Therapy, pp. 77-96, Alan R. Liss (1985)). Такие антитела могут относиться к любому классу иммуноглобулинов, в том числе IgG, IgM, IgE, IgA и IgD, а также к любому их подклассу. Гибридомы, продуцирующие mAb настоящего изобретения, могут культивироваться in vitro или in vivo.
В рамках гибридомной модели организм хозяина, например мыши, гуманизированной мыши, трансгенной мыши с генами иммунной системы человека, хомячка, кролика, крысы, верблюда или любого другого подходящего животного-хозяина, иммунизируется с целью активировать лимфоциты, которые продуцируют или в состоянии продуцировать антитела, специфично связывающиеся с IL-4 или IL-13. В альтернативном варианте лимфоциты могут быть иммунизированы in vitro. Затем лимфоциты сливают с клетками миеломы с помощью подходящего реагента для слияния, например полиэтиленгликоля, с тем чтобы образовать клетки гибридомы (Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, pp. 59-103 (1986)).
Как правило, при приготовлении продуцирующих антитела гибридом используются лимфоциты периферической крови (PBL), если желательно получить клетки человеческого происхождения, или же клетки селезенки или лимфатических узлов, если требуются клетки, происходящие от млекопитающих, кроме человека. Иммортализованные линии клеток обычно представляют собой трансформированные клетки млекопитающих, в частности, клетки миеломы, полученные от грызунов, быков или человека. Обычно используют линию клеток миеломы крыс или мышей. Клетки гибридомы могут культивироваться в подходящей культуральной среде, которая предпочтительно содержит одно или несколько соединений, ингибирующих рост или выживание неслитых, иммортализованных клеток. Например, если в родительских клетках отсутствовал фермент гипоксантин-гуанинфосфорибозилтрансферазы (HGPRT или HPRT), культуральная среда для гибридом, как правило, будет содержать гипоксантин, аминоптерин и тимидин («среда НАТ») - ещества, которые препятствуют росту HGPRT-дефицитных клеток.
К предпочтительным линиям иммортализованных клеток относятся такие, которые эффективно участвуют в слиянии, поддерживают стабильно высокий уровень продукции антитела отобранными антитело-продуцирующими клетками и чувствительны к среде, например к среде НАТ. К таким линиям клеток миеломы относятся линии миеломы мыши, например полученные из мышиных опухолей MOPC-21 и MPC-11, поставляемых Salk Institute Cell Distribution Center, San Diego, Calif. а также клетки SP2/0, FO или X63-Ag8-653, поставляемые American Type Culture Collection, Manassas, VA.
Описывалась также продукция моноклональных антител человека из линий клеток миеломы человека и мышино-человеческих клеток гетеромиеломы (Kozbor, J Immunol 133:3001 (1984); и Brodeur et al., Monoclonal Antibody Production Techniques and Applications, Marcel Dekker, Inc, pp. 51-63 (1987)). Может также использоваться линия клеток миеломы мыши NSO (European Collection of Cell Cultures, Salisbury, Wilshire, UK).
В альтернативном варианте для получения гибридом предлагается использовать электрическое слияние вместо химического. Вместе слияния В-клетки могут быть иммортализованы с использованием, например вируса Эпштейна-Барр или другого трансформирующего гена, см., например, Zurawaki et al., в Monoclonal Antibodies, ed., Kennett et al., Plenum Press, pp. 19-33. (1980). Могут также использоваться трансгенные мыши и мыши с тяжелым комбинированным иммунодефицитом (SCID), которым трансплантированы В-лимфоциты человека.
Культуральная среда, в которой выращивают клетки гибридомы, анализируется на предмет продукции моноклональных антител, направленных против IL-4 и (или) IL-13. Специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, может определяться по иммунопреципитации или анализом связывания in vitro, например радиоиммунологическим анализом (RIA), флуороцитометрическим анализом (FACS) или твердофазным иммуноферментным анализом (ELISA). Перечисленные методики известны в данной области, и ими владеет любой специалист в данной области. Аффинность связывания моноклонального антитела с IL-4 и (или) IL-13 может, например, определяться анализом по Скэтчарду (Munson et al., Anal Biochem 107:220 (1980)).
После идентификации клеток гибридомы, продуцирующих антитела с желаемой специфичностью, аффинностью и (или) активностью, клоны могут быть субклонированы с использованием процедур серийных разведений и культивироваться с помощью стандартных методов (Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, pp. 59-103 (1986)). К пригодным культуральным средам, например, относится модифицированная Дульбекко среда Игла (D-MEM) или среда RPMI-1640. Кроме того, клетки гибридомы могут выращиваться in vivo в форме асцитных опухолей в организме животного.
Моноклональные антитела, продуцируемые субклонами, надлежащим образом отделяются или выделяются из культуральной среды, асцитной жидкости или сыворотки с применением стандартных процедур очистки иммуноглобулина, например белка А-сефароза, белка G-сефароза, хроматографии на гидроксиапатите, гель-фильтрационной хроматографии, гель-электрофореза, диализа или аффинной хроматографии.
В данной области существует широкое разнообразие методик продукции моноклональных антител, а потому изобретение не ограничивается только их продукцией в гибридомах. Например, моноклональные антитела могут быть приготовлены на основе методик рекомбинантной ДНК, например, подобных описанным в патенте США № 4816567. В данном контексте термин «моноклональное антитело» относится к антителу, полученному от единственного эукариотического, фагового или прокариотического клона.
ДНК, кодирующая моноклональные антитела настоящего изобретения, легко выделяется и секвенируется с использованием стандартных процедур (например, с применением олигонуклеотидных зондов, которые в состоянии специфично связываться с генами, кодирующими тяжелую и легкую цепи мышиных антител или эти же цепи человека, гуманизированные или из других источников) (Innis et al. в PCR Protocols. A Guide to Methods and Applications, Academic (1990), и Sanger et al., Proc Natl Acad Sci 74:5463 (1977)). Клетки гибридом служат в качестве источника такой ДНК. После выделения ДНК может вводиться в векторы экспрессии, которые затем трансфицируются в клетки-хозяева, например клетки E. coli, клетки NS0, клетки COS, клетки яичников китайского хомячка (CHO) или клетки миеломы, которые в иных ситуациях не продуцируют иммуноглобулиновый белок, с тем чтобы добиться синтеза моноклональных антител в рекомбинантных клетках-хозяевах. ДНК может также модифицироваться, например, посредством подстановки константных доменов кодирующей последовательности тяжелых и легких цепей человека вместо гомологичных последовательностей мыши (патент США № 4816567; и Morrison et al., Proc Natl Acad Sci USA 81:6851 (1984)) или же ковалентного связывания кодирующей последовательности иммуноглобулина со всей или частью кодирующей последовательности неиммуноглобулинового полипептида. Такой неиммуноглобулиновый полипептид можно использовать вместо константных доменов антитела настоящего изобретения или вариабельных доменов одного из сайтов комбинирования IL-4 или IL-13 антитела настоящего изобретения, так чтобы образовать химерное бивалентное антитело.
Антитела могут быть моновалентными. Методы приготовления моновалентных антител хорошо известны специалистам в данной области. Например, один из методов предусматривает рекомбинантную экспрессию легкой цепи иммуноглобулина и модифицированной тяжелой цепи. Тяжелая цепь обычно обрезается в любой точке области Fc, с тем чтобы предупредить образование перекрестных сшивок в тяжелой цепи. В альтернативном варианте соответствующие цистеиновые остатки заменяются другим аминокислотным остатком или удаляются, с тем чтобы воспрепятствовать перекрестным сшивкам.
Фрагменты антитела, которые распознают специфические эпитопы, могут быть получены с использованием известных методик. Такие фрагменты традиционно получают методом протеолитического разрушения интактных антител (см., например, Morimoto et al., J Biochem Biophys Methods 24:107 (1992); и Brennan et al., Science 229:81 (1985)). Например, фрагменты Fab и F(ab')2 настоящего изобретения могут быть получены протеолитическим расщеплением молекул иммуноглобулина под действием таких ферментов, как папаин (для получения фрагментов Fab) или пепсин (для получения фрагментов F(ab')2). Фрагменты F(ab')2 содержат вариабельную область, константный домен легкой цепи и домен CH1 тяжелой цепи. Вместе с тем эти фрагменты могут быть получены напрямую из рекомбинантных клеток-хозяев. Например, фрагменты антитела могут быть выделены из фаговой библиотеки антитела. В альтернативном варианте фрагмены F(ab’)2-SH могут быть напрямую выделены из E. coli и химически связываться с образованием фрагментов F(ab’)2 (Carter et al., Bio/Technology 10:163 (1992). В соответствии с другим подходом фрагменты F(ab’)2 могут быть напрямую выделены из культуры рекомбинантных клеток-хозяев. Опытному экспериментатору будут очевидны и другие методики получения фрагментов антител. В других примерах осуществления предпочтительным антителом является одноцепочечный фрагмент Fv (Fv) (WO 93/16185).
Для некоторых приложений, в том числе применения антител в организме человека in vivo и аналитических методах детектирования in vitro, может оказаться предпочтительным использовать химерные, гуманизированные или человеческие антитела. Методы получения химерных антител известны специалистам в данной области, см., например, Morrison, Science 229:1202 (1985); Oi et al., BioTechniques 4:214 (1986); Gillies et al., J Immunol Methods 125:191 (1989); и патенты США №№ 5807715; 4816567 и 4816397.
Гуманизированные антитела получают из молекул антител, которые продуцируются организмами, кроме человека, и связываются с IL-4 и (или) IL-13, причем одна или несколько их CDR введена в области FR молекулы иммуноглобулина человека. Антитела могут гуманизироваться на основе множества методик, известных специалистам в данной области, в том числе, например, вставки в CDR (EPO 239400; WO 91/09967; и патенты США №№ 5225539; 5530101 и 5585089), изменения поверхности антител (resurfacing) (EPO 592106; EPO 519596; Padlan, Molecular Immunology 28:489 (1991); Studnicka et al., Protein Engineering 7:805 (1994); и Roguska et al., Proc Natl Acad Sci USA 91:969 (1994)), и перестановки в цепи (патент США № 5565332).
Гуманизированное антитело содержит один или несколько аминокислотных остатков, источником которых является любой организм, кроме человеческого. Не присутствующие у человека аминокислотные остатки часто называют «импортированными» остатками, которые обычно берут из «импортируемого» вариабельного домена. Гуманизация может в основном проводиться с использованием методов Винтера с сотрудниками (Jones et al., Nature 321:522 (1986); Riechmann et al., Nature 332:323 (1988); и Verhoeyen et al., Science 239:1534 (1988)), посредством замещения нечеловеческих CDR или участков последовательностей CDR соответствующими последовательностями антитела человека. Соответственно, такие «гуманизированные» антитела являются химерными (патент США № 4816567), в которых значительно меньший участок по сравнению с интактным вариабельным доменом человека замещен на соответствующую последовательность организма, не являющегося человеческим. На практике гуманизированные антитела обычно представляют собой антитела человека, в которых некоторые остатки CDR и, возможно, некоторые остатки FR замещены аналогичными сайтами антител грызунов. Константная область тяжелой цепи и шарнирная область могут быть взяты от любого класса или подкласса, с тем чтобы добиться желаемого эффекта, например конкретной эффекторной функции.
Часто остовные остатки остовных областей человека могут быть заменены соответствующим остатком CDR донорного антитела, с тем чтобы изменить и, по возможности, улучшить связывание антигена. Остовные замещения определяют по методам, известным специалистам в данной области, например посредством моделирования взаимодействий CDR и остовных остатков, с тем чтобы определить остовные остатки, имеющие важное значение для связывания антигена, а также путем сопоставления последовательности для идентификации необычных остовных остатков в конкретных положениях, см., например, патент США № 5585089; и Riechmann et al., Nature 332:323 (1988).
Кроме того, предпочтительно, чтобы гуманизированные антитела сохраняли высокую аффинность к IL-4 и (или) IL-13, а также сохраняли или приобретали другие благоприятные биологические свойства. Таким образом, гуманизированные антитела готовятся в рамках процесса анализа исходных последовательностей и различных концептуальных гуманизированных продуктов с помощью трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов широко доступны и известны специалистам в данной области. Существуют компьютерные программы, которые визуально представляют и отображают возможные трехмерные конформационные структуры выбранных кандидатов иммуноглобулиновых последовательностей. Изучение изображений позволяет проводить анализ вероятной роли различных остатков в функционировании иммуноглобулиновой последовательности-кандидата, то есть анализ остатков, которые влияют на способность иммуноглобулина-кандидата связывать IL-4 и (или) IL-13. Таким образом, могут отбираться и комбинироваться остатки FR из реципиентной и импортируемой последовательностей, с тем чтобы максимизировать желательную характеристику антитела, например возросшую аффинность к антигену-мишени, хотя именно остатки CDR напрямую и наиболее существенным образом влияют на связывание IL-4 или IL-13. Области CDR также могут модифицироваться, так чтобы содержать одну или несколько аминокислот, отличающихся от полученных из исходного антитела, от которого была взята CDR, с тем чтобы обеспечить усиление или появление новых интересных свойств, например связывания с большей аффинностью или большей авидностью.
Можно проводить манипуляции и вносить изменения в определенные части константных областей антитела, с тем чтобы придать гомологам, производным, фрагментам и другим элементам антитела свойства, отличающиеся от наблюдавшихся в исходном антителе или лучшие по сравнению с ним. Так, например, многие антитела IgG4 образуют внутрицепьевые дисульфидные связи в окрестностях шарнирной области. Внутрицепьевая связь в состоянии дестабилизировать исходную бивалентную молекулу с образованием моновалентных молекул, содержащих тяжелую цепь с ассоциированной легкой цепью. Такие молекулы могут вновь ассоциироваться, но уже случайным образом.
Отмечалось, что модификация аминокислот в шарнирной области молекул IgG4 может снизить вероятность образования внутрицепьевой связи, тем самым стабилизируя молекулу IgG4, что сведет к минимуму вероятность образования биспецифических молекул. Подобная модификация может оказаться полезной, если используемым для лечения антителом является молекула IgG4, поскольку возросшая стабильность будет сводить к минимуму вероятность диссоциации молекулы в процессе получения и производства, а также и in vivo. Моновалентное антитело может не обладать такой же эффективностью, что и бивалентная исходная молекула. Например, если пациенту вводится бивалентный IgG4, процент бивалентного IgG4 спадает до примерно 30% за двухнедельный период. Замещение аминокислоты в положении 228 увеличивает стабильность IgG4. Серин, который находится в положении 228, может быть замещен на другую аминокислоту, например на одну из остальных 19 аминокислот. Такое изменение может быть сделано, в частности, в случае рекомбинантных антител, где кодирующая последовательность нуклеиновой кислоты может быть мутирована, с тем чтобы получить заменяющую аминокислоту в положении 228. Например, компонент S может быть заменен на пролин.
Другой набор аминокислот, пригодный для модификации, включает аминокислоты в шарнирной области, которые влияют на связывание молекулы, содержащей тяжелую цепь с рецептором, связывающимся с Fc, и интернализацию связанного антитела. В молекулах IgG1 к таким аминокислотам относятся остатки с примерно 233 по примерно 237 (Glu-Leu-Leu-Gly-Gly); (SEQ ID NO:49) с примерно 252 по примерно 256 (Met-Ile-Ser-Arg-Thr) (SEQ ID NO:50) и с примерно 318 (Glu) по примерно 331 (Pro), включая, например, Lys320, Lys 322 и Pro329.
Использование полностью антител человека особенно желательно при терапевтическом воздействии на людей-пациентов. Антитела человека могут приготовляться с применением различных методов, известных специалистам в данной области, в том числе методов фаг-дисплея, описанных выше, с использованием библиотеки антител человека, полученных из иммуноглобулиновых последовательностей человека, см. патенты США №№ 4444887 и 4716111; и WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741. Методики из работ Cole et al. и Boerder et al. также могут применяться для приготовления моноклональных антител человека (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss (1985); и Boerner et al., J Immunol 147:86 (1991)).
Антитела человека могут быть также получены с использованием трансгенных мышей, которые неспособны к экспрессии функциональных эндогенных иммуноглобулинов, но которые также экспрессируют определенные гены иммуноглобулина человека. Например, генные комплексы тяжелой и легкой цепей иммуноглобулина человека могут вводиться в эмбриональные стволовые клетки мыши случайным образом или посредством гомологической рекомбинации. В альтернативном варианте вариабельная область человека, константная область и D-область могут вводиться в мышиные эмбриональные стволовые клетки в дополнение к генам тяжелой и легкой цепи человека. Мышиные гены тяжелой и легкой цепи иммуноглобулина можно перевести в нефункциональное состояние по отдельности или одновременно с введением локусов иммуноглобулина человека посредством гомологической рекомбинации. В частности, гомозиготная делеция в области JH препятствует эндогенной продукции антитела. Модифицированные эмбриональные стволовые клетки размножают и проводят их микроинъекцию в бластоцисты для получения химерных мышей. От химерных мышей затем выводят гомозиготное потомство, которое экспрессирует антитела человека, см., например, Jakobovitis et al., Proc Natl Acad Sci USA 90:2551 (1993); Jakobovitis et al., Nature 362:255 (1993); Bruggermann et al., Year in Immunol 7:33 (1993); и Duchosal et al., Nature 355:258 (1992)).
Трансгенные мыши обычным образом подвергаются иммунизации цитокином IL-4 или IL-13, например полной последовательностью IL-4 или IL-13 или ее частью. Моноклональные антитела, ориентированные против IL-4 и IL-13, могут быть получены от иммунизированных трансгенных мышей с помощью стандартной гибридомной технологии. Трансгены иммуноглобулина человека, накопленные трансгенными мышами, реорганизуются во время дифференциации В-клеток и затем подвергаются классовому переключению и соматической мутации. Таким образом, с помощью данной методики есть возможность продуцировать терапевтически применимые антитела IgG, IgA, IgM и IgE. Обзор см. в работе Lonberg et al., Int Rev Immunol 13:65-93 (1995). Обсуждение продукции антител человека и моноклональных антител человека и протоколов получения таких антител: см., например, WO 98/24893; WO 92/01047; WO 96/34096 и WO 96/33735; EPO No. 0 598 877; и патенты США №№ 5413923; 5625126; 5633425; 5569825; 5661016; 5545806; 5814318; 5885793; 5916771 и 5939598. Кроме того, такие компании, как Amgen (Fremont, CA), Genpharm (San Jose, CA) и Medarex, Inc. (Princeton, NJ) могут привлекаться для поставки антител человека, нацеленных против IL-4 и (или) IL-13, с использованием технологии, которая аналогична приведенной выше.
Кроме того, mAb человека могут быть приготовлены иммунизацией мышей, которым трансплантированы лейкоциты периферической крови человека, спленоциты или костный мозг (например, методика триом XTL Biopharmaceuticals, Israel). Полностью антитела человека, которые распознают выбраный эпитоп, могут быть получены с использованием методики, называемой «направленной селекцией». В рамках этого подхода отобранное нечеловеческое моноклональное антитело, например мышиное антитело, используется для направленной селекции полностью антитела человека, распознающего тот же эпитоп (Jespers et al., Bio/technology 12:899 (1988)).
При использовании рекомбинантных методик вариант антитела может продуцироваться внутриклеточно, в периплазматическом пространстве, или напрямую секретироваться в среду. Если вариант антитела продуцируется внутриклеточно, на первом этапе можно отделить остатки частиц, клетки-хозяева или фрагменты после лизиса, например с помощью центрифугирования или ультрафильтрации. В работе Carter et al., Bio/Technology 10:163 (1992) описана процедура изолирования антител, которые секретируются в периплазматическое пространство E. coli. Вктатце, клеточную пасту обрабатывают ацетатом натрия (pH 3,5) и EDTA. Остатки клеток можно удалить центрифугированием. Если вариант антитела секретируют в среду, супернатант от такой системы экспрессии обычно вначале концентрируют с помощью коммерчески доступных фильтров для концентрации белков, например системы ультрафильтрации Amicon или Millipore Pellicon. Для ингибирования протеолиза может добавляться ингибитор протеазы, например PMSF, а также можно включить антибиотики, чтобы воспрепятствовать росту случайных загрязнителей.
Препарат антител, приготовленный из клеток, может очищаться с использованием, например, хроматографии на гидроксиапатите, гель-электрофореза, диализа и аффинной хроматографии. Пригодность белка А или белка G в качестве аффинного лиганда зависит от вида и изотипа любого домена Fc иммуноглобулина, который содержится в варианте антитела. Белок А может применяться для очистки антител, в основе которых лежат тяжелые цепи IgG1, IgG2 или IgG4 человека (Lindmark et al., J Immunol Meth 62:1 (1983)). Белок G может использоваться для изотипов мышей и IgG3 человека (Guss et al., EMBO J 5:1567 (1986)). В качестве матрицы, с которой связывается аффинный лиганд, чаще всего используется агароза, но существуют и другие матрицы. Механически прочные матрицы, например стекло с регулируемой пористостью или поли(стирол-дивинил)бензол, допускают использование более высоких скоростей потока и позволяют добиваться более коротких времен обработки по сравнению с агарозой. Если в вариант антитела включен домен CH3, для очистки удобно использовать смолу Bakerbond ABXTM (JT Baker; Phillipsburg, NJ). В зависимости от выделяемого антитела и его варианта могут также применяться другие методики очистки белка, например фракционирование на ионообменной колонке, осаждение этанолом, обращенно-фазовая ВЭЖХ, хроматография на силикагеле, хроматография на гепарин-агарозе, хроматография на анионообменной или катионообменной смоле (например, на колонке с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония.
После любой стадии (стадий) предварительной очистки можно провести хроматографию с гидрофобным взаимодействием при низких рН для смеси, содержащей представляющее интерес антитело или его вариант и примеси, в условиях элюирования буфером при pH в интервале примерно 2,5-4,5, предпочтительно проводимого при низких концентрациях солей (например, в интервале примерно 0-0,25 M соли).
Антитела настоящего изобретения могут быть биспецифическими. Биспецифические антитела могут быть моноклональными, предпочтительно антителами человека или гуманизированными антителами, которые обладают специфичностью связывания по крайней мере двух различных антигенов. В предпочтительном осуществлении биспецифическое антитело, его фрагмент и т.д. демонстрирует специфичности связывания, направленные на IL-4 и IL-13.
Методы приготовления биспецифических антител хорошо известны специалистам в данной области. Обычно рекомбинантная продукция биспецифических антител основана на совместной экспрессии пар тяжелая цепь/легкая цепь двух иммуноглобулинов, причем две тяжелые цепи обладают различными специфичностями (Milstein et al., Nature 305:537 (1983)). Вследствие случайного распределения тяжелых и легких цепей иммуноглобулина гибридомы (квадромы) продуцируют возможную смесь десяти различных молекул антител, из которых лишь одна обладает правильной биспецифической структурой. Очистка нужной молекулы обычно проводится посредством нескольких стадий аффинной хроматографии. Аналогичные процедуры описаны в заявке WO 93/08829 и в работе Traunecker et al., EMBO J 10:3655 (1991). Другие методы приготовления биспецифических антител приводятся, например, в Kufer et al., Trends Biotech 22:238-244, 2004.
Вариабельные домены антитела с желаемыми специфичностями связывания могут сливаться с последовательностями константных доменов иммуноглобулинов. Слияние предпочтительно проводится с константным доменом тяжелой цепи иммуноглобулина, содержащей по крайней мере часть шарнирных областей CH2 и CH3. По крайней мере в одном из продуктов слияния может содержаться константная область первой тяжелой цепи (CH1), включающая сайт, необходимый для связывания легкой цепи. ДНК, кодирующие продукты слияния тяжелой цепи иммуноглобулина, и, если желательно, легкая цепь иммуноглобулина вводятся в различные векторы экспрессии и совместно трансформируются в подходящем организме хозяина. Более подробно о получении биспецифических антител можно узнать, например, в работе Suresh et al., Meth Enzym 121:210 (1986).
Гетероконъюгаты антител также составляют часть настоящего изобретения. Гетероконъюгаты антител состоят их двух ковалентно связанных антител. Такие антитела, например, были предложены для ориентирования клеток иммунной системы на нежелательные клетки (патент США № 4676980). Предполагается, что антитела могут быть приготовлены in vitro с помощью известных методов синтетической химии белков, в том числе с применением агентов для перекрестных сшивок. Например, иммунотоксины могут конструироваться с помощью реакции дисульфидного обмена или за счет образования тиоэфирной связи. Примерами подходящих для этого реагентов являются иминотиолат и метил-4-меркаптобутиримидат, а также предложенные, например, в патенте США № 4676980.
Кроме того, можно получить однодоменные антитела к IL-4 и (или) IL-13. Примеры подобной технологии были описаны в заявке WO 9425591 для случая антител, полученных из тяжелой цепи Ig верблюда, а также в US 20030130496, где обсуждается выделение однодоменных полностью антител человека из фаговых библиотек.
В альтернативном варианте методики, описанные при получении одноцепочечных антител (патент США № 4946778; Bird, Science 242:423 (1988); Huston et al., Proc Natl Acad Sci USA 85:5879 (1988); и Ward, et al., Nature 334:544 (1989)), могут быть адаптированы для получения одноцепочечных антител. Одноцепочечные антитела образуются посредством связывания фрагментов тяжелой и легкой цепей области Fv через аминокислотный мостик с образованием одноцепочечного полипептида. Можно также использовать методики сборки функциональных фрагментов Fv в E. coli (Skerra et al., Science 242:1038 (1988)).
Настоящее изобретение включает антитела, рекомбинантно слитые или химически конъюгированные (в том числе ковалентно и нековалентно конъюгированные) с полипептидом. Слитые или конъюгированные антитела настоящего изобретения могут использоваться для простоты очистки, см., например, WO 93/21232; EP 439095; Naramura et al., Immunol Lett 39:91 (1994); патент США № 5474981; Gillies et al., Proc Natl Acad Sci USA 89:1428 (1992); и Fell et al., J Immunol 146:2446 (1991). Аминокислотная последовательность маркера может представлять собой гексагистидиновый пептид, например подобный маркеру в векторе pQE (QIAGEN, Inc., Chatsworth, CA), среди прочих, многие из которых коммерчески доступны, Gentz et al., Proc Natl Acad Sci USA 86:821 (1989). К другим пептидным маркерам, удобным для очистки, среди прочих, относятся маркер «НА», который соответствует эпитопу, полученному из гемагглютинирующего белка гриппа (Wilson et al., Cell 37:767 (1984)) и маркер «flag».
Можно также создать одноцепочечные пептидные связывающие молекулы, в которых области тяжелой и легкой цепи Fv соединены друг с другом. Одноцепочечные антитела («scFv») и метод их конструирования описаны, например, в патенте США № 4946778. В альтернативном варианте аналогичными способами можно сконструировать и экспрессировать Fab. Все полностью или частично антитела человека могут быть менее иммуногенными, чем полностью мышиные моноклональные антитела, фрагменты и одноцепочечные антитела также могут быть менее иммуногенными.
Антитела или фрагменты антител могут выделяться из фаговых библиотек антител, полученных с помощью методик, описанных в McCafferty et al., Nature 348:552 (1990). Clarkson et al., Nature 352:624 (1991) и Marks et al., J Mol Biol 222:581 (1991) рассматривают выделение антител мыши и антител человека, соответственно, с использованием фаговых библиотек. В последующих публикациях описана продукция высокоаффинных (в интервале нМ) антител человека посредством перестановки в цепи (Marks et al., Bio/Technology 10:779 (1992)), а также метод комбинаторной инфекции и рекомбинация in vivo как стратегии построения очень больших фаговых библиотек (Waterhouse et al., Nucl Acids Res 21:2265 (1993)). Таким образом, подобные методики являются практической альтернативой традиционным гибридомным методикам в получении моноклональных антител.
Потенциальные антитела анти-IL-4 и (или) IL-13 анализировались методами твердофазного иммуноферментного анализа (ELISA), FACS, вестерн-блоттингом или другими иммунохимическими методами, известными специалистам в данной области.
Чтобы определить, связывается ли тот или иной конкретный гомолог антитела с человеческим IL-4 и (или) IL-13, можно использовать любой стандартный метод анализа связывания. К удобным методам анализа связывания IL-4 и IL-13 относятся анализ FACS, анализ ELISA, поверхностный плазмонный резонанс (Biacore), радиоиммунологические методы анализа и им подобные, которые детектируют связывание антитела с IL-4 и (или) IL-13 и возникающие в результате функции. Для таких анализов удобны рассмотренные здесь имеющие полную длину и растворимые формы IL-4 и IL-13 человека. Связывание антитела или гомолога с IL-4 и (или) IL-13, или с его растворимыми фрагментами, можно легко регистрировать за счет использования второго антитела, специфического к иммуноглобулинам вида, от которого получены антитело или гомолог.
Чтобы установить, блокирует ли в заметной степени то или иное антитело или гомолог связывание с IL-4 и (или) IL-13, можно воспользоваться любым удобным методом конкурентного анализа. К пригодным методам анализа, например, относятся методы ELISA, методы FACS, радиоиммунологические методы анализа и им подобные, которые позволяют количественно определить способность антитела или гомолога конкурировать с IL-4 и (или) IL-13. Предпочтительно, оценивается способность лиганда блокировать связывание меченого IL-4 и (или) IL-13 человека с иммобилизированным антителом или гомологом.
Антитела настоящего изобретения могут описываться или характеризоваться с точки зрения эпитопа (эпитопов) или части (частей) IL-4 и (или) IL-13, которые антитело распознает или с которыми оно специфически связывается. Эпитоп (эпитопы) или часть (части) полипептидов, как описано в настоящем документе, могут характеризоваться, например по N-концевым и C-концевым положениям, по длине непрерывной цепи аминокислотных остатков, конформационным эпитопам и т.п.
Антитела настоящего изобретения могут также описываться или характеризоваться по перекрестной реакционной способности. В сферу охвата настоящего изобретения также включаются антитела, которые связывают полипептиды IL-4 и (или) IL-13, характеризующиеся по крайней мере 95%, по крайней мере 90%, по крайней мере 85%, по крайней мере 80%, по крайней мере 75%, по крайней мере 70%, по крайней мере 65%, по крайней мере 60%, по крайней мере 55% и по крайней мере 50% идентичностью (которая рассчитывается с помощью методов, известных специалистам в данной области и описанных в настоящем документе) по сравнению с IL-4 и (или) IL-13.
Антитела настоящего изобретения могут также описываться или характеризоваться по аффинности связывания с представляющим интерес IL-4 и (или) IL-13. Антитела анти-IL-4 и (или) анти-IL-13 могут связываться с KD менее примерно 10-7 M, менее примерно 10-6 M или менее примерно 10-5 M. Более высокая аффинность связывания рассматриваемого антитела может быть более желательна, например, с равновесной константой диссоциации или KD от примерно 10-8 до примерно 10-15 M, от примерно 10-8 до примерно 10-12 M, от примерно 10-9 до примерно 10-11 M или от примерно 10-8 до примерно 10-10 M. В настоящем изобретении также предлагаются антитела, которые конкурентно ингибируют связывание антитела с эпитопом настоящего изобретения, что определяется любым методом, известным специалистам в данной области, для регистрации конкурентного связывания, например описанными в настоящем документе методами иммунологического анализа. В предпочтительных примерах осуществления антитело конкурентно ингибирует связывание с эпитопом по крайней мере на 95%, по крайней мере на 90%, по крайней мере на 85%, по крайней мере на 80%, по крайней мере на 75%, по крайней мере на 70%, по крайней мере на 60% или по крайней мере на 50%.
В сферу охвата настоящего изобретения также включаются конъюгаты, содержащие представляющее интерес антитело. Конъюгаты состоят из двух основных компонентов: рассматриваемого антитела и второго компонента, которым может быть связывающий клетки агент, цитотоксический агент и т.п.
Используемый в настоящем документе термин «связывающий клетки агент» относится к веществу, которое специфически распознает и связывает молекулу на поверхности клетки. Так, в качестве связывающего клетки агента может выступать антиген CD, патогенный антиген, например вирусный антиген, дифференцирующий антиген, раковый антиген, клеточноспецифичный антиген, тканеспецифичный антиген, Ig или подобная Ig молекула и т.п.
Связывающие клетки агенты могут быть любого типа, который известен в настоящее время или становится известным в будущем, к ним относятся пептиды, небелковые соединения, сахариды, нуклеиновые кислоты, лиганды, рецепторы и т.п., или их комбинации. Связывающим клетки агентом может быть любое соединение, которое связывает клетку как специфическим, так и неспецифическим образом. Как правило, в качестве агента может выступать антитело (особенно моноклональное антитело), лимфокины, гормоны, факторы роста, витамины, молекулы-переносчики питательных веществ (например, трансферрин) или любая другая связывающая клетку молекула или вещество.
К другим примерам связывающих клетку агентов, которые могут использоваться в настоящем изобретении, относятся: поликлональные антитела, моноклональные антитела и фрагменты антител, например, Fab, Fab', F(ab')2 и Fv (Parham, J. Immunol. 131:2895-2902 (1983); Spring et al., J. Immunol. 113:470-478 (1974); и Nisonoff et al., Arch. Biochem. Biophys. 89: 230-244 (1960)).
Вторым компонентом также может быть цитотоксический агент. Используемый в настоящем документе термин «цитотоксический агент» относится к веществу, которое подавляет или блокирует функционирование или рост клеток и (или) вызывает деструкцию клеток. Так, в качестве цитотоксического агента может выступать таксол, майтансиноид, например DM1 или DM4, CC-1065 или CC-1065 аналог, рицин, митомицин C и т.п. В некоторых примерах осуществления цитотоксический агент, подобно любому связывающему агенту конъюгата настоящего изобретения, ковалентно связан с представляющим интерес антителом напрямую или через расщепляемый или нерасщепляемый линкер.
Примерами подходящих майтансиноидов являются майтансинол и аналоги майтансинола. Майтансиноиды подавляют образование микроканальцев и в высшей степени токсичны для клеток млекопитающих.
К примерам подходящих аналогов майтансинола относятся имеющие модифицированное ароматическое кольцо, а также аналоги с модификациями в других положениях. Такие пригодные для использования майтансиноиды предлагаются в патентах США №№ 4424219; 4256746; 4294757; 4307016; 4313946; 4315929; 4331598; 4361650; 4362663; 4364866; 4450254; 4322348; 4371533; 6333410; 5475092; 5585499 и 5846545.
Примеры подходящих аналогов майтансинола с модифицированным ароматическим кольцом включают: (1) C-19-дехлор (патент США № 4256746) (получаемый, например, LAH-восстановлением ансамитоцина P2); (2) C-20-гидрокси (или C-20-деметил) +/- C-19-дехлор (патенты США № 4361650 и 4307016) (получаемый, например, деметилированием с использованием стрептомицетов или актиномицетов или дехлорированием с применением литийалюминийгидрида (LAH)); и (3) C-20-деметокси, C-20-ацилокси (-OCOR), +/-дехлор (патент США № 4294757) (получаемый ацилированием под действием ацилхлоридов).
Примеры подходящих аналогов майтансинола с модификациями в других положениях включают: (1) C-9-SH (патент США № 4424219) (получаемый по реакции майтансинола с H2S или P2S5); (2) C-14-алкоксиметил (деметокси/CH2OR) (патент США № 4331598); (3) C-14-гидроксиметил или ацилоксиметил (CH2OH или CH2OAc) (патент США № 4450254) (получаемый из нокардий); (4) C-15-гидрокси/ацилокси (патент США № 4364866) (получаемый конверсией майтансинола стрептомицетами); (5) C-15-метокси (патенты США № 4313946 и 4315929) (выделяемый из Trewia nudiflora); (6) C-18-N-деметил (патенты США № 4362663 и 4322348) (получаемый деметилированием майтансинола стрептомицетами); и (7) 4,5-деокси (патент США № 4371533) (получаемый восстановлением майтансинола под действием треххлористого титана/LAH).
Цитотоксические конъюгаты могут быть получены методами in vitro. Для связывания цитотоксического агента, лекарства или пролекарства с антителом, как правило, используется линкерная группа. Подходящие линкерные группы известны специалистам в данной области, к ним относятся дисульфидные группы, тиоэфирные группы, кислотонеустойчивые группы, фотолабильные группы, группы, неустойчивые к воздействию пептидазы, а также группы, неустойчивые к воздействию эстеразы. Например, конъюгаты могут конструироваться с помощью реакции дисульфидного обмена или за счет образования тиоэфирной связи между представляющим интерес антителом и лекарством или пролекарством.
Как обсуждалось выше, в настоящем изобретении предлагаются последовательности выделенных нуклеиновых кислот, кодирующих описанные в настоящем документе антитело или его функциональный фрагмент или вариант, конструкции векторов, включающие нуклеотидную последовательность, кодирующую связывающую часть антитела или функционального фрагмента IL-4 и (или) IL-13 настоящего изобретения, клетки-хозяева, несущие такой вектор, а также рекомбинантные методики продукции такого полипептида.
Вектор, как правило, состоит из компонентов, известных специалистам в данной области, и обычно, среди прочих, включает один или несколько перечисленных ниже элементов: сигнальная последовательность, точка начала репликации, один или несколько маркеров или генов селекции, последовательности, способствующие и (или) стимулирующие трансляцию, энхансер и т.п. Таким образом, векторы экспрессии содержат нуклеотидную последовательность, которая функционально связана с такими подходящими транскрипционными или трансляционными регуляторными нуклеотидными последовательностями, например производными генов млекопитающих, микробов, вирусов или насекомых. К примерам дополнительных регуляторных последовательностей относятся операторы, рибосомальные сайты связывания мРНК и (или) другие соответствующие последовательности, которые контролируют транскрипцию и трансляцию, например их инициирование и прекращение. Нуклеотидные последовательности являются «функционально связанными», если регуляторная последовательность имеет функциональное отношение к нуклеотидной последовательности соответствующего полипептида. Так, нуклеотидная последовательность промотора функционально связана, например, с последовательностью тяжелой цепи антитела, если нуклеотидная последовательность промотора контролирует транскрипцию такой нуклеотидной последовательности.
Кроме того, в векторы экспрессии могут встраиваться последовательности, кодирующие соответствующие сигнальные пептиды, которые обычно не являются природным образом связанными с последовательностями тяжелой и (или) легкой цепей антитела. Например, нуклеотидная последовательность сигнального пептида (секреторный лидер) может быть слита внутри рамки с полипептидной последовательностью, так чтобы антитело секретировалось в периплазматическое пространство или в среду. Сигнальный пептид, который действует в предполагаемых клетках-хозяевах, усиливает внеклеточную секрецию соответствующего антитела или его части. Сигнальный пептид может отщепляться от полипептида при выделении антитела из клетки. Примеры таких секреторных сигналов хорошо известны и включают, например, описанные в патентах США № 5698435; 5698417 и 6204023.
В качестве вектора может выступать плазмида, одноцепочечный или двухцепочечный вирусный вектор, одноцепочечная или двухцепочечная РНК или ДНК фагового вектора, фагмид, космида или любой другой носитель представляющего интерес трансгена. Такие векторы могут вводиться в клетки как полинуклеотиды, с использованием хорошо известных методик введения ДНК и РНК в клетки. Векторы, в случае фаговых или вирусных векторов, также могут вводиться в клетки в форме вируса в оболочке или в капсуле с использованием хорошо известных методик инфекции и трансдукции. Вирусные векторы могут быть компетентными или дефективными по отношению к репликации. В последнем случае размножение вируса будет, как правило, проходить только в комплементарных клетках-хозяевах и с использованием множественных векторов, несущих различные вирусные компоненты, необходимые для продукции частиц. Бесклеточные системы трансляции могут также применяться для продукции белка с использованием РНК, полученных из существующих конструкций ДНК (см., например, WO 86/05807 и WO 89/01036; и патент США № 5122464).
Экспрессия антител настоящего изобретения может осуществляться в любой клетке-хозяине. К примерам клеток-хозяев, пригодных для использования в настоящем изобретении, относятся прокариотические, дрожжевые или высшие эукариотические клетки, и сюда, среди прочих, входят микроорганизмы, например бактерии (в частности E. coli, B. subtilis, энтеробактер, эрвинии, клебсиеллы, протеус, сальмонеллы, серратии и шигеллы, а также палочковидные бактерии, псевдомонады и стрептомицеты), трансформированные с помощью векторов экспрессии рекомбинантной ДНК бактериофага, плазмидной ДНК или космидной ДНК, содержащих кодирующие последовательности представляющего интерес антитела; дрожжи (например, сахаромицеты, пичиа, актиномицеты, клюверомицеты, шизосахаромицеты, кандиды, триходерма, нейроспора и гифомицеты, такие как нейроспора, пеницилл, толипокладиум и аспергиллы), трансформированные с помощью рекомбинантных векторов экспрессии дрожжей, содержащих кодирующие антитела последовательности; клеточные системы насекомых, инфицированные рекомбинантными векторами экспрессии вируса (например, бакуловируса), содержащими последовательности, кодирующие антитела; растительные клеточные системы, инфицированные рекомбинантными векторами экспрессии вируса (например, вирус мозаики цветной капусты, CaMV; или вирус табачной мозаики, TMV) или трансформированные векторами экспрессии рекомбинантной плазмиды (например, плазмиды Ti), содержащими кодирующие последовательности антитела; или же клеточные системы млекопитающих (например, клетки COS, CHO, BHK, 293 или 3T3), несущие рекомбинантные конструкции экспрессии, содержащие промоторы, полученные из генома клеток млекопитающих (например, промотор металлотионеина) или из вирусов млекопитающих (например, поздний промотор аденовируса или 7.5K промотор вируса осповакцины).
Векторы экспрессии для использования в прокариотических клетках-хозяевах обычно включают один или несколько фенотипических селектируемых маркерных генов. Фенотипический селектируемый маркерный ген, например, представляет собой ген, кодирующий белок, который обеспечивает устойчивость по отношению к антибиотикам или удовлетворяет аутотрофным требованиям. К примерам пригодных для использования векторов экспрессии для прокариотических клеток-хозяев относятся полученные на основе коммерчески доступных плазмид, например серии векторов pKK223-3 (Pharmacia Fine Chemicals, Uppsala, Sweden), pGEM1 (Promega Biotec, Madison, WI), pET (Novagen, Madison, WI) и pRSET (Invitrogen, Carlsbad, CA) (Studier, J Mol Biol 219:37 (1991); и Schoepfer, Gene 124:83 (1993)). К промоторным последовательностям, которые обычно используются для рекомбинантных векторов экспрессии прокариотических клеток-хозяев, относятся T7, (Rosenberg et al., Gene 56:125 (1987)), β-лактамаза (пенициллиназа), промоторная система лактозы (Chang et al., Nature 275:615 (1978); и Goeddel et al., Nature 281:544 (1979)), промоторная система триптофана (Trp) (Goeddel et al., Nucl Acids Res 8:4057 (1980)), и tac-промотор (Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory (1990)).
В дрожжевых векторах часто присутствует последовательность точки начала репликации, например, от плазмиды дрожжей 2μ, автономно реплицирующаяся последовательность (ARS), область промотора, последовательности полиаденилирования, последовательности прекращения транскрипции и ген селектируемого маркера. К подходящим промоторным последовательностям для векторов дрожжей, среди прочих, относятся промоторы металлотионеина, 3-фосфоглицераткиназы (Hitzeman et al., J Biol Chem 255:2073 (1980)) или другие гликолитические ферменты (Holland et al., Biochem 17:4900 (1978)), например енолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфатизомераза, 3-фосфоглицератмутаза, пируваткиназа, триозофосфатизомераза, фосфоглюкозоизомераза и глюкокиназа. Другие пригодные векторы и промоторы для использования в экспрессии дрожжей подробно описаны в работе Fleer et al., Gene 107:285 (1991). Другие пригодные промоторы и векторы для дрожжей и протоколов трансформации дрожжей хорошо известны специалистам в данной области. Протоколы трансформации дрожжей также хорошо известны. Один из таких протоколов описан в Hinnen et al., Proc Natl Acad Sci 75:1929 (1978), где производится отбор трансформантов Trp+ в селективной среде.
Применима любая клеточная культура эукариотов, как из культуры позвоночных, так и беспозвоночных. К примерам клеток беспозвоночных относятся клетки растений и насекомых (Luckow et al., Bio/Technology 6:47 (1988); Miller et al., Genetic Engineering, Setlow et al., eds., vol. 8, pp. 277-9, Plenum Publishing (1986); и Maeda et al., Nature 315:592 (1985)). Например, для продукции гетерологичных белков могут использоваться бакуловирусные системы. В системе насекомых вирус ядерного полиэдроза Autographa californica (AcNPV) может использоваться в качестве вектора для экспрессии чужеродных генов. Вирус растет в клетках Spodoptera frugiperda. Кодирующая последовательность антитела может клонироваться под контролем промотора AcNPV (например, промотора полиэдрина). К другим установленным хозяинам относятся комары, Drosophila melanogaster и Bombyx mori. Широко доступны разнообразные вирусные штаммы для трансфекции, например вариант L-1 AcNPV и штамм Bm-5 Bombyx mori NPV. Кроме того, как известно специалистам в данной области, клеточные культуры растений, например хлопка, кукурузы, картофеля, соевых бобов, петунии, томатов и табака, также могут использоваться в качестве хозяев.
Использование клеток позвоночных и размножение клеток позвоночных в клеточной культуре (культуре тканей) может представлять собой стандартную процедуру, хотя в реальности и существуют прихотливые линии клеток, которые требуют, например, специализированной среды с уникальными факторами, питающими клетками и т.п., см. Tissue Culture, Kruse et al., eds., Academic Press (1973). Примеры пригодных для использования линий клеток-хозяев млекопитающих включают клетки почек обезьяны; клетки мезонефроса человека; клетки почек новорожденного хомячка; клетки яичников китайского хомячка/-DHFR (CHO, Urlaub et al., Proc Natl Acad Sci USA 77:4216 (1980)); мышиные клетки Сертоли; клетки карциномы шейки матки человека (например, HeLa); клетки почек собаки; клетки легкого человека; клетки печени человека; клетки опухоли молочной железы мышей и клетки NS0.
Клетки-хозяева трансформируют с помощью векторов для продукции антител и культивируют в стандартной питательной среде, содержащей факторы роста, витамины, минеральные вещества и т.п., а также индукторы, подходящие для используемых клеток и векторов. Широко применяемые последовательности промотора и последовательности энхансера получают из вируса полиомы, аденовируса 2, вируса обезьян 40 (SV40) и цитомегаловируса человека (CMV). Последовательности ДНК, полученные из вирусного генома SV40, могут использоваться для подготовки других генетических элементов для экспрессии структурной генетической последовательности в клетках-хозяевах млекопитающих, например полученных из SV40, ранних и поздних промоторов, энхансера, сайтов сплайсинга и полиаденилирования. Вирусные ранние и поздние промоторы в особенности удобны, поскольку и тот, и другой достаточно просто получить из вирусного генома в виде фрагмента, который также может содержать вирусную точку начала репликации. В продаже имеются коммерчески доступные стандартные векторы экспрессии для использования в клетках-хозяевах млекопитающих.
Для культивирования клеток-хозяев пригодны коммерчески доступные среды, например среда Хэма F10, минимальная поддерживающая среда (MEM), RPMI-1640 и модифицированная Дульбекко среда Игла (DMEM). Кроме того, любая среда из описанных в Ham et al., Meth Enzymol 58:44 (1979) и Barnes et al., Anal Biochem 102:255 (1980), и в патентах США №№ 4767704; 4657866; 4560655; 5122469; 5712163 или 6048728, может использоваться в качестве культуральной среды для клеток-хозяев. Любая из этих сред может при необходимости быть дополнена гормонами и (или) другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (например, хлоридами, в частности хлоридами натрия, кальция или магния; и фосфатами), буферами (например, HEPES), нуклеотидами (например, аденозин и тимидин), антибиотиками, микроэлементами (которые определяются как неорганические соединения, обычно присутствующие в конечных концентрациях, лежащие в микромолярном диапазоне), а также глюкозой или эквивалентным ей источником энергии. В зависимости от поставленной цели могут включаться и любые другие необходимые добавки в соответствующих концентрациях. Условия культивирования, например температура, рН и т.п., как известно специалистам в данной области, подходят для клеток и обеспечивают желаемую экспрессию трансгена.
С помощью любого метода, известного специалистам в данной области, можно получить представляющие интерес полинуклеотиды и определить нуклеотидную последовательность таких полинуклеотидов. Например, если известна нуклеотидная последовательность антитела, полинуклеотид, кодирующий антитело, может быть составлен из химически синтезированных олигонуклеотидов (например, как это описано в Kutmeier et al., Bio/Techniques 17:242 (1994)), а затем связанные с лигандами полинуклеотиды амплифицируют, например, с помощью ПЦР.
В качестве альтернативы можно создать полинуклеотид, кодирующий антитело, из нуклеиновой кислоты, которую экспрессирует та или иная клетка. Если клон, содержащий нуклеиновую кислоту, кодирующую конкретное антитело, недоступен, но последовательность молекулы антитела известна, нуклеиновую кислоту, кодирующую иммуноглобулин, можно получить из подходящего источника, например библиотеки, которая может быть специфичной для продуцирующих антитело клеток, например клеток гибридомы, отобранных для экспрессии антитела настоящего изобретения. Для ПЦР-амплификации могут быть подготовлены подходящие праймеры. Амплифицированные нуклеиновые кислоты, полученные с помощью ПЦР, могут затем клонироваться в реплицируемые векторы клонирования с помощью любого метода, известного специалистам в данной области.
После того как нуклеотидная последовательность и соответствующая последовательность антитела установлены, возможны манипуляции нуклеотидной последовательностью антитела, с тем чтобы получить представляющие интерес эквиваленты, описанные в настоящем изобретении, с использованием методов манипуляции нуклеотидными последовательностями, которые известны специалистам в данной области, например методики рекомбинантной ДНК, сайт-направленный мутагенез, ПЦР и т.п. (см., например, Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory (1990); и Ausubel et al., eds., Current Protocols in Molecular Biology, John Wiley & Sons (1998), с тем чтобы получить антитела, содержащие различные аминокислотные последовательности, например для проведения замещений, делеций и (или) вставок аминокислот.
Аминокислотная последовательность тяжелой и (или) легкой цепей вариабельного домена может анализироваться на предмет идентификации последовательностей CDR с помощью хорошо известных методов, например сопоставлением с известными аминокислотными последовательностями других тяжелых и легких цепей вариабельных областей, с тем чтобы определить области гипервариабельности последовательности. Применяя стандартные методики рекомбинантной ДНК, можно ввести одну или несколько CDR в остовные области, например в остовные области белка человека, с тем чтобы гуманизировать нечеловеческое антитело, как описано выше. Представляющий интерес полинуклеотид, полученный за счет комбинации остовных областей и одной или нескольких CDR, кодирует антитело, которое специфически связывает IL-4 и (или) IL-13 или по крайней мере его ED домен. Такие методы, например, могут использоваться для проведения замен или делеций аминокислот для одного или нескольких цистеиновых остатков вариабельной области, которые участвуют в образовании внутрицепочечной дисульфидной связи, с тем, чтобы получить молекулу антитела без одной или нескольких внутрицепочечных дисульфидных связей.
Антитела или фрагменты антитела по настоящему изобретению могут быть использованы для обнаружения IL-4 и (или) IL-13, а значит, и клеток, экспрессирующих IL-4 и (или) IL-13, в биологическом образце как in vitro, так и in vivo. В одном из примеров осуществления антитело анти-IL-4 и (или) IL-13 настоящего изобретения используется, для того чтобы установить присутствие и уровень IL-4 и (или) IL-13 в тканях или в клетках, выделенных из ткани. Уровни IL-4 и (или) IL-13 в ткани или образце биопсии можно определять, например, посредством иммуноанализа для антител или фрагментов антител настоящего изобретения. Ткань или проба ее биопсии могут замораживаться или фиксироваться. Такие же или другие методы могут использоваться, чтобы установить другие свойства IL-4 и (или) IL-13, например его уровень, клеточную локализацию, уровни мРНК, их мутации и т.п.
Описанный выше способ, например, может использоваться для диагностики рака у пациента, который подвержен риску возникновения рака или у которого предполагается рак, при этом уровень IL-4 и (или) IL-13, регистрируемый у упомянутого пациента, сопоставляется с нормальным у здорового пациента или со стандартом. Рассматриваемый анализ также может использоваться для диагностики артрита или других аутоиммунных заболеваний, для которых характерна инфильтрация и концентрация В-клеток наряду с развитием дифференцированной лимфоидной ткани.
В настоящем изобретении также предлагаются моноклональные антитела, гуманизированные антитела и их фрагменты, связывающие эпитопы, в которые вводится метка для последующего использования в исследовательских или диагностических приложениях. В некоторых примерах осуществления метка является радиоактивной, также в качестве метки используется флуорофор, хромофор, контрастный агент или ион металла.
Предлагается также способ диагностики, в котором упомянутые меченые антитела или их фрагменты, связывающие эпитоп, вводятся пациенту, у которого предполагается рак, артрит, аутоиммунное заболевание или другие опосредованные IL-4 и (или) IL-13 болезни, и измеряется или отслеживается распределение метки в организме пациента.
Антитела или их фрагменты, предлагаемые в настоящем изобретении, могут использоваться в качестве агентов для аффинной очистки. В этом процессе антитела иммобилизуют на твердой фазе, например смоле с декстраном или агарозой или на фильтровальной бумаге, с помощью методов, известных специалистам в данной области. Иммобилизованное антитело обрабатывается образцом, содержащим IL-4 и (или) IL-13 или несущие его клетки, которые подвергаются очистке, после чего подложку промывают подходящим растворителем, который удалит практически весь материал из образца, кроме IL-4 и (или) IL-13 или клеток, которые подвергаются очистке, поскольку они связаны с иммобилизированным антителом, которое представляет интерес для настоящего изобретения. Наконец, подложку промывают другим подходящим растворителем, таким как глициновый буфер, рН 5,0, который обеспечивает высвобождение IL-4 и (или) IL-13 или клеток из рассматриваемого антитела.
Для диагностических приложений рассматриваемое антитело, как правило, будет помечаться контрастным веществом. Существует множество различных меток, которые, в общем, можно сгруппировать в следующие категории: (a) радиоизотопы, например 36S, 14C, 125I, 3H и 131I (антитело может помечаться радиоизотопом на основе методик, например, описанных в работе Current Protocols in Immunology, vol. 12, Coligen et al., ed., Wiley-Interscience, New York (1991), и радиоактивность может измеряться на основе сцинтилляционного счета); (б) флуоресцентные метки, например хелаты редкоземельных металлов (хелаты европия), флуоресцеин и его производные, родамин и его производные, дансил, лиссамин, фикоэритрин и техасский красный, флуоресцентные метки могут конъюгироваться с антителом с помощью методики, изложенной, например, в Current Protocols in Immunology, как упоминалось выше, причем флуоресценция может количественно определяться с помощью флуориметра; и (в) существуют также метки в виде субстратов различных ферментов (патент США № 4275149 содержит обзор), причем фермент, как правило, катализирует химическую трансформацию хромогенного субстрата, что может определяться с помощью различных методик, например, фермент может катализировать изменение цвета субстрата, что может регистрироваться спектрофотометрически, или же фермент может воздействовать на флуоресценцию или хемилюминесценцию субстрата. Известны методы количественного определения изменения флуоресценции, например, с помощью люминометра, или же регистрации передачи энергии от метки флуоресцентному акцептору. К примерам ферментативных меток относятся люциферазы (например, люцифераза светлячка и бактериальная люцифераза; патент США № 4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназа, уреаза, пероксидаза, например пероксидаза из хрена (HRPO), щелочная фосфатаза, β-галактозидаза, глюкоамилаза, лизоцим, сахаридоксидазы (например, глюкозоксидаза, галактозоксидаза и глюкозо-6-фосфатдегидрогеназа), гетероциклические оксидазы (например, уриказа и ксантиноксидаза), лактопероксидаза, микропероксидаза и т.п. Методики конъюгирования ферментов с антителами описаны в O'Sullivan et al., Meth Enz, ed. Langone & Van Vunakis, Academic Press, New York, 73 (1981).
На случай использования таких меток существуют подходящие субстраты, например: (i) для пероксидазы из хрена с перекисью водорода в качестве субстрата, причем перекись водорода окисляет предшественник красителя (например, ортофенилендиамин (OPD) или 3,3',5,5'-тетраметилбензидингидрохлорид (TMB)); (ii) для щелочной фосфатазы (AP) в качестве хромогенного субстрата выступает п-нитрофенилфосфат; и (iii) для β-D-галактозидазы (β-D-Gal) используется хромогенный субстрат (например, п-нитрофенил-β-D-галактоза) или флуорогенный субстрат, например 4-метилумбеллиферил-β-D-галактозидаза.
Квалифицированным специалистам в данной области доступны и другие сочетания фермент-субстратов. Общий обзор см. в патентах США № 4275149 и 4318980.
В некоторых случаях метка непрямым образом конъюгируется с антителом. Например, антитело может конъюгироваться с биотином, и любой из упомянутых выше репортеров может конъюгироваться с авидином или наоборот. Биотин селективно связывается с авидином, и в этих условиях метка может непрямо конъюгироваться с антителом. В альтернативном варианте для получения непрямой конъюгации метки антитело связывается с небольшим гаптеном (например, дигоксином), и один из различных видов меток или репортеров, упомянутых выше, конъюгируется с антителом анти-дигоксина. Таким образом, используя второе антитело, можно провести непрямую конъюгацию метки с антителом или мутеином.
В другом примере осуществления изобретения в антитело необязательно вводится метка, и его наличие может регистрироваться с помощью другой формы второго антитела - меченого антитела, которое связывается с рассматриваемым антителом.
Антитела настоящего изобретения могут использоваться в любом известном методе анализа, например анализе конкурентного связывания, прямых и непрямых сэндвичевых анализах и анализах иммунопреципитации. Zola, Monoclonal Antibodies: A Manual of Techniques (CRC Press, Inc. 1987).
Анализ конкурентного связывания опирается на способность меченого стандарта конкурировать с испытываемым образцом в процессе связывания с ограниченным количеством антитела. Количество антигена в испытываемом образце обратно пропорционально количеству стандарта, который связывается с антителами. Чтобы упростить определение количества стандарта, который оказывается связанным, антитела, как правило, до или после конкурентного взаимодействия переводят в нерастворимую форму. В результате стандартный и испытываемый образцы, которые связаны с антителами, могут без труда отделяться от стандарта и испытываемого образца, которые остаются несвязанными.
Сэндвичевый анализ предполагает использование двух антител, каждое из которых в состоянии связываться с различными иммуногенными частями, детерминантами или эпитопами мишени, которая детектируется. В сэндвичевом методе испытываемый образец, связывается с первым антителом, прямо или косвенно иммобилизированным на твердой подложке, после чего второе антитело, помеченное прямым или непрямым образом, связывается с зафиксированным испытываемым образцом, тем самым образуя нерастворимый трехчастный комплекс, см., например, патент США № 4376110. Второе антитело может быть само по себе помечено регистрируемой меткой (прямой сэндвичевый метод) или может детектироваться с использованием антииммуноглобулинового антитела или другого подходящего компонента связанной пары (например, антитело/антиген, рецептор/лиганд, фермент/субстрат), который помечен детектируемой меткой (непрямой сэндвичевый метод). Например, одним из видов сэндвичевого анализа является метод ELISA, в этом случае в качестве детектируемой метки выступает фермент.
В сферу охвата настоящего изобретения также входят наборы, например, включающие антитела, их фрагменты, гомологи, их производные и т.п., такие как меченые или цитотоксические конъюгаты, а также инструкции по применению антитела, конъюгата для уничтожения определенных видов клеток и т.п. В инструкциях могут содержаться указания по использованию антитела, конъюгата и т.п. in vitro, in vivo или ex vivo. Антитело может находиться в жидкости или в твердой форме, как правило, лиофилизованной. Набор может содержать другие пригодные реагенты, например буфер, восстановленный раствор и другие необходимые ингредиенты для предполагаемого использования. Предполагается, что набор будет представлять собой упакованную комбинацию реагентов в заранее установленных количествах с инструкциями по их применению, например в лечебных целях для проведения диагностических анализов. Если в антитело вводится метка, например фермента, набор может включать субстраты и кофакторы, необходимые для фермента (например, предшественник субстрата, который обеспечивает образование регистрируемого хромофора или флуорофора). Кроме того, в набор могут включаться другие добавки, например стабилизаторы, буферы (например, блок-буфер или лизисный буфер) и т.п. Относительные количества различных реагентов можно менять, с тем, чтобы в наборе присутствовали концентраты растворов реагентов, что обеспечивает пользователю гибкость, экономию места, реагентов и т.п. Реагенты могут поставляться в виде твердых порошков, обычно лиофилизованных, вместе с наполнителями, которые после растворения образуют раствор реагента в надлежащей концентрации.
Антитела настоящего изобретения могут быть использованы для лечения млекопитающих. В одном из примеров осуществления антитело или его эквивалент, представляющие интерес, вводятся млекопитающему, кроме человека, например с целью получить доклинические данные. К примерам млекопитающих, кроме человека, которые могут получать препарат, относятся нечеловекообразные приматы, собаки, кошки, грызуны и другие млекопитающие, на которых проводятся доклинические исследования. Такими млекопитающими могут быть апробированные модели животных для той или иной болезни, которую предполагается лечить с помощью антитела, или же они могут использоваться для изучения токсичности рассматриваемого антитела. В каждом из таких примеров осуществления для млекопитающего могут проводиться исследования нарастающей дозы.
В качестве лекарственного препарата может использоваться антитело в присутствии или в отсутствие второго компонента, например терапевтического агента, конъюгированного с ним, вводится без добавок или в сочетании с цитотоксическим фактором (факторами). Настоящее изобретение посвящено терапии антителами, которая предполагает введение антител по настоящему изобретению животному, млекопитающему или человеку для лечения опосредованных IL-4 и (или) IL-13 болезней, нарушений или состояний.
Используемый в настоящем изобретении термин «лечение» относится к терапевтическому лечению и к профилактическим и предупредительным мерам. Он обозначает предупреждение, лечение, прекращение, сглаживание, смягчение, сведение к минимуму, подавление или остановку губительных эффектов болезненного состояния, прогрессирования болезни, возбудителя заболевания (например, бактерии или вируса) или другого аномального состояния.
Поэтому настоящее изобретение также включает поливалентные антитела, в том числе биспецифические антитела анти-IL-4/IL-13, со связанными с ними диагностически или терапевтически функциональными эффекторными молекулами, атомами или иными фрагментами. Например, антитело может содержать радиоактивную диагностическую метку или радиоактивный цитотоксический атом, или метал, или цитотоксические компоненты, например цепь рицина, которые связываются с ним для целей in vivo диагностики или лечения рака.
Кроме того, антитела настоящего изобретения могут использоваться в иммуноферментном анализе, в методах очистки, а также в других методах, где используются иммуноглобулины или их фрагменты. Такие применения хорошо известны специалистам в данной области.
Соответственно, в изобретении также предлагаются препараты, содержащие антитела анти-IL-13 и/или анти-IL-4 или их фрагменты в соответствии с изобретением в удобном сочетании с фармацевтически приемлемым носителем, разбавителем или наполнителем, которые принято применять в данной области.
Используемый в настоящем изобретении термин «фармацевтический препарат» относится к составам различных препаратов. Составы, содержащие терапевтически эффективные количества поливалентных антител, представляют собой стерильные жидкие растворы, жидкие суспензии или лиофилизованные варианты и могут содержать стабилизаторы или наполнители.
Используемый в настоящем изобретении термин «нарушение» относится к любому состоянию, на которое может оказать благоприятное воздействие лечение антителами настоящего изобретения. Сюда относятся хронические и острые нарушения или заболевания, в том числе такие патологические состояния, которые определяют предрасположенность млекопитающего и, в частности, человека к рассматриваемому нарушению. Среди множества примеров нарушений, лечение которых предполагается в настоящем изобретении, различные формы рака, воспаление, аутоиммунные заболевания, инфекции, сердечно-сосудистые заболевания, респираторные заболевания, неврологические заболевания и метаболические заболевания.
Антитела настоящего изобретения могут использоваться для лечения, подавления или профилактики различных заболеваний, например аллергических заболеваний, опосредованных Th2 заболеваний, опосредованных IL-13 заболеваний, опосредованных IL-4 заболеваний и/или опосредованных IL-4/IL-13 заболеваний. Примерами таких заболеваний являются болезнь Ходжкина, астма, аллергическая астма, атопический дерматит, атопическая аллергия, язвенный колит, склеродерма, аллергический ринит, идиопатический легочный фиброз ХОЗЛ3, хроническое отторжение трансплантата, вызыванный блеомицином легочный фиброз, радиационно-индуцированный легочный фиброз, легочная гранулома, прогрессирующий системный склероз, шистосомоз, фиброз печени, рак почек, лимфома Беркитта, болезнь Ходжкина, не-Ходжкинская лимфома, синдром Сезари, астма, септический артрит, герпетиформный дерматит, хроническая идиопатическая уртикария, язвенный колит, склеродерма, гипертрофическое рубцевание, синдром Уиппла, доброкачественная гиперплазия простаты, легочное расстройство, при котором определенную роль играет рецептор IL-4, состояние, при котором определенную роль играет опосредованное рецептором IL-4 нарушение эпителиального барьера, нарушение пищеварительной системы, при котором определенную роль играет рецептор IL-4, аллергическая реакция на тот или иной лекарственный препарат, болезнь Кавасаки, серповидноклеточная анемия, синдром Черджа-Стросс, диффузный токсический зоб, предэклампсия, синдром Шегрена, аутоиммунный лимфопролиферативный синдром, аутоиммунная гемолитическая анемия, пищевод Барретта, аутоиммунный увеит, туберкулез, муковисцидоз, аллергический бронхолегочный микоз, хроническое обструктивное заболевание легких, индуцированные блеомицином пневмопатия и фиброз, легочный альвеолярный протеиноз, синдром вялотекущей дыхательной недостаточности, саркоидоз, синдром Джоба, идиопатический гиперэозинофильный синдром, аутоимунное образование кожных нарывов, обыкновенная пузырчатка, буллезный пемфигоид, злокачественная миастения, синдром хронической усталости, нефроз.
Термин «аллергическое заболевание» относится к патологическому состоянию, при котором пациент гиперсенсибилизирован к веществу, которое обычно не является иммуногенным и формирует иммунологическую реакцию на такое вещество. Аллергическое заболевание обычно характеризуется активацией мастоцитов посредством IgE, которая приводит к воспалительному ответу (например, локальный ответ, системный ответ), причем ее симптомы могут быть разными: от безобидных, как насморк, до опасного для жизни анафилактического шока и смерти. Примеры аллергических заболеваний, среди прочих, включают аллергический ринит (например, сенная лихорадка), астма (например, аллергическая астма), аллергический дерматит (например, экзема), контактный дерматит, пищевая аллергия и уртикария (крапивница).
Используемый в настоящем документе термин «опосредованное Th2 заболевание» относится к заболеванию, при котором патология возникает (полностью или частично) за счет иммунного ответа (иммунный ответ Th2-типа), регулируемого посредством Т-лимфоцитов CD4+ Th2, которые обычно продуцируют IL-4, IL-5, IL-9 и IL-13. Иммунный ответ Th2-типа ассоциируется с продукцией определенных цитокинов (например, IL-4, IL-13) и определенных классов антител (например, IgE), а также связывается с гуморальным иммунитетом. Опосредованные Th2 заболевания характеризуются наличием повышенных уровней цитокинов Th2 (например, IL-4, IL-13) и/или определенных классов антител (например, IgE), а также включают, например, аллергические заболевания (например, аллергический ринит, атопический дерматит, астма (например, атопическая астма), аллергическое заболевание дыхательных путей (АЗДП), анафилактический шок, конъюктивит), аутоиммуные заболевания, связанные с повышенными уровнями IL-4 и/или IL-13 (например, ревматоидный артрит, болезнь отторжения трансплантата организмом хозяина, заболевание почек (например, нефритический синдром, волчаночный нефрит)), а также инфекции, связанные с повышенными уровнями IL-4 и/или IL-13 (например, вирусные, паразитические, грибковые (например, C. albicans) инфекции). Определенные формы рака связаны с повышенными уровнями IL-4 и/или IL-13 или ассоциируются с IL-4-индуцированной и/или IL-13-индуцированной пролиферацией раковых клеток (например, B-клеточная лимфома, T-клеточная лимфома, множественная миелома, карцинома головы и шеи, рак молочной железы и рак яичников). Такие формы рака можно лечить, подавлять или предупреждать с помощью лиганда настоящего изобретения.
Используемый в настоящем документе термин «рак» относится к физиологическому состоянию у млекопитающих, в частности человека, которое обычно характеризуется нерегулируемым ростом клеток. Примеры рака, среди прочего, включают карциному, лимфому, бластому, саркому и лейкемию.
Используемый в настоящем документе термин «аутоиммунное заболевание» относится к незлокачественному заболеванию или расстройству, возникающему в собственных тканях пациента и направленному против его собственных тканей. К примерам аутоиммунных заболеваний или нарушений, среди прочих, относятся воспалительные реакции, например воспалительные кожные заболевания, в том числе псориаз и дерматит; аллергические состояния, например экзема и астма; прочие состояния, в том числе инфильтрация Т-клеток и хронические воспалительные реакции; атеросклероз; сахарный диабет (например, сахарный диабет I типа или инсулинозависимый сахарный диабет); рассеянный склероз и воспалительное расстройство центральной нервной системы (ЦНС).
Антитела настоящего изобретения могут использоваться в качестве составов для индивидуального введения или в сочетании с другими терапевтическими агентами. Антитела могут использоваться в комбинационной терапии с существующими препаратами IL-13 (например, существующие агенты IL-13, например, анти-IL-13Rαl, ловушка IL-4/13, анти-IL-13) с антителом анти-IL-4 и существущими агентами IL-4 (например, анти-IL-4R, мутеин IL-4, ловушка IL-4/13) с антителом анти-IL-13 и антителами IL-4 (например, WO 05/0076990 (CAT), WO 03/092610 (Regeneron), WO 00/64944 (Genetic Inst.) и WO 2005/062967 (Tanox)).
Антитела настоящего изобретения могут вводиться и/или включаться в состав вместе с одним или несколькими дополнительными лекарственными или активными агентами. Если лиганд вводится вместе с дополнительным лекарственным агентом, то его можно вводить до, одновременно или после введения дополнительного агента. Как правило, лиганд и дополнительный агент вводятся таким образом, который позволяет обеспечивать перекрывание терапевтического эффекта. К дополнительным агентам, которые могут вводиться или включаться в состав вместе с лигандом настоящего изобретения, относятся, например, различные иммунотерапевтические препараты, например циклоспорин, метотрексат, адриамицин или цисплатин, антибиотики, антигрибковые средства, противовирусные агенты и иммунотоксины. Например, если антагонист вводится для профилактики, подавления или лечения воспаления легких или респираторного заболевания (например, астмы), он может вводиться вместе с ингибиторами фосфодиэстеразы (например, ингибиторы фосфодиэстеразы-4), бронходиляторами (например, β2-агонисты, антихолинергики, теофиллин), бета-агонистами кратковременного действия (например, альбутерол, сальбутамол, бамбутерол, фенотер[сигма]l, изоэтерин, изопротенерол, лева[иота]бутерол, метапротенерол, пирбутерол, тербуталин и торнлат), бета-агонистами продолжительного действия (например, формотерол и сальметерол), антихолинергики кратковременного действия (например, ипратропий бромид и окситропий бромид), антихолинергики продолжительного действия (например, тиотропий), теофиллин (например, составы кратковременного действия, составы продолжительного действия), стероиды ингаляционного применения (например, беклометазон, беклометазон, будесонид, флунизолид, флутиказон пропионат и триамциноколон), стероиды перорального применения (например, метилпреднизолон, преднизолон, преднизолон и преднизон), комбинация бета-агонистов кратковременного действия с антихолинергиками (например, альбутерол/сальбутамол/ипратопий и фенотерол/ипратопий), сочетание бета-агонистов продолжительного действия со стероидами ингаляционного применения (например, сальметерол/флутиказон и формотерол/будесонид) и муколитические агенты (например, эрдостеин, ацетилцистеин, бромгексин, сарбоцистеин, гуиафенсин и иодированный глицерин).
К другим подходящим агентам для совместной терапии, которые могут вводиться вместе с антителом настоящего изобретения для профилактики, подавления или лечения астмы (например, аллергической астмы), относятся кортикостероиды (например, беклометазон, будесонид, флутиказон), хромогликат, недокромил, бета-антагонисты (например, сальбутамол, тербуталин, бамбутерол, фенотерол, репротерол, толубутерол, сальметерол, фомтеро), зафирлукаст, сальметерол, преднизон, преднизолон, теофиллин, зилейтрон, монтелукаст и модификаторы лейкотриена. Лиганды настоящего изобретения могут совместно вводиться с разнообразными агентами для совместной терапии, пригодными для лечения заболеваний (например, заболеваний, опосредованных Th-2, опосредованных YL-A, опосредованных IL-13, опосредованных IL-4, а также рака), в том числе цитокины, анальгетики/антипиретики, противорвотные средства и препараты для химиотерапии.
Антитела настоящего изобретения могут поставляться в форме фармацевтически приемлемых составов, которые известны специалистам в данной области или описаны в настоящем документе. Термин «физиологически приемлемый», «фармацевтически приемлемый» и т.п. означает утвержденный распорядительным органом федерального правительства или правительства штата или внесенный в Фармакопею США или другую общепринятую фармакопею для использования на животных и, в особенности, на человеке.
Антитела анти-IL-4, анти-IL-13 и биспецифические антитела анти-IL-4/анти-IL-13 могут вводиться млекопитающему, в частности человеку, любым приемлемым способом. К методам введения, среди прочих, относятся парентеральный, подкожный, внутрибрюшинный, внутрилегочный, интраназальный, эпидуральный, ингаляция и оральные пути, а также, если это желательно в случае иммунодепрессивного лечения, предусматривается введение внутрь пораженного участка. Парентеральные вливания включают внутримышечное, внутрикожное, внутривенное, внутриартериальное или внутрибрюшинное введение. Антитела или составы могут вводиться любым подходящим способом, например вливанием или болюсной инъекцией, абсорбцией через эпителиальные или кожно-слизистые оболочки (например, слизистая ротовой полости, слизистая прямой кишки и кишечника и т.п.) и могут вводиться совместно с другими биологически-активными агентами. Введение может быть системным или местным. Кроме того, может быть желательно вводить терапевтические антитела или составы настоящего изобретения в центральную нервную системы любым удобным методом, в том числе посредством интравентрикулярной инъекции и инъекции в область позвоночного канала; причем интравентрикулярную инъекцию может облегчить интравентрикулярный катетер, например соединенный с резервуаром, например с резервуаром Оммайа. Кроме того, антитело удобно вводить импульсными вливаниями, особенно в случае понижающихся доз антитела. Предпочтительно, дозировка производится инъекцией, предпочтительно посредством внутривенных или подкожных инъекций, частично в зависимости от того, носит ли введение кратковременный или продолжительный характер.
Известны различные системы доставки, и они могут использоваться для введения антитела настоящего изобретения, например инкапсуляция в липосомы, микрочастицы, микрокапсулы (см. Langer, Science 249:1527 (1990); Treat et al., в Liposomes in the Therapy of Infectious Disease and Cancer; Lopez-Berestein et al., eds., p. 353-365 (1989); и Lopez-Berestein, там же, p. 317-327), а также рекомбинантные клетки, способные экспрессировать соединения, опосредованный рецепторами эндоцитоз (см., например, Wu et al., J Biol Chem 262:4429 (1987)); конструирование нуклеиновой кислоты в рамках ретровирусного или другого вектора и т.п.
Активные ингредиенты могут также захватываться в приготовленные микрокапсулы, например с помощью методик коацервации или межфазной полимеризации, например микрокапсулы гидроксиметилцеллюлозы или желатина и микрокапсулы полиметилметакрилата, соответственно, в коллоидные системы доставки лекарств (например, липосомы, микросферы альбумина, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики описаны в Remington's Pharmaceutical Sciences, 16th edition, A. Osal, Ed. (1980).
Может также применяться пульмональная доставка, например, с использованием ингалятора или аэрозольного аппарата, а также состава, содержащего агент для перевода в аэрозоль. Антитело также может вводиться в легкие пациента в форме сухого порошкового состава, см., например, патент США № 6514496.
В одном из конкретных примеров осуществления может быть желательно вводить лечебные антитела или составы настоящего изобретения местно, в зону, которая нуждается в лечении; этого можно добиться различными методами, например, среди прочих, местной инфузией, местным применением, посредством инъекции, катетера, с помощью суппозитория или импланта, причем упомянутый имплант может быть изготовлен из пористого, непористого или желатиноподобного материала, в том числе представлять собой мембрану например, силастиковую мембрану или волокна. Предпочтительно при введении антитела настоящего изобретения обращать особое внимание на использование материалов, которые не адсорбируют и не абсорбируют белок.
В еще одном примере осуществления антитело может доставляться в системе контролируемого высвобождения. В одном из примеров осуществления может использоваться насос (см. Langer, Science 249:1527 (1990); Sefton, CRC Crit Ref Biomed Eng 14:201 (1987); Buchwald et al., Surgery 88:507 (1980); и Saudek et al., N Engl J Med 321:574 (1989)). В другом примере осуществления могут применяться полимерные материалы (см. Medical Applications of Controlled Release, Langer et al., eds., CRC Press (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen et al., eds., Wiley (1984); Ranger et al., J Macromol Sci Rev Macromol Chem 23:61 (1983); см. также Levy et al., Science 228:190 (1985); During et al., Ann Neurol 25:351 (1989); и Howard et al., J Neurosurg 71:105 (1989)). В еще одном примере осуществления система контролируемого высвобождения может размещаться в непосредственной близости от терапевтической мишени.
Лечебные препараты полипептида или антитела могут готовиться для хранения в форме лиофилизованных составов или водных растворов посредством смешения полипептида желательной степени чистоты с возможными «фармацевтически приемлемыми» носителями, растворителями, наполнителями или стабилизаторами, которые обычно используются в данной области, например, буферными реагентами, стабилизирующими реагентами, консервантами, изотонификаторами, неионогенными детергентами, антиоксидантами и другими разнообразными добавками, см. Remington's Pharmaceutical Sciences, 16th ed., Osol, ed. (1980). Такие добавки, как правило, нетоксичны для организма хозяина в применяемых дозах и концентрациях, а значит, наполнители, разбавители, носители и т.п. являются фармацевтически приемлемыми.
«Выделенное», или «очищенное» антитело в достаточной степени свободно от клеточного материала или других загрязняющих белков из клеточного или тканевого источника или среды, из которой получен белок, либо в достаточной степени свободны от химических предшественников или других химических веществ при получении путем химического синтеза. Выражение «в достаточной степени свободны от клеточного материала» включает препараты антитела, в которых данный полипептид/белок отделен от клеточных компонентов клеток, из которых он выделен или получен при рекомбинации. Таким образом, антитело, в достаточной степени свободное от клеточного материала, включает препараты антитела, содержащие менее чем примерно 30%, 20%, 10%, 5%, 2,5% или 1% (сухого веса) загрязняющего белка. В том случае, когда антитело получено с помощью рекомбинантных методик, также предпочтительно, если оно будет в достаточной степени свободно от культуральной среды, то есть если культуральная среда составляет менее чем примерно 20%, 10%, 5%, 2,5% или 1% от объема препарата белка. В том случае, когда антитело получают при химическом синтезе, предпочтительно, чтоб оно было в достаточной степени свободно от химических предшественников или других химических веществ и реагентов, то есть чтобы рассматриваемое антитело было отделено от химических предшественников или других химических веществ, использованных в синтезе белка. Соответственно, такие препараты антитела содержат менее чем приблизительно 30%, 20%, 10%, 5% или 1% (сухого веса) химических предшественников или химических веществ, отличных от рассматриваемого антитела. В предпочтительном примере осуществления настоящего изобретения проводится выделение или очистка антител.
Приведенное в настоящем документе выражение «от низких до неопределяемых уровней агрегирования» относится к образцам, содержащим не более 5%, не более 4%, не более 3%, не более 2%, не более 1% и часто не более 0,5% агрегатов по весу белка, что определяется, например, высокоэффективной гель-проникающей хроматографией (ВЭГПХ).
Используемый в настоящем документе термин «от низких до неопределяемых уровней фрагментации» относится к образцам, содержащим не менее 80%, 85%, 90%, 95%, 98% или 99%, суммарного белка, например в одном пике, что определяется ВЭГПХ, или в 2 (двух) пиках (тяжелая цепь и легкая цепь), определяемых, например, с помощью восстановительного капиллярного гель-электрофореза (rCGE) и не содержащих других единичных пиков с более 5%, более 4%, более 3%, более 2%, более 1% или более 0,5% суммарного белка каждый. Используемый в настоящем документе термин rCGE относится к капилярному гель-электрофорезу в условиях восстановления, достаточных для восстановления дисульфидных связей в антителе или молекуле типа антитела, или производной молекуле.
Используемые в настоящем документе термины «стабильность» и «стабильный» в контексте жидкого препарата, содержащего антитело Il-4 и (или) IL-13 или его связывающий фрагмент, относятся к устойчивости антитела или его антиген-связывающего фрагмента в препарате к термическому или химическому разворачиванию, агрегированию, деградации или фрагментации в конкретных условиях производства, получения, транспортировки и хранения. «Стабильные» препараты настоящего изобретения сохраняют биологическую активность не менее чем на 80%, 85%, 90%, 95%, 98%, 99% или 99,5% в конкретных условиях производства, получения, транспортировки и хранения. Стабильность упомянутого препарата антитела может оцениваться по степени агрегирования, деградации или фрагментации с применением методов, известных квалифицированным специалистам в данной области, в том числе, среди прочих, rCGE, гель-электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и ВЭГПХ, по сравнению со стандартом.
Термин «носитель» относится к разбавителю, адъюванту, наполнителю или носителю, с которым вводится лекарственный препарат. Такими физиологическими носителями могут быть стерильные жидкости, например вода и масла, в том числе нефтяного, животного, растительного или синтетического происхождения, например арахисовое масло, соевое масло, минеральное масло, кунжутное масло и подобные им масла. При внутривенном введении лекарственного препарата предпочтительным носителем является вода. Физиологические растворы и водные растворы декстрозы и глицерина также могут использоваться в качестве жидких носителей, особенной для инъекционных растворов. К подходящим фармацевтическим наполнителям относятся крахмал, глюкоза, лактоза, сахароза, желатин, солод, рис, мука, мел, силикагель, стеарат натрия, глицеринмоностеарат, тальк, хлорид натрия, сухое снятое молоко, глицерин, пропиленгликоль, вода, этанол и подобные им вещества. Если желательно, состав может также содержать небольшие количества смачивающих веществ или эмульгаторов, или буферных веществ для поддержания рН. Такие препараты могут иметь форму растворов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, лекарственных форм с длительным высвобождением вещества, депо и им подобных. Состав может иметь форму суппозитория со стандартными связующими и носителями, например триглицеридами. Препараты для перорального применения могут включать стандартные носители, такие как относящиеся к фармацевтической категории маннитол, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат магния и т.п. Примеры подходящих носителей описаны в "Remington's Pharmaceutical Sciences," Martin. Такие составы будут содержать эффективное количество антитела, предпочтительно в очищенной форме, наряду с соответствующим количеством носителя, с тем чтобы обеспечить форму для надлежащего введения пациенту. Как известно специалистам в данной области, состав будет создаваться таким образом, чтобы соответствовать способу введения.
Буферные реагенты помогают поддерживать рН в интервале, который приближается к физиологическим условиям. Буферы предпочтительно присутствуют в концентрациях в интервале от примерно 2 мМ до примерно 50 мМ. В качестве подходящих буферных реагентов настоящего изобретения могут использоваться как органические, так и неорганические кислоты и их соли, например цитратные буферы (например, смесь мононатрия цитрат-динатрия цитрат, смесь лимонная кислота-тринатрия цитрат, смесь лимонная кислота-мононатрия цитрат и т.п.), сукцинатные буферы (например, смесь янтарная кислота-мононатрия сукцинат, смесь янтарная кислота-гидроксид натрия, смесь янтарная кислота-динатрия сукцинат и т.п.), тартратные буферы (например, смесь винная кислота-натрия тартрат, винная кислота-калия тартрат, смесь винная кислота-гидроксид натрия и т.п.), фумаратные буферы (например, смесь фумаровая кислота-мононатрия фумарат, смесь фумаровая кислота-динатрия фумарат, смесь мононатрия фумарат-динатрия фумарат и т.п.), глюконатные буферы (например, смесь глюконовая кислота-глюконат натрия, смесь глюконовая кислота-гидроксид натрия, смесь глюконовая кислота-глюконат калия и т.п.), оксалатные буферы (например, смесь щавелевая кислота-оксалат натрия, смесь щавелевая кислота-гидроксид натрия, смесь щавелевая кислота-оксалат калия и т.п.), лактатные буферы (например, смесь молочная кислота-лактат натрия, смесь молочная кислота-гидроксид натрия, смесь молочная кислота-лактат калия и т.п.) и ацетатные буферы (например, смесь уксусная кислота-ацетат натрия, смесь уксусная кислота-гидроксид натрия и т.п.). Могут применяться фосфатные буферы, карбонатные буферы, гистидиновые буферы, соли триметиламина, например Tris, HEPES, а также другие подобные им известные буферы.
Для замедления роста микроорганизмов могут добавляться консерванты, которые можно использовать в количествах в интервале 0,2%-1% (вес./об.). К консервантам, пригодным для использования в настоящем изобретении, относятся фенол, бензиловый спирт, м-крезол, метилпарабен, пропилпарабен, октадецилдиметилбензиламмонийхлорид, галоиды бензалкония (например, хлорид, бромид и иодид), гексаметонийхлорид, алкилпарабены, например метил- или пропилпарабен, катехол, резорцинол, циклогексанол и 3-пентанол.
Изотонификаторы вводятся, с тем чтобы обеспечить физиологическую изотоничность жидких препаратов настоящего изобретения, к таковым относятся многоатомные сахарные спирты, предпочтительно, трехатомные или более высокие сахарные спирты, например глицерин, эритритол, арабитол, ксилитол, сорбитол и маннитол. Многоатомные спирты могут присутствовать в количествах от примерно 0,1% до примерно 25%, по весу, предпочтительно от 1% до 5% с учетом относительных количеств других ингредиентов.
Стабилизаторами называют широкую категорию наполнителей, функции которых меняются от формообразующих веществ до добавок, солюбилизирующих лекарственный препарат или способствующих предупреждению денатурации или адгезии к стенкам емкости. В качестве характерных стабилизаторов могут выступать многоатомные сахарные спирты; аминокислоты, например аргинин, лизин, глицин, глутамин, аспарагин, гистидин, аланин, орнитин, L-лейцин, 2-фенилаланин, глутаминовая кислота, треонин и т.п., органические сахара или сахарные спирты, например лактоза, трегалоза, стахиоза, арабитол, эритритол, маннитол, сорбитол, ксилитол, рибитол, миоинозитол, галактитол, глицерин и им подобные, в том числе циклитолы, например инозитол; полиэтиленгликоль; полимеры аминокислот; серосодержащие восстановители, например мочевина, глутатион, липоевая кислота, тиогликолят натрия, тиоглицерин, α-монотиоглицерин и тиосульфат натрия; полипептиды с низким молекулярным весом (то есть <10 остатков); белки, например альбумин сыворотки человека, альбумин бычей сыворотки, желатин или иммуноглобулины; гидрофильные полимеры, например поливинилпирролидон, сахариды, моносахариды, например ксилоза, манноза, фруктоза, глюкоза; дисахариды, например лактоза, мальтоза и сахароза; трисахариды, например раффиноза; полисахариды, например декстран и т.п. Стабилизаторы присутствуют в интервале от 0,1 до 10000 вес/вес на одну часть активного белка.
К дополнительным различным наполнителям относятся формообразующие агенты (например, крахмал), хелатирующие агенты (например, EDTA), антиоксиданты (например, аскорбиновая кислота, метионин или витамин Е) и вспомогательные растворители.
Приведенные в настоящем документе составы также могут содержать более одного активного компонента, если необходимо для индивидуальных показаний при лечении, предпочтительно компоненты, обладающие взаимодополняющей активностью, которые не оказывают неблагоприятного влияния друг на друга. Например, может быть желательно дополнительно ввести иммунодепрессант. Подобные молекулы надлежащим образом присутствуют в составе в количествах, которые эффективны для предполагаемой цели.
Используемый в настоящем документе термин «поверхностно-активные вещества» относится к органическим соединениям, обладающим амфипатической структурой, а именно, состоящим из групп с противоположными характеристиками растворимости, как правило из жирорастворимой углеводородной цепочки и водорастворимой ионной группы. В зависимости от заряда поверхностно-активной группы поверхностно-активные вещества могут подразделяться на анионные, катионные и неионогенные. Поверхностно-активные вещества часто применяются как смачивающие, эмульгирующие, солюбилизирующие и диспергирующие агенты для различных лекарственных составов и препаратов биологических материалов.
Неионогенные поверхностно-активные вещества или детергенты (также известные как «смачивающие вещества») могут добавляться, с тем чтобы способствовать солюбилизации лекарственного средства, а также чтобы защитить лекарственный белок от вызванного встряхиванием агрегирования, что также позволяет подвергать состав воздействию поверхностного сдвига, не вызывая денатурации белка. К подходящим неионогенным поверхностно-активным веществам относятся полисорбаты (20, 80 и т.п.), полиоксамеры (184, 188 и т.п.), полиолы Pluronic® и моноэфиры полиоксиэтиленсорбитана (TWEEN-20®, TWEEN-80® и т.п.). Неионогенные поверхностно-активные вещества могут присутствовать в количествах в интервале от примерно 0,05 мг/мл до примерно 1,0 мг/мл, предпочтительно от примерно 0,07 мг/мл до примерно 0,2 мг/мл.
Используемый в настоящем документе термин «неорганическая соль» относится к любому соединению, не содержащему углерод, которое образуется в результате замены некоторых или всех кислых водородов или кислоты металлом или группой, выступающей в качестве металла, и часто используемому в качестве вещества для корректировки тоничности в лекарственных составах и препаратах из биологических материалов. Наиболее распространенными неорганическими солями являются NaCl, KCl, NaH2PO4 и т.п.
Настоящее изобретение включает жидкие составы, обладающие стабильностью при температурах, характерных для коммерческих холодильников и морозильников, которые используются в кабинетах врача или лабораториях, например от примерно -20ºC до примерно 5ºC, причем упомянутая стабильность оценивается, например, по высокоэффективной гель-проникающей хроматографии (ВЭГПХ), для целей хранения, например, в течение примерно 60 дней, примерно 120 дней, примерно 180 дней, примерно года, примерно 2 лет или более. Жидкие составы настоящего изобретения также проявляют стабильность, которая оценивается, например, по ВЭГПХ, при комнатных температурах по крайней мере в течение нескольких часов, например одного часа, двух часов или примерно трех часов до момента применения.
В сферу охвата термина «малая молекула» и аналогичных терминов, среди прочих, входят пептиды, пептидомиметики, аминокислоты, аналоги аминокислот, полинуклеотиды, аналоги полинуклеотидов, нуклеотиды, аналоги нуклеотидов, органические или неорганические соединения (например, в том числе гетероорганические и (или) металлоорганические соединения), имеющие молекулярный вес менее чем примерно 10000 грамм на моль, органические или неорганические соединения, имеющие молекулярный вес менее чем примерно 5000 грамм на моль, органические или неорганические соединения, имеющие молекулярный вес менее чем примерно 1000 грамм на моль, органические или неорганические соединения, имеющие молекулярный вес менее чем примерно 500 грамм на моль, а также соли, эфиры и другие фармацевтические приемлемые формы таких соединений.
Поэтому в случае рака антитела настоящего изобретения могут вводиться по отдельности или в сочетании с другими препаратами для лечения рака, включая стандартные химиотерапевтические лекарства (паклитаксель, карбоплатин, цисплатин и доксорубицин), анти-EGFR агенты (гефитиниб, эрлотиниб и цетуксимаб), антиангиогенные агенты (бевакузимаб и сунитиниб), а также иммуномодуляторы, например, интерферон-α и талидомид.
Используемые в настоящем изобретении определения «терапевтический агент» или «терапевтические агенты» относятся к любому агенту (агентам), которые могут использоваться при лечении, контроле или смягчении синдромов заболеваний, нарушений, расстройств и т.п., связанных с аберрантными метаболизмом и активностью IL-4 и (или) IL-13.
Кроме того, антитела настоящего изобретения могут конъюгироваться с различными эффекторными молекулами, например гетерологическими полипептидами, лекарствами, радионуклидами или токсинами, см., например, WO 92/08495; WO 91/14438; WO 89/12624; патент США № 5314995; и EPO 396387. Антитело или его фрагмент могут конъюгироваться с терапевтическим агентом, например цитотоксином (например, цитостатическим или цитопатическим агентом), терапевтическим агентом или ионом радиоактивного металла (например, α-активным изотопом, таким как 213Bi). К цитотоксинам или цитотоксическим агентам относятся любые вещества, которые оказывают разрушительное воздействие на клетки. К примерам относятся паклитаксол, цитохалазин B, грамицидин D, этидий бромид, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромицин, а также их аналоги или гомологи. К терапевтическим агентам, среди прочих, относятся антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацил и декарбазин), алкилирующие агенты (например, мехлорэтамин, хлорамбуцил, мельфалан, кармустин (BSNU) и ломустин (CCNU), циклофосфамид, бусульфан, дибромманнитол, стрептозотоцин, митомицин C и цис-дихлородиаминплатина (II) (DDP) цисплатин), антрациклины (например, даунорубицин, дауномицин и доксорубицин), антибиотики (например, дактиномицин, актиномицин, блеомицин, митрамицин и антрамицин (AMC)), а также антимитотические агенты (например, винкристин и винбластин).
Методики конъюгации такой терапевтической функции с антителами хорошо известны, см., например, Arnon et al., в Monoclonal Antibodies and Cancer Therapy, Reisfeld et al. (eds.), p. 243-56 Alan R. Liss (1985); Hellstrom et al., в Controlled Drug Delivery, 2nd ed., Robinson et al., eds., p. 623-53, Marcel Dekker (1987); Thorpe, в Monoclonal Antibodies '84: Biological And Clinical Applications, Pinchera et al., eds., p. 475-506 (1985); Monoclonal Antibodies For Cancer Detection and Therapy, Baldwin et al., eds., p. 303-16, Academic Press (1985); и Thorpe, et al., Immunol Rev 62:119 (1982). В качестве альтернативы антитело может конъюгироваться со вторым антителом с образованием гетероконъюгата антитела, например бифункционального антитела, см., например, патент США № 4676980.
Конъюгаты настоящего изобретения могут использоваться для модификации заданного биологического ответа, терапевтический агент или лекарственный препарат не должны рассматриваться как ограничиваемые классическими химическими терапевтическими агентами. Например, в качестве лекарственного препарата может выступать белок или полипептид, обладающий желательной биологической активностью. К таким белкам могут, например, относиться токсин, такой как абрин, рицин А, экзотоксин псевдомонад или дифтерический токсин; белок, например фактор некроза опухоли, α-интерферон, β-интерферон, фактор роста нервов, тромбоцитарный фактор роста, активатор тканевого плазминогена, агент апоптоза, например TNF-α, TNF-β, AIM I (WO 97/33899), AIM II (WO 97/34911), лиганд Fas (Takahashi et al., Int Immunol, 6:1567 (1994)), VEGF (WO 99/23105); тромботический агент; антиангиогенный агент, например ангиостатин или эндостатин; или модификаторы биологического ответа, например лимфокины, интерлейкин-1 (IL-1), интерлейкин-2 (IL-2), интерлейкин-6 (IL-6), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), гранулоцитарный колониестимулирующий фактор (GCSF) или другие факторы роста.
Препараты для введения in vivo должны быть стерильными. Этого можно добиться, например, фильтрацией через стерильные фильтровальные мембраны. Например, жидкие препараты настоящего изобретения могут стерилизоваться фильтрацией через фильтр 0,2 мкм или 0,22 мкм.
Могут готовиться препараты с замедленным высвобождением. К характерным примерам препаратов с замедленным высвобождением относятся полупроницаемые матрицы твердых гидрофобных полимеров, содержащих антитело, эти матрицы представляют собой формованные изделия, например пленки или матрицы. Примеры матриц с замедленным высвобождением включают полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат), поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и этил-L-глутамата, неразлагающийся этиленвинилацетат, разлагающиеся сополимеры молочной кислоты-гликолевой кислоты (например, инъекционные микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты) и поли-D-(-)-3-гидроксимасляная кислота. Такие полимеры, как этиленвинилацетат и молочная кислота-гликолевая кислота, обеспечивают высвобождение молекул в течение более 100 дней, тогда как некоторые гидрогели высвобождают белки в течение более короткого времени. Можно выработать рациональные стратегии для стабилизации в зависимости от характерных механизмов. Например, если установлено, что механизм агрегирования связан с образованием межмолекулярной связи S-S за счет тиодисульфидного обмена, стабилизация может достигаться за счет модификации сульфгидрильных остатков, лиофилизации из кислых растворов, контроля содержания влаги, использования необходимых добавок, замены аминокислот и разработки специальных составов полимерных матриц.
Состав, содержащий антитело или его вариант, будет формулироваться, дозироваться и вводиться таким способом, который находится в соответствии с надлежащими принципами медицинской практики. К факторам, которые в данном случае необходимо принимать во внимание, относятся конкретное нарушение, подлежащее излечению, конкретное млекопитающее или человек, получающий лечение, клиническое состояние конкретного пациента, причина заболевания, зона доставки агента, метод введения, схема введения и другие факторы, известные врачам. «Терапевтическое эффективное количество» антитела или варианта, которое будет при этом вводиться, определяется приведенными выше соображениями, и может представлять собой минимальное количество, необходимое для предупреждения, подавления или лечения заболевания, состояния или нарушения, опосредованного IL-4 и (или) IL-13.
Антитело или его вариант могут быть включены в состав вместе с одним или несколькими агентами, используемыми в настоящее время для профилактики или лечения рассматриваемого заболевания. Эффективное количество таких других агентов зависит от количества антитела, присутствующего в составе, вида расстройства или лечения и других обсуждавшихся выше факторов. Они, как правило, используются в тех же дозировках и с теми же методами введения, которые применялись в описанном выше тексте или же составляют примерно от 1 до 99% от применявшихся до сих пор дозировок.
Использованный в настоящем документе термин «эффективное количество» относится к количеству лекарства (например, профилактического или терапевтического агента), достаточного для уменьшения остроты и (или) продолжительности заболевания, опосредованного IL-4 и (или) IL-13, подавления одного или нескольких его симптомов, предупреждения развития заболевания, опосредованного IL-4 и (или) IL-13, или начала регрессии заболевания, или достаточного для предупреждения развития, рецидивов, начала или прогресса заболевания, опосредованного IL-4 и (или) IL-13, или одного или нескольких его симптомов, или усиления или усиления профилактического и (или) терапевтического эффекта (эффектов) другого лекарства (например, другого терапевтического агента), применяемого для лечения заболевания, опосредованного IL-4 и (или) IL-13.
Количество лекарственного антитела или его фрагмента, которое будет эффективно при использовании или лечении конкретного заболевания или состояния, будет зависеть от природы расстройства или заболевания и может определяться стандартными клиническими методиками. По возможности, вначале in vitro можно получить кривую дозовой зависимости и фармацевтические составы настоящего изобретения. При наличии подходящей модели животных можно вновь исследовать кривую дозовой зависимости, и использовать ее для экстраполяции подходящей дозы для человека, опираясь на практические методы, известные специалистам в данной области. Вместе с тем, исходя из общих знаний в данной области, лекарственный препарат, эффективно стимулирующий снижение воспалительного эффекта, например, может обеспечивать местные концентрации лекарственного средства между 5 и 20 нг/мл, и, предпочтительно, между примерно 10 и 20 нг/мл.
В предпочтительном примере осуществления водный раствор лекарственного полипептида, антитела или его фрагмента может вводиться посредством подкожной инъекции. Каждую дозу можно менять в пределах от примерно 0,5 мг до примерно 50 мг на килограмм веса тела, или, более предпочтительно, от примерно 3 мг до примерно 30 мг на килограмм веса тела. Дозировку можно определить эмпирически для конкретного заболевания, группы пациентов, способа введения и т.п. с использованием фармацевтических методов, известных специалистам в данной области.
Схему дозировки для подкожного введения можно менять от раза в неделю до раза в день, в зависимости от набора клинических факторов, включая характер заболевания, степень остроты болезни и чувствительности пациента к терапевтическому агенту.
В настоящем изобретении предлагаются способы приготовления жидких препаратов антитела или его IL-4 и (или) IL-13-связывающего фрагмента, причем упомянутые способы включают концентрирование фракции очищенного антитела до конечной концентрации примерно 15 мг/мл, примерно 20 мг/мл, примерно 30 мг/мл, примерно 40 мг/мл, примерно 50 мг/мл, примерно 60 мг/мл, примерно 70 мг/мл, примерно 80 мг/мл, примерно 90 мг/мл, примерно 100 мг/мл, примерно 200 мг/мл, примерно 250 мг/мл, примерно 300 мг/мл или более, с использованием, например, полупроницаемой мембраны с соответствующим отсечением молекулярного веса (мв) (например, отсечением 30 кД для его F(ab')2 фрагментов; и отсечением 10 кД для Fab фрагментов).
Кроме того, настоящее изобретение включает стабильные жидкие препараты рассматриваемой продукции, которые повышали полувыведение in vivo. Так, период полувыведения рассматриваемого антитела из организма, предпочтительно, человека, больше 3 дней, больше 7 дней, больше 10 дней, больше 15 дней, больше 25 дней, больше 30 дней, больше 35 дней, больше 40 дней, больше 45 дней, больше 2 месяцев, больше 3 месяцев, больше 4 месяцев, больше 5 месяцев или более.
Для увеличения продолжительности нахождения антитела в сыворотке in vivo могут использоваться различные методики. Например, инертные полимерные молекулы, такие как полиэтиленгликоль (PEG) с высоким молекулярным весом, могут связываться с антителом через многофункциональный линкер или без него либо посредством сайт-специфической конъюгации PEG с N-концевым или с C-концевым окончанием антитела, либо через ε-аминогруппы, присутствующие в лизиновых остатках. Можно образовывать такие производные линейного или разветвленного полимера, которые обеспечивают минимальную потерю биологической активности. Степень конъюгации можно четко отслеживать по SDS-PAGE и с помощью масс-спектрометрии, чтобы обеспечить надлежащую конъюгацию молекул PEG с антителами. Непрореагировавший PEG можно отделить от конъюгатов антитело-PEG посредством гель-фильтрации или ионообменной хроматографии. Производные от PEG антитела могут также испытываться на предмет активности связывания, а также эффективности in vivo, для чего могут использоваться методы, известные специалистам в данной области, например, описанные в настоящем документе методы иммуноанализа.
Антитело, обладающее повышенным уровнем полувыведения in vivo, может также получаться посредством проведения одной или нескольких модификаций аминокислот (например, замен, вставок или делеций) в константный домен IgG, или его FcR-связывающий фрагмент (например, Fe или фрагмент шарнирной области домена Fe), см., например, WO 98/23289; WO 97/34631; и патент США № 6277375.
Кроме того, антитело можно конъюгировать с альбумином с образованием антитела, более стабильного in vivo или обладающего более продолжительным периодом полувыведения in vivo. Методики хорошо известны специалистам в данной области, см., например, WO 93/15199, WO 93/15200 и WO 01/77137; а также EPO 413622. Антитело можно также модифицировать, например, посредством гликозилирования, ацетилирования, фосфорилирования, амидирования, введения известных защитных/блокирующих групп, протеолитического расщепления, связывания с клеточным лигандом или другим белком и т.п.
В одном из примеров осуществления препарат составляют в соответствии со стандартными процедурами для лекарственных препаратов, приготовляемых для внутривенного введения в организм человека. Как правило, составы для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. В необходимых случаях состав может также включать солюбилизирующий агент и местный анестетик, например лидокаин или другой «каиновый» анестетик, для уменьшения боли в месте введения. Обычно ингредиенты поставляются либо отдельно, либо смешиваются в форме единичной дозировки, например в виде сухого лиофилизованного порошка, или безводного концентрата в герметичном контейнере, например в ампуле или в пакете с указанием количества активного агента. В случаях, когда состав должен вводиться посредством вливания, он может поставляться с флаконом для вливания, содержащим стерильную воду или физиологический раствор фармацевтической категории чистоты. Если состав вводится посредством инъекции, может поставляться ампула со стерильной водой или физиологическим раствором для инъекции, например в наборе, так что ингредиенты можно смешать перед введением.
В изобретении также предусматривается, что жидкий препарат настоящего изобретения помещается в герметичный контейнер, например ампулу или пакет с указанием количества рассматриваемого продукта. Жидкие препараты настоящего изобретения могут находиться в герметичном контейнере с указанием количества и концентрации антитела или фрагмента антитела. Жидкие препараты настоящего изобретения могут поставляться в герметичном контейнере, содержащем по крайней мере 15 мг/мл, 20 мг/мл, 30 мг/мл, 40 мг/мл, 50 мг/мл, 60 мг/мл, 70 мг/мл, 80 мг/мл, 90 мг/мл, 100 мг/мл, 150 мг/мл, 200 мг/мл, 250 мг/мл или 300 мг/мл антитела IL-4 и (или) IL-13, например в объеме, равном 1 мл, 2 мл, 3 мл, 4 мл, 5 мл, 6 мл, 7 мл, 8 мл, 9 мл, 10 мл, 15 мл или 20 мл.
Выпускается изделие, в состав которого входят средства для лечения описанных выше расстройств. Изделие представляет собой контейнер и ярлык. К подходящим контейнерам относятся, например, бутылки, флаконы, шприцы и пробирки. Контейнеры могут изготовляться из самых разных материалов, например стекло или пластик. Контейнер содержит состав, который пригоден для диагностики, профилактики или лечения состояния или заболевания, опосредованного IL-4 и (или) IL-13, и может иметь стерильное отверстие для отбора (например, в качестве контейнера может использоваться мешок с раствором для внутривенного введения или флакон с пробкой, прокалываемой иглой для подкожной инъекции). На ярлыке, который находится на контейнере или прилагается к нему, указывается, что состав используется для лечения определенного состояния. Изделие также может включать второй контейнер, содержащий фармацевтически приемлемый буфер, например фосфатно-буферный физиологический раствор, раствор Рингера и раствор декстрозы. Изделие также может включать другие материалы, желательные с точки зрения коммерческих приложений и пользователя, включая буферы, разбавители, фильтры, иглы, шприцы и вкладыши с инструкциями по применению.
Ниже для сведения специалистов в данной области приводятся иллюстрации настоящего изобретения в следующих, не исчерпывающихся данным перечислением, примерах, описывающих некоторые из вариантов осуществления, с помощью которых настоящее изобретение может быть реализовано на практике.
ПРИМЕРЫ
ПРИМЕР 1: СЕКВЕНИРОВАНИЕ ДОМЕНА Fv КЛОНА B-B13 МОНОКЛОНАЛЬНОГО АНТИТЕЛА МЫШИНОГО АНТИ-ЧЕЛОВЕЧЕСКОГО IL-13
В приведенном методе в качестве реагента использовали клон B-B13 моноклонального антитела мышиного анти-IL-13, приобретенный в Cell Sciences, Inc. (Кэнтон, Массачусетс, США). Cell Sciences является дистрибьютором в США продукции компании Diaclone (Безансон, Франция), которая производит антитело B-B13.
Аминокислотную последовательность клона B-B13 моноклонального антитела мышиного анти-IL-13 определяли одновременно N-концевым секвенированием по Эдману и масс-спектрометрическим анализом. Для получения полипептида или пептидных фрагментов антитело подвергали следующим различным процедурам, и полученные пептиды фракционировали с помощью различных методов для приготовления образцов, которые затем подвергали N-концевому секвенированию по Эдману и анализировали жидкостной хроматографией/масс-спектрометрией (ЖХ-МС/МС) в сочетании с сопоставлением пептидов с базой данных последовательностей белков.
После электрофореза в ПААГ с ДДС-Na антитела, обработанного или необработанного пироглутаминопептидазой, для разделения тяжелой и легкой цепей проводили блоттинг на поливинилиденфторидной мембране (ПВДФ) с последующим N-концевым секвенированием полос по Эдману.
После ограниченного частичного протеолиза специфическими протеазами антитела проводили электрофорез в ПААГ с ДДС-Na и блоттинг на ПВДФ мембране и N-концевое секвенирование полос по Эдману.
После ограниченного химического расщепления полос геля электрофореза в ПААГ с ДДС-Na полного антитела или тяжелой и легкой цепей проводили электрофорез в ПААГ с ДДС-Na и блоттинг на ПВДФ мембране и N-концевое секвенирование полос по Эдману.
Протеолиз полос геля электрофореза в ПААГ с ДДС-Na полного антитела или тяжелой и легкой цепей специфическими протеазами и анализ ЖХ/МС/МС.
После протеолиза полос геля электрофореза в ПААГ с ДДС-Na тяжелой и легкой цепей специфическими протеазами проводили хроматографическое фракционирование высокого давления на обращенной фазе (ОФ ВЭЖХ) с последующим N-концевым секвенированием по Эдману и анализом фракций ЖХ/МС/МС.
После ограниченного протеолиза антитела протеазой папаином, фракционирования полос геля электрофореза в ПААГ с ДДС-Na фрагмента Fd (фрагмент VH-CH1 тяжелой цепи антитела), протеолиза специфическими протеазами проводили высокоэффективное хроматографическое фракционирование на обращенной фазе (ОФ ВЭЖХ) с последующим N-концевым секвенированием по Эдману и анализом фракций ЖХ/МС/МС.
ПРИМЕР 2: СЕКВЕНИРОВАНИЕ ДОМЕНА Fv КЛОНА 8D4-8 МОНОКЛОНАЛЬНОГО АНТИТЕЛА МЫШИНОГО АНТИ-ЧЕЛОВЕЧЕСКОГО IL-4
В качестве реагента использовали клон 8D4-8 моноклонального антитела мышиного анти-IL-4, который приобретали в Biozol diagnostica Vertrieb GmbH (Эхинг, Германия). Biozol является дистрибьютором в Германии компании BioLegend (Сан-Диего, Калифорния, США), которая производит антитело 8D4-8.
Аминокислотную последовательность моноклонального антитела мышиного анти-IL-4 (клон 8D4-8) определяли одновременно N-концевым секвенированием по Эдману и масс-спектрометрическим анализом (Pham et al., 2006, Anal. Biochem. 352: 77-86; Roberts et al., 2005, Anal. Chem. 67: 3613-25). Вкратце, антитело вначале разделяли на легкую и тяжелую цепи, затем каждую цепь расщепляли последовательностью спефицических протеаз или химическим способом. Полученные пептиды разделяли обращенно-фазовой хроматографией и анализировали спектроскопией матричной лазерной десорбции/ионизации (MALDI) и/или ЖХ-МС/МС. Затем для однозначного установления последовательности белка индивидуальные пептиды, а также интактные тяжелые и легкие цепи подвергали секвенированию по Эдману.
ПРИМЕР 3: ГУМАНИЗАЦИЯ ДОМЕНА Fv КЛОНА B-B13 МОНОКЛОНАЛЬНОГО АНТИТЕЛА МЫШИНОГО АНТИ-ЧЕЛОВЕЧЕСКОГО IL-13
Для гуманизации клона В-В13 использовали протокол гуманизации, описанный выше в настоящем документе. Предложили шесть гуманизированных версий, которые включали мутации в CDR для учета проблемных остатков (сайт деамидирования, доступный для растворителя метионин, кислотные лабильные позиции).
Последовательности VL и VH для B-B13 сопоставляли при помощи программы BLAST по базе данных Protein Data Bank (PDB), версия июля 2007 года. Отобрали наиболее близкие аминокислотные последовательности легкой и тяжелой цепей. Ближайшим гомологом вариабельной легкой цепи была структура 1EGJ. Ближайшим гомологом вариабельной тяжелой цепи была структура 1FNS. Структуры 1EGJ и 1FNS использовали для построения гомологической модели вариабельных доменов, которые затем минимизировали по энергии с помощью стандартной процедуры, реализованной в среде Molecular Operating Environment (MOE). MOE представляет собой универсальный пакет программного обеспечения для компьютерной разработки лекарств, который поставляется группой Chemical Computing. Расчеты молекулярной динамики (МД) для трехмерной гомологичной модели B-B13 проводили для времени 1,7 наносекунд с использованием обобщенного метода Борна с неявным растворителем. Полученные 1700 отображений траектории МД затем использовали для расчета для каждой аминокислоты B-B13 распределения ее среднеквадратичного отклонения (rmsd) по сравнению с медианным положением. Статистический тест сопоставления распределения rmsd каждой аминокислоты с глобальным rmsd распределением затем использовали, чтобы установить, достаточно ли гибкая та или иная аминокислота, как было видно на МД, и может ли она, поэтому, взаимодействовать с В-клеточными рецепторами и отвечать за активацию иммунного ответа. Гибкие положения вариабельной области мышиного B-B13 сопоставляли с соответствующими положениями последовательностей антитела человека по версии базы данных ImMunoGeneTics за январь 2007 года, которая была загружена в локальную сеть. Для поиска использовали только те остатки, которые проявляли гибкость, более чем в три раза превышающую среднюю, и несколько фланкирующих остатков, которые обеспечивали сохранение трехмерной структуры этих гибких остатков. Вариабельную область антитела человека с наиболее близкими гибкими остатками, где особое внимание уделялось положениям, находящимся в окрестности 5,0 Å от CDR, отбирали для замещения гибких остатков вариабельной области мышиного антитела B-B13. Чтобы исключить проблемные остатки, некоторые мутации в CDR также включали в предлагаемые варианты. Рассматривали следующие мотивы последовательностей: Asp-Pro (кислотная лабильная связь), Asn-X-Ser/Thr (гликозилирование), Asn-Gly/Ser/Thr (сайт деамидирования в доступной области), Met (окисление в доступной области). Для того чтобы подтвердить обоснованность сделанных допущений, полученные гуманизированные последовательности сопоставляли программой BLAST на предмет подобия с информацией базы данных UniProtKB/Swiss-Prot. Установили, что все последовательности демонстрируют высокую степень подобия с несколькими антителами человека. Кроме того, ни одна из последовательностей не содержала ни одного известного эпитопа В- или Т-клеток, приведенных в базе данных иммунных эпитопов и аналитических ресурсов (база данных IEDB).
Предложили три версии тяжелой цепи (H1, H2, H3) и три версии легкой цепи (L1, L2, L3). Три версии легкой цепи получили из CAA83271.1 (номер доступа Genebank CAA83271). Версия L1 содержит 4 мутации. Версия L2 включает дополнительную мутацию для удаления сайта DP (Pro99) в CDR3. L3 включает две дополнительные мутации, находящиеся в CDR, по сравнению с L2, которые представляют собой два предположительных сайта деамидирования (N34Q, N96A). H1, H2 и H3 версии тяжелой цепи получили из CAC39364.1 (номер доступа Genebank CAC39364). Данная матрица не была наилучшей, но она была самой подходящей матрицей, не содержащей последовательности с самой высокой гомологией (>70%) с известной иммуногенной последовательностью. Версия H1 содержит 6 мутаций, и последовательность H2 включает две дополнительные мутации для учета трех сайтов деамидирования (N60A, N73T и N83T). Последовательная нумерация аминокислот отражает их естественный порядок в белке (от N-концевого окончания до C-концевого окончания). H3 содержит две дополнительные мутации (Y100R и D106K), которые, предположительно, обеспечивают более высокий потенциал. Для получения гуманизированных антител рекомендованы шесть комбинаций вариантов VL и VH: VL1×VH1, VL2×VH2, VL1×VH3, VL3×VH1, VL3×VH2 и VL3×VH3. Как показано в таблице 1, изменения в последовательности аминокислот проводили в гуманизированных вариантах VL и VH для В-В13 с применением методики изменения поверхности (resurfacing), которая изложена в разделе настоящей заявки с подробным описанием изобретения. В левом столбце перечислены исходные аминокислоты и их положения в мышином B-B13 mAb.
(последовательная нумерация)
ПРИМЕР 4: ГУМАНИЗАЦИЯ ДОМЕНА Fv КЛОНА 8D4-8 МОНОКЛОНАЛЬНОГО АНТИТЕЛА МЫШИНОГО АНТИ-ЧЕЛОВЕЧЕСКОГО IL-4
Для гуманизации клона 8D4-8 использовали технологию гуманизации (resurfacing), описанную выше в настоящем документе. Приготовили две гуманизированных версии. Одна версия включает одну мутацию областей CDR тяжелой цепи, которая, как предполагалось, заменяла потенциально проблематичный остаток (доступная кислотная лабильная позиция).
Последовательности VL и VH для 8D4-8 сопоставляли программой BLAST по базе данных PDB, версия июля 2007 года. Отобрали наиболее близкие аминокислотные последовательности легкой и тяжелой цепей. Ближайшим гомологом вариабельной легкой цепи является структура 1YDJ. Ближайшим гомологом вариабельной тяжелой цепи была структура 1IQW. Структуры 1YDJ и 1IQW использовали для построения гомологической модели вариабельных доменов, которые затем минимизировали по энергии с помощью стандартной процедуры, реализованной в среде MOE. Расчеты молекулярной динамики (МД) для трехмерной гомологичной модели 8D4-8 проводили для времени 1,7 наносекунд с использованием обобщенного метода Борна с неявным растворителем. Полученные 1700 отображений траектории МД затем использовали для расчета для каждой аминокислоты 8D4 распределения ее среднеквадратичного отклонения (rmsd) по сравнению с медианным положением. Статистический тест сопоставления распределения rmsd каждой аминокислоты с глобальным rmsd распределением затем использовали, чтобы установить, достаточно ли гибкая та или иная аминокислота, как было видно на МД, и может ли она, поэтому, взаимодействовать с В-клеточными рецепторами и отвечать за активацию иммунного ответа. Гибкие положения вариабельной области мышиного 8D4-8 сопоставляли с соответствующими положениями последовательностей антитела человека по версии базы данных ImMunoGeneTics за январь 2007 года, которая была загружена в локальную сеть. Для поиска использовали только те остатки, которые проявляли гибкость, более чем в три раза превышающую среднюю, и несколько фланкирующих остатков, которые обеспечивали сохранение трехмерной структуры этих гибких остатков. Для замены гибких остатков вариабельного участка мышиного антитела 8D4-8 выбрали вариабельную область антитела человека с наибольшей степенью идентичности гибких остатков, обращая особое внимание на положения, находящееся в пределах 5,0 Å от гипервариабельных участков. Затем также подготовили дополнительные мутации, чтобы избежать проблематичных остатков. Рассматривали следующие мотивы последовательностей: Asp-Pro (кислотная лабильная связь), Asn-X-Ser/Thr (гликозилирование), Asn-Gly/Ser/Thr (сайт деамидирования в доступной области), Met (окисление в доступной области). Единственным проблематичным остатком оказался сайт DP в области CDR2 тяжелой цепи. Для того чтобы подтвердить обоснованность сделанных допущений, полученные гуманизированные последовательности сопоставляли программой BLAST на предмет подобия с информацией базы данных UniProtKB/Swiss-Prot. Для всех последовательностей получили высокую степень гомологии с рядом антител человека. Кроме того, ни одна из последовательностей не содержала ни одного из известных эпитопов для B-клеток или T-клеток, перечисленных в базе данных IEDB.
Предложили два варианта тяжелой цепи (H1, H2) и один вариант легкой цепи (L1). Версию L1 легкой цепи получили из BAC01676.1 (номер доступа Genebank BAC01676). Версия L1 содержит 3 мутации. Версии H1 и H2 тяжелой цепи получили из BAC02418.1 (номер доступа Genebank BAC02418). Версия H1 включает 9 мутаций, и версия H2 включает дополнительную мутацию для удаления сайта DP (Pro53) в CDR2. Подготовили два соединения, VL1×VH1 и VL1×VH2.
В таблице 2 показаны изменения в последовательностях аминокислот, которые проводили в гуманизированных вариантах VL и VH для 8D4-8 с применением технологии гуманизации (resurfacing). В левом столбце перечислены исходные аминокислоты и их положения в мышином 8D4-8 mAb.
(последовательная нумерация)
ПРИМЕР 5: КЛОНИРОВАНИЕ И ГЕНЕРАЦИЯ ХИМЕРНОГО КЛОНА B-B13 МОНОКЛОНАЛЬНОГО АНТИ-IL-13 АНТИТЕЛА, ХИМЕРНОГО КЛОНА 8D4-8 МОНОКЛОНАЛЬНОГО АНТИТЕЛА АНТИ-IL-4 И ГУМАНИЗИРОВАННЫХ ВАРИАНТОВ
Последовательности аминокислот вариабельной тяжелой и легкой цепи клона B-B13 анти-IL-13 и клона 8D4-8 анти-IL-4 транслировали обратно в последовательность нуклеотидов и генерировали, соответственно, с помощью модифицированного протокола ПЦР с удлинением перекрывания (OE-PCR), описанного в работе Young L. и Dong Q. (Nucl. Acids Res. (2004), 32(7), e59). Продукты ПЦР клонировали в pCR®4-TOPO с помощью комплекта клонирования Invitrogen TOPO TA (кат. №45-0641) и секвенировали с помощью прямого M13 и обратного M13 праймеров. Вариабельные домены сливали в постоянную тяжелую (IGHG1, номер в каталоге Genebank Q569F4) или легкую (IGKC, номер в каталоге Genebank Q502W4) цепь, соответственно, обрабатывали NheI и HindIII и каждый из них лигировали в положения NheI/HindIII вектора эписомальной экспрессии pXL, аналога вектора pTT, описанного в работе Durocher et al. (2002), Nucl. Acids Res. 30(2), E9, создавая плазмиды для экспрессии млекопитающими химерных тяжелых и легких цепей B-B13 и химерных тяжелых и легких цепей 8D4-8.
Клоны экспрессии, кодирующие гуманизированные варианты клона B-B13 анти-IL-13 и клона 8D4-8 анти-IL-4 также синтетически генерировали методом ПЦР с удлинением перекрывания (OE-PCR) на основе предложенных обменов аминокислот оригинальных последовательностей.
Плазмиды экспрессии, кодирующие тяжелую и легкую цепь антитела, репродуцировали в E.coli DH5a. Плазмиды, используемые для трансфекции, получали из E.coli с помощью комплекта Qiagen EndoFree Plasmid Mega Kit.
Для трансфекции клетки HEK293FreeStyle (Invitrogen) сеяли по 3×105 клеток на мл в 100-мл объем не содержащей сыворотки среды FreeStyle (Invitrogen) в 500-мл шейкерной колбе. Клетки культивировали в инкубаторе при температуре 37°C с увлажненной атмосферой с 8% CO2 на ротационном шейкере, вращающемся со скоростью 110 оборотов в минуту.
Через три дня после посева определяли количество жизнеспособных клеток и полное количество клеток с помощью электронного цитометра CASY (Schärfe System GmbH). Клетки с жизнеспособностью выше 90% использовали для трансфекции с плотностью клеток 1-1,5×106 клеток на мл. 100 мл клеток трансфектировали в шейкерную колбу объемом 500 мл со смесью плазмид экспрессии с тяжелой и легкой цепью (5×10-7 мкг ДНК на клетку) с помощью FugeneHD (Roche) при соотношении ДНК:FugeneHD 2:7 в условиях, описанных производителем. Трансфектированные клетки культивировали в течение 7 дней в инкубаторе при температуре 37°C (8% CO2) на ротационном шейкере со скоростью 110 оборотов в минуту.
Планшету Nunc F96-MaxiSorp-Immuno покрывали козьим античеловеческим IgG (Fc-специфическим) [NatuTec A80-104A]. Антитело разбавляли до 10 мкг/мл в карбонатном буфере для нанесения покрытий (50 мМ карбоната натрия, pH 9,6) и добавляли по 50 мкл на лунку. Планшету запечатывали клейкой лентой и хранили в течение ночи при температуре 4ºC. Планшету трижды промывали промывочным буфером (PBS pH 7,4 0,1% Tween20). 150 мкл блокирующего раствора (1% BSA/PBS) добавляли в каждую лунку планшеты. Через 1 час при комнатной температуре планшету промывали 3 раза промывочным буфером. Добавляли 100 мкл образца или стандартов (в диапазоне от 1500 нг/мл до 120 нг/мл) и оставляли на 1 час при комнатной температуре. Планшету 3 раза промывали промывочным буфером. 100 мкл козьего античеловеческого IgG-FC – HRP конъюгата [NatuTec A80-104P-60], разбавленного в пропорции 1:10000, добавляли с помощью инкубационного раствора (0,1%BSA, PBS pH 7,4, 0,05% Tween20). Через 1 час инкубации при комнатной температуре планшету промывали 3 раза промывочным буфером. 100 мкл субстрата ABTS (10 мг таблетка ABTS (Pierce 34026) в мл раствора 0,1 М Na2HPO4, 0,05 М лимонной кислоты, pH 5,0. Добавили 10 мкл 30% H2O2/10 мл буфера субстрата перед использованием) в каждую из лунок до появления окраски. После появления окраски (примерно через 10-15 минут) добавили 50 мкл 1% раствора SDS, чтобы остановить реакцию. Планшету просматривали на A405.
Белки очищали аффинной хроматографией со средой Protein A (HiTrap™ Protein A HP Columns, GE Life Sciences). После элюирования из колонки ацетатным буфером 100 мМ с 100 мМ NaCl pH 3,5 получали моноклональные антитела в PBS и фильтровали их через фильтр 0,22 мкм. Концентрацию белка определяли по поглощению на длине волны 280 нм. Каждую партию анализировали при помощи набора Protein 200 Plus LabChip на биоанализаторе Agilent 2100 в восстановительных и невосстановительных условиях для определения чистоты и молекулярного веса каждой субъединицы и мономера.
ПРИМЕР 6: ХАРАКТЕРИЗАЦИЯ ГУМАНИЗИРОВАННЫХ ВАРИАНТОВ КЛОНА B-B13 АНТИ-IL-13 И ГУМАНИЗИРОВАННЫХ ВАРИАНТОВ КЛОНА 8D4-8 АНТИ-IL-4
Реагенты рекомбинантных IL-13 и IL-4 человека приобретали в компании Chemicon (США). Кинетический анализ Biacore выполняли следующим образом.
Для подробной кинетической характеризации очищенных антител использовали технологию поверхностного плазмонного резонанса на Biacore 3000 (GE Healthcare). Применяли анализ методом ловушки с помощью антитела, специфичного к видам (например, человеческого Fc специфического MAB 1302, Chemicon) для захвата и ориентации исследуемых антител. Антитело-ловушку обездвиживали первичными аминными группами (10000 RU) на чипе исследовательского класса CM5 (GE Life Sciences) с помощью стандартных методов. Анализируемое антитело ловили с отрегулированным значением RU, приводящим к максимальному связыванию анализируемого вещества при 30 RU и скорости потока 10 мкл/мин. Измеряли кинетику связывания в зависимости от рекомбинантного человеческого IL-4 и IL-13 в диапазоне концентраций от 0 до 50 нМ в HBS EP (10 мМ HEPES pH 7,4, 150 мМ NaCl, 3 мМ EDTA, 0,005 % поверхностно-активное вещество P20) при скорости потока 30 мкл/мин. Поверхности чипа регенерировали с помощью 10 мМ глицина pH 2,5. Кинетические параметры анализировали и вычисляли в программном пакете BIAevaluation с помощью проточной кюветы без антитела-ловушки в качестве контрольного образца. Для исследования аддитивного связывания обоих антигенов применяли автоматический метод одновременной инжекции, в котором инжектировали один антиген, а сразу после этого - смесь антигенов IL-13/IL-4.
Антитела, составляющие предмет настоящего изобретения, измеряли на биологическую активность, измеряя ингибирование пролиферации клеток, опосредованной IL-4 или IL-13. Одним словом, заявители использовали IL-4 или IL-13 для стимуляции роста клеток TF-1. TF-1 - это линия клеток, зависимая от цитокинов для роста, которая реагирует на многие цитокины, в том числе IL-4 и IL-13. Индуцированный рост (по сравнению с нормальными условиями в отсутствии цитокина) представляет биологическую активность IL-4 или IL-13. Анти-IL-4, анти-IL-13 и биспецифические антитела анти-IL-4/IL-13, как выяснилось, блокируют рост клеток TF-1, индуцированный IL-4 или IL-13. Кроме того, биспецифические антитела анти-IL-4/IL-13, как было показано, блокируют пролиферацию клеток TF-1, индуцированную комбинированной стимуляцией IL-4 и IL-13. Блокирующий эффект измеряли зависимым от дозы образом с получением IC50 (концентрации антитела с 50% ингибированием) как способность к нейтрализации антителом его мишени, т.е. IL-4 или IL-13. Использовавшиеся методы подробнее описаны ниже.
Клетки TF-1 (ATCC, CRL-2003) выдерживали в полной среде (DMEM с высоким содержанием глюкозы, 25 мМ буфера Hepes и глутамином, 10% FBS, 1×P/S, 1 мМ пирувата натрия), содержащей только что добавленный hGM-CSF в конечной концентрации 4 нг/мл. За 24 часа до обработки IL-13 (15 нг/мл) или IL-4 (1 нг/мл). Клетки высеивали в 96-луночной планшете в количестве 0,05×106/мл в полной среде без hGM-CSF. Последовательно разбавленные растворы антитела с соответствующим цитокином предварительно инкубировали в течение 30 минут при температуре 37°C, прежде чем добавлять к клеткам. Клетки культивировали в течение 72 часов (37°C, 5% CO2). Добавляли водный раствор MTS/PMS cellTiter 96. Затем клетки инкубировали в течение 3 часов. По истечении этого периода записывали поглощение на длине волны 490 нм с помощью устройства для чтения планшет. Значения IC50 вычисляли с помощью программы Speed.
Кинетика связывания и активность нейтрализации гуманизированных вариантов B-B13 показана в таблице 3. (nt=не тестировалось).
(M)
(M)
Один гуманизированный вариант B-B13, huB-B13 VL3xVH2, имеет значительно более высокую аффинность по сравнению с оригинальным мышиным B-B13 (в 13 раз) и химерным B-B13 (в 6 раз). Повышенная аффинность может приводить к повышенной активности и эффективности, когда эти гуманизированные антитела анти-IL-13 будут использоваться для лечения больных астмой. Кроме того, гуманизированные антитела могут иметь пониженную иммуногенность по сравнению с мышиным антителом или химерным антителом при использовании в организме человека.
Кинетика связывания и активность нейтрализации гуманизированных вариантов 8D4-8 показана в таблице 4.
(M-1×S-1)
(S-1)
(M)
(M)
Один гуманизированный вариант 8D4-8, hu8D4-8 VL1xVH1, имеет значительно более высокую аффинность по сравнению с оригинальным мышиным 8D4-8 (в 11 раз) и химерным 8D4-8 (в 2 раза). Повышенная аффинность может приводить к повышенной активности и эффективности, когда это гуманизированное антитело анти-IL-4 будет использоваться для лечения больных астмой. Кроме того, гуманизированное антитело может иметь пониженную иммуногенность по сравнению с мышиным антителом или химерным антителом при использовании в организме человека.
ПРИМЕР 7: КЛОНИРОВАНИЕ И ГЕНЕРАЦИЯ ГУМАНИЗИРОВАННЫХ БИСПЕЦИФИЧЕСКИХ АНТИТЕЛ АНТИ-IL-4/IL-13
Формат, использовавшийся для экспрессии биспецифических антител (BsAb), - вариант IgG двухдоменного формата с двумя головками, описанного в патенте США 5989830. В этом формате молекула IgG удлинена по концевому N-остатку соответствующей тяжелой или легкой цепи дополнительным вариабельным доменом второго антитела. Таким образом, получающаяся молекула IgG представляет собой гетеротетрамер, состоящий из двух тяжелых и двух легких цепей. Тяжелые цепи состоят из двух вариабельных тяжелых доменов (VH1-VH2), происходящих от двух разных антител, соединенных мостиком, состоящим из десяти аминокислот (G4S)2, и слитых с постоянным доменом IgG4. Легкие цепи состоят из двух вариабельных легких доменов (VL1-VL2), происходящих от двух разных антител, соединенных мостиком, состоящим из десяти аминокислот (G4S)2, и слитых с постоянным каппа-областью.
Последовательности для вариабельных тяжелых и легких доменов вариантов 8D4-8 генерировали ПЦР, с введением сайта рестрикции BamHI (GGA TCC) в соответствующие 5’-концы, кодирующего часть (G4S)2-(GGA TCC)-8D4-8. Последовательность 3’ VH гуманизированных вариантов 8D4-8 заканчивалась сайтом рестрикции ApaI (кодирующим первые аминокислоты домена CH1) для последующего сливания с последовательностью IGHG4 (Q569F4, с детектированием концевого Lys и S241P и L248E двойной мутации). 3’-конец VL8D4-8 заканчивались сайтом рестрикции BsiWI, кодирующим первые две аминокислоты постоянной каппа-цепи для последующего сливания с IGKC (номер в каталоге Gene Bank Q502W4).
Последовательности для вариабельных тяжелых и легких доменов вариантов B-B13 генерировали ПЦР с введением сайта рестрикции BamHI в соответствующие 3’-концы, кодирующее часть (G4S)2-(B-B13)-(GGA GGC GGA GGG TCC GGA GGC GGA GGA TCC (SEQ ID NO: 7)). Обе последовательности для VH и VL вариантов B-B13 генерировали с сайтом рестрикции NheI в соответствующих 5’-концах с последующим стартовым кодоном ATG и последовательностью кодирования лидерного пептида.
VH B-B13 и 8D4-8 сливали по положениям BamHI в линкере (G4S)2. VL B-B13 и 8D4-8 сливали по положениям BamHI в линкере (G4S)2. Таким образом, генерируемые тандемы тяжелых и легких цепей имели следующий состав.
Тяжелая цепь биспецифического антитела: NheI-лидерный пептид-VH-B-B13 - (G4S)2 - VH 8D4-8-ApaI.
Легкая цепь биспецифического антитела: NheI-лидерный пептид-VL-B-B13 - (G4S)2 - VL 8D4-8-BsiWI.
Все промежуточные фрагменты ПЦР клонировали в pCR®4-TOPO с помощью комплекта для клонирования Invitrogen TOPO TA (кат. №: 45-0641) и секвенировали с помощью прямых M13 и обратных M13 праймеров.
После проверки последовательности тандемы с тяжелой цепью сливали по положению ApaI с последовательностью IGHG4, а переменные тандемы с легкой цепью сливали по положению BsiWI с IGKC. Полученную двухдоменную тяжелую цепь и легкую цепь обрабатывали NheI и HindIII и лигировали в положения NheI/HindIII вектора эписомальной экспрессии pXL, создавая плазмиды для экспрессии млекопитающими TBTI-тяжелых и легких цепей, соответственно.
Четыре гуманизированные биспецифические конструкции анти-IL-4/анти-IL-13 генерировали на основе следующих сочетаний гуманизированных версий VH и VL B-B13 и 8D4-8, как показано в таблице 5.
ПРИМЕР 8: ХАРАКТЕРИЗАЦИЯ ГУМАНИЗИРОВАННЫХ БИСПЕЦИФИЧЕСКИХ АНТИТЕЛ
Анализ активности связывания и нейтрализации проводили в соответствии с описанием, приведенным в предыдущих примерах.
В таблице 6 показана кинетика связывания четырех гуманизированных вариантов антител анти-IL-4/IL-13. Все четыре конструкции биспецифических антител связываются с IL-4 и IL-13 с высокой аффинностью.
Данные об активности нейтрализации гуманизированных вариантов биспецифического антитела анти-IL-4/IL-13 приведены в таблице 7. И huTBTI3-1_1 и huTBTI3-2_1 полностью нейтрализовали пролиферацию клеток TF-1, индуцированную IL-13 или IL-4, со значениями IC50, приведенными ниже.
Хорошо известно, что мутантная аллель IL-13 часто связана с астмой (Heinzmann A. et al., 2000, Hum Mol Genet 9, 4, p549-559). Поэтому была изучена кинетика связывания биспецифических антител с мутантным белком IL-13 (вариант IL-13 человека R112Q, PeproTech, Rocky Hill, NJ, USA). Результаты показали, что huTBTI3-1_1 и huTBTI3-2_1 связываются с вариантом IL-13 так же, как и с IL-13 дикого типа.
В таблице 8 показана кинетика связывания гуманизированных молекул анти-IL-4/IL-13 с мутантным белком IL-13.
(M-1×S-1)
(S-1)
(M)
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕ IL-4 И/ИЛИ IL-13, И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2580049C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕ IL-4 И/ИЛИ IL-13, И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2705551C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕ IL-4 И/ИЛИ IL-13, И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2488595C2 |
| АНТИ-IL-22R-АНТИТЕЛА | 2017 |
|
RU2758721C2 |
| ТРИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА ПРОТИВ IL-17A, IL-17F И ДРУГОЙ ПРОВОСПАЛИТЕЛЬНОЙ МОЛЕКУЛЫ | 2016 |
|
RU2680011C2 |
| IL-1бета-СВЯЗЫВАЮЩИЕ АНТИТЕЛА И ИХ ФРАГМЕНТЫ | 2006 |
|
RU2518295C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К IL-5Rα | 2017 |
|
RU2698048C2 |
| МОЛЕКУЛЫ АНТИТЕЛ ЧЕЛОВЕКА К IL-13 | 2004 |
|
RU2387667C2 |
| АНТИТЕЛА ПРОТИВ IL-6, КОМПОЗИЦИИ, СПОСОБЫ И ПРИМЕНЕНИЕ | 2002 |
|
RU2318829C2 |
| СВЯЗЫВАЮЩИЕ IL-1 БЕЛКИ | 2011 |
|
RU2615173C2 |





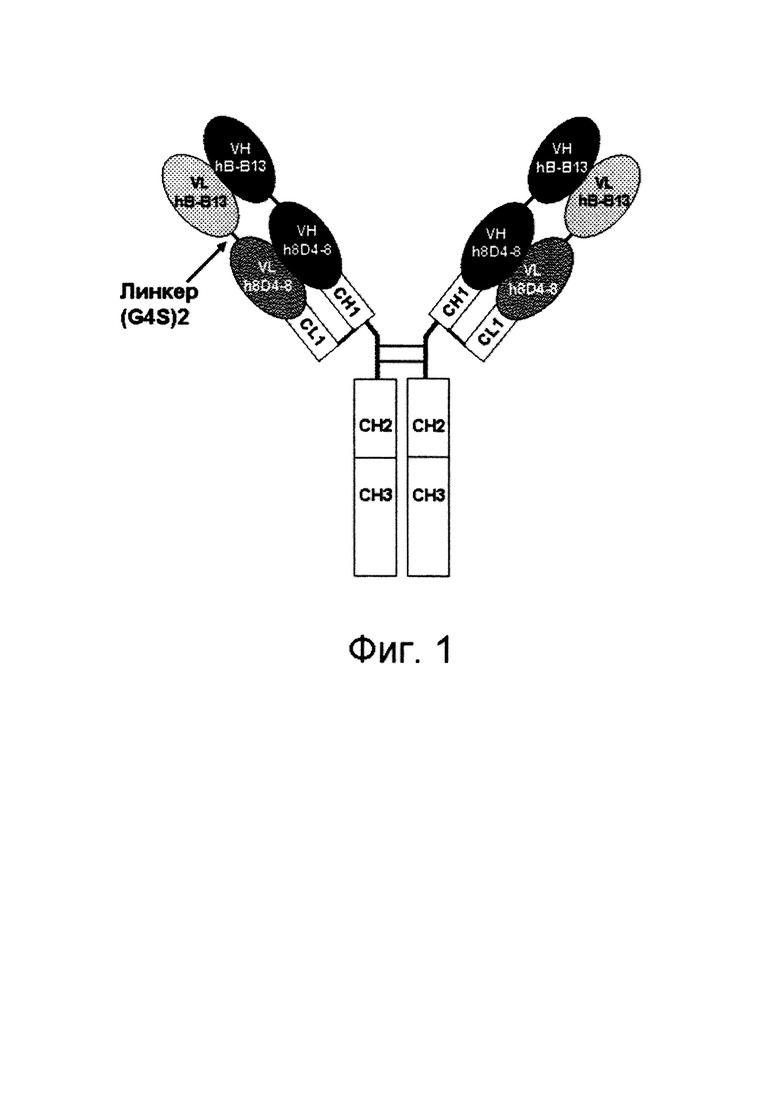

Изобретение относится к области биотехнологии. Предложены новые гуманизированные антитела, специфически связывающиеся с IL-4, и новые биспецифические антитела, которые специфически связываются с IL-4 и IL-13. Изобретение также включает использование антител для лечения или профилактики опосредованных IL-4 заболеваний или нарушений. 11 н. и 9 з.п. ф-лы, 2 ил., 8 табл., 8 пр.
1. Выделенное гуманизированное антитело или его фрагмент, которое(ый) специфически связывается с IL-4,
где антитело или его фрагмент содержит:
(a) вариабельный домен легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 3, и
вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 4;
(b) вариабельный домен легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 3, и
вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 5;
(с) вариабельный домен легкой цепи, содержащий аминокислотные последовательности
HASQNIDVWLS (CDR1),
KASNLHTG (CDR2) и
QQAHSYPFT (CDR3), и
вариабельный домен тяжелой цепи, содержащий аминокислотные последовательности
GYSFTSYWIH (CDR1),
IDPSDGETR (CDR2) и
LKEYGNYDSFYFDV (CDR3); или
(d) вариабельный домен легкой цепи, содержащий аминокислотные последовательности
HASQNIDVWLS (CDR1),
KASNLHTG (CDR2) и
QQAHSYPFT (CDR3), и
вариабельный домен тяжелой цепи, содержащий аминокислотные последовательности
GYSFTSYWIH (CDR1),
IDASDGETR (CDR2) и
LKEYGNYDSFYFDV (CDR3).
2. Выделенное гуманизированное антитело или его фрагмент, которое(ый) специфически связывается с IL-4,
где антитело или его фрагмент содержит:
(а) вариабельный домен легкой цепи, содержащий аминокислотные последовательности
HASQNIDVWLS (CDR1),
KASNLHTG (CDR2) и
QQAHSYPFT (CDR3), и
где вариабельный домен легкой цепи содержит аминокислотную последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 3, и
вариабельный домен тяжелой цепи, содержащий аминокислотные последовательности
GYSFTSYWIH (CDR1),
IDPSDGETR (CDR2) и
LKEYGNYDSFYFDV (CDR3), и
вариабельной домен тяжелой цепи содержит аминокислотную последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 4; или
(b) вариабельный домен легкой цепи, содержащий аминокислотные последовательности
HASQNIDVWLS (CDR1),
KASNLHTG (CDR2) и
QQAHSYPFT (CDR3), и
где вариабельный домен легкой цепи содержит аминокислотную последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 3, и
вариабельный домен тяжелой цепи, содержащий аминокислотные последовательности
GYSFTSYWIH (CDR1),
IDASDGETR (CDR2) и
LKEYGNYDSFYFDV (CDR3), и
вариабельной домен тяжелой цепи содержит аминокислотную последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 5.
3. Биспецифическое антитело или фрагмент биспецифического антитела, которое(ый) специфически связывается с IL-4 и IL-13, где часть антитела, которая специфически связывается с IL-4, определена в п.1 или 2.
4. Антитело или его фрагмент по п.1, где антитело или его фрагмент содержит домены константной области.
5. Антитело или его фрагмент по п.4, где домены константной области выбраны из группы, состоящей из CH1, CH2, CH3 и CL.
6. Антитело или его фрагмент по п.1, где антитело или его фрагмент представляет собой антитело IgG или его фрагмент.
7. Антитело или его фрагмент по п.6, где антитело IgG или его фрагмент представляет собой антитело IgG4 или его фрагмент.
8. Конъюгат для доставки, содержащий антитело или его фрагмент по п.1 или 2 и эффекторную молекулу.
9. Конъюгат для доставки по п.8, где эффекторная молекула представляет собой гетерологичный полипептид, лекарственное средство, радионуклеотид или токсин.
10. Фармацевтическая композиция для лечения IL-4-опосредованного заболевания, содержащая эффективное количество антитела или его фрагмента по любому из пп.1-7 или конъюгат для доставки по п.8 или 9 и фармацевтически приемлемый носитель.
11. Антитело или его фрагмент по любому из пп.1-7, которое содержит метку, где метка представляет собой радиометку, флуорофор, хромофор, агент визуализации или ион металла.
12. Применение терапевтически эффективного количества антитела или его фрагмента по любому из пп.1-7 для получения лекарственного средства для лечения IL-4-опосредованного заболевания.
13. Применение по п.12, где IL-4-опосредованное заболевание представляет собой аллергическое заболевание, злокачественное новообразование, астму, заболевание, связанное с патологической продукцией IL-4, аутоиммунное заболевание, склеродерму или идиопатический легочный фиброз.
14. Антитело или его фрагмент по любому из пп.1-7 для получения лекарственного средства для лечения, подавления или профилактики IL-4-опосредованного заболевания у млекопитающего.
15. Применение по п.14, где IL-4-опосредованное заболевание выбрано из группы, состоящей из аллергического заболевания, астмы, злокачественного новообразования, аутоиммунного заболевания, заболевания, связанного с патологической продукцией IL-4, склеродермы и идиопатического легочного фиброза.
16. Применение терапевтически эффективного количества антитела или его фрагмента по любому из пп.1-7 для получения лекарственного средства для подавления ответа, опосредованного TH-2.
17. Применение антитела или его фрагмента по любому из пп.1-7 для подавления ответа, опосредованного TH2, у млекопитающего.
18. Выделенная молекула нуклеиновой кислоты, кодирующая антитело или его фрагмент по любому из пп.1-7.
19. Вектор экспрессии, содержащий молекулу нуклеиновой кислоты по п.18.
20. Выделенная клетка-хозяин для получения антитела или его фрагмента по любому из пп.1-7, содержащая вектор по п.19.
| US 5705154 A, 06.01.1998 | |||
| WO 2007107349 A1, 27.09.2007 | |||
| РЕКОМБИНАНТНЫЕ IL4-АНТИТЕЛА, ИСПОЛЬЗУЕМЫЕ ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ, СВЯЗАННЫХ С ДЕЙСТВИЕМ IL4 | 1994 |
|
RU2162711C2 |
| HART T.K | |||
| et al., Preclinical efficacy and safety of pascolizumab (SB 240683): A humanized anti-interleukin-4 antibody with therapeutic potential in asthma, Clin Exp Immunol, 2002, vol.130, no.1, pp.93-100. | |||
Авторы
Даты
2020-05-18—Публикация
2015-09-29—Подача