Область техники
Настоящее изобретение относится к области биотехнологии, а именно к антителам или их антигенсвязывающим фрагментам, а также их применению. Более конкретно, настоящее изобретение относится к моноклональным антителам, которые специфически связываются с IL-5R((α-цепь рецептора интерлейкина 5). Изобретение также относится к нуклеиновой кислоте, кодирующей данное антитело или его антигенсвязывающий фрагмент, вектору экспрессии, способу получения антитела и применению антитела для лечения заболеваний или нарушений, связанных с IL-5Rα.
Уровень техники
Интерлейкин 5 (IL-5), провоспалительный цитокин, группы гранулоцитарно-макрофагальных колониестимулирующих факторов, который представляет собой четырехспиральный белок. Основными продуцентами интерлейкина 5 являются Тh2-клетки, тучные клетки. IL-5 стимулирует пролиферацию и дифференцировку активированных В-лимфоцитов, индуцирует переключение синтеза иммуноглобулинов на IgА. Многие функции эозинофилов и базофилов опосредованы действием интерлейкина-5 (IL-5). Известно, что IL -5 способствует дифференцировке и активации эозинофилов, а также увеличивает их жизнеспособность, ингибируя апоптоз [Lotvall J., Pullertis T. Treating asthma with Anti-IgE or Anti IL-5. Curr Pharm Des. 1999; 5:757–70 и Kolbeck R., Kozhich A., Koike M. et al. Medi-563, a humanized anti-IL-5 receptor alpha mAb with enhanced antibody-dependent cell mediated cytotoxicity function. J Allergy Clin Immunol. 2010;125(1):1344–53].
IL-5 реализует свое действие через специфический рецептор (IL-5R), экспрессированный на предшественниках человеческих эозинофилов и базофилов и на зрелых эозинофилах и базофилах. IL-5R состоит из уникальной α-цепи (IL-5Ra/CD125, внеклеточный домен) и общей с рецепторами к IL-3 и GM-CSF β-цепи (bc/CD131), которая сама по себе не связывает лиганд, однако повышает сродство IL-5 к одноименному рецептору и принимает непосредственное участие в трансдукции сигнала [Tetsuya A., Rafeul A. The mechanism of IL-5 signal transduction American Journal of Physiology - Cell Physiology Published 1 Sep-tember 1998 Vol.275 no. 3, C623-C633].
Развитие эозинофилии связывают с избирательной экспрессией IL-5R на ранних клетках-предшественниках эозинофилов в костном мозге. Таким образом, для подавления эозинофилии наиболее целесообразным представляется блокирование взаимодействия между IL-5 и его клеточным рецептором.
Терапевтическая значимость подавления эозинофилии обусловлена высокими уровнями эозинофильных гранулоцитов при ряде патологических процессов. Так увеличение содержания эозинофилов в дыхательных путях у больных бронхиальной астмой, эпителии пищевода у больных эозинофильным эзофагитом лежит в основе патофизиологии данных заболеваний. Эозинофилы высвобождают провоспалительные медиаторы, такие как эозинофильный катионный протеин (ЭКП) и лейкотриены.
Из уровня техники известно моноклональное антитело бенрализумаб, которое связывает IL-5R(и, таким образом, препятствует взаимодействию рецептора с лигандом. Данное моноклональное антитело значительно деплетирует эозинофилы крови и легких. Бенрализумаб - это гуманизированное моноклональное антитело (IgG1/k), полученное из мышиного антитела, разработанного с использованием гибридомной технологии [Koike M., Nakamura K. et.al. Establishment of humanized anti-interleukin-5 receptor alpha chain monoclonal antibodies having a potent neutralizing activity. Hum Antibodies 2009, 18(1-2):17-27]. Это антитело связывается с IL-5R(с высокой аффинностью (KD=11 pm) и ингибирует IL-5 зависимую клеточную пролиферацию (IC50=0.3 nm) [Kolbeck R., Kozhich A et.al. MEDI-563, a humanized anti-interleukin 5 receptor-alpha monoclonal antibody, with enhanced antibody-dependent cell-mediated cytotoxicity function. J Allergy Clin Immunol 2010, 125(6): 1344-53.e2]. Бенрализумаб продуцируется в афукозилированной клеточной линии, и достигаемое таким образом отсутствие фукозы в оликосахаридном ядре приводит к 5-10 кратному улучшению связывания к растворимому человеческому FcγRIIIa и таким образом увеличивает антител-зависимую клеточную цитотоксичность [Shinkawa T., Nakamura K. et al. The absence of fucose but not the presence of galactose or bisecting N-acetylglucosamine of human IgG1 complex-type oligosaccharides shows the critical role of enhancing antibody-dependent cellular cytotoxicity. J Biol Chem 2003, 278(5):3466-73]. Данное антитело находится на 3 фазе клинического исследования. Антитело бенрализумаб описано в международной заявке WO9710354 (A1).
Из уровня техники также известно биспецифическое антитело, которое связывается с IL-5R и с человеческим CD3e (ND003). Данное антитело находится на стадии доклинических исследований и описано в международных заявках WO2015172800 и WO2015058861.
В связи с вышесказанным, актуальным является создание новых антител, которые эффективно связываются с IL-5R(и ингибируют IL-5R(опосредованную активацию.
Нами было разработано полностью человеческое моноклональное антитело mAb (BCD-133), связывающее человеческий IL-5R(с аффинностью, сопоставимой с бенрализумабом, и ингибирующее IL-5R(опосредованную активацию. Подобно бенрализумабу, BCD-133 обладает усиленной антитело-зависимой цитотоксичностью, позволяя активировать иммунный ответ против клеток, несущих на себе рецептор к IL-5. Антитело BCD-133 селективно связывается с IL-5R(и является эффективным ингибитором IL-5R(опосредованной активации иммунокомпетентных клеток и связанного с ними специфического воспаления. В клеточном тесте антитело BCD-133 показывает активность, превышающую действие бенрализумаба. Более того, BCD-133 – это полностью человеческое антитело, полученное de novo, что позволяет снизить риск иммуногенности и не требует дополнительных генно-инженерных преобразований, направленных на повышение сродства к человеческому белку, которые способны привести к потере связывающий аффинности.
Краткое описание изобретения
Настоящее изобретение относится к связывающим молекулам, например, антителам, направленным на связывание с IL-5Rα. Такие антитела могут быть использованы для лечения заболевания или нарушения, опосредуемого взаимодействием IL-5 и его клеточным рецептором.
В одном из аспектов настоящее изобретение относится к моноклональному антителу или его антигенсвязывающему фрагменту, которое специфично связывается с IL-5Rα, и включает вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность по меньшей мере на 80% гомологичную последовательности SEQ ID NO: 3 и вариабельный домен легкой цепи, содержащий аминокислотную последовательность по меньшей мере на 80% гомологичную последовательности SEQ ID NO: 8, то есть аминокислотные последовательности SEQ ID NO: 3 и 8 могут включать 1 или 2 аминокислотные замены.
В одном из вариантов моноклональное антитело или его антигенсвязывающий фрагмент содержит вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 3.
В одном из вариантов моноклональное антитело или его антигенсвязывающий фрагмент содержит вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 8.
В одном из вариантов моноклональное антитело или его антигенсвязывающий фрагмент содержит вариабельный домен тяжелой цепи, включающий аминокислотные последовательности по меньшей мере на 80% гомологичные последовательностям SEQ ID NO: 1-3, то есть аминокислотные последовательности SEQ ID NO: 1-3 могут включать 1 или 2 аминокислотные замены.
В одном из вариантов моноклональное антитело или его антигенсвязывающий фрагмент содержит вариабельный домен тяжелой цепи, включающий аминокислотные последовательности, представленные последовательностями SEQ ID NO: 1-3.
В одном из вариантов моноклональное антитело или его антигенсвязывающий фрагмент содержит вариабельный домен легкой цепи, включающий аминокислотные последовательности по меньшей мере на 80% гомологичные последовательностям SEQ ID NO: 6-8, то есть аминокислотные последовательности SEQ ID NO: 6-8 могут включать 1 или 2 аминокислотные замены.
В одном из вариантов моноклональное антитело или его антигенсвязывающий фрагмент содержит вариабельный домен легкой цепи, включающий аминокислотные последовательности, представленные последовательностями SEQ ID NO: 6-8.
В одном из вариантов моноклональное антитело или его антигенсвязывающий фрагмент содержит вариабельный домен тяжелой цепи, включающий аминокислотные последовательности по меньшей мере на 80% гомологичные последовательностям SEQ ID NO: 1-3, и вариабельный домен легкой цепи, включающий аминокислотные последовательности по меньшей мере на 80% гомологичные последовательностям SEQ ID NO: 6-8, то есть аминокислотные последовательности SEQ ID NO: 1-3 и 6-8 могут включать 1 или 2 аминокислотные замены.
В одном из вариантов моноклональное антитело или его антигенсвязывающий фрагмент содержит вариабельный домен тяжелой цепи, включающий аминокислотные последовательности SEQ ID NO: 1-3, и вариабельный домен легкой цепи, включающий аминокислотные последовательности SEQ ID NO: 6-8.
В одном из вариантов моноклональное антитело или его антигенсвязывающий фрагмент содержит вариабельный домен тяжелой цепи, включающий аминокислотную последовательность по меньшей мере на 90% гомологичную аминокислотной последовательности, выбранной из группы SEQ ID NO: 4-5.
В одном из вариантов моноклональное антитело или его антигенсвязывающий фрагмент содержит вариабельный домен тяжелой цепи, включающий аминокислотную последовательность, выбранную из группы SEQ ID NO: 4-5.
В одном из вариантов моноклональное антитело или его антигенсвязывающий фрагмент содержит вариабельный домен легкой цепи, включающий аминокислотную последовательность по меньшей мере на 90% гомологичную аминокислотной последовательности, выбранной из группы SEQ ID NO: 9-10.
В одном из вариантов моноклональное антитело или его антигенсвязывающий фрагмент содержит вариабельный домен легкой цепи, включающий аминокислотную последовательность, выбранную из группы SEQ ID NO: 9-10.
В одном из вариантов моноклональное антитело или его антигенсвязывающий фрагмент содержит вариабельный домен тяжелой цепи, включающий аминокислотную последовательность по меньшей мере на 90% гомологичную аминокислотной последовательности, выбранной из группы SEQ ID NO: 4-5, и вариабельный домен легкой цепи, включающий аминокислотную последовательность по меньшей мере на 90% гомологичную аминокислотной последовательности, выбранной из группы SEQ ID NO: 9-10.
В одном из вариантов моноклональное антитело или его антигенсвязывающий фрагмент содержит вариабельный домен тяжелой цепи, включающий аминокислотную последовательность, выбранную из группы SEQ ID NO: 4-5, и вариабельный домен легкой цепи, включающий аминокислотную последовательность, выбранную из группы SEQ ID NO: 9-10.
В одном из вариантов моноклональное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, включающую аминокислотную последовательность по меньшей мере на 90% гомологичную последовательности, выбранной из группы SEQ ID NO: 11-12, и легкую цепь, включающую аминокислотную последовательность по меньшей мере на 90% гомологичную последовательности, выбранной из группы SEQ ID NO: 13-14.
В одном из вариантов моноклональное антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, включающую аминокислотную последовательность, выбранную из группы SEQ ID NO: 11-12, и легкую цепь, включающую аминокислотную последовательность, выбранную из группы SEQ ID NO: 13-14.
В одном из вариантов моноклональное антитело, специфичное к IL-5Rα, представляет собой полноразмерное антитело IgG.
В одном из вариантов моноклональное полноразмерное антитело IgG, специфичное к IL-5Rα, относится к изотипу IgG1, IgG2, IgG3 или IgG4 человека.
В одном из вариантов моноклональное полноразмерное антитело IgG, специфичное к IL-5Rα, относится к изотипу IgG1 человека.
В одном из аспектов настоящее изобретение относится к нуклеиновой кислоте, которая кодирует вышеуказанное антитело или его антигенсвязывающий фрагмент.
В одном из вариантов нуклеиновая кислота представляет собой ДНК.
В одном из вариантов нуклеиновая кислота содержит нуклеотидную последовательность, кодирующую тяжелую цепь антитела, которая по меньшей мере на 90% гомологична последовательности, выбранной из группы SEQ ID NO: 15-16, и/или нуклеотидную последовательность, кодирующую легкую цепь антитела, которая по меньшей мере на 90% гомологична последовательности, выбранной из группы, SEQ ID NO: 17-18.
В одном из вариантов нуклеиновая кислота содержит нуклеотидную последовательность, кодирующую тяжелую цепь антител, выбранную из группы SEQ ID NO: 15-16, и/или нуклеотидную последовательность, выбранную из группы SEQ ID NO: 17-18, кодирующую легкую цепь антитела.
В одном из аспектов настоящее изобретение относится к экспрессионному вектору, содержащему вышеукзанную нуклеиновую кислоту.
В одном из аспектов настоящее изобретение относится к способу получения клетки-хозяина, которая используется для получения вышеуказанного антитела или его антигенсвязывающего фрагмента, который включает трансформирование клетки вышеуказанным вектором.
В одном из аспектов настоящее изобретение относится к клетке-хозяину, которая используется для получения вышеуказанного антитела или его антигенсвязывающего фрагмента, и содержит вышеуказанную нуклеиновую кислоту.
В одном из аспектов настоящее изобретение относится к способу получения вышеуказанного антитела или его антигенсвязывающего фрагмента, и заключается в культивировании вышеуказанной клетки-хозяина в культуральной среде в условиях, достаточных для получения указанного антитела, при необходимости, с последующим выделением и очисткой полученного антитела.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции для профилактики или лечения заболевания или нарушения, опосредуемого IL-5Rα, которая включает вышеуказанное антитело или его антигенсвязывающий фрагмент, в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
В одном из вариантов фармацевтическая композиция предназначена для профилактики или лечения заболевания или нарушения, опосредуемого IL-5Rα, и выбранного из астмы, например, эозинофильной бронхиальной астмы (АБА), например, эозинофильной бронхиальной астмы (АБА) тяжелого течения; ХОБЛ (хронической обструктивной болезни легких); синдрома Чердж-Стросса; эозинофильного эзофагита; эозинофильного гастроэнтерита.
В одном из аспектов настоящее изобретение относится к фармацевтической комбинация для профилактики или лечения заболевания или нарушения, опосредуемого IL-5Rα, и включает вышеуказанное антитело или его антигенсвязывающий фрагмент и по меньшей мере одно другое терапевтически активное соединение.
В одном из вариантов фармацевтическая комбинация предназначенадля профилактики или лечения заболевания или нарушения, опосредуемого IL-5Rα, и выбранного из астмы, например, эозинофильной бронхиальной астмы (АБА), например, эозинофильной бронхиальной астмы (АБА) тяжелого течения; ХОБЛ (хронической обструктивной болезни легких); синдрома Чердж-Стросса; эозинофильного эзофагита; эозинофильного гастроэнтерита.
В одном из вариантов фармацевтическая комбинация включает терапевтически активное соединение, которое выбирают из малой молекулы, антитела или стероидных гормонов, например, кортикостероидов.
В одном из аспектов настоящее изобретение относится к способу ингибирования биологической активности IL-5R(у субъекта, нуждающемуся в таком ингибировании, и включает введение субъекту эффективного количества вышеуказанного антитела или его антигенсвязывающего фрагмента.
В одном из аспектов настоящее изобретение относится к способу лечения заболевания или нарушения, опосредованного IL-5Rα, и включает введение субъекту, нуждающемуся в таком лечении, вышеуказанного антитела или его антигенсвязывающего фрагмента или вышеуказанной фармацевтической композиции, в терапевтически эффективном количестве.
В одном из вариантов осуществления настоящего изобретения заболевание или нарушение выбрано из астмы, например, эозинофильной бронхиальной астмы (АБА), например, эозинофильной бронхиальной астмы (АБА) тяжелого течения; ХОБЛ (хронической обструктивной болезни легких); синдрома Чердж-Стросса; эозинофильного эзофагита; эозинофильного гастроэнтерита, гиперэозинофильного синдрома.
В одном из аспектов настоящее изобретение относится к применению вышеуказанного антитела или его антигенсвязывающего фрагмента или вышеуказанной фармацевтической композиции для лечения у субъекта, нуждающегося в таком лечении, заболевания или нарушения, опосредуемого IL-5Rα.
В одном из вариантов осуществления настоящего изобретения заболевание или нарушение выбрано из астмы, например, эозинофильной бронхиальной астмы (АБА), например, эозинофильной бронхиальной астмы (АБА) тяжелого течения; ХОБЛ (хронической обструктивной болезни легких); синдрома Чердж-Стросса; эозинофильного эзофагита; эозинофильного гастроэнтерита, гиперэозинофильного синдрома.
Краткое описание чертежей
Фиг.1. Карта плазмиды для транзиентной наработки антигенов с Fc фьюжн белком (а), С-концевым тагом EPEA (FE) (b), His-6 тагом (с).
Фиг.2. Электрофореграмма антигенов в редуцирующих условиях (a, b) 10% SDS-PAGE) и антител в нередуцирующих (с) (7,5% SDS-PAGE).
Фиг.3. Схема синтеза комбинаторной наивной библиотеки человека.
Фиг.4. Карта фагмиды для клонирования Fab фаговых дисплейных библиотек.
Фиг.5. Карта экспрессионной плазмиды для наработки Fab.
Фиг.6. Иммуноферментный анализ поликлонального фага постселекционных библиотек на специфические и неспецифические антигены.
Фиг.7. Сенсограммы взаимодействия антител c IL-5R(на приборе Octet RED 384 (a - BCD133-03-002, b - BCD133-03-020, c - BCD133-03-021).
Фиг.8. Зависимость антитело-зависимой клеточной цитотоксичности от концентрации антител (a). Значения полумаксимальной эффективной концентрации (EC50) в сравнительном анализе с антителом Benralizumab (b).
Фиг.9. Сенсограммы взаимодействия антител c IL-5R(макаки на приборе Octet RED 384 (a – BCD133-03-002, b - BCD133-03-020, c - BCD133-03-021).
Фиг.10 (a, b). 3D пространственная модель комплекса BCD-133 и IL-5Rα.
Фиг.11 (a, b). График зависимости среднего размера частиц (Z-average) от температуры.
Фиг.12 (a, b). Совмещенные хроматограммы BCD-133 в уменьшенном и увеличенном масштабе. Синий - интактный, красный – 72 часа инкубации при 50°С в 20mM Acetate, pH=5.0. Длина волны 220 нм.
Описание изобретения
Определения и общие методы
Если иное не определено в настоящем документе, научные и технические термины, используемые в связи с настоящим изобретением, будут иметь значения, которые обычно понятны специалистам в данной области.
Кроме того, если по контексту не требуется иное, термины в единственном числе включают в себя термины во множественном числе, и термины во множественном числе включают в себя термины в единственном числе. Как правило, используемая классификация и методы культивирования клеток, молекулярной биологии, иммунологии, микробиологии, генетики, аналитической химии, химии органического синтеза, медицинской и фармацевтической химии, а также гибридизации и химии белка и нуклеиновых кислот, описанные в настоящем документе, хорошо известны специалистам и широко применяются в данной области. Ферментативные реакции и способы очистки осуществляют в соответствии с инструкциями производителя, как это обычно осуществляется в данной области, или как описано в настоящем документе.
Определения, связанные с антителом
Термин IL-5R или «рецептор интерлейкина 5», используемый здесь, означает белок, который связывает интерлейкин 5 (IL-5). Экспрессия рецептора интерлейкина-5 (IL-5R) наблюдается в основном только на поверхности эозинофилов, базофилов и тучных клеток. IL-5R состоит из уникальной α-цепи (IL-5Ra/CD125, внеклеточный домен) и общей с рецепторами к IL-3 и GM-CSF β-цепи (bc/CD131), которая сама по себе не связывает лиганд, однако повышает сродство IL-5 к одноименному рецептору и принимает непосредственное участие в трансдукции сигнала.
Амплификация этого гена и/или сверхэкспрессия его белка были обнаружены при многих аутоиммунных заболеваниях, в том числе при астме, например, эозинофильной бронхиальной астме (АБА), например, эозинофильной бронхиальной астме (АБА) тяжелого течения; ХОБЛ (хронической обструктивной болезни легких); синдроме Чердж-Стросса; эозинофильном эзофагите; эозинофильным гастроэнтерите или гиперэозинофильном синдроме.
Термин «связывающая молекула» включает в себя антитела и иммуноглобулины.
Термин «антитело» или «иммуноглобулин» (Ig), как использовано в данном описании, включает целые антитела и любой антигенсвязывающий фрагмент (т.е. «антигенсвязывающую часть») или его отдельные цепи. Термин «антитело» относится к гликопротеину, содержащему по меньшей мере две тяжелые (H) цепи и две легкие (L) цепи, взаимосвязанные дисульфидными связями, или его антигенсвязывающей части. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно называемую в данном описании как VH) и константную область тяжелой цепи. Известно пять типов тяжелых цепей антител млекопитающих, которые обозначают греческими буквами: α, δ, ε, (и μ. Присутствующий тип тяжелой цепи определяет класс антитела; указанные цепи обнаружены в антителах типа IgA, IgD, IgE, IgG и IgM соответственно. Различные тяжелые цепи отличаются по размеру и составу; (и (содержат примерно 450 аминокислот, а μ и ε состоят примерно из 550 аминокислот. Каждая тяжелая цепь содержит две области, т.е. константную область и вариабельную область. Константная область является идентичной во всех антителах одного и того же изотипа, но отличается в антителах различного изотипа. Тяжелые цепи γ, (и δ содержат константную область, которая состоит из трех константных доменов CH1, СН2 и CH3 (выстроены в ряд) и шарнирной области, которая придает гибкость (Woof J., Burton D., Nat Rev Immunol 4, 2004, cc.89-99); тяжелые цепи μ и ε содержат константную область, которая состоит из четырех константных доменов CH1, СН2, CH3 и CH4. У млекопитающих известно только два типа легких цепей, которые обозначают как лямбда (λ) и каппа (κ). Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно называемой в данном описании как VL) и константной области легкой цепи. Примерная длина легкой цепи составляет 211-217 аминокислот.Предпочтительно легкая цепь представляет собой легкую каппа (κ)-цепь, а константный домен CL предпочтительно представляет собой С-каппа (κ).
«Антитела», согласно изобретению, могут представлять собой антитела любого класса (например, IgA, IgD, IgE, IgG и IgM, предпочтительно IgG) или подкласса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2, предпочтительно IgG1).
Области VH и VL могут быть дополнительно подразделены на области гипервариабельности, называемые определяющими комплементарность областями (CDR), разбросанные между областями, которые являются более консервативными, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат домен связывания, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями хозяина или факторами, включая различные клетки иммунной системы (например, эффекторными клетками), и первый компонент (Clq) классической системы комплемента.
Термин «антигенсвязывающая часть» антитела или «антигенсвязывающий фрагмент» (или просто «часть антитела» или «фрагмент антитела»), как использовано в данном описании, относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связываться с антигеном. Было показано, что антигенсвязывающая функция антитела может выполняться фрагментами полноразмерного антитела. Примеры связывающих фрагментов, включенных в термин «антигенсвязывающая часть» антитела включают (i) Fab-фрагмент, одновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) F(ab’)2-фрагмент, двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd- фрагмент, состоящий из доменов VH и CH1; (iv) Fv-фрагмент, состоящий из доменов VL и VH в едином плече антитела, (v) dAb-фрагмент (Ward et al., (1989) Nature 341:544-546), который состоит из домена VH/VHH; и (vi) выделенная определяющая комплементарность область (CDR). Кроме того, две области Fv-фрагмента, VL и VH, кодируются разными генами, они могут быть соединены при помощи рекомбинантных способов с использованием синтетического линкера, который дает возможность получать их в виде единой белковой цепи, в которой области VL и VH спариваются с образованием одновалентных молекул (известных как одноцепочечный Fv (scFv); см., например, Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Предполагается, что такие одноцепочечные молекулы также включены в термин “антигенсвязывающая часть» антитела. Такие фрагменты антител получают с использованием общепринятых способов, известных специалистам в данной области, и эти фрагменты подвергают скринингу таким же образом, как и интактные антитела.
Предпочтительно CDR антигенсвязывающего участка или весь антигенсвязывающий участок антител по изобретению имеет происхождение из мыши, ламы или донорской человеческой библиотеки или по существу человеческое происхождение с определенными аминокислотными остатками, измененными, например, замещенными разными аминокислотными остатками с тем, чтобы оптимизировать конкретные свойства антитела, например KD, koff, IC50, EC50, ED50. Предпочтительно каркасные участки антитела по изобретению имеют человеческое происхождение или по существу человеческое происхождение (по крайней мере на 80, 85, 90, 95, 96, 97, 98 или 99% человеческое происхождение).
В других вариантах осуществления антигенсвязывающий участок антитела по изобретению может происходить из других нечеловеческих видов, включая мыши, ламы, кролика, крысу или хомяка, но не ограничиваясь ими. Альтернативно, антигенсвязывающий участок может происходить из человеческих видов.
Термин «вариабельный» относится к тому факту, что определенные сегменты вариабельных доменов широко отличаются в последовательности среди антител. Домен V опосредует связывание антигена и определяет специфичность конкретного антитела к его конкретному антигену. Однако вариабельность неравномерно распределяется на участке вариабельных доменов из 110 аминокислот. Напротив, V области состоят из инвариантных фрагментов, называемых каркасными областями (FR) из 15-30 аминокислот, разделенных более короткими участками чрезвычайной вариабельности, называемых «гипервариабельными областями» или CDR. Каждый вариабельный домен нативных тяжелых и легких цепей содержит четыре FR, в основном принимающих конфигурацию бета-листов, связанных тремя гипервариабельными областями, которые образуют петли, связывающие, и в некоторых случаях являющиеся частью бета-складчатой структуры. Гипервариабельные области в каждой цепи удерживаются вместе в тесной близости с помощью FR и с гипервариабельными областями другой цепи вносят вклад в образование антигенсвязывающего сайта антител. Константные домены не принимают непосредственного участия в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности (АЗКЦ, ADCC).
Термин «гипервариабельная область» по данному описанию относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Обычно гипервариабельная область содержит аминокислотные остатки из «области, определяющей комплементарность» или «CDR», и/или такие остатки из «гипервариабельной петли».
В некоторых случаях может также быть предпочтительным изменение одного или более остатков аминокислот CDR-участков с целью повышения аффинности связывания с целевым эпитопом. Это известно, как «созревание аффиности» и в некоторых случаях может выполняться в связи с гуманизацией, например, в ситуациях, когда гуманизация антитела приводит к снижению специфичности или аффинности связывания, и не представляется возможным в достаточной степени улучшить специфичность или аффинность связывания с помощью только обратных мутаций. Различные методы созревания аффинности известны в данной области техники, например, способ in vitro сканирующего насыщающего мутагенеза, описанный Burks et al., Proc Natl Acad Sci USA, 94:412–417 (1997), и способ пошагового in vitro созревания аффинности, предложенный Wu et al., Proc Natl Acad Sci USA 95:6037 6042 (1998).
«Каркасные области» (FR) представляют собой остатки вариабельного домена, отличные от CDR остатков. Обычно каждый вариабельный домен имеет четыре FR, определяемые как FR1, FR2, FR3 и FR4. Если CDR определяются согласно Kabat, FR остатки легкой цепи локализуются, приблизительно, в области остатков 1-23 (LCFR1), 35-49 (LCFR2), 57-88 (LCFR3) и 98-107 (LCFR4), а остатки FR тяжелой цепи локализуются, приблизительно, в области остатков 1-30 (HCFR1), 36-49 (HCFR2), 66-94 (HCFR3) и 103- 113 (HCFR4) в тяжелой цепи. Если участки CDR содержат аминокислотные остатки из гипервариабельных петель, FR остатки легкой цепи локализуются, приблизительно, в остатках 1-25 (LCFR1), 33-49 (LCFR2), 53-90 (LCFR3) и 97-107 (LCFR4) в легкой цепи, а FR остатки тяжелой цепи локализуются, примерно, в остатках 1-25 (HCFRI), 33-52 (HCFR2), 56-95 (HCFR3) и 102-113 (HCFR4) в остатках тяжелой цепи. В некоторых примерах, когда CDR содержит аминокислоты как из CDR по Kabat, так и аминокислоты из гипервариабельной петли, FR соответствующим образом корректируются. Например, когда CDRH1 включает аминокислоты Н26-Н35, остатки FR1 тяжелой цепи находятся в положениях 1-25, а остатки FR2 находятся в положениях 36-49.
Антитело по данному изобретению, «которое связывает» целевой антиген, представляет собой антитело, которое связывает антиген с достаточной аффинностью так, что антитело можно применять в качестве диагностического и/или терапевтического агента при нацеливании на белок или клетку, или ткань, экспрессирующую антиген, и в незначительной степени перекрестно реагирует с другими белками. По данным аналитических методов: сортинга флуоресцентно-активированных клеток (FACS), радиоиммунопреципитации (RIA) или ИФА (ELISA), в таких вариантах изобретения степень связывания антитела с белком, не являющимся «мишенью» (с «нецелевым белком»), составляет менее 10% от связывания антитела с конкретным белком-мишенью. По отношению к связыванию антитела с молекулой-мишенью термин «специфическое связывание» или выражения «специфически связывается с» или «специфический к» конкретному полипептиду или эпитопу на конкретном полипептиде-мишени означает связывание, которое заметно (измеримо) отличается от неспецифического взаимодействия (например, в случае bH1-44 или bH1-81 неспецифическое взаимодействие представляет собой связывание с бычьим сывороточным альбумином, казеином, фетальной бычьей сывороткой или нейтравидином).
Специфическое связывание можно определять количественно, например, определяя связывание молекулы по сравнению со связыванием контрольной молекулы. Например, специфическое связывание можно определять конкурентной реакцией с другой молекулой, аналогичной мишени, например, с избытком немеченой мишени. В этом случае специфическое связывание указывается, если связывание меченой мишени с зондом конкурентно ингибируется избытком немеченой мишени. В данном описании термин «специфическое связывание» или выражения «специфически связывается с» или «специфический к» конкретному полипептиду или эпитопу на конкретном полипептиде-мишени можно характеризовать на примере молекулы, имеющей Kd к мишени по меньшей мере около 200 нМ, или же по меньшей мере около 150 нМ, или же по меньшей мере около 100 нМ, или же по меньшей мере около 60 нМ, или же по меньшей мере около 50 нМ, или же по меньшей мере около 40 нМ, или же по меньшей мере около 30 нМ, или же по меньшей мере около 20 нМ, или же по меньшей мере около 10 нМ, или же по меньшей мере около 8 нМ, или же по меньшей мере около 6 нМ, или же по меньшей мере около 4 нМ, или же по меньшей мере около 2 нМ, или же по меньшей мере около 1 нМ или выше. В одном варианте изобретения термин «специфическое связывание» относится к связыванию, при котором молекула связывается с конкретным полипептидом или эпитопом на конкретном полипептиде, практически не связываясь с каким-либо другим полипептидом или эпитопом на полипептиде.
Термин «Ka», как использовано в данном описании, относится к скорости ассоциации конкретного взаимодействия антитело-антиген, тогда как термин или «Kd» относится к скорости диссоциации конкретного взаимодействия антитело-антиген.
«Аффинность связывания» обычно относится к силе совокупных нековалентных взаимодействий между единичным сайтом связывания молекулы (например, антитела) и ее партнером по связыванию (например, антигеном). Если не указано иначе, «аффинность связывания» относится к внутренней (характерной, истинной) аффинности связывания, которая отражает 1:1 взаимодействие между членами пары связывания (например, антителом и антигеном). Аффинность молекулы Х к своему партнеру Y обычно можно представить константной диссоциации (Kd). Желательно, чтобы величина Kd составляла, примерно, 200 нМ, 150 нМ, 100 нМ, 60 нМ, 50 нМ, 40 нМ, 30 нМ, 20 нМ, 10 нМ, 8 нМ, 6 нМ, 4 нМ, 2 нМ, 1 нМ или менее. Аффинность можно измерять обычными методами, известными в уровне техники, включая методы по данному описанию. Низкоаффинные антитела обычно медленно связываются с антигеном и имеют тенденцию легко диссоциировать, тогда как высокоаффинные антитела обычно быстрее связывают антиген и имеют тенденцию дольше оставаться в связанном состоянии. В уровне техники известны различные методы измерения аффинности связывания, любой из этих методов можно использовать для целей настоящего изобретения.
В одном варианте изобретения «Kd» или «величину Kd» по данному изобретению измеряют методами поверхностного плазмонного резонанса на приборе BIAcore™-2000 или BIAcore™-3000 (BIAcore, Inc., Piscataway, NJ) при 25°С, используя чипы с иммобилизованным антигеном СМ5 при ~10 относительных единицах (единицах отклика, RU). Коротко говоря, биосенсорные чипы с карбоксиметилдекстраном (СМ5, BIAcore Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)-карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями производителя. Антиген разводят 10 мМ раствором ацетата натрия, рН 4.8, до концентрации 5 мкг/мл (~0.2 мкМ), а затем вводят (инжекция) при скорости потока 5 мкл/минута до достижения, примерно, 10 относительных единиц (RU) связанного белка. После введения антигена вводят 1 М раствор этаноламина, чтобы блокировать непрореагировавшие группы. Для кинетических измерений двукратные серийные разведения Fab (например, от 0.78 нМ до 500 нМ) вводят в PBS с 0.05% Tween 20 (PBST) при 25°С при скорости потока, примерно, 25 мкл/мин. Величины скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают, применяя простую модель Ленгмюра для связывания один-плюс-один (BIAcore Evaluation Software версия 3.2), с помощью одновременного получения сенсограммы ассоциации и диссоциации. Константу равновесной диссоциации (Kd) рассчитывают, как отношение koff/kon. См., например, Chen, Y., et al., (1999) J. Mol. Biol. 293: 865-881. Если по данным вышеуказанного метода поверхностного плазмонного резонанса скорость ассоциации превышает 106 М-1 сек-1, тогда ее можно определять методом тушения флуоресценции, который измеряет увеличение или уменьшение интенсивности флуоресцентной эмиссии (возбуждение=295 нм; эмиссия (излучение)=340 нм, полоса 16 нм) при 25°С раствора антитела против антигена (Fab форма) с концентрацией 20 нМ в PBS, рН 7.2, в присутствии увеличивающихся концентраций антигена, измеряемых с помощью спектрометра, такого как спектрофотометр остановленного потока (Aviv Instruments) или спектрофотометр SLM-Aminco (ThermoSpectronie) серии 8000 с кюветой с перемешиванием.
Термин «кoff» относится к константе скорости диссоциации конкретного взаимодействия связывающей молекулы и антигена. Константу скорости диссоциации koff можно измерить посредством биослойной интерферометрии, например, с помощью системы Octet™.
«Скорость ассоциации» («on-rate») или «kon» по данному изобретению можно также определять тем же самым описанным выше методом поверхностного плазмонного резонанса на приборе BIAcore™-2000 или BIAcore™-3000 (BIAcore, Inc., Piscataway, NJ) при 25°С, используя чипы с иммобилизованным антигеном СМ5 при ~10 относительных единицах (единицах отклика, RU). Коротко говоря, биосенсорные чипы с карбоксиметилдекстраном (СМ5, BIAcore Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламино пропил)-карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями производителя. Антиген разводят 10 мМ раствором ацетата натрия, рН 4.8, до концентрации 5 мкг/мл (~0.2 мкМ), а затем вводят (инжекция) при скорости потока 5 мкл/минута до достижения, примерно, 10 относительных единиц (RU) связанного белка. После введения антигена вводят 1 М раствор этаноламина, чтобы блокировать непрореагировавшие группы.
Если специально не указано иначе, выражения «биологически активный», и «биологическая активность», и «биологические характеристики», по отношению к полипептиду по данному изобретению, означают обладание способностью связываться с биологической молекулой.
Выражение «биологическая молекула» относится к нуклеиновой кислоте, белку, углеводу, липиду и их комбинации. В одном варианте изобретения биологическая молекула существует в природе.
Участки антител, такие как Fab- и F (аb ') 2-фрагменты, могут быть получены из целых антител с использованием традиционных методов, таких как папаиновый или пепсиновый гидролиз целых антител. Более того, антитела, части антител и молекулы иммуноадгезии могут быть получены с использованием стандартных методов рекомбинантной ДНК, например, как описано в настоящем документе.
Термин «рекомбинантное антитело» означает антитело, которое экспрессируется в клетке или клеточной линии, содержащей нуклеотидную последовательность (нуклеотидные последовательности), которая кодирует антитела, при этом указанная нуклеотидная последовательность (нуклеотидные последовательности) не ассоциирована с клеткой в природе.
Термин «вариантное» антитело, используемый в данном документе, относится к антителу, имеющему аминокислотную последовательность, которая отличается от аминокислотной последовательности его «родительского» антитела путем добавления, удаления и/или замены одного или более аминокислотных остатков относительно последовательности родительского антитела. В предпочтительном варианте осуществления изобретения вариантное антитело содержит по меньшей мере одно или более (например, от одного до двенадцати, например, два, три, четыре, пять, шесть, семь, восемь или девять, десять, одиннадцать или двенадцать; и в некоторых вариантах осуществления изобретения от одного до примерно десяти) добавлений, делеций и/или замен аминокислот относительно родительского антитела. В некоторых вариантах осуществления изобретение добавления, делеции и/или замены осуществляются на CDR-участках вариантного антитела. Идентичность или гомология по отношению к последовательности вариантного антитела определяется в настоящем документе как процент аминокислотных остатков в последовательности вариантного антитела, которые идентичны остаткам родительского антитела, после выравнивания последовательностей и введения гэпов, если это необходимо, для достижения максимального процента идентичности последовательности. Вариантное антитело сохраняет способность связываться с тем же антигеном, и предпочтительно эпитопом, с которым связывается родительское антитело, и в некоторых вариантах осуществления изобретения по меньшей мере одно свойство или биологическая активность превосходит аналогичные свойства родительского антитела. Например, вариантное антитело может иметь, например, более выраженную аффинность связывания, более длительный период полувыведения, более низкое значение ИК50 или повышенную способность подавлять биологическую активность антигена по сравнению с родительским антителом. Особый интерес в настоящем документе представляет вариантное антитело, показывающее биологическую активность, превышающую по меньшей мере в 2 раза (предпочтительно, по меньшей мере в 5 раз, 10 раз или 20 раз) биологическую активность родительского антитела.
Термин «биспецифичное антитело» означает антитело, содержащее антигенсвязывающий домен или антигенсвязывающие домены, которые способны к специфическому связыванию с двумя различными эпитопами на одной биологической молекуле или способны к специфическому связыванию с эпитопами на двух различных биологических молекулах. Биспецифичное антитело также упоминается в настоящем документе, как обладающее «двойной специфичностью» или как являющееся антителом с «двойной специфичностью».
Термин «химерное антитело» относится в широком смысле к антителу, которое содержит одну или более областей из одного антитела, и одну или более областей из одного или нескольких других антител, как правило, антитело, частично человеческого происхождения и частично нечеловеческого происхождения, то есть полученное частично из не относящегося к человеку животного, например, мыши, крысы или другого грызуна или верблюдовых, таких как лама или альпака. Химерные антитела являются предпочтительными по сравнению с нечеловеческими антителами для того, чтобы снизить риск иммунного ответа, направленного против антител у человека, например, ответа, направленного против мышиных антител у человека в случае мышиного антитела. Примером типичного химерного антитела является то, в котором последовательности вариабельного участка являются мышиными, в то время как последовательности константного участка являются человеческими. В случае химерного антитела нечеловеческие части могут быть подвергнуты дальнейшему изменению с целью гуманизации антитела.
Термин «гуманизация» относится к факту, что когда антитело имеет полностью или частично нечеловеческое происхождение, например, антитело мыши или ламы, полученное при иммунизации мышей или лам, соответственно, с представляющим интерес антигеном, или является химерным антителом на основе такого антитела мыши или ламы, можно заменить некоторые аминокислоты, например, в каркасных областях и константных доменах тяжелой и легкой цепей, с тем чтобы избежать или свести к минимуму иммунный ответ у человека. Специфичность взаимодействия антитела с антигеном-мишенью присуща главным образом аминокислотным остаткам, расположенных в шести CDR-участках тяжелой и легкой цепи. Поэтому аминокислотные последовательности внутри CDR-участков, являются гораздо более вариабельными между отдельными антителами, по сравнению с последовательностями вне CDR-участков. Поскольку последовательности CDR участков отвечают за большинство антитело-антиген взаимодействий, можно экспрессировать рекомбинантные антитела, которые имитируют свойства специфического природного антитела, или в более общем плане какого-либо специфического антитела с данной аминокислотной последовательностью, например, путем конструирования экспрессионных векторов, которые экспрессируют последовательности CDR-участков из специфического антитела и каркасные последовательности другого антитела. В результате, можно «гуманизировать» нечеловеческое антитело и в значительной степени сохранить специфичность связывания и аффинность исходного антитела. Несмотря на то, что невозможно точно предсказать иммуногенность и тем самым иммунный ответ, направленный против антитела у человека на конкретное антитело, нечеловеческие антитела, как правило, более иммуногенны, чем человеческие антитела. Химерные антитела, у которых инородные (например, грызуна или верблюда) константные участки были заменены последовательностями человеческого происхождения, показали в целом более низкую иммуногенность, чем антитела полностью инородного происхождения, и существует тенденция использовать в терапевтических антителах гуманизированные или полностью человеческие антитела. Химерные антитела или другие антитела нечеловеческого происхождения, таким образом, могут быть гуманизированы, чтобы снизить риск иммунного ответа, направленного против антитела, у человека.
Для химерных антител, гуманизация обычно включает в себя модификацию каркасных участков последовательностей вариабельного участка. Аминокислотные остатки, которые являются частью участков, определяющих комплементарность (CDR участков), чаще всего не будут изменяться в связи с гуманизацией, хотя в некоторых случаях это может быть желательным, чтобы изменить отдельные аминокислотные остатки CDR-участка, например, чтобы удалить участок гликозилирования, участок дезамидирования, участок изомеризации аспартата или нежелательный остаток цистеина или метионина. N-связанное гликозилирование происходит путем присоединения олигосахаридной цепи к остатку аспарагина в трипептидной последовательности Asn-X-Ser или Asn-X-Thr, где Х может быть любой аминокислотой, кроме Pro. Удаление участка N-гликозилирования может быть достигнуто путем мутирования Asn или Ser/Thr остатка другим остатком, предпочтительно путем консервативной замены. Дезамидирование остатков аспарагина и глутамина может происходить в зависимости от таких факторов, как рН и обнажение поверхности. Остатки аспарагина особенно восприимчивы к дезамидированию, прежде всего, если они присутствуют в последовательности Asn-Gly, и в меньшей степени в других дипептидных последовательностях, таких как Asn-Ala. При наличии такого дезамидированного участка, например, Asn-Gly в последовательности CDR-участка, может быть предпочтительным удалить этот участок, как правило, путем консервативной замены для удаления одного из вовлеченных остатков.
В данной области техники известны многочисленные способы гуманизации последовательности антитела. Одним из наиболее часто используемых методов является трансплантация CDR-участков. Трансплантация CDR участка может быть основана на определениях CDR-участков по Kabat, хотя в более поздней публикации (Magdelaine-Beuzelin et al., Crit Rev.Oncol Hematol. 64:210 225 (2007)) предполагается, что определение по IMGT® (the international ImMunoGeneTics information system®, www.imgt.org) может улучшить результат гуманизации (см Lefranc et al., Dev. Comp Immunol. 27:55-77 (2003)). В некоторых случаях, трансплантация CDR-участкка может уменьшить специфичность и аффинность связывания, и, следовательно, биологическую активность, в CDR трансплантированном нечеловеческом антителе, по сравнению с родительским антителом, из которого получены CDR-участки. Обратные мутации (иногда именуемые «ремонт каркасного участка»), могут применяться в выбранных положениях CDR трансплантированного антитела, как правило, в каркасных участках, для того, чтобы восстановить специфичность и аффинность связывания родительского антитела. Определение позиций для возможных обратных мутаций может быть выполнено с использованием информации, имеющейся в литературе и в базах данных антител. Аминокислотные остатки, которые являются кандидатами для обратных мутаций, как правило, расположены на поверхности молекулы антитела, в то время как остатки, которые углублены или имеют низкую степень обнажения поверхности обычно не будут подвержены изменениям. Метод гуманизации, альтернативный трансплантации CDR-участка и обратной мутации, представляет собой изменение поверхности, при котором неэкспонированные на поверхности остатки нечеловеческого происхождения, сохраняются, в то время как экспонированные на поверхности остатки изменяются в человеческие остатки.
Существует две технологии получения полностью человеческих антител: с использованием in vitro собранных фаговых библиотек или in vivo иммунизацией гуманизированных животных (мышей, крыс и т.д.).
Конструирование комбинаторных фаговых библиотек антител начинается с выбора источника генного репертуара, в зависимости от которого можно выделить несколько видов библиотек антител: наивные, иммунные или синтетические. Наивные и иммунные библиотеки конструируют, используя естественным образом реорганизованные гены, кодирующие вариабельные домены иммуноглобулинов здоровых или иммунных к какому-либо антигену доноров, соответственно. Для этого выделяют мРНК клеток лимфоидного ряда, продуцирующих антитела. Чаще всего это лимфоциты периферической крови, но в некоторых случаях используют спленоциты [Sheets MD, Amersdorfer P, Finnern R, Sargent P, Lindquist E, Schier R, et al. Efficient construction of a large nonimmune phage antibody library: the production of high-affinity human single-chain antibodies to protein antigens. Proc Natl Acad Sci U S A 1998,95:6157-6162 и de Haard HJ, van Neer N, Reurs A, Hufton SE, Roovers RC, Henderikx P, et al. A large non-immunized human Fab fragment phage library that permits rapid isolation and kinetic analysis of high affinity antibodies. J Biol Chem 1999,274:18218-18230.], клетки миндалин или лимфоциты костного мозга [Vaughan TJ, Williams AJ, Pritchard K, Osbourn JK, Pope AR, Earnshaw JC, et al. Human antibodies with sub-nanomolar affinities isolated from a large non-immunized phage display library. Nat Biotechnol 1996,14:309-314.]. На основе мРНК синтезируют кДНК, при этом для праймирования реакции могут быть взяты олиго-dT праймеры и статистические гексаолигонуклеотиды, что позволяет получать кДНК копии всех возможных вариантов генов, кодирующих вариабельные домены антител [Улитин АБ, Капралова МВ, Ламан АГ, Шепеляковсткая АО, Булгакова ЕВ, Фурсова КК, et al. Библиотека миниантител человека в формате фагового дисплея. Создание и апробация. ДАН: Изд-во «Наука»; 2005.].
Сразу могут использоваться один или несколько праймеров, ограничивающих набор амплифицируемых генов до одного или нескольких семейств генов вариабельных доменов или изотипов антител уже на уровне кДНК [Marks JD, Hoogenboom HR, Bonnert TP, McCafferty J, Griffiths AD, Winter G. Bypassing immunization. Human antibodies from V-gene libraries displayed on phage. J Mol Biol 1991,222:581-597]. Праймеры, используемые для амплификации генов, кодирующих иммуноглобулины, комплементарны их наиболее консервативным участкам. Их последовательности выбирают из коллекций генов, которые организованы в базы данных, такие как база данных Kabat или V BASE. Дизайн праймеров также предусматривает наличие в них внутренних сайтов рестрикции, позволяющих клонировать ПЦР продукты в состав соответствующих векторов.
Конструирование синтетических библиотек основано на замене природных CDR на набор случайных последовательностей, что позволяет создавать огромное разнообразие антигенсвязывающих сайтов.
Фаговый дисплей является первой и самой широко распространенной in vitro технологией для поиска антител. В 1985 году Смит обнаружил, что последовательности чужеродной ДНК могут быть клонированы в нитевидный бактериофаг M13 таким образом, что клонированные последовательности генов экспрессируются на поверхности фаговых частиц как слитые белки (Smith GP: Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface. Science 1985, 228:1315-1317.). Таким образом, можно проводить селекцю интересующих нас слитых белков на основе их способности связывать другие белки. Это открытие было скомбинировано с методами ПЦР-амплификации, что позволило клонировать кДНК репертуар генов иммуноглобулинов для создания разнообразных фаговых библиотек, содержащих вариабельные домены, которые могут быть использованы для быстрого поиска мишень-специфичных моноклональных антител. Репертуар фаговых библиотек отражает репертуар антител B-лимфоцитов каждого человека или животного, кровь которого была использована при создании библиотеки.В 1995 году две статьи сообщили о создании генетически сконструированных мышей, которые экспрессировали полностью человеческие антитела, репертуар которых может быть соспоставим с полученных гибридомной технологией (Lonberg N, Taylor LD, Harding FA, Trounstine M, Higgins KM, Schramm SR, Kuo CC, Mashayekh R, Wymore K, McCabe JG et al.: Antigen-specific human antibodies from mice comprising four distinct genetic modifications. Nature 1994, 368:856-859). У этих животных были целенаправленно разрушены гены своих собственных эндогенных тяжелых и k легких цепей иммуноглобулинов и введены трансгены, представляющие собой сегменты генов тяжелых и k легких цепей человека. Оказалось, что репертуар генов человека может быть использован мышиной иммунной системой для создания высокоспецифичных и высокоаффинных антител ко большему разнообразию антигенов. Несмотря на то, что трансгенные мыши экспрессируют B-клеточные рецепторы, которые по существу являются гибридными мышиных и человеческих (человеческий иммуноглобулин, мышиные Igα, Ig(и другие сигнальные молекулы), их B-клетки нормально развиваются и созревают.
В некоторых случаях может также быть предпочтительным изменение одного или более остатков аминокислот CDR-участков с целью повышения аффинности связывания с целевым эпитопом. Это известно, как «созревание аффинности» и в некоторых случаях может выполняться в связи с гуманизацией, например, в ситуациях, когда гуманизация антитела приводит к снижению специфичности или аффинности связывания, и не представляется возможным в достаточной степени улучшить специфичность или аффинность связывания с помощью только обратных мутаций. Различные методы созревания аффинности известны в данной области техники, например, способ in vitro сканирующего насыщающего мутагенеза, описанный Burks et al., Proc Natl Acad Sci USA, 94:412–417 (1997), и способ пошагового in vitro созревания аффинности, предложенный Wu et al., Proc Natl Acad Sci USA 95:6037 6042 (1998).
Термин «моноклональное антитело» или «mAb» относится к антителу, которое синтезировано и выделено отдельной клональной популяцией клеток. Клональная популяция может быть клональной популяцией иммортализованных клеток. В некоторых вариантах осуществления изобретения иммортализованные клетки в клональной популяции являются гибридными клетками, гибридомами, которые обычно получают путем слияния отдельных В-лимфоцитов от иммунизированных животных с отдельными клетками лимфоцитарной опухоли. Гибридомы представляют собой тип сконструированных клеток и не встречаются в природе.
«Нативные антитела» обычно являются гетеротетрамерными гликопротеидами с молекулярной массой примерно 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, тогда как количество дисульфидных связей между тяжелыми цепями варьирует в разных изотипах иммуноглобулинов. Каждая тяжелая и легкая цепь также имеет равномерно расположенные внутрицепочечные дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следует несколько константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на другом конце. Константный домен легкой цепи выровнен с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи выровнен с вариабельным доменом тяжелой цепи. Полагают, что конкретные аминокислотные остатки образуют поверхность раздела между вариабельными доменами легкой цепи и тяжелой цепи.
Определение «выделенный» («изолированный»), применяемое для описания различных антител по данному описанию, означает антитело, идентифицированное и выделенное и/или регенерированное из клетки или клеточной культуры, в которой оно экспрессируется. Примеси (загрязняющие компоненты) из природной среды представляют собой материалы, которые, как правило, мешают диагностическому или терапевтическому применению полипептида, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах изобретения антитело очищают (1) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности, при использовании секвенатора с вращающейся стеклянной чашечкой (секвенатора Эдмана), или (2) до гомогенности методом SDS-PAGE в невосстанавливающих или восстанавливающих условиях с применением окрашивания Кумасси бриллиантовым голубым или, предпочтительно, серебром. Выделенное антитело включает антитела in situ внутри рекомбинантных клеток, так как по меньшей мере один компонент природной среды полипептида отсутствует.Обычно выделенный полипептид получают в результате по меньшей мере одной стадии очистки.
«Выделенная» молекула нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, которая идентифицирована и отделена от по меньшей мере одной молекулы нуклеиновой кислоты-примеси, с которой она обычно связана в естественном источнике нуклеиновой кислоты антитела. Выделенная молекула нуклеиновой кислоты отличается от той формы или набора, в которых она находится в естественных условиях. Таким образом, выделенная молекула нуклеиновой кислоты отличается от молекулы нуклеиновой кислоты, существующей в клетках в естественных условиях. Однако выделенная молекула нуклеиновой кислоты включает молекулу нуклеиновой кислоты, находящуюся в клетках, в которых в норме происходит экспрессия антитела, например, в случае, если молекула нуклеиновой кислоты имеет локализацию в хромосоме, отличную от ее локализации в клетках в естественных условиях.
Термин «эпитоп» при использовании в данном документе относится к части (детерминанте) антигена, который специфически связывается со связывающей молекулой (например, и антитело или родственная молекула, такие как биспецифичная связывающая молекула). Эпитопные детерминанты обычно состоят из химически активных поверхностных групп молекул, таких как аминокислоты или углеводы, или боковые цепи сахаров, и, как правило, имеют специфические трехмерные структурные характеристики, а также специфические характеристики зарядов. Эпитоп может быть «линейным» или «конформационным.» В линейном эпитопе, все точки взаимодействия между белком (например, антиген) и взаимодействующей молекулой (такой как антитело) происходит линейно вдоль первичной аминокислотной последовательности белка. В конформационном эпитопе, точки взаимодействия происходят через аминокислотные остатки на белке, отделенные друг от друга в первичной аминокислотной последовательности. Когда желаемый эпитоп антигена определен, можно генерировать антитела к этому эпитопу с использованием методик, хорошо известных в данной области техники. Кроме того, генерация и характеристика антител или других связывающих молекул могут пролить свет на информацию о желательных эпитопах. Основываясь на этой информации, можно затем конкурентно скринировать связывающие молекулы для связывания с теми же или аналогичными эпитопами, например, путем проведения исследований конкуренции, чтобы найти связывающие молекулы, которые конкурируют за связывание с антигеном.
Термин «пептидный линкер» в настоящем документе означает любой пептид с возможностью соединения доменов с длиной в зависимости от доменов, которые он связывает между собой, содержащий любую аминокислотную последовательность. Предпочтительно пептидный линкер имеет длину более 5 аминокислот и состоит из любого набора аминокислот, выбранного из G, A, S, P, E, T, D, K.
Термин «in vitro» относится к биологическому объекту, биологическому процессу или биологической реакции вне организма, смоделированному в искусственных условиях. Например, рост клеток in vitro должен пониматься как рост клеток в среде вне организма, например, в пробирке, культуральном флаконе или микропланшете.
Термин «IС50» (50% ингибирующая концентрация) относится к концентрациям препарата и показывает сколько вещества ингибитора необходимо для ингибирования биологического процесса на 50%. Значение IС50 может оцениваться c помощью соответствующих кривых зависимости ответа от логарифма дозы, с использованием специальных статистических программ для обработки кривых.
Термин ED50 (EC50) (50% эффективная доза/концентрация) относится к концентрациям препарата, при которых измеряемый биологический эффект достигается на 50% (может включать цитотоксичность).
Понятие «эффекторная функция» антитела относится к видам биологической активности, связанным с Fс-областью (нативной последовательностью Fc-области или с вариантами аминокислотной последовательности Fc-области) антитела, и варьирует в зависимости от изотипа антитела. Примерами эффекторных функций антитела являются: Clq- связывание; комплементзависимая цитотоксичность; связывание Fc-рецептора; антитело-зависимая клеточно-опосредованная цитотоксичность (ADCC); фагоцитоз; понижающая регуляция рецепторов клеточной поверхности (например, В-клеточного рецептора, BCR) и В-клеточная активация.
«Антитело-зависимая клеточная цитотоксичность» или «ADCC» относится к опосредованному иммунокомпетентными клетками-эффектирами (Т-киллеры, естественные киллеры и др) ответу, при котором неспецифичные цитотоксические клетки, которые экспрессируют рецепторы Fc (FcR) (например, природные клетки-киллеры (NK), нейтрофилы и макрофаги), узнают связанное антитело на клетке-мишени и затем вызывают лизис или фагоцитоз клетки-мишени. Первичные клетки для опосредования ADCC, NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гематопоэтических клетках суммирована в таблице 3 на странице 464 в публикации Ravetch and Kinet, Annu. Rev. Immunol 9: 457-92 (1991). Чтобы оценить активность в ADCC представляющей интерес молекулы можно осуществить анализы ADCC in vitro, такие как анализы, описанные в патентах США №5500362 или 5821337. Применимые эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (PBMC) и природные клетки-киллеры (NK). Альтернативно или дополнительно ADCC-активность представляющей интерес молекулы можно оценить in vivo, например, в животной модели, такой как модель, описанная в Clynes et al. PNAS (USA) 95: 652-656 (1998).
«Эффекторными клетками человека» являются лейкоциты, которые экспрессируют один или несколько Fc-рецепторов (FcR) и осуществляют эффекторные функции. Предпочтительно клетки экспрессируют, по меньшей мере, FcγRIII и осуществляют ADCC-эффекторную функцию. Примеры лейкоцитов человека, которые опосредуют ADCC, включают мононуклеарные клетки периферической крови (PBMC), природные клетки-киллеры (NK), моноциты, цитотоксические T-клетки и нейтрофилы; при этом предпочтительны PBMC и NK-клетки. Эффекторные клетки могут быть выделены из их природного источника, например, из крови или PBMC, как описано в настоящей публикации.
Термины «Fc-рецептор» и «FcR» используют для описания рецептора, который связывается с Fc-областью антитела. Предпочтительным FcR является FcR человека с нативной последовательностью. Кроме того, предпочтительным FcR является FcR, который связывает IgG-антитело (гамма-рецептор), и к предпочтительным рецепторам относятся рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсируемые формы указанных рецепторов. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют сходные аминокислотные последовательности, которые отличаются главным образом своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит в своем цитоплазматическом домене основанный на тирозине мотив активации иммунорецептора (ITAM). Ингибирующий рецептор FcγRIIB содержит в своем цитоплазматическом домене основанный на тирозине мотив ингибирования иммунорецептора (ITIM) (см. обзор в Daëron, Annu. Rev. Immunol. 15: 203-234 (1997)). Обзор, посвященный FcR, представлен в Ravetch and Kinet, Annu. Rev. Immunol 9: 457-92 (1991). Другие FcR, включая FcR, которые будут идентифицированы в будущем, включены в настоящем описании в термин «FcR». Термин также включает неонатальный рецептор, FcRn, который отвечает за перенос материнских IgG в плод.
«Комплемент-зависимая цитотоксичность» или «CDC», относится к способности молекулы лизировать мишень в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой (например, антителом) в комплексе со своим антигеном. Чтобы оценить активацию комплемента можно осуществить анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996).
Термин «идентичность» или «гомологичность» следует толковать как означающее процентное содержание остатков аминокислот в кандидатной последовательности, которые идентичны остаткам соответствующей последовательности, с которой ее сравнивают, после сравнения последовательностей и введения «брешей», если необходимо достичь максимального процента идентичности для полной последовательности и не учитывая любые консервативные замещения как часть идентичности последовательности. Ни N- или С-концевой удлиняющей, ни инсерционные сегменты не следует толковать как уменьшающие идентичность или гомологичность. Методы и компьютерные программы для сравнения хорошо известны. Идентичность последовательности можно определить, используя программное обеспечение для анализа последовательности (например, Sequence Analysis Software Package, Genetics Computer Group, University of Wisconsin Biotechnology Center, 1710 University Ave., Madison, WI 53705). Данное программное обеспечение подходит для подобных последовательностей путем определения степени гомологичности для разнообразных замещений, делеций (элиминирований) и других модификаций.
Фразу «гомологичный», что касается полипептидной последовательности антитела, следует толковать как антитело, проявляющее по крайней мере, 70%-ную, предпочтительно 80%-ную, более предпочтительно 90%-ную и наиболее предпочтительно 95%-ную идентичность последовательности относительно полипептидной последовательности. Термин в отношении последовательности нуклеиновой кислоты следует толковать как последовательность нуклеотидов, проявляющих, по крайней мере, 85%-ную, предпочтительно 90%-ную, более предпочтительно 95%-ную и наиболее предпочтительно 97%-ную идентичность последовательности относительно последовательности нуклеиновой кислоты.
Предлагается модификация(и) аминокислотных последовательностей антител, описанных в настоящей публикации. Например, может быть желательным улучшение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотной последовательности антитела получают введением соответствующих изменений нуклеотидов в нуклеиновую кислоту антитела или пептидным синтезом. Такие модификации включают, например, делеции, и/или инсерции, и/или замены остатков в аминокислотных последовательностях антитела. Осуществляют любое сочетание делеции, инсерции и замены, чтобы получить конечную конструкцию, при условии, что конечная конструкция обладает требуемыми характеристиками. Изменения аминокислот также могут изменять посттрансляционные процессы в антителе, такие как изменение количества или положения сайтов гликозилирования.
Вариант модификации аминокислотных последовательностей антител с помощью аминокислотных замен. Такой вариант представляет собой замену, по меньшей мере, одного аминокислотного остатка в молекуле антитела на другой остаток. Места, представляющие наибольший интерес для мутагенеза путем замен, включают гипервариабельные области или CDR, но также предполагаются изменения и в области FR или Fc. Консервативные замены показаны в таблице 1 под заголовком «предпочтительные замены». Если такие замены приводят к изменению биологической активности, то могут быть введены дополнительные существенные изменения, названные «примерами заменам» в таблице А, или изменения, дополнительно описанные ниже при описании классов аминокислот, и может быть проведен скрининг продуктов.
Термины «нуклеиновая кислота», «нуклеиновая последовательность» или «нуклеиновокислотная последовательность», «полинуклеотид», «олигонуклеотид», «полинуклеотидная последовательность» и «нуклеотидная последовательность», которые используются равнозначно в данном описании, обозначают четкую последовательность нуклеотидов, модифицированных или не модифицированных, определяющую фрагмент или участок нуклеиновой кислоты, содержащую или не содержащую неприродные нуклеотиды и являющуюся либо двухцепочечной ДНК или РНК, либо одноцепочечной ДНК или РНК, либо продуктами транскрипции указанных ДНК.
Здесь также следует упомянуть, что данное изобретение не относится к нуклеотидным последовательностям в их природной хромосомной среде, т.е. в природном состоянии. Последовательности данного изобретения были выделены и/или очищены, т.е. были взяты прямо или косвенно, например, путем копирования, при этом их среда была по меньшей мере частично модифицирована. Таким образом, также здесь следует подразумевать изолированные нуклеиновые кислоты, полученные путем генетической рекомбинации, например, с помощью принимающих клеток (клеток-хозяев), или полученные путем химического синтеза.
Ссылка на нуклеотидную последовательность охватывает его комплимент, если не указано иное. Таким образом, ссылка на нуклеиновую кислоту, имеющую определенную последовательность следует понимать, как охватывающие ее комплементарную цепь с ее комплементарной последовательностью.
Выражение «контролирующие последовательности» относится к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в определенном организме-хозяине. Пригодные для прокариот контролирующие последовательности представляют собой, например, промотор, необязательно оператор и сайт связывания рибосомы. Как известно, в эукариотических клетках присутствуют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота «функционально связана», если она находится в функциональной связи с другой нуклеотидной последовательностью. Например, ДНК предпоследовательности или секреторной лидерной последовательности функционально связывают с ДНК полипептида, если он экспрессируется в виде предпротеина, который принимает участие в секреции полипептида; промотор или энхансер функционально связывают с кодирующей последовательностью, если он оказывает воздействие на транскрипцию последовательности; сайт связывания рибосомы функционально связывают с кодирующей последовательностью, если он расположен так, что может облегчать трансляцию. Как правило, «функционально связан» обозначает, что связанные последовательности ДНК являются смежными, а в случае секреторной лидерной последовательности являются смежными и находятся в фазе считывания. Однако энхансеры не обязательно должны быть смежными.
Термин «вектор» при использовании в настоящем документе означает молекулу нуклеиновой кислоты, способную транспортировать другую нуклеиновую кислоту, с которой она соединена. В некоторых вариантах осуществления изобретения вектор представляет собой плазмиду, т.е. кольцевую двухцепочечную часть ДНК, в которую могут быть лигированы дополнительные сегменты ДНК. В некоторых вариантах осуществления изобретения вектор представляет собой вирусный вектор, в котором дополнительные сегменты ДНК могут быть лигированы в вирусный геном. В некоторых вариантах осуществления изобретения векторы способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальный сайт инициации репликации и эписомные векторы млекопитающих). В других вариантах осуществления изобретения векторы (например, неэписомальные векторы млекопитающих) могут быть интегрированы в геном клетки-хозяина при введении в клетку-хозяина, и таким образом реплицируются вместе с геном хозяина. Более того, некоторые векторы способны направлять экспрессию генов, с которыми они функционально соединены. Такие векторы упоминаются в данном документе как «рекомбинантные экспрессирующие векторы» (или просто «экспрессирующие векторы»).
Термин «рекомбинантная клетка-хозяин» (или просто «клетка-хозяин») при использовании в данном документе означает клетку, в которую введен рекомбинантный экспрессионный вектор. Настоящее изобретение относится к клеткам-хозяевам, которые могут включать, например, вектор в соответствии с настоящим изобретением, описанным выше. Настоящее изобретение относится также к клеткам-хозяевам, которые включают, например, нуклеотидную последовательность, кодирующую тяжелую цепь или ее антигенсвязывающие части, нуклеотидную последовательность, кодирующую легкую цепь или ее антигенсвязывающие части, или обе из них, первого связывающего домена и/или второго связывающего домена связывающей молекулы по данному изобретению. Следует понимать, что «рекомбинантная клетка-хозяин» и «клетка-хозяин» означают не только конкретную заявленную клетку, но также и потомство такой клетки. Поскольку модификации могут проходить в последующих поколениях вследствие мутации или воздействий окружающей среды, такое потомство не может, на самом деле, быть идентичным родительской клетке, но такие клетки по-прежнему включены в объем термина «клетка-хозяин» при использовании в настоящем документе.
Термин «эксципиент» используется в данном документе для описания любого ингредиента, отличающегося от соединения(ий) по данному изобретению.
«Фармацевтическая композиция» обозначает композицию, включающую в себя антитело согласно изобретению и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например, сахара, полиолы, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например, моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие, как оливковое масло) и инъекционные органические сложные эфиры (такие, как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, альгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутриглазного, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
«Лекарственное средство (препарат)» – вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, растворов, мазей и др. готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
Термин «заболевание или нарушение, опосредованное взаимодействием IL-5 и его клеточным рецептором» подразумевает все заболевания или нарушения, которые либо прямо, либо косвенно связаны с IL-5 и IL-5R, включая этиологию, развитие, прогресс, персистентность или патологию заболевания или нарушения. «Лечить», «лечение» и «терапия» относятся к методу смягчения или устранения биологического расстройства и/или по меньшей мере одного из сопутствующих ему симптомов. Используемый в данном документе термин «облегчить» болезнь, заболевание или состояние, означает уменьшение тяжести и/или частоты возникновения симптомов заболевания, расстройства или состояния. Кроме того, содержащиеся в данном документе ссылки на «лечение» включает ссылки на лечебную, паллиативную и профилактическую терапию.
В одном аспекте субъект лечения или пациент является млекопитающим, предпочтительно человеческим субъектом. Вышеупомянутый субъект может быть мужского или женского пола любого возраста.
Термин «нарушение» означает любое состояние, которое можно улучшить в результате лечения по настоящему изобретению. В определение данного термина входят хронические и острые нарушения или заболевания, включающие в себя патологические состояния, которые вызывают предрасположенность млекопитающего к возникновению данного нарушения. Предпочтительным подлежащим лечению нарушением согласно изобретению, являются аутоиммунные заболевания.
Термины «иммунный ответ», «аутоиммунная реакция», «аутоиммунное воспаление» относятся, например, к действию лимфоцитов, антиген-представляющих клеток, фагоцитирующих клеток, гранулоцитов и растворимых макромолекул, вырабатываемых указанными клетками или клетками печени (включая антитела, цитокины и комплемент, образующиеся в результате селективного повреждения, разрушения или элиминации из человеческого организма инвазивных патогенов, клеток или тканей, инфицированных патогенами, раковых клеток или, в случаях аутоиммунитета или патологического воспаления, нормальных человеческих клеток или тканей).
Термин «аутоиммунное заболевание» в контексте настоящего описания обозначает не злокачественное заболевание или нарушение, возникающее и направленное против собственных (ауто) антигенов и/или тканей индивидуума.
Это определение охватывает, но без ограничения, ревматоидный артрит, артроз, ювенильный хронический артрит, септический артрит, артроз Лайма, псориатический артрит, реактивный артрит, спондилоартропатия, системная красная волчанка, болезнь Крона, язвенный колит, воспалительные заболевания кишечника, сахарный диабет, тиреоидит, астма, аллергические заболевания, псориаз, атопический дерматит, склеродермия, реакция «трансплантат против хозяина», отторжение трансплантата, острые или хронические иммунные заболевания, связанные с трансплантацией, саркоидоз, болезнь Кавасаки, болезнь Грейвса, нефротический синдром, синдром хронической усталости, гранулематоз Вегенера, пурпура Геноха-Шенлейна, микроскопический почечный васкулит, хронический активный гепатит, uvenita, септический шок, синдром токсического шока, септический синдром, кахексия, синдром приобретенного иммунодефицита, острый поперечный миелит, хорея Гентингтона, болезнь Паркинсона, болезнь Альцгеймера, инсульт, первичный билиарный цирроз, гемолитическая анемия, взрослых (острый) респираторный дистресс-синдром, алопеция, очаговая алопеция, серонегативная артропатия, артропатии, болезнь Рейтера, псориатическая артропатия, связанная с язвенным колитом артропатия, атопические аллергии, аутоиммунные Буллезные заболевания, пузырчатка vulgaris, листовидная пузырчатка, болезнь пемфигоида, линейные IgA, аутоиммунная гемолитическая анемия, Кумбс позитивная гемолитическая анемия, злокачественная анемия, ювенильная злокачественная анемия, артрит, первичный склерозирующий гепатит А, криптогенный аутоиммунный гепатит, фиброзирующие заболевания легких, криптогенный фиброзный альвеолит, поствоспалительные интерстициальные заболевания легких, интерстициальный пневмонит, хроническая эозинофильная пневмония chronic, постинфекционные интерстициальные заболевания легких, подагрический артрит, аутоиммунный гепатит, аутоиммунный гепатит I типа (классический аутоиммунный гепатит или липоид), аутоиммунный гепатит II типа, остеоартрит, первичный склерозирующий холангит, псориаз I типа, псориаз II типа, идеопатическая лейкопения, аутоиммунная нейтропения, ренальные NOS заболевания [renal NOS-disease], гломерулонефрит, микроскопический ренальный васкулит, дискоидный волчаночный эритематоз, идеопатическая или мужская NOS фертильность, [autoimmunity to sperm], все подтипы множественного склероза, симпатическая офтальмия, вторичная легочная гипертензия при заболеваниях соединительной ткани, синдром Гудпасчера, легочная манифестация узлового полиартрита, острая ревматическая лихорадка, ревматоидный спондилит, анкилозирующий спондилит, болезнь Стилла, системный склероз, синдром Шегрена, синдром Такаясу, аутоиммунная тромбоцитопения, идиопатическая тромбоцитопения, аутоимунный тиреоидит, гипертиреоидизм, болезнь Хашимото, аутоиммунный атрофический гипотиреоидизм, первичная микседема, факогенный увеит, первичный васкулит, витилиго, острые заболевания печени, хронические заболевания печени, аллергии, астма, психические заболевания (включая депрессию и шизофрению), заболевания опосредованные Th2 типом и Th1 типом, коньюктивиты, аллергические контактные дерматиты, аллергические риниты, дефицит альфа-1-антитрипсинa, амиотрофический латеральный склероз, анемия, цистический фиброз, заболевания ассоциированные с цитокиновой терапией, демиелизирующие заболевания, дерматиты, иридоциклит/увеит/оптический неврит, повреждение ишемической реперфузии, ишемический инсульт, ювенильный ревматоидный артрит, аутоиммунная энтеропатия, аутоимунная потеря слуха, аутоиммунный лимфопролиферативный синдром, аутоиммунный миокардит, аутоиммунная преждевременная недостаточность яичника и блефарит.Антитело может также лечить любую комбинацию из перечисленных выше расстройств.
«Терапевтически эффективным количеством» считается количество вводимого в процессе лечения терапевтического агента, которое избавит в определенной степени от одного или нескольких симптомов заболевания, по поводу которого проводится лечение.
Понятие «хроническое» применение относится к непрерывному (продолжительному) применению агента(ов) в противоположность острому (кратковременному) пути введения, так чтобы поддерживать первоначальное терапевтическое действие (активность) в течение длительного периода времени.
«Прерывистое» применение обозначает лечение, которое не осуществляют последовательно без перерывов, но которое скорее по своей природе является периодическим.
В настоящем описании и в последующей формуле изобретения, если контекстом не предусмотрено иное, слова «иметь», «включать» и «содержать» или их вариации, такие как «имеет», «имеющий», «включает», «включающий», «содержит» или «содержащий», следует понимать, как включение указанного целого или группы целых, но не исключение любого другого целого или группы целых.
Подробное описание изобретения
Антитело
Настоящее изобретение относится к антителам или антигенсвязывающему фрагменту, которые специфично связываются с IL-5Rα.
В одном из вариантов осуществления настоящее изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, которое специфично связывается с IL-5Rα, и содержит:
(a) вариабельную область тяжелой цепи, содержащую CDR3 с аминокислотной последовательностью по меньшей мере на 80%, 85% или 92% гомологичной или идентичной последовательности DYATNYGVPYFGS (SEQ ID NO: 3), то есть CDR3 передставляет собой последовательность DYATNYGVPYFGS (SEQ ID NO: 3) или последовательность DYATNYGVPYFGS (SEQ ID NO: 3) с 1 или 2 заменами, и
(b) вариабельную область легкой цепи, содержащую CDR3 с аминокислотной последовательностью по меньшей мере на 80%, 83% или 91% гомологичной или идентичной последовательности QSYDSSLSGHVV (SEQ ID NO:8), то есть CDR3 передставляет собой последовательность QSYDSSLSGHVV (SEQ ID NO:8) или последовательность QSYDSSLSGHVV (SEQ ID NO:8) с 1 или 2 заменами.
В одном из вариантов осуществления настоящее изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, которое специфично связывается с IL-5Rα, и содержит вариабельную область тяжелой цепи, содержащую CDR3 с аминокислотной последовательностью DYATNYGVPYFGS (SEQ ID NO: 3).
В одном из вариантов осуществления настоящее изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, которое специфично связывается с IL-5Rα, и содержит вариабельную область легкой цепи, содержащую CDR3 с аминокислотной последовательностью QSYDSSLSGHVV (SEQ ID NO:8).
В одном из вариантов осуществления настоящее изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, которое специфично связывается с IL-5Rα, и содержит:
(a) вариабельную область тяжелой цепи, содержащую CDR3 с аминокислотной последовательностью DYATNYGVPYFGS (SEQ ID NO: 3), и
(b) вариабельную область легкой цепи, содержащую CDR3 с аминокислотной последовательностью QSYDSSLSGHVV (SEQ ID NO:8).
В одном из вариантов осуществления настоящее изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, которое специфично связывается с IL-5Rα, и содержит:
(a) вариабельную область тяжелой цепи, содержащую:
(i) CDR1 с аминокислотной последовательностью по меньшей мере на 80% гомологичной или идентичной последовательности NYAMS (SEQ ID NO: 1), то есть CDR1 передставляет собой последовательность NYAMS (SEQ ID NO: 1) или последовательность NYAMS (SEQ ID NO: 1) с 1 заменой;
(ii) CDR2 с аминокислотной последовательностью по меньшей мере на 80%, 88%, или 94% гомологичной или идентичной последовательности AINSGGKSTNYADSVKG (SEQ ID NO: 2), то есть CDR2 передставляет собой последовательность AINSGGKSTNYADSVKG (SEQ ID NO: 2) или последовательность AINSGGKSTNYADSVKG (SEQ ID NO: 2) с 1 или 2 заменами;
(iii) CDR3 с аминокислотной последовательностью по меньшей мере на 80%, 85% или 92%гомологичной или идентичной последовательности DYATNYGVPYFGS (SEQ ID NO: 3), то есть CDR3 передставляет собой последовательность DYATNYGVPYFGS (SEQ ID NO: 3) или последовательность DYATNYGVPYFGS (SEQ ID NO: 3) с 1 или 2 заменами;
и/или
(b) вариабельную область легкой цепи, содержащую:
(i) CDR1 с аминокислотной последовательностью по меньшей мере на 80%, 85% или 92% гомологичной или идентичной последовательности SGSRSNIGSGYDVH (SEQ ID NO: 6), то есть CDR1 передставляет собой последовательность SGSRSNIGSGYDVH (SEQ ID NO: 6) или последовательность SGSRSNIGSGYDVH (SEQ ID NO: 6) с 1 или 2 заменами;
(ii) CDR2 с аминокислотной последовательностью по меньшей мере 80% или 85% гомологичной или идентичной последовательности DDNNRPS (SEQ ID NO: 7), то есть CDR2 передставляет собой последовательность DDNNRPS (SEQ ID NO: 7) или последовательность DDNNRPS (SEQ ID NO: 7) с 1 заменой;
(iii) CDR3 с аминокислотной последовательностью по меньшей мере на 80%, 83% или 91% гомологичной или идентичной последовательности QSYDSSLSGHVV (SEQ ID NO:8), то есть CDR3 передставляет собой последовательность QSYDSSLSGHVV (SEQ ID NO:8) или последовательность QSYDSSLSGHVV (SEQ ID NO:8) с 1 или 2 заменами.
В одном из вариантов осуществления настоящее изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, которое специфично связывается с IL-5Rα, и содержит:
(a) вариабельную область тяжелой цепи, содержащую:
(i) CDR1 с аминокислотной последовательностью NYAMS (SEQ ID NO: 1),
(ii) CDR2 с аминокислотной последовательностью AINSGGKSTNYADSVKG (SEQ ID NO: 2),
(iii) CDR3 с аминокислотной последовательностью DYATNYGVPYFGS (SEQ ID NO: 3), и/или
(b) вариабельную область легкой цепи, содержащую:
(i) CDR1 с аминокислотной последовательностью SGSRSNIGSGYDVH (SEQ ID NO: 6),
(ii) CDR2 с аминокислотной последовательностью DDNNRPS (SEQ ID NO: 7),
(iii) CDR3 с аминокислотной последовательностью последовательности QSYDSSLSGHVV (SEQ ID NO:8).
В одном из вариантов осуществления настоящее изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, которое специфично связывается с IL-5Rα, и содержит:
(a) вариабельную область тяжелой цепи с аминокислотной последовательностью по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% гомологичной или идентичной последовательности, выбранной из группы: QVTLKESGGGLVQPGGSLRLSCAASGFTFSNYAMSWVRQAPGKGLEWVSAINSGGKSTNYADSVKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCADYATNYGVPYFGSWGQGTTVTVSS (SEQ ID NO: 4) или QVQLQESGGGLVQPGGSLRLSCAASGFTFSNYAMSWVRQAPGKGLEWVSAINSGGKSTNYADSVKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCADYATNYGVPYFGSWGQGTMVTVSS (SEQ ID NO: 5), и/или
(b) вариабельную область легкой цепи с аминокислотной последовательностью по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% гомологичной или идентичной последовательности, выбранной из группы: QAGLTQPPSVSAAPGQRVTISCSGSRSNIGSGYDVHWYQQVPGTAPKLLIFDDNNRPSGVPDRFSGSKSGTSASLAITGLQAEDEADYYCQSYDSSLSGHVVFGGGTKLTVL (SEQ ID NO: 9) или QSVLTQPPSVSAAPGQRVTISCSGSRSNIGSGYDVHWYQQLPGTAPKLLIYDDNNRPSGVPDRFSGSKSGTSASLAITGLQAEDEADYYCQSYDSSLSGHVVFGGGTKLTVL (SEQ ID NO: 10).
В одном из вариантов осуществления настоящее изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, которое специфично связывается с IL-5Rα, и содержит:
(a) вариабельную область тяжелой цепи с аминокислотной последовательностью, выбранной из группы: QVTLKESGGGLVQPGGSLRLSCAASGFTFSNYAMSWVRQAPGKGLEWVSAINSGGKSTNYADSVKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCADYATNYGVPYFGSWGQGTTVTVSS (SEQ ID NO: 4) или QVQLQESGGGLVQPGGSLRLSCAASGFTFSNYAMSWVRQAPGKGLEWVSAINSGGKSTNYADSVKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCADYATNYGVPYFGSWGQGTMVTVSS (SEQ ID NO: 5), и/или
(b) вариабельную область легкой цепи с аминокислотной последовательностью, выбранной из группы: QAGLTQPPSVSAAPGQRVTISCSGSRSNIGSGYDVHWYQQVPGTAPKLLIFDDNNRPSGVPDRFSGSKSGTSASLAITGLQAEDEADYYCQSYDSSLSGHVVFGGGTKLTVL (SEQ ID NO: 9) или QSVLTQPPSVSAAPGQRVTISCSGSRSNIGSGYDVHWYQQLPGTAPKLLIYDDNNRPSGVPDRFSGSKSGTSASLAITGLQAEDEADYYCQSYDSSLSGHVVFGGGTKLTVL (SEQ ID NO: 10).
В одном из вариантов осуществления настоящее изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, которое специфично связывается с IL-5Rα, и содержит:
(a) тяжелую цепь с аминокислотной последовательностью по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% гомологичной или идентичной последовательности, выбранной из группы: QVTLKESGGGLVQPGGSLRLSCAASGFTFSNYAMSWVRQAPGKGLEWVSAINSGGKSTNYADSVKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCADYATNYGVPYFGSWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO: 11) или QVQLQESGGGLVQPGGSLRLSCAASGFTFSNYAMSWVRQAPGKGLEWVSAINSGGKSTNYADSVKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCADYATNYGVPYFGSWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO: 12),
и/или
(b) легкую цепь с аминокислотной последовательностью по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% гомологичной или идентичной последовательности QAGLTQPPSVSAAPGQRVTISCSGSRSNIGSGYDVHWYQQVPGTAPKLLIFDDNNRPSGVPDRFSGSKSGTSASLAITGLQAEDEADYYCQSYDSSLSGHVVFGGGTKLTVLRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 13) или QSVLTQPPSVSAAPGQRVTISCSGSRSNIGSGYDVHWYQQLPGTAPKLLIYDDNNRPSGVPDRFSGSKSGTSASLAITGLQAEDEADYYCQSYDSSLSGHVVFGGGTKLTVLRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 14).
В одном из вариантов осуществления настоящее изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, которое специфично связывается с IL-5Rα, и содержит:
(a) тяжелую цепь с аминокислотной последовательностью, выбранной из группы: QVTLKESGGGLVQPGGSLRLSCAASGFTFSNYAMSWVRQAPGKGLEWVSAINSGGKSTNYADSVKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCADYATNYGVPYFGSWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO: 11) или QVQLQESGGGLVQPGGSLRLSCAASGFTFSNYAMSWVRQAPGKGLEWVSAINSGGKSTNYADSVKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCADYATNYGVPYFGSWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO: 12),
и/или
(b) легкую цепь с аминокислотной последовательностью QAGLTQPPSVSAAPGQRVTISCSGSRSNIGSGYDVHWYQQVPGTAPKLLIFDDNNRPSGVPDRFSGSKSGTSASLAITGLQAEDEADYYCQSYDSSLSGHVVFGGGTKLTVLRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 13) или QSVLTQPPSVSAAPGQRVTISCSGSRSNIGSGYDVHWYQQLPGTAPKLLIYDDNNRPSGVPDRFSGSKSGTSASLAITGLQAEDEADYYCQSYDSSLSGHVVFGGGTKLTVLRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 14).
В одном из вариантов осуществления настоящего изобретения выделенное антитело, которое специфично связывается с IL-5Rα, представляет собой моноклональное антитело.
В одном из вариантов осуществления настоящего изобретения моноклональное антитело, которое специфично связывается с IL-5Rα, представляет собой полноразмерное антитело IgG.
В одном из вариантов осуществления настоящего изобретения полноразмерное антитело IgG, которое специфично связывается с IL-5Rα, относится к изотипу IgG1, IgG2, IgG3 или IgG4 человека.
В одном из вариантов осуществления настоящего изобретения полноразмерное антитело IgG, которое специфично связывается с IL-5Rα, относится к изотипу IgG1 человека.
В одном из вариантов осуществления настоящего изобретения выделенное антитело представляет собой антитело BCD133-03-002, которое специфично связывается с IL-5Rα, и содержит вариабельный фрагмент тяжелой цепи с аминокислотной последовательностью QVTLKESGGGLVQPGGSLRLSCAASGFTFSNYAMSWVRQAPGKGLEWVSAINSGGKSTNYADSVKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCADYATNYGVPYFGSWGQGTTVTVSS и вариабельный фрагмент легкой цепи с аминокислотной последовательностью QAGLTQPPSVSAAPGQRVTISCSGSRSNIGSGYDVHWYQQVPGTAPKLLIFDDNNRPSGVPDRFSGSKSGTSASLAITGLQAEDEADYYCQSYDSSLSGHVVFGGGTKLTVL.
В одном из вариантов осуществления настоящего изобретения выделенное антитело представляет собой антитело BCD133-03-020, которое специфично связывается с IL-5Rα, и содержит вариабельный фрагмент тяжелой цепи с аминокислотной последовательностью QVQLQESGGGLVQPGGSLRLSCAASGFTFSNYAMSWVRQAPGKGLEWVSAINSGGKSTNYADSVKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCADYATNYGVPYFGSWGQGTMVTVSS и вариабельный фрагмент легкой цепи с аминокислотной последовательностью QAGLTQPPSVSAAPGQRVTISCSGSRSNIGSGYDVHWYQQVPGTAPKLLIFDDNNRPSGVPDRFSGSKSGTSASLAITGLQAEDEADYYCQSYDSSLSGHVVFGGGTKLTVL.
В одном из вариантов осуществления настоящего изобретения выделенное антитело представляет собой антитело BCD133-03-021, которое специфично связывается с IL-5Rα, и содержит вариабельный фрагмент тяжелой цепи с аминокислотной последовательностью QVQLQESGGGLVQPGGSLRLSCAASGFTFSNYAMSWVRQAPGKGLEWVSAINSGGKSTNYADSVKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCADYATNYGVPYFGSWGQGTMVTVSS и вариабельный фрагмент легкой цепи с аминокислотной последовательностью QSVLTQPPSVSAAPGQRVTISCSGSRSNIGSGYDVHWYQQLPGTAPKLLIYDDNNRPSGVPDRFSGSKSGTSASLAITGLQAEDEADYYCQSYDSSLSGHVVFGGGTKLTVL.
В одном из вариантов осуществления настоящего изобретения выделенное антитело представляет собой антитело BCD133-03-002, которое специфично связывается с IL-5Rα, и содержит вариабельный фрагмент тяжелой цепи с аминокислотной последовательностью QVTLKESGGGLVQPGGSLRLSCAASGFTFSNYAMSWVRQAPGKGLEWVSAINSGGKSTNYADSVKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCADYATNYGVPYFGSWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK и вариабельный фрагмент легкой цепи с аминокислотной последовательностью QAGLTQPPSVSAAPGQRVTISCSGSRSNIGSGYDVHWYQQVPGTAPKLLIFDDNNRPSGVPDRFSGSKSGTSASLAITGLQAEDEADYYCQSYDSSLSGHVVFGGGTKLTVLRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC.
В одном из вариантов осуществления настоящего изобретения выделенное антитело представляет собой антитело BCD133-03-020, которое специфично связывается с IL-5Rα, и содержит тяжелую цепь с аминокислотной последовательностью QVQLQESGGGLVQPGGSLRLSCAASGFTFSNYAMSWVRQAPGKGLEWVSAINSGGKSTNYADSVKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCADYATNYGVPYFGSWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK и легкую цепь с аминокислотной последовательностью QAGLTQPPSVSAAPGQRVTISCSGSRSNIGSGYDVHWYQQVPGTAPKLLIFDDNNRPSGVPDRFSGSKSGTSASLAITGLQAEDEADYYCQSYDSSLSGHVVFGGGTKLTVLRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC.
В одном из вариантов осуществления настоящего изобретения выделенное антитело представляет собой антитело BCD133-03-021, которое специфично связывается с IL-5Rα, и содержит тяжелую цепь с аминокислотной последовательностью QVQLQESGGGLVQPGGSLRLSCAASGFTFSNYAMSWVRQAPGKGLEWVSAINSGGKSTNYADSVKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCADYATNYGVPYFGSWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK и легкую цепь с аминокислотной последовательностью QSVLTQPPSVSAAPGQRVTISCSGSRSNIGSGYDVHWYQQLPGTAPKLLIYDDNNRPSGVPDRFSGSKSGTSASLAITGLQAEDEADYYCQSYDSSLSGHVVFGGGTKLTVLRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC.
Молекулы нуклеиновых кислот
Настоящее изобретение также относится к молекулам нуклеиновых кислот, а именно к последовательностям, кодирующим антитело к IL-5R((α-цепи рецептора интерлейкина 5) по данному изобретению или любым его фрагментам и их различным комбинациям, которые описаны в данном документе, необязательно включающим любую последовательность соединяющего их пептидного линкера.
Ссылка на нуклеотидную последовательность, охватывает его комплимент, если не указано иное. Таким образом, ссылка на нуклеиновую кислоту, имеющую определенную последовательность следует понимать, как охватывающие ее комплементарную цепь с ее комплементарной последовательностью. Термин «полинуклеотид», упоминаемый в данном документе, означает полимерную форму нуклеотидов, по меньшей мере 10 оснований в длину, либо рибонуклеотидов, либо дезоксинуклеотидов или модифицированную форму любого типа нуклеотида. Термин включает в себя одно- и двухцепочечные формы.
Настоящее изобретение также относится к нуклеотидным последовательностям, которые по меньшей мере на 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% гомологичны или идентичны одной или нескольким из вышеупомянутых нуклеотидных последовательностей или нуклеотидной последовательности, кодирующей аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-3, 6-8. В определенных вариантах осуществления нуклеотидные последовательности по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% гомологичны или идентичны нуклеотидной последовательности, кодирующей аминокислотную последовательность SEQ ID NO: 4-5, 9-10. Настоящее изобретение также относится к нуклеотидным последовательностям, которые по меньшей мере на 80%, 85%, 90%, 95%, 97%, 98% или 99% идентичны одной или нескольким из вышеупомянутых нуклеотидных последовательностей или нуклеотидной последовательности, кодирующей аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 11-14.
В одном из аспектов настоящее изобретение относится к молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, которая кодирует аминокислотную последовательность, выбранную из SEQ ID NO: 1-14. Молекула нуклеиновой кислоты может также содержать любую комбинацию указанных нуклеотидных последовательностей. В одном варианте осуществления изобретения молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую SEQ ID NO: 3. В другом варианте осуществления изобретения молекула нуклеиновой кислоты содержит нуклеотидные последовательности, кодирующие SEQ ID NO: 8. В одном варианте осуществления изобретения молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую SEQ ID NO: 1-3. В другом варианте осуществления изобретения молекула нуклеиновой кислоты содержит нуклеотидные последовательности, кодирующие SEQ ID NO: 6-8. В другом варианте осуществления изобретения молекула нуклеиновой кислоты содержит нуклеотидные последовательности, кодирующие SEQ ID NO: 4 или 5. В другом варианте осуществления изобретения молекула нуклеиновой кислоты содержит нуклеотидные последовательности, кодирующие SEQ ID NO: 9 или 10. В другом варианте осуществления изобретения молекула нуклеиновой кислоты содержит нуклеотидные последовательности, кодирующие SEQ ID NO: 4 или 5, и нуклеотидные последовательности, кодирующие SEQ ID NO: 9 или 10. В другом варианте осуществления изобретения молекула нуклеиновой кислоты содержит нуклеотидные последовательности, кодирующие SEQ ID NO: 11 или 12. В другом варианте осуществления изобретения молекула нуклеиновой кислоты содержит нуклеотидные последовательности, кодирующие SEQ ID NO: 13 или 14. В другом варианте осуществления изобретения молекула нуклеиновой кислоты содержит нуклеотидные последовательности, кодирующие SEQ ID NO: 11 или 12, и нуклеотидные последовательности, кодирующие SEQ ID NO: 13 или 14.
В одном из аспектов настоящее изобретение относится к молекуле нуклеиновой кислоты, которая кодирует тяжелую цепь, и содержит нуклеотидную последовательность по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% гомологичную или идентичную последовательности, выбранной из группы: CAAGTAACCCTAAAGGAAAGTGGAGGAGGACTTGTCCAACCCGGCGGCAGTTTAAGACTTAGCTGTGCTGCTTCTGGCTTTACTTTTAGCAACTATGCTATGTCGTGGGTGCGTCAAGCGCCAGGAAAGGGCCTAGAATGGGTGAGCGCTATCAATAGCGGCGGAAAAAGCACTAACTACGCGGACAGCGTGAAAGGCCGCTTCACTATAAGTCGGGACAATGCTAAAAACACACTGTACCTCCAGATGAACTCCCTAAGAGCTGAGGACACGGCTGTGTACTACTGCGCTGATTATGCGACTAACTATGGAGTGCCATACTTCGGAAGCTGGGGCCAGGGAACGACCGTAACTGTGAGTAGTGCTAGCACCAAGGGCCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTATAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAAAGCCTCTCCCTGTCCCCGGGTAAA (SEQ ID NO: 15) или
CAAGTACAACTACAGGAAAGTGGAGGAGGACTTGTCCAACCCGGCGGCAGTTTAAGACTTAGCTGTGCTGCTTCTGGCTTTACTTTTAGCAACTATGCTATGTCGTGGGTGCGTCAAGCGCCAGGAAAGGGCCTAGAATGGGTGAGCGCTATCAATAGCGGCGGAAAAAGCACTAACTACGCGGACAGCGTGAAAGGCCGCTTCACTATAAGTCGGGACAATGCTAAAAACACACTGTACCTCCAGATGAACTCCCTAAGAGCTGAGGACACGGCTGTGTACTACTGCGCTGATTATGCGACTAACTATGGAGTGCCATACTTCGGAAGCTGGGGCCAGGGAACGATGGTAACTGTGAGTAGTGCTAGCACCAAGGGCCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTATAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAAAGCCTCTCCCTGTCCCCGGGTAAA (SEQ ID NO: 16).
В одном из аспектов настоящее изобретение относится к молекуле нуклеиновой кислоты, которая кодирует тяжелую цепь, и содержит нуклеотидную последовательность, выбранную из группы: CAAGTAACCCTAAAGGAAAGTGGAGGAGGACTTGTCCAACCCGGCGGCAGTTTAAGACTTAGCTGTGCTGCTTCTGGCTTTACTTTTAGCAACTATGCTATGTCGTGGGTGCGTCAAGCGCCAGGAAAGGGCCTAGAATGGGTGAGCGCTATCAATAGCGGCGGAAAAAGCACTAACTACGCGGACAGCGTGAAAGGCCGCTTCACTATAAGTCGGGACAATGCTAAAAACACACTGTACCTCCAGATGAACTCCCTAAGAGCTGAGGACACGGCTGTGTACTACTGCGCTGATTATGCGACTAACTATGGAGTGCCATACTTCGGAAGCTGGGGCCAGGGAACGACCGTAACTGTGAGTAGTGCTAGCACCAAGGGCCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTATAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAAAGCCTCTCCCTGTCCCCGGGTAAA (SEQ ID NO: 15) или
CAAGTACAACTACAGGAAAGTGGAGGAGGACTTGTCCAACCCGGCGGCAGTTTAAGACTTAGCTGTGCTGCTTCTGGCTTTACTTTTAGCAACTATGCTATGTCGTGGGTGCGTCAAGCGCCAGGAAAGGGCCTAGAATGGGTGAGCGCTATCAATAGCGGCGGAAAAAGCACTAACTACGCGGACAGCGTGAAAGGCCGCTTCACTATAAGTCGGGACAATGCTAAAAACACACTGTACCTCCAGATGAACTCCCTAAGAGCTGAGGACACGGCTGTGTACTACTGCGCTGATTATGCGACTAACTATGGAGTGCCATACTTCGGAAGCTGGGGCCAGGGAACGATGGTAACTGTGAGTAGTGCTAGCACCAAGGGCCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTATAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAAAGCCTCTCCCTGTCCCCGGGTAAA (SEQ ID NO: 16).
В одном из аспектов настоящее изобретение относится к молекуле нуклеиновой кислоты, которая кодирует легкую цепь, и содержит нуклеотидную последовательность по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% гомологичную или идентичную последовательности, выбранной из группы:
CAGGCTGGACTGACGCAACCGCCATCTGTGAGTGCGGCTCCAGGACAACGGGTGACTATAAGCTGCAGCGGAAGCAGAAGCAACATAGGCAGTGGATACGACGTACATTGGTACCAACAAGTACCGGGGACGGCTCCGAAACTACTGATATTTGACGATAATAATAGACCGAGCGGCGTACCAGACCGTTTTAGCGGAAGCAAAAGTGGAACGAGTGCCTCTTTAGCCATAACTGGCCTGCAAGCTGAAGATGAAGCTGATTATTACTGTCAGAGCTACGACAGCAGTCTGAGTGGACACGTAGTGTTTGGAGGAGGAACGAAGCTGACGGTATTACGTACGGTGGCTGCACCATCTGTCTTCATCTTCCCGCCATCTGATGAGCAGTTGAAATCTGGAACTGCCTCTGTTGTGTGCCTGCTGAATAACTTCTATCCCAGAGAGGCCAAAGTACAGTGGAAGGTGGATAACGCCCTCCAATCGGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGGACAGCACCTACAGCCTCAGCAGCACCCTGACGCTGAGCAAAGCAGACTACGAGAAACACAAAGTCTACGCCTGCGAAGTCACCCATCAGGGCCTGAGCTCGCCCGTCACAAAGAGCTTCAACAGGGGAGAGTGT (SEQ ID NO: 17) или
CAGAGTGTGCTGACGCAACCGCCATCTGTGAGTGCGGCTCCAGGACAACGGGTGACTATAAGCTGCAGCGGAAGCAGAAGCAACATAGGCAGTGGATACGACGTACATTGGTACCAACAACTACCGGGGACGGCTCCGAAACTACTGATATACGACGATAATAATAGACCGAGCGGCGTACCAGACCGTTTTAGCGGAAGCAAAAGTGGAACGAGTGCCTCTTTAGCCATAACTGGCCTGCAAGCTGAAGATGAAGCTGATTATTACTGTCAGAGCTACGACAGCAGTCTGAGTGGACACGTAGTGTTTGGAGGAGGAACGAAGCTGACGGTATTACGTACGGTGGCTGCACCATCTGTCTTCATCTTCCCGCCATCTGATGAGCAGTTGAAATCTGGAACTGCCTCTGTTGTGTGCCTGCTGAATAACTTCTATCCCAGAGAGGCCAAAGTACAGTGGAAGGTGGATAACGCCCTCCAATCGGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGGACAGCACCTACAGCCTCAGCAGCACCCTGACGCTGAGCAAAGCAGACTACGAGAAACACAAAGTCTACGCCTGCGAAGTCACCCATCAGGGCCTGAGCTCGCCCGTCACAAAGAGCTTCAACAGGGGAGAGTGT (SEQ ID NO: 18).
В одном из аспектов настоящее изобретение относится к молекуле нуклеиновой кислоты, которая кодирует легкую цепь, и содержит нуклеотидную последовательность, выбранную из группы:
CAGGCTGGACTGACGCAACCGCCATCTGTGAGTGCGGCTCCAGGACAACGGGTGACTATAAGCTGCAGCGGAAGCAGAAGCAACATAGGCAGTGGATACGACGTACATTGGTACCAACAAGTACCGGGGACGGCTCCGAAACTACTGATATTTGACGATAATAATAGACCGAGCGGCGTACCAGACCGTTTTAGCGGAAGCAAAAGTGGAACGAGTGCCTCTTTAGCCATAACTGGCCTGCAAGCTGAAGATGAAGCTGATTATTACTGTCAGAGCTACGACAGCAGTCTGAGTGGACACGTAGTGTTTGGAGGAGGAACGAAGCTGACGGTATTACGTACGGTGGCTGCACCATCTGTCTTCATCTTCCCGCCATCTGATGAGCAGTTGAAATCTGGAACTGCCTCTGTTGTGTGCCTGCTGAATAACTTCTATCCCAGAGAGGCCAAAGTACAGTGGAAGGTGGATAACGCCCTCCAATCGGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGGACAGCACCTACAGCCTCAGCAGCACCCTGACGCTGAGCAAAGCAGACTACGAGAAACACAAAGTCTACGCCTGCGAAGTCACCCATCAGGGCCTGAGCTCGCCCGTCACAAAGAGCTTCAACAGGGGAGAGTGT (SEQ ID NO: 17) или
CAGAGTGTGCTGACGCAACCGCCATCTGTGAGTGCGGCTCCAGGACAACGGGTGACTATAAGCTGCAGCGGAAGCAGAAGCAACATAGGCAGTGGATACGACGTACATTGGTACCAACAACTACCGGGGACGGCTCCGAAACTACTGATATACGACGATAATAATAGACCGAGCGGCGTACCAGACCGTTTTAGCGGAAGCAAAAGTGGAACGAGTGCCTCTTTAGCCATAACTGGCCTGCAAGCTGAAGATGAAGCTGATTATTACTGTCAGAGCTACGACAGCAGTCTGAGTGGACACGTAGTGTTTGGAGGAGGAACGAAGCTGACGGTATTACGTACGGTGGCTGCACCATCTGTCTTCATCTTCCCGCCATCTGATGAGCAGTTGAAATCTGGAACTGCCTCTGTTGTGTGCCTGCTGAATAACTTCTATCCCAGAGAGGCCAAAGTACAGTGGAAGGTGGATAACGCCCTCCAATCGGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGGACAGCACCTACAGCCTCAGCAGCACCCTGACGCTGAGCAAAGCAGACTACGAGAAACACAAAGTCTACGCCTGCGAAGTCACCCATCAGGGCCTGAGCTCGCCCGTCACAAAGAGCTTCAACAGGGGAGAGTGT (SEQ ID NO: 18).
В одном из аспектов настоящее изобретение относится к молекуле нуклеиновой кислоты, содержащей любые комбинации вышеуказанных последовательностей нуклеиновых кислот.
В любом из указанных выше вариантах осуществления изобретения молекулы нуклеиновых кислот могут быть выделенными.
Молекула нуклеиновой кислоты по данному изобретению может быть выделена из любого источника, который продуцирует антитело к IL-5R(или ее часть. В определенных вариантах осуществления изобретения молекула нуклеиновой кислоты данному изобретению может быть синтезирована, а не выделена.
В некоторых вариантах осуществления изобретения молекула нуклеиновой кислоты по данному изобретению может содержать нуклеотидную последовательность, кодирующую VH домен из первого или второго домена антитела по данному изобретению, соединенного в рамках считывания с нуклеотидной последовательности, кодирующей константный домен тяжелой цепи из любого источника. Аналогичным образом, молекула нуклеиновой кислоты по данному изобретению может содержать нуклеотидную последовательность, кодирующую VL домен из первой или второй области антитела по данному изобретению, объединеной в рамках считывания с нуклеотидной последовательностью, кодирующей константный домен легкой цепи из любого источника.
В еще одном аспекте настоящего изобретения молекулы нуклеиновой кислоты, кодирующие вариабельный домен тяжелой (VH) и/или легкой (VL) цепей первого или второго связывающего домена, могут «преобразовываться» по всей длине генов антитела. В одном варианте осуществления изобретения молекулы нуклеиновых кислот, кодирующие домены VH или VL преобразуются в гены антитела по всей длине путем вставки в экспрессионный вектор, уже кодирующей константные домены тяжелой цепи (СН) или легкой цепи (CL), соответственно, так что VH сегмент функционально соединен с CH сегментом(-ами) в векторе и/или VL сегмент оперативно соединен с CL сегментом в векторе. В другом варианте осуществления изобретения молекулы нуклеиновых кислот, кодирующие VH и/или VL домены преобразуются в гены по всей длине антитела путем соединения, например, лигирования, молекулы нуклеиновой кислоты, кодирующей VH и/или VL домены, к молекуле нуклеиновой кислоты, кодирующей CH и/или CL домены с использованием стандартных молекулярно-биологических методов. Молекулы нуклеиновых кислот, кодирующие по всей длине тяжелую и/или легкую цепи, могут затем экспрессироваться из клетки, в которую они были введены.
Молекулы нуклеиновой кислоты могут использоваться для экспрессии большого количества рекомбинантных антител к IL-5Rα. Молекулы нуклеиновой кислоты могут использоваться для получения человеческих антител, гуманизированных антител, химерных антител, биспецифических антител, одноцепочечных антител, иммуноадгезинов, диател, мутировавших антител и производных антител, как описано в настоящем документе.
Вектор
В еще одном аспекте настоящее изобретение относится к вектору, подходящему для экспрессии любой из нуклеотидных последовательностей, описанных в настоящем документе.
Настоящее изобретение относится к векторам, содержащим молекулы нуклеиновых кислот, которые кодируют любую из аминокислотных последовательностей антител к IL-5R(или их частей (например, последовательностей тяжелой и/или легкой цепи первого и/или тяжелой и/или легкой цепи второго связывающих доменов) как описано в настоящем документе. Настоящее изобретение далее относится к векторам, содержащим молекулы нуклеиновых кислот, кодирующих слитые белки, модифицированные антитела, фрагменты антител.
В другом варианте осуществления изобретения молекулы нуклеиновых кислот и векторы могут быть использованы для изготовления мутировавших антител к IL-5Rα. Антитела могут мутировать в вариабельных доменах тяжелой и/или легкой цепей первого и/или тяжелой и/или легкой цепей второго связывающего домена, например, для изменения связывающей способности антител к IL-5Rα. Например, мутация может произойти в одном или нескольких CDR-участках, чтобы увеличить или уменьшить KD антител, чтобы увеличить или уменьшить koff или изменить специфичность связывания антитела в отношении IL-5Rα. В другом варианте осуществления изобретения одной или более мутациям подвергнут аминокислотный остаток в первом или втором связывающем домене антитела к IL-5R(по данному изобретению. Эти мутации могут быть сделаны в CDR-участке или каркасном участке вариабельного домена, или в константном домене. В предпочтительном варианте осуществления изобретения мутации произведены в вариабельном домене. В другой варианте осуществления изобретения одной или нескольким мутациям подвергнут аминокислотный остаток, который, как известно, изменен по сравнению с зародышевой линией в CDR-участке или каркасном участке вариабельного домена антитела по данному изобретению.
В некоторых вариантах осуществления изобретения, антитела к IL-5R(по данному изобретению экспрессируются путем вставки ДНК, кодирующей частично или полностью последовательность первого и второго связывающего домена (например, последовательности тяжелой и легкой цепи, где связывающий домен содержит последовательности тяжелой и легкой цепи), полученный, как описано выше, в экспрессионных векторах таким образом, что гены функционально соединены с необходимыми последовательностями, контролирующими экспрессию, такими как транскрипционные и трансляционные контрольные последовательности. Экспрессионные векторы включают плазмиды, ретровирусы, аденовирусы, аденоассоциированные вирусы (AAV), вирусы растений, такие как вирус мозаики цветной капусты, вирусы табачной мозаики, космиды, YAC, EBV полученные эписомы и тому подобное. Молекулы ДНК могут быть лигированы в вектор таким образом, что последовательности, контролирующие транскрипцию и трансляцию в векторе, выполняют предусмотренную функцию регуляции транскрипции и трансляции ДНК. Экспрессионный вектор и последовательности контроля экспрессии могут быть выбраны таким образом, чтобы быть совместимыми с используемой экспрессирующей клеткой-хозяином. Молекулы ДНК, кодирующие частично или по всей длине последовательности первого и второго связывающих доменов (например, последовательности тяжелой и легкой цепи, где связывающий домен содержит последовательность тяжелой и легкой цепи) могут быть введены в отдельные векторы. В одном варианте осуществления изобретения любая комбинация указанных выше молекул ДНК вводится в тот же экспрессионный вектор. Молекулы ДНК могут быть введены в экспрессионный вектор стандартными способами (например, лигированием комплементарных сайтов рестрикции на фрагменте гена антитела и вектора или лигированием тупых концов, если сайты рестрикции отсутствуют).
Подходящим вектором является тот, который кодирует функционально законченные последовательности CH или CL человеческого иммуноглобулина с конструированием соответствующего места рестрикции так, что любая последовательность VH или VL может быть легко включена и экспрессирована, как описано выше. HC- и LC-кодирование генов в таких векторах может содержать интронные последовательности, что приводит к общему увеличению белковых продуктов антитела путем стабилизации соответствующей мРНК. Интронные последовательности находятся в окружении сплайс-донора и сплайс-акцептора сайтов, которые определяют, где будет происходить сплайсинг РНК. Расположение интронных последовательностей может быть либо в вариабельных или константных участках цепей антитела, или как в вариабельных, так и константных участках, когда используются несколько интронов. Прекращение полиаденилирования и транскрипции может произойти вниз по ходу сайта нативной хромосомы кодируемых участков. Рекомбинантный экспрессионный вектор также может кодировать сигнальный пептид, который облегчает выработку цепочки антитела клеткой-хозяином. Ген цепочки антитела может быть клонирован в вектор таким образом, что сигнальный пептид соединен с рамкой считывания аминоконца цепи иммуноглобулина. Сигнальным пептидом может быть сигнальный пептид иммуноглобулина или гетерологичный сигнальный пептид (то есть, сигнальный пептид белка не иммуноглобулиновой природы).
Помимо цепочки генов антител, рекомбинантная экспрессия векторов по данному изобретению может нести регулирующие последовательности, которые контролируют экспрессию генов цепи антител в клетке-хозяине. Специалистам в этой области будет понятно, что дизайн экспрессионного вектора, включая выбор регулирующих последовательностей, может зависеть от таких факторов, как селекция клетки-хозяина для трансформации, уровень экспрессии желаемого белка, и т.д. Предпочтительные регулирующие последовательности для экспрессирующей клетки-хозяина млекопитающих включают вирусные элементы обеспечивающие высокий уровень экспрессии белков в клетках млекопитающих, таких как промоторы и/или энхансеры, полученные из ретровирусной LTR, цитомегаловируса (CMV) (например, CMV промотора/энхансера), обезьяньего вируса 40 (SV40) (например, SV40 промотора/энхансера), аденовируса, (например, большого позднего промотора аденовируса (AdMLP)), вирус полиомы, а также сильных промоторов млекопитающих, таких как промотор нативных иммуноглобулинов или промотор актина. Для дальнейшего описания вирусных регулирующих элементов и их последовательностей см., например, патенты США 5,168,062, 4,510,245 and 4,968,615. Способы экспрессии связывающих молекул, таких как антитела растений, в том числе описание промоторов и векторов, а также трансформация растений, известны в данной области техники. См., например, патент США 6,517,529. Методы экспрессии полипептидов в бактериальных клетках или клетках грибов, например, дрожжевых клетках, также хорошо известны в данной области техники.
В дополнение к генам цепи антитела и регулирующим последовательностям, рекомбинантные векторы экспрессии изобретения могут нести дополнительные последовательности, такие как последовательности, которые регулируют репликацию вектора в клетках-хозяевах (например, точки начала репликации) и гены селектируемого маркера. Ген селектируемого маркера облегчает селекцию клеток-хозяев, в которые был введен вектор (см., например, патенты США 4,399,216, 4,634,665 и 5,179,017). Например, обычно ген селектируемого маркера придает устойчивость к лекарственным средствам, таким как G418, гигромицин или метотрексат, клетке-хозяину, в которую вектор введен. Например, гены селектируемого маркера включают ген дигидрофолат редуктазы (DHFR) (для использования в dhfr-клетках-хозяевах при селекции/амплификации метотрексата), ген нео (для селекции G418) и ген синтетазы глутамата.
Термин «последовательность контроля экспрессии», используемый в данном описании, означает полинуклеотидные последовательности, которые необходимы для воздействия на экспрессию и процессинг кодирующих последовательностей, к которым они лигированы. Контролирующие экспрессию последовательности включают соответствующие последовательности инициации транскрипции, терминации, промотора и энхансера; эффективные сигналы процессинга РНК, такие как сплайсинг и сигналы полиаденилирования; последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые повышают эффективность трансляции (т.е. консенсусная последовательность Козака); последовательности, которые повышают стабильность белка; и, при желании, последовательности, которые усиливают секрецию белка. Характер таких контролирующих последовательностей различается в зависимости от организма-хозяина; в прокариотах такие контролирующие последовательности, как правило, включают промотор, сайт связывания рибосомы, а также последовательности терминации транскрипции; в эукариотах, как правило, такие контролирующие последовательности включают промоторы и последовательности терминации транскрипции. Термин «контролирующие последовательности» включает, как минимум, все компоненты, наличие которых имеет важное значение для экспрессии и процессинга, и может также включать дополнительные компоненты, чье присутствие является полезным, например, лидирующие последовательности и последовательности слившихся клеток.
Клетки-хозяева
Дополнительный аспект настоящего изобретения относится к способам получения антител к IL-5R(по данному изобретению. Один вариант осуществления изобретения относится к способу получения антител, как определено в настоящем документе, содержащему введение получение рекомбинантной клетки-хозяина, способной экспрессировать антитела, культивированиеацию указанной клетки-хозяина в условиях, подходящих для экспрессии продукции антитела, и выделение полученного антитела. Антитело к IL-5Rα, полученное такой экспрессией в таких рекомбинантных клетках-хозяевах, упоминается в данном документе как «рекомбинантные антитела к IL-5Rα». Изобретение также относится к потомству клеток таких клеток-хозяев и антителам к IL-5Rα, получаемым аналогично.
Молекулы нуклеиновой кислоты, кодирующие антитела к IL-5R(по изобретению и векторы, содержащие эти молекулы нуклеиновой кислоты, могут быть использованы для трансфекции подходящего млекопитающего или его клетки, растения или его клетки, бактериальной или дрожжевой клетки-хозяина. Преобразование может происходить любым известным способом для введения полинуклеотидов в клетку-хозяина. Способы введения гетерологичных полинуклеотидов в клетки млекопитающих хорошо известны в данной области и включают декстран-опосредованную трансфекцию, трансфекцию комплексом нуклеиновой кислоты и позитивно заряженного полимера, трансфекцию преципитатом нуклеиновой кислоты и фосфата кальция, полибрен-опосредованную трансфекцию, слияние протопластов, трансфекцию инкапсулированными в липосомы полинуклеотидами и прямую микроинъекцию ДНК в ядра. В дополнение, молекулы нуклеиновых кислот могут быть введены в клетки млекопитающих вирусными векторами. Способы трансфекции клеток хорошо известны в данной области техники. См., например, патенты США, 4,399,216, 4,912,040, 4,740,461 и 4,959,455. Способы трансформации клеток растений хорошо известны в данной области, включая, например, Agrobacterium-опосредованную трансформацию, биолистическую трансформацию, прямую инъекцию, электропорацию и вирусную трансформацию. Методы трансформации клеток бактерий и дрожжей также хорошо известны в данной области.
Клеточные линии млекопитающих, используемые в качестве хозяев для трансформации, хорошо известны в данной области и включают множество иммортализованных доступных клеточных линий. К ним относятся, например, клетки яичников китайского хомячка (CHO), NS0 клетки, клетки SP2, HEK-293T клетки, 293 Фристайл клетки (Invitrogen), NIH-3T3 клетки, клетки HeLa, клетки почек хомячка (BHK), клетки почек африканских зеленых мартышек (COS), клетки гепатоцеллюлярной карциномы человека (например, Hep G2), A549 клетки и ряд других клеточных линий. Клеточные линии выбираются путем определения, какие клеточные линии имеют высокие уровни экспрессии и обеспечивают необходимые характеристики продуцируемого белка. Другими клеточными линиями, которые могут быть использованы, являются клеточные линии насекомых, такие как Sf9 или Sf21 клетки. Когда векторы рекомбинантной экспрессии, кодирующие антитела к IL-5R, вводятся в клетки-хозяева млекопитающих, антитела продуцируются путем культивирования клеток-хозяев в течение времени, достаточного для экспрессии антител в клетках-хозяевах или, предпочтительнее, выделения антител в питательную среду, в которой выращиваются клетки-хозяева. Антитела к IL-5R(могут быть выделены из питательной среды с использованием стандартных методов очистки белка. Клетки-хозяева растений, например, включают Nicotiana, Arabidopsis, ряску, кукурузу, пшеницу, картофель и т.д. Клетки бактерий хозяина включают виды Escherichia и Streptomyces. Дрожжевые клетки-хозяева включают Schizosaccharomyces pombe, Saccharomyces cerevisiae и Pichia pastoris.
Кроме того, уровень продукции антитела к IL-5R(по данному изобретению из продуцирующей клеточной линии можно усилить с помощью ряда известных методов. Например, система экспрессии гена глутамин синтетазы (система GS) является достаточно распространенной для усиления экспрессии при определенных условиях. Система GS обсуждается в целом или частично в связи с патентами ЕР 0216846, 0256055, 0323997 и 0338841.
Вполне вероятно, что антитела к IL-5R(различных клеточных линий или трансгенные животные будут отличаться друг от друга профилем гликозилирования. Однако все антитела к IL-5Rα, кодируемые молекулами нуклеиновой кислоты, описанными в данном документе, или содержащими аминокислотные последовательности, приведенные в настоящем документе, являются частью данного изобретения, независимо от состояния гликозилирования связывающих молекул и в целом, независимо от наличия или отсутствия пост-трансляционных модификаций.
Получение антител
Изобретение относится также к способам и процессам получения антител к IL-5R(и их антигенсвязывающих фрагментов.
Моноклональные антитела
Моноклональные антитела можно создавать, например, с помощью метода на основе гибридом, который впервые описан Kohler и др., Nature, 256, 1975, с.495, или с помощью методов рекомбинантной ДНК (US 4816567).
При использовании метода на основе гибридом мышь или другое пригодное животное-хозяин, такое как хомячок, иммунизируют согласно описанной выше методике, для того, чтобы вызывать образование лимфоцитов, которые продуцируют или могут продуцировать антитела, обладающие способностью специфически связываться с белком, применяемым для иммунизации. Согласно другому варианту лимфоциты можно получать в результате иммунизации in vitro. После иммунизации лимфоциты выделяют и затем сливают с клеточной линией миеломы с помощью приемлемого связывающего агента, такого как полиэтиленгликоль, с получением клетки гибридомы.
Полученные таким образом клетки гибридомы высевают и выращивают в пригодной культуральной среде, которая предпочтительно содержит одно или несколько веществ, ингибирующих рост или выживание неслитых родительских клеток миеломы. Например, если родительские клетки миеломы не содержат фермента гипоксантингуанинфосфорибозилтрансферазы (HGPRT или HPRT), то культуральная среда для гибридом, как правило, должна включать гипоксантин, аминоптерин и тимидин (НАТ-среда), т.е. вещества, которые препятствуют росту клеток с дефицитом HGPRT.
Предпочтительными применяемые в качестве компонента для слияния клетками миеломы являются клетки, которые легко поддаются слиянию, поддерживают стабильный высокий уровень производства антител выбранными продуцирующими антитела клетками и чувствительны к избирательной среде, на которой происходит отбор несвязанных родительских клеток. Предпочтительными линиями клеток миелом являются линии мышиной миеломы, такие как созданные на основе мышиных линий опухолевых клеток линии МОРС-21 и МРС-11, которые можно получать из Salk Institite Cell Disrtibution Center, Сан-Диего, шт.Калифорния, США, и линии SP-2 или Х63- Ag8-653, которые можно получать из Американской коллекции типовых культур, Роквилл, шт.Мэриленд, США. Описано также применение линий клеток человеческой миеломы и гетеромиеломы типа «мышь-человек» для производства моноклональных антител (Kozbor, J. Immunol., 133, 1984, с.3001).
Предпочтительно специфичность связывания моноклональных антител, полученных с использованием клеток гибридомы, определяют методом иммунопреципитации или с помощью анализа связывания in vitro, такого как радиоиммунный анализ (РИА) или твердофазный имммуноферментный анализ (ELISA).
Аффинность связывания моноклонального антитела можно, например, определять с помощью Скэтчард-анализа, описанного у Munson и др., Anal. Biochem., 107, 1980, с.220.
После выявления клеток гибридомы, которые продуцируют антитела требуемой специфичности, аффинности и/или активности, клоны можно субклонировать с помощью метода лимитирующих разведений и выращивать стандартными методами. Пригодные для этой цели среды включают, например, среду DMEM или RPMI-1640. Кроме того, клетки гидрибомы можно выращивать in vivo в виде асцитных опухолей в организме животных, например, путем внутрибрюшинной (i.p.) инъекции клеток мышам.
Моноклональные антитела, секретируемые субклонами, можно отделять от культуральной среды, асцитной жидкости или сыворотки с помощью обычных методов очистки антител, например, аффинной хроматографией (например, с использованием протеин А- или протеин Q-сефарозы), или ионообменной хроматографии, хроматографии на гидроксилапатитах, гель-электрофореза, диализа и т.д.
ДНК, кодирующую моноклональные антитела, можно легко выделять и секвенировать с помощью общепринятых процедур (например, с использованием олигонуклеотидных зондов, которые обладают способностью специфически связываться с генами, кодирующими тяжелые и легкие цепи мышиных антител). В качестве предпочтительного источника такой ДНК служат клетки гибридомы. После выделения ДНК можно включать в экспрессионные векторы, которыми затем трансфектируют клетки-хозяева, такие как клетки Е. coli, обезьяньи COS- клетки, клетки яичника китайского хомячка (СНО) или клетки миеломы, которые без трансфекции не продуцируют белок антитела, что приводит к синтезу моноклональных антител в рекомбинантных клетках-хозяевах.
Согласно еще одному варианту осуществления изобретения моноклональные антитела или фрагменты антител можно выделять из фаговых библиотек антител, созданных с помощью методов, описанных у McCafferty и др., Nature, 348, 1990, cc. 552-554. У Clackson и др., Nature, 352, 1991, cc. 624- 628 и Marks и др., J. Mol. Biol., 222, 1991, cc. 581-597 описано выделение мышиных и человеческих антител соответственно с помощью фаговых библиотек. В последующих публикациях было описано производство высокоаффинных (нМ-диапазон) человеческих антител с помощью перестановки цепи (Marks и др., Bio/Technology, 10, 1992, cc. 779-783), а также комбинаторная инфекция и рекомбинация in vivo в качестве стратегии конструирования очень больших фаговых библиотек (Waterhouse и др., Nucl. Acids. Res., 21, 1991, cc. 2265-2266). Таким образом, эти методы представляют собой реальную альтернативу традиционным методам выделения моноклональных антител на основе гибридом моноклональных антител.
ДНК, кодирующую антитело, можно также модифицировать, например таким образом, чтобы получать химерные или слитые полипептиды антител, например, путем замены последовательностей константных областей тяжелой и легкой цепи (Сн и CL) на гомологичные мышиные последовательности (US 4816567 и Morrison и др., Proc. Natl. Acad. Sci. USA: 81, 1984, с.6851) или с помощью ковалентного связывания кодирующей последовательности иммуноглобулина со всей или с частью кодирующей последовательности полипептида, не относящегося к иммуноглобулинам (гетерологичного полипептида). Не относящиеся к иммуноглобулинам полипептидные последовательности можно заменять на константные области антитела или заменять на вариабельные области антигенсвязывающего центра антитела, создавая химерное бивалентное антитело, которое содержит один антигенсвязывающий центр, обладающий специфичностью в отношении антигена, и другой антигенсвязывающий центр, обладающий специфичностью в отношении другого антигена.
Гуманизированные антитела
Методы создания «гуманизированных» антител животных, кроме человека, известны в данной области. Предпочтительно гуманизированное антитело имеет один или несколько встроенных в него аминокислотных остатков, полученных из источника, отличного от человека. Эти полученные из источника, отличного от человека, аминокислотные остатки часто называют «импортными» остатками, поскольку их обычно получают из «импортной» вариабельной области. Гуманизацию в целом можно осуществлять согласно методу Winter с соавторами (Jones и др., Nature, 321, 1986, сс.522-525) путем замены последовательностей гипервариабельного участка на соответствующие последовательности человеческого антитела. Таким образом, «гуманизированные» антитела представляют собой химерные антитела (US 4816567), в которых участок, существенно меньший, чем интактная человеческая вариабельная область, заменен соответствующей последовательностью, полученной из видов кроме человека. На практике гуманизированные антитела представляют собой, как правило, человеческие антитела, в которых часть остатков гипервариабельного участка и возможно часть остатков FR заменены остатками из аналогичных участков антител грызунов.
Выбор человеческих вариабельных областей как легкой, так и тяжелой цепи, предназначенных для получения гуманизированных антител, очень важен для снижения антигенности и НАМА-ответа (человеческое антимышиное антитело), когда антитело предназначено для лечения человека. Согласно так называемому методу «наилучшего подбора» последовательность вариабельной области антитела грызунов подвергают скринингу относительно полной библиотеки известных последовательностей человеческих вариабельных областей. Человеческую последовательность V-области, которая наиболее близка к последовательности из организма грызунов, идентифицируют и внутри нее выбирают человеческий каркасный участок (FR), пригодный для применения в гуманизированном антителе (Sims и др., J. Immunol., 151, 1993, с.2296). В другом методе используют определенный каркасный участок, полученный из консенсусной последовательности определенной подгруппы легких или тяжелых цепей всех человеческих антител. Один и тот же каркасный участок можно применять для нескольких различных гуманизированных антител (Carter и др., Proc. Natl. Acad. Sci. USA: 89, 1992, с.4285).
Также важно, чтобы антитела были гуманизированы с сохранением высокой связывающей способности к антигену и других важных биологических свойств. Для решения этой задачи согласно предпочтительному способу гуманизированные антитела получают с помощью анализа родительских последовательностей и различных гуманизированных продуктов с использованием умозрительных трехмерных моделей родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов общедоступны и хорошо известны специалистам в данной области. Известны компьютерные программы, которые иллюстрируют и отображают возможные трехмерные конформационные структуры выбранных перспективных последовательностей иммуноглобулинов. Изучение этих изображений позволяет осуществлять анализ возможной роли остатков в функции перспективной последовательности иммуноглобулина, т.е. анализ остатков, которые влияют на способность перспективного иммуноглобулина связываться с антигеном. Таким путем можно выбирать остатки в FR и объединять с реципиентными и импортными последовательностями для достижения требуемых характеристик антитела, таких как повышенная аффинность к антигену(ам)-мишени(ням). Как правило, остатки гипервариабельного участка оказывают непосредственное и наиболее существенное влияние на связывание антигена.
Гуманизированное антитело может представлять собой фрагмент антитела, такой как Fab-фрагмент, необязательно конъюгированный с одним или несколькими цитотоксическим(ими) агентом(ами) для создания иммуноконъюгата. В альтернативном варианте гуманизированное антитело может представлять собой полноразмерное антитело, например, полноразмерное антитело в виде IgGl.
Человеческие антитела и методика, основанная на применении фаговой дисплейной библиотеки
В качестве альтернативы гуманизации можно получать человеческие антитела. Например, в настоящее время можно получать трансгенных животных (например, мышей), которые после иммунизации могут продуцировать полный спектр человеческих антител без производства эндогенного иммуноглобулина. Например, было описано, что гомозиготная делеция областей стыка гена тяжелой цепи антитела (Jн-сегмента) в организме химерных мышей и мышей с мутацией в зародышевой линии приводит к полному ингибированию производства эндогенного антитела. Перенос набора зародышевой линии гена человеческого иммуноглобулина в такую мутантную зародышевую линию мышей приводит к производству человеческих антител после контрольного заражения антигеном (US 5545806, 5569825, 5591669 (все на имя фирмы GenPharm); 5545807; и WO 97/17852).
В альтернативном варианте для получения человеческих антител и фрагментов антител in vitro из спектра генов вариабельной области (V) иммуноглобулина из организма иммунизированных доноров можно использовать фаговую дисплейную технологию (McCafferty и др., Nature, 348, 1990, сс.552¬553). Согласно этой методике гены V-области антитела клонируют в рамке считывания либо с основным, либо с минорным геном оболочечного белка нитчатого бактериофага, такого как М13 или fd, и презентируют в виде функциональных фрагментов антитела на поверхности фаговой частицы. Поскольку нитчатая частица содержит копию одноцепочечной ДНК фагового генома, селекции по признаку функциональных свойств антитела, также приводят к отбору гена, кодирующего антитело, которое обладает указанными свойствами. Таким образом, фаг имитирует некоторые свойства В-клетки. Фаговую презентацию можно осуществлять в различных форматах. Для фаговой презентации можно использовать различные источники сегментов V-генов. Clackson и др., Nature, 352, 1991, сс.624-628 выделили различные наборы антител к оксазолону из небольшой произвольной комбинаторной библиотеки V-генов, полученной из селезенки иммунизированных мышей. Можно конструировать спектр V-генов, полученных из организма иммунизированных людей-доноров, и антитела к различному набору антигенов (включая аутоантигены) можно выделять в целом согласно методам, описанным у Marks и др., J. Mol. Biol., 222, 1991, cc. 581-597.
Как описано выше, человеческие антитела могут продуцироваться также in vitro активированными В-клетками (см. US 5567610 и 5229275).
Фрагменты антител
В определенных обстоятельствах целесообразно применять фрагменты антител, а не полные антитела. Меньший размер фрагментов способствует их быстрому клиренсу и может способствовать лучшему проникновению в плотные опухоли.
Для получения фрагментов антител разработаны различные методы. Традиционно эти фрагменты получали путем протеолитического расщепления интактных антител. Однако в настоящее время эти фрагменты можно получать непосредственно с помощью рекомбинантных клеток-хозяев. Fab-, Fv- и scFv-фрагменты антител можно экспрессировать и секретировать из Е. coli, что позволяет облегчать производство больших количеств указанных фрагментов. Фрагменты антител можно выделять из описанных выше фаговых библиотек антител. Согласно другому варианту Fab'-SH-фрагменты можно непосредственно выделять из Е. coli и химически сшивать с получением F(аb')2-фрагментов (Carter и др., Bio/Technology, 10, 1992, сс.163-167). Согласно другому подходу F(аb')2-фрагменты можно выделять непосредственно из культуры рекомбинантных клеток-хозяев. Fab- и F(аb')2-фрагмент с повышенным временем полужизни in vivo, в которых сохранены остатки эпитопсвязывающего рецептора, описаны в US 5869046. Специалистам в данной области должны быть очевидны другие методики получения фрагментов антител. В других вариантах осуществления изобретения выбранное антитело представляет собой одноцепочечный Fv- фрагмент (scFv) (см. WO 93/16185; US 5571894 и US США 5587458). Fv и sсFv представляют собой единственные виды с интактными связывающими сайтами, лишенные константных областей; в результате их можно применять для пониженного неспецифического связывания при применении in vivo. Слитые белки, несущие sсFv, можно конструировать для получения слияния эффекторного белка либо на N-, либо на С-конце sсFv. Фрагмент антитела может представлять собой также «линейное антитело», например, описанное в US 5641870. Такие фрагменты линейного антитела могут быть моноспецифическими или биспецифическими.
Биспецифические антитела
Биспецифические антитела представляют собой антитела, которые обладают специфичностью к связыванию с двумя различными эпитопами. Например, биспецифические антитела могут связываться с двумя различными эпитопами белка антитела к IL-5Rα. Другие биспецифические антитела могут нести сайт связывания с антитела к IL-5R(в сочетании с сайтом связывания другого белка. Биспецифические антитела можно получать в виде полноразмерных антител или фрагментов антител (например, F(аb')2-фрагментов биспецифических антител).
Методы создания биспецифических антител известны в данной области. Общепринятое получение полноразмерных биспецифических антител основано на совместной экспрессии двух пар тяжелых и легких цепей иммуноглобулина, где обе цепи имеют различную специфичность. Из-за случайного набора тяжелых и легких цепей иммуноглобулина, эти гибридомы (квадромы) потенциально могут продуцировать смесь из 10 различных молекул антител, из которых только одна имеет правильную биспецифическую структуру. Очистка правильной молекулы, которую обычно осуществляют в несколько стадий с помощью аффинной хроматографии, является довольно трудоемкой, а выход продукта – низким. Аналогичные процессы описаны в WO 93/08829.
Согласно другому подходу вариабельные области антитела с требуемой специфичностью связывания (антигенсвязывающие центры антитела) сливают с последовательностями константной области иммуноглобулина. Слияние предпочтительно осуществляют с константной областью тяжелой цепи Ig, которая включает по меньшей мере часть шарнирных СН2- и СН3-областей. Предпочтительно, чтобы по меньшей мере в одном из слияний присутствовала первая константная область тяжелой цепи (СН1), содержащая сайт, необходимый для связывания легкой цепи. ДНК, кодирующие слияния тяжелой цепи иммуноглобулина и при необходимости легкой цепи иммуноглобулина, встраивают в различные экспрессионные векторы и ими совместно трансфектируют приемлемый организм-хозяин. Это обеспечивает большую гибкость в подборе общих пропорций трех полипептидных фрагментов в вариантах, когда в конструкции используют неравные соотношения трех полипептидных цепей с целью оптимизации выходов. Однако можно также встраивать кодирующие последовательности в две или во все три полипептидные цепи в одном экспрессионном векторе, когда экспрессия по меньшей мере двух полипептидных цепей в равных пропорциях обеспечивает высокие выходы или, когда соотношения не имеют решающего значения.
В предпочтительном варианте осуществления указанного подхода биспецифические антитела представляют собой гибрид тяжелой цепи иммуноглобулина, обеспечивающий первую специфичность связывания в первом плече, и гибрид пары тяжелая цепь - легкая цепь иммуноглобулина (что обеспечивает вторую специфичность связывания) во втором плече. Было обнаружено, что эта асимметричная структура облегчает отделение требуемой биспецифической молекулы от нежелательных комбинаций цепей иммуноглобулинов, поскольку присутствие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы облегчает разделение. Этот подход описан в WO 94/04690. Дополнительное подробное описание получения биспецифических антител см., например, Suresh и др., Methods in Enzymology, 121, 1986, c. 210.
Согласно следующему подходу, описанному в патенте US 5731168, можно сконструировать область контакта между парой молекул антител с целью повышения до максимального уровня процентного содержания гетеродимеров, которые получают из культуры рекомбинантных клеток. Предпочтительная область контакта включает по меньшей мере часть СН3-области. Согласно этому методу одну или несколько небольших аминокислот с боковыми цепями из области контакта первой молекулы антитела заменяют на молекулы с более крупными боковыми цепями (например, на тирозин или триптофан). Уравновешивающие «полости», идентичные или близкие по размеру большой(им) боковой(ым) цепи(ям) создают в области контакта второй молекулы антитела путем замены аминокислот с крупными боковыми цепями на аминокислоты с более мелкими боковыми цепями (например, на аланин или треонин). Это обеспечивает механизм, способствующий повышению выхода гетеродимера относительно других нежелательных конечных продуктов.
Биспецифические антитела включают перекрестносшитые антитела или «гетероконъюгаты». Например, одно из антител в гетероконъюгате может быть сшито с авидином, а другое с биотином. Такие антитела можно использовать, например, для направленного переноса клеток иммунной системы к нежелательным клеткам (US 4676980) и для лечения ВИЧ-инфекции (WO 91/00360, WO 92/200373 и ЕР 03089). Антитела-гетероконъюгаты можно создавать с помощью любого из обычных методов введения перекрестных сшивок. Приемлемые кросс-линкеры хорошо известны в данной области и описаны в US 4676980 наряду с различными методами введения перекрестных сшивок.
Методы получения биспецифических антител из фрагментов антител также описаны в литературе. Например, биспецифические антитела можно получать с помощью химического связывания. Brennan и др., Science, 229, 1985, с.81 описали методику, согласно которой интактные антитела подвергают протеолитическому расщеплению, получая F(аb')2-фрагменты. Эти фрагменты восстанавливают в присутствии агента, образующего комплексы с дитиолом, такого как арсенит натрия, для стабилизации соседних дитиолов и предупреждения образования межмолекулярных дисульфидных связей. Полученные Fab'-фрагменты затем превращают в тионитробензоатное (TNB) производное. Одно из Fab'-TNB-производных затем повторно превращают в Fab'-тиол путем восстановления меркаптоэтиламином и смешивают с эквимолярным количеством другого Fab'-TNB-производного, получая биспецифическое антитело. Полученные биспецифические антитела можно применять в качестве агентов для избирательной иммобилизации ферментов.
Достигнутый в настоящее прогресс позволяет облегчать непосредственное выделение из Е. coli Fab'-SH-фрагментов, которые можно химически сшивать с образованием биспецифических антител. Shalaby и др., J. Exp.Med., 175, 1992, сс.217-225 описали получение F(аb')2-фрагмента молекулы полностью гуманизированного биспецифического антитела. Каждый Fab'-фрагмент по отдельности секретировался из Е. coli и его подвергали непосредственному химическому связыванию in vitro с получением биспецифического антитела.
Описаны также различные методы получения и выделения фрагментов биспецифических антител непосредственно из культуры рекомбинантных клеток. Например, биспецифические антитела получали с помощью лейциновых «застежек-молний» (Kostelny и др., J. Immunol., 148(5), 1992, сс.1547-1553). Пептиды лейциновых «застежек-молний» из белков Fos и Jun связывали с Fab'-фрагментами двух различных антител путем генного слияния. Гомодимеры антител восстанавливали в шарнирной области с получением мономеров, а затем путем повторного окисления получали гетеродимеры антител. Этот метод можно применять также для получения гомодимеров антител. Технология на основе «двойных антител», описанная Hollinger и др., Proc. Natl. Acad. Sci. USA, 90, 1993, сс.6444-6448, представляет собой другой механизм получения фрагментов биспецифических антител. Фрагменты содержат VH-область, связанную с VL- областью линкером, который является слишком коротким, для того чтобы позволить произойти спариванию двух доменов одной и той же цепи. Таким образом, VH- и VL-области одного фрагмента должны спариваться с комплементарными VL- и VH-областями другого фрагмента, образуя тем самым два антигенсвязывающих центра. Описана также другая стратегия получения фрагментов биспецифических антител, основанная на применении одноцепочечных (Fv)- (sFv) димеров (см. Gruber и др., J. Immunol, 152, 1994, с.5368).
Под объем изобретения подпадают также антитела, имеющие более двух валентностей. Например, можно получать триспецифические или тетраспецифические антитела.
Поливалентные антитела
Поливалентное антитело может интернализоваться (и/или диссимилироваться) клеткой, экспрессирующей антиген, с которым связывается антитело, быстрее, чем бивалентное антитело. Антитела, предлагаемые в настоящем изобретении, могут представлять собой поливалентные антитела (отличные от класса IgM) с тремя или большим количеством антигенсвяызвающих центров (например, тетравалентные антитела), которые можно легко получать путем рекомбинантной экспрессии нуклеиновой кислоты, кодирующей полипептидные цепи антитела. Поливалентное антитело может содержать димеризованный домен и три или большее количество антигенсвязывающих центров. Предпочтительный димеризованный домен содержит (или состоит из) Fc-фрагмент или шарнирную область. В таком случае антитело должно содержать Fc-фрагмент и три или большее количество антигенсвязывающих центров, расположенных на N-конце относительно Fc- фрагмента. Согласно настоящему описанию предпочтительное поливалентное антитело содержит (или состоит из) от 3 до примерно 8, но предпочтительно 4, антигенсвязывающих центров. Поливалентное антитело содержит по меньшей мере одну полипептидную цепь (и предпочтительно две полипептидные цепи), при этом полипептидная(ые) цепь(и) содержит(ат) две или большее количество вариабельных областей. Например, полипептидная(ые) цепь(и) может(ут) содержать VDl-(X1)n-VD2-(X2)n-Fc, где VD1 обозначает первую вариабельную область, VD2 обозначает вторую вариабельную область, Fc обозначает одну полипептидную цепь Fc-фрагмента, X1 и Х2 обозначают аминокислоту или полипептид и n обозначает 0 или 1. Например, полипептидная(ые) цепь(и) может(ут) содержать следующую цепь: VH-CH1-гибкий линкер-VH-CH1-Fc-фрагмент; или VH-CH1-VH-CH1-Fc-фрагмент.Поливалентное антитело, предлагаемое в настоящем изобретении, предпочтительно дополнительно содержит по меньшей мере 2 (и предпочтительно 4) полипептида вариабельной области легкой цепи. Поливалентное антитело, предлагаемое в настоящем изобретении, может, например, содержать от примерно 2 до примерно 8 полипептидов вариабельной области легкой цепи. В контексте настоящего описания подразумевается, что полипептиды вариабельной области легкой цепи содержат вариабельную область легкой цепи и необязательно дополнительно содержит CL-область.
Фармацевтические композиции
Другим аспектом изобретения является фармацевтическая композиция, содержащая в качестве активного ингредиента (или в качестве единственного активного ингредиента) антитело, которое специфично к IL-5Rα. Фармацевтическая композиция может включать по меньшей мере одно антитело, которое специфично к IL-5R(и/или одну или более дополнительных связывающих молекул (например, антител), которые нацелены на один или более соответствующих поверхностных рецепторов, как описано в данном документе. В некоторых вариантах осуществления изобретения композиции предназначены для улучшения, профилактики или лечения нарушений, которые могут быть взаимодействием IL-5 и его клеточным рецептором.
«Фармацевтическая композиция» обозначает композицию, включающую в себя антитело к IL-5R(согласно изобретению и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых эксипиентов, таких как наполнители, растворители, разбавители, носители, вспомогательные, распределяющие, средства доставки, консерванты, стабилизаторы, эмульгаторы, суспендирующие агенты, загустители, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Фармацевтические композиции по настоящему изобретению и способы их изготовления будут бесспорно очевидными для специалистов в этой области. Производство фармацевтических композиций предпочтительно должно соответствовать требованиям GMP (надлежащей производственной практики). Композиция может включать буферную композицию, тонические агенты, стабилизаторы и солюбилизаторы. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного фармацевтического ингредиента, например, моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, масла и инъекционные органические сложные эфиры.
«Лекарственное средство (препарат)» – вещество или смесь веществ в виде фармацевтической композиции в форме таблеток, капсул, порошков, лиофилизатов, инъекций, инфузий, мазей и др. готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего. Любой способ введения пептидов, белков или антител, принятый в данной области, может соответствующим образом использоваться для антитела к IL-5R(по данному изобретению.
Термин «фармацевтически приемлемый» означает один или несколько совместимых жидких или твердых компонентов, которые подходят для введения млекопитающему, предпочтительно человеку.
Термин «эксципиент» или «вспомогательное вещество» используется в данном документе для описания любого компонента, отличающегося от ранее описанных по данному изобретению. Это вещества неорганического или органического происхождения, используемые в процессе производства, изготовления лекарственных препаратов для придания им необходимых физико-химических свойств.
Под термином «буфер», «буферная композиция», «буферный агент» понимается раствор, способный сохранять значение pH, благодаря взаимодействию кислотных и щелочных компонентов, входящих в его состав, который дает возможность препарату антитела к IL-5R(проявлять устойчивость к изменениям рН. В общем случае, преимущественными являются значения рН фармацевтической композиции от 4,0 до 8,0. В качестве буферных агентов могут быть использованы, например, ацетатный, фосфатный, цитратный, гистидиновый, сукцинатный и т.п.буферные растворы, но, не ограничиваясь ими.
Термины «тонический агент», «осмолитик» или «осмотический агент» в том виде, как они здесь использованы, относятся к эксципиенту, который может подводить осмотическое давление жидкого препарата антитела. «Изотоничный» препарат представляет собой препарат, который имеет осмотическое давление, эквивалентное давлению человеческой крови. Изотоничные препараты обычно имеют осмотическое давление от примерно 250 до 350 мОсм/кг.В качестве изотоноческих агентов могут быть использованы полиолы, моно- и дисахара, аминокислоты, соли металлов, например, хлорид натрия, и т.п., но, не ограничиваясь ими.
Под «стабилизатором» понимается вспомогательное вещество или смесь двух и более вспомогательных веществ, которые обеспечивают физическую и/или химическую стабильность активного агента. В качестве стабилизаторов могут быть использованы аминокислоты, например, аргинин, гистидин, глицин, лизин, глутамин, пролин, но, не ограничиваясь ими; поверхностно-активные вещества, например, полисорбат 20 (торговое наименование Tween 20), полисорбат 80 (торговое наименование Tween 80), полиэтилен-полипропилен гликоль и его кополимеры (торговые наименования Полоксамер (Poloxaner), Плуроник (Pluronic)), натрия додецилсульфат (SDS), но, не ограничиваясь ими; антиоксиданты, например, метионин, ацетилцистеин, аскорбиновая кислота, монотиоглицерол, соли серистых кислот, и т.п., но не ограничиваясь ими; хелатирующие агенты, например, этилендиаминтетрауксусная кислота (ЭДТА), диэтилентриаминпентауксусная кислота (ДТПА), цитрат натрия и т.п., но не ограничиваясь ими.
Фармацевтическая композиция является «стабильной», если активный агент сохраняет свою физическую стабильность и/или химическую стабильность и/или биологическую активность в течение заявленного срока годности при температуре хранения, например, при 2-8 ºС.Предпочтительно, чтобы активный агент сохранял и физическую, и химическую стабильность, а также биологическую активность. Период хранения выбирается на основании результатов исследования стабильности при ускоренном и естественном хранении.
Фармацевтическая композиция по данному изобретению может изготавливаться, упаковываться или широко продаваться в виде единичной стандартной дозы или множества единичных стандартных доз в виде готовой лекарственной формы. Используемый в данном документе термин «единичная стандартная доза» означает дискретное количество фармацевтической композиции, содержащей заранее определенное количество активного ингредиента. Количество активного ингредиента обычно равно дозировке активного ингредиента, который будет вводиться субъекту, или удобной части такой дозировки, например, половине или трети такой дозировки.
Фармацевтические композиции по настоящему изобретению, как правило, пригодны для парентерального введения в виде стерильных лекарственных средств, предназначенных для введения в организм человека с нарушением целостности кожных покровов или слизистых оболочек, минуя желудочно-кишечный тракт путем инъекций, инфузий или имплантации. Например, предполагается, что парентеральное введение включает, помимо прочего, подкожную, внутрибрюшинную, внутримышечную, внутривенную, внутриартериальную, интратекальную, внутрижелудочковую, интрауретральную, внутричерепную, внутрисуставнную, трансдермальную инъекцию или инфузи.; и почечные диализные инфузионные методики. Также предусмотрена региональная перфузия. Предпочтительные варианты осуществления изобретения включают внутривенный и подкожный пути. Любой способ введения пептидов или белков, принятый в данной области, может соответствующим образом использоваться для антитела к IL-5R(по данному изобретению.
Инъекционные лекарственные средства могут быть изготовлены, упакованы или проданы в стандартной лекарственной форме, например, в ампулах, флаконах, полимерных контейнерах, преднаполненных шприцах, устройствах для автоинжекции, но, не ограничиваясь ими. Лекарственные средства для парентерального введения включают, помимо прочего, суспензии, растворы, эмульсии в масляных или водных основах, пасты и тому подобное.
Еще одним вариантом осуществления изобретения является лекарственное средство для парентерального введения, где фармацевтическая композиция предоставлена в сухой форме, то есть, порошка или гранул для растворения в подходящем растворителе (например, стерильной апирогенной воде) перед введением. Такое лекарственное средство может быть получено, например, с помощью лиофилизации, т.е. процесса, известного в данной области техники как сушка из замороженного состояния, включающая в себя замораживание препарата и последующее удаление растворителя из замороженного содержимого.
Антитело к IL-5R(по данному изобретению может также вводиться интраназально или ингаляционно, самостоятельно, в виде смеси с подходящим фармацевтически приемлемым наполнителем из ингалятора, такого как аэрозольный контейнер под давлением, помпа, спрей, распылитель) или небулайзер, в котором используется или не используется подходящий пропеллент, или в виде назальных капель или спрея.
Лекарственное средство для парентерального введения может быть немедленного или модифицированного высвобождения. Лекарственные средства с модифицированным высвобождением включают отсроченное, замедленное, пульсирующее, контролируемое, нацеленное и программируемое высвобождение.
Терапевтическое применение антитела к IL-5R(по данному изобретению
В одном аспекте антитело к IL-5R(по данному изобретению применяется в лечении нарушений, которые связаны с активностью IL-5.
В одном аспекте антитело к IL-5R(по данному изобретению применяется в лечение заболевания или нарушения, где заболевание или нарушение выбрано из группы: астма, например, эозинофильная бронхиальная астма (АБА), например, эозинофильная бронхиальная астма (АБА) тяжелого течения; ХОБЛ (хроническая обструктивная болезнь легких); синдром Чердж-Стросса; эозинофильный эзофагит; эозинофильный гастроэнтерит или гиперэозинофильного синдрома.
В одном аспекте субъект лечения или пациент является млекопитающим, предпочтительно человеческим субъектом. Вышеупомянутый субъект может быть мужского или женского пола и любого возраста.
Используемые в данном документе термины «совместное назначение», «совместно назначенный» и «в сочетании с» относящиеся антителу к IL-5R(с одним или более другими терапевтическими агентами, как предполагается, означают, сслылаются или включают:
1) одновременное введение такой комбинации антитела к IL-5R(по данному изобретению и терапевтического агента пациенту, который нуждается в лечении, когда такие компоненты сформулированы вместе в одной лекарственной форме, из которой указанные компоненты высвобождаются практически одновременно указанному пациенту,
2) одновременное введение такой комбинации антитела к IL-5R(по данному изобретению и терапевтического агента пациенту, который нуждается в лечении, когда такие компоненты сформулированы отдельно в разных лекарственных формах, введение которых происходит практически в одно и то же время указанному пациенту, после чего указанные компоненты высвобождаются практически одновременно указанному пациенту,
3) последовательное введение такой комбинации антитела к IL-5R(по данному изобретению и терапевтического агента пациенту, который нуждается в лечении, когда такие компоненты сформулированы отдельно друг от друга в отдельных лекарственных формах, которые принимаются в последовательно по времени указанным пациентом со значимым временным интервалом между каждым введением, после чего указанные компоненты высвобождаются в практически разное время указанному пациенту; а также
4) последовательное введение такой комбинации антитела к IL-5R(по данному изобретению и терапевтического агента пациенту, который нуждается в лечении, когда такие компоненты сформулированы вместе в единый лекарственной форме, из которой высвобождение указанных компонентов происходит контролируемым образом, после чего они одновременно, последовательно или совместно высвобождаются в одно и то же время и/или разное время указанному пациенту, где каждая часть может быть введена одним или разными путями.
Антитело к IL-5R(по данному изобретению могут назначаться без дополнительного терапевтического лечения, т.е. в качестве самостоятельной терапии. Кроме того, лечение антителом к IL-5R(по данному изобретению может включать по меньшей мере одно дополнительное терапевтическое лечение (комбинированная терапия). В некоторых вариантах осуществления изобретения, антитело к IL-5R(может вводиться совместно или быть скомбинированным с другим медикаментом/препаратом для аутоиммунного заболевания.
Для лечения указанных выше аутоиммунных заболеваний или родственных аутоиммунных состояний пациенту можно вводить антитела к IL-5Rα, предлагаемые в настоящем изобретении, в сочетании с другим терапевтическим агентом, используя схему лекарственного лечения на основе нескольких средств. Антитело к IL-5R(можно вводить одновременно, последовательно или попеременно с иммуносупрессором или после проявления устойчивости к другой терапии. Иммуносупрессор можно вводить в таких же или более низких дозах по сравнению с применяемыми в данной области. Выбор предпочтительного иммуносупрессора должен зависеть от многих факторов, в том числе от типа заболевания, подлежащего лечению, а также от истории болезни пациента.
В контексте настоящего описания понятие «терапевтический агент», применяемый для дополнительной терапии, относится к субстанциям, действие которых заключается в подавлении или маскировке иммунной системы пациента, например, к малым молекулам, антителам или стероидным гормонов, например, кортикостероидам. Такие агенты могут представлять собой субстанции, которые подавляют производство цитокинов, осуществляют понижающую регуляцию или подавляют экспрессию аутоантигенов или маскируют антигены главного комплекса гистосовместимости (ГКГ). Примерами таких агентов являются стероиды, такие как глюкокортикостероиды, например преднизон, метилпреднизолон и дексаметазон; 2-амино-6-арил-5-замещенные пиримидины (см. US 4665077), азатиоприн (или циклофосфамид, если существует отрицательная реакция на азатиоприн); бромокриптин; глутаровый альдегид (который маскирует антигены ГКГ, что описано в US 4120649); антиидиотипические антитела к антигенам ГКГ и фрагментам ГКГ; циклоспорин А; цитокин или антагонисты рецептора цитокина, в том числе антитело к интерферону-(-(или -α; антитела к фактору-(некроза опухолевых клеток, антитела к фактору- (некроза опухолевых клеток; антитела к интерлейкину-2 и антитела к рецептору IL-2; антитела к L3T4; гетерологичный антилимфоцитарный глобулин; рап-Т-антитела, предпочтительно антитела к CD3 или антитела к CD4/CD4a; растворимый пептид, содержащий LFA-3- связывающий домен (WO 90/08187, опубликована 26 июля 1990 г.); стрептокиназа; TGF-p; стрептодорназа; РНК или ДНК хозяина; FK506; RS-61443; дезоксиспергуалин; рапамицин; Т-клеточный рецептор (US 5114721); фрагменты Т-клеточного рецептора (Offner и др., Science 251, 1991, сс.430-432; WO 90/11294; и WO 91/01133); и антитела к Т-клеточному рецептору (ЕР 340109), такие как T10B9.
Подразумевается, что антитело к IL-5R(по данному изобретению могут использоваться в способах лечения, как описано выше, могут использоваться в лечении, как описано выше, и/или могут использоваться в производстве медикаментов для лечения, как описано выше.
Дозы и пути введения
Антитело к IL-5R(по данному изобретению будут вводиться в количестве, эффективном для лечения состояния, о котором идет речь, т.е. в дозах и в течение периодов времени, необходимых для достижения желаемого результата. Терапевтически эффективное количество может изменяться в зависимости от таких факторов, как конкретное состояние, по поводу которого проводится лечение, возраста, пола и веса пациента, а также является ли введение антитела к IL-5R(самостоятельным лечением, или оно проводится в комбинации с одним или более дополнительных анти-аутоиммунных или противовоспалительных методов лечения.
Схемы приема лекарственных средств можно регулировать, чтобы обеспечить оптимальный желаемый ответ.Например, может быть введен один болюс, несколько разделенных доз могут быть введены в течение некоторого времени, или доза может быть пропорционально уменьшена или увеличена в зависимости от остроты терапевтической ситуации. Особенно полезным является изготовление парентеральных композиций в стандартной лекарственной форме для простоты введения и однородности дозирования. Стандартная лекарственная форма при использовании в данном документе, относится к физически дискретным единицам, пригодным в качестве единичных доз для пациентов/субъектов, подлежащих лечению; каждая единица содержит заданное количество активного соединения, рассчитанное для получения желаемого терапевтического эффекта в сочетании с требуемым фармацевтическим носителем. Спецификация для стандартных лекарственных форм по настоящему изобретению, как правило, диктуется и непосредственно зависит от (a) уникальных характеристик химиотерапевтического агента и конкретного терапевтического или профилактического эффекта, которые должны быть достигнуты, и (b) ограничений, присущих в технике компаундирования такого активного соединения для лечения чувствительности у субъектов.
Таким образом, квалифицированным специалистам понятно, исходя из раскрытия, представленного в данном документе, что дозы и режим дозирования корректируются в соответствии со способами, хорошо известными в терапевтической области. Это означает, что может быть легко установлена максимально переносимая доза и может быть также определено эффективное количество, обеспечивающее обнаруживаемый терапевтический эффект для пациента так же, как и требования к времени введения каждого агента для достижения видимого терапевтического эффекта для пациента. Таким образом, хотя некоторые дозы и схемы режима введения приведены в качестве примеров в данном документе, эти примеры никоим образом не ограничивают дозы и режимы введения, которые могут понадобиться для пациента в практике применения настоящего изобретения.
Следует отметить, что значения дозировки могут изменяться, в зависимости от типа и тяжести состояния, которое следует облегчить, и может включать одну или более доз. Кроме того, необходимо понимать, что для любого конкретного пациента, конкретные схемы введения должны быть скорректированы через некоторое время согласно индивидуальной потребности и на усмотрение медицинского работника, который осуществляет введение или контролирует введение композиций, и что диапазоны концентрации, приведенные в данном описании, приведены только в качестве примера и не предназначены для ограничения объема или практики заявленных композиций. Кроме того, режим дозирования с композициями по данному изобретению может быть основан на различных факторах, включая тип заболевания, возраст, вес, пол, состояния здоровья пациента, тяжесть состояния, путь введения и конкретное используемое антитело к IL-5Rα. Таким образом, режим дозирования может широко варьироваться, но может определяться регулярно с помощью стандартных методов. Например, дозы могут быть скорректированы на основе фармакокинетических и фармакодинамических параметров, которые могут включать клинические эффекты, такие как токсические эффекты или лабораторные значения. Таким образом, настоящее изобретение охватывает индивидуальное повышение дозы, которое определяется квалифицированным специалистом. Определение необходимой дозы и режимы хорошо известны в соответствующей области техники и будут понятны специалисту в данной области после ознакомления с идеями, раскрытыми в данном документе.
Примеры подходящих способов введения предусмотрены выше.
Предполагается, что подходящая доза антитела к IL-5R(по данному изобретению будет в диапазоне от 0,1-200 мг/кг, предпочтительно 0,1-100 мг/кг, в том числе около 0,5-50 мг/кг, например, около 1-20 мг/кг.Антитело к IL-5R( может быть введено, например, в дозе по меньшей мере 0,25 мг/кг, например, по меньшей мере 0,5 мг/кг, в том числе не менее 1 мг/кг, например, по меньшей мере 1,5 мг/кг, например, также как не менее 2 мг/кг, например, по меньшей мере 3 мг/кг, в том числе по меньшей мере 4 мг/кг, например, по меньшей мере 5 мг/кг; и например вплоть до максимально 50 мг/кг, в том числе вплоть до максимально 30 мг/кг, например, вплоть до максимально 20 мг/кг, в том числе вплоть до максимально 15 мг/кг.Введение будет повторяться обычно в подходящие промежутки времени, например, раз в неделю, раз в две недели, один раз каждые три недели или один раз каждые четыре недели, и так долго, как будет сочтено целесообразным ответственным врачом, который может в некоторых случаях увеличить или уменьшить дозу при необходимости.
Изделие (продукты) и наборы
Следующим вариантом осуществления изобретения является изделие, которое содержит продукты, применяемые для лечения аутоиммунных заболеваний и родственных состояний, например, астмы, например, эозинофильной бронхиальной астмы (АБА), например, эозинофильной бронхиальной астмы (АБА) тяжелого течения; ХОБЛ (хронической обструктивной болезни легких); синдрома Чердж-Стросса; эозинофильного эзофагита; эозинофильного гастроэнтерита или гиперэозинофильного синдрома. Изделие представляет собой контейнер с этикеткой и листовкой-вкладышем, которые могут быть размещены в блистере и/или пачке. Приемлемыми контейнерами являются, например, флаконы, ампулы, шприцы и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или полимерные материалы. Контейнер содержит композицию, эффективную для лечения определенного состояния, и может иметь стерильный входной канал). По меньшей мере одно действующее вещество в композиции представляет собой антитело к IL-5Rα, предлагаемое в изобретении. На этикетке и листовке-вкладыше в упаковке указано, что лекарственное средство применяют для лечения конкретного состояния. Этикетка и/или листовка-вкладыш в упаковке дополнительно должны содержать инструкции по введению композиции антитела пациенту, в том числе информацию о показаниях, применении, дозе, пути введения, противопоказаниях и/или мерах предосторожности, касающихся применения таких терапевтических продуктов. В одном из вариантов осуществления изобретения на листовке-вкладыше в упаковке указано, что композицию применяют для лечения астмы, например, эозинофильной бронхиальной астмы (АБА), например, эозинофильной бронхиальной астмы (АБА) тяжелого течения; ХОБЛ (хронической обструктивной болезни легких); синдрома Чердж-Стросса; эозинофильного эзофагита; эозинофильного гастроэнтерита или гиперэозинофильного синдрома.
Кроме того, изделие может включать другие продукты, необходимые с коммерческой точки зрения и с точки зрения потребителя, например, растворители, разбавители, фильтры, иглы и шприцы, но не ограничиваясь ими.
Изобретение относится также к наборам, которые можно применять для различных целей, например, для очистки или иммунопреципитации IL-5R(из клеток, для выделения клеток, несущих IL-5Rα. Набор для выделения и очистки антитела к IL-5R(или клеток, несущих IL-5Rα. Набор может содержать антитело к IL-5Rα, связанное с гранулами (например, сефарозными гранулами или магнитными частицами). Набор содержит контейнер, этикетку и листовку-вкладыш в упаковке.
Диагностическое использование и композиции
Аантитело к IL-5R(по настоящему изобретению также используются в диагностических целях (например, in vitro, ex vivo). Например, антитело к IL-5R(может использоваться для обнаружения или измерения уровня IL-5R(в образцах, полученных от пациента, например, образец ткани или образец жидкости тела, такой как воспалительный экссудат, кровь, сыворотка крови, жидкость кишечника, слюна или моча. Подходящие методы обнаружения и измерения включают иммунологические методы, такие как проточная цитометрия, твердофазный иммуноферментный анализ (ИФА), хемилюминесцентный анализ, радиоиммуноанализ и иммуногистология. Изобретение далее включает наборы, например, диагностические наборы, содержащие антитело к IL-5Rα, описанные в данном документе.
Примеры
Для наилучшего понимания изобретения приводятся следующие примеры. Эти примеры приведены только в иллюстративных целях и не должны толковаться как ограничивающие сферу применения изобретения в любой форме.
Все публикации, патенты и патентные заявки, указанные в этой спецификации включены в данный документ путем отсылки. Хотя вышеупомянутое изобретение было довольно подробно описано путем иллюстрации и примера в целях исключения двусмысленного толкования, специалистам в данной области на основе идей, раскрытых в данном изобретении, будет вполне понятно, что могут быть внесены определенные изменения и модификации без отклонения от сущности и объема прилагаемых вариантов осуществления изобретения.
Материалы и общие методы
Общая информация, касающаяся нуклеотидных последовательностей легких и тяжелых цепей человеческого иммуноглобулина, представлена у: Kabat Е.А. и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991. Аминокислоты цепей антител пронумерованы согласно нумерации EU (Edelman G.M. и др., Proc. Natl. Acad. Sci. USA 63, 1969, ее. 78- 85; Kabat Е.А. и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991).
Методы рекомбинантной ДНК
Для манипуляций с ДНК использовали стандартные методы, описанные у Sambrook J. и др., Molecular cloning: A laboratory manual; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989. Реагенты для молекулярной биологии использовали согласно инструкциям производителей.
Синтез генов
Требуемые сегменты генов получали из олигонуклеотидов, созданных путем химического синтеза. Генные сегменты длиной от 300 до 4000 т.п.н., которые фланкированы уникальными сайтами рестрикции, собирали путем отжига и лигирования олигонуклеотидов, включая ПЦР-амплификацию и последующее клонирование через указанные сайты рестрикции. Последовательности ДНК субклонированных генных фрагментов подтверждали путем секвенирования ДНК.
Определение последовательностей ДНК
Последовательности ДНК определяли путем секвенирования по Сенгеру.
Анализ последовательностей ДНК и белков и обработка данных о последовательностях
Применяли пакет программ фирмы Infomax's Vector NT1 Advance suite, версия 8.0 для создания, картирования, анализа, аннотирования и иллюстрации последовательностей.
Экспрессионные векторы
Для экспрессии описанных антител и антигенов применяли варианты экспрессионных плазмид, предназначенных для экспрессии в клетках прокариот (E.coli) кратковременной экспрессии в клетках эукариот (например, в клетках CHO). Помимо кассеты экспрессии антитела векторы содержали: сайт инициации репликации, обеспечивающий репликацию указанной плазмиды в Е.coli, гены, придающие устойчивость в Е.coli к различным антибиотикам (например, к ампициллину и канамицину).
Слияние генов, содержащих описанные цепи антитела, как указано ниже, осуществляли с помощью ПЦР и/или синтеза и сборки генов с использованием известных методов и процедур рекомбинации путем соединения соответствующих сегментов нуклеиновых кислот, например, с использованием уникальных сайтов рестрикции в соответствующих векторах. Субклонированные нуклеотидные последовательности подтверждали секвенированием ДНК. Для кратковременных трансфекций создавали большие количества плазмид посредством получения плазмид из трансформированных культур E.coli.
Пример 1
Продукция рекомбинантных антигенов и антител в суспензионной культуре клеток млекопитающих
Последовательность, кодирующую экстраклеточный домен IL-5R(человека и животных, клонировали в плазмиду pEE с EPEA, FC и H6F метками для наработки белка (фиг.1 a-c) по сайтам рестрикции SalI/NotI. Плазмиду нарабатывали в необходимых количествах в клетках E.Coli и очищали при помощи набора Qiagen.
Антигены продуцировали в клетках постоянной клеточной линии, полученной из клеток яичника китайского хомячка (линия CHO-T), антитела продуцировали в CHO, согласно опубликованным протоколам [Cytotechnology (2012) 64:613–622]. Суспензионное культивирование осуществляли в колбах на орбитальном шейкере с использованием бессывороточных сред производства компании HyCell TransFx-C с добавлением 8 мМ L-глутамина и 1 г/л плюроника 68. Для транзиентной экспрессии клетки в концентрации 2-2,2×106 кл/мл трансфицировали с помощью линейного полиэтиленимина (ПЭИ «MAX», компания «Polysciences»). Соотношение ДНК/ПЭИ составляло 1:3/1:10. Через 5-7 дней после трансфекции культуральную среду центрифугировали при 2000 g в течение 20 минут и фильтровали через фильтр с размером пор 0,22 мкм. Целевые белки выделяли из культуральной жидкости с помощью аффинной хроматографии.
Рекомбинантный белок, содержащий EPEA-tag (glutamic acid-proline-glutamic acid-alanine) на С-конце белка выделяли, используя сорбент CaptureSelect C-tag Affinity Matrix. Культуральную жидкость пропускали через хроматографическую колонку, предварительно заполненную 5 мл C-tag сорбента, затем промывали колонку 25 мл ФСБ, чтобы вымыть неспецифически связывающиеся компоненты. Связанный антиген элюировали в мягких условиях, используя 20 mM Tris, 2 M MgCl2 (pH 7,0-7,4). Далее белок переводили в ФСБ (pH 7,4) с помощью диализа, используя полупроницаемую диализную мембрану, фильтровали (0,22 мкм), переносили в пробирки, и хранили при -70°С.
Рекомбинантные белки с Fc выделяли, используя сорбент HiTrap rProtein A Sepharose FF объемом 5 мл (GE Healthcare). Колонку уравновешивали, и затем промывали 5 объемами ФСБ, чтобы вымыть неспецифически связывающие компоненты. Связанный антиген элюировали, используя 0,1 М глициновый буфер (рН 3). Главный протеиновый пик элюции собирали, и доводили его рН до нейтральности с помощью 1 М буфера Tris (рН 8). Все стадии проводили при скорости потока 110 см/ч. Далее белок переводили в ФСБ (pH 7,4) с помощью диализа, используя технологию SnakeSkin Dialysis Tubing, фильтровали (0,22 мкм), переносили в пробирки, и хранили при -70°С.
Рекомбинантные белки с His выделяли с использование колонки Ni-NTA (QIAGEN), сорбент промывали трижды уравновешивающим буфером (50 мМ NaH2PO4, 300 мМ NaCl, 10 мМ имидазол (рН 8,0)). Доводили pH культуральной жидкости до 8.0, добавляли NiCl2 до конечной концентрации 1 мM. Переносили сорбент в культуральную жидкость, инкубировали 2 часа при 4°C при перемешивании. Промывали десятью объемами колонки буфером (50 мМ NaH2PO4, 300 мМ NaCl, 10 мМ имидазол), промывали двадцатью объемами колонки (50 мM Na2HPO4, 1 M NaCl, 20 мM имидазол), промывали десятью объемами ФСБ (pH 7,4), элюировали 50 мМ NaH2PO4, 300 мМ NaCl, 250 мМ имидазола (рН 8,0). Раствор белка переводили в ФСБ (рН7,4) и замораживали на -70°С.
Чистоту полученного раствора белка оценивали с помощью SDS-гель-электрофореза в редуцирующих и нередуцирующих услових (фиг.2 a-c).
Пример 2
Создание наивной фаговой Fab-библиотеки человеческих антител MeganLibTM
Суммарную РНК В-лимфоцитов из индивидуальных образцов крови более тысячи человеческих доноров выделяли с помощью набора RNeasy Mini Kit согласно предлагаемому протоколу (от QIAGEN). Концентрацию РНК определяли с помощью набора Nanovue (от GE Healthcare) и проверяли качество выделенной РНК с помощью электрофореза в 1,5%-ном агарозном геле.
Реакцию обратной транскрипции проводили с использованием набора MMLV RT kit (от Evrogen) согласно рекомендуемому протоколу с использованием обратной транскриптазы MMuLV и рандом-гексамерных олигонуклеотидов в качестве затравки.
Продукты обратной транскрипции использовали в качестве матрицы в двухступенчатой полимеразной цепной реакции для получения генов вариабельных доменов, фланкированных сайтами рестрикции, с использованием набора олигонуклеотидов по протоколам авторов [J Biol Chem. 1999 Jun 25; 274(26): 18218-30].
Полученный ДНК препарат VL-CK-VH (фиг.3) обрабатывали эндонуклеазами рестрикции NheI/Eco91I и лигировали в оригинальную фагмиду pH5 (фиг.4). Продукты лигирования трансформировали в электрокомпетентные клетки штамма SS320 E.сoli, приготовленные согласно протоколам [Methods Enzymol. 2000;328: 333-63.]. Репертуар комбинаторной фаговой Fab-дисплейной библиотеки MeganLibTM составлял 1011 трансформантов. Препараты фага Fab-библиотек готовили согласно процедуре, описанной ранее [J Mol Biol. 1991 Dec 5;222(3): 581-97].
Пример 3
Продукция человеческих анти-IL-5R(Fab при помощи фагового дисплея
Специфичные фаговые Fab-антитела человека против IL-5R(получали из комбинаторной фаговой Fab-дисплейной библиотеки MeganLibTM. Биопэннинг проводили на IL-5R(человека методом фагового дисплея [Nat Biotechnol. 1996 Mar;14(3):309-14; J Mol Biol.1991 Dec 5;222(3): 581-97], но с использованием магнитных частиц и прибора KingFisher Flex, так как использование данной методики позволяет проводить параллельно до 96 различных схем и вариантов.
Человеческий биотинилированный антиген IL-5R((Fc, EPEA) направленно иммобилизовали на поверхность стрептавидиновых магнитных частиц (streptavidin magnetic beads, NEB) в концентрации 10 мкг/мл для первого раунда, 2 мкг/мл для второго, 0,4 и 0,2 мкг/мл для третьего и четвертого, соответственно. Антиген инкубировали с частицами в течение 1 часа при комнатной температуре на ротаторе. Далее частицы отмывали ФСБ (pH 7,4) и блокировали поверхность частиц раствором 2% обезжиренного молока или 1% БСА на ФСБ (pH 7,4) в течение 1 часа. Человеческую фаговую библиотеку MeganLibTM разводили в концентрации 2*10 13 фаговых частиц на мл в ФСБ (pH 7,4) с 2% обезжиренным молоком и нецелевым антигеном с тагом целевого антигена и преселектировали с магнитными частицами, не содержащими антиген на поверхности, для удаления неспецифически связывающихся фагов. IL-5Rα-покрытые магнитные частицы затем были инкубированы с MeganLibTM в течении 1-2 часов при комнатной температуре.
Несвязавшиеся фаги удаляли в ходе нескольких отмывок магнитных частиц раствором ФСБ (pH 7,4) с 0,1% Твин 20. Количество отмывок увеличивали от раунда к раунду (на 1-ом раунде 3 отмывки, на 2-ом − 9 и на 3-ем – 12, на 4-ом – 15). Фаги, связавшиеся с антигеном на поверхности магнитных частиц, элюировали с частиц 100 мM раствором Gly-HCl (pH 2,2) в течение 15 мин при перемешивании, после элюции нейтрализовали раствор 1M Tris-HCl (pH 7,6). Бактерии штамма Е. coli TG1 инфицировали фагами, нарабатывали в культуре, и использовали их в следующем раунде селекции. После трех-четырех раундов из культуры Е. coli TG1 выделяли фагмидную ДНК согласно стандартному протоколу производителя (Qiagen). Обогащение библиотеки на целевые антигены и оценку присутствия неспецифически связывающихся фаговых частиц проводили при помощи иммуноферментного анализа поликлонального фага (ИФА).
Пример 4
Иммуноферментный анализ поликлонального фага на специфические и неспецифические антигены
Для проведения ИФА на высокосорбционные плашки (Greiner-Bio) иммобилизовали целевой антиген IL-5Rα-Fc и нецелевой с Fc-фьюжн белком. Белок добавляли в концентрации 1 и 5 мкг/мл соответственно, в 0,1 M NaHCO3 (pH 9,0) и титровали с шагом 2 до 7 разведения, после чего, герметично закрытые плашки инкубировали в течение ночи при +4°С. Все последующие этапы проводили по стандартному ИФА протоколу с использованием высокопроизводительной автоматизированной платформы на базе роботизированной системы Tecan Freedom EVO 200 (от Tecan). Для блокирования неспецифического связывания в лунки планшетов добавляли блокирующий буфер 2% обезжиренное молоко или 1% БСА на ФСБ (pH 7,4). Планшеты инкубировали в течение часа при комнатной температуре. После отмывок фосфатно-солевым буфером, содержащим Твин-20 (ФСБТ), добавляли по 50 мкл на лунку тестируемого поликлонального фага. После промывания добавляли (50 мкл/лунку) анти-M13 HRP-конъюгированного вторичного антитела (от Pierce-ThermoScientific) в соотношении 1:7500 в ФСТБ. После инкубации 50 минут при комнатной температуре планшеты отмывали ФСТБ три раза. Колориметрический сигнал развивали добавлением субстратного раствора (Н2О2-0,02% и ТМБ в CH3COONa рН5,5) на 10 минут, затем реакцию останавливали добавлением 1% серной кислоты (20 мкл). Цветовой сигнал измеряли при длине волны 450 нм, используя подходящий планшет-ридер Tecan-Sunrise (от Tecan).
После третьего и четвертого раунда селекции на целевом антигене проведенный ИФА анализ препарата поликлонального фага показал значительное обогащение (фиг.6). Для реклонирования и дальнейшего скрининга отобрали библиотеки, у которых наблюдали превышение сигнала более чем в 5 раз на минимальном разведении фаговых библиотек на негомологичные контрольные антигены.
Пример 5
Реклонирование генов вариабельных доменов антител в экспрессионную плазмиду
Реклонирование генов вариабельных доменов антител в экспрессионную плазмиду (фиг.5) из фагмидного вектора после успешных раундов селекции осуществляли по стандартному протоколу с применением рестриктазно лигазного метода.
В последующем экспрессионные вектора содержащие фрагменты антител, трансформировали в штамм E.coli BL21-Gold для проведения сравнительного анализа аффинности вариабельных фрагментов антител из дисплейных библиотек к антигену методом ИФА с использованием технологической платформы Mabnext Flow Chart.
Пример 6
Отбор высокоаффинных клонов из постселекционных библиотек, специфически связывающих IL-5R(человека
Наработку Fab проводили по стандартной методике: бактериальные клетки E.coli BL21-Gold трансформировали экспрессионными векторами, содержащими гены Fab, а последующее добавление индуктора запускало транскрипцию lac-оперона, что при культивировании полученных трансформантов вызывало экспрессию Fab, которые экспортировались в периплазматическое пространство клеток. Далее проводили ИФА для проверки связывания Fab с иммобилизованным на подложке антигеном IL-5Rα-EPEA в концентрации 0,2 мкг/мл на планшетах (medium binding от Greiner bio one) в 0,1 M NaHCO3 (pH 9,0) (антиген иммобилизовали в течение ночи при 4°С). В качестве положительного контроля использовали последовательность Fab Benralizumab (Medimmune) встроенную в экспрессионную плазмиду pLL. Все последующие этапы проводили при комнатной температуре по стандартному протоколу ИФА с использованием высокопроизводительной автоматизированной платформы на базе роботизированных систем Genetix Qpix2xt (от Molecular Device) и Tecan Freedom EVO 200 (от Tecan). После каждого этапа проводили отмывку 300 мкл на лунку 1х ФСБТ в трех повторностях. Проводили блокирования неспецифических участков связывания на планшете 1% обезжиренным молоком в 1x ФСБТ, после отмывки добавляли аналит, в качестве которого выступали супернатанты клеток E.coli в обьеме 60 мкл на лунку. Детекция иммунных комплексов осуществляли при помощи козьих анти-Fab антител коньгированных с пероксидазой (от Pierce-ThermoScientific) в разведении 1:7500. Окрашивание субстрат-хромогенной смеси проводили добавлением субстратного раствора (Н2О2-0,02% и ТМБ в CH3COONa (рН5.5)) в объеме 50 мкл на 15 минут. Остановку реакции осуществляли 25 мкл H2SO4 1%. Цветовой сигнал измеряли при длине волны 450 нм, используя подходящий планшет-ридер Tecan-Sunrise (от Tecan). Степень связывания антитела была пропорциональна продуцированию цветового сигнала. Клоны, у которых цветовой сигнал превышал сигнал от контрольного антитела, проверяли в ИФА на неспецифическое связывание.
Пример 7
Анализ неспецифического связывания отобранных Fab с другими антигенами
ИФА использовали также для анализа неспецифического связывания исследуемых Fab-фрагментов с другими антигенами. Исследование проводили, как описано выше, но в качестве антигенов для иммобилизации использовали IL6R-Fc, PCSK9-VG-FE в 0,1 M NaHCO3 (pH 9,0) (антиген иммобилизовали в течение ночи при 4°С). В качестве контроля специфического связывания использовали IL-5Rα-FE, IL-5Rα-Fc (антиген иммобилизовали в течение ночи при 4°С). Все последующие этапы проводили по стандартному протоколу ИФА с использованием высокопроизводительной автоматизированной платформы на базе роботизированных систем Genetix Qpix2xt (от Molecular Device) и Tecan Freedom EVO 200 (от Tecan). Клоны, у которых цветовой сигнал неспецифического связывания не превышал сигнал контроля, проверяли в конкурентном ИФА анализе для выявления Fab, блокирующих взаимодействие лиганда и рецептора.
Пример 8
Отбор высокоаффинных Fab фрагментов, блокирующих взаимодействия IL-5R(с лигандом IL-5
Конкурентный ИФА использовали для проверки отобранных ранее специфичных Fab против человека на способность блокировать взаимодействие IL-5R(с лигандом IL-5 (Sino Biological). В качестве положительного контроля использовали Fab с опубликованной последовательностью Benralizumab (Medimmune).
IL-5 иммобилизовали в лунках планшетов ELISA (medium binding от Greiner bio one) по 50 мкл с концентрацией 1 мкг/мл в 0,1 M NaHCO3, pH 9,0 и инкубировали в течение ночи при 4°С. Все последующие этапы проводили по стандартным ИФА протоколам при комнатной температуре с использованием высокопроизводительной автоматизированной платформы на базе роботизированных систем Genetix Qpix2xt (от Molecular Device) и Tecan Freedom EVO 200 (от Tecan). Для блокирования неспецифического связывания добавляли блокирующий буфер в объеме 200 мкл (1% обезжиренного молока в ФСБ).
Параллельно в несорбирующих планшетах смешивали в соотношении 1:1 клеточный супернатант, содержащий тестируемый Fab и IL-5R((в конечной концентрации 1 мкг/мл в ФСБT), инкубировали в течение 45 минут при комнатной температуре.
После отмывок от блокирующего буфера, в планшет переносили преинкубированную смесь. В дальнейшем, все шаги были аналогичны описанным в примере 6. Клоны, показавшие блокирование на уровне контрольного Fab антитела Benralizumab, отмечали, как позитивные и использовали в дальнейших анализах.
Гены вариабельных доменов позитивных клонов секвенировали, согласно стандартным протоколам на аппарате Applied Biosystems 3130 Genetic Analyzer (Applied Biosystems) и анализировали.
Пример 9
Отбор высокоаффинных Fab фрагментов по скорости диссоциации
Off-rate скрининг проводили с использованием прибора Pall Forte Bio Octet Red 384. Анти-FABCH1-биосенсоры в течение 30 минут регидратировали в рабочем буфере, содержащем 10 мМ ФСБ (рH 7,2-7,4), 0,1% Твин-20, 0,1% БСА. В исследуемые образцы супернатантов E.coli добавляли рабочий буфер до конечной концентрации 10%. Затем анти-FABCH1-биосенсоры погружали в супернатанты E.coli, содержащие Fab-фрагменты кандидатов антител, на 12 часов при 4°С. Сенсоры с иммобилизованными на поверхности Fab – фрагментами переносили в лунки с рабочим буфером, где прописывали базовую линию (60 с). Далее сенсоры переносили в лунки с раствором аналита (IL-5Rα-Fc, 30 мкг/мл) для ассоциации комплекса антиген-антитело (300 с). Затем сенсоры возвращали в лунки, содержащие рабочий буфер, для последующей стадии диссоциации (600 с). После каждого эксперимента использованные сенсоры регенерировали путем трехкратного помещения их в буфер для регенерации (10 мМ Gly-HCl, рH 1,7) после чего использовали в следующем эксперименте. Анализ полученных кривых проводили с помощью программного обеспечения Octet Data Analysis (версия 9.0) согласно стандартной процедуре по модели взаимодействия 1:1 Local.
Пример 10
Получение полноразмерных антител
Клонирование проводили по стандартной методике. Последовательность вариабельного домена тяжелой цепи клонировали в вектор pEE-Hc IgG1 по сайтам рестрикции Sal1/Nhe1. Вариабельный домен легкой цепи клонировали в вектор pEE-CK по сайтам рестрикции Sal1/BsiW1. Полученные генетические конструкции передали на транзиентную наработку белков в клеточной линии CHO. Белки выделяли и очищали по стандартной методике путем аффинной хроматографии на бактериальном белке Protein A как описано в примере 1. Электрофорез проводили в денатурирующем 12% ПААГ с добавлением меркаптоэтанола и нативном 8% ПААГ (фиг.2c).
Пример 11
Определение аффинности полноразмерных антител на Forte Bio Octert RED 384
Эксперименты по исследованию аффинности связывания антител к антигену IL-5R(человека проводили на приборе Forte Bio Octert RED 384. IL-5R(человека в концентрации 20 мкг/мл иммобилизовали на поверхность AR2G сенсоров (ForteBio) по стандартному протоколу согласно инструкции производителя. Анализ проводили при 30°С c использованием ФСБ, содержащим 0,1% Твин-20 и 0,1% БСА в качестве рабочего буфера. После того как в буферном растворе прописывали базовую линию сенсоры погружали в лунки с раствором антител на 300 секунд, где происходила ассоциация комплекса. Затем детектировали диссоциацию комплекса в буферном растворе в течение 600 секунд.
Кривые связывания с вычетом референсного сигнала анализировали с помощью программы Octet Data Analysis (версия 9.0) согласно стандартной процедуре с использованием модели взаимодействия 1:1 Global. Анти-IL-5R(антитела специфически и с высокой аффинностью связываются с антигеном человека. Таблица A. (фиг.7 a-c).
Таблица А. Константы диссоциации BCD-133(03-002, 03-020, 03-021).
Пример 12
Получение стабильной клеточной линии, экспрессирующей IL-5Rα
Клеточную линию CHO-K1 культивировались в среде DMEM/F12 с 5% FBS. Трансфекцию генетической конструкцией, содержащей кодирующую ДНК IL-5Rα, проводили с помощью TurboFect согласно протоколу производителя.
Через 3 суток после трансфекции в течение 14 дней проводилась селекция трансфецированной культуры добавлением гигромицина Б в среду до конечной концентрации 250 мкг/мл. Полученная после селекции популяция клеток была клонирована. Клеточный клон, экспрессирующий IL-5Rα, был выбран на основе результатов анализа уровня и гомогенности экспрессии IL-5R, с учетом скорости роста, гомогенности популяции и отсутствия морфологических изменений.
Пример 13
Сравнение контрольного воспроизведенного афукозилированного антитела и кандидатов антител против IL-5R(в ADCC тесте на клетках CHO-IL-5R.
Для анализа ADCC использовалась клеточная линия CHO-IL-5R, стабильно экспрессирующая IL-5Rα, и мононуклеарные клетки перферической крови (PBMC) здоровых доноров. Клетки CHO-IL-5R культивировались в среде DMEM/F12 с 2 мМ глутамином, 5% FBS (фетальной бычьей сывороткой), 0,05 мг/мл гентамицином и 0,4 мг/мл гигромицином Б при 37°C 5% CO2. Клетки снимались с поверхности с помощью трипсина, дважды промывались в RPMI-1640 c 2 мМ глутамином, 10% FBS. Жизнеспособность и количество клеток оценивались с помощью камеры Горяева после окраски трипановым синим. В среде RPMI-1640 c 10% FBS приготовили суспензию клеток с концентрацией 4*105/мл.
Мононуклеарные клетки периферической крови (PBMC) выделяли из венозной крови здоровых доноров с помощью фиколла разделением в градиенте плотности. После этого клетки дважды были отмыты в DPBS и ресуспендированы в среде RPMI-1640 c 2 мМ глутамином, 10% FBS до плотности 2*106/мл.
Для анализа ADCC в лунки 96-луночного планшета внесли серию разведений антител по 50 мкл с концентрациями от 0,005 нг/мл до 300 нг/мл. К ним добавили по 50 мкл суспензии целевых клеток, инкубировали планшет 30 мин при 37°C и 5% CO2. Добавили по 50 мкл суспензии эффекторных клеток. Планшет инкубировали в течение 16 часов при 37°C 5% CO2. После окончания инкубации проводили анализ цитотоксичности с помощью набора CytoTox96®Non-Radio Cytotoxicity Assay.
Для расчета эффективности ADCC использовали формулу:

Определяли полумаксимальную эффективную концентрацию (EC50) с помощью пакета GraphPad Prism 6.0. Согласно проведенному эксперименту эффективность кандидатов антител против IL-5R(BCD-133-03-002, BCD-133-03-020, BCD-133-03-021 в 1,6 раз превышают антитело Benralizumab (BCD-133-018-200617). Между собой кандидаты достоверно не отличаются по эффективности относительно Benralizumab.
Результаты показаны на фиг.8 a-b.
Пример 14
Анализ взаимодействий с рецепторами IL-5Ra макаки циномолгус, кролика и мыши на приборе Forte Bio Octet RED 384
Эксперименты по исследованию аффинности связывания антител к антигену IL-5R(животных проводили на приборе Forte Bio Octert RED 384. Антитела в концентрации 20 мкг/мл иммобилизовали на поверхность AR2G сенсоров (Forte Bio) по стандартному протоколу согласно инструкции производителя. Анализ проводили при 30°С c использованием ФСБ, содержащим 0,1% Твин-20 и 0,1% БСА в качестве рабочего буфера. После того как в буферном растворе прописывали базовую линию сенсоры погружали в лунки с раствором антигенов (IL-5R(животных) на 300 секунд, где происходила ассоциация комплекса. Затем детектировали диссоциацию комплекса в буферном растворе в течении 600 секунд.
Кривые связывания с вычетом базового сигнала анализировали с помощью программы Octet Data Analysis (версия 9.0) согласно стандартной процедуре с использованием модели взаимодействия 1:1 Global. Анти-IL-5Ra антитела специфически связываются с антигеном макаки. Таблица B. фиг.9 a-c.
Таблица B. Таблица с константами диссоциации антител к антигену макаки (IL-5Rα).
Антитела не взаимодействуют с IL-5R(мыши и кролика.
Пример 15
Создание стабильной клеточной линии, продукция и очистка анти-IL-5R антитела
Стабильную клеточную линию продуцента моноклонального антитела BCD-133 получали путем трансфекции методом электропорации с использованием прибора 4D Nucleofector (Lonza) родительской суспензионной клеточной линии CHO-K1-S векторными конструкциями, содержащими легкие и тяжелые цепи антитела в оптимизированном соотношении. Клональные линии с высоким уровнем продуктивности (более 1000 мг/л) получали с использованием роботизированной платформы ClonePix (Molecular Devices) и предварительных этапов селекции минипулов с использованием антибиотиков в разных форматах культивирования. Анализ продуктивности проводили с использованием аналитической системы Octet QK System (Pall Life Sciences). Подбор базовой среды и схемы культивирования осуществляли на базе автоматизированной системы Tecan Genesis Workstation RSP 200/8 Automatic Liquid Handling System (Tecan) с последующей математической обработкой в программном обеспечении MODDE. Для культивирования продуцента использовали бессывороточные среды и фидинги, не содержащие белков животного происхождения. Наработку препарата BCD-133 для доклинических исследований проводили в ферментере HyClone single-use bioreactor (Thermo Fisher Scientific) рабочим объемом 50 л.
Осветление культуральной жидкости проводили на глубинном фильтре Millistak C0HC (Merck-Millipore). Первичную очистку антитела из осветленной культуральной жидкости проводили на аффинном сорбенте с белком А. Специфическую элюцию целевого белка проводили в кислых условиях pH3.3-3.8 в глициновом буфере. Полученный элюат выдерживали в кислом pH в течение 30-60 минут для вирусной инактивации, а затем нейтрализовали 1M раствором Tris-OH до значения рН 6.5-7.0. Финальную хроматографическую очистку в режиме проскока проводили на сорбенте CaptoAdhere (GE HealthCare LifeSciences) для удаления остаточных ДНК, белков клеток продуцента, отщепленного лиганда аффинного сорбента, агрегатов и фрагментов антител. Для этого раствор белка пропускали через подготовленный сорбент, в pH 6,5-7,0 при низком значении кондуктивности (<3 мС/см2). Очищенный белок подвергали противовирусной фильтрации с использованием набора фильтров Viresolve PRO (Millipore), концентрированию и диафильтрации против конечного буфера, содержащего ацетатный буфер (pH 5,0-5,5) и трегалозу. Концентрация полученного белка составляла 50 мг/мл и более.
Пример 16
In silico моделирование комплекса BCD-133 антитела и IL-5R(человека
Для создания BCD-133 мутантных антител, специфичных против IL-5R(был проведен структурный анализ на основе 3D моделирования с использованием программных пакетов Schrodinger Suite версии 2017-1 компании Schrodinger. В качестве кристаллической структуры мишени была выбрана структура, депонированная в Protein Data Bank под идентификатором 3VA2. Докинг осуществлялся с помощью инструмента PIPER, часть пакета Schrodinger Suite. Выбор оптимальных позиций был проведен с помощью оценки свободной энергии (методом MM-GBSA) на 25 наносекундном интервале молекулярной динамики (инструмент Desmond компании D.E. Shaw Research). Визуализация полученной структуры создана с помощью инструмента Maestro компании Schrodinger. Модель, включающая вариабельные домены BCD-133 представлена на фиг.10
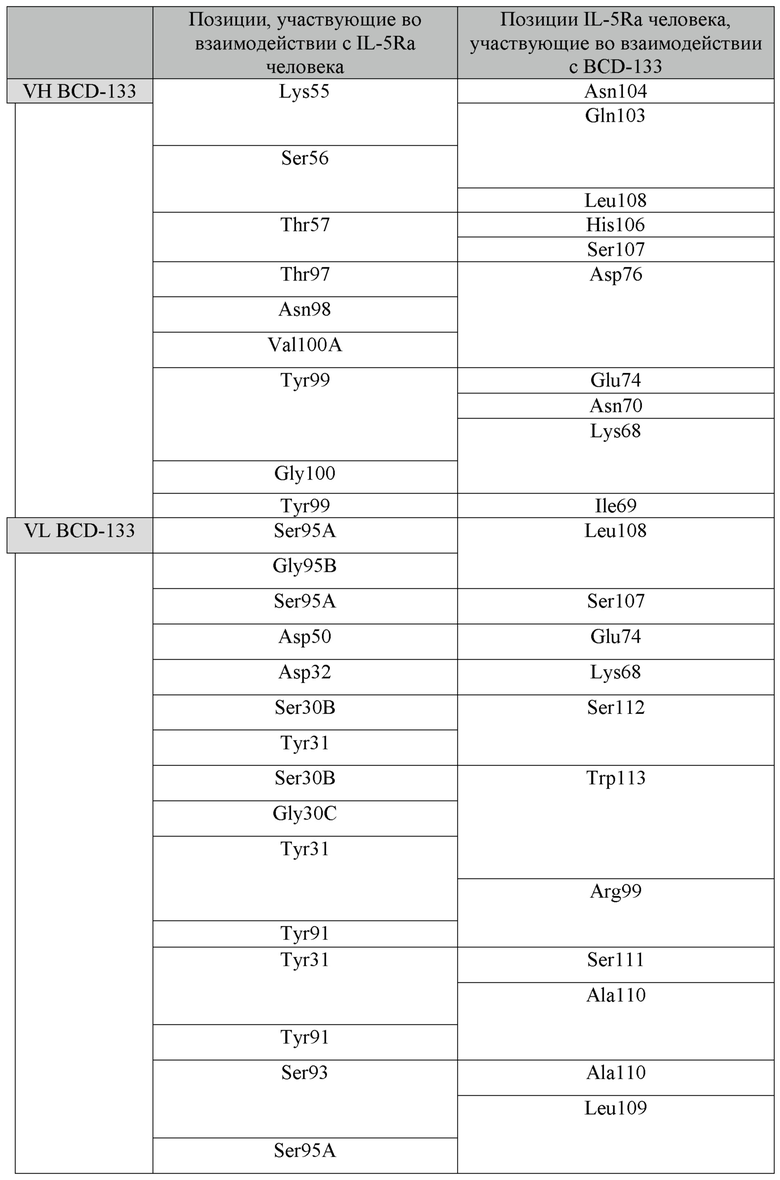
Таблица С. В среднем столбце представлены аминокислотные остатки BCD-133 антитела, образующие взаимодействие с IL-5R(человека. В правом столбце приведены соответствующие аминокислотные остатки антигена IL-5Rα, взаимодействующие с антителом BCD-133.
Пример 17
Конструирование библиотеки BCD-133 мутантных антител, специфичных к IL-5R(человека
Для создания BCD-133 мутантных антител, специфичных к IL-5R(человека, был проведен структурный анализ на основе 3D моделирования с использованием программного пакета Schrodinger Suites 2017-1 компании Scgrodinger и модели IL-5R((PDB 3VA2) (см. также Пример 16). На основе расчетной модели был создан набор 3D структур комплекса антитела с IL-5Rα, каждая из которых содержала не более 6 замен аминокислот изменения аффинности антитела и стабильности комплекса. На следующем этапе из полученного набора структур была сформирована библиотека, включающая варианты, в которых замены привели к увеличению стабильности комплекса и к увеличению аффинности антитела.
В нижеуказанной таблице разбивка на CDR-участки выполнялась по Chothia Canonical Assignment, а не по более распространенной классификации Kabat, как указаны CDR-участки с последовательностями SEQ ID NO: 1-3, 6-8, этот алгоритм разметки лучше выделяет петли на структуре антитела, по сравнению с другими вариантами (Chothia et al. (1997) http://www.sciencedirect.com/science/article/pii/S0022283697913541?via%3Dihub). Поэтому для изменения аффинности антитела использовалась именно эта разметка.
Библиотека антител, полученная по протоколу, описанному выше, включает 71 последовательность антител. Замены представлены в 16 позициях. Из них 9 позиций приходятся на CDR регионы легких цепей, 7 позиций - на CDR регионы тяжелых цепей. Количество уникальных замен составляет 60 штук. В таблице D представлены последовательности CDR петлей исходного кандидата, а также набор замен аминокислот, представленных в каждом из 71 мутантных последовательностей. В обобщенном виде последовательности CDR петлей мутантов из библиотеки можно представить в следующем виде:
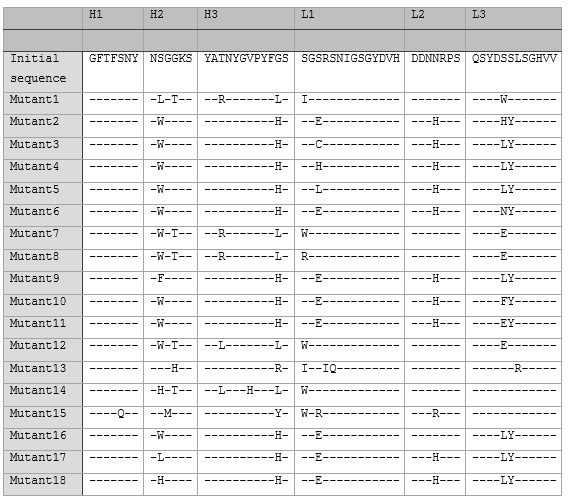


Таблица D. Последовательности CDR петлей исходного кандидата и замены.Пример 19
Определение коллоидной стабильности по точке агрегации белка методом динамического светорассеяния
Для определения температуры агрегации исследуемых образцов методом динамического светорассеяния получали зависимость размера частиц в среде от температуры с помощью прибора DynaPro® Plate Reader II (Wyatt Technology Corp.) при постепенном нагревании от 40 до 85°С.Результаты представлены в таблице E.
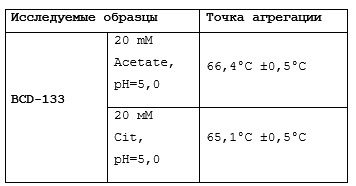
Таблица E. Точка агрегации BCD-133
Можно заключить, что молекула BCD-133 имеет высокую термо-коллоидную стабильность (точка агрегации в 20mM Acetate, pH=5,0 и 20 мМ Cit, pH=5,0 буферных растворах составляет>65°).
Пример 20
Определение термической стабильности при термострессе 50°С
Исследуемые образцы устанавливали в воздушный термостат и термостатировали при 50°С в течение 72 часов. После окончания прогрева интактные и стрессировнные образцы передавали на анализ методом эксклюзионной ВЭЖХ (SEC HPLC) с УФ-детектором и методом электрофореза в нередуцирующих условиях. Хроматографию проводили на системе ВЭЖХ Agilent 1100 на колонке Tosoh TSK-Gel G3000SWXL, детектирование проводили при длине волны 220 нм. Электрофорез проводился на приборе Caliper Labchip GX II. Приготовление рабочих растворов и подготовку чипа проводили по стандартной методике с использованием набора HT Protein Express Reagent Kit.
Результирующие данные стабильности BCD-133 при инкубировании при 50°С представлены в табл.F и на фиг.12 представлены совмещенные хроматограммы: синий – интактный, красный – 72 часа инкубации при 50°С.
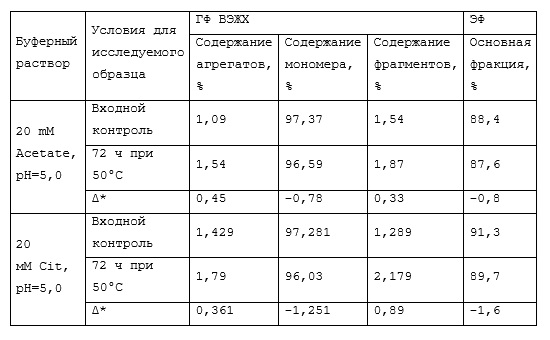
* Δ - разница чистоты стрессированного образца и чистоты интактного образца (входного контроля), %.
Таблица F. Зависимость содержания мономера по эксклюзивной ВЭЖХ и ЭФ для BCD-133.
Пример 18
Определение коллоидной стабильности по точке агрегации белка методом динамического светорассеяния
Для определения температуры агрегации исследуемых образцов методом динамического светорассеяния получали зависимость размера частиц в среде от температуры с помощью прибора DynaPro® Plate Reader II (Wyatt Technology Corp.) при постепенном нагревании от 40 до 85°С. Результаты представлены в таблице Е.
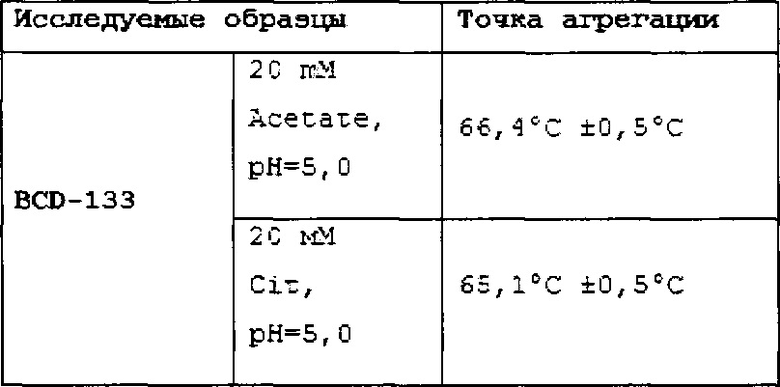
Таблица Е. Точка агрегации BCD-133
Можно заключить, что молекула BCD-133 имеет высокую термоколлоидную стабильность (точка агрегации в 2 0mM Acetate, рН=5,0 и 2 0 мМ Cit, рН=5,0 буферных растворах составляет>65°).
Пример 19
Определение термической стабильности при термострессе 50°С Исследуемые образцы устанавливали в воздушный термостат и термостатировали при 50°С в течение 72 часов. После окончания прогрева интактные и стрессировнные образцы передавали на анализ методом эксклюзионной ВЭЖХ (SEC HPLC) с УФ-детектором и методом электрофореза в нередуцирующих условиях. Хроматографию проводили на системе ВЭЖХ Agilent 1100 на колонке Tosoh TSK-Gel G3000SWXL, детектирование проводили при длине волны 22 0 нм. Электрофорез проводился на приборе Caliper Labchip GX II. Приготовление рабочих растворов и подготовку чипа проводили по стандартной методике с использованием набора НТ Protein Express Reagent Kit.
Результирующие данные стабильности BCD-133 при инкубировании при 50°С представлены в табл.F и на фиг.12 представлены совмещенные хроматограммы: синий - интактный, красный - 72 часа инкубации при 5 0°С.
Перечень последовательностей
<110>JOINT STOCK COMPANY “BIOCAD”
<120>МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К IL-5Rα
<160>18
<210>1
<211>5
<212>PRT
<213>Искусственная последовательность
<400>1
NYAMS
<210>2
<211>17
<212>PRT
<213>Искусственная последовательность
<400>2
AINSGGKSTNYADSVKG
<210>3
<211>13
<212>PRT
<213>Искусственная последовательность
<400>3
DYATNYGVPYFGS
<210>4
<211>121
<212>PRT
<213>Искусственная последовательность
<400>4
QVTLKESGGGLVQPGGSLRLSCAASGFTFSNYAMSWVRQAPGKGLEWVSAINSGGKSTNYADSVKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCADYATNYGVPYFGSWGQGTTVTVSS
<210>5
<211>121
<212>PRT
<213>Искусственная последовательность
<400>5
QVQLQESGGGLVQPGGSLRLSCAASGFTFSNYAMSWVRQAPGKGLEWVSAINSGGKSTNYADSVKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCADYATNYGVPYFGSWGQGTMVTVSS
<210>6
<211>14
<212>PRT
<213>Искусственная последовательность
<400>6
SGSRSNIGSGYDVH
<210>7
<211>7
<212>PRT
<213>Искусственная последовательность
<400>7
DDNNRPS
<210>8
<211>12
<212>PRT
<213>Искусственная последовательность
<400>8
QSYDSSLSGHVV
<210>9
<211>112
<212>PRT
<213>Искусственная последовательность
<400>9
QAGLTQPPSVSAAPGQRVTISCSGSRSNIGSGYDVHWYQQVPGTAPKLLIFDDNNRPSGVPDRFSGSKSGTSASLAITGLQAEDEADYYCQSYDSSLSGHVVFGGGTKLTVL
<210>10
<211>112
<212>PRT
<213>Искусственная последовательность
<400>10
QSVLTQPPSVSAAPGQRVTISCSGSRSNIGSGYDVHWYQQLPGTAPKLLIYDDNNRPSGVPDRFSGSKSGTSASLAITGLQAEDEADYYCQSYDSSLSGHVVFGGGTKLTVL
<210>11
<211>451
<212>PRT
<213>Искусственная последовательность
<400>11
QVTLKESGGGLVQPGGSLRLSCAASGFTFSNYAMSWVRQAPGKGLEWVSAINSGGKSTNYADSVKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCADYATNYGVPYFGSWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
<210>12
<211>451
<212>PRT
<213>Искусственная последовательность
<400>12
QVQLQESGGGLVQPGGSLRLSCAASGFTFSNYAMSWVRQAPGKGLEWVSAINSGGKSTNYADSVKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCADYATNYGVPYFGSWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
<210>13
<211>219
<212>PRT
<213>Искусственная последовательность
<400>13
QAGLTQPPSVSAAPGQRVTISCSGSRSNIGSGYDVHWYQQVPGTAPKLLIFDDNNRPSGVPDRFSGSKSGTSASLAITGLQAEDEADYYCQSYDSSLSGHVVFGGGTKLTVLRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
<210>14
<211>219
<212>PRT
<213>Искусственная последовательность
<400>14
QSVLTQPPSVSAAPGQRVTISCSGSRSNIGSGYDVHWYQQLPGTAPKLLIYDDNNRPSGVPDRFSGSKSGTSASLAITGLQAEDEADYYCQSYDSSLSGHVVFGGGTKLTVLRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
<210>15
<211>1353
<212>DNA
<213>Искусственная последовательность
<400>15
CAAGTAACCCTAAAGGAAAGTGGAGGAGGACTTGTCCAACCCGGCGGCAGTTTAAGACTTAGCTGTGCTGCTTCTGGCTTTACTTTTAGCAACTATGCTATGTCGTGGGTGCGTCAAGCGCCAGGAAAGGGCCTAGAATGGGTGAGCGCTATCAATAGCGGCGGAAAAAGCACTAACTACGCGGACAGCGTGAAAGGCCGCTTCACTATAAGTCGGGACAATGCTAAAAACACACTGTACCTCCAGATGAACTCCCTAAGAGCTGAGGACACGGCTGTGTACTACTGCGCTGATTATGCGACTAACTATGGAGTGCCATACTTCGGAAGCTGGGGCCAGGGAACGACCGTAACTGTGAGTAGTGCTAGCACCAAGGGCCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTATAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAAAGCCTCTCCCTGTCCCCGGGTAAA
<210>16
<211>1353
<212>DNA
<213>Искусственная последовательность
<400>16
CAAGTACAACTACAGGAAAGTGGAGGAGGACTTGTCCAACCCGGCGGCAGTTTAAGACTTAGCTGTGCTGCTTCTGGCTTTACTTTTAGCAACTATGCTATGTCGTGGGTGCGTCAAGCGCCAGGAAAGGGCCTAGAATGGGTGAGCGCTATCAATAGCGGCGGAAAAAGCACTAACTACGCGGACAGCGTGAAAGGCCGCTTCACTATAAGTCGGGACAATGCTAAAAACACACTGTACCTCCAGATGAACTCCCTAAGAGCTGAGGACACGGCTGTGTACTACTGCGCTGATTATGCGACTAACTATGGAGTGCCATACTTCGGAAGCTGGGGCCAGGGAACGATGGTAACTGTGAGTAGTGCTAGCACCAAGGGCCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAACTCCTGGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTATAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAAAGCCTCTCCCTGTCCCCGGGTAAA
<210>17
<211>657
<212>DNA
<213>Искусственная последовательность
<400>17
CAGGCTGGACTGACGCAACCGCCATCTGTGAGTGCGGCTCCAGGACAACGGGTGACTATAAGCTGCAGCGGAAGCAGAAGCAACATAGGCAGTGGATACGACGTACATTGGTACCAACAAGTACCGGGGACGGCTCCGAAACTACTGATATTTGACGATAATAATAGACCGAGCGGCGTACCAGACCGTTTTAGCGGAAGCAAAAGTGGAACGAGTGCCTCTTTAGCCATAACTGGCCTGCAAGCTGAAGATGAAGCTGATTATTACTGTCAGAGCTACGACAGCAGTCTGAGTGGACACGTAGTGTTTGGAGGAGGAACGAAGCTGACGGTATTACGTACGGTGGCTGCACCATCTGTCTTCATCTTCCCGCCATCTGATGAGCAGTTGAAATCTGGAACTGCCTCTGTTGTGTGCCTGCTGAATAACTTCTATCCCAGAGAGGCCAAAGTACAGTGGAAGGTGGATAACGCCCTCCAATCGGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGGACAGCACCTACAGCCTCAGCAGCACCCTGACGCTGAGCAAAGCAGACTACGAGAAACACAAAGTCTACGCCTGCGAAGTCACCCATCAGGGCCTGAGCTCGCCCGTCACAAAGAGCTTCAACAGGGGAGAGTGT
<210>18
<211>657
<212>DNA
<213>Искусственная последовательность
<400>18
CAGAGTGTGCTGACGCAACCGCCATCTGTGAGTGCGGCTCCAGGACAACGGGTGACTATAAGCTGCAGCGGAAGCAGAAGCAACATAGGCAGTGGATACGACGTACATTGGTACCAACAACTACCGGGGACGGCTCCGAAACTACTGATATACGACGATAATAATAGACCGAGCGGCGTACCAGACCGTTTTAGCGGAAGCAAAAGTGGAACGAGTGCCTCTTTAGCCATAACTGGCCTGCAAGCTGAAGATGAAGCTGATTATTACTGTCAGAGCTACGACAGCAGTCTGAGTGGACACGTAGTGTTTGGAGGAGGAACGAAGCTGACGGTATTACGTACGGTGGCTGCACCATCTGTCTTCATCTTCCCGCCATCTGATGAGCAGTTGAAATCTGGAACTGCCTCTGTTGTGTGCCTGCTGAATAACTTCTATCCCAGAGAGGCCAAAGTACAGTGGAAGGTGGATAACGCCCTCCAATCGGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGGACAGCACCTACAGCCTCAGCAGCACCCTGACGCTGAGCAAAGCAGACTACGAGAAACACAAAGTCTACGCCTGCGAAGTCACCCATCAGGGCCTGAGCTCGCCCGTCACAAAGAGCTTCAACAGGGGAGAGTGT
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО ПРОТИВ IL-5, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2772716C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО ИЛИ ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ, КОТОРОЕ СПЕЦИФИЧЕСКИ СВЯЗЫВАЕТСЯ С GD2 (ГАНГЛИОЗИД GD2), И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2796937C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО ИЛИ ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ, КОТОРОЕ СПЕЦИФИЧЕСКИ СВЯЗЫВАЕТСЯ С IL-4Rα, И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2808563C2 |
| Моноклональное антитело, которое специфически связывается с GITR | 2019 |
|
RU2734432C1 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, КОТОРОЕ СПЕЦИФИЧЕСКИ СВЯЗЫВАЕТСЯ С CSF-1R | 2020 |
|
RU2751249C1 |
| ПОЛНОСТЬЮ ЧЕЛОВЕЧЕСКОЕ АНТИТЕЛО, СПЕЦИФИЧНОЕ K ИНТЕРЛЕЙКИНУ 1-АЛЬФА | 2021 |
|
RU2838383C1 |
| АНТИТЕЛО ПРОТИВ PDL-1, ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2017 |
|
RU2693661C2 |
| ТРИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА ПРОТИВ IL-17A, IL-17F И ДРУГОЙ ПРОВОСПАЛИТЕЛЬНОЙ МОЛЕКУЛЫ | 2016 |
|
RU2680011C2 |
| АНТИТЕЛА ПРОТИВ ИНТЕРЛЕЙКИНА-13 ЧЕЛОВЕКА И ИХ ПРИМЕНЕНИЕ | 2005 |
|
RU2427589C2 |
| Моноклональные антитела, которые специфически связываются с участком бета цепи семейства TRBV-9 Т-клеточного рецептора человека, и способы их применения | 2018 |
|
RU2711871C1 |
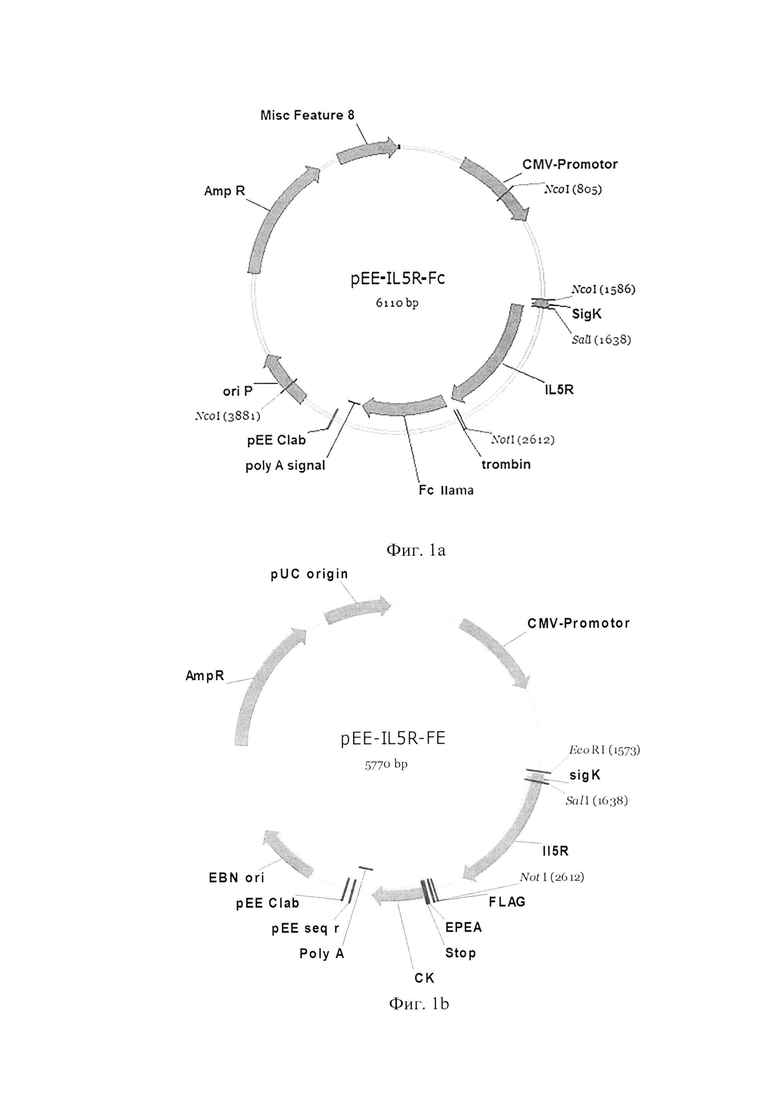
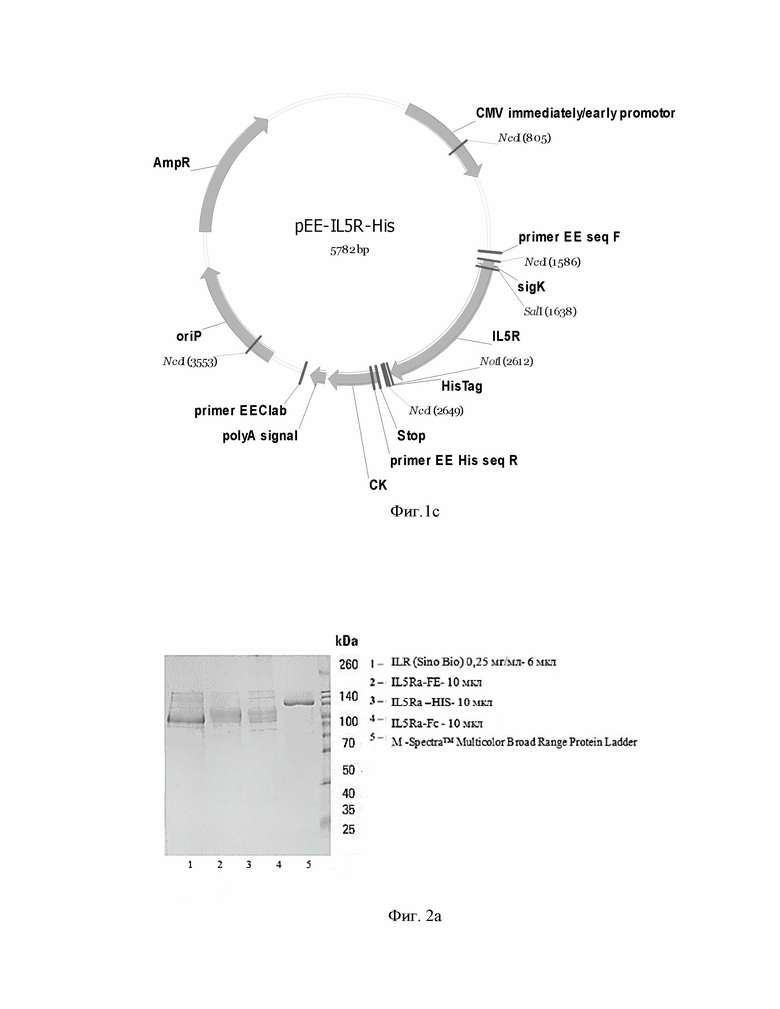
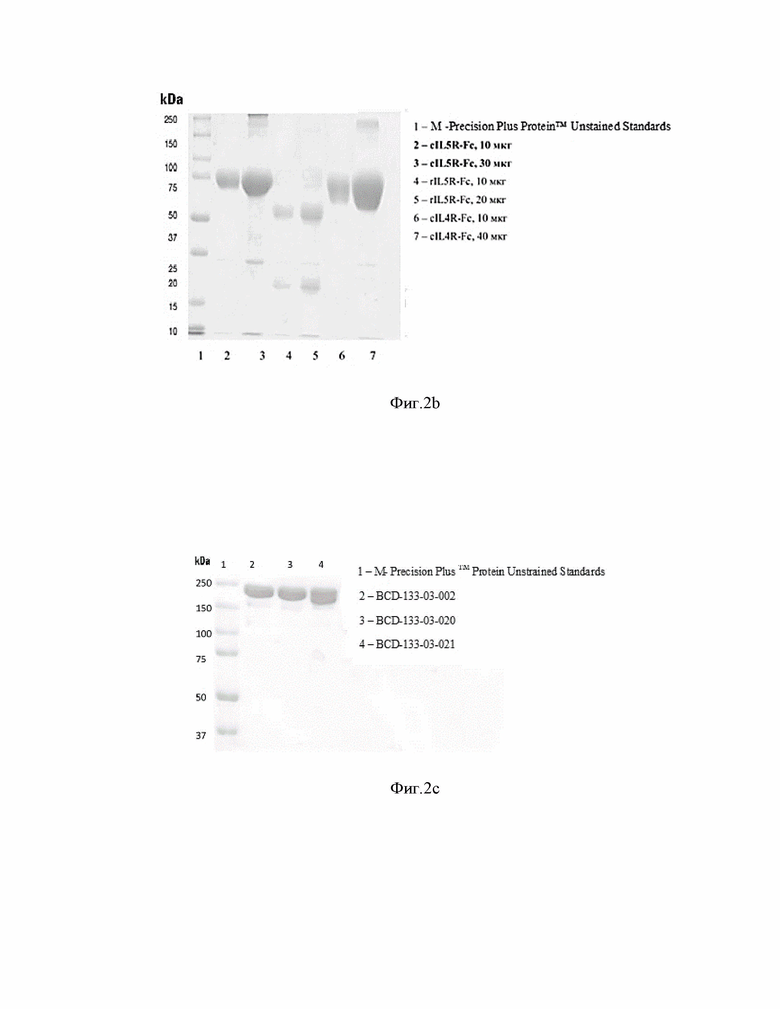
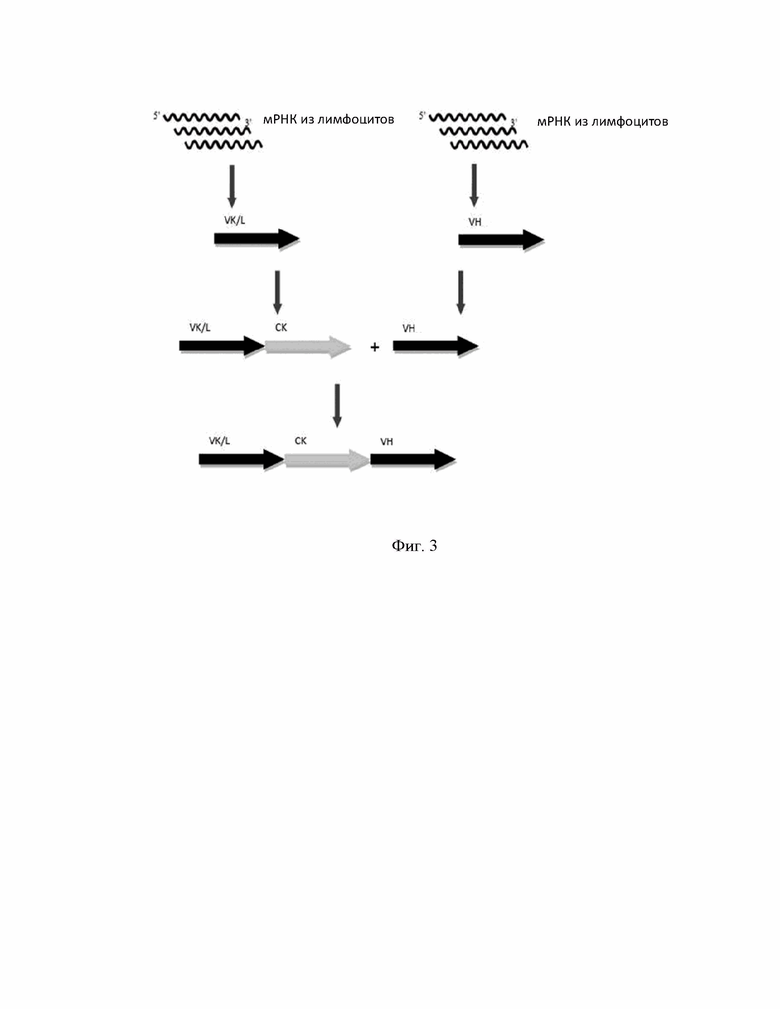
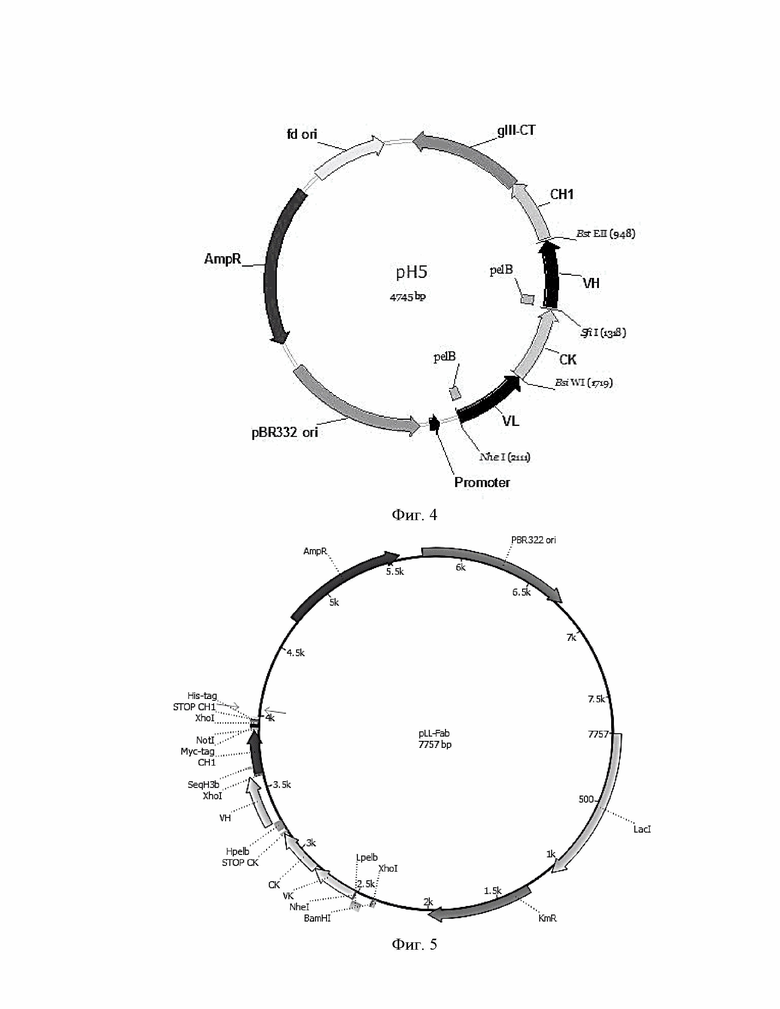
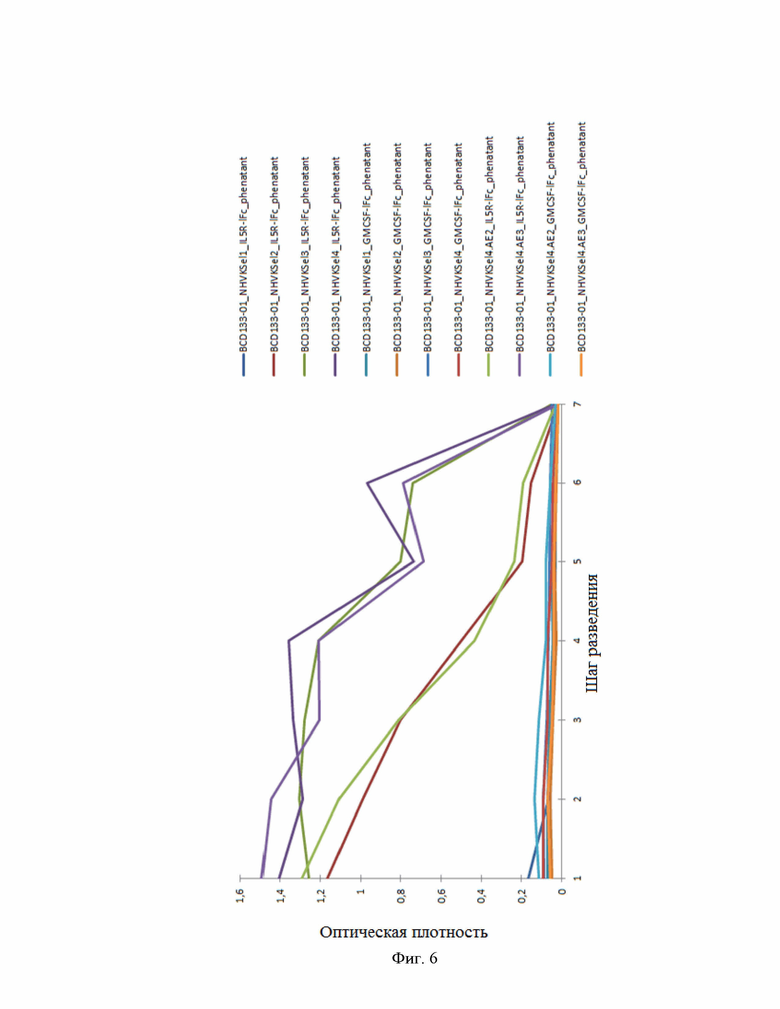
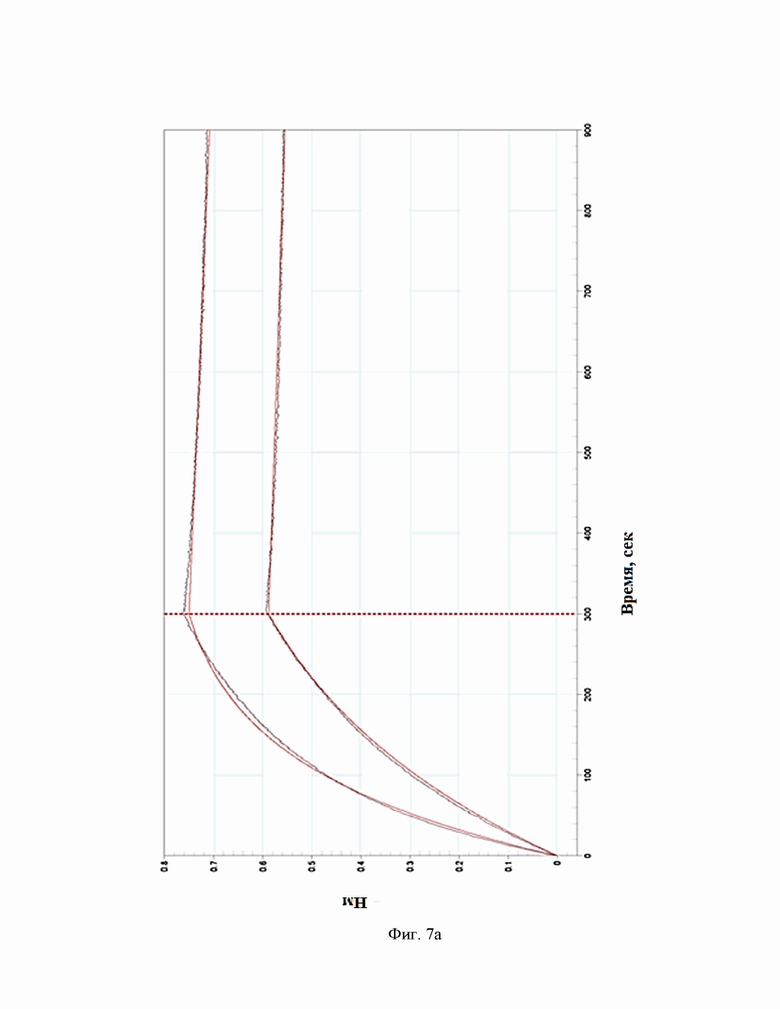
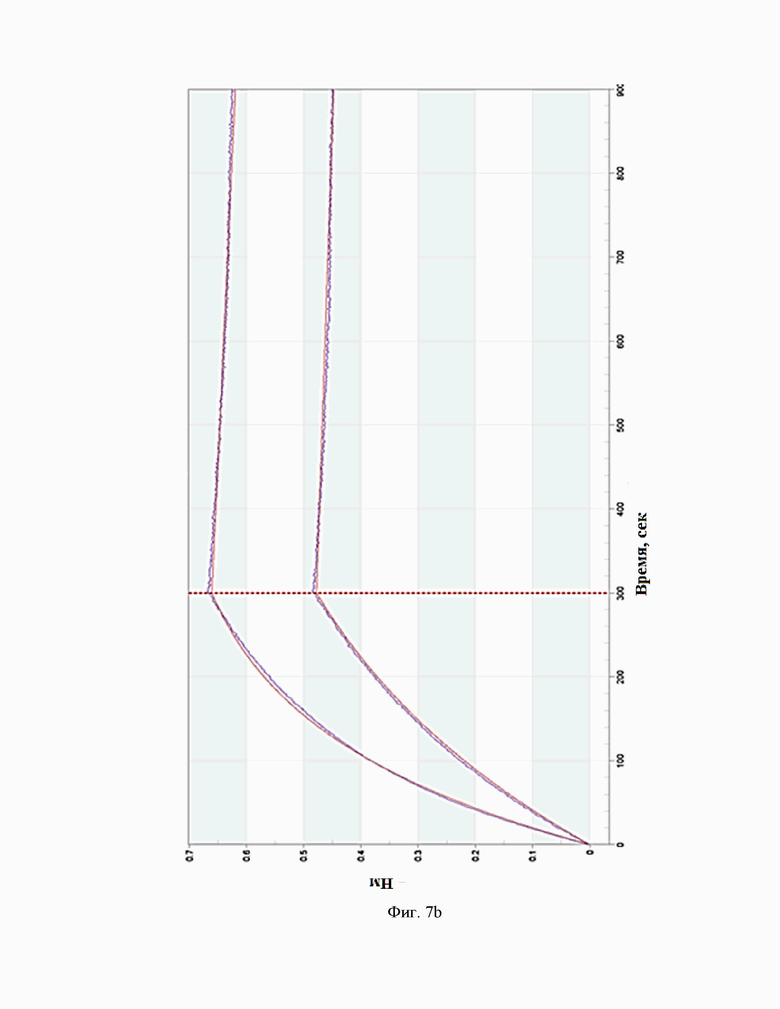
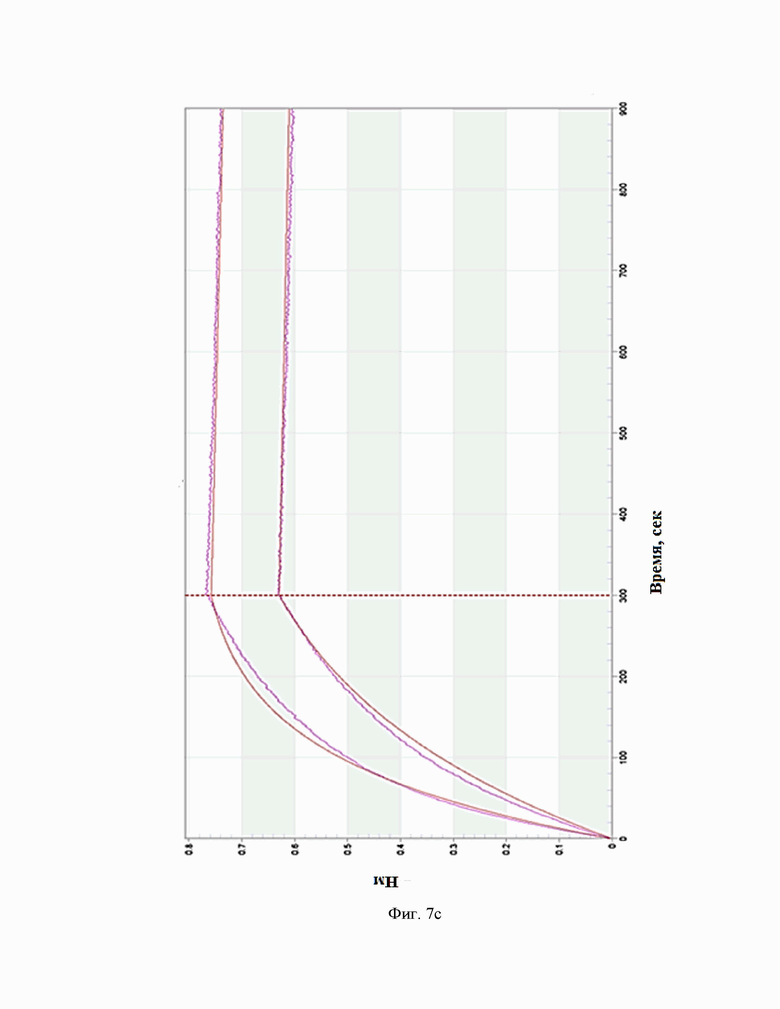
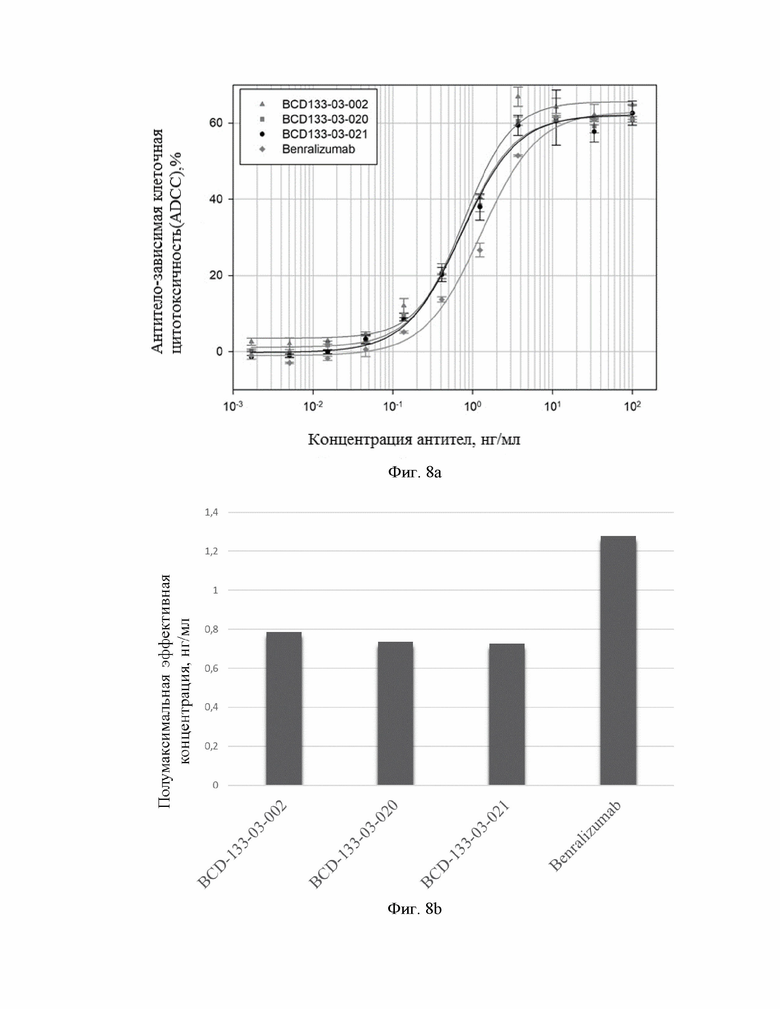
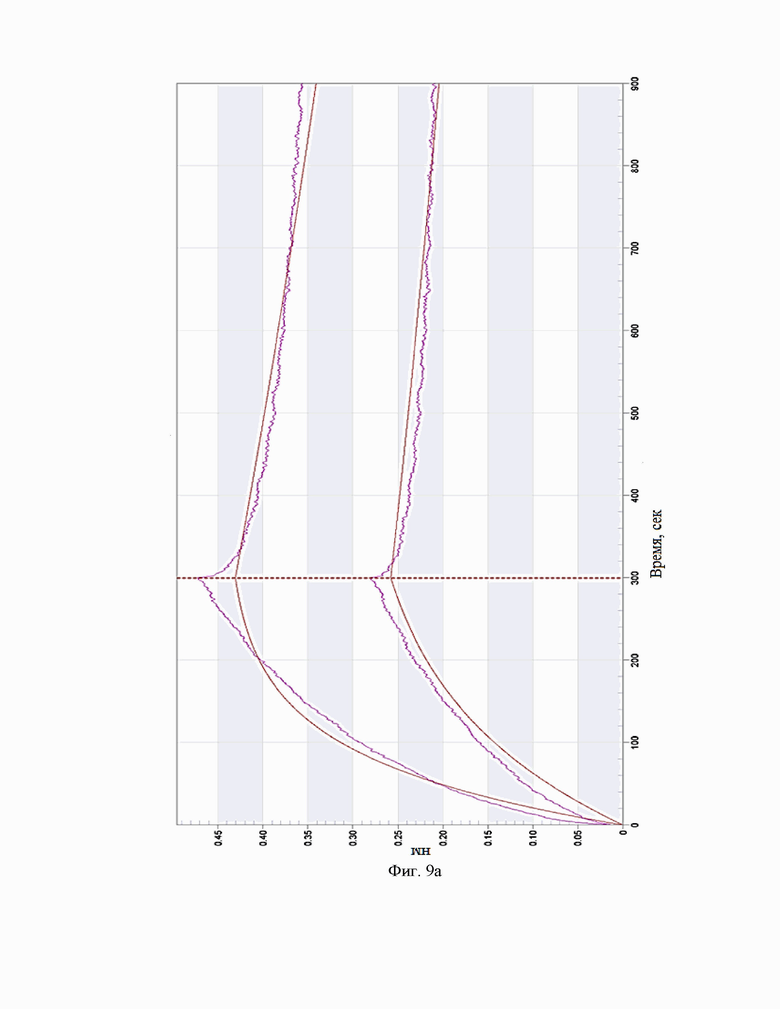
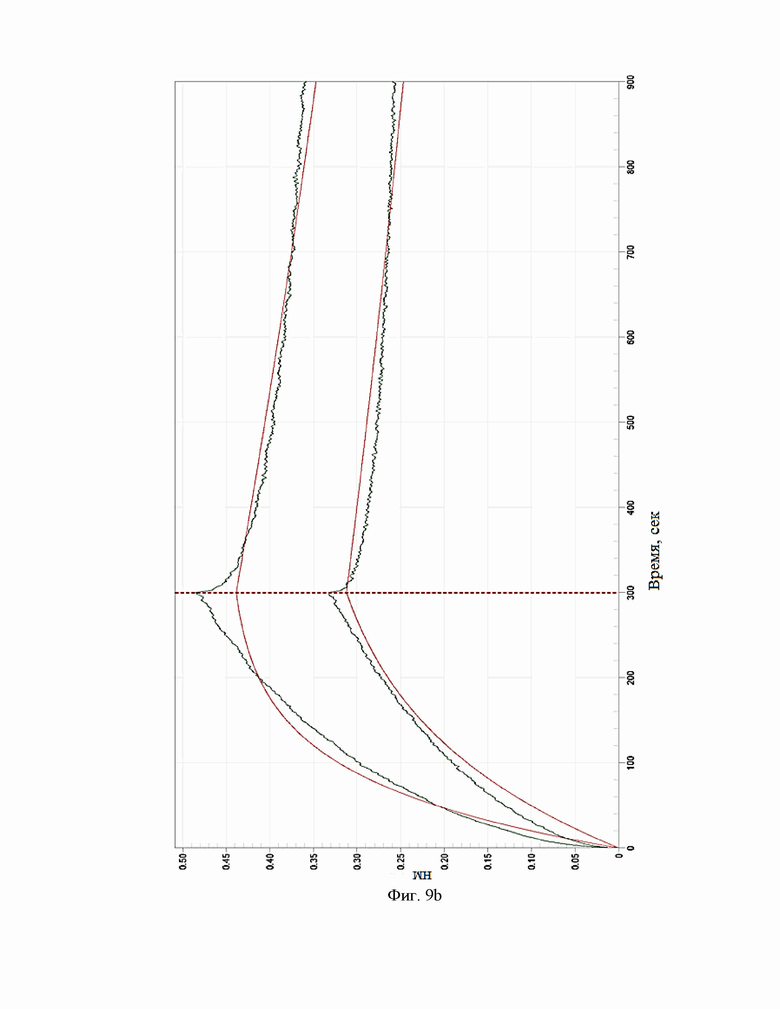
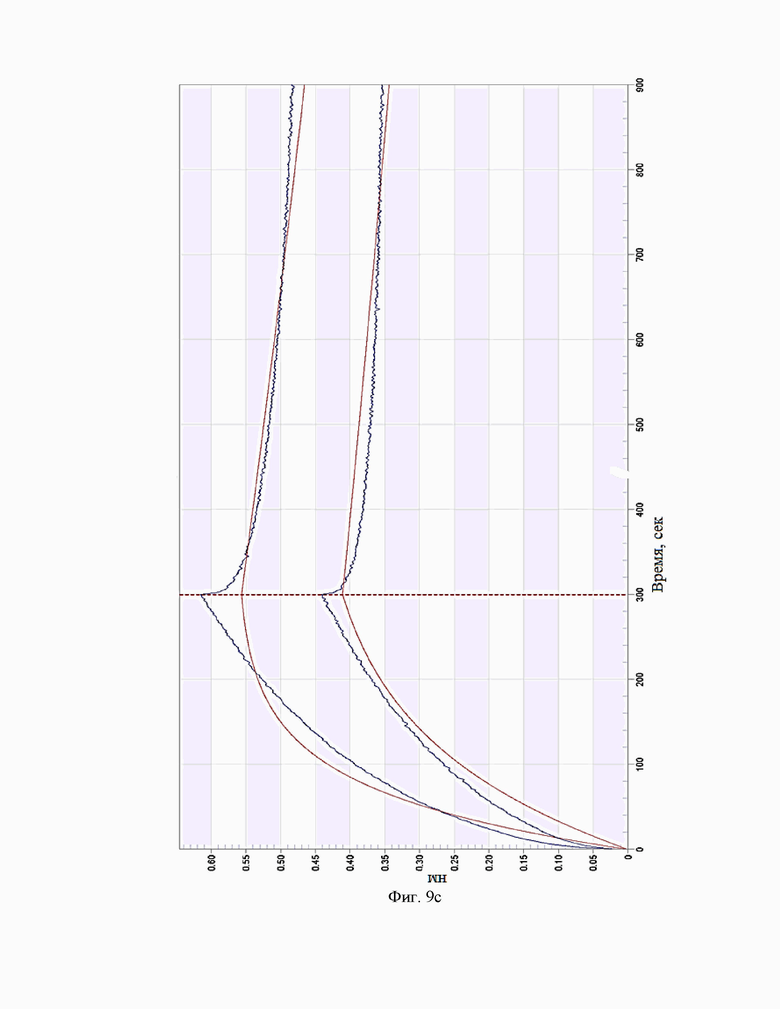
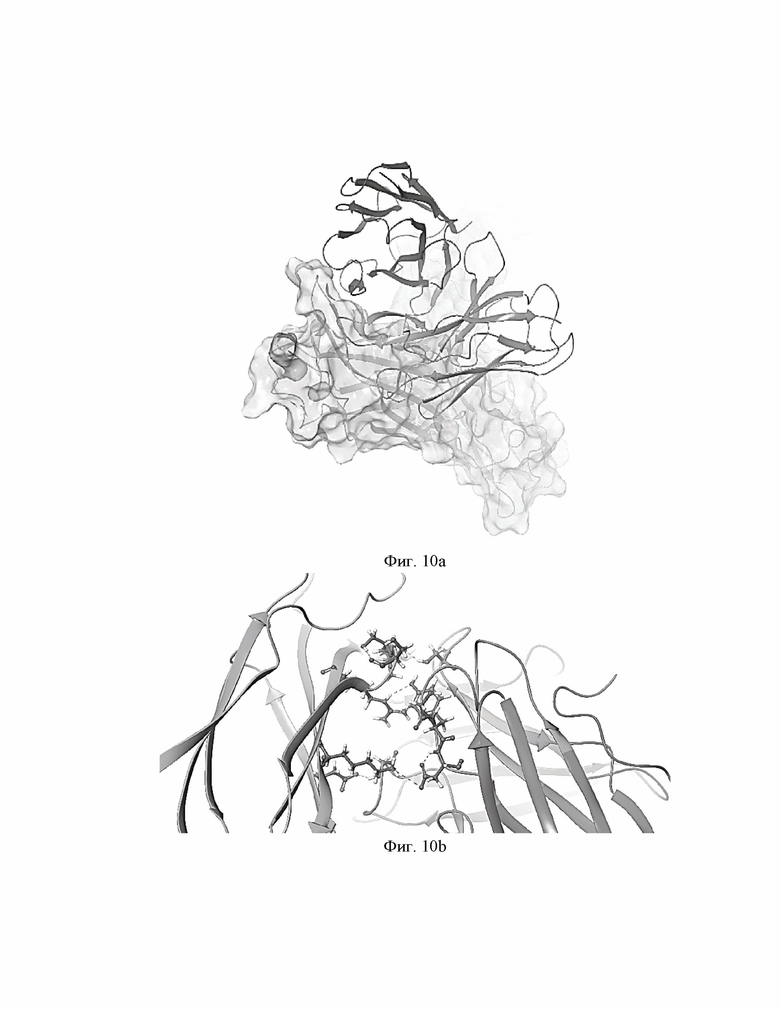
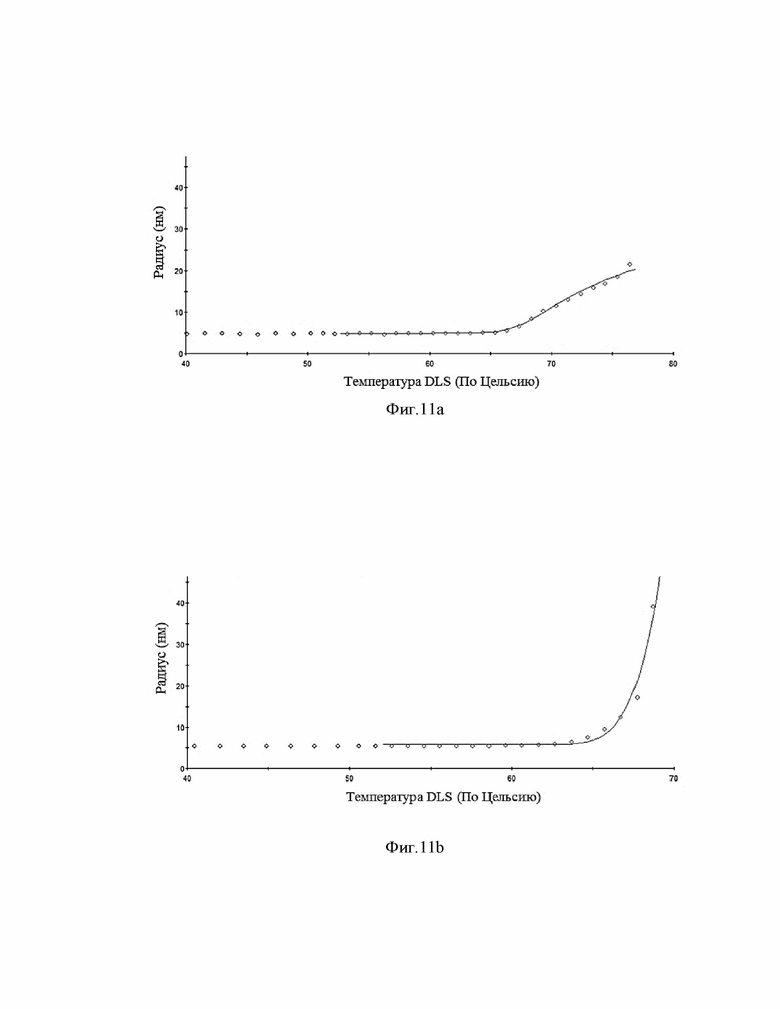
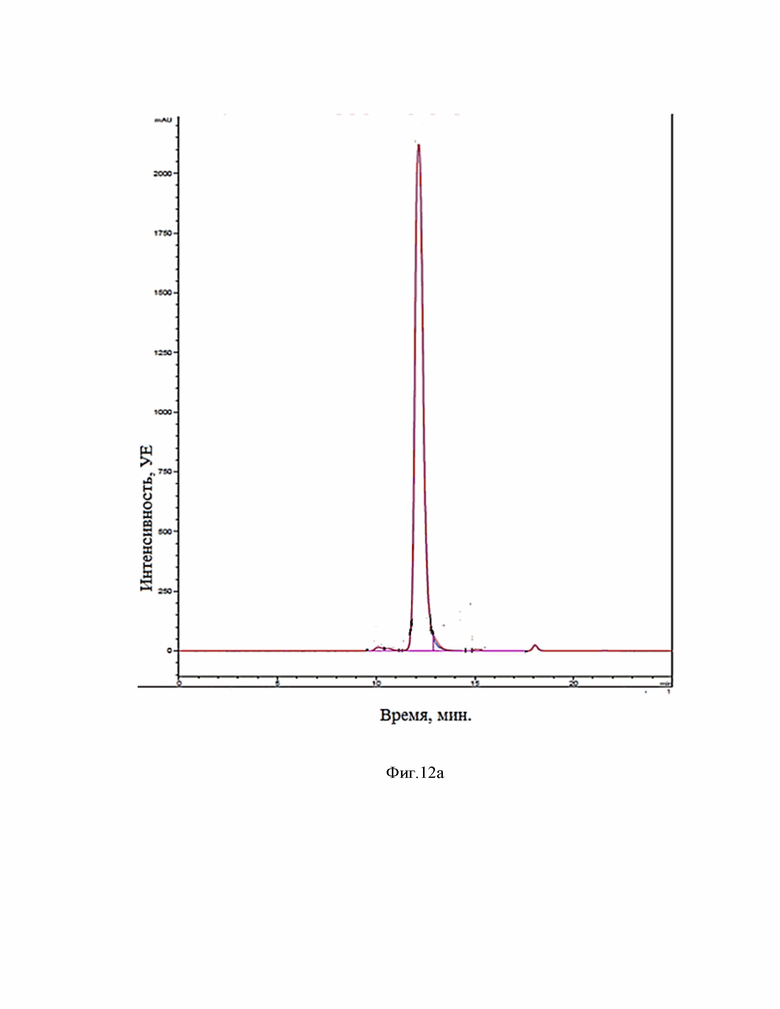
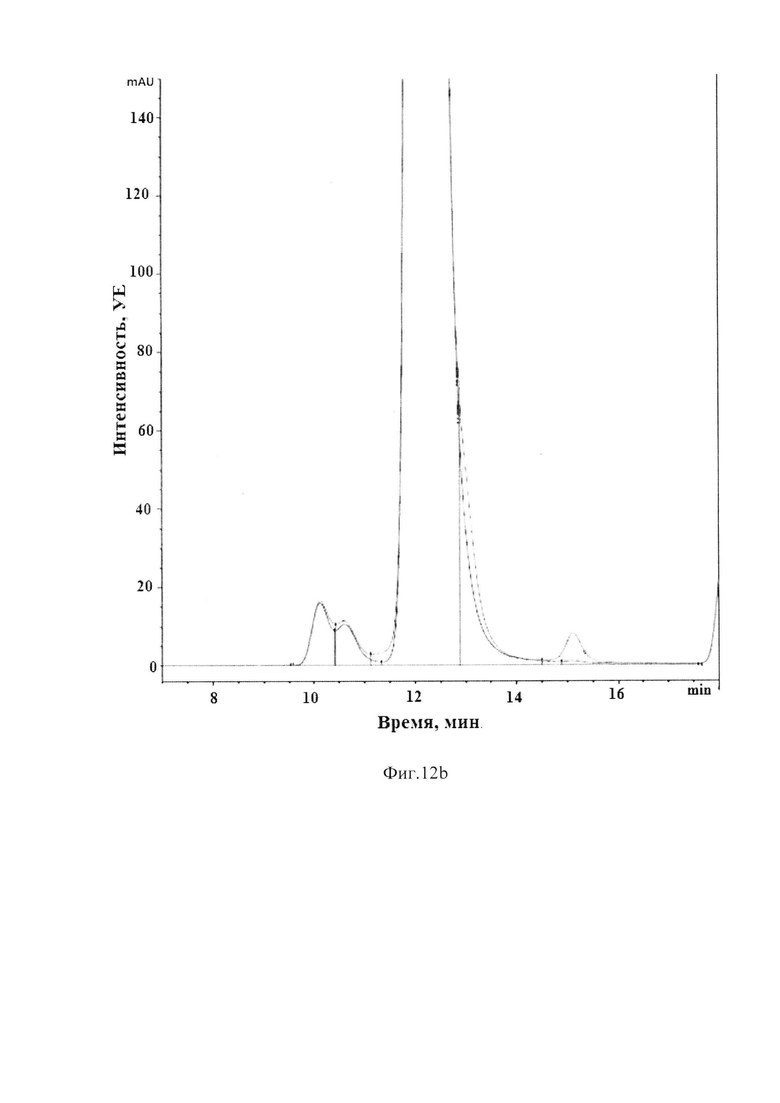
Изобретение относится к области биотехнологии и представляет собой антитела, которые специфично связываются с IL-5Rα. Изобретение также относится к ДНК, кодирующей указанные антитела, соответствующим экспрессионным векторам и способам продукции, а также к способам лечения с использованием указанных антител. 11 н. и 26 з.п. ф-лы, 12 ил., 5 табл., 20 пр.
1. Моноклональное антитело или его антигенсвязывающий фрагмент, которое специфично связывается с IL-5Rα, включающее:
1) вариабельный домен тяжелой цепи, содержащий
CDR1 с аминокислотной последовательностью, выбранной из группы: NYAMS (SEQ ID NO: 1), GFTFSNY, GFTFQNY;
CDR2 с аминокислотной последовательностью, выбранной из группы: AINSGGKSTNYADSVKG (SEQ ID NO: 2), AINSGGKSTNYADSVKG (SEQ ID NO: 2) с 1 аминокислотной заменой, AINSGGKSTNYADSVKG (SEQ ID NO: 2) с 2 аминокислотными заменами;
CDR3 с аминокислотной последовательностью, выбранной из группы: DYATNYGVPYFGS (SEQ ID NO: 3), DYATNYGVPYFGS (SEQ ID NO: 3) с 1 аминокислотной заменой, DYATNYGVPYFGS (SEQ ID NO: 3) с 2 аминокислотными заменами, DYATNYGVPYFGS (SEQ ID NO: 3) с 3 аминокислотными заменами;
2) вариабельный домен легкой цепи, содержащий
CDR1 с аминокислотной последовательностью, выбранной из группы: SGSRSNIGSGYDVH (SEQ ID NO: 6), SGSRSNIGSGYDVH (SEQ ID NO: 6) с 1 аминокислотной заменой, SGSRSNIGSGYDVH (SEQ ID NO: 6) с 2 аминокислотными заменами, SGSRSNIGSGYDVH (SEQ ID NO: 6) с 3 аминокислотными заменами;
CDR2 с аминокислотной последовательностью, выбранной из группы: DDNNRPS (SEQ ID NO: 7), DDNNRPS (SEQ ID NO: 7) с 1 аминокислотной заменой;
CDR3 с аминокислотной последовательностью, выбранной из группы: QSYDSSLSGHVV (SEQ ID NO: 8), QSYDSSLSGHVV (SEQ ID NO: 8) с 1 аминокислотной заменой, QSYDSSLSGHVV (SEQ ID NO: 8) с 2 аминокислотными заменами.
2. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где вариабельный домен тяжелой цепи содержит CDR1 с аминокислотной последовательностью NYAMS (SEQ ID NO: 1).
3. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где вариабельный домен тяжелой цепи содержит CDR2 с аминокислотной последовательностью AINSGGKSTNYADSVKG (SEQ ID NO: 2).
4. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где вариабельный домен тяжелой цепи содержит CDR3 с аминокислотной последовательностью DYATNYGVPYFGS (SEQ ID NO: 3).
5. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где вариабельный домен тяжелой цепи содержит CDR1, CDR2 и CDR3 с аминокислотными последовательностями, соответственно представленными последовательностями SEQ ID NO: 1, 2 и 3.
6. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где вариабельный домен легкой цепи содержит CDR1 с аминокислотной последовательностью SGSRSNIGSGYDVH (SEQ ID NO: 6).
7. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где вариабельный домен легкой цепи содержит CDR2 с аминокислотной последовательностью DDNNRPS (SEQ ID NO: 7).
8. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где вариабельный домен легкой цепи содержит CDR3 с аминокислотной последовательностью QSYDSSLSGHVV (SEQ ID NO: 8).
9. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где вариабельный домен легкой цепи содержит CDR1, CDR2 и CDR3 с аминокислотными последовательностями, соответственно представленными последовательностями SEQ ID NO: 6, 7 и 8.
10. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где
1) вариабельный домен тяжелой цепи содержит аминокислотные последовательности SEQ ID NO: 1, 2 и 3;
2) вариабельный домен легкой цепи содержит аминокислотные последовательности SEQ ID NO: 6, 7 и 8.
11. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где вариабельный домен тяжелой цепи содержит аминокислотную последовательность, по меньшей мере на 90% гомологичную аминокислотной последовательности, выбранной из группы SEQ ID NO: 4-5.
12. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 11, где вариабельный домен тяжелой цепи содержит аминокислотную последовательность, выбранную из группы SEQ ID NO: 4-5.
13. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где вариабельный домен легкой цепи содержит аминокислотную последовательность, по меньшей мере на 90% гомологичную аминокислотной последовательности, выбранной из группы SEQ ID NO: 9-10.
14. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 13, где вариабельный домен легкой цепи содержит аминокислотную последовательность, выбранную из группы SEQ ID NO: 9-10.
15. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, где
1) вариабельный домен тяжелой цепи содержит аминокислотную последовательность, выбранную из группы SEQ ID NO: 4-5;
2) вариабельный домен легкой цепи содержит аминокислотную последовательность, выбранную из группы SEQ ID NO: 9-10.
16. Моноклональное антитело по п. 1, включающее:
1) тяжелую цепь, содержащую аминокислотную последовательность, по меньшей мере на 90% гомологичную последовательности, выбранной из группы SEQ ID NO: 11-12;
2) легкую цепь, содержащую аминокислотную последовательность, по меньшей мере на 90% гомологичную последовательности, выбранной из группы SEQ ID NO: 13-14.
17. Моноклональное антитело по п. 16, включающее:
1) тяжелую цепь, содержащую аминокислотную последовательность, выбранную из группы SEQ ID NO: 11-12;
2) легкую цепь, содержащую аминокислотную последовательность, выбранную из группы SEQ ID NO: 13-14.
18. Моноклональное антитело по п. 1, где антитело, специфичное к IL-5Rα, представляет собой полноразмерное антитело IgG.
19. Моноклональное антитело по п. 18, где полноразмерное антитело IgG относится к изотипу IgG1, IgG2, IgG3 или IgG4 человека.
20. Моноклональное антитело по п. 19, где полноразмерное антитело IgG относится к изотипу IgG1 человека.
21. Нуклеиновая кислота, которая кодирует антитело или его антигенсвязывающий фрагмент по любому из пп. 1-20.
22. Нуклеиновая кислота по п. 21, где нуклеиновая кислота представляет собой ДНК.
23. Нуклеиновая кислота по п. 21, содержащая:
а) нуклеотидную последовательность, кодирующую тяжелую цепь антитела по п. 1 и по меньшей мере на 90% гомологичную последовательности, выбранной из группы SEQ ID NO: 15-16, и/или нуклеотидную последовательность, кодирующую легкую цепь антитела по п. 1, по меньшей мере на 90% гомологичную последовательности, выбранной из группы SEQ ID NO: 17-18; или
б) нуклеотидную последовательность, выбранную из группы SEQ ID NO: 15-16, кодирующую тяжелую цепь антитела по п. 1, и/или нуклеотидную последовательность, выбранную из группы SEQ ID NO: 17-18, кодирующую легкую цепь антитела по п. 1.
24. Экспрессионный вектор, содержащий нуклеиновую кислоту по любому из пп. 21-23.
25. Способ получения клетки-хозяина для получения антитела или его антигенсвязывающего фрагмента по любому из пп. 1-20, включающий трансформирование клетки вектором по п. 24.
26. Клетка-хозяин для получения антитела или его антигенсвязывающего фрагмента по любому из пп. 1-20, содержащая нуклеиновую кислоту по любому из пп. 21-23.
27. Способ получения антитела или его антигенсвязывающего фрагмента по любому из пп. 1-20, заключающийся в культивировании клетки-хозяина по п. 26 в культуральной среде в условиях, достаточных для получения указанного антитела, при необходимости, с последующим выделением и очисткой полученного антитела.
28. Фармацевтическая композиция для профилактики или лечения заболевания или нарушения, опосредуемого IL-5Rα, содержащая антитело или его антигенсвязывающий фрагмент по любому из пп. 1-20 в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
29. Фармацевтическая композиция по п. 28, предназначенная для профилактики или лечения заболевания или нарушения, опосредуемого IL-5Rα, выбранного из группы: астмы, например эозинофильной бронхиальной астмы (АБА), например эозинофильной бронхиальной астмы (АБА) тяжелого течения; ХОБЛ (хронической обструктивной болезни легких); синдрома Чердж-Стросса; эозинофильного эзофагита; эозинофильного гастроэнтерита.
30. Фармацевтическая комбинация для профилактики или лечения заболевания или нарушения, опосредуемого IL-5Rα, содержащая антитело или его антигенсвязывающий фрагмент по любому из пп. 1-20 и по меньшей мере одно другое терапевтически активное соединение.
31. Фармацевтическая комбинация по п. 30, предназначенная для профилактики или лечения заболевания или нарушения, опосредуемого IL-5Rα, выбранного из группы: астмы, например эозинофильной бронхиальной астмы (АБА), например эозинофильной бронхиальной астмы (АБА) тяжелого течения; ХОБЛ (хронической обструктивной болезни легких); синдрома Чердж-Стросса; эозинофильного эзофагита; эозинофильного гастроэнтерита.
32. Фармацевтическая комбинация по пп. 30, 31, где другое терапевтически активное соединение выбирают из малой молекулы, антитела или стероидных гормонов, например кортикостероидов.
33. Способ ингибирования биологической активности IL-5Rα у субъекта, нуждающегося в таком ингибировании, включающий введение субъекту эффективного количества антитела или его антигенсвязывающего фрагмента по любому из пп. 1-20.
34. Способ лечения заболевания или нарушения, опосредуемого IL-5Rα, включающий введение субъекту антитела или его антигенсвязывающего фрагмента по любому из пп. 1-20 или фармацевтической композиции по п. 28, нуждающемуся в таком лечении, в терапевтически эффективном количестве.
35. Способ лечения заболевания или нарушения по п. 34, где заболевание или нарушение выбрано из группы: астма, например эозинофильная бронхиальная астма (АБА), например эозинофильная бронхиальная астма (АБА) тяжелого течения; ХОБЛ (хроническая обструктивная болезнь легких); синдром Чердж-Стросса; эозинофильный эзофагит; эозинофильный гастроэнтерит или гиперэозинофильный синдром.
36. Применение антитела или его антигенсвязывающего фрагмента по любому из пп. 1-20 или фармацевтической композиции по п. 28 для лечения у субъекта, нуждающегося в таком лечении, заболевания или нарушения, опосредуемого IL-5Rα.
37. Применение по п. 36, где заболевание или нарушение выбрано из группы: астма, например эозинофильная бронхиальная астма (АБА), например эозинофильная бронхиальная астма (АБА) тяжелого течения; ХОБЛ (хроническая обструктивная болезнь легких); синдром Чердж-Стросса; эозинофильный эзофагит; эозинофильный гастроэнтерит.
| МОДУЛЯЦИЯ IL-2- И IL-15-ОПОСРЕДОВАННЫХ Т-КЛЕТОЧНЫХ ОТВЕТОВ | 2001 |
|
RU2280255C2 |
| US 20050226867 A1, 13.10.2005 | |||
| WO 2015058861 A1, 30.04.2015. | |||
Авторы
Даты
2019-08-21—Публикация
2017-10-03—Подача