Изобретение относится к медицине, а именно к биотехнологии, и может быть использовано для получения ассоциатов гемопоэтических и стромальных клеток-предшественников, в которых мультипотентные мезенхимальные стромальные клетки (МСК) сохраняют иммуносупрессивную активность.
В настоящее время МСК из различных тканевых источников рассматриваются как перспективный материал для клеточной терапии и регенеративной медицины (Bianco et al., 2013; Caplan, 2015). Это обусловлено их высокой функциональной активностью. МСК принимают участие в физиологическом и репаративном ремоделировании, а также в формировании различных тканевых ниш, в первую очередь - гемопоэтической (Kumar et al., 2017). Гемопоэз-поддерживающая активность МСК оказалась востребованной в протоколах ex vivo экспансии гемопоэтических стволовых и прогениторных клеток (ГСПК) из пуповинной крови для преодоления проблемы недостаточности ГСПК в одном образце. В отличие от суспензионных монокультур ГСПК, где в подавляющем числе случаев для экспансии используются гемопоэтические клетки после селекции, чаще всего по CD34 антигену, в сокультуре проводят экспансию как исходных ядросодержащих клеток ПК, так и отдельных фракций. При этом некоторые протоколы состоят из последовательных стадий, включающих разные варианты сокультивирования. Так, например, в работе Robinson et al., (2006) сначала ядросодержащие клетки пуповинной крови сокультивировали с МСК в течение 7 суток, затем суспензионную фракцию отбирали и культивировали в суспензии с добавлением гепопоэтических цитокинов, а прикрепленные ГСПК амплифицировали еще 7 дней. Затем вновь наросшие флотирующие ГСПК добавляли к отобранной ранее суспензии. Такой протокол позволил получить популяцию ГСПК, существенно обогащенную как недифференцированными (CD34+), так и коммитированными (КОЕ) гемопоэтическими предшественниками. Клеточные продукты, подготовленные описанным способом, уже прошли ограниченные клинические испытания (De Lima et al., 2012).
Однако возможности сокультуры гемопоэтических и стромальных предшественников как источника разнообразных клеточных продуктов еще не полностью использованы. В качестве достигнутого результата обычно учитывается количество суспензионных гемопоэтических предшественников или их производных, образующих гемопоэтические колонии в полужидких средах, или способных длительно поддерживать кроветворение in vivo (Flores-Guzman et al., 2009). При этом ГСПК, ассоциированные со стромальным подслоем, обычно не анализируются. Однако, как хорошо известно, взаимодействие ГСПК с клетками стромы, в частности с МСК, сопровождается распределением гемопоэтических предшественников в различные, относительно стромального слоя, компартменты. Гемопоэтические предшественники могут присутствовать в суспензии в неприкрепленном состоянии, быть прикрепленными к поверхности МСК или находиться в пространстве под слоем МСК, что было продемонстрировано еще в работах Dexter et al. (1977). ГСПК под монослоем МСК являются менее зрелыми и обладают меньшей пролиферативной активностью, тогда как гемопоэтические предшественники, адгезированные к поверхности МСК, активно делятся. Гемопоэтические клетки способны перемещаться из одного компартмента в другой. Через слой МСК преимущественно мигрируют гемопоэтические предшественники с фенотипом CD34+CD38- (Jing et al., 2010). Возможно, в пространстве под МСК создаются условия для поддержания гемопоэтических предшественников в незрелом состоянии, либо туда выборочно привлекаются незрелые предшественники (Wagner et al., 2007). Таким образом, в сокультуре ГСПК/МСК всегда существуют две фракции ГСПК: суспензионная, которая охарактеризована достаточно подробно, и гораздо менее исследованная популяция - строма-ассоциированные ГСПК, согласно некоторым данным представляющие наименее коммитированную часть гемопоэтических предшественников (Wagner et al., 2007; Jing et al., 2010).
В связи с тем, что МСК иммуноуклончивы, они используются для аллогенного введения в различных клинических протоколах (Miguel et al., 2012), в том числе и для улучшения приживления ГСПК при трансплантации. С этой точки зрения клеточные продукты, состоящие из МСК и связанных с ними ГСПК, представляют значительный интерес. Во-первых, нет необходимости разделять стромальные и гемопоэтические клетки перед трансплантацией. Во-вторых, может быть использована другая активность МСК, как например, продукция биологически активных медиаторов.
Поэтому задачей изобретения была разработка технологии, позволяющей получение ассоциатов, состоящих из гемопоэтических предшествеников пуповинной крови и МСК (МСК-ГСПК), в которых МСК сохраняют способность к подавлению активности аллогенных иммунных клеток.
Для получения ассоциатов МСК-ГСПК осуществляли следующие этапы:
- МСК выделяли из стромально-васкулярной фракции жировой ткани (жтМСК) и постоянно культивировали при концентрации О2 в среде 5%,
- проводили подготовку стромального подслоя, обрабатывая жтМСК митомицином С для остановки клеточных делений,
- добавляли мононуклеарную фракцию пуповинной крови (МНК ПК) к монослою жтМСК, обработанных митомицином С, и совместно культивировали 72 часа,
- осуществляли селекцию из МНК ПК гемопоэтических предшественников за счет адгезии к жтМСК,
- культивировали жтМСК с прикрепившимися к ним МНК ПК в течение 72 часов с образованием строма-ассоциированной популяции ГСПК (жтМСК-ГСПК).
Для анализа иммуносупрессивной активности жтМСК в ассоциатах осуществляли следующие этапы:
- сокультивирование ассоциатов жтМСК-ГСПК с аллогенными митоген-стимулированными Т-клетками периферической крови (Т-клетки) в течение 72 часов,
- определение доли Т-клеток, экспрессирующих маркер поздней активации антиген гистосовместимости класса II (HLA-DR),
- определение доли пролиферирующих Т-клеток.
Техническим результатом предлагаемого способа является получение ассоциатов ГСПК и жтМСК, в которых:
- популяция ГСПК более чем на 80% представлена клетками-предшественниками с фенотипом CD34+/CD133+, ассоциированными со стромальным подслоем из жтМСК и образующими области булыжника (КООБ).
- жтМСК в составе ассоциатов способны также эффективно, как и жтМСК в монокультуре, подавлять активацию и пролиферацию аллогенных лимфоцитов, что может быть востребовано при использовании полученных ассоциатов в качестве гемопоэтических трансплантатов.
Краткое описание чертежей
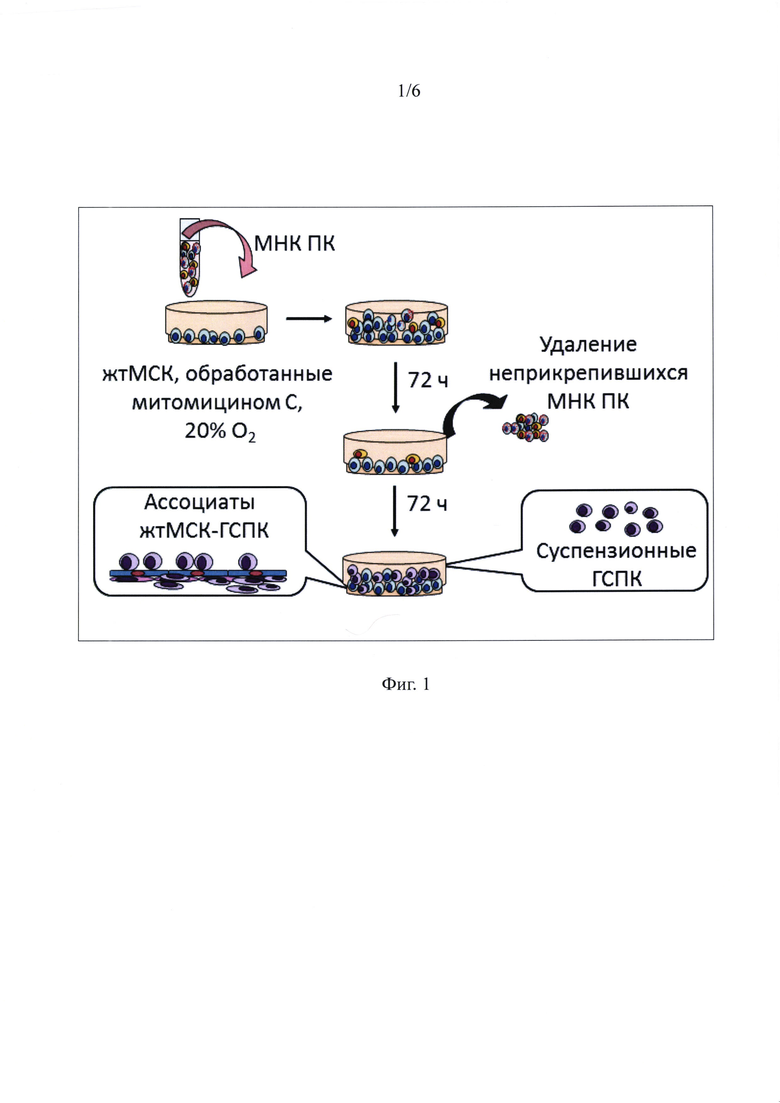
Фиг. 1 - Схема получения ГСПК после сокультивирования МНК ПК с митомицин С-обработанными жтМСК.
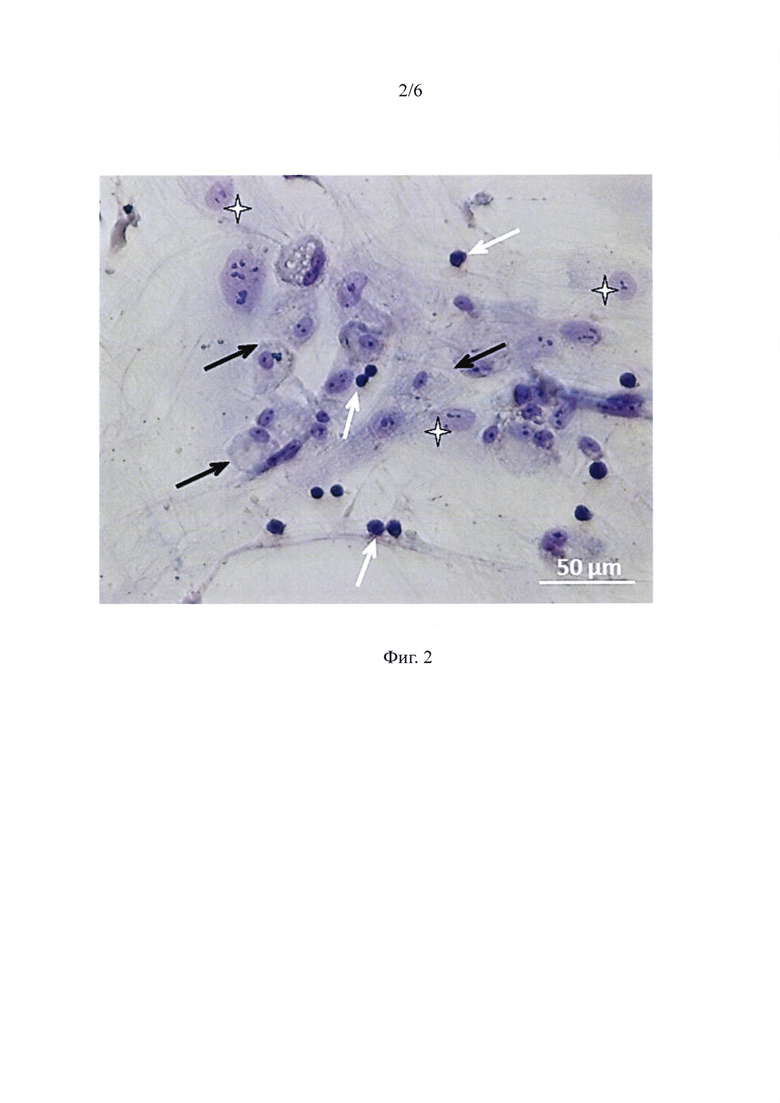
Фиг. 2 - Ассоциаты жтМСК-ГСПК после 144 часов ex vivo экспансии. жтМСК-ассоциированные ГСПК на поверхности митомицин С-обработанных жтМСК и под стромальным подслоем - КООБ.
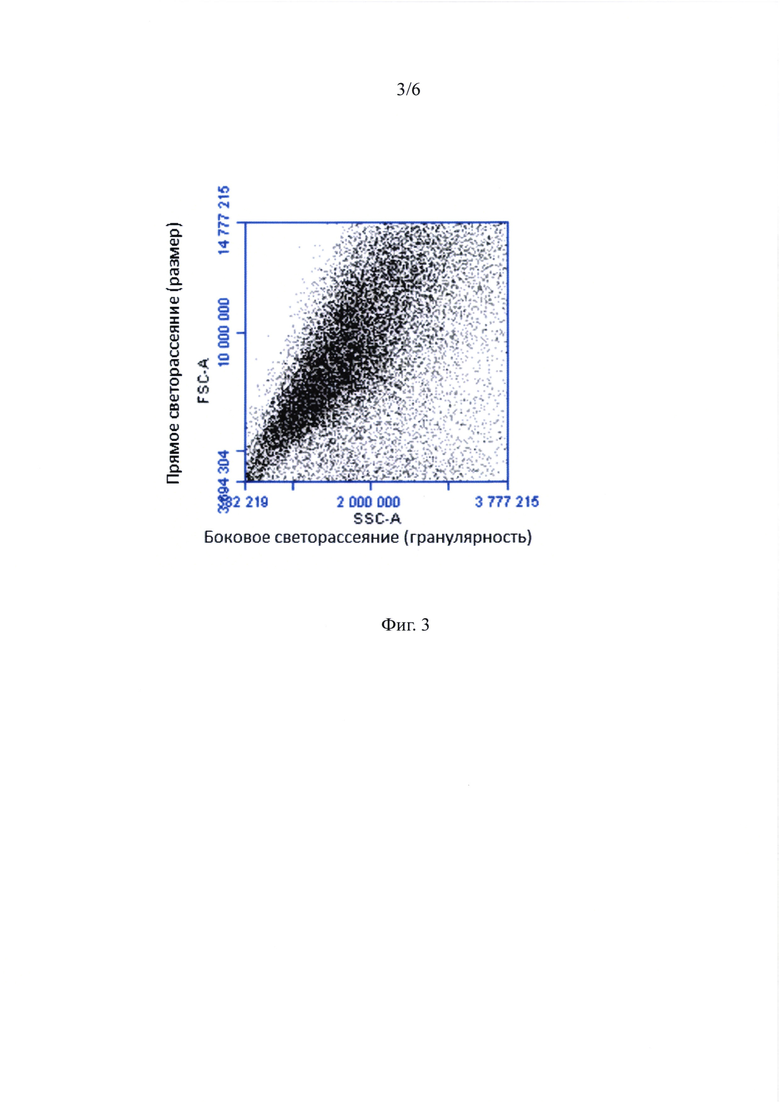
Фиг. 3 - ГСПК и жтМСК, составляющие ассоциаты, при анализе на проточном цитофлуориметре - распределение по размеру и гранулярности.
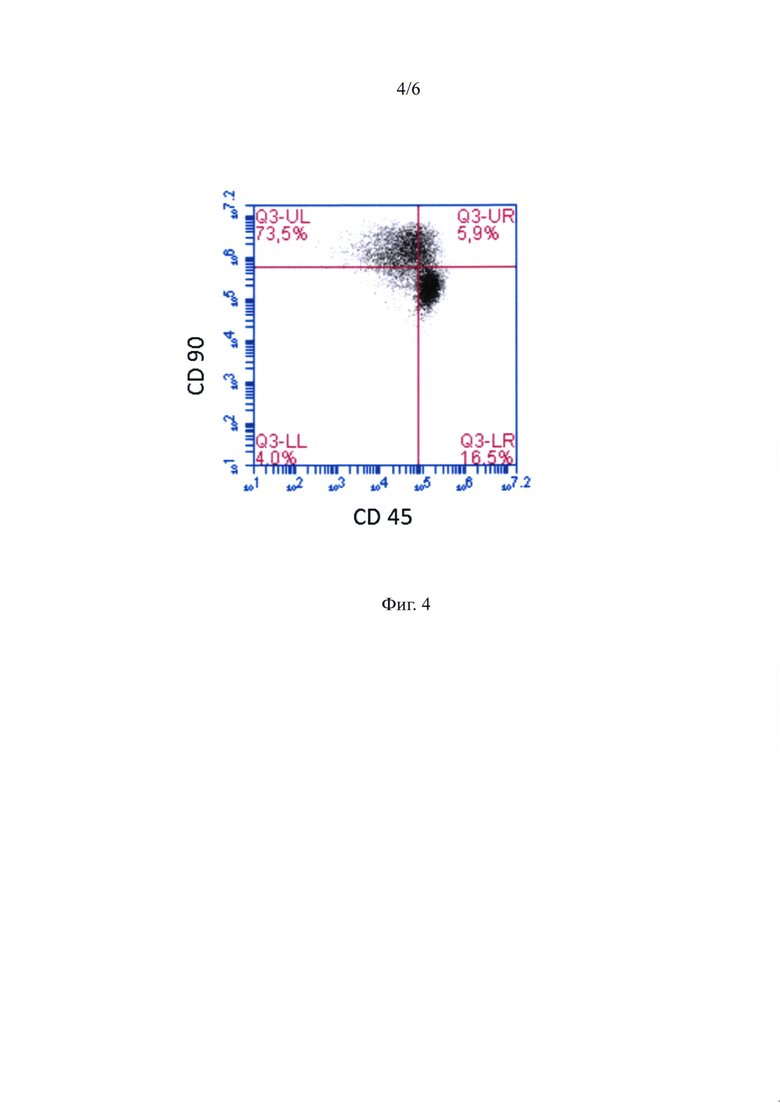
Фиг. 4 - ГСПК и жтМСК, составляющие ассоциаты, при анализе на проточном цитофлуориметре - иммунофенотипирование по экспрессии антигенов CD45 и CD90.
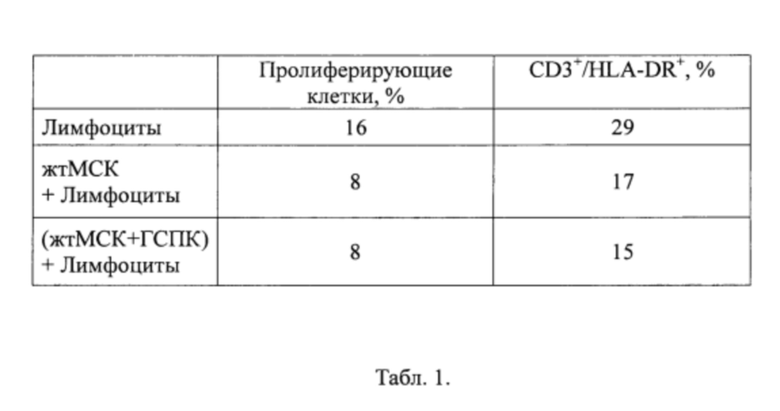
Табл. 1 - Доля фитогемагглютин-стимулированных аллогенных лимфоцитов, экспрессирующих антиген главного комплекса гистосовместимости класса II (HLA-DR), и пролиферативный индекс в присутствии жтМСК и ассоциатов жтМСК-ГСПК.
Результаты представлены как кратность отличий экспрессии генов в жтМСК из ассоциатов против жтМСК в монокультуре. Данные трех независимых экспериментов.
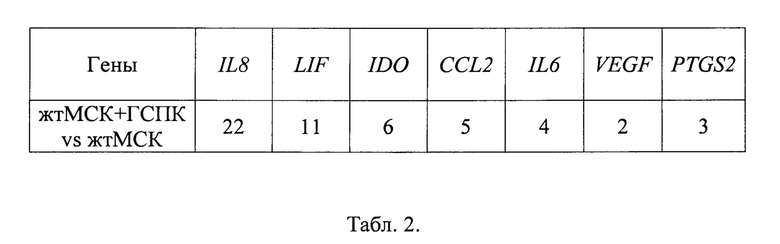
Табл. 2 - Дифференциальная экспрессия генов, кодирующих иммуносупрессивные молекулы в жтМСК (жтМСК из ассоциатов против жтМСК).
Результаты представлены как кратность отличий экспрессии генов в жтМСК из ассоциатов против жтМСК в монокультуре. Данные трех независимых экспериментов.
IL8 - интерлейкин 8; LIF - фактор, ингибирующий лейкемию; IDO -индоламин-2,3-диокси-геназа; CCL2 (МСР-1) - моноцитарный хемоаттрактантный протеин-1; IL6 - интерлейкин 6; VEGF - фактор роста эндотелия сосудов; PTGS2 - простагландин-эндопероксид-синтаза-2.
Подробное описание изобретения.
Выделение мононуклеарной фракции пуповинной крови (МНК ПК).
Заготовку ПК проводили с письменного информированного согласия обследованных здоровых рожениц в отделениях Научного центра акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова. Кровь собирали в мешки донорской системы с антикоагулянтом ЦФДА-1 и обрабатывали в течение 24 часов. Получение «концентрата ядросодержащих клеток» проводили методом двойного центрифугирования в соответствии с зарегистрированной медицинской технологией (ФС2009/387 от 23.11.2009 г.). После седиментации эритроцитов и удаления избытка плазмы фракцию ядросодержащих клеток ПК ресуспендировали в аутологичной плазме с добавлением 10% диметилсульфоксида (Sigma, США) и 1% Декстрана-40, расфасовывали в криопробирки и подвергали программному замораживанию до конечной температуры -90°С в соответствии со Стандартными операционными процедурами Банка стволовых клеток. В день эксперимента клетки размораживали на водяной бане при +37°С и отмывали от криопротектора в избытке среды культивирования (см. ниже). После оценки жизнеспособности в тесте с трипановым синим концентрацию клеток доводили до 1.5-2.5×106 клеток/мл и использовали в течение 30 минут.
Выделение и культивирование жтМСК
Для получения МСК использовали стромально-васкулярную фракцию жировой ткани человека. Клетки выделяли по стандартной методике и культивировали жтМСК постоянно при 5% O2 в мультигазовом инкубаторе (Sanyo, Япония) в среде α-МЕМ (Gibco, США) с добавлением 10% инактивированной фетальной бычьей сыворотки (Hyclone, США), 100 ед./мл пенициллина и 100 мкг/мл стрептомицина (Биолот, Россия). По достижении 70-80% конфлуентности клетки пересевали. Для экспериментов использовали МСК 2-4 пассажей (Буравкова и др., 2009).
Подготовка стромального подслоя для получения жтМСК-ГСПК ассоциатов
К жтМСК, достигшим 70-80% конфлуентного монослоя, добавляли митомицин С (1,5 мкг/мл) в ростовой среде на 18 часов. После этого клетки тщательно промывали изотоническим фосфатным буфером, открепляли от подложки с помощью раствора трипсина-ЭДТА и рассевали в чашки Петри диаметром 60 мм из расчета 8×103 клеток/см2 и помещали в CO2 инкубатор при 20% O2 (Sanyo, Япония). Плотность монослоя жтМСК после прикрепления и распластывания составляла 70-80%. Через 48 часов жтМСК использовали для сокультивирования с МНК ПК. Получение жтМСК-ассоциированных ГСПК
Схема получения ГСПК при сокультивирования МНК ПК с жтМСК показана на фигуре 1. Сокультивирование проводили в течение 144 часов. Сначала суспензию МНК ПК (10×106) в 5 мл среды добавляли к предмонослою обработанных митомицином С жтМСК в чашках Петри диаметром 60 мм и сокультивировали 72 часа. Затем неадгезированные клетки отбирали и проводили замену среды культивирования на свежую. Сокультивирование приводило к адгезии части МНК ПК. Эти клетки при дальнейшем культивировании еще в течение 72 часов давали начало новой популяции суспензионных ГСПК. При этом часть ГСПК оставались ассоциированными с жтМСК, формируя два компартмента - на поверхности и под монослоем жтМСК. По окончании сокультивирования вновь образованную суспензию ГСПК удаляли, а оставшийся комплекс жтМСК-ГСПК трипсинизировали и готовили пробы для характеристики иммунофенотипа, определения жизнеспособности и иммуносупрессивной активности с помощью проточной цитофлуориметрии.
Иммунофенотипический анализ
Фенотипирование проводили методом проточной цитофлуориметрии с использованием соответствующих антител, конъюгированных с красителями FITC, РЕ либо АРС: для жтМСК - CD73, CD90, CD 105 (IO Test, Beckman Coulter, США); для ГСПК - CD45, CD34 (BD Biosciences, США); для Т-клеток - CD3, HLA-DR (IO Test, Beckman Coulter). Для подготовки проб жтМСК или ассоциаты жтМСК-ГСПК открепляли от подложки с помощью раствора трипсина-ЭДТА. Суспензии Т-клеток, трипсинизированных жтМСК или ассоциатов жтМСК-ГСПК окрашивали антителами согласно инструкции производителя. Клетки анализировали на проточном цитофлуориметре Accuri С6 (Becton Dickinson, США). Чтобы оценить уровень неспецифического окрашивания, использовали изотопический контроль (анти-IgG1 и анти-IgG2a, BD Biosciences). Полученные данные анализировались в программе для сбора, автокомпенсации, обработки данных и получения изображений BD Accuri С6 software.
Экспрессия генов
Для оценки уровня мРНК генов, ответственных иммуносупрессивную активность, жтМСК, полученные после магнитной иммуносепарации, лизировали с помощью реагента Trizol (Qiagen, США) и выделяли мРНК, на ее матрице синтезировали кДНК с использованием Quantitech Reverse Transcription Kit (Qiagen, США). Методом ОТ-ПЦР с помощью соответствующих праймеров (Qiagen) проводили оценку уровня экспрессии генов.
Иммуномодуляторная активность Т-клеток
К суспензии трипсинизированных жтМСК или ассоциатов жтМСК-ГСПК добавляли аллогенные митоген-стимулированные Т-клетки периферической крови в среде RPMI-1640 (5% ФТС, 10 мкг/мл ФГА) в соотношении 1:10 и культивировали 72 ч. Затем были собраны все неадгезированные Т-клетки, в которых при помощи цитофлуориметрического анализа был оценен уровень активированных (HLA-DR-положительных) и пролиферировавших клеток.
Пролиферация Т-клеток
Перед проведением эксперимента Т-клетки были предварительно обработаны карбоксифлуоресцеин сукцинимидил эфиром (CFSE, Invitrogen, США) согласно стандартному протоколу. Уровень пролиферации оценивали цитофлуориметрическим методом по пропорциональному снижению интенсивности флуоресценции CFSE при делении Т-клеток.
Статистика. Статистический анализ проводили с использованием пакета программ «Microsoft Excel 2000» и «Statistica 10.0» и критерия Манна-Уитни. Различия считали достоверными при р<0.05.
Пример 1
К предмонослою митомицин С-обработанных жтМСК (70-80% конфлюэнтности), культивирование которых проводили при 5% О2, добавляли суспензию МНК ПК в количестве 2×106 клеток/мл.
Сокультивирование МНК ПК и жтМСК проводили при концентрации О2 в среде 20%. Неадгезированные в течение 72 часов МНК ПК удаляли и проводили дальнейшее культивирование оставшихся клеток еще в течение 72 часов при концентрации О2 в среде 20% с образованием строма-ассоциированной популяции ГСПК.
В ходе работы было показано, что в результате сокультивирования в течение 144 часов формируется популяция гемопоэтических клеток, ассоциированных со стромальным подслоем. На фигуре 2 приведено репрезентативное изображение ассоциатов жтМСК-ГСПК. Тонкие белые стрелки обозначают жтМСК-ассоциированные ГСПК на поверхности жтМСК, тонкие черные стрелки обозначают жтМСК-ассоциированные ГСПК под стромальным подслоем - «клетки образующие области булыжной мостовой - (КООБ)», звездочки обозначают жтМСК (дифференциальное окрашивание по Гимза, светлое поле, масштабный отрезок - 50 мкм).
жтМСК в клеточных ассоциатах имели типичный фибробластоподобный фенотип, обладали высокой жизнеспособностью (более 99%) и экспрессировали маркеры, характерные для клеток стромального дифферона: CD90, CD73, CD 105.
Жизнеспособность ГСПК и жтМСК в ассоциатах согласно тесту с трипановым синим составляла более 95%.
После трипсинизации ассоциатов жтМСК-ГСПК были получены пробы для цитофлуориметрического анализа, содержащие оба типа клеток.
Репрезентативная диаграмма распределения жтМСК и ГСПК из ассоциатов по размеру и гранулярности приведена на фигуре 3. Анализ по размеру/структуре не позволил выявить четко различимых субпопуляций. Соотношение жтМСК и ГСПК в ассоциатах по данным проточной цитофлуориметрии составило в среднем 3:1.
Далее в суспензии проводили иммунофенотипирование клеток. Гемопоэтические клетки идентифицировали по экспрессии панлейкоцитарного антигена CD45, а жтМСК - по экспрессии CD90 антигена, как показано на фигуре 4. Далее анализ проводили среди CD45-положительных клеток, среди которых были выявлены клетки, экпрессирующие только CD45 (верхний левый квадрант), а также клетки, несущие оба маркера (CD45+CD90+) (верхний правый квадрант). Как известно, CD90 экспрессируется не только стромальными клетками, но и ранними ГСПК (Pineault and Abu-Khader, 2015). Можно предположить, что клетки с иммунофенотипом CD45+CD90+ являются более ранними предшественниками, чем CD45+CD90+ клетки. Были идентифицированы примитивные ГСПК с фенотипом CD45+/CD90+/CD34+. Среди клеток, ассоциированных с жтМСК, доля некоммитированных ГСПК (CD34+) составляла в среднем 63%.
Для оценки способности жтМСК к иммуномодуляции определяли их влияние на активацию и пролиферацию митоген-стимулированных Т-клеток. В суспензию трипсинизированных жтМСК в монокультуре и в сокультуре с ГСПК добавляли ФГА-активированные аллогенные мононуклеары периферической крови (Лимфоциты). В таблице 1 приведены результаты определения доли Т-клеток, экспрессирующих маркер поздней активации HLA-DR, а также доли пролиферирующих Т-клеток. Через 72 часа супрессивный эффект в отношении Т-клеток был сходным для жтМСК в монокультурах и в ассоциатах: выявлено двукратное снижение доли HLA-DR-положительных Т-клеток и двукратное уменьшение пролиферативного индекса Т-клеток.
Дифференциальный анализ экспрессии генов жтМСК, кодирующих основные иммуносупрессивные молекулы, показал, что жтМСК в ассоциатах с ГСПК характеризовались увеличенной экспрессией генов IDO, PTGS2, LIF, кодирующих соответствующие молекулы, как представлено в Таблице 2.
В настоящее время МСК используются в различных протоколах клеточной терапии и регенеративной медицины, благодаря их потенциалу создавать регенеративное микроокружение за счет продукции различных биологически активных медиаторов (Murphy et al., 2013; Syed and Evans, 2013). жтМСК рассматриваются как один из наиболее привлекательных источников МСК (Bruun et al., 2018). Это связано, в первую очередь, с иммуномодуляторной активностью получаемых жтМСК (Bartholomew et al., 2002).
В работе Bartholomew с соавт. (2002), которая стала основополагающей в исследованиях иммуно супрессивной активности МСК, было продемонстрировано увеличение времени отторжения аллогенных кожных лоскутов у обезьян, которым вводили аллогенные МСК. Аналогичный эффект был описан в экспериментах по пересадке роговицы пресенситизированным крысам, у которых введение аллогенных МСК предотвращало отторжение пересаженных тканей (Lohan et al., 2018). В клинических исследованиях показано снижение выраженности реакции трансплантат против хозяина (РТПХ) у пациентов, устойчивых к стероидам при введении им МСК (Sanchez-Guijo et al., 2014; Amorin et al., 2014). Кроме того, ко-трансплантация МСК улучшала приживление и снижала риск отторжения при пересадке гемопоэтических клеток (Jitschin et al., 2013; Amorin et al., 2014). Способность к подавлению активности иммунных клеток реципиента позволяет использовать и стромальные предшественники из жировой ткани - жтМСК, как «третью ткань» для снижения выраженности РТПХ (Jurado et al., 2017).
жтМСК, также как и МСК из костного мозга, обладают способностью поддерживать гемопоэз, что может быть использовано для ex vivo экспансии гемопоэтических предшественников (Wagner et al., 2007; Nakao et al., 2010; Nishiwaki et al., 2012; Andreeva et al., 2015, 2018). Это особенно актуально для ГСПК из пуповинной крови, когда содержание ГСПК в одном образце недостаточно для трансплантации (Broxmeyer and Farag, 2013).
Мы показали, что в результате сокультивирования МНК ПК и жтМСК можно получить флотирующую и ассоциирированную с жтМСК популяции ГСПК. Часть ГСПК в ассоциатах демонстрировала примитивный фенотип, подтверждаемый их способностью формировать «области булыжной мостовой». Считается, что такие ГСПК способны к длительному поддержанию кроветворения in vivo (de Haan and Van Zant, 1997). Возможно, что жтМСК, используемые для сокультивирования, могут представлять интерес не только как фидерный слой для ГСПК, но и демонстрировать активность, характерную для МСК, используемых как «третья ткань».
В настоящей работе в результате ex vivo экспансии мононуклеарных клеток пуповинной крови на подслое из стромальных клеток из жировой ткани были получены гетероклеточные ассоциаты, состоящие из недифференцированных гемопоэтических предшественников - ГСПК и стромальных клеток - жтМСК. Ассоциированные с ГСПК жтМСК демонстрировали увеличение экспрессии генов, отвечающих за имуносупрессивную активность (IDO, LIF, PTGS2) и ингибировали активацию и пролиферацию аллогенных стимулированных Т-клеток.
Таким образом, нами предложен эффективный метод получения клеточных препаратов, представляющих ассоциаты некоммитированных ГСПК и жтМСК, которые способны обеспечить поддержание гемопоэза ех vivo и сохраняют способность к иммуносупрессии, что может быть востребовано при использования клеточных ассоциатов жтМСК-ГСПК для восстановления кроветворения.
Список литературы
Буравкова Л.Б., Гринаковская О.С., Андреева Е.Р., Жамбалова А.П., Козионова М.П. Характеристика мезенхимальных стромальных клеток из липоаспирата человека, культивируемых при пониженном содержании кислорода. Цитология. 2009. 51(1): 5.
Amorin В., Alegretti А.Р., Valim V., Pezzi A., Laureano A.M., da Silva M.A., Wieck A., Silla L. Mesenchymal stem cell therapy and acute graft-versus-host disease: a review. Hum Cell. 2014. 27(4): 137-150.
Andreeva E.R., Andrianova I.V., Sotnezova E.V., Buravkov S.V, Bobyleva P.I.., Romanov Y.A., Buravkova LB. Human adipose-tissue derived stromal cells in combination with hypoxia effectively support ex vivo expansion of cord blood haematopoietic progenitors. PLoS One. 2015. 10(4):e0124939.
Andreeva E.R., Andrianova I.V., Gornostaeva A.N., Gogiya B.S., Buravkova L.В., Evaluation of committed and primitive cord blood progenitors after expansion on adipose stromal cells. Cell Tissue Res. 2018. 372 (3): 523-533.
Bartholomew A., Sturgeon C., Siatskas M., Ferrer K., Mcintosh K., Patil S., Hardy W., Devine S., Ucker D., Deans R., Moseley A., Hoffman R. Mesenchymal stem cells suppress lymphocyte proliferation in vitro and prolong skin graft survival in vivo. Exp Hematol. 2002. 30(1): 42-8.
Bianco P., Cao X., Frenette P.S., Mao J.J., Robey P.G., Simmons P.J., Wang C.Y. The meaning, the sense and the significance: translating the science of mesenchymal stem cells into medicine. Nat Med. 2013. 19(1): 35-42.
Broxmeyer H.E. and Farag S. Background and future considerations for human cord blood hematopoietic cell transplantation, including economic concerns. Stem Cells Dev. 2013. 22(Suppl 1): 103-110.
Bruun K., Schermer E., Sivendra A., Valaik E., Wise R.B., Said R., Bracht J.R. Therapeutic applications of adipose-derived stem cells in cardiovascular disease. Am J Stem Cells. 2018.7(4): 94-103.
Caplan A.I. Adult mesenchymal stem cells: when, where, and how. Stem cells international. 2015. 2015: 628767.
De Lima M., McNiece I., Robinson S.N., Munsell M, Eapen M., Horowitz M., Alousi A., Saliba R., McMannis J.D., Kaur L, Kebriaei P., Parmar S., Popat U., Hosing C, Champlin R., Bollard C, Molldrem J.J., Jones R.B., Nieto Y., Andersson B.S., Shah N., Oran В., Cooper L.J., Worth L., Qazilbash M.H., Korbling M., Rondon G., Ciurea S., Bosque D., Maewal I., Simmons P.J., Shpall EJ. Cord-blood engraftment with ex vivo mesenchymal-cell coculture. N Engl J Med. 2012. 367(24): 2305-2315.
Dexter T.M., Allen T.D., Lajtha L.G., Conditions controlling the proliferation of haemopoietic stem cells in vitro. J Cell Physiol. 1977. 91(3): 335-344.
de Haan G., and Van Zant G. Intrinsic and extrinsic control of hemopoietic stem cell numbers: mapping of a stem cell gene. J. Exp. Med. 1997. 186(4): 529-536.
Flores-Guzman P., Flores-Figueroa E., Montesinos J.J.,  G.,
G.,  V., Valencia-Plata I.,
V., Valencia-Plata I.,  G., Mayani H. Individual and combined effects of mesenchymal stromal cells and recombinant stimulatory cytokines on the in vitro growth of primitive hematopoietic cells from human umbilical cord blood, Cytotherapy. 2009. 11(7): 886-896.
G., Mayani H. Individual and combined effects of mesenchymal stromal cells and recombinant stimulatory cytokines on the in vitro growth of primitive hematopoietic cells from human umbilical cord blood, Cytotherapy. 2009. 11(7): 886-896.
Jing D., Fonseca A.V., Alakel N., Fierro F.A., Muller K., Bornhauser M., Ehninger G., Corbeil D., Ordemann R., Hematopoietic stem cells in co-culture with mesenchymal stromal cells-modeling the niche compartments in vitro. Haematologica, 2010, 95 (4): 542-550.
Jitschin R., Mougiakakos D., Von Bahr L.,  S., Moll G., Ringden O., Kiessling R., Linder S., Le Blanc K. Alterations in the cellular immune compartment of patients treated with third-party mesenchymal stromal cells following allogeneic hematopoietic stem cell transplantation. Stem Cells. 2013. 31(8): 1715-1725.
S., Moll G., Ringden O., Kiessling R., Linder S., Le Blanc K. Alterations in the cellular immune compartment of patients treated with third-party mesenchymal stromal cells following allogeneic hematopoietic stem cell transplantation. Stem Cells. 2013. 31(8): 1715-1725.
Jurado M., De La Mata C.,  A.,
A.,  E., Espinosa О., Remigia M.J., Moratalla L., Goterris R.,
E., Espinosa О., Remigia M.J., Moratalla L., Goterris R.,  R., Ruiz-Cabello F.,
R., Ruiz-Cabello F.,  S., Pascual M.J.., Espigado I., Solano C. Adipose tissue-derived mesenchymal stromal cells as part of therapy for chronic graft-versus-host disease: A phase I/II study. Cytotherapy. 2017. .19(8): 927-936..
S., Pascual M.J.., Espigado I., Solano C. Adipose tissue-derived mesenchymal stromal cells as part of therapy for chronic graft-versus-host disease: A phase I/II study. Cytotherapy. 2017. .19(8): 927-936..
Kumar S., Geiger H. HSC niche biology and HSC expansion ex vivo. Trends Mol Med. 2017. 23(9): 799-819
Lohan P., Murphy N., Treacy O., Lynch K., Morcos M., Chen В., Ryan A.E., Griffin M.D., Ritter T. Third-party allogeneic mesenchymal stromal cells prevent rejection in a pre-sensitized high-risk model of corneal transplantation. Front Immunol. 2018. ;9: 2666..
Miguel M. P. De, Fuentes-Julian S., Blazquez-Martinez A., Pascual C.Y., Aller M. A., Arias J., Arnalich-Montiel F. Immunosuppressive properties of mesenchymal stem cells: advances and applications. Curr Mol Med. 2012.12 (5): 574-591.
Nakao N., Nakayama Т., Yahata Т., Muguruma Y, Saito S., Miyata Y, Yamamoto K., Naoe T. Adipose tissue-derived mesenchymal stem cells facilitate hematopoiesis in vitro and in vivo: advantages over bone marrow-derived mesenchymal stem cells. Am J Pathol. 2010. 177(2): 547-554.
Nishiwaki S., Nakayama Т., Saito S., Mizuno H., Ozaki Т., Takahashi Y., Maruyama S., Nishida Т., Murata M., Kojima S., Naoe T. Efficacy and safety of human adipose tissue-derived mesenchymal stem cells for supporting hematopoiesis. Int J Hematol. 2012. 96(3): 295-300.
Murphy M.В., Moncivais K., Caplan A.I. Mesenchymal stem cells: environmentally responsive therapeutics for regenerative medicine. Exp Mol Med. 2013. 45:e54.
Robinson S.N., Ng J., Niu T, Yang H., McMannis J.D., Karandish S., Kaur I., Fu P., Del Angel M., Messinger R., Flagge F., de Lima M., Decker W., Xing D., Champlin R., Shpall E.J. Superior ex vivo cord blood expansion following co-culture with bone marrow-derived mesenchymal stem cells, Bone Marrow Transplant. 2006. 37(4): 359-366.
 F.,
F.,  Т.,
Т.,  O., Redondo A., Parody R.,
O., Redondo A., Parody R.,  C.,
C.,  E., Andreu E.,
E., Andreu E.,  F.,
F.,  M., Regidor C., Villaron E.,
M., Regidor C., Villaron E.,  L., Caballero D.,
L., Caballero D.,  M.C.,
M.C.,  J.A.. Sequential third-party mesenchymal stromal cell therapy for refractory acute graft-versus-host disease. Biol Blood Marrow Transplant. 2014. 20(10): 1580-1585.
J.A.. Sequential third-party mesenchymal stromal cell therapy for refractory acute graft-versus-host disease. Biol Blood Marrow Transplant. 2014. 20(10): 1580-1585.
Syed, B.A., Evans, J.B. Stem cell therapy market. (2013) Nat Rev Drug Discov 12(3): 185-186.
Wagner W., Wein F., Roderburg C., Saffrich R., Faber A., Krause U., Schubert M., Benes V., Eckstein V., Maul H., Ho A.D. Adhesion of hematopoietic progenitor cells to human mesenchymal stem cells as a model for cell-cell interaction, Exp. Hematol. 2007. 35 (2): 314-325.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения МСК-ассоциированных недифференцированных гемопоэтических клеток-предшественников с фенотипов CD34+/CD133+ | 2016 |
|
RU2628092C1 |
| Способ улучшения сбора гемопоэтических клеток при их культивировании на стромальных слоях путем предварительной магнетизации последних | 2016 |
|
RU2688321C2 |
| СПОСОБ ПОЛУЧЕНИЯ МУЛЬТИПОТЕНТНЫХ МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК ИЗ ПУПОЧНОГО КАНАТИКА НОВОРОЖДЕННОГО | 2020 |
|
RU2744301C1 |
| Бесклеточные терапевтические средства для регенеративной медицины и способы их получения | 2018 |
|
RU2742034C2 |
| Способ получения и ведения мезенхимальных стволовых клеток из костного материала млекопитающих | 2023 |
|
RU2821926C1 |
| Способ получения мультипотентных стромальных клеток из криозамороженных тканей фетоплацентарного комплекса | 2015 |
|
RU2610132C1 |
| СПОСОБ УСКОРЕННОГО ФОРМИРОВАНИЯ КОСТНОЙ МОЗОЛИ У МЛЕКОПИТАЮЩИХ | 2009 |
|
RU2404242C1 |
| СПОСОБ ПРОФИЛАКТИКИ ОСТРОЙ РЕАКЦИИ ТРАНСПЛАНТАТ ПРОТИВ ХОЗЯИНА ПОСЛЕ ТРАНСПЛАНТАЦИИ АЛЛОГЕННОГО КОСТНОГО МОЗГА | 2010 |
|
RU2454247C1 |
| СПОСОБ ОЦЕНКИ ОСТЕОГЕННОГО ПОТЕНЦИАЛА МЕЗЕНХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТОК | 2007 |
|
RU2370771C2 |
| СПОСОБ УСКОРЕННОГО ПОЛУЧЕНИЯ КУЛЬТУР МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК (МСК) МЛЕКОПИТАЮЩИХ, ИСКЛЮЧАЯ ЧЕЛОВЕКА, С НИЗКОЙ ГЕТЕРОГЕННОСТЬЮ И ВЫСОКОЙ ЖИЗНЕСПОСОБНОСТЬЮ | 2007 |
|
RU2331670C1 |
Изобретение относится к биотехнологии. Описан способ получения ассоциатов гемопоэтических и стромальных клеток-предшественников. Проводят подготовку стромального подслоя из МСК из стромально-васкулярной фракции жировой ткани с остановкой клеточных делений с помощью митомицина С, добавляют мононуклеарную фракцию пуповинной крови и совместно культивируют в течение 144 часов до получения ассоциатов ГСПК с жтМСК, способных также эффективно, как жтМСК в монокультуре, подавлять активацию и пролиферацию аллогенных лимфоцитов. Способ позволяет получать ассоциаты гемопоэтических стволовых и прогениторных клеток пуповинной крови (ГСПК) и жтМСК, в которых популяция ГСПК более чем на 80% представлена клетками-предшественниками с комплексным фенотипом CD34+/CD133+, ассоциированными со стромальным подслоем жтМСК. Изобретение может быть использовано для получения ассоциатов, в которых мультипотентные мезенхимальные стромальные клетки из жировой ткани (жтМСК) сохраняют иммуносупрессивную активность. 3 з.п. ф-лы, 4 ил., 2 табл., 1 пр.
1. Способ получения ассоциатов гемопоэтических и стромальных клеток-предшественников, способных подавлять активацию и пролиферацию аллогенных лимфоцитов, включающий подготовку стромального родслоя из мультипотентных стромальных клеток, выделенных из стромально-васкулярной фракции жировой ткани взрослого человека (жтМСК), в ходе которой жтМСК постоянно культивируются при 5% О2 до получения необходимого количества клеток, затем клеточные деления жтМСК останавливаются митомицином С, проводится отмывка от митомицина С и пересев жтМСК для получения поддерживающего слоя для ГСПК; после этого на сформированный слой из жтМСК добавляют мононуклеарную фракцию пуповинной крови в количестве 2×106 клеток/мл и проводят совместное культивирование в течение 144 часов.
2. Способ по п. 1, отличающийся тем, что после первых 72 часов культивирования отбирают неадгезированные клетки и заменяют среду культивирования на свежую.
3. Способ по п. 1, отличающийся тем, что гемопоэтические клетки-предшественники представляют собой гемопоэтические стволовые и прогениторные клетки (ГСПК) из пуповинной крови.
4. Способ по п. 1, отличающийся тем, что стромальные клетки-предшественники представляют собой мультипотентные клетки жировой ткани (жтМСК).
| Способ получения МСК-ассоциированных недифференцированных гемопоэтических клеток-предшественников с фенотипов CD34+/CD133+ | 2016 |
|
RU2628092C1 |
| СПОСОБ ЭКСПАНСИИ МОНОНУКЛЕАРНЫХ КЛЕТОК ПУПОВИННОЙ КРОВИ (пкМНК) ex vivo В ПРИСУТСТВИИ МУЛЬТИПОТЕНТНЫХ СТРОМАЛЬНЫХ МЕЗЕНХИМАЛЬНЫХ КЛЕТОК (ММСК) | 2013 |
|
RU2525143C1 |
| AU 2012324017 A1, 06.06.2013 | |||
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) И СПОСОБ ЛЕЧЕНИЯ ДИЛЯТАЦИОННОЙ КАРДИОМИОПАТИИ | 2004 |
|
RU2268062C1 |
Авторы
Даты
2020-06-02—Публикация
2019-07-01—Подача