Область техники, к которой относится изобретение
Изобретение относится к области медицины, фармакологии и регенеративной медицины, в частности, и к бесклеточным лекарственным средствам для стимуляции регенерации клеток и тканей, в том числе, для стимуляции эпителио- и ангиогенеза, нейропротекции, лечении острых и хронических поражений кожных покровов и роговицы различного генеза, при поражениях центральной и периферической нервной системы различного происхождения, а также к способам получения бесклеточных лекарственных средств.
Описание предшествующего уровня техники
Мультипотентные мезенхимальные стромальные клетки (МСК) представляют собой гетерогенную группу клеток, обладающих способностью расти in vitro в прикрепленном состоянии, дифференцироваться в различные типы клеток мезодермального и немезодермального происхождения и несущих на своей поверхности определенный набор маркеров (кластеров дифференцировки).
МСК могут быть выделены из различных тканей млекопитающих, включая человека: сосудистой стенки, печени, кожи, жировой ткани, периферической, пуповинной и менструальной крови, амниотической жидкости и даже из пульпы выпавших молочных зубов [Romanov Y.A., Svintsitskaya V.A., Smirnov V.N. Searching for alternative sources of postnatal human mesenchymal stem cells: candidate MSC-like cells from umbilical cord. Stem Cells. 2003; 21(1):105-110; Gronthos S., Franklin D.M., Leddy H.A., Robey P.G., Storms R.W., Gimble J.M. Surface protein characterization of human adipose tissue-derived stromal cells. J Cell Physiol. 2001; 189(1):54-63; Igura K., Zhang X., Takahashi K., Mitsuru A., Yamaguchi S., Takashi T.A. Isolation and characterization of mesenchymal progenitor cells from chorionic villi of human placenta. Cytotherapy. 2004; 6(6):543-553; Tsai M.-S., Lee J.-L., Chang Y.-J., Hwang S.-M. Isolation of human multipotent mesenchymal stem cells from second-trimester amniotic fluid using a novel two-stage culture protocol. Hum Reprod. 2004; 19(6):1450-1456; Zvaifler N.J., Marinova-Mutafchieva L., Adams G., Edwards С.J., Moss J., Burger J.A., et al. Mesenchymal precursor cells in the blood of normal individuals. Arthritis Res. 2000; 2(6):477-488; Campagnoli C., Roberts I.A., Kumar S., Bennett P.R., Bellantuono I., Fisk N.M. Identification of mesenchymal stem/progenitor cells in human first-trimester fetal blood, liver, and bone marrow. Blood. 2001; 98(8):2396-2402; Kalaszczynska I., Ferdyn K. Wharton's jelly derived mesenchymal stem cells: future of regenerative medicine? Recent findings and clinical significance. Biomed Res Int. 2015; 2015:430847]. К наиболее перспективным источникам МСК до недавнего времени можно было отнести два: костный мозг и жировую ткань. Выделение и эффективное размножение МСК из большинства других источников, проблематично в связи с крайне низкой концентрацией искомых клеток (менее тысячных долей процента в случае пуповинной крови при доношенной беременности), либо сложностями в получении этих тканей в достаточных количествах.
Среди источников МСК постнатального происхождения наибольший интерес вызывают ткани перинатального происхождения, обладающие целым рядом неоспоримых преимуществ: содержание МСК в них значительно превосходит их концентрацию в тканях взрослого организма: около 5×104 клеток/см пуповины, против 5×103 клеток/г жировой ткани и 0.01% мононуклеарной фракции костного мозга. Кроме этого, заготовка, в частности, ткани пупочного канатика не требует специального хирургического вмешательства, безопасна, безболезненна и проводится уже после свершившихся родов, а биологические свойства «молодых» клеток (пролиферативная и синтетическая активность, способность к разнонаправленной дифференцировке и т.п.) выгодно отличают их от «взрослых» МСК, уже исчерпавших значительную часть заложенного в них от природы потенциала.
Терапевтический эффект МСК достигается как путем миграции клеток в очаг повреждения и/или воспаления, так и за счет секреции растворимых молекул, обладающих противовоспалительными, ангиогенными и иммуномодулирующими свойствами как in vitro [Arutyunyan I., Fatkhudinov Т., Kananykhina E., Usman N., Elchaninov A., Makarov A., et al. Role of VEGF-A in angiogenesis promoted by umbilical cord-derived mesenchymal stromal/stem cells: in vitro study. Stem Cell Res Ther. 2016; 7:46; Svirshchevskaya E. V, Poltavtseva R.A., Beletskii I.P., Selezneva I.I., Savilova A.M., Sukhikh G.T. Interaction of Lymphocytes with Mesenchymal Stem Cells. Bull Exp Biol Med. 2016; 161(4):571-579; Yarygin K.N., Lupatov A.Y., Sukhikh G.T. Modulation of Immune Responses by Mesenchymal Stromal Cells. Bull Exp Biol Med. 2016; 161(4):561-565; Svirshchevskaya E. V, Poltavtseva R.A., Beletskii I.P., Selezneva I.I., Sukhikh G.T. Antiproliferative Effects of Mesenchymal Stem Cells and Epithelial Cells on Lymphocytes. Bull Exp Biol Med. 2016; 161(4):518-522; Arutyunyan I. V, Kananykhina E.Y., Fatkhudinov Т.K.,  , A. V, Makarov A. V, Raimova E.S., et al. Angiogenic Potential of Multipotent Stromal Cells from the Umbilical Cord: an In Vitro Study. Bull Exp Biol Med. 2016; 161(1):141-149], так и in vivo в доклинических моделях заболеваний, включая острые повреждения легких [Matthay MA, Goolaerts A, Howard JP, Lee JW. Mesenchymal stem cells for acute lung injury: preclinical evidence. Crit Care Med. 2010, 38: S569-73; Mei SH, McCarter SD, Deng Y, Parker CH, Liles WC, et al. Prevention of LPS induced acute lung injury in mice by mesenchymal stem cells overexpressing angiopoietin 1. PLoS Med. 2007, 4: e269], септический шок [Mei SH, Haitsma JJ, Dos Santos CC, Deng Y, et al. Mesenchymal stem cells reduce inflammation while enhancing bacterial clearance and improving survival in sepsis. Am J Respir Crit Care Med. 2010, 182: 1047-1057], острый инфаркт миокарда [Boyle AJ, McNiece IK, Hare JM. Mesenchymal stem cell therapy for cardiac repair. Methods Mol Biol. 2010; 660: 65-84] и т.д. [Plotnikov E.Y., Pulkova N. V, Pevzner I.B., Zorova L.D., Silachev D.N., Morosanova M.A., et al. Inflammatory pre-conditioning of mesenchymal multipotent stromal cells improves their immunomodulatory potency in acute pyelonephritis in rats. Cytotherapy. 2013; 15(6):679-689; Bobkova N. V, Poltavtseva R.A., Samokhin A.N., Sukhikh G.T. Therapeutic effect of mesenchymal multipotent stromal cells on memory in animals with Alzheimer-type neurodegeneration. Bull Exp Biol Med. 2013; 156(1):119-121; Fatkhudinov Т.K.,
, A. V, Makarov A. V, Raimova E.S., et al. Angiogenic Potential of Multipotent Stromal Cells from the Umbilical Cord: an In Vitro Study. Bull Exp Biol Med. 2016; 161(1):141-149], так и in vivo в доклинических моделях заболеваний, включая острые повреждения легких [Matthay MA, Goolaerts A, Howard JP, Lee JW. Mesenchymal stem cells for acute lung injury: preclinical evidence. Crit Care Med. 2010, 38: S569-73; Mei SH, McCarter SD, Deng Y, Parker CH, Liles WC, et al. Prevention of LPS induced acute lung injury in mice by mesenchymal stem cells overexpressing angiopoietin 1. PLoS Med. 2007, 4: e269], септический шок [Mei SH, Haitsma JJ, Dos Santos CC, Deng Y, et al. Mesenchymal stem cells reduce inflammation while enhancing bacterial clearance and improving survival in sepsis. Am J Respir Crit Care Med. 2010, 182: 1047-1057], острый инфаркт миокарда [Boyle AJ, McNiece IK, Hare JM. Mesenchymal stem cell therapy for cardiac repair. Methods Mol Biol. 2010; 660: 65-84] и т.д. [Plotnikov E.Y., Pulkova N. V, Pevzner I.B., Zorova L.D., Silachev D.N., Morosanova M.A., et al. Inflammatory pre-conditioning of mesenchymal multipotent stromal cells improves their immunomodulatory potency in acute pyelonephritis in rats. Cytotherapy. 2013; 15(6):679-689; Bobkova N. V, Poltavtseva R.A., Samokhin A.N., Sukhikh G.T. Therapeutic effect of mesenchymal multipotent stromal cells on memory in animals with Alzheimer-type neurodegeneration. Bull Exp Biol Med. 2013; 156(1):119-121; Fatkhudinov Т.K.,  , G.B., Goldshtein D. V, Sukhikh G.T. Mechanisms of therapeutic activity of multipotent cells in heart diseases. Bull Exp Biol Med. 2014; 156(4):535-543; Silachev D.N., Plotnikov E.Y., Babenko V.A., Danilina T.I., Zorov L.D., Pevzner I.B., et al. Intra-Arterial Administration of Multipotent Mesenchymal Stromal Cells Promotes Functional Recovery of the Brain After Traumatic Brain Injury. Bull Exp Biol Med. 2015; 159(4):528-533; Danilina T.I., Silachev D.N., Pevzner I.B., Gulyaev M. V, Pirogov Y.A., Zorova L.D., et al. The Influence of Proinflammatory Factors on the Neuroprotective Efficiency of Multipotent Mesenchymal Stromal Cells in Traumatic Brain Injury. Bull Exp Biol Med. 2017; 163(4):528-534].
, G.B., Goldshtein D. V, Sukhikh G.T. Mechanisms of therapeutic activity of multipotent cells in heart diseases. Bull Exp Biol Med. 2014; 156(4):535-543; Silachev D.N., Plotnikov E.Y., Babenko V.A., Danilina T.I., Zorov L.D., Pevzner I.B., et al. Intra-Arterial Administration of Multipotent Mesenchymal Stromal Cells Promotes Functional Recovery of the Brain After Traumatic Brain Injury. Bull Exp Biol Med. 2015; 159(4):528-533; Danilina T.I., Silachev D.N., Pevzner I.B., Gulyaev M. V, Pirogov Y.A., Zorova L.D., et al. The Influence of Proinflammatory Factors on the Neuroprotective Efficiency of Multipotent Mesenchymal Stromal Cells in Traumatic Brain Injury. Bull Exp Biol Med. 2017; 163(4):528-534].
В клинических условиях эффективность МСК была убедительно показана для таких заболеваний, как злокачественные заболевания крови и болезнь «трансплантат против хозяина» (РТПХ) [Can A., Celikkan F.T., Cinar О. Umbilical cord mesenchymal stromal cell transplantations: A systemic analysis of clinical trials. Cytotherapy. 2017; 19(12):1351-1382; Macmillan M.L., Blazar B.R., DeFor Т.Е., Wagner J.E. Transplantation of ex-vivo culture-expanded parental haploidentical mesenchymal stem cells to promote engraftment in pediatric recipients of unrelated donor umbilical cord blood: results of a phase I-II clinical trial. Bone Marrow Transplant. 2009; 43(6):447-54], ишемический инсульт [Chen L., Xi H., Huang H., Zhang F., Liu Y., Chen D., et al. Multiple cell transplantation based on an intraparenchymal approach for patients with chronic phase stroke. Cell Transplant. 2013; 22 Suppl 1:S83-91; Jiang Y., Zhu W., Zhu J., Wu L., Xu G., Liu X. Feasibility of delivering mesenchymal stem cells via catheter to the proximal end of the lesion artery in patients with stroke in the territory of the middle cerebral artery. Cell Transplant. 2013; 22(12):2291-2298], рассеяный склероз [Liang J., Zhang H., Hua В., Wang H., Wang J., Han Z., et al. Allogeneic mesenchymal stem cells transplantation in treatment of multiple sclerosis. Mult Scler. 2009; 15(5):644-646; Hou Z., Liu Y., Mao X.-H., Wei C., Meng M., Liu Y., et al. Transplantation of umbilical cord and bone marrow-derived mesenchymal stem cells in a patient with relapsing-remitting multiple sclerosis. Cell Adh Migr. 7(5):404-407; Li J.-F., Zhang D.-J., Geng Т., Chen L., Huang H., Yin H.-L., et al. The potential of human umbilical cord-derived mesenchymal stem cells as a novel cellular therapy for multiple sclerosis. Cell Transplant. 2014; 23 Suppl 1:S113-22], травматические поражения головного и спинного мозга [Liu J., Han D., Wang Z., Xue M., Zhu L., Yan H., et al. Clinical analysis of the treatment of spinal cord injury with umbilical cord mesenchymal stem cells. Cytotherapy. 2013; 15(2): 185-191; Cheng H., Liu X., Hua R., Dai G., Wang X., Gao J., et al. Clinical observation of umbilical cord mesenchymal stem cell transplantation in treatment for sequelae of thoracolumbar spinal cord injury. J Transl Med. 2014; 12:253; Hua R., Li P., Wang X., Yang J., Zheng P., Niu X., et al. Evaluation of Somatosensory Evoked Potential and Pain Rating Index in a Patient with Spinal Cord Injury Accepted Cell Therapy. Pain Physician. 2016; 19(4):E659-66; Wang S., Cheng H., Dai G., Wang X., Hua R., Liu X., et al. Umbilical cord mesenchymal stem cell transplantation significantly improves neurological function in patients with sequelae of traumatic brain injury. Brain Res. 2013; 1532:76-84], ишемическая энцефалопатия и детский церебральный паралич [Wang X., Hu Н., Hua R., Yang J., Zheng P., Niu X., et al. Effect of umbilical cord mesenchymal stromal cells on motor functions of identical twins with cerebral palsy: pilot study on the correlation of efficacy and hereditary factors. Cytotherapy. 2015; 17(2):224-231; Xie В., Gu P., Wang W., Dong C., Zhang L., Zhang J., et al. Therapeutic effects of human umbilical cord mesenchymal stem cells transplantation on hypoxic ischemic encephalopathy. Am J Transl Res. 2016; 8(7):3241-50], ишемическая болезнь сердца, сердечная недостаточность и инфаркт миокарда [Ward M.R., Abadeh A., Connelly K.A. Concise Review: Rational Use of Mesenchymal Stem Cells in the Treatment of Ischemic Heart Disease. Stem Cells Transl Med. 2018; Zhao X.F., Xu Y., Zhu Z.Y., Gao C.Y., Shi Y.N. Clinical observation of umbilical cord mesenchymal stem cell treatment of severe systolic heart failure. Genet Mol Res. 2015; 14(2):3010-3107; Can A., Ulus A.T., Cinar O., Topal Celikkan F., Simsek E., Akyol M., et al. Human Umbilical Cord Mesenchymal Stromal Cell Transplantation in Myocardial Ischemia (HUC-HEART Trial). A Study Protocol of a Phase 1/2, Controlled and Randomized Trial in Combination with Coronary Artery Bypass Grafting. Stem Cell Rev. 2015; 11(5):752-760; Gao L.R., Chen Y., Zhang N.K., Yang X.L., Liu H.L., Wang Z.G, et al. Intracoronary infusion of Wharton's jelly-derived mesenchymal stem cells in acute myocardial infarction: double-blind, randomized controlled trial. BMC Med. 2015; 13:162], цирроз печени [Zhang Z., Lin H., Shi M., Xu R., Fu J., Lv J., et al. Human umbilical cord mesenchymal stem cells improve liver function and ascites in decompensated liver cirrhosis patients. J Gastroenterol Hepatol. 2012; 27 Suppl 2:112-120; Xue H.-L., Zeng W.-Z., Wu X.-L., Jiang M.-D., Zheng S.-M., Zhang Y., et al. Clinical therapeutic effects of human umbilical cord-derived mesenchymal stem cells transplantation in the treatment of end-stage liver disease. Transplant Proc. 2015; 47(2):412-418; Liang J., Zhang H., Zhao C., Wang D., Ma X., Zhao S., et al. Effects of allogeneic mesenchymal stem cell transplantation in the treatment of liver cirrhosis caused by autoimmune diseases. Int J Rheum Dis. 2017; 20(9): 1219-1226; Shi M., Zhang Z., Xu R., Lin H., Fu J., Zou Z., et al. Human mesenchymal stem cell transfusion is safe and improves liver function in acute-on-chronic liver failure patients. Stem Cells Transl Med. 2012; 1(10):725-31], диабет 1 и 2 типа [Liu X., Zheng P., Wang X., Dai G., Cheng H., Zhang Z., et al. A preliminary evaluation of efficacy and safety of Wharton's jelly mesenchymal stem cell transplantation in patients with type 2 diabetes mellitus. Stem Cell Res Ther. 2014; 5(2):57; Chen P., Huang Q., Xu X.J., Shao Z.L., Huang L.H., Yang X.Z., et al. The effect of liraglutide in combination with human umbilical cord mesenchymal stem cells treatment on glucose metabolism and β cell function in type 2 diabetes mellitus. Zhonghua nei ke za zhi. 2016; 55(5):349-354; Qin H.L., Zhu X.H., Zhang В., Zhou L., Wang W.Y. Clinical Evaluation of Human Umbilical Cord Mesenchymal Stem Cell Transplantation After Angioplasty for Diabetic Foot. Exp Clin Endocrinol Diabetes. 2016; 124(8):497-503], при заболеваниях опорно-двигательного аппарата [Qu Z., Fang G., Cui Z., Liu Y. Cell therapy for bone nonunion: a retrospective study. Minerva Med. 2015; 106(6):315-321; Cai J., Wu Z., Huang L., Chen J., Wu C., Wang S., et al. Cotransplantation of bone marrow mononuclear cells and umbilical cord mesenchymal stem cells in avascular necrosis of the femoral head. Transplant Proc. 46(l):151-5].
Терапевтическое действие МСК опосредуется синтезом и секрецией в окружающее пространство целой плеяды биологически активных соединений и структур: цитокинов, гормонов, факторов роста, пептидов, микрочастиц, равно как и различных компонентов внеклеточного матрикса, объединенных под термином 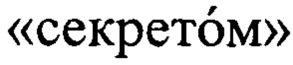 . При этом в отличие от терапевтических продуктов, содержащих живые клетки, секретом бесклеточен и обладает меньшим риском в случае применения.
. При этом в отличие от терапевтических продуктов, содержащих живые клетки, секретом бесклеточен и обладает меньшим риском в случае применения.
К ключевым компонентам, продуцируемым МСК, могут быть отнесены следующие:
- мозговой нейротрофический фактор (BDNF), способствующий выживанию и дифференцировке нейронов и уменьшению размера инфаркта [Cantinieaux, D., Quertainmont, R., Blacher, S., et al. Conditioned medium from bone marrow-derived mesenchymal stem cells improves recovery after spinal cord injury in rats: an original strategy to avoid cell transplantation. PLoS One. 2013, 8, e695158];
- эпидермальный ростовой фактор (EGF), способный стимулировать пролиферацию и дифференцировку различных типов клеток [Zagoura DS, RoubelakisMG, Bitsika V, et al. Therapeutic potential of a distinct population of human amniotic fluid mesenchymal stem cells and their secreted molecules in mice with acute hepatic failure. Gut:gutjnl-2011-300908; Park, B.-S., Kim, W.-S., Choi, J.-S., et al. Hair growth stimulated by conditioned medium of adipose-derived stem cells is enhanced by hypoxia: evidence of increased growth factor secretion. Biomedical Research, 2010, 31, 27-34; Lee, M.J., Kim, J., Lee, K.I., Shin, J. M., Chae, J.I., & Chung, H.M. Enhancement of wound healing by secretory factors of endothelial precursor cells derived from human embryonic stem cells. Cytotherapy, 2011, 13, 165-178; Kim, J., Lee, J.H., Yeo, S.M., Chung, H.M., & Chae, J.-I. Stem cell recruitment factors secreted from cord blood-derived stem cells that are not secreted from mature endothelial cells enhance wound healing. In Vitro Cellular&Developmental Biology-Animal, 2014, 50, 146-154];
- фактор роста фибробластов (FGF), участвующиий в ангиогенезе, заживлении ран, способствующий снижению апоптоза и играющий ключевую роль в процессах пролиферации и дифференцировки широкого спектра клеток и тканей [Bhang, S.H., Lee, S., Shin, J.-Y., Lee, T.-J., Jang, H.-K., & Kim, B.-S. Efficacious and clinically relevant conditioned medium of human adipose-derived stem cells for therapeutic angiogenesis. Molecular Therapy. 2014, 22, 862-872; Kim, J., Lee, J.H., Yeo, S.M., Chung, H.M., & Chae, J.-I. Stem cell recruitment factors secreted from cord blood-derived stem cells that are not secreted from mature endothelial cells enhance wound healing. In Vitro Cellular&Developmental Biology-Animal, 2014, 50, 146-154];
- колониестимулирующие факторы (Г-КСФ и ГМ-КСФ), стимулирующие продукцию нейтрофилов, гранулоцитов и макрофагов, соответственно [Park, В.-S., Kim, W.-S., Choi, J.-S., et al. Hair growth stimulated by conditioned medium of adipose-derived stem cells is enhanced by hypoxia: evidence of increased growth factor secretion. Biomedical Research. 2010, 31, 27-34];
- фактор роста гепатоцитов (HGF), способствующий мобилизации прогениторных клеток, стимулирующий ангиогенез и пролиферацию клеток [See, F., Seki, Т., Psaltis, P.J., et al. Therapeutic effects of human STRO-3-selected mesenchymal precursor cells and their soluble factors in experimental myocardial ischemia. Journal of Cellular and Molecular Medicine. 2011, 15, 2117-2129];
- фактор стволовых клеток (SCF), ндуцирующий пролиферацию стволовых клеток и способствующий их дифференцировке [See, F., Seki, Т., Psaltis, P.J., et al. Therapeutic effects of human STRO-3-selected mesenchymal precursor cells and their soluble factors in experimental myocardial ischemia. Journal of Cellular and Molecular Medicine, 2011, 15, 2117-2129; Bhang, S.H., Lee, S., Shin, J.-Y., Lee, T.-J., Jang, H.-K., & Kim, B.-S. Efficacious and clinically relevant conditioned medium of human adipose-derived stem cells for therapeutic angiogenesis. Molecular Therapy, 2014, 22, 862-872];
- фактор роста сосудистого эндотелия (VEGF), стимулирующий ангиогенез, способствующий мобилизации стволовых клеток, ингибирующий апоптоз [Bhang, S.H., Lee, S., Shin, J.-Y., Lee, T.-J., Jang, H.-K., & Kim, B.-S. Efficacious and clinically relevant conditioned medium of human adipose-derived stem cells for therapeutic angiogenesis. Molecular Therapy, 2014, 22, 862-872; Kim, J., Lee, J.H., Yeo, S.M., Chung, H.M. & Chae, J.-I. Stem cell recruitment factors secreted from cord blood-derived stem cells that are not secreted from mature endothelial cells enhance wound healing. In Vitro Cellular&Developmental Biology-Animal, 2014, 50, 146-154; See, F., Seki, Т., Psaltis, P.J., et al. Therapeutic effects of human STRO-3-selected mesenchymal precursor cells and their soluble factors in experimental myocardial ischemia. Journal of Cellular and Molecular Medicine, 2011, 15, 2117-2129];
а также ряд цитокинов (интерлейкины 6, 8, 9, 10), стимулирующих пролиферацию стволовых клеток, способствующих ангиогенезу, обладающих противовоспалительным, иммуномодулирующим и антиапоптотическим эффектом [Lee, M.J., Kim, J., Lee, K.I., Shin, J.M., Chae, J.I., & Chung, H.M. Enhancement of wound healing by secretory factors of endothelial precursor cells derived from human embryonic stem cells. Cytotherapy, 2011, 13, 165-178; Sadat, S., Gehmert, S., Song, Y.-H., et al. The cardioprotective effect of mesenchymal stem cells is mediated by IGF-I and VEGF. Biochemical and Biophysical Research Communications, 2007, 363, 674-679; Cho, Y.J., Song, H.S., Bhang, S., et al. Therapeutic effects of human adipose stem cell-conditioned medium on stroke. Journal of Neuroscience Research, 2012, 90, 1794-1802; Sze, S.K., de Kleijn, D.P., Lai, R.C., et al. Elucidating the secretion proteome of human embryonic stem cell-derived mesenchymal stem cells. Molecular & Cellular Proteomics, 2007, 6, 1680-1689; Chen, L., Tredget, E.E., Wu, P.Y., & Wu, Y. Paracrine factors of mesenchymal stem cells recruit macrophages and endothelial lineage cells and enhance wound healing. PLoS One, 2008, 3, e1886; Gao, F., Chiu, S., Motan, D., et al. Mesenchymal stem cells and immunomodulation: current status and future prospects. Cell Death & Disease, 2017, 7, e2062];
и других факторов, эффективных для применения в различных областях практической медицины: кардиологии, неврологии, ангиологии, травматологии и ортопедии, при заболеваниях печени, почек, репродуктивной системы.
В наиболее типичном случае, среда культивирования, кондиционированная несколькими десятками миллионов МСК, представляет собой практически готовый терапевтический продукт для применения в качестве иммуномодулирующего, противовоспалительного, анти-апоптотического и нейропротективного агента.
Из уровня техники известна композиция (RU 2292212 С1), представляющая собой кондиционную среду, обладающую лечебным эффектом при термических ожогах и содержащая солевой состав и аминокислоты, пенициллин, амфотерицин, L-глутамин и эмбриональную телячью или фетальную бычью сыворотку, достаточные для поддержания жизнеспособности и роста МСК костного мозга человека, отличающаяся тем, что среду получают на стадии стационарного роста культуры стабильной клеточной линии МСК, находящихся в G0 периоде клеточного цикла, а затем среду собирают. К недостаткам указанного способа можно отнести присутствие в составе среды культивирования клеток ксеногенных компонентов, содержащихся в сыворотке крови крупного рогатого скота.
Из уровня техники известно средство для лечения ожогов и ран на основе цитокинов и факторов роста, секретируемых мезенхимными клетками человека, и способ его получения (RU 2455354 С1). Получают средство способом, включающим культивирование МСК жировой ткани человека 2-5 пассажа в среде роста. Проводят отбор и очистку среды культивирования и ее концентрирование до уменьшения исходного объема очищенной среды культивирования в 9-11 раз с получением стерильного концентрата, с последующей его лиофилизацией. Средство содержит продукты секреции МСК человека, включающие FGF basic в концентрации от 2 до 4 пкг/мл, HGF в концентрации от 40 до 80 пкг/мл, VEGF в концентрации от 200 до 800 пкг/мл, ангиопоэтин-1 в концентрации от 0,5 до 10,0 пкг/мл, определяемые методом иммуноферментного анализа при восстановлении лиофилизата в 100 мл стерильного физиологического раствора. При этом среда роста содержит раствор AdvanceSTEM Cell Culture Media и добавки AdvanceSTEM Stem Cell Growth Supplement, состав которых не раскрывается фирмой-производителем.
Из уровня техники известен способ получения композиции для стимуляции роста и регенерации клеток (RU 2341270 С1), содержащей разрушенные клетки лейкоцитов периферической крови и стволовые и/или прогениторные клетки костного мозга человека в кондиционированной среде их культивирования. Способ получения данной композиции предусматривает культивирование указанных клеток в среде, содержащей ксеногенные компоненты - эмбриональную бычью сыворотку.
Из уровня техники также известна композиция, предназначенная для регенерации кожи и слизистых оболочек, содержащая культуральную питательную среду, включающую биологически активные соединения на основе низкомолекулярных пептидов и цитокинов, используемая для культивирования in vitro эукариотических клеток и содержащая продукты жизнедеятельности и ростовые факторы эукариотических клеток, выделяемые ими в питательную среду в процессе культивирования (RU 2455354 С1). В состав композиции входят также МСК человека, а питательная среда - составная часть композиции - содержит ксеногенный компонент (бычью сыворотку).
Эмбриональную бычью сыворотку содержат также композиция для предотвращения или лечения кожных дефектов (WO 2008155659 А2), а также экстракт кондиционированной культуральной среды, предназначенный для наружного применения для усиления роста волос и омоложения кожи (WO 2010038232 А1). В обоих случаях используют МСК, культивируемые в среде, содержащей сыворотку (эмбриональную бычью или полученную из крови взрослого человека), а перед получением экстракта к ней добавляют ростовые факторы. Недостатком указанных композиций является то, что в их состав входят ксеногенные компоненты, а также не определен состав веществ, непосредственно обеспечивающих действие композиции.
Из уровня техники известен способ получения косметического средства на основе продуктов секреции МСК жировой ткани человека (RU 2620342 С1), включающий в качестве основного компонента культуральную среду, кондиционированную МСК жировой ткани человека, содержащую продукты секреции, включающие VEGF в концентрации не менее 4 нг/млн клеток, FGF basic в концентрации не менее 5.8 пкг/млн клеток, PEDF в концентрации не менее 10 нг/млн клеток, PAI-1 в концентрации не менее 35 нг/млн клеток, а также комплекс из других белков. Изобретение обеспечивает стимуляцию регенерации кожи, повышение упругости кожи и улучшение ее эстетических характеристик. К недостаткам данного, а также всех описанных выше способов можно отнести то, что в качестве клеток для получения композиций использованы клетки, полученные от взрослых доноров (костного мозга, жировой ткани и периферической крови), что повышает риск инфицирования потенциального пациента (реципиента) агентами вирусной природы.
Помимо перечисленных, к недостаткам большинства предлагаемых композиций и способов их получения можно отнести отсутствие систематизированных данных о продуцируемых биологически активных молекулах и других составляющих, способных оказывать или потенцировать терапевтическое действие.
Наиболее близким к заявляемому решению является способ получения средства для стимуляции регенерации на основе продуктов секреции МСК человека (RU 2620167 C1), направленный на получения биоматериалов для стимуляции регенерации тканей после повреждения. Способ получения средства включает культивирование МСК жировой ткани в среде, поддерживающей рост недифференцированных клеток человека. Кондиционирование МСК проводят в бессывороточной среде роста. После отбора среды культивирования, содержащей продукты секреции МСК, удаляют из нее остатки клеток и очищают от низкомолекулярных компонентов с последующей лиофилизацией очищенной среды культивирования. Средство содержит продукты секреции МСК человека, включающие факторы роста: VEGF в концентрации не менее 200 пкг/мл, HGF в концентрации не менее 150 пкг/мл, FGF basic в концентрации не менее 0,29 пкг/мл, ангиопоэтин-1 в концентрации не менее 145 пкг/мл, PDGF в концентрации не менее 500 пкг/мл, определяемые методом иммуноферментного анализа при восстановлении лиофилизата в стерильном физиологическом растворе. По мнению авторов, использование полученного средства позволяет эффективно стимулировать регенерацию тканей за счет комплексного сбалансированного действия факторов роста и других биологически активных молекул, секретируемых МСК. К недостаткам данного способа можно отнести использование для изготовления композиции тканей, полученных от взрослых доноров, в частности, жировой ткани, коммерческих сред с нераскрытым производителем составом, а также манипуляций, приводящих к удорожанию конечного продукта.
Данные, касающиеся свойств и использования в регенеративной медицине как МСК, получаемых из стромы пупочного канатика, так и клеток и компонентов пуповинной крови свидетельствуют о несомненных перспективах их применения в терапии достаточно широкого спектра патологических состояний организма, вследствие чего создание новых лекарственных средств для стимуляции регенерации органов и тканей в различных областях медицины является актуальной задачей регенеративной медицины.
Краткое описание изобретения
Впервые предложен способ получения не содержащего клеток и компонентов ксеногенного происхождения терапевтического средства, содержащего природный коктейль цитокинов, факторов роста и других биологически активных молекул, секретируемых в среду культивирования, содержащую сыворотку пуповинной крови, мезенхимальными стромальными клетками (МСК) пупочного канатика человека.
Другим аспектом изобретения является способ получения не содержащего клеток и компонентов ксеногенного происхождения терапевтического средства, содержащего природный коктейль цитокинов, факторов роста и других биологически активных молекул, секретируемых в среду культивирования, содержащую сыворотку пуповинной крови, смешанной культурой МСК пупочного канатика человека и ядросодержащих клеток (ЯСК) пуповинной крови.
Еще одним аспектом изобретения является терапевтическое средство для регенеративной медицины, не содержащее клеток и компонентов ксеногенного происхождения терапевтического средства, содержащего природный коктейль цитокинов, факторов роста и других биологически активных молекул, секретируемых в среду культивирования, содержащую сыворотку пуповинной крови, мезенхимальными стромальными клетками (МСК) пупочного канатика человека.
Еще одним аспектом изобретения является терапевтическое средство для регенеративной медицины, не содержащее клеток и компонентов ксеногенного происхождения терапевтического средства, содержащего природный коктейль цитокинов, факторов роста и других биологически активных молекул, секретируемых в среду культивирования, содержащую сыворотку пуповинной крови, смешанной культурой мезенхимальных стромальных клеток (МСК) пупочного канатика человека и ядросодержащих клеток (ЯСК) пуповинной крови.
Эффективность средств обеспечивается за счет сбалансированного состава и высокого содержания природных компонентов, обладающих противовоспалительным, ангиогенным, иммуномодулирующим, анти-апоптотическим и нейропротекторным эффектом, содержащихся в сыворотке пуповинной крови и продуцируемых клетками в монокультурах или при со-культивировании.
Дополнительно, при осуществлении предложенного изобретения в результате со-культивирования двух типов клеток обеспечивается неожиданно высокая концентрация биологически активных веществ, обладающих терапевтическим действием, значительно превышающих уровень продукции данных молекул МСК по отдельности.
Подробное описание изобретения
Предложен способ получения терапевтического средства, включающий выделение и культивирование МСК с последующей очисткой кондиционированной среды от остатков клеток, замораживанием или лиофилизацией, отличающийся тем, что МСК культивируют в среде, не содержащей продуктов ксеногенного происхождения и содержащей сыворотку пуповинной крови, с получением кондиционированной среды, содержащей продукты жизнедеятельности МСК, причем указанные клетки представляют собой МСК пупочного канатика человека.
Способ получения терапевтического средства, включающий выделение и культивирование МСК с последующей очисткой кондиционированной среды от остатков клеток, замораживанием или лиофилизацией, отличающийся тем, что культивирование МСК пупочного канатика человека осуществляют в среде, не содержащей продуктов ксеногенного происхождения и содержащей сыворотку пуповинной крови, с получением кондиционированной среды, содержащей продукты жизнедеятельности МСК в условиях, описанных в Примерах 1 и 4.
Полученное в результате осуществления предложенного способа терапевтическое средство содержит природный коктейль цитокинов, факторов роста и других биологически активных молекул, секретируемых в среду культивирования МСК пупочного канатика человека, с высокой концентрацией природных компонентов, обладающих противовоспалительным, ангиогенным, иммуномодулирующим, анти-апоптотическим и нейропротекторным эффектом (см. табл. 1), и может быть использовано для регенеративной медицины.
Следовательно, другим аспектом изобретения является терапевтическое средство, полученное культивированием МСК пупочного канатика человека в синтетических средах с сывороткой пуповинной крови человека, поддерживающих жизнеспособность и пролиферацию клеток, и содержащее продукты секреции МСК, включающие факторы G-CSF (гранулоцитарный колониестимулирующий фактор) в концентрации не менее 2000 пг/мл, HGF (фактор роста гепатоцитов) в концентрации не менее 700 пг/мл, IFN-a2 (интерферон альфа-2) в концентрации не менее 10 пг/мл, IL-6 (интерлейкин-6) в концентрации не менее 2000 пг/мл, IL-8 (интерлейкин-8) в концентрации не менее 2000 пг/мл, SCF (фактор стволовых клеток) в концентрации не менее 8 пг/мл, SCGF (фактор роста стволовых клеток) в концентрации не менее 8000 пг/мл, VEGF (фактор роста сосудистого эндотелия) в концентрации не менее 50 пг/мл, FGF (фактор роста фибробластов) в концентрации не менее 15 пг/мл.
Еще одним аспектом изобретения является способ получения терапевтического средства, включающий выделение, культивирование МСК с последующей очисткой кондиционированной среды от остатков клеток, замораживанием или лиофилизацией, отличающийся тем, что МСК культивируют в среде, не содержащей продуктов ксеногенного происхождения и содержащей сыворотку пуповинной крови, совместно с ЯСК пуповинной крови человека с получением кондиционированной среды, содержащей продукты жизнедеятельности МСК и ЯСК, причем указанные клетки МСК представляют собой МСК пупочного канатика человека.
Для осуществления предложенного способа МСК и ЯСК культивируют и со-культивируют в синтетических средах (Dulbecco's Modified Eagle Medium, DMEM или ее смеси с Fisher Modified Medium 12, DMEM/F12) или других средах, поддерживающих жизнеспособность и пролиферацию клеток, в присутствии 1-10% сыворотки пуповинной крови человека (Примеры 1 и 4). Клетки культивируют в пластиковых флаконах (например, Corning-Costar, Nunk или аналогичных) при +37 град. Цельсия, 5% углекислого газа и 100% влажности с применением оборудования и расходных материалов, одобренных для медицинского применения.
Полученное в результате осуществления предложенного способа терапевтическое средство содержит природный коктейль цитокинов, факторов роста и других биологически активных молекул, секретируемых в среду культивирования смешанной культурой МСК пупочного канатика человека и ЯСК пуповинной крови, с высокой концентрацией природных компонентов, обладающих противовоспалительным, ангиогенным, иммуномодулирующим, анти-апоптотическим и нейропротекторным эффектом (см. табл. 1), и может быть использовано для регенеративной медицины.
Следует отметить, что обеспечивается неожиданно высокая концентрация биологически активных веществ, обладающих терапевтическим действием, в результате со-культивирования двух типов клеток, значительно превышающих уровень продукции данных молекул МСК по-отдельности, причем увеличение продукции факторов происходит при наличии в культуре МСК незначительного количества ЯСК (в ходе 1-2 недельного сокультивирования число ЯСК в целом сокращалось в среднем с 1 на 3-4 МСК до 1 на 6-10 МСК). Таким образом, добавление к культуре МСК клеток ЯСК увеличивает продукцию факторов МСК.
Следовательно, еще одним аспектом изобретения является терапевтическое средство, полученное со-культивированием МСК пупочного канатика и ядросодержащих клеток пуповинной крови человека в синтетических средах, поддерживающих жизнеспособность и пролиферацию клеток с сывороткой пуповинной крови человека, и содержащее продукты секреции МСК и ЯСК человека, включающие факторы G-CSF (гранулоцитарный колониестимулирующий фактор) в концентрации не менее 5000 пг/мл, HGF (фактор роста гепатоцитов) в концентрации не менее 500 пг/мл, IFN-a2 (интерферон альфа-2) в концентрации не менее 50 пг/мл, IL-6 (интерлейкин-6) в концентрации не менее 5000 пг/мл, IL-8 (интерлейкин-8) в концентрации не менее 1000 пг/мл, SCF (фактор стволовых клеток) в концентрации не менее 50 пг/мл, SCGF (фактор роста стволовых клеток) в концентрации не менее 10000 пг/мл, VEGF (фактор роста сосудистого эндотелия) в концентрации не менее 500 пг/мл, FGF (фактор роста фибробластов) в концентрации не менее 25 пг/мл.
Полученные в результате осуществления данного изобретения терапевтические средства могут быть использованы для наружного применения (в виде спрея, глазных капель, капель в нос) или внутритканевого применения в виде инъекций, а также в сочетании с биосовместимыми носителями (гелями, губками, кремами).
Изобретение иллюстрируется следующими примерами.
Пример 1. Выделение и культивирование МСК пупочного канатика человека.
Для выделения МСК используют фрагменты пупочных канатиков, получаемых во время нормальных родов от обследованных рожениц, подписавших информированное согласие. Выделение и культивирование клеток проводят в условиях сертифицированной лаборатории (чистые помещения, ГОСТ Р ИСО 14644) с использованием оборудования и расходных материалов, одобренных для медицинского применения.
Фрагмент пуповины с наложенными клипсами обтирают от крови стерильной салфеткой, обрабатывают способом орошения раствором «Октенидерм» и дают стечь избытку антисептика. Вырезают фрагмент длиной около 5-7 см; споласкивают от антисептика окунанием в пробирку со сбалансированным солевым раствором (раствор Хенкса, Эрла или физиологический раствор). С помощью стерильного инструмента измельчают фрагменты до получения кусочков ткани размером 1-2 мм. Добавляют 15-30 мл 0.1% раствора коллагеназы на среде без сыворотки и инкубируют на водяной бане в течение 1.5-3 часов при +37 град. Цельсия. Содержимое регулярно перемешивают. Полученную клеточную суспензию распределяют в пробирки объемом 50 мл и центрифугируют 15 минут при 1500-2000 об/мин. Надосадочную жидкость удаляют. Клеточный осадок ресуспендируют в среде культивирования (среда DMEM или DMEM/F-12 с добавлением антибиотиков и 10% эмбриональной телячьей сыворотки) и высевают в культуральные флаконы. Флаконы помещают в СО2-инкубатор. Через 48-72 часа среду культивирования с неприкрепившимися клетками удаляют. В каждый флакон добавляют свежую среду культивирования. Повторные смены среды проводят через 48-72 часов. При появлении клеточных колоний, занимающих более 50% поверхности флакона, производят пересев на новые флаконы. Для этого, культуры отмывают от среды культивирования стерильным солевым раствором и инкубируют в растворе трипсина-версена (1:1), подогретого до температуры +37 град. Цельсия. После открепления клеток в каждый флакон добавляют 10-25 мл среды культивирования; содержимое перемешивают пипетированием. Клеточную суспензию распределить в новые флаконы; через 24-48 часов проводят замену среды культивирования. По мере роста клеток их пересевают в новые флаконы или замораживают для длительного криогенного хранения.
Пример 2. Выделение ЯСК пуповинной крови человека (ЯСК-ПК).
Заготовку пуповинной крови проводят в стерильные емкости (системы для заготовки донорской крови), содержащие изотонический антикоагулянт, с соблюдением предосторожностей, исключающих инфицирование материала в процессе забора и транспортировки. Материал доставлялся в лабораторно-производственный комплекс в изотермическом транспортном контейнере при комнатной температуре. Все процедуры по выделению ядросодержащих клеток пуповинной крови выполняют в соответствии с национальным стандартом Российской Федерации ГОСТ Р 52249-2004 «Правила производства и контроля качества лекарственных средств» с использованием технологии, одобренной для медицинского применения.
После измерения объема пуповинной крови отбирают аликвоты для проведения гематологического анализа (содержание форменных элементов до выделения, группа крови, резус-фактор). Для получения ЯСК-ПК в контейнер с кровью добавляют 6% раствор гидроксиэтилкрахмала (ГЭК) из расчета 1 объем ГЭК к 4 объемам крови и перемешивают в течение 10-15 минут. Содержимое контейнера переносят в пробирки объемом 50 мл, центрифугируют 5 минут при 90 g и оставляют на 10-15 минут для формирования видимого раздела между обогащенной лейкоцитами плазмой и осадком эритроцитов. Обогащенную лейкоцитами плазму отбирают в отдельные пробирки и центрифугируют 10 минут при 600g для осаждения клеточных элементов. Полученные клеточные осадки ресуспендируют в аутологичной плазме. Аликвоты плазмы и клеточных суспензий используют для постановки тестов на стерильность, выявления возбудителей гемотрансмиссивных инфекционных заболеваний, подсчета числа клеток и их жизнеспособности по тесту с трипановым синим, определения содержания CD34/CD45-позитивных клеток методом проточной цитометрии. К оставшемуся объему плазмы добавляют диметилсульфоксид (ДМСО) до конечной концентрации 20%. К суспензии клеток капельно при постоянном перемешивании добавляют равный объем плазмы с ДМСО. Полученный материал распределяют в криопробирки и подвергают программному замораживанию, после чего переносят на хранение в сосуд Дюара с жидким азотом.
Образцы пуповинной крови тестируют на предмет выявления возбудителей гемотрансмиссивных инфекционных заболеваний: вируса иммунодефицита человека, вирусов гепатитов В и С, вируса Т-клеточного лейкоза, вирусов простого герпеса 1 и 2 типа, цитомегаловируса, возбудителей токсоплазмоза, сифилиса, бактериальных и грибковых агентов. Образцы, не прошедшие тест биологической безопасности, утилизируют в соответствии с действующим законодательством.
Пример 3. Получение сыворотки пуповинной крови человека.
Заготовку ПК проводят у обследованных рожениц после подписания информированного согласия. Кровь собирают в мешки донорской системы (GreenCross, Корея или аналогичные) после удаления из них раствора антикоагулянта. Образцы крови оставляют на 24 часа при комнатной температуре для формирования сгустка. В стерильных условиях (чистые помещения, ГОСТ Р ИСО 14644, ламинарный шкаф II класса биологической защиты) сыворотки отбирают, переносят в стерильные центрифужные пробирки на 50 мл и осветляют центрифугированием при 3000 g в течение 30 минут. Из каждого образца отбирают аликвоты для проведения тестов на гемотрансмиссивные инфекции (ВИЧ-1/2, гепатиты В и С, ВПГ-1/2, цитомегаловирус, токсоплазмоз, сифилис). Оставшиеся сыворотки переносят в чистые пробирки, замораживают и хранят при -18 град. Цельсия. После получения результатов тестирования, серо- и(или) ПЦР-позитивные образцы сывороток утилизируют в установленном порядке. Оставшиеся образцы размораживают, объединяют (по 10-15 для каждой серии), стерилизуют фильтрованием через мембранные фильтры с размером пор 0.22 мкм и расфасовывают. Хранение СПК осуществляют при температуре, не превышающей -18 град. Цельсия.
Пример 4. Co-культивирование МСК и ЯСК-ПК.
Клетки ПК размораживают, отмывают от криопротектора в избыточном количестве среды культивирования и ресуспендируют в среде культивирования в концентрации около 5×106/мл. Полученную суспензию добавляют к культуре МСК на 48 часов, после чего среду с неприкрепившимися клетками удаляют и заменяют на свежую. Последующие смены сред культивирования проводят с интервалом 2-3 суток. Примерно через 1 неделю, когда прикрепившиеся ЯСК начинают активно пролиферировать и формировать колонии, начинают отбор кондиционированных сред.
Пример 5. Получение кондиционированной среды.
Для получения кондиционированной среды проводят отмывку культур и замену среды культивирования на среду, содержащую 1-10% сыворотки пуповинной крови, и продолжают культивирование клеток в течение 48 часов. Повторно заменяют среду культивирования. Через 48-72 часа кондиционированную среду отбирают в стерильные пробирки и освобождают от клеточного дебриса центрифугированием при 3000 об/мин в течение 30 минут. Для получения дополнительных количеств кондиционированной среды процедуру повторяют на протяжении 1-2 недель. Полученные среды разделяют на аликвоты и хранят при температуре +4-8 град. С, замораживают и хранят при температуре, не превышающей -18 град. Цельсия или лиофилизируют.
Пример 6. Анализ продуктов секреции МСК и совместной культуры МСК и ЯСК.
Анализ продуктов секреции проводили в аликвотах кондиционированных сред после их размораживания с помощью наборов «Bio-Plex Pro Human Cytokine Group I Assay» (Eotaxin, FGF-basic, G-CSF, GM-CSF, IFN-γ, IL-β, IL-1Ra, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8/CXCL8, IL-9, IL-10, IL-12(p70), IL-13, IL-15, IL-17α, IP-10, MCP-1, MIP-1a, MIP-1β, PDGF-BB, RANTES, TNF-α, VEGF) и «Bio-Plex Pro Human Cytokine Group II Assay» (CTACK, Gro-α, HGF, IFN-α2, IL-1α, IL-2Ra, IL-3, IL-12(p40), IL-16, LIF, MCP-3, M-CSF, MIG/CXCL9, NGF-β, SCF, SCGF-β, SDF-1α+β/CXCL12, TNF-β, TRAIL) фирмы Био-Рад в соответствии с инструкциями изготовителя. Результаты определения представлены в Таблице 1.
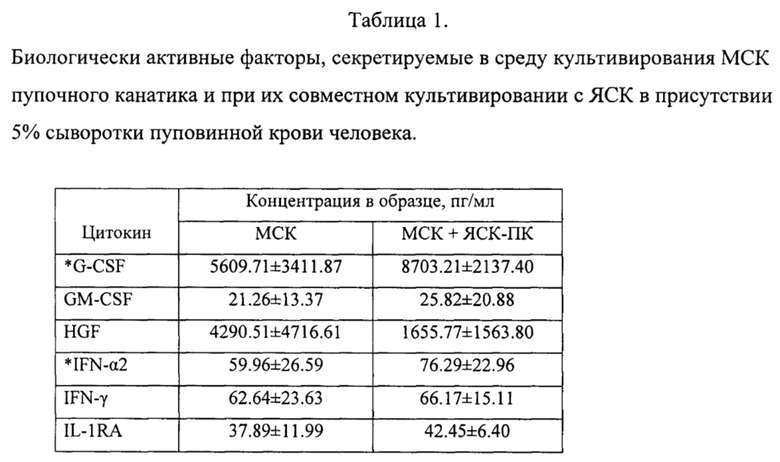
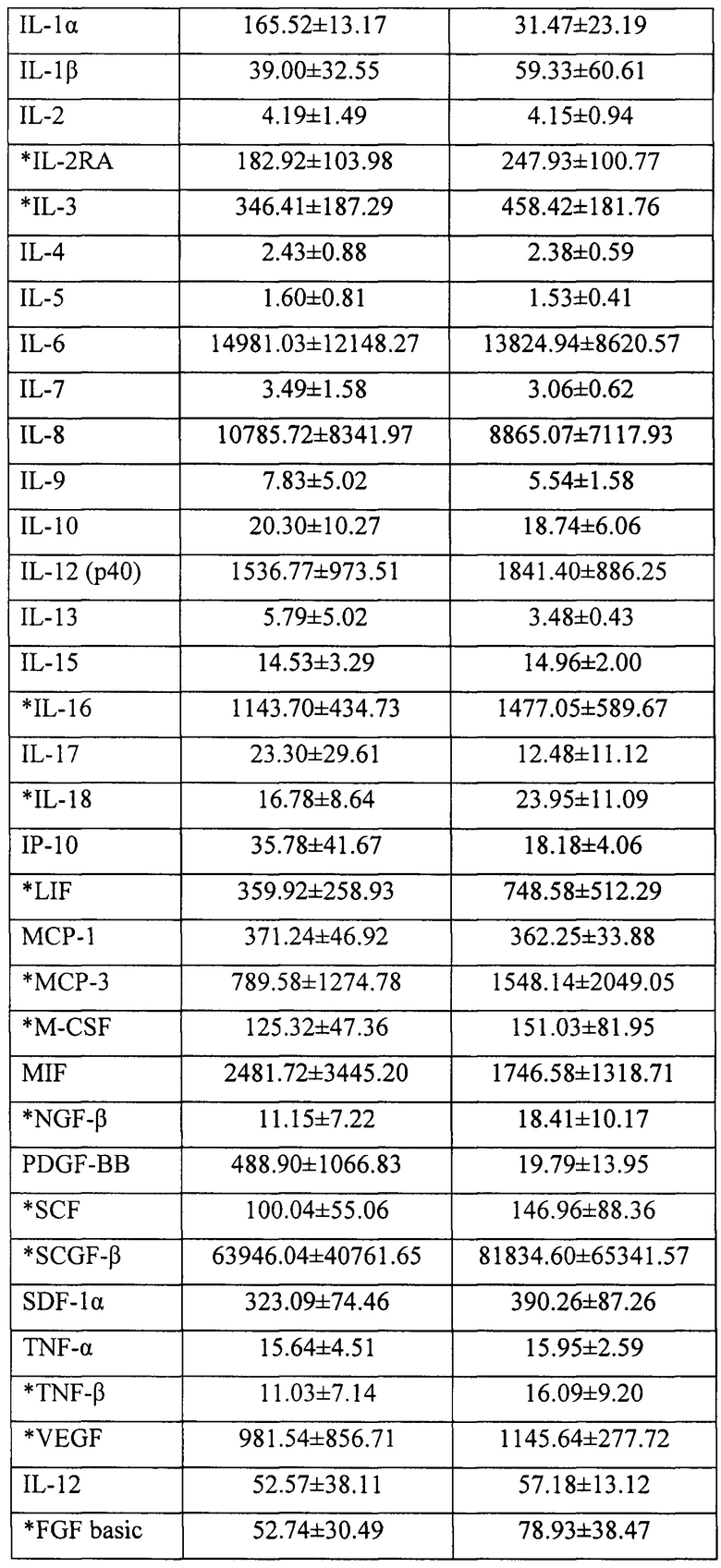
Сокращения: EGF - эпидермальный ростовой фактор; FGF - фактор роста фибробластов; G-CSF - гранулоцитарный колоние-стимулирующий фактор; GM-CSF - гранулоцитарно-макрофагальный колоние-стимулирующий фактор; GRO-связанный с ростом онкоген; HGF - фактор роста гепатоцитов; IFN - интерферон; IL - интерлейкин; IP - интерферон-гамма-индуцируемый белок; МСР - моноцитарный хемоаттрактант; MIP - макрофагальный воспалительный белок; NGF - фактор роста нервов; PDGF - тромбоцитарный фактор роста; RANTES - экспрессируемый и секретируемый Т-клетками, регулируемый при активации) SCGF - фактор роста стволовых клеток; SDF - стромальный (ростовой) фактор; SCF - фактор (роста) стволовых клеток; TGF - трансформирующий ростовой фактор; TNF - фактор некроза опухолей; VEGF - фактор роста сосудистого эндотелия.
Примечание: (*) - содержание аналита в кондиционированной среде, полученной при со-культивировании МСК и ЯСК-ПК, превышает его концентрацию в средах, полученных от культур МСК, причем увеличение продукции факторов происходит при наличии в культуре МСК незначительного количества ЯСК (в ходе 1-2 недельного сокультивирования число ЯСК в целом сокращалось в среднем с 1 на 3-4 МСК до 1 на 6-10 МСК). Таким образом, добавление к культуре МСК клеток ЯСК увеличивает продукцию факторов МСК.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения мультипотентных стромальных клеток из криозамороженных тканей фетоплацентарного комплекса | 2015 |
|
RU2610132C1 |
| СПОСОБ ЛЕЧЕНИЯ ПОСТТРАВМАТИЧЕСКОЙ ЭНЦЕФАЛОПАТИИ | 2009 |
|
RU2413523C2 |
| Способ получения ассоциатов гемопоэтических и стромальных клеток-предшественников, способных подавлять активацию и пролиферацию аллогенных лимфоцитов | 2019 |
|
RU2722669C1 |
| Способ получения МСК-ассоциированных недифференцированных гемопоэтических клеток-предшественников с фенотипов CD34+/CD133+ | 2016 |
|
RU2628092C1 |
| Способ получения аутологичного лизата тромбоцитов в качестве основы для клеточных биомедицинских препаратов ветеринарной медицины | 2020 |
|
RU2732150C1 |
| СПОСОБ ЛЕЧЕНИЯ ПСИХИЧЕСКИХ И НЕВРОЛОГИЧЕСКИХ РАССТРОЙСТВ | 2009 |
|
RU2413524C1 |
| Средство для сдерживания гибели нейронов при ишемическом инсульте головного мозга и способ клеточно-опосредованной генной терапии ишемического инсульта головного мозга средством сдерживания гибели нейронов при ишемическом инсульте головного мозга | 2017 |
|
RU2676701C1 |
| СПОСОБ ПОЛУЧЕНИЯ МУЛЬТИПОТЕНТНЫХ МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК ИЗ ПУПОЧНОГО КАНАТИКА НОВОРОЖДЕННОГО | 2020 |
|
RU2744301C1 |
| СПОСОБ СТИМУЛИРОВАНИЯ РЕГЕНЕРАЦИИ СПИННОГО МОЗГА С ПОМОЩЬЮ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК, ЗАКЛЮЧЕННЫХ В ФИБРИНОВЫЙ МАТРИКС | 2016 |
|
RU2650638C1 |
| СПОСОБ ПОЛУЧЕНИЯ КУЛЬТУРЫ МЕЗЕНХИМНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА ИЗ ПЕРИВАСКУЛЯРНОГО ПРОСТРАНСТВА ВЕНЫ ПУПОЧНОГО КАНАТИКА | 2015 |
|
RU2620981C2 |
Изобретение относится к медицине, а именно к терапевтическому средству для регенеративной медицины. Терапевтическое средство для регенеративной медицины, представляющее собой бесклеточную кондиционированную среду, содержащую продукты секреции мезенхимальных стромальных клеток (МСК) человека, включающее факторы: G-CSF (гранулоцитарный колониестимулирующий фактор), HGF (фактор роста гепатоцитов), IFN-a2 (интерферон альфа-2), IL-6 (интерлейкин-6), IL-8 (интерлейкин-8), SCF (фактор стволовых клеток), SCGF (фактор роста стволовых клеток), VEGF (фактор роста сосудистого эндотелия), FGF (фактор роста фибробластов), взятые в определенном соотношении, причем бесклеточная кондиционированная среда содержит продукты секреции МСК, полученная путем культивирования мезенхимальных стромальных клеток пупочного канатика человека в присутствии сыворотки пуповинной крови человека, с последующей очисткой кондиционированной среды от остатков клеток, замораживанием или лиофилизацией. Вышеописанное средство, не содержащее клеток и компонентов ксеногенного происхождения, содержит природный коктейль цитокинов, факторов роста и других биологически активных молекул, что обеспечивает стимуляцию регенерации. 1 табл., 6 пр.
Терапевтическое средство для регенеративной медицины, представляющее собой бесклеточную кондиционированную среду, содержащую продукты секреции мезенхимальных стромальных клеток (МСК) человека, включающее факторы:
G-CSF (гранулоцитарный колониестимулирующий фактор) в концентрации не менее 2000 пг/мл,
HGF (фактор роста гепатоцитов) в концентрации не менее 700 пг/мл,
IFN-a2 (интерферон альфа-2) в концентрации не менее 10 пг/мл,
IL-6 (интерлейкин-6) в концентрации не менее 2000 пг/мл,
IL-8 (интерлейкин-8) в концентрации не менее 2000 пг/мл,
SCF (фактор стволовых клеток) в концентрации не менее 8 пг/мл,
SCGF (фактор роста стволовых клеток) в концентрации не менее 8000 пг/мл,
VEGF (фактор роста сосудистого эндотелия) в концентрации не менее 50 пг/мл,
FGF (фактор роста фибробластов) в концентрации не менее 15 пг/мл,
причем бесклеточная кондиционированная среда содержит продукты секреции МСК, полученная путем культивирования мезенхимальных стромальных клеток пупочного канатика человека в присутствии 1-10%-ной сыворотки пуповинной крови человека, с последующей очисткой кондиционированной среды от остатков клеток, замораживанием или лиофилизацией.
| РОМАНОВ Ю.А., БАЛАШОВА Е.Е., и др | |||
| Сыворотка пуповинной крови человека: эффективная замена эмбриональной телячьей сыворотки для культивирования мультипотентных мезенхимных стромальных клеток человека//Клеточные технологии в биологии и медицине | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| С | |||
| Кузнечный горн | 1921 |
|
SU215A1 |
| Romanov Y.A., Balashova E.E., et al | |||
| Expression of surface molecules in human | |||
Авторы
Даты
2021-02-01—Публикация
2018-10-04—Подача