Изобретение относится к методам количественного определения действующих лекарственных веществ в растительном сырье и в получаемых из него препаратах, может быть использовано в химико-фармацевтической и пищевой областях промышленности.
Одной из актуальных задач в химии природных соединений является возможность их количественного определения в различных объектах (вытяжках из растительного материала, экстрактах, концентратах отходов пищевых производств). Для ее решения наиболее широко применяются физико-химические методы, в частности УФ-спектрофотометрия. Большинство приводимых в литературе методик основаны на прямом измерении концентрации гликозидов в растворе или измерении интенсивности окраски комплексных соединений с различными реагентами (например, серной кислотой). Известен способ количественного определения суммы тритерпеновых сапонинов в корневищах с корнями синюхи [Патент BY 12568 С1 2009.10.30. Голяк Ю.А., Хишова О.М., Кухарева Л.В.], заключающийся в экстракции сапонинов из навески растительного сырья и их взаимодействии с концентрированной серной кислотой. Измеряют оптическую плотность продукта реакции при длине волны (λ) 321 нм и рассчитывают содержание суммы сапонинов в пересчете на эсцин. Аналогичным образом определяют содержание стероидных сапонинов и их сапогенинов в работе [Патент №1043560, Способ определения стероидных сапонинов и сапогенинов, Кемертелидзе Э.П., Сулаквелидзе Ц.П., Чирикашвили М.Г., опубл. 23.09.1983.]. Измеряют оптическую плотность на фотоколориметре (с использованием светофильтра 400 нм, в кюветах толщиной слоя 10 см) продукта взаимодействия раствора сапонинов с уксусным ангидридом в серной кислоте.
Воспроизводимость перечисленных методик в условиях лаборатории крайне низка, что обусловлено несколькими факторами:
- измерение оптической плотности окрашенных комплексов гликозидов (сапонинов) подразумевает отсутствие взаимодействия реагентов (серной кислоты) с остальными компонентами раствора. В большинстве вытяжек из растительного материала помимо целевых компонентов содержатся побочные соединения, способные взаимодействовать с образованием окраски, что значительно увеличивает ошибку анализа.
- прямое измерение оптической плотности растворов гликозидов сопряжено с рядом трудностей, обусловленных идентификацией пиков. Низкая воспроизводимость максимумов поглощения сапонинов может быть связана с изменением соотношения индивидуальных гликозидов во фракции в зависимости от технологического способа их получения. Указанные в литературе максимумы поглощения - 205, 210, 220, 280, 350 нм не идентифицированы [United State Patent Number 5,650,398 А/ Drug delivery enhancement via modified saponins / Charlotte A. Kensil [et al.]; Cambridge Biotech Corporation. - US 08/459,502; заявл. 02.06.1995; опубл. 22.07.1997. - 40 p. LeeHu. J. Quantification of the group В soy a saponins by high-performance liquid chromatography / H.J. Lee, S. Hendrich, S. Murphy // Journal Agricultural and Food Chemistry. - 2002. - №50. - P. 2587-259.], Поэтому количественное определение гликозидов прямой УФ-спектрофотометрией затруднено.
Известна методика определения сапонинов-производных олеаноловой кислоты, приводимая в патенте [Способ определения тритерпеновых сапонинов в растительном сырье и лекарственных препаратах, патент РФ №2413951, Мироненко Н.В., Брежнева Т.А., Селеменев В.Ф., опубл. 10.03.2011.]. Предлагаемый способ наиболее близок по техническому решению и является прототипом. Способ определения тритерпеновых сапонинов в растительном сырье и лекарственных препаратах, включающий приготовление сапониносодержащей фракции, определение ее оптической плотности и расчет содержания сапонинов по предварительно построенному калибровочному графику, где для приготовления фракции в качестве растворителя используют смесь вода: аммиачный буфер 1:1, оптическую плотность (D) определяют при λ=210 нм, а содержание сапонинов рассчитывают в пересчете на олеаноловую кислоту.
Основным недостатком методики является невозможность ее использования для количественного определения сапонинов, углеводная часть которых может поглощать в области, характерной для их агликона. В УФ и видимом диапазоне длин волн спектр поглощения гликозидов - крупных органических молекул будет представлять собой широкие перекрывающиеся полосы и существенно затруднять их интерпретацию.
Оценка суммарного спектра малоинформативна и не учитывает вклад отдельных компонент. Подробное исследование спектральных свойств сапонинов, а именно оценка вклада хромофоров их функциональных групп в общий спектр поглощения может исключить влияние примесных соединений на спектральные характеристики и применять прямую спектрофотометрию более обоснованно.
Увеличения разрешения в таких спектрах можно достичь с помощью дифференцирования. Физический смысл производной заключается в том, что оценивается мгновенная скорость изменения дифференцируемой величины, в данном случае поглощения. Повторное дифференцирование будет означать скорость изменения скорости (ускорение в классической механике) и т.д. Следовательно, производные различных порядков позволяют оценить степень "выраженности изменения" исследуемой величины, что дает возможность идентифицировать плохо разрешенные переходы в молекуле. Для производной первого порядка отсутствие изменений прироста величины обращает ее в нуль, что означает наличие экстремума в исходном спектре. Однако для второй производной эта нулевая точка будет представлять собой экстремум - минимальный прирост величины относительно соседних точек, что соответствует пику поглощения (плохо разрешенному переходу) недифференцированного спектра.
Техническая задача состоит в разработке способа количественного определения в различных объектах (вытяжках из растительного материала, лекарственных препаратах) тритерпеновых сапонинов группы β-амирина, углеводная часть которых может поглощать в области, характерной для их агликона.
Технический результат заявленного изобретения заключается в разработке экспрессного, универсального, не требующего пробоподготовки способа количественного определения тритерпеновых сапонинов группы β-амиринав вытяжках из растительного материала, лекарственных препаратах, с рабочим диапазоном концентраций 0,002-8 мг/мл, с относительной ошибкой анализа, не превышающей 7,5%,с пределом количественного определения - 30 мкг в 1 мл раствора, с учетом вклада хромофоров функциональных групп сапонинов за счет разделения максимумом и их идентификации, с возможностью исключения влияния примесных соединений на точность определения (ошибку анализа).
Технический результат заключается в том, что в способе определения тритерпеновых сапонинов группы β-амирина в растительном сырье и лекарственных препаратах на их основе, включающем приготовление сапонинсодержащей фракции, определение ее оптической плотности и расчет содержания сапонинов по предварительно построенному градуировочному графику, согласно изобретению концентрацию тритерпеновых сапонинов группы β-амирина рассчитывают при уточненной дифференциальной спектрофотометрией длине волны максимума поглощения λ=193,5 нм в диапазоне концентраций сапонина в водном растворе - 0,002-1 мг/мл или при λ=280,5 нм в диапазоне концентраций сапонина в водном растворе - 0,5-8 мг/мл, определяемых по УФ-спектрам водных растворов сапонинов.
Спектры поглощения водных растворов сапонинов в диапазоне 190-350 нм зарегистрированы на спектрофотометре Shimadzu UV-2401(PC) (Япония), спектральная ширина щели 0.5 нм, шаг сканирования 0.5 нм, скорость сканирования соответствовала режиму Slow. Измерения проведены в стандартных кварцевых кюветах с оптическими длинами пути 10, 5 и 2 мм. Общая структурная формула сапонинов Quillaja Saponaria Molina приведена на Фиг. 1.
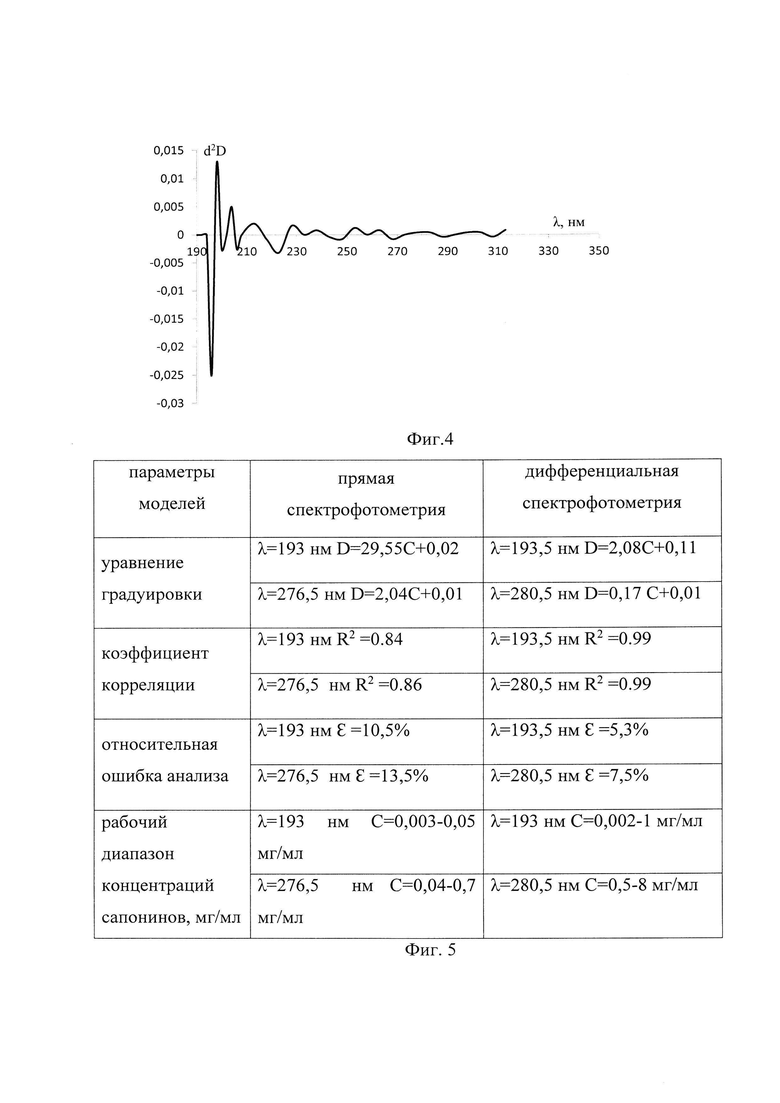
На Фиг. 2 представлены УФ-спектры поглощения водного раствора тритерпенового сапонина группы β-амирина, толщина кюветы 1-2 мм, 2-5 мм, 3-10 мм.
На Фиг. 3 приведены дифференциальные спектры поглощения тритерпенового сапонина группы β-амирина.
На Фиг. 4 представлен дифференцированный спектр агликона сапонинов-квиллайевой кислоты.
На Фиг. 5 приведены основные параметры градуировочных моделей, построенных по результатам прямой и дифференциальной спектрофотометрии, где D - оптическая плотность, λ - длина волны, R - коэффициент корреляции, ε - относительная ошибка.
На полученных кривых (фиг. 2) наблюдаются локальные максимумы поглощения при λ=193,0 и λ=276,5 нм. Анализ литературных данных [Браун Д. Спектроскопия органических веществ / Д. Браун, А. Флойд, М. Сейнзбери: пер. с англ. А.А. Кирюшкина. - М: Мир, 1992 г. - 300 с.]позволил отнести максимум при 193,0 нм (ε=4400) к π-π*- переходу в двойной связи системы колец агликона - квиллайевой кислоты и n-π-переходу карбонильных групп. Второй максимум поглощения низкой интенсивности обусловлен n-π-переходом в карбонильных группах агликона и углеводных остатках. Положение и интенсивность данного максимума не позволяет сделать однозначного вывода о его природе.
Увеличение разрешения в спектрах поглощения образцов достигалось вычислением второй производной. Необходимые расчеты выполнены с помощью программного средства Microsoft Excel (Microsoft, США). Поскольку спектр сапонина состоит из вкладов отдельных хромофоров, его дифференциальный спектр (фиг. 3) достаточно сложен для анализа. Кроме гетерогенности, создаваемой различного вида хромофорными группами, в молекуле сапонина возникает гетерогенность вследствие вклада одинаковых хромофорных групп, находящихся в различном структурном состоянии и имеющих по-разному смещенные спектры поглощения.
Помимо максимума при λ=193,0 нм, присутствующего в основном спектре, выявлен сопоставимый по интенсивности максимум при λ=196,0 нм. С увеличением числа конденсированных колец, образующих делокализованную систему π-электронов, происходит длинноволновое смещение спектров, соответствующих этим переходам. Появление алкильного заместителя в кольце приводит к сдвигу спектра поглощения в направлении больших длин волн и возрастанию его интенсивности(в результате смещения электронной плотности вдоль оси связи при действии индуктивного и резонансного механизмов). Из [Браун Д. Спектроскопия органических веществ / Д. Браун, А. Флойд, М. Сейнзбери: пер. с англ. А.А. Кирюшкина. - М: Мир, 1992 г. -300 с.] известно, что карбонильная группа поглощает в двух областях: при λ=190 и λ=274-280 нм с меньшей энергией перехода.
На спектре (фиг. 4) раствора агликона сапонинов- квиллайевой кислоты, из которого видно, что основной максимум поглощения, соответствующий π-π*-переходу в двойной связи системы колец агликона, наблюдается при длине волны 193,5 нм. Таким образом, в спектре сапонина максимум при 196,0 нм отвечает за поглощение карбонильных групп, 193,5 нм - соответствует поглощению двойной связи. В общем спектре наблюдается один суммарный максимум, определение по которому сапонинов в пересчете на агликон некорректно в случае наличия карбонильных групп в их структуре.
Положение полосы карбонильной группы зависит от природы заместителя. Увеличение размера углеводородного радикала (числа алкильных групп) приводит к батохромному сдвигу и увеличению интенсивности поглощения. Дифференциальный максимум при 226,5 нм обусловлен наличием сопряженных групп С=O в углеводной цепочке молекулы сапонина, при 274, 280,5 нм - наличием свободных карбонильных групп в молекуле сапонина. Полосы при 274, 280,5 нм соответствуют n-π* переходам и определяются только в областях больших концентраций, давая суммарный неразделенный максимум в общем спектре. Сопряженные карбонильные группы (в жирных кислотах) определяются батохромным сдвигом полосы π-π* (от 180 до 193 нм) и гипсохромным сдвигом n-л перехода - от 279 до 226,5 нм (т.е. сближение полос поглощения в спектре). Таким образом, наличие данных полос в спектре позволяет судить о присутствии углеводных остатков в структуре гликозида (моно- или бидесмозида).
Были получены градуировочные зависимости, построенные на основании результатов измерения оптической плотности рабочих растворов сапонина прямой (при длине волны 193, 276,5 нм) и дифференциальной (193,5 280,5 нм) УФ-спектрофотометрией.
Из данных таблицы (фиг. 5) следует, что градуировка по уточненным длинам волн характеризуется меньшей ошибкой анализа, а за счет снижения коэффициента чувствительности - увеличением рабочего диапазона концентраций сапонинов в водном растворе.
Предложенный способ позволяет значительно сократить время пробоподготовки фракций сапонинов, полностью исключить стадию гидролиза для получения агликона и характеризуется меньшей ошибкой определения.
Пример 1.
На первой этапе проводят построение градуировочного графика. Для этого исходные растворы сапонина готовят растворением точной навески (около 1,0 г) с последующим приготовлением серии рабочих растворов путем разбавления исходных до диапазона концентраций 0,5-8 мг/мл для измерения при 280,5 нм. Спектрофотометрические измерения проводят с использованием спектрофотометра Shumadzu. Используя раствор средней концентрации (1 мг/мл), снимают спектр поглощения в диапазоне длин волн 180-300 нм, проводят дифференцирование результатов зависимости оптической плотности от длины волны и устанавливают уточненный максимум поглощения сапонина (λ=280,5 нм).
С целью снижения случайных ошибок фотометрических измерений, обусловленных тепловым шумом фотодетектора, спектры поглощения сглаживали и аппроксимировали кубическими сплайнами с помощью оснастки Curve Fitting Toolbox (Mathworks MATLAB). Дополнительная фильтрация шумов при анализе второй производной осуществлялась аппроксимацией спектров поглощения с применением окна Кайзера-Бесселя с низкочастотной фильтрацией. Вычисление второй производной спектра поглощения осуществлялось методом центральной конечной разности в среде Mathworks MATLAB.
В установленном максимуме поглощения получают градуировочную зависимость оптической плотности растворов сапонина от их концентрации. Проводятся первичные извлечения из сырья исчерпывающей щелочной экстракцией при нагревании до 80°С (рН=11,0). Для доочистки полученных фракций применяют циркуляционное экстрагирование в аппарате Сокслета, используя в качестве органического экстрагента ацетон. Осаждение полученных сапонинов проводят в кислой среде с рН=2-3 (выход продукта составляет в среднем 70%).
Навеску выделенных из растительного сырья сапонинов, массой около 0,25 г растворяют в мерной колбе вместимостью 100,00 мл в дистиллированной воде. Полученный раствор спектрофотометрируют при λ=280,5 нм. В качестве раствора сравнения используют дистиллированную воду. Содержание сапонинов рассчитывают по следующему уравнению градуировочной кривой, полученному как описано выше:
C=(D-0,01)/0,17 при λ=280,5 нм при диапазоне концентраций 0,5-8 мг/мл с относительной ошибкой анализа 7,5%.
Время анализа не более 20 минут.
Относительная ошибка определения (с учетом стадии выделения) в растительном сырье составляет 8%.
Пример 2. Количественное определение сапонинов группы β-амирина в лекарственных препаратах.
Проводят построение градуировочного графика. Для этого исходные растворы сапонина готовят растворением точной навески (около 1,0 г) с последующим приготовлением серии рабочих растворов путем разбавления исходных до нужной концентрации 0,5-8 мг/мл для измерения при 280,5 нм. Спектрофотометрические измерения проводят с использованием спектрофотометра Shumadzu. Используя раствор средней концентрации (1 мг/мл), снимают спектр поглощения в диапазоне длин волн 180-300 нм, проводят дифференцирование результатов зависимости оптической плотности от длины волны и устанавливают максимум поглощения сапонина (λ=280,5 нм).
С целью снижения случайных ошибок фотометрических измерений, обусловленных тепловым шумом фотодетектора, спектры поглощения сглаживали и аппроксимировали кубическими сплайнами с помощью оснастки Curve Fitting Toolbox (Mathworks MATLAB). Дополнительная фильтрация шумов при анализе второй производной осуществлялась аппроксимацией спектров поглощения с применением окна Кайзера-Бесселя с низкочастотной фильтрацией. Вычисление второй производной спектра поглощения осуществлялось методом центральной конечной разности в среде Mathworks MATLAB.
В случае наличия оболочки (капсулы), ее удаляют, таблетку измельчают. Затем точную навеску около 0,5 г (в расчете на содержание сапонинов в препарате, соответствующее диапазону концентраций градуировочного графика) таблетки измельчают и растворяют в дистиллированной в воде в мерной колбе на 100,00 мл. Полученный раствор спектрофотометрируют при λ=280,5 нм.
В установленном максимуме поглощения получают градуировочную зависимость оптической плотности растворов сапонина от их концентрации. В качестве раствора сравнения используют дистиллированную воду. Содержание сапонинов рассчитывают по следующему уравнению градуировочной кривой, полученному как описано выше: С=(D-0,01)/0,17 для измерения при 280,5 нм при диапазоне концентраций 0,5-8 мг/мл.
Время анализа не более 20 минут.Источники информации:
1. United State Patent Number 5,650,398А / Drug delivery enhancement via modified saponins / Charlotte A. Kensil [et al.]; Cambridge Biotech Corporation. - US 08/459,502; заявл. 02.06.1995; опубл. 22.07.1997. - 40 р.
2. Lee Hu. J. Quantification of thegroup В soyasaponins by high-performance liquid chromatography / H.J. Lee, S. Hendrich, S. Murphy // Journal Agricultural and Food Chemistry. - 2002. - №50. - P. 2587-2594
3. Способ определения тритерпеновых сапонинов в растительном сырье и лекарственных препаратах, патент РФ №2413951. Мироненко Н.В., Брежнева Т.А., Селеменев В.Ф.
4. Браун Д. Спектроскопия органических веществ / Д. Браун, А. Флойд, М. Сейнзбери: пер. с англ. А.А. Кирюшкина. - М: Мир, 1992 г. - 300 с.
5. Анисимова Н.А. Идентификация органических соединений: учебное пособие (для студентов, обучающихся по специальности «Химия»). - ГорноАлтайск: РИО ГАГУ, 2009. 95 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ТРИТЕРПЕНОВЫХ САПОНИНОВ В РАСТИТЕЛЬНОМ СЫРЬЕ И ЛЕКАРСТВЕННЫХ ПРЕПАРАТАХ | 2009 |
|
RU2413951C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ САПОНИНОВ В ТРАВЕ ГИНОСТЕММЫ ПЯТИЛИСТНОЙ | 2022 |
|
RU2790821C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ САПОНИНОВ В ПОБЕГАХ БОЯРЫШНИКА ПЕНСИЛЬВАНСКОГО | 2023 |
|
RU2823884C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ЦЕФАЛОСПОРИНОВЫХ АНТИБИОТИКОВ В БИОСРЕДАХ | 2010 |
|
RU2445624C2 |
| СПОСОБ ПОЛУЧЕНИЯ СУХОГО РАСТИТЕЛЬНОГО ЭКСТРАКТА, ОБЛАДАЮЩЕГО ПРОТИВОВИРУСНОЙ И АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ | 2021 |
|
RU2772387C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ЖЕЛЧЕГОННОЙ, ПРОТИВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЯМИ | 2014 |
|
RU2557990C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ САПОНИНОВ В ЭКСТРАКТЕ ЖЕНЬШЕНЯ | 1986 |
|
RU1480568C |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ СУММЫ ФЕНИЛПРОПАНОИДОВ В КОРНЕВИЩАХ И КОРНЯХ ЭЛЕУТЕРОКОККА КОЛЮЧЕГО | 2022 |
|
RU2797411C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ МЕТИОНИНА В ВОДНЫХ РАСТВОРАХ | 2008 |
|
RU2366929C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ПАНАКСОЗИДОВ | 2015 |
|
RU2578964C1 |
Изобретение относится к медицине, а именно к фармакологии, и может быть использовано для определения тритерпеновых сапонинов группы β-амирина в растительном сырье и лекарственных препаратах на их основе. Для этого по УФ-спектрам водных растворов сапонинов определяют оптическую плотность сапонинсодержащей фракции. Рассчитывают содержание сапонинов по предварительно построенному градуировочному графику. При этом концентрацию тритерпеновых сапонинов группы β-амирина рассчитывают методом дифференциальной спектрофотометрии на длине волны с максимумом поглощения λ=193,5 нм в диапазоне концентраций 0,002-1 мг/мл или λ=280,5 нм в диапазоне концентраций 0,5-8 мг/мл. Измерение концентрации сапонинов в диапазоне от 0,5 до 1 мг/мл проводят при 193,5 нм или 280,5 нм. Изобретение позволяет определять количество тритерпеновых сапонинов группы β-амирина в вытяжках из растительного материала, лекарственных препаратах. 5 ил., 2 пр.
Способ определения тритерпеновых сапонинов группы β-амирина в растительном сырье и лекарственных препаратах на их основе, включающий приготовление сапонинсодержащей фракции, определение ее оптической плотности и расчет содержания сапонинов по предварительно построенному градуировочному графику, отличающийся тем, что концентрацию тритерпеновых сапонинов группы β-амирина рассчитывают при уточненной дифференциальной спектрофотометрией длине волны максимума поглощения λ=193,5 нм в диапазоне концентраций 0,002-1 мг/мл или при λ=280,5 нм в диапазоне концентраций 0,5-8 мг/мл, определяемых по УФ-спектрам водных растворов сапонинов, при этом измерение концентрации сапонинов в диапазоне от 0,5 до 1 мг/мл проводят при 193,5 нм или 280,5 нм.
| СПОСОБ ОПРЕДЕЛЕНИЯ ТРИТЕРПЕНОВЫХ САПОНИНОВ В РАСТИТЕЛЬНОМ СЫРЬЕ И ЛЕКАРСТВЕННЫХ ПРЕПАРАТАХ | 2009 |
|
RU2413951C1 |
| CN 0107441343 A, 08.12.2017 | |||
| МАЛЬЦЕВА А.А | |||
| и др | |||
| Исследование возможности количественного определения сапонинов синюхи голубой методом УФ-спектрофотометрии, Электронный научно-образовательный вестник "Здоровье и образование в XXI веке", 2006, N 10, т | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Прибор для автоматического контроля скорости поездов | 1923 |
|
SU486A1 |
| BUTOVA S | |||
| N | |||
| et al., Scientific substantiation and the | |||
Авторы
Даты
2020-06-03—Публикация
2019-05-22—Подача