Изобретения относятся к областям микробиологии, эпидемиологии, санитарии, гигиены и могут быть использованы для обнаружения биологических пленок бактерий на абиотических поверхностях в областях здравоохранения, пищевой промышленности, ветеринарии, на предприятиях бьюти-индустрии, учреждениях социальной и коммунальной сферы, питания, торговли, санитарии, гигиены и охраны здоровья населения.
Биологические пленки бактерий являются одной из основных стратегий выживания бактерий в занимаемой ими экологической нише.
Биопленки - это микробные ассоциации, представляющие собой непрерывный мультислой бактериальных клеток, прикрепленных к поверхности раздела фаз и друг к другу и заключенных в экзополисахаридный матрикс (Смирнова Т.А., Диденко Л.В., Азизбекян Р.Р., Романова Ю.М. Структурно-функциональная характеристика бактериальных биопленок. Микробиология, 2010, том 79, №4, с. 435-446).
Бактерии в прикрепленном состоянии, будучи интегрированными в биопленку, защищены от повреждающих факторов внешней среды и антибактериальных и дезинфицирующих препаратов.
Более 95% всех бактерий обитают на абиотических и биотических поверхностях в состоянии биопленки, а не в виде планктонных (свободноживущих) форм.
В связи с наличием биопленок, в санитарно-эпидемиологических исследованиях и дезинфекционных мероприятиях складывается ситуация с недостаточным лабораторным диагностированием и борьбой с возбудителями инфекционных заболеваний.
Формирование биопленки сопровождается образованием экзополимерного матрикса - продукта жизнедеятельности самих клеток.
При созревании биопленки продуцируется значительное количество экзополимера, объединяющего соседние клетки и формирующего матрикс. Экзополимеры составляют 85% массы биопленки, а 15% - бактерии. Матрикс является основным структурным компонентом биопленки. Экзополисахариды составляют значительную часть матрикса. У прокариот, так же как и у эукариот, полисахариды формируют поверхностный слой клеточной оболочки (гликокаликс). У бактерий экзополисахариды образуют капсулу, слизистые слои и могут освобождаться во внешнюю среду, отделяясь от клеточной поверхности. Экзополисахаридный матрикс (ЭПМ) также такие важнейшие функции как каркасная и защитная. ЭПМ защищает бактерии в биопленке от антибактериальных препаратов, негативных факторов внешней среды, таких, как УФ-облучение, радиация, изменения рН, осмотический шок, высыхание.
Таким образом, бактерии в биопленке заключены в ЭПМ, свойства которого определяют взаимоотношения внутри клеточного сообщества и с внешней средой. Матрикс у различных видов бактерий неодинаков по физическим свойствам и химическому составу, но, как правило, представляет собой анионный полимер. ЭПМ состоит в основном из гомо- и гетерополисахаридов.
Как анионный полимер, ЭПМ препятствует проникновению катионных антимикробных препаратов внутрь биопленки. Выявлены 4 модели взаимосвязи полимеров в ЭПМ биопленки.
Концептуальные модели сцепления матриц:
- Альгинатная парадигма. Кальций сшивает альгинаты.
- Адгезия отрицательно заряженного полимера и положительно заряженного полимера.
- Водородное связывание или гидрофобное взаимодействие.
- Бактерии частично сшиты с матрицей.
В настоящее время детекция, иначе - обнаружение бактерий в состоянии биопленки затруднено, поскольку ЭПМ препятствует механическому переносу бактерий на питательные среды для последующей идентификации.
В практике текущего санитарного надзора за критичными объектами лечебно-профилактических учреждений и предприятий пищевой промышленности широко используется метод смывов бактерий на питательные среды с целью контроля эффективности санитарной обработки поверхностей, инструментария, аппаратуры и оборудования (СП 3.1.3263-15. Санитарно-эпидемиологические правила. Профилактика инфекционных заболеваний при эндоскопических вмешательствах./Методические указания. МУ 3.1.3420-17. Обеспечение эпидемиологической безопасности нестерильных эндоскопических вмешательств на желудочно-кишечном тракте и дыхательных путях). В настоящее время лишь данный метод смывов дает возможность оценить санитарное содержание обследуемых поверхностей. Взятие смывов производится с помощью стерильных увлажненных ватных тампонов. Стерильные ватные тампоны на стеклянных, металлических или деревянных палочках, вмонтированных в пробирки с ватными пробками, заготавливают заранее в лаборатории. Однако данная методика смывов с поверхностей может определять только лишь планктонные, отдельно растущие формы бактерий или грибов, которые составляют незначительную часть вероятного микробного обременения поверхностей.
ЭПМ не позволяет качественно оценить санитарное состояние поверхностей, методом смывов, скрывая бактерии или патогенные грибы от посева при помощи тампона, препятствуя механическому переносу бактерий на питательные среды для последующей идентификации.
Таким образом, отрицательный результат санитарно-бактериологического контроля методом исследования смывов является недостаточно достоверным (ложноотрицательным) и не учитывает возможности существования бактерий и грибов в состоянии биопленки.
Недостоверные данные санитарного состояния больничной среды и пищевых производств влекут за собой составление ложных выводов и проведения неверной тактики борьбы с возбудителями инфекционных заболеваний.
Известен экспресс-тест для обнаружения биологических пленок бактерий на абиотических поверхностях («BioFinder», ITRAMHigiene https://biofilmremove.com/en/detection/), представляющий собой водно-спиртовой раствор пероксида водорода. Такой индикатор малоэффективен для выявления бактерий, находящихся в состоянии зрелой и подсушенной биопленки, вследствие наличия мощного ЭПМ, так как не содержит специальных веществ для его разрушения.
Также известен экспресс-тест для обнаружения биологических пленок бактерий на абиотических поверхностях (RU 2495098 С2, 10.10.13 г.), содержащий фермент пергидролазу и смесь ферментов для удаления, выбранную из протеазы, глюканазы и эстеразы или протеазы, глюканазы, эстеразы и маннаназы или протеазы, глюканазы, фосфолипазы и маннаназы или трех протеаз, глюканазы, фосфолипазы и маннаназы или трех протеаз, глюканазы и маннаназы; двух протеаз, целлюлазы, глюканаз, фосфолипазы и маннаназы или протеазы, глюканазы и маннаназы или протеазы, целлюлазы, фосфолипазы и эстеразы или двух протеаз, глюканазы, фосфолипазы и эстеразы или двух протеаз, глюканазы, фосфолипазы и маннаназы или трех протеаз, целлюлазы, фосфолипазы и глюканазы или трех протеаз, целлюлазы, фосфолипазы и маннаназы или трех протеаз, глюканазы, фосфолипазы и эстеразы или протеазы, целлюлазы, глюканазы, фосфолипазы и эстеразы или по меньшей мере двух амилаз и глюканазы или по меньшей мере трех амилаз или по меньшей мере двух амилаз, глюканазы и протеазы.
Недостатком данного изобретения является то, что используемые ферменты класса карбогидраз не обладают специфичностью к экзополисахаридам матрикса бактерий и поэтому состав полиферментной смеси для разрушения экзополисахаридного матрикса биопленок бактерий недостаточно эффективен и не позволяв! в достаточной мере извлечь бактерии из полимерного защитного матрикса биопленки.
Технический результат предлагаемой группы изобретений заключается в повышении достоверности выявления бактерий, находящихся в состоянии биопленки на абиотических поверхностях.
Указанный результат достигается экспресс-тестом для обнаружения биологических пленок бактерий на абиотических поверхностях, включающем использования индикатора, представляющего собой раствор флуорохромного красителя Нильский красный с концентрацией от 5 μМ до 50 μМ и предназначенного для образования свечения в зеленом свете светодиодного фонарика при наличии биологических пленок, и визуальное наблюдение такого свечения при использовании защитных от УФ-света оранжевых очков.
Технический результат достигается экспресс-тестом для обнаружения биологических пленок бактерий на абиотических поверхностях, включающем использование индикатора, предназначенного для образования пены при наличии биологических пленок, и визуальное наблюдение пены на поверхности, причем индикатор представляет собой раствор, состоящий из пероксида водорода в концентрации от 0,3% до 6,0%, катионных ПАВ, синергиста реакции N-кокоалкил-N,N-диметиламин оксид в концентрации от 0,5% до 5,0%, функциональных и технологических компонентов, включающих стабилизаторы пероксида водорода, ингибитор коррозии, комплексообразователь и загуститель.
Также результат достигается экспресс-тестом для обнаружения биологических пленок бактерий на абиотических поверхностях, включающем нанесение на поверхность индикатора и проведение бактериологических смывов для диагностирования бактерий. Используемый индикатор содержит смесь ферментов класса карбогидраз в концентрации от 0,05% до 10,0% и функциональные и технологические компоненты, в состав которых входят N-кокоалкил-N,N-диметиламин оксид и NN-бис(3-аминопропил)додециламин в концентрациях от 0,1% до 15,0%, причем смесь ферментов состоит из применяемых одновременно или в различных комбинациях протеазы, амилазы, липазы, целлюлазы, манноназы, декстраназы, хитиназы, β-глюкозидазы, ламинариназы, авицелазы, ксиланазы, хитозаназы, альгинат лиазы
В первом экспресс-тесте используется индикатор, который позволяет обнаружить биопленки бактерий за счет наличия в составе флуорохромного красителя Нильский красный, который связывается с липидами и липополисахаридами ЭПМ с образованием свечения в зеленом свете светодиодного фонарика.
Второй экспресс-тест позволяет обнаружить биопленки бактерий при помощи индикатора на основе пероксида водорода, реагирующего с ферментом каталазой, который разрушает пероксид водорода на кислород и воду. Выделение кислорода можно выявить по процессу барботирования (образование множества пузырьков), который определяется невооруженным взглядом.
Третий экспресс-тест содержит индикатор, включающий смесь ферментов класса карбогидраз, которые разрушают специфические полисахариды ЭПМ биопленки, который защищает бактерии от воздействия неблагоприятных факторов внешней среды (антибиотики, дезсредства, УФ облучение и пр.), а также препятствует механическому переносу бактерий на диагностические питательные среды при проведении санитарно-микробиологических пробах (посевах). Тем самым, после обработки содержащих биопленку поверхностей полиферментной смесью исследователь может с высокой долей вероятности проводить санитарно-микробиологических пробы (посевы) и не получать ложноотрицательных результатов посевов.
1. Экспресс-тест обнаружения экзополисахаридов (липополисахаридов) экзополисахаридного матрикса биологических пленок при помощи флуорохромного красителя.
При этом экспресс-тесте индикатор с высокой достоверностью обнаруживает липополисахариды экзополисахаридного матрикса биологических пленок грамположительных и грамотрицательных бактерий на различных абиотических поверхностях, таких как нержавеющая сталь, плитка, полипропилен, окрашенные поверхности и пр.
Обнаружение ЭПМ биологических пленок основано на специфическом связывании флуорохромного красителя (Нильский красный/ Nile red) с липополисахаридами ЭПМ и свечении в зеленом свете светодиодного фонарика, при визуализации свечения в специальных оранжевых очках.
Степень свечения зависит от количества полисахаридов ЭПМ и определяется визуальным контролем без применения методов микроскопии.
Индикатор представляет собой готовое к применению средство в виде водного раствора флуорохормного красителя оранжевого цвета. В состав индикатора входит флуорохромный краситель (Nile red) в виде водно-спиртового раствора в концентрации 5-50 μМ.
Отличие этого метода визуализации от применяющихся в настоящее время в том, что визуализация окрашенных структур проводится при помощи микроскопии.
2. Экспресс-тест обнаружения бактерий, в том числе в состоянии биопленки при помощи индикатора, реагирующего с антиоксидантной ферментной системой защиты бактериальной клетки.
В основе этого экспресс-теста лежит реакция раствора индикатора на основе смеси перекиси водорода и катионных ПАВ с антиоксидантной ферментной системой защиты микроорганизмов. Детекция бактерий в биопленке основана на появлении барботирования (образовании микропузырьков) на обработанной поверхности в результате реакции бактериальной каталазы с пероксидом водорода. Степень интенсивности барботирования зависит от степени обсеменения и позволяет обнаруживать реакцию невооруженным визуальным контролем.
Детекция при помощи индикатора для экспресс-теста - это простая, быстрая, высокоэффективная и не требующая специальных навыков процедура.
Индикатор с высокой достоверностью обнаруживает грамположительные и грамотрицательные бактерии в состоянии биопленки на различных абиотических поверхностях, таких как нержавеющая сталь, плитка, полипропилен, окрашенные поверхности и пр. Позволяет обнаруживать как моновидовые, так и поливидовые биопленки, каталазапозитивных бактерий. Преимущество данного вида детекции заключается еще и в том факте, что биопленки как правило, имеют поливидовую структуру и для детекции достаточно одного вида каталазопозитивных бактерий в биопленке.
Каталаза является основным первичным антиоксидантом системы защиты, которая катализирует разложение перекиси водорода до воды. Перекись водорода разрушается двумя классами родственных ферментов, катализирующих ее двухэлектронное восстановление до Н2О и использующих в качестве донора электронов Н2О2 в случае каталазы или различные органические соединения - в случае пероксидазы.
Каталазная и пероксидазная активности обнаружены у всех аэробных и факультативно анаэробных прокариот. Среди облигатных анаэробов эти ферменты распространены значительно в меньшей степени, чем супероксиддисмутаза.
Индикатор более эффективен по сравнению с аналогами за счет наличия специальных веществ, разрушающих защитный ЭПМ биопленки и тем самым увеличивающих количество бактериальных клеток, вступающих в реакцию.
Индикатор также обладает моющим и дезинфицирующим действием, не портит и не окрашивает обрабатываемые поверхности, хорошо растворим в воде и легко смывается, экологически безопасен и биоразлагаем. Индикатор представляет собой раствор, содержащий кислородактивные соединения в растворе с растворителями, функциональными и технологическими компонентами. Предлагаются варианты рецептур содержащие различные компоненты.
Рецептуры индикатора:
Препарат рецептура 1:
- N-кокоалкил-N,N-диметиламин оксид - 1,5%
- Пероксид водорода - 3%
- Функциональные и технологические компоненты (стабилизатор перекиси водорода, ингибитор коррозии, комплексообразователь, загуститель) - от 3% до 5%
- Краситель.
Препарат рецептура 2:
- N-кокоалкил-N,N-диметиламин оксид - 1,5%
- Пероксид водорода - 3%
- Функциональные и технологические компоненты (стабилизатор перекиси водорода, ингибитор коррозии, комплексообразователь, загуститель) - от 3% до 5%
- Яблочная кислота - 0,25%
- Триэтаноламин - 0,1%
- Краситель.
Препарат рецептура 3:
- N-кокоалкил-N,N-диметиламин оксид - 1,5%
- Пероксид водорода - 3%
- Функциональные и технологические компоненты (стабилизатор перекиси водорода, ингибитор коррозии, комплексообразователи, гелеобразователь, загуститель) - от 3% до 5%
- Хлоргексидина диглюконат - от 0,2% до 1,5%
- Глицерин - 2%
- Краситель.
Препарат рецептура 4:
- N-кокоалкил-N,N-диметиламин оксид - 3%
- Пероксид водорода - 3%
- Хлоргексидина диглюконат - от 0,2% до 1,5%
- Глицерин - 2%
- Функциональные и технологические компоненты (стабилизатор перекиси водорода, ингибитор коррозии, комплексообразователь, гелеобразователь, загуститель) - от 3% до 5%
- Краситель.
Основным отличием от аналогичных индикаторов («BioFinder», ITRAMHigiene, Испания) является наличие в рецептурах поверхностно-активных веществ (катионных и неионогенных ПАВ) обладающих дополнительным разрушающим действием на полисахариды экзополисахаридного комплекса биологических пленок, что значительно облегчает доступ кислородактивных соединений для индикаторного взаимодействия с ферментами бактериальных клеток и снижает концентрацию действующих веществ индикатора.
Каталаза является основным первичным антиоксидантом системы защиты, который катализирует разложение перекиси водорода до воды. Перекись водорода разрушается двумя классами родственных ферментов, катализирующих ее двухэлектронное восстановление до H2O и использующих в качестве донора электронов Н2О2 в случае каталазы или различные органические соединения - в случае пероксидазы.
Пена, которая образуется после нанесения индикатора в течение 5-10 сек, показывает, где именно остаются после обработки (мытья и дезинфекции) опасные уровни клинически значимых микроорганизмов.
3. Экспресс-тест, позволяющий разрушить ЭПМ биопленки и тем самым открыть защищаемые им бактерии для воздействия или различных манипуляций. Индикатор, используемый для проведения данного теста, состоит из смеси ферментов класса карбогидраз, которые разрушают специфические полисахариды ЭПМ биопленки.
Индикатор, используемый для этого теста предназначен для улучшения качества бактериологических смывов и идентификации бактерий в состоянии биологической пленки, за счет разрушения ЭПМ биопленки и увеличения доступности планктонных форм бактерий для переноса на диагностические питательные среды.
Полиферментная смесь имеет время экспозиции или время воздействия на структуры экзополисахаридного матрикса биопленки от 1 до 60 минут в зависимости от степени зрелости биопленки.
Пена сохраняет свою стабильность на поверхности долгое время, предотвращая контакт поверхности c воздухом, что способствует максимально эффективному воздействию активных веществ индикатора на структурные составляющие биологической пленки. '
После воздействия индикатором необходимо провести процедуру бактериологических смывов с обрабатываемой поверхности и посевы на индикаторные питательные среды.
Полиферментные смеси.
Композиции полиферментных смеси отличаются от известных аналогов наличием ферментов из группы карбогидраз, а именно наличием в составе новых ферментов декстраназы, хитиназы и альгинат лиазы, а в полной рецептуре препаратов смеси ферментов - наличие ПАВ, которые также разрушают полисахариды экзополисахаридного матрикса и работают с ферментами смеси, как синергисты.
1) В первом варианте полиферментной смеси состав содержит комплекс ферментов и применяется одновременно:
- амилаза, липаза, целлюлаза и декстраназа (содержание в готовом растворе 1%);
- амилаза, липаза, целлюлаза и декстраназа (содержание в готовом растворе 0,5%);
- амилаза, липаза, целлюлаза, манноназа и декстраназа (содержание в готовом растворе 1%);
- амилаза, липаза, целлюлаза, манноназа и декстраназа (содержание в готовом растворе 0,5%);
- протеаза, амилаза, липаза, целлюлаза и декстраназа (содержание в готовом растворе 1%);
- протеаза, амилаза, липаза, целлюлаза и декстраназа (содержание в готовом растворе 0,5%);
- протеаза, амилаза, липаза, целлюлаза, манноназа и декстраназа (содержание в готовом растворе 1%);
- протеаза, амилаза, липаза, целлюлаза, манноназа и декстраназа (содержание в готовом растворе 0,5%);
В полиферментные смеси добавлены поверхностно-активные вещества, как синергисты разрушения полисахаридов матрикса для усиления эффективности полиферментной субстанции: N-Cocoalkyl-N,N-dimethylamine oxide - 3,0% и NN-бис(3-аминопропил)додециламин - 3,0%.
2) Во втором варианте полиферментной смеси состав содержит комплекс ферментов и применяется одновременно:
- амилаза, липаза, целлюлаза, декстраназа и хитиназа (содержание в готовом растворе 1%);
- амилаза, липаза, целлюлаза, декстраназа и хитиназа (содержание в готовом растворе 0,5%);
- амилаза, липаза, целлюлаза, манноназа, декстраназа и хитиназа (содержание в готовом растворе 1%);
- амилаза, липаза, целлюлаза, манноназа, декстраназа и хитиназа (содержание в готовом растворе 0,5%);
- протеаза, амилаза, липаза, целлюлаза, декстраназа и хитиназа (содержание в готовом растворе 1%);
- протеаза, амилаза, липаза, целлюлаза, декстраназа и хитиназа (содержание в готовом растворе 0,5%);
- протеаза, амилаза, липаза, целлюлаза, манноназа, декстраназа и хитиназа (содержание в готовом растворе 1%);
- протеаза, амилаза, липаза, целлюлаза, манноназа, декстраназа и хитиназа (содержание в готовом растворе 0,5%);
Фермент хитиназа во всех субстанциях находится в смеси и представлен следующими ферментами:
- СМС-аза;
- Авицелаза;
- Ксиланаза;
- Ламинариназа;
- β-глюкозидаза;
- Хитиназа;
- Хитозаназа.
Также, как и в первом варианте, в полиферментные смеси добавлены поверхностно-активные вещества, как синергисты разрушения полисахаридов матрикса для усиления эффективности полиферментной субстанции: N-Cocoalkyl-N,N-dimethylamine oxide - 3,0% и NN-бис(3-аминопропил)додециламин - 3,0%.
3) В третьем варианте полиферментной смеси состав содержит комплекс ферментов и применяется одновременно:
- амилаза, липаза, целлюлаза, декстраназа и альгинат лиаза (альгиназа) (содержание в готовом растворе 1%);
- амилаза, липаза, целлюлаза, декстраназа и альгинат лиаза (альгиназа) (содержание в готовом растворе 0,5%);
- амилаза, липаза, целлюлаза, манноназа, декстраназа и альгинат лиаза (альгиназа) (содержание в готовом растворе 1%);
- амилаза, липаза, целлюлаза, манноназа, декстраназа и альгинат лиаза (альгиназа) (содержание в готовом растворе 0,5%);
- протеаза, амилаза, липаза, целлюлаза, декстраназа и альгинат лиаза (альгиназа) (содержание в готовом растворе 1%);
- протеаза, амилаза, липаза, целлюлаза, декстраназа и альгинат лиаза (альгиназа) (содержание в готовом растворе 0,5%);
- протеаза, амилаза, липаза, целлюлаза, манноназа, декстраназа и альгинат лиаза (альгиназа) (содержание в готовом растворе 1%);
- протеаза, амилаза, липаза, целлюлаза, манноназа, декстраназа и альгинат лиаза (альгиназа) (содержание в готовом растворе 0,5%);
Также, как и в первом варианте, в полиферментные смеси добавлены поверхностно-активные вещества, как синергисты разрушения полисахаридов матрикса для усиления эффективности полиферментной субстанции: N-Cocoalkyl-N,N-dimethylamine oxide - 3,0% и NN-бис(3-аминопропил)додециламин - 3,0%.
4) В четвертом варианте полиферментной смеси состав содержит комплекс ферментов и применяется одновременно:
- амилаза, липаза, целлюлаза, декстраназа, хитиназа и альгинат лиаза (альгиназа) (содержание в готовом растворе 1%);
- амилаза, липаза, целлюлаза, декстраназа, хитиназа и альгинат лиаза (альгиназа) (содержание в готовом растворе 0,5%);
- амилаза, липаза, целлюлаза, манноназа, декстраназа, хитиназа и альгинат лиаза (альгиназа) (содержание в готовом растворе 1%);
- амилаза, липаза, целлюлаза, манноназа, декстраназа, хитиназа и альгинат лиаза (альгиназа) (содержание в готовом растворе 0,5%);
- протеаза, амилаза, липаза, целлюлаза, декстраназа, хитиназа и альгинат лиаза (альгиназа) (содержание в готовом растворе 1%);
- протеаза, амилаза, липаза, целлюлаза, декстраназа, хитиназа и альгинат лиаза (альгиназа) (содержание в готовом растворе 0,5%);
- протеаза, амилаза, липаза, целлюлаза, манноназа, декстраназа, хитиназа и альгинат лиаза (альгиназа) (содержание в готовом растворе 1%);
- протеаза, амилаза, липаза, целлюлаза, манноназа, декстраназа, хитиназа и альгинат лиаза (альгиназа) (содержание в готовом растворе 0,5%);
Фермент хитиназа во всех субстанциях находится в смеси и представлен следующими ферментами:
- СМС-аза;
- Авицелаза;
- Ксиланаза;
- Ламинариназа;
- β-глюкозидаза;
- Хитиназа;
- Хитозаназа.
Также, как и в первом варианте, в полиферментные смеси добавлены поверхностно-активные вещества, как синергисты для разрушения полисахаридов матрикса для усиления эффективности полиферментной субстанции: N-Cocoalkyl-N,N-dimethylamine oxide - 3,0% и NN-бис(3-аминопропил)додециламин - 3,0%.
Краткое описание чертежей.
Фиг. 1. Фото биопленок, образованных штаммами, обозначенными на прозрачных крышках чашек, снизу (первые два ряда) и обработанных «Препаратом - рецептура 1» красный (верхний ряд) и «Препаратом - рецептура 2» голубой (второй ряд). Два ряда снизу - биопленки оставлены еще на 3-е суток для высушивания. Обозначения штаммов на прозрачных пустых лунках внизу.
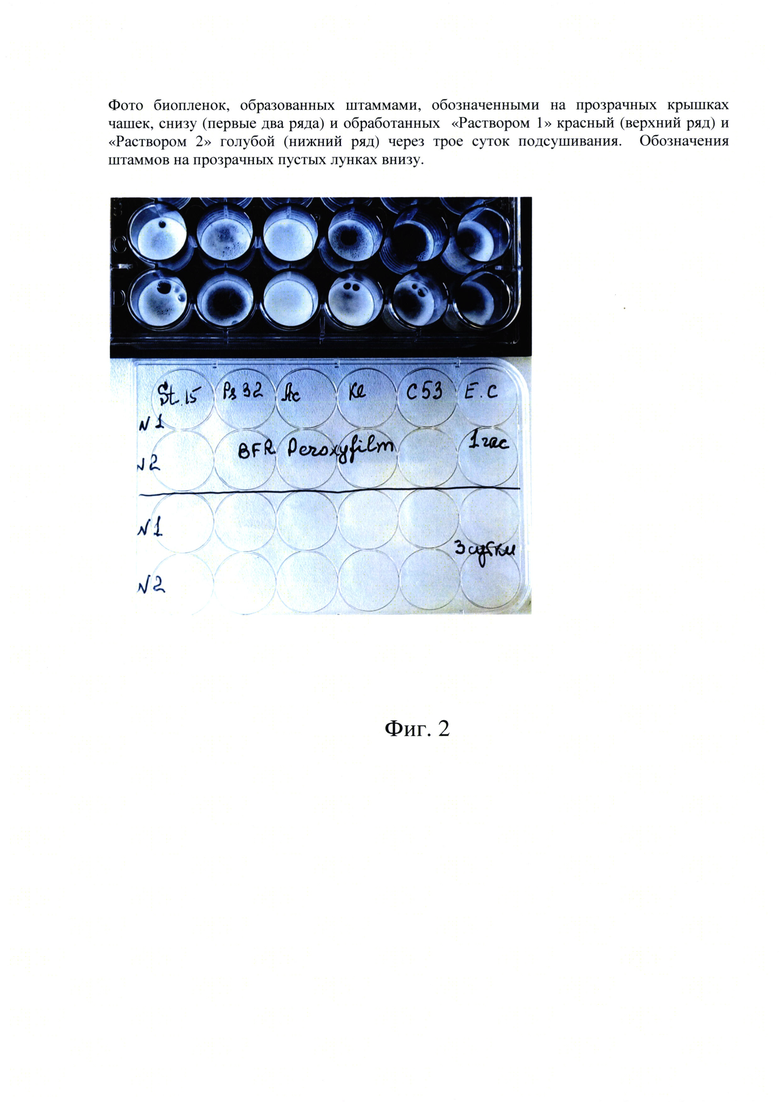
Фиг. 2. Фото биопленок, образованных штаммами, обозначенными на прозрачных крышках чашек, снизу (первые два ряда) и обработанных «Препаратом - рецептура 1» красный (верхний ряд) и «Препаратом - рецептура 2» (нижний ряд) через трое суток подсушивания. Обозначения штаммов на прозрачных пустых лунках внизу.
Фиг. 3. Фото биопленок, образованных штаммами, обозначенными на прозрачных крышках чашек, сверху (первые два ряда) и, соответственно, снизу (вторые два ряда) и обработанных «Препаратом - рецептура 3».
Фиг. 4. Фото биопленок, образованных штаммами, обозначенными на прозрачных крышках чашек, сверху (первые два ряда) и обработанных «Препаратом - рецептура 3» (верхний ряд) и «Препаратом - рецептура 4» (второй ряд). Два ряда снизу - биопленки оставлены еще на 3-е суток для высушивания.
Фиг. 5. Фото биопленок, образованных штаммами, обозначенными на прозрачных крышках чашек снизу, высушенных в течение 3-х суток и обработанных «Препаратом -рецептура 3» (первый ряд) и «Препаратом - рецептура 4» (второй ряд).
Фиг. 6. Фото биопленок, образованных штаммами, обозначенными на прозрачных крышках чашек снизу, высушенных в течение 1 часа и обработанных «Препаратом -рецептура 3» (первый ряд) и «Препаратом - рецептура 4» (второй ряд).
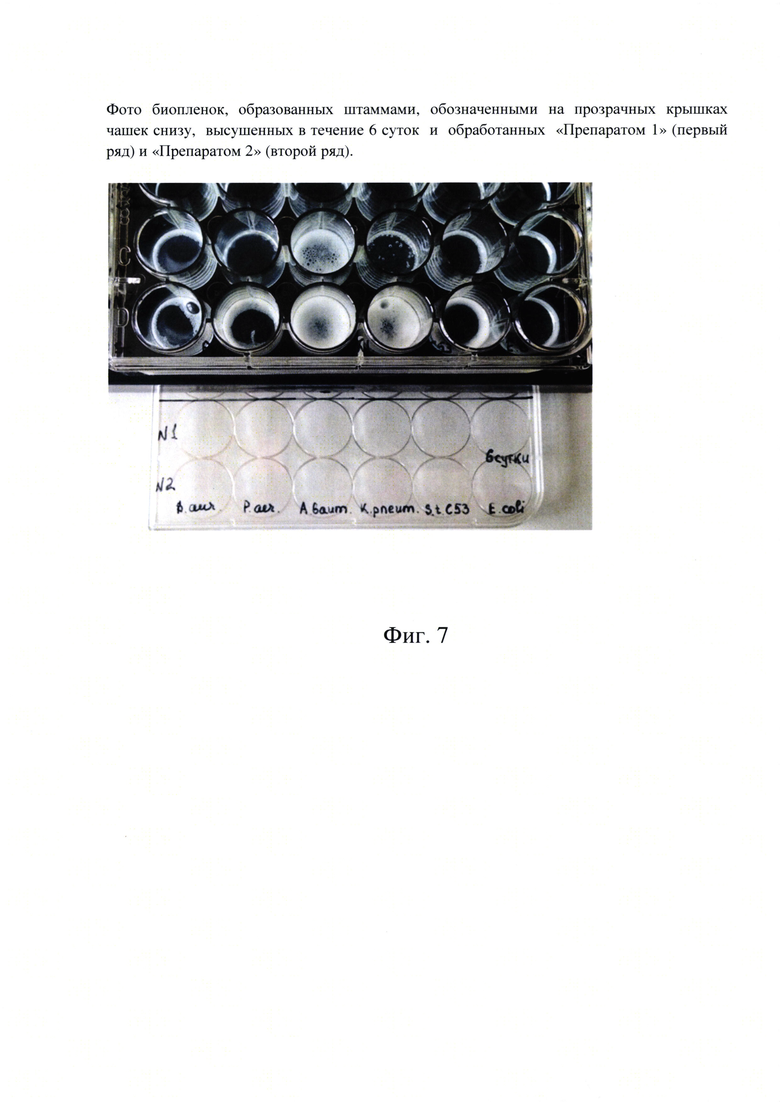
Фиг. 7. Фото биопленок, образованных штаммами, обозначенными на прозрачных крышках чашек снизу, высушенных в течение 6 суток и обработанных «Препаратом -рецептура 3» (первый ряд) и «Препаратом - рецептура 4» (второй ряд).
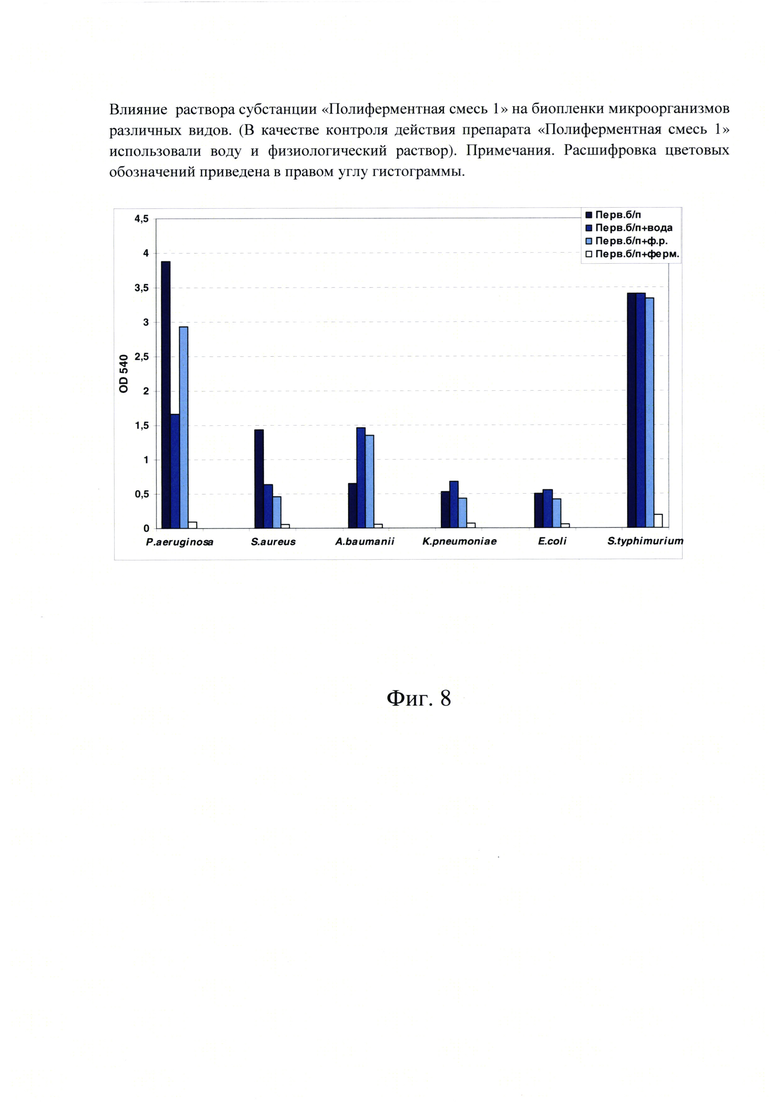
Фиг. 8. Влияние раствора субстанции «Полиферментная смесь 1» на биопленки микроорганизмов различных видов. (В качестве контроля действия препарата «Полиферментная смесь 1» использовали воду и физиологический раствор). Примечания. Расшифровка цветовых обозначений приведена в правом углу гистограммы.
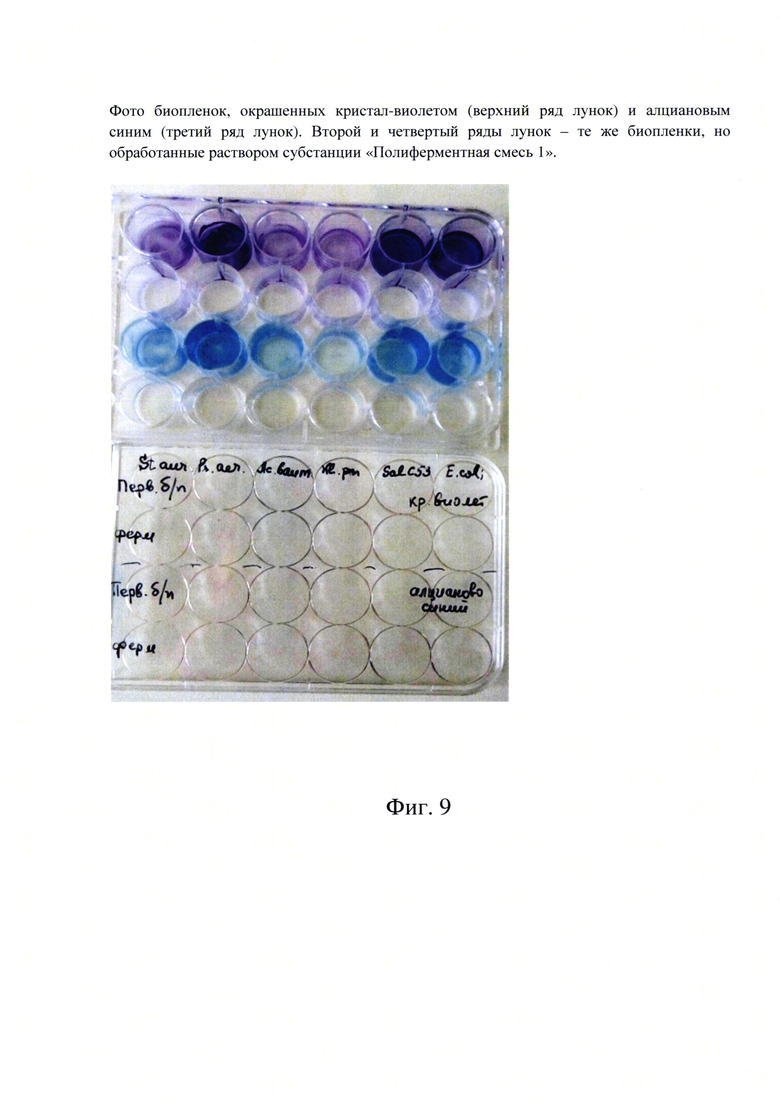
Фиг. 9. Фото биопленок, окрашенных кристал-виолетом (верхний ряд лунок) и алциановым синим (третий ряд лунок). Второй и четвертый ряды лунок - те же биопленки, но обработанные раствором субстанции «Полиферментная смесь 1».
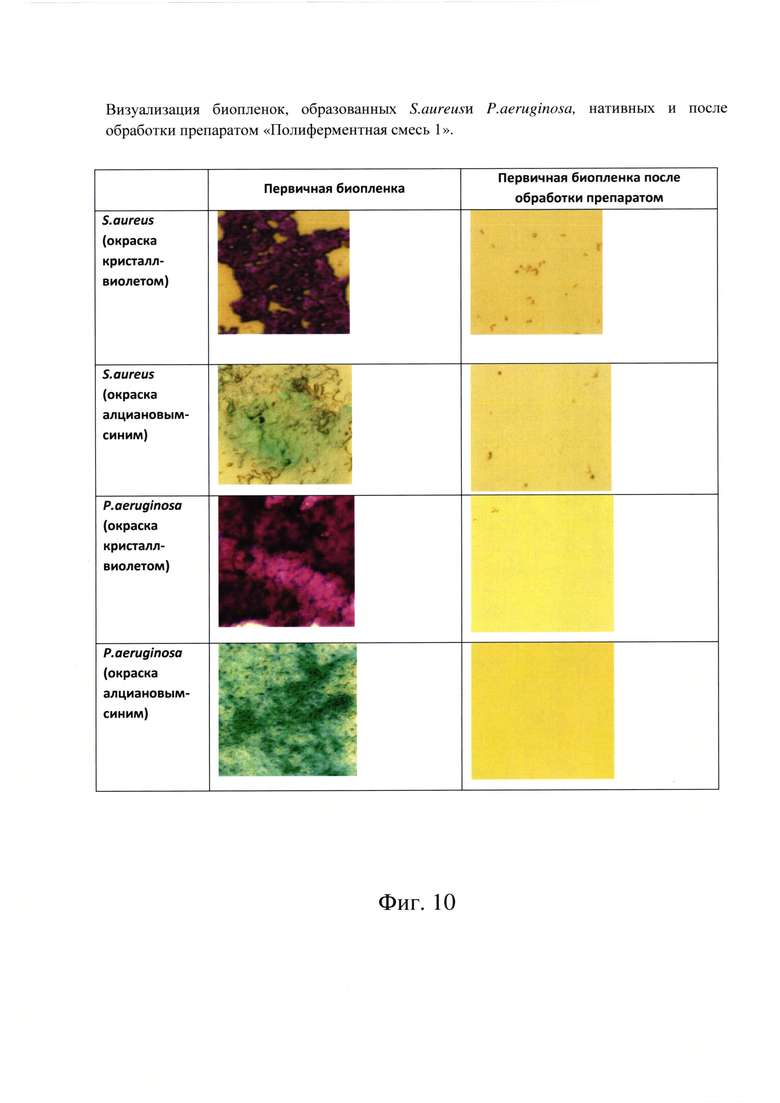
Фиг. 10. Визуализация биопленок, образованных S. aureusn P. aeruginosa, (нативных и после обработки препаратом «Полиферментная смесь 1»).
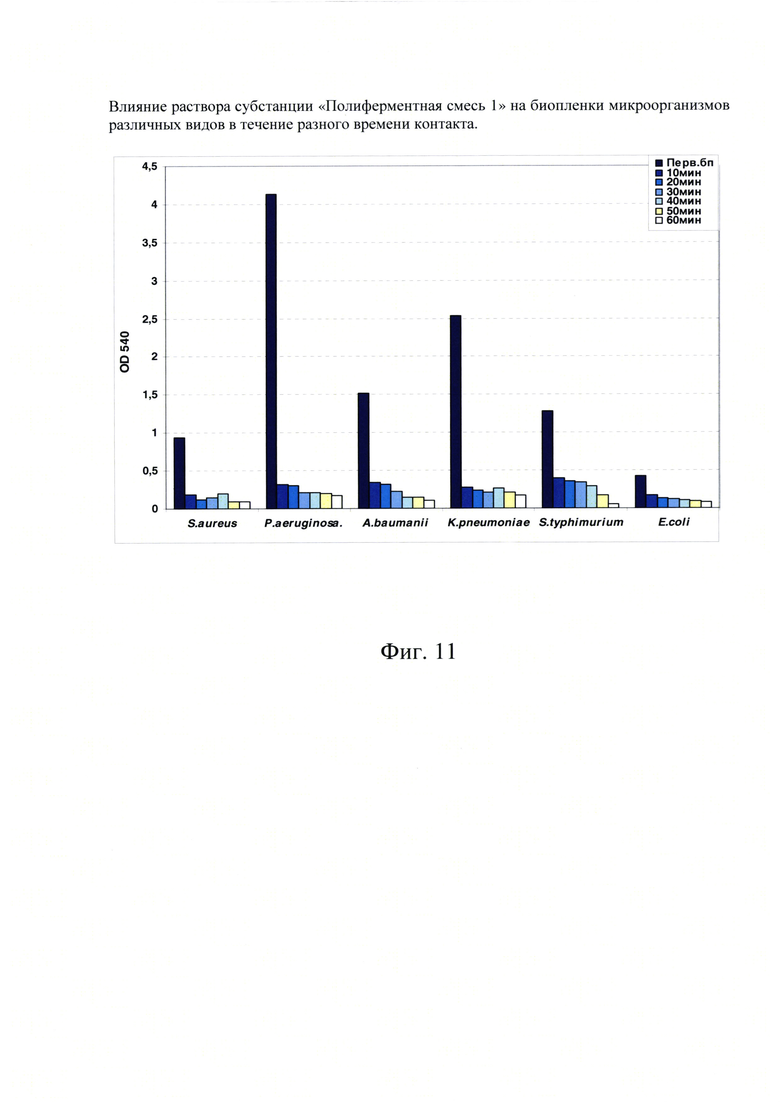
Фиг. 11. Влияние раствора субстанции «Полиферментная смесь 1» на биопленки микроорганизмов различных видов в течение разного времени контакта.
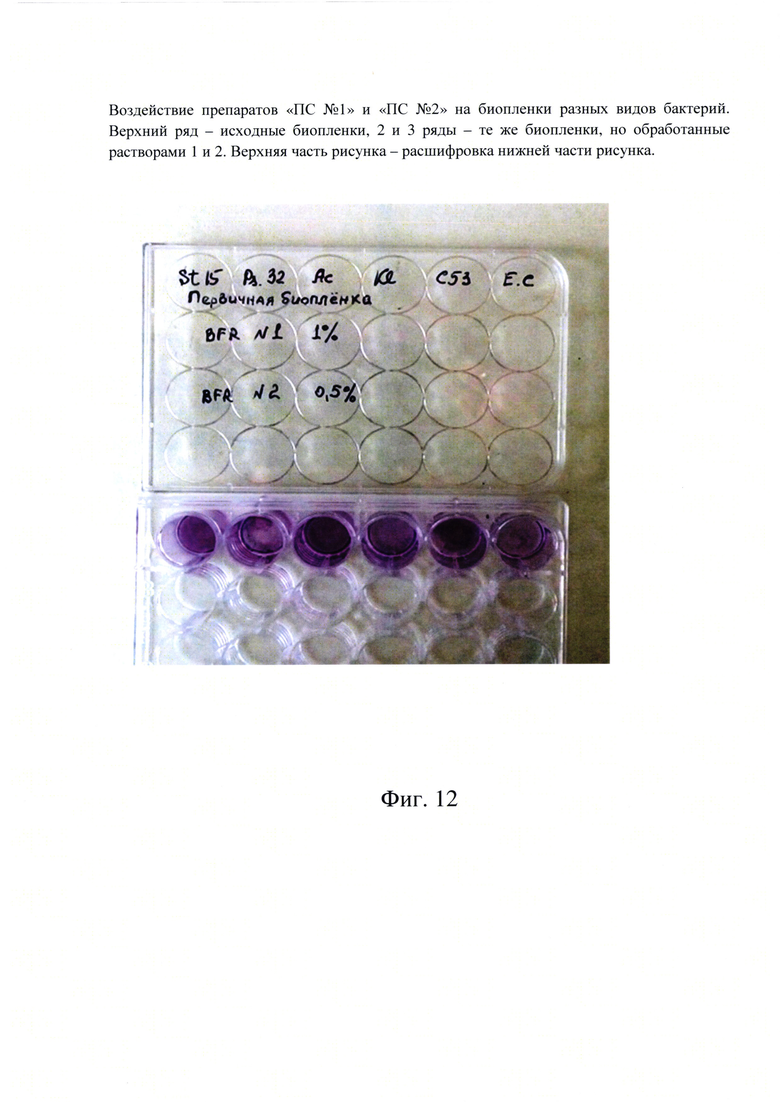
Фиг. 12. Воздействие препаратов «ПС №1» и «ПС №2» на биопленки разных видов бактерий. Верхний ряд - исходные биопленки, 2 и 3 ряды - те же биопленки, но обработанные растворами 1 и 2. Верхняя часть рисунка - расшифровка нижней части рисунка.
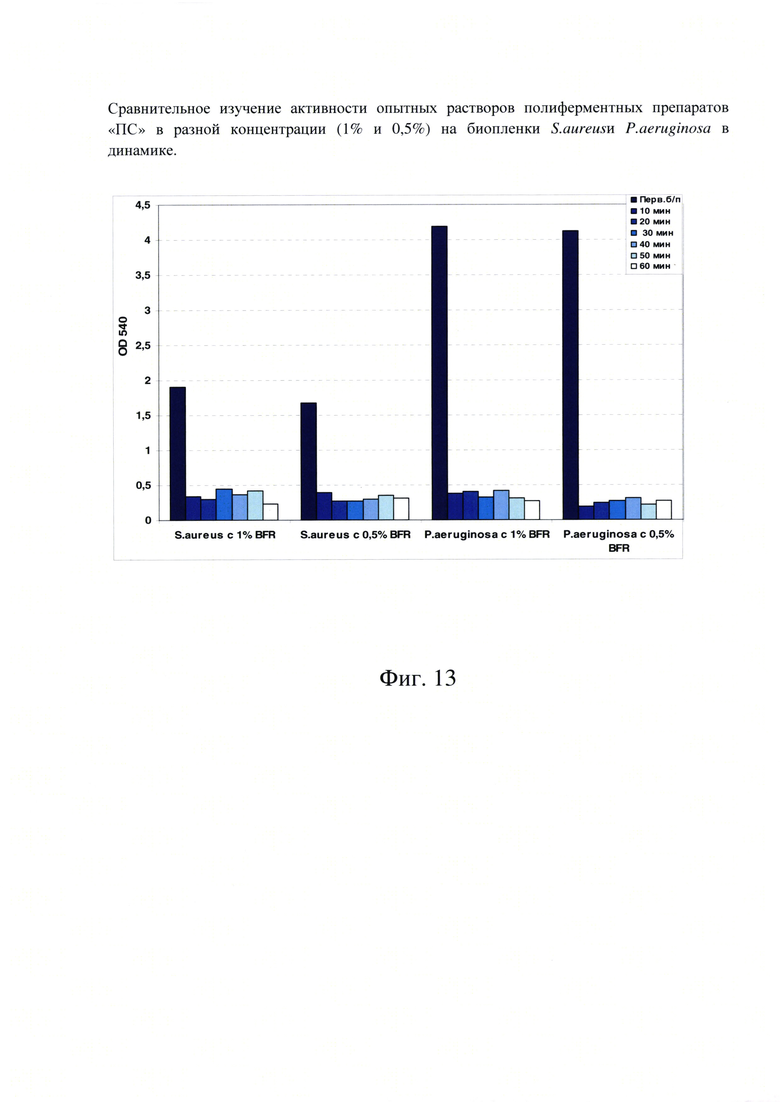
Фиг. 13. Сравнительное изучение активности опытных растворов полиферментных препаратов «ПС» в разной концентрации (1% и 0,5%) на биопленки S. aureusn P. aeruginosa в динамике.
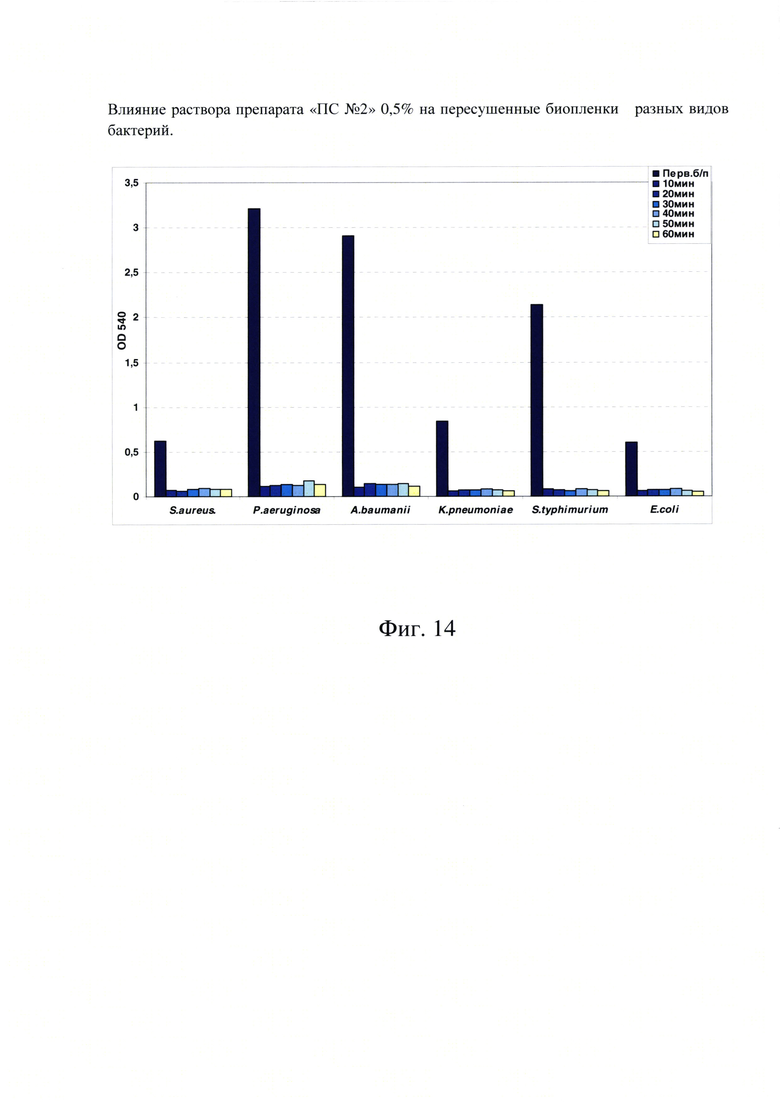
Фиг. 14. Влияние раствора препарата «ПС №2» 0,5% на пересушенные биопленки разных видов бактерий.
Изучение воздействия пероксидных соединений на клетки бактерий, входящих в состав биопленки.
Материалы и методы:
В ходе исследований тестировали два препарата в виде комбинированных растворов перекисных соединений:
- «Препарат - рецептура 1»;
- «Препарат - рецептура 2»
и те же препараты в гелевой форме:
- «Препарат - рецептура 3»;
- «Препарат - рецептура 4».
Активность препаратов тестировали на зрелых сформированных биопленках следующих штаммов:
- грамположительный:
Staphilococcus aureus 15 и
- грамотрицательные:
E.coli 717,
Pseudomonas aeruginosa 32,
Acinetobacter baumanii 503,
Klebsiella pneumonia 1553,
Salmonella typhimurium C53,
Salmonella typhimurium C53rpoS с мутацией в гене rpoS, приводящей к нарушению синтеза фермента каталазы.
Формирование бактериальных биопленок в больших лунках 24-х луночных планшет и маленьких чашечках Петри (d-3,5 мм) проводили по модифицированной методике O'Tool (O'Toole G.A., Kolter R. Flagellar and twitching motility are necessary for Pseudomonas aeruginosa biofilm development. Mol. Microbiol. 1998. V.30: 295-304), отработанной ранее (Романова Ю.М., Алексеева Н.В., Смирнова Т.А. и др. Способность к формированию биопленок в искусственных системах у различных штаммов Salmonella typhimurium. Журнал. Микробиологии, эпидемиологии и иммунологии. 2006. N4: 38-42) для 96-ти луночных планшет.
При этом формирование зрелых биопленок тестируемых бактерий происходило в течение 24 часов при 37°С. Затем планктонные клетки удаляли и образовавшиеся биопленки подсушивали в термостате при 37°С в течение 1 часа.
Фермент каталаза, является катализатором в реакции разложения перекиси водорода, при которой образуются вода и молекулярный кислород: Н2О2 + Н2О2 = О2 + 2H2O.
Биологическое значение каталазы заключается именно в разложении перекиси водорода, которая образуется в клетках при воздействии ряда флавопротеиновых оксидаз, чем обеспечивается действенная защита клеточных структур от разрушения, которое осуществляет перекись водорода. Каталаза имеется в тканях растений, животных и человека, а также и в бактериях, хотя у ряда анаэробных бактерий этот фермент отсутствует.
Каталаза - один из самых быстрых ферментов. Всего одна его молекула способна превращать миллионы молекул перекиси водорода в воду и кислород за секунду. С точки зрения энзимологии это значит, что для фермента каталазы характерно большое число оборотов. Что касается бактерий, то визуально это легко наблюдать - при взаимодействии бактериальных клеток с ферментом начинается активное выделение пузырьков кислорода.
Для того чтобы это было четко видно в нашем случае, в тестируемую коллекцию штаммов была включена изогенная пара штаммов S. typhimurium - исходного дикого штамма и штамма, несущего мутацию rpoS - глобального регулятора экспрессии генов, которая приводит к нарушению синтеза каталазы.
В первоначальном варианте для испытаний были представлены две рецептуры раствора, отличающихся количеством технологических компонентов, в большей и меньшей степени. Растворы тестировались для оптимизации эффективности и состава. Активность «Препарат - рецептура 1» и «Препарат - рецептура 2» тестировали на биопленках S. aureus 15, P. aeruginosa 32, A. baumanii 503, K. pneumoniae 1553, S. typhimurium С53, Е. coli 717, сформированных в больших лунках 24-х луночных планшет.
В верхние два ряда больших лунок со сформированными свежими и слегка подсушенными биопленками бактерий разных видов вносили по 300 мкл тестируемых «Препарат - рецептура 1» и «Препарат - рецептура 2», соответственно. В обоих случаях эффект проявлялся одновременно и сразу же после внесения препарата (Фиг. 1).
На этом же планшете с биопленками разных видов бактерий в два нижние ряда мы также вносили по 300 мкл «Препарат - рецептура 1» и «Препарат - рецептура 2» на третьи сутки после удаления питательной среды и значительного подсушивания бактериальных биопленок. Эффект воздействия перекисных растворов также был заметен сразу же после внесения растворов, но несколько в меньшей степени (Фиг. 2).
То есть, можно констатировать, что оба тестируемых раствора в равной степени активны и выявляют каталазаположительные штаммы бактерий. Однако, как было показано далее, со временем (месяц) активность «Препарат - рецептура 2» (голубой) снизилась. Поэтому, работа была продолжена на новых опытных образцах, но приготовленных и хранящихся в специальной гелеобразной форме.
Активность «Препарат - рецептура 3» и «Препарат - рецептура 4» в гелевой форме первоначально тестировали в маленьких чашечках Петри на биопленках S. aureus (грамм-положительный) и P. Aeruginosa, A. Baumanii, K. pneumonia, S. Typhimurium С53 и S. Typhimurium C53rpoS (грамм-отрицательные).
Для этого, на донышко чашечек со сформированными бактериальными биопленками внесли по 1 мл каждого гелевого препарата. Результат фиксировали фотографированием (Фиг. 3). Из фотографий, представленных на фиг.3 видно, что почти во всех случаях сразу же пошло активное образование пузырьков кислорода. Только в чашечке с биопленкой S. Typhimurium C53rpoS такой эффект полностью отсутствовал. Это свидетельствует о том, что фермент, содержащийся в препарате, активно работает на каталаза-положительных бактериях и не работает на каталаза-отрицательных.
Далее провели сравнение двух вариантов гелевых препаратов, и для сравнения мы выбрали вариант методики формирования биопленок в больших лунках 24-х луночных планшет. Это позволило нам более наглядно представить результаты сравнительного эксперимента.
Большие лунки со сформированными свежими биопленками бактерий разных видов (как и в предыдущем опыте) подсушивали в термостате в течение 1 часа, а затем в верхние два ряда вносили по 300 мкл тестируемых препаратов. В обоих случаях эффект проявлялся одновременно и сразу же после внесения препарата (Фиг. 4).
Как и в опытах, проводимых в чашечках Петри, в лунках со сформированной биопленкой всех штаммов наблюдали эффект выделения пузырьков, а в лунках с мутантным штаммом S. Typhimurium C53rpoS эффект выделения пузырьков кислорода полностью отсутствовал.
Нижние два ряда лунок с биопленками оставили при комнатной температуре на 3 суток. Затем в эти два ряда лунок также вносили по 300 мкл каждого препарата. Результат опыта также фиксировали фотографированием (Фиг. 5).
Эффект выделения пузырьков кислорода проявлялся почти во всех случаях, но в случае P. aeruginosa в пересушенной биопленке с несколько меньшей активностью. По-видимому, это связано с низкой выживаемостью клеток этого урологического штамма в условиях пересушенности.
На биопленках, образованных S. Typhimurium C53rpoS эффект препаратов не выявлялся.
В то же время можно отметить, что оба варианта и «Препарат - рецептура 3» и «Препарат - рецептура 4» работают почти одинаково как в случае со свежими сформированными биопленками грамположительных и грамотрицательных бактерий, так и с высушенными биопленками этих микроорганизмов.
После 2,5 месяцев хранения, мы снова проверили сравнительную активность этих двух гелевых форм препарата в тех же самых условиях на свежих и очень пересушенных (6-ти суточных) биопленках разных видов бактерий: S. aureus, P. aeruginosa, A. baumanii, K. pneumoniae, S. typhimurium C53, E.coli, (фиг. 6). На фото 6 хорошо видно, что на свежесформированных бактериальных биопленках оба препарата работают почти одинаково хорошо.
На 6-е сутки мы внесли по 300 мкл каждого препарата соответственно в нижние два ряда с аналогичными биопленками (фиг. 7).
Результаты этого опыта нам показали, что активность выделения пузырьков кислорода в некоторых вариантах бактериальных пересушенных биопленок значительно снизилась. Но, в то же время следует отметить, что после 2-х месячного хранения «Препарат - рецептура 4» был активнее при взаимодействии с застарелыми пересушенными биопленкам, чем «Препарат - рецептура 3».
Таким образом, проведенное исследование показало, что испытанные «Препарат -рецептура 3» и «Препарат - рецептура 4» вполне подходят для обнаружения как свежих, так и застарелых (6-ти суточных) биопленок на поверхностях абиотической природы.
Испытания по оценке активности ферментов из группы карбогидраз в отношении экзополисахаридного матрикса биологических пленок грамположительных и грамотрицательных бактерий на абиотических поверхностях.
Было проведено исследрование активности препаратов, содержащих ферменты из группы карбогидраз, на матрикс биопленок, образованных патогенными бактериями на различных поверхностях invitro.
Материалы и методы:
В качестве объектов исследования использовали клинические изоляты грамположительных - S. aureus, и грамотрицательных - P. aeruginosa, A. baumanii, K. pneumoniae, E. coli, S. typhimurium).
Штаммы микроорганизмов, используемые в испытаниях:
- Staphylococcus aureus 15
- Escherichia coli 717
- Pseudomonas aeruginosa 32
- Acinetobacter baumanii 503
- Klebsiella pneumoniae 1553
- Salmonella typhimuriumC53
Опытные образцы ферментов группы карбогидраз.
Нами были получены три варианта комплексного полиферментного препарата, в состав которого входят ферменты из группы карбогидраз.
Опытный образец полиферментной смеси, далее «Полиферментная смесь 1», содержащая ферменты - амилазу, липазу, протеазу, целлюлазу и декстаназу, проверяли на активность по отношению к биопленкам бактерий разных видов.
Формирование зрелых биопленок тестируемых бактерий осуществляли в течение 24 часов при 37°С в лунках 96-ти луночных планшет (по 4 повтора каждого варианта) по методике O'Tool (O'Toole G.A., Kolter R. Flagellarandt witching motility are necessary for
Pseudomonas aeruginosa biofilm development. Mol. Microbiol. 1998. V.30: 295-304), модифицированной и отработанной ранее (Романова Ю.М., Алексеева Н.В., Смирнова Т.А. и др. Способность к формированию биопленок в искусственных системах у различных штаммов Salmonella typhimurium. Журнал микробиологии, эпидемиологии и иммунологии. 2006. N4: 38-42).
После удаления планктонных клеток в лунки к сформировавшимся биопленкам добавляли раствор тестируемого полиферментного комплекса и выдерживали в течение 1 часа при 37°С. Затем раствор субстанции «Полиферментная смесь 1» удаляли, биопленки окрашивали раствором кристалл-виолета и отмывали от не связавшегося красителя.
Связанный клетками биопленки краситель экстрагировали этанолом в течение 1 часа и на спектрофотометре оценивали интенсивность его окраски при длине волны 540 нм.
В качестве контроля активности субстанции «Полиферментная смесь 1» использовали лунки с нативной (первичной) биопленкой, а также лунки с биопленками, обработанными водой и/или физиологическим раствором.
Интенсивность окраски в лунках, обработанных тестируемыми растворами, сравнивали с окраской исходной первичной биопленки.
Активность первого варианта субстанции «Полиферментная смесь 1» в отношении биопленок грамположительных и грамотрицательных бактерий проверяли на сформированных в течение 1 суток биопленках S. aureus (грамположительный), и Р. aeruginosa, A. baumanii, K. pneumoniae, Е. coli, S. typhimurium (грамотрицательные).
Было показано, что во всех случаях (и для грамотрицательных, и для грамположительных бактерий) интенсивность окраски экстрагированного красителя из биопленок после воздействия субстанции «Полиферментная смесь 1» была значительно ниже по сравнению с окраской нативной первичной биопленки. При этом воздействие воды и физиологического раствора на сформированные биопленки также иногда способствовало снижению интенсивности экстрагированной окраски, но в значительно меньшей степени (Фиг. 8).
По результатам этого эксперимента стало ясно, что значительное снижение интенсивности окрашивания экстракта после воздействия «Полиферментная смесь 1» на биопленки связано с утратой ими бактериальных клеток, но не за счет их гибели. Антибактериальный эффект субстанции «Полиферментная смесь 1» не обнаружен.
Комплекс ферментов, входящих в этот препарат, разрушает полисахаридный матрикс биопленок. В результате разрушения структур матрикса бактериальные клетки освобождаются и могут быть или удалены в ходе последующих методических процедур по окраске и отмывке проб или подвергнуты переносу на диагностические среды.
Эффективность воздействия субстанции «Полиферментная смесь 1» на полисахаридный матрикс бактериальных биопленок была показана в опытах с биопленками разных видов бактерий в больших лунках 24-х луночных планшет. Сформированные первичные (нативные) биопленки и биопленки, обработанные раствором субстанции «Полиферментная смесь 1», окрашивали двумя красителями: кристалл-виолетом (который окрашивает в основном клетки бактерий и внеклеточную ДНК) и алциановым-синим (который окрашивает в основном полисахаридный матрикс биопленок).
На фиг. 9 представлены результаты таких экспериментов, полученные прямой визуализацией окрашенных биопленок и фотографированием. В лунках с нативной первичной биопленкой разных видов бактерий (не подвергавшейся воздействию раствора полифермента) видно яркое окрашивание бактериальных биопленок как кристалл-виолетом, так и алциановым-синим.
Это свидетельствовало о том, что нативная биопленка содержит в себе бактериальные клетки (окрашивающиеся раствором кристалл-виолета) и полисахаридный матрикс биопленок (окрашивающийся раствором алцианового-синего). Матрикс сформирован и содержится в составе биопленок с бактериальными клетками.
После обработки всех проб раствором субстанции «Полиферментная смесь 1» окраска лунок почти исчезла. Это свидетельствует о том, что раствор субстанции «Полиферментная смесь 1» разрушил полисахаридный матрикс, освободившиеся от матрикса бактериальные клетки вышли в раствор, и были удалены в ходе промывочных процедур.
В ходе дальнейшего изучения воздействия растворов субстанции «Полиферментная смесь 1» на матрикс биопленок наше предположение было подтверждено в опытах по визуализации обработанных растворами субстанции «Полиферментная смесь 1» биопленок в флуоресцентном микроскопе Nikon H600L.
Биопленки S. aureus и P. aeruginosa были сформированы на поверхности небольших кусочков предметного стекла в одинаковых условиях. Затем, предметные стеклышки разделили на две группы:
1-я - первичную нативную биопленку обоих микроорганизмов окрашивали растворами кристалл-виолета и/или алцианового-синего;
2-я - нативную биопленку обрабатывали раствором субстанции «Полиферментная смесь 1», как и в предыдущих опытах, а затем также окрашивали.
Результаты представлены на фиг. 10. На фото хорошо видно, что при окраске кристалл-виолетом биопленка P. aeruginosa выглядит значительно интенсивнее, чем биопленка S. aureus.
При обработке биопленки раствором субстанции «Полиферментная смесь 1» происходит ее полное разрушение.
В случае P. aeruginosa первичная биопленка более интенсивна и добавление фермента полностью разрушает биопленку, и скорее всего за счет разрушения матрикса.
Во всех вариантах эксперимента при окрашивании алциановым синим было четко показано, что раствор субстанции «Полиферментная смесь 1» активно разрушает полисахаридный матрикс как грамположительного микроорганизма (S. aureus), так и грамотрицательного (P.aeruginosa). Полисахаридный матрикс полностью разрушается, бактериальные клетки высвобождаются и удаляются в ходе промывочной процедуры.
Поскольку целью предполагаемого использования полиферментной субстанции «Полиферментная смесь 1» является его использование для обработки различных поверхностей, на которых могут образовываться биопленки, поэтому, было важным проверить его активность в зависимости от разных температур инкубации (20°С и 37°С).
В ходе этих экспериментах было показано отсутствие принципиальной разницы в активности субстанции «Полиферментная смесь 1» при данных температурах инкубации и поэтому последующие эксперименты проводили при комнатной температуре.
В дальнейшем нам было интересно проверить активность воздействия субстанции «Полиферментная смесь 1» на биопленки в зависимости от времени контакта фермента с биопленккой.
Для этого в лунки с биопленками разных видов бактерий вносили раствор субстанции «Полиферментная смесь 1» и выдерживали в течение 10, 20, 30, 40, 50 и 60 минут. После соответствующего времени инкубации раствор субстанции «Полиферментная смесь 1» удаляли, обработанные биопленки стандартно окрашивали кристалл-виолетом, лунки промывали и экстрагировали связавшийся краситель этанолом.
Интенсивность окрашивания обработанных раствором субстанции «Полиферментная смесь 1» биопленок сравнивали с окраской исходной первичной биопленки разных видов бактерий (Фиг. 11). В этих экспериментах по изучению активности раствором субстанции «Полиферментная смесь 1» в зависимости от времени инкубации биопленки с препаратом была показана очень высокая степень активности раствором субстанции «Полиферментная смесь 1» вне зависимости от времени обработки.
Раствор субстанции «Полиферментная смесь 1» практически разрушал биопленки бактерий разных видов уже за первые 10 минут контакта. Дальнейшее увеличение времени инкубации показывало незначительное» увеличение в интенсивности разрушения обработанных препаратом биопленок.
На следующем этапе были получены два раствора комплексного полиферментного препарата на основе субстанции «Полиферментная смесь 1» в разных концентрациях:
ПС №1 - «Полиферментная смесь 1» - содержащая 1% смеси ферментов и
ПС №2 - «Полиферментная смесь 1» - содержащая 0,5% смеси ферментов.
Эффективность их воздействия проверяли на биопленках грамположительного S. aureus (St. 15) и грамотрицательных - P. aeruginosa (Ps. 32), A. baumanii (Ac), K. pneumoniae (Kl.), S. typhimurium (C53), E. coli (E.c.) клинических изолятов.
На фиг. 12 представлены результаты этих экспериментов. Окрашивание биопленок проводили только раствором кристалл-виолета.
Лунки с контрольными нативными биопленками (верхний ряд) бактерий ярко окрашены, что свидетельствует об интенсивности сформированных биопленок.
После обработки двух нижних рядов лунок с этими же бактериальными биопленками тестируемыми растворами препаратов ПС №1-1% и ПС №2-0,5% окрашивание лунок почти полностью исчезло. Это говорит о том, что тестируемые растворы полиферментных препаратов разрушили полисахаридный матрикс биопленок, клетки вышли в раствор и были удалены в ходе промывочных процедур. В данном случае эффект разрушения бактериальных биопленок этими растворами настолько очевиден, что количественное определение оставшихся клеток в биопленке не требуется.
Для изучения сравнительной активности двух опытных вариантов растворов полиферментных препаратов (ПС №1-1% и ПС №2-0,5%) проводили эксперименты по их воздействию на биопленки S. aureusn P. Aeruginosa в динамике, за разные промежутки времени (от 10 до 60 минут).
В этих экспериментах не было отмечено значительного отличия в активности этих вариантов полиферментного препарата по времени контакта их с биопленками выбранных грамположительных и грамотрицательных бактерий (Фиг. 13). Оба варианта полиферментных препаратов очень хорошо разрушали биопленки S. aureusn P. aeruginosa уже в течение первых 10 минут.
После того, как была установлена высокая активность обоих растворов полиферментных препаратов в разрушении свежесформированных биопленок, проверили активность «ПС №2» 0,5% раствора полифермента меньшей концентрации в отношении застарелых высушенных биопленок, что очень важно для практического использования раствора полифермента в дальнейшем.
Для этого в лунках 96-ти луночных планшет провели формирование биопленок S. aureus, P. aeruginosa, A. baumanii, K. pneumoniae, S. typhimurium и Е. coli в течение суток по стандартной методике. Затем из лунок отобрали планктонные клетки и открытые планшеты оставили подсушиваться в термостате при 37°С на 4 суток. На 5 сутки часть лунок обработали раствором препарата «ПС №2» 0,5% с различным временем инкубации (от 10 до 60 минут), затем покрасили контрольные и обработанные лунки раствором кристалл-виолета и экстрагировали связавшийся краситель этанолом. Результаты фотометрии интенсивности окраски в разных вариантах эксперимента представлены на фиг. 14.
Результаты данного эксперимента наглядно показали высокую эффективность раствора препарата «ПС №2» 0,5% для разрушения не только свежесформированных биопленок, но также и для разрушения застарелых пересушенных биопленок разных видов бактерий уже через 10 минут контакта с биопленкой при комнатной температуре.
Таким образом, испытание полиферментных препаратов «ПС №1» - 1% и «ПС №2» - 0,5% на предмет их воздействия на биопленки, показало эффективность (до 95%) обоих препаратов в разрушении, как свежих молодых, так и в отношении старых пересушенных (5-ти суточных) биопленок при их образовании на абиотических поверхностях.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ борьбы с биологическими плёнками | 2020 |
|
RU2759744C1 |
| Средство для выявления и разрушения биопленок | 2023 |
|
RU2819290C1 |
| СПОСОБ ФЕРМЕНТАТИВНОГО УДАЛЕНИЯ БИОПЛЕНКИ, КОМПОЗИЦИЯ И НАБОР | 2008 |
|
RU2495098C2 |
| СРЕДСТВО ДЛЯ СЕЛЕКТИВНОГО ВЛИЯНИЯ НА БИОПЛЕНКООБРАЗОВАНИЕ МИКРООРГАНИЗМАМИ | 2016 |
|
RU2646488C2 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ИММОБИЛИЗОВАННОГО ПРЕПАРАТА БАКТЕРИАЛЬНЫХ КЛЕТОК С АКТИВНОСТЬЮ АМИЛАЗЫ И ЛИПАЗЫ | 2022 |
|
RU2804526C1 |
| ИСПОЛЬЗОВАНИЕ АЛЬГИНАТНЫХ ОЛИГОМЕРОВ В БОРЬБЕ С БИОПЛЕНКАМИ | 2008 |
|
RU2527894C2 |
| Способ повышения эффективности дезинфектантов и состав комбинированных дезинфектантов против биоплёнок бактерий | 2023 |
|
RU2815980C1 |
| ФЕРМЕНТНЫЙ ПРЕПАРАТ ИЗ ГЕПАТОПАНКРЕАСА ПРОМЫСЛОВЫХ ВИДОВ КРАБОВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2004 |
|
RU2280076C1 |
| СПОСОБ УДАЛЕНИЯ БИСУЛЬФИТНЫХ ПОБОЧНЫХ ПРОДУКТОВ ИЗ ФЕРМЕНТНЫХ КОМПОЗИЦИЙ | 2006 |
|
RU2383617C2 |
| Индикатор для выявления биологических плёнок бактерий на медицинских инструментах (варианты) | 2020 |
|
RU2718910C1 |





Группа изобретений относится к медицине и может быть использована для обнаружения биологических пленок бактерий на абиотических поверхностях. Для этого используют индикатор, представляющий собой раствор флуорохромного красителя Нильский красный с концентрацией от 5 μМ до 50 μМ, который образует свечение в зеленом свете светодиодного фонарика при наличии биологических пленок. Также предложен экспресс-тест для обнаружения биологических пленок бактерий на абиотических поверхностях. При этом раствор индикатора состоит из пероксида водорода в концентрации от 0,3% до 6,0%, катионных ПАВ, синергиста реакции N-кокоалкил-N,N-диметиламин оксид в концентрации от 0,5% до 5,0%, стабилизаторов пероксида водорода, ингибитора коррозии, комплексообразователя и загустителя. Кроме того, предложен эспресс-тест, в котором индикатор содержит смесь ферментов класса карбогидраз в концентрации от 0,05% до 10,0%, N-кокоалкил-N,N-диметиламин оксид и NN-бис(3-аминопропил)додециламин в концентрациях от 0,1% до 15,0%. Группа изобретений позволяет эффективно обнаруживать биологические пленки грамположительных и грамотрицательных бактерий на абиотических поверхностях. 3 н п. ф-лы, 14 ил.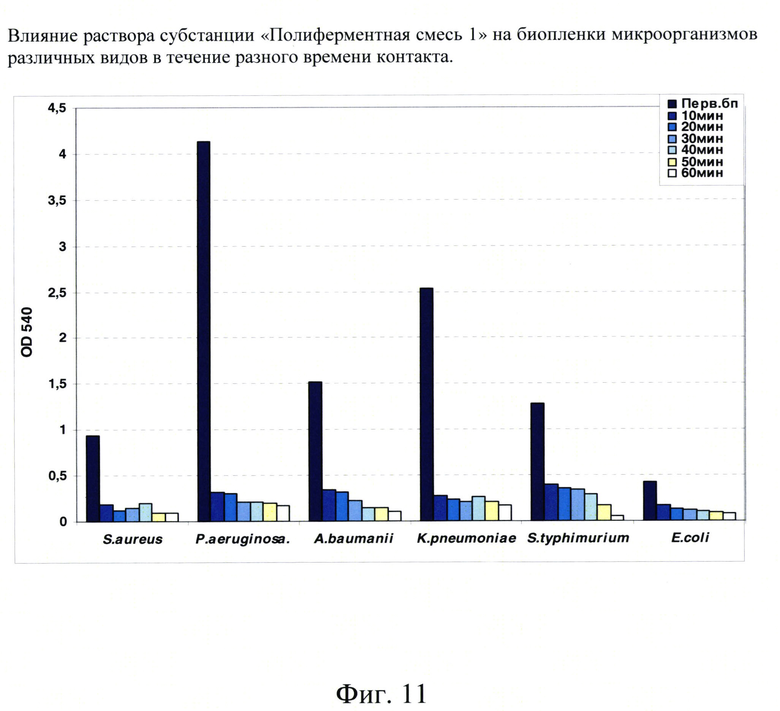
1. Экспресс-тест для обнаружения биологических пленок бактерий на абиотических поверхностях, включающий использования индикатора, представляющего собой раствор флуорохромного красителя Нильский красный с концентрацией от 5 μМ до 50 μМ и предназначенного для образования свечения в зеленом свете светодиодного фонарика при наличии биологических пленок, и визуальное наблюдение такого свечения при использовании защитных от УФ-света оранжевых очков.
2. Экспресс-тест для обнаружения биологических пленок бактерий на абиотических поверхностях, включающий использование индикатора, предназначенного для образования пены при наличии биологических пленок, и визуальное наблюдение пены на поверхности, причем индикатор представляет собой раствор, состоящий из пероксида водорода в концентрации от 0,3% до 6,0%, катионных ПАВ, синергиста реакции N-кокоалкил-N,N-диметиламин оксид в концентрации от 0,5% до 5,0%, функциональных и технологических компонентов, включающих стабилизаторы пероксида водорода, ингибитор коррозии, комплексообразователь и загуститель.
3. Экспресс-тест для обнаружения биологических пленок бактерий на абиотических поверхностях, включающий использование индикатора и проведение бактериологических смывов для диагностирования бактерий, при этом индикатор содержит смесь ферментов класса карбогидраз в концентрации от 0,05% до 10,0% и функциональные и технологические компоненты, в состав которых входят N-кокоалкил-N,N-диметиламин оксид и NN-бис(3-аминопропил)додециламин в концентрациях от 0,1% до 15,0%, причем смесь ферментов состоит из применяемых одновременно или в различных комбинациях протеазы, амилазы, липазы, целлюлазы, манноназы, декстраназы, хитиназы, β-глюкозидазы, ламинариназы, авицелазы, ксиланазы, хитозаназы, альгинат лиазы.
| СПОСОБ ФЕРМЕНТАТИВНОГО УДАЛЕНИЯ БИОПЛЕНКИ, КОМПОЗИЦИЯ И НАБОР | 2008 |
|
RU2495098C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СПОСОБНОСТИ МИКРООРГАНИЗМОВ ФОРМИРОВАТЬ БИОПЛЕНКИ НА ПОВЕРХНОСТИ ТВЕРДОЙ ФАЗЫ | 2011 |
|
RU2461631C1 |
| WO 2009110940 A2, 11.09.2009 | |||
| HONG WU, Strategies for combating bacterial biofilm infections, Int J Oral Sci | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2020-06-03—Публикация
2019-05-29—Подача