Изобретение относится к медицине, а именно к медицинской микробиологии и инфектологии, и может найти практическое применение в качестве средства растительного происхождения для профилактики и лечения заболеваний, вызванных биопленкообразующими микроорганизмами.
Существование большинства видов бактерий в природе происходит не в виде свободноживущих (планктонных) клеток, а путем организации ими специфических образований - биопленок: сообществ микробных клеток, прикрепленных к поверхности или друг к другу и заключенных в матрикс синтезированных ими внеклеточных полимерных веществ (Donlan R.M., Costerton J.W., 2002; Mulcahy R. et al., 2014). Особое значение имеет образование биопленок патогенными бактериями. Известно, что 80% всех инфекционных заболеваний, свыше 60% всех внутрибольничных инфекций вызываются микроорганизмами, находящимися в биопленках (Pintucci J.P. et al., 2010; Сидоренко С.В., 2012). С наличием биопленок связывают течение длительно рецидивирующих хронических инфекционных заболеваний, трудно поддающихся стандартной терапии: эндокардиты, лор-патология, заболевания мочевыделительной системы, болезни полости рта, зубов и десен и др. (Pintucci J.P. et al., 2010; Smith A. et al., 2011; Романова Ю.М., Гинцбург А.Л., 2011).
Важное прикладное значение имеет вопрос об образовании биопленок на абиотических поверхностях медицинского оборудования, включая контактные линзы, катетеры, протезные устройства, имплантанты, стенты, внутриматочные контрацептивы, трубки для интубации и пр. (Романова Ю.М. с соавт., 2011; Kostakioti М. et al., 2013). Очевидно, что микроорганизмы, фиксированные на поверхностях этого оборудования, представляют реальную угрозу заражения пациентов и могут служить причиной инфекционных осложнений при проведении медицинских мероприятий.
Патогенность микрофлоры, находящейся в биопленоке, во многом обусловлена следующими факторами: возрастанием резистентности к неблагоприятным факторам среды и механизмам иммунной защиты человека, значительным снижением чувствительности к антибиотикам за счет ограничения проникновения химиопрепаратов через экзополисахаридный матрикс; снижением метаболизма и скорости деления бактерий в биопленках (Hoiby N. et al., 2010); существованием в популяции биопленочных бактерий клеток-персистеров, обладающих абсолютной устойчивостью к химиопрепаратам (Льюис К., 2005). Указанные факторы обусловливают необходимость использовать для борьбы с инфекцией химиопрепараты в дозах, существенно (в 10-1000 раз) превышающих минимальные бактериостатические концентрации (МБК) для планктонных культур (Мошкевич И.Р., 2007; Чеботарь И.В. с соавт., 2012; Sadovskaya I. et al., 2010).
Отдельную задачу для практической медицины представляет создание средств с избирательным влиянием на биопленкообразование только возбудителей заболеваний микробной этиологии, поскольку современные используемые антибиопленочные средства при применении одновременно подавляют образование биопленок не только у патогенных и условно-патогенных микроорганизмов, но и у представителей нормального микробиоценоза (эубиоза) различных биотопов человека. Формирование в процессе жизнедеятельности нормальной микрофлоры биопленок обеспечивает им выполнение важнейшей защитной функции - противодействие заселению слизистых болезнетворными микроорганизмами, а также защищает саму нормофлору от неблагоприятных воздействий окружающей среды (антибиотики, другие химиопрепараты, стрессорные факторы и т.д.).
Таким образом, очевидно, что разработка средств, способных снижать биопленкообразование патогенными и условно-патогенными микроорганизмами и не подавлять биопленкообразование у представителей нормофлоры, имеет важное прикладное значение для повышения эффективности профилактики и лечения бактериальных инфекций.
Уровень техники
Интенсивная разработка проблемы борьбы с заболеваниями микробной этиологии, вызываемыми возбудителями, способными образовывать биопленки на биотических и абиотических поверхностях, базируется на представлениях об этапах формирования микробных биопленок и составляющих их механизмах. В соответствии с этими представлениями подходы, предупреждающие или лимитирующие образование биопленок, включают средства и способы, направленные на ограничение прикрепления микробных клеток к поверхностям (адгезии), нарушение созревания биопленок (роста бактериальной популяции и формирование внеклеточного матрикса), а также на дезинтеграцию уже сформированных биопленок.
Адгезия рассматривается как ключевой момент в образовании биопленки (Klemm P., Vejborg R.M., 2010; Маянский А.Н., Чеботарь И.В., 2012; Ерошенко Д.В., 2015). В ее реализации со стороны бактерий участвуют как минимум две группы адгезивных факторов, связанных с органеллами клетки, - пили и пилиподобные клубкообразные отростки (кэрли) и адгезивные молекулы нефимбриальной природы (экзополисахариды и другие соединения). Для ингибирования указанных факторов используют бициклические 2-пиридины (Pinkner J.S. et al., 2006), ионы Zn2+ (Hancock et. al., 2010), полимерные гексаны: альфа-метил-галактозиды и альфа-метил-фукоцид, связывающие лектиноподобные молекулы (Chemani С. et al., 2009); туникамицин (Thomas R., Brooks Т., 2004); аминокислоты - лейцин, триптофан, митионин, тирозин, заменяющие в пептидогликане концевую аминокислоту - D-аланин (Kolodkin-Gall, 2010).
Альтернативный подход включает средства и методы, направленные на изменения свойств субстрата, на котором происходит образование биопленки: обработка биогенных субстратов (эпителиальные клетки воздухоносных путей) нейроминидазой, сиаловыми кислотами и N-ацетилглюкозамином (Ramphal R., Arora S.K., 2001); обработка абиогенных поверхностей, меняющая их гидрофобность или заряд хелатированием двухвалентными катионами металлов (Banin Е. et al., 2006), гидрофобными агентами - р-нитрофенолом, а также покрытие их полисахаридами - декстраном, декстран-сульфатом, гепарином (Thomas R., Brooks Т., 2004) или белковой пленкой с молекулами, несущими положительный заряд (Vejborg R.M., Klemm P., 2008).
Важнейшей структурой бактериальной биопленки как естественной формы существования бактерий в окружающей среде и в организме хозяина является внеклеточный матрикс, составляющий 65-95% массы биопленки (Романова Ю.М., Гинцбург А.Л., 2011). Основными компонентами последнего служат полисахариды, белки и нуклеиновые кислоты. Исходя из этого очевидно, что все факторы, негативно влияющие на компоненты матрикса, будут предотвращать развитие биопленочного процесса или разрушать готовую биопленку (Чеботарь И.В., 2012). Этой способностью обладают альгинатлиазы Pseudomonas aeruginosa (Степанова Т.А. и соавт., 2010; Alkawash М.А. et al., 2005); протеазы, ДНК-азы (Терентьева Н.А. с соавт., 2015; Nijland R. et al., 2010; Gilan I., Sivan A., 2013), а также комбинации ферментов (Landini P. et. al., 2010); дисперсии В-гликозидгидролаза, деградирующая поли-N-ацетилглюкозамин (Kaplan J.B., 2010); N-ацетилцистеин (Zhao Т., Liu Y., 2010), снижающий продукцию матриксных полисахаридов.
Угнетение продукции компонентов биопленочного матрикса может быть достигнуто путем воздействия на систему кворум-сенсиса (QS), объединяющую сигнальные молекулы (медиаторы, аутоиндукторы, феромоны) общения между микробными клетками. Блокада QS-медиаторов может быть достигнута с помощью макролидных антибиотиков, используемых в суббактериостатических концентрациях (Nalca Y. et al., 2006), и при использовании галогенезироованных аналогов антраловой кислоты (Lesic В. et al., 2007), интерферирующих с секрецией QS-аутоиндукторов. Существенно, что среди множества QS-ингибиторов (Sintim Н.О. et al., 2010) видное место занимают природные метаболиты, полученные из экстрактов различных растений: чеснока, винограда, соевых бобов и др. (Nazzaro F. et al., 2013; Маркова Ю.А., 2014).
Подавление биопленкообразования может быть также достигнуто путем ингибирования жизнедеятельности самих бактерий с помощью микробных метаболитов: батумина (Бухарин О.В. и др., 2012); антибиотиков из группы макролидов (Карпов О.И. и соавт., 2005; Tre-Hardym М. et al., 2010).
Наконец, для разрушения уже сформированной биопленки используются физические методы воздействия, в частности эффективной оказалась ее обработка ультразвуком при лечении хронического риносинусита (Karosi Т. et al., 2013).
Наиболее близким аналогом по теме данной заявки является работа - соединения триазола для лечения образования биопленок – Патент RU №2478385). Соединения триазола в комбинации, включающей (а) 4-[3,5-бис(2-гидроксифенил)-[1,2,4]триазол-1-ил]бензойную кислоту или ее фармацевтически приемлемую соль и (б) антибиотик, выбранный из группы, включающей гентамицин, амикацин, тобрамицин, ципрофлоксацин, левофлоксацин, цефразидим, цефепим, цефпиром, пиперациллин, тикарциллин, меропенем, имипенем, полимиксин В, колистин и азреонам, предупреждают образование биопленок, формируемых P. aeruginosa, у пациентов с муковисцедозом и при лечении хронической инфекции, вызванной P. aeruginosa.
Недостатком использования соединений триазола для лечения образования биопленок является узкий спектр применения, ограничиваемый воздействием на биопленки, образуемые только P. aeruginos.
В качестве прототипа выбрано использование альгинатных олигомеров в борьбе с биопленками – Патент RU №2527894. Альгинатный олигомер молекулярной массой менее 20000 Д, содержащий по меньшей мере 70% G - остатков, используется для изготовления лекарственного средства для профилактики и борьбы с биопленкой, в том числе с биопленочной инфекцией в клинике (у пациентов с ранами, травмами, ожогами, респираторными инфекциями, инфекций ротовой полости), и для очистки и обеззараживания биотических и абиотических поверхностей посредством действия на внеклеточную полимерную матрицу любых микроорганизмов (грамположительные, грамотрицательные бактерии, грибы). Использование альгинатного олигомера возможно в сочетании с различными антимикробными агентами и деструкторами биопленок.
Недостатком использования альгинатных олигомеров в борьбе с биопленками является разрушение/подавление биопленок любых микроорганизмов посредством влияния на внеклеточный матрикс. Подобный эффект воздействия альгинатных олигомеров не исключает подавления или разрушения биопленок микроорганизмов, относящихся к нормальной микрофлоре, что может существенно снижать колонизационную резистентность слизистых различных биотопов человека и повышать риск заселения биотопов возбудителями инфекционных и гнойно-воспалительных заболеваний.
Задачей изобретения является расширение арсенала средств для борьбы с биопленкообразованием у патогенных и условно-патогенных микроорганизмов.
Раскрытие изобретения
Указанная задача решается применением тритерпеноида милиацина в качестве средства для селективного влияния на биопленкообразование микроорганизмами, снижающего биопленкообразование патогенными - Salmonella typhimurium, Salmonella enteritidis и условно-патогенными - Pseudomonas aeruginosa, Klebsiella pneumoniae, Staphylococcus aureus бактериями и одновременно сохраняющего биопленкообразование нормофлорой - лактобактериями, например Lactobacillus plantarum, Lactobacillus fermentum, Lactobacillus acidophilus и бифидобактериями, например Bifidobacterium bifidum, Bifidobacterium adolescentis.
Технический результат, обеспечиваемый изобретением, заключается в создании нового растительного средства для эффективной профилактики и лечения инфекционных и гнойно-воспалительных заболеваний, вызванных биопленкообразующими патогенными и условно-патогенными бактериями, например сальмонеллами, клебсиеллами, псвдомонадами, золотистым стафилококком, которое снижает у них способность к биопленкообразованию с одновременным сохранением биопленкообразования нормальной микрофлорой человека, например бифидобактериями и лактобактериями, являющимися ведущим звеном в формировании колонизационной резистентности организма человека, обеспечивающей защиту слизистых различных биотопов человека от болезнетворных микроорганизмов.
При оценке существующих подходов к снижению биопленокообразования у микроорганизмов обращает внимание необходимость соблюдения как минимум двух условий, обеспечивающих эффективность этих подходов. Во-первых, комплексность воздействия на микрофлору биопленки, включая антиадгезивные, антивирулентные, диспергирующие, бактерицидные или бактериостатические эффекты (Маянский А.Н., Чеботарь И.В., 2012; Чеботарь И.В. с соавт., 2012). Во-вторых, безвредность используемых средств и методов для организма. На сегодняшний день указанным условием в наибольшей степени соответствуют вещества природного, в частности растительного происхождения. Их существенным достоинством является низкая (в большинстве случаев) токсичность, а также возможность комбинированного влияния на биопленкообразование, включая воздействие на QS-систему бактерий (Nazaro F. et al., 2013), способность к адгезии (Wojnicz D. et al., 2012), поверхностные свойства и подвижность клеток (Lemos М. et al., 2014), а также экспрессию генов, регулирующих биопленочный процесс (Wojnicz D. et al., 2012).
Из этих продуктов к числу наиболее известных относятся терпеноиды (изопреноиды), представляющие собой самый многочисленный класс низкомолекулярных соединений, молекулы которых построены из разветвленных С5 единиц (Лукнер М., 1979; Гудвин Т., Мерцер Э., 1986). Присущие как эукариотным, так и прокариотным организмам, терпеноидные (изопреноидные) структуры выполняют важнейшие функции, участвуя в процессах фотосинтеза (в составе каротиноидов, хлорофиллов, пластихинона), дыхания (убихинон), гормональной регуляции (стеролы), регуляции роста и развития (в составе цитокинов, пренилированных белков), в защите от патогенов и передаче сигнальной информации - Ras-белки, в везикулярном транспорте внутри клеток - Rab-белки (Тренин А.С., 2013). У бактерий изопреноиды включены также в состав липидного переносчика, необходимого для синтеза клеточной стенки (Тренин А.С., 2013). Для продукции терпеноидов необходимо образование изопентилпирофосфата, которое может протекать по двум альтернативным вариантам: через меволонатный путь (Пасешниченко В.А., 1998), присущий эукариотам и большинству грамположительных кокков и через немеволонатный, т.н. пируват-глицеральдегидфосфатный путь (Ершов Ю.В., 2005; 2007), выявленный у подавляющего большинства грамотрицательных микроорганизмов. Для растений, продуцирующих большую часть известных сегодня изопреноидов, характерно наличие обоих путей биосинтеза изопентилпирофосфата и многие из этих продуктов имеют смешанное происхождение. (Ltittgen Н. et al., 2000).
Среди терпеноидов растительного происхождения объектом глубокого изучения являются тритерпены в связи с обнаруженными у них многообразными биологическими свойствами, используемыми в медицине, включая противовоспалительный, иммуномодулирующий, антибластомный, антигипергликемический и другие эффекты. Влияние тритерпеноидов на процесс биопленкообразования изучено недостаточно, а отдельные работы, посвященные данной проблеме, неоднозначны. В частности, по данным Raja A.F. et al. (2011) пентациклический тритерпеноид: ацетил-11-кето-6-босвеллиновая кислота, выделенный из африканского растения Boswellia, в дозах 16-128 мкг/мл ингибировал образование биопленки S. mutans и Actinomyces visiosus. Аналогичный эффект подавления биопленкообразования штаммами S. mutans и S. mitis наблюдали Evaristo F.F.V. (2014), используя тритерпен 3β, 6β, 16β-тригидроксилупен, полученный из листьев кустарника Combretum leprosum Mart., произрастающего в Бразилии. Эффективная концентрация препарата составляла 7,8 мкг/мл, что соответствовало его минимальным ростингибирующим (7,8 мкг/мл) и бактерицидным (15,6 мкг/мл) концентрациям. При этом подавление биопленкообразования не проявлялось в отношении грамотрицательных бактерий - P. aerugenosa и Klebsiella oxytoca, что подтверждало ранее полученные данные для пентациклических тритерпеноидов, выделенных из африканских растений Combretaceae (Katerere D.R. et al., 2003). Противоположные результаты были получены в работе Awolola G.V. et al. (2014), изучавших антибактериальную и антипленочную активность флавоноидов и тритерпеноидов, полученных из экстракта листьев африканского фикуса Sansilarica Moraccae. Анализ этой активности у трех идентифицированных тритерпеноидов не только не выявил в их присутствии угнетения биопленкообразования штаммами грамположительных (S. aureus) и грамотрицательных (Е.coli) микроорганизмов, но, напротив, демонстрировал в отношении одного из них (люпеол-ацетата) статистически значимое повышение адгезии для всех исследуемых штаммов бактерий во всех тестируемых концентрациях (2-15 мг/мл).
К числу тритерпеноидов, нашедших практическое применение в медицине, относится и милиацин, входящий в состав просяного масла (Олифсон Л.Е. с соавт., 1991). Ранее было показано, что применение милиацина снижает бактериальную обсемененность внутренних органов при экспериментальной сальмонеллезной инфекции и повышает выживаемость зараженных животных (Фролов Б.А. с соавт., 2013). В этой связи закономерным является интерес к исследованию способности милиацина влиять на биологические свойства микроорганизмов, колонизирующих различные биотопы организма человека, в том числе и на способность их формировать биопленку, в которой значительно возрастает устойчивость микроорганизмов к антибиотикам и факторам иммунной защиты человека.
Новизной предлагаемого изобретения является новое свойство растительного тритерпеноида милиацина селективно влиять на биопленкообразование микроорганизмов, снижая биопленкообразование у патогенных (Salmonella typhimurium, Salmonella enteritidis) и условно-патогенных (Pseudomonas aeruginosa, Klebsiella pneumoniae, Staphylococcus aureus) бактерий и одновременно сохраняя биопленкообразование у бактерий нормофлоры - лактобактерий и бифидобактерий, которое было обнаружено нами путем ряда экспериментов и его нельзя было предсказать заранее.
Предложенное средство 3-(3-метокси-А-олеанен (милиацин) относится к группе природных пентациклических тритерпеноидов, содержится в просяном масле и представляет собой вещество белого цвета с температурой плавления 285-286°С. Он оптически активен, нерастворим в воде, слаборастворим в этиловом спирте, диэтиловом эфире, ацетоне, хорошо растворим в хлороформе. Милиацин обладает хорошей переносимостью в диапазоне доз от 2 до 1000 мг/кг. ЛД50 этого соединения больше 1000 мг/кг (Олифсон Л.Е. с соавт., 1991), что свидетельствует об отсутствии у него токсических свойств. Химическая структура пентациклического тритерпеноида - милиацина (3-(3-метокси-Д,8-олеанена) представлена (фиг. 1).
Описание эксперимента
В качестве объекта исследования были использованы клинические штаммы патогенных бактерий: Salmonella серовар Enteritidis (S. enteritidis) (28 культур), Salmonella серовар Typhimurium (S. typhimurium) (24 штамма), изолированные от больных гастроинтестинальной формой сальмонеллеза. Кроме того, использовались клинические штаммы условно-патогенных бактерий: Klebsiella pneumonia (K. pneumoniae) (8 культур) и Pseudomonas aeruginosa (P. aeruginosa) (8 изолятов), выделенные от пациентов с дисбиозом кишечника II-III степени, 8 клинических штаммов Staphylococcus aureus (S. aureus), выделенных от больных с гнойно-воспалительными заболеваниями. Также в работе были использованы пробиотические культуры микроорганизмов - представители нормальной микрофлоры человека: Lactobacillus plantarum №900811 (Государственная коллекции патогенных микроорганизмов ФГБУ «НЦЭСМП» Минздрава России), Lactobacillus fermentum 90Т-С4 (ГИСК им. Л.А. Тарасевича), Lactobacillus acidophilus №42 (Государственная коллекция микроорганизмов нормальной микрофлоры ФБУН МНИИЭМ им. Г.Н. Габричевского Роспотребнадзора), Lactobacillus acidophilus NK1 (ГНИИ «Генетика»), Lactobacillus acidophilus 100аш (ГНИИ «Генетика»), Bifidobacterium bifidum №791 (№ AC-1247 в коллекции промышленных микроорганизмов ГНЦ РФ ФГУП ГосНИИ Генетики и селекции промышленных микроорганизмов), Bifidobacterium adolescentis МС-42 (ГИСК им. Л.А. Тарасевича), Bifidobacterium bifidum 1 (№900791 в Государственной коллекции патогенных микроорганизмов ФГБУ «НЦЭСМП» Минздрава России).
Антибактериальную активность милиацина исследовали методом серийных разведений с применением 96-луночных плоскодонных полистироловых планшетов, предварительно заполненных суспензией (100 мкл) суточных агаровых культур микроорганизмов в концентрации 1×106 КОЕ/мл. Для каждой исследуемой культуры бактерий использовались три группы лунок: опытные - с добавлением 100 мкл милиацина; контрольные - с добавлением 100 мкл растворителя для милиацина (твин-21 на физрастворе) и лунки группы сравнения - с добавлением 100 мкл физраствора. Конечные концентрации милиацина в опытных лунках составляли от 400 мкг/мл до 0,049 мкг/мл; конечные концентрации растворителя соответственно от 1,6×10-8 до 0,2×10-12 моль. Диапазон концентраций тритерпеноида определялся с учетом его расчетного содержания в крови животных (50 мкг/мл) при использовании в дозе 2 мг/кг, оказывавшей протективный эффект при экспериментальной инфекции (Фролов Б.А. и соавт., 2013). Учет результатов проводили после 24-часовой инкубации культур (37°С), оценивая минимальную подавляющую концентрацию милиацина (МПК), определяемую путем сравнения спектрофотометрических показателей оптической плотности исследуемых проб при длине волны 540 нм. Результаты выражали в единицах оптической плотности (ед. ОП).
Изучение биопленкообразования проводилось с использованием двух подходов: спектрофотометрической регистрации биопленочной массы, оцениваемой по интенсивности поглощения ею красителя - кристалл-виолета (O'Toole G., 2000) и с помощью атомно-силовой микроскопии. При реализации первого подхода применялись 96-луночные стерильные плоскодонные планшеты, в лунки которых одномоментно вносилось по 135 мкл суспензии суточной агаровой культуры бактерий в концентрации 0,5×106 КОЕ/мл и 15 мкл милиацина (опыт) или 15 мкл растворителя (контроль). Конечные концентрации милиацина в лунках составляли 50 и 100 мкг/мл, растворителя 2×10-9 и 4×10-9 моль. В качестве проб сравнения использовались бактериальные культуры (135 мкл), к которым добавляли 15 мкл физраствора. Все пробы инкубировались 24-48 часов статически при 37°С. Для культивирования облигатно-анаэробных бактерий (бифидобактерии) использовали CO2-инкубатор (BINDER, Германия). Учет биопленкообразования проводили через 24-48 часов инкубации проб при 37°С. Для учета биопленкообразования после удаления планктонных (свободноплавающих) клеток микроорганизмов трехкратной промывкой лунок дистиллированной водой (200 мкл) и подсушивания планшетов на воздухе (30 мин) осуществлялось окрашивание сформированных биопленок внесением в лунки 1%-ного раствора кристалл-виолета (45 мин при комнатной температуре). Отмывание свободного красителя выполняли трехкратной обработкой лунок дистиллированной водой, а экстракцию фиксированного в биопленках красителя проводили добавлением к пробам 200 мкл 96%-ного этанола. Интенсивность окрашивания последнего, соответствующую степени биопленкобразования, определяли на спектрофотометре (Биотек, США) при длине волны 540 нм. Биопленкообразование выражали в условных единицах, рассчитывая коэффициент биопленкообразования (КБПО):
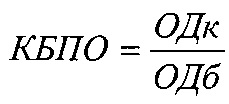 ,
,
где ОДк - оптическая плотность изучаемой культуры (для опытных, контрольных проб и проб групп сравнения, а ОДб - оптическая плотность питательного бульона без культур микроорганизмов.
Для проведения атомно-силовой микроскопии (АСМ) выполнялась подготовка образцов биопленки на поверхности скола слюды суточными бульонными культурами отдельных штаммов микроорганизмов, находящимися в стационарной фазе развития в присутствии милиацина (50 мкг/мл), растворителя (2×10-9 моль) или без их добавления. Время формирования биопленки составляло 24 часа при 37°С для факультативных анаэробов, а для бифидобактерий - 48 часов при 37°С в СО2-инкубаторе. Полученные образцы биопленок опытных, контрольных проб, а также проб группы сравнения исследовали методом АСМ в контактном режиме с использованием сканирующего зондового микроскопа SMM - 2000 (ЗАО «ПРОТОН МИЭТ», Россия). В процессе сканирования использовали кантилеверы MSCT-AUNM («Park Scientific Instruments», США) с жесткостью балки 0,05 Н/м и радиусом порядка 10 нм. Количественный морфометрический анализ полученных изображений проводили путем оценки размеров бактериальных клеток, площади и толщины биопленки, определяемых не менее чем в 50 сканах для каждой биокультуры с использованием штатного программного обеспечения микроскопа.
Статистическую обработку полученных данных осуществляли методами вариационной статистики из пакета прикладных программ Microsoft Excel и Statistica 10 с оценкой различий между средними величинами по t-критерию Стьюдента. Статистические результаты выражали в виде медианы (Me), нижних (Q25) и верхних (Q75) квартилей. Уровни статистической значимости различий определяли с помощью непараметрического критерия Манна-Уитни.
Результаты
Обобщенные значения влияния милиацина на рост патогенных и условно-патогенных исследуемых культур микроорганизмов представлены на фиг. 2. Результаты значений (средняя величина и ошибка средней, М±m) выражены в единицах оптической плотности (ед.ОП). Установлено, что ни милиацин, ни растворитель во всех исследуемых концентрациях не влияли на рост изученных видов патогенных и условно-патогенных бактерий (см. фиг. 2). Милиацин также не влиял рост пробиотических штаммов лактобактерий и бифидобактерий - представителей нормофлоры человека. Значения оптической плотности в пробах сравнения для лактобактерий и бифидобактерий составляли соответственно 1,433±0,08 ед.ОП и 1,891±0,11 ед.ОП; в опытных и конторольных пробах их колебания составляли соответственно от 1,214±0,06 ед.ОП до 1,414±0,09 ед.ОП для лактобактерий и от 1,714±0,16 ед.ОП до 1,902±0,13 ед.ОП для штаммов бифидобактерий.
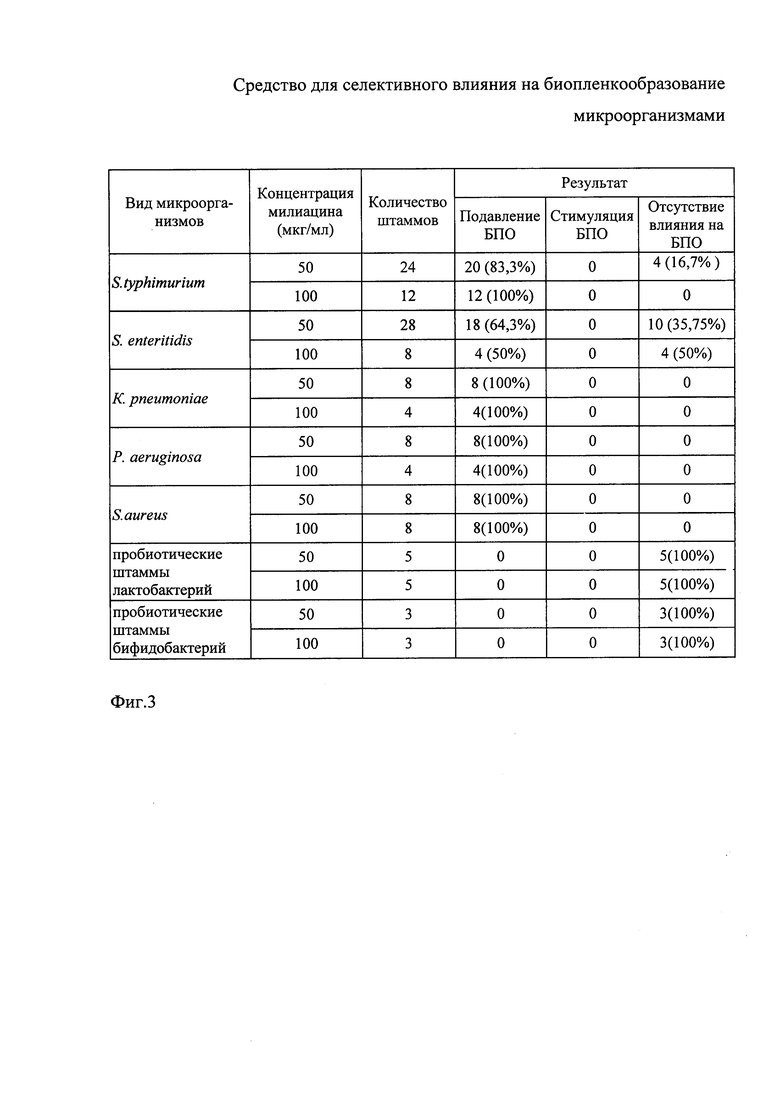
Результаты исследования влияния милиацина в концентрации 50 мкг/мл и 100 мкг/мл на биопленкообразование различными видами микроорганизмов, верифицируемое окраской биопленочной массы кристалл-виолетом, представлены на фиг. 3. Как видно на фиг. 3, исследуемые культуры бактерий проявляли различную чувствительность к действию милиацина. В частности, для S. typhimurium подавление биопленочного процесса при концентрации милиацина 50 мкг/мл отмечалось в 83,3% случаев. При увеличении дозы фитостерола до 100 мкг/мл этот показатель достигал 100%. Меньшая частота выявления ингибирующего влияния милиацина на биопленкообразование обнаруживалась в отношении культур S. enteritidis, при тестировании которых эффект ингибирования регистрировался в пределах 50-64,3% при дозах милиацина соответственно 100 мкг/мл и 50 мкг/мл. Что касается культур K. pneumoniae, S. aureus и P. aeruginosa, то они демонстрировали высокую чувствительность к действию милиацина, применявшегося в обеих концентрациях. В противоположность этому устойчивость к действию милиацина проявляли культуры пробиотических штаммов лакто- и бифидобактерий.
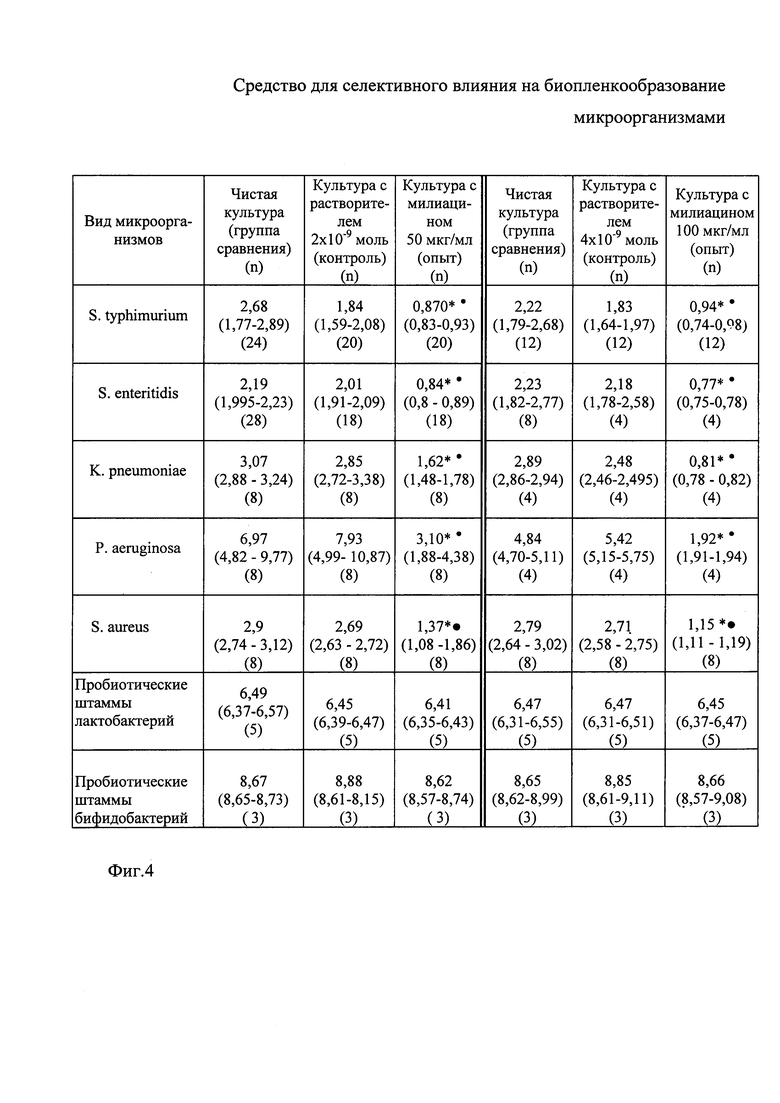
Результаты оценки выраженности ингибирования биопленкообразования, представленные коэффициентом биопленкообразования (КБПО) и выраженные в виде медианы (Me), нижних (Q25) и верхних (Q75) квартилей, приводятся на фиг. 4, где *р<0,05 по отношению к контролю; •р<0,05 по отношению к группе сравнения. Результаты значений выражены в условных единицах. Анализ полученных результатов позволил выделить 3 момента. Первый из них заключается в том, что использование растворителя в концентрациях 4×10-9 моль и 2×10-9 моль несколько уменьшало показатель биопленкообразования культур S. typhimurium в пределах от 17,6% до 31,4%; S. Enteritidis - от 4,1% до 15,2% и K. Pneumoniae - от 7,2% до 14,2% по отношению к тем же культурам, выращенным с добавлением физраствора (группа сравнения). Эти результаты соответствуют ранее полученным данным о способности детергентов снижать биопленкообразование бактерий без влияния на рост планктонных клеток (Bridgett М. et al., 1992; Chang Y. et al., 2012). Вместе с тем, диапазон отмеченных колебаний находился в пределах значений, установленных для показателей группы сравнения, что не позволяло сделать вывод о статистической значимости выявленных различий и соответственно об ингибирующем влиянии используемых доз растворителя на биопленочный процесс.
Во-вторых, милиацин, добавляемый в среду культивирования (опыт), обеспечивал выраженное подавление биопленкообразования, что проявлялось существенным снижением КБПО, оцениваемого по редукции интенсивности поглощения кристалл-виолета (в условных единицах) в культурах опытных проб по отношению как к контрольным культурам, так и к культурам группы сравнения. Для S. typhimurium это снижение по отношению к контролю составляло от 48,7% (при дозе милиацина 100 мкг/мл) до 52,8% (при дозе милиацина 50 мкг/мл), а по отношению к группе сравнения - 57,7% и 67,6% соответственно. Для S. enteritidis интенсивность снижения КБПО по отношению к контролю колебалось от 34,8% (при дозе милиацина 100 мкг/мл) до 16,9% (при дозе милиацина 50 мкг/мл), а по отношению к группе сравнения - 37,4% и 29,5%-, соответственно. Для K. pneumoniae выраженность редукции КБПО при указанных концентрациях милиацина была равна 67,4% и 47,2%, а по отношению к группе сравнения - 72% и 47,3% соответственно. Для P. aeruginosa показатели снижения биопленкообразования составляли: 64,6% и 60,9% по отношению к контролю; 60,6% и 55,6% по отношению к группе сравнения. Для S. aureus интенсивность снижения КБПО по отношению к контролю колебалось от 55,9% (при дозе милиацина 100 мкг/мл) до 52,7% (при дозе милиацина 50 мкг/мл), а по отношению к группе сравнения - 55,9% и 47,4% соответственно.
Сопоставление указанных количественных параметров позволяет выделить третий момент, характеризующий неодинаковую чувствительность различных видов микроорганизмов к действию милиацина. В соответствии с полученными результатами максимальную чувствительность демонстрировали культуры P. aeruginosa и K. pneumonia, а минимальную S. enteritidis.
Результаты этих исследований были дополнены наблюдениями над биопленкообразованием отдельными культурами микроорганизмов с использованием атомно-силовой микроскопии (АСМ), позволяющей не только визуализировать процесс, но и провести морфометрическую оценку самой биопленки, а также формирующих ее бактерий при использовании милиацина в концентрации 50 мкг/мл. Данная концентрация тритерпеноида была выбрана с учетом его расчетного содержания в крови животных (50 мкг/мл) при использовании в дозе 2 мг/кг, оказывавшей протективный эффект при экспериментальной инфекции (Фролов Б.А. и соавт., 2013).
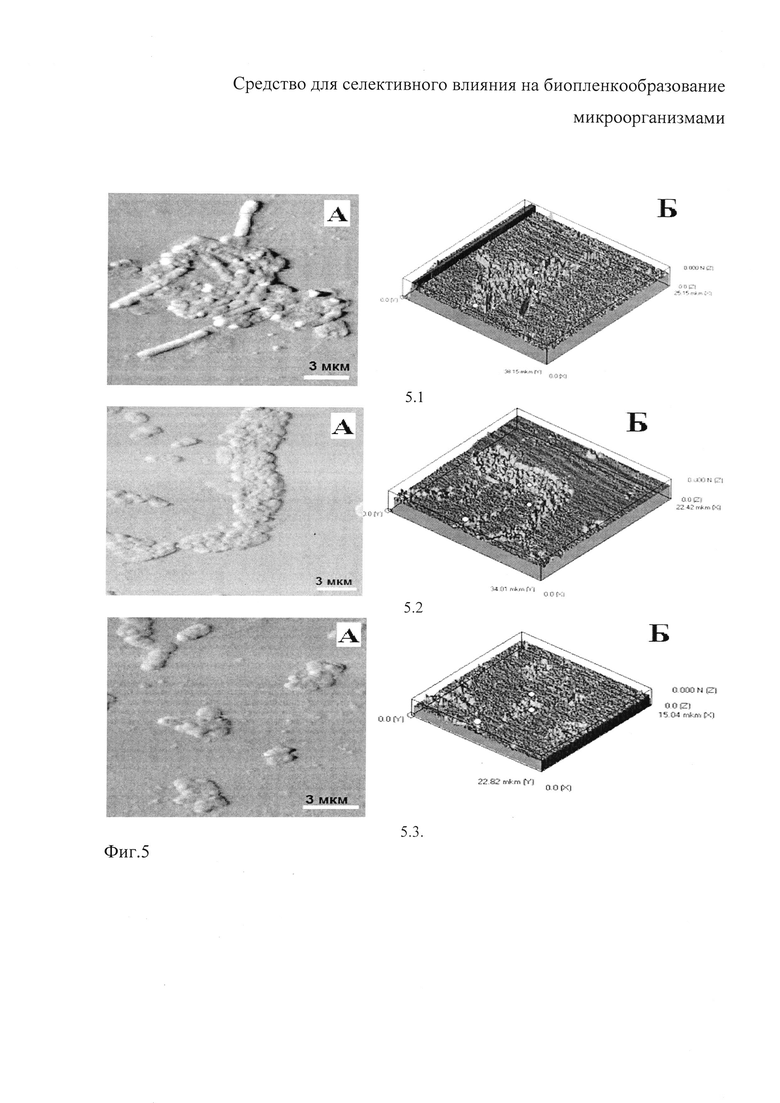
Результаты исследования влияния милиацина на биопленкообразование клинического штамма S. typhimurium 15 с использованием АСМ представлены на фиг. 5. Как следует из фиг. 5, отражающей сравнительные особенности биопленки чистой культуры бактерий клинического штамма S. typhimurium 15 (5.1), культуры этих же бактерий в присутствии растворителя (5.2) или милиацина (5.3) в концентрации 50 мкг/мл, тритерпеноид отчетливо подавлял формирование биопленки, что проявлялось ее уменьшением при двух- (А) и трехмерном (Б) изображении. Ингибирующее влияние милиацина на биопленкообразование подтверждалось также результатами морфометрического анализа (Таблица 1), характеризующего снижение высоты биопленки без изменений размеров самих микробных клеток (* - р<0,05 снижение БПО по сравнению с чистой культурой бактерий, • - р<0,05 снижение БПО по сравнению с культурой с растворителем). Из данных таблицы 1 и изображений АСМ следует, что милиацин не влиял на размеры бактериальных клеток S. thyphimurium 15, входящих в биопленку, но снижал высоту биопленки, что подтверждается визуально на изображениях АСМ.

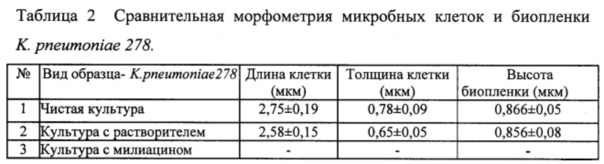
Результаты исследования влияния милиацина на биопленкообразование клинического штамма K. pneumoniae 278 с использованием АСМ представлены на фиг. 6. Фиг. 6 демонстрирует данные АСМ о выраженном ингибирующем эффекте милиацина на БПО клиническим штаммом K. pneumoniae 278 (чистая культура бактерий клинического штамма K. pneumoniae 278 (6.1)), культура этих же бактерий в присутствии растворителя (6.2) или милиацина (6.3), выразившимся в значительном снижении биопленкообразования (6.3). Эффект влияния милиацина проявлялся в снижении биопленки при двух- (А) и трехмерном (Б) изображении. Существенно, что сравнительная морфометрия длины и толщины микробных клеток K. pneumoniae 278 (см. Таблицу 2) не выявила различий этих показателей в исследуемых образцах контрольных культур и культур групп сравнения (* - р<0,05 снижение БПО по сравнению с чистой культурой бактерий, • - снижение БПО р<0,05 по сравнению с культурой с растворителем). Из данных таблицы и изображений АСМ следует, что милиацин подавил образование биопленки K. pneumoniae 278.
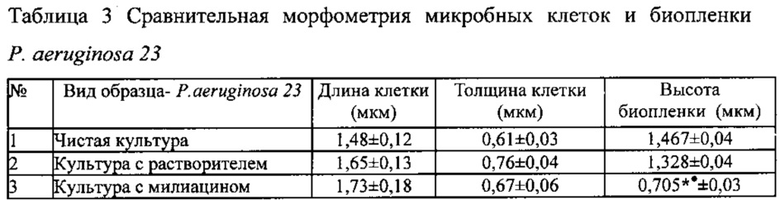
Результаты исследования с использованием АСМ влияния милиацина на биопленкообразование клинического штамма P. aeruginosa 23 представлены на фиг. 7. Как следует из фиг. 7, отражающей сравнительные особенности биопленки чистой культуры бактерий клинического штамма P. aeruginosa 23 (7.1), культуры тех же бактерий в присутствии растворителя (7.2) или милиацина (7.3) в концентрации 50 мкг/мл, тритерпеноид отчетливо подавлял формирование биопленки, что проявлялось ее уменьшением при двух- (А) и трехмерном (Б) изображении. Ингибирующее влияние милиацина на биопленкообразование подтверждалось также результатами морфометрического анализа (Таблица 3), характеризующего снижение высоты биопленки без изменений размеров самих микробных клеток P. aeruginosa 23 (* - р<0,05 снижение БПО по сравнению с чистой культурой бактерий, • - р<0,05 снижение БПО по сравнению с культурой с растворителем).
Данное обстоятельство ингибирующего влияния милиацина на биопленкообразование штаммами S. typhimurium 15, P. aeruginosa 23, характеризующегося снижением высоты биопленки без изменений размеров самих микробных клеток, свидетельствует в пользу того, что наблюдаемое снижение высоты биопленки обусловлено не изменением морфологии микроорганизмов, а нарушением самого процесса биопленкообразования, вплоть до его подавления, что и было выявлено в отношении штамма K. pneumoniae 278.
Исследование с использованием АСМ влияния милиацина на биопленкообразование клинического штамма S. aureus 19. Фигура 8 демонстрирует данные АСМ об ингибирующем эффекте милиацина на БПО клиническим штаммом S. aureus 19 (чистая культура бактерий клинического штамма S. aureus (8.1), культура этих же бактерий в присутствии растворителя (8.2) или милиацина (8.3), выразившимся в снижении биопленкообразования (8.3). Эффект влияния милиацина проявлялся в снижении биопленки при двух- (А) и трехмерном (Б) изображении. Существенно, что сравнительная морфометрия диаметра микробных клеток S. aureus 19 (см. Таблицу 4) не выявила различий этих показателей в исследуемых образцах контрольных культур и культур групп сравнения (* - р<0,05 снижение БПО по сравнению с чистой культурой бактерий, • - снижение БПО р<0,05 по сравнению с культурой с растворителем).

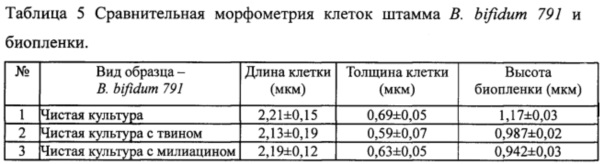
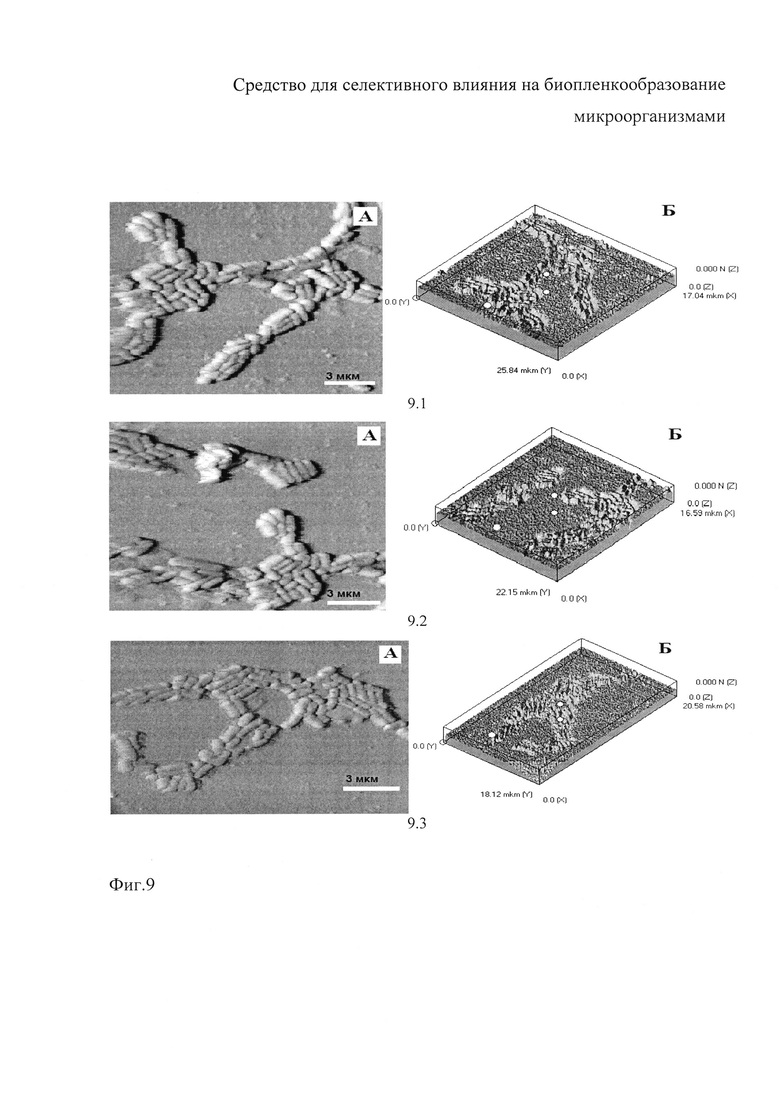
Исследование с использованием АСМ влияния милиацина на биопленкообразование эталонным штаммом Bifidobacterium bifidum 791. В отличие от патогенных и условно-патогенных бактерий биопленка, образованная пробиотическим штаммом бифидобактерий, являющихся представителями нормофлоры толстого кишечника человека, при культивировании в присутствии милиацина (см. фиг. 9.3) полностью сохраняла разветвленное строение без существенных различий с биопленкой, образованной культурой этих же бактерий в присутствии растворителя (фиг. 9.2) или чистой культурой (фиг. 9.1), как в двухмерном (А), так и в трехмерном (Б) изображениях. Морфометрические характеристики бактериальных клеток и высоты биопленки В. bifidum 791 также не различались между собой (Таблица 5), что подтверждает представленные выше данные об отсутствии влияния милиацина на этот вид бактерий (фиг. 9.3).
Результаты экспериментальных исследований, проведенные в отношении влияния милиацина на способность к биопленкообразованию патогенного штамма - сальмонеллы и представителя нормальной микробиоты кишечника - штамма бифидобактерий, выделенных от больного с гастроинтестинальной формой сальмонеллеза, приведены в примере.
Пример. Исследование выраженности влияния милицина (см. фиг. 1) на биопленкообразование клинических штаммов S. thyphimurium К-1 и В. bifidum-5.
От обследуемого К. с гастроинтестинальной формой сальмонеллеза из фекалий были выделены штаммы S. thyphimurium К-1 и В. Bifidum-5. Биопленкообразование (БПО) изучали с помощью определения способности микроорганизмов к адгезии на поверхности 96-луночного плоскодонного полистиролового стерильного планшета (О'Toole G., 2000). На Шедлер-агаре (BBL, США) при инкубировании в термостате (37°С) была получена суточная культура S. thyphimurium К-1 и на этой же питательной среде при культивировании в СО2-инкубаторе (BINDER, Германия) в течении 48 часов была получена культура В. bifidum-5. Из обеих культур бактерий готовили суспензию в концентрации 1×106 КОЕ/мл. Милиацин растворяли в растворителе твин-21 и доводили физраствором до концентрации 500 мкг/мл и 1000 мкг/мл. Для каждой исследуемой культуры бактерий использовались три группы лунок: опытные - с добавлением 15 мкл милиацина; контрольные - с добавлением 15 мкл растворителя для милиацина (твин 21 на физрастворе) и лунки группы сравнения - с добавлением 15 мкл физраствора. Исследования были выполнены в трех дублях. В лунки 96-луночных стерильных полистироловых планшетов одномоментно вносили по 135 мкл суспензии суточной агаровой культуры сальмонелл и бифидобактерий в концентрации 0,5×106 КОЕ/мл и 15 мкл милиацина (опыт) или 15 мкл растворителя (контроль). Конечные концентрации милиацина в лунках составляли 50 и 100 мкг/мл, растворителя 2×10-9 и 4×10-9 моль. В качестве проб сравнения использовались бактериальные культуры штаммов сальмонелл и бифидобактерий (135 мкл), к которым добавляли 15 мкл физраствора. Пробы с сальмонеллами инкубировались 24 часа при 37°С, пробы с бифидобактериями - 48 часов в CO2-инкубатор (BINDER, Германия) при 37°С. Учет БПО проводили через 24 часа для проб с сальмонеллами и через 48 часов для проб с бифидобактериями. Для этого после удаления планктонных (свободноплавающих) клеток микроорганизмов трехкратной промывкой лунок дистиллированной водой (200 мкл) и подсушивания планшетов на воздухе (30 мин) осуществлялось окрашивание сформированных биопленок внесением в лунки 1%-ного раствора кристалл-виолета (45 мин при комнатной температуре). Отмывание свободного красителя выполняли трехкратной обработкой лунок дистиллированной водой (200 мкл), а экстракцию фиксированного в биопленках красителя проводили добавлением к пробам 200 мкл 96%-ного этанола. Интенсивность окрашивания последнего, соответствующую степени биопленкообразования, определяли на спектрофотометре (Биотек, США) при длине волны 540 нм. На основании результатов измерений оптической плотности исследуемых проб определялся коэффициент биопленкообразования (КБПО): 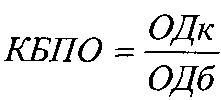 ,
,
где ОДк - оптическая плотность изучаемой культуры (для опытных, контрольных проб и проб групп сравнения, а ОДб - оптическая плотность питательного бульона с незасеянной культурой микроорганизмов. Полученные результаты в виде средней и ошибкой средней (М±м) по обоим штаммам представлены ниже (Таблица 6), (* - р<0,05 снижение БПО по сравнению с чистой культурой бактерий, • - р<0,05 снижение БПО по сравнению с культурой с растворителем). Представленные в Таблице 6 результаты экспериментального исследованиявлияния милиацина в концентрации 100 и 50 мкг/мл на БПО патогенного штамма S. typhimurium К-1 и штамма В. bifidum-5, относящегося к нормофлоре толстого кишечника, выделенных от больного К. с гастроинтестинальной формой сальмонеллеза, показали существенное снижение БПО у штамма сальмонелл и отсутствие воздействия тритерпеноида на БПО у представителя нормофлоры - культуры бифидобактерий. Полученные результаты свидетельствуют о наличии у милиацина способности снижать биопленкообразование у патогенных бактерий (сальмонеллы) и при этом не влиять на биопленкообразование у нормофлоры (бифидобактерий). 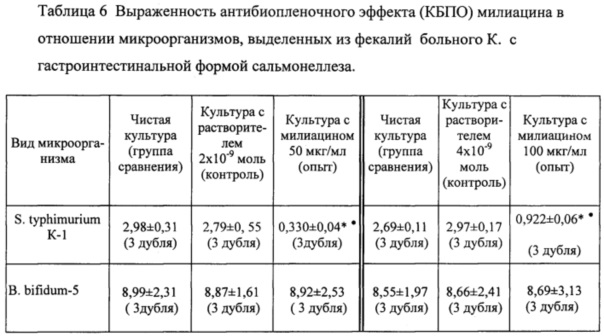
Проведенные экспериментальные исследования подтверждают расширение арсенала известных средств, снижающих биопленкообразование у микроорганизмов. Экспериментально установлено, что тритерпеноид растительного происхождения милиацин проявляет антибиопленочный эффект в отношении отдельных видов патогенных и условно-патогенных грамотрицательных (сальмонеллы, клебсиеллы, псевдомонады) и грамположительных (золотистый стафилококк) бактерий. Такая активность не связана с изменением морфологии клеток и их жизнеспособностью, поскольку используемые концентрации милиацина (50 и 100 мкг/мл) не подавляли рост бактерий. Механизмы угнетения милиацином биопленкообразования вероятнее всего связаны со стероидной структурой тритерпеноида. Такая структура позволяет ему встраиваться в клеточные мембраны и, таким образом, уменьшать их текучесть. Кроме того, она обеспечивает милиацину возможность связывания неполярных групп на поверхности бактерий, снижая их адгезивные свойства. Отсутствие чувствительности к милиацину со стороны отдельных изолятов S. enteritidis соответствует представлениям об особенностях адгезивной активности и, в частности, такого существенного ее механизма, как гидрофобность, отличающаяся варьированием в широких пределах у разных штаммов бактерий даже среди диссоциантов одного типа (Демаков В.А. с соавт., 2010).
Отдельный вопрос связан с устойчивостью к милиацину процесса биопленкообразования пробиотическими штаммами лакто- и бифидобактерий - представителями нормофлоры. Механизм такой устойчивости может быть связан со строением клеточной стенки указанных бактерий, отличающейся высоким содержанием тейхоевых кислот - мощного фактора неспецифической адгезии бактериальных клеток к биогенным и абиогенным субстратам, а также с формированием лактобактериями и бифидобактериями более выраженной, по сравнению с исследуемыми патогенными и условно-патогенными микроорганизмами биопленки, что подтверждается нашими экспериментальными данными (Таблица 5, фиг. 9.1, фиг. 9.2, фиг. 9.3), а также результатами ранее проведенных исследований (Бухарин О.В., Перунова Н.Б., 2014). Образование представителями нормофлоры биопленок в различных биотопах человека является одним из важных моментов их адаптации и рассматривается как фактор, обеспечивающий ей селективные преимущества перед условно-патогенной и патогенной микрофлорой. Кроме того, образование биопленок нормофлорой является механизмом, с помощью которого происходит приживление нормальной микробиоты в определенном биотопе организма человека с последующим участием ее в элиминации болезнетворных микроорганизмов.
Обнаруженная нами особенность действия милиацина в отношении патогенных, условно-патогенных микроорганизмов и нормофлоры - снижать способность к биопленкообразованию у болезнетворных бактерий при одновременном сохранении данного свойства у нормофлоры, может иметь важное практическое значение, поскольку использование антибиопленочных средств, обладающих избирательностью действия, по сравнению с другими средствами, используемыми для подавления биопленкообразования и не обладающими таким селективным эффектом, исключает развитие негативных влияний данных средств на нормальную микрофлору человека. Выявленное новое свойство тритерпеноида милиацина характеризует его способность ограничивать колонизацию биотопов патогенной (сальмонеллы) и условно-патогенной (псевдомонады, клебсиеллы, золотистый стафилококк) флорой с сохранением биопленкообразования у нормофлоры, участвующей в формировании защитного барьера против возбудителей инфекционных и гнойно-воспалительных заболеваний, что может повысить эффективность методов профилактики и лечения болезней бактериальной природы.
Список литературы
1. Бухарин, О.В. Микросимбиоценоз. / О.В. Бухарин, Н.Б. Перунова // Екатеринбург. - 2014. - 260 с.
2. Бухарин, О.В. Влияние антистафилококкового антибиотика батумина на биопленкообразование микроорганизмов / О.В. Бухарин [и др.] // Журн. микробиол. - 2012. - №2. - С. 8-12.
3. Гудвин, Т. Введение в биохимию растений / Т. Гудвин, Э. Мерцер // М.: Мир, 1986. - Т. 2. - С. 42-106.
4. Демаков, В.А. Гидрофобные свойства и пленкообразующая способность штаммов рода Pseudomonas, изолированных из разных экологических ниш / В.А. Демаков [и др.] // Вестник Пермского университета. - 2010. - Вып. 1(1). - С. 55-58.
5. Ерошенко, Д.В. Влияние факторов внешней среды на первые этапы образования биопленок бактериями Staphylococcus epidermidis: Автореф. дисс. канд. биол. наук. Пермь, 2015. - 23 с.
6. Ершов, Ю.В. Метилэритритолфосфатный (немевалонатный) путь биосинтеза изопреноидов / Ю.В. Ершов // Успехи биологической химии. - 2005. - Т. 45. - С. 307-354.
7. Ершов, Ю.В. 2-С-метилэритритолфосфатный путь биосинтеза изопреноидов как мишень при поиске новых антибиотиков, гербицидов и иммуномодуляторов / Ю.В. Ершов // Прикл. Биохим. и Микробиол. - 2007. - Т. 43. - №2. - С. 133-157.
8. Карпов, О.И. Макролиды: новая парадигма-фармакодинамика / иммуномодуляция / О.И. Карпов [и др.] // Клиническая фармакология и терапия. - 2005. - Т. 14(5). - С. 20-23.
9. Лукнер, М. Вторичный обмен у микроорганизмов, растений и животных / М. Лукнер // М.: Мир. - 1979. - С. 194-252.
10. Льюис, К. Персистирующие клетки и загадка выживания биопленок / Льюис К. // Биохимия. - 2005. - Т. 70. - С. 327-336.
11. Маркова, Ю.А. Растительные метаболиты как регуляторы развития микробных биопленок / Ю.А. Маркова // Вестник ОГУ. - 2014. - №13(124). - С. 59-65.
12. Маянский, А.Н. Стратегия управления бактериальным биопленочным процессом / А.Н. Маянский, И.В. Чеботарь // Журнал инфектологии. - 2012. - Т. 4. - №3. - С. 5-15
13. Мошкевич, И.Р. Микробные биопленки при смешанных инфекциях: Автореф. дисс. канд. мед. наук. Санкт-Петербург, 2007. - 22 с.
14. Олифсон, Л.Е. Химическая природа и биологическая активность милиацина / Л.Е. Олифсон [и др.] // Вопросы питания. - 1991. - №2. - С. 57-59.
15. Пасешниченко, В.А. Новый альтернативный путь биосинтеза изопре-ноидов у эубактерий и растений / В.А Пасешниченко // Биохимия. - 1998. - Т. 63. - Вып. 2. - С. 171-182.
16. Патент №2478385 (RU).
17. Патент №2527894 (RU).
18. Романова, Ю.М. Гинцбург А.Л. Бактериальные биопленки как естественная форма существования бактерий в окружающей среде и организме хозяина / Ю.М. Романова, А.Л. Гинцбург // Журн. микробиол. - 2011. - №3. - С. 99-109.
19. Романова, Ю.М. Биопленки патогенных бактерий и их роль в хронизации инфекционного процесса. Поиск средств борьбы с биопленками / Ю.М. Романова [и др.] // Вестник Российской АМН. - .2011. - №10. - С. 31-39.
20. Сидоренко, С.В. Роль бактериальных биопленок в патологии человека / С.В. Сидоренко // Инфекции в хирургии.- 2012. - №3. - С. 16-20.
21. Степанова, Т.В. Разработка средств борьбы с биопленками: изучение воздействия полисахаридных лиаз на матрикс биопленок, образуемых Pseudomonas aeruginosa и Borkholderia cenocepica / Т.В. Степанова [и др.] // Лаборатория. - 2010. - №1. - С. 44-49.
22. Терентьева, Н.А. Характеристика образования, ингибирования и разрушения биопленок Yersinia pseudotuberculosis, формирующихся на абиотических поверхностях / Н.А. Тереньева [и др.] // Ж. Микробиол. - 2015. - №3. - С. 72-78.
23. Тренин, А.С. Микробные метаболиты - ингибиторы биосинтеза стеролов, их химическое разнообразие и особенности механизма действия / А.С.Тренин // Биоорганическая химия. - 2013. - №39(6). - С. 633-657.
24. Фролов, Б.А. Защитный эффект милиацина при экспериментальной сальмонеллезной инфекции / Б.А. Фролов [и др.] // ЖМЭИ. - 2013. - №6. - С. 3-8.
25. Чеботарь, И.В. Антибиотикорезистентность биопленочных бактерий / И.В. Чеботарь [и др.] // Клин, микробиол. антимикроб, химиотер. - 2012. - №14. - С. 51-58.
26. Чеботарь, И.В. Механизмы антибиопленочного иммунитета / И.В. Чеботарь// Вестник РАМН. - 2012. - №12. - С. 22-29.
27. Alkawash, М.А. Alginate lyase enhances antibiotic killing of mucoid Pseudomonas aeruginosa in biofilms / M.A. Alkawash [et al.] // APMIS. - 2006. - V. 114(2). - P. 131-138.
28. Awolola, G.V. Antibacterial and anti-biofilm activity of flavonoids and triterpenes isolated from the extracts of Ficus sansibarica Warb. subsp. sansibarica (Moraceae) extracts / G.V. Awolola [et al.] // Afr J Tradit Complement Altern Med. - 2014. - V. 11(3). - P. 124-131.
29. Banin, E. Chelator-induced dispersal and killing of Pseudomonas aeruginosa cells in a biofilm / E. Banin [et al.] // Appl Environ Microbiol. - 2006. - 72(3). - P. 2064-2069.
30. Bridgett, M.J. Control of staphylococcal adhesion to polystyrene surfaces by polymer surface modification with surfactants / M.J. Bridgett [et al] // Biomaterials. - 1992. - V. 13. - P. 411-416.
31. Chang, Y. Low concentration of ethylenediaminetetraacetic acid (EDTA) affects biofilm formation of Listeria monocytogenes by inhibiting its initial adherence / Y. Chang [et al] // Food Microbiol. - 2012. - V. 29. - №1. - P. 10-17.
32. Chemani, С.Role of LecA and LecB lectins in Pseudomonas aeruginosa-induced lung injury and effect of carbohydrate ligands / C. Chemani [et al.] // Infect Immun. - 2009. - V. 77 (5). - P. 2065-2075.
33. Donlan, R.M. Biofilms: survival mechanisms of clinically relevant microorganisms / R.M. Donlan, J.W. Costerton // Clin Microbiol Rev. - 2002. - V.15(2). - P. 167-193.
34. Evaristo, F.F. Antimicrobial effect of the triterpene 3в,6в,16в-trihydroxylup-20(29)-ene on planktonic cells and biofilms from Gram positive and Gram negative bacteria / F.F. Evaristo [et al.] // Biomed Res Int. - 2014. - V. 2014. - Article ID729358. - P. 1-7.
35. Gilan, I. Effect of proteases on biofilm formation of the plastic-degrading actinomycete Rhodococcus ruber C208 / I. Gilan, A. Sivan // FEMS Microbiol Lett. - 2013. - V. 342(1). - P. 18-23.
36. Hancock, V. Abolition of biofilm formation in urinary tract Escherichia coli and Klebsiella isolates by metal interference through competition for fur / V. Hancock [et al.] // Appl Environ Microbiol. - 2010. - V. 76(12). - P. 3836-3841.
37. Kaplan, J.B. Biofilm dispersal: mechanisms, clinical implications, and potential therapeutic uses / Kaplan J.B. // J Dent Res. - 2010. - V. 89(3). - P. 205-218.
38. Karosi, T. Low-frequency ultrasound for biofilm disruption in chronic rhinosinusitis with nasal polyposis: in vitro pilot study / T. Karosi [et al.] // Laryngoscope. - 2013. - V. 123(1). - P. 17-23.
39. Katerere, D.R. Antimicrobial activiti of pentacyclic triterpenes isolated from African Combretaccae / D.R. Katerere [et al.] // Phytochemistry. - 2003. - V. 63. - №1. - P. 81-88.
40. Klemm, P. Prevention of bacterial adhesion / Klemm P. [et al.] // Appl Microbiol Biotechnol. - 2010. - V. 88(2). - P. 451-459.
41. Kolodkin-Gal, I. D-amino acids trigger biofilm disassembly //1. Kolodkin-Gal [et al.] // Science. - 2010. - V. 328(5978). - P. 627-629.
42. Kostakioti, M. Bacterial biofilms: development, dispersal, and therapeutic strategies in the dawn of the postantibiotic era / M. Kostakioti [et al.] // Cold Spring Harb Perspect Med. - 2013. - 3(4). - P. 1-23.
43. Landini, P. Molecular mechanisms of compounds affecting bacterial biofilm formation and dispersal / P. Landini [et al.] // Appl Microbiol Biotechnol. - 2010. - V. 86 (3). - P. 813-823.
44. Lemos, M. The effects of ferulic and salicylic acids on Bacillus cereus andPseudomonas fluoresceins single-and dual-species biofilms / M. Lemos [et al.] / /International Biodeterioration & Biodegradation V.86,. - 2014. - P. 42-51.
45. Lesic, B. Inhibitors of pathogen intercellular signals as selective anti-infective compounds / D. Lesic [et al.] // PLoS Pathog. - 2007. - V. 3(9). - P. 1229-1239.
46. Lüttgen, H. Biosynthesis of terpenoids: YchB protein of Escherichia coli phosphorylates the 2-hydroxy group of 4-diphosphocytidyl-2C-methyl-D-erythritol / H. Lüttgen [et al.] // Proc Natl Acad Sci USA.- 2000. - V. 97(3). - P. 1062-1067.
47. Mulcahy, L.R. Pseudomonas aeruginosa biofilms in disease / L.R. Mulcahy [et al.] // Microb Ecol. - 2014. - V. 68(1). - P. 1-12.
48. Nalca, Y. Quorum-sensing antagonistic activities of azithromycin in Pseudomonas aeruginosa PAO1: a global approach / Y. Nalca [et al.] // Antimicrob Agents Chemother. - 2006. - V. 50(5). - P. 1680-1688.
49. Nazzaro, F. Quorum sensing and phytochemicals / F. Nazzaro [et al.] // Int J Mol Sci. - 2013. - V. 14(6). - P. 12607-12619.
50. Nijland, R. Dispersal of biofilms by secreted, matrix degrading, bacterial DNase / R. Nijland [et al.] // PLoS One. - 2010. - V. 5(12). - e15668.
51. O'Toole, G. A. The global carbon metabolism regulator Crc is a component of a signal transduction pathway required for biofilm development by Pseudomonas aeruginosa // G.A. O'Toole [et al.] // J Bacteriol. - 2000. - V. 182. - P. 425-431.
52. Pinkner, J.S. Rationally designed small compounds inhibit pilus biogenesis in uropathogenic bacteria / J.S. Pinkner [et al.] // Proc Natl Acad Sci USA. - 2006. - V. 103(47). P. 17897-17902.
53. Pintucci, J.P. Biofilms and infections of the upper respiratory tract / J.P. Pintucci [et al.] // Eur Rev Med Pharmacol Sci. - 2010. - V. 14(8). - P. 683-690.
54. Raja, A.F. Acetyl-11-keto-B-boswellic acid (AKBA); targeting oral cavity pathogens / A.F. Raja [et al.] // BMC Res Notes. - 2011. - V. 4. - art. 406.
55. Ramphal, R. Recognition of mucin components by Pseudomonas aeruginosa / R. Ramphal, S.K. Arora // Glycoconj J. - 2001. - V. 18(9). - P. 709-713.
56. Sadovskaya, I. High-level antibiotic resistance in Pseudomonas aeruginosa biofilm: the ndvB gene is involved in the production of highly glycerol-phosphorylated beta-(1->3)-glucans, which bind aminoglycosides / I. Sadovskaya [et al.] // Glycobiology. - 2010. - V. 20(7). - P. 895-904.
57. Sintim, H.O. Paradigm shift in discovering next-generation anti-infective agents: targeting quorum sensing, c-di-GMP signaling and biofilm formation in bacteria with small molecules / H.O. Sintim [et al.] // Future Med Chem. - 2010. - V. 2(6). - P. 1005-1035.
58. Smith, A., Buchinsky FJ, Post JC. Eradicating chronic ear, nose, and throat infections: a systematically conducted literature review of advances in biofilm treatment / A. Smith [et al.] // Otolaryngol Head Neck Surg. - 2011. - V. 144(3). - P. 338-347.
59. Thomas, R. Common oligosaccharide moieties inhibit the adherence of typical and atypical respiratory pathogens / Thomas R., Brooks T. // J Med Microbiol. - 2004. - V.53 (9). - P.833-840.
60. Tre-Hardym, M. Efficacy of the combination of tobramycin and a macro-lide in an in vitro Pseudomonas aeruginosa mature biofilm model / M. Tre-Hardym [et al.] // Antimicrob Agents Chemother. - 2010. - V.54 (10). - P.4409-4415.
61. Vejborg, R.M. Blocking of bacterial biofilm formation by a fish protein coating / R.M. Vejborg, P. Klemm // Appl Environ Microbiol. - 2008. - V. 74(11). - P. 3551-3558.
62. Wojnicz, D. Medicinal plants extracts affect virulence factors expression and biofilm formation by the uropathogenic Escherichia coli / Wojnicz D. [et al.] // Urol Res. - 2012. - V. 40 (6). - P. 683-697.
63. Zhao, T. N-acetylcysteine inhibit biofilms produced by Pseudomonas aeruginosa / Zhao Т., Liu Y. // BMC Microbiol. - 2010. - V. 10. - P. 140.





Изобретение относится к области медицины, а именно к медицинской микробиологии и инфектологии, и предназначено для профилактики и лечения бактериальных инфекций. Применяют тритерпеноид милиацин в качестве средства для селективного влияния на биопленкообразование микроорганизмами, снижающего биопленкообразование патогенными - Salmonella typhimurium, Salmonella enteritidis и условно-патогенными - Pseudomonas aeruginosa, Klebsiella pneumoniae, Staphylococcus aureus бактериями и одновременно сохраняющего биопленкообразование нормофлорой - лактобактериями - Lactobacillus plantarum, Lactobacillus fermentum, Lactobacillus acidophilus и бифидобактериями - Bifidobacterium bifidum, Bifidobacterium adolescentis. Использование изобретения обеспечивает растительное средство для эффективной профилактики и лечения инфекционных и гнойно-воспалительных заболеваний, вызванных биопленкообразующими патогенными и условно-патогенными бактериями. 9 ил., 6 табл., 1 пр.
Применение тритерпеноида милиацина в качестве средства для селективного влияния на биопленкообразование микроорганизмами, снижающего биопленкообразование патогенными - Salmonella typhimurium, Salmonella enteritidis и условно-патогенными - Pseudomonas aeruginosa, Klebsiella pneumoniae, Staphylococcus aureus бактериями и одновременно сохраняющего биопленкообразование нормофлорой - лактобактериями - Lactobacillus plantarum, Lactobacillus fermentum, Lactobacillus acidophilus и бифидобактериями - Bifidobacterium bifidum, Bifidobacterium adolescentis.
| ИСПОЛЬЗОВАНИЕ АЛЬГИНАТНЫХ ОЛИГОМЕРОВ В БОРЬБЕ С БИОПЛЕНКАМИ | 2008 |
|
RU2527894C2 |
| СОЕДИНЕНИЯ ТРИАЗОЛА ДЛЯ ЛЕЧЕНИЯ ОБРАЗОВАНИЯ БИОПЛЕНОК | 2008 |
|
RU2478385C2 |
| СРЕДСТВО ДЛЯ СНИЖЕНИЯ СИСТЕМНОЙ ПАТОЛОГИЧЕСКОЙ ЭНДОТОКСИНЕМИИ | 2014 |
|
RU2564918C1 |
| РАНОЗАЖИВЛЯЮЩЕЕ СРЕДСТВО | 1986 |
|
RU2063237C1 |
| US 2015366899 A1, 24.12.2015 | |||
| WO 2014078801 A1, 22.05.2014 | |||
| MORRISON S et al | |||
| Impact of polymethylmethacrylate additives on methicillin-resistant Staphylococcus pseudintermedius biofilm formation in vitro | |||
| Am J Vet Res., 2015, 76(5), p.395-401. | |||
Авторы
Даты
2018-03-05—Публикация
2016-04-25—Подача