Изобретение относится к биотехнологии и ветеринарной медицине и может быть использовано при промышленном производстве вакцины гидроокисьалюминиевой против мастита коров.
Вакцина содержит бактериальную массу штаммов Streptococcus agalactuae 6150, Enterococcus faecalis 356, смешанных в определенной пропорции. Вакцина обладает высокой иммуногенностью, обеспечивает надежную защиту коров и коз от мастита стрептококковой этиологии.
Выпускаемая в настоящее время коммерческая вакцина против энтеро-кокковой инфекции телят, ягнят и поросят обладает невысокой эффективностью. Это объясняется тем, что указанная вакцина, содержащая антиген только из штаммов энтерококков серогруппы D, не предохраняет от стрептококков серологических групп В и С, которые наиболее часто являются этиологическим фактором заболевания телят.
Однако способ получения вакцины является лабораторным, малопроизводительным, трудоемким и непригодным для промышленного производства. Культивирование стрептококков осуществляется в мясопептонном бульоне в стеклянных баллонах в стационарных условиях. Длительность культивирования составляет 18-24 часа, накопление биомассы не выше 4 млрд. м.т./см3. Способ культивирования не управляемый, в силу чего не позволяет получать стандартную полноценную в антигенном отношении культуру в больших количествах.
Известен способ изготовления вакцины ассоциированной против стрептококкоза крупного рогатого скота [5].
Ближайшим аналогом заявленного изобретения является известный из документа US 2012128719 А1, 24.05.2012 «Способ изготовления вакцины против заболеваний и инфекций, в том числе стрептококковых крупного рогатого скота». Вакцина может содержать несколько штаммов микроорганизмов, а так же адьювант, например, гидроокись алюминия. Способ изготовления вакцины включает культивирование в питательной среде микроорганизмов, Streptococcus agalactiae, Streptococcus zooepidemicus, Enterococcus faecalis, инактивацию микроорганизмов и добавление адъюванта, например гидроокиси алюминия [6]. Отличием заявленного в формуле изобретения от ближайшего аналога является то, что при изготовлении вакцины проводят:
1) раздельное культивирование микроорганизмов в ферментерах;
2) инактивацию формальдегидом при температуре 43-47°C в течение 3-5 суток, причем конечная концентрация формальдегида в культуре составляет 0,03-0,07%;
3) смешивание инактивированных культур в равных объемах при исходных концентрациях 4-8 млрд.м т /см3;
4) снижение окислительно-восстановительного потенциала культуральной жидкости до -200÷-150 мВ.
5) до окончания процесса культивирования поддерживают рО2 в культуральной жидкости на уровне 15-25% от насыщения кислородом воздуха;
6) рН культуральной жидкости регулируют на уровне 6,8-7,2;
7) дробную подачу глюкозы осуществляют дозами до концентрации 0,05-0,20%.
Способ изготовления гидроокисьалюминевой вакцины, содержащей несколько штаммов бактерий против инфекционных заболеваний, в том числе вызванными стрептококками по известному документу (RU 2191598 С2. 27.10.2002) очевиден для свиней и нельзя гарантировать ее эффективность для вакцинации коров, в том числе с тем набором штаммов, представленных в ее описании [1]. Задачей изобретения является повышение качества целевого продукта за счет увеличения резистентности организма доящихся животных к заболеванию маститом стрептококковой этиологии. Заявляемая вакцина для коров обладает высокой профилактической эффективностью.
Технический результат изобретения достигается в способе изготовления вакцины против мастита путем включения в состав заявляемой вакцины в качестве антигенов бактериальной массы штаммов Streptococcus agalactiae 6150 (серогруппа В) и Enterococcus faecalis 356 (серогруппа D), взятых в вакцине в равных объемах при исходных концентрациях микроорганизмов 4-8 млрд.м.т./см3, а раздельное культивирование штаммов стрептококков проводят в ферментерах при окислительно-восстановительном потенциале культуральной жидкости -200÷-150 мВ, после чего до окончания процесса культивирования поддерживают рО2 в культуральной жидкости на уровне 15-25% от насыщения кислородом воздуха, рН культуральной жидкости регулируют на уровне 6,8-7,2, а дробную подачу глюкозы осуществляют дозами до концентрации 0,05-0,2% при лимитировании роста стрептококков глюкозой, инактивацию культур стрептококков проводят формальдегидом при температуре 43-47°C в течение 3-5 суток, причем конечная концентрация формальдегида в культуре составляет 0,03-0,07%.
В патентной и научно-технической литературе не известны технические решения, содержащие режимы способа изготовления вакцины против мастита коров и коз аналогичное заявляемому, т.е. предложение соответствует критерию «новизны».
Штамма Enterococcus faecalis 356 (серогруппа D) известен из уровня техники, его характеристика представлена ранее в описании к изобретению №2687488, опубликовано 14.05.2019. Штамма Streptococcus agalactuae 6150 депонирован в установленном порядке, является новым.
Все режимы способа осуществимы в промышленных условиях, направлены на решение реальной технической задачи, т.е. предложение «промышленно применимо».
Впервые предложен способ изготовления вакцины против мастита коров, где повышается качество целевого продукта за счет увеличения резистентности организма лактирующих коров и коз к заболеваниям стрептококковой этиологии; заявляемая вакцина обладает высокой профилактической эффективностью при определенных условиях, т.е. предложение соответствует критериям «новизна» и «изобретательский уровень».
Целью заявляемого изобретения является создание высокоиммуногенной гидроокисьалюминиевой, обеспечивающей надежную защиту лактирующих коров от заболеваний стрептококковой этиологии.
Эта цель достигнута подбором и введением в состав вакцины неконкурирующих между собой антигенов производственных штаммов и оптимальным количественным их соотношением, осуществлением управляемого периодического процесса культивирования и щадящих режимов инактивации.
Способ осуществляется следующим образом.
В стерильные ферментеры загружают жидкую питательную среду на основе перевара Хоттингера.
Питательную среду в ферментерах 6150 засевают раздельно маточными культурами (Streptococcus agalactiae и Enterococcus faecalis 356, выращенными в жидкой питательной среде аналогичного состава, культивируют при температуре (37±1)°C в течение 6-8 часов.
После засева ферментеров окислительно-восстановительный потенциал культуральной жидкости снижают до (-150)÷-(-200) мВ, после чего до окончания процесса культивирования поддерживают рО2 в культуральной жидкости регулируют на уровне 6,8-7,2 ед. рН, а дробную подачу глюкозы осуществляют дозами до концентрации 0,05-0,2% при лимитировании роста стрептококков глюкозой, характеризующемся резким повышением pO2 при неизменных расходе воздуха и оборотах мешалки и прекращением снижения рН культуральной жидкости. Выращивание стрептококков проводят в соответствии с патентом (1).
Полученные бактериальные массы производственных штаммов стрептококков с известной концентрацией бактерий перекачивают в отдельные заранее приготовленные стерильные реакторы (или стеклянные баллоны) и добавляют при постоянном перемешивании дробно формальдегид до его конечной концентрации 0,03-0,07%) доводят рН до 7,1-7,2 ед.рН добавлением 10%-ного раствора гидроокиси натрия, перемешивают 15-20 мин и выдерживают при температуре 43-47°C в течение 3-5 суток.
После проверки на стерильность и полноту инактивации к инактивированной формальдегидом культуре каждого штамма, содержащей известное количество микробных тел в 1 см3, добавляют 4%-ную взвесь гидрата окиси алюминия, доведенного до рН (7,2±0,1) из расчета 130 см3 на каждый 1 дм3 культуры, перемешивают 15-20 мин и выдерживают при температуре 43-47°C в течение 2 суток, ежедневно перемешивая 3-4 раза, а затем без перемешивания 2 суток. После отстоя адсорбированных на гидрате окиси алюминия культур проводят декантирование прозрачной надосодочной жидкости с таким расчетом, чтобы получить в осадке концентрацию микробных тел (4-8)⋅109 м.т./см3.
Культуры стрептококков после инактивации и адсорбции на гидрате окиси алюминия подают в оснащенный перемешивающим устройством реактор-смеситель и смешивают в равных объемах.
Бактериальную массу из штаммов Streptococcus agalactiae 6150 и Enterococcus faecalis 356 тщательно перемешивают и с соблюдением условий асептики при постоянном перемешивании расфасовывают в стерильную стеклотару.
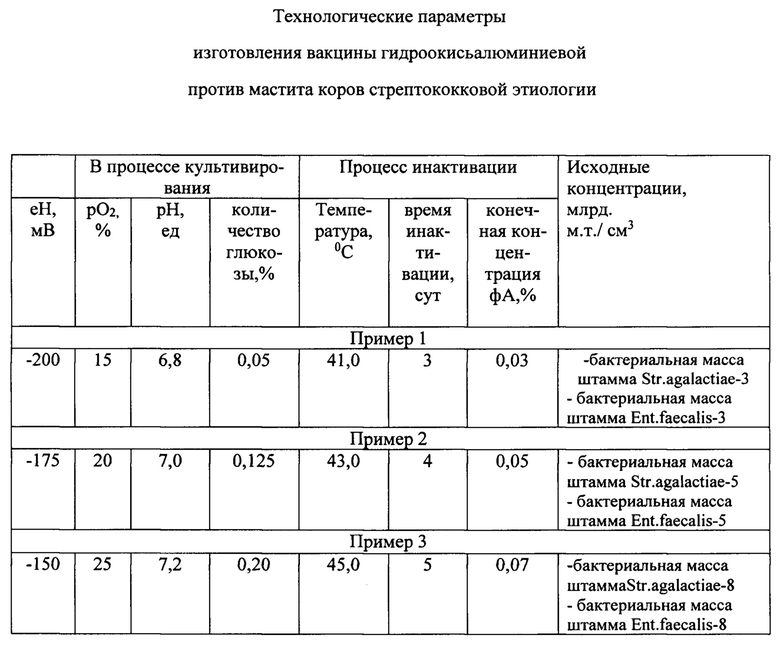
Технологические параметры изготовления гидроокисьалюминиевой вакцины против мастита стрептококковой этиологии, приведены в таблице.
Изобретение иллюстрируется на следующих примерах.
Пример 1. Способ изготовления вакцины против мастита включал культивирование в питательной среде микроорганизмов Streptococcus agalactiae 6150 и Enterococcus faecalis 356, инактивацию микроорганизмов и добавление адъюванта - гидроокиси алюминия, в качестве антигена содержал бактериальную массу штаммов Streptococcus agalactiae 6150 и Enterococcus faecalis 356, взятых в вакцине в равных объемах при исходных концентрациях микроорганизмов 3 млрд.м.т./см3, а культивирование культур штаммов стрептококков проводили при окислительно-восстановительном потенциале культуральной жидкости -200 мВ, после чего до окончания процесса культивирования поддерживали рО2 в культуральной жидкости на уровне 15% от насыщения кислородом воздуха, рН культуральной жидкости регулировали на уровне 6,8, а дробную подачу глюкозы осуществляли дозами до концентрации 0,05% при лимитировании роста стрептококков глюкозой, инактивацию культур стрептококков проводили формальдегидом при температуре 41°C в течение 3-5 суток, причем конечная концентрация формальдегида в культуре составляла 0,03%.
Вакцину применили лактирующим коровам двукратно в неблагополучной по стрептококкозу ферме. Резистентность организма животных к заболеванию стрептококковой этиологии продолжалась в течение 3 месяцев после последней вакцинации, в последствие коровы подвергались инфицированию и заболевали маститом.
Пример 2. Способ изготовления вакцины против мастита коров включал культивирование в питательной среде микроорганизмов Streptococcus agalactiae 6150 и Enterococcus faecalis 356, инактивацию микроорганизмов и добавление адъюванта - гидроокиси алюминия, в качестве антигена содержал бактериальную массу штаммов Streptococcus agalactiae 6150 и Enterococcus faecalis 356, взятых в вакцине в равных объемах при исходных концентрациях микроорганизмов 5 млрд.м.т./см3, а культивирование культур штаммов стрептококков проводили при окислительно-восстановительном потенциале культуральной жидкости -175 мВ, после чего до окончания процесса культивирования поддерживали рО2 в культуральной жидкости на уровне 20% от насыщения кислородом воздуха, рН культуральной жидкости регулировали на уровне 7,0, а дробную подачу глюкозы осуществляли дозами до концентрации 0,125% при лимитировании роста стрептококков глюкозой, инактивацию культур стрептококков проводили формальдегидом при температуре 43°C в течение 3-5 суток, причем конечная концентрация формальдегида в культуре составляла 0,05%.
Вакцину применили коровам двукратно в неблагополучной по стрептококкозу ферме. Иммунитет у животных наступал через 13-15 суток после первого введения вакцины и продолжался не менее 12 месяцев после последней иммунизации.
Из представленных данных видно, что проведенная вакцинация заявляемой вакциной позволила обеспечить 100% защиту животных в неблагополучной по стрептококкозу ферме.
Пример 3. Вакцина изготавливалась по прототипу. Культуры штаммов микроорганизмов вводилив вакцину в равных объемах при исходных концентрациях микрорганизмов 8 млрд.м.т./см3, а культивирование культур штаммов стрептококков проводили при окислительно-восстановительном потенциале культуральной жидкости -150 мВ, после чего до окончания процесса культивирования поддерживали pO2 в культуральной жидкости регулируют на уровне 7,2, а дробную подачу глюкозы осуществляют дозами до концентрации 0,20% при лимитировании культур стрептококков проводили формальдегидом при температуре 45°C в течение 5 суток, причем конечная концентрация формальдегида в культуре составляла 0,07%.
Вакцину применили коровам двукратно в неблагополучной по стрептококкозу ферме. Резистентность организма животных к заболеванию стрептококковой этиологии продолжалась в течение 12 месяцев. Иммунитет у животных наступал через 13-15 суток после первого введения вакцины и продолжался не менее 12 месяцев после последней иммунизации.
Из представленных данных видно, что проведенная вакцинация заявляемой вакциной позволила обеспечить 100% защиту животных в неблагополучной по стрептококкозу ферме.
Пример 4. Вакцина изготовлена по аналогу. Культуры штаммов микроорганизмов вводили в вакцину в равных объемах при исходных концентрациях микроорганизмов 14,0 млрд.м.т./см3, а культивирование культур штаммов стрептококков проводили при окислительно-восстановительном потенциале культуральной жидкости -175 мВ, после чего до окончания процесса культивирования поддерживали pO2 в культуральной жидкости на уровне 20% от насыщения кислородом воздуха, рН культуральной жидкости регулировали на уровне 7,0, а дробную подачу глюкозы осуществляли дозами до концентрации 0,125% при лимитировании роста стрептококков глюкозой, инактивацию культур стрептококков проводили формальдегидом при температуре 45°C в течение 3-5 суток, причем конечная концентрацияформальдегида в культуре составляла 0,05%.
Вакцину применили лактирующим коровам двукратно в неблагополучной по стрептококкозу ферме. Резистентность организма животных к заболеванию стрептококковой этиологии отсутствовала и коровы заболевали в течение 1-2 месяцев.
Пример 5. Испытание профилактической эффективности заявляемой вакцины на коровах. Вакцину применили, изготовленную по примеру 1 и 2.
В исследованиях использованы две группы коров путем двукратной вакцинации препарата в дозе 1,5-2,0 мл с интервалом 15 суток.
Одной группе коров вводили вакцину, изготовленную по примеру 1, другой группе - заявляемую вакцину по примеру 2. Через 20 дней после 2-й вакцинации все коровы, в том числе 6 контрольных невакцинированных, были заражены смесью 3-х вирулентных штаммов стрептококков в дозе 5-6 млрд. микробных клеток. Наблюдение за животными проводили в течение 15 суток, учитывали заболевших, проводили бактериологический контроль из патологического материала.
Сохранность вакцинированных коров от заболевания стрептококкозами составила 100%. Заболеваемость в контрольной группе составила 80%.
Пример 6. Определение профилактической эффективности вакцин, изготовленных по прототипу и аналогу.
Исследования проводили с использованием двух групп коров, которые подвергались двукратной иммунизации вакциной изготовленной по прототипу и аналогу, а затем заражению смесью живых вирулентных стрептококков аналогично действиям, указанным в примере №5. Вакцинированные животные заболевали, у них отмечались маститы, характерные для стрептококкоза. Сохранность коров составила только 45% и 30% соответственно прототипу и аналогу. Заболеваемость в контрольной группе составляла 80%.
Таким образом, при применении заявляемой вакцины технический результат заключается в повышении резистентности коров к заболеваниям маститом, профилактическом эффекте в течение 12 месяцев при двукратном вакцинировании.
Представленные примеры подтверждают высокое качество и эффективность вакцины, полученной заявленным способом. Применение заявляемой вакцины позволяет предохранить наибольший процент животных от заболевания стрептококкозом коров по сравнению с известными вакцинами.
1. Патент РФ №2191598 С2 от 27 октября 2002 г. К 39/102 «Вакцина ассоциированная гидроокисьалюминиевая против инфекционных пневмоний свиней бактериальной этиологии и способ ее изготовления» (аналог).
2. Патент РФ №1566533 от 7 апреля 1993 г. А 61 39/102 «Способ изготовления вакцины против пастереллеза птиц».
3. Патент РФ №2129016 от 20 апреля 1999 г. А61К 39\112 «Способ изготовления вакцины против сальмонеллеза сельскохозяйственных животных».
4. Титова М.Н. Усовершенствование лечебно-диагностических мероприятий при стрептококковом мастите коров // Автореферат диссертации кандидата ветеринарных наук. Новосибирск. 2013.
5. Патент РФ №21 79861 от 27.02.2002 А61К 39/085. Вакцина ассоциированная против стрептококкоза крупного рогатого скота.
6. US 2012128719 А1, 24.05.2012 (прототип).
7. Патент РФ №2687488 от 14 мая 2019 г. С1, «Формолвакцина против пневмонии телят стрептококковой этиологии» опубликовано Бюл. №14.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФОРМОЛВАКЦИНА ПОЛИШТАММНАЯ ПРОТИВ ПНЕВМОНИЙ ТЕЛЯТ СТРЕПТОКОККОВОЙ ЭТИОЛОГИИ | 2018 |
|
RU2687488C1 |
| Способ изготовления формолвакцины гидроокисьалюминиевой полиштаммной против стрептококковых заболеваний крупного рогатого скота | 2016 |
|
RU2649754C2 |
| Способ получения инактивированной вакцины против легочных заболеваний молодняка продуктивных животных | 2019 |
|
RU2722668C1 |
| Поливалентная инактивированная вакцина против стрептококкозов свиней, способ ее получения и применения | 2021 |
|
RU2761379C1 |
| ВАКЦИНА ПРОТИВ ИНФЕКЦИОННЫХ МАСТИТОВ И ЭНДОМЕТРИТОВ КОРОВ ИНАКТИВИРОВАННАЯ, СПОСОБ ЕЁ ПОЛУЧЕНИЯ | 2024 |
|
RU2840041C1 |
| Штамм "SA-21" бактерии рода Streptococcus вида Streptococcus agalactiae для изготовления биопрепаратов для специфической профилактики мастита коров | 2022 |
|
RU2799603C1 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ГИДРООКИСЬАЛЮМИНИЕВАЯ ПРОТИВ ИНФЕКЦИОННЫХ ПНЕВМОНИЙ СВИНЕЙ БАКТЕРИАЛЬНОЙ ЭТИОЛОГИИ И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 2000 |
|
RU2191598C2 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ИНАКТИВИРОВАННАЯ ГИДРООКИСЬАЛЮМИНИЕВАЯ ПРОТИВ ИНФЕКЦИОННОЙ ПНЕВМОНИИ И САЛЬМОНЕЛЛЕЗА СВИНЕЙ И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 2003 |
|
RU2246316C1 |
| ШТАММ БАКТЕРИЙ STREPTOCOCCUS AGALACTIAE №71 ДЛЯ ИЗГОТОВЛЕНИЯ ВАКЦИН ПРОТИВ СТРЕПТОКОККОЗА ПУШНЫХ ЗВЕРЕЙ | 2004 |
|
RU2261109C1 |
| Способ получения вакцины ассоциированной против колибактериоза, стрептококкоза и энтерококковой инфекции телят и поросят | 2017 |
|
RU2650628C1 |
Изобретение относится к биотехнологии и ветеринарной медицине. Предложен способ получения вакцины гидроокисьалюминиевой против мастита коров стрептококковой этиологии. Способ включает культивирование в питательной среде при рН 6,8-7,2 микроорганизмов штаммов Streptococcus agalactiae 6150 серогруппа В и Enterococcus faecalis 356 серогруппа D, взятых в равных объемах по 4-8 млрд м.т./см3, их инактивацию формальдегидом при 41-45°C в течение 3-5 суток и добавление адъюванта гидроокиси алюминия, причем культивирование штаммов стрептококков проводят при окислительно-восстановительном потенциале культуральной жидкости -200÷-150 мВ и pO2 на уровне 15-25% от насыщения кислородом воздуха при лимитировании роста глюкозой. Изобретение направлено на получение гидроокисьалюминиевой вакцины, обеспечивающей защиту лактирующих коров от заболеваний стрептококковой этиологии. 1 табл., 6 пр.
Способ получения вакцины гидроокисьалюминиевой против мастита коров стрептококковой этиологии, включающий культивирование в питательной среде микроорганизмов штаммов Streptococcus agalactiae 6150 серогруппа В, Enterococcus faecalis 356 серогруппа D, инактивацию микроорганизмов и добавление адъюванта - гидроокиси алюминия, отличающийся тем, что вакцина в качестве антигена содержит бактериальную массу штаммов Streptococcus agalactiae 6150 серогруппа В и Enterococcus faecalis 356 серогруппа D, взятых в вакцине в равных объемах при исходных концентрациях микроорганизмов 4-8 млрд м.т./см3, а культивирование штаммов стрептококков проводят при окислительно-восстановительном потенциале культуральной жидкости -200÷-150 мВ, после чего до окончания процесса культивирования поддерживают pO2 в культуральной жидкости на уровне 15-25% от насыщения кислородом воздуха, рН культуральной жидкости регулируют на уровне 6,8-7,2, а дробную подачу глюкозы осуществляют дозами до концентрации 0,05-0,2% при лимитировании роста стрептококков глюкозой, инактивацию культур стрептококков проводят формальдегидом при температуре 41-45°C в течение 3-5 суток, причем конечная концентрация формальдегида в культуре составляет 0,03-0,07%.
| ФОРМОЛВАКЦИНА ПОЛИШТАММНАЯ ПРОТИВ ПНЕВМОНИЙ ТЕЛЯТ СТРЕПТОКОККОВОЙ ЭТИОЛОГИИ | 2018 |
|
RU2687488C1 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ ЭШЕРИХИОЗА, СТРЕПТОКОККОЗА И СТАФИЛОКОККОЗА КРУПНОГО РОГАТОГО СКОТА | 2013 |
|
RU2553556C1 |
| Способ изготовления формолвакцины гидроокисьалюминиевой полиштаммной против стрептококковых заболеваний крупного рогатого скота | 2016 |
|
RU2649754C2 |
| CN 103800899 A, 21.05.2014. | |||
Авторы
Даты
2020-06-17—Публикация
2019-07-02—Подача