Изобретение относится к области ветеринарной микробиологии и биотехнологии, а именно к получению нового штамма Streptococcus agalactiae «SA-21» и может быть использовано при разработке и изготовлении средств специфической профилактики мастита коров.
В результате перевода животноводства на промышленную основу, автоматизации производственных процессов возникает ряд проблем, негативно сказывающихся на физиологическом состоянии животных. В частности, у коров возникают заболевания молочной железы, которые наносят значительный экономический ущерб в результате снижения молочной продуктивности, ухудшения качества молока, а также преждевременной выбраковки животных и затрат на лечение [21]. В современных условиях особое значение приобретает повышение качества молока, снижение себестоимости и обеспечение конкурентоспособности животноводческой продукции. Молоко является важным пищевым продуктом для людей и кормом для животных. Выращивание полноценного молодняка зависит в значительной мере от состояния и функции молочной железы лактирующих коров. Патологические процессы, развивающиеся в молочной железе, отрицательно сказываются на качественном составе молока и воспроизводительной способности коров. Болезни вымени (скрытый или клинический мастит) связаны с огромными потерями молока за счет уменьшения молочной продуктивности, сокращения срока хозяйственного использования коров [1, 22]. За последние годы в молочном скотоводстве страны увеличился удой на корову почти в два раза. В результате роста продуктивности обостряются проблемы здоровья вымени и оплодотворяемости коров. В хозяйствах выбраковывается ежегодно по причине мастита не менее 17% коров. У 50% и более лактирующих животных выявляется скрытая форма мастита [2, 4, 11, 15, 18, 20, 25].
Экономический ущерб при возникновении мастита весьма значительный. В зависимости от тяжести воспалительного процесса в молочной железе и продуктивности коров удои в течение года могут снижаться на 10-25%, или на 150-500 л. Кроме того, у многих животных, переболевших клинической формой мастита, молочная продуктивность полностью не восстанавливается и в последующие лактации, а в 10% и более случаев молокообразование в пораженной четверти вымени прекращается и происходит ее атрофия. Выбраковка коров по причине атрофии долей вымени и гипогалактии достигает 17 - 30% [6, 9, 11]. Воспаление молочной железы является полиэтиологическим и полифакторным заболеванием, развивающимся вследствие воздействия на нее механических, термических, химических и биологических факторов. При этом основное значение придается проникновению в вымя патогенных микроорганизмов, что приводит к более тяжелым воспалительным процессам в тканях молочной железы [3]. Поэтому наряду с исключением воздействия на организм предрасполагающих факторов особенно важным является устранение микроорганизмов - возбудителей мастита [5, 8, 13, 19, 26, 27, 30].
Мастит у коров регистрируется во все физиологические периоды жизни, но наиболее часто в лактационный. В этот период отмечается значительное увеличение уровня заболеваемости вследствие воздействия на молочную железу многих факторов, особенно нарушение правил машинного доения, немаловажным является также перенос патогенных возбудителей от больных животных к здоровым с доильными аппаратами.
Борьба с маститом может быть успешной лишь при своевременном обнаружении больных животных, а также оказании лечебной помощи на ранних стадиях воспалительного процесса вымени [7, 12, 14, 16, 17].
В настоящее время проведение традиционной профилактики и терапии осуществляется на основе использования химиотерапевтических средств. Однако повсеместное применение антибиотиков способствует появлению побочных явлений у людей и животных. Также установлено, что антимикробные препараты оказывают негативное влияние на иммунологическую реактивность организма, что может снижать эффективность лечения [10]. Кроме того, многие лекарства чрезвычайно дороги, и не нашли широкого применения в ветеринарной практике. Повсеместное и бессистемное использование большого количества препаратов, содержащих антибиотики, привело к тому, что образовались лекарственно устойчивые штаммы микроорганизмов, появился мастит грибковой этиологии [13, 23, 24, 38, 29].
В последние годы в нашей стране ведутся интенсивные работы по созданию новых, высокоэффективных противомаститных лекарственных средств антимикробного и противовоспалительного действия, допустимых к использованию в условиях современных животноводческих ферм. Однако их эффективность не всегда достаточно высокая и большинство препаратов имеют длительный период выведения.
Мастит - это инфекция молочной железы, обычно вызываемая бактериями или грибками. Среди видов бактерий, наиболее часто связанных с маститом, выделяют виды рода Streptococcus, в том числе Streptococcus uberis (нетипируемые), Streptococcus agalactie (группа Лансфилда В), Streptococcus dysgalactiae (группа Лансфилда С), Streptococcus zooepidemicus и группы Лансфилда Д, Г, Л и Н стрептококки. Некоторые из этих видов являются инфекционными (например, S. agalactiae), тогда как другие считаются патогенами окружающей среды (например, S. dysgalactiae и S. uberis).
Стрептококки группы В ассоциируются с болезнями животных, относящаяся к этой группе бактерия Streptococcus agalactiae является основной причиной возникновения маститов у рогатого скота. Хотя животные и восприимчивы к действию антибиотиков, однако, острое начало заболевания и быстрое развитие приводит к высокому проценту заболеваемости (50%).
Возбудитель Streptococcus agalactiae группы В носит антигенную структуру - С-полисахарид, с которым связаны вирулентность и иммуногенность микробной клетки. Поэтому эффективность специфической профилактики определяется наличием С-фактора в антигенном составе входящих в вакцину компонентов.
Известен штамм WC1535deltacps Streptococcus agalactiae, его конструкция и применение. Изобретение относится к технической области генной инженерии. Штамм Streptococcus agalactiae хранится в Центре сбора микробиологических культур провинции Гуандун под регистационным номером GDMCC №60208. Штамм по изобретению может быть использован для получения аттенуированных живых вакцин против стрептококкоза рыб [31].
Известен вакцинный штамм «Кощаковский» стрептококкоза серогруппы С, используемый для изготовления инактивированной ГОА -формолвакцины против стрептококкоза нутрий [32]. Штамм выделен от нутрий, адаптирован к этому виду зверей и используется для изготовления профилактических препаратов против стрептококкоза нутрий.
Известны патогенные штаммы Streptococcus agalactiae, которые являются производственными штаммами для разработки вакцин и диагностических тестов. В частности, изобретение относится к генному содержимому штаммов S. agalactiae, выделенных от рыб, но не вирулентных для рыб [33].
Известен штамм Streptococcus agalactiae №71, положительный по С-полисахариду и предназначен для производства вакцинных препаратов против стрептококковой инфекции пушных зверей, преимущественно песцов и лисиц [34].
Известен способ получения вакцины гидроокись алюминиевой против мастита коров стрептококковой этиологии. [35]. Способ включает культивирование в питательной среде при рН 6,8-7,2 микроорганизмов штаммов Streptococcus agalactiae 6150 серогруппа В и Enterococcus faecalis 356 серогруппа D.
Известна иммунизация молочного КРС белком GAPC против стрептококковой инфекции [36]. Настоящее изобретение относится к клонированию, экспрессии и характеристике плазмин-связывающих белков GAPC из Streptococcus dysgalactiae, Streptococcus agalactiae, Streptococcus uberis, Streptococcus parauberis и Streptococcus iniae и их применение в вакцинных композициях. В качестве штамма Streptococcus agalactiae группы В в данном описании используется штамм А909 (АТСС №27591).
В патентной и научно-технической литературе не известны технические решения, содержащие штамм микроорганизма «SA-21» Streptococcus agalactiae аналогичное заявляемому, т.е. предложение соответствует критерию «новизны».
Выделение штамма микроорганизма при мастите коров, и использование его в качестве производственного штамма, способствующего формированию иммунитета к циркулирующим патогенам, вызывающих мастит, который не влиял бы на качество молока и оказывал положительный экономический эффект, является актуальным направлением и будет способствовать обеспечению страны безопасной продукцией, снижению применения антибактериальных препаратов в животноводстве и за счет этого выходом продукции на экспорт.
Техническая проблема заключается в расширении арсенала актуальных производственных штаммов вида Streptococcus agalactiae и обладающих новыми биологическими характеристиками, и пригодных для изготовления биопрепаратов для специфической профилактики мастита крупного рогатого скота.
Указанная проблема решена путем получения штамма «SA-21» Streptococcus agalactiae, который может использоваться для изготовления биопрепаратов для специфической профилактики мастита коров.
Изолят Streptococcus agalactiae, послуживший источником для получения штамма «SA-21», был выделен в ФГБУ «ВНИИЗЖ» в 2021 г. при проведении бактериологических исследований проб молока, от коров из хозяйства Курской области.
Штамм «SA-21» семейства Streptococcaceae рода Streptococcus вида Streptococcus agalactiae, депонирован во Всероссийскую государственную коллекцию экзотических типов вируса ящура и других патогенов животных (ГКШМ) ФГБУ «ВНИИЗЖ» под регистрационным номером: №386 - деп / 22-20 - ГКШМ ФГБУ «ВНИИЗЖ».
Экспериментально подтверждена возможность использования штамма «SA-21» Streptococcus agalactiae для изготовления биопрепаратов для специфической профилактики, экспериментально показана выработка антител на введение моновакцины, изготовленной из антигена данного штамма, лабораторным животным.
Штамм «SA-21» вида Streptococcus agalactiae характеризуется следующими признаками и свойствами.
Морфологическая характеристика
Штамм «SA-21» семейства Streptococcaceae, рода Streptococcus, вида Streptococcus agalactiae и обладает морфологическими признаками, характерными для бактерий рода Streptococcus.
Это грамположительные кокки, располагающиеся преимущественно в виде цепочек разной длины. При окраске по Циль-Нильсону отмечены кокки синего цвета, без капсул.
Бактерии формируют круглые с ровными краями, выпуклые с гладкой поверхностью (S-форма), полупрозрачные с сероватым оттенком колонии диаметром 0,4-0,7 мм. На кровяном агаре - образуется прозрачный ореол вокруг колоний - характеризующий β гемолиз.
Культуральные свойства
- неподвижный факультативный анаэроб, оптимальная температура роста (37,0±0,5)°С;
- на агаре Колумбия с добавлением сыворотки крови лошади в количестве 5% растет в виде мелких до 1 мм, нежных серовато-прозрачных колоний с ровными краями;
- на агаре с кровью образует круглые слегка голубоватые колонии, окруженные большой зоной просветления - гемолиза;
- на среде Эндо образуют бело-розовые колонии с зоной гемолиза типа В;
- на средах Левина, Плоскерева образует мутные сероватые колонии с зоной гемолиза;
- на жидких средах МПБ и МППБ - дает придонный осадок с диффузным помутнением среды, который при тщательном встряхивании полностью разбивается.
Бактерии рода Streptococcus обладают зависимостью от наличия сыворотки крови лошади в питательной среде. Без сыворотки отмечен слабый рост на поверхности агаровой среды в виде напыления, видимый только при рассмотрении под лупой. Общепринятыми средами для выращивания стрептококков являются МПБ, МПА с 5% дефибринированной крови барана, с 1% глюкозы, рН 7,2-7,6.
Хорошо сохраняется при условии лиофильного высушивания с сахарозо-желатиновой средой, а также при быстром замораживании и хранении при - 40°С.
Ферментативные свойства
При посеве на среды Гисса проявляет следующие биохимические свойства, представленные в таблице 1:
- не разжижает желатин;
- свертывает молоко;
- свертывает и обесцвечивает лакмусовое молоко;
- ферментирует глюкозу, мальтозу, сахарозу, лактозу, маннит;
- образует муть на сорбите, дульците.
САМР-тест используют как один из стабильных биологических признаков при диффенциации S. agalactiae (серогруппа В) от гемолитических стрептококков других серологических групп. Тест основан на способности S. agalactiae продуцировать внеклеточный белковый субстрат со слабовыраженной гемолитической активностью, которая существенно возрастает при совместном его выращивании со Staphylococcus aureus, вырабатывающим (β-токсин, но без прямого контакта с последним.
На чашки Петри с кровяным агаром по диаметру высевают прямым штрихом культуру Staphylococcus aureus. Перпендикулярно линии посева Staph, aureus, но не достигая ее примерно на 0,5 см, отдельными параллельными полосами с интервалом не менее 1 см наносят 18-часовые культуры S. agalactiae. Засеянные чашки помещают в термостат при (37,0±0,5)°С. Учет результатов проводят через 20-24 ч.
Наблюдается клиновидная зона усиления β-гемолиза в точке сближения роста штамма S. agalactiae и культуры Staph. aureus, что говорит о положительном САМР-тесте - и подтверждает принадлежность исследуемой культуры штамма к виду S. agalactiae.
Антигенные свойства
Стимулирует образование в сыворотке крови типоспецифичных антител, обладающих защитным действием против стрептококкоза, выявляемых в РА.
Инактивированный штамм индуцирует выработку антител, выявляемые методами реакции агглютинации (РА) и иммуноферментным анализом (ИФА) (табл. 3).
Штамм S. agalactiae «SA-21» по капсульному антигену принадлежит к серогруппе В.
Биотехнологические свойства
Оптимальными условиями культивирования штамма «SA-21» являются следующие:
- чашки Петри с питательными средами: сывороточный агар Колумбия, кровяной агар Колумбия; посевы инкубируют в течение 24 ч при температуре (37,0±0,5)°С;
флаконы с жидкой питательной средой (сывороточный сердечно-мозговой бульон (СМБ); посев инкубируют при температуре (37,0±0,5)°С в течение 18-24 ч.
Чистоту культуры проверяют методом световой микроскопии мазков, окрашенных по Граму.
По завершении культивирования агаровую культуру штамма «SA-21» смывают стерильным физиологическим раствором в объеме 5,0 см3 на одну чашку, определяют концентрацию бактериальной суспензии по оптическому стандарту мутности. По результатам визуальной стандартизации доводят концентрацию исходной бактериальной суспензии до 109 м.к./см3.
Устойчивость к внешним факторам
Штамм S. agalactiae «SA-21» чувствителен к ампициллину с клавулановой кислотой, цефалоспоринам.
Дополнительные признаки и свойства
Иммуногенная активность - иммуногенен в составе инактивированной вакцины.
Реактогенность - реактогенными свойствами в составе инактивированной вакцины не обладает. Иммунизация кроликов в удвоенной терапевтической дозе вакцины, в соответствии с ГОСТ 31926, не вызывает местной-раздражительной и воспалительной реакций после инъекции.
Патогенные свойства - штамм S. agalactiae «SA-21» патогенен для белых мышей.
Вирулентность - высоковирулентен.
Контаминация бактериями, грибами, микоплазмами - штамм «SA-21» не контаминирован бактериями, грибами, микоплазмами. Условия хранения.
При хранении штамма в нативном состоянии при температуре -70±5°С допустимая длительность хранения без освежения составляет 12 мес, а при хранении в лиофилизированном состоянии при той же температуре - 10 лет.
Сущность предлагаемого изобретения пояснена примерами его использования, которые не ограничивают объем изобретения.
Пример 1. Культивирование штамма «SA-21», с целью получение антигена данного штамма
Для культивирования S. agalactiae «SA-21» использовали питательную среду - сердечно-мозговой бульон с добавлением 5% сыворотки крови лошади.
Для получения бактериальной массы был использован ферментер «Biotron LiFlus GX», оснащенный системами регистрации и регулирования основных параметров культивирования: температуры, концентрации водородных ионов, скорости вращения мешалки и расхода кислорода для аэрации. Объем питательной среды в аппарате составлял 7,0 л с добавлением сыворотки крови лошади в количестве 0,35 л. Культивирование проводили в течение 24 часов при температуре (37,0±0,5)°С с постоянной подачей кислорода в количестве 1 л/ч.
Через 24 ч культивирования в бактериальную суспензию добавляли 0,2% формалина по объему. Инактивацию проводили 24 часа при непрерывном перемешивании (100 об/мин) и поддержании температуры в диапазоне (37,0-37,5)°С. Для определения полноты инактивации через 24 часа после внесения формалина бактериальную суспензию высевали «газоном» в количестве 1,0 см3 на чашку Петри с сывороточным агаром Колумбия. Инкубацию чашек Петри проводили в течение 48 часов при температуре (37,0±0,5)°С в условиях обычной атмосферы. При просмотре чашек Петри с агаром Колумбия рост культур бактерий S. agalactiae отсутствовал, что характеризовало положительное проведение инактивации.
Пример 2. Определение патогенных свойств штамма «SA-21»
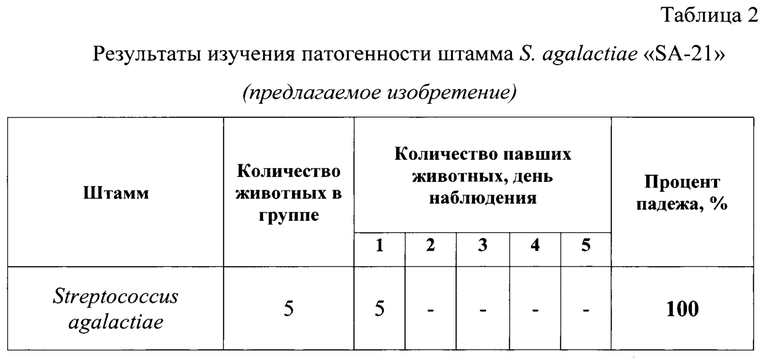
Определение патогенных свойств штамма стрептококка «SA-21» проводили на белых мышах. Для заражения были использованы 18-20 часовые бульонные культуры стрептококка, выращенного на бульоне Колумбия с добавлением 5% сыворотки крови лошади. В опыте использовали 10 белых мышей (5 голов на заражение + 5 голов контрольная группа). Культуру стрептококка вводили животным внутрибрюшинно в дозе 0,5 см3. Наблюдение за подопытными животными вели в течение 5 сут. Культуру признают патогенной при гибели не менее четырех белых мышей в группе. Для подтверждения специфической гибели белых мышей делали посевы на сывороточный сердечно-мозговой агар образцов спинного мозга, крови, сердце, печени и селезенки. Результаты оценки патогенных свойств штамма «SA-21» рода Streptococcus представлены в таблице 2.
В ходе установления специфичности гибели при проведении бактериологического исследования проб от всех павших животных была выделена чистая культура стрептококка.
Штамм «SA-21» S. agalactiae патогенен для белых мышей. Вирулентность штамма «SA-21» - высокая. Летальность составила в группе 100% в течение 24 ч.
Пример 3. Определение стабильности штамма «SA-21» S. agalactiae при хранении.
Для получения бактериальной массы штамм S. agalactiae «SA-21» высевали на чашки Петри с кровяным СМА. Посевы инкубировали при температуре (37,0±0,5)°С в течение 24 ч. По завершению инкубирования агаровую культуру смывали стерильной сахарозо-желатозной средой (стабилизирующая среда) в объеме 5,0 см3 на одну чашку. Определяли концентрацию бактериальной суспензии по стандартному образцу мутности бактерийных взвесей «ОРМЕТ». По результатам визуальной стандартизации доводили концентрацию исходной бактериальной суспензии до 109 м.к./см3.
Бактериальную суспензию фасовали по 0,5 см3 в ампулы соответствующей вместимости.
Процесс лиофилизации после внесения стабилизаторов сушки включает стадии замораживания, высушивания, досушивания и запаивания ампул.
Замораживание: бактериальную суспензию перед лиофилизацией промораживали. Для этого устанавливали три датчика контроля температуры материала в процессе сушки. При достижении температуры в материале минус (60±1)°С его выдерживали при внешней температуре не выше минус (70±1)°С в течение 24 ч, после чего процесс замораживания бактериальной суспензии считали законченным. Холодильную камеру сублиматора перед постановкой кассет с замороженным материалом дезинфицировали 70%-ным этиловым спиртом и охлаждали до температуры не выше минус (50±1)°С.
Высушивание: замороженный материал незамедлительно перегружали в камеру сублиматора. Сублимационная установка перед загрузкой должна находиться в режиме:
- температура полок - минус (50±1)°С;
- температура конденсора - минус (60±1)°С;
- вакуум-насос - в рабочем состоянии, отключен.
После загрузки камеры подключали вмороженные в материал датчики контроля температуры, камеру герметизировали и вакуумировали до остаточного давления 80-90 мм рт.ст., проводили процесс высушивания согласно установленному режиму: температура конденсора - минус 50-80°С, вакуум в камере - 80-90 мм рт.ст., время сушки - до 48 ч.
Досушивание: проводили при температуре материала 24-27°С в течение 12-16 ч. Давление в камере не должно быть выше 90 мм рт. ст. Общее время сушки с досушиванием составляет 60-64 ч.
Запаивание ампул: после завершения процесса сублимационного высушивания камеру сублиматора через стерилизующий фильтр заполняли стерильным воздухом, открывали и ампулы с материалом быстро перекладывали в эксикатор с осушенным силикагелем. Ампулы с материалом запаивали незамедлительно в день разгрузки в условиях стерильного бокса.
Датой изготовления штамма S. agalactiae «SA-21», считали дату проведения пассажа на питательной среде перед смывом культуры.
Штамм S. agalactiae «SA-21» хранят в лиофилизированном виде в запаянных ампулах, упакованных в коробки из картона и металлические контейнеры, при температуре минус (40-70)°С. Срок хранения штамма S. agalactiae «SA-21» с даты лиофилизации не ограничен.
При хранении (по истечении 6 мес.) проводили вскрытие 5 ампул с лиофилизированной культурой штамма S. agalactiae «SA-21» и определяли физико-химических и биологических показатели штамма. Все показатели соответствовали требуемым нормам, т.е. штамм при хранении в течение 6 мес. не изменил свои свойства.
Пример 4. Определение биохимических свойств штамма S. agalactiae «SA-21»
Биохимические свойства предлагаемого штамма определяли с помощью набора API Strep (BioMerieux) для идентификации бактерий семейства Streptococcaceae и родственных микроорганизмов по продукции ацетоина, гидролизу гиппуровой кислоты, гидролизу эскулина, продукции: пирролидонилариламидазы, α-галактозидазы, β-глюкуронидазы, щелочной фосфатазы, лейцинаминопептидазы, аргининдегидролазы, подкислению: D-рибозы, арабинозы, маннита, сорбита, лактозы, трегаллозы, инулина, рафиннозы, рафиннозы, амидона и гликогена.
В контейнер для инкубации (поднос и крышку) вносят 5 см3 очищенной воды для создания влажной атмосферы. Помещали стрип в контейнер для инкубации. В пробирку, содержащую 5 см3 стерильного физиологического раствора с помощью бактериологической петли вносили 2-3 изолированных колонии предлагаемого штамма S. agalactiae и тщательно растирали в пробирке. Пипеткой распределяли суспензию по лункам стрипа, избегая образования пузырьков. Поднос накрывали крышкой и инкубировали при температуре (37,0±0,5)°С в течение 18-24 ч.
Продукцию катал азы определяли в тесте с 3%-ным раствором перекиси водорода.
Биохимические свойства штамма представлены в таблице 1, соответствуют свойствам представленным в определителе Берджи - штамм «SA-21» относится к виду Streptococcus agalactiae, роду Streptococcus.
Пример 5. Определение серогрупповой принадлежности штамма S. agalactiae «SA-21», по капсульному антигену проводили с помощью набора группоспецифических сывороток в реакции латексной агглютинации Pastorex Strep (BIORAD). Латексные частицы реагентов набора индивидуально сенсибилизированы кроличьими антителами, специфичными для одного из углеводных стрептококковых антигенов групп А, В, С, D, F, G.
Отбирали отдельные колонии штамма S. agalactiae с питательной среды и суспендировали в ферментном растворе для экстракции антигенов. Экстракцию проводили в течение 15 мин при комнатной температуре. Готовый экстракт тестировали на реакционном слайде с шестью суспензиями латексных частиц, покрытых антителами, каждая из которых специфична для одной из групп стрептококков (А, В, С, D, F, G).
В присутствии гомологичного антигена латексные частицы суспензий агрегируют, давая видимую невооруженным глазом агглютинацию. Положительный контроль содержит инактивированные поливалентные экстракты для групп А, В, С, D, F, G стрептококков.
Результат теста (бихроматическое окрашивание) оценивали визуально через 1-2 мин. Проявилась красная агглютинация на зеленом фоне в пробирке с экстрактом группы В - что указывает на положительную реакцию. Штамм S. agalactiae «SA-21» принадлежит к серогруппе В.
Пример 6. Определение агглютинирующей активности антигена
Полученные препараты антигена, как описано выше, исследовали в реакции агглютинации (РА) микрометодом для выявления агглютинирующей активности антигена по ниже описанной методике.
Принцип предлагаемого варианта реакции агглютинации на планшете микрометодом заключается в склеивании и выпадении в осадок антигенов S. agalactiae под действием специфических антител (агглютининов) в специфической сыворотке крови кролика в присутствии солей электролитов, что визуально регистрировали образованием четко оформленного зонтика на дне лунки планшета. При отрицательной реакции агглютинации антиген оседает на дно в виде точки.
Использовали иммуноспецифические компоненты реакции:
- специфическая сыворотка крови кролика, двукратно иммунизированных антигеном S. agalactiae серогруппы В (положительный контроль);
- нормальная сыворотка крови кролика, не содержащая антител к S. agalactiae серогруппы В (отрицательный контроль);
- исследуемый антиген S. agalactiae «SA-21» (бактериальная суспензия, полученная методом культивирования в жидкой питательной среде, инактивированная формалином). Общую концентрацию микробных клеток в бактериальной суспензии определяют визуально по стандарту (эталону) мутности. Для постановки РА использовали инактивированный антиген из штамма S. agalactiae «SA-21» концентрацией микробных клеток 1×109 в см3.
Для постановки РА готовили двукратные разведения антигена от 1:2 до 1:4096. Для этого во все лунки планшета вносили фосфатно-солевой буферный раствор (ФСБР) - (рН 7,2-7,4) в объеме 0,05 см3. В первую лунку добавляли подготовленные пробы антигена S. agalactiae «SA-21» в объеме 0,05 см3, трехкратно пипетировали и переносили 0,05 см3 во вторую лунку и т.д. Из последней лунки после трехкратного пипетирования 0,05 см3 испытуемого материала удаляли в 2%-ый раствор едкого натрия или другой подобный дезинфектант.
Готовили рабочее разведение положительной и отрицательной контрольных сывороток (1:100) и вносили их во все лунки планшета с разведениями антигена в объеме 0,05 см3. Одновременно ставили контроли реакции:
- контроль антигена - в две лунки планшета вносили по 0,05 см3 ФСБР разведения антигена. Агглютинация антигена должна полностью отсутствовать;
- контроль сывороток на спонтанную агглютинацию - к 0,05 см3 контрольной сыворотки крови добавляли 0,05 см3 ФСБР. Спонтанная агглютинация сывороток должна отсутствовать.
Планшеты с компонентами реакции инкубировали в течение 18 часов при температуре (37±0,5)°С в статическом состоянии в шейкере-инкубаторе, затем выдерживали в бытовом холодильнике при температуре 4°С в течение 1 часа, после чего производили визуальный учет реакции.
Реакцию учитывали после полного оседания бактериальных клеток в лунках с контролем антигена.
Титром исследуемого антигена считали его наибольшее разведение, которое дает четкую видимую агглютинацию («зонтик»).
Результат реакции считали положительным, если в лунке наблюдали четко выраженную агглютинацию в виде «зонтика», с титром в РА≥1:16 (4 log2).
Результат считали отрицательным, если антиген оседал на дно лунки в виде точки («пуговки»), с титром в РА<1:16 (4 log2).
Агглютинирующий титр бактериальной суспензии штамма S. agalactiae «SA-21» составил 1:512 (9 log2).
Пример 7. Получение экспериментальной модели вакцины на основе антигена штамма «SA-21» S. agalactiae
В качестве антигена при изготовлении вакцины против мастита коров использовали бактериальную суспензию штамма «SA-21» S. agalactiae, полученную по примеру 1.
Для получения клеточного антигена из бактериальной суспензии использовали высокоскоростную проточную центрифугу BR 105BRLL, скорость подачи бактериальной суспензии составляла 1 л/час при вращении ротора 14000 об/мин. Общее время центрифугирования составило 15 мин. По окончанию работы ротор извлекали и перемещали в зону чистоты класса А.
Работу по стерильному извлечению бактериальной массы проводили в локальной чистой зоне 3W. Бактериальную массу снимали с внутренних стенок ротора центрифуги стерильным металлическим шпателем и погружали в стерильный стеклянный стакан. Предварительно в стакан был внесен стерильный фосфатно-солевой буферный раствор в объеме 0,05 л. После снятия всей бактериальной массы суспензию гомогенизировали в лабораторном гомогенизаторе Silverson L4R при комнатной температуре в течение 15 мин при частоте вращения мешалки 2500-2700 об/мин.
Полученную бактериальную суспензию фильтровали через стерильный многослойный марлевый фильтр в стерильную бутыль и определяли концентрацию клеток. При постоянном перемешивании бактериальную суспензию разбавляли стерильным фосфатно-буферным раствором до концентрации 1000 ОЕ/см3 (по стандартному образцу мутности бактерийных взвесей «ОРМЕТ»). Готовую суспензию клеточного антигена S. agalactiae «SA-21» до компоновки вакцины хранили в стеклянной бутыли под резиновой пробкой в комнате-рефрижераторе при температуре (4-8)°С. Перед перемещением на хранение антигены отбирали в количестве 5,0 см3 и передавали в отдел биологического и технологического контроля для проверки на стерильность в соответствии с ГФ XIV, т.1, стр. 1201-1222 (ОФС.1.2.4.0003.15).
Для создания экспериментальной серии препарата в количестве 1,0 тыс.доз было использовано:
- инактивированный антиген S. agalactiae «SA-21», в количестве 0,02 дм3;
- стерильный физиологический раствор, в количестве 0,48 дм3;
- адъювант Montanide ISA 206 VG, в количестве 0,5 кг;
- тиомерсал, в количестве 0,002 дм3.
С целью получения эмульсионного препарата, специфический иммуностимулятор (антиген) соединяли со стерильным физиологическим раствором, заявленное выше количество антигена сопоставимо с 2×109 м.к./доза. Масло предварительно было перелито в бутыль. Данный адъювант не пригоден для автоклавирования, поэтому перед эмульгированием подвергался холодной стерилизации через капсульный фильтр (0,22 мкм). Все компоненты вакцины были нагреты до 35,0°С. Адъювант соединяли с антигеном при низких оборотах мешалки (250 об/мин) в течение 15 мин. Для получения стабильной эмульсии полуфабрикат вакцины охлаждали до 12°С и проводили повторное эмульгирование в течение 15 мин.
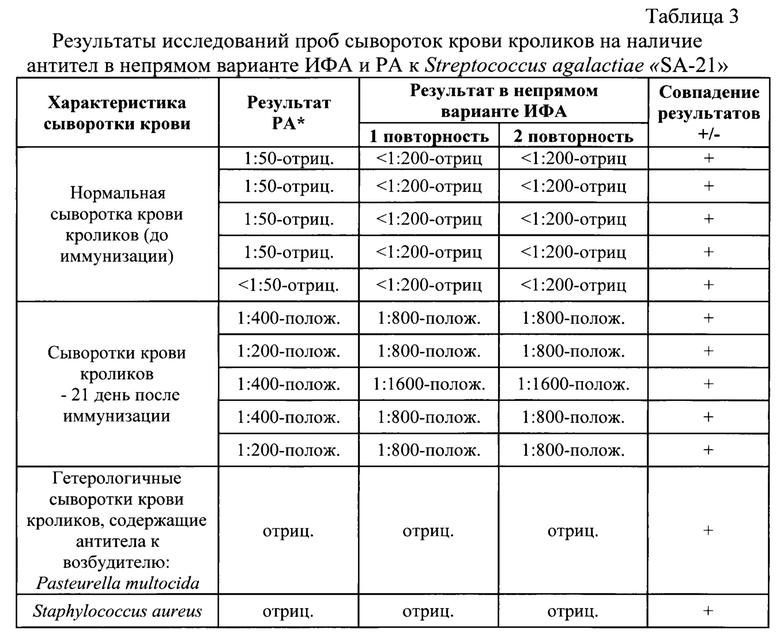
Данной вакциной было иммунизировано 28 кроликов внутримышечно прививной дозой 1,0 см3. У кроликов до иммунизации и через 21 день после вакцинации были отобраны пробы сыворотки крови. Данные сыворотки проверили на наличие антител к бактериям штамма «SA-21» S. agalactiae в РА и ИФА. Результаты исследований представлены в таблице 3.
Установлено, что через 21 сутки после однократной иммунизации кроликов инактивированной цельной вакциной, изготовленной из штамма «SA-21» в сыворотке крови кроликов обнаружены антитела к Streptococcus agalactiae в диапазоне титров от 9,64 до 10,64. log2. Показано, что полученный штамм «SA-21» S. agalactiae обладает иммуногенными свойствами.
Таким образом, заявляемый штамм «SA-21» бактерии рода Streptococcus вида Streptococcus agalactiae может быть для изготовления биопрепаратов для специфической профилактики мастита коров.
Источники информации:
1. Авдеенко А.В. Факторы риска, способствующие распространению и возникновению субклинического мастита у высокопродуктивных молочных коров / А.В. Авдеенко, Д.В. Кривенко // Ветеринарная медицина. Современ. проблемы и перспективы развития: сб. матер, междунар. науч.-практ. конф. - Саратов, 2010 - с. 6-7.
2. Анюлис Э.В. Изменение возбудителей субклинического мастита у коров при лечении антимаститными препаратами 13. В. Анюлис, С. Япертас, Ю. Рудеевне, Р. Мишейкене // Матер. междунар. Науч/-практ конф., «Современные проблемы ветеринарного обеспечения репродуктивного здоровья животных» посвященной 100-летию В.А. Акатова. - Воронеж, 2009. - с. 49-53.
3. Баймышева Д.Ш. Факторы, обусловливающие свойтаозникновение маститов / Д.Ш. Баймышева, Л.А. Коростелева, С.В. Котенков // Зоотехния. - 2007. - №8. - с. 22-24.
4. Богуш А.А. Заболеваемость коров маститами на животноводческих фермах / А.А. Богуш, В.И. Иванов, В.Г. Голынец // Ветеринарная медицина Беларуси. - 2001. -№1. - с. 41-42.
5. Богуш А.А. Мастит / А.А. Богуш, В.И. Иванов // Ветеринарная газета. - 2000. - №19, - с. 3.
6. Богуш А.А. Мастит коров и меры его профилактики: книга / А.А. Богуш, В.И. Иванов, Л.М. Бородич - Мн.: Белпринт, 2009. - 160 с.
7. Богуш А.А. Терапевтическая эффективность противомаститного препарата фитодисульфан / А.А. Богуш [и др.] // Ветеринарная наука - Минск, 2005. - Т. 38. - с. 127-128
8. Варганов А.И. Распространение и этиология мастита и эндометрита у коров / А.И. Варганов, И.Г. Конопельцев, А.В. Филатов // Актуальные проблемы ветеринарной науки: Тез. док. - Москва, 1999. - с. 7-8.
9. Голынец В.Г. Качественная характеристика молока при маститах у коров / В.Г. Голынец // Актуальные проблемы патологии сельскохозяйственных животных: мат. Межд. науч.-прак. конф. посвященной 70-летию со дня образования БелНИИЭВ им. С.Н. Вышелеского, 5-6 октября 2000 года г. Минск. - Минск: Бел. изд. Товарищество «Хата», 2000. - с. 462-463.
10. Горлов И.Ф. Комплексное лечение коров при маститах / И.Ф. Горлов, О.С. Юрина, М.И. Сложенкина // Ветеринария. - 2008. - №2. - с. 37-39.
11. Ивашкевич, О.П. Проблемы воспроизводства скота на промышленных комплексах / О.П. Ивашкевич // Ученые записки: сб. науч. тр. по мат. Междунар. науч.-практ. конф. «Инновационное развитие ветеринарного акушерства, гинекологии и биотехнологии размножения животных в условиях интенсификации животноводства» 2-5 ноября 2011 года Витебск. - Витебск, 2011. - Т. 47. - с. 53-55.
12. Климов Н.Т. Экспериментальная и клиническая фармакология лекарственных препаратов на основе диоксидина и доксициклина и их эффективность при мастите у коров: Автореф. дисс. доктора вет. наук/ Н.Т. Климов/ Воронеж. - 2009. - 32 с.
13. Ковальчук С.Н. Маститы у коров (этиология, профилактика, лечение). Автореферат дисс. кандидата вет. наук / С.Н. Ковальчук. - Витебск. - 2006. - 18 с.
14. Летунович А.А. Разработка новых средств и способов диагностики, лечения и профилактики маститов у коров: автореф. дис. канд. вет. наук: 16. 00. 07 / А.А. Летунович; УО «Витебская ордена «Знак Почета» государственная академия ветеринарной медицины». - Витебск, 2006. - 27 с.
15. Лучко И.Т. Белмаст и Альвеозан в комплексной терапии коров, больных маститом: автореф. диссер.… канд. вет. наук / И.Т. Лучко; УО «Витебская ордена «Знак Почета» государственная академия ветеринарной медицины». - Витебск, 2016. - 23 с.
16. Надточий О.О. Этиопатогенез и разработка эффективного лечения мастита у коров и острых расстройств пищеварения у телят /О.О. Надточий // Эффективность ветеринарных мероприятий в промышленном животноводстве Кубани. Краснодар: КСХИ. - 1989. - с. 20-25.
17. Париков В.А. Маститы у коров (профилактика и лечение) / В.А. Париков, Н.Т. Климов, А.И. Романенко и [др.] // Ветеринария. - 2000. - №11. - с. 34-37.
18. Париков В.А. Профилактика и лечение болезней вымени / В.А. Париков, В.И. Слободяник, В.А. Антипов // - Воронеж, 1995. - с. 31-35.
19. Першин С.С. Эффективность применения биологического стимулятора Аминоселетона в комплексной терапии больных маститом коров: автореф. дис. канд. вет. наук / С.С. Першин; - Воронеж, 2016.-23 с.
20. Решетка М.Б. Распространение и этиология мастита у коров/ М.Б. Решетка, А.Н. Турченко, И.С. Коба // Актуальные вопросы ветеринарной фармакологии и фармации: мат. Межд. науч. практ. конф. - Краснодар, 2012. - с. 113-115.
21. Слободяник В.И. Мастит парметы и акушерская патология у коров / В.И. Слободяник, А.Г. Нежданов, В.Г. Зинькевич // Ветеринария. - 1999. - №9. - с. 36-39.
22. Фенченко Н.Г. Влияние различных факторов на молочную продуктивность коров / Н.Г. Фенченко, Н.И. Хайруллина, В.Р. Хусаинов // Молочное и мясное скотоводство. - 2005. - №4. - с. 7-9.
23. Филиппова О.В. Эффективность нетрадиционных способов лечения маститов у коров / О. Филиппова [и др.] // Молочное и мясное скотоводство. - 2001. - №7 - с. 26-29.
24. Ходаков А.В. Эффективность различных препаратов при лечении скрытого мастита у коров / А.В. Ходаков // Диагностика и терапия незаразных болезней с-х. животных: Сб. науч. работ. - Воронеж, 1986. - с. 23-25.
25. Ширяев С.И. Разработка и эффективность комплексного метода фармакопрофилактики мастита и послеродовых болезней у коров: автореф. дис. канд. вет. наук / С.И. Ширяев. - Краснодар, 2010.- 21 с.
26. Bramley, A.I. Streptococcus uberis udder infectionamajor barrier to reducing mastitis incidence // Brit. Veter. J. - 1984. - V. 140. - №4. - P. 328-335.
27. Mahzounieh, M. Bacteriological and epidimiological aspects of mastitis in Arak area dairy herds Iran / M. Mahzounieh, G. Zadfar, S. Yham Magami, et all.// Acta vet. Scan. Suppe. - 2003. - №98. - P. 270.
28. Schallibaum, M. Antibiotikatherapie und Ruckstande in de Abliefertmg-smilch / M. Schallibaum // Swiss. Veter. - 1990. - №8. - S. 7-9.
29. Vaarst, M. Patterns of clinical mastitis manifestation in Danish organic dairy herds. / M. Vaarst, C. Eneroedsen // v. Dairy Res. - 1997. - V. 64. - №1. - P. 23-27.
30. Wenz, J.R. Bacteremia associated with naturally occurring acute coliform mastitis in dairy cows / J.R. Wenz, G.R. Barington // Journal American Veterinary Medicine Assoc. - 2001. - №219 (7). - P. 976-981.
31. Патент CN 107603933, от 19.10.2018 г.
32. Патент RU №2097422, от 27.11.1997 г.
33. Патент US 10786560, от 29.09.2020 г.
34. Патент RU №2261109, от 27.09.2005 г.
35. Патент RU №2723711, от 17.06.2020 г.
36. Патент WO 01/96381 А2, от 20.12.2001 г.

| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм бактерий Streptococcus dysgalactiae для изготовления биопрепаратов для специфической профилактики мастита коров | 2023 |
|
RU2818361C1 |
| СРЕДСТВО СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ ПРОТИВ КЛИНИЧЕСКИХ И СУБКЛИНИЧЕСКИХ МАСТИТОВ КОРОВ | 2024 |
|
RU2831198C1 |
| Штамм "SAU-21Л" бактерий Staphylococcus aureus для изготовления биопрепаратов для специфической профилактики мастита коров | 2023 |
|
RU2820305C1 |
| ВАКЦИНА ПРОТИВ ИНФЕКЦИОННЫХ МАСТИТОВ И ЭНДОМЕТРИТОВ КОРОВ ИНАКТИВИРОВАННАЯ, СПОСОБ ЕЁ ПОЛУЧЕНИЯ | 2024 |
|
RU2840041C1 |
| Штамм бактерии Pasteurella multocida "РМ - В" для изготовления биопрепаратов для специфической профилактики пастереллеза (геморрагической септицемии) крупного рогатого скота, вызванного пастереллой серогруппы В | 2023 |
|
RU2818959C1 |
| Поливалентная инактивированная вакцина против стрептококкозов свиней, способ ее получения и применения | 2021 |
|
RU2761379C1 |
| Способ получения вакцины гидроокисьалюминиевой против мастита коров стрептококковой этиологии | 2019 |
|
RU2723711C1 |
| ИММУНОГЕННЫЕ БЕЛКИ STREPTOCOCCUS | 2008 |
|
RU2518315C2 |
| ШТАММ Haemophilus parasuis СК-1 - ВОЗБУДИТЕЛЬ ГЕМОФИЛЕЗНОГО ПОЛИСЕРОЗИТА СВИНЕЙ ДЛЯ ИЗГОТОВЛЕНИЯ ДИАГНОСТИЧЕСКИХ И ВАКЦИННЫХ ПРЕПАРАТОВ | 2004 |
|
RU2268933C1 |
| ШТАММ HAEMOPHILUS PARASUIS ИЛ-1 - ВОЗБУДИТЕЛЬ ГЕМОФИЛЕЗНОГО ПОЛИСЕРОЗИТА СВИНЕЙ ДЛЯ ИЗГОТОВЛЕНИЯ ДИАГНОСТИЧЕСКИХ И ВАКЦИННЫХ ПРЕПАРАТОВ | 2004 |
|
RU2269570C2 |
Изобретение относится к области биотехнологии и касается нового штамма бактерий семейства Streptococcaceae рода Streptococcus вида Streptococcus agalactiae «SA-21», депонированного во Всероссийской государственной коллекции экзотических типов вирусов ящура и других патогенов животных (ГКШМ) ФГБУ «ВНИИЗЖ» под регистрационным номером: №386 – деп / 22-20 - ГКШМ ФГБУ «ВНИИЗЖ». Предложенный штамм культивируется на питательных средах - агар Колумбия и сердечно-мозговой бульон, штамм обладает выраженными свойствами, характерными для своего вида, по серогрупповой дифференциации относится к серогруппе В, является высоковирулентным, а также обладает антигенными и иммуногенными свойства. Представленный штамм может быть использован для изготовления биопрепаратов для специфической профилактики мастита коров. 3 табл., 7 пр.
Штамм бактерий Streptococcus agalactiae «SA-21», депонированный во Всероссийской государственной коллекции экзотических типов вирусов ящура и других патогенов животных ФГБУ «ВНИИЗЖ» под регистрационным номером: №386 - деп / 22-20 - ГКШМ ФГБУ «ВНИИЗЖ», для изготовления биопрепаратов для специфической профилактики мастита коров.
| Способ получения вакцины гидроокисьалюминиевой против мастита коров стрептококковой этиологии | 2019 |
|
RU2723711C1 |
| BRAMLEY, A.I., Streptococcus uberis udder infectionamajor barrier to reducing mastitis incidence, Brit | |||
| Veter | |||
| J., 1984,V | |||
| Способ закалки пил | 1915 |
|
SU140A1 |
| Способ переработки сплавов меди и цинка (латуни) | 1922 |
|
SU328A1 |
| ШИРЯЕВ С.И | |||
| Разработка и эффективность комплексного метода фармакопрофилактики мастита и послеродовых болезней у коров, автореферат | |||
| Диссертации, Краснодар, 2010, весь документ. | |||
Авторы
Даты
2023-07-07—Публикация
2022-10-18—Подача