Область техники, к которой относится изобретение
Изобретение относится к экспериментальной медицине и фармакологии и может быть использовано для изучения токсического действия на проводящую систему сердца в доклиническом исследовании новых кардиопротективных средств, изучения механизмов их действия и в разработке новых способов лечения.
Уровень техники
Экспериментальные модели токсического поражения сердца широко используются для изучения механизмов формирования патологических процессов в проводящей системе сердца, выяснения роли различных факторов внешней и внутренней среды в развитии приобретенного синдрома удлиненного интервала QT и желудочковых аритмий, дают возможность изыскать средства для рационального терапевтического вмешательства и профилактики.
Токсическое действие на проводящую систему сердца, характеризующееся удлинением интервала QT и развитием вентрикулярных аритмий, в том числе пируэтной-torsade de pointes (TdP) аритмии, выражающейся в удлинении интервала QTc от 40 до 100 мс и внезапной смертью больного, является нередким нежелательным явлением, возникающим на фоне применения фторхинолонов, макролидов, противогрибковых и противотуберкулезных препаратов (ПТП). В экспериментах на животных было установлено удлинение интервала QT при быстром внутривенном введении фторхинолонов, особенно выраженное у спарфлоксацина [Ball P. Quinolone induced QT interval prolongation: a not unexpected class effect. J Antimicrob Chemother, 2000; 45: 557-9.]. Клинические проявления кардиотоксичности также регистрировались при применении левофлоксацина, офлоксацина, моксифлоксацина, гатифлоксацина, ципрофлоксацина. Механизм кардиотоксичности фторхинолонов обусловлен влиянием на специфический ген (HERG), обеспечивающий формирование калиевых каналов и беспрепятственное прохождение по ним ионизированного калия. Вследствие нарушения калиевых токов происходит удлинение интервала QT. Наибольшую активность в отношении калиевых токов в сердце имеет моксифлоксацин. Риск аритмического синдрома при применении моксифлоксацина существенно повышается при наличии следующих факторов: пожилой возраст, нарушение клиренса креатинина, диарея или интенсивная мочегонная терапия с утратой электролитов [Stahlmann R., Lode Н. Fluoroquinolones in the elderly: safety considerations // Drugs. Aging. - 2003. - Vol.20, No 4 - P. 289-302].
У больных туберкулезом органов дыхания при наличии множественной или широкой лекарственной устойчивости возбудителя в схемы химиотерапии входят фторхинолоны (моксифлоксацин, левофлоксацин) в сочетании с резервными и новыми ПТП, среди которых - бедаквилин, обладающий кардиотоксическим потенциалом.
Увеличение интервала QT у пациентов, принимавших бедаквилин, обычно происходило в течение первых 8 недель [Fox G.J., Menzies D. A Review of the Evidence for Using Bedaquiline (TMC207) to Treat Multi-Drug Resistant Tuberculosis. // Infect Dis Ther (2013) 2:123-144]. Учитывая высокую частоту развития кардиальных проблем у больных туберкулезом (от 41 до 48%), актуальна профилактика кардиотоксичности с подбором эффективных препаратов и схем лечения на экспериментальных моделях.
Наиболее близким по совокупности существенных признаков к заявляемому изобретению является способ моделирования кардиотоксичности в эксперименте, описанный Мордык А.В. (Мордык А.В. Патогенез и обоснование способов коррекции кардиотоксического действия противотуберкулезных препаратов (клинико-экспериментальное исследование).-Автореф. дисс. … д.м.н. - 2008). Суть метода заключается в введении крысам-самцам линии Вистар массой 180-250 г 13 противотуберкулезных препаратов (ПТП) в терапевтических дозах по отдельности и в сочетаниях (3 комбинации) в течение 2 месяцев с оценкой биоэлектрической активности сердца, вариабельности сердечного ритма и центральной гемодинамики. В результате исследования установлено, что единичные экстрасистолы наблюдались в группах животных, получавших изониазид и протионамид. Достоверных различий по продолжительности интервала QT в сравниваемых группах зарегистрировано не было. Изменения в конечной части желудочкового комплекса (зубец Т) были выражены при приеме протионамида. Снижение ударного объема и ударного индекса сердца на фоне повышенного периферического сопротивления сосудов отмечено при приеме изониазида и протионамида. Наиболее выраженные проявления кардиотоксичности в виде появления единичных экстрасистол наблюдали только при использовании комбинации из основных ПТП (изониазид+рифампицин+пиразинамид+этамбутол).
Однако у данного способа моделирования кардиотоксичности имеются недостатки: длительный период моделирования (2 месяца); используемые препараты имели различный потенциал токсичности для сердца - из 13 исследованных препаратов наибольшей кардиотоксичностью обладали 2 - изониазид и протионамид. Из 3 использованных комбинаций ПТП (1 комбинация из основных ПТП, 2 - из резервных препаратов) выраженная кардиотоксичность наблюдалась на комбинации из основных ПТП.
Технической проблемой, на решение которой направлено заявляемое изобретение, является разработка способа моделирования токсического поражения сердца с преимущественным нарушением в проводящей системе, наиболее полно отражающий токсическую этиологию и патогенез развития приобретенного синдрома удлиненного интервала QT, в более короткие сроки (от 2-х недель) и минимальной смертностью животных.
Техническая проблема решается заявляемым способом путем введения экспериментальным животным комплекса противотуберкулезных препаратов моксифлоксацина, бедаквилина, линезолида, протионамида и капреомицина, при этом для моделирования в качестве экспериментальных животных использовали самки крыс в возрасте 10-12 мес.и массой 330-350 г.
Раскрытие изобретения
Техническим результатом заявляемого изобретения является создание модели, позволяющей получить у крыс нарушение функционального состояния сердца в виде синдрома удлиненного интервала QT, приближенную к клиническому течению данной патологии у больных туберкулезом органов дыхания, за короткий срок - 2 недели.
Технический результат достигается способом моделирования токсического поражения сердца, заключающийся в том, что токсическое поражение сердца у животных вызывают путем ежедневного по меньшей мере в течение 2 недель введения лабораторным животным комплекса противотуберкулезных препаратов моксифлоксацина, бедаквилина, линезолида, протионамида и капреомицина, при этом для моделирования использовали самки крыс в возрасте 10-12 мес.и массой 330-350 г, препараты моксифлоксацин, бедаквилин, линезолид, протионамид вводят внутрижелудочно в 0,1% крахмальном геле, а капреомицин вводят внутримышечно. Препараты вводят в следующих дозах моксифлоксацин - 36 мг/кг, бедаквилин - 36 мг/кг, линезолид - 54 мг/кг, протионамид - 90 мг/кг, капреомицин - 90 мг/кг и практически одновременно.
Противотуберкулезные препараты, которые использовались для создания модели обладают выраженным потенциалом кардиотоксичности с различным механизмом токсического действия. Кардиотоксичность проявляется следующим образом: уменьшение частоты сердечных сокращений с 354,7±8,4 до 320,6±15,3, появление единичных экстрасистол, нарушение сердечного ритма, связанного с электрической проводимостью - увеличение интервалов QT от 0,043±0,002 мсек до 0,056±0,002 (Р=0,03) и QRS от 0,022±0,001 до 0,028±0,003 мсек на фоне снижения содержания электролитов - калия до 2,83+0,11 при норме 4,37+0,26 и кальция до 1,19+0,01 при норме 1,27+0,02 ммоль/л.
Комплексная схема представляет собой сочетание препаратов с различными механизмами кардиотоксического действия, являющихся основой для схем лечения больных туберкулезом с широкой и множественной лекарственной устойчивостью возбудителя: моксифлоксацин+бедаквилин+линезолид+протионамид+капреомицин. Препараты вводятся одновременно: моксифлоксацин, бедаквилин, линезолид, протионамид в соответствующих дозах внутрижелудочно; капреомицин - внутримышечно. Дозы препаратов соответствуют терапевтическим дозам для человека. Использование половозрелых крыс самок в возрасте 10-12 месяцев и массой более 330 г повышает развитие кардиотоксичности, т.к. самки, более склонны к развитию сердечно-сосудистой патологии. Для экспериментов отбирались здоровые крысы, прошедшие период карантинного наблюдения в течение 2 недель, с небольшим, до 20 грамм, разбросом по массе тела. Перед введением комплекса препаратов крысам проводили функциональные исследования. На ЭКГ оценивали частоту сердечных сокращений (ЧСС), показатели временных интервалов сердечных сокращений (RR, PQ, QRS, QT).
Способ позволяет получить новую экспериментальную модель токсического поражения сердца с преимущественными нарушениями проводящей системы сердца, наиболее точно отражающую механизмы развития приобретенного синдрома удлиненного интервала QT, желудочковых аритмий и электролитного дисбаланса. Предложенная модель проста в исполнении, отличается хорошей воспроизводимостью, отсутствием выраженного летального исхода у экспериментальных животных и комплексностью воздействия на проводящую систему сердца.
Краткое описание чертежей
Изобретение поясняется следующими чертежами.
На фиг. 1 представлена кардиограмма крысы №3, 14 дней получения комплекса ПТП. На ЭКГ: Уменьшение частоты сердечных сокращений, увеличение интервалов QT и QRS по сравнению с контролем, экстрасистолы.
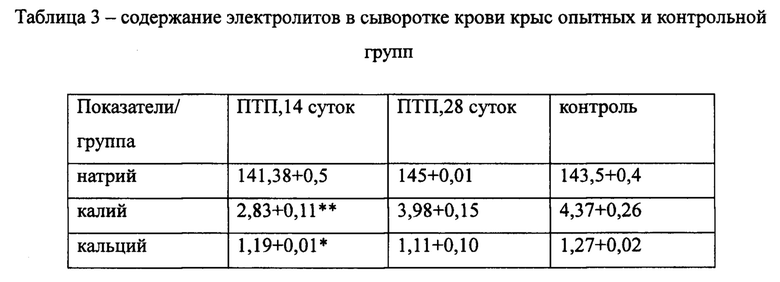
На фиг. 2 представлена кардиограмма крысы №7, 28 дней получения комплекса ПТП. На ЭКГ: Уменьшение частоты сердечных сокращений, увеличение интервалов QT и QRS по сравнению с контролем. Уплощение зубца Т.
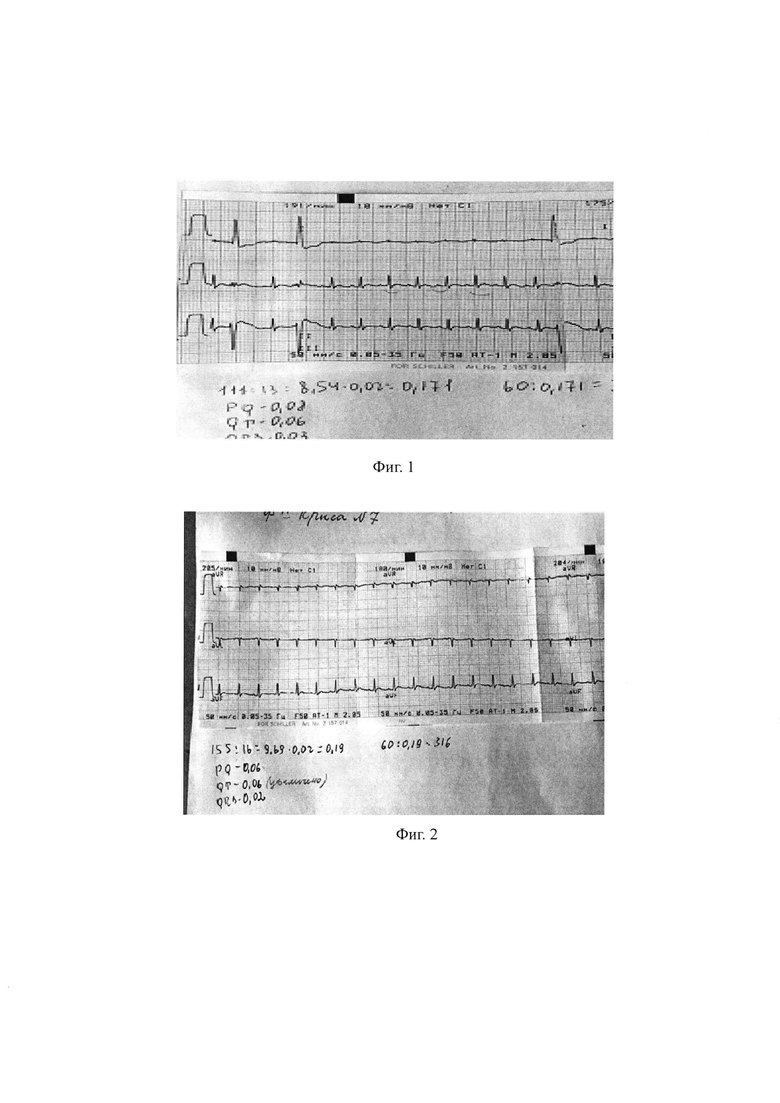
На фиг. 3 представлена кардиограмма интактной крысы (№6). ЭКГ норма.
Осуществление изобретения
Все используемые реагенты являются коммерчески доступными, все процедуры, если не оговорено особо, осуществляли при комнатной температуре или температуре окружающей среды, то есть в диапазоне от 18 до 25°С.
Возможность реализации заявляемого изобретения показана, но не ограничена, в примерах конкретного выполнения.
Использовали нелинейных самок крыс в возрасте 11 мес. массой 330-350 г, которым ежедневно в течение 2 недель вводили внутрижелудочно в 0,1% крахмальном геле комплекс ПТП в следующих дозах: моксифлоксацин (36 мг/кг)+бедаквилин (36 мг/кг)+линезолид (54 мг/кг)+протионамид (90 мг/кг). Препарат капреомицин в дозе 90 мг/кг вводили внутримышечно. Дозы препаратов соответствовали максимальным терапевтическим дозам для человека. Комплекс препаратов готовили ex tempore следующим образом: таблетку каждого препарата тщательно растирали в фарфоровых ступках и добавляли необходимый объем 0,1% крахмального геля с тем, чтобы нужное количество препарата содержалось в 0,5 мл крахмальной взвеси. Непосредственно перед введением все препараты набирали в один шприц и одномоментно в общем объеме 2 мл вводили в желудок крысе. Инъекцию капреомицина в объеме 0,5 мл в мышцу делали практически одновременно с внутрижелудочным введением таблетированных форм ПТП.
Для создания модели животные были распределены на 3 группы случайным образом. Первой группе животных (8 особей) комплекс ПТП вводили в течение 14 дней, второй группе животных (8 особей) комплекс ПТП вводили в течение 28 дней, затем выводили из эксперимента, предварительно проведя все необходимые тесты. Контрольной группе (10 особей) в течение 4 недель вводили ежедневно перорально 0,1% раствор крахмального клейстера в объеме 2,0 мл (соответствующем объему вводимого комплекса ПТП) и внутримышечно 0,9% раствор натрия хлорида в объеме 0,5 мл (соответствующем объему введения капреомицина), затем выводили из эксперимента, предварительно проведя все необходимые тесты.
Введение препаратов в течение более длительного срока (28 дней) нецелесообразно, т.к. появляется гибель животных.
Критериями оценки токсичности являлись: число павших животных и сроки их гибели, динамика массы тела, клиническая картина интоксикации, данные ЭКГ, исследования электролитов крови и патологические изменения в сердце, выявляемые при аутопсии павших и выживших животных, выведенных из эксперимента в конце опыта.
Результаты исследования.
В результате проведенных исследований установлено, что животные в течение первых 14 дней введения удовлетворительно переносили введение комплекса препаратов. Гибели животных в этот период отмечено не было. У крыс отмечали снижение аппетита, изменение цвета и консистенции фекалий, пилоэрекцию. При дальнейшем продолжении введений состояние животных ухудшалось. Отмечена гибель 1 крысы на 20 сутки введения комплекса препаратов.
Для определения динамики массы тела животных взвешивали дважды - в начале опыта и перед выведением из эксперимента. Измерение массы тела крыс проводили с помощью весов лабораторных AND EK-600i (наибольший предел взвешивания 600 г, дискретность отсчета 0,1 г), производитель "AND Company Limited", Япония. Установлено что примененный комплекс ПТП вызвал прогрессивное снижение массы тела животных в отличие от крыс контрольной группы, в которой наблюдался физиологический прирост массы тела (таблица 1).

Для определения показателей электрической активности сердца у крыс регистрировали показатели ЭКГ на электрокардиографе SHILLER АТ-1 (Швейцария) при скорости протяжки ленты 50 мм/сек в I, II и III стандартных отведениях и в усиленных однополюсных отведениях от конечностей в aVL aVR и aVF.
Оценивали частоту сердечных сокращений (ЧСС), показатели временных интервалов сердечных сокращений (RR, PQ, QRS, QT).
Выявлены изменения показателей временных интервалов сердечных сокращений у крыс опытных групп по сравнению с контрольной группой животных. Частота сердечных сокращений уменьшалось у крыс опытных групп после 14 и 28 введений комбинации препаратов по сравнению с контрольной группой животных (таблица 2).
Интервал PQ не изменялся у крыс опытных групп на всем протяжении опыта по сравнению с контрольной группой животных (таблица 3).
Интервал QT увеличился до 0,056±0,002 и до 0,067±0,003 сек у опытной группы крыс на 14 и 28 дни опыта (соответственно) по сравнению с контрольной группой животных (0,043±0,002 сек).
Интервал QRS увеличился после 14 введения до 0,028±0,003 сек по сравнению с контрольной группой животных (0,022±0,001 сек).
Выявлены качественные изменения: после 14 введения комплекса противотуберкулезных препаратов у одной из восьми крыс отмечено нарушение сердечного ритма, связанного с электрической проводимостью: выпадение третьего или пятого зубца R, при наличии зубца Р.
После 28 введения комплекса противотуберкулезных препаратов у одной из семи крыс выявлен высокий куполообразный зубец Т во И, III и aVF отведениях.
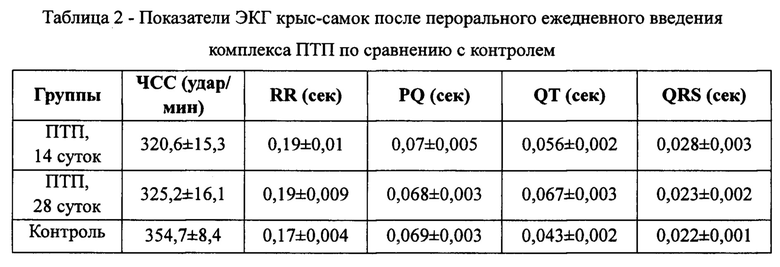
Изученная комбинация препаратов вызывает уменьшение частоты сердечных сокращений, появление высокого куполообразного зубца Т, нарушение сердечного ритма, связанного с электрической проводимостью, увеличение интервалов QT и QRS.
При макроскопическом исследовании выведенных из эксперимента животных через 14 и 28 суток существенных изменений размеров и массы сердца не обнаружено. При микроскопическом исследовании гистологических препаратов сердца крыс, получавших препараты 14 дней, морфологические изменения не выражены, соответствует контролю.
В сердце большинства крыс, получавших препараты 28 дней, морфологические изменения не обнаружены. У 1 крысы стенка сердца истончена, растянута, в миокарде левого желудочка обнаруживаются кардиомиоциты с признаками зернистой дистрофии.
Определение электролитов сыворотки крови крыс проводили на приборе GemPremier 3500 (USA). Результаты представлены в таблице 3.
Выводы: Использованный комплекс ПТП (моксифлоксацин (36 мг/кг)+бедаквилин (36 мг/кг)+линезолид (54 мг/кг)+протионамид (90 мг/кг) внутрижелудочно и капреомицин (90 мг/кг) внутримышечно) у крыс, старых самок, вызвал кардиотоксическое действие, которое проявлялось уменьшением частоты сердечных сокращений, появлением единичных экстрасистол и нарушением сердечного ритма, связанного с электрической проводимостью,- увеличение интервалов QT и QRS на фоне снижения содержания электролитов - калия и кальция по сравнению с контролем. Кардиотоксический эффект наблюдался уже через 14 дней введения комплекса ПТП.
Таким образом, проведенные исследования позволили получить новую экспериментальную модель токсического поражения сердца без органических поражений тканей сердца, в основе которой лежит комплексное сочетание кардиотоксичных потенциалов ряда противотуберкулезных препаратов и факторов (пол, возраст животных), инициирующих каскад функциональных нарушений, приводящих к развитию синдрома удлиненного интервала QT. Предложенная модель проста в исполнении, отличается хорошей воспроизводимостью, отсутствием летального исхода экспериментальных животных и коротким периодом развития патологического состояния.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОДЕЛИРОВАНИЯ СОЧЕТАННОГО МЕДИКАМЕНТОЗНОГО ПОРАЖЕНИЯ СЕРДЦА И ПОЧЕК У КРЫС | 2019 |
|
RU2726927C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ПРИОБРЕТЕННОГО СИНДРОМА УДЛИНЕННОГО ИНТЕРВАЛА QT С ПОМОЩЬЮ КОМПЛЕКСА ПРОТИВОТУБЕРКУЛЕЗНЫХ И АНТИМИКРОБНЫХ ПРЕПАРАТОВ | 2022 |
|
RU2794488C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ МЕДИКАМЕНТОЗНОЙ НЕЙРОТОКСИЧНОСТИ С ПОМОЩЬЮ КОМПЛЕКСА ПРОТИВОТУБЕРКУЛЕЗНЫХ И АНТИМИКРОБНЫХ ПРЕПАРАТОВ | 2022 |
|
RU2795524C1 |
| СПОСОБ СНИЖЕНИЯ НЕЙРОТОКСИЧНОСТИ, ВЫЗВАННОЙ КОМПЛЕКСОМ ПРОТИВОТУБЕРКУЛЕЗНЫХ ПРЕПАРАТОВ, В ЭКСПЕРИМЕНТЕ | 2023 |
|
RU2820957C1 |
| Способ дифференциальной диагностики аритмий у подростков, больных туберкулезом органов дыхания | 2023 |
|
RU2814004C1 |
| Способ мониторинга сывороточных концентраций Бедаквилина для оценки эффективности противотуберкулезной химиотерапии | 2024 |
|
RU2831888C1 |
| Способ выбора укороченных режимов химиотерапии при лечении туберкулеза легких | 2022 |
|
RU2805496C1 |
| Способ коррекции аритмии у детей старшего возраста, больных туберкулезом органов дыхания с множественной и широкой лекарственной устойчивостью МБТ, получающих бедаквилин в режимах химиотерапии | 2023 |
|
RU2826083C1 |
| ПРИМЕНЕНИЕ НАНОФОСФОЛИПИДНОЙ КОМПОЗИЦИИ РИФАМПИЦИНА СОВМЕСТНО С ПРОТИОНАМИДОМ ИЛИ ЕГО НАНОФОСФОЛИПИДНОЙ ФОРМОЙ В ЛЕЧЕНИИ ТУБЕРКУЛЕЗА | 2014 |
|
RU2595881C2 |
| Способ мониторинга кардиотоксического действия бедаквилина у детей старшего возраста и подростков больных туберкулезом органов дыхания | 2022 |
|
RU2783061C1 |
Изобретение относится к экспериментальной медицине и фармакологии и может быть использовано для изучения токсического действия на проводящую систему сердца в доклиническом исследовании новых кардиопротективных средств, изучения механизмов их действия и в разработке новых способов лечения. Способ моделирования токсического поражения сердца у крыс заключается в том, что токсическое поражение сердца у животных вызывают путем ежедневного по меньшей мере в течение 2 недель введения комплекса противотуберкулезных препаратов моксифлоксацина, бедаквилина, линезолида, протионамида и капреомицина, при этом для моделирования использовали самки крыс в возрасте 10-12 мес и массой 330-350 г. Изобретение обеспечивает хорошую воспроизводимость, отсутствие летального исхода экспериментальных животных и короткий период развития патологического состояния. 4 з.п. ф-лы, 3 ил., 3 табл.
1. Способ моделирования токсического поражения сердца у крыс, заключающийся в том, что токсическое поражение сердца у животных вызывают путем ежедневного по меньшей мере в течение 2 недель введения комплекса противотуберкулезных препаратов моксифлоксацина, бедаквилина, линезолида, протионамида и капреомицина, при этом для моделирования использовали самки крыс в возрасте 10-12 мес и массой 330-350 г.
2. Способ по п. 1, характеризующийся тем, что моксифлоксацин, бедаквилин, линезолид, протионамид вводят внутрижелудочно в 0,1% крахмальном геле.
3. Способ по п. 1, характеризующийся тем, что капреомицин вводят внутримышечно.
4. Способ по п. 1, характеризующийся тем, что препараты вводят в следующих дозах: моксифлоксацин - 36 мг/кг, бедаквилин - 36 мг/кг, линезолид - 54 мг/кг, протионамид - 90 мг/кг, капреомицин - 90 мг/кг.
5. Способ по п. 1, характеризующийся тем, что препараты вводят практически одновременно.
| А.В | |||
| МОРДЫК | |||
| Патогенез и обоснование способов коррекции кардиотоксического действия противотуберкулезных препаратов / Автореферат на соиск | |||
| уч | |||
| степ | |||
| д.м.н., Омск, 2008 | |||
| С.А | |||
| БОРТУЛЕВ и др | |||
| Морфологическая характеристика кардиомиопатии при остром тяжелом отравлении оксидом углерода / Вестник российской военно-медицинской академии, 2015, 4(52), |
Авторы
Даты
2020-07-16—Публикация
2019-12-18—Подача