Родственные заявки
Настоящей заявкой подтверждается полезность предварительной заявки на патент США, серийный номер No. 62/232,364, зарегистрированный 24 сентября 2015, полное содержание которой включено в настоящее описание полностью посредством ссылки.
Предпосылки создания изобретения
Гиалуронан, или гиалуроновая кислота (ГК (HA)) представляет собой линейный полисахарид с высокой средней молекулярной массой, который широко представлен в соединительной, эпителиальной и нервной тканях. ГК встречается в основном в экстрацеллюлярном матриксе и перицеллюлярном матриксе, но была также обнаружена и во внутриклеточном пространстве. Биологические функции ГК включают поддержание эластовязкости жидких соединительных тканей, таких как синовиальная жидкость в суставах и стекловидное тело глаза, контроль гидратации тканей и водный транспорт, надмолекулярная сборка протеогликанов в экстрацеллюлярном матриксе, и множество опосредованных участием рецепторов ролей в разъединении клеток, митозе, миграции клеток и развитии опухолей.
Некоторые уже известные к настоящему времени направления применения ГК включают лечение сухости глаза, в процедурах ухода за кожей в качестве кожных наполнителей, а также в методах лечения ран, для ускорения заживления. Зачастую, состояния сухости глаза, процедуры ухода за кожей/дерматологические процедуры и заживление ран ассоциированы с болью и дискомфортом, которые обычно требуют проведения отдельного введения средства с анальгетическим эффектом. Композиции ГК, используемые в настоящее время для лечения указанных выше состояний, неэффективны для целей лечения местной боли. Соответственно, в данной области имеется потребность в способах эффективного лечения состояний сухости глаз, для минимизации дефектов, вызываемых инъецируемыми материалами для выравнивания кожи, и для ускорения заживления ран, при сопутствующем ослаблении боли, ассоциированной с этими состояниями.
Краткое описание сущности изобретения
Авторы настоящего изобретения обнаружили, что композиции, включающие высокие концентрации ГК, например, композиции с концентрациями ГК примерно 30 мг/мл (примерно 3% вес/объем) или выше, могут эффективно применяться для ослабления боли и дискомфорта, связанных с состояниями сухости глаза, кожными процедурами и заживлением ран.
Не ограничивая себя рамками какой-то определенной теории, следует полагать, что эффективность композиций ГК по настоящему изобретению, включающих высокие концентрации ГК, применяемых для лечения боли и ослабления дискомфорта, определяется их высокой эластичностью, на что указывает высокое значение модуля упругости G'. Следует также полагать, и также не ограничивая себя рамками какой-то определенной теории, что эффективность композиций ГК по настоящему изобретению определяется относительно высокой вероятностью взаимодействия молекул ГК с каналами трансдукции боли, такими как TRPV1, снижая при этом возбудимость ноцицептора.
Соответственно, настоящее изобретение относится к способу ослабления боли и дискомфорта, связанных с состоянием сухости глаза у субъекта, при наличии такой потребности. Указанный способ включает введение в глаз указанного субъекта композиции, например, фармацевтической композиции, включающей гиалуроновую кислоту, где: указанная гиалуроновая кислота присутствует в композиции в концентрации выше чем примерно 30 мг/мл, например, около 35 мг/мл или более, примерно 40 мг/мл или более, примерно 45 мг/мл или более, примерно 50 мг/мл или более, примерно 55 мг/мл или более, примерно 60 мг/мл или более, примерно 65 мг/мл или более, примерно 70 мг/мл или более, примерно 75 мг/мл или более, примерно 80 мг/мл или более, примерно 85 мг/мл или более, примерно 90 мг/мл или более, примерно 95 мг/мл или более или примерно 100 мг/мл или более; где указанная гиалуроновая кислота имеет среднюю молекулярную массу от примерно 1 до примерно 2 миллионов; при этом гиалуроновая кислота не является поперечно-сшитой (не содержит поперечные межмолекулярные связи) и/или по существу не является химически модифицированной, что приводит к ослаблению боли и дискомфорта у субъекта.
В другом аспекте, указанная гиалуроновая кислота присутствует в композиции в концентрации от примерно 40 мг/мл до примерно 60 мг/мл.
Настоящее изобретения, в некоторых вариантах своего осуществления, также относится к способу ослабления боли и дискомфорта, связанных с состоянием сухости глаза у пациента, имеющего такую потребность, где указанный способ включает введение в глаз указанного субъекта композиции, например, фармацевтической композиции, включающей гиалуроновую кислоту, где: указанная гиалуроновая кислота присутствует в композиции в концентрации, равной по меньшей мере примерно 40 мг/мл; указанная гиалуроновая кислота имеет среднюю молекулярную массу от примерно 1 до примерно 2 миллионов; при этом гиалуроновая кислота не является поперечно-сшитой ( не содержит поперечные межмолекулярные связи) и/или по существу не является химически модифированной, что приводит к ослаблению боли и дискомфорта у субъекта.
В некоторых вариантах осуществления настоящего изобретения, рассматриваемая в нем композиция по существу не содержит другие фармацевтически активные вещества.
В некоторых аспектах, настоящая композиция не включает полигликоль.
В некоторых вариантах осуществления настоящего изобретения, указанная композиция включает также буфер, например, фосфатно-солевой буферный раствор (ФБР).
В некоторых вариантах осуществления настоящего изобретения, указанная композиция обладает эластичностью на уровне по меньшей мере примерно 200 Паскаль, по данным измерения при частоте 0,5 Гц; по меньшей мере примерно 1000 Паскаль, по данным измерения при частоте 0,5 Гц; по меньшей мере примерно 2000 Паскаль, по данным измерения при частоте 0,5 Гц; или по меньшей мере примерно 4000 Паскаль, по данным измерения при частоте 0,5 Гц.
В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет вид геля, мази, линимента, лосьона или крема.
В некоторых аспектах, указанную композицию вводят на поверхность глаза, в частности, под глазное веко, например, под верхнее или нижнее глазное веко субъекта или в пространство между роговицей и глазным веком.
В некоторых аспектах, указанную композицию вводят субъекту непосредственно перед отдыхом или перед сном.
В некоторых аспектах, указанную композицию вводят без инъекции в глаз субъекта.
В некоторых аспектах, указанную композицию вводят с использованием контейнера, например, однодозового контейнера, такого как флакон, тюбик, вакуумный тюбик, глазная ванночка, капельница или картридж из мягкого пластика.
В некоторых вариантах осуществления настоящего изобретения, указанное состояние сухости глаза связано с одним или несколькими симптомами, выбранными из группы, состоящей из сухости глаза; а также таких симптомов, как сниженная выработка слезной жидкости, ее объем и отделение; аномальный состав слезной жидкости; повышенная осмолярность слезной жидкости; кератит; точечное окрашивание конъюнктивы и роговицы; покраснение; пелена перед глазами; сниженное время разрыва слезной пленки; повышенная краснота конъюнктивы; избыточный налет в слезной пленке, ощущение песка в глазах; чувство жжения в глазах; ощущение постороннего предмета в глазах; избыточное слезоотделение; фотофобия; острая боль в глазах; нарушение рефракции; болезненная чувствительность и раздражение слизистой оболочки глаз. В других вариантах осуществления настоящего изобретения, указанное состояние сухости глаза савязано с состоянием, выбранным из группы, состоящей из аутоиммунного расстройства; хирургическим вмешательством в глаза; приема лекарственного препарата; а также состояний, определяемых сухостью окружающей среды; длительной работой с компьютером; усталостью глаз; длительным ношением контактных линз, чувствительностью роговицы; частичным закрытием века; неровностью поверхности; неровностью глазного века; а также состояния, ассоциированного с ноцицептивной болью в области роговицы, вызванной повреждением роговицы, или состояния, ассоциированного с нейропатической болью. В другом варианте осуществления настоящего изобретения, указанное состояние сухости глаза ассоциировано с глазной хирургией, и указанная глазная хирургия выбрана из группы, состоящей из фоторефракционной хирургии, такой как фоторефракционная кератэктомия (PRK), хирургия катаракты, хирургия отслойки сетчатки, лазерный специализированный кератомилез (ЛАСИК (LASIK)) и любое хирургическое лечение в области роговицы, связанное с повреждением сенсорных нервов роговицы. В другом варианте осуществления настоящего изобретения, указанное состояние сухости глаза ассоциировано с состоянием, связанным с нейропатической болью, например, при катаракте или отслойке сетчатки, при хирургическом вмешательстве, направленном на лечение катаракты или отслойки сетчатки.
В некоторых аспектах, указанную композицию вводят ежедневно, в течение 3 дней, 4 дней, 5 дней, 6 дней, 1 недели, 2 недель, 4 недель или 10 недель. В других аспектах, указанное ослабление боли и дискомфорта достигается у субъекта в течение, например, 8 часов, 12 часов, 24 часов, 1 дня, 3 дней, 5 дней, 7 дней, 14 дней или 28 дней.
В некоторых вариантах осуществления настоящего изобретения, указанный субъект представляет собой млекопитающее, например, человека.
В еще одном аспекте, настоящее изобретение также относится к способу ослабления боли и дискомфорта, при минимизации, по меньшей мере одного, дефекта, наблюдаемого у субъекта, при наличии такой потребности. Указанный способ включает введение субъекту композиции, включающей гиалуроновую кислоту, где: указанная гиалуроновая кислота присутствует в композиции в концентрации выше чем примерно 30 мг/мл; указанная гиалуроновая кислота имеет молекулярную массу от примерно 1 до примерно 2 миллионов; указанная гиалуроновая кислота не содержит поперечные межмолекулярные связи и/или по существу не содержит химические модификации, и где указанная композиция по существу не содержит других фармацевтически активных веществ, что приводит к ослаблению боли и минимизации по меньшей мере одного дефекта кожи.
В некоторых вариантах осуществления настоящего изобретения, указанная гиалуроновая кислота содержится в концентрации от примерно 40 мг/мл до примерно 60 мг/мл.
В другом аспекте, настоящее изобретение также относится к способу ослабления боли и дискомфорта, при минимизации, по меньшей мере одного, дефекта, наблюдаемого у субъекта, при наличии такой потребности. Указанный способ включает введение субъекту композиции, включающей гиалуроновую кислоту, где: указанная гиалуроновая кислота присутствует в композиции в концентрации, равной по меньшей мере примерно 40 мг/мл; указанная гиалуроновая кислота имеет молекулярную массу от примерно 1 до примерно 2 миллионов; указанная гиалуроновая кислота не содержит поперечные межмолекулярные связи и/или по существу не содержит химические модификации, и где указанная композиция по существу не содержит других фармацевтически активных веществ, что приводит к ослаблению боли и минимизации по меньшей мере одного дефекта кожи.
В некоторых вариантах осуществления настоящего изобретения, указанное другое фармацевтически активное вещество представляет собой местный анестетик, например, лидокаин или бипувакаин.
В некоторых аспектах, указанная композиция также включает буфер, например, фосфатно-солевой буферный раствор (ФБР (PBS)).
В некоторых вариантах осуществления настоящего изобретения, указанная композиция обладает эластичностью на уровне по меньшей мере примерно 200 Паскаль, по данным измерения при частоте 0,5 Гц; по меньшей мере примерно 1000 Паскаль, по данным измерения при частоте 0,5 Гц; по меньшей мере примерно 2000 Паскаль, по данным измерения при частоте 0,5 Гц; или по меньшей мере примерно 4000 Паскаль, по данным измерения при частоте 0,5 Гц.
В некоторых вариантах осуществления настоящего изобретения, указанная композиция является стерильной.
В некоторых вариантах осуществления настоящего изобретения, указанную композицию вводят путем инъекции в кожу субъекта. В другом варианте осуществления настоящего изобретения, указанную композицию инъецируют в область лица субъекта. Например, указанную композицию инъецируют в область, выбранную из группы, состоящей из носо-губной области, области верхнего века, лба, зоны глаз и зоны щек.
В некоторых вариантах осуществления настоящего изобретения, указанную композицию вводят путем инъекции с использованием шприца-тюбика, такого как, например, шприц-тюбик на 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 мл. В другом аспекте, указанный шприц-тюбик стерилизуют.
В другом аспекте, настоящее изобретение также относится к способу ослабления боли и дискомфорта, за счет облегчения заживления у субъекта, при наличии такой потребности. Указанный способ включает введение субъекту композиции, включающей гиалуроновую кислоту, где: где указанная гиалуроновая кислота присутствует в композиции в концентрации выше чем примерно 30 мг/мл; указанная гиалуроновая кислота имеет молекулярную массу от примерно 1 до примерно 2 миллионов; указанная гиалуроновая кислота не содержит поперечные межмолекулярные связи и/или по существу не содержит химические модификации, что приводит к ослаблению боли и облегчению заживления ран.
В некоторых вариантах осуществления настоящего изобретения, указанная гиалуроновая кислота содержится в концентрации от примерно 40 мг/мл до примерно 60 мг/мл.
В другом аспекте, настоящее изобретение также относится к способу ослабления боли и дискомфорта, за счет облегчения заживления ран у субъекта, при наличии такой потребности. Указанный способ включает введение субъекту композиции, включающей гиалуроновую кислоту, где: указанная гиалуроновая кислота присутствует в композиции в концентрации, равной по меньшей мере примерно 40 мг/мл; указанная гиалуроновая кислота имеет молекулярную массу от примерно 1 до примерно 2 миллионов; указанная гиалуроновая кислота не содержит поперечные межмолекулярные связи и/или по существу не содержит химические модификации, что приводит к ослаблению боли и облегчению заживления ран.
В некоторых вариантах осуществления настоящего изобретения, указанная композиция по существу не содержит другое фармацевтически активные вещества, такие как местные анестетики, например, лидокаин или бипувакаин.
В некоторых аспектах, указанная композиция также включает буфер, например, фосфатно-солевой буферный раствор (ФБР (PBS)).
В некоторых вариантах осуществления настоящего изобретения, указанная композиция обладает эластичностью на уровне по меньшей мере примерно 200 Паскаль, по данным измерения при частоте 0,5 Гц; по меньшей мере примерно 1000 Паскаль, по данным измерения при частоте 0,5 Гц; по меньшей мере примерно 2000 Паскаль, по данным измерения при частоте 0,5 Гц; или по меньшей мере примерно 4000 Паскаль, по данным измерения при частоте 0,5 Гц.
В некоторых вариантах осуществления настоящего изобретения, указанная композиция является стерильной.
В некоторых вариантах осуществления настоящего изобретения, указанную композицию вводят местно, например, например, на поверхность раны или шрама на коже.
Краткое описание чертежей
Фиг. 1 представляет собой график, показывающий давление, необходимое для того, чтобы выдавить 4% раствор ГК через иглы разного размера.
Подробное описание изобретения
Настоящее изобретение относится к способам облегчения боли, ассоциированной с состоянием сухости глаз; в процедурах ухода за кожей/дерматологического лечения и при заживлении. Способы по настоящему изобретению включают введение композиций ГК, содержащие высокие концентрации гиалуроновой кислоты (ГК (HA)), например, выше чем примерно 30 мг/мл или более. Было показано, что такие композиции обладают высокоэластичными свойствами, т.е., имеют высокий модуль упругости G', при измерении его в диапазоне частот 0,1-10 Гц. Композиции ГК, обладающие высокоэластичными свойствами, такие как, например, композиции, включающие высокие концентрации ГК, демонстрируют неожиданную эффективность в направлении ослабления боли и дискомфорта, вызванного состоянием сухости глаза; косметическим лечением; или заживлением раны. Не ограничивая себя рамками какой-то определенной теории, следует полагать, что эффективность композиций ГК по настоящему изобретению, включающих высокие концентрации ГК, применяемые для лечения боли и ослабления дискомфорта, определяется их высокой эластичностью, на что указывает высокое значение модуля упругости G'. Следует также полагать, и также не ограничивая себя рамками какой-то определенной теории, что эффективность композиций ГК по настоящему изобретению определяется относительно высокой вероятностью взаимодействия молекул ГК с каналами трансдукции боли, такими как TRPV1, снижая при этом возбудимость ноцицептора. Средняя молекулярная масса ГК, используемых в способах по настоящему изобретению, составляет 2 миллиона или менее, например, в диапазоне значений примерно 1-2 миллиона.
I. Композиции ГК, применяемые в способах по настоящему изобретению
Настоящее изобретение относится к способам, которые включают введение субъекту, при наличии соответствующей потребности, композиций, содержащих гиалуроновую кислоту (ГК (HA)). В некоторых вариантах осуществления настоящего изобретения, указанная композиция включает гиалуроновую кислоту, где указанная гиалуроновая кислота присутствует в композиции в концентрации выше, чем примерно 30 мг/мл (или выше, чем примерно 3% вес/объем); указанная гиалуроновая кислота имеет молекулярную массу от примерно 1 до примерно 2 миллионов; указанная гиалуроновая кислота не содержит поперечные межмолекулярные связи и/или по существу не содержит химические модификации.
Так, например, концентрация гиалуроновой кислоты в композиции может составлять примерно 30 мг/мл (или примерно 3% вес/объем), примерно 35 мг/мл (или примерно 3,5% вес/объем), примерно 40 мг/мл (или примерно 4% вес/объем), примерно 45 мг/мл (или примерно 4,5% вес/объем), примерно 50 мг/мл (или примерно 5% вес/объем), примерно 55 мг/мл (или примерно 5,5% вес/объем), примерно 60 мг/мл (или примерно 6% вес/объем), примерно 65 мг/мл (или примерно 6,5% вес/объем), примерно 70 мг/мл (или примерно 7% вес/объем), примерно 75 мг/мл (или примерно 7,5% вес/объем), примерно 80 мг/мл (или примерно 8% вес/объем), примерно 85 мг/мл (или примерно 8,5% вес/объем), примерно 90 мг/мл (или примерно 9% вес/объем), примерно 95 мг/мл (или примерно 9,5% вес/объем), примерно 100 мг/мл (или примерно 10% вес/объем), примерно 105 мг/мл (или примерно 10,5% вес/объем), примерно 110 мг/мл (или примерно 11% вес/объем) примерно 115 мг/мл (или примерно 11,5% вес/объем), примерно 120 мг/мл (или примерно 12% вес/объем), примерно 125 мг/мл (или примерно 12,5% вес/объем), примерно 130 мг/мл (или примерно 13% вес/объем), примерно 135 мг/мл (или примерно 13,5% вес/объем), примерно 140 мг/мл (или примерно 14% вес/объем), примерно 145 мг/мл (или примерно 14,5% вес/объем), или примерно 150 мг/мл (или примерно 15% вес/объем). В конкретном варианте осуществления настоящего изобретения, указанная ГК присутствует в композиции в концентрации примерно 40 мг/мл (или примерно 4% вес/объем). В других конкретных вариантах осуществления настоящего изобретения, указанная ГК присутствует в композиции в концентрации примерно 41 мг/мл (или примерно 4,1% вес/объем), примерно 42 мг/мл (или примерно 4.2% вес/объем), примерно 43 мг/мл (или примерно 4,3% вес/объем), примерно 44 мг/мл (или примерно 4,4% вес/объем), примерно 45 мг/мл (или примерно 4,5% вес/объем), примерно 46 мг/мл (или примерно 4,6% вес/объем), примерно 47 мг/мл (или примерно 4,7% вес/объем), примерно 48 мг/мл (или примерно 4,8% вес/объем), примерно 49 мг/мл (или примерно 4,9% вес/объем), примерно 50 мг/мл (или примерно 5,0% вес/объем), примерно 51 мг/мл (или примерно 5,1% вес/объем), примерно 52 мг/мл (или примерно 5,2% вес/объем), примерно 53 мг/мл (или примерно 5,3% вес/объем), примерно 54 мг/мл (или примерно 5,4% вес/объем), примерно 55 мг/мл (или примерно 5,5% вес/объем), примерно 56 мг/мл (или примерно 5,6% вес/объем), примерно 57 мг/мл (или примерно 5,7% вес/объем), примерно 58 мг/мл (или примерно 5,8% вес/объем), 59 мг/мл (или примерно 5,9% вес/объем) или примерно 60 мг/мл (или примерно 6% вес/объем).
В некоторых примерах, концентрация гиалуроновой кислоты в композиции может быть выше, чем примерно 30 мг/мл (или примерно 3% вес/объем), например, выше, чем примерно 31 мг/мл (или примерно 3,1%), выше, чем примерно 32 мг/мл (или примерно 3,2%), выше, чем примерно 33 мг/мл (или примерно 3,3%), выше, чем примерно 34 мг/мл (или примерно 3,4%), выше, чем примерно 35 мг/мл (или примерно 3,5%), выше, чем примерно 36 мг/мл (или примерно 3,6%), выше, чем примерно 37 мг/мл (или примерно 3,7%), выше, чем примерно 38 мг/мл (или примерно 3,8%) или выше, чем примерно 39 мг/мл (или примерно 3,9%).
В некоторых примерах, содержащаяся в композиции гиалуроновая кислота может иметь среднюю молекулярную массу от примерно 1 до примерно 2 миллионов; например, от примерно 1,1 до примерно 2 миллионов, от примерно 1,2 до примерно 2 миллионов, от примерно 1,3 до примерно 2 миллионов, от примерно 1,4 до примерно 2 миллионов, от примерно 1,5 до примерно 2 миллионов или от примерно 1,6 до примерно 2 миллионов.
В некоторых вариантах осуществления настоящего изобретения, указанная гиалуроновая кислота не содержит межмолекулярные связи и/или другие химические модификации. Например, гиалуроновая кислота, используемая в композициях по настоящему изобретению, не включает продукты амидирования, которые могли образоваться в результате реакции между карбоксильной группой ГК и аминной группой дериватизирующего средства, как описано, например, в Европейском патенте EP Patent No. 1095064 B1. Гиалуроновая кислота, используемая в композициях по настоящему изобретению, также может не включать химические модификации и межмолекулярные связи, которые могли образоваться в результате реакции гиалуроновой кислоты с карбодиимидом, такие как монокарбодиимид или бискарбодиимид, как описано, например, в патенте США U.S. Patent No. 8323617. В некоторых случаях, используемая в композициях по настоящему изобретению, также может не включать акрилаты, например, метакрилат, как описано в публикации США (U.S. Publication No. 2010/0048755); сульфаты, как описано, например, в публикации США (in U.S. Publication No. 2013/0209531); и дейтерий, как описано, например, в публикации США (U.S. Publication No. 2015/0148310).
В некоторых вариантах осуществления настоящего изобретения, рассматриваемые в нем композиции не содержат другие фармацевтически активные вещества. В контексте настоящего описания, термин ʺфармацевтически активное веществоʺ обозначает вещество, которое способно оказывать биологический эффект на субъекта, например, на человека или на животное. Термин ʺфармацевтически активное веществоʺ также включает вещества, которые могут модулировать биологический эффект композиции ГК, когда указанную композицию вводят субъекту, например, для ослабления боли и дискомфорта, ассоциированных с состоянием сухости глаза; процедурами ухода за кожей/дерматологическим лечением или заживлением ран. В некоторых вариантах осуществления настоящего изобретения, указанное фармацевтически активное вещество представляет собой белок, например, костный морфогенетический белок (BMP), такой как rhGDF-5. В некоторых вариантах осуществления настоящего изобретения, указанное фармацевтически активное вещество представляет собой гликозаминогликан (ГАГ (GAG)), отличный от ГК, например, хондроитин. В некоторых вариантах осуществления настоящего изобретения, указанное фармацевтически активное вещество представляет собой гидроксипропилметилцеллюлозу. В других вариантах осуществления настоящего изобретения, указанное фармацевтически активное вещество представляет собой местный анестетик, такой как лидокаин или бупивакаин. В некоторых случаях, указанное фармацевтически активное вещество представляет собой агонист пуринергического рецептора, например, агонист P2Y2 рецептора.
В некоторых вариантах осуществления настоящего изобретения, рассматриваемые в нем композиции ГК не содержат молекулы, способные раскислять свободные радикалы, такие как полиол, например, сорбит, мальтит, ксилит или изомальтоза. В других вариантах, композиции ГК, используемые в способах по настоящему изобретению, не содержат молекулы, которые снижают эластичность ГК, например, декстран или сахарозу.
В некоторых случаях, композиции ГК, используемые в способах по настоящему изобретению, не содержат полигликоль, например, полиэтиленгликоль.
Композиция ГК может по существу состоять из ГК, присутствующей в концентрации выше, чем примерно 30 мг/мл (примерно 3% вес/объем), или примерно 40 мг/мл (примерно 4% вес/объем) в физиологическом буфере, например, в фосфатном буфере или бикарбонатном буфере, и иметь среднюю молекулярную массу от примерно 1 миллиона до примерно 2 миллионов. Например, композиция ГК, используемая в способах по настоящему изобретению, состоит по существу из ГК, присутствующей в концентрации примерно 40 мг/мл (или примерно 4% вес/объем) и имеющей среднюю молекулярную массу от примерно 1 миллиона до примерно 2 миллионов.
Гиалуроновая кислота в композициях, используемых в способах по настоящему изобретению, обладает эластичностью на уровне по меньшей мере примерно 100 Паскаль, по данным измерения при частоте 0,5 Гц; или эластичностью по меньшей мере 400 Паскаль, по данным измерения при частоте 0,5 Гц; или эластичностью по меньшей мере примерно 1000 Паскаль, по данным измерения при частоте 0,5 Гц; по меньшей мере примерно 2000 Паскаль, по данным измерения при частоте 0,5 Гц; или по меньшей мере примерно 4000 Паскаль, по данным измерения при частоте 0,5 Гц, или эластичностью от 400 до 5000 по данным измерения при частоте 0,5 Гц.
Следует понимать, что имеется множество способов, подходящих для определения эластичности биополимера, такого как гиалуроновая кислота. В одном варианте осуществления настоящего изобретения, эластичность композиций, включающих гиалуроновую кислоту, измеряют под давлением (которое выражают в Паскалях), при определенной частоте его воздействия (которую выражают в Герц). Например, частоты, которые могут использоваться для оценки эластичности композиций, включающих гиалуроновую кислоту, по настоящему изобретению, могут составлять 0,5 Hz, 2,5 Hz или 5,0 Hz.
Следует также понимать, что указанная эластичность может быть выражена в виде значения, полученного при любой релевантной частоте. Так, например, в одном варианте осуществления настоящего изобретения, указанную эластичность выражают применительно к частоте 2,5 Гц, и композиция, включающая гиалуроновую кислоту с высокоэластичными свойствами, представляет собой композицию с эластичностью, равной по меньшей мере примерно 200 Паскаль, по данным измерения при частоте 2,5 Гц. Аналогично, в одном варианте осуществления настоящего изобретения, указанную эластичность выражают применительно к частоте 5,0 Гц, и композиция, включающая гиалуроновую кислоту с высокоэластичными свойствами, представляет собой композицию с эластичностью, равной по меньшей мере примерно 400 Паскаль, по данным измерения при частоте 5,0 Гц.
В одном варианте осуществления настоящего изобретения, композиция, включающая гиалуроновую кислоту, для применения в способах по настоящему изобретению, имеет эластичность, равную по меньшей мере примерно 100 Паскаль, по данным измерения при частоте 0,5 Гц. В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность, равную по меньшей мере примерно 300 Паскаль, по данным измерения при частоте 2,5 Гц. В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность, равную по меньшей мере примерно 350 Паскаль, по данным измерения при частоте 5,0 Гц.
В других вариантах осуществления настоящего изобретения, композиция, включающая гиалуроновую кислоту, имеет эластичность, равную по меньшей мере примерно 400 Паскаль, по данным измерения при частоте 0,5 Гц. В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность, равную по меньшей мере примерно 750 Паскаль, по данным измерения при частоте 2,5 Гц. В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность, равную по меньшей мере примерно 900 Паскаль, по данным измерения при частоте 5,0 Гц.
В другом варианте осуществления настоящего изобретения, композиция, включающая гиалуроновую кислоту, имеет эластичность, равную по меньшей мере примерно 1000 Паскаль, по данным измерения при частоте 0,5 Гц. В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность, равную по меньшей мере примерно 1600 Паскаль, по данным измерения при частоте 2,5 Гц. В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность, равную по меньшей мере примерно 2000 Паскаль, по данным измерения при частоте 5,0 Гц.
В еще одном варианте осуществления настоящего изобретения, композиция, включающая гиалуроновую кислоту, имеет эластичность, равную по меньшей мере примерно 2600 Паскаль, по данным измерения при частоте 0,5 Гц. В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность, равную по меньшей мере примерно 4000 Паскаль, по данным измерения при частоте 2,5 Гц.
В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность, равную по меньшей мере примерно 4500 Паскаль, по данным измерения при частоте 5,0 Гц.
В еще одном варианте осуществления настоящего изобретения, композиция, включающая гиалуроновую кислоту, имеет эластичность, равную по меньшей мере примерно 4000 Паскаль, по данным измерения при частоте 0,5 Гц. В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность, равную по меньшей мере примерно 5000 Паскаль, по данным измерения при частоте 2,5 Гц. В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность, равную по меньшей мере примерно 6000 Паскаль, по данным измерения при частоте 5,0 Гц.
В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность от 100 до 10000 Паскаль, по данным измерения при частоте 0,5 Гц. В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность от 400 до 5000 Паскаль, по данным измерения при частоте 0,5 Гц. В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность от 1000 до 2000 Паскаль, по данным измерения при частоте 0,5 Гц.
В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность от 300 до 10000 Паскаль, по данным измерения при частоте 2,5 Гц. В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность от 750 до 6000 Паскаль, по данным измерения при частоте 2,5 Гц. В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность от 1500 до 4000 Паскаль, по данным измерения при частоте 2,5 Гц.
В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность от 300 до 10000 Паскаль, по данным измерения при частоте 5,0 Гц. В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность от 900 до 7000 Паскаль, по данным измерения при частоте 5,0 Гц. В некоторых вариантах осуществления настоящего изобретения, указанная композиция имеет эластичность от 2000 до 5000 Паскаль, по данным измерения при частоте 5,0 Гц.
В некоторых вариантах осуществления настоящего изобретения, указанную эластичность измеряют с использованием подходящего устройства (например, реометра). Например, эластичность может быть измерена с использованием реометра Stresstech High Resolution Research Rheometer (Reologica Instruments AB). Обычно, эластичность измеряют в условиях, включающих имеющиеся в окружающей среде показатели температуры и/или давления; однако, следует понимать, что эластичность может быть измерена при значениях температуры и/или давления, отличных от соответствующих значений в условиях окружающей среды. Следует также учитывать тот факт, что любой специалист со средним уровнем знаний в данной области знает, как преобразовать показатель эластичности, полученный при различных значениях температуры и давления, в показатель эластичности, соответствующий значениям температуры и давления в условиях окружающей среды.
Композиции гиалуроновой кислоты с высокоэластичными свойствами могут быть изготовлены путем повышения концентрации гиалуроновой кислоты в композиции. Таким образом, в одном аспекте, способы по настоящему изобретению включают использование композиций с высокоэластичными свойствами, которые содержат высокие концентрации гиалуроновой кислоты. Например, указанные композиции могут включать по меньшей мере 3,0% гиалуроновой кислоты (объемная масса), по меньшей мере 3,5% гиалуроновой кислоты (объемная масса), по меньшей мере 4,0% гиалуроновой кислоты (объемная масса), по меньшей мере 4,5% гиалуроновой кислоты (объемная масса), по меньшей мере 5,0% гиалуроновой кислоты (объемная масса), по меньшей мере 5,5% гиалуроновой кислоты (объемная масса), по меньшей мере 6,0% гиалуроновой кислоты (объемная масса), по меньшей мере 6,5% гиалуроновой кислоты (объемная масса), по меньшей мере 7,0% гиалуроновой кислоты (объемная масса), по меньшей мере 7,5% гиалуроновой кислоты (объемная масса), по меньшей мере 8,0% гиалуроновой кислоты (объемная масса), по меньшей мере 8,5% гиалуроновой кислоты (объемная масса), по меньшей мере 8,9% гиалуроновой кислоты (объемная масса), по меньшей мере 9,0% гиалуроновой кислоты (объемная масса), по меньшей мере 10,0% гиалуроновой кислоты (объемная масса), по меньшей мере 11,0% гиалуроновой кислоты (объемная масса), по меньшей мере 12,0% гиалуроновой кислоты (объемная масса), по меньшей мере 13,0% гиалуроновой кислоты(объемная масса), по меньшей мере 14,0% гиалуроновой кислоты (объемная масса), или по меньшей мере 15,0% или более гиалуроновой кислоты (объемная масса).
Промежуточные значения для указанных выше величин также включаются в композиции, предназначенные для использования в способах по настоящему изобретению. Так, например, содержание гиалуроновой кислоты в указанных композициях может составлять от примерно 3% до примерно 15% (вес/объем), от примерно 3% до примерно 10% (вес/объем), от примерно 3,5% до примерно 9% (вес/объем), от примерно 4% до примерно 8% (вес/объем) или от примерно 5% до примерно 7% (вес/объем).
Следует также иметь в виду, что количество гиалуроновой кислоты в определенном объеме может также выражаться альтернативными способами (например, в грамм/литр или моль/литр). При этом, специалист со средним уровнем знаний в данной области знает, как преобразовать различные варианты выражения количества гиалуроновой кислоты в определенном объеме.
Композиции гиалуроновой кислоты с высокой концентрацией гиалуроновой кислоты, особенно со средним значением молекулярной массы, равным примерно 1-2 миллионов, отличаются особой эффективностью при лечении боли, например, боли, ассоциированной с состоянием сухости глаза, с косметологическими процедурами или заживлением ран. Таким образом, гиалуроновая кислота, включенная в композиции ГК по настоящему изобретению, может иметь среднюю молекулярную массу, величина которой укладывается в диапазон значений от 1 до 2 миллионов и может быть также меньше, чем 2 миллиона, а также меньше, чем 1,9 миллионов, меньше, чем 1,8 миллионов, меньше, чем 1,7 миллионов, меньше, чем 1,6 миллионов, меньше, чем 1,5 миллионов, меньше, чем 1,4 миллионов, меньше, чем 1,3 миллионов, меньше, чем 1,2 миллионов, меньше, чем 1,1 миллионов, меньше, чем 1 миллион, меньше, чем 0,9 миллионов, меньше, чем 0,8 миллионов, меньше, чем 0,7 миллионов, меньше, чем 0,6 миллионов, или меньше, чем 0,5 миллионов. В других случаях, гиалуроновая кислота, включенная в композиции ГК по настоящему изобретению, может иметь среднюю молекулярную массу, величина которой укладывается в диапазон значений от 1 до 2 миллионов и может быть также выше, чем 0,1 миллиона, выше, чем 0,2 миллиона, выше, чем 0,3 миллиона, выше, чем 0,4 миллиона, выше, чем 0,5 миллиона, выше, чем 0,6 миллиона, выше, чем 0,7 миллиона, выше, чем 0,8 миллиона, выше, чем 0,9 миллиона, выше, чем 1 миллион, выше, чем 1,1 миллиона, выше, чем 1,2 миллиона, выше, чем 1,3 миллиона, выше, чем 1,4 миллиона, выше, чем 1,5 миллионов, выше, чем 1,6 миллиона, выше, чем 1,7 миллиона, выше, чем 1,8 миллиона, или выше, чем 1,9 миллиона.
Промежуточные значения для указанных выше величин также входят в область настоящего изобретения. Так, например, в композициях гиалуроновой кислоты по настоящему изобретению, средняя молекулярная масса гиалуроновой кислоты составляет от 1 до 2 миллионов, от 1 до 1,5 миллионов, от 0,5 до 1 миллиона, от 0,5 до 2 миллионов или от 0,9 до 1,4 миллионов.
В некоторых вариантах композиций гиалуроновой кислоты по настоящему изобретению, большая часть гиалуроновой кислоты, содержащейся в композиции, укладывается в указанный выше диапазон значений средней молекулярной массы. Так, например, в композициях со средней молекулярной массой гиалуроновой кислоты от 0,2 до 2 миллионов, по меньшей мере 95% гиалуроновой кислоты, содержащейся в композиции, укладывается в диапазон значений от 0,2 до 2 миллионов. В некоторых вариантах осуществления настоящего изобретения, по меньшей мере 50% гиалуроновой кислоты, содержащейся в композициях по настоящему изобретению, укладывается в указанный выше диапазон значений средней молекулярной массы. В некоторых вариантах осуществления настоящего изобретения, по меньшей мере 60% гиалуроновой кислоты, содержащейся в композициях по настоящему изобретению, укладывается в указанный выше диапазон значений средней молекулярной массы. В некоторых вариантах осуществления настоящего изобретения, по меньшей мере 70% гиалуроновой кислоты, содержащейся в композициях по настоящему изобретению, укладывается в указанный выше диапазон значений средней молекулярной массы. В некоторых вариантах осуществления настоящего изобретения, по меньшей мере 80% гиалуроновой кислоты, содержащейся в композициях по настоящему изобретению, укладывается в указанный выше диапазон значений средней молекулярной массы. В некоторых вариантах осуществления настоящего изобретения, по меньшей мере 90% гиалуроновой кислоты, содержащейся в композициях по настоящему изобретению, укладывается в указанный выше диапазон значений средней молекулярной массы. В некоторых вариантах осуществления настоящего изобретения, по меньшей мере 95% гиалуроновой кислоты, содержащейся в композициях по настоящему изобретению, укладывается в указанный выше диапазон значений средней молекулярной массы. В некоторых вариантах осуществления настоящего изобретения, по меньшей мере 98% гиалуроновой кислоты, содержащейся в композициях по настоящему изобретению, укладывается в указанный выше диапазон значений средней молекулярной массы. В некоторых вариантах осуществления настоящего изобретения, по меньшей мере 99% гиалуроновой кислоты, содержащейся в композициях по настоящему изобретению, укладывается в указанный выше диапазон значений средней молекулярной массы. В некоторых вариантах осуществления настоящего изобретения, по меньшей мере 99,9% гиалуроновой кислоты, содержащейся в композициях по настоящему изобретению, укладывается в указанный выше диапазон значений средней молекулярной массы.
II. Источники гиалуроновой кислоты
Гиалуроновая кислота, используемая в композициях и способах по настоящему изобретению, может быть получена из любого источника. В основном, гиалуроновая кислота имеет одну и ту же структуру, независимо от ее источника (например, куриный или петушиный гребень, ткань человека или клеточная оболочка бактерий). Гиалуроновая кислота может быть получена, например, из куриного или петушиного гребня, из клеточной оболочки бактерий и из ткани человека (пуповина, стекловидное тело глаза, синовиальная жидкость в суставах и др.). В некоторых вариантах осуществления настоящего изобретения, гиалуроновую кислоту выделяют из куриных гребней. В некоторых вариантах осуществления настоящего изобретения, гиалуроновую кислоту выделяют из ткани человека, например, из пуповины, стекловидного тела глаза, синовиальной жидкости в суставах. В некоторых вариантах осуществления настоящего изобретения, гиалуроновую кислоту выделяют из культуры клеток. В некоторых вариантах осуществления настоящего изобретения, гиалуроновую кислоту выделяют из клеточной оболочки бактерий. Способы выделения гиалуроновой кислоты из различных источников известны специалистам в данной области. Например, выделение и очистка гиалуроновой кислоты из петушиных гребней описана в патенте США (US Patent No. 4141973), а выделение и очистка гиалуроновой кислоты из бактериальных источников описана в другом патенте США (US Patent No. 4517295). В некоторых вариантах осуществления настоящего изобретения, выделение и очистку гиалуроновой кислоты проводят с использованием 0,15M раствора NaCl при pH of 6-8. В основном, гиалуроновая кислота, полученная из разных источников, не содержит белки или гликозаминогликаны, отличные от гиалуроновой кислоты.
В некоторых вариантах осуществления настоящего изобретения, гиалуроновую кислоту подвергают дальнейшей очистке с получением гиалуроновой кислоты с показателями средней молекулярной массы в желательном диапазоне значений (например, с использованием колоночной хроматографии). Специалистам в данной области известны способы очистки гиалуроновой кислоты до достижения показателей средней молекулярной массы в желательном диапазоне значений.
В одном аспекте, указанная гиалуроновая кислота с высокоэластичными свойствами по настоящему изобретению представляет собой немодифицированную гиалуроновую кислоту. Однако, следует понимать, что в некоторых вариантах осуществления настоящего изобретения, гиалуроновая кислота может быть модифицирована химическими способами. Например, гиалуроновая кислота может быть модифицирована химическими способами для повышения эластичности гиалуроновой кислоты.
III. Стерилизация композиций гиалуроновой кислоты
В некоторых вариантах осуществления настоящего изобретения, композиции ГК по настоящему изобретению, используемые в описанных здесь способах, являются стерильными. Термин ʺстерильная композицияʺ, в контексте настоящего описания, относится к композиции, которую можно безопасно вводить субъекту, например, человеку. Соответственно, такая стерильная композиция будет содержать минимальное количество агентов, которые способны вызвать неблагоприятные побочные эффекты, такие как нежелательная реакция ткани, нежелательная иммунная реакция, воспаление или инфекция.
Способы стерилизации композиций гиалуроновой кислоты известны специалистам в данной области и включают, например, тепловую или паровую стерилизацию, например, путем автоклавирования. В некоторых вариантах осуществления настоящего изобретения, композиции ГК по настоящему изобретению стерилизуют путем нагревания указанных композиций. В некоторых вариантах осуществления настоящего изобретения, композиции ГК по настоящему изобретению стерилизуют посредством включения композиции ГК в шприц, с последующим автоклавированием шприца, содержащего ГК, при температуре 131°C в течение 2 минут или при температуре 121°C в течение 15 минут, с последующим быстрым охлаждением.
IV. Дополнительные компоненты, используемые в композициях гиалуроновой кислоты
Композиции ГК по настоящему изобретению могут включать дополнительные компоненты, которые способны стабилизировать гиалуроновую кислоту и/или придавать композиции свойства, облегчающие ее введение субъекту. В некоторых вариантах осуществления настоящего изобретения, композиции ГК по настоящему изобретению могут включать буфер. Буферы добавляют для поддержания стабильного значения pH. Подходящие для использования в настоящем изобретении буферы включают фосфатные буферы и бикарбонатные буферы. В некоторых вариантах осуществления настоящего изобретения, указанный буфер представляет собой трис-фосфатный буфер. В некоторых вариантах осуществления настоящего изобретения, указанный буфер содержится в концентрации от 1 мМ до 100 мМ, от 2 мМ до 50 мМ, или от 5 мМ до 20 мМ. В некоторых вариантах осуществления настоящего изобретения, концентрация буфера меньше, чем 1 мМ. В некоторых вариантах осуществления настоящего изобретения, концентрация буфера больше, чем 100 мМ. В некоторых вариантах осуществления настоящего изобретения, концентрация буфера составляет 10 мМ. Следует понимать, что концентрация буфера зависит от природы используемого буфера. В некоторых вариантах осуществления настоящего изобретения, величина pH в композиции составляет от pH 7 до pH 9 или от pH 7,5 до pH 8,5. В некоторых вариантах осуществления настоящего изобретения, указанная величина pH в композиции составляет 8,0. В некоторых вариантах осуществления настоящего изобретения, указанная величина pH в композиции составляет 7,5. В некоторых вариантах осуществления настоящего изобретения, указанная величина pH в композиции составляет 8,5. При необходимости, к композиции для достижения желательной величины pH, может быть добавлена кислота (такая как HCl) или может быть добавлено основание (такое как NaOH).
Так, указанные композиции ГК могут включать буфер, например, физиологически совместимый буфер, но могут не включать никакие дополнительные компоненты.
Указанные композиции ГК могут также включать стабилизирующую добавку, такую как карбоновая кислота или ее соль. В некоторых вариантах осуществления настоящего изобретения, указанная композиция включает монокарбоновую кислоту и/или ее соль. В некоторых вариантах осуществления настоящего изобретения, указанная композиция включает глюконовую кислоту и/или глюконат натрия. В некоторых вариантах осуществления настоящего изобретения, указанная композиция включает дикарбоновую кислоту и/или ее соль. В некоторых вариантах осуществления настоящего изобретения, указанная композиция включает лимонную кислоту, янтарную кислоту, малоновую кислоту, малеиновую кислоту, винную кислоту и/или соль любой такой кислоты. В некоторых вариантах осуществления настоящего изобретения, указанная карбоновая кислота представлена цитратом натрия. В некоторых вариантах осуществления настоящего изобретения, указанная композиция включает трикарбоновую кислоту (TCA) и/или ее соль. В некоторых вариантах осуществления настоящего изобретения, указанная композиция включает нитрилотриуксусную кислоту и/или натриевую соль нитрилотриуксусной кислоты. В некоторых вариантах осуществления настоящего изобретения, указанная композиция включает тетрауксусную кислоту и/или ее соль. В некоторых вариантах осуществления настоящего изобретения, указанная композиция включает этилендиаминтетрауксусную кислоту (ЭДТА) и/или натриевую соль ЭДТА. В некоторых вариантах осуществления настоящего изобретения, указанная композиция включает пентакарбоновую кислоту и/или ее соль. В некоторых вариантах осуществления настоящего изобретения, указанная композиция включает диэтилентриаминпентауксусную кислоту (ДТПА) и/или натриевую соль ДТПА. Подходящие карбоновые кислоты включают, без ограничения, соединения цитрата, такие как цитрат натрия; соединения тартрата, соединения сукцината и ЭДТА. Kaushil et al. in Protein Science 1999 8: 222-233, и Busby et al. в Journal of Biological Chemistry Volume 256, Number 23 pp 12140-1210-12147 описывают карбоновые кислоты и их применение. В некоторых вариантах осуществления настоящего изобретения, указанная стабилизирующая добавка включается в концентрации от 50 до 600 мМ, от 250 до 500 мМ или от 250 до 350 мМ. В некоторых вариантах осуществления настоящего изобретения, концентрация стабилизирующей добавки составляет 300 мМ. В некоторых вариантах осуществления настоящего изобретения, концентрация стабилизирующей добавки меньше, чем 100 мМ. В некоторых вариантах осуществления настоящего изобретения, концентрация стабилизирующей добавки больше, чем 600 мМ.
Композиции ГК по настоящему изобретению могут также включать сахар (например, дисахаридный сахар). Дисахаридные сахара, которые могут быть добавлены к композиции по настоящему изобретению включают, без ограничения, сахарозу, лактулозу, лактозу, мальтозу, трегалозу, целлобиозу, декстрозу и декстран. В некоторых случаях, указанный сахар содержится в концентрации от 0,5 до 5% (вес/объем). В некоторых случаях, указанный сахар может содержаться в концентрации от 1 до 2% (вес/объем). В одном варианте осуществления настоящего изобретения, сахар содержится в концентрации 1%. В одном варианте осуществления настоящего изобретения, сахар может содержаться в концентрации меньше, чем 1% (вес/объем). В одном варианте осуществления настоящего изобретения, сахар может содержаться в концентрации больше, чем 5% (вес/объем). В одном варианте осуществления настоящего изобретения, сахар может представлять собой сахарозу или трегалозу и может содержаться в концентрации 1% (вес/объем).
В некоторых вариантах осуществления настоящего изобретения, композиции ГК по настоящему изобретению могут также включать соли. Соли, которые могут использоваться в композициях по настоящему изобретению, включают хлорид натрия и другие физиологически совместимые соли. В некоторых вариантах осуществления настоящего изобретения, концентрация соли, содержащейся в композициях ГК по настоящему изобретению, составляет от примерно 10 мМ до примерно 250 мМ, от примерно 25 мМ до примерно 100 мМ, от примерно 30 мМ до примерно 70 мМ, от примерно 45 мМ до примерно 150 мМ, от примерно 125 мМ до примерно 200 мМ, от примерно 150 мМ до примерно 250 мМ или от примерно 190 мМ до примерно 250 мМ. В некоторых вариантах осуществления настоящего изобретения, концентрация соли составляет 50 мМ. В некоторых вариантах осуществления настоящего изобретения, указанная концентрация соли меньше, чем 10 мМ. В некоторых вариантах осуществления настоящего изобретения, указанная концентрация соли больше, чем 250 мМ. В конкретном варианте осуществления настоящего изобретения, указанная концентрация соли составляет от примерно 50 мМ до примерно 200 мМ.
В некоторых вариантах осуществления настоящего изобретения, композиции ГК по настоящему изобретению могут иметь нормальную осмолярность, например, около 310 мОсм/л. В других вариантах осуществления настоящего изобретения, композиции ГК по настоящему изобретению могут иметь осмолярность, которая ниже нормальной осмолярности, например, ниже 310 мОсм/л. Так, например, композиции ГК по настоящему изобретению могут иметь осмолярность, равную от примерно 20 мОсм/л до примерно 500 мОсм/л, например, от примерно 150 до примерно 310 мОсм/л, от примерно 150 до примерно 200 мОсм/л, от примерно 160 до примерно 220 мОсм/л, от примерно 180 до примерно 250 мОсм/л, от примерно 200 до примерно 300 мОсм/л, от примерно 250 до примерно 310 мОсм/л, от примерно 290 до примерно 310 мОсм/л, от примерно 250 до примерно 290 мОсм/л или от примерно 270 до примерно 300 мОсм/л. В некоторых вариантах осуществления настоящего изобретения, осмолярность композиций ГК по настоящему изобретению может составлять примерно 150 мОсм/л, примерно 155 мОсм/л, примерно 160 мОсм/л, примерно 165 мОсм/л, примерно 170 мОсм/л, примерно 175 мОсм/л, примерно 180 мОсм/л, примерно 185 мОсм/л, примерно 190 мОсм/л, примерно 195 мОсм/л, примерно 200 мОсм/л, примерно 205 мОсм/л, примерно 210 мОсм/л, примерно 215 мОсм/л, примерно 220 мОсм/л, примерно 225 мОсм/л, примерно 230 мОсм/л, примерно 235 мОсм/л, примерно 240 мОсм/л, примерно 245 мОсм/л, примерно 250 мОсм/л, примерно 255 мОсм/л, примерно 260 мОсм/л, примерно 265 мОсм/л, примерно 270 мОсм/л, примерно 275 мОсм/л, примерно 280 мОсм/л, примерно 285 мОсм/л, примерно 290 мОсм/л, примерно 295 мОсм/л, примерно 300 мОсм/л, примерно 305 мОсм/л или примерно 310 мОсм/л. В одном конкретном варианте осуществления настоящего изобретения, осмолярность композиций ГК по настоящему изобретению может составлять от примерно 100 мОсм/л до примерно 400 мОсм/л, например, примерно 100 мОсм/л, примерно 110 мОсм/л, примерно 120 мОсм/л, примерно 130 мОсм/л, примерно 140 мОсм/л или примерно 150 мОсм/л.
В некоторых вариантах осуществления настоящего изобретения, композиции ГК по настоящему изобретению могут включать один или несколько антиоксидантов. Антиоксиданты представляют собой вещества, способные ингибировать окисление за счет удаления свободных радикалов из раствора. Антиоксиданты хорошо известны специалистам в данной области и включают материалы, такие как аскорбиновая кислота, производные аскорбиновой кислоты (например, аскорбилпальмитат, аскорбилстеарат, аскорбат натрия или аскорбат кальция), бутилированный гидроксианизол, бутилированный гидрокситолуол, алкилгаллат, метабисульфит натрия, бисульфит натрия, дитионит натрия, натриевая соль тиогликолевой кислоты, натрий-формальдегидсульфоксилат, токоферол и его производные (d-альфа-токоферол, d-альфа-токоферола ацетат, d-альфа-токоферола сукцинат, бета-токоферол, дельта-токоферол, гамма-токоферол и d-альфа-токоферол-полиоксиэтилена 1000 сукцинат), монотиоглицерол и сульфит натрия. Такие материалы обычно добавляют в диапазоне концентраций от 0,01 до 2,0%.
В некоторых вариантах осуществления настоящего изобретения, композиции ГК по настоящему изобретению могут включать одно или несколько изотонических средств. Этот термин используется в данной области взаимозаменяемо с термином изоосмотическое средство и обозначает соединение, которое может быть добавлено к композиции для повышения осмотического давления, например, осмотического давления 0,9% раствора хлорида натрия, который характеризуется изоосмотическими свойствами с внеклеточными жидкостями человека, такими как плазма. Предпочтительные изотонические средства, которые могут использоваться в композициях ГК по настоящему изобретению включают хлорид натрия, маннит, сорбит, лактозу, декстрозу и глицерин.
В некоторых вариантах осуществления настоящего изобретения, композиции ГК по настоящему изобретению могут включать один или несколько консервантов.
Подходящие для этой цели консерванты включают, без ограничения: хлорбутанол (0,3-0,9% вес/объем), парабены (эфиры пара-оксибензойной кислоты) (0,01-5,0%), тимеросал (0,004-0,2%), бензиловый спирт (0,5-5%), фенол (0,1-1,0%) и др.
В некоторых вариантах осуществления настоящего изобретения, указанные композиции ГК могут включать компоненты, которые приемлемы для применения в офтальмологии.
В некоторых вариантах, композиции ГК по настоящему изобретению могут включать один или несколько компонентов, которые минимизируют нежелательные побочные реакции, возникающие при инъекции композиции.
V. Композиции гиалуроновой кислоты, подходящие для офтальмологического применения
Настоящее изобретение относится к способам облегчения/ослабления боли и дискомфорта, ассоциированных с состоянием сухости глаза, достигаемым за счет введения в глаз субъекта композиций, содержащих ГК.
Любой носитель из множества известных соединений такого рода может использоваться композициях ГК для офтальмологического применения, включающих воду, смеси воды и смешиваемых с водой растворителей, таких как C1-C7-алканолы, растительные масла или минеральные масла, включающие от 0,5 до 5% нетоксичных водорастворимых полимеров, природные продукты, такие как желатин, альгинаты, пектины, трагакант, камедь карайи, ксантановая камедь, каррагенан, агар и аравийская камедь, производные крахмала, такие как ацетат крахмала и гидроксипропилкрахмал, а также другие синтетические продукты, такие как поливинилкрахмал, поливинилпирролидон, поливинилметиловый эфир, полиэтиленоксид, предпочтительно, сшитая полиакриловая кислота, такая как нейтральный Carbopol, или смеси этих полимеров. Концентрация указанного носителя в типичном случае равна концентрации активного ингредиента или в 100000 раз превышает концентрацию активного ингредиента.
Дополнительные ингредиенты, которые могут быть включены в композиции ГК для офтальмологического применения включают усилители тоничности, консерванты, средства, способствующие солюбилизации, нетоксичные эксципиенты, мягчительные средства, секвестранты, средства для корректировки уровня рН (регуляторы кислотности), сорастворители и структурообразующие агенты.
Для корректировки уровня pH, предпочтительно до физиологического значения pH, особенно полезно использование буферов. Величина pH в композициях гиалуроновой кислоты, подходящих для введения в глаз, должна поддерживаться в диапазоне значений от 4,0 до 8,0, предпочтительно, примерно от 4,0 до 6,0, более предпочтительно, примерно от 6,5 до 7,8. Могут быть добавлены подходящие для целей корректировки буферы, такие как борная кислота, борат натрия, цитрат калия, лимонная кислота, бикарбонат натрия, трис(гидроксиметил)аминометан (ТРИС) и различные смеси фосфатных буферов (включающие сочетание Na2HPO4, NaH2PO4 и KH2PO4) и их смеси. В основном, указанные буферы используются в количествах, варьирующих примерно от 0,05 до 2,5 весовых процента, и более предпочтительно, от 0,1 до 1,5 процента.
Тоничность обычно корректируется, при необходимости, за счет использования усилителей тоничности. Такие средства могут быть, например, ионной и/или неионной природы. Примеры ионных усилителей тоничности включают галогениды щелочных или щелочноземельных металлов, такие как, например, CaCl2, KBr, KCl, LiCl, Nal, NaBr или NaCl, Na2SO4 или борная кислоты. Неионные усилители тоничности включают, например, мочевину, глицерин, сорбит, маннит, пропиленгликоль или декстрозу. Осмолярность композиций гиалуроновой кислоты, используемых в способах по настоящему изобретению, может быть откорректирована с использованием регуляторов тоничности, приблизительно, до величины осмотического давления, характерного для нормальной слезной жидкости, которая эквивалентна таковой для 0,9% раствора хлорида натрия или 2,5% раствора глицерина. В некоторых примерах, предпочтительна осмолярность от примерно 100 мОсм/л до примерно 150 мОсм/л, например, 100 мОсм/л, 110 мОсм/л, 120 мОсм/л, 120 мОсм/л, 130 мОсм/л, 140 мОсм/л или 150 мОсм/л. В других примерах, предпочтительна осмолярность от примерно 225 до 400 мОсм/л, например, от примерно 280 до примерно 320 мОсм/л или от примерно 297 до примерно 318 мОсм/л. В некоторых случаях, среднее значение осмолярности может колебаться между значением примерно 303,7 и примерно 306,7 мОсм/л.
В некоторых вариантах осуществления настоящего изобретения, композиции ГК, подходящие для офтальмологического применения, могут дополнительно включать консервант. В типичном случае, указанный консервант может быть выбран из четвертичного аммониевого соединения, такого как хлорид бензалкония (N-бензил-N-(C8-C18 алкил)-N,N-диметиламмония хлорид), хлорид бензоксония и др. Примеры других подходящих консервантов включают алкилртутные соли тиосалициловой кислоты, такой как, например, тиомерсал; нитрат фенилртути, ацетат фенилртути или борат фенилртути; перборат натрия; хлорит натрия; парабены, такие как, например, метилпарабен или пропилпарабен; спирты, такие как, например, хлорбутанол, бензиловый спирт или фенетиловый спирт; производные гуанидина, такие как, например, хлоргексидин или полигексаметилена бигуанид; имидазолидинилмочевина (Germall™) или сорбиновая кислота. Предпочтительные консерванты включают четвертичные аммониевые соединения, в частности, бензалкония хлорид или его производное, такое как Polyquad (см. патент США No. 4407791) U.S. Pat. No. 4,407,791), соли алкилртути и парабены. Там, где это приемлемо, добавляют достаточное количество консерванта к офтальмологической композиции для надежной защиты от вторичной контаминации в ходе применения, вызванной бактериями и грибами.
В другом варианте осуществления настоящего изобретения, композиции ГК, подходящие для офтальмологического применения, не включают консервант. Такие композиции могут быть особенно полезны для пациентов, которые носят контактные линзы, или для тех пациентов, которые применяют некоторые местные глазные капли и/или для тех пациентов, у которых уже имеются некоторые дефекты на поверхности глаза (например, сухость глаза), где ограниченное применение консерванта будет весьма желательно.
В случае композиций ГК, подходящих для офтальмологического применения, может потребоваться дополнительное введение солюбилизатора, в частности, если активные или неактивные ингредиенты имеют тенденцию к формированию суспензии или эмульсии. Солюбилизаторы, подходящие для композиций гиалуроновой кислоты, применяемых в способах по настоящему изобретению, включают, например, тилоксапол, сложные эфиры глицерин-полиэтиленгликоля и жирной кислоты, сложные эфиры полиэтиленгликоля и жирной кислоты, полиэтиленгликоли, глицериновые эфиры, циклодекстрин (например, альфа-, бета- или гамма-циклодекстрин, например, алкилированные, гидроксиалкилированные, карбоксиалкилированные или алкилоксикарбонил- алкилированные производные, или моно- или дигликозил-альфа-, бета- или гамма-циклодекстрин, моно- или димальтозил-альфа-, бета- или гамма-циклодекстрин или панозил-циклодекстрин), полисорбат 20, полисорбат 80 или смеси этих соединений. Предпочтительный солюбилизатор может представлять собой продукт реакции касторового масла с этиленоксидом, например, коммерческие продукты Cremophor EL® или Cremophor RH40®. Было показано, что продукты реакции касторового масла с этиленоксидом являются особенно подходящими солюбилизаторами, на которые очень хорошо реагирует глаз, при их офтальмологическом применении. Другим предпочтительным солюбилизатором может быть тилоксапол или циклодекстрин. Используемая концентрация солюбилизатора определяется, прежде всего, концентрацией гиалуроновой кислоты в композиции. При этом, в типичном случае, добавляемого количества достаточно для солюбилизации гиалуроновой кислоты в композиции. Например, концентрация солюбилизатора составляет от 0,1-кратного до 5000-кратного количества относительно концентрации гиалуроновой кислоты в композиции.
Композиции ГК, подходящие для офтальмологического применения, могут также включать другие нетоксичные эксципиенты, такие как, например, эмульгаторы, увлажняющие средства или наполнители, такие как, например, полиэтиленгликоли -200, 300, 400 и 600, или Carbowax-1000, 1500, 4000, 6000 и 10000. Количество и тип добавляемого эксципиента соответствует конкретным потребностям и в основном укладывается в диапазон концентраций от примерно 0,0001 вес.% до примерно 90 вес.%.
В состав композиций по настоящему изобретению могут быть также введены другие соединения для целей повышения вязкости носителя. Примеры таких загустителей включают, без ограничения, полисахариды, такие как хондроитинсульфат и его соли, декстраны, различные полимеры на основе целлюлозы; виниловые полимеры и полимеры акриловой кислоты.
В одном варианте осуществления настоящего изобретения, композиции ГК, подходящие для офтальмологического применения, могут, в дополнение к ГК, включать дополнительные ингредиенты, которые обычно используются в офтальмологических композициях. Примеры таких компонентов могут включать другие активные ингредиенты, включающие, без ограничения, вазоконстрикторы, противоаллергические средства, противоинфекционные препараты, стероиды, анестетики, противовоспалительные средства, анальгетики или средства, применяемые при лечении сухости глаза (например, стимуляторы секреции, мукомиметики, полимеры, липиды, антиоксиданты), или они могут быть введены в сочетании (одновременно или в последовательном режиме) с композициями, включающими другие активные ингредиенты, включающие, без ограничения, вазоконстрикторы, противоаллергические средства, противоинфекционные препараты, стероиды, анестетики, противовоспалительные средства, анальгетики или средства, применяемые при лечении сухости глаза (например, стимуляторы секреции, мукомиметики, полимеры, липиды, антиоксиданты).
В некоторых вариантах осуществления настоящего изобретения, рассматриваемые в нем композиции вводят на поверхность глаза субъекта, в частности, под глазное веко, например, под верхнее или нижнее глазное веко субъекта или в пространство между роговицей и глазным веком. В некоторых вариантах, композиции гиалуроновой кислоты по настоящему изобретению не подходят для использования, или не используются в качестве вискохирургического инструмента или устройства, применяемого в ходе глазной хирургии, т.е., они не подходят для инъекции в глаз в процессе хирургии глаза.
В одном примере, композиции гиалуроновой кислоты по настоящему изобретению вводят субъекту непосредственно перед отдыхом или перед сном.
VI. Композиции гиалуроновой кислоты для ухода за кожей/дерматологического применения
Настоящее изобретение также относится к способам облегчения боли и дискомфорта, при сопутствующей минимизации по меньшей мере одного дефекта кожи у субъекта, при наличии такой потребности, за счет введения композиций, включающих ГК. Такие композиции ГК предназначенные для применения в процедурах ухода за кожей/дерматологических процедурах, кроме ГК, могут включать дополнительные ингредиенты, которые обычно входят в состав таких композиций, например, композиций, которые используются в качестве дермальных филлеров. Такие ингредиенты могут включат, например, коллаген, карнитин, витамин Е, витамин А и хондроитинсульфат.
В некоторых вариантах осуществления настоящего изобретения, композиция ГК, подходящая для ухода за кожей/дерматологического применения, инъецируется в кожу. Соответственно, она может быть представлена в форме контейнера, заполненного композицией ГК, например, в виде шприца-тюбика. Любые шприцы-тюбики, известные специалистам в данной области, могут использоваться в сочетании с композицией по настоящему изобретению. Подходящие для использования шприцы-тюбики описаны, например, в PCT публикациях WO05032627, WO08094984, WO9945985, WO03077976, в патентах США US6792743, US5607400, US5893842, US7081107, US7041087, US5989227, US6807797, US6142976, US5899889, в публикациях по патентам США US20070161961A1, US20050075611A1, US20070092487A1, US20040267194A1 или US20060129108A1. Шприцы-тюбики могут быть изготовлены из разных материалов. В одном варианте осуществления настоящего изобретения, указанный шприц-тюбик представляет собой стеклянный шприц-тюбик. В другом варианте осуществления настоящего изобретения, указанный шприц-тюбик представляет собой пластиковый шприц-тюбик. Для специалистов в данной области очевидно, что природа и/или качество материалов, используемых при получении шприца, могут влиять на стабильность композиции, содержащейся в шприце. В одном варианте осуществления настоящего изобретения, указанный шприц-тюбик включает силиконовый замасливатель. В одном варианте осуществления настоящего изобретения, указанный шприц-тюбик включает отвержденный силикон. В другом варианте осуществления настоящего изобретения, указанный шприц-тюбик не включает силиконовые замасливатели. Для любого специалиста со средним уровнем знаний в данной области очевидно, что просачивание небольших количеств контаминантов в композицию из цилиндра шприца, защитного колпачка шприца, поршня или пробки шприца также может оказывать влияние на стабильность композиции. Так, например, следует понимать, что вольфрам, введенный в процессе производства, может негативно повлиять на стабильность композиции. В одном варианте осуществления настоящего изобретения, указанный шприц-тюбик может включать вольфрам на уровне значений выше 500 ppb (частей на миллиард) (частей на миллиард). В другом варианте осуществления настоящего изобретения, указанный шприц-тюбик представляет собой шприц-тюбик со сниженным содержанием вольфрама. В другом варианте осуществления настоящего изобретения, указанный шприц-тюбик может включать вольфрам на уровне значений от примерно 500 ppb (частей на миллиард) до примерно 10 ppb (частей на миллиард), от примерно 400 ppb (частей на миллиард) до примерно 10 ppb (частей на миллиард), от примерно 300 ppb (частей на миллиард) до примерно 10 ppb (частей на миллиард), от примерно 200 ppb (частей на миллиард) до примерно 10 ppb (частей на миллиард), от примерно 100 ppb (частей на миллиард) до примерно 10 ppb (частей на миллиард), от примерно 50 ppb (частей на миллиард) до примерно 10 ppb (частей на миллиард), от примерно 25 ppb (частей на миллиард) до примерно 10 ppb (частей на миллиард).
VII. Композиции гиалуроновой кислоты, применяемые для заживления ран
Настоящее изобретение также относится к способам ослабления боли и дискомфорта, достигаемого за счет облегчения заживления ран у субъекта, при наличии такой потребности. Такие композиции ГК, предназначенные для местного применения, кроме ГК, могут включать дополнительные ингредиенты, которые обычно входят в состав такого рода композиций. Такие ингредиенты могут включать, например, 1,3-бутиленгликоль, глицерин, ксантановую камедь, натрий-хондроитинсульфат, этанол, метил-п-гидроксибензоат, полиоксиэтилен-полиоксипропилен, децилтетрадециловый эфир, цитрат натрия, эдетат натрия и витамины, например, витамин А, витамин В, витамин C, витамин D, витамин E и витамин K. Такие ингредиенты могут также включать дополнительные фармацевтически активные вещества. В некоторых случаях, эти дополнительные фармацевтически активные вещества не включают анальгетики для лечения боли. В других случаях, эти дополнительные фармацевтически активные вещества включают антибиотики, например, антибиотики, которые обычно используются для лечения кожных инфекций и предназначены для местного применения.
Композиции ГК, предназначенные для использования в способах по настоящему изобретению, также включают готовый, упакованный и этикетированный фармацевтический продукт. Это производственное изделие включает соответствующую стандартную дозированную форму в подходящем сосуде или контейнере, таком как стеклянный флакон, шприц-тюбик или другой герметически закрытый контейнер. В одном варианте осуществления настоящего изобретения, указанная стандартная дозированная форма представлена в виде стерильной, не содержащей частиц композиции ГК, которая подходит для парентерального введения, например, для интрадермального или подкожного введения субъекту, например, в область лица, шеи, рук, ног или спины субъекта.
Как в случае любого фармацевтического продукта, упаковочный материал и контейнер служат для поддержания стабильности продукта при хранении и транспортировке. Кроме того, продукты по настоящему изобретению включают инструкцию по использованию или другой информационный материал, который содержит полезные для врача, обслуживающего персонала или пациента рекомендации, как лучше проводить профилактику или лечение того или иного заболевания или расстройства, а также как часто следует вводить композицию ГК.
Иными словами, указанное производственное изделие включает памятку с инструкцией, где указывается или предлагается определенный режим дозирования, включающий, без ограничения, указание фактической дозы, процедуры мониторинга и другую информацию по мониторингу.
VIII. Способы облегчения боли и дискомфорта, ассоциированных с сухостью глаз
Симптом сухости глаза представляет собой глазное заболевание, которым поражено 10-20% населения. Указанный симптом может быть aссоциирован с патологическим состоянием, таким как катаракта или аутоиммунное расстройство, или, в случае отсутствия патологического состояния, может возникнуть в результате воздействия определенных факторов или условий, таких как длительное выполнение заданий на зрительное восприятие, работа за компьютером, пребывание в условиях сухой среды, ношение контактных линз или прием препаратов, которые приводят к сухости поверхности глаза.
У индивидуумов с состоянием сухости глаза, нарушен рефлекс, связанный с морганием и секрецией вспомогательных веществ слезной жидкости. Признаки и симптомы сухости глаза включают сухость глаза; сниженную выработку слезной жидкости, ее объем и отделение; аномальный состав слезной жидкости; повышенную осмолярность слезной жидкости; кератит; точечное окрашивание конъюнктивы и роговицы; покраснение; пелену перед глазами; сниженное время разрыва слезной пленки; повышенную красноту конъюнктивы; избыточный налет в слезной пленке, ощущение песка в глазах; чувство жжения в глазах; ощущение постороннего предмета в глазах; избыточное слезоотделение; фотофобию; острую боль в глазах; нарушение рефракции; болезненную чувствительность, раздражение слизистой оболочки глаз и дискомфорт, вызванный длительным ношением контактных линз. Избыточное слезоотделение может показаться противоестественным, но это нормальный ответный рефлекс на раздражение и ощущение постороннего предмета в глазах. Некоторые индивидуумы могут ощущать зуд в глазах из-за сочетания аллергического заболевания глаз и симптомов сухости глаза.
Имеется масса переменных факторов, которые также могут оказать влияние на симптомы сухости глаза у индивидуума, включающих уровни циркулирующих в крови гормонов, различные аутоиммунные заболевания (например, синдром Шегрена и системная красная волчанка), процедуры глазной хирургии, включающие фоторефракционную кератэктомию (PRK) или лазерный специализированный кератомилез (ЛАСИК (LASIK)), прием разных лекарственных средств, определенные условия окружающей среды, визуальное напряжение при выполнении заданий на зрительное восприятие, таких как при работе с компьютером; усталость глаз; ношение контактных линз и действие факторов механического характера, таких как чувствительность роговицы; частичное закрытие века, неровности поверхности (например, птеригий) и неровности глазного века (например, птоз, заворот век/выворот века, пингвекула). Условия среды с низкой влажностью, например, такие условия, которые могут вызвать дегидратацию, могут вызвать или ухудшить симптомы сухости глаза, такие, в частности, условия, как нахождение в самолете или в автомобиле с дефростером или проживание в зоне с сухим климатом. Кроме того, визуальное напряжение при выполнении заданий на зрительное восприятие, может также ухудшить указанные симптомы. Такие задания, которые могут значительно повлиять на указанные симптомы, включают просмотр телевизионных передач или использование компьютера в течение длительного периода времени, когда снижается частота мигательных движений.
Композиции, содержащие ГК, ранее использовались для лечения состояний сухости глаза. Глазные капли, содержащие ГК, коммерчески доступны и обычно содержат ГК в концентрации меньше, чем 1%. Примеры коммерчески доступных глазных капель, содержащих ГК, включают глазные капли Opticalm (0,2% ГК); капли Aquify comfort (0,1% ГК); Blink (0,15% ГК); Hyal-drop (0,2% ГК); Hycosan (0,1% ГК); Oxyal (0,15% ГК) и Vismed (0,18% и 0,8% ГК).
Авторы настоящего изобретения неожиданно обнаружили, что высококонцентрированные композиции ГК, которые включают ГК в концентрации выше, чем примерно 30 мг/мл (или 3% ГК), например, 40 мг/мл (или 4% ГК), могут быть эффективно введены в глаз субъекта для лечения состояния сухости глаза. Такие высококонцентрированные композиции ГК ранее не применялись для лечения состояния сухости глаза, поскольку считалось, что такие композиции слишком вязкие, что будет препятствием для их эффективного введения в глаз субъекта.
Авторы настоящего изобретения неожиданно обнаружили, что, будучи введенными в глаз, концентрированные композиции ГК проявляют удивительно высокую эффективность при лечении боли и дискофорта, ассоциированных с состоянием сухости глаза. Не ограничивая себя рамками какой-то определенной теории, следует полагать, что боль, ассоциированная с состоянием сухости глаза, может быть модулирована TRPV1 каналами ноцицепторов, и что молекулы ГК в высококонцентрированных композициях ГК взаимодействуют с TRPV1 каналами, присутствующими на чувствительных нервах глаза и клетках роговицы, снижая тем самым реакцию ноцицепторов на вредные стимулы. Соответственно, в некоторых вариантах осуществления настоящего изобретения, боль и дискомфорт, ассоциированные с состоянием сухости глаза, модулируются каналами рецептора транзитного потенциала по ваниллоиду, подтип 1 (TRPV1). Кроме того, характерные для концентрированной ГК вязкоэластичные свойства снижают удаление нанесенного на поверхность глаза раствора, которое происходит при слезотечении и моргании, что пролонгирует защитные эффекты раствора ГК.
Настоящее изобретение относится к способу ослабления боли и дискомфорта, ассоциированных с состоянием сухости глаза у субъекта, при наличии такой потребности, включающему введение в глаз указанного субъекта композиции, включающей гиалуроновую кислоту, где указанная гиалуроновая кислота присутствует в композиции в концентрации выше, чем примерно 30 мг/мл; указанная гиалуроновая кислота имеет среднюю молекулярную массу от примерно 1 до примерно 2 миллионов; при этом гиалуроновая кислота не содержит поперечные межмолекулярные связи и/или по существу не содержит химические модификации, что приводит к ослаблению боли и дискомфорта у субъекта.
В некоторых случаях, указанная композиция имеет вид геля, мази, линимента, лосьона или крема. В некоторых случаях, указанная композиция не имеет вид линз или микросферы.
Композиции ГК, подходящие для офтальмологического применения, могут вводиться на поверхность глаза, в частности, под глазное веко, например, под верхнее или нижнее глазное веко субъекта, или в пространство между роговицей и глазным веком. В одном аспекте, композиции ГК не инъецируют в глаз субъекта. В связи с тем, что у субъекта, сразу после введения композиций ГК, может быть ухудшена способность видеть, указанные композиции могут вводиться в глаз субъекта непосредственно перед отдыхом или перед сном.
Любой специалист со средним уровнем знаний в данной области может определить подходящий режим введения композиций ГК для офтальмологического применения по настоящему изобретению, с тем чтобы достичь ослабления боли и дискомфорта, ассоциированных с состоянием сухости глаза. Например, указанные композиции ГК могут вводиться ежедневно вводят ежедневно, в течение 3 дней, 4 дней, 5 дней, 6 дней, 1 недели, 2 недель, 3 недель, 4 недель, 1 месяца, 2 месяцев или в течение любого срока до достижения ослабления боли и дискомфорта, ассоциированных с состоянием сухости глаза. В некоторых вариантах осуществления настоящего изобретения, такое ослабление боли и дискомфорта может быть достигнуто в течение более длительного периода времени, например, в течение примерно 12 часов, примерно 24 часов, примерно 1 дня, примерно 3 дней, примерно 5 дней, примерно 7 дней, примерно 14 дней или примерно 28 дней.
Термин ʺсостояние сухости глазаʺ включает, без ограничения, состояние сухости глаза, ассоциированное с одним или несколькими симптомами, выбранными из группы, состоящей из сухости глаза; сниженного времени разрыва слезной пленки; сниженной выработки слезной жидкости, ее объема и отделения; аномального состава слезной жидкости; повышенной осмолярности слезной жидкости; кератита; точечного окрашивания конъюнктивы и роговицы; покраснения; пелены перед глазами; повышенной красноты конъюнктивы; избыточного налета в слезной пленке; ощущения песка в глазах; чувства жжения в глазах; ощущения постороннего предмета в глазах; избыточного слезоотделения; фотофобии; острой боли в глазах; нарушения рефракции; болезненной чувствительности; раздражения слизистой оболочки глаз и дискомфорта, вызванного длительным ношением контактных линз.
Указанное состояние сухости глаза может быть также ассоциировано с состоянием, выбранным из группы, состоящей из аутоиммунного расстройства; хирургии глаза; приема лекарственных препаратов; сухих условий в окружающей среде; последствия длительной работы на компьютере; усталости глаз; ношения линз, чувствительности роговицы; частичного закрытия века; неровностей на поверхности глаза; неровностей на глазном веке; а также состояния, ассоциированного с нейропатической болью, такой как в случае катаракты или отслойки сетчатки. В одном примере, указанное состояние сухости глаза может быть ассоциировано с хирургией глаза, такой как фоторефрактивная хирургия, например, фоторефрактивная кератэктомия (PRK), хирургия катаракты, хирургия отслойки сетчатки, лазерный специализированный кератомилез (ЛАСИК (LASIK)) или любое хирургическое лечение в области роговицы, связанное с повреждением сенсорных нервов роговицы.
IX. Способы ослабления боли и дискомфорта, при минимизации дефектов кожи
ГК представляет собой основной компонент экстрацеллюлярного матрикса (ЭЦМ (ECM)) и присутствует в особо больших количествах в мягких соединительных тканях, таких как кожа. В нормальной коже, ГК синтезируется в основном фибробластами кожи и эпидермальными кератиноцитами. ГК, за счет того, что остатки в ее молекуле несут отрицательный заряд, функционирует как водный насос для поддержания гидратации и эластичности кожи. Основная роль ГК в организме связана с контролем распределения пищи, гормонов, витаминов, неорганических солей в соединительной ткани и в очищении ее от отходов метаболизма, которые могут индуцировать воспалительные реакции. С возрастом, количество ГК и степень ее полимеризации снижается, что приводит к снижению количества воды, удерживаемой в соединительной ткани. Кожа при этом подвергается старению, что приводит к усилению фиброза и снижению качества эластиновых волокон.
ГК широко использовалась в косметических процедурах, которые включали как применение композиций ГК в виде кремов или гелей для местного нанесения, так и применение композиций ГК для инъекции в кожу в качестве дермальных филлеров. Последний указанный вариант использования включает инъекцию композиций ГК в верхние соли кожи субъекта, например, в область лица, шеи, рук, ног, туловища или груди субъекта. Такой вариант применения приводит к снижению морщин как результат механического заполняющего эффекта ямок и впадин кожи, вызванных морщинами, а также за счет превентивного действия против старения кожи и деградации ЭЦМ, который необходим для поддержания механических свойств, важных для упругости и плотности кожи.
Несмотря на то, что инъекция дермальных филлеров для заполнения впадин в мягкой ткани представляет собой минимально инвазивную дерматологическую процедуру, пациенты часто выражают озабоченность по поводу боли, ассоциированной с такой процедурой. Анестезирующие кремы местного действия часто применяются для ослабления боли в ходе таких процедур, и, соответственно, анестетики также включаются в композиции ГК, используемые для инъекции.
В настоящем изобретении нет необходимости в использовании анестетиков в ходе таких процедур. Конкретно, это связано с тем, что настоящее изобретение включает способы ослабления боли и дискомфорта, ассоциированных с дерматологической процедурой, при минимизации по меньшей мере одного дефекта у субъекта, при наличии такой потребности, за счет введения указанному субъекту высококонцентрированных композиций ГК. Как отмечалось выше, было неожиданно обнаружено, что такие высококонцентрированные композиции ГК, как это здесь описано, характеризуются удивительно высокой эффективность при лечении боли и дискомфорта, ассоциированных с дерматологической процедурой, которая может включать, например, инъекцию в кожу субъекта. Не ограничивая себя рамками какой-то определенной теории, следует полагать, что боль, после инъекции композиции ГК в кожу субъекта, может быть модулирована TRPV1 каналами ноцицепторов, и что молекулы ГК в высококонцентрированных композициях ГК взаимодействуют с каналами TRPV1, присутствующими в сенсорных нервах, эпителии и в клетках соединительной ткани кожи, и в подкожной ткани, что снижает реакцию ноцицепторов на вредные стимулы.
В некоторых вариантах осуществления настоящего изобретения, композиции ГК для косметического применения могут вводиться субъекту, при наличии потребности, путем инъекции, например, подкожной или интрадермальной инъекции, с использованием соответствующего устройства для инъекции, такого как игла, трокар, катетер или перфузионное устройство. Инъекционное устройство, подходящее для инъекции композиций по настоящему изобретению, может иметь номинальный диаметр 2,11 мм или больше (соответствует игле 14G-калибра или игле 14 и более высокого калибра). В некоторых вариантах, композиции ГК по настоящему изобретению могут быть слишком вязкими для введения с использованием более мелких игл, например, игл, имеющих номинальный диаметр менее, чем 2,11 мм. В других вариантах, композиции ГК по настоящему изобретению могут быть введены с использованием более мелких инъекционных устройств, имеющих номинальный диаметр менее, чем 2,11 мм.
Например, устройство, подходящее для инъекции композиций по настоящему изобретению, такое как шприц, может иметь номинальный диаметр примерно 0,31 мм, 0,34 мм, 0,36 мм, 0,41 мм, 0,474 мм, 0,46 мм, 0,49 мм, 0,515 мм, 0,51 мм, 0,54 мм, 0,57 мм, 0,59 мм, 0,642 мм, 0,64 мм, 0,67 мм, 0,718 мм, 0,72 мм, 0,77 мм, 0,82 мм, 0,87 мм, 0,91 мм, примерно 0,99 мм, примерно 1,07 мм, примерно 1,17 мм, примерно 1,27 мм, примерно 1,42 мм, примерно 1,47 мм, примерно 1,57 мм, примерно 1,65 мм, примерно 1,73 мм, примерно 1,83 мм, примерно 1,98 мм, примерно 2,11 мм, примерно 2,26 мм, примерно 2,41 мм, примерно 2,54 мм или примерно 2,77 мм, что соответствует калибру 30, 29, 28, 27, 26s, 26, 25,5, 25s, 25, 24,5, 24, 23,5, 23s, 23, 22,5, 22s, 22, 21,5, 21, 20,5, 20, 19,5, 19, 18,5, 18, 17,5, 17, 16,5, 16, 15,5, 15, 14,5, 14, 13,5, 13, 12,5 или 12 (игла калибра 30G, 29G, 28G, 27G, 26sG, 26G, 25,5G, 25sG, 25G, 24,5G, 24G, 23,5G, 23sG, 23G, 22,5G, 22sG, 22G, 21,5G, 21G, 20,5G, 20G, 19,5G, 19G, 18,5G, 18G, 17,5G, 17G, 16,5G, 16G, 15,5G, 15G, 14,5G, 14G, 13,5G, 13G, 12,5G или 12G). В некоторых вариантах, композиции ГК по настоящему изобретению могут вводиться с использованием шприца с иглой 18G, имеющей номинальный диаметр примерно 1,27 мм. В некоторых вариантах, композиции ГК по настоящему изобретению могут быть слишком вязкими для введения с использованием более мелких игл, например, игл, имеющих номинальный диаметр менее, чем 1,27 мм.
В некоторых вариантах осуществления настоящего изобретения, рассматриваемые в нем способы могут также включать введение субъекту высококонцентрированных композиций ГК в виде инъецируемого импланта, в частности, дермального импланта.
Композиции по настоящему изобретению особенно показаны для применения в реконструктивной или пластической хирургии у людей или животных, или в процедурах косметической дерматологии для заполнения морщин, складок, кожных впадин и рубцов, включающих заполнение впадин на коже, вызванных липодистрофией или липоатрофией. Указанная композиция может представлять собой имплант, как было указано выше.
X. Способы ослабления боли и дискомфорта, при облегчении заживления ран
Кожа создает механический барьер для внешней среды, защищая от проникновения инфекционных агентов. При повреждении, нижележащие ткани подвергаются инфекционному воздействию; поэтому крайне важно провести быстрое и эффективное заживление для восстановления барьерной функции кожи. Заживление поражения кожи у взрослых представляет собой достаточно сложный процесс, включающий множество стадий, таких как воспаление, образование грануляции, повторная эпителизация и ремоделирование. ГК, по-видимому выполняет в этом процессе многофакторную роль, опосредуя все эти события на уровне клетки и матрикса. Зачастую, при этом в раны вводятся местные анестетики, для облегчения боли, вызванной этими ранами.
Настоящее изобретение относится к способам эффективного лечения ран кожи, при одновременном обеспечении противоболевого эффекта, что позволяет обойти потребность в использовании местного анестетика. Конкретно, настоящее изобретение относится к способам ослабления боли и дискомфорта, при облегчении заживления ран, путем введения субъекту, при наличии такой потребности, высококонцентрированных композиций ГК. Как уже отмечалось выше, неожиданно было обнаружено, что высококонцентрированные композиции ГК по настоящему изобретению оказались удивительно эффективными при их использовании для лечения боли и дискомфорта, ассоциированных с заживлением ран.
Композиции ГК по настоящему изобретению проявляют удивительную и неожиданную эффективность при их использовании для лечения боли и дискомфорта, ассоциированных с заживлением ран. Не ограничивая себя рамками какой-то определенной теории, следует полагать, что боль, после инъекции композиции ГК в кожу субъекта, может быть модулирована TRPV1 каналами ноцицепторов, и что молекулы ГК в высококонцентрированных композициях ГК взаимодействуют с каналами TRPV1, присутствующими в сенсорных нервах, иннервирующих поврежденную зону, и в клетках соединительной ткани в этой зоне, что снижает реакцию ноцицепторов на вредные стимулы.
Согласно способам по настоящему изобретению, указанные высококонцентрированные композиции ГК, предназначенные для местного введения в кожные раны, могут вводиться местно на поверхность раны или рубца на коже. Указанные композиции могут быть изготовлены для применения в виде водных гелей или многоатомных спиртов, содержащих полимерные загустители, такие как производные целлюлозы или полимеры на основе акриловой кислоты, в сочетании с другими эксципиентами, которые обычно применяются в данной области с указанной целью, такими как консерванты, отдушки и др.
Считается, что достигнут явный лечебный, профилактический или облегчающий эффект, если имеется статистически значимое улучшение по одному или нескольким параметрам, наблюдаемым при том или ином заболевании или патологическом состоянии, например, боли и дискомфорта, ассоциированных с состоянием сухости глаза, процедурами ухода за кожей/дерматологическими процедурами или заживлением ран. Лечебный, облегчающий или профилактический эффект также может быть оценен по отсутствию ухудшения или развития симптомов, там, где это можно было ожидать, в противном случае. В качестве примера, можно привести вариант благоприятного изменения, где изменение по меньшей мере на 10%, по измеряемому параметру заболевания или состояния, например, боли и дискомфорту, и, предпочтительно, по меньшей мере на 20%, 30%, 40%, 50% или более, может быть показателем эффективного лечения. Термин ʺпрофилактикаʺ или ʺпрофилактическийʺ, в контексте настоящего описания, включает, например, предупреждение рецидива боли и дискомфорта у субъекта, который ранее испытывал боль.
В некоторых вариантах осуществления настоящего изобретения, указанный субъект представляет собой человека, млекопитающее, например, домашнее животное (такое как кошка или собака), сельскохозяйственное животное (такое как корова, овца, лошадь или осел), или грызуна (такого как морская свинка, мышь или крыса). В одном конкретном варианте осуществления настоящего изобретения, указанный субъект представляет собой человека. В другом конкретном варианте осуществления настоящего изобретения, указанный субъект представляет собой собаку.
В контексте настоящего описания, термин ʺснижение по меньшей мере одного симптомаʺ включает снижение, ослабление или устранение по меньшей мере одного симптома, ассоциированного с болью и дискомфортом. Этот термин также включает снижение длительности активации ионных каналов, таких как TRPV1 каналы, которые вовлекаются в процесс трансдукции боли в нейронах, при введении композиции ГК по настоящему изобретению. Активация таких каналов может быть оценена, например, путем измерения изменений в содержании внутриклеточного Ca2+ в нейронах после ноцицептивного импульса, или путем измерения сигналов в нейронах на уровне целой клетки, при введении композиции ГК по настоящему изобретению. Кроме того, термин ʺснижение по меньшей мере одного симптомаʺ включает снижение ноцицептивного возбуждения нейронов, при введении композиции ГК по настоящему изобретению.
В некоторых вариантах осуществления настоящего изобретения, способы ослабления боли и дискомфорта, ассоциированных с состоянием сухости глаза, процедурами ухода за кожей/дерматологическими процедурами или заживлением ран, включают введение субъекту, при наличии такой потребности, терапевтически эффективного количества композиции по настоящему изобретению. Термин ʺтерапевтически эффективное количествоʺ, в контексте настоящего описания, обозначает количество композиции ГК по настоящему изобретению, которое, при введении его субъекту, при наличии такой потребности, является достаточным для лечения, предупреждения, снижения или ослабления боли и дискомфорта. Любой специалист в данной области, например, может легко определить количество композиции ГК, которое будет терапевтически эффективным. В основном, указанное терапевтически эффективное количество композиции составляет от примерно 0,1 до примерно 500 мг, например, примерно 0,1 мг, примерно 1 мг, примерно 5 мг, примерно 10 мг, примерно 20 мг, примерно 30 мг, примерно 40 мг, примерно 50 мг, примерно 60 мг, примерно 70 мг, примерно 80 мг, примерно 90 мг, примерно 100 мг, примерно 110 мг, примерно 120 мг, примерно 130 мг, примерно 140 мг, примерно 150 мг, примерно 160 мг, примерно 170 мг, примерно 180 мг, примерно 190 мг, примерно 200 мг, примерно 210 мг, примерно 220 мг, примерно 230 мг, примерно 240 мг, примерно 250 мг, примерно 260 мг, примерно 270 мг, примерно 280 мг, примерно 290 мг, примерно 300 мг, примерно 310 мг, примерно 320 мг, примерно 330 мг, примерно 340 мг, примерно 350 мг, примерно 360 мг, примерно 370 мг, примерно 380 мг, примерно 390 мг, примерно 400 мг, примерно 410 мг, примерно 420 мг, примерно 430 мг, примерно 440 мг, примерно 450 мг, примерно 460 мг, примерно 470 мг, примерно 480 мг, примерно 490 мг или примерно 500 мг.
Описанные здесь способы по настоящему изобретению охватывают широкий диапазон режимов введения. Так, например, субъект может принять первую дозу композиции ГК по настоящему изобретению, с последующим приемом дополнительных доз. В некоторых вариантах осуществления настоящего изобретения, после первой дозы с некоторым, определенным интервалом вводится вторая доза. В некоторых вариантах осуществления настоящего изобретения, указанная вторая доза вводится примерно через 30 дней, примерно через 60 дней, примерно через 90 дней, примерно через 120 дней, примерно через 150 дней, примерно через 180 дней, примерно через 210 дней, примерно через 240 дней, примерно через 270 дней, примерно через 300 дней, примерно через 330 примерно через или примерно через 360 дней после введения первой дозы. Следует понимать, что режим введения дозы может быть скорректирован с учетом снижения боли и дискомфорта, которые испытывает субъект. В некоторых вариантах осуществления настоящего изобретения, указанный субъект будет принимать дозу каждый месяц, каждые два месяца, каждые три месяца, каждые четыре месяца, каждые пять месяцев, каждые шесть месяцев, каждые семь месяцев, каждые восемь месяцев, каждые девять месяцев, каждые десять месяцев, каждые одиннадцать месяцев или каждые двенадцать месяцев.
Далее настоящее изобретение иллюстрируется поясняющими примерами, которые никоим образом не следует рассматривать как ограничивающие в чем-то настоящее изобретение. Полное содержание всех ссылок (включая перечень цитированной литературы, ссылки на выданные патенты, публикации по заявкам на патент и находящиеся на рассмотрении патентные заявки), приведенные в данной заявке, полностью включены в настоящее описание посредством ссылки.
ПРИМЕРЫ
Если особо не указано иное, гиалуроновая кислота (ГК), используемая в описанных здесь композициях, получена из разных источников, включающих животного, человека или бактериальный источник. Если особо не указано иное, описанные здесь композиции находятся в физиологических буферах.
Пример 1. Снижение импульсной активности в волокнах сенсорных нервов роговицы за счет местного введения в роговицу 4% натриевой соли гиалуроновой кислоты
Возбуждение ноцицепторов представляет собой первый этап в развитии болевых ощущений. В случае острой боли, величина болевого ощущения хорошо коррелирует с частотой возбуждения ноцицептивных волокон и числом волокон, задействованных указанным стимулом (Acosta e t al., 2001, J. Physiol. 534(2), 511-525). Длительная боль, возникающая после периферического повреждения, ассоциирована с продолжительной активностью, поддерживаемой в ноцицепторах (Belmonte et al., 2004, Ocular Surface, 2, 248-253).
Повышенная импульсная активность в сенсорных нервах роговицы представляет собой первый этап в развитии дискомфорта и болевых ощущений в области глаз. На поверхности глаза, вредные стимулы выявляются полимодальным ноцицептором и механорецептором, иннервирующими роговицу и конъюнктиву (Belmonte & Giraldez, 1981, J. Physiol., 437, 709-725; Gallar et al., 1993, J. Physiol., 468, 609-622). При развитии воспаления, полимодальные ноцицепторы становятся сенсибилизированными и постоянно возбуждаются, создавая длительные болевые ощущения. С другой стороны, активность в холодовых терморецепторах ассоциирована с испарением с поверхности глаза и, возможно, также вносит определенный вклад в осознаваемое ощущение сухости на поверхности глаза (Gallar et al., 1993, J. Physiol., 468, 609-622; Parra et al., 2010, Nature Medicine, 16, 1396-1399; Kovacs et al., 2016, Pain, 157, 399-417).
Цель описанных ниже экспериментов состояла в том, чтобы протестировать способность гиалуроновой кислоты в концентрации 4% (4% ГК) со средней молекулярной массой 1-2 миллиона модифицировать спонтанные и стимулированные разряды нервного импульса в сенсорных волокнах рецептора (механоноцицепторы, полимодальные ноцицепторы, холодовые терморецепторы), иннервирующих роговицу у морских свинок.
Эффективным средством генерирования химической стимуляции полимодальных ноцицепторов является применение 98,5% CO2, проявляемой за счет окисления, вызванного локальным образованием углекислоты (Chen et al., 1995, Eur. J. Neurosci. 7, 1154-1163). Было доказано, что воздействие аналогичного сигнала, создаваемого подачей CO2 на роговицу человека, во всех случаях вызывает моментальное и острое ощущение боли (Chen et al., 1995, Eur. J. Neurosci. 7, 1154-1163; Acosta et al., 2001, J. Physiol. 534(2), 511-525). Поскольку протоны быстро образуются вокруг нервных окончаний, стимулирующий эффект H+ является, прежде всего, прямым и осуществляется через активацию протонных ионных каналов, которая приводит к деполяризации нерва, возможно, через 'капсаициновый канал' TRPV1 и/или ASIC каналы. Кроме того, снижение внутриклеточного pH в эпителиальных клетках роговицы, после стимуляции CO2, также может вести к образованию и высвобождению медиаторов воспаления (например, простагландинов), которые могут способствовать сенсибилизации полимодальных ноцицепторов роговицы, вызывая фоновый разряд и повышенные импульсные реакции на прямую стимуляцию кислотой.
В случае холодовых терморецепторов роговицы, указанные волокна демонстрируют фоновую, нормальную импульсную активность при базовой температуре роговицы 34°C и повышают частоту возбуждения при очень малых величинах снижениях температуры, например, таких как изменения в сторону снижения, которые имеют место при испарении слез (Belmonte et al., 2015, Curr. Ophthalmol. Rep. 3, 111-121).
Методы
В описанных ниже экспериментах использовали самцов и самок морских свинок Dunkin Hartley весом 200-300 г. Исследование проводили в соответствии с требованиями и стандартами Руководства Национального Института Здоровья по содержанию и уходу за лабораторными животными (NIH Guide for the Care and Use of Laboratory Animals), Директивой Европейского Союза (2010/63/EU) и Правовыми Нормами Испании по защите животных, используемых для исследования, с последующим подтверждением протокола исследования и контролем Комитета по Этике (Ethics Committees) Университета Мигеля Эрнандеса (University Miguel Hernández).
Электрофизиологические исследования
Регистрировали импульсную активность периферических рецепторов роговицы разных функциональных типов. С этой целью, проводили эвтаназию животных путем интраперитонеальной инъекции пентобарбитона натрия в концентрации 100 мг/кг, и сразу оба глаза вылущивали, включая бульбарную и тарзальную конъюнктиву, а также зрительный и цилиарный нервы, и все помещали в холодный солевой раствор (4°C).
Из удаленного глазного яблока осторожно отбирали соединительную ткань и глазодвигательные мышцы, открывая заднюю стенку глаза с цилиарными нервами вокруг зрительного нерва. Затем удаленный таким образом глаз помещали в двойную камеру, специально разработанную для того, чтобы держать передний отрезок глаза с конъюнктивой отдельно от задней части и цилиарных нервов. В передней части камеры, конъюнктиву прикалывали к разделяющей стенке, установленной для целей изоляции обеих частей камеры, перфузия которых проводилась отдельно. Переднюю часть камеры перфузировали теплым (34 °C) солевым раствором, поступающим в постоянном режиме через верхний корнеосклеральный диск. В задней части камеры, заполненной теплым минеральным маслом, нервные волокна препарировали отдельно от цилиарных нервов и помещали на Ag-AgCl электрод для монополярной регистрации активности одиночных импульсов с использованием стандартного оборудования для электрофизиологических измерений. Электрические сигналы регистрировали по электроду с Ag/AgCl в заднем отделе камеры. Затем данные по регистрации электрических сигналы переносили на ПК с CED интерфейсом и анализировали с использованием соответствующего программного обеспечения. Спонтанную активность выбранного элемента регистрировали за 1 минуту до любой запланированной стимуляции. Далее определяли механический порог с использованием калиброванных нитей фон Фрея (диапазон значений 0,25-4,00 мН). Локализацию рецепторных полей афферентных волокон роговицы определяли путем механической стимуляции с использованием тонкой кисточки и далее обозначали сверхпороговое значение нагрузок по результатам стимуляции нитью фон Фрея. Для достижения химической стимуляции, на рецепторное поле роговицы в течение 30 секунд подавали струю газа, содержащего 98,5% CO2. Термическую стимуляцию проводили путем перфузии охлажденного (охлаждение до 20°C) раствора с использованием изготовленного по специальному заказу термоэлектрического охладителя Пельтье.
Анализ полученных данных
При регистрации одиночного волокна из числа полимодальных волокон, анализировали импульсное возбуждение отдельных элементов, различающихся по модальности, амплитуде и форме стимула. Показатель Распространяющаяся импульсная активность выражали в виде среднего значения частоты импульсов (в импульс/сек), измеряемой в течение 30 секунд с момента начала регистрации и в ходе всех интервалов между стимулами. Реакции на введение CO2 оценивали количественно, определяя следующие параметры: латентный период: временной интервал между началом импульсной подачи CO2 и первым импульсом, зарегистрированным от элемента; средняя скорость разрядки: среднее значение числа импульсов в секунду (имп/сек) в ходе импульсной подачи CO2; показатель после разрядки: среднее значение частоты возбуждения (имп/сек) в течение 30 секунд, сразу после импульса подачи CO2.
При регистрации нервного волокна в условиях охлаждения, рассчитывали следующие дополнительные параметры паттерна импульсов: среднее значение частоты возбуждения: среднее число импульсов, зарегистрированных в секунду (импульсы/сек); пороговое значение охлаждения: температура в ходе всего диапазона охлаждения, при которой достигается 25% повышение средней частоты нервного импульса относительно базовой температуры; пиковая реакция: максимальный показатель (импульс/сек) частоты импульсов на протяжении всего диапазона охлаждения; температура при достижении пиковой реакции: значение температуры (°C), при которой достигается пиковая частота.
Экспериментальный протокол
Ниже описана последовательность стадий, включенных в данный эксперимент:
Идентификация полимодальных ноцицептивных волокон
Идентифицировали волокно, содержащее нити, иннервирующие роговицу и отвечающие на механическую стимуляцию влажной, мелкой кистью, накладываемой на поверхность роговицы. После расщепления нервного волокна, локализацию единичного ноцицептивного элемента роговицы определяли путем механической стимуляции. С целью дальнейшей характеристики (определение полимодальности) каждого выделенного единичного элемента, проводили следующую стандартную процедуру:
1. картирование границ рецепторных полей и определение механического порога с использованием нитей фон Фрея;
2. оценка 30-секундной пульсовой подачи 98,5% CO2. Если не выявляли эффект, брали для исследования новое волокно.
Эффект 4% ГК на полимодальные ноцицепторы
Наносили 4% раствор ГК на поверхность роговицы. При этом, на роговицу регулярно добавляли по капле солевого раствора для поддержания влажности. После инстилляции 4% ГК, на поверхность роговицы, в последовательном режиме проводили 30-секундную подачу CO2 (через 5, 20, 35, 50, 65 и 80 мин после нанесения 4% ГК). Далее роговицу непрерывно промывали в течение 5 минут солевым раствором и оценивали ответ на подачу CO2 через 15 минут и 20 минут после промывки. В конце протокола определяли электрический порог для подтверждения реактивности волокна. Оценивали наличие спонтанной активности в ходе всей процедуры данного эксперимента и величину импульсного ответа на CO2 стимул.
Идентификация холодовых термочувствительных волокон
Идентифицировали волокно, содержащее холодовые термореактивные нити, иннервирующие роговицу, при нанесении капли холодного солевого раствора на роговицу. После расщепления нити, локализацию волокна, содержащего единичный холодовый элемент роговицы, определяли с использованием охлажденного льдом металлического стержня (с острием, диаметр 1 мм), прикладываемого к роговице для картирования рецепторного поля.
Регистрировали распространяющуюся импульсную активность, проявляемую окончанием единичного чувствительного к холоду нерва при температуре 34°C. Охлаждение в диапазоне температур от 34°C до 15°C создавали за счет изменения температуры рецепторного поля с помощью охладителя Пельтье.
Эффект 4% ГК на активность холодового терморецептора нерва
Наносили 4% ГК на открытую поверхность глаза, находящегося в передней части камеры, и эффект холодового термоцептора на распространяющуюся активность при температуре 34°C и в ответ на диапазон охлаждения исследовали через 5, 20, 35, 50, 65 и 80 минут после нанесения ГК, а также через 15 и 20 минут после промывки роговицы.
Определяли среднюю величину распространяющейся активности при температуре покоя 34°C, температурный порог и повышение импульсной активности в нерве в периоде охлаждения в диапазоне исследуемых температур.
Результаты
В интактной роговице, сенсорные афференты были идентифицированы как полимодальные ноцицепторные волокна, представляющие рецепторные поля роговицы, локализованные обычно на расстоянии до 1 мм от прилегающей склеры. Указанные полимодальные ноцицепторные волокна молчат в состоянии покоя, тогда как отвечают на механическую стимуляцию, а также на стимуляцию под действием 98,5% CO2.
Эффекты 4% ГК на распространяющуюся активность и на возбуждение в ответ на подачу CO2 определяли по 2 единичным полимодальным и 2 холодочувствительным единицам. Эффекты применения CO2 анализировали до и после нанесения 4% ГК на поверхность роговицы. Как показано ниже, в таблице 1, полимодальные ноцицепторы молчат в состоянии покоя, и в течение 2-минутного регистрации не отмечалась распространяющаяся активность. Они отвечали примерно через 2,5 секунды- 30 секунд после стимуляции CO2 со средней частотой импульсной разрядки, равной примерно 6 импульсов в секунду. В течение первых 35 минут после нанесения 4% ГК на роговицу, реакция на подачу CO2 заметно снижалась и позже затихала полностью. Промывка через 80 минут с использованием для обработки 4% ГК постепенно восстанавливала реакцию на CO2.
Таблица 1. Распространяющаяся активность, реакции на обработку CO2 и показатели после разрядки полимодальных ноцицепторов роговицы выражены в единицах импульсы в секунду; латентный период указан в секундах. Для холодовых терморецепторов, спонтанная активность, реакции на интервал охлаждения и показатели пиковой частоты выражены в единицах импульсы в секунду. Пороговое значение температуры и температура при пиковой частоте приведены в °C; n.r.: импульсная активность отсутствует.
(Обозначения в таблице: 1*- Распространяющаяся активность; 2*- Латентный период; 3*-Пороговое значение; 4*- Реакция на интервал охлаждения; 5*- Температура на пике)
Регистрировалась также импульсная активность холодовых терморецепторных волокон, которые составляют примерно 10% от всех сенсорных афферентов роговицы. Авторы подтвердили их нормальную импульсную активность при температуре 34°C в интактных глазах и заметное повышение частоты, вызванное воздействием охлаждающих импульсов с температурой 15°C, характерное для холодовых терморецепторов глаза (Gallar et al., 1993, J. Physiol., 468, 609-622; Parra et al., 2010, Nature Medicine, 16, 1396-1399).
Как показано в таблице 1, воздействие на роговицу в течение 4 часов 4% ГК снижало базовую распространяющуюся активность холодовых терморецепторов при температуре 34°C. Не отмечалось явных изменений в пороговом значении холода, но, как тоже показано в таблице 1, реакция на холодовый диапазон заметно снижалась и лишь частично восстановилась через 20 минут после промывки, тогда как значение пиковой частоты, вызванное снижением температур, вернулось к нормальному значению в этот период времени.
В сочетании, эти результаты указывают на то, что 4% ГК снижает аномальную импульсную активность в полимодальных ноцицепторах волокон, вызванную кислотной стимуляцией роговицы. Возможно, это является результатом взаимодействия молекул ГК с TRPV1 каналами сенсибилизированных ноцицепторных нервных окончаний of sensitized nociceptive nerve terminals (Caires et al., 2015, Nat. Comm. 6, 8095), указыающий на то, что высокие концентрации ГК очень эффективны в плане проявления такого эффекта. Кроме того, активность в холодовых терморецепторах снижалась, возможно, за счет более эффективного экранирования поверхности роговицы, чем в случае применения менее концентрированных растворов ГК.
Пример 2. Потребность в усилиях, необходимых для выдавливания композиции ГК через иглы разного размера
Измеряли давление, которое необходимо приложить, чтобы выдавить композицию, содержащую 4% ГК, из шприца объемом 3 мл с иглами разного диаметра (30-18G), полученные при этом данные показаны на фиг. 1. Усилие создавалось за счет одного диска из двух взаимно уравновешивающих дисков, действующих перпендикулярно поршневой части шприца. На контралатеральный диск прикладывали возрастающие усилия. Как показывают результаты, проиллюстрированные на фиг. 1, композиции ГК по настоящему изобретению могут вводиться субъектам с использованием игл с диаметрами в диапазоне 30-18G.
ЭКВИВАЛЕНТЫ
Приведенное выше описание рассматривается как достаточное для того, чтобы любой специалист со средним уровнем знаний в данной области мог применять на практике настоящее изобретение. Настоящее изобретение не ограничено областью и объемом приведенных примеров, поскольку указанные примеры приведены лишь с целью пояснения одного аспекта настоящего изобретения, и другие функционально эквивалентные варианты осуществления изобретение также охватываются рамками настоящего изобретения. Различные модификации, в дополнение к тому, что было описано здесь, станут понятны специалистам в данной области после ознакомления данного описания, и все они охватываются объемом прилагаемой формулы изобретения. Преимущества и объекты настоящего изобретения необязатeльно охватываются каждым вариантом осуществления настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ГЛАЗ | 2019 |
|
RU2792627C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ГЛАЗ | 2020 |
|
RU2795913C2 |
| Фармацевтическая композиция на основе трамадола для офтальмологического применения | 2016 |
|
RU2744570C2 |
| ОФТАЛЬМОЛОГИЧЕСКИЕ КОМПОЗИЦИИ С УЛУЧШЕННОЙ ЗАЩИТОЙ ОТ ОБЕЗВОЖИВАНИЯ И УДЕРЖИВАНИЕМ | 2013 |
|
RU2659207C2 |
| СОСТАВЫ КОЖНОГО НАПОЛНИТЕЛЯ, ВКЛЮЧАЯ АНТИОКСИДАНТЫ | 2012 |
|
RU2740454C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ГЛАЗ | 2019 |
|
RU2806301C2 |
| ЛЕЧЕНИЕ ДИСКОМФОРТА ГЛАЗ ПУТЕМ МЕСТНОГО ПРИМЕНЕНИЯ ОХЛАЖДАЮЩЕГО АГЕНТА НА НАРУЖНОЙ ПОВЕРХНОСТИ ВЕКА | 2010 |
|
RU2538696C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ГЛАЗ | 2020 |
|
RU2802625C2 |
| СЛЕЗОЗАМЕНИТЕЛЬ, СОДЕРЖАЩИЙ ГИАЛУРОНАТ НАТРИЯ И КАРБОКСИМЕТИЛЦЕЛЛЮЛОЗУ | 2014 |
|
RU2687275C2 |
| СТАБИЛЬНЫЕ ПЕПТИДНЫЕ КОМПОЗИЦИИ | 2018 |
|
RU2832964C2 |
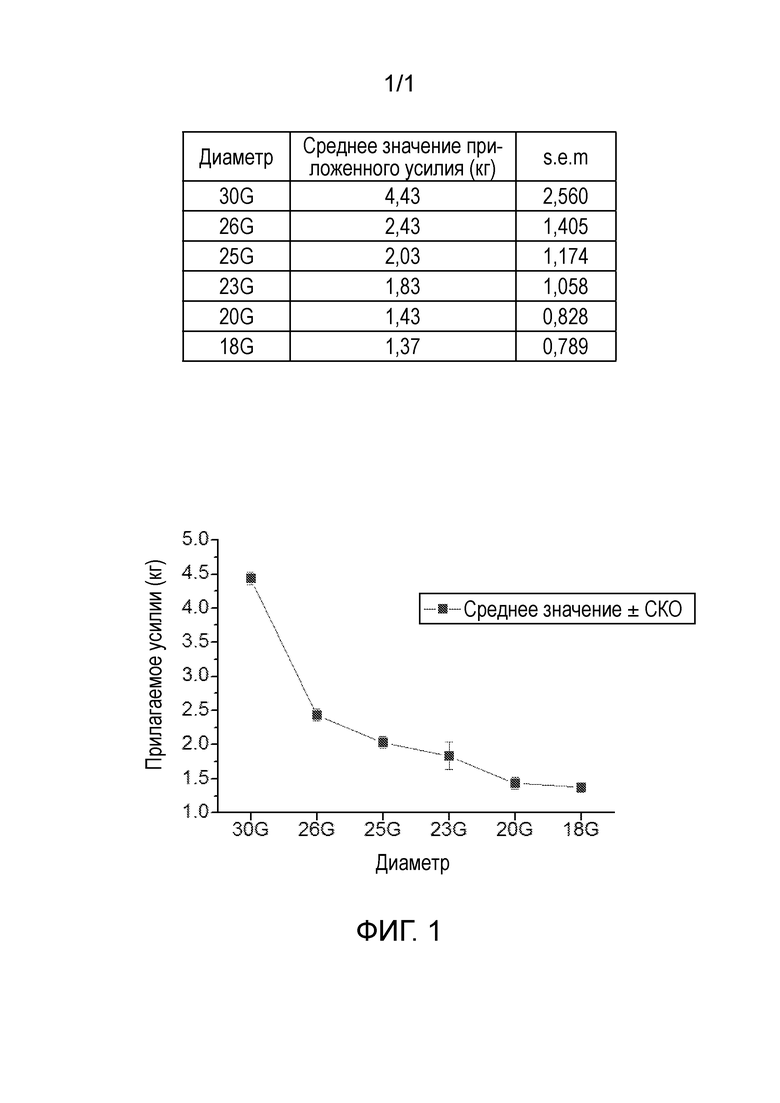
Группа изобретений относится к области медицины, а именно к офтальмологии, и предназначена для ослабления боли и дискомфорта, связанных с состоянием сухости глаза у субъекта. Способ ослабления боли и дискомфорта, связанных с состоянием сухости глаза у субъекта, при наличии такой потребности, включает введение в глаз субъекта композиции, включающей гиалуроновую кислоту, где гиалуроновая кислота содержится в композиции в концентрации от 3,5% вес./об. (35 мг/мл) до 9% вес./об. (90 мг/мл), а также в концентрации 4% вес./об. (40 мг/мл) до 8% вес./об. (80 мг/мл). Указанная гиалуроновая кислота имеет среднюю молекулярную массу от 1 до 2 миллионов, не является поперечно-сшитой и/или не является химически модифицированной, что приводит к ослаблению боли и дискомфорта у субъекта. Указанная композиция не содержит других фармацевтически активных веществ. Использование группы изобретений обеспечивает ослабление боли и дискомфорта, связанных с состоянием сухости глаза у субъекта, снизить аномальную импульсную активность в полимодальных ноцицепторах и/или в холодовых терморецепторах нервных волокон глаза. 2 н. и 27 з.п. ф-лы, 1 ил., 1 табл., 2 пр.
1. Способ ослабления боли и дискомфорта, связанных с состоянием сухости глаза у субъекта, при наличии такой потребности, отличающийся тем, что способ включает введение в глаз субъекта композиции, включающей гиалуроновую кислоту, где:
гиалуроновая кислота содержится в композиции в концентрации от 3,5% вес./об. (35 мг/мл) до 9% вес./об. (90 мг/мл);
гиалуроновая кислота имеет среднюю молекулярную массу от 1 до 2 миллионов;
гиалуроновая кислота не является поперечно-сшитой и/или не является химически модифицированной, что приводит к ослаблению боли и дискомфорта у субъекта; и
где композиция не содержит других фармацевтически активных веществ, что приводит к ослаблению указанных боли и дискомфорта у указанного субъекта.
2. Способ по п. 1, отличающийся тем, что гиалуроновая кислота содержится в композиции в концентрации от 4% вес./об. (40 мг/мл) до 6% вес./об. (60 мг/мл).
3. Способ ослабления боли и дискомфорта, связанных с состоянием сухости глаза у субъекта, при наличии такой потребности, отличающийся тем, что способ включает введение в глаз субъекта композиции, включающей гиалуроновую кислоту, где:
гиалуроновая кислота содержится в указанной композиции в концентрации 4% вес./об. (40 мг/мл) до 8% вес./об. (80 мг/мл);
гиалуроновая кислота имеет среднюю молекулярную массу от 1 до 2 миллионов;
гиалуроновая кислота не является поперечно-сшитой и/или по существу не является химически модифицированной; и
где композиция не содержит других фармацевтически активных веществ, что приводит к ослаблению боли и дискомфорта у субъекта.
4. Способ по п. 1 или 3, отличающийся тем, что 4 композиция не включает полигликоль.
5. Способ по п. 1 или 3, отличающийся тем, что указанная композиция дополнительно включает буфер.
6. Способ по п. 1 или 3, отличающийся тем, что буфер представляет собой фосфатно-солевой буферный раствор (ФБР (PBS)).
7. Способ по п. 1 или 3, отличающийся тем, что композиция обладает эластичностью на уровне по меньшей мере примерно 200 Паскаль, по данным измерения при частоте 0,5 Гц.
8. Способ по п. 1 или 3, отличающийся тем, что композиция обладает эластичностью на уровне по меньшей мере примерно 1000 Паскаль, по данным измерения при частоте 0,5 Гц.
9. Способ по п. 1 или 3, отличающийся тем, что композиция обладает эластичностью на уровне по меньшей мере примерно 2000 Паскаль, по данным измерения при частоте 0,5 Гц.
10. Способ по п. 1 или 3, отличающийся тем, что композиция обладает эластичностью на уровне по меньшей мере примерно 4000 Паскаль, по данным измерения при частоте 0,5 Гц.
11. Способ по п. 1 или 3, отличающийся тем, что композиция является стерильной.
12. Способ по п. 1 или 3, отличающийся тем, что композиция представлена в виде геля, мази, линимента, лосьона или крема.
13. Способ по п. 1 или 3, отличающийся тем, что композицию вводят на поверхность глаза.
14. Способ по п. 13, отличающийся тем, что композицию вводят под глазное веко указанного субъекта.
15. Способ по п. 13, отличающийся тем, что композицию вводят в пространство между роговицей и глазным веком.
16. Способ по п. 13, отличающийся тем, что композицию вводят субъекту непосредственно перед отдыхом или перед сном.
17. Способ по п. 1 или 3, отличающийся тем, что композицию вводят без инъекции в глаз указанного субъекта.
18. Способ по п. 17, отличающийся тем, что указанную композицию вводят с использованием контейнера, выбранного из группы, состоящей однодозового контейнера, флакона из мягкого пластика, тюбика, вакуумного тюбика, глазной ванночки, капельницы или картриджа.
19. Способ по п. 1 или 3, отличающийся тем, что состояние сухости глаза связано с одним или несколькими симптомами, выбранными из группы, состоящей из сухости глаза; сниженной выработки слезной жидкости, ее объема и отделения; аномального состава слезной жидкости; повышенной осмолярности слезной жидкости; кератита; точечного окрашивания конъюнктивы и роговицы; покраснения; пелены перед глазами; сниженного времени разрыва слезной пленки; повышенной красноты конъюнктивы; избыточного налета в слезной пленке, ощущения песка в глазах; чувства жжения в глазах; ощущения постороннего предмета в глазах; избыточного слезоотделения; фотофобии; острой боли в глазах; нарушения рефракции; болезненной чувствительности; раздражения слизистой оболочки глаз и дискомфорта, связанного с длительным ношением контактных линз.
20. Способ по п. 1 или 3, отличающийся тем, что указанное состояние сухости глаза связано с одним или несколькими симптомами, выбранными из группы, состоящей из аутоиммунного расстройства; хирургического вмешательства в глаза; приема лекарственных препаратов; а также состояний, определяемых сухостью окружающей среды; длительной работой с компьютером; усталостью глаз; длительным ношением контактных линз, чувствительностью роговицы; частичным закрытием века; неровностью поверхности; неровностью глазного века; а также состояния, связанного с нейропатической болью.
21. Способ по п. 20, отличающийся тем, что указанное состояние сухости глаза связано с хирургическим вмешательством в глаза, и где указанное хирургическое вмешательство в глаза выбрано из группы, состоящей из фоторефракционной хирургии, хирургии катаракты, хирургии отслойки сетчатки, лазерного специализированного кератомилеза (ЛАСИК (LASIK)) и любого хирургического лечение в области роговицы, связанное с повреждением сенсорных нервов роговицы.
22. Способ по п. 20, отличающийся тем, что указанное состояние сухости глаза связано с состоянием, связанным с нейропатической болью, и где состояние представляет собой состояние после хирургического вмешательства по поводу катаракты или отслойки сетчатки.
23. Способ по п. 13, отличающийся тем, что композицию вводят ежедневно в течение 3 дней, 4 дней, 5 дней, 6 дней, 1 недели, 2 недель, 4 недель или 10 недель.
24. Способ по п. 1 или 3, отличающийся тем, что достигается длительное ослабление боли и дискомфорта у субъекта.
25. Способ по п. 24, отличающийся тем, что указанная длительность составляет 8 часов, 12 часов, 24 часа, 1 день, 3 дня, 5 дней, 7 дней, 14 дней или 28 дней.
26. Способ по п. 1 или 3, отличающийся тем, что субъект представляет собой млекопитающее.
27. Способ по п. 26, отличающийся тем, что субъект представляет собой человека.
28. Способ по п.1, отличающийся тем, что композиция снижает импульсную активность в полимодальных ноцицепторах и/или холодовых терморецепторах глаза.
29. Способ по п.3, отличающийся тем, что композиция снижает импульсную активность в полимодальных ноцицепторах и/или холодовых терморецепторах глаза.
| US 2014005140 A1, 02.01.2014 | |||
| US 2009111770 A1, 30.04.2009 | |||
| US 20040022847 А1, 05.02.2004 | |||
| WO 2014032804 A1, 06.03.2014 | |||
| WO 2014191955 A1, 04.12.2014. |
Авторы
Даты
2020-07-24—Публикация
2016-09-21—Подача