ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка испрашивает преимущество по поданным ранее предварительным заявкам на получение патента Соединенных Штатов Америки №№ 62/937 458 и 62/937 473 от 19 ноября 2019 г., которые в полном объеме включены в настоящую заявку путем ссылки.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композициям, содержащим одно или более соединений и/или экстрактов, которые индуцируют, стимулируют и/или улучшают продуцирование/высвобождение/доставку/выделение муцина из роговицы и/или в роговицу, а также к способам применения этих композиций для лечения глаз.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
«Сухой глаз представляет собой многофакторное заболевание глазной поверхности, которое характеризуется потерей гомеостаза слезной пленки и сопровождается глазными симптомами, при которых нестабильность и гиперосмолярность слезной пленки, воспаление и повреждение глазной поверхности, а также нейросенсорные аномалии играют этиологическую роль». Craig, J.P. et al. TFOS DEWS II definition and classification report (Отчет по определениям и классификациям). Ocul Surf. 2017; 15: 276-283. Синдром сухого глаза может быть результатом аномального или недостаточного образования слезной жидкости и дефицита секреции муцина (т. е. сухого кератоконъюнктивита). Симптомы синдрома сухого глаза могут проявляться в результате различных основных расстройств, таких как аутоиммунные заболевания, поражающие слезные (т. е. продуцирующие слезы) железы, такие как ревматоидный артрит, синдром Шегрена, системная красная волчанка, системный склероз и саркоидоз. Синдром сухого глаза также может возникнуть после хирургического вмешательства на глазах, такого как операция методом Lasik®. По оценкам, в США синдромом сухого глаза страдает более 13 миллионов человек.
Независимо от имеющихся в основе патологических состояний синдром сухого глаза обычно включает быстрое разрушение предглазной слезной пленки, что приводит к дегидратации открытой внешней поверхности. Нормальное образование слезной жидкости необходимо для сохранения увлажненности роговицы и конъюнктивы, что, в свою очередь, помогает предотвратить изъязвление, а также сохранить прозрачность роговицы. Кроме того, слезы облегчают движение века по поверхности глаза (например, моргание) и удаление из глаза инородных веществ. Слезная жидкость также обычно содержит лизоцим, который помогает предотвратить инфекции глаза. Синдром сухого глаза может вызывать как легкий дискомфорт, так и сильную боль в глазу. Когда это происходит в течение продолжительных периодов времени, может возникать размытое зрение, зернистость и/или ощущение жжения и зуда. Если заболевание остается без лечения, оно также может привести к язвам роговицы и/или рубцеванию.
Симптомы синдрома сухого глаза включают боль или усталость глаз, усиленное моргание и воспаленные глаза. Кроме того, бактерии могут проникать через царапины и вызывать инфекцию, и если царапина достаточно глубока, она может даже повлиять на зрение. Помимо напряжения глаз причины сухости глаз включают синдром Шегрена, синдром Стивенса-Джонсона, ожоги и травмы глаз, а также побочные эффекты гипотензивных препаратов, транквилизаторов, глазных капель для лечения глаукомы и прочих подобных препаратов.
Глазные капли являются эффективным способом лечения синдрома сухого глаза. Такие глазные капли обычно содержат активные вещества для лечения синдрома сухого глаза - широко распространенным активным веществом в таких каплях является гиалуроновая кислота. Гиалуроновая кислота является макромолекулярным веществом биологического происхождения, обладает чрезвычайно высоким водоудерживанием и характерными свойствами, такими как высокая вязкоупругость, хорошие загущающие характеристики и высокая способность к нитеобразованию, и используется в качестве увлажнителя в средствах для местного применения при лечении различных видов кожных проблем и т. п. В случае синдрома сухого глаза, вызванного синдромом Шегрена, при котором сухость наблюдается во всем организме, эффективно применяют глазные капли, содержащие гиалуроновую кислоту. Однако при введении в виде глазных капель гиалуроновая кислота имеет относительно короткое время пребывания на роговице, поэтому влияние глазных капель с гиалуроновой кислотой длится всего около 2-3 часов, что означает, что пациент должен чаще использовать капли (например, от 5 до 10 раз в день).
Гиалуроновая кислота (ГК) вырабатывается эпителиальными клетками роговицы глаза. Примечательно, что значительно более высокие концентрации гиалуроновой кислоты были обнаружены в роговицах молодых людей. (См. публикацию Pacella, E., Pascella, F., De Paolis, G., et al. Glycosaminoglycans in the human cornea: age-related changes (Гликозаминогликаны в роговице человека: возрастные изменения). Ophthalmol. Eye Dis. 7:1-5, 2015).
Кроме того, слезная пленка является естественной защитой организма от сухости глаз. Слезная пленка содержит глазные муцины и необходима для поддержания гомеостаза влажной поверхности глаза. Муцины вырабатываются, помимо прочего, эпителиальными клетками роговицы глаза. Муцины представляют собой гликопротеины, экспрессируемые эпителиальными тканями слизистых оболочек. Они защищают ткани, функционируя как антиоксиданты и обеспечивая смазывание. Муциновые гены, ассоциированные со слезной пленкой, включают MUC1, MUC2, MUC4, MUC5AC, MUC5B, MUC7 и MUC16.
Муцин также используется в качестве противомикробного средства, кроме того, муцин, как и гиалуроновая кислота способствует заживлению любых ран и необходим для поддержания здоровья глаз в целом.
Таким образом, существует потребность в офтальмологической фармацевтической композиции, которая бы стимулировала и/или улучшала выработку и/или высвобождение гиалуроновой кислоты и/или муцина из роговицы и/или в роговицу.
Авторы настоящего изобретения обнаружили экстракты, или источники экстрактов, дрожжей рода Pichia, которые могут индуцировать, стимулировать и/или улучшить продуцирование/высвобождение/доставку/выделение гиалуроновой кислоты и/или муцина из роговицы и/или в роговицу.
Таким образом, аспект настоящего изобретения относится к микроэмульсионным композициям, содержащим безопасное и эффективное количество одного или более экстрактов, или источников экстрактов, дрожжей рода Pichia для индуцирования, стимулирования и/или улучшения продуцирования/высвобождения/доставки/выделения гиалуроновой кислоты и/или муцина из роговицы и/или в роговицу.
Другой аспект настоящего изобретения относится к способам индуцирования, стимулирования и/или улучшения продуцирования/высвобождения/доставки/выделения гиалуроновой кислоты и/или муцина из роговицы и/или в роговицу, включающим стадию введения офтальмологических микроэмульсионных композиций, содержащих безопасное и эффективное количество одного или более экстрактов, или источников экстрактов, дрожжей рода Pichia.
Другой аспект настоящего изобретения относится к способам лечения (например, снижения) и/или профилактики синдрома сухого глаза или симптомов, связанных с синдромом сухого глаза, включающим стадию введения офтальмологических микроэмульсионных композиций, содержащих один или более экстрактов, или источников экстрактов, дрожжей рода Pichia.
Дополнительный аспект настоящего изобретения относится к способам лечения (например, ослабления) и/или профилактики синдрома сухого глаза или симптомов, связанных с синдромом сухого глаза, включающим стадию введения офтальмологических микроэмульсионных композиций, содержащих один или более экстрактов, или источников экстрактов, дрожжей рода Pichia.
Другой аспект настоящего изобретения относится к способам профилактики и/или лечения (например, уменьшения) симптомов нарушений глаз, связанных с синдромом сухого глаза и/или возникающих в результате снижения или низкого уровня продуцирования/высвобождения/доставки/выделения гиалуроновой кислоты и/или муцина из роговицы и/или в роговицу, путем введения композиций, содержащих безопасное и эффективное количество одного или более экстрактов, или источников экстрактов, дрожжей рода Pichia.
Один аспект настоящего изобретения относится к композициям, содержащим безопасное и эффективное количество одного или более экстрактов, или источников экстрактов, дрожжей рода Pichia для индуцирования, стимулирования и/или улучшения продуцирования/высвобождения/доставки/выделения гиалуроновой кислоты и/или муцина из роговицы и/или в роговицу, причем композиции можно вводить пациентам, имеющим концентрацию MUC5AC в слезах менее 6 (или около 6), в некоторых случаях 8 (или около 8) нанограмм на миллиграмм белков таким образом, чтобы концентрация MUC5AC в слезах повышалась до значения (или становилась) от 8 или выше (или около 8) нанограмм до 15 (или около 15) нанограмм, в некоторых случаях от 9 (или около 9) нанограмм до 12 (или около 12) нанограмм на миллиграмм белков.
В определенных вариантах осуществления вышеописанная концентрация MUC5AC в слезной жидкости (т. е. от равной или превышающей 8 (или около 8) нанограмм до 15 (или около 15) нанограмм, в некоторых случаях от 9 (или около 9) нанограмм до 12 (или около 12) нанограмм на миллиграмм белков), в результате воздействия соединений и/или экстрактов, которые индуцируют, стимулируют и/или улучшают продуцирование/высвобождение/доставку/выделение гиалуроновой кислоты и/или муцина из роговицы или в роговицу, поддерживается в течение периода до, по меньшей мере, примерно 2 часов, в некоторых случаях около 4 часов, в некоторых случаях около 6 часов, в некоторых случаях около 8 часов, в некоторых случаях около 10 часов, в некоторых случаях около 12 часов или в некоторых случаях от примерно 12 до примерно 24 часов.
Концентрации MUC5AC в слезной жидкости, подробно описанной выше, определяли методом Uchino (описанным ниже в определениях).
Аналогичный аспект настоящего изобретения относится к способам индуцирования, стимулирования и/или улучшения продуцирования/высвобождения/доставки/выделения гиалуроновой кислоты из роговицы и/или в роговицу, включающим стадию введения офтальмологических композиций, содержащих безопасное и эффективное количество одного или более экстрактов, или источников экстрактов, дрожжей рода Pichia для индуцирования, стимулирования и/или улучшения продуцирования/высвобождения/доставки/выделения гиалуроновой кислоты и/или муцина из роговицы и/или в роговицу, причем композиции можно вводить пациентам с концентрацией гиалуроновой кислоты в слезной жидкости менее 10 (или около 10) нанограмм, в некоторых случаях менее 15 (или около 15) нанограмм, в некоторых случаях менее 20 (или около 20) нанограмм или в некоторых случаях менее 25 (или около 25) нанограмм, на миллиграмм белков таким образом, что концентрация гиалуроновой кислоты в их слезной жидкости превышает или становится равной 10 (или около 10), в некоторых случаях 15 (или около 15), в некоторых случаях 20 (или около 20), в некоторых случаях 25 (или около 25) нанограмм, в некоторых случаях 30 (или около 30), в некоторых случаях превышает или становится равной 35 (или около 35), в некоторых случаях превышает или становится равной 40 (или около 40) или в некоторых случаях превышает или становится равной 45 (или около 45) нанограмм на миллиграмм белков до 100 (или около 100), в некоторых случаях 90 (или около 90), в некоторых случаях 80 (или около 80), в некоторых случаях 70 (или около 70) или в некоторых случаях 60 (или около 60) нанограмм на миллиграмм белков.
В некоторых вариантах осуществления вышеописанную концентрацию гиалуроновой кислоты в слезной жидкости пациента, обусловленную соединениями и/или экстрактами настоящего изобретения, поддерживают в течение периода до, по меньшей мере, около 2 часов, в некоторых случаях около 4 часов, в некоторых случаях около 6 часов, в некоторых случаях около 8 часов, в некоторых случаях около 10 часов, в некоторых случаях около 12 часов или в некоторых случаях от примерно 12 до примерно 24 часов.
Концентрации гиалуроновой кислоты, подробно описанные выше, определяют с помощью метода Дрейфуса (описанного ниже в определениях).
Еще один аспект настоящего изобретения относится к способам стимулирования заживления или повышения скорости заживления ран в и/или на поверхности глаза (например, не относящиеся к синдрому сухого глаза, травмы глаза, послеоперационные хирургические или неспецифические раны) пациента путем введения композиций, содержащих безопасное и эффективное количество одного или более экстрактов, или источников экстрактов, дрожжей рода Pichia, которые индуцируют, стимулируют и/или улучшают продуцирование/высвобождение/доставку/выделение гиалуроновой кислоты или муцина из роговицы и/или в роговицу (а именно, для повышения продуцирования/высвобождения/доставки/выделения гиалуроновой кислоты или муцина из роговицы и/или в роговицу) в определенных вариантах осуществления, помимо соответствующих концентраций гиалуроновой кислоты или муцина, которые обычно вырабатываются у такого пациента без (или в отсутствии) введения композиций, содержащих безопасное и эффективное количество одного или более экстрактов, или источников экстрактов, дрожжей рода Pichia).
Еще один дополнительный аспект настоящего изобретения относится к способам улучшения противомикробных свойств слезной жидкости (или слезной пленки глаза) пациента путем введения композиций, содержащих безопасное и эффективное количество одного или более экстрактов, или источников экстрактов, дрожжей рода Pichia, которые индуцируют, стимулируют и/или улучшают продуцирование/высвобождение/доставку/выделение гиалуроновой кислоты и/или муцина из роговицы и/или в роговицу (а именно, для повышения продуцирования/высвобождения/доставки/выделения муцина из роговицы и/или в роговицу в определенных вариантах осуществления сверх уровня концентрации муцина, обычно вырабатываемого таким пациентом, без (или в отсутствии) введения композиций, содержащих безопасное и эффективное количество такого одного или более экстрактов, или источников экстрактов, дрожжей рода Pichia).
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к микроэмульсионной композиции для лечения глаз, содержащей:
i) один или более экстрактов, или источников экстрактов, дрожжей рода Pichia; и
ii) офтальмологически приемлемый носитель.
при этом микроэмульсионные капли или частицы имеют максимальный размер менее 1500 Å.
Настоящее изобретение относится к способам выработки/высвобождения/доставки/выведения муцина из роговицы и/или в роговицу, включающим этап введения (в некоторых случаях пациенту, требующему такой выработки/высвобождения/доставки/выведения муцина) композиции, а в некоторых вариантах осуществления к офтальмологической микроэмульсионной композиции, содержащей:
i) один или более экстрактов, или источников экстрактов, дрожжей рода Pichia;
ii) в некоторых случаях безопасное и эффективное количество усилителя проницаемости; и
iii) в некоторых случаях офтальмологически приемлемый носитель.
при этом микроэмульсионные капли или частицы имеют максимальный размер менее 1500 Å.
Настоящее изобретение относится к способам профилактики или лечения симптомов синдрома сухого глаза, включающим стадию местного введения (в некоторых случаях у пациента, нуждающегося в такой профилактике или лечении) микроэмульсионной композиции, содержащей:
i) один или более экстрактов, или источников экстрактов, дрожжей рода Pichia;
ii) одно или более мягчительное или успокоительное средство;
iii) в некоторых случаях безопасное и эффективное количество усилителя проницаемости; и
iv) в некоторых случаях офтальмологически приемлемый носитель.
при этом микроэмульсионные капли или частицы имеют максимальный размер менее 1500 Å.
Настоящее изобретение относится к способам поддержания концентрации MU5AC в слезной жидкости в диапазоне от 8 нанограмм до 15 нанограмм на миллиграмм белка или выше, включающим стадию введения (в некоторых случаях пациенту, нуждающемуся в таком поддержании) микроэмульсионной композиции, содержащей:
i) один или более экстрактов, или источников экстрактов, дрожжей рода Pichia;
ii) в некоторых случаях безопасное и эффективное количество усилителя проницаемости; и
iii) в некоторых случаях офтальмологически приемлемый носитель.
при этом микроэмульсионные капли или частицы имеют максимальный размер менее 1500 Å.
Настоящее изобретение относится к способам лечения пациентов со сниженным или низким продуцированием/высвобождением/доставкой/выделением муцина из роговицы и/или в роговицу, включающим стадию местного введения пациенту микроэмульсионной композиции, содержащей:
i) один или более экстрактов, или источников экстрактов, дрожжей рода Pichia;
ii) в некоторых случаях безопасное и эффективное количество усилителя проницаемости; и
iii) в некоторых случаях офтальмологически приемлемый носитель.
при этом микроэмульсионные капли или частицы имеют максимальный размер менее 1500 Å.
Настоящее изобретение относится к способам профилактики или лечения симптомов синдрома сухого глаза, включающим стадию местного введения пациенту (в некоторых случаях пациенту, нуждающемуся в такой профилактической микроэмульсии или уменьшении симптомов сухого глаза) микроэмульсионной композиции, содержащей:
i) один или более экстрактов, или источников экстрактов, дрожжей рода Pichia;
ii) в некоторых случаях безопасное и эффективное количество усилителя проницаемости; и
iii) в некоторых случаях офтальмологически приемлемый носитель.
при этом микроэмульсионные капли или частицы имеют максимальный размер менее 1500 Å.
Настоящее изобретение относится к способам стимулирования заживления или повышения скорости заживления ран в глазу и/или на поверхности глаза (в некоторых случаях пациента, нуждающегося в таком заживлении ран глаз), включающим этап введения микроэмульсионных композиций (т. е., которые повышают продуцирование/высвобождение/доставку/выделение муцина и/или гиалуроновой кислоты из роговицы и/или в роговицу, в определенных вариантах осуществления за пределами уровня концентрации муцина, вырабатываемого таким пациентом без (или в отсутствии) введения микроэмульсионных композиций, содержащих безопасное и эффективное количество одного или более экстрактов, или источников экстрактов, дрожжей рода Pichia), содержащих:
i) один или более экстрактов, или источников экстрактов, дрожжей рода Pichia; и
ii) в некоторых случаях офтальмологически приемлемый носитель.
при этом микроэмульсионные капли или частицы имеют максимальный размер менее 1500 Å.
Настоящее изобретение относится к способам улучшения противомикробных свойств слезной жидкости (или слезной пленки глаз) пациента (в некоторых случаях пациента, нуждающегося в таких противомикробных свойствах), включающим этап введения микроэмульсионных композиций (т. е., которые повышают продуцирование/высвобождение/доставку/выделение муцина и/или гиалуроновой кислоты из роговицы и/или в роговицу, в определенных вариантах осуществления за пределами уровня концентрации муцина, вырабатываемого таким пациентом без (или в отсутствии) введения микроэмульсионных композиций, содержащих безопасное и эффективное количество одного или более экстрактов, или источников экстрактов, дрожжей рода Pichia), содержащих:
i) один или более экстрактов, или источников экстрактов, дрожжей рода Pichia;
ii) в некоторых случаях безопасное и эффективное количество усилителя проницаемости; и
iii) в некоторых случаях офтальмологически приемлемый носитель.
при этом микроэмульсионные капли или частицы имеют максимальный размер менее 1500 Å.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1 представлены столбиковые диаграммы, на которых показано увеличение экспрессии MUC4 в эпителиальных клетках роговицы после добавления экстракта Pichia anomala в питательную среду, содержащую эпителиальные клетки роговицы.
На фиг. 2 представлены столбиковые диаграммы, на которых показано увеличение секреции муцина-1 в эпителиальных клетках роговицы после добавления экстракта Pichia anomala в питательную среду, содержащую эпителиальные клетки роговицы.
На фиг. 3 представлены столбиковые диаграммы, показывающие повышенную выработку муцина-1 в клетках ткани роговицы после местного нанесения экстракта Pichia anomala.
На фиг. 4 представлены столбиковые диаграммы, показывающие повышенную выработку ГК в эпителиальных клетках роговицы после местного нанесения экстракта Pichia anomala через 24 и 48 часов.
На фиг. 5 представлены столбиковые диаграммы, на которых показано статистически значимое увеличение выработки ГК в эпителиальных клетках роговицы через 48 часов после помещения эпителиальных клеток роговицы в питательную среду, содержащую экстракт Pichia anomala.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Считается, что, исходя из описания, представленного в настоящем документе, специалист в данной области сможет использовать это изобретение в самом полном объеме. Следующие специфические варианты осуществления можно рассматривать лишь в качестве иллюстративных примеров, которые ни в коей мере не ограничивают остальную часть настоящего описания.
Композиции настоящего изобретения могут содержать, состоять из или состоять по существу из элементов, стадий и ограничений изобретения, описанных в настоящем документе, а также любых из дополнительных или необязательных ингредиентов, компонентов или ограничений, описанных в настоящем документе.
В настоящем документе термин «содержащий» (и его грамматические разновидности) применяется в широком смысле в значении «имеющий» или «включающий в себя», а не в узком смысле в значении «состоящий только из». В настоящем документе формы единственного числа считаются охватывающими как множественное, так и единственное число.
Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют общепринятое значение, понятное любому специалисту в области, к которой относится изобретение. Кроме того, все публикации, заявки на патенты, патенты и другие ссылки, упомянутые в настоящем документе, включены в настоящий документ в полном объеме путем ссылки в той мере, в которой они не противоречат настоящему описанию. В настоящем документе все процентные значения приведены по массе от общей композиции, если не указано иное
Используемый в настоящем документе термин «роговица» или «роговичный» включает в себя и/или относится к прозрачной передней части глаза, которая покрывает радужную оболочку, зрачок и переднюю камеру, при этом слои данной прозрачной передней части включают в себя слой эпителия роговицы (содержащий клетки эпителия роговицы), боуменову мембрану (также известную как передняя ограничивающая мембрана), строму роговицы (также собственное вещество), десцеметовую мембрану (также заднюю пограничную мембрану) и эндотелий роговицы (простой сквамозный или низкокубический монослой клеток, богатых митохондриями, толщина которого составляет приблизительно 5 мкм).
Функции различных слоев приведены ниже:
Эпителий:
обеспечивает барьер для химических веществ и воды;
обеспечивает барьер для микробов;
обеспечивает гладкую оптическую поверхность как внутреннюю часть поверхности раздела слезной пленки и способствует повышению преломляющей способности глаза; и
содержит клетки Лангерганса, которые выполняют важные иммунологические функции.
Боуменова мембрана:
помогает поддерживать форму роговицы.
Строма роговицы:
обеспечивает механическую прочность роговицы;
обеспечивает прозрачность роговицы; и
действует как преломляющая линза.
Десцеметова мембрана:
действует как поддерживающий слой для клеток эндотелия.
Эндотелий роговицы:
поддерживает прозрачность роговицы, удаляя воду из стромы роговицы.
Слой эпителия роговицы состоит из 5-7 достаточно равномерно расположенных слоев клеток. Толщина эпителия роговицы составляет около 50 мкм. Эпителий является однородным для обеспечения гладкой поверхности и состоит из некератинизированного многослойного плоского эпителия. Без ограничений, накладываемых теорией, считается, что в случае выработки гиалуроновой кислоты слой эпителия роговицы дополнительно содержит структуры с плотными соединениями (т. е. структуры [например, мембраны или пленочные барьеры], как правило, мешающие проникновению химических веществ в ткани в ткани), которые могут препятствовать или выступать в качестве барьера для диффузии одного или более экстрактов или источников экстрактов, дрожжей рода Pichia, снижая диффузию одного или более экстрактов, или источников экстрактов, дрожжей рода Pichia через эпителий роговицы в ткани роговицы, таким образом снижая концентрации экстракта, который может накапливаться в тканях роговицы и контактировать с клеточными участками таких тканей, ответственными за выработку гиалуроновой кислоты.
В настоящем документе фраза «пониженное или низкое продуцирование/высвобождение/доставка/выделение гиалуроновой кислоты из роговицы и/или в роговицу» означает концентрацию гиалуроновой кислоты, которая меньше концентрации гиалуроновой кислоты в слезной жидкости нормального (т.е. здорового) человека, или, в некоторых вариантах осуществления, менее 25 (или около 25) нанограмм на миллиграмм белков, как определено способом, описанным в Dreyfuss JL, Regatieri CV, Coelho B, et al. Altered hyaluronic acid content in tear fluid of patients with adenoviral conjunctivitis (Измененное содержание гиалуроновой кислоты в слезной жидкости пациентов с аденовирусным конъюнктивитом). An Acad Bras Cienc. 2015;87(1):455-462. Этот способ (метод Дерейфуса) воспроизводится ниже:
Отбор проб
Для отбора слезной жидкости полоски Ширмера помещали на височную сторону каждого глаза под веком на 5 минут без применения местных анестетиков. Полоски высушивали при комнатной температуре и хранили при -20°C до анализа.
Подготовка пробы слезной жидкости
Слезные соединения элюировали с полосок Ширмера с использованием 100 мкл дистиллированной воды, и проводили анализ содержания гиалуроновой кислоты и белка.
Измерение гиалуроновой кислоты
Содержание гиалуроновой кислоты в слезной жидкости определяли с помощью неизотопного флуороанализа (см. Martins Jr, Passerotti CC, Maciel RM, Sampaio Lo, Dietrich CP и Nader HB. 2003.) Practical determination of hyaluronan by a new noncompetitive fluorescence-based assay on serum of normal and cirrhotic patients (Практическое определение гиалуронана с помощью нового неконкурентного флуоресцентного анализа в сыворотке крови здоровых людей и больных циррозом). Anal Biochem 319: 65-72.) Элюированные слезные жидкости и стандартные концентрации гиалуроновой кислоты (Sigma, г. Сент-Луис, штат Миссури) добавили в 96-луночные планшеты (FluoNUNC Maxisorp Microtiterplates, г. Роскильд, Дания), предварительно покрытые связывающим гиалуроновую кислоту белком. Затем планшеты последовательно инкубировали с биотинилированным белком, связывающим гиалуроновую кислоту, и меченным европием стрептавидином (Amershan, г. Пискатауэй, штат Нью-Джерси). После этого европий, остающийся в твердой фазе, высвобождали усиливающим раствором и измеряли флуоресценцию с использованием флуориметра с временным разрешением (Perkin-Elmer Life Sciences-Wallac Oy, г. Турку, Финляндия). Данные (отсчеты/с) обрабатывали автоматически с помощью программного обеспечения MultiCalc (Perkin-Elmer Life Sciences-Wallac Oy), и значения выражали в нг/мг белка.
Анализ белков
Общую концентрацию белка слезной жидкости определяли с помощью колориметрического аналитического набора в соответствии с инструкциями производителя (набор для анализа белка компании Bio-Rad, г. Геркулес, штат Калифорния, США). Профиль белка анализировали с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (ДСН-ПААГ), как описано ранее (см. Laemmli UK. 1970.) Cleavage of structural proteins during the assembly of the head of bacteriophage T4 (Расщепление структурных белков в процессе сборки головки бактериофага Т4). Nature 227: 680-685.). Вкратце, 10 мкг белка из образцов слезной жидкости наносили на 3-20% линейный градиентный полиакриламидный гель в восстановительных условиях. После электрофореза гели окрашивали кумасси синим (Bio-Rad, г. Геркулес, штат Калифорния, США). Каждую белковую полосу количественно определяли денситометрией с помощью программного обеспечения ImageJ версии 10.2 для Mac (U.S. National Institutes of Health, г. Бетесда, штат Мэриленд, США). Результаты выражены в произвольных денситометрических единицах (ADU).
В настоящем документе фраза «пониженное или низкое продуцирование/высвобождение/доставка/выделение муцина из роговицы и/или в роговицу» означает концентрацию MUC5AC, которая меньше концентрации MUC5AC в слезной жидкости нормального (т.е. здорового) человека, или, в некоторых вариантах осуществления, менее 6, в некоторых случаях менее 8 нанограмм на миллиграмм белков, как определено способом, описанным в Uchino Y, Uchino M, Yokoi N, et al. Alteration of Tear Mucin 5AC in Office Workers Using Visual Display Terminals (Изменение содержания муцина 5AC в слезной жидкости у офисных работников, использующих видеотерминалы): The Osaka Study. JAMA Ophthalmol. n2014;132(8):985-992. Данный способ (метод Uchino) воспроизводится ниже:
Концентрация MUC5AC в слезной жидкости
Концентрацию секретированного муцина MUC5AC в образцах слезной жидкости количественно определяли с помощью иммуноферментного анализа (E90756Hu; USCN Life Science). (См. Maker AV, Katabi N, Gonen M, et al. Pancreatic cyst fluid and serum mucin levels predict dysplasia in intraductal papillary mucinous neoplasms of the pancreas (Уровни панкреатической кистозной жидкости и муцина в сыворотке крови прогнозируют дисплазию во внутрипротоковых папиллярных муцинозных опухолях поджелудочной железы). Ann Surg Oncol. 2011;18(1):199-206.) Все пробы анализировали в соответствии с инструкциями производителя. Измеряли поглощение при 450 нм, и стандартные растворы в наборе представляли собой рекомбинантный человеческий MUC5AC. Набор реагентов для анализа белка (набор для анализа белка BCA; Pierce) использовали для определения концентрации белка в пробах слезной жидкости. Концентрацию MUC5AC нормализовали к содержанию белка слезной жидкости и выражали в виде белка MUC5AC (нанограмм) на общий белок слезной жидкости (миллиграмм).
В настоящем документе композиция, «по существу свободная» от ингредиента, означает композицию, содержащую около 2% или менее данного ингредиента по массе в расчете на общую массу композиции. Предпочтительно композиция, по существу свободная от ингредиента, содержит около 1% или менее, более предпочтительно около 0,5% или менее, более предпочтительно около 0,1% или менее, более предпочтительно около 0,05% или менее, более предпочтительно около 0,01% или менее ингредиента по массе в расчете на общую массу композиции. В определенных более предпочтительных вариантах осуществления композиция, по существу свободная от ингредиента, свободна от ингредиента, т. е. данный ингредиент в композиции отсутствует.
Используемый в настоящем документе термин «микроэмульсия» означает эмульсии, обладающие одной или более из следующих характеристик: i) они образуются спонтанно или практически спонтанно при приведении в контакт их компонентов, то есть без значительного источника энергии, например, без нагревания или применения оборудования с высоким усилием сдвига или другого вида существенного перемешивания; ii) они демонстрируют термодинамическую стабильность; iii) они являются однофазными; iv) они практически пропускают свет, т.е. прозрачны или опалесцируют при наблюдении оптическими микроскопическими средствами; и/или v) в ненарушенном состоянии они являются оптически изотропными, хотя анизотропную структуру можно наблюдать, например, с помощью рентгеновской методики. Частицы микроэмульсии могут быть сферическими, хотя возможны и другие структуры, например, жидкие кристаллы с пластинчатой, шестиугольной или изотропной симметрией. Обычно микроэмульсии содержат капли или частицы с максимальным размером (например, диаметром) менее 1500 Å, предпочтительно менее 1000 Å, предпочтительно менее 500 Å, но более 100 Å. Под это определение микроэмульсии подпадают самоэмульгирующиеся системы лекарственной доставки (SEDDS). SEDDS представляют собой изотропные смеси масла, поверхностно-активного вещества (с вспомогательным поверхностно-активным веществом или без него) и вспомогательного растворителя, которые спонтанно эмульгируются при воздействии водной среды при осторожном перемешивании. SEDDS можно применять для улучшения биодоступности плохо растворимых в воде лекарственных средств при пероральном введении. Добавление вспомогательного растворителя способствует образованию самоэмульгирующейся системы, поскольку значительно снижает межфазное натяжение. Таким образом, он создает текучую среду на поверхности раздела фаз, обладающую достаточной гибкостью, чтобы принимать различные степени кривизны, необходимые для образования микроэмульсии в широком диапазоне композиций. Дополнительную информацию относительно SEDDS можно найти в публикации патента США № US2018/0036233A1, Shabaik et al., полностью включенной в настоящий документ путем ссылки.
В настоящем документе термин «офтальмологически приемлемый» означает, что ингредиенты, к которым относится термин, подходят для применения в контакте с тканями (например, мягкими тканями глаза или окологлазничных кожных тканей) без побочных эффектов в виде неспецифической токсичности, несовместимости, нестабильности, раздражения, аллергической реакции и т. п. Как будет понятно любому специалисту в данной области, косметически/дерматологически приемлемые соли представляют собой кислые/анионные или щелочные/катионные соли.
При использовании в настоящем документе термин «безопасное и эффективное количество» означает количество описанного экстракта, соединения или композиции, достаточное для индуцирования, стимулирования и/или улучшения продуцирования/высвобождения/доставки/выделения гиалуроновой кислоты и/или муцина из одного или более слоев роговицы и/или в один или более слой роговицы, но достаточно низкое для предотвращения серьезных побочных эффектов. Безопасное и эффективное количество соединения, экстракта или композиции будет меняться в зависимости, например, от возраста, состояния здоровья конечного потребителя и воздействия на него условий окружающей среды, длительности и характера лечения, конкретного применяемого экстракта, ингредиента или композиции, конкретного используемого офтальмологически приемлемого носителя и тому подобных факторов.
В определенных вариантах осуществления настоящее изобретение, описанное в настоящем документе, может быть реализовано на практике в условиях отсутствия любого соединения или элемента (или группы соединений или элементов), на которые нет конкретных указаний в настоящем документе.
В целом в настоящем документе применяются правила номенклатуры Международного союза теоретической и прикладной химии (ИЮПАК) в соответствии со следующими определениями терминов.
Термин «C1-8 алкил», используемый самостоятельно или как часть замещающей группы, относится к насыщенному алифатическому разветвленно- или линейноцепочечному одновалентному углеводородному радикалу, имеющему 1-8 атомов углерода. Например, «C1-8 алкил» конкретно включает в себя радикалы метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, трет-бутил, 1-бутил, 1-пентил, 2-пентил, 3-пентил, 1-гексил, 2-гексил, 3-гексил, 1-гептил, 2-гептил, 3-гептил, 1-октил, 2-октил, 3-октил и т. п. Указанный термин может также относиться к соответствующему алкилдиильному радикалу. Алкильный и алкилдиильный радикалы могут присоединяться к основной молекуле посредством концевого атома углерода или посредством атома углерода внутри цепи. Подобным образом к алкильному или алкилдиильному радикалу может быть присоединено любое число переменных заместителей, допустимое имеющимися валентностями.
Термин «C1-4 алкил», используемый самостоятельно или как часть замещающей группы, относится к насыщенной алифатической разветвленно- или линейноцепочечной одновалентной углеводородной радикальной или алкилдиильной связующей группе, имеющей установленное число атомов углерода, причем радикал получен путем удаления одного атома водорода от атома углерода, а алкилдиильная связующая группа получена путем удаления одного атома водорода из каждого из двух атомов углерода в цепи. Термин «C1-4 алкил» относится к радикалу, имеющему 1-4 атома углерода в линейной или разветвленной конфигурации. Например, «C1-4 алкил» конкретно включает в себя радикалы метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, трет-бутил, 1-бутил и т. п. Алкильный и алкилдиильный радикалы могут присоединяться к основной молекуле посредством концевого атома углерода или посредством атома углерода внутри цепи. Подобным образом к алкильному или алкилдиильному радикалу может быть присоединено любое число переменных заместителей, допустимое имеющимися валентностями.
Термин «C2-4 алкенил» относится к алкенильному радикалу, имеющему 2-4 атома углерода. Например, конкретно включает в себя радикалы этенил, пропенил, аллил (2-пропенил), бутенил и т. п. Как описано выше, алкенильный радикал может быть аналогичным образом присоединен к основной молекуле и дополнительно замещен там, где указано.
Термин «галоген» как таковой или в комбинации с другими терминами означает атом галогена, такой как фтор, хлор, бром или йод.
Термин «замещенный» относится к основной молекуле, в которой один или более атомов водорода было замещены количеством заместителей, допустимым имеющимися валентностями. Замещение не ограничено основной молекулой, но также может происходить в замещающем радикале, при этом радикал превращается в связующую группу.
Термин «независимо выбранный» относится к двум или более заместителям, которые могут быть выбраны из группы переменных заместителей, причем выбранные заместители могут быть одинаковыми или разными.
Термин «зависимо выбранный» относится к одному или более переменным заместителям, которые заданы в указанной комбинации для замены в основной молекуле (например, переменные, которые относятся к группам заместителей, приведенным в табличном списке соединений).
Приемлемые соли, полученные с использованием неорганических оснований, включают в себя, например, соли натрия или калия и т. п. Приемлемые соли, полученные с использованием органических оснований, включают в себя, например, соли, образованные при взаимодействии с первичными, вторичными или третичными аминами и т. п.
Соединения и/или экстракты, которые индуцируют, стимулируют и/или улучшают продуцирование/высвобождение/доставку/выделение гиалуроновой кислоты и/или муцина в роговице.
Настоящее изобретение включает одно или более соединений и/или экстрактов, которые индуцируют, стимулируют и/или улучшают продуцирование/высвобождение/доставку/выделение гиалуроновой кислоты и/или муцина из роговицы и/или в роговицу.
В определенных вариантах осуществления соединения и/или экстракты, которые индуцируют, стимулируют и/или улучшают продуцирование/высвобождение/доставку/выделение гиалуроновой кислоты и/или муцина из роговицы и/или в роговицу, представляют собой, или содержат, экстракты, или источники экстрактов, дрожжей рода Pichia.
Pichia является родом дрожжей в семействе Saccharomycetaceae. Известны более 100 видов этого рода. Подходящие виды для применения в композициях настоящего изобретения включают в себя (выбирают из или выбирают из группы, состоящей из) Pichia anomala, Pichia guilliermondii, Pichia norvegensis и Pichia ohmeri. Pichia anomala (прошлое название Hansenula anomala) может встречаться в некипяченом молоке и сыре. Экстракты дрожжей рода Pichia имеют высокое содержание маннанов, полисахаридов, состоящих из мономеров маннозы. Экстракты или источники экстрактов дрожжей рода Pichia можно выделить из плодов или других надземных частей растения. Можно использовать любой офтальмологически приемлемый экстракт дрожжей рода Pichia. Также можно использовать смеси экстрактов, или источников экстракта, вышеупомянутых видов из рода Pichia.
В определенных вариантах осуществления экстракты, или источники экстрактов, дрожжей рода Pichia, используемые в настоящем изобретении, представляют собой экстракты Pichia anomala. Экстракты Pichia anomala можно выделить из плодов или других надземных частей растения. В некоторых вариантах осуществления приемлемый экстракт Pichia anomala получают из штамма Pichia anomala, находящегося на плодах или листьях киви. В другом варианте осуществления экстракт Pichia anomala можно приобрести у компании Silab-France под торговыми названиями PRO-LIPISKIN, или UNFLAMAGYL®, где экстракт получают из штамма Pichia anomala, находящегося на сахарном тростнике. Предпочтительным для применения в настоящем изобретении является экстракт Pichia anomala, характеризующийся тем, что имеет:
- содержание твердых веществ от 26 до 40 г/л,
- pH от 6 до 7,
- содержание белка от 2 до 170 г/л и
- содержание сахаров (кривая маннозы) в диапазоне от 18 до 30 г/л
(под данную характеризацию подпадают PRO-LIPISKIN и гиалуродин (Silab-France). Гиалуродин представляет собой экстракт Pichia anomala, используемый в примерах (ниже). В одном варианте осуществления экстракт Pichia anomala получают в соответствии со следующим способом, как описано в FR2897266 и FR2938768, которые включены в настоящий документ путем ссылки.
В определенных вариантах осуществления описанный ниже способ экстракции позволяет удалить из экстракта Pichia большую часть белка и повысить концентрацию активного вещества в виде маннана. Способ включает по меньшей мере один этап ферментативного гидролиза белков для получения пептидов и небольших белков, а в определенных вариантах осуществления дополнительный этап удаления этих небольших пептидов и белков путем фильтрования за счет отбора таких молекул по размеру.
В определенных вариантах осуществления экстракты дрожжей рода Pichia, включая экстракт Pichia anomala, получают способом экстракции с участием одного или более ферментов гидролиза для гидролиза белков в дрожжах рода Pichia либо последовательно, либо одновременно.
В определенных вариантах осуществления ферментативный гидролиз используют для расщепления белков в экстракте дрожжей рода Pichia на белковые фракции со средневесовой молекулярной массой менее 5000 Да. Подходящие ферменты гидролиза включают в себя, без ограничений, по меньшей мере одну пептидазу, которая в определенных вариантах осуществления выбрана из папаина, трипсина, химотрипсина, субтилизина, пепсина, термолизина, проназы, флавастацина, энтерокиназы, протеазы фактора Xa, турина, бромелаина, протеиназы K, гененазы I, термитазы, карбоксипептидазы A, карбоксипептидазы B, коллагеназы или их смесей.
В определенных вариантах осуществления ферменты, используемые для получения экстракта дрожжей рода Pichia, инактивируют перед отделением полученных растворимой и нерастворимой фаз.
В одном варианте осуществления экстракт Pichia anomala отличается тем, что имеет:
- содержание твердых веществ от 5 до 300 г/л,
- pH от 4 до 9,
- содержание белка от 2 до 10, предпочтительно 3-9 г/л, и
- содержание сахаров (кривая маннозы) в диапазоне от 1 до 100 г/л
В определенных вариантах осуществления экстракт дрожжей рода Pichia имеет содержание маннана, превышающее или равное 30% от общей массы высушенного экстракта дрожжей рода Pichia, или необязательно содержание маннана, составляющее по меньшей мере 50% по массе от общей массы высушенного экстракта дрожжей рода Pichia.
В определенных вариантах осуществления фазу экстракта дрожжей рода Pichia высушивают (и измеряют содержание твердых веществ) путем пропускания фазы, содержащей экстракт дрожжей рода Pichia, через сушильный шкаф при температуре 105 °C (или около 105 °C) при наличии песка до получения/наблюдения постоянной массы.
В определенных вариантах осуществления содержание твердых веществ (или сухого вещества) в высушенном экстракте дрожжей рода Pichia составляет от 10 до 200 г/л или в некоторых случаях от 26 до 40 г/л.
В определенных вариантах осуществления pH, измеренный потенциометрическим методом при комнатной температуре (25 °C), имеет значения от 4,5 до 8,5, необязательно от 6,0 до 7,0.
Для определения общего содержания сахаров можно использовать метод ДЮБУА (DUBOIS). При наличии концентрированной серной кислоты и фенола восстанавливающие сахара дают оранжево-желтое соединение. Общее содержание сахаров в пробе можно определить из стандартного диапазона (предпочтительно используя кривую анализа маннозы). В определенных вариантах осуществления общее содержание сахаров в высушенном экстракте дрожжей рода Pichia составляет от 7 до 145 г/л или, в некоторых случаях от 18 до 29 г/л. В определенных вариантах осуществления высушенный экстракт дрожжей рода Pichia содержит по меньшей мере 30% всех сахаров по массе высушенного экстракта дрожжей рода Pichia по сравнению с общим содержанием твердых веществ по массе высушенного экстракта дрожжей рода Pichia, в некоторых случаях по меньшей мере 50% по массе высушенного экстракта дрожжей рода Pichia.
В определенных вариантах осуществления углеводная фракция высушенного экстракта дрожжей рода Pichia состоит из маннозы и глюкозы в виде (или по существу в виде) олигосахаридов и полисахаридов, имеющих средневесовую молекулярную массу от около 180 до около 800 000 Да, в некоторых случаях от около 5000 до около 515 000 Да, в некоторых случаях от около 6000 до около 270 000 Да. В определенных вариантах осуществления по меньшей мере 70% (или около 70%), в некоторых случаях по меньшей мере 75% (или около 75%), по меньшей мере 80% (или около 80%), в некоторых случаях по меньшей мере 85% (или около 85%), по меньшей мере 90% (или около 90%), в некоторых случаях по меньшей мере 95% (или около 95%) или 100% (или около 100%) олигосахаридов и полисахаридов в высушенном экстракте дрожжей рода Pichia попадают в вышеуказанные диапазоны средневесовой молекулярной массы.
Определение содержания белков проводят методом Кьельдаля (Kjeldahl). В определенных вариантах осуществления высушенный экстракт дрожжей рода Pichia имеет содержание белков от 4 до 90 г/л или в некоторых случаях от 12 до 18 г/л. Высушенный экстракт дрожжей рода Pichia содержит менее 45% белков или в некоторых случаях менее 30% от общего содержания твердых веществ в высушенном экстракте дрожжей рода Pichia.
В определенных вариантах осуществления высушенный экстракт дрожжей рода Pichia содержит маннаны - маннозы, полимеризованные в виде олигосахаридов и полисахаридов, средневесовая молекулярная масса которых составляет от около 180 до около 800 000 Да, в некоторых случаях от около 5000 до около 515 000 Да, в некоторых случаях от около 6000 до около 270 000 Да в высушенном экстракте дрожжей рода Pichia. В определенных вариантах осуществления по меньшей мере 70% (или около 70%), в некоторых случаях по меньшей мере 75% (или около 75%), по меньшей мере 80% (или около 80%), в некоторых случаях по меньшей мере 85% (или около 85%), по меньшей мере 90% (или около 90%), в некоторых случаях по меньшей мере 95% (или около 95%) или 100% (или около 100%) олигосахаридов и полисахаридов в высушенном экстракте дрожжей рода Pichia попадают в вышеуказанные диапазоны средневесовой молекулярной массы.
В определенных вариантах осуществления после этапа ферментативного гидролиза белков способ экстракции включает этап удаления (например, посредством фильтрования) белков, имеющих средневесовую молекулярную массу менее 5000 Да. Соответственно, экстракты дрожжей рода Pichia свободны или по существу свободны от белков и/или пептидов, имеющих средневесовую молекулярную массу менее 5000 Да.
В определенных вариантах осуществления описанный выше способ экстракции может включать этап дезодорации, отбеливания и/или стабилизации экстракта дрожжей рода Pichia перед фильтрованием. Виды фильтрования могут быть следующими: пресс-фильтрование и стерилизующее фильтрование.
В определенных вариантах осуществления используемые экстракты относятся к разновидности Pichia anomala. Конкретный не имеющий ограничительного характера пример производственного процесса описан ниже.
- Экстракты (или дрожжи) Pichia anomala культивируют в культуральной среде, адаптированной для их развития, затем центрифугируют для извлечения биомассы,
- Затем биомассу размалывают в шаровой мельнице. Затем размолотый материал повторно суспендируют в воде при концентрации 50 грамм на литр перед ферментативным гидролизом в щелочной среде при 30 °C в течение 6 часов,
- После гидролиза продукт центрифугируют и фильтруют перед стерилизацией,
- Путем последовательных фильтрований на фильтрах разных размеров получают гидролизат, содержащий по меньшей мере 30% маннанов относительно общей массы твердых веществ, и/или получают белки с определенной средневесовой молекулярной массой. (Полученный гидролизат находится в виде прозрачного жидкого водного раствора светло-желтого цвета.)
В определенных вариантах осуществления экстракт Pichia anomala получают в соответствии со следующими примерами изготовления:
1. Экстракт Pichia anomala A:
I. Экстракция экстракта Pichia anomala A:
Получение экстракта Pichia anomala A включает следующие этапы:
- культивирование дрожжей Pichia anomala в среде, адаптированной для их развития,
- центрифугирование для извлечения биомассы,
- солюбилизацию биомассы,
- ферментативный гидролиз при щелочном pH,
- разделение растворимой и нерастворимой фаз,
- термообработку,
- фильтрование и
- стерильное фильтрование.
II. Характеристики экстракта Pichia anomala A:
Полученный выше экстракт Pichia anomala A характеризуется следующими параметрами:
- содержание твердых веществ от 48 до 84 г/л,
- pH от 4 до 9,
- содержание белков от 19 до 48 г/л и
- общее содержание сахаров от 10 до 42 г/л.
2. Экстракт Pichia anomala B
I. Экстракция экстракта Pichia anomala B:
Получение экстракта Pichia anomala B включает следующие этапы:
- культивирование дрожжей Pichia anomala в среде, адаптированной для их развития,
- центрифугирование для извлечения биомассы,
- солюбилизацию биомассы,
- ферментативный гидролиз при кислом pH,
- разделение растворимой и нерастворимой фаз,
- термообработку,
- фильтрование и
- стерильное фильтрование.
II. Характеристика экстракта Pichia anomala B:
Полученный выше экстракт Pichia anomala B характеризуется следующими параметрами:
- содержание твердых веществ от 58 до 95 г/л,
- pH от 4 до 9,
- содержание белков от 23 до 54 г/л и
- общее содержание сахаров от 12 до 32 г/л.
3. Экстракт Pichia anomala C
I. Экстракция экстракта Pichia anomala C:
Получение экстракта Pichia anomala C включает следующие этапы:
- культивирование дрожжей Pichia anomala в среде, адаптированной для их развития,
- центрифугирование для извлечения биомассы,
- солюбилизацию биомассы,
- последовательные операции ферментативного гидролиза в щелочной среде,
- разделение растворимой и нерастворимой фаз,
- термообработку,
- фильтрование и
- стерильное фильтрование.
II. Характеристика экстракта Pichia anomala C:
Полученный выше экстракт Pichia anomala C характеризуется следующими параметрами:
- содержание твердых веществ от 91 до 195 г/л,
- pH от 4 до 9,
- содержание белков от 36 до 111 г/л и
- общее содержание сахаров от 18 до 65 г/л.
4. Экстракт Pichia anomala D
I. Экстракция экстракта Pichia anomala D:
Получение экстракта Pichia anomala D включает следующие этапы:
- культивирование дрожжей Pichia anomala в среде, адаптированной для их развития,
- центрифугирование для извлечения биомассы,
- солюбилизацию биомассы,
- гидролизуют одновременно с по меньшей мере двумя ферментами при кислом pH,
- разделение растворимой и нерастворимой фаз,
- термообработку,
- фильтрование и
- стерильное фильтрование.
II. Характеристика экстракта Pichia anomala D:
Полученный выше экстракт Pichia anomala D характеризуется следующими параметрами:
- содержание твердых веществ от 5 до 53 г/л,
- pH от 4 до 9,
- содержание белков от 2 до 30 г/л и
- общее содержание сахаров от 1 до 18 г/л.
5. Экстракт Pichia anomala E
I. Экстракция экстракта Pichia anomala E:
Получение экстракта Pichia anomala E включает следующие этапы:
- культивирование дрожжей Pichia anomala в среде, адаптированной для их развития,
- центрифугирование для извлечения биомассы,
- солюбилизация биомассы в водно-гликолевой среде,
- гидролизуют одновременно с по меньшей мере двумя ферментами при кислом pH,
- разделение растворимой и нерастворимой фаз,
- термообработку,
- фильтрование и
- стерильное фильтрование.
II. Характеристика экстракта Pichia anomala E:
Полученный выше экстракт Pichia anomala E характеризуется следующими параметрами:
- содержание твердых веществ от 172 до 300 г/л,
- pH от 4 до 9,
- содержание белка от 69 до 170 г/л и
- общее содержание сахаров от 34 до 100 г/л.
Предпочтительно экстракт Pichia anomala получают с использованием способа получения экстракта Pichia anomala D, как описано выше.
В определенных вариантах осуществления экстракт, или источник экстрактов, дрожжей рода Pichia содержит олигосахариды и полисахариды со средней степенью полимеризации от DP 1 до DP 4444, необязательно от DP 30 до DP 2860, необязательно от DP 35 до DP 1500. В определенных вариантах осуществления по меньшей мере 70% (или около 70%), в некоторых случаях по меньшей мере 75% (или около 75%), по меньшей мере 80% (или около 80%), в некоторых случаях по меньшей мере 85% (или около 85%), по меньшей мере 90% (или около 90%), в некоторых случаях по меньшей мере 95% (или около 95%) или 100% (или около 100%) олигосахаридов и полисахаридов в высушенном экстракте дрожжей рода Pichia попадают в вышеуказанные диапазоны средней степени полимеризации.
В определенных вариантах осуществления экстракт, или источник экстрактов, дрожжей рода Pichia присутствуют в композициях настоящего изобретения, чтобы после местного нанесения создать у пользователя в роговице или клетках тканей, или в контакте со роговицей или клетками тканей, концентрацию экстракта Pichia по меньшей мере от 0,3 мг/мл (или около 0,3 мг/мл), в некоторых случаях по меньшей мере 0,5 мг/мл (или около 0,5 мг/мл), в некоторых случаях по меньшей мере 1 мг/мл (или около 1 мг/мл), в некоторых случаях по меньшей мере 1,5 мг/мл (или около 1,5 мг/мл), в некоторых случаях по меньшей мере 2 мг/мл (или около 2 мг/мл), в некоторых случаях по меньшей мере 2,5 мг/мл (или около 2,5 мг/мл), в некоторых случаях по меньшей мере 3 мг/мл (или около 3 мг/мл), в некоторых случаях по меньшей мере 3,5 мг/мл (или около 3,5 мг/мл), в некоторых случаях по меньшей мере 4 мг/мл (или около 4 мг/мл), в некоторых случаях по меньшей мере 4,5 мг/мл (или около 4,5 мг/мл), в некоторых случаях по меньшей мере 5 мг/мл (или около 5 мг/мл), или по меньшей мере 5,5 мг/мл (или около 5,5 мг/мл), в некоторых случаях по меньшей мере 6 мг/мл (или около 6 мг/мл), или в некоторых случаях по меньшей мере 6,5 мг/мл (или около 6,5 мг/мл), в некоторых случаях по меньшей мере 7 мг/мл (или около 7 мг/мл), в некоторых случаях по меньшей мере 7,5 мг/мл (или около 7,5 мг/мл), в некоторых случаях по меньшей мере 8 мг/мл (или около 8 мг/мл), в некоторых случаях по меньшей мере 8,5 мг/мл (или около 8,5 мг/мл), в некоторых случаях по меньшей мере 9 мг/мл (или около 9 мг/мл), в некоторых случаях по меньшей мере 8,5 мг/мл (или около 8,5 мг/мл), в некоторых случаях по меньшей мере 9 мг/мл (или около 9 мг/мл), в некоторых случаях по меньшей мере 9,5 мг/мл (или около 9,5 мг/мл), или в некоторых случаях по меньшей мере 10 мг/мл (или около 10 мг/мл) до 100 мг/мл (или около 100 мг/мл), в некоторых случаях до 95 мг/мл (или около 95 мг/мл), в некоторых случаях до 90 мг/мл (или около 90 мг/мл), в некоторых случаях до 85 мг/мл (или около 85 мг/мл), в некоторых случаях до 80 мг/мл (или около 80 мг/мл), в некоторых случаях до 75 мг/мл (или около 75 мг/мл), в некоторых случаях до 70 мг/мл (или около 70 мг/мл), в некоторых случаях до 65 мг/мл (или около 65 мг/мл), в некоторых случаях до 60 мг/мл (или около 60 мг/мл), в некоторых случаях до 55 мг/мл (или около 55 мг/мл), в некоторых случаях до 50 мг/мл (или около 50 мг/мл), в некоторых случаях до 45 мг/мл (или около 45 мг/мл), в некоторых случаях до 40 мг/мл (или около 40 мг/мл), в некоторых случаях до 35 мг/мл (или около 35 мг/мл), в некоторых случаях до 30 мг/мл (или около 30 мг/мл), в некоторых случаях до 25 мг/мл (или около 25 мг/мл), в некоторых случаях до 20 мг/мл (или около 20 мг/мл), или в некоторых случаях до 15 мг/мл (или около 15 мг/мл).
В определенных вариантах осуществления экстракт, или источник экстрактов, дрожжей рода Pichia присутствуют в композициях настоящего изобретения в концентрации от 0,01% (или около 0,01%), в некоторых случаях от 0,05% (или около 0,05%), в некоторых случаях от 0,1% (или около 0,1%), в некоторых случаях от 0,5% (или около 0,5%), в некоторых случаях от 1% (или около 1%), в некоторых случаях от 1,5% (или около 1,5%), в некоторых случаях от 2% (или около 2%), в некоторых случаях от 2,5% (или около 2,5%), в некоторых случаях от 3% (или около 3%), в некоторых случаях от 3,5%, (или около 3,5%), в некоторых случаях от 4% (или около 4%), в некоторых случаях от 4,5% (или около 4,5%), в некоторых случаях от 5% (или около 5%), в некоторых случаях от 5,5% (или около 5,5%), в некоторых случаях от 6% (или около 6%), в некоторых случаях от 6,5% (или около 6,5%), в некоторых случаях от 7% (или около 7%), в некоторых случаях от 7,5% (или около 7,5%), в некоторых случаях от 8% (или около 8%), в некоторых случаях от 8,5% (или около 8,5%), в некоторых случаях от 9% (или около 9%), в некоторых случаях от 9,5% (или около 9,5%), в некоторых случаях от 10% (или около 10%), в некоторых случаях от 10,5% (или около 10,5%), в некоторых случаях от 11% (или около 11%), в некоторых случаях от 11,5% (или около 11,5%), в некоторых случаях от 12% (или около 12%), в некоторых случаях от 12,5% (или около 12,5%), в некоторых случаях от 13% (или около 13%), в некоторых случаях от 13,5% (или около 13,5%), в некоторых случаях от 14% (или около 14%), в некоторых случаях от 14,5% (или около 14,5%), в некоторых случаях от 15% (или около 15%), в некоторых случаях от 15,5% (или около 15,5%), в некоторых случаях от 16% (или около 16%), в некоторых случаях от 16,5% (или около 16,5%), в некоторых случаях от 17% (или около 17%), в некоторых случаях от 17,5% (или около 17,5%), в некоторых случаях от 18% (или около 18%), в некоторых случаях от 18,5% (или около 18,5%), в некоторых случаях от 19% (или около 19%), в некоторых случаях от 19,5% (или около 19,5%), в некоторых случаях от 20% (или около 20%), в некоторых случаях от 20,5% (или около 20,5%) до 30% (или около 30%), в некоторых случаях до 35% (или около 35%), в некоторых случаях до 40% (или около 40%), в некоторых случаях до 45% (или около 45%), в некоторых случаях до 50% (или около 50%), в некоторых случаях до 55% (или около 55%), в некоторых случаях до 60% (или около 60%), в некоторых случаях до 65% (или около 65%), в некоторых случаях до 70% (или около 70%), в некоторых случаях до 75% (или около 75%), в некоторых случаях до 80% (или около 80%), в некоторых случаях до 85% (или около 85%), в некоторых случаях до 90% (или около 90%), в некоторых случаях до 95% (или около 95%) или в некоторых случаях до 100% (или около 100%) по массе от общей массы композиции.
Усилитель проницаемости
В определенных вариантах осуществления композиции настоящего изобретения необязательно содержат усилитель проницаемости.
Подходящие усилители проницаемости включают в себя (выбирают из или выбирают из группы, состоящей из), по отдельности либо в комбинации, поверхностно-активные вещества, такие как сапонины, полиоксиэтилен, простые эфиры полиоксиэтилена жирных кислот, такие как простой полиоксиэтилен 4-, 9-, 10- и 23-лауриловый эфир, простой полиоксиэтилен 10- и 20-цетиловый эфир, простой полиоксиэтилен 10- и 20-стеариловый эфир, сорбитанмоноолеат, сорбитанмонолаурат, полиоксиэтиленмонолаурат, полиоксиэтиленсорбитаны, такие как полиоксиэтиленсорбитанмонолаурат, декаметоний, бромид декаметония и бромид додецилтриметиламмония; хелаторы, такие как природные поликислоты (например, лимонная кислота), фосфатные соли (например, пирофосфат динатрия), фосфонаты, бисфосфонаты (например, этидроновая кислота), аминокарбоновые кислоты (например, этилендиаминтетрауксусная кислота (EDTA) и динатрий EDTA) и этилендиамин-N, N’-диянтарная кислота (EDDS)); желчные кислоты и соли, такие как холевая кислота, дезоксихолевая кислота, гликохолевая кислота, гликодезоксихолевая кислота, таурохолевая кислота, тауродезоксихолевая кислота, холат натрия, гликохолат натрия, гликохолат, дезоксихолат натрия, таурохолат натрия, гликодезоксихолат натрия, тауродезоксихолат натрия, хенодезоксихолевая кислота и урсодезоксихолевая кислота; производные фузидовой кислоты, глицирризиновую кислоту и глицирризинат аммония с сапонин-EDTA, фузидовую кислоту, простой полиоксиэтилен 9-лауриловый эфир, простой полиоксиэтилен 20-стеариловый эфир, гликохолат или смеси любых из вышеперечисленных веществ.
Концентрация вводимого усилителя проницаемости должна соответствовать минимальному количеству, необходимому для достаточного увеличения абсорбции соединения и/или экстракта через слизистую оболочку или другие защитные мембраны глаза. Обычно в композициях настоящего изобретения можно использовать концентрации в диапазоне от 0,01% (или около 0,01%), необязательно от 0,05% (или около 0,05%), необязательно от 0,1% (или около 0,1%), необязательно от 0,15% (или около 0,15%), необязательно от 0,2% (или около 0,2%), необязательно от 0,25% (или около 0,25%) до 2% (или около 2%), необязательно до 2,5% (или около 2,5%), необязательно до 3% (или около 3%), необязательно до 3,5%, (или около 3,5%), необязательно до 4% (или около 4%), необязательно до 4,5% (или около 4,5%), необязательно до 5% (или около 5%), необязательно до 5,5% (или около 5,5%), необязательно до 6% (или около 6%), необязательно до 6,5% (или около 6,5%), необязательно до 7% (или около 7%), необязательно до 7,5% (или около 7,5%), необязательно до 8% (или около 8%), необязательно до 8,5% (или около 8,5%), необязательно до 9% (или около 9%), необязательно до 9,5% (или около 9,5%), необязательно до 10% (или около 10%), необязательно до 10,5% (или около 10,5%), необязательно до 11% (или около 11%), необязательно до 11,5% (или около 11,5%), необязательно до 12% (или около 12%), необязательно до 12,5% (или около 12,5%), необязательно до 13% (или около 13%), необязательно до 13,5% (или около 13,5%), необязательно до 14% (или около 14%), необязательно до 14,5% (или около 14,5%), необязательно до 15% (или около 15%), необязательно до 15,5% (или около 15,5%), необязательно до 16% (или около 16%), необязательно до 16,5% (или около 16,5%), необязательно до 17% (или около 17%), необязательно до 17,5% (или около 17,5%), необязательно до 18% (или около 18%), необязательно до 18,5% (или около 18,5%), необязательно до 19% (или около 19%), необязательно до 19,5% (или около 19,5%), необязательно до 20% (или около 20%) от общего количества композиции (масс./об.).
Офтальмологически приемлемый носитель
Композиции настоящего изобретения также содержат водный раствор эмульсии типа «масло в воде», носитель эмульсии типа «вода в масле», микроэмульсию типа «масло в воде» или микроэмульсионный носитель типа «вода в масле». Носитель является офтальмологически приемлемым. Используемые носители типа «масло в воде» и «вода в масле» можно найти в публикации патента США № 20030165545A1 и патентах США №№ 9480645, 8828412 и 8496976, каждый из которых полностью включен в настоящий документ путем ссылки.
В определенных вариантах осуществления композиции настоящего изобретения включают эмульсии, в некоторых случаях самоэмульгирующиеся эмульсии, включая маслянистый компонент, такой как, например, одно или более масел, без ограничений, минеральное масло и/или одно или более других традиционных хорошо известных и/или коммерчески доступных масел, приемлемых для применения в настоящем изобретении; поверхностно-активный компонент, который включает три или более поверхностно-активных веществ; и водный компонент, который включает водную фазу. Кроме того, в настоящих композициях можно использовать несколько дополнительных компонентов. Композиции настоящего изобретения являются по существу нетоксичными и/или не раздражающими и/или не повреждающими глаз, и могут обеспечивать защитную функцию для глазных клеток и тканей.
Для образования настоящих композиций используют одно или более масел или маслянистых веществ. Можно использовать любое подходящее масло, маслянистое вещество или комбинации масел или маслянистых веществ при условии, что такие масла и/или маслянистые вещества эффективны в настоящих композициях и не вызывают значительного или существенного вредного воздействия на человека или животного, которому вводят композицию, или на обрабатываемую контактную линзу или на ношение обрабатываемой контактной линзы или на пользователя обрабатываемой контактной линзы. Маслянистый компонент может, например, без ограничений, представлять собой высший глицерид жирной кислоты, например, касторовое масло, кукурузное масло, подсолнечное масло и т. п., а также их смеси. Маслянистый компонент может включать в себя одно или более неполярных масел, таких как минеральное масло, силиконовое масло и т. п., а также их смеси.
Композиции настоящего изобретения могут в некоторых случаях содержать один или более дополнительных эксципиентов и/или один или более дополнительных активных ингредиентов. Примеры таких необязательных компонентов описаны ниже.
Эксципиенты, которые обычно используют в офтальмологических композициях, включают в себя, без ограничений, мягчительные средства, регуляторы тоничности, консерванты, хелатирующие, буферные агенты (отличные от органических кислот настоящего изобретения и дополняющие их) и поверхностно-активные вещества. Другие эксципиенты содержат солюбилизирующие, стабилизирующие, способствующие повышению комфорта агенты, полимеры, мягчители, регуляторы рН (отличные от органических кислот настоящего изобретения и дополняющие их) и/или смазывающие средства. В композициях настоящего изобретения можно применять любые из множества эксципиентов, включая воду, смеси воды и растворителей, смешивающихся с водой, таких как растительные масла или минеральные масла, содержащие от 0,5% до 5% нетоксичных водорастворимых полимеров, натуральные продукты, такие как агар и гуммиарабик, производные крахмала, такие как ацетат крахмала и гидроксипропилкрахмал, а также другие синтетические продукты, такие как поливиниловый спирт, поливинилпирролидон, поливинилметиловый эфир, полиэтиленоксид, и предпочтительно поперечно-сшитая полиакриловая кислота, и их смеси.
Мягчительные и успокоительные средства, применяемые в вариантах осуществления настоящего изобретения, включают в себя, без ограничений, производные целлюлозы (такие как гидроксиэтилцеллюлоза, метилцеллюлоза, гипромеллоза или их смеси), гиалуроновую кислоту или ее соль (например, гиалуронат натрия), экстракт семян тамаринда, глицерин, поливинилпирролидон, полиэтиленоксид, полиэтиленгликоль, пропиленгликоль и полиакриловую кислоту и их смесей. В некоторых вариантах осуществления одно или более веществ из гиалуроновой кислоты, пропиленгликоля, экстракта семян тамаринда, глицерина и/или полиэтиленгликоля 400 представляют собой мягчительные и успокоительные средства. В некоторых вариантах осуществления мягчительное и успокоительное средство выбирают из гиалуроновой кислоты, экстракта семян тамаринда или их смесей.
Композиции настоящего изобретения офтальмологически приемлемы для закапывания в глаза пациента. Термин «водный», как правило, обозначает водный состав, в котором эксципиент составляет более чем около 50%, предпочтительно более чем около 75% или в частности более чем около 90% от массы воды. В некоторых вариантах осуществления композиции настоящего изобретения по существу отсутствуют соединения, раздражающие глаза. В некоторых вариантах осуществления композиции настоящего изобретения по существу отсутствуют свободные жирные кислоты и спирты C1 - C4. В некоторых вариантах осуществления композиции настоящего изобретения содержат менее 40% (или около 40%), в некоторых случаях менее 35% (или около 35%), в некоторых случаях менее 30% (или около 30%), в некоторых случаях менее 25% (или около 25%); в некоторых случаях менее 20% (или около 20%), в некоторых случаях менее 15% (или около 15%), в некоторых случаях менее 10% (или около 10%) или в некоторых случаях менее 5% (или около 5%) неспиртового, органического наполнителя или растворителя от общей массы композиции. Эти капли могут быть извлечены из однодозной ампулы, которая предпочтительно может быть стерильной, и тогда исчезает потребность в бактериостатических компонентах в составе. Альтернативно капли могут быть извлечены из многодозового флакона, который может предпочтительно содержать устройство, извлекающее любой консервант из композиции по мере ее выдачи, и такие устройства известны в данной области.
В определенных вариантах осуществления используют композиции настоящего изобретения изотонического или слабо гипотонического типа, чтобы преодолеть любую гипертоничность слез, вызванную обезвоживанием и/или заболеванием. Для этого может потребоваться регулятор тоничности, чтобы довести уровень осмоляльности состава до или около 210-320 миллиосмолей на килограмм (мОсм/кг). Композиции настоящего изобретения обладают осмоляльностью, относящейся по существу к диапазону 220-320 мОсм/кг, или необязательно обладают осмоляльностью, относящейся к диапазону 235-300 мОсм/кг. Состав офтальмических композиций будет по существу соответствовать составу стерильных водных растворов.
Осмоляльность композиций настоящего изобретения можно регулировать регуляторами тоничности до значения, совместимого с предполагаемым применением композиций. Например, осмоляльность композиции можно регулировать для аппроксимации осмотического давления нормальной слезной жидкости, что эквивалентно приблизительно 0,9 масс./об.% хлорида натрия в воде. Примеры приемлемых регуляторов тоничности включают, без ограничений, хлорид натрия, калия, кальция и магния; декстрозу; глицерин; пропиленгликоль; маннит; сорбит и т. п., а также их смеси. В одном варианте осуществления для регулирования тоничности композиции используется комбинация хлорида натрия и хлорида калия.
Композиции настоящего изобретения можно также использовать для нанесения фармацевтически активных соединений. Такие соединения включают, без ограничений, терапевтические средства от глаукомы, обезболивающие средства, противовоспалительные и противоаллергические лекарственные средства, а также противомикробные средства. Более конкретные примеры фармацевтически активных соединений включают в себя бетаксолол, тимолол, пилокарпин, ингибиторы карбоангидразы и простагландины; дофаминэргические антагонисты; послеоперационные гипотензивные агенты, такие как пара-аминоклонидин (апраклонидин); противоинфекционные средства, такие как ципрофлоксацин, моксифлоксацин и тобрамицин; нестероидные и стероидные противовоспалительные препараты, такие как напроксен, диклофенак, непафенак, супрофен, кеторолак, тетрагидрокортизол и дексаметазон; терапевтические средства от сухости глаз, такие как ингибиторы PDE4; и противоаллергические лекарственные средства, такие как ингибиторы H1/H4, ингибиторы H4, олопатадин или их смеси.
Предполагается также, что концентрации ингредиентов, входящих в составы настоящего изобретения, могут изменяться. Специалисту среднего уровня в данной области будет понятно, что концентрации могут изменяться в зависимости от добавления, замены и/или изъятия ингредиентов в данном составе.
В некоторых вариантах осуществления композиции настоящего изобретения могут иметь pH, совместимый с предполагаемым применением, и часто находящийся в диапазоне от 4 (или около 4) до 10 (или около 10), в некоторых случаях от 6 (или около 6) до 8 (или около 8), в некоторых случаях от 6,5 (или около 6.5) до 7,5 (или около 7,5) или в некоторых случаях от 6,8 (или около 6.8) до 7,2 (или около 7,2).
В некоторых вариантах осуществления можно использовать различные традиционные буферные растворы, такие как фосфат, борат, цитрат, ацетат, гистидин, трис, бис-трис и т. п., а также их смеси. Боратные буферные растворы включают борную кислоту и ее соли, такие как борат натрия или калия. Также можно использовать тетраборат калия или метаборат калия, которые образуют борную кислоту или соль борной кислоты в растворе. Также можно использовать гидратированные соли, такие как декагидрат бората натрия. Фосфатные буферы включают фосфорную кислоту и ее соли; например, M 2HPO4 и MH2PO4, где M представляет собой щелочной металл, такой как натрий и калий. Также могут быть применены водные соли. В одном варианте осуществления настоящего изобретения в качестве буферных растворов используют Na2HPO4.7H2 O и NaH2PO2.H2O. Термин «фосфат» также включает в себя соединения, которые образуют фосфорную кислоту или соль фосфорной кислоты в растворе. Кроме того, в указанных выше буферных растворах также можно использовать органические противоионы. Концентрация буферного раствора по существу варьируется от приблизительно 0,01 до 2,5 масс./об.% и предпочтительно варьируется от около 0,05 до около 0,5 масс./об.%.
В некоторых вариантах осуществления вязкость композиций по настоящему изобретению находится в диапазоне от приблизительно 1 до приблизительно 500 сПз, в некоторых случаях от приблизительно 10 до приблизительно 200 сПз или в некоторых случаях от приблизительно 10 до приблизительно 100 сПз при измерении на реометре AR 2000 TA Instruments. Реометр AR 2000 TA Instruments необходимо использовать с методом испытания текучести AR2000 программного обеспечения TA Rheological Advantage с геометрией стальных пластин 40 мм; диапазоны вязкости должны быть определены путем измерения скорости потока в стационарном состоянии с контролируемой скоростью сдвига от 0 с¯¹ до 200 с¯¹.
В некоторых вариантах осуществления композиции настоящего изобретения используются в качестве раствора для закапывания глаз, раствора для промывания глаз, раствора для смазывания и/или увлажнения контактных линз, раствора для распыления, орошения или любого другого способа введения композиции в глаз.
Композиции настоящего изобретения также можно использовать в качестве упаковочных растворов для контактных линз. В некоторых вариантах осуществления в качестве упаковочных растворов композиции настоящего изобретения могут быть герметизированы в блистерную упаковку, а также пригодны для стерилизации.
Примеры блистерных упаковок и способов стерилизации описаны в следующих источниках, которые полностью включены в настоящий документ путем ссылки; патенты США № D435966; 4 691 820; 5 467 868; 5 704 468; 5 823 327; 6 050 398; 5 696 686; 6 018 931; 5 577 367; и 5 488 815. Эта часть производственного процесса представляет собой другой способ обработки офтальмологических изделий противоаллергическим веществом, а именно добавление противоаллергических веществ к раствору перед запечатыванием упаковки с последующей стерилизацией упаковки. Данный способ является предпочтительным способом обработки офтальмологических изделий противоаллергическими веществами.
Стерилизацию можно проводить при разных температурах и в течение разных периодов времени. Предпочтительные условия стерилизации находятся в диапазоне от приблизительно 100 °C в течение приблизительно 8 часов до приблизительно 150 °C в течение приблизительно 0,5 минут. Предпочтительные условия стерилизации находятся в диапазоне от приблизительно 115 °C в течение приблизительно 2,5 часов до приблизительно 130 °C в течение приблизительно 5,0 минут. Предпочтительные условия стерилизации составляют приблизительно 124 °C в течение приблизительно 18 минут.
При использовании в качестве упаковочных растворов композиции настоящего изобретения могут быть водными. Типичные упаковочные растворы без ограничений включают в себя физиологические растворы, другие буферные растворы и деионизированную воду. В некоторых вариантах осуществления упаковочный раствор представляет собой водный раствор в деиоинизированной воде или физиологическом растворе, содержащий соли, включая, без ограничений, хлорид натрия, борат натрия, фосфат натрия, гидрофосфат натрия, дигидрофосфат натрия или соответствующие им калиевые соли. Эти ингредиенты, как правило, объединяются с образованием буферных растворов, включающих кислоту и сопряженное основание, так что добавление кислот и оснований приводит лишь к относительно небольшому изменению pH. В некоторых вариантах осуществления pH упаковочного раствора соответствует описанному выше. Буферные растворы могут дополнительно включать в себя 2-(N-морфолино)этансульфоновую кислоту (MES), гидроксид натрия, 2,2-бис(гидроксиметил)-2,2 ',2 "-нитрилотриэтанол, n-трис(гидроксиметил)метил-2-аминоэтансульфоновую кислоту, лимонную кислоту, цитрат натрия, карбонат натрия, бикарбонат натрия, уксусную кислоту, ацетат натрия, этилендиаминтетрауксусную кислоту и т. п., а также их комбинации. Предпочтительно, чтобы раствор представлял собой боратный или фосфатный буферный солевой раствор или деионизированную воду. Наиболее предпочтительный раствор содержит от приблизительно 500 м. д. до приблизительно 18 500 м. д. бората натрия, наиболее предпочтительно приблизительно 1000 м. д. бората натрия.
Если какие-либо ингредиенты, входящие в состав упаковочных растворов, подвергаются окислительному разложению, то могут быть добавлены агенты, стабилизирующие упаковочные растворы, содержащие такие ингредиенты. К таким «стабилизаторам окисления» относятся, без ограничений, хелатирующие средства, такие как ЭДТА, Dequest, десферал, кремнезем, производные хитина, такие как хитозан, целлюлоза и ее производные, а также N, N, N ',N', N ", N" -гекса(2-пиридил)-1,3,5-трис(аминометил)бензол, а также некоторые макроциклические лиганды, такие как краун-эфиры, лигандсодержащие узлы и катенаны. См. David A. Leigh et al Angew. Chem Int. Ed., 2001, 40, No. 8, pgs. 1538-1542 and Jean-Claude Chambron et al. Pure & Appl. Chem., 1990, Vol. 62, No. 6, pgs. 1027-1034. Стабилизаторы окисления могут включать другие соединения, ингибирующие окисление, такие как соединения, выбранные из группы, состоящей из 2,2 ',2 ",6,6',6" -гекса-(1,1-диметилэтил)4,4 ',4 "-[(2,4,6-триметил-1,3,5-бензолтриил)-трисметилен]-трифенола (Irganox 1330), 1,3,5трис[3,5-ди(1,1-диметилэтил)4-гидроксибензил]-1 H,3 H,5 H-1,3,5-триазин-2,4,6-трион, пентаэритритилтетракис[3-[3,5-ди(1,1-диметилэтил)-4-гидроксифенил]-пропионат], октадецил-3-[3,5-ди(1,1-диметилэтил)-4-гидроксифенил]-пропионат, трис[2,4-ди(1,1-диметилэтил)-фенил]-фосфит, 2,2'-ди(октадецилокси)-5,5'-спироби(1,3,2-диоксафосфоринан), диоктадецил дисульфид, дидодецил-3,3'-тиодипропионат, диоктадецил-3,3'-тиодипропионат, бутилгидрокситолуол, этилен бис[3,3-ди[3-(1,1-диметилэтил)-4-гидроксифенил]бутират] и их смеси. Предпочтительными стабилизаторами окисления являются диэтилентриаминпентауксусная кислота (DTPA) или соли DTPA, такие как CaNa3DTPA, ZnNa3DTPA и Ca2DTPA. См. заявку на патент США № 60/783,557, поданную 17 марта 2006 г., озаглавленную «Способы стабилизации фармацевтических композиций, нестойких к окислению», и соответствующую ему безусловную заявку, которая полностью включена в настоящий документ путем ссылки. В некоторых вариантах осуществления концентрация стабилизаторов окисления в растворе составляет от около 2,5 мкмоль/л до около 5000 мкмоль/л, в некоторых случаях от около 20 мкмоль/л до около 1000 мкмоль/л, в некоторых случаях от около 100 мкмоль/л до около 1000 мкмоль/л или в некоторых случаях от около 100 мкмоль/л до около 500 мкмоль/л.
В конкретных вариантах осуществления композиции настоящего изобретения составляют для введения с любой частотой введения, включая один раз в неделю, один раз в пять дней, один раз в три дня, один раз в два дня, два раза в день, три раза в день, четыре раза в день, пять раз в день, шесть раз в день, восемь раз в день, каждый час или с большей частотой. Такую частоту дозирования поддерживают также в течение периода времени разной длительности в зависимости от терапевтических потребностей пациента. Длительность конкретного терапевтического режима может варьироваться от режима с однократным дозированием до режима, длящегося несколько месяцев или лет. Специалисту среднего уровня в данной области будет знакомо определение терапевтического режима по конкретным показаниям.
Композиция и продукты, содержащие такие композиции данного изобретения, можно получать с применением методики, хорошо известной специалисту средней квалификации в данной области.
ПРИМЕРЫ
Любые композиции настоящего изобретения, описанные в примерах ниже, иллюстрируют конкретные варианты осуществления композиций настоящего изобретения, но не ограничиваются ими. Другие модификации могут быть выполнены специалистом в данной области без отступления от сущности и объема данного изобретения.
В примерах использовали следующие способы испытания.
Пример 1
Для уменьшения препятствий, потенциально вызванных структурами с плотными соединениями (т. е. поверхностными структурами [например, мембранными или пленочными барьерами], как правило, мешающими проникновению химических веществ в ткани), индуцирование секреции муцина в тканях эпикорнеальной оболочки человека с 3-мерной структурой наблюдали путем приведения тканей роговицы в контакт с питательной средой, содержащей ферментативные экстракты Pichia anomala (гиалурондин) (т. е. "обработанные" среды) таким образом, что нижний слой клеток роговичных тканей (т.е., клеточный слой, не имеющий плотных соединений, мешающих проникновению химических веществ в ткани) был погружен в питательную среду. При приведении в контакт нижнего клеточного слоя тканей роговицы с питательной средой, содержащей ферментативные экстракты Pichia anomala, экстракт может непосредственно контактировать и перемещаться вверх во внутренние ткани роговицы без необходимости сначала пройти через любые структуры с плотными соединениями или другой поверхностный барьер, обеспечивая повышенную биодоступность Pichia anomala для клеток ткани роговицы.
Ткани эпикорнеальной оболочки человека с 3-мерной структурой в питательной среде, обработанной ферментативными экстрактами Pichia anomala в концентрации 1,56 мг/мл и 1,95 мг/мл (гиалуродин), показали увеличение экспрессии гена MUC4 в эпикорнеальных тканях человека.
Эпикорнеальные ткани человека приобретали у компании MatTek Company (г. Ашленд, штат Массачусетс, США). После получения эпикорнеальных тканей человека их инкубировали в среде для анализа MatTek в течение ночи в соответствии с инструкциями производителя. Эпикорнеальные ткани человека разделили на три экспериментальные группы по три ткани в каждой группе. Ферментативные экстракты Pichia anomala (гиалуродин) добавляли соответственно в культуральную среду, содержащую эпикорнеальные ткани человека из двух экспериментальных групп, чтобы получить концентрацию среды 1,56 мг/мл и 1,95 мг/мл соответственно. Эпикорнеальные ткани во всех экспериментальных группах инкубировали в течение двух дней. Использовали ферментативный экстракт Pichia anomala, поставляемый компанией Silab, Сен-Вьянс, Франция. Через два дня эпикорнеальные ткани человека с 3-мерной структурой разрезали пополам, половину ткани лизировали в 350 мкл лизирующего буфера, состоящего из 100 частей буфера RLT (набор RNeasy Mini Kit, Qiagen, г. Валенсия, штат Калифорния, США), на одну часть 2-меркаптоэтанола. Из растворов экстрагировали РНК с помощью мининабора RNeasy (QIAGEN, г. Валенсия, штат Калифорния, США) в соответствии с инструкциями производителя, и РНК элюировали в 25 мкл воды, не содержащей РНКаз.
Обратную транскрипцию (RT) выполняли с применением набора для обратной транскрипции высокой производительности Biosystems (ThermoFisher Scientific, г. Бриджуотер, штат Нью-Джерси, США). Наборы для анализа экспрессии генов, продаваемые под торговым названием TAQMAN для муцина-4 (MUC4), полипептида A (РНК) II полимеразы (РНК) (POLR2A) и мастер-микса приобретали в ThermoFisher Scientific (г. Бриджуотер, штат Нью-Джерси). Анализ кПЦР проводили с использованием мастер-микса TaqMan® (ThermoFisher Scientific, г. Бриджуотер, штат Нью-Джерси, США) и выполняли на системе ПЦР в реальном времени, реализуемой на рынке под торговым названием QUANTSTUDIO 7 Flex System (ThermoFisher Scientific, г. Бриджуотер, штат Нью-Джерси, США). Экспрессию гена MUC4 нормировали к экспрессии конститутивного гена человеческой РНК POLR2A. Кратные изменения рассчитывали по сравнению с необработанным контролем (UT) и двусторонним t-критерием Стьюдента для двух образцов (Microsoft Office Excel 2007; Microsoft, г. Редмонд, штат Вашингтон, США). Результаты показаны на фиг. 1, которая указывает на увеличение кратности изменения MUC4 в клетках ткани роговицы при повышенной концентрации ферментативного экстракта Pichia anomala в среде. «Необработанный» образец получали так же, как описано в данном примере, за исключением того, что в среду не добавляли Pichia anomala.
Пример 2
Эпикорнеальные ткани человека с 3-мерной структурой в питательной среде, обработанной таким образом, чтобы они содержали 0,39 мг/мл, 0,78 мг/мл, 1,56 мг/мл и 1,95 мг/мл ферментативных экстрактов Pichia anomala (гиалуродин), показали увеличение экспрессии гена MUC4 в эпикорнеальных тканях человека. *, p < 0,05;
Эпикорнеальные ткани человека приобретали у компании MatTek Company (г. Ашленд, штат Массачусетс, США). После получения эпикорнеальных тканей человека их инкубировали в среде для анализа MatTek в течение ночи в соответствии с инструкциями производителя. Эпикорнеальные ткани человека были разделены на пять экспериментальных групп по три ткани в каждой группе. Ферментативные экстракты Pichia anomala (гиалуродин) добавляли соответственно в культуральную среду из четырех экспериментальных групп для получения концентраций среды 0,39 мг/мл, 0,78 мг/мл, 1,56 мг/мл и 1,95 мг/мл соответственно. Эпикорнеальные ткани из всех пяти экспериментальных групп инкубировали в течение двух дней. Использовали ферментативный экстракт Pichia anomala, поставляемый компанией Silab, Сен-Вьянс, Франция. Через два дня культуральную среду собирали для измерения секреции муцина 1 с помощью набора для твердофазного иммуноферментного анализа (ИФА) человеческого муцина-1 (CA15-3) (EHMUC1, ThermoFisher Scientific, г. Бриджуотер, штат Нью-Джерси) в соответствии с протоколом производителя. Для оценки активности колориметрическое изменение измеряли с помощью микропланшетного фотометра (SpectraMax M2E, Molecular Devices, г. Саннивейл, штат Калифорния, США). В данном анализе используется стандартный метод твердофазного иммуноферментного анализа, поэтому существует линейная корреляция между концентрацией муцина-1 в образце и колориметрическим изменением. Была построена стандартная кривая с концентрацией муцина-1 по оси X и поглощением по оси Y, указывающим на соответствующую концентрацию муцина-1. Результаты показаны на фиг. 2 и указывают на повышенное продуцирование муцина-1 в клетках ткани роговицы с повышенной концентрацией ферментативного экстракта Pichia anomala в среде.
Пример 3
Композиции, имеющие концентрации экстрактов Pichia anomala в PBS 1,95 мг/мл, 7,8 мг/мл, 19,5 мг/мл и 39 мг/мл, показали увеличение секреции муцина-1 в тканях эпикорнеальной оболочки человека с 3-мерной структурой при местном нанесении на клетки ткани роговицы. *, p < 0,05;
Эпикорнеальные ткани человека приобретали у компании MatTek Company (г. Ашленд, штат Массачусетс, США). После получения эпикорнеальных тканей человека их инкубировали в среде для анализа MatTek в течение ночи в соответствии с инструкциями производителя. Эпикорнеальные ткани человека разделили на три экспериментальные группы по три ткани в каждой группе. Четыре концентрации ферментативных экстрактов Pichia anomala (гиалуродин), 1,95 мг/мл, 7,8 мг/мл, 19,5 мг/мл и 39 мг/мл суспендировали в водных фосфатно-солевых буферных растворах (PBS) и местно наносили соответственно на поверхность эпителия роговицы из четырех экспериментальных групп. Эпикорнеальные ткани из всех пяти экспериментальных групп инкубировали в течение двух дней. Использовали ферментативный экстракт Pichia anomala, поставляемый компанией Silab, Сен-Вьянс, Франция. Через два дня культуральную среду собирали для измерения секреции муцина 1 с помощью набора для твердофазного иммуноферментного анализа (ИФА) человеческого муцина-1 (CA15-3) (EHMUC1, ThermoFisher Scientific, г. Бриджуотер, штат Нью-Джерси) в соответствии с протоколом производителя. Для оценки активности колориметрическое изменение измеряли с помощью микропланшетного фотометра (SpectraMax M2E, Molecular Devices, г. Саннивейл, штат Калифорния, США). В данном анализе используется стандартный метод твердофазного иммуноферментного анализа, поэтому существует линейная корреляция между концентрацией муцина-1 в образце и колориметрическим изменением. Была построена стандартная кривая с концентрацией муцина-1 по оси X и поглощением по оси Y, указывающим на соответствующую концентрацию муцина-1. Результаты показаны на фиг. 3. (На фиг. 2 для представления ферментативного экстракта Pichia anomala используется киви).
Результаты показывают, что повышение продукции муцина-1 в клетках ткани роговицы наблюдаются после местного нанесения композиций, содержащих экстракты Pichia anomala (в PBS) в концентрации 1,95 мг/мл, 7,8 мг/мл, 19,5 мг/мл и 39 мг/мл.
Пример 4
Ферментативные экстракты Pichia anomala (гиалуродин) индуцировали секрецию гиалуроновой кислоты в эпикорнеальных тканях человека с 3-мерной структурой при нанесении местно на клетки ткани роговицы. Без ограничений, накладываемых теорией, считается, что для такого местного применения требуется диффузия ферментативных экстрактов Pichia anomala через структуры эпикорнеальной ткани человека с плотными соединениями (то есть структуры [например, мембраны или пленочные барьеры], как правило, мешающие проникновению химических веществ в ткани), чтобы достичь внутренней поверхности эпикорнеальной ткани.
Эпикорнеальные ткани человека приобретали у компании MatTek Company (г. Ашленд, штат Массачусетс, США). После получения эпикорнеальных тканей человека их инкубировали в среде для анализа MatTek в течение ночи в соответствии с инструкциями производителя. Эпикорнеальные ткани человека были разделены на пять экспериментальных групп по три ткани в каждой группе. Четыре концентрации ферментативных экстрактов Pichia anomala (гиалуродин), 1,95 мг/мл, 7,8 мг/мл, 19,5 мг/мл и 39 мг/мллина водного фосфатного буферного раствора (PBS) местно наносили соответственно на поверхность эпителия роговицы четырех экспериментальных групп (таким образом, чтобы экстракты ферментов Pichia anomala доставлялись через вышеупомянутые структуры с плотными соединениями). Эпикорнеальные ткани во всех пяти экспериментальных группах инкубировали в течение двух дней. Использовали ферментативный экстракт Pichia anomala, поставляемый компанией Silab, Сен-Вьянс, Франция. Через два дня культуральную среду собирали для измерения секреции гиалуроновой кислоты (ГК) с помощью набора реагентов для твердофазного иммуноферментного анализа (ИФА) (K-1200, Echelon, г. Солт-Лейк-Сити, штат Юта, США) в соответствии с протоколом производителя. Для оценки активности колориметрическое изменение измеряли с помощью микропланшетного фотометра (SpectraMax M2E, Molecular Devices, г. Саннивейл, штат Калифорния, США). В данном анализе используется метод конкурентного твердофазного иммуноферментного анализа, поэтому существует обратная корреляция между концентрацией ГК в образце и колориметрическим изменением. Была построена стандартная кривая с концентрацией ГК по оси X и поглощением по оси Y, указывающим на соответствующую концентрацию ГК. Результаты показаны на фиг. 4.
Хотя результаты показывают, что местное нанесение в исследуемой концентрации направленно указывает на индукцию выработки ГК в клетках роговицы, такие факторы, как структуры с плотными соединениями (или другие барьеры поверхностного или пленочного слоя), могут снижать концентрацию Pichia anomala, достигающую внутренних тканей роговицы. В таких ситуациях могут использоваться варианты осуществления настоящего изобретения, включающие в себя усилители проницаемости.
Пример 5
Для уменьшения препятствий, потенциально вызванных вышеуказанными структурами с плотными контактами (или мембранными, или пленочными барьерами), наблюдали индукцию секреции гиалуроновой кислоты в тканях эпикорнеальной оболочки человека с 3-мерной структурой путем приведения тканей роговицы в контакт с питательной средой роста, содержащей ферментативные экстракты Pichia anomala (гиалуродин) (т.е. "обработанные" среды) таким образом, что нижний слой клеток роговичных тканей (т.е., клеточные слои, не имеющие плотных соединений, мешающих проникновению химических веществ в ткани) был погружен в питательную среду. При приведении в контакт нижнего клеточного слоя тканей роговицы с питательной средой, содержащей ферментативные экстракты Pichia anomala, экстракт может непосредственно контактировать и перемещаться вверх во внутренние ткани роговицы без необходимости сначала пройти через любые структуры с плотными соединениями или другой поверхностный барьер, обеспечивая повышенную биодоступность Pichia anomala в клетки ткани роговицы.
Эпикорнеальные ткани человека приобретали у компании MatTek Company (г. Ашленд, штат Массачусетс, США). После получения эпикорнеальных тканей человека эти ткани инкубировали в среде для анализа MatTek в течение ночи в соответствии с инструкциями производителя. Эпикорнеальные ткани человека были разделены на пять экспериментальных групп по три ткани в каждой группе. Ферментативные экстракты Pichia anomala (гиалуродин) добавляли в культуральную среду из четырех экспериментальных групп для получения сред с концентрациями 0,39 мг/мл, 0,78 мг/мл, 1,56 мг/мл и 1,95 мг/мл соответственно для контакта с нижним клеточным слоем эпикорнеальных тканей человека. Эпикорнеальные ткани из всех пяти экспериментальных групп инкубировали в течение двух дней. Использовали ферментативный экстракт Pichia anomala, поставляемый компанией Silab, Сен-Вьянс, Франция. Через два дня культуральную среду собирали для измерения секреции гиалуроновой кислоты (ГК) с помощью набора реагентов для твердофазного иммуноферментного анализа (ИФА) (K-1200, Echelon, г. Солт-Лейк-Сити, штат Юта, США) в соответствии с протоколом производителя. Для оценки активности колориметрическое изменение измеряли с помощью микропланшетного фотометра (SpectraMax M2E, Molecular Devices, г. Саннивейл, штат Калифорния, США). В данном анализе используется метод конкурентного твердофазного иммуноферментного анализа, поэтому существует обратная корреляция между концентрацией ГК в образце и колориметрическим изменением. Была построена стандартная кривая с концентрацией ГК по оси X и поглощением по оси Y, указывающим на соответствующую концентрацию ГК. Результаты показаны на фиг. 5.
Результаты показывают, что статистически значимое повышение продуцирования ГК в клетках ткани роговицы наблюдалось при концентрациях Pichia anomala в окружающей ткани по меньшей мере 0,3 мг/мл (т. е. при концентрациях экстракта Pichia anomala, контактирующих с такими клетками внутренней ткани роговицы [например, концентрации жидкости роговицы]).
Пример 6
В таблице 1 представлены компоненты таких составов (как показано в составах 6A и 6B), которые можно включить в состав в соответствии с приведенным ниже описанием с помощью традиционной технологии смешивания.
Таблица 1
* доведение до тоничности 280-290 мОсм/кг
** доведение до pH 7,2
*** в достаточном количестве до 100% масс./масс.
Для примеров 6A-6B: Гиалуронат натрия может поставлять CONTIPRO A.S. (Г. ДОЛНИ-ДОБРУЧ, ЧЕШСКАЯ РЕСПУБЛИКА).
Для примеров 6 A и 6 B: Экстракт Pichia anomala поставляется компанией SILAB (Г. СЕН-ВЬЯНС, ФРАНЦИЯ).
Для примеров 6A-6B: Полисорбат 20 может поставлять Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 6A-6B: Полисорбат 80 может поставлять Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 6A: Полиэтиленгликоль 400 может поставлять Clariant Produkte (Г. БУРГКИРХЕН, ГЕРМАНИЯ).
Для примеров 6A-6B: Борную кислоту может поставлять Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 6A-6B: Борат натрия может поставлять Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 6A-6B: Хлорид натрия может поставлять Caldic (Г. ДЮССЕЛЬДОРФ, ГЕРМАНИЯ).
Для примеров 6A-6B: Хлорид калия может поставляться компанией Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 6A-6B: Дигидрат хлорида кальция может поставлять Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 6A-6B: Хлорид магния может поставлять KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 6A-6B: Поликватерний-42 (33%-й водный раствор) может поставлять DSM BIOMEDICAL (Г. БЕРКЛИ, ШТАТ КАЛИФОРНИЯ, США)
Для примеров 6A-6B: Дигидрат хлорита натрия может поставлять Oxychem (Г. УИЧИТО, ШТАТ КАНЗАС, США)
Для примеров 6A-6B: 1н гидроксид натрия может поставлять VWR (г. РАДНЕР, ШТАТ ПЕНСИЛЬВАНИЯ, США).
Для примеров 6A-6B: 1н соляную кислоту может поставлять VWR (г. РАДНЕР, ШТАТ ПЕНСИЛЬВАНИЯ, США).
Раствор 6A может быть приготовлен следующим образом:
1. В химический стакан объемом 1500 мл добавляют 800 граммов очищенной воды по USP.
2. К указанному выше раствору добавляют 10 г полисорбата 80 и 50 г полисорбата 20. Раствор помешивают до полного смешивания и растворения обоих ингредиентов.
3. К указанному выше добавляют 20,0 г экстракта Pichia anomala. Раствор помешивают до растворения экстракта Pichia anomala.
4. Раствор фильтруют через фильтр с размером пор 0,45 микрон и возвращают в лабораторный стакан объемом 1500 мл.
5. К раствору со стадии 4 добавляют 2,0 грамма гиалуроната натрия. Раствор помешивают до полного растворения гиалуроната натрия.
6. Затем последовательно добавляют следующие ингредиенты, давая каждому полностью раствориться до добавления следующего: 2,5 грамма полиэтиленгликоля-400, 6,0 грамм борной кислоты, 0,05 грамма бората натрия, 1,0 грамма хлорида натрия, 0,06 грамма хлорида кальция, 0,06 грамма хлорида магния и 0,0015 грамма хлорида калия.
7. Продолжая перемешивание, добавляют 0,14 грамма дигидрата хлорита натрия и помешивают до растворения.
8. Тоничность состава определяют и доводят до 280 мОсм/кг хлоридом натрия.
9. pH состава доводят до 7,2 с помощью 1н гидроксида натрия и/или 1н соляной кислоты.
10. Раствор доводят до массы 1000,0 грамма добавлением очищенной воды по USP и перемешивают 10 минут до полностью однородного состояния.
11. Раствор фильтруют через 0,22-микронный фильтр.
Раствор 6B может быть приготовлен следующим образом:
1. В химический стакан объемом 1500 мл добавляют 800 граммов очищенной воды по USP.
2. К указанному выше раствору добавляют 20 г полисорбата 10 и 100 г полисорбата 20. Раствор помешивают до полного смешивания и растворения обоих ингредиентов.
3. К указанному выше добавляют 50 г экстракта Pichia anomala. Раствор помешивают до растворения экстракта Pichia anomala.
4. Раствор фильтруют через фильтр с размером пор 0,45 микрон и возвращают в лабораторный стакан объемом 1500 мл.
5. К раствору со стадии 4 добавляют 1,5 грамма гиалуроната натрия. Раствор помешивают до полного растворения гиалуроната натрия.
6. Затем последовательно добавляют следующие ингредиенты, давая каждому полностью раствориться до добавления следующего: 6,0 грамм борной кислоты, 0,05 грамма бората натрия, 1,0 грамма хлорида калия, 0,06 грамма дигидрата хлорида кальция, 0,06 грамма хлорида магния и 0,0015 грамма поликватерния-42 (водного).
7. Продолжая перемешивание, добавляют 0,14 грамма дигидрата хлорита натрия и помешивают до растворения.
8. Тоничность состава определяют и доводят до 280 мОсм/кг хлоридом натрия.
9. pH состава доводят до 7,2 с помощью 1н гидроксида натрия и/или 1н соляной кислоты.
10. Раствор доводят до массы 1000,0 грамма добавлением очищенной воды по USP и перемешивают 10 минут до полностью однородного состояния.
11. Раствор фильтруют через 0,22-микронный фильтр.
Пример 7
В таблице 2 представлены компоненты составов настоящего изобретения (как показано в составах 7A и 7B), которые можно включить в состав в соответствии с приведенным ниже описанием с помощью традиционной технологии смешивания.
Таблица 2
* доведение до тоничности 280-290 мОсм/кг
** доведение до pH 7,2
*** в достаточном количестве до объема 100,00%
Для примеров 7A и 7B: Экстракт Pichia anomala может поставляться компанией SILAB (Г. СЕН-ВЬЯНС, ФРАНЦИЯ).
Для примеров 7A-7B: Полисорбат 20 может поставлять Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 7A-7B: Полисорбат 80 может поставлять Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 7A-7B:Борную кислоту может поставлять Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 7A-7B: Борат натрия может поставлять Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 7A-7B: Хлорид натрия может поставлять Caldic (Г. ДЮССЕЛЬДОРФ, ГЕРМАНИЯ).
Для примеров 7A-7B: Хлорид калия может поставляться компанией Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 7A-7B: Гипромеллоза E3 2910 может поставляться компанией DOW CHEMICAL (Г. ПЛАКЕМИН, ШТАТ ЛУИЗИАНА, США).
Для примеров 7A-7B: Глицерин может поставляться компанией Emery Oleochemicals GmbH (Г. ДЮССЕЛЬДОРФ, ГЕРМАНИЯ).
Для примеров 7A-7B: Двухзамещенный фосфат натрия может поставляться компанией KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 7A-7B: Цитрат натрия может поставляться компанией Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 7A-7B: Лактат натрия может поставляться в виде лактата натрия (50% водный раствор) компанией Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 7A-7B: Глюкоза может поставляться компанией Roquette Freres (Г. ЛАСТРЕМ, ФРАНЦИЯ).
Для примеров 7A-7B: Глицин может поставляться компанией Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 7A-7B: Аскорбиновая кислота может поставляться компанией DSM NUTRITIONAL Products (Г. ДРЕЙКМИР, ШОТЛАНДИЯ, ВЕЛИКОБРИТАНИЯ).
Для примеров 7A-7B: Поликватерний-42 может поставляться как поликватерний-42 (33% водный раствор) компанией DSM BIOMEDICAL (Г. БЕРКЛИ, ШТАТ КАЛИФОРНИЯ, США).
Для примеров 7A-7B: Эдетат динатрия может поставляться компанией Merck NV/SA (Г. ОВЕРЕЙСЕ, БЕЛЬГИЯ).
Для примеров 7A-7B: 1н гидроксид натрия может поставлять VWR (г. РАДНЕР, ШТАТ ПЕНСИЛЬВАНИЯ, США).
Для примеров 7A-7B: 1н соляную кислоту может поставлять VWR (г. РАДНЕР, ШТАТ ПЕНСИЛЬВАНИЯ, США).
Для примеров 7A-7B: Дигидрат хлорита натрия может поставляться Oxychem (Г. УИЧИТО, ШТАТ КАНЗАС, США)
Раствор 7A может быть приготовлен следующим образом:
1. В химический стакан объемом 1500 мл добавляют 800 граммов очищенной воды по USP.
2. К указанному выше раствору добавляют 10 г полисорбата 80 и 30 г полисорбата 20. Раствор помешивают до полного смешивания и растворения обоих ингредиентов.
3. К указанному выше добавляют 10,0 г экстракта Pichia anomala. Раствор помешивают до растворения экстракта Pichia anomala.
4. Раствор фильтруют через фильтр с размером пор 0,45 микрон и возвращают в лабораторный стакан объемом 1500 мл.
5. К полученному выше раствору добавляют 1,98 грамма гипромеллозы E3 Premium. Раствор помешивают до растворения гипромеллозы E3 Premium.
6. Затем последовательно добавляют следующие ингредиенты, давая каждому полностью раствориться до добавления следующего: 2,50 грамм глицерина, 4,0 грамм борной кислоты, 0,22 грамма бората натрия, 0,27 грамма гидрофосфата натрия, 4,00 грамм дигидрата цитрата натрия, 1 грамм хлорида калия, 0,57 грамма лактата натрия (50% -й водный раствор), 0,13 грамма хлорида магния, 0,036 грамма глюкозы, 0,0002 грамма глицина, 0,0001 грамма аскорбиновой кислоты, 0,10 грамма эдетата динатрия, 0,030 грамма поликватерния-42 (33% -й водный раствор) и 0,14 грамма хлорита натрия.
7. Тоничность раствора определяют и доводят до 280 мОсм хлоридом натрия.
8. Измеряют pH раствора и доводят его до 7,2 с помощью 1н гидроксида натрия и/или 1н соляной кислоты.
9. Раствор доводят до объема 1000,00 грамм очищенной водой и перемешивают в течение 10 минут.
10. Раствор фильтруют через 0,22-микронный фильтр.
Раствор 7B может быть приготовлен следующим образом:
1. В химический стакан объемом 1500 мл добавляют 800 граммов очищенной воды по USP.
2. К указанному выше раствору добавляют 10 г полисорбата 80 и 50 г полисорбата 20. Раствор помешивают до полного смешивания и растворения обоих ингредиентов.
3. К указанному выше добавляют 20,0 г экстракта Pichia anomala. Раствор помешивают до растворения экстракта Pichia anomala.
4. Раствор фильтруют через фильтр с размером пор 0,45 микрон и возвращают в лабораторный стакан объемом 1500 мл.
5. К полученному выше раствору добавляют 1,98 грамма гипромеллозы E3 Premium. Раствор помешивают до растворения гипромеллозы E3 Premium.
6. Затем последовательно добавляют следующие ингредиенты, давая каждому полностью раствориться до добавления следующего: 2,50 грамм глицерина, 4,0 грамм борной кислоты, 0,22 грамма бората натрия, 0,27 грамма гидрофосфата натрия, 4,00 грамм дигидрата цитрата натрия, 1 грамм хлорида калия, 0,57 грамма лактата натрия (50% -й водный раствор), 0,13 грамма хлорида магния, 0,036 грамма глюкозы, 0,0002 грамма глицина, 0,0001 грамма аскорбиновой кислоты, 0,05 грамма эдетата динатрия, 0,015 грамма поликватерния-42 (33% -й водный раствор) и 0,14 грамма хлорита натрия.
7. Тоничность раствора определяют и доводят до 280 мОсм хлоридом натрия.
8. Измеряют pH раствора и доводят его до 7,2 с помощью 1н гидроксида натрия и/или 1н соляной кислоты.
9. Раствор доводят до объема 1000,00 грамм очищенной водой и перемешивают в течение 10 минут.
10. Раствор фильтруют через 0,22-микронный фильтр.
Пример 8
В таблице 3 представлены компоненты таких составов (как показано в составах 8A и 8B), которые можно включить в состав в соответствии с приведенным ниже описанием с помощью традиционной технологии смешивания.
Таблица 3
* доведение до тоничности 280-290 мОсм/кг
** доведение до pH 7,2
*** в достаточном количестве до 100% масс./масс.
Для примеров 8A-8B: Гиалуронат натрия может поставлять CONTIPRO A.S. (Г. ДОЛНИ-ДОБРУЧ, ЧЕШСКАЯ РЕСПУБЛИКА).
Для примеров 8A и 8B: Экстракт киви (дрожжевой экстракт Pichia anomala) может поставляться компанией SILAB (Г. СЕН-ВЬЯНС, ФРАНЦИЯ).
Для примеров 8A-8B: Полисорбат 20 может поставлять Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 8A-8B: Полисорбат 80 может поставлять Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 8A: Полиэтиленгликоль 400 может поставлять Clariant Produkte (Г. БУРГКИРХЕН, ГЕРМАНИЯ).
Для примеров 8A-8B: Борную кислоту может поставлять Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 8A-8B: Борат натрия может поставлять Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 8A-8B: Хлорид натрия может поставлять Caldic (Г. ДЮССЕЛЬДОРФ, ГЕРМАНИЯ).
Для примеров 8A-8B: Хлорид калия может поставляться компанией Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 8A-8B: Дигидрат хлорида кальция может поставлять Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 8A-8B: Хлорид магния может поставлять KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 8A-8B: Поликватерний-42 (33%-й водный раствор) может поставлять DSM BIOMEDICAL (Г. БЕРКЛИ, ШТАТ КАЛИФОРНИЯ, США)
Для примеров 8A-8B: Дигидрат хлорита натрия может поставлять Oxychem (Г. УИЧИТО, ШТАТ КАНЗАС, США)
Для примеров 8A-8B: 1н гидроксид натрия может поставлять VWR (г. РАДНЕР, ШТАТ ПЕНСИЛЬВАНИЯ, США).
Для примеров 8A-8B: 1н соляную кислоту может поставлять VWR (г. РАДНЕР, ШТАТ ПЕНСИЛЬВАНИЯ, США).
Раствор 8A может быть приготовлен следующим образом:
1. В химический стакан объемом 1500 мл добавляют 800 граммов очищенной воды по USP.
2. К указанному выше раствору добавляют 10 г полисорбата 80 и 50 г полисорбата 20. Раствор помешивают до полного смешивания и растворения обоих ингредиентов.
3. К указанному выше раствору добавляют 20,0 г экстракта киви. Раствор помешивают до растворения экстракта киви.
4. Раствор фильтруют через фильтр с размером пор 0,45 микрон и возвращают в лабораторный стакан объемом 1500 мл.
5. К раствору со стадии 4 добавляют 2,0 грамма гиалуроната натрия. Раствор помешивают до полного растворения гиалуроната натрия.
6. Затем последовательно добавляют следующие ингредиенты, давая каждому полностью раствориться до добавления следующего: 2,5 грамма полиэтиленгликоля-400, 6,0 грамм борной кислоты, 0,05 грамма бората натрия, 1,0 грамма хлорида натрия, 0,06 грамма хлорида кальция, 0,06 грамма хлорида магния и 0,0015 грамма хлорида калия.
7. Продолжая перемешивание, добавляют 0,14 грамма дигидрата хлорита натрия и помешивают до растворения.
8. Тоничность состава определяют и доводят до 280 мОсм/кг хлоридом натрия.
9. pH состава доводят до 7,2 с помощью 1н гидроксида натрия и/или 1н соляной кислоты.
10. Раствор доводят до массы 1000,0 грамма добавлением очищенной воды по USP и перемешивают 10 минут до полностью однородного состояния.
11. Раствор фильтруют через 0,22-микронный фильтр.
Раствор 8B может быть приготовлен следующим образом:
1. В химический стакан объемом 1500 мл добавляют 800 граммов очищенной воды по USP.
2. К указанному выше раствору добавляют 20 г полисорбата 10 и 100 г полисорбата 20. Раствор помешивают до полного смешивания и растворения обоих ингредиентов.
3. К указанному выше раствору добавляют 50 г экстракта киви. Раствор помешивают до растворения экстракта киви.
4. Раствор фильтруют через фильтр с размером пор 0,45 микрон и возвращают в лабораторный стакан объемом 1500 мл.
5. К раствору со стадии 4 добавляют 1,5 грамма гиалуроната натрия. Раствор помешивают до полного растворения гиалуроната натрия.
6. Затем последовательно добавляют следующие ингредиенты, давая каждому полностью раствориться до добавления следующего: 6,0 грамм борной кислоты, 0,05 грамма бората натрия, 1,0 грамма хлорида калия, 0,06 грамма дигидрата хлорида кальция, 0,06 грамма хлорида магния и 0,0015 грамма поликватерния-42 (водного).
7. Продолжая перемешивание, добавляют 0,14 грамма дигидрата хлорита натрия и помешивают до растворения.
8. Тоничность состава определяют и доводят до 280 мОсм/кг хлоридом натрия.
9. pH состава доводят до 7,2 с помощью 1н гидроксида натрия и/или 1н соляной кислоты.
10. Раствор доводят до массы 1000,0 грамма добавлением очищенной воды по USP и перемешивают 10 минут до полностью однородного состояния.
11. Раствор фильтруют через 0,22-микронный фильтр.
Пример 9
В таблице 4 представлены компоненты составов настоящего изобретения (как показано в составах 9A и 9B), которые можно включить в состав в соответствии с приведенным ниже описанием с помощью традиционной технологии смешивания.
Таблица 4
* доведение до тоничности 280-290 мОсм/кг
** доведение до pH 7,2
*** в достаточном количестве до объема 100,00%
Для примеров 9A и 9B: Экстракт киви (дрожжевой экстракт Pichia anomala) может поставляться компанией SILAB (Г. СЕН-ВЬЯНС, ФРАНЦИЯ).
Для примеров 9A-9B: Полисорбат 20 может поставлять Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 9A-9B: Полисорбат 80 может поставлять Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 9A-9B:Борную кислоту может поставлять Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 9A-9B: Борат натрия может поставлять Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 9A-9B: Хлорид натрия может поставлять Caldic (Г. ДЮССЕЛЬДОРФ, ГЕРМАНИЯ).
Для примеров 9A-9B: Хлорид калия может поставляться компанией Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 9A-9B: Гипромеллоза E3 2910 может поставляться компанией DOW CHEMICAL (Г. ПЛАКЕМИН, ШТАТ ЛУИЗИАНА, США).
Для примеров 9A-9B: Глицерин может поставляться компанией Emery Oleochemicals GmbH (Г. ДЮССЕЛЬДОРФ, ГЕРМАНИЯ).
Для примеров 9A-9B: Двухзамещенный фосфат натрия может поставляться компанией KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 9A-9B: Цитрат натрия может поставляться компанией Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 9A-9B: Лактат натрия может поставляться в виде лактата натрия (50% водный раствор) компанией Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 9A-9B: Глюкоза может поставляться компанией Roquette Freres (Г. ЛАСТРЕМ, ФРАНЦИЯ).
Для примеров 9A-9B: Глицин может поставляться компанией Merck KGaA (Г. ДАРМШТАДТ, ГЕРМАНИЯ).
Для примеров 9A-9B: Аскорбиновая кислота может поставляться компанией DSM NUTRITIONAL Products (Г. ДРЕЙКМИР, ШОТЛАНДИЯ, ВЕЛИКОБРИТАНИЯ).
Для примеров 9A-9B: Поликватерний-42 может поставляться как поликватерний-42 (33% водный раствор) компанией DSM BIOMEDICAL (Г. БЕРКЛИ, ШТАТ КАЛИФОРНИЯ, США).
Для примеров 9A-9B: Эдетат динатрия может поставляться компанией Merck NV/SA (Г. ОВЕРЕЙСЕ, БЕЛЬГИЯ).
Для примеров 9A-9B: 1н гидроксид натрия может поставлять VWR (г. РАДНЕР, ШТАТ ПЕНСИЛЬВАНИЯ, США).
Для примеров 9A-9B: 1н соляную кислоту может поставлять VWR (г. РАДНЕР, ШТАТ ПЕНСИЛЬВАНИЯ, США).
Для примеров 9A-9B: Дигидрат хлорита натрия может поставляться Oxychem (Г. УИЧИТО, ШТАТ КАНЗАС, США)
Раствор 9A может быть приготовлен следующим образом:
1. В химический стакан объемом 1500 мл добавляют 800 граммов очищенной воды по USP.
2. К указанному выше раствору добавляют 10 г полисорбата 80 и 30 г полисорбата 20. Раствор помешивают до полного смешивания и растворения обоих ингредиентов.
3. К указанному выше раствору добавляют 10,0 г экстракта киви. Раствор помешивают до растворения экстракта киви.
4. Раствор фильтруют через фильтр с размером пор 0,45 микрон и возвращают в лабораторный стакан объемом 1500 мл.
5. К полученному выше раствору добавляют 1,98 грамма гипромеллозы E3 Premium. Раствор помешивают до растворения гипромеллозы E3 Premium.
6. Затем последовательно добавляют следующие ингредиенты, давая каждому полностью раствориться до добавления следующего: 2,50 грамм глицерина, 4,0 грамм борной кислоты, 0,22 грамма бората натрия, 0,27 грамма гидрофосфата натрия, 4,00 грамм дигидрата цитрата натрия, 1 грамм хлорида калия, 0,57 грамма лактата натрия (50%-й водный раствор), 0,13 грамма хлорида магния, 0,036 грамма глюкозы, 0,0002 грамма глицина, 0,0001 грамма аскорбиновой кислоты, 0,10 грамма эдетата динатрия, 0,030 грамма поликватерния-42 (33%-й водный раствор) и 0,14 грамма хлорита натрия.
7. Тоничность раствора определяют и доводят до 280 мОсм хлоридом натрия.
8. Измеряют pH раствора и доводят его до 7,2 с помощью 1н гидроксида натрия и/или 1н соляной кислоты.
9. Раствор доводят до объема 1000,00 грамм очищенной водой и перемешивают в течение 10 минут.
10. Раствор фильтруют через 0,22-микронный фильтр.
Раствор 9B может быть приготовлен следующим образом:
1. В химический стакан объемом 1500 мл добавляют 800 граммов очищенной воды по USP.
2. К указанному выше раствору добавляют 10 г полисорбата 80 и 50 г полисорбата 20. Раствор помешивают до полного смешивания и растворения обоих ингредиентов.
3. К указанному выше раствору добавляют 20,0 г экстракта киви. Раствор помешивают до растворения экстракта киви.
4. Раствор фильтруют через фильтр с размером пор 0,45 микрон и возвращают в лабораторный стакан объемом 1500 мл.
5. К полученному выше раствору добавляют 1,98 грамма гипромеллозы E3 Premium. Раствор помешивают до растворения гипромеллозы E3 Premium.
6. Затем последовательно добавляют следующие ингредиенты, давая каждому полностью раствориться до добавления следующего: 2,50 грамм глицерина, 4,0 грамм борной кислоты, 0,22 грамма бората натрия, 0,27 грамма гидрофосфата натрия, 4,00 грамм дигидрата цитрата натрия, 1 грамм хлорида калия, 0,57 грамма лактата натрия (50%-й водный раствор), 0,13 грамма хлорида магния, 0,036 грамма глюкозы, 0,0002 грамма глицина, 0,0001 грамма аскорбиновой кислоты, 0,05 грамма эдетата динатрия, 0,015 грамма поликватерния-42 (33%-й водный раствор) и 0,14 грамма хлорита натрия.
7. Тоничность раствора определяют и доводят до 280 мОсм хлоридом натрия.
8. Измеряют pH раствора и доводят его до 7,2 с помощью 1н гидроксида натрия и/или 1н соляной кислоты.
9. Раствор доводят до объема 1000,00 грамм очищенной водой и перемешивают в течение 10 минут.
10. Раствор фильтруют через 0,22-микронный фильтр.
Варианты осуществления настоящего изобретения
1. Микроэмульсионная композиция или микроэмульсия для лечения глаз, содержащая:
i) один или более экстрактов, или источников экстрактов, дрожжей рода Pichia; и
ii) офтальмологически приемлемый носитель.
при этом микроэмульсионные капли или частицы имеют максимальный размер менее 1500 Å.
2. Композиция по варианту осуществления 1 (или по любому из следующих вариантов осуществления), в которой представитель рода Pichia выбран из Pichia anomala, Pichia guilliermondii, Pichia norvegensis, Pichia ohmeri и их смесей.
3. Композиция по вариантам осуществления 1 и/или 2 (или по любому из следующих вариантов осуществления), в которой представителем рода Pichia является Pichia anomala.
4. Композиция по любому из вариантов осуществления 1-3 или их комбинации (или по любому из следующих вариантов осуществления), в которой один или более экстрактов, или источников экстрактов, дрожжей рода Pichia присутствуют в концентрации от около 0,01% до около 100% от общей массы композиции.
5. Композиция по любому из вариантов осуществления 1-4 или их комбинации (или по любому из следующих вариантов осуществления), в которой один или более экстрактов, или источников экстрактов, дрожжей рода Pichia присутствуют в концентрации от около 0,05% до около 95% от общей массы композиции.
6. Композиция по любому из вариантов осуществления 1-5 или их комбинации (или по любому из следующих вариантов осуществления), в которой один или более экстрактов, или источников экстрактов, дрожжей рода Pichia присутствуют в концентрации от около 0,1% до около 90% от общей массы композиции.
7. Композиция по любому из вариантов осуществления 1-6 или их комбинации (или по любому из следующих вариантов осуществления), содержащая энхансер проницаемости.
8. Композиция по любому из вариантов осуществления 1-7 или их комбинации (или по любому из следующих вариантов осуществления), в которой энхансер проницаемости присутствует в концентрации от около 0,01% до около 20% (масс./об.) от общего количества композиции.
9. Композиция по любому из вариантов осуществления 1-8 или их комбинации (или по любому из следующих вариантов осуществления), в которой энхансер проницаемости присутствует в концентрации от около 0,1% до 10% (масс./об.) от общего количества композиции.
10. Композиция по любому из вариантов осуществления 1-9 или их комбинации (или по любому из следующих вариантов осуществления), в которой энхансер проницаемости присутствует в концентрации от около 0,25% до 5% (масс./об.) от общего количества композиции.
11. Композиция по любому из вариантов осуществления 1-10 или их комбинации (или по любому из следующих вариантов осуществления), в которой энхансер проницаемости выбран из полиоксиэтилена, простых полиоксиэтиленовых эфиров жирных кислот, сорбитанмоноолеата, сорбитанмонолаурата, полиоксиэтиленмонолаурата, полиоксиэтиленсорбитанмонолаурата, фузидовой кислоты и ее производных, EDTA, динатрия EDTA, холевой кислоты, дезоксихолевой кислоты, гликохолевой кислоты, гликодезоксихолевой кислоты, таурохолевой кислоты, тауродезоксихолевой кислоты, холата натрия, гликохолата натрия, гликохолата, дезоксихолата натрия, таурохолата натрия, гликодезоксихолата натрия, тауродезоксихолата натрия, хенодезоксихолевой кислоты, урсодезоксихолевой кислоты, сапонинов, глицирризиновой кислоты, глицирризината аммония, декаметония, бромида декаметония и бромида додецилтриметиламмония или смесей любых из вышеперечисленных веществ.
12. Композиция по любому из вариантов осуществления 1-11 или их комбинации (или по любому из следующих вариантов осуществления), в которой экстракт дрожжей рода Pichia содержит олигосахариды и полисахариды со средневесовой молекулярной массой от около 180 до около 800 000 Да.
13. Композиция по любому из вариантов осуществления 1-12 или их комбинации (или по любому из следующих вариантов осуществления), в которой экстракт дрожжей рода Pichia содержит олигосахариды и полисахариды со средней степенью полимеризации от DP 1 до DP 4444.
14. Способ продуцирования/высвобождения /доставки/выделения муцина из роговицы и/или в роговицу, включающий этап введения композиции, содержащей:
i) один или более экстрактов, или источников экстрактов, дрожжей рода Pichia; и
ii) в некоторых случаях офтальмологически приемлемый носитель.
при этом микроэмульсионные капли или частицы имеют максимальный размер менее 1500 Å.
15. Способ по варианту осуществления 14 (или по любому из следующих вариантов осуществления), в котором представитель рода Pichia выбран из Pichia anomala, Pichia guilliermondii, Pichia norvegensis, Pichia ohmeri и их смесей.
16. Композиция по вариантам осуществления 14 и/или 15 (или по любому из следующих вариантов осуществления), в которой представителем рода Pichia является Pichia anomala.
17. Способ поддержания концентрации MU5AC в слезной жидкости в диапазоне от 8 нанограмм до 15 нанограмм на миллиграмм белка или выше, включающий стадию введения микроэмульсионной композиции, содержащей:
i) один или более экстрактов, или источников экстрактов, дрожжей рода Pichia; и
ii) в некоторых случаях офтальмологически приемлемый носитель.
при этом микроэмульсионные капли или частицы имеют максимальный размер менее 1500 Å.
18. Способ лечения пациента со сниженным или низким продуцированием/высвобождением/доставкой/выделением муцина из роговицы и/или в роговицу, включающий стадию местного введения пациенту микроэмульсионной композиции, содержащей:
i) один или более экстрактов, или источников экстрактов, дрожжей рода Pichia; и
ii) в некоторых случаях офтальмологически приемлемый носитель.
при этом микроэмульсионные капли или частицы имеют максимальный размер менее 1500 Å.
19. Способ стимулирования заживления или повышения скорости заживления ран в и/или на поверхности глаза пациента, содержащий этап введения микроэмульсионной композиции, содержащей:
i) один или более экстрактов, или источников экстрактов, дрожжей рода Pichia; и
ii) в некоторых случаях офтальмологически приемлемый носитель.
при этом микроэмульсионные капли или частицы имеют максимальный размер менее 1500 Å.
20. Способ улучшения противомикробных свойств слезной жидкости пациента, содержащий стадию введения микроэмульсионной композиции, содержащей:
i) один или более экстрактов, или источников экстрактов, дрожжей рода Pichia; и
ii) в некоторых случаях офтальмологически приемлемый носитель.
при этом микроэмульсионные капли или частицы имеют максимальный размер менее 1500 Å.
21. Способ лечения пациента со сниженным или низким продуцированием/высвобождением/доставкой/выделением гиалуроновой кислоты из роговицы и/или в роговицу, включающий стадию местного введения пациенту микроэмульсионной композиции, содержащей:
i) безопасное и эффективное количество одного или более экстрактов или источников экстрактов дрожжей рода Pichia для достижения концентрации экстракта дрожжей рода Pichia в жидкости роговицы в тканях роговицы глаза по меньшей мере около 0,3 мг/мл;
ii) в некоторых случаях безопасное и эффективное количество усилителя проницаемости; и
iii) в некоторых случаях офтальмологически приемлемый носитель.
при этом микроэмульсионные капли или частицы имеют максимальный размер менее 1500 Å.
22. Способ по варианту осуществления 21 (или по любому из следующих вариантов осуществления), в котором экстракт дрожжей рода Pichia в композиции содержит олигосахариды и полисахариды со средневесовой молекулярной массой от около 180 до около 800 000 Да.
23. Способ по варианту осуществления 21 и/или 22 (или по любому из следующих вариантов осуществления), в котором экстракт дрожжей рода Pichia в композиции содержит олигосахариды и полисахариды со средней степенью полимеризации от DP 1 до DP 4444.
24. Способ по любому из вариантов осуществления 21-23 или их комбинаций (или по любому из следующих вариантов осуществления), в котором композиция содержит усилитель проницаемости.
25. Способ по любому из вариантов осуществления 21-24 или их комбинаций (или по любому из следующих вариантов осуществления), в котором усилитель проницаемости присутствует в концентрации от около 0,01% до около 20% (масс./об.) от общего количества композиции.
26. Способ по любому из вариантов осуществления 21-25 или их комбинаций (или по любому из следующих вариантов осуществления), в котором усилитель проницаемости присутствует в концентрации от около 0,1% до 10% (масс./об.) от общего количества композиции.
27. Способ по любому из вариантов осуществления 21-26 или их комбинаций (или по любому из следующих вариантов осуществления), в котором усилитель проницаемости присутствует в концентрации от около 0,25% до 5% (масс./об.) от общего количества композиции.
28. Способ по любому из вариантов осуществления 21-27 или их комбинаций (или по любому из следующих вариантов осуществления), в котором усилитель проницаемости выбран из полиоксиэтилена, простых полиоксиэтиленовых эфиров жирных кислот, сорбитанмоноолеата, сорбитанмонолаурата, полиоксиэтиленмонолаурата, полиоксиэтиленсорбитанмонолаурата, фузидовой кислоты и ее производных, EDTA, динатрия EDTA, холевой кислоты, дезоксихолевой кислоты, гликохолевой кислоты, гликодезоксихолевой кислоты, таурохолевой кислоты, тауродезоксихолевой кислоты, холата натрия, гликохолата натрия, гликохолата, дезоксихолата натрия, таурохолата натрия, гликодезоксихолата натрия, тауродезоксихолата натрия, хенодезоксихолевой кислоты, урсодезоксихолевой кислоты, сапонинов, глицирризиновой кислоты, глицирризината аммония, декаметония, бромида декаметония и бромида додецилтриметиламмония или смесей любых из вышеперечисленных веществ.
29. Способ по любому из вариантов осуществления 21-28 или их комбинации (или по любому из следующих вариантов осуществления), в котором композицию вводят, когда концентрация гиалуроновой кислоты в слезной жидкости пациента составляет менее чем около 10 нанограмм на миллиграмм белков.
30. Способ по любому из вариантов осуществления 21-29 или их комбинации (или по любому из следующих вариантов осуществления), в котором композицию вводят, когда концентрация гиалуроновой кислоты в слезной жидкости пациента составляет менее чем около 15 нанограмм на миллиграмм белков.
31. Способ по любому из вариантов осуществления 21-30 или их комбинации (или по любому из следующих вариантов осуществления), в котором композицию вводят, когда концентрация гиалуроновой кислоты в слезной жидкости пациента составляет менее чем около 20 нанограмм на миллиграмм белков.
32. Способ по любому из вариантов осуществления 21-31 или их комбинации (или по любому из следующих вариантов осуществления), в котором композицию вводят, когда концентрация гиалуроновой кислоты в слезной жидкости пациента составляет менее чем около 25 нанограмм на миллиграмм белков.
33. Способ по любому из вариантов осуществления 21-32 или их комбинации (или по любому из следующих вариантов осуществления), в котором композицию вводят в глаз пациента для повышения концентрации гиалуроновой кислоты в слезной жидкости пациента до уровня, равного или превышающего около 10 нанограмм на миллиграмм белков.
34. Способ по любому из вариантов осуществления 21-33 или их комбинации (или по любому из следующих вариантов осуществления), в котором композицию вводят в глаз пациента для повышения концентрации гиалуроновой кислоты в слезной жидкости пациента до уровня, равного или превышающего около 15 нанограмм на миллиграмм белков.
35. Способ по любому из вариантов осуществления 21-34 или их комбинации (или по любому из следующих вариантов осуществления), в котором композицию вводят в глаз пациента для повышения концентрации гиалуроновой кислоты в слезной жидкости пациента до уровня, равного или превышающего около 20 нанограмм на миллиграмм белков.
36. Способ по любому из вариантов осуществления 21-35 или их комбинации (или по любому из следующих вариантов осуществления), в котором композицию вводят в глаз пациента для повышения концентрации гиалуроновой кислоты в слезной жидкости пациента до уровня, равного или превышающего около 25 нанограмм на миллиграмм белков.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ГЛАЗ | 2019 |
|
RU2793736C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ГЛАЗ | 2019 |
|
RU2792627C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ГЛАЗ | 2020 |
|
RU2802625C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ГЛАЗ | 2019 |
|
RU2802365C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ГЛАЗ | 2019 |
|
RU2806301C2 |
| КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО НАНЕСЕНИЯ, СОДЕРЖАЩАЯ ЭКСТРАКТЫ PICHIA ANOMALA И КОРНЯ ЦИКОРИЯ | 2016 |
|
RU2732398C2 |
| КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО НАНЕСЕНИЯ, СОДЕРЖАЩАЯ ГЛИЦЕРИН И ДРОЖЖЕВОЙ ЭКСТРАКТ | 2019 |
|
RU2801139C2 |
| КОМПОЗИЦИИ, ОБЕСПЕЧИВАЮЩИЕ ПОВЫШЕННЫЙ КОМФОРТ ДЛЯ ГЛАЗ | 2018 |
|
RU2806029C2 |
| КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО НАНЕСЕНИЯ, СОДЕРЖАЩАЯ ГЛИЦЕРИН И ДРОЖЖЕВОЙ ЭКСТРАКТ | 2017 |
|
RU2778810C2 |
| КОМПОЗИЦИИ ДЛЯ МЕСТНОГО НАНЕСЕНИЯ, СОДЕРЖАЩИЕ Pichia anomala И РЕТИНОЛ | 2019 |
|
RU2812891C2 |
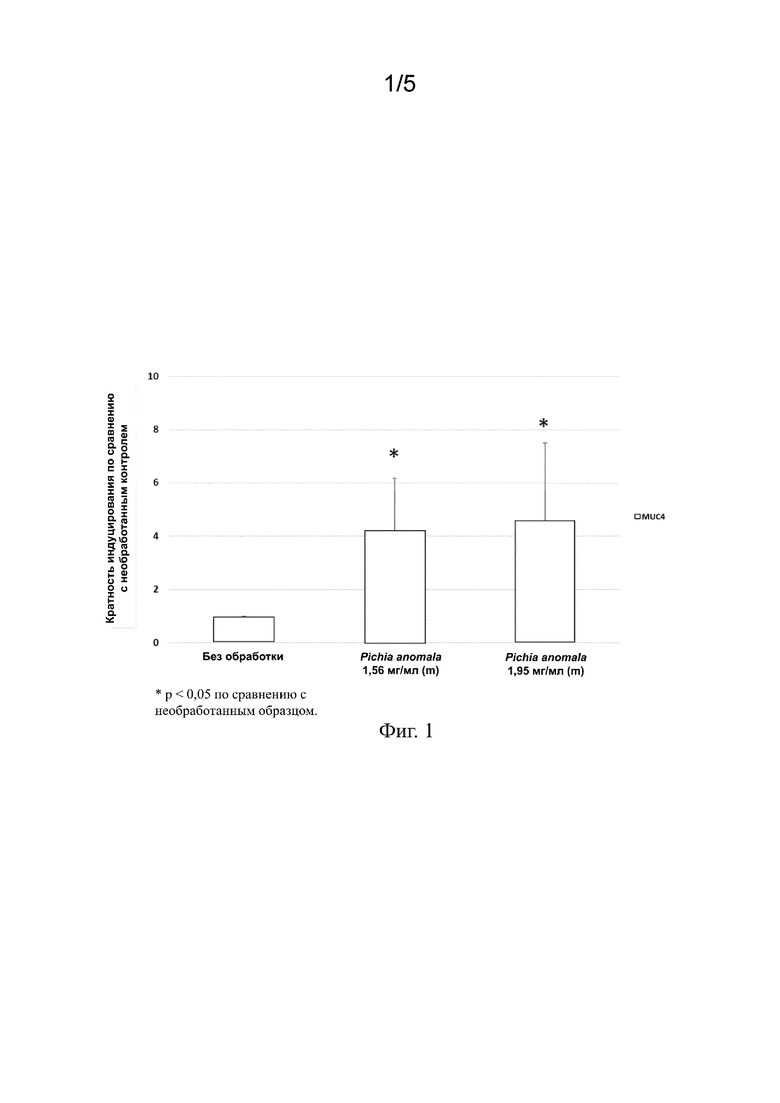
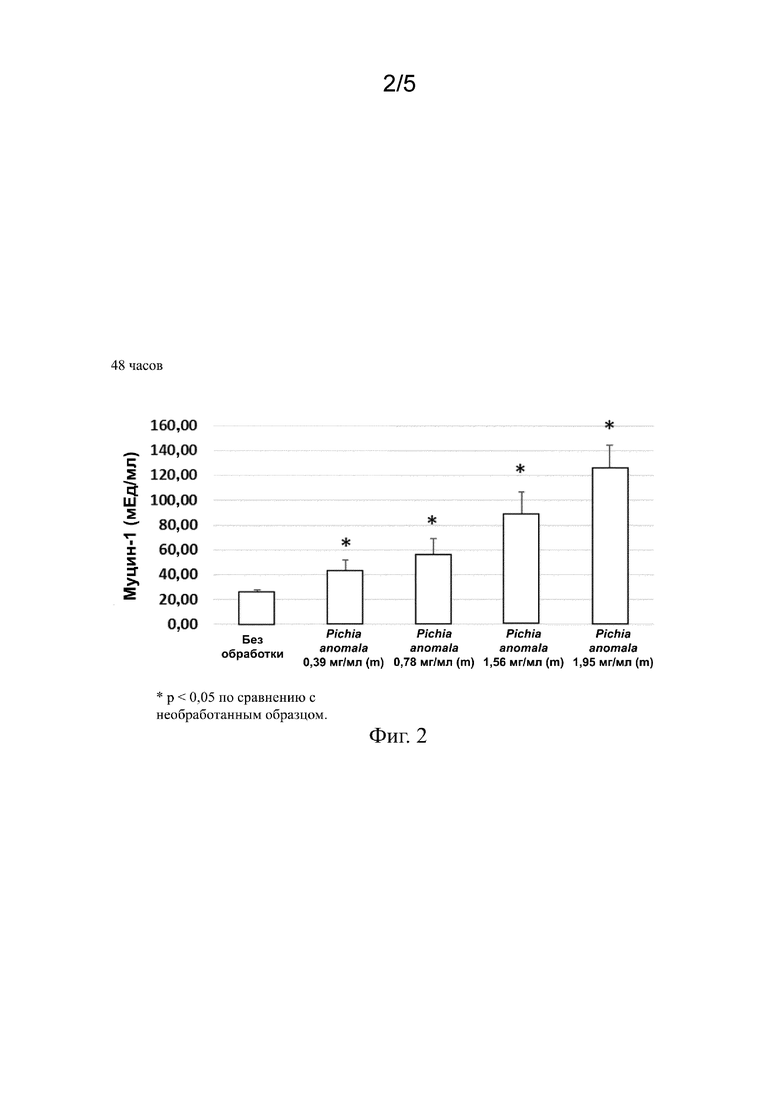
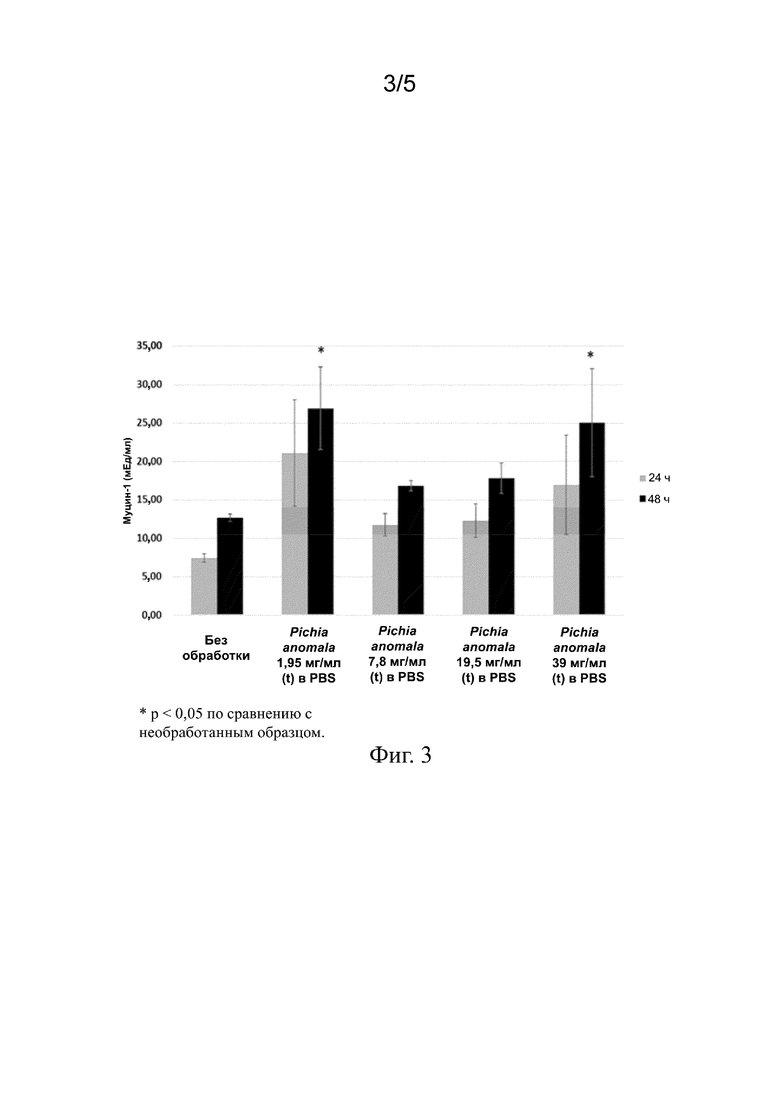
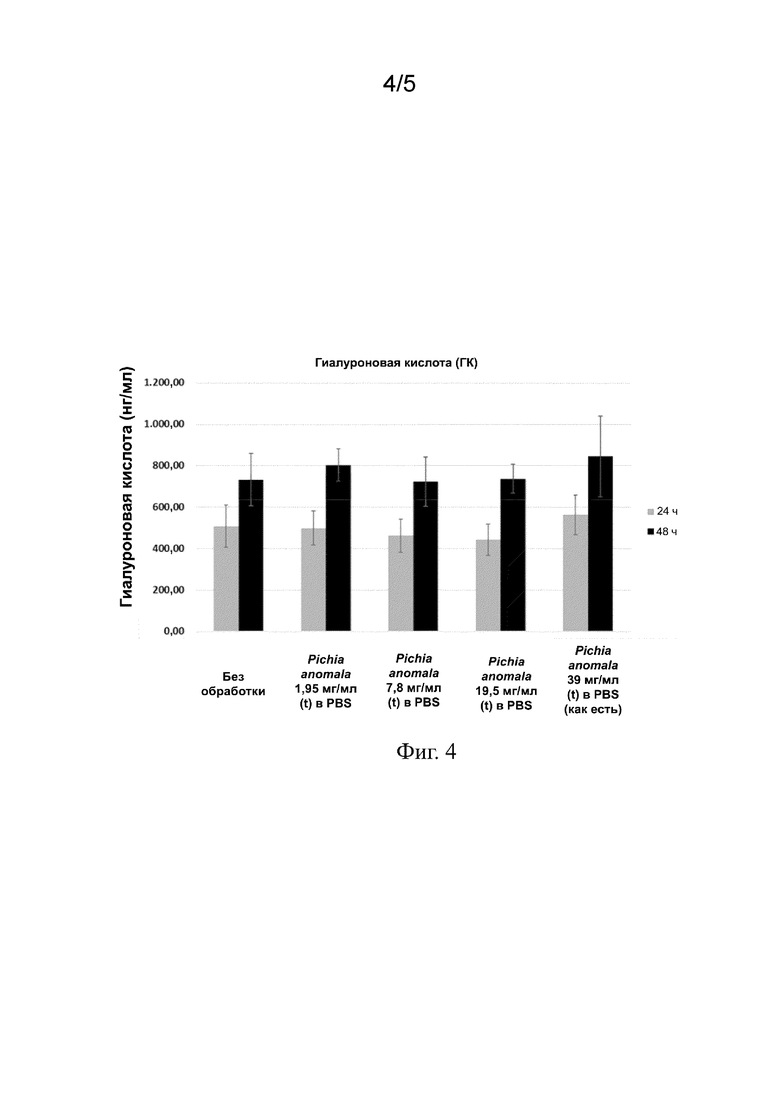
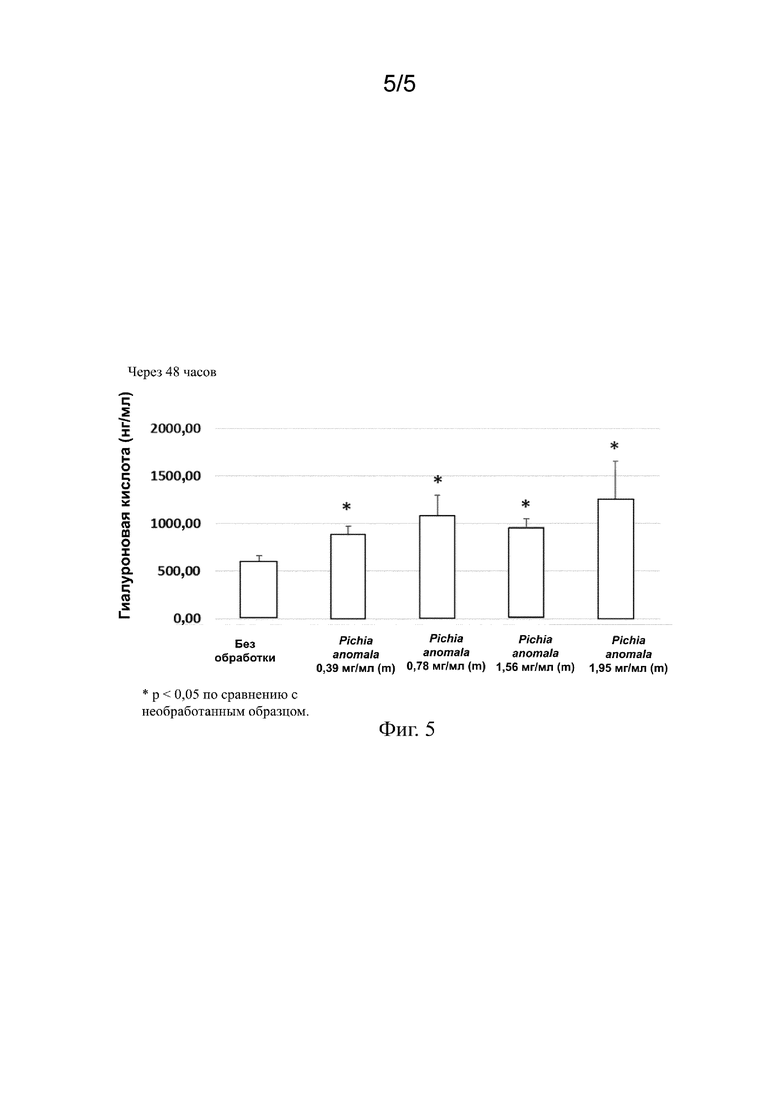
Изобретение относится к области медицины, а именно к офтальмологии, и предназначено для стимулирования и/или улучшения выработки и/или высвобождения гиалуроновой кислоты и/или муцина из роговицы и/или в роговицу. Микроэмульсионная композиция для лечения глаз содержит один или более экстрактов, или источников экстрактов, из рода Pichia и офтальмологически приемлемый носитель. Экстракт из рода Pichia является Pichia anomala и присутствует в концентрации от 0,005 до 95% от общей массы композиции. При этом микроэмульсионные капли или частицы имеют максимальный размер менее 1500  . Использование изобретения обеспечивает стимулирование и/или улучшение выработки и/или высвобождения гиалуроновой кислоты и/или муцина из роговицы и/или в роговицу, что позволяет использовать композицию при лечении заболеваний глаз. 8 з.п. ф-лы, 5 ил., 4 табл., 9 пр.
. Использование изобретения обеспечивает стимулирование и/или улучшение выработки и/или высвобождения гиалуроновой кислоты и/или муцина из роговицы и/или в роговицу, что позволяет использовать композицию при лечении заболеваний глаз. 8 з.п. ф-лы, 5 ил., 4 табл., 9 пр.
1. Микроэмульсионная композиция для лечения глаз, содержащая:
i) один или более экстрактов, или источников экстрактов, из рода Pichia, в которой экстракт из рода Pichia является Pichia anomala и в которой Pichia anomala присутствуют в
концентрации от 0,005 до 95% от общей массы композиции; и
ii) офтальмологически приемлемый носитель,
при этом микроэмульсионные капли или частицы имеют максимальный размер менее 1500  .
.
2. Композиция по п. 1, в которой один или более экстрактов, или источников экстрактов, рода Pichia присутствуют в концентрации от 0,01 до 90% от общей массы композиции.
3. Композиция по п. 1, содержащая усилитель проницаемости.
4. Композиция по п. 3, в которой усилитель проницаемости присутствует в концентрации от 0,01 до 20% (мас./об.) от общего количества композиции.
5. Композиция по п. 4, в которой усилитель проницаемости присутствует в концентрации от 0,1 до 10% (мас./об.) от общего количества композиции.
6. Композиция по п. 5, в которой усилитель проницаемости присутствует в концентрации от 0,25 до 5% (мас./об.) от общего количества композиции.
7. Композиция по п. 3, в которой усилитель проницаемости выбран из полиоксиэтилена, простых полиоксиэтиленовых эфиров жирных кислот, сорбитанмоноолеата, сорбитанмонолаурата, полиоксиэтиленмонолаурата, полиоксиэтиленсорбитанмонолаурата, фузидовой кислоты и ее производных, EDTA, динатрия EDTA, холевой кислоты, дезоксихолевой кислоты, гликохолевой кислоты, гликодезоксихолевой кислоты, таурохолевой кислоты, тауродезоксихолевой кислоты, холата натрия, гликохолата натрия, гликохолата, дезоксихолата натрия, таурохолата натрия, гликодезоксихолата натрия, тауродезоксихолата натрия, хенодезоксихолевой кислоты, урсодезоксихолевой кислоты, сапонинов, глицирризиновой кислоты, глицирризината аммония, декаметония, бромида декаметония и бромида додецилтриметиламмония или смесей любых из вышеперечисленных веществ.
8. Композиция по п. 1, в которой экстракт рода Pichia содержит олигосахариды и полисахариды со средневесовой молекулярной массой от 180 до 800000 Да.
9. Композиция по п. 1, в которой экстракт рода Pichia содержит олигосахариды и полисахариды со средней степенью полимеризации от DP 1 до DP 4444.
| FR 2897266 A1, 17.08.2007 | |||
| US 2017172913 A1, 22.06.2017 | |||
| FR 2938768 A1, 28.05.2010 | |||
| US 2015305348 A1, 29.10.2015 | |||
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ, ПРИМЕНЕНИЕ КАРБОНОВОЙ КИСЛОТЫ ДЛЯ СТАБИЛИЗАЦИИ МАКРОЛИДА В ЭТОМ СОСТАВЕ И СПОСОБ СТАБИЛИЗАЦИИ МАКРОЛИДА | 1995 |
|
RU2292887C2 |
Авторы
Даты
2023-05-15—Публикация
2020-11-18—Подача