ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому липосомному составу и процессу получения липосомного состава.
УРОВЕНЬ ТЕХНИКИ
Липосомы известны в области техники как носители для доставки терапевтических агентов целевым клеткам для лечения различных медицинских состояний. В одном из применений липосомы можно получать для инкапсулирования фармацевтического агента, который может быть селективно фагоцитирован макрофагами. После фагоцитоза липосомы, помимо прочих эффектов, внутриклеточно высвобождают агент, подавляя воспалительные функции макрофагов.
В области техники описано несколько способов получения таких липосом (см., например, Mönkkönen, J. и др., 1994, J. Drug Target, 2:299-308; Mönkkönen, J. и др., 1993, Calcif. Tissue Int., 53:139-145; Lasic DD., Liposomes Technology Inc., Elsevier, 1993, 63-105. (глава 3); Winterhalter M, Lasic DD, Chem Phys Lipids, 1993; 54(1-3):35-43). В одном из таких способов, известному, как способ гидратации тонкой липидной пленки, липосомы формируются в стеках кристаллических бислоев, которые гидратируют в гидратированные липидные пласты, которые отрываются в ходе перемешивания и закрываются в многослойные везикулы (MLV). После образования указанных частиц, их размер зависит от последующего используемого способа, например, использования ультразвуковой энергии (обработка ультразвуком) или механической энергии (экструзия). В результате обработки ультразвуком получают маленькие однослойные везикулы (SUV) и для нее требуется использование ультразвуковых диспергаторов типа ванны и/или погружного типа. Альтернативно, в результате экструзии липидов, в ходе которой липидную суспензию продавливают под высоким давлением (до 3,45 Мпа (500 psi)) через ряд поликарбонатных фильтров, обычно мембран с порами в 0,8, 0,4, 02, и 0,1 мкм, получают частицы с размером, примерно равным диаметру пор используемого фильтра. Эти способы применимы только для мелкомасштабного производства, преимущественно для исследовательских целей. Более того, способы экструзии под высоким давлением связаны с высокой стоимостью и длительными сроками проведения. Таким образом, существует потребность в способе получения липосом, подходящем для получения в промышленных масштабах, воспроизводимом и отвечающем требованиям контроля качества, стабильности, масштабируемости и стерилизации липосомной продукции.
К тому же, известные в области техники липосомные составы не являются по существу однородными по размеру и форме, что является ключевым свойтсвом фармацевтической композиции, необходимым для обеспечения стерильности продукта и избегания потенциальных токсических побочных эффектов от больших аберрантных липосом. В настоящее время трудно получить липосомный состав, имеющий однородные по размеру липосомы. В ходе процесса экструзии многослойных везикул через серию фильтров, включая, например, поликарбонатные фильтры с порами в 100 нм, не удается получить состав, состоящий из популяции по существу однородных липосом размером в 100 нм. В действительности, в зависимости от физических характеристик липосом, таких как сжимаемость и/или стабильность, средний диаметр экструдированных везикул может сильно различаться в зависимости от типа и размера используемых фильтров. Таким образом, существует потребность в способе подходящем для получения по существу однородных по размеру и форме липосомных составов.
Кроме того, многие физические характеристики липосомного состава влияют на клеточный ответ на липосомы и воздействуют на эффективность липосомы в качестве фармацевтической композиции. Способ получения во многом влияет на физические характеристики липосомного состава. Однако в области техники не раскрыто, как можно контролировать характеристики липосом в процессе получения состава таким образом, чтобы повысить эффективность получения и стабильность липосом. Таким образом, существует потребность в разработке рентабельного крупномасштабного процесса получения липосомных составов, позволяющего регулировать характеристики липосомного состава, обеспечивающего получение однородных и подхрдящих для клинического использования липосом.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении описаны новые липосомы, инкапсулирующие терапевтические агенты. Изобретение также относится к липосомным составам, имеющим высокую степень однородности размера, что приводит к минимизации побочных эффектов и увеличению надежности в процессе стерилизации. В изобретении также описан эффективный и рентабельный способ крупномасштабного получения липосом в условиях экструзии под низким давлением. Полученные таким образом липосомы имеют желательные характеристики и эффективные терапевтические свойства.
Липосомный состав характеризуется липосомами, имеющими требуемый состав и физические характеристики. Липосома содержит липидный ингредиент, инкапсулирующий терапевтический агент. Согласно одному из аспектов настоящего изобретения липидный ингредиент содержит дистеароил фосфатидилхолин (DSPC), дистеароил фосфатидилглицерин (DSPG) и холестерин, предпочтительно в молярном отношении 3:1:2 (DSPC:DSPG:холестерин).
Липосома состоит из липидного ингредиента и терапевтического агента, при этом отношение массы терапевтического агента к массе липидного ингредиента, называемое отношение лекарственное средство: липид, составляет примерно от 1:5 до 1:8 по массе, предпочтительно от 1:6 до 1:7. Отношение лекарственное средство:липид увеличивает стабильность и эффективность, а также влияет на скорость потери лекарства липосомами и на целостность липосом. Эти и другие структурные характеристики придают неожиданные преимущества составу, описанному в настоящем изобретении.
Липосомы, описанные в настоящем изобретении имеют размер 30-500 нм, предпочтительно 70-120 нм, 100-300 нм, 100-180 нм и 70-150 нм в зависимости от типа терапевтического агента и/или используемого носителя. В одном предпочтительном варианте реализации изобретения липосомы могут составлять в размере 80 ± 5 нм.
Другие физические характеристики липосомной композиции также значительно влияют на ее стабильность и эффективность. Например, электрическая проводимость липосом может повлиять на их селективное поглощение фагоцитарными клетками. В одном из вариантов реализации значение проводимости составляет 13,5-17,5 мСм/см. Также внутренняя и внешняя осмоляльность состава похожим образом влияет на его стабильность и эффективность. Предпочтительно, чтобы внешняя осмоляльность совпадала с осмоляльностью человеческого организма, причем внутренняя осмоляльность должна оставаться достаточно низкой, чтобы повысить стабильность состава. В одном из вариантов реализации изобретения внутренняя осмоляльность составляет 340-440 мО/кг. Другим важным параметром является рН липосом и/или липосомного состава. Например, внутреннее значение рН около 6,9 липосомного состава улучшает долговременную стабильность, как и скорость выведения лекарственного препарата, а также на способность к инкапсуляции лекарственного средства.
Представленные в настоящем изобретении липосомы являются достаточно жесткими, по сравнению с известными из области техники, поскольку они имеют менее сжимаемые липосомные мембраны. Липосомы, представленные в настоящем изобретении, имеют сжимаемость менее чем 0,7 мл/г. Благодаря увеличенной жесткости, представленные в настоящем изобретении липосомы имеют увеличенные стабильность и время хранения.
Липосомный состав также имеет новые и полезные характеристики. Липосомные состав согласно настоящему изобретению состоит из по существу единородных по размеру и форме и при этом сравнительно жестких липосом. Варьирование по размеру между липосомами представленного состава является небольшим. Однородность липосом, измеренная с помощью индекса разнообразия (Poly Diversity Index (ʺPDIʺ)), составляет менее 0,075, предпочтительно в диапазоне примерно 0,02-0,05, что указывает на высокую степень однородности состава. Соответственно липосомный состав согласно настоящему изобретению значительно снижает вероятность побочных эффектов, связанных с большими липосомами, а также позволяет проводить стерилизующую фильтрацию более эффективно.
Другим аспектом настоящего изобретения является способ получения липосомного состава. Способ получения включает этапы (1) смешивания терапевтического агента с предварительно выбранными липидами с образованием везикул, (2) экструзии везикул через фильтр с одним размером пор в одну стадию и (3) ультрафильтрации. После ультрафильтрации продукт может быть стандартизирован до получения желаемой конечной концентрации. Поскольку экструзию на этапе 2 проводят в одну стадию и при низком давлении, настоящий способ снижает производственные затраты и время, а также увеличивает выход продукта по сравнению с экструзией при высоком давлении и с использованием множества стадий. Данные производственные этапы можно приспособить для крупномасштабного производства.
В одном из вариантов реализации, состав получают (1) смешиванием терапевтического агента с липидами, содержащими DSPC, DSPG и холестерин в молярном отношении 3:1:2 с образованием везикул, причем отношение массы терапевтического агента к липидам составляет от примерно 1:5 до 1:8, (2) экструзией везикул через фильтр с размером пор примерно 100 нм в одну стадию, и (3) ультрафильтрацией.
Также другим аспектом настоящего изобретения является липосомный состав, полученный согласно описанным выше этапам получения. Состав включает множество липосом, состоящих из некоторого количества липидного ингредиента, инкапсулирующего терапевтический агент. Например, такой липидный ингредиент может содержать DSPC, DSPG и холестерин в молярном отношении 3:1:2, и массовое отношение терапевтического агента и липидного ингредиента может составлять примерно от 1:5 до 1:8. Состав получают в ходе следующих этапов: (1) смешивание терапевтического агента с предварительно выбранными липидами с образованием везикул, (2) экструзия везикул через фильтр с одним размером пор в одну стадию и (3) ультрафильтрация. После ультрафильтрации продукт может быть стандартизирован до получения требуемой конечной концентрации. Предпочтительно, состав, полученный указанным способом, имеет значение PDI менее чем 0,075, более предпочтительно в диапазоне от 0,02 до 0,05. В ходе этого процесса получают липосомный состав, имеющий новые и полезные свойства, включая, например, отношение липидных ингредиентов 3:1:2, отношение лекарственное средство:липид, PDI, жесткость, рН, осмоляльность и электрическая проводимость.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 изображена схема процесса получения липосомного состава согласно настоящему изобретению.
На Фиг. 2 показана схема, описывающая процесс получения 1 л липосомного алендроната для в.в. инфузий при дозировке 5 мг/мл, причем в этом процессе контролируются параметры, описанные в одном из аспектов настоящего изобретения.
На Фиг. 3 показано изображение ТЕМ липосомного алендроната согласно одному из аспектов настоящего изобретения.
На Фиг. 4 показан график сравнения удельной сжимаемости различных липосомных составов.
На Фиг. 5А показан график распределения размера липосом в составе, описанном в настоящем изобретении.
На Фиг. 5В показан график распределения размера липосом в составе, известном из уровня техники.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретения относится к новым липосомам, составу и способу его получения для применения для лечения различных заболеваний. Состав состоит из множества липосом, инкапсулирующих терапевтический агент, или «инкапсулируемый агент». Физические характеристики каждой липосомы улучшают стабильность и эффективность липосомного состава. Состав определяется липосомами, являющимися по существу однородными по форме и размеру. Также внастоящем изобретении описан эффективный и рентабельный способ получения липосомного состава, и при этом подходящий для крупномасштабного производства. Далее, изобретение относится к полученному данным способом липосомному составу, имеющему новые и полезные характеристики.
А. Компоненты липосом
Настоящее изобретение относится к новой и полезной форме липосом. Для получения липосом согласно изобретению могут использоваться различные липосомные ингредиенты. Предпочтительно липидный ингредиент является нетоксичным биосовместимым липидом, таким как, например, липиды, полученные из фосфатидил-холина, фосфоглицерина и/или холестерина. В одном из вариантов реализации настоящего изобретения липидный ингредиент включает дистеароилфосфатидилхолин (DSPC), дистеароилфосфатидилглицерин (DSPG) и холестерин, предпочтительно в молярном отношении примерно 3:1:2 (DSPC:DSPG:холестерин).
Липидный ингредиент инкапсулирует терапевтический агент, причем оба компонента имеют заданную массу. В настоящем документе термин «отношение лекарственного средства к липиду» (или «отношение лекарственное средство:липид») относится к отношению массы лекарства к массе липидного ингредиента, которые составляют липосомы и/или состав. В одном из вариантов реализации настоящего изобретения, липосомы имеют отношение лекарственное средство:липид примерно от 1:5 до 1:8, предпочтительно между 1:6 и 1:7 по массе.
В. Физические свойства липосом
Различные физические параметры и характеристики липосом могут повлиять на однородность, стабильность и эффективность состава. Указанные физические характеристики включают (1) осмоляльность липосом (внешнюю и внутреннюю), (2) проводимость липосом (внешнюю и внутреннюю по отношению к липосоме), (3) отношение лекарственного средства к липиду, (4) рН липосом (внешний и внутренний по отношению к липосоме) и (5) тип липидов и лекарственных средств, использованных в композиции.
Осмоляльность является мерой концентрации растворенных веществ липосомного состава. В настоящем документе термин «осмоляльность» относится к мере концентрации растворенных веществ, определенной как число растворенных молекул в осмолях (осмоль) растворенного вещества на килограмм растворителя (осмоль/кг). Под внутренней осмоляльностью понимают концентрацию растворенных веществ внутри липосомы, в то время как под внешней осмоляльностью понимают концентрацию растворенных веществ вне липосомы. В одном из вариантов реализации настоящего изобретения липосомы имеют низкую внутреннюю осмоляльность. Внутреннюю осмоляльность можно регулировать путем изменения количества инкапсулируемого в липосоме лекарственного вещества. В области техники описаны липосомы, содержащие так много лекарства, насколько это возможно, что приводит к получению липосом с высокой осмоляльностью (высоким инкапсулирующим отношением). Однако в настоящем изобретении описаны липосомы, имеющие более низкую осмоляльность (или более низкое инкапсулирующее отношение) по сравнению с известными из уровня техники. Сниженная осмоляльность (например, примерно 340-440 мО/кг), описанная в настоящем документе, повышает стабильность и однородность липосом в липосомном составе. Одним из способов получить низкую осмоляльность является снижение количества инкапсулируемого терапевтического агента в липосомном составе. Другим путем снижения внутренней осмоляльности, не требующим изменения отношения лекарственное средство:липид, является использование незаряженного агента, такого как некоторые полисахариды или сахара, известные из уровня техники.
Внешняя осмоляльность является предпочтительно изотонической по отношению к организму, что особенно важно для инъецируемых составов. Таким образом, внешняя осмоляльность является предпочтительно относительно постоянной. Внутренняя и внешняя осмоляльность в настоящем изобретении приводят к получению высокостабильного продукта, низкой скорости потери лекарственного и надежной способности к инкапсуляции у липосом.
Использованный в настоящем документе термин «проводимость» относится к способности липосом проводить электричество за счет ионного состава раствора. Проводимость относится к ионному составу липосом и влияет на стабильность, скорость потери лекарственного вещества липосомами и способности к инкапсуляции липосомного состава. Проводимость липосом составляет примерно 13,5-17,5 мСм/см. В одном из вариантов реализации настоящего изобретения инкапсулируемое лекарственное средство заряжено. Нужно отметить, что заряженное лекарственное средство имеет уровень корреляции 1:1 между проводимостью и осмоляльностью липосом. Поэтому изменение количества инкапсулируемого агента пропорционально влияет на обе характеристики. В альтернативном варианте реализации используется нейтральный (незаряженный) лекарственный агент. При использовании нейтральных агентов, таких как, например, полисахариды, для изменения проводимости, осмоляльность становится независимой от концентрации лекарства и, таким образом, может регулироваться независимо от концентрации лекарственного агента.
Другим новым аспектом липосом согласно изобретению, является относительная жесткость строения, то есть стабильность липосом в различных условиях окружающей среды и условиях внутри организма, а также их подверженность разрушению. Жесткость липосом является мерой прочности липосомной мембраны и ее способности противостоять сдвиговым силам и давлению, что может повысить время хранения липосом. Жесткость липосом обратно пропорциональна их сжимаемости. Липосомы, имеющие низкую сжимаемость, имеют большую жесткость. Одним из возможных способов определения жесткости липосом является ультразвуковая вискозиметрия и денситометрия. Способы определения жесткости липосом известны из области техники и описаны, например, Cavalcanti, Leide P., и др., «Compressibility study of quaternary phospholipid blend monolayers», Colloids and Surfaces B: Biointerfaces 85(2011) 153-160; и Hianik, Tibor и др., ʺSpecific volume and compressibility of bilayer lipid membranes with incorporated Na, K-ATPaseʺ General Physiology and Biophisics 30 (2011) 145-153, содержание которых полностью включено в настоящую заявку посредством ссылки.
Липосомы имеют значения рН во внешней среде липосомы (внешний рН) и во внутренней инкапсулируемой части липосомы (внутренний рН). рН влияет на стабильность, скорость потери лекарственного средства липосомой и инкапсулирующую способность липосомного состава. В одном из вариантов реализации состав имеет значение внутреннего рН примерно 6,8-7,0. Внутренний рН 6,8-7,0 является важным условием для стабильности состава. рН растворенного терапевтического агента может поддерживаться, кроме прочего, путем постоянного титрования раствора для поддержания уровня рН 6,8-7,0 или поддерживаться на заданном значении рН, например, примерно рН 6,9 с помощью растворения терапевтического агента в известном буфере. Внешний рН липосомы может отличаться от внутреннего рН липосомы. Разный рН может достигаться путем изменения рН растворов, которые составляют внутреннюю и внешнюю среды липосомы.
С. Состав
Липосомный состав, описанный в настоящем изобретении включает множество липосом, имеющих описанные выше характеристики, и по существу однородных по размеру и форме, при этом имея небольшое варьирование по размеру между липосомами. Однородность состава измеряется по его индексу полидисперсности (Poly Dipersity Index) (PDI). PDI измеряется в по нелинейной шкале от 0 до 1, где 0 означает идеально однородный состав, а состав, имеющий значение PDI равное 1 является высоко разнородным (неоднородным). Состав согласно настоящему изобретению имеет значение PDI менее 0,075, предпочтительно между 0,02 и 0,05. Значение PDI может быть посчитано, как описано в Zetasizer nano user manual, 2003, Malvern Instruments, pp 5.5-5.6 и в Kazuba M., Nano Series and HPPS Training Manual Chapter 1, 2003, Malvern Instruments, pp 9, содержание которой включено в настоящую заявку посредством ссылки. Более того, значение PDI настоящего состава близко к значению стандартов измерения, где значение PDI составляет менее 0,02. Составы, ранее описанные в уровне технике, имели заметно отличающийся уровень однородности по сравнению с настоящим изобретением, со значением PDI обычно примерно 0,3. Поскольку PDI имеет нелинейную шкалу, значение PDI настоящего изобретения значительно отличается от известных из области техники. Причем низкое значение PDI настоящего изобретения выгодно снижает токсичные эффекты, связанные с большими липосомами, и характеризует состав, более подходящий для фильтровой стерилизации.
Описанный в настоящем изобретении состав содержит липосомы с повышенными показателями жесткости и однородности, что повышает их стабильность и время хранения. Можно также предположить, что составы согласно настоящему изобретению являются эффективными. Banai, Shmuel, и др., ʺTargeted anti-inflammatory systemic therapy for restenosis: The Biorest Liposomeal Alendronate with Stent sTudy (BLAST) -a double blind, randomized clinical trialʺ, Am Heart J. (2013) 165(2): 234-40.
Липосомы настоящего состава имеют специальный размер, подходящий для поглощения макрофагами и моноцитами. Липосомы могут иметь размеры 30-500 нм. Хотя, в зависимости от типа используемого агента и/или носителя эти размеры включают, но не ограничиваются ими, 70-120 нм, 100-500 нм, 100-300 нм, 100-180 нм и 80-120 нм. Данные диапазоны, однако, являются примерами и другие конкретные размеры, подходящие для поглощения в ходе фагоцитоза, будут понятны без выхода за рамки сущности и объема настоящего изобретения. В одном предпочтительном варианте реализации размер липосом в составе составляет примерно 80±5 нм.
Липосомы согласно настоящему изобретению способны инкапсулировать множество видов терапевтических агентов. После фагоцитоза липосомы терапевтический агент становится веществом, которое может снизить или ингибировать активность и/или уничтожить некоторое число клеток фагоцитов в организме пациента. Терапевтический агент может быть химическим соединением, включая малые и большие молекулы, смесью химических соединений, органическим или неорганическим веществом, биологическими макромолекулами, такими как белки, углеводы, пептиды, антитела или нуклеиновые кислоты. Терапевтический агент может быть натуральным продуктом, полученным из известных организмов, или синтетическим соединением.
Одним из типов полезных терапевтических агентов являются бисфосфонаты. Бисфосфонаты (ранее называемые дифосфонатами) являются соединениями, характеризуемыми двумя связями С-Р. Если обе связи расположены на одном атомe углерода (Р-С-Р), их называют геминальными бисфосфонатами. Бисфосфонаты являются аналогами эндогенных неорганических пирофосфатов, которые участвуют в регуляции и резорбции формирования костей. Бисфосфонаты иногда могут формировать полимерные цепи. Будучи высоко гидрофильными и отрицательно заряженными, бисфосфонаты в свободном виде практически неспособны пересекать клеточные мембраны.
В настоящем документе термин «бисфосфонаты» относится и к геминальным и негеминальным бисфосфонатам. Предпочтительный агент, являющийся бисфосфонатом, имеет следующую формулу (I):

причем R1 является Н, ОН или атомом галогена;
R2 является галогеном, линейным или разветвленным С1-С10 алкилом или С2-С10 алкенилом, необязательно замещенным гетероарил или гетероциклил С1-С10 алкиламином или С3-С8 циклоалкиламином, где амин может быть первичным, вторичным или третичным; -NHY, где Y является водородом, С3-С8 циклоалкилом, арилом или гетероарилом; или R2 является -SZ, где Z является хлорзамещенным фенилом или пиридинилом.
Одним из примеров бисфосфонатного агента является алендронат, имеющий следующую формулу (II):
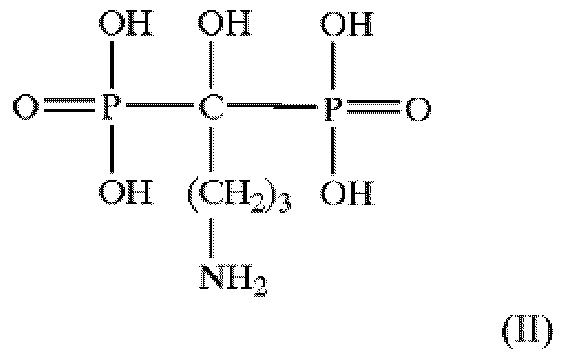
Многие бисфосфонаты имеют схожую с алендронатом активность и полезны в качестве терапевтических агентов для настоящего изобретения. Такие бисфосфонаты можно выбирать на основании их способности имитировать биологическую активность аледроната. Такая активность включает, например: ингибирующую активность in vitro у фагоцитарных клеток, например, макрофагов и фибробластов, при попадании в данные клетки; ингибирование секреции IL-2 и/или IL-6 и/или TNF-α макрофагами; и активность in vivo, например, способность испытанных составов к истощению или инактивации моноцитов крови в животных моделях или у человека или к лечению инфаркта миокарда и сокращению зоны инфаркта.
Бисфосфонаты, применимые в настоящем изобретении, включают, без ограничения, клодронат, тилудронат, 3-(N,N-диметиламино)-1-гидроксипопан-1,1- дифосфоновую кислоту, например, диметил-APD; 1-гидрокси-этилиден-1,1-бисфофоновую кислоту, например, этидронат; 1-гидрокси-3(метилпентиламино)-пропилиден-бисфосфоновую кислоту (ибандроновую кислоту), например, ибандронат; 6-амино-1-гидроксигексан-1,1-дифосфоновую кислоту, например, амино-гексил-БФ; 3-(N-метил-N-пентиламино)-1-гидроксипропан-1,1-дифосфоновую кислоту, например, метил-пентил-APD; 1-гидрокси-2-(имидазол-1-ил)этан-1,1-дифосфоновую кислоту, например, золедроновую кислоту; 1-гидрокси-2-(3-пиридил)этан-1,1-дифосфоновую кислоту (ризедроновая кислота), например, ризедронат; 3-[N-(2-фенилтиоэтил)-N-метиламино]-1-гидроксипропан-1,1-бисфосфоновую кислоту; 1-гидрокси-3-(пирролидин-1-ил)пропан-1,1-бисфосфоновую кислоту, 1-(N-фениламинотиокарбонил)метан-1,1-дифосфоновую кислоту, например FR 78844 (Fujisawa); тетраэтиловый эфир 5-бензоил-3,4-дигидро-2Н-пиразол-3,3-дифосфоновой кислоты, например U81581 (Upjohn); и 1-гидрокси-2-(имидазо[1,2-a]пиридин-3-ил)этан-1,1-дифосфоновую кислоту, например YM 529.
В некоторых вариантах реализации, таких как, например, алендронат натрия, инкапсулированный в DSPC, DSPG и холестерине, может использоваться массовое отношение лекарственное средство:липид равное 1:5,7, что примерно равно молярному отношению 1:3. В случае клодроната натрия, другого терапевтического агента, инкапсулируемого в том же липидном ингредиенте, можно использовать примерное массовое отношение 1:5,4, что примерно равно молярному отношению 1:3. В настоящем изобретении можно использовать и другие терапевтические агенты, которые ингибируют или истощают фагоцитарные клетки путем прекращения, замедления пролиферации или/и нисходящей регуляции активности фагоцитарных клеток. Специфичные терапевтические агенты включают любой агент, являющийся цитотоксичным или цитостатичным, включая без ограничений, например, галлий, золото, диоксид кремния, 5-флюроурацил, цисплатин, алкилирующие агенты, митрамицин и пакликаксел. При использовании любого из вышеперечисленных терапевтических агентов отношение лекарство/липид в липосоме составляет примерно от 1:5 до 1:8, предпочтительно между 1:6 и 1:7 по массе.
В одном из вариантов реализации, состав включает инкапсулируемый терапевтический агент, способный избирательно попадать в клетку через фагоцитоз и селективно действовать на макрофаги и моноциты, при этом не оказывая воздействия на нефагоцитарные клетки. Поскольку макрофаги и моноциты в их нормальном состоянии стягиваются в поврежденные на клеточном уровне области и вызывают воспаление, выходящее за пределы того, что было вызвано самой болезнью или состоянием, ингибирование и/или истощение моноцитов/макрофагов может смягчить состояние поврежденной области. При попадании в фагоцитарную клетку агент высвобождается и ингибирует, инактивирует, повреждает, убивает и/или истощает моноциты и/или макрофаги для лечения различных заболеваний, включающих фагоцитарный иммунный ответ, таких как, например, ишемическое реперфузионное повреждение или воспалительное повреждение, такое как, например, инфаркт миокарда, или для сокращения зоны инфаркта в финальной стадии и усиления восстановления сердца после острого инфаркта миокарда. Липосомы, входящие в описанный в настоящем изобретении состав, имеют особые характеристики, включая размер, заряд, рН, проводимость и осмоляльность, которые способствуют прямому всасыванию посредством фагоцитоза.
После поглощения моноцитами/макрофагами, агент проявляет пролонгированную ингибиторную активность по отношению к моноцитам/макрофагам. Этой пролонгированной активности достаточно для изменения воспалительной активности моноцитов/макрофагов. Таким образом, для устойчивого ингибирования активности не требуется продолжительное высвобождение агента. Соответственно способ лечения некоторых заболеваний путем ингибирования моноцитов/макрофагов, например, с использованием инкапсулируемого агента, предпочтительно является системной терапией, в которой мишенью терапевтической композиции являются циркулирующие моноциты и макрофаги. Фагоцитарные клетки могут проявлять разную реакцию, в зависимости от типа используемого инкапсулируемого терапевтического агента. Например, инкапсулируемый липосомами алендронат вызывает апоптоз, в то время как инкапсулируемый липосомами клодронат вызывает некроз. Нефагоцитарные клетки сравнительно неспособны к поглощению состава за счет специфических физико-химических свойств липосомного состава.
Более того липосомы согласно настоящему изобретению не только удерживают терапевтический агент на время, достаточное для того, чтобы агент не высвобождался в жидкости организма, но и также эффективно высвобождают его внутри целевой клетки. Липосомы, описанные в настоящем изобретении, доставляют эффективное количество агента в целевые клетки. Термин «эффективное количество» означает количество состава, которое является эффективным для достижения желаемого терапевтического результата, например, лечения эндометриоза, рестеноза, ишемического реперфузионного повреждения (ИРП), инфаркта миокарда или других связанных заболеваний. Например, снижение числа и/или активности активированных макрофагов и моноцитов уменьшает зону инфаркта и/или улучшает ремоделирование, когда заболевание связано с повреждением миокарда. Эффективное количество также зависит от ряда факторов, включая без ограничений следующие: вес и пол проходящего лечение пациента; способ введения состава (а именно вводится ли он системно или прямо в область поражения); терапевтический режим (например, вводится ли состав одни раз в день, несколько раз в день, один раз в несколько дней или разово); клинические признаки воспаления; клинические факторы, влияющие на скорость развития основного заболевания, такие как курение, гиперхолестеринемия, провоспалительный статус, заболевания почек; и от типа дозировки композиции. Успешная доставка и применение липосомного состава зависит от его стабильности и эффективности. Важными факторами, определяющими терапевтический индекс продукта, являются число молекул терапевтического агента, инкапсулированных в каждой липосоме (полезная нагрузка) и уровень свободного неинкапсулированного материала.
D. Дозировка и введение
Липосомный состав можно вводить любым способом, который эффективно перенесет липосомы в соответствующее или требуемое место действия. Предпочтительные типы введения включают внутривенное (ВВ) или внутриартериальное (ВА) (в частности подходящее для он-лайн введения) введение. Другие подходящие способы введения включают внутримышечный (ВМ), подкожный (ПК) и внутрибрюшной (ВБ) способы введения. Подобные способы введения могут представлять собой болюсные инъекции или инфузии. Другим способом введения может быть периваскулярное введение. Введение состава может осуществляться сразу непосредственно или после разведения. Согласно настоящему изобретению могут быть использованы любые комбинации описанных выше способов введения. Может быть использован любой способ введения, обеспечивающий контакт частиц с фагоцитарными клетками (например, циркулирующими моноцитами или брюшными макрофагами).
Фармацевтические композиции для использования согласно настоящему изобретению могут быть получены из одного или более физиологически приемлемых носителей, включая наполнители и вспомогательные вещества, известные в области техники, которые облегчают преобразование активных ингредиентов в препараты, которые могут быть использованы в фармацевтике.
Величина и частота дозировки могут быть установлены индивидуально для обеспечения уровней плазмы, достаточных для индукции или подавления биологического эффекта (минимально эффективная концентрация «МЭК»). Значение МЭК меняется в зависимости от препарата, но может быть определено на основе данных in vitro. Дозировки, необходимые для достижения МЭК будут зависеть от состояния пациента и способа введения. Для определения концентрации агента в плазме можно использовать способы детекции.
В зависимости от тяжести состояния пациента и его восприимчивости к лечению дозировка может осуществляться разово, или в ходе многочисленных введений, с периодом лечения от нескольких часов до нескольких недель или до того, как подействует лечение. Частота введения может зависеть от условий и тяжести заболевания. В одном из вариантов реализации состав вводят периодически. Дозировка может составлять любое количество или объем, необходимый для желаемого лечения. Например, дозировки и в 1 мкг или 10 мкг могут быть назначены пациентам, проходящим через интраваскулярные процедуры, например, имплантацию стента, с целью предотвращения дальнейшего распространения и тяжести поздней потери просвета стента. В качестве дополнительного примера, дозировка может составлять по меньшей мере 100 мкг. В таком случае состав может вводится один раз, несколько раз и/или непрерывно, например, с помощью непрерывной(ых) инфузии(ий) в течение периода времени. Например, дозы могут вводиться в соответствии с способами, описанными в Banai, Am Heart J. (2013), supra.
E. Способ получения липосом
Другой аспект настоящего изобретения относится к способу получения липосом и липосомного состава для коммерческого производства продукта. Этот способ получения позволяет управлять описанными выше физическими характеристиками, а также контролировать некоторые параметры процесса, включая отношение воды к растворителю, состав растворителя и отношения растворителя, температуру получения везикул, показателя сдвиговых усилий для везикул, температуру экструзии, давление экструзии и размер мембран и тип мембран, используемых для экструзии.
Получение липосомного состава включает этапы (1) смешивания терапевтического агента с предварительно выбранными липидами с образованием везикул, (2) экструзии везикул через фильтр с одним размером пор в одну стадию и (3) ультрафильтрации. Фраза «экструзия через фильтр в одну стадию» означает, что этап экструзии подразумевает этап фильтрации через фильтр с одним размером пор. В нее могут входить многократные прохождения через фильтр с одним размером пор, но не требуются многократные и/или последовательные прохождения через фильтры с разными размерами пор, что известно из уровня техники, например, последовательное прохождение через мембраны с порами в 1,0, 0,8, 0,6, 0,4 и 0,2 мкм. После ультрафильтрации продукт может быть стандартизирован до желаемой конечной концентрации. Поскольку экструзия на этапе (2) проводится в одну стадию и при низком давлении, настоящий способ снижает производственные затраты и время, а также увеличивает выход продукта по сравнению с экструзией при высоком давлении и с использованием множества стадий. На Фиг.1 показаны этапы процесса получения липосомного состава.
Первый этап включает смешивание в растворе терапевтического агента и предварительно выбранных липидных ингредиентов для получения везикул. Во многих случаях до смешивания друг с другом терапевтический агент и липидный ингредиент солюбизируют в виде раствора терапевтического агента и раствора липидного ингредиента. В данном варианте реализации раствор терапевтического агента имеет некоторые физические характеристики, включая рН, осмоляльность и проводимость. Раствор терапевтического агента включает внутреннюю среду липосомного состава. Поэтому рН, проводимость и осмоляльность раствора терапевтического агента влияют на внутренние рН, проводимость и осмоляльность липосомного состава. Предпочтительное значение внутренней осмоляльности находится в диапазоне 340-440 мО/кг, в то время как предпочтительная внешняя липосомная осмоляльность составляет 270-340 мО/кг. рН раствора предназначено для поддержания рН раствора терапевтического агента в требуемом диапазоне рН. Таким образом, если используется кислый терапевтический агент, например, бисфосфонат, щелочной рН раствора может использоваться для поддержания рН раствора между 6,8 и 7,0. Например, раствор терапевтического агента может быть приготовлен из алендроната натрия, растворенного в растворе NaOH, с получением конечного рН раствора алендроната примерно 6,8 и проводимостью примерно 18,0 мСм/см. Раствор в ходе процесса можно дополнительно нагреть. В альтернативном варианте реализации могут быть использованы клодронат натрия или алендроната моногидрат. Раствор может быть нагрет до температуры, улучшающей растворение бисфосфоната в щелочном растворителе, в диапазоне от 55° до 75°С, например, до 70°С. В зависимости от количества растворенных терапевтического агента и носителя раствор может иметь осмоляльность, которая станет внутренней осмоляльностью липосомного состава, в диапазоне 340-400 мО/кг. Также, в зависимости от количества терапевтических агентов и носителей, раствор может иметь проводимость, которая станет внутренней проводимостью, в диапазоне 14,0-21,0 мСм/см. Внутренние рН, осмоляльность, проводимость являются факторами, влияющими на стабильность и эффективность липосомного состава. В одном из вариантов реализации, концентрация раствора терапевтического агента может иметь значения в диапазоне 20-120 г/л в течение этапа (1) процесса получения. Раствор терапевтического агента может быть приготовлен отдельно и/или до описанного процесса получения.
Липидные ингредиенты могут быть представлены в форме раствора, содержащего желаемые начальные количества липидного ингредиента, растворенные в объеме одного или более липидных растворителей. Может быть использован любой подходящий липидный ингредиент и липидный растворитель. Например, до формирования липосом липидный ингредиент может содержать DSPC, DSPG и холестерин в молярном отношении 3:1:2, соответственно. Полученная из такой комбинвции липидов липосома может также иметь молярное отношение DSPC, DSPG и холестерина равное 3:1:2. Далее, липидный растворитель может, например, содержать трет-бутанол, этанол и воду в объемном отношении 77/77/6, соответственно. Другие липидные растворители, пригодные для формирования липосом согласно изобретению, включают хлороформ и метанол. Липидные ингредиенты растворяются в липидном растворителе. Для получения раствора липидов липидный растворитель может быть нагрет до температуры, облегчающей растворение липидных ингредиентов, которая может принимать значения в диапазоне от 55° до 57° С, например, 70°С. Концентрация растворенных липидов в растворе может принимать значения в диапазоне 50-350 г/л. Липидный раствор может быть приготовлен отдельно и/или до описанного процесса получения.
Смешивание раствора терапевтического агента и липидного раствора приводит к формированию многослойных везикул (MLV). Отношение лекарственное средство:липид в везикуле может регулироваться изменением количества раствора терапевтического агента или липидного раствора. Умеренное нагревание обоих растворов может быть дополнительно использовано для облегчения смешивания растворов. Этот процесс приводит к эффективной инкапсуляции терапевтического агента в многослойных везикулах. В одном примере липидный раствор может быть добавлен в терапевтический агент в отношении 5,3 части липида к 1 части терапевтического агента. Такое отношение лекарственное средство:липид (по массе) увеличивает стабильность липосомного состава без значительного ухудшения качества доставки терапевтического агента. Однако, этот процесс позволяет получить значения отношения лекарственное средство:липид в диапазоне от 1:4 до 1:8 по массе, предпочтительно в диапазоне от 1:5 до 1:6. Далее, перед этапом экструзии концентрация растворителя может регулироваться без нарушения целостности липосом.
Следующий этап способа получения состава включает экструзию везикул через фильтр с одним размером пор в одну стадию. Экструзия везикул уменьшает размер многослойных везикул, описанных выше. Способ включает одноэтапную экструзию при низком давлении, что позволяет получить высоко однородные по размеру и форме липосомы. Процесс экструзии может включать использование гомогенизатора высокого давления (микрофлюидайзер) или традиционного гомогенизатора. Гомогенизаторы используют сдвиговую энергию для разрывания крупных липосом на более мелкие. Гомогенизаторы, подходящие для использования в настоящем способе, включают гомогенизаторы высокого давления, выпускаемые множеством производителей, например, Microfluidics в Бостоне, МА. Распределение размера получаемых частиц может отслеживаться с помощью традиционной методики определения размеров частиц с помощью лазерного пучка. Эффективным способом для снижения размеров липосом до получения относительно четкого распределения по размеру является экструзия липосом через поликарбонатную мембрану или ассиметричную керамическую мембрану. Предпочтительная температура экструзии находится выше температуры переходной фазы липосом для облегчения уменьшения размера. Например, в случае DSPG, DSPC и холестерина желаемая температура должна составлять примерно 55° С. При использовании других липидов и переходная температура таких липидов будет являться желательной температурой для этапа экструзии. Могут потребоваться повторения экструзии для достижения желаемой гомогенности и размера везикул. По ходу этого этапа образцы могут анализироваться в реальном времени для оценки желаемого размера везикул и микробного числа.
Процесс экструзии осуществляется с использованием техники одноэтапной экструзии при низком давлении. В ходе экструзии, MLV обрабатывают в одну стадию путем экструзии непосредственно через одну мембрану при приложении низкого давления, а не путем создания небольших однослойных липосом многостадийной экструзии, когда более крупные липосомы пропускают через последовательно меньшие мембраны с помощью экструдеров при высоком давлении (как используется в способах согласно уровню техники). В одном из вариантов реализации процесс одноэтапной экструзии проводят непосредственно с помощью поликарбонатной или керамической мембраны с порами размером 0,1 мкм при приложении низкого давления в 414-620 кПа (60-90 psi) с получением липосом размером 100 нм. Также в настоящем способе используется более низкое давление 414-620 кПа (60-90 psi) по сравнению с более высоким давлением (до 3447 кПа (500psi)), используемым при проведении экструзии под высоким давлением.
Настоящий способ имеет ряд преимуществ, обусловленных отсутствием необходимости во множестве мембран и проведением экструзии при низком давлении. В первую очередь процесс одноэтапной экструзии имеет преимущество перед многоэтапным процессом экструзии, поскольку занимает меньше времени. Далее, отсутствие необходимости в экструзии под высоким давлением снижает затраты, связанные с оборудованием для такой экструзии. Одним из примеров экструдеров, подходящих для применения в настоящем изобретении, является LIPEXtm Extruder, поставляемый Northern Lipids, Inc. Более того, материалы, используемые для экструдеров низкого давления, например, сжатый воздух, обычно стоят меньше, чем материалы для экструдеров высокого давления, например, азот. Далее сокращение множества стадий экструзии до одной вызывает соответствующее сокращение количества отходов и более высокий выход продукта.
Последний этап настоящего способа включает ультрафильтрацию экструдированных везикул в забуференный раствор. В то время как процесс экструзии приводит к получению однородных по размеру и форме липосом, процесс ультрафильтрации включает приложение давления к составу и пропускание его через мембрану с целью отделения инкапсулированных липосом от неинкапсулированного терапевтическиого агента, растворителей и липидов. Этот этап предпочтительно проводят при температуре ниже переходной температуры липидов, используемых в составе, например, в большинстве случаев, ниже 45° С. В ходе процесса ультрафильтрации могут использоваться разные типы фильтрационных мембран. Один вариант реализации этапа ультрафильтрации включает использование половолоконных мембран, при использовании которых состав продавливается через открытые полости волокна, а микромолекулы (например, растворитель, неинкапсулируемый бисфосфонат, липиды) фильтруются через внешнюю мембрану волокна, в то время как более крупные липосомы остаются внутри волокна. В результате ультрафильтрации получается состав с долей однородных инкапсулированных агентов более или равной 96%.
Этап ультрафильтрации может далее включать этап диализа, причем состав подвергается диализу против некоего объема забуференного раствора. Одним из примеров забуференного раствора является натрий-фосфатный буфер (PBS), но может использоваться любой буфер, имеющий баланс положительных и отрицательных ионов, поддерживаемых на уровне физиологической осмоляльности. Другие буферные добавки, известные из техники, могут включать, например, сахарозу, глицин, сукцинат натрия и/или альбумин. Забуференный раствор предпочтительно должен отражать внешнюю среду конечного состава, поэтому важно тщательно следить за значениями рН и проводимости. Предпочтительно забуференный раствор является изотоническим и нетоксичным по отношению к клеткам. Забуференный раствор можно отфильтровать с целью снижения уровня загрязнений, также забуференный раствор может быть приготовлен заранее. Конечная точка диализа определяется как достижением составом желаемого уровня рН и проводимости.
В конце этапа ультрафильтрации состав может быть дополнительно отфильтрован для стерилизации, например, для поддержания требуемого уровня бионагрузки. В одном варианте реализации процесса стерилизационный фильтр связан с сосудом, находящимся под давлением, содержащим липосомный состав. С другой стороны стерилизационный фильтр связан со стерильным приемным резервуаром. Под давлением липосомный состав пропускается через стерилизационный фильтр. Далее на этом этапе может быть отобран образец для оценки содержания бактерий. Размеры пор стерилизационных фильтров могут иметь значения от 0,2 до 0,45 мкм. Поскольку липосомы настоящего липосомного состава являются по существу однородными, а крупные липосомы отсутствуют, стерилизационная фильтрация может пройти сравнительно без осложнений.
После получения липосомный состав можно стандартизовать. Конечная стандартизация позволяет получить серию липосомных составов имеющих стандартную концентрацию. В ходе стандартизации анализируются выход продукта, размер липосом, липидный состав, содержание инкапсулированного и свободного терапевтического агента и концентрация продукта. Анализ концентрации может быть проведен с использованием способов, известных в технике, например, ВЭЖХ или спектрофотометрического определения ортофосфата. После подтверждения концентрации ультрафитрованного продукта, определенный объем забуференного раствора используется для разбавления липосомного состава до стандартной концентрации. Конечная стандартизация также включает стерильную фильтрацию липосомного продукта. Например, после ультрафильтрации инкапсулирующий бисфофонат состав может быть разведен определенным количеством забуференного раствора до получения конечной концентрации. Похожим образом с помощью различных количеств забуференного раствора, разведенного для получения нескольких порций с разной концентрацией, продукт ультрафильтрации может быть разделен на несколько порций для использования в разных конечных концентрациях. Можно отобрать образцы для подтверждения полученной концентрации терапевтического агента.
Данный процесс получения имеет преимущество в том, что он позволяет контролировать, менять и воспроизводить физиологические и химические свойства липосом. Например, внешний рН липосомы можно контролировать путем изменения состава раствора, в котором растворен терапевтический агент. Внутренняя осмоляльность может регулироваться похожим образом путем изменения количества терапевтического агента, или, например, в зависимости от того, является ли агент заряженным или незаряженным. Отношение лекарственное средство:липид можно регулировать путем отбора липидных ингредиентов, входящих в состав липосомы, или количеством липидов, добавляемых к растворенному активному агенту. Увеличенное количество липидного ингредиента снижает отношение лекарственное средство:липид, и наоборот. Низкое отношение лекарственное средство:липид также снижает внутреннюю осмоляльность липосомного состава. Внешние рН и осмоляльность композиции частично зависят от состава забуференного раствора, который содержит конечный продукт. Проводимость можно регулировать изменением природы терапевтического агента и других вспомогательных средств, инкапсулированных в липосоме. Другие факторы, включающие без ограничений вязкость, качество вспомогательного вещества, стерильность, совместимость с физиологическим раствором, наборы и шприцы для инфузий (для препаратов для инъекций) и совместимость с оборудованием для получения состава также независимо контролируются в ходе процесса получения липосомного состава, описанного в настоящем изобретении.
В соответствии с приведенным выше описанием в одном из предпочтительных вариантов реализации процесса получения состав получают путем (1) смешивания раствора, содержащего терапевтический агент, с раствором, содержащим липиды, включающие DSPC, DSPG и холестерин в молярном отношении 3:1:2, с образованием везикул, причем массовое отношение терапевтического агента к липидам составляет от примерно 1:5 до 1:8, (2) экструзии везикул через фильтр с размером пор примерно 100 нм в одну стадию, и (3) ультрафильтрации.
Другим аспектом настоящего изобретения является липосомный состав, полученный в соответствии с приведенными выше этапами получения, причем состав содержит DSPC, DSPG и холестерин в молярном отношении 3:1:2 с образованием везикул, причем массовое отношение терапевтического агента к липидам составляет от примерно 1:5 до 1:8 и производится в ходе следующих этапов: смешивание раствора, содержащего терапевтический агент, с раствором, содержащим липиды, с образованием везикул, (2) экструзия везикул через фильтр с одним размером пор нм в одну стадию, и (3) ультрафильтрацию. После ультрафильтрации продукт может быть стандартизирован до желаемой концентрации. Состав, полученный согласно настоящему способу, имеет значение PDI менее 0,075, предпочтительно в диапазоне между 0,02 и 0,05. Указанный способ позволяет получить липосомный состав, имеющий новые и полезные качества, описанные выше, включая, например, отношение липидных ингредиентов 3:1:2, отношение лекарственное средство:липид между 1:5 и 1:8. Более того, он позволяет независимо контролировать индивидуальные липосомные характеристики, включая рН, осмоляльность, проводимость и жесткость.
Следующие примеры предназначены для иллюстрации и пояснения различных аспектов реализации настоящего изобретения и не предназначены ни в какой мере для ограничения объем изобретения. Настоящее изобретение далее описано с помощью примеров со ссылкой на сопутствующие чертежи. С особой ссылкой на прилагаемые, в частности, чертежи, подчеркивается, что частные случаи показаны в качестве примера и исключительно с целью проиллюстрировать предпочтительные варианты реализации, которые считаются наиболее полезным и понятным описанием принципов и идей настоящего изобретения. Данное описание следует рассматривать совместно с чертежами, что позволяет прояснить специалисту в данной области техники как можно реализовать на практике несколько форм настоящего изобретения.
Пример 1 - Получение партии липосомного состава
В соответствии с описанным выше процессом, приготовили иллюстративную партию липосомного состава. Следует понимать, что размер партии может меняться в зависимости от требований промышленного производства. В данном примере получили однолитровую партию липосомного алендроната, инкапсулированного в липосомах, содержащих холестерин, DSPC и DSPG, и диспергированную в натрий-фосфатном буфере. Для удобства клинического использования липосомный алендронат может быть представлен в двух концентрациях: 5 мг/мл и 0,5 мг/мл в качестве беловатой, стерильной липосомной дисперсии. Данные концентрации могут быть далее смешаны для получения желаемого количества терапевтического агента в любом конкретном объеме. Липидные ингредиенты составили из холестерина, DSPC и DSPG. Дисперсия также содержала раствор фосфатного буфера в солевом растворе для контроля уровня рН, стабильности инфузии и для поддержания изотоничности. По меньшей мере 96% лекарственного средства было инкапсулировано в липосомах. Для введения содержимое ампулы (или, при необходимости, его часть) разбавляли солевым раствором и затем вводили в виде инфузии.
Формула для получения партии, включающая количество и качество используемых при получении компонентов, а также их количество на 1 литр партии показаны в Таблице 1, представленной ниже.
Таблица 1 - Липосомный алендронат для четырех инфузий, формула для партии в 1 л.
6 ± 0,1 мл
Содержание и количественный состав липосомного алендроната для четырех инфузий, полученных из 1 литровой партии, описанной в Таблице 1, зафиксированы в Таблице 2 ниже. Следует отметить, что в этой партии молярное отношение DSPC:DSPG:холестерин составило 3:1:2. Также, значение отношения лекарственное средство:липид было определено примерно 1%5,7 ± 1,5 по объему.
Таблица 2 - Состав липосомного алендроната для ВВ инфузии
= 0,0015 ммоль/мл
= 0,015 ммоль/мл
= 0,0015 ммоль/мл
= 0,013 ммоль/мл
= 0,0022 ммоль/мл
= 0,020 ммоль/мл
= 0,0007 ммоль/мл
= 0,006 ммоль/мл
Состав липосомного алендроната для ВВ инфузий, получаемого в ходе описанного выше нового способа процесса получения, представлен на Таблице 3 ниже.
Таблица 3 - Описание лекарственной формы с концентрацией 5 мг/мл
На Фиг.2 показана схема, обобщающая процесс получения одного литра липосомного алендроната для ВВ инъекций с дозировкой 5 мг/мл, и процесс контроля характеристик липосомного алендроната. Способ получения для дозировки в 0,5 мг/мл остается таким же, как и для 5 мг/мл. Отличается только способ получения различных конечных концентраций для введения в ходе этапа конечной стандартизации. Для специалиста в области техники будет понятно, что согласно настоящему способу могут быть получены различные дозировки препарата без необходимости в дальнейших экспериментах
Раствор терапевтического агента (раствор алендроната) и липидный раствор были получены согласно следующему:
Раствор алендроната. NaOH (6,8-8,0 г) взвесили и растворили в 850 мл воды для инъекций (WFI) при температуре 70±3°С, и скорости перемешивания 600±150 об/мин. Полное растворение подтвердили визуальной проверкой. Алендронат натрия (68-80,75г) растворили в растворе NaOH при температуре 70±3°С, и скорости перемешивания 600±150 об/мин. Полное растворение подтвердили визуальной проверкой (например, на прозрачность раствора), подтвердили соответствие значений проводимости и рН (рН= 6,8±0,3. Проводимость=18,0±1 мСм/см).
Липидный раствор. Смесь липидов, включающую 30 г DSPC (37,9 ммоль), 10 г DSPG (12,5 ммоль) и 10 г холестерина (25,8 ммоль) (DSPC/DSPG/холестерин; 3/1/2 моль/моль/моль) взвесили и растворили в лабораторном стакане на 250 мл с помощью нагревающейся магнитной мешалки в 160 мл смеси трет-бутанол/этанол/вода (77/77/6, по объему) при температуре 70±3°С, с получением липидного раствора с концентрацией в 312 мг/мл. Прозрачный желтый раствор был получен при достижении необходимой температуры.
Состав MLV. Липидный раствор добавили к раствору алендроната (одна часть лекарства, на 5,3 части липида) при перемешивании при 600±150 об/мин и постоянной температуре 70±3°С. После по меньшей мере 5 минут добавили 100 мл WFI (10% от общего объема) для снижения концентрации растворителя после экструзии. Состав дополнительно перемешивали в течение 10 минут.
Экструзия. Для проведения экструзии состав поместили в нагретый экструдер из нержавеющей стали объемом 1,2 л, с монтированной в нем керамической мембраной с диаметром пор 0,14 мкм или двумя поликарбонатными мембранами (например, с порами в 0,2 мкм для предварительной фильтрации и с порами в 0,1 мкм) под давлением в 620±207 кПа (90±30 psi) и температурой 68±5°С с целью снижения размера везикул и увеличения степени гомогенности везикул. Процесс требует проведения 12-18 проходов для получения везикул в 80-100 нм. В процессе проведения проходов экструзии собирали образцы для определения размера везикул до ультрафильтрации. Анализ размера липосом анализировали с помощью анализатора Malvern Nano ZS (приемлемый размер частиц для анализа: 95±20 нм). Образцы экструдата также анализировали на содержание аэробных бактерий (контроль бионагрузки). Приемлемый предел составил <100 КОЕ/мл.
Ультрафильтрация и диафильтрация. В первую очередь состав оставляли остывать до <45°С перед последующей ультрафильтрацией. Ультрафильтрацию проводили в системе Amersham QuixStand с половолокнистой мембраной в 500К. Состав сконцентрировали, используя входящее давление, не превышающее 172 кПа (25 psi). При достижении минимального объема состав диализировали с 10-кратным исходным объемом (≈7л) раствора натрий-фосфатного буфера (PBS). Раствор PBS получили путем растворения 145 мМ NaCl, 13 мМ Na2HPO4*H2O и 7 мМ NaH2PO4*H2O в 10 л WFI. PBS имел рН примерно 6,9 и проводимость примерно 16,9 мСм/см. PBS отфильтровали через фильтр с диаметром пор в 0,2 мкм. При достижении необходимых значений рН и проводимости, диафильтрацию остановили. Состав, слитый из системы ультрафильтрации, не превышал 120% от изначального объема (≈1,2 литра). Взяли образцы для общего анализа и на содержание аэробных бактерий (контроль бионагрузки). Приемлемый предел составил <100 КОЕ/мл.
В конце диализа состав отфильтровали через фильтр с диаметром пор в 0,2 нм для поддержания требуемого уровня бионагрузки. Содержащий состав сосуд под давлением соединили со стерильным фильтром с диаметром пор 0,2 мкм (Sartorius Sartobran P). Фильтр предварительно смонтировали со стерильным приемным сосудом. Фильтрацию проводили под давлением 34-207 кПа (5-30 psi) в сосуде, содержащем состав. Взяли образцы для общего анализа и на содержание аэробных бактерий (контроль бионагрузки). Приемлемый предел составил <100 КОЕ/мл.
Конечная стандартизация. С помощью ВЭЖХ проанализировали размер липосом состава, содержание липидов/терапевтического агента в липосомах, содержание лекарственного средства и свободного терапевтического агента. Ожидаемый выход в данном примере составил один литр состава, содержащего примерно 6 мг/мл инкапсулированного алендроната и 35 мг/мл липидов. Основываясь на результатах анализа концентрации алендроната, было посчитано необходимое разбавление для получения примерно литра состава с конечной концентрацией в 5 мг/мл или 0,5 мг/мл. Для получения состава с концентрацией 5 мг/мл, примерно 900 мл липосомного алендроната после ультрафильтрации разбавили примерно 100 мл PBS, приготовленного, как описано выше. Дополнительно, для получения состава с концентрацией 0,5 мг/мл, примерно 100 мл липосомного алендроната после ультрафильтрации разбавили, примерно, 900 мл PBS. Взяли образцы для определения полученной концентрации алендроната.
После получения стандартных концентраций состава, бутыль, содержащую состав, присоединили к двум последовательным стерильным фильтрам с размером пор в 0,2 мкм (Sartorius Sartobran P), расположенным в комнате с классом стерильности 100, или в стерильном ламинаре. Фильтры заранее смонтировали с предварительно стерилизованными приемным пакетом или бутылью. Фильтрацию проводили с помощью перистальтического насоса или под давлением сжатого азота. Давление не должно превышать 69 кПа (10 psi). По окончанию фильтрации фильтр проверили на целостность.
Липосомный алендронат для ВВ инфузий, полученный в примере выше, имеет ряд желаемых характеристик, например (i) три года стабильного хранения по меньшей мере алендроната и липидов при 5°С (в диапазоне 2-8°С); (ii) средний диаметр везикул 80±5 без дисперсного материала; (iii) концентрация алендроната натрия до 5 мг/мл (в диапазоне 0,1- 5,0 мг/мл); (iv) инкапсуляция алендроната равная или выше 96%; (v) содержание липидов в молярном отношении дистеароилфосфатидилхолин/дистеароилфосфатидилглицерин/холестерин (DSPC/DSPG/холестерин), составляющее 3/1/2; (vi) физиологическая осмоляльность, составляющая 270-340 мО/кг, (vii) показатель вязкости близкий к показателю воды, то есть динамическая вязкость примерно 10 мПа·с при 20°С; (viii) значение рН равное 6,8 (в диапазоне 6,8-7,0); (ix) допустимость во всем мире в отношении качества носителя в соответствии с Фармакопеей США (USP) или Европы (EP); (х) соответствие требованиям USP, касающихся стерильности и пирогенности, согласно опубликованному в USP 24-NF 19; (xi) совместимость (при использовании) с физраствором, наборами для инфузии и шприцами; и (xii) совместимость (при получении) с фильтрами, нержавеющей сталью труб и стеклом.
На Фиг. 3 показано изображение TEMS липосомного алендроната, полученного в описанном выше примере. Можно наблюдать хороший уровень гомогенности и однородности липосомной популяции, а также то, что липосомы имеют размер от 40 до 120 нм.
Пример 2 - Тестирование жесткости липосом
В ходе анализа жесткости липосом были проанализированы четыре образца больших однослойных липосом (диаметр приблизительно 100 нм). Пустые липосомы, растворенные в PBS, полученные согласно настоящему изобретению, пометили как LPO. Липосомные составы, содержащие 5,0 мг/мл алендроната, полученные согласно настоящему изобретению, пометили как LSA. Два других липосомных образца, помеченные как KS и HU и растворенные в HEPES, получили согласно способу, известному из техники и описанному в Epstein-Barash, Hila и др., ʺPhysicochemical parameters affecting liposomal bisphosphonates bioactivity for restoring therapy: Internalization, cell inhibition, activation of cytokines and complement, and mechanism of cell deathʺ, J. Controlled Release 146 (2010) 182-195.
Каждый образец был проанализирован для определения удельной объемной сжимаемости липосом. Используя ультразвуковую вискозиметрию были оценены эластичные свойства липосом, на основании следующего отношения:

где βS, ρ и u означают адиабатическую сжимаемость, плотность и звуковую вязкость суспензии, соответственно. Hianik, T., Haburcak, M., Lohner, K., Prenner, E., Paltauf, F., & Hermetter, A. (1998). Compressibility and density of lipid bilayers composed of polyunsaturated phospholipids and cholesterol. Coll. and Surf. A 139(2), 189-197. Hianik, T., Rybár, P., Krivánek, R., Petríková, M., Roudna, M., & Apell, H. J. (2011). Specific volume and compressibility of bilayer lipid membranes with incorporated Na, K-ATPase. Gen. Physiol. Biophys. 30, 145-153. Таким образом, можно определить изменения в сжимаемости путем измерения изменений звуковой вязкости и плотности.
Ультразвуковая вязкость измеряется с использованием дифференциального вискозиметра с постоянной длинной капилляров, состоящего из двух почти идентичных полостных резонатора (Sarvazyan, A. P. (1991). Ultrasonic velocimetry of biological compounds. Annu. Rev. Biophys. Biophys. Chem. 20, 321-342; Sarvazyan, A. P., Chalikian, T. V. (1991). Theoretical analysis of an ultrasonic interferometer for precise measurements at high pressures. Ultrasonics 29, 119-124.) при использовании частот примерно 7,2 МГц. Резонансные частоты ячеек измерили с помощью компьютерного сетевого анализатора (USAT, США). Объем образца составил 0,7 мл. Резонаторные ячейки оборудовали магнитными мешалками для обеспечения гомогенного распределения образцов в ходе измерения. Один резонатор содержал липосомный состав с концентрацией фосфолипидов 10мг/мл, причем другой резонатор содержал в качестве контроля тот же самый раствор (PBS или HEPES) без добавления везикул. Перед проведением серии измерений в первую очередь сравнили резонансные частоты обоих резонаторов путем измерения обоих ячеек, наполненных одинаковой контрольной жидкостью. Поскольку энергетическая плотность ультразвукового сигнала в объеме была небольшой (амплитуда давления ультразвуковой волны составила менее чем 103 Па), удалось избежать воздействия звуковой волны на структурные свойства везикул. В целом, ультразвуковая вискозиметрия позволяет определить звуковую плотность [u] или ее изменение в зависимости от концентрации (Sarvazyan, A. P. (1982). Development of methods of precise ultrasonic measurements in small volumes of liquids. Ultrasonics 20, 151-154) как определено в уравнении:

где «с» это концентрация растворенного вещества в мг/мл, а индекс «0» относится к растворителю (буферу). Значение [u] может быть напрямую выведено из изменений резонансных частот f и f0 в обоих резонаторах (где f это резонансная частота образца, а f0 это резонансная частота контроля - буфера):
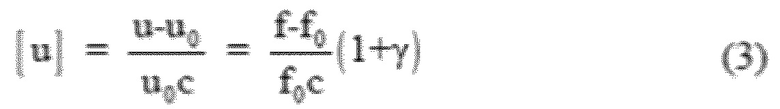
(коэффициент γ удовлетворяет условию γ <<1 и может не учитываться в расчетах)
Высокоточная денситометрическая система (DMA 60 с двумя камерами для образцов DMA 602 M, Anton Paar KG, Graz, Austria) использующая принцип вибрирующей трубки (Kratky, O., Leopold, H., & Stabinger, H. (1973). The determination of the partial specific volume of proteins by the mechanical oscillator technique. Methods in enzymology (Ed. E. Grell), vol. 27, pp. 98-110), была применена для определения плотности (ρ) раствора везикул. Парциальные удельные объемы (ϕV) рассчитали исходя из данных о плотности, используя уравнение:
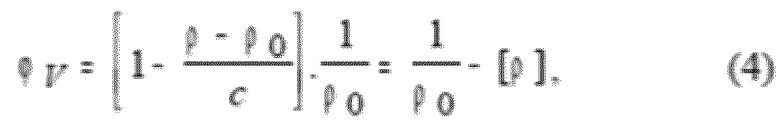
где индекс 0 относится к контрольному растворенному веществу, а [ρ]=(ρ- ρ0)/(ρ0c) обозначает связанные с концентрацией изменения плотности. Температуру ячеек контролировали с точностью ±0,02°С с помощью ультра-термостата Lauda RK 8 CS (Lauda, Германия).
Определение удельных объемов в дополнение к изменению звуковой вязкости в зависимости от концентрации позволило вычислить сниженную удельную кажущуюся сжимаемость, ϕК/β0, везикул, используя следующее уравнение:

где β0 это коэффициент сжимаемости, а ρ0 это плотность буфера (Sarvazyan 1991). Значение ϕК/β0 означает объемную сжимаемость липосом по сравнению с буфером. Высокое значение ϕК/β0 означает высокую сжимаемость (а также низкую жесткость) липосом.
С целью определения удельной объемной сжимаемости липосом измерили изменение ультразвуковой вязкости в зависимости от концентрации, [u] и плотность, ρ. Затем определили удельный объем, ϕV и удельную кажущуюся сжимаемость, ϕК/β0 по формулам (4,5).
На Фиг.4 показано, что липосомы настоящего изобретения являются по существу жесткими по сравнению с другими липосомными составами и пустыми липосомами. Как показано на Фиг. 4, удельная сжимаемость (значение, обратное жесткости) липосом LSA является значительно более низкой, чем у пустых липосом, полученных с помощью традиционных способов, известных из уровня техники. Сжимаемость липосом LSA составила порядка 0,70, в то время как это же значение для пустых липосом составило примерно 0,90. Удельная сжимаемость липосом KS и HU составила 0,75 и значительно отличалась от остальных протестированных липосом. Данный пример демонстрирует чувствительность механических свойств липосом к составу липосом и к наличию лекарственного средства внутри липосом.
Пример 3 - Анализ стабильности липосом
Стабильность липосомного состава, полученного в соответствии с примером 1, проиллюстрирована в Таблицах 4 и 5. В Таблице 4 показано, что липосомы, описанные в настоящем изобретении, являются стабильными при хранении при 4°С по меньшей мере 36 месяцев, и что состав отвечает всем необходимым требованиям.
Таблица 4 - стабильность при 4°С
ристика
В Таблице 4 показано, что липосомы, описанные в настоящем изобретении, являются стабильными при хранении при 25°С по меньшей мере 7 месяцев, и что состав отвечает всем необходимым требованиям.
ристика
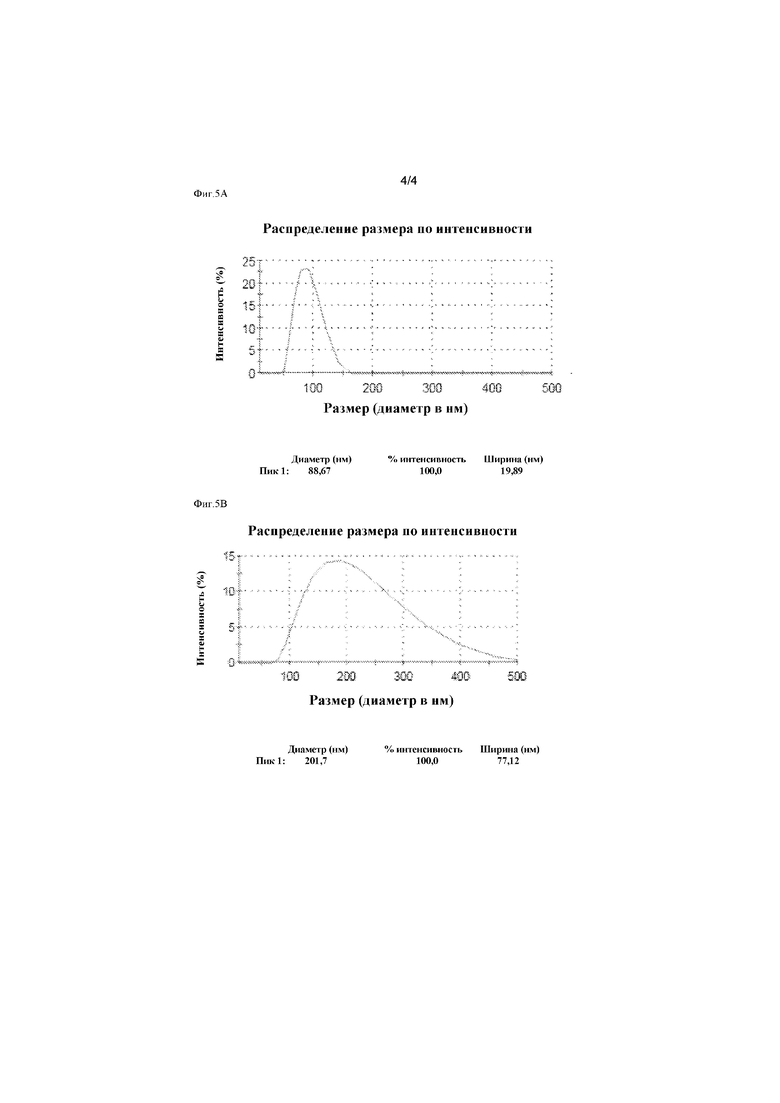
Пример 4 - Анализ однородности липосом
Анализ на однородность липосом провели с помощью измерительной системы размера частиц Malvern Nano ZS. Этот способ заключается в определении однородности размера везикул липосомного состава с помощью Динамического рассеивания света (DLS) и характеризует распределение размера частиц, суспендированных в жидкой среде. Данный способ очень чувствителен к диапазону размеров 10-1000 нм, и применим для ряда частиц, включая эмульсии липосом, наночастицы и синтетические полимеры. Данный способ может быть использован как для определения среднего диаметра гомогенного липосомного состава, так и для определения гетерогенности состава. После стандартизации измерительной системы Malvern Nano ZS в соответствии с инструкцией по эксплуатации, образцы липосом с концентрацией 0,5 мг/мл разбавили в отношении 1/3 в PBS. λмакс УФ-излучения при 600 нм разбавленного раствора определили с помощью спектрофотометра Ultraspec 2100pro UV/VIS. Липосомный образец снова разбавили до достижения значения оптической плотности (O.D.) 0.10±0,02. Затем определили, что λмакс УФ-излучения при 600 нм второго разбавления также равняется 0.10±0,02 O.D. Затем, 1,0-1,5 мл разбавленного образца поместили в пробирку для культивирования и проанализировали размер везикул с помощью измерительной системы Malvern Nano ZS. Анализ провели при комнатной температуре (23°±2°С), зафиксированном угле в 173° и длине волны лазера 633 нм. Данные были аккумулированы для достижения 150-500 Kcps (тысяч измерений в секунду).
В таблице 6 показаны данные измерения состава, описанного в настоящем изобретении. Средний размер липосом составил 80,41 нм, с PDI равном 0,04.
Таблица 6
Липосомы HU, являющиеся липосомами, известными из техники, описанными в Примере 2, проанализировали на однородность в соответствии с описанным выше способом. Z-Средний размер липосом HU составил 176,5 нм.
На Фиг. 5А и 5В показано распределение размера у липосом, полученных согласно настоящему изобретению, и липосом HU, соответственно. На фиг. 5А показано, что липосомный состав настоящего изобретения имеет средний диаметр частиц примерно 88 нм, причем диаметр частиц варьирует по существу в диапазоне от 69 до 107 нм. Напротив, на Фиг. 5В показано, что липосомный состав HU имеет средний диаметр частиц примерно 201 нм с диаметром частиц от 80 нм до 500 нм. Значение PDI состава на Фиг. 5А составило 0,025. Значение PDI состава HU на Фиг. 5В составило 0,118.
Содержание всех изданных статей, книг, вспомогательных руководств и рефератов, описанных в настоящем документе, включаются в нее в полном объеме посредством ссылки, для того чтобы как можно полнее описать уровень техники, к которому относится настоящее изобретение.
Поскольку является возможным осуществить описанное выше с различными изменениями, не выходя за рамки объема и сущности настоящего изобретения, подразумевается, что все сведения, содержащиеся в описании выше или определенные в прилагаемой формуле изобретения, должны рассматриваться исключительно в качестве описания и иллюстрации настоящего изобретения. В свете сказанного выше, возможны различные модификации и вариации настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛИПОСОМНЫЙ СОСТАВ И ЕГО ПОЛУЧЕНИЕ | 2013 |
|
RU2649805C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ КОНТРОЛИРОВАННОГО ВЫСВОБОЖДЕНИЯ ТРЕПРОСТИНИЛА | 2019 |
|
RU2796305C2 |
| ПРИМЕНЕНИЕ БИСФОСФОНАТОВ В КАЧЕСТВЕ ДОПОЛНИТЕЛЬНОГО ЛЕЧЕНИЯ ВИЧ/СПИД | 2015 |
|
RU2671973C2 |
| ЛИОФИЛИЗИРОВАННЫЕ ЛИПОСОМЫ | 2012 |
|
RU2648753C2 |
| ЛИОФИЛИЗИРОВАННЫЕ ЛИПОСОМЫ | 2012 |
|
RU2780489C2 |
| КОМБИНАЦИОННЫЕ ЛИПОСОМАЛЬНЫЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2012 |
|
RU2640934C2 |
| ЛИПОСОМНЫЕ КОМПОЗИЦИИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2015 |
|
RU2757110C2 |
| ЛИПОСОМАЛЬНЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ СЛАБОКИСЛОТНЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА, И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2778886C2 |
| ЛИПОСОМНЫЕ КОМПОЗИЦИИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2005 |
|
RU2574926C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ УПРАВЛЯЕМОГО ВЫСВОБОЖДЕНИЯ СЛАБОКИСЛОТНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ И ЕЕ ПРИМЕНЕНИЯ | 2019 |
|
RU2810790C2 |



Группа изобретений относится к медицине и может быть использована для получения лекарственного средства на основе липосомного состава для лечения состояния, связанного с воспалением. При этом липосома содержит липидный ингредиент и инкапсулирует бисфосфонат. Липосома имеет массовое отношение указанного бисфосфоната к липидному ингредиенту от 1:5 до 1:8. Липидный ингредиент содержит дистеароил фосфатидилхолин (DSPC), дистеароил фосфатидилглицерин (DSPG) и холестерин в молярном отношении 3:1:2. Липосома имеет значение сжимаемости менее 0,70 мл/г. Также предложены липосома, состав липосом и применение состава для получения лекарственного средства. Группа изобретений позволяет получить однородный и стабильный липосомный состав для лечения состояния, связанного с воспалением. 4 н.п. и 11 з.п. ф-лы, 6 таб., 5 ил., 4 пр.
1. Применение липосомы для получения лекарственного средства для лечения состояния, связанного с воспалением, где липосома, содержащая липидный ингредиент и инкапсулирующая бисфосфонат, имеет массовое отношение указанного бисфосфоната к липидному ингредиенту от 1:5 до 1:8, причем липидный ингредиент содержит дистеароил фосфатидилхолин (DSPC), дистеароил фосфатидилглицерин (DSPG) и холестерин в молярном отношении 3:1:2, и указанная липосома имеет значение сжимаемости менее 0,70 мл/г.
2. Применение состава для получения лекарственного средства для терапевтического применения, связанного с воспалением, где состав содержит множество липосом, где указанные липосомы содержат липидный ингредиент и бисфосфонат, причем липидный ингредиент содержит дистеароил фосфатидилхолин (DSPC), дистеароил фосфатидилглицерин (DSPG) и холестерин в молярном отношении 3:1:2, и состав имеет значение индекса полидисперсности (PDI) менее 0,070.
3. Липосома, содержащая липидный ингредиент и инкапсулирующая бисфосфонат, имеющая массовое отношение указанного бисфосфоната к липидному ингредиенту примерно от 1:5 до 1:8, причем липидный ингредиент содержит дистеароил фосфатидилхолин (DSPC), дистеароил фосфатидилглицерин (DSPG) и холестерин в молярном отношении 3:1:2, и указанная липосома имеет значение сжимаемости менее 0,70 мл/г.
4. Состав, содержащий множество липосом, где указанные липосомы содержат липидный ингредиент и бисфосфонат, причем липидный ингредиент содержит дистеароил фосфатидилхолин (DSPC), дистеароил фосфатидилглицерин (DSPG) и холестерин в молярном отношении 3:1:2, и состав имеет значение индекса полидисперсности (PDI) менее 0,070.
5. Применение, липосома или состав по любому из пп. 1, 2, 3 или 4, где липосомы имеют отрицательный заряд.
6. Применение, липосома или состав по любому из пп. 1, 2, 3 или 4, где липосомы имеют осмоляльность, внутреннюю по отношению к липосоме, составляющую 340-440 мО/кг.
7. Применение, липосома или состав по любому из пп. 1, 2, 3 или 4, где липосомы имеют проводимость, внутреннюю по отношению к липосоме, составляющую 13,5-17,5 мСм/см.
8. Применение, липосома или состав по любому из пп. 1, 2, 3 или 4, где липосомы имеют средний размер 80±5 нм.
9. Применение, липосома или состав по любому из пп. 1, 2, 3 или 4, где бисфосфонат является алендронатом.
10. Применение, липосома или состав по п. 9, где концентрация бисфосфоната внутри липосомы составляет от 0,5 до 5 мг/мл.
11. Применение, липосома или состав по любому из пп. 1, 2, 3 или 4, где внутренний липосомный рН составляет 6,9.
12. Применение или состав по п. 2 или 4, где по меньшей мере 96% бисфосфоната в указанном составе является инкапсулированным.
13. Применение или состав по п. 2 или 4, где массовое отношение бисфосфоната к указанному липидному ингредиенту составляет от 1:5 до 1:8.
14. Применение или состав по п. 2 или 4, где липосомы имеют значение сжимаемости не более 0,70 мл/г.
15. Применение или состав по п. 2 или 4, где значение PDI составляет от 0,02 до 0,05.
| WO 2012080369 A1, 21.06.2012 | |||
| WO 2010107990 A1, 23.09.2010 | |||
| US 2011002977 A1, 06.01.2011 | |||
| EPSTEIN-BARASH HILA et al., Physicochemical parameters affecting liposomal bisphosphonates bioactivity for restenosis therapy: Internalization, cell inhibition, activation of cytokines and complement, and mechanism of cell death, J | |||
| CONTROLLED RELEASE, 2010, |
Авторы
Даты
2020-08-03—Публикация
2018-03-22—Подача