ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к связывающему RGMa белку и его использованию.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[0002] RGM (молекулу отталкивающего направляющего сигнала), которая представляет собой GPI-заякоренный мембранный белок с молекулярной массой приблизительно 33 кДа, превоначально идентифицировали как направляющую аксоны молекулу в зрительной системе (см. непатентный документ 1). Семейство RGM включает три представителя, получивших названия RGMa, RGMb и RGMc. Среди них RGMa повторно экспрессируется после повреждения центральной нервной системы у взрослых людей и крыс, а также во время стадии развития, и ингибирование RGMa у крысы ускоряет прорастание нейритов после повреждения спинного мозга и способствует функциональному восстановлению (см. непатентный документ 2). Таким образом, полагают, что RGMa является ингибитором нейритов после повреждения центральной нервной системы.
[0003] Также опубликовано, что RGMa оказывает действие на иммунную систему. RGMa экспрессируется в дендритных клетках и действует на T-клетки, таким образом, увеличивая адгезию T-клеток с ICAM-1 и фибронектином и индуцируя продукция цитокинов (патентный документ 4). На модели рассеянного склероза на мышах введение антитела к RGMa подавляло симптомы, обусловленные энцефаломиелитом, и а также вызывало подавление начала и рецидива заболевания. Полагают, что антитело к RGMa связывается с RGMa, экспедируемой дендритными клетками, ингибируя активацию T-клеток, таким образом, оказывая воздействие на рассеянный склероз.
[0004] Также изучается механизм передачи сигнала RGMa, и опубликовано, что белок неогенин является рецептором RGMa (патентный документ 3). Неогенин является единственным трансмембранным белком, экспрессируемым нейронами и T-клетками.
RGMa связывается с неогенином на клеточной мембране, индуцируя внутриклеточную активацию RhoA и инактивацию Ras, таким образом, обеспечивая ингибирующее действие на разрастание нейритов. В тоже время известно, что неогенин вызывает апоптоз при отсутствии связывания RGMa во время развития головного мозга кур (Matsunaga et al., Dev. Growth Differ. 46, 481, 2004). Таким образом, полагают, что путь RGMa/неогенин оказывает два противоположных действия, способствуя выживания нейронов, что является благоприятным действием для регенерации нервов, и ингибируя прорастание нейритов, отрицательное действие.
[0005] В качестве фармацевтического средства, направленно воздействующего на RGM, в патентном документе 1 описано способствующее регенерации аксонов средство, содержащее нейтрализующее антитело к RGM в качестве активного ингредиента. В патентных документах 2 и 3 описано терапевтическое средство от механического повреждения головного мозга и спинного мозга, антитело к RGM, которое регулирует связывание RGM с ее рецептором неогенином. В патентном документе 4 описаны виды медицинского использования антитела к RGM, такие как для рассеянного склероза. В патентном документе 5 описаны виды терапевтического использования антитела к RGM для заболеваний, включая рассеянный склероз, повреждение головного мозга млекопитающего, повреждение спинного мозга, апоплексия, нейродегенеративное заболевание и шизофрения. Кроме того, в патентном документе 6 описаны виды терапевтического использования модуляторов RGM, таких как антитело к RGM для повреждения спинного мозга и рассеянного склероза, и в непатентном документе 3 описано терапевтическое использование для прогрессирующего рассеянного склероза.
ДОКУМЕНТЫ ИЗВЕСТНОГО УРОВНЯ ТЕХНИКИ
ПАТЕНТНЫЕ ДОКУМЕНТЫ
[0006] Патентный документ 1: WO 2005/087268
Патентный документ 2: опубликованная переведенная патентная заявка PCT Японии №2010-537655
Патентный документ 3: опубликованная переведенная патентная заявка PCT Японии №2009-510002
Патентный документ 4: WO 2011/071059
Патентный документ 5: опубликованная переведенная патентная заявка PCT Японии №2011-512806
Патентный документ 6: опубликованная переведенная патентная заявка PCT Японии №2004-525875
НЕПАТЕНТНЫЕ ДОКУМЕНТЫ
[0007] Непатентный документ 1: Neuron 5, 735-743 (1990)
Непатентный документ 2: J. Cell Biol. 173, 47-58 (2006)
Непатентный документ 3: Cell Reports 10, 1-12 (2015)
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
[0008] Как указано выше, описаны виды терапевтического использования антитела к RGMa при неврологических и иммунологических заболеваниях, но общепринятые антитела характеризуются проблемами, такими как недостаточная активность, вероятность нарушения свойственных функций RGMa и побочные эффекты. В частности, общепринятые антитела могут ингибировать связывание RGMa и неогенина, таким образом, также ингибируя благоприятные действия, такие как подавление апоптоза, возникающее в результате связывания неогенина с RGMa.
Таким образом, целью настоящего изобретения является предоставление связывающего RGMa белка, который не ингибирует взаимодействие RGMa/неогенин, но нейтрализует ингибирующую прорастание нейритов активность RGMa.
РЕШЕНИЕ ПРОБЛЕМЫ
[0009] Авторы изобретения провели тщательное исследование для решения указанных выше проблем. В результате авторам настоящего изобретения удалось получить связывающий белок RGMa, который не ингибирует связывание RGMa и неогенина, но нейтрализует ингибирующую прорастание нейритов активность RGMa, и выявить, что связывающий RGMa белок можно использовать в качестве лекарственного препарата для неврологических или иммунологических заболеваний, таким образом, выполнили настоящее изобретение.
[0010] Настоящее изобретение является таким, как указано ниже.
[1] Выделенный связывающий RGMa белок, который не ингибирует связывание RGMa и неогенина, но нейтрализует ингибирующую прорастание нейритов активность RGMa.
[2] Связывающий RGMa белок, описанный в пункте [1], который связывается с RGMa человека, крысы и/или мыши.
[3] Связывающий RGMa белок, описанный в пункте [1] или [2], который связывается с пептидами EEVVNAVEDWDSQG (SEQ ID NO: 26 в списке последовательностей), NQQIDFQAFHTNAE (SEQ ID NO: 27 в списке последовательностей), PTAPETFPYET (SEQ ID NO: 28 в списке последовательностей) и/или KLPVEDLYYQA (SEQ ID NO: 29 в списке последовательностей).
[4] Связывающий RGMa белок, описанный в любом из пунктов [1]-[3], который связывается с пептидами SEQ ID NO: 26 и 27 в списке последовательностей.
[5] Связывающий RGMa белок, описанный в любом из пунктов [1]-[4], который связывается с пептидами SEQ ID NO: 26, 27 и 28 в списке последовательностей.
[6] Связывающий RGMa белок, описанный в любом из пунктов [1]-[4], который связывается с пептидами SEQ ID NO: 26, 27 и 29 в списке последовательностей.
[7] Связывающий RGMa белок, описанный в любом из пунктов [1]-[6], где связывающий RGMa белок представляет собой антитело человека, гуманизированное антитело или химерное антитело или его антигенсвязывающий фрагмент.
[8] Молекула нуклеиновой кислоты, кодирующая участок белка связывающего RGMa белка, описанный в любом из пунктов [1]-[7].
[9] Рекомбинантный вектор, содержащий молекулу нуклеиновой кислоты, описанную в [8].
[10] Клетка-хозяин, содержащая рекомбинантный вектор, описанный в [9].
[11] Способ получения связывающего RGMa белка, описанный в пунктах [1]-[7], где способ включает этап культивирования клетки-хозяина, описанный в [10].
[12] Фармацевтическая композиция, содержащая связывающий RGMa белок, описанный в любом из пунктов [1]-[7].
[13] Фармацевтическая композиция, описанная в пункте [12] для применения в профилактике, лечении или профилактике рецидива неврологических или иммунологических заболеваний.
[14] Фармацевтическая композиция, описанная в пункте [13], где неврологические заболевания выбраны из группы, состоящей из бокового амиотрофического склероза, повреждения плечевого сплетения, повреждения головного мозга (включая травматическое повреждение головного мозга), церебрального паралича, синдрома Гийена-Барре, церебральной лейкодистрофии, рассеянного склероза (включая ремиттирующей рассеянный склероз, первичный прогрессирующий рассеянный склероз, вторичный прогрессирующий рассеянный склероз), нейромиелита зрительного нерва, постполиомиелитного синдрома, расщелины позвоночника, повреждения спинного мозга, спинальной мышечной атрофии, неоплазии позвоночного столба, поперечного миелита, деменции (включая сенильную деменцию, умеренное когнитивное нарушение, болезнь Альцгеймера, деменции, связанные с болезнью Альцгеймера), болезни Хантингтона, поздней дискинезии, мании, болезни Паркинсона, синдрома Стила-Ричардсона, синдрома Дауна, тяжелой миастении, травмы нервной системы (включая травму зрительного нерва), амилоидоза сосудов, внутримозгового кровоизлияния, связанного с амилоидозом, инфаркта головного мозга, энцефалита, острого состояния спутанности, глаукомы, шизофрении и дегенерации слоя нервных волокон сетчатки (включая диабетическую ретинопатию, ишемическую оптическую нейропатию, сцепленный с X-хромосомой ретиносхизис, индуцированной лекарственным средством оптической нейропатии, дистрофию сетчатки, связанную с возрастом дегенерации желтого пятна, заболевания глаз, характеризующиеся друзами диска зрительного нерва, заболевания глаз, характеризующиеся генетической обусловленной дегенерацией фоторецепторов, аутосомно-рецессивную палочко-колбочковую дистрофию, митохондриальное нарушение, связанное с оптической нейропатией).
[15] Фармацевтическая композиция, описанная в пункте [13], где иммунологические заболевания выбраны из группы, состоящей из рассеянного склероза (включая ремиттирующий рассеянный склероз, первичный прогрессирующий рассеянный склероз, вторичный прогрессирующий рассеянный склероз), нейромиелита зрительного нерва, псориаза, артрита (включая ревматоидный артрит, остеоартрит, псориатический артрит), синдрома Гийена-Барре, болезни Бехчета, пернициозной анемии, (инсулинозависимого) сахарного диабета I типа, системной красной волчанки (SLE), воспалительного заболевания кишечника (IBD), синдрома Шегрена, синдрома Гудпасчера, болезни Грейвса, аутоиммунной гемолитической анемии, аутоиммунной тромбоцитопенической пурпуры, астмы, поллиноза, атопического дерматита, гломерулонефрита, тяжелой миастении, болезни Хашимото и саркоидоза.
[16] Фармацевтическая композиция, описанная в пункте [13], где неврологические или иммунологические заболевания выбраны из группы, состоящей из повреждения спинного мозга, травмы нервной системы (включая травма зрительного нерва) и рассеянного склероза (включая ремиттирующий рассеянный склероз, первичный прогрессирующий рассеянный склероз, вторичный прогрессирующий рассеянный склероз).
[17] Выделенное антитело к RGMa или его антигенсвязывающий фрагмент, где аминокислотная последовательность каждой из определяющей комплементарность области легкой цепи 1 (LCDR1), определяющей комплементарность области легкой цепи 2 (LCDR2), определяющей комплементарность области легкой цепи 3 (LCDR3), определяющей комплементарность области тяжелой цепи 1 (HCDR1), определяющей комплементарность области тяжелой цепи 2 (HCDR2) и определяющей комплементарность области тяжелой цепи 3 (HCDR3) содержит следующие последовательности:
LCDR1:RASQDISSYLN (SEQ ID NO: 30 в списке последовательностей)
LCDR2:YTSRLHS (SEQ ID NO: 31 в списке последовательностей)
LCDR3:QQLNTLP (SEQ ID NO: 32 в списке последовательностей)
HCDR1:DAWMD (SEQ ID NO: 33 в списке последовательностей)
HCDR2:EIRSKANNHATYYAESVKG (SEQ ID NO: 34 в списке последовательностей) и
HCDR3:RDGAY (SEQ ID NO: 35 в списке последовательностей);
или
LCDR1:RSSQSLVHSNGNTYLH (SEQ ID NO: 36 в списке последовательностей)
LCDR2:KVSNRFS (SEQ ID NO: 37 в списке последовательностей)
LCDR3:SQSTHVP (SEQ ID NO: 38 в списке последовательностей)
HCDR1:TSYYWN (SEQ ID NO: 39 в списке последовательностей)
HCDR2:YISYDGTNNYNPSLKN (SEQ ID NO: 40 в списке последовательностей) и
HCDR3:SFG, и
где в каждой из последовательностей CDR можно замещать, удалять и/или добавлять одну или более аминокислот.
[18] Антитело к RGMa или его антигенсвязывающий фрагмент, описанный в пункте [17],
где вариабельная область тяжелой цепи (VH) содержит следующее ниже:
VH: EVQLVESGGGLVQPGRSLRLSCTASGFTFSDAWMDWVRQAPGKGLEWVAEIRSKANNHATYYAESVKGRFTISRDDSKSIVYLQMNSLRTEDTALYYCTRRDGAYWGKGTTVTVSS (SEQ ID NO: 41 в списке последовательностей) или аминокислотную последовательность, обладающую идентичностью по меньшей мере 90% с указанной аминокислотной последовательностью; и
где вариабельная область легкой цепи (VL) содержит следующее ниже:
VL: DIQMTQSPSSVSASVGDRVTITCRASQDISSYLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDFTLTISSLQPEDFASYFCQQLNTLPWTFGGGTKVEME (SEQ ID NO: 42 в списке последовательностей) или аминокислотную последовательность, обладающую идентичностью по меньшей мере 90% с указанной аминокислотной последовательностью.
[19] Антитело к RGMa или его антигенсвязывающий фрагмент, описанный в пункте [17] или [18], где антитело к RGMa представляет собой гуманизированное антитело.
[20] Антитело к RGMa или его антигенсвязывающий фрагмент, описанный в любом из пунктов [17]-[19], где антитело к RGMa содержит константную область IgG человека.
[21] Связывающий RGMa белок, который конкурирует с антителом к RGMa, описанным в пункте [17] или [18], за связывание с RGMa.
[22] Молекула нуклеиновой кислоты, кодирующая участок белка антитела к RGMa или его антигенсвязывающий фрагмент, описанный в любом из пунктов [17]-[20].
[23] Молекула нуклеиновой кислоты, описанная в пункте [22], где каждая из нуклеотидных последовательностей, кодирующих аминокислотные последовательности VH и VL представляет собой нуклеотидную последовательность, содержащую:
VH: gaagtgcagctggtggaatctggcggcggactggtgcagcctggcagatccctgagactgtcctgtaccgcctccggcttcaccttctccgacgcctggatggattgggtgcgacaggctcctggcaagggcctggaatgggtggccgagatccggtccaaggccaacaaccacgccacctactacgccgagtctgtgaagggccggttcaccatctcccgggacgactccaagtccatcgtgtacctgcagatgaactccctgcggaccgaggacaccgccctgtactactgcaccagaagggacggcgcctactggggcaagggcaccacagtgacagtgtcctcc (SEQ ID NO: 43 в списке последовательностей), и
VL: gacatccagatgacccagtccccctcctccgtgtctgcttccgtgggcgacagagtgaccatcacctgtcgggcctcccaggacatctcctcctacctgaactggtatcagcagaagcccggcaaggcccccaagctgctgatctactacacctcccggctgcactccggcgtgccctctagattttccggctctggctccggcaccgactttaccctgaccatctccagcctgcagcccgaggacttcgcctcctacttctgtcagcagctgaacaccctgccctggacctttggcggaggcaccaaggtggaaatggaa (SEQ ID NO: 44 в списке последовательностей).
[24] Рекомбинантный вектор, содержащий молекулу нуклеиновой кислоты, описанную в пунктах [22] или [23].
[25] Клетка-хозяин, содержащая рекомбинантный вектор, описанный в пункте [24].
[26] Способ получения антитела к RGMa или его антигенсвязывающего фрагмента, описанного в любом из пунктов [17]-[20], где способ включает этап культивирования клетки-хозяина, описанной в пункте [25].
[27] Фармацевтическая композиция, содержащая антитело к RGMa или его антигенсвязывающий фрагмент, описанный в любом из пунктов [17]-[20].
[28] Фармацевтическая композиция, описанная в пункте [27], для применения в профилактике, лечении или профилактике рецидива неврологических или иммунологических заболеваний.
[29] Фармацевтическая композиция, описанная в пункте [28], где неврологические заболевания выбраны из группы, состоящей из боков амиотрофического склероза, повреждения плечевого сплетения, повреждения головного мозга (включая травматическое повреждение головного мозга), церебрального паралича, синдрома Гийена-Барре, церебральной лейкодистрофии, рассеянного склероза (включая ремиттирующий рассеянный склероз, первичный прогрессирующий рассеянный склероз, вторичный прогрессирующий рассеянный склероз), нейромиелита зрительного нерва, постполиомиелитного синдрома, расщелины позвоночника, повреждения спинного мозга, спинальной мышечной атрофии, неоплазии позвоночного столба, поперечного миелита, деменции (включая сенильную деменцию, умеренное когнитивное нарушение, болезнь Альцгеймера, деменцию, связанную с болезнью Альцгеймера), болезни Хантингтона, поздней дискинезии, мании, болезни Паркинсона, синдрома Стила-Ричардсона, синдрома Дауна, тяжелой миастении, травмы нервной системы (включая травму зрительного нерва), амилоидоза сосудов, внутримозгового кровоизлияния, связанного с амилоидозом, инфаркта головного мозга, энцефалита, острого состояния спутанности, глаукомы, шизофрении и дегенерации слоя нервных волокон сетчатки (включая диабетическую ретинопатию, ишемическую оптическую нейропатию, сцепленный с X-хромосомой ретиносхизис, индуцированную лекарственным средством оптическую нейропатию, дистрофию сетчатки, связанную с возрастом дегенерацию желтого пятна, заболевания глаз, характеризующиеся друзами диска зрительного нерва, заболевания глаз, характеризующиеся генетической обусловленной дегенерацией фоторецепторов, аутосомно-рецессивную палочко-колбочковую дистрофию, митохондриальное нарушение, связанное с оптической нейропатией).
[30] Фармацевтическая композиция, описанная в пункте [28], где иммунологические заболевания выбраны из группы, состоящей из рассеянного склероза (включая ремиттирующий рассеянный склероз, первичный прогрессирующий рассеянный склероз, вторичный прогрессирующий рассеянный склероз), нейромиелита зрительного нерва, псориаза, артрита (включая ревматоидный артрит, остеоартрит, псориатический артрит), синдрома Гийена-Барре, болезни Бехчета, пернициозной анемии, (инсулинозависимого) сахарного диабета I типа, системной красной волчанки (SLE), воспалительного заболевания кишечника (IBD), синдрома Шегрена, синдрома Гудпасчера, болезни Грейвса, аутоиммунной гемолитической анемии, аутоиммунной тромбоцитопенической пурпуры, астмы, поллиноза, атопического дерматита, гломерулонефрита, тяжелой миастении, болезни Хашимото и саркоидоза.
[31] Фармацевтическая композиция, описанная в пункте [28], где неврологические или иммунологические заболевания выбраны из группы, состоящей из повреждения спинного мозга, травмы нервной системы (включая травму зрительного нерва) и рассеянного склероза (включая ремиттирующий рассеянный склероз, первичный прогрессирующий рассеянный склероз, вторичный прогрессирующий рассеянный склероз).
[32] Способ профилактики, лечения или профилактики рецидива неврологических или иммунологических заболеваний, где способ включает этап введения эффективной дозы связывающего RGMa белка, описанного в любом из пунктов [1]-[7], нуждающемуся в этом индивидууму.
[33] Способ профилактики, лечения или профилактики рецидива неврологических или иммунологических заболеваний, где способ включает этап введения эффективной дозы антитела к RGMa или его антигенсвязывающего фрагмента, описанного в любом из пунктов [17]-[20], нуждающемуся в этом индивидууму.
ПОЛЕЗНЫЙ ЭФФЕКТ ИЗОБРЕТЕНИЯ
[0011] Связывающий RGMa белок по настоящему изобретению не ингибирует взаимодействие RGMa и неогенина, таким образом, является способным поддерживать эффекты, такие как ингибирование апоптоза нейронов и т.п., вызываемые связыванием неогенина с RGMa, таким образом, обладает сильным защитным действием в отношении нейронов и незначительной опасностью побочных эффектов, связанных с истощением нейронов. Кроме того, гуманизированное антитело к RGMa по настоящему изобретению обладает лучшими свойствами по сравнению с общепринятыми антителами, такими как связывание с RGMa человека и термостабильность. Таким образом, антитело можно использовать в качестве лекарственного препарата для неврологических или иммунологических заболеваний, который обладает высокой эффективностью и незначительными побочными эффектами.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0012] На фиг. 1 представлен результат анализ ингибирования связывания RGMa-неогенин с использованием поликлонального антитела к RGMa (AF2459), антитела сравнительного примера (r5F9) и антитела по настоящему изобретению (r70E4 и 116A3).
На фиг. 2 представлен результат анализ ингибирования связывания RGMa-BMP2 с использованием контрольного IgG мыши и антител по настоящему изобретению (B5.70E4 и B5.116A3).
На фиг. 3 представлен результат теста на термостабильность для антител с использованием антитела сравнительного примера (rH5F9), химерного антитела по настоящему изобретению (r116A3C) и гуманизированных антител по настоящему изобретению (HE/KA и HA/KC).
На фиг. 4 представлен результат анализа прорастания нейритов с использованием антител по настоящему изобретению (B5.70E4 (слева) и B5.116A3 (справа)).
На фиг. 5 представлен результат теста эффективности с использованием контрольного IgG мыши (mo-IgG2bk) и антител по настоящему изобретению (r70E4 и r116A3) и с использованием модели повреждения спинного мозга на крысах. Продемонстрированы результаты тестов эффективности на (A) модели размозжения спинного мозга и (B) модели гемисекции спинного мозга.
На фиг. 6 представлен результат теста эффективности антитела по настоящему изобретению (B5.116A3) с использованием модели рассеянного склероза, индуцированного пептидом PLP139-151, на мышах. С левой стороны приведены баллы EAE, с правой стороны приведены изменения массы тела, и в верней и нижней частях приведены результаты, когда тест антитела вводили через 7 и 10 суток и через 18 и 21 суток, соответственно.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0013] Для облегчения понимания настоящего изобретения ниже приведено объяснение терминов, используемых в настоящем изобретении.
[0014] RGMa
RGMa представляет собой белок, ингибирующий прорастание нейритов, в центральной нервной системе, и белок RGMa человека биосинтезируется как белок-предшественник, содержащий 450 аминокислот, как продемонстрировано в SEQ ID NO: 1 в списке последовательностей. Сигнальный пептид Met 1-Pro 47, содержащийся на N-конце (который обозначает пептид от первого остатка метионина до 47 остатка пролина со стороны N-концца, аналогично описываемый ниже) удаляется, пептидная связь межуд Asp 168 и Pro 169 расщепляется, и C-концевой пептид Arg 423-Cys 450 удаляется и одновременно добавляется GPI-якорь к карбоксильной группе Gly 422 на C-конце, который стал C-концом. Белок RGMa человека экспрессируется на клеточной мембране посредством GPI-якоря в виде зрелого белка, в котором N-концевой домен (Cys 48-Asp 168) и C-концевой домен (Pro 169-Ala 424) соединены друг с другом дисульфидной связью. Белок-предшественник RGMa мыши содержит аминокислотную последовательность, продемонстрированную в SEQ ID NO: 2 в списке последовательностей и белок-предшественник RGMa крысы содержит аминокислотную последовательность, продемонстрированную в SEQID NO: 3 в списке последовательностей. Вследствие того, что пептиды на C-конце удаляют, зрелые белки из них обладают такими же аминокислотными последовательностями. В настоящем изобретении RGMa может относиться к белку-предшественнику, зрелому белку или его активному фрагменту, или может представлять собой его производное или вариант при условии, что он действует посредством связывания с неогенином, как описано ниже. RGMa может представлять собой RGMa человека или RGMa, получаемую из других организмов, но RGMa человека является предпочтительной.
[0015] Неогенин
Неогенин экспрессируется, например, в нейронах центральной нервной системы и функционирует как один из рецепторов RGMa. Как продемонстрировано в SEQ ID NO: 10 в списке последовательностей, белок неогенин человека содержит 1461 аминокислоту и экспрессируется в виде зрелого мембранного белка после удаления сигнального пептида Met 1-Ala 33. В настоящем изобретении неогенин может относится к белку-предшественнику, зрелому белку или связывающему RGMa фрагменту, или может представлять собой его производное или вариант при условии, что он связывается с RGMa. Неогенин может представлять собой неогенин человека или неогенин, получаемый из других организмов, но неогенин человека является предпочтительным.
[0016] Нейтрализация
Термин "нейтрализация", как используют в настоящем описании, относится к действию, посредством которого происходит связывание с представляющей интерес мишенью и ингибирование любой функции мишени. Другими словами, фраза "нейтрализация ингибирующей активности в отношении прорастания нейритов RGMa" означает, что связывающий RGMa белок связывается с RGMa, таким образом, ингибируя ингибирующую активность в отношении прорастания нейритов RGMa. Ингибирующую активность в отношении прорастания нейритов можно оценивать одним или более из ряда известных в данной области анализов in vitro или in vivo и можно оценивать, например, анализом ингибирования прорастания нейритов, описываемым в настоящем описании.
[0017] Выделенный
Термин "выделенный", такой как выделенный связывающий RGMa белок, означает идентифицированный и отделенный, и/или очищенный от компонентов в своем природном состоянии. Примеси в природном состоянии представляют собой вещества, которые могут препятствовать диагностичекому или терапевтическому использованию антитела, включая ферменты, гормоны и другие белковые или небелковые растворенные вещества. Как правило, выделение связывающего RGMa белка или т.п. можно проводить по меньшей мере посредством одного этапа очистки. Связывающий RGMa белок, очищенный по меньшей мере посредством одного этапа очистки, может быть обозначен как "выделенный связывающий RGMa белок".
[0018] Связывающий RGMa белок
Как используют в настоящем описании, термин "связывающий RGMa белок" относится к молекуле, содержащей белок, который связывается с RGMa. Примеры связывающих RGMa белков включают антитела к RGMa и их антигенсвязывающие фрагменты; связывающие RGMa каркасные белки; растворенные рецепторные белки RGMa, такие как внеклеточный домен неогенина, и их слитые белки. Термин "связывающий RGMa каркасный белок" относится к белку, который выполняет функцию связывания RGMa путем введения мутаций в домен Кунитца ингибитора сериновой протеазы, внеклеточный домен фибронектина, анкирина, липокалина человека или т.п. Термин "слитый белок" относится к связывающим RGMa белкам, связанных химически или генетически с функциональными молекулами, отличными от связывающего RGMa белка по настоящему изобретению, такими как небелковые полимеры, такие как полиэтиленгликоль (PEG), радиоактивные вещества, токсины, низкомолекулярные соединения, цитокины, факторы роста (например, TGF-β, NGF, нейротрофин), альбумин, ферменты и другие антитела.
[0019] Антитело человека
Термин "антитело человека" относится к антителу, в котором легкие и тяжелые цепи получают из иммуноглобулина человека. В зависимости от различия в константных областях тяжелых цепей антитела человека включают IgG, содержащий тяжелые γ-цепи (включая IgG1, IgG2, IgG3 и IgG4), IgM, содержащий тяжелые μ-цепи, IgA, содержащий тяжелые α-цепи (включая IgA1 и IgA2), IgD, содержащий тяжелые δ-цепи, или IgE, содержащий тяжелые ε-цепи. Легкие цепи, в основном, содержат κ-цепи или λ-цепи.
[0020] Гуманизированное антитело
Термин "гуманизированное антитело" относится к антителу, содержащему вариабельные области, содержащие определяющие комплементарность области антитела, получаемого от не являющегося человеком животного, и каркасные области, получаемые из антитела человека, и константные области, получаемые из антитела человека.
[0021] Химерное антитело
Термин "химерное антитело" относится к антителу, в котором легкая цепь, тяжелая цепь или обе цепи содержат не принадлежащую человеку вариабельную область и принадлежащую человеку константную область.
[0022] Антитело к RGMa
Как используют в настоящем описании, термин "антитело к RGMa" относится к молекулам иммуноглобулина, которые связываются с RGMa, или их модифицированным молекулам. Модифицированные молекулы включают полиспецифические антитела, химерные антитела, гуманизированные антитела, функционально модифицированные антитела и конъюгированные антитела.
[0023] Полиспецифическое антитело
Термин "полиспецифическое антитело" относится к асимметричному антителу, содержащему два или более независимых антигенраспознающих участка, обладающих двумя или более различными видами антигенной специфичности, включая биспецифическое антитело, обладающее двумя видами антигенной специфичности, и триспецифическое антитело, обладающее тремя видами антигенной специфичности.
[0024] Функционально модифицированное антитело
Как используют в настоящем описании, термин "функционально модифицированное антитело" относится к антителу, в котором функции, отличные от антигенсвязывающей функции антитела, включая функцию цитолиза клеток, функцию активации комплемента и функцию увеличенного времени полувыведения из сыворотки, модифицируют в основном путем модификации аминокислотной или сахарной цепи Fc-области антитела.
[0025] Конъюгированное антитело
Как используют в настоящем описании, термин "конъюгированное антитело" относится к антителу, связанному химически или генетически с функциональными молекулами, отличными от антитела, такими как непептидные полимеры, такие как полиэтиленгликоль (PEG), радиоактивные вещества, токсины, низкомолекулярные соединения, цитокины, факторы роста (например, TGF-β, NGF, нейротрофин), альбумин и ферменты.
[0026] Антигенсвязывающий фрагмент
Как используют в настоящем описании, термин "антигенсвязывающий фрагмент" относится к белку, который содержит часть антитела и может связываться с антигеном. Примеры антигенсвязывающего фрагмента включают F(ab')2, Fab', Fab, Fv (вариабельный фрагмент антитела), связанные дисульфидной связью Fv, одноцепочечное антитело (scFv) и их полимеры. Кроме того, антигенсвязывающий фрагмент включает конъюгированные антигенсвязывающие фрагменты, химически или генетически связанные с функциональными молекулами, отличными от антитела к RGMa в настоящей заявке, такими как непептидные полимеры, такие как полиэтиленгликоль (PEG), радиоактивные вещества, токсины, низкомолекулярные соединения, цитокины, факторы роста (например, TGF-β, NGF, нейротрофин), альбумин, ферменты и другие антитела.
[0027] Определяющая комплементарность область
Термин "определяющая комплементарность область (CDR)" относится к области, формирующей антигенсвязывающий участок в вариабельной области молекулы иммуноглобулина, которая также называется гипервариабельной областью, и в частности относится к участку, в котором аминокислотная последовательность претерпевает значительные изменения в каждой молекуле иммуноглобулина. Касательно CDR, каждые их легких и тяжелых цепей содержат три CDR (LCDR1, LCDR2, LCDR3 и HCDR1, HCDR2, HCDR3). В настоящей заявке CDR молекулы иммуноглобулина определяют в соответствии с системой нумерации по Kabat (Kabat et al., 1987, Sequences of Proteins of Immunological Interest, US Department of Health and Human Services, NIH, USA).
[0028] Процент (%) идентичности аминокислотной последовательности
"Процент (%) идентичности" в отношении идентифицированной эталонной полипептидной последовательности, такой как вариабельная область, определяют как процент аминокислотных остатков в последовательности-кандидате, которые являются идентичными аминокислотным остаткам конкретной эталонной полипептидной последовательности после выравнивания последовательностей и введения пропусков по мере необходимости для получения максимального % идентичности и при условии, что консервативные замены не составляют значительную часть идентичности последовательности. Выравнивание с целью определения % идентичности можно проводить различными способами, известными специалисту в данной области, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определять подходящие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для получения максимального выравнивания на всем протяжении полноразмерных последовательностей, которые сравнивают. Однако для целей настоящего изобретения значения % идентичности получают с использованием компьютерной программы сравнения последовательностей BLAST при попарных выравниваниях.
В случаях, когда BLAST используют для сравнений аминокислотных последовательностей, % идентичности данной аминокислотной последовательности A с данной аминокислотной последовательностью B рассчитывают так, как указано ниже:
100 умножить на дробь X/Y
где X представляет собой число аминокислотных остатков, оцениваемых как идентичные совпадения программой выравнивания последовательностей Blast при выравнивании программой A и B, и где Y представляет собой общее число аминокислотных остатков в B. Следует понимать, что если длина аминокислотной последовательности A отличается от длины аминокислотной последовательности B, % идентичности A с B будет отличаться от % идентичности B с A. Если не указано иное, все значения % идентичности в настоящем описании получают с использованием компьютерной программы BLAST, как показано в предшествующем абзаце.
[0029] Конкуренция
Как используют в настоящем описании, термин "конкуренция" с антителом к RGMa по настоящему изобретению означает, что, как измеряют поверхностным плазмонным резонансом (SPR), описываемым в настоящем описании, связывание антитела к RGMa по настоящему изобретению с RGMa уменьшается с существенной разницей вследствие присутствия указанного антитела к RGMa или его антигенсвязывающего фрагмента.
[0030] Ниже настоящее изобретение более подробно описано.
Связывающий RGMa белок
Связывающий RGMa белок по настоящему изобретению представляет собой выделенный связывающий RGMa белок, который не ингибирует связывание RGMa и неогенина, но нейтрализует ингибирующую прорастание нейритов активность RGMa.
[0031] Предпочтительно белки RGMa представляют собой белки RGMa, получаемые от млекопитающих. Например, белки RGMa человека включают белок, содержащий аминокислотную последовательность SEQ ID NO: 1 в списке последовательностей, белки RGMa мыши включают белок, содержащий аминокислотную последовательность SEQ ID NO: 2 в списке последовательностей, и RGMa белки крысы включают белок, содержащий аминокислотную последовательность SEQ ID NO: 3 в списке последовательностей. Предпочтительным также может являться полипептид, содержащий аминокислотную последовательность, где одна или более (предпочтительно от 1 до 20, более предпочтительно от 1 до 10, еще более предпочтительно от 1 до 5) аминокислот в этих последовательностях заменяют, удаляют, вводят и/или добавляют, и обладающий по существу такой же активностью как белок RGMa; или полипептид, содержащий аминокислотную последовательность, обладающую 90% или более (предпочтительно 95% или более) идентичностью с аминокислотной последовательностью.
[0032] Как используют в настоящем описании, полипептид "обладающий по существу такой же активностью как и белок RGMa" включает любой полипептид при условии, что полипептид обладает ингибирующем прорастание нейритов действием.
[0033] Замена аминокислоты предпочтительно представляет собой консервативную замену. Как используют в настоящем описании, "консервативная замена" означает замену аминокислотного остатка другим химически аналогичным аминокислотным остатком, таким образом, что активность пептида по существу не изменяется. Например, включают замену одного гидрофобного остатка другим гидрофобным остатком, замену одного полярного остатка другим полярным остатком, обладающим таким же электрическим зарядом, и т.п. Примеры функционально аналогичных аминокислот, с которыми такая замена является возможной, включают такие неполярные (гидрофобные) аминокислоты, аланин, валин, изолейцин, лейцин, пролин, триптофан, фенилаланин и метионин. Примеры полярных (нейтральных) аминокислот включают глицин, серин, треонин, тирозин, глутамин, аспарагин и цистеин. Примеры положительно заряженных (основных) аминокислот включают аргинин, гистидин и лизин. Примеры отрицательно заряженных (кислых) аминокислот включают аспарагиновую кислоту и глутаминовую кислоту.
[0034] Связывание связывающего RGMa белка по настоящему изобретению с RGMa означает специфическое связывание RGMa. Более предпочтительным является связывающий RGMa белок, обладающий низкой константой диссоциации (Kd) с RGMa человека, например, 10-8 M или менее, более предпочтительно 10-9 M или менее, еще более предпочтительно 10-10 M или менее в качестве верхнего предельного значения, и например, без ограничения, 10-14 M или более, более предпочтительно 10-13 или более в качестве нижнего предельного значения.
[0035] Белок RGMa в виде зрелого белка содержит N-концевой домен и C-концевой домен, но обладает ингибирующей прорастание нейритов активностью только с одним C-концевым доменом. Связывающий RGMa белок по настоящему изобретению предпочтительно связывается только с C-концевым доменом RGMa, нейтрализуя ингибирующую прорастание нейритов активность. Более предпочтительным является связывающий RGMa белок, обладающий низкой константой диссоциации (Kd) с C-концевым доменом RGMa человека, например, 10-8 M или менее, более предпочтительно 10-9 M или менее, еще более предпочтительно 10-10 M или менее в качестве верхнего предельного значения, и например, без ограничения, 10-14 M или более, более предпочтительно 10-13 или более в качестве нижнего предельного значения.
[0036] Связывающий RGMa белок по настоящему изобретению не ингибирует связывание RGMa и неогенина. В настоящем описании, фраза "не ингибирует связывание RGMa и неогенина" означает что в системе связывания RGMa и неогенина, приведенной в примерах, описываемых ниже, даже когда концентрация связывающего RGMa белка увеличивается, связывание RGMa и неогенина по существу не понижается. Например, в случае когда связывающий RGMa белок добавляют в систему связывания RGMa и неогенина и его концентрацию повышают, если концентрация связывающего RGMa белка, обладающего IC50, которая составляет не менее 10 мкг/мл, более предпочтительно не менее 50 мкг/мл, наиболее предпочтительно не менее 100 мкг/мл, можно говорить, что связывающий RGMa белок не ингибирует связывание RGMa и неогенина.
[0037] Неогенин, используемый для анализа связывания с RGMa, предпочтительно представляет собой неогенин того же типа что и RGMa. Другими словами, предпочтительно использовать неогенин мыши или человека для RGMa мыши или человека, соответственно. Пример неогенина человека включает белок, содержащий аминокислотную последовательность SEQ ID NO: 10 в списке последовательностей. Однако при условии, что он способен связываться с RGMa, предпочтительным может являться белок, содержащий аминокислотную последовательность с 90% или более (предпочтительно 95% или более) идентичностью с SEQ ID NO: 10 в списке последовательностей.
[0038] Связывающий RGMa белок по настоящему изобретению нейтрализует ингибирующую прорастание нейритов активность RGMa. Ингибирующую прорастание нейритов активность можно оценивать анализом прорастания нейритов, приведенных в примерах, описываемых ниже. Добавление RGMa ингибирует прорастание нейритов, но добавление связывающего RGMa белка предотвращает ингибирование прорастания нейритов RGMa. Связывающий RGMa белок по настоящему изобретению может нейтрализовать ингибирование прорастания нейритов в результате добавления RGMa на 50% или более, более предпочтительно на 80% или более и наиболее предпочтительно на 90% или более.
[0039] Вследствие того, что аминокислотные последовательности белков RGMa изменяются в зависимости от вида животного, также существуют отличия в аминокислотной последовательности RGMa человека, предоставленной SEQ ID NO: 1 в списке последовательностей, RGMa мыши, предоставленной SEQ ID NO: 2 в списке последовательностей, и RGMa крысы, предоставленной SEQ ID NO: 3 в списке последовательностей. Вследствие того, что грызунов, таких как мыши и крысы, в основном используют в качестве экспериментального материала в фармакологических испытаниях и испытаниях безопасности белковых препаратов, таких как препараты на основе антител, связывающий RGMa белок по настоящему изобретению предпочтительно связывается с RGMa мыши и/или крысы, и более предпочтительными являются связывающие RGMa белки, обладающие низкой Kd к RGMa мыши и/или крысы. Включают связывающие белки RGMa, Kd которых имеет верхний предел, например, 5×10-7 M или менее, более предпочтительно 10-8 M или менее, еще более предпочтительно 10-9 M или менее и нижнее предельное значение, например, без ограничения, 10-12 M или более, более предпочтительно 10-11 или более.
[0040] Связывающий RGMa белок по настоящему изобретению предпочтительно обладает высокой термостабильностью. Термостабильность можно оценивать по снижению связывания с RGMa в результате тепловой обработки, и связывающий RGMa белок по настоящему изобретению предпочтительно является стабильным даже при тепловой обработке при 60°C или выше, более предпочтительно даже при тепловой обработке при 65°C или выше, наиболее предпочтительно даже при тепловой обработке при 70°C или выше.
[0041] Участок связывания, когда связывающий RGMa белок по настоящему изобретению связывается с RGMa, конкретно не ограничен. Например, в RGMa человека предпочтительным является связывание с одним или более следующими ниже пептидами: EEVVNAVEDWDSQG (SEQ ID NO: 26 в списке последовательностей) (номера аминокислот 298-311 SEQ ID NO: 1 в списке последовательностей), NQQIDFQAFHTNAE (SEQ ID NO: 27 в списке последовательностей) (номера аминокислот 322-335 SEQ ID NO: 1 в списке последовательностей), PTAPETFPYET (SEQ ID NO: 28 в списке последовательностей) (номера аминокислот 349-359 SEQ ID NO: 1 в списке последовательностей), KLPVEDLYYQA (SEQ ID NO: 29 в списке последовательностей) (номера аминокислот 367-377 SEQ ID NO: 1 в списке последовательностей). Связывающий RGMa белок по настоящему изобретению связывается более предпочтительно с SEQ ID NO: 26 и 27 из списка последовательностей, более предпочтительно с SEQ ID NO: 26 и 27 из списка последовательностей и с SEQ ID NO: 28 или 29 из списка последовательностей.
[0042] Конкретные примеры связывающего RGMa белка включают антитело к RGMa, связывающий RGMa каркасный белок и их слитые белки.
[0043] Антитело к RGMa
Антитело к RGMa по настоящему изобретению относится к поликлональным или моноклональным антителам, получаемым с использованием белка RGMa или его неполного фрагмента (например, фрагмента, содержащего одну или более SEQ ID NO: 26 до 29 в указанном выше списке последовательностей) в качестве антигена и иммунизацией млекопитающего, такого как мыши антигенами; химерным антителам и гуманизированным антителам, получаемым с использованием технологии генной рекомбинации; антитела и человека, получаемым с использованием, например, трансгенных животных, вырабатывающих антитела человека, и т.п. Когда антитело по настоящему изобретению вводят в виде фармацевтического средства людям, гуманизированное антитело или антитело человека является предпочтительным с точки зрения побочных эффектов.
[0044] Антигены можно непосредственно использовать для иммунизации или можно использовать в качестве комплекса с белком-носителем. Для получения комплекса антигена и белка-носителя можно использовать конденсирующие средства, такие как глутаральдегид, карбодиимид и активный сложный эфир малеинимида. Примеры белка-носителя включают бычий сывороточный альбумин, тиреоглобулин, гемоцианин и KLH.
[0045] Примеры млекопитающих, которых можно иммунизировать, включают мышей, крыс, хомяков, морских свинок, кроликов, кошек, собак, свиней, коз, лошадей и крупный рогатый скот, и способы инокуляции включают подкожное, внутримышечное или интраперитонеальное введение. При введении антигены можно вводить в смеси с полным адъювантом Фрейнда или неполным адъювантом Фрейнда, и введение, как правило, проводят один раз каждые 2-5 недель. Продуцирующее антитело клетки, получаемые из селезенки или лимфоузлов иммунизированных животных сливают с миеломными клетками и выделяют ка гибридомы. В качестве миеломных клеток используют, миеломные клетки, получаемые от млекопитающего, такого как мышь, крыса или человек.
[0046] Поликлональное антитело
Поликлональные антитела можно получать путем проведения известных способов получения. Другими словами, поликлональные антитела можно получать из сыворотки, получаемой от животных, которых подвергали иммунизации, например, иммунизацией млекопитающего, как описано выше, антигеном, как описано выше, совместно с адъювантом Фрейнда по мере необходимости.
[0047] Моноклональное антитело
В частности, моноклональные антитела можно получать так, как указано ниже. Другими словами, антиген, как описано выше, используют в качестве иммуногена, и иммуноген инъецируют или трансплантируют один или более раз в комбинации с адъювантом Фрейнда, при необходимости, млекопитающему, как описано выше, подкожно, внутримышечно, внутривенно, в подушечку стопы или интраперитонеально для иммунизации. Как правило, иммунизацию проводят от 1 до 4 раз каждые 1-14 суток от первичной иммунизации, и продуцирующие антитело клетки получают от иммунизированного млекопитающего приблизительно через 1-5 суток после конечной иммунизации.
[0048] Моноклональные антитела можно получать хорошо известными специалистам в данной области способами (например, "Current Protocols in Molecular Biology" (John Wiley & Sons (1987)), Antibodies: A Laboratory Manual, Ed.Harlow and David Lane, Cold Spring Harbor Laboratory (1988))).
[0049] Получение "гибридом", секретирующих моноклональные антитела можно проводить способом  and Milstein et al. (Nature, 256, 495, 1975) и аналогичными способами. Таким образом, гибридомы получают слиянием продуцирующей антитело клетки, содержащейся в селезенке или т.п., получаемой от иммунизированного млекопитающего, с миеломной клеткой, не обладающей способностью продуцировать аутоантитело, получаемой от млекопитающего, предпочтительно мыши, крысы или человека.
and Milstein et al. (Nature, 256, 495, 1975) и аналогичными способами. Таким образом, гибридомы получают слиянием продуцирующей антитело клетки, содержащейся в селезенке или т.п., получаемой от иммунизированного млекопитающего, с миеломной клеткой, не обладающей способностью продуцировать аутоантитело, получаемой от млекопитающего, предпочтительно мыши, крысы или человека.
[0050] Примеры миеломных клеток, которые можно использовать для слияния клеток, включают получаемую от мыши миелому P3/X63-AG8,653 (653), P3/NSI/1-Ag4-1 (NS-1), P3/X63-Ag8.U1 (P3U1), SP2/0-Ag14 (Sp2/O, Sp2), PAI, F0 и BW5147, получаемую от крысы миелому 210RCY3-Ag.2.3 и получаемую от человека миелому U-266AR1, GM1500-6TG-A1-2, UC729-6, CEM-AGR, D1R11 и CEM-T15.
[0051] Примеры ускорителей слияния включают полиэтиленгликоль и т.п. В основном, взаимодействие продуцирующих антитело клеток и миеломных клеток в отношении, как правило, приблизительно от 1:1 до 10:1 обеспечивают путем использования полиэтиленгликоля (средней молекулярной массы: от 1000 до 4000) в концентрации приблизительно от 20 до 50%, при температуре от 20 до 40°C, предпочтительно от 30 до 37°C в течение приблизительно от 1 до 10 минут, таким образом, можно проводить слияние клеток.
[0052] Скрининг гибридомных клонов, продуцирующих моноклональные антитела, можно проводить культивированием гибридом, например, в планшетах для микротитрования, и измерением реактивности культуральных супернатантов в лунках к иммуногену иммунохимическими способами, такими как ELISA.
[0053] При скрининге продуцирующих антитело гибридом в дополнение к анализу связывания с белком RGMa, также оценивают не ингибирует ли антитело связывание белка RGMa и неогенина, и не нейтрализует ли антитело функцию белка RGMa (ингибирующую прорастание нейритов активность). Такие способы скрининга обеспечивают отбор антитела к RGMa по настоящему изобретению.
[0054] Клоны можно дополнительно получать из лунок, содержащих гибридомы, продуцирующие желаемые антитела, путем клонирования с использованием лимитирующего разведения. Отбор и размножение гибридом, как правило, проводят в среде для культивирования клеток животных, содержащей от 10 до 20% эмбриональной телячьей сыворотки, дополненной HAT (гипоксантином, аминоптерином и тимидином).
[0055] Моноклональные антитела из гибридом можно получать культивированием гибридомы in vitro или выращиваем их in vivo, например, в асцитической жидкости млекопитающих, таких как мыши и крысы, и выделением моноклональных антител из получаемого культурального супернатанта или асцитической жидкости млекопитающего.
[0056] При культивировании in vitro гибридомы выращивают, поддерживают и хранят в соответствии с различными условиями, такими как характеристики и способ культивирования видов клеток, которые необходимо культивировать, и можно использовать питательную среду, подходящую для продукции моноклональных антител в культуральном супернатанте.
[0057] Примеры основных сред включают среду с низким содержанием кальция, такую как среда Хэма F12, среда MCDB 153 или среда MEM с низким содержанием кальция и среда с высоким содержанием кальция, такая как среда MCDB 104, среда MEM, среда D-MEM, среда RPMI 1640, среда ASF 104 или среда RD. Основные среды могут содержать, например, сыворотку, гормоны, цитокины и/или различные неорганические или органические вещества в соответствии с целью.
[0058] Моноклональные антитела можно выделять и очищать, например, подвергая указанный выше культуральный супернатант или асцитическую жидкость действию насыщенного сульфата аммония, способом осаждения эуглобулином, способом с использованием капроевой кислоты, способом с использованием каприловой кислоты, ионообменной хроматографией (такой как DEAE или DE52) или аффинной колоночной хроматографией, такой как колонка с антителами к иммуноглобулину или колоночная хроматография с белком A. В частности, очистку моноклонального антитела можно проводить любыми способами, известными как способ очистки иммуноглобулина, и можно легко получать способами, такими как фракционирование сульфатом аммония, фракционирование PEG, фракционирование этанолом и аффинная хроматография с использованием анионообменного вещества и дополнительного использования белков RGMa.
[0059] Моноклональные антитела также можно получать способом фагового дисплея. В способе фагового дисплея фаги, выбранные из необязательной фаговой библиотеки антител, подвергаются скринингу с использованием желаемого иммуногена и выбирают фаги, обладающие желаемой связывающей способностью с иммуногеном. Затем, соответствующую антителу последовательность, содержащуюся в фаге, выделяют или секвенируют и конструируют экспрессирующий вектор, содержащий молекулу нуклеиновой кислоты, кодирующую антитело или антигенсвязывающ домен, на основе выделенной последовательности или определяемой информации о последовательности. В заключении, моноклональные антитела можно получать культивированием линии клеток, трансфицированных такими экспрессирующими векторами. Библиотеку антител человека можно использовать в качестве фаговой библиотеки антител для получения антител человека, обладающих желаемыми свойствами связывания.
[0060] В качестве каркасного белка используют, например, домен Кунитца ингибитора сериновой протеазы человека и внеклеточный домен фибронектина человека, и последовательность участка связывания мишени на каркасе можно модифицировать с получением каркасного белка, который связывается с RGMa (Clifford Mintz et al., BioProcess International,, 2013, Vol.11(2), pp40-48).
[0061] Слитые белки включают связывающие RGMa белки химически или генетически связанные с функциональными молекулами, отличными от связывающего RGMa белка по настоящему изобретению, такими как непептидные полимеры, такие как полиэтиленгликоль (PEG), радиоактивные вещества, токсины, низкомолекулярные соединения, цитокины, факторы роста (например, TGF-β, NGF, нейротрофин), альбумин, фермент и другие антитела.
[0062] Когда PEG связывают в качестве функциональной молекулы, можно использовать PEG с молекулярной массой без ограничения от 2000 до 100000 Да, более предпочтительно от 10000 до 50000 Да, который может быть линейным или разветвленным. С использованием, например, активной группы NHS, PEG можно связывать, например, с N-концевыми аминогруппами аминокислот связывающего RGMa белка.
[0063] В случае использования радиоактивного вещества в качестве функциональной молекулы, используют например, 131I, 125I, 90Y, 64Cu, 99Tc, 77Lu или 211At. Радиоактивные вещества можно непосредственно связывать со связывающим RGMa белком, например, способом с использованием хлорамина T.
[0064] При использовании токсина в качестве функциональной молекулы используют, например, бактериальные токсины (например, дифтерийный токсин), фитотоксины (например, рицин), низкомолекулярные токсины (например, гелданамицин), майтанзиноиды и калихимицин.
[0065] При использовании низкомолекулярных соединений в качестве функциональной молекулы, используют например, дауномицин, доксорубицин, метотрексат, митомицин, неокарзиностатин, виндезин и флуоресцентные красители, такие как FITC.
[0066] При использовании фермента в качестве функциональной молекулы используют, например, люциферазу (например, люциферазу светляков и бактериальную люциферазу; патент США №4737456), малатдегидрогеназу, уреазу, пероксидазу (например, пероксидазу хрена (HRPO)), щелочную фосфатазу, β-галактозидазуа, глюкоамилазу, лизоцим, сахаридоксидазу (например, глюкозооксидазу, галактозу оксидаза и глюкоза-6-фосфатдегидрогеназу), гетероциклическую оксидазу (например, уриказц и ксантиноксидазу), лактопероксидазу и микропероксидазу.
[0067] Примеры линкеров, используемых для химического связывания токсина, низкомолекулярного соединения или фермента, включают двухвалентные радикалы (например, алкилен, арилен, гетероарилен), повторяющиюся структурную единицу линкера или алкокси, представленный -(CR2)nO(CR2)n- (где R представляет собой необязательный заместитель, и n представляет собой положительное целое число) (например, полиэтиленокси, PEG и полиметиленокси) и алкиламино (например, полиэтиленамино, Jeffamine™) и сложные эфир двухосновных кислот и амид (например, сукцинат, сукцинамид, дигликолат, малонат и капроамид). В данной области уже установлены способы химической модификации для связывания функциональных молекул (D.J. King., Applications and Engineering of Monoclonal antibodies., 1998, T.J. International Ltd, Monoclonal Antibody-Based Therapy of Cancer., 1998, Marcel Dekker Inc; Chari et al., Cancer Res., 1992 Vol 152:127; Liu et al., Proc Natl Acad Sci USA., 1996 Vol 93:8681).
[0068] Предпочтительным вариантом осуществления связывающего RGMa белка по настоящему изобретению является химерное антитело. В качестве "химерного антитела" иллюстративным является химерное антитело, в котором вариабельная область представляет собой вариабельную область, получаемую из иммуноглобулина не являющегося человеком животного (такого как мышь, крыса, хомяк или курица), и константная область представляет собой константную область иммуноглобулина человека. Химерное антитело можно получать, например, иммунизацией мыши антигеном, вырезанием вариабельной области, которая связывается с антиген, из гена, кодирующего моноклональное антитело мыши, и объединением вариабельной области с константной областью антитела, получаемого из костного мозга человека. Константная область, получаемая из иммуноглобулина человека, содержит уникальную аминокислотную последовательность в зависимости от изотипа, такого как IgG (IgG1, IgG2, IgG3 и IgG4), IgM, IgA (IgA1 и IgA2), IgD и IgE, а константная область рекомбинантного химерного антитела по настоящему изобретению может представлять собой константную область иммуноглобулина человека, принадлежащего любому изотипу. Константная область предпочтительно представляет собой константную область IgG человека. Экспрессирующий вектор можно получать с использованием гена химерного антитела, получаемого таким образом. Клетки-хозяева трансформируют экспрессирующим вектором с получением клеток-трансформантов, продуцирующих химерное антитело, а затем трансформированные клетки культивируют с получением желаемого химерного антитела из культурального супернатанта.
[0069] Другим предпочтительным вариантом осуществления связывающего RGMa белка по настоящему изобретению является гуманизированное антитело. "Гуманизированное антитело" в настоящем изобретении представляет собой антитело, получаемое пересадкой только последовательности ДНК антигенсвязывающего участка (CDR; определяющей комплементарность области) антитела, принадлежащего не являющемуся человеком животному, такому как мышь, в ген антитела человека (пересадка CDR). Гуманизированные антитела можно получать на основании способов, описанных, например, в опубликованной переведенной патентной заявке PCT Японии № Hei 4-506458 и в патенте Японии №2912618. В частности, предусматривают гуманизированное антитело, характеризующееся тем, что часть или все CDR представляют собой CDR, получаемые из моноклональных антител от не принадлежащих человеку млекопитающих (таких как мышь, крыса и хомяк), что каркасные области вариабельной области представляют собой каркасные области вариабельных областей, получаемые из иммуноглобулина человека, и что константные области представляют собой константные области, получаемые из иммуноглобулина человека.
[0070] Гуманизированное антитело по настоящему изобретению можно получать, например, как указано, но, само собой разумеется, что способ получения не ограничен ими.
[0071] Например, рекомбинантное гуманизированное антитело, получаемое из моноклонального антитела мыши можно получать генетической инженерией на основании опубликованных переведенных патентных заявок PCT Японии № Hei 4-506458 и Sho 62-296890. Таким образом, ДНК, кодирующую участок CDR тяжелой цепи мыши, и ДНК, кодирующую участок CDR легкой цепи мышь цепи, выделяют из гибридом, продуцируемых моноклональным антителом мыши, и ген тяжелой цепи человека, кодирующий полную область, отличную от CDR тяжелой цепи человека, и ген легкой цепи человека, кодирующий полную область, отличную от CDR легкой цепи человека, выделяют из гена иммуноглобулина человека.
[0072] Ген тяжелой цепи человека, в который выделенную ДНК, кодирующую участок CDR тяжелой цепи мыши, пересаживают, вводят в соответствующий экспрессирующий вектор, таким образом, что его экспрессия является возможной. Аналогично, ген легкой цепи человека, в который ДНК, кодирующую участок CDR легкой цепи мыши, пересаживают, вводят в другой подходящий экспрессирующий вектор, таким образом, что его экспрессия является возможной. Альтернативно, гены тяжелой и легкой цепей человека, в которые пересаживают CDR мыши, можно вводить в тот же экспрессирующий вектор, таким образом, что их экспрессия является возможной. Клетки-хозяева трансформируют получаемым таким образом экспрессирующим вектором с получением клеток-трансформантов, продуцирующих гуманизированное антитело, а затем культивируют трансформированные клетки с получением желаемого гуманизированного антитела из культурального супернатанта.
[0073] Другой предпочтительный вариант осуществления связывающего RGMa белка по настоящему изобретению представляет собой антитело человека. Антитело человека относится к антителу, в котором все области, включая вариабельные области тяжелой цепи и константные области тяжелой цепи, и вариабельные области легкой цепи, и константные области легкой цепи, входящие в состав иммуноглобулина, получают из генов, кодирующих иммуноглобулин человека. Антитела человека можно получать введением генов антитела человека мышам. Антитела человека можно получать аналогичным образом, как в указанным выше способом получения поликлональных антител или моноклональных антител, в частности, например, иммунизацией трансгенного животного, получаемого интеграцией по меньшей мере генов иммуноглобулина человека в локус гена млекопитающего, отличного от человека, такого как мышь.
[0074] Например, трансгенные мыши, которые продуцируют антитела человека, можно получать способами, описанными, например, в Nature Genetics, Vol. 7, p. 13-21, 1994; Nature Genetics, Vol.15, p. 146-156, 1997; опубликованных переведенных патентных заявках PCT Японии № Hei 4-504365 и Hei 7-509137; WO 94/25585; Nature, Vol. 368, p. 856-859, 1994 и опубликованной переведенной патентной заявке PCT Японии № Hei 6-500233. Конкретные примеры трансгенных мышей включают мышь HuMab™ (Medarex, Princeton NJ), мышь KMTM (Kirin Pharma Company, Japan) и мышь KM (FCγRIIb-KO).
[0075] Конкретные примеры моноклонального антитела по настоящему изобретению включают моноклональные антитела, в которых CDR в вариабельной области тяжелой цепи содержат аминокислотные последовательности SEQ ID NO: 33 (HCDR 1), 34 (HCDR 2) и 35 (HCDR 3) в списке последовательностей, и в которых CDR в вариабельной области легкой цепи содержат аминокислотные последовательности SEQ ID NO: 30 (LCDR 1), 31 (LCDR 2) и 32 (LCDR 3) в списке последовательностей. От одной до нескольких аминокислот в одной или более CDR можно заменять при условии, что сохраняются свойства антитела по настоящему изобретению, обладающего способностью связываться с RGMa, не ингибировать связывание RGMa и неогенина, и нейтрализующего ингибирующую прорастание нейритов активность RGMa. От одной до нескольких означает, например, одну или две. Замена аминокислоты предпочтительно представляет собой консервативную замену для поддержания свойств настоящего изобретения. Сохранение свойств антитела означает, что эти свойства сохраняются в той же степени, например, 80% или более, предпочтительно 90% или более, более предпочтительно 95% или более по сравнению со свойствами до модификаций аминокислотной последовательности CDR. Сохранение также включает улучшение.
[0076] Область, отличная от CDR, конкретно не ограничена при условии, что она представляет собой последовательность, которая может сохранять структуру как антитело и выполнять его функцию, и может представлять собой любую из последовательностей, получаемых от мыши, человека и других млекопитающих, их химерные последовательности и искусственные последовательности. В случае содержания константной области, аминокислотные последовательности константных областей в тяжелой цепи и легкой цепи проиллюстрированы аминокислотными последовательностями, описанными в Nucleic Acids Research vol.14, p1779, 1986, The Journal of Biological Chemistry vol.257, p1516, 1982 and Cell vol.22, p197, 1980.
[0077] Примеры антител мыши, содержащих такие CDR, включают антитела, в которых легкая цепь содержит аминокислотную последовательность SEQ ID NO: 4 в списке последовательностей, и в которых тяжелая цепь содержит аминокислотную последовательность SEQ ID NO: 5 в списке последовательностей. В этих аминокислотных последовательностях может встречаться замена, делеция, добавление или вставка одной или более (от 1 до 20, от 1 до 10 или от 1 до 5) аминокислот при условии, что сохраняются свойства антитела, обладающего способностью связываться с RGMa, не ингибировать связывание RGMa и неогенина, и нейтрализовать ингибирующую прорастание нейритов активность RGMa. Такую замену, делецию или добавление можно вводить в CDR, но предпочтительно ее вводят в область, отличную от CDR. Замена аминокислоты предпочтительно представляет собой консервативную замену с целью сохранения свойств по настоящему изобретению.
[0078] Также включены химерные антитела мыши/человека, в которых константные области в указанном выше антителе мыши, получают от человека. Пример таких химерных антител мыши/человека представляет собой антитело, в котором легкая цепь содержит аминокислотную последовательность SEQ ID NO: 8 в списке последовательностей (вариабельная область простирается от 1 до 107), и в котором тяжелая цепь содержит аминокислотную последовательность SEQ ID NO: 9 в списке последовательностей (вариабельная область простирается от 1 до 116). В этих аминокислотных последовательностях может присутствовать замена, делеция, добавление или вставка одной или более (от 1 до 20, от 1 до 10 или от 1 до 5) аминокислот при условии, что сохраняются свойства антитела обладать способностью связываться с RGMa, не ингибировать связывание RGMa и неогенина, и нейтрализовать ингибирующую прорастание нейритов активность RGMa. Такую замену, делецию или добавление можно вводить в CDRs, но предпочтительно ее вводить в область, отличную от CDR. Замена аминокислоты предпочтительно представляет собой консервативную замену с целью сохранения свойств по настоящему изобретению.
[0079] Кроме того, иллюстративными являются гуманизированные антитела, в которых область, отличную от CDR, получают от человека. Примером таких гуманизированных антител является антитело, в котором тяжелая цепь содержит аминокислотную последовательность любой SEQ ID NO: 11-18 (вариабельная область располагается до 116-го остатка со стороны N-конца), и в котором легкая цепь содержит аминокислотную последовательность любой SEQ ID NO: 19-25 в списке последовательностей (вариабельная область простирается от 1-го до 107-го остатка со стороны N-конца).
В аминокислотных последовательностях гуманизированного антитела (тяжелая цепь: SEQ ID NO: 11-18 в списке последовательностей, легкая цепь: SEQ ID NO: 19-25 в списке последовательностей) может присутствовать замена, делеция, добавление или вставка одной или более (от 1 до 20, от 1 до 10 или от 1 до 5) аминокислот при условии, что сохраняются свойства антитела обладать способностью связываться с RGMa, не ингибировать связывание RGMa и неогенина, и нейтрализовать ингибирующую прорастание нейритов активность RGMa. Такую замену, делеция или добавление модно вводить в CDR, но предпочтительно вводить в область, отличную от CDR. Замена аминокислоты предпочтительно представляет собой консервативную замену с целью сохранения свойств по настоящему изобретению.
[0080] Аминокислотная последовательность тяжелой цепи и аминокислотная последовательность легкой цепи может представлять собой любое их сочетание, но особенно предпочтительным является антитело, содержащее тяжелые цепи, содержащие аминокислотную последовательность SEQ ID NO: 15 в списке последовательностей, и легкие цепи, содержащие аминокислотную последовательность SEQ ID NO: 19 в списке последовательностей. В аминокислотной последовательности SEQ ID NO: 15 в списке последовательностей аминокислотная последовательность, соответствующая вариабельной области тяжелой цепи, продемонстрирована в SEQ ID NO: 41 в списке последовательностей, и аминокислотная последовательность, соответствующая вариабельной области легкой цепи, продемонстрирована в SEQ ID NO: 42 в списке последовательностей. Таким образом, особенно предпочтительное антитело по настоящему изобретению представляет собой антитело, в котором вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 41 в списке последовательностей, и в котором вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID NO: 42 в списке последовательностей.
В этих аминокислотных последовательностях может присутствовать замена, делеция, добавление или вставка одной или более (от 1 до 20, от 1 до 10 или от 1 до 5) аминокислот при условии, что сохраняются свойства антитела обладать способностью связываться с RGMa, не ингибировать связывание RGMa и неогенина и нейтрализовать ингибирующую прорастание нейритов активность RGMa. Такую замену, делецию или добавление можно вводить в CDR, но предпочтительно вводить в область, отличную от CDR. Замена аминокислоты предпочтительно представляет собой консервативную замену с целью сохранения свойств по настоящему изобретению.
В аминокислотной последовательности антитела по настоящему изобретению, содержащей замену, делецию или т.п. в аминокислотной последовательности SEQ ID NO: 41 и/или 42 в списке последовательностей, как описано выше, вариабельная область тяжелой цепи представляет собой аминокислотную последовательность, обладающую 90% или более (более предпочтительно 95%, 96%, 97%, 98%, 99% или более) идентичностью с SEQ ID NO: 41 списка последовательностей, и вариабельная область легкой цепи представляет собой аминокислотную последовательность, обладающую 90% или более (более предпочтительно 95%, 96%, 97%, 98%, 99% или более) идентичностью с SEQ ID NO: 42 списка последовательностей.
[0081] Другие конкретные примеры моноклонального антитела по настоящему изобретению включают моноклональные антитела, в которых CDR в вариабельной области тяжелой цепи содержат аминокислотные последовательности SEQ ID NO: 39 (HCDR 1), 40 (HCDR 2) и SFG (HCDR 3) в списке последовательностей, и в которых CDR в вариабельной области легкой цепи содержат аминокислотные последовательности SEQ ID NO: 36 (LCDR 1), 37 (LCDR 2) и 38 (LCDR 3) в списке последовательностей. От одной до нескольких аминокислот в одной или более CDR можно заменять при условии, что сохраняются свойства антитела по настоящему изобретению обладать способностью связываться с RGMa, не ингибировать связывание RGMa и неогенина, и нейтрализовать ингибирующую прорастание нейритов активность RGMa.
От одной до нескольких означает, например, одну или две. Замена аминокислоты предпочтительно представляет собой консервативную замену с целью сохранения свойств по настоящему изобретению.
Область, отличная от CDR, конкретно не ограничена при условии, что она представляет собой последовательность, которая может сохранять структуру в виде антитела и выполнять его функцию, и может представлять собой любую из последовательностей, получаемых от мыши, человека и других млекопитающих, их химерные последовательности и искусственные последовательности. В случае содержания константной области иллюстративными являются аминокислотные последовательности константных областей в тяжелой цепи и легкой цепи, описанные в Nucleic Acids Research vol.14, p1779, 1986, The Journal of Biological Chemistry vol.257, p1516, 1982 и Cell vol. 22, p197, 1980.
[0082] Примеры антител мыши, содержащих такими CDR, включают антитела, в которых легкая цепь содержит аминокислотную последовательность SEQ ID NO: 6 в списке последовательностей, и в которых тяжелая цепь содержит аминокислотную последовательность SEQ ID NO: 7 в списке последовательностей. В таких аминокислотных последовательностях может присутствовать замена, делеция, добавление или вставка одной или более (1 до 20, 1 до 10 или 1 до 5) аминокислот при условии, что сохраняются свойства антитела обладать способностью связываться с RGMa, не ингибировать связывание RGMa и неогенина, и нейтрализовать ингибирующую прорастание нейритов активность RGMa. Такую замену, делецию или добавление можно вводить в CDR, но предпочтительно вводить в область, отличную от CDR. Замена аминокислоты предпочтительно представляет собой консервативную замену с целью сохранения свойств по настоящему изобретению.
[0083] Как указано выше, также включены антитело мыши, химерные антитела, константные области которых получают от человека. Дополнительно включены гуманизированные антитела, в которых область, отличную от CDR, получают от человека.
[0084] Антитело к RGMa по настоящему изобретению относится к полиспецифическим антителам, функционально модифицированным антителам и конъюгированным антителам, содержащим CDR, содержащим конкретные аминокислотные последовательности (например, аминокислотные последовательности SEQ ID NO: 30 в списке последовательностей для LCDR1, SEQ ID NO: 31 в списке последовательностей для LCDR2, SEQ ID NO: 32 в списке последовательностей для LCDR3, SEQ ID NO: 33 в списке последовательностей для HCDR1, SEQ ID NO: 34 в списке последовательностей для HCDR2, и SEQ ID NO: 35 в списке последовательностей для HCDR3), или содержащим вариабельные области, содержащие конкретные аминокислотные последовательности (например, аминокислотные последовательности SEQ ID NO: 41 в списке последовательностей для вариабельной области тяжелой цепи и SEQ ID NO: 42 для вариабельной области легкой цепи).
[0085] Антитело к RGMa по настоящему изобретению само по себе можно связывать с антителом, обладающим другой специфичностью связывания антигена, отличной от специфичности антитела к RGMa, способами генетической инженерией с получением полиспецифических антител, таких как биспецифические антитела. В данной области уже установлены способы генетической инженерии. Например, с применением способа для DVD-Ig, в котором вариабельные области соединяют последовательно (Wu et al., Nature Biotechnology 25(11), 1290 (2007)) или способа для ART-Ig, в котором тяжелые цепи двух типов антител, связывающих различные антигены, объединяют путем модификации Fc-области антитела (Kitazawa et al., Nature Medicine, 18(10), 1570(2012), можно получать желаемые биспецифические антитела. Другие антигены, отличные от RGMa, включают, но не ограничиваются ими, факторы, ингибирующие прорастание нейритов, такие как Nogo, MAG, Omgp, CSPG, Sema 3A и Lingo-1, и иммунозависимые молекулы, такие как TNF-α, рецептор IL-6, CD3, CD20, интегрин α4, BLys, тимусный стромальный лимфопоэтин, IgE, IL-1, IL-2, IL-4, IL-5, IL-6, IL- 13, IL- 17, IL-23 и IL-25.
[0086] Примерами функционально модифицированных антител являются модифицированные молекулы антитела к RGMa по настоящему изобретению. Функционально модифицированное антитело означает антитело, в котором функции, такие как вызывающая цитолиз клеток функция, активирующие комплемент функция и функция увеличения времени полужизни в крови, модифицируют в основном путем модификации Fc-области или т.п. (Shitara, Journal of the Pharmaceutical Society of Japan, 2009, Vol. 129(1), p3; Ishii et al., Nippon Yakubutsugaku Zasshi (Folia Pharmacologica Japonica), 2010, Vol. 136(5), p280; Hashiguchi et al., The Journal of Japanese Biochemical Society, 2010, Vol. 82(8), p710).
[0087] Функционально модифицированные антитела из антитела к RGMa получают следующим ниже способом. Например, когда антитело к RGMa по настоящему изобретению получают с использованием в качестве клеток-хозяев клетки CHO, у которых разрушали ген α1,6-фукозилтрансфераза (FUT 8), получают антитела с пониженным содержанием фукозы сахарных цепей и повышенной вызывающей цитолиз клеток функцией, и когда антитело к RGMa по настоящему изобретению получают с использованием в качестве клетки-хозяина клетки CHO, в которые вводили ген FUT8, получают антитела с низкой вызывающей цитолиз клеток функцией (WO 2005/035586, WO 2002/31140 и WO 00/61739). Функцию активации комплемента можно регулировать модификацией аминокислотных остатков в Fc-области (патенты США №6737056, 7297775 и 7317091). Увеличение времени полужизни в крови можно получать с использованием вариантов Fc-области с увеличенным связыванием с FcRn, который представляет собой один из Fc-рецепторов (Hashiguchi et al., The Journal of Japanese Biochemical Society, 2010, Vol. 82 (8), p710). Эти функционально модифицированные антитела можно получать способами генетической инженерии.
[0088] Иллюстративные конъюгированные антитела представляют собой модифицированные молекулы антитела к RGMa по настоящему изобретению. Примеры конъюгированного антитела включают конъюгированные антитела, в которых антитела к RGMa являются химически или генетически связанными с функциональными молекулами, отличными от антитела к RGMa по настоящему изобретению, такими как непептидные полимеры, такие как полиэтиленгликоль (PEG), радиоактивные вещества, токсины, низкомолекулярные соединения, цитокины, факторы роста (например, TGF-β, NGF, нейротрофин), альбумин, ферменты и другие антитела.
[0089] Когда PEG связывают в качестве функциональной молекулы, можно использовать PEG с молекулярной массой без ограничения от 2000 до 100000 Да, более предпочтительно от 10000 до 50000 Да, который может быть линейным или разветвленным. С использованием, например, активной группы NHS PEG можно связывать, например, с с N-концевой аминогруппой аминокислот антител.
[0090] В случае использования радиоактивного вещества в качестве функциональной молекулы используют, например, 131I, 125I, 90Y, 64Cu, 99Tc, 77Lu или 211At. Радиоактивные вещества можно непосредственно связывать с антителами, например, способом с использованием хлорамина T.
[0091] При использовании токсина в качестве функциональной молекулы используют, например, бактериальные токсины (например, дифтерийный токсин), фитотоксины (например, рицин), низкомолекулярные токсины (например, гелданамицин), майтанзиноиды и калихимицин.
[0092] При использовании низкомолекулярного соединение в качестве функциональной молекулы используют, например, дауномицин, доксорубицин, метотрексат, митомицин, неокарзиностатин, виндезин и флуоресцентные красители, такие как FITC.
[0093] При использовании фермента в качестве функциональной молекулы используют, например, люциферазу (например, люциферазу светляков и бактериальную люциферазу; патент США №4737456), малатдегидрогеназу, уреазу, пероксидазу (например, пероксидазу хрена (HRPO)), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, сахаридоксидазу (например, глюкозооксидазу, галактозооксидазу и глюкоза-6-фосфат дегидрогеназу), гетероциклическую оксидазу (например, уриказу и ксантиноксидазу), лакторпероксидазу и микропероксидазу.
[0094] Примеры линкеров, используемых для химического связывания токсина, низкомолекулярного соединения или фермента, включают двухвалентные радикалы (например, алкилен, арилен, гетероарилен), повторяющуюся структурную единицу линкера или алкокси, предоставленный -(CR2)nO(CR2)n- (где R представляет собой необязательный заместитель, и n представляет собой положительное целое число) (например, полиэтиленокси, PEG и полиметиленокси) и алкиламино (например, полиэтиленамино, Jeffamine™) и сложный эфир двухосновной кислоты и амид (например, сукцинат, сукцинамид, дигликолат, малонат и капроамид). В данной области уже установлены способы химической модификации связывания функциональных молекул (D.J. King., Applications and Engineering of Monoclonal antibodies., 1998 T.J. International Ltd, Monoclonal Antibody-Based Therapy of Cancer., 1998 Marcel Dekker Inc; Chari et al., Cancer Res., 1992 Vol152:127; Liu et al., Proc Natl Acad Sci USA., 1996 Vol 93:8681).
[0095] "Антигенсвязывающие фрагменты" антител в настоящем изобретении означают неполную область, обладающую антигенсвязывающим свойством описанных выше антител, включая, в частности, F(ab')2, Fab', Fab, Fv (вариабельный фрагмент антитела), связаннвй дисульфидными связями Fv, одноцепочечное антитело (scFv) и их полимеры. Антигенсвязывающий фрагменты дополнительно включают конъюгированные антигенсвязывающие фрагменты, химически или генетически связанные с функциональными молекулами отличными от антитела к RGMa по настоящему изобретению, такими как непептидные полимеры, такие как полиэтиленгликоль (PEG), радиоактивные вещества, токсины, низкомолекулярные соединения, цитокины, факторы роста (например, TGF-β, NGF, нейротрофин), альбумин, ферменты и другие антитела.
[0096] Как используют в настоящем описании, "F (ab')2" и "Fab" означают фрагменты антител, которые получают обработкой иммуноглобулинов протеазой пепсином или папаином и получают расщеплением выше и ниже дисульфидной связи, находящейся между двумя тяжелыми цепями в шарнирной области. Например, обработка папаином IgG может вызывать расщепление выше дисульфидной связи, расположенной между двумя тяжелыми цепями в шарнирной области, с получением двух гомологичных фрагментов антител, где каждый содержит легкую цепь, содержащую VL (вариабельную область легкой цепи) и a CL (константную область легкой цепи), и фрагмент тяжелой цепи, содержащий VH (вариабельную область тяжелой цепи) и CHγ1 (область γ1 в константной области тяжелой цепи), в которой фрагменты легкой цепи и тяжелой цепи связаны друг с другом через дисульфидную связь в C-концевом домене. Каждый из двух гомологичных фрагментов антител обозначают как Fab. Обработка пепсином IgG может вызывать расщепление ниже дисульфидной связи, расположенной между двумя тяжелыми цепями в шарнирной области, с получением фрагмента антитела незначительно легче, чем фрагмент, в котором два Fab связаны друг с другом в шарнирной области. Такой фрагмент антитела обозначают как F(ab')2.
[0097] Иллюстративные конъюгированные антигенсвязывающие фрагменты представляют собой модифицированные молекулы антигенсвязывающего фрагмента антитела к RGMa по настоящему изобретению. Примеры конъюгированного антигенсвязывающего фрагмента включают фрагменты, в которых неполная область, обладающая антигенсвязывающим свойством антитела к RGMa, явялется химически или генетически связанной с функциональной молекулой, отличной от антитела к RGMa по настоящему изобретению, такой как непептидные полимеры, такие как полиэтиленгликоль (PEG), радиоактивные вещества, токсины, низкомолекулярные соединения, цитокины, факторы роста (например, TGF-β, NGF, нейротрофин), альбумин, ферменты и другие антитела.
[0098] Когда PEG связывают в качестве функциональной молекулы, можно использовать PEG с молекулярной массой без ограничения от 2000 до 100000 Да, более предпочтительно от 10000 до 50000 Да, который может быть линейным или разветвленным. PEG можно связывать, например, с N-концевой аминогруппой неполной области, обладающей антигенсвязывающими свойствами антитела к RGMa, с использованием, например, активной группы NHS.
[0099] В случае использования радиоактивного вещества в качестве функциональной молекулы используют, например, 131I, 125I, 90Y, 64Cu, 99Tc, 77Lu или 211At. Радиоактивные вещества можно непосредственно связывать с неполной областью, обладающей антигенсвязывающим свойством антитела к RGMa, например, способом с использованием хлорамина T.
[0100] При использовании токсина в качестве функциональной молекулы используют, например, бактериальные токсины (например, дифтерийный токсин), фитотоксины (например, рицин), низкомолекулярные токсины (например, гелданамицин), майтанзиноиды и калихимицин.
[0101] При использовании низкомолекулярного соединения в качестве функциональной молекулы используют, например, дауномицин, доксорубицин, метотрексат, митомицин, неокарзиностатин, виндезин и флуоресцентные красители, такие как FITC.
[0102] При использовании ферментм в качестве функциональной молекулы используют, например, люциферазу (например, люциферазу светляков и бактериальную люциферазу; патент США №4737456), малатдегидрогеназу, уреазу, пероксидаза (например, пероксидазу хрена (HRPO)), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, сахаридоксидазу (например, глюкозооксидазу, галактозооксидазу и глюкоза-6-фосфатдегидрогеназу), гетероциклическую оксидазу (например, уриказу и ксантиноксидазу), лакторпероксидазу и микропероксидазу.
[0103] Примеры линкеров, используемых для химического связывания токсина, низкомолекулярного соединения или фермента, включают двухвалентные радикалы (например, алкилен, арилен, гетероарилен), повторяющуюся структурную единицу линкера или алкокси, представленный -(CR2)nO(CR2)n- (где R представляет собой необязательный заместитель, и n представляет собой положительное целое число) (например, полиэтиленокси, PEG и полиметиленокси) и алкиламино (например, полиэтиленамино, Jeffamine™) и сложный эфир двухосновной кислоты и амид (например, сукцинат, сукцинамид, дигликолат, малонат и капроамид). В данной области уже установлены способы химической модификации связывания функциональных молекул (D.J.King., Applications and Engineering of Monoclonal antibodies., 1998 T.J. International Ltd, Monoclonal Antibody-Based Therapy of Cancer., 1998 Marcel Dekker Inc; Chari et al., Cancer Res., 1992 Vol152:127; Liu et al., Proc Natl Acad Sci USA., 1996 Volatl. Acad. Sci. USA., 1996 Vol 93:8681).
[0104] В антителе к RGMa, содержащем CDR или вариабельные области, содержащие конкретные аминокислотные последовательности по настоящему изобретению, константная область предпочтительно представляет собой константную область IgG человека (IgG1, IgG2, IgG3 или IgG4) для сохранения длительного времени полужизни в крови.
[0105] Настоящее изобретение также относится к антителу к RGMa, которое конкурирует с антителом, содержащим аминокислотные последовательности конкретных CDR, как описано выше, за связывание с белками RGMa и их антигенсвязывающими фрагментами. Антитело, которое конкурирует с антителом, содержащим аминокислотные последовательности конкретных CDR, как описано выше, за связывания с белками RGMa, содержит эпитопы в бластях, выбранных из Glu 298-Gly 311, Asn 322-Glu 335, Lys 367-Ala 377 и Pro 349-Thr 359.
Антитело можно получать (проводить скрининг) или оценивать посредством того, что обеспечивают возможность присутствия антитела в системе связывания антитела, содержащего последовательности CDR, как описано выше, и белков RGMa. Например, антитело можно получать скринингом с использованием следующего ниже способа поверхностного плазмонного резонанса (SPR).
[0106] Биотинилированный белок RGMa человека (4 мкг/мл) в виде лиганда наносят на сенсорный чип с иммобилизованным авидином для иммобилизации белков RGMa человека, эквивалентных от 1300 до 1600 РЕ. Затем в качестве аналита наносят необязательное антитело к RGMa (15 мкг/мл), и оно связывается с белком RGMa человека, иммобилизованном на сенсорном чипе. Путем повторения эту процедуру много раз создают состояние, в котором необязательное антитело к RGMa связывают со всеми молекулами белка RGMa человека на сенсорном чипе (насыщенное состояние) и определяют величину связывания в насыщенном состоянии (величина насыщенного связывания 1).
Аналогичный эксперимент проводят с антителом к RGMa, содержащим аминокислотные последовательности конкретных CDR по настоящему изобретению, для определения величины связывания в насыщенном состоянии (величина насыщенного связывания 2).
Затем белки RGMa человека на сенсорном чипе насыщают антителом к RGMa, содержащим аминокислотные последовательности конкретных CDR по настоящему изобретению, а затем в качестве аналита наносят необязательное антитело к RGMa (15 мкг/мл) для исследования, связывается ли дополнительно необязательное антитело к RGMa с белком RGMa человека, насыщенным антителом к RGMa, содержащим аминокислотные последовательности конкретных CDR по изобретению.
Если необязательное антитело к RGMa может дополнительно связываться с белком RGMa человека, насыщенным антителом к RGMa, содержащим аминокислотные последовательности конкретных CDR по изобретению, при этом демонстрируют величину насыщенного связывания 1 необязательного антитела к RGMa, рассчитываемую выше, то антитело расценивают как "неконкурирующее". С другой стороны, если необязательное антитело к RGMa не может дополнительно связываться с белком RGMa человека, насыщенным антителом к RGMa, содержащим аминокислотные последовательности конкретных CDR по изобретению, то антитело расценивают как "конкурирующее". Даже если необязательное антитело к RGMa может дополнительно связываться с белком RGMa человека, насыщенным антителом к RGMa, содержащим аминокислотные последовательности конкретных CDR по изобретению, то дополнительная величина связывания не достигает величины насыщенного связывания 1 со значимым отличием, то антитело расценивают как "конкурирующее". Значимые отличия проиллюстрированы общепринятыми способами статистики (например, t-критерий Стьюдента), и уровень значимости устанавливают как 5% или менее.
[0107] Антитело к RGMa, которое конкурирует с антителом к RGMa, содержащим конкретную аминокислотную последовательность CDR, как описано выше, за связывание с RGMa, может представлять собой антитело, получаемое из антитела любого животного, такого как мышь, человек, крыса, кролик, коза или верблюд, или может представлять собой химерное или гуманизированное антитело, которое представляет собой комбинацию таких антител, но предпочтительно представляет собой химерное, гуманизированное антитело или антитело человека.
[0108] Молекулы нуклеиновой кислоты по настоящему изобретению
Примеры молекул нуклеиновой кислоты по настоящему изобретению включают полинуклеотиды, в которых область, кодирующая вариабельную область тяжелой цепи, содержит основную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 33, 34 и 35 в списке последовательностей, соответственно (в которой одну или более аминокислот можно заменять, удалять, вводить или добавлять), и область, кодирующая вариабельную область легкой цепи, содержит основную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 30, 31 и 32 в списке последовательностей, соответственно (в которой одну или более аминокислот можно заменять, удалять, вводить или добавлять); и полинуклеотиды, в которых область, кодирующая вариабельную область тяжелой цепи, содержит основную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 39, 40, и SFG в списке последовательностей, соответственно (в которой одну или более аминокислот можно заменять, удалять, вводить или добавлять), и область, кодирующая вариабельную область легкой цепи, содержит основную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 36, 37 и 38 в списке последовательностей, соответственно (в которой одну или более аминокислот можно заменять, удалять, вводить или добавлять).
[0109] Другие примеры молекулы нуклеиновой кислоты по настоящему изобретению включают полинуклеотиды, в которых область, кодирующая тяжелую цепь, содержит основную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 5 в списке последовательностей, и область, кодирующая легкую цепь, содержит основную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 4 в списке последовательностей; и полинуклеотиды, в которых область, кодирующая тяжелую цепь, содержит основную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 7 в списке последовательностей, и область, кодирующая легкую цепь, содержит основную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 6 в списке последовательностей.
[0110] Другие примеры молекулы нуклеиновой кислоты по настоящему изобретению включают полинуклеотиды, в которых область, кодирующая тяжелую цепь, содержит основную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 9 в списке последовательностей, и область, кодирующая легкую цепь, содержит основную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 8 в списке последовательностей.
[0111] Другие примеры молекулы нуклеиновой кислоты по настоящему изобретению включают полинуклеотиды, в которых область, кодирующая тяжелую цепь, содержит основную последовательность, кодирующую аминокислотную последовательность любой SEQ ID NO: 11 до 18 в списке последовательностей, и область, кодирующая легкую цепь, содержит основную последовательность, кодирующую аминокислотную последовательность любой SEQ ID NO: 19 до 25 в списке последовательностей.
[0112] Особенно предпочтительные примеры молекулы нуклеиновой кислоты по настоящему изобретению включают полинуклеотиды, в которых область, кодирующая тяжелую цепь, содержит основную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 15 в списке последовательностей, и область, кодирующая легкую цепь, содержит основную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 19 в списке последовательностей.
[0113] Другие примеры молекулы нуклеиновой кислоты по настоящему изобретению включают полинуклеотиды, в которых область, кодирующая вариабельную область тяжелой цепи содержит основную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 41 в списке последовательностей, и область, кодирующая вариабельную область легкой цепи, содержит основную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 42 в списке последовательностей.
[0114] Конкретные примеры молекулы нуклеиновой кислоты по настоящему изобретению включают полинуклеотиды, в которых область, кодирующая вариабельную область тяжелой цепи содержит основную последовательность SEQ ID NO: 43 в списке последовательностей, и область, кодирующая вариабельную область легкой цепи, содержит основную последовательность SEQ ID NO: 44 в списке последовательностей.
[0115] Молекула нуклеиновой кислоты по настоящему изобретению может представлять собой полинуклеотиды, гибридизирующиеся в жестких условиях с комплементарной цепью ДНК, содержащей основную последовательность SEQ ID NO: 43 в списке последовательностей, и полинуклеотиды, гибридизирующиеся в жестких условиях с комплементарной цепью ДНК, содержащей основную последовательность SEQ ID NO: 44 в списке последовательностей, при условии, что молекула нуклеиновой кислоты по настоящему изобретению кодирует моноклональное антитело, которое обладает способностью связываться с RGMa, не ингибирует связывание RGMa и неогенина и нейтрализует ингибирующую прорастание нейритов активность RGMa. Примеры жестких условий включают условие проведения саузерн-гибридизации и промывание при концентрации солей, соответствующей 0,1× SSC, 0,1% SDS при 68°C.
[0116] Молекула нуклеиновой кислоты по настоящему изобретению может кодировать все константные области и вариабельные области тяжелых и легких цепей, и может кодировать только вариабельные области тяжелых и легких цепей. Основная последовательность константной области тяжелых и легких цепей, в случае кодирования всех из константной области и вариабельная область, предпочтительно представляет собой основные последовательности, описанные в Nucleic Acids Research vol. 14, p1779, 1986, The Journal of Biological Chemistry vol.257, p1516, 1982 и Cell, vol.22, p197, 1980.
[0117] Молекулу нуклеиновой кислоты по настоящему изобретению можно получать, например, следующим ниже способом. Сначала получают тотальную РНК из клеток, таких как гибридомы, с использованием коммерческого набора для экстракции РНК и синтезируют кДНК обратной транскриптазой с использованием случайных праймеров или т.п. Затем кДНК, кодирующую антитело, амплифицируют способом ПЦР с использованием для праймеров олигонуклеотиды, содержащие последовательности, консервативные в вариабельных областях известных генов тяжелых и легких цепей антитела человека, соответственно. Касательно последовательности, кодирующей константную область, ее можно получать амплификацией известной последовательности способом ПЦР. Основную последовательность ДНК можно определять общепринятым способом, например, введением в плазмиду для секвенирования.
Альтернативно, ДНК, кодирующую моноклональное антитело по настоящему изобретению, также можно получать химическим синтезом последовательности вариабельной области или ее части и связыванием ее с последовательностью, содержащей константную область.
[0118] Настоящее изобретение также относится к рекомбинантному вектору, содержащему молекулу нуклеиновой кислоты по настоящему изобретению, и трансформанту (клетке-хозяину), содержащему рекомбинантный вектор. Рекомбинантный вектор может представлять собой векторы, которые можно экспрессировать в прокариотических клетках, таких как E. coli (Escherichia coli) (например, pBR322, pUC119 или их производное), и предпочтительно представляют собой векторы, которые можно экспрессировать в эукариотических клетках, и более предпочтительно представляют собой векторы, которые можно экспрессировать в получаемых от млекопитающих клетквх. Примеры векторов, которые можно экспрессировать в получаемых от млекопитающих клетках, включают плазмидные векторы, такие как pcDNA 3.1 (Invitrogen), pConPlus, pcDM8, pcDNA I/Amp, pcDNA 3.1, pREP4, и вирусные векторы, такие как pDON-AI DNA (Takara Bio). Вектор может представлять собой один вектор, содержащий кодирующую тяжелую цепь последовательность и кодирующую легкую цепь последовательность, или может представлять собой два вектора: вектор, содержащий кодирующую тяжелую цепь последовательность, и вектор, содержащий кодирующую легкую цепь последовательность.
[0119] Трансформант, в который вводят рекомбинантный вектор по настоящему изобретению, может представлять собой прокариотическую клетку, такую как Escherichia coli или Bacillus subtilis, предпочтительно эукариотическую клетку, более предпочтительно клетку млекопитающего. Примеры клеток млекопитающего включают клетки яичника китайского хомяка (клетки CHO), COS, миелому, BHK, HeLa, Vero, 293, NS0, Namalwa и YB2/0.
[0120] Получаемое антитело к RGMa или его антигенсвязывающий фрагмент можно очищать до однородного состояния. Для разделения и очистки антител можно использовать способы разделения и очистки, используемые для обычных белков и т.п. Разделение и очистку антител модно проводить соответствующим образом путем отбора и объединения, например, но без ограничения, хроматография на колонках, такая как аффинная хроматография, фильтры, ультрафильтрация, высаливание, диализ, электрофорез SDS в полиакриламидном геле или изоэлектрофокусирование (Antibodies: A Laboratory Manual. Ed Harlow and David Lane, Cold Spring Harbor Laboratory, 1988). Примеры колонок, используемых для аффинной хроматографии, включают колонку с белком A, колонку с белком G, конъюгированную с антителом к иммуноглобулину колонку и конъюгированную с антигеном колонку. Примеры колонки с белком A включают Hyper D, POROS и Sepharose F.F. (Amersham Biosciences).
[0121] Средства для профилактики или лечения иммунологических и неврологических заболеваний
Связывающий RGMa белок, в частности антитело к RGMa или его антигенсвязывающий фрагмент по настоящему изобретению нейтрализует ингибирующую прорастание нейритов активность RGMa, способствуя восстановлению функции нейронов, и, таким образом, его можно использовать в качестве средства для профилактики, лечения или профилактики рецидива неврологических заболеваний.
Связывающий RGMa белок, в частности антитело к RGMa или его антигенсвязывающий фрагмент по настоящему изобретению, также нейтрализует активацию T-клеток, вызываемую RGMa, и, таким образом, его можно использовать в качестве средства для профилактики, лечения или профилактики рецидива иммунологических заболеваний.
[0122] Примеры неврологического заболевания включают боковой амиотрофический склероз, повреждения плечевого сплетения, повреждения головного мозга (включая травматическое повреждение головного мозга), церебральный паралич, синдром Гийена-Барре, церебральную лейкодистрофию, рассеянный склероз (включая ремиттирующий рассеянный склероз, первичный прогрессирующий рассеянный склероз, вторичный прогрессирующий рассеянный склероз), нейромиелит зрительного нерва, постполиомиелитный синдром, расщелину позвоночника, повреждение спинного мозга, спинальную мышечную атрофию, неоплазию позвоночного столба, поперечный миелит, деменцию (включая сенильную деменцию, умеренное когнитивное нарушение, болезнь Альцгеймера, деменцию, связанную с болезнью Альцгеймера), болезнь Хантингтона, позднюю дискинезию, манию, болезнь Паркинсона, синдром Стила-Ричардсона, синдром Дауна, тяжелую миастению, травму нервной системы (включая травму зрительного нерва), амилоидоз сосудов, внутримозговое кровоизлияние, связанное с амилоидозом, инфаркта головного мозга, энцефалит, острое состояние спутанности, глаукому, шизофрению и дегенерацию слоя нервных волокон сетчатки (включая диабетическую ретинопатию, ишемическую оптическую нейропатию, сцепленный с X-хромосомой ретиносхизис, индуцированную лекарственным средством оптическую нейропатию, дистрофию сетчатки, связанную с возрастом дегенерацию желтого пятна, заболевание глаз, характеризующиеся друзами диска зрительного нерва, заболевание глаз, характеризующиеся генетической обусловленной дегенерацией фоторецепторов, аутосомно-рецессивную палочко-колбочковую дистрофию, митохондриальное нарушения, связанное с оптической нейропатией). Предпочтительными являются повреждение спинного мозга и травма нервной системы (включая травму зрительного нерва).
[0123] Примеры иммунологического заболевания включают рассеянный склероз (включая ремиттирующий рассеянный склероз, первичный прогрессирующий рассеянный склероз, вторичный прогрессирующий рассеянный склероз), нейромиелит зрительного нерва, псориаз, артрит (включая ревматоидный артрит, остеоартрит, псориатический артрит), синдром Гийена-Барре, болезнь Бехчета, пернициозную анемию, (инсулинозависимый) сахарный диабет I типа, системную красную волчанку (SLE), воспалительное заболевание кишечника (IBD), синдром Шегрена, синдром Гудпасчера, болезнь Грейвса, аутоиммунной гемолитической анемии, аутоиммунной тромбоцитопенической пурпуры, астма, поллиноза, атопический дерматит, гломерулонефрит, тяжелую миастению, болезнь Хашимото и саркоидоз. Предпочтительным является рассеянный склероз.
[0124] Связывающий RGMa белок, в частности антитело к RGMa или его антигенсвязывающий фрагмент по настоящему изобретению, можно использовать в качестве средства для профилактики, лечения или профилактики рецидива неврологических/иммунологических заболеваний, которые предпочтительно включают повреждение спинного мозга, травму нервной системы (включая травму зрительного нерва) и рассеянный склероз (включая ремиттирующий рассеянный склероз, первичный прогрессирующий рассеянный склероз, вторичный прогрессирующий рассеянный склероз).
[0125] Как используют в настоящем описании, термин "лечение" включает любое лечение заболеваний у млекопитающего, в частности у человека, и включает ингибирование симптомов заболевания, таким образом, ингибируя их прогрессирование или устраняя заболевания или симптомы, и ослабление симптомов заболевание, таким образом, вызывая регрессию заболеваний или симптомов или замедление развития симптомов.
[0126] "Профилактика" включает профилактику начала описанных выше заболеваний у млекопитающего, в частности у человека.
[0127] "Профилактики рецидива" включают профилактику рецидива повторной ремиссии и рецидива описанных выше заболеваний у млекопитающего, в частности человека.
[0128] Связывающий RGMa белок (антитело к RGMa или его антигенсвязывающий фрагмент) по настоящему изобретению можно использовать в качестве фармацевтической композиции для профилактики или лечения неврологических или иммунологических заболеваний.
[0129] Форма введения связывающего RGMa белка (антитела к RGMa или его антигенсвязывающего фрагмента) по настоящему изобретению конкретно не ограничена и можно вводить млекопитающим, включая людей любым путем: пероральным или парентеральным введением (например, внутривенным, внутримышечным, подкожным, ректальным, чрескожным, интрацеребральным, интраспинальным или другим местным введением).
[0130] Лекарственные формы для перорального и парентерального введение и способы их получения хорошо известны специалистам в данной области, и можно получать фармацевтическую композицию объединением антитела по изобретению с фармацевтически приемлемым носителем или т.д.
Лекарственные формы для парентерального введения включают инъецируемые препараты (например, капельные инъекции, внутривенные инъекции, внутримышечные инъекции, подкожные инъекции, интрадермальные инъекции, препараты для интрацеребрального введения и препараты для интраспинального введения), препараты для наружного применения (например, мази, компрессы и лосьоны), суппозиторий, лекарственные формы для ингаляции, глазные капли, офтальмологические мази, капли в нос, ушные капли и липосомы. В частности, когда антитело по настоящему изобретению должно непосредственно действовать на ткань центральной нервной системы, его можно непрерывно вливать с использованием медицинского микронасоса, который представляет собой осмотический насос, или смешивать с фибриновым клеем или т.п. с получением препарата с длительным высвобождением, а затем помещать на пораженную ткань.
[0131] Например, инъецируемые препараты, как правило, получают растворением антитела в дистиллированной воде для инъекций и при необходимости можно добавлять солюбилизатор, буфер, средство регуляции pH, обеспечивающее изотоничность средство, смягчающее средство, консервант и стабилизатор. Инъецируемые препараты также могут представлять собой лиофилизированные препараты, получаемые перед использованием.
[0132] Лекарственные формы для перорального введения включают твердые или жидкие лекарственные формы, в частности, таблетки, таблетки с покрытием, пилюли, мелкозернистые гранулы, гранулы, порошки, капсулы, сиропы, эмульсии, суспензии, инъекции и пастилки.
[0133] Фармацевтическая композиция по настоящему изобретению может дополнительно содержать другие терапевтически эффективные лекарственные средства, и при необходимости можно смешивать компоненты, такие как бактерицидные средства, противовоспалительные средства, витамины и аминокислоты.
[0134] Фармакологически приемлемые носители включают, например, эксципиенты, смазочные средства, связывающие средства и дезинтегранты для твердых препаратов и растворители, солюбилизаторы, суспендирующие средства, обеспечивающие изотоничность средства, буферы и смягчающие средства для жидких препаратов. При необходимости можно соответствующим образом использовать добавки, такие как общепринятые антисептики, антиоксиданты, красители, подсластители, адсорбенты и средства для смачивания в соответствующих количествах.
[0135] Дозу антитела по настоящему изобретению можно определять на основании различных факторов, таких как путь введения, тип заболевания, степень проявления симптомов, возраст, пол, масса тела, тяжесть заболевания пациентов, на основании фармакологических результатов, таких как фармакокинетические и токсикологические характеристики, используют или не используют систему доставки лекарственного средства, и вводят или не вводят его в качестве части комбинации с другими лекарственными средствами. Как правило, можно вводить от 1 до 5000 мкг/сутки, предпочтительно от 10 до 2000 мкг/сутки, более предпочтительно от 50 до 2000 мкг/сутки для перорального введения или от 1 до 5000 мкг/сутки, предпочтительно от 5 до 2000 мкг/сутки, более предпочтительно от 50 до 2000 мкг/сутки для инъекции взрослому (с массой тела 60 кг) в одной или более дозах. Для парентерального введения для полного организма можно вводить от 10 до 100000 мкг/кг, более предпочтительно от 100 до 50000 мкг/кг и даже более предпочтительно от 500 до 20000 мкг/кг массы тела с интервалом один раз в сутки, один раз в неделю, один раз в месяц или от 1 до 7 раз в год. Для местного введения с использованием осмотического насоса или т.п. в основном возможной является непрерывная инфузия со скоростью от 10 до 100000 мкг/сутки, более предпочтительно от 100 до 10000 мкг/сутки, еще более предпочтительно от 500 до 5000 мкг/сутки для взрослого (с массой тела 60 кг).
ПРИМЕРЫ
[0136] Ниже настоящее изобретение более подробно описано со ссылкой на примеры, но настоящее изобретение не является ограниченным аспектами следующих ниже примеров.
[0137] Пример 1: Получение белка RGMa человека (C-концевой домен)
Получали клетку CHO, экспрессирующую рекомбинантный белок RGMa человека, в котором гистидиновую метку сливали с C-концом Pro 169-Gly 422 (который относится к остатку пролина в положении 169 - остатку глицина в положении 422 со стороны N-конца, далее в настоящем описании описываемым аналогичным образом) белка RGMa человека (SEQ ID NO: 1 в списке последовательностей).
C-концевой домен белка RGMa человека, содержащийся в культуральном супернатанте клеток CHO, адсорбировали на колонке для никель-хелатной хроматографии (GE Healthcare, 17-5247-01) и элюировали 100 мМ раствором имидазола. Диализом заменяли фракцию элюирования имидазолом фосфатно-солевым буфером (PBS) и использовали в качестве иммуногена.
[0138] Пример 2: Получение моноклонального антитела мыши к RGMa человека
Десять микрограмм рекомбинантого белка RGMa человека, получаемого в примере 1, смешивали с полным адъювантом Фрейнда (Sigma) с получением эмульсии и иммунизировали мышь BALB/c (Charles River Japan) на нескольких подкожных участках на спине. Затем аналогично проводили иммунизацию с интервалами от 1 до 2 недель 10 мкг рекомбинантого белка RGMa человека, получаемого в эмульсии с неполным адъювантом Фрейнда (Sigma), и собирали кровь после нескольких иммунизаций. Титр антител измеряли ELISA, описанным ниже, в котором иммобилизовали белки RGMa человек или мыши. Индивидуумам, у которых демонстрировали повышенный титр антител, внутривенно вводили 10 мкг белка RGMa человека для повторной иммунизации и выделяли спленоциты через 2 или 3 суток.
Для слияния клеток клетки селезенки и миеломные клетки мыши (SP2/0, Dainippon Sumitomo Pharma), где число клеток селезенки являлось в два раза меньше, смешивали и центрифугировали, и добавляли к получаемой осажденной фракции полиэтиленгликоль (Roche Diagnostics) с получением слияний клеток. Затем клетки центрифугировали и промывали дважды D-MEM (Invitrogen). Клетки ресуспендировали в среде GIT (Nippon Pharmaceutical), содержащей 10% эмбриональной телячьей сыворотки (Invitrogen), 1% BM-Condimed (Roche Diagnostics) и HAT (Sigma-Aldrich), и высевали в каждую лунку 96-луночного планшета при 5×104 миеломных клеток/лунку. Культуральный супернатант выделяли и подвергали скринингу на продуцирующие антитело клетки посредством ELISA с иммобилизованным белком RGMa человека по примеру 3.
Продуцирующие антитело клетки, получаемые в результате скрининга, клонировали способом лимитирующего разведения и выбирали гибридомные клетки, продуцирующие два вида моноклональных антител (B5.116A3 и B5.70E4).
Изотипы обоих моноклональных антител, определяемых с использованием набора для изотипирования (Mouse MonoAB ID/SP KIT, ZYMED 93-6550) представляли собой IgG2b мыши для тяжелой цепи и каппа для легкой цепи.
Культуральные супернатанты гибридом подвергали аффинной хроматографии с использованием агарозы, на которой иммобилизовали антитела к IgG мыши (Anti-Mouse IgG-Agarose, производимый Sigma) для очистки моноклональных антител. После того, как антитело связывали с колонкой, колонку промывали PBS. Затем антитело элюировали 10 мМ гидрохлорида глицина (pH 2,7) и сразу же нейтрализовали элюат. Затем нейтрализованный элуют заменяли PBS посредством ультрафильтра.
[0139] Пример 3: ELISA, на котором иммобилизуют белки RGMa человека или мыши
Белок RGMa человека (R&D systems, 2459-RM) или белок RGMa мыши (R&D systems, 2458-RG), получаемый в концентрации 2 мкг/мл с PBS, дозировали в 96-луночный планшет по 50 мкл/лунку, и оставляли планшет отстаиваться при комнатной температуре в течение 1 часа. После удаления раствора дозировали ApplieBlock (Seikagaku Bio-Business, 200150), разбавленный в 5 раз PBS, по 200 мкл/лунку и оставляли планшет отстаиваться при комнатной температуре в течение 1 часа для блокирования неспецифического связывания. После трех промываний PBST (PBS, содержащим 0,05% Tween 20) в каждую лунку добавляли серийно разведенные PBS образцы (например, сыворотку мышь, культуральный супернатант гибридомв, супернатант культур, экспрессирующих рекомбинантное антитело, описываемый ниже, или очищенное антитело) по 50 мкл/лунку и оставляли планшет отстаиваться при комнатной температуре в течение 1 часа. Затем планшет промывали три раза PBST, а затем в каждую лунку дозировали разбавленное PBS, меченное пероксидазой антитело овцы к IgG мыши (GE Healthcare, NA9310V) по 50 мкл/лунку и оставляли планшет отстаиваться при комнатной температуре в течение 1 часа. После трех промываний добавляли набор Peroxidase-coloring (Sumitomo Bakelite, ML-1130O) и оставляли для проявления окраски в течение определенного периода времени, и измеряли оптическую плотность при 492 нм с использованием планшетного спектрофотометра.
[0140] Пример 4: Эпитопный анализ антитела
Эпитопы, с которыми связываются антитела, определяли способом пептидного сканирования. Всего 83 видов пептидов синтезировали посредством слияния аминокислотных последовательностей со стороны N-конца, состоящих из 11 последовательных остатков, сдвинутых на 3 остатка, содержащихся в Arg 172-Ala 424 белка RGMa человека (SEQ ID NO: 1 в списке последовательностей), со спейсерной последовательностью (SGSG) с биотинилированным N-концом (SEQ ID NO: 46 в списке последовательностей). После иммобилизации пептидов на планшетах покрытых авидином тестируемые антитела (B5.116A3 и B5.70E4) оставляли для взаимодействия. Затем, меченное пероксидазой антитело кролика против Ig мыши (Dako, P026002) оставляли для взаимодействия. После того, как добавляли раствор субстрата, и развивалась окраска в течение определенного времени, измеряли оптическую плотность с использованием планшетного спектрофотометра.
В результате, B5.116A3 связывалось с пептидами, получаемыми из RGMa человека Glu 298-Gly 311 (два типа пептидов: Glu 298-Asp 308 и Val 301-Gly 311), Asn 322-Glu 335 (два типа пептидов: Asn 322-Thr 332 и Ile 325-Glu 335) и Lys 367-Ala 377; и B5.70E4 связывалось с пептидами, получаемыми из RGMa человека, Glu 298-Gly 311 (два типа пептидов: Glu 298-Asp 308 и Val 301-Gly 311), Asn 322-Glu 335 (два типа пептидов: Asn 322-Thr 332 и Ile 325-Glu 335) и Pro 349-Thr 359.
[0141] Пример 5: Анализ и клонирование последовательности гена антитела мыши
Тотальную РНК экстрагировали из гибридомных клеток, продуцирующих моноклональное антитело мыши (B5.116A3 или B5.70E4). С использованием тотальной РНК в качестве матрицы синтезировали кДНК реакцией обратной транскрипции. С использованием кДНК в качестве матрицы гены вариабельных и константных областей легкой цепи и вариабельных и константных областей тяжелой цепи амплифицировали ПЦР и определяли последовательности ДНК. Затем, на основании определяемых последовательностей вариабельных и константных областей амплифицировали ПЦР и клонировали гены полноразмерного антитела. Аминокислотные последовательности, кодируемые такими генами антитела, являются таким, как указано ниже.
[0142] (1) B5.116A3 аминокислотная последовательность легкой цепи (SEQ ID NO: 4 в списке последовательностей)
DIQMTQTTSSLSASLGDRVTISCRASQDISSYLNWYQQKPDGTVKLLIYYTSRLHSGVPSRFSGSGSGTDYSLTISNLEQEDIATYFCQQLNTLPWTFGGGTKLEIKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC
[0143] (2) B5.116A3 аминокислотная последовательность тяжелой цепи (SEQ ID NO: 5 в списке последовательностей)
EVKLEESGGGLVQPGGSMKLSCAASGFTFSDAWMDWVRQSPEKGLEWVAEIRSKANNHATYYAESVKGRFTISRDDSKRSVYLQMNNLRAEDTGIYYCTRRDGAYWGQGTLVTVSAAKTTPPSVYPLAPGCGDTTGSSVTLGCLVKGYFPESVTVTWNSGSLSSSVHTFPALLQSGLYTMSSSVTVPSSTWPSQTVTCSVAHPASSTTVDKKLEPSGPISTINPCPPCKECHKCPAPNLEGGPSVFIFPPNIKDVLMISLTPKVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDYNSTIRVVSTLPIQHQDWMSGKEFKCKVNNKDLPSPIERTISKIKGLVRAPQVYILPPPAEQLSRKDVSLTCLVVGFNPGDISVEWTSNGHTEENYKDTAPVLDSDGSYFIYSKLNMKTSKWEKTDSFSCNVRHEGLKNYYLKKTISRSPGK
[0144] (3) B5.70E4 аминокислотная последовательность легкой цепи (SEQ ID NO: 6 в списке последовательностей)
DVVMTQTPLSLPVSLGDQASISCRSSQSLVHSNGNTYLHWYLQRPGQSPKLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDLGLYFCSQSTHVPYTFGGGTKLEIKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC
[0145] (4) B5.70E4 аминокислотная последовательность тяжелой цепи (SEQ ID NO: 7 в списке последовательностей)
DVKLQESGPGLVKPSQSLSLTCSVTGYSITTSYYWNWIRQFPGNKLEWMGYISYDGTNNYNPSLKNRISITRDTSKNQFFLRLNSVTTEDTATYYCAGSFGYSQGTLVTVSAAKTTPPSVYPLAPGCGDTTGSSVTLGCLVKGYFPESVTVTWNSGSLSSSVHTFPALLQSGLYTMSSSVTVPSSTWPSQTVTCSVAHPASSTTVDKKLEPSGPISTINPCPPCKECHKCPAPNLEGGPSVFIFPPNIKDVLMISLTPKVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDYNSTIRVVSTLPIQHQDWMSGKEFKCKVNNKDLPSPIERTISKIKGLVRAPQVYILPPPAEQLSRKDVSLTCLVVGFNPGDISVEWTSNGHTEENYKDTAPVLDSDGSYFIYSKLNMKTSKWEKTDSFSCNVRHEGLKNYYLKKTISRSPGK
[0146] Пример 6: Получение рекомбинантного антитела мыши и химерного рекомбинантного антитела крысы и мыши
Получали рекомбинантные антитела мыши двух типов антител к RGMa B5.116A3 и B5.70E4, получаемые из гибридов (далее в настоящем описании обозначаемые как "r116A3" и "r70E4", соответственно).
Кроме того, в качестве сравнительного примера получали рекомбинантное химерное антитело крысы и мыши (далее в настоящем описании обозначаемое как "r5F9") слиянием вариабельных областей антитела крысы 5F9 с константными областями антитела мыши (IgG2bκ) (константная область легкой цепи представляет собой Arg 108-Cys 214 SEQ ID NO: 4 в списке последовательностей, и константная область тяжелой цепи представляет собой Ala 117-Lys 452 SEQ ID NO: 5 списка последовательностей) в соответствии с патентным документом 1 (WO 2009/106356).
ДНК, кодирующую легкие и тяжелые цепи каждого антитела, вводили в pcDNA 3.3 (Life Technologies) с получением экспрессирующего вектора. Экспрессирующие вектор вводили в клетки HEK293F (Life Technologies) с использвоанием Neofection 293 (ASTEC). Клетки культивировали при 37°C в 8% атмосфере газа диоксида углерода в течение 6 суток, а затем выделяли культуральный супернатант. Для очистки рекомбинантного антитела культуральный супернатант вносили в аффинную колонку, на которой иммобилизировали белок A или белок G (GE Healthcare), и элюировали антитела, связанные с колонкой 10 мМ гидрохлоридом глицина (pH2,8). Элюат сразу же нейтрализовали, а затем заменяли PBS.
В случае, когда необходимыми являются повышенные требования к чистоте в зависимости от цели использования, антитела, очищенные с использованием колонки с белком A, очищали с использованием колонки с керамическим гидроксиапатитом 1 типа (CHT) (BIORAD). Антитела, связанные с колонкой CHT, промывали 10 мМ KH2PO4 (pH6,5), а затем элюировали 20 мМ KH2PO4 (pH6,5), 0,5 M NaCl. Элюированные фракции собирали, а затем заменяли PBS.
[0147] Пример 7: Анализ связывания на клетках, экспрессирующих белок RGMa
Вектор, экспрессирующий полноразмерный белок RGMa человека (Met 1-Cys 450 SEQ ID NO: 1 в списке последовательностей), C-концевой домен белка RGMa человека (Pro 169-Cys 450 SEQ ID NO: 1 в списке последовательностей), полноразмерный белок RGMa мыши (Met 1-Trp 454 SEQ ID NO: 2 в списке последовательностей) или C-концевой домен белка RGMa крысы (Pro 170-Trp 449 SEQ ID NO: 3 в списке последовательностей), вводили в клетки CHO или HEK 293 с получением экспрессирующих антиген клеток.
В белках RGMa C-концевой пептид подвергается процессингу во время реакции присоединения GPI-якоря. Белки RGMa мыши и крысы расщепляются по Ala 427, и C-концевой пептид удаляется. Таким образом, аминокислотные последовательности полноразмерного белка и C-концевого домена, экспрессируемого клеткой через GPI-якорь, являются одинаковыми у мыши и крысы.
Тестируемые антитела (r116A3 и r70E4) и r5F9 (сравнительный пример) в конечной концентрации 10 мкг/мл подвергали взаимодействию с описанными выше экспрессирующими антиген клетками, а затем промывали клетки PBS, содержащим 0,1% бычьего сывороточного альбумина и 0,05% NaN3. Меченное FITC антитело к иммуноглобулину мыши (DAKO) оставляли для взаимодействия и промывали клетки. Флуоресценцию измеряли проточной цитометрией (FACSCalibur, выпускаемым Beckton Dickinson), и оценивали свойства связывания тестируемых антител с использованием экспрессирующих антиген клеток (таблица 1).
В результате было выявлено, что r116A3 и r70E4 связываются с C-концевым доменом белков RGMa человека и крысы, в отличие от r5F9. Белок RGMa обладает ингибирующем прорастание нейритов действием даже только в одном C-концевом домен, и r116A3 и r70E4 ингибирует полноразмерный белок RGMa и C-концевой домен.
[0148] Таблица 1: Оценка связывания различных рекомбинантных антител к RGMa с экспрессирующими антиген клетками*
*; ++ сильное связывание
+ слабое связывание
- связывание отсутствует
[0149] Пример 8: Определение константы диссоциации для белка RGMa
Аффинность тестируемых антител (r116A3 и r70E4) и r5F9 (сравнительный пример) к белку RGMa измеряли способом поверхностного плазмонного резонанса (SPR) с использованием Proteon XPR36 (Bio-Rad).
Белок RGMa человека (R&D Systems, 2459-RM), C-концев домен белка RGMa человека (получаемый в примере 1) или белок RGMa мыши (R&D Systems, 2458-RG), разбавленный до 10 мкг/мл 10 мМ ацетатным буфером (pH4,5) иммобилизовали на сенсорном чипе GLC способом связывания амина. Серийно разведенные тестируемые антитела вносили в качестве аналитов при скорости потока 100 мкл/мин в течение 60 секунд для определения константы диссоциации (значения Kd).
Как продемонстрировано в таблице 2, r116A3 и r70E4 также связывались с C-концевым доменом белка RGMa человека, но r5F9 не связывался. R116A3 связывалось с белком RGMa человека в 32 раза сильнее, чем r5F9, и с белком RGMa мыши в 44 раза сильнее, чем r5F9.
[0150] Таблица 2: Аффинность моноклонального антитела к RGMa
[0151] Пример 9: Анализ ингибирования связывания RGMa-неогенина
Выделяли внеклеточный домен (Ala 34-Leu 1105) рекомбинантого белка неогенина человека (SEQ ID NO: 10 в списке последовательностей). Устанавливали линию клеток CHO, экспрессирующих внеклеточный домен белка неогенина человека. Гистидиновую метку сливали с C-концом. Из культурального супернатанта клеток CHO адсорбировали внеклеточный домен на колонке для никель-хелатной хроматографии (GE Healthcare, 17-5247-01), а затем элюировали 100 мМ раствора имидазола. Диализом заменяли PBS фракции элюирования имидазолом.
Белок RGMa человека (R&D systems, 2459-RM) метили биотином с использованием набора ChromaLink Biotin Labeling (Solulink). Эквивалентные количества меченного биотином белка RGMa человека, доведенного до 2 мкг/мл, и тестируемых антител (r116A3 и r70E4), подвергаемых 2-кратному серийному разведению, смешивали и оставляли для взаимодействия при комнатной температуре в течение 2 часов с получением смешанного раствора.
Одновременно в 96-луночный планшет добавляли по 50 мкл/лунку внеклеточного домена белка неогенина человека, доведенного до 2 мкг/мл PBS, и оставляли планшет отстаиваться при комнатной температуре в течение 1 часа с получением планшета с иммобилизованным неогенином. После удаления раствора добавляли 2,5% раствор бычьего сывороточного альбумина и оставляли планшет осттавиваться в течение 1 часа для блокирования неспецифического связывания. В планшет с иммобилизованным неогенином добавляли описанный выше смешанный раствор по 50 мкл/лунку и оставляли планшет отстаиваться при комнатной температуре в течение 1 часа. Затем проводили промывание и добавляли меченный пероксидазой авидин (VECTASTAIN ABC system, выпускаемый Vector Laboratories), и оставляли планшет отстаиваться при комнатной температуре в течение 1 часа. Затем проводили промывание, добавляли раствор субстрата, проводили проявление окраски в течение определенного периода времени, и измеряли оптическую плотность с использованием планшетного спектрофотометра. отношение оптической плотности при отсутствии антитела наносили на график как 1, и оценивали зависящее от концентрации ингибирование связывания RGMa-неогенина антителом (фиг. 1).
В результате в отличие от поликлонального антитела к RGMa человека (R&D Systems, AF2459) и r5F9, r116A3 и r70E4 не ингибировали связывание RGMa-неогенина.
[0152] Пример 10: Анализ ингибирования связывания RGMa-BMP2
В каждую лунку 96-луночного планшета добавляли белок RGMa человека (R&D systems, 2459-RM), доведенный до 2 мкг/мл PBS, при 50 мкл/лунку и оставляли планшет отстаиваться при комнатной температуре в течение 1 часа. Добавляли 2,5% раствор бычьего сывороточного альбумина и оставляли смесь отстаиваться в течение 1 часа для блокирования неспецифического связывания, таким образом, получая планшет с иммобилизованным белком RGMa. В планшет с иммобилизованным белком RGMa добавляли тестируемые антитела (B5.116A3 и B5.70E4), серийно разведенные от 0,01 до 10 мкг/мл, и оставляли планшет отстаиваться при комнатной температуре в течение 1 часа. Затем проводили промывание и добавляли белок BMP2 человека (R&D systems, 355-BM), разбавленный до 0,5 мкг/мл, и оставляли планшет отстаиваться при комнатной температуре в течение 1 часа.
Меченное биотином антитело к BMP2 оставляли для взаимодействия и дополнительно добавляли меченный пероксидазой авидин (VECTASTAIN ABC system, выпускаемый Vector Laboratories), и добавляли раствор субстрата, проводили проявление окраски в течение определенного периода времени, и измеряли оптическую плотность с использованием планшетного спектрофотометра (фиг. 2).
В результате, в частности, антитело к RGMa (B5.116A3) слабо ингибировало связывание RGMa-BMP2 зависящим от концентрации образом (оптическая плотность: 0,45 при 0,01 мкг/мл, 0,4 при 0,1 мкг/мл, 0,32 при 1 мкг/мл и 0,1 при 10 мкг/мл).
[0153] Пример 11: Конструирование гуманизированного антитела
Гуманизацию моноклонального антитела мыши B5.116A3 проводили способом пересадки определяющей комплементарность области (CDR) по Winter et al., описанным в патенте №2912618.
Сначала получали 3D-модели гомологии модели вариабельных областей легкой и тяжелой цепи моноклонального антитела мыши B5.116A3 и идентифицировали аминокислотные остатки в каркасной (FW) области, располагаемой около CDR. Выбирали FW антител человека, в которых эти аминокислоты сохраняются как можно в большей степени, пересаживали в них CDR антитела мыши и, таким образом, конструировали гуманизированное антитело. В сконструированной гуманизированной последовательности антитела тяжелую цепь описывают как HA (SEQ ID NO: 11 в списке последовательностей) и легкую цепь описывают как KA (SEQ ID NO: 19 в списке последовательностей). Кроме того, конструировали совокупность гуманизированных последовательностей антител введением дополнительных мутаций в аминокислоты в FW, вовлеченные в стабильность структуры вариабельной области (всего 8 тяжелых цепей в диапазоне от HB до HH, включая HA, и всего 7 легких цепей в диапазоне от KB до KG, включая KA).
[0154] Таблица 3: Сконструированные гуманизированные последовательности антител
[0155] Пример 12: Получение рекомбинантного химерного антитела мыши и человека и рекомбинантного гуманизированного антитела
(1) Рекомбинантное химерное антитело к RGMa мыши и человека 116A3 (r116A3C), содержащее следующие ниже аминокислотные последовательности, получали в соответствии с примером 6.
[0156] Легкая цепь (SEQ ID NO: 8 в списке последовательностей)
DIQMTQTTSSLSASLGDRVTISCRASQDISSYLNWYQQKPDGTVKLLIYYTSRLHSGVPSRFSGSGSGTDYSLTISNLEQEDIATYFCQQLNTLPWTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
[0157] Тяжелая цепь (SEQ ID NO: 9 в списке последовательностей)
EVKLEESGGGLVQPGGSMKLSCAASGFTFSDAWMDWVRQSPEKGLEWVAEIRSKANNHATYYAESVKGRFTISRDDSKRSVYLQMNNLRAEDTGIYYCTRRDGAYWGQGTLVTVSAASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
[0158] (2) Всего получали 20 гуманизированных антитела к RGMa, содержащих следующие ниже комбинации тяжелых и легких цепей, в соответствии с примером 6.
[0159] Комбинации тяжелая цепь/легкая цепь;
HA/KA, HA/KB, HA/KC, HA/KG, HB/KC, HC/KA, HC/KB, HD/KA, HD/KB, HD/KC, HD/KD, HE/KA, HF/KA, HF/KF, HF/KG, HG/KD, HG/KH, HH/KA, HH/KD, HH/KF
[0160] (3) Рекомбинантное гуманизированное антитело к RGMa (далее в настоящем описании обозначаемое как rH5F9) получали в соответствии с примером 6 (сравнительный пример).
Вариабельную область гуманизированного моноклонального антитела к RGMa h5F9, описанную в патентном документе 1 (WO2009/106356) (легкая цепь представляет собой seq ID_53 из патентного документа 1, и тяжелая цепь представляет собой seq ID_50 из патентного документа 1), лигировали с константной областью антитела человека (легка цепь представляет собой Arg 108-Cys 214 SEQ ID NO: 26 в списке последовательностей, и тяжелая цепь представляет собой Ala 117-Lys 446 SEQ ID NO: 27 в списке последовательностей).
[0161] Пример 13: Тест на термостабильность антитела
Собирали аликвоты по двадцать мкл культурального супернатанта, в котором экспрессировали рекомбинантное антитело, описанное в пример 12, и обрабатывали теплом в течение 10 минут при 8 значениях температуры 40, 45, 50, 55, 60, 65, 70 и 75°C, соответственно, с использованием термоциклера (Takara bio, TP 600). Культуральный супернатант разбавляли PBS, таким образом, чтобы конечная концентрация антитела составляла 125 нг/мл. Затем культуральный супернатант подвергали ELISA, в котором белки RGMa человека являлись иммобилизованными, описанным в пример 3, для оценки антигенсвязывающих свойств антитела (фиг. 3).
В результате гуманизированное антитело, содержащее комбинацию HE тяжелой цепи и KA легкой цепи (далее в настоящем описании обозначаемое как "rH116A3"), и химерное антитело мыши и человека (r116A3C) обладали лучшей термостабильностью по сравнению с гуманизированным антителом (rH5F9). Далее в настоящем описании гуманизированное антитело, содержащее такую комбинацию HE/KA, описывают как rH116A3.
Когда тепловую обработку не проводили химерное антитело мыши и человека (r116A3C) и гуманизированное антитело (rH116A3) обладали эквивалентными антигенсвязывающими свойствами, и не наблюдали ослабление антигенсвязывающего свойства, связанное с гуманизацией.
[0162] Пример 14: Установление стабильной линии клеток CHO, продуцирующей гуманизированное антитело к RGMa (rH116A3)
Стабильную линую клеток CHO, продуцирующих гуманизированное антитело к RGMa (rH116A3), устанавливали с использованием системы Lonza GS Xceed (Lonza). Вектор pXC с двумя генами, содержащий кодирующую легкую цепь последовательность (SEQ ID NO: 44 в списке последовательностей) и кодирующую тяжелую цепь последовательность (SEQ ID NO: 43 в списке последовательностей) гуманизированного антитела к RGMa (rH116A3), вводили в родительскую линию клеток CHOK1SV с нокаутом GS и получали совокупность трансформированных клеток при отборе на сульфоксиимине метионина (MSX). После разделения на одиночные клетки проточной цитометрией оценивали количество продуцируемого антитела в культуральном супернатанте, клеточную пролиферацию и т.п., и получали стабильную линию клеток CHO.
[0163] Пример 15: Анализ прорастания нейритов
У крысы неонатального периода развития (P7) вырезали мозжечок, суспендировали в растворе трипсина (0,25% раствор трипсина в PBS, содержащий 0,2% ДНКазы) и расщепляли при 37°C в течение 10-15 минут. Затем добавляли среду DMEM, содержащую 10% эмбриональную телячью сыворотку и центрифугировали смесь. Клетки ресуспендировали в той же среде и центрифугировали, и дважды повторяли аналогичную процедуру для промывания клеток. Дополнительно эту клеточную суспензию фильтровали через 70 мкм фильтр для клеток и центрифугировали, и ресуспендировали осажденную фракцию в той же среде. К клеточной суспензии добавляли добавку B27 (GIBCO) для получения гранулоцитов мозжечка крысы неонатального периода развития.
Затем высевали гранулоциты мозжечка крысы неонатального периода развития на планшет для культур клеток и культивировали при 37°C в течение 1 суток.
Добавляли рекомбинантный белок RGMa (R&D systems, 2459-RM) в конечной концентрации 2 мкг/мл и культивировали клетки при 37°C в течение 2 суток. Длину нейритов измеряли посредством микроскопии. Как приведено на фиг. 4, добавление RGMa приводило к изменениям длины нейритов от 37 мкм до 26 мкм в эксперименте на левой фигуре и от 38 мкм до 27 мкм на правой фигуре, таким образом, ингибировало прорастание нейритов. Хотя добавление только тестируемого антитела (B5.116A3 или B5.70E4) в конечной концентрации 10 мкг/мл не изменяло длины нейритов, одновременное добавление рекомбинантного белка RGMa и тестируемого антитела индуцировало прорастание нейритов в той же степени что и контроль (без добавления RGMa), что указывает на нейтрализующий эффект антитела к белку RGMa.
[0164] Пример 16: Тестирование эффективности с использованием модели повреждения спинного мозга на крысах
Крысу линии Wistar (самка, в возрасте 8 недель, массой приблизительно 200 г), анестезированную путем вдыхания галотана (Takeda Pharmaceutical), подвергали ламинэктомии переднего и заднего позвонков вокруг уровня T9 позвоночника (T8-T10) и открывали спинной мозг. В случае оценки с использованием модели размозжения спинного мозга, применяли давление 200 кдин на открытый спинной мозг с использованием импактора IH (Precision System).
Непосредственно после повреждения спинного мозга, как описано выше, под кожу на спине крысы помещали осмотический мининасос, наполненный 400 мкг/мл тестируемого антитела (r116A3 или r70E4) или контрольного антитела мыши (mo-IgG2bκ) (объем 200 мкл, 0,5 мкл/час, доставка в течение 14 суток) (Alzet, модель 2002). Кончик силиконовой трубки, соединенный с выходным отверстием осмотического мининасоса помещали в твердую мозговую оболочку на участке повреждения спинного мозга. Трубку пришивали и фиксировали к остистому отростку с правой стороны нижней конечности участка ламинэктомирования, на слои мышц и кожи накладывали швы и поднимали крысу.
Двигательную функцию на модели повреждения спинного мозга на крысах оценивали с использованием шкалы Basso-Beattie-Bresnahan (BBB) (Basso D.M., Beattie M.S., & Bresnahan J.C., A sensitive and reliable locomotor rating scale for open field testing in rats. J Neurotrauma 12, 1-21 (1995)) через 0, 1, 3 и 7 суток после травмы, и каждую неделю в дельнейшем на протяжении 8 недель. В результате, как продемонстрировано на фиг. 5(A), r116A3 или r70E4 значительно улучшало балл BBB через 4 или 3 недели после введения, соответственно, по сравнению с контрольным антителом (mo-IgG2bκ) (p<0,05, t-критерий Стьюдента).
В случае оценки с использованием модели гемисекции спинного мозга, дорсальную сторону открытого спинного мозга надрезали на глубину 1,8 мм-2,0 мм. Аналогичным образом, как указано выше тестируемое антитело (B5.116A3) или контрольное антитело мыши (mo-IgG2bκ) вводили с использованием осмотического мининасоса и оценивали с использованием шкалы BBB через 0, 1, 3 и 7 суток после повреждения и каждую неделю в дальнейшем в течение периода до 10 недель. Как продемонстрировано на фиг. 5(B), B5.116A3 значительно улучшал балл BBB через 4 недели после введения по сравнению с контрольным антителом (mo-IgG2bκ) (p<0,01, t-критерий Стьюдента).
[0165] Пример 17: Тестирование эффективности с использованием модели рассеянного склероза на мышах
Пептид PLP139-151 (HSLGKWLGHPDKF: SEQ ID NO: 45 в списке последовательностей, Peptide Institute) растворяли в физиологическом растворе (Otsuka Pharmaceutical Factory) и смешивали с неполным адъювантом Фрейнда (Sigma), в который добавляли погибшую туберкулезную бациллу H37Ra (Difco Laboratories), с получением эмульсии. Мышь SJL/JorllcoCrj (SJL/J) (Charles River Japan) иммунизировали подкожно в спину пептидом PLP139-151 при 50 мкг/голову и оценивали по шкале EAE и изменение массы тела (H. Kataoka, K. Sugahara, K. Shimano, K. Teshima, M. Koyama, A. Fukunari и K. Chiba. FTY720, sphingosine 1-phosphate receptor modulator, ameliorates experimental autoimmune encephalomyelitis by inhibition of T cell infiltration. Cellular & Molecular Immunology 6, 439-448, 2005.) (Фиг. 6).
Тестируемое антитело (B5.116A3), разведенное в физиологическом растворе, вводили интраперитонеально 20 мг/кг на 7 и 10 суток или через 18 и 21 сутки после иммунизации пептидом PLP139-151.
В результате, как продемонстрировано на фиг. 6, по сравнению с контрольным антителом (mo-IgG2bκ) моноклональное антитело мыши к RGMa (B5.116A3) ингибировало ухудшение баллов EAE в результате введения до начала (верхняя часть фиг. 6) и проявляло профилактическое действие в отношении рецидива в результате введения после начала (нижняя часть фиг. 6).
[0166] Пример 18: Тестирование иммуногенности антитела
Недифференцированные дендритные клетки, содержащиеся в периферической крови, получаемой от 51 здорового донора, подвергали созреванию путем стимуляций гранулоцитарно-моноцитарного колониестимулирующего фактора (GM-CSF) и интерлейкина 4. Тестируемое антитело (rH116A3) в конечной концентрации 50 мкг/мл добавляли к зрелым дендритным клеткам и культивировали клетки в течение 4, 5 суток, обеспечивая захват антитела дендритными клетками. CD4+ T-клетки периферической крови (хелперные T-клетки), получаемые от одного и того же донора смешивали с дендритными клетками и кокультивировали еще одну неделю, а затем измеряли пролиферацию T-клеток проточной цитометрией. С использованием активности пролиферации T-клеток тестируемого антитела в качестве показателя оценивали риск иммуногенности у человека. В результате наблюдали пролиферацию T-клеток у 4 (7,8%) из 51 донора, и, таким образом, риск иммуногенности является низким.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Mitsubishi Tanabe Pharma Corporation
Osaka University
National University Corporation Chiba University
<120> СВЯЗЫВАЮЩИЙ RGMa БЕЛОК И ЕГО ИСПОЛЬЗОВАНИЕ
<130> A16005-16140
<140> PCT/JP2016/063166
<141> 2016-04-27
<150> JP2015-091095
<151> 2015-04-28
<160> 46
<170> PatentIn version 3.5
<210> 1
<211> 450
<212> Белок
<213> Homo sapiens
<400> 1
Met Gln Pro Pro Arg Glu Arg Leu Val Val Thr Gly Arg Ala Gly Trp
1 5 10 15
Met Gly Met Gly Arg Gly Ala Gly Arg Ser Ala Leu Gly Phe Trp Pro
20 25 30
Thr Leu Ala Phe Leu Leu Cys Ser Phe Pro Ala Ala Thr Ser Pro Cys
35 40 45
Lys Ile Leu Lys Cys Asn Ser Glu Phe Trp Ser Ala Thr Ser Gly Ser
50 55 60
His Ala Pro Ala Ser Asp Asp Thr Pro Glu Phe Cys Ala Ala Leu Arg
65 70 75 80
Ser Tyr Ala Leu Cys Thr Arg Arg Thr Ala Arg Thr Cys Arg Gly Asp
85 90 95
Leu Ala Tyr His Ser Ala Val His Gly Ile Glu Asp Leu Met Ser Gln
100 105 110
His Asn Cys Ser Lys Asp Gly Pro Thr Ser Gln Pro Arg Leu Arg Thr
115 120 125
Leu Pro Pro Ala Gly Asp Ser Gln Glu Arg Ser Asp Ser Pro Glu Ile
130 135 140
Cys His Tyr Glu Lys Ser Phe His Lys His Ser Ala Thr Pro Asn Tyr
145 150 155 160
Thr His Cys Gly Leu Phe Gly Asp Pro His Leu Arg Thr Phe Thr Asp
165 170 175
Arg Phe Gln Thr Cys Lys Val Gln Gly Ala Trp Pro Leu Ile Asp Asn
180 185 190
Asn Tyr Leu Asn Val Gln Val Thr Asn Thr Pro Val Leu Pro Gly Ser
195 200 205
Ala Ala Thr Ala Thr Ser Lys Leu Thr Ile Ile Phe Lys Asn Phe Gln
210 215 220
Glu Cys Val Asp Gln Lys Val Tyr Gln Ala Glu Met Asp Glu Leu Pro
225 230 235 240
Ala Ala Phe Val Asp Gly Ser Lys Asn Gly Gly Asp Lys His Gly Ala
245 250 255
Asn Ser Leu Lys Ile Thr Glu Lys Val Ser Gly Gln His Val Glu Ile
260 265 270
Gln Ala Lys Tyr Ile Gly Thr Thr Ile Val Val Arg Gln Val Gly Arg
275 280 285
Tyr Leu Thr Phe Ala Val Arg Met Pro Glu Glu Val Val Asn Ala Val
290 295 300
Glu Asp Trp Asp Ser Gln Gly Leu Tyr Leu Cys Leu Arg Gly Cys Pro
305 310 315 320
Leu Asn Gln Gln Ile Asp Phe Gln Ala Phe His Thr Asn Ala Glu Gly
325 330 335
Thr Gly Ala Arg Arg Leu Ala Ala Ala Ser Pro Ala Pro Thr Ala Pro
340 345 350
Glu Thr Phe Pro Tyr Glu Thr Ala Val Ala Lys Cys Lys Glu Lys Leu
355 360 365
Pro Val Glu Asp Leu Tyr Tyr Gln Ala Cys Val Phe Asp Leu Leu Thr
370 375 380
Thr Gly Asp Val Asn Phe Thr Leu Ala Ala Tyr Tyr Ala Leu Glu Asp
385 390 395 400
Val Lys Met Leu His Ser Asn Lys Asp Lys Leu His Leu Tyr Asp Arg
405 410 415
Thr Arg Asp Leu Pro Gly Arg Ala Ala Ala Gly Leu Pro Leu Ala Pro
420 425 430
Arg Pro Leu Leu Gly Ala Leu Val Pro Leu Leu Ala Leu Leu Pro Val
435 440 445
Phe Cys
450
<210> 2
<211> 454
<212> Белок
<213> Mus musculus
<400> 2
Met Gln Pro Pro Arg Glu Arg Leu Val Val Thr Gly Arg Ala Gly Trp
1 5 10 15
Met Gly Met Gly Arg Gly Ala Gly Arg Ser Ala Leu Gly Leu Trp Pro
20 25 30
Thr Leu Ala Phe Leu Leu Cys Ser Phe Pro Ala Ala Ile Ser Pro Cys
35 40 45
Lys Ile Leu Lys Cys Asn Ser Glu Phe Trp Ser Ala Thr Ser Ser Gly
50 55 60
Ser His Ala Pro Ala Ser Asp Asp Val Pro Glu Phe Cys Ala Ala Leu
65 70 75 80
Arg Thr Tyr Ala Leu Cys Thr Arg Arg Thr Ala Arg Thr Cys Arg Gly
85 90 95
Asp Leu Ala Tyr His Ser Ala Val His Gly Ile Glu Asp Leu Met Ser
100 105 110
Gln His Asn Cys Ser Lys Asp Gly Pro Thr Ser Gln Pro Arg Val Arg
115 120 125
Thr Leu Pro Pro Ala Gly Asp Ser Gln Glu Arg Ser Asp Ser Pro Glu
130 135 140
Ile Cys His Tyr Glu Lys Ser Phe His Lys His Ser Ala Ala Pro Asn
145 150 155 160
Tyr Thr His Cys Gly Leu Phe Gly Asp Pro His Leu Arg Thr Phe Thr
165 170 175
Asp His Phe Gln Thr Cys Lys Val Gln Gly Ala Trp Pro Leu Ile Asp
180 185 190
Asn Asn Tyr Leu Asn Val Gln Val Thr Asn Thr Pro Val Leu Pro Gly
195 200 205
Ser Ala Ala Thr Ala Thr Ser Lys Leu Thr Ile Ile Phe Lys Asn Phe
210 215 220
Gln Glu Cys Val Asp Gln Lys Val Tyr Gln Ala Glu Met Asp Glu Leu
225 230 235 240
Pro Ser Ala Phe Ala Asp Gly Ser Lys Asn Gly Gly Asp Lys His Gly
245 250 255
Ala Asn Ser Leu Lys Ile Thr Glu Lys Val Ser Gly Gln His Val Glu
260 265 270
Ile Gln Ala Lys Tyr Ile Gly Thr Thr Ile Val Val Arg Gln Val Gly
275 280 285
Arg Tyr Leu Thr Phe Ala Val Arg Met Pro Glu Glu Val Val Asn Ala
290 295 300
Val Glu Asp Arg Asp Ser Gln Gly Leu Tyr Leu Cys Leu Arg Gly Cys
305 310 315 320
Pro Leu Asn Gln Gln Ile Asp Phe Gln Ala Phe Arg Ala Asn Ala Glu
325 330 335
Ser Pro Arg Arg Pro Ala Ala Ala Ser Pro Ser Pro Val Val Pro Glu
340 345 350
Thr Phe Pro Tyr Glu Thr Ala Val Ala Lys Cys Lys Glu Lys Leu Pro
355 360 365
Val Glu Asp Leu Tyr Tyr Gln Ala Cys Val Phe Asp Leu Leu Thr Thr
370 375 380
Gly Asp Val Asn Phe Thr Leu Ala Ala Tyr Tyr Ala Leu Glu Asp Gly
385 390 395 400
Lys Met Leu His Ser Asn Lys Asp Lys Leu His Leu Phe Glu Arg Thr
405 410 415
Arg Glu Leu Pro Gly Ala Val Ala Ala Ala Ala Ala Ala Ala Thr Thr
420 425 430
Phe Pro Leu Ala Pro Gln Ile Leu Leu Gly Thr Ile Pro Leu Leu Val
435 440 445
Leu Leu Pro Val Leu Trp
450
<210> 3
<211> 449
<212> Белок
<213> Rattus norvegicus
<400> 3
Met Gln Pro Pro Arg Glu Arg Leu Val Val Thr Gly Arg Ala Gly Trp
1 5 10 15
Met Gly Met Gly Arg Gly Ala Gly Arg Ser Ala Leu Gly Leu Trp Pro
20 25 30
Thr Leu Ala Phe Leu Leu Cys Ser Phe Pro Ala Ala Ile Ser Pro Cys
35 40 45
Lys Ile Leu Lys Cys Asn Ser Glu Phe Trp Ser Ala Thr Ser Ser Gly
50 55 60
Ser His Ala Pro Ala Ser Asp Asp Val Pro Glu Phe Cys Ala Ala Leu
65 70 75 80
Arg Thr Tyr Ala Leu Cys Thr Arg Arg Thr Ala Arg Thr Cys Arg Gly
85 90 95
Asp Leu Ala Tyr His Ser Ala Val His Gly Ile Glu Asp Leu Met Ser
100 105 110
Gln His Asn Cys Ser Lys Asp Gly Pro Thr Ser Gln Pro Arg Val Arg
115 120 125
Thr Leu Pro Pro Ala Gly Asp Ser Gln Glu Arg Ser Asp Ser Pro Glu
130 135 140
Ile Cys His Tyr Glu Lys Ser Phe His Lys His Ser Ala Ala Pro Asn
145 150 155 160
Tyr Thr His Cys Gly Leu Phe Gly Asp Pro His Leu Arg Thr Phe Thr
165 170 175
Asp His Phe Gln Thr Cys Lys Val Gln Gly Ala Trp Pro Leu Ile Asp
180 185 190
Asn Asn Tyr Leu Asn Val Gln Val Thr Asn Thr Pro Val Leu Pro Gly
195 200 205
Ser Ala Ala Thr Ala Thr Ser Lys Leu Thr Ile Ile Phe Lys Asn Phe
210 215 220
Gln Glu Cys Val Asp Gln Lys Val Tyr Gln Ala Glu Met Asp Glu Leu
225 230 235 240
Pro Ser Ala Phe Ala Asp Gly Ser Lys Asn Gly Gly Asp Lys His Gly
245 250 255
Ala Asn Ser Leu Lys Ile Thr Glu Lys Val Ser Gly Gln His Val Glu
260 265 270
Ile Gln Ala Lys Tyr Ile Gly Thr Thr Ile Val Val Arg Gln Val Gly
275 280 285
Arg Tyr Leu Thr Phe Ala Val Arg Met Pro Glu Glu Val Val Asn Ala
290 295 300
Val Glu Asp Arg Asp Ser Gln Gly Leu Tyr Leu Cys Leu Arg Gly Cys
305 310 315 320
Pro Leu Asn Gln Gln Ile Asp Phe Gln Ala Phe Arg Ala Asn Ala Glu
325 330 335
Ser Pro Arg Arg Pro Ala Ala Ala Ser Pro Ser Pro Val Val Pro Glu
340 345 350
Thr Phe Pro Tyr Glu Thr Ala Val Ala Lys Cys Lys Glu Lys Leu Pro
355 360 365
Val Glu Asp Leu Tyr Tyr Gln Ala Cys Val Phe Asp Leu Leu Thr Thr
370 375 380
Gly Asp Val Asn Phe Thr Leu Ala Ala Tyr Tyr Ala Leu Glu Asp Gly
385 390 395 400
Lys Met Leu His Ser Asn Lys Asp Lys Leu His Leu Phe Glu Arg Thr
405 410 415
Arg Glu Leu Pro Gly Ala Val Ala Ala Ala Ala Phe Pro Leu Ala Pro
420 425 430
Glu Met Leu Pro Gly Thr Val Thr Leu Leu Val Leu Leu Pro Leu Phe
435 440 445
Trp
<210> 4
<211> 234
<212> Белок
<213> Mus musculus
<400> 4
Met Met Ser Ser Ala Gln Phe Leu Gly Leu Leu Leu Leu Cys Phe Gln
1 5 10 15
Gly Thr Arg Cys Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser
20 25 30
Ala Ser Leu Gly Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp
35 40 45
Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val
50 55 60
Lys Leu Leu Ile Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser
85 90 95
Asn Leu Glu Gln Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Leu Asn
100 105 110
Thr Leu Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
115 120 125
Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln
130 135 140
Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr
145 150 155 160
Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln
165 170 175
Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg
195 200 205
His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro
210 215 220
Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
225 230
<210> 5
<211> 471
<212> Белок
<213> Mus musculus
<400> 5
Met Tyr Leu Gly Leu Asn Tyr Val Phe Ile Val Phe Leu Leu Asn Gly
1 5 10 15
Val Gln Ser Glu Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Met Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Ser Asp Ala Trp Met Asp Trp Val Arg Gln Ser Pro Glu Lys Gly Leu
50 55 60
Glu Trp Val Ala Glu Ile Arg Ser Lys Ala Asn Asn His Ala Thr Tyr
65 70 75 80
Tyr Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser
85 90 95
Lys Arg Ser Val Tyr Leu Gln Met Asn Asn Leu Arg Ala Glu Asp Thr
100 105 110
Gly Ile Tyr Tyr Cys Thr Arg Arg Asp Gly Ala Tyr Trp Gly Gln Gly
115 120 125
Thr Leu Val Thr Val Ser Ala Ala Lys Thr Thr Pro Pro Ser Val Tyr
130 135 140
Pro Leu Ala Pro Gly Cys Gly Asp Thr Thr Gly Ser Ser Val Thr Leu
145 150 155 160
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Ser Val Thr Val Thr Trp
165 170 175
Asn Ser Gly Ser Leu Ser Ser Ser Val His Thr Phe Pro Ala Leu Leu
180 185 190
Gln Ser Gly Leu Tyr Thr Met Ser Ser Ser Val Thr Val Pro Ser Ser
195 200 205
Thr Trp Pro Ser Gln Thr Val Thr Cys Ser Val Ala His Pro Ala Ser
210 215 220
Ser Thr Thr Val Asp Lys Lys Leu Glu Pro Ser Gly Pro Ile Ser Thr
225 230 235 240
Ile Asn Pro Cys Pro Pro Cys Lys Glu Cys His Lys Cys Pro Ala Pro
245 250 255
Asn Leu Glu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Asn Ile Lys
260 265 270
Asp Val Leu Met Ile Ser Leu Thr Pro Lys Val Thr Cys Val Val Val
275 280 285
Asp Val Ser Glu Asp Asp Pro Asp Val Gln Ile Ser Trp Phe Val Asn
290 295 300
Asn Val Glu Val His Thr Ala Gln Thr Gln Thr His Arg Glu Asp Tyr
305 310 315 320
Asn Ser Thr Ile Arg Val Val Ser Thr Leu Pro Ile Gln His Gln Asp
325 330 335
Trp Met Ser Gly Lys Glu Phe Lys Cys Lys Val Asn Asn Lys Asp Leu
340 345 350
Pro Ser Pro Ile Glu Arg Thr Ile Ser Lys Ile Lys Gly Leu Val Arg
355 360 365
Ala Pro Gln Val Tyr Ile Leu Pro Pro Pro Ala Glu Gln Leu Ser Arg
370 375 380
Lys Asp Val Ser Leu Thr Cys Leu Val Val Gly Phe Asn Pro Gly Asp
385 390 395 400
Ile Ser Val Glu Trp Thr Ser Asn Gly His Thr Glu Glu Asn Tyr Lys
405 410 415
Asp Thr Ala Pro Val Leu Asp Ser Asp Gly Ser Tyr Phe Ile Tyr Ser
420 425 430
Lys Leu Asn Met Lys Thr Ser Lys Trp Glu Lys Thr Asp Ser Phe Ser
435 440 445
Cys Asn Val Arg His Glu Gly Leu Lys Asn Tyr Tyr Leu Lys Lys Thr
450 455 460
Ile Ser Arg Ser Pro Gly Lys
465 470
<210> 6
<211> 238
<212> Белок
<213> Mus musculus
<400> 6
Met Lys Leu Pro Val Arg Leu Leu Val Leu Met Phe Trp Ile Pro Ala
1 5 10 15
Ser Ser Ser Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val
20 25 30
Ser Leu Gly Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu
35 40 45
Val His Ser Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Arg Pro
50 55 60
Gly Gln Ser Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser
65 70 75 80
Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
85 90 95
Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Leu Tyr Phe Cys
100 105 110
Ser Gln Ser Thr His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu
115 120 125
Glu Ile Lys Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro
130 135 140
Ser Ser Glu Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu
145 150 155 160
Asn Asn Phe Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly
165 170 175
Ser Glu Arg Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser
180 185 190
Lys Asp Ser Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp
195 200 205
Glu Tyr Glu Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr
210 215 220
Ser Thr Ser Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
225 230 235
<210> 7
<211> 466
<212> Белок
<213> Mus musculus
<400> 7
Met Lys Val Leu Ser Leu Leu Tyr Leu Leu Thr Ala Ile Pro Gly Ile
1 5 10 15
Met Ser Asp Val Lys Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro
20 25 30
Ser Gln Ser Leu Ser Leu Thr Cys Ser Val Thr Gly Tyr Ser Ile Thr
35 40 45
Thr Ser Tyr Tyr Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu
50 55 60
Glu Trp Met Gly Tyr Ile Ser Tyr Asp Gly Thr Asn Asn Tyr Asn Pro
65 70 75 80
Ser Leu Lys Asn Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln
85 90 95
Phe Phe Leu Arg Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr
100 105 110
Tyr Cys Ala Gly Ser Phe Gly Tyr Ser Gln Gly Thr Leu Val Thr Val
115 120 125
Ser Ala Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly
130 135 140
Cys Gly Asp Thr Thr Gly Ser Ser Val Thr Leu Gly Cys Leu Val Lys
145 150 155 160
Gly Tyr Phe Pro Glu Ser Val Thr Val Thr Trp Asn Ser Gly Ser Leu
165 170 175
Ser Ser Ser Val His Thr Phe Pro Ala Leu Leu Gln Ser Gly Leu Tyr
180 185 190
Thr Met Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Gln
195 200 205
Thr Val Thr Cys Ser Val Ala His Pro Ala Ser Ser Thr Thr Val Asp
210 215 220
Lys Lys Leu Glu Pro Ser Gly Pro Ile Ser Thr Ile Asn Pro Cys Pro
225 230 235 240
Pro Cys Lys Glu Cys His Lys Cys Pro Ala Pro Asn Leu Glu Gly Gly
245 250 255
Pro Ser Val Phe Ile Phe Pro Pro Asn Ile Lys Asp Val Leu Met Ile
260 265 270
Ser Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Val Ser Glu Asp
275 280 285
Asp Pro Asp Val Gln Ile Ser Trp Phe Val Asn Asn Val Glu Val His
290 295 300
Thr Ala Gln Thr Gln Thr His Arg Glu Asp Tyr Asn Ser Thr Ile Arg
305 310 315 320
Val Val Ser Thr Leu Pro Ile Gln His Gln Asp Trp Met Ser Gly Lys
325 330 335
Glu Phe Lys Cys Lys Val Asn Asn Lys Asp Leu Pro Ser Pro Ile Glu
340 345 350
Arg Thr Ile Ser Lys Ile Lys Gly Leu Val Arg Ala Pro Gln Val Tyr
355 360 365
Ile Leu Pro Pro Pro Ala Glu Gln Leu Ser Arg Lys Asp Val Ser Leu
370 375 380
Thr Cys Leu Val Val Gly Phe Asn Pro Gly Asp Ile Ser Val Glu Trp
385 390 395 400
Thr Ser Asn Gly His Thr Glu Glu Asn Tyr Lys Asp Thr Ala Pro Val
405 410 415
Leu Asp Ser Asp Gly Ser Tyr Phe Ile Tyr Ser Lys Leu Asn Met Lys
420 425 430
Thr Ser Lys Trp Glu Lys Thr Asp Ser Phe Ser Cys Asn Val Arg His
435 440 445
Glu Gly Leu Lys Asn Tyr Tyr Leu Lys Lys Thr Ile Ser Arg Ser Pro
450 455 460
Gly Lys
465
<210> 8
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь химерного антитела
<400> 8
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Leu Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 9
<211> 446
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь химерного антитела
<400> 9
Glu Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Ser Lys Ala Asn Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Arg Ser
65 70 75 80
Val Tyr Leu Gln Met Asn Asn Leu Arg Ala Glu Asp Thr Gly Ile Tyr
85 90 95
Tyr Cys Thr Arg Arg Asp Gly Ala Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 10
<211> 1461
<212> Белок
<213> Homo sapiens
<400> 10
Met Ala Ala Glu Arg Gly Ala Arg Arg Leu Leu Ser Thr Pro Ser Phe
1 5 10 15
Trp Leu Tyr Cys Leu Leu Leu Leu Gly Arg Arg Ala Pro Gly Ala Ala
20 25 30
Ala Ala Arg Ser Gly Ser Ala Pro Gln Ser Pro Gly Ala Ser Ile Arg
35 40 45
Thr Phe Thr Pro Phe Tyr Phe Leu Val Glu Pro Val Asp Thr Leu Ser
50 55 60
Val Arg Gly Ser Ser Val Ile Leu Asn Cys Ser Ala Tyr Ser Glu Pro
65 70 75 80
Ser Pro Lys Ile Glu Trp Lys Lys Asp Gly Thr Phe Leu Asn Leu Val
85 90 95
Ser Asp Asp Arg Arg Gln Leu Leu Pro Asp Gly Ser Leu Phe Ile Ser
100 105 110
Asn Val Val His Ser Lys His Asn Lys Pro Asp Glu Gly Tyr Tyr Gln
115 120 125
Cys Val Ala Thr Val Glu Ser Leu Gly Thr Ile Ile Ser Arg Thr Ala
130 135 140
Lys Leu Ile Val Ala Gly Leu Pro Arg Phe Thr Ser Gln Pro Glu Pro
145 150 155 160
Ser Ser Val Tyr Ala Gly Asn Asn Ala Ile Leu Asn Cys Glu Val Asn
165 170 175
Ala Asp Leu Val Pro Phe Val Arg Trp Glu Gln Asn Arg Gln Pro Leu
180 185 190
Leu Leu Asp Asp Arg Val Ile Lys Leu Pro Ser Gly Met Leu Val Ile
195 200 205
Ser Asn Ala Thr Glu Gly Asp Gly Gly Leu Tyr Arg Cys Val Val Glu
210 215 220
Ser Gly Gly Pro Pro Lys Tyr Ser Asp Glu Val Glu Leu Lys Val Leu
225 230 235 240
Pro Asp Pro Glu Val Ile Ser Asp Leu Val Phe Leu Lys Gln Pro Ser
245 250 255
Pro Leu Val Arg Val Ile Gly Gln Asp Val Val Leu Pro Cys Val Ala
260 265 270
Ser Gly Leu Pro Thr Pro Thr Ile Lys Trp Met Lys Asn Glu Glu Ala
275 280 285
Leu Asp Thr Glu Ser Ser Glu Arg Leu Val Leu Leu Ala Gly Gly Ser
290 295 300
Leu Glu Ile Ser Asp Val Thr Glu Asp Asp Ala Gly Thr Tyr Phe Cys
305 310 315 320
Ile Ala Asp Asn Gly Asn Glu Thr Ile Glu Ala Gln Ala Glu Leu Thr
325 330 335
Val Gln Ala Gln Pro Glu Phe Leu Lys Gln Pro Thr Asn Ile Tyr Ala
340 345 350
His Glu Ser Met Asp Ile Val Phe Glu Cys Glu Val Thr Gly Lys Pro
355 360 365
Thr Pro Thr Val Lys Trp Val Lys Asn Gly Asp Met Val Ile Pro Ser
370 375 380
Asp Tyr Phe Lys Ile Val Lys Glu His Asn Leu Gln Val Leu Gly Leu
385 390 395 400
Val Lys Ser Asp Glu Gly Phe Tyr Gln Cys Ile Ala Glu Asn Asp Val
405 410 415
Gly Asn Ala Gln Ala Gly Ala Gln Leu Ile Ile Leu Glu His Ala Pro
420 425 430
Ala Thr Thr Gly Pro Leu Pro Ser Ala Pro Arg Asp Val Val Ala Ser
435 440 445
Leu Val Ser Thr Arg Phe Ile Lys Leu Thr Trp Arg Thr Pro Ala Ser
450 455 460
Asp Pro His Gly Asp Asn Leu Thr Tyr Ser Val Phe Tyr Thr Lys Glu
465 470 475 480
Gly Ile Ala Arg Glu Arg Val Glu Asn Thr Ser His Pro Gly Glu Met
485 490 495
Gln Val Thr Ile Gln Asn Leu Met Pro Ala Thr Val Tyr Ile Phe Arg
500 505 510
Val Met Ala Gln Asn Lys His Gly Ser Gly Glu Ser Ser Ala Pro Leu
515 520 525
Arg Val Glu Thr Gln Pro Glu Val Gln Leu Pro Gly Pro Ala Pro Asn
530 535 540
Leu Arg Ala Tyr Ala Ala Ser Pro Thr Ser Ile Thr Val Thr Trp Glu
545 550 555 560
Thr Pro Val Ser Gly Asn Gly Glu Ile Gln Asn Tyr Lys Leu Tyr Tyr
565 570 575
Met Glu Lys Gly Thr Asp Lys Glu Gln Asp Val Asp Val Ser Ser His
580 585 590
Ser Tyr Thr Ile Asn Gly Leu Lys Lys Tyr Thr Glu Tyr Ser Phe Arg
595 600 605
Val Val Ala Tyr Asn Lys His Gly Pro Gly Val Ser Thr Pro Asp Val
610 615 620
Ala Val Arg Thr Leu Ser Asp Val Pro Ser Ala Ala Pro Gln Asn Leu
625 630 635 640
Ser Leu Glu Val Arg Asn Ser Lys Ser Ile Met Ile His Trp Gln Pro
645 650 655
Pro Ala Pro Ala Thr Gln Asn Gly Gln Ile Thr Gly Tyr Lys Ile Arg
660 665 670
Tyr Arg Lys Ala Ser Arg Lys Ser Asp Val Thr Glu Thr Leu Val Ser
675 680 685
Gly Thr Gln Leu Ser Gln Leu Ile Glu Gly Leu Asp Arg Gly Thr Glu
690 695 700
Tyr Asn Phe Arg Val Ala Ala Leu Thr Ile Asn Gly Thr Gly Pro Ala
705 710 715 720
Thr Asp Trp Leu Ser Ala Glu Thr Phe Glu Ser Asp Leu Asp Glu Thr
725 730 735
Arg Val Pro Glu Val Pro Ser Ser Leu His Val Arg Pro Leu Val Thr
740 745 750
Ser Ile Val Val Ser Trp Thr Pro Pro Glu Asn Gln Asn Ile Val Val
755 760 765
Arg Gly Tyr Ala Ile Gly Tyr Gly Ile Gly Ser Pro His Ala Gln Thr
770 775 780
Ile Lys Val Asp Tyr Lys Gln Arg Tyr Tyr Thr Ile Glu Asn Leu Asp
785 790 795 800
Pro Ser Ser His Tyr Val Ile Thr Leu Lys Ala Phe Asn Asn Val Gly
805 810 815
Glu Gly Ile Pro Leu Tyr Glu Ser Ala Val Thr Arg Pro His Thr Asp
820 825 830
Thr Ser Glu Val Asp Leu Phe Val Ile Asn Ala Pro Tyr Thr Pro Val
835 840 845
Pro Asp Pro Thr Pro Met Met Pro Pro Val Gly Val Gln Ala Ser Ile
850 855 860
Leu Ser His Asp Thr Ile Arg Ile Thr Trp Ala Asp Asn Ser Leu Pro
865 870 875 880
Lys His Gln Lys Ile Thr Asp Ser Arg Tyr Tyr Thr Val Arg Trp Lys
885 890 895
Thr Asn Ile Pro Ala Asn Thr Lys Tyr Lys Asn Ala Asn Ala Thr Thr
900 905 910
Leu Ser Tyr Leu Val Thr Gly Leu Lys Pro Asn Thr Leu Tyr Glu Phe
915 920 925
Ser Val Met Val Thr Lys Gly Arg Arg Ser Ser Thr Trp Ser Met Thr
930 935 940
Ala His Gly Thr Thr Phe Glu Leu Val Pro Thr Ser Pro Pro Lys Asp
945 950 955 960
Val Thr Val Val Ser Lys Glu Gly Lys Pro Lys Thr Ile Ile Val Asn
965 970 975
Trp Gln Pro Pro Ser Glu Ala Asn Gly Lys Ile Thr Gly Tyr Ile Ile
980 985 990
Tyr Tyr Ser Thr Asp Val Asn Ala Glu Ile His Asp Trp Val Ile Glu
995 1000 1005
Pro Val Val Gly Asn Arg Leu Thr His Gln Ile Gln Glu Leu Thr
1010 1015 1020
Leu Asp Thr Pro Tyr Tyr Phe Lys Ile Gln Ala Arg Asn Ser Lys
1025 1030 1035
Gly Met Gly Pro Met Ser Glu Ala Val Gln Phe Arg Thr Pro Lys
1040 1045 1050
Ala Asp Ser Ser Asp Lys Met Pro Asn Asp Gln Ala Ser Gly Ser
1055 1060 1065
Gly Gly Lys Gly Ser Arg Leu Pro Asp Leu Gly Ser Asp Tyr Lys
1070 1075 1080
Pro Pro Met Ser Gly Ser Asn Ser Pro His Gly Ser Pro Thr Ser
1085 1090 1095
Pro Leu Asp Ser Asn Met Leu Leu Val Ile Ile Val Ser Val Gly
1100 1105 1110
Val Ile Thr Ile Val Val Val Val Ile Ile Ala Val Phe Cys Thr
1115 1120 1125
Arg Arg Thr Thr Ser His Gln Lys Lys Lys Arg Ala Ala Cys Lys
1130 1135 1140
Ser Val Asn Gly Ser His Lys Tyr Lys Gly Asn Ser Lys Asp Val
1145 1150 1155
Lys Pro Pro Asp Leu Trp Ile His His Glu Arg Leu Glu Leu Lys
1160 1165 1170
Pro Ile Asp Lys Ser Pro Asp Pro Asn Pro Ile Met Thr Asp Thr
1175 1180 1185
Pro Ile Pro Arg Asn Ser Gln Asp Ile Thr Pro Val Asp Asn Ser
1190 1195 1200
Met Asp Ser Asn Ile His Gln Arg Arg Asn Ser Tyr Arg Gly His
1205 1210 1215
Glu Ser Glu Asp Ser Met Ser Thr Leu Ala Gly Arg Arg Gly Met
1220 1225 1230
Arg Pro Lys Met Met Met Pro Phe Asp Ser Gln Pro Pro Gln Pro
1235 1240 1245
Val Ile Ser Ala His Pro Ile His Ser Leu Asp Asn Pro His His
1250 1255 1260
His Phe His Ser Ser Ser Leu Ala Ser Pro Ala Arg Ser His Leu
1265 1270 1275
Tyr His Pro Gly Ser Pro Trp Pro Ile Gly Thr Ser Met Ser Leu
1280 1285 1290
Ser Asp Arg Ala Asn Ser Thr Glu Ser Val Arg Asn Thr Pro Ser
1295 1300 1305
Thr Asp Thr Met Pro Ala Ser Ser Ser Gln Thr Cys Cys Thr Asp
1310 1315 1320
His Gln Asp Pro Glu Gly Ala Thr Ser Ser Ser Tyr Leu Ala Ser
1325 1330 1335
Ser Gln Glu Glu Asp Ser Gly Gln Ser Leu Pro Thr Ala His Val
1340 1345 1350
Arg Pro Ser His Pro Leu Lys Ser Phe Ala Val Pro Ala Ile Pro
1355 1360 1365
Pro Pro Gly Pro Pro Thr Tyr Asp Pro Ala Leu Pro Ser Thr Pro
1370 1375 1380
Leu Leu Ser Gln Gln Ala Leu Asn His His Ile His Ser Val Lys
1385 1390 1395
Thr Ala Ser Ile Gly Thr Leu Gly Arg Ser Arg Pro Pro Met Pro
1400 1405 1410
Val Val Val Pro Ser Ala Pro Glu Val Gln Glu Thr Thr Arg Met
1415 1420 1425
Leu Glu Asp Ser Glu Ser Ser Tyr Glu Pro Asp Glu Leu Thr Lys
1430 1435 1440
Glu Met Ala His Leu Glu Gly Leu Met Lys Asp Leu Asn Ala Ile
1445 1450 1455
Thr Thr Ala
1460
<210> 11
<211> 446
<212> Белок
<213> Искусственная последовательность
<220>
<223> HA тяжелой цепи гуманизированного антитела
<400> 11
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Phe Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Ser Lys Ala Asn Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Leu Tyr
85 90 95
Tyr Cys Thr Arg Arg Asp Gly Ala Tyr Trp Gly Lys Gly Thr Thr Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 12
<211> 446
<212> Белок
<213> Искусственная последовательность
<220>
<223> HB тяжелой цепи гуманизированного антитела
<400> 12
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Phe Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Ser Lys Ala Asn Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Arg Thr Glu Asp Thr Ala Leu Tyr
85 90 95
Tyr Cys Thr Arg Arg Asp Gly Ala Tyr Trp Gly Lys Gly Thr Thr Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 13
<211> 446
<212> Белок
<213> Искусственная последовательность
<220>
<223> HC тяжелой цепи гуманизированного антитела
<400> 13
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Phe Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Ser Lys Ala Asn Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Leu Tyr
85 90 95
Tyr Cys Thr Arg Arg Asp Gly Ala Tyr Trp Gly Lys Gly Thr Thr Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 14
<211> 446
<212> Белок
<213> Искусственная последовательность
<220>
<223> HD тяжелой цепи гуманизированного антитела
<400> 14
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Phe Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Ser Lys Ala Asn Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Arg Thr Glu Asp Thr Ala Leu Tyr
85 90 95
Tyr Cys Thr Arg Arg Asp Gly Ala Tyr Trp Gly Lys Gly Thr Thr Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 15
<211> 446
<212> Белок
<213> Искусственная последовательность
<220>
<223> HE тяжелой цепи гуманизированного антитела
<400> 15
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Ser Lys Ala Asn Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Arg Thr Glu Asp Thr Ala Leu Tyr
85 90 95
Tyr Cys Thr Arg Arg Asp Gly Ala Tyr Trp Gly Lys Gly Thr Thr Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 16
<211> 446
<212> Белок
<213> Искусственная последовательность
<220>
<223> HF тяжелой цепи гуманизированного антитела
<400> 16
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Phe Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Ser Lys Ala Asn Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Arg Arg Asp Gly Ala Tyr Trp Gly Lys Gly Thr Thr Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 17
<211> 446
<212> Белок
<213> Искусственная последовательность
<220>
<223> HG тяжелой цепи гуманизированного антитела
<400> 17
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Ser Lys Ala Asn Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Leu Tyr
85 90 95
Tyr Cys Thr Arg Arg Asp Gly Ala Tyr Trp Gly Lys Gly Thr Thr Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 18
<211> 446
<212> Белок
<213> Искусственная последовательность
<220>
<223> HH тяжелой цепи гуманизированного антитела
<400> 18
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Ser Lys Ala Asn Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Arg Arg Asp Gly Ala Tyr Trp Gly Lys Gly Thr Thr Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 19
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> KA легкой цепи гуманизированного антитела
<400> 19
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Ser Tyr Phe Cys Gln Gln Leu Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Met Glu Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 20
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> KB легкой цепи гуманизированного антитела
<400> 20
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Ser Tyr Phe Cys Gln Gln Leu Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Met Glu Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 21
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> KC легкой цепи гуманизированного антитела
<400> 21
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Ser Tyr Phe Cys Gln Gln Leu Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Met Glu Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 22
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> KD легкой цепи гуманизированного антитела
<400> 22
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Gln Gln Leu Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Met Glu Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 23
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> KE легкой цепи гуманизированного антитела
<400> 23
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Ser Tyr Phe Cys Gln Gln Leu Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Met Glu Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 24
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> KF легкой цепи гуманизированного антитела
<400> 24
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Gln Gln Leu Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Met Glu Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 25
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь гуманизированного антитела KG
<400> 25
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Gln Gln Leu Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Met Glu Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 26
<211> 14
<212> Белок
<213> Mus musculus
<400> 26
Glu Glu Val Val Asn Ala Val Glu Asp Trp Asp Ser Gln Gly
1 5 10
<210> 27
<211> 14
<212> Белок
<213> Mus musculus
<400> 27
Asn Gln Gln Ile Asp Phe Gln Ala Phe His Thr Asn Ala Glu
1 5 10
<210> 28
<211> 11
<212> Белок
<213> Mus musculus
<400> 28
Pro Thr Ala Pro Glu Thr Phe Pro Tyr Glu Thr
1 5 10
<210> 29
<211> 11
<212> Белок
<213> Mus musculus
<400> 29
Lys Leu Pro Val Glu Asp Leu Tyr Tyr Gln Ala
1 5 10
<210> 30
<211> 11
<212> Белок
<213> Mus musculus
<400> 30
Arg Ala Ser Gln Asp Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 31
<211> 7
<212> Белок
<213> Mus musculus
<400> 31
Tyr Thr Ser Arg Leu His Ser
1 5
<210> 32
<211> 7
<212> Белок
<213> Mus musculus
<400> 32
Gln Gln Leu Asn Thr Leu Pro
1 5
<210> 33
<211> 5
<212> Белок
<213> Mus musculus
<400> 33
Asp Ala Trp Met Asp
1 5
<210> 34
<211> 19
<212> Белок
<213> Mus musculus
<400> 34
Glu Ile Arg Ser Lys Ala Asn Asn His Ala Thr Tyr Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 35
<211> 5
<212> Белок
<213> Mus musculus
<400> 35
Arg Asp Gly Ala Tyr
1 5
<210> 36
<211> 16
<212> Белок
<213> Mus musculus
<400> 36
Arg Ser Ser Gln Ser Leu Val His Ser Asn Gly Asn Thr Tyr Leu His
1 5 10 15
<210> 37
<211> 7
<212> Белок
<213> Mus musculus
<400> 37
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 38
<211> 7
<212> Белок
<213> Mus musculus
<400> 38
Ser Gln Ser Thr His Val Pro
1 5
<210> 39
<211> 6
<212> Белок
<213> Mus musculus
<400> 39
Thr Ser Tyr Tyr Trp Asn
1 5
<210> 40
<211> 16
<212> Белок
<213> Mus musculus
<400> 40
Tyr Ile Ser Tyr Asp Gly Thr Asn Asn Tyr Asn Pro Ser Leu Lys Asn
1 5 10 15
<210> 41
<211> 116
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь гуманизированного антитела
<400> 41
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Ser Lys Ala Asn Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Arg Thr Glu Asp Thr Ala Leu Tyr
85 90 95
Tyr Cys Thr Arg Arg Asp Gly Ala Tyr Trp Gly Lys Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 42
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь гуманизированного антитела
<400> 42
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Ser Tyr Phe Cys Gln Gln Leu Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Met Glu
100 105
<210> 43
<211> 348
<212> DNA
<213> Искусственная последовательность
<220>
<223> ген, кодирующий тяжелую цепь гуманизированного антитела
<400> 43
gaagtgcagc tggtggaatc tggcggcgga ctggtgcagc ctggcagatc cctgagactg 60
tcctgtaccg cctccggctt caccttctcc gacgcctgga tggattgggt gcgacaggct 120
cctggcaagg gcctggaatg ggtggccgag atccggtcca aggccaacaa ccacgccacc 180
tactacgccg agtctgtgaa gggccggttc accatctccc gggacgactc caagtccatc 240
gtgtacctgc agatgaactc cctgcggacc gaggacaccg ccctgtacta ctgcaccaga 300
agggacggcg cctactgggg caagggcacc acagtgacag tgtcctcc 348
<210> 44
<211> 321
<212> DNA
<213> Искусственная последовательность
<220>
<223> ген, кодирующий легкую цепь гуманизированного антитела
<400> 44
gacatccaga tgacccagtc cccctcctcc gtgtctgctt ccgtgggcga cagagtgacc 60
atcacctgtc gggcctccca ggacatctcc tcctacctga actggtatca gcagaagccc 120
ggcaaggccc ccaagctgct gatctactac acctcccggc tgcactccgg cgtgccctct 180
agattttccg gctctggctc cggcaccgac tttaccctga ccatctccag cctgcagccc 240
gaggacttcg cctcctactt ctgtcagcag ctgaacaccc tgccctggac ctttggcgga 300
ggcaccaagg tggaaatgga a 321
<210> 45
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> PLP139-151
<400> 45
His Ser Leu Gly Lys Trp Leu Gly His Pro Asp Lys Phe
1 5 10
<210> 46
<211> 4
<212> Белок
<213> Искусственная последовательность
<220>
<223> spacer
<400> 46
Ser Gly Ser Gly
1
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО ПРОТИВ SIRPα | 2019 |
|
RU2791002C2 |
| АНТИ-PD-L1 АНТИТЕЛО ДЛЯ ДЕТЕКЦИИ PD-L1 | 2018 |
|
RU2758723C2 |
| АНТИТЕЛО ПРОТИВ LAG-3 | 2017 |
|
RU2744866C2 |
| НЕВИРУСНЫЙ ИММУНОТАРГЕТИНГ | 2020 |
|
RU2833379C2 |
| АНТИТЕЛО К Myl9 | 2017 |
|
RU2741802C2 |
| Способ и композиция для лечения рака, уничтожения метастатических раковых клеток и профилактики метастазов рака, используя антитела к конечным продуктам повышенного гликирования ( AGE) | 2017 |
|
RU2728964C2 |
| КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ КАЛЬЦИФИКАЦИИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2757417C2 |
| СПОСОБ ПРЕДУПРЕЖДЕНИЯ ИЛИ ЛЕЧЕНИЯ ПЕРИФЕРИЧЕСКОЙ НЕЙРОПАТИИ ИЛИ БОЛИ, СОПРОВОЖДАЮЩЕЙ ЗАБОЛЕВАНИЕ, ПРИ КОТОРОМ ВЫЯВЛЕНА ПЕРИФЕРИЧЕСКАЯ НЕЙРОПАТИЯ ИЛИ НАРУШЕНИЕ АСТРОЦИТОВ | 2019 |
|
RU2822199C2 |
| УНИВЕРСАЛЬНЫЙ АНТИТЕЛООПОСРЕДОВАННЫЙ БИОСЕНСОР | 2016 |
|
RU2746486C2 |
| НАЦЕЛЕННЫЕ НА uPARAP КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2017 |
|
RU2740311C2 |
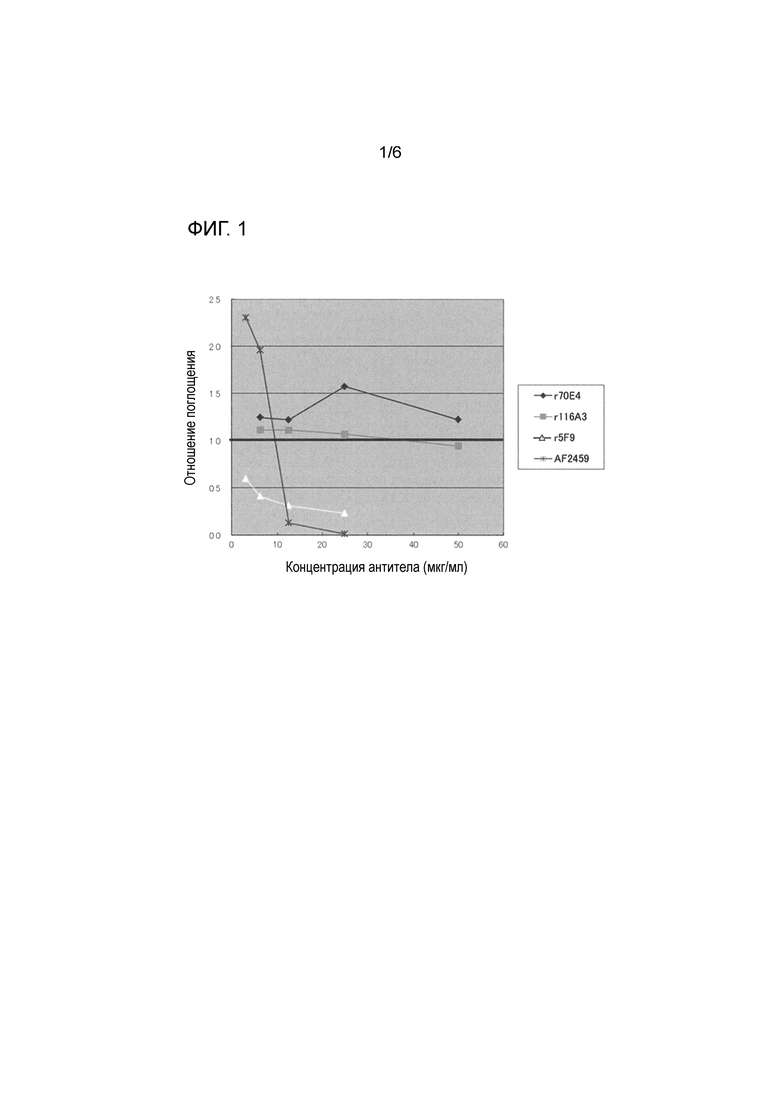
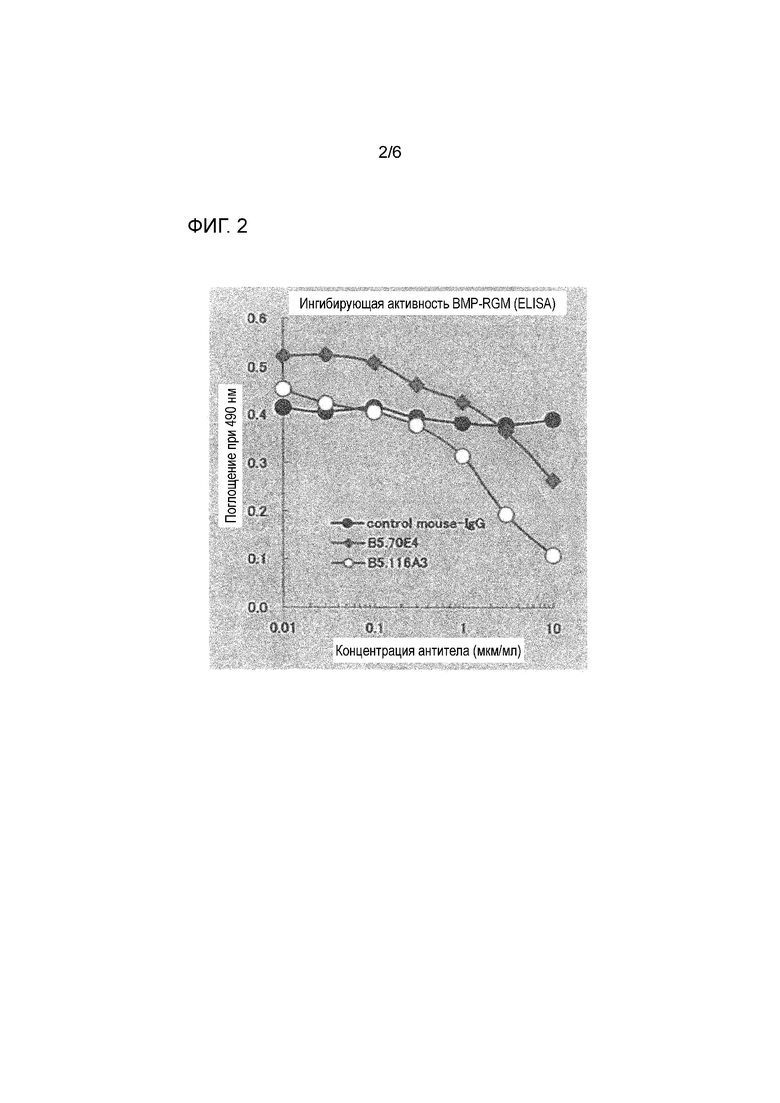
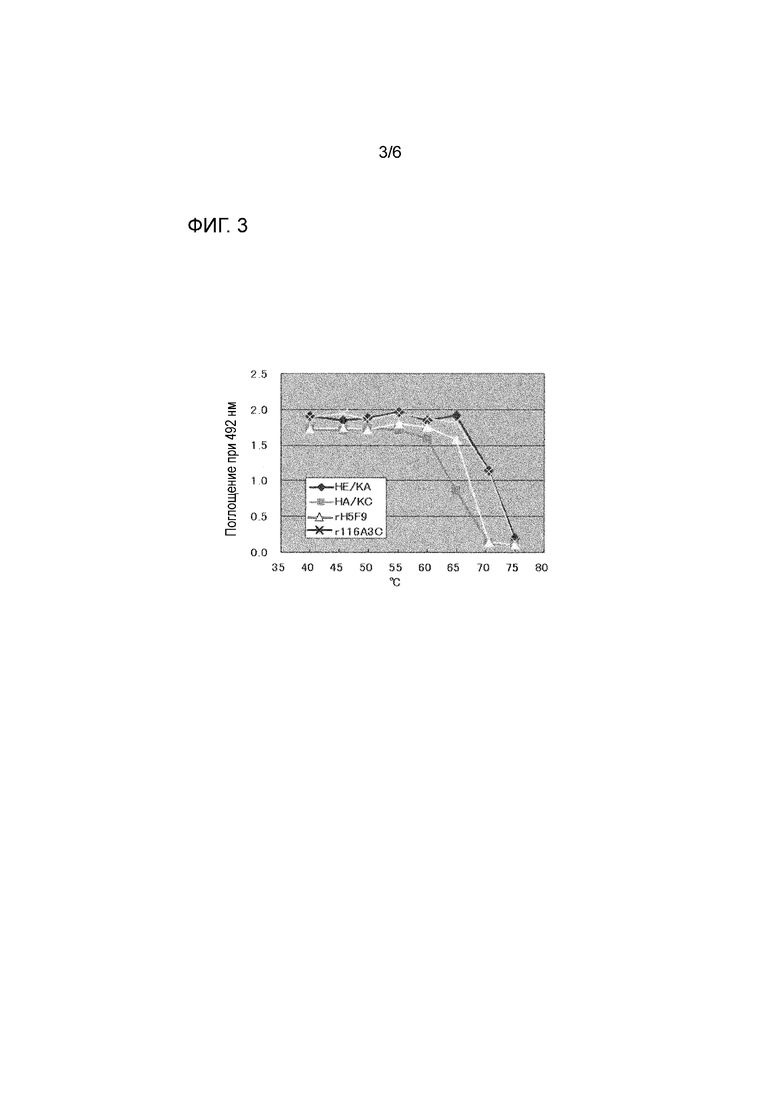

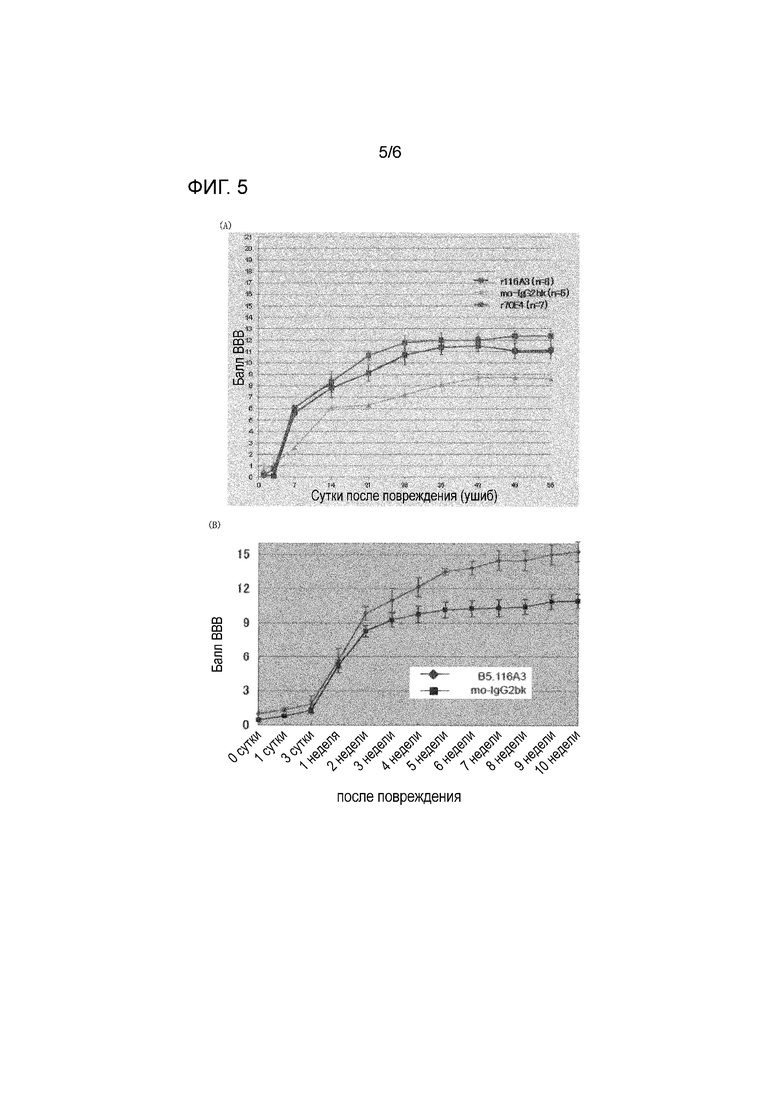
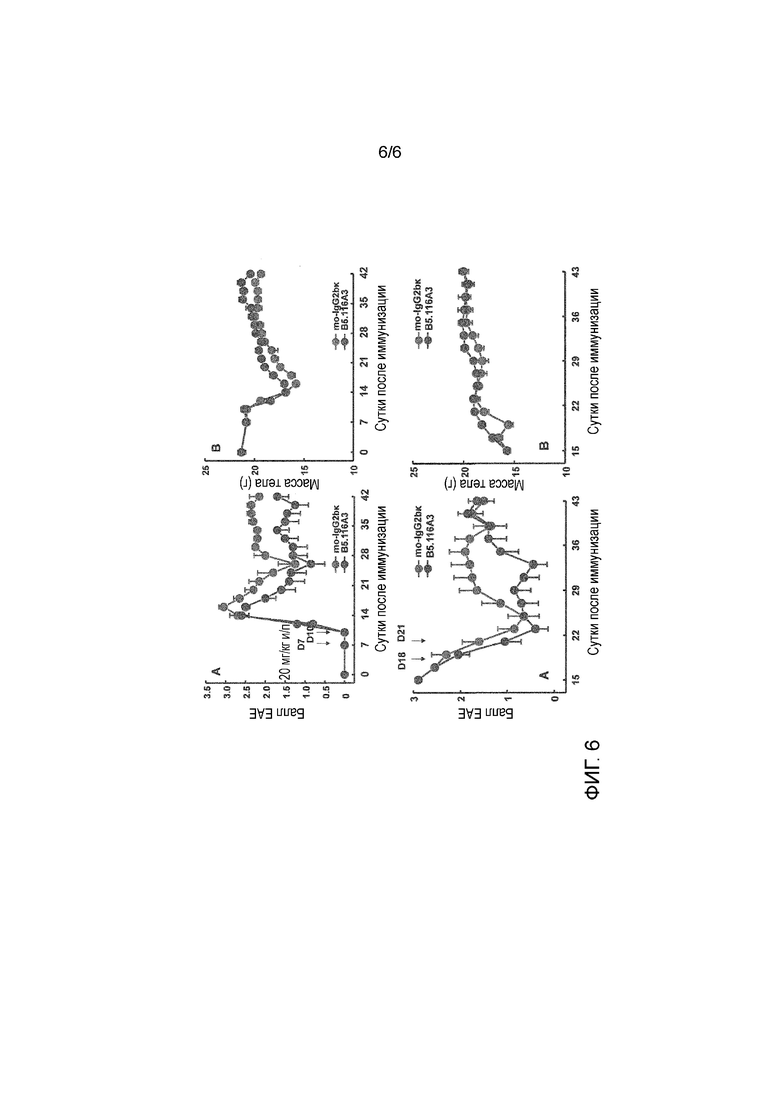
Изобретение относится к области биохимии, в частности к выделенному антителу к RGMa или его антигенсвязывающему фрагменту. Также раскрыты молекула нуклеиновой кислоты, кодирующая указанное антитело; экспрессионный вектор, содержащий указанную молекулу нуклеиновой кислоты; клетка-хозяин, содержащая указанный вектор; композиция, содержащая указанное антитело. Раскрыт способ получения указанного антитела. Изобретение позволяет эффективно лечить заболевания, в которые вовлечена активность RGMa. 7 н. и 7 з.п. ф-лы, 18 пр., 3 табл., 6 ил.
1. Выделенное антитело к RGMa или его антигенсвязывающий фрагмент,
где аминокислотная последовательность каждой из определяющей комплементарность области тяжелой цепи 1 (HCDR1), определяющей комплементарность области тяжелой цепи 2 (HCDR2) и определяющей комплементарность области тяжелой цепи 3 (HCDR3) содержит следующие последовательности:
HCDR1: DAWMD (SEQ ID NO: 33 в списке последовательностей),
HCDR2: EIRSKANNHATYYAESVKG (SEQ ID NO: 34 в списке последовательностей) и
HCDR3: RDGAY (SEQ ID NO: 35 в списке последовательностей); и
где вариабельная область легкой цепи (VL) содержит следующую аминокислотную последовательность:
DIQMTQSPSSVSASVGDRVTITCRASQDISSYLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDFTLTISSLQPEDFASYFCQQLNTLPWTFGGGTKVEME (SEQ ID NO: 42 в списке последовательностей).
2. Антитело к RGMa или его антигенсвязывающий фрагмент по п. 1, где вариабельная область тяжелой цепи (VH) содержит следующую аминокислотную последовательность:
EVQLVESGGGLVQPGRSLRLSCTASGFTFSDAWMDWVRQAPGKGLEWVAEIRSKANNHATYYAESVKGRFTISRDDSKSIVYLQMNSLRTEDTALYYCTRRDGAYWGKGTTVTVSS (SEQ ID NO: 41 в списке последовательностей).
3. Выделенное антитело к RGMa или его антигенсвязывающий фрагмент,
где вариабельная область тяжелой цепи (VH) содержит следующую аминокислотную последовательность:
EVQLVESGGGLVQPGRSLRLSCTASGFTFSDAWMDWVRQAPGKGLEWVAEIRSKANNHATYYAESVKGRFTISRDDSKSIVYLQMNSLRTEDTALYYCTRRDGAYWGKGTTVTVSS (SEQ ID NO: 41 в списке последовательностей); и
где вариабельная область легкой цепи (VL) содержит следующую аминокислотную последовательность:
DIQMTQSPSSVSASVGDRVTITCRASQDISSYLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDFTLTISSLQPEDFASYFCQQLNTLPWTFGGGTKVEME (SEQ ID NO: 42 в списке последовательностей).
4. Антитело к RGMa или его антигенсвязывающий фрагмент по любому из пп. 1-3, где антитело к RGMa представляет собой гуманизированное антитело.
5. Антитело к RGMa или его антигенсвязывающий фрагмент по любому из пп. 1-3, где антитело к RGMa содержит константные области IgG человека.
6. Антитело к RGMa или его антигенсвязывающий фрагмент по любому из пп. 1-3, где в область, отличную от CDR, могут быть введены замена, делеция, добавление или вставка 1-20 аминокислот.
7. Молекула нуклеиновой кислоты, кодирующая белок антитела к RGMa или его антигенсвязывающего фрагмента по любому из пп. 1-6.
8. Экспрессионный вектор, содержащий молекулу нуклеиновой кислоты по п. 7.
9. Клетка-хозяин для получения антитела, содержащая экспрессионный вектор по п. 8.
10. Способ получения антитела к RGMa или его антигенсвязывающего фрагмента по любому из пп. 1-6, где способ включает этап культивирования клетки-хозяина по п. 9.
11. Фармацевтическая композиция для профилактики, лечения или профилактики рецидива неврологических или иммунологических заболеваний, в которые вовлечена активность RGMa, содержащая эффективное количество антитела к RGMa или его антигенсвязывающего фрагмента по любому из пп. 1-6.
12. Фармацевтическая композиция по п. 11, где неврологические заболевания выбраны из группы, состоящей из бокового амиотрофического склероза, повреждения плечевого сплетения, повреждения головного мозга (включая травматическое повреждение головного мозга), церебрального паралича, синдрома Гийена-Барре, церебральной лейкодистрофии, рассеянного склероза (включая ремиттирующий рассеянный склероз, первичный прогрессирующий рассеянный склероз, вторичный прогрессирующий рассеянный склероз), нейромиелита зрительного нерва, постполиомиелитного синдрома, расщелины позвоночника, повреждения спинного мозга, спинальной мышечной атрофии, неоплазии позвоночного столба, поперечного миелита, деменции (включая сенильную деменцию, умеренное когнитивное нарушение, болезнь Альцгеймера, деменцию, связанную с болезнью Альцгеймера), болезни Хантингтона, поздней дискинезии, мании, болезни Паркинсона, синдрома Стила-Ричардсона, синдрома Дауна, тяжелой миастении, травмы нервной системы (включая травму зрительного нерва), амилоидоза сосудов, внутримозгового кровоизлияния, связанного с амилоидозом, инфаркта головного мозга, энцефалита, острого состояния спутанности, глаукомы, шизофрении и дегенерации слоя нервных волокон сетчатки (включая диабетическую ретинопатию, ишемическую оптическую нейропатию, сцепленный с X-хромосомой ретиносхизис, индуцированную лекарственным средством оптическую нейропатию, дистрофию сетчатки, связанную с возрастом дегенерацию желтого пятна, заболевания глаз, характеризующиеся друзами диска зрительного нерва, заболевания глаз, характеризующиеся генетической обусловленной дегенерацией фоторецепторов, аутосомно-рецессивную палочко-колбочковую дистрофию, митохондриальное нарушение, связанное с оптической нейропатией).
13. Фармацевтическая композиция по п. 11, где иммунологические заболевания выбраны из группы, состоящей из рассеянного склероза (включая ремиттирующий рассеянный склероз, первичный прогрессирующий рассеянный склероз, вторичный прогрессирующий рассеянный склероз), нейромиелита зрительного нерва, псориаза, артрита (включая ревматоидный артрит, остеоартрит, псориатический артрит), синдрома Гийена-Барре, болезни Бехчета, пернициозной анемии, (инсулинозависимого) сахарного диабета I типа, системной красной волчанки (SLE), воспалительного заболевания кишечника (IBD), синдрома Шегрена, синдрома Гудпасчера, болезни Грейвса, аутоиммунной гемолитической анемии, аутоиммунной тромбоцитопенической пурпуры, астмы, поллиноза, атопического дерматита, гломерулонефрита, тяжелой миастении, болезни Хашимото и саркоидоза.
14. Фармацевтическая композиция по п. 11, где неврологические или иммунологические заболевания выбраны из группы, состоящей из повреждения спинного мозга, травмы нервной системы (включая травму зрительного нерва), рассеянного склероза (включая ремиттирующий рассеянный склероз, первичный прогрессирующий рассеянный склероз, вторичный прогрессирующий рассеянный склероз).
| US 2012020968 A1, 26.01.2012 | |||
| WO 2011071059 A1, 16.06.2011 | |||
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ БЕЛКА RGM А И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2524136C2 |
Авторы
Даты
2023-12-13—Публикация
2016-04-27—Подача