РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной патентной заявки США номер 60/708677, поданной 16 августа 2005 года, и предварительной патентной заявки США номер 60/808076, поданной 24 мая 2006 года.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Описанное изобретение относится к способам и аналитическим методикам выявления биомаркеров, предсказывающих чувствительность клеток млекопитающих к Apo2L/TRAIL и/или агонистическим антителам рецепторов (клеточной) смерти. Более детально описанное изобретение относится к способам и аналитическим методикам, которые выявляют молекулы, ассоциированные с семейством белков GalNac-T, которые позволяют прогнозировать чувствительность раковых клеток млекопитающих к Apo2L/TRAIL и/или агонистическим антителам рецепторов (клеточной) смерти, например, к агонистическим антителам DR4 или DR5.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
В данной области техники идентифицированы различные лиганды и рецепторы, принадлежащие суперсемейству фактора опухолевого некроза (TNF). В число таких лигандов входят альфа-фактор опухолевого некроза ("TNF-альфа"), бета-фактор опухолевого некроза ("TNF-бета" или "лимфотоксин-альфа"), лимфотоксин-бета ("LT-бета"), лиганд CD30, лиганд CD27, лиганд CD40, лиганд OX-40, лиганд 4-1BB, LIGHT, лиганд Apo-1 (также называемый лиганд Fas или лиганд CD95), лиганд Apo-2 (также называемый Apo2L или TRAIL), лиганд Apo-3 (также называемый TWEAK), APRIL, лиганд OPG (также называемый лиганд RANK, ODF или TRANCE) и TALL-1 (также называемый BlyS, BAFF или THANK) (см. например, Ashkenazi, Nature Review, 2:420-430 (2002); Ashkenazi and Dixit, Science, 281:1305-1308 (1998); Ashkenazi and Dixit, Curr. Opin. Cell Biol., 11:255-260 (2000); Golstein, Curr. Biol., 7:750-753 (1997) Wallach, Cytokine Reference, Academic Press, 2000, страницы 377-411; Locksley et al., Cell, 104:487-501 (2001); Gruss and Dower, Blood, 85:3378-3404 (1995); Schmid et al., Proc. Natl. Acad. Sci., 83:1881 (1986); Dealtry et al., Eur. J. Immunol., 17:689 (1987); Pitti et al., J. Biol. Chem., 271:12687-12690 (1996); Wiley et al., Immunity, 3:673-682 (1995); Browning et al., Cell, 72:847-856 (1993); Armitage et al. Nature, 357:80-82 (1992), WO 97/01633 (публикация от 16 января 1997 г.); WO 97/25428 (публикация от 17 июля 1997 г.); Marsters et al., Curr. Biol., 8:525-528 (1998); Chicheportiche et al., Biol. Chem., 272:32401-32410 (1997); Hahne et al., J. Exp. Med., 188:1185-1190 (1998); WO 98/28426 (публикация от 2 июля 1998 г.); WO 98/46751 (публикация от 22 октября 1998 г.); WO 98/18921 (публикация от 7 мая 1998 г.); Moore et al., Science, 285:260-263 (1999); Shu et al., J. Leukocyte Biol., 65:680 (1999); Schneider et al., J. Exp. Med., 189:1747-1756 (1999); Mukhopadhyay et al., J. Biol. Chem., 274:15978-15981 (1999)).
Индукция различных клеточных реакций, опосредованных такими лигандами семейства TNF, как правило, инициируется их связыванием со специфическими клеточными рецепторами. Некоторые, но не все, лиганды семейства TNF индуцируют различные типы биологической активности, связываясь с расположенными на поверхности клеток "рецепторами смерти" и активируя каспазы или ферменты, приводящие в исполнение метаболический путь клеточной смерти или апоптоза (Salvesen et al., Cell, 91:443-446 (1997)). Среди членов суперсемейства рецепторов TNF, идентифицированных к настоящему времени, следует указать TNFR1, TNFR2, TACI, GITR, CD27, OX-40, CD30, CD40, HVEM, Fas (также называемый Apo-1 или CD95), DR4 (также называемый TRAIL-R1), DR5 (также называемый Apo-2 или TRAIL-R2), DcR1, DcR2, остеопротегерин (OPG), RANK и Apo-3 (также называемый DR3 или TRAMP) (см., например, Ashkenazi, Nature Reviews, 2:420-430 (2002); Ashkenazi and Dixit, Science, 281:1305-1308 (1998); Ashkenazi and Dixit, Curr. Opin. Cell Biol., 11:255-260 (2000); Golstein, Curr. Biol., 7:750-753 (1997) Wallach, Cytokine Reference, Academic Press, 2000, страницы 377-411; Locksley et al., Cell, 104:487-501 (2001); Gruss and Dower, Blood, 85:3378-3404 (1995); Hohman et al., J. Biol. Chem., 264:14927-14934 (1989); Brockhaus et al., Proc. Natl. Acad. Sci., 82:3127-3131 (1990); EP 417563 (публикация от 20 марта 1991 г.); Loetscher et al., Cell, 61:351 (1990); Schall et al., Cell, 61:361 (1990); Smith et al., Science, 248:1019-1023 (1990); Lewis et al., Proc. Natl. Acad. Sci., 88:2830-2834 (1991); Goodwin et al., Mol. Cell. Biol., 11:3020-3026 (1991); Stamenkovic et al., EMBO J., 8:1403-1410 (1989); Mallett et al., EMBO J., 9:1063-1068 (1990); Anderson et al., Nature, 390:175-179 (1997); Chicheportiche et al., J. Biol. Chem., 272:32401-32410 (1997); Pan et al., Science, 276:111-113 (1997); Pan et al., Science, 277:815-818 (1997); Sheridan et al., Science, 277:818-821 (1997); Degli-Esposti et al., J. Exp. Med., 186:1165-1170 (1997); Marsters et al., Curr. Biol., 7:1003-1006 (1997); Tsuda et al., BBRC, 234:137-142 (1997); Nocentini et al., Proc. Natl. Acad. Sci., 94:6216-6221 (1997); vonBulow et al., Science, 278:138-141 (1997)).
Большинство членов семейства рецепторов TNF имеют общую характерную структуру рецепторов клеточной поверхности, включая внеклеточные, трансмембранные и внутриклеточные области, но некоторые из них находятся в природе в виде растворимых белков, утратившие трансмембранный и внутриклеточный домен. Внеклеточная часть характерных рецепторов TNF содержит рисунок повторяющейся аминокислотной последовательности со множественными доменами, богатыми цистеином (CRD), начиная с NH2-конца.
Лиганд, известный как Apo-2L или TRAIL, несколько лет назад был идентифицирован как член семейства цитокинов TNF (см., например, Wiley et al., Immunity, 3:673-682 (1995); Pitti et al., J. Biol. Chem., 271:12697-12690 (1996); WO 97/01633; WO 97/25428; патент США 5763223, выданный 9 июня 1998 г., патент США 6284236, выданный 4 сентября 2001 г.). Полная длина природной последовательности полипептида человека Apo2L/TRAIL составляет 281 аминокислотный остаток, из которых сформирован трансмембранный белок II типа. Некоторые клетки могут продуцировать природную растворимую форму полипептида, существующую, благодаря ферментативному расщеплению его внеклеточной области (Mariani et al., J. Biol. Chem., 137:221-229 (1997)). Кристаллографические исследования растворимых форм Apo2L/TRAIL отражают гомотримерную структуру, сходную со структурами TNF и других родственных белков (Hymowitz et al., Molec. Cell, 4:563-571 (1999); Cha et al., Immunity, 11:253-261 (1999); Mongkolsapaya et al., Nature Structural Biology, 6:1048 (1999); Hymowitz et al., Biochemistry, 39:633-644 (2000)). Однако было обнаружено, что, в отличие от других членов семейства TNF, белок Apo2L/TRAIL имеет уникальный структурный признак, заключающийся в том, что три остатка цистеина (в 230-м положении каждой субъединицы гомотримера) совместно координируют атом цинка, а связывание цинка важно для стабильности и биологической активности тримера (Hymowitz et al., выше; Bodmer et al., J. Biol. Chem., 275:20632-20637 (2000)).
В литературе были опубликованы сведения о том, что Apo2L/TRAIL может играть роль в модулировании иммунной системы, включая аутоиммунные заболевания, например ревматоидный артрит [см., например, Thomas et al., J. Immunol., 161:2195-2200 (1998); Johnsen et al., Cytokine, 11:664-672 (1999); Griffith et al., J. Exp. Med., 189:1343-1353 (1999); Song et al., J. Exp. Med., 191:1095-1103 (2000)].
Сообщалось также о том, что растворимые формы Apo2L/TRAIL индуцируют апоптоз во многих типах раковых клеток, включая опухоли толстой кишки, легких, молочной железы, простаты, мочевого пузыря, почек, яичников и головного мозга, а также меланому, лейкоз и множественную миелому (см., например, Wiley et al., выше; Pitti et al., выше; патент США 6030945, выданный 29 февраля 2000 г.; патент США 6746668, выданный 8 июня 2004 г.; Rieger et al., FEBS Letters, 427:124-128 (1998); Ashkenazi et al., J. Clin. Invest., 104:155-162 (1999); Walczak et al., Nature Med., 5:157-163 (1999); Keane et al., Cancer Research, 59:734-741 (1999); Mizutani et al., Clin. Cancer Res., 5:2605-2612 (1999); Gazitt, Leukemia, 13:1817-1824 (1999); Yu et al., Cancer Res., 60:2384-2389 (2000); Chinnaiyan et al., Proc. Natl. Acad. Sci., 97:1754-1759 (2000)). Кроме того, исследования in vivo на моделях опухолей у мышей позволили предположить, что Apo2L/TRAIL один или в комбинации с химиотерапией или лучевой терапией может запускать значительные противоопухолевые эффекты (см., например, Ashkenazi et al., выше; Walzcak et al., выше; Gliniak et al., Cancer Res., 59:6153-6158 (1999); Chinnaiyan et al., выше; Roth et al., Biochem. Biophys. Res. Comm., 265:1999 (1999); публикация PCT US/00/15512; публикация PCT US/01/23691. В отличие от многих типов раковых клеток большинство клеток нормального типа в организме человека проявляют устойчивость к индуцированию апоптоза определенными рекомбинантными формами Apo2L/TRAIL (Ashkenazi et al., выше; Walzcak et al., выше). Jo et al. сообщили о том, что меченная полигистидином растворимая форма Apo2L/TRAIL индуцирует апоптоз in vitro в нормальных выделенных гепатоцитах человека, но не в гепатоцитах другого биологического происхождения (Jo et al., Nature Med., 6:564-567 (2000); см. также Nagata, Nature Med., 6:502-503 (2000)). Полагают, что некоторые рекомбинантные препараты Apo2L/TRAIL могут изменяться в плане биохимических свойств и биологической активности по отношению к нормальным и патологически измененным клеткам в зависимости, например, от наличия или отсутствия молекулы-метки, от содержания цинка и процентного содержания тримера (см. Lawrence et al., Nature Med., Letter to the Editor, 7:383-385 (2001); Qin et al., Nature Med., Letter to the Editor, 7:385-386 (2001)).
Было установлено, что Apo2L/TRAIL может связываться по меньшей мере с пятью разными рецепторами. По меньшей мере два из рецепторов, связывающихся с Apo2L/TRAIL, содержат функциональный цитоплазматический домен клеточной смерти. Один из рецепторов носит название "DR4" (альтернативно он называется TR4 или TRAIL-R1) (Pan et al., Science, 276:111-113 (1997); см. также WO 98/32856, опубликованный 30 июля 1998 г.; WO 99/37684, опубликованный 29 июля 1999 г.; WO 00/73349, опубликованный 7 декабря 2000 г.; US 2003/0036168, опубликованный 20 февраля 2003 г.; US 6433147, выданный 13 августа 2002 г.; US 6461823, выданный 8 октября 2002 г., и US 6342383, выданный 29 января 2002 г.).
Другой такой рецептор для Apo2L/TRAIL называется DR5 (альтернативно он называется Apo-2; TRAIL-R или TRAIL-R2, TR6, Tango-63, hAPО8, TRICK2 или KILLER) (см., например, Sheridan et al., Science, 277:818-821 (1997), Pan et al., Science, 277:815-818 (1997), WO 98/51793, опубликованный 19 ноября 1998 г.; WO 98/41629, опубликованный 24 сентября 1998 г.; Screaton et al., Curr. Biol., 2:693-696 (1997); Walczak et al., EMBO J., 16:5386-5387 (1997); Wu et al., Nature Genetics, 17:141-143 (1997); WO 98/35986, опубликованный 20 августа 1998 г.; EP870827, опубликованный 14 октября 1998 г.; WO 98/46643, опубликованный 22 октября 1998 г.; WO 99/02653, опубликованный 21 января 1999 г.; WO 99/09165, опубликованный 25 февраля 1999 г.; WO 99/11791, опубликованный 11 марта 1999 г.; WO 03/042367, опубликованный 22 мая 2003 г.; WO 02/097033, опубликованный 5 декабря 2002 г.; WO 03/038043, опубликованный 8 мая 2003 г.; US 2002/0072091, опубликованный 13 августа 2002 г.; US 2002/0098550, опубликованный 7 декабря 2001 г.; US 6313269, выданный 6 декабря 2001 г.; US 2001/0010924, опубликованный 2 августа 2001 г.; US 2003/01255540, опубликованный 3 июля 2003 г.; US 2002/0160446, опубликованный 31 октября 2002 г., US 2002/0048785, опубликованный 25 апреля 2002 г.; US 2004/0141952, опубликованный 22 июля 2004 г.; US 2005/0129699, опубликованный 16 июня 2005 г.; US 2005/0129616, опубликованный 16 июня 2005 г.; US 6342369, выданный в феврале 2002 г.; US 6569642, выданный 27 мая 2003 г., US 6072047, выданный 6 июня 2000 г., US 6642358, выданный 4 ноября 2003 г.; US 6743625, выданный 1 июня 2004 г.). Сообщалось, что, подобно DR4, DR5 он содержит цитоплазматический домен клеточной смерти и способен передавать сигнал апоптоза при связывании с лигандом (или при связывании с такой молекулой, как агонистическое антитело, которое имитирует активность лиганда). Кристаллическая структура комплекса, образующегося между Apo-2L/TRAIL и DR5, описана в работе Hymowitz et al., Molecular Cell, 4:563-571 (1999).
При связывании с лигандом как DR4, так и DR5 могут независимым образом запускать апоптоз, привлекая и активируя фактор инициации апоптоза, каспазу-8, через адапторную молекулу, содержащую домен клеточной смерти и известную как FADD/Mort1 [Kischkel et al., Immunity, 12:611-620 (2000); Sprick et al., Immunity, 12:599-609 (2000); Bodmer et al., Nature Cell Biol., 2:241-243 (2000)].
Были опубликованы сведения о том, что Apo2L/TRAIL также связывается с рецепторами, известными как DcR1, DcR2 и OPG, которые, по мнению исследователей, действуют скорее как ингибиторы, а не передатчики сигналов (см., например, DCR1 (также называемый TRID, LIT или TRAIL-R3) [Pan et al., Science, 276:111-113 (1997); Sheridan et al., Science, 277:818-821 (1997); McFarlane et al., J. Biol. Chem., 272:25417-25420 (1997); Schneider et al., FEBS Letters, 416:329-334 (1997); Degli-Esposti et al., J. Exp. Med., 186:1165-1170 (1997); а также Mongkolsapaya et al., J. Immunol., 160:3-6 (1998)]; DCR2 (также имеющий названия TRUNDD или TRAIL-R4) [Marsters et al., Curr. Biol., 7:1003-1006 (1997); Pan et al., FEBS Letters, 424:41-45 (1998); Degli-Esposti et al., Immunity, 7:813-820 (1997)], и OPG [Simonet et al., выше]). В отличие от DR4 и DR5 рецепторы DcR1 и DcR2 не передают сигналов апоптоза.
В литературе описаны некоторые антитела, связывающиеся с рецепторами DR4 и/или DR5. Например, анти-DR4 антитела, направленные на рецептор DR4 и проявляющие агонистическую или апоптотическую активность в некоторых клетках млекопитающих, описаны в таких документах, как WO 99/37684, опубликованный 29 июля 1999 г.; WO 00/73349, опубликованный 12 июля 2000 г.; WO 03/066661, опубликованный 14 августа 2003 г. См. также, например, Griffith et al., J. Immunol., 162:2597-2605 (1999); Chuntharapai et al., J. Immunol., 166:4891-4898 (2001); WO 02/097033, опубликованный 2 декабря 2002 г.; WO 03/042367, опубликованный 22 мая 2003 г.; WO 03/038043, опубликованный 8 мая 2003 г.; WO 03/037913, опубликованный 8 мая 2003 г.; US 2003/0073187, опубликованный 17 апреля 2003 г.; US 2003/0108516, опубликованный 12 июня 2003 г. Подобно этому были описаны некоторые анти-DR5 антитела, см., например, WO 98/51793, опубликованный 8 ноября 1998 г.; Griffith et al., J. Immunol., 162:2597-2605 (1999); Ichikawa et al., Nature Med., 7:954-960 (2001); Hylander et al., "Антитело к DR5 (рецептору TRAIL-2) подавляет рост полученных у больных клеток желудочно-кишечных опухолей у мышей линии SCID", тезисы, 2-й Международный конгресс по моноклональным антителам при раке, 29 августа - 1 сентября 2002 г., Банф, Альберта, Канада; WO 03/038043, опубликованный 8 мая 2003 г.; WO 03/037913, опубликованный 8 мая 2003 г.; US 2003/0180296, опубликованный 25 сентября 2003 г. В дополнение к этому, в литературе описаны некоторые антитела, проявляющие перекрестную реактивность как с рецепторами DR4, так и с рецепторами DR5 (см., например, патент США 6252050, выданный 26 июня 2001 г.).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Раскрытое изобретение относится к способам и аналитическим подходам к исследованию экспрессии одного и более биомаркеров в образцах тканей или клеток млекопитающих, причем экспрессия одного или более таких биомаркеров служит прогностическим индикатором чувствительности указанных образцов клеток и тканей к таким агентам, как Apo2L/TRAIL или агонистические анти-DR5 антитела. В различных вариантах осуществления изобретения указанные способы и аналитические подходы позволяют исследовать экспрессию молекул в семействе белков GalNac-T, в особенности, GalNAc-T14 или GalNAc-T3.
Как обсуждалось выше, большинство здоровых клеток в организме человека проявляют устойчивость к индуцированию апоптоза определенными рекомбинантными формами Apo2L/TRAIL (Ashkenazi et al., выше; Walzcak et al., выше; Walzcak et al., выше). Были также сделаны наблюдения о том, что некоторые популяции клеток человека, пораженных заболеванием (например, некоторые популяции раковых клеток), устойчивы к индуцированию апоптоза определенными рекомбинантными формами Apo2L/TRAIL (Ashkenazi et al., J. Clin. Invest., 1999, выше; Walczak et al., Nature Med., 1999, выше). Следовательно, изучая образец ткани или клеток на экспрессию избранных биомаркеров при помощи такого анализа, можно удобным и эффективным образом получить полезную информацию для оценки/выбора подходящих и эффективных методов терапии. Например, информация, полученная из анализа по выявлению экспрессии GalNac-T14 в образце ткани или клеток млекопитающего, может дать врачу полезные сведения, которые можно использовать при выборе оптимальной схемы терапии (с применением Apo2L/TRAIL или агонистических антител рецепторов клеточной смерти) для больных, страдающих раком или заболеванием, связанным с нарушением иммунитета, например аутоиммунным заболеванием.
Изобретение относится к способам прогнозирования чувствительности образцов тканей или клеток млекопитающих (например, раковых клеток) к Apo2L/TRAIL или агонистическим антителам рецепторов клеточной смерти. В некоторых вариантах осуществления изобретения указанные способы включают получение образца ткани или клеток млекопитающего и исследование этого образца ткани или клеток на экспрессию GalNac-T14. Указанные способы можно осуществлять в разнообразных форматах анализа, включая анализы по выявлению экспрессии мРНК и/или белка, анализы на ферментативную активность и другие виды анализов, обсуждаемые в настоящем описании. Определение экспрессии GalNac-T14 в указанных тканях или клетках имеет значение для предсказания чувствительности таких тканей или клеток к индуцирующей апоптоз активности Apo2L/TRAIL и/или к антителам рецепторов клеточной смерти. В некоторых (по выбору) вариантах осуществления изобретения ткани или клетки также можно исследовать на экспрессию рецепторов DR4, DR5, DcR1 или DcR2.
Дополнительные способы по изобретению включают способы индуцирования апоптоза в образце ткани или клеток млекопитающего, включающие стадии получения образца ткани или клеток, исследования ткани или клеток на экспрессию GalNac-T14 и, при выявлении того, что указанный образец ткани или клеток экспрессирует GalNac-T14, этап воздействия на этот образец эффективного количества Apo2L/TRAIL или агонистических антител рецепторов клеточной смерти. Указанные этапы способов исследования экспрессии GalNac-T14 можно осуществлять в разнообразных форматах анализа, включая анализы по выявлению экспрессии мРНК и/или белка, анализы на ферментативную активность и другие виды анализов, обсуждаемые в настоящем описании. В некоторых (по выбору) вариантах осуществления изобретения указанные способы также включают исследование образца ткани или клеток на экспрессию рецепторов DR4, DR5, DcR1 или DcR2. Необязательно, образец ткани или клеток содержит раковую ткань или клетки. Необязательно, образец ткани или клеток содержит клетки немелкоклеточного рака легких, клетки рака поджелудочной железы, клетки рака молочной железы или клетки неходжкинской лимфомы.
Еще одна серия способов по изобретению включает способы лечения заболевания у млекопитающего, например, рака или заболевания, связанного с нарушением иммунитета, причем указанные способы включают этапы получения образца ткани или клеток, исследования ткани или клеток на экспрессию GalNac-T14 и, при выявлении того, что указанный образец ткани или клеток экспрессирует GalNac-T14, введения указанному млекопитающему эффективного количества Apo2L/TRAIL или агонистических антител рецепторов клеточной смерти. Указанные этапы способов исследования экспрессии одного или более биомаркеров можно осуществлять в разнообразных форматах анализа, включая анализы по выявлению экспрессии мРНК и/или белка, анализы на ферментативную активность и другие виды анализов, обсуждаемые в настоящем описании. В некоторых (по выбору) вариантах осуществления изобретения указанные способы также включают исследование образца ткани или клеток на экспрессию рецепторов DR4, DR5, DcR1 или DcR2. Необязательно, способы включают лечение рака млекопитающего. Необязательно, способы, кроме ведения эффективного количества Apo2L/TRAIL и/или агонистических антител рецепторов клеточной смерти, включают введение указанному млекопитающему химиотерапевтического средства (средств) или проведение лучевой терапии.
В других вариантах осуществления изобретения вышеуказанные способы могут включать исследование тканей или клеток млекопитающих на экспрессию других молекул GalNac-T, например, GalNac-T3.
Другие варианты осуществления изобретения для примера можно проиллюстрировать в следующих пунктах патентной формулы:
1. Способ предсказания чувствительности образца ткани или клеток млекопитающего к Apo2L/TRAIL, включающий стадии:
получения образца ткани или клеток млекопитающего;
исследования образца ткани или клеток с целью выявления экспрессии GalNac-T14, причем экспрессия указанного GalNac-T14 позволяет предсказать, что указанный образец ткани или клеток чувствителен к индуцирующей апоптоз активности Apo2L/TRAIL.
2. Способ по п.1, в котором указанную экспрессию GalNac-T14 исследуют, определяя экспрессию мРНК GalNac-T14.
3. Способ по п.1, в котором указанную экспрессию GalNac-T14 исследуют методами иммуногистохимии.
4. Способ по п.1, дополнительно включающий стадию исследования экспрессии рецепторов DR4, DR5, DcR1 или DcR2 в указанном образце ткани или клеток.
5. Способ по п.1, в котором образец ткани или клеток содержит раковую ткань или клетки.
6. Способ по п.5, в котором указанные раковые клетки или ткань представляют собой материал из раковых опухолей поджелудочной железы, лимфомы или немелкоклеточного рака легких.
7. Способ индуцирования апоптоза в образце ткани или клеток млекопитающего, включающий стадии:
получения образца ткани или клеток млекопитающего;
исследования образца ткани или клеток с целью выявления экспрессии GalNac-T14 и, при выявлении такой экспрессии, последующего воздействия на указанный образец ткани или клеток эффективного количества Apo2L/TRAIL.
8. Способ по п.7, в котором указанную экспрессию GalNac-T14 исследуют, определяя экспрессию мРНК GalNac-T14.
9. Способ по п.7, в котором указанную экспрессию GalNac-T14 исследуют методами иммуногистохимии.
10. Способ по п.7, дополнительно включающий стадию исследования экспрессии рецепторов DR4, DR5, DcR1 или DcR2 в указанном образце ткани или клеток.
11. Способ по п.7, в котором указанный образец ткани или клеток содержит раковую ткань или клетки.
12. Способ по п.11, в котором указанные раковые клетки или ткань представляют собой материал из раковых опухолей поджелудочной железы, лимфомы или немелкоклеточного рака легких.
13. Способ по п.7, в котором указанные клетки подвергают воздействию эффективного количества полипептида Apo2L/TRAIL, содержащего аминокислоты 114-281 в соответствии с фиг.1.
14. Способ лечения заболевания у млекопитающего, например, связанного с нарушением иммунитета или ракового, включающий стадии:
получения образца ткани или клеток от указанного млекопитающего;
исследования образца ткани или клеток с целью выявления экспрессии GalNac-T14 и, при выявлении такой экспрессии, введения указанному млекопитающему эффективного количества Apo2L/TRAIL.
15. Способ по п.14, в котором указанную экспрессию GalNac-T14 исследуют, определяя экспрессию мРНК GalNac-T14.
16. Способ по п.14, в котором указанную экспрессию GalNac-T14 исследуют методами иммуногистохимии.
17. Способ по п.14, дополнительно включающий стадию исследования экспрессии рецепторов DR4, DR5, DcR1 или DcR2 в указанной ткани или клетках.
18. Способ по п.14, в котором образец ткани или клеток содержит раковую ткань или клетки.
19. Способ по п.18, в котором указанные раковые клетки или ткань представляют собой материал из раковых опухолей поджелудочной железы, лимфомы или немелкоклеточного рака легких.
20. Способ по п.14, в котором указанному млекопитающему вводят эффективное количество полипептида Apo2L/TRAIL, содержащего аминокислоты 114-281 в соответствии с фиг.1.
21. Способ по п.14, в котором указанному млекопитающему также вводят химиотерапевтическое средство (средства) или назначают лучевую терапию.
22. Способ по п.14, в котором указанному млекопитающему также вводят цитокин, цитотоксический агент или ингибитор клеточного роста.
23. Способ по п.7, в котором указанный полипептид Apo2L/TRAIL соединен с молекулой полиэтиленгликоля.
24. Способ по п.14, в котором указанный полипептид Apo2L/TRAIL соединен с молекулой полиэтиленгликоля.
25. Способ предсказания чувствительности образца ткани или клеток млекопитающего к антителам рецепторов клеточной смерти, включающий стадии:
получения образца ткани или клеток млекопитающего;
исследования образца ткани или клеток с целью выявления экспрессии GalNac-T14, причем экспрессия указанного GalNac-T14 позволяет предсказать, что указанный образец ткани или клеток чувствителен к индуцирующей апоптоз активности антител рецепторов клеточной смерти.
26. Способ по п.25, в котором указанную экспрессию GalNac-T14 исследуют, определяя экспрессию мРНК GalNac-T14.
27. Способ по п.25, в котором указанную экспрессию GalNac-T14 исследуют методами иммуногистохимии.
28. Способ по п.25, дополнительно включающий стадию исследования экспрессии рецепторов DR4, DR5, DcR1 или DcR2 в указанном образце ткани или клеток.
29. Способ по п.25, в котором образец ткани или клеток содержит раковую ткань или клетки.
30. Способ по п.29, в котором указанные раковые клетки или ткань представляют собой материал из раковых опухолей поджелудочной железы, лимфомы или немелкоклеточного рака легких.
31. Способ по п.25, в котором указанные антитела рецепторов клеточной смерти представляют собой агонистические анти-DR4 и анти-DR5 антитела.
32. Способ индуцирования апоптоза в образце ткани или клеток млекопитающего, включающий стадии:
получения образца ткани или клеток млекопитающего;
исследования образца ткани или клеток с целью выявления экспрессии GalNac-T14 и, при выявлении такой экспрессии, последующего воздействия на указанный образец ткани или клеток эффективного количества антител рецепторов клеточной смерти.
33. Способ по п.32, в котором указанную экспрессию GalNac-T14 исследуют, определяя экспрессию мРНК GalNac-T14.
34. Способ по п.32, в котором указанную экспрессию GalNac-T14 исследуют методами иммуногистохимии.
35. Способ по п.32, дополнительно включающий стадию исследования экспрессии рецепторов DR4, DR5, DcR1 или DcR2 в указанном образце ткани или клеток.
36. Способ по п.32, в котором указанный образец ткани или клеток содержит раковую ткань или клетки.
37. Способ по п.36, в котором указанные раковые клетки представляют собой раковые клетки или ткань поджелудочной железы, лимфомы или немелкоклеточного рака легких.
38. Способ по п.32, в котором указанные клетки подвергают воздействию эффективного количества агонистических антител DR4 или DR5.
39. Способ по п.38, в котором указанные клетки подвергают воздействию эффективного количества агонистических антител DR5, которые связываются с рецептором DR5, представленным на фиг.3A.
40. Способ лечения заболевания у млекопитающего, например, связанного с нарушением иммунитета или ракового, включающий стадии:
получения образца ткани или клеток от указанного млекопитающего;
исследования образца ткани или клеток с целью выявления экспрессии GalNac-T14 и, при выявлении такой экспрессии, последующего введения указанному млекопитающему эффективного количества антител рецепторов клеточной смерти.
41. Способ по п.40, в котором указанную экспрессию GalNac-T14 исследуют, определяя экспрессию мРНК GalNac-T14.
42. Способ по п.40, в котором указанную экспрессию GalNac-T14 исследуют методами иммуногистохимии.
43. Способ по п.40, дополнительно включающий стадию исследования экспрессии рецепторов DR4, DR5, DcR1 или DcR2 в указанной ткани или клетках.
44. Способ по п.40, в котором образец ткани или клеток содержит раковую ткань или клетки.
45. Способ по п.44, в котором указанные раковые клетки или ткань представляют собой материал из раковых опухолей поджелудочной железы, лимфомы или немелкоклеточного рака легких.
46. Способ по п.40, в котором указанному млекопитающему вводят эффективное количество анти-DR4 или анти-DR5 антител.
47. Способ по п.40, в котором указанному млекопитающему также вводят химиотерапевтическое средство (средства) или назначают лучевую терапию.
48. Способ по п.40, в котором указанному млекопитающему также вводят цитокин, цитотоксический агент или ингибитор клеточного роста.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг.1 представлена нуклеотидная последовательность кДНК лиганда Apo-2 человека (SEQ ID NO:2) и ее производная аминокислотная последовательность (SEQ ID NO:1). Символ "N" в положении нуклеотида 447 используется для того, чтобы указать, что нуклеотидным основанием может быть "T" (тимин) или "G" (гуанин).
На фиг.2A и 2B представлена нуклеотидная последовательность кДНК (SEQ ID NO:4) DR4 человека полной длины и ее производная аминокислотная последовательность (SEQ ID NO:3). Соответствующие нуклеотидная и аминокислотная последовательности DR4 человека также опубликованы в статье Pan et al., Science, 276:111 (1997).
На фиг.3A представлена аминокислотная последовательность из 411 аминокислотных остатков (SEQ ID NO:5) DR5 человека в том виде, как она была опубликована в WO 98/51793 от 19 ноября 1998 г. В данной области известен транскрипционный вариант сплайсинга DR5 человека. Этот вариант сплайсинга DR5 кодирует последовательность из 440 аминокислот (SEQ ID NO:6) DR5 человека, представленную на фиг.3B и 3C в том виде, как она была опубликована в WO 98/35986 от 20 августа 1998 г.
На фиг.3D-1, 3D-2 и 3D-3 представлена нуклеотидная последовательность кДНК (SEQ ID NO:7) для DcR1 человека полной длины и ее производная аминокислотная последовательность (SEQ ID NO:8). Соответствующие нуклеотидная и аминокислотная последовательности для DcR1 человека (и их специфические домены) также показаны и описаны в WO 98/58062.
На фиг.3E (3Е-1, 3Е-2) представлена нуклеотидная последовательности кДНК (SEQ ID NO:9) для DcR2 человека полной длины и ее производная аминокислотная последовательность (SEQ ID NO:10). Соответствующие нуклеотидная и аминокислотная последовательности для DcR2 человека (и их специфические домены) также показаны в WO 99/10484.
На фиг.4A (4А-1-4А-4) представлена нуклеотидная последовательность GalNac-T14 человека (SEQ ID NO:11) и ее производная аминокислотная последовательность (SEQ ID NO:12). Эти последовательности также описаны Wang et al., BBRC, 300:738-744 (2003).
На фиг.4B (4В-1-4В-4) представлена нуклеотидная последовательность GalNac-T3 человека (SEQ ID NO:13) и ее производная аминокислотная последовательность (SEQ ID NO:14). Эти последовательности также описаны Bennett et al., J. Biol. Chem., 271:17006-17012 (1996).
На фиг.5 представлена краткая схема IC50 по данным, полученным при анализе клеточных линий немелкоклеточного рака легких ("NSCLC") на чувствительность или устойчивость к апоптотической активности Apo2L (+0,5% фетальной бычьей сыворотки "FBS" или 10% FBS) либо к моноклональным антителам DR5 "DR5 ab", поперечно связанным "XL" или несвязанным (+0,5% фетальной бычьей сыворотки "FBS" или 10% FBS) по результатам измерений в анализах MTT на цитотоксичность.
На фиг.6 представлена краткая схема IC50 по данным, полученным при анализе клеточных линий рака поджелудоыной железы на чувствительность или устойчивость к апоптотической активности Apo2L (+0,5% фетальной бычьей сыворотки "FBS" или 10% FBS) либо к моноклональным антителам DR5 "DR5 ab", поперечно связанным "XL" или несвязанным (+0,5% фетальной бычьей сыворотки "FBS" или 10% FBS) по результатам измерений в анализах MTT на цитотоксичность.
На фиг.7 представлена краткая схема IC50 по данным, полученным при анализе раковых клеточных линий неходжкинской лимфомы ("NHL") на чувствительность или устойчивость к апоптотической активности Apo2L (+10% фетальной бычьей сыворотки "FBS") либо к моноклональным антителам DR5 "DR5 ab", поперечно связанным "XL" или не связанным (+10% фетальной бычьей сыворотки "FBS") по результатам измерений в анализах MTT на цитотоксичность.
На фиг.8 представлено сравнение чувствительности ("sen") или устойчивости ("RES") избранных линий раковых клеток NSCLC, рака поджелудочной железы и NHL к антителам DR5, а также корреляция с экспрессией GalNac-T14 при измерении по экспрессии мРНК GalNac-T14.
На фиг.9 представлен в виде столбчатой диаграммы график, отображающий различные клеточные линии NSCLC, рака поджелудочной железы и NHL, ранжированные (в нисходящем порядке) по уровню экспрессии мРНК GalNac-T14.
На фиг.10A-D проиллюстрирована дифференциальная экспрессия специфических ферментов O-гликозилирования в линиях раковых клеток, чувствительных и устойчивых к Apo2L/TRAIL: (A) Жизнеспособность клеток измеряли после инкубации с разными дозами Apo2L/TRAIL. Показатель IC50 для каждой клеточной линии рассчитывали как концентрацию Apo2L/TRAIL, которая снижает жизнеспособность клеток на 50%. Каждый эксперимент по анализу жизнеспособности клеток повторяли по меньшей мере три раза в присутствии низкой (0,5%) и высокой (10%) концентрации фетальной бычьей сыворотки. Черные, серые или незакрашенные символы отображают клеточные линии, высоко чувствительные, умеренно чувствительные или устойчивые к Apo2L/TRAIL соответственно. (B) Уровень экспрессии мРНК ppGalNAcT-14 (набор зондов 219271_at) в клеточных линиях рака поджелудочной железы и злокачественной меланомы. Клеточные линии упорядочены по типу ткани и чувствительности к Apo2L/TRAIL. Черные, серые или незакрашенные символы отображают клеточные линии в соответствии с фрагментом A. (C) Уровень экспрессии мРНК Fut-6 (верхняя область, набор зондов 211885_x_at) и ppGalNAcT-3 (нижняя область, набор зондов 203397_s_at) в клеточных линиях колоректального (ободочной и прямой кишки) рака. Клеточные линии упорядочены в соответствии с фрагментом B. Значения P в областях B и C основаны на критерии корреляции Фишера по чувствительности клеточных линий (включая высокие и умеренные показатели), а также по экспрессии мРНК выше точки отсечения. (D) Влияние Apo2L/TRAIL на рост доказанных опухолевых ксенотрансплантатов. Бестимусные "голые" мыши (с мутацией по гену nude), несущие GalNAcT-3/Fut-6-позитивные (левая панель) или GalNAcT-3/Fut-6-негативные (правая панель) опухоли, получали пустой вектор или Apo2L/TRAIL (60 мг/кг/день интраперитонеально с 0-го по 4-й день) с мониторингом объема опухоли (средняя±стандартное отклонение, N=10 мышей на группу).
На фиг.11 проиллюстрирована модуляция специфических ферментов O-гликозилирования, изменяющих чувствительность к Apo2L/TRAIL. (A) Клетки Colo205 были предварительно инкубированы с универсальным ингибитором ферментов O-гликозилирования бензил-GalNAc (bGalNAc) и обработаны Apo2L/TRAIL в течение 24 часов, после чего определяли жизнеспособность клеток (ДМСО = контроль с пустым вектором). (B) Клетки PSN-1 (карциномы поджелудочной железы) и Hs294T (меланомы) были трансфицированы siРНК (малыми интерферирующими РНК) каспазы-8 или ppGalNAcT-14 в течение 48 часов, затем инкубированы с Apo2L/TRAIL еще в течение 24 часов, после чего определяли жизнеспособность клеток. В качестве контроля (NTC) были использованы дуплексы siРНК против нецелевой последовательности (Dharmacon). (C) Клетки колоректальной карциномы DLD-1 были трансфицированы siРНК ppGalNAcT-3 или Fut-6 и исследованы в соответствии с пунктом B. (D) Клетки HEK293 были котрансфицированы плазмидами, кодирующими индикаторные гены в комбинации с ppGalNAcT-14 или векторным контролем. Апоптоз оценивали через 24 часа при помощи окрашивания Annexin V (левая панель). Клетки меланомы H1569 были трансдуцированы ретровирусом, управляющим экспрессией ppGalNAcT-14, или контрольным ретровирусом; полученные в результате клеточные пулы обрабатывали Apo2L/TRAIL в течение 24 часов с последующим определением жизнеспособности клеток (правая панель). Для верификации экспрессии ppGalNAcT-14 с меченым эпитопом применяли вестерн-блоттинг с анти-FLAG антителами.
На фиг.12 проиллюстрирован (A) анализ каскада каспазы, индуцированного Apo2L/TRAIL. Клетки PSN-1 и DLD-1 были трансфицированы siРНК ppGalNAcT-14 или Fut-6 соответственно в течение 48 часов. Затем клетки обрабатывали Apo2L/TRAIL в течение 4 или 8 часов, а клеточные лизаты анализировали иммуноблоттингом с антителами, специфичными для каспазы-8, Bid, каспазы-9, каспазы-3 или с актином, использованным в качестве загрузочного контроля. (B) Клетки PSN-1 были трансфицированы siРНК ppGalNAcT-14 в соответствии с пунктом A, затем обработаны Apo2L/TRAIL в течение 4 часов, после чего в клеточных лизатах определяли ферментативную активность каспазы-3/7. (C) Анализ Apo2L/TRAIL по методике DISC. Клетки PSN-1 были трансфицированы siРНК ppGalNAcT-14 в соответствии с пунктом A. Затем к этим клеткам добавляли FLAG-Apo2L/TRAIL (1 мг/мл) на 0-60 минут, клетки лизировали и подвергали иммунопреципитации с анти-FLAG антителами. При помощи иммуноблоттинга определяли DISC-ассоциированный FADD, каспазу-8, DR4. (D) Клетки PSN-1 были трансфицированы, обработаны и подвергнуты иммунопреципитации по методике DISC в соответствии с пунктом C, после чего DISC-ассоциированную ферментативную активность каспазы-8 измеряли так, как это было описано ранее (Sharp et al., J. Biol. Chem., 280:19401 (2005)).
На фиг.13 проиллюстрирован (A) моносахаридный анализ рекомбинантного DR5 человека (длинный вариант сплайсинга), выработанного в клетках CHO, который был проведен по методике HPAEC-PAD (анион-обменная хроматография высокого разрешения с пульсирующим амперометрическим выявлением). (B) Сравнение последовательностей рецепторов Apo2L/TRAIL человека (DR5 человека длиной 440 аминокислот - форма "hDR5L", DR5 человека длиной 411 аминокислот - короткая форма "hDR5S" и hDR4), DR5 мыши (mDR5), Fas человека (hFas) и TNFR1 человека (hTNFR1). Прямоугольники показывают предположительные сайты O-гликозилирования. (C) Анализ методом иммуноблоттинга всех клеточных лизатов, соответствующих пункту D. DR5L-5T и DR5S-5T представляют собой конструкции, содержащие 5 замен треонина на аланин, а DR5L-5T3S и DR5S-5T3S представляют собой конструкции, содержащие 5 замен треонина на аланин и три замены серина на аланин соответственно, в тех аминокислотных остатках, которые, предположительно, являются сайтами O-гликозилирования. (D) Клетки HEK293 были котрансфицированы индикаторными конструкциями DR5 вместе с вектором или плазмидой ppGalNAcT-14 в течение 48 часов, после чего определяли апоптоз окрашиванием Annexin V. (E) Уровень экспрессии мРНК для ppGalNAcT-14 (чип Affymetrix, набор зондов 219271_at) в первичных образцах опухолей человека: рак кожи (SCC = плоскоклеточная карцинома), рак легких, рак поджелудочной железы (Panc), рак молочной железы, рак яичников (Ov), рак эндометрия (Endo), рак мочевого пузыря (Bla, TCC=переходноклеточная карцинома) и NHL (FL=фолликулярная лимфома, DLBCL=диффузная крупная B-клеточная лимфома). Средняя экспрессия в образцах для каждого класса показана серыми горизонтальными полосками. Показано отсечение на уровне 500 и 200 (меланома) в соответствии с данными по клеточной линии из фиг.10B.
На фиг.14 проиллюстрировано (A) снижение экспрессии мРНК ppGalNAcT-14 или ppGalNAcT-3 в клетках PSN-1 или DLD-1 после 48-часового нокдауна siРНК, оцененное в анализе Такмана. (B) Экспрессия GalNAcT-14 в клетках PSN-1 восстанавливается при трансфекции пустой плазмидой (Empty), GalNAcT-14 дикого типа (GalNAcT-14) или GalNAcT-14, содержащего молчащие мутации siРНК (GalNAcT-14 si(1)Mut) после опосредованного siGalNAcT-14 (1) нокдауна ppGalNAcT-14. (C) Ингибирование ppGalNAcT-3 или Fut-6 посредством интерферирующих РНК подавляет индуцированную Apo2L/TRAIL клеточную смерть в клетках C170 (колоректальный рак). Процедура эксперимента соответствует пункту 11C. (Таблица 1) A) Сводная таблица фенотипов, полученных в результате нокдауна siРНК. Линии клеток, в которых ингибирование GalNAcT-14 или ppGalNAcT-3 и Fut-6 приводило к защите от Apo2L/TRAIL, маркированы с указанием защиты менее (+) или более 50% (++) с тестированием по меньшей мере одного олигонуклеотида siРНК. (0) указывает на отсутствие защиты против Apo2L/TRAIL. (D), (E) После 48-часового нокдауна индикаторными siРНК клетки обрабатывали нарастающими дозами этопозида или стауроспорина (STS) в течение 24 часов и анализировали на жизнеспособность. (F) Пулы клеток с ретровирусным ppGalNAcT-14 (с избыточной экспрессией PA-TU-8902) и клеточной линии PL-45 анализировали на жизнеспособность клеток после обработки Apo2L/TRAIL. Анализ по методу вестерн-блоттинга с анти-FLAG антителами указывает на ретровирусную экспрессию ppGalNAcT-14 в указанных клетках.
Фиг.15(A). Анализ по методу вестерн-блоттинга с определением индуцированного Apo2L/TRAIL каскада активации каспазы в клетках Colo205, чувствительных к Apo2L/TRAIL, и клетках колоректального рака, устойчивых к Apo2L/TRAIL, а также в клеточных линиях RKO и SW1417. Клетки обрабатывали 1000 нг/мл Apo2L/TRAIL в течение 8 и 24 часов, а полученные клеточные лизаты подвергали анализу методом вестерн-блоттинга с антителами, специфичными в отношении каспазы-8, Bid, каспазы-9, каспазы-3 и с актином в качестве загрузочного контроля. (B) Нокдаун с ограниченным привлечением Fut-6 и активацией каспазы-8 в клетках DLD-1 по методике Apo2L/TRAIL DISC. Процедура эксперимента соответствует пункту 12D. (C) Экспрессию DR4 и DR5 на клеточной поверхности измеряли анализом по методу FACS в клетках, которые были подвергнуты нокдауну siРНК с индикаторными генами.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Методики и процедуры, описанные в данном описании или упоминаемые в качестве ссылок, в целом вполне понятны и в большинстве случаев применяются в рамках традиционной методологии специалистами в данной области, такие как, например, широко используемые методологии молекулярного клонирования, описанные Sambrook et al., Molecular Cloning: A Laboratory Manual 2nd. edition (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. Как адекватные, процедуры, включающие использование поступающих в продажу наборов и реактивов, обычно выполняются в соответствии с определенными их производителями протоколами и/или параметрами, если специально не указано иное.
Прежде чем подробно описывать по изобретению способы и аналитические методики, необходимо отметить, что изобретение не ограничивается рамками конкретной методологии, протоколами, клеточными линиями, видами или родами животных, конструкциями и описанными реактивами, поскольку все они, разумеется, могут изменяться. Также необходимо отметить, что используемая в данном случае терминология применяется только в целях описания конкретных вариантов осуществления изобретения и никак не должна ограничивать рамки применения настоящего изобретения, которая ограничена только представленными пунктами патентной формулы.
Следует отметить, что при использовании в тексте настоящего описания изобретения и в прилагаемых пунктах формулы изобретения грамматические формы единственного числа включают ссылки на множественное число, если из контекста явно не следует иное. Так, например, ссылка на "генетическую альтерацию" подразумевает множество таких альтераций, а ссылка на "зонд" подразумевает ссылку на один или более зондов и их эквивалентов, известных специалисту, и т.д.
Все упоминаемые публикации включены в качестве ссылок для раскрытия описания способов и/или материалов, в связи с которыми цитируются эти публикации. Цитируемые в настоящем описании публикации известны из уровня техники до даты подачи настоящей заявки. Ничто в этом документе не должно быть истолковано как допущения того, что заявители не имеют права датировать публикации задним числом на основании ранней даты приоритета или предшествующей даты изобретения. Далее, фактические даты публикаций могут отличаться от представленных в настоящем изобретении и требовать независимой верификации.
I. ОПРЕДЕЛЕНИЯ
Термины "Apo2L/TRAIL", "Apo-2L" и "TRAIL" используются в данном описании изобретения для обозначения полинуклеотидной последовательности, которая содержит аминокислотные остатки 114-281 включительно, 95-281 включительно, остатки 92-281 включительно, остатки 91-281 включительно, остатки 41-281 включительно, остатки 15-281 включительно или остатки 1-281 включительно из аминокислотной последовательности, представленной на фиг.1, а также биологически активные фрагменты и варианты указанных последовательностей с делециями, инсерциями или замещениями. В одном из вариантов осуществления изобретения полипептидная последовательность содержит остатки 114-281, представленные на фиг.1, и, необязательно, состоит из остатков 114-281, представленных на фиг.1. Необязательно, полипептидная последовательность содержит остатки 92-281 или остатки 91-281, представленные на фиг.1. Полипептиды Apo-2L могут кодироваться природной нуклеотидной последовательностью, представленной на фиг.1. Необязательно, кодон, в котором зашифрован аминокислотный остаток Pro119 (фиг.1), может иметь структуру "CCT" или "CCG". В других вариантах осуществления изобретения фрагменты или варианты биологически активны и имеют по меньшей мере приблизительно 80% идентичность аминокислотной последовательности, более предпочтительно, по меньшей мере приблизительно 90% идентичность или, еще более предпочтительно, по меньшей мере 95%, 96%, 97%, 98% или 99% идентичность последовательности с любой из вышеперечисленных последовательностей Apo2L/TRAIL. Необязательно, полипептид Apo2L/TRAIL кодируется нуклеотидной последовательностью, которая в жестких условиях гибридизуется с кодирующей полинуклеотидной последовательностью, представленной на фиг.1. Данное определение охватывает варианты Apo2L/TRAIL с замещениями, в которых по меньшей мере одна из природных аминокислот замещена остатком аланина. Особые варианты Apo2L/TRAIL с замещениями включают такие, в которых по меньшей мере одна аминокислота замещена остатком аланина. Эти варианты с замещениями включают такие, которые идентифицированы, например, как "D203A"; "D218A" и "D269A." Данная номенклатура используется для идентификации вариантов Apo2L/TRAIL, в которых остатки аспарагиновой кислоты в положениях 203, 218 и/или 269 (в соответствии с нумерацией, представленной на фиг.1) замещены остатками аланина. Необязательно, варианты Apo2L могут содержать одно или более замещений с участием аланина, которые перечислены в таблице I опубликованной патентной заявки PCT WO 01/00832. Варианты с замещениями включают одно или более замещений аминокислотных остатков, идентифицированных в таблице I WO 01/00832, опубликованного 4 января 2001 г. Определение также охватывает природную последовательность Apo2L/TRAIL, выделенную из источника Apo2L/TRAIL либо изготовленную рекомбинантными или синтетическими способами. Apo2L/TRAIL по изобретению включает полипептиды, называемые Apo2L/TRAIL или TRAIL, которые раскрыты в публикациях PCT под номерами WO 97/01633 и WO 97/25428. Термины "Apo2L/TRAIL" или "Apo2L" используются для общего обозначения форм Apo2L/TRAIL, которые включают мономерные, димерные или тримерные формы полипептида. Вся нумерация аминокислотных остатков, имеющих отношение к последовательности Apo2L, основана на нумерации, приведенной на фиг.1, если специально не указано иное. Например, "D203" или "Asp203" относится к остатку аспарагиновой кислоты в положении 203 последовательности, представленной на фиг.1.
Термин "внеклеточный домен Apo2L/TRAIL" или "Apo2L/TRAIL ECD" означает форму Apo2L/TRAIL, которая в значительной степени свободна от трансмембранного и цитоплазматического доменов. Обычно ECD имеет менее 1% трансмембранных и цитоплазматических доменов, предпочтительно, менее 0,5% таких доменов. Будет понятно, что любой трансмембранный домен (домены), идентифицированный применительно к полипептидампо изобретению идентифицирован в соответствии с теми критериями, которые обычно применяются в данной области для идентификации гидрофобных доменов этого типа. Точные границы трансмембранного домена могут изменяться, но, наиболее вероятно, не более чем на 5 аминокислот любого конца домена, который был идентифицирован первоначально. В предпочтительных вариантах осуществления изобретения ECD состоит из растворимой последовательности внеклеточного домена полипептида, который свободен от трансмембранных и цитоплазматических или внутриклеточных доменов (и не связан с клеточной мембраной). Особые последовательности внеклеточного домена Apo-2L/TRAIL описаны в публикациях PCT под номерами WO 97/01633 и WO 97/25428.
Термин "мономер Apo2L/TRAIL" или "мономер Apo2L" означает ковалентную цепь последовательности внеклеточного домена Apo2L.
Термин "димер Apo2L/TRAIL" или "димер Apo2L" означает два мономера Apo-2L, соединенные между собой ковалентной связью через дисульфидный мостик. При использовании в данном описании этот термин включает свободно расположенные димеры Apo2L, а также димеры Apo2L, включенные в тримерные формы Apo2L (т.е. сопряженные еще с одним, третьим мономером Apo2L).
Термин "тример Apo2L/TRAIL" или "тример Apo2L" означает три мономера Apo2L, нековалентно связанные друг с другом.
Термин "агрегат Apo2L/TRAIL" используется для обозначения самоассоциированных более высоких олигомерных форм Apo2L/TRAIL, например, тримеров Apo2L/TRAIL, которые образуют, например, гексамерные или наномерные формы Apo2L/TRAIL. Определение присутствия и количества мономера, димера или тримера Apo2L/TRAIL (или других агрегатов) можно осуществить способами и аналитическими методиками, известными в данной области (с использованием имеющихся в продаже материалов), например, ВЭЖХ с исключением по природному размеру ("SEC"), денатурирующим исключением по размеру с применением додецилсульфата натрия ("SDS-SEC"), обращенно-фазовой ВЭЖХ и капиллярным электрофорезом.
Термин "рецептор лиганда Apo-2" включает рецепторы, которые упоминаются в данной области как "DR4" и "DR5", полинуклеотидные и полипептидные последовательности которых представлены на фиг.2 и 3 соответственно. Pan et al. описали член семейства рецепторов TNF, называемый "DR4" (Pan et al., Science, 276:111-113 (1997); см. также WO 98/32856, опубликованный 30 июля 1998 г.; WO 99/37684, опубликованный 29 июля 1999 г.; WO 00/73349, опубликованный 7 декабря 2000 г.; US 6433147, выданный 13 августа 2002 г.; US 6461823, выданный 8 октября 2002 г., и US 6342383, выданный 29 января 2002 г.). Sheridan et al., Science, 277:818-821 (1997) и Pan et al., Science, 277:815-818 (1997) описали еще один рецептор для Apo2L/TRAIL (см. также WO 98/51793, опубликованный 19 ноября 1998 г.; WO 98/41629, опубликованный 24 сентября 1998 г.). Этот рецептор называется DR5 (рецептор также упоминается под альтернативными названиями Apo-2; TRAIL-R, TR6, Tango-63, hAPO8, TRICK2 или KILLER; Screaton et al., Curr. Biol., 7:693-696 (1997); Walczak et al., EMBO J., 16:5386-5387 (1997); Wu et al., Nature Genetics, 17:141-143 (1997); WO 98/35986, опубликованный 20 августа 1998 г.; EP870827, опубликованный 14 октября 1998 г.; WO 98/46643, опубликованный 22 октября 1998 г.; WO 99/02653, опубликованный 21 января 1999 г.; WO 99/09165, опубликованный 25 февраля 1999 г.; WO 99/11791, опубликованный 11 марта 1999 г.; US 2002/0072091, опубликованный 13 августа 2002 г.; US 002/0098550, опубликованный 7 декабря 2001 г.; US 6313269, выданный 6 декабря 2001 г.; US 2001/0010924, опубликованный 2 августа 2001 г.; US 2003/01255540, опубликованный 3 июля 2003 г.; US 2002/0160446, опубликованный 31 октября 2002 г., US 2002/0048785, опубликованный 25 апреля 2002 г.; US 6569642, выданный 27 мая 2003 г., US 6072047, выданный 6 июня 2000 г., US 6642358, выданный 4 ноября 2003 г.). Как описано выше, другие рецепторы для Apo-2L включают DcR1, DcR2 и OPG (см., Sheridan et al., выше; Marsters et al., выше; and Simonet et al., выше). Термин "рецептор Apo-2L" при использовании в настоящем описании охватывает рецептор с природной последовательностью и варианты рецептора. Эти термины охватывают рецептор Apo-2L, экспрессируемый у ряда млекопитающих, включая человека. Рецептор Apo-2L может экспрессироваться эндогенно, что происходит естественным образом во многих линиях тканей человека, либо может экспрессироваться рекомбинантными или синтетическими способами. Термин "рецептор Apo-2L с природной последовательностью" обозначает полипептид, имеющий точно такую же последовательность, как и рецептор Apo-2L природного происхождения. Таким образом, рецептор Apo-2L с природной последовательностью может иметь аминокислотную последовательность рецептора Apo-2L природного происхождения от любого млекопитающего. Такой рецептор Apo-2L с природной последовательностью может быть получен естественным образом либо выработан рекомбинантными или синтетическими средствами. Термин "рецептор Apo-2L с природной последовательностью" специфически охватывает природные усеченные или секретируемые формы рецептора (например, растворимую форму, содержащую, например, последовательность внеклеточного домена), вариантные формы природного происхождения (например, являющиеся результатом альтернативного сплайсинга), а также аллельные варианты природного происхождения. Варианты рецептора могут включать фрагменты или быть делеционными мутантами природной последовательности рецептора Apo-2L. На фиг.3A представлена аминокислотная последовательность DR5 человека из 411 аминокислот в том виде, как она была опубликована в WO 98/51793 от 19 ноября 1998 г. В данной области известен транскрипционный вариант сплайсинга DR5 человека. Этот вариант сплайсинга DR5 кодирует последовательность DR5 человека из 440 аминокислот, представленную на фиг.3B и 3C в том виде, как она была опубликована в WO 98/35986 от 20 августа 1998 г.
Термин "антитело рецептора клеточной смерти" используется в настоящем описании для обозначения, в целом, антитела или антител, направленных на рецептор из суперсемейства рецепторов фактора опухолевого некроза и содержащий домен смерти, способный передавать сигнал апоптоза. Такие антитела включают антитело DR5 и антитело DR4.
Термин "антитело рецептора DR5", "антитело DR5" или "анти-DR5 антитело" используется в широком смысле для обозначения антител, которые связывают по меньшей мере одну форму рецептора DR5, например, последовательность 1-411, представленную на фиг.3A, или последовательность 1-440, представленную на фиг.3B-3C, либо их внеклеточный домен. Необязательно, антитело DR5 слито или сцеплено с гетерологичной последовательностью или молекулой. Предпочтительно гетерологичная последовательность позволяет или помогает антителу образовывать высшие порядки или олигомерные комплексы. Необязательно, антитело DR5 связывается с рецептором DR5, но не связывается или не реагирует перекрестно с каким-либо дополнительным рецептором Apo-2L (например, с DR4, DcR1 или DcR2). Необязательно, антитело является агонистом сигнальной активности DR5.
Необязательно, антитело DR5 по изобретению связывается с рецептором DR5 в диапазоне концентраций от приблизительно 0,1 нМ до приблизительно 20 мМ (при измерении по аналитической методике связывания BIAcore). Необязательно, антитела DR5 по изобретению демонстрируют значение Ic 50 в диапазоне концентраций от приблизительно 0,6 нМ до приблизительно 18 мМ (при измерении по аналитической методике связывания BIAcore).
Термин "антитело рецептора DR4", "антитело DR4" или "анти-DR4 антитело" используется в широком смысле для обозначения антител, которые связывают по меньшей мере одну форму рецептора DR4 или его (их) внеклеточный домен. Необязательно, антитело DR4 слито или сцеплено с гетерологичной последовательностью или молекулой. Предпочтительно гетерологичная последовательность позволяет или помогает антителу образовывать высшие порядки или олигомерные комплексы. Необязательно, антитело DR4 связывается с рецептором DR4, но не связывается или не реагирует перекрестно с каким-либо дополнительным рецептором Apo-2L (например, с DR5, DcR1 или DcR2). Необязательно, антитело является агонистом сигнальной активности DR4.
Необязательно, антитело DR4 по изобретению связывается с рецептором DR4 в диапазоне концентраций от приблизительно 0,1 нМ до приблизительно 20 мМ (при измерении по аналитической методике связывания BIAcore). Необязательно, антитела DR4 по изобретению имеют значение Ic 50 в диапазоне концентраций от приблизительно 0,6 нМ до приблизительно 18 мМ (при измерении по аналитической методике связывания BIAcore).
Термин "агонист" используется в самом широком смысле и включает любую молекулу, которая частично или полностью усиливает, стимулирует или активирует одну и более биологических активностей Apo2L/TRAIL, DR4 или DR5, in vitro, in situ или in vivo. Примерами таких биологических активностей являются связывание Apo2L/TRAIL с DR4 или DR5, включая апоптоз, а также другие варианты, опубликованные в литературе. Агонист может функционировать прямым или непрямым образом. Например, агонист может функционировать, частично или полностью усиливая, стимулируя или активируя одну или более биологических активностей DR4 или DR5, in vitro, in situ или in vivo, в результате его прямого связывания с DR4 или DR5, что вызывает активацию рецептора или сигнальную трансдукцию. Агонист также может функционировать непрямым образом, частично или полностью усиливая, стимулируя или активируя одну или более биологических активностей DR4 или DR5, in vitro, in situ или in vivo, например, в результате стимуляции другой эффекторной молекулы, которая, в свою очередь, вызывает активацию DR4 или DR5 либо сигнальную трансдукцию. Предполагается, что агонист может действовать как молекула-энхансер, которая функционирует непрямым образом, усиливая либо увеличивая активацию или активность DR4 или DR5. Например, агонист может усиливать активность эндогенного Apo-2L у млекопитающего. Это может достигаться, например, предварительным образованием комплекса DR4 или DR5 либо стабилизацией комплексов соответствующего лиганда с рецептором DR4 или DR5 (например, стабилизацией природного комплекса, образующегося между Apo-2L и DR4 или DR5).
Термин "биомаркер", использующийся в настоящей заявке, означает, в целом, молекулу (включая ген, белок, углеводную структуру или гликолипид), экспрессию которой в тканях или клетках млекопитающего можно выявить стандартными способами (или способами, раскрытыми в настоящей заявке) и по которой можно предсказать чувствительность клеток или тканей млекопитающего к Apo2L/TRAIL или антителам рецептора клеточной смерти. Такие биомаркеры по настоящему изобретению включают, но ими не ограничиваются, молекулы семейства белков GalNac-T. В литературе описаны члены семейства генов N-ацетилгалактозаминилтрансферазы человека ("GalNac-T") и кодируемые ими белки (см., например, Hang et al., "The chemistry and biology of mucin-type O-linked glycosylation initiated by the polypeptide N-acetyl- -galactosaminyltransferases", Bioorganic & Medicinal Chemistry (материал доступен с мая 2005 года по адресу www.sciensedirect.com) и цитируемые там ссылки; Wang et al., BBRC, 300:738-744 (2003) и цитируемые там ссылки), причем исследователи полагают, что они действуют, определяя число и положение O-связанных сахарных цепей в белках. Необязательно, экспрессия такого биомаркера определяется на более высоком уровне по сравнению с наблюдаемым в контрольном образце ткани или клеток. Например, необязательно, экспрессию такого биомаркера можно определять, используя микрочип экспрессии гена, количественную ПЦР или иммуногистохимический (ИГХ) анализ. Необязательно, экспрессию биомаркера GalNac-T, например, GalNac-T14 или GalNac-T3, в подопытном образце ткани или клеток можно определить в анализе с микрочипом Affymetrix U133P по меньшей мере на 750-кратном уровне или 500-кратном, или, предпочтительно, по меньшей мере 1000-кратном по сравнению с контрольными образцами тканей или клеток при выявлении экспрессии биомаркера при помощи количественной ПЦР.
"UDP-N-ацетил-D-галактозамин:полипептид N-ацетилгалактозаминилтрансфераза-T14", "pp-GalNac-T14", "GalNac-T14", "GALNT14" используются в данном случае для обозначения мембранного белка II типа, обладающего характерными признаками семейства молекул GalNac-T, содержащих N-концевой цитоплазматический домен, трансмембранный домен, стержневую область и каталитический домен. Необязательно, в одном из вариантов осуществления изобретения молекула GalNac-T14 человека содержит 1659 пар оснований, кодирующих белок из 552 аминокислот, как показано на фиг.4A. Полноразмерная кДНК человека была депонирована в GenBank под инвентарным номером AB078144. Как раскрыто Wang et al., BBRC, 300:738-744 (2003), были идентифицированы сплайсированные изоформы GalNac-T14, которые включают (или не включают) особые экзоны, например, экзоны 2, 3 и/или 4. Настоящее изобретение рассматривает исследование экспрессии таких изменяющихся изоформ GalNac-T14, причем по экспрессии любой такой изоформы можно предсказать чувствительность образца ткани или клеток млекопитающего к Apo2L/TRAIL или антителам рецептора клеточной смерти.
"UDP-N-ацетил-D-галактозамин:полипептид N-ацетилгалактозаминилтрансфераза-T3", "pp-GalNac-T3", "GalNac-T3", "GALNT3" используются в данном случае для обозначения мембранного белка II типа, обладающего характерными признаками семейства молекул GalNac-T, содержащих N-концевой цитоплазматический домен, трансмембранный домен, стержневую область и каталитический домен. Необязательно, в одном из вариантов осуществления изобретения полипептид GalNac-T3 человека содержит аминокислотную последовательность, представленную на фиг.4B. GalNac-T3 дополнительно описан Bennett et al., J. Biol. Chem., 271:17006-17012 (1996).
Под терминами "индивид" или "больной" подразумевается любой отдельный индивид, включая человека, нуждающийся в лечении. Кроме того, в качестве индивидов упоминаются любые индивиды, вовлеченные в клинические испытания, но не проявляющие никаких признаков заболевания, или индивиды, вовлеченные в клинические испытания, или индивиды, используемые в качестве контроля.
Термин "млекопитающее", как используется в настоящем документе, относится к любым животным, классифицированным как млекопитающие, включая людей, коров, лошадей, собак и кошек. В предпочтительном варианте осуществления изобретения под млекопитающим подразумевается человек.
Термин "образец ткани или клеток" означает собранный материал аналогичных клеток, полученных из ткани индивида или больного. Источником образца ткани или клеток может быть плотная ткань в виде свежего, замороженного и/или законсервированного органа или образца ткани, или биоптата, или аспирата; кровь или любые компоненты крови; биологические жидкости, например, спинномозговая жидкость, амниотическая жидкость, перитонеальная жидкость или интерстициальная жидкость; клетки, полученные в любом сроке беременности или на любом этапе развития индивида. Образец ткани также может быть первичным либо представлять собой результат культивирования клеток или клеточных линий. Необязательно, образец ткани или клеток может быть получен из первичной или метастатической опухоли. Образец ткани может содержать соединения, которые в естественных условиях не перемешаны с тканью, например консерванты, антикоагулянты, буферы, фиксаторы, нутриенты (питательные вещества), антибиотики и т.п.
В контексте настоящего описания "срез" образца ткани означает единый фрагмент или кусок образца ткани, например, тонкий слой срезанной ткани или клеток из образца ткани. Понятно, по настоящему изобретению могут быть получены и подвергнуты анализу множественные срезы образцов тканей, исходя из того, что настоящее изобретение охватывает такой способ, когда один и тот же срез образца ткани анализируется как на морфологическом, так и на молекулярном уровне или анализируется как на белки, так и на нуклеиновые кислоты.
Термины "коррелировать" или "проводить корреляцию" означают сравнение осуществления и/или результатов первого анализа или протокола с выполнением и/или результатами второго анализа или протокола. Например, специалист в данной области может использовать результаты первого анализа или протокола в выполнении следующих протоколов и/или использовать результаты первого анализа или протокола для оценки того, нужно ли проводить второй анализ или протокол. Что касается разных вариантов осуществления настоящего изобретения, то можно использовать результаты аналитических проб, например, экспрессии мРНК или ИГХ для оценки того, нужно ли применять специальную схему терапии с использованием Apo2L/TRAIL или антитела рецепторов клеточной смерти.
Под "нуклеиновой кислотой" подразумевается любая разновидность ДНК или РНК. Например, это может быть хромосомная, митохондриальная, вирусная и/или бактериальная нуклеиновая кислота, присутствующая в образце ткани. Термин "нуклеиновая кислота" охватывает или одну нить однонитевой, или обе нити двухнитевой молекулы нуклеиновой кислоты, включая любой фрагмент или любую часть интактной молекулы нуклеиновой кислоты.
Термин "ген" означает любую последовательность нуклеиновой кислоты или ее часть, обладающую функциональной ролью в кодировании, или транскрибировании белка, или в регуляции экспрессии другого гена. Ген может состоять из всех нуклеиновых кислот, ответственных за кодирование функционального белка или только части нуклеиновых кислот, ответственных за кодирование или экспрессию белка. Последовательность нуклеиновой кислоты может содержать генетическую аномалию в пределах экзонов, интронов, области инициации или терминации, промоторные последовательности, другие регуляторные последовательности или уникальные области, прилегающие к гену.
Как используется в описании, термин "метка" в этом документе означает соединение или композицию, которая прямым или непрямым образом сопряжена или слита с реактивом, например, зондом нуклеиновой кислоты или антителом и облегчает выявление реагента, с которым она сопряжена или слита. Метка может быть выявляемой сама по себе (например, радиоизотопные метки или флуоресцентные метки) либо, в случае ферментативной метки, может катализировать химическую альтерацию субстратного соединения или композиции, подлежащих выявлению.
Термин "антитело" в этом документе используется в самом широком смысле и специфически охватывает интактные моноклональные антитела, поликлональные антитела, полиспецифические антитела (например, биспецифические антитела), образовавшиеся по меньшей мере из двух интактных антител, а также фрагменты антител (до тех пор, пока они проявляют нужную биологическую активность).
"Фрагменты антитела" представляют собой часть интактного антитела, предпочтительно, содержащую его антигенсвязывающую или вариабельную область. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv; диатела; линейные антитела; одноцепочечные молекулы антител; и полиспецифические антитела, образовавшиеся из фрагментов антител.
"Нативные антитела" обычно представляют собой гетеротетрамерные гликопротеины с массой приблизительно 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, в то время как число дисульфидных связей в тяжелых цепях различных изотипов иммуноглобулина изменчиво. Каждая тяжелая и легкая цепи также имеет внутрицепевые дисульфидные мостики, расположенные друг от друга на определенном расстоянии. Каждая тяжелая цепь на одном конце имеет вариабельный домен (VH), за которым следует некоторое количество константных доменов. Каждая легкая цепь на одном конце имеет вариабельный домен (VL), а на другом конце - константный домен; константный домен легкой цепи смыкается с первым константным доменом тяжелой цепи, а вариабельный домен легкой цепи смыкается c вариабельным доменом тяжелой цепи. Считается, что поверхность раздела между вариабельными доменами легкой цепи и тяжелой цепи образована особыми аминокислотными остатками.
Термин "вариабельный" относится к тому факту, что некоторые участки вариабельных доменов в значительной степени различаются по последовательности антител и используются для специфического связывания каждого особого антитела его особым антигеном. Однако вариабельность неравномерно распределена по вариабельным доменам антител. Она сосредоточена в трех сегментах, носящих название гипервариабельных или комплементарных определяющих областей в границах вариабельных областей как легкой, так и тяжелой цепи. Более сохранные или консервативные части вариабельных доменов называются каркасными областями (FR). Каждый вариабельный домен нативной тяжелой и легкой цепей содержит четыре FR, в значительной степени принимающих структуру бета-листа, связанного тремя гипервариабельными областями, которые образуют петлевые соединения, а в некоторых случаях составляют часть структуры бета-листа. Гипервариабельные области каждой цепи удерживаются вместе в тесном соседстве с FR и с гипервариабельными областями другой цепи, внося вклад в формирование антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Константные домены напрямую не вовлечены в связывание антитела с антигеном, но обладают различными эффекторными функциями, например, участвуют в зависящей от антител клеточно-опосредованной цитотоксичности (ADCC).
Расщепление антител папаином приводит к появлению двух идентичных антигенсвязывающих фрагментов, носящих название фрагменты "Fab", причем каждый из них имеет единственный антигенсвязывающий сайт, а также остаточного фрагмента "Fc", название которого отражает его способность к быстрой кристаллизации. Обработка пепсином приводит к появлению фрагмента F(ab')2, имеющего два антигенсвязывающих сайта и все еще способного к образованию поперечных связей с антигеном.
"Fv" представляет собой минимальный фрагмент антитела, содержащий полный сайт распознавания и связывания антигена. Эта область состоит из димера вариабельных доменов одной тяжелой цепи и одной легкой цепи, находящихся в прочной нековалентной связи. Именно в такой конфигурации три гипервариабельных области каждого вариабельного домена взаимодействуют друг с другом, определяя антигенсвязывающий сайт на поверхности димера VH-VL. Все вместе шесть гипервариабельных областей придают антителу антигенсвязывающую специфичность. Однако даже единственный вариабельный домен (или половина Fv, содержащая только три гипервариабельных области, специфичных для антигена) обладает способностью распознавать и связывать антиген, хотя и на более низком уровне аффинности по сравнению со всем сайтом связывания.
Фрагмент Fab также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Фрагменты Fab' отличаются от фрагментов Fab тем, что на карбоксильном конце домена их тяжелой цепи добавлены несколько остатков, включая один или более остатков цистеина из шарнирной области антитела. Fab'-SH в настоящем описании употребляется для обозначения Fab', в котором остаток (остатки) цистеина константного домена несет по меньшей мере одну свободную тиоловую группу. Фрагменты антитела F(ab')2 изначально вырабатывались как пары фрагментов Fab', между которыми имеются шарниры из цистеина. Известны также другие химические соединения фрагментов антител.
"Легкие цепи" антител (иммуноглобулинов), принадлежащих любому виду позвоночных, можно отнести к одному из двух четко отличающихся типов, носящих названия каппа (κ) и лямбда (λ), причем это разделение основано на аминокислотных последовательностях их константных доменов.
В зависимости от аминокислотной последовательности константного домена их тяжелых цепей антитела можно подразделить на разные классы. Известны пять основных классов интактных антител: IgA, IgD, IgE, IgG и IgM, причем некоторые из них можно дополнительно разделить на подклассы (изотипы), например, IgGl, IgG2, IgG3, IgG4, IgA и IgA2. Константные домены тяжелых цепей, соответствующие разным классам антител, называются α, δ, ε, γ и µ соответственно. Хорошо известны структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов.
Фрагменты антител типа "одноцепочечный Fv" или "scFv" содержат домены антитела VH и VL, причем эти домены представлены в единственной цепи полипептида. В предпочтительном варианте полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, что позволяет scFv формировать нужную структуру для связывания антигена. Обзор по scFv см. по данным Plückthun в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 259-315 (1994).
Термин "диатела" относится к мелким фрагментам антител с двумя антигенсвязывающими сайтами, причем такие фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH-VL). За счет использования линкера, который слишком короток для спаривания (конъюгации) двух доменов в одной и той же цепи, домены принудительно подталкиваются к спариванию с комплементарными доменами другой цепи и создают два антигенсвязывающих сайта. Диатела более полно описаны, например, в ссылках EP 404097, WO 93/11161 и Hollinger et al., Proc. Natl. Acad. Sex. USA, 90:6444-6448 (1993).
Термин "моноклональное антитело" при использовании в настоящем описании означает антитело, полученное из популяции в значительной степени гомогенных антител, т.е. индивидуальные антитела, входящие в состав популяции, практически идентичны, за исключением возможных природных мутаций, которые могут присутствовать в незначительном количестве. Моноклональные антитела высокоспецифичны, т.е. направлены против единственного антигенного сайта. Кроме того, в отличие от препаратов традиционных (поликлональных) антител, которые обычно включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против единственной детерминанты антигена. В дополнение к высокой специфичности моноклональные антитела имеют то преимущество, что они синтезируются в культуре гибридомы, не загрязненной присутствием других иммуноглобулинов. Атрибут "моноклональное" указывает на тот признак, что антитело получено из практически гомогенной популяции антител, а не должно конструироваться с учетом требования выработки антител каким-либо особым способом. Например, моноклональные антитела, которые используются в соответствии с настоящим изобретением, могут быть получены способом гибридомы, впервые описанным Kohler et al., Nature, 256:495 (1975), или методами рекомбинантной ДНК (см., например, патент США № 4816567). "Моноклональные антитела" также можно выделять из библиотек фаговых антител, используя методики, описанные, например, Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol., 222:581-597 (1991).
Моноклональные антитела, упоминаемые в этом документе, специфически включают "химерные" антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям антител, полученных от особых видов либо принадлежащих особому классу или подклассу антител, причем остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям антител, полученных от других видов либо принадлежащих другому классу или подклассу антител, так же, как и фрагменты таких антител, при том условии, что они проявляют желательную биологическую активность (патент США № 4816567; Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). Химерные антитела, представляющие интерес в этом контексте, включают "приматизированные" антитела, содержащие антигенсвязывающие последовательности вариабельных доменов, полученные от нечеловекообразных приматов (например, от обезьян Старого света, например, павианов (бабуинов), макак резус или крабоедов (сванских)), а также последовательности константных областей человека (патент США № 5693780).
"Гуманизированные" формы антител нечеловеского происхождения (например, мышиные) представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина нечеловеческого происхождения. Гуманизированные антитела представляют собой большей частью иммуноглобулины человека (антитело реципиент), у которых аминокислотные остатки из гипервариабельной области реципиента замещены остатками из гипервариабельной области других биологических видов (антитело донор), например, мыши, крысы, кролика или нечеловекообразных приматов, причем они имеют желательную специфичность, аффинность и функциональную активность. В некоторых случаях остатки каркасной области (FR) иммуноглобулина человека замещены соответствующими остатками других биологических видов. Кроме того, гуманизированные антитела могут содержать остатки, отсутствующие в антителе-реципиенте или антителе-доноре. Эти модификации способствуют дальнейшему усовершенствованию производительности антител. В целом, гуманизированное антитело содержит по существу все по меньшей мере из одного, или обычно из двух вариабельных доменов, в которых все или почти все гипервариабельные петли соответствуют петлям иммуноглобулинов нечеловеческого происхождения, а все или почти все FR соответствуют последовательности иммуноглобулина человека. Необязательно, гуманизированное антитело также содержит по меньшей мере часть константной области иммуноглобулина (Fc), обычно иммуноглобулина человека. Дополнительные сведения см. в ссылках Jones et al., Nature 321:522-525 (1986); Riechmann et al. Nature 332:323-329 (1988) и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
Термин "гипервариабельная область" при использовании в настоящем описании относится к аминокислотным остаткам антитела, которое отвечает за связывание антигена. Гипервариабельная область содержит аминокислотные остатки из "области, определяющей комплементарность" или "CDR" (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи, а также 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи; Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) и/или остатки из "гипервариабельной петли" (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи; Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). "Каркасные" или "FR" остатки представляют собой такие остатки вариабельного домена, которые отличаются от данного в настоящем описании определения остатков гипервариабельной области.
Антитело, "которое связывает" представляющий интерес антиген, представляет собой антитело, способное связывать этот антиген с достаточной аффинностью и/или авидностью так, что указанное антитело полезно в качестве терапевтического или диагностического средства для нацеливания на клетку, экспрессирующую антиген.
В тех целях, которые преследует настоящее изобретение, "иммунотерапия" относится к способу лечения млекопитающего (предпочтительно, больного человека) антителами, причем конкретное антитело может быть неконъюгированным или "обнаженным" антителом, либо антитело может быть конъюгировано или слито с гетерологичной молекулой (молекулами) или агентом (агентами), например, с одним и более цитотоксическими агентами, что приводит к созданию "иммуноконъюгата".
"Выделенное" антитело представляет собой такое антитело, которое было идентифицировано и отделено от и/или извлечено из составных компонентов его природного окружения. Загрязняющие компоненты окружающей среды представляют собой материалы, которые способны создавать помехи в диагностических или терапевтических способах применения антитела, к ним относятся некоторые ферменты, гормоны и другие белковоподобные или небелковоподобные растворенные вещества. В предпочтительных вариантах осуществления изобретения антитело очищают (1) более чем до 95% по весу с определением по методу Лоури, самое предпочтительное, более чем до 99% по весу, (2) причем в достаточной степени для получения по меньшей мере 15 N-концевых или внутренних аминокислотных остатков последовательности при использовании секвенатора с вращающимся стаканом, или (3) до гомогенности по методике SDS-PAGE в редуцирующих или нередуцирующих условиях с использованием красителя кумасси голубого или, предпочтительно, окраски серебрением. Выделенное антитело включает антитело in situ внутри рекомбинантных клеток в тех случаях, когда отсутствует по меньшей мере один компонент природного окружения антитела. Однако, как правило, выделенное антитело получают по меньшей мере с одним этапом очистки.
Выражение "эффективное количество" означает такое количество агента (например, Apo2L/TRAIL, анти-DR4 антител или DR5 и т.д.), которое эффективно для профилактики, улучшения симптомов или лечения определенного заболевания или состояния.
Термины "лечение" и "терапия", как используется в этом документе, означают целебную терапию, профилактическую терапию и превентивную терапию. Последовательное лечение или введение означает лечение по меньшей мере на ежедневной основе без перерывов в лечении на один или несколько дней. Перемежающееся лечение или введение либо лечение или введение перемежающимся образом означает такое лечение, которое по своей сути скорее носит циклический, чем последовательный характер.
Термин "цитокин" представляет собой общий термин, применяемый для обозначения белков, высвобожденных одной клеточной популяцией, которые действуют на другие клетки как межклеточные медиаторы. Примерами цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. В группу цитокинов входят гормоны роста, например, гормон роста человека, N-метионил-гормон роста человека и гормон роста крупного рогатого скота; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, например, фолликулостимулирующий гормон (FSH), тиреоидный стимулирующий гормон (TSH) и лютеинизирующий гормон (LH); печеночный фактор роста; фактор роста фибробластов; пролактин; плацентарный лактоген; альфа-фактор и бета-фактор опухолевого некроза; моллерова ингибирующая субстанция; мышиный пептид, ассоциированный с гонадотропином; ингибин; активин; фактор роста сосудистого эндотелия; интегрин; тромбопоэтин (TPO); факторы роста нервов; тромбоцитарный фактор роста; трасформирующие факторы роста (TGF), такие как TGF-б и TGF-в; инсулиноподобный фактор роста I и II; эритропоэтин (EPO); остеоиндуктивные факторы; интерфероны, например, альфа-, бета-, и гамма-интерферон; колониестимулирующие факторы (CSF), например, CSF макрофагов (M-CSF), CSF гранулоцитарных макрофагов (GM-CSF) и CSF гранулоцитов (G-CSF); интерлейкины (IL), например, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-8, IL-9, IL-11, IL-12, IL-13, IL-17; а также другие полипептидные факторы, включая LIF и кит-лиганд (KL). При использовании в этом документе термин "цитокин" включает белки из природных источников или из культуры рекомбинантных клеток и биологически активные эквиваленты природных последовательностей цитокинов.
Термин "цитотоксический агент" при использовании в этом документе означает соединение, которое ингибирует или предупреждает функцию клеток и/или вызывает разрушение клеток. Этот термин предназначен для включения радиоактивных изотопов (например, I131, I125, Y90 и Re186), химиотерапевтических средств и токсинов, например, ферментативно активных токсинов бактериального, грибкового, растительного или животного происхождения или их фрагменты.
"Химиотерапевтическое средство" представляет собой химическое соединение, пригодное для лечения раковых заболеваний. Примеры химиотерапевтических средств включают алкилирующие агенты, например, тиотепа и циклофосфамид (CYTOXAN™); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (особенно, буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; CC-1065 (включая синтетические аналоги адозелезин, карзелезин и бизелезин); криптофицины (особенно, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CBI-TMI); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; производные азотистого иприта такие, как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урацил-иприт; нитрозомочевины, например, кармустин, хлорзотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, например, энедииновые антибиотики (например, калихеамицин, особенно, калихеамицин гамма-1I и калихеамицин фи-1I (см., например, Agnew, Chem Intl. Ed. Engl., 33:183-186, 1994); дайнемицин, включая дайнемицин A; биофосфонаты, например, клодронат; эсперамицин; а также неокарциностатин хромофор и родственные хромопротеиновые энедииновые антибиотики хромофоры), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (Adriamycin™) (включая морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и дезоксидорксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, например, митомицин C, микофенольную кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, например, метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, например, деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, например, флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидинов, например, анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, например, калустерон, дромостанолон пропионат, эпитиостанол, мепитиостан, тестолактон; антагонисты надпочечников, например, аминоглютетимид, митотан, трилостан; добавки фолиевой кислоты, например, фролиновая кислота; ацеглатон; альдофосфамид гликозид; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазихион; элфорнитин; эллиптиния ацетат; эпотилон; этоглуцид; галлия нитрат; гидроксимочевина; лентинан; лонидамин; майтансиноиды, например, майтансин и ансамитоцины; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновая кислота; 2-этилгидразид; прокарбазин; PSK®; разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазихион, 2,2',2”-трихлортриэтиламин; трихотецены (особенно, токсин T-2, верракурин A, роридин A и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); циклофосфамид; тиотепа; таксоиды, например, паклитаксел (TAXOL®, Bristol-Myers Squibb Oncology, Принстон, штат Нью-Джерси) и доксетаксел (TAXOTERE®, Rhône-Poulenc Rorer, Антони, Франция); хлорамбуцил; гемцитабин (Gemzar™); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, например, цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; винорелбин (Navelbine™); новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, например, ретиноевая кислота; капецитабин; а также фармацевтически приемлемые соли, кислоты и производные любого из указанных выше веществ. В это определение также включены противогормональные средства, регулирующие или подавляющие действие гормонов на опухоли, в частности, антиэстрогены и селективные модуляторы эстрогенных рецепторов (SERM), включая, например, тамоксифен (в том числе Nolvadex™), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (Fareston™); ингибиторы ароматазы, т.е. вещества, подавляющие активность фермента ароматазы, которая регулирует выработку эстрогенов в надпочечниках, например, 4(5)-имидазолы, аминоглутетимид, мегестрол ацетат (Megace™), экземестан, форместан, фадрозол, ворозол (Rivisor™), летрозол (Femara™) и анастрозол (Arimidex™); а также антиандрогены, например, флутамид, нилутамид, бикалутамид, лейпролид и госерелин; а также фармацевтически приемлемые соли, кислоты или производные любого из указанных выше веществ.
Термин "ингибиторный агент роста", как используется в этом документе, относится к соединению или композиции, которые подавляют рост клетки, особенно раковой клетки, проявляющей избыточную экспрессию любого из идентифицированных здесь генов, либо in vitro, либо in vivo. Таким образом, ингибиторный агент роста представляет собой такой агент, который значительно снижает процентную долю клеток, проявляющих избыточную экспрессию таких генов в S-фазе. Примеры ингибиторных агентов роста включают агенты, которые блокируют прогрессирование клеточного цикла (в другом месте, нежели S-фаза), то есть агенты, индуцирующие задержку G1- и M-фазы. Классические блокаторы M-фазы включают винкас (винкристин и винбластин), таксол и ингибиторы topo II, например, доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Те агенты, которые задерживают G1, также распространяют свой эффект на задержку S-фазы - это, например, ДНК-алкилирующие агенты, в частности, тамоксифен, преднизон, дакарбазин, мехлортамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дополнительную информацию смотрите в "The Molecular Basis of Cancer", Mendelsohn and Israel, eds., глава 1 под названием "Cell cycle regulation, oncogens, and antineoplastic drugs", принадлежащая коллективу авторов Murakami et al. (WB Saunders: Philadelphia, 1995), особенно стр.13.
Термины "апоптоз" и "апоптотическая активность" используются в настоящем описании в широком смысле и относятся к упорядоченной или контролируемой форме клеточной смерти у млекопитающих, как правило, сопровождающейся одним и более характерными изменениями клеток, включая конденсацию цитоплазмы, потерю микроворсин мембраны, сегментацию ядра, разрушение хромосомной ДНК или утрату митохондриальной функции. Эту активность можно определять и измерять, например, анализами на выживание клеток (в частности, анализом с красителем Alamar синим или анализом MTT), анализом FACS, активацией каспазы, фрагментацией ДНК (см., например, Nicoletti et al., J. Immunol. Methods, 139:271-279 (1991)), а также полимеразой поли-АДФ рибозы, "PARP", анализами на расщепление, известными в данной области.
При использовании в настоящем описании термин "расстройство" в целом относится к любому состоянию, которое можно улучшить в результате лечения описанными в настоящем описании композициями, включая любое заболевание или расстройство, которое можно лечить эффективным количеством Apo2L/TRAIL, анти-DR4 антител и/или анти-DR5 антител. К ним относятся острые и хронические расстройства, а также те патологические состояния, которые создают у млекопитающего предрасположенность к обсуждаемым расстройствам. Неограничивающими примерами расстройств, поддающихся лечению в соответствии с настоящим изобретением, являются доброкачественные и злокачественные опухоли; воспалительные, ангиогенные и иммунологические расстройства, аутоиммунные расстройства, артриты (включая ревматоидный артрит), рассеянный склероз и ВИЧ/СПИД.
Термины "рак", "раковый" или "злокачественный" относятся к физиологическим состояниям у млекопитающих, которые, как правило, характеризуются неуправляемым ростом клеток (или описывают такие состояния). Примеры рака включают, но не ограничиваясь ими, карциному, лимфому, лейкоз, бластому и саркому. Более специфические примеры таких раков включают плоскоклеточную карциному, миелому, мелкоклеточный рак легких, немелкоклеточный рак легких, глиому, ходжкинскую лимфому, неходжкинскую лимфому, рак желудочно-кишечного тракта, почечный, рак яичника, рак печени, лимфобластный лейкоз, лимфоцитарный лейкоз, рак толстой и прямой кишки, рак эндометрия, рак почки, рак предстательной железы, рак щитовидной железы, меланому, хондросаркому, нейробластому, рак поджелудочной железы, мультиформную глиобластому, рак шейки матки, рак головного мозга, рак желудка, рак мочевого пузыря, гепатому, рак молочной железы, карциному оболочной кишки, а также рак головы и шеи.
Термин "иммунозависимое заболевание" означает заболевание, при котором компонент иммунной системы млекопитающего вызывает или опосредует заболеваемость указанного млекопитающего либо вносит какой-либо иной вклад в эту заболеваемость. В эту группу входят и такие заболевания, при которых стимуляция иммунного ответа или вмешательство в иммунный ответ дают положительный эффект в отношении течения/прогрессирования болезни. Этот термин охватывает аутоиммунные заболевания, иммуноопосредованные воспалительные заболевания, неиммуноопосредованные воспалительные заболевания, инфекционные заболевания и заболевания, обусловленные иммунодефицитом. Примеры иммунозависимых и воспалительных заболеваний, часть которых носит иммунный характер или опосредована T-клетками и которые можно лечить способами по настоящему изобретению, включают системную красную волчанку, ревматоидный артрит, ювенильный хронический артрит, спондилоартропатии, системный склероз (склеродерму), идиопатические воспалительные миопатии (дерматомиозит, полимиозит), синдром Сьегрена (Sjogren), системный васкулит, саркоидоз, аутоиммунную гемолитическую анемию (иммунную панцитопению, пароксизмальную ночную гемоглобинурию), аутоиммунную тромбоцитопению (идиопатическую тромбоцитопеническую пурпуру, иммуноопосредованную тромбоцитопению), тиреоидит (болезнь Грейвса, тиреоидит Хашимото, ювенильный лимфоцитарный тиреоидит, атрофический тиреоидит), сахарный диабет, иммуноопосредованное заболевание почек (гломерулонефрит, тубулоинтерстициальный нефрит), демиелинизирующие заболевания центральной и периферической нервной системы, такие как рассеянный склероз, идиопатическая демиелинизирующая полинейропатия или синдром Гийена-Барре (Guillain-Barré) и хроническая воспалительная демиелинизирующая полинейропатия, гепато-билиарные заболевания, такие как инфекционный гепатит (гепатит A, B, C, D, E и другие негепатотропные вирусы), аутоиммунный хронический активный гепатит, первичный билиарный цирроз, гранулематозный гепатит и склерозирующий холангит, воспалительные и фибротические заболевания легких, например, воспалительное заболевание кишечника (язвенный колит: болезнь Крона), глютензависимую энтеропатию и болезнь Уиппла (Whipple), аутоиммунные или иммуноопосредованные кожные заболевания, в частности, буллезные поражения кожи, мультиформную эритему и контактный дерматит, псориаз, аллергические заболевания, например, астму, аллергический ринит, атопический дерматит, пищевую аллергию и крапивницу, иммунологические заболевания легких, например, эозинофильные пневмонии, идиопатический фиброз легких и гиперчувствительный пневмонит, заболевания, связанные с трансплантацией, в том числе отторжение трансплантата и болезнь "трансплантат против хозяина". Инфекционные заболевания включают СПИД (ВИЧ-инфекцию), гепатиты A, B, C, D и E, бактериальные инфекции, грибковые инфекции, протозойные инфекции и паразитарные инфекции.
"Аутоиммунное заболевание" используется в настоящем описании в самом широком и общем смысле для обозначения заболеваний или состояний у млекопитающих, когда деструкция нормальной или здоровой ткани является результатом гуморального или клеточного иммунного ответа конкретного млекопитающего на его/ее собственные тканевые компоненты. Примеры включают, но не ограничиваясь ими, красную волчанку, тиреоидит, ревматоидный артрит, псориаз, рассеянный склероз, аутоиммунный диабет и воспалительное заболевание кишечника (IBD).
Термин "меченый" при использовании в этом документе относится к химерной молекуле, содержащей антитело или полипептид, слитые с "полипептидом-меткой". Полипептид-метка имеет достаточное количество аминокислотных остатков, чтобы охватить эпитоп, против которого может быть создано антитело, или придать меченой молекуле некоторые дополнительные функции, например, способность к олигомеризации (как это, например, происходит с пептидами, имеющими домены с лейциновой молнией), но при этом остается достаточно коротким и обычно не влияет на активность антитела или полипептида. Полипептид-метка, предпочтительно, также настолько уникален, что специфическое по данной метке антитело не дает выраженной перекрестной реакции с другими эпитопами. Подходящие полипептиды-метки чаще всего имеют по меньшей мере шесть аминокислотных остатков, обычно от приблизительно 8 до приблизительно 50 аминокислотных остатков (предпочтительно, от приблизительно 10 до приблизительно 20 аминокислотных остатков).
Термин "двухвалентный ион металла" относится к иону металла, имеющему два положительных заряда. Примеры двухвалентных ионов металлов включают, но не ограничиваясь ими, ионы цинка, кобальта, никеля, кадмия, магния и марганца. Заслуживающие особого внимания такие металлы, которые могут быть задействованы в настоящем изобретении, включают солевые формы (например, фармацевтически приемлемые солевые формы), в частности, хлоридные, ацетатные, карбонатные, цитратные и сульфатные формы вышеуказанных двухвалентных ионов металлов. Необязательно, двухвалентным ионом металла для применения в рамках настоящего изобретения может быть ион цинка, предпочтительно, в солевой форме, т.е. в виде сульфата цинка или хлорида цинка.
Термин "выделенный" используется в настоящем описании для описания разных пептидов или белков, раскрытых в настоящем изобретении, и означает пептид или белок, идентифицированный и сепарированный и/или восстановленный из компонентов его природного окружения. Загрязняющие компоненты его природного окружения представляют собой материалы, которые способны создавать помехи в диагностических или терапевтических способах применения пептида или белка, и к ним относятся ферменты, гормоны и другие белковоподобные или небелковоподобные растворенные вещества. В предпочтительных вариантах осуществления изобретения пептид или белок очищают (1) в достаточной степени для получения по меньшей мере 15 N-концевых или внутренних остатков аминокислотной последовательности при использовании секвенатора с вращающимся стаканом, или (2) до гомогенности по методике SDS-PAGE в нередуцирующих или редуцирующих условиях с использованием красителя кумасси голубого или, предпочтительно, окраски серебрением, либо (3) до гомогенности, определяемой методиками масс-спектрометрии или картирования пептидов. Выделенный материал включает пептид или белок in situ внутри рекомбинантных клеток, в тех случаях, когда по меньшей мере, один компонент его природного окружения отсутствует. Однако, как правило, выделенный пептид или белок получают, по меньшей мер, с одним этапом очистки.
Определение "процентная доля (%) идентичности аминокислотной последовательности" в отношении последовательностей, идентифицированных в этом документе, означает процентную долю аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам эталонной последовательности после выверки обеих последовательностей и, при необходимости, вставления пробелов для достижения максимальной процентной идентичности, причем никакие консервативные замещения не рассматриваются как часть идентичности последовательности. Выверка в целях установления процентной идентичности аминокислотных последовательностей может осуществляться разными способами, известными в данной области и определяющими соответствующие параметры для измерения соответствия, включая алгоритмы присваивания, необходимые для достижения максимальной выверки по всей длине сравниваемых последовательностей. В целях настоящей патентной заявки процентные величины аминокислотной идентичности можно получить, используя компьютерную программу для сравнения последовательностей ALIGN-2, разработанную компанией Genentech Inc., исходный текст которой был внесен вместе с документацией для пользователей в Бюро регистрации авторских прав США (US Copyright Office, Washington, DC, 20559) и зарегистрирован там под номером TXU510087. Программа ALIGN-2 общедоступна через Genentech Inc. (South San Francisco, CA). Все параметры сравнения последовательностей заданы программой ALIGN-2 и не подлежат изменениям.
"Жесткость" реакций гибридизации хорошо понятна среднему специалисту в данной области, обычно представляя собой результат эмпирического расчета, основанного на длине зонда, температуре отмывания и концентрации солевого раствора. В целом, более длинные зонды требуют более высоких температур для правильного отжига, тогда как для относительно коротких зондов нужны пониженные температуры. Гибридизация, в целом, зависит от способности денатурированной ДНК к повторному отжигу, если комплементарные нити в окружающей среде представлены при температуре ниже точки плавления. Чем выше степень желательной идентичности между зондом и гибридизируемой последовательностью, тем выше относительная температура, которую можно использовать. Отсюда следует, что для достижения более жестких условий реакции нужны более высокие температуры, тогда как при меньших температурах условия реакции будут менее жесткими. Более подробные сведения и пояснения по вопросу жесткости реакций гибридизации см. по ссылке Ausubel et al., Current Protocols in Molecular Biology, Wiley Interscience Publishers, (1995).
"Условия высокой жесткости", как используется в настоящем описании, определяются следующим образом: (1) используют для отмывания низкую ионную силу и высокую температуру: 0,015 М хлорида натрия/0,0015 М цитрата натрия/0,1% додецилсульфата натрия при 50°C; (2) используют во время гибридизации следующий денатурирующий агент: 50% (объем/объем) формамида с 0,1% альбумина сыворотки крупного рогатого скота/0,1% среды фиколл/0,1% поливинилпирролидона/50 мМ буфера фосфата натрия при pH 6,5 с 750 мМ хлорида натрия, 75 мМ цитрата натрия при 42°C; или (3) используют 50% формамид, 5×SSC (0,75 М NaCl, 0,075 М цитрата натрия), 50 ммоль фосфата натрия (pH 6,8), 0,1% пирофосфата натрия, 5× раствор Денхардта, обработанную ультразвуком ДНК лососиной спермы (50 мкг/мл), 0,1% SDS и 10% декстран-сульфата при 42°C с отмыванием при 42°C в 0,2×SSC (хлорид натрия/цитрат натрия) и 50% формамида при 55°C, с последующим отмыванием высокой жесткости, состоящим из 0,1×SSC, содержащим ЭДТА при 55°C.
"Условия средней жесткости" можно идентифицировать в соответствии с описанием Sambrook et al., Molecular Cloning: A Laboratory Manual, New York: Cold Spring Harbor Press, 1989 - эти условия включают инкубацию в течение ночи при температуре 37°C в растворе, содержащем: 20% формамида, 5×SSC (150 мМ NaCl, 15 мМ тринатрийцитрата), 50 мМ фосфата натрия (pH 7,6), 5× раствор Денхардта, 10% декстран-сульфата и 20 мг/мл денатурированной ДНК лососиной спермы (sheared salmon sperm), с последующим отмыванием фильтров в 1×SSC при температуре около 37-50°C. Опытный специалист должен знать, как следует должным образом подбирать температуру, ионную силу и т.д., с учетом таких факторов, как длина зонда и т.п.
Термин "праймер" или "праймеры" относится к олигонуклеотидным последовательностям, которые гибридизируются с полинуклеотидом-мишенью ДНК или РНК и служат стартовой точкой для пошагового синтеза полинуклеотида из мононуклеотидов под воздействием нуклеотидилтрансферазы, как это происходит, например, в полимеразной цепной реакции.
Термин "контролирующие последовательности" относится к последовательностям ДНК, которые необходимы для экспрессии функционально связанной кодирующей последовательности в специфическом организме хозяина. Контролирующие последовательности, которые подходят для прокариот, включают, например, промотор, необязательно, последовательность-оператор и сайт связывания рибосом. Известно, что эукариотические клетки утилизируют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота "функционально связана", если она находится в функциональной взаимосвязи с другой последовательностью нуклеиновой кислоты. Например, ДНК для предпоследовательности или секреторного лидера функционально связана с ДНК для полипептида, если она экспрессируется как предбелок (препротеин), который участвует в секреции полипептида. Промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию последовательности, а сайт связывания рибосом функционально связан с кодирующей последовательностью, если он расположен так, что облегчает трансляцию. В общем понятие "функциональной связи" означает, что такие последовательности ДНК расположены рядом друг с другом, а в случае секреторного лидера не только смежны, но и находятся в фазе считывания. Однако энхансеры не должны быть смежными. Сопряжение сопровождается сшивкой в подходящих сайтах рестрикции. Если таких сайтов нет, то в соответствии с принятой практикой используются синтетические олигонуклеотидные адаптеры или линкеры.
Термины "зависимая от антител клеточно-опосредованная цитотоксичность" и "ADCC" относятся к клеточно-опосредованной реакции, в которой неспецифические цитотоксические клетки, которые экспрессируют рецепторы Fc (FcR) (например, природные клетки-киллеры (NK), нейтрофилы и макрофаги) распознают связанное антитело на целевой клетке и вслед за этим вызывают лизис целевой клетки. Основные клетки для опосредования ADCC, клетки NK, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Сводные данные по экспрессии FcR гемопоэтическими клетками приведены в таблице 3 на странице 464 в работе Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991). Для того чтобы оценить активность типа ADCC в представляющей интерес молекуле, можно провести анализ ADCC in vitro, например, описанный в патенте США № 5500362 или 5821337. Полезные эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (PBMC) и природные клетки-киллеры (NK). Альтернативно или дополнительно активность ADCC представляющей интерес молекулы можно оценить in vivo, например, в животной модели, описанной Clynes et al. PNAS (USA) 95:652-656 (1998).
"Эффекторные клетки человека" представляют собой лейкоциты, экспрессирующие один и более FcR и выполняющие функции эффекторов. Предпочтительно, чтобы клетки экспрессировали, по меньшей мере, FcγRIII и выполняли функцию эффекторов ADCC. Примеры лейкоцитов человека, опосредующих ADCC, включают мононуклеарные клетки периферической крови (PBMC), природные клетки-киллеры (NK), моноциты, цитотоксические T-клетки и нейтрофилы, причем предпочтение отдается клеткам PBMC и NK.
Термины "рецептор Fc" или "FcR" используются для описания рецептора, который связывается с областью Fc антитела. Предпочтительный FcR представляет собой природную последовательность FcR человека. Кроме того, предпочтительный FcR связывает антитело IgG (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, в том числе аллельные варианты и формы рецепторов, полученные в результате альтернативного сплайсинга. Рецепторы FcγRII включают разновидности FcγRIIA ("активирующий рецептор") и FcγRIIB ("ингибирующий рецептор"), которые имеют почти одинаковые аминокислотные последовательности, которые различаются, главным образом, в цитоплазматических доменах. Активирующий рецептор FcγRIIA в своем цитоплазматическом домене содержит иммунорецепторный мотив активации, основанный на тирозине (ITAM). Ингибирующий рецептор FcγRIIB в своем цитоплазматическом домене содержит иммунорецепторный мотив ингибирования, основанный на тирозине (ITIM) (см. Daeron, Annu. Rev. Immunol. 15:203-234 (1997)). Обзор FcR представлен в работах Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991); Capel et al., Immunomethods 4:25-34 (1994), а также de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995). В этом тексте термин FcR охватывает и другие FcR, включая те, которые могут быть идентифицированы в будущем. Этот термин также включает рецептор новорожденных (FcRn), который отвечает за перенос материнских антител IgG плоду (Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)). В этом документе FcR включают также полиморфные варианты, в частности, генетический диморфизм в гене, кодирующем FcγRIIIа, результатом которого является наличие или фенилаланина (F), или валина (V) в 158 положении, которое приходится на область рецептора, связывающиуюся с IgG1. Было установлено, что гомозиготный валин FcγIIIa (FcγIIIa-158V) имеет более высокую аффинность к IgG1 человека и опосредует повышенный уровень ADCC in vitro по сравнению с гомозиготным фенилаланином FcγIIIa (FcγIIIa-158F) или гетерозиготными рецепторами (FcγIIIa-158F/V).
Термин "зависимая от комплемента цитотоксичность" или "CDC" относится к способности молекулы лизировать клетку-мишень в присутствии комплемента. Путь активации комплемента инициируется при связывании первого компонента системы комплемента (C1q) с молекулой (например, антителом) в комплексе с родственным антигеном. Для того чтобы оценить активацию комплемента, можно провести анализ CDC, например, так, как это описано в работе Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996).
II. ПРИМЕРНЫЕ СПОСОБЫ И МАТЕРИАЛЫ ИЗОБРЕТЕНИЯ
Раскрытые в данном описании способы и аналитические методики направлены на исследование экспрессии одного или более биомаркеров в образцах тканей или клеток млекопитающих, причем выявление экспрессии одного или более таких биомаркеров служит прогностическим или диагностическим индикатором чувствительности указанных образцов клеток и тканей к таким агентам, как Apo2L/TRAIL и/или антителам рецепторов клеточной смерти, таким как агонистические анти-DR5 антитела или агонистические анти-DR4 антитела. Способы и аналитические методики включают такие, при помощи которых можно исследовать экспрессию членов семейства молекул GalNac-T, включая GalNac-T14 и GalNac-T3.
Как обсуждалось выше, существуют некоторые популяции клеток человека больного типа (например, определенные популяции раковых клеток), которые невосприимчивы к сигналам клеточной смерти, включая эффекты Apo2L/TRAIL или агонистических антител рецепторов клеточной смерти. Следовательно, надо полагать, что раскрытые в настоящем описании способы и аналитические методики могут предоставить удобные, эффективные и, возможно, экономически эффективные средства для получения данных и информации, полезных в оценке применимости и эффективности конкретных подходов к лечению больных. Например, больной, у которого было диагностировано раковое или иммунозависимое заболевание, должен пройти биопсию для получения образца ткани или клеток, а полученный образец должен быть исследован разными аналитическими методами in vitro для определения того, чувствительны ли клетки больного к воздействию терапевтического агента, например, Apo2L/TRAIL или антитело рецепторов клеточной смерти.
Изобретение предлагает способы прогнозирования чувствительности образцов тканей или клеток млекопитающих (например, раковых клеток) к Apo2L/TRAIL или агонистическим антителам, направленным на рецепторы клеточной смерти. Необязательно, полученный образец ткани или клеток млекопитающего исследуют на экспрессию GalNac-T14. Способы изобретения могут быть реализованы во многих форматах анализа, включая выявление экспрессии мРНК, экспрессии белка (например, иммуногистохимическими анализами), а также биохимические анализы, определяющие ферментативную активность UDP-N-ацетил-D-галактозамин:полипептида N-ацетилгалактозаминтрансферазы. Определение экспрессии таких биомаркеров GalNac-T14 в (или на) указанных тканях или клетках имеет значение для предсказания чувствительности таких тканей или клеток к индуцирующей апоптоз активности Apo2L/TRAIL и/или к агонистическим антителам рецепторов клеточной смерти. Заявители неожиданно обнаружили, что экспрессия GalNac-T14 коррелируется с чувствительностью таких тканей и клеток к Apo2L/TRAIL и агонистическим антителам рецепторов клеточной смерти.
Как обсуждалось выше, экспрессию различных биомаркеров, например, GalNac-T14, в образце можно анализировать на основе множества методологий, большая часть которых известна в данной области и понятна опытному специалисту, включая, но не ограничиваясь ими, иммуногистохимический и/или вестерн-анализ, количественные анализы по образцам крови (например, сывороточный метод ELISA) (например, для исследования уровня экспрессии белка), биохимические анализы ферментативной активности, гибридизацию in situ, нозерн-анализ и/или ПЦР-анализ мРНК и геномный саузерн-анализ (например, для исследования генной делеции или амплификации), а также любой другой из широкого круга анализов, которые можно проводить в совокупности генов и/или тканей. Типовые протоколы для оценки статуса генов и генных продуктов можно найти, например, у Ausubel et al. eds., 1995, Current Protocols In Molecular Biology, разделы 2 (нозерн-блоттинг), 4 (саузерн-блоттинг), 15 (иммуноблоттинг) и 18 (ПЦР-анализ).
Приведенные ниже протоколы, относящиеся к выявлению GalNac-T14 в образце, представлены в настоящем описании в иллюстративных целях.
Необязательные способы по изобретению включают протоколы, по которым можно исследовать или тестировать наличие GalNac-T14 в образце ткани или клеток млекопитающего. Для выявления GalNac-T14 можно использовать множество способов, включая, например, иммуногистохимический анализ, иммунопреципитацию, анализ вестерн-блоттингом, анализ молекулярного связывания, ELISA, ELIFA, сортировку флуоресцентно активированных клеток (FACS), а также иммунопреципитацию с последующей масс-спектрометрией (MС) и анализ моносахаридов. Например, необязательно способ для выявления экспрессии GalNac-T14 в ткани или образце включает контакт образца с анти-GalNac-T14 антителом, а затем выявление связывания антитела с GalNac-T14 в образце.
В некоторых вариантах осуществления изобретения экспрессию GalNac-T14 в образце исследуют, применяя протоколы иммуногистохимии с окрашиванием. Было продемонстрировано, что иммуногистохимическое окрашивание срезов тканей представляет собой надежный способ оценки или выявления присутствия белков в образце. Методики иммуногистохимии ("IHC") используют антитело для зондирования и визуализации клеточных антигенов in situ, обычно хромогенными или флуоресцентными методами.
Для подготовки образца можно использовать образец ткани или клеток от млекопитающего (обычно от больного человека). Примеры образцов включают, но не ограничиваясь ими, раковые клетки, например, из опухолей толстой кишки, молочной железы, предстательной железы, яичников, легких, желудка, поджелудочной железы, а также раковые клетки лимфомы и лейкоза. Необязательно, образцы включают клетки немелкоклеточного рака легких, клетки рака поджелудочной железы или клетки неходжкинской лимфомы. Образец можно получить многими способами, известными в данной области, в число которых входят, но не ограничиваясь ими, хирургическое иссечение, аспирация и биопсия. Ткань может быть свежей или замороженной. В одном из вариантов осуществления изобретения образец фиксируют и заливают парафином или подвергают какой-либо подобной обработке.
Образец ткани может быть зафиксирован (т.е. законсервирован) посредством традиционной методологии (см., например, "Manual of Histological Staining Method of the Armed Forces Institute of Pathology," 3rd edition (1960) Lee G. Luna, HT (ASCP) Editor, The Blakston Division McGraw-Hill Book Company, New York; The Armed Forces Institute of Pathology Advanced Laboratory Methods in Histology and Pathology (1994) Ulreka V. Mikel, Editor, Armed Forces Institute of Pathology, American Registry of Pathology, Washington, D.C.). Специалист поймет, что выбор фиксатора зависит от тех целей, для которых конкретный образец должен быть окрашен гистологически или проанализирован каким-либо иным образом. Специалист также поймет, что продолжительность фиксации зависит от размера образца ткани и от используемого фиксатора. В качестве примера для фиксации образца можно использовать нейтральный забуференный формалин, фиксатор Буэна или параформальдегид.
Обычно образец сначала фиксируют, а затем обезвоживают в восходящей серии спиртов, инфильтрируют и заливают парафином или другой средой для получения срезов, чтобы образец ткани можно было резать тонкими слоями. В альтернативном варианте можно сделать тонкий срез ткани и зафиксировать полученный срез. В качестве примера образец ткани можно залить парафином и обработать по традиционной методологии (см., например, "Manual of Histological Staining Method of the Armed Forces Institute of Pathology", выше). Примеры парафина, пригодного для применения, включают, но не ограничиваясь ими, Paraplast, Broloid и Tissuemay. После заливки образца ткани парафином его можно резать микротомом или аналогичным инструментом (см., например, "Manual of Histological Staining Method of the Armed Forces Institute of Pathology", выше). В качестве примера для этой процедуры срезы могут изменяться по толщине от приблизительно трех до приблизительно пяти микронов. После получения срезы можно закреплять на предметных стеклах различными стандартными способами. Примеры клеевых веществ для фиксации срезов на предметных стеклах включают, но не ограничиваясь ими, силан, желатин, поли-L-лизин и т.п. В качестве примера срезы, залитые парафином, можно прикреплять к предметным стеклам с положительным электрическим зарядом и/или к стеклам, покрытым поли-L-лизином.
Если в качестве заливочного материала был использован парафин, то срезы тканей обычно депарафинизируют и регидратируют водой. Срезы тканей можно депарафинизировать несколькими традиционными стандартными методологиями. Например, можно использовать ксилолы и плавно нисходящую серию спиртов (см., например, "Manual of Histological Staining Method of the Armed Forces Institute of Pathology", выше). В альтернативном варианте можно использовать поступающие в свободную продажу неорганические депарафинизирующие агенты, например, Hemo-De7 (CMS, Хьюстон, штат Техас).
Необязательно, после получения препарата тканевой срез можно анализировать методом IHC. Исследование по методу IHC можно провести в комбинации с дополнительными методиками, например, морфологическим окрашиванием и/или флуоресцентной гибридизацией in situ. Доступны два общих метода IHC: прямой и непрямой анализ. Согласно первому анализу, связывание антитела с целевым антигеном (например, GalNac-T14) осуществляется прямым образом. В этом прямом анализе используется меченый реактив, например флуоресцентная метка или ферментативно меченное первичное антитело, которое можно визуализировать без дальнейшего взаимодействия антител. В характерном непрямом анализе неконъюгированное первичное антитело связывается с антигеном, а затем меченое вторичное антитело связывается с первичным антителом. Если вторичное антитело конъюгировано с ферментативной меткой, то для визуализации антигена добавляют хромогенный или флюорогенный субстрат. Амплификация сигнала происходит потому, что некоторые вторичные антитела могут взаимодействовать с различными эпитопами на первичном антителе.
Первичное и/или вторичное антитело, используемое в иммуногистохимическом анализе, как правило, метят поддающимся обнаружению компонентом. Доступны многочисленные метки, которые в целом можно сгруппировать по следующим категориям:
(a) Радиоизотопы, например, 35S, 14C, 125I, 3H и 131I. Антитело может быть мечено радиоизотопом при помощи методик, описанных, например, Current Protocols in Immunology, Volumes 1 and 2, Coligen et al., Ed. Wiley-Interscience, New York, New York, Pubs. (1991), а радиоактивность можно измерять сцинтилляционным счетчиком.
(b) Частицы коллоидного золота.
(c) Флуоресцентные метки, включая, но не ограничиваясь ими, редкоземельные хелаты (хелаты европия), техасовый (техасский) красный, родамин, флуоресцеин, дансил, лиссамин, умбеллиферон, фикоэритрин, фикоцианин или поступающие в продажу флуорофоры, например, SPECTRUM ORANGE7 и SPECTRUM GREEN7 и/или производные любого из вышеуказанных веществ. Флуоресцентные метки можно конъюгировать с антителами, применяя методики, раскрытые, например, Current Protocols in Immunology, см. выше. Флуоресценцию можно оценивать количественно флуориметром.
(d) Доступны различные метки типа ферментных субстратов, а патент США № 4275149 дает обзор по некоторым из них. Фермент обычно катализирует химическое изменение хромогенного субстрата, которое можно измерить, применяя разные методики. Например, фермент может катализировать в субстрате изменение цвета, которое можно измерить спектрофотометрически. Альтернативно, фермент может изменять флуоресценцию или хемилюминесценцию субстрата. Методики количественного определения изменений флуоресценции описаны выше. Хемилюминесцентный субстрат становится электронно возбужденным в результате химической реакции, после чего может излучать свет, поддающийся измерению (например, при помощи хемилюминометра), или передает энергию флуоресцентному акцептору. Примеры ферментативных меток включают люциферазы (например, люциферазу светлячка и бактериальную люциферазу; патент США № 4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназу, уреазу, пероксидазу, например, пероксидазу хрена (HRPO), щелочную фосфатазу, бета-галактозидазу, глюкоамилазу, лизоцим, сахаридоксидазы (например, глюкозоксидазу, галактозоксидазу и глюкозо-6-фосфатдегидрогеназу), гетероциклические оксидазы (например, уриказу и ксантиноксидазу), лактопероксидазу, микропероксидазу и т.п. Методики конъюгирования ферментов с антителами описаны O'Sullivan et al., Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay, Methods in Enzym. (ed. J. Langone & H. Van Vunakis), Academic press, New York, 73:147-166 (1981).
Примеры комбинаций фермент-субстрат включают, например:
(i) Пероксидазу хрена (HRPO) с перекисью водорода в качестве субстрата, причем перекись водорода окисляет краситель-предшественник (например, ортофенилендиамин (OPD) или 3,3',5,5'-тетраметилбензидингидрохлорид (TMB));
(ii) Щелочную фосфатазу (AP) с паранитрофенилфосфатом в качестве хромогенного субстрата, а также
(iii) Бета-D-галактозидазу (β-D-Gal) с хромогенным субстратом (например, п-нитрофенил-бета-D-галактозидазой) или флуорогенным субстратом (например, 4-метилумбеллиферил-бета-D-галактозидазой).
Специалистам в данной области также известны и доступны многие другие комбинации ферментов с субстратами. Общий обзор по этому вопросу см. в патентах США №№ 4275149 и 4318980. Иногда метка конъюгирована с антителом непрямым образом. Опытный специалист должен знать о разных методиках, с помощью которых можно достичь этого. Например, антитело может быть конъюгировано с биотином, а любая из четырех широких категорий меток, упомянутых выше, может быть конъюгирована с авидином или наоборот. Биотин избирательно связывается с авидином, следовательно, метка может быть конъюгирована с антителом этим непрямым способом. Альтернативно, для достижения непрямой конъюгации метки с антителом антитело конъюгируется с мелким гаптеном, а один из разнообразных вышеупомянутых типов метки конъюгируется с противогаптенным антителом. Таким образом, может быть достигнута непрямая конъюгация метки с антителом.
Помимо процедур подготовки образца, обсужденных выше, может понадобиться дальнейшая обработка тканевого среза перед, во время или после IHC, например, способы восстановления эпитопа, такие как нагревание образца ткани в цитратном буфере (см., например, Leong et al. Appl. Immunohistochem. 4(3):201 (1996)).
После необязательного этапа блокирования тканевой срез вводят в контакт с первичным антителом на достаточное по продолжительности время и в подходящих условиях, благодаря чему первичное антитело связывается с целевым белковым антигеном в образце ткани. Соответствующие условия для достижения этого результата можно определить обычным экспериментированием. Степень связывания антитела с образцом определяют, используя любую из поддающихся обнаружению меток, которые обсуждались выше. Предпочтительно, чтобы метка была ферментной (например, HRPO) и катализировала химическое изменение хромогенного субстрата, например, 3,3'-диаминобензидинхромогена. Предпочтительно, чтобы ферментная метка была конъюгирована с антителом, которое специфически связывается с первичным антителом (например, первичное антитело представляет собой поликлональное антитело кролика, а вторичное антитело представляет собой антитело козы против кролика).
Необязательно, антитела, участвующие в анализе IHC для определения экспрессии GalNac-T14, представляют собой анти-GalNac-T14 антитела. Альтернативно, можно использовать антитела к другим антигенам GalNac-T, которые перекрестно реагируют с GalNac-T14. Необязательно, анти-GalNac-T14 антитело представляет собой моноклональное антитело.
Образцы, подготовленные таким способом, можно монтировать и закрывать покровными стеклами. Затем проводят оценочное исследование предметного стекла, например, под микроскопом, причем на этом этапе можно применять критерии интенсивности окрашивания, обычно используемые в данной области. Критерии интенсивности окрашивания можно оценивать следующим образом:
Как правило, принято считать, что балльная оценка характера окрашивания приблизительно 2+ или более в таком IHC-анализе является предиктором или индикатором чувствительности клеток млекопитающего (например, раковых клеток млекопитающего) к Apo2L/TRAIL или к агонистическим антителам рецепторов смерти.
В альтернативных способах образец может быть введен в контакт с антителом, специфичным для указанного биомаркера, причем в таких условиях, которые достаточны для формирования комплекса антитело-биомаркер, а также для обнаружения указанного комплекса. Присутствия биомаркера можно достичь многими способами, например, вестерн-блоттингом (с иммунопреципитацией или без нее) и процедурами ELISA для аналитического исследования широкого спектра тканей и образцов, включая плазму и сыворотку. Известен и доступен широкий ряд методик иммуноанализа, использующих такой аналитический формат (см., например, патенты США №№ 4016043, 4424279 и 4018653). К ним относятся как односайтовый, двухсайтовый или "сэндвич" анализы неконкурентного типа, так и традиционные варианты анализа с конкурентным связыванием. Эти анализы также включают прямое связывание меченого антитела с целевым биомаркером.
Сэндвич-анализы относятся к наиболее полезным и часто применяемым видам анализа. Существует множество вариантов методики сэндвич-анализа, и все они могут быть использованы в настоящем изобретении. Вкратце, в характерном прямом анализе немеченое антитело иммобилизуют на твердом субстрате, а образец, подлежащий тестированию, вводят в контакт со связанной молекулой. После соответствующего периода инкубации в течение такого времени, которое достаточно для образования комплекса антиген-антитело, к образцу добавляют второе антитело, специфичное по отношению к антигену и меченное репортерной группой, способной продуцировать выявляемый сигнал, после чего инкубируют в течение времени, достаточного для образования еще одного комплекса антитело-антиген-меченое антитело. Любой непрореагировавший материал отмывают, а присутствие антигена определяют, наблюдая сигнал, продуцированный репортерной группой. Результаты могут быть или качественными, в виде простого наблюдения видимого сигнала, или количественными, представляя собой сравнение с контрольным образцом, содержащим заведомо известное количество биомаркера.
Варианты прямого анализа включают одновременный анализ, при котором как образец, так и меченое антитело одновременно добавляются к связанному антителу. Эти методики хорошо известны опытному специалисту, включая, как можно легко понять, их небольшие вариации. В характерном прямом сэндвич-анализе первое антитело, специфичное по отношению к биомаркеру, или ковалентно, или пассивно связано с твердой поверхностью. Характерная твердая поверхность представляет собой стекло или полимер, причем самыми часто используемыми полимерами являются целлюлоза, полиакриламид, нейлон, полистирол, поливинилхлорид и полипропилен. Твердые опоры могут быть в виде пробирок, бисера, дисков или микропластинок, а также любых других поверхностей, пригодных для проведения иммуноанализа. Процессы связывания хорошо известны в данной области и в целом состоят из перекрестного ковалентного связывания или физической адсорбции, причем комплекс антиген-антитело отмывают в препарате испытуемого образца. Затем аликвотную часть образца, подлежащего тестированию, добавляют к твердофазному комплексу и инкубируют на протяжении определенного времени (например, от 2 до 40 минут или в течение ночи или другого, более подходящего промежутка), а также в определенных условиях (например, от комнатной температуры до 40°C или от 25°C до 32°C включительно), что позволяет связаться любым субъединицам, представленным в составе антитела. После периода инкубации субъединицу антитела в твердой фазе отмывают и высушивают, после чего инкубируют со вторым антителом, специфичным по отношению к части биомаркера. Второе антитело связано с репортерной группой, которая используется как индикатор связывания второго антитела с молекулярным маркером.
Альтернативный способ подразумевает иммобилизацию целевых биомаркеров в образце и последующий контакт иммобилизованной цели со специфическим антителом, меченным или немеченным репортерной молекулой. В зависимости от количества мишени и интенсивности сигнала репортерной группы связанная цель (мишень) может поддаваться определению за счет прямого мечения антителом. В альтернативном способе второе меченое антитело, специфичное по отношению к первому антителу, вводят в контакт с комплексом цель (мишень)-первое антитело для получения третичного комплекса цель (мишень)-первое антитело-второе антитело. Этот комплекс определяют по сигналу, эмитированному репортерной группой. Под "репортерной группой", как используется в настоящем описании, подразумевается молекула, которая по своей химической природе генерирует аналитически выявляемый сигнал, позволяющий идентифицировать антитело, связанное с антигеном. Наиболее часто используемые в этом типе анализов репортерные группы представляют собой или ферменты, флуорофоры, или молекулы, содержащие радионуклиды (например, радиоактивные изотопы) и хемилюминесцентные молекулы.
В случае иммуноферментного анализа фермент конъюгируют с вторичным антителом, обычно посредством глутаральдегида или периодата. Однако, как можно будет легко понять, существует широкий спектр различных методик конъюгации, которые без проблем доступны опытному специалисту. Часто используемые ферменты включают среди прочих пероксидазу хрена, глюкозооксидазу, галактозидазу и щелочную фосфатазу. Субстраты, которые используются со специфическими ферментами, обычно выбирают для выработки поддающихся определению изменений цвета под воздействием соответствующего фермента. Примеры подходящих ферментов включают щелочную фосфатазу и пероксидазу. Кроме того, можно использовать и флуорогенные субстраты, которые порождают флуоресцентный продукт, а не хромогенные субстраты, отмеченные выше. Во всех случаях ферментативно меченное антитело добавляют к комплексу первого антитела с молекулярным маркером для связывания и последующего отмывания избытков реактива. Затем к комплексу антитело-антиген-антитело добавляют раствор, содержащий соответствующий субстрат. Этот субстрат будет взаимодействовать с ферментом, связанным со вторым антителом, в результате чего возникает качественный визуальный сигнал, который далее можно оценивать количественно, обычно посредством спектрофотометрии, для индикации количества биомаркера, представленного в образце. В альтернативном варианте флуоресцентные соединения, например, флуоресцеин и родамин, можно химически соединить с антителами без изменения их связывающей способности. При активации световым облучением с определенной длиной волны антитело, меченное флуорохромом, поглощает световую энергию, индуцируя состояние возбудимости в молекуле, что сопровождается эмиссией света характерного цветового оттенка, который визуально определяют под световым микроскопом. Так же, как и в EIA (иммуноферментном анализе), флуоресцентно меченному антителу позволяют связаться с комплексом первое антитело-молекулярный маркер. После отмывания несвязанного реактива оставшийся третичный комплекс подвергают облучению светом с соответствующей длиной волны, а наблюдаемая флуоресценция указывает на наличие интересующего исследователя молекулярного маркера. Обе методики (иммунофлуоресценции и EIA) прочно укоренились в данной области. Однако можно использовать и другие репортерные группы, например, радиоизотопы, хемилюминесцентные или биолюминесцентные молекулы.
Подразумевается вопрос о том, что вышеописанные методики также можно использовать для выявления экспрессии GalNac-T14.
Способы по настоящему изобретению включают протоколы, по которым можно исследовать присутствие и/или экспрессию GalNac-T14 в образце ткани или клеток. Способы оценки мРНК в клетках хорошо известны и включают, например, гибридизационные анализы с использованием зондов комплементарной ДНК (в частности, гибридизацию in situ с использованием меченых рибозондов GalNac-T14, нозерн-блоттинг и родственные методики), а также разные анализы с амплификацией нуклеиновых кислот (например, RT-PCR [полимеразную цепную реакцию с обратной транскрипцией] с использованием комплементарных праймеров, специфичных в отношении GalNac-T14, и другие методы определения амплификационного типа, такие как метод амплификации разветвленной ДНК, SISBA, TMA и т.п.).
Образцы тканей или клеток млекопитающих можно легко проанализировать, например, на мРНК GalNac-T14, используя варианты анализа нозерн, дот-блот или ПЦР. Например, анализы типа RT-PCR, такие как количественная ПЦР, хорошо известны в данной области. В иллюстративном варианте осуществления изобретения способ выявления мРНК GalNac-T14 в биологическом образце включает выработку кДНК из образца путем обратной транскрипции с использованием по меньшей мере одного праймера; амплификацию полученной таким путем кДНК с использованием полинуклеотида GalNac-T14 в качестве смыслового и антисмыслового праймеров для амплификации кДНК GalNac-T14 в этом образце; а также выявление присутствия амплифицированной кДНК GalNac-T14. В дополнение к этому, такие способы могут включать один или более этапов, которые позволяют определить уровень мРНК GalNac-T14 в биологическом образце (например, путем одновременного исследования уровня сравнительной контрольной последовательности мРНК такого гена "домашнего хозяйства", как член семейства актиновых генов). Необязательно, можно определить последовательность амплифицированной кДНК GalNac-T14.
Материальные варианты осуществления этого аспекта изобретения включают праймеры GalNac-T14 и пары праймеров, которые обеспечивают специфическую амплификацию по изобретению полинуклеотидов или любых специфических частей полинуклеотидов, а также зонды, которые избирательно или специфически гибридизируются с молекулами нуклеиновых кислот, рассматриваемых в настоящем изобретении, или с любыми частями аминокислот. Зонды могут быть мечены выявляемым маркером, например радиоизотопом, флуоресцентным соединением, биолюминесцентным соединением, хемилюминесцентным соединением, хелатором металлов или ферментом. Такие зонды и праймеры можно использовать для выявления присутствия полинуклеотидов GalNac-T14 в образце, а также как средство для выявления клеточной экспрессии белков GalNac-T14. Как будет понятно опытному специалисту, на основе представленных в настоящем описании последовательностей можно изготовить очень много различных праймеров и зондов, которые можно эффективно использовать для амплификации, клонирования и/или детерминации присутствия и/или уровня мРНК GalNac-T14.
Необязательно способы по изобретению включают протоколы, по которым в образце ткани или клеток можно на основе технологии микрочипов исследовать или выявлять мРНК, например, мРНК GalNac-T14. При использовании микрочипов нуклеиновых кислот испытуемые и контрольные образцы мРНК из испытуемых и контрольных образцов тканей подвергают обратной транскрипции и мечению для генерирования зондов кДНК. Затем зонды гибридизируют с матрицей нуклеиновых кислот иммобилизованных на твердой опоре. Матрица конфигурируется как последовательность, причем положение каждого члена этой матрицы известно. Например, выборка генов, которые имеют потенциал экспрессии при определенных болезненных состояниях, может быть выстроена на твердой опоре. Гибридизация меченого зонда с конкретным членом матрицы указывает на то, что образец, из которого получен зонд, экспрессирует данный ген. Анализ больной ткани на экспрессию различных генов может дать ценную информацию. Технология микрочипов использует методики гибридизации нуклеиновых кислот и компьютерную технологию для оценки профиля экспрессии мРНК тысяч генов в рамках одного эксперимента (см., например, WO 01/75166, опубликованный 11 октября 2001 г., патент США 5700637, патент США 5445934 и патент США 5807522, Lockart, Nature Biotechnology, 14:1675-1680 (1996), Cheung, V.G. et al., Nature Genetics 21(Suppl):15-19 (1999) для получения более подробной информации по изготовлению матриц). Микрочипы ДНК представляют собой миниатюрные матрицы, содержащие фрагменты генов, которые либо прямым образом синтезированы на стеклах или других субстратах, либо перенесены на них. В одной матрице обычно представлены тысячи генов. Характерный эксперимент с микрочипом включает следующие стадии: 1) получение флуоресцентно меченной мишени из РНК, выделенной из образца; 2) гибридизация меченой мишени с микрочипом; 3) отмывание, окрашивание и сканирование матрицы; 4) анализ сканированного изображения, и 5) генерирование профилей экспрессии генов. В настоящее время используются два основных типа микрочипов ДНК: олигонуклеотидные матрицы (обычно от 25 до 70 мономеров) и матрицы генной экспрессии, содержащие продукты ПЦР, полученные из кДНК. При формировании матрицы олигонуклеотиды или могут быть изготовлены заранее и перенесены на поверхность, или непосредственно синтезированы на поверхности (in situ).
Система Affymetrix GeneChip® представляет собой поступающую в продажу систему микрочипов, которая содержит матрицы, полученные путем прямого синтеза олигонуклеотидов на стеклянной поверхности. Матрицы зонд/ген:олигонуклеотиды, обычно из 25 мономеров, синтезируют прямым образом на стеклянной подложке посредством комбинирования технологий фотолитографии на полупроводниковой основе и твердофазного химического синтеза. Каждая матрица содержит до 400000 различных олигомеров, а каждый олигомер представлен миллионами копий. Поскольку олигонуклеотидные зонды синтезируются на матрице в известных положениях, характер гибридизации и интенсивность сигнала можно интерпретировать в терминах идентичности генов и уровня относительной экспрессии, применяя программное обеспечение Affymetrix Microarray Suite. Каждый ген представлен на матрице серией разных олигонуклеотидных зондов. Каждая пара зондов состоит из олигонуклеотида с идеальным соответствием и олигонуклеотида с недостаточным соответствием. Зонд с идеальным соответствием имеет последовательность, абсолютно комплементарную конкретному гену, благодаря чему он может измерять экспрессию гена. Зонд с недостаточным соответствием отличается от зонда с идеальным соответствием заменой одного основания в центральном положении, за счет чего нарушается связывание транскрипта целевого гена. Это помогает определить фоновую и неспецифическую гибридизацию, дающую вклад в сигнал, измеряемый олигонуклеотидом с идеальным соответствием. Программное обеспечение Microarray Suite вычитает интенсивность гибридизации зондов с недостаточным соответствием из интенсивности гибридизации зондов с идеальным соответствием, определяя величину абсолютной или специфической интенсивности для каждого набора зондов. Выбор зондов основан на текущей информации из банка генов (Genbank) и других хранилищ олигонуклеотидов. Полагают, что эти последовательности распознают уникальные области на 3'-конце гена. Гибридизационная печь GeneChip (печь "rotisserie") используется для одновременной гибридизации до 64 матриц. Станция струйной техники производит отмывание и окрашивание матриц зондов. Эта станция полностью автоматизирована и содержит четыре модуля, причем каждый модуль обрабатывает одну матрицу зондов. Каждый модуль независимо от других управляется программным обеспечением Microarray Suite с использованием предварительно запрограммированных протоколов струйной автоматики. В качестве сканера используется конфокальный лазерный флуоресцентный сканер, измеряющий интенсивность флуоресценции, которую излучает меченая кРНК, связанная с матрицей зондов. Станцией струйной техники и сканером управляет компьютерная рабочая станция с программным обеспечением Microarray Suite. Под управлением программного обеспечения Microarray Suite могут находиться до восьми станций струйной техники, использующих предварительно запрограммированные протоколы гибридизации, отмывания и окрашивания для матриц зондов. Это программное обеспечение также захватывает данные по интенсивности гибридизации и преобразует их в сигнал присутствия/отсутствия для каждого гена, используя соответствующие алгоритмы. И, наконец, это программное обеспечение выявляет изменения экспрессии генов в серии экспериментов посредством сравнительного анализа и форматирует выходные данные в виде текстовых файлов (с расширением.txt), которые можно использовать в других программах для дальнейшего анализа.
Для выявления экспрессии мРНК биомаркера с использованием меченых зондов можно также применять флуоресцентную гибридизацию in situ (FISH). Анализы этого типа хорошо известны в данной области (см., например, Kallioniemi et al., 1992, патент США 6358682).
Экспрессию выбранного биомаркера также можно оценивать, исследуя делецию гена или амплификацию гена. Делецию или амплификацию гена можно измерять на основе любого из множества протоколов, известных в данной области, например, традиционными методами саузерн-блоттинга, нозерн-блоттинга для количественной оценки транскрипции мРНК (Thomas, Proc. Natl. Acad. Sci. USA, 77:5201-5205 (1980)), дот-блоттинга (анализа ДНК) или гибридизации in situ (например, FISH) с использованием соответственно меченного зонда, цитогенетическими методами или сравнительной геномной гибридизацией (CGH) с использованием соответственно меченного зонда. В качестве примера эти методы можно использовать для выявления делеции или амплификации генов GalNac-T14.
Дополнительно можно исследовать статус метилирования биомаркера, например, гена GalNac-T14 в образце ткани или клеток. В иммортализованных и трансформированных клетках часто происходит аномальное деметилирование и/или гиперметилирование островков в 5'-регуляторных областей гена, что приводит к изменению экспрессии различных генов. В данной области известно множество анализов для исследования статуса метилирования гена. Например, в подходах типа саузерн-гибридизации для оценки статуса метилирования островков CpG можно использовать чувствительные к метилированию рестрикционные ферменты, которые неспособны разрезать последовательности, содержащие метилированные сайты CpG. Кроме того, быстро обрисовать статус метилирования всех сайтов CpG, представленных в островках CpG данного гена, может MSP (ПЦР, специфичная по метилированию). Эта процедура включает начальную модификацию ДНК бисульфитом натрия (которая конвертирует все неметилированные цитозины в урацил) и последующую амплификацию с использованием праймеров, специфичных по отношению к метилированной (в отличие от неметилированной) ДНК. Протоколы, включающие вмешательство в метилирование, также можно найти, например, в Current Protocols In Molecular Biology, Unit 12, Frederick M. Ausubel et al. eds., 1995; De Marzo et al., Am. J. Pathol. 155(6): 1985-1992 (1999); Brooks et al., Cancer Epidemiol. Biomarkers Prev., 1998, 7:531-536); и Lethe et al., Int. J. Cancer 76(6): 903-908 (1998).
Экспрессию GalNac-T14 в образце ткани или клеток можно также исследовать при помощи функциональных или основанных на активности анализов. Например, можно провести известный в данной области анализ по определению или выявлению присутствия активности определенного фермента (N-ацетилгалактозаминилтрансферазы) в образце ткани или клеток (см., например, Bennett et al., J. Biol. Chem., 271:17006-17012 (1996); Wang et al., BBRC, 300:738-744 (2003); Hang et al., выше, доступ с мая 2005 г. по адресу www.sciencedirect.com).
В способах по настоящему изобретению подразумевается, что образец ткани или клеток можно также исследовать на экспрессию Apo2L/TRAIL или рецепторов в образце, который связывается с Apo2L/TRAIL или агонистическими антителами рецепторов клеточной смерти. Как описано выше и в других источниках информации по данной области знаний, в настоящее время полагают, что Apo2L/TRAIL связывается по меньшей мере с пятью разными рецепторами: DR4, DR5, DcR1, DcR2 и OPG. Экспрессию Apo2L/TRAIL, DR4, DR5, DcR1, DcR2 и/или OPG по уровню мРНК и уровню белка можно исследовать, применяя методы, известные в данной области, включая описанные в настоящем описании. В качестве примера для выявления присутствия в исследуемом образце одной или более таких молекул можно применить описанные выше методики IHC. Предполагается, что в тех способах, при помощи которых образец ткани или клеток исследуют не только на присутствие маркера GalNac-T14, но и на присутствие, например, DR4, DR5 или DcR1, из одного и того же исследуемого образца ткани можно приготовить разные микроскопические препараты, причем каждый из таких препаратов можно анализировать с реактивом, специфичным для каждого конкретного биомаркера или рецептора. В альтернативном варианте из образца ткани или клеток можно приготовить один микроскопический препарат, используя антитела, направленные на каждый биомаркер или рецептор по протоколу многоцветного окрашивания, что позволяет визуализировать и выявлять соответствующие биомаркеры или рецепторы.
После выявления того, что образец ткани или клеток экспрессирует GalNac-T14, свидетельствуя о том, что эта ткань или клетки чувствительны к Apo2L/TRAIL или агонистическим антителам рецепторов клеточной смерти, предполагается, что млекопитающему можно ввести эффективное количество Apo2L/TRAIL или антител рецепторов клеточной смерти для лечения заболевания, которым страдает это млекопитающее, например рака или иммунозависимого заболевания. Диагностика у млекопитающих различных патологических состояний, описанных в настоящем описании, может быть осуществлена опытным практикующим врачом. В данной области известны и доступны диагностические методики, которые позволяют, например, диагностировать или выявить у млекопитающего рак или иммунозависимое заболевание. Например, рак можно идентифицировать посредством методик, включающих, но не ограничиваясь ими, пальпацию, анализ крови, рентгеновское обследование, магнитно-резонансную томографию и т.п. Иммунозависимые заболевания также можно идентифицировать без больших сложностей.
Apo2L/TRAIL или антитела рецепторов клеточной смерти можно вводить в соответствии с известными способами, например, внутривенным болюсным (струйным) или непрерывным капельным вливанием в течение определенного промежутка времени, а также через внутримышечный, внутрибрюшинный, (внутри)цереброспинальный, подкожный, внутрисуставный, интрасиновиальный, интратекальный, пероральный, топический (местный) или ингаляционный пути. Необязательно, введение лекарств можно проводить посредством мини-насосного вливания, используя для этого различные поступающие в продажу устройства.
Эффективные дозировки и схемы введения Apo2L/TRAIL или антител рецепторов клеточной смерти можно определять эмпирически, руководствуясь навыками и опытом в данной области. Можно использовать как разовые, так и многократные дозировки лекарств. В настоящее время считается, что эффективная дозировка или количество Apo2L/TRAIL при изолированном применении (без других лекарств) могут изменяться от приблизительно 1:г/кг до приблизительно 100 мг/кг веса тела в день. Межвидовой пересчет дозировок можно проводить способом, известным в данной области, например, так, как это описано Mordenti et al., Pharmaceut. Res., 8:1351 (1991).
Если применяется введение Apo2L/TRAIL in vivo, то нормальная доза может изменяться от приблизительно 10 нг/кг до 100 мг/кг веса тела млекопитающего в день, предпочтительно, от приблизительно 1 мкг/кг/день до 10 мг/кг/день (в зависимости от способа введения). Руководящие указания по конкретным дозировкам и способам доставки в организм приведены в литературе (см., например, патенты США №№ 4657760, 5206344 или 5225212). Ожидается, что для различных лекарственных соединений и при различных заболеваниях будут эффективны разные рецептуры, а также, что введение, нацеленное на определенный орган или ткань, будет недостаточно эффективны для другого органа или ткани, т.е. потребуется другой способ доставки.
Предполагается, что способы лечения, рассматриваемые в настоящем изобретении, могут применяться в сочетании с дополнительными вариантами терапии. Один или более других видов терапии могут включать, но не ограничиваясь ими, лучевую терапию, цитокины, ингибиторы роста, химиотерапевтические средства, цитотоксические агенты, ингибиторы тирозинкиназы, ингибиторы ras фарнезилтрансферазы, ингибиторы ангиогенеза и ингибиторы циклинзависимой киназы, которые известны в данной области и далее определяются с вышеописанными подробностями. Предполагается, что эти дополнительные методы лечения могут применяться в виде средств, независимых от Apo2L/TRAIL или антител рецепторов клеточной смерти. В дополнение к этому, могут применяться варианты лечения, основанные на терапевтических антителах, которые нацелены на опухолевые антигены, например, Rituxan™ или Herceptin™, а также противоангиогенные антитела, например, анти-VEGF.
Получение и схемы дозирования для химиотерапевтических средств можно основывать на инструкциях производителей или определять эмпирически, что вполне доступно опытному практикующему врачу. Получение и схемы дозирования таких химиотерапевтических средств также описаны Chemotherapy Service Ed., M.C. Perry, Williams & Wilkins, Baltimore, MD (1992). Химиотерапевтическое средство можно применять до Apo2L/TRAIL или агонистических антител рецепторов клеточной смерти, после них или одновременно с ними.
Может также оказаться желательным введение антител, направленных против других антигенов, например, антител, которые связываются с CD20, CD11a, CD18, CD40, ErbB2, EGFR, ErbB3, ErbB4, сосудистым эндотелиальным фактором (VEGF) или другими членами семейства TNFR (такими как OPG, TNFR1, TNFR2, GITR, Apo-3, TACI, BCMA, BR3).
Альтернативно или в дополнение больному можно одновременно вводить два или более антител, которые связывают один и тот же или два или более разных антигенов, рассматриваемых в настоящем описании. Иногда может оказаться полезным дополнительное введение больному одного или более цитокинов. После введения указанных средств можно проанализировать подвергнутые лечению клетки in vitro. Если лечение проводилось in vivo, то клетки подвергаемого лечению млекопитающего можно мониторировать разными способами, хорошо известными опытному практикующему врачу. Например, можно пато(морфо)логически исследовать опухолевые клетки на некроз или проанализировать сыворотку на признаки ответной реакции иммунной системы.
Для использования в пунктах патентной формулы, описанных или намеченных выше, настоящее изобретение также предлагает готовые наборы или изделия. Такие наборы могут содержать лекарственные средства и носители, разделенные на отсеки и заключенные в один или более контейнеров, например пузырьков, пробирок и т.п., причем каждый контейнер содержит один из составных элементов, используемых в конкретном способе. Например, один из контейнеров может содержать зонд, который уже мечен или может быть мечен для последующего выявления. Такой зонд может представлять собой антитело или полинуклеотид, специфичные по отношению к белку GalNac-T14 или гену GalNac-T14, или к генетическому посланию соответственно. Если набор использует гибридизацию нуклеиновых кислот для выявления целевой нуклеиновой кислоты, то в наборе также могут присутствовать контейнеры, содержащие нуклеотид(ы) для амплификации последовательности целевой нуклеиновой кислоты, и/или контейнер, содержащий репортерное средство, например, белок, связывающийся с биотином (авидин или стрептавидин), который связан с репортерной группой (ферментативной, флуоресцентной или радиоизотопной меткой).
Набор по изобретению, как правило, будет содержать вышеописанный контейнер, а также один или более других контейнеров с материалами, которые желательны с коммерческой и пользовательской точки зрения, включая буферы, разбавители, фильтры, иглы, шприцы и упаковочные вкладыши с инструкциями по применению. На контейнере может присутствовать этикетка, указывающая, что композиция должна использоваться для специфического лечения или не в лечебных целях, причем на этой этикетке также могут содержаться указания по использованию in vivo или in vitro, например, так, как это описано выше.
Наборы по изобретению имеют множество вариантов применения. Характерный вариант применения представляет собой набор, включающий контейнер, этикетку на указанном контейнере и композицию, содержащуюся внутри указанного контейнера, причем такая композиция включает первичное антитело, которое связывается с полипептидной последовательностью GalNac-T14, а этикетка на указанном контейнере содержит информацию о том, что эту композицию можно использовать для оценки присутствия белков GalNac-T14 по меньшей мере в одном типе клеток млекопитающего, наряду с инструкциями по применению антитела GalNac-T14 для оценки присутствия указанных белков по меньшей мере в одном типе клеток млекопитающего. Кроме того, набор может содержать комплект инструкций и материалов по получению образца ткани, а также по применению антитела и зонда на том же срезе образца ткани. Набор может включать как первичное, так и вторичное антитело, причем вторичное антитело конъюгировано с меткой, например с ферментативной меткой.
Другой вариант применения представляет собой набор, включающий контейнер, этикетку на указанном контейнере и композицию, содержащуюся внутри указанного контейнера, причем такая композиция включает полинуклеотид, который гибридизируется с комплементом полинуклеотида GalNac-T14 в жестких условиях, а этикетка на указанном контейнере содержит информацию о том, что эту композицию можно использовать для оценки присутствия GalNac-T14 по меньшей мере в одном типе клеток млекопитающего, наряду с инструкциями по применению полинуклеотида GalNac-T14 для оценки присутствия ДНК или РНК GalNac-T14 по меньшей мере в одном типе клеток млекопитающего.
Другие компоненты набора необязательно включают один или более буферов (например, блокирующий буфер, отмывочный буфер, субстратный буфер и т.д.), прочие реактивы, такие как субстрат (например, хромоген), который подвержен химическому изменению при введении ферментативной метки, раствор для восстановления эпитопа, контрольные образцы (положительный и/или отрицательный контроль), контрольные предметные стекла и т.д.
ПРИМЕРЫ
Различные аспекты изобретения далее будут описаны и проиллюстрированы посредством приведенных ниже примеров, ни один из которых не должен рассматриваться как ограничивающий область действия изобретения.
СПОСОБЫ И МАТЕРИАЛЫ
Клеточные культуры и клеточные линии
Следующие линии клеток человека: линии немелкоклеточного рака легких (NSCLC): H2122, A427, H647, SK-MES-1, H838, H358, H2126, H460, H1703, H2405, H650, H1568, H1666, H322T, SW1573, H292, H1650, H522, EKVX, H661, H23, LXFL 529, H226, A549, H1781, H1299, HOP 62, H2009, HOP 92, H1793, H1975, H1651, calu-1, H1435, HOP 18, H520, H441, H2030, H1155, H1838, H596, HLFa; линии клеток рака поджелудочной железы: Panc 05.04, BxPC3, HPAC, SU.86.86, HuP-T3, PSN1, Panc 08.13, MiaPaCa-2, PA-TU-8988T, Panc 03.27, Capan-1, SW 1990, CFPAC-1, PA-TU-8902, Panc 02.03, Panc 04.03, PL45, Aspc-1, Hs766T, Panc 10.05, Panc1, Capan-2, HPAF-II и NHL: JEKO-1, SU-DHL-4, OCI-LY-19, SR, Farage, DOHH-2, Toledo, WSU-NHL, KARPAS-422, GRANTA-519, Pfeiffer, HT, SC-1, DB. Линии клеток были получены из депозитория ATCC (Манассас, штат Вирджиния), DSMZ (Германская коллекция микроорганизмов и клеточных культур), JCRB (Японский банк клеточных ресурсов) или ECACC (Европейская коллекция клеточных культур) и культивированы в среде RPMI-1640 с добавкой 10% термически инактивированной фетальной сыворотки крупного рогатого скота, 2 ммоль L-глутамина и 10 ммоль HEPES.
Анализы на цитотоксичность
Для определения количества живых клеток после лечения Apo2L/TRAIL или антителами DR5 был использован анализ MTT (CellTiter 96® - нерадиоактивный анализ пролиферации клеток от Promega), который представляет собой колориметрический анализ, основанный на способности живых клеток восстанавливать растворимую желтую соль тетразолия (MTT) в синие кристаллы формазана. Анализ MTT был проведен посредством добавления предварительно перемешанного оптимизированного раствора красителя к клеточной культуре в лунках 96-луночного планшета, содержащих разные концентрации Apo2L/TRAIL или антител DR5 (от 0 до 1000 нг/мл). Во время 4-часовой инкубации живые клетки преобразовывают тетразолиевый компонент раствора красителя в формазановый продукт. Затем в лунки с клеточной культурой добавляли раствор солюбилизации/стоп-реагент для растворения формазанового продукта и проводили запись поглощения света с длиной волны 570 нм при помощи считывающего устройства для 96-луночных планшетов (SpectraMax). Считывание поглощения света с длиной волны 570 нм прямо пропорционально количеству клеток, обычно используемых в анализах пролиферации. Хотя максимум поглощения для формазанового продукта приходится на 570 нм и его беспримесные растворы выглядят синими, цвет образца в конце анализа может быть не синим, что зависит от количества формазана в образце по отношению к другим компонентам в культуральной среде, включая сыворотку, окисленный феноловый красный и невосстановленный MTT.
Количество клеток было оптимизировано посредством их титрования до получения аналитического сигнала, приближающегося к верхней границе линейного спектра в данном анализе. Поскольку разные типы клеток имеют разный уровень метаболической активности, указанная процедура проводилась раздельно для каждой клеточной линии. Для большинства исследованных опухолевых клеток была использована концентрация от 5000 клеток на лунку до 20000 клеток на лунку.
Ниже приведено пошаговое описание проведенных анализов:
1. Клетки, использованные для биоанализа, были взяты из исходных (чистых) культур.
2. Определение количества клеток и их жизнеспособности по окраске трипановым синим с последующим суспендированием клеток до конечного количества от 5000 до 20000 клеток на лунку.
3. Распределение 50 мкл клеточной суспензии в 96-луночный планшет.
4. Инкубация планшетов при 37°C в увлажненной атмосфере с 5% CO2 в течение ночи.
5. Добавление к образцам в 96-луночном планшете 50 мкл культуральной среды, содержащей разные концентрации Apo2L/TRAIL или антител DR5 (в диапазоне от 0 до 1000 нг/мл). В качестве контроля были использованы 50 мкл культуральной среды (без Apo2L/TRAIL или антител DR5) и 100 мкл культуральной среды (без клеток).
Каждый эксперимент был проведен троекратно (в трех наборах лунок и в три разных дня). Общий объем материала в лунках составлял 100 мкл на лунку.
6. Инкубация планшетов при 37°C в увлажненной атмосфере с 5% CO2 в течение 72 часов.
7. Добавление 15 мкл раствора красителя в каждую лунку.
8. Инкубация планшетов при 37°C в увлажненной атмосфере с 5% CO2 до 4 часов.
9. Добавление 100 мкл раствора для солюбилизации/стоп-реагента в каждую лунку.
10. Инкубация планшетов при 37°C в течение ночи.
11. Запись поглощения света с длиной волны 570 нм с использованием считывающего устройства для 96-луночного планшета. Для уменьшения фона, создаваемого обломками клеток, отпечатками пальцев и другими неспецифическими источниками поглощения, была использована эталонная длина волны 750 нм.
12. В качестве пустого значения (бланка) для отрицательного контроля было использовано среднее значение величин поглощения, которое вычиталось из всех остальных показателей считывания. Для вычисления количества живых клеток (в процентах) среднее значение величин поглощения для каждой концентрации Apo2L/TRAIL или антител DR5 делили на среднее значение величин поглощения в положительном контроле (100% необработанных [нелеченых] живых клеток).
13. Были построены графики, отображающие процентную долю живых клеток (ось Y) в зависимости от концентрации Apo2L/TRAIL или антител DR5 (ось X, логарифмическая шкала) с последующим определением величины IC50 по точке на оси (нг/мл), соответствующей 50% живых клеток.
Протокол мечения Affymetrix
Для всех образцов было взято считывание OD260/280, и образцы были пропущены через биоанализатор. Всего было использовано 5 мкг тотальной РНК высокого качества.
A. Синтез первой нити кДНК:
1. Гибридизация праймера
2. Регулирование температуры
3. Синтез первой нити
B. Синтез второй нити кДНК
1. Ставили реакции первой нити на лед. Проводили короткое центрифугирование, чтобы сбить конденсацию на боковых стенках пробирки.
2. Получали следующую мастер-смесь второй нити:
3. Добавляли 130 мкл второй мастер-смеси к 20 мкл первой нити кДНК (Конечный объем = 150 мкл)
4. Перемешивали пипетированием вверх или вниз -ИЛИ- легким вихревым движением. Быстро вращали.
5. Инкубировали при 16°C в течение 2 часов на охлаждающей водяной бане.
6. Добавляли 2 мкл [10 Е] T4 ДНК-полимеразы. Перемешивали пипетированием вверх или вниз -ИЛИ- легким вихревым движением. Быстро вращали.
7. Инкубировали в течение 5 минут при 16°C.
8. Добавляли 10 мкл 0,5 М ЭДТА. Перемешивали легким вихревым движением. Быстро вращали.
9. Приступали к процедуре очистки кДНК -ИЛИ- хранили материал при -20°C для дальнейшего использования.
Очистка двухнитевой кДНК (модуль очистки образцов GeneChip)
1. Добавляли 600 мкл связывающего буфера кДНК к 162 мкл конечного препарата синтеза двухнитевой кДНК.
Перемешивали вихревым движением в течение 3 секунд.
2. Убежлались в том, что цвет смеси желтый (аналогично связывающему буферу кДНК без синтеза кДНК rxn.)
Если смесь имела оранжевый или фиолетовый цвет, добавляли 10 мкл 3 М ацетата натрия (pH 5,0) и перемешивали.
Смесь должна была приобрести желтый цвет.
3. Вносили 500 мкл образца в спиновую колонку для очистки кДНК, вставленную в собирательную пробирку емкостью 2 мл, и центрифугировали в течение 1 минуты со скоростью ≥8000×g (≥10000 оборотов в минуту). Сбрасывали проточную жидкость в *опасные отходы.
4. Перезагружали спиновую колонку остатком смеси (262 мкл) и центрифугировали, как указано выше.
Сбрасывали проточную жидкость в *опасные отходы и удаляли в отходы собирательную пробирку.
5. Переносили спиновую колонку в новую собирательную пробирку емкостью 2 мл (входит в комплект поставки). Пипетировали 750 мкл отмывочного буфера кДНК в спиновую колонку. Центрифугировали в течение 1 минуты со скоростью ≥8000×g (≥10000 оборотов в минуту). Сбрасывали проточную жидкость.
6. Открывали крышку спиновой колонки и центрифугировали образец в течение 5 минут с максимальной скоростью (≤25000×g). Помещали колонки в центрифугу, используя каждое второе гнездо. Позиционировали колпачки прилегающих гнезд, ориентируя их в противоположном вращению направлении (т.е., если вращение происходило по часовой стрелке, колпачки надо было направлять против часовой стрелки). Этот прием позволял избегать повреждения колпачков. Сбрасывали проточную жидкость и собирательную пробирку в отходы.
7. Переносили спиновую колонку в собирательную пробирку емкостью 1,5 мл. Пипетировали 10 мкл элюирующего буфера кДНК на мембрану спиновой колонки. Убеждались в том, что элюирующий буфер кДНК нанесен непосредственно на мембрану. Инкубировали в течение 1 минуты при комнатной температуре и центрифугировали в течение 1 минуты с максимальной скоростью (≤25000×g) для элюирования.
Настройка и выполнение реакции IVT Enzo: Набор для мечения транскрипта РНК Bioarray HighYield (компонент № 900182)
1. Использовали 10 мкл очищенной двухнитевой кДНК.
2. Получали следующую мастер-смесь IVT:
3. Добавляли 30 мкл мастер-смеси IVT к 10 мкл двухнитевой кДНК (Общий объем = 40 мкл).
4. Перемешивали пипетированием вверх и вниз -ИЛИ- легким вихревым движением. Быстро вращали.
5. Немедленно помещали пробирку в водяную баню с температурой 37°C. Инкубировали в течение 5 часов.
6. Если не проводили немедленную очистку РНК, хранили материал при -20°C.
Очистка кРНК, меченной биотином (модуль очистки образцов GeneChip)
1. Добавляли 60 мкл воды к реакции IVT и перемешивали вихревым движением в течение 3 секунд.
2. Добавляли 350 мкл связывающего буфера IVT для РНК к образцу и перемешивали вихревым движением в течение 3 секунд.
3. Добавляли к лизату 250 мкл этанола (96-100%) и хорошо перемешивали пипетированием. Не центрифугировали.
4. Вносили образец (700 мкл) в спиновую колонку IVT для очистки кРНК, вставленную в собирательную пробирку емкостью 2 мл. Центрифугировали в течение 15 секунд на скорости ≥8000×g (≥10000 оборотов в минуту).
5. Пропускали элюат через колонку еще раз.
Центрифугировали в течение 15 секунд на скорости ≥8000×g (≥10000 оборотов в минуту).
Сбрасывали проточную жидкость в **опасные отходы и удаляли в отходы собирательную пробирку.
6. Переносили спиновую колонку в новую собирательную пробирку объемом 2 мл (входит в комплект поставки).
7. Добавляли 500 мкл отмывочного буфера IVT для кРНК и центрифугировали в течение 15 секунд на скорости ≥8000×g (≥10000 оборотов в минуту) для отмывания.
Сбрасывали проточную жидкость.
8. Пипетировали 500 мкл 80% этанола (объем/объем) в спиновую колонку и центрифугировали в течение 15 секунд на скорости ≥8000×g (≥10000 оборотов в минуту). Сбрасывали проточную жидкость.
9. Открывали крышку спиновой колонки и центрифугировали образец в течение 5 минут с максимальной скоростью (≤25000×g).
Сбрасывали проточную жидкость и собирательную пробирку в отходы.
10. Переносили спиновую колонку в новую собирательную пробирку объемом 1,5 мл.
11. Пипетировали 11 мкл воды без Р-назы непосредственно на мембрану спиновой колонки. Давали материалу отстояться 1 минуту. Центрифугировали в течение 1 минуты с максимальной скоростью (≤25000×g) для элюирования.
12. Пипетировали 10 мкл воды без Р-назы непосредственно на мембрану спиновой колонки. Давали материалу отстояться 1 минуту.
Центрифугировали в течение 1 минуты с максимальной скоростью (≤25000×g) для элюирования.
Количественное определение кРНК (продукта IVT)
Для того чтобы определить выход РНК, использовали спектрофотометрический анализ. Принимали условие, что 1 OD при длине световой волны 260 нм соответствует 40 мкг/мл РНК.
Для определения концентрации и чистоты образца проверяли OD при 260 нм и 280 нм.
Поддерживали соотношение A260/A280 для чистой РНК как можно ближе к 2,0 (приемлем диапазон от 1,9 до 2,1).
Для количественного определения кРНК при использовании в качестве стартового материала тотальной РНК необходимо было рассчитывать поправку на выход кРНК, отражающую выброс немеченой тотальной РНК. Применяя оценку выброса 100%, использовали приведенную ниже формулу для определения исправленного выхода кРНК:
Исправленный выход кРНК = РНК - (тотальная РНКi)(y)
РНК = количество кРНК, измеренное после IVT (мкг)
тотальная РНКi = стартовое количество тотальной РНК (мкг)
y = фракция реакции кДНК, использованная в IVT
Фрагментирование кДНК для целевого препарата
Для фрагментирования использовали исправленную концентрацию кРНК.
1. Добавляли 2 мкл 5-кратного буфера для фрагментирования на каждые 8 мкл РНК с водой.
2. Инкубировали в течение 30 минут при 94°C. Немедленно после инкубирования ставили материал на лед.
Получение гибридизационной мишени
1. Нагревали 20-кратное количество эукариотических контролей гибридизации и олиго-B2 в течение 5 минут при 65°C.
Набор эукариотического контроля гибридизации Affymetrix GeneChip, компонент № 900362 (на 150 реакций)
2. Перемешивали легким вихревым движением, сбрасывали скорость вращения.
3. Мастер-смесь (при допущении концентрации фрагментированной кРНК 0,5 мкг/мкл):
4. Распределяли мастер-смесь аликвотными порциями (270 мкл) по пробиркам и добавляли в каждую пробирку 30 мкл фрагментированной кРНК. Получали гибридизационную смесь.
5. Непосредственно перед использованием уравновешивали зондовую матрицу при комнатной температуре.
6. Наполняли зондовую матрицу 1-кратным буфером MES Hyb и инкубировали 10 минут в духовке с вращением (60 оборотов в минуту) при температуре 45°C.
7. Нагревали гибридизационную смесь 5 минут в водяной бане с температурой 99°C.
8. Переносили гибридизационную смесь на 5 минут в водяную баню с температурой 45°C.
9. Центрифугировали гибридизационную смесь 5 минут с максимальной скоростью.
10. Удаляли 1-кратный буфер MES Hyb из матрицы зондов.
11. Наполняли зондовую матрицу 200 мкл гибридизационной смеси (из верхнего слоя).
12. Уплотняли перегородки герметиком Tough-Spots.
13. Гибридизировали зондовую матрицу при 45°C и 60 оборотах в минуту 19 часов.
14. Отмывали, окрашивали и сканировали зондовую матрицу в соответствии с протоколами Affymetrix.
Материалы Affymetrix
Количественная ПЦР
Синтез кДНК:
Условия инкубации:
25° в течение 10 минут
37° в течение 2 часов
Реакция TaqMan с секвенирующим детектором ABI Prism 7700:
Условия температурных циклов:
95° в течение 10 минут
40 циклов: 95° в течение 15 секунд
60° в течение 1 минуты
- Зонды TaqMan: Assays-on-Demand™ (TaqMan® зонды MGB, FAM™ меченные красителем)
- Амплификацию эндогенного контроля, GAPDH (при концентрации зонда 100 нМ, а также концентрации прямого и обратного праймеров 200 нМ) проводили для стандартизации количества РНК в образце (кДНК), добавляемого к каждой реакции.
Относительную квантификацию (количественное определение) проводили, применяя метод стандартных кривых. Для квантификации, нормализованной по эндогенному контролю, стандартные кривые выводили как для мишени, так и для эндогенного эталона. В каждом экспериментальном образце количество мишени и эндогенного эталона определяли по соответствующей нормальной кривой. Затем количество мишени делили на количество эндогенного эталона, получая в результате нормализованное значение для мишени. Один из экспериментальных образцов служил калибратором или образцом 1×. Затем каждое нормализованное значение мишени делили на нормализованное значение калибратора, получая в результате относительный уровень экспрессии.
Экспериментальные результаты:
Эксперименты были проведены с применением вышеописанных материалов и методов. Результаты экспериментов проиллюстрированы на фиг.5-9, как обсуждается ниже.
Фиг.5 представляет краткую схему IC50 по данным, полученным при анализе клеточных линий немелкоклеточного рака легких ("NSCLC") на чувствительность или устойчивость к апоптотической активности Apo2L (+0,5% фетальной бычьей сыворотки "FBS" или 10% FBS) либо к моноклональным антителам DR5 "mab", поперечно связанным "XL" или несвязанным (+0,5% фетальной бычьей сыворотки "FBS" или 10% FBS) по результатам измерений в анализах MTT на цитотоксичность.
Фиг.6 представляет краткую схему IC50 по данным, полученным при анализе клеточных линий рака поджелудочной железы на чувствительность или устойчивость к апоптотической активности Apo2L (+0,5% фетальной бычьей сыворотки "FBS" или 10% FBS) либо к моноклональным антителам DR5 "mab", поперечно связанным "XL" или несвязанным (+0,5% фетальной бычьей сыворотки "FBS" или 10% FBS) по результатам измерений в анализах MTT на цитотоксичность.
Фиг.7 представляет краткую схему IC50 по данным, полученным при анализе раковых клеточных линий неходжкинской лимфомы ("NHL") на чувствительность или устойчивость к апоптотической активности Apo2L (+10% фетальной бычьей сыворотки "FBS") либо к моноклональным антителам DR5 "mab", поперечно связанным "XL" или несвязанным (+0,5% фетальной бычьей сыворотки "FBS" или 10% FBS) по результатам измерений в анализах MTT на цитотоксичность.
Фиг.8 представляет сравнение чувствительности ("sen") или устойчивости ("RES") избранных линий раковых клеток NSCLC, рака поджелудочной железы и NHL к антителам DR5 и корреляцию с экспрессией GalNac-T14 при измерении по экспрессии мРНК GalNac-T14.
Фиг.9 представляет в виде столбчатой диаграммы график, отображающий различные клеточные линии NSCLC, рака поджелудочной железы и NHL, ранжированные (в нисходящем порядке) по уровню экспрессии мРНК GalNac-T14.
Апоптотическая программа клеточной смерти играет важную роль в развитии и гомеостазе многоклеточных организмов (Danial et al., Cell, 116:205 (2004)). Внутриклеточные стимулы могут инициировать апоптоз через присущий клеткам от природы путь, который связан с членами суперсемейства генов Bcl-2 и активацией апоптотической биомеханики каспазы (Cory et al., Nat. Rev. Cancer, 2:647 (2002)). Некоторые цитокины, относящиеся к суперсемейству фактора опухолевого некроза (TNF), способны активировать апоптоз через не присущий клеткам путь, взаимодействуя с некоторыми рецепторами, которые содержат функциональный “домен смерти” (DD), индуцирующий апоптоз (Ashkenazi et al., Science, 281:1305 (1998)). Лиганд Fas (FasL) стимулирует апоптоз через Fas (Apo1/CD95), в то время как лиганд Apo-2/связанный с TNF лиганд, индуцирующий апоптоз (Apo2L/TRAIL) инициирует апоптоз через DR4 (TRAIL-R1) и/или DR5 (TRAIL-R2) (LeBlanc et al., Cell Death Differ., 10:66 (2003)). При связывании своего когнатного лиганда эти рецепторы связывают адапторную молекулу FADD (ассоциированный с Fas домен смерти), а эта молекула привлекает к действию инициирующую апоптоз каспазу-8 с образованием индуцирующего клеточную смерть сигнального комплекса (DISC) (см., например, Kischkel et al., EMBO J., 14:5579 (1995); Kischkel et al., Immunity, 12:611 (2000)). Комплекс DISC стимулирует каспазу-8, которая, в свою очередь, расщепляет и активирует эффекторные протеазы, например, каспазу-3, 6 и 7, в результате чего и выполняется апоптотическая программа клеточной смерти. Во многих типах клеток перекрест с природным клеточным путем может дополнительно усиливать поступающий к клеткам извне сигнал смерти (Scaffidi et al., J. Biol. Chem., 274:1541 (1999)). Apo2L/TRAIL индуцирует апоптоз во многих типах опухолевых клеток, не влияя или незначительно влияя на нормальные ткани, а это позволяет думать о том, что данный фактор может быть полезен в терапии рака (см., например, Ashkenazi, Nat. Rev. Cancer, 2:420 (2002); Kelley et al., Curr. Opin. Pharmacol., 4:333 (2004)). Альтерации разных компонентов апоптотических путей могут снижать чувствительность специфических линий раковых клеток к Apo2L/TRAIL (Igney et al., Nat. Rev. Cancer, 2:277 (2002)).
В соответствии со способами и протоколами, изложенными ниже, были проведены различные эксперименты, и полученные в них данные представлены на фиг.10-15.
Для того чтобы исследовать чувствительность к активации рецептора, выживание клеток анализировали как функцию концентрации Apo2L/TRAIL в панели линий раковых клеток человека, включавшей 23 аденокарциномы поджелудочной железы, 18 злокачественных меланом и 36 колоректальных аденокарцином (фиг.10A, данные не представлены). По результатам этого анализа 29/77 (38%) клеточных линий были расценены как высоко или умеренно чувствительные к Apo2L/TRAIL. Концентрация Apo2L/TRAIL, необходимая для достижения гибели 50% клеток в 29 клеточных линиях, изменялась от 3 до 800 нг/мл, при средней величине 250 нг/мл.
Панель клеточных линий также была исследована на профиль генной экспрессии с использованием микрочипа с набором из 54613 генных зондов. Хотя и с несколькими исключениями, клеточные линии рака поджелудочной железы и меланомы, которые демонстрировали выраженную или промежуточную чувствительность к Apo2L/TRAIL, экспрессировали значительно более высокий уровень мРНК фермента O-гликозилирования ppGalNAcT-14, чем соответствующие, но резистентные клеточные линии (p=0,5×10-4 для точного критерия Фишера, итеративная отсечка 750 для карциномы поджелудочной железы и 300 для меланомы) (фиг.10B). Большинство клеточных линий колоректального рака, чувствительных к Apo2L/TRAIL, демонстрировали высокую экспрессию мРНК родственного фермента O-гликозилирования ppGalNAcT-3, хотя некоторые резистентные линии также экспрессировали этот ген, что выражалось в более слабом, но все-таки статистически значимом различии (p=0,026 при отсечке на уровне 2000) (фиг.10C, ниже). Исключениями во всей панели были: (a) 5/29 (17%) клеточных линий, которые были чувствительны, но при этом экспрессировали ppGalNAcT-14 или ppGalNAcT-3 ниже уровня отсечки; (b) 16/48 (33%) резистентных клеточных линий, которые, тем не менее, проявляли уровень ppGalNAcT-14 или ppGalNAcT-3 выше отсечки. При исследовании экспрессии мРНК других ферментов O-гликозилирования в колоректальных клеточных линиях повышенный уровень Fut-6 был обнаружен в 10/12 (83%) чувствительных и в 6/24 (25%) резистентных клеточных линий (p=0,013, отсечка 200) (фиг.10C, вверху). Комбинированная экспрессия ppGalNAcT-14 в клетках рака поджелудочной железы и меланомы с Fut-6 в клеточных линиях колоректального рака проявляла очень сильную корреляцию с чувствительностью к Apo2L/TRAIL (p=1,83×10-7, N=77). Этот набор генов правильно предсказывал чувствительность или резистентность для 23/32 (72%) позитивных и 39/45 (87%) негативных по маркеру клеточных линий соответственно.
Чувствительность к Apo2L/TRAIL также исследовали in vivo на ксенотрансплантатах опухолей. Пятидневное лечение препаратом Apo2L/TRAIL мышей, несущих привитые опухоли, которые были получены из Fut-6-позитивных клеточных линий колоректального рака Colo205 и DLD-1, приводило к регрессии опухолей и сильной задержке их последующего прогрессирования (фиг.10D). В отличие от этого, опухоли, полученные из Fut-6-негативных клеточных линий колоректального рака Colo320 и RKO, не реагировали на такое лечение.
Предварительная инкубация ppGalNAcT-3/Fut-6-позитивной клеточной линии Colo205 с пан-ингибитором O-гликозилтрансферазы бензил-GalNAc (Delannoy et al., Glycoconj., 13:717 (1996)) значительно снижало чувствительность к Apo2L/TRAIL (фиг.11A), что позволяет думать о функциональной связи между O-гликозилированием и сигналами Apo2L/TRAIL. Для дальнейшего исследования этого предположения в качестве целевой мРНК ppGalNacT-14, ppGalNacT-3 или Fut-6 мелкие интерферирующие олигонуклеотиды РНК (siРНК). С целью исключения внецелевых эффектов для каждого гена были синтезированы неперекрывающиеся siРНК с последующей верификацией в количественной RT-ПЦР их способности уменьшать целевую экспрессию (фиг.14A). Заявители дополнительно подтвердили специфичность siРНК с мутантной плазмидой ppGalNacT-14, содержащей 6 “молчащих” нуклеотидных замен в целевой области siРНК (Editorial, Nat. Cell. Biol., 5:489 (2003)) (фиг.14B). Трансфекция клеточных линий ppGalNAcT-14-позитивной карциномы поджелудочной железы PSN-1 и меланомы Hs294T материалом siРНК ppGalNAcT-14 значительно снижала чувствительность к Apo2L/TRAIL, в то время как siРНК каспазы-8, в соответствии с ожиданиями, обеспечивала практически полную защиту (фиг.11B). Сходным образом, трансфекция клеток колоректального рака DLD-1 или C170 материалом siРНК GalNAcT-3 или Fut-6 значительно снижала чувствительность к Apo2L/TRAIL (фиг.11C и 14C). В общем, siРНК GalNAcT-14 снижала чувствительность к Apo2L/TRAIL в 4 из 5 клеточных линий рака поджелудочной железы и в 2 из 2 клеточных линий меланомы, тогда как siРНК ppGalNAcT-3 или Fut-6 (каждая) снижали чувствительность в 2 клеточных линиях колоректального рака из 3. В отличие от этого, трансфекция клеток PSN-1 или Hs294T материалом siРНК GalNAcT-14 не изменяла чувствительность к этопозиду, ингибитору топоизомеразы II (фиг.14D). Сходным образом, трансфекция клеток PSN-1 или C170 материалом siРНК GalNAcT-14 или GalNAcT-3 не влияла на чувствительность к стауроспорину, ингибитору протеинкиназы широкого спектра (фиг.14E). Поскольку и этопозид, и стауроспорин стимулируют апоптоз через присущий клеткам природный путь (Wei et al., Science, 292:727 (2001)), эти исследования позволили предположить, что ферменты O-гликозилирования способны модулировать сигналы апоптоза через путь, связанный с сигналами клеткам извне.
Трансфекция клеток HEK293 материалом ppGalNAcT-14 приводила к клеточной смерти при котрансфекции с DR4 или DR5, но не с родственными рецепторами Fas и TNFR1 или агонистом природного пути клеточного апоптоза Bax (фиг.11D). Более того, трансфекция ppGalNAcT-14 увеличивала чувствительность к Apo2L/TRAIL резистентных клеточных линий меланомы H1568 (фиг.11E), а также карциномы поджелудочной железы PA-TU-8902 и PL-45 (фиг.14F), но не изменяла чувствительность к этопозиду (данные не представлены). В общем, избыточная экспрессия GalNAcT-14 сенсибилизировала к Apo2L/TRAIL 4 клеточных линии из 7.
Влияние "нокдауна" siРНК ppGalNacT-14 или Fut-6 было исследовано на процессинге каспазы, индуцированном Apo2L/TRAIL. В клетках PSN-1 и DLD-1, трансфицированных контрольной siРНК, Apo2L/TRAIL индуцировал практически полный процессинг каспазы-8, что приводило к расщеплению Bid, каспазы-9 и каспазы-3 (фиг.12A). Трансфекция siРНК каспазы-8 предупреждала эти явления. Нокдаун ppGalNAcT-14 в клетках PSN-1 или Fut-6 в клетках DLD-1 также значительно ослаблял индуцированный Apo2L/TRAIL процессинг каспазы-8, Bid, каспазы-9 и каспазы-3 (фиг.12A) и стимуляцию активности каспазы-3/7 (фиг.12B). Резистентные к Apo2L/TRAIL клеточные линии колоректального рака RKO и SW1417, экспрессирующие ppGalNAcT-3 и Fut-6 на низком уровне, демонстрировали сходный блок процессинга каспазы-8 (фиг.15A). Таким образом, ферменты O-гликозилирования могут модулировать путь Apo2L/TRAIL выше (ранее) явлений, ведущих к активации каспазы-8.
Активация каспазы-8 требует комплекса DISC (Ashkenazi et al., Science, 281:1305 (1998)). Анализ DISC Apo2L/TRAIL (Kischkel et al., Immunity, 12:611 (2000)) в клетках PSN-1 и DLD-1 указывает на то, что нокдаун ppGalNAcT-14 или Fut-6 снижает привлечение FADD и каспазы-8 в комплекс DISC, процессинг каспазы-8, связанной с DISC, и стимуляцию ферментативной активности каспазы-8, связанной с DISC (Sharp et al., J. Biol. Chem., 280:19401 (2005)) (фиг.12C, 12D и 15B). Ни siРНК ppGalNacT-14, ни siРНК Fut-6 существенно не изменяют количество DR4 и DR5 в комплексе DISC, а также зависимое от дозы связывание Apo2L/TRAIL с клетками PSN-1 или DLD-1, экспрессирующими как DR4, так и DR5 (фиг.12C и 15B, данные не представлены). Таким образом, ppGalNAcT-14 и Fut-6, по-видимому, не модулируют апоптоз через повреждение рецепторов клеточной поверхности или связывание Apo2L/TRAIL. В соответствии с этим, чувствительность к Apo2L/TRAIL в панели из 77 клеточных линий не проявляет значимой корреляции с экспрессией на клеточной поверхности когнатных сигнальных рецепторов DR4 и DR5 или подставные рецепторы DcR1 и DcR2 (данные не представлены). Более того, большинство siРНК против ppGalNAcT-14, ppGalNacT-3 или Fut-6 не изменяют уровень DR4 и DR5 на поверхности клеток PSN-1, C170 или DLD-1 (фиг.15C). Две siРНК не вызывают поддающегося выявлению снижения DR4 и DR5 в определенных клеточных линиях (фиг.15C). Однако другие siРНК против тех же ферментов подавляют апоптоз, индуцированный Apo2L/TRAIL, не оказывая влияния на уровень рецепторов.
Внеклеточный домен (ECD) рецептора DR5 человека был экспрессирован в клетках яичника китайского хомяка, секретированный белок был очищен, подвергнут кислому гидролизу, а ассоциированные моносахариды были проанализированы (фиг.13A). В полном соответствии с отсутствием предсказанных сайтов N-гликозилирования в ECD рецептора DR5 заявители не выявили N-связанных гликанов. Однако два образца из двух независимых экспериментов продемонстрировали 3 моль GalNAc и 3 моль Gal на каждый моль ECD DR5 (фиг.13A), что позволяет думать об O-связанной модификации трех сайтов рецептора DR5 стержневым гликаном GalNAc-Gal.
Известно, что O-гликозилирование белка связано с модификацией серинов или треонинов. Используя ранее установленный биоинформационный инструмент для предсказания потенциальных сайтов O-гликозилирования (http://www.cbs.dtu.dk/services/NetOGlyc) (Julenius et al., Glycobiology, 15:153 (2005)), заявители идентифицировали две таких области в общей последовательности ECD длинного (DR5-L) и короткого (DR5-S) вариантов сплайсинга DR5 человека, а третий сайт в пределах области альтернативного сплайсинга (фиг.13B). Первый аминокислотный сегмент (74-77) содержит три остатка серина, второй (130-144) - пять остатков треонина, а третий - четыре остатка треонина и три остатка серина. Мышиный DR5 имеет последовательности, аналогичные первым двум сегментам, с двумя серинами и четырьмя треонинами соответственно, тогда как DR4 человека также имеет две сходные последовательности, содержащие один серин и пять треонинов. Для проверки того, важны ли эти сайты для посттрансляционной модификации DR5, был получен ряд мутантов DR5L и DR5S, с заменой на аланин или пяти треонинов в сегменте 130-144 (DR5L-5T, DR5S-5T), или тех же самых пяти треонинов, а также трех серинов в сегменте 74-77 (DR5L-5T3S, DR5S-5T3S). Иммуноблот антитела DR5 с лизатами клеток HEK293, трансфицированных DR5L или DR5S, отражает присутствие ожидаемых связок DR5L или DR5S (фиг.13C). Антитело также выявляло связки DR5 более высокого молекулярного веса (MW), которые становятся более обильными при котрансфекции DR5L или DR5S материалом ppGalNAcT-14 по сравнению с контролем (фиг.13C, звездочки). Обилие таких связок с более высоким MW и их прирост при котрансфекции ppGalNAcT-14 значительно уменьшались при использовании DR5L-5T или DR5S-5T и почти устранялись при использовании DR5L-5T3S или DR5S-5T3S (по сравнению с конструкциями дикого типа). Эти результаты позволяют думать о том, что связки с более высоким MW представляют собой O-гликозилированные формы DR5: ppGalNAcT-14 содействует их образованию, а прогрессирующая элиминация предсказанных сайтов O-гликозилирования посредством замещений на аланин постепенно обращает этот эффект в противоположную сторону. Трансфекция клеток HEK293 мышиным DR5, или DR4, DR5L, DR5S человека приводит к клеточной смерти (фиг.13D), при этом каждый мутант DR5 проявляет меньшую активность по сравнению с соответствующей конструкцией дикого типа, а DR5S-5T3S (в которых утрачены все три сайта) имеют самую слабую активность. Котрансфекция материалом ppGalNAcT-14 заметно усиливает явление клеточной смерти при использовании всех конструкций DR4 и DR5, за исключением DR5S-5T3S, которые демонстрируют значительно более низкую активность.
Большинство образцов нормальных тканей и опухолевых клеток из раков кожи, легких, поджелудочной железы, молочной железы, яичников, эндометрия и мочевого пузыря или из неходжкинской лимфомы проявляют экспрессию мРНК ppGalNAcT-14 ниже величин отсечки, определяемых на уровне 500 для большинства раков и 200 для раков кожи (фиг.13E). Однако значительное подмножество опухолевых образцов, изменяющееся от 10% при лобулярном (дольковом) раке молочной железы до 30% при раке легких и диффузной крупно-B-клеточной лимфоме, демонстрируют избыточную экспрессию ppGalNAcT-14. Некоторые раковые образцы проявляют уровень экспрессии мРНК, более чем в 1000 раз превышающий таковой для соответствующих нормальных тканей. Динамическая экспрессия ppGalNAcT-14 в раковых клетках позволяет думать о том, что этот ген, а также, возможно, другие родственные ферменты могут послужить полезными биомаркерами для идентификации опухолей с повышенной чувствительностью к Apo2L/TRAIL.
O-связанные гликаны проявляют значительное структурное разнообразие и модулируют различные аспекты биологии мембранных белков плазмы, включая конформацию, агрегацию, направленную миграцию, период полураспада, а также клеточную адгезию и сигнальную активность (Hang et al., Bioorg. Med. Chem., 13:5021 (2005); Hanisch, Biol. Chem., 382:143 (2001)). Раковые клетки нередко проявляют резкие изменения профиля O-гликанов, создавая уникальные углеводные антигены, ассоциированные с опухолями (Brockhausen, Biochim. Biophys. Acta, 1473:67 (1999); Dube et al., Nat. Rev. Drug Discovery, 4:477 (2005); Fuster et al., Nat. Rev. Cancer, 5:526 (2005)). O-гликозилирование также играет важную роль в хоминге опухолевых клеток в специфические очаги метастазирования (Fuster et al., Cancer Res., 63:2775 (2003); Ohyama et al., EMBO J., 18:1516 (1999); Takada et al., Cancer Res., 53:354 (1993)). Значительное подмножество образцов первичных опухолей при многих раковых заболеваниях человека, включая рак толстой кишки и колоректальные опухоли, образцы клеток меланомы и хондросаркомы, демонстрируют повышенную экспрессию фермента O-гликозилирования ppGalNAcT-14.
СПОСОБЫ
Материалы
Реактивы для клеточных культур были закуплены в компании Gibco (Invitrogen/Gibco, Карлсбад, штат Калифорния), немеченый растворимый Apo2L/TRAIL был получен, как описано ранее (Lawrence et al., Nat. Mad., 7:383 (2001)), ингибитор O-связанного гликозилирования бензил-a-GalNAc был закуплен в компании Calbiochem, а все другие химикаты, включая этопозид и стауроспорин, в компании Sigma Aldrich (Сент-Луис, штат Миссури).
Клеточные культуры и клеточные линии
Все 119 клеточных линий карцином человека (названия и каталог приведены в дополнительных данных) были получены из ATCC или DSMZ (Брауншвейг, Германия) и культивированы при 37°C в атмосфере с 5% CO2 в RPMI1640 с добавкой 10% термически инактивированной фетальной сыворотки крупного рогатого скота, 2 мМ L-глутамина и 10 мМ HEPES без антибиотиков типа пенициллина/стрептомицина. 293 образца эмбриональных почечных клеток (номер по каталогу CRL-1573) также были получены из ATCC и культивированы в 100% среде Игла (модификация Дульбекко) с добавкой 10% FBS. Мутантная по O-гликозилированию линия клеток CHO, ldlD CHO, была предоставлена по лицензии доктором Monty Kreiger, компания MIT (Бостон, штат Массачусетс).
Анализы по оценке выживания клеток и апоптоза
Для того чтобы определить показатель IC50 применительно к Apo2L/TRAIL, клетки разносили с троекратным дублированием по 96-луночным планшетам, давали им прилипнуть к лункам в течение 24 часов, а затем обрабатывали рекомбинантным Apo2L/TRAIL человека в нарастающей концентрации (до 1000 нг/мл). После 72-часовой инкубации их подвергали анализу на выживание (анализ MTT [Pierce] или люминесцентный анализ выживаемости клеток CellTiter-Glo [Promega]) в соответствии с протоколом производителя. Каждый эксперимент по оценке выживания клеток повторяли по меньшей мере три раза в сыворотке с низким (0,5%) и высоким (10%) содержанием FBS, а линии клеток с промежуточной чувствительностью определяли по вариабельности между значениями IC50 в независимых экспериментах или между сыворотками с высоким и низким содержанием FBS. Заявители определяли клеточную линию как чувствительную, основываясь на индуцировании апоптоза по меньшей мере 50% клеток при концентрации Apo2L/TRAIL 1 мкг/мл, а промежуточную чувствительность по количественной вариабельности апоптоза, индуцированного в независимых экспериментах, или по различиям между низким (0,5%) и высоким (10%) содержанием FBS в сыворотке. Количественную оценку апоптоза проводили методом проточного цитометрического анализа, определяя среднее процентное содержание собранных клеток (прилипших + плавающих в среде), окрашенных аннексином V (BD Pharmingen).
Гибридизация микрочипа и анализ данных
Тотальная клеточная РНК была получена из необработанных клеток (3×106) с применением набора RNeasy (Quiagen). Меченая кРНК была получена и гибридизирована с нуклеотидными микрочипами (U133P GeneChip; Affymetrix Incorporated, Санта-Клара, штат Калифорния), как описано ранее (Hoffman et al., Nat. Rev. Genetics, 5:229 (2004); Yauch et al., Clin. Cancer Res., 11:8686 (2005)). Сканированные файлы изображений были проанализированы при помощи компьютерных программ GENECHIP 3.1 (Affymetrix), Spotfire, GenePattern и Cluster/TreeView. Для того чтобы идентифицировать гены с наиболее дифференцированной экспрессией в чувствительных и резистентных клеточных линиях, заявители подвергали значения генной экспрессии анализу в вариационном фильтре, при помощи которого можно было исключить гены с минимальной вариацией в серии проанализированных образцов, тестируя их на кратные изменения и абсолютную изменчивость, сравнивая соотношения максимума и минимума (max/min) и различия между максимумом и минимумом (max-min) с предварительно рассчитанными величинами и исключая гены, не соответствующие обоим условиям.
Конструкции экспрессии и ретровирусная трансдукция
Фрагмент ДНК, кодирующий ppGalNAcT-14, был клонирован из кДНК, собранной в виде пула из клеточных линий, чувствительных к Apo2L/TRAIL, и вставлен в экспрессирующую плазмиду pcDNA3.1 (Invitrogen) с N-концевой меткой FLAG. Затем эту конструкцию подвергали сайт-специфическому мутагенному воздействию (набор для мутагенеза Quikchange, Stratagene) для генерирования молчащих мутантов siРНК, имеющих 4-6 качающихся изменений пар оснований в последовательности, гомологичной siРНК, без изменения белковой последовательности. Мутации охватывали область длиной 10 пар оснований в центре связывающей последовательности siРНК из 19 пар оснований. Последовательности ДНК для DR5Long и DR5Short, DR4, мышиного рецептора TRAIL, DR4, Fas (вариант 1), TNFR1 и Bax (вариант бета) были клонированы из пулов кДНК и вставлены в вектор экспрессии pRK (Genentech). Мутанты O-гликозилирования DR5L и DR5S были генерированы сайт-специфической мутацией, заменяющей четыре остатка треонина на аланин, Mut4×TA (T130, T131, T132, T135) или пять остатков треонина на аланин, Mut5×TA (T130, T131, T132, T135, T143). Транзиторная трансфекция в клетки HEK293 с экспрессией конструкций проапоптотических молекул была проведена в 6-луночных планшетах при концентрации проапоптотической молекулы 0,5 мкг на лунку и концентрации ppGalNAcT-14 или векторного контроля 2,0 мкг. Для трансфекции клеток применяли липофектамин 2000 в соответствии с протоколом производителя. После 48-часовой инкубации клетки анализировали на апоптоз.
Для генерирования ретровирусных конструкций ppGalNAcT-14 и мутанты клонировали в ретровирусном векторе pQCXIP (Clontech). Ретровирусные супернатанты были генерированы с использованием линии хелперных клеток АNX-Ampho. Трансфекцию упаковочных клеток проводили, применяя фосфат кальция (Invitrogen). Супернатанты были выделены через 48 часов после трансфекции и добавлены к целевым клеткам наряду с 10 мкг/мл polybrene. Затем проводили стадию центрифугирования в течение 1 часа на скорости 2700 оборотов в минуту для усиления инфекции. После трансдукции клетки подвергали отбору с 2 мкг/мл пуромицина.
Конструирование siРНК и протоколы трансфекции
Конструкции siРНК против ppGalNAcT-14, ppGalNAcT-3, каспазы-8 и DR5 были созданы компанией Dharmacon (Лафейетт, штат Колорадо) с применением ее запатентованных критериев отбора. Были отобраны такие последовательности:
siGalNAcT-14 (1): 5' GACCATCCGCAGTGTATTA-dTdT 3' (=14-4) (SEQ ID NO:15)
siGalNAcT-14 (2): 5' ATACAGATATGTTCGGTGA-dTdT 3' (=14-6) (SEQ ID NO:16)
siGalNAcT-3 (1): 5' CCATAGATCTGAACACGTT-dTdT 3' (=3-2) (SEQ ID NO:17)
siGalNAcT-3 (2): 5' GCAAGGATATTATACAGCA-dTdT 3' (=3-7) (SEQ ID NO:18)
siFut-6 (1): 5' GUACCAGACACGCGGCAUA-dTdT 3' (=6-1) (SEQ ID NO:19)
siFut-6 (2): 5' ACCGAGAGGUCAUGUACAA-dTdT 3' (=6-2) (SEQ ID NO:20)
siCaspase-8: 5' GGACAAAGTTTACCAAATG-dTdT 3' (SEQ ID NO:21)
Все siРНК были приобретены как двухнитевые олигонуклеотиды РНК и трансфицированы в соответствующие клеточные линии с конечной концентрацией 25 нМ для каждой siРНК. В качестве контроля были использованы дуплексы siРНК против нецелевой последовательности (Dharmacon). Клетки были трансфицированы при помощи липофектамина 2000 (Invitrogen) посредством обратной трансфекции, когда эти клетки добавляли в суспензию с предварительно внесенными в планшеты комплексами липид-siРНК. Концентрации липофектамина 2000 соответствовали протоколу производителя. После 48-часовой инкубации клетки собирали для анализа мРНК или инкубировали далее с рекомбинантным Apo2L/TRAIL человека, этопозидом или стауроспорином в течение 24-72 часов для анализа на выживаемость или в течение 4, 8 или 24 часов для анализа методом вестерн-блоттинга.
Ингибирование O-гликозилирования при помощи бензил-a-GalNAc
Клетки линии Colo205 были выращены в присутствии бензил-a-GalNAc (2 мМ или 4 мМ) в течение 72 часов. После этого они были повторно разнесены по лункам 96-луночных планшетов и оставлены там на 24 часа для прикрепления с сохранением ингибитора. Затем их стимулировали нарастающими концентрациями Apo2L/TRAIL, как это указано и применяется в анализах на выживание клеток.
Количественная ПЦР
Уровень экспрессии транскриптов GalNacT-14 и GalNacT-3 оценивали посредством количественной RT-ПЦР, проводимой по стандартным методикам Такмана. Уровень транскрипта нормализовали по гену “домашнего хозяйства”, GAPDH, а результаты выражали как нормализованные значения экспрессии (=2-DCt). Наборы праймеров/зондов для GalNacT-14 (№ по каталогу: Hs00226180_m1_GT14), GalNacT-3 (№ по каталогу: Hs00237084_m1_GT3) и GAPDH (№ по каталогу: 402869) были закуплены в компании Applied Biosystems (Фостер Сити, штат Калифорния).
Иммунопреципитация, анализ вестерн-блоттингом и антитела
Иммунопреципитация: Моноклональные антитела типа анти-Apo2L (2E11; № доступа в ATCC HB-12256), анти-DR4 (3G1 и 4G7, № доступа в ATCC PTA-99) и анти-DR5 (3H3, № доступа в ATCC 12534 и 5C7) были генерированы в компании Genentech Inc., используя в качестве антигенов сливные белки рецептора Fc. Моноклональные анти-DR4 антитела (4G7) и анти-DR5 (5C7), использованные для иммунопреципитации Apo2L/TRAIL DISC, были конъюгированы с агарозой при помощи ориентационного набора ImmunoPure Protein G IgG Plus (№ по каталогу 44990) от компании Pierce. Моноклональные анти-DR4 (3G1) и анти-DR5 (3H3) антитела, использованные для иммунодетекции DR4/5 в иммунопреципитатах DISC, были биотинированы при помощи набора для биотинирования EZ-link Sulfo-NHS-LC (№ по каталогу 21217) от компании Pierce. Apo2L/TRAIL с меткой FLAG был получен и поперечно сшит с антителом анти-FLAG M2 (Sigma), как описано в литературе (Kischkel, Immunity, 12:611 (2000)). Эти эксперименты были проведены, как это описано ранее для анализа Apo2L/TRAIL-FLAG + анти-FLAG DISC (Kischkel, см. выше). Эксперименты по иммунопреципитации DR4/5 DISC также проводились в соответствии с описанием, с тем исключением, что моноклональные анти-DR4 (4G7) и анти-DR5 (5C7) антитела были прямым образом конъюгированы с агарозой для иммунопреципитации (Sharp et al., J. Biol. Chem., 280:19401 (2005)).
Вестерн-блоттинг: В 6-луночные планшеты были посеяны клетки из расчета 5×l05 клеток на лунку. Для экспериментов с нокдауном РНКi клетки обрабатывали различными siРНК в течение 48 часов с последующей обработкой Apo2L/TRAIL в течение 4, 8 или 24 часов. После указанных промежутков времени клетки отмывали в охлажденном на льду PBS и лизировали в 1% растворе Triton X-100, содержащем гипотонический лизисный буфер (20 мМ HEPES pH 7,5, 10 мМ KCL, 1,5 мМ MgCl2, 1 мМ ЭДТА и 1 мМ DTT). Для каждого образца 40 мкг белка выделяли в редуцирующих условиях при помощи 10% или 10-20% градиента SDS в полиакриламидных гелях. После переноса материала на нитроцеллюлозные мембраны (Schleicher и Schuell) эти мембраны инкубировали в течение 1 часа в 10% обезжиренном порошковом молоке с дальнейшей 1-часовой инкубацией со следующими первичными антителами: козье антитело анти-caspase-3 (1:1000, R&D), кроличье антитело анти-caspase-8 (1:1000, Pharmingen), мышиное антитело анти-caspase-9 5B4 (1:1000, MBL), кроличье антитело анти-Bid (1:1000, Pharmingen), кроличье антитело анти-DR5 (1:500, Cayman) или козье антитело анти-actin (1:200, Santa Cruz Biotechnology). Мембраны пятикратно отмывали TBS/0,05% Tween, а затем инкубировали с соответствующим конъюгированным с пероксидазой и аффинно очищенным вторичным антителом (1:5000, Biorad) в течение 30 минут. После этого мембраны еще пять раз отмывали, разрабатывали при помощи усиленной хемилюминесценции (ECL, Amersham) и экспонировали на пленках Kodak Biomax.
Проточная цитометрия/анализ FACS
Поверхностную экспрессию рецепторов семейства TNF (DR4 и DR5) определяли методом сортировки флуоресцентно активированных клеток (FACS), используя проточный цитометр FACS Calibur (Becton Dickinson Immunocytometry System, Сан-Хосе, штат Калифорния). Клетки линий C170 и PSN-1, трансфицированные указанными siРНК в течение 48 часов, окрашивали с 10 мкг/мл первичного антитела, 4G7 (анти-DR4) или 3H3 (анти-DR5), или мышиного контрольного антитела IgG в течение 1 часа при 4°C. Затем клетки отмывали PBS и инкубировали в течение 30 минут при 4°C с вторичным козьим противомышиным антителом, конъюгированным с флуоресцеином (FITC) (Jackson Laboratories). После этого клетки анализировали проточной цитометрией, используя проточный цитометр FACS Calibur.
Анализы каспазы
Активность каспазы-3/-7 анализировали при 37°C в 40 мкл каспазного буфера (50 мМ HEPES [pH 7,4], 100 мМ NaCl, 10% сахарозы, 1 мМ ЭДТА, 0,1% CHAPS и 10 мМ DTT), содержащего 100 мкМ флуорогенного пептида Ac-DEVD-AFC. Активность измеряли непрерывно в течение всего указанного времени по высвобождению AFC из DEVD-AFC, используя устройство типа молекулярного флуориметра в кинетическом режиме и с парой фильтров 405-510. Для оценки активности каспазы 20 мкг тотального клеточного белка (экстракты Triton X-100) использовали в 40 мкл каспазного буфера (содержащего 100 мкМ DEVD-AFC).
Анализ углеводов в DR5, полученном из CHO
Моносахаридную композицию DR5 из клеток CHO получали после гидролиза с 4 н. ТФА. Анализ высвобожденных моносахаридов выполняли в системе ВЭЖХ Dionex BioLC, применяя анионообменную хроматографию высокого разрешения в сочетании с пульсовым амперометрическим детектором.
Исследования на животных и подкожных ксенотрансплантатах
Самки бестимусных "голых" мышей (Jackson Laboratory, Бар-Харбор, штат Мэн, США) перед использованием в экспериментальном исследовании проходили акклиматизацию не менее 1 недели в виварии компании Genentech. Все экспериментальные процедуры были утверждены ведомственным комитетом Genentech по уходу за животными и их использованию (IACAUC). Мышам инокулировали подкожно 5×106 клеток на животное клетками Colo205, DLD-1 и RKO особь или 20×106 клеток на животное клетками карциномы толстой кишки человека Colo320HSR (коллекция культур американского типа). Измерение опухолей проводили штангенциркулем с цифровой индикацией, а объем опухолей рассчитывали по формуле D~G (A= длина) (B=ширина)2. После того, как опухоли достигали в объеме приблизительно 150-200 мм3, мышей случайным образом распределяли на группы и проводили лечение внутрибрюшинными инъекциями или пустого носителя (контроль), или Apo2L/TRAIL (60 мг/кг/день) с 0-го по 4-й день исследования.
| название | год | авторы | номер документа |
|---|---|---|---|
| АПОПТОТИЧЕСКАЯ ЧУВСТВИТЕЛЬНОСТЬ К Apo2L/TRAIL ПУТЕМ ТЕСТИРОВАНИЯ ЭКСПРЕССИИ GalNac-T14 В КЛЕТКАХ/ТКАНЯХ | 2006 |
|
RU2416097C2 |
| АНАЛИЗЫ И СПОСОБЫ, ИСПОЛЬЗУЮЩИЕ БИОМАРКЕРЫ | 2005 |
|
RU2410438C2 |
| АНАЛИЗЫ И СПОСОБЫ С ПРИМЕНЕНИЕМ БИОМАРКЕРОВ | 2005 |
|
RU2431676C2 |
| СПОСОБЫ И МАТЕРИАЛЫ ДЛЯ ОБНАРУЖЕНИЯ АПОПТОЗА | 2007 |
|
RU2450273C2 |
| СПОСОБЫ ПРИМЕНЕНИЯ АГОНИСТОВ АРО-2L-РЕЦЕПТОРОВ И АКТИВАТОРОВ NK-КЛЕТОК | 2005 |
|
RU2395294C2 |
| АНТИТЕЛА К DR5 И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2458072C2 |
| АНТИТЕЛО, СЕЛЕКТИВНОЕ В ОТНОШЕНИИ РЕЦЕПТОРА ЛИГАНДА, ИНДУЦИРУЮЩЕГО АПОПТОЗ И СВЯЗАННОГО С ФАКТОРОМ НЕКРОЗА ОПУХОЛИ, И ЕГО ПРИМЕНЕНИЕ | 2002 |
|
RU2313537C2 |
| КОМБИНАЦИИ АНТИТЕЛ, ОБЛАДАЮЩИХ СЕЛЕКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РЕЦЕПТОРУ ЛИГАНДА, ИНДУЦИРУЮЩЕМУ АПОПТОЗ, АССОЦИИРОВАННЫЙ С ФАКТОРОМ НЕКРОЗА ОПУХОЛИ, И ДРУГИХ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2002 |
|
RU2313368C2 |
| СПОСОБ ОЧИСТКИ АРО-2 LIGAND/TRAIL ПОСРЕДСТВОМ КРИСТАЛЛИЗАЦИИ НА ХОЛОДЕ | 2006 |
|
RU2435781C2 |
| СПОСОБ ИНДУКЦИИ ГИБЕЛИ ОПУХОЛЕВЫХ КЛЕТОК | 2015 |
|
RU2620165C2 |


































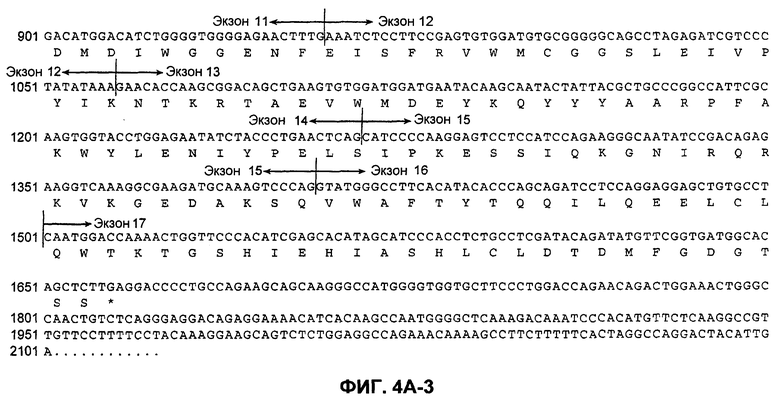
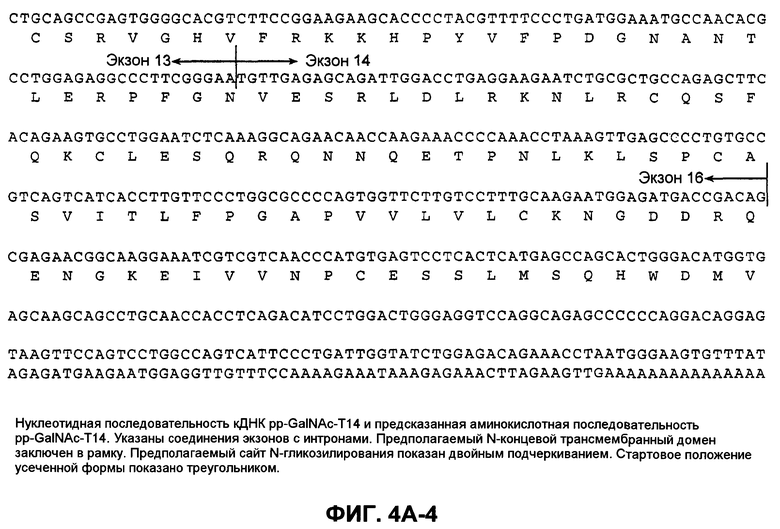
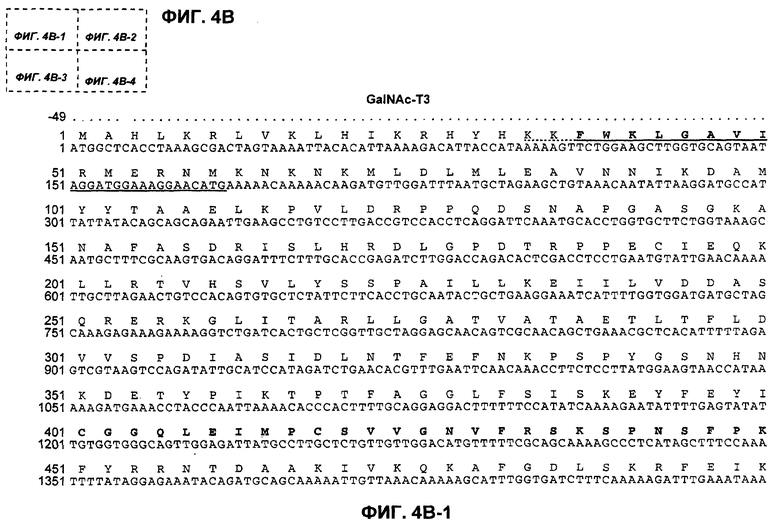
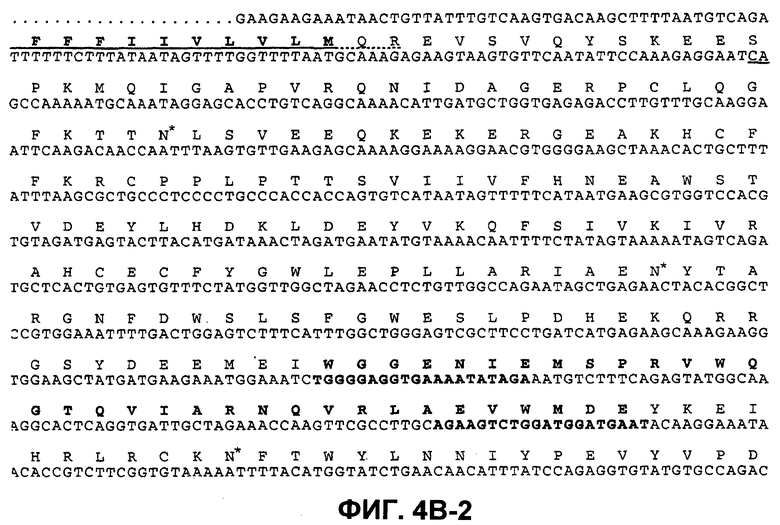
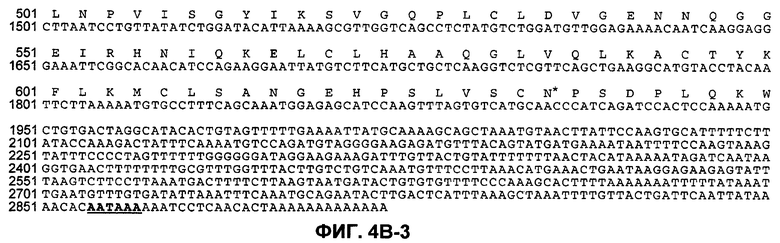


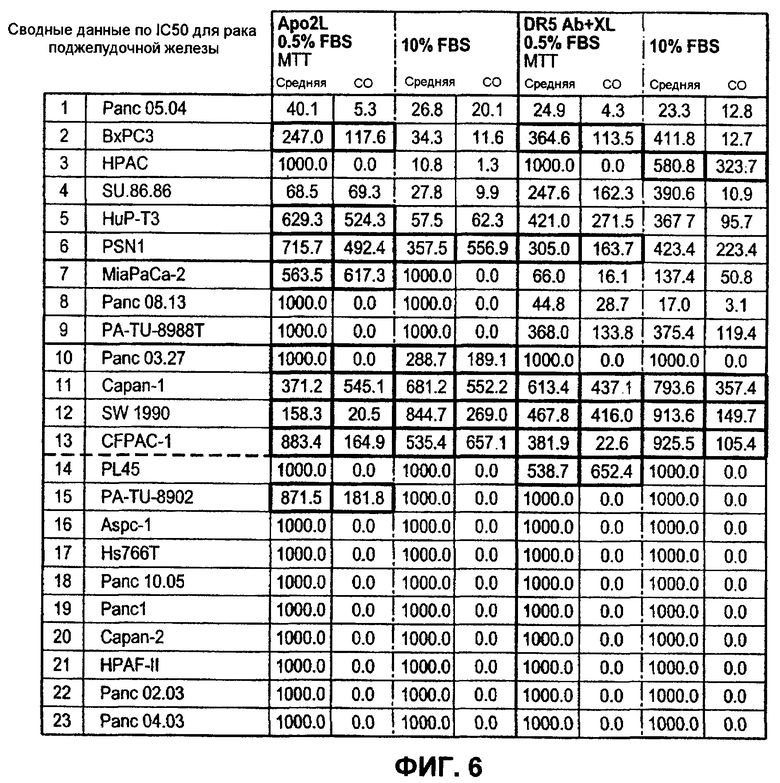
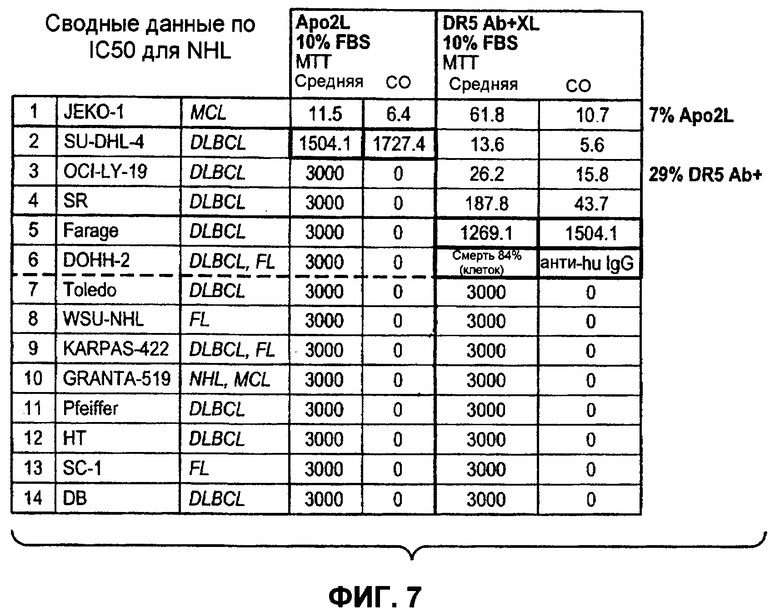
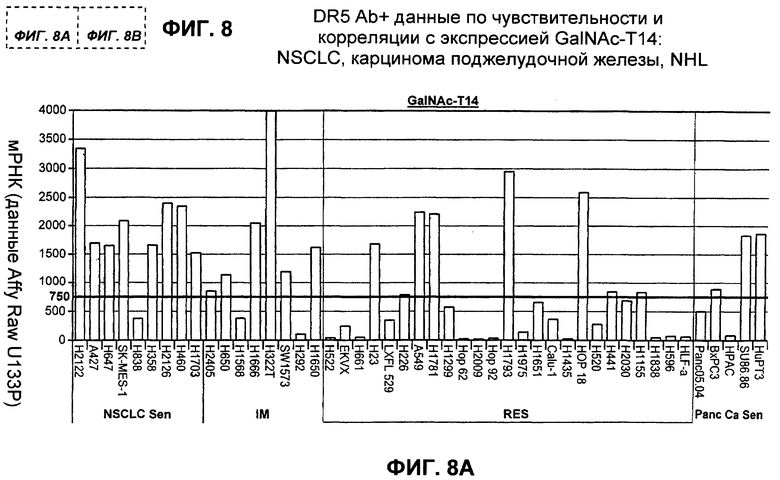
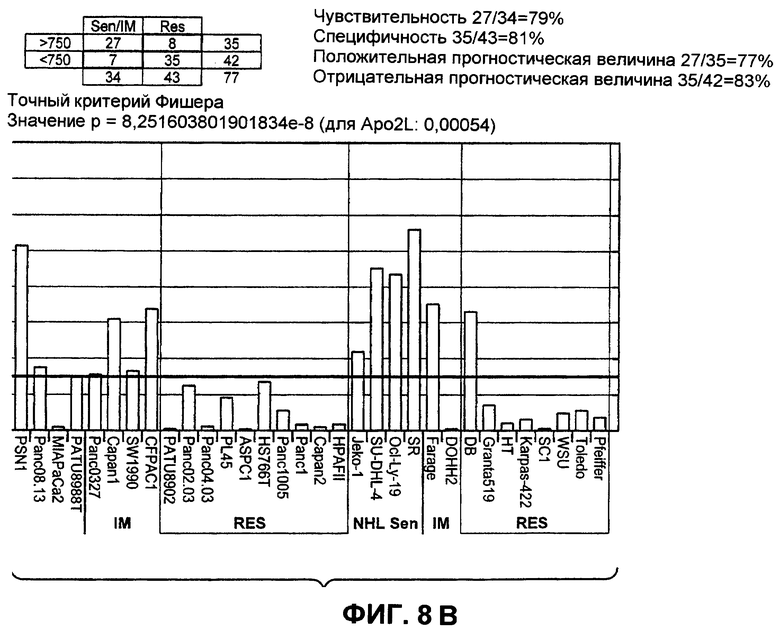
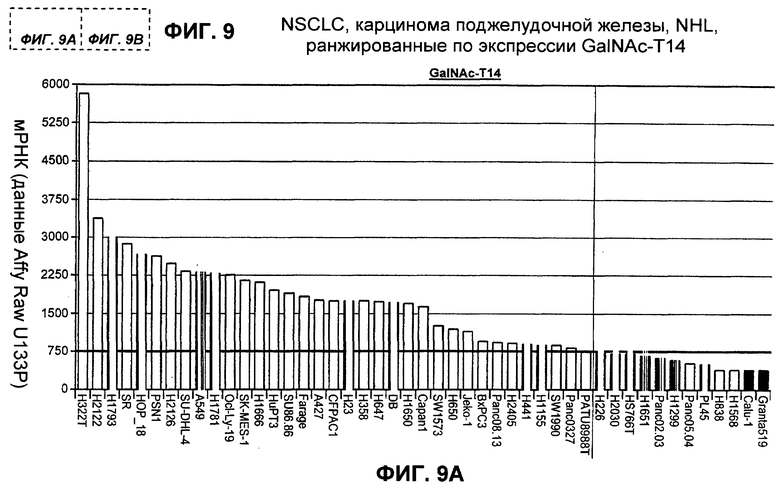

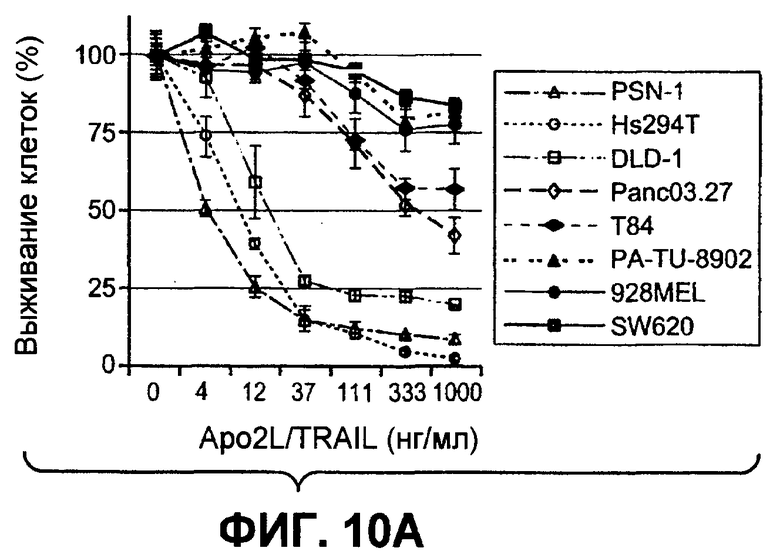
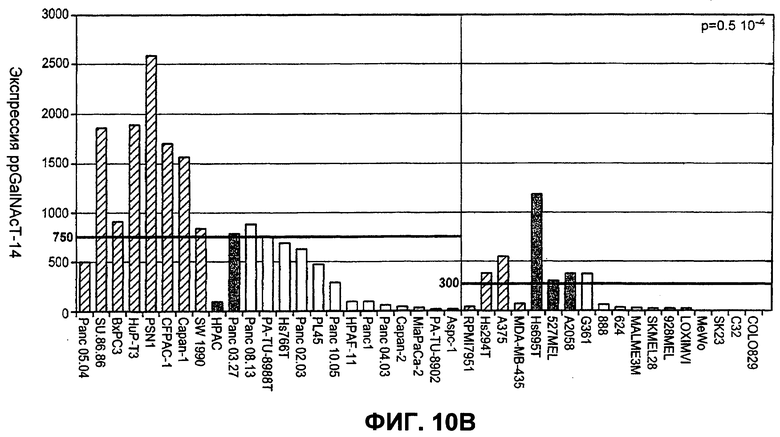
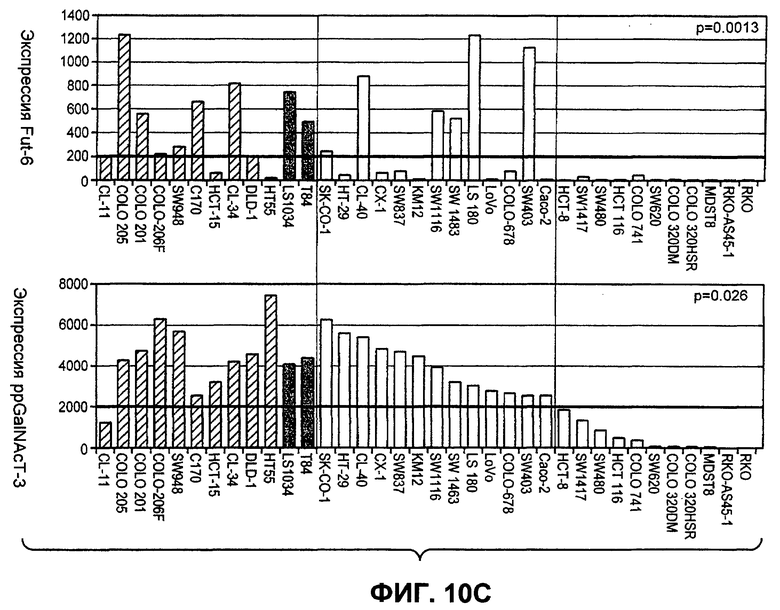
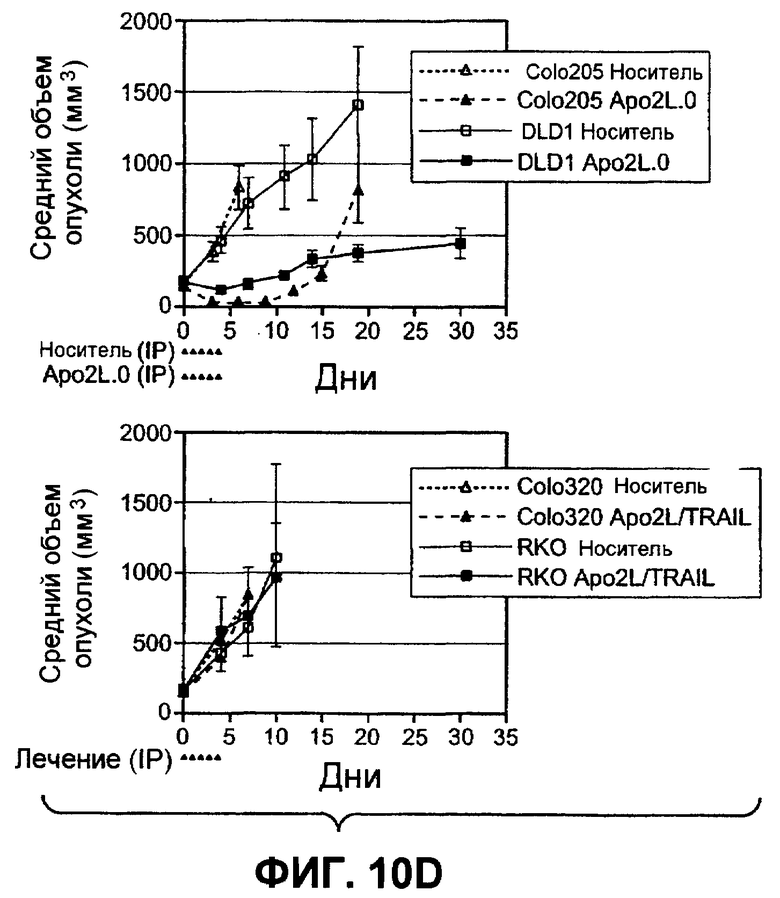

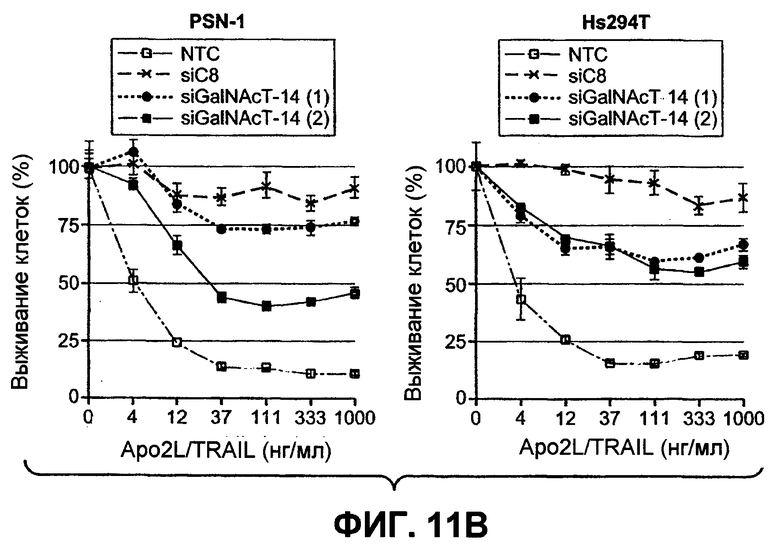

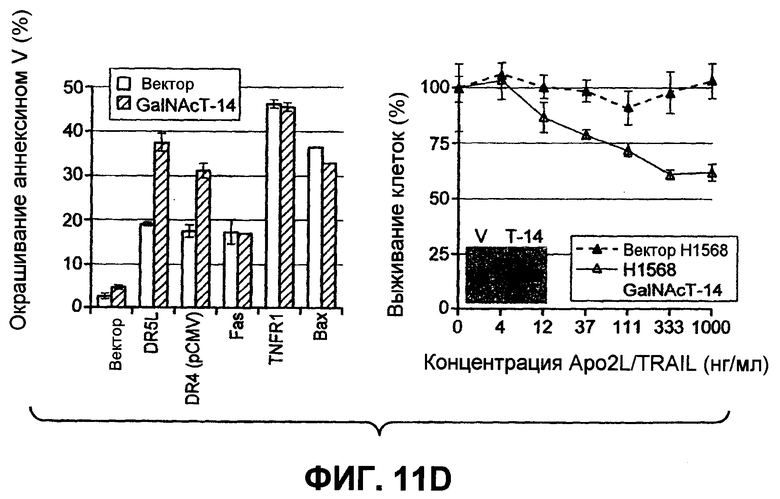
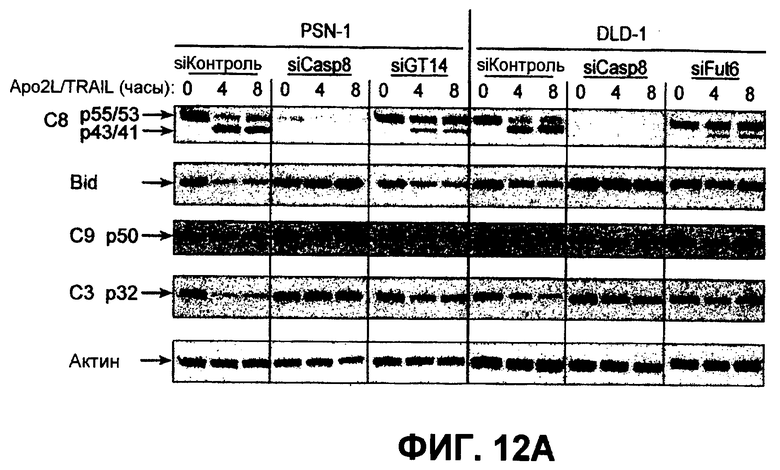

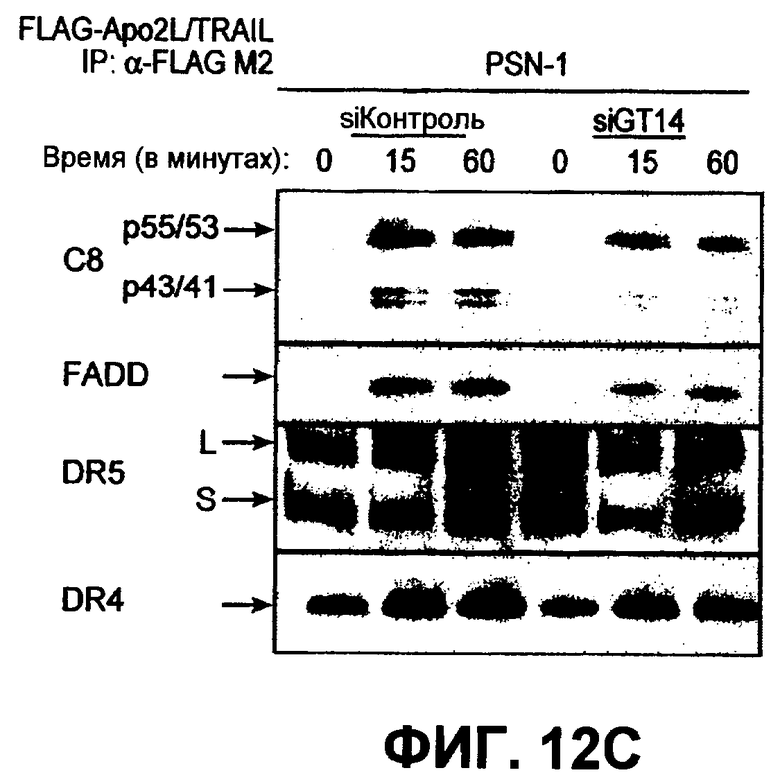
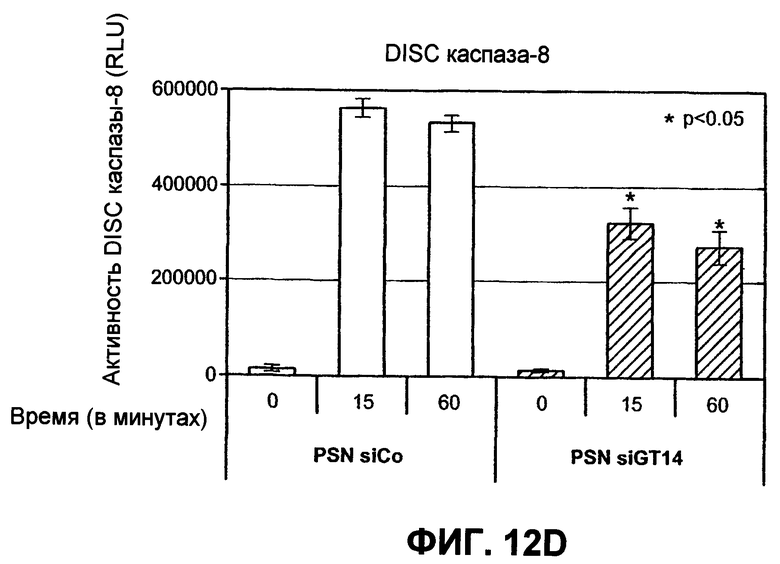
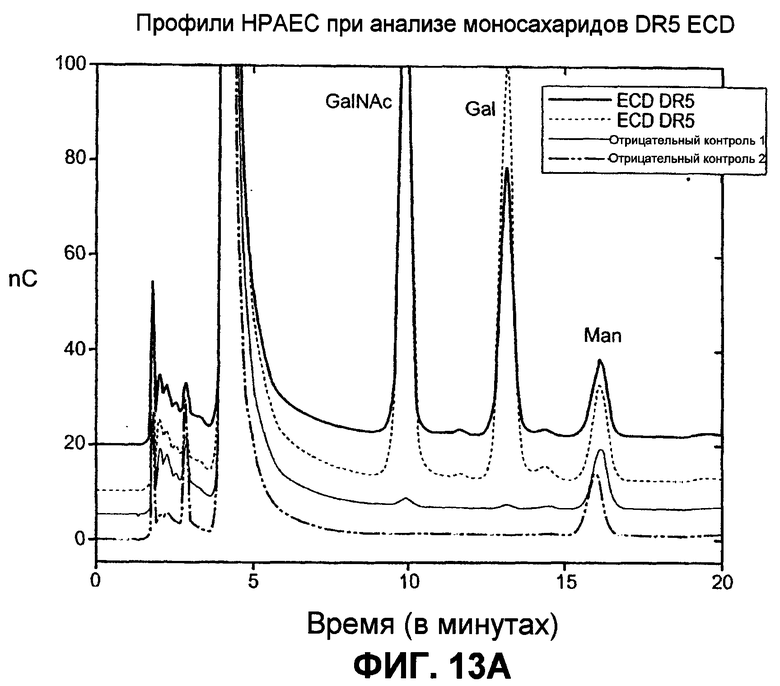
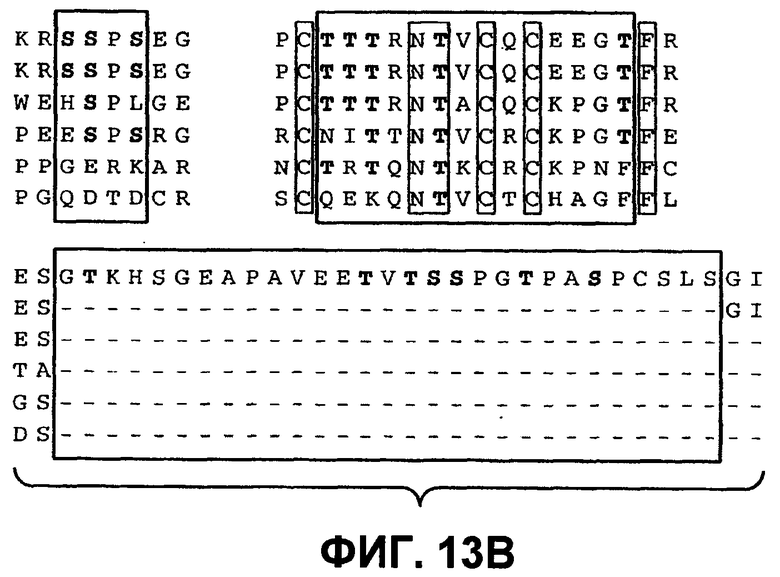

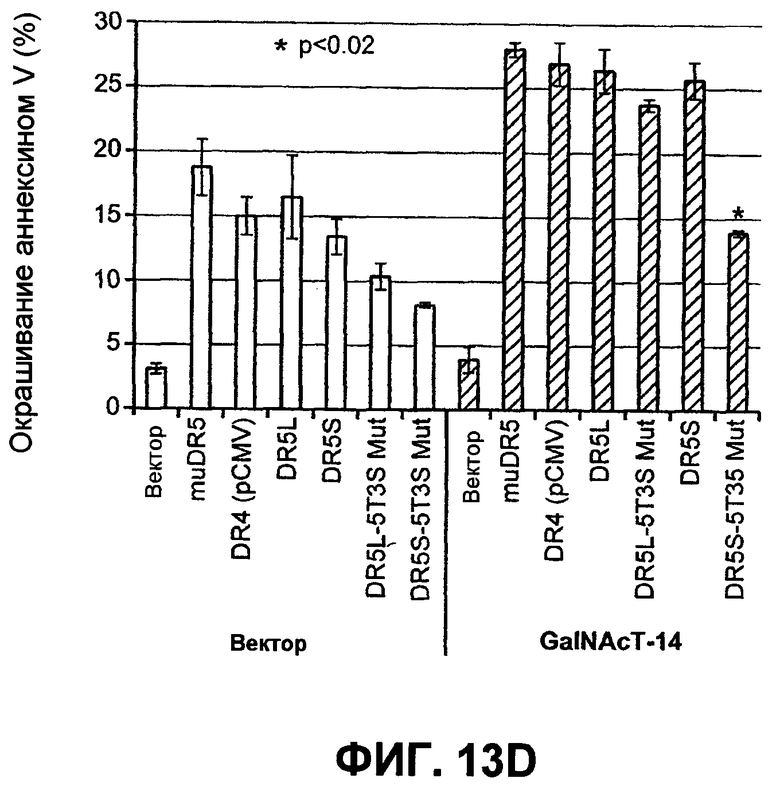
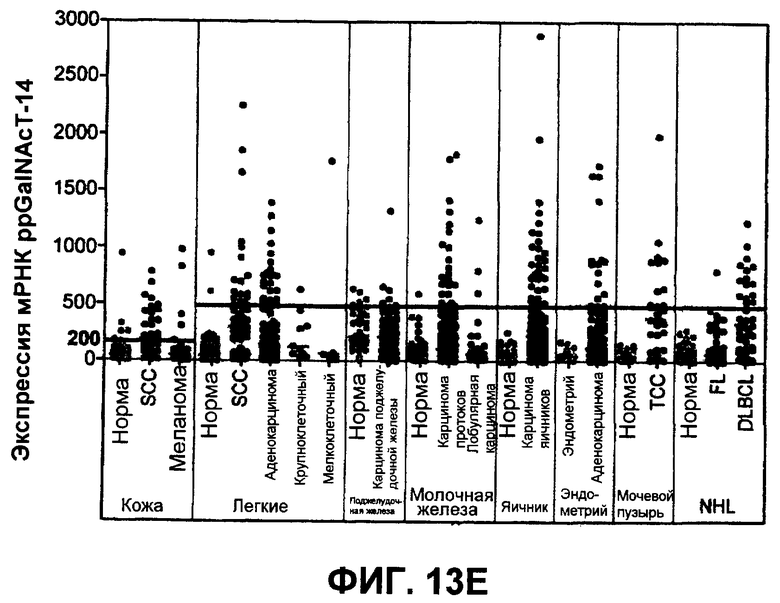
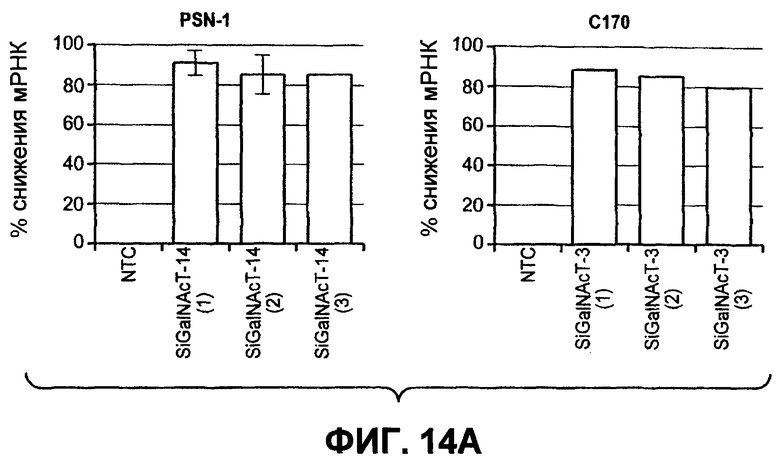
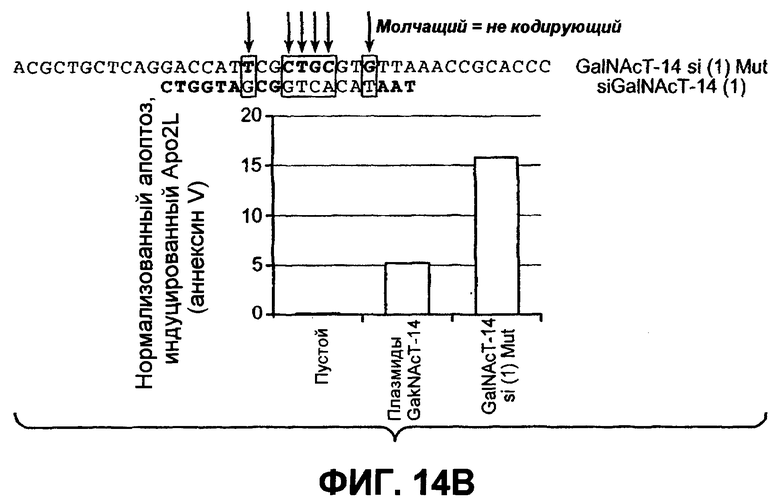
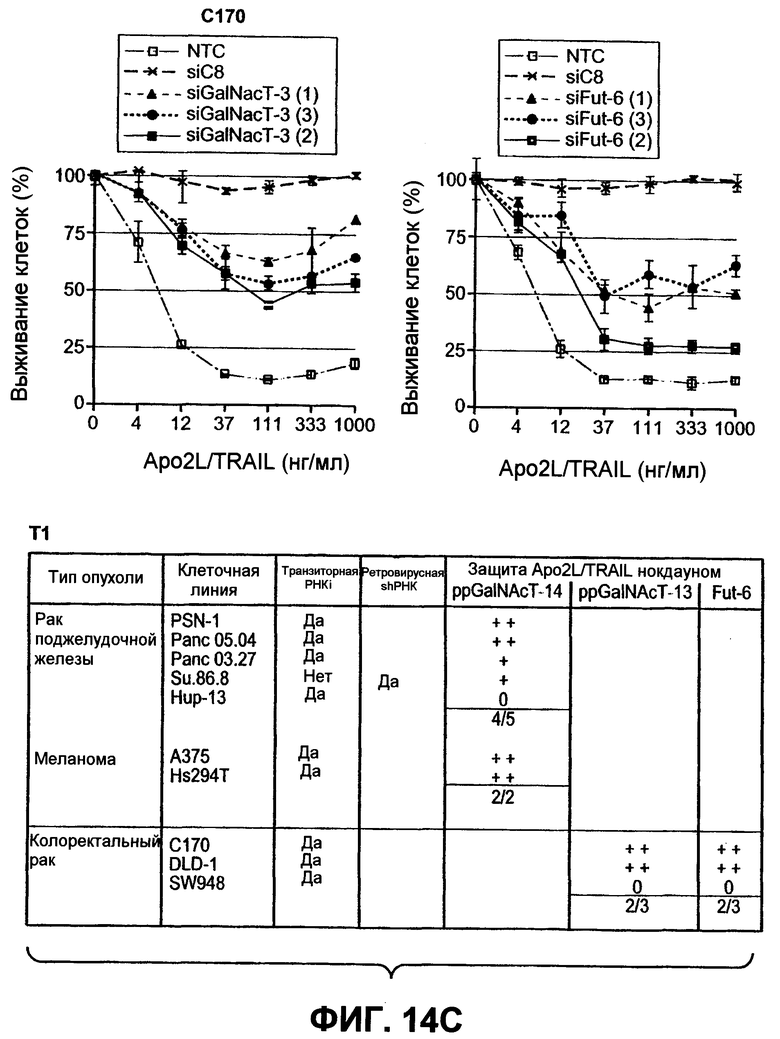
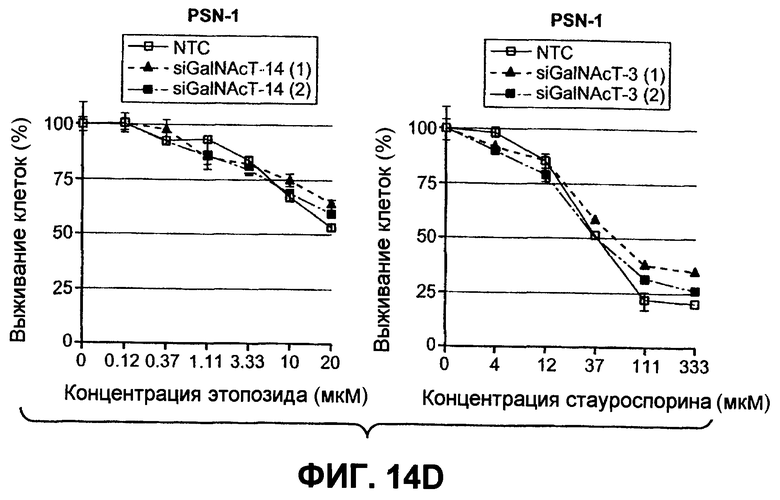
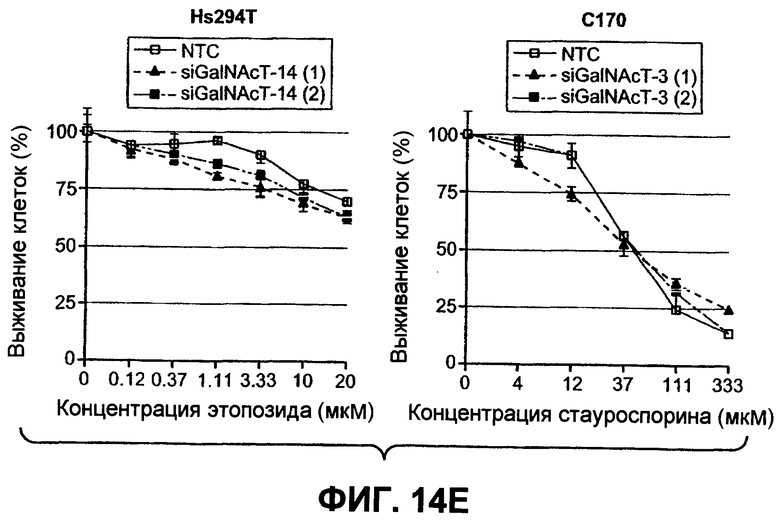
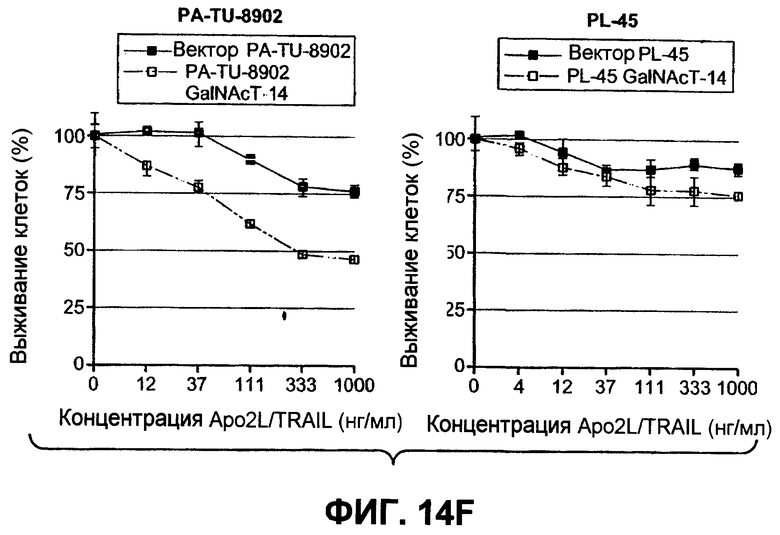
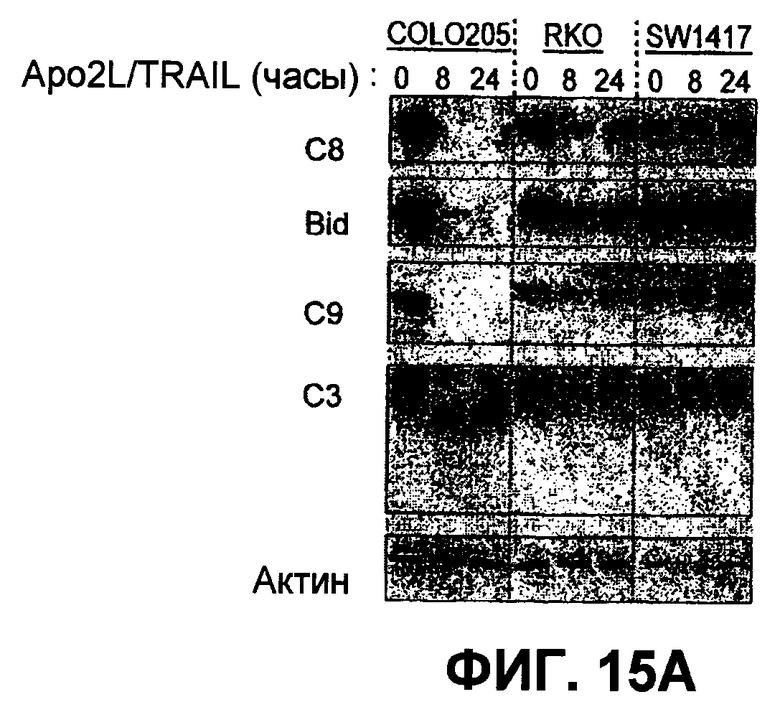

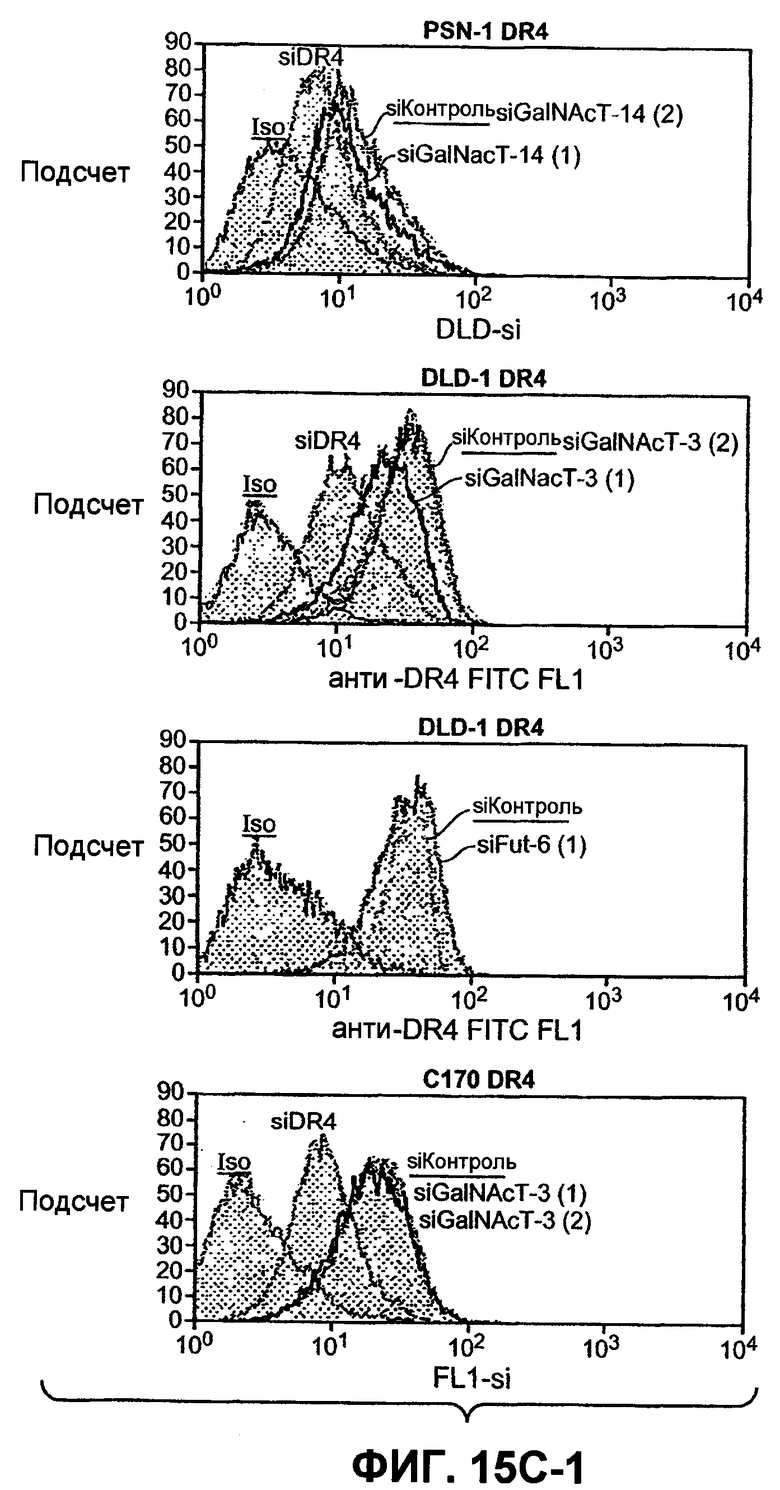
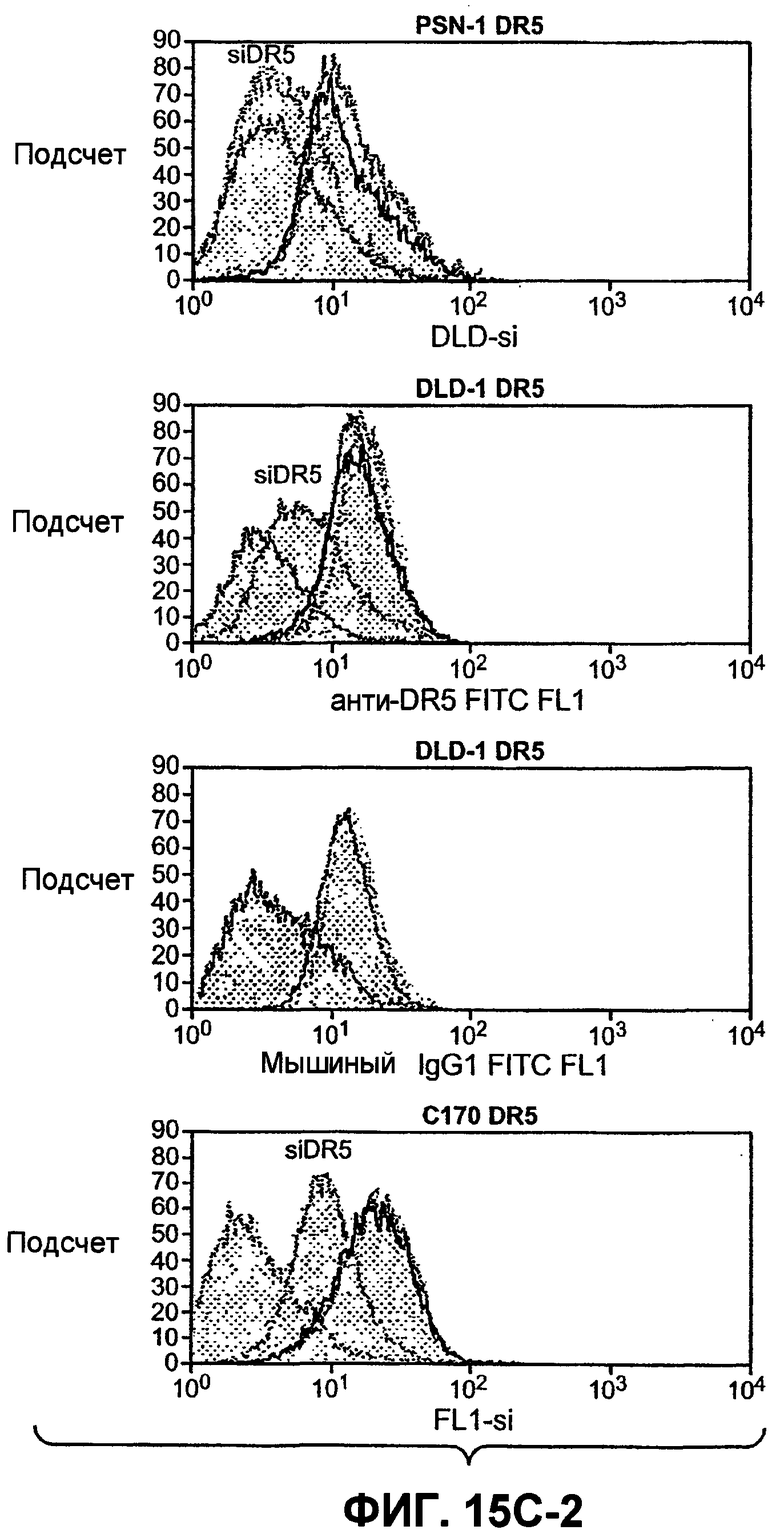
Изобретения касаются способов и анализов, позволяющих исследовать экспрессию одного или более биомаркеров в образце ткани или клеток млекопитающего, а также представлены наборы и изделия для исследований. Выявление экспрессии молекул GalNac-T14 прогнозирует чувствительность или указывает на то, что образец ткани или клеток будет чувствительным к средствам, индуцирующим апоптоз, таким как антитела-агонисты к DR4 или DR5. Информация, полученная в результате анализа, направленного на выявление экспрессии GalNac-T14 в образце ткани или клеточном образце млекопитающего, может предоставить лечащему врачу сведения, которые могут быть использованы для определения оптимальной схемы лечения для пациентов, страдающих такими заболеваниями, как рак поджелудочной железы, лимфома, немелкоклеточный рак легких, рак толстой кишки, рак прямой кишки, меланома или хондросаркома. 5 н. и 17 з.п. ф-лы, 53 ил., 14 табл.
1. Способ прогнозирования чувствительности образца ткани или клеток злокачественной опухоли млекопитающего к агонистическим антителам рецептора DR4 или агонистическим антителам рецептора DR5, включающий стадию исследования образца ткани или клеток в иммуногистохимическом анализе для выявления экспрессии GalNac-T14, где указанный иммуногистохимический анализ проводят с помощью антител против GalNac-TH, которые связывают полипептид GalNac-T14 человека, содержащий аминокислоты 1-552 или аминокислоты 39-552, указанные на фигуре 4А (SEQ ID NO:12), и где экспрессия указанного GalNac-T14 является прогностическим признаком чувствительности указанного образца ткани или клеток к апоптоз-индуцирующей активности антител рецептора DR4 или антител рецептора DR5.
2. Способ по п.1, в котором указанное антитело против GalNac-T14 представляет собой моноклональное антитело, которое связывает полипептид GalNac-T14 человека, содержащий аминокислоты 1-552, указанные на фигуре 4А (SEQ ID NO:12).
3. Способ по п.1, дополнительно включающий стадию исследования экспрессии рецепторов DR4, DR5, DcR1 или DcR2 в указанном образце ткани или клеток.
4. Способ по п.1, в котором указанные клетки злокачественной опухоли представляют собой клетки или ткань рака поджелудочной железы, лимфомы, немелкоклеточного рака легких, рака толстой кишки, рака прямой кишки, меланомы или хондросаркомы.
5. Способ индукции апоптоза в образце ткани или клеток злокачественной опухоли млекопитающих, включающий последовательные стадии:
стадию исследования образца ткани или клеток в иммуногистохимическом анализе для выявления полипептида GalNac-T14, где указанный иммуногистохимический анализ проводят с помощью антител против GalNac-Т14 человека, которые связывают полипептид GalNac-T14, содержащий аминокислоты 1-552 или аминокислоты 39-552, указанные на фигуре 4А (SEQ ID NO:12), и где экспрессия указанного полипептида GalNac-T14 является прогностическим признаком чувствительности указанного образца ткани или клеток к апоптоз-индуцирующей активности агонистического антитела рецептора DR4 или агонистического антитела рецептора DR5;
и после обнаружения экспрессии указанного полипептида GalNac-T14 стадию воздействия на указанный образец ткани или клеток эффективным количеством антител рецептора DR4 и антител рецептора DR5.
6. Способ по п.5, дополнительно включающий стадию исследования экспрессии рецепторов DR4, DR5, DcR1 или DcR2 в указанном образце ткани или клеток.
7. Способ по п.5, в котором указанные клетки злокачественной опухоли представляют собой клетки или ткань рака поджелудочной железы, лимфомы, немелкоклеточного рака легких, рака толстой кишки, рака прямой кишки, меланомы или хондросаркомы.
8. Способ по п.5, в котором указанные клетки обрабатывают эффективным количеством агонистических антител DR5.
9. Способ по п.5, в котором указанные клетки также подвергают воздействию химиотерапевтических(ого) средств(а) или лучевой терапии.
10. Способ по п.5, в котором указанные клетки также обрабатывают цитокином, цитотоксическим средством или ингибитором клеточного роста.
11. Способ по п.8, где указанные антитела рецептора DR5 связывают рецептор DR5, как указано на фиг.3А (SEQ ID NO:5).
12. Способ по п.5, где указанные клетки обрабатывают эффективным количеством антитела DR4.
13. Способ по п.5, где указанные клетки злокачественной опухоли являются клетками немелкоклеточного рака легких.
14. Способ по п.11, где указанные клетки злокачественной опухоли являются клетками немелкоклеточного рака легких.
15. Применение антитела или полинуклеотида для выявления экспрессии белка GalNac-T1-4 или мРНК в образце ткани или клеток злокачественной опухоли млекопитающего для получения набора или изделия для прогнозирования чувствительности образца ткани или клеток млекопитающего к агонистическим антителам рецептора DR4 или агонистическим антителам рецептора DR5, где экспрессия указанного GalNac-T14 является прогностическим признаком чувствительности указанного образца ткани или клеток к апоптоз-индуцирующей активности антител рецептора DR4 или антител рецептора DR5.
16. Применение по п.15, при котором указанную экспрессию GalNac-T14 оценивают по экспрессии мРНК GalNac-T14.
17. Применение п.15, при котором указанную экспрессию GalNac-T14 исследуют в иммуногистохимическом анализе.
18. Применение по п.15, при котором дополнительно проводят стадию исследования экспрессии рецепторов DR4, DR5, DcR1 или DcR2 в указанном образце ткани или клетках.
19. Применение по п.15, при котором указанные клетки злокачественной опухоли представляют собой клетки или ткань рака поджелудочной железы, лимфомы, немелкоклеточного рака легких, рака толстой кишки, рака прямой кишки, меланомы или хондросаркомы.
20. Применение набора или изделия в способе прогнозирования чувствительности образца ткани или клеток млекопитающего к апоптозу, индуцируемому агонистическими антителами против DR4 или агонистическими антителами против DR5, где набор или изделие содержит контейнер с этикеткой на указанном контейнере, причем в указанном контейнере находится композиция, которая включает первичное антитело, связывающееся с GalNac-T14, а на этикетке указанного контейнера указано, что композиция может использоваться для выявления GalNac-T14 по меньшей мере в одном типе клеток млекопитающих, и инструкции по применению антитела GalNac-T14 для оценки наличия GalNac-T14 по меньшей мере в одном типе клеток млекопитающих.
21. Применение набора или изделия по п.20, где указанное антитело является моноклональным антителом GalNac-T14.
22. Применение набора в способе прогнозирования чувствительности образца ткани или клеток млекопитающего к апоптозу, индуцированному агонистическим антителом DR4 или агонистическим антителом DR5, где набор содержит контейнер с этикеткой на указанном контейнере, причем в указанном контейнере находится композиция, которая включает полинуклеотид, который гибридизуется с комплементарным полинуклеотидом GalNac-T14 в жестких условиях, а на этикетке указанного контейнера указано, что композиция может использоваться для выявления GalNac-T14 по меньшей мере в одном типе клеток млекопитающих, и инструкции по применению полинуклеотида для оценки присутствия РНК или ДНК GalNac-T14 по меньшей мере в одном типе клеток млекопитающих.
| LeBLANC H.N | |||
| and ASHKENAZI A., Apo/TRAIL and its death and decoy receptors | |||
| Rev | |||
| // Cell Death and Differentiations, 2003, 10 P.66-75 | |||
| CHEN Q | |||
| et al., Role of Apo2L/TRAIL and Bcl-2-family proteins in apoptosis of multiple myeloma // Leuk | |||
| Lumphoma., 2003, 44(7), P | |||
| Катетер-компрессор | 1923 |
|
SU1209A1 |
| FISHER U and SCHULZE-OSTHOFF K., Apoptosis-based therapies and dmg targets | |||
| Rev | |||
| // Cell Death and Differentiation, 2005, 12, P.942-961. | |||
Авторы
Даты
2011-01-20—Публикация
2006-08-15—Подача