РОДСТВЕННВЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет международной заявки под номером PCT/CN2018/074916, поданной 1 февраля 2018 года, содержание которой полностью включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к лечению состояний, течение которых улучшается при подавлении обусловленной опухолью иммуносупрессии. Более конкретно, настоящее изобретение относится к анти-PD-1 антителам, а также к применению таких антител при лечении заболеваний, таких как злокачественные опухоли и инфекционные заболевания.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Общеизвестно, что PD-1 является одной из ключевых молекул иммунной регуляции и поддержания периферической толерантности. PD-1 умеренно экспрессируется на поверхности наивных T, B и NKT-клеток и может быть активирована сигнальными молекулами T/B-клеточных рецепторов на поверхности лимфоцитов, моноцитов и миелоидных клеток (1).
Два известных лиганда PD-1, PD-L1 (B7-H1) и PD-L2 (B7-DC), экспрессированы при злокачественных опухолях различных тканей человека. На больших выборках образцов, взятых, например, при раке яичников, почек, ободочной и прямой кишки, рака поджелудочной железы и меланомы, было показано, что экспрессия PD-L1 коррелирует с плохим прогнозом лечения, а также снижает общую выживаемость вне зависимости от последующего лечения (2-13). Аналогично, было обнаружено, что экспрессия PD-1 в инфильтрирующих опухоль лимфоцитах является маркером дисфункциональных Т-клеток при раке молочной железы и меланоме (14-15) и коррелирует с плохим прогнозом при раке почки (16). Таким образом, было предположено, что экспрессирующие PD-L1 опухолевые клетки взаимодействуют с экспрессирующими PD-1 Т-клетками, приводя к ослаблению активации Т-клеток и нарушению функции «иммунного надзора», тем самым способствуя неадекватному противоопухолевому иммунному ответу.
В данной области техники существует потребность в создании высокоэффективных терапевтических антител-антагонистов, противодействующих активности PD-1, которые могут быть использованы для инициации надежного противоопухолевого иммунного ответа.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к анти-PD-1 антителу или его антигенсвязывающему фрагменту, содержащему области CDR тяжелой и/или легкой цепи гуманизированного антитела 08A с созревшей аффинностью, такому как Fab98, 99, 100, 101, 102, 103 или 104 с коррекцией или без коррекции сайта гликозилирования S61N и/или сайта дезамидирования G56A в области CDRH2 (последовательная нумерация). Настоящее изобретение также относится к анти-PD-1 антителу или его антигенсвязывающему фрагменту, содержащему вариабельные области тяжелой и/или легкой цепи на основе гуманизированного антитела 08A с созревшей аффинностью, такому как Fab98, 99, 100, 101, 102, 103 или 104, с коррекцией или без коррекции сайта гликозилирования S61N и/или с коррекцией сайта дезамидирования G56A в области CDRH2.
В другом аспекте изобретение относится к анти-PD-1 антителу или его антигенсвязывающему фрагменту, содержащему области CDR тяжелой и/или легкой цепи гуманизированного антитела 08A с коррекцией сайта гликозилирования S61N и/или коррекцией сайта дезамидирования G56A в области CDRH2. В другом аспекте изобретение относится к анти-PD-1 антителу или его антигенсвязывающему фрагменту, содержащему вариабельные области тяжелой и/или легкой цепи гуманизированного антитела 08А с коррекцией сайта гликозилирования S61N и/или коррекцией сайта дезамидирования G56A в области CDRH2.
В дополнительном аспекте настоящее изобретение также относится к анти-PD-1 антителу или его антигенсвязывающему фрагменту, содержащему области CDR тяжелой и/или легкой цепи гуманизированного 08A с созревшей афинностью Fab128, 133, 138 или 139, с коррекцией или без коррекции сайта гликозилирования S61N, и/или с коррекцией сайта дезамидирования G56A в области CDRH2. В дополнительном аспекте настоящее изобретение также относится к анти-PD-1 антителу или его антигенсвязывающему фрагменту, содержащему вариабельные области тяжелой и/или легкой цепи гуманизированного 08A с созревшей афинностью Fab128, 133, 138 или 139 с коррекцией или без коррекции сайта гликозилирования S61N, и/или с коррекцией сайта дезамидирования G56A в области CDRH2.
Изобретение также относится к выделенным нуклеиновым кислотам, кодирующим любое из анти-PD-1-антител или антигенсвязывающих фрагментов по изобретению. Изобретение также относится к векторам экспрессии, содержащим нуклеиновую кислоту (где указанные полипептиды могут необязательно содержать лидерную последовательность). Эти выделенные нуклеиновые кислоты и содержащие их векторы экспрессии могут быть использованы для экспрессии антител по изобретению или их антигенсвязывающих фрагментов в рекомбинантных клетках-хозяевах. Таким образом, изобретение также относится к клеткам-хозяевам, содержащим такие изолированные нуклеиновые кислоты.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1: Тестирование Fab и биспецифичных антител по изобретению по разработанной методике Jurkat.hPD-1.IL2luc+THP-1.PD-L1. Биспецифичные антитела и Fabs способны предотвращать иммунную супрессию, вызванную взаимодействиями PD1-PDL1. Данный эффект определялся по увеличению уровня IL2-опосредованной люциферазы при совместном инкубировании антител/Fab с клетками Jurkat (PD1+ve) и клетками THP1PDL1 (+ LPS, IFNg, aCD3).
Фигура 2: Продукция IL-2 (нижняя панель) и IFN-γ (верхняя панель), индуцированных биспецифичными антителами в ходе проверки методом Реакции Смешанной Культуры Лимфоцитов.
Фигура 3: IFN-γ-продукция CD4+клона 4-49 Т-клеток, рестимулированных PD-L1 транфицированных JY клеток посредством биспецифичных антител.
Фигура 4: 3-D диаграмма интерфейса CH1 (серый) и CL (белый), сформированного в плече анти-PD1 биспецифического антитела 90ASU или 18ASS при введении мутаций AzymetricTM (палочки). Другой набор мутаций был введен во второе плечо анти-LAG3 для стимулирования избирательного формирования правильно спаренного интерфейса и во избежание неправильного спаривания тяжелой и легкой цепей.
Фигура 5: 3-D диаграмма интерфейса CH1 (серый) и CL (белый), сформированного во втором плече анти-LAG3 биспецифического антитела 90ASU или 18ASS при введении мутаций AzymetricTM (палочки). Другой набор мутаций введен в первое плечо анти-PD-1 для стимулирования избирательного формирования правильно спаренного интерфейса и избежания неправильного спаривания тяжелой цепи.
Фигура 6: 3-D диаграмма интерфейса гетеродимера СН3, образованного в биспецифическом антителе (18ASS и 90ASU) тяжелой цепью 1 (серая) и тяжелой цепью 2 (белая) при введении мутаций AzymetricTM (палочки).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Сокращения
Следующие сокращения используются в подробном описании и во всех примерах изобретения:
Определения
Для понимания изобретения, определенные технические и научные термины подробно определены ниже. Если термины специально не определены где-либо в данном документе, то все технические и научные термины, используемые в данном документе, имеют значение, общепринятые для специалиста в той области техники, к которой относится это изобретение.
«Введение» и «лечение», в контексте, применяемом к животному, человеку, участнику экспериментальна, клетке, ткани, органу или биологической жидкости, относится к контакту экзогенного фармацевтического, терапевтического, диагностического агента или композиции с животным, человеком, индивидом, клеткой, тканью, органом или биологической жидкостью. Обработка клетки включает в себя контакт реагента с клеткой, а также контакт реагента с жидкостью, если жидкость контактирует с клеткой. «Введение» и «лечение» также означают лечение in vitro и ex vivo, например, клетки, реагентом, диагностическим соединением, связывающим компонентом, или другой клеткой.
«Лечить» или «лечение» означает введение терапевтического агента, такого как композиция, содержащего любое из антител или антигенсвязывающих фрагментов по настоящему изобретению, внутрь или поверхностно, индивиду или пациенту, имеющему один или несколько симптомов заболевания, или подозреваемому на наличие заболевания, в отношении которого агент обладает терапевтической активностью. Как правило, агент вводят в количестве, эффективном для ослабления одного или нескольких симптомов заболевания у подвергаемого лечению индивида или популяции, будь то путем индукции регрессии или ингибирования прогрессирования такого(их) симптома(ов) в любой клинически измеримой степени. Количество терапевтического средства, эффективное для смягчения любого конкретного симптома заболевания, может варьироваться в зависимости от таких факторов, как степень заболевания, возраст и вес пациента, а также способность лекарственного средства вызывать желаемый ответ у индивида. Облегчение симптома заболевания может быть оценено с помощью любого клинического измерения, рутинно используемого врачами или другими квалифицированными медицинскими работниками для оценки степени тяжести или состояния прогрессирования этого симптома.
Антитела, мультиспецифичные антитела и антигенсвязывающие фрагменты
Настоящее изобретение включает анти-PD-1 антитела и способы их применения. Используемый в настоящем документе термин «антитело» относится к любой форме антитела, проявляющей желаемую биологическую активность. Таким образом, он используется в самом широком смысле и конкретно охватывает, не ограничиваясь таковыми, моноклональные антитела (включая полноразмерные моноклональные антитела, содержащие две легкие цепи и две тяжелые цепи), поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела), гуманизированные антитела, полностью человеческие антитела и химерные антитела.
В общем случае, структурная единица основного антитела представляет собой тетрамер. Каждый тетрамер включает две идентичные пары полипептидных цепей, где каждая пара имеет одну «легкую» (около 25 кДа) и одну «тяжелую» цепь (около 50-70 кДа). Аминоконцевая часть каждой цепи включает вариабельную область примерно от 100 до 110 или более аминокислот, главным образом ответственную за распознавание антигена. Карбокси-концевая часть тяжелой цепи может представлять собой константную область, главным образом ответственную за эффекторную функцию.
Термин «легкая цепь» в контексте по отношению к антителу относится к полипептидной цепи длиной около 25 кДа, где аминоконцевая часть включает вариабельную область от около 100 до около 110 или более аминокислот и карбоксиконцевую часть включающую в себя константную область. Приблизительная длина легкой цепи составляет от 211 до 217 аминокислот. Как правило, легкие цепи человека классифицируют как легкие цепи каппа (κ) и лямбда (λ) на основе аминокислотной последовательности константных доменов. Аминокислотные последовательности легкой цепи хорошо известны в данной области техники. Легкая цепь может являться легкой цепью человека.
Термин «тяжелая цепь» в контексте по отношению к антителу относится к полипептидной цепи длиной примерно 50-70 кДа, где аминоконцевая часть включает вариабельную область примерно от 120 до 130 или более аминокислот и карбоксиконцевую часть, включающую в себя константную область. Константная область может принадлежать к одному из пяти различных типов (например, являться изотипом), называемых альфа (α), дельта (δ), эпсилон (ε), гамма (γ) и мю (µ), в зависимости от аминокислотной последовательности константной области тяжелой цепи. Разные тяжелые цепи различаются по размеру: α, δ и γ содержат приблизительно 450 аминокислот, тогда как µ и ε содержат приблизительно 550 аминокислот. В сочетании с легкой цепью эти различные типы тяжелых цепей дают пять хорошо известных классов (изотипов) иммуноглобулина (Ig), IgA, IgD, IgE, IgG и IgM, соответственно, включая четыре подкласса IgG, а именно, IgG1, IgG2, IgG3 и IgG4. Тяжелая цепь может являться тяжелой цепью человека.
Внутри легкой и тяжелой цепей вариабельные и константные области соединены областью «J» из примерно 12 или более аминокислот, причем тяжелая цепь также включает область «D» из еще примерно 10 аминокислот. См. Fundamental Immunology, Ch. 7 (Paul, W., ed., 2nd ed. Raven Press, N.Y. (1989)).
Вариабельные области каждой пары легкой/тяжелой цепи формируют сайт связывания антитела. Таким образом, как правило, интактное антитело имеет два сайта связывания. За исключением бифункциональных или биспецифичных антител, оба сайта связывания, в общем, одинаковы.
Термины «вариабельная область», «вариабельный домен», «V-область» или «V-домен» относятся к той части легкой или тяжелой цепи антитела, которая обычно расположена на амино-конце легкой или тяжелой цепи и имеет длину примерно от 120 до 130 аминокислот в тяжелой цепи и примерно от 100 до 110 аминокислот в легкой цепи, при этом они используются для связывания и обеспечения специфичности каждого конкретного антитела для его конкретного антигена. Это тот самый сегмент цепей Ig, который является вариабельным по последовательности между различными антителами. В некоторых случаях он распространяется до остатка Кабата 109 в легкой цепи и 113 в тяжелой цепи. Вариабельная область тяжелой цепи может обозначаться как «VH». Вариабельная область легкой цепи может обозначаться как «VL». Термин «вариабельный» базируется на факте, что определенные сегменты вариабельных областей сильно различаются по последовательности среди антител. V-область опосредует связывание антигена и определяет специфичность конкретного антитела к его конкретному антигену. Однако, вариабельность неравномерно распределена по размеру вариабельной области из 110 аминокислот. Напротив, V-области состоят из менее вариабельных (например, более или менее постоянных) районов, называемых каркасными областями (FR), приблизительно из 15-30 аминокислот, разделенных более короткими областями значительной вариабельности (например, чрезмерной вариабельности), называемыми «гипервариабельными областями», каждая из которых имеет длину около 9-12 аминокислот. Каждая из вариабельных областей тяжелой и легкой цепей содержит четыре FR, в значительной степени принимающих конфигурацию β-листа, соединенных тремя гипервариабельными областями, образующими петли, соединяющие структуры β-листа (β-слоя), и в некоторых случаях даже являющиеся его частью. Гипервариабельные области в каждой цепи удерживаются вместе в непосредственной близости с помощью FR и, вместе с гипервариабельными областями из другой цепи, способствуют образованию антигенсвязывающего сайта антител (см., например, Kabat et al., Sequences of Proteins of Immunological Interest (5th ed. 1991)). Константные области непосредственно не участвуют в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антитело-зависимой клеточной цитотоксичности (ADCC) и комплемент-зависимой цитотоксичности (CDC). Вариабельные области сильно различаются по последовательности между различными антителами. В конкретных вариантах осуществления вариабельная область представляет собой вариабельную область человека.
Термины «нумерация остатков вариабельной области по Кабату» или «нумерация аминокислотных позиций по Кабату», и их варианты, относятся к системе нумерации, используемой для вариабельных областей тяжелой цепи или вариабельных областей легкой цепи при компиляции антител в соответствии с Kabat et al., выше. При использовании этой системы нумерации, фактическая линейная аминокислотная последовательность может содержать меньше аминокислот или дополнительные аминокислоты, соответствующие укорочению цепи или инсерции в FR или CDR вариабельного домена. Например, вариабельный домен тяжелой цепи может включать одну аминокислотную инсерцию (остаток 52а по Кабату) после остатка 52 и три добавленных остатка (например, остатки 82а, 82b и 82с и т.д. по Кабату) после остатка 82. Нумерация остатков по Кабату может быть определена для данного антитела путем выравнивания в областях гомологии последовательности антитела со «стандартной» последовательностью, пронумерованной по Кабату. Система нумерации по Кабату обычно используется для обозначения остатка в вариабельном домене (приблизительно остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи) (см. например, Kabat et al., выше). «Система нумерации ЕС» или «индекс ЕС» обычно используется при нумерации остатка в константной области тяжелой цепи иммуноглобулина (например, индекс ЕС, описанный в Kabat et al., выше). «Индекс ЕС по Кабату» относится к нумерации остатков человеческого антитела IgG 1EU. Другие системы нумерации были также описаны, например, AbM, Chothia, Contact, IMGT и AHon.
Как правило, вариабельные домены как тяжелой, так и легкой цепи содержат три гипервариабельные области, также называемые областями, определяющими комплементарность (CDR), и расположенными в относительно консервативных каркасных областях (FR). CDR обычно выровнены по каркасным областям, позволяя им связываться с конкретным эпитопом. Как правило, от N-конца к C-концу вариабельные домены как легкой, так и тяжелой цепей включают FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Присвоение аминокислот каждому домену происходит, как правило, в соответствии с определениями, изложенными в Sequences of Proteins of Immunological Interest, Kabat, et al.; National Institutes of Health, Bethesda, Md.; 5th ed.; NIH Publ. No. 91-3242 (1991); Kabat (1978) Adv. Prot. Chem. 32:1-75; Kabat, et al., (1977) J. Biol. Chem. 252:6609-6616; Chothia, et al., (1987) J Mol. Biol. 196:901-917 or Chothia, et al., (1989) Nature 342:878-883; and for EU numbering, see Edelman, G.M. et al., Proc. Natl. Acad. USA, 63, 78-85 (1969).
Гипервариабельная область включает аминокислотные остатки из «области, определяющей комплементарность» или «CDR» (т.е. CDRL1, CDRL2 и CDRL3 в вариабельном домене легкой цепи и CDRH1, CDRH2 и CDRH3 в вариабельном домене тяжелой цепи). «CDR» относится к одной из трех гипервариабельных областей (H1, H2 или H3) в пределах некаркасной VH области каркаса β-слоя иммуноглобулина (Ig или антитела) или к одной из трех гипервариабельных областей (L1, L2 или L3) в пределах некаркасной VL области каркаса β-листа антитела. Соответственно, CDR представляют собой последовательности вариабельной области, вкрапленные в последовательности каркасной области. Области CDR хорошо известны специалистам в данной области и были определены, например, Кабатом, как области наибольшей гипервариабельности в вариабельных (V) доменах антитела (Kabat et al., 1997, J. Biol. Chem. 252:6609-16; Kabat, 1978, Adv. Prot. Chem. 32:1-75; Kabat et al. (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (привязка CDR-областей антитела к последовательности). Последовательности области CDR также были определены структурно как те остатки, которые не являются частью консервативного каркаса β-листа и, таким образом, способны находится в различных конформациях (Chothia and Lesk (1987) J. Mol. Biol. 196: 901-917 (привязка CDR-областей антитела к структуре). Обе терминологии хорошо известны в данной области техники. Последовательности областей CDR также были определены AbM, Contact и IMGT. Положения CDR в вариабельной области канонического антитела были определены путем сравнения многочисленных структур (Al-Lazikani et al., 1997, J. Mol. Biol. 273: 927-48; Morea et al., 2000, Methods 20: 267-79). Поскольку число остатков в гипервариабельной области варьируется у разных антител, дополнительные остатки относительно канонических позиций обычно нумеруются с помощью a, b, c и так далее рядом с номером остатка в схеме нумерации канонических вариабельных областей (Al-Lazikani et al. al., см. выше). Такая номенклатура также хорошо известна специалистам в данной области техники.
Термин «гипервариабельная область», «HVR» или «HV» в контексте настоящего документа относится к участкам вариабельной области антитела, являющимся гипервариабельными по последовательности и/или формирующих структурные петли. Обычно антитела содержат шесть гипервариабельных областей, три в VH (H1, H2, H3) и три в VL (L1, L2, L3). В данном документе использован и описан ряд различных гипервариабельных областей. Области, являющиеся определяющими комплементарность по Кабату, (CDR), обладают вариабельной последовательностью и используются наиболее часто (см., например, Kabat et al., выше). Помимо этого, Chothia ссылается на расположение структурных петель (см., например, Chothia and Lesk, 1987, J. Mol. Biol. 196: 901-17). Конец петли Chothia CDR-H1 при нумерации с использованием правила Кабата варьируется между H32 и H34 в зависимости от длины петли (это происходит потому, что схема нумерации по Кабату учитывает вставки в H35A и H35B; если ни 35A, ни 35B не присутствуют, петля заканчивается на 32, если присутствует только 35А, петля заканчивается на 33; если присутствуют оба 35А и 35В, петля заканчивается на 34). Гипервариабельные области AbM представляют собой компромисс между CDR Кабата и структурными петлями Chothia и используются программным обеспечением Oxford Molecular для моделирования антител AbM (см., например, Antibody Engineering Vol. 2 (Kontermann and Dübel eds., 2d ed. 2010)). «Контактные» гипервариабельные области получены на основе анализа доступных сложных кристаллических структур. Аминокислотные остатки каждой из этих гипервариабельных областей или CDR указаны ниже.
Недавно была разработана и широко принята универсальная система нумерации, Информационная система ImMunoGeneTics (IMGT)® (Lafranc et al., 2003, Dev. Comp. Immunol. 27 (1): 55-77). IMGT - это интегрированная информационная система, специализирующаяся на иммуноглобулинах (IG), T-клеточных рецепторах (TCR) и главном комплексе гистосовместимости (MHC) человека и других позвоночных. В настоящем документе CDR упоминаются в терминах как аминокислотной последовательности, так и местоположения в легкой или тяжелой цепи. Поскольку «расположение» CDR в структуре вариабельного домена иммуноглобулина законсервировано между видами и присутствует в структурах, называемых петлями, при использовании систем нумерации, выравнивающих последовательности вариабельного домена в соответствии со структурными признаками, CDR и каркасные остатки легко идентифицируются. Эта информация может быть использована для “пересадки» и заместительного переноса остатков CDR иммуноглобулинов одного вида в акцепторный каркас, как правило, происходящий из человеческого антитела. Дополнительная система нумерации (AHon) была разработана Honegger и Plückthun, 2001, J. Mol. Biol. 309: 657-70. Соответствие между системами нумерации, включая, например, нумерацию Кабата и уникальную систему нумерации IMGT, хорошо известно специалисту в данной области техники (см., например, Kabat, выше; Chothia и Lesk, выше; Martin, выше; Lefranc et al., см. выше). В некоторых вариантах осуществления CDR являются таковыми, как определено системой нумерации IMGT. В других вариантах осуществления CDR являются таковыми, как определено системой нумерации Кабата. В некоторых вариантах осуществления CDR являются такими, как определено системой нумерации AbM. В других вариантах осуществления CDR являются таковыми, как определено системой Chothia. В еще других вариантах осуществления CDR являются таковыми, как определено системой нумерации Contact.
Гипервариабельные области могут содержать «расширенные гипервариабельные области», такие как: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 или 89-96 (L3) в VL и 26-35 или 26 35A (H1), 50-65 или 49-65 (H2) и 93-102, 94-102 или 95-102 (H3) в VH. Используемые в настоящем документе термины «HVR» и «CDR» используются взаимозаменяемо.
Используемый в настоящем документе термин «каркас» или «FR» относится к аминокислотным остаткам вариабельной области, фланкирующим CDR. Остатки FR присутствуют, например, в химерных, гуманизированных, человеческих, доменных антителах, диателах, линейных антителах и биспецифичных антителах. Аминокислотные остатки FR относятся к тем остаткам вариабельного домена, которые не принадлежат аминокислотным остаткам гипервариабельной области, определяемым в настоящем документе как остатки CDR.
Область «Fc» содержит два фрагмента тяжелой цепи, содержащих домены СН3 и СН2 антитела. Два фрагмента тяжелой цепи удерживаются вместе двумя или более дисульфидными связями и другими взаимодействиями, включая гидрофобные взаимодействия доменов СН3. Области Fc являются С-концевыми областями тяжелой цепи иммуноглобулина, и включают, например, области Fc с нативной последовательностью, области рекомбинантных Fc и варианты областей Fc. Хотя границы области Fc тяжелой цепи иммуноглобулина могут различаться, область Fc тяжелой цепи человеческого IgG часто определяется как протяженная от аминокислотного остатка в положении Cys226 или от Pro230 до его карбоксильного конца. С-концевой лизин (остаток 447 согласно системе нумерации ЕС) Fc-области может быть удален, например, во время производства или очистки антитела или путем рекомбинантного конструирования нуклеиновой кислоты, кодирующей тяжелую цепь антитела. Соответственно, композиция интактных антител может содержать популяции антител со всеми удаленными остатками K447, популяции антител без удаленных остатков K447 и популяции антител, содержащие смесь антител с и без остатка К447.
Термин «константная область» или «константный домен» относится к карбоксиконцевой части легкой и тяжелой цепей, которая непосредственно не участвует в связывании антитела с антигеном, но проявляет различные эффекторные функции, такие как взаимодействие с Fc-рецептором. Термин относится к той части молекулы иммуноглобулина, которая имеет более консервативную аминокислотную последовательность относительно другой части иммуноглобулина, вариабельной области, содержащей сайт связывания антигена. Константная область может включать области тяжелой цепи СН1, СН2 и СН3 и область CL легкой цепи. «Константный домен IgG1» включает в себя все аллотипы белка IgG1 тяжелой цепи с С-концевым лизином или без него (K), включая, но не ограничиваясь таковыми, G1m3, G1m17,1, G1m17, G1m17,1,2, G1m (f), G1m (z, a) и G1m (z, a, x). См. Таблицу 1 публикации Jefferis et al., MAbs 1: 4, 1-7; 2009, и Lefranc G и Lefranc MP, IMGT®, международная информационная система ImMunoGeneTics® (www:imgt.org/textes/IMGTrepertoire/Proteins/allotypes/human/IGH/IGHC/Hu_IGHCallotypes1.html). В одном варианте осуществления константный домен IgG1 без С-концевого лизина представлен SEQ ID NO:124.
«Константная область каппа» включает все аллотипы каппа легкой цепи белка, без ограничения таковыми, как, например, Km1, Km2 и Km3. См. Jefferis et al., MAbs 1: 4, 1-7; 2009. В одном варианте осуществления константный домен каппа представлен SEQ ID NO:125.
Термин «одноцепочечное антитело Fv» или «scFv» относится к фрагментам антитела, содержащим домены VH и VL антитела, где эти домены присутствуют в одной полипептидной цепи. Обычно полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, который позволяет scFv образовывать желаемую структуру для связывания антигена. Для обзора scFv, см. Pluckthun (1994) The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds. Springer-Verlag, New York, pp. 269-315. См. также International Publ. № WO 88/01649 и патенты США №№ 4946778 и 5260203. В одном варианте осуществления scFv содержит от N до C-конца VH-область, пептидный линкер и VL -область. В другом варианте осуществления scFv содержит от N до C-конца VL -область, пептидный линкер и VH -область.
Используемый в настоящем документе термин «диатела» относится к небольшим фрагментам антител с двумя антигенсвязывающими сайтами, которые содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в той же полипептидной цепи (VH - VL или VL- VH). При использовании линкера, который является слишком коротким, чтобы разрешить спаривание между двумя доменами в одной цепи, домены вынуждены спариваться с комплементарными доменами другой цепи и создавать два антигенсвязывающих сайта. Диатела более полно описаны, например, в EP 404,097; WO 93/11161; and Holliger et al. (1993) Proc. Natl. Acad. Sci. USA 90: 6444-6448. Для обзора вариантов сконструированных антител обычно см. Holliger and Hudson (2005) Nat. Biotechnol. 23: 1126-1136.
«Fab» состоит из областей VH и CH1 тяжелой цепи и областей VL и CL легкой цепи, которые обычно соединены между собой дисульфидными связями и имеют один антигенсвязывающий сайт. Области VH, CH1, VL и CL в Fab могут находится в различных комбинациях для придания антигенсвязывающей способности в соответствии с настоящим изобретением. Например, области VH и CH1 могут быть на одном полипептиде, а области VL и CL могут быть на отдельном полипептиде. Альтернативно, области VH, CH1, VL и CL могут быть расположены на одном и том же полипептиде, необязательно расположенные в разном порядке.
Настоящее изобретение также включает фрагменты анти-PD-1 scFv и способы их применения. Термин «одноцепочечное Fv» или «scFv» антитело относится к фрагментам антитела, содержащим домены VH и VL антитела, причем эти домены присутствуют в одной полипептидной цепи. Обычно полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, который позволяет scFv образовывать желаемую структуру для связывания антигена. Для обзора scFv см. Pluckthun (1994) The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds. Springer-Verlag, New York, pp. 269-315. См. также публикацию международной патентной заявки WO 88/01649 и патенты США №№ 4946778 и 5260203. В одном варианте осуществления scFv содержит от N до C-конца VH -область, пептидный линкер и VL -область. В другом варианте осуществления scFv содержит от N до C-конца VL -область, пептидный линкер и VH -область.
Настоящее изобретение включает анти-PD-1 диатела и способы их применения. Используемый в настоящем документе термин «диатела» относится к небольшим фрагментам антител с двумя антигенсвязывающими сайтами, которые содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в той же полипептидной цепи (VH - VL или VL - VH). При использовании линкера, который является слишком коротким, чтобы разрешить соединение между двумя доменами в той же самой цепи, домены вынуждены спариваться с комплементарными доменами другой цепи и создавать два антигенсвязывающих сайта. Диатела более полно описаны, например, в ЕР 404097; WO 93/11161; и Holliger et al. (1993) Proc. Natl. Acad. Sci. USA 90: 6444-6448. Для обзора вариантов сконструированных антител в общем случае см. Holliger and Hudson (2005) Nat. Biotechnol. 23: 1126-1136.
«Биспецифическое антитело» по изобретению включает антигенсвязывающее плечо анти-PD-1, содержащее вариабельные области тяжелой и легкой цепи любого из заявленных анти-PD-1-антител или их антигенсвязывающих фрагментов, и другое антигенсвязывающее плечо, распознающее другой антиген. В предпочтительном варианте осуществления биспецифическое антитело представляет собой гетеродимер с антиген-связывающим плечом анти-PD-1, содержащим тяжелую и легкую цепь, и другим антигенсвязывающим плечом, связывающимся с другим антигеном, и содержащим тяжелую и легкую цепь. Два антигенсвязывающих плеча соединяются, образуя гетеродимер с помощью двух константных областей тяжелой цепи, имеющих мутации в области СН3 (см., например, Фигуру 6). «Мультиспецифическое антитело» включает биспецифическое анти-PD-1 антитело и дополнительно содержит дополнительные антигенсвязывающие плечи, содержащие вариабельные области тяжелой и легкой цепи, нацеленные, по меньшей мере, на другой антиген.
Настоящее изобретение также включает антигенсвязывающие анти-PD-1 фрагменты и способы их применения. Используемый в настоящем документе термин, если не определен иначе, «фрагмент антитела» или «антигенсвязывающий фрагмент» относится к антигенсвязывающим фрагментам антител или биспецифических антител, то есть к фрагментам антител, сохраняющим способность специфически связываться с антигеном, связываемым полноразмерным антителом, например к фрагментам, которые сохраняют одну или несколько областей CDR. Примеры антигенсвязывающих фрагментов включают, не ограничиваясь таковыми, фрагменты Fab, Fab', F(ab')2 и Fv; димеры; линейные антитела; молекулы одноцепочечных антител, например sc-Fv; половину биспецифичной молекулы, включающую тяжелую и легкую цепь одного антигенсвязывающего плеча.
Как правило, антитело, биспецифическое антитело или антигенсвязывающий фрагмент по изобретению, каким-либо образом модифицированные, сохраняют по меньшей мере 10% своей связывающей активности (по сравнению с родительским антителом), когда эта активность определяется в молярном отношении. Предпочтительно, антитело или биспецифическое антитело или антигенсвязывающий фрагмент по изобретению сохраняют по меньшей мере 20%, 50%, 70%, 80%, 90%, 95% или 100% или более аффинности связывания PD-1 по сравнению с родительским антителом. Предполагается также, что антитело, биспецифическое антитело или антигенсвязывающий фрагмент по изобретению могут включать консервативные или неконсервативные аминокислотные замены (называемые «консервативными вариантами» или «функционально-консервативными вариантами» антитела), которые по существу не изменяют его биологическую активность.
Настоящее изобретение включает выделенные анти-PD-1-антитела, антигенсвязывающие фрагменты таковых и способы их применения. «Выделенные» антитела, или биспецифичные антитела, или антигенсвязывающие фрагменты таковых, по меньшей мере, частично свободны от других биологических молекул, клеток, или клеточных культур, в которых они продуцируются. Такие биологические молекулы включают нуклеиновые кислоты, белки, липиды, углеводы или другие материалы, такие как продукты распада клеток и среды культивирования. Выделенное антитело или антигенсвязывающий фрагмент может, кроме того, по меньшей мере, быть частично свободным от компонентов системы экспрессии, таких как биологических молекул, происходящих из клетки-хозяина или ее культуральной среды. Как правило, не предполагается, что термин «изолированный» обозначает полное отсутствие таких биологических молекул или отсутствие воды, буферов или солей или компонентов фармацевтической композиции, включающей антитела или фрагменты.
«Изолированная молекула нуклеиновой кислоты» или «выделенный полинуклеотид» означает ДНК или РНК геномного или синтетического происхождения, мРНК, кДНК или некоторую их комбинацию, не связанную с частью полинуклеотида или со всем нуклеотидом целиком, с которым выделенный полинуклеотид связан в природе, или с которым он не связан в природе. Для целей данного раскрытия следует понимать, что «молекула нуклеиновой кислоты, содержащая» конкретную нуклеотидную последовательность, не включает интактные хромосомы. Выделенные молекулы нуклеиновой кислоты, «содержащие» указанные последовательности нуклеиновой кислоты, могут включать, в дополнение к указанным последовательностям, последовательности, кодирующие до десяти или даже до двадцати или более других белков или их частей или фрагментов или могут включать функционально связанные регуляторные последовательности, контролирующие экспрессию кодирующей области перечисленных последовательностей нуклеиновых кислот, и/или могут включать векторные последовательности.
Фраза «контрольные последовательности» относится к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в конкретном организме-хозяине. Контрольные последовательности, подходящие для прокариот, например, включают промотор, необязательно последовательность оператора и сайт связывания рибосомы. Общеизвестно, что эукариотические клетки используют промотеры, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота или полинуклеотид «функционально связаны», когда они находятся в функциональном отношении с другой последовательностью нуклеиновой кислоты. Например, ДНК предшествующей последовательности или секреторного лидера функционально связана с ДНК полипептида, если она экспрессируется в виде белка-предшественника, который участвует в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если таковой влияет на транскрипцию последовательности; или сайт связывания рибосомы функционально связан с кодирующей последовательностью, если он расположен таким образом, чтобы облегчить трансляцию. Как правило, но не всегда, «функционально связанный» означает, что последовательности ДНК, которые связаны, являются смежными а, в случае секреторного лидера, смежными и в одной рамке считывания. Однако энхансеры не должны быть смежными. Привязка таковых осуществляется путем лигирования по удобным сайтам рестрикции. Если таких сайтов не существует, синтетические олигонуклеотидные адаптеры или линкеры используются в соответствии с общепринятой практикой.
Используемые в настоящем документе выражения «клетка», «клеточная линия» и «клеточная культура» используются взаимозаменяемо, и все такие обозначения включают потомство таковых. Таким образом, слова «трансформанты» и «трансформированные клетки» включают первичную клетку-индивид и полученные из нее культуры без учета количества пересевов. Также понятно, что не все потомство целиком будет иметь идентичное содержание ДНК из-за преднамеренных или случайных мутаций. Мутантное потомство, имеющее ту же функцию или биологическую активность, на которую изначально скринировались первоначально трансформированные клетки, также охватывается данным термином. Из контекста будет понятно, если подразумеваются разные обозначения.
Используемый в настоящем документе термин «последовательность зародышевой линии» относится к последовательности неупорядоченных последовательностей ДНК иммуноглобулина. Может быть использован любой подходящий источник неупорядоченных последовательностей иммуноглобулина. Последовательности зародышевой линии человека можно получить, например, из баз данных зародышевой линии JOINSOLVER на веб-сайте Национального института артрита и костно-мышечных и кожных заболеваний Национального института здравоохранения США (National Institute of Arthritis and Musculoskeletal and Skin Diseases of the United States National Institutes of Health). Последовательности зародышевой линии мыши могут быть получены, например, как описано в Giudicelli et al. (2005) Nucleic Acids Res. 33: D256-D261.
Анти-PD-1 антитела и антигенсвязывающие фрагменты
Изобретение относится к антителу или его антигенсвязывающему фрагменту, связывающихся с PD-1 человека, включающему:
а. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8,
b. CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:91,
c. CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10,
d. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
е. CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:11, и
f. CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:12.
В другом аспекте антитело или его антигенсвязывающий фрагмент содержит:
а. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8,
b. CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:91,
с. CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10,
d. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
е. CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:15, 18, 21, 25, 29, 32 или 35 и
f. CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:5, 22 или 26.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент содержит:
CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8,
CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:9,
CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10,
CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:15, и
CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:5.
В другом варианте осуществления антитело или его антигенсвязывающий фрагмент содержит:
CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8,
CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:9,
CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10,
CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:18, и
CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:5.
В еще одном варианте осуществления антитело или его антигенсвязывающий фрагмент содержит:
CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8,
CDR2 вариабельной области тяжелой цепи содержащий аминокислотную последовательность SEQ ID NO:9,
CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10,
CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:21, и
CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:22.
В еще одном варианте осуществления антитело или его антигенсвязывающий фрагмент содержит:
CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8,
CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:9,
CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10,
CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:25, и
CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:26.
В дополнительном варианте осуществления антитело или его антигенсвязывающий фрагмент содержит:
CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8,
CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:9,
CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10,
CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:29, и
CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:5.
В еще одном следующем воплощении антитело или его антигенсвязывающий фрагмент содержит:
CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8,
CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:9,
CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10,
CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:32, и
CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:5.
В еще одном дальнейшем варианте осуществления антитело или его антигенсвязывающий фрагмент содержит:
CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8,
CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:9,
CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10,
CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:35, и
CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:5.
В другом аспекте антитело или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую:
CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8, CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:9, 79 или 86, CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10; и
вариабельную область легкой цепи, содержащую CDR легкой цепи, выбранные из группы, состоящей из:
а. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:4, 15, 18, 29, 32 или 35 и CDR3 вариабельной легкую цепь области, содержащий аминокислотную последовательность SEQ ID NO:5;
b. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:21, и CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:22; и
с. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:25, и CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:26.
В одном варианте осуществления антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую:
CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8, CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:9, CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10; и
вариабельную область легкой цепи, содержащую:
CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:4, и CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:5.
В дополнительном аспекте антитело или его антигенсвязывающий фрагмент содержит:
вариабельную область тяжелой цепи, содержащую:
CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность e SEQ ID NO:8, CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:91, CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10; и
вариабельную область легкой цепи, содержащую:
CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:21, и CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:22.
В еще одном дополнительном аспекте антитело или его антигенсвязывающий фрагмент содержит:
вариабельную область тяжелой цепи, содержащую:
CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8, CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:86, CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10; и
вариабельную область легкой цепи, содержащую:
CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:21, и CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:22.
В другом аспекте изобретение относится к антителу или его антигенсвязывающему фрагменту, связывающихся с PD-1 человека, где антитело или его антигенсвязывающий фрагмент содержит:
вариабельную область тяжелой цепи, содержащую:
CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8, CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:86, CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10; и
вариабельную область легкой цепи, содержащую:
CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность, имеющую по меньшей мере, примерно 57%, 71% или 85% идентичность последовательности с SEQ ID NO:21, и CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность, имеющую, по меньшей мере, примерно 67%, 78% или 89% идентичности последовательности с SEQ ID NO:22.
В одном варианте осуществления антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:7 или 88, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:14, 17, 20, 24, 28, 31, 34 или 76. В одном варианте осуществления антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:7, и легкую цепь вариабельную область, содержащую аминокислотную последовательность SEQ ID NO:14, 17, 20, 24, 28, 31, 34. В одном варианте осуществления антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность изложенные в SEQ ID NO:88, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:76.
В другом варианте осуществления антитело или его антигенсвязывающий фрагмент представляет собой Fab, включающий тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:6, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:13, 16., 19, 23, 27, 30 или 33. В дополнительном варианте осуществления антитело или антигенсвязывающий фрагмент содержит: вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:92, и вариабельную область легкой цепи содержащий аминокислотную последовательность SEQ ID NO:20.
В еще одном дополнительном варианте осуществления изобретение относится к антителу или его антигенсвязывающему фрагменту, который связывается с PD-1 человека, где антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO 85 и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:20. В одном варианте осуществления антитело или антигенсвязывающий фрагмент представляет собой Fab, включающий тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:84 или 90 и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:19.
В другом аспекте изобретение относится к антителу или его антигенсвязывающему фрагменту, который связывается с человеческим PD-1, где антитело или антигенсвязывающий фрагмент содержит:
a. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8,
b. CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:9, 79, 86 или 91,
с. CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:41 или 10,
d. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
е. CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:4, и
f. CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:5.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент содержит:
a. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8,
b. CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:86,
с. CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:41,
d. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
е. CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:4, и
f. CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:5.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент содержит:
а. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8,
b. CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:79,
с. CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10,
d. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
е. CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:4, и
f. CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:5.
В другом варианте осуществления антитело или его антигенсвязывающий фрагмент содержит:
а. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8,
b. CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:79,
с. CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:41,
d. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
е. CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:4, и
f. CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:5.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент содержит:
а. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8,
b. CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:9,
с. CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:41,
d. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
е. CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:4, и
f. CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:5.
В другом варианте осуществления антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:75, 78, 81 или 88, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:76. В другом варианте осуществления антитело или антигенсвязывающий фрагмент представляет собой антитело, содержащее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:74, 77, 80, 82, 89 или 94, и легкую цепь, содержащая аминокислотную последовательность SEQ ID NO:2. В дополнительном варианте осуществления антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:95, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:76. В еще одном варианте осуществления антитело или антигенсвязывающий фрагмент представляет собой антитело, содержащее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:83, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:2. В еще одном варианте осуществления антитело или антигенсвязывающий фрагмент представляет собой антитело, содержащее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:89, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:2. В еще одном варианте осуществления антитело или антигенсвязывающий фрагмент представляет собой антитело, содержащее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:90, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:19.
В дополнительном аспекте изобретение относится к антителу или его антигенсвязывающему фрагменту, связывающихся с PD-1 человека, где антитело или антигенсвязывающий фрагмент содержит:
а. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:61,
b. CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:62,
c. CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:41,
d. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
е. CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:63, и
f. CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:64.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент содержит:
а. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:40 или 53,
b.. CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:9 или 54,
с. CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:41,
d. CDR1 вариабельной области легкой цепи содержащий аминокислотную последовательность SEQ ID NO:3,
е. CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:4, 42, 47 или 60, и
f. CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:5, 48 или 55.
В другом варианте осуществления антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, где CDR вариабельной области тяжелой и легкой цепи выбраны из группы, состоящей из:
a. CDR1 вариабельной области тяжелой цепи, содержащего аминокислотную последовательность SEQ ID NO:40, CDR2 вариабельной области тяжелой цепи, содержащего аминокислотную последовательность SEQ ID NO:9, CDR3 вариабельной области тяжелой цепи, содержащего аминокислотную последовательность SEQ ID NO:41; и CDR1 вариабельной области легкой цепи, содержащего аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащего аминокислотную последовательность SEQ ID NO:42, и CDR3 вариабельной области легкой цепи, содержащего аминокислотную последовательность SEQ ID NO: 5;
b. CDR1 вариабельной области тяжелой цепи, содержащего аминокислотную последовательность SEQ ID NO:40, CDR2 вариабельной области тяжелой цепи, содержащего аминокислотную последовательность SEQ ID NO:9, CDR3 вариабельной области тяжелой цепи, содержащего аминокислотную последовательность SEQ ID NO:41; и CDR1 вариабельной области легкой цепи, содержащего аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащего аминокислотную последовательность SEQ ID NO:47, и CDR3 вариабельной области легкой цепи, содержащего аминокислотную последовательность SEQ ID NO: 48;
с. CDR1 вариабельной области тяжелой цепи, содержащего аминокислотную последовательность SEQ ID NO:53, CDR2 вариабельной области тяжелой цепи, содержащего аминокислотную последовательность SEQ ID NO:54, CDR3 вариабельной области тяжелой цепи, содержащего аминокислотную последовательность SEQ ID NO:41; и CDR1 вариабельной области легкой цепи, содержащего аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащего аминокислотную последовательность SEQ ID NO:4, и CDR3 вариабельной области легкой цепи, содержащего аминокислотную последовательность SEQ ID NO: 55; и
d. CDR1 вариабельной области тяжелой цепи, содержащего аминокислотную последовательность SEQ ID NO:40, CDR2 вариабельной области тяжелой цепи, содержащего аминокислотную последовательность SEQ ID NO:9, CDR3 вариабельной области тяжелой цепи, содержащего аминокислотную последовательность SEQ ID NO:41; и CDR1 вариабельной области легкой цепи, содержащего аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащего аминокислотную последовательность SEQ ID NO:60, и CDR3 вариабельной области легкой цепи, содержащего аминокислотную последовательность SEQ ID NO:5.
В дополнительном аспекте изобретение относится к антителу или его антигенсвязывающему фрагменту, связывающихся с PD-1 человека, где антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи и легкой цепи, содержащую: CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность, которая имеет, по меньшей мере, примерно 80% идентичности последовательности с SEQ ID NO:40, CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность, которая имеет, по меньшей мере, примерно 70%, 76%, 82%, 88% или 94% идентичности последовательности с SEQ ID NO:9, CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:41; и CDR1 вариабельной области легкой цепи, содержащей аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность, которая имеет по меньшей мере приблизительно 57%, 71% или 85% идентичность последовательности с SEQ ID NO 60 и CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность, которая по меньшей мере примерно на 67, 78 или 89% идентична последовательности с SEQ ID NO:5.
В другом варианте осуществления антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, выбранную из группы, состоящей из:
а. вариабельной области тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO:37 или 119, и вариабельной области легкой цепи, содержащей аминокислотную последовательность SEQ ID NO:39;
b. вариабельной области тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO:44 или 121, и вариабельной области легкой цепи, содержащей аминокислотную последовательность SEQ ID NO:46;
с. вариабельной области тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO:50, и вариабельной области легкой цепи, содержащей аминокислотную последовательность SEQ ID NO:52; и
d. вариабельной области тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO:57 или 123, и вариабельной области легкой цепи, содержащей аминокислотную последовательность SEQ ID NO:59.
В одном аспекте вышеупомянутых вариантов осуществления антитело или его фрагмент связывается с PD-1 человека с KD менее 50 пМ в анализе BIACORE. В другом аспекте вышеуказанных вариантов осуществления антитело или его антигенсвязывающий фрагмент представляет собой антитело, содержащее две тяжелые цепи и две легкие цепи. В другом варианте осуществления антитело содержит область тяжелой цепи подтипа IgG1. В другом варианте осуществления константная область тяжелой цепи IgG1 дополнительно содержит один или несколько из L234A или L234D; L235A или L235D; D265S или D265A; мутации G237A в области CH2 (нумерация в ЕС). В другом варианте осуществления константная область тяжелой цепи IgG1 дополнительно содержит мутации L234A, L235A и D265S в области CH2 (нумерация в ЕС). В дополнительном варианте осуществления константная область тяжелой цепи IgG1 дополнительно содержит мутации L234A, L235A и D265A в области CH2 (нумерация в ЕС). В еще одном следующем воплощении константная область тяжелой цепи IgG1 дополнительно содержит мутации L234A, L235A и G237A в области CH2 (нумерация в ЕС). В другом варианте осуществления константная область тяжелой цепи IgG1 дополнительно содержит мутации N297A, N297Q или N297D (нумерация по ЕС). В дополнительном варианте осуществления анти-PD-1 антитело или его антигенсвязывающий фрагмент содержит константную область тяжелой цепи подтипа IgG4, необязательно с мутацией S228P (нумерация ЕС). В одном варианте осуществления константный домен IgG4 дополнительно содержит одну или несколько мутаций F234A; L235A; D265S или D265A. В одном варианте осуществления константный домен IgG4 дополнительно содержит мутации F234A, L235A и D265S. В одном варианте осуществления антитело или его антигенсвязывающий фрагмент обнаруживает паттерн гликозилирования, характерный для экспрессии в клетках млекопитающего.
В еще одном дополнительном аспекте изобретение относится к композиции, содержащей вышеуказанное антитело или антигенсвязывающий фрагмент и фармацевтически приемлемый носитель или разбавитель. В одном варианте осуществления композиция дополнительно содержит агент, выбранный из группы, содержащей:
а . анти-LAG3 антитело или его антигенсвязывающий фрагмент;
b . анти-TIGIT антитело или его антигенсвязывающий фрагмент;
с. анти-VISTA антитело или его антигенсвязывающий фрагмент;
d. анти-BTLA антитело или его антигенсвязывающий фрагмент;
е. анти-TIM3 антитело или его антигенсвязывающий фрагмент;
f. анти-CTLA4 антитело или его антигенсвязывающий фрагмент;
g. анти-HVEM антитело или его антигенсвязывающий фрагмент;
h. анти-CD70 антитело или его антигенсвязывающий фрагмент;
i . анти-ОХ40 антитело или его антигенсвязывающий фрагмент;
j . анти-CD28 антитело или его антигенсвязывающий фрагмент;
k . анти-PDL1 антитело или его антигенсвязывающий фрагмент;
l . анти-PDL2 антитело или его антигенсвязывающий фрагмент;
m . анти-GITR антитело или его антигенсвязывающий фрагмент;
n. анти-ICOS антитело или его антигенсвязывающий фрагмент;
о . анти-SIRPα антитело или его антигенсвязывающий фрагмент;
p . анти-ILT2 антитело или его антигенсвязывающий фрагмент;
q . анти-ILT3 антитело или его антигенсвязывающий фрагмент;
r . анти-ILT4 антитело или его антигенсвязывающий фрагмент;
s . анти-ILT5 антитело или его антигенсвязывающий фрагмент;
t . анти-4-1BB антитело или его антигенсвязывающий фрагмент;
u . анти-NK2GA антитело или его антигенсвязывающий фрагмент;
v . анти-NK2GC антитело или его антигенсвязывающий фрагмент;
w . анти-NK2GE антитело или его антигенсвязывающий фрагмент;
x . анти-TSLP антитело или его антигенсвязывающий фрагмент;
у . анти-IL10 антитело или его антигенсвязывающий фрагмент;
aa . STING-агонист;
bb . антагонист CXCR2; и
cc . ингибитор PARP.
В одном варианте осуществления агент представляет собой анти-LAG3 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-TIGIT антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-VISTA антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-BTLA антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-TIM3 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-CTLA4 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-HVEM антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-CD70 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-OX40 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-CD28 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-PDL1 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-PDL2 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-GITR антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-ICOS антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-SIRPα антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-ILT2 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-ILT3 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-ILT4 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-ILT5 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-4-1BB антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-NK2GA антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-NK2GE антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-IL10 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-TSLP антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент является STING-агонистом. В одном варианте осуществления агент представляет собой антагонист CXCR2. В одном варианте осуществления агент представляет собой ингибитор PARP.
Настоящее раскрытие включает любое антитело или антигенсвязывающий фрагмент, описанные в Таблице 8 ниже. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, представленный в настоящем документе, содержит последовательность CDR, приведенную в Таблице 8. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, представленный в настоящем документе, содержит выборку CDR, указанных в последовательности VH, приведенной в Таблице 8, и выборку CDR в последовательности VL, приведенной в Таблице 8. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, представленный в настоящем документе, содержит последовательность VH, указанную в Таблице 8, и последовательность VL, указанную в Таблице 8. В некоторых вариантах осуществления антитело или антигенсвязывающее фрагмент, представленный в настоящем документе, содержит последовательность тяжелой цепи, указанную в Таблице 8, и последовательность легкой цепи, указанную в Таблице 8.
Физические и функциональные свойства типичных антител
«Консервативно модифицированные варианты» или «консервативная замена» относится к заменам аминокислот в белке другими аминокислотами, имеющими сходные характеристики (например, заряд, размер боковой цепи, гидрофобность/гидрофильность, конформация и жесткость основной цепи и т. д.), так, что эти замены часто могут быть сделаны без изменения биологической активности белка. Специалисты в данной области признают, что, как правило, единичные аминокислотные замены в несущественных областях полипептида существенно не изменяют биологическую активность (см., например, Watson et al. (1987) Molecular Biology of the Gene, The Benjamin/Cummings Pub. Co., p. 224 (4th Ed.)). Кроме того, замены структурно или функционально сходных аминокислот с меньшей вероятностью нарушают биологическую активность. Типичные консервативные замены приведены в Таблице 1.
ТАБЛИЦА 1. Типичные консервативные аминокислотные замены
Функционально-консервативные варианты антител по изобретению также предусмотрены настоящим изобретением. «Функционально-консервативные варианты» в контексте настоящего описания относятся к антителам или фрагментам, в которых один или несколько аминокислотных остатков изменены без изменения желаемого свойства, такого как аффинность и/или специфичность к антигену. Такие варианты включают, без ограничения таковыми, замену аминокислоты аминокислотой, имеющей сходные свойства, такие как консервативные аминокислотные замены, представленные в Таблице 1. Также предоставляются выделенные анти-PD-1 антитела или антигенсвязывающие фрагменты по изобретению, имеющие 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более аминокислотных замен, предпочтительно в каркасной области.
Полинуклеотиды и полипептиды
Настоящее изобретение также включает полинуклеотиды, кодирующие любые полипептиды или цепи иммуноглобулинов анти-PD-1 антител и антигенсвязывающие фрагменты таковых по изобретению. Например, настоящее изобретение включает полинуклеотиды, кодирующие аминокислоты, описанные в любой из SEQ ID NO:1-95 и 118-123. В дополнительном аспекте изобретение относится: к выделенной нуклеиновой кислоте, кодирующей любое из указанных выше антител или антигенсвязывающих фрагментов и векторы экспрессии, содержащие нуклеиновую кислоту; к клетке-хозяину, содержащей антитела или антигенсвязывающие фрагменты, и/или векторы экспрессии. Клетка-хозяин может быть бактериальной клеткой, клеткой человека, клеткой млекопитающего, клеткой Pichia, растительной клеткой, клеткой HEK293 или клеткой яичника китайского хомячка.
В одном варианте осуществления предлагается выделенный полинуклеотид, например ДНК, кодирующий полипептидные цепи выделенных антител или антигенсвязывающих фрагментов, представленных в настоящем документе. В одном варианте осуществления выделенный полинуклеотид кодирует анти-PD-1 антигенсвязывающий фрагмент антитела, содержащий одну легкую цепь зрелого иммуноглобулина в соответствии с изобретением и одну тяжелую цепь зрелого иммуноглобулина в соответствии с изобретением. В некоторых вариантах осуществления изолированный полинуклеотид кодирует как легкую, так и тяжелую цепь в одной полинуклеотидной молекуле, а в других вариантах осуществления легкая и тяжелая цепи кодируются в отдельных полинуклеотидных молекулах. В другом воплощении полинуклеотид также кодирует сигнальную последовательность. В другом варианте осуществления выделенный полинуклеотид кодирует анти-PD-1 антигенсвязывающий фрагмент антитела, содержащий, по меньшей мере, один зрелый одноцепочечный Fv.
Настоящее изобретение также предоставляет векторы, например векторы экспрессии, такие как плазмиды, содержащие выделенные полинуклеотиды по изобретению, где полинуклеотид функционально связан с контрольными последовательностями, которые распознаются клеткой-хозяином, когда клетка-хозяин трансфицируется этим вектором. Также предоставлены клетки-хозяева, содержащие вектор по настоящему изобретению и способы получения антител, их антигенсвязывающих фрагментов или полипептидов, раскрытых в данном документе, включающие культивирование клетки-хозяина, несущей вектор экспрессии или нуклеиновой кислоты, кодирующей цепи иммуноглобулина антител или антигенсвязывающего фрагментов таковых, в культуральной среде и способы выделения антител или их антигенсвязывающих фрагментов из клетки-хозяина или культуральной среды.
В другом варианте осуществления изобретение относится к способу получения антитела или антигенсвязывающего фрагмента, включающему:
а. культивирование клетки-хозяина, содержащей полинуклеотид, кодирующий тяжелую цепь и/или легкую цепь любого из вышеуказанных антител или антигенсвязывающих фрагментов в условиях, благоприятных для экспрессии полинуклеотида; и
б. необязательно, выделение антитела или антигенсвязывающего фрагмента из клетки-хозяина и/или культуральной среды.
Способы получения антител и их антигенсвязывающих фрагментов.
Описанные в настоящем документе антитела также могут быть получены рекомбинантно (например, в системе экспрессии E.coli/T7, системе экспрессии клеток млекопитающих или системе экспрессии низших эукариот). В одном варианте осуществления нуклеиновые кислоты, кодирующие молекулы антител по изобретению (например, scFv, VH или VL), могут быть встроены в плазмиду на основе pET и экспрессированы в системе E.coli/T7. Например, настоящее изобретение включает способы экспрессии антител, или их антигенсвязывающих фрагментов, или цепей иммуноглобулина таковых в клетке-хозяине (например, бактериальной клетке-хозяине, такой как E.coli, такой как BL21 или BL21DE3), включающие экспрессию РНК-полимеразы T7 в клетке, которая также содержит полинуклеотид, кодирующий цепь иммуноглобулина, функционально связанную с промотором Т7. Например, в варианте осуществления изобретения бактериальная клетка-хозяин, такая как Е.coli, включает полинуклеотид, кодирующий ген РНК-полимеразы Т7, функционально связанный с lac-промотором, и экспрессия полимеразы и цепи индуцируется инкубацией клетки-хозяина с IPTG (изопропил-бета-D-тиогалактопиранозидом).
Существует несколько способов получения рекомбинантных антител, известных в данной области техники. Один пример способа рекомбинантной продукции антител раскрыт в патенте США № 4816567.
Трансформация может осуществляться любым известным способом введения полинуклеотидов в клетку-хозяина. Способы введения гетерологичных полинуклеотидов в клетки млекопитающих хорошо известны в данной области техники и включают декстран-опосредованную трансфекцию, осаждение фосфатом кальция, полибрен-опосредованную трансфекцию, слияние протопластов, электропорацию, липосомную инкапсуляцию полинуклеотида(ов), биолистическую инъекцию и прямую микроинъекцию ДНК в ядра. Кроме того, молекулы нуклеиновой кислоты могут быть введены в клетки млекопитающих вирусными векторами. Способы трансформации клеток хорошо известны в данной области. См., например, патенты США № 4399216; 4912040; 4740461 и 4959455.
Таким образом, настоящее изобретение включает рекомбинантные способы получения антител, или их антигенсвязывающих фрагментов по настоящему изобретению, или иммуноглобулиновых цепей таковых, включающие введение полинуклеотида, кодирующего одну или несколько иммуноглобулиновых цепей (например, тяжелых и/или легких цепей иммуноглобулина, scFv) антител или фрагментов таковых, в клетку; культивирование клетки-хозяина (например, CHO или Pichia или Pichia pastoris) в условиях, благоприятных для экспрессии таковых, и, необязательно, выделение антител, или фрагментов, или цепей иммуноглобулина из клетки-хозяина и/или среды, в которой кольтивируется клетка-хозяин.
Эукариотические и прокариотические клетки-хозяева, включая клетки млекопитающих в качестве хозяев для экспрессии антител, фрагментов или цепей иммуноглобулинов, описанных в настоящем документе, хорошо известны в данной области и включают множество иммортализованных клеточных линий, доступных из Американской коллекции типовых культур (American Type Culture Collection, АТСС). К ним относятся, в частности, клетки яичника китайского хомячка (CHO), клетки NSO, SP2, клетки HeLa, клетки почки хомячка (BHK), клетки почки обезьяны (COS), клетки гепатоцеллюлярной карциномы человека (например, HepG2), клетки A549, клетки 3T3, клетки HEK-293 и ряд других клеточных линий. Клетки-хозяева млекопитающих включают клетки человека, мыши, крысы, собаки, обезьяны, свиньи, козы, крупного рогатого скота, лошади и хомячка. Предпочтительные клеточные линии выбираются на основании того, какие клеточные линии показывают высокие уровни экспрессии. Другими линиями клеток, пригодных для использования, являются линии клеток насекомых, такие как клетки Sf9, клетки амфибий, бактериальные клетки, клетки растений и клетки грибов. Клетки грибов включают клетки дрожжей и нитчатых грибов, в том числе, например, Pichia pastoris, Pichia finlandica, Pichia trehalophila, Pichia koclamae, Pichia membranaefaciens, Pichia minuta (Ogataea minuta, Pichia lindneri), Pichia opuntiae, Pichia thermotolerans, Pichia salictaria, Pichia guercuum, Pichia pijperi, Pichia stiptis, Pichia methanolica, Pichia sp., Saccharomyces cerevisiae, Saccharomyces sp., Hansenula polymorpha, Kluyveromyces sp., Kluyveromyces lactis, Candida albicans, Aspergillus nidulans, Aspergillus niger, Aspergillus oryzae, Trichoderma reesei, Chrysosporium lucknowense, Fusarium sp., Fusarium gramineum, Fusarium venenatum, Physcomitrella patens and Neurospora crassa. Pichia sp., любые Saccharomyces sp., Hansenula polymorpha, любые Kluyveromyces sp., Candida albicans, any Aspergillus sp., Trichoderma reesei, Chrysosporium lucknowense, любые Fusarium sp., Yarrowia lipolytica, и Neurospora crassa. Когда рекомбинантные векторы экспрессии, кодирующие тяжелую цепь, антигенсвязывающую часть или фрагмент таковой, легкую цепь и/или антигенсвязывающий фрагмент таковой или scFv, вводятся в клетки-хозяева млекопитающих, антитела продуцируются путем культивирования клеток-хозяев в течение периода времени, достаточного для обеспечения экспрессии антител, фрагментов или цепей таковых в клетках-хозяевах или секреции таковых в культуральную среду, в которой выращиваются клетки-хозяева.
Антитела, антигенсвязывающие фрагменты таковых и цепи иммуноглобулинов могут быть выделены из культуральной среды с использованием стандартных методов очистки белка. Кроме того, экспрессия антител, их антигенсвязывающих фрагментов и цепей иммуноглобулинов (или других частей таковых) по изобретению из продуцирующих клеточных линий может быть усилена при использовании ряда известных методик. Например, система экспрессии гена глютаминсинтетазы (система GS) служит общим подходом для усиления экспрессии в определенных условиях. Система GS обсуждается полностью или частично в связи с европейскими патентами №№ 0216846, 0256055 и 0323997 и европейской заявкой на патент № 89303964.4. Исходя из этого, в варианте осуществления изобретения клетки-хозяева млекопитающих (например, СНО) лишены гена глютаминсинтетазы и выращиваются в отсутствие глютамина в среде, при этом полинуклеотид, кодирующий цепь иммуноглобулина, содержит ген глютаминсинтетазы, восполняющий отсутствие гена в клетке-хозяине.
В общем случае, гликопротеины, продуцируемые в конкретной клеточной линии или трансгенном животном, будут иметь набор паттернов гликозилирования, характерных для гликопротеинов, продуцируемых в данной клеточной линии или трансгенном животном. Следовательно, конкретная картина гликозилирования антитела будет зависеть от конкретной клеточной линии или трансгенного животного, используемого для получения антитела. Однако все антитела, содержащие аминокислотные последовательности, представленные в настоящем документе, представляют собой настоящее изобретение, независимо от паттерна гликозилирования, которым могут обладать антитела. Аналогично, в конкретных вариантах осуществления антитела с паттерном гликозилирования, включающим только нефукозилированные N-гликаны, могут оказаться преимущественными, поскольку было показано, что именно эти антитела обычно проявляют более высокую эффективность, чем их фукозилированные аналоги как in vitro, так и in vivo (см., например, Shinkawa et al., J. Biol. Chem. 278: 3466-3473 (2003); патенты США №№ 6,946,292 и 7,214,775). Эти антитела с нефукозилированными N-гликанами вряд ли будут иммуногенными, поскольку их углеводные структуры являются обычным компонентом популяции, существующей в человеческом сывороточном IgG.
Иммуноглобулины могут быть отнесены к разным классам в зависимости от аминокислотных последовательностей константного домена их тяжелых цепей. В некоторых вариантах осуществления разные константные домены могут быть присоединены к областям VL, VH или VH - VL. Существует по меньшей мере пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть далее разделены на подклассы (подтипы), например. IgG1, IgG2, IgG3 и IgG4; IgA1 и IgA2.
В одном варианте осуществления антитела или антигенсвязывающие фрагменты содержат константную область тяжелой цепи, например константную область человека, такую как константная область тяжелой цепи человека γ1, γ2, γ3, или γ4, или варианты таковых. В другом варианте осуществления антитело или антигенсвязывающий фрагмент содержит константную область легкой цепи, например константную область легкой цепи человека, такую как область легкой цепи человека лямбда или каппа или варианты таковых.
В одном варианте осуществления анти-PD-1 антитело или его антигенсвязывающий фрагмент содержит константную область тяжелой цепи подтипа IgG1. В другом варианте осуществления константная область тяжелой цепи IgG1 дополнительно содержит один или несколько из L234A или L234D; L235A или L235D; D265S или D265A; мутации G237A в области CH2 (нумерация в ЕС). В другом варианте осуществления константная область тяжелой цепи IgG1 дополнительно содержит мутации L234A, L235A и D265S в области CH2 (нумерация в ЕС). В другом варианте осуществления, константная область тяжелой цепи IgG1 дополнительно содержит мутации L234A, L235A и D265A в области CH2 (нумерация в ЕС). В еще одном варианте осуществления константная область тяжелой цепи IgG1 дополнительно содержит мутации L234A, L235A и G237A в области CH2 (нумерация в ЕС). В другом варианте осуществления константная область тяжелой цепи IgG1 дополнительно содержит мутацию N297A, N297Q или N297D (нумерация по ЕС). В другом варианте осуществления анти-PD-1 антитело или его антигенсвязывающий фрагмент содержит константную область тяжелой цепи подтипа IgG4, необязательно с мутацией S228P (нумерация EU). В одном варианте осуществления константный домен IgG4 дополнительно содержит одну или несколько мутаций F234A; L235A; D265S или D265A. В одном варианте осуществления константный домен IgG4 дополнительно содержит мутации F234A, L235A и D265S. В другом аспекте вышеуказанных вариантов осуществления константный домен IgG1 или IgG4 дополнительно содержит мутации M252Y, S254T и T256E.
Конструирование Антител
Далее включены варианты осуществления, в которых антитела и антигенсвязывающие фрагменты таковых представляют собой сконструированные антитела с внесением модификаций в аминокислотные остатки каркаса в вариабельных доменах последовательностей, представленных в настоящем документе, например, для улучшения свойств антитела или фрагмента. Как правило, такие модификации каркаса производятся для снижения иммуногенности антитела или фрагмента. Обычно это достигается путем замены не-CDR остатков в вариабельных доменах (то есть в каркасных остатках) в родительском (например, принадлежащем грызуну) антителе или его фрагменте аналогичными остатками из иммунного репертуара видов, для применения в которых будет использоваться антитело, например, аминокислотными остатками человека в случае терапии человека. Такое антитело или фрагмент называют «гуманизированным» антителом или «гуманизированным» фрагментом. Один из подходов заключается в мутировании одного или нескольких каркасных остатков в соответствующую последовательность зародышевой линии. Более конкретно, антитело или фрагмент, подвергшийся соматической мутации, может содержать каркасные остатки, отличаюиеся от таковых в последовательности зародышевой линии, из которой получено антитело. Такие остатки могут быть идентифицированы путем сравнения каркасных последовательностей антитела или фрагмента с последовательностями зародышевой линии, из которой получено антитело или фрагмент. Другой подход состоит в том, чтобы вернуться к исходному родительскому (например, принадлежащему грызуну) остатку в одном или нескольких положениях сконструированного (например, гуманизированного) антитела, например, для восстановления афинности связывания, которая могла быть потеряна в процессе замены остатков каркаса. (См., например, патент США № 5593762, патент США № 5585089 и патент США № 5530101.)
В некоторых вариантах осуществления антитела и антигенсвязывающие фрагменты таковых сконструированы (например, гуманизированы) для включения модификаций в каркас и/или CDR с целью улучшения их свойств. Такие конструктивные изменения основаны на молекулярном моделировании. Молекулярная модель вариабельной области для последовательности родительского (не принадлежащего человеку) антитела может быть построена для понимания структурных особенностей антитела и использована для идентификации потенциальных областей антитела, способных взаимодействовать с антигеном. Типичные CDR определяются по результатам выравнивания последовательностей иммуноглобулина и идентификации вариабельных областей. Kabat et al., (1991) Sequences of Proteins of Immunological Interest, Kabat, et al.; National Institutes of Health, Bethesda, Md.; 5th ed.; NIH Publ. No. 91-3242; Kabat (1978) Adv. Prot. Chem. 32:1-75; Kabat, et al., (1977) J. Biol. Chem. 252:6609-6616. Chothia и его коллеги тщательно изучили конформации петель в кристаллических структурах антител и предложили гипервариабельные петли. Chothia, et al., (1987) J Mol. Biol. 196:901-917 или Chothia, et al., (1989) Nature 342:878-883. Существуют различия между областями, классифицированными как «CDR» и «гипервариабельные петли». В более поздних исследованиях (Raghunathan et al., (2012) J. Mol. Recog. 25, 3, 103-113) ученые проанализировали несколько кристаллических комплексов антитело-антиген и обнаружили, что антигенсвязывающие области в антителах не обязательно строго соответствуют аминокислотным остаткам «CDR» или «гипервариабельным» петлям. Молекулярная модель вариабельной области антитела, не принадлежащего человеку, может применяться для выбора областей, потенциально способных связываться с антигеном. На практике потенциальные антигенсвязывающие области, определенные с помощью модели, отличаются от обычных «CDR» или «гипервариабельных» петель. Коммерческое научное программное обеспечение, такое как MOE (Chemical Computing Group), может быть использовано для молекулярного моделирования. Каркасы антител человека могут быть выбраны на основе лучших совпадений с последовательностью, отличной от человеческой, как в каркасах, так и в CDR. Для FR4 (каркас 4) в VH, области VJ человеческих зародышевых линий сравниваются с соответствующей областью, принадлежащей субьекту, отличному от человека. В случае FR4 (каркас 4) в VL, J-каппа и J-лямбда-области последовательностей зародышевой линии человека сравнивают с соответствующей областью последовательности, отличной от человеческой. Как только подходящие «человеческие» структуры определены, CDR трансплантируются в выбранные «человеческие» структуры. В некоторых случаях, определенные остатки в интерфейсе VL - VH могут быть сохранены такими, как они представлены в «нечеловеческой» (родительской) последовательности. Молекулярные модели могут также быть использованы для идентификации аминокислотный остатков, способных потенциально изменять конформации CDR и, следовательно, связываться с антигеном. В некоторых случаях эти остатки сохраняются такими, как в последовательности, не принадлежащей человеку (родительской). Молекулярные модели также можно использовать для идентификации аминокислот, подверженных воздействию растворителя, наличие которых может приводить к нежелательным эффектам, таким как гликозилирование, дезамидирование и окисление. Фильтры для разработки антител могут быть введены на ранней стадии разработки для устранения/минимизации этих потенциальных проблем.
Другой тип модификации каркаса включает в себя мутацию одного или нескольких остатков внутри каркасной области или даже внутри одной или нескольких областей CDR для удаления Т-клеточных эпитопов, чтобы тем самым снизить потенциальную иммуногенность антитела. Этот подход также называют «деиммунизацией», он более подробно описан в патенте США № 7125689.
Для конкретных вариантах осуществления было желательно заменить некоторые аминокислоты, содержащие открытые боковые цепи, на другой аминокислотный остаток с целью обеспечения большей химической стабильности конечного антитела, предотващения деамидирования или изомеризации. Деамидирование и/или изомеризация аспарагина и глутамина могут происходить в последовательностях DG, NG, NS, NA, NT, QG или QS и приводить к образованию остатка изоаспарагиновой кислоты, который вводит излом в полипептидную цепь и снижает ее стабильность (эффект изоаспарагиновой кислоты). Изомеризация может происходить в последовательностях DG, DS, DA или DT. В определенных вариантах осуществления антитела по настоящему изобретению не содержат сайтов деамидирования или сайтов изомеризации аспарагина. В одном варианте осуществления CDRH2 тяжелой цепи анти-PD-1 содержит коррекцию G56A для удаления сайта дезамидирования.
Например, остаток аспарагина (Asn) может быть заменен на Gln или Ala с целью уменьшения возможности образования изоаспартата в любых последовательностях Asn-Gly, особенно в CDR. Аналогичная проблема может возникнуть в последовательности Asp-Gly. Reissner and Aswad (2003) Cell. Mol. Life Sci. 60: 1281. Образование изоаспартата может ослаблять или полностью устранять связывание антитела с его антигеном-мишенью. См. Presta (2005) J. Allergy Clin. Immunol. 116: 731, 734. В одном варианте осуществления аспарагин заменен на глютамин (Gln). Также желательно изменить аминокислоту рядом с остатком аспарагина (Asn) или глутамина (Gln) для уменьшения вероятности дезамидирования, которое происходит с большей скоростью, если небольшие аминокислоты расположены рядом с аспарагином или глутамином. См. Bischoff & Kolbe (1994) J. Chromatog. 662: 261. Кроме того, любые остатки метионина (обычно Met, доступные воздействию растворителя) в CDR могут быть заменены на Lys, Leu, Ala или Phe или другие аминокислоты для уменьшения вероятности окисления метиониновой серы, что также может приводить к уменьшению антигенсвязывающей аффинности и способствовать молекулярной гетерогенности в конечном препарате антитела. Id. Кроме того, для предотвращения или минимизации потенциальных разрыввов пептидных связей Asn-Pro ферментом, желательно изменить любые комбинации Asn-Pro, обнаруженные в CDR, на Gln-Pro, Ala-Pro или Asn-Ala. Антитела с такими заменами впоследствии подвергаются скринингу, чтобы убедиться, что эти замены не снижают аффинность или специфичность антитела к PD-1, а также любую другую желаемую биологическую активность до неприемлемых уровней.
ТАБЛИЦА 2. Типичные варианты стабилизации CDR
(N-G)
(Q-G), (A-G), or (N-A)
(D-G)
(E-G), (A-G), or (D-A)
(M)
(K), (L), (A), or (F)
(N)
(Q) or (A)
(N-P)
(Q-P), (A-P), or (N-A)
Конструирование Fc области антител
Антитела и антигенсвязывающие фрагменты таковых, описанные в настоящем документе, также могут быть сконструированы таким образом, чтобы включать модификации в области Fc, обычно используемые для изменения одного или нескольких свойств антитела, таких как период полужизни в сыворотке, фиксация комплемента, связывание с рецептором Fc и/или эффекторной функции (например, антиген-зависимой клеточной цитотоксичности). Кроме того, антитела и антигенсвязывающие фрагменты таковых, раскрытые в данном документе, могут быть химически модифицированы (например, одна или несколько химических групп могут быть присоединены к антителу) для изменения одного или нескольких свойств антитела или фрагмента, или могут быть модифицированы для изменения его гликозилирования. Каждый из этих вариантов осуществления описан более подробно ниже. Нумерация остатков в области Fc соответствует индексу ЕС по Кабату.
Антитела и антигенсвязывающие фрагменты таковых, раскрытые в данном документе, также включают антитела и фрагменты с модифицированными (или блокированными) участками Fc для обеспечения измененных эффекторных функций. См., например, патент США. № 5624821; WO2003/086310; WO2005/120571; WO2006/0057702. Такие модификации могут быть использованы для усиления или подавления различных реакций иммунной системы, обеспечивая тем самым возможные полезные эффекты в диагностике и терапии. Модификации Fc области включают аминокислотные замены (замены, делеции и инсерции), гликозилирование или дегликозилирование и добавление нескольких областей Fc. Изменения в Fc могут также изменять период полураспада антител в терапевтических антителах, делая возможным менее частое дозирование и, таким образом, повышая удобство применения и уменьшая использование материала. См. Presta (2005) J. Allergy Clin. Immunol. 116: 731, 734-35.
В одном варианте осуществления антитело или антигенсвязывающий фрагмент по изобретению является антителом или фрагментом изотипа IgG4, содержащим мутацию замены серина на пролин в положении, соответствующем позиции 228 (S228P; нумерация EU) в шарнирной области константной области тяжелой цепи. Сообщается, что эта мутация устраняет гетерогенность дисульфидных мостиков между тяжелыми цепями в шарнирной области (Angal et al. выше; позиция 241 дана по системе нумерации Кабата).
В одном варианте осуществления изобретения шарнирная область модифицирована таким образом, что количество остатков цистеина в шарнирной области увеличивается или уменьшается. Этот подход описан подробно в патенте США № 5677425. Количество остатков цистеина в шарнирной области СН1 может быть изменено, например, для облегчения сборки легкой и тяжелой цепей или для увеличения или уменьшения стабильности антитела.
В другом варианте осуществления шарнирную область Fc антитела или антигенсвязывающего фрагмента по изобретению мутируют для уменьшения биологического периода полураспада антитела или фрагмента. Более конкретно, одну или несколько аминокислотных мутаций вводят в область интерфейса домена CH2-CH3 фрагмента Fc-шарнирной области таким образом, что в результате у антитела или фрагмента нарушается связывание стафилококцильного белка A (SpA) по сравнению со связыванием SpA антителом с нативным Fc-шарнирным доменом. Этот подход более подробно описан в патенте США № 6165745.
В другом варианте осуществления антитело или антигенсвязывающий фрагмент по изобретению модифицируют для увеличения его биологического периода полураспада. Возможны разные подходы. Например, может быть введена одна или несколько из следующих мутаций: T252L, T254S, T256F, как описано в патенте США № 6277375. Альтернативно, для увеличения биологического периода полураспада, антитело может быть изменено в области CH1 или CL таким образом, чтобы оно содержало специфический эпитоп (такой как salvage receptor binding epitope), взятый из двух петель домена CH2 области Fc IgG, как описано в патентах США №№ 5869046 и 6121022.
В других вариантах осуществления область Fc изменяется путем замены по меньшей мере одного аминокислотного остатка другим аминокислотным остатком для изменения эффекторной функции (функций) антитела или антигенсвязывающего фрагмента. Например, одну или несколько аминокислот, выбранных из аминокислотных остатков в позициях 234, 235, 236, 237, 297, 318, 320 и 322, можно заменить другим аминокислотным остатком, таким образом, что антитело приобретает измененное сродство к эффекторному лиганду и сохраняет антигенсвязывающую способность родительского антитела. Эффекторный лиганд, к которому изменяется сродство, может представлять собой, например, рецептор Fc или компонент С1 комплемента. Этот подход более подробно описан в патентах США №№ 5624821 и 5648260.
В другом примере одну или несколько аминокислот, выбранных из аминокислотных остатков в позициях 329, 331 и 322, можно заменить другими аминокислотными остатками таким образом, чтобы у антитела изменялось связывание C1q и/или уменьшалась или устранялась комплемент-зависимая цитотоксичность (CDC). Этот подход более подробно описан в патенте США № 6194551.
В другом примере один или несколько аминокислотных остатков в аминокислотных позициях 231 и 239 изменены, чтобы тем самым изменить способность антитела фиксировать комплемент. Этот подход описан далее в публикации РСТ WO 94/29351.
В еще одном примере область Fc модифицирована для уменьшения способности антитела или антигенсвязывающего фрагмента по изобретению опосредовать антителозависимую клеточную цитотоксичность (ADCC) и/или для уменьшения аффинности антитела или фрагмента к рецептору Fcγ путем модификации одной или нескольких аминокислот в следующих позициях: 238, 239, 243, 248, 249, 252, 254, 255, 256, 258, 264, 265, 267, 268, 269, 270, 272, 276, 278, 280, 283, 285, 286, 289, 290, 292, 293, 294, 295, 296, 298, 301, 303, 305, 307, 309, 312, 315, 320, 322, 324, 326, 327, 329, 330, 331, 333, 334, 335, 337, 338, 340, 360, 373, 376, 378, 382, 388, 389, 398, 414, 416, 419, 430, 434, 435, 437, 438 или 439. Этот подход описан подробно в публикации РСТ WO 00/42072. Кроме того, сайты связывания человеческого IgG1 для FcγR1, FcγRII, FcγRIII и FcRn были картированы, и были описаны варианты с улучшенным связыванием (см. Shields et al. (2001) J. Biol. Chem. 276: 6591-6604).
В одном варианте осуществления изобретения область Fc модифицирована для уменьшения способности антитела по изобретению опосредовать эффекторную функцию и/или для усиления противовоспалительных свойств путем модификации остатков 243 и 264. В одном варианте осуществления область Fc антитела или фрагмента такового модифицирована путем замены остатков в позициях 243 и 264 на аланин. В одном варианте осуществления область Fc модифицирована для уменьшения способности антитела или фрагмента опосредовать эффекторную функцию и/или для усиления противовоспалительных свойств путем модификации остатков 243, 264, 267 и 328.
Регулирование эффекторной функции
Термин «эффекторная функция» в контексте настоящего описания относится к одному или нескольким типам активности: опосредованной антителами цитотоксической активности (ADCC), опосредованной комплемент-зависимой цитотоксической активности (CDC), Fc-опосредованного фагоцитоза или антителозависимого клеточного фагоцитоза (ADCP), и рециклирования антител с помощью рецептора FcRn.
Считается, что взаимодействие между константной областью антигенсвязывающего белка и различными Fc-рецепторами (FcR), включая FcgammaRI (CD64), FcgammaRII (CD32) и FcgammaRIII (CD16), опосредует эффекторные функции антигена, такие как ADCC и CDC. Рецептор Fc также важен для сшивки антител, что может быть значимым для противоопухолевого иммунитета.
Эффекторная функция может быть измерена несколькими способами, включая, например, путем измерения связывания FcgammaRIII с клетками-естественными убийцами (Natural Killer cells или NK-клетки) или связывания FcgammaRI с моноцитами/макрофагами для оценки эффекторной функции ADCC. Например, антигенсвязывающий белок по настоящему изобретению можно оценивать на эффекторную функцию ADCC при анализе NK-клеток. Примеры таких методик можно найти в Shields et al, 2001 J. Biol. Chem., Vol. 276, p 6591-6604; Chappel et al, 1993 J. Biol. Chem., Vol 268, p 25124-25131; Lazar et al, 2006 PNAS, 103; 4005-4010.
ADCC или CDC свойства антител по настоящему изобретению или свойства антител, определяющие связывание, могут быть понижены рядом способов. Было показано, что константные области человеческого IgG1, содержащие специфические мутации или с измененным гликозилированием остатка Asn297, снижают степень связывания с Fc-рецепторами. В других случаях было также показано, что эти мутации усиливают ADCC и CDC ((Lazar et al. PNAS 2006, 103; 4005-4010; Shields et al. J Biol Chem 2001, 276; 6591-6604; Nechansky et al. Mol Immunol, 2007, 44; 1815-1817). In addition, L234A or L235A, L236A, G237A mutations result in reductions in FcɤRII recognition. Lund et al, Journal of Immunology, 147, 2657-2663 (1991).
В одном варианте осуществления настоящего изобретения такие мутации находятся в одной или нескольких позициях, выбранных из 239, 332 и 330 (IgG1), или в эквивалентных позициях в других изотипах IgG. Примерами подходящих мутаций являются S239D, I332E, и A330L. В одном варианте осуществления антигенсвязывающий белок по настоящему изобретению, описанный в настоящем документе, мутирован в позициях 239 и 332, например, S239D и I332E, или, в следующем варианте осуществления, он мутирован в трех или более положениях, выбранных из 239 и 332 и 330, например, S239D, I332E и A330L (нумерация ЕС).
Получение антител с модифицированным гликозилированием
В еще одном варианте осуществления антитела или антигенсвязывающие фрагменты по изобретению имеют определенный паттерн гликозилирования. Например, можно получить афукозилированное или агликозилированное антитело или фрагмент (то есть антитело, не содержащее фукозы, или неглкозилированное, соответственно). Характер гликозилирования антитела или фрагмента может быть изменен, например, для увеличения сродства или авидности антитела или фрагмента к антигену PD-1. Такие модификации могут быть выполнены, например, путем изменения одного или нескольких сайтов гликозилирования в последовательности антитела или фрагмента. Например, могут быть произведены одна или несколько аминокислотных замен, приводящих к удалению одного или нескольких сайтов гликозилирования вариабельной области каркаса для устранения гликозилирования по этому сайту. Такое агликозилирование может увеличивать сродство или авидность антитела или фрагмента к антигену. См., например, патенты США №№ 5714350 и 6350861. В одном варианте осуществления область CDRH2 анти-PD-1 несет коррекцию гликозилирования S61N.
Антитела и антигенсвязывающие фрагменты, раскрытые в данном документе, могут, кроме того, включать те, которые продуцируются в клетках-хозяевах низших эукариот, в частности в клетках-хозяевах класса грибов, таких как в клетках дрожжей и нитчатых грибов, генетически сконструированых для получения гликопротеинов, имеющих паттерны гликозилирования млекопитающих или человека (см. например, Choi et al., (2003) Proc. Natl. Acad. Sci. 100: 5022-5027; Hamilton et al., (2003) Science 301: 1244-1246; Hamilton et al., (2006) Science 313: 1441-1443; Nett et al., Yeast 28 (3): 237-52 (2011); Hamilton et al., Curr Opin Biotechnol. Oct; 18 (5): 387-92 (2007)). Особое преимущество этих генетически модифицированных клеток-хозяев по сравнению с используемыми в настоящее время клеточными линиями млекопитающих заключается в их способности контролировать профиль гликозилирования гликопротеинов, продуцируемых в таких клетках, таким образом, что в результате можно получать композиции гликопротеинов, в которых преобладает конкретная структура N-гликанов (см. например, патент США №7029872 и патент США №7449308). Эти генетически модифицированные клетки-хозяева были использованы для получения антител, преимущественно имеющих определенные структуры N-гликанов (см., например, Li et al., (2006) Nat. Biotechnol. 24: 210-215).
В конкретных вариантах осуществления антитела и антигенсвязывающие фрагменты таковых, раскрытые в данном документе, дополнительно включают в себя те, которые продуцируются в низших эукариотических клетках-хозяевах и которые включают фукозилированные и нефукозилированные гибридные и сложные N-гликаны, включая раздвоенные и многоантенные виды, включая, без ограничения таковыми, N-гликаны, такие как GlcNAc(1-4)Man3GlcNAc2; Gal(1-4)GlcNAc(1-4)Man3GlcNAc2; NANA(1-4)Gal(1-4)GlcNAc(1-4)Man3GlcNAc2.
В конкретных вариантах осуществления антитела и антигенсвязывающие фрагменты таковых, представленные в настоящем документе, могут включать антитела или фрагменты, имеющие по меньшей мере один гибридный N-гликан, выбранный из группы, состоящей из GlcNAcMan5GlcNAc2; GalGlcNAcMan5GlcNAc2; and NANAGalGlcNAcMan5GlcNAc2. В конкретных аспектах гибридный N-гликан является преобладающим видом N-гликана в композиции.
В конкретных вариантах осуществления антитела и антигенсвязывающие фрагменты таковых, представленные в настоящем документе, включают антитела и фрагменты, содержащие, по меньшей мере, один комплексный N-гликан, выбранный из группы, состоящей из GlcNAcMan3GlcNAc2; GalGlcNAcMan3GlcNAc2; NANAGalGlcNAcMan3GlcNAc2; GlcNAc2Man3GlcNAc2; GalGlcNAc2Man3GlcNAc2; Gal2GlcNAc2Man3GlcNAc2; NANAGal2GlcNAc2Man3GlcNAc2; и NANA2Gal2GlcNAc2Man3GlcNAc2. В конкретных аспектах, комплексный N-гликан является преобладающим видом N-гликана в композиции. В дополнительных аспектах, комплексный N-гликан представляет собой определенную разновидность N-гликана, составляющего примерно 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99% или 100% от комплексных N-гликанов в композиции. В одном варианте осуществления биспецифическое антитело и антигенсвязывающие фрагменты такового, представленные в настоящем документе, содержат сложные N-гликаны, где, по меньшей мере, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99% или 100% комплексных N-гликанов содержат структуру NANA2Gal2GlcNAc2Man3GlcNAc2, причем такая структура является афукозилированной. Такие структуры могут быть получены, например, в сконструированных клетках-хозяевах Pichia pastoris.
В конкретных вариантах осуществления N-гликан является фукозилированным. Типично, фукоза образует α1,3-связь с GlcNAc на редуцирующем конце N-гликана, α1,6-связь с GlcNAc на редуцирующем конце N-гликана, α1,2- связь с Gal на нередуцирующем конце N-гликана, α1,3-связь с GlcNac на нередуцирующем конце N-гликана или α1,4-связь с GlcNAc на редуцирующем конце N-гликана.
Таким образом, в конкретных аспектах вышеуказанных гликопротеиновых композиций гликоформа находится в α1,3-связи или α1,6-связи фукозы с целью получения гликоформы, выбранной из группы, состоящей из Man5GlcNAc2(Fuc), GlcNAcMan5GlcNAc2(Fuc), Man3GlcNAc2(Fuc), GlcNAcMan3GlcNAc2(Fuc), GlcNAc2Man3GlcNAc2(Fuc), GalGlcNAc2Man3GlcNAc2(Fuc), Gal2GlcNAc2Man3GlcNAc2(Fuc), NANAGal2GlcNAc2Man3GlcNAc2(Fuc), и NANA2Gal2GlcNAc2Man3GlcNAc2(Fuc); в α1,3-связи или α1,4-связи фукозы для получения гликоформы, выбранной из группы, состоящей из GlcNAc(Fuc)Man5GlcNAc2, GlcNAc(Fuc)Man3GlcNAc2, GlcNAc2(Fuc1-2)Man3GlcNAc2, GalGlcNAc2(Fuc1-2)Man3GlcNAc2, Gal2GlcNAc2(Fuc1-2)Man3GlcNAc2, NANAGal2GlcNAc2(Fuc1-2)Man3GlcNAc2, и NANA2Gal2GlcNAc2(Fuc1-2)Man3GlcNAc2; или в α1,2-связи фукозы для получения гликоформы, выбранной из группы, состоящей из Gal(Fuc)GlcNAc2Man3GlcNAc2, Gal2(Fuc1-2)GlcNAc2Man3GlcNAc2, NANAGal2(Fuc1-2)GlcNAc2Man3GlcNAc2, или NANA2Gal2(Fuc1-2)GlcNAc2Man3GlcNAc2.
В дополнительных аспектах антитела или антигенсвязывающие фрагменты таковых включают N-гликаны с высоким содержанием маннозы, включая, без ограничения таковыми, Man8GlcNAc2, Man7GlcNAc2, Man6GlcNAc2, Man5GlcNAc2, Man4GlcNAc2, или N-гликаны, состоящие из структуры Man3GlcNAc2 -N-гликана.
В дополнительных аспектах вышеуказанного, сложные N-гликаны дополнительно включают в себя фукозилированные и нефукозилированные раздвоенные и многоантенные виды.
Используемые в настоящем документе термины «N-гликан» и «гликоформа» используются взаимозаменяемо и относятся к N-связанному олигосахариду, например, такому, который связан аспарагин-N-ацетилглюкозаминовой связью с остатком аспарагина полипептида. N-связанные гликопротеины содержат остаток N-ацетилглюкозамина, связанный с амидным азотом остатка аспарагина в белке. Преобладающими сахарами, обнаруженными в гликопротеинах, являются глюкоза, галактоза, манноза, фукоза, N-ацетилгалактозамин (GalNAc), N-ацетилглюкозамин (GlcNAc) и сиаловые кислоты (например, N-ацетилнейраминовая кислота (NANA)). Процессинг сахарных групп происходит совместно с процессом трансляции в просвете ER и продолжается пост-трансляционно в аппарате Гольджи для N-связанных гликопротеинов.
N-гликаны имеют общее пентасахаридное ядро Man3GlcNAc2 («Man» относится к маннозе; «Glc» относится к глюкозе; «NAc» относится к N-ацетилу; GlcNAc относится к N-ацетилглюкозамину). Типично, структуры N-гликана представлены с нередуцирующим концом слева и с редуцирующим концом справа. Редуцирующий конец N-гликана является концом, присоединенным к остатку Asn, содержащему сайт гликозилирования белка. N-гликаны различаются по количеству ветвей (антенн), содержащих периферические сахара (например, GlcNAc, галактозу, фукозу и сиаловую кислоту), которые добавляются к структуре ядра Man3GlcNAc2 ("Man3"), также называемой "триманнозным ядром", "пентасахаридным ядром" или "пауциманнозным ядром" ("paucimannose core"). N-гликаны классифицируются в соответствии с их разветвленными компонентами (например, гликан с высоким содержанием маннозы, сложный (комплексный) или гибридный). N-гликан типа "с высоким содержанием маннозы" имеет пять или более остатков маннозы. N-гликан "сложного/комплексного" типа обычно имеет, по меньшей мере, один GlcNAc, присоединенный к плечу 1,3 маннозы, и, по меньшей мере, один GlcNAc, присоединенный к плечу 1,6 маннозы "триманнозного" ядра. Сложные комплекскые N-гликаны также могут иметь остатки галактозы ("Gal") или N-ацетилгалактозамина ("GalNAc"), которые необязательно модифицированы сиаловой кислотой или ее производными (например, "NANA" или "NeuAc", где "Neu" относится к нейраминовой кислоте, а «Ас» относится к ацетилу). Сложные N-гликаны также могут иметь внутрицепочечные замены, включающие «бисекционный» GlcNAc и ядро фукозы («Fuc»). Сложные N-гликаны также могут иметь несколько антенн на «триманнозном ядре», и часто называются «гликанами с множественными антеннами». «Гибридный» N-гликан имеет по меньшей мере один GlcNAc на конце 1,3-маннозового плеча триманнозного ядра и от ноля до нескольких манноз на 1,6-маннозном плече триманнозного ядра. Различные N-гликаны также называют «гликоформами».
Что касается сложных комплексных N-гликанов, термины «G-2», «G-1», «G0», «G1», «G2», «A1» и «A2» означают следующее. «G-2» относится к структуре N-гликана, которую можно охарактеризовать как Man3GlcNAc2; термин «G-1» относится к структуре N-гликана, которую можно охарактеризовать как GlcNAcMan3GlcNAc2; термин «G0» относится к структуре N-гликана, которую можно охарактеризовать как GlcNAc2Man3GlcNAc2; термин «G1» относится к структуре N-гликана, которую можно охарактеризовать как GalGlcNAc2Man3GlcNAc2; термин «G2» относится к структуре N-гликана, которую можно охарактеризовать как Gal2GlcNAc2Man3GlcNAc2; термин «А1» относится к структуре N-гликана, которую можно охарактеризовать как NANAGal2GlcNAc2Man3GlcNAc2; и термин «А2» относится к структуре N-гликана, которую можно охарактеризовать как NANA2Gal2GlcNAc2Man3GlcNAc2. Если не указано иное, термины “G-2", "G-1", "G0", "G1", "G2", "A1" и "A2" относятся к разновидностям N-гликанов, у которых отсутствует фукоза, присоединенная к GlcNAc-остатку на редуцирующем конце N-гликана. Если термин включает «F», то «F» указывает, что данная разновидность N-гликана содержит остаток фукозы на GlcNAc-остатке на редуцирующем конце N-гликана. Например, G0F, G1F, G2F, A1F и A2F все указывают на то, что N-гликан дополнительно включает остаток фукозы, присоединенный к остатку GlcNAc на редуцирующем конце N-гликана. Низшие эукариоты, такие как дрожжи и нитчатые грибы, обычно не продуцируют N-гликаны, содержащие фукозу.
Что касается многоантенных N-гликанов, термин «многоантенный N-гликан» относится к N-гликанам, дополнительно содержащим остаток GlcNAc на остатке маннозы, включая на нередуцирующих концах 1,6-плеча или 1,3-плеча N-гликана или остаток GlcNAc на каждом из остатков маннозы, включая на нередуцирующих концах 1,6-плеча и 1,3-плеча N-гликана. Таким образом, многоантенные N-гликаны могут быть охарактеризованы формулами GlcNAc(2-4)Man3GlcNAc2, Gal(1-4)GlcNAc(2-4)Man3GlcNAc2, или NANA(1-4)Gal(1-4)GlcNAc(2-4)Man3GlcNAc2. Термин «1-4» относится к 1, 2, 3 или 4 остаткам.
Что касается бисекционных N-гликанов, термин "бисекционный N-гликан" относится к N-гликанам, в которых остаток GlcNAc связан с остатком маннозы на редуцирующем конце N-гликана. Бисекционный N-гликан может быть охарактеризован формулой GlcNAc3Man3GlcNAc2, где каждый остаток маннозы связан на своем нередуцирующем конце с остатком GlcNAc. Напротив, когда многоантенный N-гликан характеризуется как GlcNAc3Man3GlcNAc2, формула указывает, что два остатка GlcNAc связаны с остатком маннозы на нередуцирующем конце одного из двух плеч N-гликана и один остаток GlcNAc связан с остатком маннозы на нередуцирующем конце другого плеча N-гликана.
Физические свойства антител
Антитела и антигенсвязывающие фрагменты таковых, раскрытые в данном описании, могут дополнительно содержать один или несколько сайтов гликозилирования в вариабельной области иммуноглобулина легкой или тяжелой цепи. Такие сайты гликозилирования могут приводить к повышенной иммуногенности антитела или фрагмента или к изменению pK антитела вследствие измененного связывания антигена (Marshall et al. (1972) Annu Rev Biochem 41:673-702; Gala and Morrison (2004) J Immunol 172:5489-94; Wallick et al (1988) J Exp Med 168:1099-109; Spiro (2002) Glycobiology 12:43R-56R; Parekh et al (1985) Nature 316:452-7; Mimura et al. (2000) Mol Immunol 37:697-706). Известно, что гликозилирование происходит в паттернах последовательности, содержащей сочетание N-X-S/T.
Каждое антитело или антигенсвязывающий фрагмент будет иметь уникальную изоэлектрическую точку (pI), которая обычно находится в диапазоне рН от 6 до 9,5. PI для антитела IgG1 обычно находится в диапазоне pH 7-9,5, а pI для антитела IgG4 обычно находится в диапазоне pH 6-8.
Каждое антитело или антигенсвязывающий фрагмент будет иметь характерную температуру плавления, причем более высокая температура плавления указывает на более высокую общую стабильность in vivo (Krishnamurthy R and Manning MC (2002) Curr Pharm Biotechnol 3: 361-71). Как правило, TM1 (температура начального плавления/развертывания белка) может быть выше 60°C, выше 65°C или выше 70°C. Температуру плавления антитела или фрагмента можно измерить с использованием дифференциальной сканирующей калориметрии (Chen et al (2003) Pharm Res 20:1952-60; Ghirlando et al (1999) Immunol Lett 68:47-52) или кругового дихроизма (Murray et al. (2002) J. Chromatogr Sci 40:343-9).
В дополнительном варианте осуществления отбираются антитела и антигенсвязывающие фрагменты таковых с замедленной деградацией. Деградация антитела или фрагмента может быть измерена с использованием капиллярного электрофореза (CE) и MALDI-MS (Alexander AJ and Hughes DE (1995) Anal Chem 67:3626-32).
В дополнительном варианте осуществления отбираются антитела и антигенсвязывающие фрагменты таковых, имеющие минимальные эффекты агрегации, которые могут приводить к запуску нежелательного иммунного ответа и/или приобретению измененных или неблагоприятных фармакокинетических свойств. Как правило, приемлемыми считаются антитела и фрагменты с агрегацией 25% или менее, 20% или менее, 15% или менее, 10% или менее или 5% или менее. Агрегация может быть измерена несколькими методами, включая использование размер-эксклюзивной хроматографии (SEC), высокоэффективной жидкостной хроматографии (ВЭЖХ) и светового рассеяния.
Конъюгаты антител
Антитела и антигенсвязывающие фрагменты таковых, раскрытые в данном документе, также могут быть конъюгированы с химическим фрагментом. Химическая часть может представлять собой, помимо прочего, полимер, радионуклид или малую молекулу, которая связывается с иммуномодуляторами. В конкретных вариантах осуществления химическая часть представляет собой полимер, способный увеличивать период полураспада антитела или фрагмента в организме индивида. Подходящие полимеры включают, не ограничиваясь таковыми, гидрофильные полимеры, включающие, без ограничения таковыми, полиэтиленгликоль (ПЭГ) (например, ПЭГ с молекулярной массой 2 кДа, 5 кДа, 10 кДа, 12 кДа, 20 кДа, 30 кДа или 40 кДа), декстран и монометоксиполиэтиленгликоль (мПЭГ). Lee, et al., (1999) (Bioconj. Chem. 10:973-981) описывает ПЭГ-конъюгированные одноцепочечные антитела. Wen, et al., (2001) (Bioconj. Chem. 12:545-553) описывает конъюгированные антитела с ПЭГ, присоединенным к радиометаллическому хелатору (диэтилентриаминпентауксусной кислоте (DTPA)).
Антитела и антигенсвязывающие фрагменты таковых, раскрытые в данном документе, также могут быть конъюгированы с метками, такими как as 99Tc,90Y, 111In, 32P, 14C, 125I, 3H, 131I, 11C, 15O, 13N, 18F, 35S, 51Cr, 57To, 226Ra, 60Co, 59Fe, 57Se, 152Eu, 67CU, 217Ci, 211At, 212Pb, 47Sc, 109Pd, 234Th, and 40K, 157Gd, 55Mn, 52Tr, и 56Fe.
Антитела и антигенсвязывающие фрагменты, раскрытые в данном документе, также могут быть пегилированы, например, для увеличения биологического (например, сывороточного) периода полураспада таковых. Чтобы ПЭГилировать антитело или фрагмент, такое антитело или фрагмент, как правило, подвергают взаимодействию с реакционноспособной формой полиэтиленгликоля (ПЭГ), с такой как реакционноспособное эфирное или альдегидное производное ПЭГ, в условиях, в которых одна или несколько групп ПЭГ присоединяются к антителу или фрагменту антитела. В конкретных вариантах осуществления ПЭГилирование проводят посредством реакции ацилирования или реакции алкилирования с реакционноспособной молекулой ПЭГ (или аналогичным реакционноспособным водорастворимым полимером). Используемый в настоящем документе термин «полиэтиленгликоль» предназначен для обозначения любой из форм ПЭГ, используемой для дериватизации других белков, таких как моно(С1-С10)алкокси- или арилокси-полиэтиленгликоль или полиэтиленгликоль-малеимид. В некоторых вариантах осуществления антитело или фрагмент, подлежащие пегилированию, представляют собой агликозилированные антитело или фрагмент. Способы ПЭГилирования белков известны в данной области техники и могут быть применены к антителам по изобретению. См., например, ЕР 0154316 и ЕР 0401384.
Антитела и антигенсвязывающие фрагменты, раскрытые в данном документе, также могут быть конъюгированы с флуоресцентными или хемилюминесцентными метками, включая флуорофоры, такие как редкоземельные хелаты, флуоресцеин и его производные, родамин и его производные, изотиоцианат, фикоэритрин, фикоцианин, аллофикоцианин, о-фталальдегид, флуоресцамин, 152Eu, дансил, умбеллиферон, люциферин, метка люминала, метка изолюминала, метка эфира ароматического акридиния, метка имидазола, метка соли акридимина, метка оксалатного эфира, метка экворина, 2,3-дигидрофталазиндионы, биотин/авидин, спин-метки и стабильные свободные радикалы.
Любой метод, известный в данной области техники, может быть использован для конъюгирования антител и их антигенсвязывающих фрагментов по изобретению с различными составляющими, включая способы, описанные Hunter, et al., (1962) Nature 144:945; David, et al., (1974) Biochemistry 13:1014; Pain, et al., (1981) J. Immunol. Meth. 40:219; and Nygren, J., (1982) Histochem. and Cytochem. 30:407. Методы конъюгирования антител и фрагментов являются общепринятыми и хорошо известны в данной области техники.
Терапевтическое использование антител
Далее предоставлены способы лечения индивидов, включая человека, нуждающихся в лечении антителами или антигенсвязывающими фрагментами таковых, раскрытыми в данном документе. В одном варианте осуществления такой индивид страдает от рака или инфекционного заболевания.
«Индивидом» может быть млекопитающее, такое как человек, собака, кошка, лошадь, корова, мышь, крыса, обезьяна (например, обезьяна-циномолг, например Macaca flavicularis) или кролик. В определенных вариантах осуществления индивидом является человек.
Термин «вместе с» указывает на то, что компоненты, вводимые способом, представленным в настоящем документе, могут быть составлены в одну композицию для одновременной доставки или составлены отдельно в две или более композиции (например, включены в набор). Каждый компонент может быть введен индивиду в любое другое время, чем время введения определенного компонента. В определенных вариантах осуществления введение каждого компонента осуществляется не одновременно, а, например, отдельно или последовательно, через несколько интервалов в течение заданного периода времени. Кроме того, отдельные компоненты могут быть введены индивиду тем же самым или различным путем.
Далее предоставлены способы лечения индивидов, включая человека, нуждающихся в лечении выделенными антителами или их антигенсвязывающими фрагментами, раскрытыми в настоящем документе. В одном варианте осуществления такой индивид страдает от инфекции или инфекционного заболевания. В некоторых вариантах осуществления в настоящем документе представлено антитело или антигенсвязывающий фрагмент для применения при лечении рака. В других вариантах осуществления настоящего документа представлено антитело или антигенсвязывающий фрагмент для применения при лечении инфекции или инфекционного заболевания. В некоторых вариантах осуществления в настоящем документе предлагается применение антитела или антигенсвязывающего фрагмента для изготовления лекарственного средства для лечения рака. В других вариантах осуществления в настоящем документе предлагается применение антитела или антигенсвязывающего фрагмента для изготовления лекарственного средства для лечения инфекции или инфекционного заболевания. В одном варианте осуществления в настоящем документе представлен способ лечения рака у человека, включающий введение индивиду эффективного количества антитела или антигенсвязывающего фрагмента, представленного в настоящем документе. В одном варианте осуществления в настоящем документе представлен способ лечения рака у индивида-человека, включающий введение индивиду эффективного количества вектора экспрессии, содержащего нуклеиновую кислоту, кодирующую антитело или антигенсвязывающий фрагмент, представленные в настоящем документе. В определенных вариантах осуществления способы, представленные в настоящем документе, дополнительно включают или каким-либо иным образом связаны с дополнительным терапевтическим средством или терапевтической процедурой.
В одном варианте осуществления дополнительный терапевтический агент выбирают из группы, включающей: (i) анти-TIGIT антитело или антигенсвязывающий фрагмента такового; (ii) анти-VISTA антитело или его антигенсвязывающий фрагмент; (iii) анти-BTLA антитело или его антигенсвязывающий фрагмент; (iv) анти-TIM3 антитело или его антигенсвязывающий фрагмент; (v) анти-CTLA4 антитело или его антигенсвязывающий фрагмент; (vi) анти-HVEM- антитело или его антигенсвязывающий фрагмент; (vii) анти-CD70 антитело или его антигенсвязывающий фрагмент; (viii) анти-ОХ40 антитело или его антигенсвязывающий фрагмент; (ix) анти-CD28 антитело или его антигенсвязывающий фрагмент; (x) анти-PDL1 антитело или его антигенсвязывающий фрагмент; (xi) анти-PDL2 антитело или его антигенсвязывающий фрагмент; (xii) анти-GITR- антитело или его антигенсвязывающий фрагмент; (xiii) анти-ICOS антитело или его антигенсвязывающий фрагмент; (xiv) анти-SIRP антитело или его антигенсвязывающий фрагмент; (xv) анти-ILT2 антитело или его антигенсвязывающий фрагмент; (xvi) анти-ILT3 антитело или его антигенсвязывающий фрагмент; (xvii) анти-ILT4- антитело или его антигенсвязывающий фрагмент; (xviii) анти-ILT5- антитело или его антигенсвязывающий фрагмент; (xix) анти-4-1BB антитело или его антигенсвязывающий фрагмент; (хх) анти-NK2GA- антитело или его антигенсвязывающий фрагмент; (xxi) анти-NK2GC антитело или его антигенсвязывающий фрагмент; (xxii) анти-NK2GE антитело или его антигенсвязывающий фрагмент; (xxiii) анти-TSLP антитело или его антигенсвязывающий фрагмент; (xxiv) анти-IL10 антитело или его антигенсвязывающий фрагмент; (XXV) агонист жало; (xxvi) антагонист CXCR2; и (xxvii) ингибитор PARP.
В одном варианте осуществления агент представляет собой анти-LAG3 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-TIGIT антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-VISTA антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-BTLA антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-TIM3 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-CTLA4 антитело или антигенсвязывающий фрагмент этого нет. В одном варианте осуществления агент представляет собой анти-HVEM антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-CD70 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-OX40 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-CD28 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-PDL1 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-PDL2 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-GITR антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-ICOS антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-SIRPα антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-ILT2 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-ILT3 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-ILT4 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-ILT5 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-4-1BB антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-NK2GA антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-NK2GE антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-IL10 антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент представляет собой анти-TSLP антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления агент является STING-агонистом. В одном варианте осуществления агент представляет собой антагонист CXCR2. В одном варианте осуществления агент представляет собой ингибитор PARP.
В другом варианте осуществления индивид страдает от рака. В одном варианте осуществления рак представляет собой остеосаркому, рабдомиосаркому, нейробластому, рак почки, лейкоз, почечно-переходный клеточный рак, рак мочевого пузыря, рак Уилма, рак яичников, рак поджелудочной железы, рак молочной железы, рак простаты, рак костей, рак легких (например, немелкоклеточный рак легкого), рак желудка, колоректальный рак, рак шейки матки, синовиальную саркому, рак головы и шеи, плоскоклеточный рак, множественную миелому, почечно-клеточный рак, ретинобластому, гепатобластому, гепатоцеллюлярную карциному, меланому, рабдоидную опухоль почки, саркому Юинга, хондросаркому, рак мозга, глиобластому, менингиому, аденому гипофиза, вестибулярную шванному (невриному слухового нерва), примитивную нейроэктодермальную опухоль, медуллобластому, астроцитому, анапластическую астроцитому, олигодендроглиому, эпендимому, хориоидпапиллому, истинную полицитемию, тромбоцитемию, идиопатический миелофиброз, саркому мягких тканей, рак щитовидной железы, рак эндометрия, карциноидный рак или рак печени, рак молочной железы или рак желудка. В одном варианте осуществления рак представляет собой метастатический рак, например, рак разновидностей, описанных выше.
Новообразования (рак), которые можно лечить антителами или антигенсвязывающими фрагментами, композициями и способами, представленными в настоящем документе, включают, без ограничения таковыми: рак, выбранный из раковых заболеваний мягких тканей: саркомы (ангиосаркомы, фибросаркомы, рабдомиосаркомы, липосаркомы), миксомы, рабдомиомы, фибромы, липомы и тератомы; рак легких, выбранный из: бронхогенной карциномы (плоскоклеточной, недифференцированной мелкоклеточной, недифференцированной крупноклеточной, аденокарциномы), альвеолярной (бронхиолярной) карциномы, бронхиальной аденомы, саркомы, лимфомы, хондроматозной гамартомы, мезотелиомы; рак желудочно-кишечного тракта: пищевода (плоскоклеточной карциномы, аденокарциномы, лейомиосаркомы, лимфомы), желудка (карциномы, лимфомы, лейомиосаркомы), поджелудочной железы (дуктальной аденокарциномы, инсулиномы, глюкагономы, гастриномы, карциноидных опухолей, випомы), тонкого кишечника (аденокарциномы, лимфомы, карциноидных опухолей, саркомы Капоши, лейомиомы, гемангиомы, липомы, нейрофибромы, фибромы), толстого кишечника (аденокарциномы, тубулярной аденомы, ворсинчатой аденомы, гамартомы, лейомиомы); рак мочеполовой системы: почек (аденокарциномы, опухоли Вильмса [нефробластомы], лимфомы, лейкоза), мочевого пузыря и уретры (плоскоклеточной карциномы, транзиторно-клеточной карциномы, аденокарциномы), предстательной железы (аденокарциномы, саркомы), яичек (семиномы, тератомы, эмбриональной карциномы, тератокарциномы, хориокарциномы, саркомы, интерстициально-клеточной карциномы, фибромы, фиброаденомы, аденоматоидных опухолей, липомы); рак печени: гепатомы (гепатоцеллюлярной карциномы), холангиокарциномы, гепатобластомы, ангиосаркомы, гепатоцеллюлярной аденомы, гемангиомы; рак костной ткани: остеогеной саркомы (остеосаркомы), фибросаркомы, злокачественной фиброзной гистиоцитомы, хондросаркомы, саркомы Юинга, злокачественной лимфомы (ретикулоклеточной саркомы), множественной миеломы, злокачественной гигантоклеточной хордомы, остеохронфромы (костно-хрящевых экзостозов), доброкачественной хондромы, хондробластомы, хондромиксофибромы, остеоидной остеомы и гигантоклеточньгх опухолей; рак нервной системы: черепа (остеомы, гемангиомы, гранулемы, ксантомы, деформирующего остоза), мозговых оболочек (менингиомы, менингиосаркомы, глиоматоза), головного мозга (астроцитомы, медуллобластомы, глиомы, эпендимомы, герминомы [пинеаломы], мультиформной глиобластомы, олигодендроглиомы, шванномы, ретинобластомы, врожденных опухолей), нейрофибромы спинного мозга, менингиомы, глиомы, саркомы); рак женских половых органов: матки (эндометриальной карциномы), шейки матки (цервикальной карциномы, предопухолевой цервикальной дисплазии), яичников (карциномы яичников [серозной цистаденокарциномы, муцинозной цистаденокарциномы, неклассифицированной карциномы], гранулоза-текально-клеточных опухолей, опухолей из сертоли-лейдиговских клеток, дисгерминомы, злокачественной тератомы), вульвы (плоскоклеточной карциномы, интраэпителиальной карциномы, аденокарциномы, фибросаркомы, меланомы), влагалища (светлоклеточной карциномы, плоскоклеточной карциномы, ботриоидной саркомы (эмбриональной рабдомиосаркомы), фаллопиевых труб (карциномы); кроветворной системы: крови и костного мозга (миелоидного лейкоза [острого и хронического], острого лимфобластного лейкоза, хронического лимфоцитарного лейкоза, миелопролиферативных заболеваний, множественной миеломы, миелодиспластического синдрома), болезни Ходжкина, неходжкинской лимфомы [злокачественной лимфомы]; кожи: злокачественной меланомы, базально-клеточной карциномы, плоскоклеточной карциномы, саркомы Капоши, диспластических невусов, липомы, ангиомы, дерматофибромы, келоидов, псориаза; и надпочечников: нейробластомы. Таким образом, термин «раковая клетка» в данном документе включает клетку, пораженную любым из указанных выше состояний.
В одном варианте осуществления злокачественные опухоли, которые можно лечить антителами или антигенсвязывающими фрагментами таковых, композициями и способами, представленными в настоящем документе, включают, не ограничиваясь таковыми: рак легкого, рак поджелудочной железы, рак толстой кишки, колоректальный рак, миелоидный лейкоз, острый миелогенный лейкоз, хронический миелогенный лейкоз, хронический миеломоноцитарный лейкоз, рак щитовидной железы, миелодиспластический синдром, карциному мочевого пузыря, эпидермальную карциному, меланому, рак молочной железы, рак простаты, рак головы и шеи, рак яичников, рак головного мозга, саркому, тератокарциному, нейробластому, почечные карциномы, гепатомы, неходжкинские лимфому, множественную миелому и анапластическую карциному щитовидной железы.
В одном варианте осуществления предоставлены способы лечения индивидов с использованием антитела или антигенсвязывающего фрагмента такового, раскрытые в данном документе, где у индивида наблюдается вирусная инфекция. В одном варианте осуществления вирусная инфекция представляет собой инфекцию вирусом, выбранным из группы, состоящей из вируса иммунодефицита человека (ВИЧ), вируса гепатита (A, B или C), вируса герпеса (например, VZV, HSV-I, HAV- 6, HSV-II и CMV, вирус Эпштейна-Барра), аденовируса, вируса гриппа, флавивирусов, эховируса, риновируса, вируса Коксаки, коронавируса, респираторно-синцитиального вируса, вируса паротита, ротавируса, вируса кори, вируса краснухи, парвовируса, вируса коровьей оспы, вируса HTLV, вируса денге, вируса папилломы, вируса моллюска, полиовируса, вируса бешенства, JC вируса или вируса арбовирусного энцефалита.
В одном варианте осуществления предоставлены способы лечения индивида с использованием антитела или антигенсвязывающего фрагмента такового, описанные в настоящем документе, где у индивида наблюдается бактериальная инфекция. В одном варианте осуществления бактериальная инфекция представляет собой инфекцию бактериями, выбранными из группы, состоящей из хламидии (Chlamydia), риккетсиозных бактерий, микобактерий, стафилококков, стрептококков, пневмонококков, менингококков и гонококков, клебсиелл, протей, серраций, псевдомоналов, Legionella, Corynebacterium diphtheriae, Salmonella, бацилл, Vibrio cholerae, Clostridium tetan, Clostridium botulinum, Bacillus anthricis, Yersinia pestis, Mycobacterium leprae, Mycobacterium lepromatosis, и Borriella.
В одном из вариантов осуществления в настоящем документе представлен способ лечения индивида с использованием антитела или антигенсвязывающего фрагмента такового, представленный в настоящем документе, где индивид страдает грибковой инфекцией. В одном варианте осуществления грибковая инфекция представляет собой грибковую инфекцию с возбудителем, выбранным из группы, состоящей из Candida (albicans, krusei, glabrata, tropicalis, и т.д.), Cryptococcus neoformans, Aspergillus (fumigatus, niger, etc.), Genus Mucorales (mucor, absidia, rhizopus), Sporothrix schenkii, Blastomyces dermatitidis, Paracoccidioides brasiliensis, Coccidioides immitis and Histoplasma capsulatum.
В одном из вариантов осуществления в настоящем документе представлен способ лечения индивидов с использованием антитела или антигенсвязывающего фрагмента, представленный в данном документе, где индивид страдает от паразитарной инфекции. В одном варианте осуществления паразитарная инфекция представляет собой инфекцию, вызываемую паразитом, выбранным из группы, состоящей из Entamoeba histolytica, Balantidium coli, Naegleria fowleri, Acanthamoeba, Giardia lambia, Cryptosporidium, Pneumocystis carinii, Plasmodium vivax, Babesia microti, Trypanosoma brucei, Trypanosoma cruzi, Leishmania donovani, Toxoplasma gondii и Nippostrongylus brasiliensis.
В конкретных вариантах осуществления антитела или антигенсвязывающие фрагменты таковых, раскрытые в данном документе, могут использоваться отдельно или в сочетании с другими дополнительными терапевтическими агентами и/или терапевтическими процедурами для лечения или профилактики любого заболевания, например, рака, как обсуждалось в настоящем документе, у индивида, нуждающегося в таком лечении или профилактике. Также рассмотрены композиции, например фармацевтические композиции, содержащие фармацевтически приемлемый носитель, или содержащие такие антитела и фрагменты в сочетании с другими терапевтическими агентами.
Следовательно, в настоящем документе представлен способ лечения рака у индивида-человека, включающий введение индивиду эффективного количества антитела или антигенсвязывающего фрагмента, раскрытого в данном документе. В определенных вариантах осуществления введение связано с дополнительным терапевтическим агентом или терапевтической процедурой.
В настоящем документе также представлен способ лечения инфекции или инфекционного заболевания у человека, включающий введение индивиду эффективного количества антитела или антигенсвязывающего фрагмента, раскрытого в данном документе. В определенных вариантах осуществления введение связано с дополнительным терапевтическим агентом или терапевтической процедурой.
В другом варианте осуществления предоставлено антитело или его антигенсвязывающий фрагмент, описанные в настоящем документе для применения при лечении рака; при лечении инфекции или инфекционного заболевания в сочетании с дополнительным терапевтическим агентом. В одном варианте осуществления антитело или его антигенсвязывающий фрагмент предназначены для применения при лечении рака. В одном варианте осуществления антитело или его антигенсвязывающий фрагмент предназначены для применения при лечении инфекции. В одном варианте осуществления антитело или его антигенсвязывающий фрагмент предназначены для применения при лечении инфекционного заболевания. В определенных вариантах осуществления лечение включает дополнительный терапевтический агент.
В дополнительном варианте осуществления описано применение антитела или антигенсвязывающего фрагмента, раскрытого в настоящем документе, для изготовления лекарственного средства для лечения рака, а также для лечения инфекции или инфекционного заболевания в сочетании с дополнительным терапевтическим агентом. В другом варианте осуществления предоставлена комбинация антитела или антигенсвязывающего фрагмента по изобретению и дополнительного терапевтического агента для лечения рака, или лечения инфекции, или инфекционного заболевания. В одном варианте осуществления предоставлено антитело или его антигенсвязывающий фрагмент для изготовления лекарственного средства для лечения рака. В одном варианте осуществления предоставлено антитело или его антигенсвязывающий фрагмент для изготовления лекарственного средства для лечения инфекции. В одном варианте осуществления предоставлено антитело или его антигенсвязывающий фрагмент для изготовления лекарственного средства для лечения инфекционного заболевания. В определенных вариантах осуществления лекарственное средство содержит дополнительный терапевтический агент.
В других вариантах осуществления предоставлен способ лечения рака или лечения инфекции или инфекционного заболевания у человека, включающий введение индивиду эффективного количества антитела или антигенсвязывающего фрагмента, описанных в настоящем документе, или вектора экспрессии или клетки-хозяина, описанных в настоящем документе, необязательно в сочетании с дополнительным терапевтическим средством или терапевтической процедурой. В одном варианте осуществления предложен способ лечения рака у индивида-человека, включающий введение индивиду эффективного количества антитела или антигенсвязывающего фрагмента, раскрытого в данном документе. В другом варианте осуществления предоставлен способ лечения инфекции у человека, включающий введение индивиду эффективного количества антитела или антигенсвязывающего фрагмента, раскрытого в данном документе. В еще одном варианте осуществления предоставлен способ лечения инфекционного заболевания у человека, включающий введение индивиду эффективного количества антитела или антигенсвязывающего фрагмента, раскрытого в данном документе. В одном варианте осуществления предоставлен способ лечения рака у индивида-человека, включающий введение индивиду эффективного количества вектора экспрессии, содержащего полинуклеотид, кодирующий антитело или антигенсвязывающий фрагмент, раскрытый в данном документе. В другом варианте осуществления предоставлен способ лечения инфекции у индивида-человека, включающий введение индивиду эффективного количества вектора экспрессии, содержащего полинуклеотид, кодирующий антитело или антигенсвязывающий фрагмент, раскрытый в данном документе. В еще одном варианте осуществления предоставлен способ лечения инфекционного заболевания у человека, включающий введение индивиду эффективного количества вектора экспрессии, содержащего полинуклеотид, кодирующий антитело или антигенсвязывающий фрагмент, раскрытый в данном документе. В одном варианте осуществления предоставлен способ лечения рака у индивида-человека, включающий введение индивиду эффективного количества клетки-хозяина, содержащей вектор экспрессии, содержащего полинуклеотид, кодирующий антитело или антигенсвязывающий фрагмент, раскрытые в данном документе. В другом варианте осуществления предоставлен способ лечения инфекции у индивида-человека, включающий введение индивиду эффективного количества клетки-хозяина, содержащей вектор экспрессии, содержащий полинуклеотид, кодирующий антитело или антигенсвязывающий фрагмент, раскрытый в данном документе. В еще одном варианте осуществления предоставлен способ лечения инфекционное заболевание у человека, включающее введение индивиду эффективного количества клетки-хозяина, содержащей вектор экспрессии, содержащий полинуклеотид, кодирующий антитело или антигенсвязывающий фрагмент, раскрытые в данном документе. В определенных вариантах осуществления способ дополнительно включает введение дополнительного терапевтического агента. В других вариантах осуществления способ дополнительно включает дополнительную терапевтическую процедуру.
В конкретных вариантах осуществления антитела или антигенсвязывающие фрагменты таковых, раскрытые в данном документе, могут быть использованы по отдельности, или в сочетании с противоопухолевыми вакцинами. Примеры противоопухолевых вакцин включают, без ограничения таковыми, вакцины против рака, вызванного вирусом папилломы человека (ВПЧ), такие как Гардасил®, Гардасил® и Церварикс®; вакцины, предотвращающие заражение вирусом гепатита В, вызывающего рак печени, такие как Engerix-B® и Recombivax HB®; онколитическую вирусную терапию, запускающую иммунный ответ, такую как Imlygic®; ДНК-вакцины, такие как плазмидная ДНК-вакцина Synchotrope MA2M и ZYC101; маммаглобин-ДНК-вакцину (см. Clinical Cancer Res. 2014 20 (23): 5964-75); векторные вакцины, такие как PSA-TRICOM (проствак), PANVAC-VF, PSA-вакцина на основе моноцитогенов Listeria (см. Терапевтические достижения в вакцинах, 2014, 2 (5) 137-148), Listeria-mesothelin Adeno-CEA; аллогенные вакцины, такие как GVAX, BLP-25 (анти-Ankara-mucin 1), белагенпуматусел-Л (Belagenpumatucel-L), TG4010, вакцину против эпидермального фактора роста CIMAvax, NY-ESO, GM.CD40L-CCL21; аутологичные вакцины, такие как: Adeno-CD40L, BCG, INGN-225, вакцины дендритных клеток, такие как Провендж (Provenge® (Sipuleucel-T)), rF-CEA-MUC1-TRICOM (Панвак, (panvac-DC)); антигенные вакцины, такие как MUC-1 (стимувакс), NY-ESO-1, GP-100, MAGE-A3 (ген, кодирующий антиген меланомы A3), INGN-225 (см. Pharmacology & Therapeutics 153 (2015) 1-9).
В конкретных вариантах осуществления антитела или антигенсвязывающие фрагменты таковых, раскрытые в данном документе, могут использоваться отдельно или в сочетании с химиотерапевтическими агентами.
В конкретных вариантах осуществления антитела или антигенсвязывающие фрагменты таковых, раскрытые в данном документе, могут использоваться отдельно или в сочетании с лучевой терапией.
В конкретных вариантах осуществления антитела или антигенсвязывающие фрагменты таковых, раскрытые в данном документе, могут использоваться отдельно или в сочетании с таргетной терапией. Примеры целенаправленной (таргетной) терапии включают: гормональную терапию, применение ингибиторов передачи сигнала (например, ингибиторов EGFR, таких как цетуксимаб (Erbitux®) и эрлотиниб (Tarceva®)); ингибиторов HER2 (например, трастузумаб (герцептин®) и пертузумаб (перъета®)); ингибиторов BCR-ABL (такие как иматиниб (Gleevec®) и дазатиниб (Sprycel®)); ингибиторов ALK (такие как кризотиниб (Xalkori®) и церитиниб (Zykadia®)); ингибиторов BRAF (такие как вемурафениб (Zelboraf®) и дабрафениб (Tafinlar®)), модуляторов экспрессии генов, индукторов апоптоза (например, бортезомиб (Velcade®) и карфилзомиб (Kyprolis®)), ингибиторов ангиогенеза (например, бевацизумаб) и рамуцирумаб (Cyramza®), моноклональных антител, присоединенных к токсинам (например, брентуксимаб ведотин (Adcetris®) и адотрастумумаб эмтансин (Kadcyla®)).
В конкретных вариантах осуществления антитела или антигенсвязывающие фрагменты таковых, представленные в настоящем документе, используются в комбинации с противораковым терапевтическим средством. В других вариантах осуществления антитела или антигенсвязывающие фрагменты таковых, представленные в настоящем документе, используются в комбинации с иммуномодулирующим лекарственным средством. В некоторых вариантах осуществления иммуномодулирующее лекарственное средство представляет собой ингибитор иммуномодулирующего рецептора. В некоторых вариантах осуществления иммуномодулирующее лекарственное средство представляет собой антитело или его антигенсвязывающий фрагмент, специфически связывающиеся с рецептором.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с одним или несколькими из списка: анти-PDL1 антитело, анти-TIGIT антитело, анти-CTLA4 антитело, анти-CS1 антитело (например, элотузумаб, анти-KIR2DL1/2/3 антитело (например, лирилумаб), анти-CD137 антитело (например, урелумаб), анти-GITR антитело (например, TRX518), анти-PD1 антитело (например, пембролизумаб, ниволумаб, пидилизумаб (CT-011)), анти-PD-L1 антитело (например, BMS-936559, дурвалюмаб (Durvalumab), MSB0010718C или MPDL3280A), анти-PD-L2 антитело, анти-ILT1 антитело, анти-ILT2 антитело, анти-ILT3 антитело, анти-ILT4 антитело, анти-ILT5 антитело, анти-ILT6-антитело, анти-ILT7-антитело, анти-ILT8-антитело, анти-CD40-антитело, анти-OX40-антитело, анти-ICOS антитело, анти-SIRPα антитело, анти-KIR2DL1 антитело, анти-KIR2DL2/3 антитело, анти-KIR2DL4 антитело, анти-KIR2DL5A-антитело, анти-KIR2DL5B антитело, анти-KIR3DL1 антитело, анти-KIR3DL2 антитело, анти-KIR3DL3 антитело, анти-NKG2A антитело, анти-NKG2C антитело, анти-NKG2E антитело, анти-4-1B антитело B (например, PF-05082566), анти-TSLP антитело, анти-IL-10 антитело, IL-10 или пегилированный IL-10 или любой ингибитор таких мишеней, принадлежащий к малым органическим молекулам.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент используют в сочетании с анти-PDL1 антителом (например, BMS-936559, дурвалюмабом (Durvalumab), MSB0010718C или MPDL3280A).
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем документе, используют в сочетании с анти-CTLA4 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-CS1 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-KIR2DL1/2/3 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-CD137 (например, урелумабом) антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем документе, используют в сочетании с анти-GITR (например, TRX518) антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-PD-L2 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-ITL1 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем документе, используют в сочетании с анти-ITL2 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем документе, используют в сочетании с анти-ITL3 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем документе, используют в сочетании с анти-ITL4 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-ITL5 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-ITL6 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем документе, используют в сочетании с анти-ITL7 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-ITL8 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-CD40 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-OX40- антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-KIR2DL1 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем документе, используют в сочетании с анти-KIR2DL2/3 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-KIR2DL4 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-KIR2DL5A антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем документе, используют в сочетании с анти-KIR2DL5B антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем документе, используют в сочетании с анти-KIR3DL1 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-KIR3DL2 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-KIR3DL3 антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-NKG2A- антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-NKG2C антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-ICOS антителом.
В варианте осуществления антитело или его антигенсвязывающий фрагмент, предоставленный в настоящем документе, используют в сочетании с анти-SIRPα антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем документе, используют в сочетании с анти-4-1BB антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с анти-IL-10 антителом.
В варианте осуществления антитело или его антигенсвязывающий фрагмент, предоставленный в настоящем документе, используют в сочетании с анти-TSLP антителом.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем документе, используют в сочетании с IL-10 или пегилированным IL-10.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, используют в сочетании с одним или несколькими ингибиторами (например, малой органической молекулой или антителом или антигенсвязывающим фрагментом такового), такими как MTOR-ингибитор (мишень рапамицина для млекопитающих), цитотоксический агент, платиновый агент, ингибитор EGFR, ингибитор VEGF, стабилизатор микротрубочек, таксаны, ингибитор CD20, ингибитор CD52, ингибитор CD30, RANK (рецепторный активатор ядерного фактора каппа- B) ингибитор, агонист STING, антагонист CXCR2, ингибитор RANKL (рецепторный активатор лиганда каппа-B ядерного фактора), ингибитор ERK, ингибитор киназы MAP, ингибитор AKT, ингибитор MEK, ингибитор PARP, ингибитор PI3K, ингибитор HER1, ингибитор HER2, ингибитор HER3, ингибитор HER4, ингибитор Bcl2, ингибитор CD22, ингибитор CD79b, ингибитор ErbB2 или ингибитор фарнезил-протеинтрансферазы.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем документе, используется в сочетании с любой одной или несколькими из списка, включающего: 13-цис-ретиноевую кислоту, 3- [5- (метилсульфонилпиперадинметил) индолил] хинолон, 4-гидрокситамоксифен, 5-дезооксиуридин, 5'-дезокси-5-фторуридин, 5-фторурацил, 6-мекаптопурин, 7-гидроксистауроспорин, A-443654, абиратеронацетат, абраксан, ABT-578, аколбифен, ADS-100380, ALT-110, альтримин, аминоглутетимид, амрубицин, амсакрин, анагрелид, анастрозол, ангиостатин, AP-23573, ARQ-197, арзоксифен, AS-252424, AS-605240, аспарагиназу, AT-9263, атрасентан, акситиниб, AZD1152, Bacillus Calmette-Guerin (BCG) вакцину, батабулин, BC-210, бесодутокс, бевацизумаб, бикалутамид, Bio111, BIO140, блеомицин, BMS-214662, BMS-247550, BMS-275291, BMS-310705, бортезимиб, бусерелин, бусульфан, кальцитриол, камптотецин, канертиниб, капецитабин, карбоплатин, кармустин, CC8490, седираниб, CG-1521, CG-781, хламидоцин, хлорамбуцил, хлоротоксин, циленгитид, цимитидин, цисплатин, кладрибин, COL-3, СР-724714, циклофосфамид, ципротерон, ципротеронацетат, цитарабин, цитозинарабинозид, дакарбазин, дациностат, дактиномицин, далотузумаб, данусертиб, дазатаниб, даунорубицин, декатаниб, дегуэлин, денилеукин, дезоксикоформицин, депсипептид, диарилпропионитрил, диэтилстилбестрол, дифититокс, доцетаксел, довитиниб, доксорубицин, дролоксифен, эдотекарин, меченный иттрием-90-эдотреотид, эдотреотид, EKB-569, EMD121974, эндостатин, эстрамустин, этопозид, эверолимус, экземестан, фиклатузумаб, финастерид, флавопиридол, флоксуридин, флударабин, флудрокортизон, флуоксиместерон, флутамид, схема FOLFOX, фулвестрант, галетерон, гефитиниб, гемцитабин, гиматекан, госерелин, госерелина ацетат, госсипол, GSK461364, GSK690693, HMR-3339, гидроксипрогестеронкапроат, гидроксимочевину, IC87114, идарубицин, идоксифен, ифосфамид, IM862, иматиниб, IMC-1C11, INCB24360, INO1001, интерферон (IFN), интерлейкин-12, ипилимумаб, иринотекан, JNJ-16241199, кетоконазол, KRX-0402, лапатиниб, лазофоксифен, летрозол, лейковорин, лейпролид, лейпролид ацетат, левамизол, липосомно-сохраненный паклитаксел, ломустин, лонафарниб, лукантон, LY292223, LY292696, LY293646, LY293684, LY294002, LY317615, маримастат, мехлоретамин, медроксипрогестеронацетат, мегестролацетат, мелфалан, меркаптопурин, метотрексат, митрамицин, митомицин, митотан, митоксантрон, тозасертиб, MLN8054, неовастат, нератиниб, нейрадиаб, нилотиниб, нилутимид, нолатрексед, NVP-BEZ235, облимерсен, октреотид, офатумумаб, олапариб, ореговомаб, ортеронел, оксалиплатин, паклитаксел, палбоциклиб, памидронат, панитумумаб, пазопаниб, PD0325901, PD184352, ПЭГ-интерферон, пеметрексед, пентостатин, перифозин, фенилаланинмустард, PI-103, пиктилизиб, PIK-75, пипендоксифен, PKI-166, пликамицин, порфимер, преднизон, прокарбазин, прогестины, PX-866, R-763, ралоксифен, ралтитрексед, разоксин, ридафоролимус, ритуксимаб, ромидепсин, RTA744, рубитекан, скриптаид, Sdx102, селициклиб, селуметиниб, семаксаниб, SF1126, сиролимус, SN36093, сорафениб, спиронолактон, скваламин, SR13668, стрептозоцин, SU6668, субероиланалид гидроксамовой кислоты, сунитиниб, синтетический эстроген, талампанел, талимоген лагерпарепвек, тамоксифен, темозоломид, темсиролимус, тенипозид, тесмилифен, тестостерон, тетрандрин, TGX-221, талидомид, тиогуанин, тиотепа, тицилимумаб, типифарниб, тивозаниб, TKI-258, TLK286, топотекан, торемифена цитрат, трабектидин, трастузумаб, третиноин, трихостатин А, трицирибинфосфата моногидрат, трипторелина памоат, TSE-424, горчичный урацил, вальпроевая кислота, валрубицин, вандетаниб, ваталаниб, афлиберцепт (VEGF Trap), винбластин, винкристин, виндезин, винорелбин, витаксин, витеспан, вориностат, VX-745, вортманнин, Xr311, занолимумаб,ZK186619, ZK-304709, ZM336372, ZSTK474.
Неограничивающие примеры подходящих противораковых агентов для использования в комбинации с антителом или антигенсвязывающим фрагментом такового, приведенные в настоящем документе, включают цитостатические агенты, цитотоксические агенты, целевые терапевтические агенты (малые молекулы, биологические препараты, siРНК и microРНК) против рака и опухолевых заболеваний. В одном варианте осуществления агент представляет собой антиметаболит (такой как метокрексат, 5-фторурацил, гемцитабин, флударабин, капецитабин). В одном варианте осуществления агент представляет собой алкилирующий агент, такой как темозоломид или циклофосфамид. В одном варианте осуществления агент представляет собой ДНК-взаимодействующий или ДНК-повреждающий агент, такой как цисплатин, оксалиплатин или доксорубицин. В одном варианте осуществления агент является ионизирующим излучением, таким как лучевая терапия. В одном варианте осуществления агент представляет собой ингибитор топоизомеразы II, такой как этопозид или доксорубицин. В одном варианте осуществления агент представляет собой ингибитор топоизомеразы I, такой как иринотекан или топотекан. В одном варианте осуществления агент представляет собой взаимодействующий с тубулином агент, такой как паклитаксел, доцетаксел, абраксанер или эпотилоны. В одном варианте осуществления агент представляет собой ингибитор белка кинезинового веретена. В одном варианте осуществления агент представляет собой ингибитор контрольной точки веретена деления. В одном варианте осуществления агент представляет собой ингибитор полимеразы поли(АДФ-рибозы) (PARP-ингибитор), такой как олапариб, нирапариб или велипариб. В одном варианте осуществления агент представляет собой ингибитор матричной металлопротеазы (ММР). В одном варианте осуществления агент представляет собой ингибитор ротеазы, такой как ингибитор катепсина D или катепсина К. В одном варианте осуществления агент представляет собой протеосому или ингибитор убиквитинирования, такой как бортезомиб. В одном варианте осуществления агент представляет собой стимулятор мутанта р53 для восстановления активности р53 дикого типа. В одном варианте осуществления агент представляет собой аденовирус-р53. В одном варианте осуществления агент представляет собой ингибитор Bcl-2, такой как ABT-263. В одном варианте осуществления агент представляет собой модулятор белка теплового шока (HSP), такой как гелданамицин и 17-AAG. В одном варианте осуществления агент представляет собой ингибитор изетондеацетилазы (HDAC), такой как вориностат (SAHA). В одном варианте осуществления агент представляет собой агент, модулирующий половые гормоны. В одном варианте осуществления агент представляет собой антиэстроген, такой как тамоксифен или фулвестрант. В одном варианте осуществления агент представляет собой селективный модулятор рецептора эстрогена (SERM), такой как ралоксифен. В одном варианте осуществления агент представляет собой антиандроген, такой как бикалутамид или флутамид. В одном варианте осуществления агент представляет собой агонист LHRH, такой как лейпролид. В одном варианте осуществления агент представляет собой ингибитор 5α-редуктазы, такие как финастерид. В одном варианте осуществления агент представляет собой цитохром P450 C17-лиазу (CYP450c17, также называемую 17αC). В одном варианте осуществления агент представляет собой ингибитор ароматазы, такой как летрозол, анастрозол или экземестан. В одном варианте осуществления агент представляет собой ингибитор киназы EGFR, такой как гефтиниб, эрлотиниб или лаптиниб. В одном варианте осуществления агент представляет собой двойной ингибитор erbB1 и erbB2, такой как лапатиниб. В одном варианте осуществления агент представляет собой многоцелевой ингибитор киназы (серин/треонин и/или тирозинкиназы). В одном варианте осуществления агент представляет собой ингибитор ABL-киназы, такой как иматиниб, нилотиниб или дазатиниб. В одном варианте осуществления агент представляет собой ингибитор VEGFR-1, VEGFR-2, PDGFR, KDR, FLT, c-Kit, Tie2, Raf, MEK или ERK, такой как сунитиниб, сорафениб, вандетаниб, пазопаниб, PLX-4032, акситиниб PTK787 или GSK-1120212. В одном варианте осуществления агент представляет собой ингибитор polo-подобной киназы. В одном варианте осуществления агент представляет собой ингибитор аврора-киназы. В одном варианте осуществления агент представляет собой ингибитор JAK. В одном варианте осуществления агент представляет собой ингибитор киназы c-MET. В одном варианте осуществления агент представляет собой ингибитор PI3K или ингибитор mTOR, такой как GDC-0941, BEZ-235, BKM-120 или AZD-8055. В одном варианте осуществления агент представляет собой рапамицин или аналог рапамицина, такой как темсиролимус, эверолимус или дефоролимус. В одном варианте осуществления агент является агонистом STING (стимулятора генов интерферона). В одном варианте осуществления агент представляет собой ингибитор CXCR (CXC Chemokine Receptor), CXCR2 антагонист.
Другие противораковые (также известные как противоопухолевое) агенты включают, не ограничиваясь таковыми, аra-C, адриамицин, цитоксан, карбоплатин, горчичный урацил, клорметин, ифосфамид, мелфалан, хлорамбуцил, пипоброман, триэтиленмеламин, Триэтилентиофосфорамин, бусульфан, кармустин, ломустин, стрептозоцин, дакарбазин, флоксуридин, цитарабин, 6-меркаптопурин, 6-тиогуанин, флударабин фосфат, пентостатин, винбластин, винкристин, виндезин, винорелбин, навелбин, блеомицин, дактиномицин, данорубицин, доксорубицин, эпирубицин, тенипозид, цитарабин, пеметрексед, идарубицин, митрамицин, деоксикоформицин, митомицин-С, L-аспарагиназа, тенипозид, этинилэстрадиол, диэтилстилбестрол, тестостерон, преднизон, флуоксиметазон, дромостанолон пропионат, тестолактон, мегестрол ацетат, метилпреднизолон, метилтестостерон, преднизолон, триамцинолон, хлортрианисен, гидроксипрогестерон, аминоглютетимид, эстрамустин, флутамид медроксипрогестерон ацетат, торемифен, гозерелин, карбоплатин, гидроксимочевина, амсакрин, прокарбазин, митотан, митоксантрон, левамизол, дроллоксафин, гексаметилмеламин, Бекссар®, Зевалин®, Трисенокс®, профимер, тиотепа, алтретамин, доксил, Онтак, Депоцит, Аранесп, Нейпоген®, Неуласта®, Кепиванс®. В одном варианте осуществления агент представляет собой ингибитор фарнезил-протеинтрансферазы, такой как SARASAR™ (4- [2- [4 - [(11R) -3,10-дибром-8-хлор-6,11-дигидро-5H-бензо) [5,6] циклогепта [1,2-b] пиридин-11-ил -] - 1-пиперидинил] -2-оксоэтил] пиперидинкарбоксамид, типифарниб. В одном варианте осуществления агент представляет собой интерферон, такой как интрон А или Peg-интрон. В одном варианте осуществления агент представляет собой анти-erbB1 антитело, такое как цетуксимаб или панитумумаб. В одном варианте осуществления агент представляет собой анти-erbB2 антитело, такое как трастузумаб. В одном варианте осуществления агент представляет собой антитело анти-CD52 антитело, такое как алемтузумаб. В одном варианте осуществления агент представляет собой анти-CD20 антитело, такое как ритуксимаб. В одном варианте осуществления агент представляет собой анти-CD33 антитело, такое как гемтузумаб озогамицин. В одном варианте осуществления агент представляет собой анти-VEGF антитело, такое как AVASTIN. Кроме того, агент представляет собой TRIAL-лиганд, такой как лексатумумаб, мапатумумаб или AMG-655. В одном варианте осуществления агент представляет собой анти-CTLA-4 антитело, такое как ипилимумаб. В одном варианте осуществления агент представляет собой антитело любого антигена, выбранного из списка: CTA1, CEA, CD5, CD19, CD22, CD30, CD44, CD44V6, CD55, CD56, EpCAM, FAP, MHCII, HGF, IL-6, MUC1, PSMA, TAL6, TAG-72, TRAILR, VEGFR, IGF-2 или FGF. В одном варианте осуществления агент представляет собой анти-IGF-1R антитело, такое как далотузумаб (MK-0646) или робатумумаб (SCH 717454).
«Модуляторы рецептора эстрогена» относятся к соединениям, которые препятствуют или ингибируют связывание эстрогена с рецептором независимо от механизма. Примеры модуляторов рецептора эстрогена включают, не ограничиваясь таковыми, тамоксифен, ралоксифен, идоксифен, LY353381, LY117081, торемифен, фульвестрант, 4- [7- (2,2-диметил-1-оксопропокси-4-метил-2- [ 4- [2- (1-пиперидинил) этокси] фенил] -2Н-1-бензопиран-3-ил] фенил-2,2-диметилпропаноат, 4,4'-дигидроксибензофенон-2,4-динитрофенилгидразон и SH646.
«Модуляторы андрогенных рецепторов» относятся к соединениям, которые препятствуют или ингибируют связывание андрогенов с рецептором независимо от механизма. Примеры модуляторов андрогенных рецепторов включают финастерид и другие ингибиторы 5α-редуктазы, нилутамид, флутамид, бикалутамид, лиарозол и абиратерона ацетат.
«Модуляторы ретиноидных рецепторов» относятся к соединениям, которые препятствуют или ингибируют связывание ретиноидов с рецептором независимо от механизма. Примеры таких модуляторов ретиноидных рецепторов включают бексаротен, третиноин, 13-цис-ретиноевую кислоту, 9-цис-ретиноевую кислоту, α-дифторметилорнитин, ILX23-7553, транс-N- (4'-гидроксифенил) ретинамид и N-4- карбоксифенил ретинамид.
«Цитотоксические/цитостатические агенты» относятся к соединениям, которые либо вызывают гибель клеток, либо ингибируют пролиферацию клеток, главным образом, путем непосредственного вмешательства в функционирование клетки, или препятствуют клеточному миозу или ингибируют таковой, и включают алкилирующие агенты, факторы некроза опухолей, интеркаляторы, активируемые гипоксией соединения, ингибиторы микротрубочек/агенты стабилизации микротрубочек, ингибиторы митотических кинезинов, ингибиторы гистондеацетилазы, ингибиторы киназ, участвующих в митотической прогрессии, ингибиторы киназ, участвующих в каскадах передачи сигналов цитокинов и факторов роста, антиметаболиты, модификаторы биологического ответа, гормональные/антигормональные терапевтические агенты, гемопоэтические факторы роста, терапевтические агенты, нацеленные на моноклональные антитела, ингибиторы топоизомеразы, ингибиторы протеосом, ингибиторы убиквитинлигазы и ингибиторы аврора-киназы.
Примеры цитотоксических/цитостатических агентов включают, не ограничиваясь таковыми, платиновые координационные соединения, сертенеф, кахектин, ифосфамид, тазонермин, лонидамин, карбоплатин, альтретамин, преднимустин, дибромдульцитол, ранимустин, фотемустин, недаплатин, оксалиплатин, темозоломид, гептаплатин, эстрамустин, тозилат импросульфана, трофосфамид, нимустин, хлорид диброспидия, пумитепу, лобаплатин, сатраплатин, профиромицин, цисплатин, ирофульвен, дексифосфамид, цис-аминдихлор(2-метилпиридин)платину, бензилгуанин, глуфосфамид, GPX100 (транс, транс, транс)-бис-мю-(гексан-1,6-диамин) -мю-[диаминплатина(II)] бис[диамин(хлор)платина(II)]тетрахлорид, диаризидинилспермин, триоксид мышьяка, 1-(11-додециламино-10-гидроксиундецил)-3,7- диметилксантин, зорубицин, идарубицин, даунорубицин, бизантрен, митоксантрон, пирарубицин, пинафид, валрубицин, амрубицин, антинеопластон, 3'-дезамино-3'-морфолино-13-дезоксо-10-гидроксикарминомицин, аннамицин, галарубицин, элинафид, MEN10755 и 4-деметокси-3-дезамино-3-азиридинил-4- метилсульфонилдаунорубицин (см. WO 00/50032).
Примером активируемого гипоксией соединения является тирапазамин.
Примеры ингибиторов протеосом включают, не ограничиваясь таковыми, лактацистин и MLN-341 (Velcade).
Примеры ингибиторов/стабилизаторов микротрубочек включают в себя таксаны в целом. Конкретные соединения включают паклитаксел (Таксол®), виндезин сульфат, 3',4'-дидегидро-4'-дезокси-8'-норвинкалеукобластин, доцетаксол (Таксотер®), ризоксин, доластатин, мивобулин изетионат, ауристатин, цемадотин, RPR109881, BMS184476, винфлунин, криптофицин, 2,3,4,5,6-пентафтор-N- (3-фтор-4-метоксифенил) бензолсульфонамид, ангидровинбластин, N, N-диметил-L-валил-L-валил-N-метил -L-валил-L-пролил-L-пролин-трет-бутиламид («L-валил-L-валил-N-метил-L-валил-L-пролил-L-пролин», описанный как SEQ ID NO:128), TDX258, эпотилоны (см., например, патенты США № 6284781 и 6288237) и BMS188797.
Некоторыми примерами ингибиторов топоизомеразы являются топотекан, гикаптамин, иринотекан, рубитекан, 6-этоксипропионил-3', 4'-O-экзобензилиден-чартреусин, 9-метокси-N, N-диметил-5-нитропиразоло [3,4,5-kl]акридин-2-(6H) пропанамин, 1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1H, 12H-бензо[де]пирано[3',4':b,7]-индолизино[1,2b]хинолин-10,13(9H,15H)дион, луртотекан, 7-[2-(N-изопропиламино)этил]-(20S)камптотецин, BNP1350, BNPI1100, BN80915, BN80942, этопозид фосфат, тенипозид, собузоксан, 2'-диметиламино-2'-дезокси-этопозид, GL331, N-[2-(диметиламино)этил]-9-гидрокси-5,6-диметил-6Н-пиридо[4,3-b]карбазол-1-карбоксамид, асулакрин, (5a,5aB,8aa,9b)-9-[2-[N-[2-(диметиламино)этил]-N-метиламино]этил]-5-[4-гидрокси-3,5-диметоксифенил]-5, 5а,6,8,8а,9-гексогидрофуро(3',4':6,7)нафто(2,3-d)-1,3-диоксол-6-он, 2,3-(метилендиокси)-5-метил-7-гидрокси-8-метоксибензо[с]-фенантридий, 6,9-бис[(2-аминоэтил)амино]бензо[g]изогуинолин-5,10-дион, 5-(3-аминопропиламино)-7, 10-дигидрокси-2-(2-гидроксиэтиламинометил)-6Н-пиразоло[4,5,1-де]акридин-6-он, N-[1-[2-(диэтиламино)этиламино]-7-метокси-9-оксо-9H-тиоксантен-4-илметил]формамид, N-(2-(диметиламино)этил)акридин-4-карбоксамид, 6-[[2-(диметиламино)этил]амино]-3-гидрокси-7H-индено[2,1-с]хинолин-7-он и димесна.
Примеры ингибиторов митотических кинезинов, и в частности митотического кинезина человека KSP, описаны в публикациях WO03/039460, WO03/050064, WO03/050122, WO03/049527, WO03/049679, WO03/049678, WO04/039774, WO03/079973, WO 03/099211, WO 03/105855, WO 03/106417, WO 04/037171, WO 04/058148, WO 04/058700, WO 04/126699, WO 05/018638, WO 05/019206, WO 05/019205, WO 05/018547, WO 05/017190, US2005/0176776. В одном варианте осуществления ингибиторы митотических кинезинов включают, не ограничиваясь таковыми, ингибиторы KSP, ингибиторы MKLP1, ингибиторы CENP-E, ингибиторы MCAK и ингибиторы Rab6-KIFL.
Примеры «ингибиторов гистондеацетилазы» включают, не ограничиваясь таковыми, SAHA, TSA, оксамфлатин, PXD101, MG98 и скриптаид. Дополнительную ссылку на другие ингибиторы гистондеацетилазы можно найти в следующей публикации: Miller, T.A. et al. J. Med. Chem. 46(24):5097-5116 (2003).
«Ингибиторы киназ, участвующих в прогрессировании митоза» включают, не ограничиваясь таковыми, ингибиторы аврора-киназы, ингибиторы Polo-подобных киназ (PLK; в частности, ингибиторы PLK-1), ингибиторы bub-1 и ингибиторы bub-R1. Примером «ингибитора аврора-киназы» является VX-680.
«Антипролиферативные агенты» включают антисмысловые олигонуклеотиды РНК и ДНК, такие как G3139, ODN698, RVASKRAS, GEM231 и INX3001, и антиметаболиты, такие как эноцитабин, эноцитабин, кармофур, тегафур, пентостатин, доксифлуридин, триметрексат, флударабин, капецитабин, галоцитабин, цитарабин окфосфат, гидрат фостеабина натрия, ралтитрексед, палтитрексид, эмитефур, тиазофурин, децитабин, нолатрексед, пеметрексед, нелзарабин, 2'-дезокси-2'-метилиденцитидин, 2'-фторометилен-2'-дезоксицитидин, N-[5-(2,3-дигидробензофурил)сульфонил]-N'-(3,4-дихлорфенил)мочевину, N6-[4-дезокси-4-[N2-[2(E),4(E)-тетрадекадиеноил]глициламино]-L-глицеро-В-L-манногептопиранозил] аденин, аплидин, эктеинасцидин, троксацитабин, 4-[2-амино-4-оксо-4,6,7,8-тетрагидро-3Н-пиримидино[5,4-b][1,4]тиазин-6-ил-(S)-этил]-2,5-тиеноил-L-глутаминовую кислоту, аминоптерин, 5-фторурацил, аланозин, эфир 11-ацетил-8-(карбамоилоксиметил)-4-формил-6-метокси-14-окса-1,11-диазатетрацикло(7.4.1.0.0)тетрадека-2,4,6-триен-9-илуксусной кислоты, швейнсонин, лометрексол, дексразоксан, метиониназу, 2'-циано-2'-дезокси-N4-пальмитоил-1-В-D-арабинофуранозилцитозин, 3-аминопиридин-2-карбоксальдегид тиосемикарбазон, и трастузумаб.
Примеры направленных терапевтических средств на основе моноклональных антител включают такие терапевтические средства, которые несут цитотоксические агенты или радиоизотопы, присоединенные к моноклональным антителам, специфичным для раковых клеток или специфичным для клеток-мишеней. Примеры включают бекссар.
«Ингибитор пренилпротеинтрансферазы» относится к соединению, ингибируещему любую отдельно взятый фермент или любое сочетание ферментов пренилпротеинтрансфераз, включая фарнезилпротеинтрансферазу (FPTase), геранилгеранилпротеинтрансферазу типа I (GGPTase-I) и геранилгеранилпротеинтрансферазу типа II (GGPTase-II, также называемую Rab GGPTase).
Примеры ингибиторов пренилпротеинтрансфераз можно найти в следующих публикацих и патентах: WO 96/30343, WO 97/18813, WO 97/21701, WO 97/23478, WO 97/38665, WO 98/28980, WO 98/29119, WO 95/32987, пат. США № 5420245, пат. США № 5523430, пат. США № 5532359, пат. США № 5510510, пат. США № 5589485, пат. США № 5602098, публ. европейского патента 0618221, публ. европейского патента 0675112, публ. европейского патента 0604181, публ. европейского патента 0696593, WO 94/19357, WO 95/08542, WO 95/11917, WO 95/12612, WO 95/12572, WO 95/10514, пат. США № 5661152, WO 95/10515, WO 95/10516, WO 95/24612, WO 95/34535, WO 95/25086, WO 96/05529, WO 96/06138, WO 96/06193, WO 96/16443, WO 96/21701, WO 96/21456, WO 96/22278, WO 96/24611, WO 96/24612, WO 96/05168, WO 96/05169, WO 96/00736, пат. США № 5571792, WO 96/17861, WO 96/33159, WO 96/34850, WO 96/34851, WO 96/30017, WO 96/33018, WO 96/30362, WO 96/30363, WO 96/31111, WO 96/31477, WO 96/31478, WO 96/31501, WO 97/00252, WO 97/03047, WO 97/03050, WO 97/04785, WO 97/02920, WO 97/170070, WO 97/23478, WO 97/26246, WO 97/30053, WO 97/44350, WO 98/02436 и пат. США № 5532359. Пример, касающийся роли ингибитора пренилпротеинтрансферазы при ангиогенезе, см. в European. J. of Cancer (1999), 35(9): 1394-1401.
«Ингибиторы ангиогенеза» относятся к соединениям, ингибирующим образование новых кровеносных сосудов, независимо от механизма. Примеры ингибиторов ангиогенеза включают, не ограничиваясь таковыми, ингибиторы тирозинкиназ, такие как ингибиторы тирозинкиназовых рецепторов Flt-1 (VEGFR1) и Flk-1/KDR (VEGFR2), ингибиторы эпидермального, фибробластного или тромбоцитарного факторов роста, ингибиторы ММР (металлопротеаз матрикса), блокаторы интегрина, интерферон-α, интерлейкин-12, пентозанполисульфат, ингибиторы циклооксигеназы, в том числе, нестероидные противовоспалительные средства (NSAID), подобные аспирину и ибупрофену, а также селективные ингибиторы циклооксигеназы-2, подобные целекоксибу и рофекоксибу (PNAS, Vol. 89, p. 7384 (1992); JNCI, Vol. 69, p. 475 (1982); Arch. Opthalmol., Vol. 108, p.573 (1990); Anat. Rec., Vol. 238, p. 68 (1994); FEBS Letters, Vol. 372, p. 83 (1995); Clin, Orthop. Vol. 313, p. 76 (1995); J. Mol. Endocrinol., Vol. 16, p.107 (1996); Jpn. J. Pharmacol., Vol. 75, p. 105 (1997); Cancer Res., Vol. 57, p. 1625 (1997); Cell, Vol. 93, p. 705 (1998); Intl. J. Mol. Med., Vol. 2, p. 715 (1998); J. Biol. Chem., Vol. 274, p. 9116 (1999), стероидные противовоспалительные средства (такие как кортикостероиды, минералокортикоиды, дексаметазон, преднизон, преднизолон, метилпред, бетаметазон), карбоксиамидотриазол, комбрестатин А-4, скваламин, 6-О-хлорацетилкарбонил)фумагиллол, талидомид, ангиостатин, тропонин-1, антагонисты ангиотензина II (см. Fernandez et al., J. Lab. Clin. Med. 105:141-145 (1985) и антитела к VEGF (см. Nature Biotechnology, Vol. 17, pp.963-968 (October 1999); Kim et al., Nature, 362, 841-844 (1993); WO 00/44777; and WO 00/61186).
Другие примеры ингибиторов ангиогенеза включают, не ограничиваясь таковыми, эндостатин, украин, ранпирназу, IM862, 5-метокси-4-[2-метил-3-(3-метил-2-бутенил)оксиранил]-1-оксаспиро[2,5]окт-6-ил(хлорацетил)карбамат, ацетилдинаналин, 5-амино-1-[[3,5-дихлор-4-(4-хлорбензоил)фенил]метил]-1H-1,2,3-триазол-4-карбоксамид, CM101, скваламин, комбретастатин, RPI4610, NX31838, фосфат сульфатированной маннопентозы, 7,7-(карбонил-бис[имино-N-метил-4,2-пирролокарбонилимино[N-метил-4,2-пиррол]карбонилимино]-бис-(1,3-нафталиндисульфонат) и 3-[(2,4-диметилпиррол-5-ил)метилен]-2-индолинон (SU5416).
Другие терапевтические агенты, модулирующие или ингибирующие ангиогенез, которые также могут использоваться в комбинации с соединениями, представленными в настоящем документе, включают агенты, модулирующие или ингибирующие системы коагуляции и фибринолиза (см. обзор в Clin. Chem. La. Med. 38:679-692 (2000)). Примеры таких агентов, модулирующих или ингибирующих каскад коагуляции и фибринолиза, включают, не ограничиваясь таковыми, гепарин (см. Thromb. Haemost. 80: 10-23 (1998)), низкомолекулярные гепарины и ингибиторы карбоксипептидазы U (также известные как ингибиторы активного тромбина, активируемого ингибитором фибринолиза [TAFIa]) (см. Thrombosis Res. 101: 329-354 (2001)). Ингибиторы TAFIa описаны в US № 60/310927 (подано 8 августа 2001 г.) и 60/349925 (подано 18 2002 г.).
«Агенты, влияющие на рецепторные тирозинкиназы (RTK)», относятся к соединениям, ингибирующим RTK и, следовательно, механизмы, участвующие в онкогенезе и прогрессировании опухоли. Такие агенты включают ингибиторы c-Kit, Eph, PDGF, Flt3 и c-Met. Другие агенты включают ингибиторы RTK, как описано в Bume-Jensen and Hunter, Nature, 411: 355-365, 2001.
«Ингибиторы клеточной пролиферации и путей передачи сигналов выживания» относятся к соединениям, ингибирующим каскады передачи сигналов, активируемые рецепторами на клеточной поверхности. Такие агенты включают ингибиторы серин/треонинкиназ (включая, без ограничения таковыми, ингибиторы Akt, такие как описаны в WO 02/083064, WO 02/083139, WO 02/083140, US 2004-0116432, WO 02/083138, US 2004- 0102360, WO 03/086404, WO 03/086279, WO 03/086394, WO 03/084473, WO 03/086403, WO 2004/041162, WO 2004/096131, WO 2004/096129, WO 2004/096135, WO 2004/096130, WO 2005/100356, WO 2005/100344, US 2005/029941, US 2005/44294, US 2005/43361, 60/734188, 60/652737, 60/670469), ингибиторы Raf-киназы (например, PLX-4032), ингибиторы MEK (например, Arry-162, RO-4987655 и GSK-1120212), ингибиторы mTOR (например, AZD-8055, BEZ-235 и эверолимус) и ингибиторы PI3K (например, GDC-0941, BKM) -120).
Как описано выше, термин "блокаторы интегрина" относится к соединениям, которые селективно противодействуют, ингибируют или препятствуют связыванию физиологического лиганда с αvβ3-интегрином, к соединениям, которые селективно противодействуют, ингибируют или препятствуют связыванию физиологического лиганда с αvβ5-интегрином, к соединениям, которые противодействуют, ингибируют или препятствуют связыванию физиологического лиганда как с αvβ3-интегрином, так и с αvβ5-интегрином, и к соединениям, которые противодействуют, ингибируют или препятствуют активности конкретного(ых) интегрина(ов), экспрессируемого(ых) в эдотелиальных клетках капилляров. Термин также относится к антагонистам αvβ6-, αvβ8-, α1β1-, α2β1-, α5β1-, α6β1- и α6β4-интегринов. Термин также относится к антагонистам любой комбинации из αvβ3-, αvβ5-, αvβ6-, αvβ8-, α1β1-, α2β1-, β5α1-, α6β1- и α6β4-интегринов.
Некоторые специфические примеры ингибиторов тирозинкиназы включают N-(трифторметилфенил)-5-метилизоксазол-4-карбоксамид, 3-[(2,4-диметилпиррол-5-ил)метилиденил)индолин-2-он, 17-(аллиламино)-17-деметоксигелданамицин, 4-(3-хлор-4-фторфениламино)-7-метокси-6-[3-(4-морфолинил)пропокси]хиназолин, N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин, BIBX1382, 2,3,9,10,11,12-гексагидро-10-(гидроксиметил)-10-гидрокси-9-метил-9,12-эпокси-1H-дииндоло[1,2,3-fg:3',2',1'-kl]пирроло[3,4-i][1,6]бензодиазоцин-1-он, SH268, генистеин, STI571, CEP2563, сульфонат 4-(3-хлорфениламино)-5,6-диметил-7H-пирроло[2,3-d]пиримидинметан, 4-(3-бром-4-гидроксифенил)амино-6,7-диметоксихиназолин, 4-(4'-гидроксифенил)амино-6,7-диметоксихиназолин, SU6668, STI571A, N-4-хлорфенил-4-(4-пиридилметил)-1-фталазинамин и EMD121974.
Комбинации непосредственно заявленных антител или антигенсвязывающих фрагментов с PPAR-γ (то есть PPAR-гамма) агонистами и PPAR-δ (то есть PPAR-дельта) агонистами могут примененяться при лечении определенных злокачественных опухолей. PPAR-γ и PPAR-δ представляют собой ядерные пероксисомные пролиферативно активированные γ- и δ-рецепторы. Экспрессия PPAR-γ в эндотелиальных клетках и ее участие в ангиогенезе было описано в литературе (см. J. Cardiovasc. Pharmacol. (1998) 31:909-913; J. Biol. Chem. (1999) 274:9116-9121; Invest. Ophthalmol Vis. Sci. (2000) 41:2309-2317). В настоящее время показано, что PPAR-γ агонисты ингибируют VEGF-опосредованный ангиогенный ответ in vitro; как троглитазон, так и малеат розиглитазона ингибируют развитие ретинальной неоваскуляризации у мышей (Arch. Ophthalmol. (2001) 119:709-717). Примеры PPAR-γ агонистов и PPAR-γ/α-агонистов включают, без ограничения, линпарзу (Lynparza®), рукапариб (Rucaparib®), талазопариб (Talazoparib®), нирапариб, велипариб (Veliparib®), тиазолидиндионы (такие, как DRF2725, CS-011, троглитазон, розиглитазон и пиоглитазон), фенофибрат, гемфиброзил, клофибрат, GW2570, SB219994, AR-H039242, JTT-501, MCC-555, GW2331, GW409544, NN2344, KRP297, NP0110, DRF4158, NN622, GI262570, PNU182716, DRF552926, 2-[(5,7-дипропил-3-трифторметил-1,2-бензизоксазол-6-ил)окси]-2-метилпропионовую кислоту и 2(R)-7-(3-(2-хлор-4-(4-фторфенокси)фенокси)пропокси)-2-этилхроман-2-карбоновую кислоту.
Антитела или антигенсвязывающие фрагменты таковых, представленные в настоящем документе, также могут применяться для лечения или профилактики рака молочной железы в сочетании с ингибиторами ароматазы. Примеры ингибиторов ароматазы включают, без ограничения, анастрозол, летрозол и экземестан.
Антитела или антигенсвязывающие фрагменты таковых, представленные в настоящем документе, также могут быть применены для лечения рака в сочетании со следующими химиотерапевтическими агентами: абареликс (Plenaxis depot®); альдеслейкин (Prokine®); Алдеслейкин (Proleukin®) ; Алемтузумабб (Campath®); алитретиноин (Panretin®); аллопуринол (Zyloprim®); альтретамин (Hexalen®); амифостин (Ethyol®); анастрозол (Arimidex®); триоксид мышьяка (Trisenox®); аспарагиназа (Elspar®); азацитидин (Vidaza®); бендамустина гидрохлорид (Treanda®); бевакузимаб (Avastin®); капсулы бексаротена (Targretin®); бексаротиновый гель (Targretin®); блеомицин (Blenoxane®); бортезомиб (Velcade®); брефельдин А; бусульфан внутривенно (Busulfex®); пероральный бусульфан (Myleran®); калустерон (Methosarb®); капецитабин (Xeloda®); карбоплатин (Paraplatin®); кармустин (BCNU®, BiCNU®); кармустин (Gliadel®); имплантат кармустина с полифепрозаном 20 20 (Gliadel Wafer®); целекоксиб (Celebrex®); цетуксимаб (Erbitux®); хлорамбуцил (Leukeran®); цисплатин (Platinol®); кладрибин (Leustatin®, 2-CdA®); клофарабин (Clolar®); циклофосфамид (Cytoxan®, Neosar®); циклофосфамид (Cytoxan Injection®); циклофосфамид (Cytoxan Tablet®); цитарабин (Cytosar-U®); цитарабин липосомальный (DepoCyt®); дакарбазин (DTIC-Dome®); дактиномицин, актиномицин D (Cosmegen®); инъекционный дальтепарин натрия (Fragmin®); Дарбепоэтин альфа (Aranesp®); дасатиниб (Sprycel®); даунорубицин липосомальный (DanuoXome®); даунорубицин, дауномицин (Daunorubicin®); даунорубицин, дауномицин (Cerubidine®); дегареликс (Firmagon®); денилейкин дифтитокс (Ontak®); дексразоксан (Zinecard®); дексразоксан гидрохлорид (Totect®); дидемнин B; 17-DMAG; доцетаксел (Taxotere®); доксорубицин (Adriamycin PFS®); доксорубицин (Adriamycin®, Rubex®); доксорубицин (Adriamycin PFS Injection®); доксорубицин липосомальный (Doxil®); дромостанолона пропионат (Dromostanolone®); дромостанолона пропионат (Masterone Injection®); инъекция экулизумаба (Soliris®); Elliott's B раствор (Elliott’s B Solution®); элтромбопаг (Promacta®); эпирубицин (Ellence®); Эпоэтин альфа (Epogen®); эрлотиниб (Tarceva®); эстрамустин (Emcyt®); этинил эстрадиол; этопозид фосфат (Etopophos®); этопозид, VP-16 (Vepesid®); таблетки эверолимуса (Afinitor®); экземестан (Aromasin®); ферумокситол (Feraheme Injection®); филграстим (Neupogen®); флоксуридин (внутриартериальный) (FUDR®); флударабин (Fludara®); фторурацил, 5-FU (Adrucil®); фулвестрант (Faslodex®); гефитиниб (Iressa®); гельданамицин; гемцитабин (Gemzar®); гемтузумаб озогамицин (Mylotarg®); ацетат гозерелина (Zoladex Implant®); ацетат гозерелина (Zoladex®); гистрелин ацетат (Histrelin implant®); гидроксимочевина (Hydrea®); Ибритумомаб Тиуксетан (Zevalin®); идарубицин (Idamycin®); ифосфамид (IFEX®); мезилат иматиниба (Gleevec®); интерферон альфа 2а (Roferon A®); Интерферон альфа-2b (Intron А®); инъекция иобенгуана I 123 (AdreView®); иринотекан (Camptosar®); иксабепилон (Ixempra®); таблетки лапатиниба (Tykerb®); леналидомид (Revlimid®); летрозол (Femara®); лейковорин (Wellcovorin®, Leucovorin®); Леупролид ацетат (Eligard®); левамизол (Ergamisol®); ломустин, CCNU (CeeBU®); меклоретамин, горчица азота (Mustargen®); ацетат мегестрола (Megace®); мелфалан, L-PAM (Alkeran®); меркаптопурин, 6-MP (Purinethol®); месна (Mesnex®); месна (Mesnex tabs®); метотрексат (Methotrexate®); метоксален (Uvadex®); 8-метоксипсорален; митомицин С (Mutamycin®); митотан (Lysodren®); митоксантрон (Novantrone®); митрамицин; нандролон фенпропионат (Durabolin -50®); неларабин (Arranon®); нилотиниб (Tasigna®); Нофетумомаб (Verluma®); офатумумаб (Arzerra®); Опрелвекин (Neumega®); оксалиплатин (Eloxatin®); паклитаксел (Paxene®); паклитаксел (Taxol®); связанные с белком частицы паклитаксела (Abraxane®); палифермин (Kepivance®); памидронат (Aredia®); панитумумаб (Vectibix®); таблетки пазопаниб (Votrienttm®); пегадемаза (Adagen (Pegademase Bovine)®); пегаспаргаза (Oncaspar®); пегфилграстим (Neulasta®); пеметрексед динатрия (Alimta®); пентостатин (Nipent®); пипоброман (Vercyte®); плериксафор (Mozobil®); пликамицин, митрамицин (Mithracin®); порфимер натрия (Photofrin®); инъекция пралатрексата (Folotyn®); прокарбазин (Matulane®); хинакрин (Atabrine®); рапамицин; расбуриказа (Elitek®); ралоксифен гидрохлорид (Evista®); Ритуксимаб (Rituxan®); ромидепсин (Istodax®); ромиплостим (Nplate®); сарграмостим (Leukine®); сарграмостим (Prokine®); сорафениб (Nexavar®); стрептозоцин (Zanosar®); сунитиниб малеат (Sutent®); тальк (Sclerosol®); тамоксифен (Nolvadex®); темозоломид (Temodar®); темсиролимус (Torisel®); тенипозид, ВМ-26 (Vumon®); тестолактон (Teslac®); тиогуанин, 6-TG (Thioguanine®); тиопурин; тиотепа (Thioplex®); топотекан (Hycamtin®); торемифен (Fareston®); Тозитумомаб (Bexxar®); Тозитумомаб/I-131 тозитумомаб (Bexxar®); транс-ретиноевая кислота; трастузумаб (Herceptin®); третиноин, ATRA (Vesanoid®); триэтиленмеламин; урацил горчица (Uracil Mustard Capsules®); валрубицин (Valstar®); винбластин (Velban®); винкристин (Oncovin®); винорелбин (Navelbine®); вориностат (Zolinza®); вортманнин; и золедронат (Zometa®).
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент, предоставленный в настоящем документе, используют в сочетании с одним или несколькими противорвотными средствами, включая, без ограничения таковыми: каспитант (GlaxoSmithKline), нетупитант (MGI-Helsinn) и другие антагонисты рецептора NK-1, палоносетрон (в продаже как Aloxi от MGI Pharma), апрепитант в продаже как Emend от Merck and Co.; Rahway, NJ), дифенгидрамин (в продаже как Benadryl® от Pfizer; Нью-Йорк, Нью-Йорк), гидроксизин (в продаже как Atarax® от Pfizer; New; Йорк, Нью-Йорк), метоклопрамид (в продаже как Reglan® от AH Robins Co, Ричмонд, Вирджиния), лоразепам (в продаже как Ativan® от Wyeth; Мэдисон, Нью-Джерси), алпразолам (в продаже как Xanax® от Pfizer; Нью-Йорк, Нью-Йорк) галоперидол (в продаже как Haldol® от Ortho-McNeil; Raritan, NJ), дроперидол (Inapsine®), дронабинол (в продаже как Marinol® от Solvay Pharmaceuticals, Inc.; Marietta, GA), дексаметазон (в продаже как Decadron® от Merck и Co.; Rahway, NJ), метилпреднизолон (в продаже как Medrol® от Pfizer; New York, NY), прохлорперазин (в продаже как Compazine® от Glaxosmithkline; Research Tri Angle Park, NC), гранисетрон (в продаже как Kytril® от Hoffmann-La Roche Inc.; Nutley, NJ), ондансетрон (продается как Zofran® от Glaxosmithkline; Research Triangle Park, NC), долазетрон (в продаже как Anzemet® от Sanofi-Aventis; New York, NY), трописетрон (в продаже как Navoban® от Novartis; East Hanover, NJ).
Другие побочные эффекты при лечении рака включают дефицит красных и белых кровяных клеток. Соответственно, в одном варианте осуществления антитело или его антигенсвязывающий фрагмент связаны с агентом, излечивающим или предотвращающим такой дефицит, как, например, филграстим, ПЭГ-филграстим, эритропоэтин, эпоэтин-альфа или дарбэпоэтин-альфа.
В одном варианте осуществления введение антитела или антигенсвязывающего фрагмента такового, представленных в настоящем документе, сочетают с противораковой лучевой терапией. Например, в одном варианте осуществления лучевая терапия представляет собой внешнюю лучевую терапию (EBT): способ доставки пучка высокоэнергетического рентгеновского излучения на локализированную опухоль. Луч генерируется вне пациента (например, линейным ускорителем) и направляется на участок опухоли. Такие рентгеновские лучи могут разрушать раковые клетки, а тщательное планирование лечения позволяет сохранить прилежащие нормальные ткани. Внутри тела пациента радиоактивные источники не размещаются. В одном варианте осуществления лучевая терапия представляет собой протонную лучевую терапию: тип конформной терапии, обеспечивающей бомбардировку больной ткани протонами вместо рентгеновских лучей. В одном варианте осуществления лучевая терапия представляет собой конформную лучевую терапию с использованием внешнего луча: процедура, в которой используются современные технологии для адаптации лучевой терапии к структурам тела индивидуума. В одном варианте осуществления лучевая терапия представляет собой брахитерапию: временное размещение радиоактивных материалов в организме, обычно используемое для подачи дополнительной дозы или повышения радиации в конкретной области.
В одном варианте осуществления хирургическая процедура удаления опухоли проводится в сочетании с терапией антителом или его антигенсвязывающим фрагментом.
Фармацевтические композиции и их введение
Для приготовления фармацевтических или стерильных композиций антител и антигенсвязывающих фрагментов, представленных в настоящем документе, антитело или его антигенсвязывающий фрагмент могут быть смешаны с фармацевтически приемлемым носителем или наполнителем. См., например, Remington’s Pharmaceutical Sciences and U.S. Pharmacopeia: National Formulary, Mack Publishing Company, Easton, PA (1984).
Составы терапевтических и диагностических агентов могут быть получены путем смешивания с приемлемыми носителями, эксципиентами или стабилизаторами в форме, например, лиофилизированных порошков, суспензий, водных растворов или суспензий (см., например, Hardman, et al. (2001) Goodman and Gilman’s The Pharmacological Basis of Therapeutics, McGraw-Hill, New York, NY; Gennaro (2000) Remington: The Science and Practice of Pharmacy, Lippincott, Williams, and Wilkins, New York, NY; Avis, et al. (eds.) (1993) Pharmaceutical Dosage Forms: Parenteral Medications, Marcel Dekker, NY; Lieberman, et al. (eds.) (1990) Pharmaceutical Dosage Forms: Tablets, Marcel Dekker, NY; Lieberman, et al. (eds.) (1990) Pharmaceutical Dosage Forms: Disperse Systems, Marcel Dekker, NY; Weiner and Kotkoskie (2000) Excipient Toxicity and Safety, Marcel Dekker, Inc., New York, NY).
Токсичность и терапевтическая эффективность антител, представленных в настоящем документе, вводимых отдельно или в комбинации с другим терапевтическим агентом, может быть определена стандартными фармацевтическими процедурами в клеточных культурах или на экспериментальных животных, используемых, например, для определения LD50 (доза, летальная для 50% популяции) и ED50 (доза, терапевтически эффективная для 50% популяции). Соотношение доз токсических и терапевтических эффектов называется терапевтическим индексом (LD50/ED50). Данные, полученные из таких анализов клеточных культур и исследований на животных, могут быть использованы при составлении диапазона дозировок примененительно к человеку. Дозировка таких соединений предпочтительно находится в диапазоне циркулирующих концентраций, включающих ED50 с небольшой токсичностью или без нее. Дозировка может варьироваться в пределах этого диапазона в зависимости от используемой лекарственной формы и пути введения.
В дополнительном варианте осуществления дополнительный терапевтический агент, вводимый индивиду в сочетании с антителом или его антигенсвязывающим фрагментом, предоставлен в настоящем документе в соответствии с Physicians’ Desk Reference 2003 (Thomson Healthcare; 57th edition (November 1, 2002)).
Режим введения может варьироваться. Пути введения включают пероральный, ректальный, трансмукозальный, кишечный, парентеральный; внутримышечный, подкожный, внутрикожный, интрамедуллярный, интратекальный, прямой внутрижелудочковый, внутривенный, внутрибрюшинный, интраназальный, внутриглазный, ингаляционный, инсуффляционный, местный, кожный, трансдермальный или внутриартериальный.
В конкретных вариантах осуществления антитела или антигенсвязывающие фрагменты таковых, представленные в настоящем документе, можно вводить инвазивным путем, таким как инъекция. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент или фармацевтическую композицию таковых вводят внутривенно, подкожно, внутримышечно, внутриартериально, внутриопухолево или путем ингаляции, аэрозолем. Также предполагается введение неинвазивными путями (например, перорально; например, в таблетках, капсулах или пилюлях).
Также предоставляется контейнер (например, пластиковый или стеклянный флакон, например, с колпачком или хроматографической колонкой, или с иглой с полым отверстием или цилиндром шприца), содержащий любое из антител или антигенсвязывающих фрагментов, представленных в настоящем документе, или фармацевтическую композицию таковых. Также предоставлено инъекционное устройство, содержащее любое из антител или антигенсвязывающих фрагментов, представленных в настоящем документе, или фармацевтическую композицию таковых. Инъекционное устройство представляет собой устройство, вводящее вещество в организм пациента парентеральным путем, например внутримышечно, подкожно или внутривенно. Например, инъекционное устройство может представлять собой шприц (например, такой как автоинжектор, предварительно заполненный фармацевтической композицией), который, например, включает цилиндр или контейнер для удерживания инъекционной жидкости (например, содержащую антитело или фрагмент или фармацевтическую композицию таковых), иглу для прокалывания кожи и/или кровеносных сосудов для инъекции жидкости; и поршень для выталкивания жидкости из цилиндра через отверстие в игле. В варианте осуществления инъекционное устройство, содержащее биспецифичное антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, или фармацевтическую композицию таковых, представляет собой устройство для внутривенных (IV) инъекций. Такое устройство содержит антитело или его фрагмент, или фармацевтическую композицию таковых в канюле или троакаре/игле, которые могут быть прикреплены к емкости, в свою очередь, прикрепленной к мешочку или резервуару для удержания жидкости (например, физиологического раствора; или раствора Рингера с лактатом, который содержит NaCl, лактат натрия, KCl, CaCl2 и, необязательно, может включать глюкозу), и которые вводятся в организм пациента через канюлю или троакар/иглу. В некоторых вариантах осуществления антитело или его фрагмент, или фармацевтическую композицию вводят в устройство после того, как троакар и канюлю вводят в вену индивида и троакар удаляют из вставленной канюли. Устройство для внутривенного вливания может, например, быть введено в периферическую вену (например, ладони или руки); верхнюю полую вену, нижнюю полую вену или вену внутри правого предсердия сердца (например, при центральном IV); или в подключичную, внутреннюю яремную или бедренную вену и, например, продвинуто по направлению к сердцу до тех пор, пока оно не достигнет верхней полой вены или правого предсердия (например, центральной венозной линии). В варианте осуществления инъекционное устройство представляет собой автоинжектор; струйный инжектор или внешний инфузионный насос. В струйном инжекторе используется узкая струя жидкости под высоким давлением, которая проникает в эпидермис, чтобы ввести антитело или его фрагмент или фармацевтическую композицию в организм пациента. Внешние инфузионные насосы представляют собой медицинские устройства, доставляющие антитело или его фрагмент или фармацевтическую композицию в организм пациента в контролируемых количествах. Внешние инфузионные насосы могут приводиться в действие электрически или механически. Различные насосы работают по-разному, например, шприцевой насос удерживает жидкость в резервуаре шприца, а подвижный поршень контролирует подачу жидкости, эластомерный насос удерживает жидкость в растяжимом резервуаре баллона и давление от упругих стенок баллона управляет доставкой жидкости. В перистальтическом насосе набор роликов прижимается к гибкой трубке, выталкивая жидкость вперед. В многоканальном насосе жидкости могут доставляться из нескольких резервуаров с различной скоростью.
Фармацевтические композиции, раскрытые в данном описании, также можно вводить с помощью безыгольного устройства для подкожных инъекций; как, например, устройства, раскрытые в патентах США №№ 6620355; 6096002; 5399163; 5383851; 5312335; 5064413; 4941880; 4790824 или 4596556. Такие безыгольные устройства, содержащие фармацевтическую композицию, также могут быть рассмотрены. Фармацевтические композиции, раскрытые в данном описании, также можно вводить инфузией. Примеры хорошо известных имплантатов и модулей для введения фармацевтических композиций включают таковые, раскрытые в: патенте США № 4487603, в котором раскрыт имплантируемый микроинфузионный насос для дозирования лекарства с контролируемой скоростью; в патенте США № 4447233, в котором раскрыт насос для инфузии лекарственного средства для доставки лекарства с точной скоростью инфузии; в патенте США № 4447224, в котором раскрыт имплантируемый инфузионный аппарат с переменным потоком для непрерывной доставки лекарственного средства; в патенте США № 4439196, в котором раскрыта осмотическая система доставки лекарственного средства, имеющая многокамерные отделения. Многие другие такие имплантаты, системы доставки и модули хорошо известны специалистам в данной области техники, и те из них, которые содержат фармацевтические композиции, представленные в настоящем документе, также могут быть рассмотрены.
Режим введения зависит от нескольких факторов, включая скорость обмена терапевтического антитела или антигенсвязывающего фрагмента в сыворотке или ткани, уровень симптомов, иммуногенность терапевтического антитела и доступность клеток-мишеней в биологическом матриксе. Предпочтительно, схема введения обеспечивает достаточное количество терапевтического антитела или фрагмента, обеспечивающего улучшение состояния целевого заболевания, при одновременной минимизации нежелательных побочных эффектов. Соответственно, количество доставляемого биопрепарата частично зависит от конкретного терапевтического антитела и тяжести состояния индивида, подлежащего лечению. Руководство по выбору подходящих доз терапевтических антител или фрагментов является доступным (см., например, Wawrzynczak (1996) Antibody Therapy, Bios Scientific Pub. Ltd, Oxfordshire, UK; Kresina (ed.) (1991) Monoclonal Antibodies, Cytokines and Arthritis, Marcel Dekker, New York, NY; Bach (ed.) (1993) Monoclonal Antibodies and Peptide Therapy in Autoimmune Diseases, Marcel Dekker, New York, NY; Baert, et al. (2003) New Engl. J. Med. 348:601-608; Milgrom et al. (1999) New Engl. J. Med. 341:1966-1973; Slamon et al. (2001) New Engl. J. Med. 344:783-792; Beniaminovitz et al. (2000) New Engl. J. Med. 342:613-619; Ghosh et al. (2003) New Engl. J. Med. 348:24-32; Lipsky et al. (2000) New Engl. J. Med. 343:1594-1602).
Определение подходящей дозы производится клиницистом, например, с использованием параметров или факторов, известных или предполагаемых в данной области, для эффективного лечения. Как правило, доза начинается с количества, несколько меньшего, чем оптимальная доза, и затем оно постепенно увеличивается, пока не будет достигнут желаемый или оптимальный эффект относительно любых отрицательных побочных эффектов. Важные диагностические измерения включают в себя диагностику симптомов, например воспалительных, или измерения уровня продуцируемых воспалительных цитокинов. В общем, желательно, чтобы используемый биопрепарат был получен из того же самого вида, что и субьект, для которого предназначено лечение, тем самым сводя к минимуму любой иммунный ответ на реагент. В случае человека, например, могут быть желательны гуманизированные и полностью человеческие антитела.
Используемый в настоящем документе термин «эффективное количество» относится к количеству биспецифичного антитела или антигенсвязывающего фрагмента такового, представленных в данном документе, которое, при введении таковых отдельно или в сочетании с дополнительным терапевтическим агентом в клетку, ткань или в организм индивида, является эффективным для индукции измеримого улучшения одного или нескольких симптомов заболевания. При применении к отдельному активному ингредиенту, вводимому отдельно, эффективная доза относится только к этому ингредиенту. При применении к комбинации, эффективная доза относится к объединенным количествам активных ингредиентов, приводящих к терапевтическому эффекту, независимо от того, вводятся ли они в комбинации, последовательно, или одновременно. Эффективное количество терапевтического средства приводит к улучшению диагностической величины или параметра, по меньшей мере, на 10%; обычно, по меньшей мере, на 20%; предпочтительно, по меньшей мере, около 30%; более предпочтительно, по меньшей мере, на 40% и, наиболее предпочтительно, по меньшей мере, на 50%. Эффективное количество может также привести к улучшению субъективного измерения в тех случаях, когда субъективные параметры используются для оценки тяжести заболевания.
Наборы
Дополнительно предоставлены наборы, содержащие один или несколько компонентов, которые включают, не ограничиваясь таковыми, анти-PD-1 антитело или его антигенсвязывающий фрагмент в сочетании с одним или несколькими дополнительными компонентами, включая, без ограничения, фармацевтически приемлемый носитель и/или терапевтический агент, как обсуждалось в данном документе. Антитело или фрагмент и/или терапевтический агент могут быть составлены в виде чистой композиции или в комбинации с фармацевтически приемлемым носителем в фармацевтической композиции.
В одном варианте осуществления набор включает антитело или его антигенсвязывающий фрагмент, представленный в настоящем документе, или фармацевтическую композицию таковых в одном контейнере (например, в стерильном стеклянном или пластиковом флаконе), и фармацевтическую композицию с терапевтическим агентом или терапевтический агент отдельно в другом контейнере (например, в стерильном стеклянном или пластиковом флаконе).
В другом варианте осуществления набор включает комбинацию, включающую антитело или его антигенсвязывающий фрагмент, предоставленные в настоящем документе, вместе с фармацевтически приемлемым носителем, необязательно в комбинации с одним или несколькими терапевтическими агентами, присутствующими вместе, необязательно, в одной фармацевтической композиции, в одном общем контейнере.
Если набор включает фармацевтическую композицию для парентерального введения индивиду, то набор может включать устройство для выполнения такого введения. Например, набор может включать одну или несколько игл для подкожных инъекций или другие инъекционные устройства, как обсуждалось выше.
Набор может включать вкладыш в упаковку, включающий информацию о фармацевтических композициях и дозированных формах, содержащихся в наборе. Как правило, такая информация помогает пациентам и врачам эффективно и безопасно использовать прилагаемые фармацевтические композиции и лекарственные формы. Например, следующая информация, касающаяся комбинации агентов, представленных в настоящем документе, может быть предоставлена во вкладыше: фармакокинетика, фармакодинамика, клинические исследования, параметры эффективности, показания к применению, противопоказания, предупреждения, меры предосторожности, побочные реакции, передозировка, правильная дозировка и способы введения, информация о поставщике, надлежащие условия хранения, справочная информация, информация о производителе/распространителе и патентная информация.
Для удобства, антитело или его антигенсвязывающий фрагмент могут быть предоставлены в наборе, то есть в упакованной комбинации реагентов в заранее определенных количествах с инструкциями для проведения анализа диагностического характера или с целью обнаружения/детекции определенных маркеров. Если метка антитела или фрагмента осуществляется ферментом, то набор может включать субстраты и кофакторы, необходимые для работы фермента (например, предшественник субстрата, предоставлеющего обнаруживаемый хромофор или флуорофор). Кроме того, могут быть включены другие добавки, такие как стабилизаторы, буферы (например, буфер-блокатор или буфер для лизиса) и тому подобное. Относительные количества различных реагентов могут широко варьироваться для обеспечения в растворе концентраций реагентов, существенно оптимизирующих чувствительность анализа. В частности, реагенты могут быть предоставлены в виде сухих порошков, обычно лиофилизированных, и могут включать наполнители, которые при растворении дают раствор реагента, имеющий соответствующую концентрацию.
Также предоставляются диагностические реагенты или реагенты для проведения детекции и наборы, содержащие один или несколько таких реагентов для использования в различных анализах обнаружения/детекции, включая, например, иммуноанализ, как например, иммуноферментный анализ (ELISA) (сэндвич-типа или альтернативного формата). Компоненты набора могут быть предварительно прикреплены к твердой подложке или могут быть нанесены на поверхность твердой подложки в ходе использовании набора. В некоторых вариантах осуществления средство генерации сигнала может предварительно связываться с антителом или фрагментом, представленными в настоящем документе, или может нуждаться в комбинации одного или нескольких компонентов, например буфера, конъюгатов антитело-фермент, субстратов фермента или тому подобных, перед использованием. Наборы могут также включать дополнительные реагенты, например блокирующие реагенты для уменьшения неспецифического связывания с поверхностью твердой фазы, моющие реагенты, субстраты ферментов и тому подобное. Поверхность твердой фазы может быть представлена в форме трубки, гранулы, микротитровального планшета, микросферы или других материалов, подходящих для иммобилизации белков, пептидов или полипептидов. В конкретных аспектах фермент, катализирующий образование хемилюминесцентного или хромогенного продукта или восстановление хемилюминесцентного или хромогенного субстрата, является компонентом схемы генерации сигнала. Такие ферменты хорошо известны в данной области техники. Наборы могут содержать любой из агентов захвата сигнала и реагентов обнаружения, описанных в настоящем документе. Необязательно, набор также может содержать инструкции по реализации способов, представленных в настоящем документе.
Также предоставлен набор, содержащий анти-PD-1 антитело или его антигенсвязывающий фрагмент, упакованный в контейнер, такой как флакон или бутылочка, и дополнительно содержащий этикетку, прикрепленную, или упакованную вместе с контейнером, описывающую содержимое контейнера и предоставляющую указания и/или инструкции по использованию содержимого контейнера для лечения одного или нескольких заболеваний, описанных в данном документе.
Как обсуждалось выше в разделе комбинированной терапии, одновременное введение двух терапевтических агентов не требует введения агентов в одно и то же время или по одному и тому же пути введения при условии, что существует перекрывание периодов времени, в течение которого агенты оказывают терапевтический эффект. Может рассматриваться как одновременное или последовательное введение, так и введение в разные дни или разные недели.
Раскрытые в настоящем документе терапевтические наборы и наборы для детекции также могут быть подготовлены с включением, по меньшей мере, одного из антител, пептида, антигенсвязывающего фрагмента или полинуклеотида, описанных в настоящем документе, и инструкций по применению композиции в качестве реагента детекции или как терапевтического агента. Контейнеры для использования в таких наборах могут содержать, по меньшей мере, один флакон, пробирку, колбу, бутылочку, шприц или другую подходящую емкость, в которую может быть помещен одна или несколько детектерных и/или терапевтических композиций, предпочтительно разделенных на удобные аликвоты. При предоставлении второго терапевтического агента, набор может также содержать второй отдельный контейнер, вмещающий вторую детекторную и/или терапевтическую композицию. Альтернативно, множество соединений может быть приготовлено в одной фармацевтической композиции и упаковано в один контейнер, такой как флакон, колба, шприц, бутылочка или другой подходящий общий контейнер. Раскрытые в настоящем документе наборы также обычно включают в себя средства для удержания флакона(-ов) плотно упакованными для коммерческой продажи, как, например, пластиковые контейнеры выдувного формования, в которых удерживаются желаемый(ые) флакон(-ы). Если в набор входит средство обнаружения или обнаруживаемая (детекторная) метка радиоактивного, хромогенного, флуоригенного или другого типа, то такой маркировочный агент может быть предоставлен либо в том же контейнере, что и сама композиция для детекции или терапии, либо альтернативно такой агент может быть помещен во второй отдельный контейнер, где эта вторая композиция соответствующим образом разделена на аликвоты. Альтернативно, реагент для детекции и этикетка могут предоставляться в одном контейнере, и в большинстве случаев набор также обычно включает средства для хранения флакона(-ов) тесно упакованными для коммерческой продажи и/или в упаковке, удобной для доставки.
Также предоставляется аппарат или устройство для осуществления способов детекции или мониторинга, описанных в настоящем документе. Такое устройство может включать камеру или трубку, в которую введится образец, систему обработки жидкости, необязательно включающую клапаны или насосы для направления потока образца сквозь устройство, необязательно - фильтры для отделения плазмы или сыворотки от цельной крови, смесительные камеры для добавления агентов захвата или реагентов детекции и, необязательно, детектирующее устройство для определения количества обнаруживаемой метки, связавшейся с иммунокомплексом агента захвата. Подача (поток) образца может осуществляться пассивно (например, под действием капиллярных, гидростатических или других сил, не требующих дополнительных манипуляций с устройством после загрузки образца) или активно (например, путем приложения силы, создаваемой механическими насосами, электроосмотическими насосами, центробежными насосами, или повышенном давлением воздуха), или при комбинации активных и пассивных сил.
В дополнительных вариантах осуществления также предоставлены процессор, компьютерная (машиночитаемая) память и подпрограмма, хранящаяся в компьютерной (машиночитаемой) памяти и адаптированная к работе процессора для выполнения операций по любому из способов, описанных в данном документе. Примеры подходящих вычислительных систем, сред и/или конфигураций включают в себя персональные компьютеры, серверные компьютеры, портативные устройства, многопроцессорные системы, микропроцессорные системы, телевизионные приставки, программируемую бытовую электронику, сетевые ПК, мини-компьютеры, мэйнфреймы, распределенные вычислительные среды, включающие в себя любую из вышеуказанных систем или устройств, или любые другие системы, известные в данной области техники.
ОБЩИЕ МЕТОДЫ
Стандартные методы молекулярной биологии описаны в книге Sambrook, Fritsch and Maniatis (1982 & 1989 2nd Edition, 2001 3rd Edition) Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; Sambrook and Russell (2001) Molecular Cloning, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; Wu (1993) Recombinant DNA, Vol. 217, Academic Press, San Diego, CA). Стандартные методы также можно найти в издании Ausbel, et al. (2001) Current Protocols in Molecular Biology, Vols.1-4, John Wiley and Sons, Inc. New York, NY, где описано клонирование в бактериальных клетках и мутагенез ДНК (том 1), клонирование в клетках млекопитающих и дрожжах (том. 2), гликоконъюгаты и экспрессия белков (том 3) и биоинформатика (том 4).
Способы очистки белка, включая иммунопреципитацию, хроматографию, электрофорез, центрифугирование и кристаллизацию описаны во множестве изданий. (Coligan, et al. (2000) Current Protocols in Protein Science, Vol. 1, John Wiley and Sons, Inc., New York). Химический анализ, химическая модификация, посттрансляционная модификация, продукция слитых белков, гликозилирование белков также описаны (см., например, Coligan, et al. (2000) Current Protocols in Protein Science, Vol. 2, John Wiley and Sons, Inc., New York; Ausubel, et al. (2001) Current Protocols in Molecular Biology, Vol. 3, John Wiley and Sons, Inc., NY, NY, pp. 16.0.5-16.22.17; Sigma-Aldrich, Co. (2001) Products for Life Science Research, St. Louis, MO; pp. 45-89; Amersham Pharmacia Biotech (2001) BioDirectory, Piscataway, N.J., pp. 384-391). Production, purification, and fragmentation of polyclonal and monoclonal antibodies are described (Coligan, et al. (2001) Current Protcols in Immunology, Vol. 1, John Wiley and Sons, Inc., New York; Harlow and Lane (1999) Using Antibodies, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; Harlow and Lane, supra). Standard techniques for characterizing ligand/receptor interactions are available (see, e.g., Coligan, et al. (2001) Current Protocols in Immunology, Vol. 4, John Wiley, Inc., New York).
Моноклональные, поликлональные и гуманизированные антитела могут быть получены в соответствии с современными протоколами (см., например, Sheperd and Dean (eds.) (2000) Monoclonal Antibodies, Oxford Univ. Press, New York, NY; Kontermann and Dubel (eds.) (2001) Antibody Engineering, Springer-Verlag, New York; Harlow and Lane (1988) Antibodies A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp. 139-243; Carpenter, et al. (2000) J. Immunol. 165:6205; He, et al. (1998) J. Immunol. 160:1029; Tang et al. (1999) J. Biol. Chem. 274:27371-27378; Baca et al. (1997) J. Biol. Chem. 272:10678-10684; Chothia et al. (1989) Nature 342:877-883; Foote and Winter (1992) J. Mol. Biol. 224:487-499; и патент США №6329511).
Описаны также одноцепочечные антитела и диатела (см., например, Malecki et al. (2002) Proc. Natl. Acad. Sci. USA 99:213-218; Conrath et al. (2001) J. Biol. Chem. 276:7346-7350; Desmyter et al. (2001) J. Biol. Chem. 276:26285-26290; Hudson and Kortt (1999) J. Immunol. Methods 231:177-189; и патент США № 4946778). Бифункциональные антитела также описаны (см., например, Mack, et al. (1995) Proc. Natl. Acad. Sci. USA 92:7021-7025; Carter (2001) J. Immunol. Methods 248:7-15; Volkel, et al. (2001) Protein Engineering 14:815-823; Segal, et al. (2001) J. Immunol. Methods 248:1-6; Brennan, et al. (1985) Science 229:81-83; Raso, et al. (1997) J. Biol. Chem. 272:27623; Morrison (1985) Science 229:1202-1207; Traunecker, et al. (1991) EMBO J. 10:3655-3659; и патенты США №№ 5932448, 5532210 и 6129914).
Также предоставляются биспецифичные антитела (см., например, Azzoni et al. (1998) J. Immunol. 161:3493; Kita et al. (1999) J. Immunol. 162:6901; Merchant et al. (2000) J. Biol. Chem. 74:9115; Pandey et al. (2000) J. Biol. Chem. 275:38633; Zheng et al. (2001) J. Biol Chem. 276:12999; Propst et al. (2000) J. Immunol. 165:2214; Long (1999) Ann. Rev. Immunol. 17:875).
Очистка антигена не является необходимой для генерации антител. Животных можно иммунизировать клетками, несущими антиген, представляющий интерес. После этого, спленоциты могут быть выделены из иммунизированных животных и слиты с клеточной линией миеломы для получения гибридомы (см., например, Meyaard et al. (1997) Immunity 7:283-290; Wright et al. (2000) Immunity 13:233-242; Preston et al., выше; Kaithamana et al. (1999) J. Immunol. 163:5157-5164).
Антитела могут быть конъюгированы, например, с малыми молекулами, относящимся к лекарственным средствам, ферментами, липосомами, полиэтиленгликолем (ПЭГ). Антитела могут быть использованы для терапевтических, диагностических или других целей, быть включенными в набор, антитела включают антитела, коньюгированные, например, с красителями, радиоизотопами, ферментами или металлами, например, коллоидным золотом (см., например, Le Doussal et al. (1991) J. Immunol. 146:169-175; Gibellini et al. (1998) J. Immunol. 160:3891-3898; Hsing and Bishop (1999) J. Immunol. 162:2804-2811; Everts et al. (2002) J. Immunol. 168:883-889).
Методы проточной цитометрии, включая сортировку клеток, активируемых флуоресценцией (FACS) являются доступными (см., например, Owens, et al. (1994) Flow Cytometry Principles for Clinical Laboratory Practice, John Wiley and Sons, Hoboken, NJ; Givan (2001) Flow Cytometry, 2nd ed.; Wiley-Liss, Hoboken, NJ; Shapiro (2003) Practical Flow Cytometry, John Wiley and Sons, Hoboken, NJ). Флуоресцентные реагенты, подходящие для модификации нуклеиновых кислот, включая праймеры и зонды нуклеиновых кислот, полипептиды и антитела, для использования, например, в качестве диагностических реагентов, также являются доступными (Molecular Probes (2003) Catalogue, Molecular Probes, Inc., Eugene, OR; Sigma-Aldrich (2003) Catalogue, St. Louis, MO).
Описаны стандартные гистологические методы для иммунной системы (см., например, Muller-Harmelink (ed.) (1986) Human Thymus: Histopathology and Pathology, Springer Verlag, New York, NY; Hiatt, et al. (2000) Color Atlas of Histology, Lippincott, Williams, and Wilkins, Phila, PA; Louis, et al. (2002) Basic Histology: Text and Atlas, McGraw-Hill, New York, NY).
Доступны пакеты программного обеспечения и базы данных для определения, например, антигенных фрагментов, лидерных последовательностей, пространственной структуры белков, функциональных доменов, сайтов гликозилирования и выравнивания последовательностей (см., например, GenBank, Vector NTI® Suite (Informax, Inc, Bethesda, MD); GCG Wisconsin Package (Accelrys, Inc., San Diego, CA); DeCypher® (TimeLogic Corp., Crystal Bay, Nevada); Menne, et al. (2000) Bioinformatics 16: 741-742; Menne, et al. (2000) Bioinformatics Applications Note 16:741-742; Wren, et al. (2002) Comput. Methods Programs Biomed. 68:177-181; von Heijne (1983) Eur. J. Biochem. 133:17-21; von Heijne (1986) Nucleic Acids Res. 14:4683-4690).
1. ПРИМЕРЫ
Примеры в этом разделе предлагаются только в качестве иллюстрации без ограничения обьема изобретения.
1.1 ПРИМЕР 1: Исследования созревания аффинности гуманизированного антитела 08А и аффинности связывания
1.1.1. Созревание аффинности 08A с помощью библиотеки мутагенеза единичного CDR-кодона
CDRH3, CDRL1 и CDRL3 гуманизированного антитела 08А (с коррекцией сайта гликозилирования S61N и последовательной нумерацией в соответствии с SEQ ID Fab001 (SEQ ID NO:1 и 2) служили мишенями для кодон-нацеленного мутагенеза. Библиотеки H3, L1 и L3 были рандомизированы в позициях H95-H100B, L27B-L32 и L90-L97 соответственно. Секвенирование репрезентативных отдельных колоний из каждой библиотеки подтвердило рандомизацию целевых остатков в соответствующих CDR. Каждая библиотека дала более 108 отдельных колоний, позволяя предполагать, что размер библиотеки был достаточным для учета каждой возможной комбинации аминокислот в целевой области.
Библиотеки были подвергнуты четырем раундам селекции на основе афинности в жидкой фазе по технологии фагового дисплея с уменьшением концентрации антигена в каждом раунде. Относительно высокая концентрация антигена (20 нМ) была использована для первого раунда. Концентрация антигена снижалась в 10 раз в каждом из последующих трех раундов для выбора вариантов с высокой афинностью (сродством). Варианты четвертого раунда были индивидуально проверены на положительное связывание с антигеном методом скрининга ELISA.
Для идентификации варианта scFv с более низким значением KD, чем у wt (дикого типа), реальную константу скорости диссоциации (Koff) определяли по методу OCTET RED96 (Fortebio, США) на неочищенном нативном scFv в бактериальных PPE. Всего 156 scFv четвертого раунда отбора были ранжированы в соответствии со значением Koff. Двадцать (20) клонов с улучшенным значением Koff были отобраны для Fab -конверсии. Kon и Koff были определены с помощью BIACORE, а значение KD было рассчитано с использованием программного обеспечения BIACORE T200. Только один Fab, Fab 004 (или 3G9), показал 2-кратное улучшение KD по сравнению с 08A.
1.1.2 Созревание аффинности 08А с помощью библиотеки случайного мутагенеза и комбинаторной библиотеки VH/VL
Для достижения улучшенного значения KD, вместо того, чтобы фокусироваться на H3, L1 и L3, мы выбрали все шесть областей VH и VL в CDR3 антитела 08A в качестве мишеней для случайного (рандомизированного) мутагенеза с целью создания библиотеки комбинаторного мутагенеза VH и VL. Такие последовательности могли бы иметь большее разнообразие по сравнению с последовательностью дикого типа, однако пэннинг с использованием сниженных концентраций антигена должен приводить к обогащению клонов с более высокой аффинностью, сохраняющих связывание с антигеном. Были созданы три комбинаторные библиотеки VH/VL для проведения пэннинга: (1) шаффлинг (shuffling) легкой цепи с использованием комбинаторной библиотеки VL 08A, (2) шаффлинг (shuffling) легкой цепи с использованием Fab 004 VH+комбинаторная VL библиотека и (3) комбинаторные библиотеки VH+VL.
Чтобы увеличить разнообразие во всех 6 CDR, локализованных в VH и VL, мы использовали стратегию случайного мутагенеза. В частности, мутагенез осуществляли с использованием рандомизации кодонов NNK для замены шести CDR на любую из 20 аминокислот. Для того, чтобы получить библиотеки последовательностей, несущих случайные мутации в каждом остатке в пределах петли CDR, было сконструировано в общей сложности двенадцать библиотек. Шесть VH библиотек были рандомизированы в позициях H31-H35 (библиотека H1), H51-H54 (библиотека H2A), H55-H59 (библиотека H2B), H60-H64 (библиотека H2C), H96-H100 (библиотека H3A) и H96A- H102 (библиотека H3B) соответственно. Шесть VL библиотек были рандомизированы в положениях L21-L27A (библиотека L1A), L27B-L29 (библиотека L1B), L30-L34 (библиотека L1C), L51-L55 (библиотека L2), L89-L93 (библиотека L3A) и L93- L97 (библиотека L3B) соответственно. Секвенирование репрезентативных отдельных колоний из каждой библиотеки подтвердило рандомизацию целевых остатков в соответствующем CDR. Каждая библиотека дала более 108 отдельных колоний, давая основания предполагагать, что размер библиотеки был достаточным для учета каждой возможной комбинации аминокислот в целевой области.
Все двенадцать библиотек были подвергнуты трем циклам пэннинга. Плазмидную ДНК третьего раунда выделяли и использовали в качестве матрицы для амплификации мутированных фрагментов CDR. Комбинаторный VH мутагенез scFv был осуществлен путем двухступенчатой ПЦР с перекрыванием для объединения трех CDR вместе. Комбинаторный VL мутагенез scFv осуществляли аналогичным образом. Комбинаторные библиотеки тяжелых и легких цепей были получены путем клонирования scFv в фагемидный вектор, как описано выше.
Все двенадцать библиотек по отдельности были подвергнуты трем циклам селекции по технологии фагового дисплея по кинетическим параметрам («off-rate selection») при уменьшении концентрации антигена в каждом раунде. Относительно высокая концентрация антигена (10 нМ) была использована для первого раунда. Концентрация антигена снижалась в 10 раз в каждом из последующих двух раундов. Комбинаторные библиотеки мутагенеза VH или VL были получены с помощью двухэтапной ПЦР с перекрыванием, объединяющей три CDR вместе, при использовании объединенных репертуаров VH или VL, полученных на выходе третьего раунда. Мы также создали шаффлинг-библиотеку цепей, объединив тяжелую цепь клона Fab 004 с комбинаторной легкой цепью, используя ПЦР с перекрыванием. Эти комбинаторные библиотеки были подвергнуты двум дополнительным раундам селекции по кинетическим параметрам («off-rate selection») при уменьшении концентрации антигена (100 нМ и 10 пМ).
Наибольшее значение придавалось пэннингу и скринингу шаффлинг-библиотеки легкой цепи Fab 004 по сравнению с шаффлинг-библиотекой VH легкой цепи 08A в связи с потенциальной возможностью большего улучшения сродства, в случае начала работы с Fab 004. Отдельные варианты, отобранные по результатам второго раунда отбора из комбинаторной шаффлинг-библиотеки Fab 004 VH легкой цепи были проверены на положительное связывание с антигеном методом скрининга ELISA. В общей сложности 108 клонов scFv были ранжированы в соответствии со значением Koff. Семь (7) клонов с улучшенным значением Koff были отобраны для конверсии Fab. Кon и Koff были определены с помощью BIACORE, KD была рассчитана. Все 7 Fabs показали 5-10-кратное улучшение KD по сравнению с 08A, что являлось значительным улучшением KD по сравнению с таковым предыдущих методов, основанным на использованием отдельных мутагенных библиотек (Таблица 4). Fab098, Fab099, Fab100, Fab101, Fab102, Fab103 и Fab104 были выделены из второго раунда селекции тяжелой цепи 3G9 в сочетании с комбинаторной библиотекой легких цепей.
Для создания библиотеки комбинаторного мутагенеза VH+VL, объединенные репертуары VH и VL по результатам первого раунда комбинаторных библиотек VH и VL были рекомбинированы путем перекрывающейся ПЦР, чтобы создать одну библиотеку рекомбинированных вариантов с мутациями в цепях VH и VL. Комбинаторные библиотеки VH и VL были подвергнуты двум дополнительным раундам селекции по кинетическим параметрам (off-rate selection) при 10 пМ антигена. Варианты селекции второго раунда комбинаторных библиотек тестировали индивидуально на положительное связывание с антигеном по методу ELISA. 216 клонов scFv были ранжированы в зависимости от значения Koff. Четыре (4) клона с улучшенным значением Koff были отобраны для Fab конверсии. Кon и Koff были определены с помощью BIACORE, а KD была рассчитана. 4 Fabs (Fab128, Fab133, Fab138 и Fab139) показали 5-18-кратное улучшение значения KD по сравнению с 08А (Таблица 4).
1.1.3 Последовательности клонов, прошедших селекцию
Вариабельные области улучшенных клонов (VH и VL), отобранных по кинетическим параметрам (off-rate selection), амплифицировали с помощью ПЦР (праймеры синтезированы Genewiz, Suzhou). Реакции ПЦР проводили при 95°С 2 минуты, 95°С 30 секунд, 52°С 1 минута, 72°С 1 минута в течение 15 циклов, затем 72°С 10 минут, а затем 4°С. Конечные продукты ПЦР проверяли в 1% агарозном геле и очищали при помощи набора для очистки Qiagen QIAQUICK.
Очищенные продукты ПЦР VL и VH клонировали в pCP-hCk (VL) или в pCP-hCg4 (вектор Fab) соответственно. Затем положительные клоны отправляли в BioSune (Шанхай) для секвенирования. Плазмидную ДНК получали с использованием набора MN midi-prep (Macherey-Nagel, США).
1.1.4 Транзиентная трансфекция в клетках линии 293
Примерно за 24 часа перед трансфекцией 2,2×106 клеток/мл линии 293-F высевали в среду CD03 OPM-293 (OPM Biosciences, Китай) и инкубировали на шейкере при 120 об/мин, 37°C и 5%CO2. В день трансфекции плотность клеток составляла около 4×106 клеток/мл. Для обеспечения оптимальной трансфекции жизнеспособность клеток должна составлять> 95%.
Приготовляли ДНК из расчета 150 мкг плазмидной ДНК на 100 мл клеточной культуры (Fd:LC=2:3). ДНК разводили в среде для экспрессии OPTI-MEM (Gibco, США) в объеме, эквивалентном одной двадцатой объема культуры, подлежащей трансфекции, и разводили 1 мг PEI (Polysciences, США) в среде OPTI-MEM в объеме, эквивалентном объему раствора ДНК. Раствор PEI добавляли в разбавленный раствор ДНК; смесь ДНК- PEI осторожно перемешивали и инкубировали в течение 15 мин при комнатной температуре до трансфекции. Смесь ДНК-PEI добавляли в клеточную культуру при медленном вращении колбы с культурой, и смесь ДНК-PEI инкубировали с клетками в течение 4 часов. В колбу добавляли пептон в размере одной двадцатой объема питательной среды (Fluka, США). Затем клетки культивировали при 125 об/мин, 37°С и 5% СО2.
1.1.5 Очистка Fabs
Кондиционированную среду, описанную выше, на День 6 загружали в 0,6 мл колонку со смолой KAPPASELECT (GE Healthcare, США), уравновешенную 25 мМ Трис, 150 мМ NaCl, рН 8,0. Затем колонку промывали уравновешивающим буфером до исходного уровня после загрузки образца. После промывки колонку элюировали 50 мМ цитратом натрия, 150 мМ NaCl, рН 3,0, с последующим немедленным добавлением 1 М аргинина, 400 мМ янтарной кислоты, рН 9,0, чтобы довести значение рН до 5,5. Конечный продукт подвергали диализу против раствора PBS. Чистоту белка анализировали с помощью SDS-PAGE, а его концентрацию определяли методом Брэдфорда.
1.1.6. Хроматографический анализ очищенного Fab с исключением по размеру
Хроматографию с исключением по размеру (SEC) для анализа очищенных антител проводили на колонке SEC SIZESEP-SIH (Waters, 7,8 мм, длина 30 см) с использованием системы HPLC (E2695, Waters) при температуре окружающей среды. В качестве подвижной фазы использовали пятикратный объем буфера PBS при скорости потока 1 мл/мин. Инъекционный объем составлял 20 мкл с детекцией при 280 нм.
1.1.7 Biacore анализ очищенных Fabs
Иммобилизация рекомбинантного PD-1 человека или PD-1 обезьяны (Сynomolgus)- на чипе CM5: сенсорный чип CM5 активировали в FC2 путем 7 минутного введения (10 мкл/мин) свежеприготовленного 1:1 50мМ NHS:200мМ EDC. PD-1 в концентрации 0,2 мкг/мл в 10 мМ натрий-ацетатном буфере pH 5,0 вводили в активированный чип при скорости 5 мкл/мин, (рабочий буфер HBS-EP: 10мМ HEPES, 150мМ NaCl, 3,4мМ EDTA, 0,005% сурфактанта P20, pH 7,4) в течение 120 секунд. Оставшиеся активные сайты связывания блокировали 7 минутным введением 1М этаноламина при 10 мкл/мин.
Измерение кинетики связывания: Различные концентрации Fab вводили со скоростью потока 30 мкл/мин в течение 180 секунд в течение фазы ассоциации. Диссоциацию связанного антитела контролировали, пропуская буфер HBS-EP по поверхности чипа в течение 600 секунд. В конце каждого цикла поверхности сенсора регенерировали, вводя регенерационный буфер (10 мМ глициновый буфер с pH 1,7) в течение 180 секунд. После коррекции сенсограмм по сигналам от эталонного потока, кинетику рассчитывали с помощью программного обеспечения BIACORE T 200 ver.1.0 (Biacore, GE, USA).
Таблица 3. Выравнивание мутаций созревания аффинности Fab98-104
(SEQ ID NO:8 & 129)
(AA 1-5 OF SEQ ID NO:130)
(AA 6-10 OF SEQ ID NO:130)
(AA 7-15 OF SEQ ID NO:130)
(AA 1-5 OF SEQ ID NO:131)
(AA 6-10 OF SEQ ID NO:131)
(SEQ ID NO:135)
(SEQ ID NO:135)
(SEQ ID NO:135)
(SEQ ID NO:135)
(SEQ ID NO:135)
(SEQ ID NO:135)
(SEQ ID NO:135)
(SEQ ID NO:145)
(AA 1-5 OF SEQ ID NO:130)
(AA 6-10 OF SEQ ID NO:130)
(AA 11-15 OF SEQ ID NO:130)
(AA 1-5 OF SEQ ID NO:131)
(AA 6-10 OF SEQ ID NO:131)
(SEQ ID NO:145)
(AA 1-5 OF SEQ ID NO:130)
(AA 6-10 OF SEQ ID NO:130)
(AA 11-15 OF SEQ ID NO:130)
(AA 1-5 OF SEQ ID NO:131)
(AA 6-10 OF SEQ ID NO:131)
(SEQ ID NO:149)
(AA 1-5 OF SEQ ID NO:150)
(AA 6-10 OF SEQ ID NO:150)
(AA 11-15 OF SEQ ID NO:150)
(AA 1-5 OF SEQ ID NO:131)
(AA 6-10 OF SEQ ID NO:131)
(SEQ ID NO:145)
(AA 1-5 OF SEQ ID NO:130)
(AA 6-10 OF SEQ ID NO:130)
(AA 11-15 OF SEQ ID NO:130)
(AA 1-5 OF SEQ ID NO:131)
(AA 6-10 OF SEQ ID NO:131)
(AA 1-5 OF SEQ ID NO:132)
(AA 6-10 OF SEQ ID NO:132)
(AA 11-15 OF SEQ ID NO:132)
(SEQ ID NO:133)
(AA 1-5 OF SEQ ID NO:134)
(AA 6-9 OF SEQ ID NO:134)
(AA 1-5 OF SEQ ID NO:132)
(AA 6-10 OF SEQ ID NO:132)
(AA 11-15 OF SEQ ID NO:132)
(SEQ ID NO:136)
(AA 1-5 OF SEQ ID NO:134)
(AA 6-9 OF SEQ ID NO:134)
(AA 1-5 OF SEQ ID NO:132)
(AA 6-10 OF SEQ ID NO:132)
(AA 11-15 OF SEQ ID NO:132)
(SEQ ID NO:137)
(AA 1-5 OF SEQ ID NO:134)
AA 6-9 OF SEQ ID NO:134)
(AA 1-5 OF SEQ ID NO:132)
(AA 6-10 OF SEQ ID NO:132)
(AA 11-15 OF SEQ ID NO:132)
(SEQ ID NO:138)
(AA 1-5 OF SEQ ID NO:139)
(AA 6-9 of SEQ ID NO:139)
(AA 1-5 OF SEQ ID NO:132)
(AA 6-10 OF SEQ ID NO:132)
(AA 11-15 OF SEQ ID NO:132)
(SEQ ID NO:140)
(AA 1-5 OF SEQ ID NO:141)
(AA 6-9 OF SEQ ID NO:141)
(AA 1-5 OF SEQ ID NO:132)
(AA 6-10 OF SEQ ID NO:132)
(AA 11-15 OF SEQ ID NO:132)
(SEQ ID NO:142)
(AA 1-5 OF SEQ ID NO:134)
(AA 6-9 OF SEQ ID NO:134)
(AA 1-5 OF SEQ ID NO:132)
(AA 6-10 OF SEQ ID NO:132)
(AA 11-15 OF SEQ ID NO:132)
(SEQ ID NO:143)
(AA 1-5 OF SEQ ID NO:134)
(AA 6-9 OF SEQ ID NO:134)
(AA 1-5 OF SEQ ID NO:132)
(AA 6-10 OF SEQ ID NO:132)
(AA 11-15 OF SEQ ID NO:132)
(SEQ ID NO:144)
(AA 1-5 OF SEQ ID NO:134)
(AA 6-9 OF SEQ ID NO:134)
(AA 1-5 OF SEQ ID NO:132)
(AA 6-10 OF SEQ ID NO:132)
(AA 11-15 OF SEQ ID NO:132)
(SEQ ID NO:146)
(AA 1-5 OF SEQ ID NO:134)
(AA 6-9 OF SEQ ID NO:134)
(AA 1-5 OF SEQ ID NO:132)
(AA 6-10 OF SEQ ID NO:132)
(AA 11-15 OF SEQ ID NO:132)
(SEQ ID NO:147)
(AA 1-5 OF SEQ ID NO:148)
(AA 6-9 OF SEQ ID NO:148)
(AA 1-5 OF SEQ ID NO:132)
(AA 6-10 OF SEQ ID NO:132)
(AA 11-15 OF SEQ ID NO:132)
(SEQ ID NO:133)
(AA 1-5 OF SEQ ID NO:151)
(AA 6-9 OF SEQ ID NO:151)
(AA 1-5 OF SEQ ID NO:132)
(AA 6-10 OF SEQ ID NO:132)
(AA 11-15 OF SEQ ID NO:132)
(SEQ ID NO:152)
(AA 1-5 OF SEQ ID NO:134)
(AA 6-9 OF SEQ ID NO:134)
Таблица 4. Афинность Fabs, выделенных из комбинаторной библиотеки мутагенеза CDR
SEQ ID Nos:
(10-10 M)
1.2. ПРИМЕР 2. Афинность мышиных и гуманизированных анти-PD-1 антител mAb к PD1 человека.
1.2.1 Кинетический анализ связывания поверхности по BIAcore
Анализ на основе поверхностного плазмонного резонанса (SPR) с использованием режима захвата использовали для определения кинетики связывания и афинности анти-PD-1 антител по отношению к меченному полигистидином человеческому PD-1 (hPD1-His, 98AFK). Следуя инструкциям изготовителя, активировали сенсорную микросхему (чип) серии S CM5 (GE Healthcare, BR100530) с использованием набора реагентов для ковалентной иммобилизации по аминогруппе (GE Healthcare, BR100050). Как в наборе реагентов для захвата антител человека (анти-человеческий Fc, 25 мкг/мл, GE Healthcare, BR100839), так и в наборе для захвата антител мыши (анти-мышиный Fc, 30 мкг/мл, GE Healthcare, BR100838) антитело, разведенное в прилагаемом буфере (pH 5,0, 10 мМ натриево-ацетатный буфер) было иммобилизовано на активированной поверхности в течение 7 минут. После иммобилизации поверхность дезактивировали 1М этаноламином/HCl (рН 8,5) в течение 7 минут. Конечные уровни иммобилизации достигали ~ 8000 единиц резонанса (RU) для связывания антител мыши или ~ 12000 RU для связывания антител человека в каждой из четырех проточных кювет.
Кинетику связывания измеряли на Biacore T200 в буфере HBS-EP + (0,01 М HEPES, рН 7,4, 0,15 М NaCl, 3 мМ ЭДТА, 0,05% об./об сурфактанта P20) при 25 ° C. Связывание антител проводили на поверхностях связывания Fc мыши или Fc человека при скорости потока 10 мкл/мин. Антитела были связаны на проточных кюветах 2, 3 и 4. Проточную кювету 1 использовали в качестве контроля/эталона без связывания антител. 6-точечные 2-кратные серийные разведения аналита 98AFK (hPD1-His), начиная с 20 нМ, готовили в рабочем буфере (HBS-EP+). Два буферных контроля были включены для двойной проверки. Серии титрования вводили в течение 3 минут со скоростью 50 мкл/мин с последующей диссоциацией в течение 600 секунд. После каждого цикла поверхности регенерировали 30-секундным введением 3М MgCl2 при 10 мкл/мин на чипе анти-человеческого Fc или 180 секундным введением 10 мМ глицина, рН 1,7 при 10 мкл/мин на чипе анти-мышиного Fc.
Обработку сенсограмм и анализ данных выполняли с помощью программного обеспечения Biacore T200 версии 2.0.4 (GE Healthcare). Сенсограммы, показывающие связывание антител, были получены после проведения двойного контроля, путем вычитания сигнала в эталонной проточной ячейке 1 и сигналов от «пустого введения». Обработанные кривые в общем соответствовали модели связывания 1: 1 для определения константы скорости ассоциации kon (M-1s-1, где «M» означает- Моль, а «s»- секунды) и константы скорости диссоциации, Кoff (s-1). Эти константы скорости были использованы для расчета равновесной константы диссоциации, KD (M) = Кoff/kon.
1.2.2 Афинность раствора по BIAcore
Анализ на основе SPR в режиме раствора использовали для определения афинности в растворе гуманизированных анти-PD-1 антител по отношению к меченому полигистидином человеческому PD-1 (hPD1-His, 98AFK). Следуя инструкциям производителя, активировали сенсорную микросхему (чип) серии S CM5 (GE Healthcare, BR100530) с использованием набора реагентов для ковалентной иммобилизации по аминогруппе (GE Healthcare, BR100050). Человеческий PD1-His (98AFK, 40 мкг/мл, разведенный в рН 5,0 10 мМ натрий-ацетатном буфере) был иммобилизован на активированной поверхности в течение 7 минут. После проведения иммобилизации, поверхности дезактивировали 1М этаноламином/HCl (рН 8,5) в течение 7 минут. Конечные уровни иммобилизации достигали приблизительно 6000 резонансных единиц (RU) в проточной ячейке.
Афинность раствора определяли путем измерения несвязанной фракции паратопа антитела в серии титрований, где концентрация антител поддерживалась постоянной (либо при 500 пМ, либо 100 пМ), а концентрация антигена, hPD1-His (98AFK), разводилась 1:2, от 100нМ до 3 пМ в 16-лунковых сериях титрования. Серии титрования инкубировали в течение 16-24 часов до достижения эквилибриума (равновесия) при комнатной температуре. Сайты без связывания антител измеряли с использованием чипа BIAcore, несущим иммобилизованные антигены, при конкурентном режиме, где обнаруженный SPR сигнал соответствовал несвязанному антителу.
Афинность раствора измеряли на BIACORE T200 в рабочем буфере HBS-EP+ (0,01 М HEPES, рН 7,4, 0,15 М NaCl, 3 мМ ЭДТА, 0,05% об./об. cурфактанта P20) при 25°C. Серии титрования, после >16 часов инкубирования наносили на сенсорный чип с иммобилизованными hPD1-His (выше). Концентрации свободных несвязанных антител измеряли как пропорциональные RU через 120 секунд (для серии 500 пМ mAb) или 400 секунд (для серии 100 пМ mAb) после введения при 10 мкл/мин. После каждого цикла поверхности регенерировали с помощью 30-секундного введения 1: 1 смеси 3М MgCl 2 и pH 2,0 10мМ глицина при 30 мкл/мин.
Анализ данных проводился с использованием KINEXA Pro Version 1.02 (Sapydyne), где RU были нормализованы и нанесены на график в зависимости от концентраций. Нормализованные данные двух титрований (с использованием 100 пМ и 500 пМ фиксированных концентраций антител) подбирали с использованием n-Curve Analysis Version 1.02 (Sapidyne) для получения значений KD (M) для каждого взаимодействия.
При стандартном измерении аффинности поверхности родительское мышиное антитело 08А показало аффинность 0,24 нМ. Напротив, варианты родительских мышей N59Q, N59E и N59A антитела 08А в VH CDR2 показали пониженную аффинность по сравнению с родительским 08А антителом мыши. Все варианты гуманизированного анти-IgA4 антитела 08А проявляли значительно усиленную аффинность по сравнению с родительским антителом 08А мыши. Последующие варианты гуманизированных анти-IgG4 антител 08A с коррекциями G56A, S61N и G56A/S61N в CDHR2 продемонстрировали тенденцию к улучшению аффинности, тогда как в случае N55E этого не происходило. Fab098 IgG4 антитело с созревшей аффинностью (вариант гуманизированного 08A с коррекцией G56A) увеличивало аффинность примерно в 3 раза. Fab100 IgG4 антитело с созревшей аффинностью, являющееся вариантом гуманизированного 08А с коррекциями S61N и G56A, улучшало аффинность примерно в 6 раз. (См. Таблицу 5)
Таблица 5. Стандартные значения афинности поверхности к человеческому PD1-His (98AFK)
При определении аффинности в режиме раствора гуманизированное IgG4 Fab 100 антитело 08A с созревшей афинностью, с коррекциями S61N и G56A показало значительное улучшение афинности по сравнению с гуманизированным IgG4 антителом 08A с коррекцией S61N (см. Таблицу 6).
Таблица 6. Афинность в растворе SPR к PD-1-His (98AFK) человека
1.3 ПРИМЕР 3: Получение биспецифичных антител анти-PD-1/LAG3
Анти-PD-1/LAG-3 биспецифичное антитело (BsAb) 18ASS имеет анти-PD-1 тяжелую цепь с вариабельной областью тяжелой цепи аффинно-зрелого Fab100 с коррекциями CDRH2 S61N и G56A и с константной областью IgG1 с мутациями CH1: L145E, K147T, Q175E и S183L; с мутациями CH2: L234A, L235A и D265S; и с мутациями CH3: T350V, L351Y, F405A, Y407V (SEQ ID NO:102); анти-PD-1 легкую цепь с вариабельной областью легкой цепи аффинно-зрелого Fab100, и с константной областью каппа цепи с мутациями Cκ Q124R, T178R (SEQ ID NO:103); анти-LAG3 тяжелую цепь с вариабельной областью тяжелой цепи гуманизированного антитела 22D2 Ab6 WO 2016028672 и константной областью IgG1 с мутацией CH1: S181K, мутациями CH2: L234A, L235A и D265S, с мутацииями CH3: T350V, T366L, K392L и T394W (SEQ ID NO:96); анти-LAG3 легкую цепь с вариабельной областью легкой цепи антитела Ab6 согласно WO 2016028672 и константной областью каппа цепи с мутациями Cκ Q124E, S131T, T178Y и T180E (SEQ ID NO:98).
Анти-PD-1/LAG3 биспецифическое антитело 90ASU имеет анти-PD-1 тяжелую цепь с вариабельной областью тяжелой цепи гуманизированного антитела 08A с коррекциями CDRH2 S61N и G56A и с константной областью IgG1 с мутациями CH1: L145E, K147T, Q175E и S183L, с мутациями CH2: L234A, L235A и D265S, с мутациями CH3: T350V, L351Y, F405 Y407V (SEQ ID NO:101); анти-PD-1 легкую цепь с вариабельной областью легкой цепи гуманизированного антитела 08А и константной областью каппа с мутациями Cκ Q124R, T178R (SEQ ID NO:100); анти-LAG3 тяжелую цепь с вариабельной областью тяжелой цепи гуманизированного антитела 22D2 Ab6 согласно с WO 2016028672 и константную область IgG1 с мутацией CH1 S181K, с мутациями CH2: L234A, L235A и D265S, с мутациями CH3: T350V, T366L, K392L и T394W (SEQ) ID NO: 96); анти-LAG3 легкую цепь с вариабельной областью легкой цепи антитела Ab6 согласно WO 2016028672 и константной областью каппа с мутациями Cκ Q124E, S131T, T178Y и T180E (SEQ ID NO:98).
Биспецифическое анти-PD-1 антитело/LAG3 33ARK имеет анти-PD-1 тяжелую цепь с вариабельной областью тяжелой цепи гуманизированного антитела 08A с коррекциями CDRH2: S61N и G56A, и с константной областью IgG1 с мутациями CH1: L145E, K147T и Q175E, с мутациями CH2: L234A, L235A и D265S, с мутациями CH3: T350V, T366L, K392L и T394W (SEQ ID NO:108); анти-PD-1 легкую цепь с вариабельной областью легкой цепи гуманизированного антитела 08А с мутацией FR Q38R и константной областью каппа с мутациями Cκ: Q124R, Q160K и T178R (SEQ ID NO:110); анти-LAG3 тяжелую цепь с вариабельной областью тяжелой цепи гуманизированного антитела 22D2 Ab6 согласно WO 2016028672 с мутацией FR Q39R, и с константнуой областью IgG1 с мутациями CH1: H168R и Q175K, с мутациями CH2: L234A, L235A и D265S, с мутациями CH3: T350V, L351Y, F405A и Y407V (SEQ ID NO:104); анти-LAG3 легкую цепь с вариабельной областью легкой цепи антитела Ab6 согласно WO2016028672 с мутацией FR Q38E, и с константной областью каппа с мутациями Cκ: Q124E, Q160E и T180E (SEQ ID NO:106).
Мутации СН3 (нумерация ЕС) в каждой из анти-PD-1 тяжелой цепи и анти-LAG3 тяжелой цепи способствуют образованию гетеродимера в плече анти-PD-1 и плече анти-LAG3. Мутации CH1 и Cκ (нумерация EU) в анти-PD-1 тяжелой и анти-PD-1 легкой цепи, а также мутации в анти-LAG3 тяжелой и анти-LAG3 легкой цепях способствуют правильному спариванию тяжелых и легких цепей. В 33ARK мутации FR также способствуют правильному спариванию тяжелой и легкой цепей. Мутации CH2 (нумерация в ЕС) снижают эффекторную функцию. Коррекция S61N удаляет сайт гликозилирования, а коррекция G56A удаляет сайт дезамидирования (последовательная нумерация в SEQ ID).
1.3.1 Трансфекция, экспрессия и очистка 18ASS и 90ASU
18ASS и 90ASU были экспрессированы рекомбинантно в культуре клеток яичника китайского хомячка (EXPIFECTAMINE; Thermo Fisher Scientific) посредством транзиентной (кратковременной) трансфекции с использованием реагентов для трансфекции EXPIFECTAMINE. Гены, кодирующие две пары цепей тяжелых и легких антител (90ASU: анти-PD-1: SEQ ID NO:100 и 101; анти-LAG3: SEQ ID NO:96 и 98) (18ASS: анти-PD-1: SEQ ID NO:102 и 103; анти-LAG3: SEQ ID NO:96 и 98), были сконструированы путем синтеза генов с использованием кодонов, оптимизированных для экспрессии в клетках млекопитающих. Кассеты экспрессии, кодирующие четыре цепи, были клонированы в pTT5, векторе экспрессии млекопитающих (получен от National Research Council, Canada). Четыре плазмидные ДНК, кодирующие различные белковые цепи (2 тяжелых цепи и 2 легких цепи), трансфицировали при соотношении плазмидной ДНК 1:1:1:1 и экспрессировали в течение 7 дней до сбора при жизнеспособности клеток 93%. Собранные секретируемые антитела отбирали из культурального супернатанта путем инкубации в течение ночи со смолой для аффинной хроматографии на основе белка A (MABSELECT SURE LX; GE Healthcare) и дополнительно очищали с помощью обычных методов очистки белка. Конечная чистота биспецифичных антител составляла> 98% по данным электрофореза в капиллярном геле, аналитической эксклюзионной хроматографии и масс-спектрометрии (интактная масса).
1.3.2 Клонирование, трансфекция, экспрессия и очистка 33ARK
Генные продукты для анти-PD-1/LAG3 биспецифического антитела 33ARK были клонированы в вектор экспрессии pTT5 млекопитающих и транзиентно (кратовременно) экспрессированы в клетках CHO (Raymond C. et al. Methods. 55 (1): 44-51 (2011)). Клетки CHO-3E7 культивировали при 37°C в среде FreeStyle TM F17 (Invitrogen cat # A-1383501) с добавлением 4 мМ глютамина и 0,1% плюроника F-68 (Invitrogen cat.# 24040-032). Четыре плазмидные ДНК, кодирующие две тяжелые цепи и две легкие цепи (анти-PD-1: SEQ ID NO: 108 и 110) и (анти-LAG3: SEQ ID NO: 104 и 106) были трансфицированы в масштабе 3 л при соотношении ДНК 15:15:20:50 (анти-LAG3 HC: анти-PD-1 HC: анти-LAG3 LC: анти-PD-1 LC). Температуру снизили до 32°С через 24 часа после трансфекции и клеточные супернатанты собрали через 10 дней.
Количественное определение антител в супернатантах проводили с использованием системы HPLC 600/717/996 (Waters Corporation, Milford, MA) с картриджем белка A (колонка POROSA20, Invitrogen, Grand Island, NY, Part # 2-1001-00, 2,1 мм диаметром х 30 мм высоты, 104 мкл). Образцы были отфильтрованы центрифугированием при 8000-11000g в течение 3 минут с использованием центрифужного оборудования NANOSEP MF GHP 0,45 мкм (Pall Life Sciences, Part # ODGHPC35) перед нанесением на колонку при скоростью потока 2 мл/мин с использованием PBS. Элюирование проводили раствором 0,15 М NaCl, рН 2,0. Программное обеспечение EMPOWER (Waters Corporation, Milford, MA) использовалось для обработки данных, кривые были построены методом линейной регрессии.
Бульон для культивирования клеток объемом 2л и 3л центрифугировали и фильтровали перед нанесением на колонку объемом 10 мл MABSELECT SURE (GE Healthcare) с белком А со скоростью 10 мл/мин. Биспецифическое антитело 33ARK элюировали 100 мМ цитратным буфером при рН 3,0 и нейтрализовали до рН 6-7 с помощью буфера TRIS рН 11. Образцы смешивали либо с денатурирующим раствором (для разрушения конформаций белка), либо с буферным раствором для экспрессии белка (для создания условий восстановления нативных белковых конформаций) и загружали в твердый 96-луночный планшет BioRad. Образцы затем нагревали при 70°С в течение 15 минут, центрифугировали и смешивали с водой и раствором гель-красителя перед обработкой на LabChip GXII. Элюат белка А очищали одним введением на Superdex 200 16/60 (GE Healthcare) с помощью ÄKTA Express FPLC при скорости потока 1 мл/мин в буфере PBS при pH 7,4. Фракции с чистотой более 90%, опеделенной с помощью CE-SDS, объединяли для формирования конечного образца, буфер заменяли на 20 мМ ацетата натрия, рН 5,0, 7% сахарозы и доводили концентрацию до более чем 2 мг/мл.
1.4 ПРИМЕР 4: Инженерный анализ Jurkat.hPD-1.IL2luc+THP-1.PD-L1
Клон DT999A1 представляет собой клон Jurkat, экспрессирующий трансген PD-1, с IL-2-зависимым репортером люциферазы (Jurkat.hPD-1.IL2luc). Клетки Jurkat.hPD-1.IL2luc выращивали в среде RPMI (Corning Cellgro 10 040-CV) с добавлением инактивированной нагреванием 10% FBS (Hyclone SH30910.03) + 2мМ глютамина (Cellgro 25-005-CI), + 2 мкг/мл пуромицина (Sigma P9620) + 0,5 мг/мл генетицина (Gibco 10131 027). Клетки разделяли два раза в неделю после начального высева клеток при 2×105 клеток/мл с последующим разделением при превышении плотности 1×106 клеток/мл. Клетки THP-1, экспрессирующие трансгенный PD L1 (THP-1.PD-L1), выращивали в среде RPMI с добавлением инактивированной нагреванием 10% FBS+2 мМ глутамина+0,5 мкг/мл пуромицина. Клетки разделяли два раза в неделю после начального высева клеток при 3×105 клеток/мл с последующим разделением при превышении плотности 1 × 106 клеток/мл.
Биоанализ проводили с использованием среды для анализа [среда RPMI без фенолового красного (Gibco 11835 030) + 10% диализированный FBS (Hyclone, SH30079.03)]. Пятьдесят микролитров 4-кратного серийного разведения антитела с начальной концентрацией 30 мкг/мл добавляли в «планшет с белыми стенками» (планшет для усиления люминисцентных сигналов). Для титрования антител использовали 50 мкл клеточной суспензии, содержащей 4×106 клеток/мл THP-1.PD-L1+1×106 клеток/мл клеток Jurkat.hPD-1.IL2luc при 2X условиях стимуляции: 2 нг/мл LPS (Sigma L4391) и 100 нг/мл IFN-g (R & D systems 285-IF/CF). В конце 22-часовой инкубации (37oC, в инкубаторе) добавляли 10 мкл 55 нг/мл анти-PD-1 антитела (BD Pharmingen 555336; 11X рабочий раствор) на дополнительные два часа. Добавляли сто микролитров реагента ONE-GLO (Promega E6120) и просчитывали планшет на Perkin Elmer ENVISION со временем интегрирования 0,1 с. Исходные данные в относительных световых единицах (RLU) наносили на график с использованием программного обеспечения GRAPHPAD и вычисляли значения EC50. Смотрите также ФИГ. 1.
Таблица 7. Значения EC50 для тестируемых образцов.
(SEQ ID NOs: 96, 98, 102 и 103)
(SEQ ID NOs: 96, 98, 100, 101)
(SEQ ID NOs: 87 и 19)
(SEQ ID NOs: 80 и 2)
(SEQ ID NOs: 104, 106, 108 и 110)
Биспецифическое антитело 18ASS с аффинно-зрелой последовательностью Fab100 (с коррекциями S61N и G56A) в 5-6 раз эффективнее, чем биспецифическое антитело 90ASU на основе гуманизированной последовательности 08A с незрелой аффинностью (с коррекциями S61N и G56A). Аналогично, Fab 31ARL с аффинно-зрелой последовательностью Fab100 (с коррекцией S61N) в 5-6 раз эффективенее, чем Fab 00APE на основе гуманизированной последовательности 08A с незрелой аффинностью (с коррекцией S61N). Биспецифичное антитело 18ASS с последовательностью Fab100 со зрелой аффинностью (с коррекциями S61N и G56A) также в 5-6 раз эффективнее, чем биспецифическое антитело 33ARK на основе гуманизированной последовательности 08A с незрелой аффинностью (с коррекцией S61N) и различными CH1- Cк и FR мутациями для формирования правильного спаривания легких и тяжелых цепей.
1.5 ПРИМЕР 5. Анализ реакции смешанных лимфоцитов (MLR).
Мононуклеарные клетки периферической крови человека (РВМС) из лейкопакетов были очищены и заморожены в морозильной камере с жидким азотом. Замороженные человеческие РВМС размораживали, разбавляли фосфатно-солевым буфером (PBS) (ThermoFisher: 20012027), центрифугировали при 450×g в течение 5 минут, и затем осадок клеток ресуспендировали буфером для разделения клеток: PBS, фетальная бычья сыворотка (FBS) (ThermoFisher Scientific; 10438026) и раствор динатриевой соли этилендиаминтетрауксусной кислоты (EDTA) (Sigma-Aldrich; E7889-100ML). Моноциты были обогащены с использованием набора для обогащения человеческих моноцитов (Human Monocyte Enrichment kit, STEMCELL technologies; 19059). Клетки переносили в 6-луночные планшеты в количестве 1×106 клеток/мл (5 мл/лунку) в среде RPMI 1640 (Gibco/ThermoFisher Scientific; 11875-119) с добавлением FBS, пенициллина-стрептомицина (Pen/Strep) (ThermoFisher Scientific; 15140122) с 100 нг/мл GM-CSF (R & D Systems; 215-GM-110) и 50 нг/мл человеческого IL-4 (R & D Systems; 204-IL-010/CF). Моноциты инкубировали при 37°С в течение 5 дней для проведения дифференцировки дендритных клеток (dendritic cells, далее DC). Полученные из моноцитов дендритные клетки (Mo-DC) собирали в День 6, подсчитывали, ресуспендировали в среде RPMI 1640 с добавлением сыворотки человека (Sigma-Aldrich; H4522-100ML) и пенициллина-стрептомицина (Pen/Strep) и использовали в анализе MLR в качестве стимулятора.
В день начала эксперимента замороженные человеческие РВМС размораживали и разбавляли буфером для разделения клеток. CD4 Т-клетки от каждого донора были обогащены с использованием набора для выделения человеческих CD4 Т-клеток (EASYSEP Human CD4 T cell isolation kit, STEMCELL technologies; 17952). Изолированные CD4 Т-клетки суспендировали при 1×106 клеток/мл в среде RPMI 1640 с добавлением сыворотки человека и Pen/Strep. Mo-DC смешивали в соотношении 1:10 (1×104 клеток/мл) с CD4+ Т-клетками (1×105 клеток/мл) и смесь клеток высевали в 96-луночный планшет с плоским дном в количестве 200 мкл/лунку. Биспецифичные антитела серийно разводили с использованием серии 6-кратных разведений и готовили 5X рабочие исходные материалы. 50 мкл каждого разведения добавляли к 200 мкл культур для получения 1X конечной концентрации биспецифичных антител. Контрольные лунки обрабатывали контрольным антителом изотипа или оставляли необработанными. Культуральные супернатанты собирали в День 2 после начала эксперимента для количественного определения IL-2 с использованием набора V-PLEX Human IL-2 (Meso Scale Discovery Cat # K151QQD-4).
Этот пример продемонстрировал, что анти-PD-1/LAG-3 (человека) биспецифичные антитела 33ARK, 90ASU и 18ASS индуцируют продукцию IFN-γ и IL-2 первичными Т-клетками CD4, стимулированными дендритными клетками, происходящими из аллогенных моноцитов (см. ФИГ.2). Образцы MLR, обработанные изотипными контрольными антителами (37ASK), а также MLR образцы без обработки (без Ab), показаны в качестве контролей.
1.6. ПРИМЕР 6. Анализ клона Т-клеток человека+JY.hPD-L1.
1.6.1. Генерирование и культивирование клона CD4+ Т-клеток человека.
Клон BC4-49 CD4+ Т-лимфоцита, специфичный к аллоантигену МНС класса II, генерировали путем 2 раундов смешанной реакции лейкоцитов с В-клеточной линией JY, трансформированной EBV, и клонировали по методу ограниченного разбавления (limiting dilution). Клон повторно стимулировали аллоспецифическими антигенами с двухнедельным интервалом и культивировали в среде Исселя (IMDM, Gibco 12440-053; сыворотка человека AB, Gemimi 100512; пенициллин/стрептомицин, Mediatech 30-002-CI; альбумин человека, Sigma A9080; ITS-X, Gibco 51500056; Трансферин, Roche 10652202001; PA Bioxtra Sigma p5585; LA-OA-Альбумин, Sigma L9655). Свежие PBMC выделяли из двух слоев “buffy coats” человека (франции антикоагулированной крови человека, имеющей-коричневато-желтый оттенок после цетрифугирования в градиенте плотности и обогащенной белыми кровяными клетками и тромбоцитами), предоставленных Stanford Blood Center, и объединяли в соотношении клеток 1:1. Перед использованием РВМС облучали в гамма-облучателе дозой 4000 рад. Клетки JY дикого типа были приготовлены и облучены дозой 5000 рад. Клоны Т-клеток культивировали с фидерными клетками в 24-луночном планшете в количестве 1 мл на лунку с конечными концентрациями CD4+ Т-клеток- 0,2 × 106/мл; облученными РВМС - 1 × 106/мл, облученными JY - 0,1 × 106/мл и PHA 100 нг/мл (Sigma L9017). Рекомбинантный человеческий IL-2 (R&D Systems; 202-IL/CF) добавляли в конечной концентрации 100 нг/мл на 3-й день после повторной стимуляции и обновляли каждые 3-4 дня на протяжении всей экспансии. Клетки рассевали до оптимальной концентрации 0,5-1,0 ×106/мл. На 7-й день после повторной стимуляции наблюдался значительный уровень LAG-3 и умеренный уровень PD-1, экспрессированных на поверхности Т-клеток.
1.6.2. Функциональный анализ CD4+Т-клеток человека
Аллоантиген-специфичные CD4+ Т-клетки собирали из 24-луночных культуральных планшетов на 7-й день после повторной стимуляции антигеном, затем дважды промывали 20 мл PBS (Hyclone, SH3002802), содержащим 2мМ EDTA (Invitrogen, 15575-38), с центрифугированием. Осадки ресуспендировали в суспензию отдельных клеток в среде Исселя. Биспецифичные антитела 90ASU, 18ASS титровали 5-кратными серийными разведениями в среде Исселя, начиная с конечной наивысшей концентрации 133 нМ с суммарными 7 разведениями в объеме 100 мкл в 96-луночных культуральных планшетах с U-образным дном (Falcon, 353077). Биспецифичные антитела несли мутацию hIgG1 Fc L234A/L235A/D265S. Контролем изотипа 37ASK (SEQ ID NO:126 и 127) служил анти-RSV с той же мутацией. Пятьдесят микролитров суспензии Т-клеток с плотностью 4×105 клеток/мл добавляли в лунки, содержащие титрованные антитела. Смесь антитело/Т-клетки предварительно инкубировали в течение 1 часа в инкубаторе при 37°С и 5% СО2. Человеческие клетки JY, экспрессирующие трансген PD-L1 (JY.hPD-L1), использовали в совместных культурах для получения аллоспецифических антигенов. Клетки JY.hPD-L1, культивированные в колбе Т-75 (Thermo Scientific, 156499) в среде RPMI (Corning Cellgro, 10-040-CV) с 10% FCS, собирали и облучали в гамма-облучателе дозой 5000 рад, затем дважды промывали PBS, содержащим 2мМ ЭДТА при использовании центрифугирования. Осадок ресуспендировали в среде Исселя и фильтровали клеточным ситом 40 мкм перед посевом. Пятьдесят мкл/лунку суспензии JY.hPD-L1 с плотностью 2×105 клеток/мл распределяли в предварительно инкубированную смесь антитело-Т-клетки с соотношением Т-клеток к клеткам JY.hPD-L1 равным 2: 1. Эпспериметы при всех условиях были выполнены в двух экземплярах. После приблизительно 3-дневного культивирования отбирали 100 мкл супернатанта с лунки для количественного определения человеческого IFN. ИФА ELIZA для человеческого IFNγ проводили для оценки уровня IFNγ в объединенном супернатанте из дубликатов с использованием набора hIFNγ QUANTIKINE (R & D Systems, SIF50). Анализы проводились в соответствии со стандартным протоколом, предоставленным производителем. Значения EC50 рассчитывали с использованием программного обеспечения GRAPHPAD Prism. Данные этих экспериментов приведены на ФИГ. 3.
Этот пример продемонстрировал, что биспецифическое анти-PD-1/LAG-3(человека) антитело 90ASU (анти-PD-1 hu-08A с коррекциями S61N и G56A/анти-LAG3 hu-22D2 Ab6) и антитело 18ASS (анти-PD-1 Fab100 со зрелой аффинностью с S61N и G56A, анти-LAG3 hu-22D2 Ab6), связывающееся как с PD-1 человека, так и с LAG-3 человека, экспрессируемыми клоном Т-клеток, блокировало взаимодействие PD-1 с PD-L1, а также блокировало LAG-3 взаимодействие с молекулами комплекса гистосовместимости класса II (MHC Class II), и, таким образом, позволяло Т-клеткам реагировать, продуцируя IFNγ в ответ на аллогенную стимуляцию, вследствие ингибирования двойной, PD-L1-опосредованной и MHC класса II опосредованной, супрессии. Кроме того, этот пример показал, что биспецифичные анти-человеческие PD-1/LAG-3 90ASU и 18ASS обладали сравнимой эффективностью в стимулировании продукции IFNγ Т-клетками. Изотип контрольного антитела 37ASK не усиливал продукцию IFNγ активированным клоном Т-клеток.
1. Sharpe, A.H, Wherry, E.J., Ahmed R., and Freeman G.J. The function of programmed cell death 1 and its ligands in regulating autoimmunity and infection. Nature Immunology (2007); 8:239-245.
2. Dong H et al. Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion. Nat Med. 2002 Aug;8(8):793-800.
3. Yang et al. PD-1 interaction contributes to the functional suppression of T-cell responses to human uveal melanoma cells in vitro. Invest Ophthalmol Vis Sci. 2008 Jun;49(6 (2008): 49: 2518-2525.
4. Ghebeh et al. The B7-H1 (PD-L1) T lymphocyte-inhibitory molecule is expressed in breast cancer patients with infiltrating ductal carcinoma: correlation with important high-risk prognostic factors. Neoplasia (2006) 8: 190-198.
5. Hamanishi J et al. Programmed cell death 1 ligand 1 and tumor-infiltrating CD8+ T lymphocytes are prognostic factors of human ovarian cancer. Proceeding of the National Academy of Sciences (2007): 104: 3360-3365.
6. Thompson RH et al. Significance of B7-H1 overexpression in kidney cancer. Clinical genitourin Cancer (2006): 5: 206-211.
7. Nomi, T. Sho, M., Akahori, T., et al. Clinical significance and therapeutic potential of the programmed death- 1 ligand/programmed death-1 pathway in human pancreatic cancer. Clinical Cancer Research (2007);13:2151-2157.
8. Ohigashi Y et al. Clinical significance of programmed death-1 ligand-1 and programmed death-1 ligand 2 expression in human esophageal cancer. Clin. Cancer Research (2005): 11: 2947-2953.
9. Inman et al. PD-L1 (B7-H1) expression by urothelial carcinoma of the bladder and BCG-induced granulomata: associations with localized stage progression. Cancer (2007): 109: 1499-1505.
10. Shimauchi T et al. Augmented expression of programmed death-1 in both neoplasmatic and nonneoplastic CD4+ T-cells in adult T-cell Leukemia/ Lymphoma. Int. J. Cancer (2007): 121:2585-2590.
11. Gao et al. Overexpression of PD-L1 significantly associates with tumor aggressiveness and postoperative recurrence in human hepatocellular carcinoma. Clinical Cancer Research (2009) 15: 971-979.
12. Nakanishi J. Overexpression of B7-H1 (PD-L1) significantly associates with tumor grade and postoperative prognosis in human urothelial cancers. Cancer Immunol Immunother. (2007) 56: 1173- 1182.
13. Hino et al. Tumor cell expression of programmed cell death-1 is a prognostic factor for malignant melanoma. Cancer (2010): 00: 1-9.
14. Ghebeh H. Foxp3+ tregs and B7-H1+/PD-1+ T lymphocytes co-infiltrate the tumor tissues of high-risk breast cancer patients: implication for immunotherapy. BMC Cancer. 2008 Feb 23;8:57.
15. Ahmadzadeh M et al. Tumor antigen-specific CD8 T cells infiltrating the tumor express high levels of PD-1 and are functionally impaired. Blood (2009) 114: 1537-1544.
16. Thompson RH et al. PD-1 is expressed by tumor infiltrating cells and is associated with poor outcome for patients with renal carcinoma. Clinical Cancer Research (2007) 15: 1757-1761.
Все ссылки, цитируемые в настоящем документе, включены в него в качестве ссылки в той же самой степени, как если бы каждая отдельная публикация, запись базы данных (например, последовательности Genbank или записи GeneID), патентная заявка или патент были специально и индивидуально указаны для включения в качестве ссылки. Заявление о включении посредством ссылки, сделанное Заявителями в соответствии с 37 C.F.R. §1.57 (b) (1), относится к каждой отдельной публикации, записи в базе данных (например, последовательности Genbank или записи GeneID), заявке на патент или патенту, каждый из которых четко идентифицирован в соответствии с 37 C.F.R. §1.57 (b) (2), даже если такое цитирование не является непосредственно смежным с конкретным заявлением о включении такового посредством ссылки. Наличие конкретных заявлений о включении посредством ссылки, если таковые имеются, в спецификацию, никоим образом не ослабляет данное общее заявление о включении публикаций посредством ссылки. Цитирование ссылок в данном документе не является признанием того, что ссылка принадлежит к предшествующему уровню техники, и не представляет собой какого-либо признания в отношении содержания или даты этих публикаций или документов.
Настоящее изобретение не должно быть ограничено в объеме конкретными вариантами осуществления, описанными в настоящем документе. Действительно, различные модификации изобретения в дополнение к тем, которые описаны в настоящем документе, станут очевидными для специалистов в данной области техники из предшествующего описания и сопроводительных чертежей. Такие модификации предназначены для включения в объем прилагаемой формулы изобретения.
Вышеизложенное письменное описание считается достаточным для того, чтобы позволить специалисту в данной области техники реализовать изобретение. Различные модификации изобретения в дополнение к тем, которые показаны и описаны в настоящем документе, будут очевидными для специалистов в данной области техники из предшествующего описания и включаются в объем прилагаемой формулы изобретения.
Таблица 8. Информация о последовательности
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNGGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVE (SEQ ID NO:1)
Fab004 или Fab001, легкая цепь (Гуманизированное 08A, Fab область легкой цепи)
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:2)
Fab004, Fab001 или Hu08A, легкая цепь CDRL области
CDRL1: RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2: LASNLES (SEQ ID NO:4)
CDRL3: QHSWELPLT (SEQ ID NO:5)
Fab 004, 98, 99, 100, 101, 102, 103 или 104 тяжелая цепь, Fab область (H3G9) с коррекцией CDRH2 S61N, и с мутациями созревания аффинности в CDRH3 (выделено крупным шрифтом, курсивом)
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNGGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRLSHYDGGFDYWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVE (SEQ ID NO:6)
Fab 004, 98, 99, 100, 101, 102, 103 и 104, тяжелая цепь, вариабельная область
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNGGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRLSHYDGGFDYWGQGTTVTVSS (SEQ ID NO:7) [Заметьте, что CDRH3 мутации созревания аффинности выделены крупным шрифтом и курсивом]
Fab 004, 98, 99, 100, 101, 102, 103 и 104 CDRH области
CDRH1: SYYLY (SEQ ID NO:8)
CDRH2: GVNPSNGGTNFNEKFKS (SEQ ID NO:9)
CDRH3: RLSHYDGGFDY (SEQ ID NO:10) [Заметьте, что CDRH3 мутации созревания аффинности выделены крупным шрифтом и курсивом]
Fab 098, 099, 100, 101, 102, 103 и 104, легкая цепь, CDRL области (включая консенснусные последовательности)
CDRL1: RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2: LY1Y2Y3Y4Y5S; где Y1 представляет собой G или S, Y2 представляет собой K, T, H, или R, Y3 представляет собой F, H, или Y, Y4 представляет собой R, G, A, L или S, and Y5 представляет собой E, A, S, Q или V. (SEQ ID NO:11)
CDRL3: Y6Y7Y8Y9Y10LPLT; где Y6 представляет собой Q, S, или A, Y7 представляет собой H или Q, Y8 представляет собой S или A, Y9 представляет собой W, Y или T, и Y10 представляет собой E, H, или Q. (SEQ ID NO:12)
Fab098, легкая цепь (L28B6) с CDRL2 мутациями созревания аффинности (крупным шрифтом, курсивом)
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLGKFRESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:13)
Fab098, легкая цепь (L28B6), вариабельная область [Заметьте, что CDRL2 мутации созревания аффинности выделены крупным шрифтом и курсивом]
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLGKFRESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIK (SEQ ID NO:14)
Fab098, легкая цепь, CDRL районы
CDRL1: RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2: LGKFRES (SEQ ID NO:15) [Заметьте, что CDRL2 мутации созревания аффинности выделены крупным шрифтом и курсивом]
CDRL3: QHSWELPLT (SEQ ID NO:5)
Fab099, легкая цепь (L28C3) с CDRL2 мутациями созревания аффинности
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLGTHRASGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:16) [Заметьте, что CDRL2 мутации созревания аффинности выделены крупным шрифтом и курсивом]
Fab099, легкая цепь (L28C3), вариабельная область [Заметьте, что CDRL2 мутации созревания аффинности выделены крупным шрифтом и курсивом]
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLGTHRASGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIK (SEQ ID NO:17)
Fab099, легкая цепь (L28C3), CDRL области
CDRL1: RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2: LGTHRAS (SEQ ID NO:18) [Заметьте, что CDRL2 мутации созревания аффинности выделены крупным шрифтом и курсивом]
CDRL3: QHSWELPLT (SEQ ID NO:5)
Fab100 легкая цепь (L28D1) с CDRL2 и CDRL3 мутациями созревания аффинности (крупным шрифтом, курсивом)
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLSKYRSSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQAYHLPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:19)
Fab100, легкая цепь (L28D1), вариабельная область [Заметьте, что CDRL2 и CDRL3 мутации созревания аффинности выделены крупным шрифтом и курсивом]
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLSKYRSSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQAYHLPLTFGQGTKLEIK (SEQ ID NO:20)
Fab100, легкая цепь (L28D1), CDRL области [Заметьте, что CDRL2 и CDRL3 мутации созревания аффинности выделены крупным шрифтом и курсивом]
CDRL1: RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2: LSKYRSS (SEQ ID NO:21)
CDRL3: SQAYHLPLT (SEQ ID NO:22)
Fab101 легкая цепь (L28G1) с CDRL2 и CDRL3 мутациями созревания аффинности (крупным шрифтом, курсивом)
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLGKYGASGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCAQATQLPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:23)
Fab101 легкая цепь (L28G1), вариабельная область [Заметьте, что CDRL2 и CDRL3 мутации созревания аффинности выделены крупным шрифтом и курсивом]
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLGKYGASGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCAQATQLPLTFGQGTKLEIK (SEQ ID NO:24)
Fab101, легкая цепь (L28G1), CDRL области [[Заметьте, что CDRL2 и CDRL3 мутации созревания аффинности выделены крупным шрифтом и курсивом]
CDRL1: RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2: LGKYGAS (SEQ ID NO:25)
CDRL3: AQATQLPLT (SEQ ID NO:26)
Fab102 легкая цепь (L28G8) с CDRL2 мутациями созревания аффинности (крупным шрифтом, курсивом)
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLGHFASSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:27)
Fab102 легкая цепь (L28G8), вариабельная область [Заметьте, что CDRL2 мутации созревания аффинности выделены крупным шрифтом и курсивом]
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLGHFASSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIK (SEQ ID NO:28)
Fab102 легкая цепь (L28G8), CDRL области
CDRL1: RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2: LGHFASS (SEQ ID NO:29) [Заметьте, что CDRL2 мутации созревания аффинности выделены крупным шрифтом и курсивом]
CDRL3: QHSWELPLT (SEQ ID NO:5)
Fab103 легкая цепь (L28H3) с CDRL2 мутациями созревания аффинности (крупным шрифтом, курсивом)
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLGRYLQSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:30)
Fab103 легкая цепь (L28H3), вариабельная область [Заметьте, что CDRL2 мутации созревания аффинности выделены крупным шрифтом и курсивом]
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLGRYLQSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIK (SEQ ID NO:31)
Fab103 легкая цепь (L28H3) CDRL regions
CDRL1: RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2: LGRYLQS (SEQ ID NO:32) [Заметьте, что CDRL2 мутации созревания аффинности выделены крупным шрифтом и курсивом]
CDRL3: QHSWELPLT (SEQ ID NO:5)
Fab104, легкая цепь (L28H10) с CDRL2 мутациями созревания аффинности (крупным шрифтом, курсивом)
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLGTHSVSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:33)
Fab104 легкая цепь (L28H10), вариабельная область [Заметьте, что CDRL2 мутации созревания аффинности выделены крупным шрифтом и курсивом]
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLGTHSVSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIK (SEQ ID NO:34)
Fab104 легкая цепь (L28H10) CDRL области
CDRL1: RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2: LGTHSVS (SEQ ID NO:35) [Заметьте, что CDRL2 мутации созревания аффинности выделены крупным шрифтом и курсивом]
CDRL3: QHSWELPLT (SEQ ID NO:5)
Fab128, тяжелая цепь, Fab область (H34B7) с CDRH1 мутациями созревания аффинности (крупным шрифтом, курсивом) и CDRH2 S61N коррекцией, A92S FR мутацией
EVQLVQSGAEVKKPGASVKVSCKASGYTFTQYYYYWVRQAPGQGLEWIGGVNPSNGGTNF
NEKFKSRVTLTVDTSISTAYMELSRLRSDDTSVYYCTRRDSNYDGGFDYWGQGTTVTVSS
ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSS
GLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVE (SEQ ID NO:36)
Fab128, тяжелая цепь, (H34B7), вариабельная область с CDRH1 мутациями созревания аффинности (крупным шрифтом, курсивом) and CDRH2 S61N коррекцией, A92S FR мутацией
EVQLVQSGAEVKKPGASVKVSCKASGYTFTQYYYYWVRQAPGQGLEWIGGVNPSNGGTNF
NEKFKSRVTLTVDTSISTAYMELSRLRSDDTSVYYCTRRDSNYDGGFDYWGQGTTVTVSS (SEQ ID NO:37)
Fab128, тяжелая цепь, (H34B7) с CDRH1 мутациями созревания аффинности (крупным шрифтом, курсивом) и CDRH2 S61N коррекцией
EVQLVQSGAEVKKPGASVKVSCKASGYTFTQYYYYWVRQAPGQGLEWIGGVNPSNGGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVE (SEQ ID NO:118)
Fab128, тяжелая цепь, (H34B7), вариабельная область с CDRH1 мутациями созревания аффинности (крупным шрифтом, курсивом) и CDRH2 S61N коррекцией
EVQLVQSGAEVKKPGASVKVSCKASGYTFTQYYYYWVRQAPGQGLEWIGGVNPSNGGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSS (SEQ ID NO:119)
Fab128 легкая цепь (L34B7), с CDRL2 мутациями созревания аффинности (крупным шрифтом, курсивом)
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLGRHRAS
GVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVF
IFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLS
STLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:38)
Fab128 легкая цепь (L34B7), вариабельная область [Заметьте, что CDRL2 мутации созревания аффинности выделены крупным шрифтом и курсивом]
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLGRHRAS
GVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIK (SEQ ID NO:39)
Fab128 (L34B7) CDRH и CDRL области
CDRH1: QYYYY (SEQ ID NO:40)
CDRH2: GVNPSNGGTNFNEKFKS (SEQ ID NO:9)
CDRH3: RDSNYDGGFDY (SEQ ID NO:41)
CDRL1: RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2: LGRHRAS (SEQ ID NO:42)
CDRL3: QHSWELPLT (SEQ ID NO:5)
Fab 133, тяжелая цепь, Fab область (H33F5) с CDRH1 мутациями созревания аффинности (крупным шрифтом, курсивом) и CDRH2 S61N коррекцией, и FR мутацией A92S
EVQLVQSGAEVKKPGASVKVSCKASGYTFTQYYYYWVRQAPGQGLEWIGGVNPSNGGTNF
NEKFKSRVTLTVDTSISTAYMELSRLRSDDTSVYYCTRRDSNYDGGFDYWGQGTTVTVSS
ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSS
GLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVE (SEQ ID NO:43)
Fab 133, тяжелая цепь, (H33F5), вариабельная область с CDRH1 мутациями созревания аффинности (крупным шрифтом, курсивом) и с CDRH2 S61N коррекцией, и с FR мутацией A92S
EVQLVQSGAEVKKPGASVKVSCKASGYTFTQYYYYWVRQAPGQGLEWIGGVNPSNGGTNF
NEKFKSRVTLTVDTSISTAYMELSRLRSDDTSVYYCTRRDSNYDGGFDYWGQGTTVTVSS (SEQ ID NO:44)
Fab 133, тяжелая цепь, Fab region (H33F5) с CDRH1 мутациями созревания аффинности (крупным шрифтом, курсивом) и CDRH2 S61N коррекцией
EVQLVQSGAEVKKPGASVKVSCKASGYTFTQYYYYWVRQAPGQGLEWIGGVNPSNGGTNF
NEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSS
ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSS
GLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVE (SEQ ID NO:120)
Fab 133, тяжелая цепь, (H33F5), вариабельная область с CDRH1 мутациями созревания аффинности (крупным шрифтом, курсивом) и CDRH2 S61N коррекцией
EVQLVQSGAEVKKPGASVKVSCKASGYTFTQYYYYWVRQAPGQGLEWIGGVNPSNGGTNF
NEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSS (SEQ ID NO:121)
Fab133 легкая цепь (L33F5) с CDRL2 и CDRL3 мутациями созревания аффинности (крупным шрифтом, курсивом)
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLGFYRTS
GVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQMADLPLTFGQGTKLEIKRTVAAPSVF
IFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLS
STLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:45)
Fab133 легкая цепь (L33F5), вариабельная область [Заметьте, что CDRL2 и CDRL3 мутации созревания аффинности выделены крупным шрифтом и курсивом]
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLGFYRTS
GVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQMADLPLTFGQGTKLEIK (SEQ ID NO:46)
Fab133 (L33F5) CDRH и CDRL области
CDRH1: QYYYY (SEQ ID NO:40)
CDRH2: GVNPSNGGTNFNEKFKS (SEQ ID NO:9)
CDRH3: RDSNYDGGFDY (SEQ ID NO:41)
CDRL1: RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2: LGFYRTS (SEQ ID NO:47)
CDRL3: SQMADLPLT (SEQ ID NO:48)
Fab 138, тяжелая цепь, (H34F11) Fab область с CDRH1 и CDRH2 мутациями созревания аффинности (крупным шрифтом, курсивом) и CDRH2 S61N коррекцией
EVQLVQSGAEVKKPGASVKVSCKASGYTFTQYYTYWVRQAPGQGLEWIGGIEPNRGGTNF
NEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSS
ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSS
GLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVE (SEQ ID NO:49)
Fab 138, тяжелая цепь, (H34F11), вариабельная область [Заметьте, что CDRH1 и CDRH2 мутации созревания аффинности выделены крупным шрифтом и курсивом]
EVQLVQSGAEVKKPGASVKVSCKASGYTFTQYYTYWVRQAPGQGLEWIGGIEPNRGGTNF
NEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSS (SEQ ID NO:50)
Fab138 легкая цепь (L34F11) c CDRL3 мутациями созревания аффинности (крупным шрифтом, курсивом)
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLASNLES
GVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCAQTFELPLTFGQGTKLEIKRTVAAPSVF
IFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLS
STLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:51)
Fab138 легкая цепь (L34F11), вариабельная область [Note that the CDRL3 affinity maturation mutations are in bold, italics.]
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLASNLES
GVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCAQTFELPLTFGQGTKLEIK (SEQ ID NO:52)
Fab138 CDRH and CDRL regions
CDRH1: QYYTY (SEQ ID NO:53)
CDRH2: GIEPNRGGTNFNEKFKS (SEQ ID NO:54)
CDRH3: RDSNYDGGFDY (SEQ ID NO:41)
CDRL1: RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2: LASNLES (SEQ ID NO:4)
CDRL3: AQTFELPLT (SEQ ID NO:55)
Fab139, тяжелая цепь, Fab region (H34G8) with CDRH1 мутациями созревания аффинности (крупным шрифтом, курсивом) и CDRH2 S61N correction, and A92S FR mutation
EVQLVQSGAEVKKPGASVKVSCKASGYTFTQYYYYWVRQAPGQGLEWIGGVNPSNGGTNF
NEKFKSRVTLTVDTSISTAYMELSRLRSDDTSVYYCTRRDSNYDGGFDYWGQGTTVTVSS
ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSS
GLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVE (SEQ ID NO:56)
Fab139, тяжелая цепь, (H34G8), вариабельная область with CDRH1 мутациями созревания аффинности (крупным шрифтом, курсивом) and CDRH2 S61N correction, and A92S FR mutation
EVQLVQSGAEVKKPGASVKVSCKASGYTFTQYYYYWVRQAPGQGLEWIGGVNPSNGGTNF
NEKFKSRVTLTVDTSISTAYMELSRLRSDDTSVYYCTRRDSNYDGGFDYWGQGTTVTVSS
(SEQ ID NO:57)
Fab139, тяжелая цепь, Fab region (H34G8) with CDRH1 мутациями созревания аффинности (крупным шрифтом, курсивом) и CDRH2 S61N correction
EVQLVQSGAEVKKPGASVKVSCKASGYTFTQYYYYWVRQAPGQGLEWIGGVNPSNGGTNF
NEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSS
ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSS
GLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVE (SEQ ID NO:122)
Fab139, тяжелая цепь, (H34G8), вариабельная область with CDRH1 мутациями созревания аффинности (крупным шрифтом, курсивом) и CDRH2 S61N коррекцией
EVQLVQSGAEVKKPGASVKVSCKASGYTFTQYYYYWVRQAPGQGLEWIGGVNPSNGGTNF
NEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSS
(SEQ ID NO:123)
Fab139, легкая цепь (L34G8) с CDRL2 мутациями созревания аффинности (крупным шрифтом, курсивом)
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLSKFRRS
GVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVF
IFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLS
STLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:58)
Fab139 легкая цепь (L34G8), вариабельная область [Заметьте, что CDRL2 мутации созревания аффинности выделены крупным шрифтом и курсивом]
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLSKFRRS
GVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIK (SEQ ID NO:59)
Fab139 CDRH и CDRL области
CDRH1: QYYYY (SEQ ID NO:40)
CDRH2: GVNPSNGGTNFNEKFKS (SEQ ID NO:9)
CDRH3: RDSNYDGGFDY (SEQ ID NO:41)
CDRL1: RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2: LSKFRRS (SEQ ID NO:60)
CDRL3: QHSWELPLT (SEQ ID NO:5)
Fab128, 133, 138 и 139 CDRH и CDRL последовательности, включая консенснусные последовательности (с коррекциями S61N or G56A или без них, одной или обех)
CDRH1: QYYZ1Y; где Z1 представляет собой T или Y (SEQ ID NO:61)
CDRH2: GZ2Z3PZ4Z5Z6GTNFZ7EKFKS; где Z2 представляет собой V или I, Z3 представляет собой E или N, Z4 представляет собой N или S, Z5 представляет собой R или N, Z6 представляет собой G or A, and Z7 представляет собой S или N. (SEQ ID NO:62)
CDRH3: RDSNYDGGFDY (SEQ ID NO:41)
CDRL1: RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2: LZ8Z9Z10Z11Z12S; wherein Z8 представляет собой G, A или S, Z9 представляет собой R, F, S или K, Z10 представляет собой H, Y, N или F, Z11 представляет собой R или L, а Z12 представляет собой A, T, E или R (SEQ ID NO:63)
CDRL3: Z13Z14Z15Z16Z17LPLT; где Z13 представляет собой Q, S или A, Z14 представляет собой Q или H, Z15 представляет собой S, M, или T, Z16 представляет собой W, A, или F, а Z17 представляет собой E or D. (SEQ ID NO:64)
Мышь, x [PD-1_H] mAb (Клон 08A) IgG1/Каппа (CE) (09AFF)
Мышь-08A mAb, тяжелая цепь:
QVQLQQPGAELVKPGASVKLSCKASGYTFTSYYLYWMKQRPGQGLEWIGGVNPSNGGTNFSEKFKSKATLTVDKSSSTAYMQLSSLTSEDSAVYYCTRRDSNYDGGFDYWGQGTTLTVSSAKTTPPSVYPLAPGSAAQTNSMVTLGCLVKGYFPEPVTVTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVPSSTWPSETVTCNVAHPASSTKVDKKIVPRDCGCKPCICTVPEVSSVFIFPPKPKDVLTITLTPKVTCVVVAISKDDPEVQFSWFVDDVEVHTAQTQPREEQFNSTFRSVSELPIMHQDWLNGKEFKCRVNSAAFPAPIEKTISKTKGRPKAPQVYTIPPPKEQMAKDKVSLTCMITDFFPEDITVEWQWNGQPAENYKNTQPIMDTDGSYFVYSKLNVQKSNWEAGNTFTCSVLHEGLHNHHTEKSLSHSPGK (SEQ ID NO:65)
Мышь-08A mAb легкая цепь:
DIVLTQSPTSLAVSLGQRATISCRASKSVSTSGFSYLHWYQQKPGQPPKLLIFLASNLESGVPARFSGSGSGTDFTLNIHPVEEEDAATYYCQHSWELPLTFGAGTKLELKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC (SEQ ID NO:66)
Mouse x [PD-1_H] mAb (clone 09A) IgG1/Kappa (CE) (03AFN)
Мышь-09A mAb Тяжелая Цепь
QVQLQQPGAELVKPGTSVKLSCKASGYTFTNYYMYWVKQRPGQGLEWIGGINPSNGGTNFNEKFKNKATLTVDSSSSTTYMQLSSLTSEDSAVYYCTRRDYRFDMGFDYWGQGTTLTVSSAKTTPPSVYPLAPGSAAQTNSMVTLGCLVKGYFPEPVTVTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVPSSTWPSETVTCNVAHPASSTKVDKKIVPRDCGCKPCICTVPEVSSVFIFPPKPKDVLTITLTPKVTCVVVDISKDDPEVQFSWFVDDVEVHTAQTQPREEQFNSTFRSVSELPIMHQDWLNGKEFKCRVNSAAFPAPIEKTISKTKGRPKAPQVYTIPPPKEQMAKDKVSLTCMITDFFPEDITVEWQWNGQPAENYKNTQPIMDTDGSYFVYSKLNVQKSNWEAGNTFTCSVLHEGLHNHHTEKSLSHSPGK (SEQ ID NO:67)
Мышь-09A mAb легкая цепь
DIVLTQSPASLAVSLGQRAAISCRASKGVSTSGYSYLHWYQQKPGQSPKLLIYLASYLESGVPARFSGSGSGTDFTLNIHPVEEEDAATYYCQHSRDLPLTFGTGTKLELKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC (SEQ ID NO:68)
Мышь x [PD-1_H] mAb (Клон 1.08 N59Q) IgG1/Kappa (CE) (38AFL)
Мышь-08A mAb, тяжелая цепь, с CDRH2 N59Q мутацией
QVQLQQPGAELVKPGASVKLSCKASGYTFTSYYLYWMKQRPGQGLEWIGGVNPSNGGTQFSEKFKSKATLTVDKSSSTAYMQLSSLTSEDSAVYYCTRRDSNYDGGFDYWGQGTTLTVSSAKTTPPSVYPLAPGSAAQTNSMVTLGCLVKGYFPEPVTVTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVPSSTWPSETVTCNVAHPASSTKVDKKIVPRDCGCKPCICTVPEVSSVFIFPPKPKDVLTITLTPKVTCVVVAISKDDPEVQFSWFVDDVEVHTAQTQPREEQFNSTFRSVSELPIMHQDWLNGKEFKCRVNSAAFPAPIEKTISKTKGRPKAPQVYTIPPPKEQMAKDKVSLTCMITDFFPEDITVEWQWNGQPAENYKNTQPIMDTDGSYFVYSKLNVQKSNWEAGNTFTCSVLHEGLHNHHTEKSLSHSPGK (SEQ ID NO:69)
Мышь-08A mAb легкая цепь
DIVLTQSPTSLAVSLGQRATISCRASKSVSTSGFSYLHWYQQKPGQPPKLLIFLASNLESGVPARFSGSGSGTDFTLNIHPVEEEDAATYYCQHSWELPLTFGAGTKLELKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC (SEQ ID NO:66)
Мышь x [PD-1_H] mAb (Клон 1.08 N59E) IgG1/Каппа (CE) (39AFL)
Мышь-08A mAb, тяжелая цепь, с CDRH2 N59E мутацией
QVQLQQPGAELVKPGASVKLSCKASGYTFTSYYLYWMKQRPGQGLEWIGGVNPSNGGTEFSEKFKSKATLTVDKSSSTAYMQLSSLTSEDSAVYYCTRRDSNYDGGFDYWGQGTTLTVSSAKTTPPSVYPLAPGSAAQTNSMVTLGCLVKGYFPEPVTVTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVPSSTWPSETVTCNVAHPASSTKVDKKIVPRDCGCKPCICTVPEVSSVFIFPPKPKDVLTITLTPKVTCVVVAISKDDPEVQFSWFVDDVEVHTAQTQPREEQFNSTFRSVSELPIMHQDWLNGKEFKCRVNSAAFPAPIEKTISKTKGRPKAPQVYTIPPPKEQMAKDKVSLTCMITDFFPEDITVEWQWNGQPAENYKNTQPIMDTDGSYFVYSKLNVQKSNWEAGNTFTCSVLHEGLHNHHTEKSLSHSPGK (SEQ ID NO:70)
Мышь-08A mAb легкая цепь
DIVLTQSPTSLAVSLGQRATISCRASKSVSTSGFSYLHWYQQKPGQPPKLLIFLASNLESGVPARFSGSGSGTDFTLNIHPVEEEDAATYYCQHSWELPLTFGAGTKLELKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC (SEQ ID NO:66)
Мышь x [PD-1_H] mAb (Клон 1.08 N59A) IgG1/Каппа (CE) (80AFH)
Мышь-08A mAb, тяжелая цепь, с CDRH2 N59A мутацией
QVQLQQPGAELVKPGASVKLSCKASGYTFTSYYLYWMKQRPGQGLEWIGGVNPSNGGTAFSEKFKSKATLTVDKSSSTAYMQLSSLTSEDSAVYYCTRRDSNYDGGFDYWGQGTTLTVSSAKTTPPSVYPLAPGSAAQTNSMVTLGCLVKGYFPEPVTVTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVPSSTWPSETVTCNVAHPASSTKVDKKIVPRDCGCKPCICTVPEVSSVFIFPPKPKDVLTITLTPKVTCVVVAISKDDPEVQFSWFVDDVEVHTAQTQPREEQFNSTFRSVSELPIMHQDWLNGKEFKCRVNSAAFPAPIEKTISKTKGRPKAPQVYTIPPPKEQMAKDKVSLTCMITDFFPEDITVEWQWNGQPAENYKNTQPIMDTDGSYFVYSKLNVQKSNWEAGNTFTCSVLHEGLHNHHTEKSLSHSPGK (SEQ ID NO:71)
Мышь-08A mAb легкая цепь
DIVLTQSPTSLAVSLGQRATISCRASKSVSTSGFSYLHWYQQKPGQPPKLLIFLASNLESGVPARFSGSGSGTDFTLNIHPVEEEDAATYYCQHSWELPLTFGAGTKLELKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC (SEQ ID NO:66)
Гуманизированное x [PD-1_H] mAb (08A/HuPD1A-11 N55E S228P) IgG4/Каппа (50AQK)
50AQK mAb, тяжелая цепь, (Hu08A Fab с CDRH2 N55E мутацией) с S228P кррекцией
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSEGGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK (SEQ ID NO:72)
50AQK mAb легкая цепь
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:2)
Гуманизированное x [PD-1_H] mAb (08A/HuPD1A-11 S228P) IgG4/Каппа (PK) (лот 73AGG)
73AGG mAb, тяжелая цепь, с S228P коррекцией (Hu08A Fab)
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNGGTNFSEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK (SEQ ID NO:73)
73AGG mAb легкая цепь
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:2)
Гуманизированное x [PD-1_H] mAb (08A/HuPD1A-11 S61N S228P скорректировано) IgG4/Каппа (CE) (98AIO)
98AIO mAb, тяжелая цепь, (Hu08A Fab с S61N коррекцией для удаления сайта N-гликозилирования) с S228P коррекцией
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNGGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK (SEQ ID NO:74)
Hu08A, тяжелая цепь, вариабельная область с S61N коррекцией для удаления сайта N-гликозилирования
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNGGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSS (SEQ ID NO:75)
98AIO mAb легкая цепь
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:2)
Hu08A легкая цепь, вариабельная область:
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIK (SEQ ID NO:76)
Hu08A, CDRH области тяжелой цепи с S61N коррекцией и CDRL области легкой цепи
CDRH1:SYYLY (SEQ ID NO:8)
CDRH2:GVNPSNGGTNFNEKFKS (SEQ ID NO:9)
CDRH3:RDSNYDGGFDY (SEQ ID NO:41)
CDRL1:RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2:LASNLES (SEQ ID NO:4)
CDRL3:QHSWELPLT (SEQ ID NO:5)
Гуманизированное x [PD-1_H] mAb (08A/HuPD1A-11 G56A) IgG4 S228P/Каппа (CX) (лот 89AVZ)
89AVZ mAb, тяжелая цепь, (Hu08A Fab с G56A коррекцией) с S228P коррекцией
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNAGTNFSEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK (SEQ ID NO:77)
Hu08A, тяжелая цепь, вариабельная область с G56A коррекцией
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNAGTNFSEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSS (SEQ ID NO:78)
89AVZ mAb легкая цепь
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:2)
Hu08A легкая цепь, вариабельная область
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIK (SEQ ID NO:76)
Hu08A, CDRH области тяжелой цепи с G56A коррекцией и CDRL области легкой цепи
CDRH1:SYYLY (SEQ ID NO:8)
CDRH2:GVNPSNAGTNFSEKFKS (SEQ ID NO:79)
CDRH3:RDSNYDGGFDY (SEQ ID NO:41)
CDRL1:RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2:LASNLES (SEQ ID NO:4)
CDRL3:QHSWELPLT (SEQ ID NO:5)
Гуманизированное x [PD-1_H] Fab (08A/HuPD1A-11 S61N WT) IgG4/Каппа (PX) (00APE)- гуманизированное 08A Fab с коррекцией по сайту N-гликозилирования (S61N)
Hu08A, тяжелая цепь, Fab область с S61N коррекцией:
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNGGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPP (SEQ ID NO:80)
Hu08A легкая цепь
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:2)
Гуманизированное x [PD-1_H] mAb (08A/HuPD1A-11 S61N WT) S228P IgG4/Kappa (PX) (67AGG)- гуманизированное 08A mAb с коррекцией по сайту N-гликозилирования (S61N) и HFR4 мутацией
67AGG mAb, тяжелая цепь, (Hu08A Fab с CDRH2 S61N коррекцией, HFR4 мутацией), с IgG4 S228P мутацией
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNGGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTLTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK (SEQ ID NO:82)
Hu08A, тяжелая цепь, вариабельная область с CDRH2 S61N коррекцией и HFR4 мутацией
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNGGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTLTVSS (SEQ ID NO:81)
67AGG mAb легкая цепь
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:2)
Hu08A легкая цепь, вариабельная область
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIK (SEQ ID NO:76)
Гуманизированное x [PD-1_H] mAb (08A/HuPD1A-11 S61N VH G56A/VL ) IgG4 S228P/Каппа (PX) (51AQK)
51AQK mAb, тяжелая цепь, (Hu08A Fab с S61N и G56A коррекциями в CDRH2), с IgG4 S228P коррекцией
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNAGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK (SEQ ID NO:83)
51AQK mAb легкая цепь
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:2)
Гуманизированное x [PD-1_H] Fab (08A/HuPD1A-11 S61N G56A CP-аффинно-созревший Fab 100 (VH H3G9 (D100L N102H мутации созревания аффинности) / VL L28D1 (A55S S56K N57Y L58R E59S Q93S H94Q S95A W96Y E97H мутации созревания аффинности) IgG4 S228P/Каппа (PX) (Fab100 с S61N и G56A коррекциями в VH-CDR2)
Fab100, тяжелая цепь, Fab область с S61N, G56A коррекциями, и с D100L N102H мутациями созревания аффинности EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNAGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRLSHYDGGFDYWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVE (SEQ ID NO:84)
Fab100, тяжелая цепь, вариабельная область с S61N, G56A коррекциями и D100L N102H мутациями созревания аффинности
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNAGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRLSHYDGGFDYWGQGTTVTVSS (SEQ ID NO:85)
Fab100 легкая цепь с A55S S56K N57Y L58R E59S Q93S H94Q S95A W96Y E97H мутациями созревания аффинности DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLSKYRSSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQAYHLPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:19)
Fab100 легкая цепь, вариабельная область с A55S S56K N57Y L58R E59S Q93S H94Q S95A W96Y E97H мутациями созревания аффинности
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLSKYRSSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQAYHLPLTFGQGTKLEIK (SEQ ID NO:20)
Fab100 CDRH и CDRL области с S61N и G56A коррекциями
CDRH1:SYYLY (SEQ ID NO:8)
CDRH2: GVNPSNAGTNFNEKFKS (SEQ ID NO:86)
CDRH3: RLSHYDGGFDY (SEQ ID NO:10)
CDRL1:RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2: LSKYRSS (SEQ ID NO:21)
CDRL3: SQAYHLPLT (SEQ ID NO:22)
Гуманизированное x [PD-1_H] Fab (08A/HuPD1A-11 S61N CP-аффинно-зрелый Fab 100 (VH H3G9 (D100L N102H мутациями созревания аффинности)/VL L28D1 (A55S S56K N57Y L58R E59S Q93S H94Q S95A W96Y E97H мутации созревания аффинности) IgG4 S228P/Каппа (PX) (31ARL)
Fab100, тяжелая цепь, Fab область с S61N коррекцией и D100L N102H мутациями созревания аффинности EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNGGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRLSHYDGGFDYWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVE (SEQ ID NO:87)
Fab100, тяжелая цепь, вариабельная область с S61N коррекцией и D100L N102H мутациями созревания аффинности EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNGGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRLSHYDGGFDYWGQGTTVTVSS (SEQ ID NO:7)
Fab100 легкая цепь с A55S S56K N57Y L58R E59S Q93S H94Q S95A W96Y E97H мутациями созревания аффинности DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLSKYRSSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQAYHLPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:19)
Fab100 легкая цепь, вариабельная область с A55S S56K N57Y L58R E59S Q93S H94Q S95A W96Y E97H мутациями созревания аффинности
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLSKYRSSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQAYHLPLTFGQGTKLEIK (SEQ ID NO:20)
Fab100 CDRH и CDRL области с S61N коррекцией
CDRH1:SYYLY (SEQ ID NO:8)
CDRH2: GVNPSNGGTNFNEKFKS (SEQ ID NO:9)
CDRH3: RLSHYDGGFDY (SEQ ID NO:10)
CDRL1:RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2: LSKYRSS (SEQ ID NO:21)
CDRL3: SQAYHLPLT (SEQ ID NO:22)
Гуманизированное x [PD-1_H] mAb (08A/HuPD1A-11 CP-аффинно-зрелый Fab 098 VH H3G9 (D100L N102H) G56A) IgG4 S228P/Каппа (CX) (90AVZ)
90AVZ mAb, тяжелая цепь, (Fab098 с G56A коррекцией и D100L N102H мутациями созревания аффинности), с IgG4 S228P мутацией
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNAGTNFSEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRLSHYDGGFDYWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK (SEQ ID NO:89)
Fab098, тяжелая цепь, вариабельная область с G56A коррекцией в D100L N102H мутациями созревания аффинности EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNAGTNFSEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRLSHYDGGFDYWGQGTTVTVSS (SEQ ID NO:88)
Fab098 легкая цепь, вариабельная область
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIK (SEQ ID NO:76)
90AVZ mAb легкая цепь
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:2)
Fab098 CDRH и CDRL области с CDRH2 G56A коррекцией и CDRH3 D100L и N102H мутациями созревания аффинности
CDRH1:SYYLY (SEQ ID NO:8)
CDRH2:GVNPSNAGTNFSEKFKS (SEQ ID NO:79)
CDRH3:RLSHYDGGFDY (SEQ ID NO:10)
CDRL1: RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2: LASNLES (SEQ ID NO:4)
CDRL3: QHSWELPLT (SEQ ID NO:5)
Гуманизированное x [PD-1_H] mAb (08A/HuPD1A-11 S61N CP-аффинно-зрелый Fab 100 (VH H3G9 (D100L N102H) G56A/VL L28D1 (A55S S56K N57Y L58R E59S Q93S H94Q S95A W96Y E97H)) L234A L235A D265S) IgG1/Каппа (CX) (25AVE)
25AVE mAb, тяжелая цепь, (Fab100 с S61N и G56A коррекциями и D100L N102H мутациями созревания аффинности), с L234A L235A D265S мутациями
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNAGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRLSHYDGGFDYWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVSVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:90)
25AVE mAb легкая цепь (Fab100 с A55S S56K N57Y L58R E59S Q93S H94Q S95A W96Y E97H мутациями созревания аффинности)
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLSKYRSSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQAYHLPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:19)
Fab100 анти-PD-1 CDRH и CDRL области с или без G56A, S61N коррекциями, одной или обеими
CDRH1: SYYLY (SEQ ID NO:8)
CDRH2: GVNPSNX1GTNFX2EKFKS; где X1=G или A, и X2= S или N (SEQ ID NO:91)
CDRH3: RLSHYDGGFDY (SEQ ID NO:10)
CDRL1: RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2: LSKYRSS (SEQ ID NO:21)
CDRL3: SQAYHLPLT (SEQ ID NO:22)
Fab100 anti-PD-1, тяжелая цепь, вариабельная область с или без G56A, S61N коррекций, одной или обеими
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNX1GTNFX2EKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRLSHYDGGFDYWGQGTTVTVSS; где X1=G или A, и X2= S или N (SEQ ID NO:92)
Hu08A anti-PD-1, тяжелая цепь, вариабельная область с или без G56A, S61N коррекций, одной или обеими
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNX1GTNFX2EKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSS; где X1=G или A, и X2= S или N (SEQ ID NO:93)
Гуманизированное x [PD-1_H] mAb (08A/HuPD1A-11 S61N VH G56A/VL) IgG1 L234A L235A D265S/Каппа (CX) (71ATV/55AFL)- гуманизированное 08A с N-glyc коррекцией и коррекцией деамидирования
55AFL mAb, тяжелая цепь, (Hu08A Fab с S61N и G56A коррекциями) с IgG1 L234A L235A D265S мутациями
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNAGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVSVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:94)
Hu08A, тяжелая цепь, вариабельная область с S61N и G56A коррекциями:
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNAGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSS (SEQ ID NO:95)
55AFL mAb легкая цепь:
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:2)
Hu08A легкая цепь, вариабельная область:
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIK (SEQ ID NO:76)
Hu08A CDRH области с S61N и G56A коррекциями и CDRL области
CDRH1:SYYLY (SEQ ID NO:8)
CDRH2:GVNPSNAGTNFNEKFKS (SEQ ID NO:86)
CDRH3:RDSNYDGGFDY (SEQ ID NO:41)
CDRL1:RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2:LASNLES (SEQ ID NO:4)
CDRL3:QHSWELPLT (SEQ ID NO:5)
Hu08A CDRH и CDRL области с или без G56A, S61N коррекциями, одной или обеими
CDRH1:SYYLY (SEQ ID NO:8)
CDRH2:GVNPSNX1GTNFX2EKFKS; где X1=G или A, и X2= S или N (SEQ ID NO:91)
CDRH3:RDSNYDGGFDY (SEQ ID NO:41)
CDRL1:RASKSVSTSGFSYLH (SEQ ID NO:3)
CDRL2:LASNLES (SEQ ID NO:4)
CDRL3:QHSWELPLT (SEQ ID NO:5)
Анти-PD1/LAG3 BsAb (08A/Hu PD1A-11 S61N G56A ZWCH1-5 ZM856A/гуманизированное hum 08A LC ZWCL-4) and (22D2 ZWCH1-6 ZM857B/22D2 LC ZWCL-5) L234A L235A D265S) IgG1/Каппа (CX)-11ARW (22D2 HC), 13ARW (22D2 LC), 12ARW (08A LC),14ARW (08A HC) (lot 90ASU)
Анти-LAG3 гуманизированное 22D2, тяжелая цепь, с CH1 мутацией (S181K), L234A, L235A, D265S мутациями в CH2, ZW 857B мутациями в CH3 (T350V, T366L, K392L, T394W)
QMQLVQSGPEVKKPGTSVKVSCKASGYTFTDYNVDWVRQARGQRLEWIGDINPNDGGTIYAQKFQERVTITVDKSTSTAYMELSSLRSEDTAVYYCARNYRWFGAMDHWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYKLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVSVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYVLPPSRDELTKNQVSLLCLVKGFYPSDIAVEWESNGQPENNYLTWPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG (SEQ ID NO:96)
Анти-LAG3 гуманизированное 22D2, тяжелая цепь, вариабельная область
QMQLVQSGPEVKKPGTSVKVSCKASGYTFTDYNVDWVRQARGQRLEWIGDINPNDGGTIYAQKFQERVTITVDKSTSTAYMELSSLRSEDTAVYYCARNYRWFGAMDHWGQGTTVTVSS (SEQ ID NO:97)
Анти-LAG3 гуманизированное 22D2 легкая цепь с Ck мутациями (Q124E, S131T, T178Y, T180E)
DIVMTQTPLSLSVTPGQPASISCKASQSLDYEGDSDMNWYLQKPGQPPQLLIYGASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQQSTEDPRTFGGGTKVEIKRTVAAPSVFIFPPSDEELKSGTATVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSYLELSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:98)
Анти-LAG3 гуманизированное 22D2, легкая цепь, вариабельная область
DIVMTQTPLSLSVTPGQPASISCKASQSLDYEGDSDMNWYLQKPGQPPQLLIYGASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQQSTEDPRTFGGGTKVEIK (SEQ ID NO:99)
Анти-PD1 humanized 08A легкая цепь with CL mutations (Q124R, T178R) DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVFIFPPSDERLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSRLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:100)
Анти-PD1 гуманизированное 08A, тяжелая цепь с S61N и G56A коррекциями, CH1 мутациями (L145E, K147T, Q175E, S183L), L234A, L235A, D265S мутации в CH2, ZW 856A мутации в CH3 (T350V, L351Y, F405A, Y407V)
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNAGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCEVTDYFPEPVTVSWNSGALTSGVHTFPAVLESSGLYSLLSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVSVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYVYPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFALVSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG (SEQ ID NO:101)
Гуманизированное x [PD-1_H] [LAG3_H] BsAb ((08A/HuPD1A-11 S61N CP-аффинно-зрелый Fab 100 VH H3G9 G56A ZWCH1-5 ZM856A/VL L28D1 ZWCL-4) и (22D2 ZWCH1-6 ZM857B/22D2 LC ZWCL-5) L234A L235A D265S) IgG1/Каппа (CX)- лот 35ASI или 18ASS)
Анти-LAG3 гуманизированное 22D2, тяжелая цепь, с CH1 мутацией (S181K), L234A, L235A, D265S мутации в CH2, ZW 857B мутации в CH3 (T350V, T366L, K392L, T394W)
QMQLVQSGPEVKKPGTSVKVSCKASGYTFTDYNVDWVRQARGQRLEWIGDINPNDGGTIYAQKFQERVTITVDKSTSTAYMELSSLRSEDTAVYYCARNYRWFGAMDHWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYKLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVSVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYVLPPSRDELTKNQVSLLCLVKGFYPSDIAVEWESNGQPENNYLTWPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG (SEQ ID NO:96)
Анти-LAG3 гуманизированное 22D2 легкая цепь с Ck мутациями (Q124E, S131T, T178Y, T180E)
DIVMTQTPLSLSVTPGQPASISCKASQSLDYEGDSDMNWYLQKPGQPPQLLIYGASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQQSTEDPRTFGGGTKVEIKRTVAAPSVFIFPPSDEELKSGTATVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSYLELSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:98)
Анти-PD1 Fab100, тяжелая цепь, с S61N и G56A коррекциями, CH1 мутациями (L145E, K147T, Q175E, S183L), L234A, L235A, D265S мутации в CH2, ZW 856A мутации в CH3 (T350V, L351Y, F405A, Y407V)
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVRQAPGQGLEWIGGVNPSNAGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRLSHYDGGFDYWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCEVTDYFPEPVTVSWNSGALTSGVHTFPAVLESSGLYSLLSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVSVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYVYPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFALVSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG (SEQ ID NO:102)
Анти-PD1 Fab100 легкая цепь с CL мутациями (Q124R, T178R)
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLQKPGQPPQLLIFLSKYRSSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQAYHLPLTFGQGTKLEIKRTVAAPSVFIFPPSDERLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSRLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:103)
Гуманизированное x [PD-1_H] [LAG3_H] BsAb (08A/ Hu PD1A-11 S61N Q39E ZW CH1-4 ZM857B и 22D2 Q39R ZW CH1-3 ZM856A) L234A, L235A, D265S IgG1/ гуманизированное 08A LC Q42R ZW CL-3 и 22D2 Q39E LC ZWCL-2) Каппа (CE) (лот 33ARK)
Анти-LAG3 гуманизированное 22D2, тяжелая цепь с FR мутацией (Q39R), CH1 мутации (H168R, Q175K), L234A, L235A, D265S мутации в CH2, ZW 857B мутации в CH3 (T350V, L351Y, F405A, Y407V)
QMQLVQSGPEVKKPGTSVKVSCKASGYTFTDYNVDWVRRARGQRLEWIGDINPNDGGTIYAQKFQERVTITVDKSTSTAYMELSSLRSEDTAVYYCARNYRWFGAMDHWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVRTFPAVLKSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVSVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYVYPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFALVSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG (SEQ ID NO:104)
Анти-LAG3 гуманизированное 22D2, тяжелая цепь, вариабельная областьс FR мутацией Q39R
QMQLVQSGPEVKKPGTSVKVSCKASGYTFTDYNVDWVRRARGQRLEWIGDINPNDGGTIYAQKFQERVTITVDKSTSTAYMELSSLRSEDTAVYYCARNYRWFGAMDHWGQGTTVTVSS (SEQ ID NO:105)
Анти-LAG3 гуманизированное 22D2, легкая цепь с FR и Ck мутациями (Q38E, Q124E, Q160E, T180E)
DIVMTQTPLSLSVTPGQPASISCKASQSLDYEGDSDMNWYLEKPGQPPQLLIYGASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQQSTEDPRTFGGGTKVEIKRTVAAPSVFIFPPSDEELKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSEESVTEQDSKDSTYSLSSTLELSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:106)
Анти-LAG3 гуманизированное 22D2 легкая цепь, вариабельная область с FR мутацией Q38E
DIVMTQTPLSLSVTPGQPASISCKASQSLDYEGDSDMNWYLEKPGQPPQLLIYGASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQQSTEDPRTFGGGTKVEIK (SEQ ID NO:107)
Анти-PD1 гуманизированное 08A, тяжелая цепь с S61N коррекцией, FR мутацией (Q39E), CH1 мутациями (L145E, K147T, Q175E), L234A, L235A, D265S мутации в CH2, ZW мутации в CH3 (T350V, T366L, K392L, T394W)
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVREAPGQGLEWIGGVNPSNGGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCEVTDYFPEPVTVSWNSGALTSGVHTFPAVLESSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVSVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYVLPPSRDELTKNQVSLLCLVKGFYPSDIAVEWESNGQPENNYLTWPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG (SEQ ID NO:108)
Анти-PD1 гуманизированное 08A, тяжелая цепь, вариабельная область с S61N коррекцией, FR мутацией Q39E
EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYLYWVREAPGQGLEWIGGVNPSNGGTNFNEKFKSRVTLTVDTSISTAYMELSRLRSDDTAVYYCTRRDSNYDGGFDYWGQGTTVTVSS (SEQ ID NO:109)
Анти-PD1 гуманизированное 08A, легкая цепь с FR и Ck мутациями (Q38R, Q124R, Q160K, T178R)
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLRKPGQPPQLLIFLASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIKRTVAAPSVFIFPPSDERLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSKESVTEQDSKDSTYSLSSRLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:110)
Анти-PD1 гуманизированное 08A, легкая цепь, вариабельная область с FR мутацией Q38R
DIVMTQTPLSLSVTPGQPASISCRASKSVSTSGFSYLHWYLRKPGQPPQLLIFLASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQHSWELPLTFGQGTKLEIK (SEQ ID NO:111)
Анти-LAG3 22D2 CDRH и CDRL области
CDRH1: DYNVD (SEQ ID NO:112)
CDRH2: DINPNDGGTIYAQKFQE (SEQ ID NO:113)
CDRH3: NYRWFGAMDH (SEQ ID NO:114)
CDRL1: KASQSLDYEGDSDMN (SEQ ID NO:115)
CDRL2: GASNLES (SEQ ID NO:116)
CDRL3: QQSTEDPRT (SEQ ID NO:117)
Тяжелая цепь IgG1, константный домен
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG (SEQ ID NO:124)
Легкая цепь, каппа, константный домен
RTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:125)
Анти-RSV Mab изотип, контроль, тяжелая цепь, (37ASK)
VTLRESGPALVKPTQTLTLTCTFSGFSLSTSGMSVGWIRQPPGKALEWLADIWWDDKKDYNPSLKSRLTISKDTSKNQVVLKVTNMDPADTATYYCARSMITNWYFDVWGAGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVSVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:126)
Анти-RSV Mab изотип, контроль, легкая цепь (37ASK)
DIQMTQSPSTLSASVGDRVTITCKCQLSVGYMHWYQQKPGKAPKLLIYDTSKLASGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCFQGSGYPFTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:127)
Мутации, выделенные крупным жирным шрифтом (для мутаций в вариабельной области используется последовательная нумерация, для мутаций в константной области используется нумерация ЕС); подчеркнутый текст: выделенные области CDR (по Кабату)
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> МЕРК ШАРП И ДОУМ КОРП.
Фаяжаь-Дилман, Лоренс
Цзюань, Вероника
Хан, Ширин
Хуян, Шаопэн
Ин, Хуа
<120> АНТИ-PD-1 АНТИТЕЛА
<130> 24564
<140> PCT/CN2018/074916
<141> 2018-02-01
<160> 152
<170> PatentIn версия 3.5
<210> 1
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 1
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu
210 215
<210> 2
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 2
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 3
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 3
Arg Ala Ser Lys Ser Val Ser Thr Ser Gly Phe Ser Tyr Leu His
1 5 10 15
<210> 4
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 4
Leu Ala Ser Asn Leu Glu Ser
1 5
<210> 5
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 5
Gln His Ser Trp Glu Leu Pro Leu Thr
1 5
<210> 6
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 6
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Leu Ser His Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu
210 215
<210> 7
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 7
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Leu Ser His Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 8
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 8
Ser Tyr Tyr Leu Tyr
1 5
<210> 9
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 9
Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe Lys
1 5 10 15
Ser
<210> 10
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 10
Arg Leu Ser His Tyr Asp Gly Gly Phe Asp Tyr
1 5 10
<210> 11
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (2)..(2)
<223> Gly или Ser
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Lys, Thr, His или Arg
<220>
<221> MOD_RES
<222> (4)..(4)
<223> Phe, His или Tyr
<220>
<221> MOD_RES
<222> (5)..(5)
<223> Arg, Gly, Ala, Leu или Ser
<220>
<221> MOD_RES
<222> (6)..(6)
<223> Glu, Ala, Ser, Gln или Val
<400> 11
Leu Xaa Xaa Xaa Xaa Xaa Ser
1 5
<210> 12
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Gln, Ser или Ala
<220>
<221> MOD_RES
<222> (2)..(2)
<223> His или Gln
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Ser или Ala
<220>
<221> MOD_RES
<222> (4)..(4)
<223> Trp, Tyr или Thr
<220>
<221> MOD_RES
<222> (5)..(5)
<223> Glu, His или Gln
<400> 12
Xaa Xaa Xaa Xaa Xaa Leu Pro Leu Thr
1 5
<210> 13
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 13
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Gly Lys Phe Arg Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 14
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 14
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Gly Lys Phe Arg Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 15
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 15
Leu Gly Lys Phe Arg Glu Ser
1 5
<210> 16
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 16
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Gly Thr His Arg Ala Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 17
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 17
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Gly Thr His Arg Ala Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 18
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 18
Leu Gly Thr His Arg Ala Ser
1 5
<210> 19
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 19
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Ser Lys Tyr Arg Ser Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ala Tyr
85 90 95
His Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 20
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 20
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Ser Lys Tyr Arg Ser Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ala Tyr
85 90 95
His Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 21
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 21
Leu Ser Lys Tyr Arg Ser Ser
1 5
<210> 22
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 22
Ser Gln Ala Tyr His Leu Pro Leu Thr
1 5
<210> 23
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 23
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Gly Lys Tyr Gly Ala Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Ala Thr
85 90 95
Gln Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 24
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 24
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Gly Lys Tyr Gly Ala Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Ala Thr
85 90 95
Gln Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 25
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 25
Leu Gly Lys Tyr Gly Ala Ser
1 5
<210> 26
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 26
Ala Gln Ala Thr Gln Leu Pro Leu Thr
1 5
<210> 27
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 27
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Gly His Phe Ala Ser Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 28
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 28
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Gly His Phe Ala Ser Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 29
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 29
Leu Gly His Phe Ala Ser Ser
1 5
<210> 30
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 30
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Gly Arg Tyr Leu Gln Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 31
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 31
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Gly Arg Tyr Leu Gln Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 32
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 32
Leu Gly Arg Tyr Leu Gln Ser
1 5
<210> 33
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 33
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Gly Thr His Ser Val Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 34
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 34
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Gly Thr His Ser Val Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 35
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 35
Leu Gly Thr His Ser Val Ser
1 5
<210> 36
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 36
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gln Tyr
20 25 30
Tyr Tyr Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ser Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu
210 215
<210> 37
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 37
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gln Tyr
20 25 30
Tyr Tyr Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ser Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 38
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 38
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Gly Arg His Arg Ala Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 39
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 39
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Gly Arg His Arg Ala Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 40
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 40
Gln Tyr Tyr Tyr Tyr
1 5
<210> 41
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 41
Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr
1 5 10
<210> 42
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 42
Leu Gly Arg His Arg Ala Ser
1 5
<210> 43
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 43
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gln Tyr
20 25 30
Tyr Tyr Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ser Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu
210 215
<210> 44
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 44
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gln Tyr
20 25 30
Tyr Tyr Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ser Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 45
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 45
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Gly Phe Tyr Arg Thr Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Met Ala
85 90 95
Asp Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 46
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 46
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Gly Phe Tyr Arg Thr Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Met Ala
85 90 95
Asp Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 47
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 47
Leu Gly Phe Tyr Arg Thr Ser
1 5
<210> 48
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 48
Ser Gln Met Ala Asp Leu Pro Leu Thr
1 5
<210> 49
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 49
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gln Tyr
20 25 30
Tyr Thr Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Ile Glu Pro Asn Arg Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu
210 215
<210> 50
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 50
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gln Tyr
20 25 30
Tyr Thr Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Ile Glu Pro Asn Arg Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 51
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 51
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Thr Phe
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 52
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 52
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Thr Phe
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 53
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 53
Gln Tyr Tyr Thr Tyr
1 5
<210> 54
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 54
Gly Ile Glu Pro Asn Arg Gly Gly Thr Asn Phe Asn Glu Lys Phe Lys
1 5 10 15
Ser
<210> 55
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 55
Ala Gln Thr Phe Glu Leu Pro Leu Thr
1 5
<210> 56
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 56
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gln Tyr
20 25 30
Tyr Tyr Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ser Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu
210 215
<210> 57
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 57
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gln Tyr
20 25 30
Tyr Tyr Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ser Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 58
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 58
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Ser Lys Phe Arg Arg Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 59
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 59
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Ser Lys Phe Arg Arg Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 60
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 60
Leu Ser Lys Phe Arg Arg Ser
1 5
<210> 61
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (4)..(4)
<223> Thr или Tyr
<400> 61
Gln Tyr Tyr Xaa Tyr
1 5
<210> 62
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (2)..(2)
<223> Val или Ile
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Glu или Asn
<220>
<221> MOD_RES
<222> (5)..(5)
<223> Asn или Ser
<220>
<221> MOD_RES
<222> (6)..(6)
<223> Arg или Asn
<220>
<221> MOD_RES
<222> (7)..(7)
<223> Gly или Ala
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Ser или Asn
<400> 62
Gly Xaa Xaa Pro Xaa Xaa Xaa Gly Thr Asn Phe Xaa Glu Lys Phe Lys
1 5 10 15
Ser
<210> 63
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (2)..(2)
<223> Gly, Ala или Ser
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Arg, Phe, Ser или Lys
<220>
<221> MOD_RES
<222> (4)..(4)
<223> His, Tyr, Asn или Phe
<220>
<221> MOD_RES
<222> (5)..(5)
<223> Arg или Leu
<220>
<221> MOD_RES
<222> (6)..(6)
<223> Ala, Thr, Glu или Arg
<400> 63
Leu Xaa Xaa Xaa Xaa Xaa Ser
1 5
<210> 64
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Gln, Ser или Ala
<220>
<221> MOD_RES
<222> (2)..(2)
<223> Gln или His
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Ser, Met или Thr
<220>
<221> MOD_RES
<222> (4)..(4)
<223> Trp, Ala или Phe
<220>
<221> MOD_RES
<222> (5)..(5)
<223> Glu или Asp
<400> 64
Xaa Xaa Xaa Xaa Xaa Leu Pro Leu Thr
1 5
<210> 65
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 65
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Met Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Ser Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val
115 120 125
Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr
130 135 140
Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr
145 150 155 160
Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser
180 185 190
Ser Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala
195 200 205
Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys
210 215 220
Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val
245 250 255
Thr Cys Val Val Val Ala Ile Ser Lys Asp Asp Pro Glu Val Gln Phe
260 265 270
Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro
290 295 300
Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val
305 310 315 320
Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr
325 330 335
Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys
340 345 350
Glu Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp
355 360 365
Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro
370 375 380
Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser
385 390 395 400
Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala
405 410 415
Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His
420 425 430
His Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 66
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 66
Asp Ile Val Leu Thr Gln Ser Pro Thr Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Phe Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg
100 105 110
Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln
115 120 125
Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr
130 135 140
Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln
145 150 155 160
Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg
180 185 190
His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro
195 200 205
Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
210 215
<210> 67
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 67
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Met Tyr Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Ile Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Asn Lys Ala Thr Leu Thr Val Asp Ser Ser Ser Ser Thr Thr Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Tyr Arg Phe Asp Met Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val
115 120 125
Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr
130 135 140
Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr
145 150 155 160
Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser
180 185 190
Ser Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala
195 200 205
Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys
210 215 220
Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val
245 250 255
Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe
260 265 270
Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro
290 295 300
Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val
305 310 315 320
Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr
325 330 335
Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys
340 345 350
Glu Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp
355 360 365
Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro
370 375 380
Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser
385 390 395 400
Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala
405 410 415
Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His
420 425 430
His Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 68
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 68
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Ala Ile Ser Cys Arg Ala Ser Lys Gly Val Ser Thr Ser
20 25 30
Gly Tyr Ser Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Tyr Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys Gln His Ser Arg
85 90 95
Asp Leu Pro Leu Thr Phe Gly Thr Gly Thr Lys Leu Glu Leu Lys Arg
100 105 110
Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln
115 120 125
Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr
130 135 140
Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln
145 150 155 160
Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg
180 185 190
His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro
195 200 205
Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
210 215
<210> 69
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 69
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Met Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Gln Phe Ser Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val
115 120 125
Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr
130 135 140
Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr
145 150 155 160
Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser
180 185 190
Ser Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala
195 200 205
Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys
210 215 220
Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val
245 250 255
Thr Cys Val Val Val Ala Ile Ser Lys Asp Asp Pro Glu Val Gln Phe
260 265 270
Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro
290 295 300
Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val
305 310 315 320
Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr
325 330 335
Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys
340 345 350
Glu Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp
355 360 365
Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro
370 375 380
Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser
385 390 395 400
Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala
405 410 415
Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His
420 425 430
His Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 70
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 70
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Met Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Glu Phe Ser Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val
115 120 125
Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr
130 135 140
Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr
145 150 155 160
Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser
180 185 190
Ser Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala
195 200 205
Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys
210 215 220
Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val
245 250 255
Thr Cys Val Val Val Ala Ile Ser Lys Asp Asp Pro Glu Val Gln Phe
260 265 270
Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro
290 295 300
Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val
305 310 315 320
Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr
325 330 335
Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys
340 345 350
Glu Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp
355 360 365
Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro
370 375 380
Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser
385 390 395 400
Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala
405 410 415
Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His
420 425 430
His Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 71
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 71
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Met Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Ala Phe Ser Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val
115 120 125
Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr
130 135 140
Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr
145 150 155 160
Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser
180 185 190
Ser Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala
195 200 205
Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys
210 215 220
Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val
245 250 255
Thr Cys Val Val Val Ala Ile Ser Lys Asp Asp Pro Glu Val Gln Phe
260 265 270
Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro
290 295 300
Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val
305 310 315 320
Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr
325 330 335
Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys
340 345 350
Glu Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp
355 360 365
Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro
370 375 380
Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser
385 390 395 400
Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala
405 410 415
Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His
420 425 430
His Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 72
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 72
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Glu Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 73
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 73
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Ser Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 74
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 74
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 75
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 75
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 76
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 76
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 77
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 77
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Ala Gly Thr Asn Phe Ser Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 78
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 78
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Ala Gly Thr Asn Phe Ser Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 79
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 79
Gly Val Asn Pro Ser Asn Ala Gly Thr Asn Phe Ser Glu Lys Phe Lys
1 5 10 15
Ser
<210> 80
<211> 225
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 80
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro
225
<210> 81
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 81
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 82
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 82
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 83
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 83
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Ala Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 84
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 84
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Ala Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Leu Ser His Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu
210 215
<210> 85
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 85
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Ala Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Leu Ser His Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 86
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 86
Gly Val Asn Pro Ser Asn Ala Gly Thr Asn Phe Asn Glu Lys Phe Lys
1 5 10 15
Ser
<210> 87
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 87
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Leu Ser His Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu
210 215
<210> 88
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 88
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Ala Gly Thr Asn Phe Ser Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Leu Ser His Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 89
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 89
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Ala Gly Thr Asn Phe Ser Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Leu Ser His Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 90
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 90
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Ala Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Leu Ser His Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Ser Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 91
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> MOD_RES
<222> (7)..(7)
<223> Gly или Ala
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Ser или Asn
<400> 91
Gly Val Asn Pro Ser Asn Xaa Gly Thr Asn Phe Xaa Glu Lys Phe Lys
1 5 10 15
Ser
<210> 92
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<220>
<221> MOD_RES
<222> (56)..(56)
<223> Gly или Ala
<220>
<221> MOD_RES
<222> (61)..(61)
<223> Ser или Asn
<400> 92
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Xaa Gly Thr Asn Phe Xaa Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Leu Ser His Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 93
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<220>
<221> MOD_RES
<222> (56)..(56)
<223> Gly или Ala
<220>
<221> MOD_RES
<222> (61)..(61)
<223> Ser или Asn
<400> 93
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Xaa Gly Thr Asn Phe Xaa Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 94
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 94
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Ala Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Ser Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 95
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 95
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Ala Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 96
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 96
Gln Met Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Asn Val Asp Trp Val Arg Gln Ala Arg Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asp Gly Gly Thr Ile Tyr Ala Gln Lys Phe
50 55 60
Gln Glu Arg Val Thr Ile Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Tyr Arg Trp Phe Gly Ala Met Asp His Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Lys Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Ser Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Leu
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Leu Thr Trp Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 97
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 97
Gln Met Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Asn Val Asp Trp Val Arg Gln Ala Arg Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asp Gly Gly Thr Ile Tyr Ala Gln Lys Phe
50 55 60
Gln Glu Arg Val Thr Ile Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Tyr Arg Trp Phe Gly Ala Met Asp His Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 98
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 98
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ala Ser Gln Ser Leu Asp Tyr Glu
20 25 30
Gly Asp Ser Asp Met Asn Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Tyr Gly Ala Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln Ser Thr
85 90 95
Glu Asp Pro Arg Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Glu
115 120 125
Leu Lys Ser Gly Thr Ala Thr Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Tyr Leu Glu Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 99
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 99
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ala Ser Gln Ser Leu Asp Tyr Glu
20 25 30
Gly Asp Ser Asp Met Asn Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Tyr Gly Ala Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln Ser Thr
85 90 95
Glu Asp Pro Arg Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 100
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 100
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Arg
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Arg Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 101
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 101
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Ala Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Glu Val Thr Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Glu Ser Ser Gly Leu Tyr Ser Leu Leu Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Ser Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Val Tyr Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly
<210> 102
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 102
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Ala Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Leu Ser His Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Glu Val Thr Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Glu Ser Ser Gly Leu Tyr Ser Leu Leu Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Ser Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Val Tyr Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly
<210> 103
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 103
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Ser Lys Tyr Arg Ser Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ala Tyr
85 90 95
His Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Arg
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Arg Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 104
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 104
Gln Met Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Asn Val Asp Trp Val Arg Arg Ala Arg Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asp Gly Gly Thr Ile Tyr Ala Gln Lys Phe
50 55 60
Gln Glu Arg Val Thr Ile Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Tyr Arg Trp Phe Gly Ala Met Asp His Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val Arg Thr Phe Pro Ala Val Leu
165 170 175
Lys Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Ser Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
340 345 350
Tyr Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 105
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 105
Gln Met Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Asn Val Asp Trp Val Arg Arg Ala Arg Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asp Gly Gly Thr Ile Tyr Ala Gln Lys Phe
50 55 60
Gln Glu Arg Val Thr Ile Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Tyr Arg Trp Phe Gly Ala Met Asp His Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 106
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 106
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ala Ser Gln Ser Leu Asp Tyr Glu
20 25 30
Gly Asp Ser Asp Met Asn Trp Tyr Leu Glu Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Tyr Gly Ala Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln Ser Thr
85 90 95
Glu Asp Pro Arg Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Glu
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Glu Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Glu Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 107
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 107
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ala Ser Gln Ser Leu Asp Tyr Glu
20 25 30
Gly Asp Ser Asp Met Asn Trp Tyr Leu Glu Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Tyr Gly Ala Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln Ser Thr
85 90 95
Glu Asp Pro Arg Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 108
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 108
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Glu Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Glu Val Thr Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Glu Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Ser Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Val Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Leu Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Leu Thr Trp Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly
<210> 109
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 109
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Leu Tyr Trp Val Arg Glu Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 110
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 110
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Arg Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Arg
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Lys Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Arg Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 111
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 111
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Phe Ser Tyr Leu His Trp Tyr Leu Arg Lys Pro Gly Gln Pro Pro
35 40 45
Gln Leu Leu Ile Phe Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 112
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 112
Asp Tyr Asn Val Asp
1 5
<210> 113
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 113
Asp Ile Asn Pro Asn Asp Gly Gly Thr Ile Tyr Ala Gln Lys Phe Gln
1 5 10 15
Glu
<210> 114
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 114
Asn Tyr Arg Trp Phe Gly Ala Met Asp His
1 5 10
<210> 115
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 115
Lys Ala Ser Gln Ser Leu Asp Tyr Glu Gly Asp Ser Asp Met Asn
1 5 10 15
<210> 116
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 116
Gly Ala Ser Asn Leu Glu Ser
1 5
<210> 117
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 117
Gln Gln Ser Thr Glu Asp Pro Arg Thr
1 5
<210> 118
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 118
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gln Tyr
20 25 30
Tyr Tyr Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu
210 215
<210> 119
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 119
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gln Tyr
20 25 30
Tyr Tyr Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 120
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 120
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gln Tyr
20 25 30
Tyr Tyr Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu
210 215
<210> 121
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 121
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gln Tyr
20 25 30
Tyr Tyr Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 122
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 122
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gln Tyr
20 25 30
Tyr Tyr Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu
210 215
<210> 123
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 123
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gln Tyr
20 25 30
Tyr Tyr Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 124
<211> 329
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 124
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly
325
<210> 125
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 125
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 126
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 126
Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln Thr
1 5 10 15
Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser Gly
20 25 30
Met Ser Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp
35 40 45
Leu Ala Asp Ile Trp Trp Asp Asp Lys Lys Asp Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Val
65 70 75 80
Leu Lys Val Thr Asn Met Asp Pro Ala Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Ser Met Ile Thr Asn Trp Tyr Phe Asp Val Trp Gly Ala Gly
100 105 110
Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Ser Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 127
<211> 213
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 127
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Cys Gln Leu Ser Val Gly Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Phe Gln Gly Ser Gly Tyr Pro Phe Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 128
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 128
Val Val Val Pro Pro
1 5
<210> 129
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 129
Ser Tyr Tyr Leu Tyr
1 5
<210> 130
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 130
Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe Lys
1 5 10 15
<210> 131
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 131
Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr
1 5 10
<210> 132
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 132
Arg Ala Ser Lys Ser Val Ser Thr Ser Gly Phe Ser Tyr Leu His
1 5 10 15
<210> 133
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 133
Ala Ser Asn Leu Glu
1 5
<210> 134
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 134
Gln His Ser Trp Glu Leu Pro Leu Thr
1 5
<210> 135
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 135
Leu Ser His Tyr Asp
1 5
<210> 136
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 136
Gly Lys Phe Arg Glu
1 5
<210> 137
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 137
Gly Thr His Arg Ala
1 5
<210> 138
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 138
Ser Lys Tyr Arg Ser
1 5
<210> 139
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 139
Ser Gln Ala Tyr His Leu Pro Leu Thr
1 5
<210> 140
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 140
Gly Lys Tyr Gly Ala
1 5
<210> 141
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 141
Ala Gln Ala Thr Gln Leu Pro Leu Thr
1 5
<210> 142
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 142
Gly His Phe Ala Ser
1 5
<210> 143
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 143
Gly Arg Tyr Leu Gln
1 5
<210> 144
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 144
Gly Thr His Ser Val
1 5
<210> 145
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 145
Gln Tyr Tyr Tyr Tyr
1 5
<210> 146
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 146
Gly Arg His Arg Ala
1 5
<210> 147
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 147
Gly Phe Tyr Arg Thr
1 5
<210> 148
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 148
Ser Gln Met Ala Asp Leu Pro Leu Thr
1 5
<210> 149
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 149
Gln Tyr Tyr Thr Tyr
1 5
<210> 150
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 150
Ile Glu Pro Asn Arg Gly Gly Thr Asn Phe Asn Glu Lys Phe Lys
1 5 10 15
<210> 151
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 151
Ala Gln Thr Phe Glu Leu Pro Leu Thr
1 5
<210> 152
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 152
Ser Lys Phe Arg Arg
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2837821C1 |
| ТЕРАПЕВТИЧЕСКИЕ АНТИТЕЛА ПРОТИВ ЛИГАНДА CD40 | 2018 |
|
RU2770209C2 |
| АНТИ-PCSK9 АНТИТЕЛО, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2016 |
|
RU2739208C2 |
| ПРОКОАГУЛЯНТНЫЕ АНТИТЕЛА | 2018 |
|
RU2810094C2 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2808030C2 |
| АНТИТЕЛО К B7-H4, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2792748C2 |
| АМАТОКСИНОВЫЕ КОНЪЮГАТЫ АНТИТЕЛА С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2826004C2 |
| АНТИТЕЛО К CLDN-18.2 И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2829997C1 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2015 |
|
RU2743464C2 |
| АНТИТЕЛО ПРОТИВ СТОЛБНЯЧНОГО ТОКСИНА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2815280C1 |
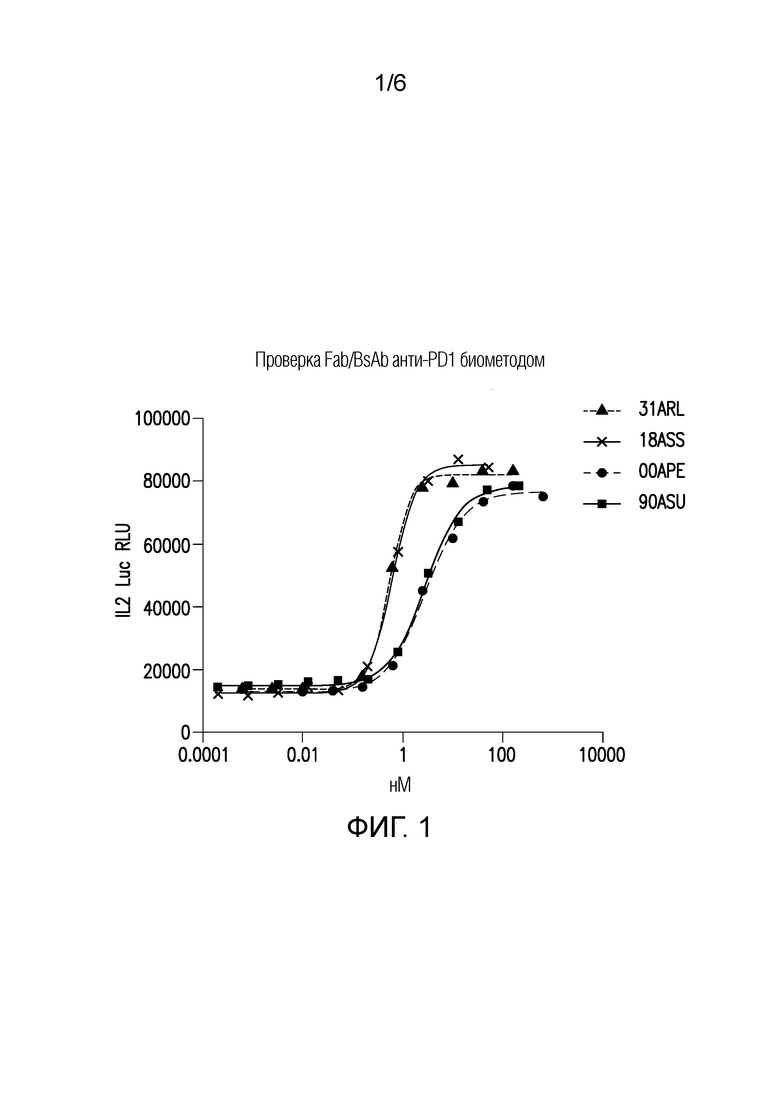
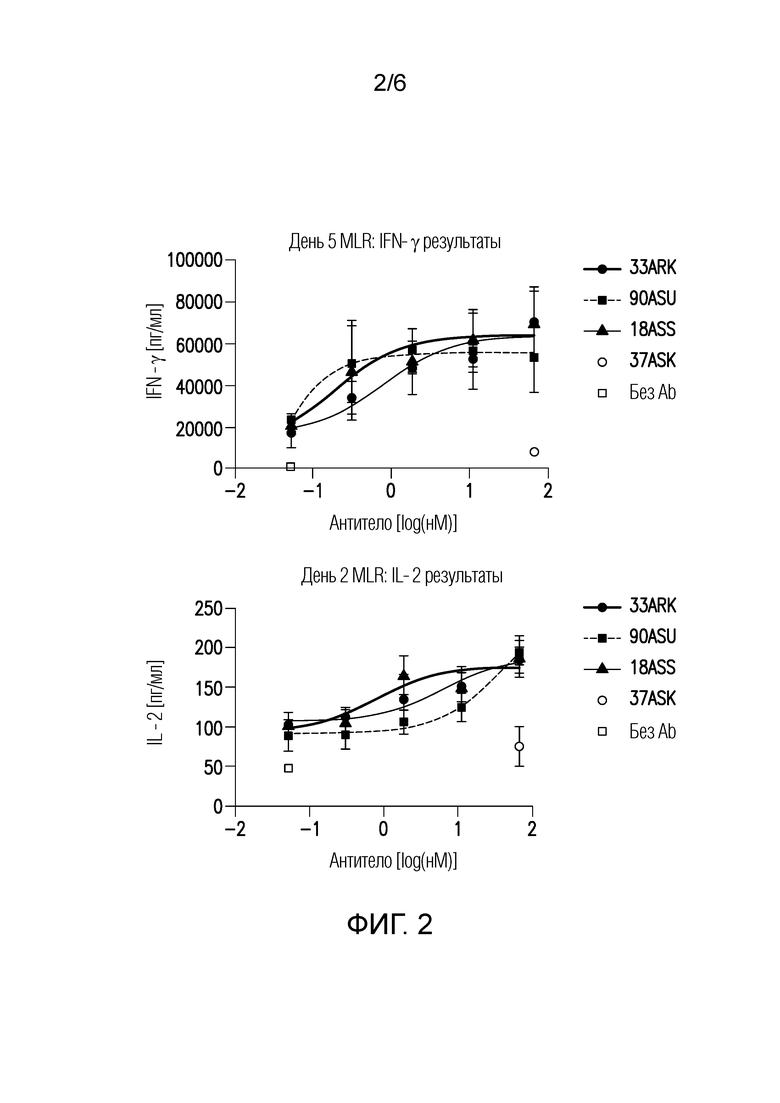
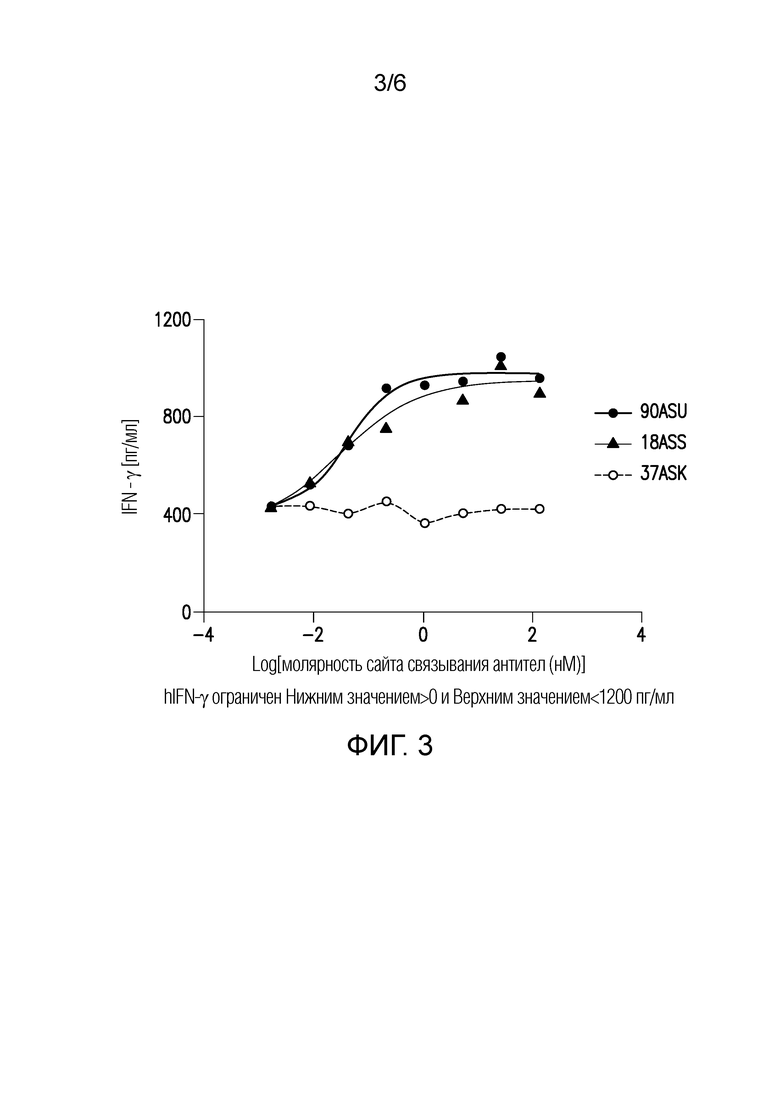
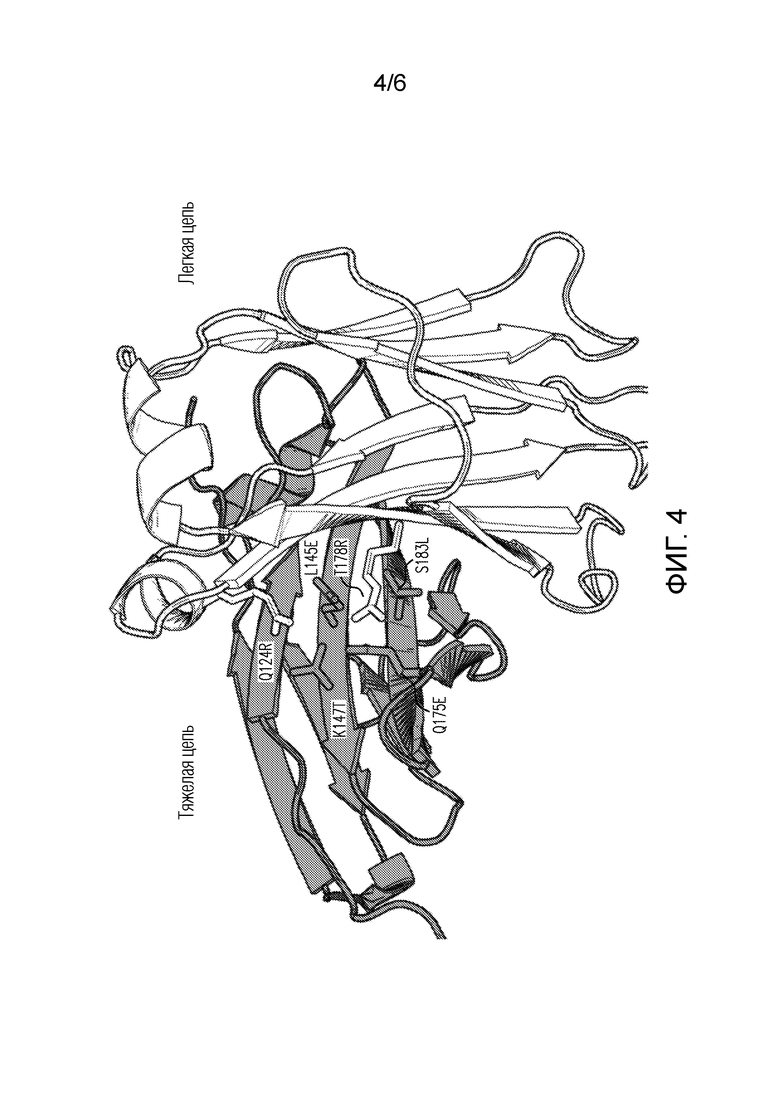
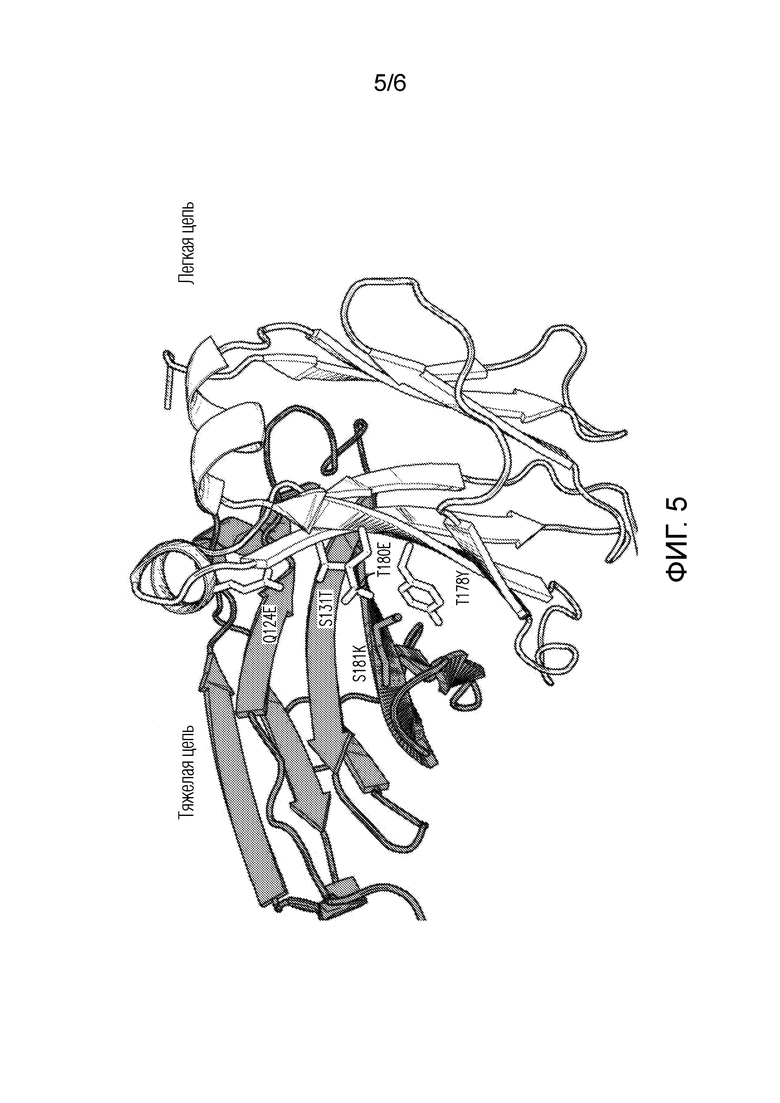
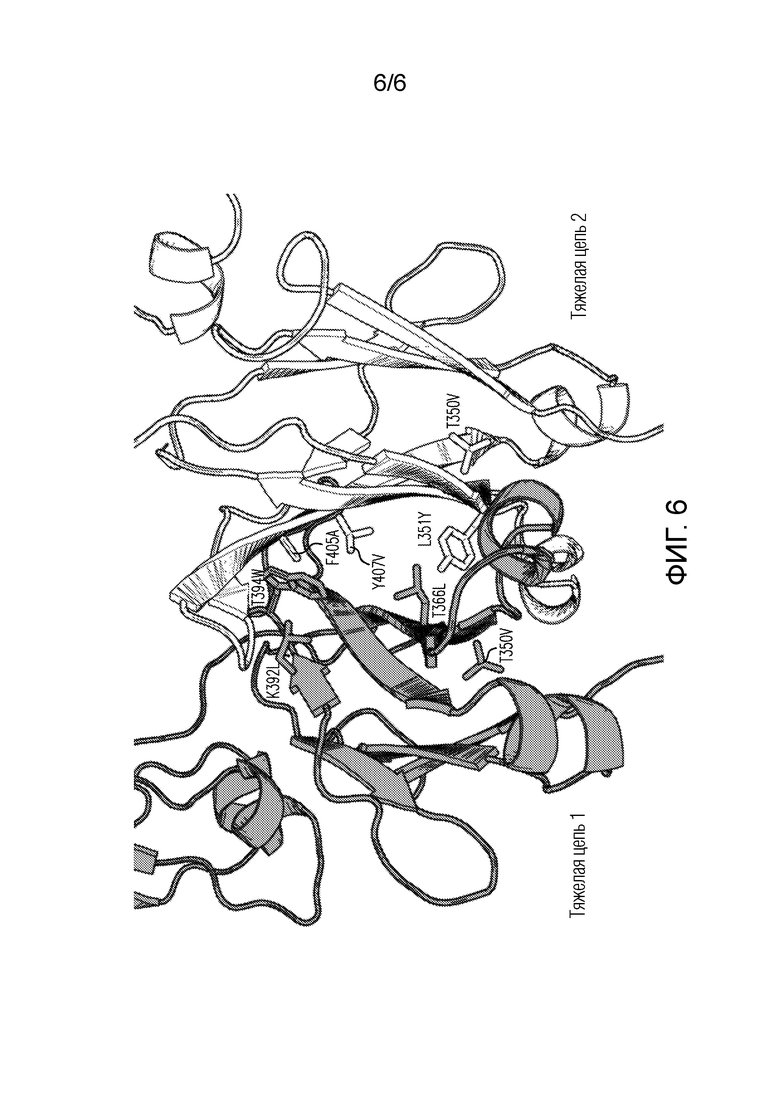
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая антитело или его антигенсвязывающий фрагмент, которое связывается с PD-1 человека (варианты), выделенную нуклеиновую кислоту, кодирующую вышеуказанное антитело или антигенсвязывающий фрагмент, вектор экспрессии, содержащий выделенную нуклеиновую кислоту, клетку-хозяина, продуцирующую антитело или антигенсвязывающий фрагмент, композицию для усиления активации иммунных клеток и способ получения антитела или антигенсвязывающего фрагмента. Изобретение расширяет арсенал средств, связывающихся с PD-1 человека. 11 н. и 24 з.п. ф-лы, 6 ил., 8 табл., 6 пр.
1. Антитело или его антигенсвязывающий фрагмент, которое связывается с PD-1 человека, где антитело или антигенсвязывающий фрагмент содержит:
a. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8,
b. CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:91,
с. CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10,
d. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
е. CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:11, и
f. CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:12.
2. Антитело или антигенсвязывающий фрагмент по п.1, где антитело или антигенсвязывающий фрагмент содержит:
a. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8,
b. CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:91,
с. CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10,
d. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
е. CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:15, 18, 21, 25, 29, 32 или 35 и
f. CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:5, 22 или 26.
3. Антитело или антигенсвязывающий фрагмент по п.1, где антитело или антигенсвязывающий фрагмент содержит:
1) вариабельную область тяжелой цепи, содержащую:
CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8, CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:9, 79 или 86, CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10; и
2) вариабельную область легкой цепи, содержащую композицию CDR легкой цепи, выбранную из группы, включающей:
a. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:4, 15, 18, 29, 32 или 35, и CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:5;
b. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:21, и CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:22; и
с. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:25, и CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:26.
4. Антитело или антигенсвязывающий фрагмент по п.1, где антитело или антигенсвязывающий фрагмент содержит:
1) вариабельную область тяжелой цепи, содержащую:
CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8, CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:91, CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10; и
2) вариабельную область легкой цепи, содержащую:
CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:21, и CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:22.
5. Антитело или антигенсвязывающий фрагмент по п.1, где антитело или антигенсвязывающий фрагмент содержит:
1) вариабельную область тяжелой цепи, содержащую:
CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8, CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:86, CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10; и
2) вариабельную область легкой цепи, содержащую:
CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:21, и CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:22.
6. Антитело или его антигенсвязывающий фрагмент, которое связывается с PD-1 человека, где антитело или антигенсвязывающий фрагмент содержит:
1) вариабельную область тяжелой цепи, содержащую:
CDR1 вариабельной области тяжелой цепи CDR1, содержащий аминокислотную последовательность SEQ ID NO:8, CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:86, CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:10; и
2) вариабельную область легкой цепи, содержащую:
CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность, имеющую, по меньшей мере, примерно 57% идентичности последовательности с SEQ ID NO:21, и CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность, имеющую, по меньшей мере, примерно 67% идентичности последовательности с SEQ ID NO:22.
7. Антитело или антигенсвязывающий фрагмент по п.1, где антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:7 или 88, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:14, 17, 20, 24, 28, 31, 34 или 76.
8. Антитело или антигенсвязывающий фрагмент по п.1, содержащее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:6, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:13, 16, 19, 23, 27, 30 или 33.
9. Антитело или антигенсвязывающий фрагмент по п.1, содержащее вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:92, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:20.
10. Антитело или его антигенсвязывающий фрагмент, которое связывается с PD-1 человека, где антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:85, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:20.
11. Антитело или антигенсвязывающий фрагмент по п.10, содержащее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:84, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:19.
12. Антитело или его антигенсвязывающий фрагмент, которое связывается с PD-1 человека, где антитело или антигенсвязывающий фрагмент содержит:
а. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8,
b. CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:9, 79, 86 или 91,
с. CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:41 или 10,
d. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
е. CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:4, и
f. CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:5.
13. Антитело или антигенсвязывающий фрагмент по п.12, где антитело или антигенсвязывающий фрагмент содержит:
а. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:8,
b. CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:86,
с. CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:41,
d. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
е. CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:4, и
f. CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:5.
14. Антитело или антигенсвязывающий фрагмент по п.12, где антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:75, 78, 81 или 88, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:76.
15. Антитело или антигенсвязывающий фрагмент по п.12, которое представляет собой антитело, содержащее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:74, 77, 80, 82 или 89, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:2.
16. Антитело или антигенсвязывающий фрагмент по п.12, где антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:95, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:76.
17. Антитело или антигенсвязывающий фрагмент по п.16, представляющее собой антитело, содержащее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:83, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:2.
18. Антитело или его антигенсвязывающий фрагмент, которое связывается с PD-1 человека, где антитело или антигенсвязывающий фрагмент содержит:
а. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:61,
b. CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:62,
с. CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:41,
d. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
е. CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:63, и
f. CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:64.
19. Антитело или антигенсвязывающий фрагмент по п.18, где антитело или антигенсвязывающий фрагмент содержит:
а. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:40 или 53,
b. CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:9 или 54,
с. CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:41,
d. CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3,
е. CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:4, 42, 47 или 60, и
f. CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:5, 48 или 55.
20. Антитело или антигенсвязывающий фрагмент по п.18, где антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, и где комбинация CDR вариабельной области тяжелой и легкой цепей выбрана из группы, состоящей из:
а. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:40, CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:9, CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:41; и CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:42, и CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 5;
b. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:40, CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:9, CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:41; и CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:47, и CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:48;
с. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:53, CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:54, и CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:41; и CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:4, и CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 55; и
d. CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:40, CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:9, CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:41; и CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:60, и CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 5.
21. Антитело или его антигенсвязывающий фрагмент, которое связывается с PD-1 человека, где антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, содержащие:
CDR1 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность, имеющую, по меньшей мере, примерно 80% идентичности последовательности с SEQ ID NO:40, CDR2 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность, имеющую, по меньшей мере, примерно 70% идентичности последовательности с SEQ ID NO:9, CDR3 вариабельной области тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:41; и CDR1 вариабельной области легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:3, CDR2 вариабельной области легкой цепи, содержащий аминокислотную последовательность, имеющую, по меньшей мере, примерно 57% идентичности последовательности с SEQ ID NO:60, и CDR3 вариабельной области легкой цепи, содержащий аминокислотную последовательность, имеющую, по меньшей мере, примерно 67% идентичности последовательности с SEQ ID NO:5.
22. Антитело или антигенсвязывающий фрагмент по п.18, где антитело или антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, выбранную из группы, состоящей из:
а. вариабельной области тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO:37 или 119, и вариабельной области легкой цепи, содержащей аминокислотную последовательность SEQ ID NO:39;
b. вариабельной области тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO:44 или 121, и вариабельной области легкой цепи, содержащей аминокислотную последовательность SEQ ID NO:46;
с. вариабельной области тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO:50, и вариабельной области легкой цепи, содержащей аминокислотную последовательность SEQ ID NO:52; и
d. вариабельной области тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO:57 или 123, и вариабельной области легкой цепи, содержащей аминокислотную последовательность SEQ ID NO:59.
23. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-22, где антитело или его антигенсвязывающий фрагмент связывается с PD-1 человека с KD менее 50 пМ в анализе BIACORE.
24. Антитело или антигенсвязывающий фрагмент по любому из пп.1-23, которое представляет собой антитело, содержащее две тяжелые цепи и две легкие цепи.
25. Антитело или антигенсвязывающий фрагмент по любому из пп.1-24, которое представляет собой антитело, содержащее область тяжелой цепи подтипа IgG4 с мутацией S228P.
26. Антитело или антигенсвязывающий фрагмент по любому из пп.1-24, которое представляет собой антитело, содержащее область тяжелой цепи подтипа IgG1.
27. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-26, где антитело или его антигенсвязывающий фрагмент обладает паттерном гликозилирования, характерным для экспрессии в клетках млекопитающего.
28. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-26, где антитело или его антигенсвязывающий фрагмент обладает паттерном гликозилирования, характерным для экспрессии в клетках СНО.
29. Выделенная нуклеиновая кислота, кодирующая любое из антител или антигенсвязывающих фрагментов по пп.1-26.
30. Вектор экспрессии, содержащий выделенную нуклеиновую кислоту по п.29.
31. Клетка-хозяин, продуцирующая антитело или антигенсвязывающий фрагмент по пп.1-26, содержащая вектор экспрессии по п.30.
32. Клетка-хозяин по п.31, представляющая собой бактериальную клетку, клетку человека, клетку млекопитающего, клетку Pichia, клетку растения, клетку HEK293 или клетку яичника китайского хомячка.
33. Композиция для усиления активации иммунных клеток, содержащая антитело или антигенсвязывающий фрагмент по любому из пп.1-28 и фармацевтически приемлемый носитель или разбавитель.
34. Композиция по п.33, дополнительно содержащая агент, выбранный из группы, содержащей:
а. анти-LAG3 антитело или его антигенсвязывающий фрагмент;
b. анти-TIGIT антитело или его антигенсвязывающий фрагмент;
с. анти-VISTA антитело или его антигенсвязывающий фрагмент;
d. анти-BTLA антитело или его антигенсвязывающий фрагмент;
е. анти-TIM3 антитело или его антигенсвязывающий фрагмент;
f. анти-CTLA4 антитело или его антигенсвязывающий фрагмент;
g. анти-HVEM антитело или его антигенсвязывающий фрагмент;
h. анти-CD70 антитело или его антигенсвязывающий фрагмент;
i. анти-ОХ40 антитело или его антигенсвязывающий фрагмент;
j. анти-CD28 антитело или его антигенсвязывающий фрагмент;
k. анти-PDL1 антитело или его антигенсвязывающий фрагмент;
l. анти-PDL2 антитело или его антигенсвязывающий фрагмент;
m. анти-GITR антитело или его антигенсвязывающий фрагмент;
п. анти-ICOS антитело или его антигенсвязывающий фрагмент;
о. анти-SIRPα антитело или его антигенсвязывающий фрагмент;
p. анти-ILT2 антитело или его антигенсвязывающий фрагмент;
q. анти-ILT3 антитело или его антигенсвязывающий фрагмент;
r. анти-ILT4 антитело или его антигенсвязывающий фрагмент;
s. анти-ILT5 антитело или его антигенсвязывающий фрагмент;
t. анти-4-1BB антитело или его антигенсвязывающий фрагмент;
u. анти-NK2GA антитело или его антигенсвязывающий фрагмент;
v. анти-NK2GC антитело или его антигенсвязывающий фрагмент;
w. анти-NK2GE антитело или его антигенсвязывающий фрагмент;
x. анти-TSLP антитело или его антигенсвязывающий фрагмент;
у. анти-IL10 антитело или его антигенсвязывающий фрагмент; и
z. STING-агонист;
аа. антагонист CXCR2; и
bb. ингибитор PARP.
35. Способ получения антитела или антигенсвязывающего фрагмента, включающий:
а. культивирование клетки-хозяина, содержащей полинуклеотид, кодирующий тяжелую цепь и/или легкую цепь любого из антител или антигенсвязывающих фрагментов по пп.1-28 в условиях, благоприятных для экспрессии полинуклеотида; и
b. выделение антитела или антигенсвязывающего фрагмента из клетки-хозяина и/или культуральной среды.
| WO 2011110604 A1, 15.09.2011 | |||
| US 8354509 B2, 15.01.2013 | |||
| АНТИ-PD-1-АНТИТЕЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ И СПОСОБ ПРИМЕНЕНИЯ | 2016 |
|
RU2656181C1 |
| Rudikoff S | |||
| et al | |||
| "Single amino acid substitution altering antigen-binding specificity", Proc | |||
| Nat | |||
| Acad | |||
| Sci | |||
| USA | |||
| Immunology, 1982, 79 | |||
| Ohno et al | |||
| "Antigen-binding specificities of antibodies are primarily determined by seven residues of VH", Proc | |||
| Natl | |||
| Acad | |||
Авторы
Даты
2023-01-16—Публикация
2019-01-31—Подача