Область техники, к которой относится изобретение
[0001]
Перекрестная ссылка на родственные патентные заявки
Настоящая заявка заявляет приоритет согласно Японской патентной заявки № 2015-177073, поданной 8 сентября 2015 года, которая включена посредством ссылки во всей полноте. Настоящее изобретение относится к новому конденсированному пиримидиновому соединению, обладающему активностью ингибирования RET, или его соли и к фармацевтическй композиции, содержащей такое соединение или соль.
Предпосылки создания изобретения
[0002]
Различные протеинкиназы присутствуют in vivo, и известно, что они вовлечены в целый ряд функциональных регуляций. RET представляет собой рецепторную тирозинкиназу, идентифицированную как один из протоонкогенов. RET связывается с глиальным нейротрофическим фактором (GDNF) и GDNF рецептором с образованием комплекса, который дает возможность RET осуществлять физиологические функции через внутриклеточную передачу сигнала фосфорилирования (Непатентная литература 1). В одном исследовании сообщается, что в нормальных тканях RET способствует развитию почек и нейрогенезу в процессе внутриутробного развития (Непатентная литература 2). Некоторые исследования показывают, что при раке, таком как рак легкого, рак щитовидной железы, рак молочной железы, рак поджелудочной железы и рак предстательной железы, транслокация, мутация или чрезмерная экспрессия RET гена повышает его активацию, способствуя, таким образом, клеточному росту, образованию опухоли или инфильтрации ткани (Непатентная литература 3, 4, 5, 6, 7, и 8). Кроме того, RET известен как неблагоприятный прогностический фактор рака, как указывается в некоторых сообщениях, что транслокация RET и уровень его активации также обратно коррелируют с прогнозом при раке (Непатентная литература 9, 10, 11, и 12).
[0003]
Поэтому считают, что ингибитор, способный ингибировать активность RET, будет полезным в качестве терапевтического средства для заболеваний, ассоциированных с аномально усиленными сигнальными путями RET.
[0004]
Ожидают, например, что при раке с вовлечением транслоцированных, мутированных и чрезмерно экспрессирующихся RET генов введение лекарственного средства, способного, в частности, ингибировать RET, будет селективно и интенсивно подавлять пролиферацию раковых клеток и способствовать лечению, продлению жизни и улучшению качества жизни раковых пациентов.
[0005]
В качестве примера таких соединений, обладающих активностью ингибирования RET, известен PP1 (Непатентная литература 13). PP1 известен как демонстрирующий высокую ингибиторную активность не только против RET, но также SRC (Непатентная литература 14), c-Kit, Bcr-Abl (Непатентная литература 15 и 16) и других. Например, в качестве побочных эффектов, ингибирование SRC может привести к аномально повышенному костеобразованию, а ингибирование LCK может подавлять T-клетки (Непатентная литература 17 и 18). Поскольку ингибиторы мультикиназ ингибируют не только RET, но также различные сигнальные пути, ингибируя клеточный рост и другие функции, такие ингибиторы вызывают опасения, связанные с различными возможными побочными эффектами, в связи с чем может потребоваться снижение дозы или лекарственные каникулы, приводящие, таким образом, к недостаточной активности ингибирования RET. С точки зрения снижения побочных эффектов, существует потребность в ингибиторе RET, который обладает высокой ингибиторной активностью против RET и который при этом демонстрирует низкую ингибиторную активность против других киназ.
Перечень ссылочных документов
Патентная литература
[0006]
Патентная литература 1: Патент США № 5665721
Патентная литература 2: WO96/40686A1
Непатентная литература
[0007]
Непатентная литература 1: Lois M. Mulligan, Nature Rev., 14(3): pp. 173-186, (2014)
Непатентная литература 2: Carlos F. Ibanez, Cold Spring Harb Perspect Biol., 5(2): pp. 1-10, (2013)
Непатентная литература 3: Takashi Kohno, Nature Med., 18(3): pp. 375-377, (2012)
Непатентная литература 4: Massimo Santoro, Eur J Endocrinol., 155: pp. 645-653, (2006)
Непатентная литература 5: Marjan Zarif Yeganeh, Asian Pac J Cancer Prev., 16(6): pp. 2107-2117, (2015)
Непатентная литература 6: Albana Gattelli, EMBO Mol Med., 5: pp. 1335-1350, (2013)
Непатентная литература 7: Yoshinori Ito, Surgery, 138: pp. 788-794, (2005)
Непатентная литература 8: Dawn M. Dawson, J Natl Cancer Inst., 90(7): pp. 519-523, (1998)
Непатентная литература 9: Weijing Cai, Cancer, 119: pp. 1486-1494, (2013)
Непатентная литература 10: Rossella Elisei, J Clin Endocrinol Metab., 93(3): pp. 682-687, (2008)
Непатентная литература 11: Albana Gattelli, EMBO Mol Med., 5: pp. 1335-1350, (2013)
Непатентная литература 12: Q Zeng, J. Int. Med. Res., 36: pp. 656-664, (2008)
Непатентная литература 13: Francesca Carlomagno, Cancer Res., 62(4): pp. 1077-1082, (2002)
Непатентная литература 14: Johannes Waltenberger, Circ Res., 85(1): pp. 12-22, (1999)
Непатентная литература 15: Louise Tatton, J Biol Chem., 278(7): pp. 4847-4853, (2003)
Непатентная литература 16: Markus Warmuth, Blood. 101(2): pp. 664-672, (2003)
Непатентная литература 17: Carolyn Lowe, Proc Natl Acad Sci USA, 90(10): pp. 4485-4489, (1993)
Непатентная литература 18: Thierry Molina, Nature, 357(6374): pp. 161-164, (1992)
Сущность изобретения
Техническая задача
[0008]
Целью настоящего изобретения является обеспечение нового ингибитора RET, включающего, в качестве активного ингредиента, соединение или его соль, которые не были известны как обладающие активностью ингибирования RET, и также обеспечение средства для профилактики или лечения заболеваний (например, злокачественных опухолей), которые можно предотвратить или лечить посредством активности ингибирования RET. Другой целью настоящего изобретения является обеспечение нового соединения или его соли, которые селективно и сильно ингибируют RET.
Решение задачи
[0009]
Авторы настоящего изобретения провели обширные исследования для достижения указанных выше целей, и в результате обнаружили, что группа соединений, представленных формулами (I) и (I'). приведенными ниже, показала отличную ингибиторную активность против RET и селективность в отношении киназ и была полезной в качестве фармацевтического препарата для лечения RET-связанных заболеваний, таких как злокачественные опухоли. Таким образом, было осуществлено настоящее изобретение.
[0010]
В частности, настоящее изобретение обеспечивает соединение, представленное формулой (I) ниже, или его соль:
[0011]
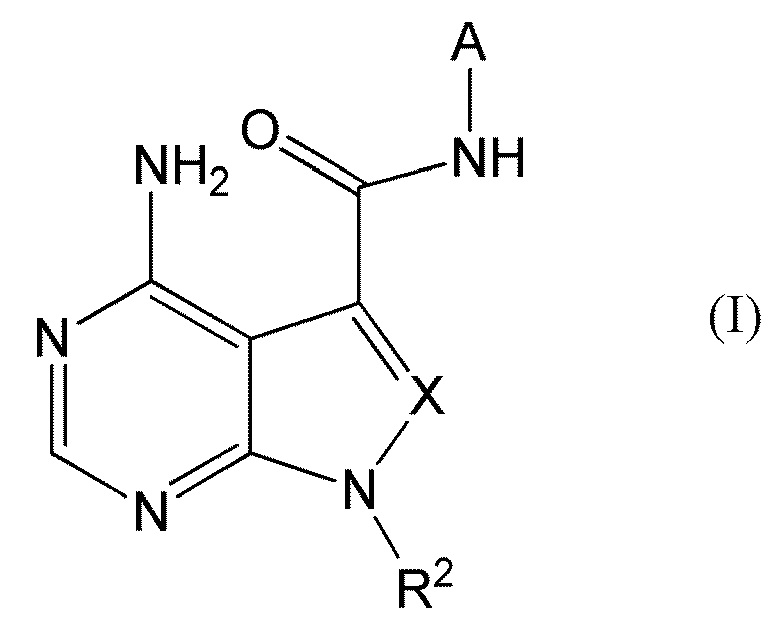
[0012]
где A представляет собой пиразолил, замещенный n-количеством заместителей R1;
R1 представляет собой
галоген,
циано,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C3-C7 циклоалкил,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы;
R2 представляет собой
замещенный или незамещенный C1-C10 алкил,
замещенный или незамещенный C3-C7 циклоалкил,
замещенный или незамещенный C2-C6 алкенил,
замещенный или незамещенный C3-C7 циклоалкенил,
замещенный или незамещенный C4-C12 связанный мостиковой связью циклоалкил,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы;
X представляет собой
N или
CR3, где R3 представляет собой
водород,
галоген,
циано,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C2-C6 алкенил,
замещенный или незамещенный C2-C6 алкинил,
замещенный или незамещенный C1-C6 алкокси,
замещенный или незамещенный амино,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; и
n представляет собой целое число, имеющее значение от 0 до 3,
при этом, когда n имеет значение 2 или 3, R1 могут быть одинаковыми или отличными друг от друга.
[0013]
Настоящее изобретение также обеспечивает соединение, представленное формулой (I') ниже, или его соль:
[0014]
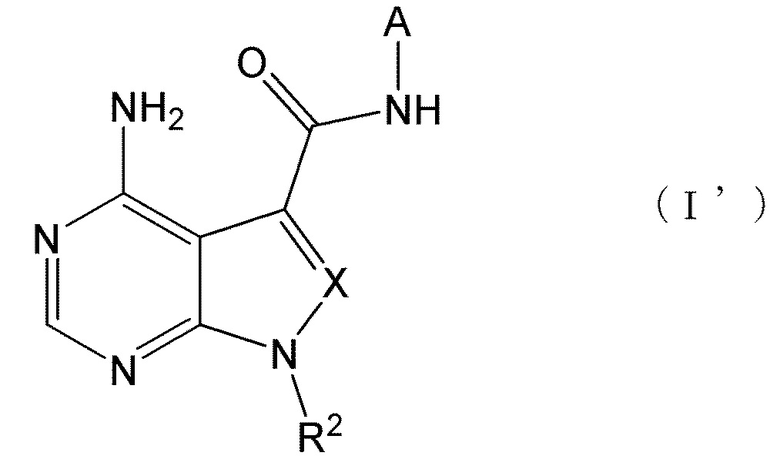
[0015]
где A представляет собой пиразолил, замещенный n-количеством заместителей R1;
R1 представляет собой
галоген,
циано,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C3-C7 циклоалкил,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы;
R2 представляет собой
замещенный или незамещенный C1-C10 алкил,
замещенный или незамещенный C3-C4 циклоалкил,
замещенный или незамещенный C2-C6 алкенил,
замещенный или незамещенный C3-C4 циклоалкенил,
замещенный или незамещенный C4-C12 связанный мостиковой связью циклоалкил,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы;
X представляет собой
N или
CR3, где R3 представляет собой
водород,
галоген,
циано,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C2-C6 алкенил,
замещенный или незамещенный C2-C6 алкинил,
замещенный или незамещенный C1-C6 алкокси,
замещенный или незамещенный амино,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; и
n представляет собой целое число, имеющее значение от 0 до 3,
при этом, когда n имеет значение 2 или 3, R1 могут быть одинаковыми или отличными друг от друга.
[0016]
Настоящее изобретение также обеспечивает ингибитор RET, включающий соединение, представленное формулой (I) или (I') выше, или его соль в качестве активного ингредиента.
[0017]
Настоящее изобретение также обеспечивает фармацевтическую композицию, включающую соединение, представленное формулой (I) или (I') выше, или его соль.
[0018]
Настоящее изобретение также обеспечивает фармацевтическую композицию, включающую соединение, представленное формулой (I) или (I') выше, или его соль, при этом фармацевтическая композиция предотвращает или лечит заболевание, которое можно лечить путем ингибирования RET.
[0019]
Настоящее изобретение также обеспечивает противоопухолевое средство, включающее соединение, представленное формулой (I) или (I') выше, или его соль.
[0020]
Настоящее изобретение также обеспечивает противоопухолевое средство, включающее соединение, представленное формулой (I) или (I') выше, или его соль, при этом противоопухолевое средство лечит злокачественную опухоль с повышенной активацией RET.
[0021]
Настоящее изобретение также обеспечивает соединение, представленное формулой (I) или (I') выше, или его соль для применения в профилактике или лечении злокачественной опухоли.
[0022]
Настоящее изобретение также обеспечивает соединение, представленное формулой (I) или (I') выше, или его соль для применения в профилактике или лечении злокачественной опухоли, где злокачественная опухоль представляет собой злокачественную опухоль с повышенной активацией RET.
[0023]
Настоящее изобретение также обеспечивает применение соединения, представленного формулой (I) или (I') выше, или его соли для получения противоопухолевого средства.
[0024]
Настоящее изобретение также обеспечивает применение соединения, представленного формулой (I) или (I') выше, или его соли для получения противоопухолевого средства, где противоопухолевое средство представляет собой противоопухолевое средство для лечения злокачественной опухоли с повышенной активацией RET.
[0025]
Настоящее изобретение также обеспечивает применение соединения, представленного формулой (I) или (I') выше, или его соли для получения ингибитора RET.
[0026]
Настоящее изобретение также обеспечивает способ для профилактики или лечения злокачественной опухоли, включающий введение млекопитающему соединения, представленного формулой (I) или (I') выше, или его соли.
[0027]
Настоящее изобретение также обеспечивает способ для профилактики или лечения злокачественной опухоли, включающий введение млекопитающему соединения, представленного формулой (I) или (I') выше, или его соли, где злокачественная опухоль представляет собой злокачественную опухоль с повышенной активацией RET.
[0028]
Настоящее изобретение также обеспечивает способ ингибирования RET, включающий введение млекопитающему соединения, представленного формулой (I) или (I') выше, или его соли.
[0029]
Патентная литература 1 и 2 не предполагает активность ингибирования RET или противоопухолевые эффекты.
[0030]
PP1, указанный выше, известен как соединение, обладающее активностью ингибирования RET. В PP1 п-толуильная группа связана с конденсированным кольцевым пиримидиновым скелетом; однако, его структура существенно отличается от настоящего изобретения тем, что PP1 не содержит пиразолильную группу, последовательно соединенную с амидной связью, которая является характерным признаком соединения по настоящему изобретению. Кроме того, как показано в Примерах испытаний, представленных ниже, соединение или его соль по настоящему изобретению обладает свойством высокой RET селективности, что является отличным от PP1.
Выгодные эффекты изобретения
[0031]
Настоящее изобретение может обеспечить новый ингибитор RET и средство для профилактики или лечения заболеваний (например, злокачественных опухолей), которые можно предотвратить или лечить посредством активности ингибирования RET, с использованием, в качестве их активных ингредиентов, соединений, представленных формулами (I) и (I'), или их солей, которые не были известны как обладающие активностью ингибирования RET. В частности, новое соединение, представленное формулой (I'), или его соль и т.д. являются предпочтительными.
[0032]
Было обнаружено, что соединение или его соль по настоящему изобретению обладает отличной RET-селективной ингибиторной активностью и эффектом ингибирования роста раковых клеток.
[0033]
RET известен в качестве онкогена и, как известно, активируется транслокацией, мутацией или чрезмерной экспрессией RET гена во многих типах рака (Непатентная литература 3, 4, 5, 6, 7 и 8). Таким образом, соединение или его соль по настоящему изобретению, которые оба обладают высокой активностью ингибирования RET, являются полезными в качестве средства для профилактики и/или лечения рака.
[0034]
Кроме того, соединение или его соль по настоящему изобретению селективно и сильно ингибирует RET, а не другие киназы, такие как SRC и LCK; поэтому побочные эффекты можно уменьшить и можно ожидать повышения безопасности.
[0035]
Кроме того, соединение или его соль по настоящему изобретению является предпочтительным, поскольку обладает отличной стабильностью в микросомах печени, можно ожидать отличных уровней его содержания в крови, и нет опасений, связанных с ингибированием Cyp.
Краткое описание чертежей
[0036]
Фиг. 1 иллюстрирует изменения относительного объема опухоли при испытании в Примере испытания 5.
Фиг. 2 иллюстрирует изменения относительного объема опухоли при испытании в Примере испытания 5
Фиг. 3 иллюстрирует изменения массы тела при испытании в Примере испытания 5.
Фиг. 4 иллюстрирует изменения массы тела при испытании в Примере испытания 5.
Описание вариантов осуществления
[0037]
Соединения по настоящему изобретению, представленные формулами (I) и (I') выше, представляют собой соединения, содержащие конденсированный циклический пиримидиновый скелет с пиразолильной группой через амидную связь, и они не были известны как обладающие активностью ингибирования RET. В частности, соединение, представленное формулой (I') выше, или его соль и т.д. являются новыми соединениями, которые не раскрыты ни в одном из перечисленных выше документов предшествующего уровня техники.
[0038]
В настоящем изобретении соединения, представленные формулами (I) и (I'), также просто указаны как ʺСоединение (I)ʺ и ʺСоединение (I')ʺ, соответственно.
[0039]
В настоящем описании, если не указано иное, примеры ʺзаместителяʺ включают галоген, гидрокси, циано, нитро, алкил, галогенoалкил, гидроксиалкил, алкоксиалкил, циклоалкил, циклоалкил-алкил, связанный мостиковой связью циклоалкил, аралкил, алкенил, алкинил, алкокси, галогенoалкокси, циклоалкокси, циклоалкил-алкокси, аралкилокси, алкилтио, циклоалкил-алкилтио, амино, моно- или диалкиламино, циклоалкил-алкиламино, ацил, ацилокси, оксо, карбоксил, алкоксикарбонил, аралкилоксикарбонил, карбамоил, насыщенную или ненасыщенную гетероциклическую группу, ароматический углеводород, насыщенную гетероциклическую окси группу и т.д. (Эти заместители также указаны как ʺЗаместители B.ʺ) Когда присутствует заместитель из перечисленных выше, его количество типично составляет один, два, или три.
[0040]
В настоящем описании примеры ʺгалогенаʺ включают фтор, хлор, бром и иод.
[0041]
В настоящем описании ʺалкилʺ может быть линейным или разветвленным. Примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, 1-метилпропил, н-пентил, изопентил, n-гексил, 1,1-диметилпропил, 1,1,2,2-тетраметилэтил, н-гептил, 1,1,2,2-тетраметилпропил, н-октил, н-нонил, н-децил и т.д.; и, в частности, включают C1-C10 алкил, C1-C6 алкил и т.д.
[0042]
В настоящем описании примеры ʺгалогенoалкилаʺ включают C1-C10 линейный или разветвленный алкил, содержащий один или несколько (например, 1-10, 1-7 или 1-5) атомов галогена (галогенo C1-C10 алкил). Примеры включают фторметил, дифторметил, трифторметил, трихлорметил, фторэтил, 1,1,1-трифторэтил, монофтор-н-пропил, перфтор-н-пропил, перфторизопропил, монофтор-н-бутил, монофтор-н-пентил, монофтор-н-гексил и т.д.; и, в частности, включают галогенo C1-C6 алкил, галогенo C1-C4 алкил и т.д.
[0043]
В настоящем описании примеры ʺгидроксиалкилаʺ включают C1-C10 линейный или разветвленный алкил, содержащий одну или несколько (например, 1-5, 1-3 или 1) гидрокси групп (гидрокси C1-C10 алкил). Примеры включают гидроксиметил, гидроксиэтил (1-гидроксиэтил или 2-гидроксиэтил), гидроксипропил, гидроксибутил, гидроксипентил, гидроксигексил и т.д.; и, в частности, включают гидрокси C1-C6 алкил, гидрокси C1-C4 алкил и т.д.
[0044]
В настоящем описании примеры ʺалкоксиалкилаʺ включают алкоксиалкил, в котором алкокси группа представляет собой C1-C6 линейный или разветвленный алкокси, и алкильная группа представляет собой C1-C10 линейный или разветвленный алкил (C1-C6 алкокси C1-C10 алкил). Примеры C1-C6 линейного или разветвленного алкокси включают такие, в которых алкильная группа представляет собой C1-C6 алкокси, из числа примеров алкила, представленных выше. Примеры алкоксиалкила включают метоксиметил, этоксиметил, н-пропоксиметил, н-бутоксиметил, 2-метоксиэтил, 1-метокси-н-пропил, 3-метокси-н-пропил, 2-этокси-н-бутил, 4-метокси-н-бутил, 5-метокси-н-пентил, 6-метокси-н-гексил и т.д.; и, в частности, включают C1-C4 алкокси C1-C6 алкил, C1-C4 алкокси C1-C4 алкил и т.д.
[0045]
В настоящем описании конкретные примеры ʺциклоалкилаʺ включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.д.; и, в частности, включают C3-C7 циклоалкил, C3-C5 циклоалкил, C3-C4 циклоалкил и т.д. В настоящем изобретении ʺциклоалкилʺ следует определять независимо от ʺсвязанного мостиковой связью циклоалкила,ʺ описанного ниже. Поэтому в настоящем изобретении ʺсвязанный мостиковой связью циклоалкилʺ исключается из ʺциклоалкилаʺ.
[0046]
В настоящем описании примеры ʺциклоалкил-алкилаʺ включают циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил, циклогептилметил и т.д.; и, в частности, включают C3-C7 циклоалкил-замещенный C1-C10 алкил, C3-C5 циклоалкил-замещенный C1-C6 алкил и т.д.
[0047]
В настоящем описании ʺсвязанный мостиковой связью циклоалкилʺ относится к связанному мостиковой связью циклическому углеводороду, в котором карбоциклическое кольцо, образующее связанный мостиковой связью циклический углеводород, имеет насыщенную структуру. В настоящем описании примеры ʺсвязанного мостиковой связью циклоалкилаʺ включают бицикло[1.1.0]бутил (бицикло[1.1.0]бутан-1-ил или бицикло[1.1.0]бутан-2-ил), бицикло[1.1.1]пентил (бицикло[1.1.1]пентан-1-ил или бицикло[1.1.1]пентан-2-ил), бицикло[3.1.0]гексил (бицикло[3.1.0]гексан-1-ил, бицикло[3.1.0]гексан-2-ил, бицикло[3.1.0]гексан-3-ил, или бицикло[3.1.0]гексан-6-ил), бицикло[2.2.1]гептил (бицикло[2.2.1]гептан-1-ил, бицикло[2.2.1]гептан-2-ил, или бицикло[2.2.1]гептан-7-ил), бицикло[3.1.1]гептил (бицикло[3.1.1]гептан-1-ил, бицикло[3.1.1]гептан-2-ил, бицикло[3.1.1]гептан-3-ил или бицикло[3.1.1]гептан-6-ил), адамантил (адамантан-1-ил или адамантан-2-ил) и т.д.; и, в частности, включают C4-C12 связанный мостиковой связью циклоалкил и т.д.
[0048]
В настоящем описании примеры ʺаралкилаʺ включают бензил, фенетил, нафтилметил, флуоренилметил и т.д.; и, в частности, включают C7-C14 аралкил и т.д.
[0049]
В настоящем описании ʺалкенилʺ может быть линейным или разветвленным и относится к ненасыщенному алифатическому углеводороду, содержащему по меньшей мере одну (например, 1 или 2 или 1) двойную связь. Примеры включают винил, аллил, 1-пропенил, 2-метил-2-пропенил, изопропенил, 1-, 2- или 3-бутенил, 2-, 3- или 4-пентенил, 2-метил-2-бутенил, 3-метил-2-бутенил, 5-гексенил, 1-циклопентенил, 1-циклогексенил, 3-метил-3-бутенил и т.д.; и, в частности, включают C2-C6 алкенил, C2-C4 алкенил и т.д.
[0050]
В настоящем описании ʺциклоалкенилʺ относится к ненасыщенному алициклическому углеводороду, содержащему по меньшей мере одну (например, 1 или 2 или 1) двойную связь. Примеры включают циклопропенил (например, 2-циклопропен-1-ил), циклобутенил (например, 2-циклобутен-1-ил), циклопентенил (например, 2-циклопентен-1-ил и 3-циклопентен-1-ил), циклопентадиенил (например, 2,4-циклопентадиен-1-ил), циклогексенил (например, 3-циклогексен-1-ил), циклогептенил (например, 3-циклогептен-1-ил) и т.д.; и, в частности, включают C3-C7 циклоалкенил, C3-C5 циклоалкенил, C3-C4 циклоалкенил и т.д.
[0051]
В настоящем описании ʺалкинилʺ может быть линейным, разветвленным или циклическим и относится к ненасыщенному углеводороду, содержащему по меньшей мере одну тройную связь. Примеры включают этинил, 1- или 2-пропинил, 1-, 2- или 3-бутинил, 1-метил-2-пропинил и т.д.; и, в частности, включают C2-C6 алкинил, C2-C4 алкинил и т.д.
[0052]
В настоящем описании ʺалкоксиʺ может быть линейным или разветвленным. Примеры включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, трет-бутокси, пентилокси, изопентилокси, гексилокси и т.д.; и, в частности, включают C1-C6 алкокси, C1-C4 алкокси и т.д.
[0053]
В настоящем описании ʺгалогенoалкоксиʺ относится к C1-C6 линейному или разветвленному алкокси, содержащему один или несколько (например, 1-10, 1-7 или 1-5) атомов галогена (галогенo C1-C6 алкокси). Примеры включают фторметокси, дифторметокси, трифторметокси, трихлорметокси, фторэтокси, 1,1,1-трифторэтокси, монофтор-н-пропокси, перфтор-н-пропокси, перфтор-изопропокси и т.д.; и, в частности, включают галогенo C1-C6 алкокси, галогенo C1-C4 алкокси и т.д.
[0054]
В настоящем описании конкретные примеры ʺциклоалкоксиʺ включают циклопропокси, циклобутокси, циклопентилокси, циклогексилокси, циклогептилокси и т.д.; и, в частности, включают C3-C7 циклоалкокси.
[0055]
В настоящем описании примеры ʺциклоалкил-алкоксиʺ включают циклопропилметокси, циклобутилметокси, циклопентилметокси, циклогексилметокси, циклогептилметокси и т.д.; и, в частности, включают C3-C7 циклоалкил-замещенн C1-C4 алкокси и т.д.
[0056]
В настоящем описании примеры ʺаралкилоксиʺ включают бензилокси, фенетилокси, нафтилметилокси, флуоренилметилокси и т.д.; и, в частности, включают C7-C14 аралкилокси и т.д.
[0057]
В настоящем описании ʺалкилтиоʺ может быть линейным или разветвленным. Примеры включают метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, изобутилтио, трет-бутилтио, n-пентилтио, изопентилтио, гексилтио и т.д.; и, в частности, включают C1-C6 алкилтио, C1-C4 алкилтио и т.д.
[0058]
В настоящем описании примеры ʺциклоалкил-алкилтиоʺ включают циклопропилметилтио, циклобутилметилтио, циклопентилметилтио, циклогексилметилтио, циклогептилметилтио и т.д.; и, в частности, включают C3-C7 циклоалкил-замещенный C1-C4 алкилтио и т.д.
[0059]
В настоящем описании примеры ʺмоноалкиламиноʺ включают метиламино, этиламино, н-пропиламино, изопропиламино, н-бутиламино, изобутиламино, трет-бутиламино, н-пентиламино, изопентиламино, гексиламино и т.д.; и, в частности, включают амино, моно-замещенный линейным или разветвленным C1-C6 алкилом.
[0060]
В настоящем описании примеры ʺдиалкиламиноʺ включают диметиламино, этилметиламино, диэтиламино, ди(н-пропил)амино, диизопропиламино, ди(н-бутил)амино, диизобутиламино, ди(трет-бутил)амино, ди(н-пентил)амино, диизопентиламино, дигексиламино и т.д.; и, в частности, включают амино, ди-замещенный линейным или разветвленным C1-C6 алкилом.
[0061]
В настоящем описании примеры ʺциклоалкил-алкиламиноʺ включают циклопропилметиламино, циклобутилметиламино, циклопентилметиламино, циклогексилметиламино, циклогептилметиламино и т.д.; и, в частности, включают C3-C7 циклоалкил-замещенный C1-C4 алкиламино и т.д.
[0062]
В настоящем описании ʺацилʺ относится к алкилкарбонилу или арилкарбонилу.
[0063]
В настоящем описании примеры ʺалкилкарбонилаʺ включают метилкарбонил, этилкарбонил, н-пропилкарбонил, изопропилкарбонил, н-бутилкарбонил, изобутилкарбонил, трет-бутилкарбонил, н-пентилкарбонил, изопентилкарбонил, гексилкарбонил и т.д.; и, в частности, включают линейный или разветвленный (C1-C6 алкил)карбонил и т.д.
[0064]
В настоящем описании примеры ʺарилкарбонилаʺ включают фенилкарбонил, нафтилкарбонил, флуоренилкарбонил, антрилкарбонил, бифенилилкарбонил, тетрагидронафтилкарбонил, хроманилкарбонил, 2,3-дигидро-1,4-диоксанафталенилкарбонил, инданилкарбонил, фенантрилкарбонил и т.д.; и, в частности, включают (C6-C14 арил)карбонил и т.д.
[0065]
В настоящем описании ʺацилоксиʺ относится к алкилкарбонилокси или арилкарбонилокси.
[0066]
В настоящем описании примеры ʺалкилкарбонилоксиʺ включают метилкарбонилокси, этилкарбонилокси, н-пропилкарбонилокси, изопропилкарбонилокси, н-бутилкарбонилокси, изобутилкарбонилокси, трет-бутилкарбонилокси, н-пентилкарбонилокси, изопентилкарбонилокси, гексилкарбонилокси и т.д.; и, в частности, включают линейный или разветвленный (C1-C6 алкил)карбонилокси и т.д.
[0067]
В настоящем описании примеры ʺарилкарбонилоксиʺ включают фенилкарбонилокси, нафтилкарбонилокси, флуоренилкарбонилокси, антрилкарбонилокси, бифенилилкарбонилокси, тетрагидронафтилкарбонилокси, хроманилкарбонилокси, 2,3-дигидро-1,4-диоксанафталенилкарбонилокси, инданилкарбонилокси, фенантрилкарбонилокси и т.д.; и, в частности, включают (C6-C14 арил)карбонилокси и т.д.
[0068]
В настоящем описании ʺалкоксикарбонилʺ может быть линейным или разветвленным. Примеры включают метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, трет-бутоксикарбонил, пентилоксикарбонил, изопентилоксикарбонил, гексилоксикарбонил и т.д.; и, в частности, включают (C1-C6 алкокси)карбонил и т.д.
[0069]
В настоящем описании примеры ʺаралкилоксикарбонилʺ включают бензилоксикарбонил, фенетилоксикарбонил, нафтилметилоксикарбонил, флуоренилметилоксикарбонил и т.д.; и, в частности, включают (C7-C14 аралкил)оксикарбонил и т.д.
[0070]
В настоящем описании ʺнасыщенная гетероциклическая группаʺ относится к моноциклической или полициклической насыщенной гетероциклической группе, содержащей гетероатом, выбранный из азота, кислорода и серы. Конкретные примеры включают морфолино, 1-пирролидинил, пиперидино, пиперазинил, 4-метил-1-пиперазинил, тетрагидрофуранил, тетрагидропиранил, тетрагидротиофенил, тиазолидинил, оксазолидинил, 7-азабицикло[2.2.1]гепт-2-ил, 2,6-диоксабицикло[3.2.1]окт-7-ил и т.д. В настоящем изобретении примеры насыщенной гетероциклической группы включают ʺC3-C10 моноциклическую или полициклическую насыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серыʺ, ʺC3-C6 моноциклическую насыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серыʺ, и ʺC4-C5 моноциклическую насыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота и кислородаʺ.
[0071]
В настоящем описании ʺненасыщенная гетероциклическая группаʺ относится к моноциклической или полициклической полностью или частично ненасыщенной гетероциклической группе, содержащей гетероатом, выбранный из азота, кислорода и серы. Конкретные примеры включают имидазолил, тиенил, фуранил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, тиадиазолил, пиразолил, триазолил, тетразолил, пиридил, пиразил, пиримидинил, пиридазинил, индолил, изоиндолил, индазолил, триазолoпиридил, бензоимидазолил, бензоксазолил, бензотиазолил, бензотиенил, бензофуранил, пуринил, хинолил, изохинолил, хиназолинил, хиноксалинил, метилендиоксифенил, этилендиоксифенил, дигидробензофуранил и т.д. В настоящем изобретении примеры ненасыщенной гетероциклической группы включают ʺC3-C10 моноциклическую или полициклическую ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы,ʺ ʺC3-C6 моноциклическую ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серыʺ, ʺC4-C5 моноциклическую ненасыщенную гетероциклическую группу, содержащую 1 или 2 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серыʺ, ʺC4-C5 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом азота, один атом кислорода или один атом серыʺ, ʺC4-C5 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серыʺ, и ʺC3-C6 моноциклическую ненасыщенную гетероциклическую группу, содержащую 1-3 атома азотаʺ.
[0072]
В настоящем описании ʺароматический углеводородʺ (арил) включает фенил, толил, ксилил, нафтил, антраценил, фенантрил, флуоренил, тетрагидронафтил и т.д.; и, в частности, включают C6-C14 ароматический углеводород и т.д.
[0073]
В настоящем описании ʺнасыщенный гетероциклический оксиʺ относится к окси, с которым связано насыщенное гетероциклическое кольцо, содержащее гетероатом, выбранный из азота, кислорода и серы. Конкретные примеры включают морфолинилокси, 1-пирролидинилокси, пиперидиноокси, пиперазинилокси, 4-метил-1-пиперазинилокси, тетрагидрофуранилокси, тетрагидропиранилокси, тетрагидротиофенилокси, тиазолидинилокси и оксазолидинилокси.
[0074]
Термин ʺCa-Cbʺ, в отношении заместителя в настоящем описании, указывает на то, что заместитель содержит количество атомов углерода от a до b. Например, ʺC1-C6 алкилʺ относится к алкилу, содержащему 1-6 атомов углерода, и ʺC6-C14 ароматический углеводород оксиʺ относится к окси, с которым связан C6-C14 ароматический углеводород. Кроме того, термин ʺa- b-членныйʺ указывает на то, что количество атомов (количество кольцевых членов), которые образуют кольцо, составляет от а до b. Например, ʺ4-10-членная насыщенная гетероциклическая группаʺ относится к насыщенной гетероциклической группе с 4-10-членным кольцом.
[0075]
В формулах (I) и (I'), A представляет собой пиразолил, замещенный n-количеством заместителей R1. Примеры пиразолила, представленного как A, включают пиразол-1-ил, пиразол-3-ил, пиразол-4-ил и пиразол-5-ил. Пиразол-3-ил является предпочтительным в настоящем изобретении.
[0076]
В формулах (I) и (I'), примеры ʺгалогенаʺ, представленного как R1, включают такие, которые указаны выше, предпочтительно хлор и бром, и более предпочтительно бром.
[0077]
В формулах (I) и (I') примеры ʺC1-C6 алкилаʺ в ʺзамещенном или незамещенном C1-C6 алкилеʺ, представленном как R1, включают такие, которые указаны выше, и предпочтительно C1-C4 алкил. Конкретные примеры включают метил, этил, н-пропил, изопропил и т.д.; более предпочтительно метил и этил; и еще более предпочтительно метил.
[0078]
Примеры ʺзаместителяʺ в ʺзамещенном или незамещенном C1-C6 алкилеʺ, представленном как R1, включают такие, которые указаны выше, и предпочтительно галоген и C1-C4 алкокси. Конкретные примеры включают фтор, метокси и т.д.; более предпочтительно галоген; и еще более предпочтительно фтор.
[0079]
Когда C1-C6 алкил является замещенным, количество заместителей конкретно не ограничивается, но предпочтительно составляет 1-3. Когда заместитель представляет собой галоген, количество заместителей предпочтительно составляет 2 или 3. Когда заместитель представляет собой C1-C4 алкокси, количество заместителей предпочтительно составляет 1.
[0080]
ʺЗамещенный или незамещенный C1-C6 алкилʺ, представленный как R1, предпочтительно представляет собой C1-C6 алкил, который может быть замещен галогеном или C1-C4 алкокси. Конкретные примеры включают метил, этил, н-пропил, изопропил, трифторметил, дифторметил, метоксиметил и т.д.; более предпочтительно C1-C6 алкил, который может быть замещен галогеном; еще более предпочтительно C1-C4 алкил, который может быть замещен галогеном; и еще более предпочтительно C1-C4 алкил, который может быть замещен фтором; еще более предпочтительно C1-C4 алкил; и еще более предпочтительно метил.
[0081]
В формулах (I) и (I'), примеры ʺC3-C7 циклоалкилаʺ в ʺзамещенном или незамещенном C3-C7 циклоалкилеʺ, представленным как R1, включают такие, которые указаны выше; предпочтительно циклопропил, циклобутил и циклопентил; и более предпочтительно циклопропил.
[0082]
Примеры ʺзаместителяʺ в ʺзамещенном или незамещенном C3-C7 циклоалкилʺ, представленным как R1, включают такие, которые указаны выше.
[0083]
ʺЗамещенный или незамещенный C3-C7 циклоалкилʺ, представленный как R1, предпочтительно представляет собой C3-C7 циклоалкил. Конкретные примеры включают циклопропил, циклобутил, циклопентил и т.д.; более предпочтительно C3-C5 циклоалкил; и еще более предпочтительно циклопропил.
[0084]
В формулах (I) и (I') примеры ʺC6-C14 ароматического углеводородаʺ в ʺзамещенном или незамещенном C6-C14 ароматическом углеводородеʺ, представленном как R1, включают такие, которые указаны выше, и предпочтительно фенил.
[0085]
Примеры ʺзаместителяʺ в ʺзамещенном или незамещенномC6-C14 ароматическом углеводородеʺ, представленном как R1, включают такие, которые указаны выше.
[0086]
ʺЗамещенный или незамещенный C6-C14 ароматический углеводородʺ, представленный как R1, предпочтительно представляет собой фенил.
[0087]
В формулах (I) и (I'), ʺC3-C10 моноциклическая или полициклическая насыщенная или ненасыщенная гетероциклическая группа, содержащая 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серыʺ в ʺзамещенной или незамещенной C3-C10 моноциклической или полициклической насыщенной или ненасыщенной гетероциклической группе, содержащей 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серыʺ, представленной как R1, предпочтительно представляет собой C3-C6 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы; более предпочтительно C4-C5 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы; еще более предпочтительно тиенил и фуранил; еще более предпочтительно следующую:
[0088]
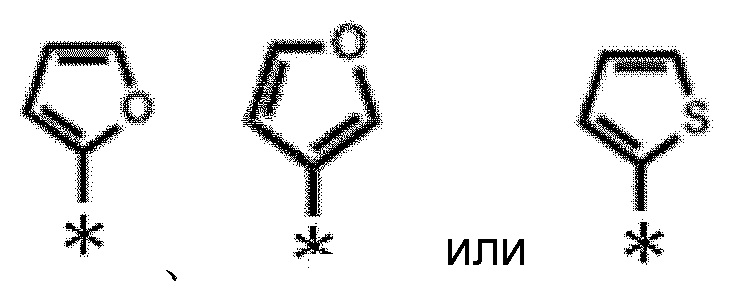
[0089]
где * представляет собой положение связывания (далее то же)
и еще более предпочтительно следующую:
[0090]
[0091]
[0092]
Примеры ʺзаместителяʺ в ʺзамещенной или незамещенной C3-C10 моноциклической или полициклической насыщенной или ненасыщенной гетероциклической группе, содержащей 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серыʺ, представленной как R1, включают такие, которые указаны выше.
[0093]
ʺЗамещенная или незамещенная C3-C10 моноциклическая или полициклическая насыщенная или ненасыщенная гетероциклическая группа, содержащая 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серыʺ, представленная как R1, предпочтительно представляет собой C3-C6 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы; более предпочтительно C4-C5 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы; еще более предпочтительно тиенил или фуранил; еще более предпочтительно следующую:
[0094]
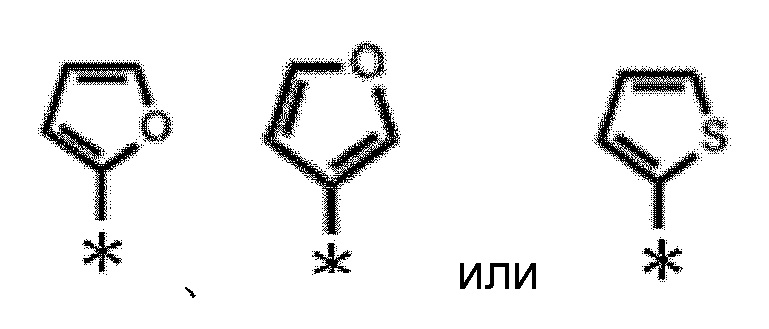
[0095]
и еще более предпочтительно следующую:
[0096]
[Формула 6]
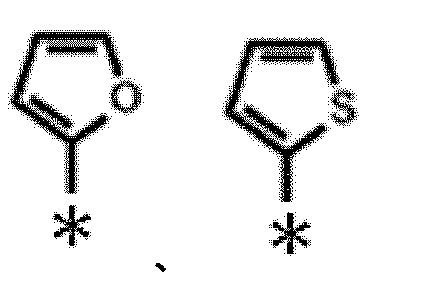
[0097]
[0098]
В формулах (I) и (I') R1 предпочтительно представляет собой
галоген,
циано,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C3-C7 циклоалкил,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы.
R1 более предпочтительно представляет собой
галоген;
циано;
C1-C6 алкил, который может быть замещен галогеном или C1-C4 алкокси;
C3-C7 циклоалкил;
фенил; или
C3-C6 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы.
R1 еще более предпочтительно представляет собой
галоген;
циано;
C1-C6 алкил, который может быть замещен галогеном;
C3-C7 циклоалкил;
фенил; или
C3-C6 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы.
R1 еще более предпочтительно представляет собой
галоген,
цианоили
C1-C4 алкил, который может быть замещен галогеном.
R1 еще более предпочтительно представляет собой галоген или C1-C4 алкил.
R1 еще более предпочтительно представляет собой метил.
[0099]
В формулах (I) и (I') примеры ʺC1-C10 алкилаʺ в ʺзамещенном или незамещенном C1-C10 алкилеʺ, представленном как R2, включают такие, которые указаны выше; предпочтительно линейный C1-C6 алкил или разветвленный C3-C8 алкил; более предпочтительно линейный C1-C4 алкил или разветвленный C3-C8 алкил; еще более предпочтительно линейный C1-C4 алкил или разветвленный C3-C6 алкил; и еще более предпочтительно разветвленный C3-C6 алкил.
[0100]
Линейный C1-C4 алкил, предпочтительно представляет собой метил, этил или н-пропил; и более предпочтительно метил.
[0101]
Разветвленный C3-C8 алкил, предпочтительно представляет собой изобутил, изопропил, втор-бутил, трет-бутил, трет-пентил, 1,1,2,2,-тетраметилпропил, 1,1,2,2,-тетраметилэтил или 1,1-диэтилметил; и более предпочтительно изопропил или трет-бутил.
[0102]
В формулах (I) и (I') примеры ʺзаместителяʺ в ʺзамещенном или незамещенном C1-C10 алкилеʺ, представленном как R2, включают такие, которые указаны выше. Заместитель предпочтительно представляет собой галоген, C3-C7 циклоалкил, который может быть замещен C1-C4 алкилом, фенил, C1-C6 алкокси или одну или несколько C3-C10 моноциклических или полициклических ненасыщенных гетероциклических групп, содержащих 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы;
более предпочтительно галоген, C3-C7 циклоалкил, который может быть замещен C1-C4 алкилом, фенилх, C1-C4 алкокси или одну или несколько C3-C6 моноциклических ненасыщенных гетероциклических групп, содержащих один атом кислорода или один атом серы; и
еще более предпочтительно фтор, C3-C7 циклоалкил, который может быть замещен C1-C4 алкилом, фенил, метокси или одну или несколько C3-C6 моноциклических ненасыщенных гетероциклических групп, содержащих один атом кислорода или один атом серы.
Конкретные примеры включают фтор, циклопропил, циклопропил, замещенный метилом, циклобутил, циклопентил, фенил, метокси, тиенил и т.д.; более предпочтительно фтор, циклопропил, циклобутил, циклопентил, метокси и следующую группу:
[0103]

[0104]
и еще более предпочтительно фтор и циклопропил.
[0105]
Когда C1-C10 алкил является замещенным, количество заместителей конкретно не ограничивается, но предпочтительно составляет 1-3.
Когда C1-C10 алкил замещен ʺгалогеномʺ, количество заместителей предпочтительно составляет 1-3; когда C1-C10 алкил замещен ʺC3-C7 циклоалкилом, который может быть замещен C1-C4 алкиломʺ, количество заместителей предпочтительно составляет 1; когда C1-C10 алкил замещен ʺфениломʺ, количество заместителей предпочтительно составляет 1; когда C1-C10 алкил замещен ʺC1-C6 алкоксиʺ, количество заместителей предпочтительно составляет 1; и когда C1-C10 алкил замещен ʺC3-C10 моноциклической или полициклической ненасыщенной гетероциклической группой, содержащей 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серыʺ, количество заместителей предпочтительно составляет 1.
[0106]
ʺЗамещенный или незамещенный C1-C10 алкилʺ, представленный как R2, предпочтительно представляет собой C1-C10 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C6 алкокси или одной или несколькими C3-C10 моноциклическими или полициклическими ненасыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы;
более предпочтительно линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом кислорода или один атом серы;
еще более предпочтительно линейный C1-C4 алкил, который замещен фтором или C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом; или
разветвленный C3-C8 алкил, который может быть замещен фтором, C3-C7 циклоалкилом, одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом кислорода или один атом серы, фенилом или C1-C4 алкокси.
Конкретные примеры включают следующие:
[0107]
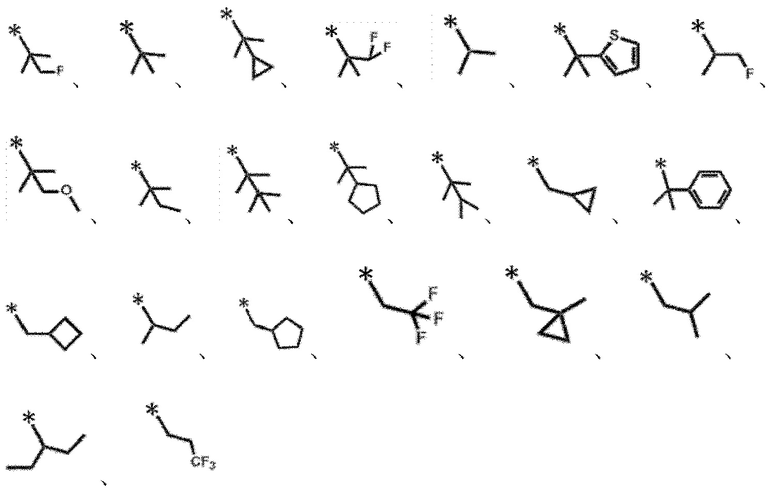
[0108]
и подобные.
[0109]
ʺЗамещенный или незамещенный C1-C10 алкилʺ, представленный как R2, более предпочтительно представляет собой линейный C1-C4 алкил, который замещен C3-C7 циклоалкилом, или
разветвленный C3-C6 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом серы или C1-C4 алкокси; и
еще более предпочтительно линейный C1-C4 алкил, который замещен C3-C7 циклоалкилом, или
разветвленный C3-C6 алкил, который может быть замещен фтором, C3-C7 циклоалкилом, одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом серы или C1-C4 алкокси.
Конкретные примеры включают следующие:
[0110]
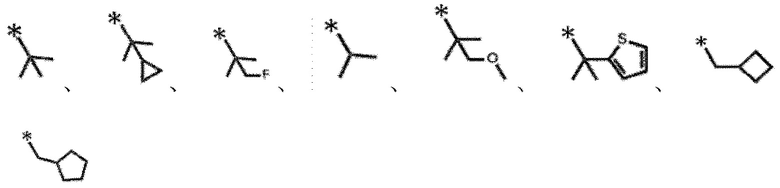
[0111]
и подобные.
[0112]
ʺЗамещенный или незамещенный C1-C10 алкилʺ, представленный как R2, более предпочтительно представляет собой разветвленный C3-C6 алкил, который может быть замещен галогеном или C3-C5 циклоалкилом;
еще более предпочтительно разветвленный C3-C6 алкил, который может быть замещен фтором или C3-C5 циклоалкилом; и
еще более предпочтительно изопропил или трет-бутил, который может быть замещен фтором или циклопропилом.
Конкретные примеры включают следующие:
[0113]

[0114]
и подобные.
[0115]
В формуле (I) примеры ʺC3-C7 циклоалкилаʺ в ʺзамещенном или незамещенном C3-C7 циклоалкилеʺ, представленном как R2, включают такие, которые указаны выше.
Конкретные примеры включают циклопропил, циклобутил, циклопентил, циклогексил и т.д.; предпочтительно C3-C5 циклоалкил; более предпочтительно C3-C4 циклоалкил; и еще более предпочтительно циклопропил.
[0116]
В формуле (I') примеры ʺC3-C4 циклоалкилаʺ в ʺзамещенном или незамещенном C3-C4 циклоалкилеʺ, представленным как R2, включают такие, которые указаны выше.
Конкретные примеры включают циклопропил, циклобутил и т.д.; и предпочтительно циклопропил.
[0117]
В формулах (I) и (I') примеры ʺзаместителяʺ в ʺзамещенном или незамещенном C3-C7 циклоалкилеʺ, представленном как R2, включают такие, которые указаны выше; и предпочтительно галоген, C1-C4 алкил, галогенo C1-C4 алкил и C3-C5 циклоалкил.
Конкретные примеры включают фтор, метил, этил, фторметил, дифторметил, циклопропил и т.д.; и более предпочтительно галоген, C1-C4 алкил и C3-C5 циклоалкил.
Конкретные примеры включают фтор, метил и циклопропил; и более предпочтительно метил.
[0118]
Когда указанный выше C3-C7 циклоалкил или C3-C4 циклоалкил является замещенным, количество заместителей конкретно не ограничивается, но предпочтительно составляет 1 или 2.
[0119]
Когда C3-C7 циклоалкил замещен ʺгалогеномʺ, количество заместителей предпочтительно составляет 1 или 2.
Когда C3-C7 циклоалкил замещен ʺC1-C4 алкиломʺ количество заместителей предпочтительно составляет 1 или 2.
Когда C3-C7 циклоалкил замещен ʺгалогенo C1-C4 алкиломʺ, количество заместителей предпочтительно составляет 1.
Когда C3-C7 циклоалкил замещен ʺC3-C5 циклоалкиломʺ, количество заместителей предпочтительно составляет 1.
[0120]
В формуле (I), ʺзамещенный или незамещенный C3-C7 циклоалкилʺ, представленный как R2, предпочтительно представляет собой C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом.
Конкретные примеры включают следующие:
[0121]
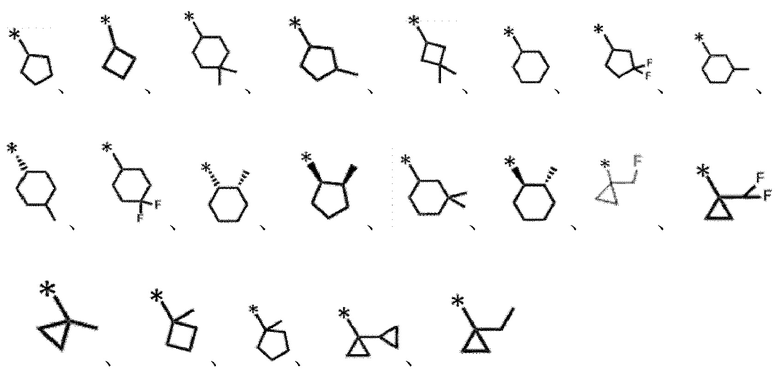
[0122]
и подобные.
[0123]
ʺЗамещенный или незамещенный C3-C7 циклоалкилʺ, представленный как R2, более предпочтительно представляет собой C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом или C3-C5 циклоалкилом; и
еще более предпочтительно C3-C7 циклоалкил, который может быть замещен фтором, C1-C4 алкилом или C3-C5 циклоалкилом.
Конкретные примеры включают следующие:
[0124]

[0125]
и подобные.
[0126]
ʺЗамещенный или незамещенный C3-C7 циклоалкилʺ, представленный как R2, более предпочтительно представляет собой C3-C5 циклоалкил, который может быть замещен C1-C4 алкилом;
еще более предпочтительно C3-C5 циклоалкил, который может быть замещен метилом;
еще более предпочтительно циклопропил, который может быть замещен метилом; и
еще более предпочтительно следующий:
[0127]

[0128]
[0129]
В формуле (I'), ʺзамещенный или незамещенный C3-C4 циклоалкилʺ, представленный как R2, предпочтительно представляет собой C3-C4 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом.
Конкретные примеры включают следующие:
[0130]
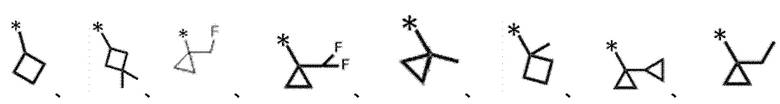
[0131]
и подобные.
[0132]
ʺЗамещенный или незамещенный C3-C4 циклоалкилʺ, представленный как R2, более предпочтительно представляет собой C3-C4 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом или C3-C5 циклоалкилом; и
еще более предпочтительно C3-C4 циклоалкил, который может быть замещен фтором, C1-C4 алкилом или C3-C5 циклоалкилом.
Конкретные примеры включают следующие:
[0133]

[0134]
и подобные.
[0135]
ʺЗамещенный или незамещенный C3-C4 циклоалкилʺ, представленный как R2, более предпочтительно представляет собой C3-C4 циклоалкил, который может быть замещен C1-C4 алкилом,
еще более предпочтительно C3-C4 циклоалкил, который может быть замещен метилом,
еще более предпочтительно циклопропил, который может быть замещен метилом, и
еще более предпочтительно следующий:
[0136]

[0137]
[0138]
В формулах (I) и (I') примеры ʺC2-C6 алкенилаʺ в ʺзамещенном или незамещенном C2-C6 алкенилеʺ, представленном как R2, включают такие, которые указаны выше, предпочтительно C2-C4 алкенил, и более предпочтительно изопропенил.
[0139]
В формулах (I) и (I'), примеры ʺзаместителяʺ в ʺзамещенном или незамещенном C2-C6 алкенилеʺ, представленном как R2, включают такие, которые указаны выше, предпочтительно галоген, и более предпочтительно фтор.
[0140]
Когда C2-C6 алкенил является замещенным, количество заместителей конкретно не ограничивается, но предпочтительно составляет 1-3. Когда заместитель представляет собой галоген, количество заместителей предпочтительно составляет 1.
[0141]
В формулах (I) и (I') ʺзамещенный или незамещенный C2-C6 алкенилʺ, представленный как R2, предпочтительно представляет собой C2-C6 алкенил, который может быть замещен галогеном;
более предпочтительно C2-C6 алкенил, который может быть замещен фтором; и
еще более предпочтительно следующий:
[0142]

[0143]
[0144]
В формулах (I) и (I') примеры ʺC3-C7 циклоалкенилаʺ и ʺC3-C4 циклоалкенилаʺ в ʺзамещенном или незамещенном C3-C7 циклоалкенилеʺ и ʺзамещенном или незамещенном C3-C4 циклоалкенилеʺ, представленном как R2, включают такие, которые указаны выше, предпочтительно C3-C4 циклоалкенил, и более предпочтительно циклобутенил.
[0145]
В формулах (I) и (I') примеры ʺзаместителяʺ в ʺзамещенном или незамещенном C3-C7 циклоалкенилеʺ и ʺзамещенном или незамещенном C3-C4 циклоалкенилеʺ, представленном как R2, включают такие, которые указаны выше, предпочтительно галоген, и более предпочтительно фтор.
[0146]
Когда C3-C7 циклоалкенил или C3-C4 циклоалкенил является замещенным, количество заместителей конкретно не ограничивается, но предпочтительно составляет 1-3. Когда заместитель представляет собой галоген, количество заместителей предпочтительно составляет 1.
[0147]
В формуле (I) ʺзамещенный или незамещенный C3-C7 циклоалкенилʺ, представленный как R2, предпочтительно представляет собой C3-C7 циклоалкенил, который может быть замещен галогеном, и
более предпочтительно C3-C4 циклоалкенил, который может быть замещен галогеном.
[0148]
В формуле (I') ʺзамещенный или незамещенный C3-C4 циклоалкенилʺ, представленный как R2, предпочтительно представляет собой C3-C4 циклоалкенил, который может быть замещен галогеном.
[0149]
В формулах (I) и (I') примеры ʺC4-C12 связанного мостиковой связью циклоалкилаʺ в ʺзамещенном или незамещенном C4-C12 связанном мостиковой связью циклоалкилеʺ, представленном как R2, включают такие, которые указаны выше;
предпочтительно бицикло[1.1.1]пентан-1-ил, бицикло[2.2.1]гептан-2-ил, адамантан-2-ил и бицикло[3.1.1]гептан-3-ил;
более предпочтительно бицикло[1.1.1]пентан-1-ил, бицикло[2.2.1]гептан-2-ил и адамантан-2-ил;
еще более предпочтительно бицикло[1.1.1]пентан-1-ил и бицикло[2.2.1]гептан-2-ил; и
еще более предпочтительно бицикло[2.2.1]гептан-2-ил.
[0150]
В формулах (I) и (I') примеры ʺзаместителяʺ в ʺзамещенном или незамещенном C4-C12 связанный мостиковой связью циклоалкилеʺ, представленном как R2, включают такие, которые указаны выше, предпочтительно C1-C4 алкил, и более предпочтительно метил.
[0151]
Когда C4-C12 связанный мостиковой связью циклоалкил является замещенным, количество заместителей конкретно не ограничивается, но предпочтительно составляет 1-3. Когда заместитель представляет собой C1-C4 алкил, количество заместителей предпочтительно составляет 1-3, и более предпочтительно 3.
[0152]
В формулах (I) и (I') ʺзамещенный или незамещенный C4-C12 связанный мостиковой связью циклоалкилʺ, представленный как R2, предпочтительно представляет собой C4-C12 связанный мостиковой связью циклоалкил, который может быть замещен C1-C4 алкилом; и
более предпочтительно C4-C12 связанный мостиковой связью циклоалкил, который может быть замещен метилом, и выбранный из бицикло[1.1.1]пентан-1-ила, бицикло[2.2.1]гептан-2-ила, адамантан-2-ила и бицикло[3.1.1]гептан-3-ила.
Конкретные примеры включают бицикло[1.1.1]пентан-1-ил, бицикло[2.2.1]гептан-2-ил, адамантан-2-ил, 2,6,6-триметилбицикло[3.1.1]гептан-3-ил и т.д.
ʺЗамещенный или незамещенный C4-C12 связанный мостиковой связью циклоалкилʺ, представленный как R2, более предпочтительно представляет собой C4-C12 связанный мостиковой связью циклоалкил;
еще более предпочтительно бицикло[1.1.1]пентан-1-ил или бицикло[2.2.1]гептан-2-ил; и
еще более предпочтительно бицикло[2.2.1]гептан-2-ил.
[0153]
В формулах (I) и (I') примеры ʺC6-C14 ароматического углеводородаʺ в ʺзамещенном или незамещенном C6-C14 ароматическом углеводородеʺ, представленном как R2, включают такие, которые указаны выше, и предпочтительно фенил.
[0154]
Примеры ʺзаместителяʺ в ʺзамещенном или незамещенном C6-C14 ароматическом углеводородеʺ, представленном как R2, включают такие, которые указаны выше.
[0155]
ʺЗамещенный или незамещенный C6-C14 ароматический углеводородʺ, представленный как R2, предпочтительно представляет собой фенил.
[0156]
В формулах (I) и (I'), ʺC3-C10 моноциклическая или полициклическая насыщенная или ненасыщенная гетероциклическая группа, содержащая 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серыʺ в ʺзамещенной или незамещенной C3-C10 моноциклической или полициклической насыщенной или ненасыщенной гетероциклической группе, содержащей 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серыʺ, представленной как R2, предпочтительно представляет собой C3-C6 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом азота, один атом кислорода или один атом серы;
более предпочтительно C4-C5 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом азота, один атом кислорода или один атом серы; и
еще более предпочтительно тиенил или фуранил.
[0157]
Примеры ʺзаместителяʺ в ʺзамещенной или незамещенной C3-C10 моноциклической или полициклической насыщенной или ненасыщенной гетероциклической группе, содержащей 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серыʺ, представленной как R2, включают такие, которые указаны выше.
[0158]
ʺЗамещенная или незамещенная C3-C10 моноциклическая или полициклическая насыщенная или ненасыщенная гетероциклическая группа, содержащая 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серыʺ, представленная как R2, предпочтительно представляет собой C3-C6 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом азота, один атом кислорода или один атом серы;
более предпочтительно C4-C5 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом азота, один атом кислорода или один атом серы; и
еще более предпочтительно тиенил или фуранил.
[0159]
R2 в формуле (I) предпочтительно представляет собой
замещенный или незамещенный C1-C10 алкил,
замещенный или незамещенный C3-C7 циклоалкил,
замещенный или незамещенный C2-C6 алкенил или
замещенный или незамещенный C4-C12 связанный мостиковой связью циклоалкил.
R2 более предпочтительно представляет собой
линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом кислорода или один атом серы;
C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, который может быть замещен C1-C4 алкилом.
R2 еще более предпочтительно представляет собой
линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом кислорода или один атом серы;
C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил.
R2 еще более предпочтительно представляет собой
линейный C1-C4 алкил, который замещен C3-C7 циклоалкилом;
разветвленный C3-C6 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом серы, или C1-C4 алкокси;
C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, выбранный из бицикло[1.1.1]пентан-1-ила и бицикло[2.2.1]гептан-2-ила.
R2 еще более предпочтительно представляет собой
разветвленный C3-C6 алкил, который может быть замещен галогеном или C3-C5 циклоалкилом;
C3-C5 циклоалкил, который может быть замещен C1-C4 алкилом, или
бицикло[2.2.1]гептан-2-ил.
R2 еще более предпочтительно представляет собой
изопропил или трет-бутил, который может быть замещен фтором или циклопропилом, или
циклопропил, который может быть замещен метилом.
[0160]
Кроме того, R2 в формуле (I') предпочтительно представляет собой
замещенный или незамещенный C1-C10 алкил,
замещенный или незамещенный C3-C4 циклоалкил,
замещенный или незамещенный C2-C6 алкенил или
замещенный или незамещенный C4-C12 связанный мостиковой связью циклоалкил.
R2 более предпочтительно представляет собой
линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом кислорода или один атом серы;
C3-C4 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, который может быть замещен C1-C4 алкилом.
R2 еще более предпочтительно представляет собой линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом кислорода или один атом серы;
C3-C4 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил.
R2 еще более предпочтительно представляет собой
линейный C1-C4 алкил, который замещен C3-C7 циклоалкилом;
разветвленный C3-C6 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом серы, или C1-C4 алкокси;
C3-C4 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, выбранный из бицикло[1.1.1]пентан-1-ила и бицикло[2.2.1]гептан-2-ила.
R2 еще более предпочтительно представляет собой
разветвленный C3-C6 алкил, который может быть замещен галогеном или C3-C5 циклоалкилом;
C3-C4 циклоалкил, который может быть замещен C1-C4 алкилом; или
бицикло[2.2.1]гептан-2-ил.
R2 еще более предпочтительно представляет собой
изопропил или трет-бутил, который может быть замещен фтором или циклопропилом, или
циклопропил, который может быть замещен метилом.
[0161]
В формулах (I) и (I') X представляет собой N или CR3, и предпочтительно CR3.
[0162]
В формулах (I) и (I') примеры ʺгалогенаʺ, представленного как R3, включают такие, которые указаны выше, и предпочтительно бром и хлор.
[0163]
В формулах (I) и (I') примеры ʺC1-C6 алкилаʺ в ʺзамещенном или незамещенном C1-C6 алкилеʺ, представленном как R3, включают такие, которые указаны выше, предпочтительно C1-C4 алкил, и более предпочтительно метил.
[0164]
Примеры ʺзаместителяʺ в ʺзамещенном или незамещенном C1-C6 алкилеʺ, представленном как R3, включают такие, которые указаны выше.
[0165]
ʺЗамещенный или незамещенный C1-C6 алкилʺ, представленный как R3, предпочтительно представляет собой C1-C6 алкил, более предпочтительно C1-C4 алкил, и еще более предпочтительно метил.
[0166]
В формулах (I) и (I') примеры ʺC2-C6 алкенилаʺ в ʺзамещенном или незамещенном C2-C6 алкенилеʺ, представленном как R3, включают такие, которые указаны выше, и предпочтительно винил и изопропенил.
[0167]
Примеры ʺзаместителяʺ в ʺзамещенном или незамещенном C2-C6 алкенилеʺ, представленном как R3, включают такие, которые указаны выше.
[0168]
В формулах (I) и (I') ʺзамещенный или незамещенный C2-C6 алкенилʺ, представленный как R3, предпочтительно представляет собой винил или изопропенил.
[0169]
Примеры ʺC2-C6 алкинилаʺ в ʺзамещенном или незамещенном C2-C6 алкинилеʺ, представленном как R3, включают такие, которые указаны выше, предпочтительно C2-C4 алкинил, и более предпочтительно этинил или пропинил.
[0170]
Количество тройных связей в ʺC2-C6 алкинилеʺ, предпочтительно представляет собой 1, и тройная связь предпочтительно расположена между атомом углерода, связанным с 7H-пирролo[2,3-d]пиримидиновым скелетом, и атомом углерода, смежным с этим атомом углерода.
[0171]
Примеры ʺзаместителяʺ в ʺзамещенном или незамещенном C2-C6 алкинилеʺ, представленном как R3, включают такие, которые указаны выше; и
предпочтительно
C1-C6 алкил, который может быть замещен гидрокси,
C3-C7 циклоалкил, который может быть замещен гидрокси,
одну или несколько C3-C10 моноциклических насыщенных гетероциклических групп, содержащих 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одну или несколько C3-C10 моноциклических или полициклических ненасыщенных гетероциклических групп, которые могут быть замещены C1-C6 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы.
Конкретные примеры включают
гидроксиизопропил,
гидроксициклопентил,
гидроксициклобутил,
морфолино,
тетрагидропиранил,
пиразолил, который может быть замещен метилом,
имидазо[1,2-b]пиридазинил,
имидазолил, который может быть замещен метилом, и
пиридинил.
ʺЗаместительʺ, более предпочтительно представляет собой
C1-C6 алкил, который может быть замещен гидрокси,
C3-C7 циклоалкил, который может быть замещен гидрокси,
одну или несколько C3-C6 моноциклических насыщенных гетероциклических групп, содержащих 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одну или несколько C3-C10 моноциклических или полициклических ненасыщенных гетероциклических групп, которые могут быть замещены C1-C6 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы.
ʺЗаместительʺ еще более предпочтительно представляет собой
C1-C6 алкил, который может быть замещен гидрокси,
C3-C7 циклоалкил, который может быть замещен гидрокси,
одну или несколько C3-C6 моноциклических насыщенных гетероциклических групп, содержащих 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одну или несколько C3-C6 моноциклических ненасыщенных гетероциклических групп, которые могут быть замещены C1-C4 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы.
ʺЗаместительʺ еще более предпочтительно представляет собой
C1-C4 алкил, который может быть замещен гидрокси,
C3-C5 циклоалкил, который может быть замещен гидрокси,
одну или несколько C3-C6 моноциклических насыщенных гетероциклических групп, содержащих 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота и кислорода, или
одну или несколько C3-C6 моноциклических ненасыщенных гетероциклических групп, которые могут быть замещены метилом и содержат 1-3 атома азота.
ʺЗаместительʺ еще более предпочтительно представляет собой
изопропил, который может быть замещен гидрокси,
C3-C5 циклоалкил, который может быть замещен гидрокси,
одну или несколько C4-C5 моноциклических насыщенных гетероциклических групп, содержащих 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота и кислорода, или
одну или несколько C3-C6 моноциклических ненасыщенных гетероциклических групп, которые могут быть замещены метилом и содержат 1-3 атома азота.
[0172]
ʺЗамещенный или незамещенный C2-C6 алкинилʺ, представленный как R3, предпочтительно представляет собой C2-C4 алкинил, который может быть замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C10 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C10 моноциклическими или полициклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C6 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы.
Конкретные примеры включают следующие:
[0173]
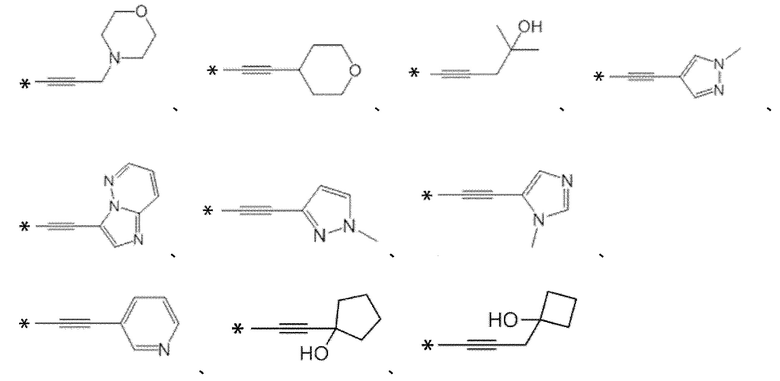
[0174]
ʺЗамещенный или незамещенный C2-C6 алкинилʺ, представленный как R3, более предпочтительно представляет собой C2-C4 алкинил, который может быть замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C10 моноциклическими или полициклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C6 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы.
ʺЗамещенный или незамещенный C2-C6 алкинилʺ, представленный как R3, еще более предпочтительно представляет собой C2-C4 алкинил, который замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C4 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы.
ʺЗамещенный или незамещенный C2-C6 алкинилʺ, представленный как R3, еще более предпочтительно представляет собой этинил или пропинил, который замещен
C1-C4 алкилом, который может быть замещен гидрокси,
C3-C5 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота и кислорода, или
одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, которые могут быть замещены метилом и содержат 1-3 атома азота.
ʺЗамещенный или незамещенный C2-C6 алкинилʺ, представленный как R3, еще более предпочтительно представляет собой этинил или пропинил, который замещен
изопропилом, который может быть замещен гидрокси,
C3-C5 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C4-C5 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота и кислорода, или
одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, которые могут быть замещены метилом и содержат 1-3 атома азота.
[0175]
Примеры ʺC1-C6 алкоксиʺ в ʺзамещенном или незамещенном C1-C6 алкоксиʺ, представленном как R3, включают такие, которые указаны выше, предпочтительно C1-C4 алкокси, и более предпочтительно метокси.
[0176]
Примеры ʺзаместителяʺ в ʺзамещенном или незамещенном C1-C6 алкоксиʺ, представленном как R3, включают такие, которые указаны выше;
предпочтительно одну или несколько C3-C10 моноциклических насыщенных гетероциклических групп, содержащих 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; и
более предпочтительно одну или несколько C3-C6 моноциклических насыщенных гетероциклических групп, содержащих один атом кислорода.
[0177]
ʺЗамещенный или незамещенный C1-C6 алкоксиʺ, представленный как R3, представляет собой C1-C4 алкокси, который может быть замещен одной или несколькими C3-C10 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
C1-C4 алкокси, который может быть замещен одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими один атом кислорода;
более предпочтительно C1-C4 алкокси; и
еще более предпочтительно метокси.
[0178]
В формулах (I) и (I'), примеры ʺзаместителяʺ в ʺзамещенном или незамещенном аминоʺ, представленном как R3, включают такие, которые указаны выше.
[0179]
В формулах (I) и (I') ʺC6-C14 ароматический углеводородʺ в ʺзамещенном или незамещенном C6-C14 ароматическом углеводородеʺ, представленном как R3, включает такие, которые указаны выше, и предпочтительно фенил.
[0180]
Примеры ʺзаместителяʺ в ʺзамещенном или незамещенном C6-C14 ароматическом углеводородеʺ, представленном как R3, включают такие, которые указаны выше.
[0181]
В формулах (I) и (I') ʺзамещенный или незамещенный C6-C14 ароматический углеводородʺ, представленный как R3, предпочтительно представляет собой фенил.
[0182]
В формулах (I) и (I') ʺC3-C10 моноциклическая или полициклическая насыщенная или ненасыщенная гетероциклическая группа, содержащая 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серыʺ в ʺзамещенной или незамещенной C3-C10 моноциклической или полициклической насыщенной или ненасыщенной гетероциклической группе, содержащей 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серыʺ, представленной как R3, предпочтительно представляет собой C3-C6 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы, и более предпочтительно тиенил или фуранил.
[0183]
Примеры ʺзаместителяʺ в ʺзамещенной или незамещенной C3-C10 моноциклической или полициклической насыщенной или ненасыщенной гетероциклической группе, содержащей 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серыʺ, представленной как R3, включают такие, которые указаны выше.
[0184]
ʺЗамещенная или незамещенная C3-C10 моноциклическая или полициклическая насыщенная или ненасыщенная гетероциклическая группа, содержащая 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серыʺ, представленная как R3, предпочтительно представляет собой C3-C6 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы, и более предпочтительно тиенил или фуранил.
[0185]
R3 предпочтительно представляет собой
водород,
галоген,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C2-C6 алкенил или
замещенный или незамещенный C1-C6 алкокси.
R3 более предпочтительно представляет собой
водород;
галоген;
C1-C6 алкил;
C2-C4 алкинил, который может быть замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C10 моноциклическими или полициклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C6 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; или
C1-C4 алкокси, который может быть замещен одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы.
R3 еще более предпочтительно представляет собой
водород;
галоген;
C1-C4 алкил;
C2-C4 алкинил, который может быть замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C10 моноциклическими или полициклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C6 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; или
C1-C4 алкокси.
R3 еще более предпочтительно представляет собой
водород; или
C2-C4 алкинил, который замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C4 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы.
R3 еще более предпочтительно представляет собой
водород; или
этинил или пропинил, который замещен
C1-C4 алкилом, который может быть замещен гидрокси,
C3-C5 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота и кислорода, или
одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, которые могут быть замещены метилом и содержат 1-3 атома азота.
R3 еще более предпочтительно представляет собой водород.
[0186]
В формулах (I) и (I'), n представляет собой целое число, имеющее значение от 0 до 3, предпочтительно от 0 до 2, более предпочтительно 1 или 2, и еще более предпочтительно 1.
[0187]
Когда n равен 2 или 3, R1 могут быть одинаковыми или отличными друг от друга, и предпочтительно являются одинаковыми.
[0188]
В формулах (I) и (I') положение связывания между амидной структурой и пиразолильной группой предпочтительно представляет собой такое, как показано в формулах (II) и (II') ниже.
[0189]
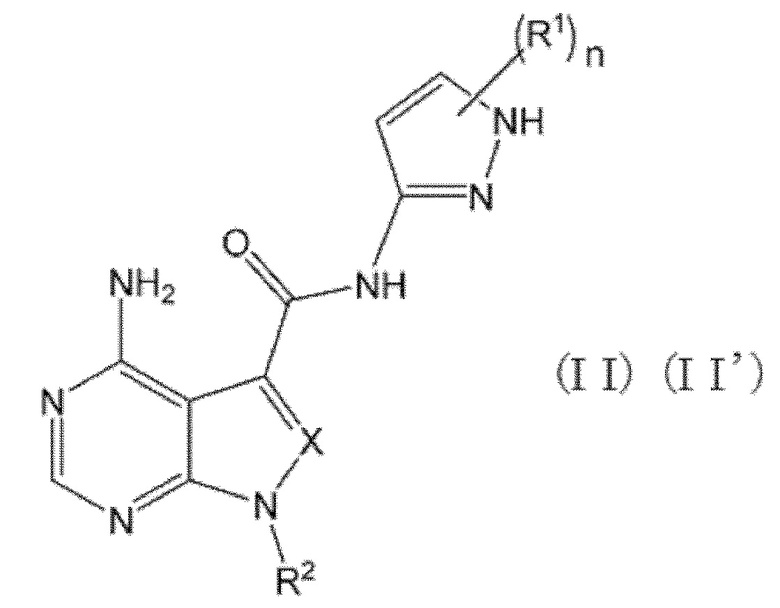
[0190]
Кроме того, когда n равен 1, положение связывания между заместителем R1 и пиразолильной группой предпочтительно представляет собой такое, как показано в формулах (VIII) и (VIII') ниже.
[0191]
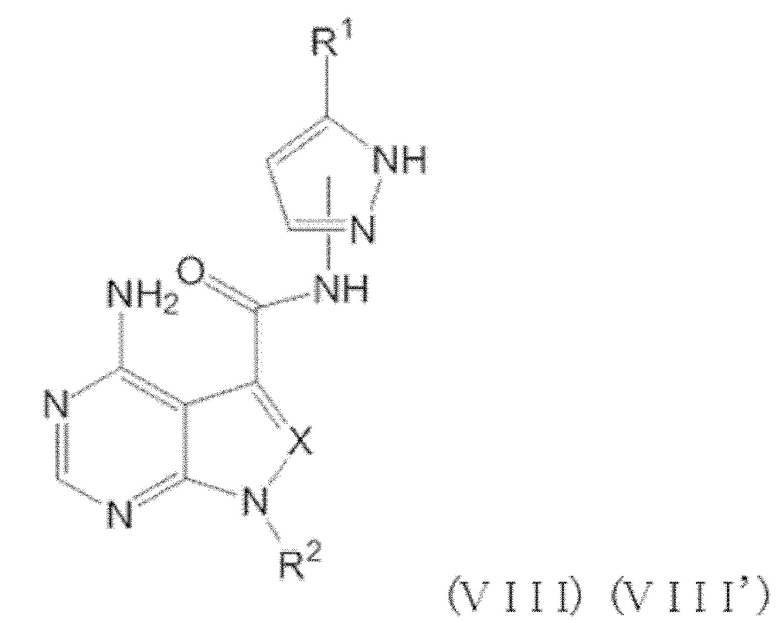
[0192]
Когда n равен 1, положение связывания между заместителем R1 и пиразолильной группой более предпочтительно представляет собой такое, как показано в формулах (IX) и (IX') ниже:
[0193]
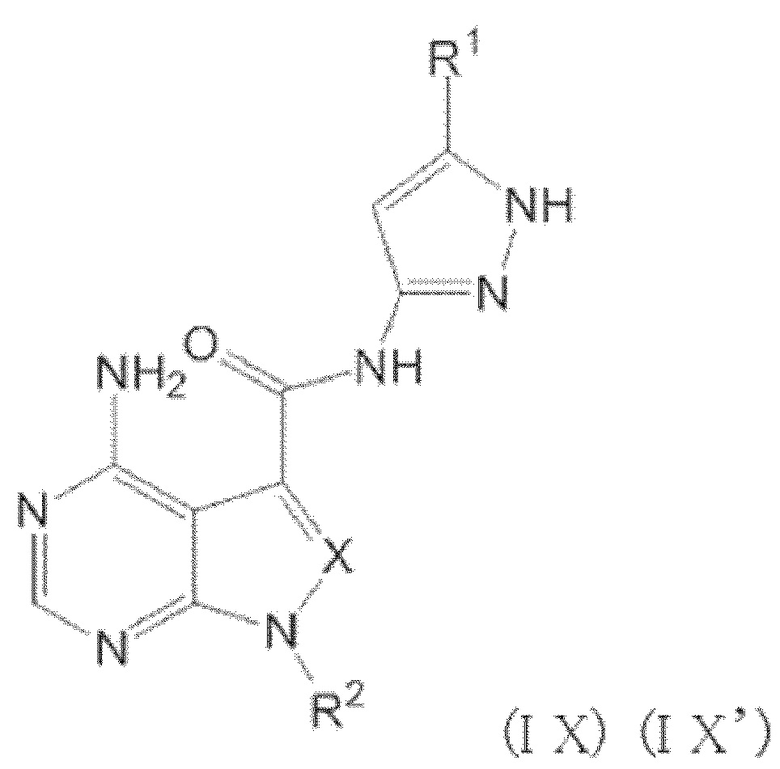
[0194]
[0195]
[1] Настоящее изобретение обеспечивает соединение, представленное формулой (I) ниже, или его соль:
[0196]
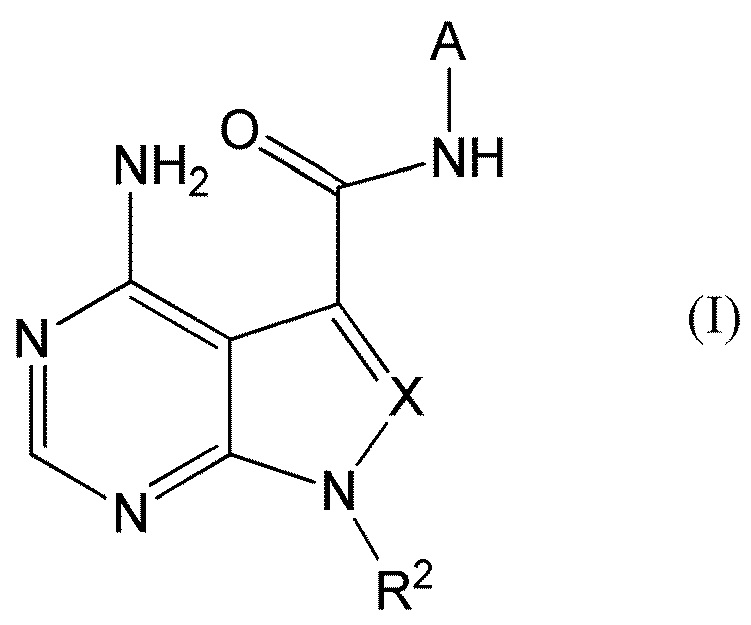
[0197]
где A представляет собой пиразолил, замещенный n-количеством заместителей R1;
R1 представляет собой
галоген,
циано,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C3-C7 циклоалкил,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы;
R2 представляет собой
замещенный или незамещенный C1-C10 алкил,
замещенный или незамещенный C3-C7 циклоалкил,
замещенный или незамещенный C2-C6 алкенил,
замещенный или незамещенный C3-C7 циклоалкенил,
замещенный или незамещенный C4-C12 связанный мостиковой связью циклоалкил,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы;
X представляет собой
N или
CR3, где R3 представляет собой
водород,
галоген,
циано,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C2-C6 алкенил,
замещенный или незамещенный C2-C6 алкинил,
замещенный или незамещенный C1-C6 алкокси,
замещенный или незамещенный амино,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; и
n представляет собой целое число, имеющее значение от 0 до 3,
при этом, когда n имеет значение 2 или 3, R1 могут быть одинаковыми или отличными друг от друга.
[0198]
[2] В формуле (I)
A предпочтительно представляет собой пиразолил, замещенный n-количеством заместителей R1;
R1 предпочтительно представляет собой
галоген,
циано,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C3-C7 циклоалкил,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы;
R2 предпочтительно представляет собой
замещенный или незамещенный C1-C10 алкил,
замещенный или незамещенный C3-C7 циклоалкил,
замещенный или незамещенный C2-C6 алкенил или
замещенный или незамещенный C4-C12 связанный мостиковой связью циклоалкил;
X предпочтительно представляет собой
N или
CR3, где R3 представляет собой
водород,
галоген,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C2-C6 алкинил или
замещенный или незамещенный C1-C6 алкокси; и
n предпочтительно представляет собой целое число, имеющее значение 1-3,
при этом, когда n имеет значение 2 или 3, R1 могут быть одинаковыми или отличными друг от друга.
[0199]
[3] В формуле (I)
A более предпочтительно представляет собой пиразолил, замещенный n-количеством заместителей R1;
R1 более предпочтительно представляет собой
галоген;
циано;
C1-C6 алкил, который может быть замещен галогеном или C1-C4 алкокси;
C3-C7 циклоалкил;
фенил; или
C3-C6 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы;
R2 более предпочтительно представляет собой
линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом кислорода или один атом серы;
C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, который может быть замещен C1-C4 алкилом;
X более предпочтительно представляет собой
N или
CR3, где R3 представляет собой
водород;
галоген;
C1-C6 алкил;
C2-C4 алкинил, который может быть замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C10 моноциклическими или полициклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C6 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; или
C1-C4 алкокси, который может быть замещен одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; и
n более предпочтительно представляет собой 1 или 2,
при этом, когда n имеет значение 2, R1 могут быть одинаковыми или отличными друг от друга.
[0200]
В другом варианте осуществления настоящего изобретения соединение формулы (I), где пиразолил связан с амидной структурой в 3-положении, является предпочтительным. Кроме того, предпочтительный вариант осуществления соединения формулы (I), где пиразолил связан с амидной структурой в 3-положении, в настоящем изобретении представляет собой
[4] соединение, представленное формулой (II) ниже, или его соль:
[0201]
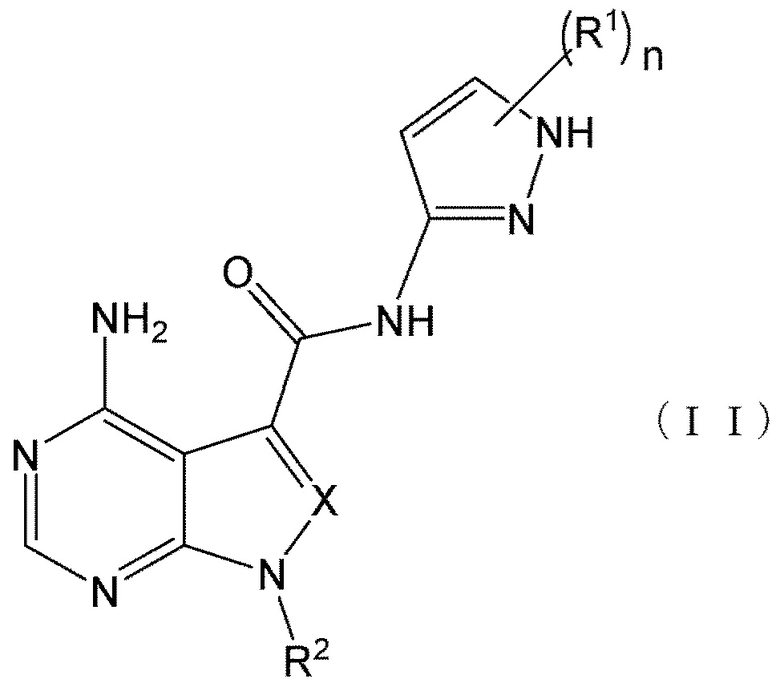
[0202]
где R1 представляет собой
галоген,
циано,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C3-C7 циклоалкил,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы;
R2 представляет собой
замещенный или незамещенный C1-C10 алкил,
замещенный или незамещенный C3-C7 циклоалкил,
замещенный или незамещенный C2-C6 алкенил или
замещенный или незамещенный C4-C12 связанный мостиковой связью циклоалкил;
X представляет собой
N или
CR3, где R3 представляет собой
водород,
галоген,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C2-C6 алкенил или
замещенный или незамещенный C1-C6 алкокси; и
n представляет собой целое число, имеющее значение 1-3,
при этом, когда n имеет значение 2 или 3, R1 могут быть одинаковыми или отличными друг от друга.
[0203]
В настоящем изобретении соединение, представленное формулой (II) выше, также просто указано как Соединение (II).
[0204]
[5] В формуле (II)
R1 более предпочтительно представляет собой
галоген;
циано;
C1-C6 алкил, который может быть замещен галогеном или C1-C4 алкокси;
C3-C7 циклоалкил;
фенил; или
C3-C6 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы;
R2 более предпочтительно представляет собой
линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом кислорода или один атом серы;
C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, который может быть замещен C1-C4 алкилом;
X более предпочтительно представляет собой
N или
CR3, где R3 представляет собой
водород;
галоген;
C1-C6 алкил;
C2-C4 алкинил, который может быть замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C10 моноциклическими или полициклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C6 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; или
C1-C4 алкокси, который может быть замещен одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; и
n более предпочтительно представляет собой 1 или 2,
при этом, когда n имеет значение 2, R1 могут быть одинаковыми или отличными друг от друга.
[0205]
[6] В формуле (II),
R1 более предпочтительно представляет собой
галоген;
циано;
C1-C6 алкил, который может быть замещен галогеном;
C3-C7 циклоалкил;
фенил; или
C3-C6 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы;
R2 более предпочтительно представляет собой
линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом кислорода или один атом серы;
C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил;
X более предпочтительно представляет собой
N или
CR3, где R3 представляет собой
водород;
галоген;
C1-C4 алкил;
C2-C4 алкинил, который может быть замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C10 моноциклическими или полициклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C6 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; или
C1-C4 алкокси; и
n более предпочтительно представляет собой 1 или 2,
при этом, когда n имеет значение 2, R1 могут быть одинаковыми или отличными друг от друга.
[0206]
[7] В формуле (II)
R1 более предпочтительно представляет собой
галоген,
циано или
C1-C4 алкил, который может быть замещен галогеном;
R2 более предпочтительно представляет собой
линейный C1-C4 алкил, который замещен C3-C7 циклоалкилом;
разветвленный C3-C6 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом серы или C1-C4 алкокси;
C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, выбранный из бицикло[1.1.1]пентан-1-ила и бицикло[2.2.1]гептан-2-ила;
X более предпочтительно представляет собой
N или
CR3, где R3 представляет собой
водород; или
C2-C4 алкинил, который замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C4 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; и
n более предпочтительно представляет собой целое число, имеющее значение 1.
[0207]
Предпочтительным в другом варианте осуществления настоящего изобретения является
[8] соединение, представленное формулой (IX) ниже, или его соль:
[0208]
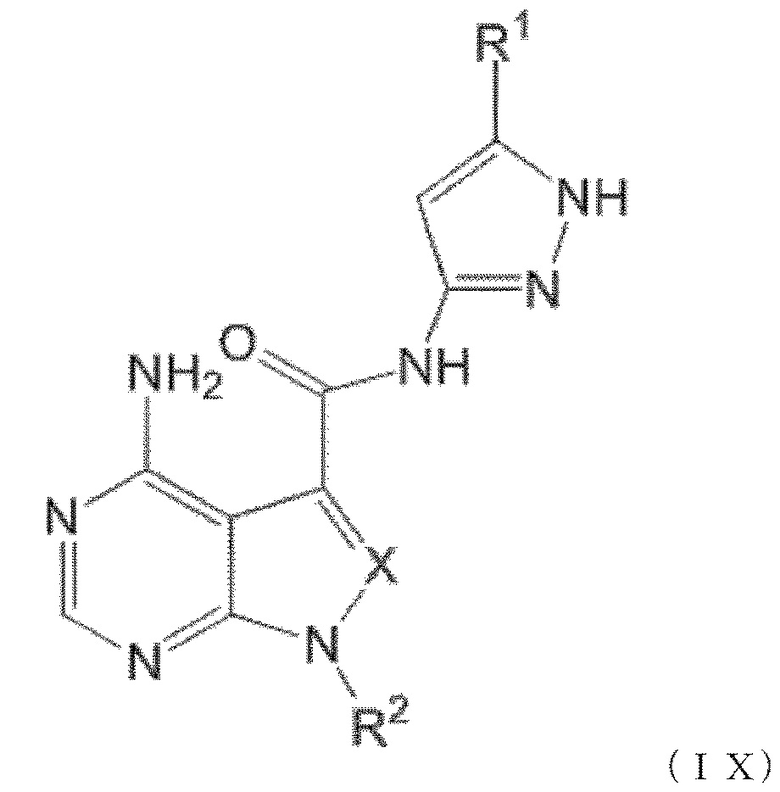
[0209]
где R1 представляет собой
галоген;
циано;
C1-C6 алкил, который может быть замещен галогеном;
C3-C7 циклоалкил;
фенил; или
C3-C6 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы;
R2 представляет собой
линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом кислорода или один атом серы;
C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил;
X представляет собой
N или
CR3, где R3 представляет собой
водород;
галоген;
C1-C4 алкил;
C2-C4 алкинил, который может быть замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C10 моноциклическими или полициклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C6 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; или
C1-C4 алкокси.
[0210]
В настоящем изобретении соединение, представленное формулой (IX) выше, также просто указано как Соединение (IX).
[0211]
[9] В формуле (IX)
R1 более предпочтительно представляет собой
галоген,
циано или
C1-C4 алкил, который может быть замещен галогеном;
R2 более предпочтительно представляет собой
линейный C1-C4 алкил, который замещен C3-C7 циклоалкилом;
разветвленный C3-C6 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом серы или C1-C4 алкокси;
C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, выбранный из бицикло[1.1.1]пентан-1-ила и бицикло[2.2.1]гептан-2-ила; и
X более предпочтительно представляет собой
N или
CR3, где R3 представляет собой
водород; или
C2-C4 алкинил, который может быть замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C4 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы.
[0212]
[10] В формуле (IX)
R1 более предпочтительно представляет собой
бром,
циано или
C1-C4 алкил, который может быть замещен фтором;
R2 более предпочтительно представляет собой
линейный C1-C4 алкил, который замещен C3-C7 циклоалкилом;
разветвленный C3-C6 алкил, который может быть замещен фтором, C3-C7 циклоалкилом, одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом серы, или C1-C4 алкокси;
C3-C7 циклоалкил, который может быть замещен фтором, C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен фтором; или
C4-C12 связанный мостиковой связью циклоалкил, выбранный из бицикло[1.1.1]пентан-1-ила и бицикло[2.2.1]гептан-2-ила; и
X более предпочтительно представляет собой
N или
CR3, где R3 представляет собой
водород; или
C2-C4 алкинил, который замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C4 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы.
[0213]
Кроме того, в другом варианте осуществления настоящего изобретения
[11] в формуле (IX)
R1 более предпочтительно представляет собой галоген или C1-C4 алкил;
R2 более предпочтительно представляет собой
разветвленный C3-C6 алкил, который может быть замещен галогеном или C3-C5 циклоалкилом,
C3-C5 циклоалкил, который может быть замещен C1-C4 алкилом, или
бицикло[2.2.1]гептан-2-ил; и
X более предпочтительно представляет собой
N или
CR3, где R3 представляет собой
водород; или
этинил или пропинил, который замещен
C1-C4 алкилом, который может быть замещен гидрокси,
C3-C5 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота и кислорода, или
одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, которые могут быть замещены метилом и содержат 1-3 атома азота.
[0214]
[12] В формуле (IX)
R1 более предпочтительно представляет собой бром или метил;
R2 более предпочтительно представляет собой
разветвленный C3-C6 алкил, который может быть замещен фтором или C3-C5 циклоалкилом, или
C3-C5 циклоалкил, который может быть замещен метилом; и
X более предпочтительно представляет собой
N или
CR3, где R3 представляет собой водород.
[0215]
[13] В формуле (IX)
R1 более предпочтительно представляет собой метил;
R2 более предпочтительно представляет собой
изопропил или трет-бутил, который может быть замещен фтором или циклопропилом, или
циклопропил, который может быть замещен метилом; и
X более предпочтительно представляет собой
N или
CR3, где R3 представляет собой водород.
[0216]
Кроме того,
[14] в формулах (I), (II) и (IX) настоящего изобретения, когда X представляет собой N,
R1 предпочтительно представляет собой
галоген,
циано,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C3-C7 циклоалкил,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; и
R2 предпочтительно представляет собой
замещенный или незамещенный C1-C10 алкил,
замещенный или незамещенный C3-C7 циклоалкил,
замещенный или незамещенный C2-C6 алкенил или
замещенный или незамещенный C4-C12 связанный мостиковой связью циклоалкил.
[0217]
Кроме того,
[15] в формулах (I), (II) и (IX) настоящего изобретения, когда X представляет собой CR3 (R3 имеет значение, определенное выше),
R1 предпочтительно представляет собой
галоген,
замещенный или незамещенный C1-C6 алкил или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; и
R2 предпочтительно представляет собой
замещенный или незамещенный C1-C10 алкил,
замещенный или незамещенный C3-C7 циклоалкил или
замещенный или незамещенный C4-C12 связанный мостиковой связью циклоалкил.
[0218]
Конкретные примеры соединения по настоящему изобретению включают, но не ограничиваются этим, соединения, полученные в примерах, описанных ниже.
[0219]
Конкретными предпочтительными примерами Соединения (I) являются следующие:
[16]
(1) 4-амино-1-циклопентил-N-(5-этил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 1);
(2) 4-амино-1-циклопентил-N-(5-(фуран-2-ил)-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 2);
(3) 4-амино-1-циклопентил-N-(5-(фуран-3-ил)-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 3);
(4) 4-амино-1-циклопентил-N-(5-(тиофен-2-ил)-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 4);
(5) 4-амино-1-циклопентил-N-(5-фенил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 5);
(6) 4-амино-1-циклопентил-N-(5-циклопентил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 6);
(7) 4-амино-1-циклопентил-N-(5-циклопропил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 7);
(8) 4-амино-1-циклопентил-N-(3-пропил-1H-пиразол-5-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 8);
(9) 4-амино-1-циклопентил-N-(1,3-диметил-1H-пиразол-5-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 9);
(10) 4-амино-1-циклопентил-N-(5-изопропил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 10);
(11) 4-амино-1-циклобутил-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 11);
(12) 4-амино-N-(5-метил-1H-пиразол-3-ил)-1-((1-метилциклопропил)метил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 12);
(13) 4-амино-N-(5-метил-1H-пиразол-3-ил)-1-(2,2,2-трифторэтил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 13);
(14) 4-амино-N-(5-метил-1H-пиразол-3-ил)-1-(3,3,3-трифторпропил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 14);
(15) 4-амино-1-(втор-бутил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 15);
(16) 4-амино-1-(циклобутилметил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 16);
(17) 4-амино-N-(5-бром-1H-пиразол-3-ил)-1-(циклобутилметил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 17);
(18) 4-амино-1-(циклопропилметил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 18);
(19) 4-амино-1-(циклопентилметил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 19);
(20) 4-амино-N-(5-бром-1H-пиразол-3-ил)-1-(циклопентилметил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 20);
(21) 4-амино-1-изопропил-N-(5-(трифторметил)-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 21);
(22) 4-амино-N-(5-бром-1H-пиразол-3-ил)-1-изопропил-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 22);
(23) 4-амино-N-(5-метил-1H-пиразол-3-ил)-1-((1R,2R)-2-метилциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 23);
(24) 4-амино-1-(4,4-диметилциклогексил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 24);
(25) 4-амино-N-(5-бром-1H-пиразол-3-ил)-1-(4,4-диметилциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 25);
(26) 4-амино-1-(3,3-диметилциклобутил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 26);
(27) 4-амино-1-(бицикло[2.2.1]гептан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 27);
(28) 4-амино-1-(бицикло[2.2.1]гептан-2-ил)-N-(5-бром-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 28);
(29) 1-(адамантан-2-ил)-4-амино-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 29);
(30) 4-амино-N-(5-метил-1H-пиразол-3-ил)-1-((2S,3R)-2,6,6-триметилбицикло[3.1.1]гептан-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 30);
(31) 4-амино-1-(3-фторпроп-1-ен-2-ил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 31);
(32) 4-амино-N-(5-бром-1H-пиразол-3-ил)-1-циклогексил-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 32);
(33) 4-амино-1-циклогексил-N-(5-(дифторметил)-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 33);
(34) 4-амино-1-(трет-бутил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 34);
(35) 4-амино-N-(5-бром-1H-пиразол-3-ил)-1-(трет-бутил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 35);
(36) 4-амино-1-(трет-бутил)-N-(5-(трифторметил)-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 36);
(37) 4-амино-1-(трет-бутил)-N-(5-(фуран-2-ил)-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 37);
(38) 4-амино-1-(трет-бутил)-N-(5-циано-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 38);
(39) 4-амино-1-(трет-бутил)-N-(5-этил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 39);
(40) 4-амино-1-(трет-бутил)-N-(5-изопропил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 40);
(41) 4-амино-1-(трет-бутил)-N-(5-циклопропил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 41);
(42) 4-амино-1-(трет-бутил)-N-(5-циклобутил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 42);
(43) 4-амино-1-(4,4-дифторциклогексил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 43);
(44) 4-амино-N-(5-бром-1H-пиразол-3-ил)-1-(4,4-дифторциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 44);
(45) 4-амино-7-изопропил-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 45);
(46) 4-амино-7-(1-фторпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 46);
(47) 4-амино-7-(4,4-диметилциклогексил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 47);
(48) 4-амино-7-(трет-бутил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 48);
(49) 4-амино-7-(трет-бутил)-N-(5-(фуран-2-ил)-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 49);
(50) 4-амино-7-(1-фтор-2-метилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 50);
(51) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 51);
(52) 4-амино-7-(2-циклопропилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 52);
(53) 4-амино-7-(1-метокси-2-метилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 53);
(54) 4-амино-7-(1-(фторметил)циклопропил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 54);
(55) 4-амино-7-(1-(дифторметил)циклопропил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 55);
(56) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(2-(тиофен-2-ил)пропан-2-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 56);
(57) 4-амино-7-(3,3-дифторциклопентил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 57);
(58) 4-амино-7-(бицикло[1.1.1]пентан-1-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 58);
(59) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопентил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 59);
(60) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(2-фенилпропан-2-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 60);
(61) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(2,3,3-триметилбутан-2-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 61);
(62) 4-амино-7-(2,3-диметилбутан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 62);
(63) 4-амино-N-(5-бром-1H-пиразол-3-ил)-7-(трет-бутил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 63);
(64) 4-амино-7-(трет-бутил)-N-(5-(метоксиметил)-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 64);
(65) 4-амино-N-(5-бром-1H-пиразол-3-ил)-7-изопропил-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 65);
(66) 4-амино-N-(5-бром-1H-пиразол-3-ил)-7-(1-фтор-2-метилпропан-2-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 66);
(67) 4-амино-N-(5-бром-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 67);
(68) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклобутил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 68);
(69) 4-амино-7-циклобутил-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 69);
(70) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(трет-пентил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 70);
(71) 4-амино-7-(бицикло[2.2.1]гептан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 71);
(72) 4-амино-7-циклопентил-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 72);
(73) 4-амино-7-(трет-бутил)-6-метил-N-(3-метил-1H-пиразол-5-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 73);
(74) 7-([1,1'-би(циклопропан)]-1-ил)-4-амино-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 74);
(75) 4-амино-6-хлор-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 75);
(76) 4-амино-6-бром-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 76);
(77) 4-амино-6-метокси-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 77);
(78) 4-амино-6-хлор-7-(1-фтор-2-метилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 78);
(79) 4-амино-6-(3-гидрокси-3-метил-1-бутин-1-ил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 79);
(80) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-6-(пиридин-3-илэтинил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 80);
(81) 4-амино-6-((1-гидроксициклопентил)этинил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 81);
(82) 4-амино-6-((1-метил-1H-пиразол-4-ил)этинил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 82);
(83) 4-амино-6-((1-метил-1H-имидазол-5-ил)этинил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 83);
(84) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-6-(3-морфолино-1-пропин-1-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 84);
(85) 4-амино-6-(3-(1-гидроксициклобутил)-1-propyne)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 85);
(86) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-6-((тетрагидро-2H-пиран-4-ил)этинил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 86);
(87) 4-амино-N-(5-метил-1H-пиразол-3-ил)-6-((1-метил-1H-пиразол-3-ил)этинил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 87);
(88) 4-амино-6-(имидазо[1,2-b]пиридазин-3-илэтинил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 88);
(89) 4-амино-6-этокси-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 89); и
(90) (R)-4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-6-((тетрагидрофуран-2-ил)метокси)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 90).
[0220]
Более предпочтительными примерами Соединения (I) являются следующие:
[17]
(27) 4-амино-1-(бицикло[2.2.1]гептан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 27);
(34) 4-амино-1-(трет-бутил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 34);
(45) 4-амино-7-изопропил-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 45);
(48) 4-амино-7-(трет-бутил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 48);
(50) 4-амино-7-(1-фтор-2-метилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 50);
(51) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 51);
(52) 4-амино-7-(2-циклопропилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 52);
(65) 4-амино-N-(5-бром-1H-пиразол-3-ил)-7-изопропил-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 65);
(68) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклобутил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 68);
(71) 4-амино-7-(бицикло[2.2.1]гептан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 71);
(72) 4-амино-7-циклопентил-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 72);
(79) 4-амино-6-(3-гидрокси-3-метил-1-бутин-1-ил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 79);
(80) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-6-(пиридин-3-илэтинил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 80);
(81) 4-амино-6-((1-гидроксициклопентил)этинил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 81);
(82) 4-амино-6-((1-метил-1H-пиразол-4-ил)этинил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 82);
(83) 4-амино-6-((1-метил-1H-имидазол-5-ил)этинил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 83);
(84) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-6-(3-морфолино-1-пропин-1-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 84); и
(85) 4-амино-6-(3-(1-гидроксициклобутил)-1-propyne)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 85).
Еще более предпочтительными примерами Соединения (I) являются следующие:
[18]
(34) 4-амино-1-(трет-бутил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 34);
(48) 4-амино-7-(трет-бутил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 48);
(50) 4-амино-7-(1-фтор-2-метилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 50);
(51) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 51); и
(52) 4-амино-7-(2-циклопропилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 52).
[0221]
Кроме того, настоящее изобретение обеспечивает ингибитор RET, включающий соединение или его соль в соответствии с любым из пунктов [1] - [18] в качестве активного ингредиента.
[0222]
Кроме того, настоящее изобретение обеспечивает фармацевтическую композицию, включающую соединение или его соль в соответствии с любым из пунктов [1] - [18].
[0223]
Кроме того, настоящее изобретение обеспечивает фармацевтическую композицию, включающую соединение или его соль в соответствии с любым из пунктов [1] - [18], при этом фармацевтическая композиция предотвращает или лечит заболевание, которое можно лечить путем ингибирования RET.
[0224]
Кроме того, настоящее изобретение обеспечивает противоопухолевое средство, включающее соединение или его соль в соответствии с любым из пунктов [1] - [18].
[0225]
Кроме того, настоящее изобретение обеспечивает противоопухолевое средство, включающее соединение или его соль в соответствии с любым из пунктов [1] - [18], при этом противоопухолевое средство лечит злокачественную опухоль с повышенной активацией RET.
[0226]
Кроме того, настоящее изобретение обеспечивает соединение или его соль в соответствии с любым из пунктов [1] - [18] для применения в профилактике или лечении злокачественной опухоли.
[0227]
Кроме того, настоящее изобретение обеспечивает соединение или его соль в соответствии с любым из пунктов [1] - [18] для применения в профилактике или лечении злокачественной опухоли, где злокачественная опухоль представляет собой злокачественную опухоль с повышенной активацией RET.
[0228]
Кроме того, настоящее изобретение обеспечивает применение соединения или его соли в соответствии с любым из пунктов [1] - [18] для получения противоопухолевого средства.
[0229]
Кроме того, настоящее изобретение обеспечивает применение соединения или его соли в соответствии с любым из пунктов [1] - [18] для получения противоопухолевого средства, где противоопухолевое средство представляет собой противоопухолевое средство для лечения злокачественной опухоли с повышенной активацией RET.
[0230]
Кроме того, настоящее изобретение обеспечивает применение соединения или его соли в соответствии с любым из пунктов [1] - [18] для получения ингибитора RET.
[0231]
Кроме того, настоящее изобретение обеспечивает способ для профилактики или лечения злокачественной опухоли, включающий введение млекопитающему соединения или его соли в соответствии с любым из пунктов [1] - [18].
[0232]
Кроме того, настоящее изобретение обеспечивает способ для профилактики или лечения злокачественной опухоли, включающий введение млекопитающему соединения или его соли в соответствии с любым из пунктов [1] - [18], где злокачественная опухоль представляет собой злокачественную опухоль с повышенной активацией RET.
[0233]
Кроме того, настоящее изобретение обеспечивает способ ингибирования RET, включающий введение млекопитающему соединения или его соли в соответствии с любым из пунктов [1] - [18].
[0234]
Кроме того, настоящее изобретение обеспечивает
[19] соединение, представленное формулой (I') ниже, или его соль:
[0235]
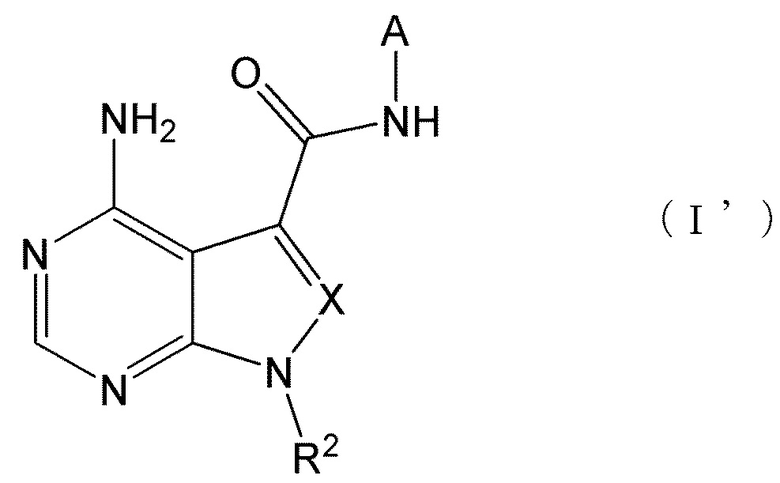
[0236]
где A представляет собой пиразолил, замещенный n-количеством заместителей R1;
R1 представляет собой
галоген,
циано,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C3-C7 циклоалкил,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы;
R2 представляет собой
замещенный или незамещенный C1-C10 алкил,
замещенный или незамещенный C3-C4 циклоалкил,
замещенный или незамещенный C2-C6 алкенил,
замещенный или незамещенный C3-C4 циклоалкенил,
замещенный или незамещенный C4-C12 связанный мостиковой связью циклоалкил,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы;
X представляет собой
N или
CR3, где R3 представляет собой
водород,
галоген,
циано,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C2-C6 алкенил,
замещенный или незамещенный C2-C6 алкинил,
замещенный или незамещенный C1-C6 алкокси,
замещенный или незамещенный амино,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; и
n представляет собой целое число, имеющее значение от 0 до 3,
при этом, когда n имеет значение 2 или 3, R1 могут быть одинаковыми или отличными друг от друга.
[0237]
[20] В формуле (I')
A предпочтительно представляет собой пиразолил, замещенный n-количеством заместителей R1;
R1 предпочтительно представляет собой
галоген,
циано,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C3-C7 циклоалкил,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы;
R2 предпочтительно представляет собой
замещенный или незамещенный C1-C10 алкил,
замещенный или незамещенный C3-C4 циклоалкил,
замещенный или незамещенный C2-C6 алкенил или
замещенный или незамещенный C4-C12 связанный мостиковой связью циклоалкил,
X предпочтительно представляет собой
N или
CR3, где R3 представляет собой
водород,
галоген,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C2-C6 алкенил или
замещенный или незамещенный C1-C6 алкокси; и
n, предпочтительно представляет собой целое число, имеющее значение 1-3,
при этом, когда n имеет значение 2 или 3, R1 могут быть одинаковыми или отличными друг от друга.
[0238]
[21] В формуле (I')
A представляет собой пиразолил, замещенный n-количеством заместителей R1;
R1 более предпочтительно представляет собой
галоген;
циано;
C1-C6 алкил, который может быть замещен галогеном или C1-C4 алкокси;
C3-C7 циклоалкил;
фенил; или
C3-C6 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы;
R2 более предпочтительно представляет собой
линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом кислорода или один атом серы;
C3-C4 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, который может быть замещен C1-C4 алкилом;
X более предпочтительно представляет собой
N или
CR3, где R3 представляет собой
водород;
галоген;
C1-C6 алкил;
C2-C4 алкинил, который может быть замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C10 моноциклическими или полициклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C6 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; или
C1-C4 алкокси, который может быть замещен одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; и
n, более предпочтительно представляет собой 1 или 2,
при этом, когда n имеет значение 2, R1 могут быть одинаковыми или отличными друг от друга.
[0239]
В другом варианте осуществления настоящего изобретения соединение формулы (I'), где пиразолил связан с амидной структурой в 3-положении, является предпочтительным. Кроме того, предпочтительный вариант осуществления соединения формулы (I'), где пиразолил связан с амидной структурой в 3-положении, в настоящем изобретении представляет собой
[22] соединение, представленное формулой (II') ниже, или его соль:
[0240]
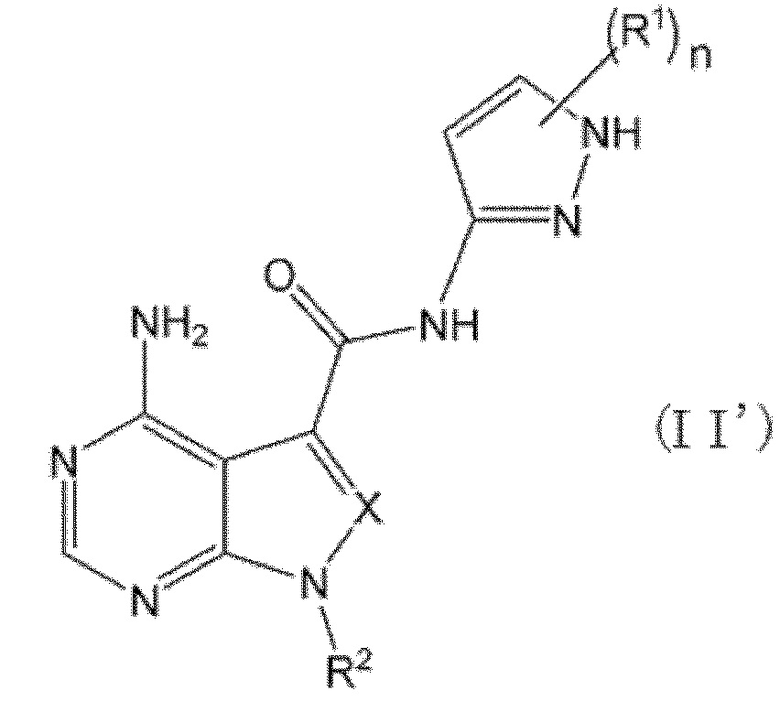
[0241]
где R1 представляет собой
галоген,
циано,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C3-C7 циклоалкил,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы;
R2 представляет собой
замещенный или незамещенный C1-C10 алкил,
замещенный или незамещенный C3-C4 циклоалкил,
замещенный или незамещенный C2-C6 алкенил, или
замещенный или незамещенный C4-C12 связанный мостиковой связью циклоалкил;
X представляет собой
N или
CR3, где R3 представляет собой
водород,
галоген,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C2-C6 алкинил или
замещенный или незамещенный C1-C6 алкокси; и
n представляет собой целое число, имеющее значение 1-3,
при этом, когда n имеет значение 2 или 3, R1 могут быть одинаковыми или отличными друг от друга.
[0242]
В настоящем изобретении соединение, представленное формулой (II') выше, также просто указано как Соединение (II').
[0243]
[23] В формуле (II')
R1 более предпочтительно представляет собой
галоген;
циано;
C1-C6 алкил, который может быть замещен галогеном или C1-C4 алкокси;
C3-C7 циклоалкил;
фенил; или
C3-C6 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы;
R2 более предпочтительно представляет собой
линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом кислорода или один атом серы;
C3-C4 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, который может быть замещен C1-C4 алкилом;
X более предпочтительно представляет собой
N или
CR3, где R3 представляет собой
водород;
галоген;
C1-C6 алкил;
C2-C4 алкинил, который может быть замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C10 моноциклическими или полициклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C6 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; или
C1-C4 алкокси, который может быть замещен одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; и
n, более предпочтительно представляет собой 1 или 2,
при этом, когда n имеет значение 2, R1 могут быть одинаковыми или отличными друг от друга.
[0244]
[24] В формуле (II')
R1 более предпочтительно представляет собой
галоген;
циано;
C1-C6 алкил, который может быть замещен галогеном;
C3-C7 циклоалкил;
фенил; или
C3-C6 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы;
R2 более предпочтительно представляет собой
линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом кислорода или один атом серы;
C3-C4 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил; и
X более предпочтительно представляет собой
N или
CR3, где R3 представляет собой
водород;
галоген;
C1-C4 алкил,
C2-C4 алкинил, который может быть замещен
C1-C6 алкилом, который может быть замещен гидрокси;
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C10 моноциклическими или полициклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C6 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; или
C1-C4 алкокси; и
n более предпочтительно представляет собой 1 или 2,
при этом, когда n имеет значение 2, R1 могут быть одинаковыми или отличными друг от друга.
[0245]
[25] В формуле (II')
R1 более предпочтительно представляет собой
галоген,
циано или
C1-C4 алкил, который может быть замещен галогеном;
R2 более предпочтительно представляет собой
линейный C1-C4 алкил, который замещен C3-C7 циклоалкилом;
разветвленный C3-C6 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом серы или C1-C4 алкокси;
C3-C4 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, выбранный из бицикло[1.1.1]пентан-1-ила и бицикло[2.2.1]гептан-2-ила;
X более предпочтительно представляет собой
N или
CR3, где R3 представляет собой
водород; или
C2-C4 алкинил, который замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C4 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; и
n более предпочтительно представляет собой целое число, имеющее значение от 1.
[0246]
Предпочтительным в другом варианте осуществления настоящего изобретения является
[26] соединение, представленное формулой (IX') ниже, или его соль:
[0247]
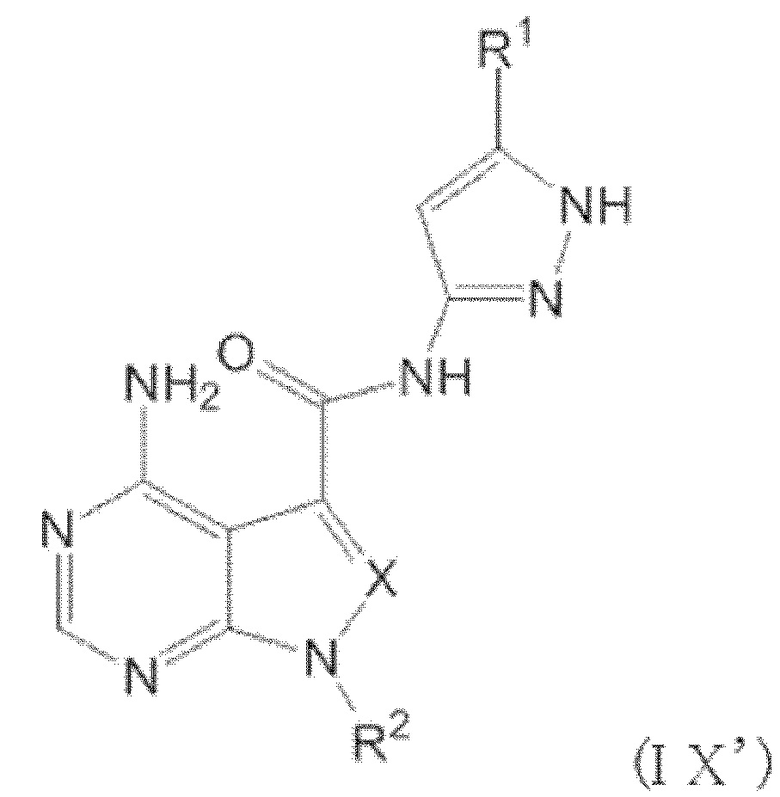
[0248]
где R1 представляет собой
галоген;
циано;
C1-C6 алкил, который может быть замещен галогеном;
C3-C7 циклоалкил;
фенил; или
C3-C6 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы;
R2 представляет собой
линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом кислорода или один атом серы;
C3-C4 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил; и
X представляет собой
N или
CR3, где R3 представляет собой
водород;
галоген;
C1-C4 алкил;
C2-C4 алкинил, который может быть замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C10 моноциклическими или полициклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C6 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; или
C1-C4 алкокси.
[0249]
В настоящем изобретении соединение, представленное формулой (IX') выше, также просто указано как Соединение (IX').
[0250]
[27] В формуле (IX')
R1 более предпочтительно представляет собой
галоген,
циано или
C1-C4 алкил, который может быть замещен галогеном;
R2 более предпочтительно представляет собой
линейный C1-C4 алкил, который замещен C3-C7 циклоалкилом;
разветвленный C3-C6 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом серы, или C1-C4 алкокси;
C3-C4 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, выбранный из бицикло[1.1.1]пентан-1-ила и бицикло[2.2.1]гептан-2-ила; и
X более предпочтительно представляет собой
N или
CR3, где R3 представляет собой
водород; или
C2-C4 алкинил, который замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C4 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы.
[0251]
[28] В формуле (IX')
R1 более предпочтительно представляет собой
бром,
циано или
C1-C4 алкил, который может быть замещен фтором;
R2 более предпочтительно представляет собой
линейный C1-C4 алкил, который замещен C3-C7 циклоалкилом;
разветвленный C3-C6 алкил, который может быть замещен фтором, C3-C7 циклоалкилом, одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, содержащими один атом серы, или C1-C4 алкокси;
C3-C4 циклоалкил, который может быть замещен фтором, C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен фтором; или
C4-C12 связанный мостиковой связью циклоалкил, выбранный из бицикло[1.1.1]пентан-1-ила и бицикло[2.2.1]гептан-2-ила; и
X более предпочтительно представляет собой
N или
CR3, где R3 представляет собой
водород; или
C2-C4 алкинил, который замещен
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C7 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, которые могут быть замещены C1-C4 алкилом и содержат 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы.
[0252]
Кроме того, в другом варианте осуществления настоящего изобретения
[29] в формуле (IX')
R1 более предпочтительно представляет собой галоген или C1-C4 алкил;
R2 более предпочтительно представляет собой
разветвленный C3-C6 алкил, который может быть замещен галогеном или C3-C5 циклоалкилом,
C3-C4 циклоалкил, который может быть замещен C1-C4 алкилом, или
бицикло[2.2.1]гептан-2-ил; и
X более предпочтительно представляет собой
N или
CR3, где R3 представляет собой
водород; или
этинил или пропинил, который замещен
C1-C4 алкилом, который может быть замещен гидрокси,
C3-C5 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота и кислорода, или
одной или несколькими C3-C6 моноциклическими ненасыщенными гетероциклическими группами, которые могут быть замещены метилом и содержат 1-3 атома азота.
[0253]
[30] В формуле (IX')
R1 более предпочтительно представляет собой бром или метил;
R2 более предпочтительно представляет собой
разветвленный C3-C6 алкил, который может быть замещен фтором или C3-C5 циклоалкилом, или
C3-C4 циклоалкил, который может быть замещен метилом; и
X более предпочтительно представляет собой
N или
CR3, где R3 представляет собой водород.
[0254]
[31] В формуле (IX')
R1 более предпочтительно представляет собой метил;
R2 более предпочтительно представляет собой
изопропил или трет-бутил, который может быть замещен фтором или циклопропилом, или
циклопропил, который может быть замещен метилом; и
X более предпочтительно представляет собой
N или
CR3, где R3 представляет собой водород.
[0255]
Кроме того,
[32] в формулах (I'), (II') и (IX') настоящего изобретения, когда X представляет собой N,
R1 предпочтительно представляет собой
галоген,
циано,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C3-C7 циклоалкил,
замещенный или незамещенный C6-C14 ароматический углеводород или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; и
R2 предпочтительно представляет собой
замещенный или незамещенный C1-C10 алкил,
замещенный или незамещенный C3-C4 циклоалкил,
замещенный или незамещенный C2-C6 алкенил или
замещенный или незамещенный C4-C12 связанный мостиковой связью циклоалкил.
[0256]
Кроме того,
[33] в формулах (I'), (II') и (IX') настоящего изобретения, когда X представляет собой CR3 (R3 имеет значение, определенное выше),
R1 предпочтительно представляет собой
галоген,
замещенный или незамещенный C1-C6 алкил или
замещенную или незамещенную C3-C10 моноциклическую или полициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы; и
R2 предпочтительно представляет собой
замещенный или незамещенный C1-C10 алкил,
замещенный или незамещенный C3-C4 циклоалкил или
замещенный или незамещенный C4-C12 связанный мостиковой связью циклоалкил.
[0257]
Конкретные примеры соединения по настоящему изобретению включают, но не ограничиваются этим, соединения, полученные в примерах, описанных ниже.
[0258]
Конкретными предпочтительными примерами Соединения (I') являются следующие:
[34]
(11) 4-амино-1-циклобутил-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 11);
(12) 4-амино-N-(5-метил-1H-пиразол-3-ил)-1-((1-метилциклопропил)метил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 12);
(13) 4-амино-N-(5-метил-1H-пиразол-3-ил)-1-(2,2,2-трифторэтил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 13);
(14) 4-амино-N-(5-метил-1H-пиразол-3-ил)-1-(3,3,3-трифторпропил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 14);
(15) 4-амино-1-(втор-бутил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 15);
(16) 4-амино-1-(циклобутилметил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 16);
(17) 4-амино-N-(5-бром-1H-пиразол-3-ил)-1-(циклобутилметил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 17);
(18) 4-амино-1-(циклопропилметил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 18);
(19) 4-амино-1-(циклопентилметил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 19);
(20) 4-амино-N-(5-бром-1H-пиразол-3-ил)-1-(циклопентилметил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 20);
(21) 4-амино-1-изопропил-N-(5-(трифторметил)-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 21);
(22) 4-амино-N-(5-бром-1H-пиразол-3-ил)-1-изопропил-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 22);
(26) 4-амино-1-(3,3-диметилциклобутил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 26);
(27) 4-амино-1-(бицикло[2.2.1]гептан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 27);
(28) 4-амино-1-(бицикло[2.2.1]гептан-2-ил)-N-(5-бром-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 28);
(29) 1-(адамантан-2-ил)-4-амино-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 29);
(30) 4-амино-N-(5-метил-1H-пиразол-3-ил)-1-((2S,3R)-2,6,6-триметилбицикло[3.1.1]гептан-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 30);
(31) 4-амино-1-(3-фторпроп-1-ен-2-ил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 31);
(34) 4-амино-1-(трет-бутил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 34);
(35) 4-амино-N-(5-бром-1H-пиразол-3-ил)-1-(трет-бутил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 35);
(36) 4-амино-1-(трет-бутил)-N-(5-(трифторметил)-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 36);
(37) 4-амино-1-(трет-бутил)-N-(5-(фуран-2-ил)-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 37);
(38) 4-амино-1-(трет-бутил)-N-(5-циано-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 38);
(39) 4-амино-1-(трет-бутил)-N-(5-этил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 39);
(40) 4-амино-1-(трет-бутил)-N-(5-изопропил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 40);
(41) 4-амино-1-(трет-бутил)-N-(5-циклопропил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 41);
(42) 4-амино-1-(трет-бутил)-N-(5-циклобутил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 42);
(45) 4-амино-7-изопропил-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 45);
(46) 4-амино-7-(1-фторпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 46);
(48) 4-амино-7-(трет-бутил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 48);
(49) 4-амино-7-(трет-бутил)-N-(5-(фуран-2-ил)-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 49);
(50) 4-амино-7-(1-фтор-2-метилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 50);
(51) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 51);
(52) 4-амино-7-(2-циклопропилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 52);
(53) 4-амино-7-(1-метокси-2-метилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 53);
(54) 4-амино-7-(1-(фторметил)циклопропил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 54);
(55) 4-амино-7-(1-(дифторметил)циклопропил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 55);
(56) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(2-(тиофен-2-ил)пропан-2-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 56);
(58) 4-амино-7-(бицикло[1.1.1]пентан-1-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 58);
(60) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(2-фенилпропан-2-ил))-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 60);
(61) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(2,3,3-триметилбутан-2-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 61);
(62) 4-амино-7-(2,3-диметилбутан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 62);
(63) 4-амино-N-(5-бром-1H-пиразол-3-ил)-7-(трет-бутил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 63);
(64) 4-амино-7-(трет-бутил)-N-(5-(метоксиметил)-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 64);
(65) 4-амино-N-(5-бром-1H-пиразол-3-ил)-7-изопропил-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 65);
(66) 4-амино-N-(5-бром-1H-пиразол-3-ил)-7-(1-фтор-2-метилпропан-2-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 66);
(67) 4-амино-N-(5-бром-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 67);
(68) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклобутил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 68);
(69) 4-амино-7-циклобутил-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 69);
(70) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(трет-пентил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 70);
(71) 4-амино-7-(бицикло[2.2.1]гептан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 71);
(73) 4-амино-7-(трет-бутил)-6-метил-N-(3-метил-1H-пиразол-5-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 73);
(74) 7-([1,1'-би(циклопропан)]-1-ил)-4-амино-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 74);
(75) 4-амино-6-хлор-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 75);
(76) 4-амино-6-бром-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 76);
(77) 4-амино-6-метокси-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 77);
(78) 4-амино-6-хлор-7-(1-фтор-2-метилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 78);
(79) 4-амино-6-(3-гидрокси-3-метил-1-бутин-1-ил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 79);
(80) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-6-(пиридин-3-илэтинил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 80);
(81) 4-амино-6-((1-гидроксициклопентил)этинил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 81);
(82) 4-амино-6-((1-метил-1H-пиразол-4-ил)этинил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 82);
(83) 4-амино-6-((1-метил-1H-имидазол-5-ил)этинил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 83);
(84) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-6-(3-морфолино-1-пропин-1-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 84);
(85) 4-амино-6-(3-(1-гидроксициклобутил)-1-propyne)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 85);
(86) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-6-((тетрагидро-2H-пиран-4-ил)этинил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 86);
(87) 4-амино-N-(5-метил-1H-пиразол-3-ил)-6-((1-метил-1H-пиразол-3-ил)этинил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 87);
(88) 4-амино-6-(имидазо[1,2-b]пиридазин-3-илэтинил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 88);
(89) 4-амино-6-этокси-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 89); и
(90) (R)-4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-6-((тетрагидрофуран-2-ил)метокси)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 90).
[0259]
Более предпочтительными примерами Соединения (I') являются следующие:
[35]
(27) 4-амино-1-(бицикло[2.2.1]гептан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 27);
(34) 4-амино-1-(трет-бутил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 34);
(45) 4-амино-7-изопропил-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 45);
(48) 4-амино-7-(трет-бутил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 48);
(50) 4-амино-7-(1-фтор-2-метилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 50);
(51) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 51);
(52) 4-амино-7-(2-циклопропилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 52);
(65) 4-амино-N-(5-бром-1H-пиразол-3-ил)-7-изопропил-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 65);
(68) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклобутил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 68);
(71) 4-амино-7-(бицикло[2.2.1]гептан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 71);
(79) 4-амино-6-(3-гидрокси-3-метил-1-бутин-1-ил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 79);
(80) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-6-(пиридин-3-илэтинил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 80);
(81) 4-амино-6-((1-гидроксициклопентил)этинил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 81);
(82) 4-амино-6-((1-метил-1H-пиразол-4-ил)этинил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 82);
(83) 4-амино-6-((1-метил-1H-имидазол-5-ил)этинил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 83);
(84) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-6-(3-морфолино-1-пропин-1-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 84); и
(85) 4-амино-6-(3-(1-гидроксициклобутил)-1-propyne)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 85).
Еще более предпочтительными примерами Соединения (I') являются следующие:
[36]
(34) 4-амино-1-(трет-бутил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид (соединение примера 34);
(48) 4-амино-7-(трет-бутил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 48);
(50) 4-амино-7-(1-фтор-2-метилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 50);
(51) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 51); и
(52) 4-амино-7-(2-циклопропилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид (соединение примера 52).
[0260]
Кроме того, настоящее изобретение обеспечивает ингибитор RET, включающий соединение или его соль в соответствии с любым из пунктов [19] - [36] в качестве активного ингредиента.
[0261]
Кроме того, настоящее изобретение обеспечивает фармацевтическую композицию, включающую соединение или его соль в соответствии с любым из пунктов [19] - [36].
[0262]
Кроме того, настоящее изобретение обеспечивает фармацевтическую композицию, включающую соединение или его соль в соответствии с любым из пунктов [19] - [36], при этом фармацевтическая композиция предотвращает или лечит заболевание, которое можно лечить путем ингибирования RET.
[0263]
Кроме того, настоящее изобретение обеспечивает противоопухолевое средство, включающее соединение или его соль в соответствии с любым из пунктов [19] - [36].
[0264]
Кроме того, настоящее изобретение обеспечивает противоопухолевое средство, включающее соединение или его соль в соответствии с любым из пунктов [19] - [36], при этом противоопухолевое средство лечит злокачественную опухоль с повышенной активацией RET.
[0265]
Кроме того, настоящее изобретение обеспечивает соединение или его соль в соответствии с любым из пунктов [19] - [36] для применения в профилактике или лечении злокачественной опухоли.
[0266]
Кроме того, настоящее изобретение обеспечивает соединение или его соль в соответствии с любым из пунктов [19] - [36] для применения в профилактике или лечении злокачественной опухоли, где злокачественная опухоль представляет собой злокачественную опухоль с повышенной активацией RET.
[0267]
Кроме того, настоящее изобретение обеспечивает применение соединения или его соли в соответствии с любым из пунктов [19] - [36] для получения противоопухолевого средства.
[0268]
Кроме того, настоящее изобретение обеспечивает применение соединения или его соли в соответствии с любым из пунктов [19] - [36] для получения противоопухолевого средства, при этом противоопухолевое средство представляет собой противоопухолевое средство для лечения злокачественной опухоли с повышенной активацией RET.
[0269]
Кроме того, настоящее изобретение обеспечивает применение соединения или его соли в соответствии с любым из пунктов [19] - [36] для получения ингибитора RET.
[0270]
Кроме того, настоящее изобретение обеспечивает способ для профилактики или лечения злокачественной опухоли, включающий введение млекопитающему соединения или его соли в соответствии с любым из пунктов [19] - [36].
[0271]
Кроме того, настоящее изобретение обеспечивает способ для профилактики или лечения злокачественной опухоли, включающий введение млекопитающему соединения или его соли в соответствии с любым из пунктов [19] - [36], где злокачественная опухоль представляет собой злокачественную опухоль с повышенной активацией RET.
[0272]
Кроме того, настоящее изобретение обеспечивает способ ингибирования RET, включающий введение млекопитающему соединения или его соли в соответствии с любым из пунктов [19] - [36].
[0273]
Далее будет описан способ получения соединения по настоящему изобретению.
[0274]
Соединение (I) по настоящему изобретению можно получить, например, способами получения, представленными ниже, или способами, описанными в примерах. Соединение (I') по настоящему изобретению также можно получить таким же способом, как способ, описанный для получения Соединения (I). Однако способ для получения Соединений (I) и (I') не ограничивается этими примерами реакций.
[0275]
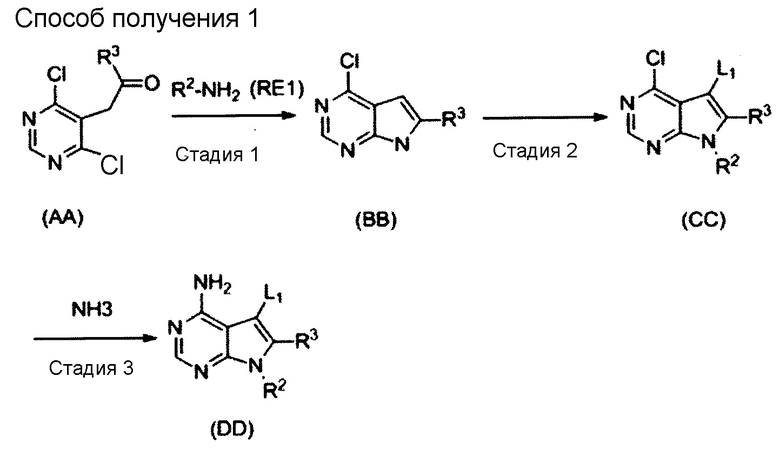
[0276]
где L1 представляет собой удаляемую группу, и R2 и R3 имеют значения, определенные выше.
[0277]
Стадия 1
На этой стадии осуществляют синтез соединения, представленного формулой (BB), из соединения, представленного формулой (AA).
[0278]
Стадию 1 осуществляют с использованием амино-соединения, представленного формулой (RE1), или его соли в количестве 0,5-5 моль, предпочтительно 0,9-1,5 моль, на моль соединения, представленного формулой (AA).
[0279]
Примеры оснований включают неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, гидроксид цезия, гидрид натрия и гидрид калия; и органические амины, такие как триметиламин, триэтиламин, трипропиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N,N-диметиламино)пиридин, лутидин и коллидин. Количество используемого основания составляет 1-100 моль, предпочтительно 1-10 моль, на моль соединения, представленного формулой (AA). Амино-соединение можно получить от коммерческих поставщиков или можно получить известным способом. Кроме того, реакцию можно промотировать путем добавления кислоты в процессе реакции, если необходимо. Примеры кислот включают муравьиную кислоту, уксусную кислоту, хлористоводородную кислоту, фосфорную кислоту и т.п. Используемое количество кислоты составляет 1-100 моль, предпочтительно 1-5 моль, на моль соединения, представленного формулой (AA).
[0280]
В качестве растворителя, используемого в реакции, можно использовать любой растворитель, который не оказывает негативного влияния на реакцию. Примеры растворителя включают спирты (например, метанол и этанол), углеводороды (например, бензол, толуол и ксилол), галогенированные углеводороды (например, метиленхлорид, хлороформ и 1,2-дихлорэтан), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан и тетрагидрофуран), апротонные полярные растворители (например, N,N-диметилформамид, диметилсульфоксид и гексаметилфосфорамид), воду и их смеси.
[0281]
Время реакции варьируется в пределах 0,1-100 часов, предпочтительно 0,5-48 часов. Температура реакции варьируется в пределах 0-120°C, предпочтительно 50-120°C.
[0282]
Полученное таким образом соединение, представленное формулой (BB), можно подвергнуть следующей стадии после, или без, выделения и очистки известными способами разделения и очистки, такими как концентрирование, концентрирование в вакууме, кристаллизация, экстракция растворителем, повторное осаждение и хроматография.
[0283]
Стадия 2
На этой стадии осуществляют синтез соединения, представленного формулой (CC), из соединения, представленного формулой (BB).
[0284]
Стадию 2 осуществляют с использованием галогенирующего реагента в количестве 1-10 моль, предпочтительно 1-5 моль, на моль соединения, представленного формулой (BB).
[0285]
Примеры галогенирующих реагентов включают N-иодсукцинимид, N-бромсукцинимид, N-хлорсукцинимид, иод, бром и т.п. Используемый в реакции растворитель конкретно не ограничивается, и можно использовать любой растворитель, который не оказывает негативного влияния на реакцию. Примеры растворителя включают толуол, бензол, тетрагидрофуран, 1,4-диоксан, диметилформамид, диметилацетамид, N-метилпирролидинон, диметилсульфоксид и их смеси.
[0286]
Примеры удаляемой группы, представленной как L1, включают хлор, бром, иод и т.п.
[0287]
Температура реакции, как правило, варьируется в пределах от -78 до 200°C, предпочтительно 0-50°C. Время реакции, как правило, варьируется в пределах от 5 минут до 6 дней, предпочтительно от 10 минут до 3 дней.
[0288]
Полученное таким образом соединение, представленное формулой (CC), можно подвергнуть следующей стадии после, или без, выделения и очистки известными способами разделения и очистки, такими как концентрирование, концентрирование в вакууме, кристаллизация, экстракция растворителем, повторное осаждение и хроматография.
[0289]
Стадия 3
На этой стадии получают соединение, представленное формулой (DD), путем взаимодействия соединения, представленного формулой (CC), с аммиаком или его солью. Количество аммиака или его соли, используемых на этой стадии, как правило, составляет от эквимолярного до избыточного молярного количества на моль соединения, представленного формулой (CC).
[0290]
Используемый в реакции растворитель конкретно не ограничивается, и можно использовать любой растворитель, который не оказывает негативного влияния на реакцию. Примеры растворителя включают воду, метанол, этанол, изопропанол, трет-бутиловый спирт, тетрагидрофуран, 1,4-диоксан, диметилформамид, N-метилпирролидон, 1,2-диметоксиэтан, диметилсульфоксид и их смеси.
[0291]
Температура реакции, как правило, варьируется в пределах 0-200°C, предпочтительно от комнатной температуры до 150°C. Время реакции, как правило, варьируется в пределах от 5 минут до 7 дней, предпочтительно от 30 минут до 48 часов.
[0292]
Полученное таким образом соединение, представленное формулой (DD), можно подвергнуть следующей стадии после, или без, выделения и очистки известными способами разделения и очистки, такими как концентрирование, концентрирование в вакууме, кристаллизация, экстракция растворителем, повторное осаждение и хроматография.
[0293]
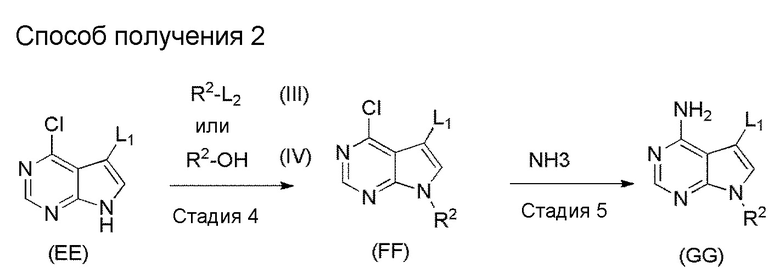
[0294]
где L1 и L2 каждый представляет собой удаляемую группу, и R2 имеет значение, определенное выше.
[0295]
Стадия 4
На этой стадии получают соединение, представленное формулой (FF), с использованием соединения, представленного формулой (EE), и соединения, представленного формулой (III) или (IV).
[0296]
Когда соединение, представленное формулой (III), используют в качестве алкилирующего реагента, соединение, представленное формулой (FF), можно получить в присутствии основания. В формуле (III) L2 представляет собой удаляемую группу, такую как хлор, бром, иод, эфир метансульфоновой кислоты или эфир п-толуолсульфоновой кислоты; и ее можно получить от коммерческих поставщиков или можно получить известным способом. Количество используемого соединения, представленного формулой (III), составляет 1-10 моль, предпочтительно 1-5 моль, на моль соединения, представленного формулой (EE).
[0297]
Примеры оснований включают неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, гидроксид цезия, гидрид натрия и гидрид калия; и органические амины, такие как триметиламин, триэтиламин, трипропиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N,N-диметиламино)пиридин, лутидин и коллидин. Количество используемого основания составляет 1-100 моль, предпочтительно 2-10 моль, на моль соединения, представленного формулой (EE).
[0298]
Примеры растворителя включают N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, тетрагидрофуран, 1,4-диоксан, N-метилпирролидин-2-он, ацетонитрил и т.п. Эти растворители можно использовать отдельно или в смеси.
[0299]
Время реакции варьируется в пределах 0,1-100 часов, предпочтительно 0,5-24 часов. Температура реакции варьируется в пределах от 0°C до температуры кипения растворителя, предпочтительно от 0 до 100°C.
[0300]
Когда соединение формулы (IV) используют в качестве алкилирующего реагента, соединение, представленное формулой (FF), можно получить через реакцию Мицунобу. Эту стадию, как правило, можно осуществить известным способом, например, способом, раскрытым в Chemical Reviews, Vol. 109, p. 2551 (2009). Например, эту стадию можно осуществить в присутствии реагента Мицунобу и фосфинового реагента в растворителе, который не оказывает негативного влияния на реакцию. Эту стадию, как правило, осуществляют с использованием соединения, представленного формулой (IV), в количестве 1-10 моль, предпочтительно 1-5 моль, на моль соединения, представленного формулой (EE).
[0301]
Примеры реагентов Мицунобу включают диэтилазодикарбоксилат, диизопропилазодикарбоксилат и т.п. Количество используемого реагента Мицунобу составляет 1-10 моль, предпочтительно 1-5 моль, на моль соединения, представленного формулой (EE).
[0302]
Примеры фосфиновых реагентов включают трифенилфосфин и трибутилфосфин. Количество используемого фосфинового реагента составляет 1-10 моль, предпочтительно 1-5 моль, на моль соединения, представленного формулой (EE).
[0303]
Используемый в реакции растворитель конкретно не ограничивается, и можно использовать любой растворитель, который не оказывает негативного влияния на реакцию. Примеры растворителя включают толуол, бензол, тетрагидрофуран, 1,4-диоксан, диметилформамид, диметилацетамид, N-метилпирролидинон, диметилсульфоксид и их смеси.
[0304]
Температура реакции, как правило, варьируется в пределах от -78 до 200°C, предпочтительно от 0 до 50°C. Время реакции, как правило, варьируется в пределах от 5 минут до 3 дней, предпочтительно от 10 минут до 10 часов.
[0305]
Полученное таким образом соединение, представленное формулой (FF), можно подвергнуть следующей стадии после, или без, выделения и очистки известными способами разделения и очистки, такими как концентрирование, концентрирование в вакууме, кристаллизация, экстракция растворителем, повторное осаждение и хроматография.
[0306]
Стадия 5
На этой стадии получают соединение, представленное формулой (GG), путем взаимодействия соединения, представленного формулой (FF), с аммиаком или его солью. Используемое на этой стадии количество аммиака или его соли, как правило, составляет от эквимолярного до избыточного молярного количества на моль соединения, представленного формулой (FF).
[0307]
Используемый в реакции растворитель конкретно не ограничивается, и можно использовать любой растворитель, который не оказывает негативного влияния на реакцию. Примеры растворителя включают воду, метанол, этанол, изопропанол, трет-бутиловый спирт, тетрагидрофуран, 1,4-диоксан, диметилформамид, 1,2-диметоксиэтан, N-метилпирролидон, диметилсульфоксид и их смеси.
[0308]
Температура реакции, как правило, варьируется в пределах 0-200°C, предпочтительно от комнатной температуры до 150°C. Время реакции, как правило, варьируется в пределах от 5 минут до 7 дней, предпочтительно от 30 минут до 24 часов.
[0309]
Полученное таким образом соединение, представленное формулой (GG), можно подвергнуть следующей стадии после, или без, выделения и очистки известными способами разделения и очистки, такими как концентрирование, концентрирование в вакууме, кристаллизация, экстракция растворителем, повторное осаждение и хроматография.
[0310]
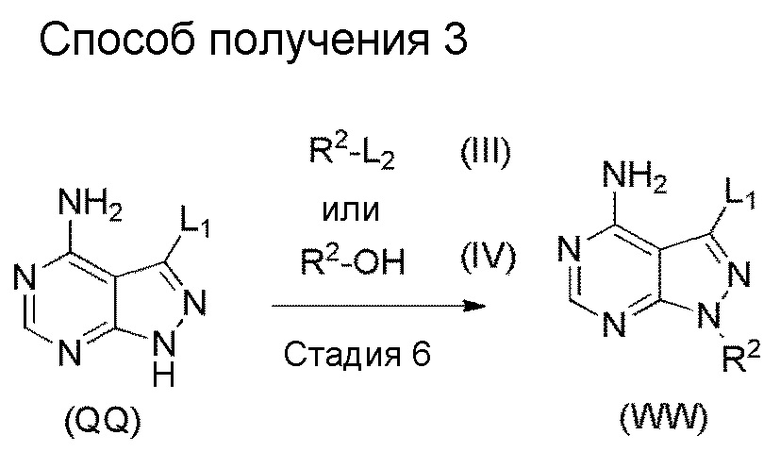
[0311]
где L1 и L2 каждый представляет собой удаляемую группу, и R2 имеет значение, определенное выше.
[0312]
Стадия 6
На этой стадии получают соединение, представленное формулой (WW), с использованием соединения, представленного формулой (QQ), и соединения, представленного формулой (III) или (IV).
[0313]
Когда соединение, представленное формулой (III), используют в качестве алкилирующего реагента, соединение, представленное формулой (WW), можно получить в присутствии основания. В формуле (III) L2 представляет собой удаляемую группу, такую как хлор, бром, иод, эфир метансульфоновой кислоты или эфир п-толуолсульфоновой кислоты; и ее можно получить от коммерческих поставщиков или можно получить известным способом. Используемое количество соединения, представленного формулой (III) составляет 1-10 моль, предпочтительно 1-5 моль, на моль соединения, представленного формулой (QQ).
[0314]
Примеры оснований включают неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, гидроксид цезия, гидрид натрия и гидрид калия; и органические амины, такие как триметиламин, триэтиламин, трипропиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N,N-диметиламино)пиридин, лутидин и коллидин. Количество используемого основания составляет 1-100 моль, предпочтительно 2-10 моль, на моль соединения, представленного формулой (QQ). Примеры растворителя включают N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, тетрагидрофуран, 1,4-диоксан, N-метилпирролидин-2-он, ацетонитрил и т.п. Эти растворители можно использовать отдельно или в смеси.
[0315]
Время реакции варьируется в пределах 0,1-100 часов, предпочтительно 0,5-24 часов. Температура реакции варьируется в пределах 0°C до температуры кипения растворителя, предпочтительно от 0 до 100°C.
[0316]
Когда соединение формулы (IV) используют в качестве алкилирующего реагента, соединение, представленное формулой (WW), можно получить через реакцию Мицунобу. Эту стадию, как правило, можно осуществить известным способом, например, способом, раскрытым в Chemical Reviews, Vol. 109, p. 2551 (2009). Например, эту стадию можно осуществить в присутствии реагента Мицунобу и фосфинового реагента в растворителе, который не оказывает негативного влияния на реакцию. Эту стадию, как правило, осуществляют с использованием соединения, представленного формулой (IV), в количестве 1-10 моль, предпочтительно 1-5 моль, на моль соединения, представленного формулой (QQ).
[0317]
Примеры реагентов Мицунобу включают диэтилазодикарбоксилат, диизопропилазодикарбоксилат и т.п. Количество используемого реагента Мицунобу составляет 1-10 моль, предпочтительно 1-5 моль, на моль соединения, представленного формулой (QQ). Примеры фосфиновых реагентов включают трифенилфосфин и трибутилфосфин. Количество используемого фосфинового реагента составляет 1-10 моль, предпочтительно 1-5 моль, на моль соединения, представленного формулой (QQ).
[0318]
Используемый в реакции растворитель конкретно не ограничивается, и можно использовать любой растворитель, который не оказывает негативного влияния на реакцию. Примеры растворителя включают толуол, бензол, тетрагидрофуран, 1,4-диоксан, диметилформамид, диметилацетамид, N-метилпирролидинон, диметилсульфоксид и их смеси.
[0319]
Температура реакции, как правило, варьируется в пределах от -78 до 200°C, предпочтительно от 0 до 50°C. Время реакции, как правило, варьируется в пределах от 5 минут до 3 дней, предпочтительно от 10 минут до 10 часов.
[0320]
Полученное таким образом соединение, представленное формулой (WW), можно подвергнуть следующей стадии после, или без, выделения и очистки известными способами разделения и очистки, такими как концентрирование, концентрирование в вакууме, кристаллизация, экстракция растворителем, повторное осаждение и хроматография.
[0321]
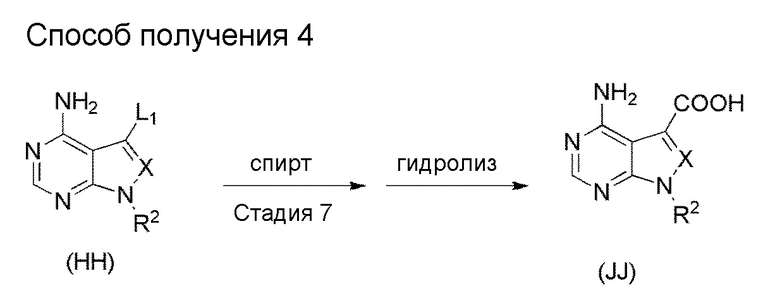
[0322]
где L1 представляет собой удаляемую группу, и R2 и X имеют значения, определенные выше.
[0323]
Стадия 7
На этой стадии получают соединение, представленное формулой (JJ), путем взаимодействия соединения, представленного формулой (HH), в атмосфере оксида углерода, в присутствии спирта, с использованием, например, переходного металла и, необязательно, основания, в растворителе, который не оказывает негативного влияния на реакцию.
[0324]
Соединение, представленное формулой (HH), можно получить путем осуществления стадий 1-3, стадий 4 и 5 или стадии 6 способа получения, раскрытого в настоящей заявке.
[0325]
На этой стадии давление оксида углерода составляет, как правило, от 1 атм до 10 атм, предпочтительно от 1 атм до 7 атм.
[0326]
Количество используемого спиртового соединения составляет от 1 до избыточного молярного количества, предпочтительно 1-200 моль, на моль соединения, представленного формулой (HH). Примеры спиртовых соединений включают метанол, этанол, пропанол, изопропиловый спирт, диэтиламиноэтанол, изобутанол, 4-(2-гидроксиэтил)морфолин, 3-морфолинопропанол, диэтиламинопропанол и т.п.
[0327]
Примеры катализаторов на основе переходных металлов, используемых на этой стадии, включают палладиевые катализаторы (например, ацетат палладия, трис(бензилиденацетон)дипалладий, бис(трифенилфосфин)палладий(II) дихлорид, комплекс 1,1-бис(дифенилфосфино)ферроцен-палладий(II) дихлорид-дихлорметан, углерод палладий на углероде и т.д.). При необходимости, добавляют лиганд (например, трифенилфосфин, xantphos, три-трет-бутилфосфин и т.д.). Количество катализатора на основе переходного металла варьируется в зависимости от типа катализатора. Например, количество используемого катализатора на основе переходного металла составляет, как правило, 0,0001-1 моль, предпочтительно 0,001-0,5 моль, на моль соединения, представленного формулой (HH). Количество используемого лиганда составляет, как правило, 0,000 1-4 моль, предпочтительно 0,01-2 моль, на моль соединения, представленного формулой (HH).
[0328]
Кроме того, можно добавить основание в процессе реакции, при необходимости. Примеры оснований включают органические основания, такие как триэтиламин, диизопропилэтиламин, пиридин, лутидин, коллидин, 4-диметиламинопиридин, N-метилморфолин, трет-бутират калия, трет-бутират натрия, метоксид натрия, этоксид натрия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия и бутиллитий; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия и гидрид натрия. Количество используемого основания составляет, как правило, 0,1-50 моль, предпочтительно 1-20 моль, на моль соединения, представленного формулой (HH).
[0329]
Используемый в реакции растворитель конкретно не ограничивается, и можно использовать любой растворитель, который не оказывает негативного влияния на реакцию. Примеры растворителя включают углеводороды (например, бензол, толуол и ксилол), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан, тетрагидрофуран и 1,4-диоксан), спирты (например, метанол и этанол), апротонные полярные растворители (например, диметилформамид, диметилацетамид, N-метилпирролидинон, диметилсульфоксид и гексаметилфосфорамид), воду и их смеси. Время реакции варьируется в пределах 0,1-100 часов, предпочтительно 0,5-24 часов. Температура реакции составляет от 0°C до 200°C, предпочтительно от 0 до 150°C.
[0330]
Когда после этой реакции получают смесь сложноэфирной формы, соответствующей используемому спирту, и карбоновокислотного соединения (JJ), можно осуществить реакцию гидролиза для преобразования этой смеси в соединение, представленное формулой (JJ). Гидролиз осуществляют с использованием основания. Примеры оснований включают органические основания, такие как диэтиламин, диизопропиламин, трет-бутират калия, трет-бутират натрия, метоксид натрия, этоксид натрия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия и бутиллитий; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия, гидроксид калия, гидроксид лития и гидроксид кальция.
[0331]
Используемый в реакции растворитель конкретно не ограничивается, и можно использовать любой растворитель, который не оказывает негативного влияния на реакцию. Примеры растворителя включают углеводороды (например, бензол, толуол и ксилол), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан, тетрагидрофуран и 1,4-диоксан), спирты (например, метанол и этанол), апротонные полярные растворители (например, диметилформамид, диметилацетамид, N-метилпирролидинон, диметилсульфоксид и гексаметилфосфорамид), воду и их смеси.
[0332]
Время реакции варьируется в пределах 0,1-100 часов, предпочтительно 0,5-24 часов. Температура реакции варьируется в пределах от 0°C до температуры кипения растворителя, предпочтительно от 0 до 150°C.
[0333]
Полученное таким образом соединение, представленное формулой (JJ), можно подвергнуть следующей стадии после, или без, выделения и очистки известными способами разделения и очистки, такими как концентрирование, концентрирование в вакууме, кристаллизация, экстракция растворителем, повторное осаждение и хроматография.
[0334]
Способ получения 5
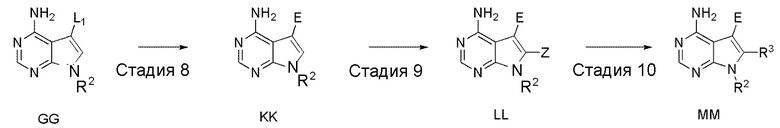
[0335]
где L1 представляет собой удаляемую группу; E представляет собой сложный эфир, циано или карбоновокислотный эквивалент, такой как карбоксамид; Z представляет собой галоген; и R2 и R3 имеют значения, определенные выше.
[0336]
Стадия 8
На этой стадии получают сложноэфирное производное или циано-производное, представленное формулой (KK), путем взаимодействия соединения, представленного формулой (GG), в атмосфере оксида углерода, в присутствии спирта или с использованием циано соединения, такого как цианид меди или цианид цинка, с использованием, например, катализатора на основе переходного металла и, необязательно, основания, в растворителе, который не оказывает негативного влияния на реакцию.
[0337]
Соединение, представленное формулой (GG), можно получить путем осуществления стадий 1-3, стадий 4 и 5 способа получения, раскрытого в настоящей заявке.
[0338]
При получении сложноэфирного производного давление оксида углерода, как правило, составляет от 1 атм до 10 атм, предпочтительно от 1 атм до 7 атм. Количество спиртового соединения, используемого в качестве реагента, составляет 1 - избыточное молярное количество, предпочтительно 1-200 моль, на моль соединения, представленного формулой (GG). Примеры спиртовых соединений включают метанол, этанол, пропанол, изопропиловый спирт, диэтиламиноэтанол, изобутанол, 4-(2-гидроксиэтил)морфолин, 3-морфолинопропанол, диэтиламинопропанол и т.п.
[0339]
Что касается циано-производного, примеры циано соединения, используемого в качестве реагента, включают цианид меди, цианид цинка, три-н-бутилцианоолово и т.п. Количество циано соединения, используемого в качестве агента, как правило, составляет 1-100 моль, предпочтительно 1-10 моль, на моль соединения, представленного формулой (GG).
[0340]
Примеры катализаторов на основе переходных металлов, используемых на этой стадии, как для получения сложноэфирного производного, так и для получения циано-производного, включают палладиевые катализаторы (например, ацетат палладия, тетракис трифенилфосфинпалладий, трис(бензилиденацетон)дипалладий, бис(трифенилфосфин)палладий(II) дихлорид, комплекс 1,1-бис(дифенилфосфино)ферроцен-палладий(II) дихлорид-дихлорметан, палладий на углероде и т.д.). При необходимости, добавляюлиганд (например, трифенилфосфин, xantphos, три-трет-бутилфосфин и т.д.). Количество катализатора на основе переходного металла варьируется в зависимости от типа катализатора. Например, количество используемого катализатора на основе переходного металла составляет, как правило, 0,0001-1 моль, предпочтительно 0,001-0,5 моль, на моль соединения, представленного формулой (GG). Количество используемого лиганда составляет, как правило, 0,000 1-4 моль, предпочтительно 0,01-2 моль, на моль соединения, представленного формулой (GG).
[0341]
Кроме того, можно добавить основание в процессе реакции при необходимости. Примеры оснований включают органические основания, такие как триэтиламин, диизопропилэтиламин, пиридин, лутидин, коллидин, 4-диметиламинопиридин, N-метилморфолин, трет-бутират калия, трет-бутират натрия, метоксид натрия, этоксид натрия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия и бутиллитий; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия и гидрид натрия. Количество используемого основания составляет, как правило, 0,1-50 моль, предпочтительно 1-20 моль, на моль соединения, представленного формулой (GG).
[0342]
Используемый в реакции растворитель конкретно не ограничивается, и можно использовать любой растворитель, который не оказывает негативного влияния на реакцию. Примеры растворителя включают углеводороды (например, бензол, толуол и ксилол), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан, тетрагидрофуран и 1,4-диоксан), спирты (например, метанол и этанол), апротонные полярные растворители (например, диметилформамид, диметилацетамид, N-метилпирролидинон, диметилсульфоксид и гексаметилфосфорамид), воду и их смеси. Время реакции варьируется в пределах 0,1-100 часов, предпочтительно 0,5-24 часов. Температура реакции составляет от 0°C до 200°C, предпочтительно от 0 до 150°C. Полученное таким образом соединение, представленное формулой (KK), можно подвергнуть следующей стадии после, или без, выделения и очистки известными способами разделения и очистки, такими как концентрирование, концентрирование в вакууме, кристаллизация, экстракция растворителем, повторное осаждение и хроматография.
[0343]
Стадия 9
На этой стадии получают галогенированное соединение (LL) путем обработки соединения, представленного формулой (KK), галогенирующим агентом.
[0344]
Эту стадию, как правило, осуществляют с использованием галогенирующего реагента в количестве 1-10 моль, предпочтительно 1-5 моль, на моль соединения, представленного формулой (KK).
[0345]
Примеры галогенирующих реагентов включают 1-хлорметил-4-фтор-1,4-диазониабицикло[2.2.2]октан бис(тетрафторборат), N-иодсукцинимид, N-бромсукцинимид, N-хлорсукцинимид, иод, бром и т.п. Используемый в реакции растворитель конкретно не ограничивается, и можно использовать любой растворитель, который не оказывает негативного влияния на реакцию. Примеры растворителя включают дихлорметан, хлороформ, толуол, бензол, тетрагидрофуран, 1,4-диоксан, диметилформамид, диметилацетамид, N-метилпирролидинон, диметилсульфоксид и их смеси.
[0346]
Примеры галогена, представленного как Z, включают фтор, хлор, бром, иод и т.п.
[0347]
Температура реакции, как правило, варьируется в пределах от -78 до 200°C, предпочтительно от 0 до 50°C. Время реакции, как правило, варьируется в пределах от 5 минут до 6 дней, предпочтительно от 10 минут до 3 дней.
[0348]
Полученное таким образом соединение, представленное формулой (LL), можно подвергнуть следующей стадии после, или без, выделения и очистки известными способами разделения и очистки, такими как концентрирование, концентрирование в вакууме, кристаллизация, экстракция растворителем, повторное осаждение и хроматография.
[0349]
Кроме того, E можно преобразовать в другой E, как требуется, известным способом, таким как гидролиз или сольволиз. Например, циано можно преобразовать в карбоксамид путем гидролиза, и циано или карбоксамид можно преобразовать в сложный эфир путем сольволиза.
[0350]
Стадия 10
На этой стадии получают соединение, представленное формулой (MM), подвергая соединение, представленн формулой (LL), реакции сочетания с боратным производным, производным борной кислоты, производным олова, ацетиленовым производным или алкоксидным производным, которое содержит R3, с использованием, например, переходного металла и, необязательно, основания, в растворителе, который не оказывает негативного влияния на реакцию.
[0351]
Количество используемого боратного производного, производного борной кислоты, производного олова, ацетиленового производного или алкоксидного производного, которое содержит R3, составляет 1-100 моль, предпочтительно 1-20 моль. Примеры катализаторов на основе переходных металлов, используемых на этой стадии, включают палладиевые катализаторы (например, ацетат палладия, тетракис трифенилфосфинпалладий, трис(бензилиденацетон)дипалладий, бис(трифенилфосфин)палладий(II) дихлорид, комплекс 1,1-бис(дифенилфосфино)ферроцен-палладий(II) дихлорид-дихлорметан и т.д.). При необходимости, добавляют лиганд (например, трифенилфосфин, xantphos, 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил, 2-дициклогексилфосфино-2',6'-диметоксибифенил, трициклогексилфосфин, три-трет-бутилфосфин и т.д.). Примеры медных катализаторов включают иодид меди, бромид меди и хлорид меди. Количество катализатора на основе переходного металла варьируется в зависимости от типа катализатора. Например, количество используемого катализатора на основе переходного металла составляет, как правило, 0,0001-1 моль, предпочтительно 0,001-0,5 моль, на моль соединения, представленного формулой (LL). Катализаторы на основе переходных металлов можно использовать в комбинации, при необходимости. Количество используемого лиганда составляет, как правило, 0,000 1-4 моль, предпочтительно 0,01-2 моль, на моль соединения, представленного формулой (LL).
[0352]
Кроме того, при необходимости можно добавить основание в процессе реакции. Примеры оснований включают органические основания, такие как триэтиламин, диизопропилэтиламин, пиридин, лутидин, коллидин, 4-диметиламинопиридин, N-метилморфолин, трет-бутират калия, трет-бутират натрия, метоксид натрия, этоксид натрия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия и бутиллитий; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, фосфат калия, гидроксид натрия и гидрид натрия. Количество используемого основания составляет, как правило, 0,1-50 моль, предпочтительно 1-20 моль, на моль соединения, представленного формулой (LL).
[0353]
Используемый в реакции растворитель конкретно не ограничивается, и можно использовать любой растворитель, который не оказывает негативного влияния на реакцию. Примеры растворителя включают углеводороды (например, бензол, толуол и ксилол), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан, тетрагидрофуран и 1,4-диоксан), спирты (например, метанол, этанол и этиленгликоль), апротонные полярные растворители (например, диметилформамид, диметилацетамид, N-метилпирролидинон, диметилсульфоксид и гексаметилфосфорамид), воду и их смеси.
[0354]
Время реакции варьируется в пределах 0,1-100 часов, предпочтительно 0,5-24 часов. Температура реакции варьируется в пределах от 0°C до температуры кипения растворителя, предпочтительно от 0 до 160°C. Кроме того, реакцию можно осуществить, осуществляя при этом подходящую защиту соединения, представленного формулой (LL), защитной группой, такой как Boc (трет-бутоксикарбонил), и затем защитную группу можно удалить.
[0355]
Полученное таким образом соединение, представленное формулой (MM), можно подвергнуть следующей стадии после, или без, выделения и очистки известными способами разделения и очистки, такими как концентрирование, концентрирование в вакууме, кристаллизация, экстракция растворителем, повторное осаждение и хроматография.
[0356]
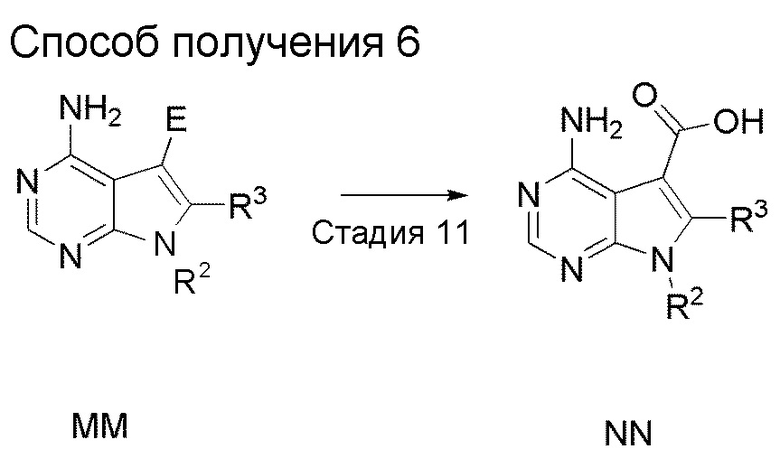
[0357]
где E, R2 и R3 имеют значения, определенные выше.
[0358]
Стадия 11
На этой стадии получают карбоновокислотное соединение, представленное формулой (NN), путем гидролиза соединения, представленного формулой (MM).
[0359]
Гидролиз осуществляют с использованием основания или кислоты. Примеры оснований включают органические основания, такие как диэтиламин, диизопропиламин, трет-бутират калия, трет-бутират натрия, метоксид натрия, этоксид натрия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия и бутиллитий; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия, гидроксид калия, гидроксид лития и гидроксид кальция. Примеры кислоты включают хлористоводородную кислоту, серную кислоту, фосфорную кислоту и т.п.
[0360]
Используемый в реакции растворитель конкретно не ограничивается, и можно использовать любой растворитель, который не оказывает негативного влияния на реакцию. Примеры растворителя включают углеводороды (например, бензол, толуол и ксилол), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан, тетрагидрофуран и 1,4-диоксан), спирты (например, метанол, этанол и этиленгликоль), апротонные полярные растворители (например, диметилформамид, диметилацетамид, N-метилпирролидинон, диметилсульфоксид и гексаметилфосфорамид), воду и их смеси.
[0361]
Время реакции варьируется в пределах 0,1-100 часов, предпочтительно 0,5-24 часов. Температура реакции варьируется в пределах от 0°C до температуры кипения растворителя, предпочтительно от 0 до 160°C.
[0362]
Полученное таким образом соединение, представленное формулой (NN), можно подвергнуть следующей стадии после, или без, выделения и очистки известными способами разделения и очистки, такими как концентрирование, концентрирование в вакууме, кристаллизация, экстракция растворителем, повторное осаждение и хроматография.
[0363]
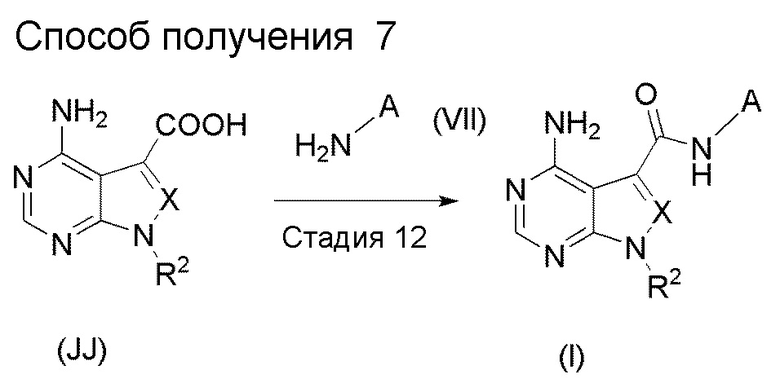
[0364]
где A, R2 и X имеют значения, определенные выше.
[0365]
Стадия 12
На этой стадии получают соединение, представленное формулой (I), осуществляя реакцию амидирования с использованием соединения, представленного формулой (JJ), и соединения, представленное формулой (VII). Эту стадию осуществляют в присутствии подходящего агента конденсации или активирующего агента в качестве агента амидирования, с использованием соединения формулы (VII) в количестве 0,5-10 моль, предпочтительно 1-3 моль, на моль соединения, представленного формулой (JJ).
[0366]
Используемый в реакции растворитель конкретно не ограничивается, и можно использовать любой растворитель, который не оказывает негативного влияния на реакцию. Примеры растворителя включают изопропанол, трет-бутиловый спирт, толуол, бензол, метиленхлорид, хлороформ, тетрагидрофуран, 1,4-диоксан, диметилформамид, диметилацетамид, N-метилпирролидинон, диметилсульфоксид, ацетонитрил и их смеси.
[0367]
Температура реакции, как правило, варьируется в пределах от -78 до 200°C, предпочтительно от 0 до 100°C. Время реакции, как правило, варьируется в пределах от 5 минут до 7 дней, предпочтительно от 5 минут до 3 дней, более предпочтительно от 5 минут до 1 дня.
[0368]
Примеры агентов конденсации и активирующих агентов включают дифенилфосфорилазид, N,N'-дициклогексилкарбодиимид, бензотриазол-1-илокси-трисдиметиламинофосфониевую соль, 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолинийхлорид, 1-этил-3-(3-диметиламинопропил)карбодиимид, комбинацию 1-этил-3-(3-диметиламинопропил)карбодиимида и 1-гидроксибензотриазола, 2-хлор-1,3-диметилимидазолинийхлорид, (диметиламино)-N,N-диметил(3H-[1,2,3]триазолo[4,5-b]пиридин-3-илокси)метанаминий гексафторфосфат, 1,1-карбонилдиимидазол, имид N-оксиянтарной кислоты и т.п.
[0369]
Кроме того, при необходимости можно добавить основание в процессе реакции. Примеры оснований включают органические основания, такие как триэтиламин, диизопропилэтиламин, пиридин, лутидин, коллидин, 4-диметиламинопиридин, трет-бутират калия, трет-бутират натрия, метоксид натрия, этоксид натрия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, диазабициклоундецен, диазабициклононен и бутиллитий; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия и гидрид натрия. Количество добавляемого основания составляет 1-100 моль, предпочтительно 1-10 моль, на моль соединения, представленного формулой (JJ).
[0370]
После завершения реакции, основание, такое как раствор гидроксида натрия, можно добавить для осуществления последующей обработки.
[0371]
Полученное таким образом соединение, представленное формулой (I), можно выделить и очистить известными способами разделения и очистки, такими как концентрирование, концентрирование в вакууме, кристаллизация, экстракция растворителем, повторное осаждение и хроматография.
[0372]
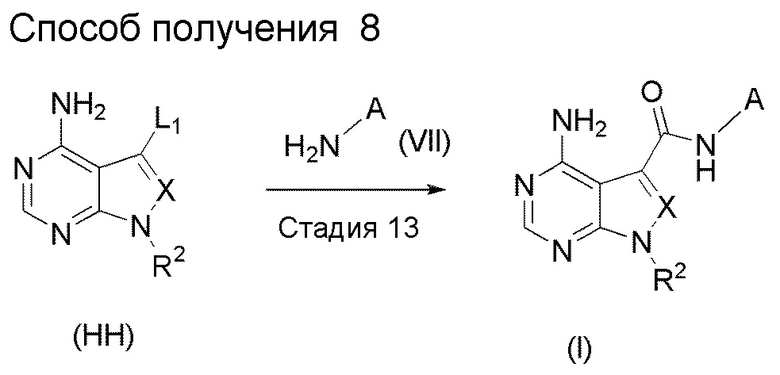
[0373]
где L1 представляет собой удаляемую группу, и A, R2 и X имеют значения, определенные выше.
[0374]
Стадия 13
На этой стадии получают соединение, представленное формулой (I), путем взаимодействия соединения, представленного формулой (HH), в присутствии Соединения (VII) в атмосфере оксида углерода с использованием, например, переходного металла и, необязательно, основания, в растворителе, который не оказывает негативного влияния на реакцию.
[0375]
На этой стадии, давление оксида углерода составляет от 1 атм до 10 атм, предпочтительно от 1 атм до 7 атм.
[0376]
Примеры катализаторов на основе переходных металлов, используемых на этой стадии, включают палладиевые катализаторы (например, ацетат палладия, трис(дибензилиденацетон)дипалладий, бис(трифенилфосфин)палладий(II) дихлорид, комплекс 1,1-бис(дифенилфосфино)ферроцен-палладий(II) дихлорид-дихлорметан, палладий на углероде и т.д.). При необходимости, добавляют лиганд (например, трифенилфосфин, xantphos, три-трет-бутилфосфин и т.д.). Количество катализатора на основе переходного металла варьируется в зависимости от типа катализатора. Например, количество используемого катализатора на основе переходного металла составляет, как правило, 0,0001-1 моль, предпочтительно 0,001-0,5 моль, на моль соединения, представленного формулой (HH). Количество используемого лиганда составляет, как правило, 0,0001-4 моль, предпочтительно 0,01-2 моль, на моль соединения, представленного формулой (HH).
[0377]
Кроме того, при необходимости можно добавить основание в процессе реакции. Примеры оснований включают органические основания, такие как триэтиламин, диизопропилэтиламин, пиридин, лутидин, коллидин, 4-диметиламинопиридин, N-метилморфолин, трет-бутират калия, трет-бутират натрия, метоксид натрия, этоксид натрия, гексаметилдисилазид лития, гексаметилдисилазид натрия, 1,8-диазабицикло[5.4.0]ундец-7-ен, гексаметилдисилазид калия и бутиллитий; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия и гидрид натрия. Количество используемого основания составляет, как правило, 0,1-50 моль, предпочтительно 1-20 моль, на моль соединения, представленного формулой (HH).
[0378]
Используемый в реакции растворитель конкретно не ограничивается, и можно использовать любой растворитель, который не оказывает негативного влияния на реакцию. Примеры растворителя включают углеводороды (например, бензол, толуол и ксилол), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан, тетрагидрофуран и 1,4-диоксан), спирты (например, метанол и этанол), апротонные полярные растворители (например, диметилформамид, диметилацетамид, N-метилпирролидинон, диметилсульфоксид и гексаметилфосфорамид), воду и их смеси. Время реакции варьируется в пределах 0,1-100 часов, предпочтительно 0,5-24 часов. Температура реакции составляет от 0°C до 250°C, предпочтительно от 0 до 200°C.
[0379]
Полученное таким образом соединение, представленное формулой (I), можно выделить и очистить известными способами разделения и очистки, такими как концентрирование, концентрирование в вакууме, кристаллизация, экстракция растворителем, повторное осаждение и хроматография.
[0380]
[0381]
где A, R2 и R3 имеют значения, определенные выше.
На этой стадии получают соединение, представленное формулой (SS), подвергая соединение, представленное формулой (RR), реакции сочетания с боратным производным, производным борной кислоты, производным олова или ацетиленовым производным, которое содержит R3, с использованием, например, переходного металла и, необязательно, основания, в растворителе, который не оказывает негативного влияния на реакцию.
[0382]
Количество используемого боратного производного, производного борной кислоты, производного олова или ацетиленового производного, которое содержит R3, составляет 1-100 моль, предпочтительно 1-20 моль. Примеры катализаторов на основе переходных металлов, используемых на этой стадии, включают палладиевые катализаторы (например, ацетат палладия, тетракистрифенилфосфинпалладий, трис(бензилиденацетон)дипалладий, бис(трифенилфосфин)палладий(II) дихлорид, комплекс 1,1-бис(дифенилфосфино)ферроцен-палладий(II) дихлорид-дихлорметан и т.д.). При необходимости, добавляют лиганд (например, трифенилфосфин, xantphos, 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил, 2-дициклогексилфосфино-2',6'-диметоксибифенил, трициклогексилфосфин, три-трет-бутилфосфин и т.д.). Примеры медных катализаторов включают иодид меди, бромид меди и хлорид меди. Количество катализатора на основе переходного металла варьируется в зависимости от типа катализатора. Например, количество используемого катализатора на основе переходного металла составляет, как правило, 0,0001-1 моль, предпочтительно 0,001-0,5 моль, на моль соединения, представленного формулой (RR). Катализаторы на основе переходных металлов можно использовать в комбинации, при необходимости. Количество используемого лиганда составляет, как правило, 0,000 1-4 моль, предпочтительно 0,01-2 моль, на моль соединения, представленного формулой (RR).
[0383]
Кроме того, при необходимости можно добавить основание в процессе реакции. Примеры оснований включают органические основания, такие как триэтиламин, диизопропилэтиламин, пиридин, лутидин, коллидин, 4-диметиламинопиридин, N-метилморфолин, трет-бутират калия, трет-бутират натрия, метоксид натрия, этоксид натрия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия и бутиллитий; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, фосфат калия, гидроксид натрия и гидрид натрия. Количество используемого основания составляет, как правило, 0,1-50 моль, предпочтительно 1-20 моль, на моль соединения, представленного формулой (RR).
[0384]
Используемый в реакции растворитель конкретно не ограничивается, и можно использовать любой растворитель, который не оказывает негативного влияния на реакцию. Примеры растворителя включают углеводороды (например, бензол, толуол и ксилол), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан, тетрагидрофуран и 1,4-диоксан), спирты (например, метанол, этанол и этиленгликол), апротонные полярные растворители (например, диметилформамид, диметилацетамид, N-метилпирролидинон, диметилсульфоксид и гексаметилфосфорамид), воду и их смеси.
[0385]
Время реакции варьируется в пределах 0,1-100 часов, предпочтительно 0,5-24 часов. Температура реакции варьируется в пределах от 0°C до температуры кипения растворителя, предпочтительно от 0 до 160°C.
[0386]
Полученное таким образом соединение, представленное формулой (SS), можно выделить и очистить известными способами разделения и очистки, такими как концентрирование, концентрирование в вакууме, кристаллизация, экстракция растворителем, повторное осаждение и хроматография.
[0387]
Когда соединение по настоящему изобретению содержит изомеры, такие как оптические изомеры, стереоизомеры, региоизомеры и ротационные изомеры, смеси любых из указанных изомеров включены в объем соединения по настоящему изобретению. Например, когда соединение по настоящему изобретению содержит оптические изомеры, оптический изомер, выделенный из рацемической смеси, также включен в объем соединения по настоящему изобретению. Каждый из таких изомеров можно получить в виде отдельного соединения известными способами синтеза и разделения (например, концентрирование, экстракция растворителем, колоночная хроматография, перекристаллизация и т.д.).
[0388]
Соединение или его соль по настоящему изобретению может быть в форме кристаллов. Монокристаллы и полиморфные смеси включены в объем соединения или его соли по настоящему изобретению. Такие кристаллы можно получить путем кристаллизации в соответствии со способом кристаллизации, известным per se в данной области техники. Соединение или его соль по настоящему изобретению может представлять собой сольват (например, гидрат) или может быть в несольватированной форме. Любые из таких форм включены в объем соединения или его соли по настоящему изобретению. Соединения, меченные изотопом (например, 2H, 3H, 13C, 14C, 35S, 125I и т.д.), также включены в объем соединения или его соли по настоящему изобретению.
[0389]
Пролекарство соединения или его соли по настоящему изобретению относится к соединению, которое может быть преобразовано в соединение или его соль по настоящему изобретению через реакцию с ферментом, желудочной кислотой или т.п. в физиологических условиях in vivo, т.е. соединение, которое может быть преобразовано в соединение или его соль по настоящему изобретению путем ферментативного окисления, восстановления, гидролиза или т.п.; соединение, которое может быть преобразовано в соединение или его соль по настоящему изобретению путем гидролиза под действием желудочной кислоты или т.п. Кроме того, пролекарство соединения или его соли по настоящему изобретению может представлять собой соединения, которые могут быть преобразованы в соединение или его соль по настоящему изобретению в физиологических условиях, такие, которые описаны в ʺIyakuhin no Kaihatsu [Development of Pharmaceuticals],ʺ Vol. 7, Molecular Design, опубликован в 1990 году Hirokawa Shoten Co., pp. 163-198.
[0390]
Соль соединения по настоящему изобретению относится к обычной соли, используемой в области органической химии. Примеры таких солей включают основно-аддитивные соли, образованные с карбоксильной группой, когда соединение содержит карбоксильную группу, и кислотно-аддитивные соли, образованные с амино или щелочной гетероциклической группой, когда соединение содержит амино или щелочную гетероциклическую группу.
[0391]
Примеры основно-аддитивных солей включают соли щелочных металлов, такие как натриевые соли и калиевые соли; соли щелочно-земельных металлов, такие как кальциевые соли и магниевые соли; соли аммония; и соли органических аминов, такие как соли триметиламина, соли триэтиламина, соли дициклогексиламина, соли этаноламина, соли диэтаноламина, соли триэтаноламина, соли прокаина и соли N,N'-дибензилэтилендиамина.
[0392]
Примеры кислотно-аддитивных солей включают соли неорганических кислот, такие как гидрохлорид, сульфат, нитрат, фосфат и перхлорат; соли органических кислот, такие как ацетат, формиат, малеат, фумарат, тартрат, цитрат, аскорбат и трифторацетат; и сульфонаты, такие как метансульфонат, изетионат, бензолсульфонат и п-толуолсульфонат.
[0393]
Соединение или его соль по настоящему изобретению обладает превосходной активностью ингибирования RET и является полезным в качестве противоопухолевого средства. Предпочтительными противоопухолевыми средствами являются противоопухолевые средства для лечения злокачественных опухолей с повышенной активацией RET. Соединение или его соль по настоящему изобретению обладает отличной селективностью в отношении RET и имеет преимущество, такое как незначительные побочные эффекты, вызываемые ингибированием других киназ.
[0394]
В настоящем описании, ʺRETʺ означает RET (rearranged during transfection(реаранжированную во время трансфекции)) тирозинкиназу и включает RET человека и RET отличных от человека млекопитающих, предпочтительно RET человека. Кроме того, термин ʺRETʺ включает изоформы.
[0395]
Кроме того, благодаря отличной активности ингибирования RET, соединение или его соль по настоящему изобретению является полезным в качестве фармацевтического препарата для профилактики и лечения RET-связанных заболеваний. Примеры ʺRET-связанных заболеванийʺ, включают заболевания, число случаев которых может быть уменьшено и симптомы которых могут быть устранены, ослаблены и/или полностью излечены путем делеции, супрессии и/или ингибирования функции RET. ʺRET-связанные заболеванияʺ, предпочтительно представляют собой заболевания, которые можно лечить путем ингибирования RET. Примеры таких заболеваний включают, но не ограничиваются этим, злокачественные опухоли и т.д. Примерами злокачественной опухоли являются опухоли с повышенной активацией RET. Злокачественная опухоль с повышенной активацией RET относится к злокачественной опухоли с повышенной активацией RET в результате транслокации, мутации (включая точечную мутацию и мутацию слияния генов) и избыточной экспрессии (включая состояния, в которых увеличивается количество копий гена RET, информационная РНК RET сверхэкспрессируется, количество RET белков увеличивается, и белки RET постоянно активируются) гена RET.
[0396]
Тип злокачественной опухоли, подлежащей лечению соединением или его солью по настоящему изобретению, конкретно не ограничивается. Примеры злокачественных опухолей включают эпителиальные раки (раки дыхательной системы, раки пищеварительной системы, раки репродуктивной системы, раки системы секреции и т.д.), саркомы, гемопоэтические опухоли, опухоли центральной нервной системы и опухоли периферических нервов.
[0397]
Конкретные примеры типа рака включают рак головы и шеи, рак щитовидной железы, рак пищевода, рак желудка, рак двенадцатиперстной кишки, рак печени, рак желчных путей (желчный пузырь, холангиокарцинома и т.д.), рак поджелудочной железы, колоректальный рак (рак толстой кишки, рак прямой кишки и т.д.), рак легких (немелкоклеточный рак легкого, мелкоклеточный рак легкого, мезотелиома и т. д.), рак молочной железы, рак яичников, рак матки (рак шейки матки, рак эндометрия и т.д.), рак почек, рак почечных лоханок-уретры, рак мочевого пузыря, рак предстательной железы, тестикулярную опухоль, лейкоз, злокачественную лимфому, множественную миелому, остеосаркому, саркому мягких тканей, рак кожи, опухоль головного мозга, опухоль надпочечников, нейробластому и т.п.
[0398]
Целевой рак предпочтительно представляет собой рак легкого (немелкоклеточный рак легкого, мелкоклеточный рак легкого, мезотелиома и т.д.), колоректальный рак (рак толстой кишки, рак прямой кишки и т.д.), рак щитовидной железы, рак молочной железы, опухоль головного мозга и лейкоз; более предпочтительно немелкоклеточный рак легкого и рак щитовидной железы; и более предпочтительно немелкоклеточный рак легкого и рак щитовидной железы с повышенной активацией RET. Значение фразы ʺповышенная активация RETʺ определено выше.
[0399]
Фармацевтическая композиция, включающая соединение или его соль по настоящему изобретению, предпочтительно представляет собой фармацевтическую композицию для профилактики или лечения заболеваний, которые можно лечить путем ингибирования RET. Предпочтительные фармацевтические композиции являются противоопухолевыми средствами. Когда соединение или его соль по настоящему изобретению используют в качестве фармацевтического препарата, можно добавить фармацевтический носитель, если необходимо, таким образом, формулируя подходящую лекарственную форму в соответствии с профилактическими и лечебными целями. Примеры лекарственной формы включают пероральные препараты, препараты для инъекций, суппозитории, мази, пластыри и т.п. Такие лекарственные формы можно получить способами, обычно известными специалистам в данной области.
[0400]
В качестве фармацевтического носителя, различные традиционные органические или неорганические вещества-носители, используемые в качестве составляющих препарат веществ, могут быть смешаны в качестве эксципиента, связующего, разрыхлителя, смазывающего вещества или агента покрытия в твердых препаратах; или в качестве растворителя, солюбилизирующего агента, суспендирующего агента, изотонического агента, pH регулятора/буфера или успокаивающего средства в жидких препаратах. Кроме того, добавки для фармацевтических препаратов, такие как антисептики, антиоксиданты, красители, подсластители и стабилизаторы, также можно использовать, если необходимо.
[0401]
Примеры эксципиентов включают лактозу, сахарозу, D-маннит, крахмал, кристаллическую целлюлозу, силикат кальция и т.п.
[0402]
Примеры связующих включают гидроксипропилцеллюлозу, метилцеллюлозу, поливинилпирролидон, кондитерский порошок, гидроксипропилметилцеллюлозу и т.п.
[0403]
Примеры разрыхлителей включают натрий крахмалгликолят, кармелозу кальция, кроскармелозу натрия, кросповидон, низкозамещенную гидроксипропилцеллюлозу, частично прежелатинизированный крахмал и т.п.
[0404]
Примеры смазывающих веществ включают тальк, стеарат магния, сложный эфир сахарозы и жирной кислоты, стеариновую кислоту, стеарилфумарат натрия и т.п.
[0405]
Примеры агентов покрытий включают этилцеллюлозу, аминоалкилметакрилатный сополимер RS, гидроксипропилметилцеллюлозу, сахарозу и т.п.
[0406]
Примеры растворителей включают воду, пропиленгликоль, физиологический солевой раствор и т.п.
[0407]
Примеры солюбилизирующих агентов включают полиэтиленгликоль, этанол, α-циклодекстрин, макрогол 400, полисорбат 80 и т.п.
[0408]
Примеры суспендирующих агентов включают каррагенан, кристаллическую целлюлозу/кармелозу натрия, полиоксиэтилен- гидрированное касторовое масло и т.п.
[0409]
Примеры изотонических агентов включают хлорид натрия, глицерин, хлорид калия и т.п.
[0410]
Примеры pH регуляторов/буферов включают цитрат натрия, хлористоводородную кислоту, молочную кислоту, фосфорную кислоту, дигидрофосфат натрия и т.п.
[0411]
Примеры успокаивающих средств включают прокаин гидрохлорид, лидокаин и т.п.
[0412]
Примеры антисептиков включают этил парагидроксибензоат, крезол, бензалконийхлорид и т.п.
[0413]
Примеры антиоксидантов включают сульфит натрия, аскорбиновую кислоту, природный витамин E и т.п.
[0414]
Примеры красителей включают оксид титана, сесквиоксид железа, пищевой синий № 1, медный комплекс хлорофилла и т.п.
[0415]
Примеры подсластителей включают аспартам, сахарин, сукралозу, l-ментол, мятную отдушку и т.п.
[0416]
Примеры стабилизаторов включают пиросульфит натрия, динатрий эдетат, эриторбиновую кислоту, оксид магния, дибутилгидрокситолуол и т.п.
[0417]
Когда получают твердый препарат для перорального введения, эксципиент, необязательно эксципиент, связующее, разрыхлитель, смазывающее вещество, краситель, подсластитель и т.п., можно добавить к соединению по настоящему изобретению; и полученную смесь можно сформулировать в таблетки, таблетки с покрытием, гранулы, порошки, капсулы и т.д., в соответствии с обычным способом.
[0418]
Когда получают препарат для инъекций, pH регулятор, буфер, стабилизатор, изотонический агент, местный анестетик и т.п. можно добавить к соединению по настоящему изобретению; и полученную смесь можно сформулировать в виде препарата для подкожных, внутримышечных и внутривенных инъекций в соответствии с обычным способом.
[0419]
Количество соединения по настоящему изобретению для включения в каждую из таких стандартных лекарственных форм зависит от состояния пациента, которому вводят соединение, лекарственной формы и т.д. Как правило, в случае перорального средства, инъекции и суппозитория, количество соединения по настоящему изобретению предпочтительно составляет 0,05-1000 мг, 0,01-500 мг и 1-1000 мг, соответственно, на стандартную лекарственную форму.
[0420]
Суточная доза лекарственного средства в такой лекарственной форме зависит от состояния, массы тела, возраста, пола и т.д. пациента и не подлежит обобщению. Например, суточная доза соединения по настоящему изобретению для взрослого (масса тела: 50 кг) может составлять, как правило, 0,05-5000 мг, и предпочтительно 0,1-1000 мг; и предпочтительно ее вводят в виде одной дозы или двух-трех дробных доз в день.
[0421]
В настоящем изобретении примеры млекопитающих, которым вводят Соединение (I) или его соль, включают человека, обезьян, мышей, крыс, кроликов, собак, кошек, коров, лошадей, свиней, овец и т.п.
Примеры
[0422]
Далее настоящее изобретение описывается более подробно со ссылкой на Примеры. Однако настоящее изобретение не ограничивается этими примерами.
[0423]
В примерах использовали коммерчески доступные реагенты, если не указано иное. Для колоночной хроматографии на силикагеле использовали следующие колонки: Purif-Pack (зарегистрированная торговая марка) SI, изготовитель Moritex Corp., KP-Sil (зарегистрированная торговая марка) заполненная диоксидом кремния колонка, изготовитель Biotage, HP-Sphere (зарегистрированная торговая марка) заполненная диоксидом кремния колонка, изготовитель Biotage, или HP-Sil (зарегистрированная торговая марка) заполненная диоксидом кремния колонка, изготовитель Biotage. Для колоночной хроматографии на щелочном силикагеле использовали Purif-Pack (зарегистрированная торговая марка) NH, изготовитель Moritex Corp., или KP-NH (зарегистрированная торговая марка) заполненную колонку, изготовитель Biotage. Для препаративной тонкослойной хроматографии использовали Kieselgel TM 60F 254, Art. 5744, изготовитель Merck, или пластину с NH2 силикагелем 60F254, изготовитель Wako. ЯМР спектры измеряли с использованием спектрометра модели AL400 (400 МГц;, изготовитель JEOL), Mercury 400 (400 МГц; изготовитель Agilent Technologies, Inc.) или спектрометра модели Inova 400 (400 МГц;, изготовитель Agilent Technologies, Inc.), снабженного OMNMR зондом (Protasis). Измерение осуществляли с использованием тетраметилсилана в качестве внутреннего стандарта, когда тетраметилсилан содержался в дейтерированном растворителе; в других случаях ЯМР растворитель использовали в качестве внутреннего стандарта. Все δ значения показаны в м.д. Реакции в условиях микроволнового облучения осуществляли с использованием Initiator, изготовитель Biotage.
[0424]
ЖХМС спектры измеряли с использованием Acquity SQD (квадрупольный), изготовитель Waters Corporation в следующих условиях.
Колонка: Acquity UPLC (торговая марка) BEH C18, 2,1 × 50 мм, 1,7 мкм (изготовитель Waters Corporation)
МС детекция: ESI в режиме положительных ионов
УФ детекция: 254 и 210 нм
Скорость потока в колонке: 0,5 мл/мин
Подвижная фаза: Вода/ацетонитрил (0,1% муравьиной кислоты)
Объем вводимой пробы: 1 мкл градиент
Очистку препаративной обращенно-фазовой ВЭЖХ осуществляли с использованием системы препаративного разделения, доступной от Gilson, Inc.
Колонка: CombiPrep Pro C18, 50 × 30 мм в.д., S-5 мкм (изготовитель YMC)
УФ детекция: 254 нм
Скорость потока в колонке: 40 мл/мин
Подвижная фаза: Вода/ацетонитрил (0,1% муравьиной кислоты)
Объем вводимой пробы: 0,1-1 мл
Далее представлены используемые аббревиатуры и их значения.
s: синглет
d: дублет
t: триплет
q: квартет
dd: двойной дублет
dt: двойной триплет
td: тройной дублет
tt: тройной триплет
ddd: двойной двойной дублет
ddt: двойной двойной триплет
dtd: двойной тройной дублет
tdd: тройной двойной дублет
m: мультиплет
br: широкий
brs: широкий синглет
CDI: карбонилдиимидазол
DMSO-d6: дейтерированный диметилсульфоксид
CDCl3: дейтерированный хлороформ
CD3OD: дейтерированный метанол
ТГФ: тетрагидрофуран
DMF: N,N-диметилформамид
DMA: N,N-диметилацетамид
NMP: 1-метил-2-пирролидинон
DMSO: диметилсульфоксид
HATU: (диметиламино)-N,N-диметил(3H-[1,2,3]триазолo[4,5-b]пиридин-3-илокси)метаниминий гексафторфосфат
DIAD: диизопропилазодикарбоксилат
DIPEA: диизопропилэтиламин
DME: 1,2-диметоксиэтан
[0425]
Ссылочный пример 1: Синтез 4-амино-1-циклопентил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты
Стадия 1: Синтез 1-циклопентил-3-иод-1H-пиразолo[3,4-d]пиримидин-4-амина
Суспензию 3,0 г 3-иод-1H-пиразолo[3,4-d]пиримидин-4-амина, синтезированного в соответствии с процедурой, описанной в Международной публикации № WO2007/126841, 3,4 г иодциклопентана и 4,8 г карбоната калия в 30 мл DMF нагревали до 80°C и перемешивали в течение 18 часов. После охлаждения полученной смеси до комнатной температуры к смеси добавляли 200 мл воды, с последующим фильтрованием образовавшегося твердого вещества. Твердое вещество промывали водой и сушили, таким образом получая 3,7 г указанного в заголовке соединения в виде желтого твердого вещества.
Физические свойства: m/z[M+H]+ 330,1.
[0426]
Стадия 2: Синтез 4-амино-1-циклопентил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты
21 г 1-циклопентил-3-иод-1H-пиразолo[3,4-d]пиримидин-4-амина, полученного на стадии 1, 42 мл 2-диэтиламиноэтанола и 2,24 г Pd(PPh3)2Cl2 растворяли в 120 мл ΝΜΡ и атмосферу в системе заменяли оксидом углерода, с последующим нагреванием до 120°C. После перемешивания в течение 2 часов полученную смесь охлаждали до комнатной температуры и к смеси добавляли 50 мл метанола. Затем к смеси добавляли 19 мл 5N водного раствора гидроксида натрия и перемешивали в течение 30 минут. После добавления воды водный слой промывали этилацетатом и промытый водный слой доводили хлористоводородной кислотой до pH 3. Осажденное твердое вещество собирали фильтрованием, промывали водой и сушили, таким образом получая 9,8 г указанного в заголовке соединения в виде бледно-желтого твердого вещества.
Физические свойства: m/z[M+H]+ 248,3.
[0427]
Ссылочный пример 2: Синтез 4-амино-1-(4,4-диметилциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты
Стадия 1: Синтез 1-(4,4-диметилциклогексил)-3-иод-1H-пиразолo[3,4-d]пиримидин-4-амина
6,08 мл диизопропилазодикарбоксилата добавляли к раствору 4 г 3-иод-1H-пиразолo[3,4-d]пиримидин-4-амина, 5,89 г 4,4-диметилциклогексанола и 8,0 г трифенилфосфина в 30 мл ТГФ при комнатной температуре, с последующим перемешиванием в течение ночи. После концентрирования остаток очищали хроматографией на силикагеле (гексан → гексан/этилацетат=1/1), таким образом получая 3,9 г указанного в заголовке соединения в виде белого твердого вещества.
Физические свойства: m/z[M+H]+ 373,1.
[0428]
Стадия 2: Синтез 4-амино-1-(4,4-диметилциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты
3,14 г 1-(4,4-диметилциклогексил)-3-иод-1H-пиразолo[3,4-d]пиримидин-4-амина, полученного на стадии 1, 5,61 мл 2-диэтиламиноэтанола и 297 мг Pd(PPh3)2Cl2 растворяли в 15 мл ΝΜΡ и атмосферу в системе заменяли оксидом углерода, с последующим нагреванием до 120°C. После перемешивания в течение 2 часов полученную смесь охлаждали до комнатной температуры и к смеси добавляли 15 мл метанола. Затем к смеси добавляли 6,9 мл 5N водного раствора гидроксида натрия и перемешивали в течение 30 минут. После добавления воды водный слой промывали этилацетатом и промытый водный слой доводили хлористоводородной кислотой до pH 3. Осажденное твердое вещество собирали фильтрованием, промывали водой и сушили, таким образом получая 2,2 г указанного в заголовке соединения в виде бледно-желтого твердого вещества.
Физические свойства: m/z[M+H]+ 290,3.
[0429]
Ссылочный пример 3: Синтез 4-амино-1-(трет-бутил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты
Стадия 1: Синтез метил 4-амино-1-(трет-бутил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксилата
3,33 г триэтиламина и 1,35 г комплекса 1,1'-бис(дифенилфосфино)ферроцен-палладий(II) дихлорид-дихлорметан добавляли к суспензии 4,45 г 3-бром-1-(трет-бутил)-1H-пиразолo[3,4-d]пиримидин-4-амина в 45 мл метанола. Смесь перемешивали в атмосфере оксида углерода в автоклаве при 0,5 МПа и при 100°C в течение 3 часов. После охлаждения смесь растворяли в хлороформе, промывали водой и сушили над безводным сульфатом натрия. Высушенную смесь затем фильтровали и концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан-этилацетат) и полученное твердое вещество суспендировали и промывали смесью гексан-этилацетат. После фильтрования твердое вещество сушили при 70°C при пониженном давлении, таким образом получая 2,37 г указанного в заголовке соединения в виде бледно-orange твердого вещества.
Физические свойства: m/z[M+H]+ 250,1.
[0430]
Стадия 2: Синтез 4-амино-1-(трет-бутил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты
2,23 г метил 4-амино-1-(трет-бутил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксилата, полученного на стадии 1 Ссылочного примера 3, суспендировали в 33 мл метанола и к смеси добавляли 3,58 мл 5M водного раствора гидроксида натрия. Смесь нагревали при кипячении с обратным холодильником при перемешивании в течение 30 минут. После охлаждения реакционный раствор нейтрализовали при помощи 5M водного раствора хлористоводородной кислоты и разбавляли водой, собирая осажденное твердое вещество фильтрованием. Полученное твердое вещество сушили при 60°C при пониженном давлении, таким образом получая 2,05 г указанного в заголовке соединения в виде бесцветного твердого вещества.
Физические свойства: m/z[M+H]+ 236,3.
[0431]
Ссылочный пример 4: Синтез 4-амино-1-(4,4-дифторциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты
Стадия 1: Синтез 1-(4,4-дифторциклогексил)-3-иод-1H-пиразолo[3,4-d]пиримидин-4-амина
1,6 мл диизопропилазодикарбоксилата добавляли к раствору 1,6 г 3-иод-1H-пиразолo[3,4-d]пиримидин-4-амина, 1,0 г 4,4-дифторциклогексанола и 2,1 г трифенилфосфина в 50 мл ТГФ при комнатной температуре, с последующим перемешиванием в течение ночи. После концентрирования смесь суспендировали и промывали метанолом и фильтровали. Полученное твердое вещество сушили при 60°C при пониженном давлении, таким образом получая 1,5 г указанного в заголовке соединения в виде бесцветного твердого вещества.
Физические свойства: m/z[M+H]+ 380,2.
[0432]
Стадия 2: Синтез метил 4-амино-1-(4,4-дифторциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксилата
Смешанный раствор 1,5 г 1-(4,4-дифторциклогексил)-3-иод-1H-пиразолo[3,4-d]пиримидин-4-амина, полученного на стадии 1 Ссылочного примера 4, 330 мг комплекса 1,1'-бис(дифенилфосфино)ферроцен-палладий(II) дихлорид-дихлорметан и 3 мл N,N-диизопропилэтиламина в 30 мл метанола перемешивали в атмосфере оксида углерода в автоклаве при 0,45 МПа и при 100°C в течение 2 часов. После охлаждения смесь концентрировали и очищали колоночной хроматографией на силикагеле (гексан-этилацетат). После концентрирования полученный неочищенный продукт снова очищали хроматографией на щелочном силикагеле (гексан-этилацетат) и полученное твердое вещество суспендировали и промывали смесью гексан-этилацетат, с последующим фильтрованием и сушкой при пониженном давлении, таким образом получая 650 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
Физические свойства: m/z[M+H]+ 312,1.
[0433]
Стадия 3: Синтез 4-амино-1-(4,4-дифторциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты
В соответствии с процедурой синтеза стадии 2 в Ссылочном примере 3, с использованием 653 мг метил-4-амино-1-(4,4-дифторциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксилата, полученного на стадии 2 выше, вместо метил 4-амино-1-(трет-бутил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксилата, используемого на стадии 2 Ссылочного примера 3, получали 605 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
Физические свойства: m/z[M+H]+ 298,1.
[0434]
Ссылочный пример 5: Синтез трет-бутил 5-амино-3-метил-1H-пиразол-1-карбоксилата
75 г 5-метил-1H-пиразол-3-амина растворяли в 800 мл дихлорметана и к смеси добавляли 750 мл 5Ν водного раствора ΝaOH. К раствору добавляли 184,5 г ди-трет-бутилдикарбоната и смесь перемешивали при комнатной температуре в течение 3 дней. К раствору добавляли воду, с последующим экстрагированием хлороформом. Органический слой промывали водой и сушили над безводным сульфатом магния. Органический раствор концентрировали при пониженном давлении и полученное твердое вещество промывали гексаном, таким образом получая 68 г указанного в заголовке соединения в виде белого твердого вещества.
Физические свойства: m/z[M+H]+ 198,1
ЯМР (DMSO-d6) δ м.д. 1,51(с, 9H), 1,98(с, 3H), 5,13(с, 1H), 6,23(с, 2H).
[0435]
Ссылочный пример 6: Синтез 4-амино-7-изопропил-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты
Стадия 1: Синтез 4-хлор-5-иод-7-изопропил-7H-пирролo[2,3-d]пиримидина
5,79 мл DIAD добавляли к раствору 4,0 г 4-хлор-5-иод-7H-пирролo[2,3-d]пиримидина, 2,58 г пропан-2-ола и 7,51 г трифенилфосфина в 30 мл тетрагидрофурана. Реакционный раствор перемешивали в течение 18 часов. Реакционный раствор концентрировали и полученный остаток очищали хроматографией на силикагеле (гексан → гексан/этилацетат=1/1), таким образом получая 4,0 г указанного в заголовке соединения в виде бледно-желтого твердого вещества.
Физические свойства: m/z[M+H]+ 322,0.
[0436]
Стадия 2: Синтез 5-иод-7-изопропил-7H-пирролo[2,3-d]пиримидин-4-амина
30 мл 1,2-диметоксиэтана и 30 мл 28% водного раствора аммиака добавляли к 3 г 4-хлор-5-иод-7-изопропил-7H-пирролo[2,3-d]пиримидина, полученного на стадии 1 выше, и смесь перемешивали в стойкой к давлению трубке из нержавеющей стали при 115°C в течение 18 часов. К реакционному раствору добавляли 300 мл воды и полученное твердое вещество промывали водой, таким образом получая 2,0 г указанного в заголовке соединения в виде белого твердого вещества.
Физические свойства: m/z[M+H]+ 303,1.
[0437]
Стадия 3: Синтез 4-амино-7-изопропил-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты
3,8 г 5-иод-7-изопропил-7H-пирролo[2,3-d]пиримидин-4-амина, полученного на стадии 2 выше, 8,3 мл 2-диэтиламиноэтанола и 0,44 г Pd(PPh3)2Cl2 растворяли в 10 мл NMP и атмосферу в системе заменяли оксидом углерода, с последующим нагреванием до 120°C. После перемешивания в течение 2 часов реакционную смесь охлаждали до комнатной температуры и к смеси добавляли 7 мл метанола. Затем к смеси добавляли 3,5 мл 5N водного раствора гидроксида натрия и смесь перемешивали в течение 30 минут. После добавления воды водный слой промывали этилацетатом и доводили при помощи хлористоводородной кислоты до pH 3, с последующим фильтрованием осажденного твердого вещества. Полученное твердое вещество промывали водой и сушили, таким образом получая 0,670 г указанного в заголовке соединения в виде бледно-желтого твердого вещества.
Физические свойства: m/z[M+H]+ 221,2.
[0438]
Ссылочный пример 7: Синтез 4-амино-7-(трет-бутил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты
Стадия 1: Синтез 7-(трет-бутил)-4-хлор-7H-пирролo[2,3-d]пиримидина
Смешанный раствор 29,3 г 2-(4,6-дихлорпиримидин-5-ил)ацетальдегида, 13,4 г трет-бутиламина и 29,7 г N,N-диизопропилэтиламина в 200 мл этанола перемешивали с нагреванием при кипячении с обратным холодильником в течение 2 часов. После охлаждения реакционную смесь концентрировали. Остаток разбавляли этилацетатом, промывали водой и затем насыщенным водным раствором хлорида натрия. Полученный органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали. Полученный остаток очищали хроматографией на силикагеле, таким образом получая 21,5 г указанного в заголовке соединения в виде бесцветного твердого вещества.
Физические свойства: m/z[M+H]+ 210,0.
[0439]
Стадия 2: Синтез 7-(трет-бутил)-4-хлор-5-иод-7H-пирролo[2,3-d]пиримидина
46,7 г N-иодсукцинимид добавляли к раствору 36 г 7-(трет-бутил)-4-хлор-7H-пирролo[2,3-d]пиримидина, полученного на стадии 1, в 360 мл DMF и смесь перемешивали при комнатной температуре в течение 3 дней. Смесь разбавляли этилацетатом и промывали водой 3 раза, с последующей промывкой насыщенным водным раствором хлорида натрия. Полученный органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали. Полученное твердое вещество суспендировали и промывали смесью гексан-этилацетат и фильтровали, с последующей сушкой при пониженном давлении, таким образом получая 45,5 г указанного в заголовке соединения в виде бледно-orange твердого вещества.
Физические свойства: m/z[M+H]+ 335,9.
[0440]
Стадия 3: Синтез 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина
Суспензию 52 г 7-(трет-бутил)-4-хлор-5-иод-7H-пирролo[2,3-d]пиримидина, полученного на стадии 2, в 180 мл ТГФ и 180 мл 28% водного раствора аммиака перемешивали при 120°C в течение 14 часов в автоклаве. После охлаждения смесь разбавляли водой, собирая осажденное твердое вещество фильтрованием, с последующей сушкой при 60°C при пониженном давлении, таким образом получая 52 г указанного в заголовке соединения в виде бесцветного твердого вещества.
Физические свойства: m/z[M+H]+ 317,3.
[0441]
Стадия 4: Синтез метил 4-амино-7-(трет-бутил)-7H-пирролo[2,3-d]пиримидин-5-карбоксилата
Суспензию 15 г 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина, полученного на стадии 3, 1,94 г комплекса 1,1'-бис(дифенилфосфино)ферроцен-палладий(II) дихлорид-дихлорметан и 13,2 мл триэтиламина в 150 мл метанола перемешивали в атмосфере оксида углерода в автоклаве при 100°C и 0,45 МПа в течение 1,5 часа. После охлаждения реакционный раствор концентрировали и очищали хроматографией на силикагеле (гексан-этилацетат). Полученное твердое вещество суспендировали и промывали смесью гексан-этилацетат, фильтровали и сушили при пониженном давлении, таким образом получая 9,70 г указанного в заголовке соединения в виде темно-красного твердого вещества.
Физические свойства: m/z[M+H]+ 249,3.
[0442]
Стадия 5: 4-амино-7-(трет-бутил)-7H-пирролo[2,3-d]пиримидин-5-карбоновая кислота
23,4 мл 5M водного раствора гидроксида натрия добавляли к суспензии 9,70 г метил 4-амино-7-(трет-бутил)-7H-пирролo[2,3-d]пиримидин-5-карбоксилата, полученного на стадии 4, в 97 мл метанола. Смесь перемешивали с нагреванием при кипячении с обратным холодильником в течение 2 часов. После охлаждения смесь нейтрализовали при помощи 5M водного раствора хлористоводородной кислоты с осаждением коричневого твердого вещества. После разбавления водой твердое вещество фильтровали и сушили при 60°C при пониженном давлении, таким образом получая 8,0 г указанного в заголовке соединения в виде коричневого твердого вещества.
Физические свойства: m/z[M+H]+ 235,2.
[0443]
Ссылочный пример 8: Синтез 7-(трет-бутил)-5-иод-6-метил-7H-пирролo[2,3-d]пиримидин-4-амина
Стадия 1: Синтез 1-(4,6-дихлорпиримидин-5-ил)пропан-2-ола
1 г 2-(4,6-дихлорпиримидин-5-ил)ацетальдегида растворяли в 20 мл ТГФ и реактор охлаждали до -78°C. К раствору медленно по каплям добавляли 4,36 мл раствора метилмагнийбромида в диэтиловом эфире (3 моль/л). При этой же температуре смесь перемешивали в течение 1 часа и медленно добавляли насыщенный водный раствор хлорида аммония для остановки реакции. Реакционную смесь перемешивали при комнатной температуре в течение 10 минут и помещали в делительную воронку, с последующим экстрагированием этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и затем сушили над сульфатом натрия для удаления растворителя. Остаток очищали хроматографией на щелочном силикагеле (гексан/этилацетат=1/0 → 3/1), таким образом получая 446 мг указанного в заголовке соединения в виде бесцветного масла.
Физические свойства: m/z[M+H]+ 207,0.
[0444]
Стадия 2: Синтез 1-(4,6-дихлорпиримидин-5-ил)пропан-2-она
246 мг 1-(4,6-дихлорпиримидин-5-ил)пропан-2-ола, полученного на стадии 1, растворяли в 2,5 мл дихлорметана и к смеси добавляли 1,0 г реагента Десса-Мартина, с последующим перемешиванием при комнатной температуре в течение 1 часа. К реакционному раствору добавляли 10% водный раствор тиосульфата натрия и насыщенный водный раствор бикарбоната натрия и смесь продолжали перемешивать в течение 30 минут. Реакционную смесь экстрагировали хлороформом и органический слой промывали водой и насыщенным водным раствором хлорида натрия, с последующим добавлением сульфата натрия для сушки. После удаления растворителя остаток очищали хроматографией на силикагеле (гексан/этилацетат=1/0 → 3/1), таким образом получая 198 мг указанного в заголовке соединения в виде желтого твердого вещества.
Физические свойства: m/z[M+H]+ 205,0.
[0445]
Стадия 3: Синтез 1-(4-(трет-бутиламино)-6-хлорпиримидин-5-ил)пропан-2-она
198 мг 1-(4,6-дихлорпиримидин-5-ил)пропан-2-она, полученного на стадии 2, 122 мкл трет-бутиламина и 252 мкл диизопропилэтиламина растворяли в 2 мл этанола и раствор перемешивали при 90°C в течение ночи.
Реакционную смесь концентрировали, затем остаток очищали хроматографией на силикагеле (гексан/этилацетат=1/0 → 3/1), таким образом получая 64 мг указанного в заголовке соединения в виде бесцветного масла.
Физические свойства: m/z[M+H]+ 242,1.
[0446]
Стадия 4: Синтез 7-(трет-бутил)-4-хлор-6-метил-7H-пирролo[2,3-d]пиримидина
64 мг 1-(4-(трет-бутиламино)-6-хлорпиримидин-5-ил)пропан-2-она, полученного на стадии 3, и 42 мкл уксусной кислоты растворяли в 5,5 мл этанола и раствор оставляли для взаимодействия в микроволновом реакторе при 120°C в течение 1 часа. После удаления растворителя остаток очищали хроматографией на силикагеле (гексан/этилацетат =1/0 → 4/1), таким образом получая 54 мг указанного в заголовке соединения в виде бесцветного масла.
Физические свойства: m/z[M+H]+ 224,1.
[0447]
Стадия 5: Синтез 7-(трет-бутил)-4-хлор-5-иод-6-метил-7H-пирролo[2,3-d]пиримидина
7-(трет-бутил)-4-хлор-6-метил-7H-пирролo[2,3-d]пиримидин, полученный на стадии 4, растворяли в 1,5 мл DMF. К смеси добавляли 64 мг N-иодсукцинимида и смесь перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли 10% водный раствор тиосульфата натрия для остановки реакции и реакционный раствор экстрагировали этилацетатом. Органический слой промывали водой и насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия, с последующим удалением растворителя. Остаток очищали хроматографией на силикагеле (гексан/этилацетат=1/0 → 4/1), таким образом получая 69 мг указанного в заголовке соединения в виде белого твердого вещества.
Физические свойства: m/z[M+H]+ 349,9.
[0448]
Стадия 6: 7-(трет-бутил)-5-иод-6-метил-7H-пирролo[2,3-d]пиримидин-4-амин
60 мг 7-(трет-бутил)-4-хлор-5-иод-6-метил-7H-пирролo[2,3-d]пиримидина, полученного на стадии 5, подвергали взаимодействию с 600 мкл DME и 600 мкл водного раствора аммиака в стойкой к давлению трубке при 115°C в течение 12 часов. После охлаждения воздухом к реакционной смеси добавляли воду. Полученное белое твердое вещество фильтровали и сушили, таким образом получая 45 мг указанного в заголовке соединения.
Физические свойства: m/z[M+H]+ 331,0.
[0449]
Пример 1: Синтез 4-амино-1-циклопентил-N-(5-этил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
30 мг 4-амино-1-циклопентил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты, полученной на стадии 2 Ссылочного примера 1, 16 мг 5-этил-1H-пиразол-3-амина и 55 мг HATU растворяли в 1 мл DMF и к смеси добавляли 62 мкл диизопропилэтиламина. Смесь перемешивали при комнатной температуре в течение 18 часов и к реакционному раствору добавляли воду, с последующим экстрагированием хлороформом. Органический слой промывали водой и сушили над безводным сульфатом магния, с последующим концентрированием органического раствора при пониженном давлении. Остаток очищали хроматографией на силикагеле (хлороформ → хлороформ/метанол=10/1), таким образом получая 29 мг указанного в заголовке соединения в виде белого твердого вещества.
[0450]
Пример 2: Синтез 4-амино-1-циклопентил-N-(5-(фуран-2-ил)-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой синтеза Примера 1, с использованием 5-(фуран-2-ил)-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (55%) в виде коричневатого твердого вещества.
[0451]
Пример 3: Синтез 4-амино-1-циклопентил-N-(5-(фуран-3-ил)-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой синтеза Примера 1, с использованием 5-(фуран-3-ил)-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (76%) в виде коричневатого твердого вещества.
[0452]
Пример 4: Синтез 4-амино-1-циклопентил-N-(5-(тиофен-2-ил)-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой синтеза Примера 1, с использованием 5-(тиофен-2-ил)-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (60%) в виде коричневатого твердого вещества.
[0453]
Пример 5: Синтез 4-амино-1-циклопентил-N-(5-фенил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой синтеза Примера 1, с использованием 5-фенил-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (77%) в виде коричневатого твердого вещества.
[0454]
Пример 6: Синтез 4-амино-1-циклопентил-N-(5-циклопентил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой синтеза Примера 1, с использованием 5-циклопентил-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (63%) в виде коричневатого твердого вещества.
[0455]
Пример 7: Синтез 4-амино-1-циклопентил-N-(5-циклопропил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой синтеза Примера 1, с использованием 5-циклопропил-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (68%) в виде коричневатого твердого вещества.
[0456]
Пример 8: Синтез 4-амино-1-циклопентил-N-(3-пропил-1H-пиразол-5-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой синтеза Примера 1, с использованием 5-пропил-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (70%) в виде коричневатого твердого вещества.
[0457]
Пример 9: Синтез 4-амино-1-циклопентил-N-(1,3-диметил-1H-пиразол-5-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой синтеза Примера 1, с использованием 1,3-диметил-1H-пиразол-5-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (28%) в виде белого твердого вещества.
[0458]
Пример 10: Синтез 4-амино-1-циклопентил-N-(5-изопропил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой синтеза Примера 1, с использованием 5-изопропил-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (89%) в виде коричневатого твердого вещества.
[0459]
Пример 11: Синтез 4-амино-1-циклобутил-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 1, с использованием бромциклобутана вместо иодциклопентана получали 4-амино-1-циклобутил-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде коричневатого твердого вещества. В соответствии с процедурой Примера 1, с использованием 4-амино-1-циклобутил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-циклопентил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты и с использованием 5-метил-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (50%) в виде коричневатого твердого вещества.
[0460]
Пример 12: Синтез 4-амино-N-(5-метил-1H-пиразол-3-ил)-1-((1-метилциклопропил)метил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 1, с использованием (1-метилциклопропил)метил метансульфоната вместо иодциклопентана получали 4-амино-7-((1-метилциклопропил)метил)-7H-пиразолo[3,4-d]пиримидин-5-карбоновую кислоту в виде коричневатого твердого вещества. В соответствии с процедурой Примера 1, с использованием 4-амино-7-((1-метилциклопропил)метил)-7H-пиразолo[3,4-d]пиримидин-5-карбоновой кислоты вместо 4-амино-1-циклопентил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты и с использованием 5-метил-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (38%) в виде коричневатого твердого вещества.
[0461]
Пример 13: Синтез 4-амино-N-(5-метил-1H-пиразол-3-ил)-1-(2,2,2-трифторэтил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 1, с использованием 2,2,2-трифторэтил метансульфоната вместо иодциклопентана получали 4-амино-1-(2,2,2-трифторэтил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде коричневатого твердого вещества. В соответствии с процедурой Примера 1, с использованием 4-амино-1-(2,2,2-трифторэтил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-циклопентил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты и с использованием 5-метил-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (51%) в виде белого твердого вещества.
[0462]
Пример 14: Синтез 4-амино-N-(5-метил-1H-пиразол-3-ил)-1-(3,3,3-трифторпропил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 1, с использованием 3-бром-1,1,1-трифторпропана вместо иодциклопентана получали 4-амино-1-(3,3,3-трифторпропил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде белого твердого вещества. В соответствии с процедурой Примера 1, с использованием 4-амино-1-(3,3,3-трифторпропил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-циклопентил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты и с использованием 5-метил-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (84%) в виде белого твердого вещества.
[0463]
Пример 15: Синтез 4-амино-1-(втор-бутил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 1, с использованием 2-бромбутана вместо иодциклопентана получали 4-амино-7-(втор-бутил)-7H-пиразолo[2,3-d]пиримидин-5-карбоновую кислоту в виде белого твердого вещества. В соответствии с процедурой Примера 1, с использованием 4-амино-7-(втор-бутил)-7H-пиразолo[2,3-d]пиримидин-5-карбоновой кислоты вместо 4-амино-1-циклопентил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты и с использованием 5-метил-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (62%) в виде коричневатого твердого вещества.
[0464]
Пример 16: Синтез 4-амино-1-(циклобутилметил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 1, с использованием (бромметил)циклобутана вместо иодциклопентана получали 4-амино-1-(циклобутилметил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде белого твердого вещества. В соответствии с процедурой Примера 1, с использованием 4-амино-1-(циклобутилметил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-циклопентил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты и с использованием 5-метил-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение в виде коричневатого твердого вещества (63%).
[0465]
Пример 17: Синтез 4-амино-N-(5-бром-1H-пиразол-3-ил)-1-(циклобутилметил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 1, с использованием (бромметил)циклобутана вместо иодциклопентана получали 4-амино-1-(циклобутилметил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде белого твердого вещества. В соответствии с процедурой Примера 1, с использованием 5-бром-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина и с использованием 4-амино-1-(циклобутилметил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-циклопентил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты получали указанное в заголовке соединение в виде коричневатого твердого вещества (42%).
[0466]
Пример 18: Синтез 4-амино-1-(циклопропилметил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамид
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 1, с использованием (бромметил)циклопропана вместо иодциклопентана получали 4-амино-1-(циклопропилметил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде белого твердого вещества. В соответствии с процедурой Примера 1, с использованием 4-амино-1-(циклопропилметил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-циклопентил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты и с использованием 5-метил-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение в виде коричневатого твердого вещества (71%).
[0467]
Пример 19: Синтез 4-амино-1-(циклопентилметил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 1, с использованием (бромметил)циклопентана вместо иодциклопентана получали 4-амино-1-(циклопентилметил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде коричневатого твердого вещества. В соответствии с процедурой Примера 1, с использованием 4-амино-1-(циклопентилметил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-циклопентил-1H-пиразолo [3,4-d]пиримидин-3-карбоновой кислоты и с использованием 5-метил-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (53%) в виде белого твердого вещества.
[0468]
Пример 20: Синтез 4-амино-N-(5-бром-1H-пиразол-3-ил)-1-(циклопентилметил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 1, с использованием (бромметил)циклопентана вместо иодциклопентана получали 4-амино-1-(циклопентилметил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде коричневатого твердого вещества. В соответствии с процедурой Примера 1, с использованием 5-бром-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина и с использованием 4-амино-1-(циклопентилметил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-циклопентил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты получали указанное в заголовке соединение (61%) в виде коричневатого твердого вещества.
[0469]
Пример 21: Синтез 4-амино-1-изопропил-N-(5-(трифторметил)-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 1, с использованием 2-бромпропана вместо иодциклопентана получали 4-амино-1-изопропил-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде белого твердого вещества. В соответствии с процедурой Примера 1, с использованием 5-(трифторметил)-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина и с использованием 4-амино-1-изопропил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-циклопентил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты получали указанное в заголовке соединение (22%) в виде коричневатого твердого вещества.
[0470]
Пример 22: Синтез 4-амино-N-(5-бром-1H-пиразол-3-ил)-1-изопропил-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 1, с использованием 2-бромпропана вместо иодциклопентана получали 4-амино-1-изопропил-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде белого твердого вещества. В соответствии с процедурой Примера 1, с использованием 5-бром-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина и с использованием 4-амино-1-изопропил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-циклопентил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты получали указанное в заголовке соединение (50%) в виде коричневатого твердого вещества.
[0471]
Пример 23: Синтез 4-амино-N-(5-метил-1H-пиразол-3-ил)-1-((1R,2R)-2-метилциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 1, с использованием [(1S,2R)-2-метилциклогексил]метансульфоната вместо иодциклопентана получали 4-амино-1-((1R,2R)-2-метилциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде коричневатого твердого вещества. В соответствии с процедурой Примера 1, с использованием 4-амино-1-((1R,2R)-2-метилциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-циклопентил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты и с использованием 5-метил-1H-пиразол-3-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (35%) в виде белого твердого вещества.
[0472]
Пример 24: Синтез 4-амино-1-(4,4-диметилциклогексил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
35 мг 4-амино-1-(4,4-диметилциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты, полученной на стадии 2 в Ссылочном примере 2, 14 мг 5-метил-1H-пиразол-3-амина и 55 мг HATU растворяли в 1 мл DMF и к смеси добавляли 63 мкл диизопропилэтиламина. После перемешивания при комнатной температуре в течение 18 часов к реакционному раствору добавляли воду, с последующим экстрагированием хлороформом. Органический слой промывали водой и сушили над безводным сульфатом магния, с последующим концентрированием органического раствора при пониженном давлении. Остаток очищали хроматографией на силикагеле (хлороформ → хлороформ/метанол=10/1), таким образом получая 27 мг указанного в заголовке соединения в виде белого твердого вещества.
[0473]
Пример 25: Синтез 4-амино-N-(5-бром-1H-пиразол-3-ил)-1-(4,4-диметилциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой Примера 24, с использованием 5-бром-1H-пиразол-3-амина вместо 5-метил-1H-пиразол-3-амина получали указанное в заголовке соединение (53%) в виде коричневатого твердого вещества.
[0474]
Пример 26: Синтез 4-амино-1-(3,3-диметилциклобутил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 2, с использованием 3,3-диметилциклобутанола вместо 4,4-диметилциклогексанола получали 4-амино-1-(3,3-диметилциклобутил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде белого твердого вещества. В соответствии с процедурой Примера 24, с использованием 4-амино-1-(3,3-диметилциклобутил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-(4,4-диметилциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты получали указанное в заголовке соединение (47%) в виде коричневатого твердого вещества.
[0475]
Пример 27: Синтез 4-амино-1-(бицикло[2.2.1]гептан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 2, с использованием бицикло[2.2.1]гептан-2-ола вместо 4,4-диметилциклогексанола получали 4-амино-1-(бицикло[2.2.1]гептан)-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде коричневатого твердого вещества. В соответствии с процедурой Примера 24, с использованием 4-амино-1-(бицикло[2.2.1]гептан)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-(4,4-диметилциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты получали указанное в заголовке соединение (57%) в виде коричневатого твердого вещества.
[0476]
Пример 28: Синтез 4-амино-1-(бицикло[2.2.1]гептан-2-ил)-N-(5-бром-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 2, с использованием бицикло[2.2.1]гептан-2-ола вместо 4,4-диметилциклогексанола получали 4-амино-1-(бицикло[2.2.1]гептан)-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде коричневатого твердого вещества. В соответствии с процедурой Примера 24, с использованием 4-амино-1-(бицикло[2.2.1]гептан)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-(4,4-диметилциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты и с использованием 3-бром-1H-пиразол-5-амина вместо 5-метил-1H-пиразол-3-амина получали указанное в заголовке соединение (61%) в виде коричневатого твердого вещества.
[0477]
Пример 29: Синтез 1-(адамантан-2-ил)-4-амино-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 2, с использованием адамантан-2-ола вместо 4,4-диметилциклогексанола получали 1-(адамантан-2-ил)-4-амино-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде коричневатого твердого вещества. В соответствии с процедурой Примера 24, с использованием 1-(адамантан-2-ил)-4-амино-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-(4,4-диметилциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты получали указанное в заголовке соединение (69%) в виде коричневатого твердого вещества.
[0478]
Пример 30: Синтез 4-амино-N-(5-метил-1H-пиразол-3-ил)-1-((2S,3R)-2,6,6-триметилбицикло[3,1,1]гептан-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 2, с использованием (2S,3S)-2,6,6-триметилнорпинан-3-ола вместо 4,4-диметилциклогексанола получали 4-амино-1-((2S,3R)-2,6,6-триметилбицикло[3,1,1]гептан-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде коричневатого твердого вещества. В соответствии с процедурой Примера 24, с использованием 4-амино-1-((2S,3R)-2,6,6-триметилбицикло[3,1,1]гептан-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-(4,4-диметилциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты получали указанное в заголовке соединение (61%) в виде коричневатого твердого вещества.
[0479]
Пример 31: Синтез 4-амино-1-(3-фторпроп-1-ен-2-ил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 2, с использованием 1,3-дифторпропан-2-ола вместо 4,4-диметилциклогексанола получали 4-амино-1-(3-фторпроп-1-ен-2-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде коричневатого твердого вещества. В соответствии с процедурой Примера 24, с использованием 4-амино-1-(3-фторпроп-1-ен-2-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-(4,4-диметилциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты получали указанное в заголовке соединение (65%) в виде коричневатого твердого вещества.
[0480]
Пример 32: Синтез 4-амино-N-(5-бром-1H-пиразол-3-ил)-1-циклогексил-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 2, с использованием циклогексанола вместо 4,4-диметилциклогексанола получали 4-амино-1-циклогексил-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде коричневатого твердого вещества. В соответствии с процедурой Примера 24, с использованием 4-амино-1-циклогексил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-(4,4-диметилциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты и с использованием 3-бром-1H-пиразол-5-амина вместо 5-метил-1H-пиразол-3-амина получали указанное в заголовке соединение (23%) в виде коричневатого твердого вещества.
[0481]
Пример 33: Синтез 4-амино-1-циклогексил-N-(5-(дифторметил)-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 2, с использованием циклогексанола вместо 4,4-диметилциклогексанола получали 4-амино-1-циклогексил-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде коричневатого твердого вещества. В соответствии с процедурой Примера 24, с использованием 4-амино-1-циклогексил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-(4,4-диметилциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты и с использованием 5-(дифторметил)-1H-пиразол-3-амина вместо 5-метил-1H-пиразол-3-амина получали указанное в заголовке соединение (41%) в виде коричневатого твердого вещества.
[0482]
Пример 34: Синтез 4-амино-1-(трет-бутил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
429 мг HATU добавляли к суспензии 177 мг 4-амино-1-(трет-бутил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты, полученной на стадии 2 Ссылочного примера 3, 109 мг o5-метил-1H-пиразол-3-амина и 0,393 мл N,N-диизопропилэтиламина в 4 мл DMF и смесь перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли 100 мкл 5M водного раствора гидроксида натрия и перемешивали в течение 1 часа. Затем смесь нейтрализовали при помощи 5M водного раствора хлористоводородной кислоты. После экстрагирования хлороформом экстракт сушили над безводным сульфатом натрия, фильтровали и концентрировали. Полученный остаток суспендировали и промывали метанолом, фильтровали и сушили при 60°C при пониженном давлении, таким образом получая 97 мг указанного в заголовке соединения в виде бесцветного твердого вещества.
[0483]
Пример 35: Синтез 4-амино-N-(5-бром-1H-пиразол-3-ил)-1-(трет-бутил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой Примера 34, с использованием 3-бром-1H-пиразол-5-амина вместо 5-метил-1H-пиразол-3-амина получали указанное в заголовке соединение в виде бледно-коричневатого твердого вещества (25%).
[0484]
Пример 36: Синтез 4-амино-1-(трет-бутил)-N-(5-(трифторметил)-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой Примера 34, с использованием 5-(трифторметил)-1H-пиразол-3-амина вместо 5-метил-1H-пиразол-3-амина получали указанное в заголовке соединение (72%) в виде бледно-коричневатого твердого вещества.
[0485]
Пример 37: Синтез 4-амино-1-(трет-бутил)-N-(5-(фуран-2-ил)-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой Примера 34, с использованием 3-(фуран-2-ил)-1H-пиразол-5-амина вместо 5-метил-1H-пиразол-3-амина получали указанное в заголовке соединение (32%) в виде бледно-коричневатого твердого вещества.
[0486]
Пример 38: Синтез 4-амино-1-(трет-бутил)-N-(5-циано-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой Примера 34, с использованием 5-амино-1H-пиразол-3-карбонитрила вместо 5-метил-1H-пиразол-3-амина получали указанное в заголовке соединение (22%) в виде коричневатого твердого вещества.
[0487]
Пример 39: Синтез 4-амино-1-(трет-бутил)-N-(5-этил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой синтеза Примера 34, с использованием 3-этил-1H-пиразол-5-амина вместо 5-метил-1H-пиразол-3-амина, с последующей очисткой препаративной обращенно-фазовой ВЭЖХ, получали указанное в заголовке соединение (55%) в виде коричневатого твердого вещества.
[0488]
Пример 40: Синтез 4-амино-1-(трет-бутил)-N-(5-изопропил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой синтеза Примера 34, с использованием 3-изопропил-1H-пиразол-5-амина вместо 5-метил-1H-пиразол-3-амина, с последующей очисткой препаративной обращенно-фазовой ВЭЖХ, получали указанное в заголовке соединение (81%) в виде коричневатого твердого вещества.
[0489]
Пример 41: Синтез 4-амино-1-(трет-бутил)-N-(5-циклопропил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой синтеза Примера 34, с использованием 3-циклопропил-1H-пиразол-5-амина вместо 5-метил-1H-пиразол-3-амина, с последующей очисткой препаративной обращенно-фазовой ВЭЖХ, получали указанное в заголовке соединение (69%) в виде коричневатого твердого вещества.
[0490]
Пример 42: Синтез 4-амино-1-(трет-бутил)-N-(5-циклобутил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой Примера 34, с использованием 3-циклобутил-1H-пиразол-5-амина вместо 5-метил-1H-пиразол-3-амина, с последующей очисткой препаративной обращенно-фазовой ВЭЖХ, получали указанное в заголовке соединение (33%) в виде коричневатого твердого вещества.
[0491]
Пример 43: Синтез 4-амино-1-(4,4-дифторциклогексил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой синтеза Примера 34, с использованием 4-амино-1-(4,4-дифторциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты, полученной на стадии 3 Ссылочного примера 4, вместо 4-амино-1-(трет-бутил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты Примера 34 получали указанное в заголовке соединение (21%) в виде бесцветного твердого вещества.
[0492]
Пример 44: Синтез 4-амино-N-(5-бром-1H-пиразол-3-ил)-1-(4,4-дифторциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой синтеза Примера 34, с использованием 4-амино-1-(4,4-дифторциклогексил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты, полученной на стадии 3 Ссылочного примера 4, вместо 4-амино-1-(трет-бутил)-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты Примера 34 и с использованием 3-бром-1H-пиразол-5-амина вместо 5-метил-1H-пиразол-3-амина получали указанное в заголовке соединение (33%) в виде бесцветного твердого вещества.
[0493]
Пример 45: Синтез 4-амино-7-изопропил-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
121 мг 5-иод-7-изопропил-7H-пирролo[2,3-d]пиримидин-4-амина, полученного на стадии 2 Ссылочного примера 6, 197 мг трет-бутил 5-амино-3-метил-1H-пиразол-1-карбоксилата, полученного в Ссылочном примере 5, и 120 мкл 1,8-диазабицикло[5.4.0]ундец-7-ена растворяли в 2 мл DMA. Затем к смеси добавляли 33 мг комплекса 1,1'-бис(дифенилфосфино)ферроцен-палладий(II) дихлорид-дихлорметан и смесь перемешивали в атмосфере оксида углерода при 110°C в течение 4 часов. Остаток, полученный концентрированием реакционной смеси, очищали хроматографией на силикагеле (гексан/этилацетат=1/1 → этилацетат/метанол=10/1), таким образом получая 52 мг указанного в заголовке соединения в виде бледно-коричневого твердого вещества.
[0494]
Пример 46: Синтез 4-амино-7-(1-фторпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 6, с использованием 1-фторпропан-2-ола вместо пропан-2-ола получали 7-(1-фторпропан-2-ил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амин в виде белого твердого вещества. В соответствии с процедурой Примера 45, с использованием 7-(1-фторпропан-2-ил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина вместо 5-иод-7-изопропил-7H-пирролo[2,3-d]пиримидин-4-амина получали указанное в заголовке соединение в виде коричневатого твердого вещества (90%).
[0495]
Пример 47: Синтез 4-амино-7-(4,4-диметилциклогексил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 6, с использованием 4,4-диметилциклогексанола вместо пропан-2-ола получали 7-(4,4-диметилциклогексил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амин в виде желтого твердого вещества. В соответствии с процедурой Примера 45, с использованием 7-(4,4-диметилциклогексил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина вместо 5-иод-7-изопропил-7H-пирролo[2,3-d]пиримидин-4-амина получали указанное в заголовке соединение (31%) в виде коричневатого твердого вещества.
[0496]
Пример 48: Синтез 4-амино-7-(трет-бутил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
Раствор 6,0 г 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина, полученного на стадии 3 Ссылочного примера 7, 7,48 г трет-бутил 5-амино-3-метил-пиразол-1-карбоксилата, полученного в Ссылочном примере 5, 5,67 мл 1,8-диазабицикло[5.4.0]ундец-7-ена и 1,55 г комплекса 1,1'-бис(дифенилфосфино)ферроцен-палладий(II) дихлорид-дихлорметан в 200 мл DMA перемешивали в атмосфере оксида углерода при 100°C в течение 3 часов. Реакционный раствор концентрировали и затем очищали хроматографией на силикагеле (гексан-этилацетат-метанол), с последующей очисткой хроматографией на щелочном силикагеле, таким образом получая 3,24 г указанного в заголовке соединения в виде коричневатого твердого вещества.
[0497]
Пример 49: Синтез 4-амино-7-(трет-бутил)-N-(5-(фуран-2-ил)-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой Примера 48, с использованием 5-(фуран-2-ил)-1H-пиразол-3-амина вместо трет-бутил 5-амино-3-метил-пиразол-1-карбоксилата, используемого в Примере 48, получали указанное в заголовке соединение (42%) в виде бледно-коричневатого твердого вещества.
[0498]
Пример 50: Синтез 4-амино-7-(1-фтор-2-метилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1, 2 и 3 в Ссылочном примере 7, с использованием 1-фтор-2-метилпропан-2-амин гидрохлорида вместо трет-бутиламина получали 7-(1-фтор-2-метилпропан-2-ил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амин в виде белого твердого вещества. В соответствии с процедурой Примера 48, с использованием 7-(1-фтор-2-метилпропан-2-ил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина вместо 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина получали указанное в заголовке соединение (70%) в виде коричневатого твердого вещества.
[0499]
Пример 51: Синтез 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1, 2 и 3 в Ссылочном примере 7, с использованием 1-метилциклопропанамин гидрохлорида вместо трет-бутиламина получали 5-иод-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-4-амин в виде белого твердого вещества. В соответствии с процедурой Примера 48, с использованием 5-иод-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-4-амина вместо 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина получали указанное в заголовке соединение (37%) в виде коричневатого твердого вещества.
[0500]
Пример 52: Синтез 4-амино-7-(2-циклопропилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1, 2 и 3 в Ссылочном примере 7, с использованием 2-циклопропилпропан-2-амин гидрохлорида вместо трет-бутиламина получали 7-(2-циклопропилпропан-2-ил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амин в виде белого твердого вещества. В соответствии с процедурой Примера 48, с использованием 7-(2-циклопропилпропан-2-ил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина вместо 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина получали указанное в заголовке соединение (60%) в виде коричневатого твердого вещества.
[0501]
Пример 53: Синтез 4-амино-7-(1-метокси-2-метилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1, 2 и 3 в Ссылочном примере 7, с использованием 2-метокси-2-метилпропан-2-амина вместо трет-бутиламина получали 5-иод-7-(1-метокси-2-метилпропан-2-ил)-7H-пирролo[2,3-d]пиримидин-4-амин в виде белого твердого вещества. В соответствии с процедурой Примера 48, с использованием 5-иод-7-(1-метокси-2-метилпропан-2-ил)-7H-пирролo[2,3-d]пиримидин-4-амина вместо 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина получали указанное в заголовке соединение (50%) в виде коричневатого твердого вещества.
[0502]
Пример 54: Синтез 4-амино-7-(1-(фторметил)циклопропил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1, 2 и 3 в Ссылочном примере 7, с использованием 1-(фторметил)циклопропанамин гидрохлорида вместо трет-бутиламина получали 7-(1-(фторметил)циклопропил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амин в виде белого твердого вещества. В соответствии с процедурой Примера 48, с использованием 7-(1-(фторметил)циклопропил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина вместо 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина получали указанное в заголовке соединение (60%) в виде коричневатого твердого вещества.
[0503]
Пример 55: Синтез 4-амино-7-(1-(дифторметил)циклопропил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1, 2 и 3 в Ссылочном примере 7, с использованием 1-(дифторметил)циклопропанамин гидрохлорида вместо трет-бутиламина получали 7-(1-(дифторметил)циклопропил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амин в виде желтого твердого вещества. В соответствии с процедурой Примера 48, с использованием 7-(1-(дифторметил)циклопропил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина вместо 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина получали указанное в заголовке соединение (40%) в виде коричневатого твердого вещества.
[0504]
Пример 56: Синтез 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(2-(тиофен-2-ил)пропан-2-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1, 2 и 3 в Ссылочном примере 7, с использованием 2-(тиофен-2-ил)пропан-2-амина вместо трет-бутиламина получали 5-иод-7-(2-(тиофен-2-ил)пропан-2-ил)-7H-пирролo[2,3-d]пиримидин-4-амин в виде желтого твердого вещества. В соответствии с процедурой Примера 48, с использованием 5-иод-7-(2-(тиофен-2-ил)пропан-2-ил)-7H-пирролo[2,3-d]пиримидин-4-амина вместо 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина получали указанное в заголовке соединение (70%) в виде коричневатого твердого вещества.
[0505]
Пример 57: Синтез 4-амино-7-(3,3-дифторциклопентил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1, 2 и 3 в Ссылочном примере 7, с использованием 3,3-дифторциклопентанамин гидрохлорида вместо трет-бутиламина получали 7-(3,3-дифторциклопентил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амин в виде желтого твердого вещества. В соответствии с процедурой Примера 48, с использованием 7-(3,3-дифторциклопентил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина вместо 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина получали указанное в заголовке соединение (50%) в виде коричневатого твердого вещества.
[0506]
Пример 58: Синтез 4-амино-7-(бицикло[1,1,1]пентан-1-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1, 2 и 3 в Ссылочном примере 7, с использованием бицикло[1,1,1]пентан-1-амин гидрохлорида вместо трет-бутиламина получали 7-(бицикло[1,1,1]пентан-1-ил)-4-хлор-5-иод-7H-пирролo[2,3-d]пиримидин. В соответствии с процедурой Примера 48, с использованием 7-(бицикло[1,1,1]пентан-1-ил)-4-хлор-5-иод-7H-пирролo[2,3-d]пиримидина вместо 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина получали указанное в заголовке соединение (36%) в виде бесцветного твердого вещества.
[0507]
Пример 59: Синтез 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопентил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1, 2 и 3 в Ссылочном примере 7, с использованием 1-метилциклопентанамин гидрохлорида вместо трет-бутиламина получали 5-иод-7-(1-метилциклопентил)-7H-пирролo[2,3-d]пиримидин-4-амин в виде белого твердого вещества. В соответствии с процедурой Примера 48, с использованием 5-иод-7-(1-метилциклопентил)-7H-пирролo[2,3-d]пиримидин-4-амина вместо 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина получали указанное в заголовке соединение (20%) в виде коричневатого твердого вещества.
[0508]
Пример 60: Синтез 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(2-фенилпропан-2-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1, 2 и 3 в Ссылочном примере 7, с использованием 2-фенилпропан-2-амина вместо трет-бутиламина получали 5-иод-7-(2-фенилпропан-2-ил)-7H-пирролo[2,3-d]пиримидин-4-амин в виде желтого твердого вещества. В соответствии с процедурой Примера 48, с использованием 5-иод-7-(2-фенилпропан-2-ил)-7H-пирролo[2,3-d]пиримидин-4-амина вместо 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина получали указанное в заголовке соединение (41%) в виде коричневатого твердого вещества.
[0509]
Пример 61: Синтез 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(2,3,3-триметилбутан-2-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1, 2 и 3 в Ссылочном примере 7, с использованием 2,3,3-триметилбутан-2-амина вместо трет-бутиламина получали 5-иод-7-(2,3,3-триметилбутан-2-ил)-7H-пирролo[2,3-d]пиримидин-4-амин в виде белого твердого вещества. В соответствии с процедурой Примера 48, с использованием 5-иод-7-(2,3,3-триметилбутан-2-ил)-7H-пирролo[2,3-d]пиримидин-4-амина вместо 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина получали указанное в заголовке соединение (60%) в виде коричневатого твердого вещества.
[0510]
Пример 62: Синтез 4-амино-7-(2,3-диметилбутан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1, 2 и 3 в Ссылочном примере 7, с использованием 2,3-диметилбутан-2-амин гидрохлорид вместо трет-бутиламина получали 7-(2,3-диметилбутан-2-ил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амин в виде белого твердого вещества. В соответствии с процедурой Примера 48, с использованием 7-(2,3-диметилбутан-2-ил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина вместо 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина получали указанное в заголовке соединение (50%) в виде коричневатого твердого вещества.
[0511]
Пример 63: Синтез 4-амино-N-(5-бром-1H-пиразол-3-ил)-7-(трет-бутил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
40 мг 4-амино-7-(трет-бутил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты, полученной на стадии 5 Ссылочного примера 7, суспендировали в 2 мл DMF и к смеси добавляли 33 мг 3-бром-1H-пиразол-5-амина, 89 мкл диизопропилэтиламина и 78 мг HATU, с последующим перемешиванием при комнатной температуре в течение ночи. К реакционной смеси добавляли 2 мл водного раствора гидроксида натрия (1 моль/л) и смесь перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь распределяли между этилацетатом и водой. Органический слой промывали водой и насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. После концентрирования остаток очищали хроматографией на силикагеле (этилацетат/метанол=1/0 → 10/1), таким образом получая 6,5 мг указанного в заголовке соединения в виде белого твердого вещества.
[0512]
Пример 64: Синтез 4-амино-7-(трет-бутил)-N-(5-(метоксиметил)-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой Примера 63, с использованием 5-(метоксиметил)-1H-пиразол-3-амина вместо 3-бром-1H-пиразол-5-амина получали указанное в заголовке соединение (24%) в виде белого твердого вещества.
[0513]
Пример 65: Синтез 4-амино-N-(5-бром-1H-пиразол-3-ил)-7-изопропил-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой Примера 63, с использованием 4-амино-7-изопропил-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты, полученной на стадии 3 Ссылочного примера 6, вместо 4-амино-7-(трет-бутил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты получали указанное в заголовке соединение (20%) в виде коричневатого твердого вещества.
[0514]
Пример 66: Синтез 4-амино-N-(5-бром-1H-пиразол-3-ил)-7-(1-фтор-2-метилпропан-2-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой стадии 3 в Ссылочном примере 6, с использованием 7-(1-фтор-2-метилпропан-2-ил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина, используемого в Примере 50, вместо 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина получали 4-амино-7-(1-фтор-2-метилпропан-2-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоновую кислоту. В соответствии с процедурой Примера 63, с использованием 4-амино-7-(1-фтор-2-метилпропан-2-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты вместо 4-амино-7-(трет-бутил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты получали указанное в заголовке соединение (29%) в виде белого твердого вещества.
[0515]
Пример 67: Синтез 4-амино-N-(5-бром-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой стадии 3 в Ссылочном примере 6, с использованием 5-иод-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-4-амина, используемого в Примере 51, вместо 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина получали 4-амино-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоновую кислоту. В соответствии с процедурой Примера 63, с использованием 4-амино-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты вместо 4-амино-7-(трет-бутил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты получали указанное в заголовке соединение (19%) в виде белого твердого вещества.
[0516]
Пример 68: Синтез 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклобутил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1-5 в Ссылочном примере 7, с использованием 1-метилциклобутан-амин гидрохлорида вместо трет-бутиламина получали 4-амино-7-(метил циклобутил)-7H-пирролo[2,3-d]пиримидин-5-карбоновую кислоту в виде белого твердого вещества. В соответствии с процедурой Примера 63, с использованием 4-амино-7-(метил циклобутил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты вместо 4-амино-7-(трет-бутил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты и с использованием 5-метил-1H-пиразол-3-амина вместо 3-бром-1H-пиразол-5-амина получали указанное в заголовке соединение (15%) в виде коричневатого твердого вещества.
[0517]
Пример 69: Синтез 4-амино-7-циклобутил-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1-5 в Ссылочном примере 7, с использованием циклобутанамина вместо трет-бутиламина получали 4-амино-7-циклобутил-7H-пирролo[2,3-d]пиримидин-5-карбоновую кислоту. В соответствии с процедурой Примера 63, с использованием 4-амино-7-циклобутил-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты вместо 4-амино-7-(трет-бутил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты и с использованием 5-метил-1H-пиразол-3-амина вместо 3-бром-1H-пиразол-5-амина получали указанное в заголовке соединение (8%) в виде коричневатого твердого вещества.
[0518]
Пример 70: Синтез 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(трет-пентил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1-5 в Ссылочном примере 7, с использованием 2-метилбутан-2-амина вместо трет-бутиламина получали 4-амино-7-(трет-пентил)-7H-пирролo[2,3-d]пиримидин-5-карбоновую кислоту в виде белого твердого вещества. В соответствии с процедурой Примера 63, с использованием 4-амино-7-(трет-пентил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты вместо 4-амино-7-(трет-бутил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты и с использованием 5-метил-1H-пиразол-3-амина вместо 3-бром-1H-пиразол-5-амина получали указанное в заголовке соединение (16%) в виде коричневатого твердого вещества.
[0519]
Пример 71: Синтез 4-амино-7-(бицикло[2.2.1]гептан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1-5 в Ссылочном примере 7, с использованием бицикло[2.2.1]гептан-2-амина вместо трет-бутиламина получали 4-амино-7-(бицикло[2.2.1]гептан-2-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоновую кислоту в виде белого твердого вещества. В соответствии с процедурой Примера 63, с использованием 4-амино-7-(бицикло[2.2.1]гептан-2-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты вместо 4-амино-7-(трет-бутил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты и с использованием 5-метил-1H-пиразол-3-амина вместо 3-бром-1H-пиразол-5-амина получали указанное в заголовке соединение (8%) в виде коричневатого твердого вещества.
[0520]
Пример 72: Синтез 4-амино-7-циклопентил-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1-3 в Ссылочном примере 6, с использованием циклопентанола вместо пропан-2-ола получали 4-амино-7-циклопентил-7H-пирролo[2,3-d]пиримидин-5-карбоновую кислоту в виде белого твердого вещества. В соответствии с процедурой Примера 63, с использованием 4-амино-7-циклопентил-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты вместо 4-амино-7-(трет-бутил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты и с использованием 5-метил-1H-пиразол-3-амина вместо 3-бром-1H-пиразол-5-амина получали указанное в заголовке соединение (15%) в виде белого твердого вещества.
[0521]
Пример 73: Синтез 4-амино-7-(трет-бутил)-6-метил-N-(3-метил-1H-пиразол-5-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой Примера 48, с использованием 7-(трет-бутил)-5-иод-6-метил-7H-пирролo[2,3-d]пиримидин-4-амина, полученного на стадии 6 Ссылочного примера 8, вместо 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина для осуществления реакции получали указанное в заголовке соединение (6,7%) в виде белого твердого вещества.
[0522]
Пример 74: Синтез 7-([1,1'-би(циклопропан)]-1-ил)-4-амино-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурами синтеза стадий 1, 2 и 3 в Ссылочном примере 7, с использованием 1-циклопропил циклопропанамин гидрохлорида вместо трет-бутиламина получали 7-([1,1'-би(циклопропан)]-1-ил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амин в виде коричневатого твердого вещества. В соответствии с процедурой Примера 48, с использованием 7-([1,1'-би(циклопропан)]-1-ил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина вместо 7-(трет-бутил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина получали указанное в заголовке соединение (59%) в виде коричневатого твердого вещества.
[0523]
Пример 75: Синтез 4-амино-6-хлор-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
Стадия 1: Синтез метил 4-амино-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксилата
12,1 г триэтиламина и 2,25 г комплекса [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид-дихлорметан добавляли к суспензии 18,85 г 5-иод-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-4-амина, полученного в качестве промежуточного соединения в Примере 51, в 180 мл метанола. Смесь перемешивали в атмосфере оксида углерода в автоклаве при 0,5 МПа и при 100°C в течение 1,5 часа. После охлаждения растворитель удаляли и остаток растворяли в 300 мл хлороформа. К смеси добавляли 20 г Целита, с последующим перемешиванием при комнатной температуре в течение 1 часа. Нерастворимое вещество удаляли фильтрованием и фильтрат промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и фильтровали, с последующим концентрированием. Полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол=100/1 → 20/1) и растворитель удаляли. Полученное твердое вещество суспендировали и промывали этилацетатом, таким образом получая 11,6 г указанного в заголовке соединения.
[0524]
Стадия 2: Синтез метил 4-амино-6-хлор-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксилатм
1,71 г метил 4-амино-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксилатм, полученного на стадии 1, растворяли в 17 мл DMF и к смеси добавляли 1,39 г N-хлорсукцинимида, с последующим перемешиванием при 50°C в течение 2 часов. К реакционному раствору добавляли 80 мл 10% водного раствора тиосульфата натрия и 120 мл воды и смесь перемешивали при охлаждении льдом в течение 3 часов, с последующим перемешиванием при комнатной температуре в течение ночи. Осадок собирали фильтрованием и промывали водой, таким образом получая 1,13 г указанного в заголовке соединения.
[0525]
Стадия 3: Синтез 4-амино-6-хлор-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты
272 мг метил 4-амино-6-хлор-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксилата, полученного на стадии 2, растворяли в 2,7 мл ТГФ и к смеси добавляли 2,7 мл метанола и 1,45 мл водного раствора гидроксида лития (4 моль/л), с последующим перемешиванием при комнатной температуре в течение ночи. К реакционному раствору добавляли 20 мл воды и 2N водный раствор хлористоводородной кислоты для подкисления раствора с получением осадка. Органический растворитель удаляли и остаток перемешивали при охлаждении льдом в течение 1 часа, с последующим фильтрованием, таким образом получая 248 мг указанного в заголовке соединения.
[0526]
Стадия 4: Синтез 4-амино-6-хлор-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
2,5 мл DMF добавляли к 48 мг 4-амино-6-хлор-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты, полученной на стадии 3, и затем к смеси добавляли 33 мг 1-гидроксибензтриазола и 38 мг 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорида, с последующим перемешиванием при комнатной температуре в течение 1,5 часа. К реакционному раствору добавляли 106 мг трет-бутил 5-амино-3-метил-1H-пиразол-1-карбоксилата, синтезированного в Ссылочном примере 5, и смесь охлаждали до 0°C. Затем к смеси добавляли 0,45 мл раствора гексаметилдисилазида лития (1M ТГФ), с последующим перемешиванием при 0°C в течение 30 минут. К реакционному раствору добавляли 5 мл 1N водного раствора гидроксида натрия и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор распределяли между этилацетатом и водой. Органический слой промывали водой три раза и промывали насыщенным водным раствором хлорида натрия, с последующей сушкой над безводным сульфатом натрия. После фильтрования полученный раствор концентрировали. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/метанол=1/0 → 8/1), таким образом получая 15 мг указанного в заголовке соединения.
[0527]
Пример 76: Синтез 4-амино-6-бром-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
Стадия 1: Синтез метил 4-амино-6-бром-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксилата
2,3 г метил 4-амино-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксилата, полученного на стадии 1 Примера 75, растворяли в 47 мл хлороформа и к смеси добавляли 3,3 г N-бромсукцинимида, с последующим перемешиванием при комнатной температуре в течение 3 дней. Реакционный раствор распределяли между хлороформом и 10% водным раствором тиосульфата натрия. Органический слой промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали. К остатку добавляли метанол и воду с образованием суспензии, затем метанол удаляли. Остаток перемешивали при 0°C в течение 1 часа и твердое вещество собирали фильтрованием, таким образом получая 2,50 г указанного в заголовке соединения.
[0528]
Стадия 2: Синтез 4-амино-6-бром-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты
В соответствии с процедурой стадии 3 в Примере 75, с использованием 1,10 г метил 4-амино-6-бром-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксилата, полученного на стадии 1, получали указанное в заголовке соединение (97%).
[0529]
Стадия 3: Синтез 4-амино-6-бром-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой стадии 4 в Примере 75, с использованием 238 мг 4-амино-6-бром-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты, полученной на стадии 2, получали указанное в заголовке соединение (26%).
[0530]
Пример 77: Синтез 4-амино-6-метокси-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамид
Стадия 1: Синтез 4-амино-6-метокси-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты
560 мг метил 4-амино-6-хлор-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксилата, полученного на стадии 2 Примера 75, суспендировали в 10 мл ТГФ и к суспензии добавляли 121 мг 4-диметиламинопиридина и 1,52 г ди-трет-бутилдикарбоната при перемешивании. Смесь перемешивали при 50°C в течение 1 часа. После охлаждения реакционный раствор концентрировали и распределяли между этилацетатом и водой. Органический слой промывали водой и насыщенным водным раствором хлорида натрия. Добавляли безводный сульфат натрия и смесь фильтровали и концентрировали. К остатку добавляли 10 мл метанола и к смеси добавляли при перемешивании 1 мл метоксида натрия (раствор в метаноле примерно 5 моль/л), с последующим перемешиванием при 50°C в течение 1 часа. После охлаждения смесь концентрировали и остаток распределяли между хлороформом и насыщенным раствором хлорида аммония. Органический слой промывали водой и насыщенным водным раствором хлорида натрия. Добавляли безводный сульфат натрия и смесь фильтровали и концентрировали. К остатку добавляли 1 мл дихлорметана и 2 мл трифторуксусной кислоты и смесь перемешивали при комнатной температуре в течение 1 часа. После концентрирования остаток распределяли между хлороформом и насыщенным водным раствором бикарбоната натрия. Органический слой промывали водой и насыщенным водным раствором хлорида натрия. Добавляли безводный сульфат натрия и смесь фильтровали и концентрировали. Остаток растворяли в 20 мл метанола и к смеси добавляли 2,3 мл водного раствора гидроксида натрия (4 моль/л и смесь перемешивали при 50°C в течение 1 часа, с последующим перемешиванием при 80°C в течение 1 часа. После охлаждения к реакционному раствору добавляли 20 мл воды и 2N водный раствор хлористоводородной кислоты для подкисления раствора, с получением осадка. Органический растворитель удаляли, затем остаток перемешивали при охлаждении льдом в течение 1 часа и фильтровали, таким образом получая 417 мг указанного в заголовке соединения.
[0531]
Стадия 2: Синтез 4-амино-6-метокси-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой стадии 4 в Примере 75, с использованием 30 мг 4-амино-6-метокси-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты, полученной на стадии 1, получали указанное в заголовке соединение (36%).
[0532]
Пример 78: Синтез 4-амино-6-хлор-7-(1-фтор-2-метилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой стадии 4 в Примере 75, с использованием 30 мг 4-амино-6-хлор-7-(1-фтор-2-метилпропан-2-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты, которая была синтезирована с использованием 7-(1-фтор-2-метилпропан-2-ил)-5-иод-7H-пирролo[2,3-d]пиримидин-4-амина, полученного в качестве промежуточного соединения в Примере 50, в соответствии с процедурами стадий 1-3 в Примере 75, получали указанное в заголовке соединение (16%).
[0533]
Пример 79: Синтез 4-амино-6-(3-гидрокси-3-метил-1-бутин-1-ил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
35 мг 4-амино-6-бром-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида, полученного в Примере 76, растворяли в 1 мл DMF. К смеси добавляли 1,7 мг иодида меди, 87 мкл 2-метил-3-бутин-1-ола, 31 мкл триэтиламина и 10 мг тетракис-трифенилфосфинпалладия и дегазировали, с последующим перемешиванием при 100°C в течение 2 часов. Реакционный раствор распределяли между хлороформом и водой. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и фильтровали, с последующим концентрированием. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/метанол=1/0 → 4/1), таким образом получая 14 мг указанного в заголовке соединения.
[0534]
Пример 80: Синтез 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-6-(пиридин-3-илэтинил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой Примера 79, с использованием 3-этинилпиридина вместо 2-метил-3-бутин-1-ола получали указанное в заголовке соединение (72%).
[0535]
Пример 81: Синтез 4-амино-6-((1-гидроксициклопентил)этинил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой Примера 79, с использованием 1-этинилциклопентан-1-ола вместо 2-метил-3-бутин-1-ола получали указанное в заголовке соединение (18%).
[0536]
Пример 82: Синтез 4-амино-6-((1-метил-1H-пиразол-4-ил)этинил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой Примера 79, с использованием 4-этинил-1-метил-1H-пиразола вместо 2-метил-3-бутин-1-ола получали указанное в заголовке соединение (43%).
[0537]
Пример 83: Синтез 4-амино-6-((1-метил-1H-имидазол-5-ил)этинил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой Примера 79, с использованием 5-этинил-1-метил-1H-имидазола вместо 2-метил-3-бутин-1-ола получали указанное в заголовке соединение (57%).
[0538]
Пример 84: Синтез 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-6-(3-морфолино-1-пропин-1-ил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой Примера 79, с использованием 4-(2-пропин-1-ил)морфолина вместо 2-метил-3-бутин-1-ола получали указанное в заголовке соединение (39%).
[0539]
Пример 85: Синтез 4-амино-6-(3-(1-гидроксициклобутил)-1-propyne)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой Примера 79, с использованием 1-(2-пропин-1-ил)циклобутан-1-ола вместо 2-метил-3-бутин-1-ола получали указанное в заголовке соединение (58%).
[0540]
Пример 86: Синтез 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-6-((тетрагидро-2H-пиран-4-ил)этинил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой Примера 79, с использованием 4-этинилтетрагидро-2H-пирана вместо 2-метил-3-бутин-1-ола получали указанное в заголовке соединение (56%).
[0541]
Пример 87: Синтез 4-амино-N-(5-метил-1H-пиразол-3-ил)-6-((1-метил-1H-пиразол-3-ил)этинил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой Примера 79, с использованием 3-этинил-1-метил-пиразола вместо 2-метил-3-бутин-1-ола получали указанное в заголовке соединение (28%).
[0542]
Пример 88: Синтез 4-амино-6-(имидазо[1,2-b]пиридазин-3-илэтинил)-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой Примера 79, с использованием 1-этинилимидазо[1,2-b]пиридазина вместо 2-метил-3-бутин-1-ола получали указанное в заголовке соединение (19%).
[0543]
Пример 89: Синтез 4-амино-6-этокси-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
Стадия 1: Синтез 4-амино-6-этокси-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты
630 мг метил 4-амино-6-бром-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксилата, полученного на стадии 1 Примера 76, суспендировали в 10 мл ТГФ. К смеси добавляли 119 мг 4-диметиламинопиридина и 1,27 г ди-трет-бутилдикарбоната при перемешивании и раствор перемешивали при 50°C в течение 1 часа. После охлаждения реакционный раствор концентрировали и распределяли между этилацетатом и водой. Органический слой промывали водой и насыщенным водным раствором хлорида натрия. К смеси добавляли безводный сульфат натрия и смесь фильтровали и концентрировали. К остатку добавляли 15 мл этанола и также добавляли 2,28 мл этоксида натрия (28% раствор в этаноле) при перемешивании, с последующим перемешиванием при комнатной температуре в течение ночи. Реакционный раствор нейтрализовали при помощи 2N водного раствора хлористоводородной кислоты и затем концентрировали. Остаток распределяли между хлороформом и водой. Органический слой промывали насыщенным водным раствором хлорида натрия и к смеси добавляли безводный сульфат. После фильтрования полученный раствор концентрировали. К остатку добавляли 3 мл дихлорметана и 6 мл трифторуксусной кислоты и смесь перемешивали при комнатной температуре в течение 1,5 часа. После концентрирования остаток распределяли между хлороформом и насыщенным водным раствором бикарбоната натрия. Органический слой промывали водой и насыщенным водным раствором хлорида натрия и к смеси добавляли безводный сульфат натрия, с последующим фильтрованием и концентрированием. Остаток растворяли в 20 мл метанола и к смеси добавляли 3,88 мл водного раствора гидроксида натрия (4 моль/л), с последующим перемешиванием при 60°C в течение 3 часов. После охлаждения к реакционному раствору добавляли 50 мл воды и 2N водный раствор хлористоводородной кислоты для подкисления раствора, с получением осадка. Органический растворитель удаляли и остаток перемешивали при охлаждении льдом в течение 1 часа, с последующим фильтрованием, таким образом получая 432 мг указанного в заголовке соединения.
[0544]
Стадия 2: Синтез 4-амино-6-этокси-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
1,2 мл DMF добавляли к 67 мг 4-амино-6-этокси-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты, полученной на стадии 1, и затем к смеси добавляли 41 мг 1-гидроксибензотриазола и 51 мг 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорида, с последующим перемешиванием при комнатной температуре в течение 2 часов. К реакционному раствору добавляли 143 мг трет-бутил 5-амино-3-метил-1H-пиразол-1-карбоксилата, синтезированного в Ссылочном примере 5, и к смеси добавляли 0,60 мл раствора трет-бутоксида натрия (2M ТГФ) при комнатной температуре. После перемешивания в течение 30 минут к реакционному раствору добавляли 5 мл 1N водного раствора гидроксида натрия, с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционный раствор распределяли между этилацетатом и водой и органический слой промывали водой три раза и промывали насыщенным водным раствором хлорида натрия. После сушки над безводным сульфатом натрия полученный раствор фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/метанол=1/0 → 5/1), таким образом получая 33 мг указанного в заголовке соединения.
[0545]
Пример 90: Синтез (R)-4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-6-((тетрагидрофуран-2-ил)метокси)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
Стадия 1: Синтез метил 4-(бис(трет-бутоксикарбонил)амино)-6-хлор-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксилата
351 мг метил 4-амино-6-хлор-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксилата, полученного на стадии 2 Примера 75, суспендировали в 6,3 мл ТГФ и к смеси добавляли 76 мг 4-диметиламинопиридина и 818 мг ди-трет-бутилдикарбоната при перемешивании. Раствор затем перемешивали при 60°C в течение 1 часа. После охлаждения реакционный раствор концентрировали и остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат=4/1 → 2/3), таким образом получая 523 мг указанного в заголовке соединения.
[0546]
Стадия 2: Синтез (R)-метил 4-(бис(трет-бутоксикарбонил)амино)-7-(1-метилциклопропил)-6-((тетрагидрофуран-2-ил)метокси)-7H-пирролo[2,3-d]пиримидин-5-карбоксилата
86 мкл (R)-(-)-тетрагидрофурфурилового спирта добавляли к суспензии 35 мг гидрида натрия (60%) в 1 мл DMF при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 30 минут. К этому раствору добавляли раствор 212 мг метил 4-(бис(трет-бутоксикарбонил)амино)-6-хлор-7-(1-метилциклопропил)-7H-пирролo[2,3-d]пиримидин-5-карбоксилата, полученного на стадии 1, в 1 мл DMF и смесь перемешивали при комнатной температуре в течение 1,5 часа. Реакционный раствор распределяли между хлороформом и водой и органический слой промывали насыщенным водным раствором хлорида натрия. К смеси добавляли безводный сульфат натрия и смесь фильтровали и затем концентрировали. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат=4/1 → 2/3), таким образом получая 141 мг указанного в заголовке соединения.
[0547]
Стадия 3: Синтез (R)-4-амино-7-(1-метилциклопропил)-6-((тетрагидрофуран-2-ил)метокси)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты
1,5 мл хлороформа и 2 мл трифторуксусной кислоты добавляли к 141 мг (R)-метил 4-(бис(трет-бутоксикарбонил)амино)-7-(1-метилциклопропил)-6-((тетрагидрофуран-2-ил)метокси)-7H-пирролo[2,3-d]пиримидин-5-карбоксилата, полученного на стадии 2, и смесь перемешивали при комнатной температуре в течение 1,5 часа. После концентрирования к остатку добавляли 2 мл метанола и 2 мл тетрагидрофурана и затем к смеси добавляли 1,29 мл водного раствора гидроксида натрия (4 моль/л), с последующим перемешиванием при 60°C в течение 3 часов. После охлаждения к реакционному раствору добавляли 10 мл воды и 2N водный раствор хлористоводородной кислоты для подкисления раствора, с получением осадка. Органический растворитель удаляли, затем остаток перемешивали при охлаждении льдом в течение 1 часа, с последующим фильтрованием, таким образом получая 52 мг указанного в заголовке соединения.
[0548]
Стадия 4: Синтез (R)-4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-6-((тетрагидрофуран-2-ил)метокси)-7H-пирролo[2,3-d]пиримидин-5-карбоксамида
В соответствии с процедурой стадии 2 в Примере 89, с использованием 52 мг (R)-4-амино-7-(1-метилциклопропил)-6-((тетрагидрофуран-2-ил)метокси)-7H-пирролo[2,3-d]пиримидин-5-карбоновой кислоты, полученной на стадии 1, получали указанное в заголовке соединение (39%).
[0549]
Сравнительный пример 1: Синтез 4-амино-1-циклопентил-N-(4-фтор-1H-индазол-3-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурой синтеза Примера 1, с использованием 4-фтор-1H-индазол-3-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (48%) в виде коричневатого твердого вещества.
[0550]
Сравнительный пример 2: Синтез 4-амино-1-циклобутил-N-(4-метилтиазол-2-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 1, с использованием бромциклобутана вместо иодциклопентана получали 4-амино-1-циклобутил-1H-пиразолo[3,4-d]пиримидин-3-карбоновую кислоту в виде коричневатого твердого вещества. В соответствии с процедурой синтеза Примера 1, с использованием 4-амино-1-циклобутил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-циклопентил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты и с использованием 4-метилтиазол-2-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (83%) в виде коричневатого твердого вещества.
[0551]
Сравнительный пример 3: Синтез 4-амино-1-циклобутил-N-(4-метил-1H-имидазол-2-ил)-1H-пиразолo[3,4-d]пиримидин-3-карбоксамида
В соответствии с процедурами синтеза стадий 1 и 2 в Ссылочном примере 1, с использованием бромциклобутана вместо иодциклопентана получали 4-амино-1-циклобутил-1H-пиразолo[2,3-d]пиримидин-3-карбоновую кислоту в виде коричневатого твердого вещества. В соответствии с процедурой синтеза Примера 1, с использованием 4-амино-1-циклобутил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты вместо 4-амино-1-циклопентил-1H-пиразолo[3,4-d]пиримидин-3-карбоновой кислоты и с использованием 4-метил-1H-имидазол-2-амина вместо 5-этил-1H-пиразол-3-амина получали указанное в заголовке соединение (58%) в виде коричневатого твердого вещества.
[0552]
Сравнительный пример 4: Синтез 1-(трет-бутил)-3-(п-толил)пиразолo[3,4-d]пиримидин-4-амина
В соответствии с процедурой синтеза, описанной в Tetrahedron Letters, 52(44), 5761-5763; 2011, получали указанное в заголовке соединение (30%) в виде белого твердого вещества.
[0553]
Таблицы 1-14 показывают формулы и физические свойства соединений, полученных в Примерах и Сравнительных примерах.
[0554]
Таблица 1
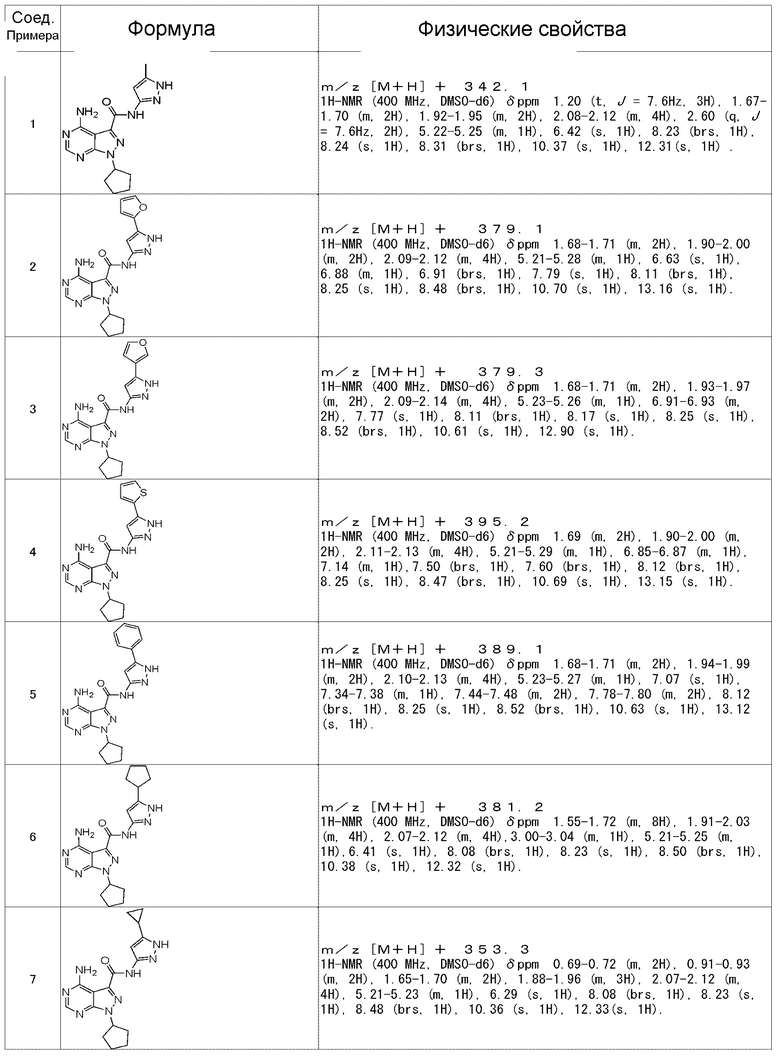
Примечание: В таблицах и рисунках ʺComp.ʺ означает соединения и ʺEx.ʺ означает Примеры.
[0555]
Таблица 2
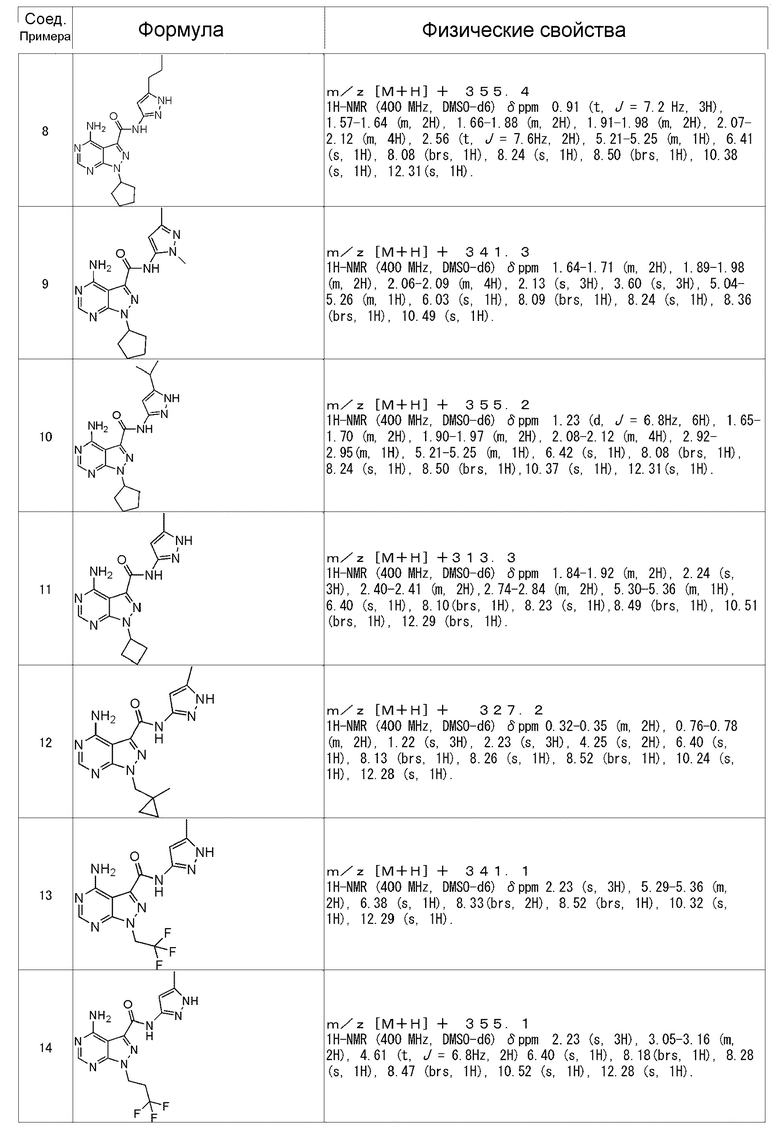
[0556]
Таблица 3
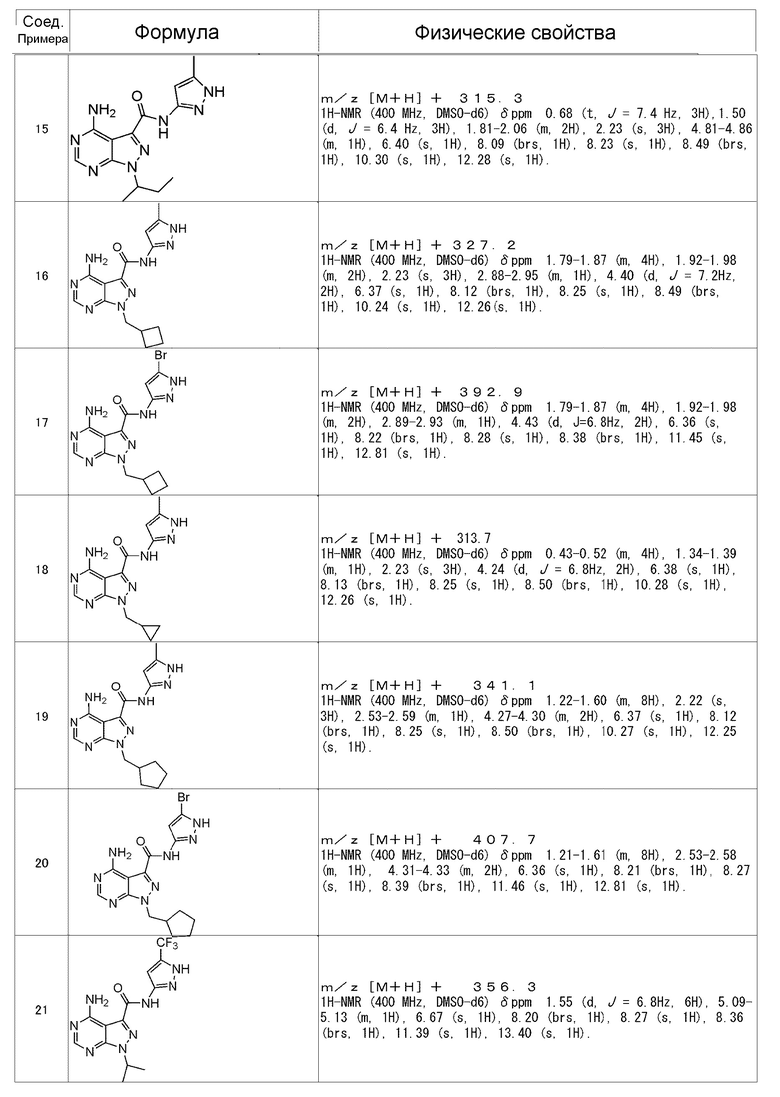
[0557]
Таблица 4

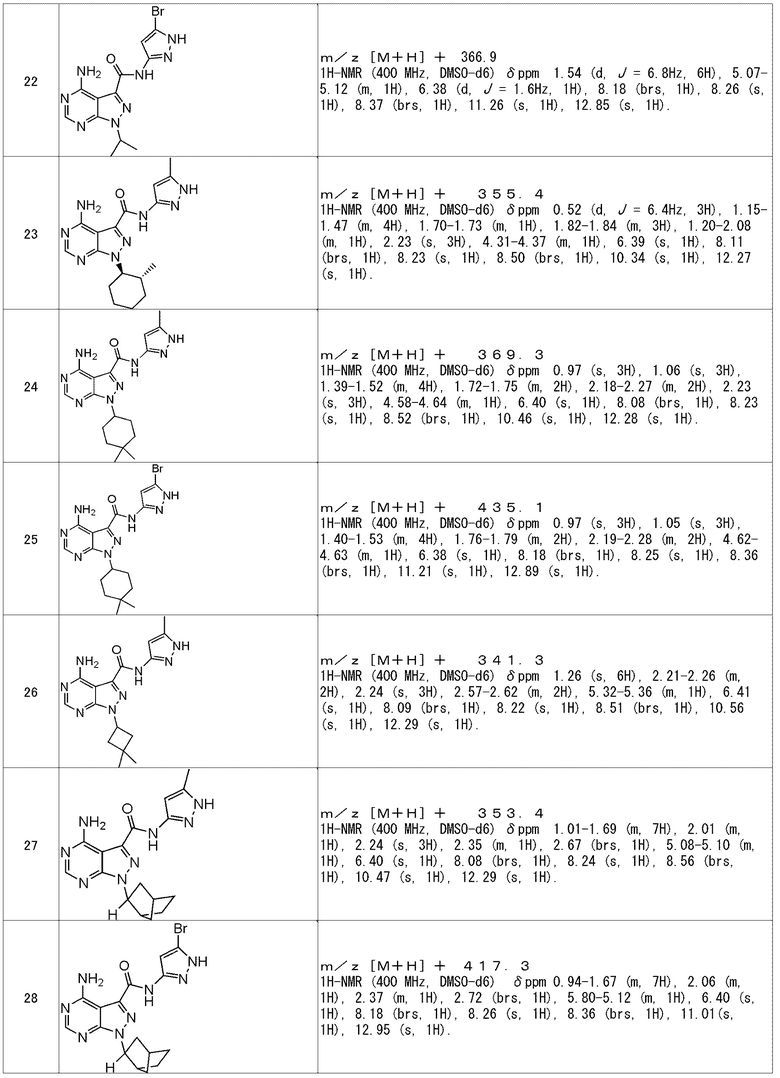
[0558]
Таблица 5
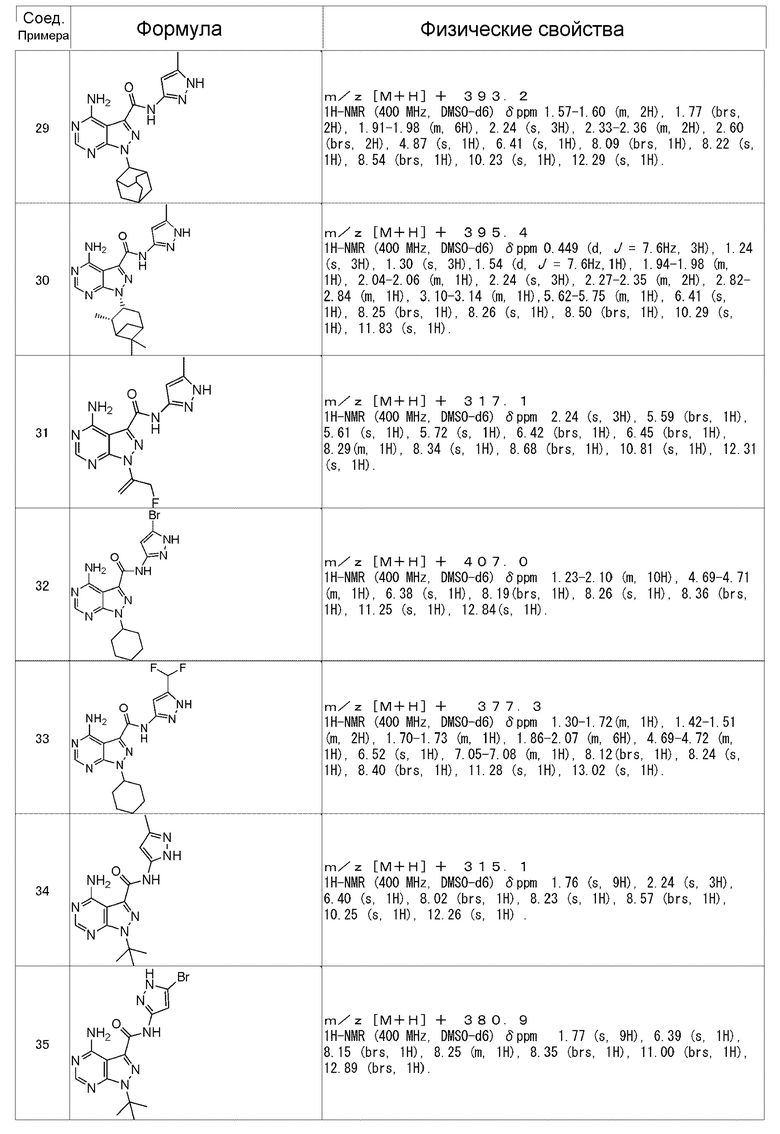
[0559]
Таблица 6

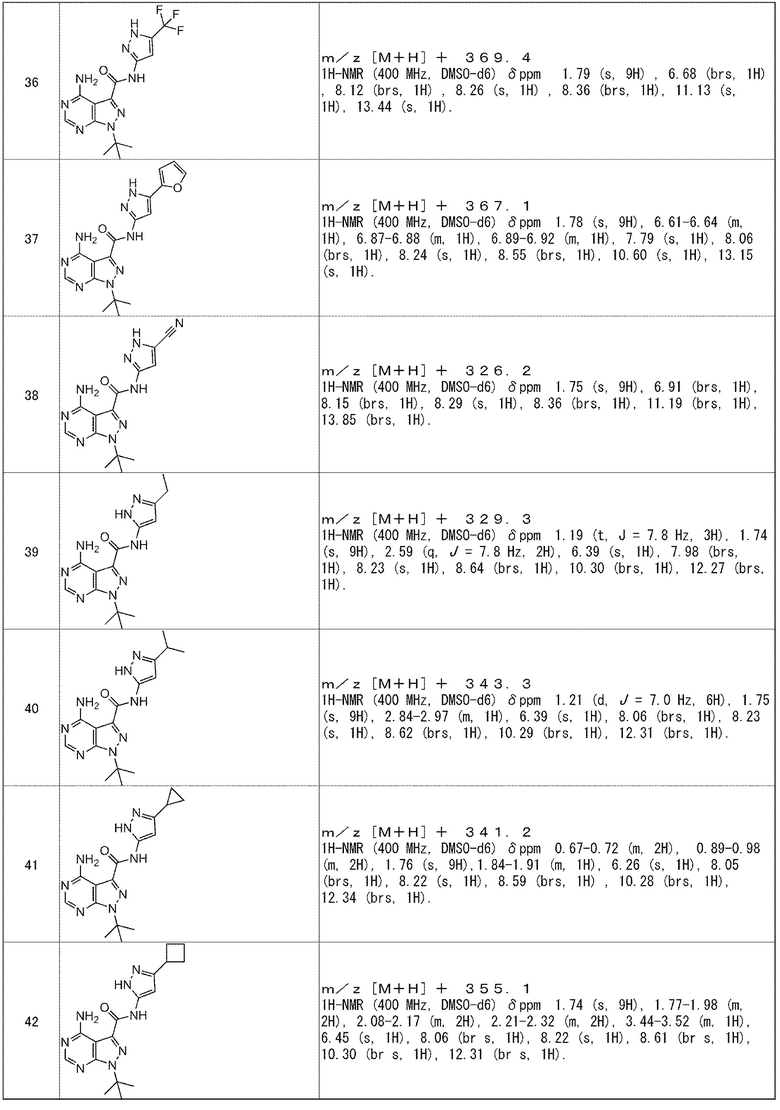
[0560]
Таблица 7

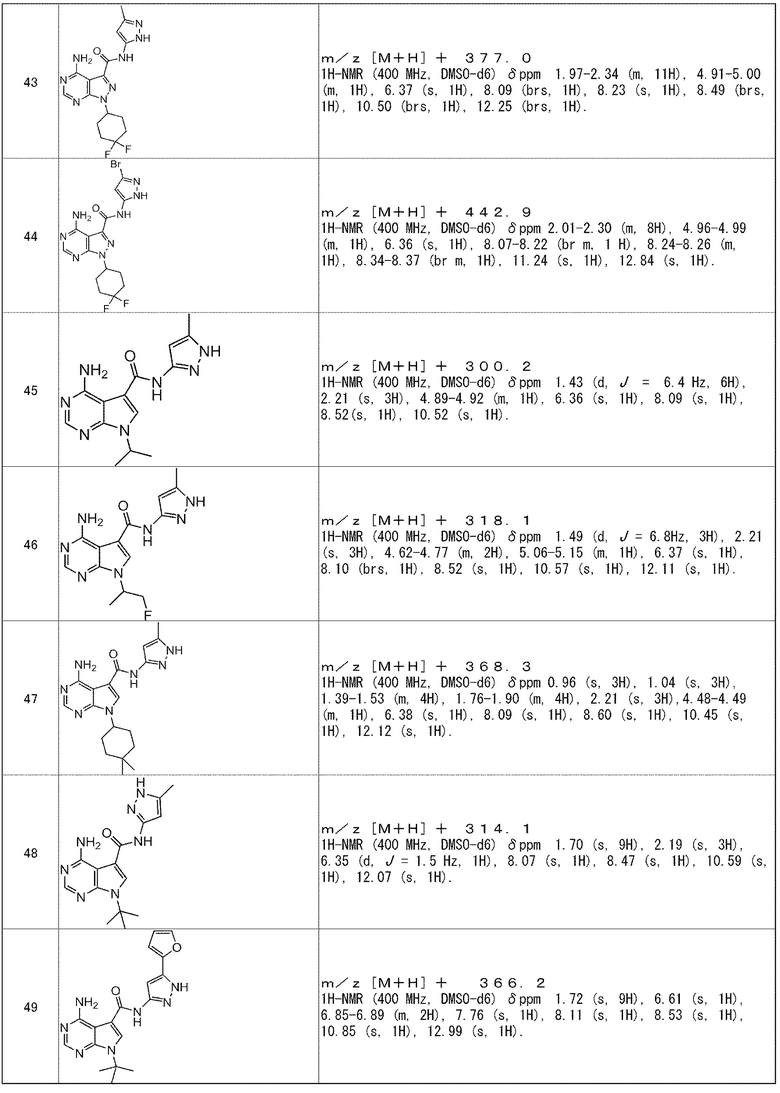
[0561]
Таблица 8

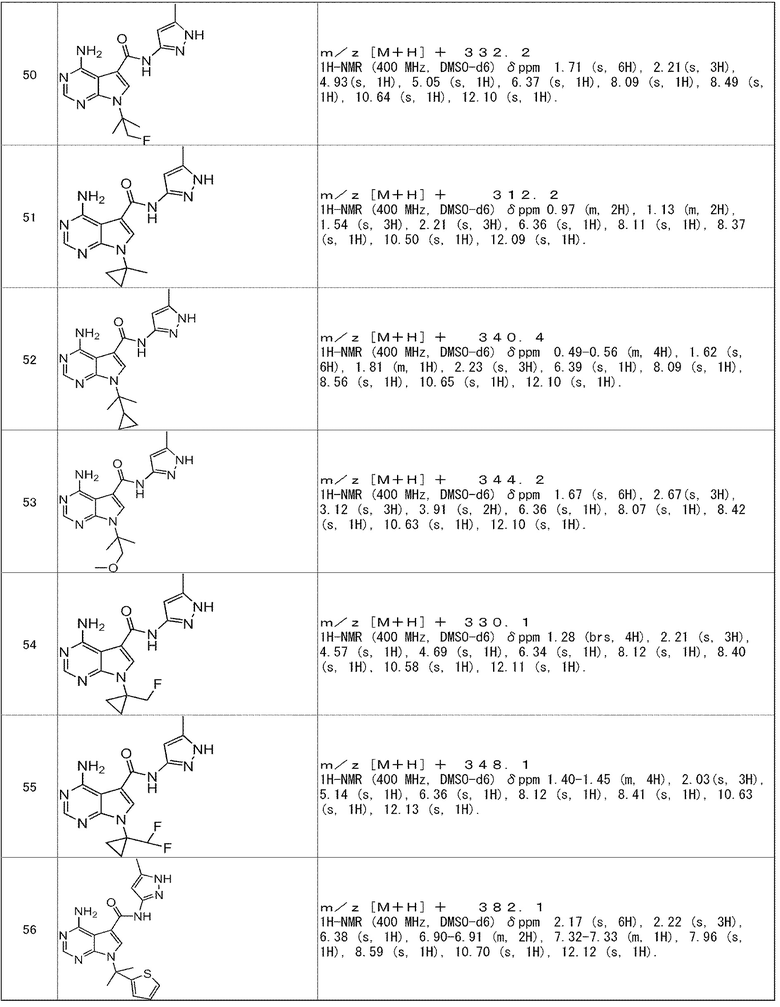
[0562]
Таблица 9

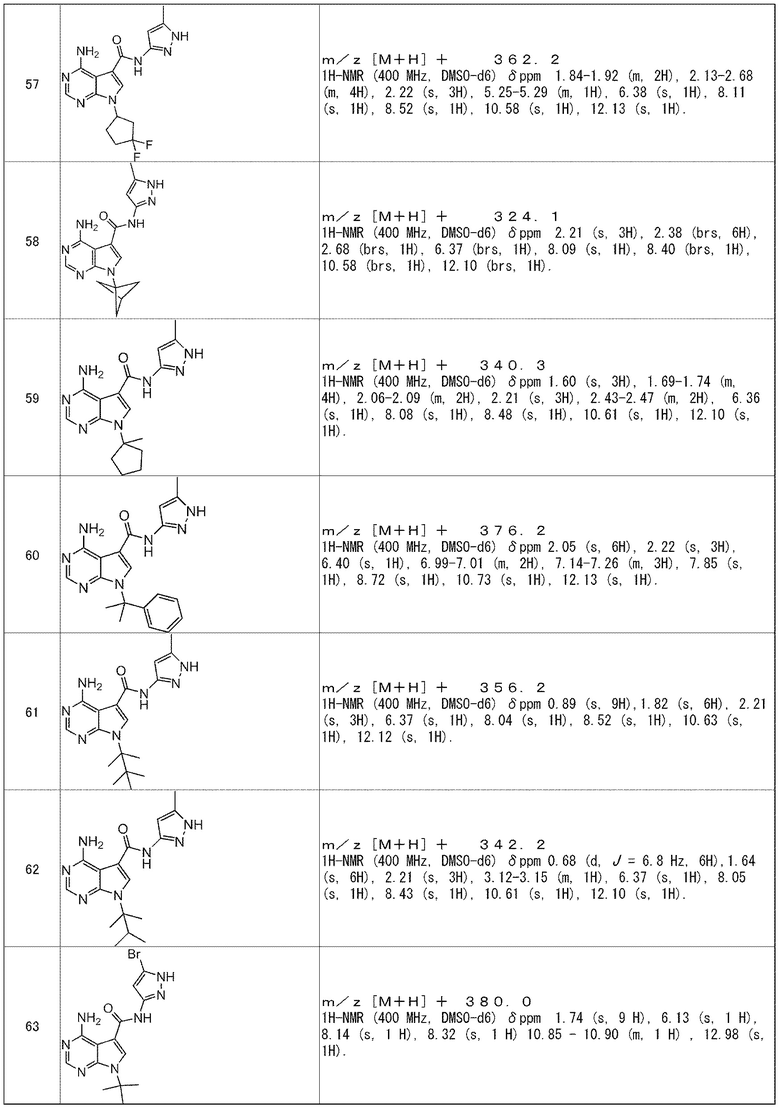
[0563]
Таблица 10

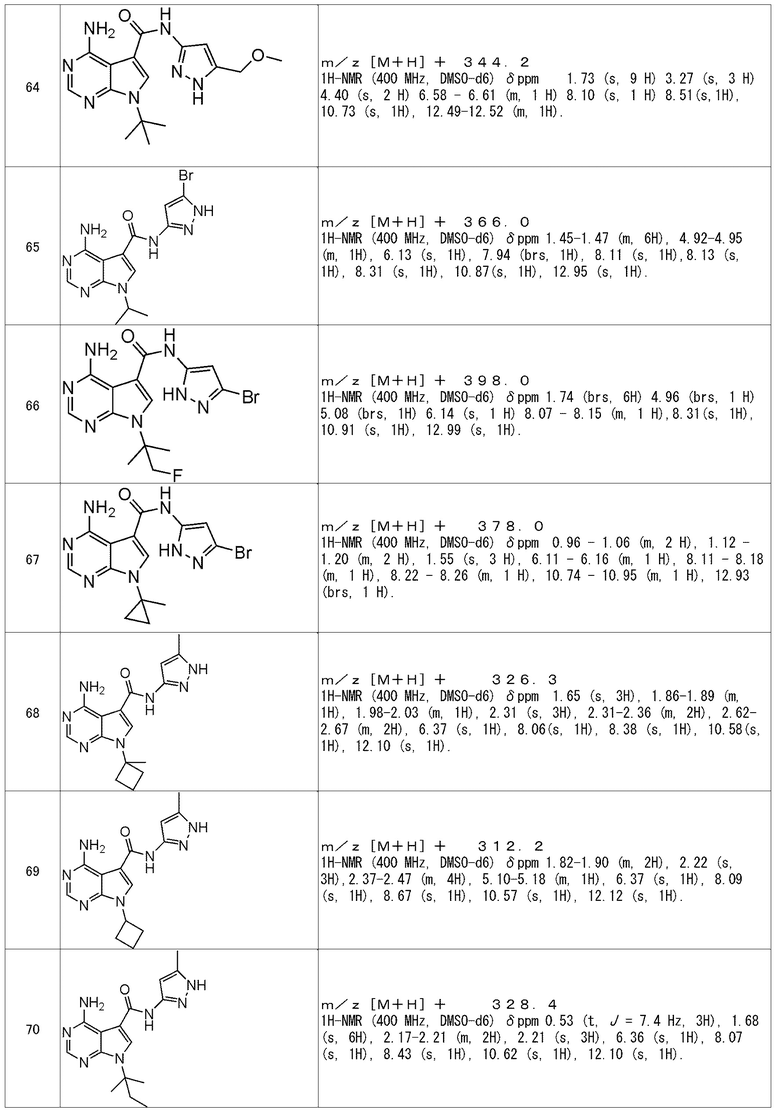
[0564]
Таблица 11

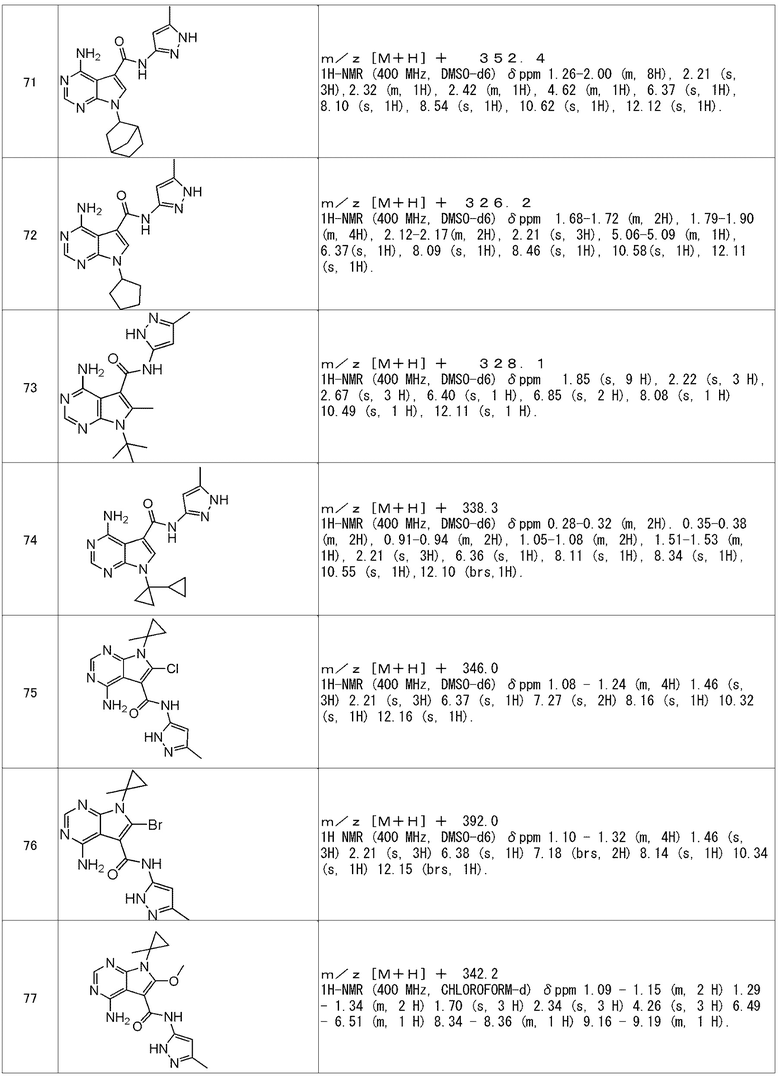
[0565]
Таблица 12

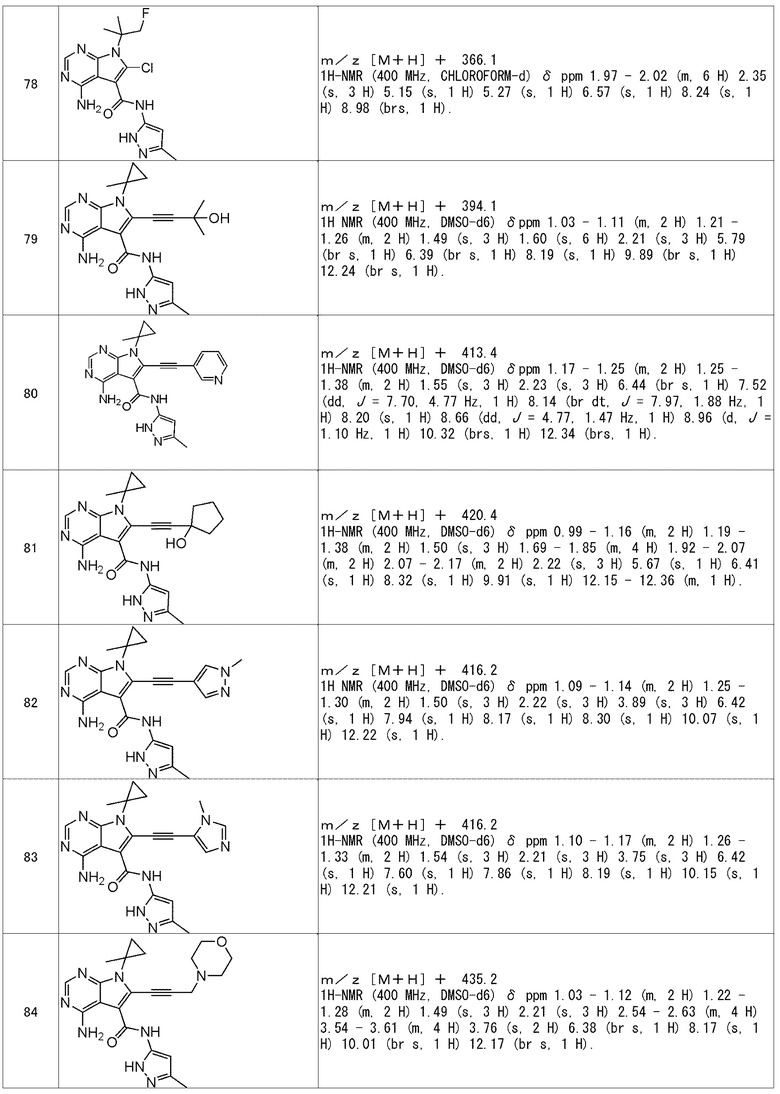
[0566]
Таблица 13

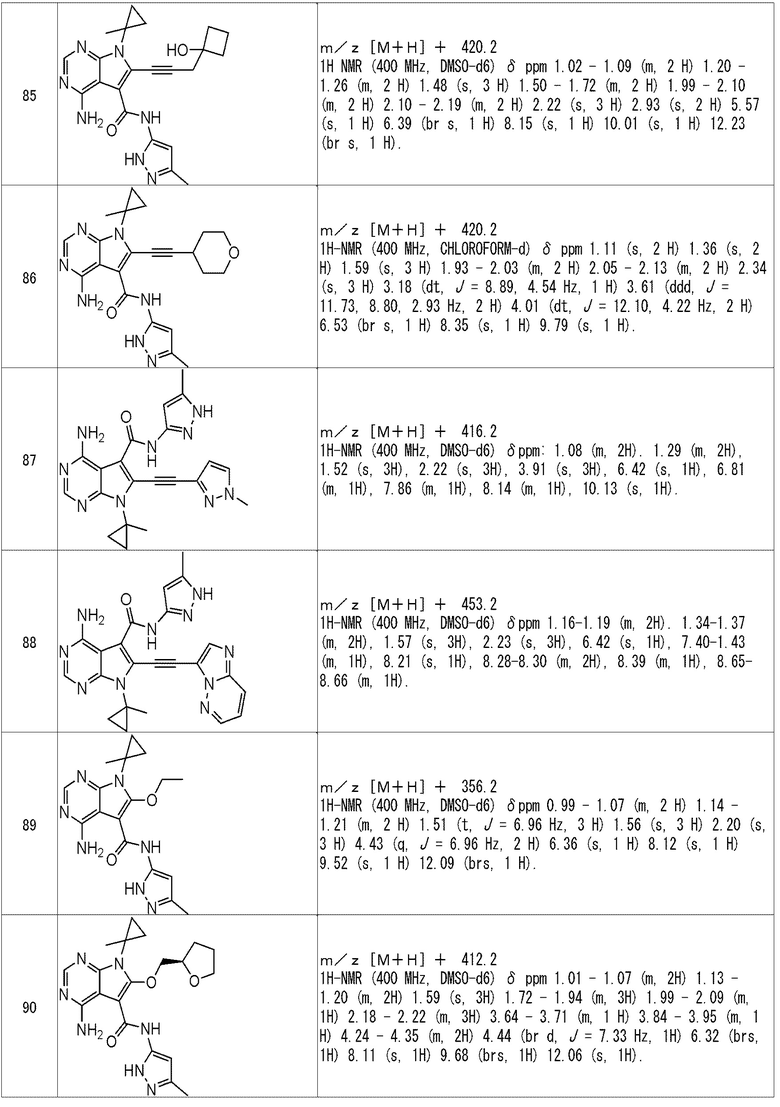
[0567]
Таблица 14

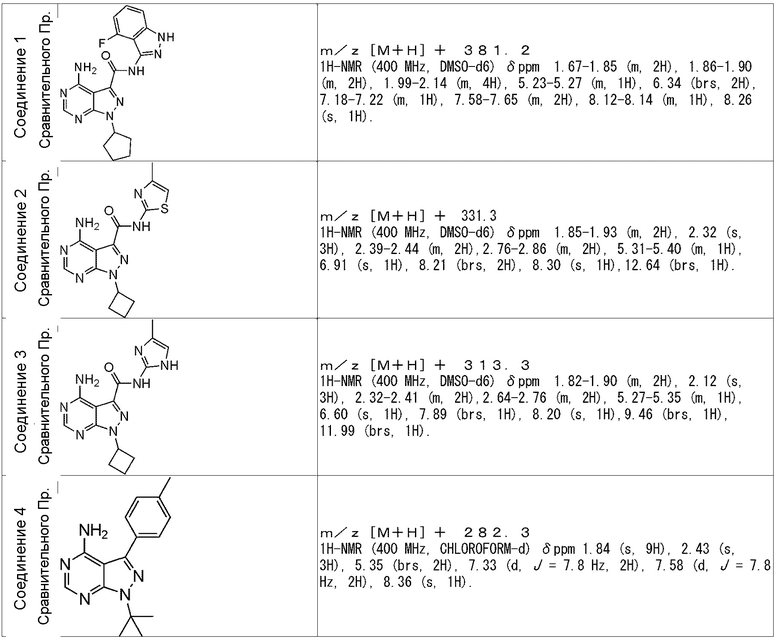
[0568]
Пример испытания 1: Измерение активности ингибирования RET (in vitro)
Что касается условий для измерения in vitro ингибиторной активности соединений против RET киназной активности, веб-сайт AnaSpec утверждает, что Srctide (GEEPLYWSFPAKKK) соответствует пептидному субстрату для реакции для измерения RET киназной активности. Таким образом, аминокислотная последовательность была частично модифицирована и биотинилирована для получения биотинилированных пептидов (биотин-EEPLYWSFPAKKK). Очищенный рекомбинантный человеческий RET белок, используемый в испытании, закупали у Carna Biosciences, Inc.
[0569]
Для измерения ингибиторной активности сначала соединения по настоящему изобретению индивидуально разбавляли диметилсульфоксидом (DMSO) постадийно. Затем RET белок, пептидный субстрат (конечная концентрация: 250 нМ), хлорид магния (конечная концентрация: 10 мМ), АТФ (конечная концентрация: 10 мкМ) и раствор соединения по настоящему изобретению в DMSO (конечная концентрация DMSO: 2,5%) добавляли к буферу для киназной реакции (13,5 мМ Tris, pH 7,5, 2 мМ дитиотреитола, 0,009% Tween-20). Каждую из смесей инкубировали при 25°C в течение 100 минут для осуществления киназной реакции. Затем добавляли EDTA с получением конечной концентрации 24 мМ, чтобы останавить реакцию. К смеси добавляли раствор для детекции, содержащий Eu-меченное антифосфотирозиновое антитело PT66 (PerkinElmer) и SureLight APC-SA (PerkinElmer), и каждой смеси давали выстояться при комнатной температуре в течение 2 часов или больше. В завершение, измеряли интенсивность флуоресценции под светом возбуждения с длиной волны 337 нм с использованием PHERAstar FS (BMG Labtech) при двух длинах волн 620 нм и 665 нм. Уровень фосфорилирования рассчитывали из отношения интенсивности флуоресценции при двух длинах волн, и концентрацию соединения, при которой фосфорилирование ингибируется на 50%, определяли как IC50 значение (нМ).
[0570]
Таблица 15 показывает IC50 (нМ) ингибиторной активности соединений Примеров и соединений 1-3 Сравнительных примеров в отношении RET (WT).
[0571]
Вандетаниб известен как обладающий высокой ингибиторной активностью против RET и демонстрирующий высокий противоопухолевый эффект (например, Carlomagno F. Cancer Res. 2002 Dec 15; 62(24): 7284-90). Было определено, что соединения по настоящему изобретению демонстрируют in vitro активность ингибирования RET на таком же или более высоком уровне по сравнению с Вандетанибом.
[0572]
Соединения 1-3 Сравнительных примеров, которые не содержат пиразолильную группу, последовательно соединенную с амидной группой, соответственно имели IC50 (нМ) 451, 752 и 486, демонстрируя слабую ингибиторную активность. В отличие от этого, соединения по настоящему изобретению имели IC50 (нМ) меньше примерно в 40 раз или больше чем в 40 раз, чем IC50 (нМ) соединений 1-3 Сравнительных примеров, показывая, что соединения по настоящему изобретению обладают высокой активностью ингибирования RET.
[0573]
Таблица 15
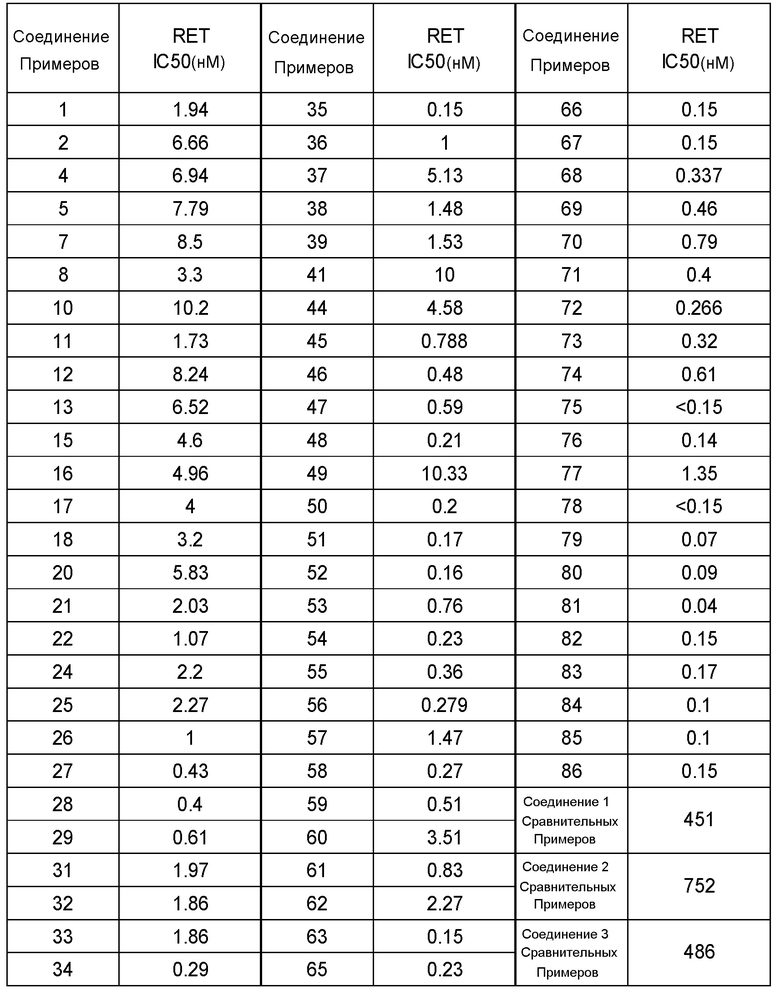
[0574]
Пример испытания 2: Селективность ингибирования RET (in vitro) по сравнению с ингибиторной активностью в отношении других киназ
1) Измерение ингибиторной активности в отношении RET
Ингибиторную активность против RET измеряли таким же способом, как в Примере испытания 1.
[0575]
2) Измерение ингибиторной активности в отношении SRC
Что касается условий для измерения in vitro ингибиторной активности соединений против SRC киназной активности, прайс-лист расходуемых реагентов серии LabChip от PerkinElmer показывает, что FL-Пептид 4 соответствует к пептидному субстрату для реакции для измерения SRC киназной активности. Таким образом, FL-Пептид 4 использовали в качестве субстрата. Очищенный рекомбинантный человеческий SRC белок, используемый в испытании, закупали у Carna Biosciences, Inc.
[0576]
Для измерения ингибиторной активности сначала соединения по настоящему изобретению индивидуально разбавляли диметилсульфоксидом (DMSO) постадийно. Затем SRC белок, FL-Пептид 4 (конечная концентрация: 1,5 мкМ), хлорид магния (конечная концентрация: 10 мМ), АТФ (конечная концентрация: 15 мкМ) и раствор соединения по настоящему изобретению в DMSO (конечная концентрация DMSO: 5%) добавляли к реакционному буферу (100 мМ HEPES, pH 7,0, 1 мМ дитиотреитола, 0,003% Brij35, 0,04% Tween-20), содержащему коктейль ингибиторов фосфатазы (PhosSTOP, Roche) и коктейль ингибиторов протеазы (cOmplete Mini, без EDTA, Roche) при рекомендуемых концентрациях. Каждую смесь инкубировали при 30°C в течение 90 минут для осуществления киназной реакции. EDTA, разбавленную буфером для разделения, доступным от PerkinElmer (конечная концентрация: 30 мМ), затем добавляли к смеси для остановки киназной реакции. В завершение, нефосфорилированные пептидные субстраты (S) и фосфорилированные пептиды (P) разделяли и осуществляли детекцию методом многоканального капиллярного электрофореза с использованием считывающего устройства LabChip EZ Reader II (PerkinElmer). Уровень фосфорилирования рассчитывали на основании высоты пиков S и P, и концентрацию соединения, при которой фосфорилирование ингибируется на 50%, определяли как IC50 значение (нМ).
[0577]
3) Измерение ингибиторной активности в отношении LCK
Что касается условий для измерения in vitro ингибиторной активности соединений против LCK киназной активности, веб-сайт AnaSpec утверждает, что Srctide (GEEPLYWSFPAKKK) соответствует пептидному субстрату для реакции для измерения LCK киназной активности. Таким образом, аминокислотная последовательность была частично модифицирована и биотинилирована для получения биотинилированных пептидов (биотин-EEPLYWSFPAKKK). Очищенный рекомбинантный человеческий LCK белок, используемый в испытании, закупали у Carna Biosciences, Inc.
[0578]
Для измерения ингибиторной активности сначала соединения по настоящему изобретению индивидуально разбавляли диметилсульфоксидом (DMSO) постадийно. Затем LCK белок, пептидные субстраты (конечная концентрация: 250 нМ), хлорид магния (конечная концентрация: 10 мМ), АТФ (конечная концентрация: 50 мкМ) и раствор соединения по настоящему изобретению в DMSO (конечная концентрация DMSO: 5%) добавляли к буферу для киназной реакции (13,5 мМ Tris, pH 7,5, 2 мМ дитиотреитола, 0,009% Tween-20). Каждую смесь инкубировали при 25°C в течение 60 минут для осуществления киназной реакции. Затем к смеси добавляли EDTA для получения конечной концентрации 40 мМ, чтобы можно было остановить реакцию. К смеси добавляли раствор для детекции, содержащий Eu-меченное антифосфотирозиновое антитело PT66 (PerkinElmer) и SureLight APC-SA (PerkinElmer), и каждой смеси давали выстояться при комнатной температуре в течение 2 часов или больше. В завершение, интенсивность флуоресценции под светом возбуждения с длиной волны 337 нм измеряли при помощи PHERAstar FS (BMG Labtech) при двух длинах волн 620 нм и 665 нм. Уровень фосфорилирования рассчитывали из отношения интенсивности флуоресценции при двух длинах волн, и концентрацию соединения, при которой фосфорилирование ингибируется на 50%, определяли как IC50 значение (нМ).
[0579]
4) Селективность ингибирования RET
Из значений, полученных в разделах 1) и 3) выше, рассчитывали отношения ингибиторная активность против SRC IC50 (нМ)/ингибиторная активность против RET IC50 (нМ) и ингибиторная активность против LCK IC50 (нМ)/ ингибиторная активность против RET IC50 (нМ) и исследовали селективность ингибирования RET испытываемыми соединениями.
[0580]
Таблица 16
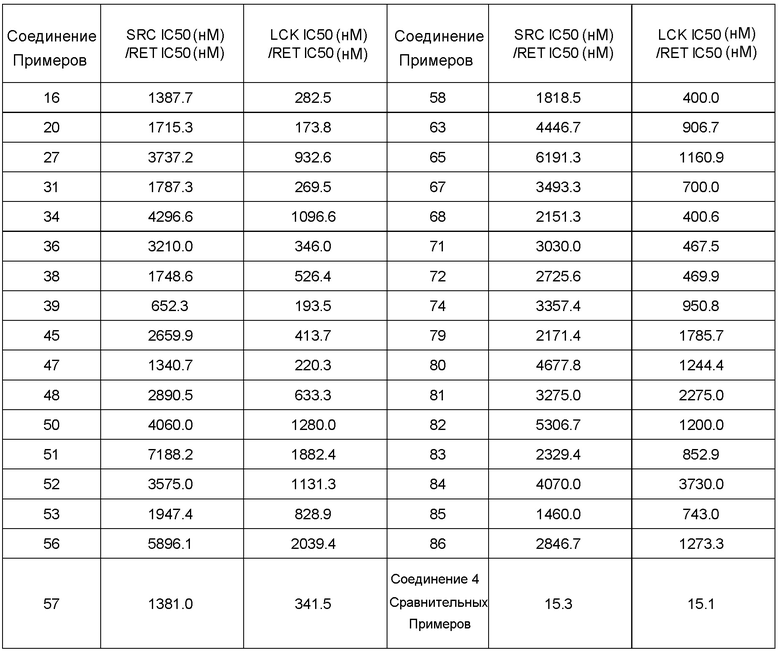
[0581]
Как показано в Таблице 16, соединение 4 Сравнительных примеров показало примерно в 15 раз бóльшую селективность ингибирования RET по сравнению с SRC или LCK.
[0582]
По сравнению с этим, соединения по настоящему изобретению показали селективность ингибирования от в несколько сотен раз больше до в несколько тысяч раз больше для RET по сравнению с SRC или LCK, демонстрируя отличную селективность ингибирования RET. Результаты также указывают на то, что для соединений по настоящему изобретению вероятность побочных эффектов, вызываемых ингибированием других киназ, отличных от RET, низкая.
[0583]
Пример испытания 3: Оценка эффекта ингибирования клеточного роста на опухолевые клетки, содержащие дефектный ген RET (1)
Испытание in vitro киллинга клеток осуществляли на TT клетках (линия клеток рака щитовидной железы человека, содержащих RET активирующую мутацию (C634W)).
[0584]
Суспензию TT клеток в 10% FBS-содержащей среде Хэма (Kaighn's) F12K (изготовитель Life Technologies Japan) инокулировани в каждую лунку 96-луночного плоскодонного микропланшета в количестве 5×103 (0,15 мл) для каждой лунки и культивировали в инкубаторе, содержащем 5% диоксида углерода, при 37°C в течение ночи (день 0). Соединения по настоящему изобретению индивидуально растворяли в диметилсульфоксиде с получением концентрации 10 мМ и затем разбавляли 10% FBS-содержащей RPMI1640 средой (изготовитель Wako Pure Chemical Industries, Ltd.), чтобы соединения по настоящему изобретению соответственно имели конечную концентрацию 40, 12, 4, 1,2, 0,4, 0,12, 0,04 и 0,012 мкМ. Соединения в различных концентрациях индивидуально добавляли в лунки содержащего TT клетки культурального планшета, описанного выше, в количестве 0,05 мл для каждой лунки (день 1) и культивировали в инкубаторе, содержащем 5% диоксида углерода, при 37°C в течение 7 дней. После культивирования (день 8) 0,1 мл среды удаляли из каждой лунки и добавляли 0,1 мл CellTiter Glo 2.0 реагента (Promega Corporation), который представляет собой люминесцентный реагент для детекции внутриклеточного АТФ, с последующим встряхиванием в течение 1 минуты. После встряхивания каждой культуре давали выстояться при комнатной температуре в течение 15 минут и хемилюминесценцию измеряли люминометром, и ее использовали в качестве показателя количества жизнеспособных клеток. Процент роста от дня 1 для соединений с различными концентрациями рассчитывали из следующих уравнений, в зависимости от значения Tдень 8 и Cдень 1, для определения концентрации (GI50 (мкМ)) испытываемых соединений, способной подавлять клеточный рост на 50%.
[0585]
1) Tдень 8≥Cдень 1
Процент роста (%)=(Tдень 8-Cдень 1)/(Cдень 8-Cдень 1)×100
T: Поглощение в лунке, в которую добавляли испытываемое соединение.
C: Поглощение в лунке, в которую не добавляли испытываемое соединение.
День 1: День, в который добавляли испытываемое соединение.
День 8: День, в который осуществляли оценку.
2) Tдень 8<Cдень 1
Процент роста (%)=(Tдень 8-Cдень 1)/(Cдень 1)×100
T: Поглощение в лунке, в которую добавляли испытываемое соединение.
C: Поглощение в лунке, в которую не добавляли испытываемое соединение.
День 1: День, в который добавляли испытываемое соединение.
День 8: День, в который осуществляли оценку.
[0586]
Таблица 17 показывает результаты. Соединения по настоящему изобретению показали более высокий эффект ингибирования роста TT клеток, чем соединение 4 Сравнительных примеров или Вандетаниб.
[0587]
Таблица 17
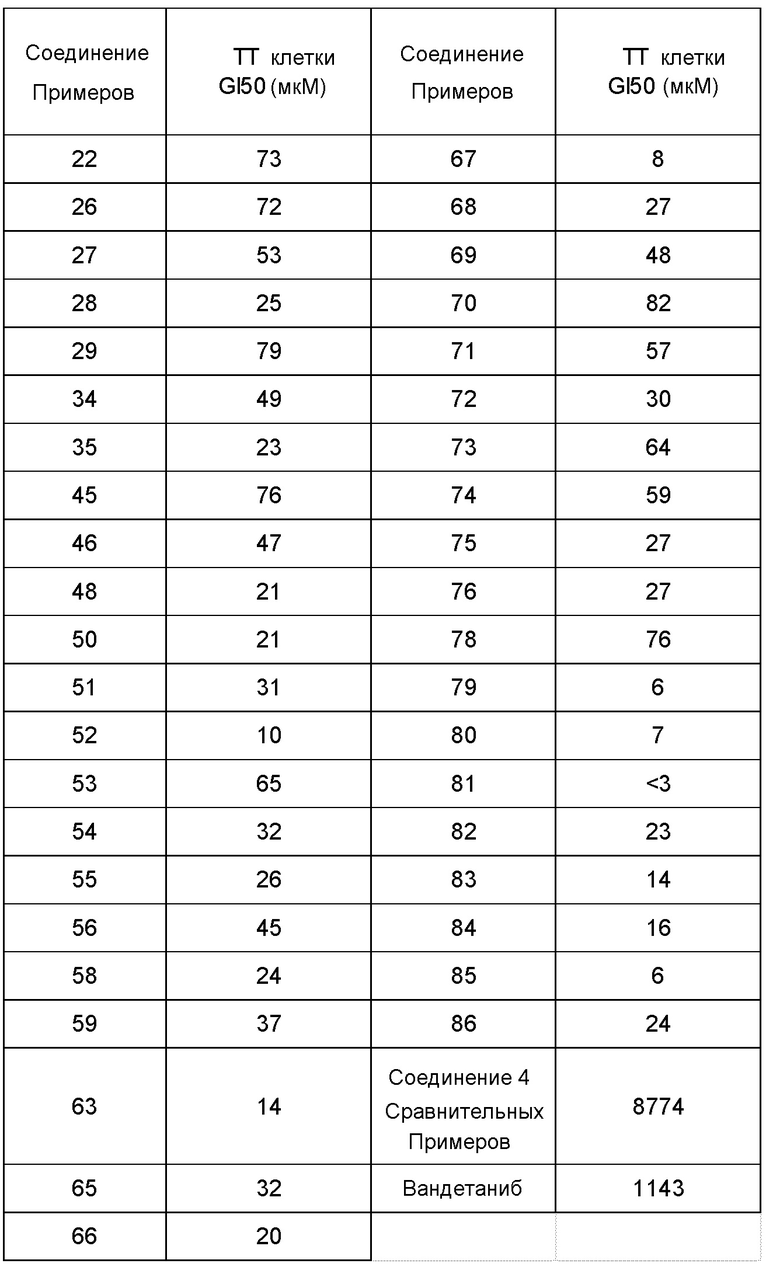
[0588]
Пример испытания 4: Оценка эффекта ингибирования клеточного роста на опухолевые клетки, содержащие дефектный ген RET (2)
Испытание in vitro киллинга клеток осуществляли на LC-2/ad клетках (линия человеческих клеток аденокарциномы легкого, содержащих CCDC6-RET слитый ген).
[0589]
Суспензию LC-2/ad клеток в 10% FBS-содержащей RPMI1640 среде инокулировани в каждую лунку 96-луночного плоскодонного микропланшета в количестве 5×103 для каждой лунки (0,15 мл) и культивировали в инкубаторе, содержащем 5% диоксида углерода, при 37°C в течение ночи (день 0). Соединения по настоящему изобретению индивидуально растворяли в диметилсульфоксиде с получением концентрации 10 мМ и затем разбавляли 10% FBS-содержащей RPMI1640 средой, чтобы соединения по настоящему изобретению соответственно имели конечную концентрацию 40, 12, 4, 1,2, 0,4, 0,12, 0,04 и 0,012 мкМ. Соединения в различных концентрациях индивидуально добавляли в лунки содержащего LC-2/ad клетки культурального планшета, описанного выше, в количестве 0,05 мл для каждой лунки (день 1) и культивировали в инкубаторе, содержащем 5% диоксида углерода, при 37°C в течение 7 дней. После культивирования (день 8) 0,1 мл среды удаляли из каждой лунки и добавляли 0,1 мл CellTiter Glo 2.0 реагента (Promega Corporation), который представляет собой люминесцентный реагент для детекции внутриклеточного АТФ, с последующим встряхиванием в течение 5 минут. После встряхивания каждой культуре давали выстояться при комнатной температуре в течение 15 минут и хемилюминесценцию измеряли люминометром, и ее использовали в качестве показателя количества жизнеспособных клеток. Процент роста от дня 1 для соединений с различными концентрациями рассчитывали из следующих уравнений, в зависимости от значения Tдень 8 и Cдень 1, для определения концентрации (GI50 (мкМ)) испытываемых соединений, способной подавлять клеточный рост на 50%.
[0590]
1) Tдень 8≥Cдень 1
Процент роста (%)=(Tдень 8-Cдень 1)/(Cдень 8-Cдень 1)×100
T: Поглощение в лунке, в которую добавляли испытываемое соединение.
C: Поглощение в лунке, в которую не добавляли испытываемое соединение.
День 1: День, в который добавляли испытываемое соединение.
День 8: День, в который осуществляли оценку.
1) Tдень 8<Cдень 1
Процент роста (%)=(Tдень 8-Cдень 1)/(Cдень 1)×100
T: Поглощение в лунке, в которую добавляли испытываемое соединение.
C: Поглощение в лунке, в которую не добавляли испытываемое соединение.
День 1: День, в который добавляли испытываемое соединение.
День 8: День, в который осуществляли оценку.
[0591]
Таблица 18 показывает результаты. Соединения по настоящему изобретению показали более высокий эффект ингибирования роста LC-2/ad клеток, чем соединение 4 Сравнительных примеров или Вандетаниб.
[0592]
Таблица 18
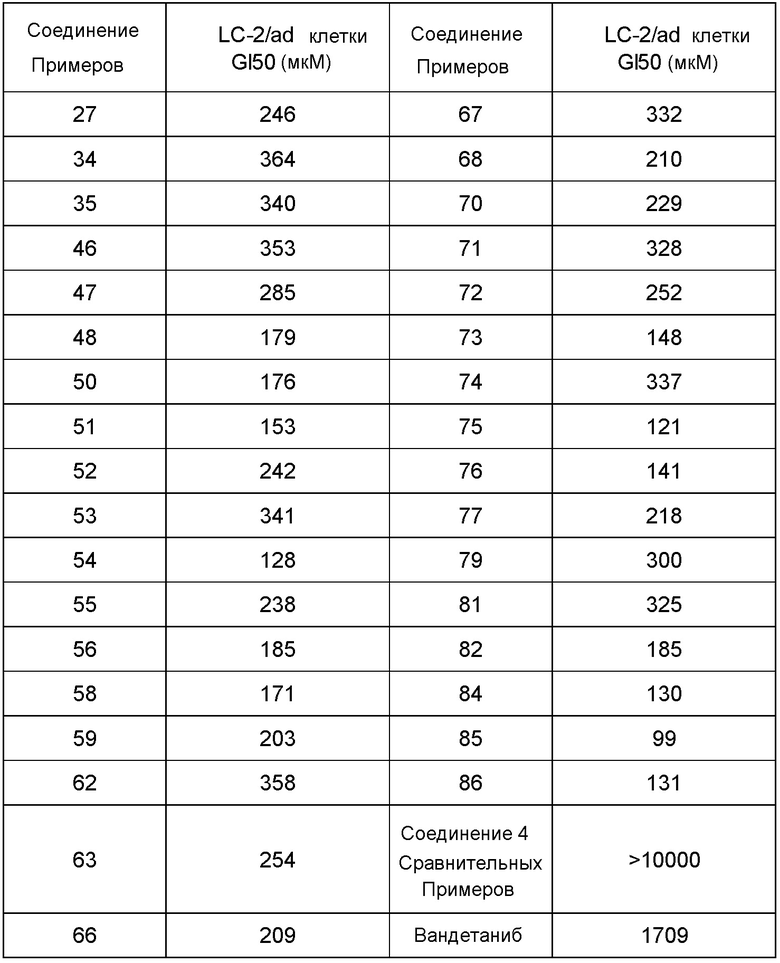
[0593]
Пример испытания 5: Оценка противоопухолевого эффекта в in vivo модели с подкожно имплантированными TT клетками (клеточная линия рака щитовидной железы человека, несущая RET активирующую мутацию)
Клеточные линии рака щитовидной железы человека (TT) подкожно имплантировали в правую грудную область самцам мышей BALB/cA Jcl-nu/nu возраста 6-7 недель. Примерно через 3 недели после имплантации клеток измеряли длину (мм) и ширину (мм) опухолей, обнаруженных у мышей. После того, как рассчитывали объем их опухолей (объем опухоли: TV), мышей разделяли на группы (n=5 или 6) так, чтобы группы имели по существу равный средний TV. День, в который мышей разделяли на группы, определяли как ʺдень распределения по группамʺ (день 0 или 1).
[0594]
Испытываемые растворы, содержащие соединения по настоящему изобретению, получали при дозе 100 мг/кг/день и перорально вводили мышам в течение последовательных 14 дней (первый день введения указан как день 1). Контрольной группе вводили растворитель (0,5% HPMC/0,1N HCl).
[0595]
Для определения показателя противоопухолевого эффекта, TV каждой группы введения лекарственного средства измеряли в день 15 и объем опухоли в день 15 относительно объема опухоли в день распределения по группам (день 0 или 1) (относительный объем опухоли: RTV) и T/C (%) рассчитывали из следующих уравнений для оценки противоопухолевого эффекта. Когда группа, которой вводили какое-либо из соединений по настоящему изобретению (группа введения испытываемого раствора) показывала статистически значимо меньший средний RTV (критерий Даннетта или t-критерий Стьюдента, p<0,05), чем средний RTV контрольной группы, определяли, что присутствует противоопухолевый эффект. Фиг. 1 и 2 и Таблицы 19 и 20 показывают результаты. На фигурах символ ʺ*ʺ указывает на статистически значимую разницу.
TV (мм3)=(длина × ширина2)/2
RTV=(TV в день 15)/(TV в день 0 или день 1)
T/C(%)=(средний RTV группы введения испытываемого раствора)/(средний RTV контрольной группы)×100
[0596]
Для определения показателя токсичности массу тела (масса тела: BW) мышей измеряли в течение определенного времени и среднее изменение массы тела (изменение массы тела: BWC (%)) с дня распределения по группам (день 0 или день 1) до дня 15 рассчитывали из следующего уравнения (n: день, в который массу тела измеряли при измерении 2 раза/неделя, и последний день измерения - это день 15, в который осуществляли конечную оценку). Фиг. 3 и 4 показывают результаты.
BWC (%)=[(BW в день n)-(BW в день 0 или день 1)]/(BW в день 0 или день 1)×100
[0597]
Как ясно видно из Фиг. 1 и 2 и Таблиц 19 и 20, соединения по настоящему изобретению показали замечательный противоопухолевый эффект на линии клеток рака щитовидной железы человека TT, несущих RET-активирующую мутацию, которые подкожно имплантированн бестимусным мышам. Как показано в Фиг. 3 и 4, токсичность, такая как потеря массы тела, не наблюдалась.
[0598]
[0599]
[0600]
Пример испытания 6: Оценка стабильности в микросомах печени
Растворы испытываемых соединений в DMSO/ацетонитриле (конечная концентрация каждого испытываемого соединения была 1 мкМ, конечная концентрация DMSO была 0,01%, и конечная концентрация ацетонитрила была 1%) индивидуально добавляли к раствору смеси микросом печени (микросомы печени мыши с конечной концентрацией 0,25 мг/мл, калийфосфатный буфер с конечной концентрацией 100 мМ, и хлорид магния с конечной концентрацией 3 мМ) и каждую смесь предварительно инкубировали при 37°C в течение 5 минут. NADPH-генерирующую систему (глюкозо-6-фосфат с конечной концентрацией 10 мМ, окисленный никотинамидадениндинуклеотид фосфат с конечной концентрацией 1 мМ, и глюкозо-6-фосфатдегидрогеназа с конечной концентрацией 1 ед./мл) добавляли к порции раствора каждой смеси и начинали метаболическую реакцию. После инкубации при 37°C в течение 30 минут добавляли двукратное количество этанола для остановки реакции, таким образом получая пост-реакционные образцы. Двукратное количество этанола добавляли к каждому из оставшихся растворов смесей и затем добавляли NADPH-генерирующую систему, таким образом получая пред-реакционные образцы. Пред-реакционные образцы и пост-реакционные образцы центрифугировали при 2000×g и их супернатант фильтровали через стеклянный фильтр. Каждый фильтрат затем вводили в ЖХ-МС/МС и определяли МС/МС пики испытываемых соединений. Из отношения пост-реакционного МС/МС пика к пред-реакционному МС/МС пику испытываемых соединений рассчитывали процент оставшихся испытываемых соединений (оставшийся %).
[0601]
Результаты показывают, что, в то время как соединение 4 Сравнительных примеров имело оставшийся процент 0% в любом случае, соединения по настоящему изобретению или их соли, описанные в Примерах, имели высокий оставшийся процент. Это показывает, что соединения по настоящему изобретению или их соли существенно более стабильны в микросомах печени мыши, чем соединение Сравнительных примеров.
[0602]
Пример испытания 7: Оценка пероральной абсорбции
Соединения по настоящему изобретению суспендировали или растворяли в 0,5% HPMC и 0,1N хлористоводородной кислоты и перорально вводили BALB/cA мышам. В точке времени 0,5, 1, 2, 4 и 6 часов после перорального введения собирали кровь мышей, взятую из глазного дна или лицевой вены и центрифугировали для получения плазмы. Концентрацию соединений в полученной плазме измеряли методом ЖХ-МС/МС и определяли пероральную абсорбцию.
[0603]
Результаты показывают, что концентрация соединений по настоящему изобретению в плазме была достаточной, что указывает на их отличную пероральную абсорбцию.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВОЕ КОНДЕНСИРОВАННОЕ ПИРИМИДИНОВОЕ СОЕДИНЕНИЕ ИЛИ ЕГО СОЛЬ | 2017 |
|
RU2770727C2 |
| N-(4-(АЗАИНДАЗОЛ-6-ИЛ)-ФЕНИЛ)-СУЛЬФОНАМИДЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2014 |
|
RU2671864C2 |
| АМИНО-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 3-ГЕТЕРОАРОИЛАМИНОПРОПИОНОВОЙ КИСЛОТЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ | 2012 |
|
RU2605600C2 |
| ЗАМЕЩЕННЫЕ ХРОМАН-6-ИЛОКСИЦИКЛОАЛКАНЫ, ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2014 |
|
RU2666350C2 |
| ПРОИЗВОДНЫЕ ГИДРОКСИМЕТИЛФУРАЗАНКАРБОНОВОЙ КИСЛОТЫ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1994 |
|
RU2134687C1 |
| ПРОИЗВОДНОЕ 7H-ПИРРОЛО[2,3-D]ПИРИМИДИН-4-АМИНА | 2020 |
|
RU2796605C2 |
| ПИРАЗОЛОПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ-ИНГИБИТОРЫ JAK И СПОСОБЫ | 2009 |
|
RU2539568C2 |
| КОНДЕНСИРОВАННЫЕ ПИРРОЛДИКАРБОКСАМИДЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ | 2013 |
|
RU2650111C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ LPAR5 АНТАГОНИСТОВ | 2013 |
|
RU2645344C2 |
| СРЕДСТВО, УСИЛИВАЮЩЕЕ ПРОТИВООПУХОЛЕВОЕ ДЕЙСТВИЕ С ПРИМЕНЕНИЕМ СОЕДИНЕНИЯ ПИРАЗОЛО[3,4-d]ПИРИМИДИНА | 2018 |
|
RU2799006C2 |
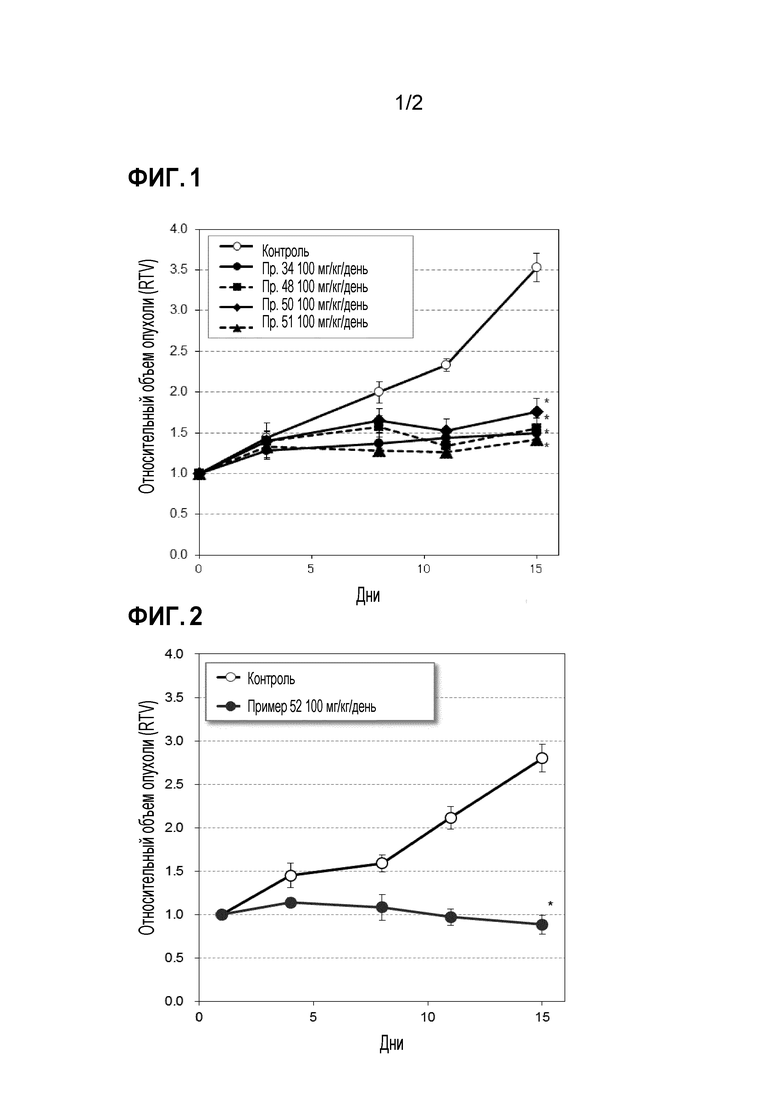
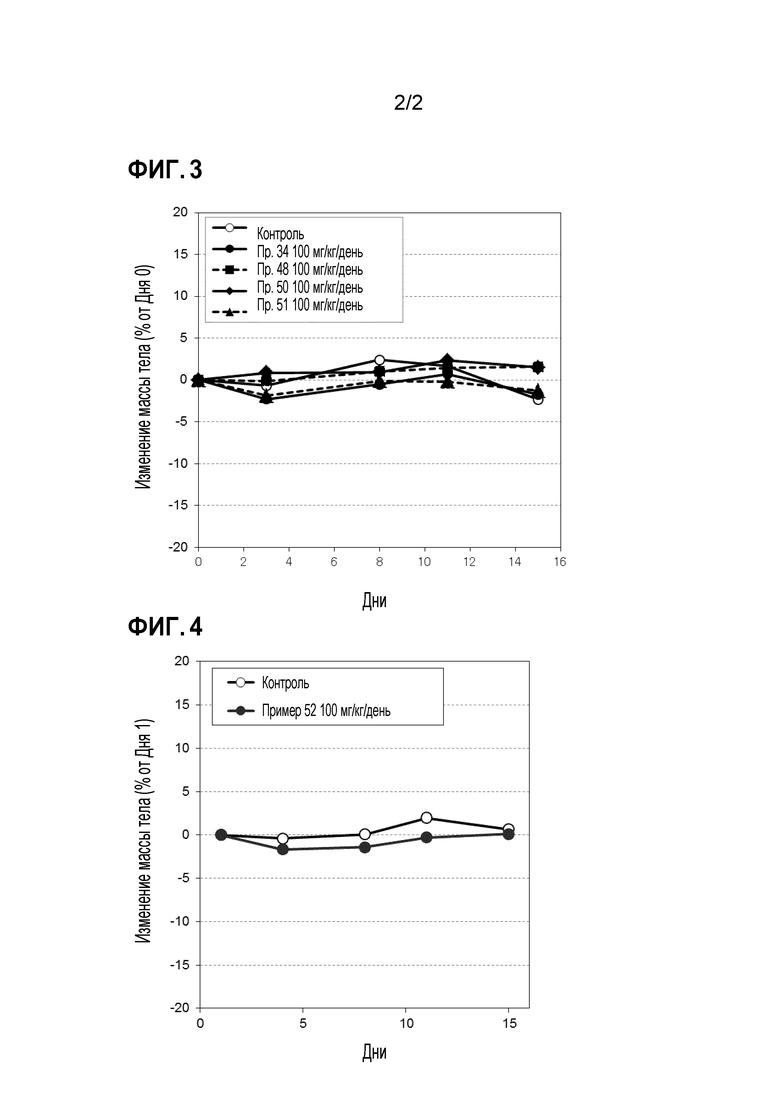
Изобретение относится к способу ингибирования RET, включающему введение пациенту соединения, представленного формулой (I)
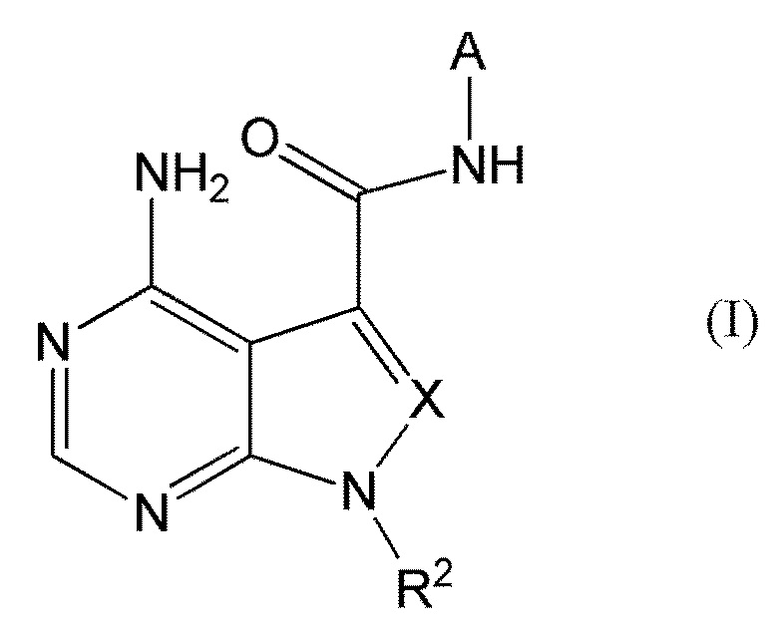
где A представляет собой пиразолил, замещенный n-количеством заместителей R1; R1 представляет собой галоген, циано, C1-C6 алкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена и C1-C6 алкокси, C3-C7 циклоалкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена, С6 ароматический углеводород, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена; или С4 моноциклическую ненасыщенную гетероциклическую группу, содержащую 1 гетероатом, выбранный из кислорода и серы, которая не замещена или замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена; R2 представляет собой C1-C10 алкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена, C1-C6 алкокси, C3-C7 циклоалкилом, который может быть замещён C1-C4 алкилом, фенилом, одной С4 моноциклической ненасыщенной гетероциклической группой, содержащей 1 гетероатом, выбранный из кислорода и серы, C3-C7 циклоалкил, незамещенный или замещенный 1-2 раза по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила, галогена, C1-C6 галогеналкила, C3-C6 циклоалкила, C2-C6 алкенил, незамещенный или замещенный галогеном, C4-C12 связанный мостиковой связью циклоалкил, незамещенный или замещенный 1-3 раза C1-C6 алкилом или C3-C10 моноциклическую или бициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, которая не замещена или замещена C1-C6 алкилом; X представляет собой N или CR3, где R3 представляет собой водород, галоген, циано, C1-C6 алкил, незамещенный или замещенный C1-C6 алкокси, C2-C6 алкинил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила, который может быть замещён гидрокси, C1-C6 алкокси, пиридинила, C3-C6 циклоалкила, который может быть замещён гидрокси, N-C1-C6 алкилпиразолила, N-C1-C6 алкилимидазолила, морфолинила, тетрагидропиранила и имидазо(1,2-b)пиридазинила, C1-C6 алкокси, незамещенный или замещенный тетрагидрофураном,n представляет собой целое число, имеющее значение от 0 до 3. 16 н. и 20 з.п. ф-лы,4 ил., 19 табл., 90 пр.
1. Способ ингибирования RET, включающий введение пациенту соединения, представленного формулой (I) ниже, или его основно-аддитивной или кислотно-аддитивной соли:
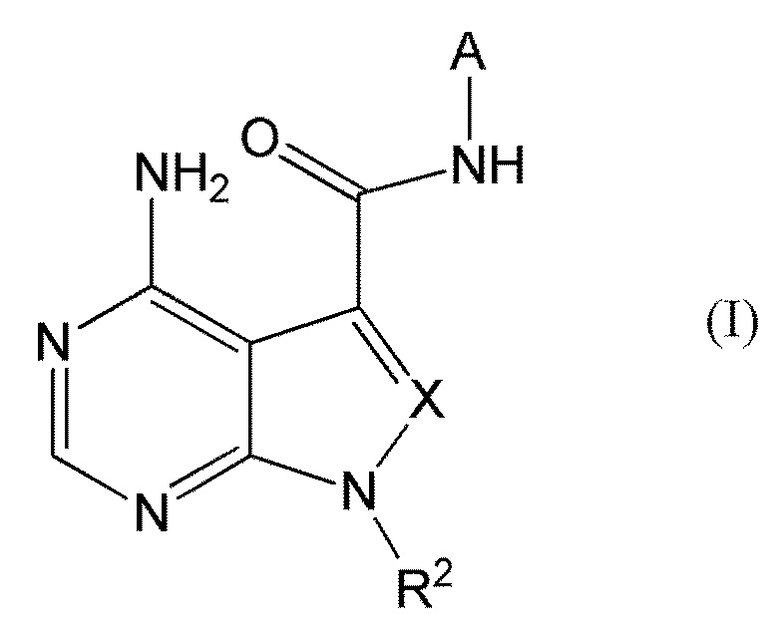
где A представляет собой пиразолил, замещенный n-количеством заместителей R1;
R1 представляет собой
галоген,
циано,
C1-C6 алкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена и C1-C6 алкокси,
C3-C7 циклоалкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена,
С6 ароматический углеводород, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена; или
С4 моноциклическую ненасыщенную гетероциклическую группу, содержащую 1 гетероатом, выбранный из кислорода и серы, которая не замещена или замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена;
R2 представляет собой
C1-C10 алкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена, C1-C6 алкокси, C3-C7 циклоалкилом, который может быть замещён C1-C4 алкилом, фенилом, одной С4 моноциклической ненасыщенной гетероциклической группой, содержащей 1 гетероатом, выбранный из кислорода и серы,
C3-C7 циклоалкил, незамещенный или замещенный 1-2 раза по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила, галогена, C1-C6 галогеналкила, C3-C6 циклоалкила,
C2-C6 алкенил, незамещенный или замещенный галогеном,
C4-C12 связанный мостиковой связью циклоалкил, незамещенный или замещенный 1-3 раза C1-C6 алкилом,
или
C3-C10 моноциклическую или бициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, которая не замещена или замещена C1-C6 алкилом;
X представляет собой
N или
CR3, где R3 представляет собой
водород,
галоген,
циано,
C1-C6 алкил, незамещенный или замещенный C1-C6 алкокси,
C2-C6 алкинил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила, который может быть замещён гидрокси, C1-C6 алкокси, пиридинила, C3-C6 циклоалкила, который может быть замещён гидрокси, N-C1-C6 алкилпиразолила, N-C1-C6 алкилимидазолила, морфолинила, тетрагидропиранила и имидазо(1,2-b)пиридазинила,
C1-C6 алкокси, незамещенный или замещенный тетрагидрофураном,
n представляет собой целое число, имеющее значение от 0 до 3,
при этом, когда n имеет значение 2 или 3, R1 могут быть одинаковыми или отличными друг от друга.
2. Способ по п. 1, где в формуле (I)
A представляет собой пиразолил, замещенный n-количеством заместителей R1;
R1 представляет собой
галоген;
циано;
C1-C6 алкил, который может быть замещен галогеном или C1-C4 алкокси;
C3-C7 циклоалкил;
фенил; или
C4 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы;
R2 представляет собой
линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной C4 моноциклической ненасыщенной гетероциклической группой, содержащей один атом кислорода или один атом серы;
C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, который может быть замещен C1-C4 алкилом;
X представляет собой
N или
CR3, где R3 представляет собой
водород;
галоген;
C1-C6 алкил;
C2-C4 алкинил, который замещен:
C1-C6 алкилом, который может быть замещен гидрокси,
C3-6 циклоалкилом, который может быть замещен гидрокси,
N-C1-C6-алкилпиразолилом, N-C1-C6-алкилимидазолилом, морфолинилом, тетрагидропиранилом и имидазо(1,2-b)пиридазинилом; или
C1-C4 алкокси, который может быть замещен тетрагидрофураном; и
n представляет собой целое число, имеющее значение 1 или 2,
при этом, когда n имеет значение 2, R1 могут быть одинаковыми или отличными друг от друга.
3. Способ по п. 1, где соединение, представленное формулой (I), или его основно-аддитивная или кислотно-аддитивная соль представляет собой соединение, представленное формулой (II) ниже, или его основно-аддитивная или кислотно-аддитивная соль:
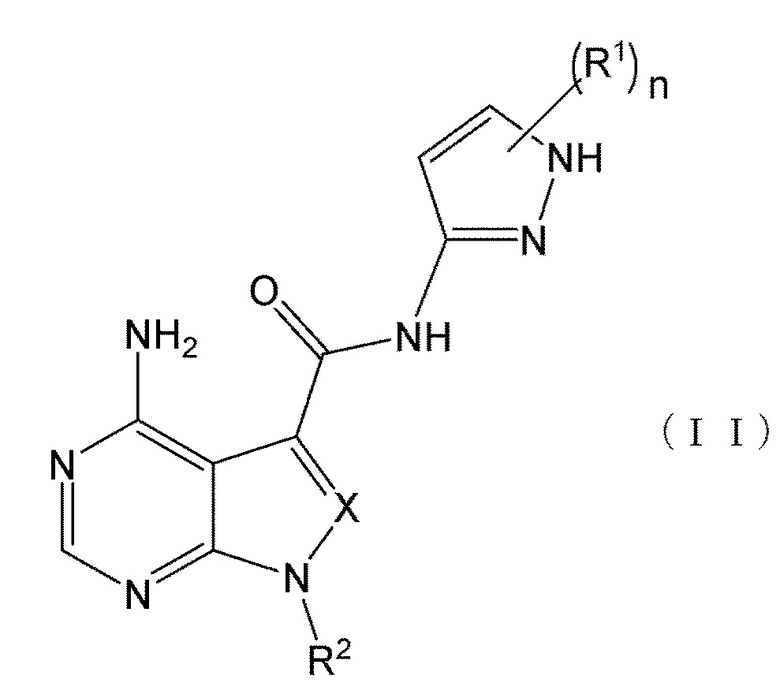
где R1 представляет собой
галоген;
циано;
C1-C6 алкил, который может быть замещен галогеном;
C3-C7 циклоалкил;
фенил; или
C4 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы;
R2 представляет собой
линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной С4 моноциклической ненасыщенной гетероциклической группой, содержащей один атом кислорода или один атом серы;
C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил;
X представляет собой
N или
CR3, где R3 представляет собой
водород;
галоген;
C1-C4 алкил;
C2-C4 алкинил, который замещен:
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C6 циклоалкилом, который может быть замещен гидрокси,
N-C1-C6-алкилпиразолилом, N-C1-C6-алкилимидазолилом, морфолинилом, тетрагидропиранилом и ; или
C1-C4 алкокси; и
n представляет собой целое число, имеющее значение 1 или 2,
при этом, когда n имеет значение 2, R1 могут быть одинаковыми или отличными друг от друга.
4. Способ по п. 3, где в формуле (II)
R1 представляет собой
галоген,
циано или
C1-C4 алкил, который может быть замещен галогеном;
R2 представляет собой
линейный C1-C4 алкил, который может быть замещен C3-C7 циклоалкилом;
разветвленный C3-C6 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, одной С4 моноциклической ненасыщенной гетероциклической группой, содержащей один атом серы, или C1-C4 алкокси;
C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, выбранный из бицикло[1.1.1]пентан-1-ила и бицикло[2.2.1]гептан-2-ила;
X представляет собой
N или
CR3, где R3 представляет собой
водород; или
C2-C4 алкинил, который замещен:
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C6 циклоалкилом, который может быть замещен гидрокси,
N-C1-C6-алкилпиразолилом, N-C1-C6-алкилимидазолилом, морфолинилом, тетрагидропиранилом и ; и
n представляет собой целое число, имеющее значение 1.
5. Способ по п. 1, где соединение, представленное формулой (I), или его основно-аддитивная или кислотно-аддитивная соль представляет собой соединение, представленное формулой (IX) ниже, или его основно-аддитивная или кислотно-аддитивная соль:
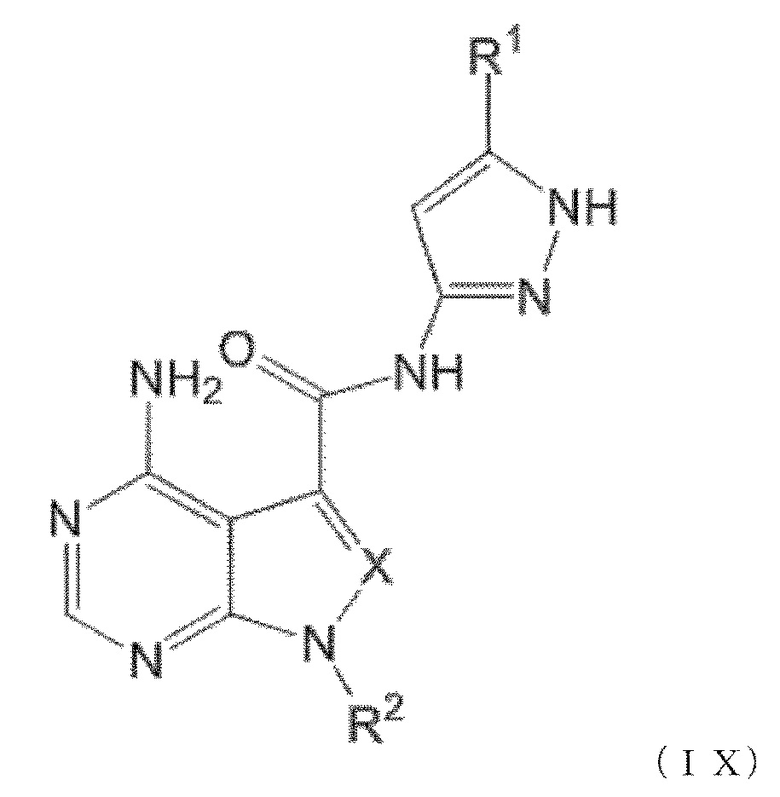
где R1 представляет собой галоген или C1-C4 алкил;
R2 представляет собой
разветвленный C3-C6 алкил, который может быть замещен галогеном или C3-C5 циклоалкилом;
C3-C5 циклоалкил, который может быть замещен C1-C4 алкилом; или
бицикло[2.2.1]гептан-2-ил; и
X представляет собой
N или
CR3, где R3 представляет собой
водород; или
этинил или пропинил, который замещен:
C1-C4 алкилом, который может быть замещен гидрокси,
C3-C5 циклоалкилом, который может быть замещен гидрокси,
N-C1-C6-алкилпиразолилом, N-C1-C6-алкилимидазолилом, морфолинилом, тетрагидропиранилом и имидазо(1,2-b)пиридазинилом.
6. Способ по п. 5, где в формуле (IX)
R1 представляет собой бром или метил;
R2 представляет собой
разветвленный C3-C6 алкил, который может быть замещен фтором или C3-C5 циклоалкилом, или
C3-C5 циклоалкил, который может быть замещен метилом; и
X представляет собой
N или
CR3, где R3 представляет собой водород.
7. Способ для профилактики или лечения злокачественной опухоли, опосредованной повышенной активностью RET, включающий введение пациенту соединения, представленного формулой (I) ниже, или его основно-аддитивной или кислотно-аддитивной соли:
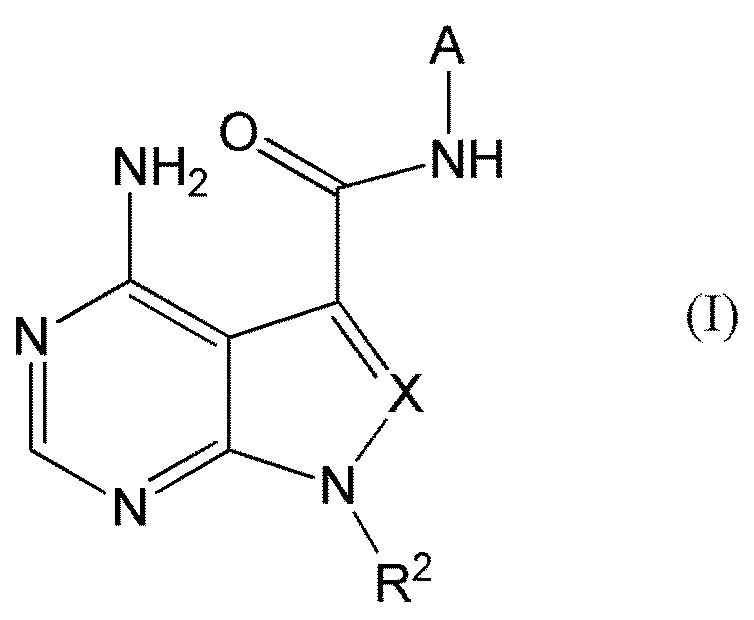
где A представляет собой пиразолил, замещенный n-количеством заместителей R1;
R1 представляет собой
галоген,
циано,
C1-C6 алкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена и C1-C6 алкокси,
C3-C7 циклоалкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена,
С6 ароматический углеводород, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена; или
С4 моноциклическую ненасыщенную гетероциклическую группу, содержащую 1 гетероатом, выбранный из кислорода и серы, которая не замещена или замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена;
R2 представляет собой
C1-C10 алкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена, C1-C6 алкокси, C3-C7 циклоалкилом, который может быть замещён C1-C4 алкилом, фенилом, одной С4 моноциклической ненасыщенной гетероциклической группой, содержащей 1 гетероатом, выбранный из кислорода и серы,
C3-C7 циклоалкил, незамещенный или замещенный 1-2 раза по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила, галогена, C1-C6 галогеналкила, C3-C6 циклоалкила,
C2-C6 алкенил, незамещенный или замещенный галогеном,
C4-C12 связанный мостиковой связью циклоалкил, незамещенный или замещенный 1-2 раза C1-C6 алкилом,
или
C3-C10 моноциклическую или бициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, которая не замещена или замещена C1-C6 алкилом;
X представляет собой
N или
CR3, где R3 представляет собой
водород,
галоген,
циано,
C1-C6 алкил, незамещенный или замещенный C1-C6 алкокси,
C2-C6 алкенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила, который может быть замещён гидрокси, C1-C6 алкокси, пиридинила, C3-C6 циклоалкила, который может быть замещён гидрокси, N-C1-C6 алкилпиразолила, N-C1-C6 алкилимидазолила, морфолинила, тетрагидропиранила и имидазо(1,2-b)пиридазинила,
C1-C6 алкокси, незамещенный или замещенный тетрагидрофураном,
n представляет собой целое число, имеющее значение от 0 до 3,
при этом, когда n имеет значение 2 или 3, R1 могут быть одинаковыми или отличными друг от друга.
8. Способ по п. 7, где соединение, представленное формулой (I), или его основно-аддитивная или кислотно-аддитивная соль представляет собой соединение, представленное формулой (II) ниже, или его основно-аддитивная или кислотно-аддитивная соль:
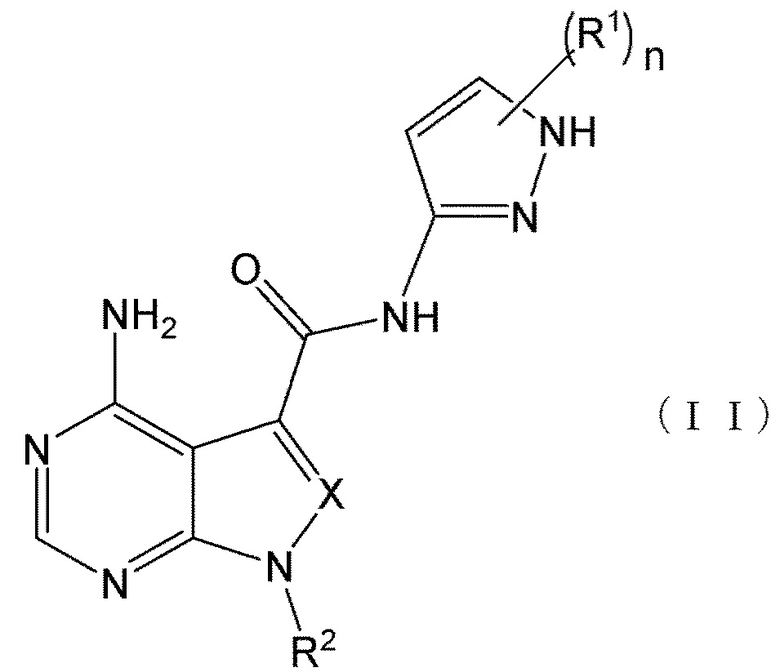
где R1 представляет собой
галоген;
циано;
C1-C6 алкил, который может быть замещен галогеном;
C3-C7 циклоалкил;
фенил; или
C4 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы;
R2 представляет собой
линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной С4 моноциклической ненасыщенной гетероциклической группой, содержащей один атом кислорода или один атом серы;
C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил;
X представляет собой
N или
CR3, где R3 представляет собой
водород;
галоген;
C1-C4 алкил;
C2-C4 алкинил, который замещен:
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C6 циклоалкилом, который может быть замещен гидрокси,
N-C1-C6-алкилпиразолилом, N-C1-C6-алкилимидазолилом, морфолинилом, тетрагидропиранилом и имидазо(1,2-b)пиридазинилом; или
C1-C4 алкокси; и
n представляет собой целое число, имеющее значение 1 или 2,
при этом, когда n имеет значение 2, R1 могут быть одинаковыми или отличными друг от друга.
9. Способ по п. 8, где в формуле (II)
R1 представляет собой
галоген,
циано или
C1-C4 алкил, который может быть замещен галогеном;
R2 представляет собой
линейный C1-C4 алкил, который может быть замещен C3-C7 циклоалкилом;
разветвленный C3-C6 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, одной С4 моноциклической ненасыщенной гетероциклической группой, содержащей один атом серы, или C1-C4 алкокси;
C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, выбранный из бицикло[1.1.1]пентан-1-ила и бицикло[2.2.1]гептан-2-ила;
X представляет собой
N или
CR3, где R3 представляет собой
водород; или
C2-C4 алкинил, который замещен:
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C6 циклоалкилом, который может быть замещен гидрокси,
N-C1-C6-алкилпиразолилом, N-C1-C6-алкилимидазолилом, морфолинилом, тетрагидропиранилом и имидазо(1,2-b)пиридазинилом; и
n представляет собой целое число, имеющее значение 1.
10. Способ по п. 7, где соединение, представленное формулой (I), или его основно-аддитивная или кислотно-аддитивная соль представляет собой соединение, представленное формулой (IX) ниже, или его основно-аддитивная или кислотно-аддитивная соль:
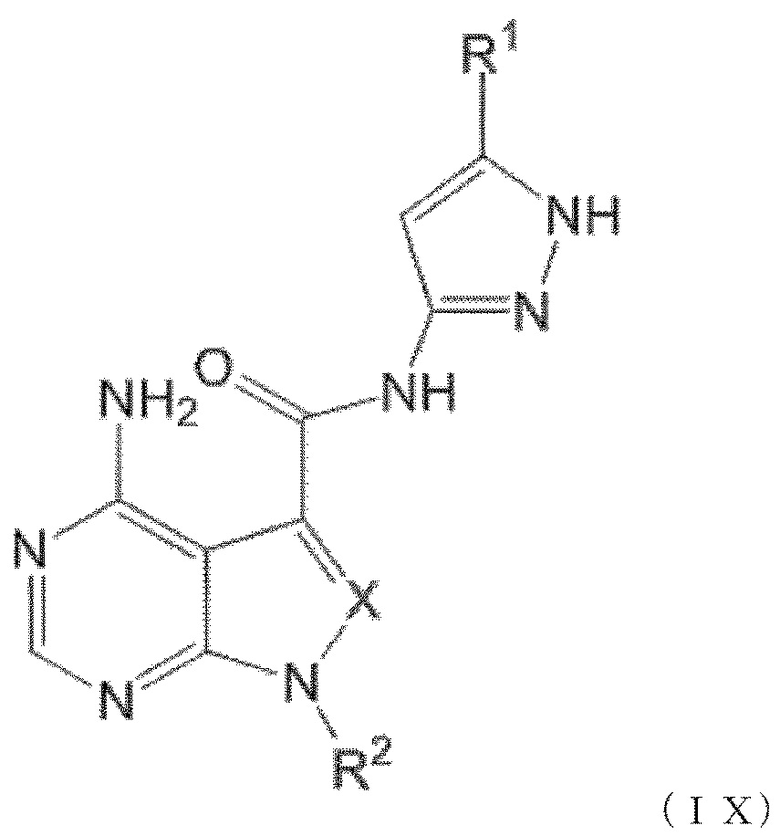
где R1 представляет собой галоген или C1-C4 алкил;
R2 представляет собой
разветвленный C3-C6 алкил, который может быть замещен галогеном или C3-C5 циклоалкилом;
C3-C5 циклоалкил, который может быть замещен C1-C4 алкилом; или
бицикло[2.2.1]гептан-2-ил; и
X представляет собой
N или
CR3, где R3 представляет собой
водород; или
этинил или пропинил, который замещен
C1-C4 алкилом, который может быть замещен гидрокси,
C3-C5 циклоалкилом, который может быть замещен гидрокси,
N-C1-C6-алкилпиразолилом, N-C1-C6-алкилимидазолилом, морфолинилом, тетрагидропиранилом и имидазо(1,2-b)пиридазинилом.
11. Способ по п. 10, где в формуле (IX)
R1 представляет собой бром или метил;
R2 представляет собой
разветвленный C3-C6 алкил, который может быть замещен фтором или C3-C5 циклоалкилом, или
C3-C5 циклоалкил, который может быть замещен метилом; и
X представляет собой
N или
CR3, где R3 представляет собой водород.
12. Применение соединения, представленного формулой (I) ниже, или его основно-аддитивной или кислотно-аддитивной соли для получения лекарственного средства, ингибирующего RET:
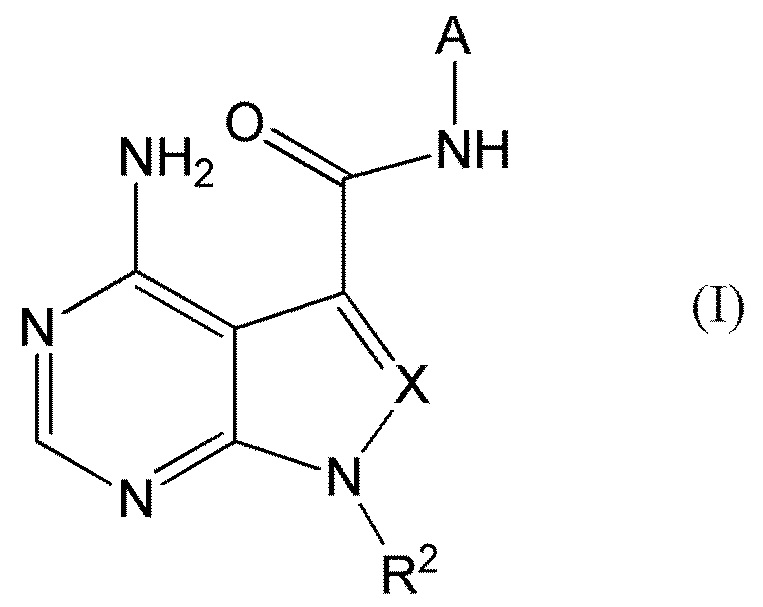
где A представляет собой пиразолил, замещенный n-количеством заместителей R1;
R1 представляет собой
галоген,
циано,
C1-C6 алкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена и C1-C6 алкокси,
C3-C7 циклоалкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена,
С6 ароматический углеводород, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена; или
С4 моноциклическую ненасыщенную гетероциклическую группу, содержащую 1 гетероатом, выбранный из кислорода и серы, которая не замещена или замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена;
R2 представляет собой
C1-C10 алкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена, C1-C6 алкокси, C3-C7 циклоалкилом, который может быть замещён C1-C4 алкилом, фенилом, одной С4 моноциклической ненасыщенной гетероциклической группой, содержащей 1 гетероатом, выбранный из кислорода и серы,
C3-C7 циклоалкил, незамещенный или замещенный 1-2 раза по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила, галогена, C1-C6 галогеналкила, C3-C6 циклоалкила,
C2-C6 алкенил, незамещенный или замещенный галогеном,
C4-C12 связанный мостиковой связью циклоалкил, незамещенный или замещенный 1-2 раза C1-C6 алкилом,
или
C3-C10 моноциклическую или бициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, которая не замещена или замещена C1-C6 алкилом;
X представляет собой
N или
CR3, где R3 представляет собой
водород,
галоген,
циано,
C1-C6 алкил, незамещенный или замещенный C1-C6 алкокси,
C2-C6 алкенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила, который может быть замещён гидрокси, C1-C6 алкокси, пиридинила, C3-C6 циклоалкила, который может быть замещён гидрокси, N-C1-C6 алкилпиразолила, N-C1-C6 алкилимидазолила, морфолинила, тетрагидропиранила и имидазо(1,2-b)пиридазинила,
C1-C6 алкокси, незамещенный или замещенный тетрагидрофураном,
n представляет собой целое число, имеющее значение от 0 до 3,
при этом, когда n имеет значение 2 или 3, R1 могут быть одинаковыми или отличными друг от друга.
13. Применение соединения, представленного формулой (I) ниже, или его основно-аддитивной или кислотно-аддитивной соли для получения лекарственного средства, обладающего противоопухолевой активностью, опосредованной повышенной активностью RET:
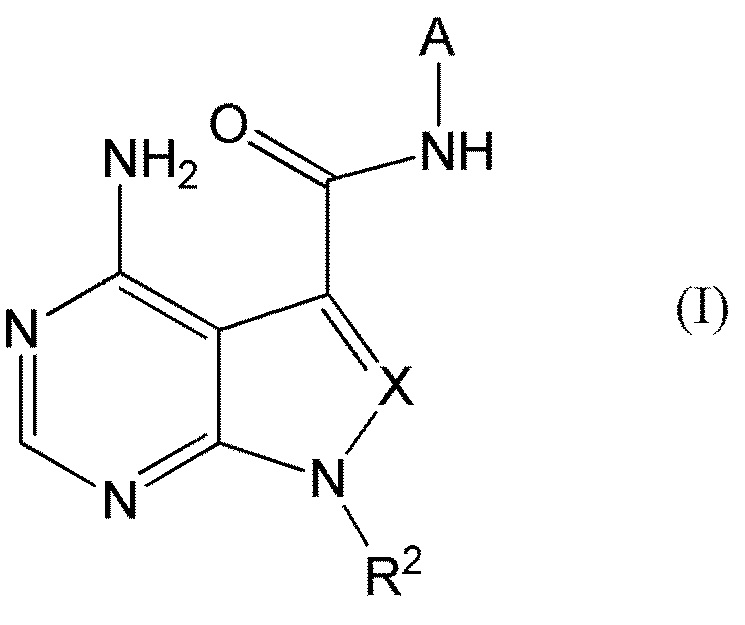
где A представляет собой пиразолил, замещенный n-количеством заместителей R1;
R1 представляет собой
галоген,
циано,
C1-C6 алкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена и C1-C6 алкокси,
C3-C7 циклоалкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена,
С6 ароматический углеводород, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена; или
С4 моноциклическую ненасыщенную гетероциклическую группу, содержащую 1 гетероатом, выбранный из кислорода и серы, которая не замещена или замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена;
R2 представляет собой
C1-C10 алкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена, C1-C6 алкокси, C3-C7 циклоалкилом, который может быть замещён C1-C4 алкилом, фенилом, одной С4 моноциклической ненасыщенной гетероциклической группой, содержащей 1 гетероатом, выбранный из кислорода и серы,
C3-C7 циклоалкил, незамещенный или замещенный 1-2 раза по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила, галогена, C1-C6 галогеналкила, C3-C6 циклоалкила,
C2-C6 алкенил, незамещенный или замещенный галогеном,
C4-C12 связанный мостиковой связью циклоалкил, незамещенный или замещенный 1-2 раза C1-C6 алкилом,
или
C3-C10 моноциклическую или бициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, которая не замещена или замещена C1-C6 алкилом;
X представляет собой
N или
CR3, где R3 представляет собой
водород,
галоген,
циано,
C1-C6 алкил, незамещенный или замещенный C1-C6 алкокси,
C2-C6 алкенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила, который может быть замещён гидрокси, C1-C6 алкокси, пиридинила, C3-C6 циклоалкила, который может быть замещён гидрокси, N-C1-C6 алкилпиразолила, N-C1-C6 алкилимидазолила, морфолинила, тетрагидропиранила и имидазо(1,2-b)пиридазинила,
C1-C6 алкокси, незамещенный или замещенный тетрагидрофураном,
n представляет собой целое число, имеющее значение от 0 до 3,
при этом, когда n имеет значение 2 или 3, R1 могут быть одинаковыми или отличными друг от друга.
14. Применение соединения, представленного формулой (I) ниже, или его основно-аддитивной или кислотно-аддитивной соли для ингибирования RET:
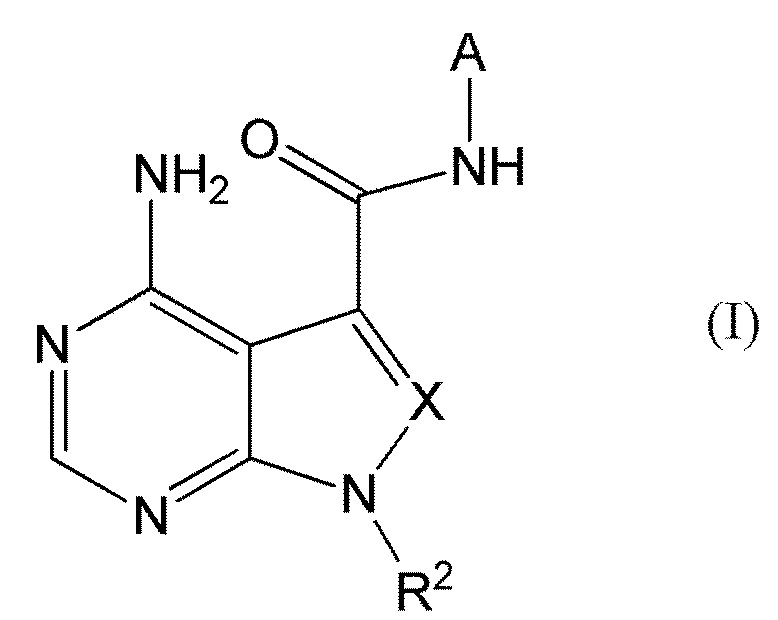
где A представляет собой пиразолил, замещенный n-количеством заместителей R1;
R1 представляет собой
галоген,
циано,
C1-C6 алкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена и C1-C6 алкокси,
C3-C7 циклоалкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена,
С6 ароматический углеводород, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена; или
С4 моноциклическую ненасыщенную гетероциклическую группу, содержащую 1 гетероатом, выбранный из кислорода и серы, которая не замещена или замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена;
R2 представляет собой
C1-C10 алкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена, C1-C6 алкокси, C3-C7 циклоалкилом, который может быть замещён C1-C4 алкилом, фенилом, одной С4 моноциклической ненасыщенной гетероциклической группой, содержащей 1 гетероатом, выбранный из кислорода и серы,
C3-C7 циклоалкил, незамещенный или замещенный 1-2 раза по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила, галогена, C1-C6 галогеналкила, C3-C6 циклоалкила,
C2-C6 алкенил, незамещенный или замещенный галогеном,
C4-C12 связанный мостиковой связью циклоалкил, незамещенный или замещенный 1-2 раза C1-C6 алкилом,
или
C3-C10 моноциклическую или бициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, которая не замещена или замещена C1-C6 алкилом;
X представляет собой
N или
CR3, где R3 представляет собой
водород,
галоген,
циано,
C1-C6 алкил, незамещенный или замещенный C1-C6 алкокси,
C2-C6 алкенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила, который может быть замещён гидрокси, C1-C6 алкокси, пиридинила, C3-C6 циклоалкила, который может быть замещён гидрокси, N-C1-C6 алкилпиразолила, N-C1-C6 алкилимидазолила, морфолинила, тетрагидропиранила и имидазо(1,2-b)пиридазинила,
C1-C6 алкокси, незамещенный или замещенный тетрагидрофураном,
n представляет собой целое число, имеющее значение от 0 до 3,
при этом, когда n имеет значение 2 или 3, R1 могут быть одинаковыми или отличными друг от друга.
15. Применение соединения, представленного формулой (I) ниже, или его основно-аддитивной или кислотно-аддитивной соли для профилактики или лечения злокачественной опухоли, опосредованной повышенной активностью RET:
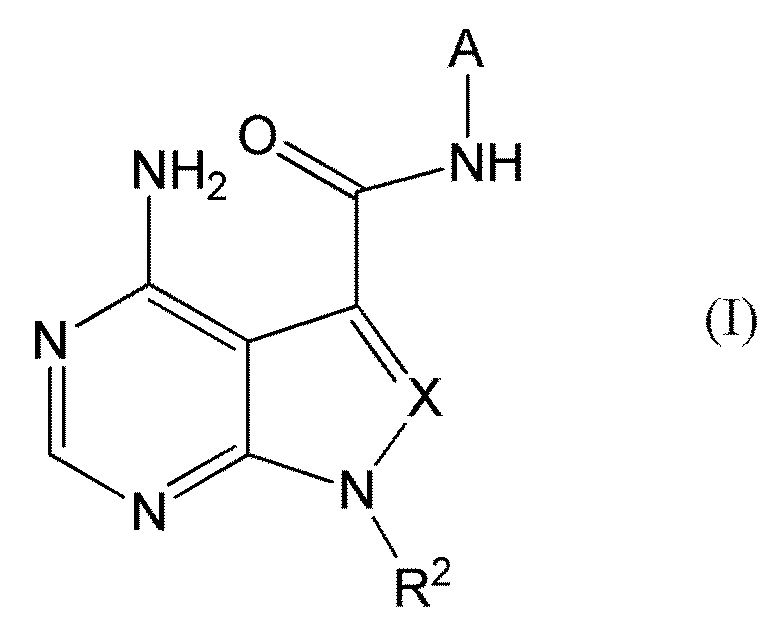
где A представляет собой пиразолил, замещенный n-количеством заместителей R1;
R1 представляет собой
галоген,
циано,
C1-C6 алкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена и C1-C6 алкокси,
C3-C7 циклоалкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена,
С6 ароматический углеводород, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена; или
С4 моноциклическую ненасыщенную гетероциклическую группу, содержащую 1 гетероатом, выбранный из кислорода и серы, которая не замещена или замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена;
R2 представляет собой
C1-C10 алкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена, C1-C6 алкокси, C3-C7 циклоалкилом, который может быть замещён C1-C4 алкилом, фенилом, одной С4 моноциклической ненасыщенной гетероциклической группой, содержащей 1 гетероатом, выбранный из кислорода и серы,
C3-C7 циклоалкил, незамещенный или замещенный 1-2 раза по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила, галогена, C1-C6 галогеналкила, C3-C6 циклоалкила,
C2-C6 алкенил, незамещенный или замещенный галогеном,
C4-C12 связанный мостиковой связью циклоалкил, незамещенный или замещенный 1-2 раза C1-C6 алкилом,
или
C3-C10 моноциклическую или бициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, которая не замещена или замещена C1-C6 алкилом;
X представляет собой
N или
CR3, где R3 представляет собой
водород,
галоген,
циано,
C1-C6 алкил, незамещенный или замещенный C1-C6 алкокси,
C2-C6 алкенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила, который может быть замещён гидрокси, C1-C6 алкокси, пиридинила, C3-C6 циклоалкила, который может быть замещён гидрокси, N-C1-C6 алкилпиразолила, N-C1-C6 алкилимидазолила, морфолинила, тетрагидропиранила и имидазо(1,2-b)пиридазинила,
C1-C6 алкокси, незамещенный или замещенный тетрагидрофураном,
n представляет собой целое число, имеющее значение от 0 до 3,
при этом, когда n имеет значение 2 или 3, R1 могут быть одинаковыми или отличными друг от друга.
16. Применение по любому из пп. 12-15, где в формуле (I)
A представляет собой пиразолил, замещенный n-количеством заместителей R1;
R1 представляет собой
галоген;
циано;
C1-C6 алкил, который может быть замещен галогеном или C1-C4 алкокси;
C3-C7 циклоалкил;
фенил; или
C4 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы;
R2 представляет собой
линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной С4 моноциклической ненасыщенной гетероциклической группой, содержащей один атом кислорода или один атом серы;
C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, который может быть замещен C1-C4 алкилом;
X представляет собой
N или
CR3, где R3 представляет собой
водород;
галоген;
C1-C6 алкил;
C2-C4 алкинил, который замещен:
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C6 циклоалкилом, который может быть замещен гидрокси,
N-C1-C6-алкилпиразолилом, N-C1-C6-алкилимидазолилом, морфолинилом, тетрагидропиранилом и имидазо(1,2-b)пиридазинилом; или
C1-C4 алкокси, который может быть замещен N-C1-C6-алкилпиразолилом, N-C1-C6-алкилимидазолилом, морфолинилом, тетрагидропиранилом и имидазо(1,2-b)пиридазинилом; и
n представляет собой целое число, имеющее значение 1 или 2,
при этом, когда n имеет значение 2, R1 могут быть одинаковыми или отличными друг от друга.
17. Применение по любому из пп. 12-15, где соединение, представленное формулой (I), или его основно-аддитивная или кислотно-аддитивная соль представляет собой соединение, представленное формулой (II) ниже, или его основно-аддитивная или кислотно-аддитивная соль:
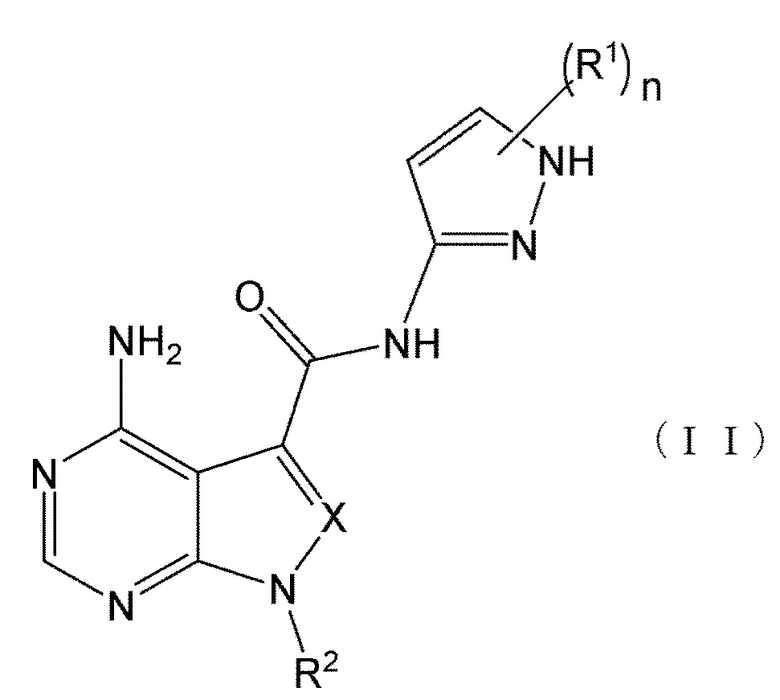
где R1 представляет собой
галоген;
циано;
C1-C6 алкил, который может быть замещен галогеном;
C3-C7 циклоалкил;
фенил; или
C4 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы;
R2 представляет собой
линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной С4 моноциклической ненасыщенной гетероциклической группой, содержащей один атом кислорода или один атом серы;
C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенoм, C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил;
X представляет собой
N или
CR3, где R3 представляет собой
водород;
галоген;
C1-C4 алкил;
C2-C4 алкинил, который замещен:
C1-C6 алкилом, который может быть замещен гидрокси, C3-C6 циклоалкилом, который может быть замещен гидрокси,
N-C1-C6-алкилпиразолилом, N-C1-C6-алкилимидазолилом, морфолинилом, тетрагидропиранилом и имидазо(1,2-b)пиридазинилом; или
C1-C4 алкокси; и
n представляет собой целое число, имеющее значение 1 или 2,
при этом, когда n имеет значение 2, R1 могут быть одинаковыми или отличными друг от друга.
18. Применение по п. 17, где в формуле (II)
R1 представляет собой
галоген,
циано или
C1-C4 алкил, который может быть замещен галогеном;
R2 представляет собой
линейный C1-C4 алкил, который может быть замещен C3-C7 циклоалкилом;
разветвленный C3-C6 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, одной С4 моноциклической ненасыщенной гетероциклической группой, содержащей один атом серы, или C1-C4 алкокси;
C3-C7 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, выбранный из бицикло[1.1.1]пентан-1-ила и бицикло[2.2.1]гептан-2-ила;
X представляет собой
N или
CR3, где R3 представляет собой
водород; или
C2-C4 алкинил, который замещен:
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C6 циклоалкилом, который может быть замещен гидрокси,
N-C1-C6-алкилпиразолилом, N-C1-C6-алкилимидазолилом, морфолинилом, тетрагидропиранилом и имидазо(1,2-b)пиридазинилом; и
n представляет собой целое число, имеющее значение 1.
19. Применение по любому из пп. 12-15, где соединение, представленное формулой (I), или его основно-аддитивная или кислотно-аддитивная соль представляет собой соединение, представленное формулой (IX) ниже, или его основно-аддитивная или кислотно-аддитивная соль:
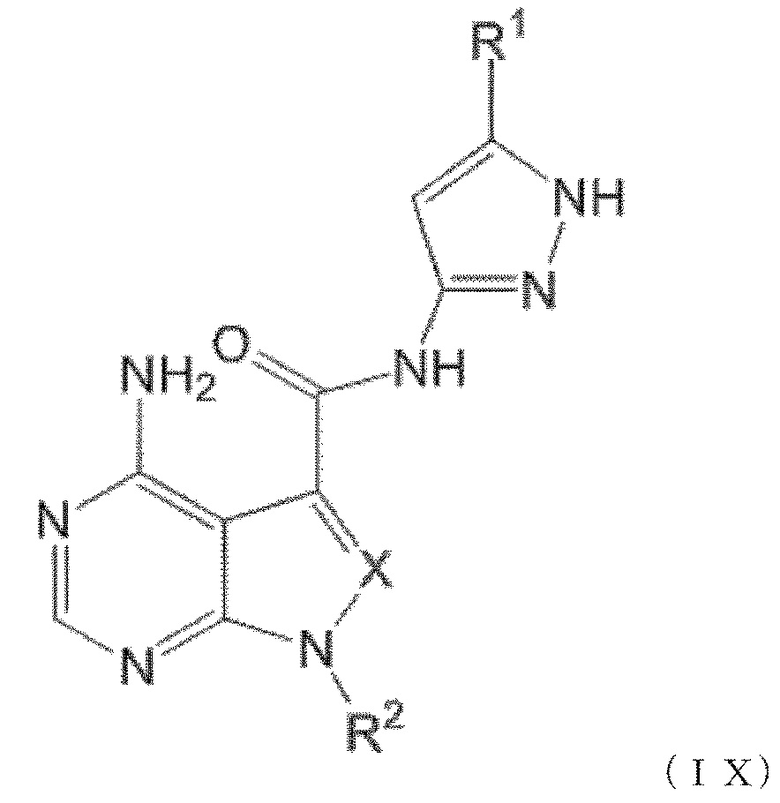
где R1 представляет собой галоген или C1-C4 алкил;
R2 представляет собой
разветвленный C3-C6 алкил, который может быть замещен галогеном или C3-C5 циклоалкилом;
C3-C5 циклоалкил, который может быть замещен C1-C4 алкилом; или
бицикло[2.2.1]гептан-2-ил; и
X представляет собой
N или
CR3, где R3 представляет собой
водород; или
этинил или пропинил, который замещен C1-C4 алкилом, который может быть замещен гидрокси,
C3-C5 циклоалкилом, который может быть замещен гидрокси,
N-C1-C6-алкилпиразолилом, N-C1-C6-алкилимидазолилом, морфолинилом, тетрагидропиранилом и имидазо(1,2-b)пиридазинилом.
20. Применение по п. 19, где в формуле (IX)
R1 представляет собой бром или метил;
R2 представляет собой
разветвленный C3-C6 алкил, который может быть замещен фтором или C3-C5 циклоалкилом, или
C3-C5 циклоалкил, который может быть замещен метилом; и
X представляет собой
N или
CR3, где R3 представляет собой водород.
21. Соединение, представленное формулой (I') ниже, или его основно-аддитивная или кислотно-аддитивная соль:
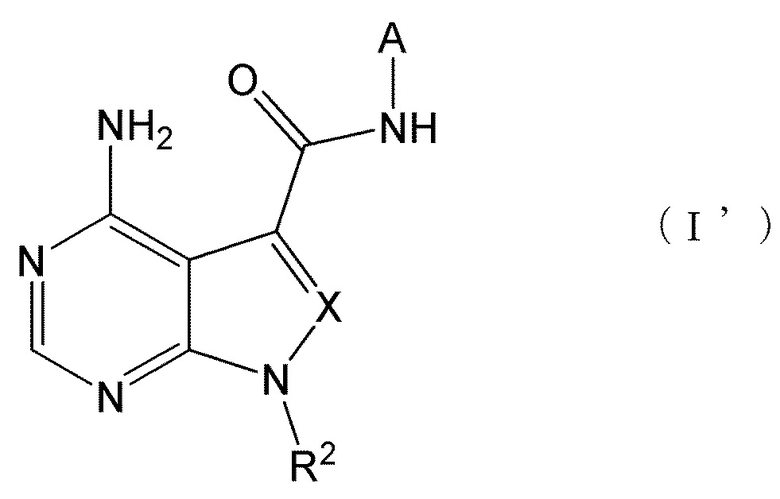
где A представляет собой пиразолил, замещенный n-количеством заместителей R1;
R1 представляет собой
галоген,
циано,
C1-C6 алкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена и C1-C6 алкокси,
C3-C7 циклоалкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена,
С6 ароматический углеводород, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена; или
С4 моноциклическую ненасыщенную гетероциклическую группу, содержащую 1 гетероатом, выбранный из кислорода и серы, которая не замещена или замещена по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила и галогена;
R2 представляет собой
C1-C10 алкил, незамещенный или замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена, C1-C6 алкокси, C3-C7 циклоалкилом, который может быть замещён C1-C4 алкилом, фенилом, одной С4 моноциклической ненасыщенной гетероциклической группой, содержащей 1 гетероатом, выбранный из кислорода и серы,
C3-C4 циклоалкил, незамещенный или замещенный 1-2 раза по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила, галогена, C1-C6 галогеналкила, C3-C6 циклоалкила,
C2-C6 алкенил, незамещенный или замещенный галогеном,
C4-C12 связанный мостиковой связью циклоалкил, незамещенный или замещенный 1-2 раза C1-C6 алкилом,
или
C3-C10 моноциклическую или бициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, которая не замещена или замещена C1-C6 алкилом;
X представляет собой
N или
CR3, где R3 представляет собой
водород,
галоген,
циано,
C1-C6 алкил, незамещенный или замещенный C1-C6 алкокси,
C2-C6 алкенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из C1-C6 алкила, который может быть замещён гидрокси, C1-C6 алкокси, пиридинила, C3-C6 циклоалкила, который может быть замещён гидрокси, N-C1-C6 алкилпиразолила, N-C1-C6 алкилимидазолила, морфолинила, тетрагидропиранила и имидазо(1,2-b)пиридазинила,
C1-C6 алкокси, незамещенный или замещенный тетрагидрофураном,
n представляет собой целое число, имеющее значение от 0 до 3,
при этом, когда n имеет значение 2 или 3, R1 могут быть одинаковыми или отличными друг от друга.
22. Соединение или его основно-аддитивная или кислотно-аддитивная соль по п. 21, где в формуле (I')
A представляет собой пиразолил, замещенный n-количеством заместителей R1;
R1 представляет собой
галоген;
циано;
C1-C6 алкил, который может быть замещен галогеном или C1-C4 алкокси;
C3-C7 циклоалкил;
фенил; или
C4 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы;
R2 представляет собой
линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной С4 моноциклической ненасыщенной гетероциклической группой, содержащей один атом кислорода или один атом серы;
C3-C4 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, который может быть замещен C1-C4 алкилом;
X представляет собой
N или
CR3, где R3 представляет собой
водород;
галоген;
C1-C6 алкил;
C2-C4 алкинил, который замещен:
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C6 циклоалкилом, который может быть замещен гидрокси,
одной или несколькими C3-C6 моноциклическими насыщенными гетероциклическими группами, содержащими 1-3 одинаковых или отличных друг от друга гетероатома, выбранных из азота, кислорода и серы, или
; или
C1-C4 алкокси, который может быть замещен N-C1-C6-алкилпиразолилом, N-C1-C6-алкилимидазолилом, морфолинилом, тетрагидропиранилом и имидазо(1,2-b)пиридазинилом; и
n представляет собой целое число, имеющее значение 1 или 2,
при этом, когда n имеет значение 2, R1 могут быть одинаковыми или отличными друг от друга.
23. Соединение или его основно-аддитивная или кислотно-аддитивная соль по п. 21, представленное формулой (II') ниже:
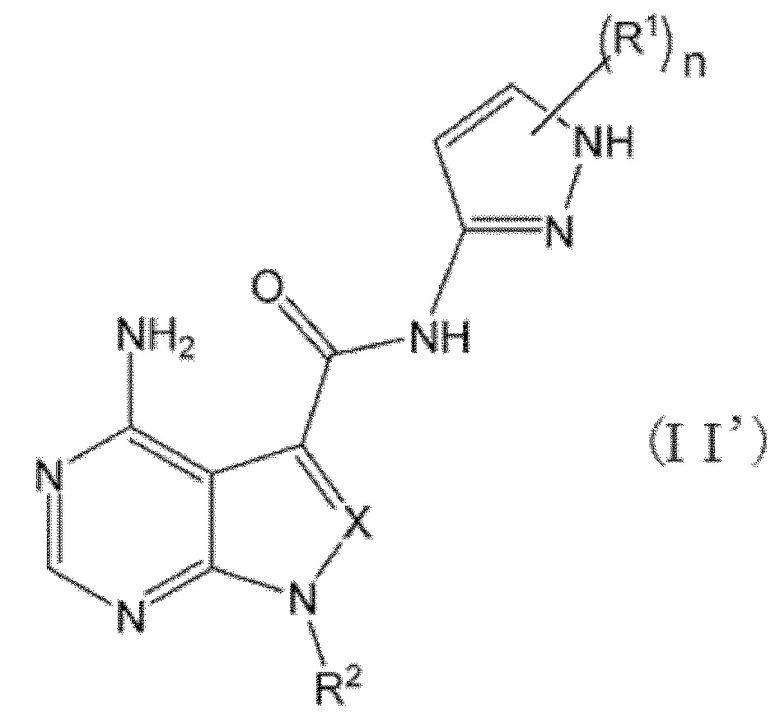
где R1 представляет собой
галоген;
циано;
C1-C6 алкил, который может быть замещен галогеном;
C3-C7 циклоалкил;
фенил; или
C4 моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом кислорода или один атом серы;
R2 представляет собой
линейный C1-C6 алкил или разветвленный C3-C8 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, который может быть замещен C1-C4 алкилом, фенилом, C1-C4 алкокси или одной С4 моноциклической ненасыщенной гетероциклической группой, содержащей один атом кислорода или один атом серы;
C3-C4 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом, галогенo C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил;
X представляет собой
N или
CR3, где R3 представляет собой
водород;
галоген;
C1-C4 алкил;
C2-C4 алкинил, который замещен:
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C6 циклоалкилом, который может быть замещен гидрокси,
N-C1-C6-алкилпиразолилом, N-C1-C6-алкилимидазолилом, морфолинилом, тетрагидропиранилом и имидазо(1,2-b)пиридазинилом; или
C1-C4 алкокси; и
n представляет собой целое число, имеющее значение 1 или 2,
при этом, когда n имеет значение 2, R1 могут быть одинаковыми или отличными друг от друга.
24. Соединение или его основно-аддитивная или кислотно-аддитивная соль по п. 23, где в формуле (II')
R1 представляет собой
галоген,
циано или
C1-C4 алкил, который может быть замещен галогеном;
R2 представляет собой
линейный C1-C4 алкил, который может быть замещен C3-C7 циклоалкилом;
разветвленный C3-C6 алкил, который может быть замещен галогеном, C3-C7 циклоалкилом, одной С4 моноциклической ненасыщенной гетероциклической группой, содержащей один атом серы, или C1-C4 алкокси;
C3-C4 циклоалкил, который может быть замещен галогеном, C1-C4 алкилом или C3-C5 циклоалкилом;
C2-C6 алкенил, который может быть замещен галогеном; или
C4-C12 связанный мостиковой связью циклоалкил, выбранный из бицикло[1.1.1]пентан-1-ила и бицикло[2.2.1]гептан-2-ила;
X представляет собой
N или
CR3, где R3 представляет собой
водород; или
C2-C4 алкинил, который замещен:
C1-C6 алкилом, который может быть замещен гидрокси,
C3-C6 циклоалкилом, который может быть замещен гидрокси,
N-C1-C6-алкилпиразолилом, N-C1-C6-алкилимидазолилом, морфолинилом, тетрагидропиранилом и имидазо(1,2-b)пиридазинилом; и
n представляет собой целое число, имеющее значение 1.
25. Соединение или его соль по п. 21, представленное формулой (IX') ниже:
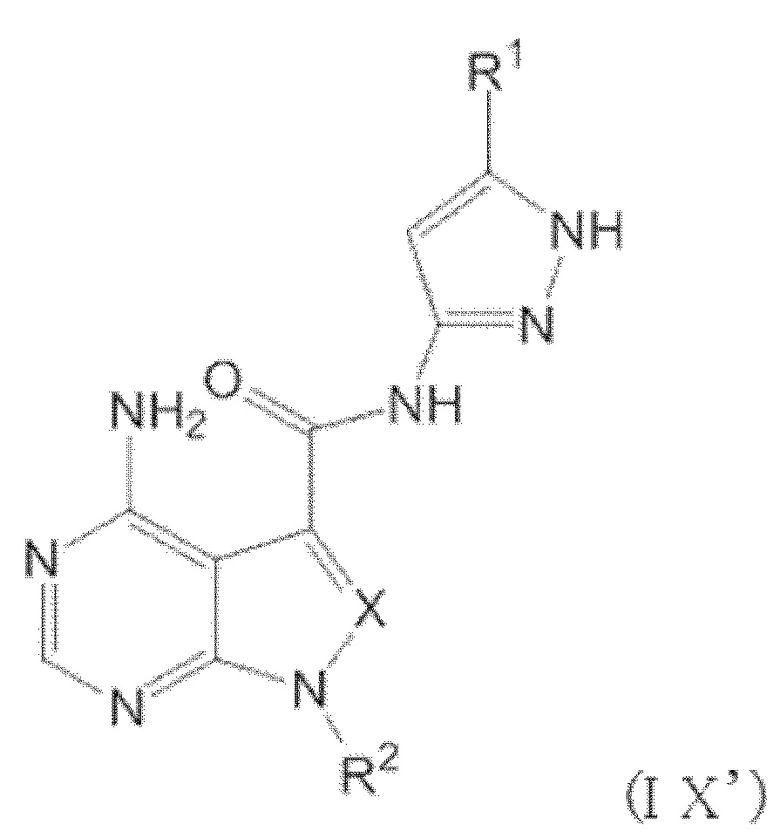
где R1 представляет собой галоген или C1-C4 алкил;
R2 представляет собой
разветвленный C3-C6 алкил, который может быть замещен галогеном или C3-C5 циклоалкилом;
C3-C4 циклоалкил, который может быть замещен C1-C4 алкилом; или
бицикло[2.2.1]гептан-2-ил; и
X представляет собой
N или
CR3, где R3 представляет собой
водород; или
этинил или пропинил, который замещен
C1-C4 алкилом, который может быть замещен гидрокси,
C3-C5 циклоалкилом, который может быть замещен гидрокси,
N-C1-C6-алкилпиразолилом, N-C1-C6-алкилимидазолилом, морфолинилом, тетрагидропиранилом и имидазо(1,2-b)пиридазинилом.
26. Соединение или его соль по п. 25, где в формуле (IX')
R1 представляет собой бром или метил;
R2 представляет собой
разветвленный C3-C6 алкил, который может быть замещен фтором или C3-C5 циклоалкилом, или
C3-C4 циклоалкил, который может быть замещен метилом; и
X представляет собой
N или
CR3, где R3 представляет собой водород.
27. Соединение или его основно-аддитивная или кислотно-аддитивная соль по п. 21, которое является по меньшей мере одним членом, выбранным из группы, включающей:
(34) 4-амино-1-(трет-бутил)-N-(5-метил-1H-пиразол-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид;
(48) 4-амино-7-(трет-бутил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид;
(50) 4-амино-7-(1-фтор-2-метилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид;
(51) 4-амино-N-(5-метил-1H-пиразол-3-ил)-7-(1-метилциклопропил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид;
(52) 4-амино-7-(2-циклопропилпропан-2-ил)-N-(5-метил-1H-пиразол-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид.
28. Фармацевтическая композиция, обладающая свойствами ингибирования RET для профилактики или лечения противоопухолевых заболеваний, включающая эффективное количество соединения или его основно-аддитивной или кислотно-аддитивной соли по любому из пп. 21-27.
29. Способ для профилактики или лечения злокачественной опухоли, опосредованной повышенной активностью RET, включающий введение пациенту соединения или его основно-аддитивной или кислотно-аддитивной соли по любому из пп. 21-27.
30. Способ ингибирования RET, включающий введение пациенту соединения или его основно-аддитивной или кислотно-аддитивной соли по любому из пп. 21-27.
31. Cоединение или его основно-аддитивная или кислотно-аддитивная соль по любому из пп. 21-27 для применения в качестве ингибитора RET для профилактики или лечения злокачественной опухоли, опосредованной повышенной активностью RET.
32. Cоединение или его основно-аддитивная или кислотно-аддитивная соль по любому из пп. 21-27 для применения в качестве противоопухолевого средства для профилактики или лечения злокачественной опухоли, опосредованной повышенной активностью RET.
33. Применение соединения или его основно-аддитивной или кислотно-аддитивной соли по любому из пп. 21-27 для получения лекарственного средства, обладающего противоопухолевой активностью, опосредованной повышенной активностью RET.
34. Применение соединения или его основно-аддитивной или кислотно-аддитивной соли по любому из пп. 21-27 для получения лекарственного средства, ингибирующего RET.
35. Применение соединения или его основно-аддитивной или кислотно-аддитивной соли по любому из пп. 21-27 для профилактики или лечения злокачественной опухоли, опосредованной повышенной активностью RET.
36. Применение соединения или его основно-аддитивной или кислотно-аддитивной соли по любому из пп. 21-27 для ингибирования RET.
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| WO 2005062795 A2, 14.07.2005 | |||
| WO 2013114113 A1, 08.08.2013 | |||
| WO 2007067781 А2, 14.06.2007 | |||
| Машина для планирования рабочих процессов | 1929 |
|
SU17865A1 |
Авторы
Даты
2020-08-11—Публикация
2016-09-07—Подача