Данная заявка заявляет преимущество предварительной заявки на патент США №60/659,696, зарегистрированной 8 марта 2005 г.
Предпосылки создания изобретения
1. Область техники, к которой относится изобретение
Настоящее изобретение относится к усовершенствованному способу получения макроциклических соединений, применимых в качестве агентов для лечения вирусных инфекций гепатита С (HCV).
2. Вспомогательная информация
Макроциклические соединения нижеследующей формулы (I) и способы их получения известны из Tsantrizos и др., патент США №6,608,027 B1, Llinas Brunet и др., заявка на патент США №2003/0224977 A1, Llinas Brunet и др., заявка на патент США №2005/0075279 A1, Llinas Brunet и др., заявка на патент США №2005/0080005 A1, Brandenburg и др., заявка на патент США №2005/0049187 А1 и Samstag и др., U.S. заявка на патент США №2004/0248779 А1:
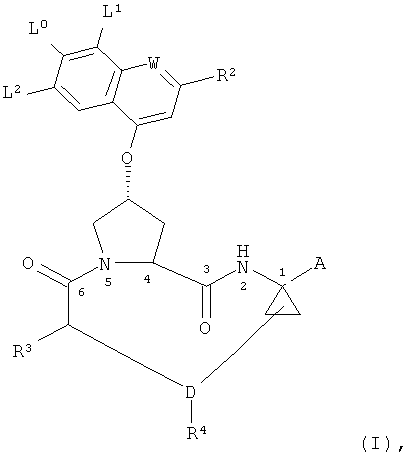
в которых
W является СН или азотом,
L0 является водородом, галоидом, (С1-С6)алкилом, (С3-С6)циклоалкилом, галоид(C1-C6)алкилом, (C1-C6)алкоксигруппой, (С3-С6)циклоалкоксигруппой, гидроксигруппой или N(R23)2, где каждый из R23 независимо является Н, (С1-С6)алкилом или (С3-С6)циклоалкилом,
L1, L2 независимо друг от друга являются водородом, галоидом, (С1-С4)алкилом, -O-(С1-С4)алкилом или -S-(С1-С4)алкилом (сера находится в любой окисленной форме), или
L0 и L1 или L0 и L2 могут быть ковалентно связаны, образуя вместе с двумя атомами углерода, к которым они присоединены, 4-, 5- или 6-членный карбоцикл, где одна или две (в случае 5- или 6-членного цикла) -СН2-группы, не связанные непосредственно друг с другом, могут быть независимо заменены на -О- или NRa, где Ra является водородом или (С1-С4)алкилом и где упомянутый цикл необязательно моно- или дизамещен (С1-С4)алкилом,
R2 является водородом, галоидом, (С1-С6)алкилом, (С3-С6)циклоалкилом, галоид(С1-С6)алкилом, (С1-С6)тиоалкилом, (С1-С6)алкоксигруппой, (С3-С6)циклоалкоксигруппой, (С2-С7)алкокси(С1-С6)алкилом, (С6)- или (С10)арилом или Het, где Het является пяти-, шести- или семичленным насыщенным или ненасыщенным гетероциклом, содержащим от одного до четырех гетероатомов, выбранных из азота, кислорода и серы, причем упомянутые циклоалкил, арил или Het замещены R6, где R6 является водородом, галоидом, (С1-С6)алкилом, (С3-С6)циклоалкилом, (С1-С6)алкоксигруппой, (С3-С6)циклоалкоксигруппой, NO2, N(R7)2, NH-C(O)-R7 или NH-C(O)-NH-R7, где каждый из R7 независимо является водородом, (С1-С6)алкилом или (С3-С6)циклоалкилом, или R6 является NH-C(O)-OR8, где R8 является (С1-С6)алкилом или (С3-С6)циклоалкилом,
R3 является гидроксигруппой, NH2 или группой формулы -NH-R9, где R9 является (С6)- или (С10)арилом, гетероарилом, -C(O)-R10, -C(O)-NHR10 или -C(O)-OR10, где R10 является (С1-С6)алкилом или (С3-С6)циклоалкилом,
D является ненасыщенной алкиленовой цепью, включающей от 5 до 10 атомов,
R4 является водородом или одним, двумя или тремя заместителями у любого из атомов углерода в указанной цепи D, каковой заместитель независимо выбран из (С1-С6)алкила, галоид(С1-С6)алкила, (С1-С6)алкоксигруппы, гидроксигруппы, галоида, аминогруппы, оксогруппы, тиогруппы и (С1-С6)тиоалкила, и
А является амидом формулы -C(O)-NH-R11, где R11 выбран из (С1-С8)алкила, (С3-С6)циклоалкила, (С6)- или (С10)арила, (С7-С16)арилалкила и SO2R11A где R11A является (C1-C8)алкилом, (С3-С7)циклоалкилом или (С1-С6)алкил(С3-С7)циклоалкилом,
или
А является карбоновой кислотой или ее фармацевтически приемлемой солью или сложным эфиром.
Соединения формулы (I) раскрываются в вышеупомянутых патентных документах как активные агенты для лечения вирусных инфекций гепатита С (HCV). Раскрываемые способы получения этих соединений включают большое число стадий синтеза. Проблема, на решение которой направлено настоящее изобретение, состоит в разработке практичного и экономичного процесса, обеспечивающего эффективное производство данных соединений с минимальным количеством стадий синтеза и с достаточным конечным выходом продукта.
Краткое описание изобретения
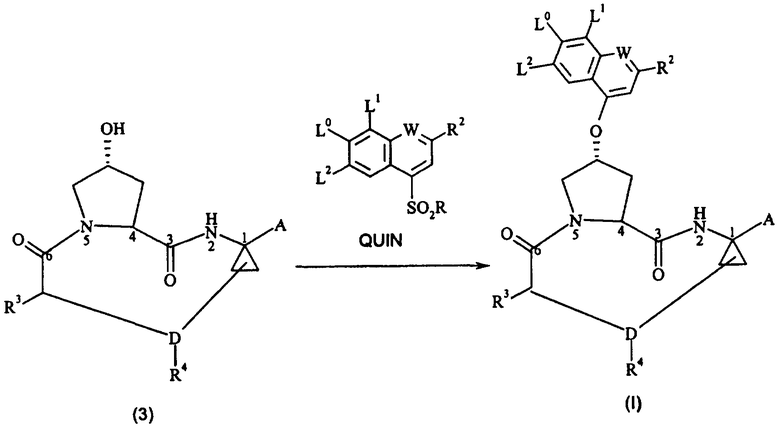
Было обнаружено, что соединения формулы (I), описанные выше, могут быть получены более эффективным образом, если синтез осуществляют с помощью нижеследующего процесса замещения в качестве ключевой стадии синтеза, заключающегося в том, что макроциклическое соединение формулы (3) взаимодействует с сульфонилзамещенным соединением формулы QUIN
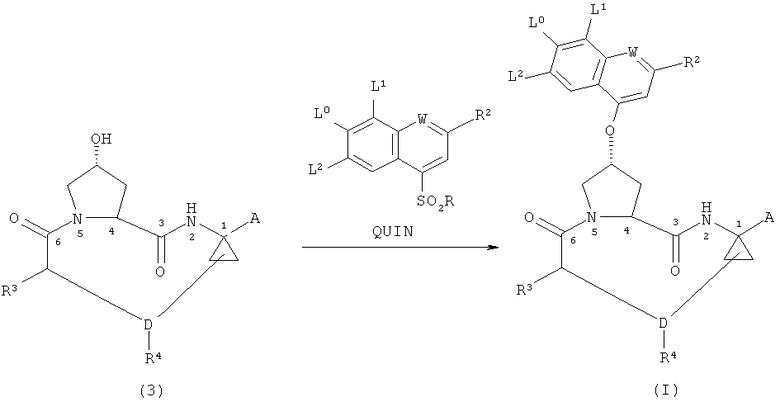
и, в тех случаях, когда А является защищенной карбоксильной группой, соединение формулы (I) необязательно осуществляют снятие защитной группы в соответствующих условиях с целью получения соединения формулы (I), в котором А является карбоксильной группой, а в тех случаях, когда А является карбоксильной группой в конечном соединении формулы (I), необязательно осуществляют реакцию сочетания данного соединения с сульфамидом формулы R11ASO2NH2 в присутствии подходящего агента для сочетания, такого как карбодиимидные реагенты, тетрафторборат O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (ТБТУ) и гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (ГАТУ), с целью получения соединения формулы (I), в котором А является -C(O)-NH-SO2R11A.
В данном способе также не происходит инверсии конфигурации при гидроксильной группе пролинового фрагмента, что дополнительно упрощает данный способ и минимизирует проблемы стереоконтроля, причем хинолиновый структурный элемент вводят в молекулу к концу процесса, минимизируя таким образом потери дорогостоящего промежуточного соединения.
Подробное описание изобретения
Определение используемых терминов и соглашений.
Терминам, которые специально не определены в контексте, следует приписывать такие значения, которые были бы им приписаны специалистом в соответствующей области в свете настоящего раскрытия и контекста. Если обратное не оговорено специально, в настоящем описании изобретения нижеследующие термины принимают указанные значения и соблюдаются нижеследующие соглашения.
В группах, радикалах или остатках, определенных ниже, обозначение количества атомов углерода часто предшествует группе. Например, (С1-С6)алкил означает алкильную группу или радикал, содержащий от 1 до 6 атомов углерода. Как правило, для групп, содержащих две или более подгруппы, группа, названная последней, содержит положение, по которому радикал образует связь, например, "тиоалкил" означает одновалентный радикал формулы HS-алкил-. За исключением специально оговоренных ниже случаев, имеют силу общепринятые определения терминов и предполагаются и достигаются стандартные стабильные валентности атомов во всех формулах и группах.
Термин "(С1-С6)алкил", как он употребляется в контексте сам по себе или в сочетании с другим заместителем, означает ациклические, неразветвленные или разветвленные алкильные заместители, содержащие от 1 до 6 атомов углерода, и включает, например, метил, этил, пропил, бутил, гексил, 1-метилэтил, 1-метилпропил, 2-метилпропил и 1,1-диметилэтил.
Термин "(С3-С6)циклоалкил", как он употребляется в контексте сам по себе или в сочетании с другим заместителем, означает циклоалкильный заместитель, содержащий от трех до шести атомов углерода, и включает циклопропил, циклобутил, циклопентил и циклогексил.
Термин "ненасыщенная алкиленовая цепь", как он употребляется в контексте, означает двухвалентный алкенильный заместитель, получаемый путем удаления одного атома водорода от каждого конца моно- или полиненасыщенного неразветвленного или разветвленного алифатического углеводорода, и включает, например -СН2-СН2-СН2-СН2-СН2-CH=СН- и -СН2-СН2-СН2-СН2-СН=СН-СН2-.
Термин "(С1-С6)алкоксигруппа", как он употребляется в контексте сам по себе или в сочетании с другим заместителем, означает заместитель (С1-С6)алкил-O-, в котором алкил отвечает вышеприведенному определению, содержащий до шести атомов углерода. Алкоксигруппа включает метоксигруппу, этоксигруппу, пропоксигруппу, 1-метилэтоксигруппу, бутоксигруппу и 1,1-диметилэтоксигруппу. Последний заместитель обычно известен как трет-бутоксигруппа.
Термин "(С3-С6)циклоалкоксигруппа", как он употребляется в контексте сам по себе или в сочетании с другим заместителем, означает заместитель (С3-С6)циклоалкил-О-, содержащий от 3 до 6 атомов углерода.
Термин "(С2-С7)алкокси(С1-С6)алкил", как он употребляется в контексте, означает заместитель (С2-С7)алкил-O-(С1-С6)алкил, в котором алкил отвечает вышеприведенному определению, содержащий до шести атомов углерода.
Термин "галоидалкил", как он употребляется в контексте сам по себе или в сочетании с другим заместителем, обозначает ациклические, неразветвленные или разветвленные алкильные заместители, в которых один или более атомов водорода замещены галоидом, выбранным из брома, хлора, фтора или йода.
Термин "тиоалкил", как он употребляется в контексте сам по себе или в сочетании с другим заместителем, обозначает ациклические, разветвленные или неразветвленные алкильные заместители, содержащие тиольную (HS) группу в качестве заместителя. Примером тиоалкильной группы является тиопропил, например, HS-CH2-CH2-CH2-.
Термин "(С6)- или (С10)арил", как он употребляется в контексте сам по себе или в сочетании с другим заместителем, означает или ароматическую моноциклическую систему, содержащую 6 атомов углерода, или ароматическую бициклическую систему, содержащую 10 атомов углерода. Например, арил включает фенильную или нафтильную систему циклов.
Термин "(С7-С16)арилалкил", как он употребляется в контексте сам по себе или в сочетании с другим заместителем, означает арил, как он определен выше, связанный через алкильную группу, причем алкил отвечает вышеприведенному определению и содержит от 1 до 6 атомов углерода. Арилалкил включает, например, бензил и бутилфенил.
Термин "Het", как он употребляется в контексте сам по себе или в сочетании с другим заместителем, означает одновалентный заместитель, получаемый удалением атома водорода от пяти-, шести- или семичленного насыщенного или ненасыщенного (включая ароматический) гетероцикла, содержащего атомы углерода и от одного до четырех кольцевых гетероатомов, выбранных из азота, кислорода и серы. Примеры подходящих гетероциклов включают тетрагидрофуран, тиофен, диазепин, изоксазол, пиперидин, диоксан, морфолин, пиримидин или
 .
.
Термин "Het" также включает гетероцикл, как он определен выше, конденсированный с одним или более другими циклами, буде они являются гетероциклами или карбоциклами, каждый из которых может быть насыщенным или ненасыщенным. Один из подобных примеров включает тиазоло[4,5-b]пиридин. Термин "гетероарил", как он употребляется в контексте, хотя и входит в общем в объем термина "Het", в точности означает ненасыщенный гетероцикл, в котором двойные связи формируют ароматическую систему. Подходящий пример гетероароматической системы включает хинолин, индол, пиридин,
 ,
, 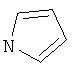 ,
, 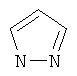 ,
, 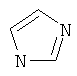 ,
, 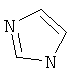 ,
,
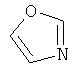 ,
, 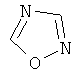 или
или 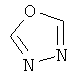 .
.
Термин "оксогруппа" означает группу (=O) с двойной связью, присоединенную в качестве заместителя.
Термин "тиогруппа" означает группу (=S) с двойной связью, присоединенную в качестве заместителя.
Как правило, подразумеваются все таутомерные формы и все изомерные формы и смеси химической структуры или соединения, будь то индивидуальные геометрические изомеры, или оптические изомеры, или рацемические или нерацемические смеси изомеров, если только конкретная стереохимия или изомерная форма не указаны специально в названии соединения или в структуре.
Термин "фармацевтически приемлемый сложный эфир", как он употребляется в контексте сам по себе или в сочетании с другим заместителем, означает сложные эфиры соединения формулы I, в котором любые карбоксильные группы молекулы, но предпочтительно концевые карбоксильные группы, заменены на алкоксикарбонильную группу
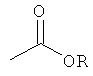 ,
,
в которой остаток R сложного эфира выбран из алкила (например, метила, этила, н-пропила, трет-бутила), алкоксиалкила (например, метоксиметила), алкоксиацила (например, ацетоксиметила), арилалкила (например, бензила), арилоксиалкила (например, феноксиметила), арила (например, фенила), необязательно замещенного галогеном, (С1-С4)алкилом или (С1-С4)алкоксигруппой. Другие подходящие сложные эфиры, которые могут выступать в качестве пролекарств, приведены в монографии "Design of Prodrugs", под ред. Bundgaard H., Elsevier (1985). Такие фармацевтически приемлемые сложные эфиры обычно гидролизуются in vivo при введении млекопитающему и преобразуются в кислотную форму соединения формулы I.
В вышеописанных сложных эфирах любой алкильный остаток преимущественно содержит, если иное не оговорено специально, от 1 до 16 атомов углерода, в частности, от 1 до 6 атомов углерода. Любой присутствующий в таких сложных эфирах арильный остаток преимущественно содержит фенильную группу.
В частности, сложные эфиры могут быть (С1-С16)алкиловым сложным эфиром, незамещенным бензиловым сложным эфиром или бензиловым сложным эфиром, замещенным по крайней мере одним галоидом, (С1-С6)алкилом, (С1-С6)алкоксигруппой, нитрогруппой или трифторметилом.
Термин "фармацевтически приемлемая соль", как он употребляется в контексте, включает соли, являющиеся производными фармацевтически приемлемых оснований. Примеры подходящих оснований включают холин, этаноламин и этилендиамин. Соли Na+, K+ и Ca+ также рассматриваются как входящие в объем настоящего изобретения (см. также "Pharmaceutical Salts", Birge S.M. и др., J. Pharm. Sci. (1977), 66, 1-19).
Нижеследующие химические соединения могут быть обозначены приводимыми аббревиатурами:
Варианты осуществления изобретения
Если иное не оговорено специально, в нижеприведенных схемах синтеза всем замещающим группам в химических формулах следует приписывать те же значения, что и в формуле (I). Реагенты, используемые в нижеприведенных схемах синтеза, или могут быть получены описанным в настоящей заявке способом, или, если они не описаны в настоящей заявке, либо являются коммерчески доступными, либо могут быть получены из коммерчески доступных веществ с помощью известных в соответствующей области способов. Некоторые исходные вещества, например, могут быть получены с помощью способов, описанных в международных заявках на изобретение WO 00/59929, WO 00/09543 и WO 00/09558, в патенте США US 6323180 В1 и в патенте США US 6608027 В1.
Оптимальные условия взаимодействия и время взаимодействия могут варьироваться в зависимости от конкретных используемых реагентов. Если иное не оговорено специально, растворители, температуры, давления и другие условия взаимодействий для получения оптимальных результатов в данной конкретной реакции, могут быть легко подобраны специалистом, обладающим стандартными знаниями в соответствующей области. Как правило, течение реакции может быть отслежено, если это необходимо, при помощи высокоэффективной жидкостной хроматографии (ВЭЖХ), а промежуточные соединения и продукты могут быть очищены при помощи хроматографии на силикагеле и/или путем перекристаллизации.
I. Общий многостадийный способ синтеза
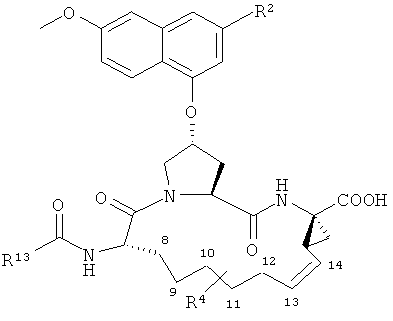
В одном из вариантов осуществления настоящего изобретения его объектом является общий многостадийный способ синтеза для получения соединений формулы (I). Более конкретно, объектом настоящего изобретения в данном варианте его осуществления является способ получения соединения нижеследующей формулы (I)

в котором
W является СН или азотом,
L0 является водородом, галоидом, (С1-С6)алкилом, (С3-С6)циклоалкилом, галоид(С1-С6)алкилом, (С1-С6)алкоксигруппой, (С3-С6)циклоалкоксигруппой, гидроксигруппой или N(R23)2, где каждый из R23 независимо является водородом, (С1-С6)алкилом или (С3-С6)циклоалкилом,
L1, L2 независимо друг от друга являются водородом, галоидом, (С1-С4)алкилом, -O-(С1-С4)алкилом или -S-(С1-С4)алкилом (сера находится в любом окисленном состоянии), или
L0 и L1 или L0 и L2 могут быть ковалентно связаны, образуя вместе с двумя атомами углерода, к которым они присоединены, 4-, 5- или 6-членный карбоцикл, где одна или две (в случае 5- или 6-членного цикла) -СН2-группы, не связанные непосредственно друг с другом, могут быть независимо друг от друга заменены на -O- или NRa, где Ra является водородом или (С1-С4)алкилом, причем упомянутый цикл необязательно содержит один или два (С1-С4)алкильных заместителя.
R2 является водородом, галоидом, (С1-С6)алкилом, (С3-С6)циклоалкилом, галоид(С1-С6)алкилом, (С1-С6)тиоалкилом, (С1-С6)алкоксигруппой, (С3-С6)циклоалкоксигруппой, (С2-С7)алкокси(С1-С6)алкилом, (С6)- или (С10)арилом или Het, где Het является пяти-, шести- или семичленным насыщенным или ненасыщенным гетероциклом, содержащим от одного до четырех гетероатомов, выбранных из азота, кислорода и серы, причем упомянутые циклоалкил, арил или Het замещены R6, где R6 является водородом, галоидом, (С1-С6)алкилом, (С3-С6)циклоалкилом, (С1-С6)алкоксигруппой, (С3-С6)циклоалкоксигруппой, NO2, N(R7)2, NH-C(O)-R7 или NH-C(O)-NH-R7, где каждый R7 независимо является водородом, (С1-С6)алкилом или (С3-С6)циклоалкилом, или R6 является NH-C(O)-OR8, где R8 является (С1-С6)алкилом или (С3-С6)циклоалкилом,
R3 является гидроксигруппой, NH2 или группой формулы -NH-R9, где R9 является (С6)- или (С10)арилом, гетероарилом, -C(O)-R10, -C(O)-NHR10 или -C(O)-OR10, где R10 является (С1-С6)алкилом или (С3-С6)циклоалкилом,
D является ненасыщенной алкиленовой цепью, содержащей от 5 до 10 атомов,
R4 является водородом или одним, двумя или тремя заместителями у любого из атомов углерода в указанной цепи D, каковой заместитель независимо выбран из (С1-С6)алкила, галоид(С1-С6)алкила, (С1-С6)алкоксигруппы, гидроксигруппы, галоида, аминогруппы, оксогруппы, тиогруппы и (С1-С6)тиоалкила, и
А является амидом формулы -C(O)-NH-R11, где R11 выбран из (C1-C8)алкила (C3-С6)циклоалкила, (С6)- или (С10)арила, (С7-С16)арилалкила и SO2R11A, где R11A является (С1-С8)алкилом, (С3-С7)циклоалкилом или (C1-C6)алкил(С3-С7)циклоалкилом,
или
А является карбоновой кислотой или ее фармацевтически приемлемой солью или сложным эфиром.
Указанный способ включает следующие стадии:
(i) в том случае, когда R=PG, где PG является защитной группой, способ включает циклизацию диенового соединения формулы (1) в присутствии подходящего катализатора с целью получения соединения формулы (2) и дальнейшее снятие защитной группы в соответствующих условиях с целью получения соединения формулы (3) или, в тех случаях, когда R=H, циклизацию диенового соединения формулы (1) в присутствии подходящего катализатора с целью получения соединения формулы (3)
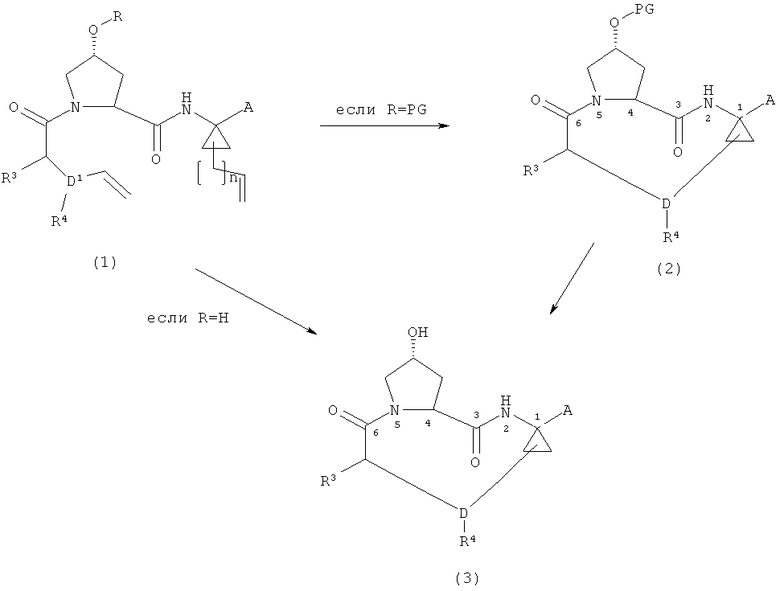 ,
,
где A, D, R3 и R4 принимают указанные для вышеприведенной формулы (I) значения, R является водородом или PG, где PG является защитной группой, n является целым числом от 0 до 2, и D1=D-(n+2),
(ii) в том случае, когда А является защищенной карбоксильной группой в формуле (3), способ необязательно включает снятие защитной группы с соединения формулы (3) в соответствующих условиях с целью получения соединения формулы (3), в котором А является карбоксильной группой, и
(iii) взаимодействие соединения формулы (3) с соединением формулы QUIN, где R3, R4, D, A, L0, L1, L2, W и R2 принимают указанные для вышеприведенной формулы (I) значения, a R является (С1-С6)алкилом, (С6)- или (С10)арилом или гетероарилом, с целью получения соединения формулы (I)
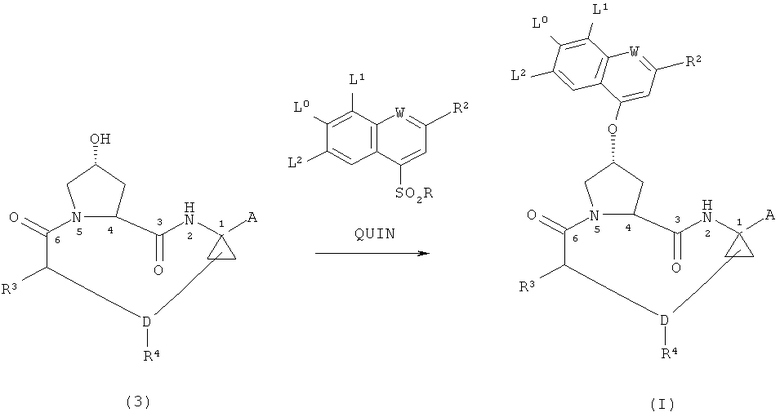
и, в тех случаях, когда А является защищенной карбоксильной группой в формуле (I), способ необязательно включает снятие защитной группы с соединения формулы (I) в соответствующих условиях с целью получения соединения формулы (I), где А является карбоксильной группой, и в тех случаях, когда А является карбоксильной группой в конечном соединении формулы (I), способ необязательно включает реакцию сочетания данного соединения с сульфамидом формулы R11ASO2NH2 в присутствии подходящего агента для сочетания, такого как карбодиимидные агенты, ТБТУ и ГАТУ, с целью получения соединения формулы (I), где А является -C(O)-NH-SO2R11A
II. Индивидуальные стадии синтеза
В дополнительных вариантах осуществления настоящего изобретения его объектом являются индивидуальные стадии вышеописанного общего многостадийного способа синтеза, а также индивидуальные промежуточные соединения, используемые на этих стадиях. Данные индивидуальные стадии и промежуточные соединения по настоящему изобретению подробно описаны ниже. Все замещающие группы в нижеописанных стадиях соответствуют определениям, данным при вышеприведенном описании общего многостадийного способа.
Стадия (i)
Данная стадия направлена на циклизацию диенового соединения формулы (1) в присутствии подходящего катализатора с целью получения соединения формулы (2), где R = защитная группа, и последующее снятие защитной группы с соединения формулы (2) в соответствующих условиях с целью получения соединения формулы (3), или, в тех случаях, когда R=H, на циклизацию диенового соединения формулы (1) в присутствии подходящего катализатора, что непосредственно приводит к соединению формулы (3)
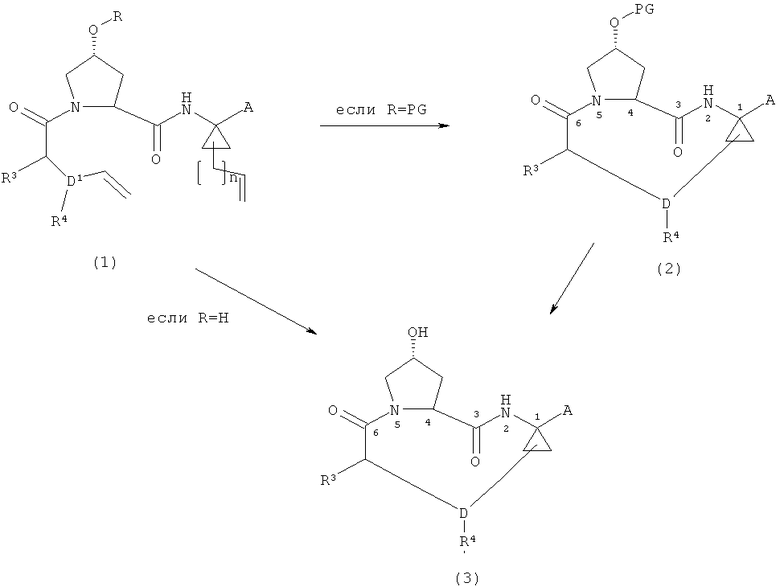
Подходящие катализаторы для стадии циклизации включают катализаторы на основе рутения, а также широко используемые катализаторы на основе молибдена (катализаторы Шрока и модифицированные катализаторы Шрока), а также катализаторы на основе вольфрама. Например, любой из хорошо известных катализаторов на основе рутения, используемых в реакциях метатезиса олефинов, такой как катализатор Граббса (первого и второго поколения), катализатор Ховейда (первого и второго поколения) и катализатор Нолана, может быть использован при соответствующей корректировке условий реакции, как это может быть необходимо для осуществления реакции закрытия цикла в зависимости от конкретного выбранного катализатора.
Подходящие рутениевые катализаторы для стадии циклизации включают, например, соединения формул А, Б, В, Г или Д
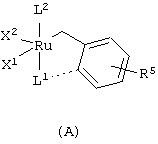 ,
, 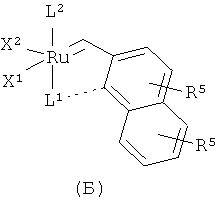 ,
, 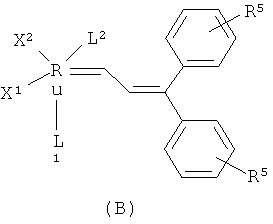
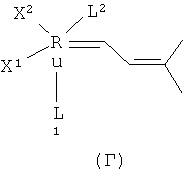 ,
, 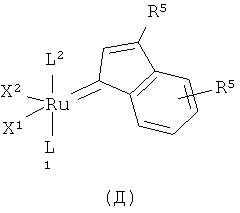 ,
,
в которых
Х1 и Х2 независимо друг от друга представляют собой анионный лиганд,
L1 представляет собой нейтральный электронно-донорный лиганд, который связан с атомом рутения и необязательно связан с фенильной группой, и
L2 представляет нейтральный электронно-донорный лиганд, который связан с атомом рутения, и
R5 выбран из одного или более заместителей в бензольный цикл, причем каждый заместитель независимо выбран из водорода, (С1-С6)алкила, галоид(С1-С6)алкила, HS-(С1-С6)алкила, НО-(С1-С6)алкила, перфтор(С1-С6)алкила, (С3-С6)циклоалкила, (С1-С6)алкоксигруппы, гидроксила, галоида, нитрогруппы, иминогруппы, оксогруппы, тиогруппы или арила,
и в которых Х2 и L2 вместе необязательно могут образовывать хелатообразующий бидентатный лиганд.
В более конкретном варианте осуществления настоящего изобретения рутениевый катализатор является соединением формулы (А-1) или (А-2):
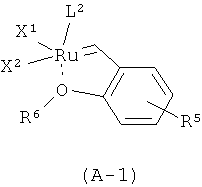
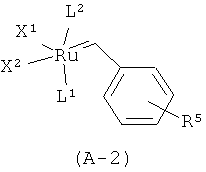 ,
,
в которых
L1 является тризамещенной фосфиновой группой формулы PR3, в которой R выбран из (С1-С6)алкила и (С3-С8)циклоалкила,
L2 является тризамещенной фосфиновой группой формулы PR3, в которой R выбран из (С1-С6)алкила и (С3-С8)циклоалкила, или L2 является группой формулы А или Б
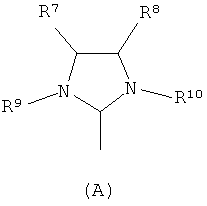
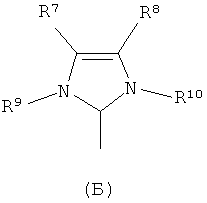
где
R7 и R8 независимо друг от друга представляют собой атом водорода или (С1-С6)алкил, (С2-С6)алкенил, (С6-С12)арил и (C6-C12)арил(C1-С6)алкил, и
R9 и R10 независимо друг от друга представляют собой атом водорода или (С1-С6)алкил, (С2-С6)алкенил, (С6-С12)арил и (С6-С12)арил(С1-С6)алкил, каждый из которых необязательно замещен одной, двумя или тремя группами, выбранными из водорода, (С1-С6)алкила, галоид(С1-С6)алкила, HS-(С1-С6)алкила, НО-(С1-С6)алкила, перфтор(С1-С6)алкила, (С3-С6)циклоалкила, (С1-С6)алкоксигруппы, гидроксила, галоида, нитрогруппы, иминогруппы, оксогруппы, тиогруппы или арила,
Х1 и Х2 независимо друг от друга представляют собой атом галогена,
R5 представляет собой водород или нитрогруппу, и
R6 представляет собой (С1-С6)алкильную группу.
В другом конкретном варианте осуществления настоящего изобретения рутениевый катализатор выбран из
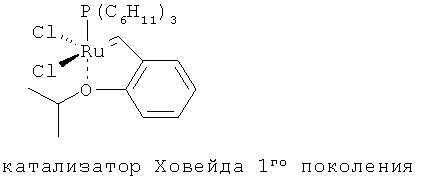
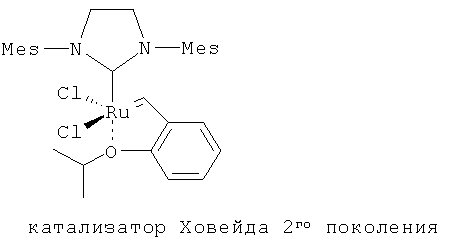
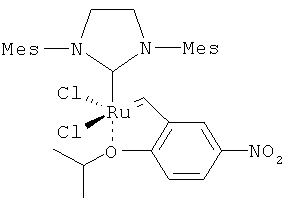

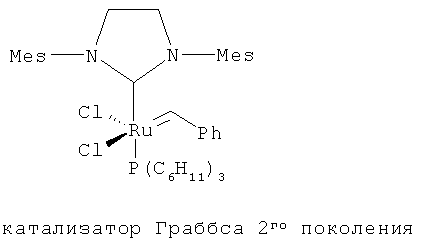
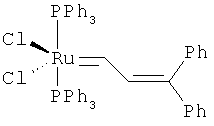 ,
,
где Ph является фенилом и Mes является 2,4,6-триметилфенилом.
Катализаторы на основе рутения пригодные для стадии метатезиса с закрытием цикла, такие как приведенные выше, являются хорошо известными катализаторами, которые могут быть получены путем хорошо известных синтетических методик. Например, см. следующие ссылки, содержащие примеры подходящих катализаторов на основе рутения:
Organometallics 2002, 21, 671; 1999, 18, 5416; 1998, 17, 2758,
J. Am. Chem. Soc. 2001, 123, 6543; 1999, 121, 791; 1999, 121, 2674; 2002, 124, 4954; 1998, 120, 2484; 1997, 119, 3887; 1996, 118, 100; 1996, 118, 9606,
J. Org. Chem. 1998, 63, 9904; 1999, 64, 7202,
Angew. Chem. Int. Ed. Engl. 1998, 37, 2685; 1995, 34, 2038; 2000, 39, 3012; 2002, 41, 4038,
Патенты США 5811515, 6306987 В1, и 6608027 В1.
В другом конкретном варианте осуществления настоящего изобретения реакцию закрытия цикла осуществляют в растворителе при температуре в интервале от, приблизительно, 20°С до, приблизительно, 120°С. Может быть применен любой растворитель, который подходит для реакции метатезиса с закрытием цикла. Примеры подходящих растворителей включают алканы, такие как н-пентан, н-гексан или н-гептан, ароматические углеводороды, такие как бензол, толуол или ксилол, хлорированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорметан или дихлорэтан, тетрагидрофуран, 2-метилтетрагидрофуран, 3-метилтетрагидрофуран, циклопентилметиловый эфир, трет-бутилметиловый эфир, диметиловый эфир, метиловый спирт, диоксан, этилацетат и трет-бутилацетат.
В другом конкретном варианте осуществления настоящего изобретения реакцию закрытия цикла осуществляют в условиях, когда мольное соотношение диенового соединения (1) и катализатора находится в пределах от 1000:1 до 100:1, предпочтительно, от 500:1 до 110:1, в особенности, от 250:1 до 150:1.
В другом конкретном варианте осуществления настоящего изобретения реакцию закрытия цикла осуществляют в условиях, когда соотношение диенового соединения (1) и растворителя находится в пределах от 1:400 по массе до 1:25 по массе, предпочтительно, от 1:200 по массе до 1:50 по массе, в особенности, от 1:150 по массе до 1:75 по массе.
В другом конкретном варианте осуществления настоящего изобретения реакцию закрытия цикла осуществляют при добавлении катализатора порциями в количестве от 2 до 6, предпочтительно, 3-5 порциями.
Специалист в соответствующей области без труда может оптимизировать стадию циклизации путем подбора и регулирования соответствующих условий, подходящих для конкретного выбранного катализатора реакции закрытия цикла. Например, в зависимости от выбранного катализатора предпочтительным может быть осуществление стадии циклизации при высокой температуре, например, выше чем 90°С, хотя также возможно осуществление взаимодействия при более низких температурах при добавлении активатора, такого как галогенид меди (CuX, где Х является галоидом), в реакционную смесь.
В конкретном варианте осуществления данной стадии соединение формулы (1) растворяют в обезгаженном органическом растворителе (таком как толуол или дихлорметан) до концентрации ниже, приблизительно, 0,02 М, затем обрабатывают катализатором на основе рутения, таким как катализатор Ховейда, при температуре от, приблизительно, 40°С до, приблизительно, 110°С вплоть до завершения взаимодействия. Часть металлического рутения или весь рутений можно удалить из реакционной смеси путем обработки подходящим поглотителем тяжелых металлов, таким как ТГМФ или другими агентами, способными захватывать тяжелые металлы. Реакционную смесь затем промывают водой, органический слой отделяют и промывают. Полученный органический раствор может быть обесцвечен, например, добавлением активированного угля с последующим фильтрованием.
В одном из вариантов осуществления данной стадии пролиновый кольцевой атом кислорода в формуле (1) защищают защитной группой (где R=PG) в любое время до стадии циклизации, используя общепринятые методики. Может быть использована любая подходящая для кислорода защитная группа, включая, например, ацетат, бензоат, пара-нитробензоат, нафтоаты, галоидацетат, метоксиацетат, фенилацетат, феноксиацетат, пивалат, кротонат, метилкарбонат, метоксиметилкарбонат, этилкарбонат, галогенкарбонат, пapa-нитрофенилкарбонат, триизопропилсилил, триэтилсилил, диметилизопропил, диэтилизопропил, диметилтексилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, трибензилсилил, трет-бутоксиметоксифенилсилил, трет-бутоксидифенилсилил и т.д. После стадии циклизации защитную группу PG в соединении (2) удаляют, используя обычные условия снятия защиты, подходящие для снятия данной конкретной защитной группы, как может быть легко понято любым специалистом в данной области, с целью получения соединения (3).
В другом варианте осуществления данной стадии может быть желательна очистка раствора диенового соединения формулы (1) прежде стадии метатезиса с закрытием цикла с целью удаления возможных примесей, которые могли бы ингибировать реакцию циклизации, из реакционной смеси. Могут быть применены общепринятые способы очистки, хорошо известные специалисту в соответствующей области. В одном из предпочтительных вариантов осуществления данной стадии раствор диенового соединения очищают посредством обработки окисью алюминия, например, активированной окисью алюминия, до того, как его используют в стадии циклизации.
Стадия (ii)
В тех случаях, когда А является защищенной карбоксильной группой в формуле (3), например, карбоксильной сложноэфирной группой, до перехода к следующей стадии соединение формулы (3) может быть необязательно подвергнуто снятию защитной группы (гидролизу) с целью получения соответствующей карбоновой кислоты в свободной форме. Гидролиз может быть осуществлен в обычных условиях гидролиза, известных в соответствующей области. В конкретном варианте осуществления, например, этерифицированное соединение формулы (3) растворяют в органическом растворителе, таком как ТГФ, и добавляют подходящий гидролизующий агент, такой как моногидрат гидроксида лития (LiOH·H2O) или гидроксид натрия (NaOH), с последующим добавлением воды. Получаемый таким образом раствор перемешивают при температуре от, приблизительно, 35°С до, приблизительно, 50°С. В конце реакции раствор охлаждают и отбирают органический слой. Подходящий растворитель, такой как этанол, добавляют к органическому слою и устанавливают pH в пределах от, приблизительно, pH 5 до, приблизительно, pH 6. Смесь затем нагревают до температуры от, приблизительно, 40°С до, приблизительно, 50°С, по достижении данной температуры добавляют воду и перемешивают раствор, вследствие чего соединение формулы (3) начинает осаждаться. После полного осаждения раствор охлаждают до комнатной температуры и соединение формулы (3) собирают посредством фильтрования, промывают и сушат.
Стадия (iii)
Данная стадия состоит в способе получения соединения формулы (I), включающем взаимодействие соединения формулы (3) с соединением формулы QUIN с целью получения соединения формулы (I)

и, в тех случаях, когда А является защищенной карбоксильной группой, необязательное снятие защитной группы с соединения формулы (I) в соответствующих условиях, с целью получения соединения формулы (I), в котором А является карбоксильной группой, а в тех случаях, когда А является карбоксильной группой в конечном соединении формулы (I), необязательное сочетание этого соединения с сульфамидом формулы R11ASO2NH2 в присутствии соответствующего агента для сочетания, такого как карбодиимидные агенты, ТБТУ или ГАТУ, с целью получения соединения формулы (I), в котором А является -C(O)-NH-SO2R11A.
Группы R в сульфонильной группе в QUIN включают, например, (С1-С6)алкил, (С6)- или (С10)арил или гетероарил. Предпочтительной группой R является фенил.
Реакцию сочетания между соединениями формулы (3) и QUIN обычно проводят в присутствии основания в подходящем растворителе или смеси растворителей. Примеры подходящих оснований для данной реакции включают t-BuOK, t-BuONa, t-BuOCs, бис(триметилсилил)амид натрия и ДМОК, причем предпочтительными основаниями являются t-BuOK и ДМОК. Примеры подходящих растворителей для данной реакции включают полярные апротонные растворители, например, ДМСО, ДМФ, НМП или другие распространенные полярные апротонные растворители, а также ТГФ и другие умеренно полярные простые эфиры, или подходящие смеси этих растворителей. Предпочтительным растворителем является ДМСО.
Предпочтительная температура находится в пределах между 0°С и 50°С (в зависимости от температуры замерзания растворителя), наиболее предпочтительно, между 10°С и 25°С.
Еще в одном предпочтительном варианте осуществления данной стадии можно использовать следующую совокупность условий реакции: в колбу помещают макроцикл (3) и хинолин QUIN, продувают азотом (3 раза), затем добавляют ДМСО через шприц. Смесь снова промывают азотом (3 раза) и доводят температуру до 20°С. К суспензии добавляют с помощью шприцевого насоса в течение часа 50% ДМОК в гептане. Получаемую таким образом смесь перемешивают в атмосфере азота при температуре ~20°С в течение 2 часов. Затем разлагают остатки реагентов, добавляя по каплям ледяную уксусную кислоту, и перемешивают смесь. После этого реакционную смесь медленно выливают в воду, что приводит к осаждению продукта. После этого суспензию перемешивают, фильтруют, промывают осадок на фильтре водой, а затем гексаном и высушивают твердое вещество.
В тех случаях, когда А является защищенной карбоксильной группой в формуле (I), например карбоксильной сложноэфирной группой, соединение формулы (I) может необязательно быть подвергнуто снятию защитной группы (гидролизу) в соответствующих условиях с целью получения соответствующей карбоновой кислоты в свободной форме. Гидролиз может быть осуществлен с использованием обычных условий гидролиза, известных в соответствующей области. Подходящими условиями являются те же, что и обсужденные ранее для стадии (ii). Кроме того, в тех случаях, когда А является карбоксильной группой в конечном соединении формулы (I), может быть осуществлено сочетание этого соединения с сульфамидом формулы R11ASO2NH2 в присутствии соответствующего агента для сочетания, такого как карбодиимидные агенты, ТБТУ или ГАТУ, с целью получения соединения формулы (I), в котором А является -C(O)-NH-SO2R11A.
III. Получение пептидного диенового исходного соединения.
Пептидное диеновое исходное соединение (1), используемое в приведенных выше схемах, может быть синтезировано из известных веществ с помощью способов, описанных ниже в схемах I, II и III.
Схема I - получение Р1-Р2
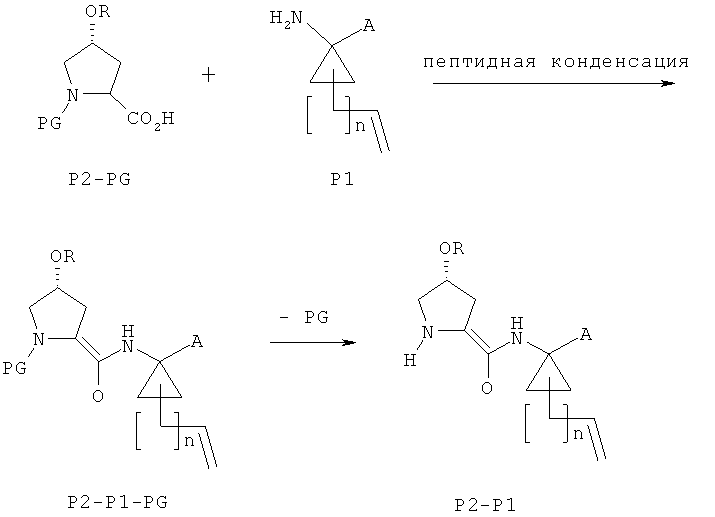
Пептидная конденсация с образованием P2-P1-PG, где PG является защитной группой для аминогруппы, на схеме I может быть осуществлена с использованием любых общепринятых реагентов пептидной конденсации и методик, известных в соответствующей области, защитная же группа PG для аминогруппы может быть любой подходящей защитной группой для аминогруппы, хорошо известной в соответствующей области. Например, смотрите промежуточные соединения и методики сочетания, раскрываемые в международных заявках на изобретение WO 00/09543, WO 00/09558 и патенте США 6608027 В1. Пептидная конденсация соединений P2-PG и Р1 может быть осуществлена, например, в разнообразных условиях, известных в соответствующей области, с использованием обычных реагентов пептидной конденсации, таких как ДЦК, ЭДК, ТБТУ, ГБТУ, ГАТУ, ДМТММ, хлорангидрид циануровой кислоты (ЦХ), тозилхлорид (TsCl), мезилхлорид (MsCl), изобутиловый эфир хлормуравьиной кислоты (ИБХ), ГОБТ или ГОАТ, в апротонных растворителях, таких как дихлорметан, хлороформ, ТГФ, ДМФ, НМП, ДМСО.
Следующая стадия расщепления защитной группы для аминогруппы в соединении формулы P2-P1-PG может также быть осуществлена хорошо известными способами, например, как это описано в международных заявках на изобретение WO 00/095543, WO 00/09558 и патенте США 6608027 В1. В конкретных вариантах осуществления данный способ включает кислотный гидролиз соединения формулы P2-P1-PG с участием органической или неорганической кислоты, такой как HCl, H2SO4, трифторуксусная кислота, уксусная кислота, MeSO3H, в разнообразных протонных или полярных апротонных растворителях, таких как спирты, простые эфиры, MeCN или MeCl2.
Соединения формулы P2-PG, используемые как исходное вещество, или являются коммерчески доступными, как, например, Boc-4(R)гидроксипролин, или могут быть получены из известных веществ с помощью общепринятых способов. В одном из примеров соединения формулы P2-PG, где R является водородом, a PG является защитной группой для аминогруппы, могут быть получены путем защиты аминогруппы в 4-гидроксипролине:
 .
.
На первой стадии подходящую защитную группу для аминогруппы вводят по кольцевому атому азота 4-гидроксипролина, используя общепринятые способы. Например, соединение может быть растворено в подходящем растворителе и введено во взаимодействие с соответствующим реагентом, внедряющим защитную группу для аминогруппы. В качестве примера, но не подразумевая ограничение рамками такового, в тех случаях, когда Boc (трет-бутоксикарбонил) является искомой защитной группой, соединение вводят во взаимодействие с ангидридом Boc2O (или Boc-ОН) в смеси растворителей, такой как ацетон/вода, МП/вода или ТГФ/вода, к которой добавляют основание, такое как NaOH, КОН, LiOH, триэтиламин, диизопропилэтиламин или N-метилпирролидин, причем взаимодействие осуществляют при температуре между 20-60°С.
Соединения формулы Р1 известны из международных заявок на изобретение WO 00/09543, WO 00/09558 и патента США 6608027 В1 и могут быть получены согласно описанным в них методикам.
Схема II - получение Р3-Р2
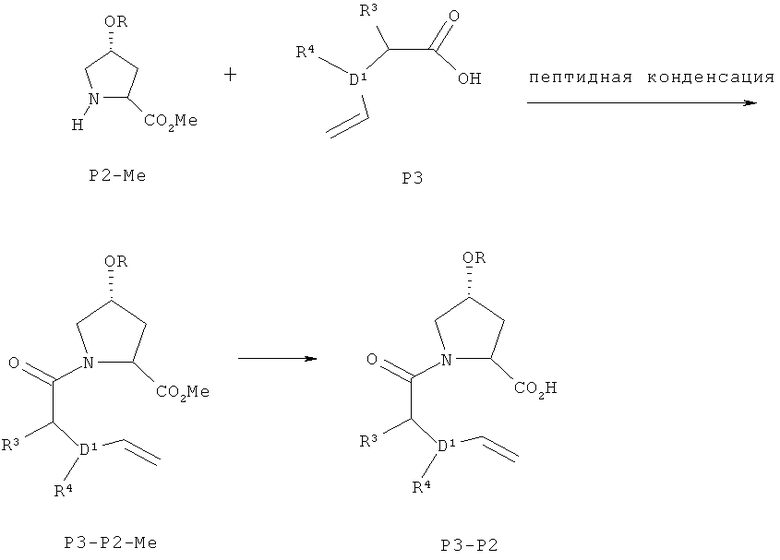
Пептидная конденсация, приводящая к Р3-Р2-Ме в схеме II, может быть осуществлена с использованием любых стандартных реагентов пептидной конденсации и методик, известных в соответствующей области. Примеры подходящих реагентов и условий приведены выше в части, касающейся пептидной конденсации в схеме I.
Последующий гидролиз, приводящий к Р3-Р2 в схеме II, может быть осуществлен в водном основном растворе, необязательно содержащем сорастворитель, который смешивается с водой, такой как ТГФ, диоксан, спирты или 1,2-диметоксиэтан (ДМЭ), или комбинации этих сорастворителей. Предпочтительной смесью растворителей может быть водный раствор основания, содержащий ТГФ в качестве сорастворителя. Может быть применено любое водорастворимое основание, такое как LiOH, NaOH, KOH, Na2CO3, K2CO3 и т.п. Предпочтительным основанием является LiOH. Количество основания может варьироваться в пределах от 1 до 100 эквивалентов, предпочтительно, 1- 10 эквивалентов. Концентрация основания может меняться в пределах от 0,25 М до 12 М, предпочтительно, 1-4 М. Температура реакции может варьироваться от -40°С до 100°С, предпочтительно, от -20°С до 50°С.
Все стадии пептидной конденсации Р3 с Р2-Ме могут быть осуществлены в одном реакторе с использованием ЦХ или хлорангидрида алкан- или аренсульфокислоты (например, TsCl, MsCl) в подходящих для конденсации условиях, приводящих к Р3-Р2-Ме, с последующим гидролизом продукта путем добавления водного основного раствора с целью получения соединения Р3-Р2 схемы II, которое затем может быть кристаллизовано. В этой однореакторной последовательности соединение Р3 также может быть применено в виде его соли со стерически затрудненным вторичным амином, такой как его соль с ДЦГА.
Замещенное кислотное соединение формулы Р3, используемое в качестве исходного вещества, известно из патента США 6608027 В1 и может быть получено из коммерчески доступных веществ с использованием методик, описанных в данной заявке.
Схема III - получение (1)
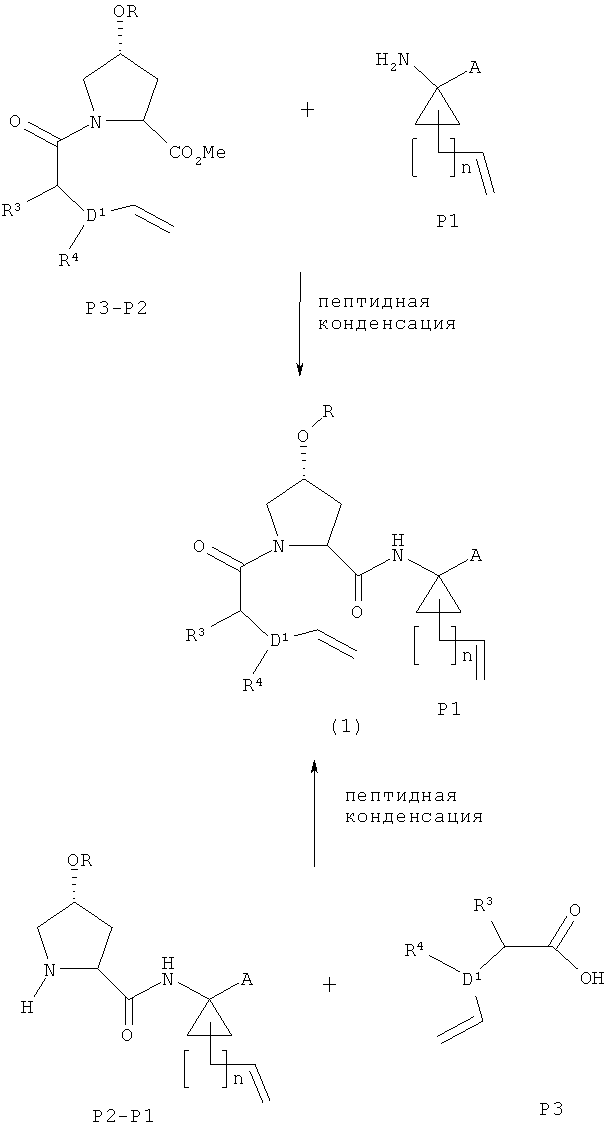
Реакции пептидной конденсации, приводящие к соединению (1) на схеме III, могут быть осуществлены с использованием любых стандартных реагентов пептидной конденсации и методик, известных в соответствующей области. Примеры подходящих реагентов и условий приведены выше в части, касающейся пептидной конденсации в схеме I. ИБХ является предпочтительным реагентом пептидной конденсации для схемы III.
IV. Получение исходного вещества - сульфированного хинолина.
Исходное вещество - сульфированный хинолин - QUIN может быть получено из известных веществ согласно способу, приведенному на нижеследующей схеме IV:
Схема IV
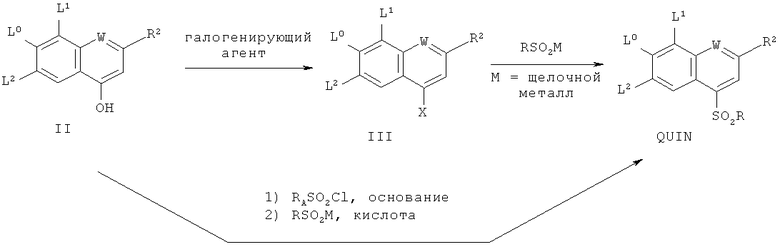
Такие гидроксизамещенные хинолины II могут быть преобразованы в сульфонхинолины QUIN посредством первоначального преобразования их в галоидхинолиновое соединение III (где Х является галогеном), следуя хорошо известным способам галогенирования с использованием различных галогенирующих агентов, таких как широко применяемые РОХ3 и РХ5, где X=F, Cl, Br или I, причем эти реагенты могут быть использованы в некоторых случаях в качестве растворителей или в сочетании с полярными апротонными растворителями, такими как ДМФ или ацетонитрил, и последующего преобразования галогенированного соединения III в искомый сульфонхинолин QUIN посредством взаимодействия с сульфинатом RSO2M, таким как PhSO2Na, где М является щелочным металлом.
В качестве альтернативы II может быть преобразовано в сульфонхинолин однореакторным способом в результате первоначального образования промежуточного сульфоната по реакции с хлорангидридом аренсульфокислоты RASO2Cl, где RA является нейтральной или богатой электронами ареновой группой, таким как бензолсульфохлорид или тозилхлорид, в присутствии подходящего основания в подходящем растворителе. Подходящие для данной стадии основания включают третичные амины, такие как N-метилпирролидин и диизопропилэтиламин, а подходящие растворители включают апротонные растворители, такие как ацетонитрил, ТГФ, толуол и ДМФ, предпочтительно, ацетонитрил. Получаемые таким образом соединения затем вводят во взаимодействие in situ в кислотных условиях (например, в присутствии уксусной, трифторуксусной, соляной кислот или им подобных, предпочтительно, уксусной кислоты) с сульфинатом RSO2M (где М является щелочным металлом), таким как PhSO2Na, PhSO2K или PhSO2Cs, в подходящих температурных условиях, например, в пределах от 0 до 100°С, предпочтительно, от 25 до 50°С. Сульфонхинолиновый продукт может быть выделен из реакционной смеси с помощью общепринятых способов, хорошо известных специалисту в соответствующей области. В одном из вариантов осуществления сульфонхинолин может быть кристаллизован посредством охлаждения раствора до комнатной температуры и добавления воды. Кристаллизованный продукт может быть затем отфильтрован, промыт и отмыт с помощью общепринятых методик.
Гидроксизамещенные хинолиновые соединения формулы (II) могут быть синтезированы из коммерчески доступных веществ с помощью методик, описанных, например, в международных заявках на изобретение WO 00/59929, WO 00/09543 и WO 00/09558, патентах США 6323180 B1, 6608027 B1 и в заявке на патент США №2005/0020503 А1.
Альтернативный способ получения некоторых гидроксизамещенных хинолиновых соединений формулы (II) и их галогенирования до соединения формулы (III) изложен ниже в схеме V (в которой соединение 7 является примером соединения (II), а соединение 8 является примером соединения (III)).
Схема V
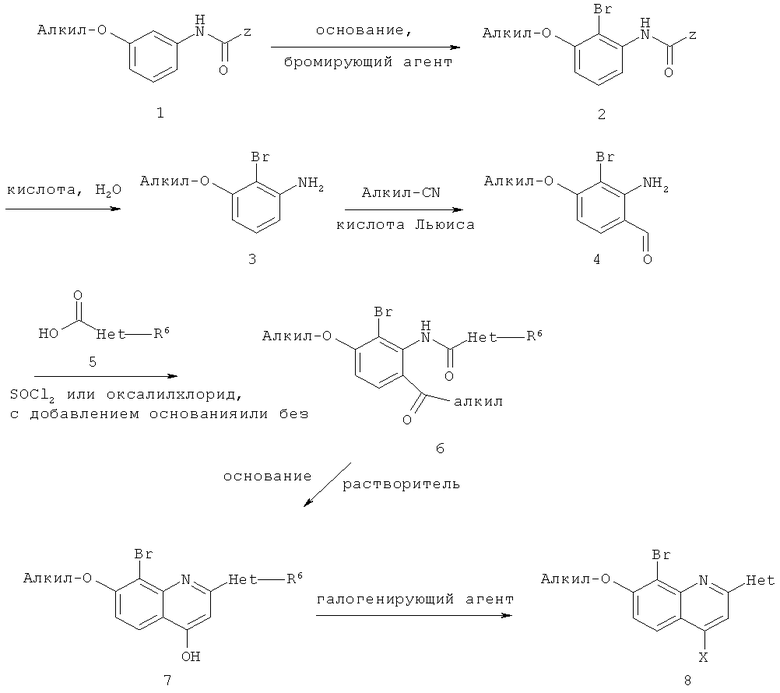
На данной схеме каждый алкил независимо является (С1-С6)алкильной группой, Х является атомом галогена, Z является трет-бутилом или трет-бутоксигруппой, R6 и Het отвечают определениям, приведенным для формулы I.
На первой стадии соединение формулы 1 обрабатывают основанием и бромирующим агентом с целью получения соединения 2. Общими требованиями для данной стадии является использование основания достаточной силы для образования искомого дианиона. Это может быть любое алкиллитиевое соединение, амид металла, такой как диизопропиламид лития (ЛДА), тетраметилпиперидид лития, гексаметилдисилазид металла, такой как гексаметилдисилазид калия (КГМДС), органоцинкат, алкоголят металла в катион-сольватирующем растворителе, таком как ДМСО, и им подобные. Предпочтительными основаниями являются н-бутиллитий и ЛДА. Могут быть применены любые органические растворители, которые не влияют на образование дианиона, такие как ТГФ, алкилпроизводные ТГФ, диоксан, алканы, циклоалканы, диалкиловые эфиры, такие как метил-трет-бутиловый эфир, циклопентилметиловый эфир, дибутиловый эфир и им подобные. Предпочтительными растворителями являются ТГФ, алкил-ТГФ и алканы. Температура для реакции образования дианиона может находиться в пределах между -100°С и 25°С, предпочтительным является интервал между -30°С и 25°С. Бромирующим агентом может быть любое соединение, содержащее подвижный атом брома, такое как Br2, N-бромсукцинимид (НБС), бромгидантоины, N-бромфталимиды, бромгалоидалканы, такие как 1,2-дибромтетрахлорэтан и перфторалкилбромиды, и им подобные. Предпочтительными бромирующими агентами являются бромгалоидалканы. Как только дианион образуется в подходящем растворителе, может быть добавлен бромирующий агент как в чистом виде, так и в растворе или, в качестве альтернативы, дианион может быть добавлен к бромирующему агенту как в чистом виде, так и в растворе. Предпочтительным способом является медленное добавление дианиона к бромирующему агенту в растворе. Температура бромирования может находиться в интервале между -100°С и 25°С, причем предпочтительный интервал лежит между -30°С и 25°С.
На следующей стадии соединение 2 гидролизуют путем обработки смесью кислот в воде с целью получения соединения 3. Может быть применена любая смесь кислот в воде, такая как вода с [трифторуксусной кислотой, хлоруксусной кислотой, такой как трихлоруксусная кислота, сульфокислотой, такой как метансульфокислота, соляной кислотой, серной кислотой, азотной кислотой, фосфорной кислотой, сильнокислой ионообменной смолой, такой как DOWEX 50], и иные подобные. Предпочтительными кислотами являются соляная и серная кислоты в концентрации 2-12 М, предпочтительно, по крайней мере, 6 М. Также могут быть использованы сорастворители, смешивающиеся с водой, такие как спирты, подобные этанолу, изопропанолу, или простые эфиры, такие как ДМЭ, диглим и им подобные. Гидролиз может быть осуществлен при температуре между 0°С и 200°С, причем предпочтительная температура находится между 0°С и 100°С.
На следующей стадии соединение 3 обрабатывают алкилнитрилом (алкил-CN) и кислотой Льюиса с целью получения соединения 4. Для преобразования 3 в 4 могут быть применены кислоты Льюиса как сами по себе, так и в сочетании, такие как AlCl3, BCl3, GaCl3, PeCl3 и их смеси, и им подобные. Предпочтительным способом является применение BCl3 с AlCl3. Могут быть применены любые растворители, которые ацилируются с трудом, такие как галоидированные углеводороды, галоидбензолы, алкилбензолы, такие как толуол, и алкилнитрилы, такие как ацетонитрил, причем предпочтительными растворителями являются 1,2-дихлорэтан, хлорбензол и толуол. Температура реакции может находиться между 0°С и 150°С, предпочтительно, между 25°С и 75°С.
На следующей стадии соединение 4 ацилируют с помощью соединения 5 с целью получения соединения 6. Для преобразования 4 в 6 ацилирование может быть осуществлено или путем первоначального преобразования карбоновой кислоты 5 в активированную форму, такую как хлорангидрид кислоты, или с помощью стандартных методик пептидной конденсации. Предпочтительным способом является образование хлорангидрида кислоты соединения 5 с использованием хлорангидрида щавелевой кислоты или тионилхлорида. Данные активированные соединения могут быть затем введены в реакцию сочетания с анилином 4 в любом органическом растворителе или в воде, с добавлением или без добавления основания. Предпочтительными растворителями являются НМП и ТГФ, а предпочтительным основанием (если таковое используется) является триэтиламин. Температура реакции может находится между -30°С и 150°С, предпочтительно, между -20°С и 50°С.
На следующей стадии соединение 6 циклизуют в присутствии основания с целью получения соединения 7. Соединение 6 может быть выделено и очищено или, в качестве альтернативы, неочищенный продукт 6 в органическом растворителе, таком как НМП, просто может быть подвергнут циклизации с целью непосредственного получения хинолина 7, что преобразует две стадии в однореакторный процесс. Для преобразования 6 в 7 в схеме V может быть использовано любое основание, способное к образованию енолята, такое как t-BuOK, ДМОК, ЛДА и им подобные, причем предпочтительными являются t-BuOK и ДМОК. Могут быть применены любые органические растворители, не вступающие в реакцию с енолятом, такие как производные ТГФ, диоксан, ДМСО, НМП, ДМЭ и им подобные, причем предпочтительными являются НМП, ДМЭ и ДМСО. Циклизация может быть осуществлена при любой температуре между 25°С и 150°С, предпочтительно, между 50°С и 100°С.
На последней стадии гидроксихинолиновое соединение 7 обрабатывают галогенирующим агентом с целью получения соединения 8. Для преобразования 7 в 8 в схеме V могут быть использованы многие галогенирующие агенты, такие как хлорангидрид метансульфокислоты, SOCl2, POCl3, PCl3, PCl5, POBr3, HF и им подобные, причем предпочтительными являются POCl3 и SOCl2. Галогенирование может быть осуществлено в чистом галогенирующем агенте или в любом органическом растворителе, который не вступает в реакцию с галогенирующим агентом, это ДМЭ, диглим, производные ТГФ, галоидированные углеводороды и им подобные, причем предпочтительными являются ДМЭ и тетрагидрофураны. Температура реакции может находиться между -20°С и 150°С, предпочтительно, между 25°С и 100°С.
V. Предпочтительные варианты реализации соединения формулы (I).
Предпочтительные варианты реализации соединений формулы (I), которые могут быть с помощью способа по настоящему изобретению, включают варианты реализации, изложенные ниже.
Предпочтительные варианты реализации включают соединения формулы (I), как они описаны выше, в которых циклопропильный остаток с правой стороны выбран из двух разных стереоизомеров, причем углеродный центр циклопропила в положении 1 имеет R-конфигурацию, как это представлено на примере структур (i) и (ii):
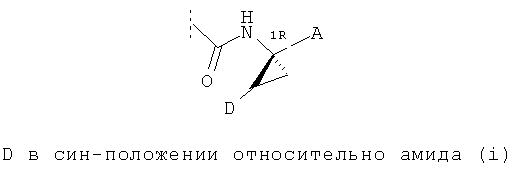
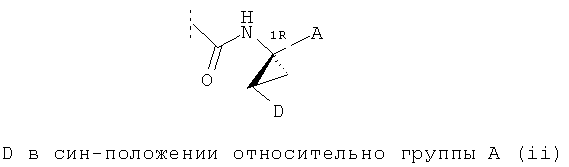 .
.
В одном из конкретных вариантов реализации соединений формулы (I) линкер D находится в син-конфигурации относительно группы А, как представлено вышеприведенной структурой (ii),
W является азотом,
L0 выбран из водорода, -ОН, -ОСН3, -OC2H5, -ОСН(СН3)2, -NHCH3, -NHC2H5, -NHC3H7, -NHCH(СН3)2, -N(СН3)2, -N(СН3)С2Н5, -N(СН3)С3Н7 и -N(СН3)СН(СН3)2.
L1 и L2 независимо друг от друга выбраны из водорода, фтора, хлора, брома, -СН3, -С2Н5, -С3Н7, -СН(СН3)2, -ОСН3, -ОС2Н5, -ОС3Н7 и -ОСН(СН3)2,
R2 является водородом, (С1-С6)тиоалкилом, (С1-С6)алкоксигруппой, фенилом или Het, выбранным из следующего списка:
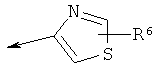 ,
, 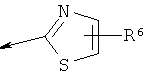 ,
, 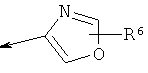 ,
,
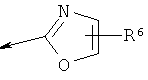 ,
, 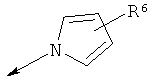 ,
, 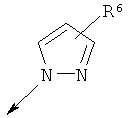 ,
, 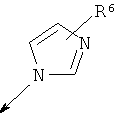 ,
, 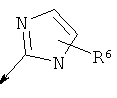 ,
,
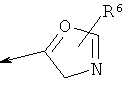 ,
, 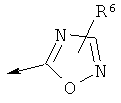 ,
, 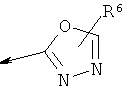 ,
,
 или
или 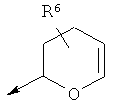 ,
,
где R6 является водородом, (С1-С6)алкилом, NH-R7, NH-C(O)-R7, NH-C(O)NH-R7, где каждый R7 независимо от остальных является водородом, (С1-С6)алкилом или (С3-С6)циклоалкилом, или R6 является NH-C(O)-OR8, где R8 является (С1-С6)алкилом,
R3 является NH-C(O)-R10, NH-C(O)-OR10 или NH-C(O)-NR10, где в каждом случае R10 является (С1-С6)алкилом или (С3-С6)циклоалкилом,
D является ненасыщенной алкиленовой цепью, включающей от 6 до 8 атомов,
R4 является водородом или (С1-С6)алкилом, и
А является карбоновой кислотой или ее фармацевтически приемлемой солью или сложным эфиром.
В другом конкретном варианте реализации соединений формулы (I) линкер D находится в син-конфигурации относительно группы А, как это представлено вышеприведенной структурой (ii),
W является азотом,
L0 выбран из водорода, -ОН, -ОСН3 и -М(СН3)2,
один из заместителей L1 и L2 является -СН3, фтором, хлором или бромом, тогда как другой из заместителей L1 и L2 является водородом, или же L1 и L2 оба являются водородом,
R2 является  ,
,  или
или  ,
,
где R6 является NH-R7 или NH-C(O)-R7, где R7 независимо является (С1-С6)алкилом или (С3 -С6)циклоалкилом,
R3 является NH-C(O)-OR10, где R10 является (С1-С6)алкилом или (С3-С6)циклоалкилом,
R4 является водородом или (С1-С6)алкилом,
D является семиатомной ненасыщенной алкиленовой цепью, содержащей одну двойную связь, и
А является карбоновой кислотой или ее фармацевтически приемлемой солью или сложным эфиром.
В другом конкретном варианте реализации соединения формулы (I) отвечают нижеприведенной формуле (I'),
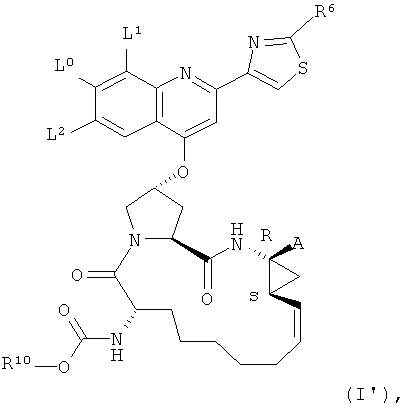
L0 является -ОСН3,
L1 является -СН3, фтором, хлором или бромом, а L2 является водородом, или же L1 и L2 оба являются водородом,
R6 является NH-R7 или NH-C(O)-R7, где R7 независимо является (С1-С6)алкилом или (С3-С6)циклоалкилом,
R10 является бутилом, циклобутилом или циклопентилом,
А является карбоновой кислотой или ее фармацевтически приемлемой солью или сложным эфиром.
В нижеследующей таблице перечислены характерные примеры соединений формулы (I). Соединение нижеприведенной формулы
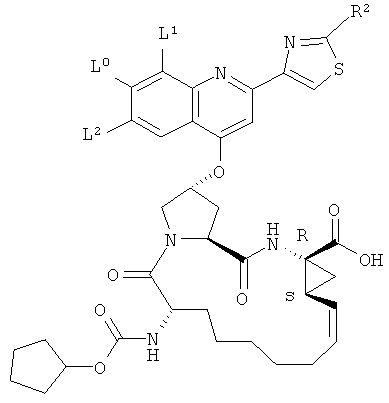 ,
,
в котором L0, L1, L2 и R2 принимают указанные ниже значения:
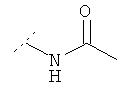
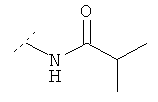
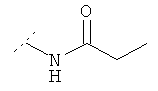

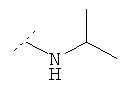








Следующая таблица представляет дополнительные соединения, являющиеся характерными примерами соединений формулы (I). Соединение нижеприведенной формулы
 ,
,
в котором связь между положением 14 и циклопропильной группой находится в син-конфигурации относительно СООН, причем заместители при упомянутой двойной связи 13, 14 находятся в цис-конфигурации, а R13, R4 и R2 принимают указанные ниже значения:
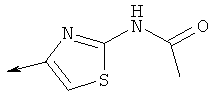
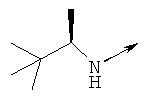

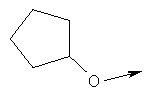
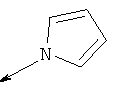

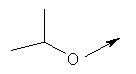



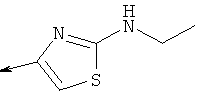

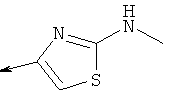

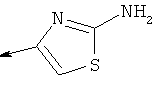

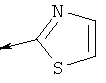

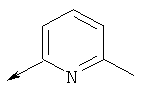
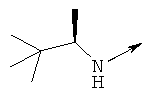


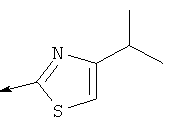

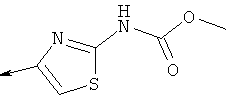

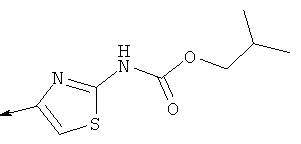



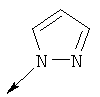

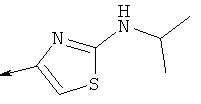

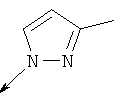


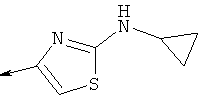

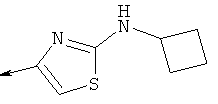

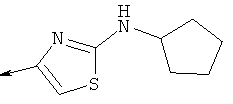

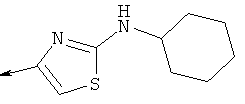
Дополнительные конкретные соединения, являющиеся характерными примерами соединений формулы (I), можно найти в патенте США 6608027 В1.
VI. Предпочтительные варианты реализации соединения формулы QUIN.
Предпочтительные варианты реализации соединений формулы QUIN, которые могут быть применены в способе по настоящему изобретению, включают варианты реализации, представленные ниже, например, такие, которые соответствуют предпочтительным вариантам реализации соединений формулы (I), описанным выше.
В одном из вариантов реализации соединений формулы QUIN
W является азотом,
L0 выбран из водорода, -ОН, -ОСН3. -ОС2Н5, -ОС3Н7, -ОСН(СН3)2. -NHCH3, -NHC2H5, -МНС3Н7, -ННСН(СН3)2, -N(CH3)2, -N(СН3)С2Н5, -N(СН3)С3Н7 и -N(CH3)CH(CH3)2.
L1 и L2 независимо друг от друга выбраны из водорода, фтора, хлора, брома, -СН3. -С2Н5, -С3Н7, -СН(СН3)2, -ОСН3, -ОС2Н5, -ОС3Н7 и -ОСН(СН3)2,
R2 является (С1-С6)тиоалкилом, (С1-С6)алкоксигруппой или Het, выбранным из нижеследующих:
 ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,
 или
или  ,
,
где R6 является водородом, (С1-С6)алкилом, NH-R7, NH-C(O)-R7, NH-C(O)-NH-R7, где каждый R7 независимо от остальных является водородом, (С1-С6)алкилом или (С3-С6)циклоалкилом, или R6 является NH-C(O)-OR8, где R8 является (С1-С6)алкилом, и
R является (С6)- или (С10)арилом.
В другом конкретном варианте реализации соединений формулы QUIN
W является азотом,
L0 выбран из водорода, -ОН, -ОСН3 и -N(CH3)2, один из заместителей L1 и L2 является -СН3, фтором, хлором или бромом, а другой из заместителей L1 и L2 является водородом, или же L1 и L2 оба являются водородом,
R2 является  ,
,  или
или  ,
,
где R6 является NH-R7 или NH-C(O)-R7, где R7 независимо является (С1-С6)алкилом или (С3-С6)циклоалкилом, и
R является (С6)- или (С10)арилом.
В другом конкретном варианте реализации соединения формулы QUIN отвечают нижеследующей формуле:
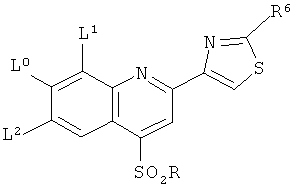
L0 является -ОСН3,
L1 является -СН3, фтором, хлором или бромом, а L2 является водородом, или же L1 и L2 оба являются водородом,
R6 является NH-R7 или NH-C(O)-R7, где R7 независимо является (С1-С6)алкилом или (С3-С6)циклоалкилом, и
R является (С6)-или (С10)арилом.
В нижеследующей таблице перечислены соединения, являющиеся характерными примерами соединений формулы QUIN. Соединение нижеприведенной формулы
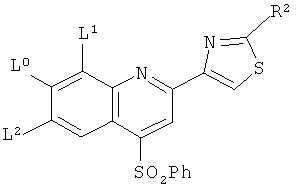
в котором Ph является фенилом, a L0, L1, L2 и R2 принимают указанные ниже значения:













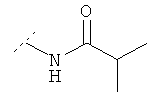
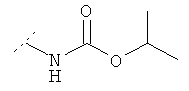
В нижеследующей таблице перечислены дополнительные соединения, являющиеся характерными примерами соединений формулы QUIN. Соединение нижеприведенной формулы
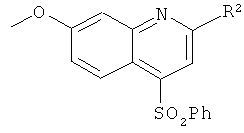 ,
,
в котором Ph является фенилом, а R2 принимает указанные ниже значения:









| название | год | авторы | номер документа |
|---|---|---|---|
| СОСТАВ ДЛЯ ПОЛУЧЕНИЯ МЕТАТЕЗИСНЫХ ПОЛИМЕРИЗАТОВ | 1995 |
|
RU2171815C2 |
| ИОННЫЕ ЖИДКОСТИ НИЗКОЙ ВЯЗКОСТИ | 2006 |
|
RU2413732C2 |
| ИНСЕКТИЦИДНЫЕ АНТРАНИЛАМИДЫ | 2001 |
|
RU2278852C2 |
| ПРОИЗВОДНЫЕ 2-АМИНО-1,3,5-ТРИАЗИНА, ГЕРБИЦИДНОЕ СРЕДСТВО НА ИХ ОСНОВЕ И СПОСОБ БОРЬБЫ С ВРЕДНЫМИ РАСТЕНИЯМИ | 1999 |
|
RU2255934C2 |
| 4-(4-ЦИАНО-2-ТИОАРИЛ)-ДИГИДРОПИРИМИДИНОНЫ И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2497813C2 |
| ПУРИНОВЫЕ ПРОИЗВОДНЫЕ ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ АГОНИСТОВ АДЕНОЗИНОВОГО РЕЦЕПТОРА А-2А | 2005 |
|
RU2403253C2 |
| СОЕДИНЕНИЕ, НАЦЕЛЕННОЕ НА БЕЛОК И ЕГО ДЕГРАДАЦИЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2829459C1 |
| НОВЫЕ АЦИКЛИЧЕСКИЕ, ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ФУРОПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ | 2006 |
|
RU2454419C2 |
| НОВЫЕ ПЕПТИДНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2699572C2 |
| АНТИБИОТИКИ ГРУППЫ КАРБАМАТКЕТОЛИДОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ | 2000 |
|
RU2188827C2 |
В настоящей заявке раскрываются сульфонилзамещенные соединения формулы QUIN, которые используют в способе получения макроциклического соединения формулы (I). Соединения формулы (I) являются действенными активными агентами для лечения инфекции вируса гепатита С (HCV). 3 н. и 5 з.п. ф-лы, 1 пр., 4 табл.
1. Соединение следующей формулы QUIN
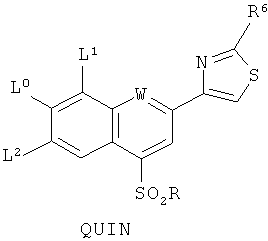
в которой W является азотом, L0 является -ОСН3,
L1 является -СН3, фтором, хлором или бромом, a L2 является водородом, или же L1 и L2 оба являются водородом,
R6 является NH-R7 или NH-C(O)-R7, где R7 независимо является (C1-С6)алкилом или (С3-С6)циклоалкилом, и
R является (С6)- или (С10)арилом.
2. Способ получения соединения формулы QUIN по п.1, каковой способ включает
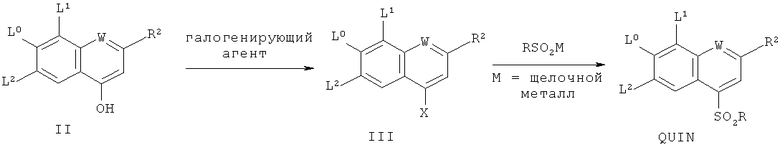
взаимодействие соединения II с галогенирующим агентом с целью получения соединения формулы III, в которой Х является атомом галогена, и последующее взаимодействие соединения формулы III с сульфинатом RSO2M, в котором М является щелочным металлом, с целью получения соединения QUIN, причем L0, L1, L2, W, R6 и R отвечают определениям по п.1,
и R2 является 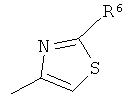
3. Способ по п.2, в котором галогенирующий агент выбран из POX3 и РХ5, где X=F, Cl, Br или I, и в котором сульфинат RSO2M является PhSO2Na.
4. Способ для получения соединения формулы QUIN по п.1, каковой способ включает
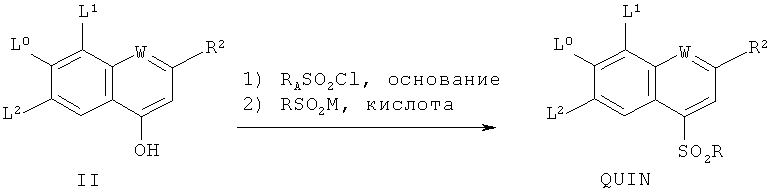
взаимодействие соединения II с хлорангидридом аренсульфокислоты RASO2Cl, где RA является нейтральной или богатой электронами ареновой группой, в присутствии соответствующего основания в подходящем растворителе, и последующее взаимодействие полученного соединения в присутствии кислоты с сульфинатом RSO2M, в котором М является щелочным металлом, с целью получения соединения QUIN, причем L0, L1, L2, W, R6 и R отвечают определениям по п.1, и R2 является 
5. Способ по п.4, в котором на первой стадии хлорангидрид аренсульфокислоты RASO2Cl является бензолсульфохлоридом или тозилхлоридом, основание является N-метилпирролидином или диизопропилэтиламином, а растворитель выбран из ацетонитрила, ТГФ, толуола и ДМФ, и на второй стадии кислота является уксусной кислотой, трифторуксусной кислотой или соляной кислотой, а сульфинат RSO2M является PhSO2Na, PhSO2K или PhSO2Cs.
6. Соединение по п.1, которое выбрано из соединений следующей формулы
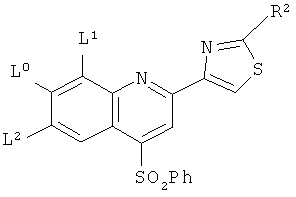
в котором Ph является фенилом, a L, L1, L2 и R2 принимают указанные ниже значения:













7. Соединение по п.1, которое выбрано из соединений следующей формулы
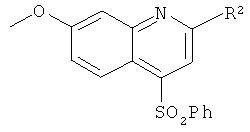
в котором Ph является фенилом, a R2 принимает указанные ниже значения:







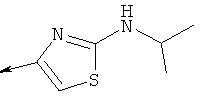




8. Соединение по п.1, которое представляет собой
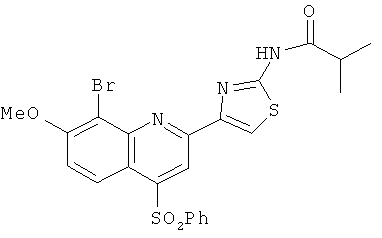
| WO 03053349 A2, 03.07.2003 | |||
| WO 2004094452 A2, 04.11.2004 | |||
| EA 200601467 A1, 29.06.2007 | |||
| US 2005049187 A1, 03.03.2005 | |||
| МАКРОЦИКЛИЧЕСКИЕ ПЕПТИДЫ, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ В ОТНОШЕНИИ ВИРУСА ГЕПАТИТА C | 2000 |
|
RU2247126C2 |
Авторы
Даты
2012-07-20—Публикация
2006-03-06—Подача