Область изобретения
Настоящее изобретение относится к маломасштабным системам культивирования клеток, в которых симулируют крупномасштабные перфузионные культуры суспендированных клеток. В частности, настоящее изобретение относится к способам культивирования клеток где седиментацию клеток используют для отделения клеток от среды для культивирования для замены части среды для культивирования. Этот способ можно использовать для симуляции крупномасштабных культур клеток и скрининга условий культивирования и клонов клеток для применения в крупномасштабных культурах клеток.
Предпосылки изобретения
Получение рекомбинантных белков является основным аспектом современной биотехнологической промышленности. Оно приобретает все большую важность, т.к. на рынке растет количество областей применения, для которых необходимы большие количества высококачественных белков. Пищевая промышленность и, в частности, фармакология являются двумя основными областями, в которых потребность в рекомбинантных белках постоянно растет. Для получения коммерчески целесообразного способа необходима более высокая эффективность продукции и, таким образом, более низкие затраты.
Однако, в то же время важно высокое качестве продукта и совместимость с применением на людях. Все в большем количестве областей применения необходимо рекомбинантное получение белков в эукариотических клетках, в частности, в клетках высших эукариот. В частности, белки, несущие посттрансляционные модификации, такие как гликозилирование (гликопротеины), значительно отличаются при их экспрессии в системах прокариотических клеток, таких как E. coli, или системах эукариотических клеток, таких как, в частности, линии клеток человека. Эти различия во многих случаях значительно влияют на биологическую активность, а также иммуногенность продуцируемых белков. Однако, многие системы экспрессии с использованием линий клеток высших эукариот отличаются, в значительной степени, низким уровнем экспрессии желаемого белка, что приводит к низким выходам и высокой стоимости рекомбинантного белка.
Для улучшения выхода и качества рекомбинантных белков, продуцируемых в эукариотических клетках, включая характеристики их посттрансляционных модификаций, оптимизируют совокупность условий культивирования и тестируют большое количество клонов клеток. Очень затратно и проблематично осуществлять этот скрининг в крупномасштабных культурах клеток, используемых для последующей продукции рекомбинантного белка. Таким образом, такой скрининг зачастую осуществляют в маломасштабных культурах. Однако, такие маломасштабные культуры часто значительно отличаются по своим характеристикам от крупномасштабных культур, которые с их помощью необходимо симулировать. При переносе в крупномасштабную культуру условия культивирования и клоны клеток, установленные в маломасштабной культуре, могут оказаться менее оптимальными.
Надежные модели меньшего масштаба необходимы для эффективной и быстрой разработки биологических процессов. Ключевые операции, подобные оптимизации сред или способа и скрининг клонов, как правило, не осуществляют в условиях способа по нескольким причинам, таким как высокая стоимость операции или низкая производительность. Основной задачей биотехнологии является нахождение подходящих моделей меньшего масштаба, представляющих способы большего масштаба настолько хорошо, насколько это возможно. Пригодная система меньшего масштаба должна, главным образом, отображать удовлетворительную сопоставимость ключевых параметров с крупномасштабным способом и средой для высокой производительности.
Система биореакторов (ambr) представляет собой такой инструмент меньшего масштаба с превосходной воспроизводимостью в отношении биореактора большего масштаба (Hsu et al. (2012) Cytotechnology 64:667-678). Система ambr состоит из одноразовых сосудов с рабочим объемом от 10 до 15 мл, робота для манипуляции с жидкостями и монитора, измеряющего насыщение кислорода (DO) и pH в реальном времени. Производительность ограничена 24 или 48 сосудами в зависимости от оборудования устройства. Систему ambr широко используют в качестве модели меньшего масштаба для периодического культивирования и культивирования с подпиткой. Однако, перфузионная культура недоступна. Лабораторный биореактор емкостью 1 л считают самой маленькой единицей для перфузионной культуры (Shimoni et al.(2014) BioProcessInt 12:54-61). Препятствием для разработки перфузионной системы меньшего масштаба является уменьшением масштаба устройства для удержания клеток. Типичные устройства для удержания клеток описывают в Voisard et al.(2003) BiotecholBioeng 82:751-765, и для механизмов на основе фильтрации или центрифугирования необходимо слишком много мертвого объема для эффективной работы с биореактором небольшого объема. В начале перфузионного культивирования клеток седиментацию исследовали в качестве способа разделения клеток, и дальнейшая разработка привела к появлению внешних устройств, таких как наклонные резурвуары. Хотя они и являются надежными и вызывают небольшое напряжение сдвига, клетки остаются вне биореактора, подвергаясь воздействию субоптимальных условий, таких как более низкая температура или недостаточное обеспечение кислородом (Voisard et al.(2003) BiotecholBioeng 82:751-765).
Таким образом, в этой области существует потребность в способах эффективной симуляции крупномасштабных культур клеток в малом масштабе в целях скрининга, особенно при использовании линий экспрессирующих эукариотических клеток.
Сущность изобретения
Как показано посредством настоящего изобретения, перфузионные культуры эукариотических клеток в суспензии можно эффективно симулировать в малом масштабе с использованием перемешиваемой культуры клеток, где после конкретных временных интервалов часть среды заменяют свежей средой. Удержания клеток в культуре достигают посредством седиментации клеток перед удалением среды для культивирования. Концентрация клеток в культуре, жизнеспособность клеток и, в частности, профиль гликозилирование продуцируемого гликопротеина крайне схожи между маломасштабной культурой клеток и крупномасштабной перфузионной культурой, которую с помощью нее симулируют.
Таким образом, в первом аспекте настоящее изобретение относится к способу культивирования клеток в суспензии, включающему
(a) получение культуры клеток;
(b) культивирование клеток в культуре клеток, где культуру клеток перемешивают;
(c) прекращение перемешивания культуры клеток;
(d) удаление части среды для культивирования из культуры клеток после, по меньшей мере, частичной седиментации клеток в культуре клеток; и
(e) добавление свежей среды для культивирования в культуру клеток.
Во втором аспекте настоящее изобретение относится к способу симуляции крупномасштабной перфузионной культуры клеток в суспензии, включающему
(a) получение маломасштабной культуры клеток, имеющей культуральный объем 10% или менее от крупномасштабной перфузионной культуры;
(b) культивирование клетки в маломасштабной культуре клеток с использованием одного или нескольких условий культивирования крупномасштабной перфузионной культуры, подлежащей симуляции, где маломасштабную культуру клеток перемешивают;
(c) прекращение перемешивания маломасштабной культуры клеток;
(d) удаление части среды для культивирования маломасштабной культуры клеток после, по меньшей мере, частичной седиментации клеток в маломасштабной культуре клеток; и
(e) добавление свежей среды для культивирования в маломасштабную культуру клеток.
В третьем аспекте настоящее изобретение относится к способу скрининга условий культивирования и/или клона клетки для крупномасштабной перфузионной культуры клеток в суспензии, включающему
(a) получение маломасштабных культур клеток, имеющих культуральный объем 10% или менее от крупномасштабной перфузионной культуры;
(b) культивирование клеток в маломасштабных культурах клеток, где маломасштабные культуры клеток перемешивают;
(c) прекращение перемешивания маломасштабных культур клеток;
(d) удаление части среды для культивирования маломасштабных культур клеток после, по меньшей мере, частичной седиментации клеток в маломасштабных культурах клеток; и
(e) добавление свежей среды для культивирования в маломасштабные культуры клеток;
где отдельные маломасштабные культуры клеток отличаются условиями культивирования и/или клоном клеток, скринингу на которые их подвергают.
Другие объекты, признаки, преимущества и аспекты настоящего изобретения будут очевидны специалистам в этой области из следующего описания и формулы изобретения. Однако, следует понимать, что следующее описание, формула изобретения и конкретные примеры, в которых указаны предпочтительные варианты осуществления изобретения, приведены исключительно в иллюстративных целях. Различные изменения и модификации в пределах сущности и объема описываемого изобретения будут очевидны специалистам в этой области при прочтении следующего ниже.
Подробное описание изобретения
Настоящее изобретение относится к способам культивирования клеток в суспензии в малом масштабе. Эти способы культивирования можно использовать для симуляции крупномасштабных перфузионных культур клеток в суспензии. Кроме того, способы скрининга для определения подходящих условий культивирования и клонов клеток можно осуществлять указанными способами культивирования.
В первом аспекте настоящее изобретение относится к способу культивирования клеток в суспензии, включающему
(a) получение культуры клеток;
(b) культивирование клеток в культуре клеток, где культуру клеток перемешивают;
(c) прекращение перемешивания культуры клеток;
(d) удаление части среды для культивирования из культуры клеток после, по меньшей мере, частичной седиментации клеток в культуре клеток; и
(e) добавление свежей среды для культивирования в культуру клеток.
Культура клеток, полученная на стадии (a), является суспензионной культурой клеток, предпочтительно, получаемой в биореакторе оборудованном средствами для перемешивания культуры клеток. Средствами для перемешивания культуры клеток, в частности, могут являться мешалка, такая как мешалка с наклонными лопастями. Биореактор можно дополнительно оборудовать средствами для обеспечения культуры клеток газом и/или жидкостью и средствами для измерения одного или нескольких условий культивирования культуры клеток. Указанные условия культивирования могут включать температуру, значение pH, концентрацию кислорода, концентрацию питательных веществ и концентрацию диоксида углерода в культуре клеток.
Для автоматизированной операции с культурой клеток биореактор дополнительно оборудуют контрольным модулем, способным контролировать подачу кислорода и/или питательных веществ, температуру и/или значение pH в культуре клеток. Контрольный модуль может автоматически контролировать один или несколько из этих параметров с учетом значений одного или нескольких условий культивирования, измеряемых в культуре клеток. Оператор может заранее задавать желаемые значения или диапазоны для каждого из условий культивирования. Подходящим биореактором для применения в способах по настоящему изобретению является микробиореактор серии Advanced Microbioreactor (AMBR) от TAB Biosystems/Sartorius, в частности, AMBR24 или AMBR15.
В определенных вариантах осуществления используют маломасштабную культуру клеток. По изобретению маломасштабные культуры клеток, в частности, имеют культуральный объем 250 мл или менее, в частности, 100 мл или менее, 50 мл или менее, 25 мл или менее или 12,5 мл или менее. Объем маломасштабной культуры клеток, в частности, находится в диапазоне от 1 мл до 200 мл, в частности, от 2 мл до 150 мл, от 3 мл до 100 мл, от 5 мл до 75 мл, от 7 мл до 50 мл, от 8 мл до 30 мл или от 9 мл до 20 мл. В конкретных вариантах осуществления маломасштабная культура клеток имеет объем от 10 мл до 15 мл, в частности, приблизительно 12 мл.
Клетки в культуре клеток, в частности, являются суспендированными клетками, т.е. клетками, способными выживать и/или пролиферировать в суспензии. В частности, клетки могут не прикрепляться к какой-либо твердой поверхности для выживания и/или пролиферации. В конкретных вариантах осуществления клетки являются эукариотическими клетками. В определенных вариантах осуществления клетки являются иммортализованными клетками крови человека, такими как иммортализованные клетки человека миелолейкозного происхождения. Конкретными клетками человека миелолейкозного происхождения являются клетки K562 и полученные из них клетки, такие как NM-F9, NM-D4, NM-H9D8, NM-H9D8-E6, NM H9D8-E6Q12, GT-2X, GT-5s и полученные из них клетки. K562 является линией клеток миелолейкоза человека, находящейся в American Type Culture Collection (ATCC CCL-243). Остальные линии клеток получают из клеток K562 и выбирают по конкретным признакам гликозилирования. Линии клеток, полученные из K562, можно культивировать и поддерживать в хорошо известных условиях, подходящих для K562. Все эти линии клеток, за исключением клеток K562, хранят в соответствии с Будапештским договором. Информацию о депонировании можно найти в конце описания. В другом варианте осуществления клетки являются клетками CHO.
В конкретных вариантах осуществления клетки в культуре клеток продуцируют интересующую биомолекулу. Клетки могут рекомбинантно продуцировать интересующую биомолекулу. В определенных вариантах осуществления интересующая биомолекула является белком, в частности, гликопротеином, таким как антитело.
На стадии (b) клетки культивируют в культуре клеток. Как правило, условия культивирования культуры клеток выбирают так, чтобы приспособить их к клеткам, подлежащим культивированию. В определенных вариантах осуществления клетки культивируют при температуре приблизительно 37°C, в частности, в диапазоне от 33°C до 40°C, в частности, от 35°C до 38°C. Кроме того, в определенных вариантах осуществления клетки культивируют при значении pH приблизительно 7,1, в частности, значении pH в диапазоне от 6,5 до 7,7, в частности, от 6,7 до 7,5, в частности, от 6,9 до 7,3. Плотность клеток в культуре клеток может составлять по меньшей мере 1×104 клеток/мл, в частности, по меньшей мере 5×104 клеток/мл или по меньшей мере 1×105 клеток/мл. Плотность клеток, в частности, находится в диапазоне, от приблизительно 1×105 клеток/мл до приблизительно 5×105 клеток/мл, в частности, от приблизительно 2×105 клеток/мл до приблизительно 3×105 клеток/мл. В конкретных вариантах осуществления концентрация кислорода в среде для культивирования составляет по меньшей мере 10%, в частности, по меньшей мере 20%, в частности, находится в диапазоне от 10% до 80%, в частности, от 20% до 60%.
В определенных вариантах осуществления значение pH и/или концентрацию кислорода в среде для культивирования контролируют в течение культивирования клеток. Контроль значения pH можно осуществлять, добавляя диоксид углерода или NaOH, если значение pH находится вне желаемого диапазона. Диоксид углерода добавляют для снижения значения pH, т.е. в случаях, когда значение pH является слишком высоким, и NaOH добавляют для повышения значения pH, т.е. в случаях, когда значение pH является слишком низким. Контроль концентрации кислорода можно осуществлять посредством контроля количества кислорода, пропускаемого в среду для культивирования. В определенных вариантах осуществления культуру клеток снабжают кислородом.
При культивировании клеток культуру клеток перемешивают. В конкретных вариантах осуществления культуру клеток перемешивают с помощью мешалки. Можно использовать любую мешалку, подходящую для перемешивания культур клеток, в частности, мешалку с наклонными лопастями. Скорость перемешивания необходимо корректировать в зависимости от используемого биореактора и культивируемых клеток. Например, в маломасштабной культуре клеток, имеющей, например, объем приблизительно от 5 мл до 50 мл, скорость перемешивания мешалки находится в диапазоне приблизительно от 500 об./мин. до приблизительно 2000 об./мин., например, от 750 об./мин. до 1500 об./мин.
На стадии (c) перемешивание культуры клеток прекращают. В определенных вариантах осуществления клетки культивируют при перемешивании на стадии (b) в течение по меньшей мере 1 ч. перед прекращением перемешивания на стадии (c). В частности, клетки культивируют при перемешивании в течение по меньшей мере 1,5 ч., по меньшей мере 2 ч., по меньшей мере 2,5 ч. или по меньшей мере 3 ч. В определенных вариантах осуществления клетки культивируют при перемешивании в течение по меньшей мере 8 ч., по меньшей мере 10 ч., по меньшей мере 11 ч. или по меньшей мере 12 ч. После прекращения перемешивания клеткам позволяют осаждаться. Седиментацию клеток можно осуществлять в течение по меньшей мере 30 мин перед удалением части среды для культивирования на стадии (d). В определенных вариантах осуществления седиментацию осуществляют в течение по меньшей мере 35 мин, в частности, в течение по меньшей мере 40 мин или по меньшей мере 45 мин. В частности, клеткам позволяют осаждаться в течение от 30 мин до 45 мин, в частности, приблизительно 40 мин. В определенных вариантах осуществления время седиментации корректируют в зависимости от культивируемых клеток. В частности, время седиментации является достаточно долгим, чтобы позволить по меньшей мере 75%, в частности, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 99% клеток в культуре клеток осесть в нижние 75% культурального контейнера, в частности, в нижней половине культурального контейнера, в частности, на дно культурального контейнера. В конкретных вариантах осуществления седиментация клеток происходит без добавления или наличия любых средств или веществ, индуцирующих или усиливающих седиментацию клеток.
В конкретных вариантах осуществления контроль значения pH и/или контроль концентрации кислорода прекращают перед прекращением перемешивания культуры клеток на стадии (c). В частности, прекращают контроль значения pH и концентрации кислорода. Контроль значения pH и/или контроль концентрации кислорода можно прекращать по меньшей мере за 5 мин, в частности, по меньшей мере 10 мин или по меньшей мере 15 мин до прекращения перемешивания культуры клеток на стадии (c).
В другом варианте осуществления седиментацию клеток после прекращения перемешивания на стадии (c) осуществляют в течение 35 мин или менее. При использовании меньшего времени седиментации не все клетки в культуре клеток будут осаждаться на дно к концу седиментации. При удалении части среды для культивирования на стадии (d) в этом варианте осуществления удаленная среда для культивирования будет содержать значительное количество клеток. Таким образом, удаляя часть среды для культивирования достигают слива клеток. Таким образом, контролируют плотность клеток и эти клетки поддерживают в фазе пролиферации. В этих вариантах осуществления на стадии (d) также можно удалять часть клеток в культуре клеток для осуществления слива клеток. В частности, время седиментации корректируют таким образом, что приблизительно от 1% до приблизительно 25%, в частности, приблизительно от 2% до приблизительно 20%, приблизительно от 5% до приблизительно 15%, приблизительно от 7,5% до приблизительно 12,5% клеток в культуре клеток удаляют со средой для культивирования, удаляемой на стадии (d). В конкретных вариантах осуществления седиментацию клеток после прекращения перемешивания на стадии (c) осуществляют в течение 30 мин или менее, 25 мин или менее или 20 мин или менее перед удалением части среды для культивирования на стадии (d). В частности, седиментацию клеток после прекращения перемешивания на стадии (c) осуществляют в течение от приблизительно 15 мин до приблизительно 35 мин, в частности, в течение от приблизительно 20 мин до приблизительно 30 мин перед удалением части среды для культивирования на стадии (d).
На стадии (d) удаляют часть среды для культивирования из культуры клеток. В определенных вариантах осуществления удаляют приблизительно от 10% до приблизительно 75% среды для культивирования. В частности, на стадии (d) удаляют от приблизительно 50% до приблизительно 50%, в частности, от приблизительно 20% до приблизительно 30% и, в частности, приблизительно 25% среды для культивирования. Среду для культивирования, предпочтительно, удаляют на стадии (d) сверху культуры клеток. В вариантах осуществления, в которых не предполагается слив клеток, среда для культивирования, удаленная на стадии (d), в частности, содержит менее 10%, в частности, менее 5%, менее 2,5% или, в частности, менее 1% клеток в культуре клеток.
На стадии (e) в культуру клеток добавляют свежую среду для культивирования. В конкретных вариантах осуществления количество свежей среды для культивирования, добавляемой на стадии (e), по существу, идентично количеству среды для культивирования, удаленной на стадии (d). В частности, количество среды для культивирования, добавляемой на стадии (e), находится в диапазоне от 75% до 125%, в частности, от 90% до 110% или от 95% до 105%, в частности, приблизительно 100% от количества среды для культивирования, удаленной на стадии (d).
В конкретных вариантах осуществления стадии (b)-(e) повторяют один или несколько раз. В частности, клетки культивируют в течение конкретного периода времени и после конкретных временных интервалов прекращают перемешивание, клеткам позволяют осаждаться, удаляют часть среды для культивирования, добавляют свежую среду для культивирования и снова начинают перемешивание. Затем снова начинают этот цикл, включающий стадии (b)-(e). В определенных вариантах осуществления после стадии (e) клетки культивируют при перемешивании в течение по меньшей мере 1 ч. перед прекращением перемешивания на стадии (c) следующего цикла. В частности, клетки культивируют при перемешивании в течение по меньшей мере 1,5 ч., по меньшей мере 2 ч., по меньшей мере 2,5 ч. или по меньшей мере 3 ч. В определенных вариантах осуществления клетки культивируют при перемешивании в течение по меньшей мере 8 ч., по меньшей мере 10 ч., по меньшей мере 11 ч. или по меньшей мере 12 ч. Способы, представленные в настоящем описании, могут включать по меньшей мере один цикл в сутки, в частности, по меньшей мере 2, по меньшей мере 3 или по меньшей мере 4 цикла в сутки, например, до 8 циклов в сутки.
Во втором аспекте настоящее изобретение относится к способу симуляции крупномасштабной перфузионной культуры клеток в суспензии, включающему
(a) получение маломасштабной культуры клеток, имеющей культуральный объем 10% или менее от крупномасштабной перфузионной культуры;
(b) культивирование клеток в маломасштабной культуре клеток с использованием одного или нескольких условий культивирования крупномасштабной перфузионной культуры, подлежащей симуляции, где маломасштабную культуру клеток перемешивают;
(c) прекращение перемешивания маломасштабной культуры клеток;
(d) удаление части среды для культивирования маломасштабной культуры клеток после, по меньшей мере, частичной седиментации клеток в маломасштабной культуре клеток; и
(e) добавление свежей среды для культивирования в маломасштабную культуру клеток.
Одно или несколько условий культивирования крупномасштабной перфузионной культуры, подлежащей симуляции, используемых для культивирования клетки в маломасштабной культуре клеток, в частности, можно выбирать из группы, состоящей из среды для культивирования или конкретных ингредиентов среды для культивирования, температуры, значения pH, концентрации кислорода, плотности клеток, добавления питательных веществ для клеток, включая время добавления и целевую концентрацию питательных веществ в среде для культивирования, время культивирования, конкретную мощность на входе, скорость подачи газа, скорость перфузии и осмолярность среды для культивирования.
С помощью маломасштабной культуры клеток не симулируют культуральный объем крупномасштабной перфузионной культуры. В конкретных вариантах осуществления с помощью небольшой культуры клеток не симулируют способ отделения клеток от среды для культивирования, подлежащей удалению, используемой в крупномасштабной перфузионной культуре.
Симуляция крупномасштабной перфузионной культуры с помощью маломасштабной культуры клеток, в частности, означает, что конкретные свойства и характеристики, наблюдаемые в маломасштабной культуре клеток будут схожим образом присутствовать в крупномасштабной перфузионной культуре. Таким образом, конкретные условия культивирования и/или клоны клеток можно тестировать в маломасштабной культуре клеток. Если эти условия культивирования и/или клоны клеток окажутся предпочтительными, то их можно использовать в крупномасштабной культуре. В определенных вариантах осуществления крупномасштабную перфузионную культуру симулируют с помощью маломасштабной культуры клеток в отношении одного или нескольких свойств и/или характеристик, выбранных из группы, состоящей из роста клеток, жизнеспособности клеток и плотности клеток. В вариантах осуществления, когда клетки продуцируют интересующую биомолекулу, в частности, гликопротеин, свойства и/или характеристики крупномасштабной перфузионной культуры, симулируемые с помощью маломасштабной культуры клеток, могут дополнительно включать выход интересующей биомолекулы, продуктивность клеток, стабильность продукции интересующей биомолекулы и качество интересующей биомолекулы, включая, в частности, одну или несколько характеристик гликозилирования биомолекулы в случае, если она является гликопротеином. Признаки гликозилирования, в частности, включают относительную степень гликозилирования, т.е. то, какая процентная доля участков гликозилирования в гликопротеине занята гликановой структурой; относительное количество типа гликановой структуры, т.е. то, какая процентная доля всех гликановых структур, присоединенных к гликопротеину, является гликановыми структурами конкретного типа, такими как N-гликаны комплексного типа; относительное количество различных моносахаридов, т.е. то, какая процентная доля всех моносахаридов в гликановых структурах, присоединенных к гликопротеину, относится к конкретному типу моносахарида, такого как и галактоза, фукоза, сиаловая кислота, N-ацетилглюкозамин и манноза; и относительное количество конкретных мотивов гликозилирования, т.е. то, какая процентная доля всех гликановых структур демонстрирует конкретный мотив гликозилирования, такой как коровая фукоза, N-ацетилглюкозамин в точке ветвления, по меньшей мере один остаток галактозы, по меньшей мере два остатка галактозы, по меньшей мере один остаток сиаловой кислоты, по меньшей мере два остатка сиаловой кислоты и моноантеннарные, диантеннарные, триантеннарные и тетраантеннарные гликаны.
В конкретном варианте осуществления способ симуляции крупномасштабной перфузионной культуры включает дополнительную стадию (g) после стадии (e):
(g) получение крупномасштабной перфузионной культуры клеток в суспензии с использованием одного или нескольких условий культивирования, используемых на стадии (b).
Крупномасштабная перфузионная культура, полученная на стадии (g), является крупномасштабной перфузионной культурой, подлежащей симуляции способом, и для нее используют одно или несколько условий культивирования крупномасштабной перфузионной культуры, подлежащей симуляции, используемых на стадии (b).
В третьем аспекте настоящее изобретение относится к способу скрининга условий культивирования и/или клона клетки для крупномасштабной перфузионной культуры клеток в суспензии, включающему
(a) получение маломасштабных культур клеток, имеющих культуральный объем 10% или менее от крупномасштабной перфузионной культуры;
(b) культивирование клеток в маломасштабных культурах клеток, где маломасштабные культуры клеток перемешивают;
(c) прекращение перемешивания маломасштабных культур клеток;
(d) удаление части среды для культивирования из маломасштабной культуры клеток после, по меньшей мере, частичной седиментации клеток в маломасштабных культурах клеток; и
(e) добавление свежей среды для культивирования в маломасштабные культуры клеток;
где отдельные маломасштабные культуры клеток отличаются условиями культивирования и/или клоном клетки, скрининг на которые осуществляют.
На стадии (a) получают две или более маломасштабных культуры клеток. В частности, получают по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 8 или по меньшей мере 10 маломасштабных культуры клеток.
В конкретных вариантах осуществления одно или несколько, в частности все, из условий культивирования, скрининг на которые не проводят, являются схожими или идентичными между маломасштабными культурами клеток. Подходящие условия культивирования, скрининг на которые можно проводить, включают, в частности, выбранные из группы, состоящей из среды для культивирования или конкретных ингредиентов среды для культивирования, температуры, значения pH, концентрации кислорода, плотности клеток, добавления питательных веществ для клеток, включая время добавления и целевую концентрацию питательных веществ в среде для культивирования, время культивирования, конкретную мощность на входе, скорость подачи газа, скорость перфузии и осмолярность среды для культивирования.
В вариантах осуществления, в которых способ предназначен для скрининга клона клетки для крупномасштабной перфузионной культуры, различные клоны клеток, используемые в различных маломасштабных культурах клеток, в частности, получают из одной родительской клетки. В случаях, когда клетки рекомбинантно продуцируют интересующую биомолекулу, различные клоны, в частности, продуцируют одну биомолекулу, и, в частности, их можно получать с помощью одного эксперимента по трансфекции.
В конкретных вариантах осуществления способ скрининга условий культивирования и/или клона клетки для крупномасштабной перфузионной культуры клеток в суспензии включает дополнительную стадию (f) после стадии (e):
(f) выбор подвергнутого скринингу на условия культивирования и/или клон клетки, обеспечивающие желаемое свойство и/или характеристику крупномасштабной перфузионной культуры.
Желаемое свойство и/или характеристику крупномасштабной перфузионной культуры, в частности, можно выбирать из группы, состоящей из роста клеток, жизнеспособности клеток и плотности клеток. В вариантах осуществления, в которых клетки продуцируют интересующую биомолекулу, в частности, гликопротеин, свойство и/или характеристика крупномасштабной перфузионной культуры может дополнительно включать выход интересующей биомолекулы, продуктивность клеток, стабильность продукции интересующей биомолекулы и качество интересующей биомолекулы, включая, в частности, одну или несколько характеристик гликозилирования биомолекулы в случае, если она является гликопротеином. Примеры характеристик гликозилирования описаны выше.
В конкретном варианте осуществления способ скрининга условий культивирования и/или клона клетки для крупномасштабной перфузионной культуры клеток в суспензии включает дополнительную стадию (g) после стадии (f):
(g) получение крупномасштабной перфузионной культуры клеток в суспензии с использованием условий культивирования и/или клона клетки, выбранных на стадии (f).
В определенных вариантах осуществления дополнительные условия культивирования крупномасштабной перфузионной культуры, полученной на стадии (g), являются схожими или идентичными с условиями культивирования маломасштабных культур клеток, скрининг на которые не проводят, по возможности. Подходящие условия культивирования, которые могут являться схожими или идентичными между крупномасштабной перфузионной культурой и маломасштабной культурой клеток, включают, в частности, выбранные из группы, состоящей из среды для культивирования или конкретных ингредиентов среды для культивирования, температуры, значения pH, концентрации кислорода, плотности клеток, добавления питательных веществ для клеток, включая время добавления и целевую концентрацию питательных веществ в среде для культивирования, время культивирования, конкретную мощность на входе, скорость подачи газа, скорость перфузии и осмолярность среды для культивирования.
В определенных вариантах осуществления способ скрининга условий культивирования и/или клона клетки для крупномасштабной перфузионной культуры клеток в суспензии включает дополнительную стадию (h):
(h) определение того, имеет ли одна или несколько из маломасштабных культур клеток свойство и/или характеристику, желаемую для крупномасштабной перфузионной культуры.
Стадию (h), в частности, можно осуществлять между стадиями (e) и (f). Свойство и/или характеристика, определяемые на стадии (h), могут являться любой одной или несколькими из свойств и/или характеристик, описанных выше в отношении стадии (f). Средства и способы определения свойств и/или характеристик известны специалисту в этой области.
В вариантах осуществления, где стадии (b)-(e) повторяют один или несколько раз, стадию (h) также можно осуществлять при каждом цикле. Альтернативно, стадию (h) можно осуществлять один или несколько раз после конкретного количества осуществленных циклов.
В определенных вариантах осуществления крупномасштабная перфузионная культура имеет объем по меньшей мере 1 л, предпочтительно - по меньшей мере 2 л, по меньшей мере 5 л или по меньшей мере 10 л. В конкретных вариантах осуществления крупномасштабная перфузионная культура имеет объем по меньшей мере 10 л или по меньшей мере 100 л. В этом отношении перфузия, в частности, означает, что часть среды для культивирования из культуры клеток заменяют свежей средой для культивирования при культивировании. Таким образом, перфузионная культура отличается от периодической культуры. Перфузию в крупномасштабной перфузионной культуре можно осуществлять любыми известными способами, и, в частности, ее осуществляют с использованием систем фильтрации или центрифугирования. Подходящими системами фильтрации являются половолоконные фильтры, в частности, используемые в системах переменного тангенциального потока (ATF). В случае систем центрифугирования, в частности, можно использовать центрифугу непрерывного действия.
В конкретных вариантах осуществления маломасштабная культура клеток имеет культуральный объем 7,5% или менее от крупномасштабной перфузионной культуры, в частности, культуральный объем 5% или менее, 2,5% или менее, 1,5% или менее или даже 1% или менее крупномасштабной перфузионной культуры. В определенных вариантах осуществления маломасштабная культура клеток даже имеет культуральный объем 0,5% или менее, в частности, 0,25% крупномасштабной перфузионной культуры.
Признаки и варианты осуществления способа культивирования клеток в суспензии, как представлено в настоящем описании, также аналогично применимы к способу симуляции крупномасштабной перфузионной культуры клеток в суспензии и способу скрининга условий культивирования и/или клона клетки для крупномасштабной перфузионной культуры клеток в суспензии.
В дополнительном аспекте настоящее изобретение относится к применению маломасштабной культуры клеток для симуляции крупномасштабной перфузионной культуры клеток в суспензии, где используют маломасштабную культуру клеток, включающему стадии
(a) получения маломасштабной культуры клеток, имеющей культуральный объем 10% или менее от крупномасштабной перфузионной культуры;
(b) культивирования клеток в маломасштабной культуре клеток с использованием одного или нескольких условий культивирования крупномасштабной перфузионной культуры, подлежащей симуляции, где маломасштабную культуру клеток перемешивают;
(c) прекращения перемешивания маломасштабной культуры клеток;
(d) удаления части среды для культивирования маломасштабной культуры клеток после, по меньшей мере, частичной седиментации клеток в маломасштабной культуре клеток; и
(e) добавления свежей среды для культивирования в маломасштабную культуру клеток.
В другом аспекте настоящее изобретение относится к применению маломасштабной культуры клеток для скрининга условий культивирования и/или клона клетки для крупномасштабной перфузионной культуры клеток в суспензии, где используют маломасштабную культуру клеток, включающему стадии
(a) получения маломасштабной культуры клеток, имеющей культуральный объем 10% или менее от крупномасштабной перфузионной культуры;
(b) культивирования клетки в маломасштабной культуре клеток, где маломасштабную культуру клеток перемешивают;
(c) прекращения перемешивания маломасштабной культуры клеток;
(d) удаления части среды для культивирования маломасштабной культуры клеток после, по меньшей мере, частичной седиментации клеток в маломасштабной культуре клеток; и
(e) добавления свежей среды для культивирования в маломасштабную культуру клеток.
В определенных вариантах осуществления используют несколько маломасштабных культур клеток, и отдельные маломасштабные культуры клеток отличаются условиями культивирования и/или клоном клетки, скринингу на которые их подвергают.
Признаки и варианты осуществления способов, представленных в настоящем описании, также аналогично применимы к применению маломасштабной культуры клеток.
В рамках изобретения выражение "содержит", помимо своего буквального значения, также включает и конкретно относится к выражениям "по существу, состоит из" и "состоит из". Таким образом, выражение "содержит" относится к вариантам осуществления, где объект изобретения, "содержащий" конкретно указанные элементы, не содержит дополнительные элементы, а также варианты осуществления, где объект изобретения, "содержащий" конкретно указанные элементы, может включать и/или фактически включает дополнительные элементы. Аналогично, выражение "имеют" следует понимать как выражение "содержат", также включающее и конкретно относящееся к выражениям "по существу, состоит из" и "состоит из".
Числовые значения, представленные в настоящем описании, включают числа, определяющие диапазон. Заголовки, представленные в настоящем описании, не предназначены для ограничения различных аспектов или вариантов осуществления настоящего изобретения, которые можно прочесть со ссылкой на описание в целом. По одному из вариантов осуществления объект изобретения, представленный в настоящем описании, включающий конкретные стадии в случае способов или включающий конкретные ингредиенты в случае композиций, относится к объекту изобретения, состоящему из соответствующих стадий или ингредиентов. Предпочтительно выбирать и комбинировать конкретные аспекты и варианты осуществления, представленные в настоящем описании, и конкретные объекты изобретения, возникающие из соответствующей комбинации конкретных вариантов осуществления, также принадлежат к настоящему изобретению.
фигуры
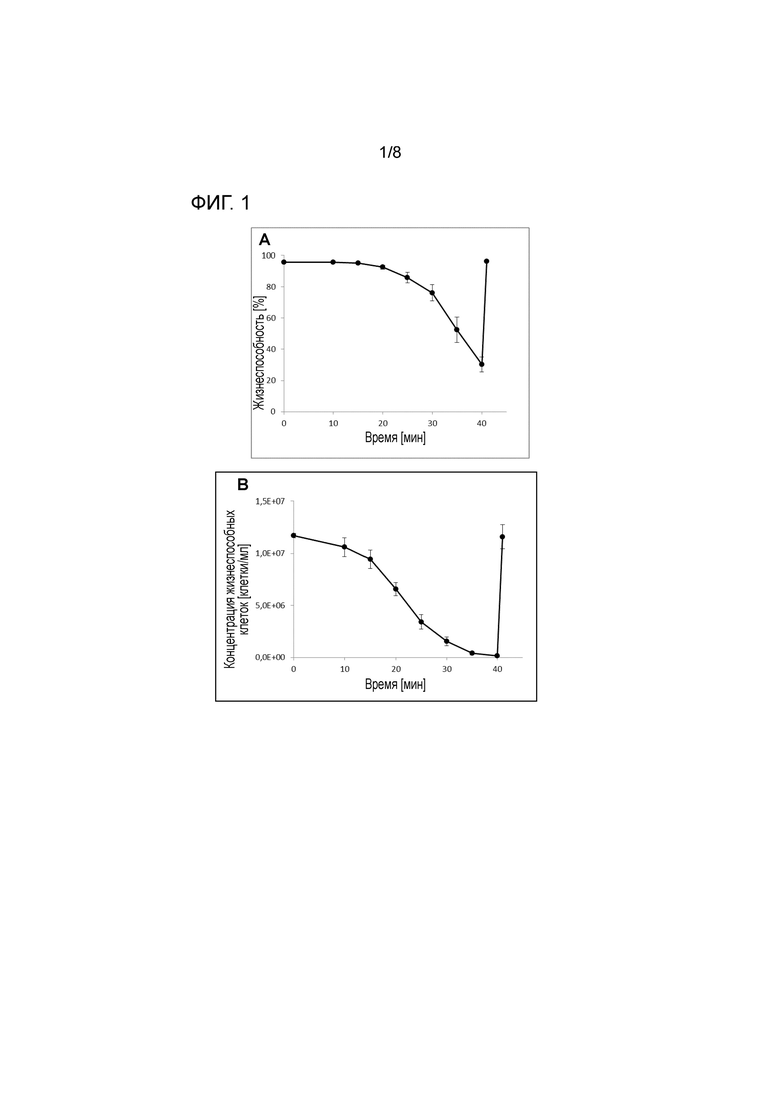
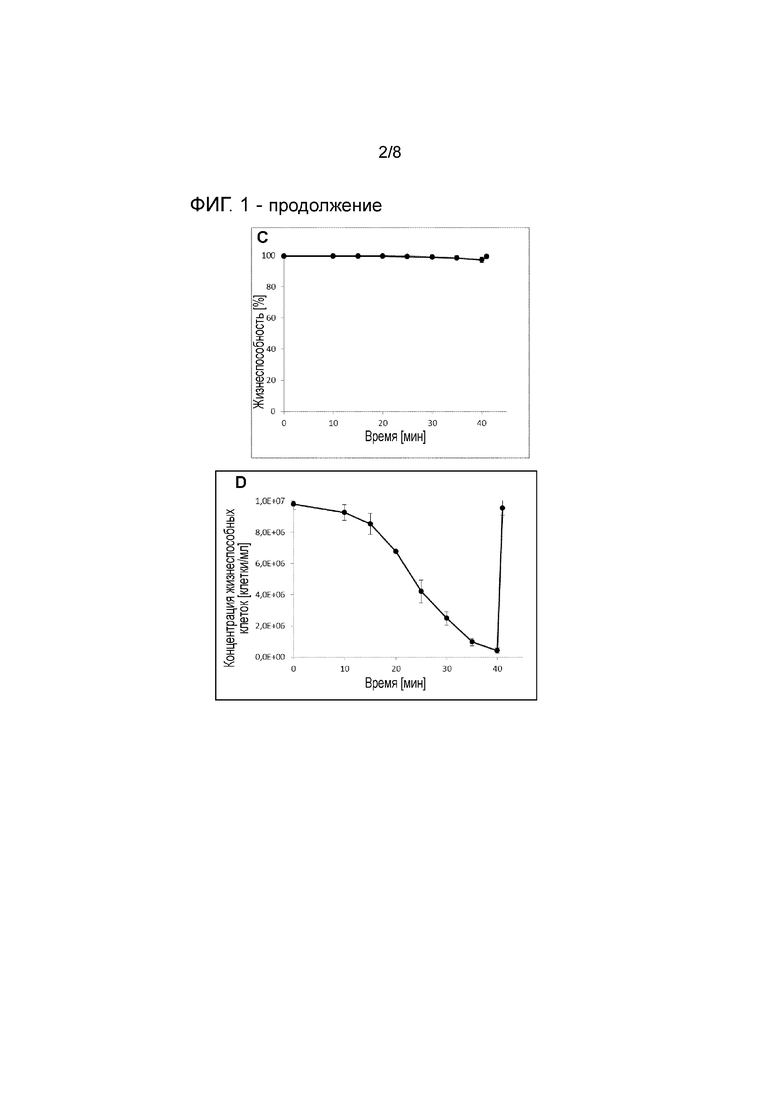
На фигуре 1 показана концентрация жизнеспособных клеток (A+C) и жизнеспособность (B+D) иммортализованных клеток крови человека миелолейкозного происхождения (A+B) и клеток CHO (C+D) при седиментации (до 40 мин) и после замены среды для культивирования и возобновления перемешивания (значение через 41 мин).
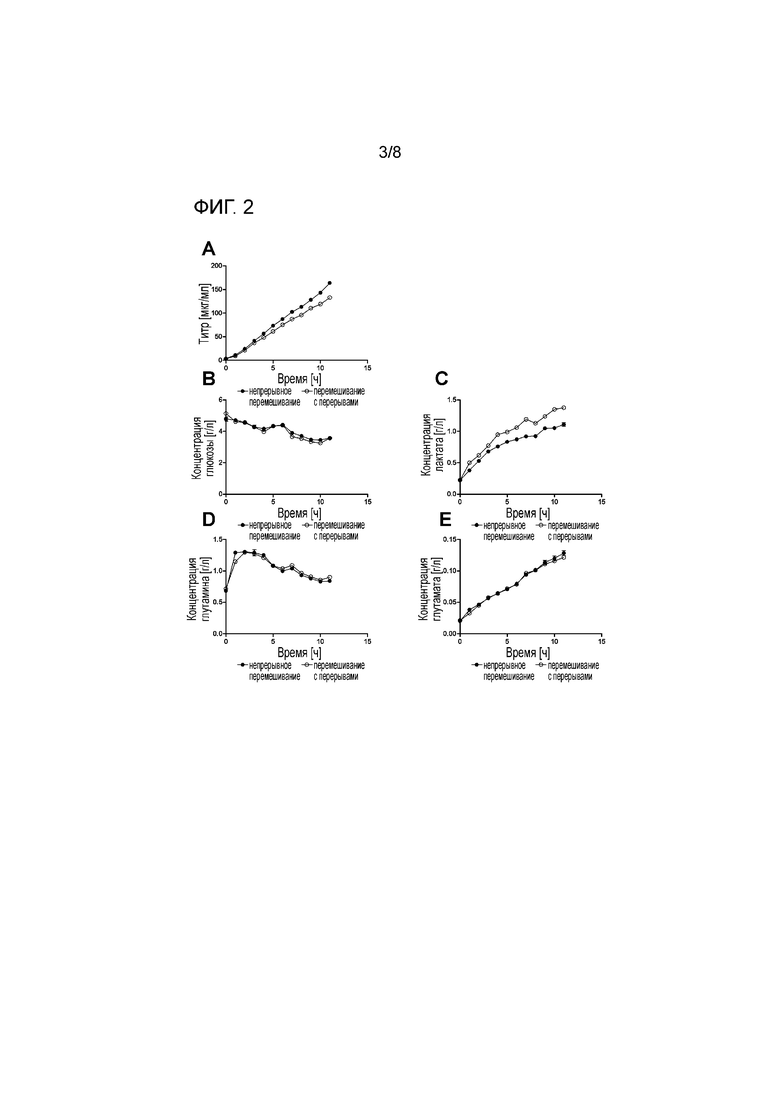
На фигуре 2 показан эффект седиментации на продуктивность (A) и метаболизм глюкозы (B-C)/глутамина (D-E) в случае непрерывно перемешиваемого и перемешиваемого с перерывами антитело-продуцирующего клона. Клетки культивировали в течение 11 часов. Перемешивание прекращали в случае седиментированных клеток (квадраты), но не контрольных клеток (круги) (планки погрешностей представляют собой s.d., n=3).
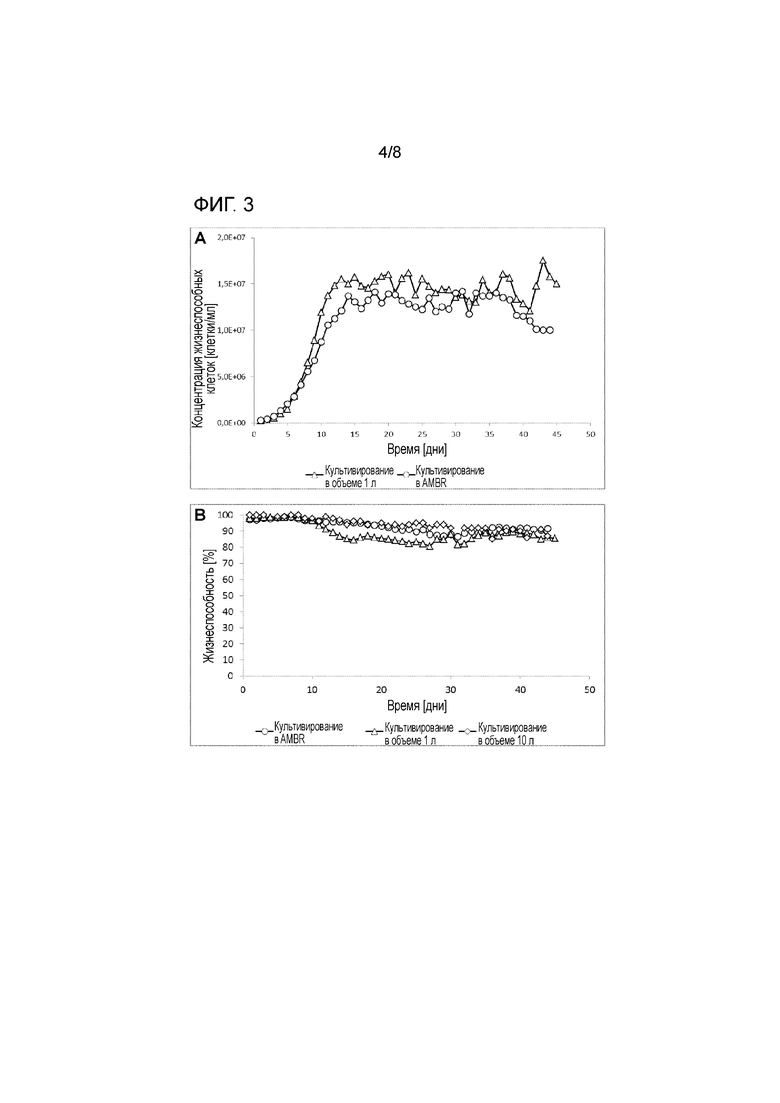
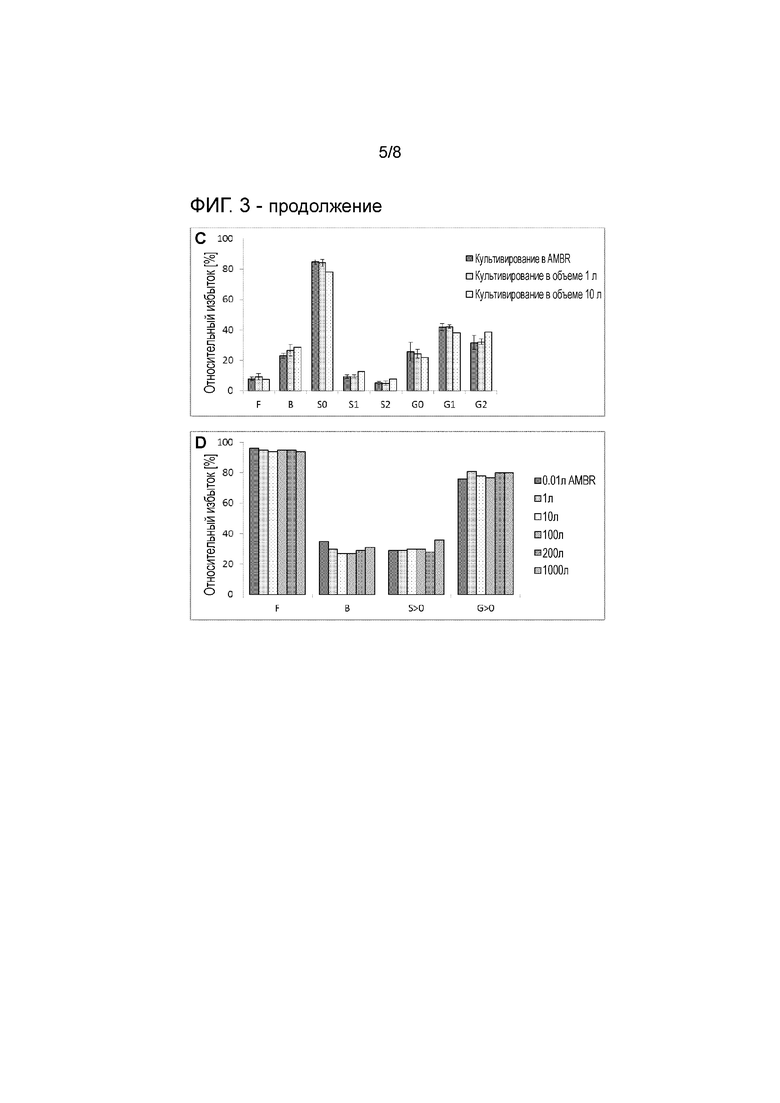
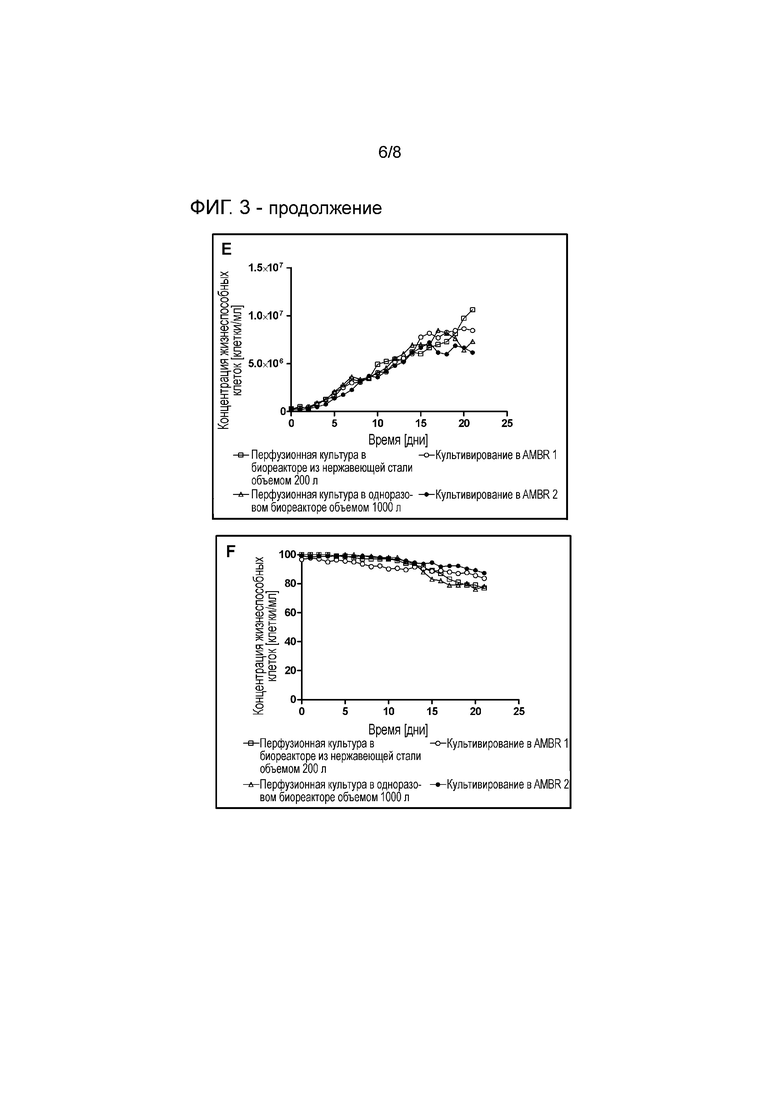
На фигуре 3 представлена концентрация жизнеспособных клеток (A), жизнеспособность (B) и гликозилирование продукта (C) при культивировании в ambr с седиментацией в 12 мл (5 заходов), перфузионной культуре объемом 1 л (7 заходов) и одноразовой биореакторной культуре клона 3 объемом 10 л (линия клеток GEX), рекомбинантно продуцирующей антитело IgG. Представлены среднее ± SEM (A-B) и среднее ± SD (C). Условия культивирования (DO, pH, температура, среды) совместимы для всех объемов. Гликозилирование продукта другого клона, продуцирующего другое антитело IgG при культивировании в ambr с седиментацией в 10 мл и стандартном культивировании в объеме от 1 л до 1000 л, представлено на (D). Кроме того, представлены концентрация жизнеспособных клеток (E) и жизнеспособность (F) при культивировании в ambr с седиментацией в 12 мл (2 захода), перфузионной культуре в биореакторе из нержавеющей стали Centritech объемом 200 л и перфузионной культуре клона 4 в одноразовом биореакторе объемом 1000 л (линия клеток GEX), рекомбинантно продуцирующего антитело IgG. Условия культивирования (DO, pH, температура, среды) сравнимы для всех объемов.
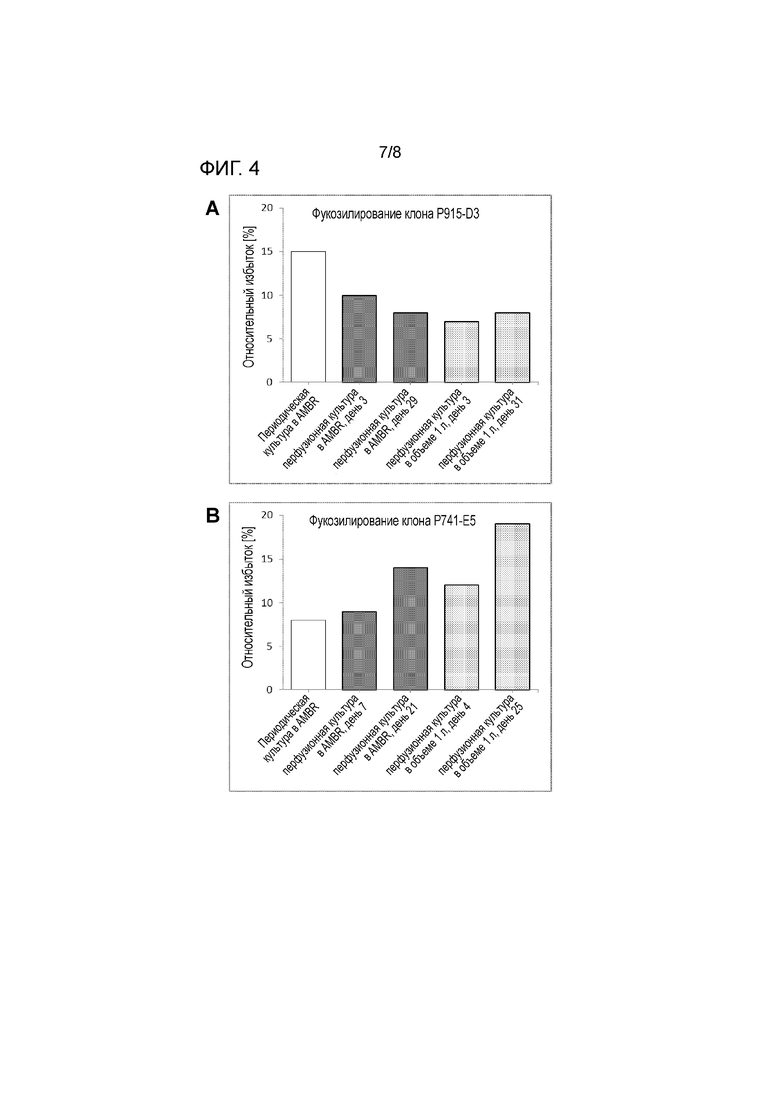
На фигуре 4 показана степень фукозилирования антитела IgG, продуцируемого клоном 1 (A) и клоном 2 (B) в случае культивирования в ambr масштабом 12 мл порционным способом (показано белым), маломасштабного культивирования в ambr перфузионным способом (показано красным) и культуры объемом 1 л (показано серым, черным).
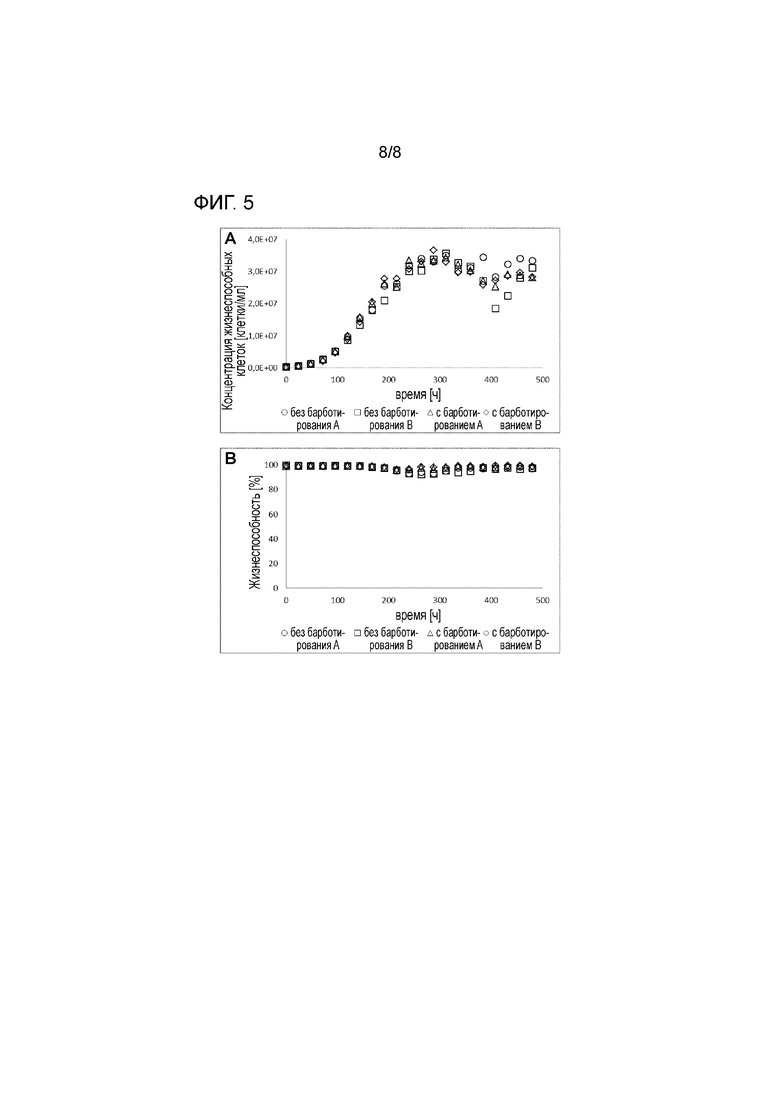
На фигуре 5 показана концентрация (A) и жизнеспособность (B) клеток из культуры клеток CHO при использовании перфузии на основе седиментации в системе ambr.
Примеры
Пример 1: Культивирование в микробиореакторной системе
Культивирование в микробиореакторе осуществляют в системе ambrTM (Advanced Mircobioreactor) (TAP Biosystems/Sartorius). Система ambr доступна в формате на 24 или 48 микробиореакторов. В настоящей работе используют только формат из 24 микробиореакторов, состоящий из двух станций для культивирования, содержащих по 12 сосудов каждая. Каждый сосуд оборудован мешалкой с наклонными областями с диаметром 11 мм. pH и DO измеряют по пятнам оптического контакта на дне каждого сосуда каждые 90 секунд. Каждый сосуд отдельно снабжают азотом (или воздухом), кислородом (для поддержания DO), диоксидом углерода (для снижения pH) или смесью этих газов. Сосуды предварительно стерилизуют, и они доступны с барботажной трубкой или без нее. Для культивирования клеток человека миелолейкозного происхождения (клеток GEX) используют сосуды без барботажных трубок. Клетки CHO DG44 культивируют с барботажной трубкой или без нее в зависимости от применения. Температуру культивирования и скорость перемешивания задают для каждой культуральной станции (набора из 12 сосудов). Все линии клеток культивируют при 37°C. Клетки GEX перемешивают при 830-1000 об./мин., а клетки CHO - при 830-1300 об./мин. в зависимости от концентрации DO. pH поддерживают посредством добавления 0,5 M NaOH (запускаемого при pH ниже 6,9) и подачи CO2 (запускаемой при pH выше 7,3). Забор и добавление сред и подпитку осуществляют с помощью программируемого жидкостного манипулятора с использованием одноразовых наконечников с максимальным объемом 1 мл или 5 мл. Рабочий объем каждого сосуда составляет 12 мл (минимум 10 мл, максимум 15 мл). Образцы для измерения концентрации клеток и метаболитов получают ежедневно (от 250 до 450 мкл в зависимости от плотности клеток). pH калибровали каждые 3-4 дня с помощью автономных измерений. Для обеспечения стерильности операций всю систему помещают в бокс биологической защиты. Сосуды инокулируют 2×105 клеток/мл в случае клеток GEX или 3×105 клеток/мл в случае клеток CHO. Культивирование прекращают, когда жизнеспособность снижается ниже 65%. При необходимости подают пеногаситель для барботируемых сосудов.
Пример 2: Перфузия в микробиореакторной системе
В случае перфузионного способа клетки инокулируют, как описано выше. Перфузию начинают с 12 мл, и когда концентрация глюкозы опускается ниже 2,5 г/л (как правило, через 72-120 ч.). Удержание клеток обеспечивают посредством седиментации. Чтобы позволить клеткам осесть, перемешивание прекращают на всей культуральной станции. За десять минут до прекращения перемешивания прекращают контроль pH с использованием NaOH для предотвращения добавления основания непосредственно перед прекращением перемешивания. Контроль DO прекращают одновременно с перемешиванием. Клеткам позволяют осаждаться в течение от 30 до 45 минут, предпочтительно - 40 минут. После этого 3 мл собранного материала удаляют с помощью жидкостного манипулятора сверху жидкости и помещают на 24-луночные планшеты с глубокими лунками. Глубину образца в системе ambr изменяют для обеспечения сбора собранного материала сверху культуральной жидкости (стандартную глубину образца устанавливают так, чтобы забирать образцы вблизи дна сосуда). Удаление собранного материала осуществляют посредством многократного пипетирования для каждого сосуда. После удаления собранного материала продолжают перемешивание и восстанавливают объем культуры до 12 мл посредством добавления свежей среды в планшеты с глубокими лунками с помощью жидкостного манипулятора. Контроль DO и pH продолжают после добавления среды. Все стадии осуществляются системой автономно (без взаимодействия с пользователем). Все стадии вместе занимают приблизительно 1 ч. Заменяют 3 мл (25% рабочего объема) на стадию. Для скорости перфузии в один объем реактора (Vr/d) необходимо четыре стадии в сутки. Взаимодействие с пользователем ограничено ежедневным забором образцов, перезагрузкой одноразовых наконечников, удалением собранного материала и пополнением сред для подпитки.
Таблица 1: Стадии, осуществляемые в системе ambr для осуществления перфузии
Пример 3: Определение времени осаждения
Следующие примеры осуществляют с использованием иммортализованных клеток крови человека миелолейкозного происхождения или клеток CHO. Для анализа продукции клеток и качества продукта клетки трансфицировали таким образом, чтобы они рекомбинантно продуцировали гликозилированное антитело.
Для определения оптимального времени осаждения прекращают перемешивание и определяют количества клеток перед осаждением, через 10, 15, 20, 25, 30, 35 и 40 минут после прекращения перемешивания и непосредственно после возобновления перемешивания и добавления свежих сред.
Эффективность разделения (SE) является общеупотребительным термином для выражения свойств удержания клеток в перфузионной культуре, и ее вычисляют следующим образом (при этом cреактор представляет собой концентрацию клеток в среде для культивирования в биореакторе, и cсобранный материал представляет собой концентрацию клеток в среде для культивирования, удаленных из биореактора после времени осаждения:

Для обеих линий клеток времени седиментации 40 минут при начальной плотности клеток приблизительно 1×107 клеток/мл достаточно для достижения эффективности разделения >95%, что означает получение почти бесклеточного собранного материала. Даже эффективность разделения ниже 90% является удовлетворительной, и иногда предпочтительно включать автоматический слив клеток. Степень слива можно корректировать по времени осаждения (меньшее время осаждения=более высокая степень слива). После продолжения перемешивания плотность клеток восстанавливается до исходной плотности клеток, что свидетельствует о том, что стадия перфузии проведена без потери клеток (см. фигуру 1A). Кроме того, на стадии седиментации жизнеспособность клеток также не затрагивается (см. фигуру 1B).
Для дальнейшего исследования эффекта седиментации на продуктивность и ключевые метаболиты эксперимент с ambr начинали с использованием типичных рабочих плотностей клеток 1×107 клеток на мл. Контрольную культуру непрерывно перемешивали, в то время как сосуды с осажденными культурами перемешивали с четырьмя перерывами в течение 40 минут при перемешивании в течение 110 минут. Среду не меняли при обоих условиях культивирования клеток.
Как видно на фигуре 2 B, C и E, уровни глюкозы, глутамина и глутамата не изменяются в зависимости от условий культивирования, как и концентрация жизнеспособных клеток и жизнеспособность (данные не представлены). Наблюдали различия в титре и уровнях лактата. Регулярно осаждаемые клетки демонстрируют более высокие уровни лактата, чем непрерывно перемешиваемые клетки. Когда перемешивание и газирование прекращают для инициации седиментации, транспорт кислорода быстро снижается до гипоксических условий. Этот эффект является даже более заметным в случае осажденных клеток на дне сосуда, где локальная концентрация клеток является гораздо более высокой, чем в условиях перемешивания. В гипоксических условиях клетки больше используют анаэробное получение энергии, что для клеток млекопитающих опухолевого происхождения означает преобразование глюкозы в лактат. Также показано, что гипоксические условия в клетках CHO снижают продукцию белка, что соответствует сниженному накоплению IgG, представленному на фигуре 2A, где количество продуцируемого специфического mAb снижается с 14,7±0,2 мкг/мл ч. до 12,1 7±0,1 мкг/мл ч.
Пример 4: Сравнение роста клеток и качества продукта
Сравнивали рост клеток и качество продукта между системой микробиореактора ambr, как описано в примерах 1 и 2 выше, и культивированием в перфузионном биореакторе емкостью 1 л.
Культуры объемом 1 л инокулировали 2,0×105 клеток/мл. Когда глюкоза снижалась ниже 2,5 г/л (как правило, в день 4-5), непрерывную операцию осуществляли посредством подпитки средой при скорости перфузии 0,5 V/d. Перфузию повышали, если концентрация глюкозы оставалась ниже 2,5 г/л, но, по меньшей мере, через день. Максимальная скорость перфузии составляла 2 объема реактора в день. pH контролировали посредством добавления 0,5 M NaOH или барботирования CO2. Культивирование прекращали, когда жизнеспособность снижалась ниже 65%, или когда достигали заданного времени эксперимента. Культивирование лабораторного масштаба в объеме 1 л осуществляли в Sartorius Biostat B-DCU 2l. Растворенный кислород и pH измеряют с помощью стандартных электродов (MettlerTorledoInPro 6800 и Mettler-Torledo 405-DPAS-SC-K8S, соответственно, MettlerTorledo, Switzerland). Перемешивание осуществляют с помощью мешалок с 3-лопастными сегментами. Перфузию осуществляют с использованием модуля ATF2 или центрифуги Centritech. Модуль ATF2 имеет мембрану 60 см PES (размер пор 0,2 мкм и площадь мембраны 0,15 м2, Spectrum, USA). Благодаря мертвому объему внутри модуля ATF2, замену мембраны осуществляют вместе со сливом 100-150 мл клеточной суспензии. Отдельную центрифугу непрерывного действия Centritech Lab II или Lab III (последующий вариант Lab II) (Berry Wehrmiller, Pneumatic scale) используют в прерывистом режиме. Это рекомендовано для маломасштабных объемов. Время ожидания между циклами корректируют для контроля скорости перфузии. В конце каждого рабочего цикла все трубки промывают супернатантом, чтобы смыть обратным противотоком оставшиеся клетки в биореактор.
Профиль роста культур в 1 л или 10 л в перфузионном биореакторе и при маломасштабном культивировании в системе ambr сопоставимы. Культуры достигают одинаковой максимальной плотности клеток. Жизнеспособность перфузионной культуры объемом 1 л немного ниже, чем при перфузии на основе седиментации в маломасштабной системе ambr или крупномасштабной культуре в объеме 10 л, но сравнима с ней. Профили гликозилирования продуктов сравнимы между маломасштабным культивированием ambr и крупномасштабными культурами объемом даже до 1000 л (средние значения, полученные при разных заходах с незначительными изменениями контроля) (см. фигуру 3). Дополнительные признаки качества приведены в таблице 2:
Таблица 2: Дополнительный анализ качества продукта.
Соответствует описанию
На фигуре 4 показано, что маломасштабная система ambr в перфузионном режиме гораздо лучше подходит для прогнозирования изменений профиля гликозилирования при культивировании большего масштаба, чем система ambr при порционном способе. В частности, клон P741-E5 демонстрирует повышение фукозилирования с течением времени (серые столбики на B) при сравнении рано собранного материала (день перфузии 4) с поздно собранным материалом (день перфузии 25). Повышение фукозилирования также наблюдают при перфузии ambr, но не при порционном способе. Клон P915-D3 демонстрирует высокое фукозилирование при порционном способе, но низкое фукозилирование при перфузии в ambr и масштабе 1 л.
Клетки CHO DG44 демонстрируют хороший и последовательный рост до 3,5×107 клеток/мл при перфузии на основе седиментации в маломасштабной системе ambr независимо от подачи газа (в барботированием или без). Жизнеспособность остается высокой в течение всего культивирования (>90%) в течение 21 дня (см. фигуру 5).
Гликозилирование моноклонального антитела, продуцируемого в масштабе 1 л и 12 мл, демонстрируемое клетками, полученными из CHO DG44, является сравнимым. Галактозилирование при перфузии на основе ambr немного снижено в случае материала, собранного на десятый день.
Таблица 3: Гликановая структура моноклонального антитела, продуцируемого в CHO DG44 в масштабе 1 л и 12 мл.
F: фукозилированные N-гликаны; B: N-ацетилглюкозамин в точке ветвления; S>0: сиалированные N-гликаны; G>0: галактозилированные N-гликаны. Относительные избытки гликановых структур относятся к общему количеству N-гликанов.
Пример 5: Дизайн эксперимента (DoE)
Для дальнейшего подтверждения пользы разработанной системы осуществляют исследования DoE. В качестве факторов DoE используют добавление химического шаперона в диапазоне концентраций от 0,5% до 1,5% (CC5), дополнение GlycoMix с 0,5-1,5-кратной стандартной концентрацией и pH процесса (6,8-7,2). Выбрали дизайн CCF (центральный композиционный план) с 4 центральными точками и 14 заходами. В качестве ответов используют среднюю жизнеспособность, интегральную плотность жизнеспособных клеток (IVCD) и общий продукт на заход. Общие сведения о подборе модели приведены в таблице 4.
Таблица 4: Общие сведения о подборе DoE
Значения R² для всех ответов являлись высокими и близкими к 1, что свидетельствует о хорошем подборе модели. Точность прогнозирования Q² также являлась высокой, составляя приблизительно 0,8 для всех трех ответов. Хорошие модели демонстрируют значения Q² более 0,5. Достоверность (должна быть более 0,25) и воспроизводимость (должна быть более 0,5) также являлись приемлемыми.
Идентификация депонируемого биологического материала
Линии клеток DSM ACC 2606 и DSM ACC 2605 депонировали в DSMZ - Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, MascheroderWeg 1b, 38124 Braunschweig (DE), Nemod Biotherapeutics GmbH & Co. KG, Robert-Rössle-Str. 10, 13125 Berlin (DE) на 14 августа 2003 года. Glycotope имеет право ссылаться на эти биологические материалы, т.к. они были в то же время направлены из NemodBiotherapeutics GmbH & Co. KG в Glycotope GmbH.
Линии клеток DSM ACC 2806, DSM ACC 2807, DSM ACC 2856, DSM ACC 2858 и DSM ACC 3078 депонированы в DSMZ - Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, Inhoffenstraße 7B, 38124 Braunschweig (DE), Glycotope GmbH, Robert-Rössle-Str. 10, 13125 Berlin (DE) в даты, указанные в следующей таблице.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ СОЗДАНИЯ БАНКОВ КЛЕТОК СО СВЕРХВЫСОКОЙ ПЛОТНОСТЬЮ | 2015 |
|
RU2723129C2 |
| СПОСОБЫ СОЗДАНИЯ БАНКОВ КЛЕТОК СО СВЕРХВЫСОКОЙ ПЛОТНОСТЬЮ | 2015 |
|
RU2826038C2 |
| ПИЩЕВЫЕ ПРОДУКТЫ, СОДЕРЖАЩИЕ СТВОЛОВЫЕ КЛЕТКИ ПТИЦ | 2019 |
|
RU2834345C2 |
| СПОСОБЫ ФОРМИРОВАНИЯ БАНКА КЛЕТОК ВЫСОКОЙ ПЛОТНОСТИ (ВАРИАНТЫ) | 2014 |
|
RU2668796C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ПОЛИПЕПТИДА | 2011 |
|
RU2577972C2 |
| СПОСОБ ПОЭТАПНОГО УДЕРЖИВАНИЯ И ПРОИЗВОДСТВЕННЫЙ МОДУЛЬ ДЛЯ ПОЛУЧЕНИЯ БИОМАКРОМОЛЕКУЛ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2769767C1 |
| УСТРОЙСТВА ДЛЯ ОСАЖДЕНИЯ ЧАСТИЦ | 2019 |
|
RU2764775C1 |
| СПОСОБЫ ПЕРФУЗИОННОГО КУЛЬТИВИРОВАНИЯ И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2733539C2 |
| СПОСОБ ПОВЫШЕНИЯ ПРОДУКТИВНОСТИ ЭУКАРИОТИЧЕСКИХ КЛЕТОК В ПРОДУЦИРОВАНИИ РЕКОМБИНАНТНОГО FVIII | 2012 |
|
RU2600886C2 |
| СПОСОБЫ ПЕРФУЗИОННОГО КУЛЬТИВИРОВАНИЯ И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2708919C2 |
Изобретение относится к области биотехнологии, а именно к скринингу условия культивирования и/или клона клетки для крупномасштабной перфузионной культуры иммортализованных клеток человека миелолейкозного происхождения или клеткок CHO в суспензии. Способ включает получение маломасштабных культур клеток, имеющих культуральный объем от 1 мл до 100 мл. Далее осуществляют культивирование клеток в маломасштабных культурах клеток путем перемешивания. Затем удаляют части среды для культивирования маломасштабных культур клеток после, по меньшей мере, частичной седиментации клеток в маломасштабных культурах клеток, добавляют свежую среду для культивирования в маломасштабные культуры клеток. Осуществляют выбор подвергнутого скринингу на условие культивирования и/или клон клетки условия, обеспечивающего желаемое свойство и/или характеристику крупномасштабной перфузионной культуры, и получают крупномасштабную перфузионную культуру клеток объемом по меньшей мере 1 л. Желаемое свойство и/или характеристику, скрининг на которые проводят, выбирают из группы, состоящей из высокой жизнеспособности клеток, высокой и/или стабильной плотности клеток, высокого и/или стабильного выхода интересующей биомолекулы, продуцируемой клетками в клеточной культуре и желаемого свойства интересующей биомолекулы, продуцируемой клетками в клеточной культуре. Изобретение позволяет расширить арсенал технических средств. 9 з.п. ф-лы, 5 ил., 5 табл., 5 пр.
1. Способ скрининга условия культивирования и/или клона клетки для крупномасштабной перфузионной культуры клеток в суспензии, включающий
(a) получение маломасштабных культур клеток, имеющих культуральный объем от 1 мл до 100 мл;
(b) культивирование клеток в маломасштабных культурах клеток, где маломасштабные культуры клеток перемешивают;
(c) прекращение перемешивания маломасштабных культур клеток;
(d) удаление части среды для культивирования маломасштабных культур клеток после, по меньшей мере, частичной седиментации клеток в маломасштабных культурах клеток;
(e) добавление свежей среды для культивирования в маломасштабные культуры клеток;
(f) выбор подвергнутого скринингу на условие культивирования и/или клон клетки условия, обеспечивающего желаемое свойство и/или характеристику крупномасштабной перфузионной культуры, и
(g) получение крупномасштабной перфузионной культуры клеток в суспензии с применением условия культивирования и/или клона клетки, выбранных на стадии (f);
где отдельные маломасштабные культуры клеток отличаются условием культивирования и/или клоном клетки, скрининг на которые проводят, и где культивируемыми клетками являются иммортализованные клетки человека миелолейкозного происхождения или клетки CHO, и где крупномасштабная перфузионная культура имеет объем по меньшей мере 1 л; и где желаемое свойство и/или характеристику, скрининг на которые проводят, выбирают из группы, состоящей из высокой жизнеспособности клеток, высокой и/или стабильной плотности клеток, высокого и/или стабильного выхода интересующей биомолекулы, продуцируемой клетками в клеточной культуре и желаемого свойства интересующей биомолекулы, продуцируемой клетками в клеточной культуре.
2. Способ по п.1, где условия культивирования, скрининг на которые проводят, выбраны из группы, состоящей из среды для культивирования, температуры, значения pH, концентрации кислорода, плотности клеток, добавления питательных веществ для клеток, включая время добавления и целевую концентрацию питательных веществ в среде для культивирования, время культивирования, конкретную мощность на входе, скорость подачи газа, скорость перфузии и осмолярность среды для культивирования.
3. Способ по п.1 или 2, где крупномасштабная перфузионная культура имеет объем по меньшей мере 10 л, и/или где маломасштабная культура клеток имеет объем от 7 мл до 50 мл.
4. Способ по любому из пп.1-3, где после прекращения перемешивания на стадии (c) осуществляют седиментацию клеток в течение по меньшей мере 35 мин перед удалением части среды для культивирования на стадии (d).
5. Способ по любому из пп.1-3, где после прекращения перемешивания на стадии (c) осуществляют седиментацию клеток в течение 30 мин или менее перед удалением части среды для культивирования на стадии (d), и где на стадии (d) также удаляют часть клеток в культуре клеток для осуществления слива клеток.
6. Способ по любому из пп.1-5, где на стадии (d) удаляют от 15% до 50% среды для культивирования; и/или где среду для культивирования удаляют на стадии (d) из верхней части культуры клеток.
7. Способ по любому из пп.1-6, где количество свежей среды для культивирования, добавляемой на стадии (e), по существу, идентично количеству среды для культивирования, удаляемой на стадии (d).
8. Способ по любому из пп.1-7, где значение pH и/или концентрацию кислорода в среде для культивирования контролируют в течение культивирования клеток; и где контроль значения pH и/или концентрации кислорода прекращают по меньшей мере за 5 мин до прекращения перемешивания культуры клеток на стадии (c).
9. Способ по любому из пп.1-8, где стадии (b)-(e) повторяют один или несколько раз, и где после стадии (e) клетки культивируют при перемешивании в течение по меньшей мере 1 ч перед прекращением перемешивания на стадии (c) следующего цикла.
10. Способ по любому из пп.1-9, где клетки рекомбинантно продуцируют интересующую биомолекулу, предпочтительно, гликопротеин.
| WO 2012085162 A1, 28.06.2012 | |||
| EP 0599651 A2, 01.06.1994 | |||
| WOODSIDE S.M., et al | |||
| "Mammalian cell retention devices for stirred perfusion bioreactors", Cytotechnology.1998; 28:163-175; | |||
| ГОРДЕЕВ А.А | |||
| "Методы скрининга живых клеток", Успехи биологической химии | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
Авторы
Даты
2020-08-24—Публикация
2016-05-25—Подача