Настоящее изобретение относится к способу повышения выхода рекомбинантного человеческого фактора VIII (rFVIII) в процессе культивирования клеток.
УРОВЕНЬ ТЕХНИКИ
Область техники
В настоящем изобретении предлагаются способы повышения выхода белка, продуцируемого культивирующимися клетками, особенно клетками млекопитающих. В частности, настоящее изобретение относится к способам получения белкового продукта(ов), например гликопротеинового продукта(ов), где характеристики белкового продукта контролируются путем манипуляций с культуральной средой с повышением усилия, применяемого к клеткам.
Уровень техники
Большое количество биотехнологических продуктов, которые либо коммерчески доступны, либо находятся в разработке, представляют собой белковые лекарственные средства. Существует большой и растущий спрос на продуцирование белков в клеточных культурах млекопитающих и на улучшенные способы, связанные с таким продуцированием. Такие улучшенные способы необходимы, особенно когда продуцируются крупные гликопротеины с низким уровнем клеточной экспрессии. Один такой белок, FVIII, имеет уровень экспрессии, по меньшей мере, на два-три порядка ниже, чем другие рекомбинантные белки, продуцирующиеся в клетках млекопитающих. Общая проблема, возникающая на поздней фазе крупномасштабного продуцирования лекарственных белковых продуктов, это повышенные требования, связанные с более масштабными клиническими испытаниями и загрязнениями на производстве продуцентов клеточных культур, что снижает производительность. Для выполнения повышенных требований общий уровень продуцирования может быть повышен несколькими путями. Однако большинство из них, такие как выбор лучшего клеточного клона или улучшение культуральной среды, представляют собой трудоемкие задачи, и, таким образом, не являются в достаточной степени быстрыми операциями. Другие пути повышения продуктивности - это повышение масштаба производства или повышение плотности клеток в подпитываемой культуре или в перфузионной культуре. Также эти изменения способа сопровождаются большими капитальными затратами, и в случае культур с высокой плотностью ограничение кислорода в культуральной емкости будет, как правило, устанавливать ограничение для максимальной клеточной плотности, которая может использоваться для продуцирования. Таким образом, настоящим состоянием данной области продиктована необходимость разработки новых способов повышения продуктивности.
Keane J.T. et al. Effect of shear stress on expression of a recombinant proetine by chinese hamster ovary cells; Biotechnology and Bioengineering, 81:211-220, 2003, подвергали воздействию прикрепленные клетки CHO сдвиговому усилию в течение 32 ч и отслеживали продуцирование рекомбинантного человеческого гормона и метаболизм глюкозы. Они наблюдали, что когда сдвиговое усилие увеличивалось с 0,005 Н/м2 (0,02 Вт/м3) до 0,8 Н/м2 (6,4×102 Вт/м3), то степень продуцирования рекомбинантного белка снижалась на 51%, степень усвоения глюкозы повышалась на 42%, и продуцирование лактата снижалось на 50%.
Godoy-Silva R et al. Physiological responses of CHO cells to repetitive hydrodynamic stress; Biotechnology and Bioengineering, Vol. 103, No. 6, August 15, 2009, изучали эффект повторяющегося гидродинамического воздействия на клетки CHO и пришли к заключению, что степень диссипации энергии до 6,4×106 Вт/м3 не влияет на клеточный рост, клеточную смерть и продуктивность.
J.A. Frangos et al. Shear stress induced stimulation of mammalian cell metabolism; Biotechnology and Bioengineering, Vol. 32, Pp. 1053-1060 (1988) раскрывают проточный аппарат для изучения метаболического ответа субстратзависимых клеток на широкий спектр стабильных и периодических сдвиговых усилий при хорошо контролируемых условиях. Данные продемонстрировали, что физиологический уровень постоянного сдвигового усилия и проявление сдвигового усилия существенно стимулируют продуцирование простациклина в человеческих культивируемых эндотелиальных клетках.
Giard и сотр. наблюдали, что человеческие фибробласты секретируют интерферон в количествах в 30 раз выше при поддержании на микроносителе в центрифужных пробирках по сравнению с клетками в роллерных флаконах (D.J. Giard, D. H. Loeb, W. G. Thilly, D. 1. C. Wang, and D.W. Levine, Biotechnol. Bioeng., 21, 433(1979)). Так как сдвиговое усилие, которому подвергаются клетки в центрифужных пробирках, гораздо выше, чем в роллерных флаконах, то повышенное продуцирование может вносить вклад в стимулирование синтеза интерферона, индуцированное сдвигом.
Timm Tanzeglock et al, Induction of mammalian cell death by simple shear and extensional flows; Biotechnology and Bioengineering, Vol. 104, No. 2, October 1, 2009, раскрыли, влияет ли тип сдвигового потока, которому экспонированы клетки, на инициирование клеточной смерти. Показано, что клетки млекопитающего действительно различают между дискретными типами потока и отвечают дифференцированно. Применяли два питателя для задания точных областей гидродинамических потоков: неизменного постоянного простого сдвигового потока и колеблющегося протяженного потока. Чтобы различить некротическую и апоптотическую клеточную смерть, использовали клеточный сортер с возбуждением флуоресценции и высвобождение ДНК в надосадочной жидкости культуры. Результаты демонстрируют, что клетки яичника китайского хомячка и человеческие эмбриональные почечные клетки будут вступать на путь апоптоза при воздействии на них низкого уровня гидродинамического усилия (около 2 Па) в колеблющемся протяженном потоке. Напротив, некротическая смерть превалирует, когда клетки экспонированы гидродинамическим усилиям около 1 Па в простом сдвиговом потоке или около 500 Па в протяженном потоке. Этих пороговых значений, при которых клетки вступают на соответствующий путь клеточной смерти, следует избегать при культивировании клеток во время продуцирования рекомбинантного белка для усиления продолжительности жизни и продуктивности культуры.
WO 2006/103258 A1 раскрывает способ повышения выхода белка, продуцируемого культивирующимися эукариотическими клетками и путем добавления ионного агента к культуральной среде перед сбором белка. Подходящие ионные агенты представляют собой соли рядов Hofmeister и аминокислоты.
WO 2008/006494 A1 раскрывает способ культивирования клеток, предпочтительно E1-иммортализованных HER-клеток, более предпочтительно PER.C6-клеток в реакторе, в виде суспензии в клеточной культуральной среде, где клетки продуцируют биологическое вещество, предпочтительно, антитело, где, по меньшей мере, один компонент клеточной культуральной среды подается в клеточную культуру, и где клеточная культура, включающая клетки, биологическое вещество и клеточную культуральную среду, культивируется в системе разделения, и где система разделения отделяет биологическое вещество от веществ, имеющих более низкую молекулярную массу, чем у биологического вещества, и где биологическое вещество сохраняется в реакторе или рециркулирует там. Предпочтительно, часть веществ более низкой молекулярной массы непрерывно удаляется из клеточной культуры.
Zhang, Hu et al. сообщают в Current Pharmaceutical Biotechnology, Volume 11, Number 1, January 2010, pp. 103-112(10), что в последние десятилетия культивирование клеток млекопитающих играет важную роль в получении белковых лекарственных средств. Многие конструктивные параметры рассматриваются для оптимизации в процессе разработки культивирования клеток млекопитающих, причем в этой статье особенно освещены сдвиг и смешивание. Считается, что сдвиговое усилие, вызванное вращением, было переоценено по отношению к разрушению клеток, но сдвиг может приводить в результате к нелетальным физиологическим ответам. Клеточные повреждения отсутствуют в областях, где пузырьки образуются, разрушаются и слипаются, но сдвиговое усилие становится значительным после поднятия пузырьков и вызывает сильное разрушение клеток в областях разрывов пузырьков. Смешивания недостаточно для обеспечения гомогенного давления растворенного кислорода, pH, CO2 и питательных элементов в крупномасштабных биореакторах, что может привносить существенные проблемы в клеточный рост, образование продукта и процесс контроля. Были разработаны мелкомасштабные реакторы, для разрешения проблем смешивания и сдвига в параллельных операциях. Вкратце, вводятся определенные технические характеристики в стандартных и недавно разработанных мелкомасштабных биореакторах. Проводятся изыскания сложностей процесса культивирования промышленных клеточных линий в высокой клеточной плотности, а также культивирование стволовых клеток и других человеческих клеток для регенеративной медицины, тканевой инженерии и генной терапии. Важные методы, такие как микроманипуляция и наноманипуляция (оптические микропинцеты) для анализа единичных клеток, расчетная гидродинамика (CFD) для характеристики сдвига и смешивания, и для разрешения этих проблем были разработаны миниатюрные биореакторы.
Timothy A. Barrett et al. in Biotechnology and Bioengineering, Vol. 105, No. 2, pages 260-275, сообщают об эксперименте в формате встряхиваемых микропланшетов, предлагая потенциальную технологическую платформу для быстрой оценки и оптимизации состояния клеточной культуры. Описано подробное определение технических характеристик переноса массы смешиваемой жидкости и газо-жидкостной массы в системы микролунок и их влияние на суспензионные клеточные культуры.
При условии, что кинетика клеточного роста и продуцирования антител сравнима с теми, что обнаружены в системах для встряхивания флаконов, использующихся в настоящее время, тогда микролуночный способ предлагает возможность получения ранних данных по разработке технологического процесса более эффективным по затратам способом и с меньшей потребностью в материалах. В данной работе подробно описано определение технических характеристик переноса массы смешиваемой жидкости и газо-жидкостной массы в системы микролунок и их влияние на суспензионные клеточные культуры. Для роста мышиных гибридомных клеток, продуцирующих IgGl, 24-луночные планшеты характеризовали по показателю диссипации энергии (P/V) (посредством Расчетной гидродинамики, CFD), потока жидкости, скорости смешивания и скорости переноса кислорода в виде функции от частоты встряхивания и объема, наполненного жидкостью. Предсказанные значения kLa варьировались между 1,3 и 29 ч-1; время смешивания жидкой фазы, которое оценивали количественно с использованием эксперимента изменения цвета йода, варьировалось от 1,7 с до 3,5 ч; в то время как предсказанные значения PlV находились в интервале от 5 до 35 Вт/м-3. CFD-стимулирования гидродинамических усилий, предсказанных на основе скорости сдвига, не губительны для клеток. Однако для гибридомных культур было показано, что высокие скорости встряхивания (>250 об./мин) имеют отрицательное влияние на клеточный рост, в то время как комбинация низкой скорости встряхивания и большого объема наполнения лунки (120 об./мин; 2000 мкл) приводит в результате к условиям ограничения по кислороду. На основе этих открытий было сделано первое техническое сравнение кинетики клеточной культуры в микролунке, а также формат встряхиваемой колбы при дублированных средних скоростях диссипации энергии. Было обнаружено, что кинетика клеточного роста и титр антитела были похожи для 24-луночных микропланшетов и для 250-мл встряхиваемых колб. В целом данная работа продемонстрировала, что клеточная культура, которую получили на встряхиваемых микропланшетах, может предоставить данные, которые являются одновременно воспроизводимыми и сравнимыми с используемыми в настоящее время системами встряхиваемых колб, предлагая при этом, по меньшей мере, 30-кратное уменьшение масштаба операции и потребности в материалах. Вместе с автоматизацией процесса это обеспечивает путь к оценке высокой пропускной способности надежных клеточных линий в реальных условиях суспензионной клеточной культуры.
William G. Whitford and John S. Cadwell in BioProcess International 2009, Vol. 7, No. 9, pages 54-64, сообщают о повышенном интересе к биореакторам с системой полых волокон.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является предложение способа повышения продуктивности, в частности, клеточно-специфичной продуктивности рекомбинантного фактора VIII (rFVIII), в частности человеческого rFVIII, продуцируемого в суспензионной культуре эукариотических клеток в процессе культивироания указанной суспензионной культуры эукариотических клеток в культуральной среде, содержащей не более чем 500 мкМ CaCl2, по меньшей мере, один неионный детергент и другие питательные компоненты, необходимые для роста клеток и продуцирования rFVIII, причем указанный способ отличается тем, что суспензионная культура культивируется при условиях сдвигового усилия, производимого с помощью механических воздействий по отношению к суспензионной культуре эукариотических клеток. Сдвиговое усилие достигается путем приложения на входе удельной мощности более чем 3 Вт/м3 по отношению к суспензионной клеточной культуре. Условия, индуцирующие сдвиговое усилие, представляют собой события, которые индуцируют механические движения клеточной суспензии или клеток в суспензии. Как правило, сдвиговое усилие применяется непосредственно к культивируемым клеткам. Механические воздействия, в частности, представляют собой такие воздействия, которые способны перемешивать клеточную суспензию.
Хотя эффекты по настоящему изобретению изучали на клетках HEK293, эти клетки представляют собой типичные человеческие клетки, и специалисту в данной области известно, что результаты, полученные для клеток HEK293, также будут достигнуты с другими клетками человеческих клеточных линий.
Входная мощность (удельная мощность, которая эквивалентна степени диссипации энергии, ε), прилагаемая с помощью механического воздействия, рассчитывается согласно следующей формуле: ε=Np·n3·di5)/V, где Np представляет собой количество турбулентных мощностей для лопастной мешалки, n представляет собой скорость перемешивания, измеренную как количество поворотов турбинной мешалки в секунду, di представляет собой диаметр лопастной мешалки, измеренный в метрах, и V представляет собой объем культуры в кубических метрах. Мощность, прилагаемая к клеточной суспензии для введения сдвигового усилия, не должна превышать значения, при котором клетки разрушаются, как правило, не должно превышаться максимальное значение, соответствующее 2000 Вт/м3. В частности, удельная мощность, прилагаемая к клеточной суспензии для введения сдвигового усилия, находится в интервале от 3 Вт/м3 до 2000 Вт/м3, предпочтительно 15 Вт/м3 - 1500 Вт/м3, более предпочтительно 30 Вт/м3 - 1250 Вт/м3, еще более предпочтительно 50 Вт/м3 - 1000 Вт/м3.
В одном воплощении изобретения, мощность вводится путем механического движения клеточной суспензии. В следующем воплощении изобретения механическое движение клеточной суспензии осуществляется посредством прокачивания клеточной суспензии через тангенциальную фильтрационную мембрану, такую как половолоконная мембрана, или механическое движение клеточной суспензии осуществляется посредством вращательного элемента, такого как мешалка, пропеллерная или лопастная.
В частности, rFVIII представляет собой rFVIII с делетированным В-доменом, в частности человеческий rFVIII с делетированным В-доменом.
Еще в одном воплощении изобретения, эукариотические клетки представляют собой клетки HEK293. В частности, молекула rFVIII продуцируется и аккумулируется на поверхности клеток HEK293. Для выделения rFVIII могут преимущественно применяться условия для высвобождения rFVIII с клеточных поверхностей, например, путем повышения ионной силы среды, окружающей клетки, или с помощью других средств для ослабления сил притяжения rFVIII и поверхности клеток HEK293.
Еще в одном воплощении изобретения неионные детергенты выбирают из Pluronic-F68, Tween 20 и Tween 80. Как правило, неионные детергенты имеют концентрацию 0,00001-1 масс.%, в частности 0,0001-0,1 масс.%, наиболее подходящими являются 0,001-0,01 масс.%.
В другом воплощении способа по изобретению низкая концентрация CaCl2 в культуральной среде регулируется для контроля агрегации клеток, например для минимизации клеточной агрегации.
Согласно изобретению мощность может вводиться в процесс культивирования клеток посредством механического движения клеточной суспензии. Механическое движение клеточной суспензии может, например, осуществляться посредством мешалки или с помощью соответствующего механического аналога, такого как встряхивающее устройство.
В конкретном воплощении изобретения входная удельная мощность, например, с механическим происхождением движения клеточной суспензии, инициируется с помощью культуральной емкости, оборудованной лопастной мешалкой, или культуральной емкостью, такой как, например, "disposable wave®" без лопастной мешалки, или аналогично вместо движения емкости в гравитации (например, с использованием вибрационной машины), таким образом индуцирующим сдвиговое усилие в указанной клеточной суспензии, или сдвиговое усилие в емкости с клеточной суспензией индуцируется посредством прокачивания клеточной суспензии через статический миксер или фильтровальное устройство.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
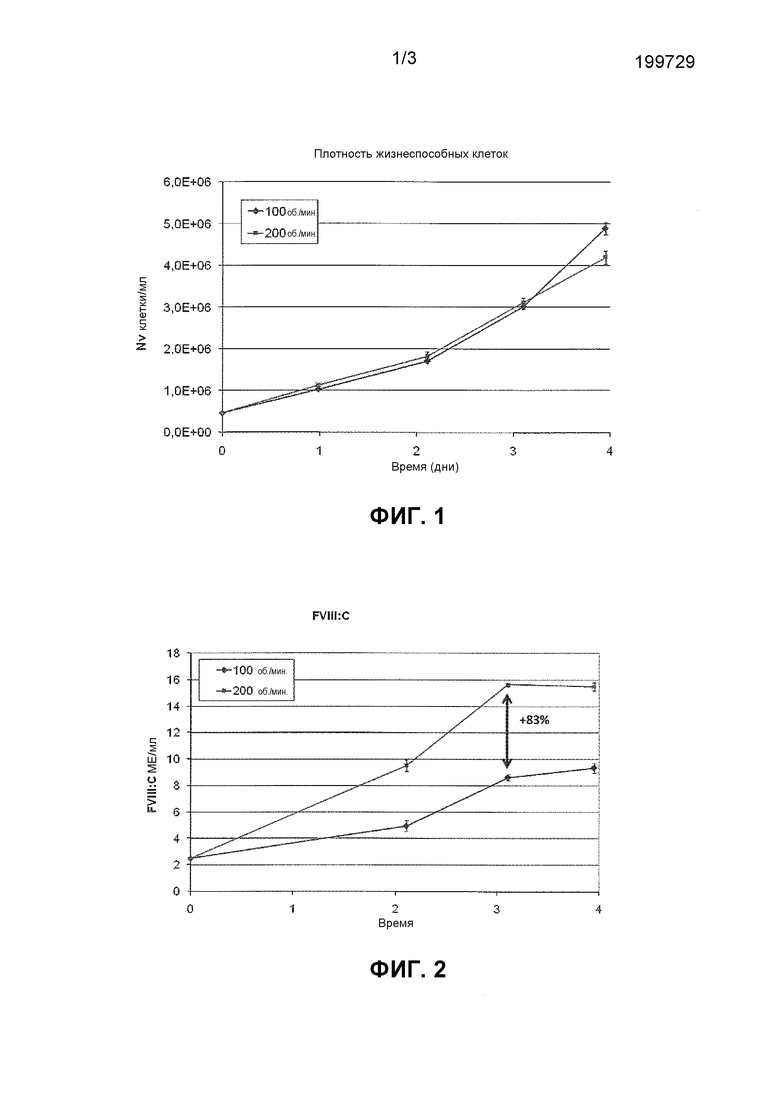
Фигура 1: Профили плотности жизнеспособных клеток.
Фигура 2: Аккумулированный FVIII:C профили.
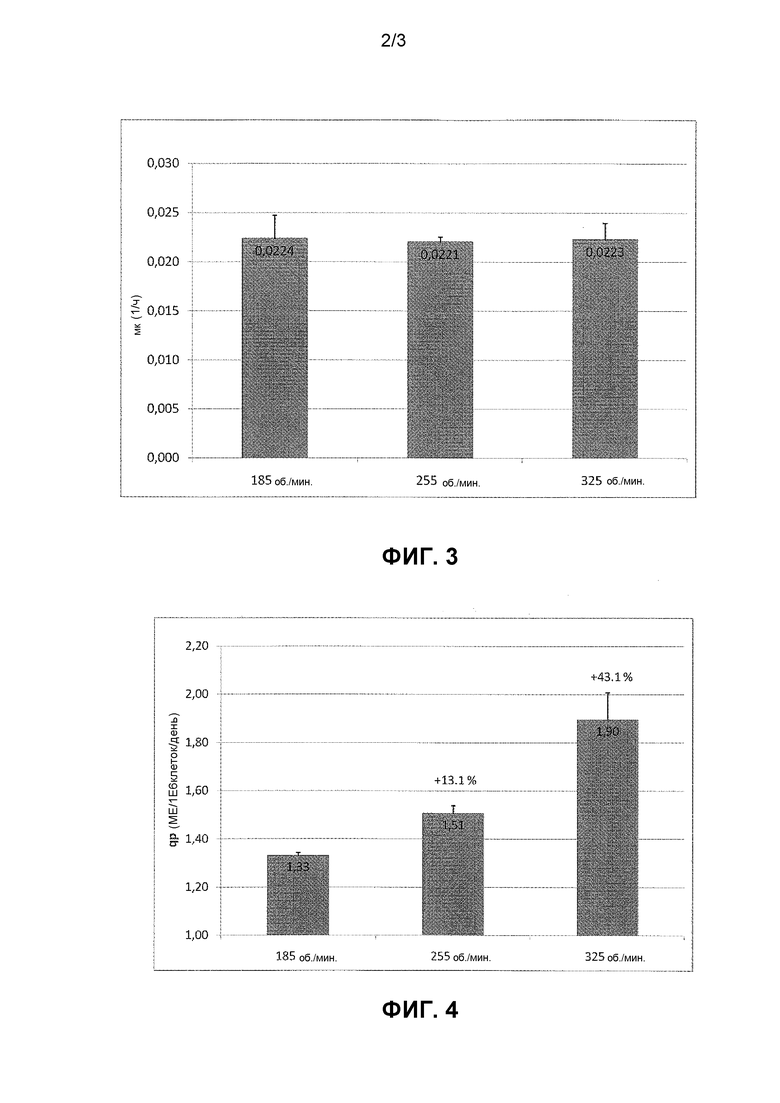
Фигура 3: Скорость клеточно-специфичного роста.
Фигура 4: Клеточно-специфичная продуктивность в непрерывной культуре при различных скоростях перемешивания.
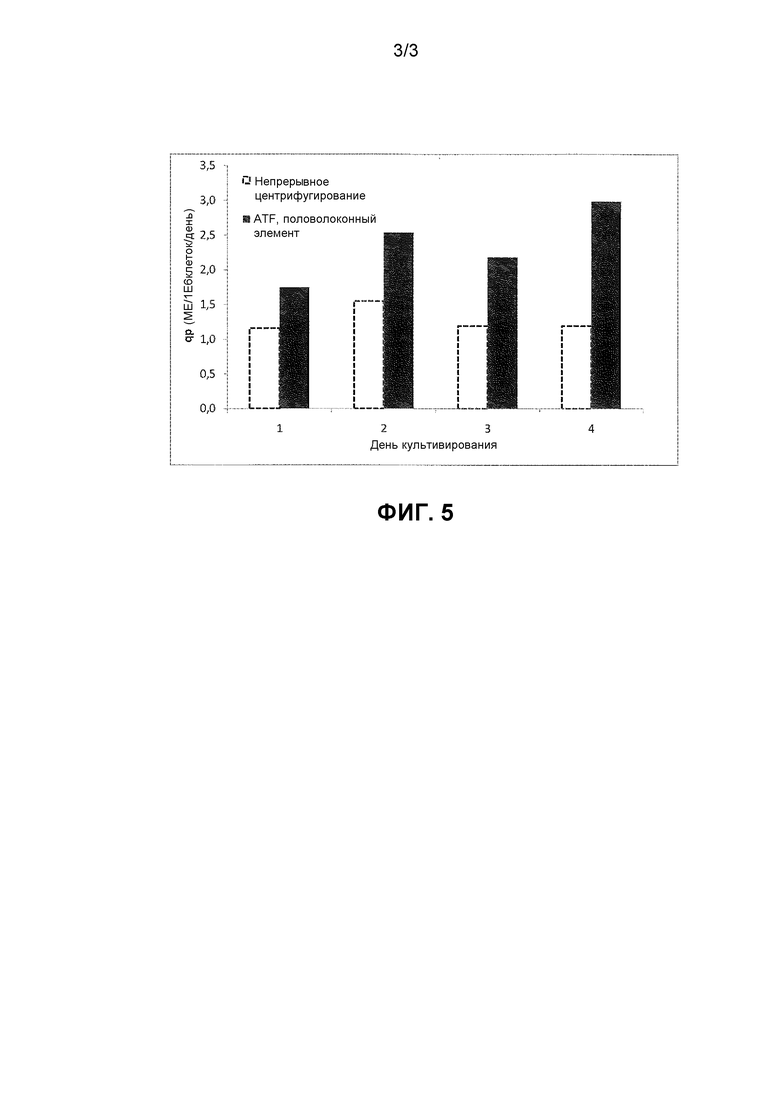
Фигура 5: Клеточно-специфичная продуктивность в непрерывной культуре по сравнению с непрерывным центрифугированием с использованием половолоконного устройства ATF.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В способе по изобретению более высокая механическая энергия с помощью введения более высокой мощности применяется к культуральному флакону, содержащему суспензионную культуру эукариотических клеток, которые растут и продуцируют rFVIII, по сравнению со стандартными способами. Количество мощности может определяться по показателю диссипации энергии, хотя и другие параметры могут коррелировать с входной мощностью. Изобретение основано на результате получения необычно высокой продуктивности FVIII, когда клетки перемешиваются с высокой скоростью перемешивания во встряхиваемой колбе или в биореакторе с механическим перемешиванием.
Согласно изобретению может использоваться любая эукариотическая клетка или клеточная линия, в частности, эукариотические клетки представляют собой клетки HEK293. Клетки, полученные с использованием генетических манипуляций, продуцируют rFVIII, в частности rFVIII с делетированным В-доменом, как, например, раскрыто в WO-A-2001/070968 и WO-A-2007/003582.
Комбинация получения молекулы rFVIII в клетках HEK293 представляет собой конкретное воплощение способа по изобретению и объясняется далее в примерах, представленных ниже.
В способе по изобретению было показано, что молекула rFVIII, продуцируемая в клетках HEK293, ассоциирована с клетками и прикрепляется к клеточной поверхности после продуцирования внутри клетки, как дополнительно описано в WO-A-2006/103258, Kohlind 2010 (Kohlind et al., The B-domain of Factor VIII reduces cell membrane attachment to host cells under serum free conditions. Journal of Biotechnology, 147 (2010), 198-204) и в Kohlind 2011 (Kohlind et al., Optimisation of the Factor VIII yield in mammalian cell cultures by reducing the membrane bound fraction. Journal of Biotechnology, 151 (2011), 357-362).
В способе по изобретению культуральная среда для роста клеток и продуцирования rFVIII содержит неионные детергенты. Как правило, полиоксиэтиленовое производное сорбитан монолаурата, такое как Tween®, которое относится к семейству множества продуктов, отличающихся длиной полиоксиэтиленовой цепи и эфирным компонентом жирной кислоты. Другие применяемые неионные детергенты представляют собой Полоксамеры, которые являются неионными три-блок-сополимерами, состоящими из центральной гидрофобной цепи полиоксипропилена (поли(пропиленоксид)), фланкированной двумя гидрофильными цепями полиоксиэтилена (поли(этиленоксид)). Полоксамеры известны под торговым названием Pluronics®. Неионные детергенты могут быть выбраны из Pluronic-F68, Tween 20 и Tween 80, в частности, в концентрации 0,00001-1 масс.%, или 0,0001-0,1 масс.%, или 0,001-0,01 масс.%.
Далее описан способ по изобретению более подробно. Клетки культивировали с различной частотой встряхивания в 125 мл перемешиваемых E-колбах. В то время как профили клеточного роста были похожи в культурах со слабым и с сильным перемешиванием (Фигура 1), аккумулированная продуктивность неожиданно оказалась на 83% выше в культурах с более сильным перемешиванием через 3 дня периодического культивирования (Фигура 2).
Другое воплощение изобретения осуществляли в периодических культурах в параллельных контролируемых биореакторах с механическим перемешиванием. Культура, которая экспонировалась с более сильным механическим усилием, демонстрировала более высокую продуктивность по сравнению с культурами с низким перемешиванием. Это показало, что в то время как другие параметры культуры, такие как pH, DOT (давление растворенного кислорода) и температура поддерживали постоянными, при этом более сильное перемешивание вызывало повышенную продуктивность.
Еще в одном воплощении изобретение экспериментально проверяли в перфузионной культуре в 2 л биореакторе с механическим перемешиванием. Культуру получили в установившемся режиме перфузионным способом с экспоненциально растущими клетками, которые поддерживали при целевой плотности путем отвода клеток из биореактора со скоростью, которая поддерживала клеточную плотность в реакторе постоянной. В то время как другие параметры культуры поддерживали постоянными, более высокая скорость перемешивания повышала клеточно-специфичную продуктивность.
Еще в одном воплощении изобретения изобретение проверяли экспериментально в биореакторе с масштабом производства 100 л, культуру, полученную перфузионным способом для достижения более высоких клеточных плотностей. Эксперимент подтвердил, что повышенная продуктивность также может быть достигнута в крупномасштабных культурах путем повышения сдвиговых усилий и входной энергии путем усиления перемешивания.
Еще в одном воплощении изобретения изобретение проверяли экспериментально в 2 л биореакторе с механическим перемешиванием, осуществлением перфузионного способа либо с использованием непрерывного центрифугирования, либо половолоконного элемента с изменением тангенциального потока (ATF). Неожиданно было показано, что повышенное сдвиговое усилие, которое прилагали к культуре с помощью элемента ATF, также повышало продуктивность FVIII.
ПРИМЕРЫ
Пример 1
Экспоненциально растущие клетки HEK293F, продуцирующие BDDrFVIII, центрифугировали, и клеточный осадок ресупендировали в бессывороточной культуральной среде до жизнеспособной клеточной плотности 0,5×106 клеток/мл. Клетки затем культивировали в 125 мл перемешиваемых колбах Эрленмейера при 100 об./мин или при 200 об./мин в шейкерных инкубаторах при 5%/95% CO2/слой воздуха при 37°C. Клеточную плотность измеряли во всех культурах каждый день с помощью метода исключения с использованием трипанового синего на автоматизированном счетчике клеток Cedex (Innovatis). Аккумулированный FVIII высвобождался из клеток с помощью повышения ионной концентрации в клеточной суспензии до 1 M NaCl + 30 мМ CaCl2. Клетки удаляли путем центрифугирования, и FVIII определяли с помощью метода с использованием хромогенного субстрата (Coatest®SP FVIII). Профили роста были похожи (Фигура 1), в то время как культуры с сильным перемешиванием демонстрировали на 83% большее аккумулирование FVIII:C концентрация через три дня периодического культивирования (Фигура 2).
Пример 2
Клетки HEK293F, продуцирующие BDDrFVIII, культивировали параллельно периодическим способом при различных скоростях перемешивания на оборудовании с использованием шести 0,4 л биореакторов (Multifors, Infors). Целью было проверить, как скорость перемешивания влияет на продуктивность в контролируемой среде, где другие параметры клеточной культуры поддерживаются постоянными. Для возможности проверки высокой скорости перемешивания (>300 об./мин), моторы биореактора с электрической мешалкой, обычно используемые для применений к клеточным культурам, меняли на более мощные моторы для мешалок, обычно используемые для применений к бактериальным культурам, которые могут работать при оборотах до 1200 об./мин. Заданное значение давления растворенного кислорода (DOT) устанавливали на 90% и регулировали путем добавления воздуха из аэратора в клеточной суспензии. Плотность жизнеспособных клеток, жизнеспособность и степень агрегации измеряли с помощью счетчика клеток Cedex (Innovatis). Аккумулированный FVIII высвобождался из клеток с помощью повышения ионной концентрации в клеточной суспензии до 1 M NaCl + 30 мМ CaCl2. Клетки удаляли путем центрифугирования, и FVIII определяли с помощью метода с использованием хромогенного субстрата (Coatest®SP FVIII). В таблице 1 представлены проверенные скорости перемешивания, диссипация энергии, которая является эквивалентным термином удельной мощности, при использовании в данном документе скорость (ε) и клеточно-специфичная продуктивность (qp). Повышенная скорость перемешивания от 200 до 950 об./мин демонстрировала повышенную клеточно-специфичную продуктивность. Повышение продуктивности нивелировалось выше 950 об./мин более низким qp при 1200 об./мин по сравнению с 950 об./мин.
[об./мин]
[М.Е./1E6 клеток/в день]
Пример 3
Клетки HEK293F, продуцирующие BDDrFVIII, культивировали в непрерывной перфузионной культуре с установившимся режимом в 2 л биореакторе с механическим перемешиванием. Биореактор использует 90 мм лопастную мешалку с наклоном для достижения перемешивания. Замену среды осуществляли путем использования половолоконного фильтра, который также создавал сдвиг по отношению к клеточной суспензии. Все параметры клеточной культуры за исключением скорости перемешивания поддерживали постоянными на протяжении эксперимента. Плотность жизнеспособных клеток, жизнеспособность и степень агрегации измеряли с помощью счетчика клеток Cedex (Innovatis). Аккумулированный FVIII высвобождался из клеток с помощью повышения ионной концентрации в клеточной суспензии до 1 M NaCl + 30 мМ CaCl2. Клетки удаляли путем центрифугирования, и FVIII определяли с помощью метода с использованием хромогенного субстрата (Coatest®SP FVIII). Проверяемые скорости перемешивания составили 185; 255 и 325 об./мин, которые придавали культуре мощность 113, 210 и 610 Вт/м3, соответственно. Скорость перемешивания не влияла на клеточно-специфичную скорость роста (Фигура 3). Однако повышенная скорость перемешивания повышала клеточно-специфичную продуктивность (Фигура 4).
Пример 4
Клетки HEK293F, продуцирующие BDDrFVIII, культивировали в 15 различных биореакторах с механическим перемешиванием с масштабом производства 100 л, два из которых использовали низкую скорость диссипации энергии (6 Вт/м3) в качестве контроля, и 13 с высокой скоростью диссипации энергии (29 Вт/м3) для исследования эффекта повышенных сдвиговых усилий. Среднее значение клеточной плотности составило 29,2 106 клеток/мл в двух партиях с низкой энергией, и 27,6 106 клеток/мл в 13 партиях с высокой энергией. Биореактор использует 225 мм лопастную мешалку с наклоном для достижения перемешивания. Замену среды осуществляли путем использования непрерывного центрифугирования. Плотность жизнеспособных клеток и жизнеспособность измеряли с помощью счетчика клеток Cedex (Innovatis). Аккумулированный FVIII высвобождался из клеток с помощью повышения ионной концентрации в клеточной суспензии до 0,3 M NaCl + 30 мМ CaCl2. Клетки удаляли путем центрифугирования, и FVIII определяли с помощью метода с использованием хромогенного субстрата (Coatest®SP FVIII). Проверяемые скорости перемешивания составили 45 и 75 об./мин, которые придавали культуре мощности 6 и 29 Вт/м3 соответственно. Эксперимент показал, что повышение входной энергии (скорость диссипации энергии, ε) по отношению к культуре путем повышения скорости перемешивания повышало продуктивность (Таблица 2). В заключение также оказалось возможным достижение повышения продуктивности путем повышения сдвиговых усилий в культурах крупномасштабного производства таким же образом, как наблюдали для культур мелкомасштабного производства.
Среднее значение[МЕ/мл]
Пример 5
Клетки HEK293F, продуцирующие BDDrFVIII, культивировали перфузионным способом в 2 л биореакторах с механическим перемешиванием, которые перемешивали постоянно при 185 об./мин с использованием 90 мм лопастной мешалки с наклоном 45°. Обычный режим операций для биореактора использовали с применением непрерывного центрифугирования для осуществления замены среды путем перфузии. Для сравнения половолоконный элемент использовали для достижения перфузии с помощью замены среды. Половолоконный элемент работал при изменении тангенциального потока, что означает, что клетки прокачивали внутрь и обратно из мембраны фильтра, что непрерывно придавало сдвиговые усилия клеточной культуре. Другие параметры клеточной культуры, такие как скорость перемешивания, pH, давление растворенного кислорода и температура, поддерживали постоянными при одних и тех же значениях в обеих культурах. Неожиданно было обнаружено, что если сдвиговые усилия повышаются с повышением входной энергии по отношению к культуре с помощью использования половолоконной мембраны для достижения сдвиговых усилий, то степень клеточно-специфичного продуцирования FVIII может значительно повыситься (Фигура 5). Аккумулированный FVIII высвобождался из клеток с помощью повышения ионной концентрации в клеточной суспензии до 0,3 M NaCl + 30 мМ CaCl2. Клетки удаляли путем центрифугирования, и FVIII определяли с помощью метода с использованием хромогенного субстрата (Coatest®SP FVIII).
Изобретение относится к области биохимии. Предложен способ повышения клеточно-специфичной продуктивности рекомбинантного фактора VIII (rFVIII), продуцируемого в суспензионной культуре клеток млекопитающих в процессе культивирования указанной суспензионной культуры клеток млекопитающих в культуральной среде. Способ включает культивирование клеточной суспензии при индуцировании механического сдвигового усилия на суспензионную культуру клеток млекопитающих путем приложения к ним удельной мощности 3 Вт/м3. Культуральная среда содержит не более чем 500 мкМ CaCl2, неионный детергент. Изобретение обеспечивает повышение выхода белка, продуцируемого культивирующимися клетками. 13 з.п. ф-лы, 5 ил., 2 табл., 4 пр.
1. Способ повышения клеточно-специфичной продуктивности рекомбинантного фактора VIII (rFVIII), продуцируемого в суспензионной культуре клеток млекопитающих в процессе культивирования указанной суспензионной культуры клеток млекопитающих в культуральной среде, содержащей не более чем 500 мкМ CaCl2, по меньшей мере один неионный детергент, причем способ отличается тем, что указанная клеточная суспензия культивируется при индуцировании механического сдвигового усилия на суспензионную культуру клеток млекопитающих путем приложения к ним удельной мощности, составляющей по меньшей мере 3 Вт/м3.
2. Способ по п. 1, где удельная мощность вводится в клеточную культуральную среду посредством механического движения клеточной суспензии.
3. Способ по п. 2, где механическое движение клеточной суспензии осуществляется посредством прокачивания клеточной суспензии через мембрану тангенциального фильтра.
4. Способ по п. 3, где мембрана тангенциального фильтра представляет собой половолоконную мембрану.
5. Способ по п. 2, где механическое движение клеточной суспензии осуществляется посредством вращающего элемента, такого как мешалка, пропеллерная мешалка или лопастная мешалка.
6. Способ по п. 1, где rFVIII представляет собой rFVIII с делетированным В-доменом.
7. Способ по п. 1, где клетки млекопитающих представляют собой клетки HEK293.
8. Способ по п. 1, где молекула rFVIII продуцируется в клетках HEK293 и ассоциирована с ними.
9. Способ по п. 1, где неионные детергенты выбирают из Pluronic-F68, Tween 20 и Tween 80.
10. Способ по пп. 1 и 9, где неионные детергенты имеют концентрацию 0,00001-1 мас.%, в частности 0,0001-0,1 мас.%, наиболее подходящая концентрация 0,001-0,01 мас.%.
11. Способ по п. 1, где агрегация клеток минимизирована посредством поддержания низкой концентрации CaCl2 в культуральной среде и путем повышения переноса CaCl2 из окружающей среды в клетки посредством увеличения сдвига.
12. Способ по пп. 2-9, 11, где механическое движение клеточной суспензии инициируется в культуральной емкости, оборудованной лопастной мешалкой, или в культуральной емкости с гравитационным движением, индуцирующим сдвиговое усилие в указанной клеточной суспензии, или сдвиговое усилие в посуде с клеточной суспензией индуцируется посредством прокачивания клеточной суспензии через статический миксер или фильтровальное устройство.
13. Способ по пп. 1, 2, где удельная мощность, прилагаемая к клеточной суспензии для введения сдвигового усилия, составляет максимум 2000 Вт/м3.
14. Способ по п. 13, где удельная мощность, прилагаемая к клеточной суспензии для введения сдвигового усилия, составляет от 3 до 2000 Вт/м3.
| CHUN B | |||
| AND ET AL., Enhanced production of recombinant B-domain deleted factor VIII from Chinese hamster ovary cells by propionic and butyric acids // Biotechnology Letters, 2003, 25, стр.315-;319 | |||
| WO 2006103258 A1, 05.10.2006 | |||
| WO 2008006494 A1, 19.01.2009 | |||
| WO 2007003582 A2, 11.01.2007 | |||
| СПОСОБ ПОЛУЧЕНИЯ И ВЫДЕЛЕНИЯ БЕЛКА, ОБЛАДАЮЩЕГО АКТИВНОСТЬЮ ФАКТОРА VIII, ЛИНИЯ КЛЕТОК НКВ, ЭКСПРЕССИРУЮЩАЯ БЕЛОК, ОБЛАДАЮЩИЙ АКТИВНОСТЬЮ ФАКТОРА VIII (ВАРИАНТЫ) | 1999 |
|
RU2249041C2 |
Авторы
Даты
2016-10-27—Публикация
2012-05-14—Подача