Область техники, к которой относится изобретение
[0001]
Настоящее изобретение относится к способу получения клеток путем культивирования клеток, взятых из ткани кожи человека, для лечения спинномозговых травм. Настоящее изобретение также относится к способу изготовления лекарственного средства, содержащего клетки, полученные с использованием вышеуказанного способа, питательную среду или продукты секреции клеток, такие как экзосомы, для лечения спинномозговых травм.
Предпосылки к созданию изобретения
[0002]
Спинномозговая травма представляет собой патологию, связанную с повреждениями спинного мозга, главным образом возникающими в результате повреждений позвоночника, обусловленных воздействием внешней чрезмерно большой силы на позвоночник. Аналогичные повреждения могут быть вызваны внутренними факторами, такими как опухоль спинного мозга, межпозвоночная грыжа или спондилотическая цервикальная миелопатия. В Японии, по оценкам, количество пациентов, страдающих от спинномозговых травм, составляет 100000. В большинстве случаев спинномозговые травмы вызваны внешними травмами, связанными с дорожно-транспортными происшествиями и падениями с высоты.
[0003]
В отличие от периферических нервов центральная нервная система, включая спинной мозг, не восстанавливается и не регенерируется после полученного повреждения. Таким образом, регенерация поврежденного спинного мозга и восстановление его функций являются неудержимым стремлением пациентов со спинномозговыми травмами, для лечения которых проводятся исследования различного характера.
[0004]
В настоящее время в Соединенных Штатах Америки существует практика введения большого количества стероидов, при этом введение препарата осуществляется в течение 48-72 часов непосредственно после получения травмы. Например, исследователями Кансайского медицинского университета (Япония) были предприняты попытки вводить инъекционно культивированную жидкость собственного костного мозга пациента в спинной мозг, в то время как исследователи научно-исследовательской группы университета Кейо (Япония) экспериментировали с введением фактора роста гепатоцитов (HFG) в течение 78 часов после получения субъектом спинномозговой травмы.
[0005]
В хронической фазе проводилась реабилитация спинного мозга. Однако, реабилитация после лечения спинномозговых травм не предусматривает восстановление утерянных функций. Ввиду того, что не происходит регенерация нервов, такое восстановление функций является невозможным. Цель реабилитации заключается в «использовании оставшихся функций с целью обеспечения выполнения элементарных действий по самообслуживанию». Кроме того, в хронической фазе возникают такие осложнения, как пролежни, инфекция мочевыводящих путей, в результате чего чрезвычайно затрудняется уход за пациентом.
[0006]
Клинические испытания по регенерации нервов с использованием стволовых клеток костного мозга или по регенерации нервной ткани рассматриваются как дающие наиболее обнадеживающие результаты по созданию метода лечения даже при хронической фазе. Сообщалось о достижении частичной эффективности при проведении экспериментов над животными; однако, указанные эксперименты находятся в настоящее время на стадии доклинических исследований по применению методов для лечения человека в качестве эффективной терапии, и необходимо прилагать энергичные усилия по интенсификации исследований в этом направлении. В настоящее время главным образом ведутся исследования по использованию индуцированных плюрипотентных стволовых клеток и эмбриональных стволовых клеток, однако существуют многочисленные проблемы, требующие своего решения. Например, использование индуцированных плюрипотентных стволовых клеток (iPS) рассматривается как позволяющее избежать иммунных реакций, но при этом была отмечена вероятность развития канцерогенеза. Кроме реакции иммунного отторжения и канцерогенеза были отмечены этические проблемы использования эмбриональных стволовых клеток.
[0007]
Несмотря на вышеизложенное, в 2010 году были опубликованы результаты проведенного в Японии исследования, при этом в публикации сообщалось, что в спинном мозге животного со спинномозговой травмой была сформирована опухоль путем применения индуцированных плюрипотентных стволовых клеток, полученных путем введения генов, что позволило решить проблемы этического характера и иммунного отторжения (Непатентный документ 1).
[0008]
По данным 2005 года в Столичном медицинском университете в Пекине (Китай) было проведено единственное клиническое лечение по регенерации спинного мозга путем инъекционного введения обонятельных клеток слизистой оболочки носа (OEG - обкладочная нейроэпителиальная клетка). Однако из университета не поступало какой-либо информации относительно проверки и подтверждения эффекта проведенного лечения в течение длительного периода времени, которые могли бы убедить мировое научное сообщество в его результативности, и проблемы, связанные с острой болью, источником обкладочной нейроэпителиальной клетки (взята из абортированного плода) и аллотрансплантацией до сих пор остаются нерешенными. В 2014 году в Японии были опубликованы результаты клинических исследований в области трансплантации собственной слизистой оболочки носа субъекта, тем не менее эти результаты не указывали на достижение существенного эффекта лечения (случай восстановления ходьбы).
[0009]
В октябре 2010 года компания «Geron Со.», Соединенные Штаты Америки, приступила к проведению клинических исследований, используя эмбриональные стволовые клетки для лечения 4-х пациентов со спинномозговыми травмами, но в ноябре 2011 года объявила об их прекращении. Хотя причины неизвестны, вполне вероятно, что клинический эффект был слабо выраженным, наблюдалась реакция иммунного отторжения, либо в спинном мозге образовывалась тератома. В 2017 году на конференции Японского научного общества регенеративной медицины, проводимой в Киото, Масая Накамура, клинический адъюнкт-профессор университета Кейо, и исследователи его группы заявили о своем плане приступить к клиническим исследованиям в области использования индуцированных плюрипотентных стволовых клеток (iPS) для лечения пациентов со спинномозговыми травмами. Субъектами исследования являлись пациенты, получившие спинномозговую травму 2-4 недели назад и имевшие поврежденные участки позвоночника, на которых воспалительный процесс стал затихать, но еще не произошло отверждение участка. Пациенты в хронической фазе не являлись субъектами исследования.
[0010]
Таким образом, лечение спинномозговых травм стволовыми клетками привлекает внимание исследователей, однако на рынке медпрепаратов в Соединенных Штатах Америки имеется лишь одно регенеративное лекарственное средство и лишь одно в ЕС в качестве лекарственного препарата для передовой терапии. В настоящее время отсутствует лекарственное средство, разрешенное для применения в регенеративной медицине для лечения спинномозговых травм.
[0011]
На практике сложно побудить мезенхимальные стволовые клетки кожи человека дифференцироваться в нервные клетки после трансплантации, кроме того, высока вероятность того, что указанные клетки дифференцируются в хондроциты или остеоциты. Проблема при использовании нейральных стволовых клеток из тканей головного мозга заключается в их низкой эффективности лечения (Непатентный документ 13).
[0012]
В свою очередь сообщалось, что кожные клетки-предшественницы являются более эффективными для лечения спинномозговых травм, чем нейральные стволовые клетки (Непатентный документ 14).
[0013]
Недавно Inoue и Kumagaya сообщили о том, что эпидермальные кератиноциты человека являются эффективными для лечения спинномозговых травм (Непатентный документ 2).
[0014]
Однако в настоящее время отсутствует способ идентификации маркера, отражающего терапевтическое воздействие на спинной мозг, и способ культивирования клеток, экспрессирующих маркер.
[0015]
Как и цитокин, в свою очередь, глиальный нейротрофический фактор (GDNF) со всей очевидностью продемонстрировал свой терапевтический эффект при лечении спинномозговых травм (Непатентные документы 4-8).
[0016]
Таким образом, были предприняты попытки создания лечебного лекарственного препарата, характеризующегося повышенным терапевтическим воздействием на спинномозговую травму с целью введения гена глиального нейротрофического фактора в клетки, что, как предполагалось, позволит достичь терапевтического эффекта (Непатентные документы 8-10). В качестве клеток, в которые введен ген, были использованы обкладочные нейроэпителиальные клетки и Шванновские клетки. Указанные клетки оказывали терапевтический эффект, который в дальнейшем имелась возможность повысить.
[0017]
Тем не менее, недостатком указанного способа является высокий риск развития рака при трансплантации клеток в живой орган ввиду использования вирусного вектора для доставки гена в клетки.
[0018]
В противоположность этому белок глиального нейротрофического фактора, как таковой, является нестабильным и трудоемким при обработке (Непатентный документ 15).
[0019]
При этом сообщалось, что GDNF (ГНФ) является эндогенным фактором, необходимым для восстановления после спинномозговых травм (Непатентный документ 16).
[0020]
Также сообщалось, что GDNF (ГНФ) является эффективным для подавления аллодинии, состояния, при котором пациенты со спинномозговыми травмами страдают от боли (Непатентные документы 17 и 18).
[0021]
Для пациентов в хронической фазе предназначен большой объем терапии спинномозговых травм, и, таким образом, способ лечения, также являющийся эффективным в хронической фазе, является наиболее целесообразным. К счастью, сообщается, что GDNF (ГНФ) является эффективным для лечения хронических спинномозговых травм (Непатентный документ 19).
[0022]
Таким образом, экспрессия GDNF (ГНФ) в клетках, которые предусматривается трансплантировать, позволяет достичь существенного повышения терапевтического эффекта при лечении спинномозговых травм (Непатентный документ 20).
Предшествующие документы Патентные документы
[0023]
Патентный документ 1. JP 2012-29684А
Непатентные документы
[0024]
[Non-patent Document 1] Tsuji О, et al.: Therapeutic potential of appropriately evaluated self-induced pluripotent stem cells for spinal cord injury. PNAS 2010; 107 (28), 12704-12709
[Non-patent Document 2] Inoue H, et al.: Improvement of hind-paralysis following traumatic spinal cord injury in rats by grafting normal human keratinocytes: new cell-therapy strategy for nerve regeneration. J Artif Organs. 2011; 14(4):375-80
[Non-patent Document 3] Inoue H, et al.: Improvement of hind-limb paralysis following traumatic spinal cord injury in rats by grafting normal human keratinocytes: new cell-therapy strategy for nerve regeneration. J Artif Organs. 2011; 14(4):375-80
[Non-patent Document 4] Ansorena E, et al.: Injectable alginate hydrogel loaded with GDNF promotes functional recovery in a hemisection model of spinal cord injury. Int J Pharm. 2013; 455(1-2):148-58.
[Non-patent Document 5] Tang XQ, et al.: Adenovirus-mediated delivery of GDNF ameliorates corticospinal neuronal atrophy and motor function deficits in rats with spinal cord injury.Neuroreport. 2004; 15(3):425-9.
[Non-patent Document 6] Guzen FP, et al.: Glial cell line-derived neurotrophic factor added to a sciatic nerve fragment grafted in a spinal cord gap ameliorates motor impairments in rats and increases local axonal growth. Restor Neurol Neurosci. 2009; 27(1):1-16.
[Non-patent Document 7] Kao CH, et al.: Exogenous administration of glial cell line-derived neurotrophic factor improves recovery after spinal cord injury. Resuscitation. 2008;77(3):395-400.
[Non-patent Document 8] Koelsch A, et al.: Transgene-mediated GDNF expression enhances synaptic connectivity and GABA transmission to improve functional outcome after spinal cord contusion. JNeurochem. 2010; 113(1): 143-52.
[Non-patent Document 9] Cao L, et al.: Olfactory ensheathing cells genetically modified to secrete GDNF to promote spinal cord repair. Brain. 2004 Mar; 127(Pt 3):535-49.
[Non-patent Document 10] Deng LX, et al.: A novel growth-promoting pathway formed by GDNF-overexpressing Schwann cells promotes propriospinal axonal regeneration, synapse formation, and partial recovery of function after spinal cord injury. J Neurosci. 2013 Mar 27; 33(13):5655-67.
[Non-patent Document 11] Stephen J. A. Daviees, et al.: Transplantaion of specific human astrocytes promotes functional recovery after spinal cord injury. PLoS ONE 2011; 6(3): el7328
[Non-patent Document 12] Sowa NA, et al.: Ecto-5'-nucleotidase (CD73) inhibits nociception by hydrolyzing AMP to adenosine in nociceptive circuits. J Neurosci. 2010 Feb 10; 30(6):2235-2244.
[Non-patent Document 13] Kim MS, et al.: Perspectives on Tissue-Engineered Nerve Regeneration for the Treatment of Spinal Cord Injury. Tissue Eng Part. 2014; 20(13-14): 1781-3
[Non-patent Document 14] Biemaskie J, et al.: Skin-derived precursors generate myelinating Schwann cells that promote remyelination and functional recovery after contusion spinal cord injury. J Neuroscience. 2007; 27(36):9545-9559.
[Non-patent Document 15] Zhao YZ, et al.: Thermosensitive heparin-poloxamer hydrogels enhance the effects of GDNF on neuronal circuit remodeling and neuroprotection after spinal cord injury. J Biomed Mater Res A. 2017; 5(10):2816-2829 [Non-patent Document 16] Zhou HL, et al.: Changes in Glial cell line-derived neurotrophic factor expression in the rostral and caudal stumps of the transected adult rat spinal cordNeurochem Res. 2008; 33(5):927-37
[Non-patent Document 17] Chou AK, et al.: Adenoviral-mediated glial cell line-derived neurotrophic factor gene transfer has a protective effect on sciatic nerve following constriction-induced spinal cord injury. PLoS One. 2014; 9(3): e92264
[Non-patent Document 18] Detloff MR, et al.: Acute exercise prevents the development of neuropathic pain and the sprouting of non-peptidergic (GDNF - and artemin-responsive) c-fibers after spinal cord injury. Exp Neurol. 2014; 255: 38-48.
[Non-patent Document 19] Dolbeare D, et al.: Restriction of axonal retraction and promotion of axonal regeneration by chronically injured neurons after intraspinal treatment with glial cell line-derived neurotrophic factor (GDNF). J Neurotrauma. 2003; 20(11):1251-61.
[Non-patent Document 20] Lu Y, et al.: Glial cell line-derived neurotrophic factor-transfected placenta-derived versus bone marrow-derived mesenchymal cells for treating spinal cord injury. Med Sci Monit. 2017; 23: 1800-1811
[Non-patent Document 21] Codega P, et al.: Prospective identification and purification of quiescent adult neural stem cells from their in vivo niche. Neuron. 2014; 82(3): 545-59.
[Non-patent Document 22] DeCarolis NA, et al.: In vivo contribution of nestin-and GLAST-lineage cells to adult hippocampal neurogenesis. Hippocampus. 2013; 23(8):708-719.
[Non-patent Document 23] Sufan Wu, et al.: Bone marrow stromal cells enhance differentiation of cocultured neurosphere cells and promote regeneration of injured spinal cord. J Neurosci Res. 2003; 72(3):343-51.
Краткое изложение существа изобретения Техническая задача изобретения
[0025]
Целью настоящего изобретения является создание способа культивирования клеток для надежного повышения экспрессии мРНК GDNF (ГНФ) клетки без введения гена с помощью вирусного вектора.
[0026]
Другой целью настоящего изобретения является создание способа культивирования клеток, экспрессирующих различные маркеры, такие как маркер нейральных стволовых клеток.
[0027]
Еще одной целью настоящего изобретения является создание способа изготовления лекарственного средства для лечения спинномозговых травм.
Решение задачи
[0028]
Настоящее изобретение основано на результатах экспериментальных исследований, указывающих на то, что мРНК нейротрофического фактора глиальной клеточной линии (GDNF) может быть экспрессирован на высоком уровне (например, по меньшей мере, в 10 раз превышающем уровень экспрессии нормальной культуры) путем культивирования стволовых клеток кожи человека в бессывороточной питательной среде включающей, по меньшей мере, химическое соединение SAG, пурморфамин и белок Sonic Hedgehog (SHH).
[0029]
Первый аспект настоящего изобретения относится к способу получения культивированных клеток, содержащих мРНК нейротрофического фактора глиальной клеточной линии (GDNF). Указанный способ включает этап культивирования стволовых клеток кожи человека в бессывороточной питательной среде, включающей, по меньшей мере, химическое соединение SAG, пурморфамин, и белок Sonic Hedgehog (SHH). С помощью указанного способа мРНК нейротрофического фактора глиальной клеточной линии (GDNF) экспрессируется на высоком уровне.
[0030]
Стволовые клетки кожи человека предпочтительно получают из клеток кожи пациента. В частности, забор культивируемых клеток предпочтительно осуществляют из ткани кожи, повреждение которой является незначительным и скорость регенерации которой является высокой. Ввиду того, что способы культивирования стволовых клеток общеизвестны, клетки фактически могут быть культивированы в соответствии со способом, описание которого приведено в данном документе, или в соответствии с известными способами (например, патент Японии №5409359 и патент Японии №6041270). Способ культивирования стволовых клеток кожи человека также известен и описан в вышеуказанных патентных документах.
[0031]
SAG относится к известному химическому соединению с регистрационным номером CAS №364590-63-6, имеющим следующее название:
«N-Метил-N'-(3-пиридинилбензил)-N'-(3-хлорбензо[b]тиофен-2-карбонил)-1,4-диаминоци клогексан».
[0032]
Как указано в публикации WO 2014-084085, SAG является химическим соединением, активизирующим Sonic Hedgehog (Shh). SAG 1.1 имеет следующее химическое название «К-Метил-N-(3-(4-бензонитрил)-4-метоксибензил)-N'-(3-хлорбензо[b]тиофен-2-карбонил)-1,4-диаминоциклогексан». Подробное описание SAG приведено в Sinha S, Chen JK. Nat Chem Biol. 2006 Jan; 2(1):29-30, и Chen JK, Taipale J, Young KE, Maiti T, Beachy PA. Proc Natl Acad Sci USA. 2002 Oct 29;99(22): 14071-6. Аналогичным образом, детальное описание SAG1.1 приведено в Chen, W., Ren, X.R., Nelson, C.D., Barak, L. S., Chen, J.K., Beachy, P.A., de Sauvage, F. & Lefkowitz, R.J. (2004) Science 306, (5705) 2257-2260,
[0033]
Пурморфамин является генерическим названием соединения
9-Циклогексил-N-[4-(4-морфолинил)фенил]-2-(1-нафталенилокси)-9H-пурин-6-амин. Пурморфамин является агонистом белка Smoothened, и его описание приведено в патенте Японии №6210881 и патенте Японии №5620821, согласно которым 2 мкмоль/л указанного вещества добавляли к питательной среде.
[0034]
Белок Sonic Hedgehog (SHH) является известным белком, и в соответствии с описанием в патенте Японии №4900587, например, 200-400 нг/мл белка SHH добавляют к бессывороточной питательной среде.
[0035]
Бессывороточная питательная среда
Питательная среда согласно настоящему изобретению является бессывороточной питательной средой, которая может содержать компонент известной среды. Например, в патенте Японии №4385076 и в выложенной заявке на патент Японии №2012-157263 раскрывается среда для культивирования животных клеток в бессывороточной питательной среде. Элементы, описание которых приведено в указанных известных документах, могут быть при необходимости добавлены к питательной среде в соответствии с настоящим изобретением.
[0036]
В качестве базальной среды для культивирования в настоящем изобретении может быть использована известная среда. Примеры такой базальной среды включают минимальную питательную среду (или среду Игла), среду Игла в модификации Дульбекко (зарегистрированное торговое название), MCDB153, среду  F12 (зарегистрированное торговое название), среду
F12 (зарегистрированное торговое название), среду  5А (зарегистрированное торговое название), среду 199 и жидкую среду Эрла (зарегистрированное торговое название), среду RPMI1640 (зарегистрированное торговое название), среду
5А (зарегистрированное торговое название), среду 199 и жидкую среду Эрла (зарегистрированное торговое название), среду RPMI1640 (зарегистрированное торговое название), среду  F10, среду МЕМ-α, среду DMEM/F12, MCDB131, MCDB153 и MCDB201.
F10, среду МЕМ-α, среду DMEM/F12, MCDB131, MCDB153 и MCDB201.
[0037]
Питательная среда при ее приведении в состояние равновесия в среде 5% СО2 имеет отрегулированную величину рН в диапазоне от рН 6,8 до 7,8, предпочтительно 7,2 (±0,1). Кислотность базальной среды может быть соответствующим образом отрегулирована с использованием буферного материла (например, бикарбоната натрия), либо с помощью регулятора рН, такого как хлорид водорода или гидроксид натрия.
[0038]
Питательная среда в соответствии с настоящим изобретением при необходимости может содержать различные низкомолекулярные соединения. Например, питательная среда в соответствии с настоящим изобретением предпочтительно содержит антиоксидант. Примеры антиоксиданта включают один или более компонентов, выбранных из группы, включающей Мелатонин, N-ацетил-L-цистеин, восстановленную форму глутатиона и аскорбиновую кислоту. Питательная среда в соответствии с настоящим изобретением может содержать фосфолипид (например, фосфатидилсерин, фосфатидилэтаноламин и фосфатидилхолин) и жирную кислоту (например, линолевую кислоту, олеиновую кислоту, линоленовую кислоту, арахидоновую кислоту, миристиновую кислоту, пальмитолеиновую кислоту, пальмитиновую кислоту и стеариновую кислоту). Примеры других компонентов, которые могут быть добавлены к питательной среде в соответствии с настоящим изобретением, включают трансферрин, селенат, глюкозу, D-биотин, кальциевую соль D-пантотеновой кислоты, холинхлорид, фолиевую кислоту, мио-инозитол, никотинамид, р-аминобензойную кислоту, пиридоксаль гидрохлорид, пиридоксин гидрохлорид, рибофлавин, тиамина гидрохлорид, Витамин В12, пируват натрия, тимидин, гипоксантин, селенит натрия, стрептомицин сульфат, калиевую соль пенициллина G и феноловый красный.
[0039]
В соответствии с вышеуказанным способом получения культивированных клеток, предпочтительно, чтобы бессывороточная питательная среда дополнительно содержала добавку В-27. Как показано в примерах, мРНК нестина экспрессируется на высоком уровне, если бессывороточная питательная среда содержит добавку В-27. Ген нестина является маркером нейральных стволовых клеток. Добавка В-27 является известным элементом в соответствии с описанием, приведенном, например, в патенте Японии №6185907 и патенте Японии №6137626, согласно которым ее добавляли к питательной среде.
[0040]
В соответствии с вышеуказанным способом получения культивированных клеток, предпочтительно, чтобы бессывороточная питательная среда дополнительно содержала ингибитор ROCK. В том случае, если бессывороточная питательная среда содержит ингибитор ROCK, обеспечивается стабильность стволовых клеток. Ингибитор ROCK определяется как вещество, ингибирующее киназную активность Rho-киназы, и его примеры включают Y-27632
(4-[(1R)-N-аминоэтил]-N-пиридин-4-ил-циклогексан- 1-карбоксамид или его дигидрохлорид (См., например, Ishizaki et al., Mol. Pharmacol. 57, 976-983 (2000); Narumiya et al., Methods Enzymol. 325, 273-284 (2000)), Фасудил/НА1077(1-(5-изохинолинсульфонил) гомопиперазин) или их дигидрохлорид (См., например, Uenata et al., Nature 389: 990-994 (1997)), H-1152 ((S)-(+) -2-Метил-1-[(4-метил-5-изохинолинил)сульфонил]-гексагидро-1Н-1,4-диазепин) или их дигидрохлорид (См., например, Sasaki et al., Pharmacol. Then 93: 225-232 (2002)), Wf-536 ((+) - (R)-4-(1-аминоэтил)-N-(4-пиридил)бензамид гидрохлорид (См., например, Nakajima et al., Cancer Chemother. Pharmacol. 52(4): 319-324 (2003)) и их производные, антисмысловую нуклеиновую кислоту к ROCK, нуклеиновую кислоту, индуцирующую интерференцию РНК (например, siRNA), доминантный негативный мутант и его векторы экспрессии. Как и ингибитор ROCK, известны другие низкомолекулярные соединения, и указанные соединения и их производные могут быть использованы в соответствии с настоящим изобретением (См., например, Публикацию патента США №20050209261, Публикацию патента США №20050192304, Публикацию патента США №20040014755, Публикацию патента США №20040002508, Публикацию патента США №20040002507, Публикацию патента США №20030125344, Публикацию патента США №20030087919 и WO 2003/062227, WO 2003/059913, WO 2003/062225, WO 2002/076976, WO 2004/039796). В соответствии с настоящим изобретением, по меньшей мере один ингибитор ROCK может быть использован. Ингибитор ROCK в целом используют в количестве от 100 нмоль/л до 50 мкмоль/л.
[0041]
В соответствии с вышеуказанным способом получения культивированных клеток предпочтительно, чтобы бессывороточная питательная среда дополнительно содержала эпидермальный фактор роста. Если бессывороточная питательная среда содержит эпидермальный фактор роста, то в этом случае обеспечивается постоянная стабильность нейральных стволовых клеток и экспрессия мРНК нестина на высоком уровне.
[0042]
Эпидермальный фактор роста является фактором роста, выбранным из семейства эпидермальных факторов роста. Например, в соответствии патентом Японии №6191694 эпидермальный фактор роста содержится в питательной среде в диапазоне окончательных концентраций, составляющих 0,5-200 нг/мл.
[0043]
Ген глиального фибриллярного кислого белка (GFAP) является маркером взрослых нейрональных стволовых клеток, или астроцитов, являющихся подходящими для трансплантации в зону спинномозговой травмы (Непатентная литература 1, 20, 22).
[0044]
В соответствии с вышеуказанным способом получения культивированных клеток предпочтительно, чтобы бессывороточная питательная среда дополнительно содержала фактор роста фибробластов (FGF2). Как показано в примерах, мРНК эпидермального фактора роста экспрессирована на высоком уровне, и белок CD 73 экспрессирован в том случае, если бессывороточная питательная среда содержит ингибитор ROCK. Фактор роста фибробластов 2 также обозначают как FGF-2. Например, в патенте Японии №5856029 FGF2 добавляли к питательной среде при концентрации, находящейся в пределах от 0,1 до 50 нг/мл, более предпочтительно от 1 до 10 нг/мл и наиболее предпочтительно от 5 нг/мл. CD73 (Экто-5'-нуклеотидаза) рассматривается в качестве наиболее вероятного обезболивающего средства для снятия острой боли, типичной для пациентов, страдающих от спинномозговых травм.
[0045]
В соответствии с вышеуказанным способом получения культивированных клеток бессывороточная питательная среда предпочтительно содержит ионы кальция при концентрации, находящейся в пределах от 0,03 ммоль/л до 0,12 ммоль/л. За счет поддержания концентрации кальция в указанном диапазоне обеспечивается супрессия дифференциации стволовых клеток.
[0046]
Упомянутые выше предпочтительные варианты осуществления настоящего изобретения могут соответствующим образом сочетаться друг с другом. Вышеупомянутые добавки, такие как SAG, пурморфамин, белок Sonic Hedgehog (SHH), добавка В-27, ингибитор ROCK, EGF и FGF2 могут быть добавлены к питательной среде в соответствующем количестве в зависимости от свойств добавки. Ввиду того, что, как известно, указанные вещества добавляют к питательной среде, добавляемое количество данных веществ может корректироваться в соответствии с известными документами. Например, каждую добавку можно добавлять в количестве, находящемся в диапазоне от 0,1 нг/мл до 20 мкг/мл (или от 0,2 нг/мл до 10 мкг/мл). Указанные добавки могут быть добавлены в зависимости от степени чистоты и требуемого количества.
[0047]
В соответствии с вышеуказанным способом производства культивированных клеток стволовые клетки кожи человека предпочтительно представляют собой клетки, полученные путем обработки взятых клеток кожи человека диспазой, трипсином и коллагеназой в указанном порядке. Обработка диспазой, трипсином и коллагеназой представляет собой так называемую ферментативную обработку. Ферментативная обработка может быть проведена в изотоническом солевом растворе, забуферированном до физиологически приемлемого значения рН, находящемся в диапазоне, например, приблизительно от 6 до 8, предпочтительно от 7,2 до 7,6, в таком как фосфатно-солевой буферный раствор (PBS) или сбалансированный солевой раствор Хенкса для трипсина, и в минимальной поддерживающей среде для диспазы и коллагеназы при температуре в диапазоне приблизительно от 4 до 40°С, предпочтительно приблизительно от 4 до 39°С в течение времени, достаточном для распада соединительных тканей, например, приблизительно от 1 до 1000 минут, предпочтительно от 5 до 720 минут и при достаточной концентрации фермента, например, в диапазоне приблизительно от 0,0001 до 5% вес/объем, предпочтительно от приблизительно 0,001 до 0,5% вес/объем.
[0048]
Согласно второму аспекту настоящего изобретения предложен способ изготовления лекарственного средства для лечения спинномозговых травм. Спинной мозг является органом центральной нервной системы, расположенным в позвоночном канале, проходящем по позвоночнику, и именно указанное лекарственное средство для спинномозговых травм используется для лечения спинного мозга. Согласно способу культивированные клетки получают за счет использования вышеупомянутого способа. Соответственно, способ позволяет получить лекарственное средство для лечения спинномозговых травм (которое в дальнейшем может называться средством настоящего изобретения), при этом лекарственное средство содержит в качестве активного ингредиента одну или несколько культивированных клеток, среду, полученную на этапе культивирования, и продукт секреции, полученный на этапе культивирования (такой как экзосома). Продукт секреции (такой как экзосома), может образовываться из супернатанта клеточной культуры. Супернатант клеточной культуры может быть использован отдельно в качестве среды.
[0049]
Лекарственное средство в соответствии с настоящим изобретением может быть изготовлено с помощью способа, известного в данной области техники. Лекарственное средство в соответствии с настоящим изобретением может быть выполнено в виде такой лекарственной формы, как пероральное средство или парентеральное средство, предпочтительно, как парентеральное средство. Лекарственная форма такого парентерального средства может представлять собой жидкое средство (например, жидкое средство на водной основе, жидкое средство на неводной основе, суспензионное средство или эмульсионное средство) или твердое средство (например, кристаллизованное порошкообразное средство или лиофилизированное средство). Средство в соответствии с настоящим изобретением может представлять собой лекарственную форму с замедленным высвобождением. Лекарственная форма средства является предпочтительно жидкой, когда средство содержит живые клетки, и лекарственная форма средства может быть либо жидкой, либо твердой, когда средство содержит часть клетки или полностью мертвые клетки.
[0050]
Основным компонентом препарата в соответствии с настоящим изобретением является одна или несколько культивированных стволовых клеток кожи человека, среда, полученная на этапе культивирования, и продукты секреции культивированных клеток (например, экзосома). В любом случае эффективная доза может быть разработана, например, на основе использования количества клеток в качестве индекса. Конечное средство может не содержать стволовых клеток. Продукты секреции могут являться продуктами, содержащимися в супернатанте питательной среды. Величина дозы, число приемов лекарственного препарата и кратность применения лекарственного препарата варьируются в зависимости от субъекта, его возраста, симптоматики и тому подобных факторов. В целом, пример величины дозы, включающей стволовые клетки кожи человека, в сутки при одном введении путем внутривенного или субарахноидального введения в качестве единицы дозы находится в диапазоне от 1×105 до 1×109 клеток, предпочтительно от 1×106 клеток до 5×108 клеток, более предпочтительно от 1×107 клеток до 2×108 клеток. В альтернативном случае пример дозы стволовых клеток кожи человека на один кг веса тела в сутки находится в диапазоне от 1×104 клеток до 1×108 клеток, предпочтительно от 1×105 клеток до 5×107 клеток, более предпочтительно от 1×106 клеток до 2×107 клеток. Средство в соответствии с настоящим изобретением может вводиться или приниматься один раз в 3 дня, в общей сложности 8 приемов или введений, либо вводиться или приниматься один раз в сутки в течение одной недели. Могут быть использованы комбинации различной кратности применения с периодами введения/приема. В случае полного ответа, когда наблюдается значительное облегчение симптомов, достаточно будет только одного начального введения. Таким образом, средство в соответствии с настоящим изобретением может быть использовано различным образом в зависимости от заболеваний и симптомов, и количество трансплантируемых клеток для каждой дозы может быть определено при необходимости и находиться в вышеупомянутых диапазонах.
[0051]
Настоящее изобретение также предусматривает использование стволовых клеток кожи человека в соответствии с настоящим изобретением, как описано выше, для изготовления лекарственного средства для лечения спинномозговых травм.
[0052]
Настоящее изобретение также предусматривает создание способа лечения спинномозговых травм. Способ лечения включает этап введения эффективного количества средства субъекту со спинномозговой травмой в соответствии с настоящим изобретением, изготовленного с помощью вышеописанного способа.
[Полезный эффект изобретения]
[0053]
Настоящее изобретение позволяет создать способ культивирования клеток, способствующего устойчивой экспрессии гена GDNF (мРНК), не применяя при этом способ введения гена с помощью вирусного вектора.
[0054]
Настоящее изобретение предусматривает создание способа культивирования клеток для экспрессии различных маркеров, таких как маркеры нейральной стволовой клетки.
[0055]
Настоящее изобретение предусматривает создание способа изготовления лекарственного средства для лечения спинномозговых травм.
[0056]
Согласно способу настоящего изобретения клетки для лечения спинномозговых травм могут быть получены из кожи человека путем бессывороточного и бесфидерного культивирования, при этом клетки исключительно легко извлечь из тканей организма человека. Исходя из способа настоящего изобретения, было обнаружено, что способ позволяет десятикратно повысить экспрессию глиального нейротрофического фактора GDNF, являющегося наиболее необходимым элементом для лечения спинномозговых травм, и при этом было подтверждено, что клетки, являющиеся высоко эффективными для лечения спинномозговых травм, могут быть получены путем экспрессии нестина, являющегося маркером нейральных стволовых клеток, экспрессии глиального фибриллярного кислого белка (ГФКБ), являющегося эффективным для лечения травм позвоночника, и экспрессии CD73, предотвращающего гипералгезию, возникающую при спинномозговых травмах, без введения генов. Клетка, полученная с помощью способа настоящего изобретения, продемонстрировала терапевтический эффект в модели спинномозговой травмы у крысы. Клетка показала отрицательный результат в тесте на канцерогенность. 47-летнему пациенту со спинномозговой травмой на уровне позвонка Th3, который не был в состояние ходить в течение более 2-х лет, вводили дважды в месяц клетки путем люмбальной пункции. Пациент начал ходить через один месяц после начала введения средства. В свою очередь, на TRI симпозиуме в 2014 году не было заявлено ни об одном случае восстановления двигательных функций и навыков ходьбы из четырех случаев при возрасте пациентов 35 лет или моложе с полным параличом ног (на уровне позвонков Th 4-7) путем проведения трансплантации слизистой оболочки носа, осуществленной в Японии.
Краткое описание чертежей
[0057]
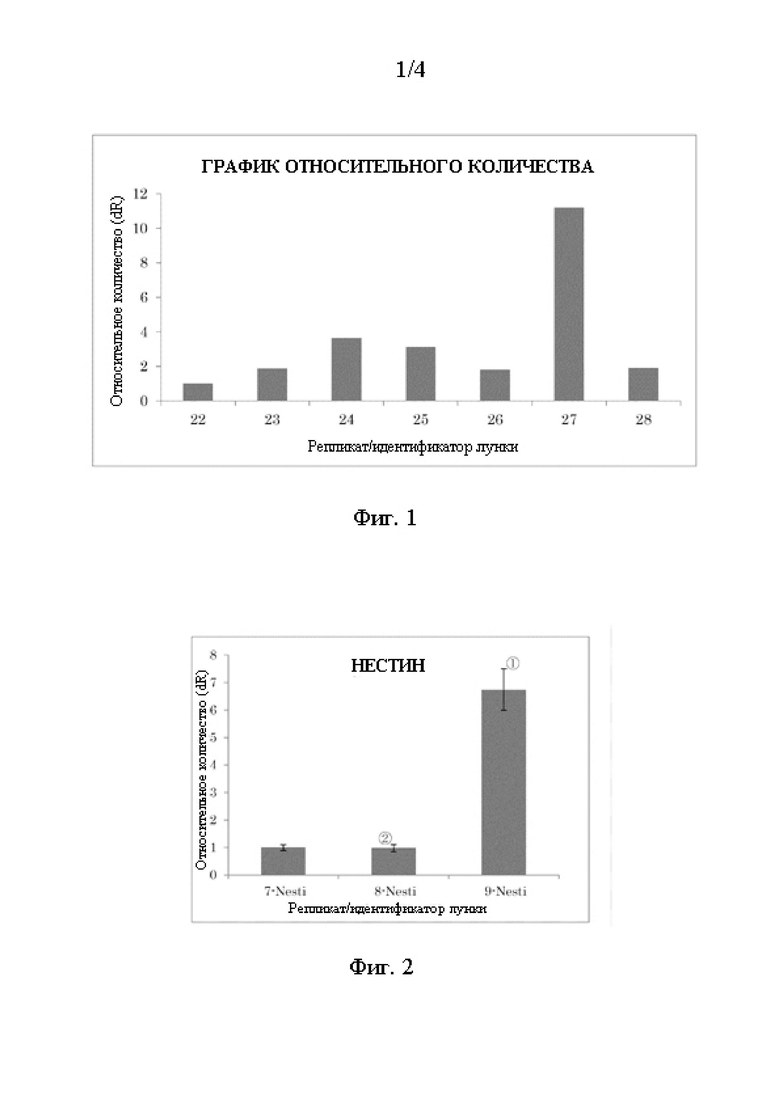
Фиг. 1 - график, на котором показан эффект повышения экспрессии мРНК GDNF (Пример 2).
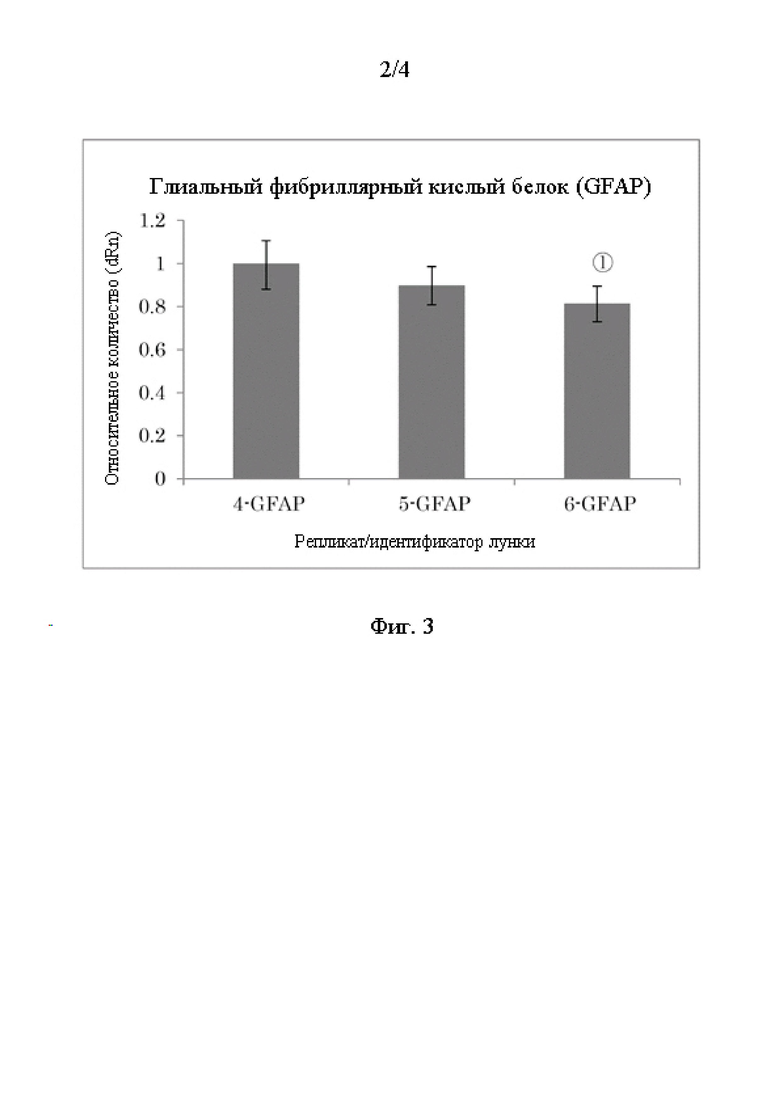
Фиг. 2 - график, на котором показана экспрессия мРНК нестина (Пример 3).
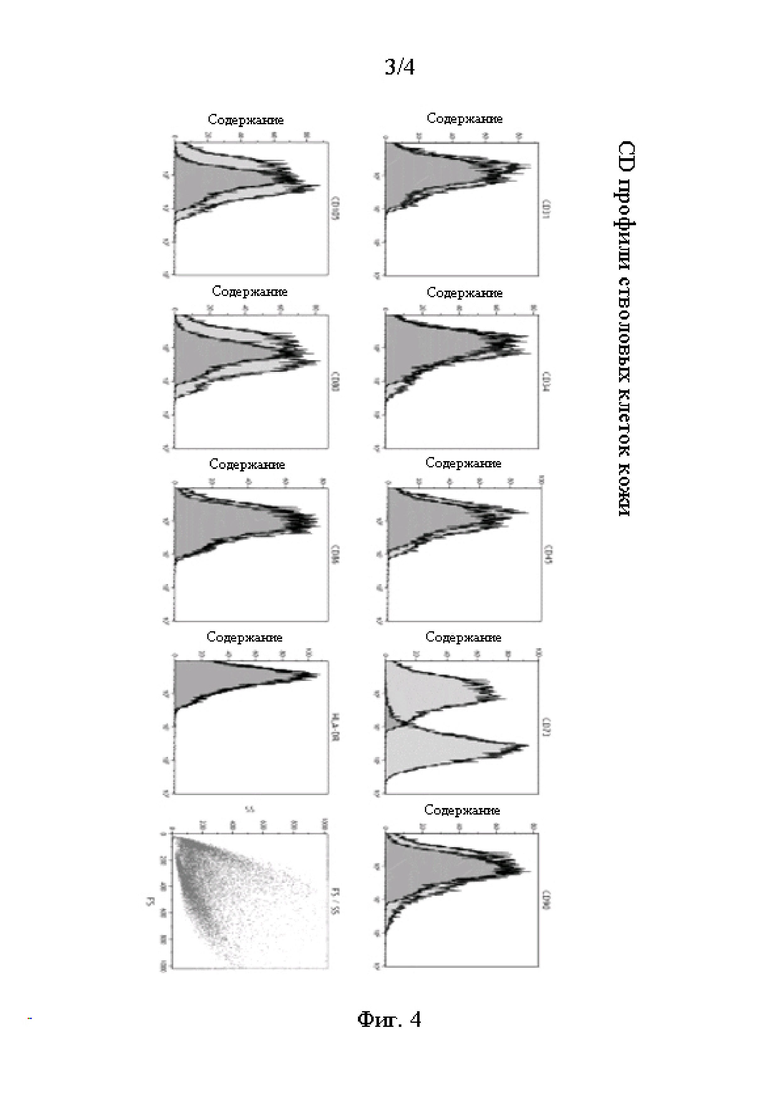
Фиг. 3 - график, на котором показана экспрессия мРНК ГФКБ (Пример 4).
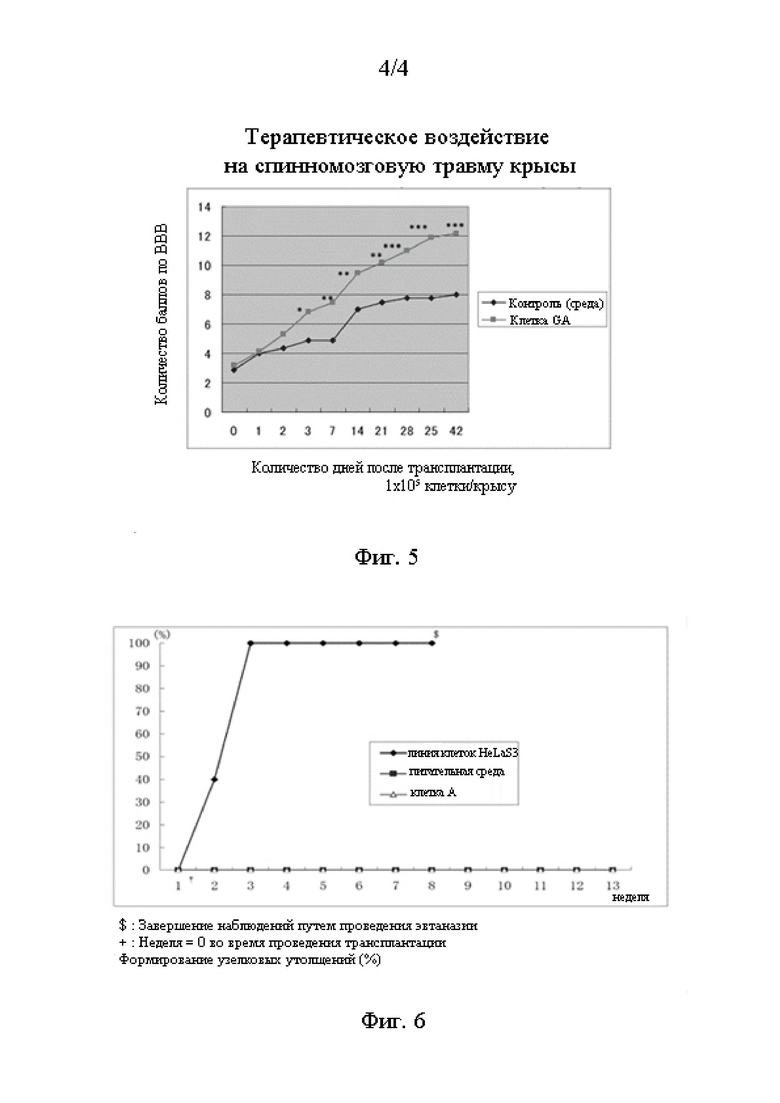
Фиг. 4 - график, на котором показана экспрессия CD73 (профиль экспрессии CD) (Пример 5).
Фиг. 5 - график, показывающий эффекты на моделях спинномозговых травм крыс (шкала оценки двигательной функции Бассо, Битти и Бреснахана) (Пример 6).
Фиг. 6 - график оценки канцерогенности.
Описание вариантов реализации настоящего изобретения
[0058]
Ниже приведено объяснение вариантов реализации настоящего изобретения. Настоящее изобретение не ограничено вариантами реализации настоящего изобретения, объяснение которых приведено ниже, и включает варианты реализации, очевидные из настоящего изобретения, в которые надлежащим образом внесены изменения специалистами в данной области техники, на основе ниже приведенных вариантов реализации настоящего изобретения.
[0059]
В настоящем изобретении предложен способ получения клеток для их непосредственного введения на участке спинномозговой травмы путем получения клеток, являющихся исключительно эффективными для лечения спинномозговых травм, при выполнении следующих этапов:
забор ткани из кожи человека и стерилизация ткани; сбор клеток и высевание клеток; пролиферация клеток; субкультивирование клеток; индуцирование и дифференциация клеток; трансплантация и обработка клеток.
В настоящем изобретении предложен способ создания клеток в комбинации с другим базовым материалом для использования в медицинских препаратах. В настоящем изобретении также предложен способ введения компонента питательной среды, используемой для культивирования на вышеупомянутых этапах.
[0060]
Ниже приведено подробное объяснение каждого этапа со ссылкой на примеры. Пояснение представляет собой Пример, и данное пояснение не должно рассматриваться как ограничивающее настоящее изобретение. Варианты реализации настоящего изобретения, очевидные из настоящего изобретения, в которые надлежащим образом могут быть внесены изменения специалистами в данной области техники, на основе ниже приведенных вариантов реализации настоящего изобретения, также включены в настоящее изобретение. Ниже по тексту "и" может обозначать «микро».
[0061]
(Этап забора ткани)
Ткань кожи, забор которой производится на этом этапе, предпочтительно берется с участка шеи или с участка выше шеи, однако с косметической точки зрения забор с постаурикулярного участка является наиболее предпочтительным в плане состояния и внешнего вида кожи. Половые ограничения не имеют значения, и проведение процедуры взятия ткани кожи у субъекта допускается в возрасте до 70 лет. Последующие этапы выполняются с использованием асептических манипуляций. Взятую ткань стерилизуют 70% водно-спиртовым раствором, прошедшим обработку путем пропускания через стерилизующий фильтр для удаления бактериальных спор, размер пор которого составлял 0,1 мкм.
[0062]
(Этап сбора клеток и высевания клеток)
Разрезанную на мелкие кусочки ткань помещали в раствор диспазы (PBS(-)), содержащий 10 мкмоль/л Y-27632 и выдерживали в течение ночи при 4°С. Затем ткань помещали в раствор трипсина (PBS(-)), содержащий 10 мкмоль/л Y-27632 при 37°С и выдерживали в течение 20 минут. Затем ткань кожи вымачивали в растворе коллагеназы (DMEM) для ферментативной обработки кожи при 37°С при постоянном перемешивании в течение 1-2 часов. Полученную в результате ферментативной обработки суспензию далее фильтровали через сито с размером ячеек 100 мкм для удаления осадка. Затем фильтрат центрифугировали с последующим 3-разовым промыванием раствором PBS(-) для удаления ферментов. Полученные таким образом клетки помещали в ингибитор трипсина и выдерживали в течение 10 минут. После удаления ингибитора путем центрифугирования клетки суспендировали в среде, содержащей 10 мкмоль/л Y-27632, и затем высевали на чашки Петри.
[0063]
(Этап пролиферации клеток)
Вплоть до 6 дня после высевания питательную среду необходимо было только добавлять, но не изменять ее состав. Последующее изменение питательной среды выполняется путем извлечения размножившихся клеток и их суспендирования в кондиционированной среде путем центрифугирования, и дальнейшего возврата клеток, суспендированных в новой среде, в культуральную систему.
[0064]
(Этап субкультивирования клеток)
Клетки подвергали обработке Y-27632 (10 мкмоль/л) в течение более 30 минут и извлекали из чашки с использованием этилендиаминтетрауксусной кислоты (EDTA) и TrypLEx Express. Затем клетки помещали в ингибитор трипсина и выдерживали в течение 10 минут. После удаления ингибитора путем центрифугирования клетки суспендировали в среде, включающей 10 мкмоль/л Y-27632, и высевали в чашки, площадь которых в 4 или 5 раз превышала площадь ранее используемых чашек. Первичную клеточную культуру получали, используя 5 чашек, при этом площадь каждой из них составляла 100 мм2. По достижению культурой стадии конфлюэнтности клетки из 3-х чашек могут быть использованы для трансплантации или криозаконсервированы до трансплантации. Клетки из оставшихся 2-х чашек подвергали субкультурированию, используя 6 чашек, при этом площадь каждой из них составляет 100 мм2, и, по достижению субкультурой стадии конфлюэнтности на следующем этапе к клеткам добавляли факторы для индуцирования.
[0065]
(Этап добавления факторов для индуцирования)
Этап добавления факторов для индуцирования представляет собой этап, на котором клетки обрабатывали средством за 3 дня до трансплантации и культивировали путем добавления необходимых факторов. На этом этапе клетки проявляли высокую степень экспрессии мРНК GDNF, например, 10-кратно превышающую экспрессию, которая могла бы быть достигнута у культивированных обычным способом клеток. На этом этапе может быть получена отрицательная клетка CD 13 - (CD13(-)). На этом этапе может быть получена отрицательная клетка CD34 - (CD34(-)). На этом этапе может быть получена отрицательная клетка CD45 - (CD45(-)). На этом этапе может быть получена отрицательная клетка CD90 (CD90(-)). На этом этапе может быть получена положительная клетка CD73 (CD73(+)). Отношение (число клеток) положительных клеток CD73 к культивированным клеткам может изменяться в следующем диапазоне: от 20% до 100%, от 40% до 100%, от 60% до 99% или, например, от 80% до 99%. Клетки, которые подверглись этапу добавления факторов для индуцирования, предпочтительно трансплантировали спустя 3 дня или криоконсервировали до трансплантации.
(Этап трансплантации или обработки)
Достаточное количество клеток для обработки, полученные на вышеуказанных предыдущих этапах, обрабатывали 10 мкмоль/л Y-27632 и извлекали из чашек, используя EDTA и TrypLEx Express. Затем клетки помещали в ингибитор трипсина и выдерживали в течение 10 минут. После удаления ингибитора путем центрифугирования клетки суспендировали при концентрации 10 клеток/мл в инфузионном растворе, когда предусматривалась их трансплантация путем спинномозговой пункции. Клетки могут быть подвержены обработке с использованием других базовых веществ или других клеток.
[0066]
Более полное понимание существа и целей настоящего изобретения может быть достигнуто из следующего ниже описания, ведущегося со ссылкой на нижеприведенные Примеры. Настоящее изобретение охватывает варианты реализации, которые специалисты в данной области техники могут создать, используя известные технологии, на основе нижеприведенных Примеров.
Пример 1
[0067]
(Сбор и культивирование стволовых клеток кожи человека)
(Сбор ткани)
Были использованы все слои кожи площадью приблизительно 2 см2, оперативно удаленные с лица 56-летней женщины при проведении косметической операции по подтяжке ее лица. Все последующие этапы были проведены с использованием асептических манипуляций. Указанную собранную ткань вымачивали в течение 30 секунд в 70% водно-спиртовом растворе, стерилизованном с использованием фильтра с размером пор 0,1 мкм, и затем незамедлительно три раза промывали фосфатно-солевым буферным раствором (PBS(-)) для удаления этанола. Из ткани ножницами удаляли как можно больший объем подкожной жировой ткани и дермальной соединительной ткани, при этом оставляя участки, на которых располагались волосяные луковицы, далее кожную ткань разрезали скальпелем на кусочки размером 1 мм2.
[0068]
(Этап 1 - сбор и высевание клеток)
Кусочки кожной ткани вымачивали в течение ночи в 5 мл предварительно охлажденного раствора диспазы (25 единиц/мл раствора PBS (-)), содержащего 10 мкмоль/л Y-27635 при 4°С.
[0069]
(Этап 2 - сбор и высевание клеток)
Указанный раствор с кожной тканью центрифугировали для удаления супернатанта. Затем оставшуюся кожную ткань вымачивали в растворе TrypLE Express (5-кратно разведенном в PBS (-)) при 37°С в течение 20 минут.
[0070]
(Этап 3 - сбор и высевание клеток)
Указанный раствор с кожной тканью центрифугировали для удаления супернатанта. Затем оставшуюся кожную ткань вымачивали в 20 мл раствора коллагеназы (среда GIBCO: тип I) (1400 единиц/мл среды DMEM) при 37°С при постоянном перемешивании в течение 1,5 часа.
[0071]
(Этап 4 - сбор и высевание клеток)
Суспензию после перемешивания пропускали через фильтр с размером ячеек 100 мкм для удаления не подвергшегося ферментации остатка. Полученную таким образом жидкость промывали PBS(-) с последующим центрифугированием для удаления ферментов, при этом процесс повторяли три раза, и по его завершению получали клетки.
[0072]
(Этап 5 - сбор и высевание клеток)
Клетки помещали в 5 мл ингибитора трипсина сои (0,25% в PBS(-)) и выдерживали в течение 10 минут.
[0073]
(Этап 6 - сбора и высевания клеток)
После удаления ингибитора путем центрифугирования клетки суспендировали в среде, содержащей 10 мкмоль/л Y-27632, и затем высевали в чашки Петри. Клетки исходной кожной ткани размером 1-2 см2 высевали во все лунки 6-луночного планшета (CellBind: COSTER, фирменное название).
[0074]
(Этап приготовления питательной среды)
Питательную среду приготавливали в соответствии с нижеприведенным описанием. Инсулин (10 мг/л), голо-трансферрин (5,5 мг/л), селен (6,7 мкг/мл), этаноламин (2 мг/л), витамин С (L-аскорбиновая кислота 2-фосфат сесквимагний соль гидрат) (50 мкг/мл), KGF (10 мкг/мл), липиды (смеси жирных кислот: арахидоновая кислота (20 мкг/мл), холестерин (2,2 мг/л), DL-a-токоферола ацетат (700 мкг/мл), линолевую кислоту (100 мкг/мл), линоленовую кислоту (100 мкг/мл), миристиновую кислоту (100 мкг/мл), олеиновую кислоту (100 мкг/мл), пальмитолеиновую кислоту (100 мкг/мл), пальмитиновую кислоту (100 мкг/мл), стеариновую кислоту (100 мкг/мл), Tween 80 (22 мг/л), Плюроник F-68 (1000 мг/л), EGF (20 мкг/мл), FGF (10 мкг/мл),Y-27632 (1 мкмоль/л) и 1% добавку В-27 XenoFree CTS (Invitrogen) добавляли в среду MCDB 153 (Sigma, Stemline кератиноцитарная базальная среда), которая является базальной средой.
[0075]
(Этап 1 - пролиферация клеток)
Первичную культуру клеток получали в кондиционированной питательной среде, добавляя 1/3 питательной среды и не изменяя питательную среду в первые 7 дней. Последующую культуру получали, изменяя питательную среду каждые 2 дня. Изменение питательной среды проводили путем центрифугирования и сливания 2/3 использованной среды и затем путем добавления свежей питательной среды в количестве 2/3 от объема питательной среды к оставшейся 1/3 смеси использованной среды, далее плавающие клетки осаждали центрифугированием и помещали обратно в чашки для культивирования. Для достижения 100% конфлюэнтности потребовалось 10 дней.
[0076]
Этап субкультивирования клеток
Y-27632 добавляли к питательной среде, в которой культивировали клетки, при концентрации 10 мкмоль/л и выдерживали при 37°С в течение 30 минут. Далее питательную среду полностью удаляли, добавляли 0,05% EDTA/PBS(-) в количестве 2 мл/лунку и выдерживали при 37°С в течение 10 минут. Затем, добавляли 5-кратно разведенный PBS(-) TrypLEx Express в количестве 0,5 мл/лунку и выдерживали при 37°С в течение 5 минут. Клетки удаляли из лунок с помощью пипетирования. Ингибитор трипсина (0,05%/PBS(-)) добавляли в количестве 2,5 мл/лунку к извлеченным клеткам и далее центрифугировали. После удаления супернатанта добавляли 2,5 мл ингибитора трипсина (0,25%/PBS(-)) для суспендирования клеток и выдерживали в течение 10 минут. После удаления ингибитора путем центрифугирования клетки суспендировали в среде, содержащей 10 мкмоль/л Y-27632 и высевали в 5 временных подложках 6-луночного планшета (CellBind: COSTAR), площадь которого в 5 раз превышала площадь ранее используемого планшета. 100% конфлюэнтность достигали через одну неделю, и полученные таким образом клетки использовали в последующих экспериментах.
Пример 2 [0077]
(Способ повышения экспрессии мРНК нейротрофического фактора глиальной клеточной линии (GDNF))
С целью обнаружения соединения или цитокина для повышения экспрессии GDNF в клетке были изучены свойства 6 потенциальных материалов: вальпроевая кислота (VA), тромбоцитарный фактор роста (PDGF), химическое соединение SAG (или Пурморфамин или rh-Sonic Hedgehog (PeproTech)) и костный морфогенетический белок 4 (ВМР4). Указанные 6 материалов добавляли в 7 лунок в нижеприведенных комбинациях, и они достигали конфлюэнтности как в Примере 1: (1) контроль (не добавляли) (2) VA (1 мкмоль/л), (3) VA (1 мкмоль/л) + PDGF (10 нг/мл), (4) VA (1 мкмоль/л) + SAG (0,3 мкмоль/л), (5) PDGF (10 нг/мл), (6) SAG (0,3 мкмоль/л), (7) МВР-4 (10 нг/мл). Через 72 часа после добавления, из каждой лунки экстрагировали общую РНК с использованием TRIzol метода. При использовании "ReverTra Асе (фирменное название) qPCR RT kit" - набора для синтеза кДНК для проведения ПЦР - 0,5 мкг каждой общей РНК добавляли к 10 мкл ReverTra Асе (фирменное название) qPCR RT набора для синтезирования соответствующей кДНК.
Проводили сравнение экспрессии мРНК GDNF в указанных образцах кДНК методом ПЦР в режиме реального времени с использованием набора праймеров ПЦР в режиме реального времени GDNF (Roche 5326257) и путем анализа интеркалятора с использованием ABI PRISM 7700 (фирменное название) компании «Applied Biosystems Inc.». Для проведения количественной ПЦР с детекцией в реальном времени использовали композицию SYBR (фирменное название) Green Realtime PCR Master Mix - Plus - компании - TOYOBO Co.Ltd.» для приготовления реакционного раствора. Приготовление реакционного раствора
Реакционный раствор помещали в каждую лунку 96-луночного планшета, в котором проводили реакцию PCR.
Реакцию PCR проводили трехэтапным методом при условиях температуры отжига 60°С/элонгации 72°С, и этапы (1) - (2) повторяли для 40 циклов. На последнем этапе проанализировали кривую плавления, и было подтверждено, что не был образован димер праймера.
95°C, 60 секунд
(1) ↓
(2) 95°C, 15 секунд
(3) 60°C, 15 секунд
(4) 72°С, 45 секунд (сбор данных)
Одновременно было проведено детектирование мРНК GAPDH, и экспрессия мРНК GDNF была скорректирована до мРНК GDNF / мРНК GAPDH. В результате этого только (6) SAG достигло более чем 10-кратного повышения экспрессии мРНК GDNF по сравнению с экспрессией (1) контроля. Пурморфамин (1,5 мкмоль/л) и rh-Sonic Hedgehog (10 нг/мл), использовавшиеся вместо SAG, также достигли практически 10-кратного повышения экспрессии мРНК GDNF (Фиг. 1). Была синтезирована GAPDH с использованием нижеприведенных праймеров:
Прямой праймер: ATCTTCTTTTGCGTCGCC (SEQ ID №1)
Обратный праймер: GATGACAAGCTTCCCGTTC (SEQ ID №2)
Длина цепи экспрессии: 250 bp (пар оснований)
[0078]
На Фиг. 1 представлен график, на котором приведены результаты экспрессии мРНК GDNF в Примере 2.
Пример 3
[0079]
(Изменение экспрессии, индуцированной нейрональной дифференцировкой мРНК нестина)
Из 3 лунок, в которых была достигнута конфлюэнтность в Примере 1, клетки 2-х лунок были культивированы в течение 7 дней в питательной среде для дифференцировки нейральных клеток-предшественниц (NPC) для определения дифференцированных нейральных клеток-предшественниц набора функциональной идентификации нейральных клеток-предшественниц человека/мыши/крысы (R&D Systems SC082). Клетки из другой одной лунки были культивированы в поддерживающей среде настоящего изобретения в течение аналогичного периода времени. На 7-й день культивирования была экстрагирована общая РНК, и кДНК была получена аналогичным образом, как и в Примере 2. При использовании кДНК экспрессия мРНК нестина, которая является маркером нейральных стволовых клеток, была измерена методом ПЦР с детекцией в реальном времени и было проведено сравнение с мРНК GAPDH в качестве базальной экспрессии. Праймеры для нестина приведены ниже:
Прямой праймер: CGTTGGAACAGAGGTTGGAG(SEQ ID №3)
Обратный праймер:TCCTGAAAGCTGAGGGAAG(SEQ ID №4)
Длина цепи экспрессии: 262 bp
Те же самые праймеры, которые использовались в Примере 2, были использованы для GAPDH.
Результаты приведены на Фиг. 2.
[0080]
На Фиг. 2 представлен график, на котором приведена экспрессия мРНК нестина в Примере 3. Как показано на Фиг. 2, экспрессия нестина (мРНК нестина/ мРНК ГАФДГ) снизилась приблизительно до 1/7 от уровня до дифференцировки путем замены питательной среды на среду для дифференцировки. Данный результат указывает на то, что пролиферативная среда настоящего изобретения обеспечивает сохранение нейральных стволовых клеток, в то время как среда для дифференцировки снижает [количество]нейральных стволовых клеток.
Пример 4
[0081]
(Изменение экспрессии путем индуцирования нейрональной дифференцировки мРНК ГФКБ)
Из 3-х лунок, в которых была достигнута конфлюэнтность в Примере 1, клетки 2-х лунок были культивированы в течение 7 дней в питательной среде для дифференцировки нейральных клеток-предшественниц (NPC) для определения дифференцированных нейральных клеток-предшественниц набора функциональной идентификации нейральных клеток-предшественниц человека/мыши/крысы (R&D Systems SC082). Клетки одной лунки из 3-х были культивированы в поддерживающей среде настоящего изобретения в течение аналогичного периода времени. На 7-й день культивирования была экстрагирована общая РНК, и кДНК была получена аналогичным образом, как и в Примере 2. При использовании кДНК экспрессия мРНК ГФКБ, которая является маркером астроцитов или взрослых нейральных стволовых клеток, была измерена методом ПЦР с детекцией в реальном времени и было проведено сравнение с мРНК GAPDH в качестве базальной экспрессии. Праймеры для ГФКБ приведены ниже:
Прямой праймер: ACATCGAGATCGCCACCTAC(SEQ ID №5)
Обратный праймер: ACATCACATCCTTGTGCTCC (SEQ ID №6)
Длина цепи экспрессии: 219 bp
Те же самые праймеры, которые использовались в Примере 2, были использованы для GAPDH.
Результаты приведены на Фиг. 3.
[0082]
На Фиг. 3 представлен график, на котором приведена экспрессия мРНК ГФКБ в Примере 4. Как показано на Фиг. 3, экспрессия ГФКБ (мРНК ГФКБ / мРНК GAPDH) несколько повысилась от уровня экспрессии до проявления дифференцировки путем замены питательной среды на среду для дифференцировки. Данный результат указывает на то, что пролиферативная среда настоящего изобретения поддерживает нейральные стволовые клетки и экспрессию ГФКБ в них.
Пример 5
[0083]
(Исследование экспрессии CD-антигена методом проточной цитометрии) Клетки, культивированные до достижения конфлюэнтности, извлекали из чашек Петри и изолировали с использованием раствора трипсин-EDTA. Далее клетки блокировали путем их выдерживания в 3% растворе BSA/PBS(-) в течение 30 минут с целью предотвращения не специфической адсорбции. После фиксации 4% параф ормальде гидом в течение 10 минут клетки инкубировали в 0,5% растворе Triton X-100/PBS(-) при 4°С в течение 5 минут. Затем клетки инкубировали при 4°С в течение ночи с моноклональным антителом к CD73, CD73-PE (BD 561014). Далее клетки 5 раз промывали для удаления несвязанных антител, и была проанализирована экспрессия антигена методом проточной цитометрии с использованием анализатора клеток ЕС800 компании «SONY Со.» Результаты приведены на Фиг. 4.
[0084]
На Фиг. 4 представлен график, на котором приведена экспрессия CD73 (профиль экспрессии CD73) в Примере 5. Как показано на Фиг. 4, клетка являлась CD13-, CD34- и CD45-отрицательной, и это указывает на то, что клетка не являлась клеткой крови. Клетка также являлась CD90-отрицательной, что указывает на то, что клетка не являлась мезенхимальной стволовой клеткой кожи человека. Сильная экспрессия CD73 не являлась наиболее ярко выраженной характеристикой профиля экспрессии CD клетки.
Пример 6
[0085]
(Исследование эффективности лечения на модели спинномозговой травмы крысы, определяемой методом суммарной оценки по шкале оценки двигательной функции Бассо, Битти и Бреснахана (ВВВ))
Культивированные клетки, которые не подвергались обработке соединением SAG или аналогичным соединением для повышения экспрессии GDNF, извлекали из чашек Петри с использованием фермента Accutase (GIBCO A11105). 1×105 извлеченных клеток суспендировали в 200 мкл раствора питательной среды и трансплантировали путем инъекционного введения в участок поврежденного спинного мозга крысы (повреждение спинного мозга было нанесено путем падения груза на позвоночник), кроме того, в поврежденный участок вводили иммунодепрессант. На крысе в качестве контроля проводили имитацию операции путем инъекционного введения аналогичного количества только одной питательной среды. В эксперименте группа, в которой проводилась трансплантация клеток, включала 5 крыс, в то время как контрольная группа включала 4 крысы. Эффективность лечения спинномозговой травмы определяли методом суммарной оценки по шкале оценки двигательной функции Бассо, Битти и Бреснахана, в рамках которого за движениями животного наблюдали с помощью видеооборудования и присуждали баллы. Результаты приведены на Фиг. 5. На чертеже по горизонтальной оси отложено количество дней после трансплантации, в то время как по продольной оси отложены баллы ВВВ. Сплошная линия показывает результаты в группе, в которой была проведена трансплантация, в то время как пунктирная линия показывает результаты в контрольной группе, и звездочки показывают результаты теста значимого различия с использованием параметрического t-критерия Стьюдента, при этом * указывает, что Р<0,05, ** - р<0,01 и *** - р<0,001. Через 3 дня после трансплантации в группе, в которой была проведена трансплантация клеток, наблюдался статистически значимый эффект (р<0,05) по сравнению с контрольной группой при разнице суммарной оценки ВВВ в количестве 2-х баллов. Через 35 дней после трансплантации в группе, в которой была проведена трансплантация клеток, наблюдался статистически значимый эффект (р<0,001) по сравнению с контрольной группой при разнице суммарной оценки ВВВ в количестве 4-х баллов. В отчете о трансплантации клеток стромы костного мозга (Непатентный документ 23) указывается, что для достижения значимого различия потребовалось почти 2 недели. При трансплантации нейральных стволовых клеток, полученных из индуцированных плюрипотентных стволовых клеток (Непатентный документ 1), потребовалось 3 недели для достижения значимого различия. По сравнению с результатами указанных исследований результаты настоящего исследования продемонстрировали существенно более быстрое достижение эффекта, наблюдавшегося всего лишь через 3 дня. Также при трансплантации стромальных клеток костного мозга наблюдалось только значимое различие при р<0,05 даже спустя 4 недели, при этом в соответствии с настоящим изобретением наибольшее значимое различие при р<0,001 наблюдалось по истечению такого же периода времени. Этот результат указывает на то, что клетки, полученные в соответствии с настоящим изобретением, являются исключительно эффективными для лечения спинномозговых травм.
Пример 7
[0086]
(Оценка канцерогенности)
Метод исследования на животных и метод проведения испытаний
Для проведения эксперимента использовали мышей линии NOD/Shi-scid, IL-2Rγnull (торговая марка) (6-недельные самки-мыши, Центральный институт исследований экспериментальных животных). После акклиматизации в течение недели мыши были разделены на 3 группы с использованием универсальной системы группирования (Visions Inc.) таким образом, чтобы животные в группах имели максимально одинаковый средний вес тела. Клетки, культивированные аналогичным способом, как и в Примере 1 (именуемые в дальнейшем "клетки А"), питательную среду в качестве отрицательного контроля или линию клеток HeLa S3 (DS Pharma Biomedical Co.Ltd.) в качестве положительного контроля трансплантировали (каждая группа клеток в количестве 0,2 мл/субъект) соответственно путем введения инъекции шприцем (Myjector (торговая марка), 27G) в правый квадрант живота мышей каждой группы. Группы именуются как "группа клетки А (10 мышей)", "группа питательной среды (10 мышей)" и группа "линии клеток HeLa S3 (5 мышей)", соответственно. Три линии клетки А были культивированы аналогичным образом, как в Примере 1. Каждую линию клеток суспендировали в питательной среде α-МЕМ при 1×107 клеток/мл и переносили в 2-мл криопробирки таким образом, чтобы исключалось включение воздуха в них. Приблизительно через 3 часа после распределения по пробиркам питательную среду α-МЕМ удаляли, и клетки снова суспендировали в питательной среде. Аналогичное количество клеток 3-х линий смешивали и получали суспензию при концентрации 5×107 клеток/мл, которую хранили при 4°С до проведения трансплантации в течение 2 часов после приготовления суспензии. Выживаемость после трансплантации образца, представлявшего собой смесь 3 линий клеток, составляла 75% от уровня, определенного непосредственно до трансплантации. За мышами каждой группы присматривали в течение 13 недель и наблюдали за их общим состоянием, измеряли вес их тела, проводили наблюдение и измерение узелковых утолщений один раз в неделю в соответствии с "Типовой инструкцией по уходу и содержанию экспериментальных животных", опубликованной Центральным институтом исследований экспериментальных животных. При наблюдении за узелковыми утолщениями проводили пальцевую пальпацию участка, на котором трансплантировали образец. Исходя из того, что образование узелкового утолщения обнаруживалось в том случае, если при ощупывании пальцами ощущалось уплотнение, проводили измерение его большой оси (L) и малой оси (W) с помощью штангенциркуля с нониусом. Объем узелкового утолщения (V) был рассчитан на основе простой формулы объема опухоли: V=LW2/2 (L и W в мм, V в мм3) в соответствии с "The Nude Mouse and Anticancer Drug Evaluation" (edited by T. Noguchi, Y.Sakurai. and M.Inaba, Kanishobo, June 1991, Kanishobo). Тела мышей группы HeLa S3 были подвергнуты эвтаназии на 5-8 неделе в качестве гуманного завершения наблюдений, поскольку было подтверждено, что вес узелкового утолщения (рассчитанный исходя из его объема, при допущении, что удельный вес составляет 1) превышал 1/10 от веса тела мыши в период проведения наблюдений. Эвтаназию осуществляли путем обескровливания мышей при анестезии изофлураном, и проводили исследование различных органов в грудной полости и брюшной полости. Также был взят образец кожи на участке трансплантации, включающий подкожную ткань, и зафиксирован 10% нейтральным буферным раствором формалина. Фиксированный в формалине образец заливали парафином, далее изготавливали срезы образца, окрашивали гематоксилином-эозином, иммунное окрашивание анти-HLA в последующем исследовали с помощью оптического микроскопа.
[0087]
Результаты
Результаты приведены на Фиг. 6. На Фиг. 6 представлен график, на котором показана оценка канцерогенности. В группе клеточной линии HeLa S3 формирование узелковых утолщений наблюдалось у 100% субъектов (5 случаев из 5) 3 недели спустя после трансплантации, в то время как формирование узелковых утолщений не наблюдалось в группе питательной среды и в группе клеток А до окончания наблюдений. Во всех случаях в группе клеточной линии HeLa S3 наблюдалось формирование узелковых утолщений. Поскольку узелковые утолщения проявляли постоянное увеличение своего объема и демонстрировали гистологический тип низкодифференцированной аденокарциномы, а также проявляли реакцию на введение анти-HLA, они являлись опухолями, возникшими из клеток HeLa S3. В группе А клеток гистопатологическое исследование позволило выявить фиброплазию на позитивный тест анти-HLA в 6 случаях из 10, которая рассматривалась как оставшиеся трансплантированные клетки. При этом формирование узелковых утолщений не наблюдалось ни в одном из случаев за весь период исследований, а также не наблюдалась гиперплазия или неопластическое изменение на гистопатологических изображениях, окрашенных гематоксилином-эозином. Приведенные результаты указывают на то, что клетки А не проявляет канцерогенности при таких условиях теста.
Пример 8
[0088]
Исследование терапевтического воздействия на человека со спинномозговой травмой: эффект GDNF
Аутологичные клетки, взятые из кожи каждого пациента, культивировали не обрабатывая химическим соединением SAG или аналогичным химическим соединением и далее извлекали из чашек Петри с использованием фермента Accutase (GIBCO A11105). До проведения трансплантации брали 1 мл спинномозговой жидкости путем проведения люмбальной пункции. 1×107 извлеченных клеток, суспендированных в 1 мл инъецируемого физиологического солевого раствора, далее аутологически трансплантировали на участке проведения люмбальной пункции. Группа из 7 пациентов (случаи 1-7) включала 6 мужчин и 1 женщину в возрасте от 32 до 51 года. Количество процедур введения препарата составляло от 2 до 3 раз с интервалом между введением доз от 1 до 3 месяцев. Период времени с момента получения травмы до введения препарата варьировался от 3 до 23 лет. Пациенты страдали квадриплегией, вызванной повреждением шейного отдела позвоночника (С4-7). Наблюдаемые побочные эффекты включали головную боль и повышенную температуру в день введения препарата. Из 7 пациентов терапевтический эффект отсутствовал у 3-х пациентов. У других 4-х пациентов наблюдались такие терапевтические эффекты и субъективные симптомы как потливость рук, кожная чувствительность, частичное избавление от проблем, связанных с задержкой мочеиспускания, увеличение силы сжатия кисти, улучшение двигательной функции пальцев или подобные эффекты. Только в случае 8 были трансплантированы клетки с повышенной [экспрессией] мРНК GDNF при обработке химическом соединением SAG. Аналогичное вышеуказанное количество клеток вводили 2 раза в течение 1 месяца. У пациента (случай 8) - 47-летнего мужчины с травмой грудного отдела спинного мозга (Th3), вызвавшего паралич нижних конечностей, - период времени с момента получения травмы до начала введения препарата составлял 2 с половиной года. Побочный эффект, выражавшийся в появлении головной боли, наблюдался в день введения препарата. Терапевтический эффект стал очевидным спустя один месяц после введения, т.е. пациент смог ходить с прямой спиной с использованием вспомогательных средств для ходьбы. Хотя в случае 8 травма пациента была менее серьезной, ввиду того, что период паралича нижних конечностей и период введения препарата был короче с момента получения травмы по сравнению со случаями 1-7, терапевтический эффект был ощутимым и выражался в быстром восстановлении двигательных функций.
Промышленная применимость
[0089]
Настоящее изобретение может найти применение в медицинской области.
[0090]
Некодированные тексты Перечня последовательностей
SEQ ID №2: праймер
SEQ ID №3: праймер
SEQ ID №4: праймер
SEQ ID №5: праймер
SEQ ID №6: праймер
Перечень последовательностей
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПОПУЛЯЦИИ СТРОМАЛЬНЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ, ИНДУЦИРОВАННЫХ К НЕЙРАЛЬНОЙ ДИФФЕРЕНЦИРОВКЕ | 2008 |
|
RU2396345C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДГЕЗИВНОЙ КУЛЬТУРЫ НЕЙТРАЛЬНЫХ СТВОЛОВЫХ/ПРОГЕНИТОРНЫХ КЛЕТОК ОБОНЯТЕЛЬНОЙ ВЫСТИЛКИ НОСА МЛЕКОПИТАЮЩИХ ДЛЯ ЛЕЧЕНИЯ ТРАВМ СПИННОГО МОЗГА | 2020 |
|
RU2749156C1 |
| СПОСОБ СТИМУЛИРОВАНИЯ РЕГЕНЕРАЦИИ СПИННОГО МОЗГА С ПОМОЩЬЮ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫХ КЛЕТОК КРОВИ ПУПОВИНЫ ЧЕЛОВЕКА | 2013 |
|
RU2521225C2 |
| СПОСОБ СТИМУЛИРОВАНИЯ РЕГЕНЕРАЦИИ СПИННОГО МОЗГА С ПОМОЩЬЮ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК, ЗАКЛЮЧЕННЫХ В ФИБРИНОВЫЙ МАТРИКС | 2016 |
|
RU2650638C1 |
| ГЕНЕТИЧЕСКАЯ КОНСТРУКЦИЯ, СОДЕРЖАЩАЯ hGDNF ПОД КОНТРОЛЕМ ТЕМПЕРАТУРОЧУВСТВИТЕЛЬНОГО ПРОМОТОРА ДЛЯ РЕГУЛИРУЕМОЙ ЭКСПРЕССИИ НЕЙРОТРОФИЧЕСКОГО ФАКТОРА КАК В КЛЕТКАХ, ТАК И НЕПОСРЕДСТВЕННО В ОРГАНИЗМЕ МЛЕКОПИТАЮЩИХ | 2012 |
|
RU2527169C2 |
| ГЕНЕТИЧЕСКИЕ НУКЛЕОТИДНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ ИСКУССТВЕННО МОДИФИЦИРОВАННОГО GDNF С ДЕЛЕТИРОВАННОЙ pro-ОБЛАСТЬЮ, ПРОДУКТ КОТОРЫХ ОБЛАДАЕТ ПОВЫШЕННЫМИ СВОЙСТВАМИ НЕЙРАЛЬНОГО ИНДУКТОРА И СТИМУЛЯТОРА ОБРАЗОВАНИЯ НЕЙРАЛЬНЫХ ОТРОСТКОВ, ПРИГОДНОГО ДЛЯ ТЕРАПИИ НЕЙРАЛЬНЫХ ТРАВМ, ИШЕМИЧЕСКИХ ИНСУЛЬТОВ И НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ, ВЕКТОР ЭКСПРЕССИИ, МОДИФИЦИРОВАННЫЙ GDNF | 2014 |
|
RU2595377C2 |
| СПОСОБ ПОЛУЧЕНИЯ НЕЙРОНАЛЬНОЙ МАТРИЦЫ | 2010 |
|
RU2431666C1 |
| КОНВЕРСИЯ СОМАТИЧЕСКИХ КЛЕТОК В ИНДУЦИРОВАННЫЕ РЕПРОГРАМИРОВАННЫЕ НЕЙРОНАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ (ИРНСК) | 2011 |
|
RU2562111C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ОБКЛАДОЧНЫХ КЛЕТОК ОБОНЯТЕЛЬНОЙ ВЫСТИЛКИ МЛЕКОПИТАЮЩИХ ДЛЯ ЛЕЧЕНИЯ ТРАВМ СПИННОГО МОЗГА | 2017 |
|
RU2676142C2 |
| Ноотропная композиция на основе полипептидных комплексов, выделенных из нейрональных прогениторных клеток в условиях гипоксии, и способ ее получения | 2019 |
|
RU2732600C1 |
Изобретение относится к области биотехнологии, а именно к получению культивированных клеток для лечения спинномозговых травм и изготовлению лекарственного средства для лечения спинномозговых травм. Способ включает этап культивирования нейральных клеток-предшественников, полученных из биоптатов кожи человека, в бессывороточной питательной среде, содержащей химическое соединение SAG, при этом полученные указанным способом клетки включают мРНК нейротрофического фактора глиальной клеточной линии (GDNF) и белок CD73. Лекарственное средство содержит, по меньшей мере, культивированные нейральные клетки- предшественники, среду, полученную на предыдущем этапе, и продукт секреции, полученный на предыдущем этапе. Изобретение позволяет расширить арсенал технических средств. 2 н. и 6 з.п. ф-лы, 6 ил., 8 пр.
1. Способ получения культивированных клеток для лечения спинномозговых травм, характеризующийся тем, что включает этап культивирования нейральных клеток-предшественников, полученных из биоптатов кожи человека, в бессывороточной питательной среде, содержащей химическое соединение SAG, при этом полученные указанным способом клетки включают мРНК нейротрофического фактора глиальной клеточной линии (GDNF) и белок CD73.
2. Способ по п. 1, в котором бессывороточная питательная среда дополнительно содержит только пурморфамин или только белок Sonic Hedgehog (SHH), либо как пурморфамин, так и белок Sonic Hedgehog.
3. Способ по п. 1, в котором бессывороточная питательная среда дополнительно содержит добавку B-27.
4. Способ по п. 1, в котором бессывороточная питательная среда дополнительно содержит ингибитор ROCK.
5. Способ по п. 1, в котором бессывороточная питательная среда дополнительно содержит эпидермальный фактор роста (EGF) или фактор роста фибробластов (FGF2).
6. Способ по п. 1, в котором бессывороточная питательная среда содержит ионы кальция при концентрации в пределах от 0,03 ммоль/л до 0,12 ммоль/л.
7. Способ по п. 1, в котором нейральные клетки-предшественники получают из биоптатов кожи человека путем обработки взятой у человека кожи диспазой, трипсином и коллагеназой в указанном порядке.
8. Способ изготовления лекарственного средства для лечения спинномозговых травм, характеризующийся тем, что включает этап получения культивированных нейральных клеток-предшественников с использованием способа по п. 1, в котором лекарственное средство содержит, по меньшей мере, культивированные нейральные клетки-предшественники, среду, полученную на предыдущем этапе, и продукт секреции, полученный на предыдущем этапе.
| MAK S.K., et al | |||
| "Small Molecules Greatly Improve Conversion of Human-Induced Pluripotent Stem Cells to the Neuronal Lineag", Stem Cells International | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| WEI G.-J., et al | |||
| Передвижная комнатная печь | 1922 |
|
SU383A1 |
Авторы
Даты
2020-08-26—Публикация
2018-08-02—Подача