Родственные заявки
Эта заявка представляет собой патентную заявку на изобретение US, приоритет которой заявлен по предварительной заявке US на патент № 61/588167, поданной 18 января 2012, которая включена в настоящий документ посредством ссылки в полном обьеме.
Дополнительное описание
Дополнительные раскрытия, относящиеся к данной заявке, можно найти в "Композиции и способы использования форболовых эфиров" заявке US на патент №12/023753, поданной 31 января 2008, Richard L. Chang и др., приоритет которой заявлен в предварительной заявке US на патент №60/898810, поданной 31 января 2007, каждая из которых включена в настоящий документ посредством ссылки во всей полноте.
Область техники
Настоящее изобретение относится в целом к медицинскому использованию форболовых эфиров в лечении или профилактике инсульта и последствий инсульта.
Уровень техники
Растения исторически использовались для многих лечебных целей. Всемирная организация здравоохранения (ВОЗ) подсчитала, что 4 миллиарда человек, 80% населения земного шара, в настоящее время используют фитотерапию для некоторых аспектов первой медицинской помощи. (WHO Fact sheet Fact sheet №134, December 2008) Тем не менее, может быть трудно выделить конкретное соединение из растения, которое имеет нужный лечебный эффект и воспроизвести его в промышленных масштабах. Кроме того, в то время как активное соединение может быть выделено из растения, другие составляющие растения, такие как минералы, витамины, эфирные масла, гликозиды, алкалоиды, биофлаваноиды и другие вещества, также могут быть вовлечены в функционирование активного соединения или лечебный эффект, который известен для растения, что делает использование, очистку и коммерциализацию растительных фармацевтических агентов проблемным.
Форбол является естественным, органическим соединением растительного происхождения из тиглианового семейства дитерпенов. Впервые он был выделен в 1934 году в качестве продукта гидролиза кротонового масла, полученного из семян Croton tiglium, зеленого кустарника семейства молочайных, который растет в Юго-Восточной Азии. Различные эфиры форбола имеют важные биологические свойства, включая известную способность имитировать диацилглицерины и активировать протеинкиназу C (PKC); и даунстрим модулирование сигнальных путей клетки, включая пути митоген-активированной протеинкиназы (МАРК). Форболовые эфиры, предположительно, дополнительно связывают химаерины, Ras активатор RasGRP, и везикуло-возбуждающий белок Munc-13 (Brose N, Rosenmund C., JCell Sci;115:4399–411 (2002)). Некоторые форболовые эфиры также индуцируют ядерный фактор-каппа В (NF-κB). Наиболее заметным физиологическим свойством форболовых эфиров является их известная способность выступать в качестве стимулятора опухолевого роста. (Blumberg, 1988; Goel, G и др., Int, Journal of Toxicology 26, 279-288 (2007)).
12-O-тетрадеканоилфорбол-13-ацетат (TPA), также называемый форбол-12-миристат-13-ацетатом (РМА), является форболовым эфиром, используемым в моделях канцерогенеза в качестве индуктора дифференциации и/или апоптоза в несколько клеточных линиях и первичных клетках. Сообщалось, что TPA также вызывает увеличение циркулирующих лейкоцитов и нейтрофилов у пациентов, у которых функция костного мозга была угнетена химиотерапией (Han Z. T. et al.. Proc. Natl. Acad. Sci. 95, 5363-5365 (1998)), и ингибирует ВИЧ-индуцированный цитопатический эффект на клетках МТ-4. (Mekkawy S. et al., Phytochemistry 53, 47-464 (2000)). Однако из-за множества факторов, в том числе каустической реакций при контакте с кожей и затруднений с его потенциальной токсичностью, не было показано, что TPA является эффективным средством для лечения, управления или профилактики болезни. Действительно, несмотря на то, что форболовые эфиры играют ключевую роль в активации протеинкиназы С, которая вызывает различные клеточные реакции, приводящие к воспалительным реакциям и развитию опухоли (Goel et al., Int, Journal of Toxicology 26, 279-288 (2007)), форболовые эфиры, как правило, исключают из возможных кандидатов для лечения состояний, которые включают воспалительные реакции, такие как инсульт.
Болезнь сердца и инсульт убивают приблизительно 17 млн человек в год, что составляет почти треть всех случаев смертей в мире. Они, по прогнозам, станут ведущей причиной смертности и нетрудоспособности во всем мире, при этом число умерших по прогнозам увеличится до более чем 20 миллионов в год к 2020 году и до 24 миллионов в год к 2030 году. (Atlas of Heart Disease and Stroke, World Health Organization 2004).
В то время как существует более 300 факторов риска, связанных с ишемической болезнью сердца и инсультом (Atlas of Heart Disease and Stroke, World Health Organization 2004), в развитых странах, по крайней мере, 1/3 всех сердечно-сосудистых заболеваний связана с употреблением табака, употреблением алкоголя, высоким кровяным давлением, высоким уровнем холестерина и ожирением.
Современные способы лечения для лечения и профилактики инсульта, как правило, сочетают препараты, такие как ингибиторы ACE, аспирин, бета-блокаторы и гиполипидемические лекарства; устройства, такие как кардиостимуляторы, имплантируемые дефибрилляторы коронарных стентов, искусственные клапаны и искусственные сердца; и такие операции, как аортокоронарное шунтирование, баллонная ангиопластика, пластика и замена клапана, пересадка сердца и операции с искусственным сердцем. "Все чаще выбираются высокотехнологичные процедуры по сравнению с менее дорогими, но, тем не менее эффективные, стратегии" (Atlas of Heart Disease and Stroke, World Health Organization 2004), что приводит к повышению затрат на здравоохранение и приводит к отмечаемым несоответствиям в качестве лечения между различными группами лиц.
Однако даже там, где передовые технологии и услуги доступны, 60% страдающих от инсульта, умирают или становятся зависимым, и каждый инсульт значительно увеличивает риск дальнейших случаев. "Во всем мире лечение сердечнососудистых заболеваний и их факторов риска остается недостаточным для большинства пациентов". (Atlas of Heart Disease and Stroke, World Health Organization 2004). Поэтому, существует четкая потребность в новых и более эффективных мерах для лечения и профилактики инсультов и для лечения или профилактики долгосрочных проявлений, вызванных инсультом.
Краткое описание изобретения
Настоящее изобретение относится к составам композиций и способам применения форболовых эфиров. Композиции и способы, описанные в настоящем документе, являются эффективными в профилактике и лечении инсульта и в управлении осложнениями инсульта, в том числе острыми ишемическими случаями.
Последствия инсульта, которые могут быть предотвращены или вылечены с помощью форболовых эфиров и производных форболовых эфиров, как описано в настоящем документе, включают паралич, нарушение пространственного восприятия, помутнение сознания, синдром игнорирования слева, потерю памяти, афазию, проблемы с координацией и балансом, тошноту, рвоту, когнитивные нарушения, нарушения восприятия, нарушения ориентации, омонимичную гемианопию и импульсивность, но не ограничиваются ими. В некоторых вариантах реализации изобретения, использование форболовых эфиров и производных форболовых эфиров может предотвратить возникновение и последующие инсульты.
Успешное лечение будет определяться в соответствии с традиционными методами, такими как снижение степени тяжести или последствий инсульта, снижение или устранение последствий инсульта, снижение факторов риска, которые предрасполагают индивидуума к инсульту, и/или уменьшение числа и степени тяжести инсультов, в том числе последующих инсультов.
В другом варианте реализации изобретения форболовые эфиры и производные форболовых эфиров, как описано в настоящем документе, могут использоваться для модуляции клеточных сигнальных путей. Такая модуляция может иметь различные результаты, например, в некоторых вариантах реализации изобретения использование композиций, содержащих форболовые эфиры и производные форболовых эфиров, может изменять высвобождение цитокинов Th1 у млекопитающих. В дополнительном варианте реализации композиции, содержащие форболовые эфиры и/или производные форболовых эфиров, могут изменять высвобождение интерлейкина 2 (IL-2) у млекопитающих. В дополнительном варианте реализации изобретения композиции, содержащие форболовые эфиры и/или производные форболовых эфиров, могут изменять высвобождение интерферона у млекопитающих. В еще одном варианте реализации изобретения композиции, содержащие форболовые эфиры и/или производные форболовых эфиров, могут изменять скорость ERK фосфорилирования.
Изобретение достигает вышесказанного и удовлетворяет дополнительные цели и преимущества, предоставляя новый и удивительно эффективный способ и композицию для лечения и профилактики инсульта, модуляции путей клеточной сигнализации и/или управления, лечения и предупреждения осложнений инсульта с использованием композиции, содержащие форболовый эфир формула I, приведенной ниже:
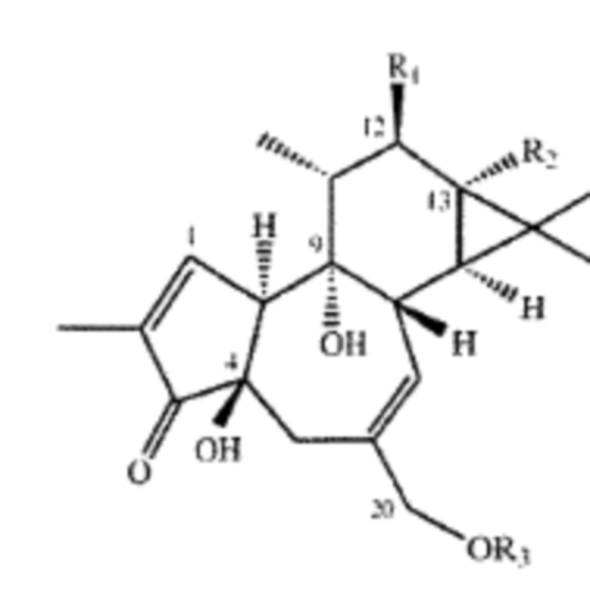
Формула I
где R1 и R2 могут независимо быть водородом; гидроксилом; 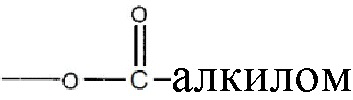 , где алкильная группа содержит от 1 до 15 атомов углерода;
, где алкильная группа содержит от 1 до 15 атомов углерода; 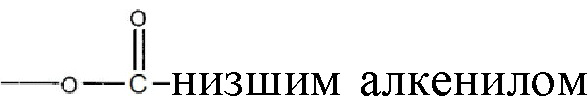 , где низшая алкенильная группа содержит от 1 до 7 атомов углерода;
, где низшая алкенильная группа содержит от 1 до 7 атомов углерода; 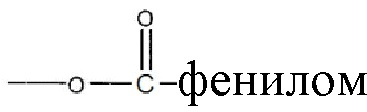 ;
; 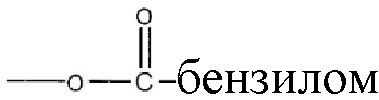 ; и их замещенными производными. R3 может независимо быть водородом или
; и их замещенными производными. R3 может независимо быть водородом или 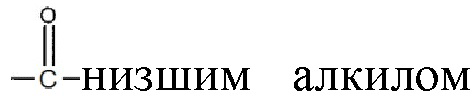 и их замещенные производные. Способы и композиции настоящего изобретения дополнительно включают любые фармацевтические соли, энантиомеры, изомеры, полиморфы, пролекарства, гидраты и сольваты соединений формулы I.
и их замещенные производные. Способы и композиции настоящего изобретения дополнительно включают любые фармацевтические соли, энантиомеры, изомеры, полиморфы, пролекарства, гидраты и сольваты соединений формулы I.
В некоторых примерах реализации изобретения, по меньшей мере, один из R1 и R2 являются отличными от водорода и R3 является водородом или 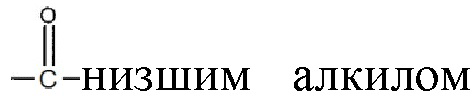 и их замещенными производными. В другом варианте реализации изобретения или R1, или R2 является
и их замещенными производными. В другом варианте реализации изобретения или R1, или R2 является 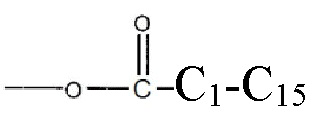 алкилом и оставшийся R1 или R2 является
алкилом и оставшийся R1 или R2 является 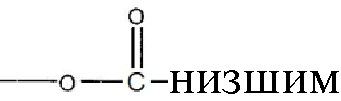 алкилом, где низший алкил содержит от 1 до 7 углеродов, а R3 является водородом.
алкилом, где низший алкил содержит от 1 до 7 углеродов, а R3 является водородом.
Алкильная, алкенильная, фенильная и бензильная группы в формулах формулы I в настоящем документе могут быть незамещены или замещены галогенами, предпочтительно, хлором, фтором или бромом; нитро; амино и/или похожими типами радикалов.
Примером форболового эфира, который используется в способах и композициях описанных в настоящем документе является 12-O-тетрадеканоилфорбол-13-ацетат (TPA) формулы II, приведенной ниже:
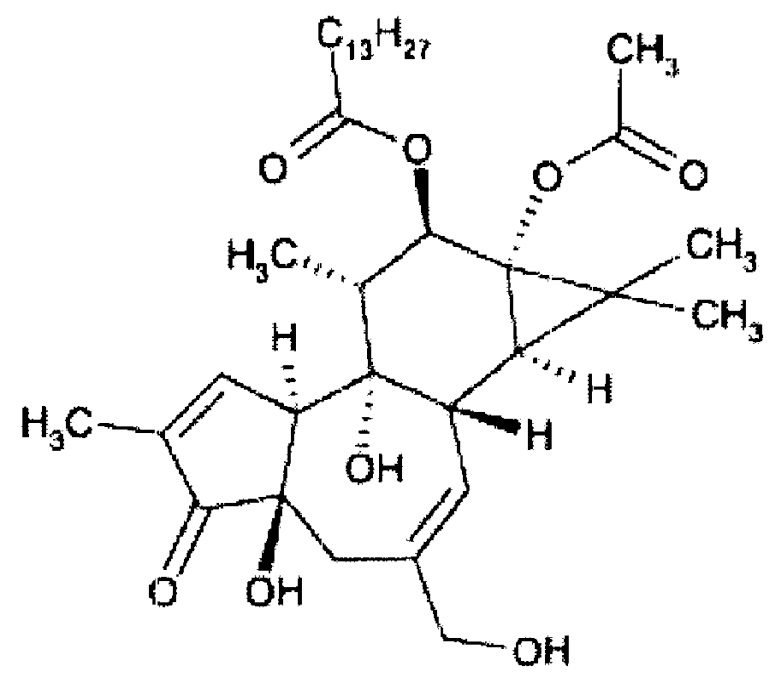
Формула II
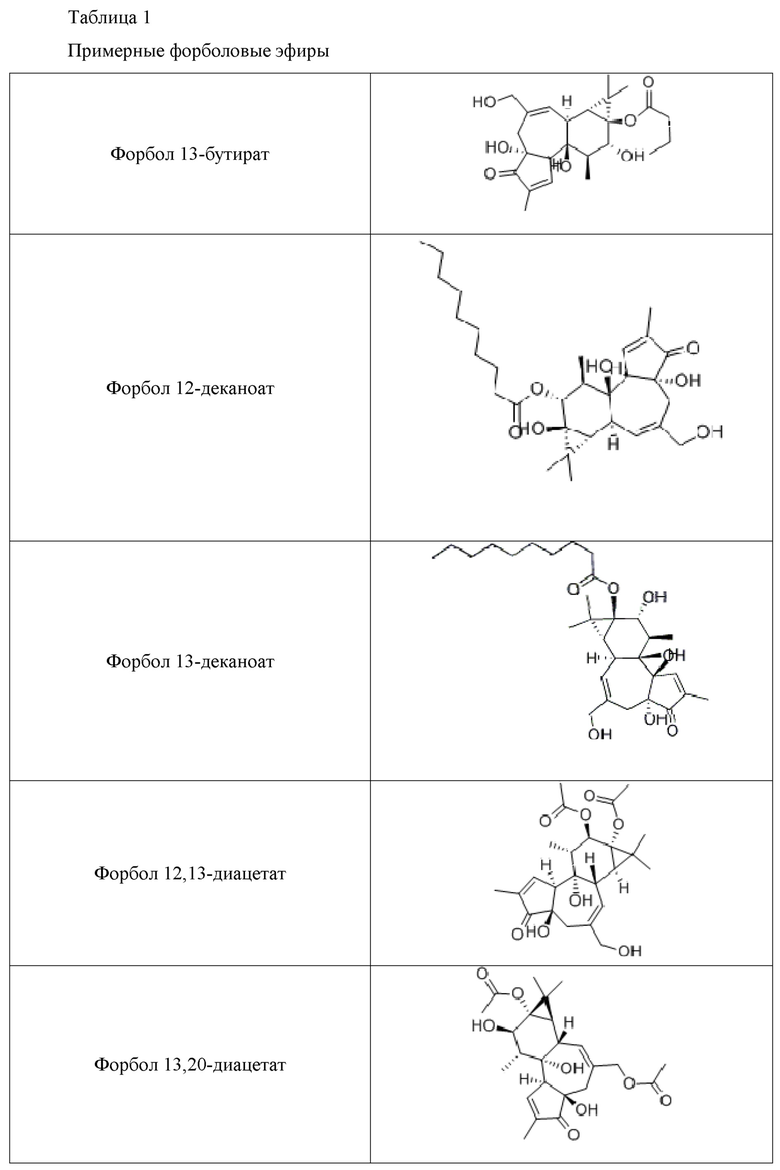
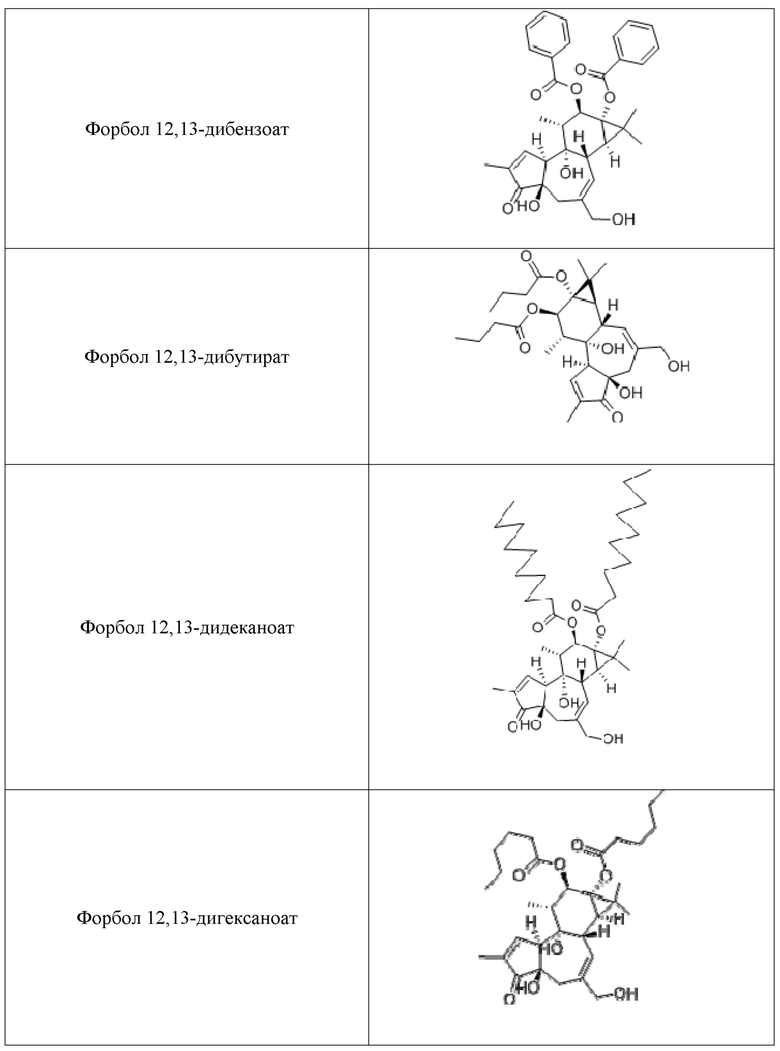
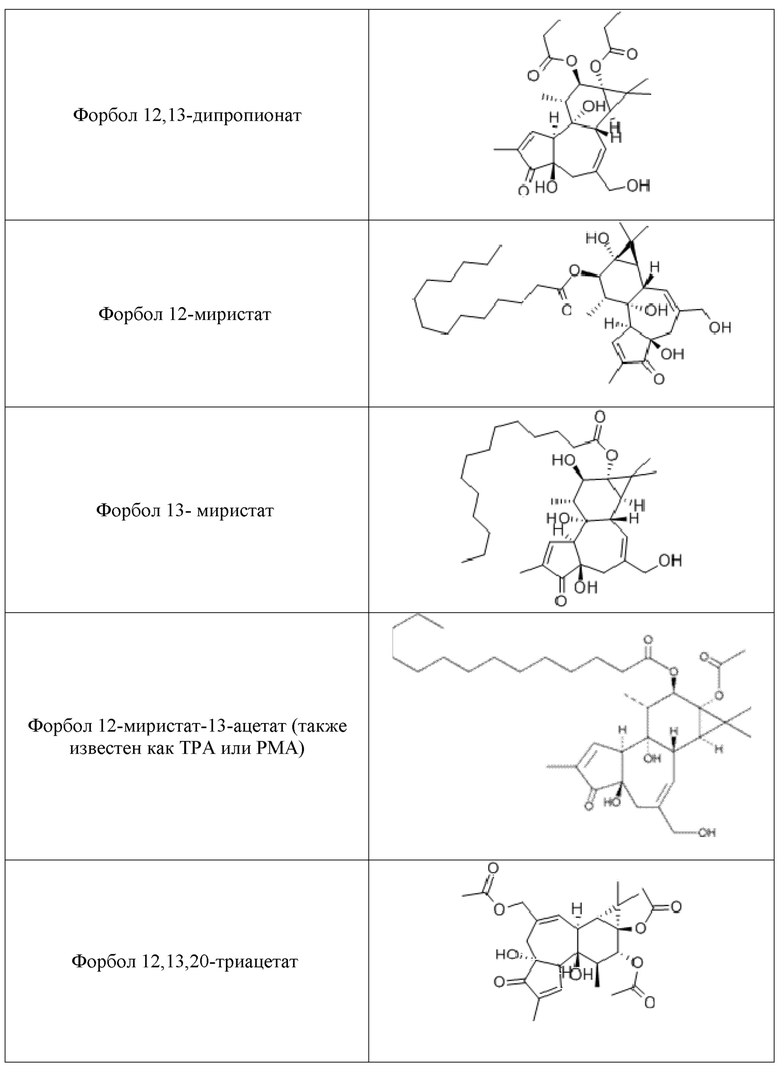
Используемые форболовые эфиры формулы I и схожие соединения и производные в композициях и способах настоящего изобретения включают другие фармацевтически приемлемые активные соли указанных соединений, такие как активные изомеры, энантиомеры, полиморфы, гликозилированные производные, сольваты, гидраты, и/или пролекарства указанных соединений, но не ограничиваются ими. Примерные формы форболовых эфиров для использования в композициях и способах настоящего изобретения включают форбол 13-бутират, форбол 12-деканоат, форбол 13-деканоат, форбол 12,13-диацетат, форбол 13,20- диацетат, форбол 12,13-дибензоат, форбол 12,13-дибутират, форбол 12,13-дидеканоат, форбол 12,13-дигексаноат, форбол 12,13-дипропионат, форбол 12-миристат, форбол 13-миристат, форбол 12,13,20-триацетат, 12-дезоксифорбол 13-ангелат, 12-дезоксифорбол 13-ангелат 20-ацетат, 12-дезоксифорбол 13-изобутират, 12-дезоксифорбол 13-изобутират-20-ацетат, 12-дезоксифорбол 13-фенилацетат, 12-дезоксифорбол 13-фенилацетат 20-ацетат, 12-дезоксифорбол 13-тетрадеканоат, форбол 12-тиглиат 13-деканоат, 12-дезоксифорбол 13-ацетат, форбол 12-ацетат, или форбол 13-ацетат, но не ограничиваются ими.
Субъекты, которыми являются млекопитающие, поддаются лечению форболовым эфиров формулы I или производными форболового эфира формулы I, в частности, ТРА, в соответствии со способами согласно настоящему изобретению, включают лиц, которые пострадали или находятся в группе риска инсульта, но не ограничиваются ими. Субъекты поддаются лечению форболовым эфиром формулы I, в частности TPA, дополнительно включают страдающих от последствий инсульта, в том числе от паралича, пространственного нарушения, помутнения сознания, синдрома игнорирования слева, потери памяти, афазии, нарушения координации и равновесия, тошноты, рвоты, когнитивных нарушений, нарушения восприятия, нарушения ориентации, омонимичной гемианопии и импульсивности, но не ограничиваясь ими.
Этих и других субъектов эффективно лечат профилактически и/или терапевтически, путем введения субъекту эффективного количества форболового эфира формулы I или производных форболового эфира формулы I, в достаточном количестве для модулирования NF-κB активности, увеличения активности цитокинов Th1, профилактики или лечения паралича, улучшения ориентации в пространстве, снижения потери памяти, снижения афазии, улучшения координации и равновесия, предотвращения или уменьшения частоты и степени тяжести инсульта, а также улучшения когнитивных функций.
Терапевтически полезные способы и композиции настоящего изобретения будут эффективно использовать форболовый эфир формулы I или производное форболового эфира формулы I в различных формах, как отмечалось выше, включая любые активные, фармацевтически приемлемые соли указанных соединений, а также активные изомеры, энантиомеры, полиморфы, сольваты, гидраты, пролекарства, и/или их комбинации. TPA формулы II используют в качестве иллюстративного варианта осуществления изобретения в примерах ниже.
В дополнительных аспектах изобретения, комбинированные композиции и способы, которые используют эффективное количество форболового эфира формулы I или производного форболового эфира формулы I в сочетании с одним или более вторичным или вспомогательным активным агентом(ами), которые сформулированы вместе или координационно вводятся с форболовым эфиром формулы I, для получения эффективного ответа у субъекта.
Комбинированные композиции и координированные способы лечения при лечении инсульта используют форболовый эфир формулы I или производное форболового эфира формулы I в сочетании с одним или более дополнительных вторичных или сопряженных терапевтических агентов для профилактики, лечения инсульта или других показаний. Вторичные или сопряженные терапевтические агенты, используемые в сочетании с форболовым эфиром, например, TPA, в этих вариантах реализации изобретения могут обладать прямым или косвенным воздействием на предотвращение или восстановление после инсульта, отдельно или в сочетании с форболовым эфиром, например, TPA; могут проявлять другую полезную дополнительную терапевтическую активность в сочетании с, например, TPA (например, антикоуголяционную, антихолестеролемную, сосудорасширяющую, антигипертензивную, снижение артериольного сопротивления, повышение венозной емкости, снижение потребности сердца в кислороде, уменьшение частоты сердечных сокращений, стабилизации частоты сердечных сокращений или нейропротекции); или могут проявлять дополнительную терапевтическую активность, полезную для лечения или профилактики инсульта, или отдельно или в сочетании со связанными с ним симптомами, например TPA. Такие вторичные или сопряженные терапевтические агенты можно вводить до, одновременно с или после введения форболового эфира формулы I или производного форболового эфира формулы I.
Полезные дополнительные или вторичные терапевтические агенты в этих комбинированных композициях и координированных способах лечения для профилактики или лечения инсульта у субъекта, которым является млекопитающее, включают активаторы тканевого плазминогена, антикоагулянты, статины, блокаторы рецепторов ангиотензина II, ангиотензин-превращающий фермент, антитромбоцитарные средства, бета-блокаторы, аспирин, фибраты, блокаторы кальциевых каналов или диуретики, но не ограничиваются ими. Кроме того, может быть использована вспомогательная или вторичная терапия, такая как хирургическое вмешательство, в том числе, каротидная эндартерэктомия, ангиопластика, баллонная ангиопластика, пластика и замена клапана, аортокоронарное шунтирование, установка стента, краниотомия, эндоваскулярная спиральная эмболизация или закрытие открытого овального отверстия, но не ограничиваясь этим.
Вышеизложенные и дополнительные цели, признаки, аспекты и преимущества настоящего изобретения станут очевидными из нижеследующего подробного описания.
Детальное описание изобретения
Новые способы и композиции были определены для использования в предупреждении и/или лечении инсульта и осложнений инсульта у млекопитающих, включая человека.
В различных вариантах осуществления композиции и способы, описанные в настоящем документе, могут увеличивать высвобождение цитокинов Th1, увеличивать фосфорилирование ERK, модулировать активность NF-κB, предотвращать или лечить паралич, улучшать ориентацию в пространстве, уменьшать потерю памяти, снижать афазию, повышать координацию и баланс, улучшать когнитивную функцию, улучшать ориентацию, уменьшать распространенность последующих инсультов, и снижать импульсивность.
Композиции и способы, представленные в настоящем документе, используют форболовый эфир формулы I или производные форболового эфира формулы I как более подробно описано в заявке на патент US № 12/023753, поданной 31 января 2008, приоритет которой заявлен в предварительной заявке на патент US серийный №60/898810, поданной 31 января 2007, которая включена в настоящее описание во всей своей полноте посредством ссылки,

Формула I
где R1 и R2 могут быть водородом; гидроксилом; 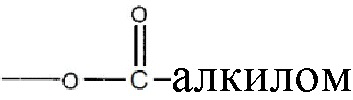 , где алкильная группа содержит от 1 до 15 атомов углерода;
, где алкильная группа содержит от 1 до 15 атомов углерода; 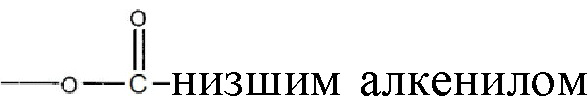 , где низшая алкенильная группа содержит от 1 до 7 атомов углерода;
, где низшая алкенильная группа содержит от 1 до 7 атомов углерода; 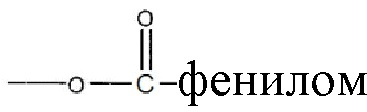 ;
; 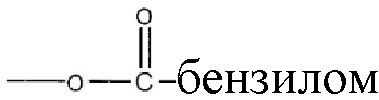 ; и их замещенными производными. R3 независимо может быть водородом или
; и их замещенными производными. R3 независимо может быть водородом или 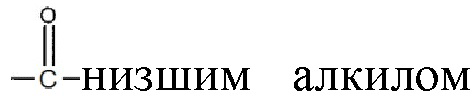 .
.
В некоторых вариантах реализации изобретения, по меньшей мере, один из R1 и R2 отличается от водорода и R3 представляет водород или 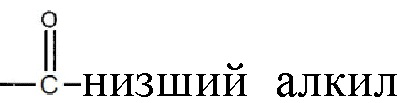 и их замещенные производные, как новые соединения для применения в лечении хронических или рецидивирующих состояний. В другом варианте реализации изобретения, или R1, или R2 представляет собой
и их замещенные производные, как новые соединения для применения в лечении хронических или рецидивирующих состояний. В другом варианте реализации изобретения, или R1, или R2 представляет собой 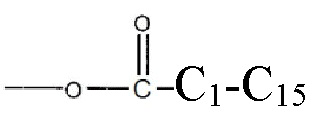 алкил, а оставшийся R1 или R2 представляет собой
алкил, а оставшийся R1 или R2 представляет собой 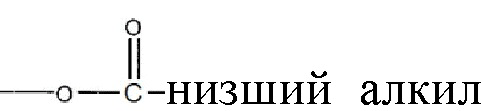 , где низший алкил содержит от 1 до 7 углеродов, и R3 представляет собой водород.
, где низший алкил содержит от 1 до 7 углеродов, и R3 представляет собой водород.
Алкильная, алкенильная, фенильная и бензильная группы в формулах в настоящем документе могут быть незамещены или замещены галогенами, предпочтительно, хлором, фтором или бромом; нитро; амино и/или похожими типами радикалов.
Композиции и способы для лечения инсульта, предусмотренные в настоящем документе, используют форболовый эфир формулы I или производное форболового эфира формулы I, представленные выше, включая все активные фармацевтически приемлемые соединения этого описания, а также различные предусмотренные и легко предусматриваемые комплексы, соли, сольваты, изомеры, энантиомеры, полиморфы и пролекарства, указанных соединений и их комбинации в качестве агентов против инсультов.
Композиции и способы для повышения Th1 цитокинов, предусмотренные в настоящем документе, используют форболовый эфир или производное формулы I, указанный выше, включая все активные фармацевтически приемлемые соединения по данному описанию, а также различные предусмотренные и легко предусматриваемые комплексы, соли, сольваты, изомеры, энантиомеры, полиморфы и пролекарства указанных соединений и их комбинации, как новые агенты для повышения уровня цитокинов Th1. Широкий спектр млекопитающих, в том числе человека, в качестве субъекта, поддающегося лечению с помощью композиций и способов изобретения. Эти субъекты включают лиц, которые пострадали или подвержены риску инсульта, но не ограничиваются ими.
Композиции и способы для повышения ERK фосфорилирования, предусмотренные в настоящем документе, используют форболовый эфир или производное формулы I, указанные выше, включают все активные фармацевтически приемлемые соединения по данному описанию, а также различные предусмотренные и легко предусматриваемые комплексы, соли, сольваты, изомеры, энантиомеры, полиморфы и пролекарства указанных соединений и их комбинации, в качестве новых агентов для повышения ERK фосфорилирования. Широкий спектр млекопитающих, в том числе человека в качестве субъекта, поддается лечению с помощью композиций и способов изобретения. Эти субъекты включают лиц, которые пострадали или подвержены риску инсульта, но не ограничиваются ими.
В способах и композициях изобретения, один или несколько форболовых эфиров формулы I или производных форболового эфира формулы I, как описано в настоящем документе, являются эффективно сформулированными или введенными в качестве средства, эффективного для лечения и профилактики инсульта или осложнений инсульта. В примерных вариантах реализации изобретения TPA продемонстрировал в иллюстративных целях эффективность в качестве агента в фармацевтических композициях и терапевтических способах, отдельно или в комбинации с одним или более вспомогательных терапевтических агентов. Настоящее изобретение дополнительно обеспечивает дополнительные фармацевтически приемлемые форболовые эфиры в форме природного или синтетического соединения, в том числе комплексов, производных, солей, сольватов, изомеров, энантиомеров, полиморфов и пролекарственных соединений, раскрытых в настоящем документе, и их комбинации, которые эффективны в качестве терапевтических агентов в способах и композициях, согласно изобретению, в лечении и профилактике инсульта и осложнений инсульта.
Инсульт вызывается нарушением кровоснабжения мозга. Это может быть результатом или закупорки (ишемический инсульт), или разрыва кровеносного сосуда (геморрагический инсульт). Симптомы инсульта включают внезапное онемение или слабость, особенно на одной стороне тела; внезапное замешательство или проблемы с речью или пониманием речи; внезапное ухудшение зрения в одном или обоих глазах; внезапные проблемы с ходьбой, головокружение или потерю равновесия или координации; или внезапную сильную головную боль без определенной причины. Факторы риска для инсульта включают высокое кровяное давление, аномальные уровни липидов в крови, употребление табака, отсутствие физической активности, ожирение, стресс, диабет, употребление алкоголя, избыточный гомоцистеин в крови, воспаление и ненормальная коагуляция. Есть также немодифицируемые факторы риска, такие как возраст, наследственность, пол и этническая принадлежность.
Лечение инсульта имеет три отдельных этапа: профилактика, лечение сразу после инсульта и реабилитация после инсульта. Композиции и способы, описанные в настоящем документе, могут быть использованы на любом этапе лечения инсульта, самостоятельно или в сочетании с одной или несколькими дополнительными терапиями, включая другие фармацевтические агенты, устройства или хирургические вмешательства.
Форбол является природным полициклическим спиртом растительного происхождения тиглианового семейства дитерпенов. Впервые он был выделен в 1934 году в качестве продукта гидролиза кротонового масла, полученного из семян Croton tiglium. Он хорошо растворим в большинстве полярных органических растворителей и в воде. Эфиры форбола имеют общую структуру формулы I, приведенную ниже:

Формула I
где R1 и R2 выбирают из группы, включающей водород; гидроксил; 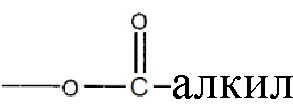 , где алкильная группа содержит от 1 до 15 атомов углерода;
, где алкильная группа содержит от 1 до 15 атомов углерода; 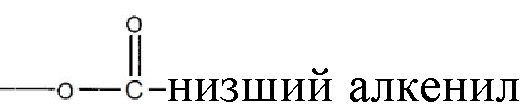 , где низшая алкенильная группа содержит от 1 до 7 атомов углерода;
, где низшая алкенильная группа содержит от 1 до 7 атомов углерода; 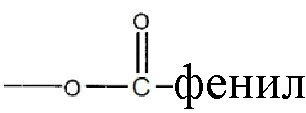 ;
; 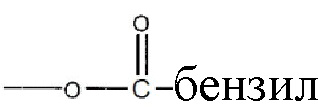 ; и их замещенные производные. R3 может быть водородом или
; и их замещенные производные. R3 может быть водородом или 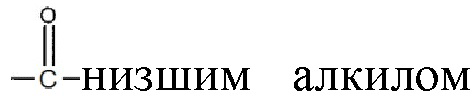 и их замещенными производными, так же как фармацевтически приемлемые соли, энантиомеры, полиморфы, пролекарства, сольваты и гидраты соединений формулы I.
и их замещенными производными, так же как фармацевтически приемлемые соли, энантиомеры, полиморфы, пролекарства, сольваты и гидраты соединений формулы I.
Термины "низший алкил" или "низший алкенил", как здесь используется, означает заместители, содержащие от 1 до 7 атомов углерода. В соединениях формулы I, алкильная или алкенильная группа могут иметь прямую или разветвленную цепь. В некоторых вариантах реализации изобретения или один или оба из R1 или R2, являются длинноцепочечным углеродным заместителем (то есть формула I представлена деканоатом или миристатом).
Алкильная, алкенильная, фенильная и бензильная группы в формулах настоящего документа могут быть незамещены или замещены галогенами, предпочтительно, хлором, фтором или бромом; нитро; амино и похожими типами радикалов.
Органические и синтетические формы форболовых эфиров, в том числе любые препараты или экстракты из растительных источников, таких как Croton tiglium, рассматриваются как полезные композиции, включающие форболовые сложные эфиры (или аналоги эфиров форбола, связанные соединения и/или производные) для использования в вариантах реализации изобретения в настоящем документе. Полезные форболовые эфиры и/или родственные соединения для использования в вариантах реализации изобретения в настоящем документе, как правило, имеют структуру, как показано на формуле I, хотя функционально эквивалентные аналоги, комплексы, конъюгаты и производные этих соединений также будут понятны специалистам в данной области в рамках настоящего изобретения.
В более подробных вариантах реализации изобретения будут выбраны иллюстративные структурные модификации в соответствии с формулой I, приведенной выше, для того чтобы обеспечить полезные соединения-кандидаты для лечения и/или профилактики инсультов, повреждений в результате инсульта и/или управления последствиями или осложнениями инсультов у млекопитающих, включая человека, где, по меньшей мере, один из R1 и R2 является отличным от водорода и R3 выбирают из группы, состоящей из водорода, или  и их замещенных производных. В другом варианте реализации изобретения, или R1, или R2 представляет собой
и их замещенных производных. В другом варианте реализации изобретения, или R1, или R2 представляет собой 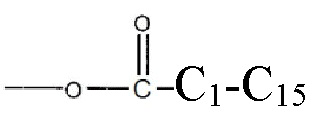 алкил, а оставшийся R1 или R2 представляет собой
алкил, а оставшийся R1 или R2 представляет собой 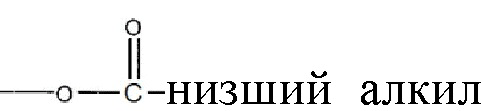 и R3 является водородом.
и R3 является водородом.
В примерном варианте реализации форболовый эфир формулы I полезный в лечении или предотвращении инсультов, нарушений, вызванных инсультом, и/или управления эффектами или последствиями инсультов у млекопитающих, включая человека, выбирают из форбол 12-миристат-13-ацетата (также известного как PMA или 12-O-тетрадеканоил-форбол-13-ацетат (TPA)) показанного на формуле II, приведенной ниже.

Формула II
Дополнительные полезные форболовые эфиры и родственные соединения и их производные в пределах композиций и способов изобретения, включают другие фармацевтически приемлемые активные соли указанных соединений, а также активные изомеры, энантиомеры, полиморфы, гликозилированные производные, сольваты, гидраты и/или пролекарства указанных соединений, но не ограничиваются ими. Производные форболовых эфиров формулы I могут или не могут быть собственно форболовыми эфирами. Дальнейшие примеры форм форболовых эфиров для использования в композициях и способах, согласно настоящему изобретению, включают форбол 13-бутират, форбол 12-деканоат, форбол 13-деканоат, форбол 12,13-диацетат, форбол 13,20-диацетат, форбол 12,13-дибензоат, форбол 12,13-дибутират, форбол 12,13-дидеканоат, форбол 12,13-дигексаноат, форбол 12,13-дипропионат, форбол 12-миристат, форбол 13-миристат, форбол 12,13,20-триацетат, 12-дезоксифорбол 13-ангелат, 12-дезоксифорбол 13-ангелат 20-ацетат, 12-дезоксифорбол 13-изобутират, 12-дезоксифорбол 13-изобутират-20-ацетат, 12-дезоксифорбол 13-фенилацетат, 12-дезоксифорбол 13-фенилацетат 20-ацетат, 12-дезоксифорбол 13-тетрадеканоат, форбол 12-тиглиат 13-деканоат, 12-дезоксифорбол 13-ацетат, форбол 12-ацетат, и форбол 13-ацетат, но, не ограниваясь ими; как показано в Таблице 1.
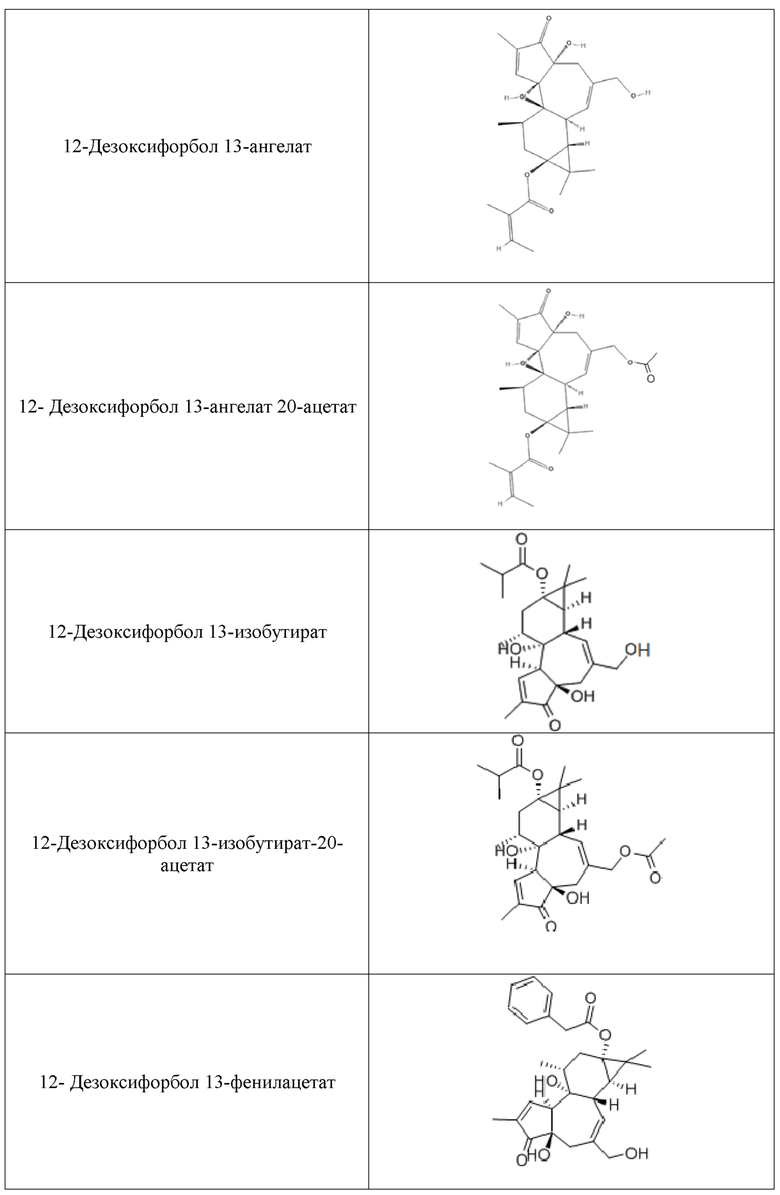
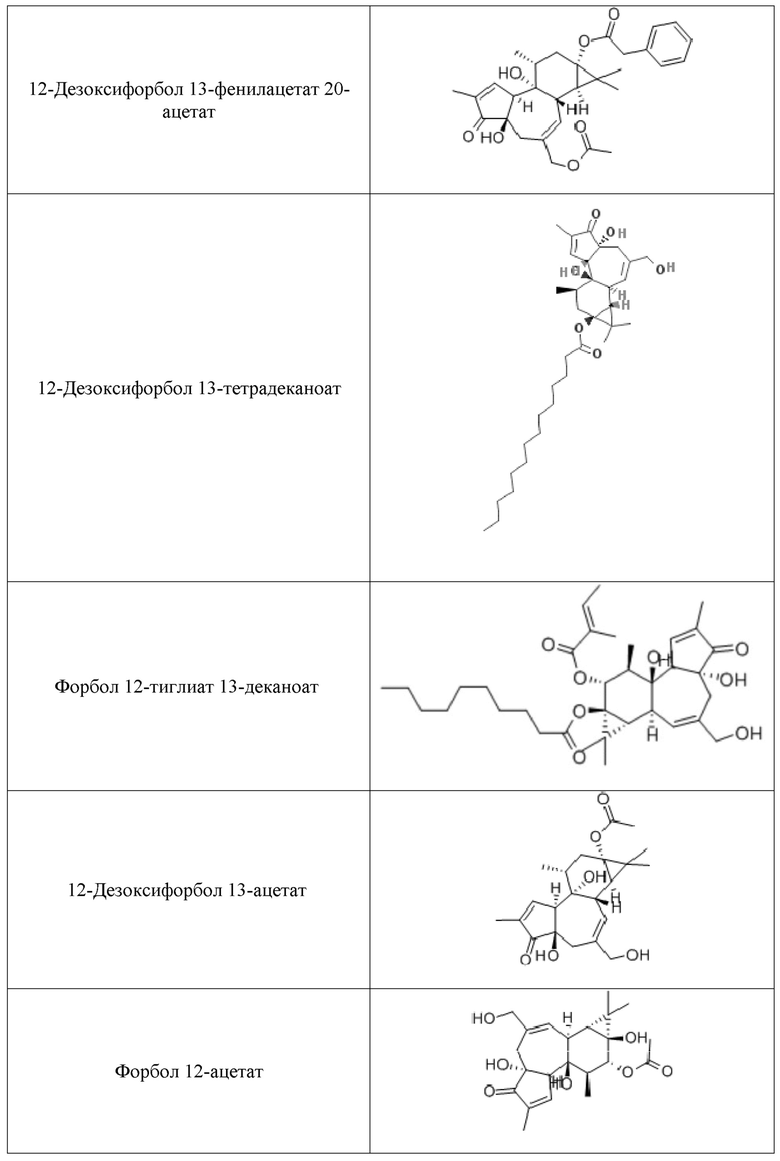

Композиции, описанные в настоящем документе, содержат композиции для лечения инсульта, включающие эффективное количество форболового эфира формулы I или производного форболового эфира формулы I, смягчающее или предотвращающее повреждения после инсульта и которое эффективно для профилактики и/или лечения инсульта или симптомов, связанных с инсультом или осложнений у млекопитающих. "Лечащее инсульт", "антикоагулирующее", "антихолостеромическое", "сосудорасширяющее", "антигипертензивное", "снижающее артериольное сопротивление", "повышающее венозную емкость", "сокращающее потребность сердца в кислороде", "уменьшающее частоту сердечных сокращений", "стабилизирующее частоту сердечных сокращений" или "нейропротекторное" эффективное количество активного соединения является терапевтически эффективным в отдельной или множественной единичной дозированной форме, в течение определенного периода терапевтического вмешательства, чтобы заметно уменьшить один или несколько симптомов или осложнений инсульта у субъектов. В иллюстративных вариантах реализации, композиции по настоящему изобретению являются эффективными в способах лечения, для предотвращения или облегчения симптомов инсульта или осложнений инсульта у человека и других млекопитающих, подверженных или которые перенесли инсульт.
Композиции форболового эфира для лечении согласно изобретению обычно содержат эффективное количество или единичную дозу форболового эфира формулы I или производного форболового эфира формулы I, которое могут быть помещено в композицию с одним или несколькими фармацевтически приемлемыми носителями, наполнителями, растворителями, эмульгаторами, стабилизаторами, консервантами, буферами и/или другими добавками, которые могут повысить стабильность, высвобождение, поглощение, период полураспада, эффективность, фармакокинетику и/или фармакодинамику, уменьшить неблагоприятные побочные эффекты или предоставляют другие преимущества для использования в фармацевтических целях. Эффективные количества форболового эфира или соответствующего производного или соединения формулы I (например, единичная доза, содержащая эффективную концентрацию/количество TPA или выбранную фармацевтически приемлемую соль, изомер, энантиомер, сольват, полиморф и/или пролекарство TPA) будут легко определены обычным специалистом в данной области, в зависимости от клинических и пациент-специфических факторов. Подходящие эффективные количества единичной дозы активных соединений для введения млекопитающим, включая человека, могут находиться в диапазоне от приблизительно 10 до приблизительно 1500 мкг, приблизительно от 20 до приблизительно 1000 мкг, приблизительно от 25 до приблизительно 750 мкг, приблизительно от 50 до приблизительно 500 мкг, приблизительно от 150 до приблизительно 500 мкг, приблизительно от 125 мкг до приблизительно 500 мкг, приблизительно от 180 до приблизительно 500 мкг, приблизительно от 190 до приблизительно 500 мкг, приблизительно от 220 до приблизительно 500 мкг, приблизительно от 240 до приблизительно 500 мкг, приблизительно от 260 до приблизительно 500 мкг, приблизительно от 290 до приблизительно 500 мкг. В некоторых вариантах реализации изобретения, эффективные дозы форболового эфира или соответствующего производного или соединения формулы I для лечения заболевание, могут быть выбраны в пределах узких диапазонов, например, от 10 до 25 мкг, 30-50 мкг, 75 мкг до 100, от 100 до 300 мкг, или 150 до 500 мкг. Эти и другие эффективные единицы дозирования количества могут быть введены в виде единичной дозы или в виде множественных ежедневных, еженедельных или ежемесячных доз, например, в режиме дозирования, содержащем от 1 до 5, или от 2 до 3, введенных доз в день, в неделю, или в месяц. В одном варианте реализации изобретения дозы от 10 до 30 мкг, от 30 до 50 мкг, от 50 до 100 мкг, от 100 до 300 мкг, или от 300 до 500 мкг вводят один, два, три, четыре или пять раз в день. В последующих вариантах реализации изобретения, дозы 50-100 мкг, 100-300 мкг, 300-400 мкг, или 400-600 мкг вводят один или два раза в день. В дополнительном варианте реализации изобретения, дозы 50-100 мкг, 100-300 мкг, 300-400 мкг, или 400-600 мкг вводят через день. В альтернативных вариантах реализации изобретения, дозы рассчитаны на основе массы тела и могут быть введены, например, в количествах от приблизительно 0,5 мкг/м2 до приблизительно 300мкг/м2 в день, приблизительно от 1 мкг/м2 до приблизительно 200 мкг/м2, приблизительно от 1 мкг/м2 до приблизительно 187.5 мкг/м2 в день, приблизительно от 1 мкг/м2 в день до приблизительно 175 мкг/м2 в день, приблизительно от 1 мкг/м2 в день до приблизительно 157 мкг/м2 в день, приблизительно от 1 мкг/м2 до приблизительно 125 мкг/м2 в день, приблизительно от 1 мкг/м2 до приблизительно 75 мкг/м2 в день, 1 мкг/м2 до приблизительно 50/ мкг/м2 в день, 2 мкг/м2 до приблизительно 50 мкг/м2 в день, 2 мкг/м2 до приблизительно 30 мкг/м2 в день или 3 мкг/м2 до приблизительно 30 мкг/м2 в день.
В одном варианте реализации изобретения дозы можно вводить менее часто, например, от 0,5 мкг/м2 до приблизительно 300 мкг/м2 через день, от приблизительно 1 мкг/м2 до приблизительно 200 мкг/м2, от приблизительно 1 мкг/м2 до приблизительно 187,5 мкг/м2 через день, от приблизительно 1 мкг/м2 до приблизительно 175 мкг/м2 через день, от приблизительно 1 мкг/м2 в день до приблизительно 157 мкг/м2 через день, от приблизительно 1 мкг/м2 до приблизительно 125 мкг/м2 через день, от приблизительно 1мкг/м2 до приблизительно 75 мкг/м2 через день, от 1 мкг/м2 до приблизительно 50 мкг/м2 через день, от 2 мкг/м2 до приблизительно 50 мкг/м2 через день, от 2 мкг/м2 до приблизительно 30 мкг/м2 в день или от 3 мкг/м2 до приблизительно 30 мкг/м2 в день. В дополнительном варианте реализации изобретения дозы можно вводить 3 раза/неделю, 4 раза/неделю, 5 раз/неделю, только в будние дни, только при взаимодействии с другими схемами лечения, в последующие дни, или в соответствующем режиме дозирования в зависимости от клинических и пациент-специфических факторов.
Количество, сроки и режим высвобождения композиций изобретения, содержащих (альтернативно "лечащую инсульт", "антикоагулирующее", "противохолеростемическое", "сосудорасширяющее", "гипотензивное", "снижающее артериольное сопротивление", "повышающее венозную емкость", "снижающее потребность сердца в кислороде", "уменьшающее частоту сердечных сокращений", "стабилизирующее частоту сердечных сокращений", "вызывающее ERK фосфорилизацию", "модулирующее IL-2" и/или "нейропротективное") эффективное количество соединения форболового эфира формулы I или производного форболового эфира формулы I, будет обычно корректироваться на индивидуальной основе, в зависимости от таких факторов, как вес, возраст, пол и состояние индивидуума, острота заболевания и/или связанные с ним симптомы, является ли введение профилактическим или терапевтическим и на основе других факторов, известных для осуществления высвобождения лекарственного средства, абсорбции и фармакокинетики, в том числе периода полураспада и эффективности.
Эффективная доза или многодозовая схема лечения для лечения текущего заболевания (альтернативно, "лечения инсульта", "антикоагуляции", "противохолеростемического действия", "сосудорасширения", "антигипертензивного действия", "ERK фосфорилирования", "снижения артериольного сопротивления", повышения венозной емкости", "снижения потребности сердца в кислороде", "уменьшения частоты сердечных сокращений", "стабилизации частоты сердечных сокращений", "уменьшения свертывание крови", "нейропротективного действия", "модулирования IL-2" или "модулирования NFκB”) композиций изобретения будут обычно выбираться так, чтобы приблизить минимальный режим дозирования, который необходим и достаточен, для существенного предотвращения или облегчения симптомов инсульта у субъекта. Дозировки и протокол введения часто включают повторное введение в течение курса в несколько дней или даже одной или нескольких недель или лет. Эффективный режим лечения может также включать профилактически вводимую дозу в день или несколько доз в день, который в основном длится в течение дней, недель, месяцев или даже лет.
Эффективность композиций и способов изобретения для лечения инсульта может быть продемонстрирована с использованием различных модельных систем, включая временную закупорку средней мозговой артерии, как показано в примере 9, постоянную закупорку средней мозговой артерии, как показано в примере 8, закупорку эндоваскулярной нити средней мозговой артерии, эмболию при закупорке средней мозговой артерии, как показано в примере 7, эндотелин-1-индуцированное сужение артерий и вен или цереброкортикальный фототромбоз. Использование форболовых эфиров в композициях настоящего изобретения снижает симптомы или долгосрочные эффекты, демонстрируемые модельными системами на 0%, 20%, 30%, 50% или более, вплоть до 75-90%, 96% или большего снижения у контрольных животных.
Эффективность композиций и способов изобретения в лечении инсульта может быть дополнительно продемонстрирована уменьшением проявления симптомов у лиц, которые перенесли инсульт. Такие симптомы включают паралич, нарушение пространственного восприятия, помутнение сознания, синдром игнорирования слева, потерю памяти, афазию, проблемы с координацией и равновесием, тошноту, рвоту, когнитивные нарушения, нарушения восприятия, ухудшение ориентации, омонимичную гемианопию и импульсивность, но не ограничиваются ими. Использование форболовых эфирных композиций настоящего изобретения будут снижать проявление симптомов у лиц на 0%, 20%, 30%, 50% или более, вплоть до 75-90%, 96% или большего снижения по сравнению с начальными состояниями.
В дополнительных аспектах изобретения, обеспечивается комбинированное лечение болезни ("лечение инсульта", "антикоагуляция", "противохолеростемическое действие", "сосудорасширяющее действие", "антигипертензивное действие", "индуцирующее ERK фосфорилирование", "понижение артериольного сопротивление", "повышение венозной емкости", "сокращение сердечной потребности в кислороде", "уменьшение частоты сердечных сокращений", "стабилизация частоты сердечных сокращений", или “NFκB модуляции"), композиции и способы координированного введения, в которых применяют эффективное количество форболового эфира формулы I или производного формулы I и один или несколько вторичных или дополнительных агентов, которые комбинированно введены в композицию или координационно вводятся с форболовым эфиром формулы I для получения комбинированной, мультиактивной композиции для лечения заболевания или координированного способа лечения.
Примерные комбинаторные композиции и координированные способы лечения для профилактики или лечения инсульта используют форболовый эфир формулы I или производное форболового эфира формулы I в комбинации с одним или несколькими дополнительными, нейропротекторными или другим показанными, вторичными или дополнительными терапевтическими агентами, которые являются полезными для лечения или профилактики целевого заболевания, состояния и/или симптома(ов). Для большинства комбинированных композиция и координированных способов лечения изобретения, форболовый эфир формулы I или схожее или производное соединение формулируют или координационно вводят в комбинации с одним или несколькими вторичными или вспомогательными терапевтическими агентами(ом), с получением комбинированной композиции или координированного способа лечения, который комбинаторно эффективен или координационно полезен для предотвращения или лечения инсульта или последствий инсульта. Примерные комбинаторные композиции и координированные способы лечения в данном контексте используют форболовый эфир формулы I или производное форболового эфира формулы I в комбинации с одним или несколькими вторичными или дополнительными терапевтическими агентами, выбранными из тканевого активатора плазминогена, антикоагулянта, статина, блокаторов рецепторов ангиотензина II, ингибиторов ангиотензин-превращающего фермента, анти-тромбоцитных агентов, фибратов, бета-блокаторов, блокаторов кальциевых каналов или диуретиков. Примеры антикоагулянтов включают гепарин, варфарин, фениндион, гепариноиды, атоментин, аценокумарол, ингибиторы фенпрокумона, идрапаринукс, фондапаринукс и тромбин, но не ограничиваются ими. Примеры статинов включают ловастатин, амлодипин, аторвастатин, розувастатин, симвастатин, флувастатин, питавастатин и правастатин, но не ограничиваются ими. Примеры блокаторов рецепторов ангиотензина II включают кандесартан, эпросартан, ирбесартан, лозартан, олмесартан, телмисартан и валсартан, но не ограничиваются ими. Ингибиторы ангиотензинпревращающего фермента включают эназиприл, каптоприл, эналаприл, фозиноприл, исиноприл, моэксиприл, периндоприл, хинаприл, рамиприл и трандолаприл, но не ограничиваются ими. Типичные бета-блокаторы включают алпренолол, буциндолол, картеолол, карведилол, лабеталол, надолол, окспренолол, пенбутолол, пиндолол пропранолол, соталол, тимолол, эвкоммия, ацебутолол, атенолол, бетаксолол, бисопролол, целипролол, эсмолол, метопролол, и небиволол, но не ограничиваются ими. Примеры блокаторов кальциевых каналов включают амлодипин, клевидипин, дилтиазем, фелодипин, исрадипин, нифедипин, никардипин, нимодипин, низолдипин и верапамил, но не ограничиваются ими. Примеры диуретиков включают хлоротиазид, гидрохлоротиазид, буметанид, этакриновую кислоту, фуросемид, амилорид, спиронолактон, эплеренон и триамтерен, но не ограничиваются ими. Примеры фибратов включают бензафибрат, ципрофибрат, клофибрат, гемфиброзил или фенофибрат, но не ограничиваются ими. Примеры антитромбоцитарных агентов включают клопидогрель и тиклопидин, но не ограничиваются ими.
Координированные способы лечения могут дополнительно использовать хирургическое вмешательство, включая использование кардиостимуляторов, имплантируемых дефибрилляторов, коронарных стентов, искусственных клапанов, аортокоронарного шунтирования, баллонную ангиопластику, пластику и замену клапана, каротидную эндартерэктомию, ангиопластику, размещение стента, трепанацию черепа, эндоваскулярную спиральную эмболизацию, закрытие открытого овального отверстия и трансплантацию сердца, но не ограничиваясь ими.
В некоторых вариантах реализации настоящее изобретение обеспечивает комбининаторное лечение болезни ("лечение инсульта", "антикоагуляцию", "противохолестеролемическое действие", "сосудорасширяющее действие", "антигипертензивное действие", "индуцирование ERK фосфорилирования", "снижение артериольного сопротивления", "повышение венозной емкости", "сокращение сердечной потребности в кислороде", "уменьшение частоты сердечных сокращений", "стабилизацию частоты сердечных сокращений" или “NFκB модуляцию”) композицией содержащей форболовый эфир и один или больше добавочных агентов, активных в лечении болезни. В таких комбинаторных композициях, форболовый эфир формулы I и дополнительный агент(ы), активный в лечении болезни, будут присутствовать в комбинированной композиции для лечения болезни ("лечение инсульта", "антикоагуляцию", "противохолестеролемическое действие", "сосудорасширяющее действие", "антигипертензивное действие", "индуцирование ERK фосфорилирования", "снижение артериольного сопротивления", "повышение венозной емкости", "сокращение сердечной потребности в кислороде", "уменьшение частоты сердечных сокращений", "стабилизацию частоты сердечных сокращений" или “NFκB модуляцию”) в эффективных количествах, по отдельности или в комбинации. В примерных вариантах реализации изобретения, форболовый эфир формулы I и дополнительный агент(ы) нефорболовый эфир будут присутствовать в количестве для лечения/предотвращения болезни (то есть, в особой дозировке, которая будет самостоятельно вызывать детектируемое ослабление симптомов у субъекта). С другой стороны, комбинаторная композиция может содержать один из или и форболовый эфир формулы I, и нефорболовоый эфир в субтерапевтическом единичном дозированном количестве(ах), где комбинаторная композиция, включающая оба агента, отличается комбинированной дозировкой обоих агентов, которые коллективно эффективны для облегчения вызванного заболевания, состояния или симптома. Таким образом, и форболовый эфир формулы I или производное форболового эфира формулы I и нефорболовый эфир могут присутствовать в композиции или вводиться согласно протоколу введения в субтерапевтических дозах, но в совокупности в композиции или способе они вызывают детектируемое уменьшение симптомов болезни, возникновения или рецидив инсульта или осложнений от инсульта у субъекта. В еще одном варианте реализации, комбинаторная композиция может включать один или несколько нейропротекторов. В дополнительном варианте реализации, комбинаторная композиция может включать один или более противовоспалительных агентов или других вторичных или дополнительных терапевтических агентов, как описано в настоящем документе.
Для практики координированных способов введения изобретения, в настоящем документе предполагается, что форболовый эфир формулы I или производное форболового эфира формулы I могут быть введены одновременно или последовательно, в соответствии с протоколом лечения с одним или более вторичных или дополнительных терапевтических агентов. Таким образом, в некоторых вариантах реализации изобретения, соединение вводят согласованно с нефорболовым эфиром или любыми другими вторичными или дополнительным терапевтическим средством, предусмотренными в настоящем описании, с использованием отдельных композиций или комбинированной композиции, как описано выше (то есть, включающей и форболовый эфир формулы I или связанное или производное соединение, и терапевтический нефорболовый эфир). Это координированное введение может осуществляться одновременно или последовательно в любом порядке, и может быть период времени, в который только один или оба (или все) активных терапевтических агента по отдельности и/или совместно проявляют свою биологическую активность.
В другом варианте реализации изобретения, такие координированные способы лечения могут быть, например, такими, которые следуют или являются полученными из различных протоколов лечения инсульта. Координированные способы лечения могут, например, включать в себя форболовый эфир и/или процедуры для профилактики или лечения повреждений, вызванных инсультом. Отличительной чертой всех таких координированных способов лечения является то, что форболовый эфир формулы I или производное форболового эфира формулы I оказывает, по меньшей мере, некоторую активность, что дает благоприятный клинический ответ в сочетании с дополнительными агентами для профилактики или лечения инсульта или напротив, клинический ответ, вызванный вторичным или дополнительными терапевтическими агентами. Часто координирование введения форболового эфира формулы I или производного форболового эфира формулы I с вторичным или дополнительным терапевтическим агентом дает улучшенные терапевтические или профилактические результаты у субъекта, выходящие за пределы терапевтического эффекта, вызываемого форболовым эфиром формулы I или производным форболового эфира формулы I или вторичным или дополнительным терапевтическим средством, вводимым в одиночку. Эта квалификация предусматривает как непосредственные проявления, так и опосредованные.
В примерных вариантах реализации изобретения, форболовый эфир формулы I или производное форболового эфира формулы I, согласованно вводится (одновременно или последовательно, в комбинированной или отдельных композициях), с одним или более вторичных соединений для лечения инсульта или других показанных или дополнительных терапевтических агентов, например, активатор тканевого плазминогена, антикоагулянт, статин, блокаторы рецепторов ангиотензина II, ингибиторы ангиотензин-превращающего фермента, фибрат, бета-блокатор, блокатор кальциевых каналов, гиполипидемические лекарства, анти-тромбоцитные агенты или диуретик. Кроме того, вспомогательная или вторичная терапия может быть использована при лечении инсульта или эффектов, таких как инсульт, но не ограничиваясь этим, электрокардиостимулятор, имплантируемый дефибриллятор, коронарный стент, искусственные клапан, искусственное сердце, аортокоронарное шунтирование, баллонная ангиопластика, пластика и замена клапана, трансплантация сердца, каротидная эндартерэктомия, ангиопластика, стентирование, трепанация черепа, эндоваскулярная спиральная эмболизация или закрытие открытого овального отверстия.
Как отмечалось выше, во всех различных вариантах реализации настоящего изобретения, рассматриваемых в настоящем документе, способы лечения болезни и композиции могут использовать форболовый эфир формулы I в любой из разнообразных форм, включая какую-либо одну или комбинацию фармацевтически приемлемых для субъекта солей, сольватов, изомеров, энантиомеров, полиморфов, сольватов, гидратов и/или пролекарств соединения. В примерных вариантах реализации настоящего изобретения, TPA используется в терапевтических композициях и способах с целью иллюстрации.
Фармацевтические композиции настоящего изобретения могут быть введены с помощью любых средств, которые обеспечивают достижение их целевого терапевтического или профилактического назначения. Подходящие способы введения для композиций изобретения, включают обычные пути высвобождения, устройства и способы, но не ограничиваются ими, включая инъекционные способы, такие как внутривенный, внутримышечный, внутрибрюшинный, интраспинальный, онтратекальный, интрацеребровентрикулярный, внутриартериальный, подкожный и интраназальный путь, но не ограничиваясь ими.
Композиции настоящего изобретения могут дополнительно включать фармацевтически приемлемый носитель, подходящий для конкретного используемого способа введения. Лекарственные формы композиций настоящего изобретения, включают наполнители, признанные в области фармацевтических рецептур в качестве пригодных для приготовления единиц дозирования, как обсуждалось выше. Такие наполнители включают связующие вещества, наполнители, смазывающие вещества, эмульгаторы, суспендирующие агенты, подсластители, ароматизаторы, консерванты, буферы, смачивающие агенты, разрыхлители, шипучие агенты и другие обычные наполнители и добавки, но не ограничиваясь ими.
По желанию, композиции изобретения могут быть введены в форме с контролируемым высвобождением с использованием носителя замедленного высвобождения, такого как гидрофильный медленновысвобождающий полимер. Типичные агенты с контролируемым высвобождением в данном контексте, включают гидроксипропилметилцеллюлозу, имеющую вязкость в диапазоне от приблизительно 100 сП до приблизительно 100000 сП или другие биосовместимые матрицы, таких как холестерин, но не ограничиваются ими.
Некоторые композиции форболовых эфиров формулы I изобретения предназначены для парентерального введения, например, для введения внутривенно, внутримышечно, подкожно или внутрибрюшинно, в том числе водных и неводных стерильных инъекционных растворов, которые, как и многие другие рассматриваемые композиции изобретения, могут дополнительно содержать антиоксиданты, буферы, бактериостатические и/или растворенные вещества, которые делают изотонической композицию по отношению к крови млекопитающего; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и/или загустители. Композиции могут быть представлены в однодозовых или в многодозовых контейнерах. Дополнительные композиции и комбинации изобретения могут включать полимеры для пролонгированного высвобождения после парентерального введения. Парентеральные препараты могут представлять собой растворы, дисперсии или эмульсии, пригодные для такого введения. Рассматриваемые агенты также могут быть помещены в композиции в полимеры для длительного высвобождения после парентерального введения. Фармацевтически приемлемые композиции и ингредиенты, как правило, стерильны или легко стерилизуемы, биологически инертны и легко вводимы. Такие полимерные материалы хорошо известны специалистам в области фармации. Парентеральные препараты обычно содержат буферирующие агенты и консерванты и инъецируемые жидкости, которые являются фармацевтически и физиологически приемлемыми, такими как вода, физиологический раствор, сбалансированные солевые растворы, водный раствор декстрозы, глицерин или тому подобное. Неподготовленные растворы для инъекций, эмульсий и суспензий могут быть приготовлены из стерильных порошков, гранул и таблеток ранее описанного типа. Предпочтительными единично дозированными композициями являются те, которые содержат суточную дозу или единичную, суточную субдозу, как описано выше в настоящем документе, или соответствующую часть активного ингредиента(ов).
В более подробных вариантах реализации композиции настоящего изобретения могут содержать форболовый эфир формулы I или производное форболового эфира формулы I инкапсулированного для высвобождения в микрокапсулы, микрочастицы или микросферы, приготовленные, например, способами коацервации или путем межфазной полимеризации, например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы, соответственно; в коллоидных системах доставки лекарственных средств (например, липосомах, альбуминовых микросферах, микроэмульсиях, наночастицах и нанокапсулах); или в макроэмульсиях.
Как отмечалось выше, в некоторых вариантах реализации изобретения способы и композиции согласно изобретению могут использовать фармацевтически приемлемые соли, например, кислотно-аддитивные или основные соли вышеуказанных форболовых эфиров формулы I и/или родственных соединений или производных. Примеры фармацевтически приемлемых аддитивных солей включают неорганические и органические кислотно-аддитивные соли. Подходящие кислотно-аддитивные соли получают из кислот, которые образуют нетоксичные соли, например, гидрохлоридные, гидробромидные, гидройодидные, сульфатные, гидросульфатные, нитратные, фосфатные и гидрофосфатные соли. Дополнительные фармацевтически приемлемые соли включают соли металлов, такие как соли натрия, соли калия, соли цезия и им подобные; щелочноземельных металлов, таких как соли кальция, соли магния и тому подобное; соли органических аминов, такие как соли триэтиламина, соли пиридина, соли пиколина, соли этаноламина, соли триэтаноламина, соли дициклогексиламина, соли N,N'-дибензилэтилендиамина и тому подобное, но не ограничиваются ими; соли органических кислот, такие как ацетат, цитрат, лактат, сукцинат, тартрат, малеат, фумарат, манделат, ацетат, дихлорацетат, трифторацетат, оксалат, и формиат; сульфонаты, такие как метансульфонат, бензолсульфонат и п-толуолсульфонат; и соли аминокислот, такие как аргинат, аспаргинат, глутамат, тартрат и глюконат. Подходящие соли оснований получают из оснований, которые образуют нетоксичные соли, например алюминий, кальций, литий, магний, калий, натрий, цинк и диэтаноламин.
В других подробных вариантах реализации, способы и композиции согласно изобретению используют пролекарства форболовых эфиров формулы I. Пролекарствами считаются любые ковалентно связанные носители, которые высвобождают активное исходное лекарство in vivo. Примеры пролекарств, полезных в изобретении, включают сложные эфиры или амиды с гидроксиалкилом или аминоалкилом в качестве заместителя, и они могут быть получены взаимодействием таких соединений, как описано выше, с ангидридами, такими как ангидрид янтарной кислоты.
Изобретение, описанное в настоящем документе, также следует понимать как включающее способы и композиции, содержащие форболовые эфиры формулы I, использующие in vivo продукты метаболизма указанных соединений (либо, генерируемые in vivo после введения предшественника соединения субъекту, или непосредственно введения в форме самого метаболического продукта). Такие продукты могут быть получены, например, в результате окисления, восстановления, гидролиза, амидирования, эстерификации и т.д. вводимых соединений, в основном за счет ферментативных процессов. Соответственно, изобретение включает способы и композиции изобретения с применением соединений, полученных по способу, включающему контактирование форболового эфира формулы I с млекопитающим, в течение периода времени, достаточного для получения его метаболического продукта. Такие продукты, как правило, определяют путем получения меченного радиоактивным изотопом соединения настоящего изобретения, введения его парентерально в детектируемой дозе животному, такому как крыса, мышь, морская свинка, обезьяна или человек, и обеспечивают достаточное время для метаболизма и выделения его преобразованного продукта из мочи, крови или других биологических образцов.
Настоящее изобретение, раскрытое в настоящем документе, также следует понимать как включающие диагностические композиции для диагностики уровня риска, присутствия, степени тяжести или лечения признаков, или, в противном случае, управления заболеванием, включая инсульт, но не ограничиваясь этим, у млекопитающего, включающий контактирование меченого (например, меченного изотопами, флуоресцентно меченного или иным путем меченного, чтобы разрешить обнаружение меченого соединения с использованием традиционных способов) форболового эфира формулы I с млекопитающим (например, с клеткой, тканью, органом или индивидуумом), которое находится в группе риска или имеет один или более симптомов инсульта и после обнаружения наличия, местоположения, метаболизма и/или связанного состояния меченого соединения с использованием любого из широкого спектра известных анализов и методов маркировки/обнаружения. В примерных вариантах реализации изобретения, форболовый эфир формулы I метят изотопом, путем замены одного или нескольких атомов на атомы, имеющие другую атомную массу или массовое число. Примеры изотопов, которые могут быть включены в описанные соединение, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F, и 36Cl, соответственно. Меченое изотопами соединение затем вводят индивидууму или другому субъекту, а затем обнаруживают, как описано выше, с получением полезных диагностических и/или терапевтических данных по управлению, в соответствии с обычными методами.
Примеры
Эксперименты, описанные ниже, демонстрируют новые и потенциальные сферы применения форболовых эфиров и производных соединений как агентов для лечения и профилактики инсульта. Эти и дополнительные открытия также расширены и выяснены в следующих примерах.
Пример I
Влияние TPA на количество периферических лейкоцитов (WBC) и гемоглобина (Hb) у мышей, которым ввели клетки S180:
Клетки саркомы 180 (S180) вводили мышам Kwen-Ming. На третий день мышам вводили TPA внутрибрюшинно (в.б.) в концентрации 50, 100 или 200 мкг/кг/сут в течение 7 дней. На второй день после окончания лечения, отбирали образцы крови из хвостов обработанных мышей для WBC и Hb анализов. Количество WBC для обработанных групп (50, 100, или 200 мкг/кг/сут в течение 7 дней) были 16,1±7,4, 18,7±3,0 и 20,7±3,4 x109 /л, соответственно; количество WBC в контрольной группе составило 13,6±1,8x109 /л. Hb групп, подвергаемых обработке, составило 136±11, 149±12 и 149±10 г/л, и Hb в контрольной группе было 134±15 г/л. Результаты показывают, что внутрибрюшинная инъекция ТРА может увеличить периферийное количество WBC у мышей в зависимости от дозы, тогда как уровни гемоглобина незначительно изменялись у мышей, обработанных ТРА, по сравнению с контрольными мышами.
Пример II
Исследование диапазона доз
В связи с сильным местным раздражением, вызываемым применением TPA, TPA вводили пациентам путем внутривенного (в.в.) вливания. Раствор TPA в стерильном шприце вводили в 200 мл стерильного физиологического раствора и хорошо перемешивали для в.в. инфузии.
Токсичность и побочные эффекты различных доз TPA, которые были клинически введены:
(1) TPA вводили по 1 мг/пациент/неделю:
Один мг TPA в растворе хорошо смешивали с 200 мл стерильного физиологического раствора для внутривенного вливания, которое завершали на протяжении 1 ч при скорости 16 мкг/мин. Через час после введения TPA пациенты начинали чувствовать озноб, который продолжался приблизительно 30 минут, с последующей лихорадкой (температура пациентов достигала 37,5-39,5ºC, и которая держалась в течение 3-5 ч, затем возвращалась к нормальной) с легким и тяжелым потоотделением. Вышеуказанные симптомы могут быть облегчены введением пациентам глюкокортикоидов. TPA в этой дозировке вызвало кровотечение у небольшого количества пациентов, несколько пациентов страдали в течение короткого периода времени затруднением дыхания, и в моче был обнаружен гемоглобин. Однако эти побочные эффекты были недолгими и обратимыми. Функции сердца, печени, почек и легких были в норме.
(2) TPA вводили по 0,5 мг/пациент х 2/недели: (две дозы в неделю)
0,5 мг TPA в растворе хорошо смешивали с 200 мл физиологического раствора для внутривенного вливания, которое завершали через 1 ч при скорости 8 мкг/мин. Реакции после введения были подобны дозировке TPA равной 1 мг, но в меньшей степени, чем доза в 1 мг. Пациенты легче переносили более низкую дозу. Иногда, Hb обнаруживался в моче пациента. Затрудненное дыхание не наблюдалось. Функции сердца, печени, почек и легких были в норме.
(3) TPA вводили по 0,25 мг/пациенту х 4/недели:
0,25 мг TPA в растворе хорошо смешивали с 200 мл физиологического раствора для внутривенного вливания, которое завершали через 1 ч при скорости 4 мкг/мин. После введения, такие симптомы, как озноб и лихорадка также наблюдались, но в гораздо меньшей степени, чем с более высокими дозами. Hb не был обнаружен в моче, и ни один пациент не страдал затруднением дыхания. Функции сердца, печени, почек и легких были в норме.
Пример III
Лечение рецидивирующих/невосприимчивых злокачественных образований с помощью TPA
Пациенты с гистологически описанными рецидивами/невосприимчивыми злокачественными образованиями/расстройствами костного мозга лечили с помощью комбинации TPA (Xichuan Pharmaceuticals, Нан Янга, Хэнань, Китай), дексаметазоном и магния холинтрисалицилатом. Сопоставимые способы, изложенные ниже для демонстрации терапевтического применения TPA в лечении острого миелобластного лейкоза (AML) будут применяться для того, чтобы продемонстрировать использование TPA для лечения других опухолевых заболеваний и злокачественных образований. В дополнение к конкретным протоколам данного описания, успешное лечение и/или ремиссия будут определены для различных целевых опухолевых и злокачественных образований в условиях с использованием любого из широкого спектра известных методов обнаружения и оценки рака, например путем определения измельчение твердых опухолей гистопатологическими исследованиями для оценки роста опухоли, стадии, метастатического потенциала, уровни наличие/экспрессии гистологических маркеров рака и т.д.
AML является агрессивным заболеванием, которое обычно гарантирует срочную и интенсивную терапию. Средний возраст пациентов с диагнозом AML составляет 64-68 лет, и пациенты в возрасте старше 60, обработанные стандартной химиотерапией излечиваются от своей болезни <20% случаев. У пациентов, у которых развивается AML после химиотерапии/лучевой терапии предшествующего гематологического расстройства или предварительного лейкоза, есть схожие плохие результаты, как и у пациентов, у которых заболевание связано с конкретными неблагоприятными цитогенетическими и клиническими особенностями. Таким образом, большинство пациентов с диагнозом AML имеют особенности, связанные с пациентом и/или с болезнью, которые связаны с очень плохим прогнозом. Для пациентов с рецидивом заболевания, стандартная беспересадочная терапия не показывает тенденцию к излечению. Для этих пациентов, AML часто является смертельным заболеванием. Необходимы новые подходы к терапии AML.
Используя методы и композиции настоящего изобретения, ТРА был разработан в качестве терапевтического агента для лечения пациентов с AML, основанного на новой роли TPA в модуляции внутриклеточных сигнальных путей, его способности индуцировать дифференцирование и/или апоптоз в клеточных линиях, и клинических данных, указывающих на эффективность TPA в лечении опухолевых и злокачественных заболеваний, в том числе миелоидных злокачественных новообразований.
До сих пор клиническая оценка ТРА показывала, что ТРА оказывает непосредственное терапевтическое цитотоксическое действие, по меньшей мере, на подмножество случаев AML, измеренное жизнеспособностью клеток и анализ апоптоза. Во всех первичных культурах, проанализированных вестерн анализом, TPA сильно индуцировал ERK фосфорилирование за 1 час в культуре. Цитотоксический эффект TPA на первичных клетки AML связан с последующей потерей сигнала способствующего выживанию люминофор-ERK после 24 часов контакта ex vivo. Это наблюдение хорошо согласуется с результатами других исследований, которые сообщили о снижении выживания первичного AML после фармакологического прерывания ERK сигнализации ингибиторами MEK, такими как PD98059, U0126 и PD184352. В наших исследованиях, потеря ERK сигнализации была связана с индукцией ERK фосфатазы.
В дополнение к протеинкиназе С и активации ERK, TPA является известным индуктором NF-κB, фактор транскрипции, способствующий выживанию, часто конститутивно действует на AML бласты и лейкозные стволовые клетки. Последние работы нашей лаборатории показали, что NF-κB клеток AML может ингибироваться in vivo с 48 часовым лечением дексаметазоном + магния холинтрисалицилатом (CMT). Кроме того, мы показали, что дексаметазон может индуцировать экспрессию фосфатазы MKP-1 ERK и повышать цитотоксичность TPA в первичных образцах AML. В этом контексте, мы выбрали в примерных вариантах реализации изобретения использование дексаметазона и CMT как дополнительных лекарств, которые будут использоваться 24 часа до и 24 часа после лечения с TPA. Эти препараты хорошо переносятся, и ожидается уменьшение воспалительных побочных эффектов от лечения и повышения цитотоксичности TPA путем увеличения экспрессии фосфатазы ERK и ингибирования NF-κB. В дополнение дексаметазон и СМТ будут использоваться в качестве дополнительного лекарства, потому что они противовоспалительные, могут улучшить побочные эффекты, и могут усилить антилейкозную активность по ингибированию антиапоптотических эффектов конститутивной экспрессии NF-κB и индукции фосфатаз, которые уменьшают активность сигнального пути.
Первоначальный Фаза 1 исследования TPA включала 35 пациентов [23 с рецидивирующим/рефрактерным AML, 2-ое с другими миелоидными злокачественными новообразованиями (CML-бластный кризис, миелодисплазия с избытком бластов), 3-ое с болезнью Ходжкина, 3-ое с неходжкинской лимфомой и 4-ро с солидными опухолями]. У большинства пациентов развился рецидивирующий/невосприимчивый AML. Наши клинические результаты включают одного пациента с AML со стабильным заболеванием для> 5 месяцев, которые получили 8 инфузий TPA. У второго пациента AML было замечено выраженное (в 5 раз) снижение количества циркулирующих бластов после введения TPA. Это снижение в лейкозных бластах сохранялось в течение 4 недель, и пациент, в конце концов, умер от грибковой инфекции. В заключение необходимо отметить, что пациент с рецидивирующей и невосприимчивой болезнью Ходжкина несмотря на высокие дозы химиотерапии с сохраненными аутологичными стволовыми клетками имел частичную ремиссию опухоли грудной клетки после введения TPA. Эскалации дозы TPA была завершена, в последней когорте 2 из 3 пациентов, которых лечили дозами по 0,188мг/м2 д1-5, 8-12 имели дело с негематологической дозой ограничения токсичности (DLT) класса III, показали максимально переносимую TPA дозу в качестве монотерапии при 0,125мг/м2/д при д1-5 и 8-12.
В случае AML и других гематологических злокачественных заболеваний, пациентам дают начальную дозу TPA 1 мг/неделю х 3 недели (дни 1, 8, 15), вводят с непрерывной/прерывистой пульсоксиметрией в течение 6 часов. За двадцать четыре часа до начала TPA терапии, пациентам дают 10 мг дексаметазона каждые шесть часов и 1500 мг магния холинтрисалицилата (CMT) каждые восемь часов до истечения 24 часов после введения TPA. После введения начальной дозы TPA, пациенты имеют двухнедельный период отдыха, после чего они могут быть переоценены. Те пациенты, которые имеют отклик заболевания или стабилизацию от начальной дозы TPA рассматриваются на срок до шести циклов по двадцать восемь дней в соответствии с приведенным ниже протоколом.
После двухнедельного периода отдыха, пациенты предварительно принимают Тайленол 650 мг и Бенадрил 25-50 мг (в зависимости от размера пациента и возраста) за тридцать минут до введения TPA. Им делают внутривенное вливание TPA через центральный венозный катетер в течение 5 дней в неделю в течение двух недель подряд с последующим 2-недельным периодом отдыха. TPA вводят в дозе 1 мг в 200 мл физиологического раствора в течение 1 часа. За двадцать четыре часа до начала TPA терапии, пациентам дают 10 мг дексаметазона каждые шесть часов и 1500 мг магния холинтрисалицилат, это продолжается каждые восемь часов до истечения 24 часов после введения TPA.
Уровень ТРА в крови измеряют до и после инфузии с использованием биоанализа, который измеряет активность дифференциации органического экстрагируемого растворителя. 1 мл крови дважды экстрагируют в 5 мл этилацетата, растворяют экстракционный остаток в 50 мкл этанола и добавляют аликвоту HL60 клеток. После 48 часов, прилипшие клетки измеряют.
Испытания также проводят на образцах крови, взятых до и после инфузии с TPA для определения уровня лейкоцитов, тромбоцитов и нейтрофилов. Образцы дополнительно анализируют на присутствие миелобластов и телец Ауэра. Эти и последующие эксперименты в дальнейшем выявят терапевтический цитотоксический и другие эффекты, которые вызывает TPA против опухолевых клеток при AML и других опухолевых и злокачественных состояниях.
Пример IV
Измерение модуляции активации ERK
Уровни люминофор-ERK измеряют в циркулирующих злокачественных клетках пациентов с лейкемией и в мононуклеарных клетках периферической крови пациентов с лимфомой/солидными опухолями. Образец крови берется у пациентов в соответствии с протоколом примера III как до, так и после введения ТРА.
У больных лейкемией с WBC ≥ 1000 в мкл, проточная цитометрия осуществляется на образце крови с использованием антитела специфического к клеточной поверхности антиген-специфического и люминофор-ERK, непосредственно конъюгированного с флюофорами (BD Biosciences, Сан-Хосе, Калифорния). Образцы отбирают перед введением TPA и через один час после инфузии TPA в 1, 2 и 11 день при начальной обработке в соответствии с протоколом примера III и в 1 и 11 день в последующих циклах. У больных лейкемией с абсолютным числом лейкобластом ≥ 2500 в мкл и прочих лейкозных больных, периферические образцы крови взяты в 1, 8 и 15 день начального цикла в соответствии с протоколом примера III до и через 1 и 4 часа после вливания. Образцы также анализировали с помощью вестерн-блот анализа для люминофора-ERK, а общие уровни ERK1/2, чтобы подтвердить результаты, полученные с помощью проточной цитометрии и для корреляции с клиническими ответами.
Вышеупомянутые анализы будут способствовать дальнейшему выяснению роли TPA в лечении опухолевых и злокачественных заболеваний, включая цитотоксический эффект TPA на злокачественные клетки, о чем свидетельствует первичные клетки AML, и связанное сокращение TPA сигнала люминофора-ERK способствующего выживанию.
Пример V
Измерение NF-κB модуляции
В предыдущих исследованиях было показано, что активность NF-κB может меняться у пациентов после введения TPA с дексаметазоном. Кроме того, было показано, что дексаметазон, индуцирует экспрессию фосфатазы MKP-1 ERK и повышает цитотоксичность TPA. Следующие исследования предназначены для дальнейшего выяснения, как активность NF-κB терапевтически модулируется у пациентов, получающих TPA и дексаметазон.
Связывание NF-κB измеряют в образцах периферической крови пациентов в начале исследования и до и после вливания от пациентов, получавших TPA в соответствии с примером III с помощью анализов на основе ELISA (BD Bioscience, Сан-Хосе, US). Уровни NF-κB количественно определяют с использованием степени выраженности хемилюминесции для детекции сигнала в ограничении количества клеточного экстракта с использованием 96-луночного формата. Кроме того, анализ изменения электрофоретической подвижности выполняют для измерения NF- κB связывания в периферической крови больного лейкозом с абсолютным числом лейкобластов ≥2500 в мкл и прочих нелейкозных больных с нормальным количеством белых кровяных телец.
Вышеприведенные исследования дополнительно показывают, что TPA является индуктором NF-κB; Однако эти эксперименты показывают, что AML клетки NF-κB могут быть ингибированы при лечении дексаметазоном и магния холинтриалицилатом.
Пример VI
Лечение лиц, которые перенесли инсульт.
Пациент N. C., мужчина, возраст 68 лет, перенес инсульт за восемнадцать месяцев до начала лечения с использованием TPA. В то время начала лечение TPA, он не мог ходить без трости, были трудности с левой рукой и левой ногой и был усталым и слабым. Он получал инъекцию 1 ампулы, содержащей 0,19 мг TPA (0,125мг/м2) через день в течение четырех недель, потом 0,24 мг TPA (1,25 x 0.125 мг/м2) через день в течение 2 недель, а затем 0,26 мг TPA (1,5 x 0,125 мг/м2) через день в течение дополнительных 3 недель. Пациент полностью выздоровел.
Пациент M. C., мужчина, возраст 65 лет, перенес инсульт за семь лет до начала лечения с использованием TPA. Он получал 3-4 инъекции 0,19 мг TPA (0,125 мг/м2) в неделю в течение десяти недель в общей сложности 35 инъекций. Он восстановил подвижность лица и имел улучшение подвижности его правой стороны на 80%.
Пример VII
Лечение эмболической модели инсульта с помощью TPA
Используют самцов крыс Sprague-Dawley (Река Чарльз, Япония), каждый с массой тела 280-350 г. Эмболический инсульт индуцируют по модификации метода Кудо и др. (1982). Крыс, которые будут использоваться для сбора крови, анестезировали 1,0% галотаном (Флуоротан™; Такеда, Осака, Япония) путем спонтанного вдыхания. Сурфло™ с 24-я датчиками (Terumo Medical Products, Elkton, MD) закрепляют в бедренной артерии и 0,1 мл артериальной крови берут с помощью 1-мл шприца для инъекций (Terumo Medical Products, Elkton, MD). Артериальную кровь в шприце инкубируют при 30оC в течение 2 дней, чтобы сформировать сгусток крови. После этого 0,1 мл физиологического солевого раствора добавляют в шприц для инъекций и пропускают через инъекционную иглу с 26-ю датчиками (Terumo Medical Products, Elkton, MD) дважды, так что сгусток крови измельчают.
Крысы, у которых индуцируют эмболический мозговой инсульт под наркозом с 1,0% галотаном путем спонтанного вдыхания. Шею крыс подвергают срединному разрезу и наружную сонную артерию, верхнюю щитовидную артерию, затылочную артерию и крылонебную артерию прижигают уколом с биполярным коагулятором (T-45; Медицинский промышленная компания Кейсей Ltd, Токио, Япония). Церебральную эмболию индуцируют путем инъекции 0,1 мл измельченного тромба во внутреннюю сонную артерию.
Оценку формирования эмболии сосудов головного мозга осуществляют с помощью лазерной допплеровской флоуметрии (FloC1; Omegawave, Токио, Япония). Снижение мозгового кровотока до уровня 30% или менее берется в качестве положительного доказательства формирования эмболии. Церебральный кровоток контролируется в течение 30 минут после инфузии сгустка крови и кровоток контролируется как оставшиеся 50% или менее от потока до инъекции тромба. После этого катетер (РЕ50) для введения лекарства закрепляют в яремной вене и животные просыпаются.
Крыс, у которых успешно сформировали церебральную эмболию, разделяют на четыре группы. Первая группа крыс получает инъекции физиологического раствора через день. Группам 2-4 вводят 0,125 мг/м2 инъекцию TPA через день в течение четырех недель. Группу 2 затем умерщвляют. Группам 3-4 вводят дополнительно 0,156 мг/м2 TPA через день в течение двух недель, а затем Группу 3 умерщвляют. Группе 4 вводят 0,18775 мг/м2 TPA через день в течение трех недель и затем умерщвляют.
Мозги вырезают после умерщвления животных и нарезают на десять частей с интервалом 1 мм, используя тканевой нож McIwain (Mickle Laboratory Engineering, U.K.) и окрашивают методом окунания на 20 минут в 2% TTC (2,3,5-трифенилтетразолия хлорид; Tokyo Kasei) при 37оC. Изображения TTC-окрашенных кусочков загружают в компьютер с помощью цифровой камеры (HC-2500; Fuji PhotoFilm) и Phatograb-2500 (Fuji Photo Film) и объем инфаркта рассчитывают с использованием Mac Scope (Mitani, Япония). Объем инфаркта задается средним значением ± стандартная ошибка. Что касается статистического теста результата объема инфаркта, оценка выполняется путем проведения теста Даннетта для контрольной группы и для каждого из групп, которым вводили TPA по сравнению с контрольной группой, а затем путем проведения Т-тест для группы, которой вводили TPA.
Неврологические симптомы наблюдались ежедневно до умерщвления и крыс оценивали по трем тестам. (1) Крыс держали нежно за хвост, задерживали на одном метре над полом, и наблюдали сгибание передних конечностей. (2) Крыс помещали на большой лист мягкой, с пластиковым покрытием, бумаги, которая может быть твердо захвачена их когтями. Хвост удерживали рукой, нежно надавливали по бокам за плечами крыс, пока передние конечности не скользили на несколько дюймов. (3) Крысам давали свободно передвигаться и наблюдали поведение при вращении. Подсчет неврологических симптомов осуществляли в соответствии со шкалой, разработанной Бедерсоном и соавт. (1986) следующим образом: 0: нет наблюдаемого дефицита; 1: сгибание передних конечностей; 2: снижение устойчивости к боковому нажиму без вращения; 3: такое же поведение, как класса 2, с вращением.
Неврологические симптомы оценивали с помощью теста Стила для контрольной группы и для каждой из групп, которым вводили TPA для сравнения с контрольной группой, а затем путем проведения теста Вилкоксона для группы, которой вводили TPA. В любом из тестов, значение при р<0,05 определялось как статистически значимое.
Пример VIII
Эффективность TPA в лечении инсульта с использованием постоянной модели закупорки средней мозговой артерии
Для этого исследования используют самцов крыс Вистар (250-320 г). Животных анестезируют изофлураном (3% введение, 1-2% поддержание). Анестезия контролируется защемлением пальца на лапе. Асептический метод используется для всех процедур во время этого исследования. Место операции обрезают и очищают спиртом и хирургическим скрабом. Животных помещают в теплую нагретую воду в емкость для поддержания температуры тела. Парамедианный надрез делают на шее над сонной артерией. Ткань прямо рассекают для выявления сонной артерии и бифуркации. Нити размещают вокруг проксимальной части или общей сонной артерии и наружной части сонной артерии. Эти нити перевязывают. Разрез делают в общей сонной артерии, дистально к перевязке сосуда. Заранее подготовленные нити (4-0 монофиламентные нити или похожий материал) помещают в сонную артерию и продвигают внутрь сонной артерии. Нить подвигают на приблизительно 20 мм через бифуркации сонной артерии, пока не почувствуете небольшое сопротивление, похожее на вклинивание в среднюю мозговую артерию. Необходимо соблюдать осторожность, чтобы не привести к разрыву артерии при введении нити. Нить привязывают на месте, а разрез кожи закрывают. Животное оценивается в сознании на предмет успешной закупорки с использованием шкалы Бедерсона. (См. Bederson и др., (1986) Stroke, 17:1304-1308.) Температуру тела измеряют каждые 15 минут, чтобы поддерживать нормотермию. У животных, которые подверглись процедуре закупорки средней церебральной артерии, могут возникнуть трудности с терморегуляцией в течение нескольких часов после операции. Животных помещают в охлаждающее или нагревающее поле, определяемое их температурой. Температуру тела поддерживают на уровне 37,5оC. Животных контролируют в течение 6 часов после средней мозговой артерии и затем помещают в клетки на ночь.
Крыс разделяют на четыре группы. Первой группе крыс делают инъекции физиологического раствора через день. Группам 2-4 вводят 0,125 мг/м2 инъекции TPA через день в течение четырех недель. Группу 2 затем умерщвляют. Группе 3-4 вводят дополнительно 0,156 мг/м2 TPA через день в течение двух недель, а затем Группу 3 умерщвляют. Группе 4 вводят 0,18775 мг/м2 TPA через день в течение трех недель, а затем умерщвляют.
Мозги вырезают после умерщвления животных и нарезают на десять частей с интервалом 1 мм, используя тканевой нож McIwain (Mickle Laboratory Engineering, U.K.) и окрашивают методом окунания на 20 минут в 2% TTC (2,3,5-трифенилтетразолия хлорид; Tokyo Kasei) при 37оC. Изображения TTC-окрашенных кусочков загружают в компьютер с помощью цифровой камеры (HC-2500; Fuji PhotoFilm) и Phatograb-2500 (Fuji Photo Film). Части мозга фотографируют и анализируют на величину инфаркта, объем инфаркта, понумбры и отечности.
Неврологические симптомы наблюдались ежедневно до умерщвления и крыс оценивали по трем тестам. (1) Крыс держали нежно за хвост, задерживали на одном метре над полом, и наблюдали сгибание передних конечностей. (2) Крыс помещали на большом листе мягкой, с пластиковым покрытием, бумаги, которая может быть твердо захвачена их когтями. Хвост удерживали рукой, нежно надавливали по бокам за плечами крыс, пока передние конечности не скользили на несколько дюймов. (3) Крысам давали свободно передвигаться и наблюдали поведение при вращении. Подсчет неврологических симптомов осуществляли в соответствии со шкалой, разработанной Бедерсоном и соавт. (1986) следующим образом: 0: нет наблюдаемого дефицита; 1: сгибание передних конечностей; 2: снижение устойчивости к боковому нажиму без вращения; 3: такое же поведение, как класса 2, с вращением.
Неврологические симптомы оценивали с помощью теста Стила для контрольной группы и для каждой из групп, которым вводили TPA для сравнения с контрольной группой, а затем путем проведения теста Вилкоксона для группы, которой вводили TPA. В любом из тестов, значение при р<0,05 определялось как статистически значимое.
Пример IX
Эффективность TPA в лечении инсульта с использованием переменной модели закупорки средней мозговой артерии
В данном исследовании используются самцы мышей С57В16 (25-30 г). Мышей анестезируют изофлураном (3% введение, 1-2% поддержание). Место операции клиппируется и очищается спиртом и хирургическим скрабом. Разрез средней линии шеи делают через сонную артерию и артерию рассекают на бифуркации. Монофиламентные нити вводили внутрь сонной артерии и расширяли, пока они не подали в среднюю мозговую артерию. Размещенные нити связывали и разрез закрывали. Через два часа после закупорки мышей повторно анестезировали и удаляли шовный материал из MCA. Температуру тела поддерживали за счет использования грелки во время и после операции. Животные контролировались в течение 4 часов после закупорки средней мозговой артерии.
Крыс разделили на четыре группы. Первой группе крыс делали инъекции физиологического раствора через день. Группами 2-4 вводили 0,125 мг/м2 инъекцию TPA через день в течение четырех недель. Группу 2 затем умерщвляли. Группам 3-4 вводили дополнительно 0,156 мг/м2 TPA через день в течение двух недель, а затем Группу 3 умерщвляли. Группе 4 вводили 0,18775 мг/м2 TPA через день в течение трех недель, а затем умерщвляли
Мозги вырезала после умерщвления животных, и нарезали на десять частей с интервалом 1 мм, используя нож для тканей McIwain (Mickle Laboratory Engineering, U.K.) и окрашивали методом окунания на 20 минут в 2% TTC (2,3,5-трифенилтетразолия хлорид; Tokyo Kasei) при 37оC. Изображения TTC-окрашенных кусочков загружают в компьютер с помощью цифровой камеры (HC-2500; Fuji PhotoFilm) и Phatograb-2500 (Fuji Photo Film). Части мозга фотографируют и анализируют на величину инфаркта, объем инфаркта, понумбры и отечности.
Неврологические симптомы наблюдались ежедневно до умерщвления и крыс оценивали по трем тестам. (1) Крыс держали нежно за хвост, задерживали на одном метре над полом, и наблюдали сгибание передних конечностей. (2) Крыс помещали на большом листе мягкой, с пластиковым покрытием, бумаги, которая может быть твердо захвачена их когтями. Хвост удерживали рукой, нежно надавливали по бокам за плечами крыс, пока передние конечности не скользили на несколько дюймов. (3) Крысам давали свободно передвигаться и наблюдали поведение при вращении. Подсчет неврологических симптомов осуществляли в соответствии со шкалой, разработанной Бедерсоном и соавт. (1986) следующим образом: 0: нет наблюдаемого дефицита; 1: сгибание передних конечностей; 2: снижение устойчивости к боковому нажиму без вращения; 3: такое же поведение, как класса 2, с вращением.
Неврологические симптомы оценивали с помощью теста Стила для контрольной группы и для каждой из групп, которым вводили TPA для сравнения с контрольной группой, а затем путем проведения теста Вилкоксона для группы, которой вводили TPA. В любом из тестов значение при р<0,05 определялось как статистически значимое.
Пример X
Клиническая эффективность использования TPA для лечения инсульта
Мужчины и женщины в возрасте 30-72 лет, перенесшие ранее инсульт менее одного месяца тому, набираются для участия в десятинедельном исследовании TPA.
Набранные лица подписывают форму информированного согласия и оцениваются с помощью компьютерной томографии (CT), физических и неврологических тестов, неврологических проверок, уровня седации, исследование инсульта Национальным институтом здравоохранения (NIHSS), электрокардиограммы в 12 отведениях, телеметрии ЭКГ, измерения пульса датчиками кислорода, основных показателей состояния организма, веса тела, истории болезни пациента, теста на беременность, измерения лекарственных средств в моче, гематологического теста, набора коагуляции, общего клинического испытания, анализа мочи. Клиническое лабораторное тестирование включает полный биохимический анализ крови (Na, K, Cl, CO2, Glu, BUN, Cr, Ca, TP, Alb, TBili, AP, AST, ALT), гематологию CBC (Hgb, Hct, RBC, WBC, Plt, Diff), и сыворотковый hCG для всех женщин.
Лицам вводят 0,125 мг/м2 TPA или плацебо через день в течение четырех недель, потом 1,25 x 0,125 мг/м2 или плацебо через день в течение пятой и шестой недель, и 1,5 x 0,125 мг/м2 или плацебо через день в течение с седьмой до девятой недели. Лица контролируются во время и в течение двух часов после введения TPA или плацебо.
На пятой неделе и десятой неделе, субъекты оцениваются с помощью NIHSS (NIH Шкалы Инсульта), индекса Бартела ADL (Granger, 1979), и модифицированной шкалы Ренкина (Farrell, 1991).
Эффективность определяется путем измерения изменений по сравнению с исходными данными NIHSS у лиц, получавших TPA по сравнению с плацебо. Вторичными переменными эффективностями являются индекс Бартела ADL и модифицированная шкала Ренкина. Меры безопасности были приняты и оценены честно, в частности, измерения изменений по сравнению с исходными данными на пятой неделе. Эти меры включают отчеты о побочных эффектах, медосмотры, основные показатели состояния организма, взвешивания, ЭКГ, результаты клинических лабораторных испытаний, и основные показатели состояния организма также как баллы за суицидальное поведение и/или идеи. Побочные эффекты это любое неблагоприятное медицинское событие, которое проявляется у субъекта, которому вводят исследуемый препарат, независимо от того, имеет ли он причинно-следственную связь с исследуемым препаратом. Поэтому побочные эффекты могут быть любыми неблагоприятными или непреднамеренными признаками (в том числе аномальных лабораторных исследований, например), симптомами или расстройствами, временно связанными с исследуемым препаратом или нет, считается связанной с исследуемым препаратом.
Субъекты считаются завершившими исследование, если они завершили все посещения. Они могут выбыть из исследования, если они не удовлетворяют критериям включения/исключения; страдают от побочных эффектов, имеют недостаточный терапевтический ответ, отозвали свое согласие, нарушают протокол, перестали приходить или умерли.
ССЫЛКИ
Altuwaijri S, Lin H K, Chuang K H, Lin W J, Yeh S, Hanchett L A, Rahman M M, Kang H Y, Tsai M Y, Zhang Y, Yang L, and Chang C. Interruption of nuclear factor kappaB signaling by the androgen receptor facilitates 12-O-tetradecanoyl frobol acetate-induced apoptosis in androgen-sensitive prostate cancer LNCaP cells. Cancer Res 2003; 63: 7106-12.
Ando I., Crawfor D. H. и др. Frobol ester-induced expression and function of the interleukin 2 receptor in human B lymphocytes. Eur J Immunol. 15(4), 341-4 (1985).
Aye M. T., Dunne J.V. Opposing effects of 12-O-tetradecanoyl frobol 13-acetate on human myeloid and lymphoid cell proliferation. J Cell Physiol. 114(2), 209-14 (1983).
Bederson JB, Pitts LH, Tsuji M, Nishimura MC, Davis RL, Bartkowski H. Rat middle cerebral artery occlusion: evaluation of the model and development of a neurologic examination. Stroke. 1986; 17: 472–476.
Boutwell R.K. Biochemical mechanism of tumor promotion, in mechanisms of tumor promotion and co-carcinogenesis. Eds. Slaga, T.J., Sivak, A.J. and Boutwell, R.K. Raven, New York, 49-58 (1978).
Boutwell R.K. The function and mechanism of promoters of carcinogenesis. CRC Crit. Rev. Toxicol 2, 419-443 (1974).
Brose N, Rosenmund C. Move over protein kinase C, you’ve got company: alternative effectors of diacylglycerol and frobol esters. JCell Sci;115:4399–411 (2002).
Cancer Chemother Pharmacol. Jun;57(6):789-95 (2006).
Cui X X, Chang R L, Zheng X, Woodward D, Strair R, and Conney A H. A sensitive bioassay for measuring blood levels of 12-O-tetradecanoylfrobol-13-acetate (TPA) in patients: preliminary pharmacokinetic studies. Oncol Res 2002; 13: 169-74.
Deegan M. J., Maeda k. Differentiation of chronic lymphocytic leukemia cells after in vitro treatment with Epstein-Barr virus or frobol ester. Immunologic and morphologic studies. Am J Hermatol. 17(4), 335-47 (1984).
Falcioni F., Rautmann A. и др. Influence of TPA (12-O-tetradodecanoyl- frobol -13-acetate) on human B lymphocte function. Clin Exp Immunol. 62(3), 163-2 (1985).
Farrell B, Godwin J, Richards S, Warlow C, и др. (1991). "The United Kingdom transient ischaemic attack (UK-TIA) aspirin trial: final results." J Neurol Neurosurg Psychiatry 54 (12): 1044–1054.
Forbes I. J., Zalewski P. D., Letarte M. Human B-lymphocyte maturation sequence revealed by TPA-induced differentiation of leukaemi cells. Immunobiology 163(1), 1-6 (1982).
Gunjan Goel, Harinder P. S. Makkar, George Francis, and Klaus Becker. Frobol Esters: Structure, Biological Activity, and Toxicity in Animals. International Journal of Toxicology, 26:279–288, 2007.Gogusev J., Barbey S., Nezelof C. Regulation of TNF-alpha and IL-1 gene expression during TPA-induced differentiation of "Malignant histiocyosis" DEL cell line t(5:6) (q35:P21). Anticancer Res. 16(1), 455-60 (1996).
Granger CV, Devis LS, Peters MC, Sherwood CC, Barrett JE. Stroke rehabilitation: analysis of repeated Barthel Index measures. Arch Phys Med Rehabil. 1979;60:14–17.
Han Z T, Zhu X X, Yang R Y, Sun J Z, Tian G F, Liu X J, Cao G S, Newmark H L, Conney A H, and Chang R L. Effect of intravenous infusions of 12-O-tetradecanoylfrobol-13-acetate (TPA) in patients with myelocytic leukemia: preliminary studies on therapeutic efficacy and toxicity. Proc Natl Acad Sci U S A 1998; 95: 5357-61.
Han Z. T., Tong Y. K., He L. M., Zhang Y., Sun J. Z., Wang T. Y., Zhang H., Cui Y. L., Newmark H. L., Conney A. H., Chang R. L. 12-O-Tetradecanoyl-frobol-13-acetate (TPA) -induced increase in depressed white blood cell counts in patients treated with cytotoxic cancer chemotherapeutic drugs. Proc. Natl. Acad. Sci. 95, 5363-5365 (1998).
Han Z.T., Zhu X. X., Yang R. Y., Sun J. Z., Tian G. F., Liu X. J., Cao G. S., NewMark H. L., Conney A. H., and Chang R. L. Effect of intravenous infusion of 12-O-tetradecanoyl-frobol-13-acetate (TPA) in patients with myelocytic leukemia: preliminary studies on therapeutic efficacy and toxicity. Pro. Natl. Acad. Sci. 95, 5357-5361 (1998).
Harada S. и др.: Tumor Promoter, TPA, Enhances Replication of HTLV-III/LAV. Virology 154, 249-258 (1986).
Hecker E. In handbuch der allgemeinen patholgie, ed. Grundmann, E. (Springer-Verlag, Berlin-Heideiberg, Vol. IV 16, 651-676 (1975).
Hecker E. Structure -activity relationships in deterpene esters irritant and co-carcinogenic to mouse skin, in mechanisms of tumor promotion and co-carcinogenesis. Eds. Slaga, T. J., Sevak, A. j. and Boutwell, R.K. Raven, New York, 11-49 (1978).
Hofmann J. The potential for isoenzyme-selective modulation of protein kinase C. FASEB J. 11, 649-669 (1997).
Huberman E., Callaham M. F. Induction of terminal differentiation in human promyelocytic leukemia cells by tumor-promoting agents. Proc. Natl. Acad. Sci.76, 1293-1297 (1979).
Hunter T. Signaling 2000 and beyond. Cell 100, 113-117 (2000).
Kassel O, Sancono A, Kratzschmar J, Kreft B, Stassen M, and Cato A C. Glucocorticoids inhibit MAP kinase via increased expression and decreased degradation of MKP-1. Embo J 2001; 20: 7108-16.
Kazanietz M.G. Eyes Wide Shut: protein kinase C isoenzymes are not the only receptors for the frobol ester tumor promoters. Mol. Carcinog. 28, 5-12 (2000).
Keoffler H. P., Bar-Eli M., Territo M. C. Frobol ester effect on differentiation of human myeloid leukemia cells lines blocked at different stages of maturation. Cancer Res. 41, 919-926 (1981).
Kim S C, Hahn J S, Min Y H, Yoo N C, Ko Y W, and Lee W J. Constitutive activation of extracellular signal-regulated kinase in human acute leukemias: combined role of activation of MEK, hyperexpression of extracellular signal-regulated kinase, and downregulation of a phosphatase, PAC1. Blood 1999; 93: 3893-9.
Kiyoi H, Naoe T, Nakano Y, Yokota S, Minami S, Miyawaki S, Asou N, Kuriyama K, Jinnai I, Shimazaki C, Akiyama H, Saito K, Oh H, Motoji T, Omoto E, Saito H, Ohno R, and Ueda R. Prognostic implication of FLT3 and N-RAS gene mutations in acute myeloid leukemia. Blood 1999; 93: 3074-80.
Kobayashi M., Okada N. и др. Intracellular interleukin-1 alpha production in human gingival fibroblasts is differentially regulated by various cytokines. J Dent Res. 78(4), 840-9 (1999).
Kudo M., Aoyama A., Ichimori S. and Fukunaga N. An animal model of cerebral infarction: homologous blood clot emboli in rats. Stroke 13: 505-508 (1982).
Lebien T. W., Bollum F. J. и др. Frobol ester-induced differentiation of a non-T, non-B leudemic cell line: model for human lymphoid progenitor cell development. J Immunol. 128(3), 1316-20 (1982).
MD Iqbal Hossain Chowdhury и др. The Frobol Ester TPA Strongly Inhibits HIV-1 Induced Syncytia Formation but Enhances Virus Production: possible involvement of protein kinase C pathway. Virology 176, 126-132, (1990).
Meinhardt G., Roth J., Hass R. Activation of protein kinase C relays distinct signaling pathways in the same cell type: differentiation and caspase-mediated apoptosis. Cell Death Differ. 7, 795-803 (2000).
Milella M, Kornblau S M, Estrov Z, Carter B Z, Lapillonne H, Harris D, Konopleva M, Zhao S, Estey E, and Andreeff M. Therapeutic targeting of the MEK/MAPK signal transduction module in acute myeloid leukemia. J Clin Invest 2001; 108: 851-9.
Mochty-Rosen D., Kauvar L. M. Modulating protein kinase C signal transduction. Adv. Pharmacol. 44, 91-145 (1998).
Morgan M A, Dolp O, and Reuter C W. Cell-cycle-dependent activation of mitogen-activated protein kinase kinase (MEK-1/2) in myeloid leukemia cell lines and induction of growth inhibition and apoptosis by inhibitors of RAS signaling. Blood 2001; 97: 1823-34.
Nagasawa K., Chechgik B. E. и др. Modulation of human T-cell differentiation markers by 12-O-tetradecanoylphorbal-13-acetate. Thymus. 3(4-5), 307-18, (1981).
Nakao Y., Matsuda S. и др. Paradoxical anti-leukemic effects of plant-derived tumor promoters on a human thymic lymphoblast cell line. Int J Cancer 30(6), 687-95 (1982).
Nakao Y., Matsuda S. и др. Frobol ester-induced differentiation of human T-lymphoblastic cell line HPB-ALL. Cancer Res. 42(9), 33843-50 (1982).
Newton A.C. Protein kinase C: structure, function and regulation. J. Biol. Chem. 270, 28495-28499 (1995).
Palombella V J, Rando O J, Goldberg A L, and Maniatis T. The ubiquitin-proteasome pathway is required for processing the NF-kappa B1 precursor protein and the activation of NF-kappa B. Cell 1994; 78: 773-85.
Platanias L C. Map kinase signaling pathways and hematologic malignancies. Blood 2003; 101: 4667-79.
Rovera G., Santoli D., Damsky C. Human promyelocytic cells in culture differentiate into macrophage-like cells treated with a frobol diester. Pro. Natl. Acad. Sci. 7, 2779-2783 (1979).
YIP, Y.K. и др. Stimulation of human gamma interferon production by diterpene esters. Infection and Immunity 34(1) 131-139 (1981).
Zhao J., Sharma Y., Agarwal R. Significant inhibition by the flavonoid antioxidant silymarin against 12-O-tetradecanoylfrobol 13-acetate-caused modulation of antioxidant and inflammatory enzymes and cyclooxygenase2 and interleukin-I alpha expression in SENCAR mouse epidermis: implications in the prevention of stage 1 tumor promotion. Mol Carcinog. 26(4), 321-33 (1999).
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ ФОРБОЛОВЫХ ЭФИРОВ ДЛЯ ЛЕЧЕНИЯ ИНСУЛЬТА | 2013 |
|
RU2650963C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ ФОРБОЛОВЫХ СЛОЖНЫХ ЭФИРОВ | 2013 |
|
RU2659684C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ ФОРБОЛОВЫХ ЭФИРОВ | 2008 |
|
RU2472511C2 |
| КОМПОЗИЦИИ ФОРБОЛОВЫХ ЭФИРОВ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ УМЕНЬШЕНИЯ ПРОДОЛЖИТЕЛЬНОСТИ ЦИТОПЕНИИ | 2015 |
|
RU2730998C2 |
| ФАРМАЦЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ ЛАНОСТА-8,24-ДИЕН-3-ОЛОВ | 2008 |
|
RU2476226C2 |
| СПОСОБ ОБЕСПЕЧЕНИЯ ТРЕБУЕМЫХ УРОВНЕЙ ФАКТОРА 2 РОСТА ГЛИИ В ПЛАЗМЕ | 2014 |
|
RU2687097C2 |
| СПОСОБ ОБЕСПЕЧЕНИЯ ТРЕБУЕМЫХ УРОВНЕЙ ФАКТОРА 2 РОСТА ГЛИИ В ПЛАЗМЕ | 2009 |
|
RU2530650C2 |
| КОМБИНАЦИИ ДЛЯ ЛЕЧЕНИЯ ИММУНОВОСПАЛИТЕЛЬНЫХ РАССТРОЙСТВ | 2002 |
|
RU2322984C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ВОСПАЛЕНИЯ И ИШЕМИЧЕСКОГО ПОРАЖЕНИЯ | 2012 |
|
RU2638807C2 |
| НОВЫЕ ПРОТИВООПУХОЛЕВЫЕ СОЕДИНЕНИЯ | 2003 |
|
RU2356908C2 |
Группа изобретений относится к фармацевтической промышленности, а именно к композиции для профилактики или лечения одного или более последствий инсульта у млекопитающего и способу профилактики или лечения одного или более последствий инсульта у млекопитающего. Композиция для профилактики или лечения одного или более последствий инсульта у млекопитающего, включающая эффективное количество форболового эфира формулы I или его фармацевтически приемлемой соли, изомера или энантиомера,
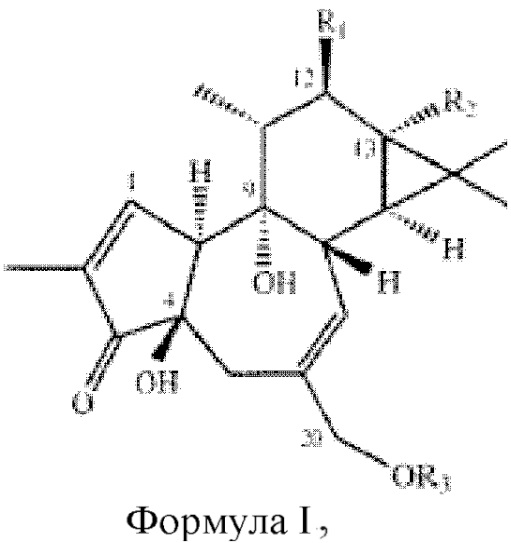
где R1 и R2 выбраны из группы, состоящей из водорода, гидроксила,  , где алкильная группа содержит от 1 до 15 атомов углерода;
, где алкильная группа содержит от 1 до 15 атомов углерода;  , где низшая алкенильная группа содержит от 1 до 7 атомов углерода;
, где низшая алкенильная группа содержит от 1 до 7 атомов углерода; 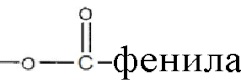 и
и 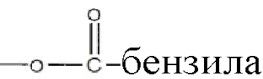 ; и R3 является водородом и
; и R3 является водородом и 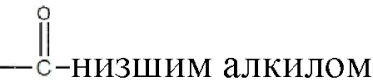 , где указанный форболовый эфир формулы I исключает 12-O-тетрадеканоил-форбол-13-ацетат (ТРА), где одним или более из побочных эффектов инсульта является паралич, расстройство пространственного восприятия, помутнение сознания, синдром игнорирования слева, афазия, проблемы с координацией и балансировкой, тошнота, рвота, когнитивное расстройство, расстройство восприятия, расстройство ориентации, омонимичная гемианопия, нарушение подвижности или импульсивность. Способ профилактики или лечения одного или более последствий инсульта у млекопитающего, включающий введение композиции, содержащей эффективное количество форболового эфира формулы I или его фармацевтически приемлемой соли, изомера или энантиомера, указанному млекопитающему. Вышеописанная композиция эффективна для профилактики или лечения одного или более последствий инсульта у млекопитающего, где одним или более из побочных эффектов инсульта является паралич, расстройство пространственного восприятия, помутнение сознания, синдром игнорирования слева, афазия, проблемы с координацией и балансировкой, тошнота, рвота, когнитивное расстройство, расстройство восприятия, расстройство ориентации, омонимичная гемианопия, нарушение подвижности или импульсивность. 2 н. и 11 з.п. ф-лы, 1 табл., 10 пр.
, где указанный форболовый эфир формулы I исключает 12-O-тетрадеканоил-форбол-13-ацетат (ТРА), где одним или более из побочных эффектов инсульта является паралич, расстройство пространственного восприятия, помутнение сознания, синдром игнорирования слева, афазия, проблемы с координацией и балансировкой, тошнота, рвота, когнитивное расстройство, расстройство восприятия, расстройство ориентации, омонимичная гемианопия, нарушение подвижности или импульсивность. Способ профилактики или лечения одного или более последствий инсульта у млекопитающего, включающий введение композиции, содержащей эффективное количество форболового эфира формулы I или его фармацевтически приемлемой соли, изомера или энантиомера, указанному млекопитающему. Вышеописанная композиция эффективна для профилактики или лечения одного или более последствий инсульта у млекопитающего, где одним или более из побочных эффектов инсульта является паралич, расстройство пространственного восприятия, помутнение сознания, синдром игнорирования слева, афазия, проблемы с координацией и балансировкой, тошнота, рвота, когнитивное расстройство, расстройство восприятия, расстройство ориентации, омонимичная гемианопия, нарушение подвижности или импульсивность. 2 н. и 11 з.п. ф-лы, 1 табл., 10 пр.
1. Композиция для профилактики или лечения одного или более последствий инсульта у млекопитающего, включающая эффективное количество форболового эфира формулы I или его фармацевтически приемлемой соли, изомера или энантиомера,
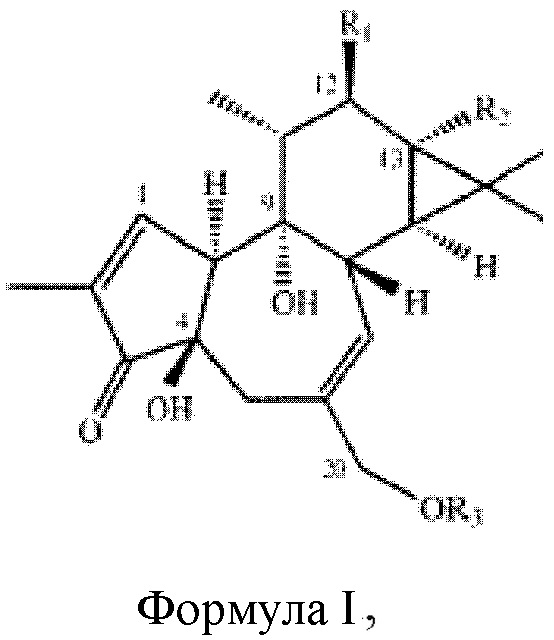
где R1 и R2 выбраны из группы, состоящей из водорода, гидроксила, 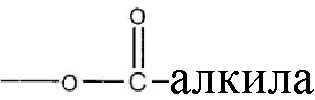 , где алкильная группа содержит от 1 до 15 атомов углерода;
, где алкильная группа содержит от 1 до 15 атомов углерода; 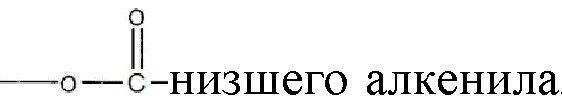 , где низшая алкенильная группа содержит от 1 до 7 атомов углерода;
, где низшая алкенильная группа содержит от 1 до 7 атомов углерода; 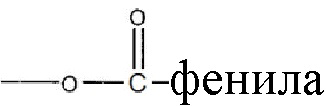 и
и 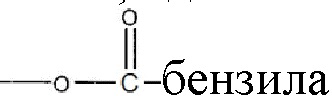 ; и R3 является водородом и
; и R3 является водородом и 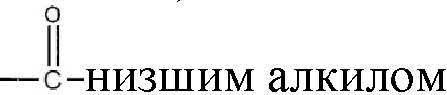 ,
,
где указанный форболовый эфир формулы I исключает 12-O-тетрадеканоил-форбол-13-ацетат (ТРА),
где одним или более из побочных эффектов инсульта является паралич, расстройство пространственного восприятия, помутнение сознания, синдром игнорирования слева, афазия, проблемы с координацией и балансировкой, тошнота, рвота, когнитивное расстройство, расстройство восприятия, расстройство ориентации, омонимичная гемианопия, нарушение подвижности или импульсивность.
2. Композиция по п. 1, где R1 или R2 является 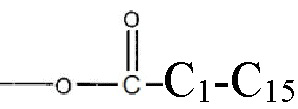 алкилом, а оставшийся из R1 или R2 является
алкилом, а оставшийся из R1 или R2 является 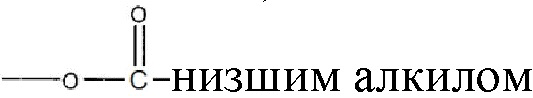 и R3 является водородом.
и R3 является водородом.
3. Композиция по п. 1, где форболовый эфир является форбол 13-бутиратом, форбол 12-деканоатом, форбол 13-деканоатом, форбол 12,13-диацетатом, форбол 13,20-диацетатом, форбол 12,13-дибензоатом, форбол 12,13-дибутиратом, форбол 12,13-дидеканоатом, форбол 12,13-дигексаноатом, форбол 12,13-дипропионатом, форбол 12-миристатом, форбол 13-миристатом, форбол 12,13,20-триацетатом, 12-дезоксифорбол 13-ангелатом, 12-дезоксифорбол 13-ангелат 20-ацетатом, 12-дезоксифорбол 13-изобутиратом, 12-дезоксифорбол 13-изобутират-20-ацетатом, 12-дезоксифорбол 13-фенилацетатом, 12-дезоксифорбол 13-фенилацетат 20-ацетатом, 12-дезоксифорбол 13-тетрадеканоатом, форбол 12-тиглиат 13-деканоатом, 12-дезоксифорбол 13-ацетатом, форбол 12-ацетатом или форбол 13-ацетатом.
4. Композиция по п. 1, дополнительно включающая один вторичный или дополнительный терапевтический агент, который эффективен в комбинированной композиции с указанным форболовым эфиром формулы I для лечения или профилактики последствий инсульта у указанного млекопитающего.
5. Композиция по п. 4, где по меньшей мере один вторичный или дополнительный терапевтический агент является активатором тканевого плазминогена, антикоагулянтом, статином, фибратом, блокатором рецептора ангиотензина-II, ингибитором ангиотензинпревращающего фермента, бета-блокатором, антиагрегантным средством, блокатором кальциевого канала или диуретиком.
6. Способ профилактики или лечения одного или более последствий инсульта у млекопитающего, включающий введение композиции по п. 1, содержащей эффективное количество форболового эфира формулы I или его фармацевтически приемлемой соли, изомера или энантиомера, указанному млекопитающему,

где R1 и R2 выбраны из группы, состоящей из водорода, гидроксила, 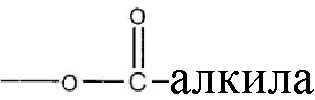 , где алкильная группа содержит от 1 до 15 атомов углерода;
, где алкильная группа содержит от 1 до 15 атомов углерода; 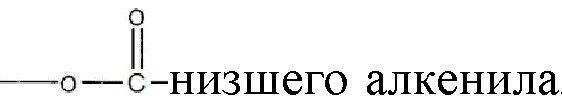 , где низшая алкенильная группа содержит от 1 до 7 атомов углерода;
, где низшая алкенильная группа содержит от 1 до 7 атомов углерода; 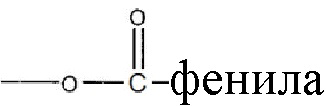 и
и 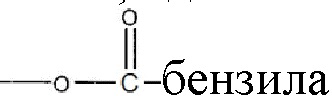 ; и R3 является водородом и
; и R3 является водородом и 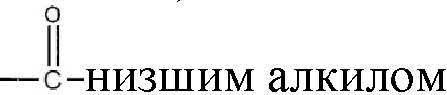 ,
,
где указанный форболовый эфир формулы I исключает 12-O-тетрадеканоил-форбол-13-ацетат (ТРА),
где одним или более из побочных эффектов инсульта является паралич, расстройство пространственного восприятия, помутнение сознания, синдром игнорирования слева, афазия, проблемы с координацией и балансировкой, тошнота, рвота, когнитивное расстройство, расстройство восприятия, расстройство ориентации, омонимичная гемианопия, нарушение подвижности или импульсивность.
7. Способ по п. 6, где R1 или R2 является 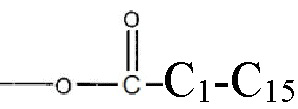 алкилом, а оставшийся из R1 или R2 является
алкилом, а оставшийся из R1 или R2 является 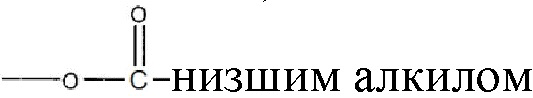 и R3 является водородом.
и R3 является водородом.
8. Способ по п. 6, где форболовый эфир является форбол 13-бутиратом, форбол 12-деканоатом, форбол 13-деканоатом, форбол 12,13-диацетатом, форбол 13,20-диацетатом, форбол 12,13-дибензоатом, форбол 12,13-дибутиратом, форбол 12,13-дидеканоатом, форбол 12,13-дигексаноатом, форбол 12,13-дипропионатом, форбол 12-миристатом, форбол 13-миристатом, форбол 12,13,20-триацетатом, 12-дезоксифорбол 13-ангелатом, 12-дезоксифорбол 13-ангелат 20-ацетатом, 12-дезоксифорбол 13-изобутиратом, 12-дезоксифорбол 13-изобутират-20-ацетатом, 12-дезоксифорбол 13-фенилацетатом, 12-дезоксифорбол 13-фенилацетат 20-ацетатом, 12-дезоксифорбол 13-тетрадеканоатом, форбол 12-тиглиат 13-деканоатом, 12-дезоксифорбол 13-ацетатом, форбол 12-ацетатом или форбол 13-ацетатом.
9. Способ по п. 6, дополнительно включающий введение по меньшей мере одного вторичного или дополнительного терапевтического агента, эффективного в комбинированной композиции или координированном режиме лечения с указанной композицией по п. 1, содержащей форболовый эфир формулы I, для лечения или профилактики последствий инсульта у указанного млекопитающего.
10. Способ по п. 9, где по меньшей мере один вторичный или дополнительный терапевтический агент вводится указанному млекопитающему в соответствии с протоколом введения одновременно с, перед или после введения указанной композиции по п. 1, содержащей форболовый эфир формулы I, указанному млекопитающему.
11. Способ по п. 9, где по меньшей мере один вторичный или дополнительный терапевтический агент является активатором тканевого плазминогена, антикоагулянтом, статином, фибратом, блокатором рецептора ангиотензина-II, ингибитором ангиотензинпревращающего фермента, бета-блокатором, антиагрегантным средством, блокатором кальциевого канала или диуретиком.
12. Способ по п. 6, дополнительно включающий хирургическое вмешательство в комбинации с композицией по п. 1, содержащей форболовый эфир формулы I, для лечения или профилактики последствий инсульта у указанного млекопитающего.
13. Способ по п. 12, где хирургическое вмешательство является каротидной эндартерэктомией, ангиопластикой, стентированием, краниотомией, вживлением кардиостимулятора, имплантацией дефибрилятора, вживлением клапана, аортокоронарным шунтированием, трансплантацией сердца, эндоваскулярной спиральной эмболизацией или закрытием открытого овального отверстия.
| 0 |
|
SU168137A1 | |
| WO 2012006525 A2, 12.01.2012 | |||
| FAZZINA G | |||
| et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| US 20110243917 A1, 06.10.2011 | |||
| JUAN MIGUEL REDONDO et all.The Role of Protein | |||
Авторы
Даты
2022-07-12—Публикация
2013-01-18—Подача