Предлагаемая группа изобретений относится к области химии, касается способа легирования порошкообразного диоксида титана наночастицами благородных металлов для создания высокоэффективного фотокатализатора, предназначенного для фотокаталитических реакций окисления органических соединений в мягких условиях, в том числе азо-красителей, фенола и его производных, что позволяет использовать реакции фотокатализа для очистки воды и воздуха от микропримесей органических загрязняющих соединений путем светового облучения (как ультрафиолетового, так и солнечного), и создания условий безопасного и комфортного обитания человека.
В связи с постоянным развитием отрасли легкой промышленности, в частности текстильной, пищевой, производства красок, а также появлением новых требований к качеству воды, остро стоит проблема загрязнения водного бассейна органическими красителями.
Фотокаталитическое окисление органических соединений в мягких условиях основано на том, что под действием квантов света с энергией, превышающей ширину запрещенной зоны полупроводникового фотокатализатора, происходит образование электрон-дырочных пар в объеме фотокатализатора. Образовавшиеся электрон и дырка (электронная вакансия) могут мигрировать к поверхности и принять участие в окислительно-восстановительных процессах с адсорбированными соединениями, что приводит к их постепенному разложению до вплоть до углекислого газа и воды. Самым известным полупроводниковым фотокатализатором является диоксид титана в силу своей низкой стоимости и нетоксичности. Окислительный потенциал дырки на поверхности TiO2 составляет 3,2-3,4 эВ в зависимости от аллотропной модификации, относительно нормального водородного электрода и это значит, что с его помощью можно окислить до CO2 и воды практически любые органические соединения.
Преимущества фотокаталитического способа окисления органических соединений, в том числе предполагающих очистку воды и воздуха, хорошо известны: 1) возможность окислить практически любые органические вещества и также ряд неорганических, таких как СО, H2S, HCN, NH3, NOx и других в мягких условиях; 2) окисление происходит при комнатной температуре и атмосферном давлении при световом облучении; 3) можно окислять даже небольшие концентрации органических соединений и загрязнителей, что обеспечивает использование фотокатализатора в процессах очистки воды и воздуха, когда это является экономически невыгодным при использовании других методов; 4) для реализации метода фотокаталитического окисления, а значит и очистки, не нужны дополнительные реагенты, т.к. окислителем является кислород воздуха.
Для фотокаталитического способа окисления органических веществ с использованием диоксида титана известны ряд недостатков, таких как: 1) сравнительно небольшая скорость очистки; 2) необходимость использования источников ультрафиолетового (УФ) света; 3) низкая адсорбционная способность простых фотокатализаторов; 4) возможность образования промежуточных продуктов при окислении больших концентраций загрязнителей. Поэтому разработка новых фотокаталитических систем, которые преодолевали бы указанные недостатки, была предметом ряда исследований. В ряде случаев при необходимости возможно использование диоксида титана в сочетании с различными окислителями, усиливающими действие оксида.
Наиболее широко используемым фотокатализатором является диоксид титана TiO2. В патенте (RU 2408427, B01J 37/08, 10.01.2011) получали пористый фотокатализатор с высокой удельной поверхностью и фотокаталитической активностью. Предполагаемый способ заключается в приготовлении водного раствора сульфата титанила, добавлении к нему кислоты, гидролизе полученного раствора в гидротермальных условиях и сушке полученной суспензии пористого диоксида титана.
Известны фотокатализаторы на основе различных аллотропных модификаций диоксида титана (анатаза или рутила), активные при УФ-облучении (Kazuhito Hashimoto, Hiroshi Irieand, Akira Fujishima. TiO2 Photocatalysis: A Historical Overview and Future Prospects // AAPPS Bulletin. - 2007. - V. 17. №6. pp. 12-29).
В работе (Yiming Xu, Wei Zheng, Weiping Liu, Enhanced photocatalytic activity of supported TiO2: dispersing effect of SiO2 // J. Photochem. Photobiol. A. - 1999. - №122. pp. 57-60) наносили диоксид титана золь-гель методом на порошок силикагеля (SiO2) и исследовали активность полученного материала в реакции фотокаталитического окисления ацетофенона в воде. Было показано, что скорость окисления ацетофенона под действием УФ-света с использованием диоксида титана, нанесенного на силикагель выше, чем с использованием чистого диоксида титана. Данный материал имеет ряд недостатков: 1) он не работает при облучении видимым светом; 2) фотокатализатор проявляет повышенную активность только по отношению к полярным соединениям, так как силикагель сам является полярным адсорбентом.
Известно, что нанесение благородных металлов на диоксид титана придает ему способность проводить окислительные процессы органических соединений, а следовательно и очистки воды и воздуха, при облучении видимым светом. Например, в работе (Xing-Gang Hou, Jun Ma, An-Dong Liu, De-Jun Li, Mei-Dong Huang, Xiang-Yun Deng. Visible light active TiO2 films prepared by electron beam deposition of noble metals // Nuclear Instruments and Methods in Physics Research B. - 2010. - №268. - pp. 550-554) приготавливали фотокатализатор методом облучения пленки TiO2, погруженной в раствор соли благородного металла, электронным пучком. Было показано, что скорость окисления метилового оранжевого при воздействии видимого света в присутствии TiO2 с нанесенными металлами из ряда - серебро, платина, палладий - существенно больше, чем на чистом TiO2.
Наиболее близким к данному изобретению является способ получения наночастиц благородного металла на поверхности диоксида титана методом фотонанесения. Например, в работе (Е.А. Kozlova, Т.Р. Lyubina, М.А. Nasalevich, A.V. Vorontsov, A.V. Miller, V.V. Kaichev, V.N. Parmon influence of the method of platinum deposition on activity and stability of Pt/TiO2 photocatalysts in the photocatalytic oxid at ion of dimethylmethylphosphonate // Catalysis Communications. - 2011. - №12. - pp. 597-601) платину наносят путем воздействия ультрафиолетового излучения на водную суспензию диоксида титана, содержащую добавки платинохлористоводороной (H2PtCl6) и уксусной кислот, что приводит к восстановлению ионов платины до металлического состояния за счет фотогенерированных электронов и закрепления металлических частиц на поверхности диоксида титана.
Недостатком данного способа является то, что восстановление ионов металла происходит только в местах выхода фотогенерированных электронов на поверхность диоксида титана, которыми являются дефекты его поверхности и поверхностные примеси. Такой механизм восстановления приводит к образованию крупных, неравномерно распределенных агломератов частиц благородного металла, что приводит к низкой активности фотокатализатора.
Из приведенных примеров видно, что, несмотря на разнообразие методов и составов приготовления новых фотокаталитически активных материалов на основе диоксида титана, усиленных импрегнированными частицами благородных металлов, ни один не сочетает в себе простоту получения, равномерность распределения наночастиц по объему материала и его высокую фотокаталитическую активность.
В задачу группы изобретений положено создание нового способа легирования порошкообразного диоксида титана наночастицами благородных металлов для создания высокоактивных фотокатализаторов в реакциях окисления органических веществ.
Техническим результатом от использования предлагаемой группы изобретений является упрощение, снижение энергозатрат при легировании поверхности диоксида титана наночастицами благородных металлов, повышение эффективности и равномерности распределения наночастиц благородных металлов на поверхности диоксида титана.
Поставленная задача достигается тем, что способ легирования диоксида титана анатазной аллотропной модификации наночастицами благородных металлов включает приготовление водного раствора солевой формы хитозана, в который вводят допант прекурсора наночастиц золота, или серебра, после чего систему интенсивно перемешивают и подвергают УФ-воздействию для формирования наночастиц благородных металлов при температуре 20-70°С, формирование наночастиц металлов контролируют спектрофотометрически, и, после достижения максимальной интенсивности полосы плазмонного резонанса наночастиц, в систему при постоянном перемешивании вводят диоксид титана анатазной аллотропной модификации, затем в дисперсию вводят фермент, ферментативное разложение макромолекул хитозана проводят при температуре 35-40°С до полной деградации хитозана; перед введением в систему фермента проводят дополнительную ультразвуковую обработку дисперсии с частотой до 35 кГц; в качестве фермента используют папаин, или панкреатин, или амилазу, или глюкоамилазу, или хитозан; концентрация хитозана в растворе составляет 0,1-3 масс. %, концентрацию диоксида титана в растворе хитозана составляет 0,01-20 масс. % от массы сухого хитозана, прекурсоров наночастиц благородных металлов - от 0,01 до 5 масс. % от массы сухого хитозана; после выпадения в осадок всего модифицированного диоксида титана систему подвергают термообратоке при температуре 70-100°С.
Поставленная задача достигается, также тем, что способ легирования диоксида титана анатазной аллотропной модификации наночастицами благородных металлов включает диспергирование диоксида титана анатазной аллотропной модификации в водном растворе солевой формы хитозана при интенсивном перемешивании, затем в дисперсию вводят допант прекурсора наночастиц золота, или серебра, систему перемешивают и подвергают УФ-воздействию для формирования наночастиц благородных металлов при температуре 20-70°С, формирование наночастиц металлов контролируют спектрофотометрически, и, после достижения максимальной интенсивности полосы плазмонного резонанса наночастиц, в систему вводят фермент, ферментативное разложение макромолекул хитозана проводят при температуре 35-40°С до полной деградации хитозана; перед введением в систему допанта прекурсора наночастиц проводят дополнительную ультразвуковую обработку дисперсии с частотой до 35 кГц; в качестве фермента используют папаин, или панкреатин, или амилазу, или глюкоамилазу, или хитозан; концентрация хитозана в растворе составляет 0,1-3 масс. %, концентрацию диоксида титана в растворе хитозана составляет 0,01-20 масс. % от массы сухого хитозана, прекурсоров наночастиц благородных металлов 0,01-5 масс. % от массы сухого хитозана; после выпадения в осадок всего модифицированного диоксида титана систему подвергают термообратоке при температуре 70-100°С.
На фиг. 1 представлен рисунок, на котором показано расположение атомов титана (синий) и кислорода (красный) в кристаллической решетке диоксида титана анатазной аллотропной модификации.
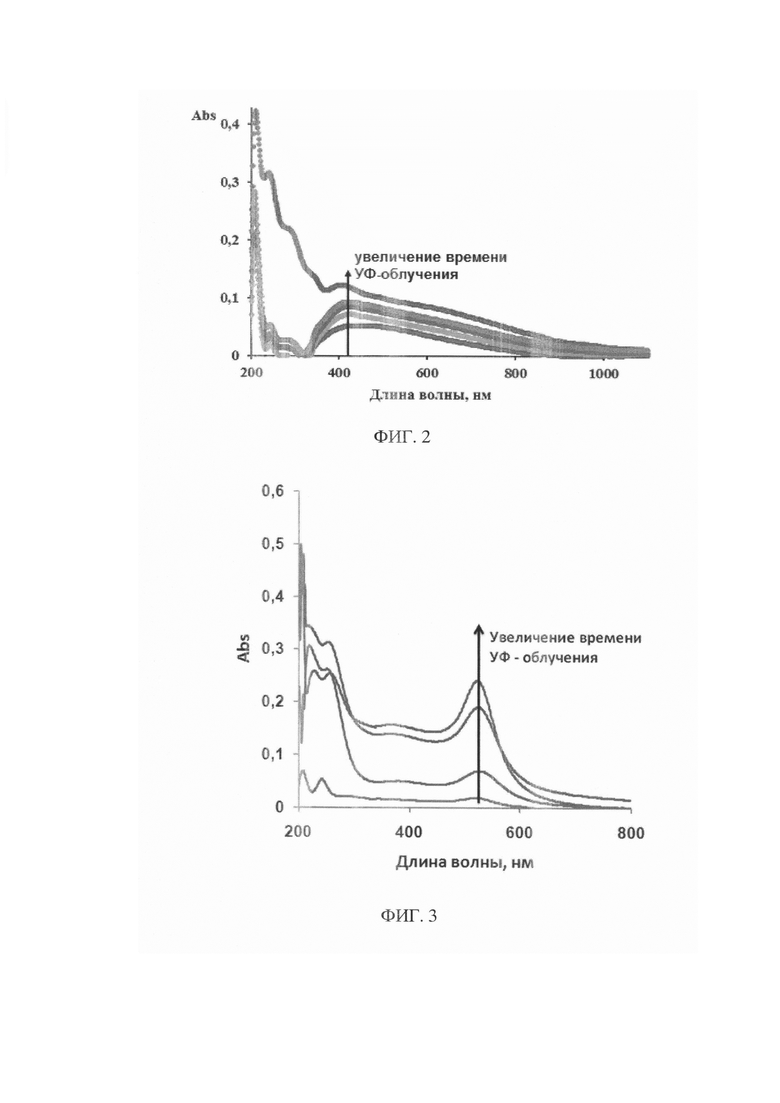
На фиг. 2 представлено изменение кривых спектра поглощения растворов хитозана, содержащих AgNO3, в процессе формирования в них наночастиц серебра (красная - спектр раствора спустя 30 минут УФ-облучения, зеленая - спектр раствора спустя спустя 60 минут УФ-облучения, фиолетовая - спектр раствора спустя 90 минут УФ-облучения, голубая - спектр раствора спустя 120 минут УФ-облучения, синяя - спектр раствора спустя 120 минут УФ-облучения и прогрева в течение 30 минут при температуре 70°С).
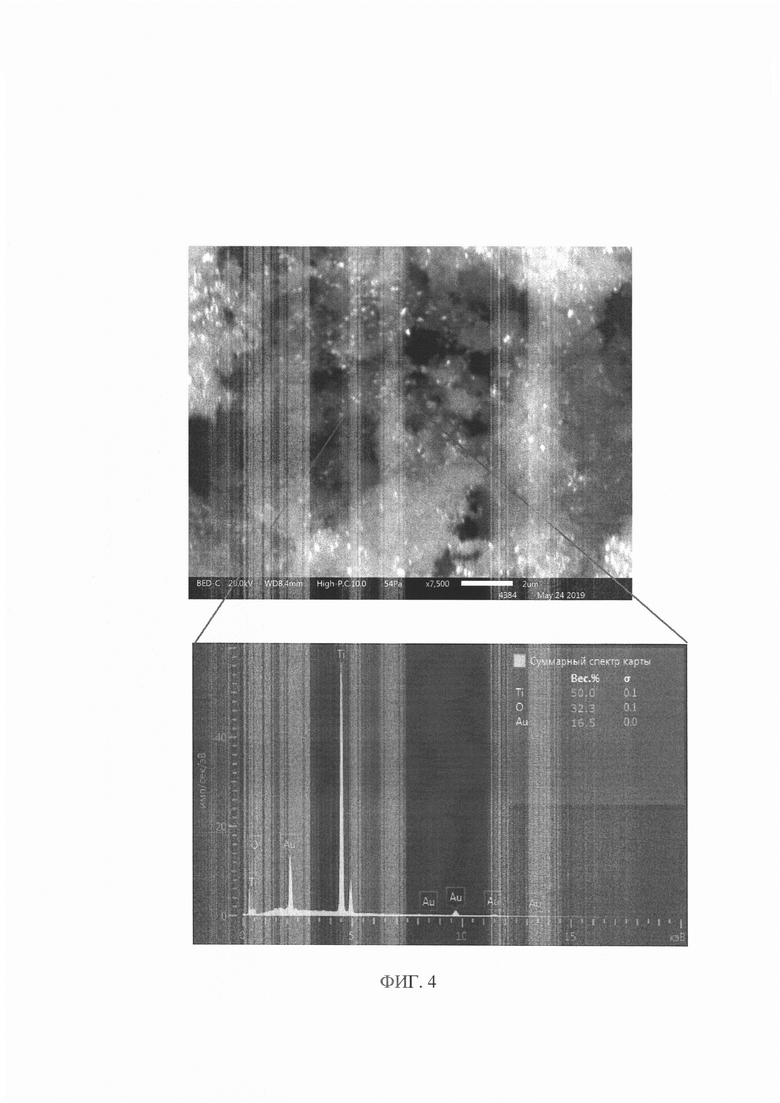
На фиг. 3 представлено изменение кривых спектра поглощения растворов хитозана, содержащих HAuCl4, в процессе формирования в них наночастиц золота (голубая - спектр раствора спустя 30 минут УФ-облучения раствора, синяя - спектр раствора спустя 60 минут УФ-облучения, красная - спектр раствора спустя 120 минут УФ-облучения, фиолетоая - спектр раствора спустя 120 минут УФ-облучения и прогрева в течение 30 минут при температуре 70°С).
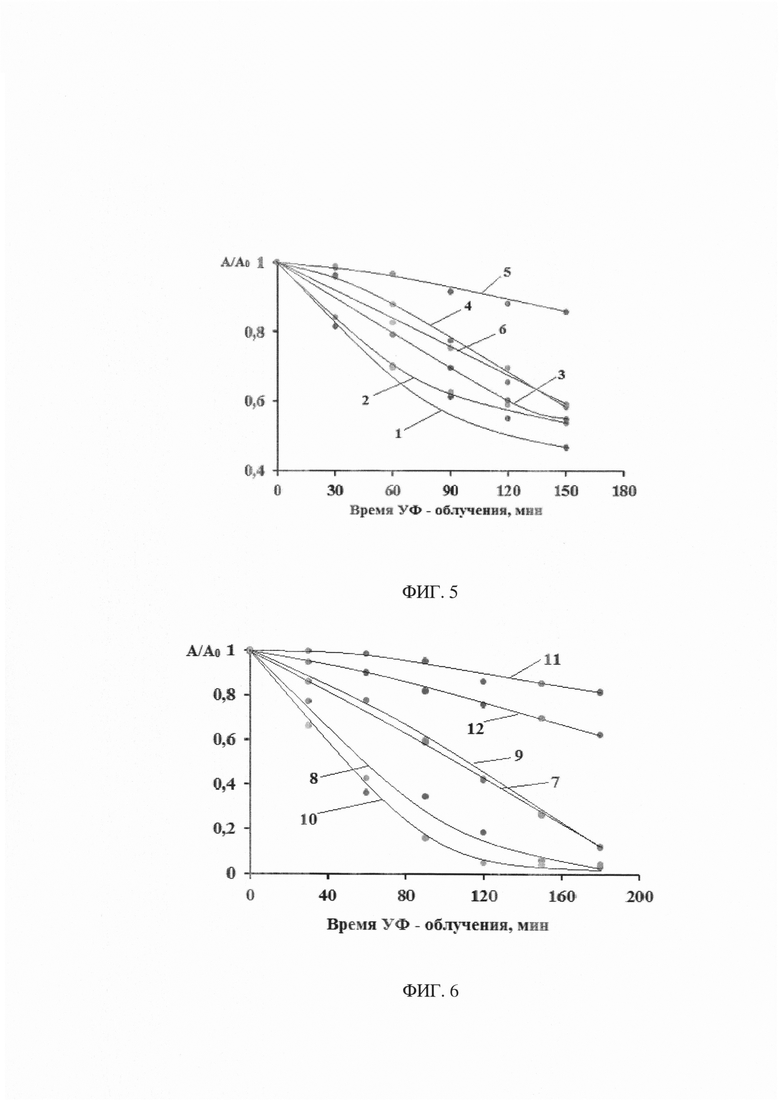
На фиг. 4 представлено изображение порошка TiO2/Au, полученное с помощью сканирующего электронного микроскопа, и рентгенофлюорисцентный анализ его поверхности.
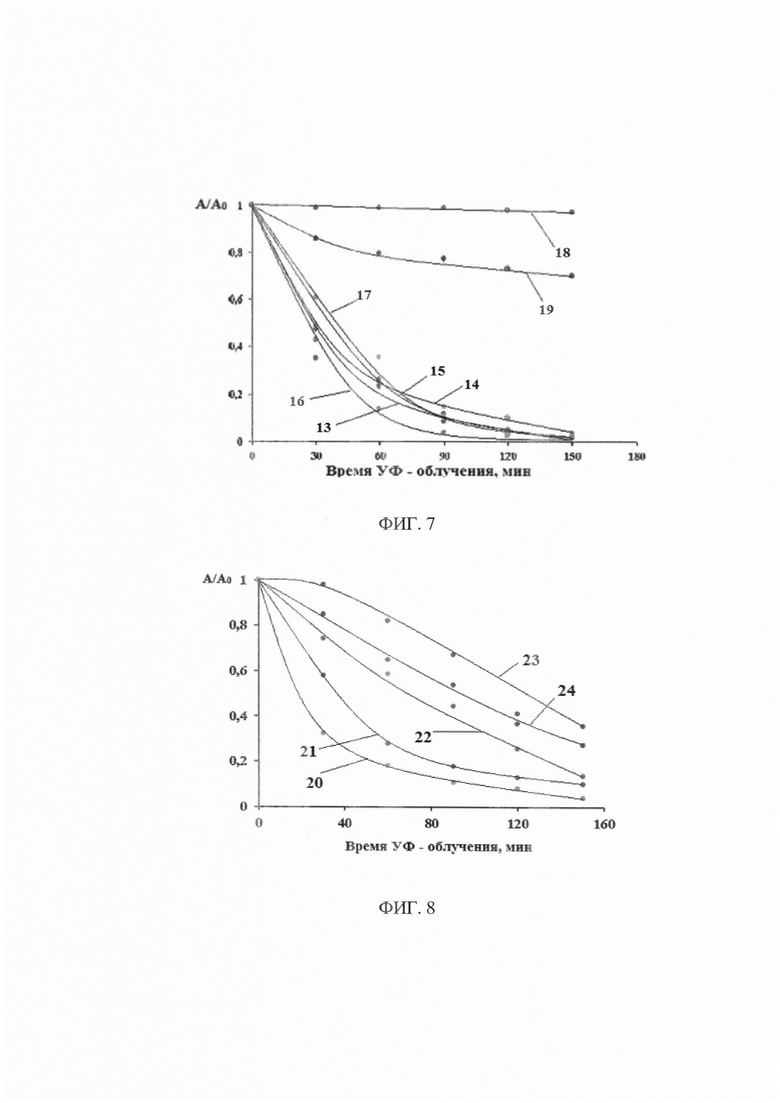
На фиг. 5 представлены графики относительного изменения концентрации метиленового оранжевого в водном растворе при УФ - облучении: кривая 1 - в присутствии катализатора №3; кривая 2 - катализатора №4; кривая 3 - катализатора №5; кривая 4 - катализатора №6; кривая 5 - без катализатора; кривая 6 - в присутствии порошка TiO2. Номера катализаторов указаны в соответствии с таблицей 2.
На фиг. 6 представлены графики относительного изменения концентрации метиленового синего в водном растворе при УФ - облучении: кривая 7 - в присутствии катализатора №3; кривая 8 - катализатора №4; кривая 9 - катализатора №5; кривая 10 - катализатора №6; кривая 11 - без катализатора; кривая 12 - в присутствии порошка TiO2. Номера катализаторов указаны в соответствии с таблицей 2.
На фиг. 7 представлены графики относительного изменения концентрации водного раствора 4-нитрофенола при УФ - облучении: кривая 13 - в присутствии катализатора №7; кривая 14 - катализатора №8; кривая 15 - катализатора №9; кривая 16 - катализатора №11; кривая 17 - катализатора №10; кривая 18 - без катализатора; кривая 19 - в присутствии порошка TiO2. Номера катализаторов указаны в соответствии с таблицей 2.
На фиг. 8 представлены графики относительного изменения концентрации водного раствора конго красного при УФ - облучении: кривая 20 - в присутствии катализатора №12, кривая 21 - катализатора №7, кривая 22 - катализатора №13, кривая 23 - без катализатора, кривая 24 - диоксида титана. Номера катализаторов указаны в соответствии с таблицей 2.
Предлагаемый способ легирования порошкообразного диоксида титана наночастицами благородных металлов осуществляют следующим образом.
Наночастицы металлов из их соответствующих солей - прекурсоров формируют под действием УФ-света в присутствии полимера-стабилизатора образующихся наночастиц - хитозана - и диоксида титана с последующим ферментативным разложением полисахарида и осаждением наночастиц металлов на поверхности TiO2.
Звено (ХТЗ), представляющее собой β - D-глюкозу, может выполнять функцию не только стабилизатора наночастиц (НЧ), но и их восстановителя. Этот полимер представляет собой аминополисахарид, который в нейтральных и щелочных средах содержит свободные NH2- группы, а в кислых средах они протонированы - NH3+, а также гидроксильные группы, что открывает возможности для эффективной стабилизации НЧ за счет их адсорбции на макромолекулах хитозана.
Разработано два варианта легирования частиц диоксида титана анатазной аллотропной модификации.
Первый вариант заключается в следующем. Готовят водный раствор солевой формы хитозана, в который вводят прекурсор в форме соответствующей соли металла - золота, или серебра. Систему интенсивно перемешивают и подвергают УФ-воздействию для формирования наночастиц благородных металлов при температуре 20-70°С. Формирование наночастиц металлов контролируют спектрофотометрически, и, после достижения максимальной интенсивности полосы плазмонного резонанса наночастиц, в систему при постоянном перемешивании вводят диоксид титана анатазной аллотропной модификации. Возможно проведение дополнительной ультразвуковой обработки дисперсий с частотой до 35 кГц. Затем в дисперсию вводят фермент, способный разрушить полимерные цепи хитозана (папаин, панкреатин, амилаза, глюкоамилаза, хитозаназа). Ферментативное разложение макромолекул хитозана проводят при температуре 35-40°С, при которой ферменты проявляют максимальную активность, в течение времени, соответствующего полной деградации хитозана. По окончании всех процедур происходит осаждение наночастиц металлов на поверхности диоксида титана (фиг. 3).
Второй вариант заключается в следующем. Диоксид титана анатазной аллотропной модификации диспергируют в водном растворе солевой формы хитозана при интенсивном перемешивании. Возможно проведение дополнительной ультразвуковой обработки дисперсий с частотой до 35 кГц. В дисперсию вводят прекурсор в форме соответствующей соли - золота, или серебра. Систему перемешивают и подвергают УФ-воздействию для формирования наночастиц благородных металлов при температуре 20-70°С. Формирование наночастиц металлов контролируют спектрофотометрически, и, после достижения максимальной интенсивности полосы плазмонного резонанса наночастиц, в систему вводят фермент, способный разрушить полимерные цепи хитозана. Ферментативное разложение макромолекул хитозана проводят при температуре от 35-40°С, при которой ферменты проявляют максимальную активность, в течение времени, соответствующего полной деградации хитозана. По окончании всех процедур происходит осаждение наночастиц металлов на поверхности диоксида титана.
Как в первом, так и во втором вариантах после окончания процесса и выпадения в осадок всего модифицированного диоксида титана систему подвергают термообратоке при температуре 70-100°С, обеспечивающей полную дезактивацию и разрушение ферментов.
Во всех случаях макромолекулы хитозана играют роль сильного стабилизатора при формировании наночастиц золота, или серебра, что позволяет ограничить их размеры до 20 нм. Молекулярная масса хитозана варьируется от 50000 до 200000, степень деацетилирования - от 0,50 до 0,92. Для растворения хитозана его переводят в солевую форму добавлением органических или неорганических кислот: уксусной, соляной, молочной, бензойной, аспарагиновой, янтарной и других. Концентрация хитозана в таких растворах составляет 0,1-3 масс. %. В качестве диоксида титана используют TiO2 анатазной аллотропной модификации. Диоксид титана является крупнотоннажным продуктом химической промышленности и в чистом виде представляет собой белый порошок. TiO2 принадлежит к классу оксидов переходных металлов и имеет несколько аллотропных модификаций, одной из которых является анатаз. Основой кристаллической структуры TiO2 анатазной аллотропной модификации являются октаэдры TiO6 (фиг. 1). В анатазе каждый атом Ti находится в центре октаэдра и окружен 6 атомами кислорода. Октаэдры расположены таким образом, что каждый ион кислорода принадлежит трем октаэдрам. В анатазе на один октаэдр приходится 4 общих ребра (Simons Р Y, Dachille F. The structure of TiO2 II, a high-pressure phase of TiO2 // Acta Crystallographica. 1967. V. 23. №2. P. 334-336). TiO2 антазной аллотропной модификации относится к полупроводникам с шириной запрещенной зоны в 3,2 эВ (Zhao Y, Li С, Liu X., Gu F., Jiang H., Shao W., Zhang L., He Y. Synthesis and optical properties of TiO2 nanoparticles // Materials Letters. - 2007. - V.61. №1. - pp. 79-83.). Из литературы известно, что запрещенная зона анатаза является самой узкой среди аллотропных модификаций диоксида титана (анатаза, рутила или брукита). Это означает, что для активации процесса 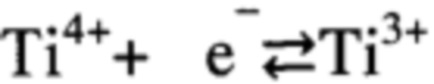 с эффективным разделением зарядов и образованием электрон-дырочных пар, а, следовательно, и генерации окислительных супер-оксидных и гидроксильных радикалов и «запуска» фотокаталитических процессов, необходимо световое излучение с меньшей энергией, то есть большей длиной волны ультрафиолетового излучения (A. Fujishima, Т.N. Rao, D.A. Tryk. Titanium dioxide photocatalysis // J. Photochemistry and Photobiology C: Photochemistry Reviews. - 2000. - V. 1. - pp. 1-21). Обычно граница фотопоглощения анатаза составляет 355 нм, а для рутила или брукита - менее 340 нм (Chen X., Мао S. Titanium dioxide nanomaterials: synthesis, properties, modifications, and applications // Chemical Reviews. - 2007. - V.107. №7. - pp. 2891-2959). Из этого следует, что при УФ-облучении анатаза происходит более интенсивное образование активных форм кислорода и более активно происходят фотокталитические процессы на его поверхности (A. Fujishima, X. Zhang, D. Tryk. Heterogeneous photocatalysis: From water photolysis to applications in environmental clean up // Int. J. Hydrogen. Ener. - 2007. - V. 14. - pp. 2664-2672).
с эффективным разделением зарядов и образованием электрон-дырочных пар, а, следовательно, и генерации окислительных супер-оксидных и гидроксильных радикалов и «запуска» фотокаталитических процессов, необходимо световое излучение с меньшей энергией, то есть большей длиной волны ультрафиолетового излучения (A. Fujishima, Т.N. Rao, D.A. Tryk. Titanium dioxide photocatalysis // J. Photochemistry and Photobiology C: Photochemistry Reviews. - 2000. - V. 1. - pp. 1-21). Обычно граница фотопоглощения анатаза составляет 355 нм, а для рутила или брукита - менее 340 нм (Chen X., Мао S. Titanium dioxide nanomaterials: synthesis, properties, modifications, and applications // Chemical Reviews. - 2007. - V.107. №7. - pp. 2891-2959). Из этого следует, что при УФ-облучении анатаза происходит более интенсивное образование активных форм кислорода и более активно происходят фотокталитические процессы на его поверхности (A. Fujishima, X. Zhang, D. Tryk. Heterogeneous photocatalysis: From water photolysis to applications in environmental clean up // Int. J. Hydrogen. Ener. - 2007. - V. 14. - pp. 2664-2672).
В качестве предшественника наночастиц золота используют золотохлористоводородную кислоту HAuCl4, наночастиц серебра - нитрат серебра AgNO3. Концентрацию доксида титана в растворах хитозана варьируют в пределах 0,01-20 масс. % от массы сухого хитозана, прекурсоров наночастиц металлов 0,01-5 масс. % от массы сухого хитозана. В качестве ферментов используют папаин, панкреатин, амилаза, глюкоамилаза, хитозаназа. Концентрации ферментов подбирают в соответствии с их природой и активностью при температуре менее 40°С.
Интервал молекулярных масс хитозана выбран в соответствии с тем, чтобы при переводе полисахарида в солевую форму и растворении его в воде в указанном интервале концентраций не происходило образование высоковязких растворов. Кроме того, применение хитозана с молекулярной массой выше 200000 не обеспечивает достаточно быстрое ферментативное разрушение хитозана, а хитозан с молекулярной массой менее 50000 не является высокоэффективным стабилизатором наночастиц металлов. В указанном интервале степеней деацетилирования хитозана эго макромолекулы обеспечивают максимальную способность его макромолекул эффективно стабилизировать наночастицы металлов. Концентрация хитозана в растворах от 0,1 до 3,0 масс. % обеспечивает получение растворов умеренной вязкости. При введении в растворы хитозана от 0,01 до 20 масс. % диоксида титана от массы сухого хитозана происходит образование устойчивых дисперсий, в которых не наблюдается преждевременного осаждения частиц диоксида титана. В интервале концентраций прекурсоров наночастиц от 0,01 до 5 масс. % от массы сухого хитозана происходит формирование наночастиц металлов с размером менее 20 нм. Увеличение содержания прекурсоров приводит к укрупнению наночастиц. Ферментативное разложение хитозана происходит в интервале температур от 35 до 40°С, поскольку в этом температурном диапазоне ферменты имеют наибольшую активность в реакциях гидролиза полисахаридов. Дополнительная термообратока суспензий проводится при температуре 70-100°С, так как в этом интервале обеспечивается полная дезактивация и разрушение ферментов. Формирование наночастиц проводят при температуре от 30 до 70°С, в этом случае обеспечивается наиболее полная сформированность наночастиц за 2 часа УФ-воздействия. При температуре меньше 30°С возрастает вязкость раствора, что приводит к структурированию системы и увеличению времени, необходимого для образования наночастиц металлов. При температуре выше 70°С происходит интенсивное испарение воды из раствора, что приводит к нежелательному изменению концентраций веществ, и, как следствие, неконтролируемому росту наночастиц.
Ниже представлены примеры конкретного осуществления предлагаемого изобретения.
Пример 1.
Готовят водный раствор 3 масс. % ХТЗ в 1,5 масс. % уксусной кислоте (УК). Для этого на 100 г раствора берут 3 г сухого ХТЗ, в который добавляют рассчитанное количество дистиллированной воды, и выдерживают в таком виде некоторое время. Далее в суспензию при постоянном перемешивании добавляют рассчитанное количество (1,5 г) УК. Оставляют раствор для полного растворения ХТЗ на 48 часов. В раствор хитозана вносят порошкообразный диоксид титана в количестве 20 масс. % от массы сухого ХТЗ - 0.6 г. Для получения более однородной суспензии, проводят УЗ - облучение системы в течение 30 минут при частоте 35 кГц. После завершения процесса диспергирования в суспензию вводят 1,5 г водного раствора 1 масс. % HAuCl4 так, чтобы концентрация сухой HAuCl4 по отношению к массе сухого ХТЗ составила 0,5 масс. %. Проводят УФ-облучение дисперсии в течение 2 часов при температуре 30°С с последующей ее термообработкой при температуре от 70 до 100°С в течение 30 минут. Постоянство максимума интенсивности полосы поглощения в области 500-550 нм, соответствующей полосе плазмонного резонанса наночастиц золота, свидетельствует о завершении процесса формирования наночастиц. После этого в дисперсию вводят фермент папаин в количестве 10 масс. % от массы сухого ХТЗ и термостатируют при 40°С в течение двух часов, что обеспечивает ферментативное разрушение макромолекул хитозана. Затем прогревают растворы при 70°С для дезактивации фермента. Разрушение цепей ХТЗ контролируют по снижению вязкости раствора. При этом происходит выпадение осадка розового цвета. Дисперсию промывают с помощью спиртового раствора NaOH. Осадок центрифугируют, промывают дистиллированной водой до нейтрального значения рН (рН=6-7) и сушат в вакуумном шкафу до постоянной массы. После высушивания порошок имеет розовую окраску. Образец дополнительно диспергируют любым механическим приемом. Наличие наночастиц золота на поверхности диоксида титана контролируют рентгенофлюорисцентным и рентгеноструктурным анализом. Далее исследуют фотокаталитическую активность.
Пример 2.
Готовят дисперсию диоксида титана в вводно-кислотном растворе хитозана в полном соответствии с методикой, описанной в примере 1. Затем в дисперсию при постоянном перемешивании вводят прекурсор наночастиц серебра - AgNO3 в виде 0,1 масс. % водного раствора нитрата серебра так, чтобы концентрация сухого AgNO3 по отношению к массе сухого хитозана составила 1 масс. % (30 г в расчете на 100 г 3 масс. % раствора ХТЗ в 1,5 масс. % УК). Дисперсию подвергают УФ-облучению для формирования наночастиц серебра в течение 2 часов при температуре 30°С. Процесс формирования наночастиц серебра и его завершение контролируют спектрофотометрически по постоянству интенсивности максимума полосы плазмонного резоненса наночастиц серебра в области 390-430 нм. Затем дополнительно проводят термообработку дисперсии при температуре 70°С. После этого в дисперсию вводят фермент папаин в количестве 10 масс. % от массы сухого ХТЗ и термостатируют при 40°С в течение двух часов, что обеспечивает ферментативное разрушение макромолекул хитозана. Затем прогревают растворы при 70°С для дезактивации фермента. Разрушение цепей ХТЗ контролируют по снижению вязкости раствора. При этом происходит выпадение осадка серо-коричневого цвета. Дисперсию промывают с помощью спиртового раствора NaOH. Осадок центрифугируют, промывают дистиллированной водой до нейтрального значения рН (рН=6-7) и сушат до постоянной массы. После высушивания порошок имеет серо-коричневую окраску. Образец дополнительно механически диспергируют. Наличие наночастиц серебра на поверхности диоксида титана контролируют рентгенофлюорисцентным и рентгеноструктурным анализом. Далее исследуют фотокаталитическую активность.
Пример 3.
Готовят раствор 3 масс. % ХТЗ в 1,5 масс. % УК в полном соответствии примеру 1. В раствор вводят 1,5 г водного раствора 1 масс. % HAuCl4 так, чтобы концентрация сухой HAuCl4 по отношению к массе сухого ХТЗ составила 0,5 масс. %. Проводят УФ-облучение раствора в течение 2 часов при температуре 30°С с последующей его термообработкой при температуре от 70 до 100°С в течение 30 минут. Постоянство максимума интенсивности полосы поглощения в области 500-550 нм, соответствующей полосе плазмонного резонанса наночастиц золота, свидетельствует о завершении процесса формирования наночастиц. В нанодисперсию вносят порошкообразный диоксид титана в количестве 20 масс. % от массы сухого ХТЗ - 0.6 г. Для получения более однородной суспензии, проводят УЗ - облучение системы в течение 30 минут при частоте 35 кГц. После этого в дисперсию вводят фермент папаин в количестве 10 масс. % от массы сухого ХТЗ и термостатируют при 40°С в течение двух часов, что обеспечивает ферментативное разрушение макромолекул хитозана. Затем прогревают растворы при 70°С для дезактивации фермента. Разрушение цепей ХТЗ контролируют по снижению вязкости раствора. При этом происходит выпадение осадка розового цвета. Дисперсию промывают с помощью спиртового раствора NaOH. Осадок центрифугируют, промывают дистиллированной водой до нейтрального значения рН (рН=6-7) и сушат в вакуумном шкафу до постоянной массы. После высушивания порошок имеет розовую окраску. Образец дополнительно механически диспергируют. Наличие наночастиц золота на поверхности диоксида титана контролируют рентгенофлюорисцентным и рентгеноструктурным анализом. Далее исследуют фотокаталитическую активность.
Пример 4.
Аналогичен примеру 1 по методике приготовления порошков, за исключением того, что в дисперсию вводят 3 масс. % HAuCl4 по отношению к массе сухого хитозана.
Пример 5.
Аналогичен примеру 1 по методике приготовления порошков, за исключением того, что используют раствор 0,5 масс. % ХТЗ в 1,5 масс. % УК.
Пример 6.
Аналогичен примеру 1 по методике приготовления порошков за исключением того, что в исходный раствор хитозана вводят 20 масс. % TiO2 по отношению к массе сухого ХТЗ.
Пример 7.
Аналогичен примеру 1 по методике приготовления порошков за исключением того, что УФ-индуцированное формирование наночастиц золота проводят при температуре 70°С.
Пример 8.
Аналогичен примеру 1 по методике приготовления порошков за исключением того, что ферментативное разрушение макромолекул хитозана проводят в присутствии панкреатина в количестве 10 масс. % по отношению к массе сухого хитозана.
Пример 9.
Аналогичен примеру 2 по методике приготовления порошков, за исключением того, что в дисперсию вводят 3 масс. % AgNO3 по отношению к массе сухого хитозана.
Пример 10.
Аналогичен примеру 2 по методике приготовления порошков за исключением того, что в исходный раствор хитозана вводят 5 масс. % TiO2 по отношению к массе сухого ХТЗ.
Пример 11.
Аналогичен примеру 2 по методике приготовления порошков за исключением того, что УФ-индуцированное формирование наночастиц серебра проводят при температуре 50°С.
Пример 12.
Аналогичен примеру 2 по методике приготовления порошков за исключением того, что ферментативное разрушение макромолекул хитозана проводят амилазой и глюкоамилазой в количестве 10 масс. % по отношению к массе сухого хитозана.
Пример 13.
Аналогичен примеру 3 по методике приготовления порошков за исключением того, что в раствор хитозана сначала вводят 3 масс. % AgNO3 для УФ-индуцированного формирования наночастиц серебра, которое проводят при температуре 70°С, затем в дисперсию вводят 5 масс. % порошкообразного диоксида титана анатазной аллотропной модификации, для разрушения макромолекул хитозана в дальнейшем используется хитозаназа в количестве 0,1 масс. % по отношению у массе сухого хитозана.
Характеристика образцов.
В работе было выполнено формирование наночастиц Au (Ag) in situ в растворах хитозана из прекурсов HAuCl4 (AgNO3) при их УФ - восстановлении. Процесс контролировали спектрофотометрическим методом по появлению и нарастанию полосы плазмонного резонанса (ПНР) наночастиц серебра в области 390-430 нм, золота - 500-550 нм (фиг. 1, 2).
Распределение наночастиц золота или серебра по размерам во всех случаях составило от 2 до 30 нм. Средний размер частиц порошка TiO2 был определен методом седиментации и составил 220 мкм, полидисперсность 23.
Были проведены исследования влияния различных ферментов на вязкость растворов хитозана, а, следовательно, и на молекулярную массу (ММ) полисахарида. В качестве ферментов использовали папаин, панкреатин, амилазу в совокупности с глюкоамилазой и хитозаназу. В раствор 3 масс. % хитозана в 1,5 масс. % уксусной кислоте были добавлены сухие папаин или панкреатин, а также растворы амилазы в совокупности с глюкоамилазой в количестве 10 масс. % от массы сухого хитозана или раствора хитозаназы, содержащей 0,0145 единиц активного фермента. Растворы термостатировали при 40°С в течении 1,5 часов. Вязкость растворов измеряли каждые 20 минут с помощью вискозиметра Брукфильда. Результаты приведены в таблице 1.
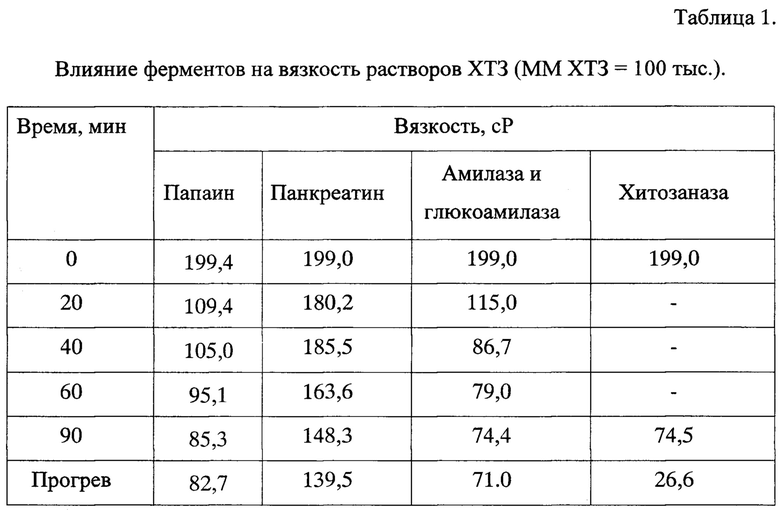
Из таблицы видно, что выбранные количества ферментов в данных условиях снижают вязкость растворов на 50% в случае папаина, на 30% - в случае панкреатина, на 60% - в случае амилазы в совокупности с глюкоамилазой. Из этого следует, что макромолекулы хитозана разрушаются неэффективно. В связи с этим для более эффективного разрушения хитозана необходимо было использовать другой фермент. В качестве такого фермента была выбрана хитозаназа в растворе, содержащая 0,0145 единиц активного фермента, которая снижает вязкость раствора хитозана на 88% в тех же условиях, что и остальные выбранные нами ферменты. Это свидетельствует о наиболее эффективном разрушении макромолекул хитозана.
Таким образом, для разложения хитозана в процессах получения фотокатализаторов можно использовать все указанные ферменты, но наилучшее действие проявляет хитозаназа.
Все порошки фотокатализаторов были охарактеризованы с помощью сканирующей электронной микроскопии (СЭМ) в совокупности с рентгенофлюорисцентным анализом. В качестве примера на фиг. 3 приведены микрофотографии порошка TiO2/Au. Из рисунков видно, что после ферментативного разрушения макромолекул хитозана порошок представляет собой диоксид титана с равномерно распределенными по его поверхности наночастицами золота. Дополнительных примесей в порошке обнаружено не было.
Фотокаталитические свойства порошков легированного диоксида титана.
Апробация порошков легированного диоксида титана в качестве фотокатализаторов осуществлена в реакциях окисления азо-красителей (метиленового оранжевого (МО), метиленового синего (МС), конго красного (КК)), фенолов (фенол или 4-нитрофенол (НФ)), хинонов, спиртов, крахмала.
Испытания фотокаталитической активности полученных образцов проводят следующим образом: берут 20 мл водного раствора органического соединения с концентрацией от 0,001 масс. % до 1 масс. % и вносят в него 0,02 г фотокатализатора. Системы помещают под УФ - лампу и подвергают УФ-облучению при постоянном перемешивании на открытом воздухе при температуре 25-30°С. Через каждые 20-30 минут облучения снимают спектры растворов красителей на спекторофотометре с целью контроля за реакцией разложения соединений по снижению соответствующих им характерных полос поглощения. По окончании процесса строят зависимости изменения оптической плотности растворов органических соединений от времени их облучения: А/А0=f(t) (А - текущая оптическая плотность, А0 - оптическая плотность исходного раствора органического соединения).
Результаты по разложению азо-красителей в присутствии катализаторов представлены в таблице 2 и на фиг. 4-7.
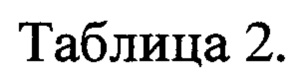
Из рисунков видно, что все материалы проявляют фотокаталитическую активность. МО и МС при действии УФ - облучения в отсутствие катализатора почти не разлагаются, о чем свидетельствует практически постоянное значение их концентрации.
Фотокаталитичкая активность образцов диоксида титана, легированных наночастицами Au (Ag), выше фотокаталитической активности чистого TiO2 (анатаз). Так, при использовании TiO2 (анатаз) за 150 минут разлагается примерно 60% красителя, в то время как при использовании TiO2/Au (Ag) глубина разложения МО и МС выше, достигая 97%.
При разложении МО наилучшие результаты демонстрирует образцы фотокатализатора с наночастицами золота, а в случае МС - с Ag. При этом практически не имеет значения, на каком этапе получения фотокатализаторов был добавлен диоксид титана.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения наноразмерного диоксида титана с вариабельными оптическими свойствами, модифицированного металлическими плазмонными наночастицами | 2021 |
|
RU2771768C1 |
| ФОТОКАТАЛИТИЧЕСКИЙ СОРБИРУЮЩИЙ ТКАНЕВЫЙ МАТЕРИАЛ | 2014 |
|
RU2562485C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФОТОКАТАЛИТИЧЕСКОГО СОРБИРУЮЩЕГО ТКАНЕВОГО МАТЕРИАЛА | 2014 |
|
RU2559506C1 |
| КОМПОЗИТНЫЙ ФОТОКАТАЛИЗАТОР ДЛЯ ОЧИСТКИ ВОДЫ И ВОЗДУХА | 2011 |
|
RU2478413C1 |
| КОМПОЗИТНЫЙ АДСОРБЦИОННО-КАТАЛИТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ ФОТОКАТАЛИТИЧЕСКОГО ОКИСЛЕНИЯ | 2011 |
|
RU2465046C1 |
| CПОСОБ ПОЛУЧЕНИЯ ФИЛЬТРУЮЩЕ-СОРБИРУЮЩЕГО МАТЕРИАЛА С ФОТОКАТАЛИТИЧЕСКИМИ СВОЙСТВАМИ | 2011 |
|
RU2482912C1 |
| Катализатор для фотоокисления монооксида углерода под действием ультрафиолетового излучения и видимого света | 2023 |
|
RU2841051C1 |
| Катализатор на основе порошка из микрочастиц титана | 2023 |
|
RU2810580C1 |
| ФОТОКАТАЛИЗАТОР-АДСОРБЕНТ (ВАРИАНТЫ) | 2008 |
|
RU2375112C1 |
| Способ приготовления металл-нанесенного катализатора для процесса фотокаталитического окисления монооксида углерода | 2016 |
|
RU2637120C1 |

Группа изобретений относится к области химии, а именно к технологии легирования диоксида титана анатазной аллотропной модификации наночастицами благородных металлов для создания высокоэффективного фотокатализатора, предназначенного для фотокаталитических реакций окисления органических соединений в мягких условиях. В первом варианте способ включает приготовление водного раствора солевой формы хитозана, в который вводят прекурсор - соответствующие соли золота или серебра. После этого систему интенсивно перемешивают и подвергают УФ-воздействию для формирования наночастиц благородных металлов при температуре 20-70°С. После достижения максимальной интенсивности полосы плазмонного резонанса наночастиц в систему при постоянном перемешивании вводят диоксид титана анатазной аллотропной модификации. Затем в дисперсию вводят фермент. Ферментативное разложение макромолекул хитозана проводят при температуре 35-40°С до полной деградации хитозана. Во втором варианте проводят диспергирование диоксида титана анатазной аллотропной модификации в водном растворе солевой формы хитозана при интенсивном перемешивании. Затем в дисперсию вводят прекурсор - соответствующие соли золота или серебра. Систему перемешивают и подвергают УФ-воздействию для формирования наночастиц благородных металлов при температуре 20-70°С. Формирование наночастиц металлов контролируют спектрофотометрически. После достижения максимальной интенсивности полосы плазмонного резонанса наночастиц в систему вводят фермент. Ферментативное разложение макромолекул хитозана проводят при температуре 35-40°С до полной деградации хитозана. Техническим результатом является упрощение процесса при снижении энергозатрат, повышение эффективности и равномерности распределения наночастиц благородных металлов на поверхности диоксида титана. 2 н. и 8 з.п. ф-лы, 8 ил., 2 табл., 13 пр.
1. Способ легирования диоксида титана анатазной аллотропной модификации наночастицами благородных металлов, включающий приготовление водного раствора солевой формы хитозана, в который вводят допант прекурсора наночастиц золота или серебра, после чего систему интенсивно перемешивают и подвергают УФ-воздействию для формирования наночастиц благородных металлов при температуре 20-70°С, формирование наночастиц металлов контролируют спектрофотометрически, и после достижения максимальной интенсивности полосы плазмонного резонанса наночастиц в систему при постоянном перемешивании вводят диоксид титана анатазной аллотропной модификации, затем в дисперсию вводят фермент, ферментативное разложение макромолекул хитозана проводят при температуре 35-40°С до полной деградации хитозана.
2. Способ по п. 1, отличающийся тем, что перед введением в систему фермента проводят дополнительную ультразвуковую обработку дисперсии с частотой до 35 кГц.
3. Способ по п. 1, отличающийся тем, что в качестве фермента используют папаин, или панкреатин, или амилазу, или глюкоамилазу, или хитозаназу.
4. Способ по п. 1, отличающийся тем, что концентрация хитозана в растворе составляет 0,1-3 мас. %, концентрация диоксида титана в растворе хитозана составляет 0,01-20 мас. % от массы сухого хитозана, прекурсоров наночастиц благородных металлов - 0,01-5 мас. % от массы сухого хитозана.
5. Способ по п. 1, отличающийся тем, что после выпадения в осадок всего модифицированного диоксида титана систему подвергают термообработке при температуре 70-100°С.
6. Способ легирования диоксида титана анатазной аллотропной модификации наночастицами благородных металлов - золота или серебра, включающий диспергирование диоксида титана анатазной аллотропной модификации в водном растворе солевой формы хитозана при интенсивном перемешивании, введение в полученную дисперсию допанта прекурсора наночастиц золота или серебра, перемешивание системы и УФ-воздействие для формирования наночастиц благородных металлов при температуре 20-70°С, контролирование формирования наночастиц металлов спектрофотометрически, при этом после достижения максимальной интенсивности полосы плазмонного резонанса наночастиц в систему вводят фермент, а ферментативное разложение макромолекул хитозана проводят при температуре 35-40°С до полной деградации хитозана.
7. Способ по п. 6, отличающийся тем, что перед введением в систему допанта прекурсора наночастиц проводят дополнительную ультразвуковую обработку дисперсии с частотой до 35 кГц.
8. Способ по п. 6, отличающийся тем, что в качестве фермента используют папаин, или панкреатин, или амилазу, или глюкоамилазу, или хитозаназу.
9. Способ по п. 6, отличающийся тем, что концентрация хитозана в растворе составляет 0,1-3 мас. %, концентрация диоксида титана в растворе хитозана составляет 0,01-20 мас. % от массы сухого хитозана, прекурсоров наночастиц благородных металлов - 0,01-5 мас. % от массы сухого хитозана.
10. Способ по п. 6, отличающийся тем, что после выпадения в осадок всего модифицированного диоксида титана систему подвергают термообратоке при температуре 70-100°С.
| KOZLOVA Е.А | |||
| et al., Influence of the method of platinum deposition on activity and stability of Pt/TiO2 photocatalysts in the photocatalytic oxidation of dimethyl methylphosphonate, "Catalysis Communications", 2011, No.12, pp | |||
| ПРИБОР ДЛЯ КОНТРОЛЯ ВРЕМЕНИ ПРИХОДА И УХОДА НА РАБОТУ | 1921 |
|
SU597A1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ КАТАЛИЗАТОРА НА ОСНОВЕ ДИОКСИДА ТИТАНА (ВАРИАНТЫ) | 2003 |
|
RU2243033C1 |
| SHAO FENG CHEN et al., Large Scale Photochemical Synthesis of M@TiO2 Nanocomposites | |||
Авторы
Даты
2020-09-01—Публикация
2019-09-11—Подача