ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к способу оценки стабильности композиции на основе белка по отношению к смазывающему веществу смазанного контейнера, предназначенного для хранения указанной композиции. Изобретение дополнительно относится к способу модификации состава композиции на основе белка к смазывающему веществу смазанного контейнера и способу выбора смазывающего вещества, подходящего для смазывания контейнера, предназначенного для хранения композиции на основе белка, для повышения стабильности указанной композиции по отношению к данному смазывающему веществу.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Предварительно наполненные устройства для инъекций представляют собой обычные контейнеры для доставки лекарственных средств или вакцин пациентам и включают шприцы, картриджи и шприцы-ручки. Они обычно включают изолирующий уплотнитель для скользящего введения в контейнер, при этом контейнер наполняется фармацевтической композицией для обеспечения специалиста-практика готовым к использованию устройством для инъекций.
По сравнению с пустыми устройствами для инъекций, которые наполняют хранящейся в ампулах фармацевтической композицией непосредственно перед инъекцией, применение предварительно наполненных устройств для инъекций ведет к нескольким преимуществам. В частности, в результате ограничения приготовления перед инъекцией, предварительно наполненные устройства для инъекций обеспечивают сокращение медицинских ошибок при дозировании, минимизируется риск микробного загрязнения, и увеличивается удобство использования для специалистов-практиков. Кроме того, такие предварительно наполненные контейнеры способствуют и упрощают самостоятельное введение препарата пациентами, что позволяет снизить стоимость терапии и повысить ответственность пациента. Наконец, предварительно наполненные устройства для инъекций снижают потерю ценной фармацевтической композиции, которая обычно происходит при переносе фармацевтической композиции из ампулы в предварительно ненаполненное устройство для инъекций. Это приводит к большему количеству возможных инъекций для данной серии производства фармацевтического продукта, снижая, таким образом, затраты на покупку и систему поставок.
Однако наряду с этими улучшениями, коммерциализация фармацевтической композиции в предварительно наполненных устройствах для инъекций вызывает свой собственный комплекс проблем, особенно в случае чувствительных биологических препаратов. В действительности, биологические препараты, такие как цитокины, моноклональные антитела, продукты на основе нуклеиновых кислот и вакцины, являются весьма сложными молекулами и подвергаются множеству путей деградации, что может влиять на эффективность терапии и безопасность пациента.
Например, в случае предварительно наполненного шприца, компоненты, такие как вольфрам, смазывающее вещество на основе силикона и клеящие вещества, были определены как возможные источники несовместимости в отношении биологических препаратов. Смазывающие вещества в целом и более конкретно силиконовые масла, получили повышенное внимание со стороны ученых, занимающихся композициями, в вопросах понимания их совместимости с белками и вакцинами. Силиконовые масла фармацевтической степени чистоты, такие как поли(диметилсилоксан) (ПДМС), обычно используются в устройствах для инъекций ввиду их смазывающих свойств: они обеспечивают эффективное скольжение уплотнителя в цилиндре устройства для инъекций во время введения пациенту фармацевтической композиции. Силиконовые масла, однако, как сообщалось, участвуют в деградации терапевтических белков, например, образовании частиц в фармацевтических композициях, включающих вакцины. Данные частицы часто включают белки агрегированные с адъювантами и/или силиконовым маслом.
Кроме значимых потерь белковой активности, результатом парентерального введения таких агрегированных белков могут быть нежелательные клинические эффекты и проблемы с безопасностью. Кроме того, даже очень низкий процент степени агрегирования, такой как 1 %, может сделать фармацевтическую композицию неприемлемой для лучших современных практических подходов и нормативов. Однако оценка стабильности композиции на основе белка при хранении в смазанном контейнере может быть сложной и трудоемкой. Кроме того, модификация состава композиции на основе белка к таким контейнерам часто является эмпирической и проводится на поздней стадии разработки продукта. Некоторые фармацевтические композиции на основе белка, таким образом, могут быть допущены на более поздние стадии разработок до определения больших проблем со стабильностью при хранении в устройстве для инъекций. Это приводит к дорогостоящим стадиям изменения состава лекарственного средства и недоступности дорогих фармацевтических композиций для пациентов.
Наконец, когда имеется несколько смазывающих веществ, отсутствует быстрый способ выбора наиболее подходящего смазывающего вещества для данной композиции на основе белка. Трудоемкие исследования стабильности, таким образом, должны проводиться медицинскими компаниями для разных устройств для инъекций и смазывающих композиций, без какой-либо возможности создать краткий перечень наиболее многообещающих решений.
Вследствие этого, существует большая потребность в быстром и эффективном способе оценки стабильности композиции на основе белка по отношению к смазывающему веществу смазанного контейнера, который предназначен для хранения указанной композиции. Кроме того, существует необходимость в надежном способе руководства при разработке композиций на основе белка, предназначенных для хранения в смазанных контейнерах. Наконец, способ выбора наиболее подходящего смазывающего вещества для контейнера, предназначенного для хранения композиции на основе белка, также является желательным.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Таким образом, первый аспект настоящего изобретения представляет собой способ оценки стабильности композиции на основе белка, включающей белок, пептид и/или производное белка, и буфер по отношению к смазывающему веществу смазанного контейнера, который предназначен для хранения указанной композиции, включающий:
а) оценку уменьшения с течением времени межфазного натяжения между буфером и смазывающим веществом,
б) оценку уменьшения с течением времени межфазного натяжения между композицией на основе белка и смазывающим веществом,
в) определение по меньшей мере одного компонента композиции на основе белка, взаимодействующего со смазывающим веществом, посредством сравнения уменьшения, оцененного на стадии б), с уменьшением, оцененным на стадии а).
Данный способ обеспечивает очень хорошее понимание стабильности композиции на основе белка по отношению к смазывающему веществу смазанного контейнера, используя простые и недорогие измерения межфазного натяжения. В частности, данный способ позволяет определять происходит ли взаимодействие между белком и смазывающим веществом или между буфером и смазывающим веществом. Таким образом, он позволяет выявлять проблемы, связанные со стабильностью, на очень ранней стадии разработки композиции и избежать дорогих стадий изменения состава лекарственного средства во время более поздних стадий разработки композиции. Данный способ, таким образом, является очень важным для уменьшения риска, связанного со стабильностью, во время разработки композиции на основе белка и экономии времени и денег для фармацевтических компаний.
В одном из вариантов осуществления данный способ дополнительно включает оценку уменьшения межфазного натяжения между каждым компонентом буфера и смазывающим веществом на стадии а). Действительно, нестабильность композиции на основе белка и смазывающего вещества может быть связана с любым компонентом композиции и не только с белком. Данный способ, таким образом, является полезным для определения взаимодействующего(их) компонента(ов) среди всех компонентов буфера.
Второй аспект настоящего изобретения представляет собой способ повышения стабильности композиции на основе белка по отношению к смазывающему веществу указанного контейнера. В первом подходе данный способ включает:
а) оценку стабильности композиции на основе белка согласно первому аспекту настоящего изобретения,
б) выбор адъюванта, вызывающего большее уменьшение с течением времени межфазного натяжения со смазывающим веществом, чем композиция на основе белка,
в) модификация состава композиции на основе белка посредством добавления указанного выбранного адъюванта к композиции на основе белка.
Данный адъювант может уже присутствовать в буфере и его концентрация может, таким образом, быть повышена настолько, чтобы конкурировать с взаимодействием, определяемым в первом аспекте настоящего изобретения, например, взаимодействием белка со смазывающим веществом. Таким образом, нежелательное взаимодействие заменяется нечувствительным взаимодействием, которое не препятствует стабильности или эффективности композиции на основе белка. Добавляемый адъювант также может представлять собой адъювант, не присутствующий в композиции на основе белка перед модификацией состава композиции настоящим способом. Например, адъювант может представлять собой поверхностно-активное вещество, такое как Полисорбат 80.
Во втором подходе данный способ включает:
а) оценку стабильности композиции на основе белка согласно первому аспекту настоящего изобретения,
б) выбор адъюванта, способного к комплексообразованию с белком композиции на основе белка,
в) модификацию состава композиции на основе белка посредством добавления указанного выбранного адъюванта так, чтобы по меньшей мере частично снизить уменьшение с течением времени межфазного натяжения между композицией на основе белка и смазывающим веществом.
Во втором подходе нежелательное взаимодействие, определенное в первом аспекте настоящего изобретения, может быть предотвращено посредством образования комплекса белка и адъюванта, и модифицированная композиция на основе белка не демонстрирует какого-либо уменьшения с течением времени межфазного натяжения со смазывающим веществом. Например, добавляемый адъювант может представлять собой соль, такую как соль алюминия, например, гидроксид алюминия.
Оба подхода второго аспекта настоящего изобретения обеспечивают простой способ изменения состава композиции на основе белка, которая была признана нестабильной по отношению к данному смазывающему веществу в смазанном контейнере. Посредством использования межфазного натяжения в качестве руководства, дорогие и длительные исследования стабильности могут быть предвидены и сокращены.
Третий аспект настоящего изобретения представляет собой способ выбора смазывающего вещества, подходящего к контейнеру, предназначенному для хранения композиции на основе белка, включающий:
а) предоставление по меньшей мере одного смазывающего вещества, подлежащего исследованию,
б) оценку стабильности композиции на основе белка по отношению к указанному по меньшей мере одному смазывающему веществу способом согласно первому аспекту настоящего изобретения,
в) определение чувствительности композиции на основе белка к взаимодействию, определенному на стадии б),
г) выбор смазывающего вещества, вызывающего нечувствительное взаимодействие с композицией на основе белка, или модификация состава композиции на основе белка посредством способа согласно второму аспекту настоящего изобретения.
Данный способ позволяет выбирать смазывающее вещество наиболее подходящее к конкретной композиции на основе белка.
Более точно, стадия б) позволяет определить по меньшей мере один компонент композиции на основе белка, который взаимодействует с по меньшей мере одним смазывающим веществом, подлежащим исследованию на стадии а). Данный компонент определяют посредством сравнения уменьшения с течением времени межфазного натяжения между композицией на основе белка и смазывающим веществом с уменьшением с течением времени межфазного натяжения между каждым компонентом буфера и смазывающим веществом согласно первому аспекту изобретения.
То есть, это последнее сравнение уменьшения с течением времени межфазного натяжения между каждым компонентом буфера и смазывающим веществом необходимо, только тогда, когда все смазывающие вещества взаимодействуют с композицией на основе белка. В противном случае должно быть выбрано смазывающее вещество, которое не взаимодействует с композицией на основе белка.
Когда компонент композиции на основе белка, который взаимодействует со смазывающим веществом, был определен согласно стадии б), стадия в) дополнительно позволяет определять чувствительность композиции на основе белка по отношению к взаимодействию указанного компонента со смазывающим веществом. Затем, в случае, когда по меньшей мере одно смазывающее вещество вызывает нечувствительное взаимодействие с композицией на основе белка, то выбирают данное смазывающее вещество. В случае, когда все смазывающие вещества вызывают чувствительное взаимодействие с композицией на основе белка, композицию на основе белка модифицируют посредством добавления адъюванта к данной композиции, который вызывает большее уменьшение с течением времени межфазного натяжения, или настоящее исследование может быть проведено с другими смазывающими веществами.
Стадии а) и б) являются быстрыми и недорогими. Определение чувствительности композиции на основе белка по отношению к взаимодействию согласно стадиям в) и г) может, однако, требовать дополнительных экспериментов, известных специалисту в этой области и выбранных с учетом конкретного исследуемого взаимодействия. Например, если определяют взаимодействие между буфером и смазывающим веществом, может требоваться контроль pH. Однако если происходит ограниченное взаимодействие с белком, то исследование структуры и сворачивания данного взаимодействующего белка может потребовать использование кругового дихроизма, инфракрасной и Рамановской спектроскопии или ядерного магнитного резонанса.
Таким образом, межфазное натяжение используют в качестве мощного инструмента для исследования стабильности композиции на основе белка в смазанном контейнере. При выявлении взаимодействия межфазное натяжение также представляет собой ценное руководство либо при модификации состава композиции на основе белка к смазанному контейнеру, либо при выборе смазывающего вещества, совместимого с композицией на основе белка.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1 представляет собой график, показывающий уменьшение с течением времени межфазного натяжения двух вакцин против менингита, а именно вакцины А и вакцины B, и их соответствующего буфера, а именно буфера вакцины A и буфера вакцины B, которые представляют собой композиции вакцины без белка вакцины.
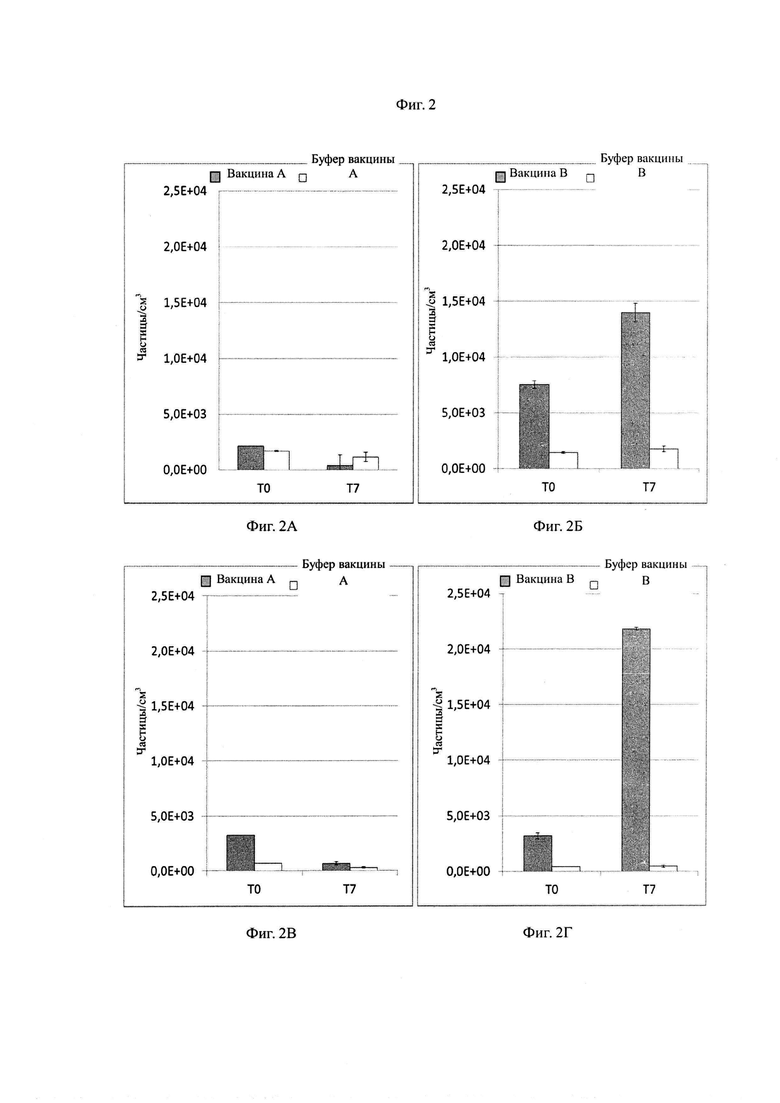
Фиг. 2А-2Г представляют собой графики, показывающие концентрацию частиц, измеренную с помощью метода визуализации микропотока (Micro-Flow Imaging), соответственно, для вакцины A, буфера вакцины A (Фиг. 2А и 2В), вакцины B и буфера вакцины B (Фиг. 2Б и 2Г). Фиг. 2А и 2Б представляют собой концентрации глобулярных частиц, и Фиг. 2В и 2Г представляют собой концентрации неглобулярных частиц.
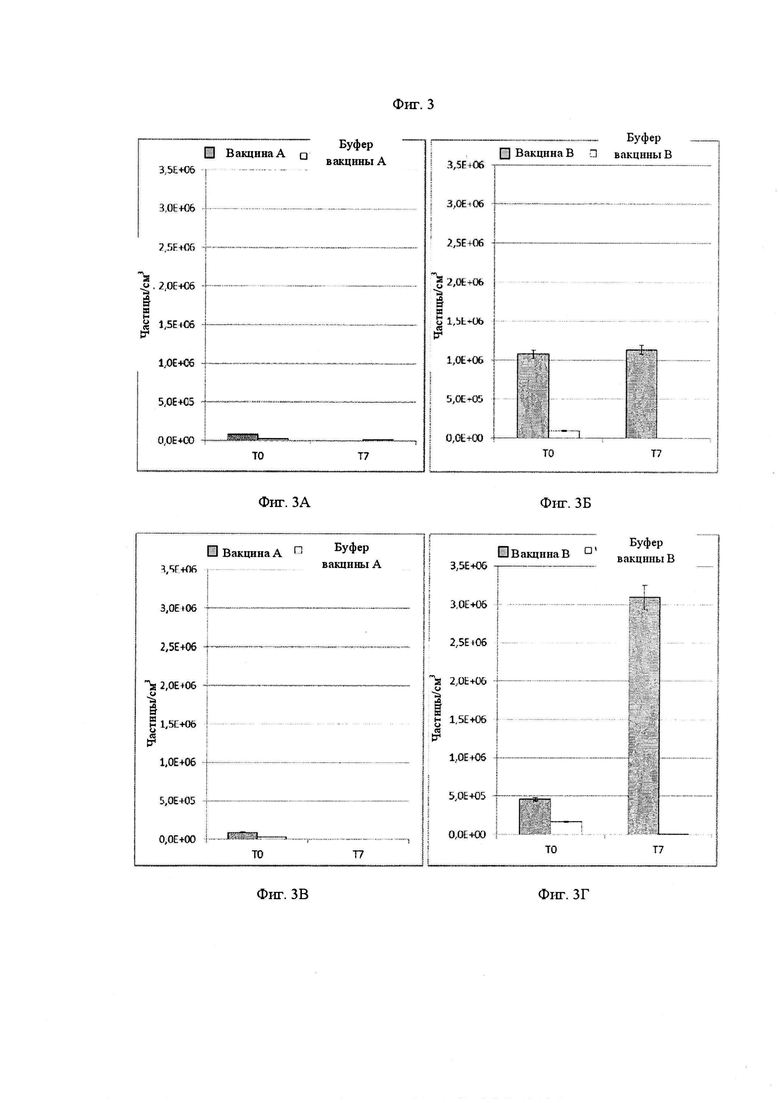
Фиг. 3А-3Г представляют собой графики, показывающие концентрацию частиц, измеренную с помощью метода резонансного измерения массы (Resonance Mass Measurement), соответственно, для вакцины A, буфера вакцины A (Фиг. 3А и 3В), вакцины B и буфера вакцины B (Фиг. 3Б и 3Г). Фиг. 3А и 3Б представляют собой концентрации положительно заряженных частиц, и Фиг. 3В и 3Г представляют собой концентрацию отрицательно заряженных частиц.
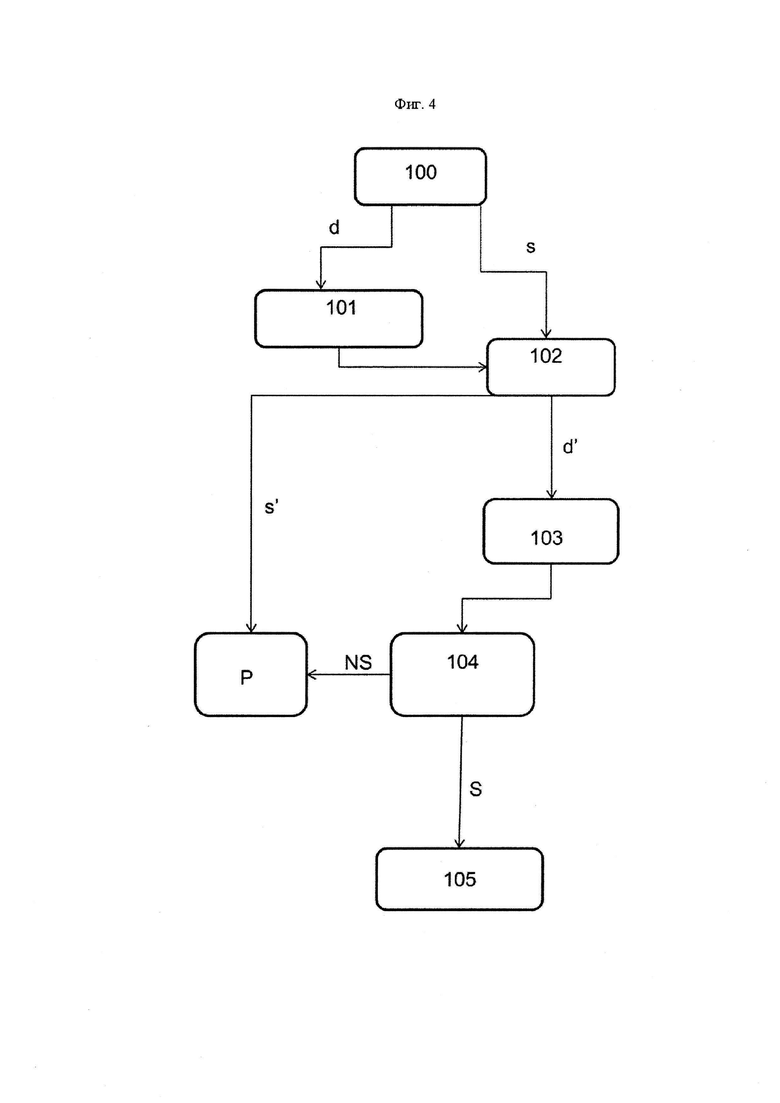
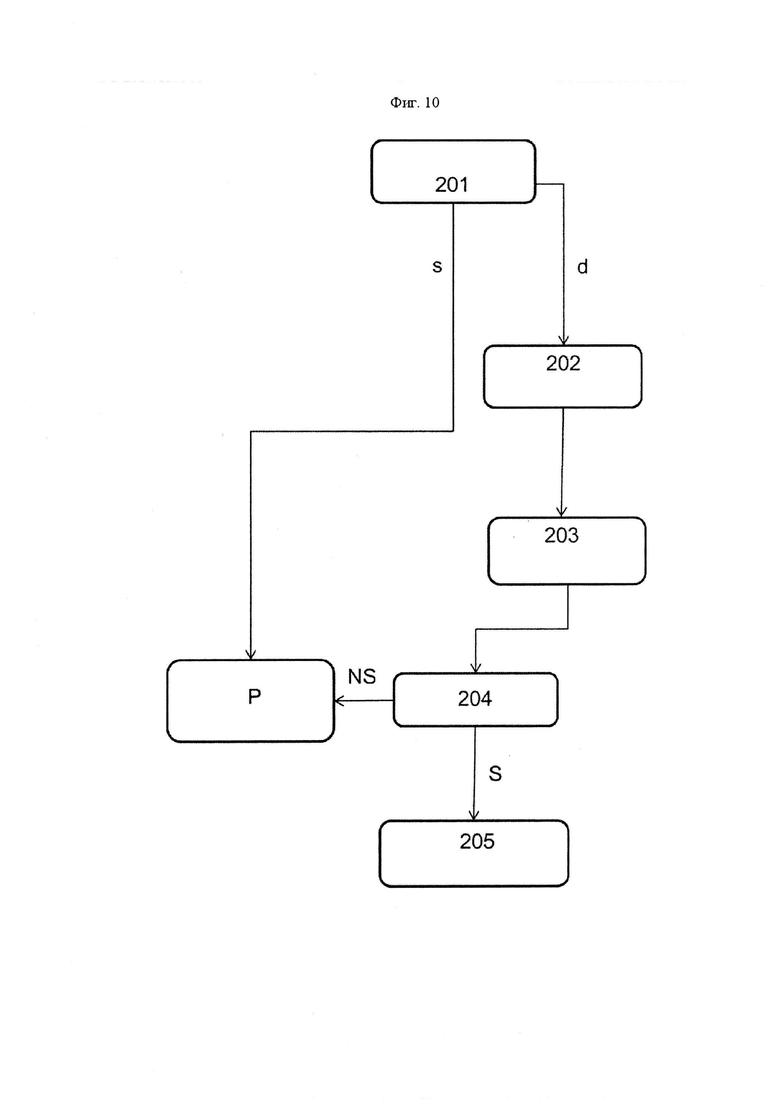
Фиг. 4 представляет собой блок-схему, обобщающую способ согласно первому аспекту настоящего изобретения.
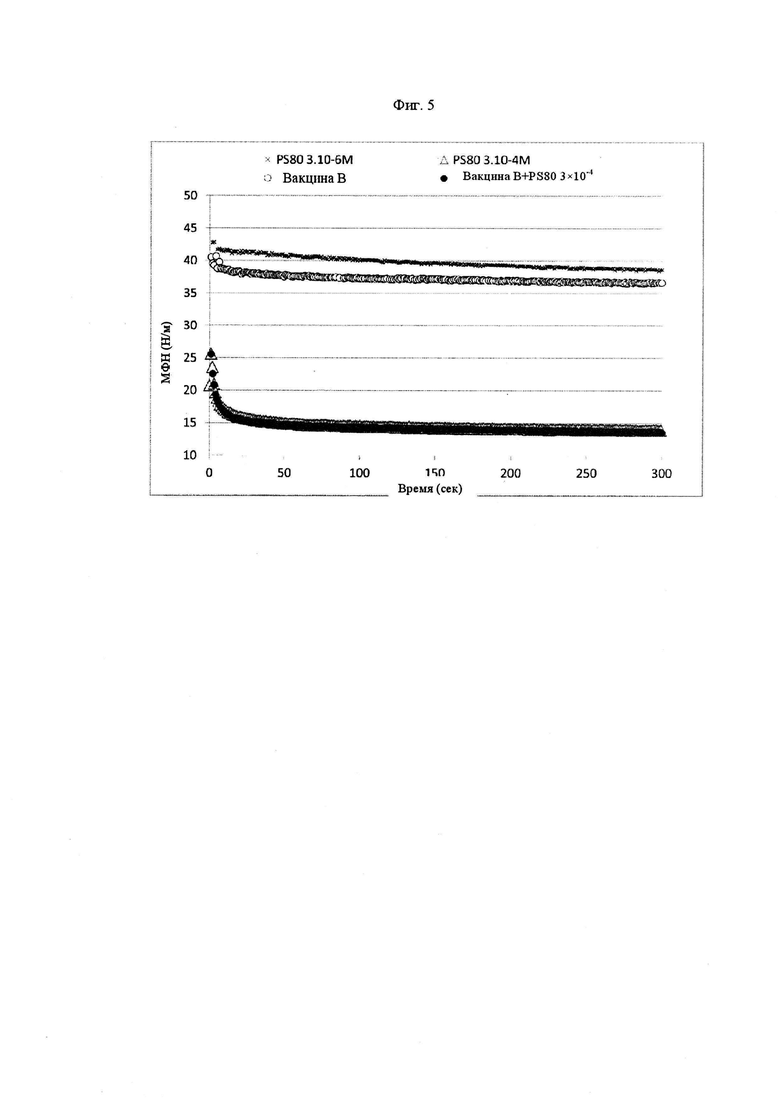
Фиг. 5 представляет собой график, показывающий уменьшение с течением времени межфазного натяжения между силиконовым маслом и соответственно Полисорбатом 80 при концентрации 3×10-6 М (крест), Полисорбатом 80 при концентрации 3×10-4 М (треугольники), вакциной B (пустые круги) и вакциной B с Полисорбатом 80 при концентрации 3×10-4 М (обычные круги).
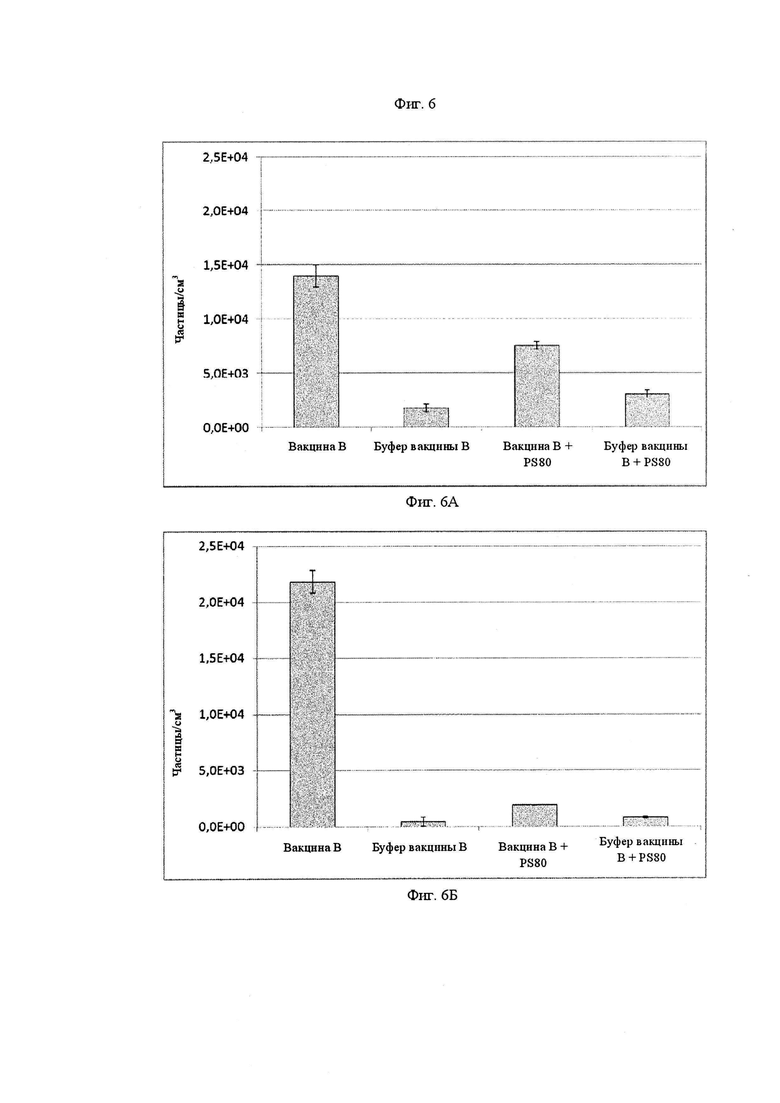
Фиг. 6А и 6Б представляют собой графики, показывающие концентрацию частиц, измеренную с помощью метода визуализации микропотока, соответственно, для вакцины B, буфера вакцины B, вакцины B с Полисорбатом 80 при концентрации 3×10-4 М и буфера вакцины B с Полисорбатом 80 при концентрации 3×10-4 М.
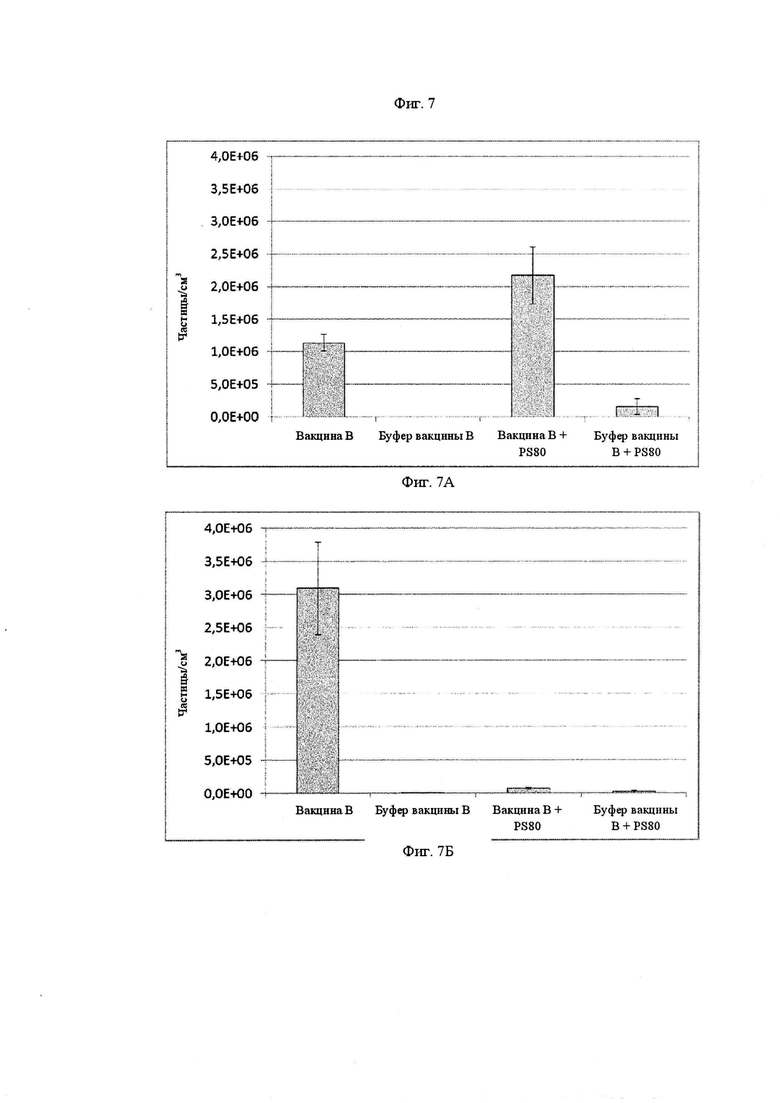
Фиг. 7А и 7Б представляют собой графики, показывающие концентрацию частиц, измеренную с помощью метода резонансного измерения массы, соответственно, для вакцины B, буфера вакцины B, вакцины B с Полисорбатом 80 при концентрации 3×10-4 М и буфера вакцины B с Полисорбатом 80 при концентрации 3×10-4 М.
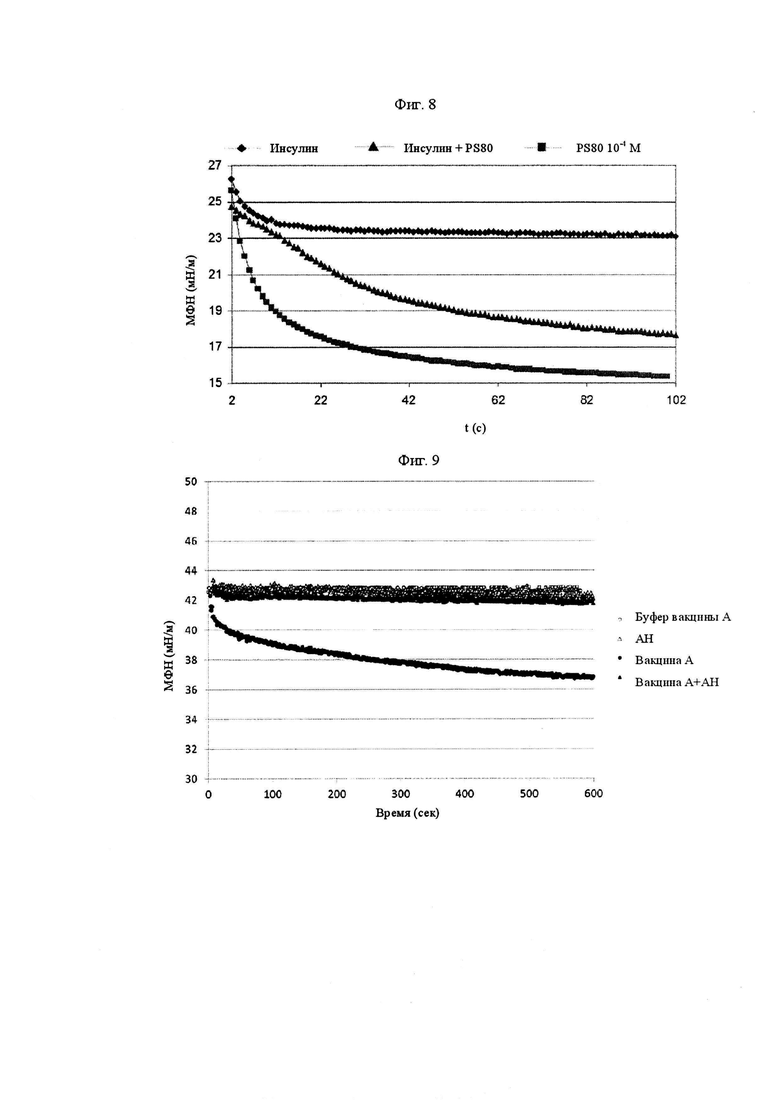
Фиг. 8 представляет собой график, показывающий уменьшение с течением времени межфазного натяжения между силиконовым маслом и соответственно инсулином при концентрации 1 г/л, Полисорбатом 80 при концентрации 10-4 М (ромбы), Полисорбатом 80 при концентрации 3×10-4 М (треугольники) и инсулином, модицифированным Полисорбатом 80 при концентрации 10-4 М (квадраты).
Фиг. 9 представляет собой график, показывающий уменьшение межфазного натяжения с течением времени между силиконовым маслом и соответственно буфером вакцины A (пустые круги), гидроксидом алюминия (пустые треугольники), вакциной A (обычные круги) и вакциной с гидроксидом алюминия (обычные треугольники).
Фиг. 10 представляет собой блок-схему, обобщающую способ по третьему аспекту настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В данном описании смазанный контейнер может представлять собой любой контейнер, подходящий для хранения композиции на основе белка и содержащий уплотнитель и смазывающее вещество, предназначенное для облегчения скольжения уплотнителя в пределах контейнера. Указанный контейнер может представлять собой, например, ампулу, картридж или шприц. Термин «композиция на основе белка» используется для любой профилактической или терапевтической фармацевтической композиции, содержащей пептид, белок или производное белка. Слово «вакцина» используется для композиции вакцины, включающей белок вакцины и все адъюванты и растворители. Термин «белок вакцины» используют для одного лишь белка вакцины, включая антигены и белок-носитель, но без адъювантов и растворителей. Термин «буфер вакцины» используют для композиции вакцины без белка вакцины, а именно только адъювантов и растворителей.
Межфазное натяжение определяют как натяжение, существующее на поверхности раздела между двумя несмешивающимися жидкостями, которое возникает из-за разницы в межмолекулярных взаимодействиях между этими двумя жидкостями. В объеме жидкости каждая молекула равным образом притягивается в каждом направлении соседними молекулами. Однако, молекулы, расположенные на поверхности раздела с несмешивающейся жидкостью, не будут притягиваться молекулами другой жидкости, а только их похожими «соседями». Это приводит к натяжению, которое вызывает сокращение поверхности жидкости с минимизированием межповерхностной энергии. В настоящем изобретении межфазное натяжение используется в качестве изобретательского инструмента в области композиций на основе белка
Первый аспект изобретения предполагает использование межфазного натяжения в способе оценки стабильности композиции на основе белка по отношению к смазывающему веществу смазанного контейнера. Важность данного способа была продемонстрирована с двумя поликонъюгированными вакцинами против менингита, а именно вакцинами A и B, в присутствии обычно используемого силиконового масла, то есть поли(диметилсилоксана) – см. Материалы и Методы.
Следующий способ осуществляли для обеих вакцин A и B.
На первой стадии оценивали уменьшение с течением времени межфазного натяжения между буфером вакцины и силиконовым маслом (поли(диметилислоксаном)), получая Кривую 1. Как отмечено выше, буфер вакцины соответствует композиции вакцины без белка вакцины.
На второй стадии оценивали уменьшение с течением времени межфазного натяжения между вакциной и силиконовым маслом, получая Кривую 2.
На третьей стадии сравнивали Кривую 1 и Кривую 2, например, посредством наложения на одном и том же графике, как показано на Фиг. 1.
В широком смысле, как показано на Фиг. 1, как вакцина A, так и вакцина B вызывают значительное уменьшение с течением времени межфазного натяжения с силиконовым маслом. Данные уменьшения, полученные с обеими вакцинами, таким образом, демонстрируют существование взаимодействия между силиконовым маслом и вакцинами, причем такое взаимодействие приводит к стабилизации поверхности раздела и, таким образом, уменьшению натяжения между вакциной и несмешивающимся силиконовым маслом.
Однако, кривые, полученные для вакцины A и вакцины B, представляют два разных профиля. Действительно, в случае вакцины A кривая (обычные треугольники на Фиг. 1) снижается равномерно с умеренным наклоном, приводя к снижению межфазного натяжения примерно на 13 % (от 41,6 до 36,2 мН/м) на протяжении эксперимента (т.е. 500 секунд). Напротив, на кривой межфазного натяжения, полученной с вакциной B (обычные круги на Фиг. 1), показан значительный наклон в течение первых 15 секунд и достигается снижение более чем на 20 % в конце эксперимента (от 43,9 до 35,0 мН/м) на протяжении такого же периода времени.
Теперь рассмотрим кривые, полученные с буферами вакцины A (пустые треугольники на Фиг. 1) и B (пустые круги на Фиг. 1), значимого уменьшения с течением времени межфазного натяжения не наблюдается, что указывает на то, что никакое взаимодействие не может стабилизировать поверхность раздела, которая остается в состоянии высокого натяжения. Так как уменьшение межфазного натяжения с течением времени наблюдается с вакцинами и не наблюдается с буферами вакцин (композиции вакцины без белков вакцин), можно сделать вывод о том, что белки вакцин ответственны за уменьшение с течением времени межфазного натяжения. Таким образом, данные результаты демонстрируют значимое взаимодействие между белками обеих вакцин и силиконовым маслом, причем вакцина B имеет более сильное взаимодействие с силиконовым маслом, чем вакцина A.
Не будучи связанными какой-либо теорией, это можно объяснить движением белка вакцины B к поверхности раздела с силиконовым маслом, которое приводит к быстрому уменьшению (за первые 15 секунд) межфазного натяжения. Оказавшись на поверхности раздела, белок вакцины B может разворачиваться в энергетически более благоприятные конформации, обеспечивающие дополнительное уменьшение межфазного натяжения. Развернутые белки затем могут взаимодействовать с композицией вакцины и образовывать агрегаты белков, при этом поверхность раздела между силиконовым маслом и вакциной B, таким образом, обеспечивает центры нуклеации для агрегирования белков вакцины.
В противоположность этому, вакцина A показывает более ограниченное взаимодействие с силиконовым маслом, указывающее на медленное движение белков к поверхности раздела и ограниченное образование агрегатов белка.
Данный анализ подтверждается результатами, полученными двумя разными аналитическими методиками, а именно визуализацией микропотока (MFITM) и резонансным измерением массы (RMM).
MFITM представляет собой технологию проточной микроскопии, которая фиксирует изображение взвешенных частиц в текущем потоке. Имеются заданные точки при разном увеличении для соответствия желаемым размерам частиц и качеству изображения. Изображения частиц затем можно дополнительно анализировать для того, чтобы отличить глобулярные частицы от неглобулярных частиц. В настоящем случае глобулярные частицы могут быть отнесены силиконовым частицам, в то время как неглобулярные частицы могут быть отнесены к белковым агрегатам, т.е. несвернутым белкам, агрегированным вместе.
В данном эксперименте шприцы, смазанные силиконовым маслом, наполняли соответственно вакциной A, буфером вакцины A, вакциной B и буфером вакцины B. Концентрации глобулярных и неглобулярных частиц затем измеряли вскоре после наполнения (T0) и после 7-суточной инкубации при 25 °C (T7).
Данные, полученные с помощью MFITM, показаны на Фиг. 2A-2Г, где на Фиг. 2А и 2Б показаны числовые концентрации (количество частиц на кубический сантиметр) глобулярных частиц, и Фиг. 2В и 2Г показывают концентрации неглобулярных частиц. Концентрации частиц, измеренные для вакцины A и буфера вакцины A, показаны на Фиг. 2А и 2В, в то время как на Фиг. 2Б и 2Г изображена концентрация, измеренная для вакцины B и буфера вакцины B.
Как показано на Фиг. 2А, концентрации глобулярных частиц остаются на уровне предельного значения 369 частиц/см3 для вакцины A и 1172 частиц/см3 для буфера вакцины A после хранения. Теперь в отношении вакцины B, очень высокая концентрация глобулярных частиц видна на Фиг. 2Б, вплоть до 7543 частиц/см3 после наполнения и 13959 частиц/см3 после 7-суточной инкубации, в то время как буфер вакцины B образовывал концентрации частиц ниже 1800 частиц/см3.
Похожий результат получен с неглобулярными частицами, отнесенными к агрегатам белка, как видно на Фиг. 2В и 2Г. В действительности, для смазанных шприцов, наполненных вакциной A, предельные значения концентраций составляют 673 частиц/см3, и для буфера вакцины A после 7 суток (Фиг. 2В) было получено 283 частиц/см3 , но очень высокая концентрация неглобулярных частиц равная выше 21000 частиц/см3 достигалась в смазанных шприцах, наполненных вакциной B (Фиг. 2Г), после 7 суток. И вновь, буфер вакцины B образует только предельное количество неглобулярных частиц равное 444 частиц/см3 при 7-суточной инкубации в смазанном контейнере.
Данные результаты демонстрируют сильное взаимодействие между белком вакцины B и силиконовым маслом, в соответствии с результатами, полученными способом согласно первому аспекту изобретения, основывающиеся на уменьшения межфазного натяжения.
Помимо MFITM данные были собраны посредством использования метода резонансного измерения массы (RMM). RMM основан на колебательном микрожидкостном контуре, позволяющем определять число и размер частиц, циркулирующих через него, путем измерения сдвига частоты вибрации. Данный эксперимент делает возможным измерение частиц меньшего размера, чем MFITM, а так же отличие капелек силиконового масла от агрегатов белков, так как сдвиг частоты вибрации зависит от массы частиц. Следовательно, частицы, имеющие более низкую плотность, чем среда анализа (соответствующий буфер вакцины в данном эксперименте), дают положительный сдвиг и могут быть отнесены к силиконовому маслу. Напротив, частицы, имеющие более высокую плотность, чем среда анализа, дают отрицательный сдвиг и могут быть отнесены к агрегатам белка.
Результаты данных экспериментов показаны на Фиг. 3А-3Г: Фиг. 3А и 3Б соответствуют концентрации положительно заряженных частиц, в то время как на Фиг. 3В и 3Г показана концентрация отрицательно заряженных частиц. Полученные данные показывают низкие концентрации положительно заряженных частиц 79933 частиц/см3 (относящиеся к силиконовому маслу) для вакцины А и 25867 частиц/см3 для буфера вакцины А после смешивания (T0) и даже более низкую концентрацию после 7-суточного хранения (T7, см. Фиг. 3А). Напротив, как видно на Фиг. 3Б, вакцина B образует высокую концентрацию положительно заряженных частиц (выше 1×106 частиц на см3) во время инкубации в смазанном контейнере, в то время как буфер вакцин A и B не образует значимой концентрации частиц, ниже 95000 частиц/см3. Теперь рассмотрим измерения отрицательно заряженных частиц, относящихся к агрегатам белка (Фиг. 3В и 3Г): вакцина A и буфер вакцины A не образуют значимых концентраций частиц, ниже 100000 частиц/см3, как и буфер вакцины B - ниже 170000 частиц/см3. Напротив, смазанные шприцы, наполненные вакциной B, образуют значимую концентрацию более чем 460000 отрицательно заряженных частиц на кубический сантиметр после смешивания (T0), причем данная концентрация после семи суток (T7) показывает очень сильное повышение, превосходящее 600 %, достигая 3,1×106 частиц на см3.
Таким образом, на основании данных разных экспериментов, можно сделать вывод о том, что происходит значимое взаимодействие между вакциной B и силиконовым маслом. Данное взаимодействие может быть отнесено к природе белка вакцины, находящегося в вакцине B, так как буфер вакцины B не образует значимой концентрации частиц в присутствии силиконового масла.
Результаты как экспериментов MFITM, так и RMM, таким образом, обеспечивают достаточное подтверждение выводу, полученному с помощью способа согласно настоящему изобретению с измерением межфазного натяжения: вакцина B несовместима с силиконовым маслом, и либо композицию вакцины B, либо силиконовое масло в качестве смазывающего вещества следует поменять для введения стабильной вакцины B в предварительно наполненный контейнер, смазанный силиконовым маслом. Это также подтверждает межфазное натяжение в качестве быстрого и мощного инструмента для получения понимания стабильности композиции на основе белка в смазанном контейнере. В действительности, уменьшение с течением времени межфазного натяжения между смазывающим веществом и композицией на основе белка, например, вакциной, коррелирует с низкой стабильностью и образованием высокой концентрации агрегатов белка.
В отношении частиц, относящихся к силиконовому маслу, разные результаты, наблюдаемые между умеренной концентрацией глобулярных частиц, измеренной посредством MFITM, и высокой концентрацией положительно заряженных частиц, измеренной посредством RMM, могут быть связаны с разными размерами частиц, полученными посредством данных методик. В частности, при MFITM наблюдаются частицы, имеющие диаметры, находящиеся в интервале от 1 до 100 микрометров, в то время как RMM выявляет частицы с диаметрами, находящимися в интервале от 0,05 до 5,00 микрометров. Также известно, что Полисорбат 80 способен стабилизировать пузырьки воздуха в виде частиц небольшого размера, эффективно наблюдаемых с помощью RMM в виде положительно заряженных частиц.
В примерах вакцин A и B, на первой стадии способа оценивали только зависимость от времени межфазного натяжения между буфером вакцины и смазывающим веществом, так как существовало взаимодействие между смазывающим веществом и белком вакцин. Однако другие компоненты буфера могут взаимодействовать с силиконовым маслом, что приводит к оценке уменьшения с течением времени межфазного натяжения между компонентами композиции и смазывающим веществом, чтобы определить на третьей стадии, какие компоненты являются ответственными за данное взаимодействие. Действительно, некоторые компоненты буфера могут также осуществлять сильное взаимодействие со смазывающим веществом, что приводит к образованию частиц, деградации терапевтического белка или по меньшей мере дестабилизации композиции на основе белка.
Блок-схема, представленная на Фиг. 4, обобщает разные стадии общего способа оценки стабильности любой композиции на основе белка по отношению к смазывающему веществу смазанного контейнера. На стадии 100 оценивается межфазное натяжение между буфером и смазывающим веществом.
Например, если межфазное натяжение между буфером и смазывающим веществом уменьшается с течением времени на первой стадии способа (ветвь d), вследствие этого требуется промежуточная стадия 101 для оценки межфазного натяжения между каждым компонентом буфера композиции и смазывающим веществом. В качестве альтернативы, если обнаруживается, что межфазное натяжение между буфером и смазывающим веществом является стабильным (ветвь s), то можно непосредственно проводить вторую стадию 102. На указанной второй стадии 102 способа оценивают межфазное натяжение между композицией на основе белка и смазывающим веществом. Если на данной стадии обнаруживают стабильность, можно сделать вывод о том, что композиция на основе белка является стабильной в изучаемом смазанном контейнере (ветвь s′), и можно проводить следующую стадию разработки P.
Однако если какое-либо взаимодействие выявляют с помощью уменьшения межфазного натяжения (ветвь d'), тогда требуется определить то, какой компонент в действительности взаимодействует на третьей стадии 103 настоящего способа. Это позволяет на четвертой стадии 104 исследовать чувствительность композиции на основе белка по отношению к взаимодействию, определенного на третьей стадии. Действительно, ограниченное взаимодействие компонента композиции со смазывающим веществом может быть приемлемым, например, если данный компонент вводят в значительной концентрации и/или если данное взаимодействие не мешает его функции. Другие примеры могут, таким образом, требоваться для определения того, воздействует ли в действительности взаимодействие на стабильность или эффективность композиции на основе белка. Например, если на третьей стадии 103 способа определяют, что существует взаимодействие между pH буферным агентом и смазывающим веществом, может потребоваться проверка pH композиции на основе белка после старения, чтобы убедиться в том, что композиция на основе белка все еще имеет требуемый pH. Аналогично, если обнаруживается, что поглотитель кислорода взаимодействует со смазывающим веществом, может потребоваться исследовать окисление белка после старения, так как кислород может конкурировать со смазывающим веществом и подавлять взаимодействие с поглотителем. В случае, когда композиция на основе белка не является чувствительной к взаимодействию (ветвь NS), тогда может быть возможным проведение следующей стадии разработки P композиции на основе белка. Однако если обнаруживают, что композицию на основе белка является чувствительной к конкретному взаимодействию (ветвь S), может потребоваться модификация состава композиции на основе белка или смазывающего вещества (стадия 105).
В общем, изучение взаимодействия между белком и некоторыми важными компонентами, такими как сквален, в случае эмульсионно-адъювантной вакцины, может не требовать дополнительных экспериментов, так как высокая чувствительность композиции на основе белка к данным взаимодействиям является очевидной или хорошо известной. В данных случаях может требоваться модифицировать состав композиции на основе белка или смазывающее вещество, без определения чувствительности композиции на основе белка на возможной четвертой стадии 104.
Согласно второму аспекту изобретения межфазное натяжение используют в способе для модификации состава композиции на основе белка к смазанному контейнеру. Как указано ранее, путь для преодоления данной несовместимости между композицией на основе белка и смазывающим веществом может заключаться в модификации состава композиции на основе белка для предупреждения нежелательного взаимодействия, определенного в способе согласно первому аспекту изобретения.
Модификация состава композиции на основе белка к смазанному контейнеру может быть достигнута посредством добавления компонента композиции, реализующего конкурентное взаимодействие, то есть либо кинетически, либо термодинамически более выгодное, чем взаимодействие между определенным взаимодействующим компонентом и смазывающим веществом. Конкурентное взаимодействие может либо происходить между дополнительным компонентом и смазывающим веществом, либо дополнительным компонентом и композицией на основе белка.
Первый подход, таким образом, заключается в предотвращении взаимодействия между композицией на основе белка и смазывающим веществом посредством создания более сильного конкурентного взаимодействия между дополнительным компонентом буфера и смазывающим веществом. Данный дополнительный компонент может представлять собой новый компонент для композиции на основе белка или уже присутствующий компонент, при условии, что концентрация компонента может значительно меняться, не оказывая влияния на стабильность композиции на основе белка.
Данный первый подход был исследован заявителем в примере вакцины B. Действительно, способ согласно первому аспекту изобретения продемонстрировал несовместимость между белком вакцины B и силиконовым маслом. Однако вакцина B содержит Полисорбат 80 в качестве неионного поверхностно-активного вещества (см. Материалы и Методы), и данный компонент может конкурировать с белком вакцины B во взаимодействии с силиконовым маслом.
Для определения соответствующей концентрации Полисорбата 80 уменьшение с течением времени межфазного натяжения между разными концентрациями Полисорбата 80 и силиконовым маслом оценивали и сравнивали с уменьшением, образуемым вакциной B.
На Фиг. 5 уменьшение с течением времени межфазного натяжения между Полисорбатом 80 в концентрациях 3×10-6 М и 3×10-4 М и силиконовым маслом накладывают на уменьшение межфазного натяжения между вакциной B и силиконовым маслом. Если концентрация Полисорбата 80 3×10-6 М вызывает только ограниченное уменьшение от 41 до 36 мН/м, концентрация 3×10-4 М вызывает очень сильное уменьшение межфазного натяжения, достигая минимума 14 мН/м, который намного ниже минимума на уровне 36 мН/м, полученного с вакциной B. Данный результат указывает на то, что вакцина B может быть модифицирована для того, чтобы быть стабильной по отношению к силиконовому маслу, посредством установления концентрации Полисорбата 80 на уровне 3×10-4 М. Данную модифицированную композицию затем называют вакциной B+PS80 для следующих исследований и соответствующий буфер называют буфером вакцины B+PS80.
Стабильность вакцины B+PS80 затем оценивали с помощью экспериментами посредством визуализации микропотока (MFITM) и резонансного измерения массы (RMM).
На Фиг. 6A и 6Б показана концентрация частиц, образующаяся вакциной B и вакциной B+PS80, измеренная MFITM, а также концентрация частиц для буфера вакцины B и буфера вакцины B+PS80, все после семи суток инкубации в шприце, смазанном силиконовым маслом. На Фиг. 6А представлена концентрация глобулярных частиц (отнесенных к силиконовому маслу), в то время как на Фиг. 6Б представлена концентрация неглобулярных частиц (отнесенных к агрегатам белка). В данном эксперименте обнаружили, что концентрация глобулярных частиц (Фиг. 6А), образующаяся модифицированной композицией, а именно вакциной B+PS80, составляла почти половину концентрации, образующейся исходной композицией (вакцина B), от 13959 до 7533 частиц/см3. В отношении неглобулярных частиц, относящихся к агрегатам белка (см. Фиг. 6Б), модифицированная вакцина B+PS80 образует только концентрацию 1887 частей/см3, что составляет примерно 9 % от концентрации 21826 частей/см3, образованной вакциной B.
Результаты RMM показаны на Фиг. 7А и 7Б, где на Фиг. 7А показана концентрация положительно заряженных частиц (относимых к силиконовым частицам) и на Фиг. 7Б показана концентрация отрицательно заряженных частиц (относимых к агрегатам белка). После 7 суток инкубации модифицированная композиция (вакцина B+PS80) образует более высокую концентрацию положительно заряженных частиц, чем вакцина B, выше 2×106 частиц/см3. Однако, концентрация отрицательно заряженных частиц, образующаяся вакциной B+PS80, снижается до 72667 частиц/см3, что составляет примерно 3,3 % от концентрации, образующейся вакциной B.
Данные экспериментальные результаты обеспечивают подтверждение то, что существует сильное уменьшение взаимодействия между вакциной B и силиконовым маслом в качестве смазывающего вещества после добавления Полисорбата 80, согласно способу второго аспекта изобретения. Полисорбат 80 успешно конкурирует с белком вакцины B во взаимодействии с белком, причем взаимодействию между белком вакцины B и силиконовым маслом эффективно препятствует Полисорбат 80. Таким образом, данный способ делает возможной модификации состава композиции на основе белка к данному смазывающему веществу и в данном случае позволяет безопасно хранить вакцину B в смазанном контейнере, таком как предварительно наполненный шприц. Несмотря на то, что Полисорбат 80 использовали для модификации вакцины B, другое неионное поверхностно-активное вещество может быть уместным, при условии, что они совместимы с белком и другими компонентами композиции.
Похожий подход исследовали в случае с инсулином, который является другой традиционной композицией на основе белка.
Теперь обратимся к Фиг. 8, уменьшение с течением времени межфазного натяжения между композицией инсулина и силиконовым маслом демонстрирует значительное взаимодействие. Композицию инсулина успешно модифицировали к силиконовому маслу посредством добавления Полисорбата 80 в концентрации 1×10-4 М и на Фиг. 8 ее называют «инсулин+PS80». Инсулин+PS80 вызывает большее уменьшение с течением времени межфазного натяжения с силиконовым маслом, вплоть до 17 мН/м, чем уменьшение, наблюдаемое с исходной композицией инсулина (23 мН/м при 100 с). Однако наложение кривых межфазного натяжения Полисорбата 80 и модифицированной композиции инсулина позволяет сделать вывод о том, что только Полисорбат 80 взаимодействует с силиконовым маслом, при этом нежелательное взаимодействие с инсулином эффективно экранируется.
Второй подход, исследуемый заявителем, заключался в добавлении дополнительного компонента, взаимодействующего с белком нестабильной композиции на основе белка. Действительно, суммарный заряд белка вакцины А является отрицательным, и с катионами алюминия может образовываться комплекс. Вакцина A была, таким образом, модифицирована посредством введения 2 г/дм3 гидроксида алюминия, причем модифицированную композицию называют «вакцина A+AH».
На Фиг. 9 отслеживается уменьшение с течением времени межфазного натяжения между силиконовым маслом и соответственно буфером вакцины A, вакциной A и вакциной A+AH (модифицированная композиция). В то время как уменьшение межфазного натяжения от 43 до 36 мН/м показано между вакциной А и силиконовым маслом как результат ранее продемонстрированного взаимодействия, как и ранее, вакцина А+AH вызывает только ограниченное уменьшение межфазного натяжения до 42 мН/м. Данное уменьшение схоже с уменьшением, вызванным буфером вакцины A за тот же период времени. Вследствие этого, можно сделать вывод о том, что вакцина А+AH, хранящаяся в контейнере, смазанном силиконовым маслом, будет образовывать предельную концентрацию частиц, аналогично той, что получают для буфера вакцины A и показанной на Фиг. 2А, 2В, 3А, 3В. В отличие от первого подхода, где Полисорбат 80 успешно конкурировал с белком вакцины B во взаимодействии с силиконовым маслом, взаимодействие между белком вакцины A и силиконовым маслом в данном втором подходе было предотвращено в результате образования комплекса белка вакцины. Такой комплекс белка вакцины больше не может взаимодействовать с силиконовым маслом, и вакцина A+AH является такой же стабильной, как и буфер вакцины A. Данный результат, таким образом, подтверждает эффективную модификацию вакцины A посредством добавления комплексообразующей соли. Гидроксид алюминия использовали в примере ниже, но может быть выбрана другая соль, такая как фосфат алюминия.
Согласно третьему аспекту изобретения межфазное натяжение используют в способе выбора смазывающего вещества, подходящего к контейнеру, предназначенному для хранения композиции на основе белка.
В отношении Фиг. 10, уменьшение с течением времени межфазного натяжения между композицией на основе белка и каждым исследуемым смазывающим веществом оценивают на первой стадии 201. Если смазывающее вещество не вызывает значимого уменьшения, то есть не осуществляет какого-либо взаимодействия с композицией на основе белка (ветвь s), тогда его можно выбрать и приступить к следующей фазе P процесса изготовления лекарственного средства.
Однако если все смазывающие вещества взаимодействуют с композицией на основе белка (ветвь d), уменьшение с течением времени межфазного натяжения между каждым компонентом буфера и каждым исследуемым смазывающим веществом должно оцениваться на второй стадии 202. Данная стадия позволяет определять на третьей стадии 203 то, какой(ие) компонент(ы) композиции на основе белка в действительности взаимодействует(ют) с какими смазывающими веществами. На данной стадии смазывающее вещество, не взаимодействующее с белком композиции на основе белка, может быть выбрано для дальнейшего исследования, в то время как смазывающее вещество, взаимодействующее с белком, может быть признано непригодным.
С этими данными, можно определить на четвертой стадии 204 является ли композиция на основе белка чувствительной к взаимодействию с выбранным смазывающим веществом посредством проведения дополнительных экспериментов. Данные эксперименты могут включать способы подсчета частиц, такие как MFITM или RMM (резонансное измерение массы), структурные методики, такие как ядерный магнитный резонанс или круговой дихроизм, и другие методики, такие как жидкостная хроматография, эксклюзионная хроматография, pH-метрия, иммунологические пробы или эксперименты in vivo, в зависимости от компонента композиции на основе белка, который взаимодействует со смазывающим веществом. В действительности, некоторые взаимодействия могли бы оказаться приемлемыми, если они не препятствуют эффективности или стабильности композиции на основе белка. Если смазывающее вещество, осуществляющее нечувствительное взаимодействие с композицией на основе белка, обнаружено на данной четвертой стадии 204 (ветвь NS), оно может быть выбрано перед тем, как преступить к следующей стадии разработки P композиции на основе белка. Однако если все смазывающие вещества осуществляют чувствительные взаимодействия с композицией на основе белка (ветвь S), на пятой стадии 205 может потребоваться либо модифицировать композицию на основе белка, как описано во втором аспекте настоящего изобретения, либо проводить текущее исследование с другими смазывающими веществами.
Материалы и Методы
Растворы
Способы по настоящему изобретению исследовали с двумя разными поликонъюгированными вакцинами против менингита, а именно вакциной A и вакциной B, причем обе содержали только один серотип. Данные вакцины приобретали на рынке. Буфер вакцины A содержал 7 мг/мл NaCl, 0,184 мг/мл NaH2PO4×H2O, 0,96 мг/мл Na2HPO4×7H2O и 14,6 мг/мл маннита. Буфер вакцины B содержал 9 мг/мл NaCl; 1,335 мг/мл Na2HPO4×2H2O; 0,345 мг/мл NaH2PO4×H2O, 0,68 мг/мл KH2PO4 и 25 мг/мл сахарозы. Все химические компоненты приобретали в Sigma-Aldrich. Раствор гидроксида алюминия (AH) добавляли в приобретенный набор вакцины A, в концентрации 2 мг/мл, и таким образом он соответствовал степени чистоты USP и EP.
Полиоксиэтилен сорбитан моноолеат, называемый Полисорбатом 80 или PS80, приобретали со степенью чистоты для молекулярной биологии у Sigma-Aldrich под торговым названием TWEEN® 80. Растворы PS80 готовили с конечной концентрацией 3×10-4 M, 3×10-5 M и 3×10-6 M, соответственно. Вакцину B+PS80 готовили с конечной концентрацией PS 80 3×10-4 M.
Силиконовое масло представляло собой поли(диметилсилоксан) (ПДМС) с фармацевтической степенью чистоты, приобретенный в Dow Corning под названием DC 360. Как 20 сСт (сантистокс), так и 1000 сСт исследовали в предварительном исследовании, и идентичные кривые межфазного натяжения получали с воздухом или фосфатным буферным раствором, соответственно. Следовательно, менее вязкий ПДМС 20 сСт, дающий большую кривизну капли, использовали для измерений межфазного натяжения (см. материалы и методы измерений межфазного натяжения).
Измерения межфазного натяжения
Уменьшение с течением времени межфазного натяжения измеряли с использованием тензиометра для профильного анализа (тензиометр PAT-1M, SINTERFACE Technologies, Берлин, Германия) на основе метода висячей капли. Тензиометр PAT-1M генерирует капельки в воздухе или жидкости с помощью управляемой системы дозирования, при этом образование капли улавливается видеокамерой высокой четкости. Программное обеспечение тензиометра Sinterface PAT-1M делает возможным получение изображений, выделение краёв и применение уравнения Юнга-Лапласа для определения межфазного натяжения. Температуру измерения в 20 мл стеклянной ячейке контролировали на уровне 25 °C плюс/минус 2 °C. Ячейку закрывали крышкой с погруженным капилляром на основе поли(тетрафторэтилена) (PTFE), имеющим внешний диаметр 1,0 мм. Капля изучаемого раствора образовывалась на погруженном конце капилляра. В настоящих способах капля вакцины, буфера вакцины или модифицированной композиции образовывалась в среде ДПМС (20 сСт). Площадь поверхности капли контролировали так, чтобы она была постоянной на протяжении всего эксперимента с помощью автоматической регуляции. Объем, добавляемый к капле во время эксперимента, также непрерывно отслеживали. Поверхности капель регулировали для каждого эксперимента, позволяя отслеживать кривизну капли, в соответствии с уравнением Юнга-Лапласа. В результате, поверхность капли 70 мм2 использовали для раствора, не содержащего PS80, или с концентрацией PS80 ниже CMC (критическая концентрация мицеллообразования) (1×10-5 М), и 40 мм2 для других растворов.
Исследование стабильности
Стабильность композиций вакцины A и вакцины B в смазанных контейнерах исследовали для подтверждения корреляции с измерениями межфазного натяжения. Контейнеры представляли собой стеклянные шприцы (Hypak™, 29G½, RNS BD260 Black, Ultra low tungsten, BD - Pharmaceutical Systems, Le Pont-de-Claix, Франция), смазанные 0,4 мг силикона, с проникающим наконечником. Все шприцы закупоривали Hypak SCF 1 мл несмазанными уплотнителями с покрытием.
Шприцы наполняли соответствующим раствором (вакцина или буфер) и хранили в вертикальном положении (кончиком вверх) при температуре 25 °C плюс/минус 2 °C и влажности 60 % RH (относительная влажность) плюс/минус 5 %. Шприцы открывали посредством аккуратного удаления уплотнителя и перемещения раствора от бортика в чистую лабораторную посуду. Подсчет частиц проводили на MicroFluid Imaging™ (MFI™) и с помощью оборудования для резонансного измерения массы (RMM) Archimedes вскоре после наполнения и после 7-суточного хранения.
Способы подсчета частиц, используемые во время исследования стабильности
Для оценки концентрации и размера частиц, созданных во время исследования стабильности, использовали MFITM-DPA5200 серии A Brightwell Technologies и резонансное измерение массы (RMM) посредством системы Archimedes (Affinity Biosensors, Santa Barbara, Калифорния).
Прибор MFITM-5200 был оснащен 100 мкм проточной ячейкой, работал при высоком увеличении. Для анализа данных использовали версию 2.R3 MVSS и версию 1 MVAS (Protein-Simple) программного обеспечения MFI™ View. Оборудование исходно калибровали с использованием 10 мкм полистирольных прослеживаемых стандартов размера частиц NIST (Duke Scientific Corp. Fremont, CA). Перед каждым прогоном образца систему промывали жидкостью, не содержащей частиц, для обеспечения чистой базовой линии и оптимизации освещения. Затем образцы аккуратно вставляли в проточную ячейку с использованием перистальтического насоса. Проводили три отдельных прогона с объемами запуска 0,5 мл. Потребительские фильтры были созданы, благодаря программному обеспечению MVAS системы MFITM. В соответствии с Sharma et al, PharmTech 2009 (33), p.74-9, капельки силиконового масла имеют стабильно более высокое аспектное отношение, по сравнению с агрегированными белковыми частицами того же размера, что подтверждает применение простого фильтра программного обеспечения с аспектным отношением (AR) предельной величины больше 0,85. Данный фильтр разделял глобулярные популяции от неглобулярных и улавливал примерно от 95 до 98 % частиц с визуально волокнистой морфологией.
Система Archimedes была оснащена микросенсором Hi-Q (Affinity Biosensors) и контролировалась посредством версии программного обеспечения 1,8 PartickeLab. Перед анализом сенсор промывали в течение 60 с очищенной водой. Затем, возможные примеси в системе удаляли по меньшей мере пятью операциями «чихания» (жидкость в сенсоре проталкивается в обоих направлениях) и систему еще раз промывали очищенной водой в течение 60 с. Раствор образов затем загружали в течение 45 с, как описано в D. Weinbuch et al., Journal of Pharmaceutical Sciences 2013 (102), p.2152-65. Анализ настраивали в течение периода 10 мин. Свежий раствор образца загружали для каждого из трех измерений. Определение размера и сортировка посредством RMM основаны на сдвиге частоты и объясняются в P. Dextras et al, Analytical Chemistry 2009 (81), p. 4517-23.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИННЫЕ СОСТАВЫ ПРОТИВ ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА (HPV), СОДЕРЖАЩИЕ АЛЮМИНИЕВЫЙ АДЪЮВАНТ, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2610174C2 |
| ПОЛИВАЛЕНТНАЯ ВАКЦИНА ПРОТИВ ГРИППА НА ОСНОВЕ НАНОЧАСТИЦ | 2019 |
|
RU2805552C2 |
| НОВЫЕ СОСТАВЫ, КОТОРЫЕ СТАБИЛИЗИРУЮТ ИММУНОГЕННЫЕ КОМПОЗИЦИИ И ИНГИБИРУЮТ ИХ ОСАЖДЕНИЕ | 2007 |
|
RU2482878C2 |
| ПОЛУЧЕНИЕ ВАКЦИН, СОДЕРЖАЩИХ ПОВЕРХНОСТНЫЙ АНТИГЕН ВИРУСА ГЕПАТИТА В И ПОВЕРХНОСТНО-АКТИВНОЕ ВЕЩЕСТВО | 2006 |
|
RU2444374C2 |
| СОСТАВ ПНЕВМОКОККОВОЙ КОНЪЮГАТНОЙ ВАКЦИНЫ | 2018 |
|
RU2789546C2 |
| ВАКЦИННЫЕ КОМПОЗИЦИИ, ХАРАКТЕРИЗУЮЩИЕСЯ УЛУЧШЕННОЙ СТАБИЛЬНОСТЬЮ И ИММУНОГЕННОСТЬЮ | 2016 |
|
RU2730625C2 |
| СПОСОБ ХРАНЕНИЯ ВАКЦИНЫ С ЭМУЛЬСИОННЫМ АДЪЮВАНТОМ В СМАЗАННОМ МЕДИЦИНСКОМ ИНЪЕКЦИОННОМ УСТРОЙСТВЕ | 2015 |
|
RU2684400C2 |
| НАБОР ДЛЯ ПОЛУЧЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ ПРОТИВ Neisseria meningitidis СЕРОЛОГИЧЕСКОЙ ГРУППЫ В | 2008 |
|
RU2498815C2 |
| ПОЛИВАЛЕНТНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ КОНЪЮГАТЫ ПНЕВМОКОККОВЫЙ ПОЛИСАХАРИД-БЕЛОК | 2013 |
|
RU2605834C2 |
| СТАБИЛЬНЫЕ КОМПОЗИЦИИ АНТИГЕНОВ Neisseria meningitidis rLP2086 | 2011 |
|
RU2580620C2 |

Группа изобретений относится к медицине и касается способа оценки стабильности композиции на основе белка, включающей белок, пептид и/или производное белка и буфер, по отношению к смазывающему веществу смазанного контейнера, который предназначен для хранения указанной композиции, включающего а) оценку уменьшения с течением времени межфазного натяжения между буфером и смазывающим веществом, б) оценку уменьшения с течением времени межфазного натяжения между композицией на основе белка и смазывающим веществом, в) определение по меньшей мере одного компонента композиции на основе белка, взаимодействующего со смазывающим веществом, посредством сравнения уменьшения, оцененного на стадии б), с уменьшением, оцененным на стадии а), г) на основании указанного определения по меньшей мере одного компонента, взаимодействующего со смазывающим веществом, определение риска нестабильности, связанного с буфером или белком, пептидом и/или производным белка, композиции на основе белка. Группа изобретений также касается способа повышения стабильности композиции на основе белка по отношению к смазывающему веществу смазанного контейнера, который предназначен для хранения указанной композиции. Группа изобретений обеспечивает оценку стабильности композиции на основе белка, включающей белок, пептид и/или производное белка и буфер, по отношению к смазывающему веществу. 4 н. и 3 з.п. ф-лы, 1 пр., 10 ил.
1. Способ оценки стабильности композиции на основе белка, включающей белок, пептид и/или производное белка и буфер, по отношению к смазывающему веществу смазанного контейнера, который предназначен для хранения указанной композиции, включающий:
а) оценку уменьшения с течением времени межфазного натяжения между буфером и смазывающим веществом,
б) оценку уменьшения с течением времени межфазного натяжения между композицией на основе белка и смазывающим веществом,
в) определение по меньшей мере одного компонента композиции на основе белка, взаимодействующего со смазывающим веществом, посредством сравнения уменьшения, оцененного на стадии б), с уменьшением, оцененным на стадии а),
г) на основании указанного определения по меньшей мере одного компонента, взаимодействующего со смазывающим веществом, определение относительного риска нестабильности, связанного с буфером или белком, пептидом и/или производным белка, композиции на основе белка.
2. Способ по п. 1, дополнительно включающий оценку уменьшения межфазного натяжения между каждым компонентом буфера и смазывающим веществом на стадии а).
3. Способ повышения стабильности композиции на основе белка по отношению к смазывающему веществу смазанного контейнера, который предназначен для хранения указанной композиции, включающий:
а) оценку стабильности композиции на основе белка по отношению к указанному смазывающему веществу способом по п. 1 или 2,
б) выбор адъюванта, вызывающего большее уменьшение с течением времени межфазного натяжения со смазывающим веществом, чем композиция на основе белка,
в) модификацию состава композиции на основе белка посредством добавления указанного выбранного адъюванта к композиции,
где композиция на основе белка, содержащая указанный выбранный адъювант, имеет повышенную стабильность по отношению к смазывающему веществу.
4. Способ по п. 3, где адъювант представляет собой поверхностно-активное вещество.
5. Способ повышения стабильности композиции на основе белка по отношению к смазывающему веществу смазанного контейнера, который предназначен для хранения указанной композиции, включающий:
а) оценку стабильности композиции на основе белка способом по п. 1 или 2,
б) выбор адъюванта, способного к комплексообразованию с белком композиции на основе белка,
в) модификацию состава композиции на основе белка посредством добавления к композиции на основе белка указанного адъюванта так, чтобы по меньшей мере частично снизить уменьшение с течением времени межфазного натяжения между композицией на основе белка и смазывающим веществом,
где композиция на основе белка, содержащая указанный выбранный адъювант, имеет повышенную стабильность по отношению к смазывающему веществу.
6. Способ по п. 5, где добавленный адъювант представляет собой соль.
7. Способ выбора смазывающего вещества, подходящего к контейнеру, который предназначен для хранения композиции на основе белка, включающий:
а) предоставление по меньшей мере одного смазывающего вещества, подлежащего исследованию,
б) оценку стабильности композиции на основе белка по отношению к указанному по меньшей мере одному смазывающему веществу способом по п. 2,
в) определение чувствительности композиции на основе белка к взаимодействию, определенному на стадии б),
г) выбор смазывающего вещества, вызывающего нечувствительное взаимодействие с композицией на основе белка.
| US6737401 B2, 18.05.2004 | |||
| WO2008086221 A2, 17.07.2008 | |||
| LI J., et al., Mechanistic understanding of protein-silicone oil interactions.Pharm Res | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| MEHTA SB., et al., Gelation of a monoclonal antibody at the silicone oil-water interface and subsequent rupture of the interfacial | |||
Авторы
Даты
2020-09-11—Публикация
2017-02-10—Подача