Изобретение относится к области медицины и конкретно касается структурирования поверхности титановых дентальных имплантов (с целью формирования биоактивного, антибактериального и износостойкого покрытия), предназначенных для введения в костную ткань с целью устранения костных дефектов.
Известен способ изготовления стоматологического импланта с многослойным биоактивным покрытием (патент РФ №2146535, МПК A61L 27/00, дата приоритета 20.07.1998, дата публикации 20.03.2000). Данный способ включает предварительную пескоструйную обработку импланта с целью структурирования поверхности и последующее плазменное напыление, которое позволяет обеспечить адгезионную прочность.
Недостатком данного способа является отсутствие возможности формирования упорядоченной микро- и наноструктуры с заданными геометрическими параметрами - периодом и высотой, в результате чего не достигается нужный уровень остеоинтеграции импланта.
Известен способ нанесения покрытия на имплант из титана и его сплавов (патент РФ №2154463, МПК А61К 6/033, дата приоритета 07.07.1999, дата публикации 20.08.2000), заключающийся в анодировании титана и его сплавов. Сущность способа заключается в следующем: берется электролит (представляющий собой фосфорную кислоту), в него добавляется порошок гидроксиапатита, готовый к покрытию имплантат помещается в ванну с электролитом. Через электролит пропускается импульсный или постоянный ток напряжением до 80-150 В с частотой следования импульсов 0,5-10,0 Гц в течение 2-30 минут. Процесс ведется при постоянном перемешивании и температуре 20°С. Полученная толщина покрытия составляет 3-20 мкм.
Недостатком данного способа также является отсутствие возможности получить упорядоченную пористость покрытия с заданными значениями периода и высоты, что снижает его остеоинтеграционные свойства. Включения в состав покрытия оксидов меди, гидроксиаппатитов, фосфора и кальция нарушает сплошность оксидной пленки из TiO2 и может приводить к сколам, что также отрицательно влияет на остеоинтеграцию.
Известен способ создания наноструктурной пористой поверхности имплантов из титана и его сплавов (патент РФ №2469744, МПК A61L 31/08, дата приоритета 30.06.2011, дата публикации 20.12.2012). Данный способ включает пескоструйную обработку для придания поверхности титана шероховатости, с последующим травлением в кислотах для удаления примесей и получения на поверхности чистого титана и обжигом в печи для структурирования кристаллов и удаления связанной воды из пор поверхности.
Недостатком данного способа является низкая точность обработки имплантатов, использование последующих дополнительных этапов обработки, не экологичное использование кислот для удаления примесей, а также невозможность получения упорядоченной структуры, что также снижает остеоинтеграцию.
Недостатком всех вышеупомянутых методов является большое количество технологических этапов, что ведет к временным и экономическим потерям, а также к повышению вероятности возникновения брака на производстве. Кроме того, рассмотренные способы не позволяют локально формировать разномасштабные структуры: макро- (для замещения утраченной части кости), микро- (для клеток костной ткани) и наноразмеров (для белков) с заданным химическим составом.
Известен способ лазерного структурирования поверхности подложки, в том числе из титана, взятый за прототип (патент US №20050211680 А1, МПК В23K 26/0624, дата приоритета 23.05.2003, дата публикации 29.09.2005). Данный способ лазерного структурирования поверхности титановых дентальных имплантов заключается после предварительной очистки и стерилизации поверхности импланта в создании на поверхности импланта микроканавок с глубиной и шириной в диапазоне от 20 мкм до 30 мкм ее обработкой воздействием излучения лазера с наносекундной длительностью импульсов его сканированием.
Несомненным преимуществом предложенного способа является то, что обработка поверхности происходит бесконтактным воздействием на материал и без использования химических добавок при формировании структуры.
Недостатком предложенного способа является формирование только одного типа структур - микроканавки, в то время как для приживаемости дентальных имплантов на раннем этапе остеоинтеграции необходима наношероховатость, а также необходимость ручного изменения положения импланта для его обработки со всех сторон.
Задачей, на решение которой направлено предлагаемое изобретение, является получение поверхности титанового дентального импланта, удовлетворяющей высокой степени остеоинтеграции импланта в организме человека.
Поставленная задача решается за счет достижения технического результата, заключающегося в формировании упорядоченной микроструктуры с наношероховатостью по всей поверхности импланта.
Указанный технический результат достигается путем лазерного структурирования поверхности титановых дентальных имплантов, включающей цилиндрические части в виде резьбы и шейки, а также плоские части. После предварительной очистки и стерилизации поверхности импланта, а также его закреплении в наклонно-поворотном устройстве, на поверхности импланта создаются микроканавки с глубиной и шириной в диапазоне от 20 мкм до 30 мкм ее обработкой воздействием излучения лазера с наносекундной длительностью импульсов его сканированием при плотности мощности излучения 630 МВт/см2, ориентируя имплант с помощью наклонно-поворотного устройства для обеспечения падения излучения на обрабатываемую часть поверхности. При этом лазерное воздействие производят последовательно на боковые поверхности резьбы импланта, ее выступы и впадины, затем на шейку импланта с одновременным вращением импланта с линейной скоростью 5 мм/с, после чего осуществляют только сканирование лазерного излучения по плоским частям поверхности импланта с шагом 2 мкм, причем для создания каждой следующей микроканавки на всех частях поверхности импланта сканирование осуществляют с шагом 30 мкм.
Сущность изобретения поясняется чертежами, где:
- на фиг. 1 показана схема и пример готового устройства, с помощью которого реализуется предлагаемый способ лазерного структурирования поверхности титановых дентальных имплантов, на выноске показан внешний вид дентального импланта до и после лазерного структурирования его поверхности;
- на фиг. 2 представлены СЭМ- снимки поверхностей дентального импланта: плоской части импланта (слева от фотографии импланта) и резьбы импланта (справа от фотографии импланта) после лазерного структурирования;
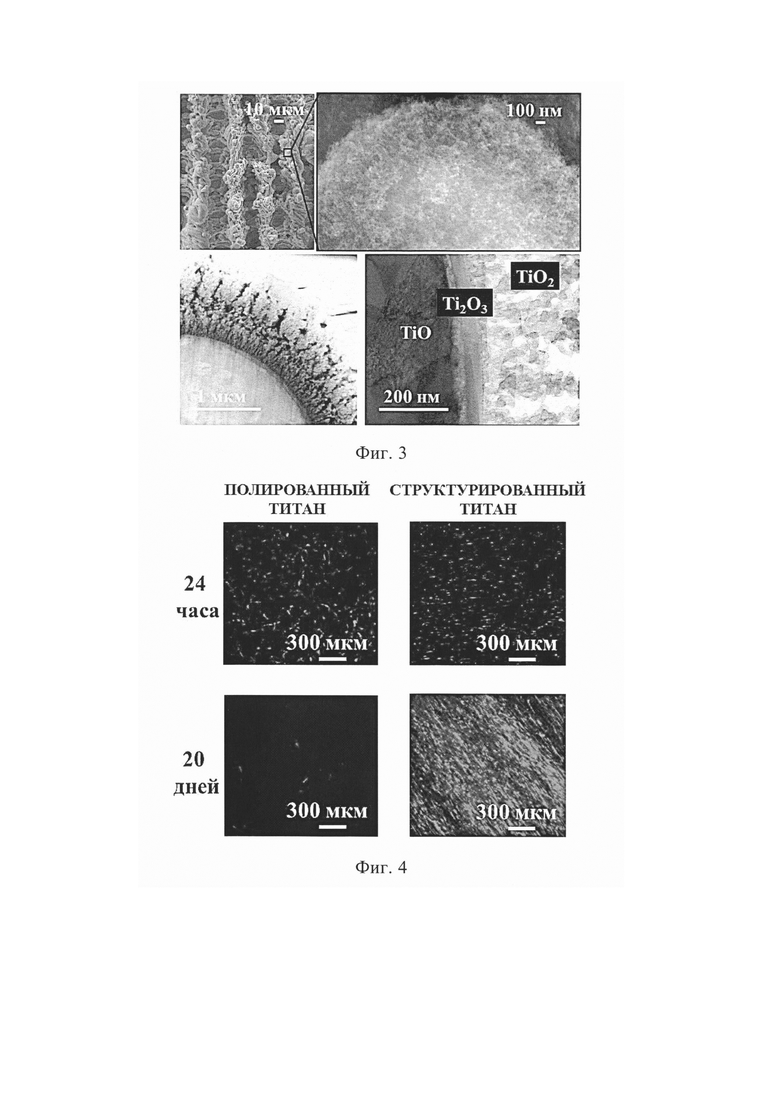
- на фиг. 3 показаны СЭМ и ПЭМ-снимки с разным увеличением поверхности дентального импланта после лазерного структурирования;
- на фиг. 4 продемонстрированы результаты проведенных исследований in vitro, которые показывают процесс дифференциации клеток на поверхности титана до и после лазерного воздействия.
Реализация предлагаемого способа происходит с помощью устройства для лазерного структурирования поверхности титановых дентальных имплантов, например, на базе твердотельного импульсного волоконного лазера 1 с диодной накачкой наносекундной длительности импульсов, в состав которого также входят устройство оптической транспортировки излучения 2 к обрабатываемому импланту 3, контроллер 4, сканаторы 5, фокусирующая система 6 и наклонно-поворотное устройство 7 (Фиг. 1). В управляющий персональный компьютер 8 заносится алгоритм получения заданных микроструктур. Имплант после предварительной очистки и стерилизации закрепляется в наклонно-поворотном устройстве 7, после этого вся поверхность изделия подвергается воздействию лазерного излучения, при этом лазерный пучок и имплант перемещаются в соответствии с программой по заданному алгоритму в соответствии с формой импланта: последовательно на боковые поверхности резьбы импланта, ее выступы и впадины, затем на шейку импланта.
Используемый режим лазерного воздействия позволяет нагреть поверхность титана выше температуры кипения металла и приводит к образованию упорядоченной микроструктуры по всей поверхности импланта в виде канавок с глубиной и шириной в диапазоне от 20 мкм до 30 мкм (Фиг. 2). Полученные геометрические размеры канавок соответствуют размерам клеток костной ткани (например, размер ядра стволовых мезенхемальных клеток человека составляет порядка 20÷30 мкм, а продольный размер клетки при хорошей адгезии - 100÷150 мкм), что обеспечивает лучшую остеоинтеграцию импланта в организме человека. Одновременно с образованием микроструктуры на ее поверхности формируется наношероховатость (Фиг. 3), возникающая при конденсации испаренного металла с его одновременным окислением при обработке в воздушной среде. На Фиг. 3 показаны морфология и состав образовавшейся многослойной оксидной пленки. Характерный размер полученной наношероховатости соответствует размеру белков (в среднем 1÷100 нм), что играет важную роль на ранних этапах остеоинтеграции.
Импланта из диоксида титана обладают повышенной биосовместимостью (показано, например, в [De Nardo L, Raffaini G, Ganazzoli F, Chiesa R. Metal surface oxidation and surface interactions. In: Williams R, ed. Surface modification of biomaterials: methods, analysis and applications. Cambridge, UK: Woodhead Publishing; 2011: 102-142]), также они являются антибактериальными, губительными для широкого круга микроорганизмов, среди которых бактерии и эндоспоры [Foster НА, Ditta IB, Varghese S, Steele A. Photocatalytic disinfection using titanium dioxide: spectrum and mechanism of antimicrobial activity. Appl Microbiol Biotechnol. 2011; 90(6):1847-1868].
На Фиг. 4 показаны результаты проведенных исследований in vitro, которые показывают процесс дифференциации клеток на поверхности титана до и после лазерного воздействия. На образцах титана до и после лазерного структурирования было проведено культивирование стволовых мезенхимальных стромальных клеток (МСК) человека в течение 24 часов и 20 дней. Анализ пролиферации клеток с использованием красителя TurboFP635 был выполнен с помощью флуоресцентной микроскопии и показал, что после 24 часов высаженные клетки были найдены на всех типах образцов и показывали хорошую адгезию клеток к поверхности титана (как до, так и после лазерного структурирования). После 20 дней количество клеток на структурированных образцах значительно увеличилось, в то время как на образцах до лазерной обработки количество клеток даже уменьшилось. На структурированном титане клетки располагаются не только на поверхности, но и в порах, что поможет импланту надежнее зафиксироваться в формирующейся костной ткани.
Согласно отличительным признакам изобретения способ лазерного структурирования поверхности титановых дентальных имплантов, изложенный выше, позволяет улучшить остеоинтеграцию импланта в организме человека за счет микроструктурирования его поверхности канавками с глубиной и шириной в диапазоне от 20 мкм до 30 мкм, покрытыми по всей поверхности нанорельефом, состоящем из оксидов титана, которые обеспечивают хорошие бактерицидные свойства и повышают коррозионную стойкость покрытия.
Вышеупомянутый технический результат доказывает, что способ лазерного структурирования поверхности дентальных имплантов является действующим и конкуреноспособным (за счет использования наклонно-поворотного устройства происходит обработка всей поверхности импланта при бесконтакном воздействии на материал и без использования химических добавок) для получения микроструктуры с наношероховатостью на поверхности импланта, обеспечивающей повышение биосовместимости, коррозионной стойкости и бактерицидных свойств импланта.
| название | год | авторы | номер документа |
|---|---|---|---|
| Дентальный внутрикостный конусный имплантат из легированных сплавов титана с наноструктурированной поверхностью и способ его изготовления | 2022 |
|
RU2801029C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ МИКРО-НАНОСТРУКТУРИРОВАННОГО ПОРИСТОГО СЛОЯ НА ПОВЕРХНОСТИ ТИТАНОВЫХ ИМПЛАНТАТОВ | 2018 |
|
RU2677271C1 |
| Способ изготовления дентального имплантата из нанотитана с использованием лазерного структурирования поверхности и наноструктурированного композитного покрытия и имплатат | 2019 |
|
RU2724437C1 |
| ДЕНТАЛЬНЫЙ ВНУТРИКОСТНЫЙ ИМПЛАНТАТ | 2008 |
|
RU2376955C1 |
| Способ лазерной обработки поверхности металлов и сплавов | 2024 |
|
RU2837319C1 |
| СПОСОБ ФОРМИРОВАНИЯ МИКРОСТРУКТУРИРОВАННОГО СЛОЯ НИТРИДА ТИТАНА | 2013 |
|
RU2522919C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ СТОМАТОЛОГИЧЕСКОГО ОСТЕОИНТЕГРИРУЕМОГО ИМПЛАНТАТА | 2019 |
|
RU2712642C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДЕНТАЛЬНОГО ИМПЛАНТАТА ПОГРУЖНОГО ТИПА ИЗ ТИТАНА ИЛИ ТИТАНОВОГО СПЛАВА И ДЕНТАЛЬНЫЙ ИМПЛАНТАТ ИЗ ТИТАНА ИЛИ ТИТАНОВОГО СПЛАВА | 2013 |
|
RU2524764C1 |
| Способ цветной маркировки поверхности металла или его сплава лазерным импульсным излучением | 2015 |
|
RU2616703C2 |
| СПОСОБ СОЗДАНИЯ НАНОСТРУКТУРНОЙ БИОИНЕРТНОЙ ПОРИСТОЙ ПОВЕРХНОСТИ НА ТИТАНОВЫХ ИМПЛАНТАТАХ | 2011 |
|
RU2469744C1 |

Изобретение относится к способу лазерного структурирования поверхности титановых дентальных имплантов. Благодаря лазерному структурированию поверхности импланта, заключающемуся в последовательном воздействии лазерного излучения на все части поверхности импланта с плотностью мощности излучения 630 МВт/см2, при этом воздействие на цилиндрические части импланта производят с одновременным вращением импланта с линейной скоростью 5 мм/с, а на плоские части поверхности импланта с шагом 2 мкм, причем для создания каждой следующей микроканавки на всех частях поверхности импланта сканирование осуществляют с шагом 30 мкм, предлагаемый способ обеспечивает получение микроструктуры с наношероховатостью на поверхности импланта, обеспечивающей повышение биосовместимости, коррозионной стойкости и бактерицидных свойств импланта. 4 ил.
Способ лазерного структурирования поверхности титановых дентальных имплантов, включающей цилиндрические части в виде резьбы и шейки, а также плоские части, заключающийся, после предварительной очистки и стерилизации поверхности импланта, в создании на поверхности импланта микроканавок с глубиной и шириной в диапазоне от 20 мкм до 30 мкм обработкой сканирующим импульсным лазером с наносекундной длительностью импульсов, отличающийся тем, что после очистки и стерилизации имплант закрепляют в наклонно-поворотном устройстве, воздействие лазерного излучения на все части поверхности импланта производят при плотности мощности излучения 630 МВт/см2, ориентируя имплант с помощью наклонно-поворотного устройства для обеспечения нормального падения излучения на обрабатываемую часть поверхности, при этом воздействие производят последовательно на боковые поверхности резьбы импланта, ее выступы и впадины, затем на шейку импланта с одновременным вращением импланта с линейной скоростью 5 мм/с, после чего осуществляют только сканирование лазерного излучения по плоским частям поверхности импланта с шагом 2 мкм, причем для создания каждой следующей микроканавки на всех частях поверхности импланта сканирование осуществляют с шагом 30 мкм.
| US 8784104 B2, 22.07.2014 | |||
| US 20170014169 A1, 29.01.2017 | |||
| СПОСОБ И УСТРОЙСТВО ДЛЯ СТРУКТУРИРОВАНИЯ ПОВЕРХНОСТИ ТВЕРДОГО ТЕЛА, ПОКРЫТОГО ТВЕРДЫМ МАТЕРИАЛОМ, С ПОМОЩЬЮ ЛАЗЕРА | 2010 |
|
RU2567138C2 |
| СПОСОБ ФОРМИРОВАНИЯ МИКРОРЕЛЬЕФА ПОВЕРХНОСТИ ИЗДЕЛИЙ | 2003 |
|
RU2248266C2 |
Авторы
Даты
2020-09-25—Публикация
2019-03-15—Подача