Изобретение относится к медицине, частности области онкологии, а именно к прогнозированию развития отдаленных метастазов у больных раком молочной железы (РМЖ) и может быть использовано при выборе адекватного объема лечения больных с опухолями этой локализации для улучшения отдаленных результатов лечения.
В структуре злокачественных опухолей женщин РМЖ занимает ведущее место. Это обуславливает огромное количество как клинических, так и экспериментальных исследований, посвященных изучению биологических особенностей данного новообразования и разработки подходов к его лечению. В то же время, несмотря на определенные успехи в этой области, смертность от рака молочной железы (РМЖ) остается высокой [2,3,4]. В значительной мере это объясняется относительно большой вероятностью появления отдаленных метастазов не только у больных с метастазами в регионарные лимфатические узлы, у которых осуществлено радикальное комбинированное лечение, но и у больных с локальным процессом, получивших только оперативное лечение [7]. Это привело к заключению о том, что отдаленные микрометастазы, не выявляемые клинически, существуют у пациенток уже в момент установления диагноза. Следовательно, актуальной стала проблема выявления больных, у которых несмотря на отсутствие клинических проявлений отдаленных метастазов, возможна быстрая генерализация процесса.
Аналогом данной работы служат исследования Богатырева В.Н. [1]. Автор провел длительное (до 8 лет) наблюдение за выживаемостью больных с РМЖ разных клинико-морфологических групп, у которых до начала лечения оценивалась пролиферативная активность (ПА) клеток в опухоли и содержание ДНК. Было показано, что у больных в группе T1NOMO с опухолями, характеризующимися высокой ПА и индексом ДНК >2,2с, прогрессирование заболевания наблюдалось в ранние сроки (в течении 1,5 лет после операции): в среднем продолжительность жизни у таких больных составила 3,5 года. Неблагоприятные результаты были получены у больных других клинических групп (Т2, Т3, N0, N1, MO), опухоли которых имели высокую ПА и высокую степень анеуплоидии. Диплоидные и тетраплоидные опухоли с низкой ПА были расценены как прогностически более благоприятные (время безрецидивного периода после радикального лечения у этих больных в среднем превышало пять лет). Эти данные свидетельствуют о том, что уровень ПА и плоидность ДНК претендуют на роль независимых (от клинико-морфологических параметров) факторов клинической агрессивности опухолевого процесса [6].
Прототипом данной работы служат исследования Remvikos Y., Mosseri V. 1993, [8], в которых была изучена прогностическая роль уровня ПА (количество клеток в S-phase) у больных РМЖ с II-IIIa стадиями заболевания. Авторы делают вывод, что исследование клеточной кинетики в опухолях молочной железы позволяет прогнозировать с большой достоверностью время безрецидивного периода на основании того, что около 70% больных с низким уровнем пролиферирующих клеток в опухоли не имели рецидивов заболевания в течение 45 месяцев наблюдения, тогда как у больных, имеющих высокий уровень пролиферации, рецидивы заболевания возникали в 75% случаев в течение 24 месяцев.
Недостатком способа-прототипа является отсутствие индивидуального прогнозирования вероятности генерализации процесса после клинически-радикального лечения для каждого больного по уровню ПА в опухоли (и на этой основе планирование объема оперативного и консервативного лечения). А также использование опухолевого материала, полученного только при ножевой биопсии.
Целью настоящего изобретения является повышение точности индивидуального прогноза генерализации процесса в первые 2 года у больных РМЖ после радикального оперативного вмешательства. Цель достигается тем, что дополнительно к рутинному гистологическому исследованию опухолей оценивают долю пролиферирующих клеток РМЖ с помощью моноклональных антител к ядерным белкам пролиферации и при значении ПА выше 24% оценивают возможность генерализации процесса у конкретной больной с вероятностью 75% и более.
Согласно предлагаемому способу была оценена ПА опухолей у 120 больных РМЖ разных клинических групп. У этих пациенток было отслежено возникновение отдаленных метастазов в средние сроки наблюдения (21,2+ 0,8 месяца) после операции. На момент анализа документации наличие отдаленных метастазов было установлено у 17 больных. Сроки отдаленного метастазирования в среднем составляли 12,1+1,3 месяца. В целом, средняя ПА первичных опухолей больных РМЖ, у которых возникли отдаленные метастазы, оказалась в 2,5 раза выше, чем у больных, у которых отдаленные метастазы не были зарегистрированы (18,8+2,8% и 7,2+0,1% соответственно).
Мы провели анализ зависимости частоты выявления отдаленных метастазов при разных уровнях ПА клеток первичной опухоли. Вероятность возникновения отдаленных метастазов при каждом уровне ПА оценивали как отношение доли больных с метастазами и с уровнем ПА, превышающей заданную величину, ко всем больным с уровнем ПА, превышающей заданную величину X=A/B, где X - вероятность возникновения отдаленных метастазов, A - доля больных с выявленными отдаленными метастазами при уровне ПА, превышающем заданную величину, B - доля больных с уровнем ПА, превышающем заданную величину.
В качестве заданных величин ПА использовали следующие уровни ПА: >1%, >4%, >6%, >8%. .... >24%. Полученные данные свидетельствуют о том, что вероятность возникновения отдаленных метастазов у больных РМЖ монотонно возрастает с увеличением ПА первичной опухоли. Так, частота отдаленных метастазов составляет для больных с ПА, например >8% 27,0+6,1%, а с ПА >24% 75,0+15,3%. Полученные данные в графическом выражении представлены на чертеже. Этот график позволяет при любом экспериментально установленном уровне ПА опухоли оценить вероятность генерализации процесса.
Способ осуществляется следующим образом.
Цитологические мазки, приготовленные из опухолевой ткани сразу после ее получения (операционный или пункционный материал, полученный методом аспирационной биопсии), высушивали при комнатной температуре и фиксировали в течении 10 мин в ледяном метаноле (-20oC). Оценку ПА опухолевых клеток РМЖ осуществляли с помощью непрямого иммунофлуоресцентного метода, используя в качестве первых антител мышиные моноклональные антитела (MAT) к ядерному белку пролиферации К1-67 ("Dako", Дания) в разведении 1:20. В качестве вторых антител использовали козьи моноклональные антитела против lgG мыши, меченные FITC (Sigma, США), в разведении 1:50. Иммуноокрашивание проводили по стандартной методике. Для разведения антител и отмывки препаратов использовали PBS (pH 7,6) с добавлением 0,1% детергента (TritonX100) и 2% BSA. В качестве отрицательного контроля использовали мазки без первых антител. Учет доли пролиферирующих клеток осуществляли с помощью флуоресцентного микроскопа "Opton Axioplan" при увеличении х400. Реакцию в опухолевых клетках считали положительной при интенсивном специфическом свечении в ядрах. Для каждого опухолевого образца проанализировано 2-3 цитологических препарата. На каждом препарате просчитывали не менее 500 опухолевых клеток. Долю пролиферирующих клеток определяли как отношение положительно окрашенных клеток к общему числу просчитанных и выражали в процентах.
Пример. 1. Больная N и. б. ВА-3518, рак левой молочной железы, T2NOMO, (IIA ст. ). Уровень ПА 29,5%. Вероятность отдаленного метастазирования 75%. По истечение 23 месяцев с момента операции были обнаружены отдаленные метастазы в легкие.
Пример 2. Больная N и. Б., ВА- 2344, рак правой молочной железы, T2NIMO, (IIB ст.) уровень ПА 2,4%. Вероятность отдаленного метастазирования 18%. За время наблюдения за больной (22 месяца с момента операции) генерализации процесса не выявлено.
Технико-экономическая эффективность способа.
Применение данного способа позволит с высокой вероятностью прогнозировать возможность генерализации процесса в течение первых 2-х лет после установления диагноза у первичных больных РМЖ уже на старте лечения в комплексе с клинико-морфологическими параметрами. Это даст возможность выбрать более адекватную тактику лечения больных этой группы, что в конечном итоге повысит эффективность терапии у больных РМЖ.
Список литературы:
1. Богатырев В.Н. Значение количественных методов исследования (морфометрии, проточной цитофлуорометрии, сканирующей микрофотометрии) в клинической онкоцитологии. Дис. д.м.н., ВОНЦ, 1991.
2. Гистологическая классификация опухолей молочной железы.- Всемирная организация здравохранения (ВОЗ), Медицина, 1984.
3. Двойрин В. В., Аксель Е.М., Трапезников Н.Н. Заболеваемость и смертность от злокачественных новообразований населения России и некоторых других стран СНГ в 1993 г. -М.: 1995.
4. Соколовская Н. Л. , Моисеенко В. М. , Пожарисский К. М. , Семиглазов В. Ф. , Черномордиков М. Ф. Морфологические особенности первичного рака молочной железы с разным темпом роста. Вопр. онкологии, т. 38, 1992, N 6, с. 688-693.
5. Berg J.W., Hutter R.V.P. Breast cancer. Cancer, v.75, N 1, suppl., p. 257-269, 1995.
6. EI-Naggar A. K. Clinical relevance of the flow cytometric analysis In cancer. Cancer J., v.5, N 6, p. 321-327, 1992.
7. Fisher E. B. , Redmond С., Ficher В., Bass G. Pathological findings from the national surgical adjuvant breast and bowel projects (NSABP). Prognostic discriminants for 8-year sirvival for node negative invasive breast cancer patients. Cancer (Philad.), v. 65, p. 2121- 2128, 1990.
8. Revmikos Y. , Mosseri V. , et al. Prognostic value of the S-phase fraction of breast cancer treated by primary radiotherapy or neoadjuvant chemotherapy. Paris, France, Institut Curie, 1993.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ РАННЕГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2014 |
|
RU2554749C1 |
| Способ прогнозирования течения патологического процесса при первично-операбельном люминальном без гиперэкспрессии Her2neu раке молочной железы у женщин в постменопаузе | 2018 |
|
RU2694843C1 |
| СПОСОБ ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 1993 |
|
RU2077268C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДОВ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2008 |
|
RU2361222C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА ПРОГРЕССИРОВАНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ НА ФОНЕ ТАМОКСИФЕНА С УЧЕТОМ ЭКСПРЕССИОННЫХ ОСОБЕННОСТЕЙ ОПУХОЛИ | 2023 |
|
RU2823488C1 |
| СПОСОБ ОЦЕНКИ АНГИОГЕННЫХ ФАКТОРОВ ПРИ ХИМИОТЕРАПИИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2006 |
|
RU2341198C2 |
| СПОСОБ ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 1995 |
|
RU2111707C1 |
| Способ прогнозирования резистентности к неоадъювантной химиотерапии у больных раком молочной железы | 2022 |
|
RU2802671C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ГОРМОНОЗАВИСИМОСТИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2014 |
|
RU2559152C1 |
| Способ прогнозирования риска опухолевой прогрессии у больных раком молочной железы | 2024 |
|
RU2838618C1 |
Изобретение относится к медицине, в частности к онкологии, а именно к прогнозированию развития отдаленных метастазов у больных раком молочной железы. Способ обеспечивает повышение точности прогноза генерализации процесса в первые 2 года у больных раком молочной железы (РМЖ) после радикального оперативного вмешательства. Проводят гистологическое исследование опухолей МЖ, при этом оценивают долю пролиферирующих клеток РЖ с помощью моноклональных антител к ядерным белкам пролиферации и по уровню пролиферативной активности оценивают вероятность генерализации процесса для каждой больной. Применение данного способа прогноза позволяет с высокой вероятностью прогнозировать возможность быстрой генерализации процесса у первичных больных PМЖ уже на старте лечения в комплексе с клинико-морфологическими параметрами, что дает возможность выбрать более адекватную тактику лечения больных этой группы и в конечном итоге повысить эффективность терапии у больных РМЖ. 1 ил.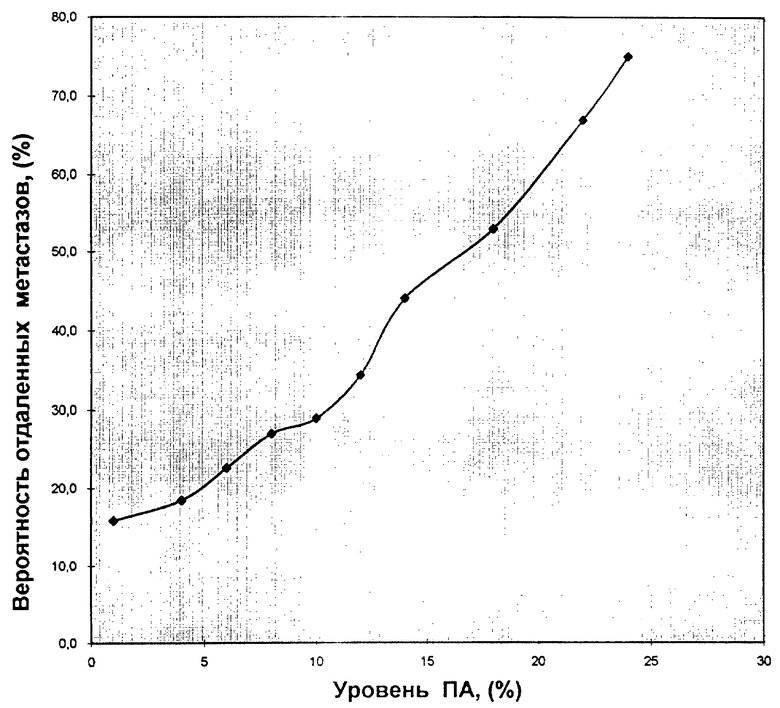
Способ прогнозирования отдаленных метастазов у больных раком молочной железы путем иммуноцитохимического исследования пролиферативной активности клеток первичной опухоли, отличающийся тем, что долю профилирующих клеток оценивают с помощью моноклональных антител к ядерным белкам пролиферирующих клеток и при значении уровня пролиферативной активности более 24% прогнозируют клиническое выявление отдаленных метастазов в первые 2 года после установления диагноза с вероятностью 75%.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| US 4687733 А, 18.08.87 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Revmikos Y., Mosseri V | |||
| Et al Prognostic value of the S-phase fraction of breast cancer treated by primary radiotherapy or neoadjuvant chemotherapy | |||
| Paris, Frace.Jnstitut Curie, 1993. | |||
Авторы
Даты
1999-04-20—Публикация
1997-07-22—Подача