Перекрестная ссылка
Настоящая заявка заявляет приоритет по заявке Великобритании №: 1321196.6, поданной 2 декабря 2013 года, содержание которой включено в настоящий документ посредством ссылки.
Область техники
Изобретение относится к области мультиплексных методов параллельного обнаружения нескольких последовательностей нуклеиновых кислот, с использованием зондов, которые связывают специфические последовательности. Изобретение также относится к количественному определению видов нуклеиновой кислоты, например, определению относительных количеств двух разных хромосом в образце, в том числе использованию таких способов в неинвазивной внутриутробной диагностике анеуплоидий плода.
Уровень техники
Многие заболевания вызваны или характеризуются дисбалансом числа хромосом (анеуплоидией) или дисбалансом числа хромосомных сегментов (частичная анеуплоидией) в клетках индивидуума по сравнению с нормальным числом хромосом или хромосомных сегментов для данного вида. Диплоидный генома человека состоит из 23 пар хромосом; парные хромосомы от 1 до 22 и половые хромосомы XX или XY. Термины моносомия и трисомия относятся к недостающей или дополнительной хромосоме, в то время как частичная моносомия и частичная трисомия относятся к дисбалансу генетического материала, вызванного потерей или получением соответственной части хромосомы. Анеуплоидия и частичная анеуплоидия генома индивида связаны с врожденными нарушениями, такими как синдром Дауна (трисомия хромосомы 21 человека) и синдромом Тернера (моносомия или частичная моносомия половых хромосом). Анеуплоидия и частичное анеуплоидия могут также возникать через соматические мутации в тканях взрослого организма. Например, многие раковые клетки демонстрируют хромосомную ломкость что приводит к транслокациям хромосомных фрагментов и анеуплоидии опухолевых клеток.
Были разработаны способы диагностики заболеваний, связанных с хромосомными дефектами. Традиционные способы кариотипирования включали получение образца ткани, окрашивание хромосом и их рассмотрение под световым микроскопом.  et al. (Science 273 (5274): 494-497, 1996 год) описал многоцветное спектральное кариотипирование, с использованием флуоресцентной гибридизации in situ (FISH) для одновременной визуализации всех хромосом человека в различных цветах. Для каждой хромосомы путем мечения специфической для хромосом ДНК различными флуорофорами были сделаны флуоресцентно меченые зонды. Поскольку существует ограниченное количество спектрально различных флуорофоров, для получения необходимого количества различных спектров испускания использовался комбинаторный способ мечения. Сгенерированные комбинаторным мечением спектральные различия были захвачены и проанализированы с помощью интерферометра, прикрепленного к флуоресцентному микроскопу. Затем программное обеспечение для обработки изображений присваивает цвет для каждой спектрально различной комбинации, что позволяет визуализировать индивидуально окрашенные хромосомы.
et al. (Science 273 (5274): 494-497, 1996 год) описал многоцветное спектральное кариотипирование, с использованием флуоресцентной гибридизации in situ (FISH) для одновременной визуализации всех хромосом человека в различных цветах. Для каждой хромосомы путем мечения специфической для хромосом ДНК различными флуорофорами были сделаны флуоресцентно меченые зонды. Поскольку существует ограниченное количество спектрально различных флуорофоров, для получения необходимого количества различных спектров испускания использовался комбинаторный способ мечения. Сгенерированные комбинаторным мечением спектральные различия были захвачены и проанализированы с помощью интерферометра, прикрепленного к флуоресцентному микроскопу. Затем программное обеспечение для обработки изображений присваивает цвет для каждой спектрально различной комбинации, что позволяет визуализировать индивидуально окрашенные хромосомы.
Сравнительная геномная гибридизация (СГГ) включает выделение ДНК из двух источников для сравнения, чаще всего тестового и эталонного источников, независимую маркировку каждого образца ДНК с флуорофорами разного цвета (обычно красного и зеленого), денатурацию ДНК до одноцепочечной, и гибридизацию двух результирующих образцов в соотношении 1:1 с нормальной метафазной пластинкой хромосом, на которых меченые пробы ДНК связываются в локусе их происхождения. С помощью флуоресцентного микроскопа и компьютерного программного обеспечения, дифференцированно окрашенные флуоресцентные сигналы затем сравниваются по длине каждой хромосомы для идентификации хромосомных различий между двумя источниками. Более высокая интенсивность цвета исследуемого образца в конкретной области хромосомы указывает на увеличение количества материала в этой области соответствующего исходного образца, в то время как более высокая интенсивность цвета эталонного образца указывает на потерю материала в исследуемом образце в данной конкретной области. Нейтральный цвет (когда флуорофорные метки красные и зеленые - желтый) указывает на отсутствие разницы между двумя образцами в этом месте. СГГ был описан Kallioniemi et al., Science 258(5083): 818-21 1992 год и Pinkel et al., Nat Genet. 20(2): 207-11 1998 год.
В последнее время, для количественного определения числа копий в геномном масштабе были разработаны цифровые или виртуальные способы кариотипирования (Wang et al., PNAS 99(25): 16156-16161 2002 год). По сравнению с обычным кариотипированием хромосом на основе СГГ, цифровое кариотипирование позволяет в более высоком разрешении обнаруживать различия в количестве копий. Короткие последовательности ДНК из специфических локусов по всему геному являются изолированными и точно подсчитанными. Метки, каждая длиной 21 п. н., могут быть получены из определенных мест в геноме и как правило, содержат информацию, достаточную для однозначной идентификации геномного локуса, из которого они были получены. Метки могут быть подобраны таким образом, чтобы соответствовать точным положениям на хромосоме и плотность меток может быть оценена перемещением окон для обнаружения отклонений в содержании ДНК-последовательности. Способы сопоставления меток последовательности к их положениям на хромосоме включают высокопроизводительное секвенирование, использование сравнительной геномной гибридизации на микрочипах и массивов SNP.
Микрочипы состоят из зондов, количество которых может составлять от сотен до миллионов, комплементарных к интересующей области генома. ДНК из исследуемого образца является фрагментированной, меченной и гибридизированной на микрочипе. Интенсивности сигнала гибридизации для каждого зонда количественно определенна для каждой позиции на микрочипе. Знание адреса каждого зонда на микрочипе и адреса каждого зонда в геноме, позволяет использовать алгоритм для выстраивания зондов в хромосомной порядке и реконструирования генома in silico. Разрешение цифрового кариотипирования зависит от плотности зондов на микрочипе.
Неинвазивное пренатальное кариотипирование является одной из областей, где требуется высокая точность анализа. Беременные женщины несут циркулирующую в крови внеклеточную ДНК, из которой 4-30% происходит от плода. Можно определить кариотип плода путем определения обилия внеклеточной ДНК, происходящей из каждой хромосомы. Например, если внеклеточная ДНК состоит на 95% из материнской ДНК и на 5% из ДНК плода, и если плод имеет трисомию 21-й хромосомы (синдром Дауна), то общее количество внеклеточной ДНК из хромосомы 21 должно превышать количество любой другой области генома того же размера на 2,5%. Детектирование хромосомной анеуплоидии в фетальной ДНК требует очень точного измерения для обнаружения подобных незначительных несоответствий в относительных количествах различных хромосом. Трудность усугубляется необходимостью работы с относительно небольшими образцами для обеспечения способа, который удобен и приемлем для пациентов и врачей.
Анализ конкретных целей из одной или более молекул ДНК традиционно является технической проблемой. Способы копирования ДНК, как правило, требуются для получения достаточного сигнала для последующих анализирующих процедур. Методы анализа, такие как секвенирование ДНК, гель-электрофорез и ДНК-микрочипы, как правило, требуют усиления сигнала ДНК в предоставленном образце. Наиболее распространенным способ амплификации для амплификации специфической целевой ДНК является ПЦР, которая может обеспечить миллионы (или миллиарды) копий конкретных целей из образца ДНК. Тем не менее, если для анализа необходимо амплифицировать многие регионы геномного образца, в результате выполнения нескольких различных амплификаций одновременно в той же самой реакционной смеси могут возникнуть артефакты амплификации. Кроме того, использование амплификации может привести к потере информации, касающейся относительных количеств последовательностей в образце, так как исходная разница в относительном количестве, может быть ничтожной по сравнению с абсолютной величиной амплифицированных продуктов нуклеиновых кислот, и, так как различные последовательности могут быть амплифицированы с разной эффективностью.
Сущность изобретения
Некоторые варианты реализации способа, описанного в данном документе, вводят новый подход, в котором представляющие интерес типы нуклеиновой кислоты (например, хромосомы), содержащие несколько уникальных целевых последовательностей, детектируются с использованием нескольких специфических зондов. Множественные зонды используются для обеспечения обнаруживаемого сигнала, где величина сигнала является пропорциональной количеству зондов, распознающих их целевые последовательности. Индивидуальные сигналы от множества датчиков преобразуются в один кумулятивный детектируемый сигнал, усиливающий отдельные сигналы с помощью мультиплексного зондирования. Десять или более зондов производят усиление сигнала в десять или более раз. Генерируемые сигналы зависят от правильного реагирования зондов при распознавании целей, с использованием специфической к последовательности гибридизации и ферментативного катализа для создания специфических продуктов, из которых получается сигнал.
Некоторые варианты реализации изобретения используют детектирования множественных локусов на целевой молекуле представляющего интерес типа нуклеиновой кислоты в качестве усиления сигнала, и, следовательно, обеспечивают генерирование и обнаружение сигналов без необходимости амплификации продуктов прореагировавших зондов. Сигнал от продуктов мультиплексов, однако, может быть дополнительно усилен традиционными путями усиления сигнала. Может быть выполнено клональное усиление сигнала. Подходящие способы амплификации включают амплификацию по типу катящегося кольца, твердофазную ПЦР, эмПЦР и цифровую ПЦР.
Каждый зонд, который распознает свою целевую последовательность, генерирует продукт лигирования, и продукты дотирования, производимые в результате гибридизации каждого зонда, могут детектироваться индивидуально, так что отдельный сигнал может быть получен от каждого зонда. Тем не менее, элегантная особенность некоторых реализаций данного способа заключается в том, что эти отдельные сигналы не нуждаются в индивидуальном обнаружении, но вместо этого они сливаются в кумулятивный сигнал и детектируется уже сам кумулятивный сигнал. Кумулятивный сигнал является комбинацией отдельных сигналов и, таким образом, может быть использован для детектирования и/или количественного определения продуктов лигирования, отображая присутствие или количество типов исследуемых нуклеиновых кислот. Это допускает более раннее слияние сигналов зондов по сравнению с способами, включающими секвенирование и микрочипы, в которых отдельные сигналы генерируются для нескольких зондов по всему региону, а затем сигнал сливается и анализируется для представления региона. Сигнал может быть объединен перед детектированием, так что отдельные сигналы не будут отдельно отображаться или запрашиваться. Это дает возможность более простому формату считывания.
Способ усиления сигнала посредством мультиплексирования может быть использован для обнаружения в образце представляющих интерес типов нуклеиновых кислот, например, когда тип нуклеиновой кислоты является небольшим или микроскопическим компонентом в сложном образце нуклеиновой кислоты. Усиление мультиплексированием обеспечивает надежное детектирование. Это может использоваться, например, для обнаружения микробной нуклеиновой кислоты в образцах, таких как образцы пациентов, для диагностических целей. Образцы могут быть зондированы с помощью зондов, специфичных до микробных нуклеиновых кислот множества типов, для обнаружения и идентификации тех, которые присутствуют. Это полезно для обнаружения таких возбудителей инфекционных заболеваний, как бактерии, вирусы и грибы. Могут быть обнаружены конкретные транскрипты нуклеиновых кислот. Усиление посредством мультиплексирования также может быть использовано для количественного определения типов нуклеиновых кислот. При зондировании двух или более типов нуклеиновой кислоты - один или более тип, представляющий интерес, и один или более тип эталонной нуклеиновой кислоты - настоящий способ обеспечивает количественную оценку относительного количества двух типов в образце. Способ особенно полезен, когда применяется в детектировании и определении количества хромосом или хромосомных локусов, например, для обнаружения числа хромосомных копий. Применение конкретного значения представляет использование таких способов для выявления хромосомных дефектов, в том числе для диагностики раковых заболеваний и врожденных анеуплоидий. Конкретно описано использование для неинвазивной пренатальной диагностики (НПД). Данный способ конкретно используется, когда запрашиваются/детектируются большие нуклеиновые кислоты, содержащие множество целевых последовательностей, особенно если эти нуклеиновые кислоты присутствуют в низком молярном количестве, и когда они должны измеряться или количественно определяться с очень высокой точностью, как в случае с НПД.
Типы нуклеиновой кислоты в образце могут быть обнаружены путем контактирования образца с набором зондов, где каждый зонд специфически распознает отдельную целевую последовательность в детектируемых типах нуклеиновой кислоты, и где распознавание каждой целевой последовательности каждым зондом генерирует продукт и детектирует кумулятивный сигнал, который является комбинацией сигналов от продуктов, причем обнаружение сигнала указывает на присутствие типов нуклеиновой кислоты в образце. Виды нуклеиновых кислот могут быть количественно определены путем количественного определения кумулятивного сигнала для определения уровня сигнала, причем уровень сигнала является пропорциональным количеству типов нуклеиновой кислоты в образце, и, таким образом, определяет количество типов нуклеиновой кислоты в образце. Первый тип нуклеиновой кислоты может быть количественно определен по отношению ко второму или эталонному типу нуклеиновой кислоты путем контактирования образца с первым набором зондов и вторым набором зондов, причем зонды первого набора каждый специфически распознает отдельную целевую последовательность в пределах первого типа нуклеиновой кислоты и, в котором зонды второго набора каждый специфически распознает отдельную целевую последовательность в пределах второго или эталонного типа нуклеиновой кислоты. Детектируются первый и второй кумулятивные сигналы, первый кумулятивный сигнал является сочетанием отдельных сигналов от продуктов, полученных с помощью зондов первого набора, распознающих их целевые последовательности, а второй кумулятивный сигнал является сочетанием отдельных сигналов от продуктов, полученных с помощью зондов второго набора, распознающих их целевые последовательности. Первый и второй сигналы определяются количественно для определения первого и второго уровней сигналов, соответственно, что является пропорциональным к количеству первого и второго типа нуклеиновой кислоты в образце. Относительные количества первого и второго типа нуклеиновых кислот в образце, могут быть таким образом определены путем сравнения первого и второго уровней сигналов.
Например, кумулятивный сигнал может быть суммированным перечислением клонально амплифицированных и/или меченых продуктов зондов, которые распознают свои целевые последовательности, например, продукты амплификации по типу катящегося кольца или флуоресцентного сигнала, излучаемого из всех продуктов, где каждый продукт излучает флуоресцентный сигнал. Для количественного определения относительных количеств нескольких типов нуклеиновых кислот для каждого типа используются разные сигналы, например, продукты из одного набора зондов могут излучать различные длины волн или спектр флуоресценции по сравнению с продуктами другого набора зондов.
Преимущества достигаются, когда целевое распознавания зондом зависит как от гибридизации так и от ферментативной дискриминации, таким образом, что выходной сигнал зависит от правильной реакции ферментативного зонда. Предпочтительно, распознавание целевой последовательности с помощью зонда включает гибридизацию зонда с целевой последовательностью и генерацию продукта лигирования, где генерация продукта лигирования зависит от конкретной гибридизации зонда с его целевой последовательностью. В настоящем документе описаны зонды, которые сконструированы для того, чтобы специально подходить для использования в данном способе. Тем не менее, зонды не являются ограниченными какой-либо одной конструкцией зонда и обычно используется множество известных зондов нуклеиновой кислоты, в том числе, например, замыкающие кольцо зонды, отборочные зонды, зонды лигирования олигонуклеотидов, зонды молекулярной инверсии и тандемные зонды.
Первый аспект данного изобретения обеспечивает способ выявления типов нуклеиновой кислоты в образце, включающий
контактирование образца с набором зондов, причем каждый зонд специфически распознает отдельную целевую последовательность в пределах типов детектируемой нуклеиновой кислоты,
обеспечение условий, при которых целевые последовательности в типах нуклеиновой кислоты, являются, по меньшей мере частично одноцепочечными,
обеспечение условий для отжига и лигирования, при таких условиях зонды гибридизируются с их целевыми последовательностями и генерируют продукты лигирования, каждый продукт лигирования, содержащий соединение лигирования, и
обнаружение кумулятивного сигнала, который является комбинацией отдельных сигналов от всех продуктов лигирования,
причем обнаружение сигнала указывает на присутствие типов нуклеиновой кислоты в образце.
Второй аспект данного изобретения обеспечивает способ количественной оценки типов нуклеиновой кислоты в образце, включающий
контактирование образца с набором зондов, причем каждый зонд специфически распознает отдельную целевую последовательность в пределах типов количественно оцениваемой нуклеиновой кислоты,
обеспечение условий, при которых целевые последовательности в типах нуклеиновой кислоты, являются, по меньшей мере частично одноцепочечными,
обеспечение условий для отжига и лигирования, при таких условиях зонды гибридизируются с их целевыми последовательностями и генерируют продукты лигирования, каждый продукт лигирования, содержащий соединение лигирования, и
обнаружение кумулятивного сигнала, который является комбинацией отдельных сигналов от всех продуктов лигирования,
количественную оценку кумулятивного сигнала для определения уровня сигнала, причем уровень сигнала является пропорциональным количеству типов нуклеиновой кислоты в образце, и
таким образом определяет количество типов нуклеиновой кислоты в образце.
Способ может быть использован для количественной оценки первого типа нуклеиновой кислоты по отношению ко второму типу нуклеиновой кислоты в образце. Соответственно, способ может включать
контактирование образца с первым набором зондов и вторым набором зондов, причем зонды первого набора каждый специфически распознает отдельную целевую последовательность в пределах первого типа нуклеиновой кислоты и, в котором зонды второго набора каждый специфически распознает отдельную целевую последовательность в пределах второго типа нуклеиновой кислоты,
обеспечение условий, при которых целевые последовательности в первом и втором типе нуклеиновой кислоты, являются, по меньшей мере частично одноцепочечными,
обеспечение условий для отжига и лигирования, при таких условиях зонды гибридизируются с их целевыми последовательностями и генерируют продукты лигирования, каждый продукт лигирования, содержащий соединение лигирования,
обнаружение первого кумулятивного сигнала, который является комбинацией отдельных сигналов от продуктов лигирования, полученных с помощью зондов первого набора, и их количественное определение для определения уровня первого сигнала, причем уровень первого сигнала является пропорциональным количеству первых типов нуклеиновой кислоты в образце,
обнаружение второго кумулятивного сигнала, который является комбинацией отдельных сигналов от продуктов лигирования, полученных с помощью зондов второго набора, и их количественное определение для определения уровня второго сигнала, причем уровень второго сигнала является пропорциональным количеству второго типа нуклеиновой кислоты в образце,
сравнение уровней первого и второго сигналов, таким образом определяя относительные количества первого и второго типа нуклеиновых кислот в образце.
Другой аспект предусматривает способ количественного определения первой хромосомы или хромосомного локуса относительно второй хромосомы или хромосомного локуса в образце нуклеиновой кислоты, включающий
контакт образца с первым и вторым набором зондов, причем каждый из зондов первого набора специфически распознает особую целевую последовательность в пределах первой хромосомы или хромосомного локуса, и где каждый из зондов второго набора специфически распознает особую целевую последовательность в пределах второй хромосомы или хромосомного локуса,
обеспечения условий, при которых целевые последовательности в первой и второй хромосоме или хромосомном локусе являются по меньшей мере частично одноцепочечными,
обеспечение условий для отжига и лигирования, при таких условиях зонды гибридизируются с их целевыми последовательностями и генерируют продукты лигирования, каждый продукт лигирования является кольцом нуклеиновой кислоты, содержащим соединение лигирования,
обеспечение условий для репликация колец нуклеиновой кислоты по типу катящегося кольца,
подсчет количества первых продуктов амплификации по типу катящегося кольца, причем продукты амплификации по типу катящегося кольца являются амплифицированными из продуктов лигирования, полученных с помощью зондов первого набора для обеспечения первого подсчета,
подсчет количества вторых продуктов амплификации по типу катящегося кольца, причем вторые продукты амплификации по типу катящегося кольца являются амплифицированными из продуктов лигирования, полученных с помощью зондов второго набора для обеспечения второго подсчета, и
сравнение первого и второго подсчетов, таким образом определяя относительные количества первого и второго типа нуклеиновых кислот в образце.
В этих вариантах реализации настоящего изобретения продукты амплификации по типу катящегося кольца могут быть индивидуально подсчитаны путем: (а) получения подложки, содержащей множество комплексов, распределенных на поверхности подложки, причем каждый из комплексов содержит одиночный продукт RCA и множество меченых олигонуклеотидных зондов, которые гибридизуются с продуктом RCA, причем комплексы, соответствующие первым продуктами амплификации по типу катящегося кольца, и комплексы, соответствующие вторым продуктам амплификации по типу катящегося кольца являются по-разному меченными; и (б) подсчета количества первых продуктов RCA и, независимо, подсчета количества вторых продуктов RCA, которые присутствуют на поверхности подложки. В этом варианте реализации изобретения, олигонуклеотиды могут быть флуоресцентно меченными.
Как правило, для обнаружения или количественного определения каждого типа нуклеиновой кислоты необходимо по меньшей мере десять зондов. Количество, естественно, относится к количеству различных зондов, а не к абсолютному количеству молекул зонда. Соответственно, нуклеиновая кислота будет содержать, по меньшей мере, десять различных конкретных целевых последовательностей, а кумулятивный сигнал является комбинацией отдельных сигналов, по меньшей мере, десяти уникальных зондов, этот кумулятивный сигнал представляет один тип нуклеиновой кислоты. Высокие уровни мультиплексирования могут быть использованы для получения соответственно высоких уровней усиления сигнала. Например, по меньшей мере 100, по меньшей мере 1000, по меньшей мере, 10000 или даже большее число зондов может быть использовано для обнаружения или количественного определения каждого типа нуклеиновой кислоты.
Как было отмечено, для использования в данном способе пригодными являются разнообразные конструкции зондов. Зонды, которые генерируют продукты лигирования после правильной гибридизации с их целевыми последовательностями включают:
а) Замыкающие кольцо зонды, когда зонд округляется путем гибридизации с целевой последовательностью, и круг нуклеиновой кислоты зонда генерируется путем лигирования. Замыкающие кольцо зонды описаны в патентах США 5854033 (Lizardi), WO 99/49079 (Landegren) и США 5871921 (Landegren & Kwiatkowski). Вариант замыкающего кольцо зонда, известного как зонд молекулярной инверсии, описан в патенте США 6858412 (Willis et al.). Зонды молекулярной инверсии являются замыкающими кольцо зондами, содержащими сайт расщепления в каркасе зонда, позволяя округленному зонду расщепляться с образованием линейного продукта, который затем может быть амплифицирован и детектирован.
б) Тандемные зонды, округленные вместе с соединительным олигонуклеотидом на соединении с целевой последовательностью. Лигирование матрицы целевой последовательности двух последовательностей зондов с соединительным олигонуклеотидом между ними. Две последовательности зондов затем лигируются для формирования круга. Зонды такого типа описаны в патенте США 2013/0172212 (Ariosa). Тандемные зонды похожи на замыкающие кольцо зонды, но округление зонда происходит отдельным этапом после лигирования, а не во время лигирования.
в) Целевые округленные зонды. В зондах этого типа, фрагмент целевой последовательности является округленным с помощью матричного олигонуклеотида. Концы целевой последовательностью могут быть лигированы вместе, в некоторых случаях со встроенной последовательностью между ними. Целевые округленные зонды описаны в WO 2008/033442 (Stanford). ЕР 1997909 (полученный из WO 99/49079) описывает зонд, имеющий две примыкающие последовательности, комплементарные к определенной 5'-целевой последовательности и определенной 3'-целевой последовательности, таким образом что гибридизация целевого фрагмента с зондом сводит целевые концы вместе с лигированием матрицы целевых концов для округления целевой нуклеиновой кислоты.
г) Отборочные зонды, которые являются двухцепочечными отборочными конструктами, имеющими один или два выступающих конца комплементарных концам целевой последовательности, которые гибридизируются с целевой последовательностью и лигируются к каждому концу целевой последовательности, образуя кольцевой или линейный продукт лигирования, содержащий нуклеиновую кислоту зонда и целевую последовательность. Известно множество отборочных зондов. Отборочные зонды описаны, например, в WO 2005/111236 (Dahl); WO 2011/009941 (Olink Genomics); WO 2011/067378 (Olink Genomics) и WO 2008/153492 (Agilent).
д) ЛОЗ (лигирование олигонуклеотидных зондов) зонды. Такие зонды были описаны для использования в SNP генотипировании. Каждый зонд содержит пару олигонуклеотидов, которая гибридизируется со смежными регионами целевой последовательности таким образом, что 5'-конец одного олигонуклеотида соединяет примыкающий к 3'-конец другого нуклеотида и концы затем лигируются. Варианты использования зондов ЛОЗ включают заполнение пробела полимеризацией в 3'-5' направлении (анализ "золотые ворота") или заполнение пробела путем лигирования дополнительного олигонуклеотида между двумя фланкирующими зондами (анализ DANSR). Анализ "золотые ворота" был описан в Fan, J.В. et al.. Высокопараллельное SNP генотипирование. Cold Spring Harb. Symp. Quant. Biol. 68, 69-78 (2003 год). Анализ DANSR был описан в А.В. Sparks, Е.Т. Wang, С.А. Struble et al., Selective analysis of cell-free DNA in maternal blood for evaluation of fetal trisomy, Prenat Diagn (2012 год).
В целом, подходящими зондами для использования в данном способе являются зонды, которые гибридизируются с целевой последовательностью и образуют продукт лигирования, и генерация продукта лигирования зависит от специфической гибридизации зонда с целевой последовательностью. Это включает в себя примеры всех зондов, перечисленных выше. Предпочтительно, чтобы продукт лигирования являлся продуктом двойного лигирования (например, отборочные зонды и тандемные зонды). Предпочтительно, чтобы продукт лигирования содержал саму целевую последовательность, например, где целевая последовательность представляет собой фрагмент типа нуклеиновой кислоты, сам фрагмент лигируется с зондом и таким образом включается в продукт лигирования. Это позволяет проверить целевую последовательность посредством секвенирования продукта. Продукт лигирования может быть кольцевой или линейной нуклеиновой кислотой, но кольцевые продукты имеют определенные преимущества (например, использование замыкающих кольцо зондов, отборочных зондов или целевых кольцевых зондов), такие как способность к клональной амплификации и обнаружение продуктов репликации по типу катящегося кольца.
Следовательно, в некоторых случаях зонды, используемые в данном способе, будут иметь один или более из перечисленных выше особенностей.
В данном документе описана новая конструкция зонда, которая идеально подходит для использования в способах данного способа. Зонды имеют наиболее желаемую комбинацию функций, в том числе (в различных вариантах реализации изобретения) все перечисленные выше свойства. Эти новые зонды включают в себя
нацеливающий олигонуклеотид, который длиннее, чем целевой фрагмент и содержит внутреннюю целевую комплементарную последовательность, таким образом, что гибридизация между нацеливающим олигонуклеотидом и целевым фрагментом формирует двухцепочечную последовательность, расположенную между вышележащими и нижележащими фланкирующими последовательностями нацеливающего олигонуклеотида, и
последовательности, находящиеся в начале и в конце, имеющие свободные 5'- и 3'-концы соответственно, причем последовательности, расположенные в начале и в конце, являются комплементарными вышележащим и нижележащим фланкирующим последовательностями, соответственно.
В условиях отжига и лигирования, последовательности, расположенные в начале и в конце, гибридизируются с фланкирующими последовательностями, а целевой фрагмент, если он присутствует, гибридизуруется с целевой комплементарной последовательностью, таким образом, позиционируя концы целевого фрагмента в соприкасании с 5'-концом последовательности, расположенной в начале, и 3'-концом последовательности, расположенной в конце. 5'-конец последовательности, расположенной в начале, и 3'-конец целевого фрагмента гибридизируется с примыкающими к нацеливающему олигонуклеотиду нуклеотидами, и 3'-конец последовательности, расположенной в конце, и 5'-конец целевого фрагмента гибридизируется с примыкающими к нацеливающему олигонуклеотиду нуклеотидами. Если целевой фрагмент присутствует, 3'-конец целевого фрагмента лигирует с 5'-концом последовательности, расположенной в начале, с образованием первого стыка лигирования, и 5'-конец целевого фрагмента лигирует с 3'-концом последовательности, расположенной в конце, с образованием второго стыка лигирования, продуцируя продукт двойного лигирования, который включает в себя непрерывную цепь нуклеиновой кислоты, содержащую последовательности, расположенные в начале и в конце, и целевой фрагмент.
Продукт двойного лигирования может быть кольцевым или линейным в соответствии с конкретной конструкцией зонда, которая представлена в данном документе в другом месте.
В данном документе предложен способ анализа образца. В некоторых вариантах реализации изобретения способ включает в себя: а) гибридизацию образца, включающего фрагментированную ДНК, (например, образец, который был расщеплен с помощью рестриктазы) с миксом зонда, который содержит первый набор зондов, причем зонды первого набора гибридизируются с различными сайтами (например, различными последовательностями) первой хромосомы и образуют нековалентно связанные кольцевые продукты, содержащие смежные для лигирования стыки, во время гибридизации с фрагментами ДНК первой хромосомы. В данном контексте термин "смежный для лигирования" означает, что нет никаких промежуточных нуклеотидов между двумя олигонуклеотидами, и они могут быть лигированы друг с другом с помощью лигазы. Примеры таких зондов описаны более подробно выше и ниже по тексту. Примеры таких зондов проиллюстрированы примером на фиг. 3 и 4. Далее, как проиллюстрировано на фиг. 2, способ включает в себя: б)  лигирование смежных для лигирования стыков вместе, для производства множества ковалентно связанных кольцевых продуктов лигирования. Таким образом, следующий этап способа включает: в) амплификацию ковалентно связанных кольцевых продуктов лигирования посредством амплификации по типу катящегося кольца (RCA) для получения множества молекул - продуктов RCA. Затем продукты RCA могут быть мечены и измерены количественно, таким образом обеспечивая оценку количества ДНК, соответствующей первой хромосоме в образце. Округленные продукты обеспечивают значительное преимущество для выявления, так как они могут быть амплифицированы по типу катящегося кольца (RCA). RCA производит сотни или тысячи копий округленного продукта в форме одной молекулы, таким образом эффективно амплифицирует округленный продукт и делает его относительно легким для обнаружения, используя, например, меченные олигонуклеотиды, которые гибридизируются с мотивом в продукте. Определенные количественно сигналы от отдельных продуктов RCA имеют большое значение, так как во многих областях применения (например, неинвазивная пренатальная диагностика с помощью анализа внеклеточной ДНК) количество фрагментов, соответствующих отдельным хромосомам (например, 21 хромосоме) должна быть определена достаточно точно и беспристрастно. Типичные способы анализа используют ПЦР, которая, как хорошо известно, является очень предвзятой процедурой в том смысле, что некоторые последовательности амплифицируются гораздо с более высокой эффективностью, чем другие. Это делает стратегии, основанные на ПЦР, непрактичными для многих диагностических действий.
лигирование смежных для лигирования стыков вместе, для производства множества ковалентно связанных кольцевых продуктов лигирования. Таким образом, следующий этап способа включает: в) амплификацию ковалентно связанных кольцевых продуктов лигирования посредством амплификации по типу катящегося кольца (RCA) для получения множества молекул - продуктов RCA. Затем продукты RCA могут быть мечены и измерены количественно, таким образом обеспечивая оценку количества ДНК, соответствующей первой хромосоме в образце. Округленные продукты обеспечивают значительное преимущество для выявления, так как они могут быть амплифицированы по типу катящегося кольца (RCA). RCA производит сотни или тысячи копий округленного продукта в форме одной молекулы, таким образом эффективно амплифицирует округленный продукт и делает его относительно легким для обнаружения, используя, например, меченные олигонуклеотиды, которые гибридизируются с мотивом в продукте. Определенные количественно сигналы от отдельных продуктов RCA имеют большое значение, так как во многих областях применения (например, неинвазивная пренатальная диагностика с помощью анализа внеклеточной ДНК) количество фрагментов, соответствующих отдельным хромосомам (например, 21 хромосоме) должна быть определена достаточно точно и беспристрастно. Типичные способы анализа используют ПЦР, которая, как хорошо известно, является очень предвзятой процедурой в том смысле, что некоторые последовательности амплифицируются гораздо с более высокой эффективностью, чем другие. Это делает стратегии, основанные на ПЦР, непрактичными для многих диагностических действий.
Фиг. 8 иллюстрирует, как продукты амплификации по типу катящегося кольца могут быть определены количественно. В настоящем способе этап количественного анализа может быть осуществлен путем разделения отдельных молекулярных продуктов амплификации по типу катящегося кольца, полученных на стадии в) друг от друга, и подсчета количества отдельных молекул продуктов амплификации по типу катящегося кольца на определенной площади или объеме. Как показано на фиг. 8, округленные продукты 22 (включают в себя кольцевые продукты 22а, 22b, 22с и 22d), которые содержат целевую последовательность X и фланкирующие последовательности А и В, амплифицируются с праймером 52 для получения набора продуктов RCA. Затем продукты RCA распределяются на поверхности, а количество продуктов RCA может непосредственно быть подсчитано с помощью микроскопии, где термин "распределение" означает, что продукты RCA оседают на поверхности плоской подложки и свободно по ней распространяются. Продукты RCA не должны быть связаны с подложкой, но в некоторых случаях могут (например, посредством биотина или т.п.).
В этих вариантах реализации изобретения этап количественного анализа может быть осуществлен путем: i. гибридизации меченого олигонуклеотида с молекулами продукта RCA, где меченый олигонуклеотид гибридизуется с последовательностью, которая повторяется в продукте RCA, в результате чего получается множество комплексов, каждый из которых включает один продукт RCA и множество меченых олигонуклеотидов, которые гибридизуются с продуктом RCA; и п. подсчета количества меченых комплексов в определенной области на поверхности подложки. Как показано на фиг. 2, в точке обнаружения, продукт RCA является частью комплекса, содержащего сам продукт RCA, один кольцевой продукт, и множество меченых олигонуклеотидов, которые гибридизуются с последовательностью, которая повторяется в продукте RCA.
Как будет определено, продукты RCA могут быть помечены до или после распределения на подложке. Таким образом, в данных вариантах реализации изобретения, этап количественного анализа может быть осуществлен путем: (а) получения подложки, содержащей меченые комплексы, распределенные на поверхности подложки; и (б) подсчета количества продуктов RCA, которые находятся на первом участке подложки. Способ может быть мультиплексирован таким образом, чтобы одновременно можно было количественно определить другие циклические продукты. Например, наборы зондов, используемые в способе, могут содержать различные последовательности (например, зонды к 21 хромосоме могут содержать первую последовательность и зонды к 18 хромосоме могут содержать вторую последовательность), и различные наборы продуктов RCA, полученные в результате округления этих зондов, можно отличить с помощью различных меченых олигонуклеотидов, которые гибридизуются с первой и второй последовательностями.
В данных вариантах реализации изобретения способ может включать: (а) получение подложки, включающей первое и второе множества комплексов, распределенных на поверхности подложки, где каждый из комплексов включает один продукт RCA и множество меченых олигонуклеотидных зондов, которые гибридизируются с продуктом RCA, первое и второе множества комплексов мечены различным образом, и первое и второе множества комплексов соответствуют разным хромосомам; и (б) подсчет числа первого множества продуктов RCA и, независимо от этого, подсчет числа продуктов RCA второго множества, которые присутствуют на первом участке подложки. В этом варианте реализации изобретения олигонуклеотиды могут быть флуоресцентно меченными. Подходящие пары флуоресцентно различимых меток, используемые в данных способах, включают Су-3 и Су5 (Амершам Инк. Пискатавей, штат Нью-Джерси), Quasar 570 и Quasar 670 (Биосерч Технолоджи, Новато, штат Калифорния), Alexafluor555 и Alexafiuor647 (Молекулар Пробс, Юджин, штат Орегон), BODIPY V-1002 и BODIPY V1005 (Молекулар Пробс, Юджин, штат Орегон), РОРО-3 и ТОТО-3 (Молекулар Пробе, Юджин, штат Орегон), и POPRO3 TOPRO3 (Молекулар Пробе, Юджин, штат Орегон). Дополнительные подходящие различимые детектируемые метки могут быть найдены в Kricka и соавт. (Ann Clin Biochem. 39: 114-29, 2002).
В некоторых вариантах реализации изобретения, образец может содержать фрагменты геномной ДНК, например, геномной ДНК практически любого организма, в том числе, но не ограничиваясь, растений, животных (например, рептилий, млекопитающих, насекомых, червей, рыб и т.д.), образцы тканей, бактерии, грибы (например, дрожжи), фаги, вирусы, трупной ткани, археологические/древние образцы и т.д. В некоторых вариантах реализации изобретения геномная ДНК, используемая в способе, может быть получена из млекопитающего, и в некоторых вариантах реализации изобретения млекопитающее является человеком. В примерных вариантах реализации изобретения, геномный образец может содержать геномную ДНК из клеток млекопитающих, например, человека, мыши, крысы или обезьяны. Образец может быть изготовлен из культивируемых клеток или клеток клинического препарата, например, биопсии ткани, соскоба или смыва, или из клеток судебно-медицинской пробы (то есть, клеток из образца, собранного на месте преступления). В конкретном варианте реализации изобретения, образец нуклеиновой кислоты может быть получен из биологических образцов, таких как клетки, ткани, физиологические жидкости и испражнения. Биологические жидкости интереса включают в себя, но не ограничиваются ими, кровь, сыворотку, плазму, слюну, слизь, мокроту, спинномозговую жидкость, плевральную жидкость, слезы, жидкость молочных проток, лимфу, цереброспинальную жидкость, синовиальную жидкость, мочу, амниотическую жидкость и семенную жидкость. В конкретных вариантах реализации изобретения, образец может быть получен из субъекта, например, человека. В некоторых вариантах реализации изобретения, анализируемый образец может быть образцом внеклеточной ДНК, полученной из крови, например, из крови беременной особи женского пола. В некоторых вариантах реализации изобретения, геномная ДНК может быть амплифицирована, например, с использованием метода амплификации целого генома, до фрагментации. Образец может содержать микробную ДНК, например, ДНК из генома вируса или бактерии.
В любом варианте реализации изобретения, микс зондов может содержать второй набор зондов, в котором зонды второго набора зондов гибридизуются с различными участками второй хромосомы и образуют нековалентно связанные кольцевые продукты, содержащие смежные для лигирования стыки при гибридизации с фрагментами ДНК второй хромосомы. В настоящем способе этап количественного анализа может отдельно содержать оценку количества молекул продуктов амплификации по типу катящегося кольца, которые соответствуют первой и второй хромосомам, тем самым обеспечивая оценку относительного количества ДНК, соответствующей первой и второй хромосоме в образце. Как было отмечено выше, продукты RCA, соответствующие первой и второй хромосомам, могут быть отдельно подсчитаны посредством гибридизации с ними различимо меченых олигонуклеотидов и распространения на поверхности подложки, например, на предметном стекле микроскопа.
Также способ может быть использован для изучения суб-хромосомных участков. В этих вариантах реализации изобретения, первый набор зондов может гибридизоваться с различными сайтами первого участка хромосомы. В этих вариантах реализации изобретения, микс зондов может содержать второй набор зондов, в котором зонды второго набора зондов гибридизуются с различными участками второй хромосомы и образуют нековалентно связанные кольцевые продукты, содержащие смежные для лигирования стыки, при гибридизации с фрагментами ДНК второй хромосомы. В настоящем способе этап количественного анализа может отдельно содержать подсчет молекул продуктов амплификации по типу катящегося кольца, которые соответствуют первому и второму участкам первой хромосомы, тем самым обеспечивая оценку относительного количества ДНК, соответствующей первому и второму участку хромосомы в образце. Как было отмечено выше, продукты RCA, соответствующие первой и второй хромосомам, могут быть отдельно подсчитаны посредством гибридизации с ними различимо меченых олигонуклеотидов и распространения на поверхности подложки, например, на предметном стекле микроскопа.
Для такого варианта реализации изобретения, как неинвазивная пренатальная диагностика, целевой фрагмент может находиться, например, на 21, 13 или 18 хромосоме человека, хотя могут быть исследованы другие хромосомные аномалии (например, другие трисомии или делеции или вставки конкретного участка). Вариации числа копий (ВЧК) являются изменениями геномной ДНК, которые касаются относительно больших областей генома, которые были удалены или амплифицированы на определенных хромосомах. Вариации числа копий могут быть вызваны геномными перестройками, такими как делеции, дупликации, инверсии и транслокации. Вариации числа копий связаны с различными формами рака (Cappuzzo F, Hirsch, и соавт. (2005) 97 (9): 643-655) неврологическими нарушениями (Sebat, J., et al. (2007) Science 316 (5823): 445-9, включая аутизм (Sebat, J., и соавт. (2007) Science 316 (5823): 445-9), и шизофрению St Clair D (2008). Schizophr Bull 35 (1): 9-12 Обнаружение вариаций числа копий на хромосоме интереса или ее части в конкретной клеточной популяции может являться мощным инструментом для выявления генетических диагностических или прогностических показателей заболевания или расстройства. В некоторых вариантах реализации изобретения первой хромосомой является 21 хромосома, а вторая хромосома выбирается из хромосомы 13 и хромосомы 18.
В любом варианте реализации изобретения каждый из нековалентно связанных кольцевых продуктов содержит фрагмент ДНК из образца. В вариантах реализации изобретения, показанных на фиг. 3 и 4 зонды, используемые в способе, могут включать в себя: i. последовательность, расположенную в начале и последовательность, расположенную в конце, где последовательности, расположенные в начале и конце, находятся на концах первой олигонуклеотидной молекулы; и ii. последовательность шунта, которая содержит, в следующем порядке: вышележащую фланкирующую последовательность, которая является комплементарной к последовательности, расположенной в начале; целевую комплементарную последовательность, которая является комплементарной к целевому фрагменту; и нижележащую фланкирующую последовательность, которая является комплементарной к последовательности, расположенной в конце. В этих вариантах реализации изобретения в нековалентно связанных кольцевых продуктах концы целевого фрагмента являются смежными для лигирования с концам последовательностей, расположенных в начале и конце первой олигонуклеотидной молекулы. В этих вариантах реализации изобретения последовательность шунта может находиться в первой олигонуклеотидной молекуле. В альтернативном варианте, последовательность шунта может находиться во второй олигонуклеотидной молекуле.
В некоторых вариантах реализации изобретения способ включает гибридизацию образца со множеством, по меньшей мере, 50 (например, по меньшей мере, 100, по меньшей мере, 200, по меньшей мере, 500, по меньшей мере, 1000, по меньшей мере, 2000 или, по меньшей мере, 5000) указанных зондов, где указанные зонды метят различные фрагменты на той же самой хромосоме (например, 21, 13 или 18 хромосоме человека), и в котором способ приводит к получению множества циклических продуктов, среди которых имеются целевые фрагменты. Число произведенных циклических продуктов может быть подсчитано с помощью, например, их амплификации с помощью RCA и подсчета количества продуктов RCA, как описано выше.
Краткое описание графических материалов
Квалифицированному специалисту будет понятно, что графические материалы, описанные ниже, представлены здесь только для иллюстрационных целей. Графические материалы никоим образом не предназначены для ограничения объема данного принципа.
Фиг. 1 схематично иллюстрирует один вариант реализации данного способа, в котором типы целевой ДНК интереса контактируют со множеством меченых линейных зондов и от связанных таким образом меток обнаруживается кумулятивный сигнал.
Фиг. 2 схематично иллюстрирует один вариант реализации данного способа, в котором типы целевой ДНК интереса контактируют со множеством кольцевых зондов, которые клонально амплифицируются по типу катящегося кольца и от амплифицированных продуктов обнаруживается кумулятивный сигнал.
Фиг. 3 иллюстрирует зонд, который содержит олигонуклеотид с округленным каркасом, связанный со своим целевым фрагментом. Зонд иллюстрируется в двух вариантах А и В.
Фиг. 4 иллюстрирует округленный однонуклеотидный зонд, связанный с целевым фрагментом.
Фиг. 5 иллюстрирует округленный зонд с двойной петлей, содержащий нацеливающий олигонуклеотид и петлевой олигонуклеотидный каркас, связанный с целевым фрагментом.
Фиг. 6 иллюстрирует линейный зонд с петлей, который содержит нацеливающий олигонуклеотид и линейный каркасный олигонуклеотид, связанный с целевым фрагментом.
Фиг. 7 иллюстрирует линейный зонд, который содержит два каркасных олигонуклеотида, связанный со своим целевым фрагментом.
Фиг. 8 иллюстрирует способ, с помощью которого продукты RCA могут быть подсчитаны.
Фиг. 9 представляет собой изображение геля, показывающее специфичность способа, описанного в данном документе.
Фиг. 10 представляет собой график, показывающий точность способа, описанного в данном документе.
Фиг. 11 панель А показывает изображение меченых продуктов RCA на поверхности препарата; панель В показывает, как соотношение фрагментов разных хромосом может быть точно определено путем подсчета отдельных продуктов RCA.
Подробное описание
Мультиплексное распознавание целевых последовательностей
Детектируемые или количественного определяемые типы нуклеиновых кислот включает в себя множество целевых последовательностей. Эти целевые последовательности отличаются друг от друга. Поэтому, на нуклеиновой кислоте они будут отображаться на пространственно различные локациях, хотя могут и перекрываться. Целевые последовательности в нуклеиновой кислоте данных типов могут быть перекрывающимися, неперекрывающимися, или могут представлять собой смесь перекрывающихся и неперекрывающихся целевых последовательностей. В предпочтительном варианте целевые последовательности являются неперекрывающимися. Фактически, множество целевых последовательностей для типов нуклеиновой кислоты представляют собой различные эпитопы для обнаружения таких же типов нуклеиновых кислот.
Как правило, в нуклеиновой кислоте будет по меньшей мере 10, по меньшей мере 100, по меньшей мере 1000, или же по меньшей мере 10000 различных целевых последовательностей, и каждая из них может быть зондированной.
Подходящие концентрации зондов могут быть определены на основании концентрации (или ожидаемой концентрации) типов нуклеиновой кислоты в образце. Как проиллюстрировано в Примерах, зонды могут быть добавлены к образцу в концентрации 10 пМ на зонд. В случае, если образец контактирует с несколькими зондами (например, набором зондов), концентрации отдельных зондов могут составлять 10 пМ. В предпочтительном варианте, для детекции или количественного определения используются зонды в концентрации, превышающей ожидаемую концентрацию представляющих интерес типов нуклеиновой кислоты. Использование зонда в превышающей концентрации должно обеспечить распознование всех копий целевых последовательностей, присутствующих в образце. Это увеличивает чувствительность детекции. Также, когда способы включают количественное определение, это гарантирует, что детекция лигированых продуктов или кумулятивный сигнал из набора зондов является пропорционым количеству целевых последовательностей в образце.
Когда один тип нуклеиновой кислоты должны быть количественно определен по отношению к другому, целевые последовательности являются специфическими для типов нуклеиновой кислоты, то есть, не найдены в других типах нуклеиновой кислоты и, в предпочтительном случае, не найдены в каких-либо других типах нуклеиновой кислоты, которые могут находиться в образце.
Для многих диагностических и других применений, типы нуклеиновой кислоты являются хромосомой или хромосомным локусом, например, человеческая хромосома или хромосомный локус. Таким образом, каждый фрагмент целевой последовательности может быть специфическим для такой одной хромосомы генома организма. Другими словами, он может быть найден только на одной хромосоме генома и отсутствовать на других хромосомах такого генома. Главным образом, способ по настоящему изобретению будет использоваться для анализа генома человека, в этом случае целевая последовательность может быть фрагментом, специфичным к одной хромосоме человека, то есть, находиться на такой хромосоме и отсутствовать на других человеческих хромосомах. Например, целевые последовательности могут быть специфическими к 21-ой хромосоме. Целевые последовательности могут быть специфическими к одному локусу хромосомы. Соответственно, они могут быть найдены в этом хромосомном локусе и отсутствовать на других локусах той же хромосомы или других хромосомах этого же генома. Так, например, целевые последовательности могут быть специфическими к одному локусу хромосомы человека.
Данные типы нуклеиновой кислоты в образце могут включать в себя некоторую вариабельность, например, образец может содержать хромосомы разных индивидуумов, таких как нуклеиновая кислота, полученная из материнской крови, которая содержит материнскую ДНК и ДНК плода. В этом случае, представляющие интерес типы могут быть конкретной хромосомой, что является подходящим для выявления всех копий такой хромосомы, будь она фетального или материнского происхождения. Таким образом, представляющие интерес типы могут являться одной хромосомой или хромосомным локусом, и тогда целевые последовательности находятся на такой хромосоме или локусе как в материнской, так и в фетальной копиях хромосомы или хромосомного локуса.
Типы нуклеиновой кислоте могут быть фрагментированы. Целевые последовательности могут являться последовательностями или фрагментами типов нуклеиновой кислоты, то есть целевыми фрагментами.
В предпочтительном варианте, целевые последовательности являют собой фрагменты, чья последовательность является заранее определенной. Может быть известна последовательность всего фрагмента, включая концы. Известные фрагменты заранее определенной последовательности могут быть получены посредством скорее специфической, чем произвольной, фрагментации типов нуклеиновой кислоты. Специфические методы фрагментации включают расщепление ферментами рестрикции, ПЦР (например, мультиплексную ПЦР), а также другие способы целевого определения концов фрагмента, включающие другие ферменты, рибозимы или сочетание таких методов.
Предпочтительным способом фрагментации является расщепление с использованием рестриктазы или комбинации из двух либо более рестриктаз. Таким образом, в образце может происходить расщепление нуклеиновой кислотой ферментом рестрикции и целевыми последовательностями могут быть фрагменты рестрикции.
Известно большое разнообразие специфических ферментов, расщепляющих нуклеиновую кислоту, и любой подходящий фермент может быть использован в методе настоящего изобретения, в том числе ферменты, которые расщепляют в заранее определенной позиции внутри специфической последовательности нуклеиновой кислоты, или эндонуклеазы, которые расщепляют либо до, либо после специфической последовательности распознавания на нуклеиновой кислоте, и никазы (ферменты, надрезающие сбоку). Каталитические нуклеиновые кислоты, такие как рибозимы, могут быть также использованы для фрагментации ДНК. Ферменты могут расщеплять две цепи нуклеиновой кислоты с образованием тупого конца или липкого конца, или могут расщеплять одну цепь нуклеиновой кислоты. Известны различные типы ферментов рестрикции, в том числе Тип I, Тип II, Тип III, Тип IV и Тип V. Подходящие ферменты или комбинации ферментов могут быть выбраны по желанию для использования в способе настоящего изобретения. Например, нуклеиновая кислота в образце (например, 10 нг ДНК) может быть расщеплена ферментом рестрикции (например, 1 U) в соответствующем, сочетаемым с рестриктазой, буфере. Реакция может быть инкубирована при подходящих условиях (например, 37°С на протяжении 1 часа) с последующей ферментативной дезактивацией (например, при 80°С на протяжении 20 минут).
Другой удобный способ предоставления фрагментированной нуклеиновой кислоты заключается в использовании праймеров для амплификации специфических линейных последовательностей из типов нуклеиновой кислоты. Может быть использована мультиплексная ПЦР, которая обрабатывает нуклеиновую кислоту с несколькими парами специфических праймеров для амплификации нескольких специфических фрагментов. В этом случае концы целевых последовательностей соответствуют последовательностям пар праймеров.
Образцы нуклеиновой кислоты могут быть предоставлены в любом подходящем виде, например, в качестве образцов биологической ткани или жидкости пациентов. Образцы могут быть образцами крови, цельной крови, плазмы или сыворотки крови, образцами тканей, например, залитыми в парафин фиксированными в формалине образцами ткани, или могут быть образцами нуклеиновой кислоты, выделенной из крови или ткани.
Образцом может быть любой образец, который содержит нуклеиновую кислоту. Нуклеиновая кислота, содержащаяся в образце, может быть представлена ДНК и/или РНК. Образцом может быть комплексное соединение, например, целая геномная ДНК, или кДНК из целого организма, ткани или популяции клеток, или их фракции. В связи с этим он может, например, быть прямым продуктом процедуры выделения нуклеиновой кислоты, или методики лизиса клеток, или же он может быть дополнительно фракционирован или очищен каким-либо образом, например, он может содержать нуклеиновые кислоты, которые частично или полностью разделены каким-либо образом, или обработаны каким-либо образом, например, РНК для получения кДНК. Образец может быть из любого эукариотического или прокариотического или вирусного источника, например, может быть микробным (например, бактериальным или грибковым), растением или животным. Так, например, типы нуклеиновой кислоты, которые будут обнаружены и количественно оценены могут быть микробной ДНК. Предпочтительно образцы имеют человеческое происхождение, например, геномная ДНК человека. Образец может быть образцом ткани или крови из животного, где детектируемая нуклеиновая кислота, является микробной, например, бактериальной, вирусной или грибковой. Для многих диагностических и других применений, образец является образцом фрагментированных хромосом (например, хромосом человека или микробных хромосом). Для способов, относящихся к неинвазивной пренатальной диагностике, образец получают из крови беременной женщины, и включает ДНК плода. В других примерах, детектируемая и определенная количественно нуклеиновая кислота является ассоциированной с опухолью ДНК.
Данные типы нуклеиновой кислоты в образце могут включать в себя некоторую вариабельность, например, образец может содержать хромосомы разных индивидуумов, таких как нуклеиновая кислота, полученная из материнской крови, которая содержит материнскую ДНК и ДНК плода. В этом случае, представляющие интерес типы могут быть конкретной хромосомой, что является подходящим для выявления всех копий такой хромосомы, будь она фетального или материнского происхождения. Таким образом, представляющие интерес типы могут являться одной хромосомой или хромосомным локусом, и тогда целевые фрагменты получают из такой хромосомы или локуса в обеих материнской и фетальной копиях хромосомы или хромосомного локуса.
Настоящий способ может быть осуществлен на образцах в лабораторных условиях. Соответственно, способы, как правило, не включают в себя диагностику проводимую in vivo на организме человека или животного или способы лечения организма человека или животного путем хирургической операции или терапии. Тем не менее, результаты диагностических методов полученные в лабораторных условиях могут быть использованы с целью предоставления информации для последующего лечения пациентов.
Денатурирование целевой нуклеиновой кислоты
Посредством гибридизации зонд распознает и связывает целевую последовательность в, по меньшей мере, частично одноцепочечной форме. Для некоторых конструкций зонда целевая последовательность должна быть полностью одноцепочечной, особенно те, которые гибридизуются по всей длине целевой последовательности. Для других зондов, например, тех, которые гибридизуются только к районами целевой последовательности, требуется только частично одноцепочечная целевая нуклеиновая кислота. Соответственно, в зависимости от типа используемого зонда, должны быть предусмотрены соответствующие условия для раскрытия участка связывания целевой последовательности с зондом.
Если целевая последовательность в образце уже не является одноцепочечной или, по меньшей мере, частично одноцепочечной, должны быть созданы условия для разделения одноцепочечной целевой последовательности от ее комплементарной цепи нуклеиновой кислоты. Такие условия могут быть денатурирующими условиями или, в некоторых случаях, обработкой экзонуклеазой.
Денатурирующие условия могут иметь достаточно высокую температуру для разделения целевой последовательности от ее комплементарной последовательности. Денатурирующими условиями может быть инкубация при 95°С в течение подходящего времени, например, 10 минут. В качестве альтернативы может быть выполнена химическая денатурация.
Комплементарность и гибридизация
Специфическое связывание между зондом и целевой последовательностью является важной особенностью методов данного способа. Зонд предпочтительно содержит комплементарную последовательность одной цели, которая распознает целевую последовательность. Тем не менее, как это показано замыкающими кольцо зондами и отборочными зондами, например, зонды могут включать множество последовательностей комплементарных к разным регионам целевой последовательности.
Максимальная специфичность по отношению к целевой последовательности достигается в том случае, если зонд содержит последовательность, комплементарную мишени, которая является точно комплементарной к целевой последовательности или региону целевой последовательности, таким образом, что существует идеальная гибридизация между зондом и целевой последовательностью. Тем не менее, это не является обязательным во всех случаях, и малая степень несовпадения может быть приемлемой, например, с целью обнаружения последовательностей, которые демонстрируют аллельную вариацию там, где это желательно для обнаружения целевой последовательности, независимо от присутствия точного аллеля в образце. В альтернативном варианте, для различных последовательностей могут быть разработаны многочисленные зонды. Это может сделать возможным как обнаружение так и распознавание различных аллелей или мутаций. Предполагается, что большинство зондов будут иметь идеальную комплементарность для их целевых последовательностей, но некоторые зонды могут связывать цели с незначительными несовпадениями.
В некоторых вариантах реализации изобретения зонды, используемые в данном способе, содержат каждый целевую комплементарную последовательность, которая имеет несовпадение менее 5 пар оснований с целевой последовательностью или областью целевой последовательности. Там необязательно может быть одна, две, три или четыре пары оснований несовпадения между целевой последовательностью или областью и целевой комплементарной последовательностью. Несовпадение может быть точкой, в которой из одной последовательности отсутствует соответствующее основание, таким образом, что комплементарная последовательность образует петлю в точке несовпадения, или может возникать там, где некомплементарный нуклеотид присутствует в одной последовательности и таким образом не соединяется с основанием в соответствующем положении другой последовательности. Там, где существует неправильное спаривание оснований, то есть, спаривание А или Т с С или G, между основаниями двух цепей не возникают водородные связи, хотя гибридизация будет по-прежнему происходить между целевой последовательностью и целевой комплементарной последовательностью нацеливающего олигонуклеотида вследствие спаривания оснований между соседними с несовпадением нуклеотидами. Несовпадения могут быть между неоднозначными основаниями. Неоднозначное основание, как правило, соответствует положению в целевой комплементарной последовательности, которая соединяется с положением известной генетической вариации в целевом фрагменте. Зонд может быть синтезирован путем добавления одного или более дидезоксинуклеотидов в течение конкретного цикла синтеза для положения неоднозначного основания. Это, как правило, имеет место для традиционного синтеза олигонуклеотидов. В альтернативном варианте, может быть произведено множество отдельных зондов, по одному для каждого генетического варианта. Это, как правило, происходит, если зонды синтезированы с использованием синтеза на основе микрочипов. Неоднозначное основание может соответствовать однонуклеотидным различиям между кодонами, где различные кодоны кодируют ту же самую аминокислоту.
В общем, более длинные целевые комплементарные последовательности для гибридизации более длинных целевых последовательностей или их областей могут допускать большее количество несовпадений, по сравнению с более короткими целевыми комплементарными последовательностями. Целевая комплементарная последовательность, может, например, иметь не более 1 из 8, 1 из 9 или 1 из 10 пары оснований с несоответствием целевой последовательности или ее области. Любые такие несоответствия должны быть ограничены внутренней областью целевой комплементарной последовательности и целевой последовательности или области, таким образом, чтобы они не ингибировали лигирование или сайт-специфическую целевую фрагментацию, например расщепление ферментами рестрикции. Соответственно, предпочтительно существует совершенная комплементарность между целевой последовательностью и целевой комплементарной последовательностью в концевых 6-8 нуклеотидах, предпочтительно 10 концевых нуклеотидов на каждом конце целевой последовательности.
Предпочтительно, зонд содержит одиночную целевую комплементарную последовательность, которая имеет такую же длину, как и целевая последовательность. Полная длина целевой последовательности, таким образом ограничена целевой комплементарной последовательностью. Гибридизация целевой последовательности с нацеливающим олигонуклеотидом является одиночным событием связывания между двумя молекулами нуклеиновых кислот, контрастирующими с зондами, которые связывают два конца целевой молекулы или две несмежные области цели.
Целевая комплементарная последовательность, может иметь длину по меньшей мере 10 нуклеотидов, например, по меньшей мере 15 нуклеотидов. Она может быть длиной до 20, 25, 30, 35 или 40 нуклеотидов. Предпочтительные диапазоны включают 10-20 нуклеотидов, 10-30 нуклеотидов и 10-40 нуклеотидов. Такие относительно короткие целевые комплементарные последовательности являются подходящими для связывания соответственно коротких целевых последовательностей. Короткая последовательность способствует специфичности реакции двойного лигирования, поскольку ДНК-лигазы чувствительны к несовпадению пар оснований и преимущественно лигируют идеально подходящие последовательности. Там, где несовпадения присутствуют в зоне действия ДНК-лигазы, связанной с двухцепочечной последовательностью, последовательности не могут быть лигированы, что обеспечивает дополнительный этап проверочного считывания, гарантирующий высокую специфичность выявления целевой последовательности в предпочтении последовательностям с различными, но похожими последовательностями. ДНК-лигаза, как правило, имеет зону действия 6-8 оснований на каждой стороне разрыва. Таким образом, если целевая последовательность имеет 20 оснований, 12-16 оснований будут покрываться за счет специфичности лигазы.
Гибридизация зонда будет дискриминационной в отношении несовпадений, в особенности в центральной части гибридизированной последовательности, в то время как лигирование дискриминирует несовпадения на концах цели. Вместе это создает высокоспецифическое выявление.
Как описано более подробно другом месте настоящего описания, зонд предпочтительно содержит:
нацеливающий олигонуклеотид, который длиннее, чем целевая последовательность и содержит внутреннюю целевую комплементарную последовательность, таким образом что гибридизация между нацеливающим олигонуклеотидом и целевой последовательностью формирует двухцепочечную последовательность, расположенную между вышележащими и нижележащими фланкирующими последовательностями нацеливающего олигонуклеотида, и
последовательности, находящиеся в начале и в конце, имеющие свободные 5'- и 3'-концы соответственно, причем последовательности, расположенные в начале и в конце, являются комплементарными вышележащим и нижележащим фланкирующим последовательностями, соответственно.
Такие зонды особенно пригодны для использования там, где тип нуклеиновой кислоты фрагментирован и целевые последовательности являются фрагментами определенной последовательности. Нацеливающий олигонуклеотид является более длинным, чем целевая последовательность, поскольку он включает в себя фланкирующие последовательности, а также целевую комплементарную последовательность. Вышележащая фланкирующая область является вышележащей или 5'-концом целевой комплементарной последовательности в нацеливающем олигонуклеотиде. Нижележащая фланкирующая область является нижележащей или 3'-концом целевой комплементарной последовательности в нацеливающем олигонуклеотиде. Соответственно, целевая комплементарная последовательность является внутренней по отношению к нацеливающему олигонуклеотиду и не включает в себя конец нацеливающего олигонуклеотида, так как он фланкирован вышележащими и нижележащими фланкирующими последовательностями.
Двухцепочечная последовательность производится путем гибридизации целевой последовательности и целевая комплементарная последовательность может рассматриваться как гибрид двухцепочечной последовательности, так как она является гибридом цели и зонда. Как правило, двухцепочечная последовательность принимает двойную спиральную конформацию, в которой целевая последовательность является одной цепью, а нацеливающий олигонуклеотид является второй цепью двойной спирали. Гибридная двухцепочечная последовательность фланкирована вышележащими и нижележащими фланкирующими последовательностями нацеливающего олигонуклеотида, который, в свою очередь гибридизируется с последовательностями, находящимися в начале и конце, создавая таким образом двухцепочечную последовательность. Опять же, эти, как правило, принимают нормальную двойную спиральную конформацию двухцепочечной нуклеиновой кислоты.
Вышележащие и нижележащие фланкирующие последовательности предпочтительно отличаются друг от друга, то есть, предпочтительно имеют различные последовательности. Предпочтительно, чтобы последовательность, находящаяся в начале, являлась комплементарной к вышележащей фланкирующей последовательности, но не к нижележащей фланкирующей последовательности, и чтобы последовательность находящаяся в конце являлась комплементарной к нижележащей фланкирующей последовательности, но не к вышележащей фланкирующей последовательности. Это гарантирует, что последовательности, лежащие в начале и в конце гибридизируются только к вышележащей и, соответственно, нижележащей фланкирующим последовательностям.
Последовательность, находящаяся в начале, как правило, такой же длины как вышележащая фланкирующая последовательность. Последовательность, находящаяся в конце, как правило, такой же длины как нижележащая фланкирующая последовательность.
Обычная длина для фланкирующих последовательностей составляет от 10 до 40 нуклеотидов, например, 10-20 или 10-30 нуклеотидов. Фланкирующие последовательности могут быть одинаковой длины. Одна или обе фланкирующие последовательности могут быть одинаковой длины как и целевая комплементарная последовательность. Таким образом, вышележащая и/или нижележащая фланкирующая последовательность может иметь длину по меньшей мере 10 нуклеотидов, например, по меньшей мере 15 нуклеотидов. Она может быть длиной до 20, 25, 30, 35 или 40 нуклеотидов.
Предпочтительно, чтобы последовательность находящаяся в начале являлась комплементарной вышележащей последовательности. Предпочтительно, чтобы последовательность находящаяся в конце являлась комплементарной нижележащей последовательности. Идеальное совпадение последовательностей является желательным для оптимального связывания зонда, таким образом последовательности лежащие в начале и в конце являются правильно расположенными для лигирования целевой последовательности. При необходимости, однако, может быть несовпадение в одну, две, три или четыре пары оснований между последовательностью, находящейся в начале и вышележащей фланкирующей последовательностью, и/или между последовательностью, находящейся в конце и нижележащей фланкирующей последовательностью. Предпочтительно, имеется менее 5 несовпадений пар оснований.
Иначе чем целевая комплементарная последовательность, зонды должны, как правило, не быть комплементарными к целевой последовательности или к другим нуклеиновым кислотам, которые могут присутствовать в образце. Это позволяет избежать нежелательной гибридизации зонда с нуклеиновой кислотой, отличающейся от цели. Таким образом, если зонд используется для связывания последовательности геномной ДНК человека, зонд может быть разработан таким образом, чтобы последовательности, отличающиеся от целевой комплементарной последовательности являлись не комплементарными геномной ДНК человека, таким образом, зонд гибридизируется только с целевой последовательностью, а не с другой нуклеиновой кислотой в образце.
Зонды могут включать одну или более заданных последовательностей. Заданная последовательность не является комплементарной к другим местам зонда или к целевой последовательности - другими словами, она не гибридизируются с другими местами зонда (за пределами заданной последовательности) или с целевой последовательностью в условиях отжига. Заданные последовательности могут быть использованы для детектирования, например, штрихкодов или меток для идентификации зондов, принадлежащих к набору, как описано других местах настоящего описания.
Генерирование продуктов лигирования
В условиях для отжига и лигирования, зонды гибридизируются со своими целевыми последовательностями и лигируются для генерирования продуктов лигирования. Гибридизация каждого зонда приводит к создания продукта лигирования. Соответственно, генерация продукта лигирования зависит от специфической гибридизации зонда с его целевой последовательностью.
Продукт лигирования может содержать или состоять из зонда нуклеиновой кислоты или целевой нуклеиновой кислоты, или может включать как зонд так и целевую нуклеиновую кислоту. Продукт лигирования содержит стык лигирования, который образован лигированием 5'-конца нуклеиновой кислоты с 3'-концом нуклеиновой кислоты. Там, где несколько нуклеиновых кислот лигируются вместе, возможно наличие двух стыков лигирования.
Тип образующегося продукта лигирования зависит от типа используемого зонда. Продукты лигирования могут быть в форме кольца нуклеиновой кислоты или могут быть линейными молекулами нуклеиновой кислоты.
Примером зонда, который образует кольцевой продукт лигирования является замыкающий кольцо зонд. Известны различные типы замыкающего кольцо зонда, например, стандартный, заполняющий пробел, зонды молекулярной инверсии (ЗМИ). Замыкающие кольцо зонды являются линейными олигонуклеотидами с целевыми комплементарными последовательностями на концах и нецелевой комплементарной последовательностью между ними. В условиях для отжига и лигирования, целевые комплементарные последовательности сведены вместе начало к концу для гибридизации с примыкающими областями целевой последовательности, и лигируются с образованием кольца нуклеиновой кислоты. Таким образом, зонд округляется путем гибридизации с целевой последовательностью, и продукт лигирования является кольцом нуклеиновой кислоты зонда. Продукт лигирования в виде кольца, как правило, содержит один стык лигирования, где 5' и 3'-концы линейного зонда лигированы вместе. Известны вариации, в том числе олигонуклеотиды, образующие сшивки и зонды, заполняющие пробел. Зонды могут содержать участок расщепления в каркасе зонда, что позволяет округленному продукту лигирования расщепляться с образованием линейного продукта, который затем может быть амплифицирован и обнаружен (ЗМИ).
Предпочтительно, гибридизацию зонда с целевой последовательностью ориентирует олигонуклеотид зонда для лигирования с целевой последовательностью. Соответственно, целевая последовательность может быть включена в продукт лигирования. Это является преимуществом перед зондами, такими как замыкающие кольцо зонды, поскольку позволяет проверить целевые последовательности с помощью секвенирования продуктов лигирования. Предпочтительно, чтобы зонд лигировался с каждым концом своей целевой последовательности, образуя стык лигирования на каждом конце целевой последовательности. В таких способах, типы нуклеиновой кислоты, обнаруженные или количественно определенные, предпочтительно, фрагментируются для получения целевых фрагментов, соответствующих целевым последовательностям. Концы целевого фрагмента затем могут быть лигированы с концами зонда, захватывая целевую последовательность внутри продукта лигирования. В таких случаях, целевой фрагмент лигируется через высокоспецифическую реакцию на обоих концах. Поскольку целевой фрагмент, как правило, является продуктом специфической фрагментации нуклеиновой кислоты, эти концы обычно имеют специфическую, заранее определенную последовательность. На стадии лигирования, эти концы конкретно детектируются с помощью зависимого от последовательности лигирования с последовательностями, лежащими в начале и в конце, соответственно. Предпочтительно, связывание целевого фрагмента с зондом создает два идеально пригнанных стыка лигирования, один между 3'-концом целевого фрагмента и 5'-концом последовательности, находящейся в начале, и один между 5'-концом целевого фрагмента и 3'-концом последовательности, находящейся в конце.
Лигирование 5'-конца нуклеиновой кислоты с 3'-концом нуклеиновой кислоты может произойти, когда основания обеих концов спарены с примыкающими нуклеотидами комплементарной последовательности. Спариванием оснований соответствующих концевых нуклеотидов с прилегающими нуклеотидами образует цепь нуклеиновой кислоты, содержащую разрыв между двумя концами. Лигирование двух концов может катализироваться ДНК-лигазой. Обеспечение условий для лигирования поэтому, как правило, включает фермент ДНК-лигазы и условия реакции, при которых ДНК-лигаза лигирует два конца с образованием непрерывной цепи нуклеиновой кислоты, замыкая разрыв. Некоторые ферменты лигаз являются коммерчески доступными, такие как Ampligase (фирма "Epicentre"), для которой подходящими условиями является добавление 1 U фермента и инкубирование при 55°С в течение 1 часа в лигазном буфере.
Примерами зонда, который генерирует продукт лигирования, объединяющий целевую последовательность, является отборочный зонд. Такие зонды являются двухцепочечными отборочными конструктами, имеющими один или два выступающих конца комплементарных концам целевой последовательности, которые гибридизируются с целевой последовательностью и лигируются к каждому концу целевой последовательности, образуя кольцевой или линейный продукт лигирования, содержащий нуклеиновую кислоту зонда и целевую последовательность. В условиях для отжига и лигирования, концевые последовательности селекторов гибридизируются с концевыми последовательностями фрагментов и лигируются с селекторами. Где зонд содержит пару отборочных конструкций каждая из которых имеет выступающий конец, каждый из которых может быть лигирован с одним концом целевого фрагмента таким образом, чтобы продукт лигирования являлся линейной нуклеиновой кислотой, содержащей целевую последовательность между двумя последовательностями зонда. Где зонд содержит одну отборочную конструкцию, имеющую два выступающих конца, он может быть лигирован с каждым концом целевого фрагмента таким образом, чтобы продукт лигирования являлся кольцевой нуклеиновой кислотой, содержащей целевую последовательность и нуклеиновую кислоту зонда. В обоих случаях, продукт лигирования включает в себя два стыка лигирования.
Многочисленные другие примеры подходящих зондов описаны других местах настоящего описания.
В некоторых вариантах реализации изобретения настоящий способ может использовать зонды, которые включают:
нацеливающий олигонуклеотид, который длиннее, чем целевой фрагмент и содержит внутреннюю целевую комплементарную последовательность, таким образом, что гибридизация между нацеливающим олигонуклеотидом и целевым, фрагментом формирует двухцепочечную последовательность, расположенную между вышележащими и нижележащими фланкирующими последовательностями нацеливающего олигонуклеотида, и
последовательности, находящиеся в начале и в конце, имеющие свободные 5'- и 3'-концы соответственно, причем последовательности, находящиеся в начале и в конце, являются комплементарными вышележащим и нижележащим фланкирующим последовательностями, соответственно, причем
в условиях отжига и лигирования, последовательности начала и конца гибридизируются с фланкирующими последовательностями, а целевой фрагмент, если он присутствует, гибридизуется с целевой комплементарной последовательностью, таким образом, позиционируя концы целевого фрагмента в соприкасании с 5'-концом последовательности начала и 3'-концом последовательности конца, причем 3'-конец целевого фрагмента лигирован с 5'-концом последовательности начала с образованием первого стыка лигирования, и 5'-конец целевого фрагмента лигируется с 3'-концом последовательности конца с образованием второго стыка лигирования, производя продукт двойного лигирования, включающий непрерывную цепь нуклеиновой кислоты, содержащую последовательности начала и конца и целевой фрагмент.
В данных зондах, из-за расположения целевой комплементарной последовательности между фланкирующими последовательностями, нацеливающий олигонуклеотид служит матрицей целевому фрагменту для лигирования последовательностей, расположенных в начале и в конце. В условиях отжига, при наличии целевого фрагмента, последовательности, находящиеся в начале и в конце, гибридизируются с фланкирующими последовательностями, определяя пробел между 5'-концом последовательности, находящейся в начале и 3'-концом последовательности, находящейся в конце. Целевой фрагмент гибридизуется с целевой комплементарной последовательностью в пробеле. Таким образом, гибридизация последовательностей, находящихся в начале и в конце, и целевого фрагмента с нацеливающим олигонуклеотидом позиционирует 3'-конец целевого фрагмента в соприкасании с 5'-концом последовательности, находящейся в начале, и позиционирует 5'-конец целевого фрагмента в соприкасании с 3'-концом последовательности, находящейся в конце.
Позиционирование двух концов в соприкасании обеспечивает субстрат для ДНК-лигазы для лигирования концов вместе. Предпочтительно, чтобы 5'-конец последовательности, расположенной в начале и 3'-конец целевого фрагмента гибридизировался с примыкающими к нацеливающему олигонуклеотиду нуклеотидами, и 3'-конец последовательности, расположенной в конце, и 5'-конец целевого фрагмента гибридизировался с примыкающими к нацеливающему олигонуклеотиду нуклеотидами. Соответственно, вышележащая фланкирующая последовательность может быть непосредственно примыкающей к целевой комплементарной последовательности, без промежуточных нуклеотидов. Аналогичным образом, нижележащая фланкирующая последовательность может быть непосредственно примыкающей к целевой комплементарной последовательности, без промежуточных нуклеотидов. Прилегающие 3'- и 5'-концы могут быть непосредственно лигированы с помощью ДНК-лигазы, запечатывающей разрыв между ними с образованием непрерывной цепи нуклеиновой кислоты.
Продукт двойного лигирования, то есть продукт лигирования как последовательности, находящейся в начале, так и последовательности, находящейся в конце, с целевым фрагментом, представляет собой непрерывную цепь нуклеиновой кислоты. Она непрерывна в том смысле, что она не содержит никаких разрывов или пробелов, таким образом все нуклеотиды в цепи ковалентно связаны.
Зонд может быть разработан таким образом, что непрерывная цепь нуклеиновой кислоты, содержащая последовательности, лежащие в начале и в конце, и целевой фрагмент является кольцом нуклеиновой кислоты. Термин кольцо здесь относится к топологии замкнутой в петлю цепи, без свободного конца.
В условиях отжига, при наличии целевого фрагмента, последовательности, находящиеся в начале и в конце, гибридизируются с фланкирующими последовательностями, определяя пробел между 5'-концом последовательности, находящейся в начале и 3'-концом последовательности, находящейся в конце. Целевой фрагмент, гибридизуется с целевой комплементарной последовательностью в пробеле, таким образом, позиционируя концы целевого фрагмента в соприкасании с 5'-концом последовательности, находящейся в начале и 3'-концом последовательностей, находящихся в конце, и завершает кольцо нуклеиновой кислоты, которое содержит целевой фрагмент и последовательности, расположенные в начале и в конце.
Молекулы нуклеиновых кислот, которые образуют кольцо имеют свои концы в соприкасании. Лигирование концов производит непрерывную кольцевую цепь нуклеиновой кислоты, содержащую по меньшей мере последовательности, лежащие в начале и в конце, и целевой фрагмент.
Зонды, которые образуют кольцо нуклеиновой кислоты включают зонды, в которых последовательности, расположенные в начале и в конце, предоставляются на одной молекуле нуклеиновой кислоты. Например, в дополнение к нацеливающему олигонуклеотиду, зонд может содержать каркасный олигонуклеотид, имеющий последовательности, расположенные в начале и в конце на его 5'- и 3'-концах соответственно, причем последовательности, расположенные в начале и в конце каркасного олигонуклеотида связываются in trans с фланкирующими последовательностями нацеливающего олигонуклеотида в условиях отжига. Каркасный олигонуклеотид может включать заданную последовательность между последовательностями, расположенными в начале и в конце. Фигура 3 иллюстрирует варианты реализации таких зондов. В альтернативном варианте, последовательности, находящиеся в начале и в конце, каркасного олигонуклеотида могут быть примыкающими, без заданной нуклеотидной последовательности между ними.
В другом примере, последовательности, находящиеся в начале и в конце, могут находиться на концах нацеливающего олигонуклеотида и связываться in cis с фланкирующими последовательностями в условиях отжига. Нацеливающий олигонуклеотид может включать заданную последовательность между нацеливающим олигонуклеотидом и последовательностями, расположенными в начале и/или в конце. Фигура 4 иллюстрирует вариант реализации такого зонда.
Зонды, которые образуют кольцо нуклеиновой кислоты также включают зонды, в которых последовательности, расположенные в начале и в конце, предоставляются на разных молекулах нуклеиновой кислоты. В таких случаях, кольцо нуклеиновой кислоты, которое образуется в условиях отжига будет содержать, по меньшей мере, три молекулы нуклеиновой кислоты - целевой фрагмент, последовательность, находящуюся в начале и последовательность, находящуюся в конце. Как было указано ранее, все концы молекул нуклеиновых кислот будут соприкасаться. В таких случаях, для формирования непрерывной кольцевой цепи нуклеиновой кислоты необходимо более двух реакций лигирования. Примером может являться, когда последовательность, находящаяся в конце, является 3'-концом нацеливающего нуклеотида, и зонд содержит каркасный олигонуклеотид, имеющий последовательность, находящуюся в начале, на его 5'-конце. В условиях отжига, последовательность, находящаяся в конце, связывается in cis с нижележащей фланкирующей последовательностью нацеливающего олигонуклеотида, и последовательность, находящаяся в начале, каркасного олигонуклеотида связывается in trans с вышележащей последовательностью нацеливающего олигонуклеотида. Связывание in cis означает, что связывание происходит на той же молекуле нуклеиновой кислоты, то есть, одна цепь нуклеиновой кислоты образует трехмерную структуру, в которой различные участки сведены вместе и гибридизируются. Связывание in trans означает, что связывание происходит между различными молекулами нуклеиновых кислот. В некоторых случаях, каркасный олигонуклеотид содержит пару последовательностей обращенных повторов, которые формируют шпилькообразную структуру в условиях отжига, тем самым позиционируя 3'-конец каркасного олигонуклеотида в соприкасании с 5'-концом нацеливающего олигонуклеотида. Существует разрыв между двумя концами. Зонд такого типа проиллюстрирован на Фигуре 5. Когда обеспечены условия лигирования, 5'-конец нацеливающего олигонуклеотида является литерованным с 3'-концом каркасного олигонуклеотида. Продукт двойного лигирования представляет собой кольцо нуклеиновой кислоты, содержащее нацеливающий олигонуклеотид, целевой фрагмент и каркасный олигонуклеотид. В альтернативном варианте, когда между 5'-концом нацеливающего олигонуклеотида и 3'-концом каркасного олигонуклеотида существует разрыв, зонд, показанный на Фигуре 5, не будет округляться лигированием - вместо этого непрерывная цепь нуклеиновой кислоты, содержащая последовательности, расположенные в начале и в конце, и целевой фрагмент, является линейной цепью нуклеиновой кислоты.
Зонд, в альтернативном варианте, может быть расположен в противоположной ориентации таким образом, что последовательность, находящаяся в начале расположена на 5'-конце нацеливающего нуклеотида, и зонд содержит каркасный олигонуклеотид, имеющий последовательность, находящуюся в конце, на его 3'-конце. В этом случае, в условиях отжига, последовательность, находящаяся в начале, связывается in cis с вышележащей фланкирующей последовательностью нацеливающего олигонуклеотида, и последовательность, находящаяся в конце, каркасного олигонуклеотида связывается in trans с нижележащей последовательностью нацеливающего олигонуклеотида. И вновь, каркасный олигонуклеотид может содержать пару последовательностей обращенных повторов, которые формируют шпилькообразную структуру в условиях отжига в положении 5'-конца каркасного олигонуклеотида в соприкасании с 3'-концом нацеливающего олигонуклеотида. 3'-конец нацеливающего олигонуклеотида затем лигирован с 5'-концом каркасного олигонуклеотида, таким образом, что продукт двойного лигирования представляет собой кольцо нуклеиновой кислоты, содержащее нацеливающий олигонуклеотид, целевой фрагмент и каркасный олигонуклеотид. В альтернативном варианте, как было отмечено выше, отжиг может помещать 5'-конец каркасного олигонуклеотида возле 3'-конца нацеливающего олигонуклеотида, но разделенными пробелом из одного или более нуклеотидов. Продукт лигирования будет представлять собой непрерывную линейную цепь нуклеиновой кислоты, содержащую последовательности, расположенные в начале и в конце, и целевой фрагмент.
Каркасный олигонуклеотид может содержать заданную последовательность между последовательностью обращенного повтора, таким образом, что в условиях отжига каркасный олигонуклеотид образует шпилькообразную петлю, как проиллюстрировано на Фигуре 5.
Как было отмечено, зонды могут быть разработаны таким образом, что непрерывная цепь нуклеиновой кислоты, содержащая последовательности, лежащие в начале и в конце, и целевой фрагмент является линейной цепью нуклеиновой кислоты. В условиях отжига, при наличии целевого фрагмента, последовательности, находящиеся в начале и в конце, гибридизируются с фланкирующими последовательностями, определяя пробел между 5'-концом последовательности, находящейся в начале и 3'-концом последовательности, находящейся в конце. Целевой фрагмент, гибридизуется с целевой комплементарной последовательностью в пробеле, таким образом, позиционируя концы целевого фрагмента в соприкасании с 5'-концом последовательности, находящейся в начале и 3'-концом последовательностей, находящихся в конце, и завершает цепь нуклеиновой кислоты, которая содержит целевой фрагмент и последовательности, расположенные в начале и в конце. Молекулы нуклеиновых кислот, которые образуют цепь имеют свои концы в соприкасании. Термин соприкасание был обсужден в другом месте. Существует разрыв между двумя концами, которые будут лигированы. Лигирование концов производит непрерывную цепь нуклеиновой кислоты, содержащую, по меньшей мере, последовательности, лежащие в начале и в конце, и целевой фрагмент.
Зонд может содержать нацеливающий олигонуклеотид, имеющий последовательность, расположенную в конце, на своем 3'-конце и линейный каркасный олигонуклеотид, имеющий последовательность, расположенную в начале, на своем 5'-конце. В условиях отжига, последовательность, находящаяся в конце, связывается in cis с нижележащей фланкирующей последовательностью нацеливающего олигонуклеотида, и последовательность, находящаяся в начале, каркасного олигонуклеотида связывается in trans с вышележащей последовательностью нацеливающего олигонуклеотида. Нацеливающий олигонуклеотид может содержать заданную последовательность между нижележащей фланкирующей последовательностью и последовательностью, расположенной в конце, таким образом, что в условиях отжига, нацеливающий олигонуклеотид образует шпилькообразную петлю. Линейная цепь нуклеиновой кислоты, образовавшаяся в условиях отжига, содержит каркасный олигонуклеотид, целевой фрагмент и нацеливающий олигонуклеотид. Фигура 6 иллюстрирует это расположение.
Зонд может быть в равной степени расположен в обратной ориентации, где последовательность, находящаяся в начале, расположена на 5'-конце нацеливающего нуклеотида, и зонд содержит каркасный олигонуклеотид, имеющий последовательность, находящуюся в конце, на его 3'-конце. В этом случае, последовательность, находящаяся в начале, связывается in cis с вышележащей фланкирующей последовательностью нацеливающего олигонуклеотида, и последовательность, находящаяся в конце, каркасного олигонуклеотида связывается in trans с нижележащей последовательностью нацеливающего олигонуклеотида.
Другой формой зонда, которая образует линейную цепь нуклеиновой кислоты в качестве продукта лигирования, является зонд, содержащий последовательности, лежащие в начале и в конце, на отдельных каркасных олигонуклеотидах. Такой зонд может содержать каркасный олигонуклеотид, содержащий последовательность, расположенную в начале, имеющую свободный 5'-конец, и каркасный олигонуклеотид, содержащий последовательность, расположенную в конце, имеющую свободный 3'-конец, причем, в условиях отжига, последовательности, расположенные в начале и в конце связываются in trans с фланкирующими последовательностями нацеливающего олигонуклеотида. Один или оба каркасных олигонуклеотида могут дополнительно содержать заданную последовательность. Фигура 7 иллюстрирует зонды этого типа.
Предпочтительно, олигонуклеотиды зонда в его нелигированной форме являются линейными. Таким образом, предпочтительно, нацеливающий олигонуклеотид является линейной молекулой нуклеиновой кислоты. Зонды, включающие один или более каркасные олигонуклеотиды, также предпочтительно являются линейными. Это обеспечивает удобную дифференциацию между дотированными и нелигированными зондами, где кольцо ДНК образуется только в результате успешного лигирования кольцевых вариантов реализации зонда. Линейные молекулы нуклеиновых кислот, не амплифицируются репликацией по типу катящегося кольца.
Амплификация продуктов
Детектирование сигнала в настоящем способе зависит от сигналов, генерируемых с помощью, или из правильного реагирования зондов с последующим распознаванием целей, с использованием специфической к последовательности гибридизации и ферментативного катализа для создания специфических продуктов, из которых получается сигнал. Настоящий метод использует детектирования множественных локусов на целевой молекуле представляющего интерес типа нуклеиновой кислоты в качестве усиления сигнала, и, следовательно, обеспечивает генерирование и обнаружение сигналов без необходимости амплификации продуктов прореагировавших зондов. Сигналы могут быть получены и кумулятивный сигнал может быть детектирован без амплификации продуктов лигирования. В некоторых случаях, однако, сигнал от объединенных продуктов может быть усилен традиционными путями усиления сигнала.
Способ может включать обогащение продуктов лигирования до обнаружения. Продукты могут быть обогащены посредством амплификации и/или с помощью твердофазной химии. Кольцевые продукты нуклеиновых кислот могут быть выборочно обогащены путем обработки образца экзонуклеазой (например, Лямбда экзонуклеазой) для расщепления линейных продуктов нуклеиновой кислоты. В общем, если продукты лигирования защищены от экзонуклеазной деградации, экзонуклеазная деградация может быть использована для обогащения продуктов лигирования. Экзонуклеаза затем должна быть дезактивирована (например, воздействием высокой температуры) до любой последующей стадии с участием полимеризации, например, до амплификации по типу катящегося кольца. Как иллюстрируется в Примере 2, 1U экзонуклеазы может быть добавлен для удаления непрореагировавших зондов и фрагментов. Подходящими условиями является инкубация при 37°С в течении 1 часа в соответствующем экзонуклеазном буфере, с последующей инактивацией фермента при 80°С в течении 20 минут. Там, где способы захвата/детектирования использованы, продукты лигирования могут быть обогащены путем захвата продуктов на твердой фазе с помощью фрагмента захвата. Как иллюстрируется в Примере 1, раствор, содержащий линейные продукты лигирования может быть смешан с 10 мл М-280 магнитных микроносителей, покрытых стрептавидином (Инвитроджен) в Трис-HCl (рН 7,5), 3,5 мМ ЭДТА и 0,07% Tween-20 в конечном объеме 200 мл, и инкубирован при комнатной температуре в течение 15 мин. После инкубации шарики собираются с помощью кольцевого магнита и супернатант удаляется. Другие способы обогащения для продуктов лигирования включают специфический отбор продуктов лигирования по размеру.
Продукты лигирования могут быть амплифицированы с помощью клональной амплификации. Подходящие способы амплификации включают амплификацию по типу катящегося кольца (см. ниже), твердофазную ПЦР (Addessi С, et al., Nucleic Acids Res. 15 октября 2000 года; 28(20): Е87), эмульсионную ПЦР (цифровая ПЦР в эмульсиях была описана Dressman et al., Proc Natl Acad Sci США. 22 июля 2003 года; 100(15): 8817-22. Epub 11 июля 2003 года) и цифровая ПЦР (Vogelstein и Kinzler, Proc Natl Acad Sci США. 3 августа 1999 года; 96(16): 9236-41). Клонально локализованная амплификация в гелях была описана Mitra и Church, Nucleic Acids Res. 15 декабря 1999 года; 27(24): е34. Вариант реализации настоящего способа может включать амплификацию продуктов лигирования и получение кумулятивного сигнала, который является сочетанием индивидуальных сигналов от амплифицированных продуктов. Предпочтительно, продукты лигирования амплифицированы через стык лигирования или, для продуктов двойного лигирования, через оба стыка лигирования.
Там, где продукты лигирования являются кольцами нуклеиновой кислоты, амплификация может включать создание условий для репликации колец нуклеиновой кислоты по типу катящегося кольца и детектирования продуктов репликации по типу катящегося кольца. Репликация по типу катящегося кольца была описана в патенте США 5854033 (Lizardi) и Fire и Xu, Proc Natl Acad Sci США. 9 мая 1995 года; 92(10): 4641-5. Репликация по типу катящегося кольца является амплификацией кольцевой молекулы нуклеиновой кислоты с использованием ДНК-полимеразы замещающей цепь, что приводит к большим молекулам ДНК, содержащим тандемные повторы амплифицированной последовательности. ДНК-полимераза катализирует удлинение праймера и смещение цепи в процессивной реакции полимеризации по типу катящегося кольца, которая продолжается столько, сколько является необходимым. Это приводит к амплификации округленной последовательности зонда в больших порядках, чем за один цикл ПЦР репликации и в других методах амплификации, в которых каждый цикл ограничен удвоению числа копий целевой последовательности. Дополнительная амплификация может быть получена с помощью каскада реакций замещения цепи. Репликация по типу катящегося кольца может быть сверхразветвленной репликацией по типу катящегося кольца. Сверхразветвленная RCA была описана Lizardi et al., Nat Genet. июль 1998 года; 19(3): 225-32. Условия для полимеризации по типу по типу катящегося кольца проиллюстрированы в Примерах, например, инкубация с полимеразой phi29 (фирма "Нью Инглэнд Биолабс") 1U которой может быть добавлен в соответствующий буфер phi29 с олигонуклеотидами (дНТФ) при 37°С в течении 1 часа.
Обнаружение
Продукты лигирования могут индивидуально обнаруживаться, так что отдельный сигнал может быть получен из продуктов лигирования в результате распознавания каждой целевой последовательности соответствующим зондом. Тем не менее, в данном способе продукты лигирования не обязательно должны быть индивидуально обнаружены. Отдельные сигналы от продуктов лигирования объединяются в кумулятивный сигнал и кумулятивный сигнал обнаруживается.
Тип сигнала и способ обнаружения может быть подходящим образом выбран в зависимости от типа зонда, или зонд может быть разработан таким образом, чтобы обеспечить желанный тип сигнала и способ обнаружения. Способ не ограничивается конкретными типами сигнала или обнаружение сигнала означает скорее то, что способ может быть осуществлен с помощью любого способа преобразования отдельных сигналов от множества зондов в один кумулятивный детектируемый сигнал, тем самым усиливая отдельные сигналы благодаря мультиплексной природе зондирования.
В целом, обнаружение сигналов от продуктов лигирования зависит от создания каждого продукта после связывание зонда с его целевой последовательностью, что указывает, присутствует ли целевая последовательность в образце. Таким образом, сигналы могут быть специально получены из продуктов, которые содержат стык лигирования или, для продуктов двойного лигирования, оба стыка лигирования. Отдельные сигналы могут быть получены от каждого стыка лигирования, образованного в результате гибридизации зонда с каждой целевой последовательностью. Так, например, если набор зондов включает 10 различных зондов, которые распознают 10 целевых последовательностей интереса, то образуется 10 продуктов лигирования, включая стыки лигированя, и кумулятивный сигнал может быть обнаружен, представляя собой комбинацию отдельных сигналов от 10 продуктов лигирования. Конечно, в этом примере фактическое число молекул зондов, целевых последовательностей и продуктов лигирования может быть выше 10, поскольку, как правило, имеется множество копий каждой целевой последовательности в образце, и образец будет контактировать со множеством копий каждого зонда.
Продукты лигирования, генерируемые набором зондов могут производить индивидуальные сигналы, которые характеризуют данный набор, и которые отличаются от сигналов, получаемых от продуктов лигирования, полученных с помощью зондов другого набора, что позволяет отличать и отдельно количественно характеризовать кумулятивные сигналы от каждого набора зондов. Например, зонды в пределах набора могут иметь заданную последовательность, которая является общей для этого набора, и отличатся от заданных последовательностей зондов в других наборах, что позволяет легко идентифицировать зонды из каждого набора. Каждый набор зондов может содержать, по меньшей мере, 500, 600, 700, 800, 900 или, по меньшей мере 1000 различных зондов для связывания со множеством целевых последовательностей, специфических для разновидностей нуклеиновых кислот. Например, способ может использовать 1000 различных нацеливающих олигонуклеотидов к каждой из 21, 13 и 18 хромосоме соответственно, и три различных набора зондов, каждый из которых является меченным уникальной заданной последовательностью, по одной для каждой хромосомы. В случае необходимости, мотивы, кодирующие специфические аллели и/или локусы, могут быть включены в заданную последовательность в высоком множестве копий.
Относительные количества двух или более хромосом в образце могут быть определены путем обнаружения кумулятивных сигналов от продуктов двойного лигирования от каждого из двух или более наборов зондов, каждый из которых распознает целевые последовательности, специфические к одной хромосоме, и определяет количество разных кумулятивных сигналов.
Удобный способ получения сигналов от продуктов лигирования заключается в обеспечении амплификации и определении наличия продуктов амплификации. Существует несколько возможных подходов амплификации, например, NASPA, LAMP, Т7 амплификация, ПЦР или репликация по типу катящегося кольца, где продукт лигирования представляет собой кольцо. Получение сигналов может вызывать амплификацию через стыки лигирования и обнаружение сигналов от продуктов амплификации (например, с помощью ПЦР или для кольцевых вариантов реализации зонда, репликации по типу катящегося кольца) или захват непрерывной нити нуклеиновой кислоты в одном ее конце и детектирование ее другого конца. Сигналы могут быть получены из амплифицированных или неамплифицированных продуктов лигирования с использованием любого из обычных систем обнаружения для нуклеиновых кислот, таких как обнаружение флуоресцентных меток, систем обнаружения, связанных с ферментами, обнаружение метки посредством антител и обнаружение радиоактивных меток. Предпочтительно, чтобы продукт амплификации по типу катящегося кольца обнаруживался посредством гибридизации меченного олигонуклеотида обнаружения с мотивом в продукте RCA, например, мотив в заданной последовательности зонда. Поскольку количество продуктов лигирования прямо пропорционально количеству целевой последовательности, присутствующей в образце, количественные измерения достоверно представляют количество целевой последовательности в образце. Основными преимуществами этого способа является то, что стадией лигирования можно манипулировать для получения аллельной дискриминации, стадия репликации ДНК является изотермической, а сигналы строго количественными, так как реакция амплификации является линейной и катализируется чрезвычайно последовательным ферментом. Олигонуклеотидный праймер, используемый для ПЦР может быть одинаковым для всех зондов из набора или для множества наборов зондов в реакционной смеси.
Один из примеров обнаружения сигнала использует метод захвата/метки. В данном случае продукты лигирования содержат фрагмент захвата на одной стороне стыка лигирования и метки на другой стороне стыка лигирования, и способ включает в себя получение сигналов от продуктов лигирования путем захвата продуктов лигирования на подложке с помощью фрагмента захвата, промывание подложки и удержания захваченной фракции, включающей подложку и захваченный продукт лигирования, и обнаружение метки на продуктах лигирования в захваченной фракции. Такие способы особенно пригодны, когда продукт лигирования является линейным, так что один конец продукта захватывается, а другой обнаруживается. Вместе с тем, способы также могут быть использованы, когда продукт лигирования имеет кольцевую форму, путем включения стадии расщепления кольца, чтобы преобразовать его в линейный продукт. Сигнал может быть получен от гетерогенной метки или последовательности зонда, например, заданной последовательности.
Могут быть использованы флуоресцентные сигналы, например, путем мечения зондов первого и второго наборов различными флуоресцентными метками. Таким образом, способ может включать в себя контакт нуклеиновой кислоты в образце с первым набором зондов и вторым набором зондов, и детектирование первого и второго кумулятивных сигналов, где
первый кумулятивный сигнал является флуоресценцией при первой длине волны, излучаемой продуктами лигирования, созданными с помощью зондов первого набора, и где
второй кумулятивный сигнал является флуоресценцией при второй длине волны, излучаемой продуктами лигирования, созданными с помощью зондов второго набора.
В некоторых из этих вариантов реализации изобретения продукты репликации по типу катящегося кольца продуктов лигирования, созданных с помощью зондов первого и второго набора, являются различимо мечеными.
Методы захвата/обнаружения особенно удобны для использования с зондами, которые содержат отдельные молекулы нуклеиновых кислот (например, последовательности, расположенные в начале и конце, на отдельных молекулах нуклеиновых кислот). Затем продукт лигирования содержит последовательности обеих молекул (например, последовательности, расположенные в начале и конце) в одной молекуле нуклеиновой кислоты (продукт лигирования), в то время, как нелигируемые зонды не содержат этого. Таким образом сигналы могут быть получены от продуктов лигирования путем захвата молекулы нуклеиновой кислоты, содержащей одну последовательность (например, последовательность, расположенную в начале), промывки для удаления нелигируемой зондом нуклеиновой кислоты, а затем детектирование наличия другой последовательности (например, последовательности, расположенной в конце) в захваченной фракции. Детектирование является специфическим для дотированных зондов, так как в нелигируемых зондах две последовательности соединены только путем гибридизации между нуклеиновыми кислотами и отделены друг от друга промыванием, в то время как лигируемые зонды содержат две последовательности с каждой стороны стыка лигирования в непрерывной нити нуклеиновой кислоты, то есть, связанные ковалентно.
Как уже отмечалось, зонды могут быть модифицированы, чтобы нести фрагменты захвата. Фрагмент захвата может позволять совершить присоединение к такой твердой подложке, как шарик (микроноситель). Подходящим фрагментом захвата является биотин, который соединяется со стрептавидином, позволяя модифицированной нуклеиновой кислоте зонда быть изолированной на твердой подложке, покрытой стрептавидином. Это может быть удобно для обеспечения зонда фрагментом захвата перед объединением зонда с образцом. В альтернативном варианте фрагмент захвата может быть введен после стадии лигирования.
В случае, если зонд содержит каркасный олигонуклеотид, содержащий либо последовательность, расположенную в начале или конце, и отдельную нуклеиновую кислоту (нацеливающий олигонуклеотид или второй каркасный олигонуклеотид), содержащую либо последовательность, расположенную в начале или конце соответственно, либо эти молекулы нуклеиновых кислот могут нести фрагмент захвата, например, могут быть биотинилированными.
Если одна молекула нуклеиновой кислоты зонда содержит фрагмент захвата, то другая может нести метку. Существует возможность использования самой последовательности нуклеиновой кислоты в качестве метки, обнаруживая заданную последовательность, которая идентифицирует молекулы нуклеиновых кислот, которые будут обнаружены, например, присутствует во всех зонах одного набора, но не в зондах другого набора. Комплементарный олигонуклеотид может быть использован для обнаружения. В качестве альтернативы нуклеиновая кислота может нести гетерогенную метку, такую как флуорофор. Гетерогенный метка не является частью самой нуклеиновой кислоты. Могут быть использованы другие метки, такие как квантовые точки, биолюминесценция, генерация сигналов ферментными каскадами, например, тирамидиновое усиление сигнала и радиоактивные фрагменты. Затем способ может включать обнаружение присутствия метки, например, обнаружение флуоресценции, обнаружение квантовых точек, обнаружения биолюминесценции, обнаружение сигнала, генерируемого с помощью фермента или обнаружение радиоактивности, соответственно.
В качестве примера, получение сигналов от продуктов лигирования может включать захват каркасных олигонуклеотидов из зондов на подложке с помощью фрагментов захвата, промывание субстрата для удаления нелигированных зондов и удержание захваченной фракции, включающей подложку и захваченный каркасный олигонуклеотид, а также получение сигналов от продуктов двойного лигирования в захваченной фракции. Если продукт двойного лигирования содержит метку, это может включать в себя обнаружение метки в захваченной фракции.
Фрагмент захвата может быть ботиновой молекулой с аффинностью к стрептавидиновой подложке. Другие подходящие метки аффинности включают полигистидиновые теги с аффиностью к иммобилизованным ионам металлов, таким как кобальт, никель, медь, которые могут быть использованы для очистки последовательностей, содержащих гистидин, например, каркасных олигонуклеотидов. Таким образом, фрагмент захвата может быть частью последовательности для захвата, например, последовательностью Гис-тег, или он может представлять собой гетерогенную часть молекулы, которая не является частью самой нуклеиновой кислоты.
Подходящий твердый субстрат представляет собой шарик, например, магнитный шарик (микроноситель), для облегчения накопление захваченных продуктов с помощью магнита. Подложка может быть покрыта связующим элементом для фрагмента захвата, например, стрептавидиновые магнитные шарики (микроносители) могут быть использованы с биотинилированными зондами.
Определение количества
Количественный анализ определяет количество разновидностей нуклеиновой кислоты в образце. В некоторых случаях это количество может быть определено и сравнено с известным контролем, что позволяет определить абсолютное или относительное количество нуклеиновой кислоты в образце. В других случаях, несколько разновидностей нуклеиновой кислоты может быть исследовано в образце, например, одновременно. Это позволяет использовать одну разновидность нуклеиновой кислоты в качестве эталона для количественной оценки различных видов нуклеиновых кислот по отношению друг к другу, например, определять, содержит ли проба больше 21 хромосомы или 1 хромосомы.
Количество может быть представлено в виде концентрации или количества (например, в молях или единицах массы), они являются взаимозаменяемыми, и концентрация является количеством нуклеиновой кислоты, деленное на объем образца.
Зонды
Примеры зондов и их особенности уже были описаны выше. Некоторые дополнительные особенности и примеры описаны здесь.
Нуклеиновая кислота зонда предпочтительно является ДНК. Тем не менее, это может быть другая нуклеиновая кислота, естественного происхождения или нет. Стандартными основами ДНК являются А, Т, С и G, но нуклеиновая кислота зонда данного способа может необязательно включать нестандартные нуклеотиды.
В общем, зонд для использования в способах настоящего способа может содержать целевой олигонуклеотид и последовательности, расположенные в начале и в конце. Последовательности, расположенные в начале и в конце, могут быть частью нацеливающего олигонуклеотида, либо одна либо обе из них могут быть на разной молекуле нуклеиновой кислоты. При необходимости, зонд содержит нацеливающий олигонуклеотид, каркасный олигонуклеотид, содержащий последовательность, находящуюся в начале и каркасный олигонуклеотид, содержащий последовательность, находящуюся в конце. Поэтому зонд может содержать одну, две или три молекулы нуклеиновой кислоты в ее нелигированной форме.
Предпочтительно, зонды используются для гибридизации с целевыми последовательностями, которые являются фрагментами определенной последовательности, генерируемой из типов нуклеиновой кислоты, которая должна быть количественно определена или идентифицирована. Эти целевые последовательности могут упоминаться как целевые фрагменты.
Нацеливающий олигонуклеотид длиннее, чем целевой фрагмент и содержит внутреннюю целевую комплементарную последовательность, таким образом что гибридизация между нацеливающим олигонуклеотидом и целевым фрагментом формирует двухцепочечную последовательность, расположенную между вышележащими и нижележащими фланкирующими последовательностями нацеливающего олигонуклеотида. Последовательности, находящиеся в начале и в конце, имеют свободные 5'- и 3'-концы соответственно, и являются комплементарными вышележащим и нижележащим фланкирующим последовательностями, соответственно. В условиях отжига, при наличии целевого фрагмента, последовательности, находящиеся в начале и в конце гибридизируются с фланкирующими последовательностями, определяя пробел между 5'-концом последовательности, находящейся в начале и 3'-концом последовательности, находящейся в конце, причем целевой фрагмент гибридизуется с целевой комплементарной последовательностью в пробеле, таким образом, позиционируя концы целевого фрагмента в соприкасании с 5'-концом последовательности, находящейся в начале и 3'-концом последовательности, находящейся в конце.
Зонды такого типа могут быть использованы для обнаружения типа нуклеиновой кислоты в способе, включающем:
(i) получение образца, в котором тип нуклеиновой кислоты фрагментируется на целевые фрагменты,
(ii) обеспечение денатурирующих условий, при которых целевые фрагменты являются одноцепочечными
(iii) контактирование образца с набором зондов, причем каждый зонд специфически распознает отдельную целевую последовательность в пределах типов детектируемой нуклеиновой кислоты, причем целевые последовательности являются последовательностями целевых фрагментов, и в котором каждый зонд содержит
нацеливающий олигонуклеотид, который длиннее, чем целевой фрагмент и содержит внутреннюю целевую комплементарную последовательность, таким образом, что гибридизация между нацеливающим олигонуклеотидом и целевым фрагментом формирует двухцепочечную последовательность, расположенную между вышележащими и нижележащими фланкирующими последовательностями нацеливающего олигонуклеотида, и
последовательности, находящиеся в начале и в конце, имеющие свободные 5'- и 3'-концы соответственно, причем последовательности, находящиеся в начале и в конце, являются комплементарными вышележащим и нижележащим фланкирующим последовательностями, соответственно,
(iv) обеспечение условий отжига при которых последовательности начала и конца гибридизируются с фланкирующими последовательностями, а целевые фрагменты, если они присутствуют, гибридизуются с целевой комплементарной последовательностью зондов, таким образом, позиционируя концы целевого фрагмента в соприкасании с 3'-концом последовательности начала и 3'-концом последовательности конца
(v) обеспечение условий для лигирования при которых, если целевой фрагмент присутствует, 3'-конец целевого фрагмента лигирует с 5'-концом последовательности начала с образованием первого стыка лигирования, и 5'-конец целевого фрагмента лигирует с 3'-концом последовательности конца с образованием второго стыка лигирования, продуцируя продукт двойного лигирования, который включает в себя непрерывную цепь нуклеиновой кислоты, содержащую последовательности начала и конца и целевой фрагмент, и
(vi) обнаружение кумулятивного сигнала, который является комбинацией отдельных сигналов от всех продуктов,
причем обнаружение сигнала указывает на присутствие типов нуклеиновой кислоты в образце.
Типы нуклеиновой кислоте могут быть количественно определены с помощью способа, включающего
(i) получение образца, в котором тип нуклеиновой кислоты фрагментируется на целевые фрагменты
(ii) обеспечение денатурирующих условий, при которых целевые фрагменты являются одноцепочечными
(iii)  контактирование образца с набором зондов, причем каждый зонд специфически распознает отдельный целевой фрагмент типов определяемой количественно нуклеиновой кислоты, причем каждый зонд содержит
контактирование образца с набором зондов, причем каждый зонд специфически распознает отдельный целевой фрагмент типов определяемой количественно нуклеиновой кислоты, причем каждый зонд содержит
нацеливающий олигонуклеотид, который длиннее, чем целевой фрагмент и содержит внутреннюю целевую комплементарную последовательность, таким образом, что гибридизация между нацеливающим олигонуклеотидом и целевым фрагментом формирует двухцепочечную последовательность, расположенную между вышележащими и нижележащими фланкирующими последовательностями нацеливающего олигонуклеотида, и
последовательности, находящиеся в начале и в конце, имеющие свободные 5'- и 3'-концы соответственно, причем последовательности, находящиеся в начале и в конце, являются комплементарными вышележащим и нижележащим фланкирующим последовательностями, соответственно,
(iv) обеспечение условий отжига при которых последовательности начала и конца гибридизируются с фланкирующими последовательностями, а целевые фрагменты, если они присутствуют, гибридизуются с целевой комплементарной последовательностью зондов, таким образом, позиционируя концы целевого фрагмента в соприкасании с 3'-концом последовательности начала и 3'-концом последовательности конца
(v) обеспечение условий для лигирования при которых, если целевой фрагмент присутствует, 3'-конец целевого фрагмента лигирует с 5'-концом последовательности начала с образованием первого стыка лигирования, и 5'-конец целевого фрагмента лигирует с 3'-концом последовательности конца с образованием второго стыка лигирования, продуцируя продукт двойного лигирования, который включает в себя непрерывную цепь нуклеиновой кислоты, содержащую последовательности начала и конца и целевой фрагмент,
(vi) обнаружение кумулятивного сигнала, который является комбинацией отдельных сигналов от всех продуктов лигирования, и
(vii) количественное определение кумулятивного сигнала для определения уровня сигнала, причем уровень сигнала является пропорциональным количеству типов нуклеиновой кислоты в образце, и
таким образом определяет количество типов нуклеиновой кислоты в образце.
Способ может быть использован для количественной оценки первого типа нуклеиновой кислоты по отношению ко второму типу нуклеиновой кислоты в образце. Соответственно, способ может включать
(i)  получение образца, в котором первый и второй тип нуклеиновой кислоты фрагментирован на целевые фрагменты
получение образца, в котором первый и второй тип нуклеиновой кислоты фрагментирован на целевые фрагменты
(ii) обеспечение денатурирующих условий, при которых целевые фрагменты являются одноцепочечными
(iii) контактирование образца с первым набором зондов и вторым набором зондов, причем зонды первого набора специфически распознают отдельные целевые фрагменты первого типа нуклеиновой кислоты и, в котором зонды второго набора специфически распознают отдельные целевые фрагменты второго типа нуклеиновой кислоты, причем каждый зонд содержит
нацеливающий олигонуклеотид, который длиннее, чем целевой фрагмент и содержит внутреннюю целевую комплементарную последовательность, таким образом, что гибридизация между нацеливающим олигонуклеотидом и целевым фрагментом формирует двухцепочечную последовательность, расположенную между вышележащими и нижележащими фланкирующими последовательностями нацеливающего олигонуклеотида, и
последовательности, находящиеся в начале и в конце, имеющие свободные 5'- и 3'-концы соответственно, причем последовательности, находящиеся в начале и в конце, являются комплементарными вышележащим и нижележащим фланкирующим последовательностями, соответственно,
(iv) обеспечение условий отжига при которых последовательности начала и конца гибридизируются с фланкирующими последовательностями, а целевые фрагменты, если они присутствуют, гибридизуются с целевой комплементарной последовательностью зондов, таким образом, позиционируя концы целевого фрагмента в соприкасании с 3'-концом последовательности начала и 3'-концом последовательности конца
(v) обеспечение условий для лигирования при которых, если целевой фрагмент присутствует, 3'-конец целевого фрагмента лигирует с 5'-концом последовательности начала с образованием первого стыка лигирования, и 5'-конец целевого фрагмента лигирует с 3'-концом последовательности конца с образованием второго стыка лигирования, продуцируя продукт двойного лигирования, который включает в себя непрерывную цепь нуклеиновой кислоты, содержащую последовательности начала и конца и целевой фрагмент,
(vi) обнаружение первого кумулятивного сигнала, который является комбинацией отдельных сигналов от продуктов лигирования, полученных с помощью зондов первого набора, и их количественное определение для определения уровня первого сигнала, причем уровень первого сигнала является пропорциональным количеству первого типа нуклеиновой кислоты в образце,
(vii) обнаружение второго кумулятивного сигнала, который является комбинацией отдельных сигналов от продуктов лигирования, полученных с помощью зондов второго набора, и их количественное определение для определения уровня второго сигнала, причем уровень второго сигнала является пропорциональным количеству второго типа нуклеиновой кислоты в образце, и
(viii) сравнение уровней первого и второго сигналов, таким образом определяя относительные количества первого и второго типа нуклеиновых кислот в образце.
Зонды могут быть разработаны таким образом, чтобы гибридизация целевого фрагмента в пробеле завершала кольцо нуклеиновой кислоты, кольцо, содержащее целевой фрагмент и последовательности, расположенные в начале и в конце.
Последовательность зонда, расположенная в начале и в конце, является предпочтительно присоединенной к заданной последовательности, которая не является комплементарной к другим областями зонда или целевого фрагмента.
В некоторых вариантах реализации изобретения зонда, одна молекула нуклеиновой кислоты содержит последовательности, расположенные в начале и в конце.
Последовательности, лежащие в начале и в конце могут быть отделены от нацеливающего олигонуклеотида таким образом, что они связываются in trans с фланкирующими последовательностями. Например, последовательности, расположенные в начале и в конце могут быть, соответственно, на 5'- и 3'-концах каркасного олигонуклеотида. Заданная последовательность может быть включена между последовательностями каркасного олигонуклеотида, расположенными в начале и в конце. Пример такого зонда проиллюстрирован на Фигуре 3. В альтернативном варианте, последовательности, находящиеся в начале и в конце каркасного олигонуклеотида могут быть примыкающими, без промежуточной нуклеотидной последовательности. В таком случае, фланкирующие последовательности нацеливающего олигонуклеотида гибридизируются по всей длине олигонуклеотида каркаса и могут округлить его.
Зонды могут быть разработаны таким образом, чтобы последовательность, находящаяся в начале являлась 5'-концом нацеливающего олигонуклеотида и/или последовательность находящаяся в конце являлась 3'-концом нацеливающего олигонуклеотида, таким образом, чтобы гибридизация целевого фрагмента в пробеле завершала цепь нуклеиновой кислоты, содержащей целевой фрагмент, последовательности, лежащие в начале и в конце, целевую комплементарную последовательность и фланкирующие последовательности. Последовательности, лежащие в начале и в конце могут находиться на концах нацеливающего олигонуклеотида и связываться in cis с фланкирующими последовательностями. Пример такого зонда проиллюстрирован на Фигуре 4. В этой версии зонда, последовательности, расположенные в начале и в конце, и целевая комплементарная последовательность все становятся округленными с целевым фрагментом. Заданные последовательности могут быть расположены в петлях олигонуклеотида. Нуклеиновая кислота зонда является относительно длинной, но имеет преимуществом соединение структуры олигонуклеотида в одну молекулу, которая является предварительно собранной и не требует гибридизации различных молекул нуклеиновой кислоты зонда.
Зонды могут также быть разработаны с каркасным олигонуклеотидом, который является отдельной молекулой нуклеиновой кислоты из нацеливающего олигонуклеотида. Последовательность, находящаяся в конце может быть 3'-концом нацеливающего олигонуклеотида, а последовательность, находящаяся в начале 5'-концом каркасного олигонуклеотида. В альтернативном варианте, последовательность, находящаяся в начале может быть 5'-концом нацеливающего олигонуклеотида, а последовательность, находящаяся в конце 3'-концом каркасного олигонуклеотида. Заданная последовательность может быть введена в нацеливающий олигонуклеотид, например, для обеспечения петли между последовательностями, находящимися в начале и в конце и фланкирующей последовательностью. Преимуществом использования данного подхода зонда состоит в том, что последовательность детектирования может быть введена в петлю и ассоциирована с целевой комплементарной последовательностью, что может быть полезно для способов усиления, особенно усилений высших порядков со схемами обнаружения "high-plex". Каркасный олигонуклеотид может дополнительно включать заданную последовательность. При обеспечении зонда двумя олигонуклеотидами, молекулы нуклеиновой кислоты зонда являются более короткими, чем однонуклеотидная версия, но сохраняют ту же самую функцию.
Другая конструкция зонда обеспечивает последовательности, лежащие в начале и в конце на двух каркасных олигонуклеотидах. Таким образом, зонд содержит
нацеливающий олигонуклеотид, который длиннее, чем целевой фрагмент и содержит внутреннюю целевую комплементарную последовательность, таким образом что гибридизация между нацеливающим олигонуклеотидом и целевым фрагментом формирует двухцепочечную последовательность, расположенную между вышележащими и нижележащими фланкирующими последовательностями нацеливающего олигонуклеотида,
каркасный олигонуклеотид, содержащий последовательность, находящуюся в начале, имеющую свободный 5'-конец, и
каркасный олигонуклеотид, содержащий последовательность, находящуюся в конце, имеющую свободный 3'-конец,
причем, последовательности, находящиеся в начале и конце являются комплементарными вышележащим и нижележащим фланкирующим последовательностями, соответственно.
Один каркасный олигонуклеотид может нести фрагмент захвата, и в этом случае другой каркасный олигонуклеотид используется для обнаружения и может нести гетерогенную метку. Один или оба каркасных олигонуклеотида могут дополнительно содержать заданную последовательность. В альтернативном или дополнительном варианте, нацеливающий олигонуклеотид может включать заданную последовательность.
В условиях отжига, при наличии целевого фрагмента, последовательности, находящиеся в начале и в конце гибридизируются с фланкирующими последовательностями, определяя пробел между 5'-концом последовательности, находящейся в начале и 3'-концом последовательности, находящейся в конце, причем целевой фрагмент гибридизуется с целевой комплементарной последовательностью в пробеле, таким образом, позиционируя концы целевого фрагмента в соприкасании с 5'-концом последовательности, находящейся в начале и 3'-концом последовательности, находящейся в конце. Гибридизация целевого фрагмента в пробеле завершает цепь нуклеиновой кислоты, содержащую целевой фрагмент и последовательности, расположенные в начале и в конце. Цепь несет фрагмент захвата и метку, позволяющие детектирование с помощью способов захвата/детектирования, описанных других местах настоящего описания.
Цифровое кариотипирование и неинвазивная пренаталъная диагностика
Некоторые реализации данного способа обеспечивают особые преимущества в областях, в которых необходимо точное определение количества целевой ДНК. Это включает в себя ряд диагностических способов, связанных с нуклеиновыми кислотами. Одной из таких областей является анализ ДНК злокачественных опухолей из биологических образцов пациента (например, крови). Другой такой областью является неинвазивная пренатальная диагностика (НПД) путем анализа внеклеточной ДНК.
Проблемой, возникающей при проведении НПД, является то, что большое количество специфических фрагментов генома должно учитываться для того, чтобы достичь статистической достоверности, необходимой для диагностики хромосомных анеуплоидий. Поскольку ДНК плода смешивается с материнской ДНК и составляет 4-30% генетического материала в крови беременной женщины, наблюдение за хромосомной анеуплоидией в ДНК плода требует очень точного измерения.
Данный способ может быть использован для анализа свободно циркулирующей ДНК плода в образцах материнской крови. При использовании множества зондов, предназначенных для различных фрагментов одной хромосомы и множества зондов, предназначенных для различных фрагментов другой хромосомы, способ определяет дисбаланс в относительных количествах двух хромосом в образце. Это позволяет диагностировать в фетальной ДНК такие виды хромосомной анеуплоидий, как трисомия, даже при высоком фоне материнской ДНК.
Данный способ может быть использован, например, для тестирования образцов крови беременных женщин для выявления фетальной ДНК и диагностики таких хромосомных аномалий, как трисомия, изучения образцов пациентов на наличие опухолевой ДНК для диагностики или мониторинга наличия опухоли у пациента. Другие области применения включают анализ образцов материала на наличие микробной нуклеиновой кислоты, где обнаружение микробной нуклеиновой кислоты указывает на инфицирование материала микроорганизмом, который может быть таким инфекционным агентом, как бактерия, вирус или грибок. Образцом может быть ткань или кровь пациента.
В более общем смысле, используя сотни или тысячи различных зондов, некоторые реализации данного способа могут обеспечивать высокую точность путем обнаружения сотен или тысяч специфических фрагментов нуклеиновых кислот, обеспечивая преимущества по целому ряду диагностических применений. Обнаружение большого количества фрагментов ДНК из хромосомы или хромосомного локуса, связанного с конкретным заболеванием позволяет сравнить эту хромосому или локус с контрольной хромосомой или локусом, таким образом, что даже небольшие различия в образцах могут быть обнаружены точно.
Большая часть сильно фрагментированной внеклеточной ДНК, которая находится в материнской крови, может быть эффективно проанализирована путем исследования небольших целевых фрагментов. Это имеет важное значение, поскольку очень малые количества внеклеточной ДНК доступны в материнской крови.
Способ количественного определения первой хромосомы или хромосомного локуса относительно второй хромосомы или хромосомного локуса в образце нуклеиновой кислоты, полученном из индивидуума, может включать в себя
контакт образца с первым и вторым набором зондов, причем каждый из зондов первого набора специфически распознает особую целевую последовательность в пределах первой хромосомы или хромосомного локуса, и где каждый из зондов второго набора специфически распознает особую целевую последовательность в пределах второй хромосомы или хромосомного локуса,
обеспечение условий, при которых целевые последовательности в первой и второй хромосомах или хромосомных локусах являются по меньшей мере частично одноцепочечными,
обеспечение условий для отжига и лигирования, при таких условиях зонды гибридизируются с целевыми последовательностями и генерируют продукты лигирования,
обнаружение первого кумулятивного сигнала, который является комбинацией отдельных сигналов от продуктов лигирования, полученных с помощью зондов первого набора, и их количественное определение для определения уровня первого сигнала, причем уровень первого сигнала является пропорциональным количеству первой хромосомы или хромосомного локуса в образце,
опеределение второго кумулятивного сигнала, который является комбинацией отдельных сигналов от продуктов лигирования, полученных с помощью зондов второго набора, и их количественную оценку для определения уровня второго сигнала, причем уровень второго сигнала является пропорциональным количеству второй хромосомы или хромосомного локуса в образце, и
сравнение уровней первого и второго сигналов, таким образом определяя относительные количества первой и второй хромосом или первого и второго хромосомного локуса в образце.
Данный способ может быть использован для диагностики анеуплоидий у плода (например, трисомии), где образец нуклеиновой кислоты представляет собой образец, полученный из материнской крови и содержащий внеклеточную ДНК плода, смешанную с материнской ДНК, и в котором неравное соотношение первого и второго уровней сигналов свидетельствует об анеуплоидий (например, трисомии).
Примеры
Следующие примеры приведены для того, чтобы продемонстрировать и в дальнейшем проиллюстрировать некоторые варианты реализации и аспекты данного изобретения и не должны быть истолкованы как ограничивающие его объем.
Пример 1
Данный пример иллюстрирует обнаружение и определение количества свободно циркулирующей ДНК плода в материнской крови с использованием данного способа.
Образец крови берется у беременной матери, и выделяется свободно циркулирующая ДНК из плазмы крови. Затем ДНК подвергается взаимодействию с целевыми специфическими ДНК-зондами, которые специфически взаимодействуют с фрагментами ДНК хромосом, предназначенных для анализа и количественной оценки. В этом примере мы проиллюстрируем использование так называемых "зондов Лотус", предназначенных для нацеливания и взаимодействия со специфическими фрагментами 21 хромосомы и эталонной хромосомы. Вместе с тем, могут быть использованы технологии на основе зондов, которые предназначены для нацеливания на специфические ДНК фрагменты, например, замыкающие кольцо зонды/зонды молекулярной инверсии (ЗМИ), отборочные зонды, зонды лигирования олигонуклеотидов.
Предлагаются зонды Лотус, мишенями которых являются несколько фрагментов каждой из двух хромосом. После распознавания мишеней, зонды с соответствующими фрагментами генерируют продукт лигирования, который имеет один конец с флуоресцентной меткой, и другой с биотиновой меткой. Продукты лигирования метят двумя различными флуорофорами, для каждого из которых мишенью является отдельная хромосома. Протокол может быть проиллюстрирован следующим образом:
1) 10 нг ДНК расщепляется с помощью 1 единицы рестриктазы в соответствующем буфере, совместимом с данным ферментом. Реакция инкубируется при 37 С в течение 1 ч, с последующей ферментативной дезактивацией при 80°С в течение 20 мин.
2) Фрагменты ДНК денатурируют до одноцепочечных фрагментов при 95°С в течение 10 мин и смешиваются с зондами и лигазой для образования линейных продуктов лигирования. Набор зондов в концентрации по 10 пМ каждый вместе с 1 ед. Амфилигазы (Эпицентр) добавляется в лигазный буфер и инкубируется при 55°С в течение 1 ч.
3) продукт лигирования улавливается с помощью магнитных микроносителей (шариков), покрытых стрептавидином. Для удаления непрореагировавших зондов и фрагментов раствор смешивается с 10 мл М-280 магнитных микроносителей, покрытых стрептавидином (Инвитроджен) в Трис-HCl (рН 7,5), 3,5 мМ ЭДТА и 0,07% Tween-20 в конечном объеме 200 мл, и инкубируется при комнатной температуре в течение 15 мин. После инкубации шарики собираются с помощью кольцевого магнита и супернатант удаляют.
4) Оставшиеся связанные с микроносителем зонды обнаруживаются и подсчитываются. Суммарная интенсивность флуоресценции измеряется для каждой из двух меток, а относительная интенсивность измеряется между двумя цветами.
5) В случае пренатальной диагностики окончательный результат обуславливается относительной величиной флуоресценции. Упрощенный пример; если 1000 геномных эквивалентов и 10% всей циркулирующей внеклеточной ДНК в материнской крови происходит от плода, а также 1000 зондов, специфических к 21 хромосоме используются для создания общей флуоресценции, то нормальный образец будет генерировать сигнал в 1000000 флуорофоров, а образец плода с трисомией по 21 хромосоме будет генерировать сигнал, соответствующий 1050000 флуорофорам. Кроме того, для достижения более высокой статистической точности, если 1000 зондов, меченных вторым флуорофором, нацелены на "нормализационные", не подверженные анеуплоидии регионы, относительная величина флуоресценции может быть измерена.
Пример 2
В следующем примере зонды Лотус, мишенями которых являются несколько фрагментов каждой из двух хромосом. После распознавания мишеней, зонды с соответствующими им фрагментами генерируют округленный продукт лигирования. Округленные продукты лигирования содержат любой из двух мотивов последовательности, которые могут быть использованы для последующего мечения, при этом каждый мотив последовательности соответствует любой из двух хромосом, которые являются мишенью. Протокол может быть проиллюстрирован следующим образом:
1) 10 нг ДНК расщепляется с помощью 1 единицы рестриктазы в соответствующем буфере, совместимом с данным ферментом. Реакция инкубируется при 37 С в течение 1 ч, с последующей ферментативной дезактивацией при 80°С в течение 20 мин.
2) Фрагменты ДНК денатурируют до одноцепочечных фрагментов при 95°С в течение 10 мин и смешиваются с зондами и лигазой для образования кольцевых продуктов. Набор зондов в концентрации по 10 пМ каждый вместе с 1 ед. Амфилигазы (Эпицентр) добавляется в лигазный буфер и инкубируется при 55°С в течение 1 ч.
3) 1 ед. экзонуклеазы добавляется для удаления непрореагировавших зондов и их фрагментов. 1 ед экзонуклеазы Лямбда (Эпицентр) добавляется при 37°С в течение 1 ч в соответствующий экзонуклеазных буфер с последующей инактивацией фермента при 80°С в течение 20 мин.
4) Оставшиеся кольцевые продукты копируются путем амплификации по типу катящегося кольца (RCA). 1 ед. phi29 полимеразы (Нью Ингланд Биолоабс) и нуклеотиды (дНТФ) добавляются в соответствующих буфер при 37°С в течение 1 ч. Комплементарные к продуктам RCA зонды, каждый из которых меченный одним из двух различных флуорофоров, добавляются в RCA-микс. Полученные меченые продукты RCA подсчитываются индивидуально, и относительное количество продуктов RCA измеряется между двумя цветами.
5) В случае пренатальной диагностики окончательный результат обуславливается относительной величиной флуоресценции. Упрощенный пример; если 1000 геномных эквивалентов и 10% всей циркулирующей внеклеточной ДНК в материнской крови происходит от плода, а также 1000 зондов, специфических к 21 хромосоме используются для создания общей флуоресценции, то нормальный образец будет генерировать сигнал в 1000000 флуорофоров, а образец плода с трисомией по 21 хромосоме будет генерировать сигнал, соответствующий 1050000 флуорофорам. Кроме того, для достижения более высокой статистической точности, если 1000 зондов, меченных вторым флуорофором, нацелены на "нормализационные", не подверженные анеуплоидии регионы, относительная величина флуоресценции может быть измерена.
Пример 3
Материалы и методы
Пробоподготовка. У каждого субъекта отбирается по 10 мл крови в пробирку для внеклеточной ДНК (Стрек, Омаха, штат Небраска). Плазма выделяется из крови с помощью двойного центрифугирование (1600 g в течение 10 мин, а затем 16000 g в течение 10 мин, после перемещения пробирки после первого центрифугирования). Внеклеточная ДНК выделяется с помощью набора Квайджен для выделения циркулирующей внеклеточной нуклеиновой кислоты (Квайджен, Хильден, Германия) в соответствии с протоколом производителя. Полученная ДНК элюируется в 50 мкл буфера (часть набора Квайджен).
Разработка зонда и каркаса. Технология мультиплексной амплификации зонда, описанная в данном документе, осуществляет специфическую и одновременную амплификацию тысяч хромосомных фрагментов. Зонды предназначаются для захвата 2500-5000 фрагментов (мишеней) на любой из 21, 18, и 13 хромосом. Мишени размером 18-35 п. н. выбираются таким образом, чтобы они являлись уникальной последовательностью в геноме, имели унифицированный AT/ГС состав, не включали в себя ни известный полиморфизм ни вариации числа копий. Зонды, нацеленные на 2500 фрагментов любой из 13 и 18 хромосом, объединяются вместе с 5000 зондами, нацеленными на фрагменты 21 хромосомы, чтобы создать единый пул олиго зондов. Пример последовательности зондов, "N" представляет собой целевую комплементарную последовательность:
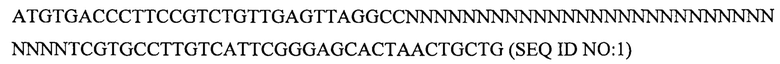
Каркасы с последовательностями, которые расположенны в начале и в конце и комплиментарными к концевым последовательностям зонда, были разработаны для того, чтобы включать в себя мотивы последовательностей как для секвенирования, так и для цифрового подсчета. Два каркаса использовались в экспериментах, которые описаны в разделе результаты; один комплементарный к зондам, которые нацелены на 13 и 18 хромосомы:
 , и
, и
второй нацелен на 21 хромосому:
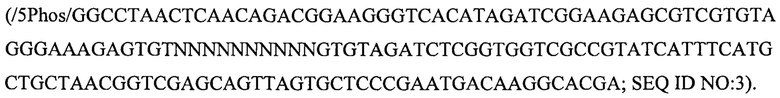
Биохимический протокол зонда: 50 мкл очищенной внеклеточной ДНК расщепляется с помощью 5 ед. MseI (Нью Ингланд Биолоабс) и 1х БСА буфера (Нью Ингланд Биолоабс) в общем объеме 55 мкл при 37°С в течение 30 мин с последующей тепловой инактивацией при 65°С в течение 20 мин. Затем расщепленная ДНК смешиваются с лигирующим миксом вместе с зондами и каркасами. 55 мкл расщепленной ДНК смешивается с зондами (1 пМ/зонд), каркасами (60 нМ каждый), 1х буфером для лигирования (Эпицентр), 100 ед. Амфилигазы (Эпицентр), 1 мМ НАД, и 5 мМ магния2+ в общем объеме 70 мкл. Расщепленные фрагменты сначала денатурируют до одноцепочечной ДНК при 95°С в течение 5 мин с последующей гибридизацией и лигированием при 55С в течение 16 ч. Затем лигированный микс обрабатывается экзонуклеазами для удаления оставшихся линейных молекул ДНК. Реакция лигирования смешивается с 20 ед. ExoI (НЕБ) и 5 ед. ExoIII (НЕБ) и 1х БСА в общем объеме 75 мкл при 37°С в течение 60 мин с последующей тепловой инактивацией при 65С в течение 10 мин.
Анализ: Для проведения секвенирования, кольцевые продукты, которые подверглись воздействию Ехо, амплифицируются с подходящими для Illumina праймерами для секвенирования, а затем загружаются в Illumina Miseq в соответствии с рекомендованным производителем протоколом.
Для цифрового анализа, реакции, связанные с воздействием Ехо, подвергают амплификации по типу катящегося кольца (RCA) для создания дискретных ДНК копий конкатемерных кольцевых продуктов. 37,5 мкл кольцевых структур, подданных воздействию Ехо, смешиваются с 4 мМ DTT, 3 ед. phi29 полимеразы (НЕБ), 0,1 мМ праймера, 1 мМ миксом дНТФ (НЕБ) и 1х БСА, в общем объеме 50 мкл, и инкубируются при 37°С в течение 1 ч с последующей термоинактивацией при 65°С в течение 10 мин. Затем реакция RCA метится комплементарными к последовательности каркаса флуоресцентными олигонуклеотидами. 50 мкл продуктов RCA смешиваются с 0,1% Tween 20 (Сигма), 5 нМ меченных олигонуклеотидов и 2 х SSC (Сигма), в общем объеме 100 мкл. Наконец, меченые RCA-продукты осаждаются на предметное стекло микроскопа, покрытое полилизином (Сигма), и подсчитываются с помощью флуоресцентного микроскопа.
Результаты
Зондовый метод, описанный в данном документе, демонстрируется на Illumina секвенировании и цифровой системой подсчета. Чтобы продемонстрировать эффективность зондового метода, образец ДНК с трисомией по 21 хромосоме смешивается с ДНК, выделенной из нормальных образцов плазмы (3-5 мл плазмы) в различных концентрациях. Затем образцы исследуются с помощью зондового метода и оцениваются посредством секвенирования.
Для результатов, показанных на Фиг. 8, 100 нг ДНК клеточной линии анализируется согласно протоколу, описанному выше. 10000 зондов смешиваются, чтобы специфически объединиться в кольцевые структуры с соответствующими 10000 хромосомными фрагментами 13, 18, и 21 хромосом. Затем, 10000 полученных кольцевых структур амплифицируются с соответствующими ПЦР-праймерами Illumina и анализируются в геле перед секвенированием. Линия 1 соответствует маркеру длины ДНК, линия 2 образцу ДНК после расщепления, и линия 3 продукту ПЦР с 10000 амплифицированных фрагментов.
Для результатов, показанных на Фиг. 9, 12 нормальных образцов плазмы анализировались параллельно с образцами ДНК с трисомией по 21 хромосоме в различных концентрациях. ДНК выделялась и обрабатывалась по протоколу для зонда 10K-plex и, потом секвенировалась на секвенаторе Illumina. Используя доверительный интервал, обеспечивающий 99% специфичности, положительные образцы детектируются с 90% чувствительностью на основании предполагаемого нормального распределения.
Дополнительные инструкции
Следующие пункты представляют собой аспекты настоящего изобретения и являются частью описания.
1. Способ детектирования типов нуклеиновой кислоты в образце, включающий
контактирование образца с набором зондов, причем каждый зонд специфически распознает отдельную целевую последовательность в пределах типов детектируемой нуклеиновой кислоты,
обеспечение условий, при которых целевые последовательности в типах нуклеиновой кислоты, являются, по меньшей мере частично одноцепочечными,
обеспечение условий для отжига и лигирования, при таких условиях зонды гибридизируются с их целевыми последовательностями и генерируют продукты лигирования, каждый продукт лигирования, содержащий соединение лигирования, и
обнаружение кумулятивного сигнала, который является комбинацией отдельных сигналов от всех продуктов лигирования,
причем обнаружение сигнала указывает на присутствие типов нуклеиновой кислоты в образце.
2. Способ количественной оценки типов нуклеиновой кислоты в образце, включающий
контактирование образца с набором зондов, причем каждый зонд специфически распознает отдельную целевую последовательность в пределах типов количественно оцениваемой нуклеиновой кислоты,
обеспечение условий, при которых целевые последовательности в типах нуклеиновой кислоты, являются, по меньшей мере частично одноцепочечными,
обеспечение условий для отжига и лигирования, при таких условиях зонды гибридизируются с их целевыми последовательностями и генерируют продукты лигирования, каждый продукт лигирования, содержащий соединение лигирования, и
обнаружение кумулятивного сигнала, который является комбинацией отдельных сигналов от всех продуктов лигирования,
количественную оценку кумулятивного сигнала для определения уровня сигнала, причем уровень сигнала является пропорциональным количеству типов нуклеиновой кислоты в образце, и
таким образом определяет количество типов нуклеиновой кислоты в образце.
3. Способ количественной оценки первого вида нуклеиновой кислоты по отношению ко второму виду нуклеиновой кислоты в образце, включающий
контактирование образца с первым набором зондов и вторым набором зондов, причем зонды первого набора каждый специфически распознает отдельную целевую последовательность в пределах первого типа нуклеиновой кислоты и, в котором зонды второго набора каждый специфически распознает отдельную целевую последовательность в пределах второго типа нуклеиновой кислоты,
обеспечение условий, при которых целевые последовательности в первом и втором типе нуклеиновой кислоты, являются, по меньшей мере частично одноцепочечными,
обеспечение условий для отжига и лигирования, при таких условиях зонды гибридизируются с их целевыми последовательностями и генерируют продукты лигирования, каждый продукт лигирования, содержащий соединение лигирования,
обнаружение первого кумулятивного сигнала, который является комбинацией отдельных сигналов от продуктов лигирования, полученных с помощью зондов первого набора, и их количественное определение для определения уровня первого сигнала, причем уровень первого сигнала является пропорциональным количеству первых типов нуклеиновой кислоты в образце,
обнаружение второго кумулятивного сигнала, который является комбинацией отдельных сигналов от продуктов лигирования, полученных с помощью зондов второго набора, и их количественное определение для определения уровня второго сигнала, причем уровень второго сигнала является пропорциональным количеству второго типа нуклеиновой кислоты в образце,
сравнение уровней первого и второго сигналов, таким образом определяя относительные количества первого и второго типа нуклеиновых кислот в образце.
4. Способ по любому из предшествующих пунктов, отличающийся тем, что целевая последовательность является неперекрывающейся.
5. Способ по любому из предшествующих пунктов, отличающийся тем, что набор зондов включает по меньшей мере 10 зондов, каждый из которых специфически распознает отдельную целевую последовательность.
6. Способ по п. 5, отличающийся тем, что набор зондов включает по меньшей мере 100 зондов, каждый из которых специфически распознает отдельную целевую последовательность.
7. Способ по п. 6, отличающийся тем, что набор зондов включает по меньшей мере 1000 зондов, каждый из которых специфически распознает отдельную целевую последовательность.
8. Способ по п. 7, отличающийся тем, что набор зондов включает по меньшей мере 10000 зондов, каждый из которых специфически распознает отдельную целевую последовательность.
9. Способ по любому из предшествующих пунктов, включающий амплификацию продуктов лигирования и получение кумулятивного сигнала, который является сочетанием индивидуальных сигналов от амплифицированных продуктов.
10. Способ по п. 9, отличающийся тем, что амплификация является клональной амплификацией.
11. Способ по п. 9 или п. 10, содержащий амплификацию продуктов лигирования через стык лигирования.
12. Способ по любому из предшествующих пунктов, отличающийся тем, что продукты лигирования являются продуктами двойного лигирования, каждый из которых содержит первый и второй стыки лигирования.
13. Способ по п. 12, отличающийся тем, что способ включает амплификацию продуктов лигирования через первый и второй стыки лигирования.
14. Способ по любому из пп. 1-8, включающий получение кумулятивного сигнала, который является комбинацией отдельных сигналов от продуктов лигирования без амплификации продуктов лигирования.
15. Способ по любому из пп. 1-13, отличающийся тем, что продукты лигирования являются кольцом нуклеиновой кислоты.
16. Способ по п. 15, включающий обеспечение условий для репликации по типу катящегося кольца колец нуклеиновой кислоты и детектирования продуктов репликации по типу катящегося кольца.
17. Способ по п. 16, отличающийся тем, что репликация по типу катящегося кольца является сверхразветвленной репликацией по типу катящегося кольца.
18. Способ по любому из пп. 1-14, отличающийся тем, что продукты лигирования являются линейными нуклеиновыми кислотами.
19. Способ по п. 18, отличающийся тем, что продукты лигирования содержат фрагмент захвата на одной стороне стыка лигирования и метку на другой стороне стыка лигирования, и способ включает получение сигналов от продуктов лигирования путем захвата продуктов лигирования на подложке с помощью фрагмента захвата, промывание подложки и удержания захваченной фракции, содержащей подложку и захваченный продукт лигирования, и детектирование метки на продуктах лигирования в захваченной фракции.
20. Способ по любому из предшествующих пунктов, отличающийся тем, что сигнал является флуоресценцией.
21. Способ по п. 20, включающий контактирование нуклеиновой кислоты в образце с первым набором зондов и вторым набором зондов, и детектирование первого и второго кумулятивных сигналов, отличающийся тем, что
первый кумулятивный сигнал является флуоресценцией при первой длине волны, излучаемой продуктами лигирования, созданными с помощью зондов первого набора, и где
второй кумулятивный сигнал является флуоресценцией при второй длине волны, излучаемой продуктами лигирования, созданными с помощью зондов второго набора.
22. Способ по любому из предшествующих пунктов, отличающийся тем, зонды лигированы для создания продуктов лигирования.
23. Способ по п. 22, отличающийся тем, что зонды и целевые последовательности лигированы для создания продуктов лигирования.
24. Способ по любому из предшествующих пунктов, отличающийся тем, что продукты лигирования являются кольцами нуклеиновой кислоты, содержащими целевые последовательности.
25. Способ по любому из предшествующих пунктов, отличающийся тем, что тип нуклеиновой кислоты является фрагментированным.
26. Способ по п. 25, отличающийся тем, что целевые последовательности являются последовательностями фрагментов типов нуклеиновых кислот.
27. Способ по п. 25 или п. 26, отличающийся тем, что образец является рестриктом нуклеиновой кислоты и целевая последовательность является фрагментом рестрикции.
28. Способ по любому из пп. 25-27, отличающийся тем, что зонд является лигированным к каждому концу целевой последовательности.
29. Способ по п. 28, отличающийся тем, что зонды каждый содержит
нацеливающий олигонуклеотид, который длиннее, чем целевой фрагмент и содержит внутреннюю целевую комплементарную последовательность, таким образом, что гибридизация между нацеливающим олигонуклеотидом и целевым фрагментом формирует двухцепочечную последовательность, расположенную между вышележащими и нижележащими фланкирующими последовательностями нацеливающего олигонуклеотида, и
последовательности, находящиеся в начале и в конце, имеющие свободные 5'- и 3'-концы соответственно, причем последовательности, находящиеся в начале и в конце, являются комплементарными вышележащим и нижележащим фланкирующим последовательностями, соответственно, причем
в условиях отжига и лигирования, последовательности начала и конца гибридизируются с фланкирующими последовательностями, а целевой фрагмент, если он присутствует, гибридизуется с целевой комплементарной последовательностью, таким образом, позиционируя концы целевого фрагмента в соприкасании с 5'-концом последовательности начала и 3'-концом последовательности конца, причем 3'-конец целевого фрагмента лигирован с 5'-концом последовательности начала с образованием первого стыка лигирования, и 5'-конец целевого фрагмента лигируется с 3'-концом последовательности конца с образованием второго стыка лигирования, производя продукт двойного лигирования, включающий непрерывную цепь нуклеиновой кислоты, содержащую последовательности начала и конца и целевой фрагмент.
30. Способ по п. 29, отличающийся тем, что образец фрагментированной нуклеиновой кислоты расщеплен ферментом рестрикции, а целевой фрагмент является фрагментом рестрикции.
31. Способ по п. 28 или п. 29, отличающийся тем, что этап выявления продукта двойного лигирования содержит создание условий для амплификации через первый и второй стык лигирования непрерывной цепи нуклеиновой кислоты, и детектирование с целью определить присутствует ли продукт амплификации.
32. Способ по любому из пп. 29-31, отличающийся тем, что непрерывная цепь нуклеиновой кислоты, содержащая последовательности, лежащие в начале и в конце, и целевой фрагмент являются кольцом нуклеиновой кислоты.
33. Способ по п. 32, отличающийся тем, что этап детектирование продукта двойного лигирования включает создание условий для репликации по типу катящегося кольца, и детектирование с целью определить присутствует ли продукт репликации по типу катящегося кольца.
34. Способ по п. 33, отличающийся тем, что репликация по типу катящегося кольца является сверхразветвленной репликацией по типу катящегося кольца.
35. Способ по любому из пп. 32-34, отличающийся тем, что зонд содержит последовательности, находящиеся в начале и в конце на одной молекуле нуклеиновой кислоты.
36. Способ по п. 35, отличающийся тем, что зонд содержит каркасный олигонуклеотид, имеющий последовательности, расположенные в начале и в конце на его 5'- и 3'-концах соответственно, причем последовательности, расположенные в начале и в конце каркасного олигонуклеотида связываются in trans с фланкирующими последовательностями нацеливающего олигонуклеотида в условиях отжига.
37. Способ по п. 36, отличающийся тем, что каркасный олигонуклеотид содержит заданную последовательность между последовательностями, расположенными в начале и в конце, причем заданная последовательность не является комплементарной с другими местами зонда или с целевым фрагментом.
38. Способ по п. 36, отличающийся тем, что последовательности, расположенные в начале и в конце каркасного олигонуклеотида являются примыкающими.
39. Способ по любому из пп. 32-35, отличающийся тем, что последовательности, находящиеся в начале в конце расположены на концах нацеливающего олигонуклеотида и связываются in cis с фланкирующими последовательностями в условиях отжига.
40. Способ по п. 39, отличающийся тем, что нацеливающий олигонуклеотид содержит заданную последовательность между нацеливающим олигонуклеотидом и последовательностями, расположенными в начале и/или в конце, причем заданная последовательность не является комплементарной с другими местами зонда или с целевым фрагментом.
41. Способ по любому из пп. 29-34, отличающийся тем, последовательность, находящаяся в конце расположена на 3'-конце нацеливающего нуклеотида, и зонд содержит каркасный олигонуклеотид, имеющий последовательность, находящуюся в начале на его 5'-конце,
причем, в условиях отжига, последовательность, находящаяся в конце связывается in cis с нижележащей фланкирующей последовательностью нацеливающего олигонуклеотида, и последовательность, находящаяся в начале, каркасного олигонуклеотида связывается in trans с вышележащей последовательностью нацеливающего олигонуклеотида.
42. Способ по п. 41, отличающийся тем, что каркасный олигонуклеотид содержит пару последовательностей обращенных повторов, причем
в условиях отжига последовательности обращенных повторов образуют шпилькообразную структуру, тем самым позиционируя 3'-конец каркасного олигонуклеотида в соприкасании с 5'-концом нацеливающего олигонуклеотида, и отличающийся тем, что
в условиях лигирования, 5'-конец нацеливающего олигонуклеотида лигирован с 3'-концом каркасного олигонуклеотида, таким образом, что продукт двойного лигирования представляет собой кольцо нуклеиновой кислоты, содержащее нацеливающий олигонуклеотид, целевой фрагмент и каркасный олигонуклеотид.
43. Способ по любому из пп. 29-34, отличающийся тем, последовательность, находящаяся в начале расположена на 5'-конце нацеливающего нуклеотида, и зонд содержит каркасный олигонуклеотид, имеющий последовательность, находящуюся в конце на его 3'-конце,
причем, в условиях отжига, последовательность, находящаяся в начале связывается in cis с вышележащей фланкирующей последовательностью нацеливающего олигонуклеотида, и последовательность, находящаяся в конце, каркасного олигонуклеотида связывается in trans с нижележащей последовательностью нацеливающего олигонуклеотида.
44. Способ по п. 43, отличающийся тем, что каркасный олигонуклеотид содержит пару последовательностей обращенных повторов, причем
в условиях отжига последовательности обращенных повторов образуют шпилькообразную структуру, тем самым позиционируя 5'-конец каркасного олигонуклеотида в соприкасании с 3'-концом нацеливающего олигонуклеотида, и отличающийся тем, что
в условиях лигирования, 3'-конец нацеливающего олигонуклеотида лигирован с 3'-концом каркасного олигонуклеотида, таким образом, что продукт двойного лигирования представляет собой кольцо нуклеиновой кислоты, содержащее нацеливающий олигонуклеотид, целевой фрагмент и каркасный олигонуклеотид.
45. Способ по любому из пп. 41-44, отличающийся тем, что каркасный олигонуклеотид содержит заданную последовательность между последовательностью обращенного повтора, таким образом, что в условиях отжига каркасный олигонуклеотид образует шпилькообразную петлю.
46. Способ по любому из пп. 29-33, отличающийся тем, что непрерывная цепь нуклеиновой кислоты, содержащая последовательности, лежащие в начале и в конце, и целевой фрагмент являются линейной цепью нуклеиновой кислоты.
47. Способ по п. 46, отличающийся тем, последовательность, находящаяся в конце расположена на 3'-конце нацеливающего нуклеотида, и зонд содержит каркасный олигонуклеотид, имеющий последовательность, находящуюся в начале, на его 5'-конце,
причем, в условиях отжига, последовательность, находящаяся в конце связывается in cis с нижележащей фланкирующей последовательностью нацеливающего олигонуклеотида, и последовательность, находящаяся в начале, каркасного олигонуклеотида связывается in trans с вышележащей последовательностью нацеливающего олигонуклеотида.
48. Способ по любому из пп. 41, 42 или 47, отличающийся тем, что нацеливающий олигонуклеотид содержит заданную последовательность между нижележащей фланкирующей последовательностью и последовательностью, расположенной в конце, таким образом, что в условиях отжига, нацеливающий олигонуклеотид образует шпилькообразную петлю.
49. Способ по п. 46, отличающийся тем, последовательность, находящаяся в начале расположена на 5'-конце нацеливающего нуклеотида, и зонд содержит каркасный олигонуклеотид, имеющий последовательность, находящуюся в конце, на его 3'-конце,
причем, в условиях отжига, последовательность, находящаяся в начале связывается in cis с вышележащей фланкирующей последовательностью нацеливающего олигонуклеотида, и последовательность, находящаяся в конце, каркасного олигонуклеотида связывается in trans с нижележащей последовательностью нацеливающего олигонуклеотида.
50. Способ по любому из пп. 43, 44 или 49, отличающийся тем, что нацеливающий олигонуклеотид содержит заданную последовательность между последовательностью, расположенной в начале и вышележащей фланкирующей последовательностью, таким образом, что в условиях отжига, нацеливающий олигонуклеотид образует шпилькообразную петлю.
51. Способ по любому из пп. 41-45 или 47-50, отличающийся тем, что каркасный олигонуклеотид несет фрагмент захвата.
52. Способ по п. 46, отличающийся тем, что зонд содержит каркасный олигонуклеотид, содержащий последовательность, расположенную в начале, имеющую свободный 5'-конец, и каркасный олигонуклеотид, содержащий последовательность, расположенную в конце, имеющую свободный 3'-конец, причем, в условиях отжига, последовательности, расположенные в начале и в конце связываются in trans с фланкирующими последовательностями нацеливающего олигонуклеотида.
53. Способ по п. 52, отличающийся тем, что один или оба каркасных олигонуклеотида дополнительно содержат заданную последовательность, причем заданная последовательность не является комплементарной с другими местами зонда или с целевым фрагментом.
54. Способ по п. 52 или 53, отличающийся тем, что один из каркасных олигонуклеотидов несет фрагмент захвата.
55. Способ по п. 54, отличающийся тем, что другой каркасный олигонуклеотид несет гетерогенную метку.
56. Способ по п. 55, отличающийся тем, что метка является флуорофором.
57. Способ по п. 51 или по любому из пп. 54-56, отличающийся тем, что этап детектирования присутствия продукта двойного лигирования включает захватывание каркасного олигонуклеотида на подложке с помощью фрагмента захвата, промывание подложки для удаления нелигированных зондов и удержание захваченной фракции, включающей подложку и захваченный каркасный олигонуклеотид, а также тестирование на наличие продукта двойного лигирования в захваченной фракции.
58. Способ по п. 55 или по п. 56, отличающийся тем, что этап детектирования присутствия продукта двойного лигирования включает захватывание каркасного олигонуклеотида на подложке с помощью фрагмента захвата, промывание подложки для удаления нелигированных зондов и удержание захваченной фракции, включающей подложку и захваченный каркасный олигонуклеотид, а также тестирование на наличие метки в захваченной фракции.
59. Способ по п. 51 или по любому из пп. 54-58, отличающийся тем, что фрагмент захвата является биотином.
60. Способ по любому из пп. 29-59, отличающийся тем, что целевая комплементарная последовательность имеет длину от 10 до 30 нуклеотидов.
61. Способ по любому из пп. 29-60, отличающийся тем, что целевая комплементарная последовательность имеет несовпадение с целевым фрагментом меньше чем 5 пар оснований.
62. Способ по п. 61, отличающийся тем, что целевая комплементарная последовательность является точно комплементарной с целевым фрагментом.
63. Способ по любому из пп. 29-62, отличающийся тем, что фланкирующие последовательности каждая имеет длину от 10 до 30 нуклеотидов.
64. Способ по любому из пп. 29-63, отличающийся тем, что вышележащие и нижележащие фланкирующие последовательности отличаются друг от друга.
65. Способ по любому из пп. 29-64, отличающийся тем, что последовательность, расположенная в начале имеет несовпадение с вышележащей фланкирующей последовательностью менее чем 5 пар оснований и последовательность, расположенная в конце имеет несовпадение с нижележащей фланкирующей последовательностью менее чем 5 пар оснований.
66. Способ по п. 65, отличающийся тем, что последовательность, находящаяся в начале является точно комплементарной к вышележащей фланкирующей последовательности и последовательность, находящаяся в конце является точно комплементарной к нижележащей фланкирующей последовательности.
67. Способ по любому из пп. 29-66, отличающийся тем, что нацеливающий олигонуклеотид является линейным.
68. Способ по любому из пп. 29-67, отличающийся тем, что образец представляет собой образец фрагментированных хромосом человека.
69. Способ по п. 68, отличающийся тем, что типы нуклеиновой кислоты являются хромосомой и целевые последовательности являются фрагментами генома человека, специфичными к этой хромосоме.
70. Способ по п. 68, отличающийся тем, что типы нуклеиновой кислоты являются хромосомным локусом и целевые фрагменты являются специфическими к этому локусу генома человека.
71. Способ по любому из предшествующих пунктов, отличающийся тем, что нуклеиновая кислота зонда является ДНК.
72. Способ по п. 68 или п. 69, отличающийся тем, что способ включает контактирование образца фрагментированных хромосом с набором зондов для связывания нескольких фрагментов хромосомы, причем каждый зонд в наборе используется для связывания другого целевого фрагмента специфичного для этой хромосомы.
73. Способ по п. 72, отличающийся тем, что зонды имеют общую заданную последовательность.
74. Способ по любому из предшествующих пунктов, отличающийся тем, что способ включает контактирование образца фрагментированных хромосом с двумя или более наборами зондов для связывания нескольких фрагментов двух или более хромосом, содержащий:
первый набор зондов для связывания множества целевых фрагментов, специфичных к первой хромосоме, и
второй набор зондов для связывания множества целевых фрагментов, специфичных ко второй хромосоме, и, в некоторых случаях,
один или более дополнительных наборов зондов для связывания множества целевых фрагментов, специфичных к одной или более дополнительным хромосомам.
75. Способ по п. 74, отличающийся тем, что каждый набор зондов включает по меньшей мере 500 различных зондов для связывания множества целевых фрагментов, специфичных к хромосоме.
76. Способ по п. 74 или п. 75, отличающийся тем, что зонды в пределах набора имеют заданную последовательность, которая является общей для этого набора, и отличается от заданных последовательностей зондов в других наборах.
77. Способ по п. 76, включающий определение относительных количеств двух или более хромосом в образце путем выявления и количественной оценки кумулятивных сигналов от заданных последовательностей в продуктах двойного лигирования для каждого набора зондов.
78. Способ по любому из пп. 72-77, отличающийся тем, что хромосома или хромосомы являются человеческими.
79. Способ по п. 28, отличающийся тем, что зонды содержат двухцепочечные селекторные конструкции, каждый отдельный селектор, содержащий одну или две выступающие концевые последовательности комплементарные к концам целевых фрагментов, причем
в условиях отжига и лигирования, концевые последовательности селекторов гибридизируются с концевыми последовательностями фрагментов и лигируются с селекторами.
80. Способ по п. 22, отличающийся тем, что зонды являются замыкающими кольцо зондами, каждый из которых содержит линейные олигонуклеотиды с целевыми комплементарными последовательностями на концах и нецелевой комплементарной последовательностью между ними, причем
в условиях для отжига и лигирования, целевые комплементарные последовательности сведены вместе начало к концу для гибридизации с примыкающими областями целевой последовательности, и лигируются с образованием кольца нуклеиновой кислоты.
81. Способ по любому из предшествующих пунктов, отличающийся тем, что типы нуклеиновой кислоты являются хромосомой или хромосомным локусом.
82. Способ по любому из предшествующих пунктов, отличающийся тем, что образец является образцом крови или ткани.
83. Способ по п. 82, отличающийся тем, что образец содержит смесь фетальной и материнской ДНК из крови беременной женщины.
84. Способ по п. 81 или п. 82, отличающийся тем, что тип детектируемой и количественно определяемой нуклеиновой кислоты является ассоциированной с опухолью ДНК.
85. Способ по п. 81 или п. 82, отличающийся тем, что тип детектируемой и количественно определенной нуклеиновой кислоты является микробной ДНК.
86. Способ количественного определения первой хромосомы или хромосомного локуса относительно второй хромосомы или хромосомного локуса в образце нуклеиновой кислоты, полученном из индивидуума, содержащий
контакт образца с первым и вторым набором зондов, причем каждый из зондов первого набора специфически распознает особую целевую последовательность в пределах первой хромосомы или хромосомного локуса, и где каждый из зондов второго набора специфически распознает особую целевую последовательность в пределах второй хромосомы или хромосомного локуса,
обеспечение условий, при которых целевые последовательности в первой и второй хромосомах или хромосомных локусах являются по меньшей мере частично одноцепочечными,
обеспечение условий для отжига и лигирования, при таких условиях зонды гибридизируются с целевыми последовательностями и генерируют продукты лигирования,
обнаружение первого кумулятивного сигнала, который является комбинацией отдельных сигналов от продуктов лигирования, полученных с помощью зондов первого набора, и их количественное определение для определения уровня первого сигнала, причем уровень первого сигнала является пропорциональным количеству первой хромосомы или хромосомного локуса в образце,
опеределение второго кумулятивного сигнала, который является комбинацией отдельных сигналов от продуктов лигирования, полученных с помощью зондов второго набора, и их количественную оценку для определения уровня второго сигнала, причем уровень второго сигнала является пропорциональным количеству второй хромосомы или хромосомного локуса в образце, и
сравнение уровней первого и второго сигналов, таким образом определяя относительные количества первой и второй хромосом или первого и второго хромосомного локуса в образце.
87. Способ по п. 83 или п. 86, для диагностики трисомии у плода, отличающийся тем, что образец нуклеиновой кислоты являются образцом внеклеточной фетальной ДНК, полученной из крови матери, и в котором неравное отношение первого и второго уровней сигнала является свидетельством трисомии.
88. Зонд нуклеиновой кислоты для связывания фрагмента одноцепочечной целевой нуклетиновой кислоты, отличающийся тем, что зонд содержит
нацеливающий олигонуклеотид, который длиннее, чем целевой фрагмент и содержит внутреннюю целевую комплементарную последовательность, таким образом, что гибридизация между нацеливающим олигонуклеотидом и целевым фрагментом формирует двухцепочечную последовательность, расположенную между вышележащими и нижележащими фланкирующими последовательностями нацеливающего олигонуклеотида, и
последовательности, находящиеся в начале и в конце, имеющие свободные 5'- и 3'-концы соответственно, причем последовательности, находящиеся в начале и в конце, являются комплементарными вышележащим и нижележащим фланкирующим последовательностями, соответственно,
таким образом, что в условиях отжига, при наличии целевого фрагмента, последовательности, находящиеся в начале и в конце гибридизируются с фланкирующими последовательностями, определяя пробел между 5'-концом последовательности, находящейся в начале и 3'-концом последовательности, находящейся в конце, причем целевой фрагмент гибридизуется с целевой комплементарной последовательностью в пробеле, таким образом, позиционируя концы целевого фрагмента в соприкасании с 3'-концом последовательности, находящейся в начале и 3'-концом последовательности, находящейся в конце, и причем
гибридизация целевого фрагмента в пробеле завершает кольцо нуклеиновой кислоты, кольцо содержит целевой фрагмент и последовательности, расположенные в начале и в конце.
89. Зонд нуклеиновой кислоты по п. 88, отличающийся тем, что последовательности, расположенные в начале и/или в конце, являются присоединенными к заданной последовательности, причем заданная последовательность не является комплементарной с другими местами зонда или с целевым фрагментом.
90. Зонд нуклеиновой кислоты по п. 88 или п. 89, отличающийся тем, что одна молекула нуклеиновой кислоты содержит последовательности, расположенные в начале и в конце.
91. Зонд по п. 88 или п. 89, отличающийся тем, что последовательности, лежащие в начале и в конце, отделены от нацеливающего олигонуклеотида и связываются in trans с фланкирующими последовательностями.
92. Зонд по п. 91, отличающийся тем, что последовательности, расположенные в начале и в конце, находятся на 5'- и 3'-концах, соответственно, каркасного олигонуклеотида.
93. Зонд по п. 92, отличающийся тем, что каркасный олигонуклеотид содержит заданную последовательность между последовательностями, расположенными в начале и в конце, причем заданная последовательность не является комплементарной с другими местами зонда или с целевым фрагментом.
94. Зонд по п. 92, отличающийся тем, что последовательности, расположенные в начале и в конце каркасного олигонуклеотида являются примыкающими.
95. Зонд нуклеиновой кислоты для связывания фрагмента одноцепочечной целевой нуклетиновой кислоты, отличающийся тем, что зонд содержит
нацеливающий олигонуклеотид, который длиннее, чем целевой фрагмент и содержит внутреннюю целевую комплементарную последовательность, таким образом, что гибридизация между нацеливающим олигонуклеотидом и целевым фрагментом формирует двухцепочечную последовательность, расположенную между вышележащими и нижележащими фланкирующими последовательностями нацеливающего олигонуклеотида, и
последовательности, находящиеся в начале и в конце, имеющие свободные 5'- и 3'-концы соответственно, причем последовательности олигонуклеотида, находящиеся в начале и в конце, являются комплементарными вышележащим и нижележащим фланкирующим последовательностями, соответственно,
таким образом, что в условиях отжига, при наличии целевого фрагмента, последовательности, находящиеся в начале и в конце гибридизируются с фланкирующими последовательностями, определяя пробел между 5'-концом последовательности, находящейся в начале и 3'-концом последовательности, находящейся в конце, причем целевой фрагмент гибридизуется с целевой комплементарной последовательностью в пробеле, таким образом, позиционируя концы целевого фрагмента в соприкасании с 5'-концом последовательности, находящейся в начале и 3'-концом последовательности, находящейся в конце, и причем
последовательность, находящаяся в начале является 5'-концом нацеливающего олигонуклеотида и/или последовательность находящаяся в конце является 3'-концом нацеливающего олигонуклеотида, таким образом, чтобы гибридизация целевого фрагмента в пробеле завершала цепь нуклеиновой кислоты, содержащей целевой фрагмент, последовательности, лежащие в начале и в конце, целевую комплементарную последовательность и фланкирующие последовательности.
96. Зонд по п. 88 или п. 95, отличающийся тем, что последовательности, лежащие в начале и в конце, находятся на концах нацеливающего олигонуклеотида и связываются in cis с фланкирующими последовательностями.
97. Зонд по п. 88 или п. 95, отличающийся тем, что последовательность, находящаяся в конце, является 3'-концом нацеливающего нуклеотида, а последовательность, находящаяся в начале, является 5'-концом каркасного нуклеотида отдельно от нацеливающего нуклеотида.
98. Зонд по п. 88 или п. 95, отличающийся тем, что последовательность, находящаяся в начале, является 5'-концом нацеливающего нуклеотида, а последовательность, находящаяся в конце, является 3'-концом каркасного нуклеотида отдельно от нацеливающего нуклеотида.
99. Зонд по п. 97 или п. 98, отличающийся тем, что каркасный олигонуклеотид дополнительно содержит заданную последовательность, причем заданная последовательность не является комплементарной с другими местами зонда или с целевым фрагментом.
100. Зонд нуклеиновой кислоты для связывания фрагмента одноцепочечной целевой нуклетиновой кислоты, отличающийся тем, что зонд содержит
нацеливающий олигонуклеотид, который длиннее, чем целевой фрагмент и содержит внутреннюю целевую комплементарную последовательность, таким образом что гибридизация между нацеливающим олигонуклеотидом и целевым фрагментом формирует двухцепочечную последовательность, расположенную между вышележащими и нижележащими фланкирующими последовательностями нацеливающего олигонуклеотида,
каркасный олигонуклеотид, содержащий последовательность, находящуюся в начале, имеющую свободный 5'-конец, и
каркасный олигонуклеотид, содержащий последовательность, находящуюся в конце, имеющую свободный 3'-конец,
причем, последовательности, находящиеся в начале и в конце, являются комплементарными вышележащим и нижележащим фланкирующим последовательностями, соответственно, и причем
один каркасный олигонуклеотид несет фрагмент захвата, а другой каркасный олигонуклеотид несет гетерогенную метку,
таким образом, что в условиях отжига, при наличии целевого фрагмента, последовательности, находящиеся в начале и в конце гибридизируются с фланкирующими последовательностями, определяя пробел между 5'-концом последовательности, находящейся в начале и 3'-концом последовательности, находящейся в конце, причем целевой фрагмент гибридизуется с целевой комплементарной последовательностью в пробеле, таким образом, позиционируя концы целевого фрагмента в соприкасании с 3'-концом последовательности, находящейся в начале и 3'-концом последовательности, находящейся в конце, и причем
гибридизация целевого фрагмента в пробеле завершает цепь нуклеиновой кислоты, содержащую целевой фрагмент и последовательности, расположенные в начале и в конце, причем цепь несет фрагмент захвата и метку.
101. Зонд по п. 100, отличающийся тем, что фрагмент захвата является биотином.
102. Зонд по п. 100 или п. 101, отличающийся тем, что метка является флуорофором.
103. Зонд по любому из пп. 100-102, отличающийся тем, что один или оба каркасных олигонуклеотида дополнительно содержат заданную последовательность, причем заданная последовательность не является комплементарной с другими местами зонда или с целевым фрагментом.
104. Зонд по любому из пп. 88-103, отличающийся тем, что нацеливающий олигонуклеотид дополнительно содержит заданную последовательность, которая не является комплементарной с другими местами зонда или с целевым фрагментом.
105. Зонд по любому из пп. 88-104, отличающийся тем, что целевая комплементарная последовательность имеет длину от 10 до 30 нуклеотидов.
106. Зонд по любому из пп. 88-105, отличающийся тем, что целевая комплементарная последовательность имеет несовпадение с целевым фрагментом меньше чем 5 пар оснований.
107. Зонд по п. 106, отличающийся тем, что целевая комплементарная последовательность является точно комплементарной с целевым фрагментом.
108. Зонд по любому из пп. 88-107, отличающийся тем, что фланкирующие последовательности каждая имеет длину от 10 до 30 нуклеотидов.
109. Зонд по любому из пп. 88-108, отличающийся тем, что вышележащие и нижележащие фланкирующие последовательности нацеливающего олигонуклеотида отличаются друг от друга.
110. Зонд по любому из пп. 88-109, отличающийся тем, что последовательность, расположенная в начале имеет несовпадение с вышележащей фланкирующей последовательностью менее чем 5 пар оснований и последовательность, расположенная в конце имеет несовпадение с нижележащей фланкирующей последовательностью менее чем 5 пар оснований.
111. Зонд по п. 110, отличающийся тем, что последовательности, лежащие в начале и в конце, являются полностью комплементарными с фланкирующими последовательностями.
112. Зонд по любому из пп. 88-111, отличающийся тем, что нацеливающий олигонуклеотид является линейным.
113. Зонд по любому из пп. 88-112, отличающийся тем, что целевой фрагмент является фрагментом эндонуклеазы рестрикции.
114. Зонд по любому из пп. 88-113, отличающийся тем, что целевой фрагмент является фрагментом генома человека.
115. Зонд по п. 114, отличающийся тем, что целевой фрагмент является фрагментом генома человека специфичным к одной хромосоме.
116. Зонд п. 115, отличающийся тем, что целевой фрагмент является специфичным к одному локусу генома человека.
117. Зонд по любому из пп. 88-116, отличающийся тем, что нуклеиновая кислота зонда является ДНК.
118. Набор зондов для связывания одноцепочечных целевых фрагментов нуклеиновой кислоты, содержащий множество зондов по любому из пп. 88-117, зондов, имеющих множество различных целевых комплементарных последовательностей для связывания множества различных целевых фрагментов.
119. Набор зондов по п. 118, который предназначен для связывания нескольких фрагментов хромосомы человека, причем каждый зонд в наборе используется для связывания другого целевого фрагмента специфичного для этой хромосомы.
120. Набор зондов по п. 119, отличающийся тем, что зонды имеют общую заданную последовательность.
121. Наборы зондов для связывания различных фрагментов двух или более хромосом человека, содержащие:
первый набор зондов для связывания множества целевых фрагментов, специфичных к первой хромосоме, и
второй набор зондов для связывания множества целевых фрагментов, специфичных ко второй хромосоме, и, в некоторых случаях,
один или более дополнительных наборов зондов для связывания множества целевых фрагментов, специфичных к одной или более дополнительным хромосомам.
122. Набор зондов по п. 121, отличающийся тем, что зонды в пределах набора имеют заданную последовательность, которая является общей для этого набора, и отличается от заданных последовательностей зондов в других наборах.
123. Комплект, содержащий набор или наборы зондов по любому из пп. 118-122 в растворе в одном или более контейнерах.
124. Использование зонда по любому из пп. 88-117, набор или наборы зондов по любому из пп. 118-122, или комплект по п. 123, для проверки пробы на наличие типа нуклеиновой кислоты.
125. Использование набора зондов для проверки образца на наличие целевых фрагментов, полученных из типов нуклеиновой кислоты,
причем каждый зонд набора содержит нацеливающий олигонуклеотид, содержащий последовательность, которая является точно комплементарной к целевому фрагменту, а также расположенные в начале и в конце последовательности олигонуклеотида, которые гибридизируются смежно с целевым фрагментом на нацеливающем олигонуклеотиде,
причем гибридизация между целевым фрагментом и зондом служит матрицей целевому фрагменту для лигирования с последовательностями, расположенными в начале и в конце.
Вариант реализации изобретения обеспечивает способ анализа образца, содержащий:
а) гибридизацию образца, содержащего фрагментированную ДНК с миксом зонда, содержащим первый набор зондов, причем зонды первого набора:
i. гибридизируются с различными сайтами первой хромосомы; и ii. образуют нековалентно связанные кольцевые продукты, содержащие смежные для лигирования стыки при гибридизации с фрагментами ДНК первой хромосомы;
б) лигирование смежных для лигирования стыков вместе, для производства множества ковалентно связанных кольцевых продуктов лигирования;
в) амплификацию ковалентно связанных кольцевых продуктов лигирования посредством амплификации по типу катящегося кольца (RCA) для получения множества молекул - продуктов RCA;
г) мечение молекул продукта RCA; и
д) количественную оценку числа меченых молекул продукта RCA, полученных на этапе г), тем самым обеспечивая оценку количества ДНК, соответствующей первой хромосоме в образце.
В любом варианте реализации изобретения первая хромосома может быть хромосомой 21, 13 или 18.
В любом варианте реализации изобретения, микс зондов может содержать второй набор зондов, причем зонды второго набора зондов гибридизуются с различными участками второй хромосомы и образуют нековалентно связанные кольцевые продукты, содержащие смежные для лигирования стыки при гибридизации с фрагментами ДНК второй хромосомы; и этап д) включает отдельное количественное определение количества молекул продукта амплификации по типу катящегося колеса, которые соответствуют первой и второй хромосомам, тем самым обеспечивая оценку относительного количества ДНК, соответствующей первой и второй хромосомам в образце.
В некоторых вариантах реализации изобретения первый набор зондов гибридизируется с различными сайтами первого участка первой хромосомы. В этих вариантах реализации изобретения, микс зондов может содержать второй набор зондов, причем зонды второго набора зондов гибридизуются с различными участками во второй области в первой хромосоме и образуют нековалентно связанные кольцевые продукты, содержащие смежные для лигирования стыки при гибридизации с фрагментами ДНК второй хромосомы; и этап д) включает отдельное количественное определение количества молекул продукта амплификации по типу катящегося колеса, которые соответствуют первой и второй областям первых хромосом, тем самым обеспечивая оценку относительного количества ДНК, соответствующей первой и второй областям первых хромосом в образце.
В любом варианте реализации изобретения, первой хромосомой является 21 хромосома, а вторая хромосома выбирается из хромосомы 13 и хромосомы 18.
В любом варианте реализации изобретения каждый из нековалентно связанных кольцевых продуктов содержит фрагмент ДНК из образца. В данных вариантах реализации изобретения зонды этапа а) могут содержать:
i. последовательность, расположенную в начале и последовательность, расположенную в конце, где последовательности, расположенные в начале и в конце, находятся на концах первой олигонуклеотидной молекулы; и
ii. последовательность шунта, которая содержит, в следующем порядке:
вышележащую фланкирующую последовательность, которая является комплементарной к последовательности, расположенной в начале;
целевую комплементарную последовательность, которая является комплементарной к целевому фрагменту; и
нижележащую фланкирующую последовательность, которая является комплементарной к последовательности, расположенной в конце;
и, в нековалентно связанных кольцевых продуктах концы целевого фрагмента являются смежными для лигирования с концам последовательностей, расположенных в начале и в конце первой олигонуклеотидной молекулы.
В этих вариантах реализации изобретения последовательность шунта может находиться в первой олигонуклеотидной молекуле. В альтернативном варианте, последовательность шунта может находиться во второй олигонуклеотидной молекуле.
В любом варианте реализации изобретения образец может быть расщеплен ферментом рестрикции.
В любом варианте реализации изобретения образец содержит геномную ДНК, например, внеклеточную ДНК, полученную из крови.
В любом варианте реализации изобретения, образец может содержать внеклеточную ДНК, выделенную из крови беременного человека.
В любом варианте реализации изобретения хромосома может быть выделена из биопсии ткани.
В любом варианте реализации изобретения хромосома может быть микробной хромосомой.
В любом варианте реализации изобретения, этап количественного анализа может быть осуществлен путем разделения отдельных молекулярных продуктов амплификации по типу катящегося кольца, полученные на стадии в) друг от друга, и подсчета количества отдельных молекулярных продуктов амплификации по типу катящегося кольца на определенной площади или объеме.
В этих вариантах реализации изобретения этап количественного анализа может быть осуществлен путем:
i. гибридизации меченого олигонуклеотида с молекулами продукта RCA, где меченый олигонуклеотид гибридизуется с последовательностью, которая повторяется в продукте RCA, в результате чего получается множество комплексов, каждый из которых включает один RCA продукт и множество меченых олигонуклеотидов, которые гибридизуются с RCA продуктом; и
ii. подсчета количества меченых комплексов.
В этих вариантах реализации изобретения этап количественного анализа может быть осуществлен путем:
(а) получения подложки, содержащей меченые комплексы, распределенные на поверхности подложки; и
(б) подсчета количества продуктов RCA, которые находятся на первом участке подложки.
В данных вариантах реализации изобретения способ может включать:
(а) получение подложки, включающей первое и второе множества комплексов, распределенных на поверхности подложки, где каждый из комплексов включает один продукт RCA и множество меченых олигонуклеотидных зондов, которые гибридизируются с продуктом RCA, первое и второе множества комплексов мечены различным образом, и первое и второе множества комплексов соответствуют разным хромосомам; и
(б) подсчет количества первого множества продуктов RCA и, независимо, подсчет количества второго множества продуктов RCA, которые находятся на первом участке подложки. В этом варианте реализации изобретения олигонуклеотиды могут быть флуоресцентно меченными.
В данных вариантах реализации изобретения, первый набор зондов может содержать, по меньшей мере 50 зондов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗОНД НУКЛЕИНОВОЙ КИСЛОТЫ И СПОСОБ ДЕТЕКТИРОВАНИЯ ГЕНОМНЫХ ФРАГМЕНТОВ | 2014 |
|
RU2733888C2 |
| НАБОР ЗОНДОВ ДЛЯ АНАЛИЗА ОБРАЗЦОВ ДНК И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2016 |
|
RU2753883C2 |
| УЛАВЛИВАНИЕ И ХАРАКТЕРИСТИКА СОВМЕСТНО ЛОКАЛИЗОВАННОГО ХРОМАТИНА | 2006 |
|
RU2478716C2 |
| ПРЯМОЙ ЗАХВАТ, АМПЛИФИКАЦИЯ И СЕКВЕНИРОВАНИЕ ДНК-МИШЕНИ С ИСПОЛЬЗОВАНИЕМ ИММОБИЛИЗИРОВАННЫХ ПРАЙМЕРОВ | 2011 |
|
RU2565550C2 |
| Способ получения панели ДНК-зондов для определения хромосомных транслокаций, делеций и амплификаций | 2023 |
|
RU2828103C1 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ПОЛУЧЕНИЯ БИБЛИОТЕК НУКЛЕИНОВЫХ КИСЛОТ | 2018 |
|
RU2788402C2 |
| СПОСОБЫ НЕИНВАЗИВНОГО ПРЕНАТАЛЬНОГО УСТАНОВЛЕНИЯ ПЛОИДНОСТИ | 2011 |
|
RU2671980C2 |
| РАСТЕНИЯ-ТРАНСФОРМАНТЫ КУКУРУЗЫ PV-ZMIR13 (MON863) И КОМПОЗИЦИИ И СПОСОБЫ ИХ ОБНАРУЖЕНИЯ | 2003 |
|
RU2352638C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ВЫСОКОМУЛЬТИПЛЕКСНОЙ ПЦР | 2012 |
|
RU2650790C2 |
| СПОСОБЫ ДИСКРЕТНОЙ АМПЛИФИКАЦИИ ПОЛНОГО ГЕНОМА | 2016 |
|
RU2736351C2 |


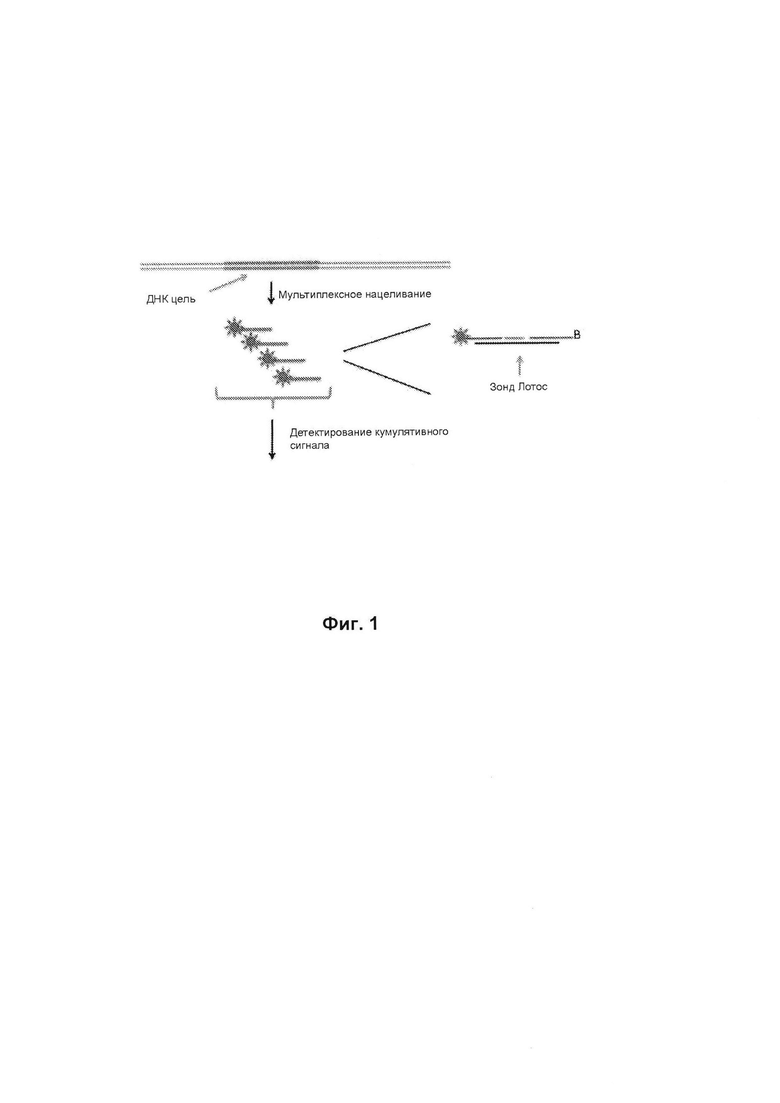
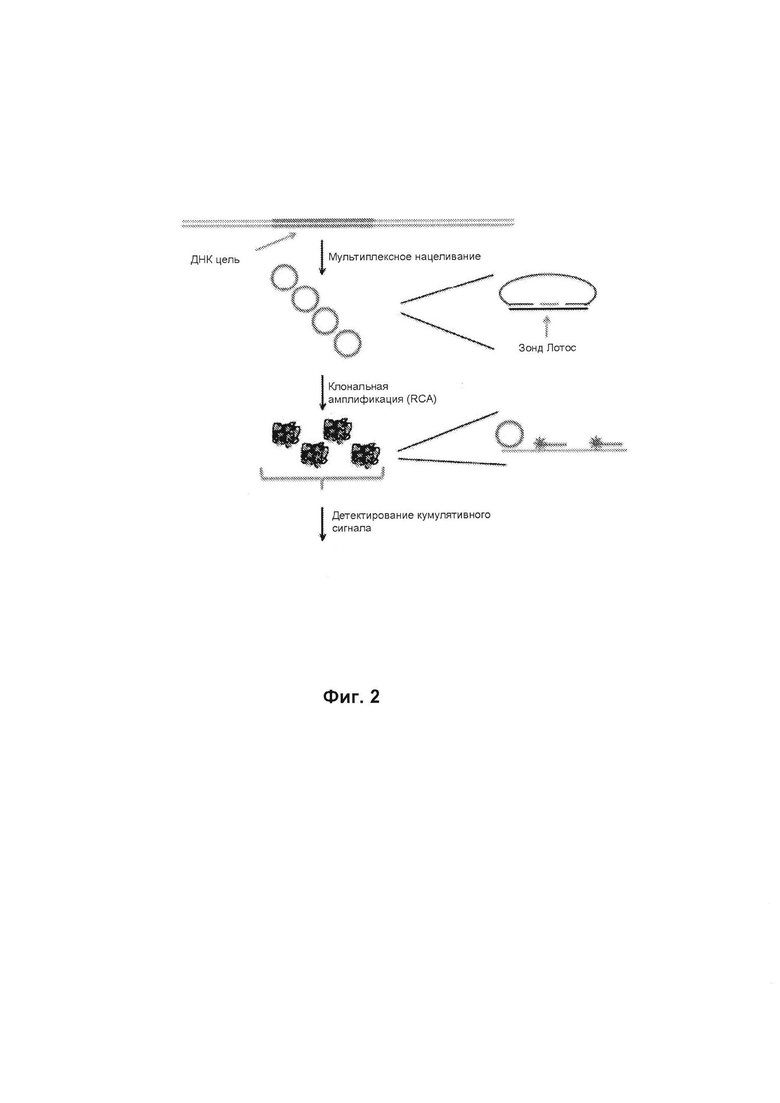

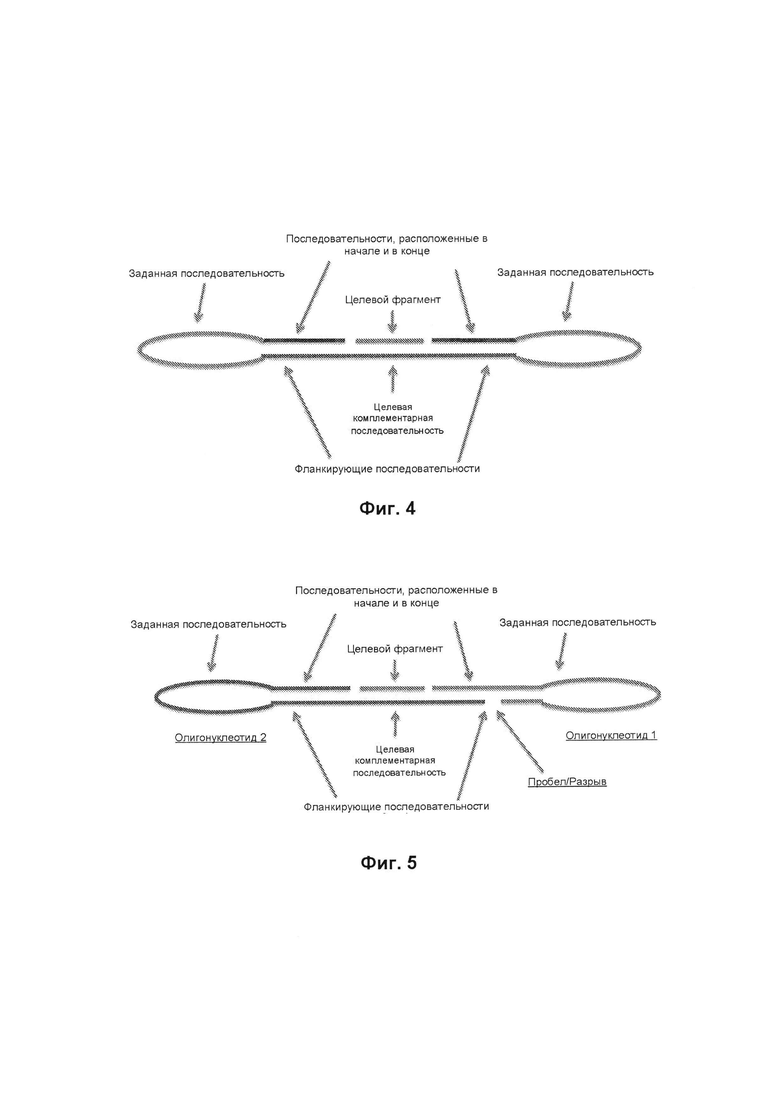

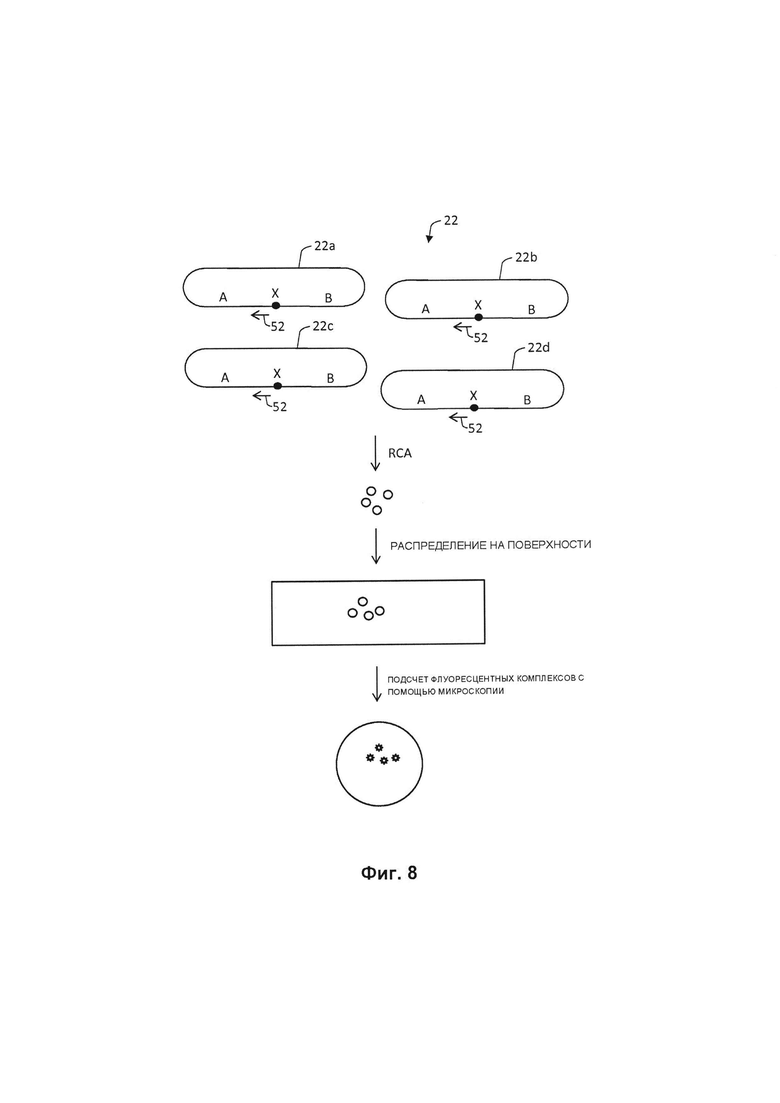
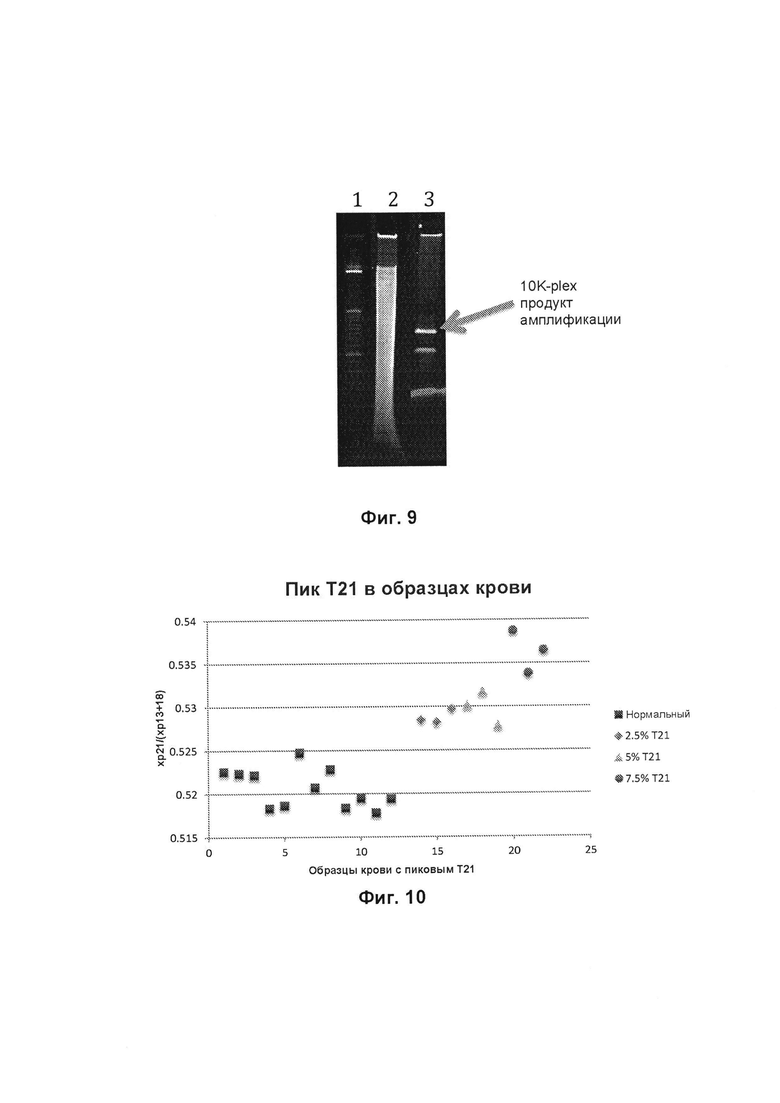
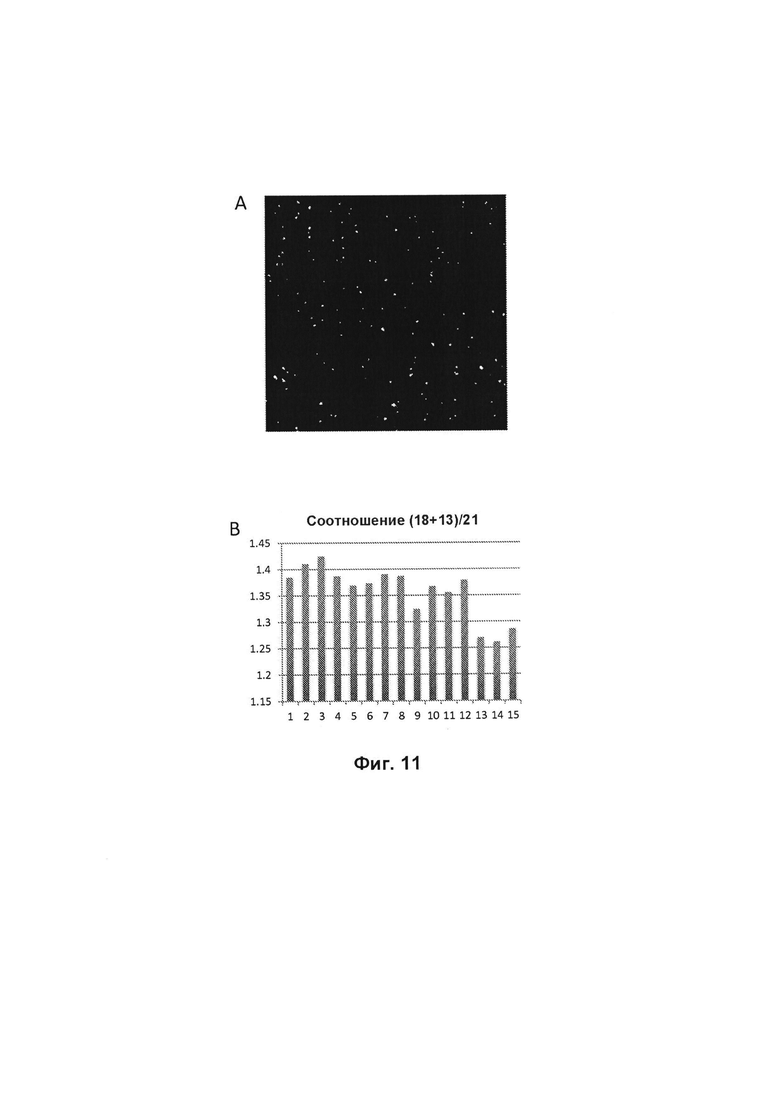
Изобретение относится к биотехнологии. Описан способ обнаружения анеуплоидии плода путем количественного определения первой хромосомы или хромосомного локуса относительно второй хромосомы или хромосомного локуса в образце материнской cfDNA, где образец содержит смесь ДНК плода и матери из крови беременной женщины. Способ включает: контактирование образца с первым и вторым набором зондов, причем каждый из зондов первого набора специфически распознает особую целевую последовательность в пределах первой хромосомы или хромосомного локуса, и при этом каждый из зондов второго набора специфически распознает особую целевую последовательность в пределах второй хромосомы или хромосомного локуса, обеспечение условий, при которых целевые последовательности в первой и второй хромосоме или хромосомном локусе являются по меньшей мере частично одноцепочечными, обеспечение условий для отжига и лигирования, при которых зонды гибридизируются с их целевыми последовательностями и генерируют продукты лигирования, при этом каждый продукт лигирования является кольцом нуклеиновой кислоты, содержащим соединение лигирования, обеспечение условий для репликации колец нуклеиновой кислоты по типу катящегося кольца, мечение продуктов RCA до их распределения на поверхности подложки, подсчет количества первых продуктов репликации по типу катящегося кольца, где первые продукты репликации по типу катящегося кольца амплифицированы из продуктов лигирования, полученных с помощью зондов первого набора для обеспечения первого подсчета, подсчет количества вторых продуктов репликации по типу катящегося кольца, где вторые продукты репликации по типу катящегося кольца амплифицированы из продуктов лигирования, полученных с помощью зондов второго набора для обеспечения первого подсчета, и сравнение первого и второго подсчитанных количеств, с определением, таким образом, относительных количеств первого и второго типа нуклеиновых кислот в образце. Изобретение расширяет арсенал средств детекции представляющей интерес разновидности нуклеиновой кислоты (например, хромосома), содержащей несколько уникальных целевых последовательностей, с использованием нескольких специфических зондов, которые амплифицируются амплификацией по типу катящегося кольца. 11 з.п. ф-лы, 11 ил., 3 пр.
1. Способ обнаружения анеуплоидии плода путем количественного определения первой хромосомы или хромосомного локуса относительно второй хромосомы или хромосомного локуса в образце материнской cfDNA, где образец содержит смесь ДНК плода и матери из крови беременной женщины, включающий:
контактирование образца с первым и вторым набором зондов, причем каждый из зондов первого набора специфически распознает особую целевую последовательность в пределах первой хромосомы или хромосомного локуса, и при этом каждый из зондов второго набора специфически распознает особую целевую последовательность в пределах второй хромосомы или хромосомного локуса,
обеспечение условий, при которых целевые последовательности в первой и второй хромосоме или хромосомном локусе являются по меньшей мере частично одноцепочечными,
обеспечение условий для отжига и лигирования, при которых зонды гибридизируются с их целевыми последовательностями и генерируют продукты лигирования, при этом каждый продукт лигирования является кольцом нуклеиновой кислоты, содержащим соединение лигирования,
обеспечение условий для репликации колец нуклеиновой кислоты по типу катящегося кольца,
мечение продуктов RCA до их распределения на поверхности подложки,
подсчет количества первых продуктов репликации по типу катящегося кольца, где первые продукты репликации по типу катящегося кольца амплифицированы из продуктов лигирования, полученных с помощью зондов первого набора для обеспечения первого подсчета,
подсчет количества вторых продуктов репликации по типу катящегося кольца, где вторые продукты репликации по типу катящегося кольца амплифицированы из продуктов лигирования, полученных с помощью зондов второго набора для обеспечения первого подсчета, и
сравнение первого и второго подсчитанных количеств, с определением, таким образом, относительных количеств первого и второго типа нуклеиновых кислот в образце.
2. Способ по п. 1, в котором первая хромосома является хромосомой 21, а вторая хромосома выбрана из хромосомы 13 и хромосомы 18.
3. Способ по п. 1 или 2, в котором набор зондов включает по меньшей мере 1000 зондов, каждый из которых специфически распознает отдельную последовательность-мишень.
4. Способ по п. 3, в котором набор зондов включает по меньшей мере 10000 зондов, каждый из которых специфически распознает отдельную последовательность-мишень.
5. Способ по п. 1, в котором продукты лигирования являются продуктами двойного лигирования, каждый из которых содержит первый и второй стыки лигирования.
6. Способ по п. 1, в котором стадии подсчета завершаются отделением индивидуальных молекул продукта репликации по типу катящегося кольца друг от друга и подсчетом количества индивидуальных молекул продукта репликации по типу катящегося кольца в определенной площади или объеме.
7. Способ по п. 6, в котором стадия подсчета завершается:
i) гибридизацией меченого олигонуклеотида с молекулами продукта RCA, где меченый олигонуклеотид гибридизуется с последовательностью, которая повторяется в продукте RCA, посредством чего получается множество комплексов, каждый из которых содержит одиночный продукт RCA и множество меченых олигонуклеотидов, которые гибридизуются с продуктом RCA, и
ii) подсчетом количества меченых комплексов.
8. Способ по любому из предыдущих пунктов, в котором продукты амплификации по типу катящегося кольца (RCA) индивидуально подсчитывают как:
(а) получение субстрата, содержащего множество комплексов, распределенных на поверхности субстрата, где каждый из комплексов содержит один продукт RCA и множество меченых олигонуклеотидных зондов, которые гибридизуются с продуктом RCA, и где комплексы, соответствующие первым продуктам амплификации по типу катящегося кольца, и комплексы, соответствующие вторым продуктам амплификации по типу катящегося кольца, имеют различные метки, и
(b) подсчета количества первых продуктов RCA и, независимо, подсчета количества вторых продуктов RCA, которые присутствуют в области субстрата.
9. Способ по любому из предыдущих пунктов, в котором продукты лигирования представляют собой кольца нуклеиновой кислоты, содержащие целевые последовательности.
10. Способ по любому из предыдущих пунктов, в котором хромосома представляет собой фрагментированную хромосому.
11. Способ по п. 10, в котором образец является рестриктом нуклеиновой кислоты, а целевая последовательность является фрагментом рестрикции.
12. Способ по п. 1, в котором каждый зонд содержит:
нацеливающий олигонуклеотид, который длиннее, чем целевой фрагмент, и содержит внутреннюю целевую комплементарную последовательность, таким образом, что гибридизация между нацеливающим олигонуклеотидом и целевым фрагментом формирует двухцепочечную последовательность, расположенную между вышележащими и нижележащими фланкирующими последовательностями нацеливающего олигонуклеотида, и
последовательности, находящиеся в начале и в конце, имеющие свободные 5'- и 3'-концы соответственно, причем последовательности, находящиеся в начале и в конце, являются комплементарными вышележащим и нижележащим фланкирующим последовательностями, соответственно,
причем в условиях отжига и лигирования, последовательности начала и конца гибридизируются с фланкирующими последовательностями, а целевой фрагмент, если он присутствует, гибридизуется с целевой комплементарной последовательностью, таким образом, позиционируя концы целевого фрагмента в соприкасании с 5'-концом последовательности начала и 3'-концом последовательности конца, причем 3'-конец целевого фрагмента лигирован с 5'-концом последовательности начала с образованием первого стыка лигирования, и 5'-конец целевого фрагмента лигируется с 3'-концом последовательности конца с образованием второго стыка лигирования, производя продукт двойного лигирования, включающий непрерывную цепь нуклеиновой кислоты, содержащую последовательности начала и конца и целевой фрагмент, причем непрерывная цепь является кольцом.
| УЛАВЛИВАНИЕ И ХАРАКТЕРИСТИКА СОВМЕСТНО ЛОКАЛИЗОВАННОГО ХРОМАТИНА | 2006 |
|
RU2478716C2 |
| WO 2011142836 А, 17.11.2011 | |||
| WO 2012019200 А2, 09.02.2012. | |||
Авторы
Даты
2020-10-07—Публикация
2014-11-26—Подача