Заявление об интересах государства
Это изобретение выполнено при государственной поддержке на основании 5DP1CA186693 от Национального института здравоохранения. Правительство имеет определенные права на это изобретение.
Уровень техники
Область техники
Варианты осуществления настоящего изобретения в целом имеют отношение к методам и композициям для амплификации микроколичества ДНК, например, ДНК из отдельной клетки, с целью определения ее генетической последовательности, в частности полного генома.
Предшествующий уровень техники
Возможность определения геномной последовательности одиночной клетки является важной в исследованиях, где ключевую роль играют изменения от клетки к клетке и гетерогенность популяции, например, при опухолевом росте, перепрограммировании стволовой клетки, эмбриональном развитии и т.д. Секвенирование генома одиночной клетки также важно в том случае, когда образцы клеток, подвергающихся секвенированию, являются дорогими или редкими или имеются в ничтожных количествах. Для точного секвенирования генома одиночной клетки важной является первоначальная амплификация геномной ДНК, которая может быть в наличии в ничтожных количествах.
Амплификация с множественным вытеснением цепи (MDA) является распространенным в данной области техники способом, используемым в отношении геномной ДНК из одиночной клетки до секвенирования и других анализов. В этом способе случайный отжиг праймеров сопровождается удлинением за счет использования ДНК полимеразы, обладающей сильной активностью, связанной с замещением цепи. Исходная геномная ДНК из одиночной клетки амплифицируется экспоненциально подобным каскаду образом с образованием сверхразветвленных структур ДНК. Другой способ амплификации геномной ДНК из одной клетки описан в Zong, C., Lu, S., Chapman, A.R., and Xie, X.S. (2012), Genome-wide detection of single-nucleotide and copy-number variations of a single human cell, Science 338, 1622-1626, которая описывает гибридный линейный метод полногеномной амплификации (MALBAC). Другим способом, известным в данной области техники, является ПЦР с вырожденными олигонуклеотидными праймерами, или DOP-PCR. Некоторые другие способы, используемые в отношении геномной ДНК одиночной клетки, включают Cheung, V.G. and S.F. Nelson, Whole genome amplification using a degenerate oligonucleotide primer allows hundreds of genotypes to be performed on less than one nanogram of genome DNA, Proceedings of the National Academy of Sciences of the United States of America, 1996. 93(25): p. 14676-9; Telenius, H., et al., Degenerate oligonucleotide-primed PCR: general amplification of target DNA by a single degenerate primer, Genomics, 1992. 13(3): p. 718-25; Zhang, L., et al., Whole genome amplification from a single cell: implications for genetic analysis. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(13): p. 5847-51; Lao, K., N.L. Xu, and N.A. Straus, Whole genome amplification using single-primer PCR, Biotechnology Journal, 2008, 3(3): p. 378-82; Dean, F.B., et al., Comprehensive human genome amplification using multiple displacement amplification, Proceedings of the National Academy of Sciences of the United States of America, 2002. 99(8): p. 5261-6; Lage, J.M., et al., Whole genome analysis of genetic alterations in small DNA samples using hyperbranched strand displacement amplification and array-CGH, Genome Research, 2003, 13(2): p. 294-307; Spits, C., et al., Optimization and evaluation of single-cell whole-genome multiple displacement amplification, Human Mutation, 2006, 27(5): p. 496-503; Gole, J., et al., Massively parallel polymerase cloning and genome sequencing of single cells using nanoliter microwells, Nature Biotechnology, 2013. 31(12): p. 1126-32; Jiang, Z., et al., Genome amplification of single sperm using multiple displacement amplification, Nucleic Acids Research, 2005, 33(10): p. e91; Wang, J., et al., Genome-wide Single-Cell Analysis of Recombination Activity and De Novo Mutation Rates in Human Sperm, Cell, 2012. 150(2): p. 402-12; Ni, X., Reproducible copy number variation patterns among single circulating tumor cells of lung cancer patients, PNAS, 2013, 110, 21082-21088; Navin, N., Tumor evolution inferred by single cell sequencing, Nature, 2011, 472 (7341):90-94; Evrony, G.D., et al., Single-neuron sequencing analysis of l1 retrotransposition and somatic mutation in the human brain, Cell, 2012. 151(3): p. 483-96; и McLean, J.S., et al., Genome of the pathogen Porphyromonas gingivalis recovered from a biofilm in a hospital sink using a high-throughput single-cell genomics platform, Genome Research, 2013. 23(5): p. 867-77. Способы, имеющие отношение к аспектам амплификации полного генома, раскрыты в WO 2012/166425, США 7,718,403, США 2003/0108870 и США 7,402,386.
Тем не менее, существует потребность в дополнительных способах амплификации маленьких количеств геномной ДНК, например, из одиночной клетки или небольших групп клеток.
Раскрытие изобретения
Настоящее раскрытие предоставляет способ амплификации геномной ДНК, такой как амплификация полного генома, например, равномерная амплификация геномной ДНК, включающий использование системы транспозазы для получения фрагментов геномной ДНК, содержащей участки связывания праймеров, выделение каждого фрагмента в своей собственной микрокапле вместе с реагентами для амплификации, амплификацию каждого фрагмента в своей собственной микрокапле для создания ампликонов фрагмента в микрокапле и сбор и секвенирование ампликонов из каждой микрокапли. Согласно одному аспекту раскрытие предоставляет способ амплификации геномной ДНК, такой как амплификация полного генома, например, равномерная амплификация геномной ДНК, включающий использование системы транспозазы для получения в водных средах фрагментов геномной ДНК и вставку или прикрепление участка связывания специфического ПЦР-праймера к каждому фрагменту, разделение водных сред на большое число водных капелек в масле, при этом каждая капля содержит не более одного фрагмента ДНК вместе с ПЦР-реагентами, причем в каждой капле происходит амплификация каждого фрагмента в капле с помощью ПЦР до насыщения, деэмульгирование всех капелек, т.е. разрушение капель с использованием реагента для деэмульгирования, например, чтобы восстановить или собрать ампликоны, и секвенирование ампликонов.
Согласно одному аспекту предоставляется способ амплификации геномной ДНК, такой как амплификация целого генома, включающий использование системы транспозазы для получения фрагментов геномной ДНК, содержащей участки связывания праймеров, изолирование в масле каждого фрагмента в его собственной микрокапле вместе с реагентами для ПЦР амплификации, амплификацию каждого фрагмент в его собственной водной микрокапле, деэмульгирование микрокапель с целью получения ампликонов и секвенирование ампликонов.
Варианты осуществления настоящего раскрытия имеют отношение к способам амплификации ДНК, в частности, небольшого количества геномной ДНК или ограниченное количество ДНК, например, геномной последовательности или геномных последовательностей, полученных из отдельной клетки или некоторого количества клеток того же самого клеточного типа или из ткани, жидкости или образца крови, полученного от индивиидуума или из субстрата. Согласно некоторым аспектам настоящего раскрытия описанные в данном документе способы могут осуществляться в одной пробирке с использованием одной реакционной смеси. Согласно некоторым аспектам настоящего раскрытия образец нуклеиновой кислоты может находиться в неочищенном или необработанном лизате отдельной клетки. Нуклеиновые кислоты, подлежащие обработке способами, раскрытыми в описании, необязательно должны быть очищены, например, путем очистки на колонке, до приведения в контакт с различными реагентами и при разных условиях, описанных в этом документе. Описанные в данном документе способы могут предоставить существенное и равномерное покрытие полного генома отдельной клетки, продуцируя амплифицированную ДНК для высокопроизводительного секвенирования.
Варианты осуществления настоящего изобретения в целом имеют отношение к способам и композициям для получения фрагментов ДНК, например, фрагментов ДНК из полного генома одиночной клетки, который может быть подвергнут спосбу амплификации, известному специалистам в данной области техники. Согласно одному аспекту, транспозаза как часть транспосомы используется для создания множества фрагментов. Каждый фрагмент двухцепочечной геномной ДНК изолируется в капле, такой как микрокапля, вместе с реагентами, используемыми для того, чтобы амплифицировать фрагмент двухцепочечной геномной ДНК. Фрагмент двухцепочечной геномной ДНК амплифицируется внутри капли, например, с помощью методов, известных специалистам в данной области техники, таких как ПЦР амплификация, и методов, описанных в этом документе. Соответственно, предоставляется метод, в котором каждый фрагмент двухцепочечной геномной ДНК изолируется в соответствующей капле и затем амплифицируется с целью получения ампликонов. Согласно одному аспекту, каждый фрагмент в капле амплифицируется до момента, в котором реакция амплификации насыщается. Поскольку каждый фрагмент двухцепочечной геномной ДНК изолируется и амплифицируется до насыщения, способ уменьшает или исключает смещение амплификации, которое может происходить в том случае, когда некоторое количество фрагментов двухцепочечной геномной ДНК амплифицируются иным образом в пределах одного и того же объема реакционной смеси.
Согласно некоторым аспектам описанные в этом документе способы получения фрагментов нуклеиновой кислоты используют транспозазу. Транспозаза образует комплекс с ДНК-транспозоном, содержащим двухцепочечный сайт связывания транспозазы и первую нуклеиновокислотную последовательность, включающую одно или более из штрихкодовой последовательности и сайта связывания праймера для формирования комплекса транспозаза/транспозон ДНК. Штрихкодовая последовательность включает нуклеиновокислотную последовательность, которая однозначно идентифицирует отдельную клетку или группу клеток.
Первая нуклеиновокислотная последовательность может быть в одноцепочечной форме. Согласно некоторым аспектам транспозазы обладают способностью связываться с ДНК транспозоном и димеризоваться при контактировании между собой, будучи помещенными в реакционный сосуд или реакционный объем, формируя комплексный димер транспозаза/ транспозон ДНК, называемый транспосомой.
Согласно одному аспекту каждая транспосома включает две транспозазы и два транспозона ДНК. Транспозон ДНК включает сайт связывания транспозазы, необязательный штрихкод и участок связывания праймера. Согласно одному аспекту транспозон ДНК включает отдельный сайт связывания транспозазы, необязательный штрихкод и участок связывания праймера. Каждый ДНК-транспозон является отдельной нуклеиновой кислотой, связанной с транспозазой в участке связывания транспозазы. Транспосома представляет собой димер из двух отдельных транспозаз, каждая из которых связана со своим собственным ДНК-транспозоном. Согласно одному аспекту транспосома включает два отдельных и индивидуальных транспозона ДНК, каждый из которых связан с соответствующей транспозазой. Согласно одному аспекту транспосома включает только две транспозазы и только два ДНК-транспозона. Согласно одному аспекту два транспозона ДНК как часть транспосомы являются отдельными, индивидуальными или несвязанными с транспозонами ДНК, каждый из которых связан с соответствующей транспозазой. В качестве примера, отдельный и индивидуальный транспозон ДНК, как описано в этом документе, имеет один участок связывания транспозона, необязательный штрихкод и участок связывания праймера.
Транспосомы обладают способностью случайным образом связываться с целевыми местоположениями, расположенными вдоль двухцепочечных нуклеиновых кислот, таких как двухцепочечная геномная ДНК, образуя комплекс, включающий транспосому и двухцепочечную геномную ДНК. Транспозазы в транспосоме расщепляют двухцепочечную геномную ДНК, при этом одна транспозаза расщепляет верхнюю цепь и одна транспозаза расщепляет нижнюю цепь. Транспозон ДНК в транспосоме присоединяется к двухцепочечной геномной ДНК на участке разрезания. Соответственно, транспосомы используются для транспозиции, т.е. «вставки» ДНК транспозона и получения фрагментов. Согласно некоторым аспектам некоторое количество димеров комплексов транспозаза/транспозон ДНК соединяется с соответствующим количеством целевых местоположений, расположенных вдоль двухцепочечной геномной ДНК, например, и затем расщепляет двухцепочечную геномную ДНК на множество двухцепочечных фрагментов, при этом каждый фрагмент, имеющий ДНК-транспозон, прикрепляется к каждому концу двухцепочечного фрагмента. Согласно одному аспекту ДНК-транспозон прикрепляется к или вставляется в двухцепочечную геномную ДНК, и имеется одноцепочечный пропуск между одной цепью геномной ДНК и одной цепью транспозона ДНК. Согласно одному аспекту проводится удлинение в пропуске, чтобы заполнить пропуск и создать двухцепочечное соединение между двухцепочечной геномной ДНК и двухцепочечным транспозоном ДНК. Согласно одному аспекту сайт связывания транспозазы ДНК-транспозона прикрепляется на каждом конце двухцепочечного фрагмента. Согласно некоторым аспектам транспозаза соединяется с ДНК-транспозоном, который прикрепляется к каждому концу двухцепочечного фрагмента. Согласно одному аспекту транспозазы удаляются из транспозона ДНК, который прикреплен к каждому концу фрагментов двухцепочечной геномной ДНК.
Согласно одному аспекту настоящего раскрытия фрагменты двухцепочечной геномной ДНК, продуцируемые транспозазами, которые имеют ДНК-транспозон, прикрепленный на каждом конце фрагментов двухцепочечной геномной ДНК, затем подвергаются заполнению пропуска и удлинению с использованием ДНК-транспозона в качестве матрицы. Соответственно, образуется двухцепочечный продукт удлинения нуклеиновой кислоты, который включает фрагмент двухцепочечной геномной ДНК и двухцепочечный ДНК-транспозон, содержащий участок связывания праймера на каждом конце двухцепочечной геномной ДНК. Согласно одному аспекту участки связывания праймеров на каждом конце двухцепочечной геномной ДНК имеют одну и ту же последовательность.
Двухцепочечные продукты удлинения нуклеиновых кислот, содержащие фрагмент геномной ДНК, затем изолируются в каплях (например, микрокаплях, которые можно получить с помощью известного специалистам в данной области техники способа образования капель в эмульсии или путем смешивания масляной фазы с водной фазой для спонтанного создания микрокапель или иначе) вместе с реагентами для амплификации, известными специалистам в данной области техники. Согласно одному аспекту каждая капля включает один двухцепочечный нуклеиновокислотный продукт удлинения, т.е. один фрагмент двухцепочечной геномной нуклеиновой кислоты с присоединенными участками связывания праймеров, и реагенты для амплификации, а затем фрагмент двухцепочечной геномной нуклеиновой кислоты может быть амплифицирован с использованием методов, известных специалистам в данной области техники, таких как ПЦР, для получения ампликонов двухцепочечного фрагмента геномной нуклеиновой кислоты. Согласно одному аспекту ампликоны из каждой капли высвобождают, например, при помощи лизиса капли, и собирают для дальнейшего исследования, такого как секвенирование с использованием методов, известных в данной области техники, чтобы идентифицировать фрагмент последовательности и присоединенную штрихкодовую последовательность, если необходимо. Собранные ампликоны могут быть очищены для последующего анализа.
Варианты осуществления настоящего раскрытия имеют отношение к способу амплификации ДНК с использованием способов, описанных в этом документе, в частности, небольшое количество геномной ДНК или ограниченное количество ДНК, такое как геномная последовательность или геномные последовательности, полученные из одиночной клетки или некоторого количества клеток одного и того же клеточного типа или из ткани, жидкости или образца крови, полученного от индивидуума или субстрата. Согласно некоторым аспектам настоящего раскрытия, способы, описанные в этом документе, могут осуществляться в одной пробирке для создания фрагментов, которые затем изолируют внутри микрокапель и амплифицируют в микрокаплях, причем ампликоны собирают из микрокапель. Термины капля или микрокапля могут использоваться в описании взаимозаменяемым образом. Способы, описанные в документе, предупреждают, ингибируют, предотвращают или уменьшают смещение амплификации, имеющееся у способов амплификации предшествующего уровня техники, когда множество фрагментов амплифицируются вместе в одной и той же реакционной смеси. Способы, раскрытые в описании, могут обеспечить значительное покрытие целого генома отдельной клетки, предоставляя амплифицированную ДНК для высокопроизводительного секвенирования.
Согласно дополнительному аспекту в этом документе предоставляются методы проведения амплификации полного генома отдельной клетки с высокой точностью и однородностью амплификации или покрытия в пределах разных локусов в геноме, которые используется для дальнейшего секвенирования или анализов с использованием методов высокопроизводительного секвенирования, известных специалистам в данной области техники. Более однородная амплификация полного генома, как правило, приводит к бóльшему покрытию полного генома. Покрытие представляет собой процент геномной ДНК отдельной клетки, который может быть сохранен после амплификации. Например, покрытие 50% означает, что половина генетического материала утрачена в ходе процесса амплификации полного генома отдельной клетки. Способы, предоставленные в этом описании, сводят к минимуму утрату генома и смещение амплификации и обеспечивают практически полное или полное покрытие генома при секвенировании геномной ДНК из отдельной клетки. Способы, описанные в этом документе, могут амплифицировать больше 90 процентов, больше 95 процентов, больше 96 процентов, больше 97 процентов, больше 98 процентов или больше 99 процентов геномной ДНК из отдельной клетки, принимая во внимание, что больше 70 процентов или 75 процентов геномной ДНК может быть секвенировано с глубиной секвенирования 7x или 10x или 15x или 30x с небольшим количеством, практически единичными или полностью отсутствующими химерными последовательностями.
Аспекты способов настоящего раскрытия уменьшают частоту выпадения аллели (ADO). Геном человека является диплоидным геномом, что означает, что существуют две копии каждой из 23 хромосом, одна материнская копия и одна отцовская копия для каждой хромосомы. ADO является результатом неравномерной амплификации материнской копии и отцовской копии. Если отдельная человеческая клетка имеет гетерозиготную мутацию, отсутствие амплификации в одной из двух аллелей вызывает ADO, что является основной причиной ложноотрицательного распознавания SNV отдельной клетки. ADO измеряется отношением необнаруженных и действительных гетерозиготных однонуклеотидных вариаций (SNV) в отдельной клетке. Описанные в этом документе способы in vitro транспозиции и амплификации в каплях эмульсии уменьшают частоту выпадения аллелей.
Описанные в этом документе способы уменьшают или устраняют порождение артефактов секвенирования и способствуют усовершенствованному геномному анализу однонуклеотидных полиморфизмов отдельной клетки, вариаций числа копий и структурных изменений. Способы, описанные в этом документе, находят применение в биологических системах или образцах тканей, которые характеризуются высоко гетерогенной клеточной популяцией, такой как опухолевая или нервная масса. Описанные в этом документе способы амплификации геномной ДНК облегчают анализ такой амплифицированной ДНК с использованием способов секвенирования следующего поколения, известных в данной области техники и описанных в этом документе.
Способы амплификации ДНК согласно настоящему раскрытию будут полезны для амплификации небольших или ограниченных количеств ДНК, что дает возможность генотипировать множество сайтов в образце ДНК для скрининга с высокой пропускной способностью. Кроме того, настоящий метод может обеспечить возможность быстрого конструирования группоспецифических окрашивающих зондов для любого участка хромосомы и также может использоваться для того, чтобы разделить на микроучастки и амплифицировать неподдающиеся идентификации участки хромосом или маркерные хромосомы в аномальных кариотипах. Раскрываемые способы также обеспечивают возможность быстрого клонирования амплифицированной ДНК для секвенирования и создания библиотек ДНК. Таким образом, способ будет не только доступным средством для анализа генотипа и высокопроизводительного скрининга, он также должен быть полезным инструментом при установлении цитогенетического диагноза. Способы, описанные в этом документе, могут использовать разные источники материалов ДНК, включая генетически гетерогенные ткани (например, раковые ткани), редкие и ценные образцы (например, эмбриональные стволовые клетки) и неделящиеся клетки (например, нейроны) и тому подобное, а также способы секвенирования и генотипирования, известные специалистам в данной области техники.
Дополнительные отличительные признаки и преимущества некоторых вариантов осуществления настоящего раскрытия станут более наглядными после прочтения следующего описания вариантов осуществления, чертежей и пунктов формулы изобретения.
Краткое описание чертежей
Вышеизложенные и другие отличительные признаки и преимущества настоящего изобретения станут более понятными на основании последующего подробного описания иллюстративных вариантов осуществления во взаимосвязи с прилагаемыми чертежами.
Фиг. 1 – схематическое изображение образования транспосомы, фрагментации геномной ДНК и вставки транспозона, образования микрокапель, при этом каждая микрокапля включает один фрагмент геномной ДНК и реагенты для амплификации, и амплификации внутри каждой капли для получения ампликонов.
Фиг. 2 схематически показывает структуру ДНК-транспозона с линейным удлинением 5'-конца вместе с или без штрихкода, где T - двухцепочечный сайт связывания транспозазы, P - сайт связывания праймера на одном конце удлинения и B - штрихкодовая последовательность.
Фиг. 3 - схематическое изображение одного варианта осуществления ДНК-транспозона и образования транспосомы.
Фиг. 4 - схематическое изображение связывания транспосомы с геномной ДНК, разрезания на фрагменты и добавления или вставки ДНК-транспозона.
Фиг. 5 – схематическое изображение удаления транспозазы, заполнения пропуска и удлинения с образованием удлиненных продуктов нуклеиновой кислоты, включающих геномную ДНК.
Фиг. 6 графически изображает распределение по размеру ДНК фрагментов, возникающих в результате применения способа фрагментaции транспосомы и амплификации каждого индивидуального фрагмента в микрокапле, в настоящем документе этот метод называется "DIANTI".
Фиг. 7 графически изображает глубину считывания при секвенировании трех отдельных клеток человека, амплифицированных с использованием способа фрагментации транспосомы и амплификации каждого отдельного фрагмента в микрокапле.
Подробное описание изобретения
При осуществлении на практике некоторых вариантов или характерных особенностей некоторых вариантов осуществления могут использоваться, если не указано иначе, обычные методы молекулярной биологии, микробиологии, рекомбинантных ДНК и так далее, которые известны средним специалистам в данной области техники. Такие методы полностью объясняются в литературе. Смотри, например, Sambrook, Fritsch, and Maniatis, MOLECULAR CLONING: A LABORATORY MANUAL, Second Edition (1989), OLIGONUCLEOTIDE SYNTHESIS (M. J. Gait Ed., 1984), ANIMAL CELL CULTURE (R. I. Freshney, Ed., 1987), серии METHODS IN ENZYMOLOGY (Academic Press, Inc.); GENE TRANSFER VECTORS FOR MAMMALIAN CELLS (J. M. Miller and M. P. Calos eds. 1987), HANDBOOK OF EXPERIMENTAL IMMUNOLOGY, (D. M. Weir and C. C. Blackwell, Eds.), CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (F. M. Ausubel, R. Brent, R. E. Kingston, D. D. Moore, J. G. Siedman, J. A. Smith, and K. Struhl, eds., 1987), CURRENT PROTOCOLS IN IMMUNOLOGY (J. E. coligan, A. M. Kruisbeek, D. H. Margulies, E. M. Shevach and W. Strober, eds., 1991); ANNUAL REVIEW OF IMMUNOLOGY; а также монографии в журналах, таких как ADVANCES IN IMMUNOLOGY. Все патенты, патентные заявки и публикации, упомянутые в описании, и выше и ниже, полностью включены в описание путем отсылки.
Термины и символы химии нуклеиновых кислот, биохимии, генетики и молекулярной биологии, использованные в этом документе, придерживаются стандартных терминов и символов, использованных в научных трудах и текстах в данной области техники, например, Kornberg and Baker, DNA Replication, Second Edition (W.H. Freeman, New York, 1992); Lehninger, Biochemistry, Second Edition (Worth Publishers, New York, 1975); Strachan and Read, Human Molecular Genetics, Second Edition (Wiley-Liss, New York, 1999); Eckstein, editor, Oligonucleotides and Analogs: A Practical Approach (Oxford University Press, New York, 1991); Gait, editor, Oligonucleotide Synthesis: A Practical Approach (IRL Press, Oxford, 1984); и т.п.
Настоящее изобретение основывается отчасти на открытии способов получения матриц фрагментов ДНК, например, из геномной ДНК, с использованием транспозазы или транспосомы, изолировании каждой матицы фрагмента ДНК в соответствующей микрокапле, т.е. одного фрагмента ДНК в микрокапле, и амплификации каждой матрицы фрагмента ДНК в соответствующей микрокапле, т.е. при отсутствии других матриц фрагмента ДНК, для получения ампликонов. Согласно одному аспекту микрокапля включает только одну матрицу фрагмента ДНК для амплификации. Ампликоны каждой матрицы фрагмента ДНК могут быть собраны из капель и секвенированы. Собранные ампликоны образуют библиотеки ампликонов фрагментов геномной ДНК.
Согласно одному аспекту получают геномную ДНК, такую как геномная нуклеиновая кислота, полученная из отдельной лизированной клетки. Множество транспосом, каждая из которых является димером транспозазы, связанной с ДНК-транспозоном, при этом ДНК-транспозон имеет сайт связывания транспозазы и сайт связывания специфического праймера, используется для разрезания геномной ДНК на двухцепочечные фрагменты, при этом ДНК-транспозон оказывается прикрепленным к верхней и нижней цепям каждого двухцепочечного фрагмента. Сайт связывания специфического праймера является "специфическим" в такой степени, что последовательность участка связывания праймера является одной и той же, в результате чего для амплификации каждого фрагмента необходима только одна единственная последовательность праймера. Двухцепочечные фрагменты ДНК, имеющие присоединенные к ним участки связывания праймеров, затем обрабатываются для заполнения пропусков, и загружаются в микрокапли вместе с реагентами для амплификации, по одному фрагменту ДНК на каплю, с использованием микрофлюидного устройства, имеющего область образования капель.
Согласно одному аспекту количество созданных капель превышает количество фрагментов ДНК, так что только один фрагмент ДНК изолируется в одной капле. Способы получения капель водной фазы известны специалистам в данной области техники. Этот аспект раскрытия устраняет конкуренцию между фрагментами ДНК во время амплификации, так как каждая капля изолирует отдельный фрагмент ДНК для амплификации внутри капли. Специфические праймеры, нацеленные на участки связывания транспозона, и сайт связывания праймера используются вместе с ДНК полимеразой, чтобы амплифицировать каждый из фрагментов, которые суммарно равняются полной геномной ДНК. После амплификации капли разрушают, и продукты амплификации собирают для дальнейшего анализа.
Согласно одному аспекту комбинация системы транспозона и способа амплификации в микрокаплях дает в результате равномерную амплификацию геномной ДНК, т.e., полного генома, полученного из отдельной клеки, например, in vitro транспозиция используется для того, чтобы добавить специфические сайты связывания праймера к фрагментам геномной ДНК, чтобы избежать использования вырожденных олигонуклеотидов. В этом аспекте та же самая последовательность праймера используется, чтобы амплифицировать каждый фрагмент полного генома. Типовой способ использует микрокапли, чтобы физически разделить фрагменты геномной ДНК отдельной клетки перед амплификацией, тем самым устранив конкуренцию среди разных фрагментов во время амплификации, что в результате приводит к равномерной амплификации полного генома.
Как указано, матрицы ДНК фрагментов, полученные с использованием описанных в этом документе способов с использованием транспозазы, могут быть амплифицированы внутри микрокапель с использованием способов, известных специалистам в данной области техники. Микрокапли могут быть образованы в виде эмульсии масляной фазы и водной фазы. Эмульсия может включать водные капли или изолированные водные объемы в непрерывной масляной фазе. Описываемые способы амплификации полного генома в эмульсии используют водные капли небольшого объема в масле для того, чтобы изолировать каждый фрагмент с целью равномерной амплификации генома отдельной клетки. В результате распределения каждого фрагмента в его собственную каплю или изолированный водный реакционный объем, каждая капля имеет возможность достигать насыщения амплификации ДНК. Ампликоны в каждой капле затем объединяются посредством деэмульгирования, что приводит в результате к равномерной амплификации всех фрагментов полного генома отдельной клетки.
В некоторых аспектах амплификация осуществляется при помощи ПЦР. ПЦР – это реакция, при которой получают идентичные копии целевого полинуклеотида с использованием пары праймеров или набора праймеров, состоящего из прямого праймера и обратного праймера, и катализатора полимеризации, такого как ДНК-полимераза, и в большинстве случаев термоустойчивого фермента полимеразы. Способы ПЦР хорошо известны в данной области техники и раскрыты, например, в MacPherson et al. (1991) PCR 1: A Practical Approach (IRL Press at Oxford University Press). Термин “полимеразная цепная реакция” (“ПЦР”) Mullis (патенты США № 4,683,195, 4,683,202 и 4,965,188) имеет отношение к методу увеличения концентрации сегмента целевой последовательности без клонирования или очистки. Этот процесс, предназначенный для амплификации целевой последовательности, включает предоставление олигонуклеотидных праймеров с желательной целевой последовательностью и реагентов для амплификации, с последующей точной последовательностью циклов изменения температуры в присутствии полимеразы (например, ДНК-полимеразы). Праймеры являются комплементраными к их соответствующим цепям ("последовательностям, связывающим праймер") двухцепочечной целевой последовательности. Для осуществления амплификации двухцепочечную целевую последовательность подвергают денатурации и затем праймеры подвергают гибридизации (отжигу) с их комплементарными последовательностями в целевой молекуле. После отжига праймеры удлиняют с помощью полимеразы, для того, чтобы образовать новую пару комплементарных цепей. Этапы денатурации, отжига праймеров и удлинения с помощью полимеразы могут повторяться много раз (т.е., денатурация, отжиг и удлинение составляют один “цикл”; причем может иметь место множество “циклов”), чтобы получить высокую концентрацию амплифицированного сегмента желательной целевой последовательности. Длина амплифицированного сегмента желательной целевой последовательности обусловлена относительными положениями праймеров относительно друг друга и, следовательно, эта длина является контролируемым параметром. Принимая во внимание повторение процесса, способ называется “полимеразная цепная реакция” (в дальнейшем “ПЦР”) и целевая последовательность называется “ПЦР амплифицированной." ПЦР амплификация достигает насыщения, когда двухцепочечный ДНК-продукт амплификации накапливается до некоторого количества, при котором активность ДНК-полимеразы ингибируется. После насыщения ПЦР амплификация достигает плато, поскольку количество продукта амплификации не увеличивается при добавочных ПЦР циклах.
С помощью ПЦР можно амплифицировать единственную копию конкретной целевой последовательности в геномной ДНК до уровня, обнаружимого с помощью нескольких разных методов (например, гибридизации с меченым зондом; включения биотинилированных праймеров с последующим обнаружением конъюгата авидин-фермент; включения 32P-меченых дезоксинуклеотидтрифосфатов, таких как dCTP или dATP, в амплифицированный сегмент). В дополнение к геномной ДНК любая олигонуклеотидная или полинуклеотидная последовательность может быть амплифицирована с помощью подходящего набора праймеров. В частности, амплифицированные сегменты, созданные с помощью процесса ПЦР в каждой микрокапле, сами являются эффективными матрицами для последующих ПЦР амплификаций. Методы и наборы для проведения ПЦР хорошо известны в данной области техники. Все процессы получения идентичных копий полинуклеотида, такие как ПЦР или клонирование генов, вместе называются в описании репликацией. Праймер также может использоваться в качестве зонда в реакциях гибридизации, таких как саузерн-блот или нозерн-блот анализы.
Выражение "амплификация" относится к процессу, посредством которого образуются дополнительные или множество копий конкретного полинуклеотида. Амплификация включает такие методы как ПЦР, амплификация, обусловленная лигированием (или лигазная цепная реакция, LCR), и другие методы амплификации. Эти методы известны и широко применяются на пратике в данной области техники. Смотри, например, патенты США № 4,683,195 и 4,683,202 и Innis et al., ''PCR protocols: a guide to method and applications” Academic Press, Incorporated (1990) (в отношении ПЦР); и Wu et al. (1989) Genomics 4:560-569 (в отношении LCR). В общем, процедура ПЦР описывает способ амплификации гена, который состоит из (i) последовательность-специфичной гибридизации праймеров с конкретными генами в образце ДНК (или библиотеке), (ii) последующей амплификации, включающей некоторое количество циклов отжига, элонгации и денатурации с использованием ДНК полимеразы и (iii) скрининга ПЦР-продуктов относительно полосы надлежащего размера. Используемые праймеры представляют собой олигонуклеотиды достаточной длины и соответствующей последовательности для обеспечения инициации полимеризации, т.е. каждый праймер является специально спроектированным, для того, чтобы он был комплементарным к каждой цепи геномного локуса, который будет подвергаться амплификации.
Реагенты и оборудование для проведения реакций амплификации доступны коммерчески. Праймеры, используемые для амплификации последовательностей из конкретного участка гена, предпочтительно являются комплементарными им и гибридизируются специфически с последовательностями в целевом участке или в его фланкирующих участках и могут быть получены с помощью методов, известных специалистам в данной области техники. Последовательности нуклеиновых кислот, полученные с помощью амплификации, могут сразу же подвергаться секвенированию.
В том случае, когда гибридизация происходит в антипараллельной конфигурации между двумя одноцепочечными полинуклеотидами, реакция называется "отжиг", а такие полинуклеотиды описываются как "комплементарные". Двухцепочечный полинуклеотид может быть комплементарным или гомологичным другому полинуклеотиду, если гибридизация может происходить между одной из цепей первого полинуклеотида и вторым. Комплементарность или гомология (степень, в которой один полинуклеотид является комплементарным другому) поддается количественному определению, если говорить о доле оснований в противостоящих цепях, которые образуют водородные связи друг с другом согласно общепринятым правилам спаривания оснований.
Термины “ПЦР-продукт,” “ПЦР-фрагмент” и “продукт амплификации” относятся к полученной в результате смеси соединений после завершения двух или более циклов ПЦР-этапов денатурации, отжига и удлинения. Эти термины включают случай, когда наблюдается амплификация одного или более сегментов одной или более целевых последовательностей. Согласно одному аспекту настоящего раскрытия каждая микрокапля включает ПЦР-продукт одного фрагмента ДНК-матрицы.
Термин “реагенты для амплификации” относится к реагентам (дезоксирибонуклеотидтрифосфатам, буферу и т.д.), необходимым для амплификации, за исключением праймеров, матрицы нуклеиновой кислоты и фермента для амплификации. Как правило, реагенты для амплификации наряду с другими компонентами для реакции помещают и содержат в реакционном сосуде (пробирке, микролунке и т.д.). Методы амплификации включают методы ПЦР, известные специалистам в данной области техники, а также включают амплификацию по типу катящегося кольца (Blanco et al., J. Biol. Chem., 264, 8935-8940, 1989), сверхразветвленную амплификацию по типу катящегося кольца (Lizard et al., Nat. Genetics, 19, 225-232, 1998) и изотермическую амплификацию с образованием петель (Notomi et al., Nuc. Acids Res., 28, e63, 2000), каждая из которых полностью включена в описание путем отсылки.
Что касается эмульсионной ПЦР, эмульсионная ПЦР-реакция создается путем энергичного встряхивания или перемешивания смеси "вода-в-масле" с целью получения миллионов водных компартментов микронного размера. Микрофлюидные чипы могут быть снабжены устройством для создания эмульсии путем встряхивания или перемешивания масляной фазы в водной фазе. Альтернативно, водные капли могут образовываться спонтанным образом при объединении какого-либо масла с водной фазой или введении водной фазы в масляную фазу. Библиотеку ДНК, подлежащую амплификации, смешивают в предельном разведении до приготовления эмульсии. Для того чтобы создать компартменты, содержащие, в среднем, только одну молекулу ДНК, используется сочетание размера компартмента, т.е. размера микрокапель, и количества микрокапель, результатом чего является предельное разведение библиотеки фрагментов ДНК, которые должны амплифицироваться. В зависимости от размера водных компартментов, образованных в ходе формирования микрокапель или стадии эмульгирования, до 3x109 индивидуальных ПЦР-реакций на мкл может осуществляться одновременно в одной и той же «пробирке». Фактически каждый небольшой компартмент водной микрокапли в эмульсии образует микро-ПЦР-реактор. Средний размер компартмента в эмульсии находится в пределах от субмикрона в диаметре до 100 микрон, или от 1 пиколитра до 1000 пиколитров или от 1 нанолитра до 1000 нанолитров или от 1 пиколитра до 1 нанолитра или от 1 пиколитра до 1000 нанолитров в зависимости от условий эмульгирования.
Другие методы амплификации, описанные в патентной заявке Великобритании № GB 2,202,328 и в PCT патентной заявке № PCT/US89/01025, которые включаются в описание путем отсылки, могут использоваться в соответствии с настоящим раскрытием. В первой заявке "модифицированные" праймеры используются в ПЦР-подобном синтезе, зависимом от матрицы и фермента. Праймеры могут быть модифицированы введением метки в виде агента захвата (например, биотина) и/или агента-детектора (например, фермента). В последней заявке в образец добавляют избыток меченых зондов. В присутствии целевой последовательности зонд связывается и расщепляется каталитически. После расщепления целевая последовательность высвобождается в неповрежденном виде и связывается избыточным зондом. Расщепление меченого зонда сигнализирует о присутствии целевой последовательности.
Другие подходящие методы амплификации включают "быструю (ПЦР-БАКК)" и "асимметричную ПЦР". (Frohman, In: PCR Protocols: A Guide To Methods and Applications, Academic Press, N.Y., 1990, которая включается в описание путем отсылки). Методы, основанные на лигировании двух (или более) олигонуклеотидов в присутствии нуклеиновой кислоты, имеющей последовательность получающегося в результате "диолигонуклеотида", посредством этого амплификации ди-олигонуклеотида, также могут использоваться для амплификации ДНК в соответствии с настоящим раскрытием (Wu et al., Genomics 4:560-569, 1989, включенный в описание путем отсылки).
Согласно некоторым аспектам типичная транспозоновая система включает Tn5 транспозазу, Mu транспозазу, Tn7 транспозазу или IS5 транспозазу и тому подобные. Другие подходящие системы транспозона известны специалистам в данной области техники и включают систему транспозона Tn3 (смотри Maekawa, T., Yanagihara, K., and Ohtsubo, E. (1996), A cell-free system of Tn3 transposition and transposition immunity, Genes Cells 1, 1007-1016), транспозоновую систему Tn7 (смотри Craig, N.L. (1991), Tn7: a target site-specific transposon, Mol. Microbiol. 5, 2569-2573), транспозоновую систему Tn10 (смотри Chalmers, R., Sewitz, S., Lipkow, K., and Crellin, P. (2000), Complete nucleotide sequence of Tn10, J. Bacteriol 182, 2970-2972), транспозоновую систему Piggybac (смотри Li, X., Burnight, E.R., Cooney, A.L., Malani, N., Brady, T., Sander, J.D., Staber, J., Wheelan, S.J., Joung, J.K., McCray, P.B., Jr., et al. (2013), PiggyBac transposase tools for genome engineering, Proc. Natl. Acad. Sci. USA 110, E2279-2287), транспозоную сиcтему «Спящая красавица» (смотри Ivics, Z., Hackett, P.B., Plasterk, R.H., and Izsvak, Z. (1997), Molecular reconstruction of Sleeping Beauty, a Tc1-like transposon from fish, and its transposition in human cells, Cell 91, 501-510), транспозоновую систему Tol2 (смотри Kawakami, K. (2007), Tol2: a versatile gene transfer vector in vertebrates, Genome Biol. 8 Suppl. 1, S7.)
ДНК, которую нужно амплифицировать, может быть получена из отдельной клетки или небольшой популяции клеток. Способы, описанные в этом документе, дают возможность амплифицировать ДНК из любого вида или организма в реакционной смеси, например, в одной реакционной смеси, причем реакция может проводиться в одном реакционном сосуде. В одном аспекте описанные в этом документе способы включают независимую от последовательности амплификацию ДНК из любого источника, включая, но не ограничиваясь этим, человека, животного, растение, дрожжи, вирус, эукариотическую и прокариотическую ДНК.
Согласно одному аспекту предложен способ амплификации и секвенирования полного генома отдельной клетки, который включает контактирование двухцепочечной геномной ДНК из отдельной клетки с Tn5 транспозазами, каждая из которых связана с ДНК-транспозоном, при этом ДНК-транспозон включает двухцепочечный сайт связывания транспозазы (Tnp) в 19 п.о. и первую последовательность нуклеиновой кислоты, включающую одно или более из необязательной штрихкодовой последовательности и участка связывания праймера для формирования димера комплекса транспозаза/ ДНК-транспозон, называемого транспосомой. Первая последовательность нуклеиновой кислоты может быть в форме одноцепочечного удлиняемого участка. Согласно одному аспекту, первая последовательность нуклеиновой кислоты может быть липким концом, например 5’-липким концом, при этом липкий конец включает необязательный штрихкодовый участок и сайт связывания праймера. Липкий конец может быть любой длины, подходящей для включения одного или более из необязательного штрихкодового участка штрих-кода и сайта связывания праймера по желанию. Транспосома связывается с целевыми положениями вдоль двухцепочечной геномной ДНК и расщепляет двухцепочечную геномную ДНК на некоторое количество двухцепочечных фрагментов, при этом каждый двухцепочечный фрагмент имеет первый комплекс, присоединенный к верхней цепи посредством участка связывания Tnp, и второй комплекс, присоединенный к нижней цепи посредством участка связывания Tnp. Участок связывания транспозона присоединяется к каждому 5’-концу двухцепочечного фрагмента. Согласно одному аспекту транспозазы Tn5 удаляются из комплекса. Двухцепочечные фрагменты удлиняют вдоль ДНК-транспозона с образованием двухцепочечного продукта удлинения, имеющего участки связывания праймеров, предпочтительно на каждом конце. Согласно одному аспекту, пропуск, который может появляться в результате прикрепления сайта связывания транспозазы Tn5 к фрагменту двухцепочечной геномной ДНК, может быть заполнен. Двухцепочечный продукт удлинения помещают в реакционный «объем капли» для амплификации, такой как микрокапля, вместе с реагентами для амплификации, и фрагмент двухцепочечной геномной ДНК амплифицируют внутри капли. Ампликоны, которые могут включать штрихкодовую последовательность, однозначно идентифицирующую данную клетку или образец, из которого был получен фрагмент двухцепочечной геномной ДНК, собирают, например, путем лизиса капли. Двухцепочечные ДНК-ампликоны из каждой капли затем могут быть секвенированы с использованием, например, высокопроизводительных методов секвенирования, известных специалистам в данной области техники.
В отдельном аспекте варианты осуществления имеют отношение к способам амплификации по сути дела полного генома без потери в представлении специфических сайтов (в соответствии с определением в данном документе "амплификации полного генома”). В отдельном варианте осуществления амплификация полного генома включает амплификацию практически всех фрагментов или всех фрагментов геномной библиотеки. В еще одном конкретном варианте осуществления "практически весь" или "существенная часть" относится примерно к 80%, примерно 85%, примерно 90%, примерно 95%, примерно 97% или примерно 99% всех последовательностей в геноме.
Согласно одному аспекту образец ДНК представляет собой геномную ДНК, разделенную на микрочасти хромосомную ДНК, ДНК искусственной хромосомы дрожжей (YAC), космидную ДНК, фаговую ДНК, ДНК искусственной хромосомы на основе бактериофага P1 (PAC) или ДНК искусственной бактериальной хромосомы (BAC). В другом предпочтительном варианте осуществления образец ДНК является ДНК млекопитающего, растительной ДНК, ДНК дрожжей, вирусной ДНК или прокариотической ДНК. В другом предпочтительном варианте осуществления образец ДНК получают от человека, жвачного животного, свиньи, овцы, лошади, грызуна, птицы, рыбы, креветки, растения, вируса или бактерии. Предпочтительно образец ДНК является геномной ДНК.
Согласно некоторым характерным аспектам транспозоновую систему используют, чтобы получить фрагменты нуклеиновой кислоты для амплификации и секвенирования, по желанию. Согласно одному аспекту транспозоновую систему используют для того, чтобы фрагментировать геномную ДНК на фрагменты двухцепочечной геномной ДНК с вставленным туда ДНК-транспозоном. Согласно одному отдельному аспекту транспозоновую систему комбинируют со способом микрокапельной амплификации для амплификации генома отдельной клетки, где каждый фрагмент из библиотеки фрагментов ДНК, созданных транспозовновой системой, изолируется внутри одной капли эмульсии водных капель в масляной фазе и затем амплифицируется в каждой капле, например, при помощи ПЦР. Согласно некоторым аспектам использование капли для получения ампликонов одного фрагмента ДНК с целью исключения других ДНК-фрагментов, т.е. в отсутствие других фрагментов ДНК из библиотеки фрагментов ДНК, т.е. когда капля включает только один фрагмент ДНК, эффективно обеспечивает высококачественную амплификацию геномной ДНК отдельной клетки (gДНК), уменьшая или избегая смещения амплификации, приводящего к «зашумленным» результатам секвенирования отдельной клетки, что далее оказывает влияние на покрытие генома, а также приводит к низкому разрешению пределов обнаружения вариаций числа копий (CNV). ПЦР в сущности является способом экспоненциальной амплификации, т.е. новые копии получают на базе копий из предшествующих циклов амплификации. Согласно одному аспекту, поскольку каждый фрагмент ДНК из библиотеки ДНК фрагментов амплифицируется отдельно и в отсутствии других членов библиотеки, получается небольшое смещение амплификации или смещение отсутствует, потому что отсутствует или существует небольшое различие в эффективности амплификации между ампликонами, которые в противном случае могут накапливаться и приводить к смещению амплификации между разными ампликонами после многих циклов. Согласно одному аспекту, в котором смещение амплификации может происходить между ампликонами, используется достаточное число циклов ПЦР, чтобы осуществить реакцию амплификации в каждой капле до насыщения. Когда ПЦР-реакции достигают насыщения, разные ампликоны из разных капель амплифицируются до сходного количества.
Как показано на Фиг. 1, ДНК-транспозон, содержащий специфический сайт связывания праймера в RED, «вставляется» в геномную ДНК отдельной клетки, создавая при этом миллионы небольших фрагментов с использованием транспозазы. После удаления транспозазы и заполнения пропуска, фрагменты геномной ДНК, имеющие участки связывания праймеров, загружают в микрокапли. Количество капель превышает число фрагментов, для того, чтобы гарантировать, что большая часть капель содержит только один фрагмент ДНК. Затем специфические праймеры используют вместе с ДНК-полимеразой для того, чтобы амплифицировать с помощью ПЦР полный геном отдельной клетки.
Согласно некоторым аспектам при амплификации небольших количеств ДНК, таких как ДНК из отдельной клетки, стадию очистки ДНК на колонке не проводят для максимального увеличения небольшого количества (~6 пг) геномной ДНК, которая может быть получена из отдельной клетки до амплификации. ДНК может быть амплифицирована непосредственно из клеточного лизата или другого неочищенного состояния. Соответственно, образец ДНК может быть загрязненным, неочищенным или невыделенным. Соответственно, аспекты настоящего способа обеспечивают возможность максимально увеличить геномную ДНК для амплификации и уменьшить потери за счет очистки. Согласно дополнительному аспекту, описанные в этом документе способы могут использовать иные методы амплификации помимо ПЦР, которые являются пригодными для способа амплификации в каплях эмульсии.
Согласно одному аспекту и как проиллюстрировано на Фиг. 2, транспозон ДНК создается так, чтобы он содержал двухцепочечный сайт связывания транспозазы (Tnp) Tn5 в 19 п.о. на одном конце, связанный или соединенный, например, с помощью ковалентной связи, с одноцепочечным липким концом, включающим необязательный штрихкодовый участок и сайт связывания праймера на одном конце липкого конца. После транспозиции Tnp и транспозон ДНК связываются друг с другом и димеризуются с образованием транспосом.
В варианте осуществления, показанном на Фиг. 3, транспозон ДНК показан как одноцепочечный липкий конец. Транспозаза связывается с двухцепочечным сайтом связывания транспозазы ДНК-транспозона и два таких комплекса димеризуются с образованием транспосомы. Как видно на Фиг. 4, транспосомы случайным образом захватываются или иным образом связываются с целевой одноцепочечной геномной ДНК одиночной клетки как димеры. Характерные транспосомы пронумерваны как 1-3. Затем, транспозазы в транспосоме вырезают геномную ДНК с помощью одной транспозазы, разрезающей верхнюю цепь, и одной транспозазы, разрезающей нижнюю цепь, для создания фрагмента геномной ДНК. Множество транспосом создает множество фрагментов геномной ДНК. Тким образом, транспозон ДНК вставляется случайным образом в геномную ДНК одной клетки, оставляя пропуск на обоих концах сайта транспозиции/ встраивания. Пропуск может иметь любую длину, но типичным является пропуск длиной 9 нуклеотидов. Результатом является фрагмент геномной ДНК с сайтом связывания Tnp ДНК-транспозона, присоединенным к 5’ положению верхней цепи, и сайтом связывания Tnp транспозона ДНК, присоединенным к 5’ положению нижней цепи. Показаны пропуски, являющиеся результатом прикрепления или вставки ДНК-транспозона. После транспозиции транспозаза удаляется и проводится удлинение в пропуске, чтобы заполнить пропуск в дополнение к одноцепочечному липкому конецу, первоначально созданному в ДНК-транспозоне, как показано на Фиг. 5. Вследствие этого, последовательности участка связывания праймера присоединяются к обоим концам каждого фрагмента геномной ДНК, как показано на Фиг. 5. Сайты связывания праймеров являются одними и теми же для каждого фрагмента и являются одними и теми же для всех фрагментов, полученных с помощью транспосом.
Конкретные транспозоновые системы Tn5 описаны и доступны специалистам в данной области техники. Смотри Goryshin, I.Y. and W.S. Reznikoff, Tn5 in vitro transposition. The Journal of biological chemistry, 1998. 273(13): p. 7367-74; Davies, D.R., et al., Three-dimensional structure of the Tn5 synaptic complex transposition intermediate. Science, 2000. 289(5476): p. 77-85; Goryshin, I.Y., et al., Insertional transposon mutagenesis by electroporation of released Tn5 transposition complexes. Nature biotechnology, 2000. 18(1): p. 97-100 и Steiniger-White, M., I. Rayment, и W.S. Reznikoff, Structure/function insights into Tn5 transposition. Current opinion in structural biology, 2004. 14(1): p. 50-7, каждая из которых полностью включена в описание путем отсылки во всех отношениях. Наборы, использующие транспозоновую систему Tn5 для получения библиотеки ДНК и других вариантов применения, известны. Смотри Adey, A., et al., Rapid, low-input, low-bias construction of shotgun fragment libraries by high-density in vitro transposition. Genome biology, 2010. 11(12): p. R119; Marine, R., et al., Evaluation of a transposase protocol for rapid generation of shotgun high-throughput sequencing libraries from nanogram quantities of DNA. Applied and environmental microbiology, 2011. 77(22): p. 8071-9; Parkinson, N.J., et al., Preparation of high-quality next-generation sequencing libraries from picogram quantities of target DNA. Genome research, 2012. 22(1): p. 125-33; Adey, A. and J. Shendure, Ultra-low-input, tagmentation-based whole-genome bisulfite sequencing. Genome research, 2012. 22(6): p. 1139-43; Picelli, S., et al., Full-length RNA-seq from single cells using Smart-seq2. Nature protocols, 2014. 9(1): p. 171-81 и Buenrostro, J.D., et al., Transposition of native chromatin for fast and sensitive epigenomic profiling of open chromatin, DNA-binding proteins and nucleosome position. Nature methods, 2013, каждая из которых полностью включена в описание путем отсылки во всех отношениях. Смотри также WO 98/10077, EP 2527438 и EP 2376517, каждый из которых полностью включен в описание путем отсылки. Коммерчески доступный набор для транспозиции продается на рынке под названием NEXTERA и доступен от компании Illumina.
Согласно одному аспекту способ амплификации ДНК дополнительно включает анализ генотипа амплифицированного ДНК-продукта. Альтернативно, способ амплификации ДНК предпочтительно дополнительно включает идентификацию полиморфизма, такого как однонуклеотидный полиморфизм (SNP) в амплифицированном ДНК-продукте. В предпочтительных вариантах осуществления SNP может быть установлен в ДНК организма с помощью целого ряда способов, известных специалистам в данной области техники, включая, но не ограничиваясь этим, идентификацию SNP с помощью секвенирования ДНК, путем амплификации продукта ПЦР и секвенирования продукта ПЦР, с помощью анализа лигирования олигонуклеотидов (OLA), с помощью Doublecode OLA, с помощью анализа достройки по одному основанию, с помощью аллельспецифического удлинения праймера или гибридизации ошибочных спариваний. Предпочтительно идентифицированный SNP должен быть связан с фенотипом, включая болезненный фенотип и желательные фенотипические характеристики. Амплифицированная ДНК, полученная при помощи раскрытого способа ДНК амплификации, также может предпочтительно использоваться для создания библиотеки ДНК, включая, но не ограничиваясь этим, библиотеки геномной ДНК, библиотеки ДНК, разрезанной на микрокусочки, BAC библиотеки, YAC библиотеки, PAC библиотеки, библиотеки кДНК, фаговые библиотеки и космидные библиотеки.
Термин "геном", использованный в описании, определяется как совокупный набор генов, который «несет» индивидуум, клетка или органелла. Использованный в описании термин "геномная ДНК" определяется как материал ДНК, содержащий частичный или полный совокупный набор генов, который несет индивидуум, клетка или органелла.
Использованный в описании термин “нуклеозид” относится к молекуле, имеющей пуриновое или пиримидиновое основание, ковалентно связанное с моносахаридом рибозой или дезоксирибозой. Примеры нуклеозидов включают аденозин, гуанозин, цитидин, уридин и тимидин. Дополнительные примеры нуклеозидов включают инозин, 1-метил-инозин, псевдоуридин, 5,6-дигидроуридин, риботимидин, 2N-метилгуанозин и 2,2N,N- диметилгуанозин (также известные как “редкие” нуклеозиды). Термин “нуклеотид” относится к нуклеозиду, имеющему одну или более фосфатных групп, соединенных сложноэфирными связями с сахарным компонентом. Характерные нуклеотиды включают нуклеозид монофосфаты, дифосфаты и трифосфаты. Термины “полинуклеотид”, “олигонуклеотид” и “молекула нуклеиновой кислоты” используются в описании взаимозаменяемым образом и имеют отношение к полимеру из нуклеотидов, дезоксирибонуклеотидов или рибонуклеотидов, любой длины, соединенных вместе с помощью фосфодиэфирной связи между 5' и 3' атомами углерода. Полинуклеотиды могут иметь любую трехмерную структуру и могут осуществлять любую функцию, известную или неизвестную. Следующие неограничивающие примеры полинуклеотидов включают ген или фрагмент гена (например, зонд, праймер, EST или SAGE tag), экзоны, интроны, информационную РНК (мРНК), транспортную РНК, рибосомную РНК, рибозимы, кДНК, рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, векторы, выделенную ДНК любой последовательности, выделенную РНК любой последовательности, зонды и праймеры нуклеиновой кислоты. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и аналоги нуклеотидов. Термин также относится и к двухцепочечным и к одноцепочечным молекулам. Если специально не указано или не требуется иначе, любой вариант соуществления этого изобретения, который содержит полинуклеотид, включает и двухцепочечную форму и каждую из двух комплементарных одноцепочечных форм, известных или подходящих для получения двухцепочечной формы. Полинуклеотид состоит из определенной последовательности четырех нуклеотидных оснований: аденина (A); цитозина (C); гуанина (G); тимина (T); и урацила (U) вместо тимина в том случае, когда полинуклеотид представляет собой РНК. Таким образом, термин полинуклеотидная последовательность является буквенным «отображением» молекулы полинуклеотида. Это буквенное «отображение» может быть внесено в базы данных в компьютер, имеющий центральный процессор, и может использоваться в областях применения биоинформатики, таких как функциональная геномика и поиск гомологии.
Термины “ДНК”, “молекула ДНК” и “молекула дезоксирибонуклеиновой кислоты” относятся к полимеру из дезоксирибонуклеотидов. ДНК может быть синтезирована естественным путем (например, путем репликации ДНК). РНК может быть посттранскрипционно модифицирована. ДНК также может быть синтезирована химическим путем. ДНК может быть одноцепочечной (т.е., ssДНК) или полицепочечной (например, двухцепочечной, т.е., dsДНК).
Термины “нуклеотидный аналог”, “измененный нуклеотид” и “модифицированный нуклеотид” относятся к нестандартному нуклеотиду, включая неприродные рибонуклеотиды или дезоксирибонуклеотиды. В некоторых характерных вариантах осуществления нуклеотидные аналоги подвергаются модификации в любом положении, для того, чтобы изменить некоторые химические свойства нуклеотида, в то же время сохраняя способность аналога нуклеотида осуществлять его предусмотренную функцию. Примеры положений нуклеотида, которые могут быть дериватизированы, включают 5 положение, например, 5-(2-амино)пропил-уридин, 5-бром-уридин, 5-пропин-уридин, 5-пропенил-уридин и т.д.; 6 положение, например, 6-(2-амино)-пропил-уридин; 8-положение для аденозина и/или гуанозина, например, 8-бром-гуанозин, 8-хлор-гуанозин, 8-фтор-гуанозин и т.д. Аналоги нуклеотидов также включают деаза-нуклеотиды, например, 7-деаза-аденозин; O- и N-модифицированные (например, алкилированные, например, N6-метил-аденозин или другие известные в данной области техники) нуклеотиды; и другие гетероциклически модифицированные аналоги нуклеотидов, такие как, например, описанные в Herdewijn, Antisense Nucleic Acid Drug Dev., 2000 Aug. 10(4):297-310.
Нуклеотидные аналоги также могут содержать модификации в молекуле сахара нуклеотидов. Например, 2' OH-группа может быть заменена группой, выбранной из H, OR, R, F, Cl, Br, I, SH, SR, NH2, NHR, NR2, COOR или OR, где R является замещенным или незамещенным C1-C6 алкилом, алкенилом, алкинилом, арилом и т.д. Другие возможные модификации включают модификации, описанные в патентах США № 5,858,988 и 6,291,438.
Фосфатная группа нуклеотида также может быть модифицирована, например, посредством замены одного или более кислородов фосфатной группы на серу (например, тиофосфаты), или путем других замен, которые позволят нуклеотиду выполнять его предусмотренные функции, например, такие, как описаны в Eckstein, Antisense Nucleic Acid Drug Dev. 2000 Apr. 10(2):117-21, Rusckowski et al. Antisense Nucleic Acid Drug Dev. 2000 Oct. 10(5):333-45, Stein, Antisense Nucleic Acid Drug Dev. 2001 Oct. 11(5): 317-25, Vorobjev et al. Antisense Nucleic Acid Drug Dev. 2001 Apr. 11(2):77-85 и патенте США № 5,684,143. Некоторые из указанных выше модификаций (например, модификации фосфатных групп) снижают скорость гидролиза, например, полинуклеотидов, содержащих указанные аналоги in vivo или in vitro.
Термин “in vitro” имеет значение, принятое в данной области, например, и относится к очищенным реагентам или экстрактам, например, клеточным экстрактам. Термин “in vivo” также имеет принятое в данной области значение, например, относится к живым клеткам, например, иммортализованным клеткам, первичным клеткам, клеточным линиям и/или клеткам в организме.
Использованные в описании термины “комплементарный” и “комплементарность” используются при упоминании последовательностей нуклеотидов, соединенных в соответствии с правилами спаривания оснований. Например, последовательность 5'-AGT-3' является комплементарной с последовательностью 5'-ACT-3'. Комплементарность может быть неполной или полной. Неполная комплементарность наблюдается в том случае, когда одно или более оснований нуклеиновых кислот не соответствует правилам спаривания оснований. Полная комплементарность между нуклеиновыми кислотами наблюдается в том случае, когда все без исключения основания нуклеиновых кислот соответствуют другому основанию согласно правилам спаривания оснований. Степень комплементарности между цепями нуклеиновой кислоты оказывает существенное влияние на эффективность и силу гибридизации между цепями нуклеиновой кислоты.
Термин “гибридизация” относится к спариванию комплементарных нуклеиновых кислот. Гибридизация и сила гибридизации (т.е. сила соединения между нуклеиновыми кислотами) находится под влиянием таких факторов, как степень комплементарности между нуклеиновыми кислотами, строгость имеющих место условий, Tm сформированного гибрида и отношение G:C в нуклеиновых кислотах. Отдельная молекула, содержащая в своей структуре спаривание комплементарных нуклеиновых кислот, называется “само-гибридизирующейся.”
Термин “Tm” относится к температуре плавления нуклеиновой кислоты. Температура плавления – это температура, при которой половина количества молекул двухцепочечных нуклеиновых кислот разделяется на одиночные цепи. Уравнение для вычисления Tm нуклеиновых кислот хорошо известно в данной области техники. Согласно стандартным ссылкам, упрощенная оценка значения Tm может быть произведена с помощью уравнения: Tm = 81.5 + 0.41 (% G + C), когда нуклеиновая кислота находится в водном растворе при 1 M NaCl (смотри, например, Anderson and Young, Quantitative Filter Hybridization, in Nucleic Acid Hybridization (1985)). Другие ссылки включают более сложные вычисления, которые принимают во внимание структурные характеристики, а также характеристики последовательности для вычисления Tm.
Термин “жесткость” относится к условиям температуры, ионной силы и присутствия других соединений, таких как органические растворители, при которых проводится гибридизация нуклеиновых кислот.
“Условия низкой жесткости” в случае использования со ссылкой на гибридизацию нуклеиновой кислоты, включают условия, соответствующие связыванию и гибридизации при 42°C в растворе, состоящем из 5x SSPE (43,8 г/л NaCl, 6,9 г/л NaH2PO4(H2O) и 1,85 г/л EDTA, при pH, отрегулированным до значения 7,4 с помощью NaOH), 0,1% SDS, 5x реагента Денхардта (50x реагент Денхардта содержит на 500 мл: 5г фиколл (Type 400, Pharmacia), 5г BSA (Fraction V; Sigma)) и 100 г/мл денатурированной ДНК из молок лосося с последующей промывкой в растворе, содержащем 5x SSPE, 0,1% SDS при 42°C, когда используется зонд около 500 нуклеотидов в длину.
“Условия умеренной жесткости”, в случае использования со ссылкой на гибридизацию нуклеиновой кислоты, включают условия, соответствующие связыванию и гибридизации при 42°C в растворе, состоящем из 5x SSPE (43,8 г/л NaCl, 6,9 г/л NaH2PO4(H2O) и 1,85 г/л EDTA, при pH, отрегулированным до значения 7,4 с помощью NaOH), 0,5% SDS, 5x реагента Денхардта и 100 г/мл денатурированной ДНК из молок лосося с последующей промывкой в растворе, содержащем 1,0x SSPE, 1,0% SDS при 42°C, когда используется зонд около 500 нуклеотидов в длину.
“Условия высокой жесткости”, в случае использования со ссылкой на гибридизацию нуклеиновой кислоты, включают условия, соответствующие связыванию или гибридизации при 42°C в растворе, состоящем из 5x SSPE (43,8 г/л NaCl, 6,9 г/л NaH2PO4(H2O) и 1,85 г/л EDTA, при pH, отрегулированным до значения 7,4 с помощью NaOH), 0,5% SDS, 5x реагента Денхардта и 100 г/мл денатурированной ДНК из молок лосося с последующей промывкой в растворе, содержащем 0,1x SSPE, 1,0% SDS при 42°C, когда используется зонд около 500 нуклеотидов в длину.
В некоторых характерных вариантах осуществления клетки идентифицируют, а затем изолируют отдельную клетку или множество клеток. Клетки в рамках настоящего раскрытия включают любой тип клеток, в том случае, когда специалисты в данной области техники считают, что могут быть полезными сведения о содержании ДНК. Клетка согласно настоящему раскрытию включает раковую клетку любого типа, гепатоцит, ооцит, эмбриональную, стволовую клетку, iPS клетку, ES клетку, нейрон, эритроцит, меланоцит, половую клетку, олигодендроцит, клетку почки и т.п. Согласно одному аспекту способы настоящего изобретения осуществляются на практике с использованием клеточной ДНК из отдельной клетки. Множество клеток включает примерно от 2 до 1000000 клеток, примерно от 2 до 10 клеток, примерно от 2 до 100 клеток, примерно от 2 до 1000 клеток, примерно от 2 до 10000 клеток, примерно от 2 до 100000 клеток, примерно от 2 до 10 клеток или примерно от 2 до 5 клеток.
Нуклеиновые кислоты, обработанные описанными в этом документе способами, могут быть ДНК, и они могут быть получены из любого подходящего источника, такого как, например, образец, полученный от человека. В конкретных вариантах осуществления двухцепочечная ДНК молекула, кроме того, определяется, как содержащая геном, такой, например, как геном, полученный из образца человека. Образец может быть таким образцом, полученным от человека, как кровь, сыворотка, плазма, цереброспинальная жидкость, соскоб со щеки, аспират из соска, биопсийный материал, сперма (которая называется эякулятом), моча, кал, волосяной фолликул, слюна, пот, иммунопреципитированный или физически изолированный хроматин и так далее. В специфических вариантах осуществления образец содержит одну клетку. В отдельных вариантах осуществления образец содержит только отдельную клетку.
В отдельных вариантах осуществления амплифицированная молекула нуклеиновой кислоты из образца предоставляет диагностическую или прогностическую информацию. Например, полученная из образца молекула нуклеиновой кислоты предоставляет информацию о числе геномных копий и/или информацию о последовательности, информацию об аллельном разнообразии, информацию для диагностики рака, пренатальной диагностики, информацию об отцовстве, информацию для диагностики болезни, информацию об обнаружении, мониторинге и/или лечении, информацию о последовательности и так далее.
При использовании в описании "отдельная клетка" относится к одной клетке. Отдельная клетка, используемая в описанных в этом документе способах, может быть получена из интересующей ткани или из биопсийного образца, образца крови или клеточной культуры. Кроме того, могут быть получены клетки из отдельных органов, тканей, опухолей, новообразований или тому подобного, которые могут использоваться в описанных в этом документе способах. Более того, вообще клетки из любой популяции могут использоваться в данных способах, например, популяции прокариоотческих или эукариотических одноклеточных организмов, включая бактерии и дрожжи. Суспензия отдельных клеток может быть получена с помощью стандартных методов, известных в данной области техники, включая, например, использование ферментов трипсина или папаина для переваривания белков, соединяющих клетки в образцах ткани, или высвобождения прикрепленных клеток в культуре или механического разделения клеток в образце. Отдельные клетки могут быть помещены в любой подходящий реакционный сосуд, в котором отдельные клетки могут обрабатываться индивидуально. Например, 96-луночный планшет, с таким расчетом, что каждая отдельная клетка помещается в отдельную лунку.
Методы манипуляций с отдельными клетками хорошо известны в данной области техники и включают сортировку флуоресцентно-активированных клеток (FACS), проточную цитометрию (Herzenberg., PNAS USA 76:1453-55 1979), микроманипуляцию и использование полуавтоматических устройств для сбора клеток (например, системы переноса клеток QuixellTM от Stoelting Co.). Например, отдельные клетки могут быть отобраны индивидуально, исходя их характерных признаков, обнаруженных при микроскопическом исследовании, таких как положение, морфология или экспессия гена-репортера. Кроме того, может использоваться сочетание центрифугирования в градиенте и проточной цитометрии с целью улучшения выделения или эффективности сортировки.
Как только желательная клетка идентифицирована, клетка подвергается лизису для высвобождения клеточного содержимого, включая ДНК, с помощью методов, известных специалистам в данной области техники. Клеточное содержимое содержится в сосуде или совокупном объеме. В некоторых аспектах изобретения клеточное содержимое, такое как геномная ДНК, можно высвободить из клеток посредством лизиса клеток. Лизис можно осуществить, например, путем нагревания клеток или путем использования детергентов или других химических методов или путем их комбинации. Однако, можно использовать любой подходящий метод лизиса, известный в данной области техники. Например, нагревания клеток при 72°C в течение 2 минут в присутствии Твина-20 достаточно для того, чтобы лизировать клетки. Альтернативно, клетки можно нагреть до 65°C в течение 10 минут в воде (Esumi et al., Neurosci Res 60(4):439-51 (2008)); или 70°C в течение 90 секунд в буфере II для ПЦР (Applied Biosystems) с добавлением 0,5% NP-40 (Kurimoto et al., Nucleic Acids Res 34(5):e42 (2006)); или лизис можно провести с помощью протеазы, такой как Протеиназа K, или путем использования хаотропных солей, таких как гуанидин-изотиоцианат (публикация США № 2007/0281313). Амплификация геномной ДНК согласно описанным в этом документе способам может быть проведена непосредственно на клеточных лизатах, при этом реакционная смесь может быть добавлена к клеточным лизатам. Альтернативно, клеточный лизат может быть разделен на два или более объемов, например, на два или более контейнеров, пробирок или отделений, с помощью методов, известных специалистам в данной области техники, при этом часть клеточного лизата будет содержаться в объеме каждого контейнера, пробирки или отделения. Геномная ДНК, содержащаяся в каждом контейнере, пробирке или отделении, затем может быть амплифицирована с помощью методов, описанных в этом документе, или методов, известных специалистам в данной области техники.
Нуклеиновая кислота, используемая в изобретении, также может включать нативные или ненативные основания. В этом отношении нативная дезоксирибонуклеиновая кислота может иметь одно или более оснований, выбранных из группы, состоящей из аденина, тимина, цитозина или гуанина, а рибонуклеиновая кислота может иметь одно или более оснований, выбранных из группы, состоящей из урацила, аденина, цитозина или гуанина. Примеры ненативных оснований, которые могут быть включены в нуклеиновые кислоты, будь то нативный остов или аналогичная структура, включают, без ограничения, инозин, ксантанин, гипоксантин, изоцитозин, изогуанин, 5-метилцитозин, 5-гидроксиметилцитозин, 2-аминоаденин, 6-метиладенин, 6-метилгуанин, 2-пропилгуанин, 2-пропиладенин, 2-тиоурацил, 2-тиотимин, 2-тиоцитозин, 15-галоурацил, 15 -галоцитозин, 5-пропинил-урацил, 5-пропинил-цитозин, 6-азоурацил, 6-азоцитозин, 6-азотимин, 5-урацил, 4-тиоурацил, 8-галоаденин или гуанин, 8-амино-аденин или гуанин, 8-тиоладенин или гуанин, 8-тиоалкил-аденин или гуанин, 8-гидроксиладенин или гуанин, 5-галозамещенный урацил или цитозин, 7-метилгуанин, 7-метиладенин, 8-азагуанин, 8-азааденин, 7-деазагуанин, 7-деазааденин, 3-деазагуанин, 3-деазааденин или тому подобное. Конкретный вариант осуществления может использовать изоцитозин и изогуанин в нуклеиновой кислоте, для того, чтобы уменьшить неспецифическую гибридизацию, как описано в патенте США № 5,681,702.
Использованный в описании термин “праймер”, как правило, включает олигонуклеотид, природный или искусственный, который является способным, после формирования дуплекса с матрицей полинуклеотида, действовать в качестве точки инициации синтеза нуклеиновой кислоты, например, праймер для секвенирования, и удлиняющийся от его 3' конца вдоль матрицы таким образом, что формируется удлиненный дуплекс. Последовательность нуклеотидов, добавленная во время процесса удлинения, определяется последовательностью полинуклеотидной матрицы. В большинстве случаев праймеры удлиняются с помощью ДНК-полимеразы. Праймеры обычно имеют в длину от 3 до 36 нуклеотидов, также от 5 до 24 нуклеотидов, также от 14 до 36 нуклеотидов. Праймеры в рамках изобретения включают ортогональные праймеры, праймеры для амплификации, праймеры для конструирования и тому подобные. Пары праймеров могут фланкировать интересующую последовательность или набор интересующих последовательностей. Праймеры и зонды могут быть вырожденными или квазивырожденными в последовательности. Праймеры в рамках настоящего изобретения связываются рядом с целевой последовательностью. "Праймер" может считаться коротким полинуклеотидом, в большинстве случаев со свободной 3'-OH группой, которая связывается с мишенью или матрицей, возможно присутствующей в интересующем образце, путем гибридизации с мишенью, в дальнейшем способствуя полимеризации полинуклеотида комплементарно с мишенью. Праймеры настоящего изобретения состоят из нуклеотидов в пределах от 17 до 30 нуклеотидов. В одном аспекте праймер состоит, по меньшей мере, из 17 нуклеотидов, или альтернативно, по меньшей мере, 18 нуклеотидов, или альтернативно, по меньшей мере, 19 нуклеотидов, или альтернативно, по меньшей мере, 20 нуклеотидов, или альтернативно, по меньшей мере, 21 нуклеотида, или альтернативно, по меньшей мере, 22 нуклеотидов, или альтернативно, по меньшей мере, 23 нуклеотидов, или альтернативно, по меньшей мере, 24 нуклеотидов, или альтернативно, по меньшей мере, 25 нуклеотидов, или альтернативно, по меньшей мере, 26 нуклеотидов, или альтернативно, по меньшей мере, 27 нуклеотидов, или альтернативно, по меньшей мере, 28 нуклеотидов, или альтернативно, по меньшей мере, 29 нуклеотидов, или альтернативно, по меньшей мере, 30 нуклеотидов, или альтернативно по меньшей мере, 50 нуклеотидов, или альтернативно по меньшей мере, 75 нуклеотидов или альтернативно по меньшей мере, 100 нуклеотидов.
Выражение "амплификация" относится к процессу, с помощью которого образуются дополнительные копии или множество копий конкретного полинуклеотида.
ДНК, амплифицированная в соответствии с описанными в этом документе способами, может быть секвенирована и проанализирована с помощью методов, известных специалистам в данной области техники. Установление последовательности в представляющей интерес нуклеиновокислотной последовательности может быть осуществлено при помощи целого ряда методов секвенирования, известных в данной области, включая, но не ограничиваясь этим, секвенирование путем гибридизации (SBH), секвенирование лигированием (SBL) (Shendure et al. (2005) Science 309:1728), количественное секвенирование с пофазным добавлением флуоресцентных нуклеотидов (QIFNAS), ступенчатое лигирование и расщепление, флуоресцентный резонансный перенос энергии (FRET), молекулярные маяки, расщепление репортерного TaqMan зонда, пиросеквенирование, флуоресцентное секвенирование in situ (FISSEQ), FISSEQ гранулы (патент США № 7,425,431), воббл-секвенирование (PCT/US05/27695), мультиплексное секвенирование (США серийный № 12/027,039, зарегистрированная 6 февраля 2008; Porreca et al (2007) Nat. Methods 4:931), полони-секвенирование («полимеризованная колония») (POLONY) (патент США № 6,432,360, 6,485,944 и 6,511,803, и PCT/US05/06425); секвенирование по типу раскручивающейся нанорешетки (ROLONY) (США серийный № 12/120,541, зарегистрированная 14 мая 2008), аллельспецифическое лигирование олигонуклеотидных зондов (например, лигирование олигонуклеотидных зондов (OLA), OLA одной матричной молекулы с использованием лигированного линейного зонда и амплификации по типу катящегося кольца (RCA), лигированных замыкающих кольцо зондов и/или одномолекулярное OLA с использованием лигированного замыкающего кольцо зонда и амплификации по типу «катящегося кольца» (RCA)) и тому подобное. Методы высокопроизводительного секвенирования, например, с использованием такой платформы, как Roche 454, Illumina Solexa, AB-SOLiD, Helicos, Polonator platforms и тому подобных, также могут использоваться. Целый ряд методов секвенирования на основе света (light-based) известны в данной области техники (Landegren et al. (1998) Genome Res. 8:769-76; Kwok (2000) Pharmacogenomics 1:95-100; и Shi (2001) Clin. Chem. 47:164-172).
Амплифицированная ДНК может быть секвенирована с помощью любого подходящего способа. В частности, амплифицированная ДНК может быть секвенирована с помощью высокопроизводительного способа скрининга, такого как технология секвенирования SOLiD от компании Applied Biosystems или анализатора генома от компании Illumina. В одном аспекте изобретения амплифицированная ДНК может быть секвенирована методом «дробовика». Число прочтений может составлять, по меньшей мере, 10000, по меньшей мере, 1 миллион, по меньшей мере, 10 миллионов, по меньшей мере, 100 миллионов или, по меньшей мере, 1000 миллионов. В другом аспекте число прочтений может составлять от 10000 до 100000, или альтернативно от 100000 до 1 миллиона, или альтернативно от 1 миллиона до 10 миллионов, или альтернативно от 10 миллионов до 100 миллионов, или альтернативно от 100 миллионов до 1000 миллионов. "Прочтение" – это длина непрерывной нуклеиновокислотной последовательности, полученной при помощи секвенирующей реакции.
"Дробное секвенирование" имеет отношение к методу, который используется для синтеза очень большого количества ДНК (такого как полный геном). В этом методе ДНК, подлежащая секвенированию, сначала разрезается на более мелкие фрагменты, которые могут быть секвенированы по отдельности. Последовательности этих фрагментов затем снова собираются в их первоначальном порядке, исходя из их перекрывающихся последовательностей, давая в результате полную последовательность. "Разрезание" ДНК может быть выполнено с помощью целого ряда различных методов, включая расщепление рестрикционным ферментом или механическое разрезание. Перекрывающиеся последовательности в большинстве случаев выравнивают при помощи соответствующих компьютерных программ. Методы и программы для дробного секвенирования библиотеки кДНК хорошо известны в данной области техники.
Методы амплификации и секвенирования используются в области предсказательной медицины, в которой дагностические анализы, прогностические анализы, фармакогеномика и мониторинговые клинические испытания используются для прогностических (предсказательных) целей, чтобы в силу этого применять профилактическое индивидуальное лечение. Соответственно, один аспект настоящего изобретения имеет отношение к диагностическим анализам геномной ДНК для того, чтобы определить, имеется ли у индивидуума риск развития нарушения и/или болезни. Такие анализы могут использоваться с прогностической или предсказательной целью, чтобы вследствие этого профилактически лечить индивидуума до начала нарушения и/или болезни. Соответственно, в некоторых типичных вариантах осуществления предоставляются методы диагностирования и/или прогнозирования одной или более болезней и/или нарушений с использованием одного или более методов определения профилей экспрессии, описанных в этом документе.
Использованный в описании термин “биологический образец” включает, но не ограничивается этим, ткани, клетки, биологические жидкости и их изоляты, полученные от субъекта, а также ткани, клетки и жидкости, присутствующие у субъекта.
В некоторых характерных вариантах осуществления предоставляются читаемые электронной аппаратурой носители, содержащие одну или более последовательностей геномной ДНК, описанной в этом документе. При использовании в описании термин “носитель, читаемый электронной аппаратурой,” относится к любой подходящей среде для накопления, хранения и удерживания данных или информации, которая может быть прочитана с помощью электронной аппаратуры, имеющей к ней доступ. Такие среды могут включать, но не ограничиваются этим: магнитные запоминающие устройства, такие как гибкие диски, жесткие диски для хранения информации и магнитная лента; средства оптического хранения информации, такие как компакт-диск; электронные носители информации, такие как RAM, ROM, EPROM, EEPROM и тому подобные; обычные жесткие диски и гибриды этих категорий, такие как средства магнитного/оптического хранения информации. Данный носитель приспособлен или сконфигурирован для того, чтобы содержать записанный на нем один или более профилей экспрессии, описанных в этом документе.
При использовании в описании термин “электронная аппаратура” включает любое вычислительное или обрабатывающее устройство или другое устройство, сконфигурированное или адаптированное для хранения данных или информации. Примеры электронной аппаратуры, подходящей для использования настоящим изобретением, включают отдельное вычислительное устройство; сети, включая локальную сеть (LAN), глобальную сеть (WAN) Интернет, Интранет и Экстранет; электронные приборы, такие как персональные цифровые ассистенты (PDAs), мобильный телефон, пэйджер и тому подобное; и системы локальной и распределенной обработки данных.
При использовании в этом документе “записанный (сохраненный)” относится к процессу хранения или кодировки информации на носителе, читаемом электронной аппаратурой. Специалисты в данной области техники могут легко ввести в использование любой из известных в настоящее время методов кодировки информации на известных носителях, чтобы получить изделие, содержащее один или более профилей экспрессии, описанных в этом документе.
Ряд программных продуктов и форматов может использоваться для хранения информации о геномной ДНК на носителе, читаемом с помощью электронной аппаратуры. Например, последовательность нуклеиновой кислоты может быть представлена в виде электронно-обработанного текстового файла, отформатированного коммерчески доступным программным обеспечением, таким как WordPerfect и MicroSoft Word, или представленного в форме ASCII файла, сохраненного в приложении с базой данных, такой как DB2, Sybase, Oracle, или тому подобных, а также в других формах. Любое число устройств для обработки данных, структурирующих форматы (например, текстовый файл или база данных), может использоваться, для того, чтобы получить или создать среду для записи на ней одного или более профилей экспрессии, описанных в этом документе.
Следует понимать, что описанные варианты осуществления настоящего изобретения имеют чисто иллюстративный характер, касающийся некоторых случаев применения на практике принципов настоящего изобретения. Многочисленные модификации могут быть сделаны специалистами в данной области техники на основе идей, представленных в данном описании, без отступления от существа и объема изобретения. Содержание всех ссылок, патентов и опубликованных патентных заявок, цитированных на всем протяжении этой заявки, включается в описание путем отсылки во всей полноте во всех отношениях.
Следующие примеры изложены в качестве иллюстрации настоящего изобретения. Эти примеры не следует рассматривать как ограничивающие объем изобретения, тем более, что эти и другие эквивалентные варианты осуществления будут понятны с учетом настоящего раскрытия, фигур и сопутствующих пунктов формулы изобретения.
Пример I
Общий протокол
Следующий общий протокол подходит для амплификации полного генома. Отдельную клетку лизируют в лизирующем буфере. Транспосома образуется путем инкубации равномолярных ДНК-транспозона и транспозазы Tn5 при комнатной температуре в течение 1 часа. К лизированным клеткам добавляют транспосому и буфер для транспозиции, хорошо перемешивают и инкубируют при 55°C в течение 10 минут. Добавляют 1 мг/мл протеазы после транспозиции, чтобы прекратить связывание транспозазы с геномной ДНК отдельной клетки. Deep vent (экзо-) ДНК-полимеразу (New England Biolabs), dNTP, буфер для ПЦР-реакции и праймеры добавляют в реакционную смесь, которую нагревают до 72°C в течение 10 минут, чтобы заполнить пропуск, получившийся в результате вставки транспозона. Реакционную смесь загружают в микрофлюидное устройство для формирования микрокапель. Капли, содержащие матрицу геномной ДНК отдельной клетки, ДНК полимеразу, dNTP, реакционный буфер и праймер, объединяют в ПЦР-пробирках. Проводят от 40 до 60 циклов ПЦР-реакции для амплификации геномной ДНК отдельной клетки. Для того, чтобы провести реакцию амплификации в каплях до насыщения, проводят ряд циклов. Капли лизируют, а продукты амплификации очищают для дополнительных анализов, подобных глубокому секвенированию с высокой пропускной способностью.
ПРИМЕР II
Сочетание транспозазы с ДНК-транспозоном
Транспозазу Tn5 (Epicentre) смешивают с ДНК-транспозоном в равном молярном количестве в буфере, содержащем EDTA, и инкубируют при комнатной температуре в течение 10-60 минут. Конечная концентрация транспосомы составляет 0,1-10 мкM. Структура транспозона ДНК имеет двухцепочечный сайт связывания транспозазы в 19 п.о. на одном конце и сайт связывания праймера на другом конце. Одноцепочечный сайт связывания праймера формирует 5’ выступающий конец. Штрихкодовые последовательности с переменной длиной и сложные последовательности могут быть сконструированы при необходимости между сайтом связывания в 19 п.о. и сайтом связывания праймера. Транспосому можно разбавить в несколько раз в растворе 50% Tris-EDTA и 50% глицерина и хранить при -20°C.
ПРИМЕР III
Лизис клеток
Клетку выбирают, «снимают» с культуральной чашки и переносят в пробирку с помощью лазерной препаровальной лупы (LMD-6500, Leica), как указано далее. Клетки высевают на покрытую мембраной чашку для культивирования и проводят наблюдение с помощью светлопольной микроскопии с объективом 10x (Leica). Затем используют УФ лазер, чтобы разрезать мембрану вокруг индивидуально отобранной клетки, так что она попадает в «крышечку» ПЦР-пробирки. Пробирку недолго центрифугируют, чтобы осадить клетку на дно пробирки. 3 – 5мкл лизирующего буфера (30mM Tris-Cl PH 7.8, 2mM EDTA, 20mM KCl, 0,2% Тритон X-100, 500 мкг/мл Qiagen Protease) добавили в ПЦР-пробирку по боковой стенке. Затем захваченную клетку лизировали термически с использованием следующего температурного режима на ПЦР-машине: 50°C 3 часа, 75°C 30 минут. Альтернативно, ртом пипетировали отдельную клетку в буфер с низким содержанием соли, включающий EDTA и протеазу, такую как QIAGEN протеаза (QIAGEN) при концентрации 10 - 5000 мкг/мл. Условия инкубации варьируют, исходя из используемой протеазы. В случае протеазы QIAGEN, инкубация должна проходить при 37-55°C в течение 1 – 4 часов. Затем протеазу инактивируют нагреванием до 80°C и затем инактивируют специфическими ингибиторами протеаз, такими как 4-(2-аминоэтил) бензолсульфонил-фторидгидрохлорид (AEBSF) или фенилметансульфонил-фторид (PMSF) (Sigma Aldrich). Клеточный лизат хранят при -80°C.
Альтернативно, линию человеческих BJ клеток, культивированных в чашке Петри, обрабатывали трипсином и собирали в пробирку Эппендорфа с низким связыванием. Клетки промыли PBS, чтобы удалить среду для роста клеток и ресуспендировали в 150mM NaCl буфере. Клетки дополнительно разбавляли до ~5 клеток/мкл и помещали на чашку для культивирования, покрытую мембраной. Отдельные клетки помещали в 5мкл лизирующего буфера (20mM Tris pH 8.0, 20mM NaCl, 0,2% Тритон X-100, 15mM DTT, 1mM EDTA, 1мг/мл Qiagen протеазы) с помощью системы для пипетирования ртом. Затем захваченную клетку термически лизировали с использованием следующего температурного режима на ПЦР-машине: 50°C 3 час, 70°C 30 минут. Лизированные клетки хранили при -80°C до дискретной амплификации путем вставки транспозона (DIANTI).
ПРИМЕР IV
Транспозиция
Лизат отдельной клетки и транспосому смешивали в буферной системе, содержащей 1-100 mM Mg2+ и необязательно 1-100 mM Mn2+ или Co2+ или Ca2+ и инкубировали при 37 - 55°C в течение 5-240 минут. Реакционный объем варьирует в зависимости от объема клеточного лизата. Количество транспосомы, добавленной в реакционную смесь, может быть легко отрегулировано в зависимости от желаемого размера фрагментaции. Реакцию транспозиции останавливают путем хелатирования Mg2+ с использованием EDTA и необязательно EGTA или других агентов, образующих комплексные соединения с ионами. Необязательно, короткая двухцепочечная ДНК может добавляться к смеси в качестве spike-in. Остаток транспосомы инактивируется путем расщепления протеазой, такой как QIAGEN протеаза, при окончательной концентрации 1 - 500 мкг/мл при 37 - 55°C в течение 10-60 минут. Затем протеаза инактивируется нагреванием и/или ингибитором протеазы, таким как AEBSF.
ПРИМЕР V
Заполнение пропуска
После транпозиции и удаления транспозазы к раствору добавляют реакционную смесь для ПЦР, включающую Mg2+, dNTP смесь, праймеры и термически устойчивую ДНК-полимеразу, такую как Deep Vent (экзо-)ДНК полимераза (New England Biolabs) при подходящей температуре и в течение подходящего периода времени для заполнения пропуска в 9 п.о., оставшегося в результате реакции транспозиции. Температура инкубации и время для заполнения пропуска зависят от конкретной используемой ДНК-полимеразы. После реакции ДНК-полимераза необязательно инактивируется нагреванием и/или обработкой протеазой, такой как QIAGEN протеаза. Протеаза, в случае, если она используется, затем инактивируется нагреванием и/или ингибитором протеазы.
ПРИМЕР VI
Создание микрокапель, изолирование каждого фрагмента ДНК в отдельной микрокапле и амплификация
Согласно одному аспекту для создания капель, содержащих реагенты для реакции ПЦР амплификации, используются общие методы, известные специалистам в данной области техники, причем реакции проводят в каждой капле, чтобы амплифицировать фрагмент ДНК внутри капли. Двухцепочечные продукты с заполненным пропуском из вышеприведенного Примера, включающие фрагменты ДНК с участками связывания праймеров, добавляются к реагентам для ПЦР-реакции в водной среде, которая затем объединяется с маслом, и данная комбинация дает в результате капли, причем количество капель превышает количество двухцепочечных продуктов с заполненным пропуском, при этом отдельный двухцепочечный продукт с заполненным пропуском изолируется в одной капле вместе с реагентами, достаточными для проведения ПЦР-реакции. Затем капли подвергаются условиям прохождения ПЦР-реакции для ПЦР-амплификации каждого фрагмента ДНК в каждой капле. Подходящие методы амплификации в каплях эмульсии известны специалистам в данной области техники и включают методы, описанные в Mazutis, L., et al. Single-cell analysis and sorting using droplet-based microfluidics, Nature Protocols, 2013, 8, p. 870-891; Williams, R, et al. Amplification of complex gene libraries by emulsion PCR, Nature Methods, 2006, 3, p. 545-550; Fu, Y, et al. Uniform and accurate single-cell sequencing based on emulsion whole-genome amplification. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(38): p. 11923-8; Sidore, A. M., et al. Enhanced sequencing coverage with digital droplet multiple displacement amplification amplification. Nucleic Acids Research. 2015, Dec. 23; Nishikawa, Y, et al. Monodisperse picoliter droplets for low-bias and contamination-free reactions in single-cell whole genome amplification. PLoS One. 2015, September 21; Rhee, M., et al. Digital droplet multiple displacement amplification (ddMDA) for whole genome sequencing of limited DNA samples. PLoS One. 2016. May 4; Guo, M.T., et al. Droplet microfluidics for high-throughput biological assays, Lab on a Chip, 2012, 12, p. 2146-2155; Chabert, M., et al. Automated microdroplet platform for sample manipulation and polymerase chain reaction, Analytical Chemistry, 2006, 78(22), p.7722-7728; Kiss, M.M., High-throughput quantitative polymerase chain reaction in picoliter droplets, Analytical Chemistry, 2008, 80(23), p. 8975-8981; Lan, F., et al. Droplet barcoding for massively parallel single-молекула deep sequencing, Nature Communications, 2016, 7(11784), каждая из этих ссылок полностью включается в описание путем отсылки. Подходящие масляные фазы известны специалистам в данной области техники, в которых водная фаза спонтанно приводит к образованию капель воды или изолированных объемов или компартментов, окруженных масляной фазой. Характерные масла включают масло для создания капель QX200TM Droplet Generation Oil для использования с красителем Evagreen (Bio-Rad), фторированное поверхностно-активное вещество 008-FluoroSurfactant в HFE 7500 (RAN Biotechnologies), Pico-Surf TM 1 (Dolomite Microfluidics), патентованные масляные поверхностно-активные вещества (RainDance Technologies), фторированные поверхностно-активные вещества и фторированные масла, обсуждаемые в Mazutis, L., et al. Single-cell analysis и sorting using droplet-based microfluidics, Nature Protocols, 2013, 8, p. 870-891, и другие поверхностно-активные вещества и масла, описанные в Baret, J.-C. Lab on a Chip, 2012, 12, p. 422-433, каждая из этих ссылок полностью включается в описание путем отсылки.
Подходящие микрофлюидные устройства для осуществления амплификации полного генома отдельной клетки описаны в Wang et al., Cell 150(2):402-412 (2012), de Bourcy CFA, PLOS ONE 9(8):e105585 (2014), Gole et al., Nat Biotechnol 31(12):1126-1132 (2013) и Yu et al., Anal Chem 86(19):9386-9390 (2014); Fu, Y, et al. Uniform and accurate single-cell sequencing based on emulsion whole-genome amplification. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(38): p. 11923-8; Sidore, A. M., et al. Enhanced sequencing coverage with digital droplet multiple displacement amplification. Nucleic Acids Research. 2015, Dec. 23; Nishikawa, Y, et al. Monodisperse picoliter droplets for low-bias и contamination-free reactions in single-cell whole genome amplification. PLoS One. 2015, September 21; Rhee, M., et al. Digital droplet multiple displacement amplification (ddMDA) for whole genome sequencing of limited DNA samples. PLoS One. 2016. May 4; Lan, F., et al. Droplet barcoding for massively parallel single-молекула deep sequencing, Nature Communications, 2016, 7(11784), каждая из этих ссылок полностью включена в описание путем отсылки. Подобные устройства дают возможность избежать загрязнения и обеспечивают анализы с высокой пропускной способностью нескольких отдельных молекул или отдельных клеток. Небольшие общие реакционные объемы (от микролиторов до нанолитров) микрофлюидных устройств не только способствуют эффективности реакций, но также обеспечивают существенное снижение затрат на используемые ферменты и реагенты.
ПРИМЕР VII
Амплификация фрагмента ДНК, изолированного в микрокапле
Фрагменты ДНК с заполненными пропусками из вышеприведенного Примера загружали в микрофлюидный чип, чтобы создать от 1 до 100 миллионов микрокапель. Устройство микрофлюидного чипа было модифицировано по сравнению с обычным дизайном устройства генерирования капель при фокусировке потока, предоставленного Macosko et al. Cell 161 (5), 2015, полностью включенного в описание путем отсылки. Дизайн микрофлюидного чипа включал входное отверстие для гидрофобной жидкости (называемое впуск масла), входное отверстие для раствора ДНК или водной фазы, зону объединения масляной фазы и водной фазы, соединенную с помощью микроканалов с возможностью переноса жидкости, дополнительно соединенных с участком выхода капли эмульсии с возможностью переноса жидкости. Площадь поверхности и острые углы по ходу водного потока были минимизированы по сравнению с устройством Macosko et al. Cell 161 (5), 2015, чтобы предотвратить «застревание» ДНК фрагментов на поверхности микрофлюидного чипа. Входное отверстие для масла содержало фильтр, обычно используемый в микрофлюидных устройствах, таких как фильтрующие квадраты (filtering squares). Входное отверстие для воды также содержало фильтр, обычно используемый в микрофлюидных устройствах, таких как фильтрующие квадраты, однако площадь поверхности фильтрующих квадратов была уменьшена, чтобы минимизировать площадь поверхности, входящую в контакт с гидрофобной фазой. Подходящей гидрофобной фазой является фаза, генерирующая капли воды при введении водной среды в гидрофобную фазу. Типичная гидрофобная фаза включает гидрофобную жидкость, такую как масло, такую как фторированное масло, такое как 3-этоксиперфтор(2-метилгексан), и поверхностно-активное вещество. Поверхностно-активные вещества хорошо известны специалистам в данной области техники. Типичной гидрофобной фазой, включающей подходящее масло и поверхностно-активное вещество, является коммерчески доступная как QX200TM Droplet Generation Oil для Evagreen (Bio-Rad), гидрофобная, содержащая поверхностно-активное вещество жидкость, которая не смешивается с водным раствором или не оказывает негативного воздействия на биохимические реакции в водном растворе. Другие комбинации подходящего масла и поверхностно-активного вещества коммерчески доступны или известны специалистам в данной области техники. Когда масляная фаза и водная фаза объединяются в участке для объединения или участке выхода капли эмульсии, водная фаза будет спонтанно формировать капли, окруженные масляной фазой. Согласно одному аспекту для промывки требуется объем гидрофобной жидкости, такой как масло, которое может не содержать поверхностно- активное вещество, располагающееся «выше» водной фазы или в микрофлюидном устройстве или в шприце или инжекторе, используемом для введения водной фазы в микрофлюидное устройство, эта промывочная гидрофобная жидкость используется для того, чтобы «вытеснить» какую-либо водную фазу, которая в ином случае может занимать «мертвый объем», с целью минимизировать потерю первоначальной водной фазы, введенной в микрофлюидный чип. Подходящий дизайн микрофлюидного чипа может быть создан с использованием программного обеспечения AutoCAD (Autodesk Inc.) и может быть напечатан CAD Art Services Inc. в виде фотошаблона для производства микрофлюидных утройств. Формы или шаблоны (master) могут быть созданы с помощью обычных методов, как описано в Mazutis et al. Nature Protocols 8 (5), 2013, полностью включенном в описание путем отсылки. Микрофлюидные чипы могут быть изготовлены из шаблона путем вулканизации невулканизированного (неотвержденного) полидиметилсилоксана (PDMS) (Dow Corning Sylgard 184), вылитого в шаблон и нагретого до вулканизации, чтобы создать поверхность с полостями или каналами. Делаются входное и выходное отверстия, и вулканизированная поверхность с каналами располагается напротив стеклянной вставки и прикрепляется для создания микроканалов и микрофлюидного чипа. Перед использованием внутреннее пространство микрофлюидного чипа может быть обработано соединением для улучшения гидрофобности внутренней стороны микрофлюидного чипа и промыто с целью удаления возможного загрязнения.
Для проведения экспериментов, описанных в этом документе, каждый микрофлюидный чип был обработан Aquapel (Aquapel), чтобы сделать поверхность каналов гидрофобной. Перед началом каждого эксперимента устройство промывали водой без нуклеазной активности, чтобы удалить возможное загрязнение, и затем промывали маслом, генерирующим капли, таким как QX200TM Bio-Rad Droplet Generation Oil для Evagreen. Масло, генерирующее капли, находится в шприце, соединенном с входом для масла микрофлюидного чипа через полиэтиленовый канал (Scientific Commodities # BB31695-PE/2). Выходное отверствие чипа соединяется с 2 мл ДНК LoBind пробиркой для сбора капель через полиэтиленовый канал.
Чтобы загрузить раствор геномной ДНК (gДНК) в микрофлюидный чип без появления «мертвого объема», шприц в 1 мл, соединенный с полиэтиленовой трубкой длиной 140 см через иглу шприца, был предварительно заполнен 3-этоксиперфтор(2-метилгексаном) (“HFE масло”). Затем раствор геномной ДНК (приготовленный из вставки транспозона для заполненеия пропуска) засасывали в трубку, не касаясь иглы шприца или шприца, где возникает «мертвый объем». Чтобы отличить HFE масло от раствора геномной ДНК внутри полиэтиленовой тубы (и то и другое является прозрачным), небольшое количество воздуха набирается в полиэтиленовую тубу до втягивания раствора геномной ДНК, чтобы разделить оба типа жидкостей. Этот метод позволяет перекачать весь раствор геномной ДНК в чип без остатка в игле шприца или шприце; раствор полностью выталкивается в чип с помощью HFE масла, которое не смешивается с ним.
Когда раствор геномной ДНК и масло для генерирования капель объединяются в микрофлюидном устройстве, капли формируются спонтанно в циркуляционном потоке. Затем аликвоты капель помещали в пробирки для ПЦР для термоциклирования с целью амплификации. Реакцию ПЦР проводили в термоциклере согласно следующему режиму:
После этого 75 мкл перфтороктанола (TCI Chemicals) добавили в каждую пробирку для ПЦР; после встряхивания вручную и центрифугирования, все капли лизировали, и водный раствор, содержащий продукты ДНК-амплификации, собирали в пробирки Эппендорфа с уменьшенным сцеплением со стенками и очищали с помощью Zymo Research DNA Clean & Concentrator-5 и объединяли вместе для последующих анализов. Концентрацию очищенных ДНК-продуктов измеряли с помощью флюориметра Qubit 2.0. 10 нг амплифицированной ДНК используется для одного локуса для праймирования в кПЦР, чтобы определить выход амплификации и однородность амплификации, являющейся следствием системы транспозиции и способа амплификации в каплях эмульсии.
1 мкг амплифицированного ДНК-продукта используется в качестве вводимого количества для получения библиотеки секвенирования Illumine с помощью наборов Illumina TruSeq DNA PCR-free library preparation kits. Вводимую ДНК сначала обрабатывают ультразвуком на соникаторе Covaris и проводят подбор размера, чтобы произвести обогащение фрагментами ДНК с длиной около 300 п.о. Три образца человеческих клеток, SC2, SC3d2 и SC6 загружают в трехполосную систему секвенирования Illumina HiSeq 4000. Около 60G исходных данных получают на образец.
Данные по секвенированию выравнивали относительно эталонного генома человека с помощью Burrows-Wheeler Aligner (BWA). Покрытие определяли путем построения кривой Лоренца по показаниям секвенирования. SNV определяли с помощью SAMtools. Уровень выпадения аллелей (ADO) вычисляли по отношению неустановленных и действительных гетерозиготных SNV в отдельной клетке.
ПРИМЕР VIII
Анализ размера фрагмента ДНК
Согласно одному аспекту получение транспосомы Tn5 и условия реакции транспозиции могли варьировать, чтобы давать в результате фрагменты ДНК разного размера. Эффективность транспозиции Tn5 и плотности вставки могли быть налажены, по желанию, в большом диапазоне. После амплификации геномной ДНК отдельной клетки, как описано в этом документе, более 1 микрограмма продукта амплификации получали в результате амплификации, при этом распределение продукта по размеру было исследовано с помощью DNA BioAnalyzer, результаты показаны на Фиг. 6. Х-ось показывает размер фрагмента, и y-axis – это относительное количество, выраженное интенсивностью флуоресценции с использованием относительных единиц. Два острых пика с обеих сторон изображения – это два резких скачка от ДНК фрагментов в 35 п.о. и 10380 п.о., соответственно. Средняя длина продукта амплификации была 3000 п.о.
Результаты кПЦР с 8 разными локусами в пределах полного генома клеток человека показали очень однородную амплификацию, как показано в Таблице 1 ниже.
Для дальнейшего исследования эффективности амплификации были созданы библиотеки продуктов амплификации от всех трех отдельных клеток и отсеквенированы с покрытием 30X на системе высокопроизводительного секвенирования Illumina. Результаты секвенирования были сопоставлены с эталонным геномом человека с помощью Burrows-Wheeler Aligner (BWA). После анализа получили среднее покрытие 90% эталонного генома человека и средний уровень выпадения аллелей (ADO) 30%, как указано в Таблице 2 ниже, что превосходит существующие на данный момент коммерциализированные наборы для амплификации полного генома отдельной клетки (Таблица 2).
Анализ глубины прочтения, как видно на Фиг. 7, трех отдельных клеток человека, когда полные геномы были амплифицированы с использованием системы транспозиции и способа амплификации в каплях эмульсии, описанного в этом документе, показал весьма равномерную эффективность амплификации в пределах полного генома человека, что является полезным для улучшения разрешения и точности определения вариаций числа копий (CNV).
ПРИМЕР IX
Методы разделения
После амплификации может быть желательным отделение продуктов амплификации, имеющих разную длину, друг от друга, от матрицы и от избыточных праймеров с целью анализа.
В одном варианте осуществления продукты амплификации разделяют с помощью агарозного, агароз-акриламидного или полиакриламидного гель-электрфореза с помощью стандартных методов (Sambrook et al., "Molecular Cloning," A Laboratory Manual, 2d Ed., Cold Spring Harbor Laboratory Press, New York, 13.7-13.9:1989). Методы гель-электрофореза хорошо известны в данной области техники.
Альтернативно, для эффективного разделения могут использоваться хроматографические методы. Существует много видов хроматографии, которые могут использоваться в настоящем раскрытии: адсорбционная, распределительная, ионообменная и молекулярно-ситовая, а также многие специализированные методы, включая колоночную, бумажную, тонкослойную и газовую хроматографию (Freifelder, Physical Biochemistry Applications to Biochemistry and Molecular Biology, 2nd ed. Wm. Freeman and Co., New York, N.Y., 1982). Еще одной альтернативой является захват нуклеиновокислотных продуктов, меченых, например, биотином или антигеном, с помощью зерен, несущих авидин или антитело, соответственно.
Микрофлюидные методы включают разделение на такой платформе как микрокапилляры, включая, например, разработанные ACLARA BioSciences Inc., или LabChip.TM. созданные Caliper Technologies Inc. Эти микрофлюидные подходы требуют всего лишь нанолитры объема образца, в противоположность микролитрам объема, которые требуются для других методов разделения. Миниатюризация некоторых процессов, вовлеченных в генетический анализ, достигается путем использования микрофлюидных устройств. Например, опубликованная PCT заявка № WO 94/05414, в Northrup and White, включенная в описание путем отсылки, сообщает об интегрированном микро-PCR.TM. аппарате для сбора и амплификации нуклеиновых кислот из образца. Патенты США № 5,304,487, 5,296,375, и 5,856,174 описывают прибор и способы, включающие различные обрабатывающие и аналитические операции, вовлеченные в анализ нуклеиновой кислоты, эти работы включаются в описание путем ссылки.
В некоторых вариантах осуществления может быть желательно предоставление дополнительных или альтернативных средств для исследования амплифицированной ДНК. В этих вариантах осуществления предполагается использование набора микрокапилляров для анализа. Электрофорез с помощью набора микрокапилляров, как правило, включает использование тонкого капилляра или канала, который может быть или может не быть наполнен определенной средой для разделения. Электрофорез образца через капилляр обеспечивает профиль разделения, основанный на размере. Электрофорез с помощью набора микрокапилляров, как правило, обеспечивает быстрый способ секвенирования на основе размера, анализ ПЦР-продукта и распределение по величине фрагментов рестрикции. Высокое отношение поверхности к объему этих капилляров допускает применение более сильных электрических полей по всему капилляру без существенного изменения температуры вдоль капилляра, соответственно создавая возможность для более быстрого разделения. Более того, при сочетании с способами конфокальной визуализации эти методы обеспечивают чувствительность порядка аттомолей, которая сравнима с чувствительностью методов секвенирования с использованием радиоактивного мечения. Микропроизводство микрофлюидных устройств, включая микрокапеллярные электрофоретические устройства, подробно обсуждается, например, в Jacobson et al., Anal Chem, 66:1107-1113, 1994; Effenhauser et al., Anal Chem, 66:2949-2953, 1994; Harrison et al., Science, 261:895-897, 1993; Effenhauser et al., Anal Chem, 65:2637-2642, 1993; Manz et al., J. Chromatogr 593:253-258, 1992; и патенте США № 5,904,824, включенных в данный документ путем отсылки. Как правило, эти методы включают фотолитографическое травление каналов микронного размера на диоксиде кремния, оксиде кремния или другом кристаллическом субстрате или чипе, и могут быть легко адаптированы для использования в настоящем раскрытии.
Tsuda et al. (Anal Chem, 62:2149-2152, 1990) описывает прямоугольные капилляры в качестве альтернативы цилиндрическим стеклянным капиллярам. Некоторыми преимуществами этих систем являются их эффективная теплоотдача вследствие большого отношения высоты к ширине и, следовательно, высокого отношения поверхности к объему, и высокой чувствительности обнаружения на оптических режимах детектирования на колонке. Эти каналы плоского разделения способны осуществлять двумерное разделение, при этом одна сила прилагается поперек разделительного канала, а зоны образца детектируют с использованием многоканального матричного детектора.
Во многих способах капиллярного электрофореза капилляры, например, капилляры из кварцевого стекла или протравленные каналы, полученные с помощью механической обработки или отлитые в плоских подложках, заполняются подходящей матрицей для разделения/просеивания. Как правило, целый ряд просеивающих матриц, известных в данной области техники, может использоваться в микрокапиллярах. Примеры таких матриц включают, например, гидроксиэтилцеллюлозу, полиакриламид, агарозу и тому подобное. Как правило, специфическую гелевую матрицу, подвижные буферы и рабочие режимы выбирают с целью максимизирования характеристик разделения при конкретном применении, например, с учетом размера фрагментов нуклеиновых кислот, необходимого разрешения и присутствия нативных или неденатурированных молекул нуклеиновых кислот. Например, подвижные буферы включают денатурирующие реагенты, хаотропные агенты, такие как мочевина, чтобы денатурировать нуклеиновые кислоты в образце.
Масс-спектрометрия предоставляет средство для "взвешивания" отдельных молекул путем ионизации молекул в вакууме и получения их в "летучем" виде путем испарения. Траектории «полета» ионов под влиянием комбинаций электрических и магнитных полей зависят от их индивидуальной массы (m) и заряда (z). Для молекул с низким молекулярным весом масс-спектрометрия является частью обычного набора физико-органических методов исследования и характеризации органических молекул путем определения массы исходного молекулярного иона. В дополнение к этому, при столкновениях этого исходного молекулярного иона с другими частицами (например, атомами аргона), молекулярный ион фрагментируется, образуя вторичные ионы при помощи, так называемой диссоциации, индуцированной столкновениями (CID). Характер/путь фрагментации часто обеспечивает получение подробной информации о структуре. Другие варианты использования методов масс-спектрометрии в данной области техники обсуждаются в Methods in Enzymology, Vol. 193: "Mass Spectrometry" (J. A. McCloskey, editor), 1990, Academic Press, New York.
Вследствие очевидных аналитических преимуществ масс-спектрометрии в обеспечении высокой чувствительности обнаружения, точности измерения массы, подробной информации о структуре посредством CID в сочетании с MS/MS конфигурацией и быстротой, а также передаче данных онлайн на компьютер, наблюдается значительный интерес к использованию масс-спектрометрии для структурного анализа нуклеиновых кислот. Обзоры, обсуждающие эту область, включают (Schram, Methods Biochem Anal, 34:203-287, 1990) и (Crain, Mass Spectrometry Reviews, 9:505-554, 1990), которые включены в описание путем отсылки. Самая большая проблема в применении масс-спектрометрии к нуклеиновым кислотам заключается в трудности испарения этих сильно полярных биополимеров. Вследствие этого "секвенирование" ограничивается синтетическими олигонуклеотидами с низким молекулярным весом посредством определения массы исходного молекулярного иона и с помощью этого подтверждения уже известной последовательности, или альтернативно, подтверждения известной последовательности в ходе возникновения вторичных ионов (фрагментов ионов) при помощи CID в MS/MS конфигурации, используя, в частности, для ионизации и испарения способ бомбардировки быстрыми атомами (FAB масс-спектроскопия) или масс-спектрометрию с плазменной десорбцией (PD масс-спектрометрия). В качестве примера, было описано применение FAB для анализа защищенных димерных блоков для химического синтеза олигодезоксинуклеотидов (Koster et al., Biomedical Environmental Mass Spectrometry 14:111-116, 1987).
Два способа десорбции/ионизации - это электрораспыление/ионо-распыление (ES) и лазерная десорбция/ионизация в присутствии матрицы (MALDI). ES масс-спектроскопия была введена Fenn et al., J. Phys. Chem. 88;4451-59,1984; PCT заявка № WO 90/14148 и варианты ее применения суммируются в обзорных статьях, например, Smith et al., Anal Chem 62:882-89, 1990, и Ardrey, Electrospray Mass Spectrometry, Spectroscopy Europe, 4:10-18, 1992. В качестве масс-анализатора чаще всего используется квадруполь. Определение молекулярных весов в фемтомолярных количествах образца является очень точным благодаря присутствию многочисленных ионных пиков, которые могут использоваться для вычисления массы.
Масс-спектрометрия MALDI, напротив, может быть особенно перспективной, когда в качестве масс-анализатора используется время-пролетная (TOF) конфигурация. MALDI-TOF масс-спектрометрия была введена (Hillenkamp et al., Biological Mass Spectrometry eds. Burlingame and McCloskey, Elsevier Science Publishers, Amsterdam, pp. 49-60, 1990). Поскольку, в большинстве случаев, порождается немного пиков молекулярных ионов при использовании этого способа, масс-спектры, в принципе, выглядят проще по сравнению с ES масс-спектрометрией. ДНК молекулы до молекулярного веса 410,000 дальтон могут быть десорбированы и испарены (Williams et al., Science, 246:1585-87, 1989). В последнее время показано, что использование лазеров инфракрасного диапазона (IR) в этой методике (в противоположность УФ-лазерам) обеспечивают масс-спектры более крупных нуклеиновых кислот, таких как синтетическая ДНК, фрагменты плазмидной ДНК, полученные при помощи рестрикционных ферментов, и транскрипты РНК до размера 2180 нуклеотидов (Berkenkamp et al., Science, 281:260-2, 1998). Berkenkamp также описывает, как образцы ДНК и РНК могут быть проанализированы при ограниченной очистке образца с использованием MALDI-TOF IR.
В японском патенте № 59-131909 описан прибор, который обнаруживает фрагменты нуклеиновой кислоты, выделенные электрофорезом, жидкостной хроматографией или высокоскоростной гель-хроматографией. Масс-спектрометрическое обнаружение достигается путем введения в нуклеиновые кислоты атомов, которые в обычных условиях не встречаются в ДНК, такие как S, Br, I или Ag, Au, Pt, Os, Hg.
Мечение гибридизационных олигонуклеотидных зондов флуоресцентными метками является хорошо известным методом в данной области техники и представляет собой чувствительный, нерадиоактивный метод для облегчения обнаружения гибридизации зондов. Разработанные в последнее время способы детектирования используют процесс переноса энергии флуоресценции (FET) в отличие от прямого детектирования интенсивности флуоресценции для обнаружения гибридизации зонда. FET происходит между донором-флуорофором и красителем-акцептором (который может быть или не быть флюорофором), в том случае, когда спектр поглощения одного (акцептор) перекрывает спектр излучения другого (донор), и два красителя находятся в непосредственной близости. Красители с этими свойствами называются донорно-акцепторными парами красителей или парами красителей с переносом энергии. Возбужденное состояние донорного флуорофора переносится путем резонансного взаимодействия диполь-индуцированного диполя на близлежащий акцептор. Это приводит к тушению флуоресценции донора. В некоторых случаях, если акцептор является также флюорофором, интенсивность его флюоресцеции может увеличиваться. Эффективность переноса энергии является сильно зависимой от дистанции между донором и акцептором, и уравнения, предсказывающие эти взаимоотношения, были разработаны Forster, Ann Phys 2:55-75, 1948. Расстояние между донорным и акцепторным красителями, при котором перенос энергии составляет 50%, называется расстоянием Ферстера (Ro). Другие механизмы тушения флуоресценции также известны в данной области техники, включая, например, перенос заряда и ударное гашение.
Перенос энергии и другие механизмы, которые базируются на взаимодействии двух находящихся в непосредственной близости красителей для получения тушения, являются перспективными средствами для обнаружения или идентификации нуклеотидных последовательностей, так как такие анализы могут проводиться в гомогенных форматах. Форматы гомогенных анализов отличаются от общепринятых анализов гибридизации зонда, которые основываются на обнаружении флюоресценции одной флуорофорной метки, потому что гетерогенные анализы в большинстве случаев требуют дополнительных стадий для разделения гибридизированной метки и свободной метки. Некоторые форматы анализов для FET гибридизации рассматриваются в Nonisotopic DNA Probe Techniques (Academic Press, Inc., pgs. 311-352, 1992).
Гомогенные методы, использующие энергию переноса или другие механизмы тушения флуоресценции для обнаружения амплификации нуклеиновой кислоты, также описаны. Higuchi et al. (Biotechnology 10:413-417, 1992) раскрывает методы обнаружения ДНК-амплификации в реальном времени путем мониторинга повышенной флуоресценции этидия бромида, поскольку он связывается с двухцепочечной ДНК. Чувствительность этого способа ограничена, потому что связывание этидия бромида не является мишень-специфическим, и также детектируются фоновые продукты амплификации. Lee et al. (Nucleic Acids Res 21:3761-3766, 1993) раскрывает метод детектирования в реальном времени, в котором детекторный зонд с двойной меткой расщепляется специфическим образом относительно амплификации мишени в ходе PCR.TM. Детекторный зонд гибридизируется «ниже» праймера амплификации, так что 5'-3' экзонуклеазная активность полимеразы Taq расщепляет детекторный зонд, разделяя два флуоресцентных красителя, которые затем образуют пару переноса энергии. Интенсивность флуоресценции увеличивается, поскольку зонд расщепляется. Опубликованная PCT заявка WO 96/21144 раскрывает непрерывный флуориметрический анализ, в котором опосредованное ферментом расщепление нуклеиновых кислот приводит к повышенной флуоресценции. Перенос энергии флуоресценции предлагается для применения только в контексте способа, использующего отдельную флуоресцентную метку, которая гасится при гибридизации с мишенью.
Сигнальные праймеры или детекторные зонды, которые гибридизируются с целевой последовательностью ниже сайта гибридизации праймеров амплификации, были описаны для использования при обнаружении амплификации нуклеиновых кислот (патент США № 5,547,861). Сигнальный праймер удлиняется полимеразой по аналогии с удлинением праймеров амплификации. Удлинение праймера амплификации замещает продукт удлинения сигнального праймера зависимым от амплификации мишени образом, продуцируя двухцепочечный продукт вторичной амплификации, который может быть обнаружен как показатель амплификации мишени. Продукты вторичной амплификации, полученные от сигнальных праймеров, могут детектироваться посредством целого ряда меток и репортерных групп, сайтов рестрикции в сигнальном праймере, которые расщепляются с образованием фрагментов характерного размера, захватных групп и структурных признаков, таких как тройные спирали и участки распознавания связывающих двухцепочечную ДНК белков.
Многие пары донорно-акцепторных красителей известны в данной области техники и могут использоваться в настоящем раскрытии. Включаются, но не ограничиваются этим: флюоресцеин изотиоцианат (FITC)/тетраметилродамин изотиоцианат (TALIC), молекулярные зонды с FITC/техасский красный.TM., FITC/N-гидрокси сукцинимидил 1-пиренбутират (PYB), FITC/эозин изотиоцианат (EITC), N-гидроксисукцинимидил 1-пиренсульфонат (PYS)/FITC, FITC/родамин X, FITC/тетраметилродамин (TAMRA) и другие. Выбор конкретной донорно-акцепторной пары флуорофоров не является критичным. Для механизмов тушения энергии переноса достаточно, что длина волны излучения донорного флуорофора перекрывала длину волны возбуждения акцептора, т.е., должно иметь место достаточное спектральное наложение между двумя красителями, чтобы обеспечить эффективную энергию переноса, перенос заряда или тушение флуоресценции. P-(диметил аминофенилазо)-бензойная кислота (DABCYL) является нефлуоресцентным акцепторным красителем, который эффективно тушит флуоресценцию от соседнего флуорофора, например, флуоресцеина или 5-(2'-аминоэтил) аминонафталина (EDANS). Любая пара красителей, которая обеспечивает тушение флуоресценции в детекторной нуклеиновой кислоте, подходит для использования в способах раскрытия, независимо от механизма, посредством которого происходит флуоресценция. Оба способа мечения, концевой и внутренний, известны в данной области техники и могут использоваться в обычном порядке для соединения донорного и акцепторного красителей в их соответствующих участках в детекторной нуклеиновой кислоте.
В частности, в настоящем раскрытии рассматривается использование или анализ амплифицированных продуктов с помощью микроматричного анализа и/или технологий ДНК на основе чипа, таких как описанные (Hacia et al., Nature Genet, 14:441-449, 1996) и (Shoemaker et al., Nature Genetics, 14:450-456, 1996). Эти методы включают быстрые и точные количественные методы анализа большого числа генов. При маркировке генов олигонуклеотидами или использовании набора фиксированных зондов, технологии на основе чипа могут использоваться, чтобы выделить целевые молекулы в высокоплотный массив и скринировать эти молекулы на основе гибридизации (Pease et al., Proc Natl Acad Sci USA, 91:5022-5026, 1994; Fodor et al, Nature, 364:555-556, 1993).
Также рассматривается использование BioStar's OIA технологии для количественного анализа амплифицированных продуктов. OIA использует зеркалоподобную поверхность кремниевой подложки в качестве субстрата. Тонкопленочное оптическое покрытие и иммобилизованное антитело прикрепляются к кремниевой подложке. Белый свет, отраженный через покрытие выглядит как золотой фоновый цвет. Этот цвет не изменяется до тех пор, пока толщина оптической молекулярной тонкой пленки не изменится.
Когда положительный образец наносится на подложку, происходит связывание между лигандом и антителом. Когда добавляется субстрат, чтобы завершить увеличение массы, соответствующее изменение цвета от золотистого до багрово-синего происходит в результате утолщения тонкой молекулярной пленки. Метод описан в патенте США № 5,541,057, включенном в описание путем отсылки.
Амплифицированная ДНК может быть оценена количественно с помощью способа ПЦР в реальном времени (Higuchi et al., Biotechnology 10:413-417, 1992). При помощи определения концентрации амплифицированных продуктов, которые получены за то же самое число циклов и находятся в их линейных диапазонах, можно определить относительные концентрации конкретной целевой последовательности в первоначальной смеси ДНК. Целью эксперимента с ПЦР в реальном времени является определение избытка конкретных образцов РНК или ДНК относительно среднего избытка всех молекул РНК или ДНК в образце.
Технология Luminex обеспечивает возможность количественного определения продуктов нуклеиновых кислоты, иммобилизированных на микросферах с цветной маркировкой. Величина биомолекулярной реакции измеряется с помощью второй молекулы, называемой репортером. Молекула-репортер сообщает о степени реакции при присоединении к молекулам на микросферах. Поскольку и микросферы и репортерные молекулы кодируются цветом, цифровая обработка сигналов обеспечивает возможность трансляции сигналов в реальном времени, т.е. количественных данных для каждой реакции. Стандартный метод описан в патенте США № 5,736,303 и 6,057,107, включенном в данное описание путем отсылки.
ПРИМЕР X
Методы идентификации
Продукты амплификации можно визуализировать, для того, чтобы подтвердить амплификацию последовательности(ей) гена(ов)-мишени(ей). Один типичный метод визуализации включает окрашивание геля флюоресцентным красителем, таким как этидия бромид или Vistra Green, и визуализацию при УФ-свете. Альтернативно, если продукты амплификации полностью помечены радио- или флурометрически мечеными нуклеотидами, продукты амплификации можно визуализировать, используя рентгеновскую пленку, или их можно визуализировать под воздействием соответствующего возбуждающего спектра после разделения.
В одном варианте осуществления визуализация обеспечивается опосредованно с использованием зонда нуклеиновой кислоты. После разделения продуктов амплификации меченый зонд нуклеиновой кислоты приводится в контакт с амплифицированными продуктами. Предпочтительно зонд является конъюгированным с хромофором, но может быть радиомеченым. В другом варианте осуществления зонд конъюгируют с партнером по связыванию, таким как антитело или биотин, причем другой член связывающейся пары несет поддающуюся обнаружению молекулу. В других вариантах осуществления зонд включает флуоресцентный краситель или метку. В других вариантах осуществления зонд имеет масс-метку, которая может использоваться для детектирования амплифицированной молекулы. Другие варианты осуществления также рассматривают использование TAQMAN и MOLECULAR BEACON зондов. В других вариантах осуществления могут использоваться методы твердофазного захвата в сочетании со стандартным зондом.
Тип метки, введенной в продукты амплификации ДНК, обуславливается используемым для анализа способом. При использовании капиллярного электрофореза, микрофлюидного электрофореза, разделения посредством ВЭЖХ или ЖХ, используются введенные или интеркалирующие флуоресцентные красители для того, чтобы пометить и обнаружить продукты амплификации. Образцы детектируют в динамическом режиме, в том отношении, что флуоресценция количественно определяется по мере того, как меченые молекулы проходят через детектор. Если для разделения используется какой-либо электрофоретический метод, ВЭЖХ или ЖХ, продукты можно детектировать по поглощению УФ света, присущему ДНК свойству и, следовательно, добавление метки не требуется. Если используется электрофорез в полиакриламидном геле или блочный гель-электрофорез, праймеры для реакций амплификации могут быть помечены флуорофором, хромофором или радиоизотопом, или с помощью соответствующей ферментативной реакции. Ферментативное обнаружение включает связывание фермента с праймером, например, через взаимодействие биотин:авидин, с последующим разделением продуктов амплификации на геле, а затем обнаружение с помощью химической реакции, такой как хемилюминесценция, полученная при помощи люминола. Флуоресцентный сигнал можно контролировать в динамическом режиме. Обнаружение с помощью радиоизотопа или ферментативной реакции требует первоначального разделения с помощью гель-электрофореза с последующим переносом молекул ДНК на твердую подложку (блот) перед анализом. Если делаются блоты, они могут быть проанализированы более одного раза посредством зондирования, обесцвечивания блота (удаления зонда), с последующим повторным зондированием. Если продукты амплификации разделяют с использованием масс-спектрометра, метка не требуется, потому что нуклеиновые кислоты детектируются непосредственно.
Ряд указанных выше методов разделения можно объединять с целью осуществления разделения на основе двух различных свойств. Например, некоторые из ПЦР-праймеров могут быть соединены с молекулой, обеспечивающей аффинный захват, в то время как некоторые праймеры могут быть оставлены немодифицированными. Модификации могут включать модификацию сахара (для связывания на колонке с лектином), гидрофобной группы (для связывания на колонке с обращенной фазой), биотин (для связывания на колонке со стрептавидином) или антиген (для связывания на колонке с антителами). Образцы пропускают через колонку для аффинной хроматографии. Проточную фракцию собирают, и связанную фракцию элюируют (путем химического расщепления, элюирования солевыми растворами и т.д.). Затем каждый образец дополнительно разделяют на фракции, исходя из свойства, например, массы, чтобы идентифицировать отдельные компоненты.
ПРИМЕР XI
Наборы
Материалы и реагенты, необходимые для раскрытого способа амплификации могут содержаться вместе в виде набора. Наборы настоящего раскрытия в большинстве случаев включают, по меньшей мере, транспосому (состоит из фермента транспозазы и транспозона ДНК), нуклеотиды и ДНК-полимеразу, необходимую для осуществления заявленного способа, вместе с набором праймеров, определенным согласно потребности. В предпочтительном варианте осуществления набор также может содержать инструкции в отношении амплификации ДНК из образцов ДНК. Типичными наборами являются наборы, пригодные для амплификации полной геномной ДНК. В каждом случае наборы предпочтительно содержат разные контейнеры для каждого из числа отдельного реагента, фермента или вещества, участвующего в реакции. Каждый агент в большинстве случаев разделяют на аликвоты в своих соответствующих контейнерах. Контейнер набора в большинстве случаев включает, по меньшей мере, один флакон или пробирку. Также могут использоваться флаконы, бутылки и другие контейнерные средства, в которых помещаются и разделяются на аликвоты реагенты. Отдельные контейнеры набора предпочтительно содержат в закрытой оболочке для коммерческой продажи. Подходящие контейнеры большего размера могут включать инжекционные или пластиковые контейнеры, изготовленные выдувным формованием, в которых содержатся требуемые флаконы. Предпочтительно, вместе с набором предоставляются инструкции.
ПРИМЕР XII
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Настоящее раскрытие предоставляет способ амплификации геномной нуклеиновой кислоты, включающий обработку геномной ДНК в водной среде множеством димеров транспозазы, связанной с ДНК-транспозоном, при этом ДНК-транспозон включает сайт связывания транспозазы и специфический сайт связывания праймера для ПЦР, при этом множество димеров связывается с целевыми местоположениями вдоль двухцепочечной нуклеиновой кислоты, и транспозаза расщепляет геномную ДНК на множество фрагментов двухцепочечной геномной ДНК, представляющих библиотеку фрагментов геномной ДНК, при этом каждый фрагмент двухцепочечной геномной ДНК имеет транспозон ДНК, связанный с каждым 5’-концом фрагмента двухцепочечной геномной ДНК, заполнение пропуска между ДНК-транспозоном и фрагментом геномной ДНК с образованием библиотеки продуктов удлинения фрагментов двухцепочечной геномной ДНК, имеющих специфические участки связывания праймеров ПЦР на каждом конце, разделение водной среды на большое количество капель воды в масляной фазе, при этом каждая капля воды включает не более одного фрагмента двухцепочечной геномной ДНК и дополнительно включает реагенты для амплификации, в каждой капле воды амплификацию фрагмента двухцепочечной геномной ДНК для создания ампликонов фрагмента двухцепочечной геномной ДНК в капле воды, при этом амплификация происходит во всех каплях подмножества, и ампликоны собирают из капель воды путем деэмульгирования капель воды.
Настоящее раскрытие предоставляет способ амплификации геномной нуклеиновой кислоты, включающий контактирование геномной ДНК с множеством димеров транспозазы, связанной с транспозоном ДНК, при этом транспозон ДНК содержит сайт связывания транспозазы, необязательную штрихкодовую последовательность и сайт связывания праймера, при этом множество димеров связывается с целевыми местоположениями вдоль двухцепочечной нуклеиновой кислоты, и транспозаза расщепляет геномную ДНК на множество фрагментов двухцепочечной геномной ДНК, предоставляя библиотеку фрагментов геномной ДНК, при этом каждый фрагмент двухцепочечной геномной ДНК имеет транспозон ДНК, связанный с каждым 5’-концом фрагмента двухцепочечной геномной ДНК, заполнение пропуска между транспозоном ДНК и фрагментом геномной ДНК с образованием библиотеки продуктов удлинения фрагментов двухцепочечной геномной ДНК, имеющих участки связывания праймеров на каждом конце, создание подмножества из некоторого количества водяных капель в масляной фазе, при этом каждая водяная капля подмножества включает продукт удлинения фрагмента двухцепочечной геномной ДНК из библиотеки и реагенты для амплификации, в каждой капле подмножества амплификацию фрагмента двухцепочечной геномной ДНК для создания ампликонов фрагмента двухцепочечной геномной ДНК в водяной капле, при этом амплификация происходит во всех каплях подмножества, и сбор ампликонов из водяных капель подмножества. Согласно одному аспекту, геномная ДНК является полной геномной ДНК, полученной из отдельной клетки. Согласно одному аспекту транспозаза представляет собой транспозазу Tn5. Согласно одному аспекту транспозон ДНК включает штрихкодовую последовательность. Согласно одному аспекту транспозон ДНК включает штрихкодовую последовательность, и при этом сайт связывания праймера располагается на 5’-конце транспозона ДНК. Согласно одному аспекту транспозон ДНК включает двухцепочечный сайт связывания Tnp в 19 п.о. и липкий конец, при этом липкий конец включает штрихкодовую последовательность и сайт связывания праймера на 5’-конце липкого конца. Согласно одному аспекту связанные транспозазы удаляют из двухцепочечных фрагментов до заполнения пропуска и удлинения фрагментов двухцепочечной геномной ДНК. Согласно одному аспекту транспозазы являются транспозазами Tn5, входящими в состав транспозона ДНК, при этом ДНК-транспозон включает двухцепочечный сайт связывания Tnp в 19 п.о. и липкий конец, при этом липкий конец включает штрихкодовую последовательность и сайт связывания праймера. Согласно одному аспекту способ дополнительно включает стадию секвенирования ампликонов, собранных из водных капель подмножества. Согласно одному аспекту способ дополнительно включает стадию обнаружения однонуклеотидных вариаций в ампликонах, собранных из водных капель подмножества. Согласно одному аспекту способ дополнительно включает стадию обнаружения вариаций числа копий в ампликонах, собранных из капель воды подмножества. Согласно одному аспекту способ дополнительно включает стадию обнаружения структурных изменений в ампликонах, собранных из капель воды подмножества. Согласно одному аспекту геномная ДНК представляет собой ДНК из пренатальной клетки. Согласно одному аспекту геномная ДНК представляет собой ДНК из раковой клетки. Согласно одному аспекту геномная ДНК представляет собой ДНК из циркулирующей в крови опухолевой клетки. Согласно одному аспекту геномная ДНК представляет собой ДНК из отдельной пренатальной клетки. Согласно одному аспекту геномная ДНК представляет собой ДНК из отдельной раковой клетки. Согласно одному аспекту геномная ДНК представляет собой ДНК из отдельной циркулирующей в крови опухолевой клетки. Согласно одному аспекту множество капель воды в масляной фазе получают путем объединения масла с некоторым объемом водной среды, содержащей библиотеку продуктов удлинения фрагментов двухцепочечной геномной ДНК и реагенты для амплификации, и таким образом, чтобы получить больше капель, чем имеется продуктов удлинения фрагментов двухцепочечной геномной ДНК в библиотеке. Согласно одному аспекту множество капель воды в масляной фазе создается путем объединения масла с некоторым объемом водной среды, содержащей библиотеку продуктов удлинения фрагментов двухцепочечной геномной ДНК и реагенты для амплификации, и таким образом, чтобы получить больше капель, чем имеется продуктов удлинения фрагментов двухцепочечной геномной ДНК в библиотеке, и при этом множество водных капель создается спонтанно. Согласно одному аспекту множество капель воды в масляной фазе создается путем объединения масла с некоторым объемом водной среды, содержащей библиотеку продуктов удлинения фрагментов двухцепочечной геномной ДНК и реагенты для амплификации, и таким образом, чтобы получить больше капель, чем имеется продуктов удлинения фрагментов двухцепочечной геномной ДНК в библиотеке, и при этом множество водных капель создается путем энергичного смешивания масляной фазы и водной среды. Согласно одному аспекту множество капель воды в масляной фазе создается путем объединения масляной фазы и водной среды внутри микрофлюидного чипа. Согласно одному аспекту амплификация фрагментов двухцепочечной геномной ДНК в каждой водной капле подмножества происходит в микрофлюидном чипе. Согласно одному аспекту сайт связывания праймера представляет собой сайт связывания специфического праймера ПЦР. Согласно одному аспекту амплификация, происходящая во всех каплях подмножества, представляет собой ПЦР-амплификацию с использованием последовательности специфического праймера.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ АМПЛИФИКАЦИИ ДНК ДЛЯ СОХРАНЕНИЯ СТАТУСА МЕТИЛИРОВАНИЯ | 2018 |
|
RU2754038C2 |
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ АНАЛИЗА КЛЕТОЧНЫХ КОМПОНЕНТОВ | 2016 |
|
RU2717491C2 |
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ АНАЛИЗА КЛЕТОЧНЫХ КОМПОНЕНТОВ | 2016 |
|
RU2761432C2 |
| ТАГМЕНТАЦИЯ С ПРИМЕНЕНИЕМ ИММОБИЛИЗОВАННЫХ ТРАНСПОСОМ С ЛИНКЕРАМИ | 2018 |
|
RU2783536C2 |
| АНАЛИЗ МНОЖЕСТВА АНАЛИТОВ С ИСПОЛЬЗОВАНИЕМ ОДНОГО АНАЛИЗА | 2019 |
|
RU2824049C2 |
| СИСТЕМА АНАЛИЗА ДЛЯ ОРТОГОНАЛЬНОГО ДОСТУПА К БИОМОЛЕКУЛАМ И ИХ МЕЧЕНИЯ В КЛЕТОЧНЫХ КОМПАРТМЕНТАХ | 2017 |
|
RU2771892C2 |
| ПОЛНОГЕНОМНЫЕ БИБЛИОТЕКИ ОТДЕЛЬНЫХ КЛЕТОК ДЛЯ БИСУЛЬФИТНОГО СЕКВЕНИРОВАНИЯ | 2018 |
|
RU2770879C2 |
| СПОСОБЫ ИНКАПСУЛИРОВАНИЯ ОДИНОЧНЫХ КЛЕТОК, ИНКАПСУЛИРОВАННЫЕ КЛЕТКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2750567C2 |
| СПОСОБЫ И СРЕДСТВА ПОЛУЧЕНИЯ БИБЛИОТЕКИ ДЛЯ СЕКВЕНИРОВАНИЯ | 2019 |
|
RU2815513C2 |
| СПОСОБЫ ИНКАПСУЛИРОВАНИЯ ОДИНОЧНЫХ КЛЕТОК, ИНКАПСУЛИРОВАННЫЕ КЛЕТКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2793717C2 |
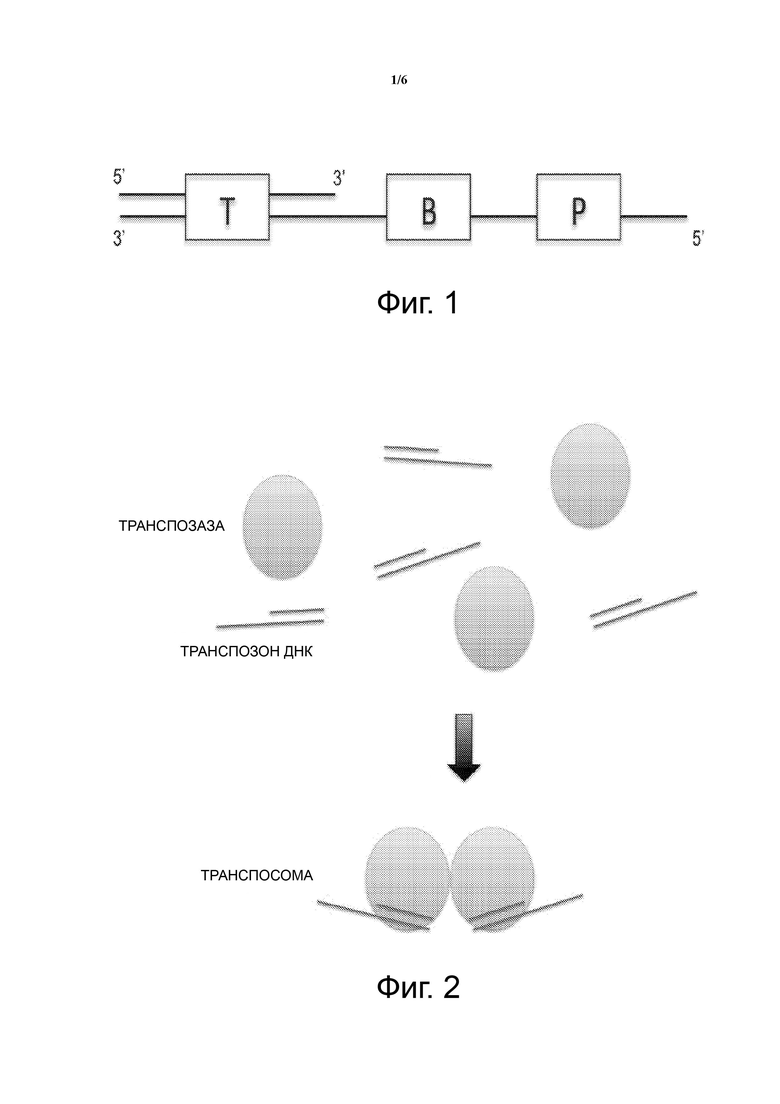
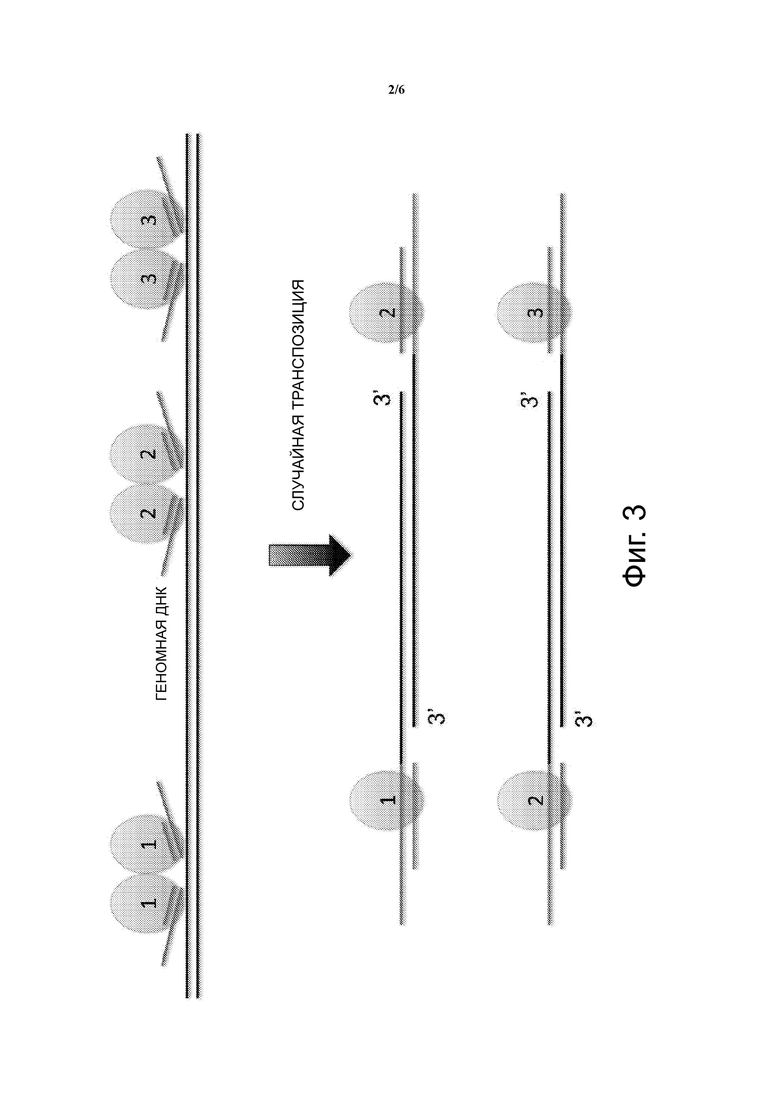
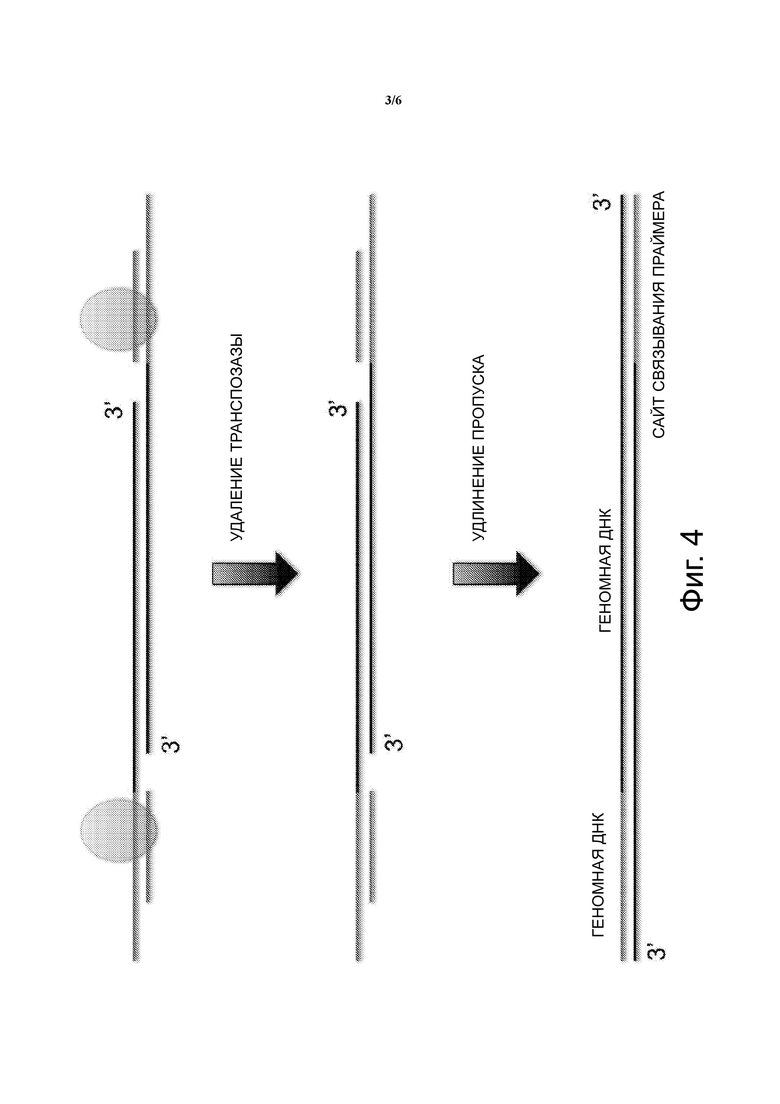
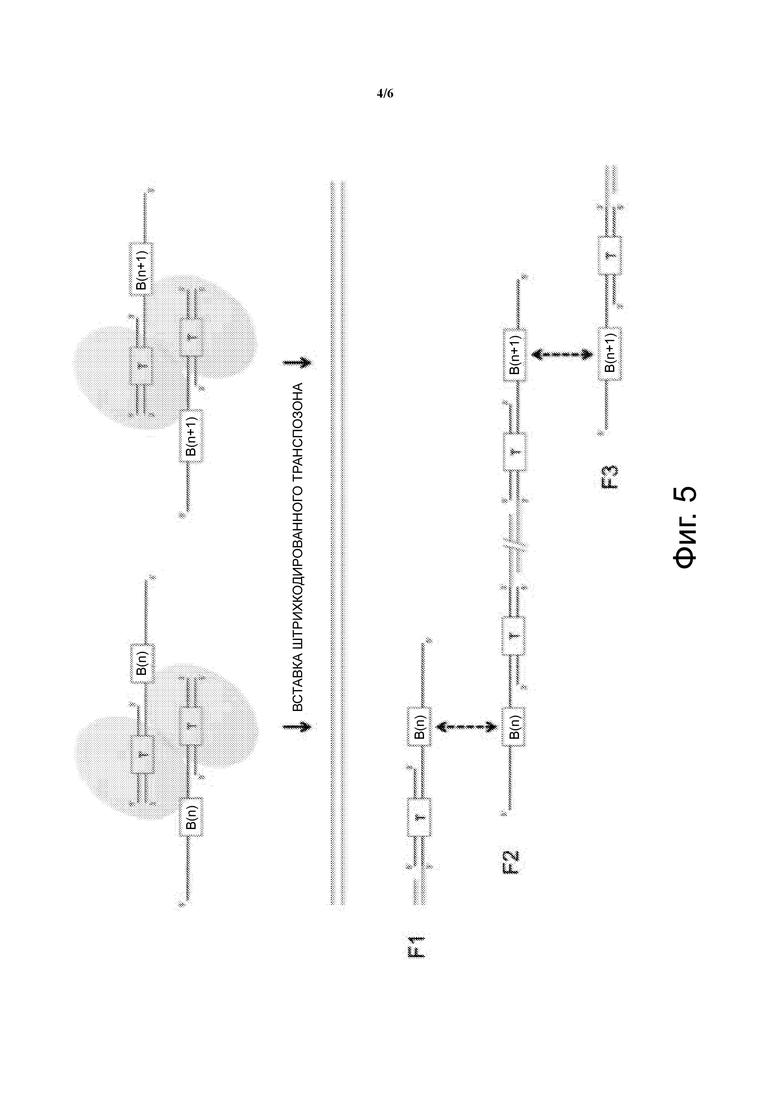
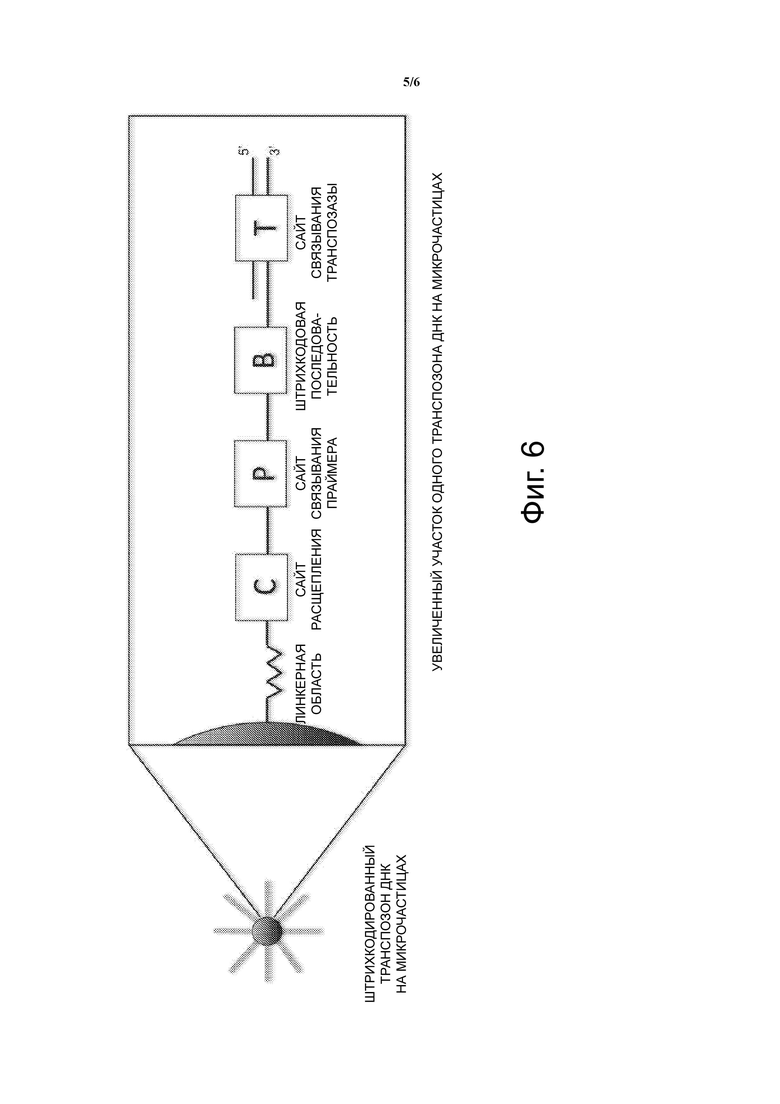
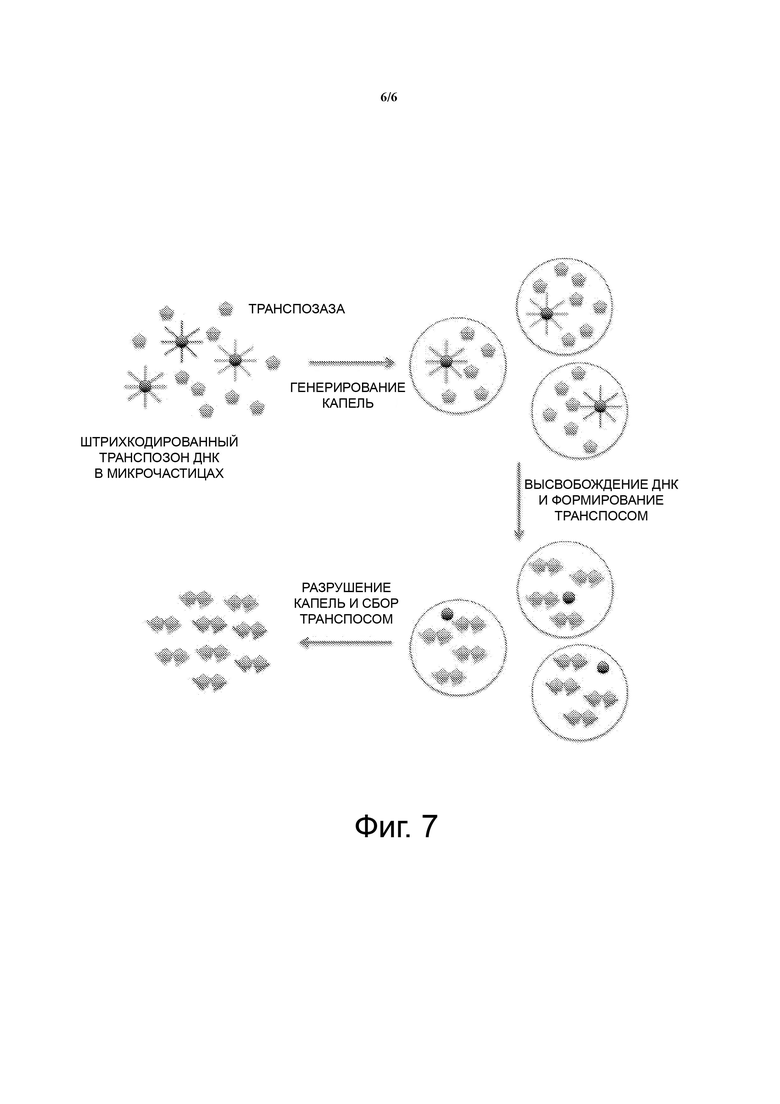
Изобретение относится к биотехнологии и представляет способ амплификации геномной ДНК, например, полного генома, включающий использование системы транспозазы для получения фрагментов геномной ДНК, содержащих участки связывания праймеров, изолирование в масле каждого фрагмента внутри его собственной микрокапли воды вместе с реагентами для ПЦР-амплификации, амплификацию каждого фрагмента внутри его собственной микрокапли воды, деэмульгирование микрокапель с целью получения ампликонов и секвенирование ампликонов. 2 н. и 24 з.п. ф-лы, 7 ил., 2 табл., 9 пр.
1. Способ амплификации геномной нуклеиновой кислоты, включающий
контактирование геномной ДНК с множеством димеров транспозазы, связанной с транспозоном ДНК, при этом транспозон ДНК включает сайт связывания транспозазы, необязательную штрихкодовую последовательность и сайт связывания праймера, при этом множество димеров связывается с целевыми местоположениями вдоль двухцепочечной нуклеиновой кислоты, и транспозаза расщепляет геномную ДНК на множество фрагментов двухцепочечной геномной ДНК, представляющих собой библиотеку фрагментов геномной ДНК, при этом каждый фрагмент двухцепочечной геномной ДНК содержит транспозон ДНК, связанный с каждым 5’-концом двухцепочечного фрагмента геномной ДНК,
заполнение пропуска между ДНК-транспозоном и фрагментом геномной ДНК с образованием библиотеки продуктов удлинения фрагментов двухцепочечной геномной ДНК, имеющих участки связывания праймеров на каждом конце,
создание подмножества водных капель в масляной фазе, при этом каждая водная капля подмножества содержит продукт удлинения фрагмента двухцепочечной геномной ДНК из библиотеки и реагенты для амплификации,
амплификацию фрагмента двухцепочечной геномной ДНК в каждой капле воды из подмножества капель с целью создания ампликонов фрагментов двухцепочечной геномной ДНК в каждой капле воды, причем амплификация происходит во всех каплях подмножества капель, и
сбор ампликонов из подмножества капель воды.
2. Способ по п. 1, согласно которому геномная ДНК является полной геномной ДНК, полученной из одной клетки.
3. Способ по п. 1, согласно которому транспозаза является транспозазой Tn5, транспозазой Mu, транспозазой Tn7 или транспозазой IS5.
4. Способ по п. 1, согласно которому транспозон ДНК включает штрихкодовую последовательность.
5. Способ по п. 1, согласно которому транспозон ДНК включает штрихкодовую последовательность, и при этом сайт связывания праймера находится на 5’-конце транспозона ДНК.
6. Способ по п. 1, согласно которому транспозон ДНК включает двухцепочечный сайт связывания Tnp в 19 п.о. и липкий конец, при этом липкий конец включает штрихкодовую последовательность и сайт связывания праймера на 5’-конце липкого конца.
7. Способ по п. 1, согласно которому связанные транспозазы удаляют из двухцепочечных фрагментов до заполнения пропуска и удлинения фрагментов двухцепочечной геномной ДНК.
8. Способ по п. 1, согласно которому транспозазы представляют собой транспозазы Tn5, каждая из которых образует комплекс с транспозоном ДНК, при этом транспозон ДНК включает двухцепочечный сайт связывания Tnp в 19 п.о. и липкий конец, при этом липкий конец включает штрихкодовую последовательность и сайт связывания праймера.
9. Способ по п. 1, дополнительно включающий стадию секвенирования ампликонов, собранных из подмножества капель воды.
10. Способ по п. 1, дополнительно включающий стадию обнаружения однонуклеотидных вариаций в ампликонах, собранных из подмножества капель воды.
11. Способ по п. 1, дополнительно включающий стадию обнаружения вариаций числа копий в ампликонах, собранных из подмножества капель воды.
12. Способ по п. 1, дополнительно включающий стадию обнаружения структурных изменений в ампликонах, собранных из подмножества капель воды.
13. Способ по п. 1, согласно которому геномная ДНК представляет собой ДНК из пренатальной клетки.
14. Способ по п. 1, согласно которому геномная ДНК представляет собой ДНК из раковой клетки.
15. Способ по п. 1, согласно которому геномная ДНК представляет собой ДНК из циркулирующей в крови опухолевой клетки.
16. Способ по п. 1, согласно которому геномная ДНК представляет собой ДНК из отдельной пренатальной клетки.
17. Способ по п. 1, согласно которому геномная ДНК представляет собой ДНК из отдельной раковой клетки.
18. Способ по п. 1, согласно которому геномная ДНК представляет собой ДНК из отдельной циркулирующей в крови опухолевой клетки.
19. Способ по п. 1, согласно которому множество водных капель в масляной фазе создают путем объединения масла с некоторым объемом водной среды, содержащей библиотеку продуктов удлинения фрагментов двухцепочечной геномной ДНК и реагенты для амплификации, таким образом, чтобы создать больше капель, чем имеется продуктов удлинения фрагментов двухцепочечной геномной ДНК в библиотеке.
20. Способ по п. 1, согласно которому множество водных капель в масляной фазе создают путем объединения масла с некоторым объемом водной среды, содержащей библиотеку продуктов удлинения фрагментов двухцепочечной геномной ДНК и реагенты для амплификации, таким образом, чтобы создать больше капель, чем имеется продуктов удлинения фрагментов двухцепочечной геномной ДНК в библиотеке, и при этом множество водных капель образуется спонтанно.
21. Способ по п. 1, согласно которому множество водных капель в масляной фазе создают путем объединения масла с некоторым объемом водной среды, содержащей библиотеку продуктов удлинения фрагментов двухцепочечной геномной ДНК и реагенты для амплификации, таким образом, чтобы создать больше капель, чем имеется продуктов удлинения фрагментов двухцепочечной геномной ДНК в библиотеке, и при этом множество водных капель создают путем энергичного смешивания масляной фазы и водной среды.
22. Способ по п. 1, согласно которому множество водных капель в масляной фазе создают путем объединения масляной фазы и водной среды внутри микрофлюидного чипа.
23. Способ по п. 1, согласно которому амплификация фрагмента двухцепочечной геномной ДНК в каждой водной капле из множества капель протекает в микрофлюидном чипе.
24. Способ по п. 1, согласно которому сайт связывания праймера является сайтом связывания специфического праймера ПЦР.
25. Способ по п. 1, согласно которому амплификация, происходящая во всех каплях множества капель, является ПЦР-амплификацией с использованием последовательности специфического праймера.
26. Способ амплификации геномной нуклеиновой кислоты, включающий
обработку геномной ДНК в водной среде множеством димеров транспозазы, связанной с транспозоном ДНК, при этом транспозон ДНК включает сайт связывания транспозазы и специфический сайт связывания праймера ПЦР, при этом множество димеров связывается с целевыми местоположениями вдоль двухцепочечной нуклеиновой кислоты, и транспозаза расщепляет геномную ДНК на множество фрагментов двухцепочечной геномной ДНК, представляющих библиотеку фрагментов геномной ДНК, при этом каждый фрагмент двухцепочечной геномной ДНК имеет транспозон ДНК, связанный с каждым 5’-концом фрагмента двухцепочечной геномной ДНК,
заполнение пропуска между транспозоном ДНК и фрагментом геномной ДНК с образованием библиотеки продуктов удлинения фрагментов двухцепочечной геномной ДНК, имеющих специфические участки связывания праймеров ПЦР на каждом конце,
разделение водной среды на большое число водных капель в масляной фазе, при этом каждая водная капля включает не более одного фрагмента двухцепочечной геномной ДНК и дополнительно включает реагенты для амплификации,
амплификацию фрагмента двухцепочечной геномной ДНК в каждой капле воды с целью создания ампликонов фрагментов двухцепочечной геномной ДНК в каждой капле воды, причем амплификация происходит во всех каплях подмножества капель, и
сбор ампликонов из водных капель путем деэмульгирования водных капель.
| Беленький Б | |||
| Г., Комяк Н | |||
| И., Курочкин В | |||
| Е., Евстрапов А | |||
| А., Суханов В | |||
| Л., Микрофлюидные аналитические системы (часть 2), Научное приборостроение, том 10, номер 3, 2000, стр | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Rhee, Minsoung et al., "Digital Droplet Multiple Displacement Amplification (ddMDA) for Whole Genome Sequencing of Limited DNA Samples.", PloS one vol | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
Авторы
Даты
2020-11-16—Публикация
2016-08-31—Подача