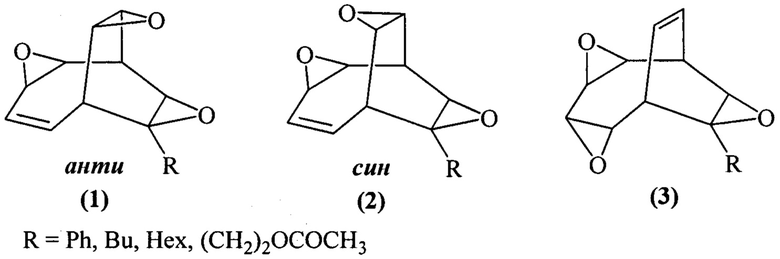
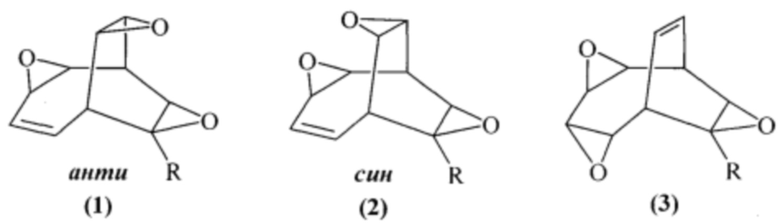
Предлагаемое изобретение относится к способам получения новых полициклических оксирановых соединений, конкретно, к способу получения анти-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-енов формулы (1), син-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-енов формулы (2) и 3,6,10-триоксапентацикло[6.3.2.02,4.05,7.09,11]тридец-12-енов формулы (3):
Указанные соединения относятся к классу оксиранов, используемых при производстве тепло, термо-, хемостойких композиций, лакокрасочных оптически прозрачных материалов, клеев (Smits J., Marx Е., Kooijmans P. et al. Pat. 20030004281 A1 USA. Publ. 2003; Сорокин М.Ф., Шоде Л.Г., Кузьмин А.И. и др. Лакокрасочные материалы и их применение. 1983. №4. С. 4-7). Оксираны находят широкое применение в органическом синтезе, благодаря уникальному строению цикла, позволяющему проводить преобразование с широким диапазоном возможностей под действием реагентов разной природы, к примеру, нуклеофильных агентов (Ю.Н. Беспалько, Е.Н Швед, Н.М. Олейник // Теор. и эспер. Химия. 2008. Т. 44, №5. С. 292-297; М.Ф. Сорокин, Э.Л. Гершанова // Кинетика и катализ. 1967. Т. 8, №3. С. 512-519).
Известен способ (F. Turecek, V. Hanus, P. Sedmera, H. Antropiusova, K. Mach. Cycloheptatriene dimers: new precursors of diamantane // Collection Czechoslovak Chem. Commun., 1981, 46, 1474) получения 8,9:12,13-диэпоксипентацикло[8.4.0.03,704,14.06,11]тетрадекана (4) реакцией эпоксидирования пентацикло[8.4.0.03,7.04,14.06,11]тетрадека-8,12-диена м-хлорнадбензойной кислотой при температуре 0°С в течение 12 ч с выходом 87% по схеме:
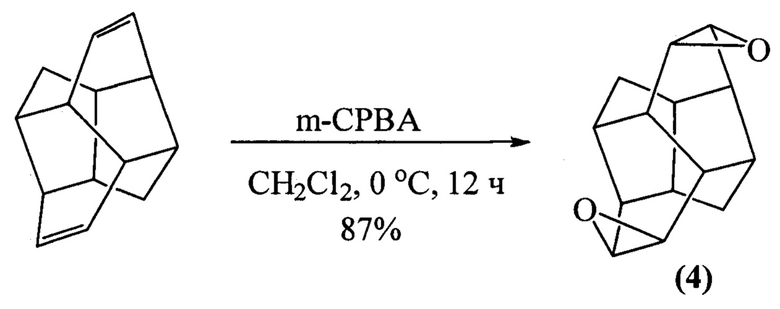
Известным способом не может быть осуществлен синтез анти-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-енов формулы (1), син-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-енов формулы (2) и 3,6,10-триоксапентацикло[6.3.2.02,4.05,7.09,11]тридец-12-енов формулы (3).
Известен способ (N. Toselli, D. Martin, М. Achard, A. Tenaglia, G. Buono. Highly regio- and stereocontrolled formation of functionalized tricyclo[4.2.1.02,8]non-3-enes // J. Org. Chem., 2009, 74, 3783) получения 7,8-эпокси-7-фенил(бутил)бицикло[4.2.1]нона-2,4-диена (5) реакцией эпоксидирования 7-бутил(фенил)бицикло[4.2.1]нона-2,4,7-триена м-хлорнадбензойной кислотой при температуре 0°С за 25 мин:
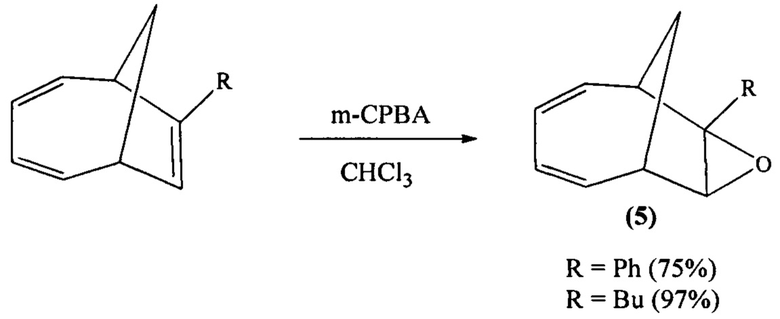
Известным способом не могут быть получены анти-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ены формулы (1), син-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ены формулы (2) и 3,6,10-триоксапентацикло[6.3.2.02,4.05,7.09,11]тридец-12-ены формулы (3).
Таким образом, в литературе отсутствуют сведения по синтезу анти-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-енов формулы (1), син-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-енов формулы (2) и 3,6,10-триоксапентацикло[6.3.2.02,4.05,7.09,11]тридец-12-енов формулы (3).
Предлагается новый способ синтеза анти-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-енов формулы (1), син-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-енов формулы (2) и 3,6,10-триоксапентацикло[6.3.2.02,4.05,7.09,11]тридец-12-енов формулы (3).
Сущность способа заключается во взаимодействии бицикло[4.2.2]дека-2,4,7,9-тетраенов (БДТ) общей формулы (6) (где R=Ph, Bu, Hex, (СН2)2ОСОСН3) с м-хлорнадбензойной кислотой (m-СРВА), при мольном соотношении БДТ : m-СРВА = 2:(10-20), предпочтительно 2:10. Реакцию проводят при температуре 0-40°С. Время реакции 3-23 ч, общий выход целевых продуктов (1), (2), (3) 40-86% в соотношении (1):(2):(3)=1:2:1. В качестве растворителя необходимо использовать дихлорметан.
Реакция протекает по схеме:
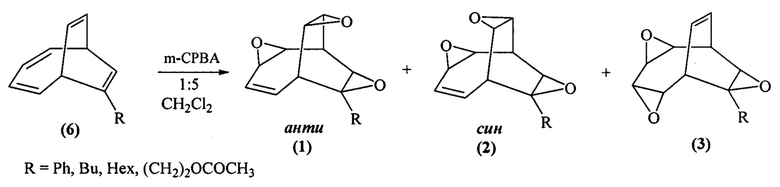
БДТ общей формулы (6) получены по способу, приведенному в работе Dyakonov V.A., Kadikova G.N., Dzhemileva L.U., Gazizullina G.F., Ramazanov I.R., Dzhemilev U.M. // Cobalt-Catalyzed [6+2] Cycloaddition of Alkynes with 1,3,5,7-Cyclooctatetraene as a Key Element in the Direct Construction of Substituted Bicyclo[4.3.1]decanes, J. Org. Chem., 2017, 82(1), 471.
Целевые продукты (1), (2), (3) образуются только лишь с участием бицикло[4.2.2]дека-2,4,7,9-тетраенов и м-хлорнадбензойной кислоты.
Проведение реакции в присутствии м-хлорнадбензойной кислоты больше 20 ммоль на 2 ммоль бицикло[4.2.2]дека-2,4,7,9-тетраена не приводит к увеличению выхода целевых продуктов (1), (2), (3). При использовании м-хлорнадбензойной кислоты в количестве 4 ммоль на 2 ммоль бицикло[4.2.2]дека-2,4,7,9-тетраена оксираны (1), (2), (3) не образуются, так как в данных условиях эпоксидированию подвергается одна двойная связь. Опыты проводили при температуре 0-40°С. При более высокой температуре (например, 40°С) не происходит существенного увеличения выхода целевых продуктов (1), (2), (3). Уменьшение продолжительности реакции (например, 3 ч) приводит к снижению выхода анти-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-енов формулы (1), син-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-енов формулы (2) и 3,6,10-триоксапентацикло[6.3.2.02,4.05,7.09,11]тридец-12-енов формулы (3).
Существенные отличия предлагаемого способа:
1. Способ позволяет синтезировать соединения - анти-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ены формулы (1), син-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ены формулы (2) и 3,6,10-триоксапентацикло[6.3.2.02,4.05,7.09,11]тридец-12-ены формулы (3).
2. Предлагаемый способ базируется на использовании в качестве исходных реагентов бицикло[4.2.2]дека-2,4,7,9-тетраенов и м-хлорнадбензойной кислоты. В известных способах:
- соединение (4) получают с использованием пентацикло[8.4.0.03,7.04,14.06,11]тетрадека-8,12-диена и м-хлорнадбензойной кислоты.
- соединение (5) получают с использованием 7-бутил(фенил)бицикло[4.2.1]нона-2,4,7-триена и м-хлорнадбензойной кислоты.
Предлагаемый способ обладает следующими преимуществами:
1. Способ позволяет получать с высокими выходами пентациклические оксираны анти-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ены формулы (1), син-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ены формулы (2) и 3,6,10-триоксапентацикло[6.3.2.02,4.05,7.09,11]тридец-12-ены формулы (3), синтез которых в литературе не описан.
Способ поясняется следующими примерами:
ПРИМЕР 1. В стеклянную ампулу в атмосфере сухого аргона загружали 0.026 г (0.1 ммоль) Со(асас)2, 0.040 г (0.1 ммоль) 1,2-бис(дифенилфосфино)этана и 0.020 г (0.3 ммоль) цинкового порошка в 1.5 мл C2H4Cl2. Смесь перемешивалась при комнатной температуре 2 минуты. Затем были добавлены 0.125 г (1.2 ммоль) 1,3,5,7-циклооктатетраена, 0.102 г (1.0 ммоль) фенилацетилена, 1.5 мл C2H4Cl2 и 0.064 г (0.2 ммоль) ZnI2. После нагревания при 60°С в течение 20 ч, ампулу вскрывали, содержимое отфильтровывали, легкие растворители удаляли под вакуумом, остаток хроматографировали на колонке SiO2 (элюент - петролейный эфир).
ПРИМЕР 2. В стеклянный реактор при перемешивании загружали 0.41 г (2 ммоль) 7-фенилбицикло[4.2.2]дека-2,4,7,9-тетраена и 30 мл дихлорметана. Смесь охлаждали до 0°С и добавляли 1.73 г (10 ммоль) м-хлонадбензойной кислоты. Реакционную массу перемешивали 3 ч при 0°С и 12 ч при комнатной температуре. Затем добавляли 0.4 г (10 ммоль) гидрокарбоната натрия и перемешивали 1 ч при 0°С. Реакционную смесь промывали 1 М раствором гидроксида натрия (30 мл) и насыщенным раствором хлорида натрия (2×10 мл). Получали анти-8-фенил-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ен (1) (белые пластинчатые кристаллы, Тплав.=161-162°С), син-8-фенил-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ен (2) и 9-фенил-3,6,10-триоксапентацикло[6.3.2.02,4.05,7.09,11]тридец-12-ен (3) (белые игольчатые кристаллы, Тплав.=171-172°С) с общим выходом 84%.
Структура анти-8-фенил-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ена (1) в кристалле приведена на рис. 1. Согласно данным РСА, молекула анти-8-фенил-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ена (1) состоит из бициклического каркаса, в котором эпоксидная группа O(12) анти-ориентирована по отношению к двойной связи С(5)-С(6), в то время как O(9) и O(12) эпоксидные группы син-ориентированы друг относительно друга, при этом плоскость оксиранового фрагмента С(11)-O(12)-С(13) почти параллельна плоскости С(8)-О(9)-С(10) (угол между ними составляет порядка 6.44). Фенильный фрагмент связан с С(8) атомом бициклического каркаса, а двойная связь находится при С(5)-С(6) атомах. Молекулы соединения (1) стабилизированы в кристалле с помощью бифуркатных С(4)-H(4)…O(9)/C-H(phenolic)…O(9) и C-H(phenolic)…O(12)/C(1)-H(1)…O(12), а также трифуркатных С(13)-Н(13)…O(3)/С(7)-Н(7)…O(3)/С(6)-Н(6)…О(3) межмолекулярных взаимодействий. Длина расстояний Н…О в них находится в пределах 2.4-2.8  что меньше суммы ван-дер-ваальсовых радиусов атомов водорода и кислорода. В конечном счете, это приводит к P21/c пространственной группе кристаллической решетки анти-8-фенил-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ена (1).
что меньше суммы ван-дер-ваальсовых радиусов атомов водорода и кислорода. В конечном счете, это приводит к P21/c пространственной группе кристаллической решетки анти-8-фенил-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ена (1).
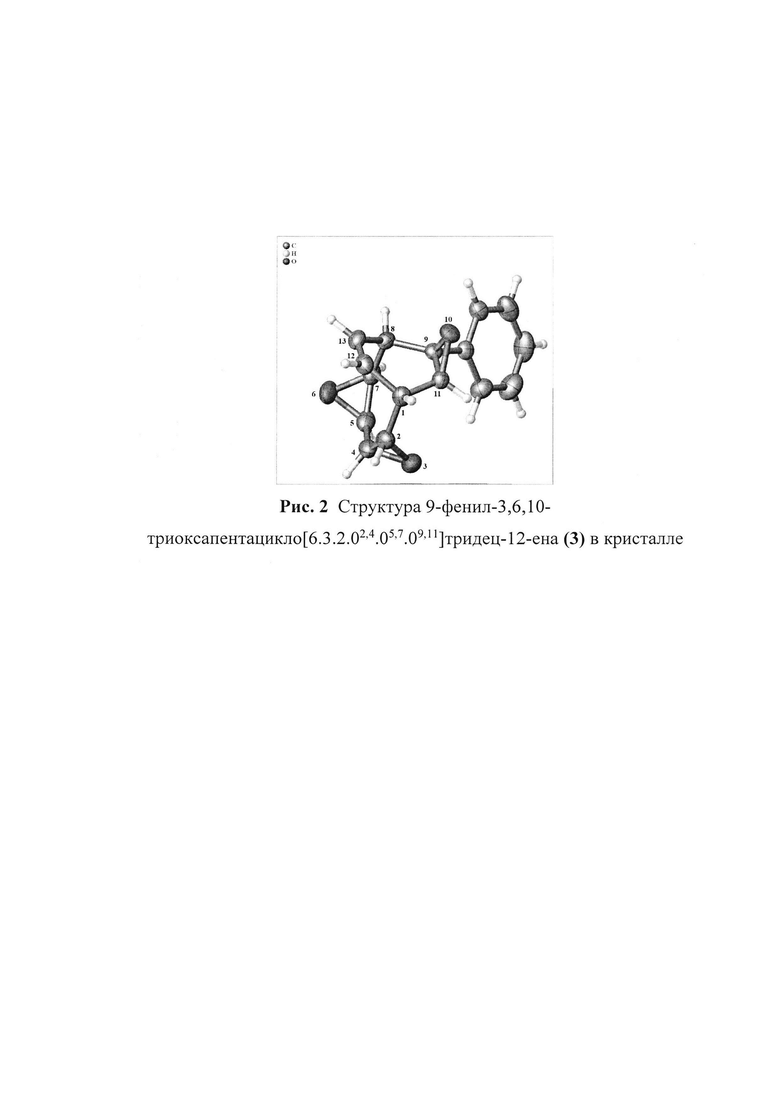
Структура 9-фенил-3,6,10-триоксапентацикло[6.3.2.02,4.05,7.09,11]тридец-12-ена (3) в кристалле приведена на рис. 2. Согласно данным РСА в молекуле 9-фенил-3,6,10-триоксапентацикло[6.3.2.02,4.05,7.09,11]тридец-12-ена (3) двойная связь локализована при С(12)-С(13) атомах бициклического каркаса. Это привело к тому, что О(3) и О(6) атомы стали анти-ориентированными друг относительно друга. Молекулы соединения (3) в кристалле стабилизированы за счет С(7)-Н(7)…О(10), бифуркатных С(3)-Н(3)…O(6)/С(11)-Н(11)…O(6) и трифуркатных C-H(phenolic)…О(3) межмолекулярных взаимодействий, в которых расстояние Н…О варьируется в пределах 2.4-2.8  В результате этого, кристаллы соединения (3) относятся к P21/c пространственной группе.
В результате этого, кристаллы соединения (3) относятся к P21/c пространственной группе.
Спектральные характеристики анти-8-фенил-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ена (1), син-8-фенил-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ена (2) и 9-фенил-3,6,10-триоксапентацикло[6.3.2.02,4.05,7.09,11]тридец-12-ена (3):
Спектр ЯМР 1Н (500 МГц, CDCl3, δ, м.д.) анти-8-фенил-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ена (1): 3.15 (т, 1Н, J=4.0 Гц), 3.30-3.33 (м, 1Н), 3.36 (дд, 1Н, J=6.0 Гц, J=4.0 Гц), 3.45 (т, 1Н, J=2.4 Гц), 3.65 (дд, 1Н, J=6.6 Гц, J=3.9 Гц), 3.69 (дд, 1Н, J=8.7 Гц, J=2.6 Гц), 3.75-3.79 (м, 1Н), 5.82 (дд, 1Н, J=12.4 Гц, J=8.7 Гц), 6.17 (дд, 1Н, J=12.3 Гц, J=6.1 Гц), 7.26-7.34 (м, 3Н), 7.36-7.43 (м, 2Н). Спектр ЯМР 13С (125 МГц, CDCl3, δ, м.д.): 31.0, 37.7, 50.6, 51.3, 52.4, 55.6, 57.4, 61.2, 128.2 (3С), 128.4 (2С), 129.0, 133.2, 139.0.
Спектр ЯМР 1Н (500 МГц, CDCl3, δ, м.д.) син-8-фенил-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ена (2): 3.08 (т, 1Н, J=4.0 Гц), 3.16-3.20 (м, 1Н), 3.35 (дд, 1Н, J=5.5 Гц, J=3.9 Гц), 3.49 (т, 1Н, J=2.5 Гц), 3.66 (дд, 1Н, J=6.2 Гц, J=4.0 Гц), 3.72-3.78 (м, 2Н), 6.07 (дд, 1Н, J=12.3 Гц, J=8.4 Гц), 6.21 (дд, 1Н, J=12.3 Гц, J=5.6 Гц), 7.27-7.35 (м, 5Н). Спектр ЯМР 13С (125 МГц, CDCl3, δ, м.д.): 31.1, 37.8, 49.2, 50.6, 53.1, 56.8, 58.9, 60.3, 127.4 (2С), 128.3 (3С), 129.3, 132.9, 138.7.
Спектр ЯМР 1H (500 МГц, CDCl3, δ, м.д.) 9-фенил-3,6,10-триоксапентацикло[6.3.2.02,4.05,7.09,11]тридец-12-ена (3): 3.04-3.08 (м, 2Н), 3.25 (дд, 1H, J=5.9 Гц, J=4.0 Гц), 3.28 (т, 1Н, J=4.0 Гц), 3.39-3.41 (м, 1Н), 3.66-3.70 (м, 1Н), 3.81-3.85 (м, 1Н), 6.26 (дд, 1Н, J=12.3 Гц, J=8.6 Гц), 6.36 (дд, 1H, J=12.3 Гц, J=6.0 Гц), 7.26-7.45 (м, 5Н). Спектр ЯМР 13С (125 МГц, CDCl3, δ, м.д.): 34.0, 34.3, 50.4, 50.7, 51.5, 57.3, 58.2, 62.0, 127.7 (2С), 128.8 (3С), 130.9, 132.1, 138.1.
Другие примеры, подтверждающие способ, приведены в таблице 1.

ПРИМЕР 3
Оценка противоопухолевой активности эпоксидов общей формулы (1), (2), (3) осуществлена методом проточной цитофлуориметрии, по отношению к трем клеточным линиям: Jurkat, K562 и U937.
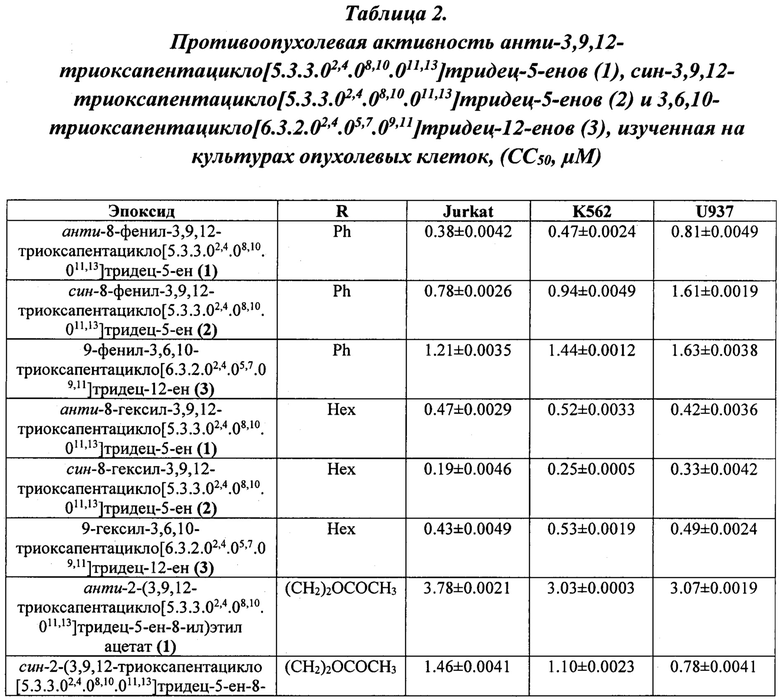
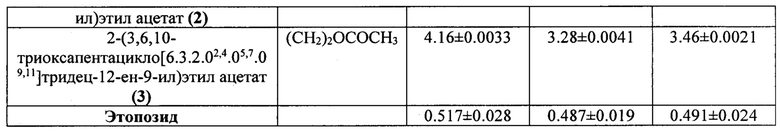
Установлено, что цитотоксическая активность имеет выраженный дозозависимый характер. В целом, значения ингибирующей концентрации СС50, полученные в результате экспозиции исследуемых соединений на упомянутых выше клеточных линиях с последующим окрашиванием клеток красителем 7AAD варьируются в зависимости от клеточной культуры в интервале 0,38-1.63 μМ для эпоксидов, где R=Ph; 0,19-0.53 μM для эпоксидов, где R=Hex; 0,78-4.16 μM для эпоксидов, где R=(СН2)2ОСОСН3. Было установлено, что среди испытанных пентациклических эпоксидов, наиболее высокую противоопухолевую активность на всех используемых клеточных линиях проявил эпоксид син-8-гексил-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ен (2) (R=Hex) (СС50 0.19±0.0046 - 0.33±0.0042 μМ). К тому же син-8-гексил-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ен (2) на всех исследуемых опухолевых клеточных линиях проявляет более высокую цитотоксическую активность по сравнению с этопозидом.
В целом, для исследованных эпоксидов цитотоксическая активность убывает в ряду (СН2)2ОСОСН3 (3) < (СН2)2ОСОСН3 (anti) (1) < Ph (3) < (СН2)2ОСОСН3 (syn) (2) < Ph (syn) (2) < Hex (3) < Ph (anti) (1) < Hex (anti) (1) < Hex (syn) (2), при этом введение метоксикарбонильного заместителя в структуру эпоксида приводит к уменьшению цитотоксичности.
Краткое описание чертежей
Рис. 1. Структура анти-8-фенил-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ена (1) в кристалле.
Согласно данным РСА, молекула анти-8-фенил-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ена (1) состоит из бициклического каркаса, в котором эпоксидная группа O(12) анти-ориентирована по отношению к двойной связи С(5)-С(6), в то время как O(9) и O(12) эпоксидные группы син-ориентированы друг относительно друга, при этом плоскость оксиранового фрагмента С(11)-O(12)-С(13) почти параллельна плоскости С(8)-О(9)-С(10) (угол между ними составляет порядка 6.44). Фенильный фрагмент связан с С(8) атомом бициклического каркаса, а двойная связь находится при С(5)-С(6) атомах. Молекулы соединения (1) стабилизированы в кристалле с помощью бифуркатных С(4)-H(4)…O(9)/C-H(phenolic)…O(9) и C-H(phenolic)…O(12)/C(1)-H(1)…O(12), а также трифуркатных С(13)-Н(13)…O(3)/С(7)-Н(7)…O(3)/С(6)-Н(6)…О(3) межмолекулярных взаимодействий. Длина расстояний Н…О в них находится в пределах 2.4-2.8  что меньше суммы ван-дер-ваальсовых радиусов атомов водорода и кислорода. В конечном счете, это приводит к Р21/с пространственной группе кристаллической решетки анти-8-фенил-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ена (1).
что меньше суммы ван-дер-ваальсовых радиусов атомов водорода и кислорода. В конечном счете, это приводит к Р21/с пространственной группе кристаллической решетки анти-8-фенил-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ена (1).
Рис. 2. Структура 9-фенил-3,6,10-триоксапентацикло[6.3.2.02,4.05,7.09,11]тридец-12-ена (3) в кристалле
Согласно данным РСА в молекуле 9-фенил-3,6,10-триоксапентацикло[6.3.2.02,4.05,7.09,11]тридец-12-ена (3) двойная связь локализована при С(12)-С(13) атомах бициклического каркаса. Это привело к тому, что O(3) и О(6) атомы стали анти-ориентированными друг относительно друга. Молекулы соединения (3) в кристалле стабилизированы за счет С(7)-Н(7)…О(10), бифуркатных С(3)-Н(3)…O(6)/С(11)-Н(11)…O(6) и трифуркатных C-H(phenolic)…O(3) межмолекулярных взаимодействий, в которых расстояние Н…О варьируется в пределах 2.4-2.8  В результате этого, кристаллы соединения (3) относятся к P21/c пространственной группе.
В результате этого, кристаллы соединения (3) относятся к P21/c пространственной группе.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ 3'-ЗАМЕЩЕННЫХ СПИРО[3,9-ДИОКСАТЕТРАЦИКЛО[5.3.2.0.0]ДОДЕЦ-5-ЕН-11,2'-ОКСИРАНОВ] И СПИРО[3,9-ДИОКСАТЕТРАЦИКЛО[5.3.2.0.0]ДОДЕЦ-5-ЕН-12,2'-ОКСИРАНОВ], ПРОЯВЛЯЮЩИХ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 2019 |
|
RU2735664C2 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ 1-АЛКИЛ(ФЕНИЛ)БИЦИКЛО[4.3.1]ДЕКА-2,4,8-ТРИЕН-7,10-ДИОЛОВ И 6-АЛКИЛБИЦИКЛО[4.3.1]ДЕКА-2,4,8-ТРИЕН-7,10-ДИОЛОВ | 2017 |
|
RU2677651C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3,16,19-ТРИОКСАГЕКСАЦИКЛО[10.5.3.0.0.0.0]ИКОС-13-ЕНА, ПРОЯВЛЯЮЩЕГО ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 2019 |
|
RU2726355C1 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ 1-МЕТИЛ-ЗАМЕЩЕННЫХ БИЦИКЛО[4.2.1]НОНА-2,4,7-ТРИЕНОВ, ПРОЯВЛЯЮЩИХ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 2019 |
|
RU2735663C1 |
| СПОСОБ ПОЛУЧЕНИЯ (Е)-БИЦИКЛО[4.2.2]ДЕКА-2,4,7-ТРИЕНОВ | 2015 |
|
RU2605428C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БИЦИКЛО [3.1.0]ГЕКСАНА И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ЭТОЙ ЦЕЛИ | 2004 |
|
RU2388747C2 |
| (22ζ)-6b-МЕТОКСИ-3a,5-ЦИКЛО-5a-ХОЛЕСТАН-24-ОН-22-ОЛ В КАЧЕСТВЕ ПОЛУПРОДУКТА В СИНТЕЗЕ (22R,23R)-3b-АЦЕТОКСИ-22,23-ИЗОПРОПИЛИДЕНДИОКСИ-24-МЕТИЛХОЛЕСТ-5-ЕНА | 1991 |
|
RU2024540C1 |
| СПОСОБ ПОЛУЧЕНИЯ (4Е)-ТРИДЕЦ-4-ЕН-1-ИЛАЦЕТАТА | 2013 |
|
RU2538753C1 |
| Хиральные монотерпеновые сульфинамиды | 2017 |
|
RU2646959C1 |
| ПРОИЗВОДНЫЕ БИЦИКЛО[2,2,1]ГЕПТ-7-ИЛАМИНА И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2442771C2 |

Изобретение относится к способу получения анти-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-енов формулы (1), син-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-енов формулы (2) и 3,6,10-триоксапентацикло[6.3.2.02,4.05,7.09,11]тридец-12-енов формулы (3) , где R=Ph, Bu, Hex, (СН2)2ОСОСН3 который заключается в том, что бицикло[4.2.2]дека-2,4,7,9-тетраены (БДТ) взаимодействуют с м-хлорнадбензойной кислотой (m-СРВА), при мольном соотношении БДТ : m-СРВА = 2 : (10-20), при 0-40°С, в дихлорметане, в течение 3-23 ч. Технический результат – получены новые соединения, которые могут найти применение в медицине в качестве биологически активных веществ, обладающих противоопухолевой активностью. 4 н.п. ф-лы, 2 табл., 10 пр., 2 ил.
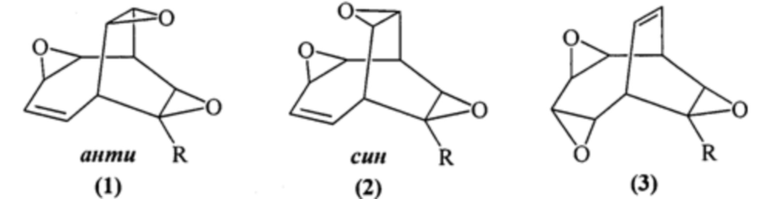
1. Способ совместного получения анти-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-енов формулы (1), син-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-енов формулы (2) и 3,6,10-триоксапентацикло[6.3.2.02,4.05,7.09,11]тридец-12-енов формулы (3),
где R=Ph, Bu, Hex, (СН2)2ОСОСН3,
отличающийся тем, что бицикло[4.2.2]дека-2,4,7,9-тетраены (БДТ) взаимодействуют с м-хлорнадбензойной кислотой (m-СРВА), при мольном соотношении БДТ : m-СРВА = 2:(10-20), при 0-40°С, в дихлорметане, в течение 3-23 ч.
2. Соединение анти-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ен (1), проявляющее противоопухолевую активность.
3. Соединение син-3,9,12-триоксапентацикло[5.3.3.02,4.08,10.011,13]тридец-5-ен (2), проявляющее противоопухолевую активность.
4. Соединение 3,6,10-триоксапентацикло[6.3.2.02,4.05,7.09,11]тридец-12-ен (3), проявляющее противоопухолевую активность.
| Tureček F | |||
| et al.: Collect | |||
| Czech | |||
| Chem | |||
| Commun.,1981, vol.46, no.11, P | |||
| Рефлектор для дуговых ламп | 1924 |
|
SU1474A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭПОКСИДА ДИЦИКЛОПЕНТЕНА (ЭПОКСИДА ТРИЦИКЛО-[5.2.1.0]ДЕЦЕНА-3,9-ОКСАТЕТРАЦИКЛО-[5.3.1.0.0]-УНДЕКАНА) | 2011 |
|
RU2471789C1 |
Авторы
Даты
2020-10-15—Публикация
2019-05-13—Подача