Предлагаемое изобретение относится к области органической химии, конкретно, к способу получения 1-алкил(фенил)бицикло[4.3.1]дека-2,4,8-триен-7,10-диолов формулы (1) и 6-алкилбицикло[4.3.1]дека-2,4,8-триен-7,10-диолов формулы (2):
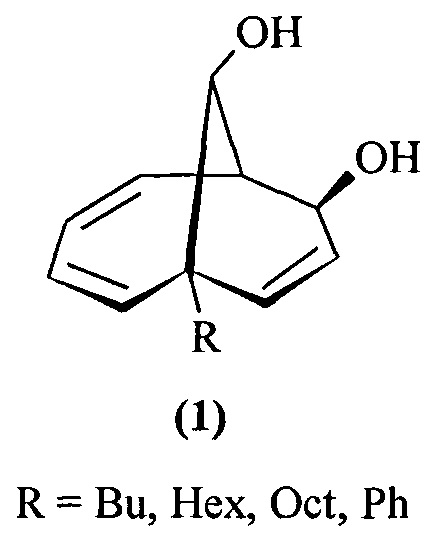
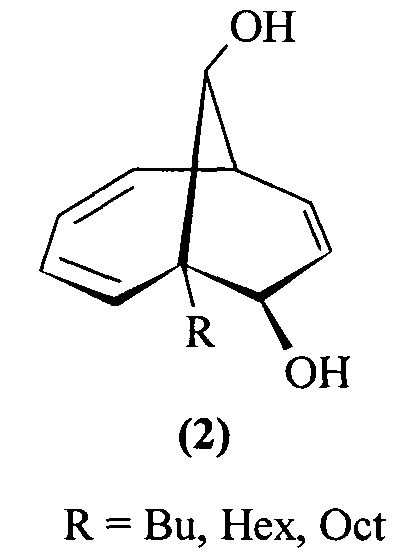
Указанные соединения относятся к классу бициклических углеводородов - производных бицикло[4.3.1]декана, которые выступают в качестве ключевых прекурсоров в синтезе важнейших биологически активных соединений: кариоланов, фомоидрида В, вибсанинов, накафурана-9, флорлидов, паллесценсинов С и Д, проявляющих анти-ВИЧ, противораковую и противобактериальную активность [Scheuer, P.J. Marine Natural Products. Chemical and Biological Perspectives; Academic Press, Inc: New York, USA, 1983; 442 pp; Choudhary, M.I.; Siddiqui, Z.A.; Nawaz, S.A.; Atta-ur-Rahman J. Nat. Prod. 2006, 69, 1429; Dabrah, Т.Т.; Harwood, H.J.; Huang, L.H.; Jankovich, N.D.; Kaneko, Т.; Li, J.-C; Lindsey, S.; Moshier, P.M.; Subashi, T.A.; Therrien, M.; Watts, P.C.J. Antibiot. 1997, 50, 1]
Авторами [В.M. Trost, P.J. McDougall, O. Hartmann, P.T. Wathen J., Asymmetric Synthesis of Bicyclo[4.3.1]decadienes and Bicyclo[3.3.2]decadienes via [6+3] Trimethylenemethane Cycloaddition with Tropones, J. Am. Chem. Soc. 2008, 130, 14960] осуществлен синтез бицикло[4.3.1]декадиенов (6) с помощью реакции [Pd]-катализируемого [6+3] циклоприсоединения триметиленметана к тропону по схеме:
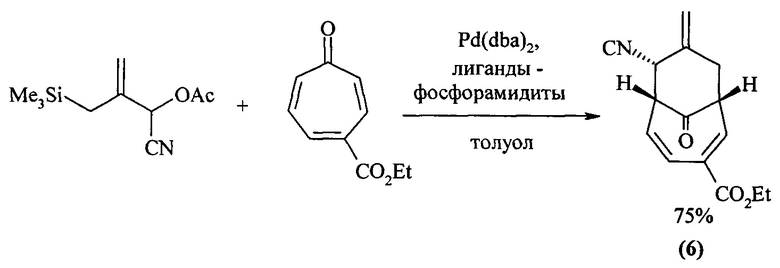
Известным способом не могут быть получены 1-алкил(фенил)бицикло[4.3.1]дека-2,4,8-триен-7,10-диолы (1) и 6-алкилбицикло[4.3.1]дека-2,4,8-триен-7,10-диолы (2).
Известен способ синтеза [G. Schroder, U. Prange, В. Putze, J. Thio, J.F. M. Oth, Uberbruckte Bishomotropylium-Ionen aus Bicyclo[4.3.1]decatrienen, Chem. Ber., 1971, 104, 3406] бицикло[4.3.1]дека-2,4,8-триенов (4), (5) основанный на реакции электрофильной активации двойных связей бицикло[4.2.2]дека-2,4,7,9-тетраена (3) - бромирования и гидробромирования:
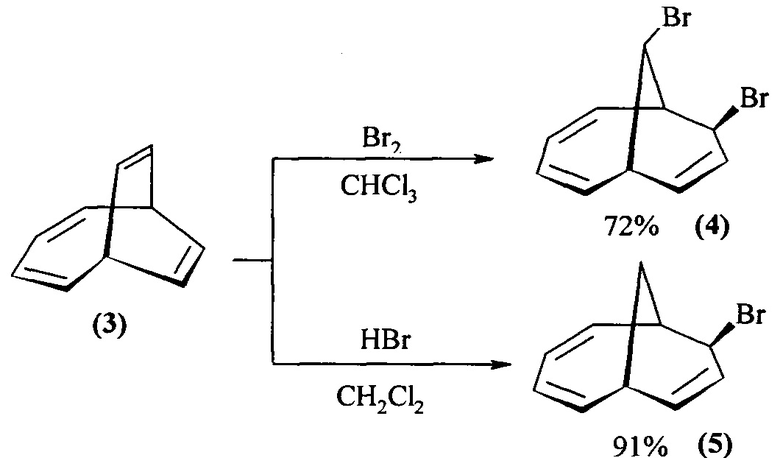
Известным способом не могут быть получены 1-алкил(фенил)бицикло[4.3.1]дека-2,4,8-триен-7,10-диолы (1) и 6-алкилбицикло[4.3.1]дека-2,4,8-триен-7,10-диолы (2).
Таким образом, в литературе отсутствуют сведения по синтезу 1-алкил(фенил)бицикло[4.3.1]дека-2,4,8-триен-7,10-диолов общей формулы (1) и 6-алкилбицикло[4.3.1]дека-2,4,8-триен-7,10-диолов общей формулы (2).
Предлагается способ синтеза 1-алкил(фенил)бицикло[4.3.1]дека-2,4,8-триен-7,10-диолов общей формулы (1) и 6-алкилбицикло[4.3.1]дека-2,4,8-триен-7,10-диолов общей формулы (2).
Сущность способа заключается во взаимодействии 7-алкил(фенил)бицикло[4.2.2]дека-2,4,7,9-тетраенов общей формулы (7) с м-хлорнадбензойной кислотой (m-СРВА), взятых в мольном соотношении 7-алкил(фенил)бицикло[4.2.2]дека-2,4,7,9-тетраен : m-СРВА=10:(14-20), предпочтительно 10:14. Реакция проходит при температуре 0-40°С. Время реакции 3-15 ч, выход целевого продукта 38-82%. В качестве растворителя необходимо использовать дихлорметан.
Реакция протекает по схеме:
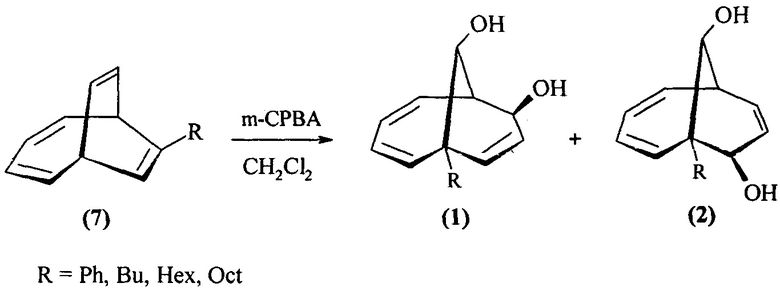
Целевые продукты (1) и (2) образуются только лишь с участием 7-алкил(фенил)бицикло[4.2.2]дека-2,4,7,9-тетраенов и м-хлорнадбензойной кислоты.
Проведение реакции 7-алкил(фенил)бицикло[4.2.2]дека-2,4,7,9-тетраена с м-хлорнадбензойной кислотой, взятых в мольном соотношении бицикло[4.2.2]дека-2,4,7,9-тетраен : m-СРВА=10:20, не приводит к изменению выхода целевых продуктов. При использовании м-хлорнадбензойной кислоты в количестве 30 ммоль на 10 ммоль 7-алкил(фенил)бицикло[4.2.2]дека-2,4,7,9-тетраена целевые продукты (1) и (2) не образуются, так как в данных условиях окислению подвергается более одной двойной связи. Опыты проводили при температуре 0 (3 ч) - 40°С (12 ч). Увеличение температуры реакции до 40°С не приводит к изменению
выхода соединений (1) и (2). Уменьшение продолжительности реакции (например, 3 ч) приводит к снижению выхода целевых продуктов (1) и (2).
Существенные отличия предлагаемого способа: 1. Предлагаемый способ базируется на использовании в качестве исходных реагентов 7-алкил(фенил)бицикло[4.2.2]дека-2,4,7,9-тетраенов и м-хлорнадбензойной кислоты. В известных способах:
- соединения (4) и (5) получают с использованием бицикло[4.2.2]дека-2,4,7,9-тетраена, брома и бромоводорода;
- соединение (6) получают с использованием триметиленметана и тропона.
Предлагаемый способ обладает следующими преимуществами:
1. Способ позволяет получать с высокими выходами 1-алкил(фенил)бицикло[4.3.1]дека-2,4,8-триен-7,10-диолы (1) и 6-алкилбицикло[4.3.1]дека-2,4,8-триен-7,10-диолы (2), синтез которых в литературе не описан.
Способ поясняется следующими примерами:
ПРИМЕР 1. В стеклянный реактор при перемешивании загружали 0.37 г (2 mmol) 7-бутилбицикло[4.2.2]дека-2,4,7,9-тетраена и 46 мл дихлорметана. Смесь охладили до 0°С и добавили 0.69 g (2.8 ммоль) м-хлонадбензойной кислоты. Реакционная масса перемешивалась 3 ч при 0°С и 12 ч при комнатной температуре. Затем добавили 0.34 г (4 ммоль) гидрокарбоната натрия и перемешивали 1 ч при 0°С. Реакционная смесь была промыта 1 М раствором гидроксида натрия (23 мл) и насыщенным раствором хлорида натрия (2×10 мл). Получали 1-бутилбицикло[4.3.1]дека-2,4,8-триен-7,10-диол (1) и 6-бутилбицикло[4.3.1]дека-2,4,8-триен-7,10-диол (2) с общим выходом 80%.
Спектральные характеристики соединений (1) и (2):
Спектр ЯМР 1Н (CDCl3, δ, м.д.) 1-бутилбицикло[4.3.1]дека-2,4,8-триен-7,10-диола (1): 6.12 (дд, J=10.0 Hz, J=5.2 Hz, 1H), 5.74-5.81 (м, 2H), 5.60-5.65 (м, 1Н), 5.55-5.57 (м, 2H), 4.08-4.11 (м, 2Н), 3.27 (д, J=4.3 Hz, 1Н), 1.81-1.88 (м, 1H), 1.36-1.53 (м, 5Н), 0.96 (т, J=7.0 Hz, 3Н).
Спектр ЯМР 13С (CDCl3, δ, м.д.) 1-бутилбицикло[4.3.1]дека-2,4,8-триен-7,10-диола (1): 135.21, 130.61, 130.23, 125.95, 124.71, 123.88, 70.03, 66.51, 47.94, 45.26, 38.95, 25.54, 23.50, 14.09.
Спектр ЯМР 1Н (CDCl3, δ, м.д.) 6-бутилбицикло[4.3.1]дека-2,4,8-триен-7,10-диола (2): 6.17 (ддд, J=9.8 Hz, J=5.5 Hz, J=1.8 Hz, 1H), 5.93-5.97 (м, 1H), 5.87 (дд, J=10.7 Hz, J=7.0 Hz, 1H), 5.80 (дд, J=12.3 Hz, J=6.9 Hz, 1H), 5.49-5.53 (м, 1H), 5.27 (д, J=12.3 Hz, 1H), 3.99 (с, 1H), 3.71 (с, 1H), 3.28 (дд, J=9.0 Hz, J=4.4 Hz, 1H), 2.13-2.19 (м, 1H), 1.51-1.57 (м, 1H), 1.33-1.40 (м, 4H), 0.95 (т, J=5.6 Hz, 3H).
Спектр ЯМР 13C (CDCl3, δ, м.д.) 6-бутилбицикло[4.3.1]дека-2,4,8-триен-7,10-диола (2): 136.44, 129.73, 127.98, 126.22, 123.75, 121.48, 70.84, 70.00, 47.78, 44.85, 34.58, 25.49, 23.53, 14.19.
Другие примеры, подтверждающие способ, приведены в таблице 1.
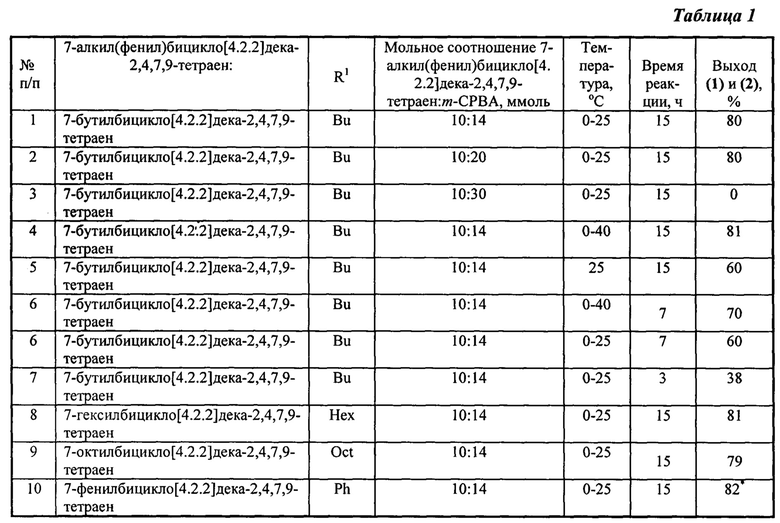
* - образуется только 1-фенилбицикло[4.3.1]дека-2,4,8-триен-7,10-диол формулы (1)
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ АНТИ-3,9,12-ТРИОКСАПЕНТАЦИКЛО[5.3.3.0.0.0]ТРИДЕЦ-5-ЕНОВ, СИН-3,9,12-ТРИОКСАПЕНТАЦИКЛО[5.3.3.0.0.0]ТРИДЕЦ-5-ЕНОВ И 3,6,10-ТРИОКСАПЕНТАЦИКЛО[6.3.2.0.0.0]ТРИДЕЦ-12-ЕНОВ, ПРОЯВЛЯЮЩИХ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 2019 |
|
RU2734346C1 |
| СПОСОБ ПОЛУЧЕНИЯ (Е)-БИЦИКЛО[4.2.2]ДЕКА-2,4,7-ТРИЕНОВ | 2015 |
|
RU2605428C2 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ 3'-ЗАМЕЩЕННЫХ СПИРО[3,9-ДИОКСАТЕТРАЦИКЛО[5.3.2.0.0]ДОДЕЦ-5-ЕН-11,2'-ОКСИРАНОВ] И СПИРО[3,9-ДИОКСАТЕТРАЦИКЛО[5.3.2.0.0]ДОДЕЦ-5-ЕН-12,2'-ОКСИРАНОВ], ПРОЯВЛЯЮЩИХ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 2019 |
|
RU2735664C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3,16,19-ТРИОКСАГЕКСАЦИКЛО[10.5.3.0.0.0.0]ИКОС-13-ЕНА, ПРОЯВЛЯЮЩЕГО ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 2019 |
|
RU2726355C1 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ 1-ГИДРОКСИМЕТИЛ-ЗАМЕЩЕННЫХ БИЦИКЛО[4.2.1]НОНА-2,4,7-ТРИЕНОВ, ПРОЯВЛЯЮЩИХ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 2019 |
|
RU2735661C1 |
| СПОСОБ ПОЛУЧЕНИЯ Si-СОДЕРЖАЩИХ БИЦИКЛО[4.2.1]НОНА-2,4,7-ТРИЕНОВ, ПРОЯВЛЯЮЩИХ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 2018 |
|
RU2726195C2 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ 1-МЕТИЛ-ЗАМЕЩЕННЫХ БИЦИКЛО[4.2.1]НОНА-2,4,7-ТРИЕНОВ, ПРОЯВЛЯЮЩИХ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 2019 |
|
RU2735663C1 |
| СПОСОБ ПОЛУЧЕНИЯ Si-СОДЕРЖАЩИХ БИЦИКЛО[4.2.1]НОНА-2,4,7-ТРИЕНОВ | 2013 |
|
RU2559365C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-СОДЕРЖАЩИХ БИЦИКЛО[4.2.1]НОНА-2,4,7-ТРИЕНОВ, ПРОЯВЛЯЮЩИХ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 2019 |
|
RU2735662C1 |
| ПРОИЗВОДНЫЕ ЭСТРА-1,3,5(10)-ТРИЕНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2139885C1 |
Изобретение относится к способу совместного получения 1-алкилбицикло[4.3.1]дека-2,4,8-триен-7,10-диолов общей формулы (1) и 6-алкилбицикло[4.3.1]дека-2,4,8-триен-7,10-диолов общей формулы (2) или 1-фенилбицикло[4.3.1]дека-2,4,8-триен-7,10-диола:
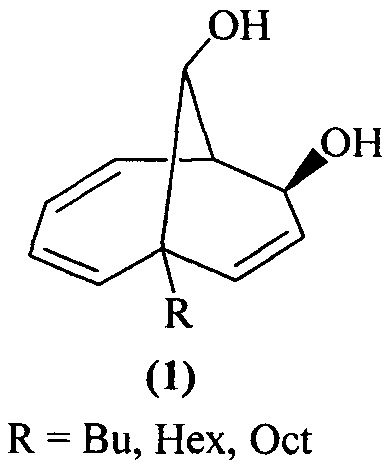
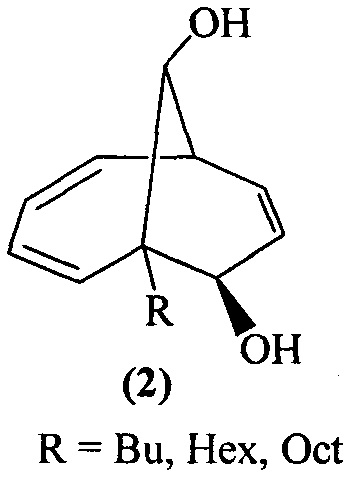 , которые выступают в качестве ключевых прекурсоров в синтезе важнейших биологически активных соединений: кариоланов, фомоидрида В, вибсанинов, накафурана-9, флорлидов, паллесценсинов С и Д, проявляющих анти-ВИЧ, противораковую и противобактериальную активность. Способ заключается в том, что 7-алкилбицикло[4.2.2]дека-2,4,7,9-тетраены общей формулы
, которые выступают в качестве ключевых прекурсоров в синтезе важнейших биологически активных соединений: кариоланов, фомоидрида В, вибсанинов, накафурана-9, флорлидов, паллесценсинов С и Д, проявляющих анти-ВИЧ, противораковую и противобактериальную активность. Способ заключается в том, что 7-алкилбицикло[4.2.2]дека-2,4,7,9-тетраены общей формулы 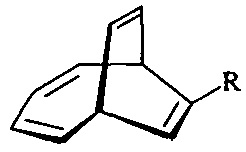 (где R - указанные выше) или 7-фенилбицикло[4.2.2]дека-2,4,7,9-тетраен взаимодействуют с м-хлорнадбензойной кислотой (m-СРВА), при мольном соотношении 7-алкилбицикло[4.2.2]дека-2,4,7,9-тетраен или 7-фенилбицикло[4.2.2]дека-2,4,7,9-тетраен : м-хлорнадбензойная кислота=10:(14-20), при температуре 0-40°С, в дихлорметане в течение 3-15 ч. Предлагаемый способ позволяет получить целевые продукты с выходом 38-82%. 1 табл., 10 пр.
(где R - указанные выше) или 7-фенилбицикло[4.2.2]дека-2,4,7,9-тетраен взаимодействуют с м-хлорнадбензойной кислотой (m-СРВА), при мольном соотношении 7-алкилбицикло[4.2.2]дека-2,4,7,9-тетраен или 7-фенилбицикло[4.2.2]дека-2,4,7,9-тетраен : м-хлорнадбензойная кислота=10:(14-20), при температуре 0-40°С, в дихлорметане в течение 3-15 ч. Предлагаемый способ позволяет получить целевые продукты с выходом 38-82%. 1 табл., 10 пр.
Способ совместного получения 1-алкилбицикло[4.3.1]дека-2,4,8-триен-7,10-диолов общей формулы (1) и 6-алкилбицикло[4.3.1]дека-2,4,8-триен-7,10-диолов общей формулы (2) или 1-фенилбицикло[4.3.1]дека-2,4,8-триен-7,10-диола:
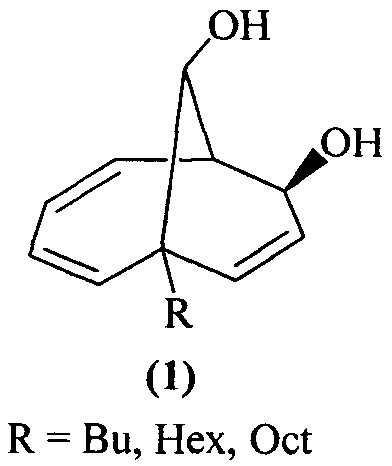
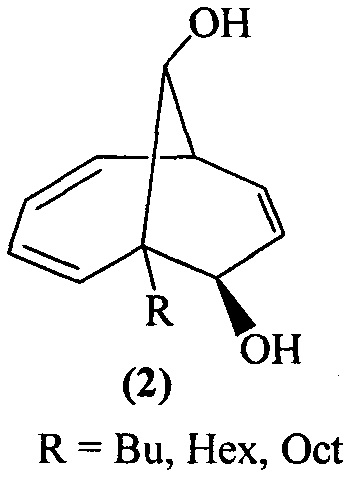
характеризующийся тем, что 7-алкилбицикло[4.2.2]дека-2,4,7,9-тетраены общей формулы 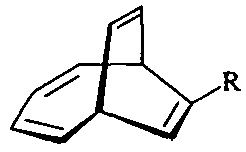 (где R - указанные выше) или 7-фенилбицикло[4.2.2]дека-2,4,7,9-тетраен взаимодействуют с м-хлорнадбензойной кислотой (m-СРВА), при мольном соотношении 7-алкилбицикло[4.2.2]дека-2,4,7,9-тетраен или 7-фенилбицикло[4.2.2]дека-2,4,7,9-тетраен : м-хлорнадбензойная кислота=10:(14-20), при температуре 0-40°С, в дихлорметане в течение 3-15 ч.
(где R - указанные выше) или 7-фенилбицикло[4.2.2]дека-2,4,7,9-тетраен взаимодействуют с м-хлорнадбензойной кислотой (m-СРВА), при мольном соотношении 7-алкилбицикло[4.2.2]дека-2,4,7,9-тетраен или 7-фенилбицикло[4.2.2]дека-2,4,7,9-тетраен : м-хлорнадбензойная кислота=10:(14-20), при температуре 0-40°С, в дихлорметане в течение 3-15 ч.
| V.L.A | |||
| Paquette | |||
| Die charakteristischen Eigenschaften homoaromatischer Systeme | |||
| Angew | |||
| Chem., 1978, 90, 114-123 | |||
| Ю.Н | |||
| Бубнов | |||
| Аллилбораны | |||
| Принципы реагирования и применение в органическом синтезе | |||
| Вестн.Моск.Ун-та | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Химия, 2005, 46(3), 140-154 | |||
| V.A.D’yakonov et al | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Eur.J.Org.Chem., 2015, 20, 4464-4470. | |||
Авторы
Даты
2019-01-18—Публикация
2017-03-29—Подача