Предлагаемое изобретение относится к области медицины, биологии и ветеринарии и может быть использовано для определения кинетики биодеградации полимерных скаффолдов, используемых в тканевой инженерии и регенеративной медицине.
При создании и использовании таких скаффолдов очень важно знать скорость биодеградации (биорезорбции) скаффолда, т.е. процесса его разрушения в организме животных посредством клеточных и ферментативных реакций, а также иметь возможность проанализировать in vivo совокупность явлений, происходящих при взаимодействии материала скаффолда с биологическими жидкостями и тканями в процессе биодеградации.
Известен способ определения кинетики биодеградации полимерных скаффолдов in vivo, включающий получение скаффолда с флуоресцентными метками и его имплантацию в тело животного с последующим возбуждением флуоресценции полимерного скаффолда в теле животного излучением с длинами волн 340, 450 и 572 нм и регистрацией интенсивности флуоресцентного излучения на длинах волн 470, 515 и 629 нм [Патент РФ №2 634 032].
Недостатком предлагаемого способа является то, что возбуждение флуоресценции на указанных длинах волн неизбежно приведет к автофлуоресценции биотканей исследуемого животного, интенсивность которой в зоне хирургического вмешательства и имплантации будет значительной и пространственно неоднородной (предположительно, случайным образом из-за особенностей конкретного случая имплантации). Кроме того, как возбуждающее излучение с указанными длинами волн 340, 450 и 572 нм, так и излучение флуоресценции в спектральных диапазонах 470, 515 и 629 нм будут интенсивно поглощаться и рассеиваться биотканями, неизбежно содержащими гемоглобин и производные порфиринов, так что регистрируемый сигнал будет в основном содержать информацию о явлениях в кожных покровах животного, а не в различных зонах интереса вблизи скаффолда. Поэтому известный способ может дать только грубую оценку скорости биодеградации полимерного скаффолда, но не позволит изучать характер биодеградации скаффолда и реакции окружающих тканей на него.
Задачей предлагаемого изобретения является создание способа определения кинетики и определение характера и кинетики биодеградации скаффолда и реакции окружающих тканей на него, лишенного недостатков прототипа.
Техническим результатом предлагаемого изобретения является повышение информативности определения кинетики биодеградации полимерного скаффолда.
Технический результат достигается тем, что в способе мониторинга биодеградации полимерного скаффолда с флуоресцентной меткой в теле лабораторного животного in vivo, включающем получение скаффолда с флуоресцентной меткой и его имплантацию в тело животного, в качестве флуоресцентной метки используют индоцианиновый зеленый (ICG), который вводят в полимер для получения 0,05-0,15 % масс. содержания ICG в полимере, возбуждение и регистрацию его флуоресценции проводят в ближнем ИК диапазоне, а в процессе мониторинга дополнительно проводят магнитно-резонансную томографию в режиме T2 FSE и затем анализируют МРТ-изображения животного.
Технический результат достигается также тем, что в полимер скаффолда вводят и флуоресцентную метку индоцианиновый зеленый, и хлорид гадолиния с получением в итоге в полимере цитрата гадолиния 0,0001-0,0005% масс, а в процессе мониторинга дополнительно проводят магнитно-резонансную томографию в режиме T1 GRE и затем анализируют МРТ-изображения животного.
Все используемые метки (ICG и производное/соль гадолиния) нетоксичны для мышей и разрешены к использованию в клинической практике.
Предлагаемый способ осуществляют следующим образом.
Для последующего получения скаффолдов синтезируют полимер на основе пентадиола-1,5, пропиленгликоля, янтарной кислоты, и лимонной кислоты в качестве сшивающего агента с получением поли(1,5-пентандиол дисукцинат-со-1,2-пропандиол дисукцинат-со-1,5-пентандиол-со-лимонной кислоты). Для этого последовательно синтезируют мономеры на основе пропиленгликоля и пентандиола; а затем проводят олигомеризацию полиэфирного сополимера. Затем в полученный олигомер добавляют метки таким образом, чтобы они были равномерно распределены в нем, и проводят полимеризацию на ПЭТ-подложке. В качестве меток используют либо только индоцианиновый зеленый (ICG), либо и ICG, и соль гадолиния. Введение меток в олигомер описано в Примере 1.
Для полимеризации подложку с модифицированной олигомерной смолой помещают в чашку Петри и выдерживают в течение ночи для испарения ацетона. На следующий день подложку нагревают до 100°С и выдерживают в течение 1-2 часов, после чего закрывают крышкой и продувают аргоном. Полимеризацию проводят постепенным нагреванием сначала при 140°С в течение 40 минут, а затем при 160°С в течение 30 минут. После полимеризации закрытую чашку Петри охлаждают до комнатной температуры.
Перед процедурой имплантации скаффолда животных визуализируют с применением МРТ и флуоресцентного имиджинга для измерения уровня фона ткани, а также для оценки картины нормальной анатомии тела животных.
Предварительно вырезанные из образца полимера скаффолды диаметром 5 мм и высотой 1 мм±0,1 мм перед имплантацией подвергают стерилизации 80%-ным этанолом в течение 30 мин, далее промывают стерильной водой. Два скаффолда подсаживают подкожно в продольные контралатеральные разрезы на депилированной спине мышей.
Регистрацию флуоресценции индоцианинового зеленого в тканях животных проводят по интенсивности флуоресценции. Для измерений животное размещают на чистой подложке (чашке Петри). Флуоресцентные изображения получают с использованием флуоресцентной аналитической системы iBox (UVP, США) с возбуждением на длине волны 650 нм и регистрацией флуоресценции в диапазоне 787±40 нм (время экспозиции регулируется в диапазоне 10 сек - 2 мин в зависимости от интенсивности флуоресцентного сигнала). Имиджинг животных проводят с кратностью 1 раз в 7-10 дней в течение месяца и /или до полной биодеградации скаффолда. Полученные флуоресцентные изображения обрабатывают в программе Fiji/ImageJ (NIH, США).
Для полуколичественной оценки скорости биодеградации определяют среднюю интенсивность флуоресценции, интегральную плотность сигнала, а также площадь скаффолда. Нормирование флуоресценции ICG на фон/автофлуоресценцию флуоресценции (сигнал с поверхности кожи) при тех же параметрах возбуждения флуоресценции позволяет проводить динамическое наблюдение за изменением сигнала в течение указанного времени, вне зависимости от необходимости использовать различное время экспозиции при регистрации флуоресценции.
Пример конкретного исполнения дан в виде протокола эксперимента (Пример 2).
Магнитно-резонансные (МР) изображения получают с помощью компактной высокопроизводительной системы М3™ МРТ (МРТ M3, Aspect Imaging, Shoham, Израиль), сконструированной на основе высокоэффективного постоянного магнита с напряженностью магнитного поля 1 Тесла с внутренним отверстием 50-150 мм, оборудованной градиентами 440 мТл/м (скорость нарастания 1750 Тл/м/с при токе 60 А). Животных вводят в наркоз газовой смесью кислорода, содержащего 4% изофлурана, в течение 4 мин, далее размещают на подложке съемного манипулятора в интегрированную радиочастотную катушку для тела (длина 50 мм, диаметр 38 мм) и переключают наркозную станцию на подачу газовой смеси в катушку. Для регистрации дыхания и температуры тела используют систему физиологического мониторинга. При МРТ исследовании частота дыхания экспериментального животного поддерживается на уровне 30 дыхательных движений/мин путем регулирования уровня изофлурана в газовой смеси.
МРТ-исследования проводят 1 раз до имплантации скаффолдов, а затем, начиная со второго дня после имплантации, 1 раз в 7-10 дней в течение месяца или до полной деградации скаффолда в аксиальных или саггитальных проекциях.
Регистрацию МР-сигнала для скаффолда, меченого только ICG, проводят в режиме T2w: с использованием системы импульсов быстрого спин эха с Т2-взвешиванием T2w FSE (T2-weigted fast spin echo): TR/TE 4000/42, FOV 40x40 мм, матрица 256x256, ETL 8, NEX 4) на основе контраста между гипоинтенсивной областью скаффолда и менее гипоинтенсивными окружающими скаффолд участками кожи и мышечного слоя.
Изображения МРТ Т2-взвешенных изображений анализируют путем отбора 4-6 томографических срезов толщиной 1 мм. Изменения интенсивности сигнала определяют путем анализа изображений с использованием программы Fiji /ImageJ.
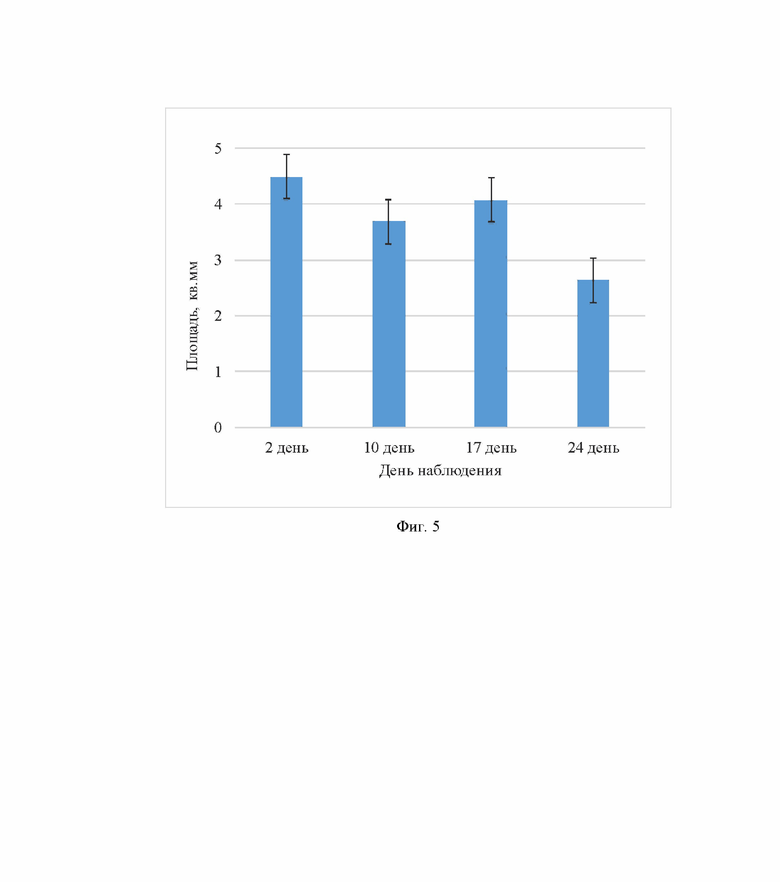
Гипоинтенсивные области, соответствующие скаффолдам, сегментируют с помощью ROI (область интереса) и проводят нормирование интенсивности сигнала в режиме T2w FSE на гауссов шум катушки (SNR- signal to noise ratio). Значения гауссова шума получают на основе выделенных ROI по диагонали по отношению к телу мыши (Фигура 5). На основании полученных данных строят диаграммы, отражающие зависимость площади скаффолдов oт срока наблюдения за их биодеградацией, что представлено на Фиг.6
Пример конкретного исполнения дан в виде протокола эксперимента (Пример 3).
Регистрация магнитно-резонансного сигнала для скаффолда, меченого ICG и цитратом гадолиния, ведется в режиме T1 с использованием системы импульсов 3-мерного градиент эха с Т1 взвешиванием (последовательностей градиентного эха Т1wGRE): TR / TE = 60/ 3 мс, FA 20, NEX 7, FOV 40x40 мм, матрица 256х256) на основе усиленного гадолинием контраста гиперинтенсивной области скаффолда и окружающих тканей животного.
Изображения МРТ Т1wGRE анализируют путем отбора 4-6 томографических срезов толщиной 1 мм. Изменения интенсивности сигнала определяют путем анализа изображений с использованием Fiji/ImageJ. Зависящие от времени изменения интенсивности сигнала рассчитывали с помощью вручную выделенных ROI.
Пример конкретного исполнения дан в виде протокола эксперимента (Пример 4).
ПРИМЕР 1.
Получение полимера скаффолда
К 5 г олигомерной смолы, полученной после олигомеризации мономера, добавляли 10-20 мл ацетона и тщательно перемешивали на магнитной мешалке до полного растворения олигомера. К полученной смеси олигомеров добавляли раствор флуоресцентной метки ICG (1мг) в 0.5 мл смеси ацетона и воды.
В случае одновременнного мечения и флуоресцентной, и парамагнитной меткой вносили как раствор флуоресцентной метки ICG (1мг) в 0.5 мл смеси ацетона и воды, так и водный раствор хлорида гадолиния (12.5 мкмоль) в 0.5 мл воды для получения связанного с сополимером комплекса цитрата гадолиния. Смесь тщательно перемешивали, а затем выливали на подложку из полиэтилентерефталата.
ПРИМЕР 2
Животное - мышь линии BALB/с, самка массой 27 г. В сделанные на спине мышей после депиляции в контрлатеральные разрезы имплантировали два (по одному с каждой стороны от позвоночника) диска-скаффолда диаметром 5 мм, полученные из полимера на основе поли(1,5-пентандиол дисукцинат-со-1,2-пропандиол дисукцинат-со-1,5-пентандиол-со-лимонной кислоты), содержащего в своем составе ICG.
Перед имплантацией и начиная со второго дня после имплантации с периодичностью раз в неделю в течение месяца или до полной деградации скаффолда регистрировали флуоресцентные изображения животного с использованием флуоресцентной аналитической системы iBox (UVP, США) с возбуждением на длине волны 650 нм и регистрацией флуоресценции в диапазоне 787±40 нм (использованное время экспозиции находилось в диапазоне 10 сек - 2 мин в зависимости от интенсивности регистрируемого флуоресцентного сигнала, чтобы избежать насыщения). Полученные флуоресцентные изображения обрабатывали в программе Fiji/ImageJ.
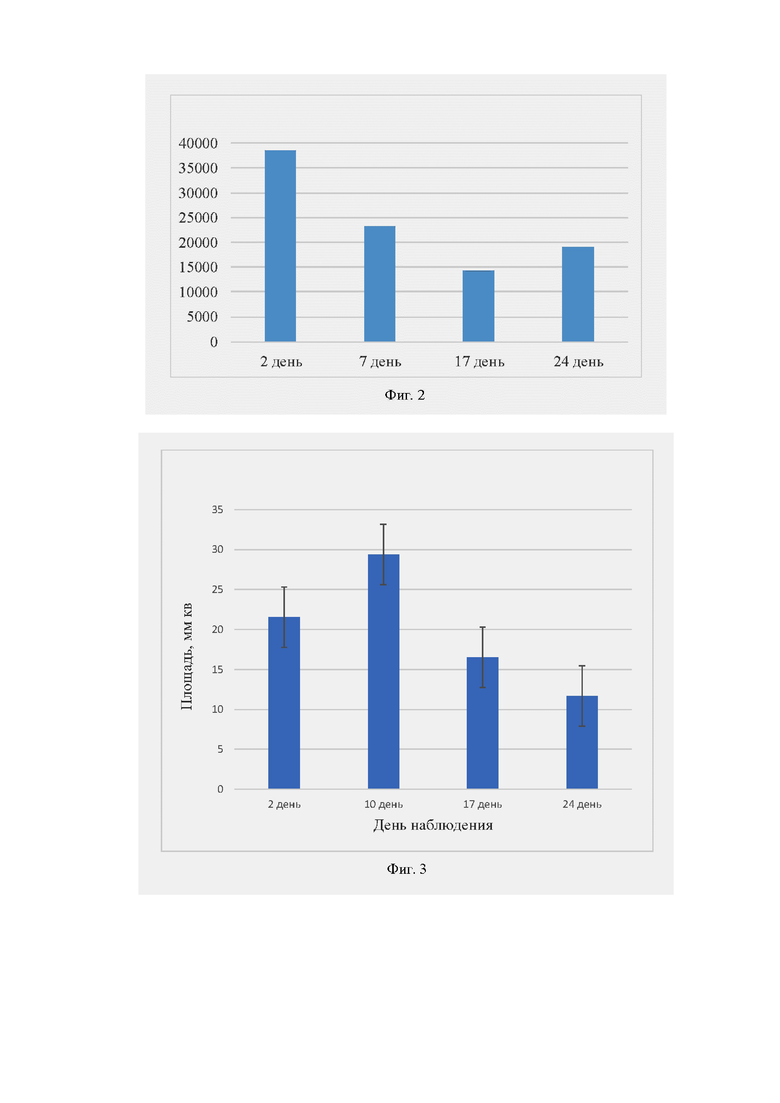
Визуально наблюдалось снижение интенсивности флуоресцентного сигнала в области имплантации скаффолдов и изменение площади полимерных дисков в период наблюдения со 2 по 24 день. Интегральная плотность интенсивности флуоресцентного сигнала снижалась на протяжении всего времени наблюдения. Биодеградация скаффолдов сопровождалась снижением средней интенсивности флуоресценции, что отражало уменьшение количества флуоресцентной метки в образцах.
Наблюдался эффект снижения флуоресценции к 17 дню, что соответствует наблюдаемому увеличению площади начиная с 7 дня (набуханию скаффолдов), приводящему к усилению гидролитических процессов в скаффолде.
После деградации скаффолда, судя по наличию флуоресцентного сигнала в прилегающих к месту имплантации скаффолдов областях, мелкие фрагменты полимера присутствуют в фиброзной ткани.
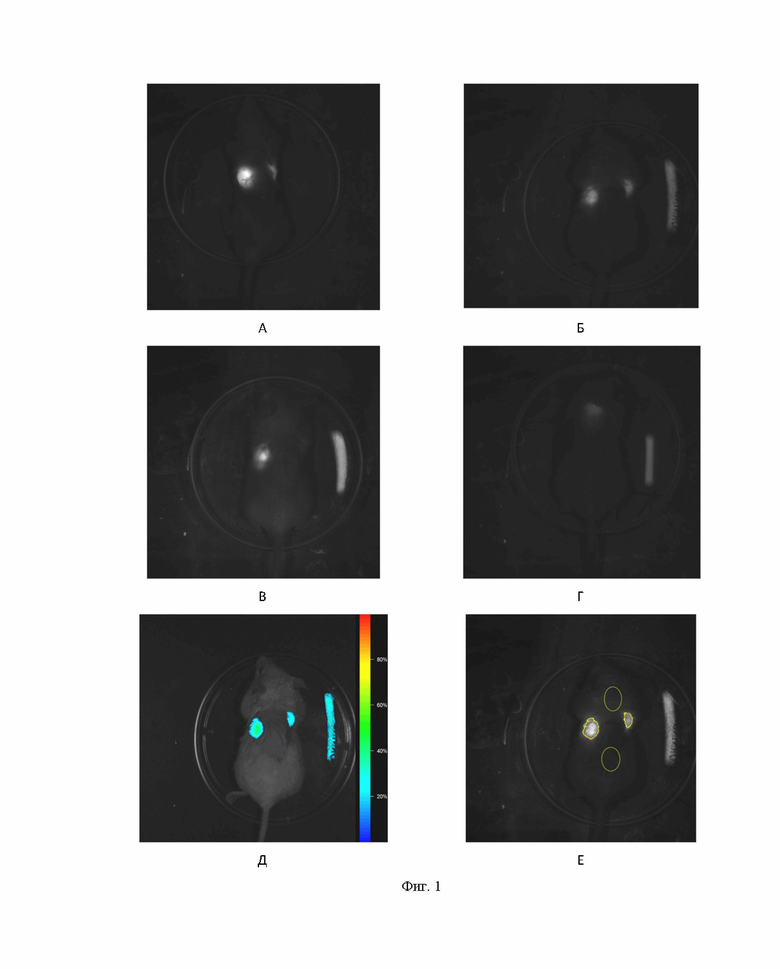
Пример иллюстрируется Фиг. 1, на которых представлены флуоресцентные изображения полимерных скаффолдов, меченых индоцианиновым зеленым, на мышах BALB/c (время экспозиции 30 с).
А - на 2 день после операции ; Б - на 17 день после операции; В - на 24 день после операции; Г - на 31 день после операции; Д - пример получения псевдоцветного изображение с наложением сигналов с экспозиции на 17 день после операции; Е - пример сегментации (выделения ROI - «области интереса») скаффолдов и областей ROI кожного покрова животного для получения соотношения сигнал/шум.
Также пример иллюстрируется Фиг. 2, где представлено изменение средней интенсивности флуоресценции полимерных дисков-скаффолдов, меченых индоцианиновым зеленым, в зависимости от времени, прошедшего после имплантации скаффолдов, на мышах BALB/с. Время экспозиции 30 с.
Также пример иллюстрируется Фиг. 3, где представлено изменение площади полимерных скаффолдов, меченых индоцианиновым зеленым, в зависимости от времени, прошедшем после имплантации скаффолдов, на мышах BALB/с. Площадь рассчитана с помощью программы Fiji/ImageJ по ROI флуоресцентного сигнала. Время экспозиции 30 с.
ПРИМЕР 3
Животное - мышь линии BALB/с, самка массой 27 г. В сделанные на спине мышей после депиляции в контрлатеральные разрезы имплантировали два (по одному с каждой стороны от позвоночника) диска-скаффолда диаметром 5 мм, полученные из полимера на основе поли(1,5-пентандиол дисукцинат-со-1,2-пропандиол дисукцинат-со-1,5-пентандиол-со-лимонной кислоты), содержащего в своем составе ICG.
Магнитно-резонансные изображения получали перед имплантацией и начиная со второго дня после имплантации с периодичностью раз в 7-10 дней в течение месяца или до полной резорбции скаффолда. Магнитно-резонансные изображения получали с помощью компактной высокопроизводительной системы М3™ МРТ (МРТ M3, Aspect Imaging, Shoham, Израиль), сконструированной на основе высокоэффективного постоянного магнита с напряженностью магнитного поля 1 Тесла с внутренним отверстием 50-150 мм, оборудованной градиентами 440 мТл/м (скорость нарастания 1750 Тл/м/с при токе 60 А). Животных вводили в наркоз газовой смесью кислорода, содержащего 4% изофлурана, в течение 4 мин, далее размещали на подложке съемного манипулятора в интегрированную радиочастотную катушку для тела (длина 50 мм, диаметр 38 мм) и переключали наркозную станцию на подачу газовой смеси в катушку. Для регистрации дыхания и температуры тела использовали систему физиологического мониторинга. МРТ проводили, регулируя подачу изофлурана, для поддержания частоты дыхания около 30 дыхательных движений/мин.
Магнитно-резонансная томография (МРТ) использовалась для неинвазивной оценки биодеградации полимерных скаффолдов с использованием системы импульсов быстрого спин-эха с Т2-взвешиванием T2w FSE (T2-weigted fast spin echo): TR/TE 4000/42, FOV 40x40 мм, матрица 256x256, ETL 8, NEX 4) на основе контраста между гипоинтенсивной областью скаффолда и менее гипоинтенсивными окружающими скаффолд участками кожи и мышечного слоя. Измерения проводили 1 раз в 7-10 дней.
МРТ Т2-взвешенных изображений анализировали путем отбора 4-6 томографических срезов толщиной 1 мм. Изменения интенсивности сигнала определяли с помощью анализа изображений в формате TIFF с помощью Fiji /ImageJ.
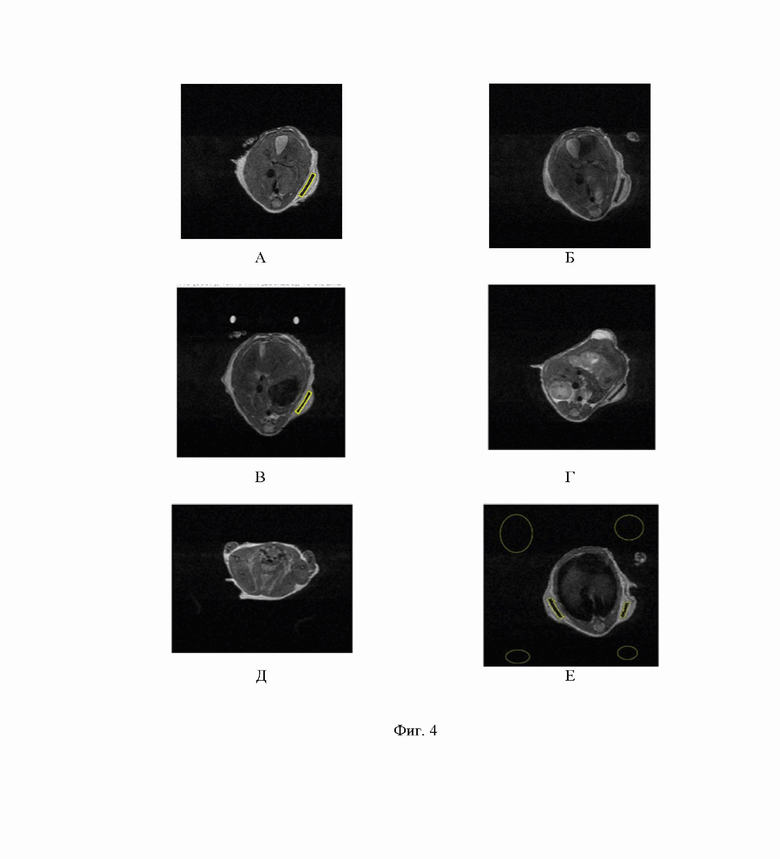
Гипоинтенсивные области, соответствующие скаффолдам, сегментировали (выделяли ROI - «область интереса») и проводили нормирование интенсивности сигнала в режиме T2w FSE на гауссов шум катушки (SNR- signal to noise ratio). Значения гауссова шума получали на основе выделенных ROI по диагонали по отношению к телу мыши. Это проиллюстрировано на Фиг. 4, где представлены изображения МР-срезов полимерных скаффолдов, меченых только ICG, в режиме T2FSE со 2-ого по 31 день после имплантации в аксиальной проекции, демонстрирующие площадь торцевой части скаффолдов, исходно с длиной 5 мм и высотой 1 мм ±0,1 мм. Наблюдалось (Фиг. 4 А-Д), как минимум, 2 группы процессов, связанных с изменением Т2-сигнала. В первые дни наблюдался отек вокруг имплантированного скаффолда, при этом за счет сжатия скаффолда наблюдалось снижение высоты скаффолда (Фиг. 4 А, Б). К 17 - 24 дню наблюдалось уменьшение поперечных размеров скаффолда (Фиг. 4 В, Г).
А - на 2 день после операции; Б - на 17 день после операции; В - на 24 день после операции; Г - на 31 день после операции; Д - пример получения псевдоцветного изображение с наложением сигналов с экспозиции на 17 день после операции; Е - пример сегментации (выделения ROI - «области интереса») скаффолдов и областей ROI кожного покрова животного для получения соотношения сигнал/шум.
На основании полученных данных строили диаграммы, отражающие изменение площади скаффолдов по его поперечным размерам oт срока наблюдения за их биодеградацией, что проиллюстрировано на Фиг.5. К 17 - 24 дню наблюдалось уменьшение поперечных размеров скаффолда и связанного с ней площади, что представлено на диаграмме (Фиг. 5).
ПРИМЕР 4
Животное - мышь линии BALB/с, самка массой 26 г. В контрлатеральные разрезы имплантировали два (по одному с каждой стороны от позвоночника) диска-скаффолда диаметром 5 мм, полученные из полимера на основе поли(1,5-пентандиол дисукцинат-со-1,2-пропандиол дисукцинат-со-1,5-пентандиол-со-лимонной кислоты), содержащего в своем составе ICG и цитрат гадолиния.
Магнитно-резонансные изображения получали перед имплантацией и начиная со второго дня после имплантации с периодичностью раз в 7-10 дней в течение месяца или до полной резорбции скаффолда Магнитно-резонансные изображения получали с помощью компактной высокопроизводительной системы М3™ МРТ (МРТ M3, Aspect Imaging, Shoham, Израиль), которая сконструирована на основе высокоэффективного постоянного магнита с напряженностью магнитного поля 1 Тесла с внутренним отверстием 50-150 мм, оборудованная градиентами 440 мТл/м (скорость нарастания 1750 Тл/м/с при токе 60 А). Животных вводили в наркоз в камере с газовой смесью кислорода с 4% изофлурана в течение 4 мин, далее размещали на подложке съемного манипулятора в интегрированную радиочастотную катушку для тела (длина 50 мм, диаметр 38 мм) и переключали наркозную станцию на подачу газовой смеси в катушку. Для регистрации дыхания и температуры тела использовали систему физиологического мониторинга. МРТ проводили с регулировкой скорости потока изофлурана для поддержания частоты дыхания около 30 дыхательных движений/мин.
Магнитно-резонансная томография (МРТ) использовалась для неинвазивной оценки биодеградации полимерных скаффолдов в режиме Т1, усиленной гадолинием, на основе очевидного контраста гиперинтенсивной области скаффолда и окружающих тканей животного.
Изображения животных с имплантированными скаффолдами, мечеными цитратом гадолиния, были получены с использованием системы импульсов 3-мерного градиентного эха Т1wGRE): TR / TE = 60/ 3 мс, FA 20, NEX 7, FOV 40x40 мм, матрица 256х256. Измерения проводили 1 раз в 7-10 дней.
МРТ Т1wGRE изображений анализировали путем отбора 4-6 томографических срезов толщиной 1 мм. Изменения интенсивности сигнала определяли путем анализа изображений с использованием ПО Fiji/ImageJ.
Пример проиллюстрирован Фиг. 6 и Фиг.7.
На Фиг. 6 наблюдается как минимум 2 группы процессов, связанных с изменением Т1 сигналов. В первые дни наблюдается отек вокруг имплантированного скаффолда, сигнал Т1 незначительно повышен по сравнению с окружающей тканью, скаффолд сохраняет исходный поперечный размер. С 10-ого дня наблюдается рост среднего значения гиперинтенсивного Т1, связанного с диффузией воды в имплантированный скаффолд и сокращением времени релаксации Т1, что приводит к усилению сигнала, и вследствие этого к повышению контрастности изображения T1 в присутствие комплекса гадолиния (Фиг.6 Б-Г). Параллельно с разрушением скаффолда происходит процесс выхода микроскопических частиц скаффолда в окружение скаффолда, что характеризуется нарастанием сигнала Т1 в окружении скаффолда (Фиг.6 Б-Г).
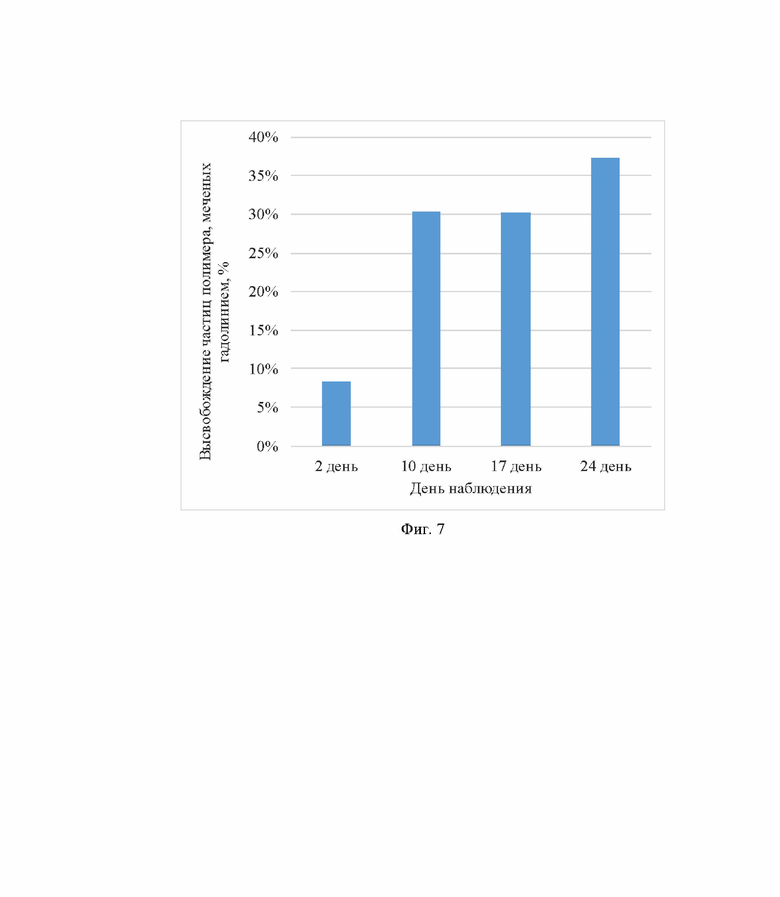
А - на 2 день после операции; Б - на 17 день после операции; В - на 24 день после операции; Г - на 31 день после операции; Д - пример получения псевдоцветного изображение с наложением сигналов с экспозиции на 17 день после операции; Е - пример сегментации (выделения ROI - «области интереса») скаффолдов и областей ROI высвободившихся микроскопических участков скаффолда, усиленных контрастом гадолиния (ROI обведено черным). Путем вычитания результатов интегральной нормированной на шум SNR Т1 более темного участка скаффолда (1) из суммарного МР-сигнал скаффолда и МР-сигнала окружающего участка воспаления (3) можно получить значения высвободившегося гадолиния (2) (ROI обведено черным на Фиг Е), которое можно выразить в % по отношению к суммарному МР-сигналу скаффолда и МР-сигналу окружающего участка воспаления (Фиг. 7)
Таким образом, мечение скаффолдов гадолиниевой меткой позволяет регистрировать кинетику высвобождения микроскопических частиц скаффолда вследствие биодеградации, контраст которых повышен в режиме Т1 при мечении скаффолда комплексом гадолиния цитрата.
Таким образом, предлагаемый способ обеспечивает определение кинетики и выявление особенностей биодеградации полимерного скаффолда, повышая точность и информативность характеризации процесса биодеградации полимерного скаффолда.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения кинетики биодеградации полимерных скаффолдов in vivo | 2016 |
|
RU2634032C1 |
| МОДИФИЦИРОВАННЫЕ ЦИАНИНОВЫЕ КРАСИТЕЛИ И ИХ КОНЪЮГАТЫ | 2020 |
|
RU2833355C2 |
| НОВАЯ МЕТЯЩАЯ КОМПОЗИЦИЯ ДЛЯ РАКОВОГО ПОРАЖЕНИЯ | 2013 |
|
RU2619556C2 |
| ПОЛИМЕРНЫЕ НАНОЧАСТИЦЫ, ПОКРЫТЫЕ ОКСИДОМ МАГНИТНОГО МЕТАЛЛА, И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2472530C2 |
| СПОСОБ IN VIVO ОПРЕДЕЛЕНИЯ БИОСОВМЕСТИМОСТИ СКАФФОЛДОВ ДЛЯ НЕЙРОТРАНСПЛАНТАЦИИ | 2021 |
|
RU2812608C2 |
| СПОСОБ ВИЗУАЛИЗАЦИИ БИОЛОГИЧЕСКИХ ТКАНЕЙ И/ИЛИ ОРГАНОВ | 2019 |
|
RU2735463C1 |
| ИНЪЕКЦИОННАЯ КОМПОЗИЦИЯ ДЛЯ МЕЧЕНИЯ ПОРАЖЕНИЯ | 2017 |
|
RU2717239C1 |
| Способ in vitro определения биосовместимости скаффолдов для нейротрансплантации | 2020 |
|
RU2776455C2 |
| Носитель для трансплантируемых клеток для замещения дефекта, полученного при черепно-мозговой травме | 2016 |
|
RU2659842C2 |
| Способ получения частиц гематита с помощью сильных минеральных кислот | 2020 |
|
RU2770641C1 |

Изобретение относится к области биотехнологии, а именно к способу неинвазивного мониторинга биодеградации полимерного скаффолда с флуоресцентной меткой в теле лабораторного животного in vivo. Для осуществления способа проводят получение скаффолда с флуоресцентной меткой и его имплантацию в тело животного. В качестве флуоресцентной метки в составе полимера используют индоцианиновый зеленый, который вводят в олигомеры, составляющие указанный полимер, для получения 0,05-0,15% масс. содержания индоцианинового зеленого в полимере, возбуждение и регистрацию его флуоресценции проводят в ближнем ИК диапазоне, а в процессе мониторинга дополнительно проводят магнитно-резонансную томографию в режиме T2 FSE и затем анализируют МРТ-изображения животного. Способ обеспечивает повышение точности и информативности определения кинетики биодеградации полимерного скаффолда. 1 з.п. ф-лы, 7 ил.
1. Способ неинвазивного мониторинга биодеградации полимерного скаффолда с флуоресцентной меткой в теле лабораторного животного in vivo, включающий получение скаффолда с флуоресцентной меткой и его имплантацию в тело животного, отличающийся тем, что в качестве флуоресцентной метки в составе полимера используют индоцианиновый зеленый, который вводят в олигомеры, составляющие указанный полимер, для получения 0,05-0,15% масс. содержания индоцианинового зеленого в полимере, возбуждение и регистрацию его флуоресценции проводят в ближнем ИК диапазоне, а в процессе мониторинга дополнительно проводят магнитно-резонансную томографию в режиме T2 FSE и затем анализируют МРТ-изображения животного.
2. Способ по п.1, отличающийся тем, что в полимер скаффолда дополнительно вводят хлорид гадолиния для получения в итоге в полимере 0,0001-0,0005% масс. комплекса хлорида гадолиния, а в процессе мониторинга дополнительно проводят магнитно-резонансную томографию в режиме T1 GRE и затем анализируют МРТ-изображения животного.
| ЛИХОВ А.Р | |||
| и др | |||
| Визуализация имплантов на основе полиэфирных сополимеров методом МРТ, Научный аспект, 23.05.2023, том 12, номер 4, стр | |||
| Прибор для питания паровых котлов помощью резервуара, расположенного выше котла и сообщающегося то с котлом, то с атмосферой | 1925 |
|
SU1511A1 |
| Способ определения кинетики биодеградации полимерных скаффолдов in vivo | 2016 |
|
RU2634032C1 |
| SOON HEE KIM et al | |||
| Near-infrared fluorescence imaging for noninvasive trafficking of scaffold degradation, Sci Rep., 2013, vol | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| HANNA TALACUA et al | |||
Авторы
Даты
2024-12-23—Публикация
2024-01-17—Подача