В настоящем изобретении предложен новый способ получения комплексов рутения и их применение в метатезисе олефинов в качестве предшественников катализаторов и/или катализаторов. Настоящее изобретение находит свое применение в широком спектре путей органического синтеза с участием реакций перекрестного метатезиса (CM) олефинов, реакций метатезиса с замыканием цикла (RCM), реакций метатезиса енинов с замыкания цикла (RCEYM), в реакции метатезиса с диастереоселективной перестройкой цикла (DRRM), при полимеризации олефинов в реакциях метатезисной полимеризации с раскрытием цикла (ROMP) и метатезиса ациклических диенов (ADMET).
За последние несколько лет в органическом синтезе был достигнут значительный прогресс в области метатезиса олефинов [R. H. Grubbs (ed.), A. G. Wenzel (ed.), D. J. O'Leary (ed.), E. Khosravi (ed.), Handbook of Olefin Metathesis, 2nd ed., 3 volumes 2015, John Wiley & Sons, Inc., 1608 pages].
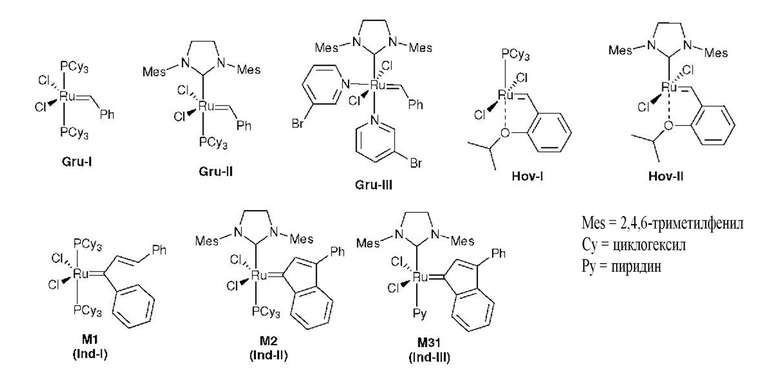
Из уровня техники известны десятки коммерчески доступных карбеновых комплексов рутения, выполняющих функцию предшественников катализаторов и/или катализаторов, характеризующихся как высокой активностью в различных типах реакций метатезиса, так и широкой переносимостью функциональных групп. Вышеупомянутое сочетание свойств определяет пригодность такого типа предшественников катализаторов и/или катализаторов в органическом синтезе. Наиболее широко известными из литературы комплексами рутения в реакциях метатезиса олефинов являются комплексы рутения Граббса 1-го, 2-го и 3-го поколения (Gru-I, Gru-II и Gru-III), комплексы Ховейды (Hov-I и Hov-II) и инденилиденовые комплексы (Ind-I, Ind-II и Ind-III) [Grubbs et al. Chem. Rev. 2010, 110, 1746-1787; Nolan et al. Chem. Commun. 2014, 50, 10355-10375]. В других случаях большинство каталитических структур для метатезиса олефинов являются производными от вышеупомянутых комплексов рутения.
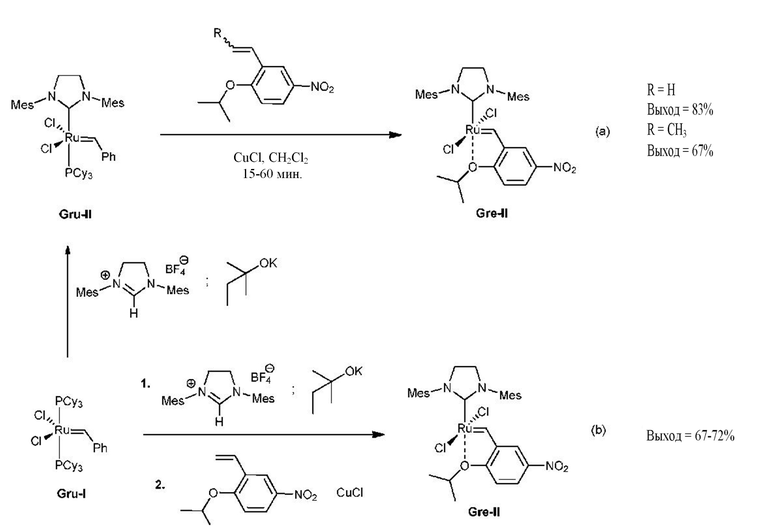
Из уровня техники известно несколько способов получения предшественников катализаторов Ховейды второго поколения [K. Grela, et al., Organometallics, 2007, 26, 1096-1099]. Они предусматривают введение в контакт комплексов Граббса второго поколения (Gru-II) с 1-изопропокси-5-нитростиролом или 1-изопропокси-4-нитро-2-пропенилбензолом в присутствии соли меди(I), путь (а). Другой способ получения комплексов Ховейды второго поколения представляет собой трехстадийную однореакторную процедуру, путь (b). Он предусматривает получение in situ лиганда N-гетероциклического карбена (NHC) и приведение его в контакт с комплексом Gru-I, а затем добавление 1-изопропокси-5-нитростирола в присутствии хлорида меди(I). К сожалению, применение производных стирола в крупномасштабном синтезе является нежелательным. Такие соединения получают с помощью трудоемкой реакции Виттига или реакции сочетания Стилла. Намного более желательным в промышленном масштабе является применение производных пропенила, таких как 1-изопропокси-4-нитро-2-пропенилбензол. Производные пропенила получают в последовательности реакций: алкилирование подходящего производного фенола с аллилгалогенидом, кляйзеновская перегруппировка [3,3] и изомеризация C=C связей.
Альтернативные пути синтеза комплексов Ховейды второго поколения (Hov-II) предусматривают приведение в контакт комплексов Ховейды первого поколения (Hov-I) с NHC, полученными in situ или другим образом введенными в реакционную среду, пути (c), (d) и (e). Эти способы дополняют ранее представленные, но не лишены важных промышленных недостатков.
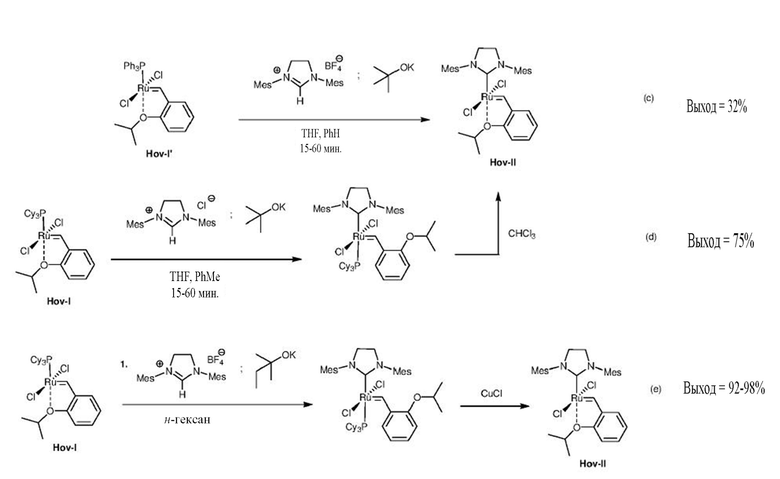
Наиболее важным из них является синтез катализатора Ховейды первого поколения (Hov-I), при котором необходимо применение диазосоединения [A. H. Hoveyda et al., J. Am. Chem. Soc. 1999, 121, 791-799]. Альтернативно, Hov-I можно получить в реакции катализатора первого поколения, содержащего два фосфиновых лиганда (например, Gru-I или Ind-I), с 2-изопропоксистиролом, синтез которого, как уже упоминалось выше, является трудоемким. Важно отметить, что катализаторы первого поколения, содержащие два фосфиновых лиганда, не вступают в реакцию ни с легко получаемым 2-изопропоксипропенилбензолом, ни с его замещенными в ароматических циклах производными.
На практике при применении реакции метатезиса олефинов, особенно в промышленном масштабе, наиболее важными параметрами являются число оборотов (TON) и селективность реакции. Одним из видов реакции метатезиса олефинов с крупным промышленным потенциалом является перекрестный метатезис с этиленом (т.е. этенолиз), в частности этенолиз производных ненасыщенных жирных кислот.
Катализаторы первого поколения обладают относительно хорошей селективностью в реакции этенолиза, но неудовлетворительной эффективностью (низкое TON). С другой стороны, катализаторы второго поколения, содержащие NHC-лиганды, обладают хорошей эффективностью (высоким TON), но низкой селективностью. Наилучшие результаты в реакции этенолиза получают с комплексами, содержащими как CAAC-лиганды (Cyclic Alkyl Amino Carbene - циклический алкиламинокарбен), так и бензилиденовый лиганд Ховейды (Hov-CAAC).
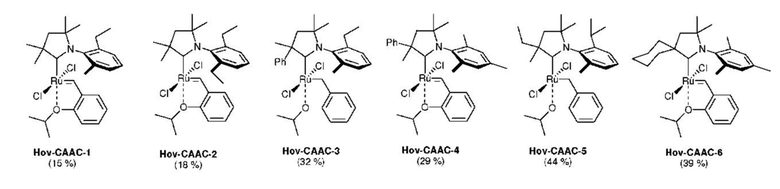
Известный из уровня техники способ синтеза комплекса Hov-CAAC предусматривает приведение в контакт CAAC-лиганда (в его чистой форме или полученным in situ) с комплексом Hov-I, синтез аналогичен путям (c), (d) и (e). Данный способ является неудобным не только из-за трудоемкого синтеза комплекса Hov-I [A. H. Hoveyda et al., J. Am. Chem. Soc. 1999, 121, 791-799], но также из-за его низких выходов и необходимости использования перчаточного бокса [US2014309433A1; G. Bertrand and R. H. Grubbs et al., Angew. Chem. Int. Ed., 2015, 54, 1919-1923]. Недостатком такого подхода синтеза является сложная модификация бензилиденового лиганда, которая может затрагивать активность и эффективность целевого комплекса рутения. Для получения комплексов Ховейды второго поколения, содержащих CAAC-лиганд и модифицированный бензилиденовый лиганд, в соответствии с известным из уровня техники способом, каждый раз необходим синтез надлежащим образом модифицированного 2-изопропоксистирола, а затем соответствующего комплекса Ховейды первого поколения.
Из уровня техники также известна проблема с получением предшественников катализаторов, содержащих как CAAC-лиганд, так и модифицированный бензилиденовый лиганд. В патенте Франции [FR2947189B1] предложен трудоемкий способ замены неактивированного бензилиденового (=CH-C6H4-OCH(CH3)2) лиганда в предшественнике катализатора Hov-CAAC-типа, который по этой причине вводили в контакт с 5 молярными эквивалентами 1-изопропокси-5-диэтиламино-2-пропенилбензола в присутствии газообразного этилена, который служил активатором реакции.
Из уровня техники также известна реакция CAAC-карбена с комплексом Граббса, содержащим как трициклогексилфосфин, так и два пиридиновых лиганда Gru-I-Py2, путь (f). Такая реакция приводит к замещению фосфинового лиганда СААС-карбеном и образованию соответствующего комплекса Gru-III-CAAC третьего поколения, который характеризовался неожиданно низкими активностями в стандартной реакции RCM замыкания диенового цикла [G. Bertrand and R. H. Grubbs et al., Angew. Chem., 2007, 119, 7400-7403].
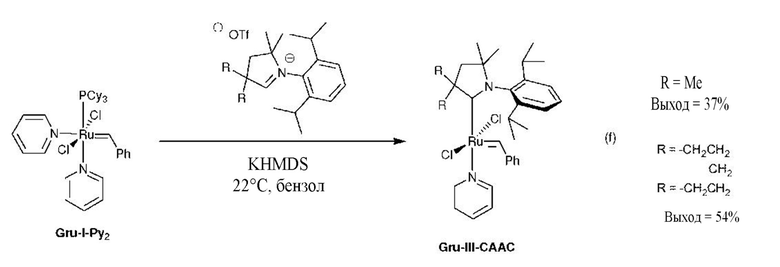
Описанный выше наиболее предпочтительный способ синтеза комплексов Ховейды второго поколения, содержащих NHC-лиганды, в которых предшественник рутения представляет собой комплекс первого поколения, содержащий два фосфиновых лиганда, никогда не использовали в синтезе комплекса Hov-CAAC-типа.
Был бы полезен синтез комплексов Hov-CAAC-типа из комплексов первого поколения, содержащих два фосфиновых лиганда, особенно с точки зрения крупномасштабного производства. Более того, было бы особенно полезно, если бы такой трехстадийный синтез мог быть осуществлен в одном реакционном сосуде (однореакторный синтез).
В ходе лабораторных исследований комплексов рутения было неожиданно обнаружено, что лиганды CAAC-типа вступают в реакцию с комплексами первого поколения, содержащими два фосфиновых лиганда, вызывая замену обоих фосфинов, что приводит к образованию комплекса, содержащего два СААС-лиганда. С 1,25-2 молярными эквивалентами СААС-лиганда в ТСХ-анализе можно наблюдать образование лишь незначительных количеств комплекса, содержащего как один СААС-лиганд, так и один фосфиновый лиганд. Неожиданно было обнаружено, что в присутствии соединения, которое может образовывать комплексы с карбенами (например, CuCl или другим акцептором фосфинового и/или NHC-лиганда), комплексы, содержащие два CAAC-лиганда, вступают в реакцию с соответствующими производными пропенилбензола с образованием комплексов Hov-CAAC-типа. Более того, было отмечено, что данная реакция может быть проведена без выделения комплекса, содержащего два СААС-лиганда, т.е. комплекс Hov-CAAC-типа можно легко получить согласно многостадийной однореакторной процедуре, которая начинается с комплекса первого поколения, содержащего два фосфиновых лиганда. Способ по настоящему изобретению позволяет избежать трудоемкого синтеза комплекса Hov-I и позволяет произвести простую модификацию бензилиденового лиганда. Каталитические свойства полученных комплексов можно модулировать посредством подбора надлежащего СААС-лиганда, бензилиденового лиганда или анионных лигандов. В ходе исследований было также отмечено, что активность и эффективность комплексов, содержащих два СААС-лиганда, сильно зависят от структуры СААС-лиганда. Относительно быстро инициирующиеся комплексы, содержащие два CAAC-лиганда, продемонстрировали себя отличными катализаторами для метатезиса олефинов.
В настоящей заявке предложен общий и экономически выгодный способ синтеза комплекса Hov-CAAC-типа, в котором предшественником рутения является любой комплекс первого поколения, содержащий два фосфиновых лиганда, например, Gru-I, Ind-I или Umicore M10TM. В настоящем изобретении предложены также комплексы, содержащие два CAAC-лиганда, которые могут служить в качестве предшественников в синтезе комплекса Hov-CAAC, а также в качестве катализаторов метатезиса олефинов.
Настоящее изобретение будет описано более подробно в предпочтительном варианте осуществления и в вариантах осуществления настоящего изобретения со ссылкой на прилагаемый графический материал, где:
на фиг. 1 представлены коммерчески доступные предшественники катализаторов и катализаторы метатезиса олефинов и новые предшественники катализаторов и катализаторы по настоящему изобретению.
Таким образом, в настоящем изобретении предложен способ получения соединения, представленного формулой 1,
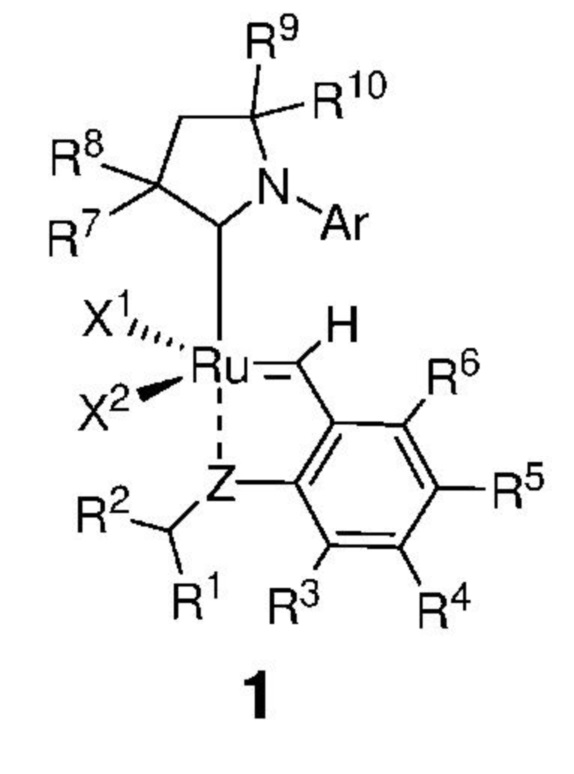 ,
,
где:
каждый из X1 и X2 независимо представляет собой анионный лиганд, выбранный из атомов галогена, группы -CN, -SCN, -OR', -SR', -O(C=O)R', -O(SO2)R' и -OSi(R')3, где R' представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
Z представляет собой атом, выбранный из группы, состоящей из O, S, NR', где R' представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
Ar представляет собой арильную группу, замещенную атомами водорода или необязательно замещенную по меньшей мере одним/одной C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси и C5-C20-гетероарилоксигруппой или атомом галогена;
каждый из R1 и R2 независимо представляет собой атом водорода, C1-C25-алкильную группу, C1-C25-алкоксигруппу, C2-C25-алкенильную группу, C1-C12-перфторалкил, C5-C20-арил, C5-C24-арилокси, C5-C20-гетероарилокси, или же они могут быть объединены друг с другом с образованием замещенной или незамещенной C4-C10-циклической или C4-C12-полициклической системы, также может представлять собой сложноэфирную (-COOR'), амидную (-CONR'2), формильную (-CHO), кетонную (-COR') и гидроксамовую (-CON(OR')(R')) группу или атом галогена, в которой R' представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
каждый из R3, R4, R5, R6 независимо представляет собой атом водорода, C1-C25-алкильную группу, C1-C25-алкоксигруппу или C2-C25-алкенильную группу, причем заместители R3, R4, R5, R6 могут быть объединены друг с другом с образованием замещенной или незамещенной C4-C10-циклической или C4-C12-полициклической системы, также независимо может представлять собой алкоксигруппу (-OR'), сульфидную (-SR'), сульфоксидную (-S(O)R'), сульфониевую (-S+R'2), сульфоновую (-SO2R'), сульфонамидную (-SO2NR'2), аминогруппу (-NR'2), аммониевую группу (-N+R'3), нитрогруппу (-NO2), цианогруппу (-CN), фосфонатную (-P(O)(OR')2), фосфинатную (-P(O)R'(OR')), фосфониниевую (-P(OR')2), фосфиновую (-PR'2), фосфиноксидную (-P(O)R'2), фосфониевую (-P+R'3), карбоксигруппу (-COOH), сложноэфирную (-COOR'), амидную (-CONR'2 или -NR'C(O)R'), формильную (-CHO) и кетонную (-COR') группу, где R' представляет собой C1-C5-алкил, C1-C5-перфторалкил, C5-C24-арил, C7-C24-аралкил, C5-C24-перфторарил;
каждый из R7, R8, R9 и R10 независимо представляет собой атом водорода или C1-C25-алкильную группу, R7 и/или R8 могут быть объединены с R9 и/или R10 с образованием циклической системы, также независимо представляет собой C1-C12-алкильную группу, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, C1-C5-перфторалкил, C7-C24-аралкил, C5-C24-перфторарил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
отличающийся тем, что алкилиденовый комплекс рутения, представленный формулой 2,
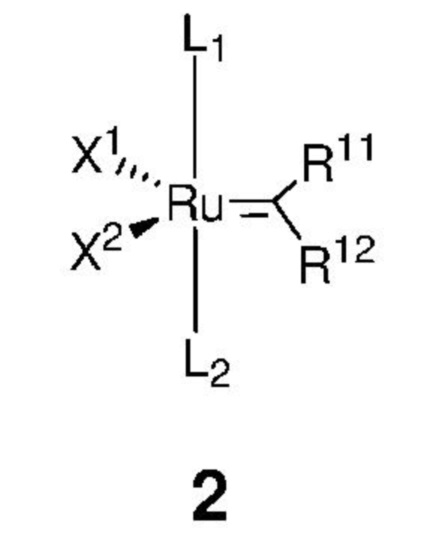 ,
,
где:
каждый из L1, L2 представляет собой нейтральный лиганд, выбранный из группы, включающей фосфин, в частности P(R')3, где каждый R' независимо представляет собой C1-C12-алкил, C3-C12-циклоалкил, C5-C20-арил, C7-C24-аралкил, C5-C24-перфторарил, 5-12-членный гетероарил; два R' могут быть объединены друг с другом с образованием циклоалкильного кольца, содержащего атом фосфора в кольце;
каждый из X1, X2 представляет собой анионный лиганд, независимо выбранный из группы, включающей галид-анионы, группу -CN, -SCN, -OR', -SR', -O(C=O)R', -O(SO2)R' и -OSi(R')3, где R' представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил или C5-C20-арил, который необязательно замещен по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
каждый из R11, R12 независимо представляет собой атом водорода, атом галогена, необязательно замещенный C1-C25-алкил, необязательно замещенный C1-C25-перфторалкил, необязательно замещенный C2-C25-алкен, необязательно замещенный C3-C7-циклоалкил, необязательно замещенный C2-C25-алкенил, необязательно замещенный C3-C25-циклоалкенил, необязательно замещенный C2-C25-алкинил, необязательно замещенный C3-C25-циклоалкинил, необязательно замещенный C1-C25-алкокси, необязательно замещенный C5-C24-арилокси, необязательно замещенный C5-C20-гетероарилокси, необязательно замещенный C5-C24-арил, необязательно замещенный C5-C20-гетероарил, необязательно замещенный C7-C24-аралкил, необязательно замещенный C5-C24-перфторарил, необязательно замещенный 3-12-членный гетероцикл;
при этом заместители R11 и R12 могут быть объединены друг с другом с образованием кольца, выбранного из группы, включающей C3-C7-циклоалкил, C3-C25-циклоалкенил, C3-C25-циклоалкинил, C5-C24-арил, C5-C20-гетероарил, C5-C24-перфторарил, 3-12-членный гетероцикл, которые могут быть независимо замещены одним и/или несколькими заместителями, выбранными из группы, включающей атом водорода, атом галогена, C1-C25-алкил, C1-C25-перфторалкил, C2-C25-алкен, C3-C7-циклоалкил, C2-C25-алкенил, C3-C25-циклоалкенил, C2-C25-алкинил, C3-C25-циклоалкинил, C1-C25-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси, C5-C24-арил, C5-C20-гетероарил, C7-C24-аралкил, C5-C24-перфторарил, 3-12-членный гетероцикл;
вводят в реакцию с карбеном, представленным формулой 3,
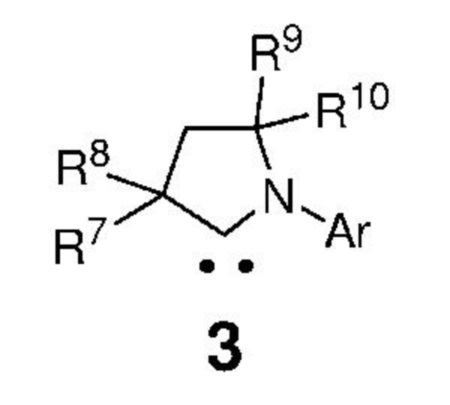 ,
,
где:
Ar представляет собой арильную группу, замещенную атомами водорода или необязательно замещенную по меньшей мере одним/одной C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилоксигруппой или атомом галогена;
каждый из R7, R8, R9 и R10 независимо представляет собой атом водорода или C1-C25-алкильную группу, R7 и/или R8 могут быть объединены с R9 и/или R10 с образованием циклической системы, также может независимо представлять собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, C1-C5-перфторалкил, C7-C24-аралкил и C5-C24-перфторарильную группу, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
затем сформированную таким образом реакционную смесь вводят в контакт с соединением, представленным формулой 4,
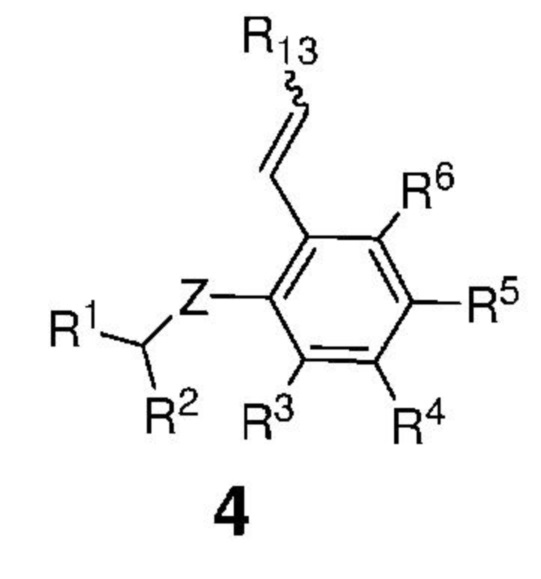 ,
,
где:
Z представляет собой атом, выбранный из группы, состоящей из O, S, NR', где R' представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
каждый из R1 и R2 независимо представляет собой атом водорода, C1-C25-алкильную группу, C1-C25-алкоксигруппу, C2-C25-алкенильную группу, C1-C12-перфторалкил, C5-C20-арил, C5-C24-арилокси, C5-C20-гетероарилокси, или же они могут быть объединены друг с другом с образованием замещенной или незамещенной C4-C10-циклической или C4-C12-полициклической системы, также может представлять собой сложноэфирную (-COOR'), амидную (-CONR'2), формильную (-CHO), кетонную (-COR') и гидроксамовую (-CON(OR')(R')) группу или атом галогена, где R' представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
каждый из R3, R4, R5, R6 независимо представляет собой атом водорода, C1-C25-алкильную группу, C1-C25-алкоксигруппу или C2-C25-алкенильную группу, причем заместители R3, R4, R5, R6 могут быть объединены друг с другом с образованием замещенной или незамещенной C4-C10-циклической или C4-C12-полициклической системы, также независимо может представлять собой алкоксигруппу (-OR'), сульфидную (-SR'), сульфоксидную (-S(O)R'), сульфониевую (-S+R'2), сульфоновую (-SO2R'), сульфонамидную (-SO2NR'2), аминогруппу (-NR'2), аммониевую группу (-N+R'3), нитрогруппу (-NO2), цианогруппу (-CN), фосфонатную (-P(O)(OR')2), фосфинатную (-P(O)R'(OR')), фосфониниевую (-P(OR')2), фосфиновую (-PR'2), фосфиноксидную (-P(O)R'2), фосфониевую (-P+R'3), карбоксигруппу (-COOH), сложноэфирную (-COOR'), амидную (-CONR'2 или -NR'C(O)R'), формильную (-CHO), кетонную (-COR') группу, где R' представляет собой C1-C5-алкил, C1-C5-перфторалкил, C5-C24-арил, C7-C24-аралкил, C5-C24-перфторарил;
R13 представляет собой атом водорода, C1-C25-алкильную группу, C1-C25-алкоксигруппу, C2-C25-алкенильную группу, C1-C12-перфторалкил, C5-C20-арил, C5-C24-арилокси, C5-C20-гетероарилокси, или же они могут быть объединены друг с другом с образованием замещенной или незамещенной C4-C10-циклической или C4-C12-полициклической системы, или атом галогена;
с получением соединения, представленного формулой 1.
Предпочтительно, реакционную смесь вводят в контакт с соединением, представленным формулой 4, в присутствии акцептора фосфинового лиганда PR'3 и/или акцептора CAAC-лиганда.
Предпочтительно, карбены, представленные формулой 3, вводят в реакционную среду путем их получения in situ из подходящих предшественников карбенов, солей CAAC, представленных формулой 3a,
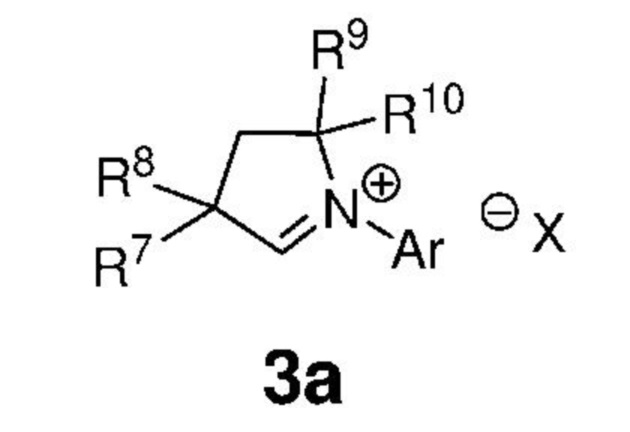 ,
,
где:
Ar представляет собой арильную группу, замещенную атомами водорода или необязательно замещенную по меньшей мере одной/одним C1-C12-алкильной группой, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
каждый из R7, R8, R9 и R10 независимо представляет собой атом водорода или C1-C25-алкильную группу, R7 и/или R8 могут быть объединены с R9 и/или R10 с образованием циклической системы, также может независимо представлять собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, C1-C5-перфторалкил, C7-C24-аралкил и C5-C24-перфторарильную группу, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
X- представляет собой галид-анион или BF4-, PF6-, ClO4-, CF3SO2O-;
что предусматривает приведение в контакт соединения, представленного формулой 3a, с подходящим основанием, выбранным из N,N'-бис(триметилсилил)амида калия, N,N'-бис(триметилсилил)амида лития, N,N'-бис(триметилсилил)амида натрия, трет-амилата калия, трет-бутоксида калия и гидрида натрия.
Предпочтительно, карбены, представленные формулой 3, вводят в реакционную среду путем их получения in situ из подходящих предшественников карбенов, представленных формулой 3а, которые приводят в контакт с основанием, таким как N,N'-бис(триметилсилил)амид щелочного металла.
Предпочтительно, карбены, представленные формулой 3, вводят в реакционную среду путем их термического получения in situ из подходящих предшественников карбенов, представленных формулой 3b, которые представляют собой аддукты хлороформа или спирта,
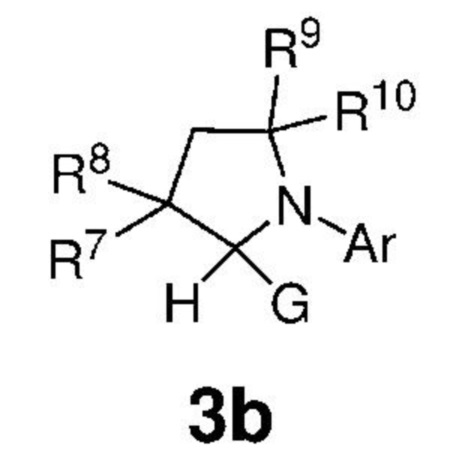 ,
,
где:
G представляет собой CCl3 или OR', где R' представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, который необязательно замещен по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
Ar представляет собой арильную группу, замещенную атомами водорода или необязательно замещенную по меньшей мере одним/одной C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси и C5-C20-гетероарилоксигруппой или атомом галогена;
каждый из R7, R8, R9 и R10 независимо представляет собой атом водорода или C1-C25-алкильную группу, R7 и/или R8 могут быть объединены с R9 и/или R10 с образованием циклической системы, также может независимо представлять собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, C1-C5-перфторалкил, C7-C24-аралкил и C5-C24-перфторарильную группу, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена.
Предпочтительно, алкилиденовый комплекс рутения, представленный формулой 2, приводят в контакт с соединением, представленным формулой 3с, которое выполняет роль донора карбенового СААС-лиганда, представленного формулой 3,
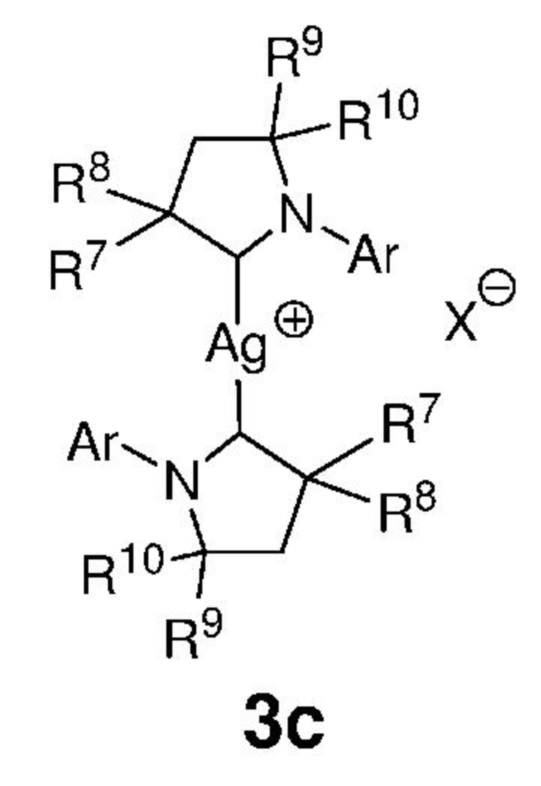 ,
,
где:
Ar представляет собой арильную группу, замещенную атомами водорода или необязательно замещенную по меньшей мере одним/одной C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси и C5-C20-гетероарилоксигруппой или атомом галогена;
каждый из R7, R8, R9 и R10 независимо представляет собой атом водорода или C1-C25-алкильную группу, R7 и/или R8 могут быть объединены с R9 и/или R10 с образованием циклической системы, также может независимо представлять собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, C1-C5-перфторалкил, C7-C24-аралкил и C5-C24-перфторарильную группу, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
X представляет собой галид-анион или BF4-, PF6-, ClO4-, CF3SO3-.
Предпочтительно, карбены, представленные формулой 3, вводят в реакционную среду путем их непосредственного внесения в реакционную смесь.
Предпочтительно, алкилиденовый комплекс рутения, представленный формулой 2, вводят в реакцию с карбеном, представленным формулой 3, с получением промежуточного соединения, представленного формулой 5,
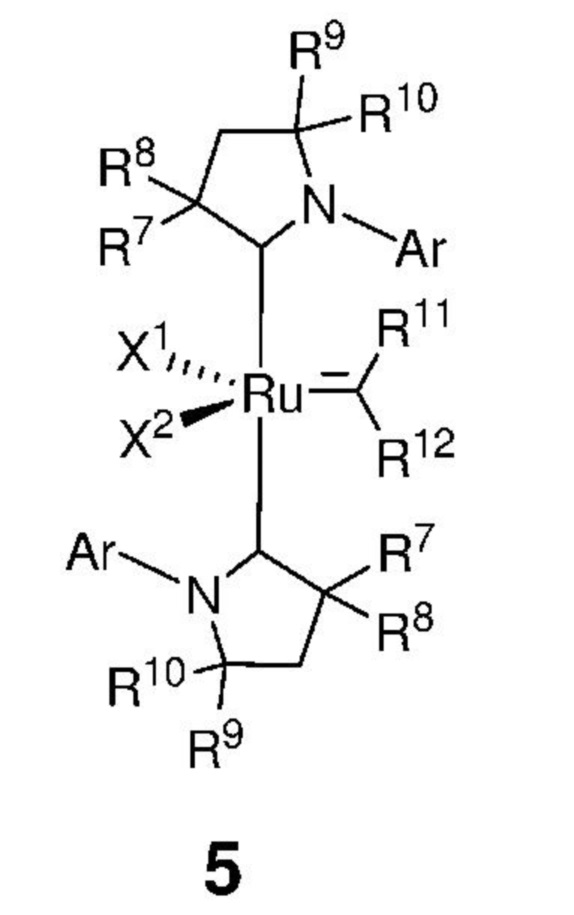 ,
,
где:
каждый из X1 и X2 независимо представляет собой анионный лиганд, выбранный из атомов галогена, группы -CN, -SCN, -OR', -SR', -O(C=O)R', -O(SO2)R' и -OSi(R')3, где R' представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
Ar представляет собой арильную группу, замещенную атомами водорода или необязательно замещенную по меньшей мере одним/одной C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси и C5-C20-гетероарилоксигруппой или атомом галогена;
каждый из R7, R8, R9 и R10 независимо представляет собой атом водорода или C1-C25-алкильную группу, R7 и/или R8 могут быть объединены с R9 и/или R10 с образованием циклической системы, также может независимо представлять собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, C1-C5-перфторалкил, C7-C24-аралкил и C5-C24-перфторарильную группу, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
каждый из R11, R12 независимо представляет собой атом водорода, атом галогена, необязательно замещенный C1-C25-алкил, необязательно замещенный C1-C25-перфторалкил, необязательно замещенный C2-C25-алкен, необязательно замещенный C3-C7-циклоалкил, необязательно замещенный C2-C25-алкенил, необязательно замещенный C3-C25-циклоалкенил, необязательно замещенный C2-C25-алкинил, необязательно замещенный C3-C25-циклоалкинил, необязательно замещенный C1-C25-алкокси, необязательно замещенный C5-C24-арилокси, необязательно замещенный C5-C20-гетероарилокси, необязательно замещенный C5-C24-арил, необязательно замещенный C5-C20-гетероарил, необязательно замещенный C7-C24-аралкил, необязательно замещенный C5-C24-перфторарил, необязательно замещенный 3-12-членный гетероцикл;
при этом заместители R11 и R12 могут быть объединены друг с другом с образованием кольца, выбранного из группы, включающей C3-C7-циклоалкил, C3-C25-циклоалкенил, C3-C25-циклоалкинил, C5-C24-арил, C5-C20-гетероарил, C5-C24-перфторарил, 3-12-членный гетероцикл, которые могут быть независимо замещены одним и/или несколькими заместителями, выбранными из группы, включающей атом водорода, атом галогена, C1-C25-алкил, C1-C25-перфторалкил, C2-C25-алкен, C3-C7-циклоалкил, C2-C25-алкенил, C3-C25-циклоалкенил, C2-C25-алкинил, C3-C25-циклоалкинил, C1-C25-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси, C5-C24-арил, C5-C20-гетероарил, C7-C24-аралкил, C5-C24-перфторарил, 3-12-членный гетероцикл;
которое затем вводят в контакт с соединением, представленным формулой 4,
 ,
,
где:
Z представляет собой атом, выбранный из группы, состоящей из O, S, NR', где R' представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
каждый из R1 и R2 независимо представляет собой атом водорода, C1-C25-алкильную группу, C1-C25-алкоксигруппу, C2-C25-алкенильную группу, C1-C12-перфторалкил, C5-C20-арил, C5-C24-арилокси, C5-C20-гетероарилокси, или же они могут быть объединены друг с другом с образованием замещенной или незамещенной C4-C10-циклической или C4-C12-полициклической системы, также может представлять собой сложноэфирную (-COOR'), амидную (-CONR'2), формильную (-CHO), кетонную (-COR') и гидроксамовую (-CON(OR')(R')) группу или атом галогена, где R' представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
каждый из R3, R4, R5, R6 независимо представляет собой атом водорода, C1-C25-алкильную группу, C1-C25-алкоксигруппу или C2-C25-алкенильную группу, причем заместители R3, R4, R5, R6 могут быть объединены друг с другом с образованием замещенной или незамещенной C4-C10-циклической или C4-C12-полициклической системы, также независимо может представлять собой алкоксигруппу (-OR'), сульфидную (-SR'), сульфоксидную (-S(O)R'), сульфониевую (-S+R'2), сульфоновую (-SO2R'), сульфонамидную (-SO2NR'2), аминогруппу (-NR'2), аммониевую группу (-N+R'3), нитрогруппу (-NO2), цианогруппу (-CN), фосфонатную (-P(O)(OR')2), фосфинатную (-P(O)R'(OR')), фосфониниевую (-P(OR')2), фосфиновую (-PR'2), фосфиноксидную (-P(O)R'2), фосфониевую (-P+R'3), карбоксигруппу (-COOH), сложноэфирную (-COOR'), амидную (-CONR'2 или -NR'C(O)R'), формильную (-CHO) и кетонную (-COR') группу, где R' представляет собой C1-C5-алкил, C1-C5-перфторалкил, C5-C24-арил, C7-C24-аралкил, C5-C24-перфторарил;
R13 представляет собой атом водорода, C1-C25-алкильную группу, C1-C25-алкоксигруппу, C2-C25-алкенильную группу, C1-C12-перфторалкил, C5-C20-арил, C5-C24-арилокси, C5-C20-гетероарилокси, или же они могут быть объединены друг с другом с образованием замещенной или незамещенной C4-C10-циклической или C4-C12-полициклической системы, или атом галогена;
с получением соединения, представленного формулой 1.
Предпочтительно, соединение 5 вводят в реакцию с соединением 4 в присутствии акцептора фосфинового лиганда PR'3 и/или акцептора СААС-лиганда.
Предпочтительно, в качестве акцептора фосфинового лиганда PR'3 и/или акцептора CAAC-лиганда применяют соединение, выбранное из солей меди(I) и/или HCl.
Предпочтительно, все стадии реакции проводят в полярном и/или неполярном растворителе, предпочтительно в алифатических или ароматических углеводородах, в течение периода от 1 минуты до 24 часов.
Настоящим изобретением также предложено соединение, представленное формулой 1,
 ,
,
где:
каждый из X1 и X2 независимо представляет собой анионный лиганд, выбранный из атомов галогена, группы -CN, -SCN, -OR', -SR', -O(C=O)R', -O(SO2)R' и -OSi(R')3, где R' представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
Z представляет собой атом, выбранный из группы, состоящей из O, S, NR', где R' представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
Ar представляет собой арильную группу, замещенную атомами водорода или необязательно замещенную по меньшей мере одним/одной C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилоксигруппой или атомом галогена;
каждый из R1 и R2 независимо представляет собой атом водорода, C1-C25-алкильную группу, C1-C25-алкоксигруппу, C2-C25-алкенильную группу, C1-C12-перфторалкил, C5-C20-арил, C5-C24-арилокси, C5-C20-гетероарилокси, или же они могут быть объединены друг с другом с образованием замещенной или незамещенной C4-C10-циклической или C4-C12-полициклической системы, также может представлять собой сложноэфирную (-COOR'), амидную (-CONR'2), формильную (-CHO), кетонную (-COR') и гидроксамовую (-CON(OR')(R')) группу или атом галогена, в которой R' представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
каждый из R3, R4, R5, R6 независимо представляет собой атом водорода, сульфоксидную группу (-S(O)R'), сульфонамидную группу (-SO2NR'2), фосфонатную группу (-P(O)(OR')2), фосфинатную группу (-P(O)R'(OR')), фосфониниевую группу (-P(OR')2), фосфиновую группу (-PR'2), нитрогруппу (-NO2), нитрозогруппу (-NO), карбоксигруппу (-COOH), сложноэфирную группу (-COOR'), формильную группу (-CHO) и кетонную группу (-COR'), где R' представляет собой C1-C5-алкил, C1-C5-перфторалкил, C5-C24-арил, C7-C24-аралкил, C5-C24-перфторарил;
где если R1 и R2 представляют собой группу -CH3, то по меньшей мере один из заместителей R3, R4, R5, R6 не является атомом водорода;
каждый из R7, R8, R9 и R10 независимо представляет собой атом водорода или C1-C25-алкильную группу, R7 и/или R8 могут быть объединены с R9 и/или R10 с образованием циклической системы, также независимо представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, C1-C5-перфторалкил, C7-C24-аралкил и C5-C24-перфторарильную группу, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или галогеном.
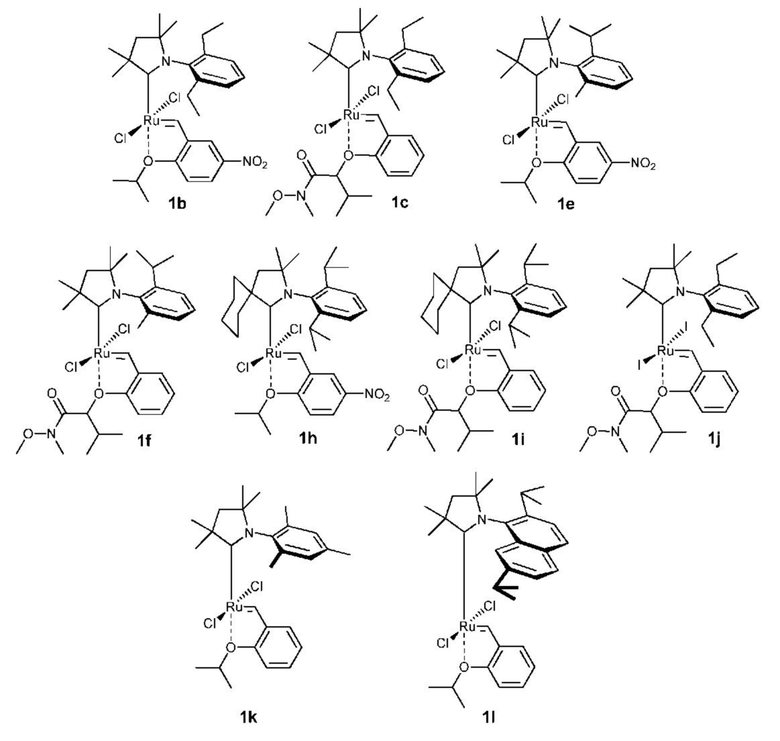
Предпочтительно, в настоящем изобретении предложено соединение со структурой, представленной формулой, выбранной из 1b, 1c, 1e, 1f, 1h, 1i, 1j, 1k, 1l:
В настоящем изобретении также предложено соединение, представленное формулой 5,
 ,
,
где:
каждый из X1 и X2 независимо представляет собой анионный лиганд, выбранный из атомов галогена, группы -CN, -SCN, -OR', -SR', -O(C=O)R', -O(SO2)R' и -OSi(R')3, где R' представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
Ar представляет собой арильную группу, замещенную атомами водорода или необязательно замещенную по меньшей мере одним/одной C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси и C5-C20-гетероарилоксигруппой или атомом галогена;
каждый из R7, R8, R9 и R10 независимо представляет собой атом водорода или C1-C25-алкильную группу, R7 и/или R8 могут быть объединены с R9 и/или R10 с образованием циклической системы, также может независимо представлять собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C5-C20-арил, C1-C5-перфторалкил, C7-C24-аралкил, C5-C24-перфторарил, которые необязательно замещены по меньшей мере одним/одной C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C5-C24-арилокси и C5-C20-гетероарилоксигруппой или атомом галогена;
каждый из R11, R12 независимо представляет собой атом водорода, атом галогена, необязательно замещенный C1-C25-алкил, необязательно замещенный C1-C25-перфторалкил, необязательно замещенный C2-C25-алкен, необязательно замещенный C3-C7-циклоалкил, необязательно замещенный C2-C25-алкенил, необязательно замещенный C3-C25-циклоалкенил, необязательно замещенный C2-C25-алкинил, необязательно замещенный C3-C25-циклоалкинил, необязательно замещенный C1-C25-алкокси, необязательно замещенный C5-C24-арилокси, необязательно замещенный C5-C20-гетероарилокси, необязательно замещенный C5-C24-арил, необязательно замещенный C5-C20-гетероарил, необязательно замещенный C7-C24-аралкил, необязательно замещенный C5-C24-перфторарил, необязательно замещенный 3-12-членный гетероцикл;
при этом заместители R11 и R12 могут быть объединены друг с другом с образованием кольца, выбранного из группы, включающей C3-C7-циклоалкил, C3-C25-циклоалкенил, C3-C25-циклоалкинил, C5-C24-арил, C5-C20-гетероарил, C5-C24-перфторарил, 3-12-членный гетероцикл, которые могут быть независимо замещены одним и/или несколькими заместителями, выбранными из группы, включающей атом водорода, атом галогена, C1-C25-алкил, C1-C25-перфторалкил, C2-C25-алкен, C3-C7-циклоалкил, C2-C25-алкенил, C3-C25-циклоалкенил, C2-C25-алкинил, C3-C25-циклоалкинил, C1-C25-алкокси, C5-C24-арилокси, C5-C20-гетероарилокси, C5-C24-арил, C5-C20-гетероарил, C7-C24-аралкил, C5-C24-перфторарил, 3-12-членный гетероцикл.
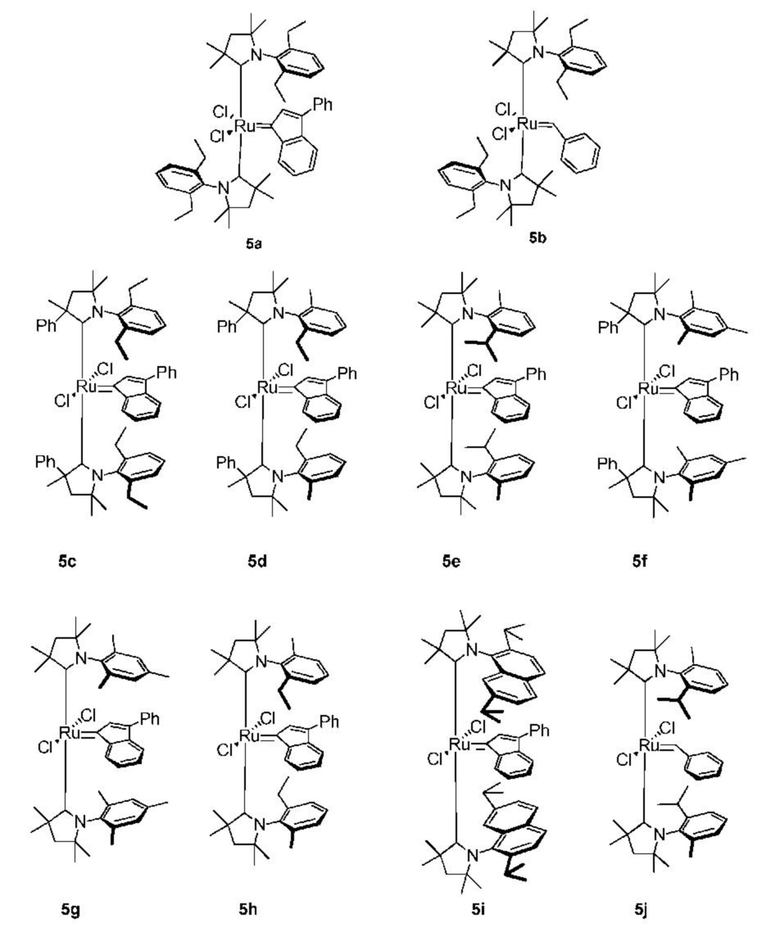
Предпочтительно, настоящее изобретение относится к соединению со структурой, представленной формулой, выбранной из 5а-5j (причем эти соединения могут быть в форме ротамера):
 .
.
В настоящем изобретении также предложено применение соединения, представленного формулой 1, полученного с помощью вышеупомянутого способа, в качестве предшественника катализатора и/или катализатора в реакциях метатезиса олефинов, особенно в реакциях метатезиса с замыканием цикла (RCM), гомометатезиса, перекрестного метатезиса (CM), этенолиза и изомеризации, в реакции метатезиса с диастереоселективной перестройкой цикла (DRRM), в реакциях метатезиса «алкен-алкинового» (ен-инового) типа или полимеризации ROMP-типа.
Предпочтительно, соединение, представленное формулой 1, применяют в качестве предшественника катализатора и/или катализатора в реакционной смеси в течение периода от 1 минуты до 24 часов в органических растворителях или без растворителя. Настоящее изобретение также относится к применению соединения, представленного формулой 1, полученного так, как описано выше, в качестве субстрата для синтеза других соединений комплекса рутения, которые являются предшественниками катализаторов и/или катализаторами для метатезиса олефинов.
В настоящем изобретении также предложено применение соединения, представленного формулой 5, в качестве предшественника катализатора и/или катализатора в реакциях метатезиса олефинов, особенно в реакциях метатезиса с замыканием цикла (RCM), гомометатезиса, перекрестного метатезиса (CM), этенолиза и изомеризации, в реакции метатезиса с диастереоселективной перестройкой цикла (DRRM), в реакциях метатезиса «алкен-алкинового» (ен-инового) типа или полимеризации ROMP-типа, а также применение соединения, представленного формулой 5, в качестве предшественника катализатора и/или катализатора в реакциях метатезиса олефинов в присутствии акцептора CAAC-лиганда.
Настоящее изобретение и его преимущественные эффекты показаны на фигурах, где:
на фиг. 1 показаны структуры соединений по настоящему изобретению;
на фиг. 2 показаны графики, изображающие соотношение между площадью под пиком (AUP) на хроматограмме и концентрацией (мг/мл) анализируемого соединения для реакции из Примера XXXX;
на фиг. 3 показаны графики, изображающие соотношение между площадью под пиком (AUP) на хроматограмме и концентрацией (мг/мл) анализируемого соединения для реакции из Примера XXXXI;
на фиг. 4 показана стандартная кривая для продукта P9 из Примера XXXXVI.
Термины, применяемые в настоящем описании, имеют приведенные далее значения.
Термин «атом галогена» или «галоген» означает элемент, выбранный из F, Cl, Br, I.
Термин «карбен» означает частицу, содержащую нейтральный атом углерода с валентным числом два и двумя неспаренными (триплетное состояние) или спаренными (синглетное состояние) валентными электронами. Термин «карбен» также охватывает аналоги карбена, в которых атом углерода заменен другим химическим элементом, таким как бор, кремний, германий, олово, свинец, азот, фосфор, сера, селен и теллур.
Термин «алкил» относится к насыщенному, неразветвленному или разветвленному углеводородному заместителю с указанным числом атомов углерода. Примерами алкильного заместителя являются -метил, -этил, -н-пропил, -н-бутил, -н-пентил, -н-гексил, -н-гептил, -н-октил, -н-нонил и -н-децил. К иллюстративным разветвленным -(C1-C10)алкилам относятся -изопропил, -втор-бутил, -изобутил, -трет-бутил, -изопентил, -неопентил, -1-метилбутил, -2-метилбутил, -3-метилбутил, -1,1-диметилпропил, -1,2-диметилпропил, -1-метилпентил, -2-метилпентил, -3-метилпентил, -4-метилпентил, -1-этилбутил, -2-этилбутил, -3-этилбутил, -1,1-диметилбутил, -1,2-диметилбутил, -1,3-диметилбутил, -2,2-диметилбутил, -2,3-диметилбутил, -3,3-диметилбутил, -1-метилгексил, -2-метилгексил, -3-метилгексил, -4-метилгексил, -5-метилгексил, -1,2-диметилпентил, -1,3-диметилпентил, -1,2-диметилгексил, -1,3-диметилгексил, -3,3-диметилгексил, -1,2-диметилгептил, -1,3-диметилгептил и -3,3-диметилгептил и др.
Термин «алкокси» относится к описанному выше алкильному заместителю, присоединенному при помощи атома кислорода.
Термин «перфторалкил» означает описанную выше алкильную группу, в которой все атомы водорода заменены атомами галогена одного и того же типа или различных типов.
Термин «циклоалкил» относится к насыщенному моно- или полициклическому углеводородному заместителю с указанным числом атомом углерода. Примерами циклоалкильного заместителя являются -циклопропил, -циклобутил, -циклопентил, -циклогексил, -циклогептил, -циклооктил, -циклононил, -циклодецил и др.
Термин «алкенил» относится к насыщенному, неразветвленному или разветвленному ациклическому углеводородному заместителю с указанным числом атомов углерода и содержащему по меньшей мере одну углерод-углеродную двойную связь. Примерами алкенильного заместителя являются -винил, -аллил, -1-бутенил, -2-бутенил, -изобутенил, -1-пентенил, -2-пентенил, -3-метил-1-бутенил, -2-метил-2-бутенил, -2,3-диметил-2-бутенил, -1-гексенил, -2-гексенил, -3-гексенил, -1-гептенил, -2-гептенил, -3-гептенил, -1-октенил, -2-октенил, -3-октенил, -1-ноненил, -2-ноненил, -3-ноненил, -1-деценил, -2-деценил, -3-деценил и др.
Термин «циклоалкенил» относится к насыщенному моно- или полициклическому углеводородному заместителю с указанным числом атомом углерода и содержащему по меньшей мере одну углерод-углеродную двойную связь. Примерами циклоалкенильного заместителя являются -циклопентенил, -циклопентадиенил, -циклогексенил, -циклогексадиенил, -циклогептенил, -циклогептадиенил, -циклогептатриенил, -циклооктенил, -циклооктадиенил, -циклооктатриенил, -циклооктатетраенил, -циклононенил, -циклононадиенил, -циклодеценил, -циклодекадиенил и др.
Термин «алкинил» относится к насыщенному, неразветвленному или разветвленному ациклическому углеводородному заместителю с указанным числом атомов углерода и содержащему по меньшей мере одну углерод-углеродную тройную связь. Примерами алкинильного заместителя являются -ацетиленил, -пропинил, -1-бутинил, -2-бутинил, -1-пентинил, -2-пентинил, -3-метил-1-бутинил, -4-пентинил, -1-гексинил, -2-гексинил, -5-гексинил и др.
Термин «циклоалкинил» относится к насыщенному моно- или полициклическому углеводородному заместителю с указанным числом атомом углерода и содержащему по меньшей мере одну углерод-углеродную тройную связь. Примерами циклоалкинильного заместителя являются -циклогексинил, -циклогептинил, -циклооктинил и др.
Термин «арил» относится к ароматическому моно- или полициклическому углеводородному заместителю с указанным числом атомом углерода. Примерами арильного заместителя являются -фенил, -толил, -ксилил, -нафтил, -2,4,6-триметилфенил, -2-фторфенил, -4-фторфенил, -2,4,6-трифторфенил, -2,6-дифторфенил, -4-нитрофенил и др.
Термин «аралкил» относится к описанному выше алкильному заместителю, замещенному по меньшей мере одним описанным выше арилом. Примерами аралкильного заместителя являются -бензил, -дифенилметил, -трифенилметил и др.
Термин «гетероарил» относится к ароматическому моно- или полициклическому углеводородному заместителю с указанным числом атомов углерода, где по меньшей мере один атом углерода был заменен гетероатомом, выбранным из атомов O, N и S. Примерами гетероарильного заместителя являются -фурил, -тиенил, -имидазолил, -оксазолил, -тиазолил, -изоксазолил, триазолил, -оксадиазолил, -тиадиазолил, -тетразолил, -пиридил, -пиримидил, -триазинил, -индолил, -бензо[b]фурил, -бензо[b]тиенил, -индазолил, -бензимидазолил, -азаиндолил, -хинолил, -изохинолил, -карбазолил и др.
Термин «гетероцикл» относится к насыщенному или частично ненасыщенному моно- или полициклическому углеводородному заместителю с указанным числом атомов углерода, где по меньшей мере один атом углерода был заменен гетероатомом, выбранным из атомов O, N и S. Примерами гетероциклического заместителя являются фурил, тиофенил, пирролил, оксазолил, имидазолил, тиазолил, изоксазолил, пиразолил, изотиазолил, триазинил, пирролидинонил, пирролидинил, гидантоинил, оксиранил, оксетанил, тетрагидрофуранил, тетрагидротиофенил, хинолинил, изохинолинил, хромонил, кумаринил, индолил, индолизинил, бензо[b]фуранил, бензо[b]тиофенил, индазолил, пуринил, 4H-хинолизинил, изохинолил, хинолил, фталазинил, нафтиридинил, карбазолил, β-карболинил и др.
Термин «нейтральный лиганд» относится к незаряженному заместителю, который может образовывать координационную связь с центральным металлом (атомом рутения). Примерами таких лигандов могут быть амины, фосфины и их оксиды, алкил- и арилфосфиты и алкил- и арилфосфаты, арсины и их оксиды, простые эфиры, алкил- и арилсульфиды, углеводороды с координационными связями, алкил- и арилгалогениды.
Термин «инденилиден» относится к ненасыщенному углеводородному заместителю с инденовым (бензоциклопентадиеновым) остовом, связанным двойной связью с атомом металла.
Термин «гетероинденилиден» относится к инденилиденовому заместителю, определение которому дано выше, где по меньшей мере один атом углерода был заменен гетероатомом из группы, включающей азот, кислород, серу.
Термин «анионный лиганд» относится к заместителю, который может образовывать координационную связь с центральным металлом (атомом рутения) и имеет заряд, который может частично или полностью компенсировать заряд центрального металла. Примерами таких лигандов могут быть фтор-, хлорид-, бромид-, йодид-, цианид-, цианат- и тиоцианат-анионы, анионы карбоновой кислоты, анионы спиртов, фенольные анионы, тиоловые и тиофенольные анионы, анионы углеводородов с делокализованным зарядом (например, циклопентадиен), анионы (органо)серной и (органо)фосфорной кислот и их сложных эфиров (такие как, например, анионы алкилсульфоновых и арилсульфоновых кислот, анионы алкилфосфорных и арилофосфорных кислот, анионы алкиловых и ариловых эфиров серной кислоты, анионы алкиловых и ариловых эфиров фосфорной кислоты, анионы алкиловых и ариловых эфиров алкилфосфорной и арилфосфорной кислоты). Необязательно, анионный лиганд может иметь группу L1, L2 и L3, присоединенную таким же образом, как и анион катехола, анион ацетилацетона и анион салицилальдегида. Анионные лиганды (X1, X2) и нейтральные лиганды (L1, L2, L3) могут быть объединены друг с другом с образованием полидентатных лигандов, например: бидентатного лиганда (X1-X2), тридентатного лиганда (X1-X2-L1), тетрадентатного лиганда (X1-X2-L1-L2), бидентатного лиганда (X1-L1), тридентатного лиганда (X1-L1-L2), тетрадентатного лиганда (X1-L1-L2-L3), бидентатного лиганда (L1-L2), тридентатного лиганда (L1-L2-L3).
Примерами таких лигандов являются: анион катехола, анион ацетилацетона и анион салицилальдегида.
Термин «гетероатом» означает атом, выбранный из группы, состоящей из кислорода, серы, азота, фосфора и других.
Термин «хлорированный растворитель» означает растворитель, содержащий в своей структуре по меньшей мере один атом фтора, хлора, брома или йода; предпочтительнее содержащий более одного атома. Примерами таких растворителей являются дихлорметан, хлороформ, тетрахлорметан (четыреххлористый углерод), 1,2-дихлорэтан, хлорбензол, перфторбензол, перфтортолуол, фреоны и другие.
Термин «неполярный растворитель» означает растворитель, характеризующийся нулевым или очень малым дипольным моментом. Примерами таких растворителей являются пентан, гексан, октан, нонан, декан, бензол, толуол, тетрагидрофуран (THF) и его производные, простой диэтиловый эфир, дихлорметан, этилацетат, хлороформ и другие.
Термин «DEDAM» означает диэтилдиаллилмалонат, применяемый в качестве модельного диена в реакциях RCM с целью сравнения активностей доступных предшественников катализаторов и катализаторов для реакций метатезиса олефинов.
Термин «ГХ» означает газовую хроматографию.
Термин «ЖХВД» означает жидкостную хроматографию высокого давления, а растворители, обозначенные как растворители для «ЖХВД», представляют собой растворители с подходящей степенью чистоты для ЖХВД-анализа.
Термин «ЯМР» означает ядерный магнитный резонанс.
Термин «NHC» означает N-гетероциклический карбен.
Термин «ТСХ» означает тонкослойную хроматографию.
Термин «алкенин» означает соединение, имеющее в своей структуре двойную и тройную связь (ен-ин).
Термин «предшественник катализатора» в случае комплексов рутения означает 16-электронное химическое соединение, которое после стадии диссоциации одного лиганда или молекулярной реорганизации превращается в надлежащий 14-электронный катализатор метатезиса олефинов, который принимает активное участие в каталитическом цикле.
Соединения комплекса рутения по настоящему изобретению получают с помощью реакций, показанных на приведенной далее общей схеме реакций, схеме 1 и 2.
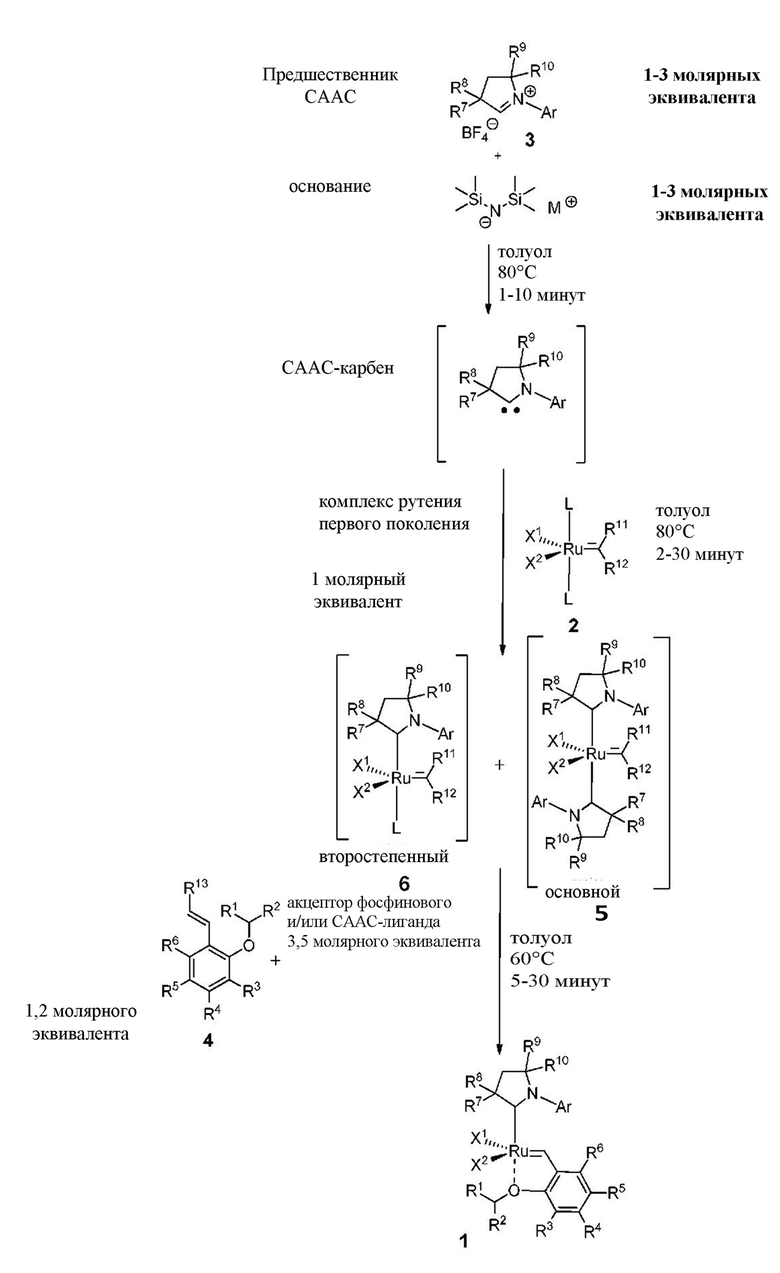
Схема 1
На схеме 1 показан общий ход реакций на отдельных стадиях способа получения комплексных соединений, представленных формулой 1, по настоящему изобретению. Первая стадия заключается в получении CAAC-карбена в реакции депротонизации соли CAAC с помощью подходящего основания. Наиболее предпочтительными основаниями являются соли гексаметилдисилазана [бис(триметилсилил)амиды металлов], представленные формулой MHMDS, где М представляет собой щелочной металл, такой как калий или литий. Процесс депротонизации или приведения в контакт вместе с подходящими реагентами можно проводить во многих полярных или неполярных растворителях. В качестве растворителя предпочтительно применяют толуол. На следующей стадии образовавшийся CAAC-карбен вводят в контакт с комплексом рутения первого поколения, содержащим в своей структуре два лиганда фосфинового типа.
Было показано, что основным продуктом данной реакции является комплекс второго поколения, содержащий два СААС-лиганда. В ТСХ-анализе можно было наблюдать также небольшие количества другого комплекса второго поколения, который, по всей вероятности, содержит один CAAC-лиганд и один фосфиновый лиганд, схема 1 и 2.
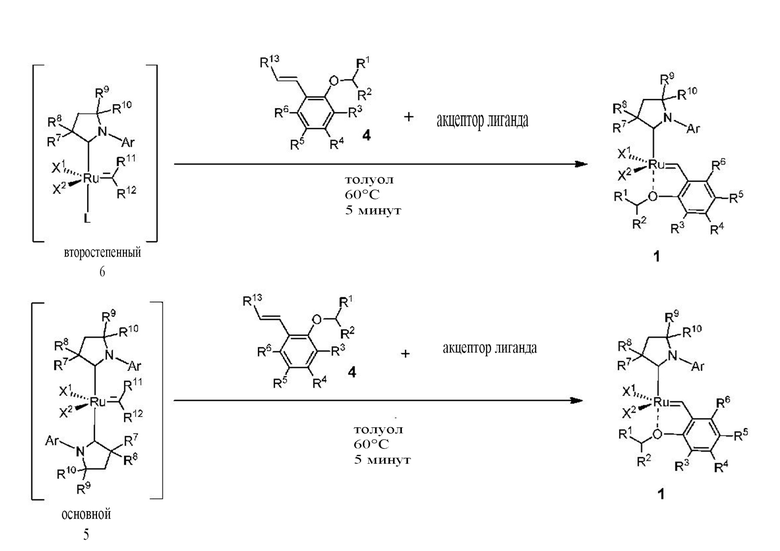
Схема 2
Последняя стадия способа заключается в добавлении бензилиденового лиганда 4 к смеси с неизвестным относительным содержанием основных и второстепенных промежуточных соединений 5 в присутствии акцептора фосфинового лиганда и/или акцептора СААС-лиганда (схема 2). На схеме 2 показан лишь предполагаемый ход образования 16-электронного комплекса рутения без детального анализа механизма процесса метатезиса. Предпочтительно, в качестве бензилиденового лиганда применяют производные 2-изопропоксипропенилбензола. Как оказалось, предпочтительными акцепторами фосфинового и/или CAAC-лиганда были соли меди(I), в том числе CuCl. Реакции, показанные на схеме 1 и 2, проводили в одном реакционном сосуде без выделения промежуточных соединений (Варианты осуществления I-XIV).
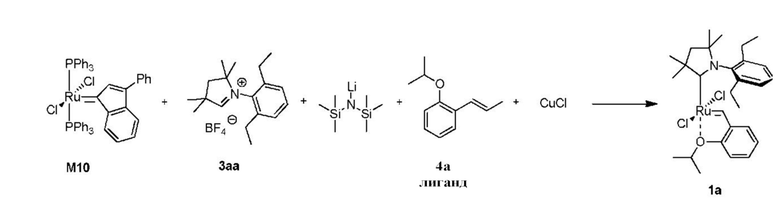
Для подтверждения того, что промежуточное соединение 5 принимает активное участие в способе получения предшественников катализаторов, представленных формулой 1, предыдущий однореакторный способ был разделен на две независимые реакционные части, (а) и (b) на схеме 3. Комплексы рутения, представленные общей формулой 5, выделяли и определяли их характеристики с помощью ЯМР и МС анализа, который подтверждал отсутствие фосфинового лиганда в структуре и наличие двух СААС-лигандов. Было показано, что соединения, представленные структурой 5, в реакции с бензилиденовым лигандом 4 в присутствии акцептора СААС-лиганда дают соединения, представленные формулой 1. Реакции для отдельных стадий были показаны на схеме 3 (часть (а) в Вариантах осуществления XV, XVI и XVIII и часть (b) в Вариантах осуществления XVII и XIX). Кроме того, авторы настоящего изобретения решили проверить, являются ли промежуточные соединения, представленные общей формулой 5, активными предшественниками катализатора в метатезе олефинов, что было показано в Примере XXII.
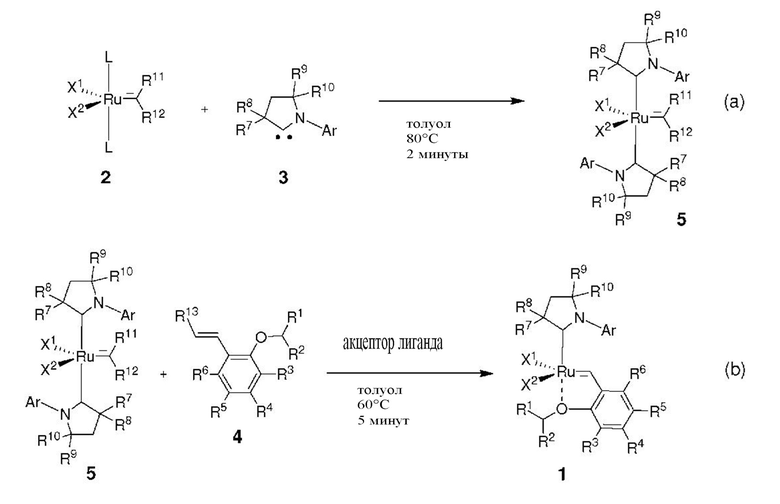
Схема 3
В описанных ниже примерах были проиллюстрированы способы получения и применение новых комплексов рутения по настоящему изобретению. Показанные ниже примеры представлены для лучшего понимания настоящего изобретения и не предназначены для какого-либо ограничения его объема. Примеры получения катализатора по настоящему изобретению подтверждают более высокие выходы при данном способе и более предпочтительные параметры получения комплекса рутения в промышленном масштабе. Сравнительные примеры с известными применяемыми комплексами подтверждают, что комплексы по настоящему изобретению имеют другие каталитические свойства.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Пример I
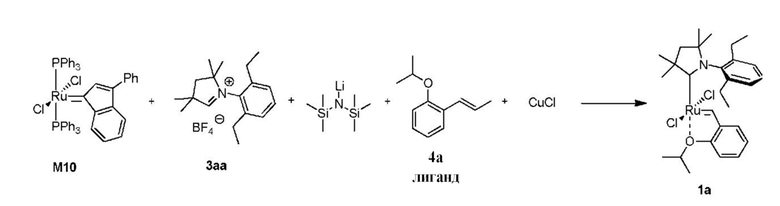
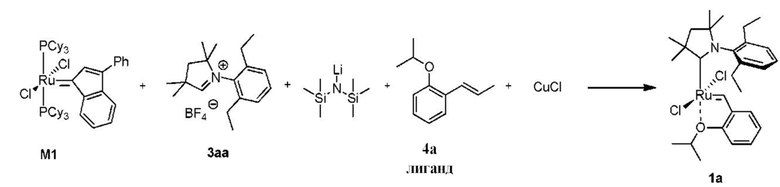
Способ получения предшественника катализатора 1a:
К соли 3аа (1,73 г, 5,0 ммоль, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (20 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 5,0 мл, 5,0 ммоль, 2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (2,22 г, 2,5 ммоля, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до 60°С. Добавляли бензилиденовый лиганд 4a (0,529 г, 3,0 ммоля, 1,2 молярного эквивалента) и CuCl (0,866 г, 8,75 ммоля, 3,5 молярного эквивалента). Реакционную смесь перемешивали в течение 5 минут при 60°С и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и фильтровали. Растворитель выпаривали, остаток промывали изопропанолом и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катализатора 1a (0,584 г, 40%).
1H ЯМР (C6D6, 500 МГц): δ = 16,41 (s, 1H), 7,33-7,28 (m, 1H), 7,22-7,18 (m, 2H), 7,16-7,11 (m, 1H), 7,01 (dd, J = 7,6; 1,6 Гц, 1H), 6,64 (td, J = 7,4; 0,8 Гц, 1H), 6,46-6,42 (m, 1H), 4,67 (септет, J = 6,1 Гц, 1H), 2,87-2,78 (m, 2H), 2,45-2,35 (m, 2H), 2,23 (s, 6H), 1,77 (s, 2H), 1,70 (d, J = 6,1 Гц, 6H), 0,97-0,92 (m, 12H) м.д.
Пример II
Способ получения предшественника катализатора 1а; попытка с большим количеством соли CAAC 3aa - в данном случае 3 молярных эквивалента:
К соли 3аа (1,40 г, 4,05 ммоля, 3 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (10 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 4,05 мл, 4,05 ммоля, 3 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (1,20 г, 1,35 ммоля, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до 60°C. Добавляли лиганд 4a (0,286 г, 1,62 ммоля, 1,2 молярного эквивалента) и CuCl (0,601 г, 6,08 ммоля, 4,5 молярного эквивалента). Реакционную смесь перемешивали в течение 5 минут при 60°С и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и фильтровали. Растворитель выпаривали, остаток промывали изопропанолом и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катализатора 1a (0,408 г, 52%). Сравнение с Примером I.
Пример III
Способ получения предшественника катализатора Ховейды 1a с применением другого предшественника первого поколения, в данном случае M1 (Umicore M1TM):
К соли 3аа (1,06 г, 3,07 ммоля, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (12 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 3,07 мл, 3,07 ммоля, 2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M1 (1,42 г, 1,53 ммоля, 1 молярный эквивалент). Спустя 10 минут смесь охлаждали до 60°С. Добавляли бензилиденовый лиганд 4a (0,325 г, 1,84 ммоля, 1,2 молярного эквивалента) и CuCl (0,532 г, 5,37 ммоля, 3,5 молярного эквивалента). Реакционную смесь перемешивали в течение 10 минут при 60°С и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и фильтровали. Растворитель выпаривали, остаток промывали изопропанолом и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катализатора 1a (0,520 г, 58%). Сравнение с Примером I.
Пример IV
Способ получения предшественника катализатора 1a с применением другого предшественника первого поколения, в данном случае Gru-I:
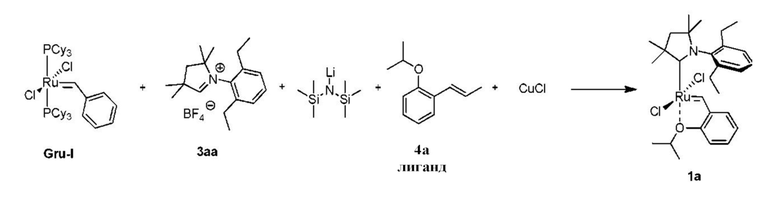
К соли 3аа (1,04 г, 3,0 ммоля, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (12 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 3,0 мл, 3,0 ммоля, 2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс Gru-I (1,23 г, 1,5 ммоля, 1 молярный эквивалент). Спустя 30 минут смесь охлаждали до 60°C. Добавляли бензилиденовый лиганд 4a (0,317 г, 1,8 ммоля, 1,2 молярного эквивалента) и CuCl (0,520 г, 5,25 ммоля, 3,5 молярного эквивалента). Реакционную смесь перемешивали в течение 10 минут при 60°С и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и фильтровали. Растворитель выпаривали, остаток промывали изопропанолом и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катализатора 1a (0,409 г, 47%). Сравнение с Примером I.
Пример V
Способ получения предшественника катализатора 1b, содержащего бензилиден с активированной нитрогруппой:
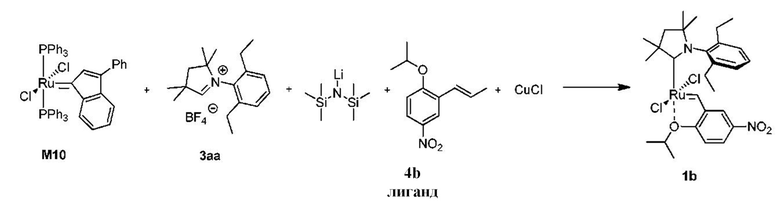
К соли 3аа (3,45 г, 10,0 ммоль, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (40 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 10,0 мл, 10,0 ммоль, 2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (4,43 г, 5,0 ммоль, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до 60°C. Добавляли бензилиденовый лиганд 4b (1,33 г, 6,0 ммоль, 1,2 молярного эквивалента) и CuCl (1,73 г, 17,5 ммоля, 3,5 молярного эквивалента). Реакционную смесь перемешивали в течение 5 минут при 60°С и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и фильтровали. Растворитель выпаривали, остаток промывали изопропанолом и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катализатора 1b (1,57 г, 50%).
1H ЯМР (CD2Cl2, 500 МГц): δ = 16,29 (s, 1H), 8,46 (dd, J = 9,1; 2,7 Гц, 1H), 7,72-7,65 (m, 2H), 7,51 (d, J = 7,7 Гц, 2H), 7,08 (d, J = 8,7 Гц, 1H), 5,26 (септет, J = 6,1 Гц, 1H), 2,61-2,49 (m, 4H), 2,21 (s, 2H), 2,07 (s, 6H), 1,77 (d, J = 6,2 Гц, 6H), 1,33 (s, 6H), 0,91 (t, J =7,4 Гц, 6H) м.д.
13C ЯМР (CD2Cl2, 125 МГц): δ = 290,4, 263,8, 165,6, 157,1, 143,7, 143,4, 138,8, 129,9, 127,7, 125,7, 118,3, 113,7, 79,4, 78,2, 56,5, 52,3, 29,9, 28,9, 25,3, 22,4, 14,9 м.д.
HRMS-ESI, рассчитанное для C28H39N2O3Ru [M-2Cl+H]+: 553,2006; полученное: 553,2004.
Элементный анализ: рассчитанные для C28H38N2Cl2O3Ru:
C 54,02; H 6,15; N 4,50; Cl 11,39; полученные: C 54,18; H 6,09; N 4,42; Cl 11,20.
Пример VI
Способ получения предшественника катализатора 1c, содержащего бензилиден с активированной гидроксамовой группой:
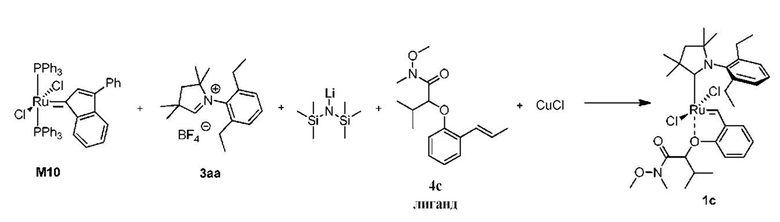
К соли 3аа (3,45 г, 10,0 ммоль, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (40 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 10,0 мл, 10,0 ммоль, 2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (4,43 г, 5,0 ммоль, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до 60°C. Добавляли бензилиденовый лиганд 4c (1,66 г, 6,0 ммоль, 1,2 молярного эквивалента) и CuCl (1,73 г, 17,5 ммоля, 3,5 молярного эквивалента). Реакционную смесь перемешивали в течение 5 минут при 60°С и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол -> этилацетат/циклогексан 3:7 об./об.). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и фильтровали. Растворитель выпаривали, а остаток растворяли в минимальном количестве метиленхлорида и добавляли н-гептан. Метиленхлорид медленно удаляли на испарителе, полученные кристаллы отфильтровывали, промывали небольшим количеством н-гептана и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катилизатора 1c (1,05 г, 31%).
1H ЯМР (CD2Cl2, 500 МГц): δ = 16,46 (s, 1H), 7,62-7,55 (m, 2H), 7,50-7,46 (m, 1H), 7,43-7,39 (m, 1H), 7,03 (d, J = 8,3 Гц, 1H), 6,97 (t, J = 7,4 Гц, 1H), 6,92-6,89 (m, 1H), 5,50 (d, J = 7,5 Гц, 1H), 3,75 (s, 3H), 3,39 (s, 3H), 2,90 (dq, J = 15,0; 7,4 Гц, 1H), 2,66 (dq, J = 15,0; 7,4 Гц, 1H), 2,58 (dq, J = 14,0; 7,0 Гц, 1H), 2,32 (q, J = 7,5 Гц, 2H), 2,28 (s, 3H), 2,25-2,21 (m, 1H), 2,15-2,11 (m, 1H), 1,94 (s, 3H), 1,31 (s, 3H), 1,22 (s, 3H), 1,11 (t, J = 7,4 Гц, 3H), 0,98 (dd, J = 9,2; 6,9 Гц, 6H), 0,79 (t, J = 7,4 Гц, 3H) м.д.
13C ЯМР (CD2Cl2, 125 МГц): δ = 305,2, 267,2, 170,0, 154,3, 146,0, 143,8, 143,4, 140,2, 130,0, 129,0, 127,2, 126,9, 123,6, 123,4, 113,2, 79,9, 79,8, 78,2, 62,3, 62,2, 56,3, 53,4, 32,6, 32,5, 31,3, 31,2, 30,9, 29,4, 29,3, 25,6, 25,5, 25,4, 25,1, 25,0, 19,9, 18,2, 14,8, 14,7, 14,6 м.д.
HRMS-ESI, рассчитанное для C33H49N2O4Ru [M-2Cl+CH3O]+: 639,2740; полученное: 639,2718.
Элементный анализ: рассчитанные для C32H46N2Cl2O3Ru:
C 56,63; H 6,83; N 4,13; Cl 10,45; полученные: C 56,63; H 6,73; N 4,01; Cl 10,25.
Пример VII
Способ получения предшественника катализатора 1d:

К соли 3ab (1,73 г, 5,0 ммоль, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (20 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 5,0 мл, 5,0 ммоль, 2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (2,22 г, 2,5 ммоля, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до 60°С. Добавляли бензилиденовый лиганд 4a (0,529 г, 3,0 ммоля, 1,2 молярного эквивалента) и CuCl (0,866 г, 8,75 ммоля, 3,5 молярного эквивалента). Реакционную смесь перемешивали в течение 5 минут при 60°С и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и фильтровали. Растворитель выпаривали, остаток промывали изопропанолом и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катализатора 1d (0,688 г, 47%).
1H ЯМР (CD2Cl2, 500 МГц): δ = 16,20 (s, 1H), 7,60-7,53 (m, 2H), 7,50-7,47 (m, 1H), 7,29 (ddd, J = 7,4; 1,7; 0,8 Гц, 1H), 6,97 (d, J = 8,3 Гц, 1H), 6,92-6,85 (m, 2H), 5,16 (септ., J = 6,1 Гц, 1H), 2,98 (септ., J = 6,6 Гц, 1H), 2,24 (s, 3H), 2,23-2,16 (m, 2H), 2,13 (s, 3H), 2,02 (s, 3H), 1,75 (d, J = 6,1 Гц, 3H), 1,71 (d, J = 6,1 Гц, 3H), 1,40 (s, 3H), 1,36 (s, 3H), 1,28 (d, J = 6,7 Гц, 3H), 0,67 (d, J = 6,5 Гц, 3H) м.д.
Пример VIII
Способ получения предшественника катализатора 1d; попытка с уменьшенным количеством соли CAAC 3ab:

К соли 3ab (1,08 г, 3,13 ммоля, 1,25 молярного эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (22 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 3,0 мл, 3,0 ммоля, 1,2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (2,22 г, 2,5 ммоля, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до 60°С. Добавляли бензилиденовый лиганд 4a (0,529 г, 3,0 ммоля, 1,2 молярного эквивалента) и CuCl (0,619 г, 6,25 ммоля, 2,5 молярного эквивалента). Реакционную смесь перемешивали в течение 5 минут при 60°С и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и фильтровали. Растворитель выпаривали, остаток промывали изопропанолом и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катализатора 1d (0,596 г, 41%). Сравнение с Примером VI.
Пример IX
Способ получения предшественника катализатора 1e, содержащего бензилиден с активированной нитрогруппой:
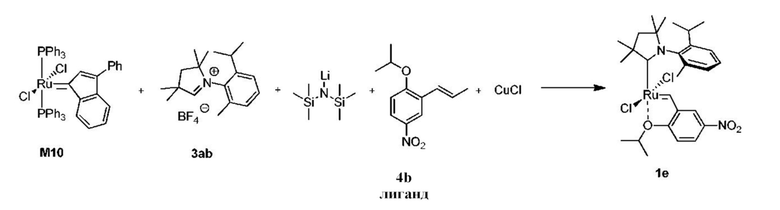
К соли 3ab (1,73 г, 5,0 ммоль, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (20 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 5,0 мл, 5,0 ммоль, 2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (2,22 г, 2,5 ммоля, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до 60°С. Добавляли бензилиденовый лиганд 4b (0,664 г, 3,0 ммоля, 1,2 молярного эквивалента) и CuCl (0,866 г, 8,75 ммоля, 3,5 молярного эквивалента). Реакционную смесь перемешивали в течение 5 минут при 60°С и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и фильтровали. Растворитель выпаривали, остаток промывали изопропанолом и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катализатора 1e (0,663 г, 42%).
1H ЯМР (CD2Cl2, 500 МГц): δ = 16,19 (s, 1H), 8,45 (dd, J = 9,1; 2,7 Гц, 1H), 7,70 (d, J = 2,7 Гц, 1H), 7,65 (t, J = 7,7 Гц, 1H), 7,55 (dd, J = 8,0; 1,5 Гц, 1H), 7,35 (ddd, J = 7,5; 1,6; 0,7 Гц, 1H), 7,08 (d, J = 8,9 Гц, 1H), 5,26 (септ., J = 6,2 Гц, 1H), 2,97 (септ., J = 6,7 Гц, 1H), 2,26-2,19 (m, 5H), 2,13 (s, 3H), 2,03 (s, 3H), 1,77 (dd, J = 16,1; 6,1 Гц, 6H), 1,43 (s, 3H), 1,38 (s, 3H), 1,30 (d, J = 6,6 Гц, 3H), 0,68 (d, J = 6,5 Гц, 3H) м.д.
13C ЯМР (CD2Cl2, 125 МГц): δ = 290,2, 264,6, 157,2, 149,1, 143,5, 143,4, 138,5, 138,4, 130,4, 130,0, 126,5, 125,8, 118,4, 113,7, 79,4, 78,2, 56,6, 52,3, 29,9, 29,7, 29,6, 29,1, 28,9, 26,3, 24,3, 22,4, 22,3, 21,8 м.д.
HRMS-ESI, рассчитанное для C28H38ClN2O3Ru [M-Cl]+: 587,1613; полученное: 587,1636.
Элементный анализ: рассчитанные для C28H38N2Cl2O3Ru:
C 54,02; H 6,15; N 4,50; Cl 11,39; полученные: C 54,19; H 6,18; N 4,37; Cl 11,21.
Пример X
Способ получения предшественника катализатора 1f, содержащего бензилиден с активированной гидроксамовой группой:
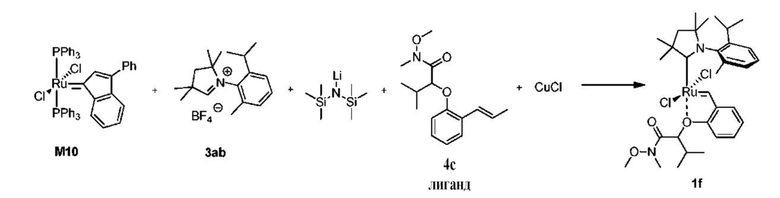
К соли 3ab (1,73 г, 5,0 ммоль, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (20 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 5,0 мл, 5,0 ммоль, 2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (2,22 г, 2,5 ммоля, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до 60°С. Добавляли бензилиденовый лиганд 4c (0,832 г, 3,0 ммоля, 1,2 молярного эквивалента) и CuCl (0,866 г, 8,75 ммоля, 3,5 молярного эквивалента). Реакционную смесь перемешивали в течение 5 минут при 60°С и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол -> этилацетат/циклогексан 3:7 об./об.). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и фильтровали. Растворитель выпаривали, а остаток растворяли в минимальном количестве метиленхлорида и добавляли н-гептан. Метиленхлорид медленно удаляли на испарителе, полученные кристаллы отфильтровывали, промывали небольшим количеством н-гептана и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катилизатора 1f (0,390 г, 23%). Смесь изомеров A:B = 1,8:1.
В связи с очень сложным спектром 1Н ЯМР приведены только характерные сдвиги протонов бензилидена: изомер A: синглет 16,42 м.д., изомер B: синглет 16,45 м.д. (CD2Cl2).
13C ЯМР (CD2Cl2, 125 МГц): δ = 304,0 (A), 303,5 (B), 268,1 (B), 267,9 (A), 170,0 (A), 169,4 (B), 154,4 (A), 154,3 (B), 149,0 (B), 148,6 (A), 145,4 (B), 145,3 (A), 139,9 (B), 139,8 (A), 138,8 (A), 138,5 (B), 130,2(A), 130,16 (B), 130,0 (A), 129,9 (B), 129,2 (B), 129,2 (A), 126,2 (B), 125,9 (A), 123,8 (B), 123,8 (A), 123,7 (B), 123,5 (A), 113,3 (B), 113,1 (A), 79,8 (B), 79,6 (A), 78,1 (B), 78,0 (A), 62,4 (A), 62,2 (B), 56,4 (B), 56,3 (A), 53,7 (A), 53,5 (B), 32,6 (A), 32,4 (B), 31,3 (A), 31,1 (B), 30,8 (B), 30,8 (B) 30,7 (A), 30,6 (A), 29,0 (B), 28,9 (A), 28,7 (B), 28,6 (A), 26,9, 24,9 (A), 24,8 (B), 22,3 (A), 21,7 (B), 20,0 (B), 19,9 (A), 18,2 м.д.
HRMS-ESI, рассчитанное для C33H49N2O4Ru [M-2Cl+CH3O]+: 639,2740; полученное: 639,2756.
Элементный анализ: рассчитанные для C32H46N2Cl2O3Ru:
C 56,63; H 6,83; N 4,13; Cl 10,45; полученные: C 56,69; H 6,80; N 4,07; Cl 10,41.
Пример XI
Способ получения предшественника катализатора 1g:
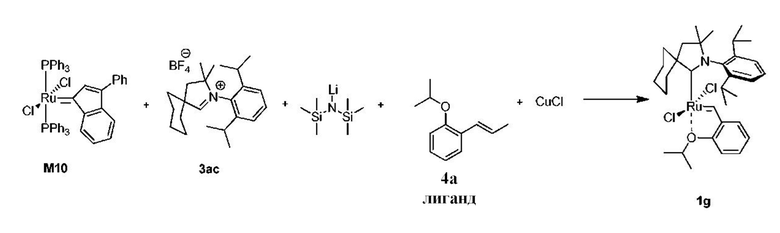
К соли 3ac (0,413 г, 1,0 ммоль, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (4 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 1,0 мл, 1,0 ммоль, 2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (0,443 г, 0,5 ммоля, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до 60°C. Добавляли бензилиденовый лиганд 4a (0,106 г, 0,6 ммоля, 1,2 молярного эквивалента) и CuCl (0,173 г, 1,75 ммоля, 3,5 молярного эквивалента). Реакционную смесь перемешивали в течение 25 минут при 60°С и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и фильтровали. Растворитель выпаривали, остаток промывали изопропанолом и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катализатора 1g (0,118 г, 37%).
1H ЯМР (C6D6, 500 МГц): δ = 16,56 (s, 1H), 7,38-7,35 (m, 1H), 7,28-7,25 (m, 2H), 7,14-7,11 (m, 1H), 7,03-7,00 (m, 1H), 6,65 (t, J = 7,4 Гц, 1H), 6,44 (d, J = 8,3 Гц, 1H), 4,66 (септ., J = 6,0 Гц, 1H), 3,77 (td, J = 13,0; 3,4 Гц, 2H), 3,21 (септ., J = 6,4 Гц, 2H), 2,50 (d, J= 12,7 Гц, 2H), 1,93 (s, 2H), 1,90-1,85 (m, 2H), 1,74 (d, J = 6,1 Гц, 6H), 1,70-1,60 (m, 2H), 1,43-1,34 (m, 2H), 1,16 (d, J = 6,6 Гц, 6H), 1,00 (s, 6H), 0,93 (d, J = 6,4 Гц, 6H) м.д.
Пример XII
Способ получения предшественника катализатора 1g; попытка с другим основанием для получения СААС-карбена - в данном случае KHMDS:
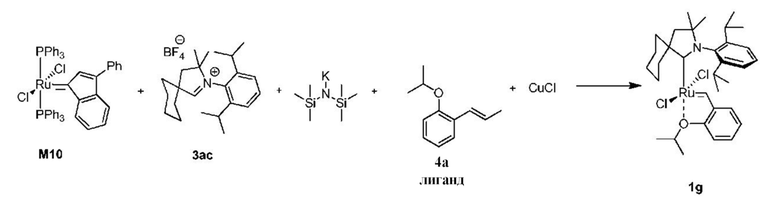
К соли 3ac (1,65 г, 4,0 ммоля, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (12 мл). Смесь нагревали до 80°C и добавляли раствор KHMDS в толуоле (0,5 M, 8,0 мл, 4,0 ммоля, 2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (1,77 г, 2,0 ммоля, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до 60°C. Добавляли бензилиденовый лиганд 4a (0,423 г, 2,4 ммоля, 1,2 молярного эквивалента) и CuCl (0,693 г, 7,0 ммоль, 3,5 молярного эквивалента). Реакционную смесь перемешивали в течение 25 минут при 60°С и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и фильтровали. Растворитель выпаривали, остаток промывали изопропанолом и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катализатора 1g (0,580 г, 45%). Сравнение с Примером XI.
Пример XIII
Способ получения предшественника катализатора 1h, содержащего бензилиден с активированной нитрогруппой:

К соли 3ac (1,65 г, 4,0 ммоля, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (16 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 4,0 мл, 4,0 ммоля, 2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (1,77 г, 2,0 ммоля, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до 60°C. Добавляли бензилиденовый лиганд 4b (0,531 г, 2,4 ммоля, 1,2 молярного эквивалента) и CuCl (0,693 г, 7,0 ммоль, 3,5 молярного эквивалента). Реакционную смесь перемешивали в течение 25 минут при 60°С и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и фильтровали. Растворитель выпаривали, остаток промывали изопропанолом и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катализатора 1h (0,550 г, 40%).
1H ЯМР (CD2Cl2, 500 МГц): δ = 16,42 (s, 1H), 8,44 (dd, J = 9,1; 2,7 Гц, 1H), 7,71 (t, J = 7,8 Гц, 1H), 7,65 (d, J = 2,7 Гц, 1H), 7,51 (d, J = 7,8 Гц, 2H), 7,10-7,07 (m, 1H), 5,25 (септ., J = 5,9 Гц, 1H), 3,30-3,21 (m, 2H), 2,96 (септ., J = 6,6 Гц, 2H), 2,31 (s, 2H), 2,28-2,22 (m, 2H), 1,96-1,89 (m, 2H), 1,78 (d, J = 6,1 Гц, 6H), 1,60-1,46 (m, 4H), 1,35 (s, 6H), 1,26 (d, J = 6,6 Гц, 6H), 0,64 (d, J = 6,4 Гц, 6H) м.д.
13C ЯМР (CD2Cl2, 125 МГц): δ = 288,9, 264,7, 157,5, 148,7, 143,3, 142,9, 136,7, 130,4, 126,5, 125,7, 118,4, 113,8, 79,0, 78,2, 62,8, 44,9, 35,3, 30,8, 28,9, 26,8, 26,1, 24,6, 23,6, 22,5 м.д.
HRMS-ESI, рассчитанное для C33H47N2O3Ru [M-2Cl+H]+: 621,2634; полученное: 621,2630.
Элементный анализ: рассчитанные для C33H46N2Cl2O3Ru:
C 57,38; H 6,71; N 4,06; Cl 10,27; полученные: C 57,27; H 6,58; N 4,18; Cl 10,12.
Пример XIV
Способ получения предшественника катализатора 1i, содержащего бензилиден с активированной гидроксамовой группой:
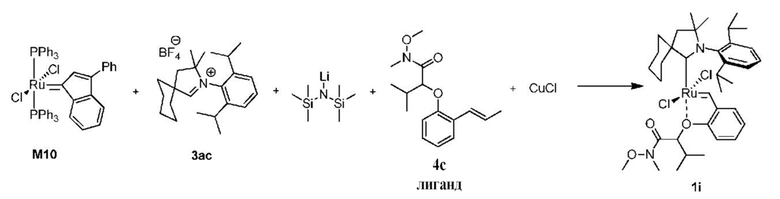
К соли 3ac (1,16 г, 2,8 ммоля, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (11 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 2,8 мл, 2,8 ммоля, 2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (1,24 г, 1,4 ммоля, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до 60°C. Добавляли бензилиденовый лиганд 4c (0,466 г, 1,68 ммоля, 1,2 молярного эквивалента) и CuCl (0,485 г, 4,9 ммоля, 3,5 молярного эквивалента). Реакционную смесь перемешивали в течение 5 минут при 60°С и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол -> этилацетат/циклогексан 3:7 об./об.). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и фильтровали. Растворитель выпаривали, а остаток растворяли в минимальном количестве метиленхлорида и добавляли н-гептан. Метиленхлорид медленно удаляли на испарителе, полученные кристаллы отфильтровывали, промывали небольшим количеством н-гептана и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катилизатора 1i (0,324 г, 31%).
1H ЯМР (CD2Cl2, 500 МГц): δ = 16,74 (s, 1H), 7,62-7,55 (m, 1H), 7,48-7,38 (m, 2H), 7,28 (d, J = 7,7 Гц, 1H), 7,07 (d, J = 8,4 Гц, 1H), 6,93 (td, J = 7,4; 0,8 Гц, 1H), 6,84 (dd, J = 7,5; 1,7 Гц, 1H), 5,51 (d, J = 8,3 Гц, 1H), 3,73 (s, 3H), 3,35 (s, 3H), 3,16 (септ., J = 6,5 Гц, 1H), 2,80-2,70 (m, 2H), 2,65 (септ., J = 6,7 Гц, 1H), 2,22 (t, J = 6,3 Гц, 2H), 1,36 (s, 3H), 1,33 (s, 3H), 1,32-1,28 (m, 6H), 1,25 (s, 3H), 1,19 (dd, J = 15,4; 6,6 Гц, 6H), 0,98 (dd, J = 8,8; 6,8 Гц, 6H), 0,76 (d, J = 6,3 Гц, 3H), 0,57 (d, J = 6,4 Гц, 3H) м.д.
13C ЯМР (CD2Cl2, 125 МГц): δ = 299,3, 267,8, 169,1, 154,6, 148,8, 148,6, 145,1, 144,1, 137,8, 132,9, 130,2, 130,0, 129,7, 126,3, 126,0, 125,1, 124,2, 123,4, 113,4, 81,5, 79,5, 78,1, 62,3, 62,1, 58,3, 45,8, 45,5, 37,3, 35,5, 34,6, 32,5, 32,0, 31,7, 30,2, 29,9, 29,6, 29,1, 28,6, 27,5, 27,2, 26,5, 25,8, 25,6, 25,0, 24,8, 24,0, 23,8, 23,7, 22,4, 19,9, 18,3 м.д.
LRMS-ESI, рассчитанное для C38H57N2O4Ru [M-2Cl+CH3O]+: 707,3; полученное: 707,3.
HRMS-ESI, рассчитанное для C37H54N2O3NaCl2Ru [M+Na]+: 769,2453; полученное 769,2437.
Пример XV
Способ получения промежуточного соединения 5а из предшественника первого поколения M1:
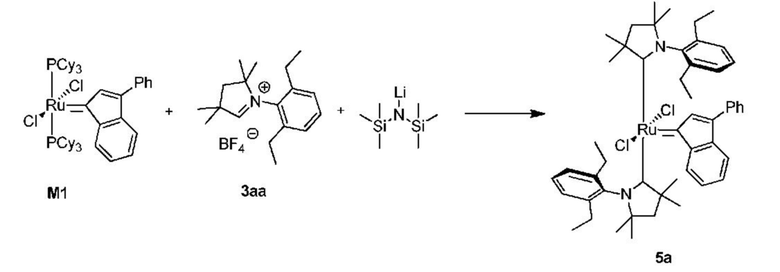
К соли 3aa (1,20 г, 3,48 ммоля, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (14 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 3,48 мл, 3,48 ммоля, 2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M1 (1,60 г, 1,74 ммоля, 1 молярный эквивалент). Спустя 20 минут смесь охлаждали до комнатной температуры. Реакционную смесь фильтровали через небольшое количество силикагеля и промывали толуолом. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: этилацетат/циклогексан 1:9 об./об.). Красную фракцию собирали и концентрировали досуха. Ее растворяли в н-пентане и медленно концентрировали досуха (продукт кристаллизовался в процессе удаления растворителя). Получали красное кристаллическое твердое вещество - промежуточное соединение 5а (1,07 г, 70%).
1H ЯМР (C6D6, 500 МГц): δ = 9,74 (d, J = 7,7 Гц, 0,25H), 9,09 (d, J = 7,3 Гц, 0,5H), 8,16 (s, 0,25H), 7,95-7,75 (m, 2H), 7,55-7,18 (m, 6H), 7,10-6,20 (m, 7H), 3,86-3,66 (m, 1H), 3,30-2,50 (m, 6H), 2,37 (d, J = 13,0 Гц, 9H), 1,75-1,22 (m, 12H), 1,10-0,85 (m, 20H) м.д.
13C ЯМР (CD2Cl2, 125 МГц): δ = 279,9, 278,5, 277,8, 276,2, 145,5, 144,1, 143,6, 143,5, 141,3, 141,1, 140,8, 140,7, 140,2, 139,0, 138,6, 138,4, 137,9, 137,6, 134,3, 134,1, 130,6, 129,8, 129,4, 129,2, 128,2, 127,9, 127,6, 127,4, 127,0, 126,9, 126,7, 125,7, 125,5, 124,9, 124,7, 116,5, 116,1, 81,3, 79,7, 61,5, 56,9, 56,4, 55,0, 34,7, 32,5, 32,0, 31,5, 31,0, 30,5, 30,3, 30,0, 29,9, 29,6, 29,2, 27,5, 27,4, 25,3, 25,2, 24,7, 22,9, 14,8, 14,7, 14,4, 13,5, 13,2, 12,9 м.д.
LRMS-ESI, рассчитанное для C51H64ClN2Ru [M-Cl]+: 841,4; полученное: 841,4.
HRMS-ESI, рассчитанное для C51H64N2Cl2Ru [M-]+: 876,3490; полученное 876,3471.
Элементный анализ: рассчитанные для C51H64N2Cl2Ru:
C 69,84; H 7,36; N 3,19; Cl 8,08; полученные: C 69,88; H 7,22; N 3,21; Cl 8,05.
Пример XVI
Способ получения промежуточного соединения 5a из предшественника M1, попытка с большим количеством соли CAAC 3aa - в данном случае 3 молярных эквивалента:
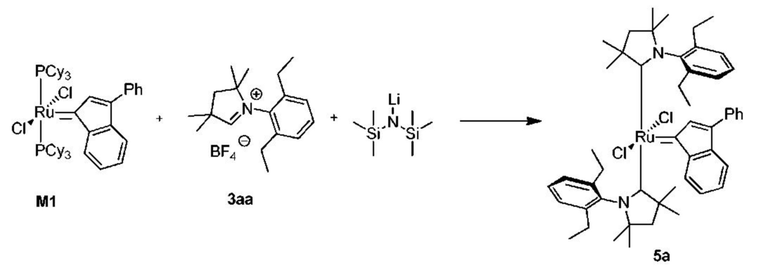
К соли 3аа (1,40 г, 4,05 ммоля, 3 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (10 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 4,05 мл, 4,05 ммоля, 3 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M1 (1,25 г, 1,35 ммоля, 1 молярный эквивалент). Спустя 5 минут смесь охлаждали до комнатной температуры. Реакционную смесь фильтровали через небольшое количество силикагеля и промывали толуолом. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: этилацетат/циклогексан 1:9 об./об.). Красную фракцию собирали и концентрировали досуха. Ее растворяли в н-пентане и медленно концентрировали досуха (продукт кристаллизовался в процессе удаления растворителя). Получали красное кристаллическое твердое вещество - промежуточное соединение 5а (1,02 г, 86%). Сравнение с Примером XV.
Пример XVII
Способ получения предварительного катализатора 1a - одностадийная процедура из промежуточного соединения 5а:
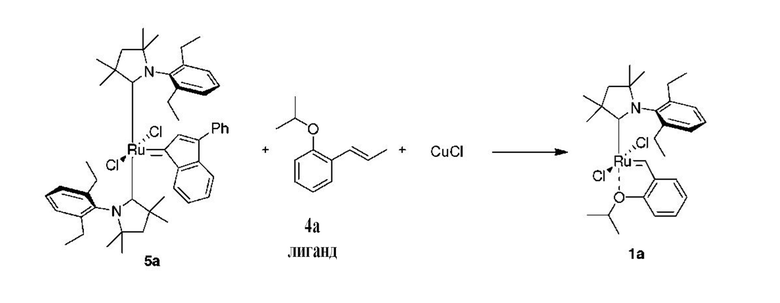
К раствору промежуточного соединения 5a (0,948 г, 1,08 ммоля, 1 молярный эквивалент) в сухом бескислородном толуоле (10 мл) при 60°C добавляли бензилиденовый лиганд 4a (0,228 г, 1,29 ммоля, 1,2 молярного эквивалента) и CuCl (0,214 г, 2,16 ммоля, 2 молярных эквивалента). Реакционную смесь перемешивали в течение 30 минут и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и фильтровали. Растворитель выпаривали, остаток промывали изопропанолом и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катализатора 1a (0,390 г, 62%).
Пример XVIII
Способ получения промежуточного соединения 5b из предшественника первого поколения Gru-I:
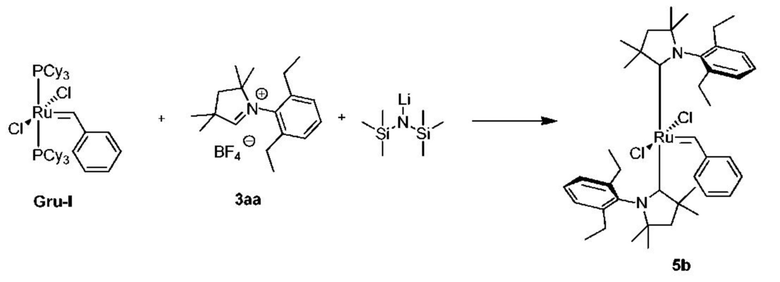
К соли 3aa (2,76 г, 8,0 ммоль, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (32 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 8,0 мл, 8,0 ммоль, 2 молярных эквивалента). Спустя 2 минуты добавляли твердый комплекс Gru-I (3,29 г, 4,0 ммоля, 1 молярный эквивалент). Спустя 25 минут смесь охлаждали до комнатной температуры. Реакционную смесь фильтровали через небольшое количество силикагеля и промывали толуолом. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: этилацетат/циклогексан 1:9 об./об.). Бурую фракцию собирали и концентрировали досуха. Ее растворяли в н-пентане и медленно концентрировали (продукт кристаллизовался в процессе удаления растворителя). Его отфильтровывали и промывали холодным н-пентаном. Получали бурое кристаллическое твердое вещество - промежуточное соединение 5b (1,55 г, 50%).
Смесь изомеров A:B = 3,2:1. В связи с очень сложным спектром 1Н ЯМР приведены только характерные сдвиги протонов бензилидена: изомер A: синглет 17,60 м.д., изомер B: синглет 18,52 м.д. (CD2Cl2).
13C ЯМР (CD2Cl2, 125 МГц): δ = 283,7, 280,0, 279,9, 278,7, 150,6, 148,3, 143,7, 143,1, 141,6, 141,0, 140,7, 139,7, 139,0, 138,3, 132,5, 131,7, 131,3, 129,7, 128,5, 128,4, 127,7, 127,5, 127,4, 127,3, 127,2, 125,7, 125,5, 125,1, 124,8, 81,0, 79,5, 79,4, 59,0, 56,7, 56,1, 53,7, 53,4, 32,3, 31,7, 31,1, 30,9, 30,6, 30,2, 29,6, 29,0, 28,5, 28,2, 27,3, 27,1, 25,7, 25,4, 24,4, 22,9, 15,2, 14,9, 14,5, 14,4, 12,5, 12,4 м.д.
LRMS-ESI, рассчитанное для C43H60ClN2Ru [M-Cl]+: 741,3; полученное: 741,3.
HRMS-ESI, рассчитанное для C43H60N2Cl2Ru [M-]+: 776,3177; полученное 776,3156.
Элементный анализ: рассчитанные для C43H60N2Cl2Ru:
C 66,47; H 7,78; N 3,61; Cl 9,13; полученные: C 66,42; H 7,75; N 3,59; Cl 9,18.
Пример XIX
Способ получения предшественника катализатора 1a из промежуточного соединения 5b:
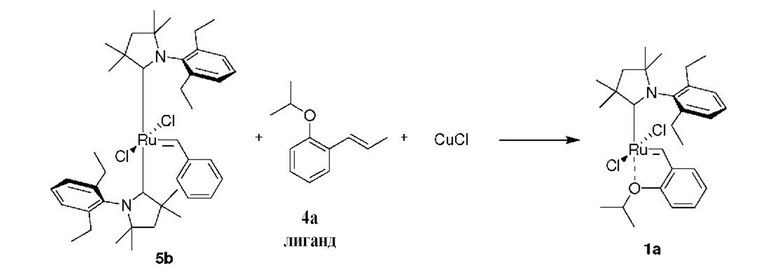
К раствору промежуточного соединения 5b (0,801 г, 1,03 ммоля, 1 молярный эквивалент) в сухом бескислородном толуоле (10 мл) при 60°C добавляли бензилиденовый лиганд 4a (0,217 г, 1,23 ммоля, 1,2 молярного эквивалента) и CuCl (0,204 г, 2,06 ммоля, 2 молярных эквивалента). Реакционную смесь перемешивали в течение 10 минут и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и фильтровали. Растворитель выпаривали, остаток промывали изопропанолом и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катализатора 1a (0,385 г, 65%).
Пример XX
Способ получения предшественника катализатора 1j, содержащего бензилиден с активированной гидроксамовой группой и йодид-лиганды:

К суспензии йодида натрия (1,04 г, 6,97 ммоля, 30 молярных эквивалентов) в ацетоне (2,3 мл) добавляли твердый предшественник катализатора 1c (0,158 г, 0,232 ммоля, 1 молярный эквивалент). Всю смесь перемешивали при комнатной температуре в течение 3 часов, а затем концентрировали досуха. Остаток растворяли в метиленхлориде, а неорганические соли удаляли путем фильтрования. Остаток фильтровали через небольшое количество силикагеля (элюент: этилацетат/циклогексан 3:7 об./об.). Растворитель выпаривали, а остаток растворяли в минимальном количестве метиленхлорида и добавляли н-гептан. Метиленхлорид медленно удаляли на испарителе, полученные кристаллы отфильтровывали, промывали небольшим количеством н-гептана и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества 1j (0,178 г, 89%).
1H ЯМР (CD2Cl2, 500 МГц): δ = 15,83 (s, 1H), 7,60 (dt, J = 8,7; 4,6 Гц, 1H), 7,57-7,52 (m, 1H), 7,47-7,44 (m, 1H), 7,42-7,38 (m, 1H), 7,03 (d, J = 8,3 Гц, 1H), 6,95 (d, J = 4,5 Гц, 2H), 5,50 (d, J = 7,7 Гц, 1H), 3,87 (s, 3H), 3,41 (s, 3H), 3,24 (dq, J = 15,1; 7,5 Гц, 1H), 2,80-2,62 (m, 3H), 2,44-2,36 (m, 4H), 2,24-2,20 (m, 1H), 2,15 (s, 3H), 2,14-2,10 (m, 1H), 1,35 (s, 3H), 1,26 (s, 3H), 1,20 (t, J = 7,4 Гц, 3H), 1,04 (dd, J = 7,0; 5,3 Гц, 6H), 0,94 (t, J = 7,4 Гц, 3H) м.д.
13C ЯМР (CD2Cl2, 125 МГц): δ = 306,5, 271,3, 170,8, 155,0, 146,3, 144,1, 143,7, 140,3, 130,2, 129,0, 127,3, 127,0, 123,8, 123,3, 113,6, 80,9, 78,4, 62,5, 55,7, 53,2, 35,2, 34,8, 33,4, 32,6, 30,0, 29,5, 27,2, 26,7, 20,8, 18,6, 15,5, 15,3 м.д.
HRMS-ESI, рассчитанное для C32H46IN2O3Ru [M-I]+: 735,1600; полученное: 735,1636.
Элементный анализ: рассчитанные для C32H46N2I2O3Ru:
C 44,61; H 5,38; N 3,25; I 29,46; полученные: C 44,47; H 5,37; N 3,21; I 29,29.
Пример XXI
Применение предшественников катализаторов 1a-1j в реакциях метатезиса с замыканием цикла (RCM) диэтилдиаллиломалоната S1, приводящих к образованию циклического соединения P1:

К раствору диэтилдиаллиломалоната S1 (120,1 мг, 0,5 ммоля) в сухом бескислородном толуоле (5 мл) при 29°C добавляли раствор соответствующего предшественника катализатора (1a-1j), 0,1 мол. %) в сухом бескислородном толуоле (50 мкл). Перемешивали в атмосфере аргона. Через определенные промежутки времени собирали 0,1 мл образцы реакционной смеси, к которым добавляли одну каплю простого этилвинилового эфира для дезактивации катализатора. Конверсию субстрата в зависимости от времени определяли с помощью ГХ-анализа. Обобщенные данные представлены в таблице 1.
Таблица 1. Конверсия DEDAM в зависимости от времени
Пример XXII
Применение предшественника катализатора 5a в реакциях метатезиса с замыканием цикла (RCM) диэтилдиаллиломалоната S1, приводящих к образованию циклического соединения P1:

К раствору диэтилдиаллиломалоната S1 (480,6 мг, 2,0 ммоля) в сухом бескислородном толуоле (20 мл) при 60°C добавляли раствор предшественника катализатора 5a (1,75 мг, 0,002 ммоля, 0,1 мол. %) в сухом бескислородном толуоле (50 мкл). В случае реакции с акцептором CAAC-карбена к реакционной смеси добавляли CuCl (1,98 мг, 0,02 ммоля). Всю смесь перемешивали в атмосфере аргона. Через определенные промежутки времени собирали 0,1 мл образцы реакционной смеси, к которым добавляли одну каплю простого этилвинилового эфира для дезактивации катализатора. Реакцию конверсии в зависимости от времени определяли с помощью ГХ-анализа. Обобщенные данные представлены в таблице 2.
Таблица 2. Конверсия DEDAM с промежуточным соединением 5a в зависимости от времени
Пример XXIII
Применение предварительных катализаторов 1a-1j в реакциях этенолиза метиловых эфиров жирных кислот, которые были получены путем переэтерификации рапсового масла (MOR):

Для данной реакции применяли смесь метиловых эфиров жирных кислот, которые были получены путем переэтерификации рапсового масла (MOR), состоящую из приблизительно 61% метилолеата, приблизительно 21% метилового эфира линолевой кислоты, приблизительно 10% эфира α-линоленовой кислоты, приблизительно 7% метиловых эфиров насыщенных жирных кислот, в том числе приблизительно 4% метилпальмитата и приблизительно 2% метилстеарата.
К дегазированной MOR (610 г), охлажденной до 0°C, добавляли раствор катализатора (0,052 ммоля) в сухом бескислородном толуоле (5 мл). Смесь под вакуумом закачивали в автоклав и перемешивали в течение 2 часов при 30°C под давлением 10 бар этилена. Спустя 2 часа реакцию гасили и к реакционной смеси добавляли 6 мл 0,1 М раствора SnatchCat [CAS: 51641-96-4] для дезактивации катализатора.
SnatchCat
Образцы анализировали с помощью газовой хроматографии. Конверсию определяли с применением метилпальмитата в качестве внутреннего стандарта.
Реакционные смеси, полученные в реакциях, катализируемых 1d и 1е, после фильтрации через тонкую подушку силикагеля, отгоняли при пониженном давлении с получением соответственно 173 г и 179 г метилового эфира 9-деценовой кислоты (9-DAME).
Конверсия и процент (площадь ГХ-пика) метилового эфира 9-деценовой кислоты (9-DAME) приведены в таблице 3.
Таблица 3. Конверсия MOR в реакции этенолиза с предшественниками катализаторов 1a-1i
(%)
Аналитические данные для 9-DAME:
1H ЯМР (CDCl3, 500 МГц): δ = 5,79 (ddt, J = 17,0; 10,2; 6,7 Гц, 1H), 4,98 (dq, J = 17,1; 1,7 Гц, 1H), 4,92 (ddd, J = 11,4; 2,3; 1,2 Гц, 1H), 3,66 (s, 3H), 2,29 (t, J = 7,5 Гц, 2H), 2,06-1,99 (m, 2H), 1,66-1,56 (m, 2H), 1,40-1,24 (m, 8H) м.д.
13C ЯМР (CDCl3, 125 МГц): 174,3, 139,1, 114,2, 51,4, 34,1, 33,7, 29,1, 28,9, 28,8, 24,9 м.д.
Пример XXIV
Способ получения промежуточного соединения 5c из предшественника M10 и соли CAAC 3ad:
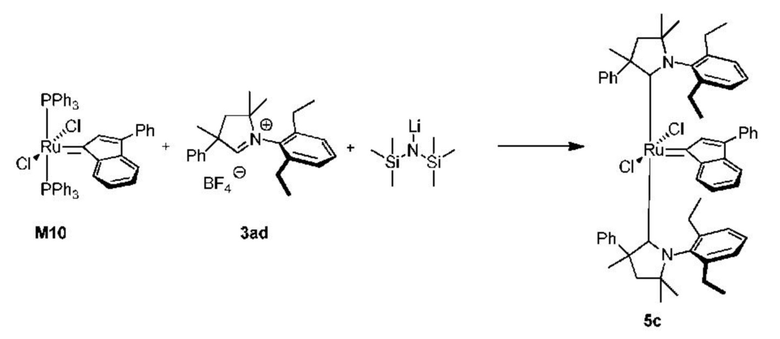
К соли 3ad (6,00 г, 14,73 ммоля, 3 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (35 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 14,73 мл, 14,73 ммоля, 3 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (4,35 г, 4,91 ммоля, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до комнатной температуры. Добавляли триэтиламин (2 мл) и фильтровали через тонкую подушку силикагеля (дезактивированного триэтиламином), который промывали 100 мл смеси толуола/триэтиламина (95:5 об./об.). Растворители выпаривали при пониженном давлении. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (дезактивированном триэтиламином, элюент: от циклогексана/триэтиламина (95:5 об./об.) до циклогексана/этилацетата/триэтиламина (90:5:5 об./об./об.)). Красно-бурую фракцию собирали и концентрировали досуха. Остаток растворяли в н-пентане. Растворитель выпаривали до 25% от его первоначального количества, осадок, образовавшийся в процессе выпаривания, отфильтровывали, промывали минимальным количеством холодного н-пентана и сушили в условиях высокого вакуума с получением оранжево-бурого кристаллического твердого вещества - соединения 5с (1,73 г, 35%).
1H ЯМР (C6D6, 500 МГц): δ = 9,59 (d, J = 7,5 Гц, 1H), 8,06 (d, J = 7,7 Гц, 2H), 7,76 (d, J = 7,4 Гц, 2H), 7,49-7,43 (m, 3H), 7,42-7,37 (m, 2H), 7,37-7,23 (m, 6H), 7,22-7,06 (m, 5H), 7,01-6,97 (m, 1H), 6,88 (t, J = 7,3 Гц, 1H), 6,81 (d, J = 7,6 Гц, 1H), 6,64 (t, J = 7,6 Гц, 1H), 6,34 (d, J = 7,5 Гц, 1H), 4,14 (dq, J = 14,9; 7,2 Гц, 1H), 3,10-2,83 (m, 4H), 2,83-2,73 (m, 1H), 2,73-2,63 (m, 1H), 2,57-2,48 (m, 1H), 2,05 (d, J = 12,3 Гц, 1H), 1,94-1,89 (m, 1H), 1,84 (d, J = 12,7 Гц, 1H), 1,78 (s, 3H), 1,62 (d, J = 12,7 Гц, 1H), 1,48-1,40 (m, 6H), 1,03 (dt, J = 14,5; 7,3 Гц, 6H), 0,95 (dt, J = 14,5; 7,3 Гц, 3H), 0,77 (s, 3H), 0,71 (s, 3H), 0,63 (s, 3H), 0,50 (s, 3H) м.д.
13C ЯМР (CD2Cl2, 125 МГц): δ = 288,1, 279,5, 273,4, 263,3, 150,5, 148,9, 148,1, 147,8, 147,2, 146,6, 144,9, 143,8, 143,8, 143,3, 142,0, 141,6, 141,4, 140,5, 140,2, 139,0, 138,9, 138,6, 138,1, 137,9, 137,5, 136,6, 135,9, 135,0, 131,0, 130,7, 130,4, 130,0, 129,9, 129,7, 129,2, 128,8, 128,7, 128,2, 128,1, 127,8, 127,7, 127,6, 127,5, 127,4, 127,3, 127,3, 127,2, 127,2, 127,2, 127,0, 126,9, 126,8, 126,6, 126,5, 126,4, 126,3, 126,3, 126,1, 125,4, 125,0, 124,7, 118,7, 116,5, 115,7, 96,2, 81,5, 80,5, 79,0, 68,9, 66,0, 65,1, 57,1, 55,4, 52,1, 49,1, 44,4, 32,2, 31,5, 30,2, 29,7, 29,4, 29,1, 28,6, 28,0, 27,7, 27,6, 27,3, 27,2, 26,6, 25,7, 25,5, 24,8, 24,8, 24,4, 16,3, 16,1, 14,5, 14,4, 14,0, 13,6, 13,4, 12,4 м.д.
HRMS-ESI, рассчитанное для C61H68N2Cl2Ru [M-]+: 1000,3803; полученное 1000,3798.
Элементный анализ: рассчитанные для C61H68N2Cl2Ru:
C 73,18; H 6,85; N 2,80; Cl 7,08; полученные: C 73,14; H 7,00; N 2,95; Cl 7,10.
Пример XXV
Способ получения промежуточного соединения 5d из предшественника M10 и соли CAAC 3ae:
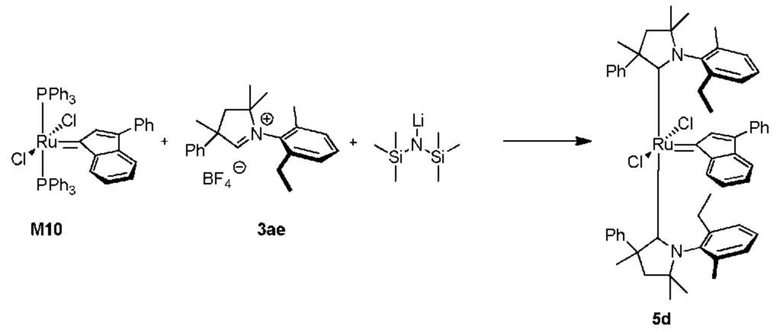
К соли 3ae (2,36 г, 6,0 ммоль, 3 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (14 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 6,0 мл, 6,0 ммоль, 3 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (1,77 г, 2,0 ммоля, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до комнатной температуры. Добавляли триэтиламин (2 мл) и фильтровали через тонкую подушку силикагеля (дезактивированного триэтиламином), который промывали 50 мл смеси толуола/триэтиламина (95:5 об./об.). Растворители выпаривали при пониженном давлении. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (дезактивированном триэтиламином, элюент: от циклогексана/триэтиламина (95:5 об./об.) до циклогексана/этилацетата/триэтиламина (90:5:5 об./об./об.)). Красно-бурую фракцию собирали и концентрировали досуха. Остаток растворяли в н-пентане. Растворитель выпаривали до 25% от его первоначального количества, осадок, образовавшийся в процессе выпаривания, отфильтровывали, промывали минимальным количеством холодного н-пентана и сушили в условиях высокого вакуума с получением оранжево-бурого кристаллического твердого вещества - соединения 5d (0,345 г, 18%).
1H ЯМР (C6D6, 500 МГц): δ = 9,69-9,49 (m, 1H), 8,17-7,99 (m, 2H), 7,82-7,65 (m, 2H), 7,60-7,23 (m, 9H), 7,23-7,04 (m, 6H), 7,02-6,10 (m, 6H), 3,14-2,76 (m, 4H), 2,74-2,46 (m, 2H), 2,38-2,24 (m, 3H), 2,10-1,35 (m, 12H), 1,31-1,23 (m, 2H), 1,08-0,92 (m, 5H), 0,80-0,59 (m, 10H) м.д.
13C ЯМР (C6D6, 125 МГц): δ = 290,2, 289,9, 289,0, 288,6, 280,9, 279,2, 279,1, 274,5, 274,2, 274,0, 149,4, 149,3, 149,3, 149,2, 149,0, 148,3, 145,3, 145,3, 145,2, 144,4, 144,2, 144,1, 144,1, 142,4, 142,1, 141,9, 141,8, 141,8, 141,1, 140,9, 139,6, 139,4, 139,2, 139,1, 139,0, 138,8, 138,6, 138,2, 138,1, 138,1, 136,9, 136,6, 136,0, 136,0, 135,7, 135,6, 135,5, 135,2, 131,1, 131,0, 130,9, 130,8, 130,7, 130,6, 130,4, 130,3, 130,1, 130,0, 129,9, 129,7, 129,6, 129,5, 129,1, 129,1, 129,0, 128,7, 128,3, 128,0, 127,9, 127,8, 127,8, 127,7, 127,7, 127,7, 127,6, 127,6, 127,3, 127,2, 126,8, 126,8, 126,7, 126,5, 126,3, 124,8, 124,6, 116,9, 116,9, 81,7, 81,5, 81,1, 80,9, 80,7, 69,1, 69,0, 65,4, 65,3, 65,2, 56,8, 56,7, 56,6, 55,5, 55,1, 53,9, 53,6, 31,0, 30,7, 30,2, 29,9, 29,9, 29,6, 29,6, 29,5, 29,3, 29,2, 29,0, 28,0, 27,9, 27,6, 27,4, 27,4, 27,3, 27,1, 25,8, 25,5, 25,4, 25,2, 25,1, 25,1, 25,0, 24,2, 24,0, 22,7, 22,6, 14,9, 14,8, 14,0, 13,8, 12,6, 12,6 м.д.
HRMS-ESI, рассчитанное для C59H64N2Cl2Ru [M-]+: 972,3490; полученное 972,3475.
Элементный анализ: рассчитанные для C59H64N2Cl2Ru:
C 72,82; H 6,63; N 2,88; Cl 7,29; полученные: C 72,69; H 6,68; N 2,71; Cl 7,07.
Пример XXVI
Способ получения промежуточного соединения 5e из предшественника M10 и соли CAAC 3ab:
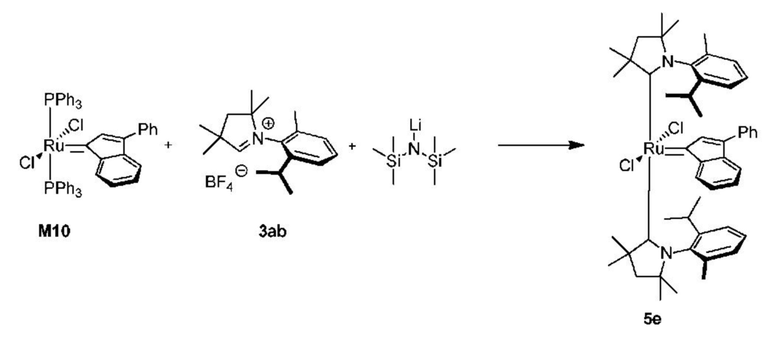
К соли 3ab (8,29 г, 24,0 ммоля, 3 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (56 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 24,0 мл, 24,0 ммоля, 3 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (7,09 г, 8,0 ммоль, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до комнатной температуры. Добавляли триэтиламин (5 мл) и фильтровали через тонкую подушку силикагеля (дезактивированного триэтиламином), который промывали 75 мл смеси толуола/триэтиламина (95:5 об./об.). Растворители выпаривали при пониженном давлении. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (дезактивированном триэтиламином, элюент: от циклогексана/триэтиламина (95:5 об./об.) до циклогексана/этилацетата/триэтиламина (90:5:5 об./об./об.)). Красно-бурую фракцию собирали и концентрировали досуха. Остаток растворяли в н-пентане. Растворитель выпаривали до 25% от его первоначального количества, осадок, образовавшийся в процессе выпаривания, отфильтровывали, промывали минимальным количеством холодного н-пентана и сушили в условиях высокого вакуума с получением оранжево-бурого кристаллического твердого вещества - соединения 5e (2,89 г, 41%).
1H ЯМР (C6D6, 500 МГц): δ = 10,05-8,65 (m, 1H), 8,50-7,45 (m, 3H), 7,40-7,15 (m, 7H), 7,05-6,05 (m, 5H), 3,86-3,62 (m, 1H), 3,12-2,89 (m, 1H), 2,86-2,02 (m, 8H), 1,92-1,11 (m, 22H), 1,10-0,65 (m, 14H), 0,44 (s, 2H) м.д.
13C ЯМР (CD2Cl2, 125 МГц): δ = 281,7, 281,0, 280,1, 279,1, 278,5, 147,6, 146,3, 142,0, 141,8, 141,1, 140,9, 139,9, 139,8, 139,5, 137,7, 136,7, 136,4, 136,1, 134,0, 131,8, 130,7, 130,0, 129,8, 129,5, 129,4, 129,2, 129,0, 128,7, 127,5, 127,3, 127,2, 127,0, 126,6, 125,8, 125,4, 116,6, 116,5, 80,3, 80,3, 62,7, 61,9, 61,4, 57,3, 56,8, 56,0, 32,0, 31,4, 30,8, 30,0, 28,9, 28,8, 28,6, 28,4, 27,8, 27,5, 27,3, 26,9, 26,5, 26,4, 25,7, 25,4, 24,0, 23,8, 23,2, 22,7 м.д.
HRMS-ESI, рассчитанное для C51H64N2Cl2Ru [M-]+: 876,3490; полученное 876,3477.
Элементный анализ: рассчитанные для C51H64N2Cl2Ru:
C 69,84; H 7,36; N 3,19; Cl 8,08; полученные: C 69,94; H 7,43; N 3,14; Cl 8,17.
Пример XXVII
Способ получения промежуточного соединения 5e из предшественника M1 и соли CAAC 3ab:
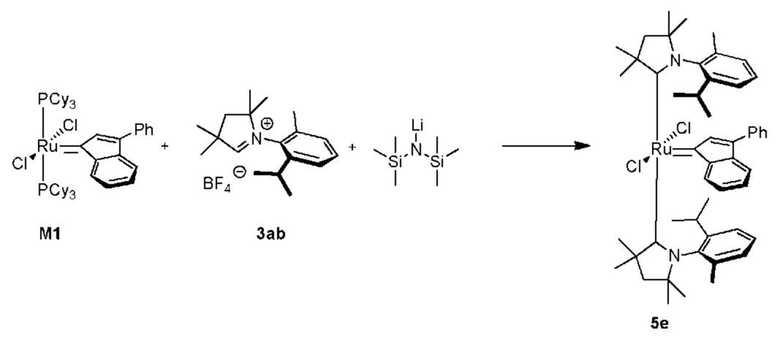
К соли 3аb (1,04 г, 3,0 ммоля, 3 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (7 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 3,0 мл, 3,0 ммоля, 3 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M1 (0,923 г, 1,0 ммоль, 1 молярный эквивалент). Спустя 10 минут смесь охлаждали до комнатной температуры. Добавляли триэтиламин (1 мл) и фильтровали через тонкую подушку силикагеля (дезактивированного триэтиламином), который промывали 25 мл смеси толуола/триэтиламина (95:5 об./об.). Растворители выпаривали при пониженном давлении. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (дезактивированном триэтиламином, элюент: от циклогексана/триэтиламина (95:5 об./об.) до циклогексана/этилацетата/триэтиламина (90:5:5 об./об./об.)). Красно-бурую фракцию собирали и концентрировали досуха. Остаток растворяли в н-пентане. Растворитель выпаривали до 25% от его первоначального количества, осадок, образовавшийся в процессе выпаривания, отфильтровывали, промывали минимальным количеством холодного н-пентана и сушили в условиях высокого вакуума с получением оранжево-бурого кристаллического твердого вещества - соединения 5e (0,72 г, 82%).
Аналитические данные для соединения 5е, полученные в этом Примере, были идентичны данным в Примере XXVI.
Пример XXVIII
Способ получения промежуточного соединения 5f из предшественника M10 и соли CAAC 3af:
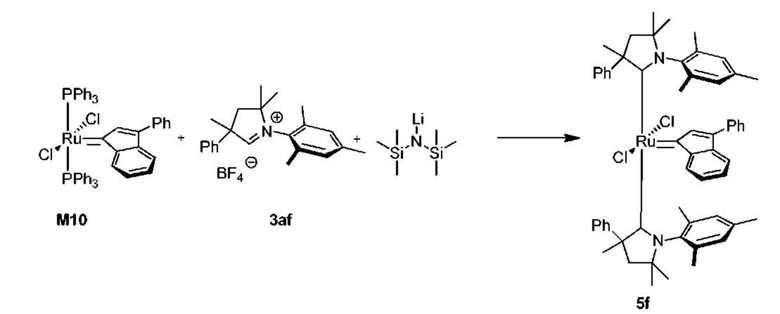
К соли 3af (2,36 г, 6,0 ммоль, 3 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (14 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 6,0 мл, 6,0 ммоль, 3 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (1,77 г, 2,0 ммоля, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до комнатной температуры. Добавляли триэтиламин (2 мл) и фильтровали через тонкую подушку силикагеля (дезактивированного триэтиламином), который промывали 50 мл смеси толуола/триэтиламина (95:5 об./об.). Растворители выпаривали при пониженном давлении. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (дезактивированном триэтиламином, элюент: от циклогексана/триэтиламина (95:5 об./об.) до циклогексана/этилацетата/триэтиламина (90:5:5 об./об./об.)). Красно-бурую фракцию собирали и концентрировали досуха. Остаток растворяли в н-пентане. Растворитель выпаривали до 25% от его первоначального количества, осадок, образовавшийся в процессе выпаривания, отфильтровывали, промывали минимальным количеством холодного н-пентана и сушили в условиях высокого вакуума с получением оранжево-бурого кристаллического твердого вещества - соединения 5f (0,210 г, 11%).
1H ЯМР (C6D6, 500 МГц): δ = 9,57 (d, J = 7,6 Гц, 1H), 8,14 (d, J = 7,8 Гц, 2H), 7,73 (d, J = 7,6 Гц, 2H), 7,61 (s, 1H), 7,52 (d, J = 7,5 Гц, 2H), 7,44 (t, J = 7,6 Гц, 2H), 7,37-7,16 (m, 5H), 7,15-7,11 (m, 1H), 7,086,80 (m, 5H), 6,64 (s, 1H), 6,42 (s, 1H), 5,90 (s, 1H), 2,85 (s, 3H), 2,32 (s, 6H), 2,22 (s, 3H), 2,19 (s, 3H), 2,10 (d, J = 12,5 Гц, 1H), 1,95-1,84 (m, 2H), 1,77 (s, 3H), 1,70 (s, 3H), 1,64 (d, J = 12,7 Гц, 1H), 1,50 (s, 3H), 0,80 (s, 3H), 0,72 (s, 3H), 0,67 (s, 3H), 0,61 (s, 3H) м.д.
13C ЯМР (CD2Cl2, 125 МГц): δ = 286,8, 278,5, 272,1, 148,7, 147,8, 144,8, 141,2, 139,1, 138,8, 138,5, 138,2, 137,7, 137,6, 136,6, 136,1, 136,0, 135,2, 134,3, 131,7, 131,0, 130,3, 130,2, 129,8, 129,6, 128,8, 128,6, 128,1, 127,5, 127,3, 127,3, 127,0, 126,6, 126,4, 116,0, 82,0, 81,9, 68,8, 65,0, 57,0, 55,6, 30,39, 30,16, 29,55, 28,50, 27,86, 27,37, 24,64, 24,30, 21,91, 21,13, 21,0 м.д.
HRMS-ESI, рассчитанное для C59H64N2Cl2Ru [M-]+: 972,3490; полученное 972,3483.
Элементный анализ: рассчитанные для C59H64N2Cl2Ru:
C 72,82; H 6,63; N 2,88; Cl 7,29; полученные: C 72,88; H 6,78; N 2,71; Cl 7,16.
Пример XXIX
Способ получения промежуточного соединения 5g из предшественника M10 и соли CAAC 3ag:
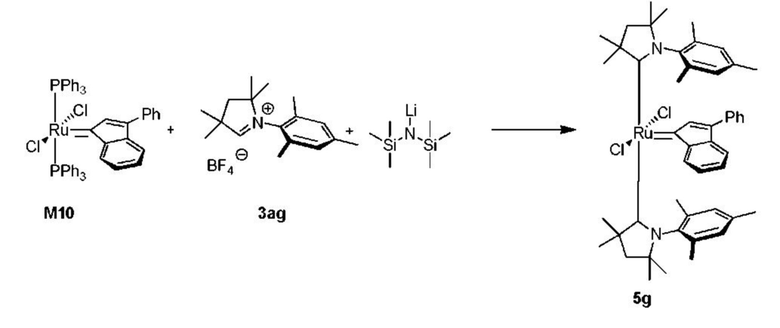
К соли 3ag (1,99 г, 6,0 ммоль, 3 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (14 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 6,0 мл, 6,0 ммоль, 3 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (1,77 г, 2,0 ммоля, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до комнатной температуры. Добавляли триэтиламин (2 мл) и фильтровали через тонкую подушку силикагеля (дезактивированного триэтиламином), который промывали 50 мл смеси толуола/триэтиламина (95:5 об./об.). Растворители выпаривали при пониженном давлении. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (дезактивированном триэтиламином, элюент: от циклогексана/триэтиламина (95:5 об./об.) до циклогексана/этилацетата/триэтиламина (90:5:5 об./об./об.)). Красно-бурую фракцию собирали и концентрировали досуха. Остаток растворяли в н-пентане. Растворитель выпаривали до 25% от его первоначального количества, осадок, образовавшийся в процессе выпаривания, отфильтровывали, промывали минимальным количеством холодного н-пентана и сушили в условиях высокого вакуума с получением оранжево-бурого кристаллического твердого вещества - соединения 5g (0,561 г, 33%).
1H ЯМР (CD2Cl2, 500 МГц): δ = 8,51 (d, J = 7,6 Гц, 1H), 7,75-7,65 (m, 2H), 7,52-7,46 (m, 1H), 7,46-7,39 (m, 2H), 7,14 (s, 1H), 7,11-7,04 (m, 1H), 7,03-6,96 (m, 1H), 6,84 (dd, J = 7,2; 1,4 Гц, 1H), 6,23 (s, 2H), 5,79 (s, 2H), 2,16 (s, 6H), 2,11 (s, 6H), 2,06-2,03 (m, 10H), 1,86 (s, 6H), 1,72 (s, 6H), 1,18 (s, 6H), 1,12 (s, 6H) м.д.
13C ЯМР (CD2Cl2, 125 МГц): δ = 280,2, 277,9, 144,0, 140,7, 138,2, 137,9, 137,4, 136,4, 135,8, 135,4, 134,1, 129,7, 129,6, 129,3, 129,2, 127,3, 127,0, 126,6, 126,6, 115,5, 80,9, 56,9, 54,5, 32,3, 32,1, 30,2, 29,5, 21,6, 21,4, 21,0 м.д.
HRMS-ESI, рассчитанное для C49H60N2Cl2Ru [M-]+: 848,3177; полученное 848,3161.
Элементный анализ: рассчитанные для C49H60N2Cl2Ru:
C 69,32; H 7,12; N 3,30; Cl 8,35; полученные: C 69,40; H 7,03; N 3,22; Cl 8,56.
Пример XXX
Способ получения промежуточного соединения 5g и второстепенного соединения 6g из предшественника M1 и соли CAAC 3ag:
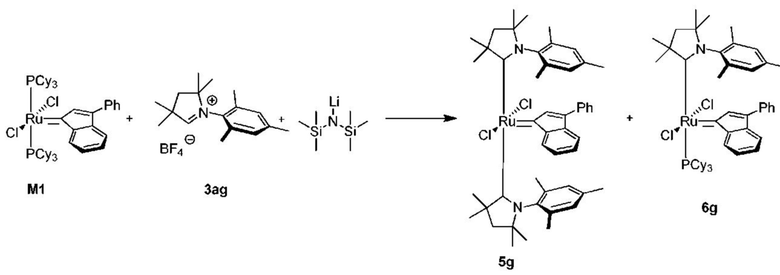
К соли 3ag (1,99 г, 6,0 ммоль, 3 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (14 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 6,0 мл, 6,0 ммоль, 3 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M1 (1,85 г, 2,0 ммоля, 1 молярный эквивалент). Спустя 30 минут смесь охлаждали до комнатной температуры. Добавляли триэтиламин (2 мл) и фильтровали через тонкую подушку силикагеля (дезактивированного триэтиламином), который промывали 50 мл смеси толуола/триэтиламина (95:5 об./об.). Растворители выпаривали при пониженном давлении. Неочищенные продукты 5g и 6g выделяли с помощью колоночной хроматографии на силикагеле (дезактивированном триэтиламином, элюент: от циклогексана/триэтиламина (95:5 об./об.) до циклогексана/этилацетата/триэтиламина (90:5:5 об./об./об.)). Две красно-бурых фракции собирали и концентрировали досуха. Остаток первой фракции растворяли в н-пентане. Растворитель выпаривали до 25% от его первоначального количества, осадок, образовавшийся в процессе выпаривания, отфильтровывали, промывали минимальным количеством холодного н-пентана и сушили в условиях высокого вакуума с получением оранжево-бурого кристаллического твердого вещества - соединения 6g (0,270 г, 15%). Остаток второй фракции растворяли в н-пентане. Растворитель выпаривали до 25% от его первоначального количества, осадок, образовавшийся в процессе выпаривания, отфильтровывали, промывали минимальным количеством холодного н-пентана и сушили в условиях высокого вакуума с получением оранжево-бурого кристаллического твердого вещества - соединения 5g (0,350 г, 21%).
Аналитические данные для соединения 5g, полученные в этом Примере, были идентичны данным в Примере XXIX. Аналитические данные для соединения 6g:
1H ЯМР (CD2Cl2, 500 МГц): δ = 8,61 (d, J = 7,3 Гц, 1H), 7,70 (dd, J = 8,2; 1,4 Гц, 2H), 7,54-7,47 (m, 1H), 7,42 (t, J = 7,6 Гц, 2H), 7,30 (s, 1H), 7,24-7,18 (m, 1H), 7,17-7,11 (m, 1H), 7,06-7,01 (m, 1H), 6,39 (s, 1H), 6,01 (s, 1H), 2,50-2,38 (m, 3H), 2,31 (s, 3H), 2,17 (s, 3H), 2,14 (d, J = 1,8 Гц, 2H), 2,06 (s, 3H), 2,00 (s, 3H), 1,93 (s, 3H), 1,90-1,80 (m, 3H), 1,76-1,54 (m, 12H), 1,53-1,34 (m, 6H), 1,22 (s, 6H), 1,20-1,06 (m, 9H) м.д.
13C ЯМР (CD2Cl2, 125 МГц): δ = 287,7, 287,7, 274,7, 274,2, 144,8, 141,4, 138,3, 137,4, 137,3, 137,3, 136,9, 136,5, 136,2, 130,0, 129,9, 129,6, 129,5, 128,1, 128,1, 127,8, 126,8, 116,5, 80,3, 80,3, 57,5, 57,4, 53,5, 53,5, 36,1, 35,6, 32,8, 32,7, 31,9, 31,6, 30,4, 30,1, 29,9, 28,8, 28,6, 28,5, 28,4, 28,3, 27,6, 27,5, 27,2, 27,1, 26,9, 26,9, 26,8, 22,9, 21,7, 21,4, 21,2 м.д.
31P ЯМР (CD2Cl2, 202 МГц): δ = 28,7 м.д.
HRMS-ESI, рассчитанное для C50H68NCl2RuP [M-]+: 885,3510; полученное 885,3506.
Элементный анализ: рассчитанные для C50H68Cl2NPRu:
C 67,78; H 7,74; N 1,58; Cl 8,00; полученные: C 67,84; H 7,67; N 1,47; Cl 7,91.
Пример XXXI
Способ получения промежуточного соединения 5h из предшественника M10 и соли CAAC 3ah:
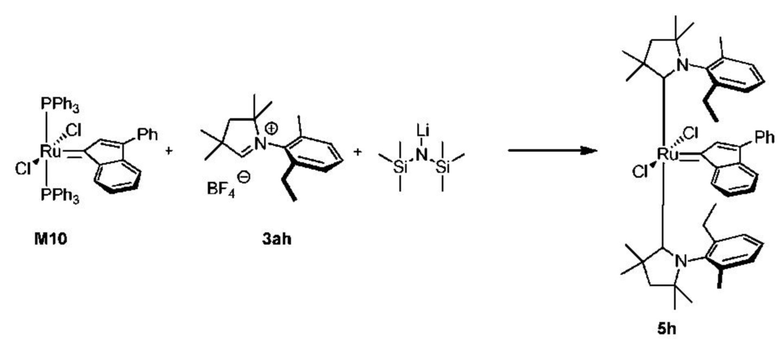
К соли 3ah (1,99 г, 6,0 ммоль, 3 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (14 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 6,0 мл, 6,0 ммоль, 3 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (1,77 г, 2,0 ммоля, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: циклогексан/этилацетат (9:1 об./об.)). Красно-бурую фракцию собирали и концентрировали досуха. Остаток растворяли в небольшом количестве метиленхлорида и добавляли избыток метанола. Метиленхлорид удаляли при пониженном давлении, осадок, образовавшийся в процессе выпаривания, отфильтровывали, промывали минимальным количеством холодного метанола и сушили в условиях высокого вакуума с получением оранжево-бурого кристаллического твердого вещества - соединения 5h (0,589 г, 35%).
1H ЯМР (C6D6, 500 МГц): δ = 9,88-8,08 (m, 1H), 8,02-7,40 (m, 3H), 7,39-7,20 (m, 4H), 7,12-6,85 (m, 3H), 6,75-6,10 (m, 5H), 3,85-2,90 (m, 2H), 2,87-2,67 (m, 1H), 2,66-2,50 (m, 1H), 2,46-2,22 (m, 12H), 2,21-2,01 (m, 3H), 1,80-1,15 (m, 7H), 1,14-0,65 (m, 18H) м.д.
13C ЯМР (CD2Cl2, 125 МГц): δ = 280,4, 280,3, 277,9, 277,8, 277,6, 144,2, 144,1, 141,1, 141,0, 140,9, 139,5, 139,4, 139,1, 139,1, 138,8, 137,9, 137,8, 137,8, 137,4, 135,5, 135,0, 134,6, 134,5, 131,0, 130,5, 129,7, 129,3, 129,2, 129,1, 129,0, 128,7, 128,4, 127,8, 127,7, 127,4, 127,3, 127,0, 126,8, 126,7, 126,6, 126,5, 125,2, 124,3, 116,3, 116,2, 116,1, 81,9, 80,6, 80,5, 61,5, 57,0, 56,9, 56,5, 54,9, 54,8, 54,7, 54,6, 32,7, 32,4, 32,4, 32,0, 31,8, 31,0, 30,2, 29,6, 29,5, 29,1, 28,8, 27,4, 25,2, 25,1, 24,6, 22,1, 21,8, 14,7, 13,1, 12,7 м.д.
HRMS-ESI, рассчитанное для C49H60N2Cl2Ru [M-]+: 848,3177; полученное 848,3159.
Элементный анализ: рассчитанные для C49H60N2Cl2Ru:
C 69,32; H 7,12; N 3,30; Cl 8,35; полученные: C 69,15; H 7,30; N 3,48; Cl 8,40.
Пример XXXII
Способ получения промежуточного соединения 5i из предшественника M10 и соли CAAC 3ai:
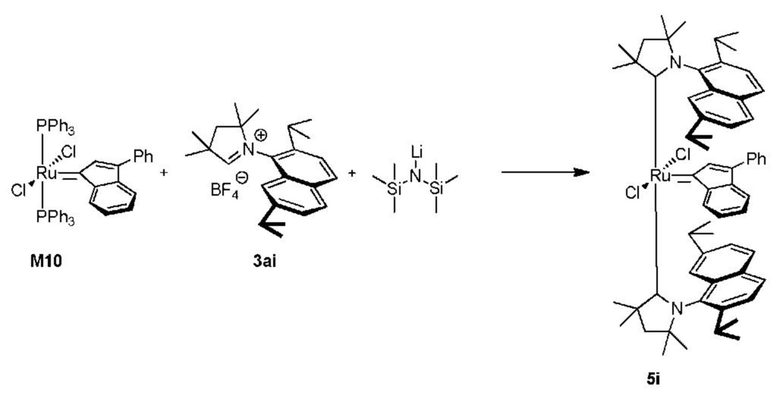
К соли 3ai (0,847 г, 2,0 ммоля, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (8 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 2,0 мл, 2,0 ммоля, 2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (0,887 г, 1,0 ммоль, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до комнатной температуры. Добавляли триэтиламин (1 мл) и фильтровали через тонкую подушку силикагеля (дезактивированного триэтиламином), который промывали 50 мл смеси толуола/триэтиламина (95:5 об./об.). Растворители выпаривали при пониженном давлении. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (дезактивированном триэтиламином, элюент: от циклогексана/триэтиламина (95:5 об./об.) до циклогексана/этилацетата/триэтиламина (90:5:5 об./об./об.)). Красно-бурую фракцию собирали и концентрировали досуха. Остаток растворяли в н-пентане. Растворитель выпаривали до 25% от его первоначального количества, осадок, образовавшийся в процессе выпаривания, отфильтровывали, промывали минимальным количеством холодного н-пентана и сушили в условиях высокого вакуума с получением оранжево-бурого кристаллического твердого вещества - соединения 5i (0,147 г, 14%) в виде смеси изомеров (изомер А - основной, а изомер В - второстепенный). Фильтрат выпаривали досуха. Его растворяли в небольшом количестве метиленхлорида и добавляли избыток метанола. Метиленхлорид выпаривали при пониженном давлении, осадок, образовавшийся в процессе выпаривания, отфильтровывали, промывали минимальным количеством холодного метанола и сушили в условиях высокого вакуума с получением красного кристаллического твердого вещества - соединения 5i (0,184 г, 18%) в виде смеси изомеров (изомер А - второстепенный, а изомер В - основной).
1H ЯМР (C6D6, 500 МГц): δ = 9,86-8,38 (m, 1H), 8,35-7,65 (m, 6H), 7,62-7,53 (m, 1H), 7,51-7,45 (m, 1H), 7,44-7,37 (m, 1H), 7,35-7,25 (m, 5H), 7,10-6,55 (m, 5H), 4,04-3,72 (m, 1H), 3,45-2,75 (m, 3H), 2,08-1,94 (m, 3H), 1,65-1,05 (m, 35H), 0,98-0,71 (m, 14H) м.д. (смесь изомеров).
13C ЯМР (CD2Cl2, 125 МГц): δ = 282,3, 281,1, 280,2, 279,0, 278,9, 277,5, 145,9, 145,3, 144,5, 144,5, 144,4, 142,8, 142,4, 141,2, 140,6, 140,2, 138,0, 137,5, 135,0, 134,7, 134,4, 134,4, 134,2, 133,2, 132,8, 132,6, 132,6, 132,5, 132,4, 132,4, 132,2, 131,8, 131,8, 131,4, 131,2, 130,6, 130,5, 129,5, 129,4, 129,2, 129,1, 129,0, 128,9, 128,7, 128,4, 128,0, 127,9, 127,6, 127,5, 127,4, 127,3, 127,2, 127,2, 127,1, 126,9, 126,2, 126,0, 125,7, 125,7, 125,6, 125,4, 125,2, 125,1, 124,7, 123,7, 123,6, 116,1, 115,6, 115,3, 81,5, 81,3, 80,8, 80,1, 62,0, 61,5, 56,5, 56,2, 55,8, 55,3, 54,8, 35,5, 35,4, 35,0, 34,3, 33,2, 32,2, 32,2, 31,6, 31,5, 31,3, 31,3, 30,8, 30,7, 30,6, 30,6, 30,5, 30,5, 30,4, 30,2, 30,1, 30,0, 29,9, 29,7, 29,5, 29,5, 28,9, 28,9, 28,8, 28,7, 28,3, 27,6, 27,5, 27,3, 26,8, 26,2, 26,0, 25,7, 25,7, 25,4, 24,9, 24,8, 24,7, 24,6, 24,5, 24,4, 24,3, 24,2, 23,8, 23,3, 23,2, 23,1, 23,1, 23,0, 22,9, 22,5 м.д.
Аналитические данные для смеси, обогащенной изомером A:
HRMS-ESI, рассчитанное для C63H76N2Cl2Ru [M-]+: 1032,4429; полученное 1032,4402.
Элементный анализ: рассчитанные для C63H76N2Cl2Ru:
C 73,23; H 7,41; N 2,71; Cl 6,86; полученные: C 73,19; H 7,46; N 2,60; Cl 6,84.
Аналитические данные для смеси, обогащенной изомером В:
HRMS-ESI, рассчитанное для C63H76N2Cl2Ru [M-]+: 1032,4429; полученное 1032,4426.
Элементный анализ: рассчитанные для C63H76N2Cl2Ru:
C 73,23; H 7,41; N 2,71; Cl 6,86; полученные: C 73,16; H 7,31; N 2,74; Cl 6,97.
Пример XXXIII
Способ получения промежуточного соединения 5j из предшественника Gru-I и соли CAAC 3ab:
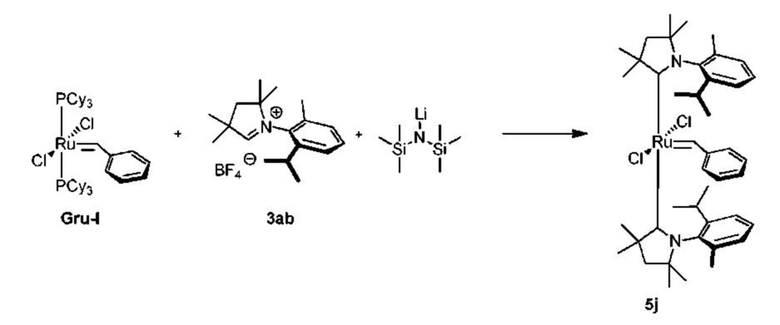
К соли 3аb (1,04 г, 3,0 ммоля, 3 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (7 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 3,0 мл, 3,0 ммоля, 3 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс Gru-I (0,823 г, 1,0 ммоль, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до комнатной температуры. Добавляли триэтиламин (1 мл) и фильтровали через тонкую подушку силикагеля (дезактивированного триэтиламином), который промывали 25 мл смеси толуола/триэтиламина (95:5 об./об.). Растворители выпаривали при пониженном давлении. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (дезактивированном триэтиламином, элюент: от циклогексана/триэтиламина (95:5 об./об.) до циклогексана/этилацетата/триэтиламина (90:5:5 об./об./об.)). Бурую фракцию собирали и концентрировали досуха. Остаток растворяли в н-пентане. Растворитель выпаривали до 25% от его первоначального количества, осадок, образовавшийся в процессе выпаривания, отфильтровывали, промывали минимальным количеством холодного н-пентана и сушили в условиях высокого вакуума с получением темно-бурого кристаллического твердого вещества - соединения 5j (0,441 г, 57%).
1H ЯМР (C6D6, 500 МГц): δ = 18,29 (s, 1H), 9,41 (d, J = 8,1 Гц, 1H), 7,12-7,07 (m, 1H), 7,01-6,95 (m, 1H), 6,84 (dd, J = 7,9; 1,6 Гц, 2H), 6,67 (td, J = 7,6; 1,5 Гц, 1H), 6,42 (t, J = 7,7 Гц, 2H), 6,22 (d, J = 7,9 Гц, 1H), 5,93 (dd, J = 7,5; 1,6 Гц, 2H), 3,23 (гепт., J = 6,4 Гц, 2H), 2,31 (d, J = 4,1 Гц, 12H), 2,21 (s, 6H), 1,74-1,60 (m, 10H), 1,18 (s, 6H), 1,11 (d, J = 6,6 Гц, 6H), 0,73 (s, 6H) м.д. (основной изомер).
13C ЯМР (CD2Cl2, 125 МГц): δ = 285,0, 284,9, 281,5, 149,4, 145,3, 139,1, 136,8, 131,9, 130,9, 129,1, 128,3, 127,6, 127,5, 127,3, 124,5, 79,3, 56,5, 55,2, 32,8, 31,8, 31,1, 29,8, 28,9, 28,5, 28,4, 28,3, 26,8, 22,2 м.д.
HRMS-ESI, рассчитанное для C43H60N2Cl2Ru [M-]+: 776,3177; полученное 776,3140.
Элементный анализ: рассчитанные для C43H60N2Cl2Ru:
C 66,47; H 7,78; N 3,61; Cl 9,13; полученные: C 66,24; H 7,75; N 3,46; Cl 9,01.
Пример XXXIV
Способ получения предшественника катализатора 1k из предшественника M10 и соли CAAC 3aj:
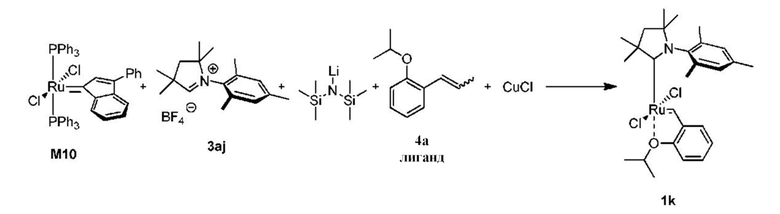
К соли 3aj (0,331 г, 1,0 ммоль, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (4 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 1,0 мл, 1,0 ммоль, 2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (0,443 г, 0,5 ммоля, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до 60°C. Добавляли бензилиденовый лиганд 4a (0,106 г, 0,6 ммоля, 1,2 молярного эквивалента) и CuCl (0,173 г, 1,75 ммоля, 3,5 молярного эквивалента). Всю смесь перемешивали в течение 20 минут при 60°С и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и фильтровали. Растворитель выпаривали, остаток промывали изопропанолом и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катализатора 1k (0,112 г, 40%).
1H ЯМР (CD2Cl2, 500 МГц): δ = 16,22 (s, 1H), 7,61 (ddd, J = 8,2; 7,1; 2,0 Гц, 1H), 7,15 (s, 2H), 7,01-6,89 (m, 3H), 5,16 (гепт., J = 6,2 Гц, 1H), 2,48 (s, 3H), 2,20 (s, 8H), 2,07 (s, 6H), 1,71 (d, J = 6,1 Гц, 6H), 1,41 (s, 6H) м.д.
13C ЯМР (CD2Cl2, 125 МГц): δ = 298,3, 298,1, 266,5, 152,6, 144,9, 139,2, 138,6, 138,2, 131,2, 131,0, 130,9, 123,8, 122,6, 113,6, 79,2, 75,5, 56,5, 52,5, 29,7, 29,3, 22,3, 21,3, 20,9 м.д.
HRMS-ESI, рассчитанное для C27H37NONaCl2Ru [M+Na]+: 586,1193; полученное 586,1185.
Элементный анализ: рассчитанные для C27H37NOCl2Ru:
C 57,54; H 6,62; N 2,49; Cl 12,58; полученные: C 57,51; H 6,62; N 2,39; Cl 12,68.
Пример XXXV
Способ получения предшественника катализатора 1l из предшественника M10 и соли CAAC 3ai:
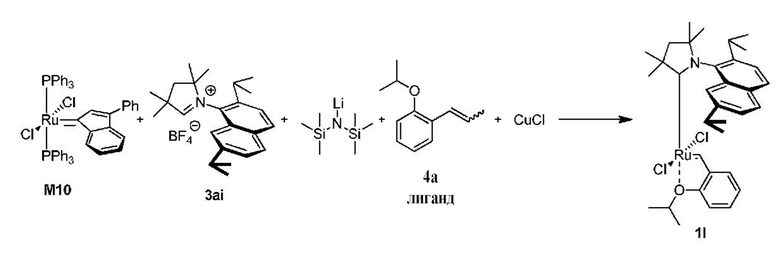
К соли 3ai (1,27 г, 2,0 ммоля, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (12 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 3,0 мл, 3,0 ммоля, 2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (1,33 г, 1,0 ммоль, 1 молярный эквивалент). Спустя 2 минуты смесь охлаждали до 60°C. Добавляли бензилиденовый лиганд 4a (0,317 г, 1,8 ммоля, 1,2 молярного эквивалента) и CuCl (0,520 г, 5,25 ммоля, 3,5 молярного эквивалента). Всю смесь перемешивали в течение 10 минут при 60°С и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и фильтровали. Растворитель выпаривали, остаток промывали изопропанолом и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катализатора 1l (0,517 г, 53%).
1H ЯМР (CD2Cl2, 500 МГц): δ = 15,98 (s, 1H), 8,11 (d, J = 8,7 Гц, 1H), 7,87-7,84 (m, 1H), 7,81 (d, J = 8,4 Гц, 1H), 7,68 (d, J = 8,7 Гц, 1H), 7,47 (ddd, J = 8,3; 7,4; 1,7 Гц, 1H), 7,35 (dd, J = 8,5; 1,7 Гц, 1H), 6,90 (d, J = 8,3 Гц, 1H), 6,76 (td, J = 7,5; 0,9 Гц, 1H), 6,52 (dd, J = 7,6; 1,7 Гц, 1H), 5,12 (гепт., J = 6,1 Гц, 1H), 3,23 (гепт., J = 6,6 Гц, 1H), 2,97 (гепт., J = 6,9 Гц, 1H), 2,38-2,33 (m, 4H), 2,29-2,25 (m, 1H), 2,05 (s, 3H), 1,76 (d, J = 6,1 Гц, 3H), 1,66 (d, J = 6,1 Гц, 3H), 1,45 (s, 3H), 1,39 (d, J = 6,7 Гц, 3H), 1,20 (d, J = 6,9 Гц, 6H), 1,17 (s, 3H), 0,80 (d, J = 6,5 Гц, 3H) м.д.
13C ЯМР (CD2Cl2, 125 МГц): δ = 296,2, 296,0, 268,5, 152,8, 146,6, 145,4, 143,8, 134,6, 132,1, 131,7, 131,0, 130,1, 127,6, 126,6, 124,4, 124,1, 123,6, 122,3, 113,4, 79,0, 75,5, 56,7, 52,7, 34,8, 31,0, 30,2, 29,6, 29,4, 29,2, 25,4, 24,4, 23,8, 23,4, 22,4, 22,3 м.д.
HRMS-ESI, рассчитанное для C34H45NOKCl2Ru [M+K]+: 694,1559; полученное 694,1552.
Элементный анализ: рассчитанные для C34H45NOCl2Ru:
C 62,28; H 6,92; N 2,14; Cl 10,81; полученные: C 62,25; H 6,88; N 1,98; Cl 10,76.
Пример XXXVI
Применение предшественников катализаторов 5a-5i в реакциях метатезиса с замыканием цикла (RCM) диэтилдиаллиломалоната S1, приводящих к образованию циклического соединения P1:

К раствору диэтилдиаллиломалоната S1 (480,6 мг, 2,0 ммоля) в сухом бескислородном толуоле (20 мл) при 40°C или 60°C добавляли раствор соответствующего предшественника катализатора 5a-5i (0,002 ммоля, 0,1 мол. %) в сухом бескислородном толуоле (50 мкл). Всю смесь перемешивали в атмосфере аргона. Через определенные промежутки времени собирали 0,1 мл образцы реакционной смеси, к которым добавляли одну каплю простого этилвинилового эфира для дезактивации катализатора. Конверсию субстрата определяли с помощью газовой хроматографии. Обобщенные данные представлены в таблице 4 (40°C) и таблице 5 (60°C).
Таблица 4. Конверсия DEDAM в зависимости от времени для реакции, проводимой при 40°C
Таблица 5. Конверсия DEDAM в зависимости от времени для реакции, проводимой при 60°C
Пример XXXVII
Применение предшественников катализаторов 5c-5i в реакциях этенолиза метилолеата (MO):

К дегазированному МО (35,0 г, 118 ммоль) добавляли раствор катализатора (10 м.д. или 5 м.д.) в сухом бескислородном толуоле (100 мкл). Смесь под вакуумом закачивали в автоклав и перемешивали в течение 5 часов при подходящей температуре под давлением 10 бар этилена. Спустя 5 часов реакцию гасили и после удаления этилена из реактора в реакционную смесь добавляли 0,1 мл 0,1 М раствора SnatchCat [CAS: 51641-96-4] в метиленхлориде для дезактивации катализатора. Образцы разводили метиленхлоридом и анализировали с помощью газовой хроматографии. Конверсии рассчитывали с применением остаточного метилстеарата в качестве внутреннего стандарта. Результаты были обобщены в таблице 6.
Для определения коэффициентов отклика детекторов ионизации на отдельные компоненты реакционной смеси готовили смесь субстрата, т. е. метилолеата (МО), требуемых продуктов реакции, которые представляли собой 1-ДЕЦЕН и 9-DAME, и побочных продуктов реакции, которые представляли собой ОД-9-ЕН и СЛОЖНЫЙ ДИЭФИР-C18, согласно приведенной ниже таблице. Полученную смесь разводили толуолом до 10 мл и анализировали с помощью газовой хроматографии. Площадь под пиком (AUP) для каждого компонента (среднее семи инъекций) делили на массу компонента аналитического образца с учетом степени его чистоты и с получением абсолютного коэффициента отклика у заданного компонента Rf'. Полагая, что коэффициент отклика метилолеата (МО) равен Rf=1, из пропорций рассчитывали абсолютные коэффициенты отклика Rf для остальных компонентов.
Таблица 6.
[мг]
AUP [мкВ×с]
При дальнейших расчетах площадь под пиком у заданного компонента на хроматограмме преобразовывали в процент в смеси с помощью рассчитанных выше коэффициентов отклика.
Селективность реакции (S) определяли по формуле:
S=100×(n1-ДЕЦЕН+n9-DAME)/[(n1-ДЕЦЕН+n9-DAME)]+2×(nОД-9-ЕН+nСЛОЖНЫЙ ДИЭФИР-C18)], где n обозначает число молей
Выход реакции (Y) определяли по формуле:
Y=конверсия×селективность/100
TON=выход реакции/количество катализатора в м.д.×10000.
Таблица 7. Этенолиз метилолеата (MO) с применением предшественников катализаторов 5c-5i и 1d
Пример XXXVIII
Применение предшественника катализатора 5c в реакции метатезиса с замыканием цикла (RCM) диаллилтозиламида S2, приводящей к образованию циклического соединения P2:
К раствору диаллилтозиламида S2 (205,0 мг, 0,816 ммоля) в сухом бескислородном толуоле (3 мл) при 55°C добавляли раствор предшественника катализатора 5с (0,041 мг, 0,041 мкмоля, 50 м.д.) в сухом бескислородном толуоле (50 мкл). Всю смесь перемешивали в атмосфере аргона. Спустя 20 минут забирали 0,1 мл образец реакционной смеси, в который добавляли каплю 0,1 М раствора SnatchCat для дезактивации катализатора. Конверсия субстрата, по результатам определения с помощью газовой хроматографии, превышала 99,5%.
Пример XXXIX
Применение предшественника катализатора 5c в реакции метатезиса с замыканием цикла (RCM) соединения S3, приводящей к образованию циклического соединения P3:

К раствору соединения S3 (212,0 мг, 0,776 ммоля) в сухом бескислородном толуоле (3 мл) при 55°C добавляли раствор предшественника катализатора 5с (0,039 мг, 0,039 мкмоля, 50 м.д.) в сухом бескислородном толуоле (50 мкл). Всю смесь перемешивали в атмосфере аргона. Спустя 1 час забирали 0,1 мл образец реакционной смеси, в который добавляли каплю 0,1 М раствора SnatchCat для дезактивации катализатора. Конверсия субстрата, по результатам определения с помощью газовой хроматографии, превышала 99,5%. Побочных продуктов не наблюдали.
1H ЯМР (CDCl3, 500 МГц): δ = 7,39-7,27 (m, 5H), 5,74-5,62 (m, 2H), 5,19-5,10 (m, 2H), 4,46-4,06 (m, 2H), 3,64-3,56 (m, 1H), 2,26-2,08 (m, 2H), 1,93-1,67 (m, 2H), 1,15 (dd, J = 6,4; 4,5 Гц, 3H) м.д.
13C ЯМР (CDCl3, 125 МГц): δ = 156,04, 155,96, 137,2, 137,1, 131,7, 131,4, 128,4, 128,3, 127,8, 127,7, 127,6, 127,4, 66,9, 66,7, 52,5, 52,3, 39,4, 39,1, 34,0, 33,9, 27,1, 26,9, 19,6, 19,1 м.д.
Пример XXXX
Применение предшественника катализатора 5c в реакции гомометатезиса метилового эфира 9-деценовой кислоты 9-DAME, приводящей к образованию соединения СЛОЖНЫЙ ДИЭФИР-C18:
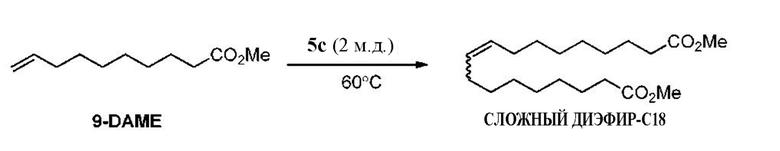
К метиловому эфиру 9-деценовой кислоты 9-DAME (5,53 г, 30,0 ммоль) при 60°С добавляли раствор предшественника катализатора 5c (0,060 мг, 0,060 мкмоля, 2 м.д.) в сухом бескислородном толуоле (50 мкл). Всю смесь перемешивали в атмосфере аргона (аргон барботировали через реакционную смесь). Спустя 2 часа реакционную смесь охлаждали до температуры окружающей среды, добавляли 5 капель 0,1 М раствора SnatchCat и реакционную смесь перемешивали в течение следующих 30 минут.
Для построения стандартных кривых готовили два аналитических образца соответственно субстрата и продукта. Аналитические образцы разводили до получения соответствующих концентраций стандартного раствора. Графики, изображающие соотношение между площадью под пиком (AUP) на хроматограмме и концентрацией (мг/мл) анализируемого соединения, показаны на фиг. 2.
Готовили 28,70 мг аналитического образца постреакционной смеси и разводили до 10 мл (2,87 мг/мл).
На хроматограмме такого полученного раствора AUP для субстрата составляла 166469,8 мкВ×с (среднее трех инъекций), а AUP для продукта составляла 47666,1 мкВ×с (среднее трех инъекций), что соответствовало концентрации субстрата 0,89 мг/мл (исходя из стандартной кривой для субстрата) и концентрации продукта 1,95 мг/мл (исходя из стандартной кривой для продукта).
Конверсию и выход определяли по формулам:
Конверсия=100%×(1-(0,89/2,87))=68,99%
Выход=100%×1,95/2,87=67,94%.
Селективность=100%×выход/конверсия=98,48%.
TON=169850.
Смесь E/Z изомеров (1,5:1).
1H ЯМР (CDCl3, 500 МГц): δ = 5,36 (ddd, J = 5,3; 3,7; 1,6 Гц, 2H, E), 5,32 (ddd, J = 5,7; 4,3; 1,1 Гц, 2H, Z), 3,65 (s, 6H), 2,29 (t, J = 7,5 Гц, 4H), 2,03-1,90 (m, 4H), 1,68-1,56 (m, 4H), 1,35-1,23 (m, 16H) м.д.
13C ЯМР (CDCl3, 125 МГц): δ = 174,25 (E), 174,24 (Z), 130,3 (E), 129,8 (Z), 51,4, 34,1, 32,5, 29,6 (Z), 29,5 (E), 29,12 (Z), 29,08 (E), 29,07 (E), 29,05 (Z), 28,9, 27,1 (Z), 24,9 (E) м.д.
Пример XXXXI
Применение предшественника катализатора 5c в реакции гомометатезиса 1-ДЕЦЕНА, приводящей к образованию октадец-9-ена E:
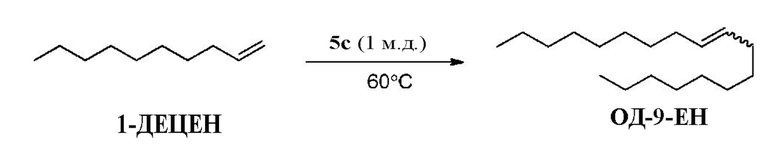
К 1-ДЕЦЕНУ (5,22 г, 37,2 ммоля) при 60°C добавляли раствор предшественника катализатора 5c (0,037 мг, 0,037 мкмоля, 1 м.ч.) в сухом бескислородном толуоле (50 мкл). Всю смесь перемешивали в атмосфере аргона (аргон барботировали через реакционную смесь). Спустя 2 часа реакционную смесь охлаждали до температуры окружающей среды, добавляли 5 капель 0,1 М раствора SnatchCat и перемешивали в течение следующих 30 минут. Затем отдельно готовили два раствора реакционной смеси с известной концентрацией. Конверсию (64%) и выход (63%) определяли газовой хроматографией с помощью способа внешнего стандарта (расчеты проводили аналогично показанным в Примере XXXX). Графики, изображающие соотношение между площадью под пиком (AUP) на хроматограмме и концентрацией (мг/мл) анализируемого соединения, показаны на фиг. 3. Селективность реакции 98%. TON составляло 316398.
Смесь E/Z изомеров (4:1).
1H ЯМР (CDCl3, 500 МГц): δ = 5,39 (ddd, J = 5,3; 3,7; 1,6 Гц, 2H, E), 5,35 (ddd, J = 5,7; 4,4; 1,1 Гц, 2H, Z), 2,06-1,91 (m, 4H), 1,38-1,18 (m, 24H), 0, 88 (t, J = 6,9 Гц, 6H) м.д.
13C ЯМР (CDCl3, 125 МГц): δ = 130,4 (E), 129,9 (Z), 32,6, 31,9, 29,8 (Z), 29,7 (E), 29,53 (Z), 29,51 (E), 29,3, 29,2 (E), 27,2 (Z), 22,7, 14,1 м.д.
Пример XXXXII
Применение предшественника катализатора 5c в реакции перекрестного метатезиса метилового эфира 9-деценовой кислоты 9-DAME с акрилонитрилом S6, приводящей к образованию соединения P6:
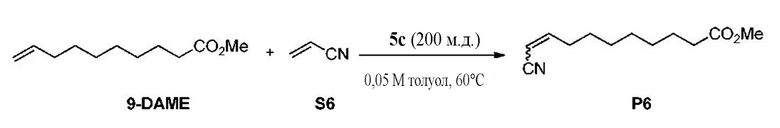
К раствору метилового эфира 9-деценовой кислоты 9-DAME (184,0 мг, 1,0 ммоль) в сухом бескислородном толуоле (20 мл) добавляли акрилонитрил S6 (99 мкл, 1,50 ммоля, 1,5 молярного эквивалента) и метилстеарат (10 мг, внутренний стандарт) при 60°C с последующим добавлением раствора предшественника катализатора 5c (0,1 мг, 0,1 мкмоля, 100 м.д.) в сухом бескислородном толуоле (50 мкл). Реакционную смесь перемешивали в атмосфере аргона. Спустя 1 час, а затем спустя 2 часа добавляли дополнительные порции предшественника катализатора 5c (2× 0,05 мг, 0,05 мкмоля, 50 м.д.) в сухом бескислородном толуоле (50 мкл). Всего было использовано 0,2 мг, 0,2 мкмоля, 200 м.д. предшественника катализатора 5с. Спустя еще час забирали 0,1 мл образец реакционной смеси, в который добавляли каплю 0,1 М раствора SnatchCat для дезактивации катализатора. Конверсия субстрата, по результатам определения с помощью газовой хроматографии с внутренним стандартом, составляла 87%. Содержание продукта P6 на хроматограмме составляло 75%.
Смесь E/Z изомеров (1:4).
1H ЯМР (CDCl3, 500 МГц): δ = 6,69 (dt, J = 16,4; 7,0 Гц, 1H, E), 6,46 (dt, J = 10,9; 7,7 Гц, 1H, Z), 5,30 (dt, J = 16,4; 1,7 Гц, 1H, E), 5,29 (dt, J = 10,9; 1,3 Гц, 1H, Z), 3,65 (s, 3H, E + 3H, Z), 2,40 (dq, J = 7,6; 1,3 Гц, 2H, Z), 2,29 (t, J = 7,5 Гц, 2H, E + 2H, Z), 2,20 (qd, J = 7,1; 1,7 Гц 2H, E), 1,64-1,54 (m, 2H, E + 2H, Z), 1,50-1,39 (m, 2H, E + 2H, Z), 1,36-1,26 (m, 6H, E + 6H, Z) м.д.
13C ЯМР (CDCl3, 125 МГц): δ = 174,12 (Z), 174,08 (E), 156,0 (E), 155,0 (Z), 117,5 (E), 116,0 (Z), 99,6 (E), 99,5 (Z), 51,39 (E), 51,37 (Z), 33,95 (Z), 33,92 (E), 33,2 (E) 31,7 (Z), 28,87 (Z), 28,85 (E), 28,83 (Z+E), 28,72 (Z), 28,68 (E), 28,1 (Z), 27,5 (E), 24,77 (Z), 24,75 (E) м.д.
Пример XXXXIII
Применение предшественника катализатора 5c в реакции перекрестного метатезиса метилового эфира 9‑деценовой кислоты 9-DAME с метилакрилатом S7, приводящей к образованию соединения P7:
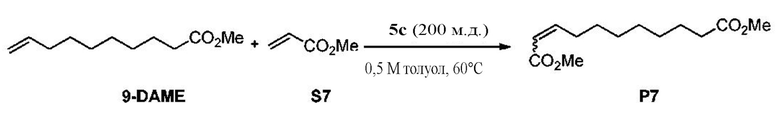
К раствору метилового эфира 9-деценовой кислоты 9-DAME (400,0 мг, 2,17 ммоля) в сухом бескислородном толуоле (4 мл) добавляли метилакрилат S7 (0,98 мкл, 10,9 ммоля, 5 молярных эквивалентов), метилстеарат (20 мг, внутренний стандарт) при 60°C с последующим добавлением раствора предшественника катализатора 5c (0,109 мг, 0,109 мкмоля, 50 м.д.) в сухом бескислородном толуоле (50 мкл). Всю смесь перемешивали в атмосфере аргона. Спустя 1 час, 2 часа и 3 часа добавляли дополнительные порции предшественника катализатора 5c (3× 0,109 мг, 0,109 мкмоля, 50 м.д.) в сухом бескислородном толуоле (50 мкл). Всего было использовано 0,436 мг, 0,436 мкмоля, 200 м.д. предшественника катализатора 5с. Спустя еще час забирали 0,1 мл образец реакционной смеси, в который добавляли каплю 0,1 М раствора SnatchCat для дезактивации катализатора. Конверсия субстрата, по результатам определения с помощью газовой хроматографии с внутренним стандартом, составляла 99%. Содержание продукта Р7 в постреакционной смеси составляло 97%.
Смесь E/Z изомеров (87:13).
Изомер E:
1H ЯМР (CDCl3, 500 МГц): δ = 6,94 (dt, J = 15,7; 7,0 Гц, 1H), 5,80 (dt, J = 15,6; 1,6 Гц, 1H), 3,71 (s, 3H), 3,65 (s, 3H), 2,28 (t, J = 7,5 Гц, 2H), 2,17 (dq, J = 7,1; 1,6 Гц, 2H), 1,64-1,56 (m, 2H), 1,47-1,39 (m, 2H), 1,33-1,26 (m, 6H) м.д.
13C ЯМР (CDCl3, 125 МГц): δ = 174,2, 167,1, 149,6, 133,4, 120,8, 51,4, 51,3, 34,0, 32,1, 29,0, 28,9, 27,9, 24,8 м.д.
Изомер Z:
1H ЯМР (CDCl3, 500 МГц): δ = 6,22 (dt, J = 11,6; 7,5 Гц, 1H), 5,76 (dt, J = 11,5; 1,7 Гц, 1H), 3,70 (s, 3H), 3,66 (s, 3H), 2,64 (dq, J = 7,5; 1,7 Гц, 2H), 2,30 (t, J = 7,5 Гц, 2H), 1,65-1,56 (m, 2H), 1,47-1,39 (m, 2H), 1,34-1,28 (m, 6H) м.д.
13C ЯМР (CDCl3, 125 МГц): δ = 174,3, 166,8, 150,8, 119,2, 51,4, 51,0, 34,1, 29,1, 29,0, 28,9, 24,9, 24,8 м.д.
Пример XXXXIV
Применение предшественника катализатора 5c в реакции метатезиса с замыканием цикла S8, приводящей к образованию соединения P8 с тетразамещенной двойной связью:
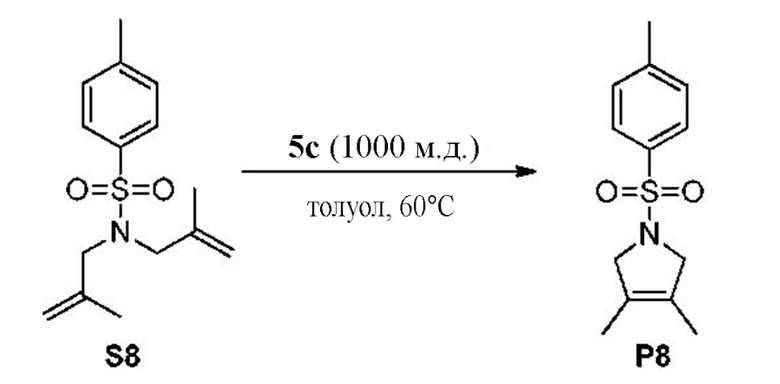
К раствору соединения S8 (509,0 мг, 1,82 ммоля) в сухом бескислородном толуоле (6,8 мл) при 60°C в атмосфере аргона каждые 10 минут добавляли раствор предшественника катализатора 5c (0,182 мг, 0,182 мкмоля, 100 м.д.) в сухом бескислородном толуоле (50 мкл) до общего количества 1000 м.д. предшественника катализатора 5c (10 частей). Всю смесь перемешивали в атмосфере аргона в течение дополнительного часа. Забирали 0,1 мл образца реакционной смеси, в который добавляли каплю 0,1 М раствора SnatchCat для дезактивации катализатора. Конверсия субстрата, по результатам определения с помощью газовой хроматографии, составляла 90%. Продукт выделяли с помощью колоночной хроматографии на силикагеле. Белое твердое вещество, 361 мг (79%).
1H ЯМР (CDCl3, 500 МГц): δ = 7,70 (d, J = 8,2 Гц, 2H), 7,30 (d, J = 8,0 Гц, 2H), 3,96 (s, 4H), 2,41 (s, 3H), 1,53 (s, 6H) м.д.
13C ЯМР (CDCl3, 125 МГц): δ = 143,2, 134,2, 129,6, 127,4, 126,1, 58,7, 21,4, 11,0 м.д.
Пример XXXXV
Применение предшественника катализатора 5c в реакции гомометатезиса метилолеата MO, приводящей к образованию соединений ОД-9-ЕНА и СЛОЖНОГО ДИЭФИРА-C18:
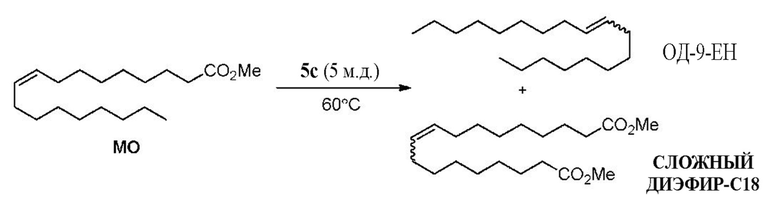
К метилолеату MO (19,52 г, 65,9 ммоля) при 60°C в атмосфере аргона каждые 30 минут добавляли раствор предшественника катализатора 5c (0,066 мг, 0,066 мкмоля, 1 м.д.) в сухом бескислородном толуоле (50 мкл) до 5 м.д. предшественника катализатора 5c (5 частей). Всю смесь перемешивали в атмосфере аргона в течение дополнительного часа. Забирали каплю реакционной смеси и разводили ее этилацетатом до 1 мл, а затем для дезактивации катализатора добавляли каплю 0,1 М раствора SnatchCat. Образец анализировали с помощью газовой хроматографии. На полученной хроматограмме соотношение площадей ОД-9-ЕНА/MO/СЛОЖНОГО ДИЭФИРА-C18 соответственно составляло 21%/57%/22%.
Пример XXXXVI
Применение предшественника катализатора 5c в реакции метатезиса с замыканием цикла соединения S9, приводящей к образованию макроциклического лактона P9:
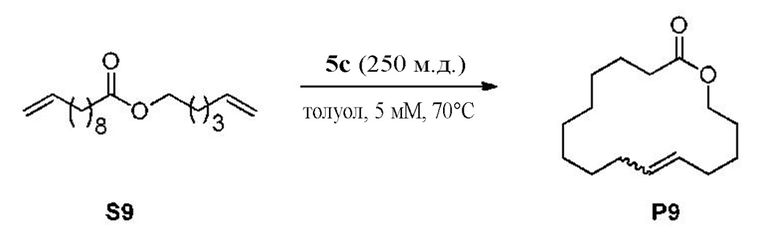
К раствору соединения S9 (213,0 мг, 0,799 ммоля) в сухом бескислородном толуоле (160 мл, CS9=5 мM) при 70°C в атмосфере аргона каждые 15 минут добавляли раствор предшественника катализатора 5c (0,040 мг, 0,040 мкмоля, 50 м.д.) в сухом бескислородном толуоле (50 мкл) до общего количества (предшественника) катализатора 250 м.д. (5 частей). Всю смесь перемешивали в атмосфере аргона в течение дополнительного часа. Забирали 1 мл образца реакционной смеси, в который добавляли каплю 0,1 М раствора SnatchCat для дезактивации катализатора. Конверсия субстрата, по результатам определения с помощью газовой хроматографии с внешним стандартом, составляла 95%. E/Z=65:35. Стандартная кривая для продукта P9 показана на фиг. 4.
Постреакционную смесь анализировали с помощью ГХ без дополнительных разведений. Кумулятивная площадь под пиками (изомеров E и Z) продукта составляла 1165868 (среднее трех инъекций). Концентрация продукта в постреакционной смеси составляла 4,56 мМ (C=1165868/255756). Выход ГХ Y=4,56 мM×100%/5 мM=91%.
1H ЯМР (CDCl3, 500 МГц): δ = 5,43-5,23 (m, 2H), 4,13 (t, J = 6,3 Гц, 2H, Z), 4,11 (t, J = 7,1 Гц, 2H, E), 2,35-2,27 (m, 2H), 2,07-1,98 (m, 4H), 1,67-1,55 (m, 4H), 1,44-1,16 (m, 12H) м.д.
13C ЯМР (CDCl3, 125 МГц): δ = 173,8, 131,8 (E), 130,3 (E), 130,1 (Z), 129,5 (Z), 64,1 (Z), 63,9 (E), 34,7 (E), 33,8 (Z), 32,0 (E), 31,9 (E), 29,1 (Z), 28,4 (Z), 28,3 (E), 28,3 (E), 28,2 (E), 28,1 (Z), 28,0 (E), 27,9 (Z), 27,6 (Z), 27,21 (E), 27,18 (Z), 27,1 (Z), 26,6 (Z), 26,5 (E), 26,4 (Z), 25,4 (E), 25,20 (Z), 25,18 (E) м.д.
Пример XXXXVII
Способ получения предшественника катализатора 1d без CuCl:
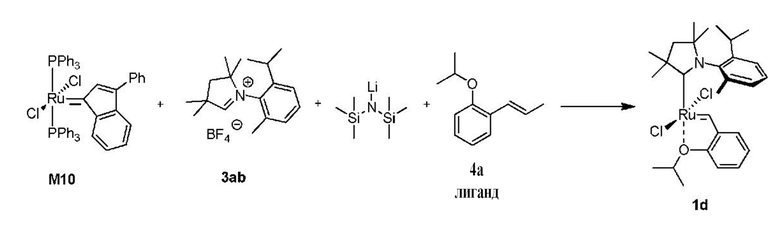
К соли 3ab (0,345 г, 1,0 ммоль, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (4 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 1,0 мл, 1,0 ммоль, 2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (0,443 г, 0,5 ммоля, 1 молярный эквивалент). Спустя 2 минуты добавляли бензилиденовый лиганд 4a (0,176 г, 1,0 ммоль, 2,0 молярных эквивалента). Всю смесь перемешивали в течение 30 минут при 105°С и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в этилацетате и выпаривали, а затем остаток промывали изопропанолом и сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катализатора 1d (0,130 г, 45%).
Аналитические данные для продукта 1d, полученного с помощью данного способа, были идентичны данным в Примере VII.
Пример XXXXVIII
Способ получения предшественника катализатора 1m без CuCl:
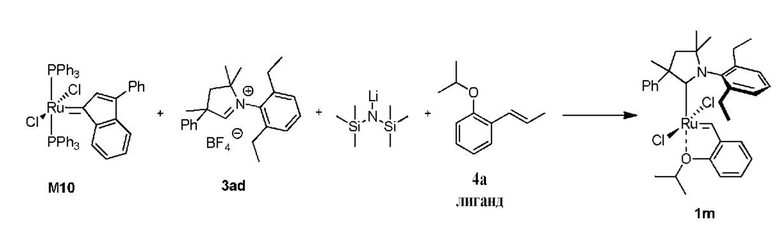
К соли 3ad (0,407 г, 1,0 ммоль, 2 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (4 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 1,0 мл, 1,0 ммоль, 2 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (0,443 г, 0,5 ммоля, 1 молярный эквивалент). Спустя 2 минуты добавляли бензилиденовый лиганд 4a (0,176 г, 1,0 ммоль, 2,0 молярных эквивалента). Всю смесь перемешивали в течение 30 минут при 105°С и охлаждали до комнатной температуры. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: толуол). Зеленую фракцию собирали и концентрировали досуха. Остаток растворяли в метиленхлориде и добавляли избыток изопропанола. Метиленхлорид выпаривали при пониженном давлении, полученный в результате осадок отфильтровывали и промывали небольшим количеством изопропанола. Его сушили в условиях высокого вакуума с получением зеленого кристаллического твердого вещества - предшественника катализатора 1m (0,151 г, 47%). Смесь изомеров A:B = 1:4.
В связи с очень сложным спектром 1Н ЯМР приведены только характерные сдвиги протонов бензилидена: изомер A: синглет 17,88 м.д., изомер B: синглет 16,51 м.д. (C6D6).
Пример XXXXIX
Способ получения промежуточного соединения 5а из предшественника первого поколения M10:
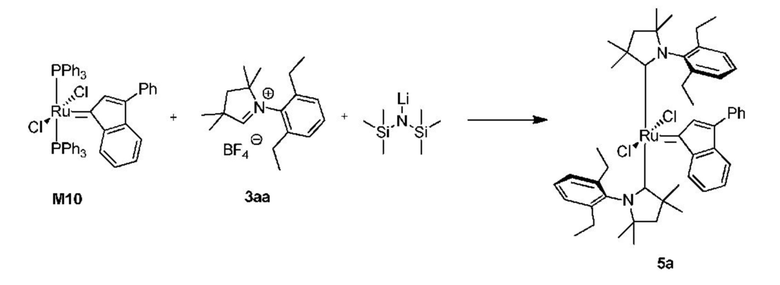
К соли 3aa (10,00 г, 29,0 ммоль, 3 молярных эквивалента) в атмосфере аргона добавляли сухой бескислородный толуол (50 мл). Смесь нагревали до 80°C и добавляли раствор LiHMDS в толуоле (1 M, 29,0 мл, 29,0 ммоль, 3 молярных эквивалента). Спустя 1 минуту добавляли твердый комплекс M10 (8,56 г, 9,66 ммоля, 1 молярный эквивалент). Спустя 5 минут смесь охлаждали до комнатной температуры. Реакционную смесь фильтровали через небольшое количество силикагеля и промывали толуолом. Неочищенный продукт выделяли с помощью колоночной хроматографии на силикагеле (элюент: этилацетат/циклогексан 1:9 об./об.). Красную фракцию собирали и концентрировали досуха. Ее растворяли в н-пентане и медленно концентрировали досуха (продукт кристаллизовался в процессе удаления растворителя). Получали красное кристаллическое твердое вещество - промежуточное соединение 5а (5,02 г, 59%). Сравнение с Примером XV.
Проект, который привел к созданию настоящей заявки, получил финансирование в результате научно-исследовательской программы European Union's Horizon 2020 в рамках грантового соглашения № 635405.
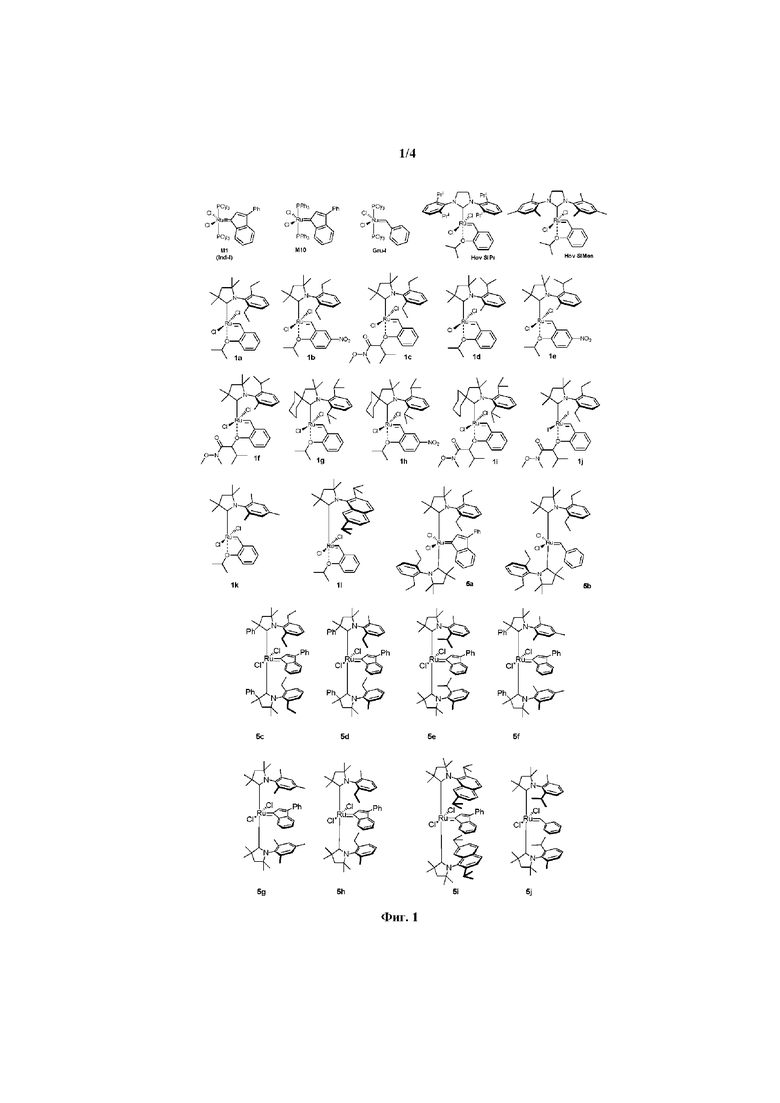
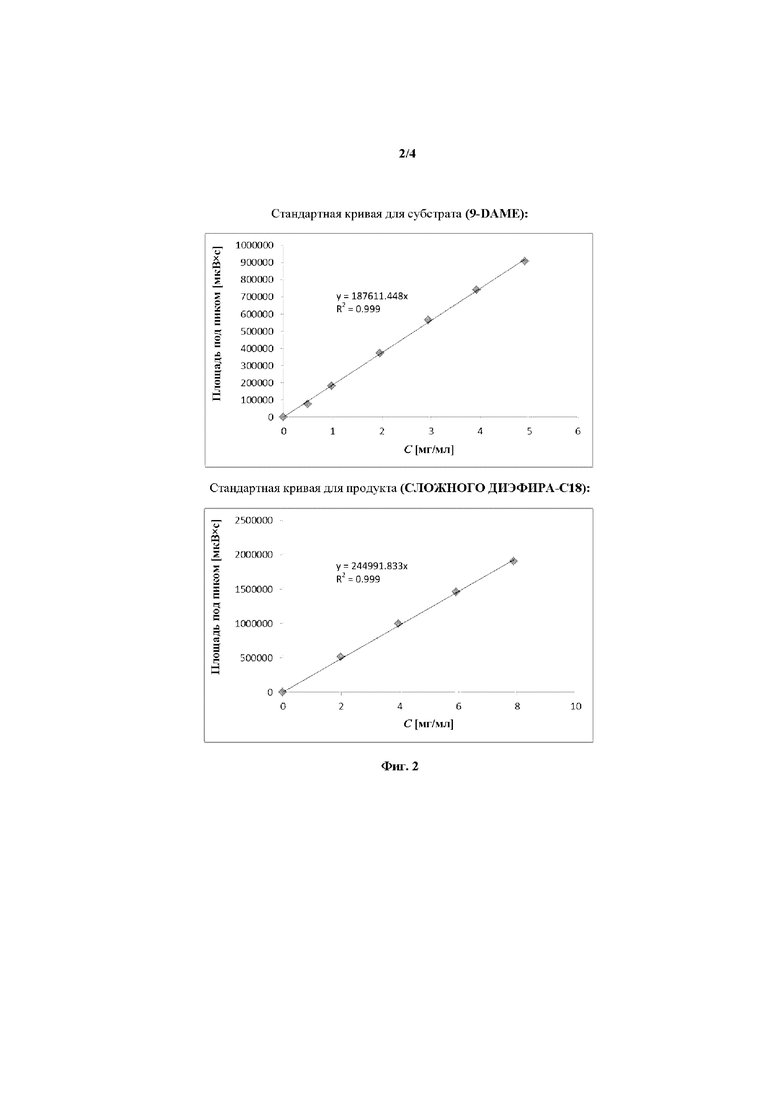

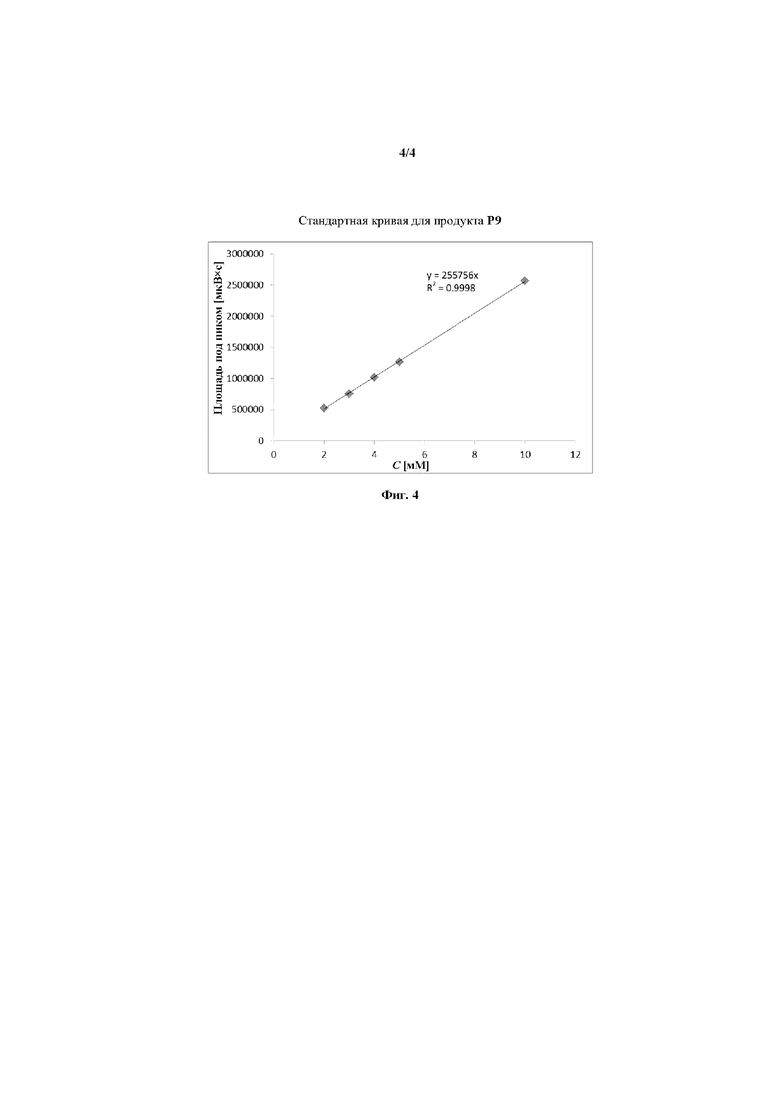
Настоящее изобретение относится к способу получения соединения, представленного формулой 1,
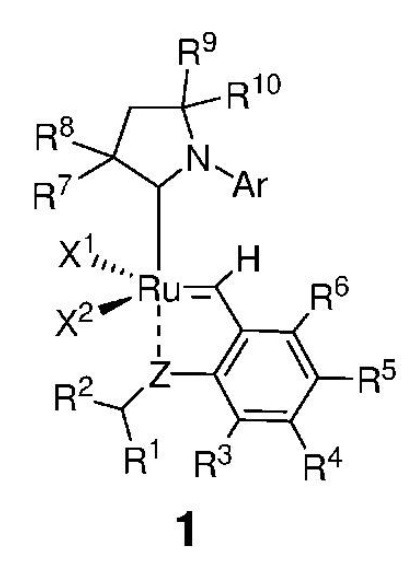 , где значения заместителей такие, как определены в формуле изобретения. Способ включает контактирование алкилиденового комплекса рутения, представленного формулой 2,
, где значения заместителей такие, как определены в формуле изобретения. Способ включает контактирование алкилиденового комплекса рутения, представленного формулой 2, 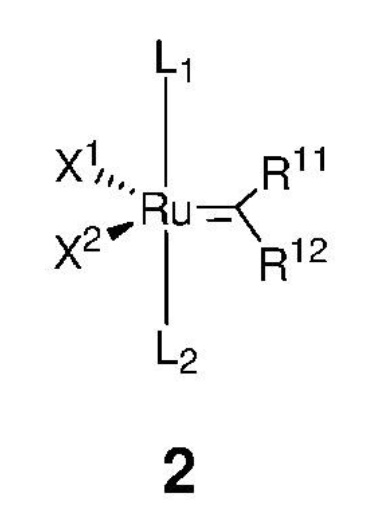 , с карбеном, представленным формулой 3,
, с карбеном, представленным формулой 3, 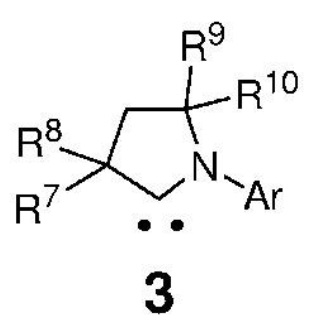 , затем сформированную таким образом реакционную смесь вводят в контакт с соединением, представленным формулой 4,
, затем сформированную таким образом реакционную смесь вводят в контакт с соединением, представленным формулой 4, 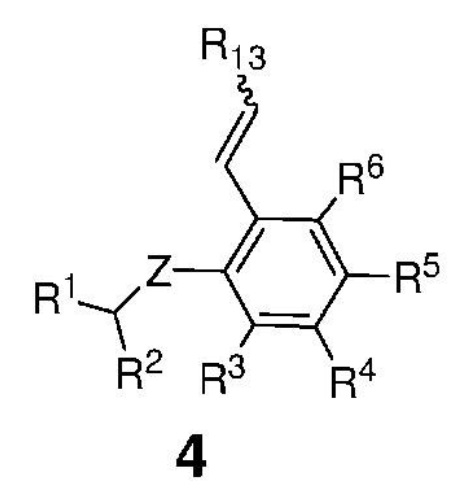 , с получением соединения, представленного формулой 1. Также предложены соединение формулы 1, промежуточное соединение формулы 5, применение соединений формулы 1 и формулы 5. Способ по настоящему изобретению позволяет избежать трудоемкого синтеза комплекса и позволяет произвести простую модификацию бензилиденового лиганда. Полученные соединения продемонстрировали себя отличными катализаторами для метатезиса олефинов. 7 н. и 13 з.п. ф-лы, 7 табл., 49 пр., 4 ил.
, с получением соединения, представленного формулой 1. Также предложены соединение формулы 1, промежуточное соединение формулы 5, применение соединений формулы 1 и формулы 5. Способ по настоящему изобретению позволяет избежать трудоемкого синтеза комплекса и позволяет произвести простую модификацию бензилиденового лиганда. Полученные соединения продемонстрировали себя отличными катализаторами для метатезиса олефинов. 7 н. и 13 з.п. ф-лы, 7 табл., 49 пр., 4 ил.
1. Способ получения соединения, представленного формулой 1,
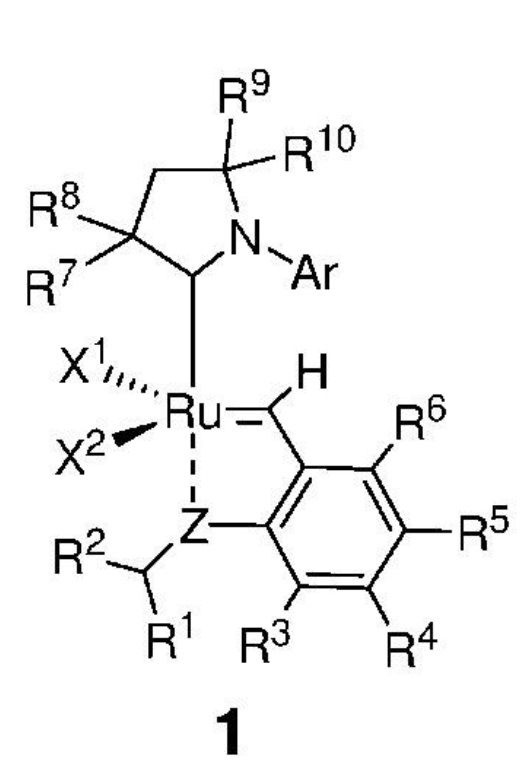 ,
,
где:
каждый из X1 и X2 независимо представляет собой анионный лиганд, выбранный из атомов галогена;
Z представляет собой атом, выбранный из группы, состоящей из O, NR’, где R’ представляет собой C1-C12-алкил, C3-C12-циклоалкил, C5-C20-арил;
Ar представляет собой арильную группу, замещенную атомами водорода или необязательно замещенную по меньшей мере одним C1-C12-алкилом;
каждый из R1 и R2 независимо представляет собой атом водорода, C1-C25-алкильную группу, C6-C20-арил, или же они могут быть объединены друг с другом с образованием замещенной или незамещенной C4-C10-циклической системы, также может представлять собой сложноэфирную (-COOR’), амидную (-CONR’2), кетонную (-COR’) и гидроксамовую (-CON(OR’)(R’)) группу или атом галогена, в которой R’ представляет собой C1-C12-алкил, C3-C12-циклоалкил;
каждый из R3, R4, R5, R6 независимо представляет собой атом водорода, C1-C25-алкильную группу, C1-C25-алкоксигруппу, причем заместители R3, R4, R5, R6 могут быть объединены друг с другом с образованием замещенной или незамещенной C4-C10-циклической или C4-C12-полициклической системы, также независимо может представлять собой алкоксигруппу (-OR’), сульфоновую (-SO2R’), сульфонамидную (-SO2NR’2), нитрогруппу (-NO2), цианогруппу (-CN), карбоксигруппу (-COOH), сложноэфирную (-COOR’), амидную (-CONR’2 или -NR’C(O)R’) и кетонную (-COR’) группу, где R’ представляет собой C1-C5-алкил, C6-C24-арил, C7-C24-аралкил;
каждый из R7, R8, R9 и R10 независимо представляет собой атом водорода или C1-C25-алкильную группу, R7 и R8 могут быть объединены с образованием циклической системы, также независимо представляет собой C1-C12-алкильную группу, C3-C12-циклоалкил, C2-C12-алкенил, C6-C20-арил, C7-C24-аралкил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом;
отличающийся тем, что алкилиденовый комплекс рутения, представленный формулой 2,
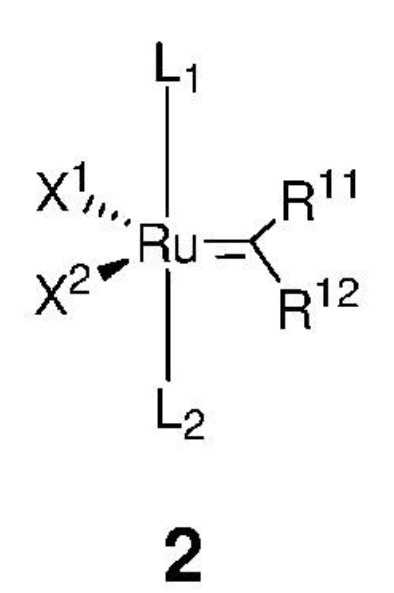 ,
,
где:
каждый из L1, L2 представляет собой нейтральный лиганд, выбранный из группы, включающей фосфин, в частности P(R’)3, где каждый R’ независимо представляет собой C1-C12-алкил, C3-C12-циклоалкил, C6-C20-арил, C7-C24-аралкил, C5-C24-перфторарил, 5-12-членный гетероарил; два R’ могут быть объединены друг с другом с образованием циклоалкильного кольца, содержащего атом фосфора в кольце;
каждый из X1, X2 представляет собой анионный лиганд, независимо выбранный из группы, включающей галоген-анионы;
каждый из R11, R12 независимо представляет собой атом водорода, атом галогена, необязательно замещенный C1-C25-алкил, необязательно замещенный C1-C25-алкокси, необязательно замещенный C6-C24-арилокси, необязательно замещенный C6-C20-гетероарилокси, необязательно замещенный C6-C24-арил, необязательно замещенный C7-C24-аралкил, необязательно замещенный C5-C24-перфторарил;
при этом заместители R11 и R12 могут быть объединены друг с другом с образованием кольца, выбранного из группы, включающей C3-C7-циклоалкил, C3-C25-циклоалкенил, C3-C25-циклоалкинил, C6-C24-арил, C6-C20-гетероарил, 3-12-членный гетероцикл, которые могут быть независимо замещены одним и/или несколькими заместителями, выбранными из группы, включающей атом водорода, атом галогена, C1-C25-алкил, C3-C7-циклоалкил, C2-C25-алкенил, C3-C25-циклоалкенил, C2-C25-алкинил, C3-C25-циклоалкинил, C1-C25-алкокси, C6-C24-арилокси, C6-C20-гетероарилокси, C6-C24-арил, C5-C20-гетероарил, C7-C24-аралкил, 3-12-членный гетероцикл;
вводят в реакцию с карбеном, представленным формулой 3,
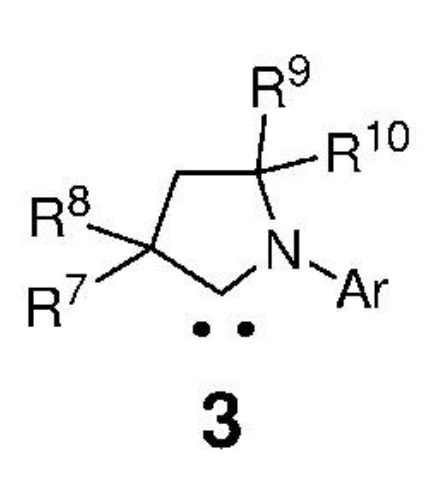 ,
,
где:
Ar представляет собой арильную группу, замещенную атомами водорода или необязательно замещенную по меньшей мере одним C1-C12-алкилом;
каждый из R7, R8, R9 и R10 независимо представляет собой атом водорода или C1-C25-алкильную группу, R7 и R8 могут быть объединены с образованием циклической системы, также может независимо представлять собой C1-C12-алкильную, C3-C12-циклоалкильную, C2-C12-алкенильную, C6-C20-арильную, C7-C24-аралкильную группу, которые необязательно замещены по меньшей мере одним C1-C12-алкилом;
затем сформированную таким образом реакционную смесь вводят в контакт с соединением, представленным формулой 4,
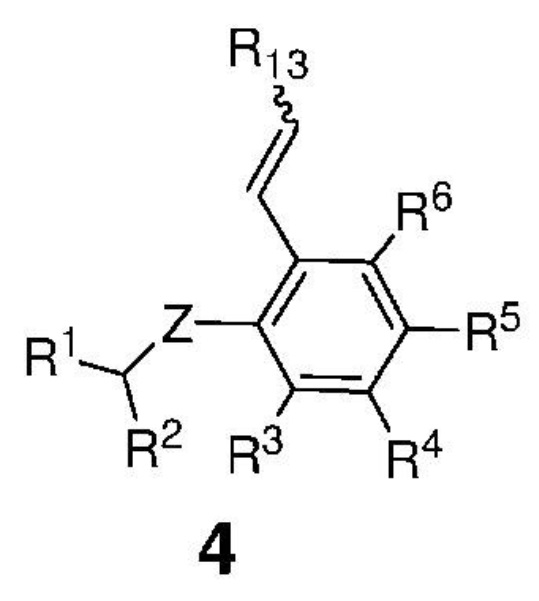 ,
,
где:
Z представляет собой атом, выбранный из группы, состоящей из O, NR’, где R’ представляет собой C1-C12-алкил, C3-C12-циклоалкил, C5-C20-арил,
каждый из R1 и R2 независимо представляет собой атом водорода, C1-C25-алкильную группу, C1-C25-алкоксигруппу, C6-C20-арил, или же они могут быть объединены друг с другом с образованием замещенной или незамещенной C4-C10-циклической системы, также может представлять собой сложноэфирную (-COOR’), амидную (-CONR’2), кетонную (-COR’) и гидроксамовую (-CON(OR’)(R’)) группу или атом галогена, где R’ представляет собой C1-C12-алкил, C3-C12-циклоалкил;
каждый из R3, R4, R5, R6 независимо представляет собой атом водорода, C1-C25-алкильную группу, C1-C25-алкоксигруппу, причем заместители R3, R4, R5, R6 могут быть объединены друг с другом с образованием замещенной или незамещенной C4-C10-циклической или C4-C12-полициклической системы, также независимо может представлять собой алкоксигруппу (-OR’), сульфоновую (-SO2R’), сульфонамидную (-SO2NR’2), нитрогруппу (-NO2), цианогруппу (-CN), карбоксигруппу (-COOH), сложноэфирную (-COOR’), амидную (-CONR’2 или -NR’C(O)R’) и кетонную (-COR’) группу, где R’ представляет собой C1-C2-алкил, C6-C24-арил, C7-C24-аралкил;
R13 представляет собой атом водорода, C1-C25-алкильную группу, C1-C25-алкоксигруппу, C2-C25-алкенильную группу, C6-C20-арил, C6-C24-арилокси, с получением соединения, представленного формулой 1.
2. Способ по п. 1, отличающийся тем, что реакционную смесь вводят в контакт с соединением, представленным формулой 4, в присутствии акцептора фосфинового лиганда PR’3 и/или акцептора CAAC-лиганда.
3. Способ получения соединения, представленного формулой 1, по п. 1 или 2, отличающийся тем, что карбены, представленные формулой 3, вводят в реакционную среду путем их получения in situ из подходящих предшественников карбенов, солей CAAC, представленных формулой 3a,
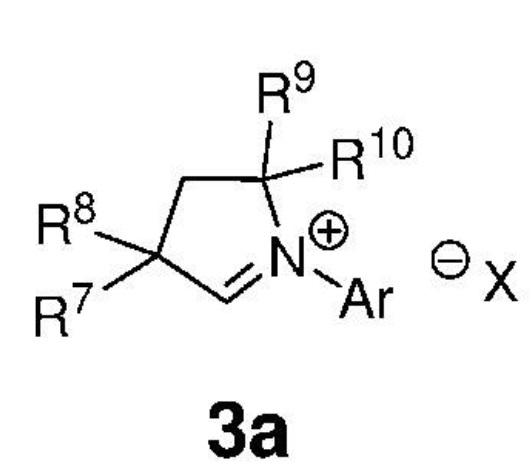 ,
,
где:
Ar представляет собой арильную группу, замещенную атомами водорода или необязательно замещенную по меньшей мере одним C1-C12-алкилом;
каждый из R7, R8, R9 и R10 независимо представляет собой атом водорода или C1-C25-алкильную группу, R7 и R8 могут быть объединены с образованием циклической системы, также может независимо представлять собой C1-C12-алкил, C3-C12-циклоалкил, C6-C20-арил, C7-C24-аралкил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом;
X- представляет собой галоген-анион или BF4-, PF6-, ClO4-, CF3SO2O-;
что предусматривает приведение в контакт соединения, представленного формулой 3a, с подходящим основанием, выбранным из N,N’-бис(триметилсилил)амида калия, N,N’-бис(триметилсилил)амида лития, N,N’-бис(триметилсилил)амида натрия, трет-амилата калия, трет-бутоксида калия, гидрида натрия.
4. Способ получения соединения, представленного формулой 1, по п. 3, отличающийся тем, что карбены, представленные формулой 3, вводят в реакционную среду путем их получения in situ из подходящих предшественников карбенов, представленных формулой 3а, которые приводят в контакт с основанием, таким как N,N’-бис(триметилсилил)амид щелочного металла.
5. Способ получения соединения, представленного формулой 1, по п. 1 или 2, отличающийся тем, что карбены, представленные формулой 3, вводят в реакционную среду путем их термического получения in situ из подходящих предшественников карбенов, представленных формулой 3b, которые представляют собой аддукты хлороформа или спирта,
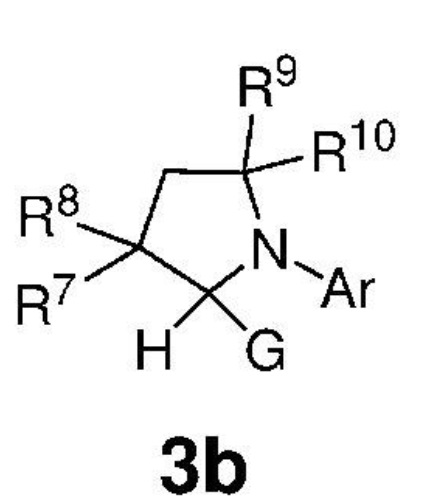 ,
,
где:
G представляет собой CCl3 или OR’, где R’ представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C6-C20-арил, который необязательно замещен по меньшей мере одним C1-C12-алкилом, C1-C12-перфторалкилом, C1-C12-алкокси, C6-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
Ar представляет собой арильную группу, замещенную атомами водорода или необязательно замещенную по меньшей мере одним C1-C12-алкилом;
каждый из R7, R8, R9 и R10 независимо представляет собой атом водорода или C1-C25-алкильную группу, R7 и R8 могут быть объединены с образованием циклической системы, также может независимо представлять собой C1-C12-алкил, C3-C12-циклоалкил, C6-C20-арил, C7-C24-аралкил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом.
6. Способ получения соединения, представленного формулой 1, по любому из пп. 1-5, отличающийся тем, что алкилиденовый комплекс рутения, представленный формулой 2, приводят в контакт с соединением, представленным формулой 3с, которое выполняет роль донора карбенового СААС-лиганда, представленного формулой 3,
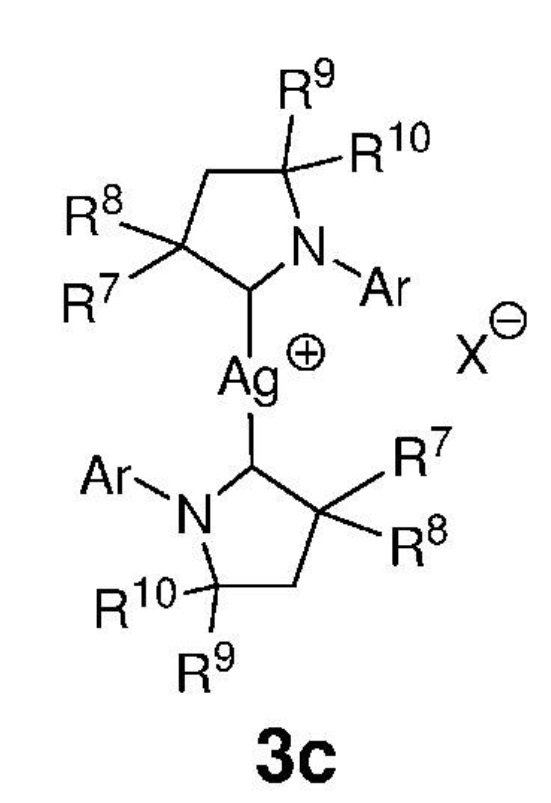 ,
,
где:
Ar представляет собой арильную группу, замещенную атомами водорода или необязательно замещенную по меньшей мере одним C1-C12-алкилом;
каждый из R7, R8, R9 и R10 независимо представляет собой атом водорода или C1-C25-алкильную группу, R7 и R8 могут быть объединены с образованием циклической системы, также может независимо представлять собой C1-C12-алкил, C3-C12-циклоалкил, C6-C20-арил, C7-C24-аралкил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом;
X представляет собой галоген-анион или BF4-, PF6-, ClO4-, CF3SO3-.
7. Способ получения соединения, представленного формулой 1, по пп. 1, 2, отличающийся тем, что карбены, представленные формулой 3, вводят в реакционную среду путем их непосредственного внесения в реакционную смесь.
8. Способ получения соединения, представленного формулой 1, по любому из пп. 1-7, отличающийся тем, что алкилиденовый комплекс рутения, представленный формулой 2, вводят в реакцию с карбеном, представленным формулой 3, с получением промежуточного соединения, представленного формулой 5,
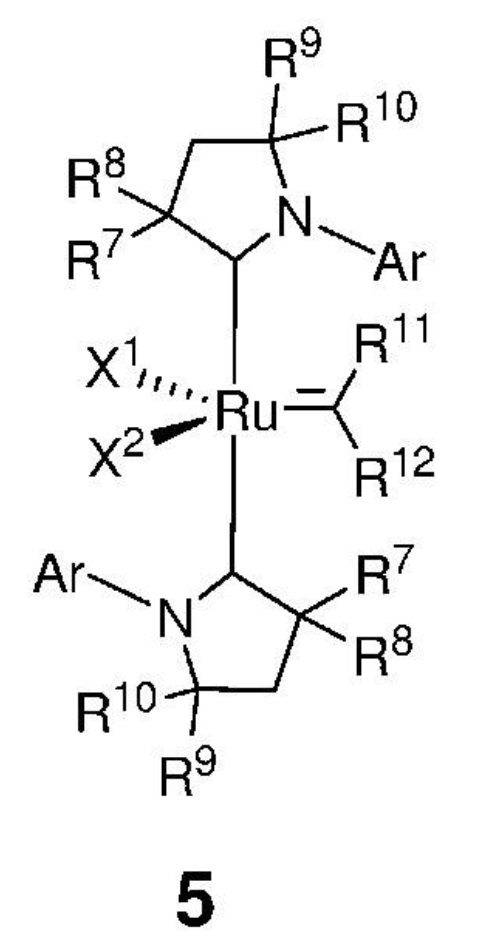 ,
,
где:
каждый из X1 и X2 независимо представляет собой анионный лиганд, выбранный из атомов галогена;
каждый из R7, R8, R9 и R10 независимо представляет собой атом водорода или C1-C25-алкильную группу, R7 и R8 могут быть объединены с образованием циклической системы, также может независимо представлять собой C1-C12-алкил, C3-C12-циклоалкил, C6-C20-арил, C7-C24-аралкил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом;
каждый из R11, R12 независимо представляет собой атом водорода, атом галогена, необязательно замещенный C1-C25-алкил, необязательно замещенный C1-C25-алкокси, необязательно замещенный C6-C24-арилокси, необязательно замещенный C5-C20-гетероарилокси, необязательно замещенный C6-C24-арил, необязательно замещенный C7-C24-аралкил;
при этом заместители R11 и R12 могут быть объединены друг с другом с образованием кольца, выбранного из группы, включающей C3-C7-циклоалкил, C3-C25-циклоалкенил, C3-C25-циклоалкинил, C6-C24-арил, C6-C20-гетероарил, 3-12-членный гетероцикл, которые могут быть независимо замещены одним и/или несколькими заместителями, выбранными из группы, включающей атом водорода, атом галогена, C1-C25-алкил, C3-C7-циклоалкил, C2-C25-алкенил, C3-C25-циклоалкенил, C2-C25-алкинил, C3-C25-циклоалкинил, C1-C25-алкокси, C6-C24-арилокси, C5-C20-гетероарилокси, C6-C24-арил, C6-C20-гетероарил, C7-C24-аралкил, 3-12-членный гетероцикл;
которое затем вводят в контакт с соединением, представленным формулой 4,
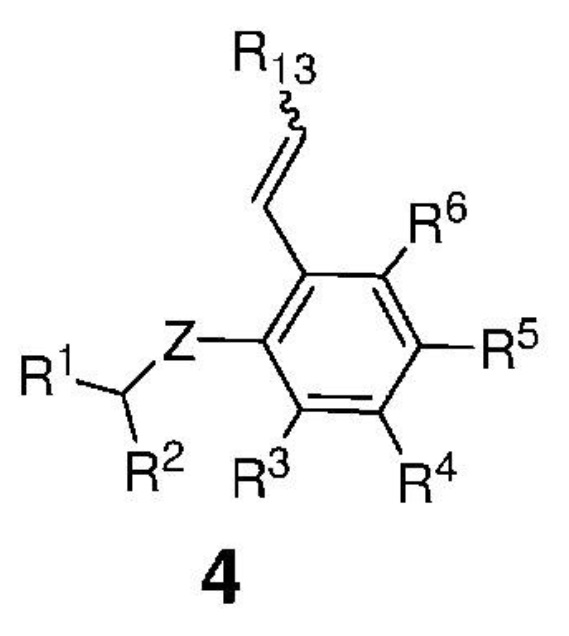 ,
,
где:
Z представляет собой атом, выбранный из группы, состоящей из O, S, NR’, где R’ представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C6-C20-арил,
каждый из R1 и R2 независимо представляет собой атом водорода, C1-C25-алкильную группу, C1-C25-алкоксигруппу, C2-C25-алкенильную группу, C6-C20-арил, C6-C24-арилокси, C5-C20-гетероарилокси, или же они могут быть объединены друг с другом с образованием замещенной или незамещенной C4-C10-циклической или C4-C12-полициклической системы, также может представлять собой сложноэфирную (-COOR’), амидную (-CONR’2), формильную (-CHO), кетонную (-COR’) и гидроксамовую (-CON(OR’)(R’)) группу или атом галогена, где R’ представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C6-C20-арил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-алкокси, C6-C24-арилокси, C5-C20-гетероарилокси;
каждый из R3, R4, R5, R6 независимо представляет собой атом водорода, C1-C25-алкильную группу, C1-C25-алкоксигруппу или C2-C25-алкенильную группу, причем заместители R3, R4, R5, R6 могут быть объединены друг с другом с образованием замещенной или незамещенной C4-C10-циклической или C4-C12-полициклической системы, также независимо может представлять собой алкоксигруппу (-OR’), сульфоновую (-SO2R’), сульфонамидную (-SO2NR’2), нитрогруппу (-NO2), цианогруппу (-CN), фосфонатную (-P(O)(OR’)2), фосфинатную (-P(O)R’(OR’)), фосфониниевую (-P(OR’)2), фосфиновую (-PR’2), фосфиноксидную (-P(O)R’2), карбоксигруппу (-COOH), сложноэфирную (-COOR’), амидную (-CONR’2 или -NR’C(O)R’), формильную (-CHO) и кетонную (-COR’) группу, где R’ представляет собой C1-C5-алкил, C6-C24-арил, C7-C24-аралкил;
R13 представляет собой атом водорода, C1-C25-алкильную группу, C1-C25-алкоксигруппу, C2-C25-алкенильную группу, C6-C20-арил, C6-C24-арилокси;
с получением соединения, представленного формулой 1.
9. Способ по п. 8, отличающийся тем, что реакцию соединения 5 с соединением 4 проводят в присутствии акцептора фосфинового лиганда PR’3 и/или акцептора CAAC-лиганда.
10. Способ получения соединения, представленного формулой 1, по любому из пп. 2-7 или 9, отличающийся тем, что в качестве акцептора фосфинового лиганда PR’3 и/или акцептора CAAC-лиганда применяют соединение, выбранное из солей меди(I) и/или HCl.
11. Способ получения соединения, представленного формулой 1, по любому из пп. 1-10, отличающийся тем, что все стадии реакции проводят в полярном и/или неполярном растворителе, предпочтительно в алифатических или ароматических углеводородах, в течение периода от 1 минуты до 24 часов.
12. Соединение, представленное формулой 1,
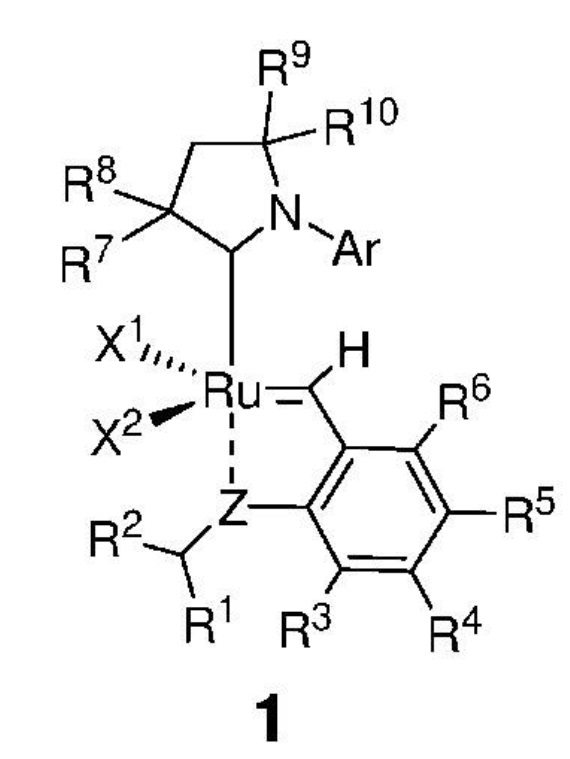 ,
,
где:
каждый из X1 и X2 независимо представляет собой анионный лиганд, выбранный из атомов галогена;
Z представляет собой атом, выбранный из группы, состоящей из O, S, NR’, где R’ представляет собой C1-C12-алкил, C3-C12-циклоалкил, C6-C20-арил;
Ar представляет собой арильную группу, замещенную атомами водорода или необязательно замещенную по меньшей мере одним C1-C12-алкилом;
каждый из R1 и R2 независимо представляет собой атом водорода, C1-C25-алкильную группу, C6-C20-арил, или же они могут быть объединены друг с другом с образованием C4-C10-циклической или C4-C12-полициклической системы, замещенной или незамещенной по меньшей мере одним C1-C12-алкилом, C3-C12-циклоалкилом, C6-C20-арилом, C7-C24-аралкилом, C1-C12-алкокси, C6-C24-арилокси, C5-C20-гетероарилокси, или атомом галогена, также может представлять собой сложноэфирную (-COOR’), амидную (-CONR’2), кетонную (-COR’) и гидроксамовую (-CON(OR’)(R’)) группу или атом галогена, в которой R’ представляет собой C1-C12-алкил, C3-C12-циклоалкил;
каждый из R3, R4, R5, R6 независимо представляет собой атом водорода, нитрогруппу (-NO2), карбоксигруппу (-COOH), сложноэфирную группу (-COOR’), кетонную группу (-COR’), где R’ представляет собой C1-C5-алкил, C6-C24-арил, C7-C24-аралкил;
где если R1 и R2 представляют собой группу -CH3, то по меньшей мере один из заместителей R3, R4, R5, R6 не является атомом водорода;
каждый из R7, R8, R9 и R10 независимо представляет собой атом водорода или C1-C25-алкильную группу, R7 и R8 могут быть объединены с образованием циклической системы, также независимо представляет собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C6-C20-арил, C7-C24-аралкил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом, C1-C12-алкокси, C6-C24-арилокси, C5-C20-гетероарилокси или атомом галогена.
13. Соединение по п. 12 со структурой, представленной формулой, выбранной из 1b, 1c, 1e, 1f, 1h, 1i-1l:
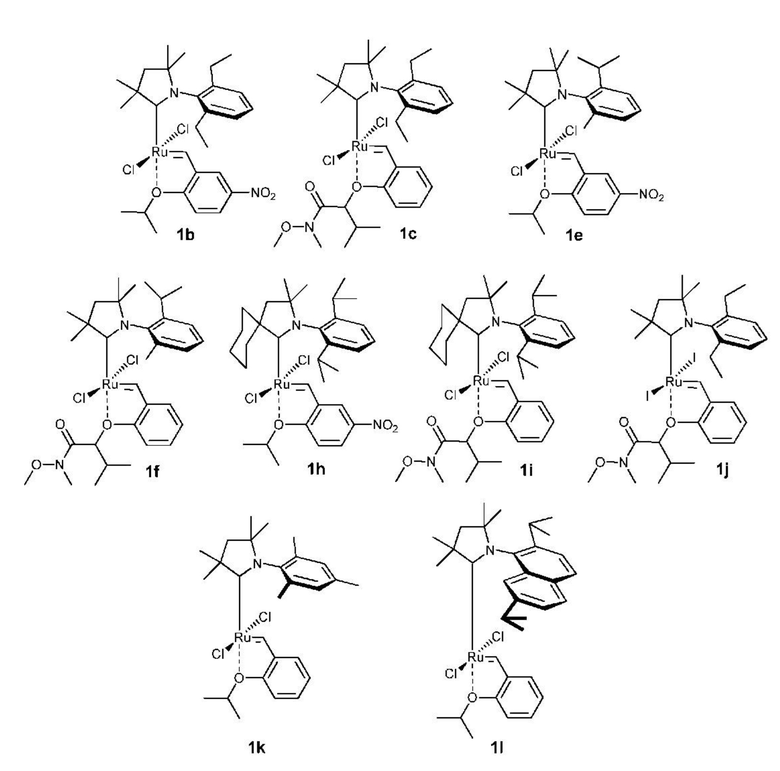 .
.
14. Соединение, представленное формулой 5,
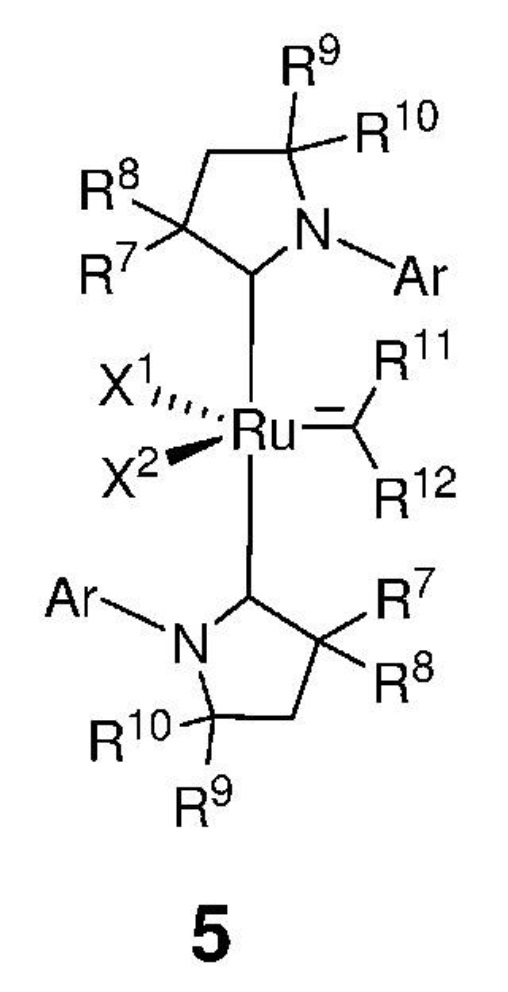 ,
,
где:
каждый из X1 и X2 независимо представляет собой анионный лиганд, выбранный из атомов галогена;
Ar представляет собой арильную группу, замещенную атомами водорода или необязательно замещенную по меньшей мере одним C1-C12-алкилом;
каждый из R7, R8, R9 и R10 независимо представляет собой атом водорода или C1-C25-алкильную группу, R7 и R8 могут быть объединены с образованием циклической системы, также может независимо представлять собой C1-C12-алкил, C3-C12-циклоалкил, C2-C12-алкенил, C6-C20-арил, C7-C24-аралкил, которые необязательно замещены по меньшей мере одним C1-C12-алкилом;
каждый из R11, R12 независимо представляет собой атом водорода, атом галогена, необязательно замещенный C1-C25-алкил, необязательно замещенный C1-C25-алкокси, необязательно замещенный C6-C24-арилокси, необязательно замещенный C5-C20-гетероарилокси, необязательно замещенный C6-C24-арил, необязательно замещенный C7-C24-аралкил, где необязательно замещенный означает необязательно замещенный по меньшей мере одним C1-C12-алкилом, C3-C12-циклоалкилом, C6-C20-арилом, C7-C24-аралкилом, C1-C12-алкокси, C6-C24-арилокси, C5-C20-гетероарилокси или атомом галогена;
при этом заместители R11 и R12 могут быть объединены друг с другом с образованием кольца, выбранного из группы, включающей C3-C7-циклоалкил, C3-C25-циклоалкенил, C3-C25-циклоалкинил, C6-C24-арил, C6-C20-гетероарил, 3-12-членный гетероцикл, которые могут быть независимо замещены одним и/или несколькими заместителями, выбранными из группы, включающей атом водорода, атом галогена, C1-C25-алкил, C3-C7-циклоалкил, C2-C25-алкенил, C3-C25-циклоалкенил, C2-C25-алкинил, C3-C25-циклоалкинил, C1-C25-алкокси, C6-C24-арилокси, C5-C20-гетероарилокси, C6-C24-арил, C6-C20-гетероарил, C7-C24-аралкил, 3-12-членный гетероцикл.
15. Соединение по п. 14 со структурой, представленной формулой, выбранной из 5a - 5j:
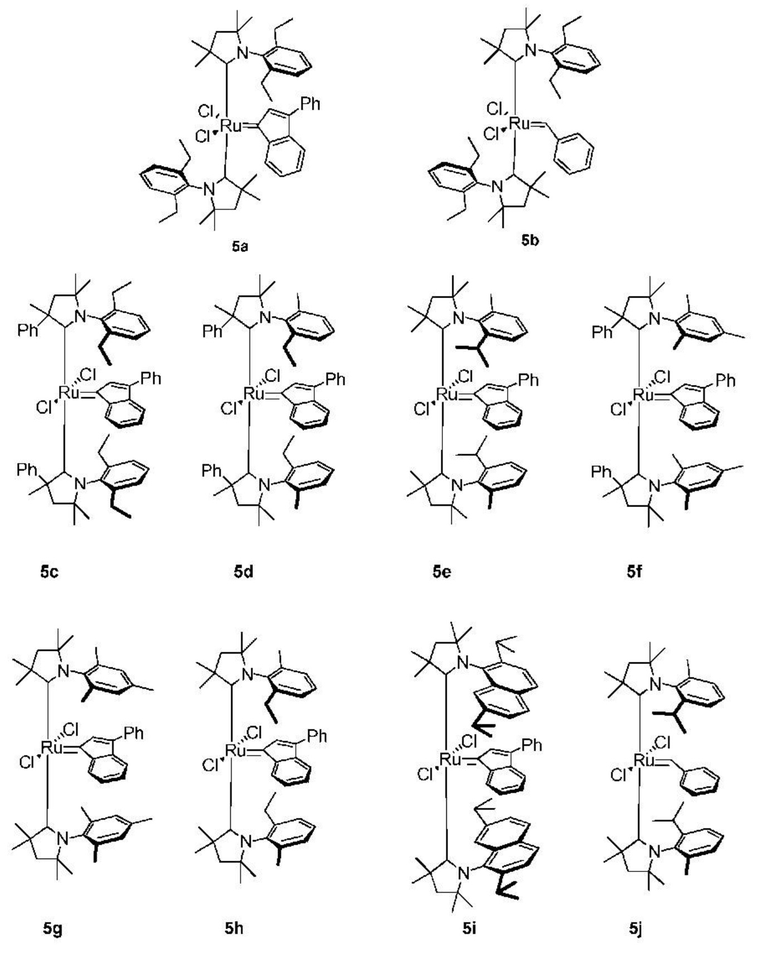 .
.
16. Применение соединения, представленного формулой 1, полученного с помощью способа по любому из пп. 1-11, в качестве предшественника катализатора и/или катализатора в реакциях метатезиса олефинов, особенно в реакциях метатезиса с замыканием цикла (RCM), гомометатезиса, перекрестного метатезиса (CM), этенолиза, изомеризации, в реакции метатезиса с диастереоселективной перестройкой цикла (DRRM), в реакциях метатезиса «алкен-алкинового» (ен-инового) типа или полимеризации ROMP-типа.
17. Применение по п. 16, где соединение, представленное формулой 1, применяют в качестве предшественника катализатора и/или катализатора в реакционной смеси в течение периода от 1 минуты до 24 часов в органическом растворителе, смеси органических растворителей или без растворителя.
18. Применение соединения, представленного формулой 5, полученного с помощью способа по любому из пп. 1-11, в качестве субстрата для синтеза других соединений комплекса рутения, которые являются предшественниками катализаторов и/или катализаторами для метатезиса олефинов.
19. Применение соединения, представленного формулой 5, по п. 14 или 15 в качестве предшественника катализатора и/или катализатора в реакциях метатезиса олефинов, особенно в реакциях метатезиса с замыканием цикла (RCM), гомометатезиса, перекрестного метатезиса (CM), этенолиза, изомеризации, в реакции метатезиса с диастереоселективной перестройкой цикла (DRRM), в реакциях метатезиса «алкен-алкинового» (ен-инового) типа или полимеризации ROMP-типа и в реакции метатезисной деполимеризации.
20. Применение соединения, представленного формулой 5, по п. 14 или 15 в качестве предшественника катализатора и/или катализатора в реакциях метатезиса олефинов в присутствии акцептора CAAC-лиганда.
| WO 2011056881 A2, 12.05.2011 | |||
| US 20030069374 A1, 10.04.2003 | |||
| WO 2004035596 A1, 29.04.2004 | |||
| ЛИГАНД КОМПЛЕКСА РУТЕНИЯ, КОМПЛЕКС РУТЕНИЯ, КАТАЛИЗАТОР КОМПЛЕКСА РУТЕНИЯ И СПОСОБЫ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2006 |
|
RU2435778C2 |
Авторы
Даты
2020-11-06—Публикация
2016-07-27—Подача