Настоящее изобретение касается способа получения галогенидметаллоценовых соединений высокой чистоты и с высокими выходами.
Металлоценовые соединения хорошо известны в данной области как каталитические компоненты для полимеризации олефинов. Например, Европейская патентная заявка EP 0129368 раскрывает катализаторы, содержащие моно- и дициклопентадиенильные координационные комплексы с переходным металлом в комбинации с алюмоксаном.
В данных металлоценовых соединениях центральный металл координирован с одним или несколькими π-связанными лигандами, обычно циклопентадиенильными фрагментами, и с одним или несколькими сигма-связанными лигандами. Последние обычно представляют собой галоген, предпочтительно хлор. В обычном способе получения дигалогенидметаллоценовых соединений осуществляют взаимодействие солей лития с данными лигандами с тетрагалогенидом металла. Данный способ дает LiCl как побочный продукт, который трудно отделить из-за низкой растворимости дигалогенидметаллоценовых соединений в обычных растворителях, и выход способа часто является неудовлетворительным.
Например, F. Wild и др. (J. Organomet. Chem., 288:63-67, 1985) описывают синтез хиральных анза-цирконоценовых производных, имеющих лиганды с этиленовыми мостиками. В частности, сообщается о получении этилен-бис(1-инденил)цирконийдихлорида при взаимодействии дилитиевой соли бис(1-инденил)этана с ZrCl4 с выходом примерно 35%. Лучшие результаты получены I.M. Lee и др. (Organometallics, 11:2115-2122, 1992), которые получили этилен-бис(1-инденил)цирконийдихлорид с выходом 52%. Другой пример можно найти в Polyhedron 1990, 9, 301, где сообщается о синтезе бис(инденил)цирконийдихлорида, исходя из индена и тетрахлорида циркония с конечным выходом 58%.
В WO 02/083699 диалкилметаллоценовые соединения обрабатывают агентом галогенирования, таким как HCl, галогениды переходных металлов, BCl3 и подобные, для получения моногалогенидного или дигалогенидного соединения с высоким выходом. В настоящее время обнаружено, что при использовании различных агентов галогенирования выходы данного способа можно дополнительно увеличить.
Таким образом, согласно первому аспекту настоящее изобретение касается способа получения галогенидметаллоценовых соединений формулы (I):
(Cp)(ZR1 m)n(A)rMLyL't (I)
в которой (ZR1 m)n обозначает двухвалентную группу, соединяющую мостиком фрагменты Cp и A; при этом Z обозначает C, Si, Ge, N или P и группы R1, одинаковые или разные, обозначают водород или линейные или разветвленные, насыщенные или ненасыщенные C1-C20 алкильные, C3-C20 циклоалкильные, C6-C20 арильные, C7-C20 алкиларильные или C7-C20 арилалкильные группы, необязательно содержащие один или более гетероатомов принадлежащих группам 13-17 периодической таблицы элементов, или два R1 могут образовывать алифатический или ароматический C4-C7 цикл, который может нести заместители;
Cp обозначает незамещенную или замещенную циклопентадиенильную группу, необязательно конденсированную с одним или несколькими незамещенными или замещенными, насыщенными, ненасыщенными или ароматическими циклами, содержащими от 4 до 6 атомов углерода, необязательно содержащими один или более гетероатомов, принадлежащих группам 13-17 периодической таблицы элементов;
A обозначает O, S, NR2 или PR2, при этом R2 представляет собой водород, линейный или разветвленный, насыщенный или ненасыщенный C1-C20 алкил, C3-C20 циклоалкил, C6-C20 арил, C7-C20 алкиларил или C7-C20 арилалкил, или A имеет такое же значение как Cp;
M обозначает цирконий, титан или гафний;
заместители L, одинаковые или разные, предпочтительно одинаковые, представляют собой хлор, бром, йод, предпочтительно хлор;
L' обозначает водород или линейную или разветвленную, насыщенную или ненасыщенную C1-C20 алкильную, C3-C20 циклоалкильную, C6-C20 арильную, C7-C20 алкиларильную или C7-C20 арилалкильную группу, необязательно содержащую один или более атомов Si или Ge; предпочтительно L' представляет собой метил, этил, н-бутил, втор-бутил, фенил, бензил или -CH2Si(CH3)3; более предпочтительный L' представляет собой метил;
m равно 1 или 2 в зависимости от окислительного состояния Z, более конкретно m равно 1, если Z обозначает N или P, и m равно 2, если Z обозначает C, Si или Ge;
n равно 0, 1, 2, 3 или 4, предпочтительно n равно 0, 1 или 2; равное 0, если r равно 0 или 2;
r равно 0, 1 или 2, предпочтительно r равно 0 или 1; более предпочтительно r равно 1;
y равно 1, 2 или 3; предпочтительно y равно 2; и t равно 0, 1 или 2, предпочтительно t равно 0; причем сумма y+t равна степени окисления металла M минус 1+r;
при этом указанный способ включает взаимодействие соединения формулы (II):
(Cp(ZR1 m)n(A)rML'p (II)
в которой Cp, Z, R1, A, M, V, m, r и n имеют такие же значения, как указанные выше; и p равно степени окисления металла M минус 1+r; предпочтительно p равно 2;
по меньшей мере, с p-t эквивалентами (относительно металла M соединения формулы (II)) агента галогенирования формулы (III):
R3 XTLw (III)
или аддукта, содержащего соединение формулы (III);
в которой L имеет такое же значение, как указанное выше;
R3 обозначает водород или линейную или разветвленную, насыщенную или ненасыщенную C1-C20 алкильную, C3-C20 циклоалкильную, C6-C20 арильную, C7-C20 алкиларильную или C7-C20 арилалкильную группу; предпочтительно R3 обозначает метил, этил, н-пропил, изопропил, н-бутил, изобутил, фенил или бензил; более предпочтительно R3 обозначает метил, этил, н-пропил, изопропил, н-бутил или изобутил;
T обозначает металл групп 2-14 периодической таблицы элементов; предпочтительно T обозначает металл групп 11-14 периодической таблицы элементов; более предпочтительно T обозначает алюминий, цинк, олово, германий или медь;
x > 1 и w > 1 так что x+w равна степени окисления металла T; предпочтительно x равно 1.
Соединения формулы (II) можно получить известными способами, которые описаны, например, в WO 99/36427, WO 00/75151 и WO 03/057705.
Способ настоящего изобретения может также представлять последнюю стадию способа "в одном сосуде", в котором соединение формулы (I) получают согласно WO 99/36427, WO 00/75151 и WO 03/057705 и затем без выделения указанное соединение галогенируют согласно способу настоящего изобретения.
Таким образом, еще одну цель настоящего изобретения представляет способ получения галогенидметаллоценовых соединений формулы (I):
(Cp)(ZR1 m)n(A)rMLyL't (I)
в которой Cp, Z, R1, m, n, A, r, M, L, L', t и y имеют такие же значения, как указанные выше;
включающий следующие стадии:
a) взаимодействие лиганда формулы (Y-Cp)(ZR1 m)n(A-Y)r или, если n равно 0, смеси лигандов Y-Cp и r(A-Y) с некоторым количеством EQ соединения формулы L'jB или L'MgL"' так, что EQ>1+r молярных эквивалентов относительно Cp, предпочтительно 1+r < EQ < 4+r, где Cp, A, Z, R1, m, n, r и L' имеют указанные выше значения; L"' выбран из группы, включающей хлор, бром, йод; группы Y, одинаковые или разные, являются подходящими уходящими группами; Mg обозначает магний; B обозначает щелочной или щелочноземельный металл; и j равно 1 или 2, причем j равно 1, если B обозначает щелочной металл, и j равно 2, если B обозначает щелочноземельный металл;
b) взаимодействие продукта, полученного с предыдущей стадии, по меньшей мере, с 1 молярным эквивалентом (относительно Cp) соединения формулы ML"4, где M имеет указанные выше значения, L" выбран из группы, включающей хлор, бром, йод;
c) необязательно очистку смеси и разделение мезо- и рацемических форм; и
d) взаимодействие смеси, полученной с предыдущих стадий, по меньшей мере, с y эквивалентами (относительно металла M) агента галогенирования формулы (III):
R3 XTLw (III)
где R3, T, L, x и w описаны выше.
Согласно предпочтительному варианту настоящего изобретения все взаимодействия указанных выше способов проводят в апротонном растворителе, полярном или неполярном. Указанный апротонный растворитель предпочтительно представляет собой ароматический или алифатический углеводород, необязательно галогенированный, или простой эфир, более предпочтительно он выбран из группы, включающей бензол, толуол, пентан, гексан, гептан, циклогексан, дихлорметан, хлорбензол, диэтиловый эфир, тетрагидрофуран или их смеси.
Количество вводимого агента галогенирования зависит от типа соединения. Для целей настоящего изобретения выражение "эквивалент агента галогенирования" касается эквивалентов активных групп L, т.е. групп L в соединении формулы (III), которые способны реагировать. Количество активных групп L может быть равно или меньше w. В любом случае можно применять избыток агента галогенирования. Уходящая группа Y предпочтительно представляет водород или триалкилсилильную группу.
Реагент ML"4 предпочтительно выбран из группы, включающей TiCl4, ZrCl4, HfCl4. Его можно применять даже в виде стабилизированного производного, такого как эфиратный комплекс ML"4, имеющийся в свободной продаже.
Соединения L'jB и L"'MgL' представляют собой агенты алкилирования. Предпочтительно L' выбран из группы, включающей метил, этил, н-бутил, втор-бутил, фенил, бензил и -CH2Si(CH3)3. Более предпочтительный L' представляет метил или бутил.
В соединении L'jB B обозначает щелочной или щелочноземельный металл, предпочтительно Li или Mg; j может быть равно 1 или 2, как уже сообщалось.
Соединение L"'MgL' представляет собой реактив Гриньяра, в котором Mg обозначает магний и L"' и L' имеют указанные выше значения. L"' предпочтительно обозначает бром или йод.
Согласно предпочтительному варианту способа данного изобретения указанный агент алкилирования представляет собой соединение формулы L'jB, более предпочтительно бутиллитий или метиллитий. Предпочтительно проводят стадию a) представленного выше способа в две подстадии:
a-1) взаимодействие при температуре от -10°C до 70°C лиганда формулы (Y-Cp)(ZR1 m)n(A-Y)r или, если n равно 0, смеси лигандов Y-Cp и r(A-Y) с некоторым количеством EQ соединения формулы L'jB или L'MgL"', так что EQ составляет примерно 1+r молярных эквивалента относительно Cp; и
a-2) после завершения взаимодействия, т.е. через промежуток времени от 1 мин до 6 ч, предпочтительно от 20 мин до 5 ч, более предпочтительно от 40 мин до 5 ч, добавляют дополнительное количество EQ соединения формулы L'jB или L'MgL"', так что 1+r < EQ < 2+r.
Для цели настоящего изобретения термин "примерно" означает, что количество, к которому данное выражение относится, можно варьировать от -15% до +15%.
Агенты алкилирования, используемые на подстадиях a-1) и a-2), могут быть одинаковыми или разными. Например, бутиллитий или гидрид натрия можно применять на стадии a-1) и метиллитий можно применять на стадии a-2). Это дает преимущество в том, что на стадии a-1) можно применять более сильные и иногда менее дорогие реагенты, не влияя на выбор заместителей L' на стадии a-2).
В способах получения соединений формулы (I) на стадии (a) или подстадиях a-1) и a-2) предпочтительно добавлять агент алкилирования в виде раствора в одном из упомянутых выше апротонных растворителей, предпочтительно по капле.
Перед взаимодействием с ML"4 на стадии (b) смесь, полученную со стадии (a), предпочтительно нагревают при температуре от 0°C до 80°C и более предпочтительно от 20°C до 74°C. Потом к данной суспензии быстро добавляют соединение ML"4 в виде раствора или взвеси в одном из упомянутых выше апротонных растворителей, предпочтительно пентане, гексане, гептане или толуоле. Далее реакционную смесь оставляют взаимодействовать в течение периода от 10 мин до 36 ч и более предпочтительно от 1 ч до 18 ч.
На стадии галогенирования d), где добавляют соединение формулы (III), температура находится в диапазоне от -50°C до +150°C, предпочтительно от 0°C до 100°C, более предпочтительно от 20°C до 75°C. Агент галогенирования обычно добавляют по капле и далее предпочтительно оставляют реакционную смесь взаимодействовать при перемешивании в течение периода от 1 до 6 ч, более предпочтительно от 2 до 3 ч при температуре от -10°C до +80°C. Неограничительными примерами агентов галогенирования формулы (III) являются: MeAlCl2, EtAlCl2, Me2AlCl, MeZnCl, Et2AlCl, Et2AlCl.EtAlCl2, Me2AlCl.MeAlCl2, н-Pr2AlCl, н-PrAlCl2, н-Bu2AlCl, н-BuAlCl2, изо-Pr2AlCl, изо-PrAlCl2, изо-Bu2AlCl, изо-BuAlCl2Me2, GeCl2, Me2SnCl2, EtGeCl3, MeSnCl3, н-BuSnCl3, изо-BuSnCl3, в которых Me обозначает метильный радикал, Et обозначает этильный радикал, н-Pr обозначает нормальный пропильный радикал, изо-Pr обозначает изопропильный радикал, н-Bu обозначает нормальный бутильный радикал, изо-Bu обозначает изобутильный радикал. Полученные таким образом металлоценовые соединения формулы (I) можно выделить по общепринятым методикам, известным в данной области.
На необязательной стадии (c) очистку реакционной смеси с целью удаления солей предпочтительно проводить простым фильтрованием раствора. Также можно применять другие системы очистки, например добавление подходящего растворителя для осаждения нежелательных побочных продуктов с последующим фильтрованием. На данных стадиях также имеется возможность разделить рацемические и мезоформы (если таковые присутствуют), применяя способы, известные в данной области.
Например, используя подходящие растворители, можно осадить одну форму с последующим фильтрованием. Все операции проводят в инертной атмосфере.
В металлоценах формулы (I) и (II) двухвалентный мостик (ZR1 m)n предпочтительно выбран из группы, включающей CR1 2, (CR1 2)2, (CR1 2)3, SiR1 2, GeR1 2, NR1 и PR1, имеющей указанное выше значение. Более предпочтительным указанным двухвалентным мостиком является Si(CH3)2, SiPh2, CH2, (CH2)2, (CH2)3 или C(CH3)2.
Переменная m равна 1 или 2; переменная n составляет от 0 до 4, предпочтительно 1 или 2, если n > 1, атомы Z могут быть одинаковыми или разными, как в двухвалентных мостиках -CH2-O-, -CH2-S- и -CH2-Si(CH3)2-. Если n = 0 и r = 1, A может иметь только значение Cp.
В металлоценах формулы (I) лиганд Cp, который π-связан с указанным металлом M, предпочтительно выбран из группы, включающей циклопентадиенил, моно-, ди-, три- и тетраметилциклопентадиенил; 4-трет-бутилциклопентадиенил; 4-адамантилциклопентадиенил; инденил; моно-, ди-, три- и тетра-метилинденил; 2-метил-4-фенилинденил, в котором фенил может быть алкилзамещенным; 2-изопропил-4-фенилинденил, в котором фенил может быть алкилзамещенным; 4,5,6,7-тетрагидроинденилфлуоренил; 5,10-дигидроиндено[1,2-b]индол-10-ил; N-метил- или N-фенил-5,10-дигидроиндено[1,2-b]индол-10-ил; 5,6-дигидроиндено[2,1-b]индол-6-ил; N-метил- или N-фенил-5,6-дигидроиндено[2,1-b]индол-6-ил; азапентален-4-ил; тиапентален-4-ил; азапентален-6-ил; тиапентален-6-ил; моно-, ди- и триметилазапентален-4-ил и 2,5-диметилциклопента[ 1,2-b:4,3-b']-дитиофен.
Группа A предпочтительно имеет такое же значение Cp или обозначает N-метил, N-этил, N-изопропил, N-бутил, N-фенил, N-бензил, N-циклогексил и N-циклододецил.
Более предпочтительно, если группа Cp представляет фрагмент формулы (IV):
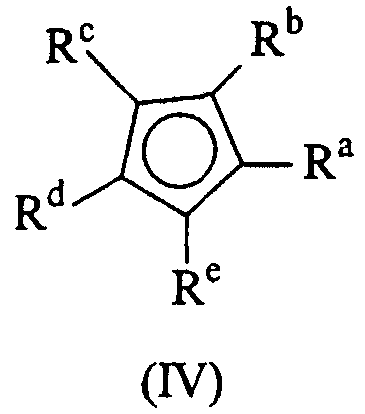
в которой Ra, Rb, Rc, Rd и Re, одинаковые или разные, обозначают атомы водорода или линейные или разветвленные, насыщенные или ненасыщенные C1-С40-алкильные, C3-С40-циклоалкильные, C6-С40-арильные, C7-С40-алкиларильные или C7-С40-арилалкильные радикалы, необязательно содержащие гетероатомы, принадлежащие группам 13-17 периодической таблицы элементов; два вицинальных Rа, Rb, Rc, Rd и Re могут также образовывать один или более конденсированных 5- или 6-членных насыщенных или ненасыщенных циклов, необязательно содержащих гетероатомы, принадлежащие группам 13-16 периодической таблицы элементов, причем указанные циклы могут нести C1-C20-алкильные или C6-С20-арилалкильные или алкиларильные заместители; Re также может представлять собой простую связь, которая связывает фрагмент формулы (IV) с мостиковой группой (ZR1 m)n.
Металлоценовые соединения формулы (I) предпочтительно являются кремний-мостиковыми металлоценовыми соединениями формулы (V):
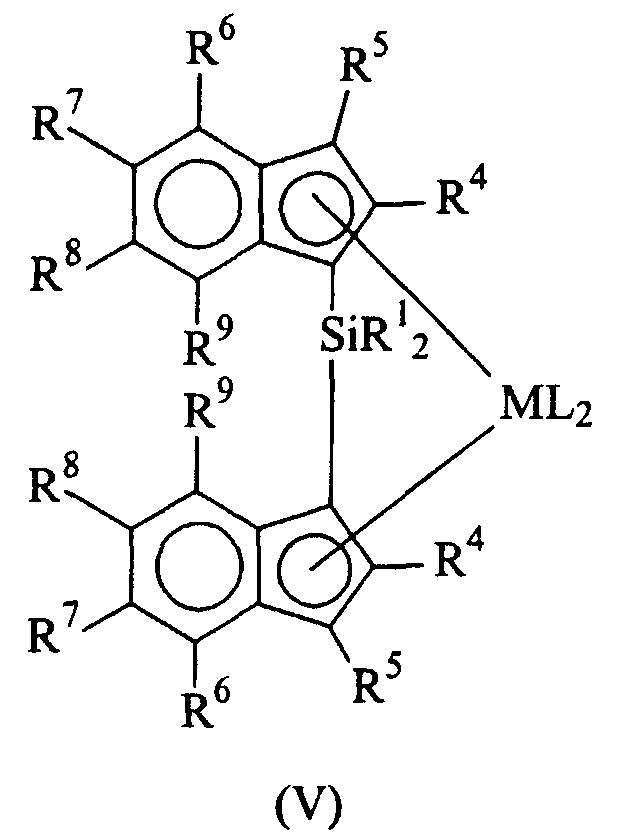
в которой:
M, L и R1 имеют указанные выше значения;
R4, одинаковые или разные, обозначают атомы водорода или линейные или разветвленные, насыщенные или ненасыщенные С1-C20-алкильные, C3-C20-циклоалкильные, C6-C20-арильные, C7-C20-алкиларильные или C7-C20-арилалкильные радикалы, необязательно содержащие гетероатомы, принадлежащие группам 13-17 периодической таблицы элементов;
R5, R6, R7, R8 и R9, одинаковые или разные, обозначают атомы водорода или линейные или разветвленные, насыщенные или ненасыщенные C1-C20-алкильные, C3-C20-циклоалкильные, C6-C20-арильные, C7-C20-алкиларильные или C7-C20-арилалкильные радикалы, необязательно содержащие гетероатомы, принадлежащие группам 13-17 периодической таблицы элементов; два вицинальных R5, R6, R7, R8 и R9 также могут образовывать один или более конденсированных 5- или 6-членных насыщенных или ненасыщенных циклов, необязательно содержащих гетероатомы, принадлежащие группам 13-16 периодической таблицы элементов; указанные циклы могут нести C1-C40-алкильные заместители.
Предпочтительные R4, одинаковые или разные, обозначают C1-C20-алкильный радикал; более предпочтительно, если два фрагмента R4, одинаковые или разные, представляют собой радикалы метил, этил или изопропил;
R6 предпочтительно обозначает C1-C20-алкильные, C6-C20-арильные или C7-C20-арилалкильные радикалы; более предпочтительно, если R6 обозначает фенил или 4-C1-C10-алкил-замещенный фенильный радикал, такой как 4-третбутилфенильный радикал. Неограничительные примеры металлоценовых соединений формулы (I) представляют рацемические и мезоформы (если таковые присутствуют) следующих соединений:
бис(циклопентадиенил)цирконийдихлорид;
бис(инденил)цирконийдихлорид;
бис(тетрагидроинденил)цирконийдихлорид;
бис(флуоренил)цирконийдихлорид;
диметилсиландиилбис(инденил)цирконийдихлорид;
диметилсиландиилбис(2-метил-4-фенилинденил)цирконийдихлорид;
диметилсиландиилбис(4-нафтилинденил)цирконийдихлорид;
диметилсиландиилбис(2-метилинденил)цирконийдихлорид;
диметилсиландиилбис(2-метил-(4-трет-бутилфенил)инденил)цирконийдихлорид;
диметилсиландиил(2-метил-(4-трет-бутилфенил)инденил)(2-изопропил(4-трет-бутилфенил)инденил)цирконийдихлорид;
диметилсиландиилбис(2-метил-4-изопропилинденил)цирконийдихлорид;
диметилсиландиилбис(2,4-диметилинденил)цирконийдихлорид;
диметилсиландиилбис(2-метил-4,5-бензоинденил)цирконийдихлорид;
диметилсиландиилбис(2,4,7-триметилинденил)цирконийдихлорид;
диметилсиландиилбис(2,4,6-триметилинденил)цирконийдихлорид;
диметилсиландиилбис(2,5,6-триметилинденил)цирконийдихлорид;
метил(фенил)силандиилбис(2-метил-4,6-диизопропилинденил)цирконийдихлорид;
метил(фенил)силандиилбис(2-метил-4-изопропилинденил)цирконийдихлорид;
1,3-пропиленбис(инденил)цирконийдихлорид;
1,3-пропиленбис(4,7-диметилинденил)цирконийдихлорид;
1,3-пропиленбис(2-метил-4-фенилинденил)цирконийдихлорид;
1,3-пропиленбис(2-метил-4,6-диизопропилинденил)цирконийдихлорид;
1,3-пропиленбис(2-метил-4,5-бензоинденил)цирконийдихлорид;
1,2-этиленбис(инденил)цирконийдихлорид;
1,2-этиленбис(4,7-диметилинденил)цирконийдихлорид;
1,2-этиленбис(2-метил-4-фенилинденил)цирконийдихлорид;
1,4-бутандиилбис(2-метил-4-фенилинденил)цирконийдихлорид;
1,2-этиленбис(2-метил-4,6-диизопропилинденил)цирконийдихлорид;
1,4-бутандиилбис(2-метил-4-изопропилинденил)цирконийдихлорид;
1,4-бутандиилбис(2-метил-4,5-бензоинденил)цирконийдихлорид;
1,2-этиленбис(2-метил-4,5-бензоинденил)цирконийдихлорид;
[4-(η5-циклопентадиенил)-4,6,6-триметил(η5-4,5-тетрагидропентален)]цирконийдихлорид;
[4-( η5-3'-триметилсилилциклопентадиенил)-4,6,6-триметил(η5-4,5-тетрагидропентален)]цирконийдихлорид;
(трет-бутиламидо)(тетраметил- η5-циклопентадиенил)-1,2-этантитандихлорид;
(метиламидо)(тетраметил- η5-циклопентадиенил)диметилсилилтитандихлорид;
(метиламидо)(тетраметил- η5-циклопентадиенил)-1,2-этандиилтитандихлорид;
(третбутиламидо)(2,4-диметил-2,4-пентадиен-1-ил)диметилсилилтитандихлорид;
бис(1,3-диметилциклопентадиенил)цирконийдихлорид;
метилен(3-метилциклопентадиенил)-7-(2,5-диметилциклопентадиенил-[1,2-b:4,3-b']дитиофен)цирконийдихлорид;
метилен(3-изопропилциклопентадиенил)-7-(2,5-диметилциклопентадиенил-[1,2-b:4,3-b']дитиофен)цирконийдихлорид;
метилен(2,4-диметилциклопентадиенил)-7-(2,5-диметилциклопентадиенил-[1,2-b:4,3-b']дитиофен)цирконийдихлорид;
метилен(2,3,5-триметилциклопентадиенил)-7-(2,5-диметилциклопентадиенил-[1,2-b:4,3-b']дитиофен)цирконийдихлорид;
метилен-1-(инденил)-7-(2,5-диметилциклопентадиенил-[1,2-b:4,3-b']дитиофен)цирконийдихлорид;
метилен-1-(инденил)-7-(2,5-дитриметилсилилциклопентадиенил-[1,2-b:4,3-b'] дитиофен)цирконийдихлорид;
метилен-1-(3-изопропилинденил)-7-(2,5-диметилциклопентадиенил-[1,2-b:4,3-b']дитиофен)цирконийдихлорид;
метилен-1-(2-метилинденил)-7-(2,5-диметилциклопентадиенил-[1,2-b:4,3-b']дитиофен)цирконийдихлорид;
метилен-1-(тетрагидроинденил)-7-(2,5-диметилциклопентадиенил-[1,2-b:4,3-b']дитиофен)цирконийдихлорид;
метилен(2,4-диметилциклопентадиенил)-7-(2,5-диметилциклопентадиенил-[1,2-b:4,3-b']диоксазол)цирконийдихлорид;
метилен(2,3,5-триметилциклопентадиенил)-7-(2,5-диметилцикло-пентадиенил-[1,2-b:4,3-b']диоксазол)цирконийдихлорид;
метилен-1-(инденил)-7-(2,5-диметилциклопентадиенил-[1,2-b:4,3-b']диоксазол)цирконийдихлорид;
изопропилиден(3-метилциклопентадиенил)-7-(2,5-диметилциклопентадиенил-[1,2-b:4,3-b']дитиофен)цирконийдихлорид;
изопропилиден(2,4-диметилциклопентадиенил)-7-(2,5-диметилциклопентадиенил-[1,2-b:4,3-b']дитиофен)цирконийдихлорид;
изопропилиден(2,4-диэтилциклопентадиенил)-7-(2,5-диметилциклопентадиенил-[1,2-b:4,3-b']дитиофен)цирконийдихлорид;
изопропилиден(2,3,5-триметилциклопентадиенил)-7-(2,5-диметилциклопентадиенил-[1,2-b:4,3-b']дитиофен)цирконийдихлорид;
изопропилиден-1-(инденил)-7-(2,5-диметилциклопентадиенил-[1,2-b:4,3-b']дитиофен)цирконийдихлорид;
изопропилиден-1-(2-метилинденил)-7-(2,5-диметилциклопентадиенил-[1,2-b:4,3-b']дитиофен)цирконийдихлорид;
диметилсиландиил-1-(2-метилинденил)-7-(2,5-диметилциклопентадиенил-[1,2-b:4,3-b']дитиофен)гафнийдихлорид;
диметилсиландиил(3-трет-бутилциклопентадиенил)(9-флуоренил)цирконийдихлорид;
диметилсиландиил(3-изопропилциклопентадиенил)(9-флуоренил)цирконийдихлорид;
диметилсиландиил(3-метилциклопентадиенил)(9-флуоренил)цирконийдихлорид;
диметилсиландиил(3-этилциклопентадиенил)(9-флуоренил)цирконийдихлорид;
1-2-этан(3-трет-бутилциклопентадиенил)(9-флуоренил)цирконийдихлорид;
1-2-этан(3-изопропилциклопентадиенил)(9-флуоренил)цирконийдихлорид;
1-2-этан(3-метилциклопентадиенил)(9-флуоренил)цирконийдихлорид;
1-2-этан(3-этилциклопентадиенил)(9-флуоренил)цирконийдихлорид;
диметилсиландиилбис-6-(3-метилциклопентадиенил-[1,2-b]-тиофен)цирконийдихлорид;
диметилсиландиилбис-6-(4-метилциклопентадиенил-[1,2-b]-тиофен)цирконийдихлорид;
диметилсиландиилбис-6-(4-изопропилциклопентадиенил-[1,2-b]-тиофен)цирконийдихлорид;
диметилсиландиилбис-6-(4-трет-бутилциклопентадиенил-[1,2-b]-тиофен)цирконийдихлорид;
диметилсиландиилбис-6-(3-изопропилциклопентадиенил-[1,2-b]-тиофен)цирконийдихлорид;
диметилсиландиилбис-6-(3-фенилциклопентадиенил-[1,2-b]-тиофен)цирконийдихлорид;
диметилсиландиилбис-6-(2,5-диметил-3-фенилциклопентадиенил-[1,2-b]-тиофен)цирконийдихлорид;
диметилсиландиилбис-6-[2,5-диметил-3-(2-метилфенил)циклопентадиенил-[1,2-b]-тиофен]цирконийдихлорид;
диметилсиландиилбис-6-[2,5-диметил-3-(2,4,6-триметилфенил)циклопентадиенил-[1,2-b]-тиофен]цирконийдихлорид;
диметилсиландиилбис-6-[2,5-диметил-3-мезитиленциклопентадиенил-[1,2-b]-тиофен]цирконийдихлорид;
диметилсиландиилбис-6-(2,4,5-триметил-3-фенилциклопентадиенил-[1,2-b]-тиофен)цирконийдихлорид;
диметилсиландиилбис-6-(2,5-диэтил-3-фенилциклопентадиенил-[1,2-b]-тиофен)цирконийдихлорид;
диметилсиландиилбис-6-(2,5-диизопропил-3-фенилциклопентадиенил-[1,2-b]-тиофен)цирконийдихлорид;
диметилсиландиилбис-6-(2,5-ди-трет-бутил-3-фенилциклопентадиенил-[1,2-b]-тиофен)цирконийдихлорид;
диметилсиландиилбис-6-(2,5-дитриметилсилил-3-фенилциклопентадиенил-[1,2-b]-тиофен)цирконийдихлорид;
диметилсиландиилбис-6-(3-метилциклопентадиенил-[1,2-b]-силол)цирконийдихлорид;
диметилсиландиилбис-6-(3-изопропилциклопентадиенил-[1,2-b]-силол)цирконийдихлорид;
диметилсиландиилбис-6-(3-фенилциклопентадиенил-[1,2-b]-силол)цирконийдихлорид;
диметилсиландиилбис-6-(2,5-диметил-3-фенилциклопентадиенил-[1,2-b]-силол)цирконийдихлорид;
диметилсиландиилбис-6-[2,5-диметил-3-(2-метилфенил)циклопентадиенил-[1,2-b]-силол]цирконийдихлорид;
диметилсиландиилбис-6-[2,5-диметил-3-(2,4,6-триметилфенил)циклопентадиенил-[1,2-b]-силол]цирконийдихлорид;
диметилсиландиилбис-6-[2,5-диметил-3-мезитиленциклопентадиенил-[1,2-b]-силол]цирконийдихлорид;
диметилсиландиилбис-6-(2,4,5-триметил-3-фенилциклопентадиенил-[1,2-b]-силол)цирконийдихлорид;
[диметилсилил(трет-бутиламидо)][(N-метил-1,2-дигидроциклопента[2,1-b]индол-2-ил)]титандихлорид;
[диметилсилил(трет-бутиламидо)][(6-метил-N-метил-1,2-дигидроциклопента[2,1-b]индол-2-ил)]титандихлорид;
[диметилсилил(трет-бутиламидо)][(6-метокси-N-метил-1,2-дигидроциклопента[2,1-b]индол-2-ил)]титандихлорид;
[диметилсилил(трет-бутиламидо)][(N-этил-1,2-дигидроциклопента[2,1-b]индол-2-ил)]титандихлорид;
[диметилсилил(трет-бутиламидо)][(N-фенил-1,2-дигидроциклопента[2,1-b]индол-2-ил)]титандихлорид;
[диметилсилил(трет-бутиламидо)][(6-метил-N-фенил-1,2-дигидроциклопента[2,1-b]индол-2-ил)]титандихлорид;
[диметилсилил(трет-бутиламидо)][(6-метокси-N-фенил-1,2-дигидроциклопента[2,1-b]индол-2-ил)]титандихлорид;
[диметилсилил(трет-бутиламидо)][(N-метил-3,4-диметил-1,2-дигидроциклопента[2,1-b]индол-2-ил)]титандихлорид;
[диметилсилил(трет-бутиламидо)][(N-этил-3,4-диметил-1,2-дигидроциклопента[2,1-b]индол-2-ил)]титандихлорид;
[диметилсилил(трет-бутиламидо)][(N-фенил-3,4-диметил-1,2-дигидроциклопента[2,1-b]индол-2-ил)]титандихлорид;
а также соответствующие соединения титана и гафния, дибромиды и дийодиды.
Способ настоящего изобретения показывает некоторые преимущества относительно обычных способов, известных в данной области. Общие выходы, исходя из лигандов, обычно выше выходов, сообщаемых для данной области. Кроме того, требуемый продукт легче очищать, благодаря лучшей растворимости образующегося промежуточного алкилированного металлоцена относительно дигалогенидов или моногалогенидов. Также, благодаря более высокой растворимости указанного промежуточного металлоцена, на данной стадии легко разделять рацемическую и мезоформу и получать, таким образом, по существу чистую рацемическую или мезоформу в качестве конечного продукта.
Металлоценовые соединения, полученные способом настоящего изобретения, в комбинации с подходящим активатором, таким как алюмоксан, или соединение, способное образовывать алкилметаллоценовый катион, можно применять в качестве катализатора для полимеризации олефинов.
В частности, их можно применять для гомо- или co-полимеризаци альфа-олефинов формулы CH2=CHR, в которых R обозначает водород или C1-C20 алкил, такой как пропилен, 1-бутен, 1-пентен, 4-метил-1-пентен, 1-гексен и 1-октен.
Интересным применением является получение изотактического, синдиотактического или атактического полипропилена.
Другим интересным применением является применение для сополимеризации этилена с альфа-олефинами, такими как пропилен, 1-бутен, 1-пентен, 4-метил-1-пентен, 1-гексен и 1-октен, с циклоолефинами, такими как циклопентен, циклогексен, норборнен и 4,6-диметил-1-гептен, или с полиенами, такими как 1,4-гексадиен, изопрен, 1,3-бутадиен, 1,5-гексадиен и 1,6-гептадиен.
Кроме того, их можно с пользой применять при олигомеризации олефинов или в реакциях гидрирования.
Считается, что алюмоксаны, которые можно применять, являются линейными, разветвленными или циклическими соединениями, содержащими, по меньшей мере, одну группу типа:
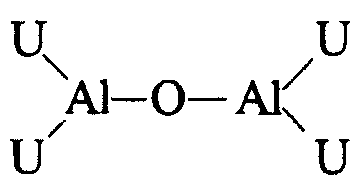
где заместители U, одинаковые или разные, представляют собой атомы водорода, атомы галогенов, C1-C20-алкильные, C3-C20-циклоалкильные, C6-C20-арильные, C7-C20-алкиларильные или C7-C20-арилалкильные радикалы, необязательно содержащие атомы кремния или германия, при условии, что, по меньшей мере, один U отличен от галогена.
В частности, алюмоксаны формулы:
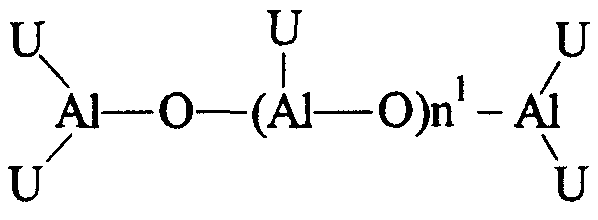
можно применять в случае линейных соединений, в которых n1 равно 0 или целому числу от 1 до 40 и заместители U определены выше; или алюмоксаны формулы:
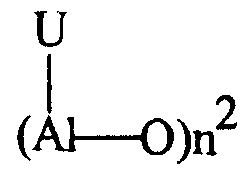
можно применять в случае циклических соединений, в которых n2 равно целому числу от 2 до 40 и заместители U определены выше.
Неограничительные примеры соединений, способных образовывать алкилметаллоценовый катион, представляют соединения формулы D+E-, в которых D+ является кислотой Бренстеда, способной отдавать протон и необратимо взаимодействовать с заместителем X металлоцена формулы (I), и E- является совместимым анионом, который способен стабилизировать активные каталитические виды, получающиеся при взаимодействии двух соединений, и который достаточно лабилен для того, чтобы быть удаленным посредством олефинового мономера.
Предпочтительно, если анион E- содержит один или более атомов бора. Более предпочтительно, если анион E- представляет собой анион формулы BAr4 (-), в котором заместители Ar, которые могут быть одинаковыми или разными, обозначают арильные радикалы, такие как фенил, пентафторфенил или бис(трифторметил)фенил. Тетракиспентафторфенилборат является особо предпочтительным соединением, которое описано в WO 91/02012. Кроме того, соединения формулы BAr3 можно удобно применять. Соединения данного типа описаны, например, в международной патентной заявке WO 92/00333. Другими примерами соединений, способных образовывать алкилметаллоценовый катион, являются соединения формулы BAr3P, в которых P представляет замещенный или незамещенный пиррольный радикал. Данные соединения описаны в WO 01/62764. Соединения, содержащие атомы бора, можно легко обеспечить на носителе согласно описанию DE-A-19962814 и DE-A-19962910.
Каталитический компонент, образованный при взаимодействии металлоценового соединения и алюмоксана, или соединение, способное образовывать алкилметаллоценовый катион, можно удобно применять на инертных носителях, таких как диоксид кремния, оксид алюминия, сополимеры стирол/дивинилбензол, полиэтилен или полипропилен, в особенности для применения при полимеризации в газовой фазе.
Способы полимеризации олефинов можно осуществлять в жидкой фазе, необязательно в присутствии инертного углеводородного растворителя, ароматического (например, толуола) или алифатического (например, пропана, гексана, гептана, изобутана, циклогексана и 2,2,4-триметилпентана). Температура полимеризации обычно составляет примерно от 0°C до 250°C и предпочтительно от 20 до 150°C.
Следующие примеры приведены для иллюстративных целей, а не для ограничения.
ОБЩИЕ МЕТОДИКИ И ХАРАКТЕРИСТИКИ
Все операции проводят в атмосфере азота, применяя обычные методики Schlenk-line. Растворители очищают, дегазируя N2 и пропуская через активированный (8 ч, продувка N2, 300°C) Al2O3, и хранят под азотом. EtAlCl2 (Aldrich) и AlCl3 (Aldrich) используют, как общепринято.
Протонные спектры лигандов и металлоценов получены на спектрометре Bruker DPX 200, работающем в режиме преобразования Фурье при комнатной температуре при 200,13 МГц. Образцы растворяют в CD2Cl2 (Aldrich, 99,5 атомных % D) или 1,1,2,2-тетрахлорэтан-d2 (Acros, 99 атомных % D). Подготовку образцов проводят в атмосфере азота, применяя стандартные методики для инертной атмосферы. В качестве стандарта используют остаточный пик CHDCl2 или C2HDCl4 в 1H спектрах (5,35 м.д. и 5,95 м.д. соответственно). Протонные спектры получают при 15° импульсе и задержке между импульсами 2 с; для каждого спектра осуществляют 32 накопления.
Диметилсиландиил[2-метил-4-(4'-трет-бутилфенил)инденил][2-изопропил-4-(4'-трет-бутилфенил)инденил)]диметилцирконий получают по аналогичной методике, описанной в примере 5 PCT/EP02/14899 при использовании [2-метил-4-(4'-трет-бутилфенил)инденил][2-изопропил-4-(4'-трет-бутилфенил)инденил)]диметилсилана вместо бис(2-метил-инден)диметилсилана.
Диметилсиландиил бис[2-метил-(4,5-бензоинденил)]диметил цирконий получают по аналогичной методике, описанной в примере 5 PCT/EP02/14899, используя бис[2-метил-(4,5-бензоинденил)]диметилсилан вместо бис(2-метилинденил)диметилсилана.
Пример 1
1,8 M раствор EtAlCl2 в толуоле (Aldrich, 6,3 мл, 11,34 ммоль, Al/Zr = 2,17/1) добавляют по капле при комнатной температуре в атмосфере азота к суспензии 3,8 г диметилсиландиил[2-метил-4-(4'-трет-бутилфенил)инденил][2-изопропил-4-(4'-трет-бутилфенил)инденил)]диметилциркония (ММ=728,26, 5,22 ммоль) в 20 мл толуола в колбе Шленка на 50 мл. При добавлении цвет меняется от желтого до оранжево-красного. Затем реакционную смесь нагревают при 60°C в течение 40 мин: 1H ЯМР анализ CD2Cl2 показывает почти количественное превращение диметилового комплекса в дихлоридный комплекс (рац/мезо 92/8). Конечную суспензию фильтруют при комнатной температуре на фритте G4: далее остаток промывают толуолом и затем сушат в вакууме, получая 3,90 г оранжевого порошка. Полученный порошок представляет собой диметилсиландиил[2-метил-4-(4'-трет-бутилфенил)инденил][2-изопропил-4-(4'-трет-бутилфенил)инденил)]цирконийдихлорид (рац/мезо 92/8) по данным 1H ЯМР анализа в CD2Cl2: выход выделенного продукта 97,2%. 1H ЯМР (CD2Cl2, δ, м.д.): 1,07 (д, 3H, J=6,85 Гц, CH3, рац); 1,15 (д, 3H, J=6,85 Гц, CH3, рац); 1,22 (д, 3H, J=6,85 Гц, CH3, мезо); 1,32 (c, 3H, Me2Si, мезо); 1,37, 1,38 (c, 36H, трет-Bu, рац и мезо); 1,39, 1,40 (c, 6H, Me2Si, рац); 1,48 (д, 3H, J=6,85 Гц, CH3, мезо); 1,54 (c, 3H, Me2Si, мезо); 2,28 (c, 3H, 2-CH3, рац); 2,41 (c, 3H, 2-CH3, мезо); 3,18-3,38 (м, 2H, J=6,85 Гц, CH, рац и мезо); 6,86-7,75 (м, 32H, Cp-H и Ar, рац и мезо).
Сравнительный пример 1
Медленно добавляют хлорид алюминия (Aldrich, 99,9%, 0,18 г, ММ = 133,34, 1,35 ммоль, Al/Zr=2,50/1) при комнатной температуре в атмосфере азота к суспензии 0,39 г диметилсиландиил[2-метил-4-(4'-трет-бутилфенил)инденил][2-изопропил-4-(4'-трет-бутилфенил)инденил)]диметилциркония (ММ=728,26, 0,54 ммоль) в 10 мл толуола в колбе Шленка на 100 мл. Реакционную смесь нагревают при 40°C в течение 2 ч: 1H ЯМР анализ в CD2Cl2 показывает превращение диметилового комплекса в дихлоридный комплекс (рац/мезо 56/44), к тому же, не идентифицируют загрязнение побочными продуктами. В конечную суспензию добавляют 60 мл толуола, нагревают при 60°C, перемешивают в течение 15 мин при данной температуре и фильтруют на фритте G4. Остаток отбрасывают, тогда как фильтрат сушат в вакууме и затем обрабатывают этиловым эфиром. Полученную суспензию перемешивают при комнатной температуре в течение 15 мин и затем фильтруют на фритте G4: остаток сушат в вакууме, получая 0,31 г оранжевого порошка. Последний представляет собой диметилсиландиил[2-метил-4-(4'-трет-бутилфенил)инденил][2-изопропил-4-(4'-трет-бутилфенил)инденил)]цирконийдихлорид (рац/мезо 56/44) по данным 1H ЯМР анализа в CD2Cl2: выход выделенного продукта 74,7%.
Пример 2
1,8 M раствор EtAlCl2 в толуоле (Aldrich, 0,85 мл, 1,53 ммоль, Al/Zr=2,16/1) добавляют по капле при комнатной температуре в атмосфере азота к суспензии 0,38 г диметилсиландиил бис[2-метил-(4,5-бензоинденил)]диметилциркония (ММ=535,92, 0,71 ммоль) в 15 мл толуола в колбе Шленка на 50 мл. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч: 1H ЯМР анализ в CD2Cl2 показывает почти количественное превращение диметилового комплекса в дихлоридный комплекс. Конечную суспензию фильтруют при комнатной температуре на фритте G4: остаток дополнительно промывают толуолом и затем сушат в вакууме, получая 0,38 г желтого порошка. Последний представляет собой диметилсиландиил бис[(2-метил-(4,5-бензоинденил)]цирконийдихлорид (рац/мезо 28/72) по данным 1H ЯМР анализа в CD2Cl2: выход выделенного продукта 92,8%.
1H ЯМР (CD2Cl2, δ, м.д.): 1,30 (c, 3H, Me2Si, мезо); 1,39 (c, 6H, Me2Si, рац); 1,50 (c, 3H, Me2Si, мезо); 2,39 (c, 6H, 2-CH3, рац); 2,58 (c, 6H, 2-CH3, мезо); 7,14-8,00 (м, 28H, Cp-H и Ar, рац и мезо).
Сравнительный пример 2
Медленно добавляют хлорид алюминия (Aldrich, 99,9%, 0,27 г, ММ = 133,34, 2,02 ммоль, AVZr = 2,77/1) при комнатной температуре в атмосфере азота к суспензии 0,39 г диметилсиландиил бис[2-метил-(4,5-бензоинденил)]диметилциркония (ММ=535,92, 0,73 ммоль) в 15 мл толуола в колбе Шленка на 150 мл. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч: 1H ЯМР анализ в CD2Cl2 показывает превращение диметилового комплекса в дихлоридный комплекс (рац/мезо 2611 A), к тому же, не идентифицируют загрязнение побочными продуктами. К конечной суспензии добавляют 80 мл толуола, нагревают при 60°C, перемешивают в течение 30 мин при данной температуре и фильтруют на фритте G4. Фильтрат отбрасывают, а остаток экстрагируют далее толуолом и сушат в вакууме. Затем экстракт обрабатывают 20 мл этилового эфира. Полученную суспензию перемешивают при комнатной температуре в течение 20 мин и затем фильтруют на фритте G4: остаток сушат в вакууме, получая 0,34 г желтого порошка. Последний представляет собой диметилсиландиил бис[(2-метил-(4,5-бензоинденил)]цирконийдихлорид (рац/мезо 29/71) по данным 1H ЯМР анализа в CD2Cl2: выход выделенного продукта 80,9%.
Пример 3 - синтез "в одном сосуде"
3,05 M раствор MeLi в диэтоксиметане (Chemetall, 11,2 мл, 34,16 ммоль, MeLi:лиганд=2,08:1) добавляют по капле при комнатной температуре в атмосфере азота к раствору 10,00 г [2-метил-4-(4'-трет-бутилфенил)инденил][2-изопропил-4-(4'-трет-бутилфенил)инденил)]диметилсилана (98,6% чистоты по данным ГХ-МС, ММ=608,98, 16,42 ммоль) в 60 мл ТГФ в 500 мл реакторе. В конце добавления реакционную смесь перемешивают в течение 2 ч с образованием в результате оранжево-красного раствора. Примерно через 1 час к дилитиевой соли лиганда быстро добавляют при комнатной температуре еще 11,2 мл 3,05 M раствора MeLi в диэтоксиметане (34,16 ммоль, MeLi:лиганд=2,08:1). В то же время к 3,82 г ZrCl4 (Aldrich, ММ 233,03, 16,39 ммоль, ZrCl4:лиганд=1/1) медленно добавляют безводный ТГФ (60 мл) при -20°C в атмосфере азота в колбе Шленка на 250 мл. В конце добавления суспензии, содержащей ZrCl4(ТГФ)2, дают нагреться до комнатной температуры и перемешивают в течение 1 ч. Затем медленно добавляют при комнатной температуре суспензию ZrCl4(ТГФ)2 к раствору лигандов, содержащему 2-кратный избыток MeLi. Полученную реакционную смесь нагревают при 65°C и перемешивают в течение 12 ч при данной температуре. 1H ЯМР анализ в CD2Cl2 показывает почти количественное превращение исходного лиганда в диметиловый комплекс. Затем реакционную смесь концентрируют в вакууме до 10% общего объема (примерно 15 мл); добавляют пентан (примерно 50 мл) и полученную суспензию перемешивают в течение 15 мин при комнатной температуре. Затем ее фильтруют на фритте G4 с механической мешалкой, допускающей непрерывное и эффективное перемешивание сырой смеси. Остаток на фритте промывают один раз пентаном (50 мл), при этом фильтраты отбрасывают. Остаток на фритте обрабатывают при 60°C и перемешивании примерно 300 мл толуола и затем снова фильтруют на фритте G4 для отделения диметилового комплекса (в виде фильтрата). К полученному выше раствору добавляют по капле при комнатной температуре 1,8 M раствор EtAlCl2 в толуоле (Aldrich, 6,5 мл, 11,7 ммоль, Al/Zr=0,71/1). Реакционную смесь нагревают при 65°C в течение 1 ч: 1H ЯМР анализ в CD2Cl2 показывает почти количественное превращение диметилового комплекса в дихлоридный комплекс. Оранжево-красную суспензию концентрируют до 10% общего объема (примерно 30 мл) и фильтруют при комнатной температуре на фритте G4 с механической мешалкой, допускающей непрерывное и эффективное перемешивание сырой смеси. Остаток на фритте промывают один раз толуолом и затем сушат в вакууме, получая оранжевый порошок. Последний представляет собой рац/мезо смеси [2-метил-4-(4'-трет-бутилфенил)инденил][2-изопропил-4-(4'-трет-бутилфенил)инденил)]цирконийдихлорида по данным 1H ЯМР анализа в CD2Cl2: выход выделенного продукта 62,5% в расчете на Zr.
Дополнительный 1H ЯМР анализ конечного порошка проводят в 1,1,2,2-тетрахлорэтане-d2, получив образец, полностью растворимый в ЯМР-растворителе.
1H ЯМР (C2D2Cl4, δ, м.д.) рацемический изомер: 0,99 (д, 3H, J=6,46 Гц, CH3); 1,09 (д, 3H, J=6,46 Гц, CH3); 1,30 (c, 18H, трет-Bu); 1,31 (ш.с., 6H, Me2Si); 2,22 (c, 3H, 2-CH3); 3,23 (м, 1H, J=6,46 Гц, CH); 6,96 (д, 2H, J=8,41 Гц, CH); 7,07 (т, 2H, J=7,83 Гц, CH); 7,28-7,64 (м, 12H, CH).
Описан улучшенный способ получения галогенидметаллоценовых соединений общей формулы (V), где М - Zr, L - Cl, R1 - СН3, R4 - С1-С6алкил; R5, R6, R7, R8 и R9 - Н, или С1-С20алкил, С7-С20арилалкил или два вицинальных R5, R6, R7, R8 и R9 образуют конденсированный 6-членный ненасыщенный цикл, действием агента галогенирования формулы III на соединение формулы V, где L замещен на L′, где L′ - метил. Способ позволяет получать высокие выходы и легко разделять рацемическую и мезоформу вследствие высокой растворимости промежуточного алкилированного металлоцена. 2 н. и 2 з.п. ф-лы.

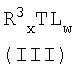
L - Cl, T - Al, R3 - C1-20алкил
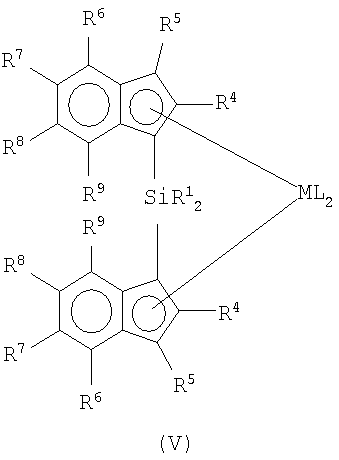
в которой М обозначает цирконий;
L представляет собой хлор;
R1 представляет собой метил;
R4 представляет собой линейный или разветвленный C1-C6алкильный радикал;
R5 R6, R7, R8 и R9, одинаковые или разные, обозначают атомы водорода или линейные или разветвленные C1-C20алкильные или С7-С20арилалкильные радикалы или два вицинальных R5, R6, R7, R8 и R9 также могут образовывать конденсированный 6-членный ненасыщенный цикл;
указанный способ включает взаимодействие соединения формулы (V), в которой L замещен L′, где L′ представляет собой метил
с по меньшей мере, с p-t эквивалентами относительно металла М соединения формулы (II) агента галогенирования формулы (III)
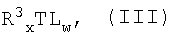
в которой L представляет собой хлор;
R3 представляет собой линейный или разветвленный С1-С20алкил;
Т представляет собой алюминий;
х≥1 и w≥1, так что x+w равно степени окисления металла Т.
R3 обозначает метил, этил, н-пропил, изопропил, н-бутил, изобутил и х равно 1.
а) взаимодействие лиганда формулы
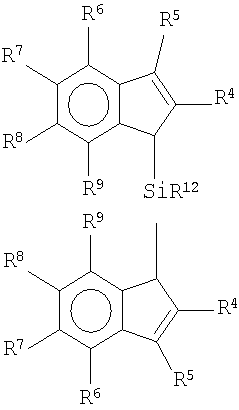
с некоторым количеством EQ соединения формулы L′jB, так что EQ≥1+r молярных эквивалента относительно инденильного фрагмента, где A, Z, R1, m, n, и L′ имеют значения, описанные в п.1;
В обозначает литий;
b) взаимодействие продукта, полученного на предыдущей стадии, по меньшей мере, с 1 молярным эквивалентом относительно инденильного фрагмента соединения формулы ML′′4, в которой М имеет указанные выше значения, L′′ выбран из группы, включающей хлор;
c) взаимодействие смеси, полученной на предыдущих стадиях, по меньшей мере, с 2 эквивалентами относительно металла М агента галогенирования формулы (III)
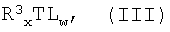
в которой R3, T, L, х и w имеют значения, описанные в п.1.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
Авторы
Даты
2008-10-10—Публикация
2004-04-29—Подача