Область техники
Изобретение относится к технологиям производства сорбентов, применяемых для медицинских целей, а именно для экстракорпоральной терапии больных с сепсисом с использованием сорбции биологических жидкостей, и является продолжением и развитием авторских изобретений в патентах RU 2694883 и RU 2684639.
Уровень техники
Для предлагаемого способа получения сорбента были отобраны следующие аналоги.
Патент Китая CN 106589202 (A) LYSOZYME IMMOBILIZED CARRIER AND PREPARATION METHOD THEREOF (Опубликовано: 2017-04-26). Изобретение относится к матрице (носителю) иммобилизованного лизоцима и способу получения, относящемуся к области иммобилизации фермента. В изобретении применяется экологически безопасный технологический процесс суспензионной полимеризации с использованием метилакрилата в качестве основного сырья, дивинилбензола в качестве сшивающего агента, регулирующего структуру смолы путем добавления третьего мономерного стирола для увеличения механической прочности носителя, макропористый носитель лизоцима был приготовлен в присутствии реагента, а гидролиз слабокислой макропористой катионообменной смолы был получен с получением ферментного Носителя. В конце отвержденный лизоцим получали взаимодействием смолы, глутаральдегида и лизоцима. Активность иммобилизованного лизоцима составляла от 3000 до 5000 мкг/г.
Однако для данного материала не показана гемосовместимость.
В научной литературе описаны различные примеры химической модификации лизоцима с целью улучшения его антимикробных свойств (статьи: L.Aminlari, M.Hashemi, M.Aminlari, Modified lysozymes as novel broad spectrum natural antimicrobial agents in foods, J. Food Sci. 79 (2014) R1077-R1090. https://doi.ore/10.1111/1750-3841.12460:  S.Krist, M.Vehabovic, C.Valenta, Synthesis and evaluation of lysozyme derivatives exhibiting an enhanced antimicrobial action, Eur. J. Pharm. Sci. 6 (1998) 303-309. https://doi.org/10.1016/S0928-0987(97) 10026-4: H.R.Ibrahim, A.Kato, K.Kobayashi, Antimicrobial effects of lysozyme against gram-negative bacteria due to covalent binding of palmitic acid, J. Agric. Food Chem. 39 (1991) 2077-2082. https://doi.org/10.1021/if00011a039: H.R.Ibrahim, H.Hatta, M.Fujiki, M.Kim, T.Yamamoto, Enhanced antimicrobial action of lysozyme against gram-negative and gram-positive bacteria due to modification with perillaldehyde, J. Agric. Food Chem. 42(8) (1994) 1813-1817 https://doi.org/10.1021 /if00044a046).
S.Krist, M.Vehabovic, C.Valenta, Synthesis and evaluation of lysozyme derivatives exhibiting an enhanced antimicrobial action, Eur. J. Pharm. Sci. 6 (1998) 303-309. https://doi.org/10.1016/S0928-0987(97) 10026-4: H.R.Ibrahim, A.Kato, K.Kobayashi, Antimicrobial effects of lysozyme against gram-negative bacteria due to covalent binding of palmitic acid, J. Agric. Food Chem. 39 (1991) 2077-2082. https://doi.org/10.1021/if00011a039: H.R.Ibrahim, H.Hatta, M.Fujiki, M.Kim, T.Yamamoto, Enhanced antimicrobial action of lysozyme against gram-negative and gram-positive bacteria due to modification with perillaldehyde, J. Agric. Food Chem. 42(8) (1994) 1813-1817 https://doi.org/10.1021 /if00044a046).
В статье C.Valenta, A.Bernkop-Schnurch, M.Schwartz. Modification of lysozyme with cinnamaldehyde: A strategy for constructing novel preservatives for dermatics, Int. J. Pharm. 148 (1997) 131-137. https://doi.org/10.1016/S0378-5173(96)04839-9) описана модификация лизоцима с улучшением его свойств альдегидом, а именно коричным альдегидом. Коричный альдегид с ε-аминогруппами остатков лизина образует основание Шиффа, которое может быть затем восстановлено с помощью борогидрида натрия для получения химически стабильной связи. Показано, что такая модификация значительно повышает антибактериальную активность лизоцима по отношению к ряду видов бактерий.
Но при этом в этой статье нет указания иммобилизации лизоцима, нет сорбента и нет проверки сорбции эндотоксина полученным сорбентом.
В патенте RU 2694883 (Опубликовано: 17.07.2019 Бюл. №20) представлен способ ковалентной иммобилизации лизоцима для последующего применения иммобилизованного лизоцима для снижения бактериальной обсемененности биологических жидкостей, в котором производят иммобилизацию лизоцима на аминированную агарозную матрицу с получением молекулярного спейсера -NH-C6H12-NH-C5H10-NH-, присоединяющего молекулу лизоцима. В качестве матрицы гемосовместимого сорбента используют промышленно выпускаемые макропористые агарозные матрицы марок Sepharose (Сефароза) (производитель GE Healthcare, США) и WorkBeads (WB) 200 Sec (производитель Bio-Works, Швеция). Иммобилизованный лизоцим в составе полученного сорбента с отсутствием риска утечки лизоцима применяют для снижения бактериальной обсемененности биологических жидкостей посредством лизиса бактериальных клеток.
Однако в этом аналоге нет химической модификации лизоцима альдегидом и сравнительно невысокая емкость иммобилизованного лизоцима по эндотоксину (сорбент не столь эффективен).
Что касается самого сорбента, то отобраны следующие его авторские аналоги.
В патенте RU 2684639 (Опубликовано: 11.04.2019 Бюл. №11) Способ удаления эндотоксинов из биологических жидкостей с помощью ковалентно иммобилизованного лизоцима в качестве лиганда представлен сорбент с иммобилизованным лизоцимом в качестве лиганда в матрице гемосовместимого сорбента для удаления эндотоксинов из биологических жидкостей с отсутствием риска утечки лизоцима в сорбируемую биологическую жидкость (водный раствор, в том числе физиологический раствор, плазму крови и цельную кровь (с учетом гемосовместимости сорбента). В статье П.А. Левашов, Д.А. Матолыгина, Е.Д. Овчинникова, И.Ю. Адамова, О.А. Дмитриева, А.В. Нуждина, Н.С. Покровский, Н.Л. Еремеев. Новый сорбент на основе ковалентно иммобилизованного лизоцима для удаления бактериального липополисахарида (эндотоксина) из биологических жидкостей, Биохимия (Москва) 84 (2019) стр. 33-39. https://doi.org/10.1134/ S0006297919010048 также описан тот же сорбент, что и в патенте RU 2684639.
Однако можно повысить эффективность сорбции эндотоксинов этим сорбентом с помощью дополнительной предварительной химической модификации лизоцима до его иммобилизации.
Раскрытие изобретения Задачей предлагаемого изобретения явилось создание более эффективного гемосовместимого сорбента с улучшенными свойствами с помощью дополнительной предварительной химической модификации лизоцима бензальдегидом до иммобилизации лизоцима.
За основу была взята идея модификации лизоцима ароматическими альдегидами с целью улучшения антимикробных свойств лизоцима. Выбор бензальдегида обусловлен его относительно хорошей растворимостью в воде, что упрощает технологию модификации лизоцима и, следовательно, будет более удобен для будущего масштабирования процесса для производства. Кроме того, этот альдегид не имеет алкеновой двойной связи, которая может быть восстановлена во время процедуры модификации, сделав состав продуктов реакции более неопределенным.
Задача решается тем, что разработан способ получения сорбента для сорбции бактериальных эндотоксинов - на основе ковалентно иммобилизованного и химически модифицированного бензальдегидом лизоцима, содержащий две стадии.
Первая стадия: модификация лизоцима бензальдегидом, для этого растворы лизоцима (2 мг/мл) и бензальдегида (1,5 мг/мл) готовят в буфере NаНСО3-Nа2СО3 (50 мМ, рН 8,0) с разными молярными соотношениями лизоцим/бензальдегид. Далее реакционную смесь инкубируют при 25°С в течение 3 часов на роторном шейкере (10 об/мин), далее добавляют свежеприготовленный 2%-ный водный раствор NaBH4 к полученному препарату (до конечной концентрации смеси 0,1%) и инкубируют при 25°С в течение 30 минут при перемешивании с повтором этой процедуры дважды. Для отделения лизоцима от низкомолекулярных компонентов проводят хроматографию на колонке с сефадексом G-25 (7 см * 5 см2), уравновешенной буфером K2НРО4-KОН (20 мМ, рН 8,0) при скорости потока 2 мл/мл. Далее определяют степень модификации лизоцима, а именно: уменьшение количества свободных аминогрупп лизоцима определяют с использованием тринитробензолсульфоновой кислоты (TNBS), измерения проводят при 37°С в буфере Н3ВО3-NaOH (0,1 М, рН 9,5); раствор TNBS добавляют в кювету с белковым раствором до концентрации 0,04%, рост поглощения регистрируют при 420 нм до достижения плато в течение примерно 50 минут; величину поглощения на плато (D420) используют для построения калибровочных кривых, используя данные для немодифицированного лизоцима (0,7-4,0 мкМ) и ε-аминокапроновой кислоты (2-16 мкМ). Степень модификации лизоцима рассчитывают из значений отношения D420 для растворов модифицированного и нативного лизоцима с равными концентрациями белка.
Вторая стадия: ковалентная иммобилизация химически модифицированного лизоцима, которую осуществляют путем присоединения белка к аминированной матрице; для аминирования матрица активирована (окислена) NaIO4; для чего вначале матрицу промывают, используя воронку Бюхнера со спеченным диском, 20-кратным объемом (по отношению к объему матрицы) дистиллированной воды, а затем добавляют двукратный объем 2%-ного раствора NaIO4; далее смесь инкубируют при 20°С в течение 2 часов на роторном шейкере (5 об/мин); после инкубации матрицу промывают 20-кратным объемом дистиллированной воды; далее к активированной матрице добавляют один объем 2 М раствора 1,6-диаминогексана с последующей инкубацией смеси при 20°С в течение 2 часов на роторном шейкере (5 об/мин). Затем к полученному препарату добавляют двойной объем свежеприготовленного 0,5% водного раствора NaBH4 и инкубируют в течение 30 минут при перемешивании, затем добавляют другую аналогичную порцию свежеприготовленного раствора NaBH4; и смесь инкубируют в течение дополнительных 30 минут; далее аминированную матрицу промывают 5-кратным объемом 1 М раствора NaCl и 10-кратным объемом буфера KН2РО4-K2НРО4 (10 мМ, рН 7,0, 130 мМ NaCl) (буфер А). Далее 0,56 мл 25%-ного раствора глутаральдегида добавляют к 10 мл 50%-ной суспензии аминированной матрицы, содержащей 50% осадка по объему, в буфере NaHCO3-NaOH (30 мМ, рН 10,0); эту смесь перемешивают при 25°С в течение 30 минут на роторном шейкере (5 об/мин); полученный гель промывают 50 мл буфера NaHCO3-NaOH (30 мМ, рН 10,0) и добавляют 10 мл 7,5 мг/мл раствора лизоцима в том же буфере; смесь инкубируют при 25°С в течение 3 часов на роторном шейкере (5 об/мин). К полученному препарату добавляют двойной объем свежеприготовленного 0,5%-ного водного раствора NaBH4; и инкубируют в течение 20 минут при перемешивании, затем добавляют другую аналогичную порцию свежеприготовленного раствора NaBH4 и смесь снова инкубируют в течение дополнительных 20 минут.
Наконец, полученный сорбент промывают 200 мл дистиллированной воды и затем промывают 150 мл буфера А; количество иммобилизованного лизоцима определяют по разнице между добавленным количеством и количеством в супернатанте (суспензии клеток без иммобилизованного лизоцима) после процедуры иммобилизации (после инкубации раствора лизоцима с гелем перед добавлением NaBH4). Концентрацию лизоцима определяют спектрофотометрически по оптическому поглощению раствора при 280 нм.
В качестве гемосовместимой полимерной агарозной матрицы для иммобилизации лизоцима используют матрицу марки WorkBeads (WB) 200 Sec (производитель Bio-Works, Швеция) с диаметром гранул 200 мкм.
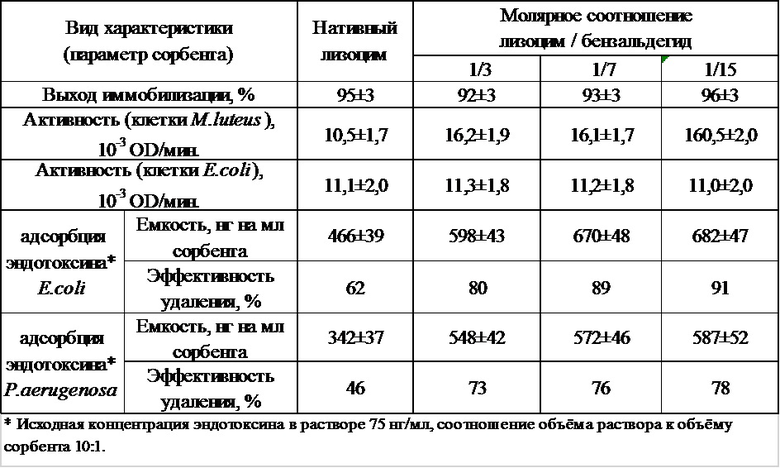
Сорбент, полученный вышеописанным способом, характеризуется улучшенными свойствами ковалентно иммобилизованного лизоцима с различной степенью химической модификации (молярные соотношения лизоцим/бензальдегид в реакционной среде: 1/0 (нативный лизоцим для сравнения), 1/3, 1/7 и 1/15) и в зависимости от этого различной степени бактериолитической активности и сорбционных характеристик в соответствии с данными таблицы характеристик (прим.: экспериментальные данные представлены в виде средних значений и 95% доверительного интервала, рассчитанного по распределению Стьюдента):
Осуществление изобретения
Для промышленной применимости предлагаемый способ получения сорбента достаточно подробно представлен в предыдущем разделе «Раскрытие изобретения».
А для анализа характеристик полученного сорбента используют следующие техники.
Для анализа бактериолитической активности полученного сорбента с иммобилизованным и химически модифицированным лизоцимом в качестве модельных бактериальных субстратов используют грамотрицательные клетки Escherichia coli и грамположительные клетки Micrococcus luteus. Измеряют уменьшение поглощения клеточной суспензии при длине волны 650 нм в буферной среде 0.01 М трис-MES рН 8.5; количество бактериальных клеток, добавленных в реакционную смесь, подбирают таким образом, чтобы исходная оптическая плотность составляла 0,5-0,55; количество добавленного иммобилизованного лизоцима составляет 35 мкл на 1 мл смеси. Реакционную смесь инкубируют в пробирках (10 мл каждый час) в термостате на роторном шейкере со скоростью 10 об/мин, но не более 14 об/мин; образцы объемом 1 мл отбирают из смеси каждые 2 минуты, оставляя оставшуюся смесь для дальнейшей инкубации. Отобранные образцы помещают в пробирки, частицам иммобилизованного фермента дают отстояться в течение 0,5 минут и затем измеряют оптическую плотность супернатанта. Зависимость изменения оптической плотности супернатанта от времени наносят на график, а скорость изменения оптической плотности во времени (активность) определяют по наклону зависимости. Для коррекции скорости лизиса на фоне изменения оптической плотности проводят контрольные эксперименты путем добавления в смесь матрицы без лизоцима.
Для исследования сорбции эндотоксинов полученным сорбентом с иммобилизованным и химически модифицированным лизоцимом используют препараты липополисахаридов Escherichia coli и Pseudomonas aerugenosa. Сорбцию исследуют методом «сорбции в объеме». При этом 100 мкл сорбентов помещают в пластиковые пробирки и промывают 20 объемами воды для LAL-теста. Концентрированные растворы эндотоксинов разбавляют буфером А до конечной концентрации 75 нг/мл. Затем 10 объемов раствора эндотоксина добавляют к сорбентам и инкубируют в течение 30 минут при 37°С на шейкере (5 об/мин); после инкубации и центрифугирования (3 мин при центробежном ускорении 6708 g) отбирают образцы супернатанта и разводят в 200 раз водой для LAL-теста. Концентрацию эндотоксина определяют по его активности в образцах методом конечной точки LAL. В качестве контроля сорбцию эндотоксина тестируют на сырой матрице WorkBeads 200SEC, а эффективность сорбции рассчитывают как отношение количества эндотоксина до и после инкубации с сорбентом.
Химическая модификация бензальдегидом затрагивает только 1-2 аминогруппы молекулы белка фермента лизоцима, что не препятствует дальнейшей ковалентной иммобилизации лизоцима с использованием оставшихся свободных аминогрупп. Бактериолитическая активность лизоцима сохраняется после химической модификации и после последующей ковалентной иммобилизации. В результате химической модификации иммобилизованный лизоцим более эффективно сорбирует бактериальные липополисахариды (эндотоксины). Полученный сорбент может быть использован в качестве медицинского материала для экстракорпорального лечения сепсиса.
Предлагаемые объекты изобретения получены в рамках выполнения работы по Соглашению №14.574.21.0181 между Минобрнауки Российской Федерации (Госзаказчик) и МГТУ им. Н.Э. Баумана.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ N2 получения сорбента на основе ковалентно иммобилизованного и химически модифицированного лизоцима для сорбции бактериальных эндотоксинов и сам сорбент | 2019 |
|
RU2736150C1 |
| Способ сорбционного удаления целых патогенных бактериальных клеток из раствора с помощью автоклавированного иммобилизованного лизоцима | 2019 |
|
RU2734538C1 |
| Способ ковалентной иммобилизации лизоцима для последующего применения иммобилизованного лизоцима для снижения бактериальной обсемененности биологических жидкостей | 2018 |
|
RU2694883C1 |
| Способ удаления эндотоксинов из биологических жидкостей с помощью ковалентно иммобилизованного лизоцима в качестве лиганда | 2018 |
|
RU2684639C1 |
| СОРБЕНТ ДЛЯ УДАЛЕНИЯ ИММУНОГЛОБУЛИНОВ | 2008 |
|
RU2389022C2 |
| Сорбент для сочетанного удаления из плазмы человека атерогенных липопротеидов и С-реактивного белка | 2019 |
|
RU2700605C1 |
| СОРБЕНТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2203730C1 |
| Сорбционный материал, способ его получения и способ его применения | 2016 |
|
RU2641924C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ НАЛИЧИЯ БАКТЕРИЙ Escherichia coli O157:H7 В БИОЛОГИЧЕСКИХ И ПИЩЕВЫХ ОБРАЗЦАХ НА ОСНОВЕ ИММУНОДЕТЕКЦИИ, СОПРЯЖЕННОЙ С ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИЕЙ | 2014 |
|
RU2569196C1 |
| Способ получения альфа-фетопротеина, иммобилизованного на ПЭТ-микрочастицах | 2018 |
|
RU2731415C2 |
Изобретение относится к технологиям производства сорбентов, применяемых для медицинских целей. Техническим результатом заявленного изобретения стало создание более эффективного гемосовместимого сорбента с улучшенными свойствами и способа его получения. Полученный сорбент характеризуется улучшенными свойствами ковалентно иммобилизованного лизоцима с различной степенью химической модификации бензальдегидом и в зависимости от этого различной степенью бактериолитической активности и сорбционных характеристик. 2 н. и 1 з.п. ф-лы, 1 табл., 1 пр.
1. Способ получения сорбента на основе ковалентно иммобилизованного и химически модифицированного лизоцима для бактериальных эндотоксинов, характеризующийся двумя стадиями:
- первая стадия: модификация лизоцима бензальдегидом, для этого растворы лизоцима в концентрации 2 мг/мл и бензальдегида в концентрации 1,5 мг/мл готовят в 50 мМ буфере NaHCO3-Na2CO3 с рН 8 с молярными соотношениями лизоцим/бензальдегид, равными 1/3, 1/7 или 1/15, далее реакционную смесь инкубируют в течение 3 часов на роторном шейкере при 25°С и скорости 10 об/мин, далее добавляют свежеприготовленный 2% водный раствор NaBH4 к полученному препарату до конечной концентрации смеси 0,1% и инкубируют при 25°С в течение 30 минут при перемешивании с повтором этой процедуры дважды;
далее для отделения лизоцима от низкомолекулярных компонентов проводят хроматографию на колонке с сефадексом G-25, уравновешенной 20 мМ буфером K2HPO4-KOH с рН 8;
далее определяют степень модификации лизоцима, а именно: уменьшение количества свободных аминогрупп лизоцима определяют с использованием тринитробензолсульфоновой кислоты, измерения проводят при 37°С в 0,1 М буфере Н3ВО3-NaOH с рН 9,5;
раствор тринитробензолсульфоновой кислоты добавляют в кювету с белковым раствором до концентрации 0,04%, рост поглощения регистрируют при 420 нм до достижения плато в течение примерно 50 минут;
величину поглощения на плато используют для построения калибровочных кривых, используя данные для немодифицированного лизоцима и ε-аминокапроновой кислоты;
степень модификации лизоцима рассчитывают из значений отношения величины поглощения на плато для растворов модифицированного и нативного лизоцима с равными концентрациями белка;
- вторая стадия: ковалентная иммобилизация химически модифицированного лизоцима, которую осуществляют путем присоединения белка к аминированной матрице;
для аминирования матрица окислена NaIO4;
для чего вначале матрицу промывают, используя воронку Бюхнера со спеченным диском, 20-кратным объемом по отношению к объему матрицы дистиллированной воды, а затем добавляют двукратный объем 2% раствора NaIO4;
далее смесь инкубируют в течение 2 часов на роторном шейкере при 20°С и скорости 5 об/мин;
после инкубации матрицу промывают 20-кратным объемом дистиллированной воды;
далее к активированной матрице добавляют один объем 2 М раствора 1,6-диаминогексана с последующей инкубацией смеси в течение 2 часов на роторном шейкере при 20°С и скорости 5 об/мин;
затем к полученному препарату добавляют двойной объем свежеприготовленного 0,5% водного раствора NaBH4 и инкубируют в течение 30 минут при перемешивании, затем добавляют другую аналогичную порцию свежеприготовленного раствора NaBH4 и смесь инкубируют в течение дополнительных 30 минут;
далее аминированную матрицу промывают 5-кратным объемом 1 М раствора NaCl и 10-кратным объемом 10 мМ буфера KH2PO4-K2HPO4 с рН 7 и 130 мМ NaCl;
далее 0,56 мл 25%-ного раствора глутаральдегида добавляют к 10 мл 50%-ной суспензии аминированной матрицы, содержащей 50% осадка по объему, в 30 мМ буфере NaHCO3-NaOH с рН 10;
эту смесь перемешивают в течение 30 минут на роторном шейкере при 25°С и скорости 5 об/мин;
полученный гель промывают 50 мл 30 мМ буфера NaHCO3-NaOH с рН 10 и добавляют 10 мл 7,5 мг/мл раствора лизоцима в том же буфере;
смесь инкубируют в течение 3 часов на роторном шейкере при 25°С и скорости 5 об/мин;
к полученному препарату добавляют двойной объем свежеприготовленного 0,5%-ного водного раствора NaBH4 и инкубируют в течение 20 минут при перемешивании, затем добавляют другую аналогичную порцию свежеприготовленного раствора NaBH4 и смесь снова инкубируют в течение дополнительных 20 минут;
наконец, полученный сорбент промывают 200 мл дистиллированной воды и затем промывают 150 мл 10 мМ буфера KH2PO4-K2HPO4 с рН 7 и 130 мМ NaCl;
количество иммобилизованного лизоцима определяют по разнице между добавленным количеством и количеством в супернатанте после процедуры иммобилизации;
концентрацию лизоцима определяют спектрофотометрически по оптическому поглощению раствора при 280 нм.
2. Способ по п. 1, характеризующийся тем, что в качестве гемосовместимой полимерной агарозной матрицы для иммобилизации лизоцима используют матрицу марки WorkBeads 200 Sec производства Bio-Works с диаметром гранул 200 мкм.
3. Сорбент, полученный способом по п. 1, характеризующийся свойствами ковалентно иммобилизованного лизоцима с молярными соотношениями лизоцим/бензальдегид в реакционной среде, равными 1/3, 1/7 или 1/15, при этом при соотношении 1/3 выход иммобилизации будет составлять 92±3%, активность клеток M.luteus – 16,2±1,9 10-3 OD/мин, активность клеток E.coli – 11,3±1,8 10-3 OD/мин, емкость эндотоксина E.coli – 598±43 нг/мл сорбента, эффективность удаления эндотоксина E.coli – 80%, емкость эндотоксина P.aerugenosa – 548±42 нг/мл сорбента, эффективность удаления эндотоксина P.aerugenosa – 73%;
при соотношении 1/7 выход иммобилизации будет составлять 93±3%, активность клеток M.luteus – 16,1±1,7 10-3 OD/мин, активность клеток E.coli – 11,2±1,8 10-3 OD/мин, емкость эндотоксина E.coli – 670±48 нг/мл сорбента, эффективность удаления эндотоксина E.coli – 89%, емкость эндотоксина P.aerugenosa – 572±46 нг/мл сорбента, эффективность удаления эндотоксина P.aerugenosa – 76%;
при соотношении 1/15 выход иммобилизации будет составлять 96±3%, активность клеток M.luteus – 160,5±2,0 10-3 OD/мин, активность клеток E.coli – 11,0±2,0 10-3 OD/мин, емкость эндотоксина E.coli – 682±47 нг/мл сорбента, эффективность удаления эндотоксина E.coli – 91%, емкость эндотоксина P.aerugenosa – 587±52 нг/мл сорбента, эффективность удаления эндотоксина P.aerugenosa – 78%.
| МОРОЗОВ А.С | |||
| и др | |||
| Сорбенты для экстракорпорального удаления токсических веществ и молекул с нежелательной биологической активностью (обзор), GENERAL REANIMATOLOGY, 2016, т.12, н.6, стр.82-107 | |||
| МОРОЗОВ А.С | |||
| и др | |||
| Селективный сорбент для удаления из крови бактериальных эндотоксинов, ЖУРНАЛ ФИЗИЧЕСКОЙ ХИМИИ, 2016, т.90, н.12, с.1876-1882 | |||
| VALENTA |
Авторы
Даты
2020-11-12—Публикация
2019-10-29—Подача