Область техники
Изобретение относится к технологиям использования сорбентов, применяемых в том числе для медицинских целей, а именно для экстракорпоральной терапии больных с сепсисом с использованием сорбции биологических жидкостей.
Уровень техники
Использование препаратов иммобилизованного лизоцима является важной задачей, расширяющей спектр медицинского и биотехнологического применения данного фермента.
Бактериальный эндотоксин (БЭ) - это поверхностный липополисахарид бактерий, который накапливается в крови при сепсисе, на который сильно реагирует иммунная система человека. С медицинской точки зрения иногда важнее быстро убрать находящиеся в биожидкости БЭ, чем добиваться полного обезвреживания бактерий, продуцирующих эти БЭ. Проблема удаления БЭ в современной практике частично решается рядом сорбентов с синтетическими лигандами. Есть патенты на эту тему. Выборочно это:
В международной заявке на изобретение WO 2010083545 SORBENT FOR ENDOTOXINS (Опубликовано: 2010-07-29) описывается сорбент для удаления БЭ из биологической жидкости, который содержит нерастворимый в воде пористый носитель и полимиксин (polymixin), который иммобилизуется на носителе, причем упомянутый носитель имеет нейтральную, гидрофобную поверхность и иммобилизированный полимиксин удерживается на поверхности сорбента путем гидрофобного взаимодействия. Сорбент разработан для экстракорпоральной очистки крови, прежде всего, для лечения сепсиса. Данная заявка фактически покрывает все варианты сорбентов с полимиксином, иммобилизированным посредством гидрофобного взаимодействия.
Однако, такой способ иммобилизации не исключает утечку лиганда.
В патенте на изобретение DE 4209988 ENDOTOXIN ADSORBER HAVING HIGH BINDING CAPACITY - COMPRISES POLYETHYLENEIMINE BONDED TO POROUS CARRIER, ESP. POLYSACCHARIDE (Опубликовано: 1993-03-04) заявляются адсорбенты эндотоксинов, содержащие полиэтиленимин, нековалентно или ковалентно связанные с внутренней и/или наружной поверхностью пористого материала носителя. Материал-носитель представляет собой мембрану или гранулу, например, полисахарид, целлюлозу, полисульфон, полиакрилонитрил или полиамид. Такие адсорбенты используются для удаления БЭ из биологических жидкостей.
Однако, в изобретении не показана гемосовместимость сорбента и сам лиганд иной, чем в предлагаемом изобретении.
В патенте RU 2641924 СОРБЦИОННЫЙ МАТЕРИАЛ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ЕГО ПРИМЕНЕНИЯ (Опубликовано: 23.01.2018 Бюл. №3) описан сорбционный материал, содержащий пористый носитель, функциональные группы на поверхности которого ковалентно связаны с лигандом, способным к образованию прочных комплексов с бактериальными эндотоксинами. Пористый носитель представляет собой гранулы размером от 50 до 900 микрон, выполненные из полимера или сополимера. Изобретение обеспечивает получение новых селективных сорбентов для очистки жидких сред от БЭ.
Однако, отличается материал носителя (матрицы), способ иммобилизации и сам лиганд. Кроме того, не показана гемосовместимость сорбента.
Найдена только лишь одна статья Capture of bacterial endotoxins using a supermacroporous monolithic matrix with immobilized polyethyleneimine, lysozyme or polymyxin В. Авторы: Amro Наnоrа, Fatima M. Plieva, Martin  , Igor Yu. Galaev, Bo Mattiasson Publication: Journal of Biotechnology 118 (2005) 421-433 Publisher: Elsevier Date: 10 September 2005. В статье представлены результаты обстоятельного научного исследования удаления (захвата) БЭ (липополисахаридов) с помощью супермакропористых монолитных колонн с непрерывным слоем, так называемых криогелевых колонн, с ковалентно иммобилизованными полиэтиленимином (PEI), полимиксином В (РМВ) и лизоцимом (в том числе с иммобилизацией лизоцима в отдельности). БЭ были количественно сорбированы из смесей с модельным белком, бычьим сывороточным альбумином (БСА) при рН 7,2 практически без потерь белка. При рН 3,6 БЭ были сорбированы непосредственно из неочищенного клеточного лизата Escherichia coli (E.coli).
, Igor Yu. Galaev, Bo Mattiasson Publication: Journal of Biotechnology 118 (2005) 421-433 Publisher: Elsevier Date: 10 September 2005. В статье представлены результаты обстоятельного научного исследования удаления (захвата) БЭ (липополисахаридов) с помощью супермакропористых монолитных колонн с непрерывным слоем, так называемых криогелевых колонн, с ковалентно иммобилизованными полиэтиленимином (PEI), полимиксином В (РМВ) и лизоцимом (в том числе с иммобилизацией лизоцима в отдельности). БЭ были количественно сорбированы из смесей с модельным белком, бычьим сывороточным альбумином (БСА) при рН 7,2 практически без потерь белка. При рН 3,6 БЭ были сорбированы непосредственно из неочищенного клеточного лизата Escherichia coli (E.coli).
Однако, здесь испытания по удалению БЭ проводилась только на модельных растворах с БЭ и нет исследований гемосовместимости сорбента. Также использована другая схема иммобилизации в отличие от схемы в предлагаемом изобретении.
Еще имеется работа, посвященная криогелю поливинилового спирта, в который был нековалентно включен лизоцим на стадии изготовления самого криогеля в процессе циклического многократного замораживания-оттаивания (ИММОБИЛИЗАЦИЯ ЛИЗОЦИМА В КРИОГЕЛЬ ПОЛИВИНИЛОВОГО СПИРТА. Декина С.С., Романовская И.И., Овсепян А.М., Молодая А.Л., Пашкин И.И. // Biotechnol. Acta. 2014. V.7. No 3. Р. 69). Иммобилизованный таким образом лизоцим характеризуется расширенным рН-профилем активности, существенно отличным от такового для растворимого фермента. Расширение рН-профиля активности является положительным моментом в плане дополнительного расширения спектра условий применимости лизоцима.
Однако, у лизоцима, нековалентно иммобилизованного в криогеле поливинилового спирта, есть ограничения по сферам применения, особенно в медицине, так как в этом варианте иммобилизации присутствует фактор утечки фермента из геля, и не была показана возможность удаления БЭ из биожидкости.
Еще один вариант иммобилизации лизоцима - это включение белка в нанопоры наночастиц силикагеля (Као K.-Ch., Lin T.-S., Мои Ch.-Y. // J. Phys. Chem. C. 2014. V. 118. P. 6734). Было показано, что при такой иммобилизации несколько возрастала активность и заметно улучшалась стабильность активности лизоцима.
Однако следует отметить, что данный вариант иммобилизации также является нековалентным присоединением и соответственно предполагает утечку белка с частиц, и также не была показана возможность удаления БЭ из биологической жидкости.
Существует способ приготовления лизоцима, ковалентно иммобилизованного на полистироле (Wu Y., Daeschel М.А. // J. Food Sci. 2007. V. 72. Nr.9 P.M369). В этом методе применяются подходы из твердофазного синтеза пептидов. Используют хлорметил-полистирол, на который прививают s-аминокапроновую кислоту с третбутилоксикарбонильной защитой, затем переводят аминогруппу в бромацетил производное с последующим присоединением единственного гистидина лизоцима (His-15). Полученный иммобилизованный лизоцим обладает хорошей стабильностью. Из плюсов способа следует отметить точную направленную иммобилизацию и отсутствие побочных продуктов с неустановленной структурой.
Из минусов способа можно отметить высокую стоимость исходных материалов и сложность схемы синтеза, что однозначно станет препятствием для широкого практического применения. Также не показана возможность удаления БЭ из биологической жидкости.
Также в ходе патентного поиска были проанализированы несколько патентов про способы иммобилизации лизоцима в матрицах сорбентов.
Патент RU 2569510 СОРБЕНТ, ПРЕДСТАВЛЯЮЩИЙ СОБОЙ НАНОАЛМАЗНЫЙ МАТЕРИАЛ (ВАРИАНТЫ), СПОСОБЫ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ (Опубликовано: 27.11.2015 Бюл. №33). Сорбенты из наноалмазсодержащих материалов получают в результате детонационного синтеза и модификации. Поверхность детонационных наноалмазов подвергают целенаправленному изменению путем модифицирования химически активными жидкими и газообразными веществами при повышенных температурах. В результате модифицирования состав поверхностных радикалов, содержащих атомы неуглеродной природы (О, Н, N, S), пополняется дополнительными атомами, что приводит к появлению дополнительных аналогичных или новых функциональных групп, способных образовывать связи с функциональными группами биологических объектов. Изобретение обеспечивает возможность удаления широкого спектра белковых материалов с помощью полученных сорбентов из различных биологических жидкостей.
Однако, наноалмазы в медицинских экстракорпоральных процедурах не используются, лизоцим привязан нековалентно и поэтому не исключена утечка в биожидкость.
Патент Китая CN 106589202 (A) LYSOZYME IMMOBILIZED CARRIER AND PREPARATION METHOD THEREOF (Опубликовано: 2017-04-26). Изобретение относится к матрице (носителю) иммобилизованного лизоцима и способу получения, относящемуся к области иммобилизации фермента. В изобретении применяется экологически безопасный технологический процесс суспензионной полимеризации с использованием метилакрилата в качестве основного сырья, дивинилбензола в качестве сшивающего агента, регулирующего структуру смолы путем добавления третьего мономерного стирола для увеличения механической прочности носителя, макропористый носитель лизоцима был приготовлен в присутствии реагента, а гидролиз слабокислой макропористой катионообменной смолы был получен с получением ферментного носителя. В конце отвержденный лизоцим получали взаимодействием смолы, глутаральдегида и лизоцима.
Однако, для данного материала не была показана гемосовместимость и не была показана возможность удаления БЭ из биологической жидкости.
Таким образом в ходе тщательных патентно-информационных поисков не удалось найти ни одной публикации про удаление эндотоксинов из биологических жидкостей с помощью гемосовместимого сорбента с иммобилизованным лизоцимом, что позволяет сделать предварительный вывод, что, вероятно, этого никто еще не делал практически до сих пор.
Раскрытие изобретения
Задачей предлагаемого изобретения явилась практическая реализация идеи применения иммобилизованного лизоцима в качестве лиганда в матрице гемосовместимого сорбента для удаления БЭ из биологических жидкостей с практическим отсутствием риска утечки лизоцима (невнесение никаких дополнительных веществ) в сорбируемую биологическую жидкость (водный раствор, в том числе физраствор, плазму крови и цельную кровь (с учетом гемосовместимости сорбента)). Возможна адаптация и к другим биожидкостям.
Задача решается предлагаемым способом удаления БЭ из биологических жидкостей с помощью химически (ковалентно) иммобилизованного в аминированной агарозной матрице лизоцима в качестве лиганда. Способ проверен на удалении энтеробактериальных эндотоксинов (кишечной палочки Escherichia coli, сорбция 65±17 нг на мл сорбента) и псевдомонадных эндотоксинов (синегнойной палочки Pseudomonas aeruginosa, сорбция 190±25 нг на мл сорбента). Кишечная палочка и синегнойная палочка относятся к тем бактериям, эндотоксины которых очень серьезно ухудшают прогноз у больных с сепсисом.
Иммобилизацию лизоцима на агарозной аминированной матрице проводят с получением молекулярного спейсера -NH-C6H12-NH-C5H10-NH-, присоединяющего молекулу лизоцима.
Перечень рисунков
Рис. 1 - Схема приготовления аминированной матрицы и затем ковалентная иммобилизация (присоединение к матрице) лизоцима через молекулярный спейсер.
Осуществление изобретения
На рис. 1 представлена схема приготовления аминированной матрицы и затем ковалентная иммобилизация (присоединение к матрице) лизоцима через молекулярный спейсер. Большую роль в повышении эффективности действия иммобилизованного лизоцима играет применение спейсера (для устранения стерических препятствий присоединению макромолекулярных лигандов (лизоцима) между ними и матрицей бывает необходимо ввести молекулу спейсера). Наиболее перспективный вариант иммобилизованного лизоцима получен ковалентным присоединением фермента к матрице через спейсер -NH-C6H12-NH-C5H10-NH-.
Для аминирования агарозной матрицы ее промывали 10-тью объемами дистиллированной воды на стеклянном фильтре, присоединенном к водоструйному насосу с помощью колбы Бунзена. К навеске геля добавляли двукратное количество 2% водного раствора периодата натрия и инкубировали 2 часа на качалке при 20°С. После инкубации матрицу промывали 20-кратным объемом дистиллированной воды. К матрице, активированной периодатом натрия, добавляли однократный объем 2М раствора 1,6-диаминогексана и инкубировали 2 часа на качалке при 25°С. Затем добавляли 2-кратный объем свежеприготовленного 0,5% (по весу) раствора натрия боргидрида натрия и инкубировали 30 минут при перемешивании. Обработку боргидридом повторяли дважды. Далее промывали гель 5-кратным объемом 1 М раствора NaCl и 20-кратным объемом дистиллированной воды. Затем к 10 мл 50% суспензии аминированной матрицы в буферной смеси 30 мМ NaHCO3-NaOH, рН=10,0 добавляли 0,56 мл 25% раствора глутарового альдегида и перемешивали в течение 30 мин на качалке при 25°С. Далее гель промывали 50 мл буферного раствора 30 мМ NaHCO3-NaOH, рН=10,0 и смешивали с 10 мл раствора лизоцима в том же буферном растворе (концентрация лизоцима 7,5 мг/мл). Смесь инкубировали 1 час на качалке при 25°С. Полученный сорбент обрабатывали 10 мл 0,5% (по весу) водного раствора боргидрида натрия дважды. Время каждой инкубации с раствором боргидрида натрия составляло 20 мин. После блокировки сорбент промывали 200 мл дистиллированной воды. Выход на стадии иммобилизации лизоцима для всех образцов составил не менее 98%. В качестве матрицы сорбента использовали промышленно выпускаемые макропористые агарозные матрицы марок Sepharose (Сефароза) (производитель GE Healthcare, США) и WorkBeads (WB) 200 Sec (производитель Bio-Works, Швеция) (прим.: в настоящий момент максимальный опыт использования в клинической медицинской практике накоплен для сорбентов на основе агарозных матриц).
Для доказательства, что лиганд иммобилизованного лизоцима не отваливается от матрицы (и потом не утекает из сорбента) получали смывы с гелей препаратов иммобилизованного лизоцима. В колонку высотой 5 см и сечением 1 см2 помещали 2 мл 50% суспензии сорбента. Далее исследовали связывание иммобилизованным лизоцимом бактериальных эндотоксинов (липополисахаридов) при добавлении полученного на выходе из колонки смыва. Затем собирали вытекший из колонки раствор и дополнительно промывали колонку буферной смесью. Собирали смыв с колонку до достижения суммарного объема жидкости 3 мл. В случае наличия утечки лиганда, смывы будут обладать бактериолитической активностью. Бактериолитическая активность регистрируется уже при концентрации лизоцима 0,05 мкг в мл и более. Так как в смывах активности нами не обнаружено, то мы можем гарантировать, что концентрация лизоцима в смывах менее 0,05 мкг в мл. Весь смыв может содержать не более 3×0,05 мкг = 0,15 мкг. Объем сорбента в этом испытании был 1 мл, иммобилизованного лизоцима было 15 мг (15000 мкг) на мл сорбента. Таким образом в смыве не может быть лизоцима в количестве более 0,15/15000=0,00001 (одной стотысячной части) от иммобилизованного количества (или 0,001%).
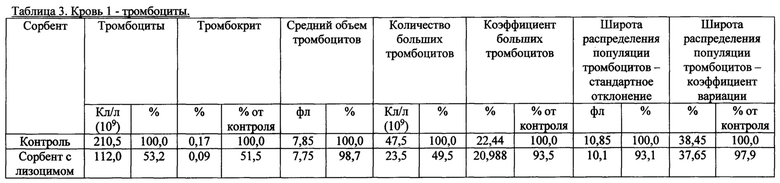
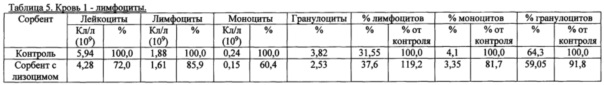
Также были получены экспериментальные результаты проверки гемосовместимости (с кровью человека) синтезированного сорбента с иммобилизованным лизоцимом. По методике проверки кровь доноров брали в пробирки 50 мл с предварительно добавленным до конечной концентрации 2,5 Ед/мл гепарином. Колонку делали из носика 10 мл и фильтра 90 (133) мкм. Вносили 200 мкл сорбента, промывали 2 мл физиологического раствора, снизу надевали силиконовый шланг. Предобработку сорбента гепарином проводили после промывки физиологическим раствором из расчета 100 Ед гепарина на 1 мл сорбента, инкубация сорбента с 2-кратным объемом физ. раствора с гепарином, RT, перемешивание, 10 мин. Хроматографию сорбента с 4 мл крови проводили при комнатной температуре, самотеком, время контакта от 20 до 30 минут. Кровь после хроматографии собирали в пробирку 15 мл. В качестве отрицательного контроля использовалась колонка без сорбента. В кровь после колонки добавляли ЭДТА до конечной концентрации 10 мМ, аликвотили по 1 мл и измеряли клетки в геманализаторе Elite3 Erba Mannheim (2-3 параллели). Сравнительные результаты представлены в таблицах 1-8 по эритроцитам, тромбоцитам, лимфоцитам, гемоглобину и гематокриту.
Общим выводом анализа результатов в таблицах является то, что синтезированный по предлагаемому способу сорбент с иммобилизованным лизоцимом совместим с цельной кровью человека (гемосовместим).
Результаты проверки гемосовместимости полученного сорбента с ковалентно иммобилизованным лизоцимом
1. Эритроциты
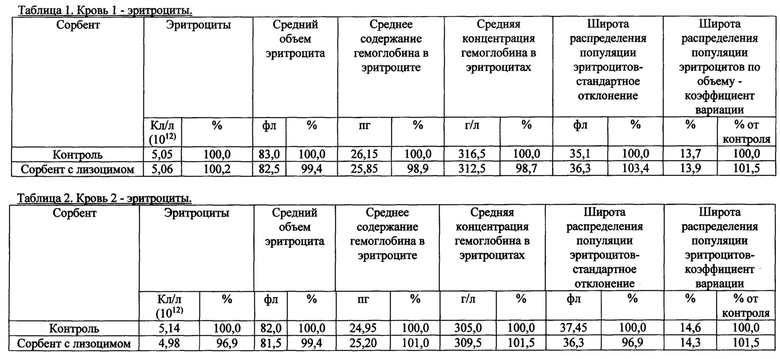
2. Тромбоциты.
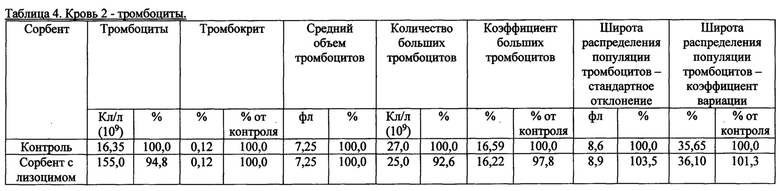
3. Лимфоциты

4. Гемоглобин, гематокрит.


Примеры проверки осуществления способа - с энтеробактериальными эндотоксинами и псевдомонадными эндотоксинами.
В таблице 9 представлены данные по связыванию иммобилизованным лизоцимом бактериальных токсинов (липополисахаридов) микроорганизма Escherichia coli (кишечная палочка) семейства Enterobacteriaceae и микроорганизма Pseudomonas aeruginosa (синегнойная палочка) семейства Pseudomonadaceae. Концентрацию эндотоксина определяли по его активности при помощи набора для определения активности эндотоксина "Hycult". В качестве стандарта энтеробактериального эндотоксина использовали препарат Escherichia coli 055-В5 ("Endosafe", США), и стандарт псевдомонадного эндотоксина Pseudomonas_aeruginosa «Пирогенал» 100 мкг/мл ("Медгамал", Россия).

Прим.: 1 нанограмм (нг) на мл геля = 5 ЕЭ (единиц эндотоксина)
Из данных таблицы 9 видно, что вышеописанный иммобилизованный лизоцим способен достаточно эффективно связывать (удалять) эндотоксины кишечной и синегнойной палочек. Например, при тяжелом сепсисе у пациента может быть порядка 100 или более ЕЭ на мл плазмы крови. Соответственно, например, колонка с сорбентом объемом 250 мл может удалять до 81250 ЕЭ энтеробактериального эндотоксина или 237500 ЕЭ псевдомонадного эндотоксина, что соответствует содержанию эндотоксинов: в 0,812 литра (для энтеробактериального эндотоксина) или 2,375 литра (для псевдомонадного эндотоксина) такого пациента, у которого исходно 100 ЕЭ на мл плазмы его крови. При 2-3 литрах плазмы объем крови пациента составляет до 4-6 литров.
Таким образом, иммобилизованный лизоцим в сорбенте способен существенно снижать уровень эндотоксинов при его применении в сорбционных колонках.
Представленные экспериментальные данные подтверждают практическое решение задач изобретения. Результаты экспериментов показали достаточно высокую эффективность и доказали возможность применения вышеописанного иммобилизованного лизоцима в качестве лиганда в матрице сорбента для удаления эндотоксинов из биологических жидкостей с отсутствием риска утечки лизоцима в обрабатываемую (фильтруемую) биологическую жидкость и при этом подтверждена гемосовместимость сорбента.
Предлагаемый способ разработан в рамках выполнения работы по Соглашению №14.574.21.0181 между Министерством образования и науки Российской Федерации (Госзаказчик) и МГТУ им. Н.Э. Баумана.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ ковалентной иммобилизации лизоцима для последующего применения иммобилизованного лизоцима для снижения бактериальной обсемененности биологических жидкостей | 2018 |
|
RU2694883C1 |
| Способ N2 получения сорбента на основе ковалентно иммобилизованного и химически модифицированного лизоцима для сорбции бактериальных эндотоксинов и сам сорбент | 2019 |
|
RU2736150C1 |
| Способ N1 получения сорбента на основе ковалентного иммобилизованного и химически модифицированного лизоцима для сорбции бактериальных эндотоксинов и сам сорбент | 2019 |
|
RU2736149C1 |
| Способ сорбционного удаления целых патогенных бактериальных клеток из раствора с помощью автоклавированного иммобилизованного лизоцима | 2019 |
|
RU2734538C1 |
| СОРБЕНТ ДЛЯ УДАЛЕНИЯ ИММУНОГЛОБУЛИНОВ | 2008 |
|
RU2389022C2 |
| Сорбционный материал, способ его получения и способ его применения | 2016 |
|
RU2641924C1 |
| Сорбент для сочетанного удаления из плазмы человека атерогенных липопротеидов и С-реактивного белка | 2019 |
|
RU2700605C1 |
| Способ определения бактериального эндотоксина в биологических жидкостях | 2017 |
|
RU2691413C1 |
| СПОСОБ ИДЕНТИФИКАЦИИ И ЭКСТРАКЦИИ ЭНДОТОКСИНА | 2003 |
|
RU2344425C2 |
| Способ изготовления матричного биосенсора на основе восстановленного оксида графена и матричный биосенсор на полимерной подложке | 2019 |
|
RU2745663C1 |

Изобретение относится к технологиям использования сорбентов, применяемых в том числе для медицинских целей, а именно для экстракорпоральной терапии больных с сепсисом с использованием сорбции биологических жидкостей. Задача изобретения: практическая реализация идеи применения иммобилизованного лизоцима в качестве лиганда в матрице гемосовместимого сорбента для удаления эндотоксинов из биологических жидкостей с отсутствием риска утечки лизоцима в сорбируемую биологическую жидкость (водный раствор, в том числе физраствор, плазму крови и цельную кровь (с учетом гемосовместимости сорбента)). Задача решается предлагаемым способом удаления (сорбции) эндотоксинов из биологических жидкостей с помощью химически (ковалентно) иммобилизованного в аминированной агарозной матрице лизоцима в качестве лиганда. Иммобилизацию лизоцима на агарозной аминированной матрице проводят с получением молекулярного спейсера -NH-C6H12-NH-C5H10-NH-, присоединяющего молекулу лизоцима. 1 з.п. ф-лы, 1 ил., 9 табл.
1. Способ удаления эндотоксинов из биологических жидкостей с помощью ковалентно иммобилизованного лизоцима в качестве лиганда гемосовместимого сорбента, характеризующийся связыванием эндотоксинов кишечной и синегнойной палочек лизоцимом, иммобилизованным на агарозной аминированной матрице с молекулярным спейсером -NH-C6H12-NH-C5H10-NH-, присоединяющим молекулу лизоцима; в качестве матрицы гемосовместимого сорбента с отсутствием риска утечки иммобилизованного лизоцима используют промышленно выпускаемые крупнопористые агарозные матрицы.
2. Способ по п. 1, характеризующийся сорбцией энтеробактериальных эндотоксинов кишечной палочки Escherichia coli 65±17 нг на мл сорбента и сорбцией псевдомонадных эндотоксинов синегнойной палочки Pseudomonas aeruginosa 190±25 нг на мл сорбента.
| Левашов П.А | |||
| и др | |||
| "СИНТЕЗ АФФИННЫХ СОРБЕНТОВ С ИММОБИЛИЗОВАННЫМИ СИНТЕТИЧЕСКИМИ ЛИГАНДАМИ ДЛЯ ПРОЦЕДУР ТЕРАПЕВТИЧЕСКОГО АФЕРЕЗА", Биомедицинская химия, т.56(6), 2010, 739-746 | |||
| Dekina S.S et al."MUCOADHESIVE GEL WITH IMMOBILIZED LYSOZYME: PREPARATION AND PROPERTIES", Biotechnologia Acta, 2015, Vol.8, No | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| CN 106589202 A, 26.04.2017 | |||
| Способ выделения рекомбинантного интерлейкина-2 из бактериальных клеток | 1988 |
|
SU1622398A1 |
Авторы
Даты
2019-04-11—Публикация
2018-06-07—Подача