Область техники
Изобретение относится к технологиям производства и использования сорбентов, применяемых в том числе для медицинских целей, а именно для экстракорпоральной терапии больных с сепсисом с использованием сорбции биологических жидкостей.
Уровень техники
Получение и использование препаратов иммобилизованного лизоцима является важной задачей, расширяющей спектр медицинского и биотехнологического применения данного самого коммерчески распространенного фермента.
Один из существующих вариантов иммобилизации лизоцима - это нековалентное включение фермента в криогель поливинилового спирта на стадии изготовления геля в процессе циклического многократного замораживания-оттаивания (ИММОБИЛИЗАЦИЯ ЛИЗОЦИМА В КРИОГЕЛЬ ПОЛИВИНИЛОВОГО СПИРТА. Декина С.С., Романовская И.И., Овсепян A.M., Молодая А.Л., Пашкин И.И. // Biotechnol. Acta. 2014. V.7. No 3. Р.69) В данном варианте лизоцим сохраняет бактериолитическую активность и проявляет хорошую стабильность в работе и хранении. Кроме того иммобилизованный таким образом лизоцим характеризуется расширенным рН-профилем активности, существенно отличным от такового для растворимого фермента. Расширение рН-профиля активности является положительным моментом в плане дополнительного расширения спектра условий применимости лизоцима. Активность данного варианта иммобилизованного лизоцима была проверена на кишечной палочке (Escherichia coli), золотистом стафилококке (Staphylococcus aureus) синегнойной палочке (Pseudomonas aeruginosa).
Однако, у лизоцима, нековалентно иммобилизованного в криогеле поливинилового спирта, есть ограничения по сферам применения, особенно в медицине, так как в этом варианте иммобилизации присутствует фактор утечки фермента из геля.
Ещё один вариант иммобилизации лизоцима - это включение белка в нанопоры наночастиц силикагеля (Kao K.-Ch., Lin T.-S., Мои Ch.-Y. // J. Phys. Chem. C. 2014. V. 118. P. 6734). Было показано, что при такой иммобилизации несколько возрастала активность и заметно улучшалась стабильность активности лизоцима.
Однако следует отметить, что данный вариант иммобилизации также является нековалентным присоединением и соответственно предполагает утечку белка с частиц. Кроме того, использование данного материала для лизиса целых клеток микроорганизмов может оказаться весьма проблематично ввиду стерической недоступности фермента в наноразмерных порах.
Лизоцим можно иммобилизовывать как нековалентно так и ковалентно на хитине и хитозане (Jiang S.S., Qin Ya., Yang J., Li M., Xiong L., Sun Q.J. // Food Chem. 2017. V.221. P. 1507; Lian Z.X., Ma Zh.S., Wei J., Liu H. // Proc. Biochem. 2012. V.47. P. 201; патент Китая CN106519271 (A) METHOD FOR PREPARING ANTIBACTERIAL MEMBRANE BY N-SUCCINYL-CHITOSAN IMMOBILIZED LYSOZYME (Опубликовано: 2017-03-22)). Показано, что активность нековалентно иммобилизованного на хитине лизоцима в полтора раза выше, чем у нативного лизоцима, если сравнивать их действие на клетки Micrococcus luteus. Нековалентно и ковалентно иммобилизованный на хитозане лизоцим демонстрирует стабильную активность в отношении Escherichia coli и Staphylococcus aureus.
В качестве недостатка препаратов на основе хитина и хитозана следует отметить то, что природное сырьё хитин и хитозан может сильно различаться в зависимости от способов получения и источников, что может негативно сказаться на практическом применении данных материалов в медицине.
Существует способ приготовления лизоцима, ковалентно иммобилизованного на полистироле (Wu Y., Daeschel М.А. // J. Food Sci. 2007. V.72. Nr.9 P.M369). В этом методе применяются подходы из твердофазного синтеза пептидов. Используют хлорметил-полистирол, на который прививают ε-аминокапроновую кислоту с третбутилоксикарбонильной защитой, затем переводят аминогруппу в бромацетил производное с последующим присоединением единственного гистидина лизоцима (His-15). Полученный иммобилизованный лизоцим обладает хорошей стабильностью, проявляя около 15% активности от исходного растворимого лизоцима при действии на клетки Micrococcus luteus. Сниженная активность вероятно является следствием стерической ограниченной доступности лизоцима для клеток. Из плюсов способа следует отметить точную направленную иммобилизацию и отсутствие побочных продуктов с неустановленной структурой.
Из минусов способа можно отметить высокую стоимость исходных материалов и сложность схемы синтеза, что однозначно станет препятствием для широкого практического применения.
Также в ходе патентного поиска были найдены несколько патентов про способы иммобилизации лизоцима.
Патент RU2569510 СОРБЕНТ, ПРЕДСТАВЛЯЮЩИЙ СОБОЙ НАНОАЛМАЗНЫЙ МАТЕРИАЛ (ВАРИАНТЫ), СПОСОБЫ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ (Опубликовано: 27.11.2015 Бюл. № 33). Сорбенты на основе наноалмазов могут быть использованы для иммобилизации или удаления вирусов, специфических антител, иммуносорбции, в диагностических целях, для дезактивации и удаления вирусов из внешней среды. Сорбенты из наноалмазсодержащих материалов получают в результате детонационного синтеза и модификации. Поверхность детонационных наноалмазов подвергают целенаправленному изменению путем модифицирования химически активными жидкими и газообразными веществами при повышенных температурах. В результате модифицирования состав поверхностных радикалов, содержащих атомы неуглеродной природы (О, Н, N, S), пополняется дополнительными атомами, что приводит к появлению дополнительных аналогичных или новых функциональных групп, способных образовывать связи с функциональными группами биологических объектов. Изобретение обеспечивает возможность удаления широкого спектра белковых материалов с помощью полученных сорбентов из различных биологических жидкостей.
Однако, наноалмазы в медицинских экстракорпоральных процедурах не используются, лизоцим привязан нековалентно и поэтому не исключена утечка.
Патент Китая CN106589202 (A) LYSOZYME IMMOBILIZED CARRIER AND PREPARATION METHOD THEREOF (Опубликовано: 2017-04-26). Изобретение относится к матрице (носителю) иммобилизованного лизоцима и способу получения, относящемуся к области иммобилизации фермента. В изобретении применяется экологически безопасный технологический процесс суспензионной полимеризации с использованием метилакрилата в качестве основного сырья, дивинилбензола в качестве сшивающего агента, регулирующего структуру смолы путем добавления третьего мономерного стирола для увеличения механической прочности носителя, макропористый носитель лизоцима был приготовлен в присутствии реагента, а гидролиз слабокислой макропористой катионообменной смолы был получен с получением ферментного носителя. В конце отвержденный лизоцим получали взаимодействием смолы, глутаральдегида и лизоцима. Активность иммобилизованного лизоцима составляла от 3000 до 5000 мкг / г.
Однако, для данного материала не была показана гемосовместимость.
Таким образом иммобилизованный лизоцим в составе сорбентов может быть получен различными способами и способен проявлять эффективность действия в составе самых разных материалов. Однако, для медицинских целей, а именно для методов экстракорпоральной терапии, следует в первую очередь рассматривать способы ковалентной иммобилизации, так как они минимизируют риск утечки лиганда. При выборе матрицы следует ориентироваться на варианты, совместимые с плазмой и цельной кровью. При выборе способа получения практический приоритет имеют более простые схемы синтеза без использования дорогостоящих или токсичных реагентов.
Также актуальна задача сохранения антибактериальной активности лизоцима при его иммобилизации в матрице сорбента. По этой задаче также найден ряд публикаций патентов, а именно:
Патент RU2476205 КОМПОЗИЦИЯ С ПРОТИВОИНФЕКЦИОННОЙ АКТИВНОСТЬЮ (Опубликовано: 27.02.2013 Бюл. № 6). Изобретение относится к области медицины и фармацевтической промышленности и представляет собой композицию с противоинфекционной активностью, представляющую собой сбалансированный комплекс, включающий пробиотический агент, адсорбент и вспомогательную добавку. В качестве адсорбента - цеолит, в том числе с лизоцимом. Изобретение обеспечивает высокую эффективность и универсальность в отношении опасных инфекций бактериальной и вирусной этиологии, является безопасным и стабильным при хранении.
Однако, для экстракорпоральной терапии людей лизоцим, сорбированный на цеолите (с возможностью утечки белка), - это непригодная-система.
Патент Китая CN106519271 (A) METHOD FOR PREPARING ANTIBACTERIAL MEMBRANE BY N-SUCCINYL-CHITOSAN IMMOBILIZED LYSOZYME (Опубликовано: 2017-03-22). Изобретение раскрывает способ получения антибактериальной мембраны путем иммобилизации N-сукцинил-хитозан (NSC) с лизоцимом, в частности, для разработки естественной бактериостатической мембраны с сильной водорастворимостью. NSC получали путем сукцинилирования хитозана, карбоксильную группу NSC активировали, затем ковалентно связывали с лизоцимом и, наконец, антибактериальную мембрану готовили методом сквозной перегонки. Способ прост и удобен в работе, а подготовленная мембрана обладает сильной антибактериальной активностью против бактерий Staphylococcus aureus и Listeria.
Однако, свойства природного полимер хитозана могут сильно варьироваться и плохо поддаются стандартизации, что может послужить проблемой для медицинского использования
Общим недостатком всех вышеуказанных способов является отсутствие показанной гемо-совместимости сорбента с ковалентно иммобилизованным лизоцимом.
Раскрытие изобретения
Задачей изобретения было расширение ассортимента способов эффективного получения и антибактериального применения в составе сорбента ковалентно иммобилизованного лизоцима с отсутствием риска утечки лизоцима (невнесение никаких дополнительных веществ) в сорбируемую биологическую жидкость (водный раствор, в том числе физраствор, а также плазма крови и цельная кровь (с учетом гемосовместимости сорбента)). Возможна адаптация способа и к другим биологическим жидкостям.
Задача решается предлагаемым способом ковалентной иммобилизации лизоцима на аминированную агарозную матрицу, а именно: иммобилизация лизоцима на аминированную агарозную матрицу с получением молекулярного спейсера -NH-C6H12-NH-C5H10-NH-, присоединяющего молекулу лизоцима.
Для аминирования агарозной матрицы ее промывали 10-тью объемами дистиллированной воды на стеклянном фильтре, присоединённом к водоструйному насосу с помощью колбы Бунзена. К навеске геля добавляли двукратное количество 2% водного раствора периодата натрия и инкубировали 2 часа на качалке при 20°С. После инкубации матрицу промывали 20-кратным объемом дистиллированной воды. К матрице, активированной периодатом натрия, добавляли однократный объем 2М раствора 1,6-диаминогексана и инкубировали 2 часа на качалке при 25°С. Затем добавляли 2-кратный объем свежеприготовленного 0,5% (по весу) раствора натрия боргидрида натрия и инкубировали 30 минут при перемешивании. Обработку боргидридом повторяли дважды. Далее промывали гель 5-кратным объемом 1 М раствора NaCl и 20-кратным объемом дистиллированной воды.
Затем к 10 мл 50% суспензии аминированной матрицы в буферной смеси 30 мМ NaHCO3-NaOH, рН=10,0 добавляли 0,56 мл 25% раствора глутарового альдегида и перемешивали в течение 30 мин на качалке при 25°С. Далее гель промывали 50 мл буферного раствора 30 мМ NaHCO3-NaOH, рН=10,0 и смешивали с 10 мл раствора лизоцима в том же буферном растворе (концентрация лизоцима 7,5 мг/мл). Смесь инкубировали 1 час на качалке при 25°С. Полученный сорбент обрабатывали 10 мл 0,5% (по весу) водного раствора боргидрида натрия дважды. Время каждой инкубации с раствором боргидрида натрия составляло 20 мин. После блокировки сорбент промывали 200 мл дистиллированной воды. Выход на стадии иммобилизации лизоцима для всех образцов составил не менее 98%.
В качестве матрицы сорбента использовали промышленно выпускаемые макропористые агарозные матрицы марок Sepharose (Сефароза) (производитель GE Healthcare, США) и WorkBeads (WB) 200 Sec (производитель Bio-Works, Швеция) (прим.: в настоящий момент максимальный опыт использования в клинической медицинской практике накоплен для сорбентов на основе агарозных матриц).
В плане проверок антибактериального использования иммобилизованный лизоцим в составе полученного сорбента с отсутствием риска утечки лизоцима (невнесения никаких дополнительных веществ в обрабатываемую (фильтруемую) биологическую жидкость) применяют для снижения бактериальной обсемененности биологических жидкостей посредством лизиса бактериальных клеток с наблюдением результатов лизиса двумя путями: статически со слежением падения оптической плотности или динамически в протоке на сорбционной колонке.
Перечень рисунков
Рис. 1 - Схема приготовления аминированной матрицы и затем ковалентная иммобилизация (присоединение к матрице) лизоцима через молекулярный спейсер.
Рис. 2 - кинетические кривые лизиса клеток Escherichia coli (E.coli) для различных количеств геля с иммобилизованным лизоцимом (изменение оптического поглощения во времени при инкубации E.coli с различным количеством препарата иммобилизованного лизоцима).
Рис. 3 - зависимость скорости лизиса Escherichia coli от количества сорбента (количества препарата иммобилизованного лизоцима).
Рис. 4 - калибровочная кривая для растворимого лизоцима (зависимость скорости лизиса Escherichia coli от концентрации свободного лизоцима).
Осуществление изобретения
На рис. 1 представлена схема приготовления аминированной матрицы и затем ковалентная иммобилизация (присоединение к матрице) лизоцима через спейсер. Большую роль в повышении эффективности действия иммобилизованного лизоцима играет применение молекулярного спейсера (для устранения стерических препятствий присоединению макромолекулярных лигандов (лизоцима) между ними и матрицей бывает необходимо ввести молекулу спейсера). Наиболее перспективный вариант иммобилизованного лизоцима получен ковалентным присоединением фермента к матрице через связь спейсер -NH-C6H12-NH-C5H10-NH-. Иммобилизованный лизоцим такого типа обладает бактериолитической активностью как по отношению грамотрицательных, так и по отношению к грамположительным бактериям. Выбранный вариант иммобилизованного лизоцима способен лизировать клетки Escherichia coli в более расширенном диапазоне значений рН по сравнению с растворимой формой фермента. При этом препарат стабилен в хранении.
Сорбенты, полученные на матрице, активированной периодатом натрия без использования молекулярного спейсера, независимо от типа матрицы имеют существенно сниженную активность в отношении грамположительных бактерий Micrococcus luteus. При введении молекулярного спейсера путем введения фрагмента -NH-C6H12-NH- и последующей конденсации с глутаровым альдегидом с получением соединяющей молекулярной структуры -NH-C6H12-NH-C5H10-NH-, у лизоцима заметно повышается способность к лизису как грамположительных бактерий так и грамотрицательных бактерий. Наличие более высокой активности по отношению к грамотрицательным бактериям у лизоцима, иммобилизованного с применением молекулярного спейсера, является очень важным моментом, так как при сепсисе часто ключевую роль играют грамотрицательные бактерии.
Пример способа получения сорбента.
Одна из наиболее удобных матриц - это вариант сшитой агарозы, для которого изначально коммерчески доступны гемосовместимые матрицы, для которых на стадии производства можно варьировать размеры и форму гранул, размеры их внутренних пор. Примером подобной потенциально гемосовместимой агарозной матрицы может служить материал WorkBeads компании Bio-Works (Швеция) или его ближайшие аналоги. Препарат самого лизоцима был промышленного производства компании Sigma (США).
Для получения сорбента на основе агарозной матрицы с иммобилизованным лизоцимом предлагаемым способом вначале для аминирования агарозной матрицы ее промывали 10-тью объемами дистиллированной воды на стеклянном фильтре, присоединённом к водоструйному насосу с помощью колбы Бунзена. К навеске геля добавляли двукратное количество 2% водного раствора периодата натрия и инкубировали 2 часа на качалке при 20°С. После инкубации матрицу промывали 20-кратным объемом дистиллированной воды. К матрице, активированной периодатом натрия, добавляли однократный объем 2М раствора 1,6-диаминогексана и инкубировали 2 часа на качалке при 25°С.
Затем добавляли 2-кратный объем свежеприготовленного 0,5% (по весу) раствора натрия боргидрида натрия и инкубировали 30 минут при перемешивании. Обработку боргидридом повторяли дважды. Далее промывали гель 5-кратным объемом 1 М раствора NaCl и 20-кратным объемом дистиллированной воды. Затем к 10 мл 50% суспензии аминированной матрицы в буферной смеси 30 мМ NaHCO3-NaOH, рН=10,0 добавляли 0,56 мл 25% раствора глутарового альдегида и перемешивали в течение 30 мин на качалке при 25°С. Затем гель промывали 50 мл буферного раствора 30 мМ NaHCO3-NaOH, рН=10,0 и смешивали с 10 мл раствора лизоцима в том же буферном растворе (концентрация лизоцима 7,5 мг/мл). Смесь инкубировали 1 час на качалке при 25°С. Полученный сорбент обрабатывали 10 мл 0,5% (по весу) водного раствора боргидрида натрия дважды. Время каждой инкубации с раствором боргидрида натрия составляло 20 мин. После блокировки сорбент промывали 200 мл дистиллированной воды. Выход на стадии иммобилизации лизоцима для всех образцов составил не менее 98%.
Для доказательства, что лиганд иммобилизованного лизоцима не отваливается от матрицы (и потом не утекает из сорбента в биожидкость) получали смывы с гелей препаратов иммобилизованного лизоцима. В колонку высотой 5 см и сечением 1 см2 помещали 2 мл 50% суспензии сорбента. Далее исследовали лизис бактериальных клеток при добавлении полученного на выходе из колонки смыва. И далее собирали вытекший из колонки раствор и дополнительно промывали колонку буферной смесью. Собирали смыв с колонку до достижения суммарного объема жидкости 3 мл. В случае наличия утечки лиганда, смывы будут обладать бактериолитической активностью. Бактериолитическая активность регистрируется уже при концентрации лизоцима 0,05 мкг в мл и более. Так как в смывах активности не обнаружено, то можно гарантировать, что концентрация лизоцима в смывах менее 0,05 мкг в мл. Весь смыв может содержать не более 3×0,05 мкг=0,15 мкг. Объем сорбента в этом испытании был 1 мл, иммобилизованного лизоцима было 15 мг (15000 мкг) на мл сорбента. Таким образом в смыве не может быть лизоцима в количестве более 0,15/15000=0,00001 (одной стотысячной части) от иммобилизованного количества (или 0,001%).
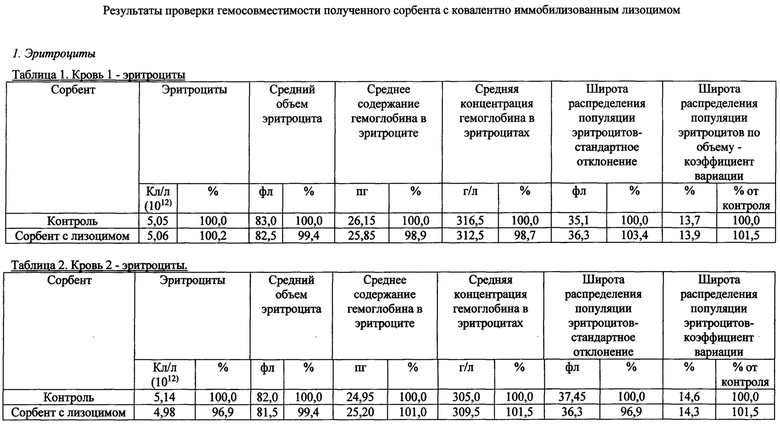
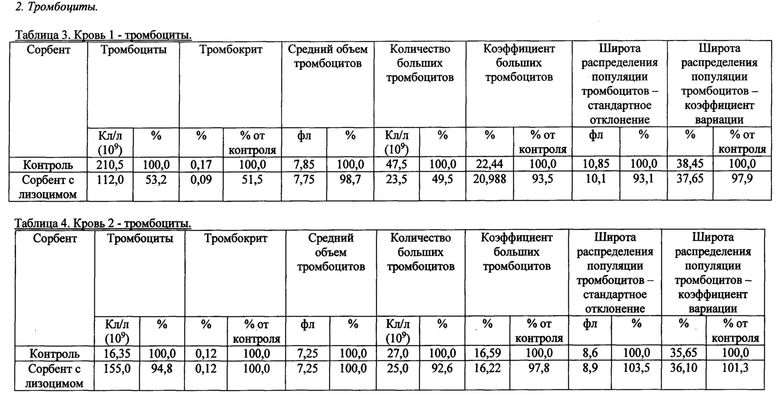
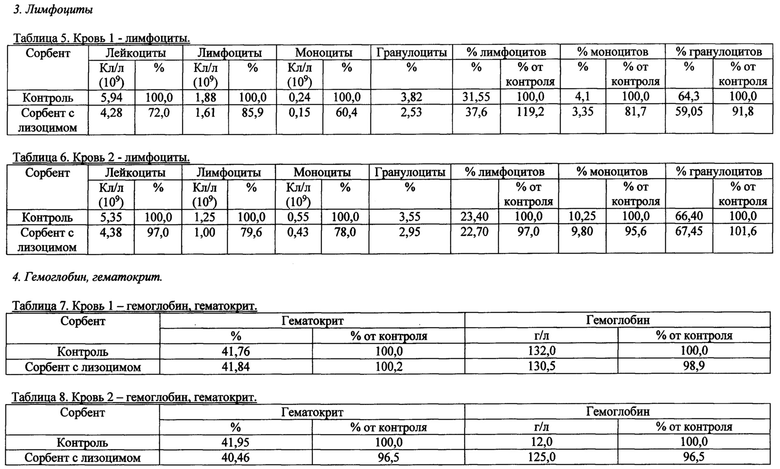
Также были получены экспериментальные результаты проверки гемосовместимости (с кровью человека) синтезированного сорбента с иммобилизованным лизоцимом.
По методике проверки кровь доноров брали в пробирки 50 мл с предварительно добавленным до конечной концентрации 2,5 Ед/мл гепарином. Колонку делали из носика 10 мл и фильтра 90 (133) мкм. Вносили 200 мкл сорбента, промывали 2 мл физиологического раствора, снизу надевали силиконовый шланг. Предобработку сорбента гепарином проводили после промывки физиологическим раствором из расчета 100 Ед гепарина на 1 мл сорбента, инкубация сорбента с 2-кратным объемом физ.раствора с гепарином, RT, перемешивание, 10 мин. Хроматографию сорбента с 4 мл крови проводили при комнатной температуре, самотеком, время контакта от 20 до 30 минут. Кровь после хроматографии собирали в пробирку 15 мл. В качестве отрицательного контроля использовалась колонка без сорбента. В кровь после колонки добавляли ЭДТА до конечной концентрации 10 мМ, аликвотили по 1 мл и измеряли клетки в геманализаторе Elite3 Erba Mannheim (2-3 параллели). Сравнительные результаты представлены в таблицах 1-8 по эритроцитам, тромбоцитам, лимфоцитам, гемоглобину и гематокриту.
Общим выводом анализа результатов в таблицах является то, что синтезированный по предлагаемому способу сорбент с иммобилизованным лизоцимом совместим с цельной кровью человека (гемосовместим).
Пример наблюдения результатов лизиса бактериальных клеток статически со слежением падения оптической плотности.
К 200 мкл 50% суспензии препарата иммобилизованного лизоцима или 200 мкл смыва с геля добавляли 900 мкл буферного раствора 0,02М Tris-HCl, рН=8,3 и 20-100 мкл суспензии бактериальных клеток (до достижения оптического поглощения 0,4). Инкубировали смесь 5-20 мин на качалке при температуре 25°С. В качестве отрицательного контроля использовали суспензии матриц без иммобилизованного лизоцима, в качестве положительного контроля - раствор лизоцима в концентрации 10 мкг/мл. В надосадочном растворе после инкубации с препаратами иммобилизованного лизоцима определяли долю нелизированных бактериальных клеток спектрофотометрически при длине волны 650-660 нм.
Были получены кинетические кривые лизиса клеток Escherichia coli для различных количеств геля с иммобилизованным лизоцимом (рис. 2). Скорость лизиса бактериальных клеток (оптических единиц поглощения в мин) определяли на начальных линейных участках полученных кривых. На рис. 3 представлена зависимость скорости лизиса Escherichia coli от количества сорбента (количества иммобилизованного фермента).
Количество иммобилизованного лизоцима определяли по разнице между добавленным количеством и количеством в надосадочной жидкости после процедуры иммобилизации. Концентрацию лизоцима определяли спектрофотометрически по оптическому поглощению раствора при длине волны 280 нм. Для определения доли активного (доступного для клеток) иммобилизованного лизоцима по отношению к общему количеству иммобилизованного фермента считали, что иммобилизованный лизоцим проявляет или не проявляет активность вследствие разной стерической доступности. Рассчитывали значения по калибровочной кривой (рис. 4) (активность от концентрации), полученной для стандартного раствора свободного лизоцима. По калибровочной кривой соотносили величину активности иммобилизованного лизоцима с количеством растворимого фермента, которое обеспечивает такую же активность. Исходя из общего количества иммобилизованного фермента, вычисляли долю фермента, обладающего активностью. По уравнению, описывающему калибровочную кривую на рис. 4, рассчитали количество активного иммобилизованного лизоцима, которое составило 37±3 мкг на мл геля.
Пример наблюдения результатов лизиса бактериальных клеток динамически в протоке на сорбционной колонке при физиологических значениях ионной силы и рН.
Проводили лизис бактериальных клеток сорбентом с иммобилизованным лизоцимом при пропускании препарата через колонку в протоке и при физиологических значениях ионной силы и рН. Использовали иммобилизованный лизоцим и суспензию клеток Micrococcus lisodeikticus (синоним Micrococcus luteus). Суспензия клеток этих бактерий обладает наиболее стабильными оптическими характеристиками во времени и наиболее удобна для проведения длительного эксперимента. Через колонку высотой 5 см и сечением 0,8 см2 (объём геля 4 мл) многократно пропускали 10 мл суспензии клеток Micrococcus lisodeikticus в буферном растворе, содержащем 10мМ KН2РО4, 0,9% NaCl, рН=7,0. Скорость потока составляла около 4 мл в мин. Суспензию клеток пропускали суммарно 12 раз через колонку, после 3-го, 6-го, 9-го и 12-го раза остатки суспензии вытесняли 4 мл буферной смесью ЗФР и измеряли оптическое поглощение суспензии при длине волны 660 нм и объём суспензии.
В таблице 9 представлены данные по способности иммобилизованного лизоцима лизировать клетки бактерий Micrococcus lisodeikticus в протоке. Исходную концентрацию клеток брали 2,5⋅107 КОЕ/мл в буферной смеси 10мМ KH2PO4-NaOH, 0,9% NaCl, рН=7, Как видно из таблицы, иммобилизованный лизоцим способен лизировать бактериальные клетки в протоке и при физиологических значениях ионной силы и рН. После трехкратного пропускания суспензии клеток было лизировано 40% бактерий. Уровень лизированных клеток после 12 пропусканий составил 75%, то есть осталось 25% целых клеток от их исходного количества.
Таблица 9 - Изменение концентрации клеткок Micrococcus lisodeikticus при пропускании бактериальной суспензии через колонку с иммобилизованным лизоцимом

Представленные экспериментальные данные подтверждают практическое решение задач изобретения. Результаты всех экспериментов показали достаточно высокую эффективность и доказали возможность расширения ассортимента способов эффективного получения и антибактериального применения в составе сорбента ковалентно иммобилизованного лизоцима с отсутствием риска утечки лизоцима в обрабатываемую (фильтруемую) биологическую жидкость, а также при этом подтверждена гемосовместимость сорбента.
Предлагаемый способ разработан в рамках выполнения работы по Соглашению №14.574.21.0181 между Министерством образования и науки Российской Федерации (Госзаказчик) и МГТУ им. Н.Э. Баумана.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ сорбционного удаления целых патогенных бактериальных клеток из раствора с помощью автоклавированного иммобилизованного лизоцима | 2019 |
|
RU2734538C1 |
| Способ удаления эндотоксинов из биологических жидкостей с помощью ковалентно иммобилизованного лизоцима в качестве лиганда | 2018 |
|
RU2684639C1 |
| Способ N2 получения сорбента на основе ковалентно иммобилизованного и химически модифицированного лизоцима для сорбции бактериальных эндотоксинов и сам сорбент | 2019 |
|
RU2736150C1 |
| Способ N1 получения сорбента на основе ковалентного иммобилизованного и химически модифицированного лизоцима для сорбции бактериальных эндотоксинов и сам сорбент | 2019 |
|
RU2736149C1 |
| СОРБЕНТ ДЛЯ УДАЛЕНИЯ ИММУНОГЛОБУЛИНОВ | 2008 |
|
RU2389022C2 |
| Сорбент для сочетанного удаления из плазмы человека атерогенных липопротеидов и С-реактивного белка | 2019 |
|
RU2700605C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА, ШТАММ Escherichia coli, ХИМЕРНЫЙ БЕЛОК И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2422524C1 |
| РЕКОМБИНАНТНЫЙ БЕЛОК LACspCBD, ОБЛАДАЮЩИЙ БЕТА-ГАЛАКТОЗИДАЗНОЙ АКТИВНОСТЬЮ И СПОСОБНОСТЬЮ САМОПРОИЗВОЛЬНО СВЯЗЫВАТЬСЯ С ЦЕЛЛЮЛОЗОСОДЕРЖАЩИМИ СОРБЕНТАМИ, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, КОДИРУЮЩАЯ СИНТЕЗ РЕКОМБИНАНТНОГО БЕЛКА LACspCBD, ШТАММ Escherichia coli M15 [pREP4, pLACspCBD] - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО БЕЛКА LACspCBD, СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОГО РЕКОМБИНАНТНОГО БЕЛКА LACspCBD НА ЦЕЛЛЮЛОЗЕ И СПОСОБ ФЕРМЕНТАТИВНОГО РАСЩЕПЛЕНИЯ ЛАКТОЗЫ | 2004 |
|
RU2278160C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА, ШТАММ Escherichia coli, ХИМЕРНЫЙ БЕЛОК И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2422525C1 |
| Способ выделения рекомбинантного интерлейкина-2 из бактериальных клеток | 1988 |
|
SU1622398A1 |
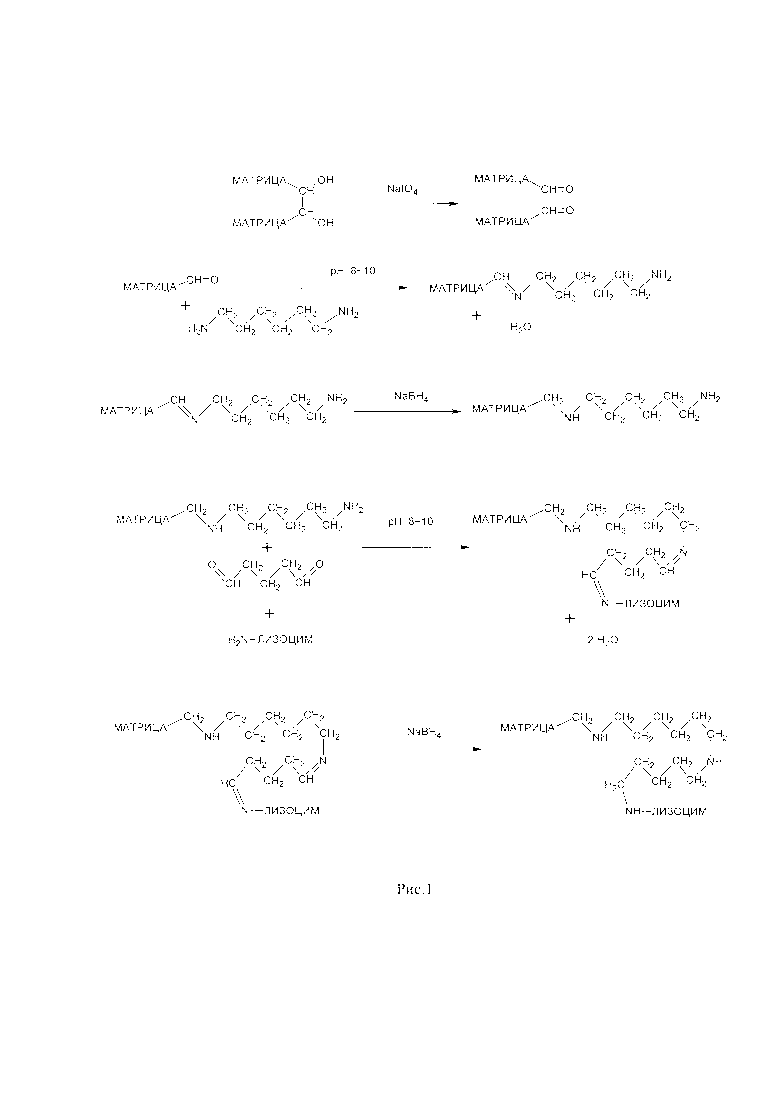

Изобретение относится к технологиям производства и использования сорбентов, применяемых в том числе для медицинских целей, а именно для экстракорпоральной терапии больных с сепсисом с использованием сорбции биологических жидкостей. Задача изобретения: расширение ассортимента способов эффективного получения и антибактериального применения в составе сорбента ковалентно иммобилизованного лизоцима с отсутствием риска утечки лизоцима в биожидкость (водный раствор, в том числе физраствор, а также плазму крови и цельную кровь (с учетом гемосовместимости сорбента)). Задача решается предлагаемым способом ковалентной иммобилизации лизоцима на аминированную агарозную матрицу, а именно: иммобилизация лизоцима на аминированную агарозную матрицу с получением молекулярного спейсера -NH-C6H12-NH-C5H10-NH-, присоединяющего молекулу лизоцима. В качестве матрицы гемосовместимого сорбента используют промышленно выпускаемые макропористые агарозные матрицы марок Sepharose (Сефароза) (производитель GE Healthcare, США) и WorkBeads (WB) 200 Sec (производитель Bio-Works, Швеция). Иммобилизованный лизоцим в составе полученного сорбента с отсутствием риска утечки лизоцима применяют для снижения бактериальной обсемененности биологических жидкостей посредством лизиса бактериальных клеток с наблюдением результатов лизиса двумя путями: статически со слежением падения оптической плотности или динамически в протоке на сорбционной колонке. 2 н. и 1 з.п. ф-лы, 4 ил., 9 табл., 1 пр.
1. Способ химической ковалентной иммобилизации лизоцима, характеризующийся иммобилизацией лизоцима на агарозную аминированную матрицу с получением молекулярного спейсера -NH-C6H12-NH-C5H10-NH-, присоединяющего молекулу лизоцима, а именно: для аминирования агарозной матрицы ее промывают 10 объемами дистиллированной воды; к навеске геля добавляют двукратное количество 2% водного раствора периодата натрия и инкубируют 2 часа на качалке при 20°С; после инкубации матрицу промывают 20-кратным объемом дистиллированной воды; далее к матрице, активированной периодатом натрия, добавляют однократный объем 2М раствора 1,6-диаминогексана и инкубируют 2 часа на качалке при 25°С; затем добавляют 2-кратный объем свежеприготовленного 0,5% (по весу) раствора натрия боргидрида натрия и инкубируют 30 минут при перемешивании; обработку боргидридом повторяют дважды; далее промывают гель 5-кратным объемом 1М раствора NaCl и 20-кратным объемом дистиллированной воды; а затем к 10 мл 50% суспензии аминированной матрицы в буферной смеси 30 мМ NaHCO3-NaOH, рН=10,0, добавляют 0,56 мл 25% раствора глутарового альдегида и перемешивают в течение 30 мин на качалке при 25°С; полученный гель промывают 50 мл буферного раствора 30 мМ NaHCO3-NaOH, рН=10,0, и смешивают с 10 мл раствора лизоцима в том же буферном растворе (концентрация лизоцима 7,5 мг/мл); смесь инкубируют 1 час на качалка при 25°С; далее полученный сорбент обрабатывают 10 мл 0,5% (по весу) водного раствора боргидрида натрия дважды; время каждой инкубации с раствором боргидрида натрия составляет 20 минут; затем после блокировки гемосовместимый сорбент промывают 200 мл дистиллированной воды, при этом выход на стадии иммобилизации лизоцима для всех образцов составляет не менее 98%.
2. Способ по п. 1, характеризующийся тем, что в качестве матрицы сорбента используют промышленно выпускаемые макропористые агарозные матрицы.
3. Способ снижения бактериальной обсемененности биологических жидкостей, включающий иммобилизацию лизоцима способом по п. 1, и далее проводят лизис бактериальных клеток с наблюдением результатов лизиса двумя путями: статически со слежением падения оптической плотности или динамически в протоке на сорбционной колонке.
| Левашов П.А | |||
| и др | |||
| "СИНТЕЗ АФФИННЫХ СОРБЕНТОВ С ИММОБИЛИЗОВАННЫМИ СИНТЕТИЧЕСКИМИ ЛИГАНДАМИ ДЛЯ ПРОЦЕДУР ТЕРАПЕВТИЧЕСКОГО АФЕРЕЗА", Биомедицинская химия, т.56(6), 2010, 739-746 | |||
| Dekina S | |||
| S et al | |||
| "MUCOADHESIVE GEL WITH IMMOBILIZED LYSOZYME: PREPARATION AND PROPERTIES", Biotechnologia Acta, 2015, Vol.8, No | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| CN 106589202 A, 26.04.2017 | |||
| СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНЫХ ПРЕПАРАТОВЛИЗОЦИЛ\ОВ | 0 |
|
SU220920A1 |
| Способ выделения рекомбинантного интерлейкина-2 из бактериальных клеток | 1988 |
|
SU1622398A1 |
| Способ лечения гнойных ран | 1989 |
|
SU1690767A1 |
| Способ подготовки металлических пластинок, в особенности алюминиевых, для фотоснимков | 1929 |
|
SU17000A1 |
Авторы
Даты
2019-07-17—Публикация
2018-06-07—Подача