Настоящее изобретение относится к способу получения аналогов метионина, а также селеновых производных аналогов метионина, из имеющихся в избытке и доступных соединений, полученных из биомассы.
Метионин и его аналоги, такие как 2-гидрокси-4-метилтиобутановая кислота (НМТВА) и 2-оксо-4-метилтиобутановая кислота (КМВ), а также соли, хелаты, в частности хелаты металлов (Zn, Ca, Mn, Mg, Cu, Na …) и сложные эфиры этих кислот, такие как изопропиловый и трет-бутиловый эфиры НМТВА, широко используются в кормлении животных. Селеновые производные метионина и его гидрокси-аналогов также составляют основной интерес в кормлении животных.
Учитывая постоянно растущие объемы потребления этих ингредиентов во всем мире, необходимо разработать способы изготовления из возобновляемых, энергосберегающих и незагрязняющих источников.
Таким образом, авторы разработали способ получения этих соединений из органических кислот, их солей или производных, которые могут быть получены из биомассы, в частности путем биологических превращений, таких как ферментативные способы.
Согласно изобретению этот способ позволяет получить соединение или его соль, где указанное соединение имеет формулу (I)
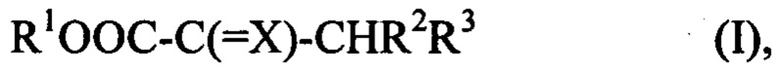
где X выбран из О; N-R', где R' представляет собой Н или С1-С6 алкильную группу; и N-OR'', где R'' представляет собой Н, С1-С6 алкильную группу или алкиларильную группу;
R1 представляет собой Н или С1-С6 алкильную группу;
R2 представляет собой Н, С1-С6 алкильную группу или алкиларильную группу; и
R3 представляет собой CH2SR4 или CH2SeR4, где R4 представляет собой Н или С1-С6 алкильную группу,
из соединения формулы (II) или его соли
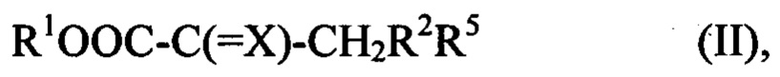
где R1, R2 и X определены выше; и
R5 представляет собой Н или COOR6, где R6 представляет собой Н или С1-С6 алкильную группу.
Этот способ позволяет изготавливать аналоги метионина, такие как КМВ, из кислот, таких как щавелевоуксусная кислота и пировиноградная кислота, с интересующими выходами для промышленного использования без высвобождения субпродуктов в избыточных количествах, и включая умеренные реакционные условия и доступные реагенты. Кроме того, эти соединения представляют собой чрезвычайно интересные предшественники метионина в его разных активных формах D, L; D и L, и НМТВА в ее разных энантиомерных формах D, L; D и L. В действительности они могут быть превращены в указанный метионин или указанную НМТВА в ходе простого восстановления, например с гидридами типа NaBH4 или в ходе каталитического или биокаталитического гидрирования или в ходе рацемического или энантиоселективного биохимического превращения, или любым другим способом, известным квалифицированным специалистам в данной области техники.
А именно, способ по изобретению осуществляют в присутствии соединения формулы (III)

где Y представляет собой Н;
OR7, где R7 представляет собой Н, С1-С6 алкильную группу или ацильную группу формулы CO-R4, где R4 соответствует предыдущему определению; SR4 или SeR4, где R4 соответствует предыдущему определению; или NR8R9,
где R8 и R9 одинаковые или разные, каждый в отдельности или вместе представляют собой С1-С6 алкильную группу или алкиларильную группу;
Z, одинаковый с или отличный от Y, представляет собой OR10, где R10 представляет собой Н, С1-С6 алкильную группу или CO-R4, где R4 соответствуют предыдущему определению; циклическую или ациклическую группу N(COR4)(COR4), где R4 соответствует предыдущему определению; или группу NR11R12, где R11 и R12 одинаковые или разные, каждый в отдельности или вместе представляют собой С1-С6 алкильную группу или алкиларильную группу;
или Y и Z вместе представляют собой =O;
и указанный способ включает следующие стадии, согласно которым:
соединение (II) подвергают взаимодействию с соединением (III), что приводит к получению соединения, имеющему структуру (IV)
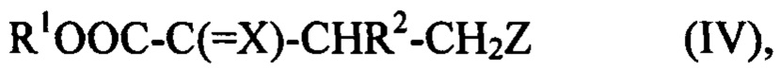
где R1, R2, X и Z определены выше,
таким образом полученное соединение (IV) подвергают взаимодействию с R4SH или его солью, или R4SeH или его солью, где R4 соответствует предыдущему определению, уже находящимся в реакционной среде или добавленным в ходе способа, затем, по завершении реакции, выделяют соединение (I) или его соль.
Как описано далее в данном документе, согласно варианту способа в ходе реакции соединения (IV) с R4SH или его солью, или R4SeH или его солью, где R4 соответствует предыдущему определению, уже находящимся в реакционной среде или добавленным в ходе способа, получают соединение, имеющее структуру (V)
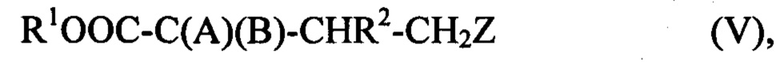
где R1, R2 и Z определены выше,
А представляет собой ОН; HN-R', где R' представляет собой Н или С1-С6 алкильную группу; или HN-OR'', где R'' представляет собой Н, С1-С6 алкильную группу или алкиларильную группу; и
В представляет собой SR4 или SeR4, где R4 соответствует предыдущему определению.
Перед раскрытием изобретения более подробно некоторые термины, используемые в тексте, определены ниже.
В формулах, определяющих соединения и реагенты, полученные или включенные, термин "алкил" обозначает линейный или разветвленный одновалентный углеводородный радикал, имеющий 1-20 атомов углерода, преимущественно 1-6 атомов углерода, такой как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, неопентил, н-гексил, или циклический одновалентный углеводородный радикал, имеющий 3-20 атомов углерода, преимущественно 3-6 атомов углерода, такой как циклопропил, циклогексил.
Алкиларильная группа означает арильную группу, включающую 6-20 атомов углерода, указанная арильная группа замещена по меньшей мере одной алкильной группой, соответствующей вышеприведенному определению.
Изобретение подробно описано далее в данном документе, и представлены его преимущественные варианты.
Раскрытый выше способ можно выполнять в соответствии с несколькими подходами.
Согласно первому подходу предпочтительно подвергают взаимодействию соединение (II) с формальдегидом или параформальдегидом, в гидратированной или негидратированной форме, в основной среде и в присутствии MeSH или его соли, такой как соли натрия, калия или кальция метилмеркаптана.
Согласно второму подходу подвергают взаимодействию соединение (II) с соединением (III), указанное соединение (III) выбрано из 1-[(метилсульфанил)метил]-пиперидина, 1-[(метилсульфанил)метил]-пирролидина и 1-[(метилсульфанил)метил]-диэтиламина. Этот второй подход приводит к промежуточному соединению, которое может быть выделено или не выделено, которое является предметом настоящего изобретения. Это соединение имеет формулу (V):
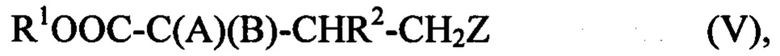
где R1 представляет собой Н или С1-С6 алкильную группу;
R2 представляет собой Н, С1-С6 алкильную группу или алкиларильную группу;
А представляет собой ОН, HN-R', где R' представляет собой Н или С1-С6 алкильную группу, или HN-OR'', где R'' представляет собой Н или С1-С6 алкильную группу, или алкиларильную группу;
В представляет собой SR4 или SeR4, где R4 представляет собой Н или С1-С6 алкильную группу;
Z представляет собой OR10, где R10 представляет собой Н; С1-С6 алкильную группу; группу CO-R4, где R4 представляет собой Н или С1-С6 алкильную группу, циклическую или ациклическую группу N(COR4)(COR4), где R4 соответствует предыдущему определению; или NR11R12, где R11 и R12, одинаковые или разные, каждый в отдельности или вместе представляют собой С1-С6 алкильную группу или алкиларильную группу.
Согласно второму подходу преимущественно приводят в контакт щавелевоуксусную кислоту или ее сложный эфир, то есть соединение формулы (II), в которой X представляет собой О, R2 представляет собой Н, и R5 представляет собой CO2R6, где R6 представляет собой Н или С1-С6 алкильную группу, с соединением формулы (III) типа CH2(Y)(Z), в котором Y и Z соответственно представляют собой группу SCH3 и группу NR11R12, как определено ранее; предпочтительно группа NR11R12 представляет собой группу пиперидинила. Следовательно, изобретение также относится к соединению формулы (V), в которой А представляет собой ОН, В представляет собой SCH3, R2 представляет собой Н, и Z представляет собой группу пиперидинила.
Согласно третьему подходу возможно подвергнуть взаимодействию соединение (II) с соединением (III), выбранным из метилендипиперидина, метилендипирролидина и метиленди(диэтиламин). Промежуточное соединение этого третьего подхода, которое может быть выделено или не выделено, также является предметом изобретения. Оно имеет формулу (IV):
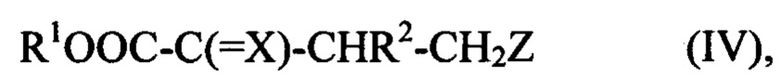
где X выбран из О; N-R', где R' представляет собой Н или С1-С6 алкильную группу; и N-OR'', где R'' представляет собой Н, С1-С6 алкильную группу или арильную группу;
R1 представляет собой Н или С1-С6 алкильную группу;
R2 представляет собой Н, С1-С6 алкильную группу или алкиларильную группу; и
Z представляет собой NR8R9, где R8 и R9, одинаковые или разные, каждый в отдельности или вместе представляют собой С1-С6 алкильную группу или алкиларильную группу.
Как будет проиллюстрировано в примерах, согласно третьему подходу преимущественно приводят в контакт щавелевоуксусную кислоту или ее сложный эфир, то есть соединение формулы (II), в которой X представляет собой О, R2 представляет собой Н, и R5 представляет собой CO2R6 с R6=H, с соединением формулы (III), в которой Y и Z соответственно представляют собой группу NR8R9 и группу NR11R12, как определено ранее. Предпочтительно, по меньшей мере один из NR8R9 и NR11R12, а еще лучше оба, представляют собой одну и ту же группу пиперидинила. Таким образом, изобретение относится к промежуточному соединению формулы (IV), в которой X представляет собой О, R2 представляет собой Н, и Z представляет собой группу пиперидинила, R1 является таким, как определено ранее, а именно Н, когда соединение (II) представляет собой щавелевоуксусную кислоту, или С1-С6 алкильной группо й, когда соединение (II) представляет собой соответствующий сложный эфир щавелевоуксусной кислоты.
Независимо от фиксированного подхода соединение (II) преимущественно выбрано из щавелевоуксусной кислоты и пировиноградной кислоты.
Как указано ранее, способ по изобретению позволяет получить разные аналоги метионина. В особенности 2-оксо-4-метилтиобутановая кислота (КМВ) или ее соль, такая как соли кальция, магния, марганца, меди, цинка, натрия или аммония, и ее селеновый аналог или его соль являются продуктами способа по изобретению при экономически привлекательных условиях и выходах.
Другим предметом изобретения является способ получения D,L-метионина, D- или L-метионина, D,L-2-гидрокси-4-метилтиобутановой кислоты (НМТВА) или D- или L-ГМТБК из 2-оксо-4-метилтиобутановой кислоты (КМВ), согласно которому получают КМВ согласно способу по изобретению, как определено выше, затем превращают таким образом полученную КМВ в метионин или НМТВА, химически или биологически, методиками, известными квалифицированным специалистам в данной области техники.
Настоящее изобретение описано более подробно с помощью следующих примеров, иллюстрирующих синтез КМВ из щавелевоуксусной кислоты и пировиноградной кислоты согласно разным синтетическим подходам, все их которых находятся в объеме изобретения.
Пример 1: Получение КМВ в ходе первого подхода в присутствии NaOH, НСНО и MeSNa
Общая схема синтеза является следующей:

В реактор помещают 100 мг щавелевоуксусной кислоты и добавляют 1 М раствор NaOH (2 экв.). Температуру реактора устанавливают на 30°С и растворение щавелевоуксусной кислоты происходит немедленно. Через 2 минуты добавляют 37% в весовом отношении раствор формальдегида (1 экв). Продолжают перемешивать в течение 2 минут при 30°С, затем добавляют MeSNa (2 экв., 108 мг) за один раз, и реакционную среду перемешивают при 30°С.
Наблюдение за реакцией с помощью ВЭЖХ-УФ (высокоэффективная жидкостная хроматография с ультрафиолетовым излучением) (колонка С18 Hydro-RP) осуществляют после 10 минут контакта, затем каждые 20 минут.Лучшие характеристики были измерены после 30 минут контакта при 30°С со следующими результатами:
 Превращение щавелевоуксусная кислота равно 100%,
Превращение щавелевоуксусная кислота равно 100%,
 Порция выработки КМВ равна 75%,
Порция выработки КМВ равна 75%,
 Селективность КМВ равна 75%. Пример 2: Получение КМВ в ходе второго подхода при использовании активированного тиометильного производного и щавелевоуксусной кислоты
Селективность КМВ равна 75%. Пример 2: Получение КМВ в ходе второго подхода при использовании активированного тиометильного производного и щавелевоуксусной кислоты
Общая схема синтеза является следующей:
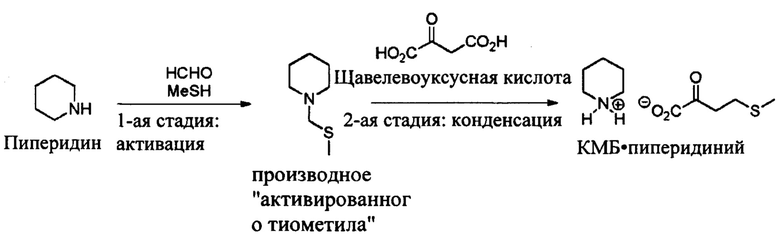
1-ая стадия: Синтез активированного тиометильного производного [соединения (III)]
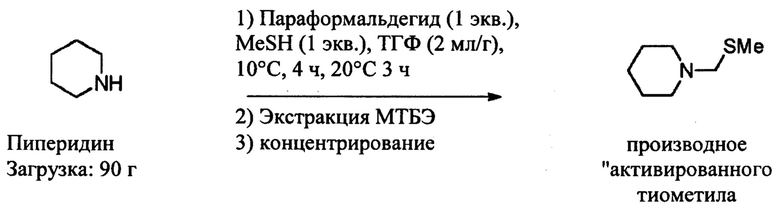
В 1 л реактор в атмосфере аргона вводят последовательно при перемешивании при 20°С:
- 90,0 г пиперидина,
-180 мл ТГФ (тетрагидрофуран),
- 34,4 г параформальдегида.
Реакционную среду охлаждают до 10°С, затем добавляют MeSH, барботируя реакционную среду, при 10°С до необходимого количества (1 экв.). Добавление завершают через 4 часа, затем заданную температуру увеличивают до 20°С. Реакционную среду перемешивают в течение 3 часов при этой температуре. Контроль с помощью ГХ-ПИД (газовая хроматография с пламенно-ионизационным детектором) (колонка Equity-1) указывает на то, что превращение пиперидина завершено и RRпорция в частицах "активированного тиометила" составляет 97%.
Добавляют 180 мл метил-трет-бутилового эфира (МТВЕ), затем 180 мл насыщенного водного раствора NaCl к реакционной среде, две фазы перемешивают в течение 5 минут и затем разделяют. Органическую фазу дважды промывают 180 мл насыщенного водного раствора NaCl, затем сушат над Na2SO4 и концентрируют при пониженном давлении (10 мбар, 30°С). Производное "активированного тиометила" получают в форме бесцветной жидкости без дополнительной очистки (150,4 г). Были получены следующие характеристики:
 Полное превращение пиперидина,
Полное превращение пиперидина,
 Выработка выделенного активированного тиометильного производного равна 95%,
Выработка выделенного активированного тиометильного производного равна 95%,
 Титр равен 94% (дозировано в ходе 1Н ЯМР (ядерный магнитный резонанс) в сравнении с 3,5-диметиланизолом).
Титр равен 94% (дозировано в ходе 1Н ЯМР (ядерный магнитный резонанс) в сравнении с 3,5-диметиланизолом).
2- ая стадия: Синтез КМВ пиперидиния

В 100 мл реактор в атмосфере аргона, снабженный ванной с термостатическим регулированием, вводят 3 г (1 экв.) щавелевоуксусной кислоты и 30 мл этанола. После растворения при 20°С (около 1 минуты) добавляют производное активированного тиометила (1 экв.), затем среду нагревают до 60°С за 30 минут, затем температуру поддерживают в течение 1 часа.
Наблюдение за реакцией с помощью ВЭЖХ-УФ (колонка С18 Hydro-RP) осуществляют после 10 минут контакта, затем каждые 20 минут. Лучшие характеристики были измерены после 1 часа контакта при 60°С:
 Полное превращение щавелевоуксусной кислоты,
Полное превращение щавелевоуксусной кислоты,
 Порция выработки КМВ равна 78%,
Порция выработки КМВ равна 78%,
 Селективность КМВ равна 78%.
Селективность КМВ равна 78%.
Реакционную среду извлекают, затем концентрируют при пониженном давлении (10 мбар, 20°С, 6 ч). КМВ пиперидиний получают в форме желтого масла без дополнительной очистки.
 Выработка выделенного КМВ пиперидиния равна 60%.
Выработка выделенного КМВ пиперидиния равна 60%.
 Титр равен 60% (дозировано с помощью ВЭЖХ в сравнении со стандартом).
Титр равен 60% (дозировано с помощью ВЭЖХ в сравнении со стандартом).
Пример 3: Получение КМВ в ходе второго подхода при использовании производного активированного тиометила и пировиноградной кислоты
Общая схема синтеза является следующей:
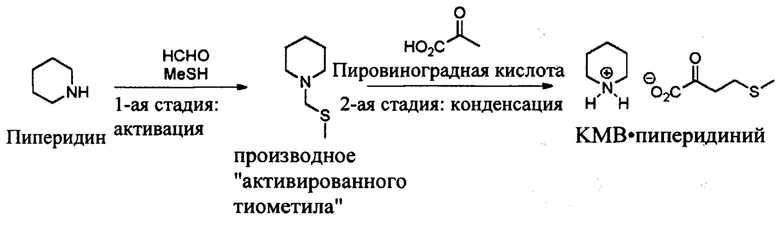
1-ая стадия: Синтез производного активированного тиометила
Описан на первой стадии примера 2.
2-ая стадия: Конденсация с пировиноградной кислотой
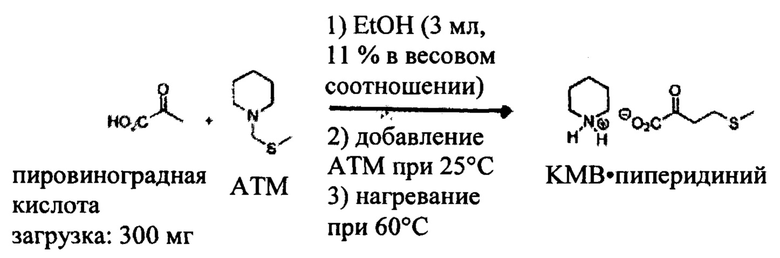
В колбу вводят 300 мг (1 экв.) пировиноградной кислоты и 3 мл этанола. После растворения при 20°С добавляют производное активированного тиометила (ТМА) (1 экв.), затем колбу помещают на плиту, предварительно нагретую до 60°С. Реакционную среду перемешивают при этой температуре в течение 1 часа.
Наблюдение за реакцией с помощью ВЭЖХ-УФ (колонка С18 Hydro-RP) осуществляют после 15 минут контакта, затем каждые 15 минут. Лучшие характеристики были измерены после 15 минут контакта при 60°С:
 Превращение пировиноградной кислоты равно 57%,
Превращение пировиноградной кислоты равно 57%,
 Порция выработки КМВ равна 42%,
Порция выработки КМВ равна 42%,
 Селективность КМВ равна 74%.
Селективность КМВ равна 74%.
Пример 4: Получение КМВ в ходе третьего подхода последовательным образом посредством частиц метилендипиперидина
Общая схема синтеза является следующей:
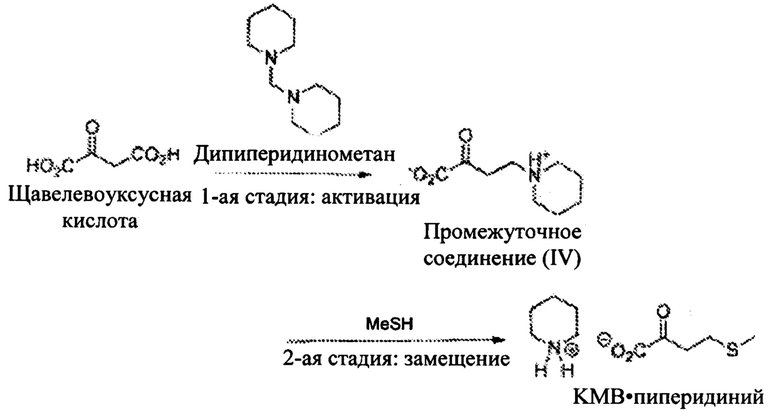
1-ая стадия: Синтез промежуточного соединения (IV)
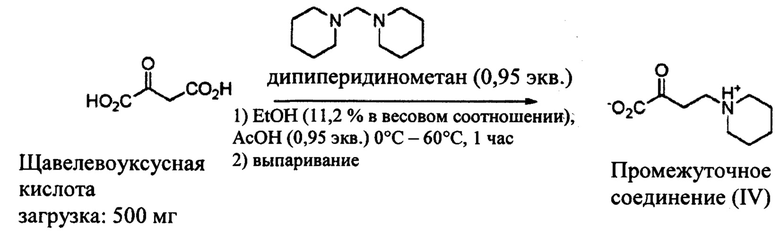
В 10 мл реактор в атмосфере аргона, снабженный температурным датчиком, последовательно вводят при 0°С:
- 500 мг щавелевоуксусной кислоты,
- 5 мл ЕtOН,
- 209 мг уксусной кислоты.
После растворения кислоты (приблизительно после 5 минут перемешивания) добавляют дипиперидинометан (0,95 экв.) за 50 минут посредством шприцевого насоса. После добавления среду нагревают до 60°С за 1 час, затем перемешивают при этой температуре в течение 10 минут. Контроль с помощью ВЭЖХ-МС (масс-спектрометрия) (ЭСИ+ (электрораспыление положительно заряженных ионов)) подтверждает образование промежуточного соединения IV.
Реакционную среду охлаждают до 20°С, затем растворитель выпаривают при пониженном давлении (10 мбар, 20°С, 1 час), что дает (IV) в форме бледно-желтого масла (1,2 г).
 Полное ТТщавелевоуксусная кислота.
Полное ТТщавелевоуксусная кислота.
 RRвыделенный производного активированного тиометила равен 60%.
RRвыделенный производного активированного тиометила равен 60%.
 Титр равен 35% (дозировано в ходе 1Н ЯМР в сравнении с 3,5-диметиланизолом).
Титр равен 35% (дозировано в ходе 1Н ЯМР в сравнении с 3,5-диметиланизолом).
2-ая стадия: синтез КМВ пиперидиния

В 10 мл реактор в атмосфере аргона, снабженный температурным датчиком, последовательно вводят при перемешивании при 0°С:
- 300 мг промежуточного соединения (IV),
- 5 мл ЕtOН.
После того, как температура реакционной среды становится ниже 5°С, вводят газ MeSH за 1 час (посредством шприцевого насоса). Затем реакционную среду нагревают до 60°С за 1 час, затем эту температуру поддерживают в течение 30 минут.
ВЭЖХ контроль показывает полное превращение промежуточного соединения и образование большей части КМВ пиперидиния.
Реакционную среду извлекают, затем концентрируют при пониженном давлении (10 мбар, 20°С, 1 час). КМВ пиперидиний получают в форме желтого масла без дополнительной очистки (260 мг).
 Полное ТТпромежуточное соединение IV.
Полное ТТпромежуточное соединение IV.
 RRвыделенный КМВ пиперидиния равен 90%.
RRвыделенный КМВ пиперидиния равен 90%.
 Титр равен 45% (дозировано с помощью ВЭЖХ в сравнении со стандартом).
Титр равен 45% (дозировано с помощью ВЭЖХ в сравнении со стандартом).
Изобретение относится к способу получения соединения формулы (I) или одной из его солей, а также к соединению формулы (IV) и к способу изготовления по меньшей мере одного из: метионина, 2-гидрокси-4-метилтиобутановой кислоты (ГМТБК) из 2-оксо-4-метилтиобутановой кислоты (КМВ). 3 н. и 7 з.п. ф-лы, 4 пр.
1. Способ получения соединения или его соли, где указанное соединение имеет формулу (I)
R1OOC-C(=X)-CHR2R3 (I),
где X представляет собой O;
R1 представляет собой H или C1-C6 алкильную группу;
R2 представляет собой H, C1-C6 алкильную группу или алкиларильную группу; и
R3 представляет собой CH2SR4 или CH2SeR4, где R4 представляет собой H или C1-C6 алкильную группу,
из соединения формулы (II) или его соли
R1OOC-C(=X)-CHR2R5 (II),
где R1, R2 и X определены выше; и
R5 представляет собой H или COOR6, где R6 представляет собой H или C1-C6 алкильную группу,
указанный способ осуществляют в присутствии соединения формулы (III)
CH2(Y)(Z) (III),
где Y представляет собой H; OR7, где R7 представляет собой H, C1-C6 алкильную группу или ацильную группу формулы CO-R4, где R4 соответствует предыдущему определению; SR4 или SeR4, где R4 соответствует предыдущему определению; или NR8R9, где R8 и R9 одинаковые или разные, каждый в отдельности представляет собой C1-C6 алкильную группу или алкиларильную группу, или вместе представляют собой C3-C6 циклоалкильную группу;
Z представляет собой OR10, где R10 представляет собой H, C1-C6 алкильную группу или CO-R4, где R4 соответствует предыдущему определению; циклическую или aциклическую группу N(COR4)(COR4), где R4 соответствует предыдущему определению; или NR11R12, где R11 и R12 одинаковые или разные, каждый в отдельности представляет собой C1-C6 алкильную группу или алкиларильную группу, или вместе представляют собой C3-C6 циклоалкильную группу;
где Z и Y одинаковы или различны,
или Y и Z вместе представляют собой =O;
где указанный способ отличается тем, что
соединение (II) подвергают взаимодействию с соединением (III), с получением промежуточного соединения, имеющего структуру (IV)
R1OOC-C(=X)-CHR2-CH2Z (IV),
где R1, R2, X и Z имеют вышеприведенное определение,
полученное таким образом соединение (IV) подвергают взаимодействию с R4SH или его солью, или R4SeH или его солью, где R4 соответствует предыдущему определению, уже находящимся в реакционной среде или добавленным в ходе способа,
затем, по завершении реакции, выделяют соединение (I) или его соль.
2. Способ по п. 1, отличающийся тем, что в ходе реакции соединения (IV) с R4SH или его солью, или R4SeH или его солью, где R4 является таким, как определено в п. 1, уже находящимся в реакционной среде или добавленным в ходе способа, получают соединение, имеющее структуру (V)
R1OOC-C(A)(B)-CHR2-CH2Z (V),
где R1, R2 и Z являются такими, как определено в п. 1;
A представляет собой OH; и
B представляет собой SR4 или SeR4, где R4 является таким, как определено в п. 1.
3. Способ по п. 1, отличающийся тем, что соединение (II) подвергают взаимодействию с гидратированным или негидратированным формальдегидом или параформальдегидом в основной среде и в присутствии MeSH или его соли.
4. Способ по п. 1, отличающийся тем, что соединение формулы (II) подвергают взаимодействию с соединением (III), выбранным из 1-[(метилсульфанил)метил]-пиперидина, 1-[(метилсульфанил)метил]-пирролидина и 1-[(метилсульфанил)метил]-диэтиламина.
5. Способ по п. 1, отличающийся тем, что соединение формулы (II) подвергают взаимодействию с соединением (III), выбранным из метилендипиперидина, метилендипирролидина и метиленди(диэтиламина).
6. Способ по любому из пп. 1-5, отличающийся тем, что соединение (II) выбрано из щавелевоуксусной кислоты и пировиноградной кислоты.
7. Способ по любому из пп. 1-6, отличающийся тем, что согласно указанному способу получают 2-оксо-4-метилтиобутановую кислоту (KMB) или ее соль, предпочтительно выбранную из солей кальция, натрия, аммония, марганца, меди, цинка и магния.
8. Соединение, имеющее формулу (IV)
R1OOC-C(=X)-CHR2-CH2Z (IV),
где R1 представляет собой H или C1-C6 алкильную группу;
X представляет собой O, R2 представляет собой H, и Z представляет собой группу пиперидинила.
9. Соединение формулы (IV) по п. 8, где R1 представляет собой H.
10. Способ изготовления по меньшей мере одного из: метионина, 2-гидрокси-4-метилтиобутановой кислоты (ГМТБК), из 2-оксо-4-метилтиобутановой кислоты (KMB), отличающийся тем, что включает получение KMB согласно способу по любому из пп. 1-7, и затем химическое или биологическое превращение KMB в метионин или ГМТБК.
| Lane R | |||
| S | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Synthesis, chemical properties, and as a substrate for lactate dehydrogenase of rabbit muscle", Biochemistry, 1969, vol.8, n.7, 2958-2966 | |||
| Tibrewal N | |||
| et al | |||
| "Evaluation of hadacidin analogues", Bioorganic & Medicinal Chemistry Letters, 2011, vol.21, n.1, p.517-519 | |||
| J.A | |||
| CHRISTENSEN et al | |||
| "ACTA | |||
Авторы
Даты
2020-11-12—Публикация
2017-01-17—Подача