ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к терапевтическим средствам на основе внеклеточных везикул (ВВ, EV), содержащих по меньшей мере один представляющий интерес полипептид (Pol).
УРОВЕНЬ ТЕХНИКИ
Совершенная специфичность между антителом и его антигеном, или, фактически, между любым типом биофармацевтического препарата на основе белка и его мишенью, является идеальной основой для терапевтического вмешательства. Однако терапевтическое применение антител и белковых биопрепаратов ограничено внеклеточными мишенями из-за крайне ограниченного доступа крупных молекул во внутриклеточную среду. В настоящий момент изучаются различные несущие среды для доставки терапевтических полипептидов внутрь клетки, и недавние исследования показали практическую ценность, например, проникающих в клетку пептидов (обзор которых можно найти, например, у Dinca et al., Int J Mol Sci, 2016) и биспецифических антител, нацеленных на существующие пути переноса (Yu et al., Sci Trans Med, 2014).
Совершенно иной подход был использован в основополагающей заявке на патент WO 2013/084000, в которой раскрыто применение экзосом для внутриклеточной доставки биотерапевтических средств. Более конкретно, в WO 2013/084000 показано, как терапевтические средства на основе полипептидов могут быть загружены в экзосомы методами экзогенной и эндогенной загрузки. Экзогенная загрузка экзосом может осуществляться при помощи электропорации или трансфекции представляющего интерес полипептида в экзосомы после выделения из родительской клетки, тогда как эндогенная загрузка основана на трансфекции в родительскую клетку конструкции, кодирующей представляющий интерес полипептид, с последующей сверхэкспрессией этой конструкции и сбора экзосом, содержащих биотерапевтический полипептид.
В другой революционной заявке на патент (WO 2014/168548) раскрыты терапевтические везикулы для доставки, такие как экзосомы, содержащие прикрепленную к мембране полипептидную конструкцию, содержащую, по меньшей мере, один полипептид-носитель, слитый с по меньшей мере одним терапевтическим полипептидом, который, по меньшей мере, частично находится снаружи везикулы таким образом, что он обнаруживается во вневезикулярной среде. В других патентных заявках была предпринята попытка использовать экзосомы для доставки белковых биопрепаратов, например, гепарин-связывающего эпидермального фактора роста (HB-EGF), описанная в WO 2015/138878.
Однако для успешной внутриклеточной доставки биоактивных белковых биопрепаратов, в частности, антител/интрател и других полипептидов, предназначенных для взаимодействия со специфической внутриклеточной мишенью, часто требуется, чтобы представляющий интерес терапевтический полипептид доставлялся с высокой эффективностью в свободной и неконъюгированной форме. Экзогенная загрузка экзосом после выделения часто является трудоемкой и неэффективной стратегией для загрузки полипептидов, и аналогичным образом стратегии эндогенной загрузки предшествующего уровня техники подразумевают, что загрузка в полость ВВ либо является неэффективной, либо представляющий интерес полипептид (Pol) не находится в биоактивной неконъюгированной форме. Недавно в WO 2016/178532 был описан оптогенетический способ создания ВВ, несущих белок, согласно которому в родительскую клетку вводят две сложные димерные оптогенетические конструкции. При экзогенном воздействии света два разных оптогенетических белка связываются, а при прекращении воздействия света белки диссоциируют. В этом способе необходимо длительное воздействие источника света на биологический материал для транспортировки белка в экзосомы и последующего его освобождения от экзосомального переносчика. Таким образом, недостатками этого способа являются проблемы, связанные с масштабируемостью, потенциальной токсичностью, а также трудоемкостью самого процесса отчасти из-за длительного экзогенного воздействия источника света. Кроме того, димерная конструкция подразумевает необходимость использования нескольких векторов, а также существенное увеличение риска неправильного сворачивания белка, агрегации токсичных белков и ошибок трансляции, в дополнение к риску неполной ассоциации и диссоциации между белками.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Следовательно, целью настоящего изобретения является преодоление указанных выше проблем, связанных с доставкой белковых биопрепаратов в целевую клетку, и удовлетворение существующих потребностей в данной области, например, обеспечение возможности достижения антителами или интрателами внутриклеточных мишеней, предоставление ферментов для ферментозаместительной терапии, или ферментов для редактирования генов, или любого другого полипептида, который оказывает биологически активное воздействие на целевую клетку или целевую ткань. Настоящее изобретение позволяет решить эти проблемы путем использования терапевтических средств на основе внеклеточных везикул (ВВ), в основе которых лежат экзосомы, или ВВ любого другого типа, содержащие по меньшей мере один представляющий интерес полипептид/белок (Pol), причем Pol освобождается от эндогенно активируемой системы высвобождения на основе полипептида и затем доставляется в целевую клетку, например конкретно в подходящий клеточный компартмент или в органеллу целевой клетки. Система высвобождения по настоящему изобретению основана на слитом белке, расположенном между экзосомальным полипептидом и доменом, обеспечивающим присоединение Pol с возможностью эндогенно активируемое высвобождаемого, что означает, что Pol может быть освобожден посредством фактора эндогенной активации в любое место, например, в полость ВВ, в мембрану ВВ, или в любой компартмент или органеллу целевой клетки или целевой ткани. Важно отметить, что эндогенная активация домена высвобождения на основе полипептида означает, что способ является в высокой степени масштабируемым, не содержит никаких дополнительных этапов, во время которых биологический материал подвергается длительному воздействию потенциально токсичных экзогенных стимулов или состояний, и допускает замену терапевтических платформ. Не ограничиваясь какой-либо теорией, предполагается, что эндогенная активация может быть результатом, например, снижения рН, конкуренции между партнерами по связыванию и, как правило, любого изменения биологических условий в клетке, которые могут способствовать высвобождению Pol через активацию домена высвобождения на основе полипептида.
Этот очень сложный подход к доставке неконъюгированных представляющих интерес терапевтических полипептидов в полость или мембрану ВВ обеспечивает чрезвычайно эффективную доставку биоактивных полипептидов, представляющих терапевтический интерес, во внутриклеточную среду и/или в структуру клеточной мембраны любого типа (такой как плазматическая мембрана, мембрана органеллы, такой как ядро, лизосома или эндоплазматическая сеть (ЭР), или любой другой тип мембранного компартмента) целевой клетки. Таким образом, настоящее изобретение может быть применено к любому типу внутриклеточной и/или внутримембранной доставки полипептидов, например, для введения или замены белка или пептида любого типа. Неограничивающим примером может быть фермент, который отсутствует или неактивен при заболеваниях, включающих, например, генетическую аномалию, таких как лизосомальные болезни накопления, или любой тип внутриклеточного или интегрального мембранного белка, который необходимо заменить или необходимо увеличить его концентрацию в мишени. В качестве еще одного неограничивающего примера настоящее изобретение очень полезно при лечении рака, при котором можно использовать ВВ по настоящему изобретению для введения во внутриклеточную среду белка-онкосупрессора (или его варианта или производного), такого как р53 или р21, или полипептида любого типа (такого как интратело или антитело), который связывается и подавляет путь образования опухоли (онкогенный путь). Другие неограничивающие примеры включают доставку факторов транскрипции или компонентов сигнальных путей для модуляции воспалительных реакций или индукции репарации тканей, или доставку РНК-связывающих белков, которые могут нести одноцепочечные или двухцепочечные РНК, обладающие терапевтической активностью.
Таким образом, настоящее изобретение относится, помимо прочего, к ВВ, содержащим по меньшей мере один Pol, причем указанный по меньшей мере один Pol присоединен к экзосомальному полипептиду через эндогенно активируемую систему высвобождения. Для ясности настоящее изобретение, таким образом, относится как к ВВ, содержащим Pol, который высвобождается в полость ВВ и/или мембрану ВВ посредством системы высвобождения, а также к ВВ, содержащим Pol, который все еще прикреплен, с возможностью высвобождения, к эндогенно активируемой системе высвобождения на основе полипептидов. Модульность полипептидных конструкций по настоящему изобретению (которые включают представляющий интерес полипептид, эндогенно активируемый домен высвобождения на основе полипептида и экзосомальный полипептид) обеспечивает высоко контролируемое эндогенное продуцирование ВВ для доставки неконъюгированных Pol (как указано выше, либо в виде растворимого Pol, либо в виде связанного с мембраной Pol, где Pol может контактировать либо с внешней средой, либо с внутренней средой, либо с обеими средами в виде трансмембранного Pol). Это полностью отличается от предшествующего уровня техники, в котором просто описывается эндогенная загрузка Pol, которые либо необратимо конъюгированы с экзосомальными белками, либо Pol, загруженных в ВВ без помощи какого-либо экзосомального полипептида, либо Pol, которые транспортируются и высвобождаются в ВВ в результате длительного воздействия экзогенного источника света, что означает, что процессы загрузки и продуцирования являются чрезвычайно неэффективными, трудоемкими, немасштабируемыми и/или потенциально токсичными по сравнению с загрузкой и производством ВВ по настоящему изобретению.
Кроме того, настоящее изобретение относится к нескольким новым способам загрузки и продуцирования ВВ, содержащих Pol, в клетках, содержащих полинуклеотидные и/или полипептидные конструкции, обеспечивающие такое продуцирование, и полинуклеотидным и/или полипептидным конструкциям по настоящему изобретению, как таковым. Более подробно, настоящее изобретение относится к применению цис-расщепляющих полипептидов (т.е. полипептидов или пептидов, содержащих специфические аминокислотные последовательности, которые запускают высвобождение (которое может происходить при помощи различных механизмов, например сплайсинга или расщепления) требуемых частей пептида, в свою очередь, высвобождая Pol), и полипептидов, связывающих сигнал ядерной локализации (NLS) (NLSBP) (например, полипептида импортин-альфа) для ВВ-опосредованной доставки представляющих интерес неконъюгированных полипептидов (Pol), находящихся в просвете ВВ и/или ассоциированных с мембраной. В одном отдельном варианте осуществления предусмотрено применение простой мономерной системы высвобождения на основе полипептида, которая может запускаться очень быстрой вспышкой света (в отличие от систем переноса и высвобождения, основанных на длительном воздействии света, таких как описанные в WO 2016/178532).
Настоящее изобретение также относится к способам внутриклеточной доставки неконъюгированных Pol, которые включают этапы контактирования целевой клетки с ВВ, содержащей (i) Pol, присоединенный, с возможностью высвобождения, к экзосомальному полипептиду через домен(-ы) эндогенно инициируемого высвобождения, или (ii) Pol, освобождаемый от экзосомального полипептида (обычно в просвет или мембрану ВВ) через эндогенную активацию. ВВ обычно может поступать в целевую клетку и доставлять загруженный в нее полипептид, что приводит к высокоэффективной внутриклеточной или внутримембранной доставке терапевтического полипептида. Таким образом, ВВ и способы их получения и внутриклеточной доставки обладают обширным медицинским потенциалом, например, для профилактики и/или лечения большого количества заболеваний и болезненных состояний, в частности онкологических, воспалительных и аутоиммунных заболеваний, нейровоспалительных и нейродегенеративных заболеваний, генетических заболеваний, лизосомальных болезней накопления, нарушений памяти, поражений и функциональной недостаточности органов, мышечных дистрофий, таких как DMD, сердечно-сосудистых и метаболических нарушений, заболеваний почек и печени, таких как неалкогольный стеатогепатит (NASH) и т.д.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 схематически показана полипептидная конструкция, содержащая систему высвобождения цис-расщеплением (такую как интеин) для высвобождения представляющего интерес полипептида (Pol).
На фиг. 2 показан общий вид полипептидной конструкции, содержащей мономерную систему высвобождения через индуцируемое кратковременной вспышкой света расщепление для высвобождения Pol. Кратковременная вспышка света приводит к расщеплению системы высвобождения и, следовательно, высвобождению Pol, без каких-либо токсических эффектов и без проблем, связанных с масштабируемостью.
На фиг. 3 показаны результаты клеток с дефицитом GBA, обработанных ВВ, обогащенных интеин-GBA слитыми белками с повышенным содержанием GBA. В клетках реципиента снижен уровень глюкоцереброзида после доставки биологически активного GBA. Аналогичный эксперимент был проведен с транспортером NPC1 в фибробластах с дефицитом NPC1.
На фиг. 4 показана полипептидная конструкция, содержащая основанную на GFP-подобном белке Dendra систему высвобождения через индуцируемое светом расщепление для высвобождения Pol. Dendra представляет собой мономерную систему высвобождения, которая может быть активирована кратковременной вспышкой света.
На фиг. 5 показаны результаты анализа негомологичного соединения концов (NHEJ). Клетки HEK293T (красные), содержащие репортерную систему, трансфицировали экзосомами, содержащими гидовую РНК (гРНК) и полипептидную конструкцию, содержащую CD81 в качестве экзосомального полипептида, Kaede в качестве мономерной системы высвобождения через индуцируемое светом расщепление и Cas9 в качестве Pol. Экзосомы получали из клеточной культуры, на которую воздействовали или не воздействовали кратковременной вспышкой синего света в процессе продуцирования экзосом. Только экзосомы, полученные из клеток, подвергшихся воздействию света, вызвавшему расщепление Kaede и, следовательно, высвобождение Cas9, показали увеличение процента положительных клеток.
На фиг. 6 показаны результаты высокоточного анализа кинетики плавления (HRM) клеток, обработанных ВВ, которые были собраны из клеток, подвергшихся воздействию света. ВВ, содержащие такую же полипептидную конструкцию, что и на фиг. 5, индуцировали Cas9-опосредованные мутации в локусе AAVS в результате эффективной внутриклеточной доставки биоактивных Cas9 и гРНК.
На фиг. 7 показаны эффекты, выявленные в результате NHEJ анализа ВВ, содержащих полипептидную конструкцию, содержащую Cas9, слитый с CD63 через мономерный полипептид индуцируемого светом высвобождения Dendra2, обеспечивающий получение функционального Cas9 в ВВ после облучения УФ/синим светом.
На фиг. 8 показаны результаты HRM для клеток, обработанных ВВ, которые были собраны из клеток, подвергшихся воздействию УФ/синего света. ВВ, содержащие такую же полипептидную конструкцию, что и на фиг. 7, индуцировали Cas9-опосредованные мутации в локусе AAVS в результате эффективной внутриклеточной доставки биоактивных Cas9 и гРНК.
На фиг. 9 показано устойчивое подавление ответа NfKB, достигаемое ВВ, загруженными полипептидной конструкцией нацеленного на WASP одноцепочного вариабельного фрагмента (scFv)-KikGR-CD63, которые были подвергнуты воздействию УФ света для высвобождения scFv внутри целевого макрофага, полученного из костного мозга.
На фиг. 10 показаны результаты для клеток Jurkat, стимулированных для экспрессии IL2-рецептора и одновременно обработанных ВВ, загруженными scFv, нацеленными на субъединицу IL2R-альфа. Только положительный контроль и ВВ, загруженные scFv-Dendra2-CD63 (и подвергнутые воздействию УФ-света), индуцировали уменьшение количества IL2R на клеточной поверхности клеток Jurkat, согласно результатам анализа FACS.
На фиг. 11 показаны результаты для erbB-2-положительной линии клеток рака яичника SKOV3, обработанных ВВ, загруженными scFv, нацеленными на онкопротеин erb-2. Уровень гибели клеток оценивали через 48 часов после обработки. Только ВВ, загруженные scFv-Dendra2-CD63 (и затем подвергшиеся воздействию УФ-света), вызывали гибель клеток на уровнях, сравнимых с положительным контролем.
На фиг. 12 показаны результаты загрузки фактора транскрипции NRF2 в ВВ при помощи системы высвобождения на основе NLSBP-NLS и связанные с этим эффекты при индукции экспрессии целевого гена HMOX1 в клетках-реципиентах. Осуществляли слияние NLSBP (KPNA1, также известного как импортин α5) с экзосомальным белком CD63 и совместную экспрессию с NRF2 в исходных клетках, содержащих ВВ (были протестированы различные типы иммунных клеток с хорошими результатами). Совместная экспрессия привела к значительному улучшению ВВ-опосредованного сортинга NRF2, оцененного вестерн-блот анализом, по сравнению с экспрессией только NRF2. Доставка ВВ, загруженных NRF2, при помощи этой стратегии приводит к индукции экспрессии целевого гена в клетках-реципиентах ВВ.
На фиг. 13 показан эксперимент, аналогичный проиллюстрированному на фиг. 5, но в данном случае с цис-расщепляющим интеином (включающим аминокислотную последовательность Val-Val-Val-His-Asn) в качестве системы высвобождения, слитым с CD63, CD81 (данные не показаны), и синтенином (данные не показаны) и Cas9. Как видно на фиг. 13, только немутированный интеин индуцировал соответствующие уровни NHEJ.
На фиг. 14 показаны результаты вестерн-блот анализа увеличения количества Cre-рекомбиназы в экзосомах при помощи системы высвобождаемого полипептида на основе интеина. Дорожки 1-3 соответствуют экзосомам, а дорожки 5-7 - соответствующим им лизатам цельных клеток. Дорожка 1 и 5 соответствуют растворимому NLSCre; дорожки 2 и 6 - CD63-интеин-Cre; Дорожки 3 и 7 - CD63-интеин-NLSCre; дорожка 4 - набору маркерных белков. Красный - контроль загрузки Alix; зеленый - Cre рекомбиназа.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к ВВ, содержащим полипептидную конструкцию, которая, в свою очередь, содержит (i) по меньшей мере один Pol, (ii) по меньшей мере один экзосомальный полипептид и (iii) по меньшей мере одну систему высвобождения на основе полипептида, где по меньшей мере один Pol присоединен, с возможностью высвобождения, к по меньшей мере одному экзосомальному полипептиду при помощи системы высвобождения, причем система высвобождения является эндогенно активируемой, и высвобождение Pol, таким образом, запускается автоматически, независимо от каких-либо экзогенных стимулов. Кроме того, настоящее изобретение также относится к ВВ, содержащим по меньшей мере один Pol, который освободился от по меньшей мере одного экзосомального полипептида при помощи системы высвобождения в ВВ, по существу, в полость ВВ или находится в ассоциации (например, внутри) с мембраной ВВ. Кроме того, изобретение относится к различным родственным аспектам, которые будут более подробно описаны ниже, например, к полинуклеотидным и полипептидным конструкциям и клеткам, содержащим такие конструкции, способам получения и способам внутриклеточной доставки in vitro и in vivo представляющих интерес полипептидов/белков, а также медицинским применениям таких ВВ и фармацевтических композиций, содержащих такие ВВ.
Для удобства и ясности некоторые термины, используемые в настоящей заявке, отобраны и описаны ниже. Если только не определено иное, все технические и научные термины, используемые в настоящем документе, имеют такие же значения, как их обычно понимают специалисты в соответствующей области техники, к которой относится настоящее изобретение.
Когда признаки, аспекты, варианты осуществления или альтернативные варианты настоящего изобретения описаны в терминах групп Маркуша, специалисту в данной области техники будет очевидно, что описанное таким образом изобретение также относится к любому отдельному члену или подгруппе членов группы Маркуша. Специалисту в данной области техники также будет очевидно, что изобретение также описывается в терминах любой комбинации отдельных членов или подгрупп членов группы Маркуша. Кроме того, следует отметить, что варианты осуществления и признаки, описанные в отношении одного из аспектов и/или вариантов осуществления настоящего изобретения, также применимы с соответствующими изменениями ко всем другим аспектам и/или вариантам осуществления изобретения. Например, любой по меньшей мере один представляющий интерес полипептид (Pol), описанный в отношении ВВ, следует рассматривать как раскрытый и значимый также в терминах полипептидных конструкций или фармацевтических композиций, содержащих ВВ, или в качестве продуктов экспрессии полинуклеотидных конструкций по настоящему изобретению. Кроме того, определенные варианты осуществления, описанные в связи с определенными аспектами, например, способы введения ВВ, описанные в отношении аспектов, относящихся к лечению определенных медицинских состояний, могут, естественно, также иметь отношение к другим аспектам и/или вариантам осуществления, таким как аспекты/варианты осуществления, относящиеся к фармацевтическим композициям или способам внутриклеточной доставки по настоящему изобретению. В качестве общего замечания, представляющие интерес полипептиды (Pol), экзосомальные полипептиды, эндогенно активируемые системы высвобождения и нацеливающие фрагменты, источники клеток и все другие аспекты, варианты осуществления и альтернативы в соответствии с настоящим изобретением могут быть свободно объединены в любых возможных комбинациях без отклонения от объема и сущности изобретения. Кроме того, любой полипептид или полинуклеотид или любые полипептидные или полинуклеотидные последовательности (аминокислотные последовательности или нуклеотидные последовательности, соответственно) по настоящему изобретению могут значительно отличаться от исходных полипептидов, полинуклеотидов и последовательностей при условии, что любая данная молекула сохраняет способность обеспечивать связанный с ней технический эффект. Процент отличий (рассчитанный, например, при помощи программы BLAST или ClustalW) полипептидных и/или полинуклеотидных последовательностей по настоящей заявке от нативной последовательности может составлять до 50% при условии сохранения ими биологических свойств, хотя более высокая идентичность последовательности является более предпочтительной. Комбинирование (слияние), например, по меньшей мере одного представляющего интерес полипептида с по меньшей мере одной системой высвобождения на основе пептида/полипептида и с по меньшей мере одним экзосомальным полипептидом подразумевает, что определенные сегменты соответствующих полипептидов могут быть заменены и/или модифицированы, что означает, что отклонение от нативной последовательности может быть значительным при условии сохранения ключевых свойств. Естественно, что аналогичные аргументы применимы к полинуклеотидным последовательностям, кодирующим такие полипептиды.
Термины «внеклеточная везикула» или «ВВ» или «экзосома» следует понимать как относящиеся к везикуле любого типа, которая, например, может быть получена из клетки, например микровезикула (например, любая везикула, выделенная из плазматической мембраны клетки), экзосома (например, любая везикула, полученная из эндолизосомального пути), апоптотическое тело (например, полученное из апоптотических клеток), микрочастица (которая может быть получена, например, из тромбоцитов), эктосома (полученная, например, из нейтрофилов и моноцитов сыворотки), простатосома (например, полученная из клеток рака предстательной железы) или кардиосома (например, полученная из клеток сердечной ткани) и т.д. Кроме того, следует понимать, что указанные термины также относятся к липопротеиновым частицам, таким как ЛПНП, ЛПОНП, ЛПВП и хиломикронам, а также имитаторам внеклеточных везикул, везикулам клеточных мембран, полученным методом мембранной экструзии или другими методами, и т.д. По существу, настоящее изобретение может относиться к структуре любого типа на основе липидов (с везикулярной морфологией или подходящей морфологией любого другого типа), которая может функционировать в качестве среды доставки или транспортировки представляющего интерес полипептида (Pol) и полипептидных конструкций, содержащих такие Pol. Специалисту в данной области техники будет понятно, что при описании применений и приложений ВВ в области медицины и науки настоящее изобретение, как правило, относится к нескольким ВВ, т.е., популяции ВВ, которая может содержать тысячи, миллионы, миллиарды, триллионы или даже квадриллионы или квинтиллионы (например, 103-1018) ВВ, или даже более многочисленные популяции ВВ (> 1018 частиц ВВ). Аналогично, следует понимать, что термин «популяция», который может, например, относиться к ВВ, содержащему Pol определенного типа и/или полипептидную конструкцию определенного типа, содержащую Pol, охватывает множество объектов (обычно подсчитываемых как частицы), составляющих такую популяцию. Другими словами, отдельные ВВ, когда присутствуют в большом количестве, составляют популяцию ВВ. Таким образом, специалисту понятно, что настоящее изобретение относится как к отдельным ВВ, содержащим различные Pol, так и к популяциям, содержащим ВВ, которые, в свою очередь, содержат различные Pol.
Термины «экзосомальный полипептид» и «экзосомальный белок», а также «полипептид ВВ» и «белок ВВ» используются в настоящей заявке взаимозаменяемо, и их следует понимать как относящиеся к любому полипептиду, который можно использовать для транспортировки полипептидной конструкции (которая дополнительно к экзосомальному белку обычно содержит по меньшей мере один представляющий интерес полипептид и по меньшей мере одну систему высвобождения на основе полипептида) в подходящей везикулярной структуре, т.е. в подходящей ВВ. Более конкретно, термин «экзосомальный полипептид» следует понимать как включающий любой полипептид, который обеспечивает транспортировку, перенос или перемещение полипептидной конструкции (которая, как указано выше, обычно содержит по меньшей мере один Pol и по меньшей мере одну систему высвобождения на основе полипептида, но которая также может включать нацеливающий пептид/полипептид) в везикулярной структуре, такой как экзосома. Примерами таких экзосомальных полипептидов являются, например, CD9, CD53, CD63, CD81, CD54, CD50, FLOT1, FLOT2, CD49d, CD71, CD133, CD138, CD235a, ALIX, Синтенин-1, Синтенин-2, Lamp2b, TSPAN8, TSPAN14, CD37, CD82, CD151, CD231, CD102, NOTCH1, NOTCH2, NOTCH3, NOTCH4, DLL1, DLL4, JAG1, JAG2, CD49d/ITGA4, ITGB5, ITGB6, ITGB7, CD11a, CD11b, CD11c, CD18/ITGB2, CD41, CD49b, CD49c, CD49e, CD51, CD61, CD104, Fc-рецепторы, рецепторы интерлейкина, иммуноглобулины, компоненты MHC-I или MHC-II, CD2, CD3-эпсилон, CD3-дзета, CD13, CD18, CD19, CD30, CD34, CD36, CD40, CD40L, CD44, CD45, CD45RA, CD47, CD86, CD110, CD111, CD115, CD117, CD125, CD135, CD184, CD200, CD279, CD273, CD274, CD362, COL6A1, AGRN, EGFR, GAPDH, GLUR2, GLUR3, HLA-DM, HSPG2, L1CAM, LAMB1, LAMC1, LFA-1, LGALS3BP, Mac-1 альфа, Mac-1 бета, MFGE8, SLIT2, STX3, TCRA, TCRB, TCRD, TCRG, VTI1A, VTI1B и любые их комбинации, но многочисленные другие полипептиды, способные транспортировать полипептидную конструкцию в ВВ, также включены в объем настоящего изобретения. Белки ВВ обычно имеют человеческое происхождение и могут быть найдены в различных общедоступных базах данных, таких как Uniprot, RCSB и т.д.
Термины «представляющий интерес полипептид», «представляющий интерес белок», «представляющий интерес терапевтический полипептид», «Pol», «биотерапевтический агент», «биологический агент» и «биологический белок» используются в настоящей заявке взаимозаменяемо, и их следует понимать как относящиеся к любому полипептиду, который можно использовать в терапевтических целях, например, путем связывания мишени и/или взаимодействия любым другим способом с партнером по взаимодействию и/или путем замены белка и/или добавления или дополнения существующего внутриклеточного белка, тем самым оказывая терапевтический эффект. Указанные термины могут представлять следующие неограничивающие примеры представляющих интерес терапевтических полипептидов: антитела, интратела, одноцепочечные вариабельные фрагменты (scFv), аффитела, биспецифические или мультиспецифические антитела или связующие, рецепторы, лиганды, ферменты, например, для ферментозаместительной терапии или редактирования генов, онкосупрессоры, вирусные или бактериальные ингибиторы, белки клеточных компонентов, ДНК и/или РНК-связывающие белки, ингибиторы репарации ДНК, нуклеазы, протеиназы, интегразы, факторы транскрипции, факторы роста, ингибиторы и индукторы апоптоза, токсины (например, экзотоксины pseudomonas), структурные белки, нейротрофические факторы, такие как NT3/4, нейротрофический фактор мозга (BDNF) и фактор роста нервов (NGF) и его отдельные субъединицы, такие как бета-субъединица 2.5S, ионные каналы, мембранные транспортеры, факторы протеостаза, белки, участвующие в клеточной сигнализации, белки, связанные с трансляцией и транскрипцией, нуклеотид-связывающие белки, протеин-связывающие белки, липид-связывающие белки, гликозаминогликаны (GAG) и GAG-связывающие белки, метаболические белки, белки, регулирующие клеточный стресс, белки, регулирующие воспаление и иммунную систему, митохондриальные белки и белки теплового шока, и т.д. В одном из предпочтительных вариантов осуществления изобретения Pol представляет собой CRISPR-ассоциированный (Cas) полипептид с интактной нуклеазной активностью, который связан (т.е. несет) с цепью РНК, которая обеспечивает проявление нуклеазной активности полипептида Cas в целевой клетке после ВВ-опосредованной доставки. Альтернативно, в другом предпочтительном варианте осуществления полипептид Cas может быть каталитически неактивным для обеспечения целевой генной инженерии. Еще одной альтернативой может быть любой другой тип CRISPR-эффектора, такой как одиночная эндонуклеаза Cpf1, направляемая РНК. Включение Cpf1 в качестве Pol является конкретным предпочтительным вариантом осуществления настоящего изобретения, поскольку она расщепляет целевую ДНК посредством ступенчатого двухцепочечного разрыва, причем Cpf1 может быть получена из видов, таких как Acidaminococcus или Lachnospiraceae. В другом примере варианта осуществления полипептид Cas также может быть слит с активатором транскрипции (таким как ядерный белок P3330) для обеспечения специфической индукции экспрессии гена. Дополнительные предпочтительные варианты осуществления включают Pol, выбранные из группы, содержащей ферменты для лизосомальных болезней накопления, например глюкоцереброзидазы, такие как имиглюцераза, альфа-галактозидаза, альфа-L-идуронидаза, идуронат-2-сульфатаза и идурсульфаза, арилсульфатазу, галсульфазу, кислую альфа-глюкозидазу, сфингомиелиназу, галактоцереброзидазу, галактозилцерамидазу, церамидазу, альфа-N-ацетилгалактозаминидазу, бета-галактозидазу, лизосомную кислую липазу, кислую сфингомиелиназу, NPC1, NPC2, гепарансульфамидазу, N-ацетилглюкозоминидазу, гепарин-α-глюкозаминид-N-ацетилтрансферазу, N-ацетилглюкозамин 6-сульфатазу, галактозо-6-сульфат-сульфатазу, галактозо-6-сульфат-сульфатазу, гиалуронидазу, альфа-N-ацетилнейраминидазу, GlcNAc-фосфотрансферазу, муколипин1, пальмитоил-протеин тиоэстеразу, трипептидилпептидазу 1, пальмитоил-протеин тиоэстеразу 1, трипептидилпептидазу 1, баттенин, линклин, альфа-D-маннозидазу, бета-маннозидазу, аспартилглюкозаминидазу, альфа-L-фукозидазу, цистинозин, катепсин К, сиалин, LAMP2 и гексаминидазу. В других предпочтительных вариантах осуществления Pol может представлять собой, например, внутриклеточный белок, который модифицирует воспалительные реакции, например эпигенетические белки, такие как метилазы и бромодомены, или внутриклеточный белок, который модифицирует мышечную функцию, например, факторы транскрипции, такие как MyoD или Myf5, белки, регулирующие сокращение мышц, например, миозин, актин, кальций/связывающие белки, такие как тропонин, или структурные белки, такие как дистрофин, утрофин, титин, небулин, дистрофин-ассоциированные белки, такие как дистробревин, синтрофин, синкойлин, десмин, саркогликан, дистрогликан, саркоспан/агрин и фукутин. Pol, как правило, представляют собой белки или пептиды человеческого происхождения, если иное не следует из их названия, любой другой номенклатуры или из информации, известной специалисту в данной области техники, и эти белки могут быть найдены в различных общедоступных базах данных, таких как Uniprot, RCSB и т.д.
Термин «высвобождаемый внутрь», как в контексте «высвобождаемый внутрь ВВ» или «высвобождаемый внутрь целевой клетки» означает высвобождение представляющего интерес полипептида (Pol) полностью и/или частично внутрь ВВ (или целевой клетки), т.е., что Pol высвобождается в полость ВВ (или целевой клетки), в мембрану ВВ (или целевой клетки) либо полностью, либо частично (например, в трансмембранной конфигурации), либо наружу мембраны ВВ (или целевой клетки). Указанный термин также означает высвобождение Pol на внешней стороне мембраны ВВ (или целевой клетки). Кроме того, этот термин также может включать высвобождение внутри любой биологической системы, например, конкретной ткани или целевого органа.
Термины «эндогенная активация», «эндогенный запуск» и их варианты (такие как «эндогенно активируемый» или «эндогенно запускаемый») следует понимать как относящиеся к активации, индукции и/или запуску высвобождения Pol системой высвобождения без каких-либо внешних стимулов, т.е., высвобождение Pol запускается внутри ВВ или внутри клетки простым воздействием окружающей экзосомальной и/или клеточной и/или биологической среды (например, в результате изменения pH, изменения других физиологических параметров, таких как соленость, конкуренция между партнерами по связыванию, ферментативная активность, например, протеолитическая активность и т.д.).
Термины «исходная клетка» или «клетка-источник ВВ» или «родительская клетка» или «источник клеток» или «клетка, продуцирующая ВВ» или любую другую аналогичную терминологию следует понимать как относящуюся к клетке любого типа, которая способна продуцировать ВВ в подходящих условиях культивирования клеток, например, в суспензионной культуре или в адгезивной культуре или в любой другой системе культивирования. Исходные клетки по настоящему изобретению могут быть выбраны из широкого спектра клеток, например, мезенхимальных стволовых или стромальных клеток (которые можно получить, например, из костного мозга, жировой ткани, вортонова студня, перинатальной ткани, зубных зачатков, пуповинной крови и т.д.), клеток амниона, эпителиальных клеток амниона, миелоидных супрессорных клеток, иммортализованных клеточных линий, одним из неограничивающих примеров которых являются эмбриональные клетки почки человека (HEK), дендритных клеток (DC) или других клеток иммунной системы, таких как макрофаги, моноциты, B- или Т-клетки, NK-клетки, нейтрофилы, эозинофилы, тучные клетки или базофилы и т.д. Как правило, ВВ могут быть получены практически из любого источника клеток, будь то источник первичных клеток или иммортализованная клеточная линия. Клетки-источники ВВ могут представлять собой любые типы эмбриональных, зародышевых и взрослых соматических стволовых клеток, включая индуцированные плюрипотентные стволовые клетки (iPSC) и другие стволовые клетки, полученные любым способом. При лечении неврологических заболеваний в качестве исходных клеток можно использовать, например, первичные нейроны, астроциты, олигодендроциты, микроглию и нейральные клетки-предшественники. Используемая для лечения пациента исходная клетка может быть по своей природе аллогенной, аутологичной или даже ксеногенной, т.е., клеткой полученной от самого пациента или от неродственного, совместимого или несовместимого донора. В определенных контекстах аллогенные клетки могут быть предпочтительными с медицинской точки зрения, поскольку они могут обеспечивать иммуномодулирующие эффекты, которые могут быть недоступны для аутологичных клеток пациента, страдающего определенным заболеванием. Например, в контексте лечения периферического или неврологического воспаления аллогенные MSC могут быть предпочтительными, так как ВВ, получаемые из таких клеток, могут обеспечивать иммуномодуляцию, например, посредством фенотипического переключения макрофагов и/или нейтрофилов (от провоспалительных фенотипов M1 или N1 к противовоспалительным фенотипам M2 или N2, соответственно). И наоборот, при использовании ВВ для лечения солидной опухоли или гематологического злокачественного заболевания более предпочтительным может быть выбор иммунных клеток, таких как DC, в качестве источника клеток, продуцирующих ВВ.
В первом аспекте настоящее изобретение относится к ВВ, содержащей по меньшей мере один представляющий интерес полипептид (Pol), где указанный по меньшей мере один Pol присоединяется, с возможностью освобождения, к экзосомальному полипептиду. Присоединение Pol к экзосомальному полипептиду является высвобождаемым для обеспечения эффективной, беспрепятственной загрузки и эндогенно запускаемого высвобождения представляющего интерес терапевтического полипептида в ВВ. Присоединение Pol, с возможностью высвобождения, к экзосомальному полипептиду является признаком, опосредованным системой высвобождения по изобретению, которая обеспечивает эндогенно активируемое высвобождение Pol внутри ВВ и/или впоследствии внутри целевой клетки или целевой ткани для оптимизации загрузки и проявления терапевтической активности. Система высвобождения представляет собой систему на основе полипептида, которая может быть выбрана из группы, включающей различные системы высвобождения, основанные на взаимодействии полипептидов, которые могут активироваться или запускаться без необходимости в экзогенных стимулах (т.е. системы высвобождения обычно запускаются за счет эндогенной активности в клетке или ВВ или, по существу, в любой биологической системе), например, система высвобождения на основе цис-расщепляющего полипептида (например, на основе интеинов), система высвобождения на основе комплекса сигнал ядерной локализации (NLS) - сигнал ядерной локализации-связывающего белка (NLSBP) или системы высвобождения на основе других белковых доменов. В одном из вариантов осуществления можно использовать мономерную систему высвобождения на основе индуцируемого светом расщепления, где используется только очень короткая вспышка света для запуска эндогенного протеолитического расщепления мономерного белкового домена и высвобождения Pol.
В предпочтительном варианте осуществления настоящее изобретение относится к ВВ, содержащей представляющий интерес полипептид, который присоединяется, с возможностью высвобождения, к системе высвобождения на основе интеина, и/или представляющий интерес полипептид (Pol), который высвобождается из системы высвобождения на основе интеина внутри ВВ или внутри целевой клетки или целевого органа. Типичная полипептидная конструкция, в которой используется система высвобождения на основе интеина, может быть схематически описана следующим образом (приведенное ниже обозначение не следует рассматривать как демонстрирующую какое-либо направление, от С и/или N-конца, оно просто является иллюстрацией):
Pol - цис-расщепляющий полипептид - экзосомальный белок.
Альтернативно, полипептидная конструкция может быть сконструирована таким образом, чтобы она включала нацеливающий фрагмент, который будет обнаруживаться на поверхности ВВ, для еще большего увеличения ее терапевтического потенциала путем нацеливания на представляющий интерес тип ткани или клетки:
Pol - цис-расщепляющий полипептид - экзосомальный белок - нацеливающий фрагмент.
Система высвобождения на основе цис-расщепляющего полипептида может представлять собой систему с быстрым или медленным расщеплением. В некоторых случаях можно использовать быстро расщепляющую цис-расщепляющую систему высвобождения (такую как быстро расщепляющий цис-расщепляющий интеин), тогда как медленно расщепляющая система высвобождения может быть выгодной в других условиях. Как правило, медленно расщепляющую систему высвобождения можно использовать для предоставления большего времени для загрузки Pol в ВВ, тогда как быстро расщепляющая система может оказаться предпочтительной, когда необходимо быстро собрать ВВ.
В предпочтительном варианте осуществления цис-расщепляющая система высвобождения основана на интеиновой системе, где С-концевая часть интеина может содержать аминокислотные последовательности Val-Val-Val-His-Asn or Val-Val-Val-His-Asn-Cys. Для целей настоящего изобретения также может быть использован укороченный или иным способом оптимизированный интеин, т.е. интеин, в котором одна или более аминокислот удалены или заменены для усиления функциональной активности. Не ограничиваясь какой-либо теорией, предполагается, что укорочение или мутация, приводящая к усилению функциональной активности, могут повысить чувствительность интеина к pH, что еще больше увеличит его ценность тносительно высвобождения биологически активных Pol из системы доставки на основе ВВ, поскольку обеспечивается возможность интернализации ВВ в клетки через процессы эндоцитоза. Однако, в более широком смысле, цис-расщепляющая система высвобождения может быть выбрана из группы цис-расщепляющих систем, включающих различные другие системы высвобождения на основе полипептидов, например, из цис-расщепляющих систем высвобождения на основе сортазы А, N-концевой протеазы, FrpC и цистеинпротеазы или других подходящих цис-расщепляющих систем высвобождения и любых их комбинаций. Цис-расщепляющие белки высвобождения могут быть преимущественно присоединены к концам находящегося внутри экзосомы полипептида, обеспечивая высвобождение Pol внутри ВВ или в мембрану ВВ, хотя также можно использовать другие точки присоединения, например, точки для встроенного присоединения.
В одном из вариантов осуществления изобретения высвобождение Pol из экзосомального полипептида, который направил Pol в ВВ, может быть достигнуто через индуцируемое светом расщепление. В отличие от предшествующего уровня техники в настоящем изобретении используются мономерные системы высвобождения через индуцируемое светом расщепление, активируемые кратковременной вспышкой света, которые могут быть выбраны из группы, включающей мономерные белки, такие как Kaede, KikGR, EosFP, tdEosFP, mEos2 PSmOrange и GFP-подобные белки Dendra и Dendra2. В отличие от систем оптогенетической димеризации, таких как CRY2-CIBN, мономерные белки, такие как Dendra, Kaede, KikGR, EosFP, tdEosFP, mEos2, PSmOrange и Dendra2, имеют преимущества отщепления только небольшого остаточного полипептидного домена на Pol, что означает, что биоактивность доставляемого Pol не подвергается негативному воздействию. Кроме того, в отличие от доменов оптогенетической димеризации, системы высвобождения через индуцируемое светом расщепление значительно легче контролировать, что подразумевает высокоточную загрузку Pol в ВВ. Таким образом, системы высвобождения на основе индуцируемого светом расщепления по настоящему изобретению обеспечивают высоко контролируемое высвобождение Pol в нужные моменты времени в нужных местах, как in vitro, так и in vivo, просто путем воздействия света подходящей длины волны (в случае Dendra, Kaede, KikGr и большинства других протеинов высвобождения на основе расщепления, индуцируемого светом либо УФ, либо синим светом, тогда как в случае PSmOrange используются более длинные волны в красно-оранжевом спектре. Важно отметить, что для системы высвобождения через индуцируемое светом расщепление просто требуется очень короткая вспышка света для запуска эндогенного процесса расщепления, что означает возможность избежать потенциально токсических эффектов, вызываемых длительным и трудоемким процессом воздействия света. Полипептидные конструкции, основанные на системах высвобождения через индуцируемое светом расщепление могут быть схематически описаны следующим образом (приведенное ниже обозначение не следует рассматривать как демонстрирующую какое-либо направление, от С и/или N-конца, оно просто является иллюстрацией):
Pol - Dendra - экзосомальный белок,
Pol - Kaede - экзосомальный белок.
В подходящее время в процессе продуцирования ВВ полипептидную конструкцию, содержащую Pol, систему индуцируемого светом расщепления и экзосомальный полипептид, подвергают воздействию вспышки света подходящей длины волны, приводящему к расщеплению и высвобождению Pol. При кратковременном воздействии ультрафиолетового или синего света Dendra или другие мономерные белки высвобождения через индуцируемое УФ/синим светом расщепление, которые могут быть вставлены в виде белка слияния между Pol и экзосомальным полипептидом, отщепляются через внутреннее расщепление пептидного остова, освобождая Pol и экзосомальный белок. Небольшие полипептидные домены могут оставаться как на Pol, так и на экзосомальном полипептиде, но присутствие этих небольших остатков не препятствует проявлению активности Pol.
В еще одном варианте осуществления настоящего изобретения система высвобождения может быть основана на взаимодействии между сигнал ядерной локализации (NLS)-связывающим полипептидом (NLSBP) и NLS. Система высвобождения NLSBP-NLS может содержать по меньшей мере один Pol, содержащий по меньшей мере один классический или неклассический NLS. В качестве дополнительной альтернативы можно использовать NLS-подобные последовательности (NLSLS), которые связываются с NLSBP, но не запускают процесс импорта Pol в ядро при помощи NLSLS. NLS может представлять собой встречающуюся в природе NLSLS или NLS (как в случае большинства Pol, предназначенных для ядра, например, факторов транскрипции и нуклеаз) с перекрывающимся РНК/ДНК-связывающим доменом или без него, или NLS, рекомбинантно слитый с Pol, который в принципе не содержит NLS. Экзосомальный полипептид, в свою очередь, модифицируют путем введения подходящего NLSBP (например, из семейств импортинов альфа или бета, например импортин альфа KPNA1, или любых других белков, участвующих в ядерном импорте), что обеспечивает присоединение, с возможностью высвобождения, между NLS-содержащим Pol и NLSPB-содержащим экзосомальным полипептидом при эндогенной активации NLS-NLSBP системы высвобождения. Триггер высвобождения Pol обычно запускается конкуренцией между различными парами NLS-NLSBP, приводя к высвобождению Pol. Полипептидные конструкции, основанные на NLS-NLSBP системах высвобождения, могут быть схематически описаны следующим образом (приведенное ниже обозначение не следует рассматривать как демонстрирующую какое-либо направление, от С и/или N-конца, оно просто является иллюстрацией):
Pol - NLS-NLSBP - экзосомальный белок.
Как указано выше, NLSBP, присутствующие в целевой клетке, будут вытеснять (после ВВ-опосредованной доставки NLS-содержащего Pol) NLSBP-содержащий экзосомальный полипептид, в результате чего произойдет эндогенное высвобождение Pol и его транспортировка в нужный клеточный компартмент. Естественно, система высвобождения на основе NLSBP-NLS очень подходит для представляющих интерес полипептидов, которые должны проявлять требуемую активность в ядре и/или ядрышке, однако представляющие интерес белки, предназначенные для цитоплазмы или других внутриклеточных компартментов, также совместимы с NLS-NLSBP системой высвобождения, особенно когда вместо NLS используется NLSLS. Неограничивающие примеры систем высвобождения NLSBP-NLS могут включать следующие: KPNA1-NRF2, KPNA6-STAT3, KPNB1-STAT3, KPNA2- и HSF1. NLSBP могут содержать импортины из семейств импортинов альфа и бета и другие NLS-связывающие белки, включая KPNA1, KPNA2, KPNA3, KPNA4, KPNA5, KPNA6, KPNA7, KPNB1, IPO4, IPO5, IPO7, IPO8, IPO9, IPO11, IPO13, TPNO1, TNPO2, TNPO3, HIKESHI, SNUPN, HEATR3 и другие RAN-связывающие белки. NLS-содержащие белки могут быть выбраны из неограничивающих примеров, таких как факторы транскрипции, нуклеазы и другие ядерные белки, такие как CREB, C/EBP, bZIP, bHLH, MyoD, cMyc, SERBP, NF-1, Cys4, GATA-факторы, OCT4, NANOG, KLF4, SOX2, HSF1, STAT3, SMAD3, p53, MEF2, SRF, NFkB, CAS9, нуклеазы цинкового пальца, hnRNPA1, hnRNPA2, NUP153, RPL23A, RPS7, RPL5, RPL23A, H2A, H2B, гистоны H3 и H4, TNRC6A, SRP19, SNAI1, PRKCI, HSP70, U1 snRNP, U2 snRNP, U4 snRNP, U5 snRNP и U6 snRNP. Как правило, неограничивающими примерами подходящих Pol являются, например, нуклеазы, такие как Cas и Cas9 (которые являются РНК-направляемой ДНК-эндонуклеазой из Streptococcus pyogenes, среди других бактерий); связанные с транскрипцией белки, такие как NF-κB и NRF2; ДНК-связывающие белки, такие как гистоны и полимеразы; РНК-связывающие белки, такие как hnRNPA1-2 и белок оболочки MS2, которые можно использовать для транспорта различных типов РНК; антитела и/или интратела с ядерными мишенями, ферменты для ферментозаместительной терапии, такие как NPC1, NPC2 и GBA, и т.д. Предпочтительным примером настоящего изобретения является слияние KPNA1 с CD63 и коэкспрессия с MyoD в подходящей клетке-источнике ВВ, такой как MSC или эпителиальная клетка амниона, таким образом, получая терапевтические ВВ в высокой степени пригодных для лечения, например, DMD.
Как указано выше, настоящее изобретение относится к терапевтическим средствам на основе ВВ, содержащим, по существу, любой представляющий интерес полипептид (Pol), обычно для терапевтических или профилактических целей, но потенциально также для косметических целей. Pol, один или более, если используется множество (т.е., более одного) Pol, может быть любым подходящим полипептидом, т.е., любой молекулой, содержащей множество аминокислот, т.е., белком или пептидом. Pol может быть выбран из любого из следующих неограничивающих примеров терапевтических, профилактических или косметических полипептидов: антител, интрател, одноцепочечных вариабельных фрагментов (scFv), аффител, биспецифических или мультиспецифических антител или связующих, рецепторов, лигандов, ферментов такие как ферменты, отсутствующие и/или дефектные при лизосомальных болезнях накопления (LSD), онкосупрессоров, таких как p53, pVHL, APC, CD95, ST5, YPEL3, ST7 и ST14, вирусных или бактериальных ингибиторов, белков клеточных компонентов, ДНК и/или РНК-связывающих белков, нуклеаз, таких как Cas, Cas9 и Cpf1, протеаз, интеграз, факторов транскрипции, факторов роста, ингибиторов и индукторов апоптоза, структурных белков, ионных каналов, мембранных транспортеров, факторов протеостаза, белков, участвующих в передаче клеточных сигналов, белков, относящихся к трансляции и транскрипции, нуклеотид-связывающих белков, белок-связывающих белков, липид-связывающих белков, гликозаминогликанов (GAG) и GAG-связывающих белков, метаболических белков, белков, регулирующих клеточный стресс, белков, регулирующих воспаление и иммунную систему, митохондриальных белков, белков теплового шока и т.д. Тот факт, что ВВ позволяют достигать внутриклеточной среды с высокой эффективностью, означает возможность воздействия лекарственными веществами на огромное количество внутриклеточных мишеней. Таким образом, представляющий интерес терапевтический белок (Pol), как правило, представляет собой либо белок, который связывается с внутриклеточной мишенью (например, интратело к онкогенному белку, такому как c-Myc, либо рецептор-ловушка, связывающий своего партнера при внутриклеточном взаимодействии), либо Pol, который предназначен для осуществления внутриклеточно требуемого воздействия (Pol может представлять собой, например, дистрофин для лечения мышечной дистрофии Дюшенна (DMD), Pol для замены отсутствующего или дефектного белка (например, фермента, такого как NPC1, GBA или AGAL и т.д.) в ферментозаместительной терапии, белок Хантингтина или BDNF для лечения, например, болезни Хантингтона или других нейродегенеративных расстройств), онкосупрессор, такой как р53, для лечения рака, либо ингибитор NFkB для лечения воспалительных заболеваний. Представляющие интерес мишени для интрател, доставляемых с помощью ВВ по настоящему изобретению, могут включать патологические формы альфа-синуклеина, LRRK2, Tau, бета-амилоида, APP, C9orf72, SOD1, TDP43, FUS и прионных белков. Одним из классов Pol со значительным терапевтическим потенциалом являются РНК-связывающие белки (RBP), которые могут быть использованы для облегчения внутриклеточной доставки РНК-терапевтических агентов, таких как агенты мРНК, РНКи, такие как короткие шпилечные РНК или микроРНК, или антисмысловые агенты для сплайсинга-переключения или сайленсинга. Неограничивающими примерами РНК-связывающих белков являются hnRNPA1, hnRNPA2B1, DDX4, ADAD1, DAZL, ELAVL4, IGF2BP3, SAMD4A, TDP43, FUS, FMR1, FXR1, FXR2, EIF4A1-3, белок оболочки MS2, а также их любые домены, части или производные. В более широком смысле, конкретные подклассы РНК-связывающих белков и доменов включают, например, мРНК-связывающие белки (mRBP), пре-рРНК-связывающие белки, тРНК-связывающие белки, малые ядерные или нуклеолярные РНК-связывающие белки, некодирующие РНК-связывающие белки и факторы транскрипции (TF). Кроме того, в качестве Pol для транспортировки загруженной РНК также можно использовать различные домены и производные. Неограничивающие примеры РНК-связывающего Pol включают малые РНК-связывающие домены (RBD) (которые могут быть как одноцепочечными, так и двухцепочечными RBD (ssRBD и dsRBD)), такие как DEAD, KH, GTP_EFTU, dsrm, G-patch, IBN_N, SAP, TUDOR, РНазаA, MMR-HSR1, KOW, РНазаT, MIF4G, zf-RanBP, NTF2, PAZ, RBM1CTR, PAM2, Xpo1, Piwi, CSD и рибосомный_L7Ae. Такие РНК-связывающие домены могут присутствовать в больших количествах отдельно или в комбинации с другими и также могут образовывать часть более крупной конструкции на основе РНК-связывающего белка при условии сохранения их ключевой функции (т.е. способности транспортировать представляющую интерес загруженную РНК, например, мРНК или короткую РНК).
Кроме того, как упомянуто выше, экзосомальные полипептиды по настоящему изобретению могут представлять собой по существу любой подходящий полипептид, который обеспечивает транспортировку в ВВ по меньшей мере одного Pol. Как упомянуто выше, фактическая локализация Pol после его переноса в ВВ может варьировать в зависимости от природы экзосомального полипептида и/или природы Pol, т.е. Pol может быть транспортирован в просвет ВВ, в мембрану ВВ, к месту, связанному с мембраной и/или в любую другую подходящую часть ВВ. Неограничивающими примерами таких экзосомальных полипептидов являются, например, CD81, Itab1, Mfge8, CD63, CD151, Hspg2, Lgals3bp, Col6a1, Agrn, Tspan14, Lamc1, Lamb1, Tfrc, CD47, CD82, Slit2, синтенин, Alix, синдекан, синаптотагмин, Lamp2, Lamp2b, CD13, CD86, флотилин, синтаксин-3, LiCAM, LFA-1, Mac-1 альфа и бета, Vti-1A и B, ICAM-1, CD2, CD18, CD37, CD36, CD53, CD82, CXCR4, FcR, CD40, CD40L, CD41a, CD44, CD45 и тетраспанины, GluR2/3, HLA-DM, иммуноглобулины, MHC-I или MHC-II и их компоненты, а также TCR-бета и многочисленные другие полипептиды, способные транспортировать в ВВ полипептидную конструкцию, содержащую Pol.
В еще одном варианте осуществления ВВ по настоящему изобретению дополнительно содержат по меньшей мере один нацеливающий фрагмент. Как правило, нацеливающий фрагмент присутствует на поверхности ВВ (т.е., выступает из мембраны ВВ во вневезикулярную среду) обычно в форме слитых белков между нацеливающим фрагментом и белком ВВ, способствуя достижению нужной ткани или типа клеток in vivo и/или in vitro. ВВ также могут содержать усилители проникновения для улучшения проникновения в выбранные ткани или компартменты. Такими усилителями проникновения могут быть пептиды или полипептиды, экспрессируемые на поверхности ВВ в виде слитых конструкций с подходящим экзосомальным полипептидом. Усилителями проникновения могут представлять собой, например, проникающие в клетки пептиды (СРР) (такие как Tat, транспортан, транспортан 10, поли-Arg, MPG, Pep-1, пенетратин и т.д.), антитела (способные воздействовать на рецепторы клеточной поверхности, способствующие интернализации, например, рецептор трансферрина или рецептор инсулина) или аффитела, или молекулы любого другого типа, которые позволяют увеличить интернализацию и/или проникновение ВВ в ткани. По аналогии с нацеливающими фрагментами усилители проникновения могут экспрессироваться на поверхности ВВ путем создания слитых конструкций между экзосомальным полипептидом и по меньшей мере одним усилителем проникновения.
В еще одном аспекте настоящее изобретение относится к высокоэффективному способу получения большого количества ВВ, обладающих высокой терапевтической эффективностью. Способы по настоящему изобретению включают этапы (а) введения в исходную клетку по меньшей мере одной полинуклеотидной конструкции, которая кодирует по меньшей мере один Pol, эндогенно активируемую систему высвобождения на основе полипептида и экзосомальный полипептид, и (b) экспрессии соответствующего(-их) полипептида(-ов) из полинуклеотидной конструкции(-ий). Как правило, способ также включает этап (с) сбора ВВ, сгенерированных (т.е. высвобожденных) исходной клеткой, в которую ВВ высвободили Pol посредством эндогенного запуска домена высвобождения на основе белка.
Введение подходящих полинуклеотидных конструкций в исходную клетку (как правило, клеточную культуру, содержащую подходящий тип продуцирующих ВВ клеток для продуцирования ВВ) может быть достигнуто различными общепринятыми методами, такими как трансфекция, вирус-опосредованная трансформация, электропорация и т.д. Трансфекция может быть осуществлена с использованием обычных реагентов для трансфекции, таких как липосомы, CPP, катионные липиды или полимеры, фосфат кальция, дендримеры и т.д. Вирус-опосредованная трансфекция также является весьма подходящим методом и может быть осуществлена с использованием обычных вирусных векторов, таких как аденовирусные или лентивирусные векторы. Вирус-опосредованная трансформация особенно актуальна при создании стабильных клеточных линий для создания банка клеток, т.е., для создания главного банка клеток (MCB) и рабочих банков клеток (WCB), которые являются источником продуцирующих ВВ клеток.
В некоторых случаях может оказаться полезным введение более одной полинуклеотидной конструкции, например, в случае использования NLS-NLSBP системы высвобождения. В таких случаях полипептидные конструкции, кодируемые полинуклеотидными конструкциями, будут транслироваться отдельно с последующим требуемым специфическим взаимодействием между полипептидами (например, между Pol, содержащим NLS, и экзосомальным белком, слитым с NLSBP) внутри исходной клетки после трансляции. Если, с другой стороны, используется мономерная система, такая как система высвобождения на основе белка Dendra или система высвобождения через цис-расщепление (например, система высвобождения на основе интеина), более выгодным может оказаться введение в исходную клетку одной полинуклеотидной конструкции для кодирования одной полипептидной конструкции. В дополнительном варианте осуществления продуцирование ВВ клетками клеточной культуры может быть улучшено путем воздействия на клетки различных условий, которые могут индуцировать усиленное продуцирование ВВ. Сывороточное голодание, гипоксия, воздействие цитокинов, таких как TNF-альфа или интерфероны, антибиотиков, таких как бафиломицин, и других веществ являются методами, которые можно использовать для усиления продуцирования ВВ, увеличения выхода, а также улучшения качества ВВ.
В дополнительных аспектах настоящее изобретение также относится к полинуклеотидным и полипептидным конструкциям по изобретению. Полинуклеотидные конструкции по настоящему изобретению обычно содержат нуклеотидные участки, кодирующие по меньшей мере один Pol, по меньшей мере одну эндогенно активируемую систему высвобождения на основе полипептида или часть системы высвобождения на основе полипептида и по меньшей мере один экзосомальный полипептид. Неограничивающим примером может быть полинуклеотидная конструкция, кодирующая фермент Pol (такой как NPC1 или GBA) для лечения лизосомальных болезней накопления, цис-расщепляющий интеин и экзосомальный полипептид, такой как CD81, синтенин или CD63. Таким образом, настоящее изобретение, естественно, также относится к соответствующим полипептидным конструкциям, т.е., к полипептидным конструкциям, содержащим по меньшей мере один Pol, по меньшей мере одну эндогенно инициируемую систему высвобождения на основе полипептида или часть системы высвобождения на основе полипептида и по меньшей мере один экзосомальный полипептид. Кроме того, настоящее изобретение также относится к продуцирующим ВВ клеткам (обычно клеткам, присутствующим в форме клеточной культуры, но также и отдельным клеткам как таковым), содержащим вышеупомянутую полинуклеотидную(-ые) конструкцию(-и) и/или вышеупомянутый(-ые) полипептид(-ы).
В другом аспекте настоящее изобретение относится к способам доставки Pol во внутриклеточную среду или в мембрану целевой клетки либо in vitro, либо in vivo. Способы включают контактирование целевой клетки с ВВ, содержащей либо (i) Pol, который присоединяется, с возможностью высвобождения, к экзосомальному полипептиду при помощи эндогенно активируемой системы высвобождения на основе пептида, либо (ii) Pol, который освобождается от экзосомального полипептида либо внутри ВВ, либо внутри целевой клетки. Важно, что в отличие от предшествующего уровня техники, Pol по настоящему изобретению доставляются в целевые клетки в практически неконъюгированной форме, т.е. рассматриваемый Pol не является конъюгированным с большим экзосомальным белком (или в случае димерных оптогенетических белков, оптогенетическим димером), который потенциально может препятствовать активности Pol. Например, в WO 2014/168548 описаны экзосомы, содержащие представляющие интерес терапевтические полипептиды, которые конъюгированы с экзосомальными белками, что является превосходной стратегией для определенных типов терапевтических белков, которые способны проявлять требуемую активность, несмотря на то, что они конъюгированы с экзосомальным белком. Однако способы по настоящему изобретению позволяют доставлять гораздо более широкий диапазон терапевтических Pol посредством управляемых эндогенно активируемых систем высвобождения по изобретению, которые высвобождают Pol в требуемом(-ых) месте(-ах) без необходимости воздействия каких-либо экзогенных стимулов.
В некоторых вариантах осуществления по настоящему изобретению Pol может представлять собой цельный мембранный белок, конъюгированный с экзосомальным полипептидом при помощи систем эндогенно запускаемого высвобождения на основе белка. Интегрированный в мембрану Pol может находиться на внешней, внутренней или обеих поверхностях ВВ. Не ограничиваясь какой-либо теорией, предполагается, что после поглощения ВВ целевой клеткой, содержащий полипептидную конструкцию, которая, в свою очередь, содержит интегрированный в мембрану Pol, переносится в эндоплазматический ретикулум (ER). Содержимое ВВ, т.е., полипептидная конструкция, содержащая интегрированный в мембрану Pol, может быть обработана и отсортирована в ВВ с последующим ВВ-опосредованным переносом в соответствующий компартмент целевой клетки. Таким образом, полипептидная конструкция, содержащая экзосомальный белок, конъюгированный через систему высвобождения на основе полипептида с интегрированным в плазматическю мембрану белком (например, рецептором, связанным с G-белком (GPCR)), будет доставлена на плазматическую мембрану целевой клетки, тогда как мембранный белок, присутствующий в естественных условиях в лизосомальной мембране (т.е., лизосомальный мембранный белок), будет доставлен в лизосому целевой клетки. Одним из особенно важных примеров мембранного Pol является NPC1, который представляет собой мембранный транспортер холестерина, и дефект которого приводит к болезни накопления, такой как болезнь Ниманна-Пика.
Высвобождение Pol опосредовано, как указано выше, эндогенно активируемой системой высвобождения на основе полипептида, которая слита с Pol и/или с экзосомальным полипептидом. В предпочтительном варианте осуществления полинуклеотидная конструкция, впоследствии кодирующая полипептидную конструкцию, создана таким образом, чтобы система высвобождения находилась между Pol и экзосомальным полипептидом. Такая компоновка позволяет легко изготавливать конструкции и эффективно высвобождать Pol в нужном месте.
В еще одном аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим ВВ по настоящему изобретению. Как правило, фармацевтические композиции по настоящему изобретению содержат по меньшей мере терапевтические ВВ одного типа (т.е., популяцию ВВ, содержащих определенный требуемый Pol) в составе по меньшей мере с одним фармацевтически приемлемым формообразующим веществом. По меньшей мере, одно фармацевтически приемлемое формообразующее вещество может быть выбрано из группы, содержащей любой фармацевтически приемлемый материал, композицию или несущую среду, например твердый или жидкий наполнитель, разбавитель, формообразующее вещество, носитель, растворитель или инкапсулирующий материал, который может способствовать, например, временному прекращению проявления или сохранению активности или переносу или транспортировке терапевтических везикул доставки из одного органа или части тела в другой орган или часть тела (например, из крови в любую представляющую интерес ткань и/или орган и/или часть тела).
Настоящее изобретение также относится к косметическому применению ВВ, содержащих Pol. Таким образом, настоящее изобретение относится к продуктам для ухода за кожей, таким как кремы, лосьоны, гели, эмульсии, мази, пасты, пудры, линименты, солнцезащитные кремы, шампуни и т.д., содержащие подходящую ВВ, для улучшения и/или облегчения симптомов и таких проблемных явлений, как сухость кожи, морщины, складки, гребешки и/или бороздки на коже. В одном из вариантов осуществления как косметического, так и терапевтического характера ВВ по настоящему изобретению могут содержать ботулинический токсин (например, ботокс, например, ботулинический токсин типа A-G) в качестве Pol (ботулинические токсины не обязательно можно использовать только для косметических применений, их также можно использовать для лечения мигрени и дистонии). В предпочтительном варианте осуществления ВВ (которые содержат по меньшей мере один тип Pol), получаемые из подходящей продуцирующей экзосомы клетки с регенеративными свойствами (такой как мезенхимальная стволовая клетка), содержатся в косметическом креме, лосьоне или геле для применения с целью косметического или терапевтического уменьшения морщин, линий, складок, гребней и/или бороздок на коже.
В еще одном аспекте настоящее изобретение относится к ВВ по настоящему изобретению для применения в медицине. Естественно, когда ВВ, содержащя Pol по настоящему изобретению, используется в медицине, фактически обычно используется популяция ВВ. Доза ВВ, вводимая пациенту, будет зависеть от количества Pol, загруженных в ВВ, заболевания или симптомов, которые необходимо вылечить или облегчить, пути введения, фармакологического действия самого Pol, а также различных других значимых параметров.
ВВ по настоящему изобретению могут быть использованы в профилактических и/или терапевтических целях, например, для профилактики и/или лечения и/или облегчения различных заболеваний и расстройств. Неограничивающий пример заболеваний, для которых могут применяться ВВ по настоящему изобретению, включает болезнь Крона, язвенный колит, анкилозирующий спондилит, ревматоидный артрит, рассеянный склероз, системную красную волчанку, саркоидоз, идиопатический легочный фиброз, псориаз, периодический синдром ассоциированный с рецептором фактора некроза опухоли (TNF) (TRAPS), дефицит антагониста рецептора интерлейкина-1 (DIRA), эндометриоз, аутоиммунный гепатит, склеродермию, миозит, инсульт, острое повреждение спинного мозга, васкулит, синдром Гийена-Барре, острый инфаркт миокарда, ARDS, сепсис, менингит, энцефалит, печеночную недостаточность, почечную недостаточность, болезнь трансплантат-против-хозяина, мышечную дистрофию Дюшенна и другие мышечные дистрофии, лизосомальные болезни накопления, такие как болезнь Гоше, болезнь Фабри, MPS I, II (синдром Хантера) и III, болезнь Ниманна-Пика, болезнь Помпе и др., нейродегенеративные заболевания, включая болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона и другие заболевания, связанные с тринуклеотидными повторами, деменцию, ALS, вызванную раком кахексию, анорексию, сахарный диабет 2 типа и различные виды рака.
Фактически все типы рака являются релевантными мишенями для настоящего изобретения, например, острый лимфобластный лейкоз (ALL), острый миелоидный лейкоз, адренокортикальная карцинома, связанная со СПИДом карцинома, связанная со СПИДом лимфома, рак анального канала, рак аппендикса, мозжечковая или церебральная астроцитома, базально-клеточная карцинома, рак желчных протоков, рак мочевого пузыря, опухоль костей, глиома ствола головного мозга, рак головного мозга, опухоль головного мозга (мозжечковая астроцитома, церебральная астроцитома/злокачественная глиома, эпендимома, медуллобластома, супратенториальные первичные нейроэктодермальные опухоли, глиома зрительного пути и гипоталамическая глиома), рак молочной железы, бронхиальные аденомы/карциноиды, лимфома Беркитта, карциноидная опухоль (детская, желудочно-кишечная), карцинома с неизвестной первичной локализации, лимфома центральной нервной системы, мозжечковая астроцитома/злокачественная глиома, рак шейки матки, хроническая лимфоцитарная лейкемия, хронический миелоидный лейкоз, хронические миелопролиферативные заболевания, рак толстой кишки, Т-клеточная лимфома кожи, десмопластическая мелкоклеточная опухоль, эндометриальный рак, эпендимома, рак пищевода, экстракраниальная герминоклеточная опухоль, экстрагонадная герминоклеточная опухоль, рак внепеченочных желчных протоков, рак глаза (внутриглазная меланома, ретинобластома), рак желчного пузыря, рак желудка, карциноидная опухоль желудочно-кишечного тракта, гастроинтестинальная стромальная опухоль (GIST), опухоль из зародышевых клеток (экстракраниальная, эестрагонадная или яичников), гестационная трофобластическая опухоль, глиома (глиома ствола головного мозга, церебральная астроцитома, глиома зрительного пути и гипоталамическая глиома), карциноид желудка, волосатоклеточный лейкоз, рак головы и шеи, рак сердца, гепатоцеллюлярный (печень) рак, лимфома Ходжкина, рак гипофарингеальной области, внутриглазная меланома, карцинома островковых клеток (эндокринной поджелудочной железы), саркома Капоши, рак почки (почечно-клеточный рак), рак гортани, лейкозы (острый лимфобластный (также называемый острым лимфоцитарным лейкозом), острый миелоидный (также называемый острым миелогенным лейкозом), хронический лимфоцитарный (также называемый хроническим лимфоцитарным лейкозом), хронический миелогенный (также называемый хроническим миелоидным лейкозом), волосатоклеточный лейкоз), рак губ и полости рта, липосаркома, рак печени (первичный), рак легких (немелкоклеточный, мелкоклеточный), лимфомы (связанная со СПИДом лимфома, лимфома Беркитта, Т-клеточная лимфома кожи, лимфома Ходжкина, неходжкинская лимфома (старая классификация всех лимфом, кроме лимфомы Ходжкина), первичная лимфома центральной нервной системы), медуллобластома, карцинома Меркеля, мезотелиома, метастатический плоскоклеточный рак шейки матки с латентной первичной формой, рак рта, синдром множественной эндокринной неоплазии, множественная миелома/неоплазия плазматических клеток, грибовидный микоз, миелодиспластические/миелопролиферативные заболевания, миелогенный лейкоз, хронический миелоидный лейкоз (острый, хронический), миелома, рак полости носа и околоносовых пазух, назофарингеальная карцинома, нейробластома, рак полости рта, орофарингеальный рак, остеосаркома/злокачественная фиброзная гистиоцитома кости, рак яичников, эпителиальный рак яичников (поверхностная эпителиально-стромальная опухоль), герминоклеточная опухоль яичников, опухоль яичников с низким злокачественным потенциалом, рак поджелудочной железы, рак островковых клеток поджелудочной железы, рак околощитовидной железы, рак полового члена, рак глотки, феохромоцитома, астроцитома шишковидного тела, герминома шишковидной железы, пинеобластома и супратенториальные примитивные нейроэктодермальные опухоли, аденома гипофиза, плевро-легочная бластома, рак предстательной железы, рак толстой кишки, почечно-клеточная карцинома (рак почки), ретинобластома, рабдомиосаркома, рак слюнных желез, саркома (семейство опухолей саркомы Юинга, саркома Капоши, саркома мягких тканей, саркома матки), сезарный синдром, рак кожи (немеланома, меланома), плоскоклеточный рак тонкой кишки, плоскоклеточный рак шеи, рак желудка, супратенториальная первичная нейроэктодермальная опухоль, рак яичка, рак горла, тимома и карцинома тимуса, рак щитовидной железы, переходно-клеточный рак почечной лоханки и мочеточника, рак мочеточника, рак матки, саркома матки, рак влагалища, вульварный рак, макроглобулинемия Вальденстрема и/или опухоль Вильмса.
ВВ по настоящему изобретению можно вводить человеку или животному различными способами, например аурикулярным (в ухо), буккальным, конъюнктивальным, наружным, дентальным, электроосмотическим, эндоцервикальным, эндосинусиальным, эндотрахеальным, энтеральным, эпидуральным, экстраамниотическим, экстракорпоральным, гемодиализным, путем инфильтрации, интерстициальным, интраабдоминальным, интраамниотическим, внутриартериальным, внутрисуставным, интрабилиарным, внутрибронхиальным, интрабурсальным, внутрисердечным, внутрихрящевым, интракаудальным, внутрикавернозным, внутриполостным, интрацеребральным, интрацистернальным, внутрироговичным, внутрикоронковым (дентальным), внутрикоронарным введением, веденеим в пещеристое тело, нутридермальным, введением в межпозвонковое пространство, интрадуктальным, интрадуоденальным, интрадуральным, внутриэпидермальным, внутрь пищевода, интрагастральным, введением внутрь десны, внутрь подвздошной кишки, внутриочаговым, интралюминальным, внутрилимфатическим, интрамедуллярным, внутриоболочечным, внутримышечным, внутриглазным, внутриматочным, внутриперикардиальным, интраперитонеальным, интраплевральным, внутрипростатным, внутрилегочным, внутрисинусным, интраспинальным, интрасиновиальным, внутрисухожильным, интратестикулярным, интратекальным, интраторакальным, внутритубулярным, внутриопухолевым, интратимпональным, внутриматочным, внутрисосудистым, внутривенным, внутривенным болюсным, внутривенным капельным, внутрижелудочковым, внутривезикулярным, внутривитреальным введением, при помощи ионофореза, спринцеванием, внутригортанным, назальным, назогастральным способом, при помощи герметичной повязки, глазным, пероральным введением, введением в орофарингиальную полость, другими способами, парентеральным, чрескожным, околосуставным, эдуральным, периневральным, периодонтальным, ректальным, респираторным (ингаляционным), ретробульбарным введением, введением в мягкие ткани, субарахноидальным, субконъюнктивальным, подкожным, подъязычным, сублингвальным, субмукозным, топическим, трансдермальным, трансмукозальным, трансплацентарным, транстрахеальным, транстимпаническим, уретеральным введением, введением в мочеточник и/или вагинальным введением и/или любой комбинацией вышеуказанных способов введения.
В дополнительном аспекте настоящее изобретение относится, как указано выше, к способу получения ВВ (или, более точно, к получению популяций ВВ), включающему этапы (а) введения в источник клеток (обычно в культуру клеток) одной или более полинуклеотидных конструкций, кодирующих по меньшей мере один Pol, эндогенно активируемую систему высвобождения на основе полипептида и экзосомальный полипептид, (b) экспрессию полипептидной конструкции(-ий), кодируемой(-ых) полинуклеотидной(-ыми) конструкцией(-ями), и (c) сбор сгенерированных клеткой ВВ. Если для высвобождения Pol используется мономерная система индуцируемого светом расщепления, то способ получения содержит дополнительный этап кратковременного воздействия на ВВ светом подходящей длины волны. Этап воздействия света может осуществляться, когда ВВ все еще формируются внутри клеток, когда ВВ только что были высвобождены в среду для культивирования клеток, когда ВВ подвергаются дополнительной обработке (например, фильтрации с тангенциальным вводом потока (TFF), ультрафильтрации, хроматографии с элюированием на шариках, эксклюзионной хроматографии или любой их комбинации) или, по существу, всякий раз, когда это подходит, в зависимости от источника клеток, характеристик продукции ВВ и самих ВВ. Подходящие системы культивирования включают обычную 2D-культуру клеток, 3D-культуру клеток, биореакторы, биореакторы с полыми волокнами и т.д.
Способ также может включать такое воздействие на исходные клетки, как сывороточное голодание, гипоксия, воздействие бафиломицином или цитокинами, такими как TNF-альфа и/или IFN-гамма, для оказания влияния на выход или свойства получаемых ВВ. Масштаб продуцирования и временная шкала продуцирования ВВ будут сильно зависеть от клетки или линии клеток, продуцирующих ВВ, и, таким образом, могут быть соответствующим образом подобраны специалистом в данной области техники.
Способы получения могут дополнительно включать этап очистки, на котором ВВ очищают при помощи процедуры, выбранной из группы, включающей жидкостную хроматографию (ЖХ), ЖХ с элюированием на шариках, эксклюзионную ЖХ, высокоэффективную жидкостную хроматографию (ВЭЖХ), спиновую фильтрацию, фильтрацию с тангенциальным вводом потока, фильтрацию с полыми волокнами, центрифугирование, иммунопреципитацию и т.д. или любую их комбинацию.
В предпочтительном варианте осуществления очистку ВВ осуществляют путем последовательной комбинации фильтрации (предпочтительно ультрафильтрации (UF), фильтрации с тангенциальным вводом потока (TFF) или фильтрации с полыми волокнами) и жидкостной хроматографии с элюированием на шариках или эксклюзионной жидкостной хроматографии (ЖХ). Эта комбинация этапов очистки обеспечивает оптимизированную очистку, что, в свою очередь, дает превосходную терапевтическую активность. Кроме того, по сравнению с ультрацентрифугированием (UC), которое обычно используется для очистки экзосом, последовательная комбинация методов фильтрации и хроматографии значительно ускоряет процесс и позволяет увеличивать до более высоких объемов производства, что является существенным недостатком современного метода UC, который доминирует в предшествующем уровне техники.
Следует понимать, что вышеописанные иллюстративные аспекты, варианты осуществления, альтернативы и варианты могут быть модифицированы без отклонения от объема изобретения. Далее изобретение дополнительно проиллюстрировано прилагаемыми примерами, которые, естественно, также могут быть изменены в значительной степени без отклонения от объема и сущности изобретения.
Экспериментальная часть
Материалы и методы
Создание конструкции и клонирование
Оценивали различные цис-расщепляющие эндогенно активируемые системы высвобождения на основе полипептидов (таких как интеины с медленным расщеплением, интеины с быстрым расщеплением, сортаза A и FrpC) в комбинации с несколькими Pol (такими как Cre, NPC1, IL10, РНК-связывающий белок оболочки MS2) и экзосомальными полипептидами (CD81, CD63, CD9, синтенин, синдекан, Alix, CD133 и др.). Аналогичным образом, оценивали различные NLS-NLSBP системы высвобождения и мономерные системы индуцируемого светом высвобождения вместе с Pol и белками ВВ. NLS-NLSBP системы включают: KPNA1-NRF2, KPNA6-STAT3, KPNB1-STAT3, KPNA2-HSF1. NLSBP включают импортины из семейств импортинов альфа и бета и другие NLS-связывающие белки, включая KPNA1, KPNA2, IPO8, TPNO1, HIKESHI, SNUPN, HEATR3 и другие RAN-связывающие белки. Белки, содержащие NLS, включают различные факторы транскрипции, нуклеазы и другие ядерные белки, такие как bHLH, MyoD, cMyc, HSF1, STAT3, p53, NFkB, Cas9, HSP70 и snRNP U1. К мономерным системам индуцируемого светом расщепления относятся: Kaede, KikGR, EosFP и Dendra. Pol включают NPC1, GBA, AGAL, гентингтин, BDNF, супер-супрессор NFkB, РНК-связывающие белки и домены, такие как hnRNPA1, белок оболочки MS2, G-patch и т.д. В случае РНК-связывающих белков, их объединяли с представляющим интерес полинуклеотидом, который затягивал указанные РНК-связывающие белки в ВВ. Оценивали большое количество экзосомальных белков: CD81, CD63, CD9, синдекан, Alix, CD133, Синтенин-1, Синтенин-2, Lamp2b, TSPAN8 и TSPAN14, а также их варианты и домены.
При оценке конструкций цис-расщепляющей системы высвобождения и мономерной системы индуцируемого светом расщепления ОРС обычно генерировали путем синтеза и клонировали в вектор экспрессии в клетках млекопитающих pSF-CAG-Amp. Вкратце, синтезированную ДНК и векторную плазмиду расщепляли ферментами NotI и SalI в соответствии с инструкцией производителя (NEB). Подвергнутые рестрикции, очищенные фрагменты ДНК лигировали вместе при помощи лигазы Т4 в соответствии с инструкцией производителя (NEB). Успешные события лигирования отбирали путем бактериальной трансформации на чашках с добавлением ампициллина. Плазмиду для трансфекции создавали при помощи набора «Maxi-prep» в соответствии с инструкцией производителя.
В случае NLS-NLSBP системы высвобождения последовательности ОРС обычно приобретали на рынке (Origene Technologies, Inc.), амплифицировали и клонировали в сайт MSC A бицистронного вектора экспрессии pIRES (Clonetech, Laboratories Inc.), так что после трансляции NLSBP белок экспрессировался в виде химеры, слитой с экзосомальным полипептидом. NLS либо сливали с Pol, не содержащим NLS, либо с Pol, в котором уже присутствовал NLS иногда с генетическими модификациями. В большинстве случаев клонирование выполняли при помощи набора для клонирования для сборки ДНК NEBuilder HiFi (NEB, Inc.) и подтверждали секвенированием по Сэнгеру (Source BioScience). Вектор pIRES обеспечивает бицистронную экспрессию обоих трансгенов одновременно, таким образом, что в продуцирующих ВВ клетках осуществляется одновременная экспрессия обоих трансгенов. Плазмиды трансформировали в компетентные клетки NEB 5-альфа E. coli (NEB, Inc.) и выращивали в течение ночи во встряхиваемом инкубаторе в соответствии с рекомендациями производителя. Плазмиды выделяли и очищали при помощи набора «Maxi-prep» в соответствии с инструкциеями производителя (Macherey-Nagel).
Клеточная культура и трансфекция
В зависимости от плана эксперимента и анализов, в некоторых случаях невирусную временную трансфекцию и продуцирование экзосом осуществляли в традиционной 2D-культуре клеток, тогда как в других случаях использовали вирус-опосредованную трансдукцию для создания стабильных клеточных линий, которые обычно культивировали в биореакторах разного типа. Для краткости в настоящей заявке приведены только несколько примеров.
Клетки HEK293T обычно высевали в чашки размером 15 см (9×106 клеток на чашку) и оставляли на ночь в сыворотке, содержащей DMEM, рекомендованной ATCC. На следующий день клетки подвергали временной трансфиции при помощи ДНК-липидного комплекса (липоплексированной ДНК), который добавляли непосредственно к клеткам. Вкратце, ДНК и полиэтиленимин (PEI) инкубировали, каждый отдельно, в OptiMEM в течение 5 минут, а затем объединяли в течение 20 минут при комнатной температуре. Липоплексированную ДНК и клетки совместно инкубировали в течение 6 часов, после чего кондиционированную культуральную среду заменяли средой OptiMEM в течение 48 часов. Другие клетки и клеточные линии, которые оценивали в чашках, колбах и другой посуде для культивирования клеток, включали полученные из костного мозга мезенхимальные стромальные клетки (BM-MSC) и клетки, полученные из вортонова студня MSC (WJ-MSC), клетки амниона, фибробласты, различные эндотелиальные и эпителиальные клетки, а также различные иммунные клетки и клеточные линии.
В случае вирусной трансдукции и создания стабильных клеточных линий для различных комбинаций Pol, системы высвобождения и экзосомального полипептида источники клеток, таких как BM-MSC, WJ-MSC, фибробласты, клетки амниона, фибробласты, различные эндотелиальные и эпителиальные клетки, трансдуцировали вирусом, обычно лентивирусом (LV). Обычно за 24 часа до заражения в 6-луночный планшет высевали 100000 клеток (например, фибробласты, MSC и т.д.) или 200000 клеток (например, HEK293T). Добавляли 2 мкл LV и, необязательно, полибрен (или бромид гексадиметрина с конечной концентрацией в лунке 8 мкг/мл), и через 24 часа после трансдукции заменяли клеточную среду трансдуцированных клеток свежей полной средой. Через 72 часа после трансдукции осуществляли отбор при помощи пуромицина (4-6 мкг/мл), обычно в течение 7 дней, с последующим анализом стабильной экспрессии полипептидной конструкции.
Стабильные клетки культивировали либо в 2D-культуре, либо в биореакторах, обычно в биореакторах с полыми волокнами, и затем собирали кондиционированные среды для приготовления экзосом. Выполняли различные стадии приготовления и очистки. Стандартный рабочий процесс включал этапы предварительной очистки супернатанта, процесс концентрации путем фильтрации, удаление белковых загрязнений при помощи хроматографии и необязательное приготовление лекарственных составов полученной in vitro и/или in vivo экзосомальной композиции в подходящем буфере для анализов.
Анализы и аналитика
Вестерн-блот анализ - очень удобный аналитический метод для оценки обогащения Pol в ВВ. Вкратце, SDS-PAGE выполняли в соответствии с инструкцией производителя (Invitrogen, 4-12% PAGE гели Novex), таким образом в лунку загружали 1×1010 экзосом и 20 мкг клеточного лизата. Белки из SDS-PAGE геля переносили на мембрану PVDF в соответствии с инструкцией производителя (Immobilon, Invitrogen). Мембраны блокировали в блокирующем буфере Odyssey (Licor) и зондировали антителами против Pol и экзосомального белка в соответствии с инструкцией производителя (первичные антитела - Abcam, вторичные антитела - Licor). Молекулярные зонды визуализировали, используя волны длиной 680 и 800 нм. На фиг. 14 показаны результаты этого анализа для комбинации Cre рекомбиназы в качестве Pol и Alix в качестве экзосомального белка.
Для определения размера ВВ выполняли анализ траекторий движения наночастиц (NTA) при помощи прибора NanoSight, снабженного аналитическим программным обеспечением. Для всех записей использовали уровень камеры 13 или 15, и все параметры после приобретения устанавливались автоматически. Электронную микроскопию и флуоресцентную микроскопию часто использовали для определения местоположения и выделения Pol, а также для количественной оценки и анализа ВВ.
ВВ выделяли и очищали различными методами, обычно комбинацией фильтрации, такой как TFF, с ЖХ. Как правило, содержащие ВВ среды собирали и подвергали низкоскоростному центрифугированию при 300 g в течение 5 минут с последующим центрифугированием при 2000 g в течение 10 минут для удаления более крупных частиц и остатков клеток. Затем супернатант фильтровали через 0,22 мкм шприцевой фильтр и подвергали различным стадиям очистки. Большие объемы подвергали диафильтрации и концентрировали до примерно 20 мл при помощи устройства тангенциального ввода потока (TFF) Vivaflow 50R (Sartorius) с отсекающими фильтрами 100 кДа или при помощи системы TFF KR2i (SpectrumLabs) с фильтрами из полых волокон 100 или 300 кДа. Затем предварительно концентрированную среду загружали в колонки для элюентной хроматографии, заполненные шариками (колонки HiScreen или HiTrap Capto Core 700, GE Healthcare Life Sciences), соединенные с хроматографической системой ÄKTAprime plus или ÄKTA Pure 25 (GE Healthcare Life Sciences). Настройки скорости для уравновешивания колонки, загрузки образца и очистки колонки на месте выбирали в соответствии с инструкциями производителя. Образец собирали на основе УФ-абсорбционной хроматограммы и концентрировали, используя спин-фильтр, отсекающий по молекулярной массе Amicon Ultra-15 10 кДа (Millipore), до конечного объема 100 мкл, и хранили при -80°C для будущего последующего анализа. Для оценки профилей элюции белка и РНК среду концентрировали и подвергали диафильтрации, используя систему KR2i TFF со 100 кДа и 300 кДа фильтрами из полых волокон, и образец анализировали на колонке Tricorn 10/300 Sepharose 4 Fast Flow (S4FF) (GE Healthcare Life Sciences).
Примеры
На фиг. 3 показаны результаты анализа полученных от пациента лимфоцитов, дефицитных по GBA, которые были обработаны BM-MSC ВВ, обогащенными полипептидной конструкцией, содержащей интеин с медленным расщеплением, вставленный между ферментом GBA и экзосомальным белком CD63. Используя анализ на основе ВЭЖХ, было показано, что клетки реципиента демонстрируют снижение уровней липидного глюкоцереброзида после опосредованной ВВ доставки свободно высвобождаемого GBA. Аналогичный эксперимент проводили с использованием полипептидной конструкции, включающей в качестве Pol белок-переносчик липидов NPC1, систему быстрого расщепления на основе интеина и экзосомальный белок CD133. ВВ, включающие эту полипептидную конструкцию, эффективно доставляли NPC1 в NPC1-дефицитные фибробласты, что приводило к значимо более высокому уровню транспортировки функционального холестерина по сравнению с контрольными ВВ, содержащими нефункциональную систему высвобождения.
В другом примере использовали эндогенно активируемую систему высвобождения на основе N-концевой протеазы для слияния p53 в качестве Pol с синдеканом в качестве экзосомального белка в фибробластах в качестве родительской клетки, продуцирующей ВВ. ВВ-опосредованная доставка эндогенно активируемого высвобождения p53 в раковые клетки MDA-MB-231 in vitro была значительно более эффективной, чем доставка без высвобождения с использованием той же самой полипептидной конструкции ВВ.
На фиг. 5 показаны результаты анализа негомологичного присоединения концов (NHEJ). HEK293T-эритроциты, содержащие репортерную систему, трансфицировали экзосомами, содержащими гидовую РНК (гРНК) и полипептидную конструкцию, содержащую CD81 в качестве экзосомального полипептида, Kaede в качестве мономерной системы высвобождения через индуцируемое светом расщепление и Cas9 в качестве Pol. ВВ получали из клеточной культуры, которую подвергали или не подвергали воздействию кратковременной вспышки синего света в процессе получения экзосом. Только экзосомы, полученные из клеток, подвергшихся воздействию кратковременной вспышки света, которая индуцировала расщепление Kaede и, следовательно, высвобождение Cas9, показали увеличение процента положительных клеток. Аналогично, на фиг. 6 показаны результаты высокоточного анализа кинетики плавления (HRM) клеток, обработанных ВВ, собранных из клеток, подвергшихся воздействию света. ВВ, полученные из фибробластов, содержащие ту же полипептидную конструкцию, что и на фиг. 5, индуцировали Cas9-опосредованные мутации в локусе AAVS в результате эффективной внутриклеточной доставки биоактивных Cas9 и гРНК. На фиг. 7 показаны эффекты, выявленные в NHEJ анализе ВВ, полученных из эпителиальных клеток амниона и содержащих полипептидную конструкцию, содержащую Cas9, слитую с CD63 через мономерный полипептид Dendra2 индуцируемого светом высвобождения, который обеспечивает получение после облучения УФ/синим светом функционального Cas9 в ВВ. На фиг. 8 показаны результаты HRM для клеток, обработанных ВВ из WJ-MSC, собранных из клеток, подвергшихся воздействию УФ/синего света. ВВ, содержащие ту же полипептидную конструкцию (но на этот раз ВВ, полученные из WJ-MSC), что и на фиг. 7, индуцировали Cas9-опосредованные мутации в локусе AAVS благодаря эффективной внутриклеточной доставке биоактивных Cas9 и гРНК. На фиг. 9 показана устойчивое подавление ответа NfKB, достигаемое ВВ из HEK, загруженными полипептидной конструкцией нацеленного на WASP одноцепочного вариабельного фрагмента (scFv)-KikGR-CD63 под воздействием УФ света для высвобождения scFv внутри целевого макрофага, полученного из костного мозга.
На фиг. 10 показаны результаты для клеток Jurkat, стимулированных для экспрессии рецептора IL2 и одновременно обработанных ВВ из HEK, загруженными нацеленным на IL2R-альфа scFv. Только положительный контроль и ВВ, загруженные scFv-Dendra2-CD63 (и подвергнутые воздействию УФ-света), индуцировали уменьшение числа IL2R на клеточной поверхности клеток Jurkat, согласно анализу FACS. На фиг. 11 показаны результаты для erbB-2-положительной линии клеток рака яичника SKOV3, обработанных ВВ, загруженными нацеленным на онкопротеин erb-2 scFv. Уровень гибели клеток оценивали через 48 часов после обработки. Только ВВ, загруженные scFv-Dendra2-CD63 (и затем подвергшиеся краткому воздействию УФ-света), вызывали гибель клеток на уровнях, сравнимых с положительным контролем.
На фиг. 12 показаны результаты загрузки фактора транскрипции NRF2 с системой высвобождения на основе NLSBP-NLS в ВВ, полученные из BM-MSC, и связанные с этим эффекты результате индукции экспрессии гена-мишени HMOX1 в клетках-реципиентах. Осуществляли слияние NLSBP (KPNA1, также известного как импортин α5) с экзосомальным белком CD63 и коэкспрессировали с NRF2 в клетках-источниках ВВ (дополнительно к BM-MSC, были протестированы различные типы иммунных клеток, которые дали хорошие результаты). Совместная экспрессия приводит к значительному улучшению сортинга ВВ по NRF2, оцененного вестерн-блот анализом, по сравнению с экспрессией только NRF2. Доставка ВВ, загруженных NRF2, при помощи этой стратегии приводит к индукции экспрессии целевого гена в анализе клеток НЕК. Генерирование полипептидной конструкции на основе других белков ВВ также приводило к аналогичному эффекту, например, при использовании Alix и синтенина. На фиг. 13 показан эксперимент, аналогичный описанному на фиг. 5, но в этом случае с цис-расщепляющим интеином (включающим аминокислотную последовательность Val-Val-Val-His-Asn) в качестве системы высвобождения, слитого с CD63, CD81 (данные не показаны), и синтенином (данные не показаны) и Cas9. Как видно на фиг. 13, только немутированный интеин индуцировал соответствующие уровни NHEJ.
Другой пример эндогенно активируемой NLS-NLSBP системы высвобождения на основе полипептида включает слияние KPNA2 с экзосомальным белком CD47 и его коэкспрессию с фактором транскрипции HSF1 в фибробластах, таким образом осуществляя загрузку HSF1 в экзосомы. Полученные из фибробластов экзосомы выделяли и использовали для обработки мышиных первичных нейронов ядер мозжечка, которые подвергали воздействию низкой или высокой концентрации калия в культуральных средах. Обработка ВВ, загруженных HSF1, приводила к значительно более высокой жизнеспособности клеток по сравнению с обработкой контрольными экзосомами без NLS-NLSBP системы высвобождения в условиях низкого содержания калия, индуцирующего апоптоз.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Evox Therapeutics Ltd
<110> Isis Innovation Ltd
<120> ЭКЗОСОМЫ, СОДЕРЖАЩИЕ ТЕРАПЕВТИЧЕСКИЕ ПОЛИПЕПТИДЫ
<130> EVOX-002/001WO 328109-2018
<140> PCT/GB2017/051479
<141> 2017-05-25
<150> GB1609216.5
<151> 2016-05-25
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 5
<212> PRT
<213> Mycobacterium tuberculosis
<400> 1
Val Val Val His Asn
1 5
<210> 2
<211> 6
<212> PRT
<213> Mycobacterium tuberculosis
<400> 2
Val Val Val His Asn Cys
1 5
<---
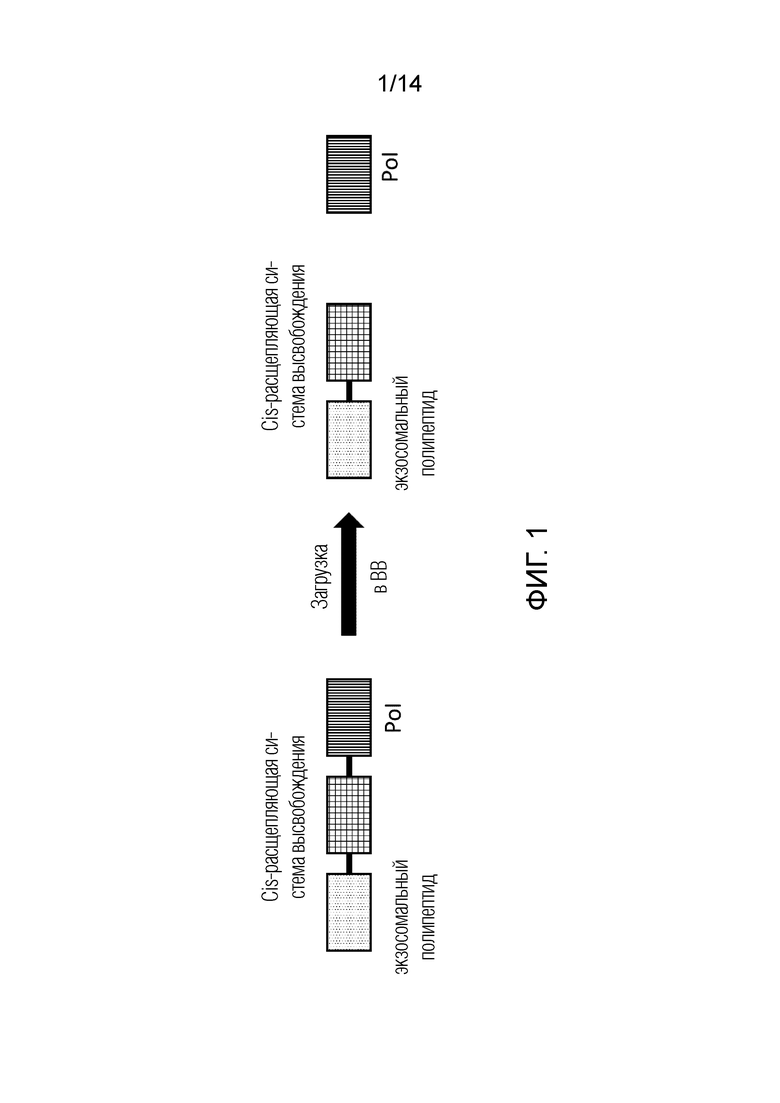
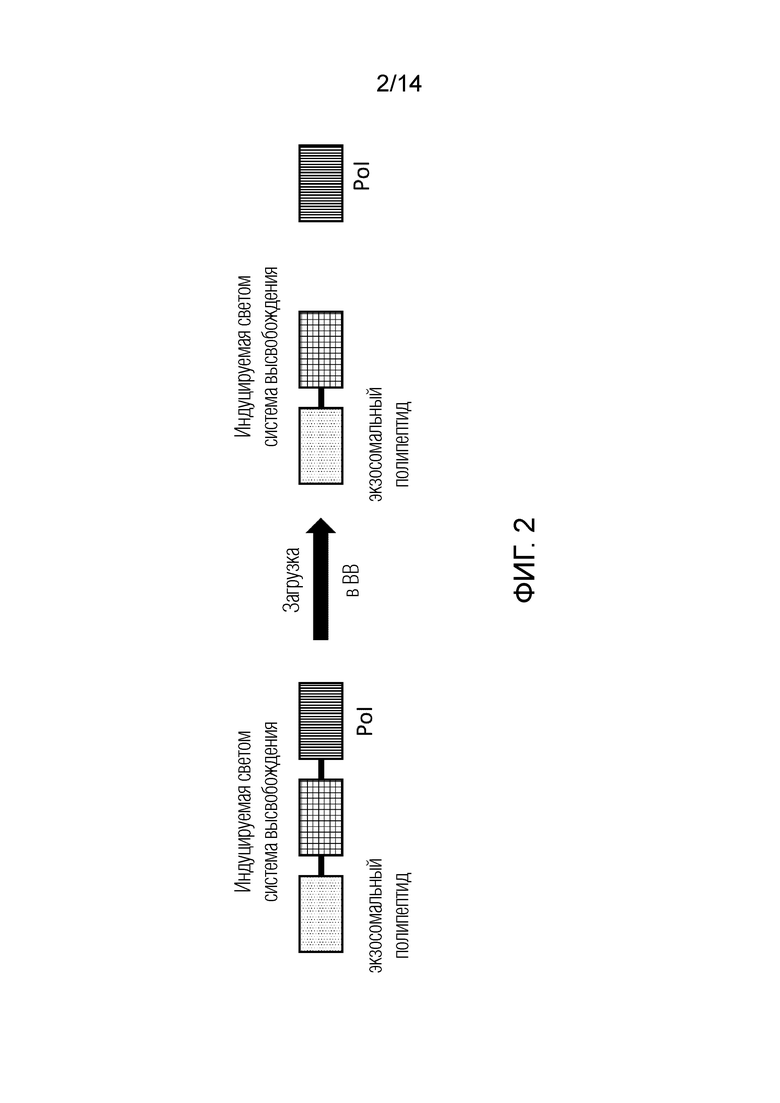
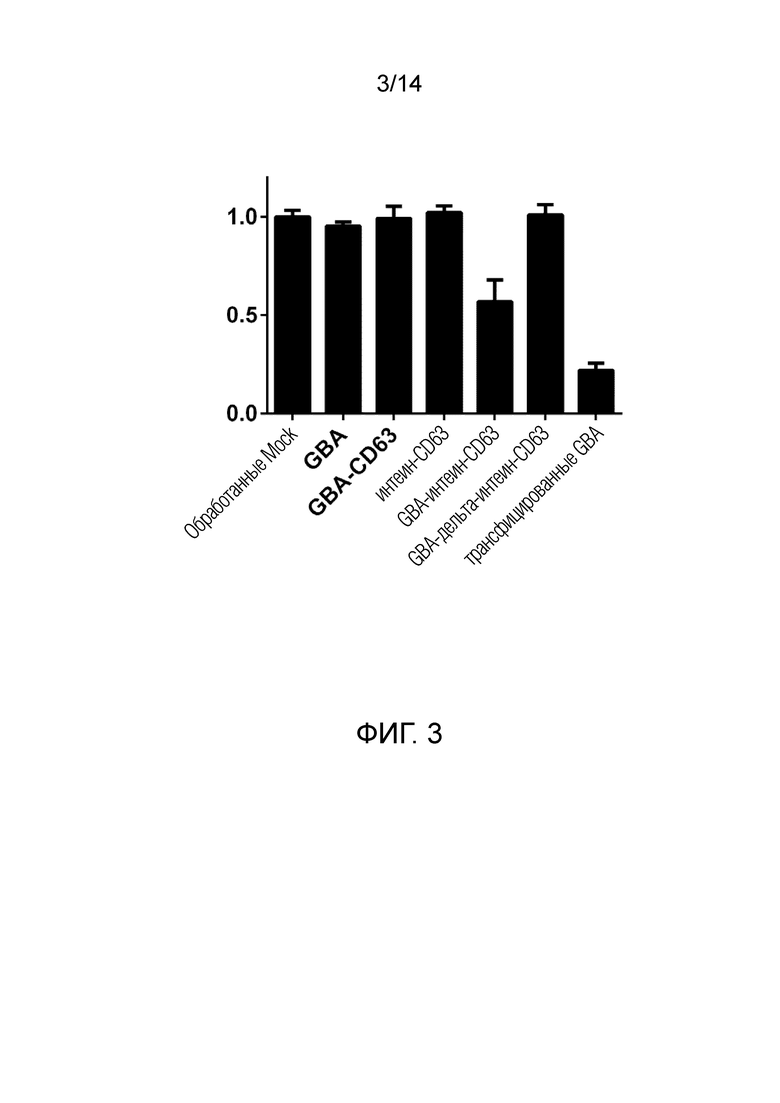
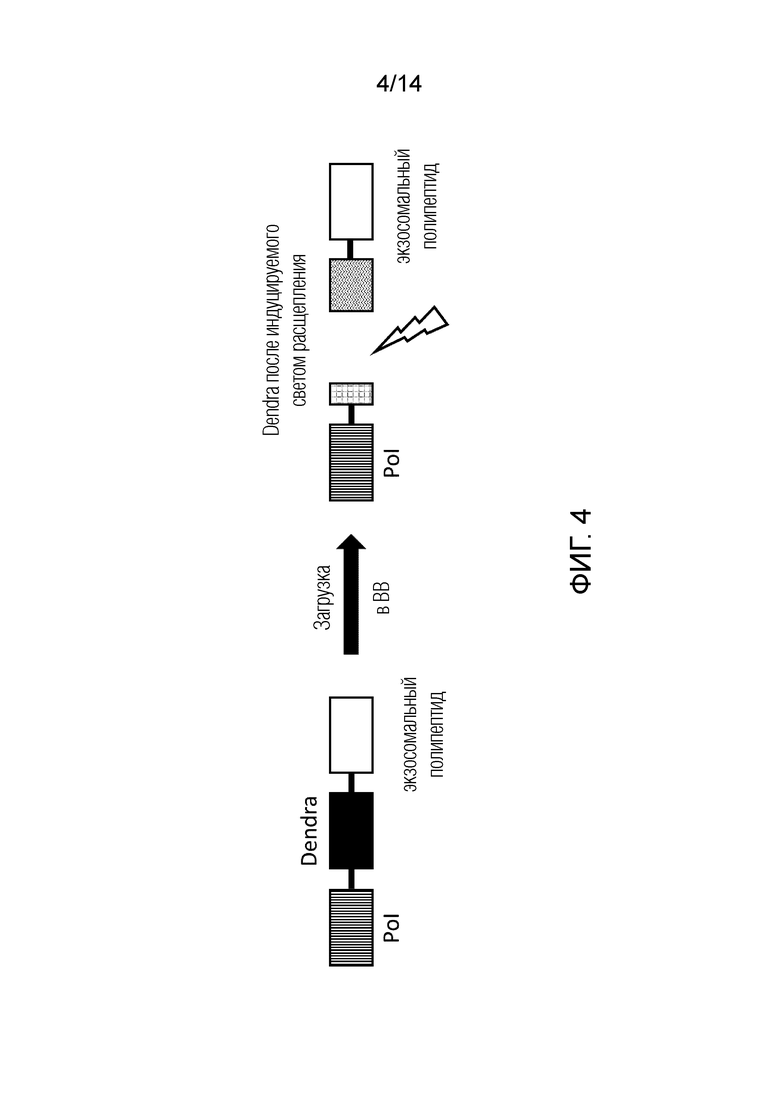
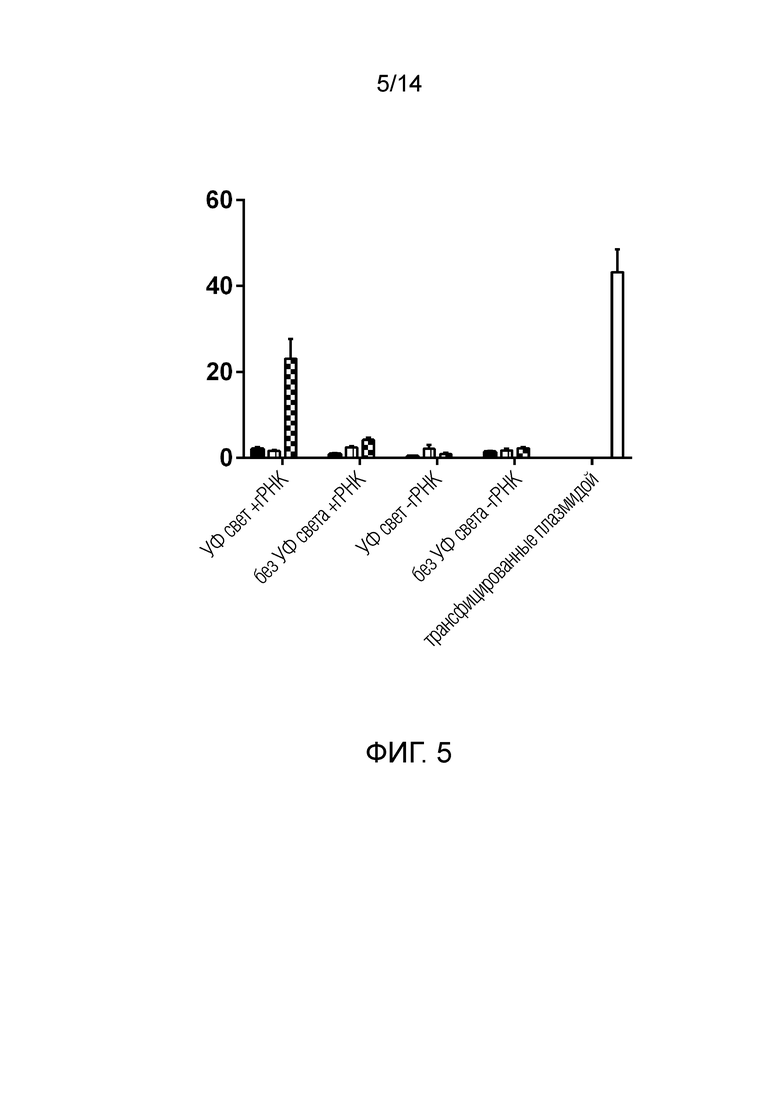
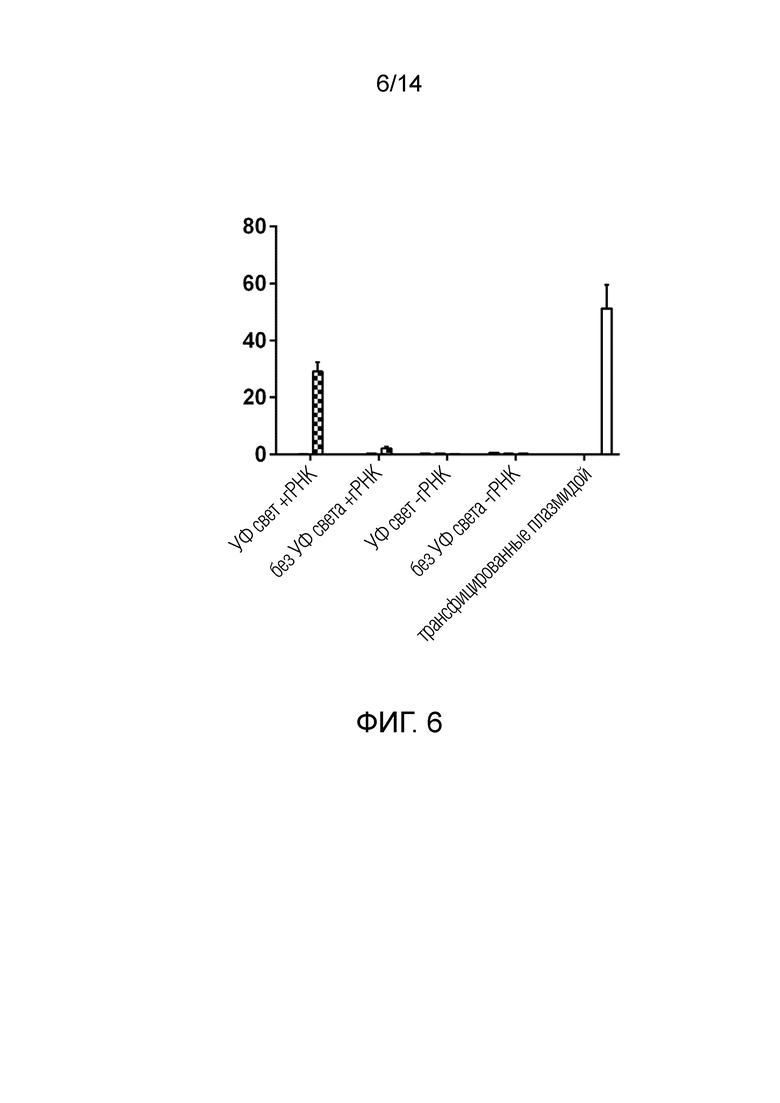
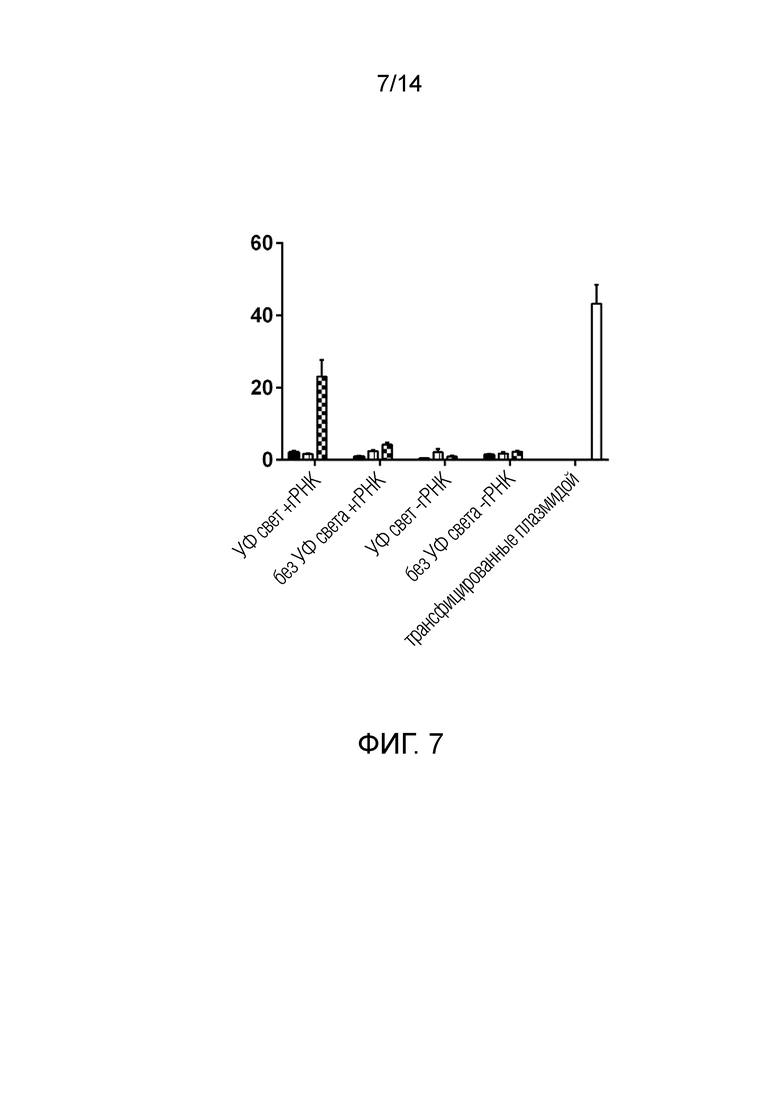
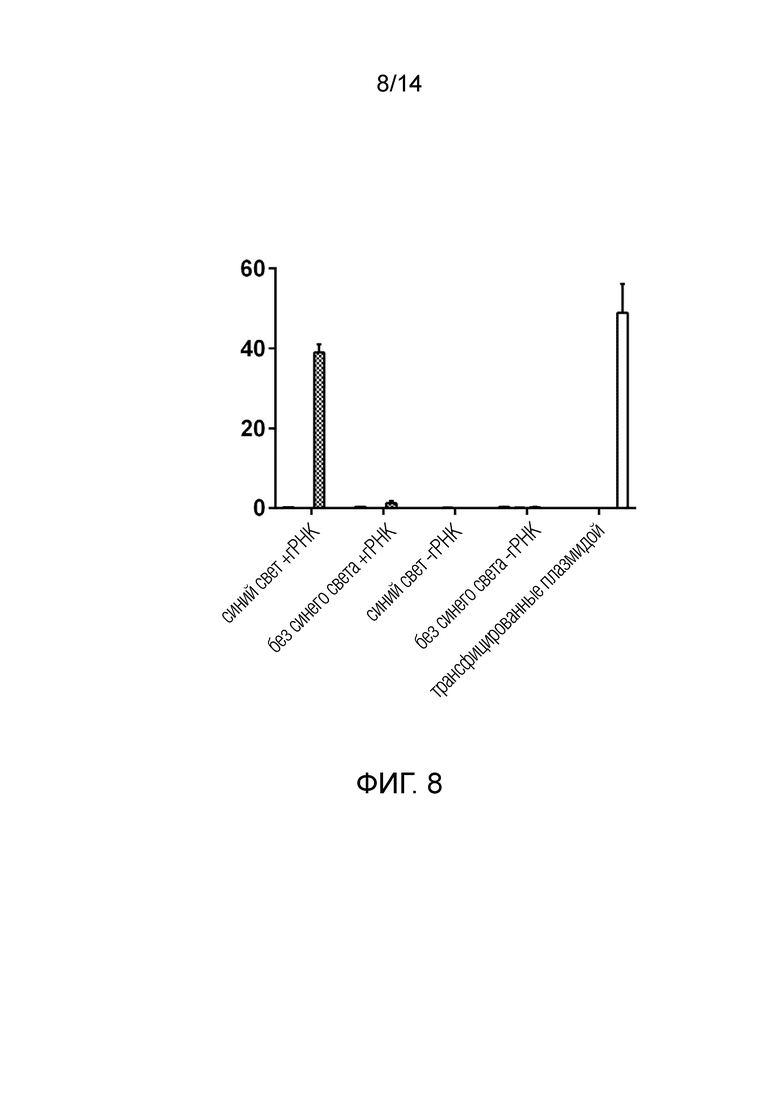
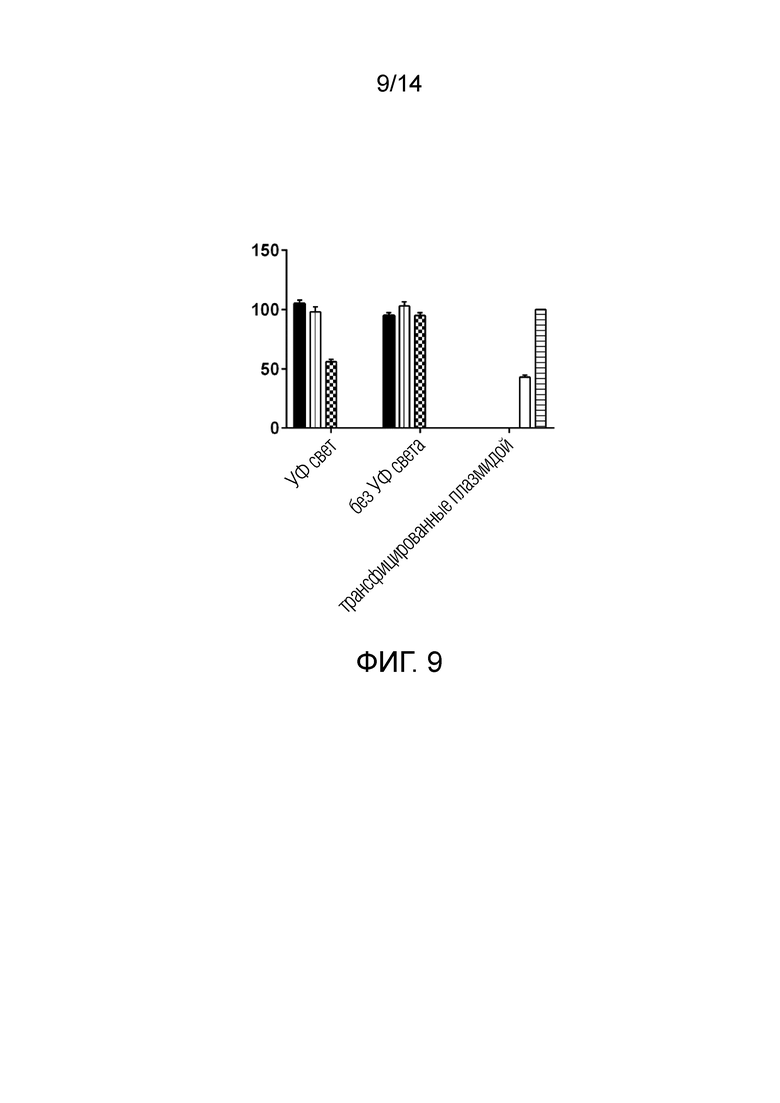
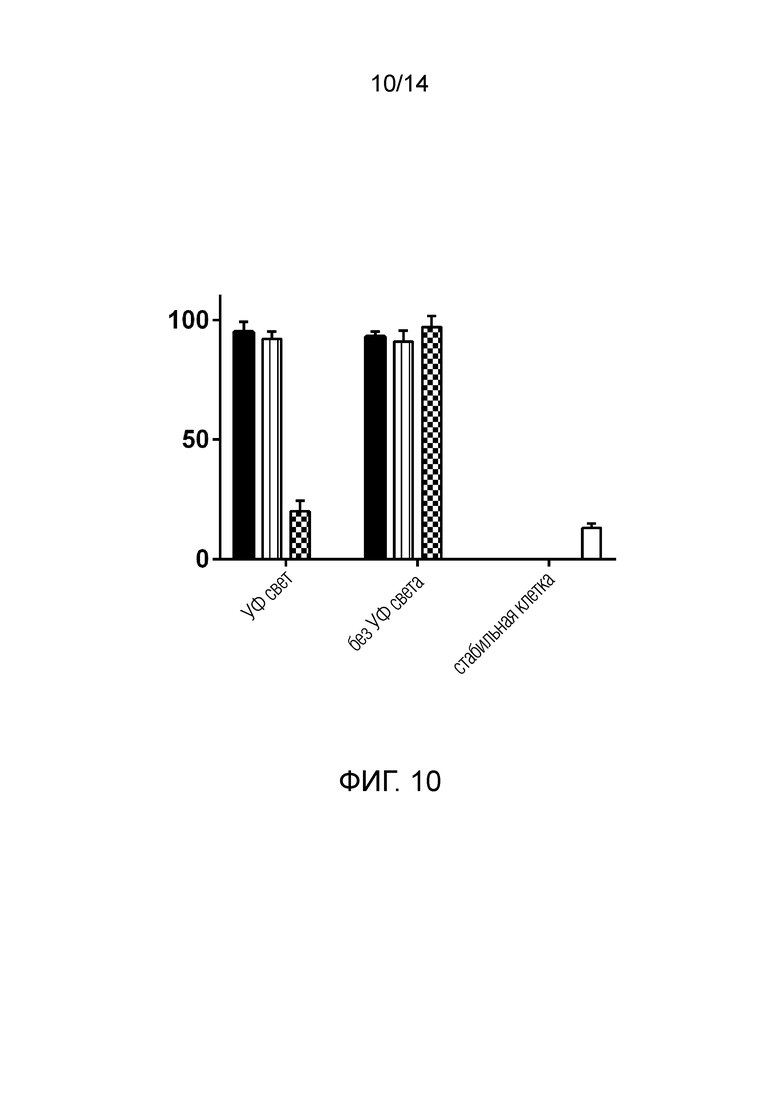
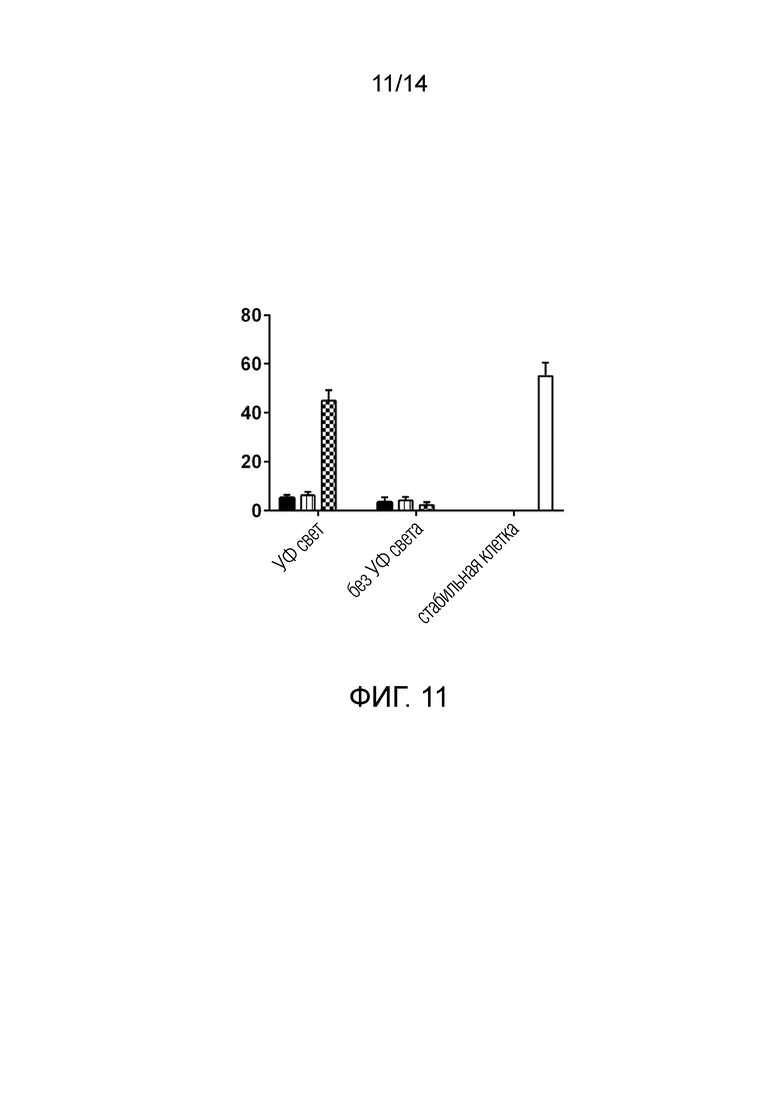
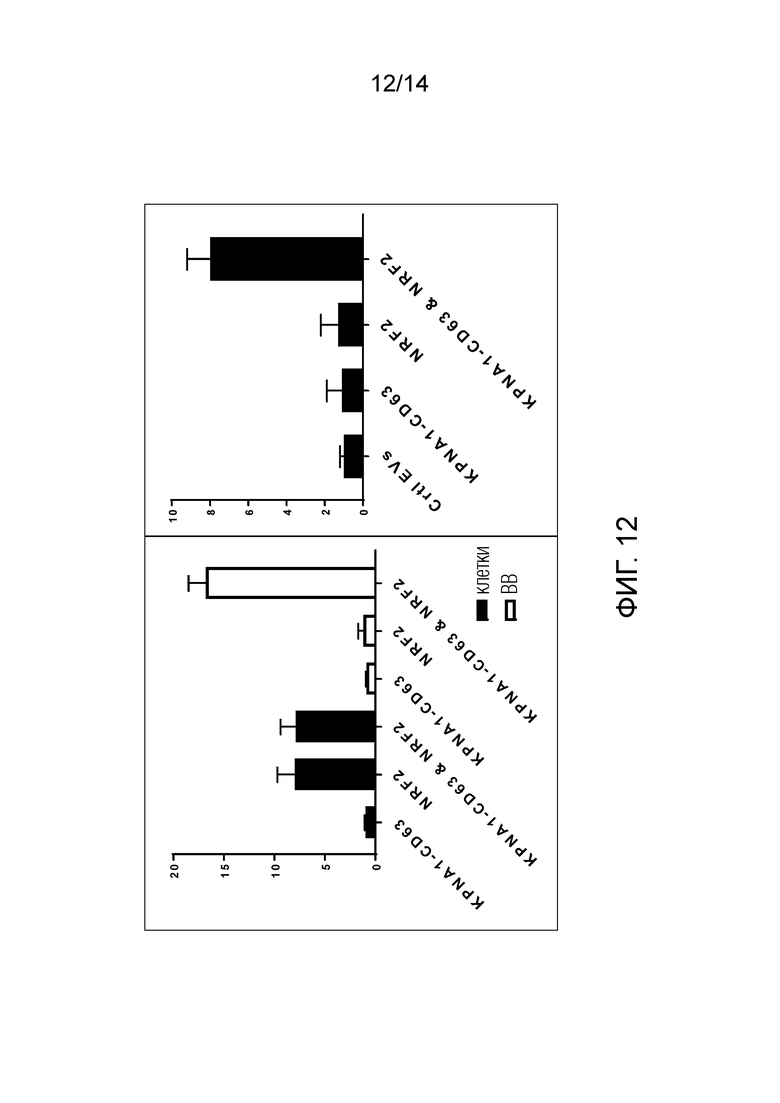
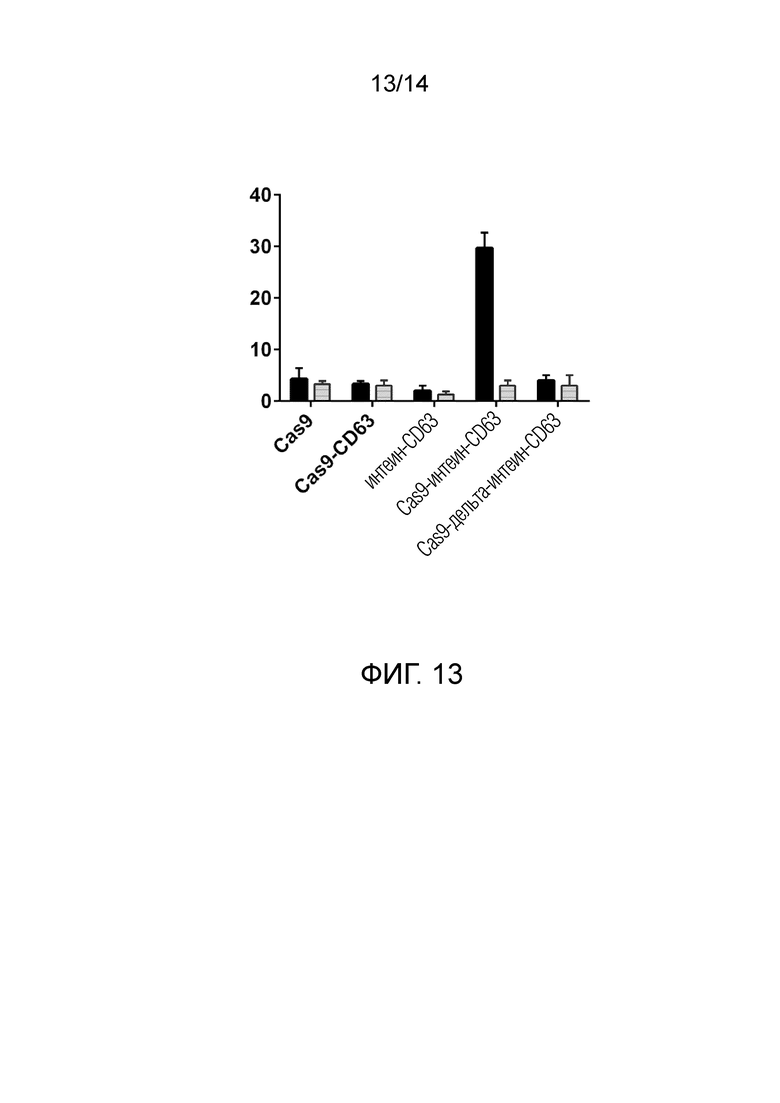
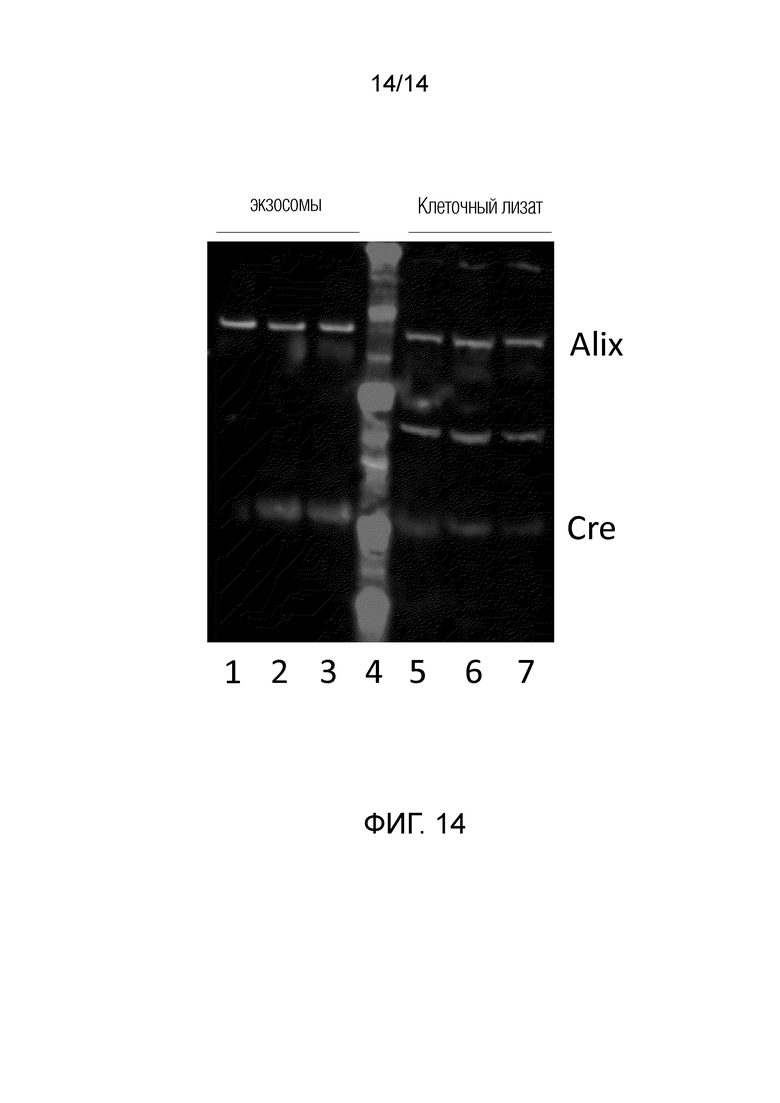
Группа изобретений относится к механизму внутриклеточной и внутримембранной доставки терапевтических полипептидов. Внеклеточная везикула (ВВ) для внутриклеточной доставки полипептида содержит по меньшей мере одну полипептидную конструкцию, содержащую: (i) по меньшей мере один представляющий интерес полипептид (Pol); (ii) по меньшей мере один экзосомальный полипептид и (iii) систему высвобождения на основе полипептида, которая освобождает указанный по меньшей мере один Pol от по меньшей мере одного экзосомального полипептида при эндогенной активации, где указанный по меньшей мере один Pol присоединен к экзосомальному полипептиду через эндогенно активируемую систему высвобождения. Также раскрыты способ продуцирования ВВ, полипептидная конструкция для получения ВВ, полинуклеотидная конструкция для получения ВВ, клетка для продуцирования ВВ, in vitro способ внутриклеточной доставки по меньшей мере одного представляющего интерес полипептида, фармацевтическая композиция, применение ВВ в медицине. Группа изобретений обеспечивает доставку представляющего интерес терапевтического полипептида с высокой эффективностью в свободной и неконъюгированной форме. 9 н. и 6 з.п. ф-лы, 14 ил., 1 пр.
1. Внеклеточная везикула (ВВ) для внутриклеточной доставки полипептида, содержащая по меньшей мере одну полипептидную конструкцию, содержащую:
(i) по меньшей мере один представляющий интерес полипептид (Pol);
(ii) по меньшей мере один экзосомальный полипептид; и
(iii) систему высвобождения на основе полипептида, которая освобождает указанный по меньшей мере один Pol от по меньшей мере одного экзосомального полипептида при эндогенной активации,
где указанный по меньшей мере один Pol присоединен к экзосомальному полипептиду через эндогенно активируемую систему высвобождения.
2. ВВ по п. 1, где систему высвобождения на основе полипептида выбирают из цис-расщепляющей системы высвобождения или системы высвобождения на основе комплекса сигнал ядерной локализации (NLS) - сигнал ядерной локализации - связывающий белок (NLSBP) (NLS-NLSBP).
3. ВВ по любому из предшествующих пунктов, где Pol представляет собой терапевтический полипептид, выбранный из группы, содержащей антитела, интратела, одноцепочечные вариабельные фрагменты, аффитела, ферменты для, например, ферментозаместительной терапии или редактирования генов, онкосупрессоры, вирусные или бактериальные ингибиторы, белки клеточных компонентов, ДНК и/или РНК-связывающие белки, ингибиторы репарации ДНК, нуклеазы, протеиназы, интегразы, факторы транскрипции, факторы роста, ингибиторы и индукторы апоптоза, токсины, структурные белки, нейротрофические факторы, мембранные транспортеры, нуклеотид-связывающие белки, белки теплового шока, CRISPR-ассоциированные белки и любую их комбинацию.
4. ВВ по любому из предшествующих пунктов, где экзосомальный полипептид выбирают из группы, содержащей CD9, CD53, CD63, CD81, CD54, CD50, FLOT1, FLOT2, CD49d, CD71, CD133, CD138, CD235a, ALIX, синтенин-1, синтенин-2, Lamp2b, TSPAN8, TSPAN14, CD37, CD82, CD151, CD231, CD102, NOTCH1, NOTCH2, NOTCH3, NOTCH4, DLL1, DLL4, JAG1, JAG2, CD49d/ITGA4, ITGB5, ITGB6, ITGB7, CD11a, CD11b, CD11c, CD18/ITGB2, CD41, CD49b, CD49c, CD49e, CD51, CD61, CD104, тетраспанины, Fc-рецепторы, рецепторы интерлейкина, иммуноглобулины, компоненты MHC-I или MHC-II, CD2, CD3-эпсилон, CD3-дзета, CD13, CD18, CD19, CD30, CD34, CD36, CD40, CD40L, CD44, CD45, CD45RA, CD47, CD86, CD110, CD111, CD115, CD117, CD125, CD135, CD184, CD200, CD279, CD273, CD274, CD362, COL6A1, AGRN, EGFR, GAPDH, GLUR2, GLUR3, HLA-DM, HSPG2, L1CAM, LAMB1, LAMC1, LFA-1, LGALS3BP, Mac-1 альфа, Mac-1 бета, MFGE8, SLIT2, STX3, TCRA, TCRB, TCRD, TCRG, VTI1A, VTI1B и любые другие экзосомальные полипептиды.
5. ВВ по любому из предшествующих пунктов, где ВВ дополнительно содержит по меньшей мере один представляющий интерес полинуклеотид.
6. ВВ по п. 5, где транспорт представляющего интерес полинуклеотида в ВВ осуществляют через взаимодействие с РНК-связывающим Pol или ДНК-связывающим Pol.
7. ВВ по любому из предшествующих пунктов, где ВВ дополнительно содержит по меньшей один нацеливающий фрагмент.
8. Способ продуцирования ВВ по любому из предшествующих пунктов, содержащий:
(i) введение в продуцирующую ВВ клетку по меньшей мере одной полинуклеотидной конструкции, кодирующей по меньшей мере одну полипептидную конструкцию из п. 1;
(ii) экспрессию продуцирующей ВВ клеткой по меньшей мере одной полипептидной конструкции из (i); и
(iii) сбор из продуцирующей ВВ клетки содержащих полипептидную конструкцию из п. 1 ВВ.
9. Полипептидная конструкция для получения внеклеточной везикулы по п. 1, содержащая:
(i) по меньшей мере один представляющий интерес полипептид (Pol);
(ii) по меньшей мере один экзосомальный полипептид; и
(iii) систему высвобождения на основе полипептида, которая освобождает указанный по меньшей мере один Pol от по меньшей мере одного экзосомального полипептида при эндогенной активации,
где указанный по меньшей мере один Pol присоединен к экзосомальному полипептиду через эндогенно активируемую систему высвобождения.
10. Полинуклеотидная конструкция для получения внеклеточной везикулы по п. 1, кодирующая полипептидную конструкцию по п. 9.
11. Внеклеточная везикула (ВВ) для внутриклеточной доставки полипептида, содержащая по меньшей мере одну полипептидную конструкцию по п. 9.
12. Клетка для продуцирования внеклеточной везикулы по п. 1, содержащая: (i) по меньшей мере одну полинуклеотидную конструкцию по п. 10 и/или (ii) по меньшей мере одну полипептидную конструкцию по п. 9, и/или (iii) по меньшей мере одну ВВ по любому из пп. 1-7 и/или 11.
13. In vitro способ внутриклеточной доставки по меньшей мере одного представляющего интерес полипептида (Pol), включающий контактирование целевой клетки с по меньшей мере одной ВВ по любому из пп. 1-7 и/или 11.
14. Фармацевтическая композиция, содержащая: (i) по меньшей мере одну полинуклеотидную конструкцию по п.10 и/или (ii) по меньшей мере одну полипептидную конструкцию по п. 9, и/или (iii) по меньшей мере одну ВВ по любому из пп. 1-7 и/или 11, и/или (iv) клетку по п. 12.
15. Применение внеклеточной везикулы (ВВ) по любому из пп. 1-7 или 11 в медицине.
| WO 2014168548 А2, 16.10.2014 | |||
| US 5834247 A1, 10.11.1998 | |||
| ПЕПТИД FOXM1 И ВКЛЮЧАЮЩЕЕ ЕГО МЕДИЦИНСКОЕ СРЕДСТВО | 2008 |
|
RU2487886C2 |
| CDH3-ПЕПТИД И ВКЛЮЧАЮЩЕЕ ЕГО ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2008 |
|
RU2483078C2 |
Авторы
Даты
2020-12-02—Публикация
2017-05-25—Подача