Родственные заявки и включение при помощи ссылки
Заявляется приоритет по предварительным заявкам на патенты США 61/836123, поданной 17 июня 2013 г., 61/847537, поданной 17 июля 2013 г., 61/862355, поданной 5 августа 2013 г., 61/871301, поданной 28 августа 2013 г., 61/915203, поданной 12 декабря 2013 г., 61/979573, поданной 15 апреля 2014 г., и PCT/US 2013/074667, поданной 12 декабря 2013 г., относительно которых применительно к Соединенным Штатам настоящая заявка также является частично продолжающей; и, как может быть разрешено согласно законодательству США, ее эквивалент в США или на национальной фазе может дополнительно заявлять и заявляет приоритет по PCT/US 2013/074667 и заявкам, по которым PCT/US 2013/074667 заявляет приоритет.
Вышеприведенные заявки, и все документы, цитируемые в них или во время их рассмотрения ("документы, цитируемые в заявке"), и все документы, цитируемые или упомянутые в документах, цитируемых в заявке, и все документы, цитируемые или упомянутые в данном документе ("документы, цитируемые в данном документе"), и все документы, цитируемые или упомянутые в документах, цитируемых в данном документе, вместе с любыми инструкциями изготовителя, описаниями, характеристиками продукта и технологическими картами для любых продуктов, упомянутыми в данном документе или в любом документе, включенном с помощью ссылки в данный документ, настоящим включены в данный документ с помощью ссылки и могут быть использованы в практическом осуществлении настоящего изобретения. Более конкретно, все ссылочные документы включены при помощи ссылки в такой же мере, как если бы конкретно и отдельно было указано, что каждый отдельный документ включен при помощи ссылки.
Область изобретения
Настоящее изобретение в целом относится к доставке, конструированию, оптимизации и применениям в терапии систем, способов и композиций, используемых для контроля экспрессии генов, включающего целенаправленное воздействие на последовательность, такое как внесение изменений в геном или редактирование гена, связанное с короткими палиндромными повторами, регулярно расположенными группами (CRISPR), и их компонентами. В частности, настоящее изобретение относится к аспектам, связанным с доставкой в постмитотические клетки, включая без ограничений головной мозг или почку, для генной терапии состояний в указанных клетках, понимания функции генов в указанных клетках и создания моделей, содержащих указанные клетки.
Заявление в отношении финансируемого из федерального бюджета исследования Настоящее изобретение было разработано при правительственной поддержке в рамках NIH Pioneer Award (1DP1MH100706), выданного Национальными институтами здравоохранения. Правительство обладает определенными правами на настоящее изобретение.
Предпосылки изобретения
Недавние достижения в технологиях секвенирования генома и способах анализа значительно ускорили возможность каталогизации и картирования генетических факторов, ассоциированных с широким разнообразием биологических функций и заболеваний. Точные технологии целенаправленного воздействия на геном необходимы для обеспечения систематичного обратного конструирования казуальных генетических изменений путем обеспечения возможности селективного внесения изменений в отдельные генетические элементы, а также для продвижения применений в области синтетической биологии, биотехнологии и медицины. Несмотря на то, что технологии редактирования генома, такие как использование "дизайнерских" ферментов с "цинковыми пальцами", эффекторов, подобных транскрипционным активаторам (TALE), или хоминг-мегануклеаз, доступны для осуществления внесения изменений в целевой геном, все еще существует необходимость в новых технологиях геномной инженерии, которые являются доступными, простыми в осуществлении, масштабируемыми и пригодными для целенаправленного воздействия на несколько положений в эукариотическом геноме.
Краткое описание изобретения
Система CRISPR-Cas не требует создания индивидуализированных белков для целенаправленного воздействия на конкретные последовательности, а скорее один фермент Cas может быть запрограммирован короткой молекулой РНК для узнавания конкретной целевой ДНК. Добавление системы CRISPR-Cas к спектру технологий секвенирования генома и способам анализа может значительно упростить методику и ускорить возможность каталогизации и картирования генетических факторов, ассоциированных с широким спектром биологических функций и заболеваний. Для того, чтобы систему CRISPR-Cas эффективно использовать для редактирования генома без вредных воздействий, важно понимать аспекты конструирования, оптимизации и специфичной относительно типа клетки/ткани/органа доставки этих инструментов для геномной инженерии, которые являются аспектами заявленного изобретения.
Существует актуальная необходимость в альтернативных и функциональных системах и технологиях для целенаправленного воздействия на последовательность нуклеиновой кислоты с широким спектром применений. Аспекты настоящего изобретения удовлетворяют эту необходимость и предусматривают связанные с этим преимущества. Иллюстративный комплекс CRISPR содержит фермент CRISPR, образующий комплекс с направляющей последовательностью, которая гибридизируется с целевой последовательностью в целевом полинуклеотиде. Направляющая последовательность связана с парной tracr-последовательностью, которая, в свою очередь, гибридизируется с tracr-последовательностью.
В одном аспекте настоящее изобретение предусматривает способы применения одного или нескольких элементов системы CRISPR-Cas. Комплекс CRISPR по настоящему изобретению обеспечивает эффективное средство модификации целевого полинуклеотида. Комплекс CRISPR по настоящему изобретению характеризуется большим разнообразием полезных свойств, включающих модификацию (например, делецию, вставку, транслокацию, инактивацию, активацию) целевого полинуклеотида во множестве типов клеток в различных тканях и органах. Комплекс CRISPR по настоящему изобретению как таковой имеет широкий спектр применений в, например, редактировании генов или генома, генной терапии, изыскании новых лекарственных средств, скрининге лекарственных средств, диагностике и прогнозировании заболеваний. Предусматриваются применения in vivo, in vitro и ex vivo.
Аспекты настоящего изобретения относятся к ферментам Cas9, обладающим улучшенной специфичностью целенаправленного воздействия в постмитотической клетке в системе CRISPR-Cas9, имеющей направляющие РНК, характеризующиеся оптимальной активностью, имеющим меньшую длину, чем ферменты Cas9 дикого типа, и к кодирующим их молекулам нуклеиновых кислот, и к химерным ферментам Cas9, а также к способам улучшения специфичности целенаправленного воздействия фермента Cas9, или разработки системы CRISPR-Cas9, включающим разработку или получение направляющих РНК, характеризующихся оптимальной активностью, и/или выбора или получения фермента Cas9, имеющего меньшие размер или длину, чем Cas9 дикого типа, при этом упаковка кодирующей его нуклеиновой кислоты в вектор доставки является более совершенной, поскольку в векторе доставки кодирующая его часть является меньшей, чем в случае Cas9 дикого типа, и/или создания химерных ферментов Cas9.
Также представлены применения последовательностей, векторов, ферментов или систем по настоящему изобретению в медицине. Также представлены их применения в редактировании генов или генома. Это относится к постмитотическим тканям или клеткам, как in vivo, так и ex vivo,
В дополнительном аспекте настоящего изобретения фермент Cas9 может содержать одну или несколько мутаций и может применяться в качестве стандартного ДНК-связывающего белка, слитого или не слитого с функциональным доменом. Мутации могут быть мутациями, введенными искусственным образом, или мутациями с приобретением или потерей функции. Мутации могут включать, без ограничения, мутации в одном из каталитических доменов (D10 и Н840) среди каталитических доменов RuvC и HNH, соответственно. Были охарактеризованы дополнительные мутации. В одном аспекте настоящего изобретения домен активации транскрипции может представлять собой VP64. В других аспектах настоящего изобретения домен репрессии транскрипции может представлять собой KRAB или SID4X. Другие аспекты настоящего изобретения относятся к мутантному ферменту Cas9, слитому с доменами; которые включают, без ограничения, активатор транскрипции, репрессор транскрипции, рекомбиназу, транспозазу, фактор ремоделирования гистонов, деметилазу, ДНК-метилтрансферазу, криптохром, домен, индуцируемый/регулируемый светом, или домен, индуцируемый/регулируемый химическими веществами.
В дополнительном варианте осуществления настоящее изобретение предусматривает способы создания мутантной tracrRNA и последовательностей прямых повторов или мутантных химерных направляющих последовательностей, обеспечивающих повышение производительности этих РНК в клетках. Аспекты настоящего изобретения также предусматривают отбор указанных последовательностей.
Аспекты настоящего изобретения также предусматривают способы упрощения клонирования и доставки компонентов комплекса CRISPR. В предпочтительном варианте осуществления настоящего изобретения подходящий промотор, такой как промотор U6, амплифицируют с ДНК-олигонуклеотидом и добавляют к направляющей РНК. Полученным в результате продуктом ПЦР можно затем трансфицировать клетки для управления экспрессии направляющей РНК. Аспекты настоящего изобретения также относятся к направляющей РНК, транскрибированной in vitro или полученной от компании, проводящей синтез, и трансфицируемой напрямую.
В одном аспекте настоящее изобретение предусматривает способы улучшения активности путем применения более активной полимеразы. В предпочтительном варианте осуществления экспрессия направляющих РНК под контролем промотора Т7 управляется экспрессией полимеразы Т7 в клетке. В преимущественном варианте осуществления клетка является эукариотической клеткой. В преимущественном варианте осуществления эукариотическая клетка является клеткой человека. В более предпочтительном варианте осуществления клетка человека является индивидуальной клеткой.
В одном аспекте настоящее изобретение предусматривает способы снижения токсичности ферментов Cas. В определенных аспектах фермент Cas представляет собой любой Cas9, описанный в данном документе, например, любой встречающийся в природе бактериальный Cas9, а также любые химерные формы, мутантные формы, гомологи или ортологи. В предпочтительном варианте осуществления Cas9 доставляют в клетку в форме мРНК. Это обеспечивает транзиентную экспрессию фермента со снижением таким образом токсичности. В другом предпочтительном варианте осуществления настоящее изобретение также предусматривает способы экспрессии Cas9 под контролем индуцируемого промотора и конструкции, применяемые в них.
В другом аспекте настоящее изобретение предусматривает способы улучшения in vivo применений системы CRISPR-Cas. В предпочтительном варианте осуществления фермент Cas представляет собой Cas9 дикого типа или любой из модифицированных вариантов, описанных в данном документе, в том числе любой встречающийся в природе бактериальный Cas9, а также любые химерные формы, мутантные формы, гомологи или ортологи. Преимущественный аспект настоящего изобретения предусматривает отбор гомологов Cas9, которые легко упаковываются в вирусные векторы для доставки. Ортологи Cas9, как правило, имеют общую структуру, включающую 3-4 домена RuvC и домен HNH. Наиболее близкий к 5'-концу домен RuvC расщепляет некомплементарную нить, а домен HNH расщепляет комплементарную нить. Все обозначения приведены в отношении направляющей последовательности.
Каталитический остаток в 5'-концевом домене RuvC идентифицируют посредством сравнения с целью поиска гомологии представляющего интерес Cas9 и других ортологов Cas9 (из локуса CRISPR типа II S. pyogenes, локуса 1 CRISPR S. thermophilus, локуса 3 CRISPR S. thermophilus и локуса CRISPR типа II Franciscilla novicida), и консервативный остаток Asp (D10) подвергают мутации по типу замены на аланин с превращением Cas9 в фермент, вносящий однонитевой разрыв в комплементарную нить. Аналогично, консервативные остатки His и Asn в доменах HNH подвергают мутации по типу замены на аланин с превращением Cas9 в фермент, вносящий однонитевой разрыв в некомплементарную нить. В некоторых вариантах осуществления можно осуществлять мутации из обеих групп для превращения Cas9 в неразрезающий фермент.
В некоторых вариантах осуществления фермент CRISPR представляет собой фермент CRISPR типа I или III, предпочтительно фермент CRISPR типа II. Этот фермент CRISPR типа II может быть любым ферментом Cas. Предпочтительный фермент Cas может быть идентифицирован как Cas9, поскольку он может относиться к общему классу ферментов, обладающих гомологией с самой большой нуклеазой с несколькими нуклеазными доменами системы CRISPR типа II. В наиболее предпочтительном случае фермент Cas9 получен или происходит из spCas9 или saCas9. Под происходящим заявители подразумевают, что в основе происходящего фермента главным образом лежит фермент дикого типа в том смысле, что он характеризуется высокой степенью гомологии последовательности с этим ферментом, но он был некоторым образом подвергнут мутации (модифицирован), как описано в данном документе.
Следует иметь в виду, что выражения Cas и фермент CRISPR обычно используются в данном документе взаимозаменяемо, если не очевидно иное. Как упоминается выше, многие из порядков нумерации остатков, используемых в данном документе, относятся к ферменту Cas9 из локуса CRISPR типа II Streptococcus pyogenes. Однако следует иметь в виду, что настоящее изобретение включает многие другие Cas9 из других видов микроорганизмов, такие как SpCas9, SaCas9, St1Cas9 и т.д. Дополнительные примеры представлены в данном документе. Специалист в данной области будет способен определить надлежащие соответствующие остатки в ферментах Cas9, отличных от SpCas9, путем сравнения необходимых аминокислотных последовательностей. Таким образом, если конкретное аминокислотное замещение обозначается с помощью нумерации SpCas9, то, если из контекста не очевидно, что это не предназначено для применения в отношении других ферментов Cas9, подразумевается, что настоящее раскрытие охватывает соответствующие модификации в других ферментах Cas9. Особенно преимущественным является SaCas9.
Пример кодон-оптимизированной последовательности, в данном случае оптимизированной для человека (т.е. оптимизированной для экспрессии у человека), представлен в данном документе, см. кодон-оптимизированную последовательность SaCas9 для человека. Хотя это является предпочтительным, следует иметь в виду, что возможны другие примеры и что для вида-хозяина известна оптимизация кодонов.
В дополнительных вариантах осуществления настоящее изобретение предусматривает способы усиления функционирования Cas9 посредством образования химерных белков Cas9. Химерные белки Cas9 - химерные Cas9 - могут быть новыми Cas9, содержащими фрагменты из более чем одного встречающегося в природе Cas9. Эти способы могут включать слияние N-концевых фрагментов одного гомолога Cas9 с С-концевыми фрагментами другого гомолога Cas9. Эти способы также обеспечивают отбор новых свойств, проявляемых химерными белками Cas9.
Следует иметь в виду, что в способах по настоящему изобретению, где организм представляет собой животное или растение, модификация может иметь место ex vivo или in vitro, например, в клеточной культуре, и в ряде случаев не in vivo. В других вариантах осуществления она может иметь место in vivo.
В одном аспекте настоящее изобретение предусматривает способ модификации организма или отличного от человеческого организма путем манипуляции с целевой последовательностью в представляющем интерес локусе генома, включающий доставку не встречающейся в природе или сконструированной композиции, содержащей:
А) - I. полинуклеотидную последовательность РНК системы CRISPR-Cas, необязательно полинуклеотидную последовательность химерной РНК (chiRNA), где полинуклеотидная последовательность содержит:
(a) направляющую последовательность, способную гибридизироваться с целевой последовательностью в эукариотической клетке,
(b) парную tracr-последовательность и
(с) tracr-последовательность, и
II. полинуклеотидную последовательность, кодирующую фермент CRISPR, содержащий по меньшей мере одну или несколько последовательностей ядерной локализации,
где (а), (b) и (с) расположены в 5'-3' ориентации,
где при транскрипции парная tracr-последовательность гибридизируется с tracr-последовательностью, а направляющая последовательность управляет специфичным к последовательности связыванием комплекса CRISPR с целевой последовательностью, и
где комплекс CRISPR содержит фермент CRISPR, образующий комплекс с (1) направляющей последовательностью, которая гибридизируется с целевой последовательностью, и (2) парной tracr-последовательностью, которая гибридизируется с tracr-последовательностью, и полинуклеотидная последовательность, кодирующая фермент CRISPR представляет собой ДНК или РНК,
или
(В) I. полинуклеотиды, содержащие:
(а) направляющую последовательность, способную гибридизироваться с целевой последовательностью в эукариотической клетке, и
(b) по меньшей мере одну или несколько парных tracr-последовательностей,
II. полинуклеотидную последовательность, кодирующую фермент CRISPR, и
III. полинуклеотидную последовательность, содержащую tracr-последовательность,
где при транскрипции парная tracr-последовательность гибридизируется с tracr-последовательностью, а направляющая последовательность управляет специфичным к последовательности связыванием комплекса CRISPR с целевой последовательностью, и
где комплекс CRISPR содержит фермент CRISPR, образующий комплекс с (1) направляющей последовательностью, которая гибридизируется с целевой последовательностью, и (2) парной tracr-последовательностью, которая гибридизируется с tracr-последовательностью, и полинуклеотидная последовательность, кодирующая фермент CRISPR представляет собой ДНК или РНК.
Следующее относится в равной степени ко всем аспектам настоящего изобретения. Целевая последовательность наиболее предпочтительно представляет собой целевую последовательность постмитотической клетки. Поскольку в данном документе может быть упомянута печень, это следует подразумевать как ссылку на постмитотические клетки в целом, в частности, клетки почки или клетки головного мозга. Постмитотическая клетка может находиться в или происходить из (т.е. источник клетки или тип клетки) какого-либо одного из следующих органов или может представлять собой органоиды или модели ex vivo или совокупности клеток, содержащие клетки:
почки, такие как клетки клубочка;
пищеварительной системы, в том числе желудка, поджелудочной железы, двенадцатиперстной кишки, подвздошной кишки и/или толстой кишки;
сердца;
легкого;
головного мозга, в частности, нейроны, и/или ЦНС в целом;
глаза, в том числе ткани сетчатки;
уха, в том числе внутреннего уха;
кожи;
мышц;
костей и/или
печени в целом, хотя она исключена в некоторых вариантах осуществления, поскольку она также является объектом отдельного применения.
Головной мозг и почка являются особенно предпочтительными. В некоторых вариантах осуществления клетка представляет собой клетку головного мозга, как, например, нейрон. В некоторых вариантах осуществления клетка представляет собой клетку почки.
Предпочтительные клетки почки включают какую-либо одну или несколько из:
париетальной клетки почечного клубочка;
подоцит почечного клубочка;
клетка щеточной каемки проксимального канальца почки;
клетка тонкого сегмента петли Генле;
клетки толстого восходящего колена;
клетка дистального канальца почки;
клетка собирающего протока почки и
интерстициальные клетки почки.
Предпочтительные примеры мишеней в почке представлены в приведенной ниже таблице, под разделом, озаглавленным "Почка", а также в таблице В. Предпочтительными являются любая одна или несколько из данных мишеней. Примеры 1 и 18 также направлены на клетки почки (пускай даже стволовые клетки не представляют собой постмитотические клетки), но применимым может быть принцип повторной доставки.
В некоторых особенно предпочтительных вариантах осуществления манипуляция вызывает фенотипическое изменение в клетке.
В некоторых вариантах осуществления фенотипическое изменение может вызываться или поддерживаться в клетке in vivo. Клетку трансфицируют in vivo или экстрагируют, трансфицируют ex vivo и затем повторно вводят (трансплантируют) обратно тому же или другому хозяину.
Экспрессия фермента CRISPR и необязательно направляющей последовательности может находиться под контролем промотора, специфичного для постмитотической клетки, например содержащегося в кассете экспрессии, способной экспрессировать фермент и необязательную направляющую последовательность в указанной постмитотической клетке. Другими словами, фермент CRISPR и необязательно направляющая последовательность функционально связаны с указанным промотором, специфичным для постмитотической клетки. Векторные системы на основе AAV являются особенно предпочтительными, главным образом, когда постмитотическая клетка представляет собой нейрон.
Промотор для фермента CRISPR и необязательный промотор для направляющей последовательности могут быть одинаковыми или разными.
Следующее также относится к любому способу, применению или композиции, описанным в данном документе. РНК системы CRISPR-Cas может представлять собой химерную РНК (chiRNA). Система CRISPR-Cas может представлять собой мультиплексную ферментную систему CRISPR, дополнительно содержащую несколько химер и/или несколько направляющих последовательностей для нескольких мишеней и одну tracr-последовательность. Фермент CRISPR может представлять собой нуклеазу, управляющую расщеплением обеих нитей в определенной точке целевой последовательности. Фермент CRISPR может содержать одну или несколько мутаций. Фермент CRISPR может содержать одну или несколько мутаций D10A, Е762А, Н840А, N854A, N863A или D986A. Одна или несколько мутаций могут присутствовать в домене RuvC1 фермента CRISPR. Фермент CRISPR может представлять собой никазу, направляющую расщепление в определенной точке целевой последовательности. Никаза может представлять собой двойную никазу. Предпочтительными являются по меньшей мере две или более NLS.
Фермент CRISPR может представлять собой тип II, предпочтительно Cas и наиболее предпочтительно Cas9. Ссылку на Cas или Cas9 (например, в CRISPR-Cas или CRISR Cas9) следует понимать как любой Cas, наиболее предпочтительно Cas9, и, в частности, Sa- или SpCas9 (охватывая все мутации, как, например, от D10A до представленного DSB, функцию никазы или двойной никазы).
Фермент CRISPR может иметь одну или несколько мутаций в каталитическом домене, где при транскрипции парная tracr-последовательность гибридизируется с tracr-последовательностью, а направляющая последовательность управляет специфичным к последовательности связыванием комплекса CRISPR с целевой последовательностью, и где фермент дополнительно содержит функциональный домен. Функциональный домен может представлять собой домен активации транскрипции. Домен активации транскрипции может представлять собой VP64.
Способы могут дополнительно включать сведение к минимуму нецелевых модификаций посредством манипуляции с первой и второй целевыми последовательностями на противоположных нитях ДНК-дуплекса в представляющем интерес локусе генома в клетке, что предусматривает
доставку не встречающейся в природе или сконструированной композиции, содержащей:
I. полинуклеотидную последовательность химерной РНК (chiRNA) системы CRISPR-Cas, где полинуклеотидная последовательность содержит:
(a) первую направляющую последовательность, способную гибридизироваться с первой целевой последовательностью,
(b) первую парную tracr-последовательность,
(c) первую tracr-последовательность,
(d) вторую направляющую последовательность, способную гибридизироваться со второй целевой последовательностью,
(e) вторую парную tracr-последовательность и
(f) вторую tracr-последовательность, и
необязательно где линкерная последовательность присутствует между первой tracr-последовательностью и второй направляющей последовательностью, при этом первая направляющая последовательность и вторая направляющая последовательность расположены последовательно; и
II. полинуклеотидную последовательность, кодирующую фермент CRISPR, содержащий по меньшей мере одну или несколько последовательностей ядерной локализации, где (а), (b), (с), (d), (е) и (f) расположены в 5'-3' ориентации, где полинуклеотидная последовательность содержит линкерную последовательность между первой tracr-последовательностью и второй направляющей последовательностью, в результате чего первая направляющая последовательность и вторая направляющая последовательность расположены последовательно, и где при транскрипции, первая и вторая парные tracr-последовательности гибридизируются с первой и второй tracr-последовательностями, соответственно, а первая и вторая направляющие последовательности управляют специфичным к последовательности связыванием первого и второго комплексов CRISPR с первой и второй целевыми последовательностями, соответственно,
или
II. второй регуляторный элемент, функционально связанный с кодирующей фермент последовательностью, кодирующей фермент CRISPR, и где компоненты I и II находятся в одном и том же или в разных векторах системы, и при транскрипции первая парная tracr-последовательность гибридизируется с первой tracr-последовательностью, а первая и вторая направляющие последовательности управляют специфичным к последовательности связыванием первого и второго комплексов CRISPR с первой и второй целевыми последовательностями, соответственно;
где первый комплекс CRISPR содержит фермент CRISPR, образующий комплекс с (1) первой направляющей последовательностью, которая гибридизируется с первой целевой последовательностью, и (2) первой парной tracr-последовательностью, которая гибридизируется с первой tracr-последовательностью.
где второй комплекс CRISPR содержит фермент CRISPR, образующий комплекс со (1) второй направляющей последовательностью, которая гибридизируется со второй целевой последовательностью, и со (2) второй парной tracr-последовательностью, которая гибридизируется со второй tracr-последовательностью.
где полинуклеотидная последовательность, кодирующая фермент CRISPR, представляет собой ДНК или РНК и
где первая направляющая последовательность управляет расщеплением одной нити ДНК-дуплекса возле первой целевой последовательности, а вторая направляющая последовательность управляет расщеплением другой нити возле второй целевой последовательности, индуцируя двухнитевой разрыв, с модификацией таким образом организма или отличного от человеческого организма путем сведения к минимуму нецелевых модификаций.
В некоторых вариантах осуществления вторая вышеуказанная альтернатива (В) является предпочтительной. Однако первая альтернатива (А) является особенно предпочтительной. Это применимо ко всем аспектам настоящего изобретения, представляющих два альтернативных подхода CRISPR.
Следует иметь в виду, что настоящая заявка направлена на постмитотические клетки вне зависимости от того, представляют ли они орган как таковой, или ткань в нем, или просто одну или несколько постмитотических клеток, таких как нейроны. Нейроны и клетки почки являются предпочтительными. Постмитотические клетки могут содержаться в позвоночном животном, являющимся или пациентом (в том смысле, что животное нуждается в генной терапии под управлением CRISPR), или модельным организмом, или могут находиться в клеточной культуре, органоиде или другой ткани ex vivo, такой как "печень на чипе", например, где гепатоциты высевают и выращивают на подложке. Гепатоциты, взятые из нетрансплантированных органов, также являются применимой мишенью. С учетом развития методик 3D-печати, применяемых в биологии, печатные ткани находятся в пределах доступности, и целенаправленное воздействие вполне возможно осуществить также и в клетках или тканях печени, напечатанных таким образом для создания органоида или находящихся на чипе. Также предусмотрены отличные от печени альтернативы, в частности, для тканей почки или других постмитотических клеток/тканей.
Таким образом, представлен модельный организм, содержащий постмитотические клетки, такие как нейроны или клетки почки, в которые была доставлена система CRISPR-Cas по настоящему изобретению. Аналогично, также представлена совокупность ex vivo двух или более постмитотических клеток, таких как нейроны или клетки почки, в которые была доставлена система CRISPR-Cas по настоящему изобретению. Такие совокупности могут включать постмитотические органы, органоиды, клетки, заселяющие подложку ('почка на чипе'). Также представлены способы создания таких моделей или совокупностей.
В частности, такие постмитотические клетки могут экспрессировать или содержать полинуклеотиды, способные экспрессировать фермент Cas. Как обсуждается в данном документе, преимуществом этого является обеспечение готовой модели для исследования функций генов посредством внесения изменений в гены, в том числе нокдауна. Это особенно применимо при изучении состояний постмитотических клеток, например, почки или головного мозга, как например, тех, что перечислены в данном документе, а также более общих состояний, таких как ожирение.
В данном документе также представлены способы исследования функции генов постмитотической клетки. Они обычно включают доставку в постмитотические клетки либо in, либо ex vivo системы CRISPR-Cas. Однако, если клетки уже содержат Cas, экспрессируемый в виде белка или кодируемый полинуклеотидами, уже содержащимися в клетках, тогда необходимо доставить только полинуклеотид CRISPR. Способ может включать извлечение из постмитотической клетки и необязательно повторное введение обратно в нее. Под доставкой в действительности подразумевают физическую доставку полинуклеотидов в ядро клетки, а также трансфекцию. Следовательно, доставку также следует понимать как включающую трансфекцию, если не очевидно иное.
Также представлен способ индукции внесения изменений в гены в одной или нескольких постмитотических клетках, включающий трансдукцию первой популяции клеток системой CRISPR-Cas согласно настоящему изобретению с изменением таким образом генома первой популяции клеток и получением второй популяции клеток. Способ можно осуществлять ex vivo или in vitro, например, в клеточной культуре или в модели ex vivo, или in vitro (такой как органоид или 'постмитотическая клетка на чипе'). Альтернативно, способ можно осуществлять in vivo, и в этом случае он может также включать выделение первой популяции клеток из субъекта и трансплантацию второй популяции клеток (обратно) субъекту. Внесение изменений в гены может производиться в отношении одного или нескольких, или двух или более, или трех или более, или четырех или более генов. Внесение изменений в гены может представлять собой ослабление функционирования гена (т.е. активности кодируемого продукта гена). Его можно индуцировать, например, путем изменения генома первой популяции клеток с получением второй популяции клеток, где вторая популяция клеток имеет дефектный генотип, как, например, при моногенном состоянии, которое отсутствует у первой популяции клеток. Для него может требоваться соответствующая матрица для репарации, обсуждаемая в данном документе, для получения дефектной последовательности, или его можно осуществлять посредством индукции DSB. В частности, внесение изменений в гены представляет собой нокдаун генов. В некоторых вариантах осуществления постмитотическая клетка наиболее предпочтительно представляет собой клетку почки или головного мозга (нейрон) или клетку печени, такую как первичный гепатоцит.
Альтернативно, внесение изменений в гены может представлять собой усиление функции гена (т.е. активности кодируемого продукта гена). Его можно индуцировать, например, путем изменения генома первой популяции клеток с получением второй популяции клеток, где первая популяция клеток имеет дефектный генотип, как, например, при моногенном состоянии, которое отсутствует (т.е. подвергнуто коррекции) у второй популяции клеток. Для него может требоваться соответствующая матрица для репарации, обсуждаемая в данном документе, для получения скорректированной последовательности.
Если применяется мультиплексирование, то предусматривается комбинация ослабления функционирования одного или нескольких генов и усиление функционирования одного или нескольких генов. Этого можно достичь путем обеспечения одной или нескольких направляющих последовательностей (в мультиплексе) и соответствующих матриц для репарации, которые можно применять для ослабления функционирования, и в то же время одну или несколько направляющих последовательностей и соответствующих им матриц для репарации можно применять для усиления функций.
Также представлен способ исследования функции одного или нескольких генов и одной или нескольких постмитотических клеток, включающий определение изменений экспрессии одного или нескольких генов в первой популяции постмитотических клеток, индукцию указанного внесения изменений в гены в указанной первой популяции для получения указанной второй популяции с измененный геномом (или генотипом) и определение изменений в экспрессии одного или нескольких генов во второй популяции постмитотических клеток, с исследованием таким образом функции одного или нескольких генов. В некоторых вариантах осуществления постмитотическая клетка наиболее предпочтительно представляет собой клетку почки или головного мозга (нейрон) или клетку печени, такую как первичный гепатоцит.
Также представлена модель и способ создания такой модели. Модель может представлять собой животное, имеющее постмитотическую клетку (модель in vivo), или она может представлять собой модель ex vivo или in vitro, такую как постмитотический органоид или 'постмитотическая клетка на чипе', или совокупность постмитотических клеток, как, например, на подложке, как описано в данном документе. Постмитотические клетки любой модели предпочтительно трансфицируют с помощью Cas9. Соответственно, определенным образом представлена модель, содержащая одну или несколько постмитотических клеток, содержащих фермент CRISPR, предпочтительно Cas9, такой как Sa- или SpCas9. Модельные клетки могут быть трансфицированы или трансдуцированы вторым регуляторным элементом, представленным в данном документе, который является вторым регуляторным элементом, функционально связанным с кодирующей фермент последовательностью, кодирующей фермент CRISPR, содержащий по меньшей мере одну или несколько последовательностей ядерной локализации (NLS). Модель может являться, как описано выше, моделью in vivo, или она может являться моделью ex vivo или in vitro. Такая модель позволяет проводить быстрое исследование функций одного или нескольких генов, поскольку для изменения функций указанного гена необходима доставка только полинуклеотидной последовательности из системы CRISPR-Cas (содержащей одну или несколько направляющих последовательностей, осуществляющих нацеливание на указанные один или несколько генов). Другими словами, способы исследования функций генов в таких моделях могут включать только доставку полинуклеотидной последовательности из системы CRISPR-Cas (содержащей одну или несколько направляющих последовательностей), при этом наличие Cas (фермента CRISPR) в клетке(клетках) модели уже было обеспечено. Также представлены способы создания таких моделей, включающие трансдукцию или трансфекцию одной или нескольких постмитотических клеток в первой популяции постмитотических клеток вторым регуляторным элементом, функционально связанным с кодирующей фермент последовательностью, кодирующей фермент CRISPR, содержащий по меньшей мере одну или несколько последовательностей ядерной локализации (NLS), как описано в данном документе, для получения таким образом одной или нескольких постмитотических клеток второй популяции, содержащих или экспрессирующих фермент CRISPR. В некоторых вариантах осуществления постмитотическая клетка наиболее предпочтительно представляет собой клетку почки или головного мозга (нейрон) или клетку печени, такую как первичный гепатоцит.
Также представлены способы создания моделей с внесенными изменениями в генах, в частности, моделей с нокдауном генов. Эти способы обычно могут включать индукцию внесения изменений в гены в одном или нескольких генах, как описано в данном документе, в первой популяции клеток с получением таким образом второй популяции клеток с измененным геномом (или генотипом). Вторую популяцию клеток можно затем высеять на подложку или на чип, например, с получением таким образом модели ex vivo или in vitro. Альтернативно, вторая популяция может содержаться в животном in vivo.
Также предусмотрены способы генной терапии. Например, коррекцию одного или нескольких дефектных генотипов (например, одиночных точечных мутаций) можно осуществить посредством применения системы CRISPR-Cas по настоящему изобретению в постмитотических клетках, обсуждаемых в данном документе (в том числе в моделях). Моногенные состояния, связанные с постмитотическими клетками, являются особенно предпочтительными и проиллюстрированы в данном документе, смотри пример 36, в котором мишенью для системы CRISPR-Cas9, для которой она была эффективной в индуцировании фенотипического изменения in vivo, являлся ApoB, ген, участвующий в метаболизме липидов. Пример 38 также является наглядным в отношении фенотипических изменений поведения, наблюдаемых in vivo в головном мозге мышей, трансдуцированных системой по настоящему изобретению. Также представлены композиции для применения в генной терапии.
Хотя предусмотрены различные ферменты Cas, Cas9 является особенно предпочтительным, и авторами настоящего изобретения была продемонстрирована особенная эффективность SaCa9 в печени. Tracr-последовательность из Sa также является предпочтительной, если фермент Cas является ферментом SaCas. Подходящим РАМ в данном случае является NNGRR.
Хотя можно применять одну направляющую последовательность, так называемое мультиплексирование с двумя, тремя, четырьмя или более направляющими последовательностями является особенно применимым в исследовании функций генов и создании моделей (с получением нокдауна нескольких генов), а также в генной терапии, когда коррекции подлежат несколько дефектных генотипов (несколько ошибок в одном гене либо, с большей долей вероятности, несколько ошибок, распределенных среди нескольких генов). Альтернативно, мультиплексирование с двумя направляющими последовательностями применимо в подходе с двойной никазой для снижения частоты нецелевых эффектов или попросту для отбора нескольких мишеней в одном гене для обеспечения привлечения Cas. Предпочтительными являются тройные и четверные направляющие последовательности. В данном документе на ген и локус генома ссылаются взаимозаменяемо.
Также применимым в этом отношении является подход с интроном, описанный в данном документе, где направляющая последовательность расположена в интроне Cas.
Предпочтительные средства доставки включают способы, описанные Kanasty ниже, такие как LNP, особенно если доставке подлежит только направляющая последовательность или она подлежит доставке в отдельности. Тем не менее, для печени, как правило, предпочтительными являются вирусные векторы, в том числе лентивирусные и AAV, поскольку до сих пор они были успешными. Среди них предпочтительным является AAV и особенно серотип 8, при этом было показано, что AAV2/8 является эффективным. Некоторые предпочтительные мишени, при условии, что они присутствуют, или состояния почки представляют собой нарушения метаболизма, такие как любое из следующих: амилоидная невропатия (TTR, PALB); амилоидоз (АРОА1, АРР, ААА, CVAP, AD1, GSN, FGA, LYZ, TTR, PALB); цирроз (KRT18, KRT8, CIRH1A, NAIC, ТЕХ292, KIAA1988); муковисцидоз (CFTR, ABCC7, CF, MRP7); болезни накопления гликогена (SLC2A2, GLUT2, G6PC, G6PT, G6PT1, GAA, LAMP2, LAMPB, AGL, GDE, GBE1, GYS2, PYGL, PFKM); аденома печени, 142330 (TCF1, HNF1A, MODY3), печеночная недостаточность с ранним началом и с неврологическим нарушением (SCOD1, SCO1), недостаточность печеночной липазы (LIPC), гепатобластома, рак и виды эпителиомы (CTNNB1, PDGFRL, PDGRL, PRLTS, AXIN1, AXIN, CTNNB1, ТР53, Р53, LFS1, IGF2R, MPRI, MET, CASP8, МСН5); заболевание по типу медуллярной кистозной нефропатии (UMOD, HNFJ, FJHN, MCKD2, ADMCKD2); фенилкетонурия (РАН, PKU1, QDPR, DHPR, PTS); поликистоз почек и печени (FCYT, PKHD1, ARPKD, PKD1, PKD2, PKD4, PKDTS, PRKCSH, G19P1, PCLD, SEC63). Другие предпочтительные мишени включают какую-либо одну или несколько из PCSK9, HMGCR, АРОВ, LDLR, ANGPTL3, F8, F9/FIX, ААТ, FAH, HPD, TAT, ATP7B, UGT1A1, ОТС, ARH.
Следует иметь в виду, что способы изменения экспрессии в постмитотической клетке не включают изменение в зародышевой линии, которое может быть исключено по моральным соображениям. В действительности, хотя трансфекция стволовых клеток предусмотрена и является безусловно предпочтительной в некоторых вариантах осуществления, нейроны или клетки почки являются особенно предпочтительными, в особенности если они могут демонстрировать некоторую регенерацию или могут быть стимулированы для ее демонстрации.
CRISPR типа II являются особенно предпочтительными, в частности, для применения у эукариот, как в данном случае, поскольку в любом случае печень обнаружена лишь у эукариот, в частности, у позвоночных животных.
Применение систем CRISPR-Cas для вызова фенотипического изменения, в частности, in vivo, является особенным преимуществом. Авторы настоящего изобретения продемонстрировали это в настоящей заявке.
Если предусмотрены применения в терапии или другая геномная инженерия в постмитотических клетках, то при необходимости коррекции следует иметь в виду, что после внесения однонитевого разрыва в геномную ДНК-мишень или ее расщепления предпочтительной является последующая коррекция посредством пути HDR. Для нокдауна генов преимущественным является NHEJ, однако, для терапии предпочтительной является коррекция посредством пути HDR. В таких случаях предпочтительной является доставка матрицы для репарации. Она наиболее предпочтительно представляет собой ssDNA, хотя также возможно использование РНК посредством ретровирусного вектора, обеспечивающего соответствующую ДНК-матрицу. Специалист в данной области может без труда осуществить настоящее изобретение на практике на основании изложенных в данном документе идей, вносящих вклад в уровень техники; и в этом отношении упоминается, что специалист в данной области на основании изложенных в данном документе идей, вносящих вклад в уровень техники, может без труда понимать и внедрять соображения, касающиеся длины гомологичных плечей. Упомянуты патентные заявки и публикации, в том числе автора Zhang, включенные в данный документ, в том числе цитируемые в данном документе. Матрицу для репарации предпочтительно доставляют совместно с одним или несколькими элементами системы CRISPR-Cas.
Также представлен способ изменения экспрессии по меньшей мере одного продукта гена постмитотической клетки, включающий введение в эукариотическую клетку печени, например, гепатоцит, содержащую и экспрессирующую молекулу ДНК, имеющую целевую последовательность и кодирующую продукт гена, сконструированной не встречающейся в природе системы коротких палиндромных повторов, регулярно расположенных группами (CRISPR), и CRISPR-ассоциированных генов (Cas) (CRISPR-Cas), содержащей один или несколько векторов, содержащих:
a) первый регуляторный элемент, функционирующий в эукариотической клетке, функционально связанный по меньшей мере с одной нуклеотидной последовательностью, кодирующей направляющую РНК системы CRISPR-Cas, которая гибридизируется с целевой последовательностью, и
b) второй регуляторный элемент, функционирующий в эукариотической клетке, функционально связанный с нуклеотидной последовательностью, кодирующей белок Cas9 типа II,
где компоненты (a) и (b) находятся в одном и том же или в разных векторах системы, в результате чего направляющая РНК осуществляет нацеливание на целевую последовательность, а белок Cas9 расщепляет молекулу ДНК, в результате чего экспрессия по меньшей мере одного продукта гена постмитотической клетки изменяется; и где белок Cas9 и направляющая РНК не встречаются вместе в естественных условиях.
Мишени, на которые ссылаются ниже, понимают как мишени постмитотической клетки или другие гены, экспрессируемые в постмитотической клетке, если не очевидно иное.
Любая или все из полинуклеотидной последовательности, кодирующей фермент CRISPR, направляющей последовательности, парной tracr-последовательности или tracr-последовательности могут представлять собой РНК. Полинуклеотиды, кодирующие последовательность, кодирующую фермент CRISPR, направляющую последовательность, парную tracr-последовательность или tracr-последовательность, могут представлять собой РНК, и их могут доставлять посредством липосом, наночастиц, экзосом, микропузырьков или генной пушки.
Следует иметь в виду, что если ссылаются на полинуклеотид, который представляет собой РНК и, как говорят, 'содержит' элемент, такой как парная tracr-последовательность, то последовательность РНК содержит данный элемент. Если полинуклеотид представляет собой ДНК и, как говорят, содержит элемент, такой как парная tracr-последовательность, то последовательность ДНК транскрибируется или может быть транскрибирована в РНК, содержащую элемент, о котором идет речь. Если элемент представляет собой белок, такой как фермент CRISPR, то упоминаемая последовательность ДНК или РНК транслируется или может быть транслирована (а в случае ДНК сначала транскрибируется).
Соответственно, в определенных вариантах осуществления настоящее изобретение предусматривает способ модификации постмитотических клеток организма, например, млекопитающего, в том числе человека, или отличного от человека млекопитающего или организма путем манипуляции с целевой последовательностью в представляющем интерес локусе генома, включающий доставку не встречающейся в природе или сконструированной композиции, содержащей вирусную или плазмидную векторную систему, содержащую один или несколько вирусных или плазмидных векторов, функционально кодирующих композицию для ее экспрессии, где композиция содержит: (А) не встречающуюся в природе или сконструированную композицию, содержащую векторную систему, содержащую один или несколько векторов, содержащих I. первый регуляторный элемент, функционально связанный с полинуклеотидной последовательностью химерной РНК (chiRNA) системы CRISPR-Cas, где полинуклеотидная последовательность содержит (а) направляющую последовательность, способную гибридизироваться с целевой последовательностью в эукариотической клетке, (b) парную tracr-последовательность и (с) tracr-последовательность, и II. второй регуляторный элемент, функционально связанный с кодирующей фермент последовательностью, кодирующей фермент CRISPR, содержащий по меньшей мере одну или несколько последовательностей ядерной локализации (или необязательно по меньшей мере одну или несколько последовательностей ядерной локализации, поскольку некоторые варианты осуществления могут не включать NLS), где (а), (b) и (с) расположены в 5'-3' ориентации, где компоненты I и II находятся в одном и том же или в разных векторах системы, где при транскрипции парная tracr-последовательность гибридизируется с tracr-последовательностью, а направляющая последовательность управляет специфичным к последовательности связыванием комплекса CRISPR с целевой последовательностью, и где комплекс CRISPR содержит фермент CRISPR, образующий комплекс с (1) направляющей последовательностью, которая гибридизируется с целевой последовательностью, и (2) парной tracr-последовательностью, которая гибридизируется с tracr-последовательностью, или (В) не встречающуюся в природе или сконструированную композицию, содержащую векторную систему, содержащую один или несколько векторов, содержащих I. первый регуляторный элемент, функционально связанный с (а) направляющей последовательностью, способной гибридизироваться с целевой последовательностью в эукариотической клетке, и (b) по меньшей мере одной или несколькими парными tracr-последовательностями, II. второй регуляторный элемент, функционально связанный с кодирующей фермент последовательностью, кодирующей фермент CRISPR, и III. третий регуляторный элемент, функционально связанный с tracr-последовательностью, где компоненты I, II и III находятся в одном и том же или в разных векторах системы, где при транскрипции парная tracr-последовательность гибридизируется с tracr-последовательностью, а направляющая последовательность управляет специфичным к последовательности связыванием комплекса CRISPR с целевой последовательностью, и где комплекс CRISPR содержит фермент CRISPR, образующий комплекс с (1) направляющей последовательностью, которая гибридизируется с целевой последовательностью, и (2) парной tracr-последовательностью, которая гибридизируется с tracr-последовательностью. В некоторых вариантах осуществления компоненты I, II и III находятся в одном и том же векторе. В других вариантах осуществления компоненты I и II находятся в одном и том же векторе, тогда как компонент III находится в другом векторе. В других вариантах осуществления компоненты I и III находятся в одном и том же векторе, тогда как компонент II находится в другом векторе. В других вариантах осуществления компоненты II и III находятся в одном и том же векторе, тогда как компонент I находится в другом векторе. В других вариантах осуществления каждый из компонентов I, II и III находится в отдельном векторе. Настоящее изобретение также предусматривает вирусную или плазмидную векторную систему, описанную в данном документе.
Вектор предпочтительно представляет собой вирусный вектор, как, например, векторы на основе лентивируса, или бакуловируса, или, предпочтительно, аденовируса/аденоассоциированного вируса, но известны и предусмотрены другие средства доставки (такие как дрожжевые системы, микропузырьки, генные пушки/средства прикрепления векторов к наночастицам золота). В некоторых вариантах осуществления один или несколько вирусных или плазмидных векторов можно доставлять посредством липосом, наночастиц, экзосом, микропузырьков или генной пушки.
Под манипуляцией с целевой последовательностью заявители также подразумевают эпигенетическую манипуляцию с целевой последовательностью. Она может осуществляться в отношении состояния хроматина целевой последовательности, как, например, путем модификации состояния метилирования целевой последовательности (т.е. добавление или устранение метилирования, или паттернов метилирования, или CpG-островков), модификации гистонов, повышения или снижения доступности целевой последовательности, или путем активации укладки в 3D-структуру.
Следует иметь в виду, что если ссылаются на способ модификации организма или млекопитающего, в том числе человека, или отличного от человека млекопитающего или организма путем манипуляции с целевой последовательностью в представляющем интерес локусе генома, тогда его можно использовать в отношении организма (или млекопитающего) в целом или всего лишь одной клетки или популяции клеток из этого организма (если организм является многоклеточным). В случае человека, например, заявители предусматривают, помимо прочего, одну клетку или популяцию клеток, и их можно предпочтительно модифицировать ex vivo и затем вводить обратно. В этом случае может быть необходим биоптат или другой образец ткани, или биологической жидкости. Стволовые клетки также являются особенно предпочтительными в этом отношении. Но, разумеется, также предусматриваются варианты осуществления in vivo.
В определенных вариантах осуществления настоящее изобретение предусматривает способ лечения или подавления состояния, вызванного дефектом в целевой последовательности в представляющем интерес локусе генома у субъекта (например, млекопитающего или человека) или отличного от человека субъекта (например, млекопитающего), нуждающегося в этом, включающий модификацию субъекта или отличного от человека субъекта путем манипуляции с целевой последовательностью, и где состояние является чувствительным к лечению или подавлению путем манипуляции с целевой последовательностью, включающий обеспечение лечения, предусматривающего доставку не встречающейся в природе или сконструированной композиции, содержащей векторную систему на основе AAV или лентивируса, содержащую один или несколько векторов на основе AAV или лентивируса, функционально кодирующих композицию для ее экспрессии, где манипуляцию с целевой последовательностью осуществляют с помощью композиции при ее экспрессии, где композиция содержит: (А) не встречающуюся в природе или сконструированную композицию, содержащую векторную систему, содержащую один или несколько векторов, содержащих I. первый регуляторный элемент, функционально связанный с полинуклеотидной последовательностью химерной РНК (chiRNA) системы CRISPR-Cas, где полинуклеотидная последовательность содержит (а) направляющую последовательность, способную гибридизироваться с целевой последовательностью в эукариотической клетке, (b) парную tracr-последовательность и (с) tracr-последовательность, и II. второй регуляторный элемент, функционально связанный с кодирующей фермент последовательностью, кодирующей фермент CRISPR, содержащий по меньшей мере одну или несколько последовательностей ядерной локализации (или необязательно по меньшей мере одну или несколько последовательностей ядерной локализации, поскольку некоторые варианты осуществления могут не включать NLS), где (а), (b) и (с) расположены в 5'-3' ориентации, где компоненты I и II находятся в одном и том же или в разных векторах системы, где при транскрипции парная tracr-последовательность гибридизируется с tracr-последовательностью, а направляющая последовательность управляет специфичным к последовательности связыванием комплекса CRISPR с целевой последовательностью, и где комплекс CRISPR содержит фермент CRISPR, образующий комплекс с (1) направляющей последовательностью, которая гибридизируется с целевой последовательностью, и (2) парной tracr-последовательностью, которая гибридизируется с tracr-последовательностью, или (В) не встречающуюся в природе или сконструированную композицию, содержащую векторную систему, содержащую один или несколько векторов, содержащих I. первый регуляторный элемент, функционально связанный с (а) направляющей последовательностью, способной гибридизироваться с целевой последовательностью в эукариотической клетке, и (b) по меньшей мере одной или несколькими парными tracr-последовательностями, II. второй регуляторный элемент, функционально связанный с кодирующей фермент последовательностью, кодирующей фермент CRISPR, и III. третий регуляторный элемент, функционально связанный с tracr-последовательностью, где компоненты I, II и III находятся в одном и том же или в разных векторах системы, где при транскрипции парная tracr-последовательность гибридизируется с tracr-последовательностью, а направляющая последовательность управляет специфичным к последовательности связыванием комплекса CRISPR с целевой последовательностью, и где комплекс CRISPR содержит фермент CRISPR, образующий комплекс с (1) направляющей последовательностью, которая гибридизируется с целевой последовательностью, и (2) парной tracr-последовательностью, которая гибридизируется с tracr-последовательностью. В некоторых вариантах осуществления компоненты I, II и III находятся в одном и том же векторе. В других вариантах осуществления компоненты I и II находятся в одном и том же векторе, тогда как компонент III находится в другом векторе. В других вариантах осуществления компоненты I и III находятся в одном и том же векторе, тогда как компонент II находится в другом векторе. В других вариантах осуществления компоненты II и III находятся в одном и том же векторе, тогда как компонент I находится в другом векторе. В других вариантах осуществления каждый из компонентов I, II и III находится в отдельном векторе. Настоящее изобретение также предусматривает вирусную (например, на основе AAV или лентивируса) векторную систему, описанную в данном документе, и она может быть частью векторной системы, описанной в данном документе.
Некоторые способы по настоящему изобретению могут включать индукцию экспрессии. Организм или субъект является эукариотом (в том числе млекопитающим, в том числе человеком), или отличным от человека эукариотом, или отличным от человека животным, или отличным от человека млекопитающим, при условии, что у него есть постмитотическая клетка (например, головного мозга или почки) и соответствующая функция. В некоторых вариантах осуществления организм или субъект является отличным от человека животным и может быть членистоногим, например, насекомым, или может быть нематодой. В некоторых способах по настоящему изобретению организм или субъект является млекопитающим или отличным от человека млекопитающим. Отличное от человека млекопитающее может быть, например, грызуном (предпочтительно мышью или крысой), копытным или приматом. В некоторых способах по настоящему изобретению вирусный вектор представляет собой AAV или лентивирус и может быть частью векторной системы, описанной в данном документе. В некоторых способах по настоящему изобретению фермент CRISPR представляет собой Cas9. В некоторых способах по настоящему изобретению экспрессия направляющей последовательности находится под контролем промотора Т7 и управляется экспрессией полимеразы Т7.
Настоящее изобретение в некоторых вариантах осуществления охватывает способ доставки фермента CRISPR, включающий доставку в клетку мРНК, кодирующей фермент CRISPR. В некоторых из данных способов фермент CRISPR представляет собой Cas9.
Настоящее изобретение также предусматривает способы получения векторных систем по настоящему изобретению, в частности, вирусных векторных систем, описанных в данном документе. Настоящее изобретение в некоторых вариантах осуществления охватывает способ получения AAV по настоящему изобретению, включающий трансфекцию плазмиды(плазмид), содержащей молекулу(молекулы) нуклеиновой кислоты, кодирующие AAV, или по сути состоящих из них, в клетки, инфицированные AAV, и обеспечение rep и/или cap AAV, обязательных для репликации и упаковки AAV. В некоторых вариантах осуществления rep и/или cap AAV, обязательные для репликации и упаковки AAV, обеспечивают путем трансфекции клеток плазмидой-помощником(плазмидами-помощниками) или вирусом-помощником(вирусами-помощниками). В некоторых вариантах осуществления вирусом-помощником является поксвирус, аденовирус, герпесвирус или бакуловирус. В некоторых вариантах осуществления поксвирус представляет собой вирус осповакцины. В некоторых вариантах осуществления клетки являются клетками млекопитающих. А в некоторых вариантах осуществления клетки являются клетками насекомых, а вирус-помощник представляет собой бакуловирус. В других вариантах осуществления вирус представляет собой лентивирус.
Настоящее изобретение дополнительно охватывает композицию по настоящему изобретению или ее фермент CRISPR (в том числе, или альтернативно, мРНК, кодирующую фермент CRISPR) для применения в медицине или в терапии. В некоторых вариантах осуществления настоящее изобретение охватывает композицию согласно настоящему изобретению или ее фермент CRISPR (в том числе, или альтернативно, мРНК, кодирующую фермент CRISPR) для применения в способе согласно настоящему изобретению. В некоторых вариантах осуществления настоящее изобретение предусматривает применение композиции по настоящему изобретению или ее фермента CRISPR (в том числе, или альтернативно, мРНК, кодирующей фермент CRISPR) в редактировании генов или генома ex vivo. В определенных вариантах осуществления настоящее изобретение охватывает применение композиции по настоящему изобретению или ее фермента CRISPR (в том числе, или альтернативно, мРНК, кодирующей фермент CRISPR) в производстве лекарственного препарата для редактирования генов или генома ex vivo или для применения в способе согласно настоящему изобретению. Настоящее изобретение в некоторых вариантах осуществления охватывает композицию по настоящему изобретению или ее фермент CRISPR (в том числе, или альтернативно, мРНК, кодирующую фермент CRISPR), где целевая последовательность фланкирована на своем 3'-конце РАМ-последовательностью (мотивом, прилегающим к протоспейсеру), содержащей 5'-концевой мотив, особенно если Cas9 представляет собой (или получен из) Cas9 S. pyogenes или S. aureus. Например, подходящий РАМ представляет собой 5'-NRG или 5'-NNGRR (где N представляет собой любой нуклеотид) для ферментов SpCas9 или SaCas9 (или происходящих из них ферментов), соответственно, как отмечено ниже.
Следует иметь в виду, что SpCas9 или SaCas9 получены или происходят из Cas9 S. pyogenes или S. aureus. Они, разумеется, могут быть подвергнуты мутации или иным образом изменены по сравнению с диким типом для соответствия предполагаемому применению, описанному в данном документе. Предпочтительными являются мутантная форма или вариант двойной никазы D10A, особенно в комбинации с двумя перекрывающимися направляющими последовательностями, ориентированными как противоположные сайты в различных нитях одной и той же хромосомы.
Аспекты настоящего изобретения охватывают улучшение специфичности фермента CRISPR, например, Cas9, опосредующей целенаправленное воздействие на гены, и снижение вероятности нецелевой модификации ферментом CRISPR, например, Cas9. Настоящее изобретение в некоторых вариантах осуществления охватывает способ модификации организма или отличного от человеческого организма посредством сведения к минимуму нецелевых модификаций путем манипуляции с первой и второй целевыми последовательностями на противоположных нитях ДНК-дуплекса в представляющем интерес локусе генома в клетке, включающий доставку не встречающейся в природе или сконструированной композиции, содержащей:
I. первую полинуклеотидную последовательность химерной РНК (chiRNA) системы CRISPR-Cas, где первая полинуклеотидная последовательность содержит:
(a) первую направляющую последовательность, способную гибридизироваться с первой целевой последовательностью,
(b) первую парную tracr-последовательность и
(c) первую tracr-последовательность,
II. вторую полинуклеотидную последовательность chiRNA системы CRISPR-Cas, где вторая полинуклеотидная последовательность содержит:
(a) вторую направляющую последовательность, способную гибридизироваться со второй целевой последовательностью,
(b) вторую парную tracr-последовательность и
(c) вторую tracr-последовательность, и
III. полинуклеотидную последовательность, кодирующую фермент CRISPR, содержащий по меньшей мере одну или несколько последовательностей ядерной локализации и содержащий одну или несколько мутаций, где (а), (b) и (с) расположены в 5'-3' ориентации, где при транскрипции первая и вторая парные tracr-последовательности гибридизируются с первой и второй tracr-последовательностями, соответственно, а первая и вторая направляющие последовательности управляют специфичным к последовательности связыванием первого и второго комплексов CRISPR с первой и второй целевыми последовательностями, соответственно, где первый комплекс CRISPR содержит фермент CRISPR, образующий комплекс с (1) первой направляющей последовательностью, которая гибридизируется с первой целевой последовательностью, и (2) первой парной tracr-последовательностью, которая гибридизируется с первой tracr-последовательностью, где второй комплекс CRISPR содержит фермент CRISPR, образующий комплекс со (1) второй направляющей последовательностью, которая гибридизируется со второй целевой последовательностью, и (2) второй парной tracr-последовательностью, которая гибридизируется со второй tracr-последовательностью, где полинуклеотидная последовательность, кодирующая фермент CRISPR, представляет собой ДНК или РНК, и где первая направляющая последовательность управляет расщеплением одной нити ДНК-дуплекса возле первой целевой последовательности, а вторая направляющая последовательность управляет расщеплением другой нити возле второй целевой последовательности, индуцируя двухнитевой разрыв, с модификацией таким образом организма или отличного от человеческого организма посредством сведения к минимуму нецелевых модификаций.
В некоторых способах по настоящему изобретению какая-либо или все из полинуклеотидной последовательности, кодирующей фермент CRISPR, первой и второй направляющих последовательностей, первой и второй парных tracr-последовательностей или первой и второй tracr-последовательностей представляет собой/представляют собой РНК. В дополнительных вариантах осуществления настоящего изобретения полинуклеотиды, кодирующие последовательность, кодирующую фермент CRISPR, первую и вторую направляющие последовательности, первую и вторую парные tracr-последовательности или первую и вторую tracr-последовательности, представляют собой РНК, и их доставляют посредством липосом, наночастиц, экзосом, микропузырьков или генной пушки. В определенных вариантах осуществления настоящего изобретения первая и вторая парные tracr-последовательности обладают 100% идентичностью, и/или первая и вторая tracr-последовательности обладают 100% идентичностью. В некоторых вариантах осуществления полинуклеотиды могут содержаться в векторной системе, содержащей один или несколько векторов. В предпочтительных вариантах осуществления настоящего изобретения фермент CRISPR представляет собой фермент Cas9, например, SpCas9. В аспекте настоящего изобретения фермент CRISPR содержит одну или несколько мутаций в каталитическом домене, где одна или несколько мутаций выбраны из группы, состоящей из D10A, Е762А, Н840А, N854A, N863A и D986A. В особенно предпочтительном варианте осуществления фермент CRISPR имеет мутацию D10A. В предпочтительных вариантах осуществления первый фермент CRISPR имеет одну или несколько мутаций, вследствие которых фермент представляет собой фермент, вносящий однонитевой разрыв в комплементарную нить, а второй фермент CRISPR имеет одну или несколько мутаций, вследствие которых фермент представляет собой фермент, вносящий однонитевой разрыв в некомплементарную нить. Альтернативно, первый фермент может являться ферментом, вносящим однонитевой разрыв в некомплементарную нить, а второй фермент может являться ферментом, вносящим однонитевой разрыв в комплементарную нить.
В предпочтительных способах по настоящему изобретению первая направляющая последовательность, управляющая расщеплением одной нити ДНК-дуплекса возле первой целевой последовательности, и вторая направляющая последовательность, управляющая расщеплением другой нити возле второй целевой последовательности, обуславливают возникновение "липкого" 5'-конца. В вариантах осуществления настоящего изобретения "липкий" 5'-конец содержит не более 200 пар оснований, предпочтительно не более 100 пар оснований или более предпочтительно не более 50 пар оснований. В вариантах осуществления настоящего изобретения "липкий" 5'-конец содержит по меньшей мере 26 пар оснований, предпочтительно по меньшей мере 30 пар оснований или более предпочтительно 34-50 пар оснований. Перекрывание наиболее предпочтительно охватывает от 5 до -1 пары оснований.
Настоящее изобретение в некоторых вариантах осуществления охватывает способ модификации организма или отличного от человеческого организма посредством сведения к минимуму нецелевых модификаций путем манипуляции с первой и второй целевыми последовательностями на противоположных нитях ДНК-дуплекса в представляющем интерес локусе генома в клетке, включающий доставку не встречающейся в природе или сконструированной композиции, содержащей векторную систему, содержащую один или несколько векторов, содержащих:
I. первый регуляторный элемент, функционально связанный с
(a) первой направляющей последовательностью, способной гибридизироваться с первой целевой последовательностью, и
(b) по меньшей мере одной или несколькими парными tracr-последовательностями,
II. второй регуляторный элемент, функционально связанный со
(a) второй направляющей последовательностью, способной гибридизироваться со второй целевой последовательностью, и
(b) по меньшей мере одной или несколькими парными tracr-последовательностями,
III. третий регуляторный элемент, функционально связанный с кодирующей фермент последовательностью, кодирующей фермент CRISPR, и
IV. четвертый регуляторный элемент, функционально связанный с tracr-последовательностью,
где компоненты I, II, III и IV находятся в одном и том же или в разных векторах системы, где при транскрипции парная tracr-последовательность гибридизируется с tracr-последовательностью, а первая и вторая направляющие последовательности управляют специфичным к последовательности связыванием первого и второго комплексов CRISPR с первой и второй целевыми последовательностями, соответственно, где первый комплекс CRISPR содержит фермент CRISPR, образующий комплекс с (1) первой направляющей последовательностью, которая гибридизируется с первой целевой последовательностью, и (2) парной tracr-последовательностью, которая гибридизируется с tracr-последовательностью, где второй комплекс CRISPR содержит фермент CRISPR, образующий комплекс со (1) второй направляющей последовательностью, которая гибридизируется со второй целевой последовательностью, и (2) парной tracr-последовательностью, которая гибридизируется с tracr-последовательностью, где полинуклеотидная последовательность, кодирующая фермент CRISPR, представляет собой ДНК или РНК, и где первая направляющая последовательность управляет расщеплением одной нити ДНК-дуплекса возле первой целевой последовательности, а вторая направляющая последовательность управляет расщеплением другой нити возле второй целевой последовательности, индуцируя двухнитевой разрыв, с модификацией таким образом организма или отличного от человеческого организма посредством сведения к минимуму нецелевых модификаций.
Настоящее изобретение также предусматривает векторную систему, описанную в данном документе. Система может содержать один, два, три или четыре различных вектора. Компоненты I, II, III и IV могут таким образом находиться в одном, двух, трех или четырех различных векторах, и в данном документе предусмотрены все комбинации возможных местоположений компонентов, например: компоненты I, II, III и IV могут находиться в одном и том же векторе; каждый из компонентов I, II, III и IV может находиться в отдельном векторе; компоненты I, II, III и IV могут находиться в общей сложности в двух или трех различных векторах, при этом предусмотрены все комбинации местоположений, и т.п.
В некоторых способах по настоящему изобретению любая или все из полинуклеотидной последовательности, кодирующей фермент CRISPR, первой и второй направляющих последовательностей, первой и второй парных tracr-последовательностей или первой и второй tracr-последовательностей представляет собой/представляют собой РНК. В дополнительных вариантах осуществления настоящего изобретения первая и вторая парные tracr-последовательности обладают 100% идентичностью, и/или первая и вторая tracr-последовательности обладают 100% идентичностью. В предпочтительных вариантах осуществления настоящего изобретения фермент CRISPR представляет собой фермент Cas9, например, SpCas9. В аспекте настоящего изобретения фермент CRISPR содержит одну или несколько мутаций в каталитическом домене, где одна или несколько мутаций выбраны из группы, состоящей из D10A, Е762А, Н840А, N854A, N863A и D986A. В особенно предпочтительном варианте осуществления фермент CRISPR имеет мутацию D10A. В предпочтительных вариантах осуществления первый фермент CRISPR имеет одну или несколько мутаций, вследствие которых фермент является ферментом, вносящим однонитевой разрыв в комплементарную нить, а второй фермент CRISPR имеет одну или несколько мутаций, вследствие которых фермент является ферментом, вносящим однонитевой разрыв в некомплементарную нить. Альтернативно, первый фермент может являться ферментом, вносящим однонитевой разрыв в некомплементарную нить, а второй фермент может являться ферментом, вносящим однонитевой разрыв в комплементарную нить. В дополнительном варианте осуществления настоящего изобретения один или несколько вирусных векторов доставляют посредством липосом, наночастиц, экзосом, микропузырьков или генной пушки.
В предпочтительных способах по настоящему изобретению первая направляющая последовательность, управляющая расщеплением одной нити ДНК-дуплекса возле первой целевой последовательности, и вторая направляющая последовательность, управляющая расщеплением другой нити возле второй целевой последовательности, обуславливают возникновение "липкого" 5'-конца. В вариантах осуществления настоящего изобретения "липкий" 5'-конец содержит не более 200 пар оснований, предпочтительно не более 100 пар оснований или более предпочтительно не более 50 пар оснований. В вариантах осуществления настоящего изобретения "липкий" 5'-конец содержит по меньшей мере 26 пар оснований, предпочтительно по меньшей мере 30 пар оснований или более предпочтительно 34-50 пар оснований.
Настоящее изобретение в некоторых вариантах осуществления охватывает способ модификации представляющего интерес локуса генома посредством сведения к минимуму нецелевых модификаций путем введения в клетку, содержащую и экспрессирующую двухнитевую молекулу ДНК, кодирующую представляющий интерес продукт гена, сконструированной не встречающейся в природе системы CRISPR-Cas, содержащей белок Cas, имеющий одну или несколько мутаций, и две направляющие РНК, которые осуществляют нацеливание на первую нить и вторую нить молекулы ДНК, соответственно, при этом направляющие РНК осуществляют нацеливание на молекулу ДНК, кодирующую продукт гена, а белок Cas вносит однонитевой разрыв в каждую из первой нити и второй нити молекулы ДНК, кодирующей продукт гена, в результате чего экспрессия продукта гена изменяется; и где белок Cas и две направляющие РНК не встречаются вместе в естественных условиях.
В предпочтительных способах по настоящему изобретению белок Cas вносит однонитевой разрыв в каждую из первой нити и второй нити молекулы ДНК, кодирующей продукт гена, что обуславливает возникновение "липкого" 5'-конца. В вариантах осуществления настоящего изобретения "липкий" 5'-конец содержит не более 200 пар оснований, предпочтительно не более 100 пар оснований или более предпочтительно не более 50 пар оснований. В вариантах осуществления настоящего изобретения "липкий" 5'-конец содержит по меньшей мере 26 пар оснований, предпочтительно по меньшей мере 30 пар оснований или более предпочтительно 34-50 пар оснований.
Варианты осуществления настоящего изобретения также охватывают направляющие РНК, содержащие направляющую последовательность, слитую с парной tracr-последовательностью и tracr-последовательностью. В аспекте настоящего изобретения белок Cas является кодон-оптимизированным для экспрессии в эукариотической клетке, предпочтительно в клетке млекопитающего или клетке человека. В дополнительных вариантах осуществления настоящего изобретения белок Cas представляет собой белок системы CRISPR-Cas типа II, например, белок Cas9. В особенно предпочтительном варианте осуществления белок Cas представляет собой белок Cas9, например, SpCas9. В аспектах настоящего изобретения белок Cas имеет одну или несколько мутаций, выбранных из группы, состоящей из D10A, Е762А, Н840А, N854A, N863A и D986A. В особенно предпочтительном варианте осуществления белок Cas имеет мутацию D10A.
Аспекты настоящего изобретения относятся к снижению экспрессии продукта гена, или к дополнительному введению матричного полинуклеотида в молекулу ДНК, кодирующую продукт гена, или к точному вырезанию вставочной последовательности путем обеспечения повторного отжига и дотирования двух "липких" 5'-концов, или к изменению активности или функционирования продукта гена, или к повышению экспрессии продукта гена. В варианте осуществления настоящего изобретения продукт гена представляет собой белок.
Настоящее изобретение также охватывает сконструированную не встречающуюся в природе систему CRISPR-Cas, содержащую белок Cas с одной или несколькими мутациями, и две направляющие РНК, которые осуществляют нацеливание на первую нить и вторую нить, соответственно, двухнитевой молекулы ДНК, кодирующей продукт гена в клетке, при этом направляющие РНК осуществляют нацеливание на молекулу ДНК, кодирующую продукт гена, а белок Cas вносит однонитевой разрыв в каждую из первой нити и второй нити молекулы ДНК, кодирующей продукт гена, в результате чего экспрессия продукта гена изменяется; и где белок Cas и две направляющие РНК не встречаются вместе в естественных условиях.
В аспектах настоящего изобретения направляющие РНК могут содержать направляющую последовательность, слитую с парной tracr-последовательностью и tracr-последовательностью. В варианте осуществления настоящего изобретения белок Cas представляет собой белок системы CRISPR-Cas типа II. В аспекте настоящего изобретения белок Cas является кодон-оптимизированным для экспрессии в эукариотической клетке, предпочтительно в клетке млекопитающего или клетке человека. В дополнительных вариантах осуществления настоящего изобретения белок Cas представляет собой белок системы CRISPR-Cas типа II, например, белок Cas9. В особенно предпочтительном варианте осуществления белок Cas представляет собой белок Cas9, например, SpCas9. В аспектах настоящего изобретения белок Cas имеет одну или несколько мутаций, выбранных из группы, состоящей из D10A, Е762А, Н840А, N854A, N863A и D986A. В особенно предпочтительном варианте осуществления белок Cas имеет мутацию D10A.
Аспекты настоящего изобретения относятся к снижению экспрессии продукта гена, или к дополнительному введению матричного полинуклеотида в молекулу ДНК, кодирующую продукт гена, или к точному вырезанию вставочной последовательности путем обеспечения повторного отжига и дотирования двух "липких" 5'-концов, или к изменению активности или функции продукта гена, или к повышению экспрессии продукта гена. В варианте осуществления настоящего изобретения продукт гена представляет собой белок.
Настоящее изобретение также охватывает сконструированную не встречающуюся в природе векторную систему, содержащую один или несколько векторов, содержащих:
a) первый регуляторный элемент, функционально связанный с каждой из двух направляющих РНК системы CRISPR-Cas, которые осуществляют нацеливание на первую нить и вторую нить, соответственно, двухнитевой молекулы ДНК, кодирующей продукт гена,
b) второй регуляторный элемент, функционально связанный с белком Cas,
где компоненты (а) и (b) находятся в одном и том же или в разных векторах системы, при этом направляющие РНК осуществляют нацеливание на молекулу ДНК, кодирующую продукт гена, а белок Cas вносит однонитевой разрыв в каждую из первой нити и второй нити молекулы ДНК, кодирующей продукт гена, в результате чего экспрессия продукта гена изменяется; и где белок Cas и две направляющие РНК не встречаются вместе в естественных условиях.
В аспектах настоящего изобретения направляющие РНК могут содержать направляющую последовательность, слитую с парной tracr-последовательностью и tracr-последовательностью. В варианте осуществления настоящего изобретения белок Cas представляет собой белок системы CRISPR-Cas типа II. В аспекте настоящего изобретения белок Cas является кодон-оптимизированным для экспрессии в эукариотической клетке, предпочтительно в клетке млекопитающего или клетке человека. В дополнительных вариантах осуществления настоящего изобретения белок Cas представляет собой белок системы CRISPR-Cas типа II, например, белок Cas9. В особенно предпочтительном варианте осуществления белок Cas представляет собой белок Cas9, например, SpCas9. В аспектах настоящего изобретения белок Cas имеет одну или несколько мутаций, выбранных из группы, состоящей из D10A, Е762А, Н840А, N854A, N863A и D986A. В особенно предпочтительном варианте осуществления белок Cas имеет мутацию D10A.
Аспекты настоящего изобретения относятся к снижению экспрессии продукта гена, или к дополнительному введению матричного полинуклеотида в молекулу ДНК, кодирующую продукт гена, или к точному вырезанию вставочной последовательности путем обеспечения повторного отжига и дотирования двух "липких" 5'-концов, или к изменению активности или функции продукта гена, или к повышению экспрессии продукта гена. В варианте осуществления настоящего изобретения продукт гена представляет собой белок. В предпочтительных вариантах осуществления настоящего изобретения векторы системы являются вирусными векторами. В дополнительном варианте осуществления векторы системы доставляют посредством липосом, наночастиц, экзосом, микропузырьков или генной пушки.
В одном аспекте настоящее изобретение предусматривает способ модификации целевого полинуклеотида в постмитотической эукариотической клетке. В некоторых вариантах осуществления способ включает обеспечение связывания комплекса CRISPR с целевым полинуклеотидом для осуществления расщепления указанного целевого полинуклеотида с модификацией таким образом целевого полинуклеотида, где комплекс CRISPR содержит фермент CRISPR, образующий комплекс с направляющей последовательностью, гибридизирующейся с целевой последовательностью в указанном целевом полинуклеотиде, где указанная направляющая последовательность связана с парной tracr-последовательностью, которая, в свою очередь, гибридизируется с tracr-последовательностью. В некоторых вариантах осуществления указанное расщепление включает расщепление одной или двух нитей в определенной точке целевой последовательности указанным ферментом CRISPR. В некоторых вариантах осуществления указанное расщепление приводит к сниженной транскрипции целевого гена. В некоторых вариантах осуществления способ дополнительно включает репарацию указанного расщепленного целевого полинуклеотида при помощи гомологичной рекомбинации с экзогенным матричным полинуклеотидом, где указанная репарация приводит к мутации, включающей вставку, делецию или замену одного или нескольких нуклеотидов указанного целевого полинуклеотида. В некоторых вариантах осуществления указанная мутация приводит к одной или нескольким аминокислотным заменам в белке, экспрессируемом с гена, содержащего целевую последовательность. В некоторых вариантах осуществления способ дополнительно включает доставку одного или нескольких векторов в указанную эукариотическую клетку, где один или несколько векторов управляют экспрессией одного или нескольких из: фермента CRISPR, направляющей последовательности, связанной с парной tracr-последовательностью, и tracr-последовательности. В некоторых вариантах осуществления указанные векторы доставляют в эукариотическую клетку в субъекте. В некоторых вариантах осуществления указанная модификация имеет место в указанной эукариотической клетке в клеточной культуре. В некоторых вариантах осуществления способ дополнительно включает выделение указанной эукариотической клетки из субъекта перед указанной модификацией. В некоторых вариантах осуществления способ дополнительно включает возвращение указанной эукариотической клетки и/или клеток, полученных из субъекта, указанному субъекту.
В одном аспекте настоящее изобретение предусматривает способ модификации экспрессии полинуклеотида в постмитотической эукариотической клетке. В некоторых вариантах осуществления способ включает обеспечение связывания комплекса CRISPR с полинуклеотидом так, что указанное связывание приводит к повышенной или пониженной экспрессии указанного полинуклеотида; где комплекс CRISPR содержит фермент CRISPR, образующий комплекс с направляющей последовательностью, гибридизирующейся с целевой последовательностью в указанном целевом полинуклеотиде, где указанная направляющая последовательность связана с парной tracr-последовательностью, которая, в свою очередь, гибридизируется с tracr-последовательностью. В некоторых вариантах осуществления способ дополнительно включает доставку одного или нескольких векторов в указанные эукариотические клетки, где один или несколько векторов управляют экспрессией одного или нескольких из: фермента CRISPR, направляющей последовательности, связанной с парной tracr-последовательностью, tracr-последовательности.
В одном аспекте настоящее изобретение предусматривает способ получения модельной постмитотической эукариотической клетки, содержащей мутантный ген, ответственный за развитие заболевания. В некоторых вариантах осуществления ген, ответственный за развитие заболевания, является любым геном, ассоциированным с повышением риска наличия или развития заболевания. В некоторых вариантах осуществления способ включает (а) введение одного или нескольких векторов в эукариотическую клетку, где один или несколько векторов управляют экспрессией одного или нескольких из: фермента CRISPR, направляющей последовательности, связанной с парной tracr-последовательностью, и tracr-последовательности; и (b) обеспечение связывания комплекса CRISPR с целевым полинуклеотидом для осуществления расщепления целевого полинуклеотида в указанном гене, ответственном за развитие заболевания, где комплекс CRISPR содержит фермент CRISPR, образующий комплекс с (1) направляющей последовательностью, которая гибридизируется с целевой последовательностью в целевом полинуклеотиде, и (2) парной tracr-последовательностью, которая гибридизируется с tracr-последовательностью, получая таким образом модельную эукариотическую клетку, содержащую мутантный ген, ответственный за развитие заболевания. В некоторых вариантах осуществления указанное расщепление включает расщепление одной или двух нитей в определенной точке целевой последовательности указанным ферментом CRISPR. В некоторых вариантах осуществления указанное расщепление приводит к сниженной транскрипции целевого гена. В некоторых вариантах осуществления способ дополнительно включает репарацию указанного расщепленного целевого полинуклеотида при помощи гомологичной рекомбинации с экзогенным матричным полинуклеотидом, где указанная репарация приводит к мутации, включающей вставку, делецию или замену одного или нескольких нуклеотидов указанного целевого полинуклеотида. В некоторых вариантах осуществления указанная мутация приводит к одной или нескольким аминокислотным заменам при экспрессии белка с гена, содержащего целевую последовательность.
В одном аспекте настоящее изобретение предусматривает способ отбора одной или нескольких постмитотических клеток путем введения одной или нескольких мутаций в ген в одной или нескольких клетках, при этом способ включает введение одного или нескольких векторов в клетку(клетки), где один или несколько векторов управляют экспрессией одного или нескольких из: фермента CRISPR, направляющей последовательности, связанной с парной tracr-последовательностью, tracr-последовательности и матрицы редактирования; где матрица редактирования содержит одну или несколько мутаций, которые прекращают расщепление ферментом CRISPR; обеспечение гомологичной рекомбинации матрицы редактирования с целевым полинуклеотидом в отбираемой(отбираемых) клетке(клетках); обеспечение связывания комплекса CRISPR с целевым полинуклеотидом для осуществления расщепления целевого полинуклеотида в указанном гене, где комплекс CRISPR содержит фермент CRISPR, образующий комплекс с (1) направляющей последовательностью, которая гибридизируется с целевой последовательностью в целевом полинуклеотиде, и (2) парной tracr-последовательностью, которая гибридизируется с tracr-последовательностью, где связывание комплекса CRISPR с целевым полинуклеотидом индуцирует гибель клеток, с обеспечением тем самым отбора одной или нескольких прокариотических клеток, в которые были введены одна или несколько мутаций. В предпочтительном варианте осуществления фермент CRISPR представляет собой Cas9. Аспекты настоящего изобретения обеспечивают возможность отбора конкретных клеток без необходимости наличия маркера отбора или двухстадийного способа, который может включать систему негативного отбора.
В одном аспекте настоящее изобретение предусматривает способы модификации целевого полинуклеотида в постмитотической эукариотической клетке. В некоторых вариантах осуществления способ включает обеспечение связывания комплекса CRISPR с целевым полинуклеотидом для осуществления расщепления указанного целевого полинуклеотида с модификацией таким образом целевого полинуклеотида, где комплекс CRISPR содержит фермент CRISPR, образующий комплекс с направляющей последовательностью, гибридизирующейся с целевой последовательностью в указанном целевом полинуклеотиде, где указанная направляющая последовательность связана с парной tracr-последовательностью, которая, в свою очередь, гибридизируется с tracr-последовательностью.
В других вариантах осуществления настоящее изобретение предусматривает способ модификации экспрессии полинуклеотида в постмитотической эукариотической клетке. Способ включает повышение или снижение экспрессии целевого полинуклеотида при помощи комплекса CRISPR, который связывается с полинуклеотидом.
При желании для осуществления модификации экспрессии в клетке один или несколько векторов, содержащих tracr-последовательность, направляющую последовательность, связанную с парной tracr-последовательностью, последовательность, кодирующую фермент CRISPR, доставляют в клетку. В некоторых способах один или несколько векторов содержат регуляторный элемент, функционально связанный с кодирующей фермент последовательностью, кодирующей указанный фермент CRISPR, содержащий последовательность ядерной локализации; и регуляторный элемент, функционально связанный с парной tracr-последовательностью и одним или несколькими сайтами встраивания для встраивания направляющей последовательности выше парной tracr-последовательности. При экспрессии направляющая последовательность управляет специфичным к последовательности связыванием комплекса CMSPR с целевой последовательностью в клетке. Как правило, комплекс CRISPR содержит фермент CRISPR, образующий комплекс с (1) направляющей последовательностью, которая гибридизируется с целевой последовательностью, и (2) парной tracr-последовательностью, которая гибридизируется с tracr-последовательностью.
В некоторых способах целевой полинуклеотид можно инактивировать для осуществления модификации экспрессии в клетке. Например, при связывании комплекса CRISPR с целевой последовательностью в клетке целевой полинуклеотид инактивируется таким образом, что последовательность не транскрибируется, кодируемый белок не продуцируется или последовательность не функционирует так, как последовательность дикого типа. Например, последовательность, кодирующую белок или микроРНК, можно инактивировать таким образом, что белок не будет продуцироваться.
В определенных вариантах осуществления фермент CRISPR содержит одну или несколько мутаций, выбранных из группы, состоящей из D10A, Е762А, Н840А, N854A, N863A или D986A, и/или одна или несколько мутаций находятся в домене RuvC1 или HNH фермента CRISPR или представляют собой другую мутацию, обсуждаемую в данном документе. В некоторых вариантах осуществления фермент CRISPR имеет одну или несколько мутаций в каталитическом домене, где при транскрипции парная tracr-последовательность гибридизируется с tracr-последовательностью, а направляющая последовательность управляет специфичным к последовательности связыванием комплекса CRISPR с целевой последовательностью, и где фермент дополнительно содержит функциональный домен. В некоторых вариантах осуществления функциональный домен представляет собой домен активации транскрипции, предпочтительно VP64. В некоторых вариантах осуществления функциональный домен представляет собой домен репрессии транскрипции, предпочтительно KRAB. В некоторых вариантах осуществления домен репрессии транскрипции представляет собой SID или конкатемеры SID (например, SID4X). В некоторых вариантах осуществления функциональный домен представляет собой домен, участвующий в эпигенетической модификации, так что обеспечивается фермент, участвующий в эпигенетической модификации. В некоторых вариантах осуществления функциональный домен представляет собой активаторный домен, который может представлять собой активаторный домен Р65.
В некоторых вариантах осуществления фермент CRISPR представляет собой фермент CRISPR типа I или III, но предпочтительно представляет собой фермент CRISPR типа II. Этот фермент CRISPR типа II может быть любым ферментом Cas. Фермент Cas может быть идентифицирован как Cas9, поскольку он может относиться к общему классу ферментов, обладающих гомологией с самой большой нуклеазой с несколькими нуклеазными доменами системы CRISPR типа II. В наиболее предпочтительном случае фермент Cas9 получен или происходит из spCas9 или saCas9. Под происходящим заявители подразумевают, что в основе происходящего фермента главным образом лежит фермент дикого типа в том смысле, что он характеризуется высокой степенью гомологии последовательности с этим ферментом, но он был некоторым образом подвергнут мутации (модифицирован), как описано в данном документе.
Следует иметь в виду, что выражения Cas и фермент CRISPR обычно используются в данном документе взаимозаменяемо, если не очевидно иное. Как упоминается выше, многие из порядков нумерации остатков, используемых в данном документе, относятся к ферменту Cas9 из локуса CRISPR типа II Streptococcus pyogenes. Однако, следует иметь в виду, что настоящее изобретение включает многие другие Cas9 из других видов микроорганизмов, такие как SpCas9, SaCa9, StlCas9 и т.д.
Пример кодон-оптимизированной последовательности, в данном случае оптимизированной для человека (т.е. оптимизированной для экспрессии у человека), представлен в данном документе, смотри кодон-оптимизированную последовательность SaCas9 для человека. Хотя это является предпочтительным, следует иметь в виду, что возможны другие примеры и что для вида-хозяина известна оптимизация кодонов.
Доставку предпочтительно осуществляют в форме вектора, который может представлять собой вирусный вектор, как, например, векторы на основе лентивируса, или бакуловируса, или, предпочтительно, аденовируса/аденоассоциированного вируса, но известны и предусмотрены другие средства доставки (такие как дрожжевые системы, микропузырьки, генные пушки/средства прикрепления векторов к наночастицам золота). Вектор может означать не только вирусную или дрожжевую систему (например, где нуклеиновые кислоты, представляющие интерес, могут быть функционально связанными с промотором и находиться под его контролем (как, например, для получения в конечном счете процессированной РНК, если говорить об экспрессии)), но также и прямую доставку нуклеиновых кислот в клетку-хозяина. Хотя в способах в данном документе вектор может быть вирусным вектором, и он преимущественно представляет собой AAV, можно использовать другие вирусные векторы, обсуждаемые в данном документе, такие как лентивирусы. Например, бакуловирусы можно использовать для экспрессии в клетках насекомых. Эти клетки насекомых могут, в свою очередь, быть применимыми для получения больших количеств дополнительных векторов, таких как векторы на основе AAV или лентивируса, приспособленных для доставки по настоящему изобретению. Также предусматривается способ доставки фермента CRISPR по настоящему изобретению, включающий доставку в клетку мРНК, кодирующей фермент CRISPR. Следует иметь в виду, что в определенных вариантах осуществления фермент CRISPR является усеченным, и/или содержит менее одной тысячи аминокислот или менее четырех тысяч аминокислот, и/или представляет собой нуклеазу или никазу, и/или является кодон-оптимизированным, и/или содержит одну или несколько мутаций, и/или включает химерный фермент CRISPR, и/или предусматривает другие варианты, обсуждаемые в данном документе. Предпочтительными являются векторы на основе AAV и лентивируса.
В определенных вариантах осуществления целевая последовательность на своем 3'-конце фланкирована или расположена перед РАМ, подходящим для фермента CRISPR, обычно Cas и, в частности, Cas9.
Например, подходящий РАМ представляет собой 5'-NRG или 5'-NNGRR для ферментов SpCas9 или SaCas9 (или происходящих из них ферментов), соответственно.
Следует иметь в виду, что SpCas9 или SaCas9 получены или происходят из Cas9 S. pyogenes или S. aureus.
Соответственно, целью настоящего изобретения не является охват в пределах настоящего изобретения любого ранее известного продукта, способа получения продукта или способа применения продукта, так что заявители оставляют за собой право и настоящим раскрывают отказ от прав на любой ранее известный продукт, процесс или способ. Следует дополнительно отметить, что настоящее изобретение не предназначено охватывать в пределах объема настоящего изобретения любой продукт, способ получения продукта или способ применения продукта, который не соответствует письменному описанию и требованиям достаточного раскрытия сути изобретения USPTO (первый пункт §112 статьи 35 USC) или ЕРО (статья 83 ЕРС), так что заявители оставляют за собой право и настоящим раскрывают отказ от прав на любой ранее описанный продукт, способ получения продукта или способ применения продукта.
Следует отметить, что в данном раскрытии и особенно в формуле изобретения и/или абзацах такие выражения, как "содержит", "содержащийся", "содержащий" и т.п., могут иметь значение, приписываемое им в патентном законодательстве США, например, они могут означать "включает", "включенный", "включающий" и т.п., и что такие выражения, как "по сути состоящий из" и "по сути состоит из" имеют значение, приписываемое им в патентном законодательстве США, например, они допускают не указанные прямо элементы, но исключают элементы, которые имеются в известном уровне техники или которые влияют на основные или новые характеристики настоящего изобретения.
Эти и другие варианты осуществления раскрыты или являются очевидными на основании следующего подробного описания и охвачены им.
Краткое описание графических материалов
Новые признаки настоящего изобретения изложены с характерными особенностями в прилагаемой формуле изобретения. Лучшее понимание признаков и преимуществ настоящего изобретения будет доступно благодаря ссылке на следующее подробное описание, в котором изложены показательные варианты осуществления, в которых используют принципы настоящего изобретения, и на сопутствующие графические материалы.
На фигуре 1 изображена схематическая модель системы CRISPR. Нуклеаза Cas9 из Streptococcus pyogenes (желтый) целенаправленно воздействует на геномную ДНК при помощи синтетической направляющей РНК (sgRNA), состоящей из 20-нуклеотидной направляющей последовательности (голубой) и каркаса (красный). Направляющая последовательность образует пары оснований с ДНК-мишенью (голубой) непосредственно выше необходимого мотива 5'-NGG, прилегающего к протоспейсеру (РАМ; пурпурный), и Cas9 опосредует двухнитевой разрыв (DSB) на ~3 п.о. выше РАМ (красный треугольник).
На фигурах 2A-F показана иллюстративная система CRISPR, возможный механизм действия, пример адаптации для экспрессии в эукариотических клетках и результаты тестов, оценивающих ядерную локализацию и активность CRISPR.
На фигуре 3A-D показаны результаты оценки специфичности SpCas9 в отношении мишени-примера.
На фигурах 4A-G показана иллюстративная векторная система и результаты ее применения при управлении гомологичной рекомбинацией в эукариотических клетках.
На фигуре 5 представлена таблица последовательностей протоспейсеров и обобщены результаты определения эффективности модификаций для протоспейсеров-мишеней, сконструированных на основе иллюстративных систем CRISPR S. pyogenes и S. thermophilus с соответствующими РАМ, воздействующих на локусы в геномах человека и мыши. Клетки трансфицировали Cas9 и либо pre-crRNA/tracrRNA, либо химерной РНК и анализировали через 72 часа после трансфекции. Процент вставок/делеций рассчитывали на основе результатов анализа с помощью Surveyor с указанными линиями клеток (N=3 для всех протоспейсеров-мишеней, ошибки представляют собой S.E.M., "N.D." означает "не выявляется посредством анализа с помощью Surveyor", и "N.T." означает "не тестировали в данном тестировании").
На фигурах 6А-С показано сравнение различных транскриптов tracrRNA для опосредованного Cas9 целенаправленного воздействия на ген.
На фигуре 7 показано схематическое изображение анализа с помощью нуклеазы Surveyor для выявления индуцированных двухнитевым разрывом микровставок и микроделеций.
На фигурах 8А-В показаны иллюстративные бицистронные векторы экспрессии для экспрессии элементов системы CRISPR в эукариотических клетках.
На фигурах 9А-С показаны гистограммы расстояний между смежными РАМ (NGG) локуса 1 S. pyogenes SF370 (фигура 9А) и РАМ (NNAGAAW) локуса 2 LMD9 S. thermophilus (фигура 9В) в геноме человека и расстояния для каждого РАМ в хромосомах (Chr) (фигура 9С).
На фигурах 10A-D показана иллюстративная система CRISPR как пример адаптации для экспрессии в эукариотических клетках и результаты тестов, оценивающих активность CRISPR.
На фигурах 11А-С показаны иллюстративные манипуляции с системой CRISPR для целенаправленного воздействия на геномные локусы в клетках млекопитающего.
На фигурах 12А-В показаны результаты анализа с помощью нозерн-блоттинга процессинга crRNA в клетках млекопитающего.
На фигурах 13А-В показан иллюстративный отбор протоспейсеров в локусах PVALB человека и Th мыши.
На фигуре 14 показаны иллюстративные целевые последовательности протоспейсера и соответствующего РАМ для системы CRISPR S. thermophilus в локусе ЕМХ1 человека.
На фигуре 15 представлена таблица последовательностей для праймеров и зондов, используемых для анализа с помощью Surveyor, RFLP, геномного секвенирования и анализов с помощью нозерн-блоттинга.
На фигурах 16А-С показана иллюстративная манипуляция с системой CRISPR с химерными РНК и результаты анализов с помощью SURVEYOR в отношении активности системы в эукариотических клетках.
На фигурах 17А-В показано графическое изображение результатов анализа с помощью SURVEYOR в отношении активности системы CRISPR в эукариотических клетках.
На фигуре 18 показано иллюстративное отображение некоторых целевых сайтов для Cas9 S. pyo genes в геноме человека, полученное с использованием геномного браузера UCSC.
На фигурах 19A-D показано круговое отображение филогенетического анализа, выявляющего пять семейств Cas9, включая три группы больших Cas9 (~1400 аминокислот) и две малых Cas9 (~1100 аминокислот).
На фигуре 20A-F показано линейное отображение филогенетического анализа, выявляющего пять семейств Cas9, включая три группы больших Cas9 (~1400 аминокислот) и две малых Cas9 (~1100 аминокислот).
На фигурах 21A-D показано редактирование генома посредством гомологичной рекомбинации, (а) Схематическое изображение никазы SpCas9 с мутацией D10A в каталитическом домене RuvC I. (b) Схематическое представление гомологичной рекомбинации (HR) в локусе ЕМХ1 человека при использовании смысловых или антисмысловых однонитевых олигонуклеотидов в качестве матриц для репарации. Красная стрелка вверху указывает на сайт расщепления для sgRNA; праймеры для ПЦР для генотипирования (таблицы J и K) обозначены стрелками в правой панели, (с) Последовательность участка, модифицированного с помощью HR. (d) Анализ вставок/делеций в целевом локусе 1 ЕМХ1 (n=3), опосредованных SpCas9 дикого типа (wt) и никазой SpCas9 (D10A), с помощью SURVEYOR. Стрелки указывают положения фрагментов ожидаемого размера.
На фигурах 22А-В показаны одиночные векторные структуры для SpCas9.
На фигуре 23 показана диаграмма, представляющая распределение ортологов Cas9 по длине.
На фигуре 24А-М показаны последовательности, где точки мутаций расположены в гене SpCas9.
На фигуре 25А показана карта вектора для целенаправленного воздействия с зависимой от условий экспрессией Cas9, Rosa26.
На фигуре 25В показана карта вектора для целенаправленного воздействия с конститутивной экспрессией Cas9, Rosa26.
На фигуре 26 показано схематическое изображение важных элементов в конструкциях для конститутивной и зависимой от условий экспрессии Cas9.
На фигуре 27 показаны данные о доставке и in vivo экспрессии Cas9 в головном мозге мышей.
На фигуре 28 показана доставка Cas9 и химерной РНК в виде РНК в клетки. (А) Доставка репортера GFP в виде ДНК или мРНК в клетки Neuro-2A. (В) Доставка Cas9 и химерной РНК, воздействующих на ген Icam2, в виде РНК приводит к разрезанию одного из двух тестируемых спейсеров. (С) Доставка Cas9 и химерной РНК, воздействующих на ген F7, в виде РНК приводит к разрезанию одного из двух тестируемых спейсеров.
На фигуре 29 показано, как репарация двухнитевого разрыва (DSB) ДНК способствует редактированию генов. В пути склонного к ошибкам негомологичного соединения концов (NHEJ) концы DSB подвергаются обработке посредством эндогенных механизмов репарации ДНК и соединяются вместе, что может приводить к случайным мутациям по типу вставки или делеции (вставки/делеции) в месте соединения. Мутации по типу вставки/делеции, имеющие место в кодирующем участке гена, могут обуславливать сдвиг рамки считывания и появление преждевременного стоп-кодона, что приводит к нокауту гена. В альтернативном случае матрицу для репарации в форме плазмиды или однонитевых олигодезоксинуклеотидов (ssODN) можно предоставлять для эффективного использования пути репарации с участием гомологичной рекомбинации (HDR), что обеспечивает высокое качество и точное редактирование.
На фигурах 30А-С показаны предполагаемые результаты HDR в клетках HEK и HUES9. (а) Плазмиду для целенаправленного воздействия или ssODN (смысловой или антисмысловой) с гомологичными плечами можно использовать для редактирования последовательности в целевом локусе генома, расщепляемом Cas9 (красный треугольник). Для анализа эффективности HDR вводили сайт для HindIII (красный прямоугольник) в целевой локус, который подвергали ПЦР-амплификации с праймерами, отжигаемыми за пределами участка гомологии. При расщеплении продукта ПНР с помощью HindIII выявляют число случаев обнаружения событий HDR. (b) ssODN, ориентированные в смысловом или антисмысловом (s или а) направлении относительно представляющего интерес локуса, можно использовать в сочетании с Cas9 для достижения эффективного опосредованного HDR редактирования в целевом локусе. С каждой стороны от места модификации (красный прямоугольник) рекомендуется наличие минимального участка гомологии размером 40 п.о. и предпочтительно 90 п.о. (с) Пример эффекта ssODN в отношении HDR в локусе ЕМХ1 показан с использованием как Cas9 дикого типа, так и никазы Cas9 (D10A). Каждый ssODN содержит гомологичные плечи размером 90 п.о., фланкирующие вставку двух сайтов рестрикции размером 12 п.о.
На фигурах 31А-С показана стратегия репарации для мутации дельтаF508 гена-регулятора трансмембранной проводимости при муковисцидозе.
На фигурах 32А-В (а) показано схематическое изображение экспансии GAA-повтора в интроне 1 FXN и (b) показано схематическое изображение стратегии, принятой для вырезания участка экспансии GAA с помощью системы CRISPR/Cas.
На фигуре 33 показан скрининг в отношении эффективного опосредованного SpCas9 целенаправленного воздействия на локусы генов Tetl-3 и Dnmtl, 3а и 3b. Анализ с помощью Surveyor в отношении ДНК из трансфицированных клеток N2A демонстрирует эффективное расщепление ДНК путем использования различных gRNA.
На фигуре 34 показана стратегия мультиплексного целенаправленного воздействия на геном с применением 2-векторной системы в системе доставки на основе AAV1/2. GRNA, воздействующая на Tetl-3 и Dnmtl, 3a и 3b, находится под контролем промотора U6. GFP-KASH находится под контролем промотора гена синапсина человека. Сайты рестрикции демонстрируют простую стратегию замены gRNA путем субклонирования. Показан SpCas9, меченный НА, фланкированный двумя сигналами ядерной локализации (NLS). Оба вектора доставляют в головной мозг с помощью вируса AAV1/2 в соотношении 1:1.
На фигуре 35 показано подтверждение функциональных свойств мультиплексного вектора #1 для целенаправленного воздействия на DNMT посредством анализа с помощью Surveyor. Клетки N2A совместно трансфицировали вектором #1 для целенаправленного воздействия на DNMT (+) и вектором, кодирующим SpCas9, для тестирования опосредованного SpCas9 расщепления локусов генов семейства DNMT. gRNA в отдельности (-) представляет собой отрицательный контроль. Клетки собирали для очистки и последующей обработки ДНК через 48 ч. после трансфекции.
На фигуре 36 показано подтверждение функциональных свойств мультиплексного вектора #2 для целенаправленного воздействия на DNMT посредством анализа с помощью Surveyor. Клетки N2A совместно трансфицировали вектором #1 для целенаправленного воздействия на DNMT (+) и вектором, кодирующим SpCas9, для тестирования опосредованного SpCas9 расщепления локусов генов семейства DNMT. gRNA в отдельности (-) представляет собой отрицательный контроль. Клетки собирали для очистки и последующей обработки ДНК через 48 ч. после трансфекции.
На фигуре 37 показано схематическое представление коротких промоторов и коротких вариантов поли(А), используемых для экспрессии HA-SpCas9 in vivo. Размеры кодирующих участков от L-ITR до R-ITR показаны справа.
На фигуре 38 показано схематическое представление коротких промоторов и коротких вариантов поли(А), используемых для экспрессии HA-SaCas9 in vivo. Размеры кодирующих участков от L-ITR до R-ITR показаны справа.
На фигуре 39 показана экспрессия SpCas9 и SaCas9 в клетках N2A. Иллюстративный вестерн-блот-анализ меченных НА вариантов SpCas9 и SaCas9 под контролем различных коротких промоторов и с короткими поли(А)-последовательностями (spA). Тубулин представляет собой контроль загрузки. mCherry (mCh) представляет собой контроль трансфекции. Через 48 ч. после трансфекции клетки собирали и подвергали дальнейшей обработке для вестерн-блоттинга.
На фигуре 40 показан скрининг в отношении эффективного опосредованного SaCas9 целенаправленного воздействия на локус гена Tet3. Анализ с помощью Surveyor в отношении ДНК из трансфицированных клеток N2A демонстрирует эффективное расщепление ДНК путем применения различных gRNA с последовательностью PUM NNGGGT. Клетки, трансфицированные GFP, и клетки, экспрессирующие только SaCas9, являются контрольными.
На фигуре 41 показана экспрессия HA-SaCas9 в головном мозге мышей. Животным инъецировали в зубчатые извилины вирус, управляющий экспрессией HA-SaCas9 под контролем промотора гена синапсина человека. Животных умерщвляли через 2 недели после хирургической операции. НА-метку выявляли с помощью моноклонального антитела кролика C29F4 (Cell Signaling). Клеточные ядра окрашивали синим цветом с помощью красителя DAPI.
На фигуре 42 показана экспрессия SpCas9 и SaCas9 в первичных кортикальных нейронах в культуре через 7 дней после трансдукции. Иллюстративный вестерн-блот-анализ меченных НА вариантов SpCas9 и SaCas9 под контролем различных промоторов и с последовательностями bgh или короткими поли(А) (spA). Тубулин представляет собой контроль загрузки.
На фигуре 43 показано окрашивание с выявлением живых/мертвых первичных кортикальных нейронов через 7 дней после трансдукции частицами AAV1, несущими SpCas9 с различными промоторами и мультиплексные конструкции gRNA (пример показан на последней панели для DNMT). Нейроны после трансдукции с помощью AAV сравнивали с контрольными нетрансдуцированными нейронами. Красные ядра указывают на мертвые клетки с нарушенной проницаемостью мембраны (второй ряд панелей). Живые клетки отмечены зеленым цветом (третий ряд панелей).
На фигуре 44 показано окрашивание первичных кортикальных нейронов с помощью LIVE/DEAD через 7 дней после трансдукции частицами AAV1, несущими SaCas9 с различными промоторами. Красные ядра указывают на мертвые клетки с нарушенной проницаемостью мембраны (второй ряд панелей). Живые клетки отмечены зеленым цветом (третий ряд панелей).
На фигуре 45 показано сравнение морфологических характеристик нейронов после трансдукции вирусом AAV1, несущим SpCas9 и мультиплексы gRNA для локусов генов ТЕТ и DNMT. Нейроны без трансдукции показаны в качестве контроля.
На фигуре 46 показано подтверждение функциональных свойств мультиплексного вектора #1 для целенаправленного воздействия на DNMT посредством анализа с помощью Surveyor в первичных кортикальных нейронах. Клетки совместно трансдуцировали вектором #1 для целенаправленного воздействия на DNMT (+) и вирусами с SpCas9 с различными промоторами для тестирования опосредованного SpCas9 расщепления локусов генов семейства DNMT.
На фигуре 47 показана in vivo эффективность расщепления SpCas9 в головном мозге. Мышам инъецировали вирус AAV1/2, несущий мультиплекс gRNA, осуществляющий нацеливание на локусы генов семейства DNMT, вместе с вирусами с SpCas9 под контролем 2 различных промоторов: Меср2 мыши и Map1b крысы. Через две недели после инъекции ткань головного мозга извлекали, и ядра получали и сортировали с помощью FACS на основе экспрессии GFP под управлением промотора гена синапсина из мультиплексной конструкции gRNA. После экстракции gDNA выполняли анализ с помощью Surveyor. + означает GFP-положительные ядра, а - означает контрольные, GFP - отрицательные ядра от того же животного. Числа применительно к гелю означают оцененную эффективность SpCas9.
На фигуре 48 показана очистка меченных GFP-KASH клеточных ядер из нейронов гиппокампа. Внешняя ядерная мембрана (ONM) ядерной мембраны клетки мечена продуктом слияния GFP и белкового трансмембранного домена KASH. Наблюдается интенсивная экспрессия GFP в головном мозге через неделю после стереотаксического хирургического вмешательства и инъекции AAV1/2. Осуществляли стадию центрифугирования в градиенте плотности для очистки клеточных ядер от интактного головного мозга. Показаны очищенные ядра. Хроматин, окрашенный рубиновым красителем Vybrant® DyeCycle™, показан красным цветом, меченные GFP ядра показаны зеленым цветом. Иллюстративный профиль FACS GFP+ и GFP- клеточных ядер (пурпурный цвет: рубиновый краситель Vybrant® DyeCycle™, зеленый цвет: GFP).
На фигуре 49 показана эффективность расщепления SpCas9 в головном мозге мышей. Мышам инъецировали вирус AAV1/2, несущий мультиплекс gRNA, осуществляющий нацеливание на локусы генов семейства ТЕТ, вместе с вирусами с SpCas9 под контролем 2 различных промоторов: Меср2 мыши и Map1b крысы. Через три недели после инъекции ткань головного мозга извлекали, ядра получали и сортировали с помощью FACS на основании экспрессии GFP под управлением промотора гена синапсина из мультиплексной конструкции gRNA. После экстракции gDNA выполняли анализ с помощью Surveyor. + означает GFP-положительные ядра, а - означает контрольные, GFP - отрицательные ядра от того же животного. Числа применительно к гелю означают оцененную эффективность SpCas9.
На фигуре 50 показана экспрессия GFP-KASH в кортикальных нейронах в культуре. Нейроны трансдуцировали вирусом AAV1, несущим мультиплексные конструкции gRNA, осуществляющие нацеливание на локусы генов ТЕТ. Локализация самого сильного сигнала возле клеточных ядер обусловлена локализацией домена KASH.
На фигуре 51 показан (в верхней части) перечень расстояний (на которые указывает схема расположения для двух РАМ-последовательностей) между парами направляющих РНК. Только для пар направляющих РНК, удовлетворяющих паттернам 1, 2, 3, 4, проявляются вставки/делении в случае применения с никазой SpCas9(D10A). (Нижняя часть) Изображения гелей, демонстрирующие, что комбинация SpCas9(D10A) с парами направляющих РНК, удовлетворяющих паттернам 1, 2, 3, 4, приводит к образованию вставок/делеций в целевом сайте.
На фигуре 52 показан перечень последовательностей обратных праймеров для U6, используемых для создания кассет экспрессии U6-направляющая РНК. Каждый праймер необходимо применять в паре с прямым праймером для U6 "gcactgagggcctatttcccatgattc" для образования ампликонов, содержащих U6 и требуемую направляющую РНК.
На фигуре 53 показана карта секвенирования генома в локусе Emx1 человека, демонстрирующая местоположения 24 паттернов, перечисленных на фигуре 33.
На фигуре 54 показано (справа) изображение геля, указывающее на образование вставок/делеций в целевом сайте при наличии различных "липких" 5'-концов после расщепления никазой Cas9, нацеливаемой различными парами направляющих РНК. (Слева) Таблица, в которой указаны номера дорожек для геля справа и различные параметры, в том числе идентификация применяемых пар направляющих РНК и длина "липкого" 5'-конца, имеющегося в наличии после расщепления никазой Cas9.
На фигуре 55 показана карта секвенирования генома в локусе Emx1 человека, демонстрирующая местоположения различных пар направляющих РНК, которые обуславливают картины разделения в геле, показанные на фиг. 54 (справа), и которые дополнительно описаны в примере 35.
На фигуре 56А показано, что направляющая последовательность для целевого сайта 1 индуцировала самое высокое процентное значение количества вставок/делеций в АроВ.
На фигуре 56В показаны результаты анализа в геле с помощью нуклеазы Surveyor в отношении эффективности образования вставок/делеций через 4 недели после инъекции.
На фигуре 57В показано окрашивание масляным красным для выявления фенотипа накопления липидов в печени in vivo после доставки AAV-Cas9-sgRNA. Масштабная метка в каждой квадратной панели представляет 20 микрометров.
На фигуре 58 показано, что оптимальной длиной спейсера является 21 нуклеотид (нтд)/пара оснований (п.о.), представленные серыми прямоугольниками, по сравнению по меньшей мере с 20 или 22 парами оснований (представленными черными и белыми прямоугольниками, соответственно) среди ряда мишеней в двух различных генах (AAVS1 иЕМХ1).
На фигуре 59 показано, можно ли направляющую последовательность вставить в интронную последовательность Cas9.
На фигуре 60 показано, что промотор H1 полной длины (серый прямоугольник) все же является более слабым, чем промотор U6 (черный прямоугольник), поскольку U6 демонстрирует повышенное процентное значение количества образующихся вставок/делений для каждой тестируемой мишени.
На фигуре 61 показано, что короткий промотор H1 является более слабым, чем промотор HI полной длины.
На фигуре 62 показано расстояние между 5'-концами двух направляющих последовательностей в конструкции, измеренное применительно к эффективности расщепления двойной никазой SaCas9 D10A.
На фигуре 63 (пример 38) показана доставка и целенаправленное воздействие системы CRISPR-Cas9 на локус Меср2 в головном мозге мыши. (а) Векторы экспрессии AAV-SpCas9 и AAV-SpGuide (Меср2). Вектор sgRNA содержит последовательность, кодирующую белок слияния GFP-KASH для идентификации трансдуцированных нейронов. (b) Экспрессия HA-Cas9 и GFP-KASH в дорсальной части зубчатой извилины (DG) гиппокампа мыши. Масштабная метка - 100 мкм. (с) Количественная оценка клеток, в которых произошло эффективное целенаправленное воздействие двухвекторной системы Cas9-CRISPR. (d) Графическое представление локуса Меср2 мыши, демонстрирующее местоположение целевого сайта для Cas9; sgRNA показана синим цветом. Последовательность РАМ отмечена розовым цветом. Иллюстративные паттерны мутаций, выявленные путем секвенирования локуса Меср2, показаны ниже: зеленый цвет - последовательность дикого типа; красные черточки - удаленные основания; красные основания: вставка или мутации; красный указатель стрелки указывает на сайт разрезания CRISPR-Cas9. (е) Анализ в геле с помощью SURVEYOR™, демонстрирующий модификацию локуса Меср2 через 2 недели после доставки с помощью AAV в DG-отдел. (f) Вестерн-блот анализ экспрессии белка МеСР2 в целевом отделе головного мозга и количественная оценка уровней белка МеСР2 в дорсальной части DG (t-критерий, **p<0,001, n=4 от 3 животных, планки погрешностей: s.e.m.). (g) Изображения дорсальной части DG-участка через 2 недели после целенаправленного воздействия CRISPR-Cas9 на локус Меср2. Масштабная метка - 150 мкм. (h) Количественная оценка популяции МеСР2-положительных клеток среди всех выявленных клеток (окрашивание DAPI) в целевом отделе головного мозга по сравнению с контрольным коллатеральным участком (t-критерий, ****p<0,0001, n=290 и 249 клеток от 2 животных, соответственно; планки погрешностей: s.e.m). (ITR - инвертированный концевой повтор; НА -гемагглютининовая метка; NLS - сигнал ядерной локализации; spA - синтетический сигнал полиаденилирования; U6 - промотор PolIII; sgRNA - одиночная направляющая РНК; hSyn - промотор гена синапсина 1 человека; GFP - зеленый флуоресцентный белок; KASH - ядерный трансмембранный домен гомологии Klarsicht/ANCl/Syne; bGH pA - сигнал полиаденилирования бычьего гормона роста; WPRE - посттранскрипционный регуляторный элемент вируса гепатита сурков).
На фигуре 64 (пример 38) показан анализ экспрессии генов в нейронах с нокдауном МеСР2, опосредованным Cas9. (а) Стратегия очистки клеточных ядер из клеток головного мозга мыши, подвергнутых целенаправленному воздействию CRISPR-Cas9. (b) Иерархическая кластеризация дифференциально экспрессируемых генов (t-критерий, p<0,01, n=19 групп отсортированных ядер от 8 животных), выявленная путем секвенирования РНК. Относительные уровни экспрессии генов в log2(TPM+1) нормализованы для каждого ряда и отображены на красно-синей цветовой шкале. В каждом столбце представлена группа из 100 целевых ядер нейронов, отсортированных путем FACS из выделенной популяции клеток зубчатой извилины контрольных или трансдуцированных sgRNA для Меср2 животных, как указано.
На фигуре 65 (пример 38) показаны клеточно-автономные дефекты свойств клеточных реакций нейронов после опосредованного CRISPR нокдауна МеСР2. (а) Рисунок, на котором показана схема эксперимента in vivo, состоящая из зрительной коры мыши и параметра зрительной стимуляции. Показан GFP+ нейрон. Масштабная метка - 20 мкм. (b) Рисунок, на котором показана схема регистрации в возбуждающих нейронах в слоях 2/3, которые получают специфический входной сигнал, направленный как на контра-, так и на ипсилатеральный глаз. GFP+ клетки с модифицированным геномом показаны зеленым цветом, тогда как немодифицированные клетки показаны серым цветом. Стандартная форма спайка указывает на возбуждающие нейроны с регулярными спайками. (c, d) Средние значения OSI (с) и вызванной FR (d) измеряли в GFP4" клетках, экспрессирующих Меср2 и контрольную sgRNA, соответственно (t-критерий, *p<0,05; числа на графике означают количество клеток, в которых проводили регистрацию; n=2-3 животных; планки погрешностей: s.e.m).
На фигуре 66 (пример 38) показано одновременное мультиплексное редактирование генов в головном мозге мыши, (а) Схематическое изображение системы CRISPR-Cas9, предназначенной для мультиплексного целенаправленного воздействия на геном. (b) Графическое представление целевых локусов DNMT мыши. Направляющие РНК показаны синим цветом. Последовательности РАМ отмечены розовым цветом, (с) Анализ в геле с помощью SURVEYOR™, демонстрирующий модификацию локусов DNMT в отсортированных путем FACS GFP-KASH-положительных клетках через 4 недели после доставки с помощью AAV в DG-область. (d) Анализ модификации локусов DNMT в отдельных клетках на основе глубокого секвенирования, демонстрирующий совместную встречаемость модификаций в нескольких локусах. (е) Вестерн-блот анализ белков Dnmt3a и Dnmt1 после доставки in vivo системы CRISPR-Cas9, целенаправленно воздействующей на гены семейства DNMT (верхняя часть). Количественная оценка уровней белков Dnmt3a и Dnmt1 в DG посредством вестерн-блот-анализа после целенаправленного воздействия CRISPR-Cas9 in vivo (нижняя часть; t-критерий, **р<0,001, *р<0,05, Dnmt3a: n=7; Dnmt1: n=5 от 5 животных; планки погрешностей: s.e.m). (f) Контекстные дефициты обучения через 8 недель после целенаправленного воздействия на гены DNMT с помощью SpCas9 в DG-области гиппокампа при тестировании в тренировочном и измененном контексте (t-критерий, ***р<0,0001, n=18 животных, 2 независимых эксперимента; планки погрешностей: s.e.m).
На фигуре 67 (пример 38) показаны клонирование и экспрессия меченного НА SpCas9 (HA-SpCas9) при упаковке в AAV. (а) Схематический обзор различных стратегий клонирования для сведения к минимуму размера кассеты экспрессии SpCas9 с помощью короткого промотора Map1b крысы (pMap1b), усеченного варианта промотора Меср2 мыши (рМеср2) и короткого мотива поли(А) (spA). (b) Вестерн-блот анализ культуры первичных кортикальных нейронов, экспрессирующих HA-SpCas9 с помощью различных кассет экспрессии SpCas9. (с) Промотор Меср2 управляет экспрессией HA-SpCas9 (красный цвет) в нейронах (Map1b, NeuN; стрелки), но не в астроглии (GFAP, указатели стрелок). Показана совместная экспрессия HA-SpCas9 и GFP-KASH (нижняя часть). Ядра метили с помощью DAPI (синий цвет). Масштабные метки - 20 мкм. (d) Схематический обзор мечения с помощью GFP. Проиллюстрированы улучшенный зеленый флуоресцентный белок (GFP), слитый с ядерным трансмембранным доменом KASH, и интеграция GFP-KASH во внешнюю ядерную мембрану, (е) Расчет эффективности совместного инфицирования, показывающий популяции клеток, экспрессирующих как HA-SpCas9, так и GFP-KASH (n=973 нейрона из 3 культур; планки погрешностей: s.e.m). (f) Клетки окрашивали с помощью набора LIFE/DEAD® (через 7 дней после доставки. Количественная оценка DAPI+ и мертвых (DEAD+) клеток (n=518 контрольных ядер DAPI+; n=1003 ядра DAPI+ с SpCas9/GFP-KASH из 2 культур; планки погрешностей: s.e.m). (ITR - инвертированный концевой повтор; НА - гемагглютининовая метка; NLS - сигнал ядерной локализации; spA - синтетический сигнал полиаденилирования; U6 - промотор PolIII; sgRNA - одиночная направляющая РНК; hSyn - промотор гена синапсина 1 человека; GFP - зеленый флуоресцентный белок; KASH - ядерный трансмембранный домен гомологии Klarsicht/ANC1/Syne; bGH рА - сигнал полиаденилирования бычьего гормона роста; WPRE - посттранскрипционный регуляторный элемент вируса гепатита сурков).
На фигуре 68 (пример 38) показано целенаправленное воздействие на Меср2 в клетках Neuro-2a. (а) Целевые последовательности Меср2 и соответствующие мотивы, к протоспейсерам (РАМ). (b) Оценивание 6 sgRNA для Меср2, введенных путем совместной трансфекции с SpCas9 в клетки Neuro-2a. Показатели эффективности модификации локусов анализировали через 48 ч. после трансфекции с применением анализа с помощью SURVEYOR™.
На фигуре 69 (пример 38) показано целенаправленное воздействие CRISPR-SpCas9 на Меср2 в первичных кортикальных нейронах, (а) Иммунофлуоресцентное окрашивание МеСР2 (красный цвет) в культивируемых нейронах через 7 дней после трансдукции AAV-CRISPR (зеленый цвет, GFP-KASH). Ядра метили с помощью DAPI (синий цвет). Масштабная метка - 20 мкм. (b) Оценивание целенаправленного воздействия на локус Меср2 с применением SpCas9 или dSpCas9 вместе с sgRNA для Меср2 или контрольной sgRNA (осуществляющей нацеливание на бактериальный ген lacZ) посредством анализа в геле с помощью SURVEYOR™, (с) Количественная оценка МеСР2-положительных ядер в целевой популяции нейронов (GFP+). (d) Вестерн-блот анализ уровней белка МеСР2 после целенаправленного воздействия CRISPR-SpCas9 на локус Меср2 и количественная оценка уровней белка МеСР2 (t-критерий, **р<0,001, n=5 из 3 культур, планки погрешностей: s.e.m).
На фигуре 70 (пример 38) показаны морфологические изменения в дендритном дереве нейронов после опосредованного SpCas9 нокдауна МеСР2 in vitro, (а) Снижение сложности дендритного дерева в нейронах после целенаправленного воздействия CRISPR-SpCas9 на локус Меср2. Масштабная метка - 20 мкм. (b) Изменения в морфологии дендритных шипиков в нейронах, подвергнутых целенаправленному воздействию SpCas9 и sgRNA для Меср2. Масштабная метка - 10 мкм. Морфологию клеток визуализировали путем совместной трансфекции с конструкцией mCherry. Клетки для морфологического анализа выбирали на основании результата окрашивания Меср2. (с) Морфология дендритного дерева, оцениваемая по количеству кончиков дендритов, и (d) анализ Шолла (t-критерий, ***р<0,0001, n=40 из 2 культур), (е) Количественная оценка плотности шипиков (t-критерий, ***р<0,0001, n=40 из 2 культур, планки погрешностей: s.e.m).
На фигуре 71 (пример 38) показано секвенирование РНК в ядрах нейронов от контрольных животных и с опосредованным SpCas9 нокдауном Меср2. На диаграмме размаха представлено количество выявленных генов среди библиотек для секвенирования РНК (19 библиотек для каждого из 100 ядер, отобранных из ядер, трансдуцированных контрольной sgRNA или sgRNA для Меср2; n=4 животных/группа) на квантиль уровня экспрессии. Все гены разделяли на 10 квантилей по их среднему уровню экспрессии в log2(TPM+1), а затем для каждого квантиля подсчитывали количество выявленных генов (log2(TPM+1)>2) в каждом образце. Три показанные целевые последовательности представляют собой SEQ ID NO: _, SEQ ID NO: _ и SEQ ID NO: _ для Dnmt3a, Dnmt1 и Dnmt3b, соответственно.
На фигуре 72 (пример 38) показано мультиплексное целенаправленное воздействие на геном в отношении представителей семейства DNMT in vitro, (а) Целевые последовательности Dnmt3a, Dnmt1 и Dnmt3b и соответствующие мотивы, прилегающие к протоспейсерам (РАМ). (b) Анализ клеток Neuro-2a с помощью нуклеазы SURVEYOR™ через 48 часов после трансфекции с помощью вектора с SpCas9 и 3 х sgRNA для DNMT, нацеливающегося на локусы Dnmt3a, Dnmt1 и Dnmt3b. Показано эффективное редактирование генома для всех трех целевых генов.
На фигуре 73 (пример 38) показано секвенирование нового поколения для целевых локусов Dnmt3a, Dnmt1 и Dnmt3b. Примеры результатов секвенирования мутантных локусов Dnmt3a (a), Dnmt1 (b) и Dnmt3b (с) после доставки SpCas9 и 3 х sgRNA для DNMT в зубчатую извилину мыши in vivo. Зеленый цвет: последовательность дикого типа, красные черточки: удаленные основания, красные основания: вставка или мутации. Красные указатели стрелок указывают на сайт разрезания CRISPR-SpCas9. Полные последовательности, используемые на данной фигуре, приведены как SEQ ID NO: , SEQ ID NO: и SEQ ID NO: для локусов Dnmt3a, Dnmt1 и Dnmt3b, соответственно. Они представляют собой:
SEQ ID NO: (Dnmt3a):
CCT CCG TGT CAG CGA CCC ATG CCA A
SEQ ID NO: (Dnmt1):
CCA GCG TCG AAC AGC TCC AGC CCG
SEQ ID NO: (Dnmt3b)
AGA GGG TGC CAG CGG GTA TAT GAG G
На фигуре 74 показаны последовательности белка SaCas9, являющиеся кодоноптимизированными ("повт.опт.") и с удаленными сигналами убиквитинирования "повт. опт. (Ub)") для повышения экспрессии. Белковые блоты меченных FLAG и НА SaCas9 демонстрируют приблизительно 2-кратное повышение экспрессии оптимизированного SaCas9 (повт. опт., №2-4) по сравнению с исходными конструкциями (№№0, 5 и 6) и сходный уровень по сравнению с SpCas9 (SpCas9 330, верхний прямоугольник на левой панели; SpCas9 414, верхний прямоугольник на правой панели). Добавление метки 3 х НА (правая панель, №6) усиливает детектирующий сигнал по сравнению с таковым для метки 1 х НА (правая панель, №5) в ~ 2 раза.
На фигуре 75 показана эффективность введения вставок/делеций с помощью sgRNA, транскрибируемых под контролем промотора U6 в существующем состоянии (серый цвет, левый прямоугольник для каждого количества нтд) или с присоединенным "G" (синий цвет, правый прямоугольник для каждого количества нтд и с более толстой рамкой) до наиболее близкого к 5'-концу положения sgRNA для SaCas9. Значения общей длины спейсерных sgRNA (включая G) указаны по оси х. На графике представлены совокупные данные для 5 sgRNA.
На фигуре 76 показана оптимизация длины спейсерной sgRNA (по оси х). На графиках показано образование вставок/делеций с различными значениями длины спейсерной sgRNA в клетках HEK (слева) и Нера (справа).
Фигуры приведены в данном документе только в целях иллюстрации, и они не обязательно изображены в масштабе.
Подробное описание изобретения
Относительно общей информации о системах CRISPR-Cas: ссылка делается на предварительные заявки на патенты США 61/758468; 61/802174; 61/806375; 61/814263; 61/819803 и 61/828130, поданные 30 января 2013 г.; 15 марта 2013 г.; 28 марта 2013 г.; 20 апреля 2013 г.; 6 мая 2013 г. и 28 мая 2013 г., соответственно. Ссылка также делается на предварительную заявку на патент США 61/836123, поданную 17 июня 2013 г. Ссылка также делается на предварительные заявки на патенты США 61/736527 и 61/748427, поданные 12 декабря 2012 г. и 2 января 2013 г., соответственно. Ссылка также делается на предварительную заявку на патент США 61/791409, поданную 15 марта 2013 г. Ссылка также делается на предварительную заявку на патент США 61/799800, поданную 15 марта 2013 г. Ссылка также делается на предварительные заявки на патенты США 61/835931, 61/835936, 61/836127, 61/836101, 61/836080 и 61/835973, каждая из которых подана 17 июня 2013 г. Ссылка дополнительно делается на предварительные заявки на патенты США 61/862468 и 61/862355, поданные 5 августа 2013 г.; 61/871301, поданную 28 августа 2013 г.; 61/960777, поданную 25 сентября 2013 г., и 61/961980, поданную 28 октября 2013 г. Каждая из данных заявок, и все документы, цитируемые в них или во время их рассмотрения ("документы, цитируемые в заявке"), и все документы, цитируемые или упомянутые в документах, цитируемых в заявке, вместе с любыми инструкциями, описаниями, характеристиками продукта и технологическими картами для любых продуктов, упомянутыми в них или в любом документе, упомянутом в них и включенном с помощью ссылки в данный документ, настоящим включены в данный документ с помощью ссылки и могут быть использованы в практическом осуществлении настоящего изобретения. Все документы (например, данные заявки и документы, цитируемые в заявке) включены в данный документ при помощи ссылки в таком же объеме, как если бы конкретно и отдельно было указано, что каждый отдельный документ включен при помощи ссылки.
Также относительно общей информации о системах CRISPR-Cas упоминают:
Multiplex genome engineering using CRISPR/Cas systems. Cong, L., Ran, F.A., Cox, D., Lin, S., Barretto, R., Habib, N., Hsu, P.D., Wu, X., Jiang, W., Marraffini, L.A., & Zhang, F. Science Feb 15; 339(6121): 819-23 (2013);
RNA-guided editing of bacterial genomes using CRISPR-Cas systems. Jiang W., Bikard D., Cox D., Zhang F, Marraffini LA. Nat Biotechnol Mar; 31(3): 233-9 (2013);
One-Step Generation of Mice Carrying Mutations in Multiple Genes by CRISPR/Cas-Mediated Genome Engineering. Wang H., Yang H., Shivalila CS., Dawlaty MM., Cheng AW., Zhang F., Jaenisch R. Cell May 9; 153(4): 910-8 (2013);
Optical control of mammalian endogenous transcription and epigenetic states. Konermann S, Brigham MD, Trevino AE, Hsu PD, Heidenreich M, Cong L, Platt RJ, Scott DA, Church GM, Zhang F. Nature. 2013 Aug 22; 500(7463): 472-6. doi: 10.1038/Nature12466. Epub 2013 Aug 23;
Double Nicking by RNA-Guided CRISPR Cas9 for Enhanced Genome Editing Specificity. Ran, FA., Hsu, PD., Lin, CY., Gootenberg, JS., Konermann, S., Trevino, AE., Scott, DA., Inoue, A., Matoba, S., Zhang, Y., & Zhang, F. Cell Aug 28. pii: S0092-8674(13)01015-5. (2013);
DNA targeting specificity of RNA-guided Cas9 nucleases. Hsu, P., Scott, D., Weinstein, J., Ran, FA., Konermann, S., Agarwala, V., Li, Y., Fine, E., Wu, X., Shalem, O., Cradick, TJ., Marraffini, LA., Bao, G., & Zhang, F. Nat Biotechnol doi:10.1038/nbt.2647 (2013);
Genome engineering using the CRISPR-Cas9 system. Ran, FA., Hsu, PD., Wright, J., Agarwala, V., Scott, DA., Zhang, F. Nature Protocols Nov; 8(11): 2281-308. (2013);
Genome-Scale CRISPR-Cas9 Knockout Screening in Human Cells. Shalem, O., Sanjana, NE., Hartenian, E., Shi, X., Scott, DA., Mikkelson, Т., Heckl, D., Ebert, BL., Root, DE., Doench, JG., Zhang, F. Science Dec 12. (2013). [Электронная публикация, предшествующая печатной];
Crystal structure of cas9 in complex with guide RNA and target DNA. Nishimasu, H., Ran, FA., Hsu, PD., Konermann, S., Shehata, SI., Dohmae, N., Ishitani, R., Zhang, F., Nureki, O. Cell Feb 27. (2014). 156(5):935-49;
Genome-wide binding of the CRISPR endonuclease Cas9 in mammalian cells. Wu X., Scott DA., Kriz AJ., Chiu AC, Hsu PD., Dadon DB., Cheng AW., Trevino AE., Konermann S., Chen S., Jaenisch R., Zhang F., Sharp PA. Nat Biotechnol. (2014) Apr 20. doi: 10.1038/nbt.2889 и
Development and Applications of CRISPR-Cas9 for Genome Engineering, Hsu et al, Cell 157, 1262-1278 (June 5,2014) (Hsu 2014),
каждый из которых включен в данный документ с помощью ссылки и вкратце обсуждается ниже.
Cong и соавт. сконструировали системы CRISPR/Cas типа II на основе Cas9 Streptococcus thermophilus, а также и Cas9 Streptococcus pyogenes для применения в эукариотических клетках и продемонстрировали, что нуклеазы Cas9 могут быть направлены короткими РНК на индукцию точного расщепления ДНК в клетках человека и мыши. Их исследование дополнительно показало, что Cas9, превращенный в фермент, вносящий однонитевой разрыв, можно применять для содействия репарации с участием гомологичной рекомбинации в эукариотических клетках с минимальной мутагенной активностью. Дополнительно, их исследование продемонстрировало, что в одной матрице CRISPR могут быть закодированы несколько направляющих последовательностей для обеспечения одновременного редактирования в нескольких сайтах эндогенных локусов генома в геноме млекопитающих, что демонстрирует легкую программируемость и широкое применение технологии нуклеаз, направляемых РНК. Эта возможность применения РНК для программирования специфичного к последовательности расщепления ДНК в клетках определила новый класс инструментов для геномной инженерии. Данные исследования дополнительно показали, что другие локусы CRISPR, вероятно, можно пересадить в клетки млекопитающих, и они могут также опосредовать расщепление генома млекопитающих. Важно отметить, что можно предусмотреть дополнительное улучшение некоторых аспектов системы CRISPR/Cas для повышения ее эффективности и эксплуатационной гибкости.
Jiang и соавт. применяли эндонуклеазы Cas9, ассоциированные с короткими палиндромными повторами, регулярно расположенными группами (CRISPR), в комплексе с двойной РНК для введения точных мутаций в геномы Streptococcus pneumoniae и Escherichia coli. Подход опирался на расщеплении в целевом сайте генома под управлением системы двойная РНК:Cas9 для уничтожения немутантных клеток и устранял необходимость в селектируемых маркерах или системах негативного отбора. В исследовании сообщалось о перепрограммировании специфичности системы двойная РНК:Cas9 путем изменения последовательности короткой РНК CRISPR (crRNA) для внесения одно- или многонуклеотидных изменений, выполняемых с помощью матриц редактирования. Исследование показало, что одновременное использование двух crRNA обеспечивало мультиплексный мутагенез. Кроме того, когда подход применяли в комбинации с рекомбинационной инженерией, у S. pneumoniae практически 100% клеток, извлеченных с помощью описанного подхода, содержали желаемую мутацию, а у Е. coli 65% извлеченных таковых содержали мутацию.
Konermann и соавт. изучали существующую в данной области техники необходимость в гибких и надежных технологиях, позволяющих осуществлять оптическое и химическое модулирование фермента Cas9 CRISPR на основе ДНК-связывающих доменов, а также эффекторов, подобных транскрипционным активаторам.
Как обсуждается в настоящем описании, нуклеаза Cas9 из микробной системы CRISPR-Cas направляется на конкретные локусы генома направляющей последовательностью размером 20 нт, которая может допускать некоторые несовпадения с ДНК-мишенью и, таким образом, способствует нежелательному нецелевому мутагенезу. Для изучения этого Ran и соавт. описали подход, в котором мутантную никазу Cas9 применяли в сочетании с парными направляющими РНК для введения целевых двухнитевых разрывов. Поскольку отдельные однонитевые разрывы в геноме подвергаются высокоточной репарации, одновременное внесение однонитевых разрывов с помощью соответствующим образом смещенных друг относительно друга направляющих РНК является необходимым для образования двухнитевых разрывов и увеличивает количество специфически распознаваемых оснований для расщепления мишени. Авторы продемонстрировали, что применение парного внесения однонитевых разрывов может снижать нецелевую активность в линиях клеток в 50-1500 раз и облегчать нокаут генов в зиготах мышей без уменьшения эффективности целевого расщепления. Данная гибкая стратегия обеспечивает большое разнообразие применений редактирования генома, требующих высокой специфичности.
Hsu и соавт. охарактеризовали специфичность целенаправленного воздействия SpCas9 в клетках человека, чтобы предоставить информацию для выбора целевых сайтов и избежать нецелевых эффектов. В исследовании оценивали >700 вариантов направляющей РНК и уровней мутаций по типу вставок/делеций, индуцированных SpCas9, в>100 предсказанных нецелевых локусах генома в клетках 293Т и 293FT. Авторы показали, что SpCas9 допускает ошибки спаривания между направляющей РНК и целевой ДНК в различных положениях в зависимости от последовательности с чувствительностью к количеству, положению и распределению ошибок спаривания. Авторы дополнительно показали, что на опосредованное SpCas9 расщепление не влияет метилирование ДНК и что для сведения к минимуму нецелевых модификаций можно подобрать дозу SpCas9 и sgRNA. Дополнительно, для содействия применениям в геномной инженерии млекопитающих авторы сообщили о получении инструментального программного обеспечения на веб-основе для управления выбором и подтверждением целевых последовательностей, а также анализов нецелевых явлений.
Ran и соавт. описали набор инструментов для опосредованного Cas9 редактирования генома посредством негомологичного соединения концов (NHEJ) или репарации с участием гомологичной рекомбинации (HDR) в клетках млекопитающих, а также создания модифицированных линий клеток для последующих функциональных исследований. Для сведения к минимуму нецелевого расщепления авторы дополнительно описали стратегию внесения двойных однонитевых разрывов с помощью мутантной никазы Cas9 с парными направляющими РНК. Протокол, представленный авторами, является полученным экспериментальным путем руководством по выбору целевых сайтов, оцениванию эффективности расщепления и анализу нецелевой активности. Исследования показали, что, начиная с конструирования мишени, модификации генов можно получить в течение всего-навсего 1-2 недель, и модифицированные клональные линии клеток можно получить в течение 2-3 недель.
Shalem и соавт. описали новый способ исследования функций генов в полногеномном масштабе. Их исследования показали, что доставка библиотеки CRISPR-Cas9 для нокаута в масштабе генома (GeCKO), целенаправленно воздействующей на 18 080 генов, с 64 751 уникальной направляющей последовательностью обеспечивала скрининг путем как позитивного, так и негативного отбора в клетках человека. Во-первых, авторы показали применение библиотеки GeCKO для идентификации генов, существенных для жизнеспособности клеток у раковых и плюрипотентных стволовых клеток. Далее, в модели меланомы, авторы провели скрининг генов, утрата функций которых вовлечена в устойчивость к вемурафенибу, терапевтическому средству, ингибирующему мутантную протеинкиназу BRAF. Их исследования показали, что кандидаты высшего ранга включали ранее подтвержденные гены NF1 и MED12, а также новые хиты NF2, CUL3, TADA2B и TADA1. Авторы наблюдали высокий уровень согласованности между независимыми направляющими РНК, осуществляющими нацеливание на один и тот же ген, и высоким показателем подтверждения хитов и, таким образом, продемонстрировали перспективность скрининга с помощью Cas9 в масштабе генома.
Nishimasu и соавт. сообщали о кристаллической структуре Cas9 Streptococcus pyogenes в комплексе с sgRNA и ее целевой ДНК при разрешающей способности в 2,5 А°. В структуре была выявлена двухлопастная архитектура, образованная лопастью распознавания мишени и нуклеазной лопастью, обеспечивающих размещение гетеродуплекса sgRNA:ДНК в положительно заряженной бороздке на поверхности их соприкосновения. При том, что лопасть распознавания является существенной для связывания sgRNA и ДНК, нуклеазная лопасть содержит нуклеазные домены HNH и RuvC, расположенные надлежащим образом для расщепления комплементарной и некомплементарной нитей целевой ДНК, соответственно. Нуклеазная лопасть также содержит карбоксиконцевой домен, отвечающий за взаимодействие с мотивом, прилегающим к протоспейсеру (РАМ). Эти структурные анализы с высокой разрешающей способностью и сопутствующие функциональные анализы выявили' молекулярный механизм целенаправленного воздействия Cas9, направляемых РНК, на ДНК, проложив таким образом путь для рациональной разработки новых универсальных технологий редактирования генома.
Wu и соавт. производили полногеномное картирование сайтов связывания для каталитически неактивного Cas9 (dCas9) из Streptococcus pyogenes, который вводили с одиночными направляющими РНК (sgRNA) в эмбриональные стволовые клетки мыши (mESC). Авторы показали, что каждая из четырех тестируемых sgRNA осуществляет нацеливание dCas9 на сайты генома в количестве от нескольких десятков до нескольких тысяч, что часто характеризуется наличием 5-нуклеотидной затравочной области в sgRNA и NGG-мотива, прилегающего к протоспейсеру (РАМ). Недоступность хроматина снижает связывание dCas9 с другими сайтами с последовательностями, комплементарными затравочной; таким образом, 70% нецелевых сайтов ассоциированы с генами. Авторы показали, что целенаправленное секвенирование 295 сайтов связывания для dCas9 в mESC, трансфицированных каталитически активным Cas9, выявило мутацию, превышающую фоновые уровни, только в одном сайте. Авторы предложили модель связывания с Cas9 и опосредованного им расщепления с двумя состояниями, в которой последовательность, комплементарная затравочной, запускает связывание, но для расщепления необходимо образование многочисленных пар с целевой ДНК.
Hsu 2014 представляет собой обзорную статью, в которой в общих чертах обсуждается история CRISPR-Cas9 от йогуртной культуры до редактирования генома, в том числе генетический скрининг клеток, которая содержится в информации, данных и полученных результатах в заявках, из которых происходит настоящее описание, поданных до 5 июня 2014 г. Общие идеи Hsu 2014 не включают конкретные модели и животных из настоящего описания.
Настоящее изобретение относится к конструированию и оптимизации систем, способов и композиций, применяемых для контроля экспрессии генов, включающего целенаправленное воздействие на последовательность, такое как внесение изменений в геном или редактирование генов, связанное с системой CRISPR-Cas и ее компонентами. В преимущественных вариантах осуществления фермент Cas представляет собой Cas9.
Полинуклеотидная последовательность CRISPR-Cas обычно именуется в данном документе направляющей или даже направляющей РНК (sgRNA), хотя будет понятно, что данная терминология ранее не являлась обычной. Дополнительно, в данном документе делается ссылка на систему CRISPR-Cas9, хотя следует иметь в виду, что это общая ссылка на любой Cas, при условии что он обладает функцией нуклеазы для индукции DSB, однонитевого разрыва, или двойного однонитевого разрыва, хотя Cas9 является предпочтительным и SaCas9 является особенно предпочтительным.
Некоторые из основных положений данных по печени в настоящем изобретении обобщены ниже и касаются постмитотических клеток в целом, поскольку клетки печени обычно являются постмитотическими.
AAV2/8
Предпочтительная доставка системы CRISPR-Cas осуществляется посредством вирусного вектора. Этот вектор может представлять собой лентивирусный вектор или вектор на основе AAV, как подробно обсуждается в данном документе. В частности, авторы настоящего изобретения продемонстрировали, что AAV является предпочтительным примером вирусного вектора. В рамках этого авторы настоящего изобретения перешли к демонстрации того, что AAV8 и, в частности, AAV2/8 (AAV8, упакованный с помощью ITR AAV2 в качестве упаковочного сигнала) является применимым для доставки в печень, в особенности in vivo.
Фенотипические изменения, наблюдаемые in vivo
Как обсуждается в другом месте в данном документе, авторы настоящего изобретения были способны продемонстрировать in vivo, что фенотипическое изменение - можно выявить. Это является значительным шагом вперед, поскольку недостаток, часто сглаживаемый посредством RNAi, заключается в отсутствии наблюдаемого длительного эффекта. В настоящем изобретении впервые можно увидеть фенотипическое изменение в печени. Предпочтительной схемой для его достижения является применяемая в примере 36. Ее важные элементы являются предпочтительными в отдельности или в комбинации, а именно:
SaCas9;
применение направляющей РНК, содержащей направляющую последовательность, tracr-последовательность и парную tracr-последовательность;
что касается tracr-последовательности, tracr Sa является предпочтительной для привлечения SaCas9;
AAV8 или, более предпочтительно, AAV2/8;
для экспериментальных целей Rosa26 является применимым отрицательным контролем;
хотя применение промотора CMV в векторе AAV является целесообразным, особенно эффективным является применение печеночноспецифического промотора (для целенаправленного воздействия на печень), такого как TBG;
мишень или мишени могут находиться в широком диапазоне, поскольку было показано, что CRISPR имеет широкую применимость среди мишеней, так как ее направляющие последовательности успешно доставляются, а ферменты Css9 экспрессируются надлежащим образом. Однако, предпочтительные мишени в печени (для воздействия на которые могут быть предназначены направляющие последовательности), тем не менее, включают одну или несколько из: PCSK9; Hmgcr; SERPINA1; АроВ и/или LDL.
Соответственно, в некоторых вариантах осуществления особенно предпочтительно, чтобы фермент Cas представлял собой SaCas9. Полинуклеотидная последовательность CRISPR-Cas предпочтительно является химерной и предпочтительно включает в себя tracr Sa, где Cas9 представляет собой SaCas9. Можно применять вирусный вектор, который предпочтительно представляет собой AAV2/8. Кроме того, наиболее подходящим является печеночноспецифический промотор, и предпочтительным примером является TBG. Все из этого можно применять в комбинации с получением химерной полинуклеотидной последовательности CRISPR-Cas, включающей в себя tracr Sa, где Cas9 представляет собой SaCas9, а вектор представляет собой AAV2/8, и по меньшей мере Cas9 находится под контролем печеночноспецифического промотора, такого как TBG. Данная система может быть направлена на любую из вышеприведенных мишеней, в частности, АроВ ввиду его важной роли в ожирении.
В недавней статье Yin и Anderson в Nature Biotech (NBT 2884, упоминаемой в данном документе) дополнительно подтверждены фенотипические изменения in vivo, уже продемонстрированные авторами настоящего изобретения.
Дополнительные данные, приведенные авторами настоящего изобретения, в этом случае дают дополнительное подтверждение посредством демонстрации эффективного редактирования в соматической ткани печени in vivo с помощью Cas9. Более того, доставка с помощью AAV2/8 и применение SaCas9 опять-таки демонстрируют применимость данного конкретного подхода in vivo. На предпочтительный АроВ вновь осуществляли целенаправленное воздействие.
В последующих примерах 36 и 37 показаны превосходные in vivo данные об эффективности индукции фенотипического изменения in vivo: в частности, относительно АроВ, гена, участвующего в метаболизме липидов, при этом в примере 38 показана применимость методики к постмитотическим клеткам, среди которых клетки печени являются важным примером. В примере 39 показано, что для целей выявления предпочтительными являются множественные эпитопные метки.
Хотя предпочтительными являются вирусные векторы, в некоторых вариантах осуществления применение пептидов, проникающих в клетку, является жизнеспособной альтернативой и поэтому также является предпочтительным.
В примере 36 показано, что в случае использования систем CRISPR-Cas наблюдаются как генотипические, так и, что особенно важно, фенотипические изменения. Система CRISPR-Cas9, хотя и не только она, являлась эффективной в индукции фенотипического изменения in vivo. В частности, мишень представляла собой АроВ, ген, участвующий в метаболизме липидов. Обнадеживающим является то, что можно сказать, что АроВ является "золотым стандартом" в доставке в печень и широко применяется в мышиных моделях ожирения. В некоторых вариантах осуществления клетка печени является предпочтительной постмитотической клеткой, хотя она может также быть исключена в других вариантах осуществления. В любом случае, настоящее изобретение обеспечивает подтверждение принципа, заключающегося в том, что фенотипическое изменение наблюдается даже in vivo, и это положение в равной степени применимо к другим постмитотическим клеткам. Так, пример 38 обеспечивает дополнительное подтверждение данного положения в отдельной ткани, головного мозга, с использованием постмитотических нейронов. Доставку в примере 36 осуществляли посредством внутривенной инъекции. Применяли вектор AAV, а также печеночно-специфический промотор (TBG) для Cas9. Доставка посредством экспрессии с вирусного вектора, рассматриваемая здесь, является улучшением по сравнению с предложенным Anderson/Yin (NBT 2884) применением гидродинамической доставки в качестве способа доставки, поскольку для гидродинамической доставки требуется инъекция нескольких мл жидкости, что является стрессогенным для организма мыши и может быть смертельным. Гидродинамическая доставка лучше всего подходит для доставки плазмидной ("оголенной") ДНК, тогда как авторы настоящего изобретения показали, что упаковка направляющей последовательности и последовательности Cas9 в вирусный вектор доставки является предпочтительной с точки зрения значительно возрастающей эффективности. Более того, необходимо вводить лишь относительно небольшие объемы, и это можно выполнить внутривенно (i.v.), что, вероятно, является намного более приемлемым с терапевтической точки зрения. Особенно обнадеживающим является то, что для гена, являющегося "золотым стандартом" в печени, такого как АроВ, наблюдали не только генотипические изменения, но регистрировали также и фенотипические изменения. Предыдущая работа с PCSK9 показала генотипические, но не фенотипические изменения, так что фенотипические изменения, наблюдаемые для АроВ, подтверждают возможность доставки CRISPR в печень и ее способность к осуществлению фенотипического изменения в ней. Ее применяют в сочетании с более приемлемыми с терапевтической точки зрения способами доставки (i.v. по сравнению с гидродинамической доставкой). В связи с этим вирусная доставка системы CRISPR-Cas9 (направляющей последовательности и Cas9), особенно внутривенная, является предпочтительной.
Возможные мишени включают: PCSK9, HMGCR, АРОВ, LDLR, ANGPTL3, F8, F9/FIX, ААТ, FAH, HPD, TAT, АТР7 В, UGT1A1, ОТС, ARH.
Соответственно, представлены способы индукции фенотипического изменения in vivo, включающие введение системы CRISPR-Cas9 в целевые клетки, например, в печень. В данном документе описаны подходящие пути доставки, но в некоторых вариантах осуществления предпочтительной является i.v. инъекция. Предпочтительными являются вирусные векторы, в особенности на основе AAV, в частности, AAV серотипа 2/8.
Также представлена система CRISPR-Cas9, содержащая одну или несколько направляющих последовательностей, осуществляющих нацеливание на гены, участвующие в метаболизме липидов, например АроВ. Также предусмотрены способы лечения ожирения, включающие введение указанной системы CRISPR-Cas9. Мышиная модель, содержащая в печени один или несколько генов с нокдауном, в частности, генов, участвующих в метаболизме липидов, например, включающих АроВ, является предпочтительной.
Печеночно-специфические промоторы для Cas9 будут очевидными, но могут включать перечисленные в данном документе. Предпочтительным примером является TBG.
Как показано в примере 37, направляющая последовательность может иметь длину 18-23 нуклеотида. Ее длина может составлять 18-22, или 19-22, или 18-21, 20-22, но предпочтительно 22 и наиболее предпочтительно 21 нуклеотид.
Также представлены проверка и подтверждение принципа успешной упаковки направляющей последовательности в интрон SaCas9. Соответственно, системы CRISPR-Cas9, где одна или несколько направляющих последовательностей упакованы (помещены или вставлены) в интрон Cas9, являются предпочтительными.
Промотор H1 может применяться и может быть предпочтительным в некоторых обстоятельствах.
Дополняя работу Ran (Cell, 154, 21 августа 2013 г.), исследовали степень перекрывания в подходе с двумя направляющими последовательностями с использованием двойной никазы D10A. Оптимальные результаты демонстрировались от -5 до +1 п.о. (от 5' до 5'). Соответственно, предпочтительным является применение подхода с двумя направляющими последовательностями для сведения к минимуму нецелевых эффектов. Они предпочтительно перекрываются или близки к перекрыванию на своих 5'-концах в различных нитях ДНК в геномной мишени. Перекрывание предпочтительно находится в диапазоне от -5 до +1 п.о. В этих случаях будет понятно, что Cas9 является двойной никазой, такой как предпочтительный вариант D10A.
Для Cas9 предпочтительными являются множественные или повторяющиеся эпитопные метки. В частности, в примере 39 показана тройная эпитопная метка для улучшения выявления. Метка предпочтительно является повторяющейся, более предпочтительно тройной повторяющейся. НА является предпочтительной эпитопной меткой для Cas9. Тройная эпитопная НА-метка, таким образом, является предпочтительной в некоторых вариантах осуществления.
В примере 38 представлены следующие конкретные положения. В нем представлены:
первая демонстрация успешной опосредованной AAV доставки Cas9 in vivo, а также эффективной модификации генома в постмитотических нейронах;
разработка методики мечения ядер, позволяющей осуществлять простое выделение ядер нейронов из клеток, экспрессирующих Cas9 и sgRNA;
демонстрация путей применения анализа транскриптома нейрона путем секвенирования РНК;
то, как электрофизиологические исследования и другие методики можно объединить с опосредованным Cas9 внесением изменений в геном для определения фенотипических изменений и
демонстрация мультиплексного целенаправленного воздействия и возможности изучения функций генов по поведению грызунов с помощью опосредованного Cas9 редактирования генома.
На основании этого можно увидеть, что пример 38 обеспечивает дополнительное подтверждение концепции в двух основных областях:
в понимании и тестировании функций генов, включая создание и тестирование моделей; и
в генной терапии.
Дополнительный аспект, обсуждаемый в дальнейшем ниже, относится к способу мечения ядер.
Будет понятно, что ссылка на системы CRISPR-Cas9 в данном документе является сокращенной ссылкой на ферменты Cas9, представленные в данном документе, в комбинации с направляющими последовательностями или направляющими последовательностями, применяемыми для нацеливания на одну или несколько геномных последовательностей. Ссылка на направляющую(направляющие) последовательность(последовательности) включает sgRNA, а также химерные полинуклеотидные последовательности, описанные в данном документе, содержащие направляющие последовательности, способные к гибридизации с целевыми последовательностями в геноме субъекта, парную tracr-последовательность и tracr-последовательность.
Эти данные по сути показывают фенотипические изменения, обусловленные нокдауном генов с помощью двух отдельных систем CRISPR-Cas9 согласно настоящему изобретению (направляющей РНК в комбинации с ферментом Cas9), в данном случае для успешного изменения функционирования генов. Выбранная ткань представляла собой ткань головного мозга, но результаты обеспечивают подтверждение принципа действия для широкого диапазона постмитотических тканей. Это является важным отличием, поскольку предыдущая работа была сфокусирована на делящихся клетках (т.е. премитотических).
Иными словами, при том, что SpCas9 широко применялся в генной инженерии делящихся клеток, авторы настоящего изобретения продемонстрировали, что SpCas9 также можно применять для геномной инженерии постмитотических нейронов. Ее осуществляют с высокой эффективностью посредством опосредованного NHEJ образования вставок/делеций для получения нокдаунов, но применения в терапии, включающие коррекцию посредством механизма HDR (при обеспечении наличия матрицы для репарации), также предусмотрены. Оба эти направления зависят от успешной доставки и функциональной экспрессии Cas9 и направляющей или направляющих РНК, показанной здесь.
Тот факт, что генотипические изменения, индуцируемые системами CRISPR-Cas9, впоследствии приводят к фенотипическому изменению, также важен для обеих вышеуказанных областей (исследования функций генов и генной терапии).
В первой системе CRISPR-Cas9 использовали направляющие последовательности, направленные на (осуществляющие нацеливание на) Меср2. Двухвекторная система CRISPR-Cas9, в которой один вектор содержит направляющую последовательность, а другой содержит Cas9, использовалась успешно, что предоставляло дополнительное подтверждение принципа действия для таких двухвекторных систем. Двухвекторную систему CRISPR-Cas9 успешно доставляли посредством стереотаксической инъекции в два отдельных участка головного мозга, а именно в зубчатую извилину гиппокампа и зрительную кору. В обоих случаях наблюдалось внесение изменений в гены в отношении одного и того же гена, Меср2, что указывало на успешную доставку двухвекторной системы и ее действие в соответствии с ожиданием, с транскрипцией и функциональной активностью фермента Cas9 (в данном случае SpCas9) и успешным привлечением Cas9 к целевой геномной последовательности с помощью направляющих последовательностей.
Опосредованная AAV доставка SpCas9 и sgRNA in vivo обеспечивает быструю и эффективную технологию осуществления внесения точных изменений в геном в интактных нервных цепях. В силу этого применяемым вектором являлся вектор на основе AAV, что дает дополнительное основание для его применения в общем и в двухвекторных системах CRISPR-Cas9 в частности, в особенности в постмитотических клетках и тканях и, в частности, в головном мозге.
Разумеется, будет понятно, что выбор промотора является важным в осуществлении экспрессии системы CRISPR-Cas9, в частности, Cas9 или как направляющей(направляющих) последовательности(последовательностей), так и Cas9. Подходящие примеры специфичности к клетке и стадии жизненного цикла клетки можно определить из литературы. Тем не менее, авторы настоящего изобретения приводят несколько неограничивающих примеров: TBG, печеночно-специфический промотор, применяемый здесь для управления экспрессией SaCas9; промотор H1; усеченный промотор H1; промотор U6. Также, поскольку направляющим последовательностям не обязательно нужен конкретный промотор, одна или несколько направляющих последовательностей могут быть упакованы аналогичным образом в интрон Cas9.
Вторая применяемая система CRISPR-Cas9 предусматривает мультиплексный подход. Одним из ключевых преимуществ системы SpCas9 является ее способность к содействию мультиплексному редактированию генома. Данная вторая система успешно целенаправленно воздействовала на три гена из одного семейства (в данном случае Dmnt1, 3а и 3b) благодаря включению подходящих направляющих последовательностей и приводила к стабильным нокаутам нескольких генов. Это явление широко применяется для изучения функций не только отдельных генов, но также и целых семейств генов в тканях живых животных. Оно является особенно важным для таких тканей, как головной мозг, где оно не было возможным ранее или могло быть достигнуто лишь спустя долгие годы применения методов классической генетики. Заявители показали, что у нормального животного в постмитотических клетках может иметь место внесение изменений в один или несколько генов (и даже полный нокдаун). Его, однако, в равной степени можно применять к модельному организму (например, уже несущему мутацию или внесенное изменение в гене или имеющему некоторым образом измененную экспрессию) или трансгенному организму, предоставляя быструю альтернативу существующим способам получения модельных организмов и применения модельных организмов для понимания функций генов. Для осуществления последующих циклов внесения изменений в гены и/или их восстановления (с возобновлением функционирования гена, например, путем коррекции гена с внесенными изменениями посредством обеспечения наличия, например, матрицы для репарации, такой как ssDNA, подходящей для HDR) в том же организме можно использовать дополнительные направляющие последовательности (и/или целые системы CRISPR-Cas9).
Известно, что при опосредованном SpCas9 целенаправленном воздействии на один или несколько генов, как правило, могут воспроизводиться морфологические, электрофизиологические и поведенческие фенотипы, наблюдаемые при применении классических, более трудоемких генетических мышиных моделей.
Альтернативно, относительно нокдауна целых семейств генов или родственных генов данные также предоставляют здесь проверку и подтверждение принципа, заключающегося в том, что одновременный нокдаун трех или более неродственных генов является в равной степени возможным. Он применим во всех тканях, но особенно убедительно представлен в отношении постмитотических тканей, особенно головного мозга.
Другим применимым аспектом данной работы является то, что она продемонстрировала, что для исследования функций генов можно прибегнуть к комбинированному, или интегрированному, подходу, в котором используют CRISPR для осуществления генотипического изменения, а затем используют классические инструменты, такие как электрофизиологическое исследование (особенно в отношении ткани головного мозга и CNS), снятие биохимических, относящихся к секвенированию, электрофизиологических и/или поведенческих показателей, для установления того, какие фенотипические изменения, если они имеют место, обусловлены генотипическим изменением, индуцированным системой CRISPR-Cas9. Например, в головном мозге он позволяет исследовать функции отдельных генов, а также их групп в нервных процессах и их роль в мозговых нарушениях in vivo.
Успешное внесение изменений в гены в данной работе в равной степени применимо для коррекции или восстановления функции гена, т.е. для применения систем CRISPR-Cas9 в генной терапии. В частности, это относится к целенаправленному воздействию в постмитотических клетках, особенно в головном мозге.
В целом, применение систем CRISPR-Cas9 демонстрирует улучшения по сравнению с существующими методиками, такими как применение Zn-пальцев, разработка и получение которых занимает длительное время и которые не могут функционировать в мультиплексе, и shRNA, которые имеют слишком много нецелевых эффектов, тогда как нецелевые эффекты CRISPR можно свести к минимуму путем применения подходов с двойной никазой.
Целенаправленное воздействие в тканях
В работе данного документа обосновано применение систем CRISPR-Cas9 для целенаправленного воздействия на гены в постмитотических клетках посредством доставки системы CRISPR-Cas9 в соответствующий участок (т.е. в клетки в органах или тканях, представляющих интерес). Предпочтительные ткани находятся в следующих органах:
почка;
пищеварительная система, в том числе желудок, поджелудочная железа, двенадцатиперстная кишка, подвздошная кишка и/или толстая кишка;
сердце;
легкое;
головного мозга, в частности, нейроны, и/или ЦНС в целом;
глаз, в том числе ткань сетчатки;
ухо, в том числе внутреннее ухо;
кожа;
мышцы;
кости и/или
печень в целом.
Будет понятно, что многие из вышеперечисленных органов могут содержать премитотические клетки, но данный аспект настоящего изобретения направлен на постмитотические клетки или ткани в этих органах.
Предпочтительно органом является почка или головной мозг. Данные, в частности, демонстрируют доставку в зубчатую извилину гиппокампа и зрительную кору в головном мозге, которые являются предпочтительными тканями, хотя другие ткани, включающие любое одно или несколько из следующего: первичную моторную кору, первичную слуховую кору, первичную соматосенсорную кору, мозжечок, главную обонятельную луковицу, префронтальную кору, эндопириформное ядро, миндалевидное тело, черную субстанцию, полосатое тело, бледный шар, таламус, гипоталамус, парабрахиальное ядро, верхний оливарный комплекс, кохлеарные ядра, ядра сосцевидных тел, также являются предпочтительными в некоторых вариантах осуществления.
Клетки из головного мозга, и в частности, нейроны, являются особенно предпочтительными.
Выбор промотора для управления экспрессией системы CRISPR-Cas9, в частности, Cas9, является важным, как упоминается выше. При выборе промотора необходимо учитывать стадию клеточного цикла (раннюю/позднюю) и тип клеток, поскольку промоторы будут специфичными к одному или нескольким типам клеток и одной или нескольким стадиям клеточного цикла. Подходящие промоторы могут в некоторых вариантах осуществления включать в себя любой один или несколько из следующих.
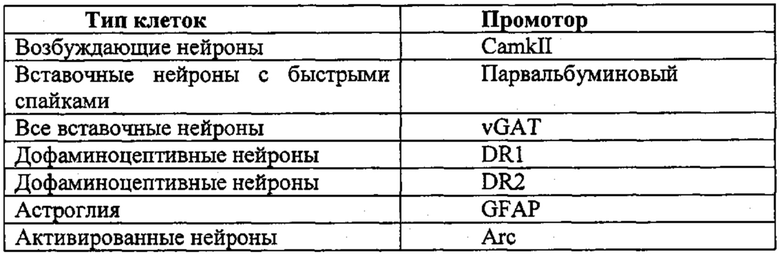
В двухвекторной системе CRISPR-Cas9, применяемой для целенаправленного воздействия в головном мозге, в частности, в зубчатой извилине гиппокампа, кассеты экспрессии SpCas9 и sgRNA упакованы в два отдельных вирусных вектора. Cas9, в частности, SpCas9, таким образом, предпочтительно доставляют с помощью аденовирусных векторов, в частности, AAV (т.е. в виде AAV-SpCas9). Направляющие последовательности предпочтительно доставляют в виде кассет экспрессии sgRNA с помощью аденовирусных векторов, в частности, на основе AAV (т.е. в виде AAV-Sp-направляющая последовательность). Предпочтительным путем для данной ткани (зубчатой извилины гиппокампа) и для головного мозга в целом является стереотаксическая инъекция.
Понимание и тестирование функций генов и создание и применение моделей для этого
Состояния, которые могут быть рассмотрены, включают болезнь Гентингтона, но по сути включают любое состояние, обнаруживаемое в постмитотических клетках, и особенно те, изучение которых in vivo может принести пользу или для которых отсутствует применимая модель.
Как упоминается выше, системы CRISPR-Cas9 можно применять для исследования функций одного или нескольких генов в постмитотических клетках. Это можно осуществлять посредством доставки системы CRISPR-Cas9 в постмитотическую клетку и ее экспрессии в ней, где направляющая(направляющие) последовательность(последовательности) системы CRISPR-Cas9 предназначены для привлечения Cas9 к геномной мишени или мишеням, представляющим интерес. В то же время, если Cas9 уже содержится в постмитотической клетке в форме белка (транскрибированной), то доставка направляющих последовательностей в постмитотическую клетку будет достаточной. Если Cas9 уже содержится в постмитотической клетке в форме полинуклеотида (нетранскрибированной), то доставка направляющих последовательностей в постмитотическую клетку, а также индукция транскрипции полинуклеотида Cas9 будет необходимой. Наличие Cas9 под контролем индуцируемого или репрессируемого промотора, такого как система tet-on/off (тетрациклиновая), здесь может быть преимущественным.
Одним особенно многообещающим аспектом является объединение методик CRISPR с фенотипическими анализами для определения фенотипических изменений, если они имеют место, обусловленных внесением изменений в гены, в частности, нокдаунами. Например, в примере 40 показано, чего можно достичь с помощью целенаправленного внесения изменений в геном в сочетании со снятием количественных показателей для обеспечения проникновения в сущность биологических функций конкретных элементов генома. В частности, опосредованное Cas9 редактирование генома в головном мозге in vivo можно также сочетать с электрофизиологической регистрацией для исследования эффекта от внесения изменений в геном в отношении конкретных типов клеток или компонентов нервной цепи. В более широком смысле применение систем CRISPR-Cas9 (для обеспечения опосредованного Cas9 внесения изменений в геном) можно объединять с биохимическим, секвенирующим, электрофизиологическим и поведенческим анализом для исследования функций целевого элемента генома.
Таким образом, в одном аспекте представлен способ исследования функции одного или нескольких генов в постмитотической клетке, включающий индукцию дефектного генотипа или нокдаун генов, как описано ниже, и определение изменений в экспрессии одного или нескольких генов в данном состоянии с исследованием таким образом функции одного или нескольких генов.
Необязательно способ может также включать трансплантацию второй популяции клеток субъекту с индукцией таким образом состояния, ассоциированного с дефектным генотипом или нокдауном генов. Это может предшествовать этапу определения.
Следующее относится в широком смысле к соответствующим аспектам настоящего изобретения. Клетка может находиться в субъекте, таком как человек, животное или модельный организм, так что функции генов исследуют in vivo. Однако также предусмотрено, что клетка может находиться ex vivo, например, в клеточной культуре или в модельном органе или органоиде. В некоторых вариантах осуществления способ может включать выделение первой популяции клеток из субъекта, необязательно их культивирование и их трансдукцию одной или несколькими системами CRISPR-Cas9. За этим может следовать необязательное дополнительное культивирование. Затем может происходить трансплантация трансдуцированных клеток обратно субъекту.
Клетка может быть получена из любой ткани или органа, описанных в данном документе. Головной мозг является одним предпочтительным примером, обеспечивающим осуществление указанного способа исследования функций одного или нескольких генов, где постмитотическая клетка является клеткой головного мозга, например, нейроном. В частности, он обеспечивает исследование функций генов in vivo по поведению животного. Животное предпочтительно является млекопитающим, например, грызуном. С учетом сложности нервной системы, состоящей из разветвленных сетей разнородных типов клеток, способность к эффективному редактированию генома нейронов in vivo позволяет осуществлять прямое тестирование функций генов в надлежащих типах клеток, погруженных в естественный контекст. Это подтверждается данными авторов настоящего изобретения, где нокаутные мыши демонстрировали ухудшение консолидации памяти при тестировании в условиях тренировочного контекста. Результаты данного документа демонстрируют, что опосредованный CRISPR-Cas9 нокаут представителей семейства DNMT в нейронах зубчатой извилины является достаточным для изучения функций генов в поведенческих задачах.
Это показывает оперативную гибкость Cas9 в облегчении целенаправленного нокаута генов в головном мозге млекопитающих in vivo для изучения функций генов и, в частности, для разъединения нейронных цепей. Введение стабильных нокаутов нескольких генов в головной мозг живых животных будет иметь потенциально многообещающие применения, такие как казуальное исследование полигенных механизмов, лежащих в основе физиологических и невропатологических состояний.
Характерной особенностью данной работы является то, что заявители выбрали промотор Меср2 мыши (235 п. о., рМеср2)7 и минимальный сигнал полиаденилирования (48 п. о., spA) на основании их способности к обеспечению достаточных уровней экспрессии SpCas9 в культивируемых первичных кортикальных нейронах мыши. Ген Меср2 играет важнейшую роль при синдроме Ретта, типе расстройства аутистического спектра. Для целенаправленного воздействия на Меср2 авторы настоящего изобретения вначале разработали несколько sgRNA, осуществляющих нацеливание на экзон 3 гена Меср2 мыши, и оценивали их эффективность с применением клеток Neuro-2a. Наиболее эффективную sgRNA идентифицировали путем применения анализа с помощью нуклеазы SURVEYOR. Доставку осуществляли посредством стереотаксической инъекции смеси (в соотношении 1:1) высокого титра AAV-SpCas9 и AAV-SpGuide. Авторы настоящего изобретения также успешно протестировали возможность мультиплексного редактирования генома в головном мозге; авторы настоящего изобретения разработали мультиплексный вектор экспрессии sgRNA, состоящий из трех sgRNA в тандеме вместе с GFP-KASH для мечения ядер.
Таким образом, также представлены способы индукции состояний, характеризирующихся одним или несколькими нокдаунами генов в постмитотической клетке. Примеры таких состояний являются многочисленными, но могут включать синдром Ретта, проиллюстрированный на примере. Подходящие промоторы будут очевидными, и промотор Меср2 является наиболее подходящим для синдрома Ретта. Одним из способов выбора промотора для управления экспрессией системы CRISPR-Cas9, в частности, Cas9, является выбор промотора для гена, представляющего интерес.
Таким образом, в одном аспекте представлен способ индукции состояний, характеризующихся одним или несколькими дефектными генами(или генотипами) в постмитотической клетке, включающий:
трансдукцию первой популяции клеток не встречающейся в природе или сконструированной композицией, содержащей векторную систему, содержащую один или несколько векторов, содержащих
первый регуляторный элемент, функционально связанный с полинуклеотидной последовательностью химерной РНК (chiRNA) системы CRISPR-CAS, где полинуклеотидная последовательность содержит
одну, две, три, четыре или более направляющих последовательностей, способных к гибридизации с тремя или более целевыми последовательностями в геноме субъекта,
парную tracr-последовательность, и
tracr-последовательность, и
второй регуляторный элемент, функционально связанный с кодирующей фермент последовательностью, кодирующей фермент CRISPR, содержащий по меньшей мере одну или несколько последовательностей ядерной локализации (NLS), где (а), (b) и (с) расположены в 5'-3' ориентации,
где компоненты I и II находятся в одном и том же или в разных векторах системы, где при транскрипции парная tracr-последовательность гибридизируется с tracr-последовательностью, а направляющая последовательность управляет специфичным к последовательности связыванием комплексов CRISPR с целевой последовательностью,
где комплекс CRISPR содержит фермент CRISPR, образующий комплекс с (1) направляющей последовательностью, которая гибридизируется с целевой последовательностью, и (2) парной tracr-последовательностью, которая гибридизируется с tracr-последовательностью,
где фермент CRISPR изменяет геном клеток первой популяции с получением второй популяции клеток, содержащих один или несколько дефектных генов или генов с нокдауном.
Необязательно способ может также включать выделение первой популяция клеток из субъекта.
Необязательно способ может включать трансплантацию второй популяции клеток субъекту с индукцией таким образом пролиферативного состояния.
Она по сути может включать индукцию нефункционального (включающего частично нефункциональное) состояния генотипа в целевой клетке с получением таким образом модели для изучения (в том числе будущего восстановления функционального генотипа).
Системы CRISPR-Cas9 также можно применять для облегчения изучения функций генов в клеточных анализах путем обеспечения целенаправленного нокаута в постмитотических нейронах.
Способы доставки нуклеотидов в нервные клетки хорошо известны и рассматриваются Karra and Dahm в The Journal of Neuroscience (5 May 2010, 30(18): 6171-6177; doi: 10.1523/JNEUROSCI.0183-10.2010). Примеры включают электрические способы трансфекции (такие как электропорация, нуклеофекция и электропорация отдельных клеток); химические способы трансфекции (такие как совместное осаждение фосфатом Са2+ и липофекция); вирусная доставка (как, например, с помощью аденовируса, аденоассоциированного вируса (AAV), лентивируса и вируса простого герпеса) и физические способы трансфекции (такие как микроинъекция и баллистическая трансфекция (применение частиц золота, покрытых ДНК)). Все их можно применять для доставки системы CRISPR-Cas9, но липофекция или вирусные способы, в особенности с применением AAV или лентивируса, являются предпочтительными.
Модели
Представлены модели с нокдауном одного или нескольких генов. Примером может быть модель синдрома Ретта с нокдауном по Меср2 на грызунах. В других моделях предусмотрены нокдауны генов семейства Dmnt, в частности, нокдауны Dmnt1, 3а и 3b. В силу этого представлены модели, в которых изучают неврологические состояния. Все, что должно быть сделано - это идентификация целевых генов, представляющих интерес, разработка подходящей(подходящих) направляющей(направляющих) последовательности(последовательностей) и включение их в состав подходящей системы CRISPR-Cas9, а также ее доставка в постмитотическую(постмитотические) клетку(клетки) in vivo либо ex vivo в соответствии с требованиями. Например, представлены модели, которые могут иметь измененную морфологию дендритного дерева и/или плотность шипиков.
Как упоминается выше, представлены также, модельные ткани, такие как органоиды или "печень на чипе" или их эквиваленты, отличные от печени, такие как ткани уха, почки и головного мозга, например, на чипе или закрепленные на подложке. Предпочтительными являются животные модели и модельные ткани. Они могут быть уже трансформированы с помощью Cas9, так что они содержат Cas9 в форме нуклеотида или белка, как упоминается выше. Их преимущество заключается в том, что Cas9 не нужно доставлять вместе с направляющей(направляющими) последовательностью(последовательностями), и это, в свою очередь, может обеспечивать значительно более высокую степень мультиплексирования направляющих последовательностей, которые следует поместить в векторы доставки. В этом случае применение индуцируемых или репрессируемых систем, таких как tet-on или tet-off, здесь также может быть преимущественным.
Все эти модели можно получить с применением системы CRISPR-Cas9, как описано выше. Ввиду оперативной гибкости системы CRISPR-Cas9 диапазон возможных моделей, на человеке, грызунах, млекопитающих либо иных, является весьма разнообразным, и он может быть установлен путем простого выбора соответствующей(соответствующих) направляющей(направляющих) последовательности (последовательностей). Также представлены способы создания таких моделей, которые включают следующее.
Генная терапия
Данные в примере 40 ориентированы на внесение изменений в гены, главным образом на нокдаун. Нокдаун генов, вероятно, является лишь небольшой, хотя и важной частью общей совокупности возможных применений систем CRISPR-Cas9 в генной терапии. Как уже было показано в статье Yin and Anderson (Nature Biotech 2884, опубликованной в режиме онлайн 30 марта 2014 г.), функциональный фенотип можно восстановить после коррекции мутации недостаточности при наследственной тирозинемии I типа (HTI), в иных случаях смертельном состоянии, вызываемом мутацией фумарилацетоацетатгидролазы (FAH) (замена G на А в последнем нуклеотиде экзона 8), вызывающей пропуск экзона 8 при сплайсинге и обуславливающей образование усеченного нестабильного белка FAH, что приводит к накоплению токсичных метаболитов. Коррекция мутации А с возвращением к генотипу G дикого типа приводила к восстановлению фенотипа.
В силу этого подходы, принятые в настоящей работе, демонстрируют, что настоящее изобретение, вероятно, может применяться в генной терапии. В частности, подход с двумя векторами, подход с мечением ядер, характерные особенности доставки в головной мозг (форма инъекции, применяемые промоторы и/или вирусные векторы), а также мультиплексирование (применение нескольких направляющих последовательностей для нескольких мишеней в одном и том же либо в разных генах) можно в равной степени применять в коррелирующей генной терапии (т.е. где коррекции подвергается дефектный генотип), а также и в проиллюстрированном на примере нокдауне генов. Основным различием между коррекционной генной терапией и нокдауном генов является то, что в целях коррекции дефектного генотипа, как, например, точечной мутации (например, при муковисцидозе, смотри ссылку на Schwank et al, Cell Stem Cell 13, 653-658, 5 декабря 2013 г.), преимущественным является обеспечение наличия матрицы для репарации для стимуляции механизма HDR, а в идеальном случае также обеспечение наличия подходящей никазы Cas9.
Соответственно, векторы по настоящему изобретению предпочтительно целенаправленно воздействуют на постмитотические клетки. Если направляющая последовательность или направляющие последовательности осуществляют нацеливание на дефектный генотип, то они предпочтительно также представлены вместе с матрицей для репарации, например, ssDNA, соответствующей скорректированной последовательности (генотипу, обеспечивающему наличие функционального фенотипа). Матрицы для репарации описаны в данном документе. Cas9 можно предусматривать в том же векторе, что и направляющую последовательность или направляющие последовательности, или в другом векторе. Векторы предпочтительно являются вирусными векторами, более предпочтительно аденовирусными векторами и наиболее предпочтительно векторами на основе AAV. Доставку в клетки предпочтительно осуществляют посредством внутривенной инъекции или посредством стереотаксической инъекции в соответствующих случаях. Выбор промотора может быть важным, и предпочтительные примеры приведены в данном документе.
Представлены способы лечения генетических заболеваний или состояний, обусловленных или ассоциированных с дефектным генотипом в постмитотических клетках, включающие доставку системы CRISPR-Cas9 в соответствующую клетку. Дефектный генотип может представлять собой генотип, отличный от дикого типа. В частности, одиночные точечные мутации и/или моногенные нарушения особенно подходят для лечения с помощью систем CRISPR-Cas9. Если редактирования или коррекции требуют несколько генов, то для одновременного целенаправленного воздействия на всех них можно применять мультиплексный подход. Альтернативно, могут быть предусмотрены два или более цикла применения различных систем CRISPR-Cas9. Целью коррекции предпочтительно является получение генотипа дикого типа. Он не обязательно должен быть наиболее распространенным генотипом, при условии, что в фенотипе восстанавливается или улучшается функция.
Примером восстановленного фенотипа является восстановление слуха с восстановлением функции VGLUT3 во внутреннем ухе и, следовательно, слуха у мышей (Omar Akil, Rebecca P. Seal, Kevin Burke, Chuansong Wang, Aurash Alemi, Matthew During, Robert H. Edwards, Lawrence R. Lustig. Restoration of Hearing in the VGLUT3 Knockout Mouse Using Virally Mediated Gene Therapy. Neuron, 2012; 75(2): 283 DOI: 10.1016/j.neuron.2012.05.019). Его осуществляли с помощью опосредованной AAV доставки самого VGLUT3, но вполне вероятно, что также можно было применять систему CRISPR-Cas9, предпочтительно также с помощью векторов на основе AAV, для целенаправленного воздействия в клетках внутреннего уха и коррекции нефункционального генотипа VGLUT3 с аналогичными фенотипическими последствиями, а именно восстановлением слуха. В силу этого предпочтительной является доставка системы CRISPR-Cas9 во внутреннее ухо, предпочтительно с помощью векторов на основе AAV с лечением таким образом потери слуха. В связи с этим можно заметить, что восстановление функций генов в органах чувств, таких как глаз, в том числе сетчатка, нос и ухо (в частности, внутреннее ухо), является предпочтительным.
Сравнительно недавний обзор, включающий обсуждение нарушений в постмитотических тканях (в глазу, ухе и за их пределами), представлен Kaufmann и соавт.(EMBO Mol Med (2013, 5, р. 1642-1661). Он подтверждает применимость AAV в коррекции моногенных нарушений в постмитотических тканях. В нем отмечено, что "в сочетании с другими характеристиками, такими как низкая воспалительная активность, они продемонстрировали, что обладают превосходным профилем безопасности и поэтому являются весьма привлекательными инструментами для генной терапии in vivo. Так, Glybera® является рекомбинантным AAV для прямой внутримышечной инъекции …" В данной статье вместе с цитируемыми документами рассматривается генная терапия в сетчатке, центральной нервной системе, печени, скелетной и сердечной мускулатуре в качестве целевых тканей. Также в ней вместе с цитируемыми документами указано, что "в начальных исследованиях использовали вектор-прототип на основе AAV серотипа 2, ассортимент векторов на основе AAV недавно был расширен с включением дополнительных серотипов и даже сконструированных капсидов". Статья Kaufmann и документы, цитируемые в статье Kaufmann, настоящим включены в данный документ с помощью ссылки.
Анализ транскриптома путем секвенирования РНК
Комбинация опосредованного SpCas9 внесения изменений в геном и анализ путем секвенирования РНК на популяционном уровне дает возможность охарактеризовать регуляцию транскрипции и предположить, какие гены могут быть важными для конкретных функций или болезненных процессов в рассматриваемых клетках. В частности, клетки являются клетками головного мозга, в частности, нейронами. Быстродействующие методики, такие как применение системы CRISPR-Cas9, являются преимущественными в исследовании транскриптома, который по своей природе является изменчивым. В силу этого представлено применение систем CRISPR-Cas9 согласно настоящему изобретению в анализе транскриптома (секвенировании РНК).
Способ мечения ядер
Для облегчения иммунофлуоресцентной идентификации нейронов, экспрессирующих SpCas9, авторы настоящего изобретения метили SpCas9 эпитопной НА-меткой (полученной из гемагглютинина вируса гриппа человека, обычной эпитопной меткой, широко применяемой в векторах экспрессии).
Авторы настоящего изобретения упаковывали в вектор AAV-Sp-направляющая последовательность кассету экспрессии U6-sgRNA, а также зеленый флуоресцентный белок (GFP), слитый с ядерным трансмембранным доменом KASH, под управлением промотора гена синапсина I человека. Белок слияния GFP-KASH направляет GFP во внешнюю ядерную мембрану и обеспечивает флуоресцентную идентификацию и очистку интактных ядер нейронов, трансдуцированных AAV-SpGuide.
Соответственно, векторы по настоящему изобретению предпочтительно приспосабливают аналогичным образом. Таким образом, представлены векторы, где Cas9 помечен эпитопной меткой, такой как эпитопная НА-метка. Cas9 может представлять собой любой Cas9, описанный в данном документе, например, Sp или SaCas9, и может представлять собой любой вариант (такой как двойная никаза D10A и т.д.), при условии, что он помечен или может быть помечен соответствующим образом.
Векторы по настоящему изобретению могут также быть адаптированы так, чтобы направляющая РНК была упакована в кассету экспрессии, которая содержит:
репортерный белок и
необязательно подходящий промотор для направляющей РНК, такой как U6;
где репортерный белок слит с ядерным трансмембранным доменом, функционально связанным с подходящим для него промотором.
Репортерный белок предпочтительно представляет собой флуоресцентный белок, например, один из зеленого, красного или желтого флуоресцентных белков (GFP, RFP, YFP) и т.д.
Примеры ядерных трансмембранных доменов включают KASH-подобные домены, домены Sun2, домены LEM. В некоторых предпочтительных вариантах осуществления ядерный трансмембранный домен представляет собой ядерный трансмембранный домен KASH. Промотор для трансмембранного домена предпочтительно представляет собой промотор гена синапсина I человека; смотри также документы, цитируемые в данном документе.
Данный подход с мечением можно применять в рамках одновекторных или двухвекторньгх систем, но предпочтительно в рамках двухвекторных систем, поскольку в одновекторных системах пространство ограничено, и необходимость в отдельных метках также снижается.
Дополнительно, каждый аспект данной методики мечения можно применять независимо от другого, так что эпитопное мечение Cas9 можно применять в отдельности, или подход с кассетой с репортерным/флуоресцентным белком можно применять в отдельности, или, более предпочтительно, оба их можно применять вместе.
Публикация Kanasty and Anderson (Nature Materials, Vol 12 Nov 2013), изначально поданная 11 марта 2013 г. и опубликованная в режиме онлайн 23 октября 2013 г., является полезным обзором доставки средств для RNAi. Ввиду сходств между средствами для RNAi и направляющими последовательностями CRISPR идеи этого и других источников из уровня техники в отношении RNAi являются информативными относительно механизмов доставки направляющих последовательностей в системе CRISPR-Cas9 авторов настоящего изобретения. Некоторые из описанных методик также подходят для доставки Cas9. В некоторых случаях может быть целесообразной доставка направляющих последовательностей системы CRISPR-Cas9 авторов настоящего изобретения отдельно от Cas9. Она может быть частью двухвекторной системы доставки, где векторы рассматриваются в самом широком смысле попросту как любые средства доставки, а не как конкретные вирусные векторы. Предусмотрено, что Cas9 можно доставлять с помощью вирусного вектора, и что направляющие последовательности, специфичные к геномным мишеням, доставляют отдельно. Как обсуждается в данном документе, направляющие последовательности можно доставлять с помощью тех же типов векторов, что и в случае Cas9, например, с использованием двухвекторной системы, где Cas9 доставляют в векторе на основе AAV, а направляющую(направляющие) последовательность(последовательности) доставляют в отдельном векторе на основе AAV. Это можно осуществлять практически одновременно (т.е. путем совместной доставки), но это также можно осуществлять в разные моменты времени, разделенные даже несколькими неделями или месяцами. Например, если были доставлены системы CRISPR-Cas9 для первого цикла, но затем впоследствии требуется обеспечение наличия дополнительных направляющих последовательностей, то первоначальный Cas9, который, как следует надеяться, по-прежнему является функциональным в целевых клетках, можно использовать повторно. Если Cas9 находится под контролем индуцируемого промотора, то предпочтительной является индукция транскрипции нового Cas9 в целевых клетках. В то же время, если применяется модель, экспрессирующая Cas9, представленная в данном документе, то необходимой является только доставка направляющей(направляющих) последовательности (последовательностей). Соответственно, если требуется доставка направляющей(направляющих) последовательности (последовательностей) отдельно от Cas9, то их можно доставлять практически таким же образом, как и средство для RNAi. В силу этого обзор Kanasty является полезным в том, что указывает на ряд известных подходов, являющихся подходящими, сосредотачивая особое внимание на печени, хотя средства доставки, как правило, пригодны для широкого диапазона клеток. Примеры включают следующее:
"липосомную систему доставки, а также siRNA, конъюгированные с липофильными молекулами, которые взаимодействуют с сывороточными липопротеинами и впоследствии проникают в гепатоциты, поглощающие эти липопротеины";
пегилирование;
конъюгаты, такие как:
динамические поликонъюгаты (DPC, наночастицы размером 10 нм), которые, как было показано, доставляют средства для RNAi с успешным подавлением экспрессии АроВ (что таким образом пересекается с работой авторов настоящего изобретения по целенаправленному воздействию на АроВ с помощью системы CRISPR-Cas9); и
трехантенные конъюгаты GalNAc
являются "высокоэффективными в обеих категориях", в особенности GalNAc;
другие наночастицы включают:
полимерные наночастицы на основе циклодекстрина (CDP), включающие дополнительные компоненты состава, такие как адамантин-PEG (AD-PEG) и адамантин-PEG-трансферрин (AD-PEG-Tf);
липидные наночастицы (LNP), включающие катионные или ионизируемые липиды, экранирующие липиды, холестерин и эндогенные или экзогенные нацеливающие лиганды. Примером эндогенного нацеливающего лиганда является ретинол-связывающий белок (RBP), применимый для нацеливания на звездчатые клетки печени и поджелудочной железы, которые экспрессируют рецептор RBP. Примером экзогенного нацеливающего лиганда является GalNac, который также осуществляет нацеливание на печень посредством асиалогликопротеинового рецептора на поверхности гепатоцитов. В случае ALN-VSP от Anlylams представлен комбинированный подход;
"фенестрация эндотелия печени позволяет молекулам диаметром 100-200 нм диффундировать из кровотока и получать доступ к гепатоцитам и другим клеткам печени";
лиганды, такие как GalNAc, подходят для доставки в непаренхимные клетки печени, экспрессирующие маннозный рецептор, и в гепатоциты, где было показано, что конъюгация подходящей siRNA с лигандом GalNAc обеспечивает успешное подавление экспрессии PCSK9; и
олигонуклеотидные наночастицы (ONP), состоящие из комплементарных фрагментов ДНК, предназначенных для гибридизации в предварительно определенную 3D-структуру. С помощью подходящих последовательностей с "липкими" 3'-концами к каждой частице могут быть прикреплены, и даже в определенном положении, 6 нитей siRNA. Гидродинамический диаметр составлял приблизительно 29 нм.
Эти подходы в некоторых вариантах осуществления являются предпочтительными для доставки по меньшей мере направляющих последовательностей системы CRISPR-Cas9. Особенно предпочтительными являются динамические поликонъюгаты или применение эндогенных нацеливающих лигандов, таких как ретинол-связывающий белок, или экзогенных нацеливающих лигандов, таких как GalNac.
Системы доставки и/или составы на основе частиц
Известно, что несколько типов систем доставки и/или составов на основе частиц являются применимыми в разнообразном спектре биомедицинских применений. Частицу обычно определяют как небольшой объект, ведущий себя как целая единица в том, что касается ее транспорта и свойств. Частицы дополнительно классифицируют по диаметру. Крупные частицы охватывают диапазон от 2500 до 10000 нанометров. Тонкодисперсные частицы имеют размер от 100 до 2500 нанометров. Ультрадисперсные частицы, или наночастицы, как правило, имеют размер от 1 до 100 нанометров. Основанием для предела в 100 нм является тот факт, что новые свойства, отличающие частицы от насыпного материала, обычно проявляются в критическом линейном масштабе менее 100 нм.
Как используется в данном документе, систему доставки и/или состав на основе частиц определяют как любые биологические систему доставки/состав, содержащие частицы в соответствии с настоящим изобретением. Частица в соответствии с настоящим изобретением представляет собой любой объект, имеющий наибольшую размерность (например, диаметр) менее 100 микрон (мкм). В некоторых вариантах осуществления частицы по настоящему изобретению имеют наибольшую размерность менее 10 мкм. В некоторых вариантах осуществления частицы по настоящему изобретению имеют наибольшую размерность менее 2000 нанометров (нм). В некоторых вариантах осуществления частицы по настоящему изобретению имеют наибольшую размерность менее 1000 нанометров (нм). В некоторых вариантах осуществления частицы по настоящему изобретению имеют наибольшую размерность менее 900 нм, 800 нм, 700 нм, 600 нм, 500 нм, 400 нм, 300 нм, 200 нм или 100 нм. Частицы по настоящему изобретению обычно имеют наибольшую размерность (например, диаметр) 500 нм или менее. В некоторых вариантах осуществления частицы по настоящему изобретению имеют наибольшую размерность (например, диаметр) 250 нм или менее. В некоторых вариантах осуществления частицы по настоящему изобретению имеют наибольшую размерность (например, диаметр) 200 нм или менее. В некоторых вариантах осуществления частицы по настоящему изобретению имеют наибольшую размерность (например, диаметр) 150 нм или менее. В некоторых вариантах осуществления частицы по настоящему изобретению имеют наибольшую размерность (например, диаметр) 100 нм или менее. В некоторых вариантах осуществления настоящего изобретения применяют меньшие частицы, например, имеющие наибольшую размерность 50 нм или менее. В некоторых вариантах осуществления частицы по настоящему изобретению имеют наибольшую размерность, варьирующую в диапазоне от 25 нм до 200 нм.
Получение характеристик частиц (в том числе, например, получение характеристик морфологии, размеров и т.д.) осуществляют с применением ряда различных методик. Стандартными методиками являются электронная микроскопия (ТЕМ, SEM), атомно-силовая микроскопия (AFM), динамическое рассеяние света (DLS), рентгеновская фотоэлектронная спектроскопия (XPS), порошковая рентгеновская дифракция (XRD), инфракрасная спектроскопия с преобразованием Фурье (FTIR), времяпролетная масс-спектрометрия с лазерной десорбцией/ионизацией из матрицы (MALDI-TOF), спектроскопия в ультрафиолетовой и видимой области спектра, двойная поляризационная интерферометрия и ядерный магнитный резонанс (NMR). Получение характеристик (измерения размеров) можно проводить в отношении нативных частиц (т.е. до загрузки) или после загрузки молекулы-карго (в данном документе молекула-карго относится, например, к одному или нескольким компонентам системы CRISPR-Cas, например, ферменту или мРНК CRISPR, или направляющей РНК, или к любой их комбинации, и может включать дополнительные компоненты, носители и/или наполнители) для получения частиц, имеющих оптимальный размер для доставки, для любого применения настоящего изобретения in vitro, ex vivo и/или in vivo. В определенных предпочтительных вариантах осуществления получение характеристик размеров частиц (например, диаметра) основано на измерениях с применением динамического рассеяния лазерного излучения (DLS). Упоминаются патент США №8709843; патент США №6007845; патент США №5855913; патент США №5985309; патент США №5543158 и публикация James Е. Dahlman and Carmen Barnes et al. Nature Nanotechnology (2014), опубликованная онлайн 11 мая 2014 г., doi:10.1038/nnano.2014.84, которая относится к частицам, способам их получения и применения и их измерениям.
Системы доставки на основе частиц в пределах объема настоящего изобретения могут быть представлены в любой форме, в том числе, без ограничения, в форме твердых, полутвердых, эмульгированных или коллоидных частиц. В силу этого любые системы доставки, описанные в данном документе, в том числе, без ограничения, например, липидные системы, липосомы, мицеллы, микропузырьки, экзосомы или генная пушка, могут быть представлены в качестве систем доставки на основе частиц в пределах объема настоящего изобретения.
Наночастицы
Что касается данного изобретения, предпочтительно иметь один или несколько компонентов комплекса CRISPR, например, фермент или мРНК CRISPR или направляющую РНК, доставленные с помощью наночастиц или липидных оболочек. Вместе с аспектами наночастиц по настоящему изобретению можно применять другие системы доставки или векторы.
"Наночастица" обычно относится к любой частице, имеющей диаметр менее 1000 нм. В определенных предпочтительных вариантах осуществления наночастицы по настоящему изобретению имеют наибольшее измерение (например, диаметр) 500 нм или менее. В других предпочтительных вариантах осуществления наночастицы по настоящему изобретению имеют наибольшее измерение, варьирующее в диапазоне от 25 нм до 200 нм. В других предпочтительных вариантах осуществления наночастицы по настоящему изобретению имеют наибольшее измерение 100 нм или менее. В других предпочтительных вариантах осуществления наночастицы по настоящему изобретению имеют наибольшую размерность, варьирующую в диапазоне от 35 нм до 60 нм.
Наночастицы, охватываемые настоящим изобретением, могут быть представлены в различных формах, например, в виде твердых наночастиц (например, металла, такого как серебро, золото, железо, титан, неметалла, липидных твердых веществ, полимеров), суспензий наночастиц или их комбинаций. Могут быть получены наночастицы металла, диэлектрика и полупроводника, а также гибридные структуры (например, наночастицы типа ядро/оболочка). Наночастицы, изготовленные из полупроводникового материала, также могут являться метящими квантовыми точками, если они достаточно малы (как правило, менее 10 нм), чтобы происходило квантование уровней энергии электронов. Такие наноразмерные частицы используются в биомедицинских применениях в качестве носителей лекарственных средств или визуализирующих средств и могут быть приспособлены для аналогичных целей в настоящем изобретении.
Были получены полутвердые и мягкие наночастицы, и они находятся в пределах объема настоящего изобретения. Наночастицей-прототипом полутвердой природы является липосома. Различные типы наночастиц-липосом в настоящее время применяют в клинической практике в качестве систем доставки противораковых лекарственных средств и вакцин. Наночастицы, одна полусфера которых является гидрофильной, а другая полусфера - гидрофобной, называются частицами Януса и являются особенно эффективными в стабилизации эмульсий. Они способны к самосборке на поверхностях раздела вода/масло и действовать в качестве твердых поверхностно-активных веществ.
В патенте США №8709843, включенном в данный документ посредством ссылки, представлена система доставки лекарственных средств для целенаправленной доставки частиц, содержащих терапевтическое средство, в ткани, клетки и внутриклеточные компартменты. Настоящее изобретение предусматривает нацеливающие частицы, содержащие полимер, конъюгированный с поверхностно-активным веществом, гидрофильным полимером или липидом.
В патенте США №6007845, включенном в данный документ с помощью ссылки, представлены частицы, имеющие сердцевину из мультиблочного сополимера, образованного ковалентными связями соединения с несколькими функциональными группами с одним или несколькими гидрофобными полимерами и одним или несколькими гидрофильными полимерами, и содержащие биологически активный материал.
В патенте США №5855913, включенном в данный документ с помощью ссылки, представлена композиция в форме частиц, содержащая аэродинамически легкие частицы, имеющие плотность после утряски менее 0,4 г/см3 и средний диаметр от 5 мкм до 30 мкм, содержащие поверхностно-активное вещество на их поверхности, для доставки лекарственных средств в легочную систему.
В патенте США №5985309, включенном в данный документ с помощью ссылки, представлены частицы, содержащие поверхностно-активное вещество и/или гидрофильный или гидрофобный комплекс положительно или отрицательно заряженного терапевтического или диагностического средства и заряженной молекулы, имеющей противоположный заряд, для доставки в легочную систему.
В патенте США №5543158, включенном в данный документ с помощью ссылки, представлены биоразлагаемые инъекционные наночастицы, имеющие биоразлагаемую твердую сердцевину, содержащую биологически активный материал, и поли(алкиленгликолевые) фрагменты на поверхности.
В WO 2012135025 (также опубликованном как US 20120251560), включенном в данный документ с помощью ссылки, описаны конъюгированные полимеры на основе полиэтиленимина (PEI) и конъюгированные азамакроциклы (совместно именуемые "конъюгированным липополимером" или "липополимерами"). В определенных вариантах осуществления может быть предусмотрено, что такие конъюгированные липополимеры можно применять в случае с системой CRISPR-Cas для осуществления внесения изменений в геном in vitro, ex vivo и in vivo с модификацией экспрессии гена, включающей модулирование экспрессии белка.
В одном варианте осуществления наночастица может представлять собой гибрид липида, модифицированного эпоксидными группами, и полимера, преимущественно 7С1 (см., например, James Е. Dahlman and Carmen Barnes et al. Nature Nanotechnology (2014), опубликовано онлайн 11 мая 2014 г., doi:10.1038/nnano.2014.84). С71 синтезировали путем осуществления реакции липидов С15 с концевыми эпоксидными группами с PEI600 в молярном соотношении 14:1 и составляли с C14PEG2000 с получением наночастиц (диаметром от 35 до 60 нм), которые были стабильными в растворе PBS в течение по меньшей мере 40 дней.
Гибрид липида, модифицированного эпоксидными группами, и полимера можно использовать для доставки системы CRISPR-Cas по настоящему изобретению в клетки легких, сердечно-сосудистой системы или почек, однако, специалист в данной области может приспособить систему для доставки в другие целевые органы. Предусмотрена доза, варьирующая в диапазоне от приблизительно 0,05 до приблизительно 0,6 мг/кг. Также предусмотрен прием доз в течение нескольких дней или недель, при этом общая доза составляет приблизительно 2 мг/кг.
Преимущество способов по настоящему изобретению заключается в том, что система CRISPR избегает нецелевого связывания и возникающих в результате этого побочных эффектов. Это достигается при применении систем, предусматривающих наличие высокой степени специфичности к последовательности в отношении целевой ДНК.
Cas9
Оптимизацию Cas9 можно применять для улучшения функционирования или для формирования новых функций, можно создавать химерные белки Cas9. Созданные заявителями образцы представлены в примере 6. Химерные белки Cas9 можно получать путем объединения фрагментов от различных гомологов Cas9. Например, в данном документе описаны два иллюстративных химерных белка Cas9 из Cas9. Например, заявители слили N-конец St1Cas9 (фрагмент из этого белка выделен жирным шрифтом) с С-концом SpCas9. Выгода от создания химерных Cas9 включает любое или все из следующего: пониженная токсичность; улучшенная экспрессия в эукариотических клетках; повышенная специфичность; сниженный молекулярный вес белка, например, при получении меньшего белка за счет объединения наименьших доменов от различных гомологов Cas9; и/или изменение требований к последовательности РАМ.
Cas9 можно использовать в качестве стандартного ДНК-связывающего белка. Например, как показано в примере 7, заявители использовали Cas9 в качестве стандартного ДНК-связывающего белка путем внесения мутации в два каталитических домена (D10 и Н840), ответственных за расщепление обеих нитей ДНК-мишени. С целью повышающей регуляции транскрипции гена в целевом локусе заявители слили домен активации транскрипции (VP64) с Cas9. Известны и другие домены активации транскрипции. Как показано в примере 17, активация транскрипции является возможной. Как также показано в примере 17, репрессия генов (в этом случае гена бета-катенина) возможна при использовании репрессора Cas9 (ДНК-связывающего домена), который связывается с последовательностью целевого гена, тем самым подавляя ее активность.
Cas9 и одну или несколько направляющих РНК можно доставлять при помощи аденоассоциированного вируса (AAV), лентивируса, аденовируса или других типов плазмидных или вирусных векторов, в частности, с применением составов и доз, например, из патентов США №№8454972 (составы, дозы для аденовируса), 8404658 (составы, дозы для AAV) и 5846946 (составы, дозы для ДНК-плазмид) и из клинических испытаний и публикаций относительно клинических испытаний, предусматривающих использование лентивируса, AAV и аденовируса. Например, для AAV путь введения, состав и доза могут быть определены в патенте США №8454972 и в клинических испытаниях с участием AAV. Для аденовируса путь введения, состав и доза могут быть определены в патенте США №8404658 и в клинических испытаниях с участием аденовируса. Для доставки с помощью плазмид путь введения, состав и доза могут быть такими, как определено в патенте США №5846946 и в клинических испытаниях с участием плазмид. Дозы могут быть определены в расчете на или экстраполированы на среднего индивидуума массой 70 кг и могут быть скорректированы для пациентов, субъектов, млекопитающих с другой массой и из другого вида. Частота введения входит в пределы компетенции практикующего врача или ветеринара (например, доктора, ветеринарного врача) и зависит от обычных факторов, в том числе от возраста, пола, общего состояния здоровья, других состояний пациента или субъекта и конкретных рассматриваемых состояния или симптомов.
Вирусные векторы можно инъецировать в представляющую интерес ткань. В случае модификации генома, специфической относительно типа клетки, экспрессия Cas9 может управляться промотором, специфическим относительно типа клетки. Например, при печеночно-специфической экспрессии может использоваться промотор гена альбумина, а при нейрон-специфической экспрессии может использоваться промотор гена синапсина I.
Трансгенные животные
Также представлены трансгенные животные (модели), и следующее в равной степени относится к модельным тканям и совокупностям тканей ex vivo, таким как органоиды, печень на чипе и т.д. Предпочтительные примеры включают животных, содержащих Cas9, имея при этом в виду полинуклеотиды, кодирующие Cas9, или белок сам по себе. Предпочтительными являются мыши, крысы и кролики. Для получения трансгенных мышей с конструкциями в соответствии с примерами в данном документе можно инъецировать чистую линейную ДНК в пронуклеус зиготы от псевдобеременной самки, например, самки СВ56. Особей-основателей можно затем идентифицировать, генотипировать и подвергать обратному скрещиванию с мышами СВ57. Конструкции можно затем клонировать и необязательно проверять, например, посредством секвенирования по Сэнгеру. Предусматриваются нокауты, где, например, один или несколько генов в модели подвергают нокауту. Однако, также предусматриваются нокины (в отдельности или в комбинации). Были получены иллюстративные мыши с нокином по Cas9, и это представлено на примере, однако, нокины Cas9 являются предпочтительными. Для создания нокина Cas9 можно целенаправленно воздействовать теми же конструкциями для конститутивной и условной экспрессии на локус Rosa26, что описаны в данном документе (фиг. 25А-В и 26). Способы из публикаций заявок на патенты США №№20120017290 и 20110265198, закрепленных за Sangamo Biosciences, Inc., относящиеся к целенаправленному воздействию на локус Rosa, можно модифицировать для использования системы CRISPR-Cas по настоящему изобретению. В другом варианте осуществления способы из публикации заявки на патент США №20130236946, закрепленной за Cellectis, относящиеся к целенаправленному воздействию на локус Rosa, можно также модифицировать для использования системы CRISPR-Cas по настоящему изобретению.
Полезность мышей с условной экспрессией Cas9. Заявители показали на клетках 293, что конструкция для условной экспрессии Cas9 может активироваться при совместной экспрессии с Cre. Заявители также показали, что подвергшиеся точному целенаправленному воздействию mESC R1 могут иметь активный Cas9, когда Cre экспрессируется. Поскольку за Cas9 следует последовательность расщепления пептида Р2А, а затем EGFP, заявители идентифицировали успешную экспрессию путем наблюдения EGFP. Заявители показали активацию Cas9 в mESC. Эта же идея делает использование мышей с экспрессией Cas9 при определенных условиях столь полезным. Заявители могут скрещивать свою мышь с экспрессией Cas9 при определенных условиях с мышью, у которой повсеместно экспрессируется Cre (линия АСТВ-Cre), и могут получать мышь, которая экспрессирует Cas9 в каждой клетке. Для этого потребуется только доставка химерной РНК для индукции редактирования генома у мышиных эмбрионов или взрослых мышей. Что интересно, если мышь с экспрессией Cas9 при определенных условиях скрестить с мышью, экспрессирующей Cre под контролем тканеспецифического промотора, Cas9 будет лишь в тканях, в которых также экспрессируется Cre. Этот подход можно применять для редактирования генома только в определенных тканях путем доставки химерной РНК в ту же ткань.
Как указано выше, трансгенные животные также представлены. В этом отношении предпочтительными являются трансгенные животные, в особенности млекопитающие, такие как крупный рогатый скот (коровы, овцы, козы и свиньи), но также домашняя птица и съедобные насекомые.
Аденоассоциированный вирус (AAV)
Что касается доставки in vivo, то AAV является преимущественным по сравнению с другими вирусными векторами по двум причинам:
низкая токсичность (она может быть обусловлена способом очистки, не требующим ультрацентрифугирования клеточных частиц, которые могут активировать иммунный ответ);
низкая вероятность вызывания инсерционного мутагенеза, поскольку он не интегрируется в геном хозяина.
AAV имеет предел упаковки, составляющий 4,5 или 4,75 т.п.о. Это означает, что все из Cas9, а также промотора и терминатора транскрипции должны вместиться в один вирусный вектор. Конструкции, размер которых превышает 4,5 или 4,75 т.п.о., будут обуславливать значительное снижение продуцирования вируса. SpCas9 является довольно большим, размер гена самого по себе превышает 4,1 т.п.о., что осложняет его упаковку в AAV. Следовательно, варианты осуществления настоящего изобретения включают использование более коротких гомологов Cas9. Например:

Эти виды, таким образом, в целом являются предпочтительными видами для получения Cas9. Заявители показали данные о доставке и in vivo экспрессии Cas9 в головном мозге мышей.
Предпочтительными являются два способа упаковки молекул нуклеиновых кислот, кодирующих Cas9, например, ДНК, в вирусные векторы для опосредования модификации генома in vivo.
Для обеспечения опосредованного NHEJ нокаута гена.
Один вирусный вектор:
вектор, содержащий две или более кассеты экспрессии:
промотор-молекула нуклеиновой кислоты, кодирующая Cas9-терминатор;
промотор-gRNA1-терминатор;
промотор-gRNA2-терминатор;
промотор-gRNA(N)-терминатор (до предельного размера вектора).
Два вирусных вектора:
вектор 1, содержащий одну кассету экспрессии для управления экспрессией Cas9:
промотор-молекула нуклеиновой кислоты, кодирующая Cas9-терминатор;
вектор 2, содержащий одну или несколько кассет экспрессии для управления экспрессией одной или нескольких направляющих РНК:
промотор-gRNA1-терминатор;
промотор-gRNA(N)-терминатор (до предельного размера вектора).
Для опосредования репарации с участием гомологичной рекомбинации. В дополнение к подходам с одним и двумя вирусными векторами, описанными выше, используют дополнительный вектор для доставки матрицы для репарации с участием гомологичной рекомбинации.
Промотор, используемый для управления экспрессией молекулы нуклеиновой кислоты, кодирующей Cas9, может включать следующее.
ITR AAV может служить в качестве промотора: это является преимущественным для устранения необходимости в дополнительном промоторном элементе (который может занимать пространство в векторе). Освободившееся дополнительное пространство можно задействовать для управления экспрессией дополнительных элементов (gRNA и т.д.). Также активность ITR является относительно более слабой, поэтому ее можно использовать для снижения токсичности, обусловленной сверхэкспрессией Cas9.
Для повсеместной экспрессии можно использовать следующие промоторы: CMV, CAG, CBh, PGK, SV40, генов тяжелой или легкой цепей ферритина и т.д.
Для экспрессии в головном мозге можно использовать следующие промоторы: гена синапсина I для всех нейронов, гена CaMKII-альфа для возбуждающих нейронов, GAD67, или GAD65, или VGAT для GABA-эргических нейронов и т.д.
Для экспрессии в печени можно использовать промотор гена альбумина.
Для экспрессии в легких можно использовать SP-B.
Для эндотелиальных клеток можно использовать ICAM.
Для гемопоэтических клеток можно использовать промотор гена IFN-бета или CD45.
Для остеобластов можно использовать OG-2.
Промотор, используемый для управления направляющей РНК, может включать следующее.
Промоторы для Pol III, такие как U6 или H1
Использование промотора для Pol II и интронных кассет для экспрессии gRNA.
Что касается AAV, AAV может представлять собой AAV1, AAV2, AAV5 или любую их комбинацию. Можно выбрать AAV из AAV с учетом клеток, подлежащих целенаправленному воздействию, например, можно выбрать AAV серотипов 1, 2, 5, или гибридный капсид AAV1, AAV2, AAV5, или любую их комбинацию для целенаправленного воздействия в головном мозге или нервных клетках; и можно выбрать AAV4 для целенаправленного воздействия в сердечной ткани. AAV8 применим для доставки в печень. Вышеуказанные промоторы и векторы являются предпочтительными по отдельности.
Доставка РНК также является применимым способом доставки in vivo. На фигуре 27 показаны данные о доставке и экспрессии Cas9 в головном мозге мышей in vivo. Возможно доставлять Cas9 и gRNA (и, например, матрицу для HR-репарации) в клетки посредством липосом или наночастиц. Таким образом, доставка фермента CRISPR, такого как Cas9, и/или доставка РНК по настоящему изобретению может осуществляться в форме РНК и посредством микропузырьков, липосом или наночастиц. Например, мРНК Cas9 и gRNA могут быть упакованы в липосомные частицы для доставки in vivo. Реагенты для липосомной трансфекции, такие как Lipofectamine от Life Technologies, и другие реагенты, имеющиеся в продаже, могут эффективно доставлять молекулы РНК в печень.
Повышение эффективности NHEJ или HR также способствует доставке. Предпочтительно, чтобы эффективность NHEJ повышали посредством совместной экспрессии ферментов для обработки концов, таких как Trex2 (Dumitrache et al. Genetics. 2011 August; 188(4): 787-797). Предпочтительно, чтобы эффективность HR повышалась путем транзиентного ингибирования компонентов механизма NHEJ, таких как Ku70 и Ku86. Эффективность HR также можно повысить путем совместной экспрессии прокариотических или эукариотических ферментов гомологичной рекомбинации, таких как RecBCD, RecA.
Различные средства доставки описаны в данном документе и дополнительно обсуждаются в данном разделе.
Вирусная доставка: фермент CRISPR, например, Cas9, и/или любую из РНК по настоящему изобретению, например, направляющую РНК, можно доставлять с помощью аденоассоциированного вируса (AAV), лентивируса, аденовируса или других типов вирусных векторов или их комбинаций. Cas9 и одну или несколько направляющих РНК можно упаковать в один или несколько вирусных векторов. В некоторых вариантах осуществления вирусный вектор доставляют в представляющую интерес ткань посредством, например, внутримышечной инъекции, тогда как в других случаях вирусная доставка осуществляется посредством внутривенного, трансдермального, интраназального, перорального, трансмукозального или других способов доставки. Такая доставка может осуществляться в виде однократной дозы или многократных доз. Специалист в данной области понимает, что фактическая доза, подлежащая доставке, в данном документе может в значительной степени варьировать в зависимости от ряда факторов, таких как выбранный вектор, целевые клетка, организм или ткань, общее состояние субъекта, подлежащего лечению, степень желаемой трансформации/модификации, путь введения, способ введения, тип желаемой трансформации/модификации и т.п.
Такая доза может дополнительно содержать, например, носитель (воду, солевой раствор, этанол, глицерин, лактозу, сахарозу, фосфат кальция, желатин, декстран, агар, пектин, арахисовое масло, кунжутное масло и т.д.), разбавитель, фармацевтически приемлемый носитель (например, фосфатно-солевой буфер), фармацевтически приемлемый наполнитель и/или другие соединения, известные из уровня техники. Такой дозированный состав может без труда определить специалист в данной области. Доза может дополнительно содержать одну или несколько фармацевтически приемлемых солей, таких как, например, соль неорганической кислоты, такая как гидрохлорид, гидробромид, фосфат, сульфат и т.д.; и соли органических кислот, такие как ацетаты, пропионаты, малонаты, бензоаты и. т.д. Дополнительно, в данном документе также могут присутствовать вспомогательные вещества, такие как смачиватели или эмульгаторы, буферные вещества, поддерживающие рН, гели или гелеобразующие материалы, ароматизаторы, красители, микросферы, полимеры, суспендирующие средства и т.д. В дополнение, также могут присутствовать один или несколько других традиционных фармацевтических ингредиентов, таких как консерванты, увлажнители, суспендирующие средства, поверхностно-активные вещества, антиоксиданты, средства, предотвращающие слеживание, наполнители, хелатообразователи, покрывающие средства, химические стабилизаторы и т.д., особенно если лекарственная форма представляет собой растворимую форму. Подходящие иллюстративные ингредиенты включают микрокристаллическую целлюлозу, натрий-карбоксиметилцеллюлозу, полисорбат 80, фенилэтиловый спирт, хлорбутанол, сорбат калия, сорбиновую кислоту, диоксид серы, пропилгаллат, парабены, этилванилин, глицерин, фенол, парахлорфенол, желатин, альбумин и их комбинацию. Подробное обсуждение фармацевтически приемлемых наполнителей доступно в REMINGTON'S PHARMACEUTICAL SCIENCES (Mack Pub. Co., N.J. 1991), включенном в данный документ посредством ссылки.
В варианте осуществления в данном документе доставку осуществляют посредством аденовируса, который может находиться в однократной бустерной дозе, содержащей по меньшей мере 1×105 частиц (также называемых единичными частицами, pu) аденовирусного вектора. В варианте осуществления в данном документе доза предпочтительно составляет по меньшей мере приблизительно 1×106 частиц (например, приблизительно 1×106-1×1012 частиц), более предпочтительно по меньшей мере приблизительно 1×107 частиц, более предпочтительно по меньшей мере приблизительно 1×108 частиц (например, приблизительно 1×108-1×1011 частиц или приблизительно 1×108-1×1012 частиц) и наиболее предпочтительно по меньшей мере приблизительно 1×100 частиц (например, приблизительно 1×109-1×1010 частиц или приблизительно 1×109-1×1012 частиц) или даже по меньшей мере приблизительно 1×1010 частиц (например, приблизительно 1×1010-1×1012 частиц) аденовирусного вектора. Альтернативно, доза содержит не более приблизительно 1×1014 частиц, предпочтительно не более приблизительно 1×1013 частиц, еще более предпочтительно не более приблизительно 1×1012 частиц, еще более предпочтительно не более приблизительно 1×1011 частиц и наиболее предпочтительно не более приблизительно 1×1010 частиц (например, не более приблизительно 1×109 частиц). Таким образом, доза может включать в себя однократную дозу аденовирусного вектора с, например, приблизительно 1×106 единичных частиц (pu), приблизительно 2×106 pu, приблизительно 4×106 pu, приблизительно 1×107 pu, приблизительно 2×107 pu, приблизительно 4×107 pu, приблизительно 1×108 pu, приблизительно 2×108 pu, приблизительно 4×108 pu, приблизительно 1×109 pu, приблизительно 2×109 pu, приблизительно 4×109 pu, приблизительно 1×1010 pu, приблизительно 2×1010 pu, приблизительно 4×1010 pu, приблизительно 1×1011 pu, приблизительно 2×1011 pu, приблизительно 4×1011 pu, приблизительно 1×1012 pu, приблизительно 2×1012 pu или приблизительно 4×1012 pu аденовирусного вектора. См., например, аденовирусные векторы в патенте США №8454972 В2 Nabel, et. al., выданном 4 июня 2013 г.; включенном в данный документ посредством ссылки, и дозы в столбце 29, строках 36-58 данного патента. В варианте осуществления в данном документе аденовирус доставляют посредством многократных доз.
В варианте осуществления в данном документе доставку осуществляют посредством AAV. Полагают, что терапевтически эффективная доза для доставки AAV человеку in vivo находится в диапазоне от приблизительно 20 до приблизительно 50 мл физиологического раствора, содержащего от приблизительно 1×1010 до приблизительно 1×1010 функциональных частиц AAV/мл раствора. Дозу можно скорректировать для уравновешивания терапевтической пользы и любых побочных эффектов. В варианте осуществления в данном документе доза AAV, как правило, находится в диапазоне концентраций от приблизительно 1×105 до 1×1050 геномов AAV, от приблизительно 1×108 до 1×1020 геномов AAV, от приблизительно 1×1010 до приблизительно 1×1016 геномов или от приблизительно 1×1011 до приблизительно 1×1016 геномов AAV. Доза для человека может составлять приблизительно 1×1013 геномов AAV. Такие концентрации можно доставлять в от приблизительно 0,001 мл до приблизительно 100 мл, от приблизительно 0,05 до приблизительно 50 мл или от приблизительно 10 до приблизительно 25 мл раствора носителя. Другие эффективные дозы может без труда установить один из специалистов в данной области посредством стандартных испытаний с построением кривых зависимости "доза-эффект". См., например, патент США №8404658 В2 Hajjar et al, выданный 26 марта 2013 г., в столбце 27, строках 45-60.
В варианте осуществления в данном документе доставку осуществляют посредством плазмиды. В таких плазмидных композициях доза должна быть количеством плазмид, достаточным для того, чтобы вызвать эффект. Например, подходящее количество плазмидной ДНК в плазмидных композициях может составлять от приблизительно 0,1 до приблизительно 2 мг или от приблизительно 1 мкг до приблизительно 10 мкг.
Дозы в данном документе определяются в расчете на среднего индивидуума массой 70 кг. Частота введения находится в пределах компетенции практикующего врача или ветеринара (например, доктора, ветеринарного врача) или ученого, являющегося специалистом в данной области. Мыши, используемые в эксперименте, имели массу приблизительно 20 г. Дозы, вводимые мыши массой 20 г, можно экстраполировать на индивидуума массой 70 кг.
Лентивирус
Лентивирусы являются сложными ретровирусами, которые обладают способностью инфицировать как митотические, так и постмитотические клетки и экспрессировать в них свои гены. Наиболее широко известным лентивирусом является вирус иммунодефицита человека (HIV), который использует гликопротеины оболочки других вирусов для целенаправленного воздействия на широкий спектр типов клеток.
Лентивирусы можно получить следующим образом. После клонирования pCasES10 (которая содержит остов лентивирусной плазмиды-переносчика) HEK293FT, прошедшие малое количество пассажей (р=5), высевали в колбу Т-75 до 50% конфлюентности за день до трансфекции в DMEM с 10% фетальной бычьей сывороткой и без антибиотиков. Через 20 часов среду заменяли на среду OptiMEM (бессывороточную), и 4 часа спустя проводили трансфекцию. Клетки трансфицировали с помощью 10 мкг лентивирусной плазмиды-переносчика (pCasES10) и следующих пакующих плазмид: 5 мкг pMD2.G (псевдотип VSV-g) и 7,5 мкг psPAX2 (gag/pol/rev/tat). Трансфекцию проводили в 4 мл OptiMEM со средством доставки на основе катионного липида (50 мкл Lipofectamine 2000 и 100 мкл реагента Plus). Через 6 часов среду заменяли на DMEM, не содержащую антибиотиков, с 10% фетальной бычьей сывороткой.
Лентивирус можно очистить следующим образом. Вируссодержащие надосадочные жидкости отбирали через 48 часов. Надосадочные жидкости сперва очищали от дебриса и фильтровали через 0,45 мкм фильтр с низкой степенью связывания белка (PVDF). Затем их центрифугировали на ультрацентрифуге в течение 2 часов при 24000 об./мин. Вируссодержащие осадки ресуспендировали в 50 мкл DMEM в течение ночи при 4°С. Затем их разделяли на аликвоты и сразу же замораживали при -80°С.
В другом варианте осуществления также предусмотрены минимальные лентивирусные векторы для отличных от приматов организмов на основе вируса инфекционной анемии лошадей (EIAV), особенно для генной терапии глаз (см., например, Balagaan, J Gene Med 2006; 8: 275-285, опубликовано онлайн 21 ноября 2005 г. в Wiley InterScience (www.interscience.wiley.com). DOI: 10.1002/jgm.845). В другом варианте осуществления также предусмотрен RetinoStat®, лентивирусный вектор на основе вируса инфекционной анемии лошадей для генной терапии, экспрессирующий ангиостатические белки эндостатин и ангиостатин, который доставляют посредством субретинальной инъекции для лечения влажной формы возрастной макулодистрофии (см., например, Binley et al., HUMAN GENE THERAPY 23:980-991 (September 2012)), который может быть модифицирован для системы CRISPR-Cas по настоящему изобретению.
В другом варианте осуществления самоинактивирующиеся лентивирусные векторы с siRNA, целенаправленно воздействующими на общий экзон, который имеют tat/rev HIV, сигналом ядрышковой локализации TAR-ловушкой и специфичным к CCR5 рибозимом в виде головки молотка (см., например, DiGiusto et al. (2010) Sci Transl Med 2:36ra43), можно использовать и/или приспосабливать к системам CRISPR-Cas по настоящему изобретению. Не менее 2,5×106 CD34+клеток на килограмм массы пациента можно собирать и предварительно стимулировать в течение 16-20 часов в среде Х-VIVO 15 (Lonza), содержащей 2 микромоля/л L-глутамина, фактор стволовых клеток (100 нг/мл), лиганд Flt-3 (Flt-3L) (100 нг/мл) и тромбопоэтин (10 нг/мл) (CellGenix) при плотности 2×106 клеток/мл. Предварительно стимулированные клетки можно трансдуцировать лентивирусом при множественности заражения 5 в течение 16-24 часов во флаконах с культурой тканей на 75 см2, покрытых фибронектином (25 мг/см2) (RetroNectin, Takara Bio Inc.).
Лентивирусные векторы были раскрыты в отношении лечения болезни Паркинсона, смотри, например, публикацию заявки на патент США №20120295960 и патенты США №№7303910 и 7351585. Лентивирусные векторы также были раскрыты в отношении лечения заболеваний глаз, смотри, например, публикации заявок на патенты США №№20060281180, 20090007284, US 20110117189; US 20090017543; US 20070054961, US 20100317109. Лентивирусные векторы также были раскрыты в отношении доставки в головной мозг, смотри, например, публикации заявок на патенты США №№US 20110293571; US 20110293571, US 20040013648, US 20070025970, US 20090111106 и патент США №US 7259015.
Доставка РНК
Доставка РНК: фермент CRISPR, например, Cas9, и/или любую из РНК по настоящему изобретению, например, направляющую РНК, также можно доставлять в форме РНК. МРНК Cas9 можно получить с помощью in vitro транскрипции. Например, мРНК Cas9 можно синтезировать с помощью кассеты для ПЦР, содержащей следующие элементы: промотор Т7-последовательность Козак (GCCACC)-Cas9-3'-UTR гена бета-глобина-поли(А)-хвост (цепь из 120 или более адениновых остатков). Кассету можно использовать для транскрипции под действием полимеразы Т7. Направляющие РНК также можно транскрибировать с помощью in vitro транскрипции с кассеты, содержащей промотор Т7-GG-последовательность направляющей РНК.
Для повышения экспрессии и снижения токсичности фермент CRISPR и/или направляющую РНК можно модифицировать с помощью псевдо-U или 5-метил-С.
Способы доставки мРНК в настоящее время являются особенно перспективными для доставки в печень. В частности, для AAV8 особенно предпочтительной является доставка в печень.
Наночастицы
МРНК фермента CRISPR и направляющую РНК можно доставлять одновременно с помощью наночастиц или липидных оболочек.
Например, у Su X, Fricke J, Kavanagh DG, Irvine DJ ("In vitro and in vivo mRNA delivery using lipid-enveloped pH-responsive polymer nanoparticles" Mol Pharm. 2011 Jun 6; 8(3): 774-87. doi: 10.1021/mp100390w. Epub 2011 Apr 1) раскрываются биоразлагаемые наночастицы со структурой ядро/оболочка с ядром из сложного поли-β-аминоэфира (РВАЕ), окруженным фосфолипидной двуслойной оболочкой. Они были разработаны для in vivo доставки мРНК. Чувствительный к рН компонент РВАЕ был выбран для содействия разрушению эндосом, тогда как поверхностный липидный слой был выбран для сведения к минимуму токсичности поликатионного ядра. Они, таким образом, являются предпочтительными для доставки РНК по настоящему изобретению.
В одном варианте осуществления предусмотрены наночастицы на основе самособирающихся биоадгезивных полимеров, которые во всех случаях можно использовать для пероральной доставки пептидов, внутривенной доставки пептидов и интраназальной доставки пептидов в головной мозг. Также предусмотрены другие варианты осуществления, такие как абсорбция при пероральном применении и внутриглазная доставка гидрофобных лекарственных средств. Технология молекулярных оболочек предусматривает сконструированную полимерную оболочку, защищенную и доставляемую в очаг заболевания (см., например, Mazza, М. et al. ACSNano, 2013. 7(2): 1016-1026; Siew, A., et al. Mol Pharm, 2012. 9(l): 14-28; Lalatsa, A., et al. J Contr Rel, 2012. 161(2): 523-36; Lalatsa, A., et al., Mol Pharm, 2012. 9(6): 1665-80; Lalatsa, A., et al. Mol Pharm, 2012. 9(6): 1764-74; Garrett, N.L., et al. J Biophotonics, 2012. 5(5-6): 458-68; Garrett, N.L., et al. J Raman Spect, 2012. 43(5): 681-688; Ahmad, S., et al. J Royal Soc Interface 2010. 7: S423-33; Uchegbu, I.F. Expert Opin Drug Deliv, 2006. 3(5): 629-40; Qu, X., et al. Biomacromolecules, 2006. 7(12): 3452-9 и Uchegbu, I.F., et al. Int J Pharm, 2001. 224: 185-199). Предусмотрены дозы, составляющие приблизительно 5 мг/кг, которые в зависимости от целевой ткани будут однократными или многократными дозами.
В одном варианте осуществления наночастицы, которые могут доставлять РНК в раковые клетки для прекращения роста опухолей, разработанные в лаборатории Дэна Андерсона в MIT, можно использовать для систем CRISPR-Cas по настоящему изобретению и/или приспосабливать к ним. В частности, в лаборатории Андерсона были разработаны полностью автоматизированные, комбинаторные системы для синтеза, очистки, исследования и составления новых биоматериалов и наносоставов. Смотри, например, Alabi et al., Proc Natl Acad Sci USA. 2013 Aug 6;110(32):12881-6; Zhang et al., Adv Mater. 2013 Sep 6;25(33):4641-5; Jiang et al., Nano Lett. 2013 Mar 13;13(3): 1059-64; Karagiannis et al, ACS Nano. 2012 Oct 23;6(10):8484-7; Whitehead et al., ACS Nano. 2012 Aug 28;6(8):6922-9 и Lee et al., Nat Nanotechnol. 2012 Jun 3;7(6):389-93.
Заявка на патент США 20110293703 относится к липидоподобным соединениям, также являющимся особенно применимыми при введении полинуклеотидов, которые можно использовать для доставки системы CRISPR-Cas по настоящему изобретению. В одном аспекте аминоспиртовые липидоподобные соединения объединяют со средством, подлежащим введению в клетку или субъекту, с образованием микрочастиц, наночастиц, липосом или мицелл. Средство, подлежащее доставке с помощью частиц, липосом или мицелл, может быть в форме газа, жидкости или твердого вещества, и средство может представлять собой полинуклеотид, белок, пептид или малую молекулу. Аминоспиртовые липидоподобные соединения можно объединять с другими аминоспиртовыми липидоподобными соединениями, полимерами (синтетическими или природными), поверхностно-активными веществами, холестерином, углеводами, белками, липидами и т.д. с образованием частиц. Эти частицы можно затем необязательно объединять с фармацевтическим наполнителем с образованием фармацевтической композиции.
В публикации заявки на патент США №0110293703 также представлены способы получения аминоспиртовых липидоподобных соединений. Одному или нескольким эквивалентам амина позволяют вступать в реакцию с одним или несколькими эквивалентами соединения с концевыми эпоксидными группами в подходящих условиях с образованием аминоспиртового липидоподобного соединения по настоящему изобретению. В определенных вариантах осуществления все аминогруппы амина полностью реагируют с соединением с концевыми эпоксидными группами с образованием третичных аминов. В других вариантах осуществления не все аминогруппы амина полностью вступают в реакцию с соединением с концевыми эпоксидными группами с образованием третичных аминов, в результате чего, таким образом, образуются первичные или вторичные аминогруппы аминоспиртового липидоподобного соединения. Эти первичные или вторичные аминогруппы оставляют в существующем состоянии или могут вводить в реакцию с другим электрофилом, таким как другое соединение с концевыми эпоксидными группами. Специалисту в данной области следует принять во внимание, что введение амина в реакцию с меньшим, чем избыточное, количеством соединения с концевыми эпоксидными группами приведет к получению множества различных аминоспиртовых липидоподобных соединений с различным количеством хвостов. Определенные амины могут быть полностью функционализированными с помощью двух хвостов соединений, полученных из эпоксидов, тогда как другие молекулы могут быть не полностью функционализированными с помощью хвостов соединений, полученных из эпоксидов. Например, диамин или полиамин может содержать один, два, три или четыре хвоста соединений, полученных из эпоксидов, у различных аминофрагментов молекулы, в результате чего образуются первичные, вторичные и третичные аминогруппы. В определенных вариантах осуществления все аминогруппы являются не полностью функционализированными. В определенных вариантах осуществления используют два соединения с концевыми эпоксидными группами одного типа. В других вариантах осуществления используют два или более различных соединений с концевыми эпоксидными группами. Синтез аминоспиртовых липидоподобных соединений осуществляют с помощью или без растворителя, и синтез можно осуществлять при более высоких температурах, варьирующих в диапазоне от 30 до 100°С, предпочтительно при примерно 50-90°С. Получаемые аминоспиртовые липидоподобные соединения можно необязательно очищать. Например, смесь аминоспиртовых липидоподобных соединений можно очищать с получением аминоспиртового липидоподобного соединения с определенным количеством хвостов соединений, полученных из эпоксидов. Или же смесь можно очищать с получением определенного стерео- или региоизомера. Аминоспиртовые липидоподобные соединения можно также алкилировать с помощью алкилгалогенида (например, йодистого метила) или другого алкилирующего средства, и/или их можно ацилировать.
В публикации заявки на патент США №0110293703 также представлены библиотеки аминоспиртовых липидоподобных соединений, полученных согласно способам по настоящему изобретению. Эти аминоспиртовые липидоподобные соединения можно получать и/или подвергать скринингу с применением высокопроизводительных методик, предусматривающих использование дозирующих станций, роботов, планшетов для микротитрования, компьютеров и т.д. В определенных вариантах осуществления аминоспиртовые липидоподобные соединения подвергают скринингу в отношении их способности к трансфекции полинуклеотидов или других средств (например, белков, пептидов, малых молекул) в клетку.
Публикация заявки на патент США №20130302401 относится к классу поли(бета-аминоспиртов) (РВАА), получаемых при помощи комбинаторных методик полимеризации. РВАА по настоящему изобретению можно использовать в биотехнологии и медико-биологических применениях в качестве покрытий (таких как пленочные покрытия или многослойные пленки для медицинских инструментов или имплантатов), добавок, материалов, наполнителей, средств против биологического обрастания, средств для формирования микроструктуры и средств для инкапсулирования клеток. В случае применения в качестве поверхностных покрытий эти РВАА вызывают различные уровни воспаления как in vitro, так и in vivo в зависимости от их химических структур. Большое химическое разнообразие этого класса материалов позволяет идентифицировать полимерные покрытия, ингибирующие активацию макрофагов in vitro. Кроме того, эти покрытия уменьшают привлечение воспалительных клеток и уменьшают выраженность фиброза после подкожной имплантации микрочастиц карбоксилированного полистирола. Эти полимеры можно использовать для образования капсул на основе полиэлектролитных комплексов для инкапсулирования клеток. Настоящее изобретение также может иметь много других путей применения в биологии, таких как получение противомикробных покрытий, доставка ДНК или siRNA и тканевая инженерия с применением стволовых клеток. Идеи, изложенные в публикации заявки на патент США №20130302401, можно применять к системе CRISPR-Cas по настоящему изобретению.
В другом варианте осуществления предусмотрены липидные наночастицы (LNP). В частности, малые интерферирующие РНК, воздействующие на транстиретин, инкапсулированные в липидных наночастицах (см., например, Coelho et al., N Engi J Med 2013; 369: 819-29), можно применять в отношении системы CRISPR-Cas по настоящему изобретению. Предусмотрены дозы, составляющие от приблизительно 0,01 до приблизительно 1 мг на кг массы тела, вводимые внутривенно. Предусмотрены лекарственные препараты для снижения риска возникновения инфузионных реакций, такие как дексаметазон, ацетаминофен, дифенгидрамин или цетиризин и ранитидин. Также предусмотрены многократные дозы, состоящие из пяти доз по приблизительно 0,3 мг на килограмм, принимаемых каждые 4 недели.
Было показано, что LNP являются высокоэффективными в доставке siRNA в печень (см., например, Tabernero et al., Cancer Discovery, April 2013, Vol. 3, No. 4, pages 363-470) и, таким образом, предусмотрены для доставки CRISPR-Cas в печень. Может быть предусмотрен режим дозирования с приемом приблизительно четырех доз по 6 мг/кг LNP (или РНК системы CRISPR-Cas) каждые две недели. Tabernero и соавт. продемонстрировали, что после первых 2 циклов введения LNP в дозе 0,7 мг/кг наблюдалась регрессия опухоли, а к концу 6 циклов у пациента достигался частичный ответ с полной регрессией метастазов в лимфатических узлах и значительным уменьшением размеров опухолей в печени. У данного пациента, у которого сохранялась ремиссия и который завершил лечение после получения доз в течение 26 месяцев, полный ответ достигался после приема 40 доз. У двух пациентов с RCC и внепеченочными очагами заболевания, включающими почку, легкое и лимфатические узлы, в которых наблюдалось прогрессирование после предшествующей терапии ингибиторами сигнального пути VEGF, наблюдалось стабильное заболевание во всех очагах в течение примерно 8-12 месяцев, а пациент с PNET и метастазами в печени продолжал участие в расширенном исследовании в течение 18 месяцев (36 доз) при стабильном заболевании.
Однако следует принимать во внимание заряд LNP. Так, объединение катионных липидов с отрицательно заряженными липидами индуцирует образование структур, не являющихся двуслойными, которые облегчают внутриклеточную доставку. Поскольку заряженные LNP быстро выводятся из кровотока после внутривенной инъекции, были разработаны ионизируемые катионные липиды со значениями pKa ниже 7 (см., например, Rosin et al, Molecular Therapy, vol. 19, no. 12, pages 1286-2200, Dec. 2011). Отрицательно заряженные полимеры, такие как олигонуклеотиды siRNA, можно загружать в LNP при низких значениях рН (например, рН 4), где ионизируемые липиды проявляют положительный заряд. Однако, при физиологических значениях рН LNP проявляют низкий поверхностный заряд, совместимый с большими значениями времени пребывания в кровотоке. Основное внимание было сосредоточено на четырех молекулах ионизируемых катионных липидов, а именно 1,2-дилинолеоил-3-диметиламмонийпропан (DLinDAP), 1,2-дилинолеилокси-3-N,N-диметиламинопропан (DLinDMA), 1,2-дилинолеилоксикето-N,N-диметил-3-аминопропан (DLinKDMA) и 1,2-дилинолеил-4-(2-диметиламиноэтил)-[1,3]-диоксолан (DLinKC2-DMA). Было показано, что системы LNP с siRNA, содержащие эти липиды, проявляют существенно отличающиеся свойства сайленсинга генов в гепатоцитах in vivo, при этом их активность изменяется в ряду DLinKC2-DMA>DLinKDMA>DLinDMA>>DLinDAP, при использовании модели сайленсинга гена фактора VII (см., например. Rosin et al, Molecular Therapy, vol. 19, no. 12, pages 1286-2200, Dec. 2011). Могут быть предусмотрены уровни дозы 1 мкг/мл, особенно для состава, содержащего DLinKC2-DMA.
Получение LNP и инкапсулирование CRISPR-Cas можно применять и/или модифицировать согласно Rosin et al, Molecular Therapy, vol. 19, no. 12, pages 1286-2200, Dec. 2011. Катионные липиды 1,2-дилинолеоил-3-диметиламмонийпропан (DLinDAP), 1,2-дилинолеилокси-3-N,N-диметиламинопропан (DLinDMA), 1,2-дилинолеилоксикето-N,N-диметил-3-аминопропан (DLinK-DMA), 1,2-дилинолеил-4-(2-диметиламиноэтил)-[1,3]-диоксолан (DLinKC2-DMA), (3-о-[2''-(метоксиполиэтиленгликоль 2000)-сукциноил]-1,2-димиристоил-sn-гликоль (PEG-S-DMG) и R-3-[(ω-метоксиполи(этиленгликоль)2000)-карбамоил]-1,2-димиристилоксипропил-3-амин (PEG-C-DOMG) могут быть предоставлены Tekmira Pharmaceuticals (Ванкувер, Канада) или синтезированы. Холестерин можно приобрести у Sigma (Сент-Луис, Миссури). Конкретную РНК CRISPR-Cas можно инкапсулировать в LNP, содержащую DLinDAP, DLinDMA, DLinK-DMA и DLinKC2-DMA (катионный липид : DSРС : холестерин : PEG-S-DMG или PEG-C-DOMG в молярном соотношении 40:10:40:10). При необходимости можно включать в состав 0,2% SP-DiOC18 (Invitrogen, Берлингтон, Канада) для определения клеточного поглощения, внутриклеточной доставки и биораспределения. Инкапсулирование можно осуществлять путем растворения липидных смесей, содержащих катионный липид : DSPC : холестерин : РЕG-С-DОМG (молярное соотношение 40:10:40:10) в этаноле до конечной концентрации липидов 10 ммоль/л. Этот раствор липидов в этаноле можно добавлять по каплям к 50 ммоль/л цитрата, рН 4,0, с образованием многослойных пузырьков до получения конечной концентрации этанола 30% об./об. Крупные однослойные пузырьки можно формировать после экструзии многослойных пузырьков через два установленных один над другим поликарбонатных фильтра Nuclepore на 80 нм при помощи экструдера (Northern Lipids, Ванкувер, Канада). Инкапсулирование можно осуществлять путем добавления РНК, растворенной при 2 мг/мл в 50 ммоль/л цитрата, рН 4,0, содержащего 30% этанола об./об., по каплям к экструдированным предварительно сформированным крупным однослойным пузырькам и инкубирования при 31°С в течение 30 минут при постоянном перемешивании до конечного весового соотношения РНК/липид 0,06/1 вес./вес. Удаление этанола и нейтрализацию буфера для получения состава проводили путем диализа против фосфатно-солевого буфера (PBS), рН 7,4, в течение 16 часов при помощи диализных мембран Spectra/Por 2 из регенерированной целлюлозы. Распределение наночастиц по размеру можно определить посредством динамического рассеяния света с использованием измерителя размера частиц NICOMP 370, режимов объема пузырьков/интенсивности рассеянного света и аппроксимации функцией Гаусса (Nicomp Particle Sizing, Санта-Барбара, Калифорния). Размер частиц для всех трех систем LNP может составлять ~70 нм в диаметре. Эффективность инкапсулирования siRNA можно определить путем удаления свободной siKNA из образцов, отобранных до или после диализа, с помощью колонок VivaPureD MiniH (Sartorius Stedim Biotech). Инкапсулированную РНК можно экстрагировать из элюированных наночастиц и подвергать количественной оценке при 260 нм. Соотношение siRNA и липидов определяли путем измерения содержания холестерина в пузырьках с помощью ферментативного анализа Cholesterol E от Wako Chemicals USA (Ричмонд, Виргиния). Для доставки также можно применять пегилированные липосомы (или LNP).
Получение крупных LNP можно применять и/или приспосабливать согласно Rosin et al, Molecular Therapy, vol. 19, no. 12, pages 1286-2200, Dec. 2011. Раствор предварительно приготовленной смеси липидов (общая концентрация липидов 20,4 мг/мл) 100 можно получать в этаноле, содержащем DLinKC2-DMA, DSPC и холестерин в молярном соотношении 50:10:38,5. К предварительно приготовленной смеси липидов можно добавлять ацетат натрия в молярном соотношении 0,75:1 (ацетат натрия : DLinKC2-ВМА). Липиды затем можно гидрировать путем объединения смеси с 1,85 объема цитратного буфера (10 ммоль/л, рН 3,0) при энергичном перемешивании, вызывая самопроизвольное образование липосом в водном буфере, содержащем 35% этанол. Раствор липосом можно инкубировать при 37°С для обеспечения зависимого от времени увеличения размера частиц. Можно отбирать аликвоты в различные моменты времени в ходе инкубирования для изучения изменений размера липосом посредством динамического рассеяния света (Zetasizer Nano ZS, Malvern Instruments, Вустершир, Великобритания). По достижении желаемого размера частиц к смеси липосом можно добавлять водный раствор конъюгатов PEG-липид (исходный раствор =10 мг/мл PEG-DMG в 35% (об./об.) этаноле) с получением конечной молярной концентрации PEG 3,5% от общего количества липидов. После добавления конъюгатов PEG-липид липосомы должны сохранять свой размер с эффективным подавлением дальнейшего роста. К "пустым" липосомам можно затем добавить РНК при соотношении siRNA и общих липидов, составляющем примерно 1:10 (вес : вес), с последующим инкубированием в течение 30 минут при 37°С с образованием нагруженных LNP. Смесь можно затем подвергнуть диализу в течение ночи в PBS и отфильтровать через, шприцевой фильтр с диаметром пор 0,45 мкм.
Конструкции сферических нуклеиновых кислот (SNA™) и другие наночастицы (в частности, наночастицы золота) также предусмотрены в качестве средств доставки системы CRISPR/Cas к предполагаемым мишеням. Достоверные данные показывают, что конструкции сферических нуклеиновых кислот (SNA™) от AuraSense Therapeutics на основе наночастиц золота, функционализированных нуклеиновыми кислотами, превосходят альтернативные платформы за счет нескольких следующих ключевых факторов успеха.
Высокая стабильность in vivo. По причине их плотной загрузки большинство молекул-карго (ДНК или siRNA) остаются связанными с конструкциями внутри клеток, что придает нуклеиновым кислотам стабильность и устойчивость к ферментативному расщеплению.
Возможность доставки. Для всех изучаемых типов клеток (например, нейронов, линий опухолевых клеток и т.д.) конструкции демонстрируют 99% эффективность трансфекции без необходимости в носителях или средствах для трансфекции.
Терапевтическое целенаправленное воздействие. Уникальная аффинность связывания с мишенью и специфичность конструкций обеспечивают превосходную специфичность в отношении совпадающих целевых последовательностей (т.е. с ограниченными нецелевыми эффектами).
Превосходящая эффективность. Конструкции значительно превосходят ведущие традиционные реагенты для трансфекции (Lipofectamine 2000 и Cytofectin).
Низкая токсичность. Конструкции могут поступать в ряд культивируемых клеток, первичных клеток и тканей без видимой токсичности.
Отсутствие значительного иммунного ответа. Конструкции вызывают минимальные изменения глобальной экспрессии генов согласно измерениям в полногеномных микроматричных исследованиях и специфичных в отношении цитокинов анализах белков.
Способность получения заданных химических свойств. Для получения заданных свойств поверхности конструкций можно использовать любое количество отдельных или комбинированных средств (например, белков, пептидов, малых молекул).
Данная платформа для терапевтических средств на основе нуклеиновых кислот может быть применима к многочисленным болезненным состояниям, включающим воспаление и инфекционное заболевание, рак, кожные нарушения и сердечно-сосудистое заболевание.
Литературные источники, на которые можно ссылаться, включают: Cutler et al.,. J. Am. Chem. Soc. 2011 133: 9254-9257, Hao et al., Small. 2011 7: 3158-3162, Zhang et al., ACS Nano. 2011 5: 6962-6970, Cutler et al., J. Am. Chem. Soc. 2012 134: 1376-1391, Young et al.,. Nano Lett. 2012 12: 3867-71, Zheng et al., Proc. Natl. Acad. Sci. USA. 2012 109: 11975-80, Mirkin, Nanomedicine 2012 7: 635-638, Zhang et al., J. Am. Chem. Soc. 2012 134: 16488-1691, Weintraub, Nature 2013 495:S14-S16, Choi et al., Proc. Natl. Acad. Sci. USA. 2013 110(19):7625-7630, Jensen et al., Sci. Transl. Med. 5, 209ral52 (2013) и Mirkin, et al., Small, doi.org/10.1002/smll.201302143.
Самособирающиеся наночастицы с siRNA могут быть сконструированы с помощью полиэтиленимина (PEI), пегилированного пептидным лигандом Arg-Gly-Asp (RGD), присоединенным к дистальному концу полиэтиленгликоля (PEG), например, в качестве средства для нацеливания на новообразованные сосуды опухоли, в которых экспрессируются интегрины, и использоваться для доставки siRNA, ингибирующих экспрессию рецептора-2 фактора роста эндотелия сосудов (VEGF R2) и, таким образом, ангиогенез опухоли (см., например, Schiffelers et al., Nucleic Acids Research, 2004, Vol. 32, No. 19). Наноплексы можно получать путем смешивания равных объемов водных растворов катионного полимера и нуклеиновой кислоты с получением чистого молярного избытка ионизируемого азота (полимера) относительно фосфата (нуклеиновой кислоты) в диапазоне от 2 до 6. Электростатические взаимодействия между катионными полимерами и нуклеиновой кислотой приводили к образованию полиплексов, характеризующихся распределением частиц по размеру со средним размером, составляющим приблизительно 100 нм, называемых здесь в связи с этим наноплексами. Для доставки в самособирающихся наночастицах согласно Schiffelers и соавт. предполагается доза, составляющая приблизительно от 100 до 200 мг CRISPR-Cas.
Наноплексы по Bartlett et al. (PNAS, September 25, 2007, vol. 104, no. 39) также можно применять в настоящем изобретении. Наноплексы по Bartlett и соавт. получают путем смешивания равных объемов водных растворов катионного полимера и нуклеиновой кислоты с получением чистого молярного избытка ионизируемого азота (полимера) относительно фосфата (нуклеиновой кислоты) в диапазоне от 2 до 6. Электростатические взаимодействия между катионными полимерами и нуклеиновой кислотой приводили к образованию полиплексов, характеризующихся распределением частиц по размеру со средним размером, составляющим приблизительно 100 нм, называемых здесь, таким образом, наноплексами. Конъюгаты DOTA-siRNA no Bartlett и соавт. синтезировали следующим образом. Сложный моно(N-гидроксисукцинимидный эфир) 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислоты (сложный эфир DOTA-NHS) заказывали у Macrocyclics (Даллас, Техас). В микроцентрифужную пробирку добавляли аминомодифицированную смысловую нить РНК со 100-кратным молярным избытком сложного эфира DOTA-NHS в карбонатном буфере (рН 9). Содержимое вводили в реакцию путем перемешивания в течение 4 ч. при комнатной температуре. Конъюгат DOTA-смысловая нить РНК осаждали этанолом, ресуспендировали в воде и отжигали с немодифицированной антисмысловой нитью с получением конъюгата DOTA-siRNA. Все жидкости предварительно обрабатывали с помощью Chelex-100 (Bio-Rad, Геркулес, Калифорния) для удаления следовых количеств металлических примесей. Нацеленные на Tf или ненацеленные наночастицы с siRNA можно получать с помощью поликатионов, содержащих циклодекстрин. Как правило, наночастицы получают в воде при соотношении зарядов 3 (+/-) и концентрации siRNA 0,5 г/литр. Один процент молекул конъюгатов адамантан-PEG на поверхности нацеленных наночастиц модифицировали с помощью Tf (адамантан-PEG-Tf). Наночастицы суспендировали в 5% (вес/об.) глюкозе в качестве раствора-носителя для инъекции.
Davis et al. (Nature, Vol 464, 15 April 2010) проводят клиническое испытание с siRNA, в котором используют систему доставки на основе нацеленных наночастиц (регистрационный номер клинического испытания NCT00689065). Пациентам с солидными формами рака, трудно поддающимися стандартным методикам лечения, вводили дозы нацеленных наночастиц в дни 1, 3, 8 и 10 21-дневного цикла посредством 30-минутной внутривенной инфузии. Наночастицы состоят из синтетической системы доставки, содержащей: (1) линейный полимер на основе циклодекстрина (CDP), (2) лиганд, нацеливающийся на белок трансферрин человека (TF), представленный на внешней поверхности наночастиц, который входит в контакт с рецепторами TF (TFR) на поверхности раковых клеток, (3) гидрофильный полимер (полиэтиленгликоль (PEG), используемый для обеспечения стабильности наночастиц в биологических жидкостях), и (4) siRNA, предназначенную для снижения экспрессии RRM2 (последовательность, применяемая в клинической практике, ранее была обозначена как siR2B+5). Давно известно, что в злокачественных клетках повышена экспрессия TFR, a RRM2 является общепризнанной мишенью для противоопухолевой терапии. Было показано, что эти наночастицы (клинический вариант обозначен как CALAA-01) хорошо переносятся в исследованиях с использованием многократных доз у отличных от человека приматов. Даже при том, что отдельным пациентам с хроническим миелоидным лейкозом вводили siRNA посредством доставки с помощью липосом, клиническое испытание по Davis и соавт. является первым испытанием с участием человека, в котором проводят системную доставку siRNA с помощью системы целенаправленной доставки и лечат пациентов с солидным раком. Для того, чтобы выяснить, может ли система целенаправленной доставки обеспечивать эффективную доставку функциональных siRNA в опухоли человека, Davis и соавт. исследовали биоптаты от трех пациентов из трех различных когорт дозирования; пациентов А, В и С, все из которых имели метастазирующую меланому и получали дозы CALAA-01 с 18, 24 и 30 мг*м-2 siRNA, соответственно. Аналогичные дозы также могут быть предусмотрены для системы CRISPR-Cas по настоящему изобретению. Доставку по настоящему изобретению можно осуществлять с помощью наночастиц, содержащих линейный полимер на основе циклодекстрина (CDP), лиганд, нацеливающийся на белок трансферрин человека (TF), представленный на внешней поверхности наночастиц, который входит в контакт с рецепторами TF (TFR) на поверхности раковых клеток, и/или гидрофильный полимер (например, полиэтиленгликоль (PEG), применяемый для обеспечения стабильности наночастиц в биологических жидкостях).
Экзосомы
Экзосомы являются эндогенными нанопузырьками, переносящими РНК и белки, которые могут доставлять короткие интерферирующие РНК (siRNA) в головной мозг мышей. Для снижения иммуногенности Alvarez-Erviti et al. (2011, Nat Biotechnol 29: 341) использовали аутогенные дендритные клетки для получения экзосом. Нацеливания достигали путем конструирования дендритных клеток, экспрессирующих Lamp2b, мембранный белок экзосом, слитый с нейрон-специфическим пептидом RVG. Очищенные экзосомы нагружали экзогенной siRNA путем электропорации. Меченные RVG нацеленные экзосомы, инъецируемые внутривенно, осуществляли специфическую доставку siRNA для GAPDH в нейроны, микроглию, олигодендроциты в головном мозге, обуславливая нокдаун конкретного гена. Предварительное воздействие меченных RVG экзосом не ослабляло выраженность нокдауна, и неспецифическое поглощение в других тканях не наблюдалось. Терапевтические возможности опосредованной экзосомами доставки siRNA были продемонстрированы сильно выраженным нокдауном мРНК (60%) и белка (62%) ВАСЕ1, терапевтической мишени при болезни Альцгеймера.
Для получения пула иммунологически инертных экзосом Alvarez-Erviti и соавт. отбирали костный мозг у инбредных мышей C57B L/6 с гомогенным гаплотипом главного комплекса гистосовместимости (МНС). Поскольку незрелые дендритные клетки вырабатывают большие количества экзосом, лишенных активаторов Т-клеток, таких как MHC-II и CD86, Alvarez-Erviti и соавт. производили отбор дендритных клеток с гранулоцитарно-макрофагальным колониестимулирующим фактором (GM-CSF) в течение 7 дней. Экзосомы очищали от культуральной надосадочной жидкости на следующий день с применением общепринятых протоколов ультрацентрифугирования. Вырабатываемые экзосомы были физически гомогенными и характеризовались распределением по размеру с пиком при 80 нм в диаметре, как определяли с помощью анализа отслеживания наночастиц (NTA) и электронной микроскопии. Alvarez-Erviti и соавт. получали 6-12 мкг экзосом (измерено по концентрации белка) на 106 клеток.
Затем Alvarez-Erviti и соавт. исследовали возможность загрузки модифицированных экзосом экзогенными молекулами-карго с применением протоколов электропорации, приспособленных для применений на наноразмерном уровне. Поскольку электропорация для мембранных частиц в нанометрическом масштабе изучена недостаточно хорошо, для эмпирической оптимизации протокола электропорации использовали неспецифическую меченную Cy5 siRNA. Количество инкапсулированной siRNA анализировали после ультрацентрифугирования и лизиса экзосом. Электропорация при 400 В и 125 мкФ приводила к наибольшему удержанию siRNA и применялась для всех последующих экспериментов.
Alvarez-Erviti и соавт. вводили по 150 мкг каждой siRNA для ВАСЕ1, инкапсулированной в 150 мкг RVG-экзосом, нормальным мышам C57BL/6 и сравнивали эффективность нокдауна с таковой в четырех контрольных группах: необработанные мыши, мыши, которым инъецировали только RVG-экзосомы, мыши, которым инъецировали siRNA для ВАСЕ1 в комплексе с реагентом на основе катионных липосом для доставки in vivo, и мыши, которым инъецировали siRNA для ВАСЕ1 в комплексе с RVG-9R, пептидом RVG, конъюгированным с 9 остатками D-аргинина, который электростатически связывается с siRNA. Образцы кортикальной ткани анализировали через 3 дня после введения, и как у обработанных siRNA-RVG-9R, так и у обработанных меченными RVG экзосомами с siRNA мышей наблюдали значительный нокдаун белка (45%, Р<0,05 и 62%, Р<0,01), обусловленный значительным снижением уровней мРНК ВАСЕ1 (66% [+ или -] 15%, Р<0,001 и 61% [+ или -] 13%, Р<0,01, соответственно). Кроме того, заявители продемонстрировали значительное снижение (55%, Р<0,05) общих уровней [бета]-амилоидного пептида 1-42, основного компонента амилоидных бляшек в патологическом процессе при болезни Альцгеймера у животных, обработанных меченными RVG экзосомами. Наблюдавшееся снижение было большим, чем снижение уровней β-амилоидного пептида 1-40, демонстрируемое у нормальных мышей после внутрижелудочковой инъекции ингибиторов ВАСЕ1. Alvarez-Erviti и соавт. проводили быструю амплификацию 5'-концов кДНК (RACE) в отношении продукта расщепления ВАСЕ1, что свидетельствовало об опосредованном RNAi нокдауне с помощью siRNA.
Наконец, Alvarez-Erviti и соавт. исследовали, индуцируют ли меченные RVG экзосомы с siRNA иммунные ответы in vivo, путем определения концентраций IL-6, IP-10, TNFα и IFN-α в сыворотке. После обработки с помощью меченных RVG экзосом с siRNA для всех цитокинов регистрировали незначительные изменения подобно обработке реагентом для трансфекции с siRNA и в отличие от siRNA-RVG-9R, который активно стимулировал секрецию IL-6, что подтверждало иммунологическую инертность как особенность обработки экзосомами. С учетом того, что экзосомы инкапсулируют только 20% siRNA, доставка с помощью меченных RVG экзосом, по-видимому, является более эффективной, чем доставка с помощью RVG-9R, поскольку с использованием в пять раз меньшего количества siRNA без соответствующего уровня стимуляции иммунного ответа достигали сопоставимого нокдауна мРНК и большего нокдауна белка. Данный эксперимент продемонстрировал терапевтические возможности технологии меченных RVG экзосом, которая потенциально подходит для долговременного сайленсинга генов, связанных с нейродегенеративными заболеваниями. Систему доставки на основе экзосом по Alvarez-Erviti и соавт. можно использовать для доставки системы CRISPR-Cas по настоящему изобретению к терапевтическим мишеням, особенно при нейродегенеративных заболеваниях. В настоящем изобретении может быть предусмотрена доза, составляющая приблизительно 100-1000 мг CRISPR-Cas, инкапсулированных в приблизительно 100-1000 мг меченных RVG экзосом.
El-Andaloussi et al. (Nature Protocols 7, 2112-2126(2012)) раскрывают, как экзосомы, полученные из культивируемых клеток, можно приспособить для доставки siRNA in vitro и in vivo. В данном протоколе впервые описано создание нацеленных экзосом посредством трансфекции вектором экспрессии, содержащим белок экзосом, слитый с пептидным лигандом. Затем E1-Andaloussi и соавт. объясняют, как очищать и характеризовать экзосомы из надосадочной жидкости с трансфицированными клетками. Затем El-Andaloussi и соавт. подробно описывают важнейшие стадии загрузки siRNA в экзосомы. Наконец, El-Andaloussi и соавт. излагают в общих чертах, как использовать экзосомы для эффективной доставки siRNA in vitro и in vivo в головной мозг мышей. Также приведены примеры предполагаемых результатов, в которых опосредованная экзосомами доставка siRNA оценивается посредством функциональных анализов и визуализации. Выполнение полного протокола занимает ~3 недели. Доставку или введение согласно настоящему изобретению можно осуществлять с помощью экзосом, полученных из аутогенных дендритных клеток.
В другом варианте осуществления предусмотрены плазменные экзосомы по Wahlgren et al. (Nucleic Acids Research, 2012, Vol. 40, No. 17 e130). Экзосомы представляют собой наноразмерные пузырьки (размером 30-90 нм), вырабатываемые многими типами клеток, в том числе дендритными клетками (DC), В-клетками, Т-клетками, тучными клетками, эпителиальными клетками и опухолевыми клетками. Данные пузырьки образуются путем внутреннего почкования поздних эндосом, а затем высвобождаются во внеклеточную среду при слиянии с плазматической мембраной. Поскольку экзосомы в естественных условиях переносят РНК между клетками, это свойство может быть полезным в генной терапии.
Экзосомы из плазмы получают путем центрифугирования лейкоцитарной пленки при 900 g в течение 20 мин. для выделения плазмы с последующим сбором надосадочной жидкости с клетками, центрифугированием при 300 g в течение 10 мин. для удаления клеток и при 16500g в течение 30 мин. с последующей фильтрацией через фильтр с диаметром пор 0,22 мм. Экзосомы осаждают путем ультрацентрифугирования при 120000 g в течение 70 мин. Введение siRNA в экзосомы посредством химической трансфекции проводят согласно инструкциям производителя в наборе RNAi Human/Mouse Starter Kit (Quiagen, Хильден, Германия). siRNA добавляют к 100 мл PBS в конечной концентрации 2 ммоль/мл. После добавления реагента для трансфекции HiPerFect смесь инкубируют в течение 10 мин. при RT. С целью удаления избытка мицелл экзосомы повторно выделяют при помощи латексных гранул с альдегидными/сульфатными группами. Введение CRISPR-Cas в экзосомы посредством химической трансфекции можно проводить аналогично введению siRNA. Экзосомы можно совместно культивировать с моноцитами и лимфоцитами, выделенными из периферической крови здоровых доноров. Таким образом, может быть предусмотрено, чтобы экзосомы, содержащие CRISPR-Cas, можно было вводить в моноциты и лимфоциты и подвергать аутологическому обратному введению в организм человека. Соответственно, доставку или введение согласно настоящему изобретению можно осуществлять с помощью плазменных экзосом.
Липосомы
Доставку или введение согласно настоящему изобретению можно осуществлять с помощью липосом. Липосомы являются сферическими везикулярными структурами, содержащими одно- или многослойный липидный бислой, окружающий внутренние водные компартменты, и относительно непроницаемый внешний липофильный фосфолипидный бислой. Липосомы получили значительное внимание в качестве носителей для доставки лекарственных средств, поскольку они являются биологически совместимыми, нетоксичными, могут доставлять как гидрофильные, так и липофильные молекулы лекарственных средств, защищают свою молекулу-карго от расщепления ферментами плазмы и переносят свой "груз" через биологические мембраны и гематоэнцефалический барьер (ВВВ) (для обзора см., например, Spuch and Navarro, Journal of Drug Delivery, vol. 2011, Article ID 469679, 12 pages, 2011. doi: 10.1155/2011/469679).
Липосомы можно получать из нескольких различных типов липидов; однако, для создания липосом в качестве носителей лекарственных средств чаще всего применяют фосфолипиды. Хотя образование липосом является самопроизвольным при смешивании липидной пленки с водным раствором, его также можно ускорить путем приложения силы в виде встряхивания посредством применения гомогенизатора, ультразвукового диспергатора или экструзионного аппарата (для обзора смотри, например, Spuch and Navarro, Journal of Drug Delivery, vol. 2011, Article ID 469679, 12 pages, 2011. doi: 10.1155/2011/469679).
К липосомам можно добавлять некоторые другие добавки с целью модификации их структуры и свойств. Например, холестерин либо сфингомиелин можно добавлять к смеси липосом в целях содействия стабилизации структуры липосом и предотвращения утечки внутренних молекул-карго липосом. Дополнительно, липосомы получают из гидрогенизированного яичного фосфатидилхолина или яичного фосфатидилхолина, холестерина и диацетилфосфата, и их средние размеры пузырьков доводили до приблизительно 50 и 100 нм (для обзора смотри, например, Spuch and Navarro, Journal of Drug Delivery, vol. 2011, Article ID 469679,12 pages, 2011. doi: 10.1155/2011/469679).
Традиционный липосомный состав содержит главным образом природные фосфолипиды и липиды, такие как 1,2-дистеароил-sn-глицеро-3-фосфатидилхолин (DSPC), сфингомиелин, формы яичного фосфатидилхолина и моносиалоганглиозид. Поскольку данный состав состоит только из фосфолипидов, липосомные составы сталкиваются со многими проблемами, одной из которых является нестабильность в плазме. Было предпринято несколько попыток преодоления данных проблем, в частности, посредством манипуляции с липидной мембраной. Одна из этих попыток направлена на манипуляцию с холестерином. Добавление холестерина к традиционным составам уменьшает быстрое высвобождение инкапсулированного биологически активного соединения в плазму, а 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин (DOPE) повышает стабильность (для обзора см., например, Spuch and Navarro, Journal of Drug Delivery, vol. 2011, Article ID 469679, 12 pages, 2011. doi: 10.1155/2011/469679).
В особенно преимущественном варианте осуществления желательными являются липосомы "троянские кони" (также известные как "молекулярные троянские кони"), и протоколы можно найти в http://cshprotocols.cshlp.org/content/2010/4/pdb.prot5407.long. Эти частицы обеспечивают доставку трансгена в головной мозг в целом после внутрисосудистой инъекции. Без ограничений полагают, что нейтральные липидные частицы со специфичными антителами, конъюгированными с поверхностью, обеспечивают проникновение через гематоэнцефалический барьер посредством эндоцитоза. Заявитель теоретически допускает использование липосом "троянских коней" для доставки нуклеаз семейства CRISPR в головной мозг посредством внутрисосудистой инъекции, что будет обеспечивать получение животных с трансгенами во всем головном мозге без необходимости в манипуляции с эмбрионами. Может быть предусмотрено приблизительно 1-5 г молекулы нуклеиновой кислоты, например, ДНК, РНК, для введения в липосомы in vivo.
В другом варианте осуществления систему CRISPR-Cas можно вводить в липосомы, такие как стабильная частица из нуклеиновой кислоты и липидов (SNALP) (см., например, Morrissey et al., Nature Biotechnology, Vol. 23, No. 8, August 2005). Предусматриваются ежедневные внутривенные инъекции приблизительно 1, 3 или 5 мг/кг/день специфичной целенаправленно воздействующей CRISPR-Cas в SNALP. Ежедневное лечение можно осуществлять в течение приблизительно трех дней и затем еженедельно в течение приблизительно пяти недель. В другом варианте осуществления также предусмотрена специфичная CRISPR-Cas, инкапсулированная в SNALP, вводимая посредством внутривенной инъекции в дозах, составляющих приблизительно 1 или 2,5 мг/кг (см., например, Zimmerman et al., Nature Letters, Vol. 441, 4 May 2006). Состав на основе SNALP может содержать липиды 3-N-[(ω-метоксиполи(этиленгликоль)2000)карбамоил] -1, 2-димиристилоксипропиламин (PEG-C-DMA), 1,2-дилинолеилокси-N,N-диметил-3-аминопропан (DLinDMA), 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC) и холестерин в молярном процентном соотношении 2:40:10:48 (смотри, например, Zimmerman et al., Nature Letters, Vol. 441,4 May 2006).
В другом варианте осуществления было подтверждено, что стабильные частицы из нуклеиновой кислоты и липидов (SNALP) являются эффективными молекулами для доставки в высоковаскуляризированные опухоли печени, происходящие из HepG2, но не в слабо васкуляризированные опухоли печени, происходящие из НСТ-116 (смотри, например, Li, Gene Therapy (2012) 19, 775-780). SNALP-липосомы можно получать путем составления D-Lin-DMA и PEG-C-DMA с дистеароилфосфатидилхолином (DSPC), холестерином и siRNA с использованием соотношения липид/siRNA 25:1 и молярного соотношения холестерин/D-Lin-DMA/DSPC/PEG-C-DMA 48/40/10/2. Полученные в результате SNALP-липосомы имеют размер приблизительно 80-100 нм.
В еще одном варианте осуществления SNALP может содержать синтетический холестерин (Sigma-Aldrich, Сент-Луис, Миссури, США), дипальмитоилфосфатидилхолин (Avanti Polar Lipids, Алабастер, Алабама, США), 3-N-[(ω-метоксиполи(этиленгликоль)2000)карбамоил]-1,2-димиристилоксипропиламин и катионный 1,2-дилинолеилокси-3-N,N-диметиламинопропан (смотри, например, Geisbert et al., Lancet 2010; 375: 1896-905). Может предусматриваться режим дозирования с приемом приблизительно 2 мг/кг общего количества CRISPR-Cas на дозу, вводимую, например, в виде болюсной внутривенной инфузии.
В еще одном варианте осуществления SNALP может содержать синтетический холестерин (Sigma-Aldrich), 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC; Avanti Polar Lipids Inc.), PEG-C-DMA и 1,2-дилинолеилокси-3-(N,N-диметил)аминопропан (DLinDMA) (смотри, например. Judge, J. Clin. Invest. 119: 661-673 (2009)). Составы, используемые для in vivo исследований, могут содержать липиды и РНК в конечном массовом соотношении, составляющем приблизительно 9:1.
Профиль безопасности нанопрепаратов для RNAi был рассмотрен Barros и Gollob из Alnylam Pharmaceuticals (смотри, например, Advanced Drug Delivery Reviews 64 (2012) 1730-1737). Стабильная частица из нуклеиновой кислоты и липидов (SNALP) содержит четыре различных липида - ионизируемый липид (DLinDMA), который является катионным при низком рН, нейтральный липид-помощник, холестерин и диффундирующий конъюгат полиэтиленгликоль (РЕG)-липид. Частица имеет диаметр примерно 80 нм и является электронейтральной при физиологическом значении рН. Во время составления ионизируемый липид служит для конденсации липида с анионной siRNA в ходе образования частиц. Будучи положительно заряженным в условиях возрастающей кислотности в эндосомах, ионизируемый липид также опосредует слияние SNALP с мембраной эндосомы, обеспечивая высвобождение siRNA в цитоплазму. Конъюгат PEG-липид стабилизирует частицу и уменьшает агрегацию во время составления, а также впоследствии обеспечивает нейтральную гидрофильную внешнюю поверхность, улучшающую фармакокинетические свойства.
К настоящему времени была начата реализация двух программ клинических исследований с применением составов на основе SNALP с siRNA. В Tekmira Pharmaceuticals недавно завершили фазу I однодозового исследования SNALP-ApoB с участием взрослых добровольцев с повышенным уровнем холестерина LDL. АроВ преимущественно экспрессируется в печени и тонкой кишке и является ключевым для сборки и секреции VLDL и LDL. АроВ также успешно подвергается целенаправленному воздействию систем CRISPR-Cas авторов настоящего изобретения, смотри примеры 38-39. Семнадцать субъектов получали однократную дозу SNALP-ApoB (повышение дозы, охватывающее 7 уровней дозирования). Не наблюдалось свидетельств гепатотоксичности (предполагаемой в качестве возможной дозолимитирующей токсичности на основании доклинических исследований). Один (или два) субъекта при наиболее высокой дозе испытывали симптомы гриппоподобных заболеваний, указывающие на стимуляцию иммунной системы, и было принято решение завершить испытание.
В Alnylam Pharmaceuticals аналогичным образом успешно провели исследование ALN-TTR01, который использует технологию SNALP, описанную выше, и целенаправленно воздействует на выработку гепатоцитами как мутантного TTR, так и TTR дикого типа, для лечения опосредованного TTR амилоидоза (ATTR). Были описаны три синдрома при ATTR: семейная амилоидическая полинейропатия (FAP) и семейная амилоидическая кардиомиопатия (FAC) - оба из которых обусловлены аутосомно-доминантными мутациями в TTR; и старческий системный амилоидоз (SSA), обусловленный TTR дикого типа. Недавно завершили I фазу плацебо-контролируемого испытания с повышением однократной дозы ALN-TTR01 с участием пациентов с ATTR. Введение ALN-TTR01 осуществляли в виде 15-минутной IV инфузии 31 пациенту (исследуемое лекарственное средство для 23 и плацебо для 8) в диапазоне доз 0,01-1,0 мг/кг (из расчета siRNA). Лечение хорошо переносилось без значительного повышения показателей печеночных проб. Инфузионные реакции отмечались у 3 из 23 пациентов при ≥0,4 мг/кг; все они реагировали на замедление скорости инфузии и все они продолжали исследование. Минимальные и временные повышения уровней цитокинов IL-6, IP-10 и IL-1RA в сыворотке отмечались у двух пациентов при наиболее высокой дозе 1 мг/кг (как предполагалось на основании доклинических исследований и исследований с участием NHP). Снижение уровня TTR в сыворотке, ожидаемый фармакодинамический эффект ALN-TTR01, наблюдалось при 1 мг/кг.
В еще одном варианте осуществления SNALP можно получить путем солюбилизации катионного липида, DSPC, холестерина и конъюгата PEG-липид, которые солюбилизируют в этаноле в молярном соотношении 40:10:40:10, соответственно (смотри Semple et al., Nature Biotechnology, Volume 28 Number 2 February 2010, pp. 172-177). Смесь липидов добавляли к водному буферу (50 мМ цитрат, рН 4) с перемешиванием до конечной концентрации этанола и липидов 30% (об./об.) и 6,1 мг/мл, соответственно, и ей позволяли уравновешиваться при 22°С в течение 2 мин. перед экструзией. Гидрированные липиды экструдировали через два установленных один над другим фильтра с размером пор 80 нм (Nuclepore) при 22°С при помощи экструдера Lipex (Northern Lipids) до достижения диаметра пузырьков 70-90 нм, определяемого посредством анализа по методу динамического рассеяния света. Для этого обычно требовалось 1-3 прохождения. siRNA (солюбилизированную в водном растворе, содержащем 30% этанол, с 50 мМ цитратом, рН 4) добавляли к предварительно уравновешенным (35°С) пузырькам со скоростью ~5 мл/мин, при перемешивании. После достижения конечного целевого соотношения siRNA/липиды 0,06 (вес/вес) смесь инкубировали в течение дополнительных 30 мин. при 35°С для обеспечения реорганизации пузырьков и инкапсулирования siRNA. Этанол затем удаляли, а внешний буфер заменяли на PBS (155 мМ NaCl, 3 мМ Na2HPO4, 1 мМ KH2PO4, рН 7,5) путем диализа либо тангенциальной поточной диафильтрации. siRNA инкапсулировали в SNALP посредством регулируемого способа по методу ступенчатого разбавления. Липидные составляющие KC2-SNALP представляли собой DLin-KC2-DMA (катионный липид), дипальмитоилфосфатидилхолин (DPPC; Avanti Polar Lipids), синтетический холестерин (Sigma) и PEG-C-DMA, используемые в молярном соотношении 57,1:7,1:34,3:1,4. После образования нагруженных частиц SNALP подвергали диализу против PBS и стерилизации путем фильтрации через фильтр с диаметром пор 0,2 мкм перед применением. Средние значения размера частиц составляли 75-85 нм, и 90-95% siRNA были инкапсулированы в липидных частицах. Конечное соотношение siRNA/липиды в Составах, используемых для тестирования in vivo, составляло ~0,15 (вес/вес). Системы LNP-siRNA, содержащие siRNA для фактора VII, разводили до соответствующих концентраций в стерильном PBS непосредственно перед применением, и составы вводили внутривенно через латеральную хвостовую вену в общем объеме 10 мл/кг. Данный способ можно экстраполировать на систему CRISPR-Cas по настоящему изобретению.
Другие липиды
Другие катионные липиды, такие как аминолипид 2,2-дилинолеил-4-диметиламиноэтил-[1,3]-диоксолан (DLin-KC2-DMA), можно использовать для инкапсулирования CRISPR-Cas аналогично siRNA (смотри, например, Jayaraman, Angew. Chem. Int. Ed. 2012, 51, 8529-8533). Может быть предусмотрен предварительно сформированный пузырек со следующим составом липидов: аминолипид, дистеароилфосфатидилхолин (DSPC), холестерин и (R)-2,3-бис(октадецилокси)пропил-1-(метоксиполи(этиленгликоль)2000)пропилкарбамат (конъюгат PEG-липид) в молярном соотношении 40/10/40/10, соответственно, и с соотношением siRNA для FVII/общие липиды, составляющим примерно 0,05 (вес/вес). Для обеспечения узкого распределения частиц по размеру в диапазоне 70-90 нм и низкого коэффициента полидисперсности 0,11±0,04 (n=56) частицы можно экструдировать до трех раз через мембраны с диаметром пор 80 нм перед добавлением РНК CRISPR-Cas. Можно использовать частицы, содержащие высокоактивный аминолипид 16, в которых молярное соотношение четырех липидных компонентов 16, DSPC, холестерина и конъюгата PEG-липид (50/10/38,5/1,5) можно дополнительно оптимизировать для повышения активности in vivo.
Michael S D Kormann et al. ("Expression of therapeutic proteins after delivery of chemically modified mRNA in mice: Nature Biotechnology, Volume: 29, Pages: 154-157 (2011), опубликовано в интернете 09 января 2011 г.) описывает применение липидных оболочек для доставки РНК. Применение липидных оболочек также является предпочтительным в настоящем изобретении.
В другом варианте осуществления липиды можно составлять с системой CRISPR-Cas по настоящему изобретению с образованием липидных наночастиц (LNP). Липиды включают, без ограничения, DLin-KC2-DMA4, С12-200 и совместно действующие липиды дистеароилфосфатидилхолин, холестерин и PEG-DMG, которые можно составлять с CRISPR-Cas вместо siRNA (смотри, например, Novobrantseva, Molecular Therapy-Nucleic Acids (2012) 1, e4; doi: 10.1038/mtna.2011.3) с помощью процедуры самопроизвольного образования пузырьков. Молярное соотношение компонентов может составлять приблизительно 50/10/38,5/1,5 (DLin-KC2-DMA или С12-200/дистеароилфосфатидилхолин/холестерин/PEG-DMG). Конечное весовое соотношение липиды:siRNA может составлять ~12:1 и 9:1 в случае липидных наночастиц (LNP) на основе DLin-KC2-DMA и С12-200, соответственно. Составы могут характеризоваться средними диаметрами частиц ~80 нм при >90% эффективности включения. Может быть предусмотрена доза 3 мг/кг.
Tekmira имеет портфель из примерно 95 семейств патентов-аналогов, выданных в США и за границей, которые направлены на различные аспекты LNP и составы на основе LNP (см., например, патенты США №№7982027; 7799565; 8058069; 8283333; 7901708; 7745651; 7803397; 8101741; 8188263; 7915399; 8236943 и 7838658 и европейские патенты №№1766035; 1519714; 1781593 и 1664316), все из которых можно применять в настоящем изобретении и/или приспосабливать к нему.
Систему CRISPR-Cas можно доставлять инкапсулированной в микросферах на основе PLGA, таких как дополнительно описанные в опубликованных заявках на патенты США 20130252281, и 20130245107, и 20130244279 (закрепленных за Moderna Therapeutics), которые относятся к аспектам составления композиций, содержащих модифицированные молекулы нуклеиновых кислот, которые могут кодировать белок, предшественник белка или частично или полностью процессированную форму белка или предшественника белка. Состав может характеризоваться молярным соотношением 50:10:38,5:1,5-3,0 (катионный липид : фузогенный липид : холестерин : конъюгат PEG-липид). Конъюгат PEG-липид может быть выбран, без ограничения, из PEG-C-DOMG, PEG-DMG. Фузогенный липид может представлять собой DSPC. Смотри также Schrum et al., Delivery and Formulation of Engineered Nucleic Acids, опубликованную заявку на патент США 20120251618.
Технология Nanomerics преодолевает проблемы, связанные с биологической доступностью, для широкого спектра терапевтических средств, в том числе низкомолекулярных гидрофобных лекарственных средств, пептидов и терапевтических средств на основе нуклеиновых кислот (плазмид, siRNA, miRNA). Конкретные пути введения, для которых технология продемонстрировала очевидные преимущества, включают пероральный путь, перенос через гематоэнцефалический барьер, доставка в солидные опухоли, а также в глаз. Смотри, например, Mazza et al., 2013, ACS Nano. 2013 Feb 26; 7(2):1016-26; Uchegbu and Slew, 2013, J Pharm Sci. 102(2):305-10 и Lalatsa et al., 2012, J Control Release. 2012 Jul 20; 161(2):523-36.
В публикации заявки на патент США №20050019923 описаны катионные дендримеры для доставки биологически активных молекул, таких как молекулы полинуклеотидов, пептиды и полипептиды и/или фармацевтические средства, в организм млекопитающего. Дендримеры подходят для обеспечения нацеленной доставки биологически активных молекул в, например, печень, селезенку, легкое, почку или сердце. Дендримеры являются синтетическими 3-мерными макромолекулами, получаемыми ступенчатым способом из простых разветвленных мономерных звеньев, природу и количество функциональных групп которых можно легко регулировать и изменять. Дендримеры синтезируют путем повторяющегося присоединения "строительных блоков" в направлении от сердцевины с несколькими функциональными группами (дивергентный подход к синтезу) или к сердцевине с несколькими функциональными группами (конвергентный подход к синтезу), и каждое присоединение 3-мерной оболочки из "строительных блоков" приводит к образованию дендримеров более высокой генерации. Синтез полипропилениминовых дендримеров начинается с диаминобутановой сердцевины, к которой присоединяют удвоенное количество аминогрупп посредством двойного присоединения по Михаэлю ацетонитрила к первичным аминогруппам с последующим гидрированием нитрильных групп. Это обуславливает удвоение количества аминогрупп. Полипропилениминовые дендримеры содержат 100% протонируемых атомов азота и до 64 концевых аминогрупп (генерация 5, DAB 64). Протонируемые группы обычно представляют собой аминогруппы, способные принимать протоны при нейтральном рН. Применение дендримеров в качестве средств для доставки генов в основном ориентировано на использование полиамидоамина и фосфорсодержащих соединений со смесью из амина/амида или N--P(O2)S в качестве конъюгирующих единиц, соответственно, при этом в работах не сообщалось о применении полипропилениминовых дендримеров более низкой генерации для доставки генов. Полипропилениминовые дендримеры также изучали в качестве рН-чувствительных систем с контролируемым высвобождением для доставки лекарственных средств и для инкапсулирования в них гостевых молекул в случае химической модификации периферических аминокислотных групп. Также изучали цитотоксичность и взаимодействие полипропилениминовых дендримеров с ДНК, а также эффективность трансфекции с помощью DAB 64.
Публикация заявки на патент США №20050019923 основана на наблюдении того, что, в противоположность более ранним сообщениям, катионогенные дендримеры, такие как Полипропилениминовые дендримеры, проявляют надлежащие свойства, такие как специфичное нацеливание и низкая токсичность, для применения в целенаправленной доставке биологически активных молекул, таких как генетический материал. В дополнение, производные катионного дендримера также проявляют подходящие свойства для нацеленной доставки биологически активных молекул. См. также "Биологически активные полимеры", публикация заявки на патент США 20080267903, в которой раскрыто следующее: "Показано, что различные полимеры, в том числе катионные полиаминные полимеры и дендримерные полимеры, обладают антипролиферативной активностью и могут, таким образом, быть применимьми для лечения нарушений, характеризующихся нежелательной пролиферацией клеток, таких как неоплазии и опухоли, воспалительные нарушения (в том числе аутоиммунные нарушения), псориаз и атеросклероз. Полимеры можно применять в отдельности в качестве активных средств или в качестве средств доставки других терапевтических средств, таких как молекулы лекарственных средств или нуклеиновые кислоты, для генной терапии. В таких случаях присущая полимерам собственная противоопухолевая активность может дополнять активность средства, подлежащего доставке".
Белки с избыточным зарядом
Белки с избыточным зарядом представляют собой класс сконструированных или встречающихся в природе белков с необычно высоким положительным или отрицательным теоретическим суммарным зарядом. Белки как с избыточным отрицательным, так и с избыточным положительным зарядом проявляют особое свойство устойчивости к термически или химически индуцированной агрегации. Белки с избыточным положительным зарядом также способны проникать в клетки млекопитающих. Ассоциация молекул-карго, таких как плазмидная ДНК, siRNA, с этими белками или другими белками может обеспечивать функциональную доставку данных макромолекул в клетки млекопитающих как in vitro, так и in vivo. В лаборатории Дэвида Лю сообщили о создании и определении характеристик белков с избыточным зарядом в 2007 г. (Lawrence et al., 2007, Journal of the American Chemical Society 129, 10110-10112).
Невирусная доставка siRNA и плазмидной ДНК в клетки млекопитающих является значимой как в исследованиях, так и в терапевтических применениях (Akinc et al., 2010, Nat. Biotech. 26, 561-569). Очищенный белок GFP с зарядом +36 (или другой белок с избыточным положительным зарядом) смешивают с siRNA в подходящей бессывороточной среде, и обеспечивают возможность образования ими комплекса перед добавлением к клеткам. Включение сыворотки на этой стадии ингибирует образование комплексов белок с избыточным зарядом-siRNA и снижает эффективность обработки. Было обнаружено, что следующий протокол является эффективным для ряда линий клеток (McNaughton et al., 2009, Proc. Natl. Acad. Sci. USA 106, 6111-6116). Однако, в целях оптимизации процедуры для конкретных линий клеток следует проводить предварительные эксперименты с различными дозами белка и siRNA.
(1) За один день до обработки высеять 1×105 клеток на лунку в 48-луночный планшет.
(2) В день обработки развести очищенный белок GFP с зарядом +36 в бессывороточной среде до конечной концентрации 200 нМ. Добавить siRNA до конечной концентрации 50 нМ. Перемешать вихревой мешалкой и инкубировать при комнатной температуре в течение 10 мин.
(3) Во время инкубирования аспирировать среду от клеток и промыть один раз с помощью PBS.
(4) После инкубирования GFP с зарядом +36 и siRNA добавить к клеткам комплексы белок-siRNA.
(5) Инкубировать клетки с комплексами при 37°С в течение 4 ч.
(6) После инкубирования аспирировать среду и промыть три раза с помощью 20 ЕД/мл гепарина в PBS. Инкубировать клетки в сывороточной среде в течение дополнительных 48 ч. или дольше в зависимости от анализа нокдауна.
(7) Анализировать клетки с помощью иммуноблоттинга, количественной ПЦР, фенотипического анализа или другого соответствующего способа.
Было обнаружено, что GFP с зарядом +36 является эффективным реагентом для доставки плазмид в ряд клеток. Поскольку плазмидная ДНК является более крупной молекулой-карго, чем siRNA, то для образования эффективного комплекса с плазмидами требуется пропорционально больше белка GFP с зарядом +36. Для эффективной доставки плазмид заявители разработали вариант GFP с зарядом +36, несущий С-концевую пептидную метку НА2, известный пептид, разрушающий эндосомы, происходящий из белка гемагглютинина вируса гриппа. Следующий протокол был эффективным для многих клеток, но, как указано выше, рекомендуется, чтобы дозы плазмидной ДНК и белка с избыточным зарядом были оптимизированы для конкретных линий клеток и применений в доставке.
(1) За один день до обработки высеять 1×105 клеток на лунку в 48-луночный планшет.
(2) В день обработки разбавить очищенный белок GFP с зарядом +36 в бессывороточной среде до конечной концентрации 2 мМ. Добавить 1 мг плазмидной ДНК. Перемешать вихревой мешалкой и инкубировать при комнатной температуре в течение 10 мин.
(3) Во время инкубирования аспирировать среду от клеток и промыть один раз с помощью PBS.
(4) После инкубирования GFP с зарядом +36 и плазмидной ДНК осторожно добавить к клеткам комплексы белок-ДНК.
(5) Инкубировать клетки с комплексами при 37°С в течение 4 ч.
(6) После инкубирования аспирировать среду и промыть с помощью PBS. Инкубировать клетки в сывороточной среде и инкубировать в течение дополнительных 24-48 ч.
(7) При необходимости проанализировать доставку плазмид (например, посредством экспрессии генов, обусловленной плазмидами).
Смотри также, например, McNaughton et al., Proc. Natl. Acad. Sci. USA 106, 6111-6116 (2009); Cronican et al., ACS Chemical Biology 5, 747-752 (2010); Cronican et al., Chemistry & Biology 18, 833-838 (2011); Thompson et al., Methods in Enzymology 503, 293-319 (2012); Thompson, D.B., et al., Chemistry & Biology 19 (7), 831-843 (2012). Способы использования белков с избыточным зарядом можно применять для доставки системы CRISPR-Cas по настоящему изобретению и/или приспосабливать к ней.
Пептиды, проникающие в клетку
В еще одном варианте осуществления предусмотрены пептиды, проникающие в клетку (СРР), для доставки системы CRISPR-Cas. CPP представляют собой короткие пептиды, содействующие поглощению клетками различных молекул-карго (от наноразмерных частиц до малых химических молекул и крупных фрагментов ДНК). Выражение "молекула-карго", используемое в данном документе, включает, без ограничения, группу, состоящую из терапевтических средств, диагностических зондов, пептидов, нуклеиновых кислот, антисмысловых олигонуклеотидов, плазмид, белков, наночастиц, липосом, хромофоров, малых молекул и радиоактивных материалов. В аспектах настоящего изобретения молекула-карго может также содержать любой компонент системы CRISPR-Cas или всю функциональную систему CRISPR-Cas. В аспектах настоящего изобретения дополнительно представлены способы доставки желаемой молекулы-карго субъекту, включающие: (а) получение комплекса, содержащего пептид, проникающий в клетку, по настоящему изобретению и желаемую молекулу-карго, и (b) пероральное, внутрисуставное, внутрибрюшинное, интратекальное, внутриартериальное, интраназальное, интрапаренхиматозное, подкожное, внутримышечное, внутривенное, накожное, ректальное или местное введение комплекса субъекту. Молекула-карго связана с пептидами химической связью посредством ковалентных связей либо посредством нековалентных взаимодействий.
Функцией СРР является доставка молекулы-карго в клетки, процесс, который обычно происходит с молекулой-карго, доставляемой в эндосомы живых клеток млекопитающих, посредством эндоцитоза. Пептиды, проникающие в клетку, имеют различные размер, аминокислотные последовательности и заряды, но все СРР имеют одну отличительную характеристику, которая представляет собой способность к перемещению через плазматическую мембрану и содействию доставке различных молекул-карго в цитоплазму или органеллу. Перемещение СРР можно подразделить на три основных механизма поступления: прямое прохождение через мембрану, поступление, опосредованное эндоцитозом, и перемещение посредством образования промежуточной структуры. СРР нашли многочисленные применения в медицине в качестве средств для доставки лекарственных средств при лечении различных заболеваний, в том числе рака, и ингибиторов вирусов, а также контрастных средств для мечения клеток. Примеры последнего включают действие в качестве носителя GFP, контрастных средств для MRI или квантовых точек. СРР обладают большим потенциалом в качестве векторов доставки in vitro и in vivo для применения в исследованиях и медицине. СРР обычно имеют такой аминокислотный состав, при котором они характеризуются высокой относительной распространенностью положительно заряженных аминокислот, таких как лизин или аргинин, либо имеют последовательности, характеризующиеся чередующимся расположением полярных/заряженных аминокислот и неполярных гидрофобных аминокислот. Эти два типа структур называются поликатионным или амфипатическим, соответственно. Третьим классом СРР являются гидрофобные пептиды, содержащие только неполярные остатки с низким суммарным зарядом или имеющие гидрофобные группы аминокислот, крайне важные для поглощения клетками. Одним из первых обнаруженных СРР был трансактивирующий активатор транскрипции (Tat) вируса иммунодефицита человека 1 (HIV-1), который, как было выявлено, эффективно поглощался из окружающей среды многочисленными типами клеток в культуре. С тех пор количество известных СРР значительно увеличилось, и были созданы низкомолекулярные синтетические аналоги с более эффективными свойствами белковой трансдукции. СРР включают, без ограничения, пенетратин. Tat (48-60), транспортан и (R-AhX-R4) (Ahx = аминогексаноил).
В патенте США 8372951 представлен СРР, полученный из катионного белка эозинофилов (ЕСР), проявляющий высокую эффективность проникновения в клетку и низкую токсичность. Также представлены аспекты доставки СРР со своей молекулой-карго позвоночному субъекту. Дополнительные аспекты, касающиеся СРР и их доставки, описаны в патентах США 8575305, 8614194 и 8044019.
Эти СРР можно использовать для доставки системы CRISPR-Cas, что также представлено в рукописи "Gene disruption by cell-penetrating peptide-mediated delivery of Cas9 protein and guide RNA" Suresh Ramakrishna, Abu-Bonsrah Kwaku Dad, Jagadish Beloor, et al. Genome Res. 2014 Apr 2. [Электронная публикация, предшествующая печатной], включенной с помощью ссылки во всей своей полноте, где продемонстрировано, что обработка с помощью рекомбинантного белка Cas9, конъюгированного с СРР, и направляющих РНК, образующих комплекс с СРР, приводит к нарушениям функционирования эндогенных генов в линиях клеток человека. В данной статье белок Cas9 был конъюгирован СРР с помощью тиоэфирной связи, тогда как направляющая РНК образовывала комплекс с СРР с образованием конденсированных положительно заряженных наночастиц. Было показано, что одновременная и последовательная обработка клеток человека, в том числе эмбриональных стволовых клеток, дермальных фибробластов, клеток НЕК293Т, клеток HeLa и клеток эмбриональной карциномы, модифицированным Cas9 и направляющей РНК приводила к эффективным нарушениям функционирования генов со снижением частоты нецелевых мутаций по сравнению с трансфекцией плазмидами.
Имплантируемые устройства
В другом варианте осуществления также предусмотрены имплантируемые устройства для доставки системы CRISPR-Cas. Например, в публикации заявки на патент США 20110195123 раскрыто представленное имплантируемое медицинское устройство, высвобождающее лекарственное средство локально и в течение длительного периода, в том числе несколько типов такого устройства, реализуемые методы лечения и способы имплантации. Устройство содержит полимерный субстрат, такой как матрица, например, применяемый в качестве корпуса устройства, и лекарственные средства, и в некоторых случаях дополнительные трехмерные подложки-носители, такие как металлы или дополнительные полимеры, и материалы для улучшения видимости и визуализации. В основе выбора лекарственного средства лежит преимущество высвобождения лекарственного средства, происходящего локально и в течение длительного периода, где лекарственное средство высвобождается непосредственно во внеклеточный матрикс (ЕСМ) пораженной заболеванием области, как, например, в случае опухоли, воспаления, дегенерации, или в целях симптоматической терапии, или в пораженные гладкомышечные клетки, или для предупреждения. Один вид лекарственных средств представляет собой лекарственные средства для сайленсинга генов на основе РНК-интерференции (RNAi), включающие, без ограничения, siRNA, shRNA или антисмысловые РНК/ДНК, рибозимы и нуклеозидные аналоги. Таким образом, данную систему можно применять для системы CRISPR-Cas по настоящему изобретению и/или приспосабливать к ней. Методы имплантации в некоторых вариантах осуществления представляют собой существующие процедуры имплантации, разработанные и применяемые в настоящее время для других видов лечения, в том числе для близкофокусной лучевой терапии и пункционной биопсии. В таких случаях размеры нового имплантата, описанного в настоящем изобретении, аналогичны размерам первоначального имплантата. Как правило, в ходе одной процедуры лечения имплантируют несколько устройств.
Как описано в публикации заявки на патент США 20110195123, представлена имплантируемая или вставная система доставки лекарственных средств, в том числе системы, применимые для введения в полость, такую как брюшная полость, и/или для любого другого типа введения, в которой система доставки лекарственных средств не закреплена и не присоединена, содержащая биоустойчивый, и/или разлагаемый, и/или биопоглощаемый полимерный субстрат, который может, например, необязательно представлять собой матрицу. Следует отметить, что выражение "вставка" также включает имплантацию. Система для доставки лекарственных средств преимущественно реализуется как "Loder", что описано в публикации заявки на патент США 20110195123.
Полимер или множество полимеров, содержащие средство и/или множество средств, являются биосовместимыми, обеспечивая высвобождение средства с контролируемой скоростью, где общий объем полимерного субстрата, такого как матрица, например, в некоторых вариантах осуществления необязательно и предпочтительно не превосходит максимальный объем, позволяющий достигнуть терапевтического уровня средства. В качестве неограничивающего примера, такой объем предпочтительно находится в диапазоне от 0,1 м3 до 1000 мм3, как того требует объем загруженного средства. Loder необязательно может иметь больший размер, например, будучи включенной в состав устройства, размер которого определяется функциональным назначением, например, без ограничения коленного сустава, внутриматочного или шеечного кольца и т.п.
Система доставки лекарственных средств (для доставки композиции) в некоторых вариантах осуществления предназначена для предпочтительного использования разлагаемых полимеров, где основным механизмом высвобождения является объемная эрозия; или же в некоторых вариантах осуществления применяются неразлагаемые или медленно разлагаемые полимеры, где основным механизмом высвобождения является диффузия, а не объемная эрозия, так что их наружная часть функционирует в качестве мембраны, а их внутренняя часть функционирует в качестве депо лекарственного средства, которое практически не подвергается воздействию окружения в течение продолжительного периода (например, от приблизительно недели до приблизительно нескольких месяцев). Также можно необязательно применять комбинации различных полимеров с различными механизмами высвобождения. Градиент концентраций на поверхности предпочтительно эффективно поддерживается постоянным в течение значительного периода в ходе общего периода высвобождения лекарственного средства, и, таким образом, скорость диффузии (называемой "диффузией нулевого порядка") является эффективно постоянной. Под выражением "постоянный" подразумевают скорость диффузии, которая предпочтительно поддерживается выше нижнего порога терапевтической эффективности, но которая, тем не менее, может необязательно характеризоваться начальным всплеском и/или колебаться, например, повышаясь и понижаясь в некоторой степени. Скорость диффузии предпочтительно поддерживается таким образом в течение длительного периода, и до определенного уровня она может считаться постоянной для оптимизации терапевтически эффективного периода, например, эффективного периода сайленсинга.
Система доставки лекарственных средств необязательно и предпочтительно предназначена для защиты нуклеотидного терапевтического средства от деградации, химической по своей природе или обусловленной воздействием ферментов и других факторов в организме субъекта.
Система доставки лекарственных средств, описанная в публикации заявки на патент США 20110195123, необязательно связана с чувствительными и/или активирующими приборами, функционирующими во время и/или после имплантации устройства посредством неинвазивных и/или минимально инвазивных способов активации и/или ускорения/замедления, например, необязательно включающих, без ограничения, способы или устройства с применением термического нагревания и охлаждения, лазерных пучков и ультразвука, в том числе фокусированного ультразвука, и/или RF (радиочастот).
Согласно некоторым вариантам осуществления публикации заявки на патент США 20110195123 участок для локальное доставки может необязательно включать целевые участки, характеризующиеся высокой аномальной пролиферацией клеток и подавлением апоптоза, в том числе опухоли, очаги активного и/или хронического воспаления и инфекции, включающих аутоиммунные болезненные состояния, ткань с дегенеративными изменениями, включающую мышечную и нервную ткань, очаги хронической боли, участки с дегенеративными изменениями, и местоположения переломов костей, и другие местоположения ран, для усиления регенерации ткани, а также поврежденные сердечные, гладкие и поперечно-полосатые мышцы. Участок для локальной доставки также может необязательно включать участки, позволяющие осуществлять профилактические мероприятия, в том числе при беременности, при предупреждении инфекции и старения.
Участок для имплантации композиции, или целевой участок, предпочтительно характеризуется радиусом, площадью и/или объемом, достаточно малыми для целенаправленной локальной доставки. Например, целевой участок необязательно имеет диаметр в диапазоне от приблизительно 0,1 мм до приблизительно 5 см.
Местоположение целевого участка предпочтительно выбирают для достижения максимальной терапевтической эффективности. Например, композицию системы для доставки лекарственных средств (необязательно вместе с устройством для имплантации, описанным выше) необязательно и предпочтительно имплантируют в опухолевое окружение, или рядом с ним, или в кровеносную сеть, связанную с ним.
Например, композицию (необязательно вместе с устройством) необязательно имплантируют в поджелудочную железу, предстательную железу, молочную железу, печень или рядом с ними, через сосок, в сосудистую систему и т.д.
Целевое местоположение необязательно выбирают из группы, состоящей из (только в качестве неограничивающих примеров, поскольку любой участок в организме необязательно может подходить для имплантации Loder): 1. участков головного мозга с дегенеративными изменениями, таких как базальные ганглии, белое и серое вещество, при болезни Паркинсона или Альцгеймера; 2. спинного мозга, как в случае бокового амиотрофического склероза (ALS); 3. шейки матки для предупреждения HPV-инфекции; 4. суставов с активным или хроническим воспалением; 5. дермы, как в случае псориаза; 6. участков симпатических и чувствительных нервов для обезболивающего эффекта; 7. участков внутрикостной имплантации; 8. очагов острой и хронической инфекции; 9. интравагинальных участков; 10. внутреннего уха слуховой системы, лабиринта внутреннего уха, вестибулярной системы; 11. внутритрахеальных участков; 12. внутрисердечных участков; участков коронарных сосудов, эпикардиальных участков; 13. мочевого пузыря; 14. желчевыделительной системы; 15. паренхимной ткани, включающей, без ограничения, почку, печень, селезенку; 16. лимфатических узлов; 17. слюнных желез; 18. десен вокруг зубов; 19. внутрисуставных участков (имплантация в суставы); 20. внутриглазных участков; 21. ткани головного мозга; 22. желудочков головного мозга; 23. полостей, в том числе брюшной полости (например, без ограничения, для лечения рака яичника); 24. внутрипищеводных участков и 25. внутрипрямокишечных участков.
Вставка системы (например, устройства, содержащего композицию) необязательно связана с инъекцией материала в ЕСМ целевого участка и окружение этого участка для воздействия на локальные рН, и/или температуру, и/или другие биологические факторы, влияющие на диффузию лекарственного средства и/или кинетику лекарственного средства в ЕСМ целевого участка и окружении такого участка.
Согласно некоторым вариантам осуществления высвобождение указанного средства необязательно может быть связано с чувствительными и/или активирующими приборами, функционирующими до, и/или во время, и/или после вставки посредством неинвазивных, и/или минимально инвазивных, и/или других способов активации и/или ускорения/замедления, включающих способы или устройства с применением лазерных пучков, излучения, термического нагревания и охлаждения, и ультразвука, в том числе фокусированного ультразвука, и/или RF (радиочастот), а также химических активаторов.
Согласно другим вариантам осуществления в публикации заявки на патент США 20110195123 лекарственное средство предпочтительно включает биологическое лекарственное средство для сайленсинга генов на основе RNAi, например, для лечения случаев локализованного рака молочной железы, поджелудочной железы, головного мозга, почки, мочевого пузыря, легкого и предстательной железы, описанных ниже. Кроме того, многие лекарственные средства, отличные от siRNA, применимы для инкапсулирования в Loder и могут применяться в контексте настоящего изобретения, поскольку такие лекарственные средства могут быть инкапсулированы в субстрат Loder, такой как, например, матрица. Такие лекарственные средства включают одобренные лекарственные средства, доставляемые в настоящее время с помощью способов, отличных от способов по настоящему изобретению, включающие амфотерицин В для лечения грибковой инфекции; антибиотики, как, например, при остеомиелите; обезболивающие средства, такие как наркотические средства; антидегенеративные средства, как, например, при болезни Альцгеймера или Паркинсона, в Loder, имплантируемой вблизи спинного мозга в случае боли в спине. Такую систему можно применять для доставки системы CRISPR-Cas по настоящему изобретению и/или приспосабливать к ней.
Например, для конкретных применений, таких как предупреждение роста или возобновления роста гладкомышечных клеток (поврежденных в ходе процедуры стентирования и вследствие этого склонных к пролиферации), лекарственное средство может необязательно представлять собой siRNA, осуществляющую сайленсинг в гладкомышечных клетках, в том числе сайленсинг H19, или лекарственное средство, выбранное из группы, состоящей из таксола, рапамицина и аналогов рапамицина. В таких случаях Loder предпочтительно представляет собой стент, выделяющий лекарственное средство (DES), с пролонгированным высвобождением при постоянной скорости либо выделенное устройство, которое имплантируют отдельно, совместно со стентом. Все из этого можно применять для системы CRISPR-Cas по настоящему изобретению и/или приспосабливать к ней.
В качестве другого примера конкретного применения, нейродегенеративные и дегенеративные заболевания мышц развиваются в связи с аномальной экспрессией генов. Локальная доставка РНК для сайленсинга может иметь терапевтические свойства, препятствующие такой аномальной экспрессии генов. Локальная доставка антиапоптотических, противовоспалительных и антидегенеративных лекарственных средств, в том числе низкомолекулярных лекарственных средств и макромолекул, может также необязательно быть терапевтической. В таких случаях Loder применяют для пролонгированного высвобождения при постоянной скорости и/или посредством выделенного устройства, которое имплантируют отдельно. Все из этого можно применять для системы CRISPR-Cas по настоящему изобретению и/или приспосабливать к ней.
В качестве еще одного примера конкретного применения, психические и когнитивные расстройства лечат с помощью модификаторов генов. Нокдаун гена с помощью РНК для сайленсинга является возможным методом лечения. Применение Loder для локальной доставки нуклеотидных средств в участки центральной нервной системы является возможным методом терапии психических и когнитивных расстройств, в том числе, без ограничения, психоза, биполярных расстройств, невротических расстройств и расстройств поведения. Loder могут также обеспечивать локальную доставку лекарственных средств, в том числе низкомолекулярных лекарственных средств и макромолекул, при имплантации в конкретные участки головного мозга. Все из этого можно применять для системы CRISPR-Cas по настоящему изобретению и/или приспосабливать к ней.
В качестве другого примера конкретного применения, сайленсинг генов медиаторов врожденного и/или приобретенного иммунного ответа в локальных участках обеспечивает предупреждение отторжения трансплантированного органа. Локальная доставка РНК для сайленсинга и иммуномодулирующих реагентов с помощью Loder, имплантированной в трансплантированный орган и/или участок имплантации, активирует подавление местного иммунитета в отношении трансплантированного органа путем отвлечения иммунных клеток, таких как CD8+. Все из этого можно применять для системы CRISPR-Cas по настоящему изобретению и/или приспосабливать к ней.
В качестве другого примера конкретного применения, факторы роста сосудов, в том числе VEGF, и ангиогенин, и другие, являются существенно важными для неоваскуляризации. Локальная доставка факторов, пептидов, пептидомиметиков или подавление их репрессоров является важным терапевтическим воздействием; сайленсинг репрессоров и локальная доставка факторов, пептидов, макромолекул и низкомолекулярных лекарственных средств, стимулирующих ангиогенез, с помощью Loder являются терапевтическими мерами в отношении заболевания периферических сосудов, системного заболевания сосудов и заболевания сосудов сердца.
Способ вставки, такой как имплантация, необязательно можно еще применять для других типов имплантации в ткань, и/или для вставок, и/или для отбора образцов тканей, необязательно без модификаций или, альтернативно, необязательно лишь с незначительными модификациями таких способов. Такие способы необязательно включают, без ограничения, способы близкофокусной лучевой терапии, биопсию, эндоскопию с применением ультразвуковых технологий и/или без них, такую как ERCP, стереотаксические способы в отношении ткани головного мозга, лапароскопию, в том числе имплантацию с помощью лапароскопа в суставы, органы брюшной полости, стенку мочевого пузыря и полости тела.
мРНК фермента CMSPR и направляющая РНК
мРНК фермента CRISPR и направляющую РНК можно также доставлять по отдельности. мРНК фермента CRISPR можно доставлять перед направляющей РНК, чтобы предоставить время для экспрессии фермента CRISPR. мРНК фермента CRISPR можно вводить за 1-12 часов (предпочтительно примерно за 2-6 часов) до введения направляющей РНК.
Альтернативно, мРНК фермента CRISPR и направляющую РНК можно вводить совместно. Вторую бустерную дозу направляющей РНК можно преимущественно вводить через 1-12 часов (предпочтительно примерно через 2-6 часов) после первого введения мРНК фермента CRISPR + направляющей РНК.
Введение дополнительных доз мРНК фермента CRISPR и/или направляющей РНК может быть применимым для достижения наиболее эффективных уровней модификации генома.
Для сведения к минимуму токсичности и нецелевого эффекта будет важной регуляция концентрации доставляемых мРНК фермента CRISPR и направляющей РНК. Оптимальные концентрации мРНК фермента CRISPR и направляющей РНК можно определить путем тестирования различных концентраций в клеточной или животной модели и применения глубокого секвенирования для анализа степени модификации в возможных нецелевых локусах генома. Например, для направляющей последовательности, нацеливающейся на 5'-GAGTCCGAGCAGAAGAAGAA-3' (SEQ ID NO:) в гене ЕМХ1 генома человека, можно применять глубокое секвенирование для определения уровня модификации в следующих двух нецелевых локусах, 1: 5'-GAGTCCTAGCAGGAGAAGAA-3' (SEQ ID NO:) и 2: 5'-GAGTCTAAGCAGAAGAAGAA-3' (SEQ ID NO:). Для доставки in vivo следует выбрать концентрацию, дающую наиболее высокий уровень целевой модификации при сведении к минимуму уровня нецелевой модификации.
Альтернативно, для сведения к минимуму уровня токсичности и нецелевого эффекта можно доставлять мРНК фермента никазы CRISPR (например, Cas9 S. pyogenes с мутацией D10A) вместе с парой направляющих РНК, которые осуществляют нацеливание на сайт, представляющий интерес. Две направляющие РНК необходимо расположить следующим образом. Направляющие последовательности показаны красным (одинарное подчеркивание) и синим (двойное подчеркивание), соответственно (эти примеры основаны на требованиях к РАМ для Cas9 Streptococcus pyogenes).




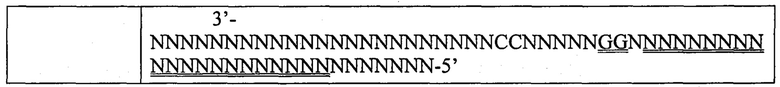
Дополнительное исследование системы предоставило заявителям свидетельство наличия "липкого" 5'-конца (см., например. Ran et al., Cell. 2013 Sep 12; 154(6): 13 80-9 и предварительную заявку на патент США с регистрационным номером 61/871301, поданную 28 августа 2013 г.). Заявители дополнительно идентифицировали параметры, связанные с эффективным расщеплением мутантной никазой Cas9 в сочетании с двумя направляющими РНК, и эти параметры включают, без ограничения, длину "липкого" 5'-конца. В вариантах осуществления настоящего изобретения "липкий" 5'-конец содержит не более 200 пар оснований, предпочтительно не более 100 пар оснований или более предпочтительно не более 50 пар оснований. В вариантах осуществления настоящего изобретения "липкий" 5'-конец содержит по меньшей мере 26 пар оснований, предпочтительно по меньшей мере 30 пар оснований или более предпочтительно 34-50 пар оснований или 1-34 пары оснований. В других предпочтительных способах по настоящему изобретению первая направляющая последовательность, управляющая расщеплением одной нити ДНК-дуплекса возле первой целевой последовательности, и вторая направляющая последовательность, управляющая расщеплением другой нити возле второй целевой последовательности, обуславливают возникновение "тупого" конца или "липкого" 3'-конца. В вариантах осуществления настоящего изобретения "липкий" 3'-конец содержит не более 150, 100 или 25 пар оснований или не менее 15, 10 или 1 пары оснований. В предпочтительных вариантах осуществления "липкий" 3'-конец содержит 1-100 пар оснований.
Аспекты настоящего изобретения относятся к снижению экспрессии продукта гена, или к дополнительному введению матричного полинуклеотида в молекулу ДНК, кодирующую продукт гена, или к точному вырезанию вставочной последовательности путем обеспечения повторного отжига и дотирования двух "липких" 5'-концов, или к изменению активности или функционирования продукта гена, или к повышению экспрессии продукта гена. В варианте осуществления настоящего изобретения продукт гена представляет собой белок.
Только пары sgRNA, создающие "липкие" 5'-концы, с перекрыванием между направляющими последовательностями, составляющим менее 8 п. о. (смещение превышает -8 п. о.), были способны опосредовать выявляемое образование вставок/делеций. Важно, что каждая направляющая последовательность, применяемая в данных анализах, способна эффективно индуцировать образование вставок/делеций при спаривании с Cas9 дикого типа, что указывает на то, что взаимное расположение пар направляющих последовательностей является наиболее важным параметром для предсказания активности внесения двойных однонитевых разрывов.
Поскольку Cas9n и Cas9H840A вносят однонитевые разрывы в противоположные нити ДНК, замена Cas9n на Cas9H840A с указанной парой sgRNA должна обуславливать инверсию типа "липкого" конца. Например, пара sgRNA, которая с Cas9n будет образовывать "липкий" 5'-конец, теоретически будет образовывать вместо этого соответствующий "липкий" 3'-конец. Таким образом, пары sgRNA, обуславливающие с Cas9n образование "липкого" 3'-конца, можно применять с Cas9H840A для образования "липкого" 5'-конца. Заявители тестировали Cas9H840A с набором пар sgRNA, предназначенных для образования "липких" как 5'-, так и 3'-концов (диапазон смещений от -278 до +58 п.о.), но, вопреки ожиданиям, не могли наблюдать образование вставок/делеций. Может потребоваться дополнительная работа для определения необходимых правил конструирования пар sgRNA для обеспечения внесения двойных однонитевых разрывов с помощью Cas9H840A.
Печень, пропротеинконвертаза субтилизин/кексин 9 (PCSK9)
Данные демонстрируют фенотипическую конверсию.
Пропротеинконвертаза субтилизин/кексин 9 (PCSK9) является представителем семейства сериновых протеаз субтилизинового типа. PGSK9 экспрессируется главным образом в печени и является критически важным для снижения экспрессии рецепторов LDL в гепатоцитах. Уровни LDL-C в плазме значительно повышены у людей с мутациями приобретения функции в PCSK9, вследствие чего их считают имеющими тяжелую гиперхолестеринемию. Таким образом, PCSK9 является привлекательной мишенью для CRISPR. Целенаправленно воздействующие на PCS9K CRISPR можно составлять в липидных частицах и вводить, например, при приблизительно 15, 45, 90, 150, 250 и 400 мкг/кг внутривенно (см., например, http://www.alnylam.com/capella/wp-content/uploads/2013/08/ALN-PCS02-001-Protocol-Lancet.pdf).
Bailey et al. (J Mol Med (Beri). 1999 Jan; 77(1):244-9) раскрывает доставку инсулина посредством генной терапии соматических клеток ex vivo, включающей выделение отличных от В-клеток соматических клеток (например, фибробластов) у пациента с диабетом и генетическое изменение их in vitro для выработки и секреции инсулина. Клетки можно выращивать в культуре и возвращать донору в качестве источника заменителя инсулина. Клетки, модифицированные таким образом, можно оценивать перед имплантацией, а резервные запасы можно подвергать криоконсервации. В случае применения собственных клеток пациента процедура будет избавлена от необходимости в 132 подавлении иммунитета и преодолеет проблему снабжения тканей, избегая при этом повторного разрушения клеток. Для генной терапии соматических клеток ex vivo требуется доступный и устойчивый тип клеток, поддающийся нескольким трансфекциям и подвергаемый регулируемой пролиферации. Особые проблемы, связанные с применением отличных от В-клеток соматических клеток, включают процессинг проинсулина в инсулин и придание чувствительности стимулируемому глюкозой биосинтезу проинсулина и регулируемому высвобождению инсулина. Предварительные исследования с применением фибробластов, гипофизарных клеток, клеток почек (COS) и клеток яичников (СНО) позволяют предположить, что эти проблемы могут быть разрешены и что генная терапия соматических клеток ех vivo предлагает возможный подход к заместительной терапии инсулином. Систему по Bailey и соавт. можно применять для доставки системы CRISPR-Cas по настоящему изобретению в печень и/или приспосабливать к ней.
Способы по Sato et al. (Nature Biotechnology Volume 26 Number 4 April 2008, Pages 431-442) можно применять для доставки системы CRISPR-Cas по настоящему изобретению в печень. Sato и соавт. обнаружили, что виды лечения с помощью связанных с витамином А липосом, содержащих siRNA, практически полностью устраняли фиброз печени и продлевали период выживаемости у крыс со смертельным в иных случаях циррозом печени, индуцированным диметилнитрозамином, в зависимости от дозы и продолжительности. Катионные липосомы (Lipotrust), содержащие O,O'-дитетрадеканоил-N-(а-триметиламмонийацетил)диэтаноламинохлорид (DC-6-14) в качестве катионного липида, холестерин и диолеоилфосфатидилэтаноламин в молярном соотношении 4:3:3 (демонстрировавшие высокую эффективность трансфекции в условиях сывороточной среды для доставки генов in vitro и in vivo), приобретали у Hokkaido System Science. Липосомы изготовляли посредством способа с применением подвергнутых сублимационной сушке "пустых" липосом и получали в концентрации 1 мМ (DC-16-4) путем добавления бидистиллированной воды (DDW) к лиофилизированной смеси липидов при перемешивании вихревой мешалкой перед применением. Для получения связанных с VA липосом 200 нмоль витамина А (ретинол, Sigma), растворенного в DMSO, смешивали с суспензиями липосом (в виде 100 нмоль DC-16-4) путем перемешивания вихревой мешалкой в пробирке на 1,5 мл при 25°С. Для получения связанных с VA липосом, несущих siRNAgp46 (VA-липосома-siRNAgp46), раствор siRNAgp46 (580 пмоль/мл в DDW) добавляли к раствору связанных с ретинолом липосом при перемешивании при 25°С. Соотношение siRNA и DC-16-4 составляло 1:11,5 (моль/моль), а соотношение siRNA и липосом (вес/вес) составляло 1:1. Любой свободный витамин А или siRNA, не поглощенную липосомами, отделяли от липосомальных препаратов при помощи системы микроразделения (концентратор VIVASPIN 2, MWCO 30000, PES, VIVASCIENCE). Суспензию липосом добавляли на фильтры и центрифугировали при 1500 g в течение 5 мин. 3 раза при 25°С. Фракции собирали, и материал, захваченный фильтром, разводили в PBS с получением желаемой дозы для применения in vitro или in vivo. Крысам проводили три инъекции по 0,75 мг/кг siRNA через день. Систему по Sato и соавт. можно применять для доставки системы CRISPR-Cas по настоящему изобретению в печень посредством доставки приблизительно 0,5-1 мг/кг РНК CRISPR-Cas в липосомах, как описано Sato и соавт. , людям, и/или приспосабливать к ней.
Способы по Rozema et al. (PNAS, August 7, 2007, vol. 104, no. 32) в отношении средств доставки siRNA в гепатоциты как in vitro, так и in vivo, которые Rozema и соавт. назвали динамическими поликонъюгатами siRNA, можно также применять в настоящем изобретении. Ключевые особенности технологии динамических поликонъюгатов включают применение мембраноактивного полимера, способность к обратимой маскировке активности данного полимера до достижения им кислой среды эндосом и способность к специфичному целенаправленному воздействию этого модифицированного полимера и его молекулы-карго siRNA на гепатоциты in vivo после простой i.v. инъекции под низким давлением. SATA-модифицированные siRNA синтезируют с помощью реакции 5'-аминомодифицированной siRNA с 1 весовым эквивалентом (вес. экв.) реагента N-сукцинимидил-S-ацетилтиоацетата (SATA) (Pierce) и 0,36 вес. экв. NaHCO3 в воде при 4°С в течение 16 ч. Модифицированные siRNA затем осаждают путем добавления 9 об. этанола и инкубирования при 80°С в течение 2 ч. Осадок ресуспендируют в 1X буфере для siRNA (Dharmacon) и оценивают количественно путем измерения поглощения при длине волны 260 нм. PBAVE (30 мг/мл в 5 мМ TAPS, pH 9) модифицируют путем добавления 1,5 вес. % SMPT (Pierce). После инкубирования в течение 1 ч. 0,8 мг SMPT-PBAVE добавляли к 400 мкл изотонического раствора глюкозы, содержащего 5 мМ TAPS (pH 9). К этому раствору добавляли 50 мкг SATA-модифицированной siRNA. Для экспериментов по изучению зависимости "доза-эффект", где [PBAVE] была постоянной, добавляют различные количества siRNA. Смесь затем инкубируют в течение 16 ч. К раствору затем добавляют 5,6 мг свободного основания Hepes, а после этого смесь 3,7 мг CDM-NAG и 1,9 мг CDM-PEG. Раствор затем инкубируют в течение по меньшей мере 1 ч. при комнатной температуре перед инъекцией. CDM-PEG и CDM-NAG синтезируют из хлорангидрида, образующегося посредством применения оксалилхлорида. К хлорангидриду добавляют 1,1 молярного эквивалента монометилового эфира полиэтиленгликоля (средняя молекулярная масса 450) с образованием CDM-PEG или (аминоэтокси)этокси-2- (ацетиламино)-2-дезокси-β-D-глюкопиранозида с образованием CDM-NAG. Конечный продукт очищают с помощью обращенно-фазовой HPLC с 0,1% TFA в градиенте вода/ацетонитрил. Мышам доставляли приблизительно 25-50 мкг siRNA. Систему по Rozema и соавт. можно применять для доставки системы CRISPR-Cas по настоящему изобретению в печень, например, предусматривая дозу от приблизительно 50 до приблизительно 200 мг CRISPR-Cas для доставки человеку.
Кость
Oakes and Lieberman (Clin Orthop Relat Res. 2000 Oct; (379 Suppl): S101-12) обсуждают доставку генов в кость. Путем переноса генов в клетки в конкретном анатомическом участке можно использовать остеоиндуктивные свойства факторов роста в физиологических дозах в течение длительного периода для содействия более значительной реакции заживления. Конкретный анатомический участок, качество кости и мягкотканный футляр влияют на выбор целевых клеток для регионарной генной терапии. Векторы для генной терапии, доставляемые в обрабатываемый участок в остеоиндуктивных носителях, давали многообещающие результаты. Некоторые исследователи показали впечатляющие результаты, применяя регионарную генную терапию в животных моделях ex vivo и in vivo. Такую систему можно применять для доставки системы CRISPR-Cas в кость и/или приспосабливать к ней.
Головной мозг
Варианты доставки в головной мозг включают инкапсулирование фермента CRISPR и направляющей РНК в форме ДНК или РНК в липосомы и конъюгацию с "молекулярными троянскими конями" для доставки через гематоэнцефалический барьер (ВВВ). Было показано, что "молекулярные троянские кони" являются эффективными для доставки векторов экспрессии B-gal в головной мозг отличных от человека приматов. Этот же подход можно применять для доставки векторов, содержащих фермент CRISPR и направляющую РНК. Например, Xia CF and Boado RJ, Pardridge WM ("Antibody-mediated targeting of siRNA via the human insulin receptor using avidin-biotin technology." Mol Pharm. 2009 May-Jun; 6(3):747-51. doi: 10.1021/mp800194) описывают возможность доставки коротких интерферирующих РНК (siRNA) в клетки в культуре и in vivo в случае комбинированного применения моноклонального антитела (mAb), специфичного к рецептору, и авидин-биотиновой технологии. Авторы также сообщают, что, поскольку в случае применения авидин-биотиновой технологии связь между нацеливающим mAb и siRNA является устойчивой, после внутривенного введения целенаправленно воздействующей siRNA наблюдаются эффекты RNAi in vivo в отдаленных участках, таких как головной мозг.
Zhang et al. (Mol Ther. 2003 Jan; 7(1):11-8.)) описывают, как экспрессионные плазмиды, кодирующие репортеры, такие как люцифераза, инкапсулировали во внутреннее пространство "искусственного вируса", включающего пегилированную иммунолипосому размером 85 нм, нацеливаемую на головной мозг макака-резуса in vivo с помощью моноклонального антитела (MAb) к рецептору инсулина человека (HIR). МАb к HIR позволяет липосоме, несущей экзогенный ген, подвергаться трансцитозу через гематоэнцефалический барьер и эндоцитозу через плазматическую мембрану нейронов после внутривенной инъекции. Уровень экспрессии гена люциферазы в головном мозге у макака-резуса был в 50 раз выше по сравнению с крысой. Широко распространенная экспрессия гена бета-галактозидазы в нейронах головного мозга приматов была продемонстрирована с помощью как гистохимического анализа, так и конфокальной микроскопии. Авторы указывают, что данный подход позволяет достичь обратимой экспрессии трансгена у взрослых животных в течение 24 часов. Соответственно, применение иммунолипосом является предпочтительным. Их можно использовать в сочетании с антителами для нацеливания на конкретные ткани или белки клеточной поверхности.
Также являются предпочтительными другие средства доставки РНК, как, например, посредством наночастиц (Cho, S., Goldberg, M., Son, S., Xu, Q., Yang, F., Mei, Y., Bogatyrev, S., Langer, R. and Anderson, D., Lipid-like nanoparticles for small interfering RNA-delivery to endothelial cells. Advanced Functional Materials, 19: 3112-3118, 2010) или экзосом (Schroeder, A., Levins, С., Cortez, С., Langer, R., and Anderson, D., Lipid-based nanotherapeutics for siRNA delivery. Journal of Internal Medicine, 267: 9-21, 2010, PMID: 20059641).
Так, было показано, что экзосомы являются особенно применимыми в доставке siRNA, системы, в некоторой степени сходной с системой CRISPR. Например, Еl-Andaloussi S, et al. ("Exosome-mediated delivery of siRNA in vitro and in vivo." Nat Protoc. 2012 Dec; 7(12): 2112-26. doi: 10.1038/nprot.2012.131. Epub 2012 Nov 15.) описывают, как экзосомы, являющиеся перспективными инструментами доставки лекарственных средств через различные биологические барьеры, можно приспособить для доставки siRNA in vitro и in vivo. Данный подход заключается в создании нацеленных экзосом посредством трансфекции вектором экспрессии, содержащим белок экзосом, слитый с пептидным лигандом. Экзосомы затем очищают от надосадочной жидкости с трансфицированными клетками и характеризуют, а затем в экзосомы загружают siRNA. Доставку или введение согласно настоящему изобретению можно осуществлять с помощью экзосом, в частности, без ограничения, в головной мозг.
Витамин Е (α-токоферол) можно конъюгировать с CRISPR-Cas и доставлять в головной мозг вместе с липопротеином высокой плотности (HDL), например, аналогично тому, как это было выполнено Uno et al. (HUMAN GENE THERAPY 22: 711-719 (June 2011)) для доставки коротких интерферирующих РНК (siRNA) в головной мозг. Мышам проводили инфузию с помощью осмотических мининасосов (модель 1007D; Alzet, Купертино, Калифорния), наполненных фосфатно-солевым буфером (PBS), или свободной Toc-siBACE, или Toc-siBACE/HDL, и соединенных с набором 3 для инфузий в головной мозг (Alzet). Канюлю для инфузий в головной мозг размещали приблизительно на 0,5 мм кзади от брегмы на средней линии для инфузий в дорсальную часть третьего желудочка. Uno и соавт. обнаружили, что всего 3 нмоля Toc-siRNA с HDL в том же способе ICV инфузий могут индуцировать сравнимую степень целевого снижения. Аналогичная доза CRISPR-Cas, конъюгированной с α-токоферолом и вводимой совместно с HDL, нацеливающейся на головной мозг, может предусматриваться в настоящем изобретении для людей, например, может предусматриваться от приблизительно 3 нмоль до приблизительно 3 мкмоль CRISPR-Cas, нацеливающейся на головной мозг.
Zou et al. ((HUMAN GENE THERAPY 22: 465-475 (April 2011)) описывают способ опосредованной лентивирусами доставки коротких шпилечных РНК, целенаправленно воздействующих на PKCγ, для in vivo сайленсинга генов в спинном мозге крыс. Zou и соавт. вводили приблизительно 10 мкл рекомбинантного лентивируса с титром 1×109 трансдуцирующих единиц (ТЕ)/мл с помощью интратекального катетера. Аналогичная доза экспрессируемой CRISPR-Cas в лентивирусном векторе, нацеливающемся на головной мозг, может предусматриваться в настоящем изобретении для людей, например, может предусматриваться приблизительно 10-50 мл CRISPR-Cas, нацеливающейся на головной мозг, в лентивирусе с титром 1×109 трансдуцирующих единиц (ТЕ)/мл.
Направленная деления, терапевтические применения
Целенаправленная делеция генов является предпочтительной. Примеры проиллюстрированы в примере 18. Таким образом, предпочтительными являются гены, вовлеченные в биосинтез холестерина, биосинтез жирных кислот и другие I метаболические нарушения, гены, кодирующие неправильно свернутые белки, вовлеченные в амилоидоз и другие заболевания, онкогены, приводящие к трансформации клеток, гены латентных вирусов и гены, приводящие к доминантно-негативным нарушениям среди прочих нарушений. Как проиллюстрировано здесь, заявители отдают предпочтение доставке генов системы CRISPR-Cas в ткань печени, головного мозга, глазную, эпителиальную, кроветворную или иную ткань субъекта или пациента, нуждающегося в этом, страдающего от метаболических нарушений, амилоидоза и заболеваний, связанных с агрегацией белков, трансформации клеток, возникающей в результате генетических мутаций и транслокаций, доминантно-негативных эффектов генных мутаций, латентных вирусных инфекций и других связанных симптомов, с использованием либо вирусных систем доставки, либо систем доставки на основе наночастиц.
Терапевтические применения системы CRISPR-Cas включают применения при глаукоме, амилоидозе и болезни Гентингтона. Они проиллюстрированы в примере 20, и особенности, описанные там, являются предпочтительными по отдельности или в комбинации.
Другой пример заболевания, характеризующегося экспансией полиглутаминовых повторов, которое можно лечить с помощью настоящего изобретения, включает спинально-церебеллярную атаксию 1 типа (SCA1). При внутримозжечковой инъекции векторы на основе рекомбинантного аденоассоциированного вируса (AAV), экспрессирующие короткие шпилечные РНК, существенно улучшают координацию движений, восстанавливают морфологические характеристики мозжечка и устраняют характерные включения атаксина 1 в клетках Пуркинье мышей с SCA1 (см., например, Xia et al., Nature Medicine, Vol. 10, No. 8, Aug. 2004). В частности, предпочтительными являются векторы AAV1 и AAV5, и желаемыми являются титры AAV, составляющие приблизительно 1×1012 векторных геномов/мл.
В качестве примера, можно лечить или предупреждать хроническую инфекцию, вызываемую HIV-1. Для выполнения этой задачи можно создать направляющие РНК CRISPR-Cas, которые осуществляют нацеливание на подавляющее большинство геномов HIV-1 с учетом вариантов штаммов HIV-1 для максимального охвата и эффективности. Можно осуществлять доставку системы CRISPR-Cas с помощью общепринятой, опосредованной аденовирусом или лентивирусом инфекции иммунной системы хозяина. В зависимости от подхода иммунные клетки хозяина могут быть а) выделены, трансдуцированы CRISPR-Cas, подвергнуты отбору и повторно введены хозяину или b) трансдуцированы in vivo путем системной доставки системы CRISPR-Cas. Первый подход обеспечивает возможность получения популяции устойчивых иммунных клеток, тогда как второй, по всей вероятности, целенаправленно воздействует на скрытые резервуары вируса в хозяине. Более подробно это обсуждается в разделе "Примеры".
В другом примере публикация заявки на патент США №20130171732, закрепленная за Sangamo BioSciences, Inc., относится к вставке в геном трансгена, действующего против HIV, способы которой можно применять к системе CRISPR-Cas по настоящему изобретению. В другом варианте осуществления можно целенаправленно воздействовать на ген CXCR4, и систему TALE согласно публикации заявки на патент США №20100291048, закрепленной за Sangamo BioSciences, Inc., можно модифицировать для системы CRISPR-Cas по настоящему изобретению. Способ согласно публикациям заявок на патенты США №№20130137104 и 20130122591, закрепленным за Sangamo BioSciences, Inc., и публикации заявки на патент США №20100146651, закрепленной за Cellectis, может быть в более общем смысле применимьм к экспрессии трансгена, поскольку он включает модификацию локуса гена гипоксантингуанинфосфорибозилтрансферазы (HPRT) для повышения частоты модификации гена.
В настоящем изобретении также предусматривается создание клеточной библиотеки нокаутных генов. Каждая клетка может иметь один нокаутный ген. Это проиллюстрировано в примере 23.
Можно получить библиотеку клеток ES, в которой каждая клетка имеет один нокаутный ген, и в полной библиотеке клеток ES все без исключения гены будут нокаутными. Эта библиотека применима для скрининга функции гена в клеточных процессах, а также в заболеваниях. Для получения этой клеточной библиотеки заявители могут интегрировать Cas9, управляемый индуцируемым промотором (например, индуцируемым доксициклином промотором), в клетку ES. Кроме того, можно интегрировать одну направляющую РНК, осуществляющую нацеливание на конкретный ген в клетке ES. Для создания библиотеки клеток ES можно просто смешать клетки ES с библиотекой генов, кодирующих направляющие РНК, которые осуществляют нацеливание на каждый ген в геноме человека. Сначала можно ввести один сайт attB для ВхВ1 в локус AAVS1 в клетках ES человека. Затем можно использовать интегразу ВхВ1 для облегчения интеграции отдельных генов направляющих РНК в сайт attB для ВхВ1 в локусе AAVS1. Для облегчения интеграции каждый ген направляющей РНК можно размещать на плазмиде, которая несет один сайт attP. Таким образом, ВхВ1 будет рекомбинировать сайт attB в геноме с сайтом attP на плазмиде, содержащей направляющую РНК. Для создания клеточной библиотеки можно взять библиотеку клеток, имеющих отдельные интегрированные направляющие РНК, и индуцировать экспрессию Cas9. После индукции Cas9 опосредует двухнитевой разрыв в сайтах, определенных направляющей РНК.
Длительное введение белковых терапевтических средств может вызвать нежелательные иммунные ответы на данный белок. Иммуногенность белковых лекарственных средств может объясняться наличием нескольких иммунодоминантных эпитопов для Т-лимфоцитов-хелперов (HTL). Путем снижения аффинности связывания этих эпитопов для HTL, содержащихся в данных белках, с МНС можно создавать лекарственные средства с более низкой иммуногенностью (Tangri S, et al. ("Rationally engineered therapeutic proteins with reduced immunogenicity" J Immunol. 2005 Mar 15; 174(6): 3187-96.) В настоящем изобретении иммуногенность фермента CRISPR, в частности, можно снизить, следуя подходу, впервые изложенному Tangri и соавт. в отношении эритропоэтина и впоследствии получившему развитие. Соответственно, для снижения иммуногенности фермента CRISPR (например, Cas9) у вида-хозяина (человека или другого вида) можно применять направленную эволюцию или рациональное проектирование.
В примере 28 заявители применяют 3 направляющие РНК, представляющие интерес, и могут визуализировать эффективное расщепление ДНК in vivo, имеющее место лишь в небольшой субпопуляции клеток. В сущности, здесь заявители показали направленное расщепление in vivo. В частности, это предоставляет подтверждение концепции, заключающейся в том, что у высших организмов, таких как млекопитающие, также можно достичь специфичного целенаправленного воздействия. Это также подчеркивает множественность аспекта в том отношении, что несколько направляющих последовательностей (т.е. воздействующих на отдельные мишени) можно использовать одновременно (в смысле совместной доставки). Другими словами, заявители применяли многосторонний подход с несколькими различными последовательностями, целенаправленно воздействующими в одно и то же время, но независимо.
Подходящий пример протокола получения AAV, предпочтительного вектора согласно настоящему изобретению, приведен в примере 34.
Нарушения, связанные с экспансией тринуклеотидных повторов, являются предпочтительными состояниями для лечения. Они также проиллюстрированы в данном документе.
Например, в публикации заявки на патент США №20110016540 описывается применение нуклеаз с "цинковыми пальцами" для генетической модификации клеток, животных и белков, ассоциированных с нарушениями, связанными с экспансией тринуклеотидных повторов. Нарушения, связанные с экспансией тринуклеотидных повторов, являются комплексными прогрессирующими нарушениями, затрагивающими биологию развития нервной системы и часто нарушающими когнитивные функции, а также сенсомоторные функции.
Белки, связанные с экспансией тринуклеотидных повторов, представляют собой разнородную группу белков, ассоциированных с восприимчивостью к развитию нарушения, связанного с экспансией тринуклеотидных повторов, наличием нарушения, связанного с экспансией тринуклеотидных повторов, тяжестью нарушения, связанного с экспансией тринуклеотидных повторов, или любой их комбинацией. Нарушения, связанные с экспансией тринуклеотидных повторов, подразделяют на две категории, определяемые типом повтора. Наиболее распространенным повтором является триплет CAG, который в случае наличия в кодирующем участке гена кодирует аминокислоту глутамин (Q). Таким образом, эти нарушения называются нарушениями, связанными с экспансией полиглутаминовых повторов (поли-Q), и включают следующие заболевания: болезнь Гентингтона (HD); спинобульбарную мышечную атрофию (SBMA); формы спинально-церебеллярной атаксии (SCA типов 1, 2, 3, 6, 7 и 17) и дентато-рубро-паллидо-льюисову атрофию (DRPLA). Остальные нарушения, связанные с экспансией тринуклеотидных повторов, при которых триплет CAG не вовлечен либо триплет CAG находится не в кодирующем участке гена, называются, таким образом, нарушениями, не связанными с экспансией полиглутаминовых повторов. Нарушения, не связанные с экспансией полиглутаминовых повторов, включают синдром ломкой Х-хромосомы (FRAXA); синдром умственной отсталости, сцепленный с ломкой Х-хромосомой (FRAXE); атаксию Фридрейха (FRDA); миотоническую дистрофию (DM) и формы спинально-церебеллярной атаксии (SCA типов 8 и 12).
Белки, ассоциированные с нарушениями, связанными с экспансией тринуклеотидных повторов, обычно выбирают на основании экспериментального изучения взаимосвязи белка, ассоциированного с нарушением, связанным с экспансией тринуклеотидных повторов, и нарушения, связанного с экспансией тринуклеотидных повторов. Например, скорость образования или концентрация в кровотоке белка, ассоциированного с нарушением, связанным с экспансией тринуклеотидных повторов, может быть повышенной или пониженной в популяции, имеющей нарушение, связанное с экспансией тринуклеотидных повторов, по сравнению с популяцией, не имеющей нарушения, связанного с экспансией тринуклеотидных повторов. Различия по уровням белка можно оценить при помощи протеомных методик, в том числе, без ограничения, вестерн-блот-анализа, иммуногистохимического окрашивания, твердофазного иммуноферментного анализа (ELISA) и масс-спектрометрии. В альтернативном случае белки, ассоциированные с нарушениями, связанными с экспансией тринуклеотидных повторов, можно идентифицировать путем получения профилей экспрессии генов для генов, кодирующих белки, при помощи методик геномного анализа, в том числе, без ограничения, микроматричного анализа ДНК, серийного анализа экспрессии генов (SAGE) и количественной полимеразной цепной реакции в режиме реального времени (Q-PCR).
Неограничивающие примеры белков, ассоциированных с нарушениями, связанными с экспансией тринуклеотидных повторов, включают AR (андрогенный рецептор), FMR1 (белок 1, ассоциированный с умственной отсталостью, сцепленной с ломкой Х-хромосомой), НТТ (гентингтин), DMPK (протеинкиназу, ассоциированную с миотонической дистрофией), FXN (фратаксин), ATXN2 (атаксин 2), ATN1 (атрофин 1), FEN1 (структуроспецифичную флэп-эндонуклеазу 1), TNRC6A (белок, кодируемый геном 6А, содержащим тринуклеотидные повторы), PABPN1 (ядерный поли(А)-связывающий белок 1), JPH3 (юнктофилин 3), MED15 (субъединицу 15 медиаторного комплекса), ATXN1 (атаксин 1), ATXN3 (атаксин 3), ТВР (ТАТА-бокс-связывающий белок), CACNA1A (альфа-1A-субъединицу потенциал-зависимого кальциевого канала P/Q-типа), ATXN80S (белок, синтезируемый с противоположной нити ATXN8 (не кодирующей белок)), PPP2R2B (бета-изоформу регуляторной субъединицы В протеинфосфатазы 2), ATXN7 (атаксин 7), TNRC6B (белок, кодируемый геном 6В, содержащим тринуклеотидные повторы), TNRC6C (белок, кодируемый геном 6С, содержащим тринуклеотидные повторы), CELF3 (CUGBP, член 3 семейства Elav-подобных белков), MAB21L1 (mab-21-подобный белок 1 (С.elegans)), MSH2 (гомолог 2 mutS, ассоциированный с неполипозным колоректальным раком типа 1 (Е. coli)), TMEM185A (трансмембранный белок 185А), SIX5 (белок, кодируемый гомеобоксом 5 SIX), CNPY3 (гомолог Canopy 3 (данио-рерио)), FRAXE (белок, ассоциированный с "редким" ломким сайтом, проявляющимся при недостатке фолиевой кислоты, fra(X)(q28) Е), GNB2 (бета-полипептид 2 белка, связывающего гуаниновые нуклеотиды (G-белка)), RPL14 (рибосомный белок L14), ATXN8 (атаксин 8), INSR (инсулиновый рецептор), TTR (транстиретин), ЕР400 (E1A-связывающий белок р400), GIGYF2 (белок GYF 2, взаимодействующий с GRB10), OGG1 (8-оксогуанин-ДНК-гликозилазу), STC1 (станниокальцин 1), CNDP1 (карнозиндипептидазу 1 (металлопептидазу семейства М20)), C10orf2 (белок, кодируемый открытой рамкой считывания 2 хромосомы 10), MAML3 (mastermind-подобный белок 3 (Drosophila)), DKC1 (белок 1, ассоциированный с врожденным дискератозом, дискерин), PAXIP1 (белок 1, взаимодействующий с PAX (с доменом активации транскрипции)), CasK (кальций/кальмодулин-зависимую сериновую протеинкиназу (семейства MAGUK)), МАРТ (белок tau, ассоциированный с микротрубочками), SP1 (фактор транскрипции Sp1), POLG (полимеразу гамма (ДНК-направленную)), AFF2 (член 2 семейства AF4/FMR2), THBS1 (тромбоспондин 1), ТР53 (опухолевый белок р53), ESR1 (эстрогеновый рецептор 1), CGGBP1 (белок 1, связывающий триплетный повтор CGG), ABT1 (активатор 1 базальной транскрипции), KLK3 (родственную калликреину пептидазу 3), PRNP (белок приона), JUN (онкоген jun), KCNN3 (кальций-активируемый калиевый канал средней/малой проводимости, представитель 3 подсемейства N), ВАХ (BCL2-ассоциированный белок X), FRAXA (белок, ассоциированный с "редким" ломким сайтом, проявляющимся при недостатке фолиевой кислоты, fra(X)(q27.3) А (макроорхидизм, умственная отсталость)), KBTBD10 (белок 10, содержащий повтор Kelch и домен ВТВ (POZ)), MBNL1 (muscleblind-подобный белок (Drosophila)), RAD51 (гомолог RAD51 (гомолог RecA, E.coli) (S. cerevisiae)), NCOA3 (коактиватор 3 ядерных рецепторов), ERDA1 (белок с экспансией повторяющихся доменов, CAG/CTG 1), TSC1 (белок 1, ассоциированный с туберозным склерозом), СОМР (олигомерный матриксный белок хряща), GCLC (каталитическую субъединицу глутаматцистеинлигазы), RRAD (Ras-родственный белок, ассоциированный с сахарным диабетом), MSH3 (гомолог 3 mutS (E.coli)), DRD2 (дофаминовый рецептор D2), CD44 (молекулу CD44 (система групп крови Indian)), CTCF (СССТС-связывающий фактор (белок с "цинковыми пальцами")), CCND1 (циклин D1), CLSPN (гомолог класпина (Xenopus laevis)), MEF2A (энхансерный фактор 2А миоцитов), PTPRU (протеинтирозинфосфатазу рецепторного типа U), GAPDH (глицеральдегид-3-фосфатдегидрогеназу), TRIM22 (белок 22, содержащий тройной мотив), WT1 (белок 1 опухоли Вильмса), AHR (арил-углеводородный рецептор), GPX1 (глутатионпероксидазу 1), ТРМТ (тиопурин-3-метилтрансферазу), NDP (белок, ассоциированный с болезнью Норри (псевдоглиомой)), ARX (белок, кодируемый гомеобоксом гена, родственного aristaless), MUS81 (гомолог эндонуклеазы MUS81 (S. cerevisiae)), TYR (тирозиназу (глазокожный альбинизм IA)), EGR1 (белок 1 раннего ростового ответа), UNG (урацил-ДНК-гликозилазу), NUMBL (белок, подобный гомологу numb (Drosophila)), FABP2 (белок 2, связывающий жирные кислоты в кишечнике), EN2 (белок, кодируемый гомеобоксом engrailed 2), CRYGC (гамма-С-кристаллин), SRP14 (гомологичный РНК-связывающий белок Alu размером 14 кДа из частицы узнавания сигнала), CRYGB (гамма-В-кристаллин), PDCD1 (белок 1 запрограммированной гибели клеток), НОХА1 (белок, кодируемый гомеобоксом A1), ATXN2L (атаксин-2-подобный белок), PMS2 (PMS2, белок 2, противодействующий повышению уровня постмейотической сегрегации (S. cerevisiae)), GLA (альфа-галактозидазу), CBL (белок, кодируемый последовательностью, трансформирующей с экотропным ретровирусом Cas-Br-M (мышей)), FTH1 (полипептид 1 тяжелой субъединицы ферритина), IL12RB2 (бета-2-субъединицу рецептора интерлейкина 12), ОТХ2 (белок, кодируемый гомеобоксом orthodenticle 2), НОХА5 (белок, кодируемый гомеобоксом А5), POLG2 (вспомогательную гамма-2-субъединицу полимеразы (ДНК-направленной)), DLX2 (белок, кодируемый гомеобоксом distal-less 2), SIRPA (сигнально-регуляторный белок альфа), ОТХ1 (белок, кодируемый гомеобоксом orthodenticle 1), AHRR (репрессор арил-углеводородного рецептора), MANF (мезэнцефальный нейротрофический фактор, происходящий из астроцитов), ТМЕМ158 (трансмембранный белок 158 (ген/псевдоген)) и ENSG00000078687.
Предпочтительные белки, ассоциированные с нарушениями, связанными с экспансией тринуклеотидных повторов, включают НТТ (гентингтин), AR (андрогенный рецептор), FXN (фратаксин), Atxn3 (атаксин), Atxn1 (атаксин), Atxn2 (атаксин), Atxn7 (атаксин), Atxn10 (атаксин), DMPK (миотонин-протеинкиназу), Atn1 (атрофин 1), СВР (creb-связывающий белок), VLDLR (рецептор липопротеинов очень низкой плотности) и их любую комбинацию.
В соответствии с другим аспектом предусматривается способ генной терапии для лечения субъекта, имеющего мутацию в гене CFTR, который включает введение в клетки субъекта терапевтически эффективного количества частиц с CRISPR-Cas для генной терапии, необязательно посредством биологически совместимого фармацевтического носителя. Предпочтительно целевая ДНК содержит мутацию deltaF508. Обычно предпочтительно, чтобы у мутантов восстанавливался дикий тип. В этом случае мутация представляет собой делению трех нуклеотидов, включающих в себя кодон фенилаланина (F), в положении 508. Соответственно, репарация в данном случае требует повторного введения мутанту недостающего кодона.
Для реализации этой стратегии репарации генов предпочтительно, чтобы векторную систему на основе аденовируса/AAV вводили в клетку-хозяина, в клетки или пациенту. Система предпочтительно содержит Cas9 (или никазу Cas9) и направляющую РНК вместе с векторной системой на основе аденовируса/AAV, содержащей матрицу для репарации путем гомологичной рекомбинации, содержащую остаток F508. Ее можно вводить субъекту посредством одного из обсуждаемых ранее способов доставки. Система CRISPR-Cas может направляться химерной направляющей РНК для дельта-508 CFTR. Она целенаправленно воздействует на конкретный сайт локуса генома CFTR, подлежащий внесению однонитевого разрыва или расщеплению. После расщепления матрицу для репарации вставляли в сайт расщепления посредством гомологичной рекомбинации, исправляющей делецию, которая приводит к муковисцидозу или вызывает связанные с муковисцидозом симптомы. Данную стратегию для управления доставкой и обеспечения системного встраивания систем CRISPR с помощью соответствующих направляющих РНК можно использовать для целенаправленного воздействия на генные мутации, чтобы редактировать или проводить иного рода манипуляции с генами, которые вызывают метаболические заболевания и нарушения, заболевания и нарушения печени, почек и заболевания и нарушения, связанные с белками, такие как приведенные в таблице В.
Редактирование генома
Системы CRISPR/Cas9 по настоящему изобретению можно применять для коррекции генетических мутаций, попытки которой с ограниченным успехом ранее предпринимались с применением TALEN и ZFN. Например, в опубликованной заявке Duke University WO 2013163628 А2 "Генетическая коррекция мутантных генов" описаны попытки коррекции, например, мутации по типу сдвига рамки считывания, которая вызывает появление преждевременного стоп-кодона и усечение продукта гена, которую можно скорректировать посредством опосредованного нуклеазами негомологичного соединения концов, как, например, обуславливающей мышечную дистрофию Дюшенна ("DMD"), рецессивное смертельное сцепленное с Х-хромосомой нарушение, приводящее к мышечной дегенерации в связи с мутациями гена дистрофина. Большинство мутаций гена дистрофина, вызывающих DMD, представляют собой делеции экзонов, нарушающие рамку считывания и вызывающие преждевременную терминацию трансляции гена дистрофина. Дистрофии представляет собой цитоплазматический белок, обеспечивающий стабильность структуры дистрогликанового комплекса клеточной мембраны, отвечающего за регуляцию целостности и функционирования мышечных клеток. Ген дистрофина или "ген DMD", как взаимозаменяемо используется в данном документе, образован 2,2 миллиона пар оснований в локусе Хр21. Размер первичного транскрипта составляет приблизительно 2400 т.п.о., при этом размер зрелой мРНК составляет приблизительно 14 п.о. 79 экзонов кодируют белок, образованный более 3500 аминокислотами. Экзон 51 часто является смежным с положениями делеции, нарушающих рамку считывания, у пациентов с DMD, и в клинических испытаниях на него был направлен пропуск экзона, основанный на применении олигонуклеотидов. Недавно в клиническом испытании с пропуском экзона 51 с помощью соединения этерлипсена сообщали о значительном положительном функциональном эффекте в течение 48 недель со средним количеством дистрофин-положительных волокон 47% по сравнению с исходным уровнем. Мутации в экзоне 51 идеально подходят для устойчивой коррекции посредством редактирования генома на основе NHEJ.
Способы согласно публикации заявки на патент США №20130145487, закрепленной за Cellectis, которые относятся к вариантам мегануклеаз для расщепления целевой последовательности гена дистрофина человека (DMD), также можно модифицировать для системы CRISPR-Cas по настоящему изобретению.
Кровь
Настоящее изобретение также предусматривает доставку системы CRISPR-Cas в кровь.
Плазменные экзосомы по Wahlgren et al. (Nucleic Acids Research, 2012, Vol. 40, No. 17 e130) были описаны ранее и могут быть использованы для доставки системы CRISPR-Cas в кровь.
Система CRISPR-Cas по настоящему изобретению также предусматривается для лечения гемоглобинопатии, таких как формы талассемии и серповидно-клеточная анемия. См., например, международную публикацию заявки на патент WO 2013/126794 в отношении потенциальных мишеней, на которые может целенаправленно воздействовать система CRISPR-Cas по настоящему изобретению.
Публикации заявок на патенты США №№20110225664, 20110091441, 20100229252, 20090271881 и 20090222937, закрепленные за Cellectis, относятся к вариантам CREI, где по меньшей мере один из двух мономеров I-CreI имеет по меньшей мере две замены, по одной в каждом из двух функциональных субдоменов сердцевинного домена LAGLIDADG, расположенных, соответственно, в положениях 26-40 и 44-77 I-CreI, при этом указанный вариант способен расщеплять целевую последовательность ДНК гена гамма-цепи рецептора интерлейкина-2 человека (IL2RG), также называемого геном общей гамма-цепи рецепторов цитокинов или геном гамма-С. Целевые последовательности, указанные в публикациях заявок на патенты США №№20110225664, 20110091441, 20100229252, 20090271881 и 20090222937, можно использовать для системы CRISPR-Cas по настоящему изобретению.
Тяжелый комбинированный иммунодефицит (SCID) возникает в результате нарушения созревания Т-лимфоцитов, во всех случаях ассоциированного с нарушением функционирования В-лимфоцитов (Cavazzana-Calvo et al., Annu. Rev. Med., 2005, 56, 585-602; Fischer et al., Immunol. Rev., 2005, 203, 98-109). Общая заболеваемость по оценкам составляет 1 на 75000 родившихся. Пациенты с нелеченым SCID подвержены множественным инфекциям, вызываемым условно-патогенными микроорганизмами, и живут, как правило, не более одного года. SCID можно лечить путем аллогенного переноса гемопоэтических стволовых клеток от донора-родственника. Степень гистосовместимости с донором может варьировать в широких пределах. В случае аденозиндезаминазной (ADA) недостаточности, одной из форм SCID, пациентов можно лечить с помощью инъекции рекомбинантного фермента аденозиндезаминазы.
Поскольку было показано, что ген ADA у пациентов с SCID является мутантным (Giblett et al., Lancet, 1972, 2, 1067-1069), были идентифицированы некоторые другие гены, вовлеченные в SCID (Cavazzana-Calvo et al., Annu. Rev. Med., 2005, 56, 585-602; Fischer et al., Immunol. Rev., 2005, 203, 98-109). Существуют четыре основные причины SCID: (i) Наиболее часто встречающуюся форму SCID, SCID-X1 (SCID, сцепленный с Х-хромосомой, или X-SCID), вызывает мутация в гене IL2RG, которая приводит к отсутствию зрелых Т-лимфоцитов и NK-клеток. IL2RG кодирует белок гамма-С (Noguchi, et al., Cell, 1993, 73, 147-157), общий компонент по меньшей мере пяти рецепторных комплексов интерлейкинов. Данные рецепторы активируют несколько мишеней с помощью киназы JAK3 (Macchi et al., Nature, 1995, 377, 65-68), инактивация которой приводит к возникновению того же синдрома, что и инактивация гамма-С.(ii) Мутация в гене ADA приводит к нарушению метаболизма пуринов, вызывающему гибель предшественников лимфоцитов, что, в свою очередь, приводит к кажущемуся отсутствию В-, Т- и NK-клеток. (iii) V(D)J-рекомбинация является существенным этапом созревания иммуноглобулинов и рецепторов Т-лимфоцитов (TCR). Мутации в генах, активирующих рекомбинацию, 1 и 2 (RAG1 и RAG2) и Artemis, трех генах, участвующих в этом процессе, приводят к отсутствию зрелых Т- и В-лимфоцитов. (iv) Также сообщали о мутациях в других генах, таких как CD45, участвующих в специфичной передаче сигналов в Т-клетках, хотя они представляют меньшинство случаев (Cavazzana-Calvo et al., Annu. Rev. Med., 2005, 56, 585-602; Fischer et al., Immunol. Rev., 2005,203, 98-109).
С тех пор, как были выявлены их генетические основы, различные формы SCID стали модельными для подходов к генной терапии (Fischer et al., Immunol. Rev., 2005, 203, 98-109) по двум основным причинам. Во-первых, как и при всех заболеваниях крови, может быть предусмотрено лечение ex vivo. Можно выделить гемопоэтические стволовые клетки (HSC) из костного мозга и сохранять их свойства плюрипотентности в течение нескольких клеточных делений. Таким образом, их можно обрабатывать in vitro, а затем повторно инъецировать пациенту, где они повторно заселяют костный мозг. Во-вторых, поскольку созревание лимфоцитов у пациентов с SCID ухудшено, скорректированные клетки имеют селективное преимущество. Таким образом, небольшое количество скорректированных клеток может восстановить функционирование иммунной системы. Эта гипотеза была неоднократно подтверждена (i) частичным восстановлением иммунных функций, связанным с реверсией мутаций у пациентов с SCID (Hirschhorn et al., Nat. Genet., 1996, 13, 290-295; Stephan et al., N. Engl. J. Med., 1996, 335, 1563-1567; Bousso et al., Proc. Natl., Acad. Sci. USA, 2000, 97, 274-278; Wada et al., Proc. Natl. Acad. Sci. USA, 2001, 98, 8697-8702; Nishikomori et al., Blood, 2004, 103, 4565-4572), (ii) коррекцией форм недостаточности SCID-X1 in vitro в гемопоэтических клетках (Candotti et al., Blood, 1996, 87, 3097-3102; Cavazzana-Calvo et al., Blood, 1996, Blood, 88, 3901-3909; Taylor et al., Blood, 1996, 87, 3103-3107; Hacein-Bey et al., Blood, 1998, 92, 4090-4097), (iii) коррекцией форм недостаточности SCID-X1 (Soudais et al., Blood, 2000, 95, 3071-3077; Tsai et al., Blood, 2002, 100, 72-79), JAK-3 (Bunting et al., Nat. Med., 1998, 4, 58-64; Bunting et al., Hum. Gene Ther., 2000, 11, 2353-2364) и RAG2 (Yates et al., Blood, 2002, 100, 3942-3949) in vivo в животных моделях и (iv) результатом клинических испытаний генной терапии (Cavazzana-Calvo et al., Science, 2000, 288, 669-672; Aiuti et al., Nat. Med., 2002; 8, 423-425; Gaspar et al., Lancet, 2004, 364, 2181-2187).
Публикация заявки на патент США №20110182867, закрепленная за Children's Medical Center Corporation и президентом и членами управляющего совета Гарвардского университета, относится к способам модулирования экспрессии фетального гемоглобина (HbF) и ее применениям в гемопоэтических клетках-предшественниках с помощью ингибиторов экспрессии или активности BCL11A, таких как средства для RNAi и антитела. На мишени, раскрытые в публикации заявки на патент США №20110182867, такие как BCL11A, можно целенаправленно воздействовать с помощью системы CRISPR-Cas по настоящему изобретению для модулирования экспрессии фетального гемоглобина. См. также Bauer et al. (Science 11 October 2013: Vol. 342 no. 6155 pp. 253-257) и Xu et al. (Science 18 November 2011: Vol. 334 no. 6058 pp. 993-996) в отношении дополнительных мишеней BCL11 А.
Уши
Настоящее изобретение также предусматривает доставку системы CRISPR-Cas в одно ухо или оба уха.
Исследователи рассматривают вопрос о том, можно ли применять генную терапию для содействия существующим способам лечения глухоты - а именно, применению кохлеарных имплантатов. Глухоту часто вызывают утрата или повреждение волосковых клеток, которые не могут передавать сигналы слуховым нейронам. В таких случаях можно применять кохлеарные имплантаты для обеспечения реакции на звук и передачи электрических сигналов нервным клеткам. Однако эти нейроны часто дегенерируют и подвергаются ретракции отростков в улитке, поскольку пораженные волосковые клетки высвобождают меньше факторов роста.
В заявке на патент США 20120328580 описана инъекция фармацевтической композиции в ухо (например, путем ушного введения), как, например, в просветы улитки (например, в проток улитки, лестницу преддверия и барабанную лестницу улитки), например, с помощью шприца, например, шприца с однократной дозой. Например, одно или несколько соединений, описанных в данном документе, можно вводить путем интратимпанальной инъекции (например, в среднее ухо) и/или инъекций в наружное, среднее и/или внутреннее ухо. Такие способы регулярно применяются в данной области, например, для введения стероидов и антибиотиков в уши людей. Инъекцию можно осуществлять, например, через круглое окно уха или через капсулу улитки. В данной области известны и другие способы введения во внутреннее ухо (см., например, Salt and Plontke, Drug Discovery Today, 10:1299-1306, 2005).
В другом способе введения фармацевтическую композицию можно вводить in situ с помощью катетера или насоса. Катетер или насос могут, например, направлять фармацевтическую композицию в просветы улитки, или круглое окно уха, и/или просвет толстой кишки. Иллюстративный аппарат для доставки лекарственных средств и способы, подходящие для введения одного или нескольких соединений, описанных в данном документе, в ухо, например, в ухо человека, описаны McKenna и соавт. (публикация заявки на патент США №2006/0030837) и Jacobsen и соавт. (патент США №7206639). В некоторых вариантах осуществления катетер или насос могут быть расположены, например, в ухе (например, в наружном, среднем и/или внутреннем ухе) пациента во время хирургического вмешательства. В некоторых вариантах осуществления катетер или насос могут быть расположены, например, в ухе (например, в наружном, среднем и/или внутреннем ухе) пациента без необходимости в хирургическом вмешательстве.
Альтернативно или в дополнение, одно или несколько соединений, описанных в данном документе, можно вводить в сочетании с механическим устройством, таким как кохлеарный имплантат или слуховой аппарат, которое носят в наружном ухе. Иллюстративный кохлеарный имплантат, подходящий для применения в настоящем изобретении, описан Edge и соавт. (публикация заявки на патент США №2007/0093878).
В некоторых вариантах осуществления способы введения, описанные выше, можно комбинировать в любом порядке и можно применять одновременно или попеременно.
Альтернативно или в дополнение, настоящее изобретение можно применять согласно любому из способов, одобренных Управлением по контролю качества пищевых продуктов и лекарственных средств, например, описанных в справочнике стандартов CDER, версия номер 004 (доступном по адресу fda.give/cder/dsm/DRG/drg00301.htm).
В целом, способы клеточной терапии, описанные в заявке на патент США 20120328580, можно применять для стимуляции полной или частичной дифференцировки клеток в определенный тип зрелых клеток внутреннего уха (например, в волосковые клетки) или в его направлении in vitro. Клетки, полученные в результате осуществления таких способов, можно затем трансплантировать или имплантировать пациенту, нуждающемуся в таком лечении. Способы культивирования клеток, необходимые для осуществления на практике этих способов, включающие способы идентификации и отбора подходящих типов клеток, способы стимуляции полной или частичной дифференцировки выбранных клеток, способы идентификации полностью или частично дифференцированных типов клеток и способы имплантации полностью или частично дифференцированных клеток, описаны ниже.
Клетки, подходящие для применения в настоящем изобретении, включают, без ограничения, клетки, способные к полной или частичной дифференцировке в зрелые клетки внутреннего уха, например, в волосковые клетки (например, внутренние и/или наружные волосковые клетки), при контакте, например, in vitro, с одним или несколькими соединениями, описанными в данном документе. Иллюстративные клетки, способные к дифференцировке в волосковые клетки, включают, без ограничения, стволовые клетки (например, стволовые клетки внутреннего уха, взрослые стволовые клетки, стволовые клетки костномозгового происхождения, эмбриональные стволовые клетки, мезенхимальные стволовые клетки, стволовые клетки кожи, iPS-клетки и стволовые клетки жировой ткани), клетки-предшественники (например, клетки-предшественники внутреннего уха), поддерживающие клетки (например, клетки Дейтерса, столбовые клетки, внутренние фаланговые клетки, тектальные клетки и клетки Гензена) и/или зародышевые клетки. Применение стволовых клеток для замещения чувствительных клеток внутреннего уха описано Li и соавт. (публикация заявки на патент США №2005/0287127) и Li и соавт. (патент США с регистрационным №11/953797). Применение стволовых клеток костномозгового происхождения для замещения чувствительных клеток внутреннего уха описано Edge и соавт. в PCT/US 2007/084654. iPS-клетки описаны, например, в Takahashi et al., Cell, Volume 131, Issue 5, Pages 861-872 (2007); Takahashi and Yamanaka, Cell 126, 663-76 (2006); Okita et al., Nature 448, 260-262 (2007); Yu, J. et al., Science 318(5858): 1917-1920 (2007); Nakagawa et al., Nat. Biotechnol. 26:101-106 (2008) и Zaehres and Scholer, Cell 131(5): 834-835 (2007).
Такие подходящие клетки можно идентифицировать путем анализа (например, качественного или количественного) наличия одного или нескольких тканеспецифичных генов. Например, экспрессию гена можно выявить путем выявления белкового продукта одного или нескольких тканеспецифичных генов. Методики выявления белков включают окрашивание белков (например, с использованием клеточных экстрактов или цельных клеток) с помощью антител к соответствующему антигену. В данном случае соответствующий антиген является белковым продуктом экспрессии тканеспецифичного гена. Хотя, в принципе, меченым может быть первое антитело (т.е. антитело, связывающее антиген), более распространенным (и улучшающим визуализацию) является применение второго антитела, направленного против первого (например, антитела к IgG). Данное второе антитело конъюгируют с флуорохромами, или соответствующими ферментами для колориметрических реакций, или гранулами золота (для электронной микроскопии), или с системой биотин-авидин, так что можно определить местоположение первичного антитела и, следовательно, антигена.
Молекулы CRISPR-Cas по настоящему изобретению можно доставлять в ухо путем непосредственного внесения фармацевтической композиции в наружное ухо с применением модифицированных композиций из опубликованной заявки на патент США 20110142917. В некоторых вариантах осуществления фармацевтическую композицию вносят в наружный слуховой проход. Доставка в ухо может также называться внутриушной или ушной доставкой.
В некоторых вариантах осуществления молекулы РНК по настоящему изобретению доставляют в липосомных составах или составах на основе Lipofectin и т.п., и их можно получить с помощью способов, хорошо известных специалистам в данной области. Такие способы описаны, например, в патентах США №№5593972, 5589466 и 5580859, включенных в данный документ посредством ссылки.
Были разработаны системы доставки, специально предназначенные для повышения эффективности и улучшения доставки siRNA в клетки млекопитающих (см., например, Shen et al FEBS Let. 2003, 539: 111-114; Xia et al., Nat. Biotech. 2002, 20:1006-1010; Reich et al., Mol. Vision. 2003, 9: 210-216; Sorensen et al., J. Mol. Biol. 2003, 327: 761-766; Lewis et al., Nat. Gen. 2002, 32: 107-108 и Simeoni et al., NAR 2003, 31, 11: 2717-2724), и их можно применять в настоящем изобретении. siRNA недавно успешно применяли для ингибирования экспрессии генов у приматов (смотри, например, Tolentino et al., Retina 24(4):660), и их также можно применять в настоящем изобретении.
Qi и соавт. раскрывают способы эффективного введения siRNA во внутреннее ухо через неповрежденное круглое окно путем трансфекции с помощью новой технологии доставки протеидов, которую можно применять в отношении к системе CRISPR-Cas по настоящему изобретению (смотри, например, Qi et al., Gene Therapy (2013), 1-9). В частности, успешным было применение доменов ТАТ, связывающих двухнитевую РНК (TAT-DRBD), с помощью которых можно трансфицировать меченную Су3 siRNA в клетки внутреннего уха, в том числе внутренние и наружные волосковые клетки, ампулярный гребешок, пятно эллиптического мешочка и пятно сферического мешочка, посредством проникновения через неповрежденное круглое окно, для доставки двухнитевых siRNA in vivo для лечения различных болезней внутреннего уха и сохранения слуховой функции. Приблизительно 40 мкл 10 мМ РНК может быть предусмотрено в качестве дозы для введения в ухо.
Согласно Rejali et al. (Hear Res. 2007 Jun; 228(1-2): 180-7), функционирование кохлеарных имплантатов можно улучшить путем надлежащего сохранения нейронов спирального ганглия, которые являются мишенью для электростимуляции имплантатом, и ранее было показано, что нейротрофический фактор головного мозга (BDNF) повышает выживаемость спирального ганглия в ушах с экспериментально индуцированной глухотой. Rejali и соавт. тестировали модифицированную конструкцию электрода кохлеарного имплантата, имеющего покрытие из клеток-фибробластов, трансдуцированных вирусным вектором со вставкой гена BDNF. Для осуществления данного типа переноса генов ex vivo Rejali и соавт. трансдуцировали фибробласты морской свинки аденовирусом со вставкой кассеты с геном BDNF, и определили, что эти клетки секретируют BDNF, а затем прикрепили клетки, секретирующие BDNF, к электроду кохлеарного имплантата с помощью агарозного геля и имплантировали электрод в барабанную лестницу улитки. Rejali и соавт. определили, что электроды с экспрессией BDNF были способны обеспечивать сохранение значительно большего количества нейронов спирального ганглия в базальных витках улитки через 48 дней после имплантации по сравнению с контрольными электродами и демонстрировали возможность осуществления терапии с применением кохлеарных имплантатов в комбинации с переносом генов ex vivo для повышения выживаемости нейронов спирального ганглия. Такую систему можно применять для доставки системы CRISPR-Cas по настоящему изобретению в ухо.
Mukherjea et al. (Antioxidants & Redox Signaling, Volume 13, Number 5, 2010) документально подтверждают, что нокдаун NOX3 с помощью короткой интерферирующей (si) РНК нейтрализовал ототоксичность цисплатина, о чем свидетельствует защита ОНС от повреждения и снижение величин сдвига порогов стволомозговых слуховых вызванных потенциалов (ABR). Крысам вводили различные дозы siNOX3 (0,3, 0,6 и 0,9 мкг), и экспрессию NOX3 оценивали с помощью ОТ-ПЦР в режиме реального времени. Наименьшая применяемая доза siRNA для NOX3 (0,3 мкг) не демонстрировала какого-либо ингибирования мРНК NOX3 по сравнению с транстимпанальным введением скремблированной siRNA или отсутствием обработки улиток. Введение более высоких доз siRNA для NOX3 (0,6 и 0,9 мкг), однако, снижало экспрессию NOX3 по сравнению с контрольной скремблированной siRNA. Такую систему можно применять для транстимпанального введения системы CRISPR-Cas по настоящему изобретению в дозе от приблизительно 2 мг до приблизительно 4 мг CRISPR-Cas для введения человеку.
Jung et al. (Molecular Therapy, vol. 21 no. 4, 834-841 apr. 2013) демонстрируют, что уровни Hes5 в эллиптическом мешочке снижались после внесения siRNA и что количество волосковых клеток в этих эллиптических мешочках было значительно большим, чем после контрольной обработки. Данные позволяют предположить, что технология siRNA может быть применимой для индукции восстановления и регенерации во внутреннем ухе и что сигнальный путь Notch является потенциально применимой мишенью для ингибирования экспрессии конкретного гена. Jung и соавт. инъецировали 8 мкг siRNA для Hes5 в объеме 2 мкл, полученном путем добавления стерильного нормального физиологического раствора к лиофилизированной siRNA, в вестибулярный эпителий уха. Такую систему можно применять для введения системы CRISPR-Cas по настоящему изобретению в вестибулярный эпителий уха в дозе от приблизительно 1 до приблизительно 30 мг CRISPR-Cas для введения человеку.
Глаза
Настоящее изобретение также предусматривает доставку системы CRISPR-Cas в один глаз или оба глаза.
В еще одном аспекте настоящего изобретения систему CRISPR-Cas можно использовать для корректировки офтальмологических дефектов, которые являются результатом нескольких генетических мутаций, дополнительно описанных в Genetic Diseases of the Eye, Second Edition, edited by Elias I. Traboulsi, Oxford University Press, 2012.
Для введения в глаз особенно предпочтительными являются лентивирусные векторы, в частности, вирусы инфекционной анемии лошадей (EIAV).
В другом варианте осуществления также предусмотрены минимальные лентивирусные векторы для отличных от приматов организмов на основе вируса инфекционной анемии лошадей (EIAV), особенно для генной терапии глаз (смотри, например, Balagaan, J Gene Med 2006; 8: 275-285, опубликовано онлайн 21 ноября 2005 г. в Wiley InterScience (www.interscience.wiley.com). DOI: 10.1002/jgm.845). Предусмотрено, что векторы имеют промотор цитомегаловируса (CMV), управляющий экспрессией целевого гена. Также предусмотрена любая из внутрикамерной, субретинальной, внутриглазной и интравитреальной инъекций (смотри, например, Balagaan, J Gene Med 2006; 8: 275-285, опубликовано онлайн 21 ноября 2005 г. в Wiley InterScience (www.interscience.wiley.com). DOI: 10.1002/jgm.845). Внутриглазные инъекции можно осуществлять с помощью операционного микроскопа. В случае субретинальной и интравитреальной инъекций можно выпятить глаза путем осторожного надавливания пальцами и визуализировать глазное дно с помощью системы контактных линз, состоящей из капли раствора контактной среды на роговице, накрытой покровным стеклом для микропрепаратов. При субретинальных инъекциях наконечник иглы 34 калибра на 10 мм, закрепленной на 5-мкл шприце Hamilton, можно при непосредственной визуализации продвигать через экваториальную область верхней части склеры тангенциально к заднему полюсу глазного яблока, пока в субретинальном пространстве не будет видна апертура иглы. Затем можно инъецировать 2 мкл суспензии вектора, вызывая буллезное верхнее отслоение сетчатки, что, таким образом, подтверждает субретинальное введение вектора. В данном подходе производят самогерметизирующийся разрез склеры, позволяющий суспензии вектора удерживаться в субретинальном пространстве до поглощения ее RPE, обычно в течение 48 ч. после процедуры. Эту процедуру можно повторить в нижнем полушарии, вызывая нижнее отслоение сетчатки. Данная методика обуславливает воздействие суспензии вектора на приблизительно 70% нейросенсорной части сетчатки и RPE. В случае интравитреальных инъекций можно продвигать наконечник иглы через склеру на 1 мм кзади от корнеосклерального лимба и инъецировать 2 мкл суспензии вектора в полость стекловидного тела. В случае внутрикамерных инъекций можно продвигать наконечник иглы через парацентез корнеосклерального лимба в направлении центральной части роговицы и можно инъецировать 2 мкл суспензии вектора. В случае внутрикамерных инъекций можно продвигать наконечник иглы через парацентез корнеосклерального лимба в направлении центральной части роговицы и можно инъецировать 2 мкл суспензии вектора. Эти векторы можно инъецировать в титрах 1,0-1,4×1010 или 1,0-1,4×109 трансдуцирующих единиц (ТЕ)/мл.
В другом варианте осуществления также предусмотрен RetinoStat®, лентивирусный вектор на основе вируса инфекционной анемии лошадей для генной терапии, экспрессирующий ангиостатические белки эндостатин и ангиостатин, который доставляют посредством субретинальной инъекции для лечения влажной формы возрастной макулодистрофии (смотри, например, Binley et al., HUMAN GENE THERAPY 23: 980-991 (September 2012)). Такой вектор может быть модифицирован для системы CRISPR-Cas по настоящему изобретению. Каждый глаз можно обрабатывать любым RetinoStat® в дозе 1,1×105 трансдуцирующих единиц на глаз (ТЕ/глаз) в общем объеме 100 мкл.
В другом варианте осуществления может быть предусмотрен аденовирусный вектор с делецией Е1 и Е4 и частичной делецией Е3 для доставки в глаз. Двадцать восемь пациентов с неоваскулярной возрастной макулодистрофией на поздней стадии (AMD) получали однократную интравитреальную инъекцию аденовирусного вектора с делецией Е1 и Е4 и частичной делецией Е3, экспрессирующего фактор пигментного эпителия человека (AdPEDF.ll) (смотри, например, Campochiaro et al., Human Gene Therapy 17:167-176 (February 2006)). Исследовали дозы, варьирующие в диапазоне от 106 до 109,5 единичных частиц (PU), и не наблюдали серьезных нежелательных явлений, связанных с AdPEDF.ll, и дозолимитирующей токсичности (смотри, например, Campochiaro et al., Human Gene Therapy 17:167-176 (February 2006)). Опосредованный аденовирусными векторами перенос генов в глаза, по-видимому, является действенным подходом для лечения нарушений со стороны органов зрения и может применяться для системы CRISPR-Cas.
В другом варианте осуществления систему sd-rxRNA® от RXi Pharmaceuticals можно применять для доставки CRISPR-Cas в глаз и/или приспосабливать к ней. В этой системе однократное интравитреальное введение 3 мкг sd-rxRNA приводит к специфичному относительно последовательности снижению уровней мРНК PPIB в течение 14 дней. Систему sd-rxRNA® можно применять для системы CRISPR-Cas по настоящему изобретению, предусматривая введение человеку дозы CRISPR, составляющей приблизительно 3-20 мг.
Millington-Ward et al. (Molecular Therapy, vol. 19 no. 4, 642-649 apr. 2011) описывают векторы на основе аденоассоциированного вируса (AAV) для доставки супрессора родопсина, функционирующего на основе РНК-интерференции (RNAi), и замещающего гена родопсина с модифицированными кодонами, устойчивого к супрессии в связи с нуклеотидными изменениями в вырожденных положениях в целевом сайте для RNAi. Осуществляли субретинальную инъекцию 6,0×108 vp или 1,8×1010 vp AAV в глаза согласно Millington-Ward и соавт. Векторы на основе AAV согласно Millington-Ward и соавт. можно применять для системы CRISPR-Cas по настоящему изобретению, предусматривая введение человеку дозы, составляющей от приблизительно 2×1011 до приблизительно 6×1013 vp.
Dalkara et al. (Sci Transl Med 5, 189ra76 (2013)) также обращаются к направленной эволюции in vivo для конструирования вектора на основе AAV, доставляющего варианты дефектных генов дикого типа по всей сетчатке после безвредной инъекции в жидкую часть стекловидного тела глаза. Dalkara описывает дисплейную библиотеку 7-мерных пептидов и библиотеку AAV, сконструированную посредством ДНК-шаффлинга генов cap AAV1, 2, 4, 5, 6, 8 и 9. Упаковывали библиотеки rcAAV и векторы на основе rAAV, экспрессирующие GFP под контролем промотора CAG или Rho, и с помощью количественной ПЦР получали титры геномов, устойчивых к действию дезоксирибонуклеаз. Библиотеки объединяли, и проводили два цикла эволюции, каждый из которых состоял из диверсификации исходной библиотеки с последующими тремя этапами отбора in vivo. На каждом таком этапе мышам Р30, экспрессирующим rho-GFP, интравитреально инъецировали 2 мл очищенной йодиксанолом и подвергнутой диализу против фосфатно-солевого буфера (PBS) библиотеки с титром геномов приблизительно 1×1012 вирусных геномов/мл. Векторы на основе AAV согласно Dalkara и соавт. можно применять для системы CRISPR-Cas по настоящему изобретению, предусматривая введение человеку дозы, составляющей от приблизительно 1×1015 до приблизительно 1×1016 вирусных геномов/мл.
В другом варианте осуществления можно целенаправленно воздействовать на ген родопсина для лечения пигментного ретинита (RP), где систему согласно публикации заявки на патент США №20120204282, закрепленной за Sangamo Biosciences, Inc., можно модифицировать по образу системы CRISPR-Cas по настоящему изобретению.
В другом варианте осуществления способы согласно публикации заявки на патент США №20130183282, закрепленной за Cellectis, направленной на способы расщепления целевой последовательности гена родопсина человека, можно также модифицировать для системы CRISPR-Cas по настоящему изобретению.
Публикация заявки на патент США №20130202678, закрепленная за Academia Sinica, относится к способам лечения форм ретинопатии и офтальмологических нарушений с угрозой потери зрения, относящимся к доставке гена Puf-A (экспрессируемого в ганглиозных и пигментных клетках сетчатки в тканях глаза и проявляющего уникальную антиапоптотическую активность) в субретинальное или интравитреальное пространство глаза. В частности, желаемые мишени представляют собой zgc:193933, prdm1a, spata2, tex10, rbb4, ddx3, zp2.2, Blimp-1 и HtrA2, на все из которых можно целенаправленно воздействовать с помощью системы CRISPR-Cas по настоящему изобретению.
Wu (Cell Stem Cell, 13:659-62, 2013) разработал направляющую РНК, которая нацеливает Cas9 на местоположение мутации в одной паре оснований, вызывающей формы катаракты у мышей, где он индуцирует расщепление ДНК. Затем с помощью другого аллеля дикого типа или олигонуклеотидов, вводимых в зиготы, механизмы репарации корригируют последовательность поврежденного аллеля и корригируют генетический дефект, вызывающий катаракту, у мутантной мыши.
В публикации заявки на патент США №20120159653 описывается применение нуклеаз с "цинковыми пальцами" для генетической модификации клеток, животных и белков, ассоциированных с макулодистрофией (MD). Макулодистрофия (MD) является основной причиной ухудшения зрения у лиц пожилого возраста, однако также является характерным симптомом детских заболеваний, таких как болезнь Штаргардта, дистрофия глазного дна Сорсби и детские нейродегенеративные заболевания с летальным исходом, при этом начало заболеваний проявляется уже в младенческом возрасте. Макулодистрофия приводит к потере зрения в центре поля зрения (желтом пятне) по причине поражения сетчатки. Существующие в настоящее время животные модели не воспроизводят основные отличительные признаки заболевания, как это наблюдается у людей. В доступных животных моделях, предусматривающих мутантные гены, кодирующие ассоциированные с MD белки, также получают крайне изменчивые фенотипы, переходя к проблематике заболевания человека и разработки способов терапии.
Один аспект публикации заявки на патент США №20120159653 относится к редактированию любых хромосомных последовательностей, которые кодируют белки, ассоциированные с MD, что можно применять по отношению к системе CRISPR-Cas по настоящему изобретению. Белки, ассоциированные с MD, как правило, выбирают, исходя из экспериментально установленной взаимосвязи белка, ассоциированного с MD, с нарушением по типу MD. Например, скорость образования или циркулирующая концентрация белка, связанного с MD, может быть повышенной или пониженной в популяции с нарушением по типу MD по сравнению с популяцией без нарушения по типу MD. Различия по уровням белка можно оценить при помощи протеомных методик, в том числе, без ограничения, вестерн-блот-анализа, иммуногистохимического окрашивания, твердофазного иммуноферментного анализа (ELISA) и масс-спектрометрии. В альтернативном случае, белки, ассоциированные с MD, можно идентифицировать путем получения профилей экспрессии генов для генов, кодирующих белки, при помощи методик геномного анализа, в том числе, без ограничения, микроматричного анализа ДНК, серийного анализа экспрессии генов (SAGE) и количественной полимеразной цепной реакции в режиме реального времени (Q-PCR).
В качестве неограничивающего примера, белки, ассоциированные с MD, включают, без ограничения, следующие белки: представитель 4 подсемейства А (АВС1) АТФ-связывающей кассеты (АВСА4), АСНМ1 - белок 1, ассоциированный с ахроматопсией (палочковым монохроматизмом), АроЕ - аполипопротеин Е (АроЕ), C1QTNF5 (CTRP5) - C1q/белок 5, родственный фактору некроза опухолей (C1QTNF5), С2 - компонент 2 системы комплемента (С2), компонент С3 системы комплемента (С3), CCL2 - хемокиновый лиганд 2 (с мотивом С-С) (CCL2), CCR2 - рецептор хемокина 2 (с мотивом С-С) (CCR2), CD36 - кластер дифференцировки 36, CFB - фактор В системы комплемента, CFH - фактор Н системы комплемента (CFH), CFHR1 - белок 1, родственный фактору Н системы комплемента, CFHR3 - белок 3, родственный фактору Н системы комплемента, CNGB3 - бета-3-субъединица ионного канала, регулируемого циклическими нуклеотидами, CP - церулоплазмин (CP), CRP - С-реактивный белок (CRP) CST3 -цистатин С или цистатин 3 (CST3), CTSD - катепсин D (CTSD), CX3CR1 - рецептор хемокина 1 (с мотивом С-Х3-С), ELOVL4 - белок 4, отвечающий за удлинение жирных кислот с очень длинной цепью, ERCC6 - белок эксцизионной репарации, вступающий в перекрестную комплементацию, корректирующий дефицит репарации у грызунов, комплементационная группа 6, FBLN5 - фибулин-5, FBLN5 - фибулин 5, FBLN6 - фибулин 6, FSCN2 - фасцин (FSCN2), HMCN1 - гемицентрин 1, HMCN1 - гемицентрин 1, HTRA1 - сериновая пептидаза HtrA 1 (HTRA1), HTRA1 - сериновая пептидаза HtrA 1, IL-6 - интерлейкин 6, IL-8 - интерлейкин 8, LOC387715 - гипотетический белок, PLEKHA1 - белок, содержащий плекстрин-гомологичный домен, представитель 1 семейства А (PLEKHA1), PROM1 - проминин 1 (PROM1 или CD133), PRPH2 - периферин-2, RPGR - регулятор ГТФазы, ассоциированный с пигментным ретинитом, SERPING1 - ингибитор сериновой пептидазы, представитель 1 клады G (С1-ингибитор), TCOF1 - Treacle, TIMP3 -ингибитор 3 металлопротеиназ (TIMP3), TLR3 - Toll-подобный рецептор 3.
Идентичность белка, ассоциированного с MD, редактирование хромосомной последовательности которого осуществляют, может и будет варьировать. В предпочтительном варианте осуществления белки, ассоциированные с MD, редактирование хромосомных последовательностей которых осуществляют, могут представлять собой белок представитель 4 (АВСА4) подсемейства А (АВС1) АТФ-связывающей кассеты, кодируемый геном ABCR, белок аполипопротеин Е (АРОЕ), кодируемый геном АРОЕ, белок хемокиновый лиганд 2 (с мотивом С-С) (CCL2), кодируемый геном CCL2, белок рецептор хемокина 2 (с мотивом С-С) (CCR2), кодируемый геном CCR2, белок церулоплазмин (CP), кодируемый геном CP, белок катепсин D (CTSD), кодируемый геном CTSD, или белок ингибитор 3 металлопротеиназ (TIMP3), кодируемый геном TIMP3. В иллюстративном варианте осуществления генетически модифицированное животное представляет собой крысу, и редактируемые хромосомные последовательности, кодирующие белок, ассоциированный с MD, могут быть следующими: NM_000350 (АВСА4) для представителя 4 подсемейства А (АВС1) АТФ-связывающей кассеты, NM_138828 (АРОЕ) для аполипопротеина Е АРОЕ, NM_031530 (CCL2) для хемокинового лиганда 2 (с мотивом С-С) CCL2, NM_021866 (CCR2) для рецептора хемокина 2 (с мотивом С-С) CCR2, NM_012532 (CP) для церулоплазмина CP, NM_134334 (CTSD) для катепсина D CTSD, NM_012886 (TIMP3) для ингибитора 3 металлопротеиназ TIMP3. Животное или клетка могут содержать 1, 2, 3, 4, 5, 6, 7 или более хромосомных последовательностей с нарушенной структурой, кодирующих белок, ассоциированный с MD, и ноль, 1, 2, 3, 4, 5, 6, 7 или более интегрированных в хромосомы последовательностей, кодирующих белок с нарушенной структурой, ассоциированный с MD.
Отредактированную или интегрированную хромосомную последовательность можно модифицировать так, чтобы она кодировала измененный белок, ассоциированный с MD. Некоторые мутации в хромосомных последовательностях, связанных с MD, были ассоциированы с MD. Неограничивающие примеры мутаций в хромосомных последовательностях, ассоциированные с MD, включают те, которые могут вызывать MD, в том числе в белке ABCR - E471K (т.е. глутамат в положении 471 заменен на лизин), R1129L (т.е. аргинин в положении 1129 заменен на лейцин), Т1428М (т.е. треонин в положении 1428 заменен на метионин), R1517S (т.е. аргинин в положении 1517 заменен на серин), I1562T (т.е. изолейцин в положении 1562 заменен на треонин) и G1578R (т.е. глицин в положении 1578 заменен на аргинин); в белке CCR2 - V64I (т.е. валин в положении 192 заменен на изолейцин); в белке CP - G969B (т.е. глицин в положении 969 заменен на аспарагин или аспартат); в белке TIMP3 - S156C (т.е. серии в положении 156 заменен на цистеин), G166C (т.е. глицин в положении 166 заменен на цистеин), G167C (т.е. глицин в положении 167 заменен на цистеин), Y168C (т.е. тирозин в положении 168 заменен на цистеин), S170C (т.е. серии в положении 170 заменен на цистеин), Y172C (т.е. тирозин в положении 172 заменен на цистеин) и S181C (т.е. серии в положении 181 заменен на цистеин). В данной области известны и другие взаимосвязи генных вариантов генов, ассоциированных с MD, и заболевания.
Сердце
Настоящее изобретение также предусматривает доставку системы CRISPR-Cas в сердце. Для сердца предпочтительным является тропный к миокарду аденоассоциированный вирус (AAVM), в частности AAVM41, при использовании которого продемонстрирован преимущественный перенос генов в сердце (смотри, например, Lin-Yanga et al., PNAS, March 10, 2009, vol. 106, no. 10). Введение может быть системным или местным. Доза в приблизительно 1-10×1014 векторных геномов предусматривается для системного введения. Смотри также, например, Eulalio et al. (2012) Nature 492: 376 и Somasuntharam et al. (2013) Biomaterials 34: 7790.
Например, в публикации патентного документа США №20110023139 описывается применение нуклеаз с "цинковыми пальцами" для генетической модификации клеток, животных и белков, ассоциированных с сердечно-сосудистым заболеванием. Сердечно-сосудистые заболевания, как правило, включают высокое кровяное давление, сердечные приступы, сердечную недостаточность и инсульт, а также TIA. Любую хромосомную последовательность, связанную с сердечно-сосудистым заболеванием, или белок, кодируемый любой хромосомной последовательностью, связанной с сердечно-сосудистым заболеванием, можно использовать в способах, описанных в настоящем раскрытии. Белки, связанные с сердечно-сосудистым заболеванием, обычно выбирают исходя из экспериментально подтвержденной ассоциации белка, связанного с сердечно-сосудистым заболеванием, с развитием сердечно-сосудистого заболевания. Например, скорость образования или концентрация в кровотоке белка, связанного с сердечно-сосудистым заболеванием, может быть повышенной или пониженной в популяции с сердечно-сосудистым заболеванием по сравнению с популяцией без сердечно-сосудистого заболевания. Различия по уровням белка можно оценить при помощи протеомных методик, в том числе, без ограничения, вестерн-блот анализа, иммуногистохимического окрашивания, твердофазного иммуноферментного анализа (ELISA) и масс-спектрометрии. В альтернативном случае, белки, связанные с сердечно-сосудистым заболеванием, можно идентифицировать путем получения профилей генной экспрессии для генов, кодирующих белки, при помощи методик геномного анализа, в том числе, без ограничения, микроматричного анализа ДНК, серийного анализа экспрессии генов (SAGE) и количественной полимеразной цепной реакции в режиме реального времени (Q-PCR).
В качестве примера, хромосомная последовательность может содержать без ограничения следующие: IL1B (интерлейкин 1, бета), XDH (ксантиндегидрогеназа), ТР53 (опухолевый белок р53), PTGIS (простагландин 12 (простациклин) синтаза), MB (миоглобин), IL4 (интерлейкин 4), ANGPT1 (ангиопоэтин 1), ABCG8 (АТФ-связывающая кассета, подсемейство G (WHITE), представитель 8), CTSK (катепсин K), PTGIR (рецептор простагландина 12 (простациклина) (IP)), KCNJ11 (входящий калиевый канал, подсемейство J, представитель 11), INS (инсулин), CRP (С-реактивный белок, родственный пентраксину), PDGFRB (полипептид рецептора тромбоцитарного фактора роста бета), CCNA2 (циклин А2), PDGFB (полипептид тромбоцитарного фактора роста бета (гомолог онкогена вируса саркомы обезьян (v-sis))), KCNJ5 (входящий калиевый канал, подсемейство J, представитель 5), KCNN3 (кальций-активируемый калиевый канал средней/малой проводимости, подсемейство N, представитель 3), CAPN10 (кальпаин 10), PTGES (простагландин Е синтаза), ADRA2B (адренергический, альфа-2В-, рецептор), ABCG5 (АТФ-связывающая кассета, подсемейство G (WHITE), представитель 5), PRDX2 (пероксиредоксин 2), CAPN5 (кальпаин 5), PARP14 (семейство полимераз поли(АДФ-рибозы), представитель 14), МЕХ3С (гомолог С mex-3 (С. elegans)), АСЕ, ангиотензинпревращающий фермент I (пептидилдипептидаза А) 1), TNF (фактор некроза опухоли (суперсемейство TNF, представитель 2)), IL6 (интерлейкин 6 (интерферон, бета 2)), STN (статин), SERPINE1 (ингибитор серпиновой пептидазы, клада Е (нексин, ингибитор активатора плазминогена типа 1), представитель 1), ALB (альбумин), ADIPOQ (адипонектин, содержащий C1Q и коллагеновый домен), АРОВ (аполипопротеин В (в том числе антиген Ag(x))), АРОЕ (аполипопротеин Е), LEP (лептин), MTHFR (5,10-метилентетрагидрофолатредуктаза (NADPH)), АРОА1 (аполипопротеин A-I), EDN1 (эндотелин 1), NPPB (предшественник В натрийуретического пептида), NOS3 (синтаза 3 оксида азота (эндотелиальная клетка)), PPARG (рецептор гамма, активируемый пролифератором пероксисом), PLAT (активатор плазминогена, ткань), PTGS2 (простагландин-эндопероксидсинтаза 2 (простагландин G/H синтаза и циклооксигеназа)), СЕТР (транспортный белок сложного эфира холестерина, плазма), AGTR1 (рецептор ангиотензина II, тип 1), HMGCR (редуктаза 3-гидрокси-3-метилглутарилкофермента А), IGF1 (инсулиноподобный фактор роста 1 (соматомедин С)), SELE (селектин Е), REN (ренин), PPARA (альфа-рецептор, активируемый пролифератором пероксисом), PON1 (параоксоназа 1), KNG1 (кининоген 1), CCL2 (лиганд 2 хемокина (мотив С-С)), LPL (липопротеинлипаза), VWF (фактор фон Виллебранда), F2 (фактор коагуляции II (тромбин)), ICAM1 (внутриклеточная молекула адгезии 1), TGFB1 (трансформирующий фактор роста, бета 1), NPPA (предшественник А натрийуретического пептида), IL10 (интерлейкин 10), ЕРО (эритропоэтин), SOD1 (супероксиддисмутаза 1, растворимая), VCAM1 (молекула адгезии сосудистого эндотелия типа 1), IFNG (интерферон, гамма), LPA (липопротеин, Lp(a)), МРО (миелопероксидаза), ESR1 (эстрогеновый рецептор 1), MAPK1 (митоген-активируемая протеинкиназа 1), HP (гаптоглобин), F3 (фактор коагуляции III (тромбопластин, тканевой фактор)), CST3 (цистатин С), COG2 (компонент олигомерного комплекса Гольджи 2), ММР9 (матриксная металлопептидаза 9 (желатиназа В, 92 кДа желатиназа, 92 кДа коллагеназа типа IV)), SERPINC1 (ингибитор серпиновой пептидазы, клада С (антитромбин), представитель 1), F8 (фактор коагуляции VIII, прокоагулянтный компонент), НМОХ1 (гемоксигеназа (дециклизирующая) 1), АРОС3 (аполипопротеин С-III), IL8 (интерлейкин 8), PROK1 (прокинетицин 1), CBS (цистатион-бета-синтаза), NOS2 (синтаза 2 оксида азота, индуцируемая), TLR4 (толл-подобный рецептор 4), SELP (селектин Р (гранулярный мембранный белок 140 кДа, антиген CD62)), АВСА1 (АТФ-связывающая кассета, подсемейство А (АВС1), представитель 1), AGT (ангиотензиноген (ингибитор серпиновой пептидазы, клада А, представительн 8)), LDLR (рецептор липопротеинов низкой плотности), GPT (глутамат-пируватная трансаминаза (аланинаминотрансфераза)), VEGFA (фактор роста эндотелия сосудов A), NR3C2 (ядерный рецептор, подсемейство 3, группа С, представитель 2), IL18 (интерлейкин 18 (интерферон-гамма-индуцирующий фактор)), NOS1 (синтаза 1 оксида азота (нейрональная)), NR3C1 (ядерный рецептор, подсемейство 3, группа С, представитель 1 (глюкокортикоидный рецептор)), FGB (бета-цепь фибриногена), HGF (фактор роста гепатоцитов (гепапоэтин А; рассеивающий фактор)), IL1A (интерлейкин 1, альфа), RETN (резистин), AKT1 (гомолог 1 онкогена v-akt вируса тимомы мышей), LIPC (липаза, печеночная), HSPD1 (60 кДа белок теплового шока 1 (шаперонин)), MAPK14 (митоген-активируемая протеинкиназа 14), SPP1 (секретируемый фосфопротеин 1), ITGB3 (интегрин, бета 3 (гликопротеин 111а тромбоцитов, антиген CD61)), CAT (каталаза), UTS2 (уротензин 2), THBD (тромбомодулин), F10 (фактор коагуляции X), CP (церулоплазмин (ферроксидаза)), TNFRSF11B (суперсемейство рецепторов фактора некроза опухоли, представитель 11b), EDNRA (рецептор эндотелина типа A), EGFR (рецептор эпидермального фактора роста (гомолог онкогена вируса эритробластического лейкоза (v-erb-b), птичий)), ММР2 (матриксная металлопептидаза 2 (желатиназа А, 72 кДа желатиназа, 72 кДа коллагеназа типа IV)), PLG (плазминоген), NPY (нейропептид Y), RHOD (гомолог белка семейства генов ras, представитель D), MAPK8 (митоген-активируемая протеинкиназа 8), MYC (гомолог онкогена v-myc вируса миелоцитоматоза (птичий)), FN1 (фибронектин 1), СМА1 (химаза 1, тучная клетка), PLAU (активатор плазминогена, урокиназа), GNB3 (белок, связывающий гуаниновый нуклеотид (G-белок), бета-полипептид 3), ADRB2 (адренергический, бета-2-, рецептор, поверхностный), АРОА5 (аполипопротеин A-V), SOD2 (супероксиддисмутаза 2, митохондриальная), F5 (фактор коагуляции V (проакцелерин, лабильный фактор)), VDR (рецептор витамина D (1,25-дигидроксивитамин D3)), ALOX5 (арахидонат-5-липоксигеназа), HLA-DRB1 (главный комплекс гистосовместимости, класс II, DR-бета 1), PARP1 (полимераза 1 поли(АDР-рибозы)), CD40LG (лиганд CD40), PON2 (параоксоназа 2), AGER (рецептор, специфичный к конечным продуктам усиленного гликозилирования), IRS1 (субстрат 1 инсулинового рецептора), PTGS1 (простагландин-эндопероксидсинтаза 1 (простагландин G/H синтаза и циклооксигеназа)), ЕСЕ1 (эндотелин-превращающий фермент 1), F7 (фактор коагуляции VII (сывороточный ускоритель превращения протромбина)), URN (антагонист рецептора интерлейкина 1), ЕРНХ2 (эпоксидгидролаза 2, цитоплазматическая), IGFBP1 (белок 1, связывающий инсулиноподобный фактор роста), MAPK10 (митоген-активируемая протеинкиназа 10), FAS (Fas (суперсемейство рецепторов TNF, представитель 6)), АВСВ1 (АТФ-связывающая кассета, подсемейство В (MDR/TAP), представитель 1), JUN (онкоген jun), IGFBP3 (белок 3, связывающий инсулиноподобный фактор роста), CD14 (молекула CD14), PDE5A (фосфодиэстераза 5А, cGMP-специфичная), AGTR2 (рецептор ангиотензина II, тип 2), CD40 (молекула CD40, представитель 5 суперсемейства рецепторов TNF), LCAT (лецитинхолестеринацилтрансфераза), CCR5 (рецептор 5 хемокина (мотив С-С)), ММР1 (матриксная металлопептидаза 1 (интерстициальная коллагеназа)), TIMP1 (ингибитор 1 металлопептидазы TIMP), ADM (адреномедуллин), DYT10 (белок 10, связанный с дистонией), STAT3 (переносчик сигнала и активатор транскрипции 3 (фактор ответа острой фазы)), ММР3 (матриксная металлопептидаза 3 (стромелизин 1, прожелатиназа)), ELN (эластин), USF1 (транскрипционный фактор 1, расположенный выше промотора), CFH (фактор комплемента Н), HSPA4 (70 кДа белок теплового шока 4), ММР12 (матриксная металлопептидаза 12 (эластаза макрофагов)), ММЕ (мембранная металлоэндопептидаза), F2R (рецептор фактора коагуляции II (тромбина)), SELL (селектин L), CTSB (катепсин В), ANXA5 (аннексин А5), ADRB1 (адренергический, бета-1-, рецептор), CYBA (цитохром b-245, альфа-полипетид), FGA (альфа-цепь фибриногена), GGT1 (гамма-глутамилтрансфераза 1), LIPG (липаза, эндотелиальная), HIF1A (фактор 1, индуцируемый гипоксией, альфа-субъединица (транскрипционный фактор с основным доменом типа спираль-петля-спираль)), CXCR4 (рецептор 4 хемокина (мотив С-Х-С)), PROC (белок С (инактиватор факторов коагуляции Va и VIIIa)), SCARB1 (класс В фагоцитарных рецепторов, представитель 1), CD79A (молекула CD79a, иммуноглобулин-ассоциированная альфа), PLTP (белок, переносящий фосфолипиды), ADD1 (аддуцин 1 (альфа)), FGG (гамма-цепь фибриногена), SAA1 (сывороточный амилоид A1), KCNH2 (калиевый потенциалзависимый канал, подсемейство Н (eag-родственный), представитель 2), DPP4 (дипептидилпептидаза 4), G6PD (глюкозо-6-фосфатдегидрогеназа), NPR1 (рецептор А натрийуретического пептида/гуанилатциклаза А (рецептор А атрионатрийуретического пептида)), VTN (витронектин), KIAA0101 (KIAA0101), FOS (гомолог онкогена вируса остеосаркомы мышей FBJ), TLR2 (толл-подобный рецептор 2), PPIG (пептидилпролилизомераза G (циклофилин G)), IL1R1 (рецептор интерлейкина 1, тип I), AR (андрогеновый рецептор), CYP1A1 (цитохром Р450, семейство 1, подсемейство А, полипептид 1), SERPINA1 (ингибитор серпиновой пептидазы, клада А (альфа-1 антипротеиназа, антитрипсин), представитель 1), MTR (5-метилтетрагидрофолатгомоцистеинметилтрансфераза), RBP4 (белок 4, связывающий ретинол, плазма), АРОА4 (аполипопротеин A-IV), CDKN2A (ингибитор 2А циклин-зависимой киназы (меланома, р16, ингибирует CDK4)), FGF2 (фактор 2 роста фибробластов (основной)), EDNRB (рецептор эндотелина типа В), ITGA2 (интегрин, альфа 2 (CD49B, субъединица альфа 2 рецептора VLA-2)), CABIN1 (белок 1, связывающий кальциневрин), SHBG (глобулин, связывающий половые гормоны), HMGB1 (группа белков с высокой подвижностью 1), HSP90B2P (90 кДа белок теплового шока бета (Grp94), представитель 2 (псевдоген)), CYP3A4 (цитохром Р450, семейство 3, подсемейство А, полипептид 4), GJA1 (белок межклеточных щелевых контактов, альфа 1, 43 кДа), CAV1 (кавеолин 1, кавеолярный белок, 22 кДа), ESR2 (эстрогеновый рецептор 2 (ER-бета)), LTA (лимфотоксин-альфа (суперсемейство TNF, представитель 1)), GDF15 (фактор 15 роста и дифференцировки), BDNF (нейротрофический фактор головного мозга), CYP2D6 (цитохром Р450, семейство 2, подсемейство D, полипептид 6), NGF (фактор роста нервов (бета-полипептид)), SP1 (транскрипционный фактор Sp1), TGIF1 (гомеобокс 1 TGFB-индуцируемого фактора), SRC (гомолог онкогена v-src вируса саркомы (Schmidt-Ruppin А-2) (птичий)), EGF (эпидермальный фактор роста (бета-урогастрон)), PIK3CG (фосфоинозитид-3-киназа, каталитическая, гамма-полипептид), HLA-A (главный комплекс гистосовместимости, класс I, A), KCNQ1 (калиевый потенциалзависимый канал, подсемейство KQT-подобных белков, представитель 1), CNR1 (каннабиноидный рецептор 1 (головной мозг)), FBN1 (фибриллин 1), CHKA (холинкиназа альфа), BEST1 (бестрофин 1), АРР (белок-предшестенник бета-амилоида (А4)), CTNNB1 (катенин (кадгерин-ассоциированный белок), бета 1, 88 кДа), IL2 (интерлейкин 2), CD36 (молекула CD36 (рецептор тромбоспондина)), PRKAB1 (протеинкиназа, АМР-активируемая, бета 1, некаталитическая субъединица), ТРО (тиреоидная пероксидаза), ALDH7A1 (семейство альдегиддегидрогеназы 7, представитель A1) CX3CR1 (рецептор 1 хемокина (мотив С-Х3-С)), ТН (тирозингидроксилаза), F9 (фактор коагуляции IX), GH1 (гормон роста 1), TF (трансферрин), HFE (гемохроматоз), IL17A (интерлейкин 17A), PTEN (гомолог фосфатазы и тензина), GSTM1 (глутатион-S-трансфераза mu 1), DMD (дистрофин), GATA4 (GATA-связывающий белок 4), F13A1 (фактор коагуляции XIII, полипептид A1), TTR (транстиретин), FABP4 (белок 4, связывающий жирные ксилоты, адипоцитарный), PON3 (параоксоназа 3), АРОС1 (аполипопротеин C-I), INSR (инсулиновый рецептор), TNFRSF1B (суперсемейство рецепторов фактора некроза опухоли, представитель 1B), HTR2A (5-гидрокситриптаминовый (серотониновый) рецептор 2А), CSF3 (колониестимулирующий фактор 3 (гранулоцитарный)), CYP2C9 (цитохром Р450, семейство 2, подсемейство С, полипептид 9), TXN (тиоредоксин), CYP11B2 (цитохром Р450, семейство 11, подсемейство В, полипептид 2), РТН (паратиреоидный гормон), CSF2 (колониестимулирующий фактор 2 (гранулоцитарно-макрофагальный)), KDR (рецептор вставочного домена киназы (рецептор тирозинкиназы III типа)), PLA2G2A (фосфолипаза А2, группа IIA (тромбоциты, синовиальная жидкость)), В2М (бета-2-микроглобулин), THBS1 (тромбоспондин 1), GCG (глюкагон), RHOA (гомолог белка семейства генов ras, представитель A), ALDH2 (семейство альдегиддегидрогеназы 2 (митохондриальная)), TCF7L2 (белок 2, подобный транскрипционному фактору 7 (специфический по отношению к Т-клеткам, HMG-бокс)), BDKRB2 (брадикининовый рецептор В2), NFE2L2 (белок 2, подобный ядерному фактору (эритроидному 2)), NOTCH1 (гомолог Notch 1, ассоциированный с транслокацией (Drosophila)), UGT1A1 (семейство UDP-глюкуронозилтрансферазы 1, полипептид A1), IFNA1 (интерферон, альфа 1), PPARD (рецептор дельта, активируемый пролифератором пероксисом), SIRT1 (сиртуин (гомолог регулятора 2 экспрессии, обеспечивающего сайленсинг) 1 (S. cerevisiae)), GNRH1 (гонадотропин-рилизинг гормон 1 (лютеинизирующий рилизинг-гормон)), РАРРА (ассоциированный с беременностью белок плазмы А, паппализин 1), ARR3 (аррестин 3, ретинальный (Х-аррестин)), NPPC (предшественник С натрийуретического пептида), AHSP (белок, стабилизирующий альфа-гемоглобин), PTK2 (PTK2 тирозиновая протеинкиназа 2), IL13 (интерлейкин 13), MTOR (механистическая мишень рапамицина (серин/треонинкиназа)), ITGB2 (интегрин, бета 2 (субъединица рецептора 3 и 4 компонента комплемента 3)), GSTT1 (глутатион-S-трансфераза тета 1), IL6ST (переносчик сигнала интерлейкина 6 (gp130, рецептор онкостатина М)), СРВ2 (карбоксипептидаза В2 (плазма)), CYP1A2 (цитохром Р450, семейство 1, подсемейство А, полипептид 2), HNF4A (гепатоцитарный ядерный фактор 4, альфа), SLC6A4 (семейство переносчиков растворенных веществ 6 (транспортер нейротрансмиттеров, серотониновый), представитель 4), PLA2G6 (фосфолипаза А2, группа VI (цитозольная, кальций-независимая)), TNFSF11 (суперсемейство фактора некроза опухоли (лиганд), представитель 11), SLC8A1 (семейство переносчиков растворенных веществ 8 (натрий/кальциевый обменник), представитель 1), F2RL1 (белок 1, подобный рецептору фактора коагуляции II (тромбина)), AKR1A1 (семейство 1 альдокеторедуктаз, представитель А1 (альдегидредуктаза)), ALDH9A1 (семейство альдегиддегидрогеназы 9, представитель A1), BGLAP (гамма-карбоксиглутаматный (gla) белок кости), МТТР (микросомальный белок-переносчик триглицеридов), MTRR (редуктаза 5-метилтетрагидрофолат-гомоцистеинметилтрансферазы), SULT1A3 (семейство сульфотрансфераз, цитозольная, 1А, преимущественно воздействующих на фенол, представитель 3), RAGE (антиген опухоли почек), С4В (компонент комплемента 4В (группа крови Chido), P2RY12 (пуринергический рецептор P2Y, связанный с G-белком, 12), RNLS (реналаза, FAD-зависимая аминоксидаза), CREB1 (белок 1, связывающий сАМР-чувствительный элемент), РОМС (проопиомеланокортин), RAC1 (родственный ras субстрат 1 ботулотоксина С3 (семейство rho, малый GTP-связывающий белок Rac1)), LMNA (ламин NC), CD59 (молекула CD59, регуляторный белок комплемента), SCN5A (натриевый канал, потенциалзависимый, тип V, альфа-субъединица), CYP1B1 (цитохром Р450, семейство 1, подсемейство В, полипептид 1), MIF (фактор ингибирования миграции макрофагов (фактор, ингибирующий гликозилирование)), ММР13 (матриксная металлопептидаза 13 (коллагеназа 3)), TIMP2 (ингибитор 2 металлопептидазы TIMP), CYP19A1 (цитохром Р450, семейство 19, подсемейство А, полипептид 1), CYP21A2 (цитохром Р450, семейство 21, подсемейство А, полипептид 2), PTPN22 (тирозиновая протеинфосфатаза, нерецепторного типа 22 (лимфоидная)), MYH14 (миозин, тяжелая цепь 14, отличный от мышечного), MBL2 (лектин, связывающий маннозу (белок С) 2, растворимый (опсонический дефект)), SELPLG (лиганд селектина Р), АОС3 (аминоксидаза, белок 3, содержащий медь (васкулярный адгезивный белок 1)), CTSL1 (катепсин L1), PCNA (ядерный антиген пролиферирующих клеток), IGF2 (инсулиноподобный фактор роста 2 (соматомедин A)), ITGB1 (интегрин, бета 1 (рецептор фибронектина, бета-полипептид, антиген CD29, включающий MDF2, MSK12)), CAST (кальпастатин), CXCL12 (лиганд 12 хемокина (мотив С-Х-С) (стромальный клеточный фактор 1)), IGHE (константный участок тяжелой эпсилон-цепи иммуноглобулина), KCNE1 (калиевый потенциалзависимый канал, Isk-родственное семейство, представитель 1), TFRC (рецептор трансферрина (р90, CD71)), COL1A1 (коллаген, тип I, альфа 1), COL1A2 (коллаген, тип I, альфа 2), IL2RB (рецептор интерлейкина 2, бета), PLA2G10 (фосфолипаза А2, группа X), ANGPT2 (ангиопоэтин 2), PROCR (рецептор белка С, эндотелиальный (EPCR)), NOX4 (NADPH-оксидаза 4), НАМР (противомикробный пептид гепсидин), PTPN11 (тирозиновая протеинфосфатаза, нерецепторного типа 11), SLC2A1 (семейство 2 переносчиков растворенных веществ (транспортер, обеспечивающий облегченный перенос глюкозы), предствитель 1), IL2RA (рецептор интерлейкина 2, альфа), CCL5 (лиганд 5 хемокина (мотив С-С)), IRF1 (регуляторный фактор 1 интерферона), CFLAR (CASP8 и FADD-подобный регулятор апоптоза), CALCA (полипептид альфа, родственный кальцитонину), EIF4E (эукариотический фактор инициации трансляции 4Е), GSTP1 (глутатион-S-трансфераза пи 1), JAK2 (Janus киназа 2), CYP3A5 (цитохром Р450, семейство 3, подсемейство А, полипептид 5), HSPG2 (гепарансульфат-протеогликан 2), CCL3 (лиганд 3 хемокина (мотив С-С)), MYD88 (белок гена первичного ответа, связанного с дифференцировкой миелоидных клеток (88)), VIP (вазоактивный интестинальный пептид), SOAT1 (стерол-О-ацилтрансфераза 1), ADRBK1 (адренергическая, бета, рецепторная киназа 1), NR4A2 (ядерный рецептор, подсемейство 4, группа А, представитель 2), ММР8 (матриксная металлопептидаза 8 (коллагеназа нейтрофилов)), NPR2 (рецептор В натрийуретического пептида/гуанилатциклаза В (рецептор В атрионатрийуретического пептида)), GCH1 (GTP-циклогидролаза 1), EPRS (глутамилпролил-тРНК-синтетаза), PPARGC1A (гамма-рецептор, активируемый пролифератором пероксисом, коактиватор 1 альфа), F12 (фактор коагуляции XII (фактор Хагемана)), РЕСАМ1 (молекула клеточной адгезии эндотелиальных клеток/тромбоцитов), CCL4 (лиганд 4 хемокина (мотив С-С)), SERPINA3 (ингибитор серпиновой пептидазы, клада А (альфа-1 антипротеиназа, антитрипсин), представитель 3), CASR (кальций-чувствительный рецептор), GJA5 (белок межклеточных щелевых контактов, альфа 5, 40 кДа), FABP2 (белок 2, связывающий жирные кислоты, кишечный), TTF2 (фактор терминации транскрипции, РНК-полимераза II), PROS1 (белок S (альфа)), CTF1 (кардиотрофин 1), SGCB (саркогликан, бета (43 кДа дистрофин-ассоциированный гликопротеин)), YME1L1 (YME1-подобный белок 1 (S. cerevisiae)), CAMP (противомикробный пептид кателицидин), ZC3H12A (белок 12А СССН-типа, содержащий "цинковые пальцы"), AKR1B1 (семейство 1 альдокеторедуктаз, представитель В1 (альдозоредуктаза)), DES (десмин), ММР7 (матриксная металлопептидаза 7 (матрилизин, маточный)), AHR (арилуглеводородный рецептор), CSF1 (колониестимулирующий фактор 1 (макрофагальный)), HDAC9 (деацетилаза гистонов 9), CTGF (фактор роста соединительной ткани), KCNMA1 (кальций-активируемый калиевый канал большой проводимости, подсемейство М, альфа, представитель 1), UGT1A (семейство UDP-глюкуронозилтрансферазы 1, полипептид А сложного локуса), PRKCA (протеинкиназа С, альфа), СОМТ (катехол-бета-метилтрансфераза), S100B (S100 кальций-связывающий белок В), EGR1 (белок, связанный с ранними стадиями роста 1), PRL (пролактин), IL15 (интерлейкин 15), DRD4 (допаминовый рецептор D4), CAMK2G (кальций/кальмодулин-зависимая протеинкиназа II гамма), SLC22A2 (семейство 22 переносчиков растворенных веществ (транспортер органических катионов), представитель 2), CCL11 (лиганд 11 хемокина (мотив С-С)), PGF (В321 плацентарный фактор роста), ТНРО (тромбопоэтин), GP6 (гликопротеин VI (тромбоцитарный)), TACR1 (тахикининовый рецептор 1), NTS (нейротензин), HNF1A (HNF1 гомеобокс A), SST (соматостатин), KCND1 (калиевый потенциалзависимый канал, Shal-родственное подсемейство, представитель 1), LOC646627 (ингибитор фосфолипазы), TBXAS1 (тромбоксан А синтаза 1 (тромбоцитарная)), CYP2J2 (цитохром Р450, семейство 2, подсемейство J, полипептид 2), TBXA2R (рецептор тромбоксана А2), ADH1C (алкогольдегидрогеназа 1С (класс I), гамма-полипептид), ALOX12 (арахидонат 12-липоксигеназа), AHSG (альфа-2-HS-гликопротеин), ВНМТ (бетаин-гомоцистеинметилтрансфераза), GJA4 (белок межклеточных щелевых контактов, альфа 4, 37 кДа), SLC25A4 (семейство 25 переносчиков растворенных веществ (митохондриальный переносчик; переносчик адениновых нуклеотидов), представитель 4), ACLY (АТР-цитратлиаза), ALOX5AP (арахидонат-5-липоксигеназа-активирующий белок), NUMA1 (белок 1 ядерного митотического аппарата), CYP27B1 (цитохром Р450, семейство 27, подсемейство В, полипептид 1), CYSLTR2 (цистеиниллейкотриеновый рецептор 2), SOD3 (супероксиддисмутаза 3, внеклеточная), LTC4S (лейкотриен-С4-синтаза), UCN (урокортин), GHRL (препропептид грелин/обестатин), АРОС2 (аполипопротеин С-II), CLEC4A (семейство 4 лектиновьгх доменов С-типа, представитель A), KBTBD10 (белок 10, содержащий повтор kelch и домен ВТВ (POZ)), TNC (тенасцин С), TYMS (тимидилатсинтетаза), SHC1 (SHC (гомолог 2, содержащий домен Src) трансформирующий белок 1), LRP1 (белок 1, родственный рецептору липопротеинов низкой плотности), SOCS3 (супрессор цитокинового сигнала 3), ADH1B (алкогольдегидрогеназа 1 В (класс I), бета-полипептид), KLK3 (калликреин-родственная пептидаза 3), HSD11B1 (гидроксистероидная (11-бета) дегидрогеназа 1), VKORC1 (комплекс эпоксидредуктазы и витамина K, субъединица 1), SERPINB2 (ингибитор серпиновой пептидазы, клада В (овальбумин), представитель 2), TNS1 (тензин 1), RNF19A (белок 19А с доменом ring), EPOR (рецептор эритропоэтина), ITGAM (интегрин, альфа М (субъединица рецептора 3 компонента комплемента 3)), PITX2 (гомеодомен 2, подобный парному), MAPK7 (митоген-активируемая протеинкиназа 7), FCGR3A (Fc-фрагмент IgG, белок 111а с низким сродством, рецептор (CD16a)), LEPR (лептиновый рецептор), ENG (эндоглин), GPX1 (глутатионпероксидаза 1), GOT2 (глутамат-оксалоацетат-трансаминаза 2, митохондриальная (аспартатаминотрансфераза 2)), HRH1 (гистаминовый рецептор H1), NR112 (ядерный рецептор, подсемейство 1, группа I, представитель 2), CRH (кортикотропин-рилизинг-гормон), HTR1A (5-гидрокситриптаминовый (серотониновый) рецептор 1А), VDAC1 (потенциалзависимый анионный канал 1), HPSE (гепараназа), SFTPD (сурфактантный белок D), ТАР2 (транспортер 2, АТР-связывающая кассета, подсемейство В (MDR/TAP)), RNF123 (белок 123 с доменом ring), PTK2B (PTK2B тирозиновая протеинкиназа 2 бета), NTRK2 (нейротрофическая тирозинкиназа, рецептор, тип 2), IL6R (рецептор интерлейкина 6), ACHE (ацетилхолинэстераза (группа крови Yt)), GLP1R (рецептор глюкагон-подобного пептида 1), GHR (рецептор гормона роста), GSR (глутатионредуктаза), NQO1 (NAD(Р)Н-дегидрогеназа, хинон 1), NR5A1 (ядерный рецептор, подсемейство 5, группа А, представитель 1), GJB2 (белок межклеточных щелевых контактов, бета 2, 26 кДа), SLC9A1 (семейство 9 переносчиков растворенных веществ (натрий/водородный обменник), представитель 1), МАОА (моноаминоксидаза А), PCSK9 (пробелок-конвертаза субтилизин/кексин типа 9), FCGR2A (Fc-фрагмент IgG, белок IIa с низким сродством, рецептор (CD32)), SERPINF1 (ингибитор серпиновой пептидазы, клада F (альфа-2 антиплазмин, фактор из пигментного эпителия), представитель 1), EDN3 (эндотелин 3), DHFR (дигидрофолатредуктаза), GAS6 (белок 6, специфический по отношению к остановке роста), SMPD1 (сфингомиелинфосфодиэстераза 1, кислая лизосомная), UCP2 (разобщающий белок 2 (митохондриальный, переносчик протонов)), TFAP2A (транскрипционный фактор АР-2 альфа (активирующий энхансер-связывающий белок 2 альфа)), С4ВРА (компонент комплемента 4 связывающий белок, альфа), SERPINF2 (ингибитор серпиновой пептидазы, клада F (альфа-2 антиплазмин, фактор из пигментного эпителия), представитель 2), TYMP (тимидинфосфорилаза), ALPP (щелочная фосфатаза, плацентарная (изофермент Regan)), CXCR2 (рецептор 2 хемокина (мотив С-Х-С)), SLC39A3 (семейство 39 переносчиков растворенных веществ (цинковый транспортер), представитель 3), ABCG2 (АТР-связывающая кассета, подсемейство G (WHITE), представитель 2), ADA (аденозиндезаминаза), JAK3 (Janus киназа 3), HSPA1A (70 кДа белок теплового шока 1А), FASN (синтаза жирных кислот), FGF1 (фактор 1 роста фибробластов (кислый)), F11 (фактор коагуляции XI), АТР7А (АТФаза, Cu++-транспортирующая, альфа-полипетид), CR1 (рецептор 1 компонента комплемента (3b/4b) (группа крови Knops)), GFAP (глиальный фибриллярный кислый белок), ROCK1 (Rho-ассоциированная, протеинкиназа 1, содержащая суперспираль), МЕСР2 (метил-CpG-связывающий белок 2 (синдром Ретта)), MYLK (киназа легкой цепи миозина), ВСНЕ (бутирилхолинэстераза), LIPE (липаза, гормон-чувствительная), PRDX5 (пероксиредоксин 5), ADORA1 (рецептор аденозина A1), WRN (синдром Вернера, белок, подобный хеликазе RecQ), CXCR3 (рецептор 3 хемокина (мотив С-Х-С)), CD81 (молекула CD81), SMAD7 (представитель 7 семейства SMAD), LAMC2 (ламинин, гамма 2), MAP3K5 (митоген-активируемая протеинкиназа 5), CHGA (хромогранин А (паратиреоидный секреторный белок 1)), IAPP (островковый амилоидный полипептид), RHO (родопсин), ENPP1 (эктонуклеотидпирофосфатаза/фосфодиэстераза 1), PTHLH (гормон, подобный паратиреоидному гормону), NRG1 (нейрегулин 1), VEGFC (фактор роста эндотелия сосудов С), ENPEP (глутамиламинопептидаза (аминопептидаза А)), СЕВРВ (ССААТ/энхансер-связывающий белок (С/ЕВР), бета), NAGLU (N-ацетилглюкозаминидаза, альфа-), F2RL3 (белок 3, подобный рецептору фактора коагуляции II (тромбина)), CX3CL1 (лиганд 1 хемокина (мотив С-Х3-С)), BDKRB1 (брадикининовый рецептор B1), ADAMTS13 (ADAM металлопептидаза с мотивом тромбоспондина типа 1, 13), ELANE (эластаза, экспрессируемая нейтрофилами), ENPP2 (эктонуклеотидпирофосфатаза/фосфодиэстераза 2), CISH (индуцируемый цитокинами белок, содержащий SH2), GAST (гастрин), MYOC (миоциллин, обеспечивающий индуцируемую чувствительность трабекулярной сети к глюкокортикоидам), АТР1А2 (АТФаза, Na+/K+-транспортирующая, альфа 2 полипептид), NF1 (нейрофибромин 1), GJB1 (белок межклеточных щелевых контактов, бета 1, 32 кДа), MEF2A (энхансерный фактор миоцитов 2А), VCL (винкулин), BMPR2 (рецептор костного морфогенетического белка, тип II (серин/треонинкиназа)), TUBB (тубулин, бета), CDC42 (белок 42 цикла клеточного деления (GTP-связывающий белок, 25 кДа)), KRT18 (кератин 18), HSF1 (транскрипционный фактор 1 теплового шока), MYB (гомолог онкогена v-myb вируса миелобластоза (птичий)), PRKAA2 (протеинкиназа, АМР-активируемая, альфа 2 каталитическая субъединица), ROCK2 (Rho-ассоциированная, протеинкиназа 2, содержащая суперспираль), TFPI (ингибитор пути тканевого фактора (липопротеин-ассоциированный ингибитор коагуляции)), PRKG1 (протеинкиназа, cGMP-зависимая, тип I), ВМР2 (костный морфогенетический белок 2), CTNND1 (катенин (кадгерин-ассоциированный белок), дельта 1), СТН (цистатионаза (цистатион гамма-лиаза)), CTSS (катепсин S), VAV2 (фактор обмена гуаниновых нуклеотидов vav 2), NPY2R (рецептор Y2 нейропептида Y), IGFBP2 (белок 2, связывающий инсулиноподобный фактор роста, 36 кДа), CD28 (молекула CD28), GSTA1 (глутатион-S-трансфераза альфа 1), PPIA (пептидилпролилизомераза А (циклофилин А)), АРОН (аполипопротеин Н (бета-2-гликопротеин I)), S100A8 (S100 кальций-связывающий белок А8), IL11 (интерлейкин 11), ALOX15 (арахидонат-15-липоксигеназа), FBLN1 (фибулин 1), NR1H3 (ядерный рецептор, подсемейство 1, группа Н, представитель 3), SCD (стеароил-СоА-десатураза (дельта-9-десатураза)), GIP (желудочный ингибиторный полипептид), CHGB (хромогранин В (секретогранин 1)), PRKCB (протеинкиназа С, бета), SRD5A1 (стероид-5-альфа-редуктаза, альфа-полипетид 1 (3-оксо-5-альфа-стероид-дельта-4-дегидрогеназа альфа 1)), HSD11B2 (гидроксистероид (11-бета) дегидрогеназа 2), CALCRL (белок, подобный кальцитониновому рецептору), GALNT2 (UDP-N-ацетил-альфа-D-галактозамин:полипептид N-ацетилгалактозаминилтрансфераза 2 (GalNAc-T2)), ANGPTL4 (белок 4, подобный ангиопоэтину), KCNN4 (кальций-активируемый калиевый канал средней/малой проводимости, подсемейство N, представитель 4), PIK3C2A (фосфоинозитид-3-киназа, класс 2, альфа-полипетид), HBEGF (гепарин-связывающий EGF-подобный фактор роста), CYP7A1 (цитохром Р450, семейство 7, подсемейство А, полипептид 1), HLA-DRB5 (главный комплекс гистосовместимости, класс II, DR бета 5), BNIP3 (19 кДа белок 3 аденовируса Е1В, взаимодействующий с BCL2), GCKR (регулятор глюкокиназы (гексокиназы 4)), S100A12 (S100 кальций-связывающий белок А12), PADI4 (пептидиларгининдезиминаза, тип IV), HSPA14 (70 кДа белок 14 теплового шока), CXCR1 (рецептор 1 хемокина (мотив С-Х-С)), H19 (H19, подвергающийся импринтингу, экспрессируемый с материнской хромосомы транскрипт (не кодирующий белок)), KRTAP19-3 (кератин-ассоциированный белок 19-3), IDDM2 (инсулин-зависимый белок 2, связанный с сахарным диабетом), RAC2 (родственный ras субстрат 2 ботулотоксина С3 (семейство rho, малый GTP-связывающий белок Rac2)), RYR1 (рианодиновый рецептор 1 (скелетный)), CLOCK (гомолог clock (мышь)), NGFR (суперсемейство рецепторов фактора роста нервов (TNFR, представитель 16)), DBH (допамин-бета-гидроксилаза (допамин-бета-монооксигеназа)), CHRNA4 (холинергический рецептор, никотиновый, альфа 4), CACNA1C (кальциевый канал, потенциалзависимый, L-тип, субъединица альфа 1С), PRKAG2 (протеинкиназа, АМР-активируемая, некаталитическая субъединица гамма 2), CHAT (холинацетилтрансфераза), PTGDS (21 кДа простагландин-D2-синтаза (головной мозг)), NR1H2 (ядерный рецептор, подсемейство 1, группа Н, представитель 2), TEK (тирозинкиназа TEK, эндотелиальная), VEGFB (фактор роста эндотелия сосудов В), MEF2C (энхансерный фактор миоцитов 2С), MAPKAPK2 (митоген-активируемая протеинкиназа-активируемая протеинкиназа 2), TNFRSF11A (суперсемейство рецепторов фактора некроза опухоли, представитель 11a, активатор NFKB), HSPA9 (70 кДа белок 9 теплового шока (морталин)), CYSLTR1 (цистеиниллейкотриеновый рецептор 1), МАТ1А (метионинаденозилтрансфераза I, альфа), OPRL1 (белок 1, подобный опиатному рецептору), IMPA1 (инозитол(мио)-1(или 4)-монофосфатаза 1), CLCN2 (хлорный канал 2), DLD (дигидролипоамиддегидрогеназа), PSMA6 (субъединица протеасомы (просома, макропаин), тип альфа, 6), PSMB8 (субъединица протеасомы (просома, макропаин), тип бета, 8 (большая мультифункциональная пептидаза 7)), CHI3L1 (белок 1, подобный хитиназе 3 (хрящевой гликопротеин-39)), ALDH1B1 (семейство альдегиддегидрогеназы 1, представитель B1), PARP2 (полимераза 2 поли(ADP-рибозы)), STAR (стероидогенный острый регуляторный белок), LBP (липополисахарид-связывающий белок), АВСС6 (АТФ-связывающая кассета, подсемейство C(CFTR/MRP), представитель 6), RGS2 (регулятор 2 передачи сигнала G-белком, 24 кДа), EFNB2 (эфрин-В2), GJB6 (белок межклеточных щелевых контактов, бета 6, 30 кДа), АРОА2 (аполипопротеин А-II), AMPD1 (аденозинмонофосфатдезаминаза 1), DYSF (дисферлин, белок 2В, связанный с тазово-плечевой мышечной дистрофией (аутосомно-рецессивное наследование)), FDFT1 (фарнезилдифосфатфарнезилтрансфераза 1), EDN2 (эндотелин 2), CCR6 (рецептор 6 хемокина (мотив С-С)), GJB3 (белок межклеточных щелевых контактов, бета 3, 31 кДа), IL1RL1 (белок 1, подобный рецептору интерлейкина 1), ENTPD1 (эктонуклеозидтрифосфатдифосфогидролаза 1), BBS4 (белок 4, связанный с синдромом Барде-Бидля), CELSR2 (кадгерин, рецептор 2 G-типа с доменами EGF и LAG (гомолог flamingo, Drosophila)), F11R (рецептор F11), RAPGEF3 (фактор обмена гуаниновых нуклеотидов Rap (GEF) 3), HYAL1 (гиалуроноглюкозаминидаза 1), ZNF259 (белок 259, содержащий "цинковые пальцы"), АТОХ1 (гомолог антиоксидантного белка 1 АТХ1 (дрожжи)), ATF6 (активирующий транскрипционный фактор 6), KHK (кетогексокиназа (фруктокиназа)), SAT1 (спермидин/спермин-N1-ацилтрансфераза 1), GGH (гамма-глутамилгидролаза (конъюгаза, фолилполигаммаглутамилгидролаза)), TIMP4 (ингибитор 4 металлопептидазы TIMP), SLC4A4 (семейство 4 переносчиков растворенных веществ, котранспортер бикарбоната натрия, представитель 4), PDE2A (фосфодиэстераза 2А, cGMP-стимулируемая), PDE3B (фосфодиэстераза 3 В, cGMP-ингибируемая), FADS1 (десатураза 1 жирных кислот), FADS2 (десатураза 2 жирных кислот), TMSB4X (тимозин бета 4, Х-сцепленный), TXNIP (белок, взаимодействующий с тиоредоксином), LIMS1 (домены 1, подобные антигенам LIM и сенесцентных клеток), RHOB (гомолог белка семейства генов ras, представитель В), LY96 (лимфоцитарный антиген 96), FOXO1 (белок forkhead box O1), PNPLA2 (белок 2, содержащий домен фосфолипазы, подобной пататину), TRH (тиреотропин-рилизинг гормон), GJC1 (белок межклеточных щелевых контактов, гамма 1, 45 кДа), SLC17A5 (семейство 17 переносчиков растворенных веществ (анионный/сахарный транспортер), представитель 5), FTO (белок, ассоциированный с жировой массой и ожирением), GJD2 (белок межклеточных щелевых контактов, дельта 2, 36 кДа), PSRC1 (белок 1 с суперспиралью, богатой пролином/серином), CASP12 (каспаза 12 (ген/псевдоген)), GPBAR1 (G белок-связанный рецептор 1 желчной кислоты), PXK (серин/треонинкиназа, содержащая домен РХ), IL33 (интерлейкин 33), TRIB1 (гомолог 1 белка nibbles (Drosophila)), РВХ4 (гомеобокс 4, связанный с лейкозом с вовлечением В-клеток-предшественников), NUPR1 (ядерный белок, регулятор транскрипции, 1), 15-Sep (15 кДа селенопротеин), CILP2 (хрящевой белок 2 промежуточного слоя), TERC (РНК-компонент теломеразы), GGT2 (гамма-глутамилтрансфераза 2), МТ-CO1 (кодируемая митохондриальным геномом цитохром с-оксидаза I) и UOX (уратоксидаза, псевдоген).
В дополнительном варианте осуществления хромосомная последовательность также может быть выбрана из следующих: Pon1 (параоксоназа 1), LDLR (рецептор LDL), АроЕ (аполипопротеин Е), Аро В-100 (аполипопротеин В-100), АроА (аполипопротеин(а)), ApoA1 (аполипопротеин A1), CBS (цистатион-В-синтаза), гликопротеин IIb/IIb, MTHRF (5,10-метилентетрагидрофолатредуктаза (NADPH) и их комбинаций. В одном случае хромосомные последовательности и белки, кодируемые хромосомными последовательностями, связанные с сердечно-сосудистым заболеванием, могут быть выбраны из Cacna1C, Sod1, Pten, Ppar(альфа), Аро Е, лептина и их комбинаций.
Почки
Настоящее изобретение также предусматривает доставку системы CRISPR-Cas в почку. Стратегии доставки для индукции поглощения клетками терапевтической нуклеиновой кислоты предусматривают использование физических сил или векторных систем, например, доставку с использованием вирусов, липидов, или комплексов, или наноносителей. Исходя из первоначальных применений, имеющих незначительную возможную клиническую значимость, в случае доставки нуклеиновых кислот в клетки почки при помощи гидродинамической системной инъекции с созданием высокого давления, широкий диапазон вирусных и невирусных носителей для генной терапии уже применяется для целенаправленного воздействия на посттранскрипционные события в различных животных моделях заболевания почек in vivo (Csaba  and Peter Hamar (2011). Delivery Methods to Target RNAs in the Kidney, Gene Therapy Applications, Prof. Chunsheng Kang (Ed.), ISBN: 978-953-307-541-9, InTech, доступно по ссылке: http://www.intechopen.com/books/gene-therapy-applications/delivery-methods-to-target-rnas-in-the-kidney). Способы доставки в почку обобщены ниже.
and Peter Hamar (2011). Delivery Methods to Target RNAs in the Kidney, Gene Therapy Applications, Prof. Chunsheng Kang (Ed.), ISBN: 978-953-307-541-9, InTech, доступно по ссылке: http://www.intechopen.com/books/gene-therapy-applications/delivery-methods-to-target-rnas-in-the-kidney). Способы доставки в почку обобщены ниже.
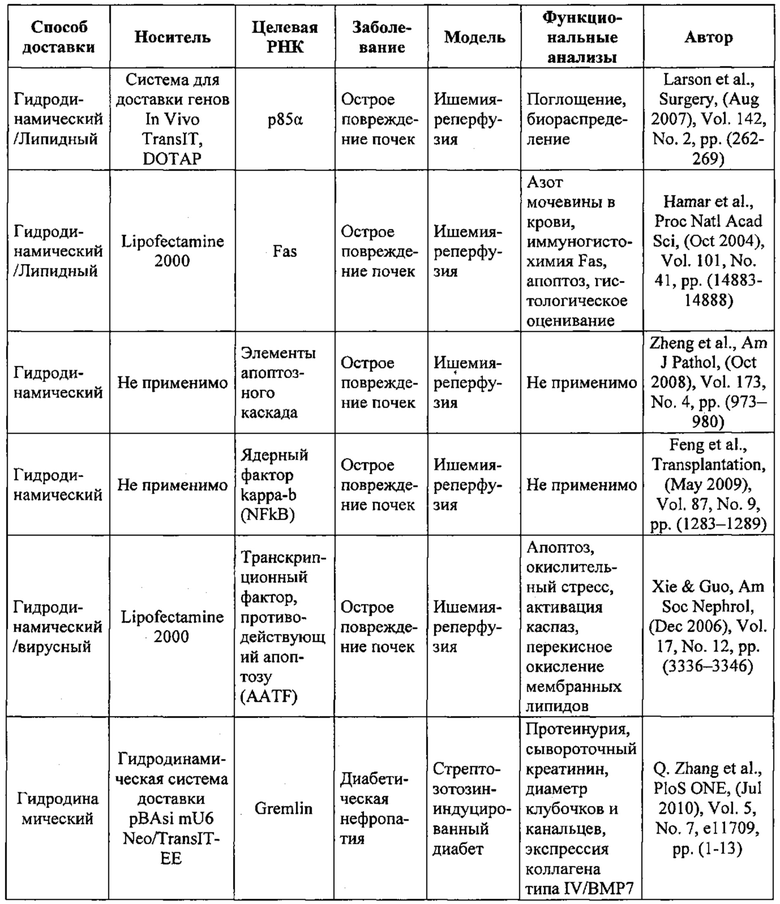
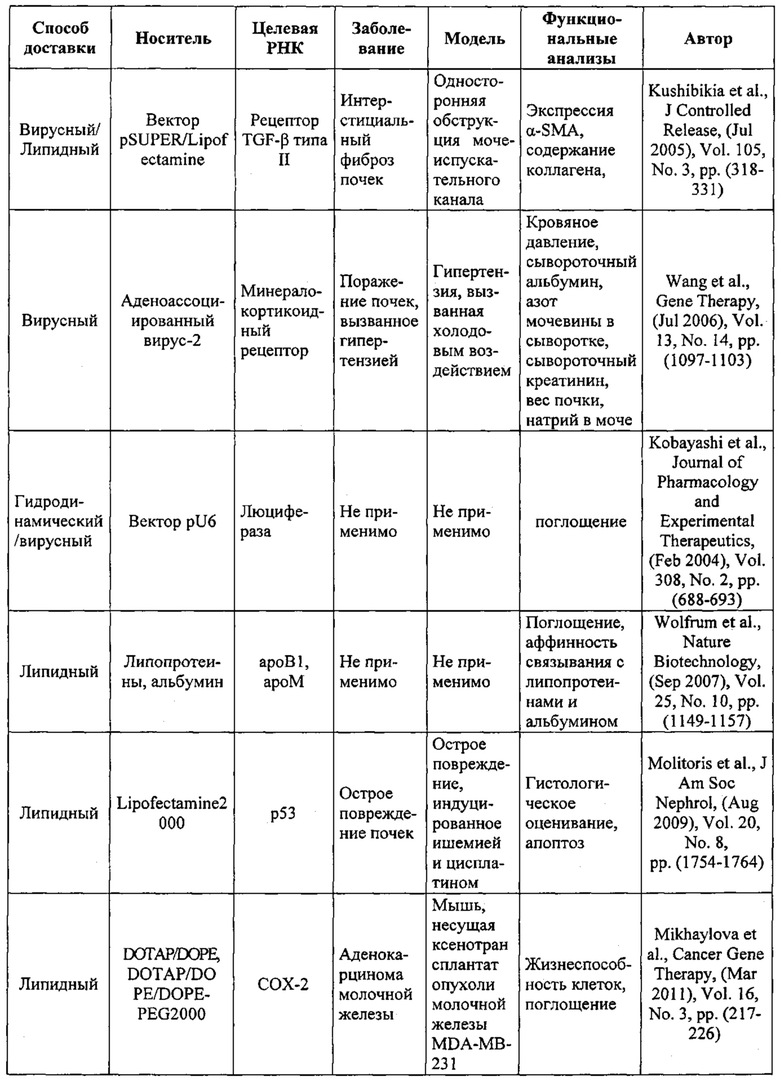
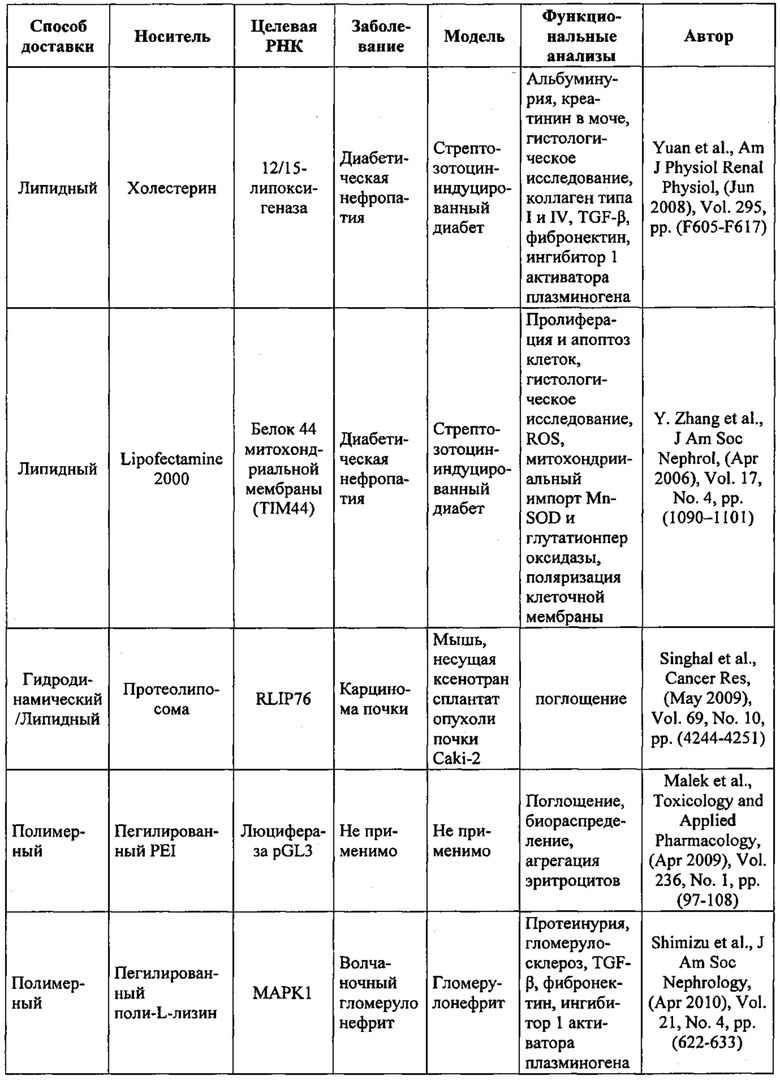
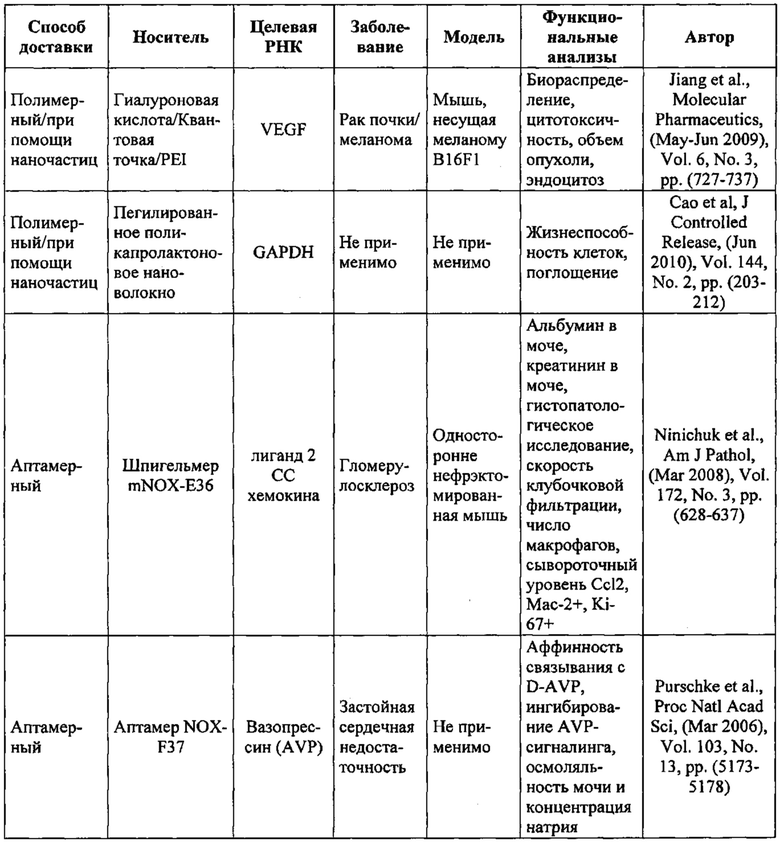
Yuan et al. (Am J Physiol Renal Physiol 295: F605-F617, 2008) исследовали, может ли in vivo доставка малых интерферирующих РНК (siRNA), целенаправленно воздействующих на 12/15-липоксигеназный (12/15-LO) путь метаболизма арахидоновой кислоты, приводить к уменьшению повреждения почек и диабетической нефропатии (DN) в модели диабета 1 типа на мышах, которым инъецировали стрептозотоцин. Для достижения большей in vivo доступности и экспрессии siRNA в почке Yuan и соавт. использовали двухнитевые олигонуклеотиды siRNA к 12/15-LO, конъюгированные с холестерином. Приблизительно 400 мкг siRNA вводили мышам путем подкожной инъекции. Способ согласно Yuang и соавт. можно применять по отношению к системе CRISPR-Cas согласно настоящему изобретению, что предусматривает подкожную инъекцию человеку 1-2 г CRISPR-Cas, конъюгированной с холестерином, для доставки в почки.
Molitoris et al. (J Am Soc Nephrol 20: 1754-1764, 2009) использовали клетки проксимальных канальцев (РТС) в качестве участка реабсорбции олигонуклеотидов в почке для исследования эффективности siRNA, целенаправленно воздействующей на р53, ключевой белок в апоптическом пути, для предупреждения повреждения почки. "Оголенная" синтетическая siRNA к р53, которую вводили путем внутривенной инъекции через 4 ч после ишемического повреждения, обеспечивала максимальную защиту как РТС, так и функции почки. Данные Molitoris и соавт. указывают на быструю доставку siRNA в клетки проксимальных канальцев после внутривенного введения. Для анализа зависимости эффекта от дозы крысам инъецировали дозы siP53 0,33; 1, 3 или 5 мг/кг, которые предоставляли в одни и те же четыре момента времени, что давало в результате суммарные дозы 1,32; 4, 12 и 20 мг/кг, соответственно. Все тестированные дозы siRNA приводили к эффекту, связанному с уменьшением SCr, в день один, причем более высокие дозы являлись эффективными в течение приблизительно пяти дней по сравнению с обработанными PBS контрольными крысами с ишемией. Суммарные дозы 12 и 20 мг/кг обеспечивали наилучший защитный эффект.Способ согласно Molitoris и соавт. можно применять по отношению к системе CRISPR-Cas согласно настоящему изобретению что предусматривает введение человеку суммарных доз 12 и 20 мг/кг для доставки в почки.
Thompson et al. (Nucleic Acid Therapeutics, Volume 22, Number 4, 2012) сообщили о токсикологических и фармакокинетических свойствах синтетических малых интерферирующих РНК I5NP после внутривенного введения грызунам и приматам, отличным от человека. I5NP разработан так, чтобы действовать посредством пути РНК-интерференции (RNAi) для временного ингибирования экспрессии проапоптического белка р53 и создан для защиты клеток от повреждений, связанных с острой ишемией/реперфузией, как, например, острое повреждение почки, что может возникать при обширной операции на сердце, и отсроченная функция трансплантата, что может возникать после пересадки почки. Дозы 800 мг/кг I5NP для грызунов и 1000 мг/кг I5NP для приматов, отличных от человека, требовались для того, чтобы вызвать нежелательные эффекты, которые у обезьян сводились к непосредственному воздействию на кровь, которое включало бессимптомную активацию комплемента и несколько увеличенное время свертывания крови. У крыс не наблюдали дополнительных нежелательных эффектов при использовании аналога I5NP, предназначенного для крыс, что указывало на то, что эти эффекты, вероятно, представляют собой эффекты, связанные с классом синтетических РНК-дуплексов, а не с токсичностью, обусловленной целевой фармакологической активностью I5NP. Взятые вместе, эти данные согласуются с клиническим исследованием с внутривенным введением I5NP для сохранения функции почек после повреждения, связанного с острой ишемией/реперфузией. Уровень, при котором не наблюдали нежелательных эффектов (NOAEL) у обезьян, составлял 500 мг/кг.Не наблюдали эффектов в отношении параметров сердечно-сосудистой, дыхательной и нервной системы у обезьян после внутривенного введения при уровнях дозы до 25 мг/кг.Следовательно, аналогичная доза может предусматриваться для внутривенного введения CRISPR-Cas в почки человека.
Shimizu et al. (J Am Soc Nephrol 21: 622-633, 2010) разработали систему для целенаправленной доставки siRNA в клубочки при помощи средств на основе полиэтиленгликоля и поли-L-лизина. Диаметр комплекса siRNA/наноноситель составлял примерно 10-20 нм в диаметре, причем данный размер будет позволять ему проходить через фенестрированный эндотелий для того, чтобы попасть в мезангий. После интраперитонеальной инъекции флуоресцентно меченых комплексов siRNA/наноноситель, Shimizu и соавт. выявляли siRNA в кровотоке в течение длительного времени. Повторное интраперитонеальное введение комплекса siRNA к митоген-активируемой протеинкиназе 1 (MAPK1)/наноноситель подавляло экспрессию мРНК и белка MAPK1 в клубочках в мышиной модели гломерулонефрита. Для исследования накопления siRNA Су5-меченые siRNA в комплексе с PIC наноносителями (0,5 мл, содержание siRNA 5 нмоль), "оголенные" Су5-меченые siRNA (0,5 мл, 5 нмоль) или Су5-меченые siRNA, инкапсулированные в HVJ-E (0,5 мл, содержание siRNA 5 нмоль), вводили мышам BALB-c. Способ согласно Shimizu и соавт. можно применять по отношению к системе CRISPR-Cas согласно настоящему изобретению, что предусматривает дозу приблизительно 10-20 мкмоль CRISPR-Cas в комплексе с наноносителями на приблизительно 1-2 литра для интраперитонеального введения человеку и доставки в почки.
Легкие
Настоящее изобретение также предусматривает доставку системы CRISPR-Cas в одно легкое или оба легких.
Несмотря на то, что векторы на основе AAV-2 были изначально предложены для доставки CFTR в дыхательные пути при CF, другие серотипы, например, AAV-1, AAV-5, AAV-6 и AAV-9, демонстрировали улучшенную эффективность переноса генов в ряде моделей эпителия легких (смотри, например, Li et al., Molecular Therapy, vol. 17 no. 12, 2067-2077 Dec 2009). Как было продемонстрировано, AAV-1 являлся в ~100 раз более эффективным, чем AAV-2 и AAV-5 при трансдукции эпителиальных клеток дыхательных путей человека in vitro, хотя эффективность трансдукции при помощи AAV-1 эпителия воздухоносных путей трахеи мышей in vivo была равной таковой для AAV-5. Другие исследования продемонстрировали, что AAV-5 является в 50 раз более эффективным, чем AAV-2, при доставке генов в эпителий дыхательных путей человека (НАЕ) in vitro и значительно более эффективным в эпителии воздухоносных путей легких мышей in vivo. Также было продемонстрировано, что AAV-6 являлся более эффективным, чем AAV-2, в эпителиальных клетках дыхательных путей человека in vitro и дыхательных путях мышей in vivo. Как было показано, обнаруженный позже изолят, AAV-9, продемонстрировал большую эффективность переноса генов, чем AAV-5, в назальном и альвеолярном эпителии мышей in vivo, причем экспрессию гена выявляли в течение более 9 месяцев, что позволяет предположить, что AAV может обеспечивать длительную экспрессию генов in vivo, являющуюся необходимым свойством для вектора для доставки гена CFTR. Более того, было продемонстрировано, что AAV-9 можно повторно вводить в легкие мышей без потери экспрессии CFTR и с минимальными последствиями, связанными с иммунной системой. Культуры НАЕ с CF и без CF можно инокулировать на апикальной поверхности 100 мкл векторов AAV в течение нескольких часов (смотри, например, Li et al., Molecular Therapy, vol. 17 no. 12, 2067-2077 Dec 2009). MOI может варьировать от 1×103 до 4×105 векторных геномов/клетка, в зависимости от концентрации вируса и целей экспериментов. Упомянутые выше векторы предусматриваются для доставки и/или введения согласно настоящему изобретению.
Zamora et al. (Am J Respir Crit Care Med Vol 183. pp 531-538, 2011) представили пример применения терапевтического средства на основе РНК-интерференции для лечения инфекционных заболеваний человека, а также рандомизированного исследования противовирусного лекарственного средства у реципиентов трансплантата легкого, инфицированного респираторным синцитиальным вирусом (RSV). Zamora и соавт. провели рандомизированное, двойное слепое, плацебо-контролируемое исследование у реципиентов LTX с инфекцией дыхательных путей RSV. Пациентам давали возможность получать стандартное лечение RSV. ALN-RSV01 в форме аэрозоля (0,6 мг/кг) или плацебо вводили ежедневно в течение 3 дней. Это исследование продемонстрировало, что терапевтическое средство на основе RNAi, целенаправленно воздействующее на RSV, можно вводить без риска реципиентам LTX с инфекцией RSV. Три ежедневные дозы ALN-RSV01 не приводили в результате к какому-либо обострению симптомов в дыхательных путях или нарушению функции легких и не проявляли каких-либо системных провоспалительных эффектов, таких как индукция цитокинов или CRP. Фармакокинетические исследования продемонстрировали только низкий уровень временного системного воздействия после ингаляции, что согласуется с данными доклинических исследований на животных, демонстрирующих, что ALN-RSV01, вводимый внутривенно или путем ингаляции, подвергается быстрому клиренсу из кровотока при помощи опосредованного экзонуклеазами расщепления и почечной экскреции. Способ согласно Zamora и соавт. можно применять по отношению к системе CRISPR-Cas согласно настоящему изобретению и при этом CRISPR-Cas в форме аэрозоля, например, при дозе 0,6 мг/кг, может предусматриваться в соответствии с настоящим изобретением.
Что касается примера химерной направляющей РНК для CFTR с мутацией дельта-508, смотри пример 22, в котором демонстрируется перенос генов или доставка генов системы CRISPR-Cas в дыхательные пути нуждающегося в этом субъекта или пациента, страдающего от муковисцидоза или от связанных с муковисцидозом (CF) симптомов, с использованием частиц аденоассоциированного вируса (AAV). В частности, на примере представлена стратегия репарации для мутации дельта-F508 при муковисцидозе. Этот тип стратегии может применяться у всех организмов. В особенности, что касается CF, подходящие пациенты могут включать следующих: человек, не относящийся к человеку примат, собака, кошка, корова, лошадь и другие домашние животные. В этом случае авторы настоящего изобретения использовали систему CRISPR-Cas, содержащую фермент Cas9, для целенаправленного воздействия на дельта-F508 или другие мутации, индуцирующие CFTR.
Подвергающиеся лечению субъекты в данном случае получали фармацевтически эффективное количество векторной системы на основе AAV в форме аэрозоля на легкое, доставляемое эндобронхиально при самостоятельном дыхании. Таким образом, в общем, доставка в форме аэрозоля является предпочтительной для доставки с помощью AAV. Аденовирус или частицу AAV можно использовать для доставки. Подходящие конструкции с генами, каждый из которых функционально связан с одной или несколькими регуляторными последовательностями, можно клонировать в вектор доставки. В этом случае следующие конструкции представлены в качестве примеров: промотор Cbh или EF1a для Cas9, промотор U6 или H1 для химерной направляющей РНК. Предпочтительной схемой является применение химерной направляющей последовательности, целенаправленно воздействующей на CFTR с мутацией дельта-508, матрицы для репарации мутации дельта-F508 и кодон-оптимизированного фермента Cas9 (предпочтительными Cas9 являются ферменты с нуклеазной или никазной активностью) необязательно с одним или несколькими сигналами или последовательностями ядерной локализации (NLS), например, с двумя (2) NLS. Также предусматриваются конструкции без NLS.
Для идентификации целевого сайта Cas9 авторы настоящего изобретения анализировали локус генома CFTR человека и идентифицировали целевой сайт Cas9. Предпочтительно, как правило и в данном случае с CF, РАМ может содержать мотив NGG или NNAGAAW.
Соответственно, в случае CF способ по настоящему изобретению предусматривает манипуляцию с целевой последовательностью в представляющем интерес локусе генома, включающую
доставку не встречающейся в природе или сконструированной композиции, содержащей вирусную векторную систему, содержащую один или несколько вирусных векторов, функционально кодирующих композицию для ее экспрессии, где композиция содержит:
не встречающуюся в природе или сконструированную композицию, содержащую векторную систему, содержащую один или несколько векторов, содержащих
I. первый регуляторный элемент, функционально связанный с полинуклеотидной последовательностью химерной РНК (chiRNA) системы CRISPR-CAS, где полинуклеотидная последовательность содержит
(a) направляющую последовательность, способную гибридизироваться с целевой последовательностью, связанной с CF, в подходящей клетке млекопитающего,
(b) парную tracr-последовательность, и
(c) tracr-последовательность, и
II. второй регуляторный элемент, функционально связанный с кодирующей фермент последовательностью, кодирующей фермент CRISPR, содержащий по меньшей мере одну или несколько последовательностей ядерной локализации,
где (а), (b) и (с) расположены в 5'-3' ориентации,
где компоненты I и II находятся в одном и том же или в разных векторах системы,
где при транскрипции парная tracr-последовательность гибридизируется с tracr-последовательностью, а направляющая последовательность управляет специфичным к последовательности связыванием комплекса CRISPR с целевой последовательностью, и
где комплекс CRISPR содержит фермент CRISPR, образующий комплекс с (1) направляющей последовательностью, которая гибридизируется с целевой последовательностью, и (2) парной tracr-последовательностью, которая гибридизируется с tracr-последовательностью. Что касается CF, предпочтительные целевые последовательности ДНК содержат CFTR с мутацией дельта-508. Предпочтительный РАМ описан выше. Предпочтительным ферментом CRISPR является любой Cas (описанный в данном документе, но в особенности описанный в примере 22).
Альтернативы CF включают любое наследственное заболевание, и их примеры хорошо известны. Другим предпочтительным способом или применением согласно настоящему изобретению является коррекция дефектов в генах ЕМР2А и ЕМР2В, которые, как было идентифицировано, ассоциированы с болезнью Лафора.
В некоторых вариантах осуществления "направляющая последовательность" может отличаться от "направляющей РНК". Направляющая последовательность может относиться к последовательности, составляющей приблизительно 20 п.о., в пределах направляющей РНК, которая определяет целевой сайт.
В некоторых вариантах осуществления Cas9 представляет собой (или происходит из) SpCas9. В этих вариантах осуществления предпочтительными мутациями являются мутации по любому или всем из положений 10, 762, 840, 854, 863 и/или 986 в SpCas9 или соответствующим положениям в других Cas9 (которые могут быть определены, например, при помощи стандартных инструментов сравнения последовательностей). В частности, любые или все из следующих мутаций являются предпочтительными для SpCas9: D10A, Е762А, Н840А, N854A, N863A и/или D986A; а также предусматривается консервативная замена для любого аминокислотного замещения. То же самое (или консервативные замены по этим мутациям) также является предпочтительным в сортветствующих положениях других Cas9. Особенно предпочтительными являются D10 и Н840 в SpCas9. Однако, в других Cas9 остатки, соответствующие SpCas9 D10 и Н840, также являются предпочтительными. Преимущественными являются те, которые обеспечивают никазную активность. Эти мутации можно применять согласно всем аспектам настоящего изобретения, не только для лечения CF.
Schwank et al. (Cell Stem Cell, 13:653-58, 2013) использовали CRISPR/Cas9 для коррекции дефекта, ассоциированного с муковисцидозом, в стволовых клетках человека. Целью исследователей являлся ген ионного канала, рецептора трансмембранной проводимости, связанного с муковисцидозом (CFTR). Делеция в CFTR приводит к неправильной укладке белка у пациентов с муковисцидозом. С использованием культивируемых стволовых клеток кишечника, полученных из образцов клеток от двух детей с муковисцидозом, Schwank и соавт. могли исправить дефект с использованием CRISPR вместе с донорной плазмидой, содержащей репаративную последовательность, подлежащую вставке. Исследователи затем вырастили клетки до "органоидов" кишечника или кишок небольшого размера и продемонстрировали, что они нормально функционировали. В этом случае приблизительно половина клональных органоидов подвергалась надлежащей коррекции наследственного материала.
Мышцы
Настоящее изобретение также предусматривает доставку системы CRISPR-Cas в мышцу (мышцы).
Bortolanza et al. (Molecular Therapy vol. 19 no. 11, 2055-2064 Nov. 2011) продемонстрировали, что системная доставка кассет экспрессии для РНК-интерференции у мышей FRG1 после начала проявления плече-лопаточно-лицевой мышечной дистрофии (FSHD) приводила к дозозависимому длительному нокдауну FRG1 без симптомов токсичности. Bortolanza и соавт. обнаружили, что однократная внутривенная инъекция 5×1012 vg (векторных геномов) rAAV6-sh1FRG1 восстанавливает гистопатологические характеристики мышц и функцию мышц у мышей FRG1. Более подробно, 200 мкл, содержащие 2×1012 или 5×1012 vg вектора в физиологическом растворе, инъецировали в хвостовую вену с использованием шприца Terumo с иглой 25-ого калибра. Способ согласно Bortolanza и соавт. можно применять в отношении AAV, экспрессирующего CRISPR-Cas, и вводить его человеку путем инъекции в дозе приблизительно 2×1015 или 2×1016 vg вектора.
Dumonceaux et al. (Molecular Therapy vol. 18 no. 5, 881-887 May 2010) осуществляли ингибирование пути миостатина с применением методики РНК-интерференции, направленной против мРНК рецептора миостатина AcvRIIb (sh-AcvRIIb). Восстановление квази-дистрофина было опосредовано методикой направленного U7 пропуска экзона (U7-DYS). Векторы на основе аденоассоциированных вирусов, несущих либо только конструкцию sh-AcvrIIb, только конструкцию U7-DYS, либо комбинацию обеих конструкций, инъецировали в переднюю большеберцовую (ТА) мышцу мышей mdx с дистрофией. Инъекции осуществляли с использованием 1011 геномов вируса AAV. Способ согласно Dumonceaux и соавт. можно применять в отношении AAV, экспрессирующего CRISPR Cas, и вводить его человеку путем инъекции, например, при дозе от приблизительно 1014 до приблизительно 1015 vg вектора.
Kinouchi et al. (Gene Therapy (2008) 15, 1126-1130) сообщили об эффективности in vivo доставки siRNA в скелетные мышцы нормальных или больных мышей посредством образования наночастиц не модифицированной химически siRNA с ателоколлагеном (ATCOL). ATCOL-опосредованное местное применение siRNA, целенаправленно воздействующей на миостатин, отрицательный регулятор роста скелетных мышц, при введении в скелетные мышцы мышей или внутривенно приводило к существенному увеличению мышечной массы в течение нескольких недель после применения. Эти результаты указывают на то, что ATCOL-опосредованное применение siRNA является мощным инструментом для дальнейшего терапевтического применения для лечения заболеваний, в том числе мышечной атрофии. Mst-siRNA (конечная концентрация, 10 мМ) смешивали с ATCOL (конечная концентрация для местного введения, 0,5%) (AteloGene, Kohken, Токио, Япония) в соответствии с инструкциями производителя. После анестезии мышей (самцы C57BL/6 в возрасте 20 недель) при помощи нембутала (25 мг/кг, интраперитонеально) комплекс Mst-siRNA/ATCOL complex инъецировали в жевательные мышцы и двуглавую мышцу бедра. Способ согласно Kinouchi и соавт. можно применять в отношении CRISPR Cas и вводить ее человеку путем инъекции, например, в дозе от приблизительно 500 до 1000 мл 40 мкМ раствора в мышцу.
Hagstrom et al. (Molecular Therapy Vol. 10, No. 2, August 2004) описывали интраваскулярную методику без использования вируса, которая обеспечивает эффективную и воспроизводимую доставку нуклеиновых кислот в мышечные клетки (мышечные волокна) мышц конечностей млекопитающих. Методика включает инъекцию "оголенной" плазмидной ДНК или siRNA в вену дистальной части конечности, временно изолированную при помощи жгута или пневматической манжеты. Доставка нуклеиновой кислоты в мышечные волокна обеспечивается посредством ее быстрого введения путем инъекции при объеме, достаточном для обеспечения просачивания раствора нуклеиновой кислоты в мышечную ткань. Высокие уровни экспрессии трансгена в скелетной мышце достигались как у мелких, так и у крупных животных при минимальной токсичности. Также были получены доказательства доставки siRNA в мышцу конечности. Для внутривенной инъекции плазмидной ДНК макаку-резусу трехходовый кран присоединяли к двухшприцевым насосам (Model PHD 2000; Harvard Instruments), в каждый из которых помещали один шприц. Через пять минут после инъекции папаверина инъецировали pDNA (15,5-25,7 мг в 40-100 мл физиологического раствора) при скорости 1,7 или 2,0 мл/с.Это можно воспроизводить в увеличенном масштабе для плазмидной ДНК, экспрессирующей CRISPR-Cas согласно настоящему изобретению, причем с инъекцией человеку от приблизительно 300 до 500 мг в 800-2000 мл физиологического раствора. Для инъекции аденовирусного вектора крысе 2×109 инфекционных частиц в 3 мл физиологического солевого раствора (NSS) вводили путем инъекции. Это можно воспроизводить в увеличенном масштабе для аденовирусного вектора, экспрессирующего CRISPR-Cas согласно настоящему изобретению, причем путем инъекции человеку приблизительно 1×1013 инфекционных частиц в 10 литрах NSS. Что касается siRNA, крысе инъецировали в большую подкожную вену 12,5 мкг siRNA, а примату инъецировали в большую подкожную вену 750 мкг siRNA. Это можно воспроизводить в увеличенном масштабе для CRISPR-Cas согласно настоящему изобретению, например, с инъекцией от приблизительно 15 до приблизительно 50 мг в большую подкожную вену человека.
Кожа
Настоящее изобретение также предусматривает доставку системы CRISPR-Cas в кожу.
Работа Hickerson et al. (Molecular Therapy-Nucleic Acids (2013) 2, e129) имеет отношение к снабженному приводом устройству с матрицей микроигл для доставки в кожу, предназначенному для самостоятельной (sd) доставки siRNA в кожу человека и мыши. Основной проблемой, связанной с переносом терапевтических средств на основе siRNA для кожи, в клиническую практику, является разработка эффективных систем доставки. Значительные усилия были приложены к созданию ряда методик доставки в кожу с ограниченным успехом. В клиническом исследовании, в котором кожу обрабатывали siRNA, острая боль, связанная с инъекцией при помощи иглы для подкожных инъекций, препятствовала включению дополнительных пациентов в исследование, что придает большое значение потребности в улучшенных, более "удобных для пациента" (т.е. слабая боль или без боли) средствах доставки. Микроиглы представляют эффективный способ доставки крупных заряженных молекул-карго, включающих siRNA, через первичный барьер, роговой слой, и, как правило, считаются причиняющими меньшую боль, чем обычные иглы для подкожных инъекций. Снабженные приводом устройства "штамповочного типа" с микроиглами, в том числе снабженное приводом устройство с матрицей микроигл (MMNA), используемое Hickerson и соавт., как было продемонстрировано, были безопасными в исследованиях на безволосых мышах и причиняли слабую боль или не причиняли боли, о чем свидетельствует (i) широкое применение в косметологии и (ii) ограниченное тестирование, в котором практически все добровольцы считали применение устройства причиняющим намного меньшую боль, чем при вакцинации против гриппа, что позволяет предположить, что результатом доставки siRNA с применением этого устройства будет намного меньшая болезненность, чем испытываемая в предшествующих клинических исследованиях с применением игл для подкожных инъекций. Устройство MMNA (имеющееся в продаже как Triple-M или Tri-M от Bomtech Electronic Со, Сеул, Южная Корея) приспособили для доставки siRNA в кожу мыши и человека. Раствор sd-siRNA (до 300 мкл 0,1 мг/мл РНК) вводили в камеру одноразового инъекционного картриджа с иглами Tri-M (Bomtech), которые устанавливали на глубину 0,1 мм. Для обработки кожи человека деидентифицированную кожу (полученную непосредственно после хирургических процедур) растягивали вручную и прикалывали к пробковому столу перед обработкой. Все интрадермальные инъекции осуществляли при помощи инсулинового шприца с 0,5-дюймовой иглой 28 калибра. Устройство MMNA и способ согласно Hickerson и соавт. можно применять и/или приспосабливать для доставки CRISPR-Cas согласно настоящему изобретению, например, в дозе до 300 мкл 0,1 мг/мл CRISPR-Cas, в кожу.
Работа Leachman et al. (Molecular Therapy, vol. 18 no. 2, 442-446 Feb. 2010) имеет отношение к клиническому исследованию фазы Ib применительно к лечению редкого кожного заболевания врожденной пахионихии (PC), аутосомно-доминантного синдрома, который включает повреждение подошвенной кератодермы, с использованием первого терапевтического средства на основе короткой интерферирующей РНК (siRNA) для кожи. Эта siRNA, под названием TD101, специфично и эффективно целенаправленно воздействует на мРНК мутантного кератина 6а (K6a) N171K, не оказывая влияния на мРНК K6a дикого типа. Схема с увеличением дозы представлена ниже:
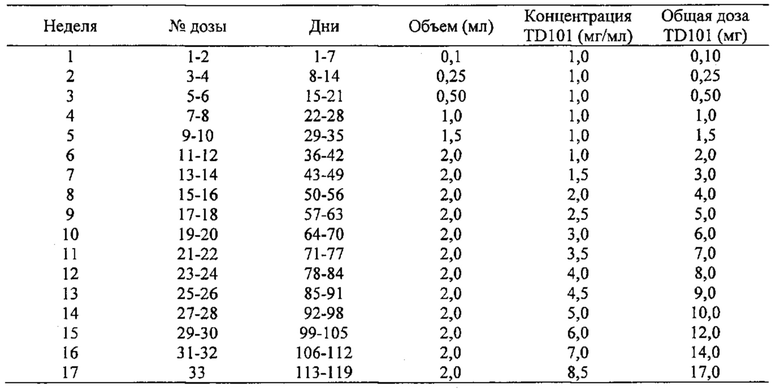
Вначале 0,1 мл 1,0 мг/мл раствора TD101 или только среды (фосфатно-солевого буферного раствора Дульбекко без кальция или магния) вводили в симметрично расположенные мозоли. Определяли шесть возрастающих объемов дозы без нежелательной реакции на увеличения: 0,1, 0,25, 0,5, 1,0, 1,5 и 2,0 мл 1,0 мг/мл раствора TD101 на инъекцию. Так как наиболее высокий запланированный объем (2,0 мл) был хорошо переносимым, концентрацию TD101 затем увеличивали каждую неделю от 1 мг/мл до конечной концентрации 8,5 мг/мл. Аналогичные дозы предусматриваются для введения CRISPR-Cas, которая специфично и эффективно целенаправленно воздействует на мРНК мутантного кератина 6а (K6a) N171K.
Zheng et al. (PNAS, July 24, 2012, vol. 109, no. 30, 11975-11980) продемонстрировали, что конъюгаты сферических наночастиц с нуклеиновой кислотой (SNA-NC), причем ядра из золота окружены плотной оболочкой из строго ориентированных, ковалентно иммобилизованных siRNA, свободно проникают практически в 100% кератиноцитов in vitro в коже мыши и в эпидермисе человека в течение нескольких часов после применения. Zheng и соавт. продемонстрировали, что однократное применение 25 нМ SNA-NC к рецептору эпидермального фактора роста (EGFR) в течение 60 ч демонстрировало эффективный нокдаун гена в коже человека. Аналогичная доза может предусматриваться для CRISPR-Cas, иммобилизованной в SNA-NC для введения в кожу.
Вирусы гепатита
Настоящее изобретение также можно применять для лечения вируса гепатита В (HBV). Однако система CRISPR-Cas должна быть приспособлена для того, чтобы избежать недостатков RNAi, таких как риск перенасыщения эндогенных путей малых РНК, с помощью, например, оптимизации дозы и последовательности (смотри, например, Grimm et al., Nature vol. 441, 26 May 2006). Например, предусматриваются низкие дозы, такие как приблизительно 1-10×1014 частиц на человека.
В другом варианте осуществления систему CRISPR-Cas, направленную против HBV, можно вводить в липосомах, таких как стабильная частица из нуклеиновой кислоты и липидов (SNALP) (смотри, например, Morrissey et al., Nature Biotechnology, Vol. 23, No. 8, August 2005). Предусматриваются ежедневные внутривенные инъекции приблизительно 1, 3 или 5 мг/кг/день CRISPR-Cas, целенаправленно воздействующей на РНК HBV, в SNALP. Ежедневное лечение можно осуществлять в течение приблизительно трех дней и затем еженедельно в течение приблизительно пяти недель.
В другом варианте осуществления систему согласно Chen et al. (Gene Therapy (2007) 14, 11-19) можно применять в системе CRISPR-Cas согласно настоящему изобретению и/или приспосабливать к ней. Chen и соавт. использовали двухнитевой псевдотипированный вектор на основе аденоассоциированного вируса 8 (dsAAV2/8) для доставки shRNA. Однократное введение вектора dsAAV2/8 (1×1012 векторных геномов на мышь), несущего специфичную к HBV shRNA, эффективно подавляло стабильный уровень белка, мРНК и репликативной ДНК HBV в печени трансгенных мышей с HBV, что приводило к снижению нагрузки HBV в кровотоке на вплоть до 2-3 log10. Значительное подавление HBV продолжалось в течение по меньшей мере 120 дней после введения вектора. Терапевтический эффект shRNA зависел от целевой последовательности и не включал активацию интерферона. В соответствии с настоящим изобретением систему CRISPR-Cas, направленную в отношении HBV, можно клонировать в вектор на основе AAV, например, вектор на основе dsAAV2/8, и вводить человеку, например, в дозе от приблизительно 1×1015 векторных геномов до приблизительно 1×1016 векторных геномов на человека.
В другом варианте осуществления способ согласно Wooddell et al. (Molecular Therapy vol. 21 no. 5, 973-985 May 2013) можно применять в системе CRISPR-Cas согласно настоящему изобретению и/или приспосабливать к ней. Woodell и соавт. продемонстрировали, что простая совместная инъекция целенаправленно воздействующего на гепатоциты, конъюгированного с N-ацетилгалактозамином мелиттин-подобного пептида (NAG-MLP) с тройной к печени конъюгированной с холестерином siRNA (chol-siRNA), целенаправленно воздействующей на фактор коагуляции VII (F7), приводит в результате к эффективному нокдауну F7 у мышей и приматов, отличных от человека, без изменений клинических химических показателей или индукции цитокинов. Используя временные и трансгенные мышиные модели инфекции HBV, Wooddell и соавт. продемонстрировали, что однократная совместная инъекция NAG-MLP с активной chol-siRNA, целенаправленно воздействующей на консервативные последовательности HBV, приводила в результате к многократной репрессии вирусной РНК, белков и вирусной ДНК с большой продолжительностью эффекта. Внутривенные совместные инъекции, например, приблизительно 6 мг/кг NAG-MLP и 6 мг/кг специфичной к HBV CRISPR-Cas могут предусматриваться в соответствии с настоящим изобретением. В альтернативном случае приблизительно 3 мг/кг NAG-MLP и 3 мг/кг специфичной к HBV CRISPR-Cas могут доставляться в первый день с последующим введением приблизительно 2-3 мг/кг NAG-MLP и 2-3 мг/кг специфичной к HBV CRISPR-Cas две недели спустя.
Настоящее изобретение также можно применять для лечения вируса гепатита С (HCV). Способы согласно Roelvinki et al. (Molecular Therapy vol. 20 no. 9, 1737-1749 Sep 2012) можно применять по отношению к системе CRISPR-Cas. Например, вектор на основе AAV, такого как AAV8, может быть предполагаемым вектором, и может предусматриваться, например, доза от приблизительно 1,25×1011 до 1,25×1013 векторных геномов на килограмм массы тела (vg/кг).
В еще одном варианте осуществления редактирование генома, опосредованное CRISPR-Cas9, можно применять для коррекции мутации и/или фенотипа, связанных с заболеванием. Это редактирование генома, опосредованное CRISPR-Cas9, можно применять для коррекции мутации и/или фенотипа, связанных с заболеванием, в печени и/или гепатоцитах, что проиллюстрировано в рукописи Нао Yin и соавт. под названием "Genome editing with Cas9 in adult mice corrects a disease mutation and phenotype", опубликованной в Nature Biotechnology, опубликованной онлайн 30 марта 2014 г.; исправленной онлайн 31 марта 2014 т., доступной на веб-сайте nature.com/doifinder/10.1038/nbt.2884, включенной в данный документ с помощью ссылки во всей своей полноте. Данная статья относится к опосредованной CRISPR-Cas9 коррекции мутации Fah в гепатоцитах в мышиной модели заболевания человека врожденной тирозинемии. Было показано, что доставка компонентов системы CRISPR-Cas9 с помощью гидродинамической инъекции приводила к исходному уровню экспрессии белка Fah дикого типа в ~1/250 клеток печени. Было дополнительно показано, что размножение Fah-положительных гепатоцитов избавляло от фенотипа потери массы тела.
Будет очевидно, что организм-хозяин с другими заболеваниями можно лечить подобным образом. Некоторые примеры наследственных заболеваний, вызванных мутациями, приведены в данном документе, но известно их намного больше. Изложенную выше стратегию можно применять для лечения этих заболеваний.
Болезнь Гентингтона (HD)
РНК-интерференция (RNAi) предоставляет терапевтические возможности для лечения этого нарушения посредством уменьшения экспрессии НТТ, гена, приводящего к развитию болезни Гентингтона (смотри, например, McBride et al., Molecular Therapy vol. 19 no. 12 Dec. 2011, pp. 2152-2162), следовательно, заявитель настоящего изобретения предполагает, что ее можно использовать и/или адаптировать к системе CRISPR-Cas. Систему CRISPR-Cas можно получить с использованием алгоритма для уменьшения возможности нецелевого воздействия антисмысловых последовательностей. Последовательности CRISPR-Cas могут целенаправленно воздействовать на последовательность в экзоне 52 гентингтина мыши, макака-резуса или человека и экспрессироваться вирусным вектором, например, AAV. Животным, в том числе человеку, можно вводить приблизительно три микроинъекции на полушарие (всего шесть инъекций): первую на 1 мм ростральнее передней спайки (12 мкл) и две оставшиеся инъекции (12 мкл и 10 мкл, соответственно) на расстоянии 3 и 6 мм каудальнее по отношению к первой инъекции, причем с 1e12 вирусных геномов/мл (vg/ml) AAV при скорости приблизительно 1 мкл/минута, при этом иглу оставляли на месте в течение дополнительных 5 минут для обеспечения диффузии вводимого вещества с наконечника иглы.
DiFiglia et al. (PNAS, October 23, 2007, vol. 104, no. 43, 17204-17209) наблюдали, что однократное введение в полосатое тело взрослого организма siRNA, целенаправленно воздействующей на Htt, может привести к сайленсингу Htt, ослаблению нейрональной патологии и задержке развития аномального поведенческого фенотипа, наблюдаемого в модели HD на трансгенных мышах, полученной с использованием вируса, с быстрым началом проявления. DiFiglia инъецировал мышам в полосатое тело 2 мкл Су3-меченых cc-siRNA-Htt или неконъюгированных siRNA-Htt при 10 мкМ. Аналогичная доза CRISPR-Cas, целенаправленно воздействующей на Htt, может предусматриваться в настоящем изобретении для человека, например, от приблизительно 5 до приблизительно 10 мл 10 мкМ CRISPR-Cas, целенаправленно воздействующей на Htt, можно инъецировать в полосатое тело.
В другом примере Boudreau et al. (Molecular Therapy vol. 17 no. 6 june 2009) инъецировали 5 мкл рекомбинантных векторов на основе вируса AAV серотипа 2/1, экспрессирующих htt-специфичный вирус для RNAi (при 4×1012 вирусных геномов/мл) в полосатое тело. Аналогичная доза CRISPR-Cas, целенаправленно воздействующей на Htt, может предусматриваться в настоящем изобретении для человека, например, от приблизительно 10 до приблизительно 20 мл 4×1012 вирусных геномов/мл), причем CRISPR-Cas, целенаправленно воздействующую на Htt, можно инъецировать в полосатое тело.
В другом примере CRISPR-Cas, целенаправленно воздействующую на НТТ, можно вводить непрерывно (смотри, например, Yu et al., Cell 150, 895-908, August 31, 2012). Yu и соавт. использовали доставку при помощи осмотических насосов, обеспечивающих скорость 0,25 мл/ч (модель 2004), для доставки 300 мг/день ss-siRNA или фосфатно-солевого буферного раствора (PBS) (Sigma Aldrich) в течение 28 дней, и насосы, выполненные с возможностью доставки 0,5 мкл/ч (модель 2002), использовали для доставки 75 мг/день МОЕ ASO положительного контроля в течение 14 дней. Насосы (Durect Corporation) заполняли ss-siRNA или МОЕ, разведенным стерильным PBS, а затем инкубировали при 37°С в течение 24 или 48 (модель 2004) часов перед имплантацией. Мышей анестезировали 2,5% изофлураном и делали срединный разрез у основания черепа. Используя стереотаксические зонды, имплантировали канюлю в боковой правый желудочек и закрепляли при помощи клея Loctite. Катетер, прикрепленный к осмотическому мини-насосу Alzet, прикрепляли к канюле, и насос размещали подкожно между лопатками. Разрез закрывали швами, используя нейлон 5,0. Аналогичная доза CRISPR-Cas, целенаправленно воздействующей на Htt, может предусматриваться в настоящем изобретении для человека, например, можно вводить от приблизительно 500 до 1000 г/день CRISPR-Cas, целенаправленно воздействующей на Htt.
В другом примере непрерывной инфузии Stiles et al. (Experimental Neurology 233 (2012) 463-471) имплантировали интрапаренхиматозный катетер с титановым наконечником иглы в правую скорлупу. Катетер присоединяли к насосу SynchroMed® II (Medtronic Neurological, Миннеаполис, Миннесота), подкожно имплантированному в области живота. После 7 дней инфузии фосфатно-солевого буферного раствора при 6 мкл/день насосы повторно заполняли исследуемым препаратом и программировали на непрерывную доставку в течение 7 дней. От приблизительно 2,3 до 11,52 мг/день siRNA вводили путем инфузии при различных значениях скорости инфузии от приблизительно 0,1 до 0,5 мкл/мин. Аналогичная доза CRISPR-Cas, целенаправленно воздействующей на Htt, может предусматриваться в настоящем изобретении для человека, например, можно вводить от приблизительно 20 до 200 мг/день CRISPR-Cas, целенаправленно воздействующей на Htt.
В другом примере способы согласно публикации патентного документа США №20130253040, закрепленного за Sangamo, также можно адаптировать исходя из TALES к системе CRISPR-Cas согласно настоящему изобретению для лечения болезни Гентингтона.
Нуклеиновые кислоты, аминокислоты и белки
В настоящем изобретении нуклеиновые кислоты используются для связывания целевых последовательностей ДНК. Это является преимущественным, поскольку получать нуклеиновые кислоты намного легче и дешевле, чем белки, и специфичность может варьировать в зависимости от длины фрагмента, если необходима гомология. Например, не требуется сложное 3D-определение положений многочисленных доменов.
Выражения "полинуклеотид", "нуклеотид", "нуклеотидная последовательность", "нуклеиновая кислота" и "олигонуклеотид" используют взаимозаменяемо. Они обозначают полимерную форму нуклеотидов любой длины, как дезоксирибонуклеотидов, так и рибонуклеотидов или их аналогов. Полинуклеотиды могут обладать любой пространственной структурой и могут выполнять любую функцию, известную или неизвестную. Неограничивающими примерами полинуклеотидов являются следующие: кодирующие или некодирующе участки гена или фрагмента гена, локусы (локус), определенные в результате анализа сцепления, экзоны, интроны, матричная РНК (мРНК), транспортная РНК, рибосомная РНК, короткая интерферирующая РНК (siRNA), короткая шпилечная РНК (shRNA), микроРНК (miRNA), рибозимы, кДНК, рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, векторы, выделенные ДНК любой последовательности, выделенные РНК любой последовательности, нуклеиновые кислоты-зонды и праймеры. Выражение также охватывает структуры, подобные нуклеиновым кислотам, с синтетическими остовами, смотри, например, WO 97/03211; WO 96/39154. Полинуклеотид может содержать один или несколько модифицированных нуклеотидов, как, например, метилированные нуклеотиды и аналоги нуклеотидов. При наличии, модификации в нуклеотидную структуру могут быть внесены до или после сборки полимера. Последовательность нуклеотидов может прерываться отличными от нуклеотидов компонентами. Полинуклеотид можно дополнительно модифицировать после полимеризации, как, например, путем конъюгации с компонентом для мечения.
Используемое в данном документе выражение "дикий тип" является выражением из данной области, понятным специалисту в данной области, и означает типичную форму организма, штамма, гена или характеристики, которые встречаются в природе в отличие от мутантных или вариантных форм.
Используемое в данном документе выражение "вариант" следует понимать как означающее проявление качеств, которые характеризуются паттерном, который отличается от такового, встречающегося в природе.
Выражение "не встречающийся в природе" или "сконструированный" используют взаимозаменяемо, и оно указывает на вмешательство человека. Выражения, в тех случаях, когда они касаются молекул нуклеиновых кислот или полипептидов, означают, что молекула нуклеиновой кислоты или полипептид по меньшей мере практически не содержат по меньшей мере один отличный компонент, с которым они естественным образом связаны в природе и встречаются в природе.
"Комплементарность" означает способность нуклеиновой кислоты образовывать водородную(водородные) связь(связи) с другой последовательностью нуклеиновой кислоты при помощи либо традиционного спаривания оснований по Уотсону-Крику, либо других нетрадиционных типов. Процент комплементарности показывает процентное значение остатков в молекуле нуклеиновой кислоты, которые могут образовывать водородные связи (к примеру, спаривание оснований по Уотсону-Крику) со второй последовательностью нуклеиновой кислоты (к примеру, при этом 5, 6, 7, 8, 9, 10 из 10 будут на 50%, 60%, 70%, 80%, 90% и 100% комплементарны). "Точная комплементарность" означает, что все граничащие остатки последовательности нуклеиновой кислоты будут связаны водородными связями с тем же количеством граничащих остатков во второй последовательности нуклеиновой кислоты. Выражение "практически комплементарный", используемое в данном документе, означает степень комплементарности, которая составляет по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% или 100% в пределах участка из 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50 или более нуклеотидов, или относится к двум нуклеиновым кислотам, которые гибридизируются при жестких условиях.
Используемые в данном документе "жесткие условия" в отношении гибридизации означают условия, при которых нуклеиновая кислота с комплементарностью к целевой последовательности преимущественно гибридизируется с целевой последовательностью и практически не гибридизируется с нецелевыми последовательностями. Жесткие условия, как правило, являются зависимыми от последовательности и изменяются в зависимости от ряда факторов. В общем, чем длиннее последовательность, тем выше температура, при которой последовательность специфично гибридизируется со своей целевой последовательностью. Неограничивающие примеры жестких условий описаны подробно в Tijssen (1993), Laboratory Techniques In Biochemistry And Molecular Biology-Hybridization With Nucleic Acid Probes Part I, Second Chapter "Overview of principles of hybridization and the strategy of nucleic acid probe assay", Elsevier, N.Y. Если предполагается полинуклеотидная последовательность, то также предусматриваются комплементарные или частично комплементарные последовательности. Они предпочтительно способны гибридизироваться с эталонной последовательностью при очень жестких условиях. Как правило, для доведения до максимума скорости гибридизации, выбирают условия гибридизации относительно низкой жесткости: температура на приблизительно 20-25°С ниже температуры точки плавления (Tm). Tm представляет собой температуру, при которой 50% специфичной целевой последовательности гибридизируется с точно комплементарным зондом в растворе при определенной ионной силе и рН. Как правило, если требуется по меньшей мере приблизительно 85% нуклеотидная комплементарность гибридизированных последовательностей, выбирают очень жесткие условия отмывки с температурой на приблизительно 5-15°С ниже, чем Tm. Если требуется по меньшей мере приблизительно 70% нуклеотидная комплементарность гибридизированных последовательностей, выбирают умеренно жесткие условия отмывки с температурой на приблизительно 15-30°С ниже, чем Tm. Высоко пермиссивные (очень низкой жесткости) условия отмывки могут характеризоваться наименьшей температурой на 50°С ниже Tm, что допускает высокий уровень ошибочных совпадений между гибридизированными последовательностями. Специалисты в данной области поймут, что другие физические и химические параметры на стадиях гибридизации и отмывки также можно изменять для того, чтобы повлиять на получаемый в результате выявляемый сигнал гибридизации, исходя из конкретного уровня гомологии между целевой последовательностью и последовательностью зонда. Предпочтительные условия высокой жесткости предусматривают инкубирование в 50% формамиде, 5×SSC и 1% SDS при 42°С или инкубирование в 5×SSC и 1% SDS при 65°С с отмывкой в 0,2×SSC и 0,1% SDS при 65°С.
"Гибридизация" означает реакцию, при которой один или несколько полинуклеотидов реагируют с образованием комплекса, который стабилизируется посредством образования водородных связей между основаниями нуклеотидных остатков. Образование водородных связей может происходить по принципу спаривания оснований по Уотсону-Крику, Хугстиновского связывания или любым другим специфичным к последовательности образом. Комплекс может содержать две нити, образующие дуплексную структуру, три или более нитей, образующих многонитевой комплекс, одиночную самогибридизирующуюся нить или любую их комбинацию. Реакция гибридизации может представлять собой стадию в более обширном способе, таком как начальная стадия ПЦР или расщепление полинуклеотида при помощи фермента. Последовательность, способную гибридизироваться с данной последовательностью, называют "комплементарной последовательностью" для данной последовательности.
Используемое в данном документе выражение "локус генома" или "локус" (форма множественного числа локусы) представляет собой конкретное положение гена или последовательности ДНК на хромосоме. "Ген" относится к фрагментам ДНК или РНК, которые кодируют цепь полипептида или РНК, которые играют функциональную роль в организме, и, следовательно, представляют собой молекулярную единицу наследственности в живых организмах. Для цели настоящего изобретения может считаться, что гены содержат участки, которые регулируют образование продукта гена, независимо от того, являются ли регуляторные последовательности смежными с кодирующими и/или транскрибируемыми последовательностями или нет. Соответственно, ген содержит, но без обязательного ограничения, промоторные последовательности, терминаторы, последовательности регуляции трансляции, например, участки связывания рибосомы и участки внутренней посадки рибосомы, энхансеры, сайленсеры, инсуляторы, граничные элементы, точки начала репликации, участки прикрепления к матриксу и регуляторные участки локуса.
Используемое в данном документе выражение "экспрессия локуса генома" или "экспрессия гена" относится к процессу, в ходе которого информация гена используется в синтезе функционального продукта гена. Продукты экспрессии генов часто представляют собой белки, но у генов, не кодирующих белки, например, генов рРНК или генов тРНК, продукт представляет собой функциональную РНК. Процесс экспрессии генов используется всеми известными живыми организмами - эукариотами (в том числе многоклеточными организмами), прокариотами (бактериями и археями) и вирусами - для образования функциональных продуктов, необходимых для выживания. Используемое в данном документе выражение "экспрессия" гена или нуклеиновой кислоты охватывает не только экспрессию генов в клетках, но также транскрипцию и трансляцию нуклеиновой кислоты(нуклеиновых кислот) в системах клонирования и в любом другом контексте. Используемое в данном документе выражение "экспрессия" означает процесс, при котором полинуклеотид транскрибируется с ДНК-матрицы (как, например, с образованием мРНК или другого РНК-транскрипта), и/или процесс, при помощи которого транскрибированная мРНК далее транслируется с образованием пептидов, полипептидов или белков. Транскрипты и закодированные полипептиды можно в совокупности называть "продуктом гена". Если полинуклеотид получен из геномной ДНК, то экспрессия может включать сплайсинг мРНК в эукариотической клетке.
Выражения "полипептид", "пептид" и "белок" используют взаимозаменяемо в данном документе для обозначения полимеров из аминокислот любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты, и его структура может прерываться отличными от аминокислот компонентами. Выражения также охватывают полимер из аминокислот, который был модифицирован; например, образованием дисульфидных связей, гликозилированием, липидизацией, ацетилированием, фосфорилированием или любой другой манипуляцией, такой как конъюгация с компонентом для мечения. Используемое в данном документе выражение "аминокислота" включает природные и/или отличные от природных или синтетические аминокислоты, в том числе глицин и как D-, так и L-оптические изомеры, и аналоги аминокислот, и пептидомиметики.
Используемое в данном документе выражение "домен" или "домен белка" относится к части последовательности белка, которая может существовать и функционировать независимо от остальной части белковой цепи.
Как описано в аспектах согласно настоящему изобретению, идентичность последовательности относится к гомологии последовательности. Сравнения гомологии можно проводить на глаз или, что делается чаще, с помощью легко доступных программ для сравнения последовательностей. При помощи этих коммерчески доступных компьютерных программ можно рассчитывать процент (%) гомологии между двумя или более последовательностями и также можно рассчитывать идентичность последовательности между двумя или более аминокислотными последовательностями или последовательностями нуклеиновых кислот. В некоторых предпочтительных вариантах осуществления участок кэпирования dTALE, описанный в данном документе, имеет последовательности по меньшей мере на 95% идентичные или обладающие идентичностью с участком кэпирования аминокислотных последовательностей, представленных в данном документе.
Значения гомологии последовательности можно получить при помощи любой из ряда компьютерных программ, известных в данной области техники, например, BLAST или FASTA и т.д. Подходящей компьютерной программой для осуществления такого выравнивания является пакет программ GCG Wisconsin Bestfit (Университет Висконсина, США; Devereux et al., 1984, Nucleic Acids Research 12:387). Примеры другого программного обеспечения, при помощи которого можно осуществлять сравнения последовательностей, включают, без ограничения, пакет программ BLAST (см. Ausubel et al., 1999 ibid - Chapter 18), FASTA (Atschul et al., 1990, J. Mol. Biol., 403-410) и набор инструментов для сравнения GENEWORKS. Как в BLAST, так и в FASTA доступны оффлайн- и онлайн-поиск (см. Ausubel et al., 1999 ibid, pages 7-58 - 7-60). Однако, предпочтительным является использование программы GCG Bestfit.
Процент (%) гомологии последовательности можно рассчитывать для непрерывных последовательностей, т.е. одну последовательность выравнивают с другой последовательностью и каждую аминокислоту или нуклеотид в одной последовательности непосредственно сравнивают с соответствующей аминокислотой или нуклеотидом в другой последовательности, один остаток за один раз. Это называется выравниванием "без гэпов". Как правило, такие выравнивания без гэпов осуществляют только для относительно малого числа остатков.
Несмотря на то, что этот способ является очень простым и последовательным, при его применении не учитывается то, что, например, в паре последовательностей, которые в остальном являются идентичными, одна вставка или делеция может привести к тому, что следующие за ней аминокислотные остатки не будут учитываться при выравнивании, что, таким образом, потенциально приводит в результате к значительному уменьшению % гомологии при осуществлении глобального выравнивания. Следовательно, большинство способов сравнения последовательностей разработаны для получения оптимальных выравниваний, в которых учитываются возможные вставки и делеции без наложения чрезмерного штрафа на общую гомологию или балл идентичности. Это достигается путем вставки "гэпов" в выравнивание последовательностей в попытке доведения до максимума локальной гомологии или идентичности.
Однако в этих более сложных способах назначаются "штрафы за внесения гэпа" для каждого гэпа, который встречается при выравнивании, таким образом, для одинакового количества идентичных аминокислот выравнивание последовательностей с наименьшим количеством гэпов, что отражает высокую степень родства между двумя сравниваемыми последовательностями, может привести в результате к более высокому баллу, чем выравнивание с большим количеством гэпов. Как правило, используют "значения аффинного штрафа за внесение гэпа для родственных последовательностей", с использованием которых начисляют относительно высокое значение за существование гэпа и меньший штраф за каждый последующий остаток в гэпе. Это наиболее часто используемая система оценки гэпов. Высокие штрафы за внесение гэпа, конечно, могут привести к оптимизированным выравниваниям с меньшим количеством гэпов. В большинстве программ выравнивания допускается изменение штрафов за внесение гэпа. Однако, предпочтительно использовать значения по умолчанию при использовании такого программного обеспечения для сравнений последовательностей. Например, при использовании пакета программ GCG Wisconsin Bestfit штраф за внесение гэпа по умолчанию для аминокислотной последовательности составляет -12 для гэпа и -4 за каждый остаток его продолжения.
Для расчета максимального % гомологии, следовательно, изначально требуется получение оптимального выравнивания с учетом штрафов за внесение гэпа. Подходящая компьютерная программа для осуществления такого выравнивания представляет собой пакет программ GCG Wisconsin Bestfit (Devereux al., 1984 Nuc. Acids Research 12 p387). Примеры другого программного обеспечения, при помощи которого можно осуществлять сравнения последовательностей, включают, без ограничения, пакет программ BLAST (см. Ausubel et al., 1999 Short Protocols in Molecular Biology, 4th Ed. - Chapter 18), FASTA (Altschul et al., 1990 J. Mol. Biol. 403-410) и набор инструментов для сравнения GENEWORKS. Как в BLAST, так и в FASTA доступны оффлайн- и онлайн-поиск (см. Ausubel et al., 1999, Short Protocols in Molecular, pages 7-58 - 7-60). Однако, для некоторых задач предпочтительно использовать программу GCG Bestfit. Новый инструмент под названием BLAST 2 Sequences также доступен для сравнения белковых и нуклеотидных последовательностей (смотри FEMS Microbiol Lett. 1999 174(2): 247-50; FEMS Microbiol Lett. 1999 177(1): 187-8 и веб-сайт Национального центра биотехнологической информации на веб-сайте Национальных институтов здравоохранения).
Несмотря на то, что конечный % гомологии можно измерять в единицах идентичности, способ выравнивания сам по себе, как правило, не основывается на сравнении пар по типу "все или ничего". Вместо этого, как правило, используется матрица замен со шкалой сходства, с использованием которой назначаются баллы для каждого попарного сравнения на основании химического сходства или эволюционного расстояния. Примером этой матрицы, используемой чаще всего, является матрица BLOSUM62 - матрица по умолчанию для набора программ BLAST. В программах GCG Wisconsin, как правило, используются общедоступные значения по умолчанию или специальные таблицы сравнения символов, если предоставляются (дополнительные подробности смотри в руководстве пользователя). Для некоторых задач предпочтительным является применение общедоступных значений по умолчанию для пакета программ GCG или, в случае другого программного обеспечения, матрицы по умолчанию, например, BLOSUM62.
В альтернативном случае процентные значения гомологии можно рассчитывать с использованием функции множественного выравнивания в DNASIS™ (Hitachi Software) с применением алгоритма, аналогичного CLUSTAL (Higgins DG & Sharp РМ (1988), Gene 73(1), 237-244). После того, как программное обеспечение предоставит оптимальное выравнивание, возможно рассчитать % гомологии, предпочтительно % идентичности последовательности. Программное обеспечение, как правило, осуществляет это в ходе сравнения последовательностей и выдает численный результат.
Последовательности также могут иметь делеции, вставки или замены аминокислотных остатков, которые приводят к молчащему изменению и приводят в результате к функционально эквивалентному веществу. Преднамеренные аминокислотные замены могут быть сделаны на основании сходства свойств аминокислот (например, полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатков), и, следовательно, они являются применимыми для того, чтобы сгруппировать аминокислоты в функциональные группы. Аминокислоты можно сгруппировать на основании свойств только их боковых цепей. Однако также, более полезно включить данные о мутациях. Группы аминокислот, полученные таким образом, вероятно, будут консервативными по структурным причинам. Эти группы могут быть описаны в форме диаграммы Венна (Livingstone C.D. and Barton G.J. (1993) "Protein sequence alignments: a strategy for the hierarchical analysis of residue conservation" Comput. Appl. Biosci. 9: 745-756) (Taylor W.R. (1986) "The classification of amino acid conservation" J. Theor. Biol. 119; 205-218). Консервативные замены могут быть сделаны, например, в соответствии с таблицей, представленной ниже, в которой описывается общепринятая группировка аминокислот в форме диаграммы Венна.

Варианты осуществления согласно настоящему изобретению охватывают последовательности (как полинуклеотидные, так и полипептидные), которые могут содержать гомологичную замену (используемые в данном документе как замена, так и замещение означают обмен существующего аминокислотного остатка или нуклеотида на альтернативный остаток или нуклеотид), которая может происходить, т.е., в случае аминокислот, замену на аналогичную, например, основной на основную, кислой на кислую, полярной на полярную и т.д. Также может происходить негомологичная замена, т.е. остатка из одного класса на остаток из другого или, в альтернативном случае, связанная с включением аминокислот, отличных от природных, например, орнитина (далее в данном документе называемого Z), орнитиндиаминомасляной кислоты (далее в данном документе называемой В), норлейцинорнитина (далее в данном документе называемого О), пиридилаланина, тиенилаланина, нафтилаланина и фенилглицина.
Вариантные аминокислотные последовательности могут содержать подходящие спейсерные группы, которые могут быть вставлены между любыми двумя аминокислотными остатками последовательности, в том числе алкильные группы, например, метальную, этильную или пропильную группы, в дополнение к аминокислотным спейсерам, таким как глициновые или β-аланиновые остатки. Другая форма вариации, которая включает присутствие одного или нескольких аминокислотных остатков в пептоидной форме, может быть хорошо понятна специалистам в данной области. Для того, чтобы избежать сомнений, "пептоидная форма" используется для обозначения вариантных аминокислотных остатков, где замещающая группа для α-углерода расположена на атоме азота остатка, а не на α-углероде. Способы получения пептидов в пептоидной форме известны из уровня техники, например, Simon RJ et al., PNAS (1992) 89(20), 9367-9371, и Horwell DC, Trends Biotechnol. (1995) 13(4), 132-134.
Практическое применение настоящего изобретения предусматривает, если не указано иное, традиционные методики иммунологии, биохимии, химии, молекулярной биологии, микробиологии, клеточной биологии, геномики и технологию рекомбинантной ДНК, которые находятся в пределах квалификации специалиста в данной области. Смотри Sambrook, Fritsch and Maniatis, MOLECULAR CLONING: A LABORATORY MANUAL, 2nd edition (1989); CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (F.M. Ausubel, et al. eds., (1987)); серия METHODS IN ENZYMOLOGY (Academic Press, Inc.): PCR 2: A PRACTICAL APPROACH (M.J. MacPherson, B.D. Hames and G.R. Taylor eds. (1995)), Harlow and Lane, eds. (1988) ANTIBODIES, A LABORATORY MANUAL и ANIMAL CELL CULTURE (R.I. Freshney, ed. (1987)).
Векторы
В одном аспекте настоящее изобретение предусматривает векторы, которые применяются при конструировании и оптимизации систем CRISPR-Cas.
Как используется в данном документе, "вектор" представляет собой инструмент, который позволяет или облегчает перенос объекта из одной среды в другую. В репликон, такой как плазмида, фаг или космида, может быть встроен другой сегмент ДНК для осуществления, таким образом, репликации встроенного сегмента. Как правило, вектор способен к репликации, если ассоциирован с соответствующими регуляторными элементами. В целом, выражение "вектор" относится к молекуле нуклеиновой кислоты, способной переносить другую нуклеиновую кислоту, с которой она была связана. Векторы включают, без ограничения, молекулы нуклеиновых кислот, которые являются однонитевыми, двухнитевыми или частично двухнитевыми; молекулы нуклеиновых кислот, которые содержат один или несколько свободных концов, не содержат свободных концов (к примеру, кольцевые); молекулы нуклеиновых кислот, которые содержат ДНК, РНК или и ту, и другую; и другие разновидности полинуклеотидов, известных из уровня техники. Одним типом вектора является "плазмида", которая означает кольцевую петлю двухнитевой ДНК, в которую можно встраивать дополнительные сегменты ДНК, как, например, при помощи стандартных технологий молекулярного клонирования. Другим типом вектора является вирусный вектор, где полученные из вируса последовательности ДНК или РНК присутствуют в векторе для упаковки в вирус (к примеру, ретровирусы, ретровирусы с дефектной системой репликации, аденовирусы, аденовирусы с дефектной системой репликации и аденоассоциированные вирусы (AAV)). Вирусные векторы также включают полинуклеотиды, переносимые вирусами для трансфекции клетки-хозяина. Определенные векторы способны к саморегулируемой репликации в клетке-хозяине, в которую они введены (к примеру, бактериальные векторы с бактериальной точкой начала репликации и эписомные векторы для млекопитающих). Другие векторы (к примеру, неэписомные векторы для млекопитающих) интегрируются в геном клетки-хозяина после введения в клетку-хозяина и, таким образом, реплицируются наряду с геномом хозяина. Более того, определенные векторы способны управлять экспрессией генов, с которыми они функционально связаны. Такие векторы в данном документе называют "векторами экспрессии". Общепринятые пригодные в технологиях рекомбинантной ДНК векторы экспрессии часто находятся в форме плазмид.
Рекомбинантные векторы экспрессии могут содержать нуклеиновую кислоту согласно настоящему изобретению в форме, подходящей для экспрессии нуклеиновой кислоты в клетке-хозяине, что означает, что рекомбинантные векторы экспрессии включают один или несколько регуляторных элементов, которые могут быть выбраны с учетом клеток-хозяев, которые предполагается использовать для экспрессии, которые функционально связаны с последовательностью нуклеиновой кислоты, экспрессия которой предполагается. В контексте рекомбинантного вектора экспрессии выражение "функционально связанный" предназначено означать, что представляющая интерес нуклеотидная последовательность связана с регуляторным(регуляторными) элементом(элементами) таким образом, при котором обеспечивается возможность экспрессии нуклеотидной последовательности (к примеру, в in vitro системе транскрипции/трансляции или в клетке-хозяине, когда вектор вводят в клетку-хозяина). Что касается способов рекомбинации и клонирования, следует упомянуть заявку на патент США №10/815730, опубликованную 2 сентября 2004 г. как US 2004-0171156 A1, содержание которой включено в данный документ посредством ссылки во всей полноте.
Аспекты настоящего изобретения относятся к векторам для химерной РНК и Cas9. Бицистронные векторы экспрессии для химерной RNA и Cas9 являются предпочтительными. В общем и конкретно в данном варианте осуществления Cas9 предпочтительно управляется промотором CBh. Химерная РНК предпочтительно может управляться промотором U6. Оптимальным является их сочетание. Химерная направляющая РНК, как правило, состоит из направляющей последовательности (Ns) из 20 п. о., которая может быть соединена с tracr-последовательностью (проходящей от первого "U" в нижней нити к концу транскрипта). В разных указанных положениях tracr-последовательность может быть усечена. Направляющие и tracr-последовательности разделены парной tracr-последовательностью, которая может представлять собой GUUUUAGAGCUA. За ней может следовать показанная последовательность петли GAAA. Обе из них являются предпочтительными примерами. Заявители продемонстрировали Саs9-опосредованные вставки/делеции в локусах ЕМХ1 и PVALB человека посредством анализов с помощью SURVEYOR. ChiRNA показаны путем обозначения их "+n", a crRNA относится к гибридной РНК, в которой направляющие и tracr-последовательности экспрессируются в виде раздельных транскриптов. По всей данной заявке химерная РНК также может называться одиночной направляющей или синтетической направляющей РНК (sgRNA). Петля предпочтительно представляет собой GAAA, но не ограничивается этой последовательностью или действительно ее длина составляет только 4 п. о. Действительно, предпочтительные петлеобразующие последовательности для использования в шпилечных структурах имеют длину четыре нуклеотида и наиболее предпочтительно имеют последовательность GAAA. Однако, можно использовать более короткие или длинные последовательности петли, а также альтернативные последовательности. Последовательности предпочтительно включают нуклеотидный триплет (например, AAA) и дополнительный нуклеотид (например, С или G). Примеры петлеобразующих последовательностей включают СААА и AAAG.
Выражение "регуляторный элемент" предназначено включать промоторы, энхансеры, участки внутренней посадки рибосомы (IRES) и другие контролирующие экспрессию элементы (к примеру, сигналы терминации транскрипции, такие как сигналы полиаденилирования и поли-U-последовательности). Такие регуляторные элементы описаны, например, в Goeddel, GENE EXPRESSION TECHNOLOGY: METHODS IN ENZYMOLOGY 185, Academic Press, San Diego, Calif. (1990). Регуляторные элементы включают такие, которые управляют конститутивной экспрессией нуклеотидной последовательности во многих типах клеток-хозяев, и такие, которые управляют экспрессией нуклеотидной последовательности только в определенных клетках-хозяевах (к примеру, тканеспецифичные регуляторные последовательности). Тканеспецифичный промотор может управлять экспрессией преимущественно в представляющей интерес целевой ткани, такой как мышца, нейрон, кость, кожа, кровь, конкретных органах (к примеру, печени, поджелудочной железе) или определенных типах клеток (к примеру, лимфоцитах). Регуляторные элементы также могут управлять экспрессией зависимым от времени образом, как, например, зависимым от клеточного цикла или зависимым от стадии развития образом, который может быть или может не быть также тканеспецифичным или специфичным к типу клеток. В некоторых вариантах осуществления вектор содержит один или несколько промоторов для pol III (к примеру, 1, 2, 3, 4, 5 или более промоторов для pol III), один или несколько промоторов для pol II (к примеру, 1, 2, 3, 4, 5 или более промоторов для pol II), один или несколько промоторов для pol I (к примеру, 1, 2, 3, 4, 5 или более промоторов для pol I) или их комбинации. Примеры промоторов для pol III включают, без ограничения, промоторы U6 и H1. Примеры промоторов для pol II включают, без ограничения, ретровирусный промотор LTR вируса саркомы Рауса (RSV) (необязательно с энхансером RSV), промотор цитомегаловируса (CMV) (необязательно с энхансером CMV) [смотри, например, Boshart et al, Cell, 41:521-530 (1985)], промотор SV40, промотор дигидрофолатредуктазы, промотор β-актина, промотор глицерофосфаткиназы (PGK) и промотор EF1α. Также выражением "регуляторный элемент" охвачены энхансерные элементы, такие как WPRE; энхансеры CMV; сегмент R-U5' в LTR HTLV-I (Mol. Cell. Biol., Vol. 8(1), p. 466-472, 1988); энхансер SV40; и интронная последовательность между экзонами 2 и 3 β-глобина кролика (Proc. Natl. Acad. Sci. USA., Vol. 78(3), p. 1527-31, 1981). Специалистам в данной области будет понятно, что конструкция вектора экспрессии может зависеть от таких факторов, как выбор клетки-хозяина, подлежащей трансформации, желательный уровень экспрессии и т.п. Вектор можно вводить в клетки-хозяева с получением, таким образом, транскриптов, белков или пептидов, в том числе белков слияния или пептидов, кодируемых нуклеиновыми кислотами, которые описаны в данном документе (к примеру, транскриптов коротких палиндромных повторов, регулярно расположенных группами (CRISPR), белков, ферментов, их мутантных форм, белков слияния на их основе и т.п.). Что касается регуляторных последовательностей, следует упомянуть заявку на патент США №10/491026, содержание которой включено в данный документ посредством ссылки во всей ее полноте. Что касается промоторов, следует упомянуть РСТ публикацию WO 2011/028929 и заявку на патент США №12/511940, содержание которых включено в данный документ посредством ссылки во всей их полноте.
Векторы могут быть разработаны для экспрессии транскриптов CRISPR (к примеру, транскриптов нуклеиновых кислот, белков или ферментов) в прокариотических или эукариотических клетках. Например, транскрипты CRISPR могут экспрессироваться в клетках бактерий, как, например, Escherichia coli, клетках насекомых (с использованием бакуловирусных векторов экспрессии), клетках дрожжей или клетках млекопитающих. Подходящие клетки-хозяева дополнительно рассматриваются в Goeddel, GENE EXPRESSION TECHNOLOGY: METHODS IN ENZYMOLOGY 185, Academic Press, San Diego, Calif. (1990). В качестве альтернативы рекомбинантный вектор экспрессии может транскрибироваться и транслироваться in vitro, например, при помощи регуляторных последовательностей промотора Т7 и полимеразы Т7.
Векторы можно вводить и размножать в прокариоте или прокариотической клетке, В некоторых вариантах осуществления прокариота используют для амплификации копий вектора, который предполагается вводить в эукариотическую клетку, или в качестве промежуточного вектора при получении вектора, который предполагается вводить в эукариотическую клетку (к примеру, путем амплификации плазмиды как части системы упаковки вирусного вектора). В некоторых вариантах осуществления прокариота используют для амплификации копий вектора и экспрессии одной или нескольких нуклеиновых кислот, как, например, для обеспечения источника одного или нескольких белков для доставки в клетку-хозяина или организм-хозяин. Экспрессию белков в прокариотах наиболее часто осуществляют в Escherichia coli с векторами, содержащими конститутивные или индуцируемые промоторы, управляющие экспрессией белков слияния либо белков, не являющихся белками слияния. Слитые векторы добавляют некоторое количество аминокислот к белку, закодированному в них, как, например, к амино-концу рекомбинантного белка. Такие слитые векторы могут служить для одной или нескольких целей, как, например: (i) для повышения экспрессии рекомбинантного белка; (ii) для повышения растворимости рекомбинантного белка и (iii) для содействия очистке рекомбинантного белка путем функционирования в качестве лиганда при аффинной очистке. Часто в слитых векторах экспрессии сайт протеолитического расщепления вводят в место соединения фрагмента слияния и рекомбинантного белка для облегчения отделения рекомбинантного белка от фрагмента слияния после очистки белка слияния. Такие ферменты и их когнатные распознающие последовательности включают фактор Ха, тромбин и энтерокиназу. Иллюстративные слитые векторы экспрессии включают pGEX (Pharmacia Biotech Inc; Smith and Johnson, 1988. Gene 67: 31-40), pMAL (New England Biolabs, Беверли, Массачусетс) и pRIT5 (Pharmacia, Пискатауэй, Нью-Джерси), в которых глутатион-S-трансфераза (GST), мальтоза-связывающий белок Е или белок А, соответственно, слиты с целевым рекомбинантным белком.
Примеры подходящих индуцируемых не являющихся слитыми векторов экспрессии в Е. coli включают pTrc (Amrann et al., (1988) Gene 69:301-315) и pET 11d (Studier et al., GENE EXPRESSION TECHNOLOGY: METHODS IN ENZYMOLOGY 185, Academic Press, San Diego, Calif. (1990) 60-89).
В некоторых вариантах осуществления вектор является вектором экспрессии для дрожжей. Примеры векторов для экспрессии в дрожжах Saccharomyces cerevisiae включают pYepSecl (Baldari, et al., 1987. EMBO J. 6: 229-234), pMFa (Kuijan and Herskowitz, 1982. Cell 30: 933-943), pJRY88 (Schultz et al., 1987. Gene 54: 113-123), pYES2 (Invitrogen Corporation, Сан-Диего, Калифорния) и picZ (InVitrogen Corp, Сан-Диего, Калифорния).
В некоторых вариантах осуществления вектор управляет экспрессией белка в клетках насекомых при помощи бакуловирусных векторов экспрессии. Бакуловирусные векторы, доступные для экспрессии белков в культивируемых клетках насекомых (к примеру, клетках SF9), включают группу рАс (Smith, et al., 1983. Mol. Cell. Biol. 3: 2156-2165) и группу pVL (Lucklow and Summers, 1989. Virology 170: 31-39).
В некоторых вариантах осуществления вектор способен управлять экспрессией одной или нескольких последовательностей в клетках млекопитающих при помощи вектора экспрессии для млекопитающих. Примеры векторов экспрессии для млекопитающих включают pCDM8 (Seed, 1987. Nature 329: 840) и рМТ2РС (Kaufman, et al., 1987. EMBO J. 6: 187-195). При использовании клеток млекопитающих функции контроля вектора экспрессии, как правило, обеспечиваются одним или несколькими регуляторными элементами. Например, широко используемые промоторы получают из вируса полиомы, аденовируса 2, цитомегаловируса, вируса обезьян 40 и других, раскрыты в данном документе и известны из уровня техники. Что касается других подходящих систем экспрессии как для прокариотических, так и для эукариотических клеток, смотри, к примеру, главы 16 и 17 в Sambrook, et al., MOLECULAR CLONING: A LABORATORY MANUAL. 2nd ed., Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989.
В некоторых вариантах осуществления рекомбинантные векторы экспрессии для млекопитающих способны управлять экспрессией нуклеиновой кислоты преимущественно в определенном типе клеток (к примеру, тканеспецифичные регуляторные элементы используют для экспрессии нуклеиновой кислоты). Тканеспецифичные регуляторные элементы известны из уровня техники. Неограничивающие примеры подходящих тканеспецифичных промоторов включают промотор гена альбумина (печеночноспецифический; Pinkert, et al., 1987. Genes Dev. 1: 268-277), lymphoid-specific промоторы (Calame and Eaton, 1988. Adv. Immunol. 43: 235-275), в частности, промоторы генов Т-клеточных рецепторов (Winoto and Baltimore, 1989. EMBOJ. 8: 729-733) и иммуноглобулинов (Baneiji, et al., 1983. Cell 33:729-140; Queen and Baltimore, 1983. Cell 33: 741-748), нейрон-специфичные промоторы (к примеру, промотор гена нейрофиламента; Byrne and Ruddle, 1989. Proc. Natl. Acad. Sci. USA 86: 5473-5477), специфичные к клеткам поджелудочной железы промоторы (Edlund, et al., 1985. Science 230: 912-916) и специфичные к клеткам молочной железы промоторы (к примеру, промотор гена белка молочной сыворотки; патент США №4873316 и публикация европейской заявки №264166). Регулируемые стадией развития промоторы также охвачены, к примеру, промоторы генов hox мыши (Kessel and Grass, 1990. Science 249: 374-379) и промотор гена α-фетопротеина (Campes and Tilghman, 1989. Genes Dev. 3: 537-546). Что касается этих прокариотических и эукариотических векторов, следует упомянуть патент США №6750059, содержание которого включено в данный документ посредством ссылки во всей его полноте. Другие варианты осуществления согласно настоящему изобретению могут относиться к вирусным векторам, которые упоминаются в заявке на патент США №13/092085, содержание которой включено в данный документ посредством ссылки во всей ее полноте. Тканеспецифичные регуляторные элементы известны из уровня техники, и в связи с этим следует упомянуть патент США №7776321, содержание которого включено в данный документ посредством ссылки во всей его полноте.
Регуляторные элементы
В некоторых вариантах осуществления регуляторный элемент является функционально связанным с одним или несколькими элементами системы CRISPR так, чтобы управлять экспрессией одного или нескольких элементов системы CRISPR. В целом, CRISPR (короткие палиндромные повторы, регулярно расположенные группами), также известные как SPIDR (прерываемые спейсерами прямые повторы), составляют семейство локусов ДНК, которые, как правило, специфичны для определенного вида бактерий. Локус CRISPR включает определенный класс чередующихся коротких повторов последовательностей (SSR), которые были обнаружены у Е. coli (Ishino et al., J. Bacteriol., 169:5429-5433 [1987]; and Nakata et al., J. Bacteriol., 171:3553-3556 [1989]), и ассоциированные гены. Подобные чередующиеся SSR были идентифицированы у Haloferax mediterranei, Streptococcus pyogenes, Anabaena и Mycobacterium tuberculosis (см., Groenen et al., Mol. Microbiol., 10:1057-1065 [1993]; Hoe et al., Emerg. Infect. Dis., 5:254-263 [1999]; Masepohl et al., Biochim. Biophys. Acta 1307:26-30 [1996]; и Mojica et al., Mol. Microbiol., 17:85-93 [1995]). Локусы CRISPR, как правило, отличаются от других SSR по структуре повторов, которые были названы короткими повторами с регулярными интервалами (SRSR) (Janssen et al., OMICS J. Integ. Biol., 6:23-33 [2002]; и Mojica et al., Mol. Microbiol., 36:244-246 [2000]). В целом, повторы являются короткими элементами, которые встречаются группами, которые регулярно разделены уникальными вставочными последовательностями с практически постоянной длинной (Mojica et al., [2000], выше). Несмотря на то, что последовательности повторов высоко консервативны между штаммами, некоторое количество чередующихся повторов и последовательностей спейсерных участков, как правило, отличаются от штамма к штамму (van Embden et al., J. Bacteriol., 182:2393-2401 [2000]). Локусы CRISPR были идентифицированы у более чем 40 видов прокариотов (смотри, к примеру, Jansen et al., Mol. Microbiol., 43:1565-1575 [2002]; и Mojica et al., [2005]), в том числе, без ограничения, Aeropyrum, Pyrobaculum, Sulfolobus, Archaeoglobus, Halocarcula, Methanobacterium, Methanococcus, Methanosarcina, Methanopyrus, Pyrococcus, Picrophilus, Thermoplasma, Corynebacterium, Mycobacterium, Streptomyces, Aquifex, Porphyromonas, Chlorobium, Thermus, Bacillus, Listeria, Staphylococcus, Clostridium, Thermoanaerobacter, Mycoplasma, Fusobacterium, Azarcus, Chromobacterium, Neisseria, Nitrosomonas, Desulfovibrio, Geobacter, Myxococcus, Campylobacter, Wolinella, Acinetobacter, Erwinia, Escherichia, Legionella, Methylococcus, Pasteurella, Photobacterium, Salmonella, Xanthomonas, Yersinia, Treponema и Thermotoga.
В целом, "система CRISPR" означает в совокупности транскрипты и другие элементы, участвующие в экспрессии CRISPR-ассоциированных ("Cas") генов или управляющие их активностью, в том числе последовательности, кодирующие ген Cas, tracr-(транс-активируемую CRISPR) последовательность (к примеру, tracrRNA или активную частичную tracrRNA), парную tracr-последовательность (охватывающую "прямой повтор" и tracrRNA-процессированный неполный прямой повтор в контексте эндогенной системы CRISPR), направляющую последовательность (также называемую "спейсером" в контексте эндогенной системы CRISPR) или другие последовательности и транскрипты из локуса CRISPR. В вариантах осуществления согласно настоящему изобретению выражения направляющая последовательность и направляющая РНК используются взаимозаменяемо. В некоторых вариантах осуществления один или несколько элементов системы CRISPR получены из системы CRISPR I типа, II типа или III типа. В некоторых вариантах осуществления один или несколько элементов системы CRISPR получены из определенного организма, содержащего эндогенную систему CRISPR, как, например, Streptococcus pyogenes. В целом, система CRISPR характеризуется элементами, которые способствуют образованию комплекса CRISPR в сайте целевой последовательности (также называемом протоспейсером в контексте эндогенной системы CRISPR). В контексте образования комплекса CRISPR "целевая последовательность" означает последовательность, по отношению к которой направляющая последовательность разработана так, чтобы обладать комплементарностью, где гибридизация между целевой последовательностью и направляющей последовательностью способствует образованию комплекса CRISPR. Целевая последовательность может содержать любой полинуклеотид, как, например, ДНК- или РНК-полинуклеотиды. В некоторых вариантах осуществления целевая последовательность расположена в ядре или цитоплазме клетки.
В некоторых вариантах осуществления прямые повторы можно идентифицировать in silico посредством поиска повторяющихся мотивов, которые соответствуют любым или всем из следующих критериев:
1. обнаруживаются в окне размером 2 т.п.о. геномной последовательности, фланкирующей CRISPR типа II;
2. имеют протяженность от 20 до 50 п. о. и
3. расположены с интервалами от 20 до 50 п. о.
В некоторых вариантах осуществления можно использовать 2 из этих критериев, например, 1 и 2, 2 и 3 или 1 и 3. В некоторых вариантах осуществления можно использовать все 3 критерия.
В некоторых вариантах осуществления кандидатные tracrRNA можно впоследствии предсказать с использованием последовательностей, которые соответствуют любым или всем из следующих критериев:
1. гомология последовательности с прямыми повторами (поиск мотивов в Geneious с несовпадениями вплоть до 18 п. о.);
2. наличие предсказанного Rho-независимого терминатора транскрипции по направлению транскрипции и
3. стабильная шпилечная вторичная структура между tracrRNA и прямым повтором.
В некоторых вариантах осуществления можно использовать 2 из этих критериев, например, 1 и 2, 2 и 3 или 1 и 3. В некоторых вариантах осуществления можно использовать все 3 критерия.
В некоторых вариантах осуществления химерные конструкции синтетических направляющих РНК (sgRNA) могут включать по меньшей мере 12 п. о. дуплексной структуры между прямым повтором и tracrRNA.
В предпочтительных вариантах осуществления настоящего изобретения система CRISPR представляет собой систему CRISPR типа II, и фермент Cas представляет собой Cas9, который катализирует расщепление ДНК. Ферментативная активность Cas9, происходящего из Streptococcus pyogenes, или любого близкородственного Cas9 приводит к образованию двухнитевых разрывов в последовательностях целевого сайта, который гибридизируется с 20 нуклеотидами направляющей последовательности и который содержит последовательность мотива, прилегающего к протоспейсеру (РАМ) (примеры включают NGG/NRG или РАМ, который можно определить, как описано в данном документе) после 20 нуклеотидов целевой последовательности. Активность CRISPR посредством Cas9 по отношению к сайт-специфическому распознаванию и расщеплению ДНК определяется направляющей последовательностью, tracr-последовательностью, которая частично гибридизируется с направляющей последовательностью и последовательностью РАМ. Больше аспектов системы CRISPR описаны в Karginov and Hannon, The CRISPR system: small RNA-guided defence in bacteria and archaea, Mole Cell 2010, January 15; 37(1): 7.
Локус CRISPR типа II происходит из Streptococcus pyogenes SF370, который содержит кластер из 4 генов Cas9, Cas1, Cas2 и Csn1, а также 2 некодирующих элемента РНК, tracrRNA и характерный массив повторяющихся последовательностей (прямых повторов), чередующихся с короткими фрагментами неповторяющихся последовательностей (спейсерами, приблизительно 30 п. о. каждый). В данной системе целенаправленный двухнитевой разрыв (DSB) целевой ДНК образуется в ходе четырех последовательных стадий (фигура 2А). Во-первых, две некодирующих РНК, массив pre-crRNA и tracrRNA транскрибируются с локуса CRISPR. Во-вторых, tracrRNA гибридизируется с прямыми повторами pre-crRNA, которая затем процессируется в зрелые crRNA, содержащие индивидуальные спейсерные последовательности. В-третьих, комплекс зрелая crRNA:tracrRNA направляет Cas9 к ДНК-мишени, состоящей из протоспейсера и соответствующего РАМ, посредством образования гетеродуплекса между спейсерным участком crRNA и протоспейсерной ДНК. И наконец, Cas9 опосредует расщепление целевой ДНК выше РАМ с образованием DSB внутри протоспейсера (фигура 2А). На фигуре 2В представлена ядерная локализация кодон-оптимизированного Cas9. Для того, чтобы способствовать точной инициации транскрипции, промотор U6, зависимый от РНК-полимеразы III, выбирали для управления экспрессией tracrRNA (фигура 2С). Подобным образом, конструкцию на основе промотора U6 разработали для экспрессии массива pre-crRNA, состоящего из одного спейсера, фланкированного двумя прямыми повторами (DR, также включены в термин "парные tracr-последовательности"; фигура 2С). Исходный спейсер был сконструирован для нацеливания на целевой сайт размером 33 пары оснований (п.о.) (протоспейсер из 30 п. о., а также последовательность мотива CRISPR (РАМ) из 3 п. о., соответствующая мотиву узнавания NGG у Cas9) в локусе ЕМХ1 человека (фигура 2С), ключевом гене в развитии коры головного мозга.
Как правило, в контексте эндогенной системы CRISPR образование комплекса CRISPR (содержащего направляющую последовательность, гибридизирующуюся с целевой последовательностью и образующую комплекс с одним или несколькими белками Cas) приводит к расщеплению одной или обеих нитей в или около (к примеру, в пределах 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 50 или более пар оснований) целевой последовательности. Не желая ограничиваться какой-либо теорией, полагают, что tracr-последовательность, которая может содержать всю или часть tracr-последовательности дикого типа или состоять из нее (к примеру, приблизительно или более чем приблизительно 20, 26, 32, 45, 48, 54, 63, 67, 85 или более нуклеотидов tracr-последовательности дикого типа), может также образовывать часть комплекса CRISPR, как, например, путем гибридизации вдоль по меньшей мере части tracr-последовательности со всей или частью парной tracr-последовательности, которая функционально связана с направляющей последовательностью. В некоторых вариантах осуществления один или несколько векторов, управляющих экспрессией одного или нескольких элементов системы CRISPR, вводят в клетку-хозяина, так что экспрессия элементов системы CRISPR управляет образованием комплекса CRISPR в одном или нескольких целевых сайтах. Например, каждое из фермента Cas, направляющей последовательности, связанной с парной tracr-последовательностью, и tracr-последовательности может быть функционально связано с отдельными регуляторными элементами в отдельных векторах. В качестве альтернативы, два или более элементов, экспрессируемых с одних и тех же или различных регуляторных элементов, можно объединять в одиночном векторе, при этом один или несколько дополнительных векторов обеспечивают любые компоненты системы CRISPR, не включенные в первый вектор. Элементы системы CRISPR, которые объединены в одиночном векторе, могут быть расположены в любой удобной ориентации, как, например, один элемент, расположенный 5' ("выше") относительно или 3' ("ниже") относительно второго элемента. Кодирующая последовательность одного элемента может быть расположена на той же или противоположной нити кодирующей последовательности второго элемента и направлена в том же или противоположном направлении. В некоторых вариантах осуществления один промотор управляет экспрессией транскрипта, кодирующего фермент CRISPR, и одной или нескольких из направляющей последовательности, парной tracr-последовательности (необязательно функционально связанной с направляющей последовательностью) и tracr-последовательности, встроенных в одну или несколько интронных последовательностей (к примеру, каждая в отдельном интроне, две или более по меньшей мере в одном интроне или все в одном интроне). В некоторых вариантах осуществления фермент CRISPR, направляющая последовательность, парная tracr-последовательность и tracr-последовательность функционально связаны с одним и тем же промотором и экспрессируются при помощи него.
В некоторых вариантах осуществления вектор содержит один или несколько сайтов встраивания, как, например, последовательность узнавания для рестрикционной эндонуклеазы (также называемая "сайтом клонирования"). В некоторых вариантах осуществления один или несколько сайтов встраивания (к примеру, приблизительно или более чем приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более сайтов встраивания) расположены выше и/или ниже последовательности одного или нескольких элементов одного или нескольких векторов. В некоторых вариантах осуществления вектор содержит сайт встраивания выше парной tracr-последовательности и необязательно ниже регуляторного элемента, функционально связанного с парной tracr-последовательностью, так что после встраивания направляющей последовательности в сайт встраивания и при экспрессии направляющая последовательность управляет специфичным к последовательности связыванием комплекса CRISPR с целевой последовательностью в эукариотической клетке. В некоторых вариантах осуществления вектор содержит два или более сайта встраивания, при этом каждый сайт встраивания расположен между двумя парными tracr-последовательностями с тем, чтобы обеспечить возможность встраивания направляющей последовательности в каждый сайт. В таком расположении две или более направляющие последовательности могут содержать две или более копий одиночной направляющей последовательности, две или более различных направляющих последовательностей или их комбинации. В тех случаях, когда применяют несколько различных направляющих последовательностей, может быть использована одиночная экспрессирующая конструкция для целенаправленного воздействия активности CRISPR на несколько различных соответствующих целевых последовательностей в клетке. Например, одиночный вектор может содержать приблизительно или более чем приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20 или более направляющих последовательностей. В некоторых вариантах осуществления приблизительно или более чем приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более таких содержащих направляющие последовательности векторов могут быть предусмотрены и необязательно доставлены в клетку.
В некоторых вариантах осуществления вектор содержит регуляторный элемент, функционально связанный с кодирующей фермент последовательностью, кодирующей фермент CRISPR, как, например, белок Cas. Неограничивающие примеры белков Cas включают Cas1, Cas1B, Cas2, Cas3, Cas4, Cas5, Cas6, Cas7, Cas8, Cas9 (также известный как Csn1 и Csx12), Cas10, Csy1, Csy2, Csy3, Cse1, Cse2, Csc1, Csc2, Csa5, Csn2, Csm2, Csm3, Csm4, Csm5, Csm6, Cmr1, Cmr3, Cmr4, Cmr5, Cmr6, Csb1, Csb2, Csb3, Csx17, Csx14, Csx10, Csx16, CsaX, Csx3, Csx1, Csx15, Csf1, Csf2, Csf3, Csf4, их гомологи или их модифицированные варианты. В некоторых вариантах осуществления немодифицированный фермент CRISPR, как, например, Cas9, обладает активностью в отношении расщепления ДНК. В некоторых вариантах осуществления фермент CRISPR управляет расщеплением одной или обеих нитей в определенной точке целевой последовательности, как, например, в пределах щелевой последовательности и/или в пределах комплементарной последовательности для целевой последовательности. В некоторых вариантах осуществления фермент CRISPR управляет расщеплением одной или обеих нитей в пределах приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 50, 100, 200, 500 или более пар оснований от первого или последнего нуклеотида целевой последовательности. В некоторых вариантах осуществления вектор кодирует фермент CRISPR, который подвергся мутации относительно соответствующего фермента дикого типа, так что у подвергшегося мутации фермента CRISPR отсутствует способность расщеплять одну или обе нити целевого полинуклеотида, содержащего целевую последовательность. Например, замена аспартата на аланин (D10A) в каталитическом домене RuvC I Cas9 из S. pyogenes превращает Cas9 из нуклеазы, которая расщепляет обе нити, в никазу (расщепляет одну нить). Другие примеры мутаций, которые делают Cas9 никазой, включают, без ограничения, Н840А, N854A и N863A. В качестве дополнительного примера два или более каталитических доменов Cas9 (RuvC I, RuvC II и RuvC III или домен HNH) можно подвергать мутациям с получением мутированного Cas9, у которого практически полностью отсутствует активность по расщеплению ДНК. В некоторых вариантах осуществления мутацию D10A объединяют с одной или несколькими из мутаций Н840А, N854A или N863A с получением фермента Cas9, у которого практически полностью отсутствует активность в отношении расщепления ДНК. В некоторых вариантах осуществления фермент CRISPR рассматривают как такой, у которого практически полностью отсутствует активность в отношении расщепления ДНК, в случаях, когда активность в отношении расщепления ДНК мутантного фермента составляет менее приблизительно 25%, 10%, 5%, 1%, 0,1%, 0,01% или меньше по отношению к его немутантной форме. Если фермент не является SpCas9, мутации можно осуществлять по любому или всем остаткам, соответствующим положениям 10, 762, 840, 854, 863 и/или 986 SpCas9 (которые могут быть определены, например, при помощи стандартных инструментов сравнения последовательностей). В частности, любые или все из следующих мутаций являются предпочтительными для SpCas9: D10A, Е762А, Н840А, N854A, N863A и/или D986A; а также предусматривается консервативная замена для любого аминокислотного замещения. То же самое (или консервативные замены по этим мутациям) также является предпочтительным в соответствующих положениях других Cas9. Особенно предпочтительными являются D10 и Н840 в SpCas9. Однако в других Cas9 остатки, соответствующие D10 и Н840 SpCas9, также являются предпочтительными.
Замену аспартата на аланин (D10A) в каталитическом домене RuvC I в SpCas9 производили с применением методик генной инженерии для превращения нуклеазы в никазу (SpCas9n) (смотри, например, Sapranauskas et al., 2011, Nucleic Acids Research, 39: 9275; Gasiunas et al., 2012, Proc. Natl. Acad. Sci. USA, 109:E2579) так, чтобы геномная ДНК с однонитевым разрывом подвергалась высокоточной репарации с участием гомологичной рекомбинации (HDR). Анализ с помощью Surveyor подтвердил, что SpCas9n не образует вставок/делеций в протоспейсере-мишени ЕМХ1. Совместная экспрессия целенаправленно воздействующей на ЕМХ1 химерной crRNA (также содержащей компонент tracrRNA) с SpCas9 приводила к вставкам/делециям в целевом сайте, тогда как совместная экспрессия с SpCas9n - нет (n=3). Более того, секвенирование 327 ампликонов не обнаружило каких-либо вставок/делеций, индуцированных SpCas9n. Тот же локус выбирали для тестирования опосредованной CRISPR HR при совместной трансфекции клеток НЕK 293FT химерной РНК, целенаправленно воздействующей на ЕМХ1, hSpCas9 или hSpCas9n, а также матрицей для HR для введения пары сайтов рестрикции (для HindIII и NheI) возле протоспейсера.
Предпочтительные ортологи описаны в данном документе. Фермент Cas может быть идентифицирован как Cas9, поскольку он может относиться к общему классу ферментов, обладающих гомологией с самой большой нуклеазой с несколькими доменами нуклеаз системы CRISPR типа II. В наиболее предпочтительном случае фермент Cas9 получен или происходит из spCas9 или saCas9. Под происходящим заявители подразумевают, что в основе происходящего фермента главным образом лежит фермент дикого типа в том смысле, что он характеризуется высокой степенью гомологии последовательности с этим ферментом, но он был некоторым образом подвергнут мутации (модифицирован), как описано в данном документе.
Следует иметь в виду, что выражения Cas и фермент CRISPR обычно используются в данном документе взаимозаменяемо, если не очевидно иное. Как упоминается выше, многие из порядков нумерации остатков, используемых в данном документе, относятся к ферменту Cas9 из локуса CRISPR типа II Streptococcus pyogenes. Однако следует иметь в виду, что настоящее изобретение включает многие другие Cas9 из других видов микроорганизмов, такие как SpCas9, SaCa9, St1Cas9 и т.д.
Оптимизация кодонов
Пример кодон-оптимизированной последовательности, в данном случае оптимизированной для человека (т.е. оптимизированной для экспрессии у человека), представлен в данном документе, смотри кодон-оптимизированную последовательность SaCas9 для человека. Хотя это является предпочтительным, следует иметь в виду, что возможны другие примеры, и что для вида-хозяина известна оптимизация кодонов.
В некоторых вариантах осуществления кодирующая фермент последовательность, кодирующая фермент CRISPR, является кодон-оптимизированной для экспрессии в определенных клетках, как, например, эукариотических клетках. Эукариотические клетки могут быть клетками определенного организма или полученными из него, как, например, млекопитающего, в том числе, без ограничения, человека, мыши, крысы, кролика, собаки или отличного от человека млекопитающего или примата. В некоторых вариантах осуществления могут исключаться способы модификации генетической идентичности зародышевой линии человека и/или способы модификации генетической идентичности животных, которые, вероятно, могут причинить им страдания без какой-либо значительной медицинской пользы для человека или животных, а также животные,, являющиеся результатом таких способов.
В целом, оптимизация кодонов означает способ модификации последовательности нуклеиновой кислоты для повышения экспрессии в представляющих интерес клетках-хозяевах путем замещения по меньшей мере одного кодона (к примеру, приблизительно или более чем приблизительно 1, 2, 3, 4, 5, 10, 15, 20, 25, 50 или более кодонов) нативной последовательности кодонами, которые чаще или наиболее часто используют в генах этой клетки-хозяина, с сохранением в то же время нативной аминокислотной последовательности. Разные виды проявляют определенное "предпочтение" в отношении конкретных кодонов определенной аминокислоты. "Предпочтение" кодонов (различия в частоте использования кодонов между организмами) часто взаимосвязано с эффективностью трансляции матричной РНК (мРНК), которая, в свою очередь, как полагают, зависит, среди прочего, от свойств кодонов, которые транслируются, и доступности конкретных молекул транспортной РНК (тРНК). Преобладание выбранных тРНК в клетке, как правило, является отражением кодонов, используемых наиболее часто при синтезе пептидов. Соответственно, гены могут быть приспособлены для оптимальной экспрессии генов в данном организме с использованием оптимизации кодонов. Таблицы частоты использования кодонов общедоступны, например, в "Базе данных частот использования кодонов", доступной в интернете по адресу www.kazusa.orjp/codon/ (просмотрена 9 июля 2002 г.), и эти таблицы можно адаптировать различными способами. Смотри Nakamura, Y., et al. "Codon usage tabulated from the international DNA sequence databases: status for the year 2000" Nucl. Acids Res. 28:292 (2000). Также доступны компьютерные алгоритмы для оптимизации кодонов определенной последовательности для экспрессии в определенной клетке-хозяине, как, например, Gene Forge (Aptagen; Джакобус, Пенсильвания). В некоторых вариантах осуществления один или несколько кодонов (к примеру, 1, 2, 3, 4, 5, 10, 15, 20, 25, 50 или более или все кодоны) в последовательности, кодирующей фермент CRISPR, соответствуют наиболее часто используемому кодону для определенной аминокислоты.
Последовательности ядерной локализации (NLS)
В некоторых вариантах осуществления вектор кодирует фермент CRISPR, содержащий одну или несколько последовательностей ядерной локализации (NLS), как, например, приблизительно или более чем приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более NLS. В некоторых вариантах осуществления фермент CRISPR содержит приблизительно или более чем приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более NLS на амино-конце или рядом с ним, приблизительно или более чем приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более NLS на карбокси-конце или рядом с ним или их комбинацию (к примеру, одну или несколько NLS на амино-конце и, одну или несколько NLS на карбокси-конце). В тех случаях, когда присутствуют несколько NLS, каждая может быть выбрана независимо от других, так что одна NLS может присутствовать в нескольких копиях и/или в комбинации с одной или несколькими другими NLS, присутствующими в одной или нескольких копиях. В предпочтительном варианте осуществления настоящего изобретения фермент CRISPR содержит не более 6 NLS. В некоторых вариантах осуществления считают, что NLS находится рядом с N- или С-концом в тех случаях, когда самая близкая аминокислота NLS находится в пределах приблизительно 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 40, 50 или более аминокислот вдоль полипептидной цепи от N- или С-конца. Неограничивающие примеры NLS включают последовательности NLS, полученные из: NLS из большого Т-антигена вируса SV40 с аминокислотной последовательностью PKKKRKV(SEQ ID NO:); NLS из нуклеоплазмина (к примеру, двойной NLS из нуклеоплазмина с последовательностью KRPAATKXAGQAKKKK (SEQ ID NO:)); NLS из c-myc с аминокислотной последовательностью PAAKRVKLD (SEQ ID NO:) или RQRRNELKRSP (SEQ ID NO:); NLS из hRNPA1 M9 с последовательностью NQSSNFGPMKGGNFGGRSSGPYGGGGQYFAKPRNQGGY (SEQ ID NO:); последовательность RMRIZFKNKGKDTAELRRRRVEVSVELRKAKKDEQILKRRNV (SEQ ID NO:) домена IBB из импортина-альфа; последовательности VSRKRPRP (SEQ ID NO:) и PPKKARED (SEQ ID NO:) из Т-белка миомы; последовательность POPKKKPL из р53 человека; последовательность SALIKKKKKMAP из c-abl IV мыши; последовательности DRLRR (SEQ ID NO:) и PKQKKRK (SEQ ID NO:) из NS1 вируса гриппа; последовательность RKLKKKIKKL (SEQ ID NO:) из дельта-антигена вируса гепатита; последовательность REKKKFLKRR (SEQ ID NO:) из белка M×1 мыши; последовательность KRKGDEVDGVDEVAKKKSKK (SEQ ID NO:) из поли(АДФ-рибоза)-полимеразы человека и последовательность RKCLQAGMNLEARKTKK (SEQ ID NO:) рецепторов стероидных гормонов глюкокортикоидов (человека).
В целом, одна или несколько NLS являются достаточно эффективными, чтобы управлять накоплением фермента CRISPR в обнаруживаемом количестве в ядре эукариотической клетки. В целом, степень проявления активности ядерной локализации может быть обусловлена количеством NLS в ферменте CRISPR, конкретной(конкретными) используемой(используемыми) NLS или комбинацией этих факторов. Обнаружение накопления в ядре можно выполнять при помощи любой подходящей методики. Например, детектируемый маркер может быть слит с ферментом CRISPR, так что расположение в клетке может быть визуализировано, как, например, в комбинации со средствами для обнаружения расположения ядра (к примеру, окрашивающим средством, специфичным к ядру, таким как DAPI). Ядра клеток также можно выделять из клеток, содержимое которых можно затем анализировать при помощи любого подходящего способа для обнаружения белка, как, например, иммуногистохимического анализа, вестерн-блот анализа или анализа активности фермента. Накопление в ядре также можно определить опосредованно, как, например, при помощи анализа эффекта образования комплекса CRISPR (к примеру, анализа расщепления ДНК или мутации в целевой последовательности или анализа в отношении активности экспрессии генов, измененной под воздействием образования комплекса CRISPR и/или активности фермента CRISPR) по сравнению с контролем, который не подвергали воздействию фермента или комплекса CRISPR или подвергали воздействию фермента CRISPR, у которого отсутствуют одна или несколько NLS.
Направляющая последовательность
Особенно предпочтительные направляющие последовательности имеют длину в диапазоне 20-22 нуклеотидов (нт), что обсуждается в данном документе; смотри пример 39. В целом, направляющая последовательность представляет собой любую полинуклеотидную последовательность, обладающую достаточной комплементарностью с целевой полинуклеотидной последовательностью для гибридизации с целевой последовательностью и управления специфичным к последовательности связыванием комплекса CRISPR с целевой последовательностью. В некоторых вариантах осуществления степень комплементарности между направляющей последовательностью и ее соответствующей целевой последовательностью при оптимальном выравнивании с использованием подходящего алгоритма выравнивания составляет приблизительно или более чем приблизительно 50%, 60%, 75%, 80%, 85%, 90%, 95%, 97,5%, 99% или более. Оптимальное выравнивание можно определять при помощи любого подходящего алгоритма для выравниваемых последовательностей, неограничивающие примеры которого включают алгоритм Смита-Ватермана, алгоритм Нидлмана-Вунша, алгоритмы, основанные на преобразовании Барроуза-Уилера (к примеру, Burrows Wheeler Aligner), ClustalW, Clustal X, BLAT, Novoalign (Novocraft Technologies; доступный на www.novocraft.com), ELAND (Illumina, Сан-Диего, Калифорния), SOAP (доступный на soap.genomics.org.cn) и Maq (доступный на maq.sourceforge.net). В некоторых вариантах осуществления направляющая последовательность имеет длину приблизительно или более чем приблизительно 5, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 75 или более нуклеотидов. В некоторых вариантах осуществления направляющая последовательность имеет длину менее чем приблизительно 75, 50, 45, 40, 35, 30, 25, 20, 15, 12 или менее нуклеотидов. Способность направляющей последовательности управлять специфичным к последовательности связыванием комплекса CRISPR с целевой последовательностью можно оценить при помощи любого подходящего анализа. Например, компоненты системы CRISPR, достаточные для образования комплекса CRISPR, в том числе направляющая последовательность, подлежащая тестированию, могут быть доставлены в клетку-хозяина с соответствующей целевой последовательностью, как, например, при помощи трансфекции векторами, кодирующими компоненты последовательности CRISPR, с последующей оценкой предпочтительного расщепления в пределах целевой последовательности, как, например, при помощи анализа с помощью Surveyor, как описано в данном документе. Подобным образом, расщепление целевой полинуклеотидной последовательности может быть установлено в пробирке путем обеспечения целевой последовательности, компонентов комплекса CRISPR, в том числе направляющей последовательности, подлежащей тестированию, и контрольной направляющей последовательности, отличной от тестовой направляющей последовательности, и сравнения воздействий тестовой и контрольной направляющей последовательности на связывание или скорость расщепления целевой последовательности. Другие анализы возможны и будут очевидны специалисту в данной области.
Направляющая последовательность может быть выбрана для нацеливания на любую целевую последовательность. В некоторых вариантах осуществления целевая последовательность является последовательностью в пределах генома клетки. Иллюстративные целевые последовательности включают те, которые являются уникальными в целевом геноме. Например, для Cas9 S. pyogenes уникальная целевая последовательность в геноме может включать целевой сайт Cas9 в виде MMMMMMMMNNNNNNNNNNNNXGG (SEQ ID NO:), где NNNNNNNNNNNNXGG (SEQ ID NO:) (N представляет собой A, G, Т или С, и X может быть любым) характеризуется единичным появлением в геноме. Уникальная целевая последовательность в геноме может включать целевой сайт для Cas9 S. pyogenes в виде MMMMMMMMMNNNNNNNNNNNXGG (SEQ ID NO:), где NNNNNNNNNNNXGG (SEQ ID NO:) (N представляет собой A, G, T или С, и X может быть любым) характеризуется единичным появлением в геноме. Для Cas9 CRISPR1 S. thermophilus уникальная целевая последовательность в геноме может включать целевой сайт для Cas9 в виде MMMMMMMMNNNNNNNNNNNNXXAGAAW (SEQ ID NO:), где NNNNNNNNNNNNXXAGAAW (SEQ ID NO:) (N представляет собой A, G, T или С; X может быть любым; a W представляет собой А или Т) характеризуется единичным появлением в геноме. Уникальная целевая последовательность в геноме может включать целевой сайт для Cas9 CRISPR1 S. thermophilus в виде MMMMMMMMNINNNNNNNNNNNXXAGAAW (SEQ ID NO:), где NNNNNNNNNNNXXAGAAW (SEQ ID NO:) (N представляет собой A, G, T или С; X может быть любым; a W представляет собой А или Т) характеризуется единичным появлением в геноме. Для S. pyogenes Cas9 уникальная целевая последовательность в геноме может включать целевой сайт Cas9 в виде MMMMMMMMNNNNNNNNNNNNXGGXG (SEQ ID NO:, где NNNNNNNNNNNNXGGXG (SEQ ID NO:) (N представляет собой A, G, T или С, и X может быть любым) характеризуется единичным появлением в геноме. Уникальная целевая последовательность в геноме может включать целевой сайт для Cas9 S. pyogenes в виде MMMMMMMMMNNNNNNNNNNNXGGXG (SEQ ID NO:), где NNNNNNNNNNNXGGXG (SEQ ID NO:) (N представляет собой A, G, Т или С, и X может быть любым) характеризуется единичным появлением в геноме. В каждой из этих последовательностей "М" может представлять собой A, G, Т или С и не должен учитываться при идентификации последовательности как уникальной.
В некоторых вариантах осуществления направляющая последовательность выбрана для снижения доли вторичной структуры в направляющей последовательности. В некоторых вариантах осуществления приблизительно или менее приблизительно 75%, 50%, 40%, 30%, 25%, 20%, 15%, 10%, 5%, 1% или меньше нуклеотидов направляющей последовательности участвуют в самокомплементарном спаривании оснований при оптимальном сворачивании. Оптимальное сворачивание можно определить при помощи любого подходящего алгоритма сворачивания полинуклеотида. Некоторые программы основаны на вычислении минимальной свободной энергии Гиббса. Примером одного такого алгоритма является mFold, который описан Zuker and Stiegler (Nucleic Acids Res. 9 (1981), 133-148). Другим примером алгоритма сворачивания является доступный в режиме онлайн веб-сервер RNAfold, разработанный в Институте теоретической химии при Венском университете, использующий алгоритм предсказания структуры на основе центроидного метода (смотри, к примеру, A.R. Gruber et al., 2008, Cell 106(1): 23-24; и PA Carr and GM Church, 2009, Nature Biotechnology 27(12): 1151-62).
Парная tracr-последовательность
В целом, парная tracr-последовательность включает любую последовательность, которая характеризуется достаточной комплементарностью с tracr-последовательностью для содействия одному или нескольким из следующих: (1) вырезанию направляющей последовательности, фланкированной парными tracr-последовательностями, в клетке, содержащей соответствующую tracr-последовательность; и (2) образованию комплекса CRISPR в целевой последовательности, где комплекс CRISPR содержит парную tracr-последовательность, которая гибридизируется с tracr-последовательностью. В общем, степень комплементарности указана на основании оптимального выравнивания парной tracr-последовательности и tracr-последовательности по длине более короткой из двух последовательностей. Оптимальное выравнивание можно определить при помощи любого подходящего алгоритма выравнивания и можно дополнительно высчитать для вторичных структур, как, например, участка самокомплементарности в пределах tracr последовательности или парной tracr-последовательности. В некоторых вариантах осуществления степень комплементарности между tracr-последовательностью и парной tracr-последовательностью по длине более короткой из двух при оптимальном выравнивании составляет приблизительно или более чем приблизительно 25%, 30%, 40%, 50%, 60%, 70%), 80%, 90%, 95%), 97,5%, 99% или более. В некоторых вариантах осуществления tracr-последовательность составляет приблизительно или более чем приблизительно 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18,19, 20, 25, 30, 40, 50 или более нуклеотидов в длину. В некоторых вариантах осуществления tracr-последовательность и парная tracr-последовательность содержатся в одиночном транскрипте, так что гибридизация между ними двумя дает транскрипт со вторичной структурой, такой как "шпилька". В одном варианте осуществления настоящего изобретения транскрипт или транскрибированная полинуклеотидная последовательность характеризуются по меньшей мере двумя или более "шпильками". В предпочтительных вариантах осуществления транскрипт характеризуется двумя, тремя, четырьмя или пятью "шпильками". В дополнительном варианте осуществления настоящего изобретения транскрипт характеризуется не более чем пятью "шпильками". В шпилечной структуре часть последовательности в 5' направлении по отношению к концевому "N" и выше петли соответствует парной tracr-последовательности, а часть последовательности в 3' направлении по отношению к петле соответствует tracr-последовательности. Дополнительными неограничивающими примерами отдельных полинуклеотидов, содержащих направляющую последовательность, парную tracr-последовательность и tracr-последовательность, являются следующие (перечисленные от 5' к 3'), где "N" представляет собой основание направляющей последовательности, первый блок букв нижнего регистра представляет собой парную tracr-последовательность, а второй блок букв нижнего регистра представляет собой tracr-последовательность, и конечная поли-Т-последовательность представляет собой терминатор транскрипции: 

 В некоторых вариантах осуществления последовательности (1)-(3) используют в комбинации с Cas9 из CRISPR1 S. thermophilus. В некоторых вариантах осуществления последовательности (4)-(6) используют в комбинации с Cas9 из S. pyogenes. В некоторых вариантах осуществления tracr-последовательность является транскриптом, отдельным от транскрипта, содержащего парную tracr-последовательность.
В некоторых вариантах осуществления последовательности (1)-(3) используют в комбинации с Cas9 из CRISPR1 S. thermophilus. В некоторых вариантах осуществления последовательности (4)-(6) используют в комбинации с Cas9 из S. pyogenes. В некоторых вариантах осуществления tracr-последовательность является транскриптом, отдельным от транскрипта, содержащего парную tracr-последовательность.
Матрица для рекомбинации
В некоторых вариантах осуществления также предусмотрена матрица для рекомбинации. Матрица для рекомбинации может быть компонентом другого вектора, который описан в данном документе, может содержаться в отдельном векторе или предусматриваться в качестве отдельного полинуклеотида. В некоторых вариантах осуществления матрица для рекомбинации разработана так, чтобы служить в качестве матрицы при гомологичной рекомбинации, как, например, в пределах целевой последовательности, подвергнутой внесению однонитевого разрыва или расщеплению ферментом CRISPR, или рядом с ней в качестве части комплекса CRISPR. Матричный полинуклеотид может быть любой подходящей длины, как, например, иметь длину приблизительно или более чем приблизительно 10, 15, 20, 25, 50, 75, 100, 150, 200, 500, 1000 или более нуклеотидов. В некоторых вариантах, осуществления матричный полинуклеотид комплементарен части полинуклеотида, содержащего целевую последовательность. При оптимальном выравнивании матричный полинуклеотид может перекрываться с одним или несколькими нуклеотидами целевых последовательностей (к примеру, с приблизительно или более чем приблизительно 1, 5, 10, 15, 20 или более нуклеотидами). В некоторых вариантах осуществления при оптимальном выравнивании матричной последовательности и полинуклеотида, содержащего целевую последовательность, наиболее близкий нуклеотид матричного полинуклеотида находится в пределах приблизительно 1, 5, 10, 15, 20, 25, 50, 75, 100, 200, 300, 400, 500, 1000, 5000, 10000 или более нуклеотидов от целевой последовательности. В данном документе представлено дополнительное обсуждение пути HDR; например, применительно к 'комплексам CRISPR'.
Белок слияния
В некоторых вариантах осуществления фермент CRISPR является частью белка слияния, содержащего один или несколько доменов гетерологичного белка (к примеру, приблизительно или более чем приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более доменов в дополнение к ферменту CRISPR). Белок слияния, содержащий фермент CRISPR, может содержать любую дополнительную последовательность белка и необязательно линкерную последовательность между любыми двумя доменами. Примеры доменов белков, которые могут быть слиты с ферментом CRISPR, включают, без ограничения, эпитопные метки, последовательности генов-репортеров и домены белков с одним или несколькими из следующих видов активности: метилазной активности, деметилазной активности, активности в отношении активации транскрипции, активности в отношении репрессии транскрипции, активности фактора освобождения при транскрипции, активности в отношении модификации гистонов, активности в отношении расщепления ДНК и активности в отношении связывания нуклеиновой кислоты. Неограничивающие примеры эпитопных меток включают гистидиновые (His) метки, V5-метки, FLAG-метки, метки из гемагглютинина вируса гриппа (НА), Мус-метки, VSV-G-метки и тиоредоксиновые (Trx) метки. Примеры генов-репортеров включают, без ограничения, гены глутатион-S-трансферазы (GST), пероксидазы хрена (HRP), хлорамфеникол-ацетилтрансферазы (CAT), бета-галактозидазы, бета-глюкуронидазы, люциферазы, зеленого флуоресцентного белка (GFP), HcRed, DsRed, голубого флуоресцентного белка (CFP), желтого флуоресцентного белка (YFP) и автофлуоресцирующих белков, в том числе синего флуоресцентного белка (BFP). Фермент CRISPR может быть слит с последовательностью гена, кодирующей белок или фрагмент белка, которые связываются с молекулой ДНК или связываются с другими клеточными молекулами, в том числе, без ограничения, связывающий мальтозу белок (МВР), S-метку, продукты слияния Lex А и ДНК-связывающего домена (DBD), продукты слияния GAL4 и ДНК-связывающего домена и продукты слияния белка BP 16 вируса простого герпеса (HSV). Дополнительные домены, которые могут образовывать часть белка слияния, содержащего фермент CRISPR, описаны в US 20110059502, включенном в данный документ при помощи ссылки. В некоторых вариантах осуществления меченный фермент CRISPR используют для идентификации расположения целевой последовательности.
Индуцируемая система
В некоторых вариантах осуществления фермент CRISPR может образовывать компонент индуцируемой системы. Индуцируемая природа системы будет обеспечивать возможность пространственно-временного контроля редактирования генов или экспрессии генов с использованием определенной формы энергии. Форма энергии может включать, без ограничения, электромагнитное излучение, звуковую энергию, химическую энергию и тепловую энергию. Примеры индуцируемой системы включают индуцируемые тетрациклином промоторы (Tet-On или Tet-Off), двугибридные системы активации транскрипции с использованием малых молекул (FKBP, ABA и т.д.) или индуцируемые светом системы (фитохром, домены LOV или криптохром). В одном варианте осуществления фермент CRISPR может быть частью индуцируемого светом транскрипционного эффектора (LITE) для управления изменениями транскрипционной активности специфичным к последовательности образом. Компоненты индуцируемой светом системы могут включать фермент CRISPR, чувствительный к свету гетеродимер криптохрома (например, из Arabidopsis thaliana) и домен активации/репрессии транскрипции. Дополнительные примеры индуцируемых ДНК-связывающих белков и способы их применения представлены в US 61/736465 и US 61/721283, которые включены в данный документ посредством ссылки во всей полноте.
Доставка
В некоторых аспектах настоящее изобретение предусматривает способы, включающие доставку одного или нескольких полинуклеотидов, как, например, одного или нескольких векторов, которые описаны в данном документе, одного или нескольких их транскриптов и/или одного или нескольких белков, транскрибируемых с них, в клетку-хозяина. В некоторых аспектах настоящее изобретение дополнительно предусматривает клетки, полученные при помощи таких способов, и животных, содержащих такие клетки или полученных из них. В некоторых вариантах осуществления фермент CRISPR в комбинации с (и необязательно образующий комплекс с) направляющей последовательностью доставляют в клетку. Традиционные способы переноса генов с использованием вирусов и без использования вирусов можно применять для введения нуклеиновых кислот в клетки млекопитающих или целевые ткани. Такие способы можно использовать для введения нуклеиновых кислот, кодирующих компоненты системы CRISPR, в клетки в культуре или в организме-хозяине. Системы доставки на основе невирусных векторов включают плазмидные ДНК, РНК (к примеру, транскрипт вектора, описанного в данном документе), "оголенную" нуклеиновую кислоту и нуклеиновую кислоту, образующую комплекс со средством доставки, как, например, липосомой. Системы доставки на основе вирусного вектора включают ДНК- и РНК-содержащие вирусы, которые имеют либо эписомальный, либо интегрированный геномы после доставки в клетку. В отношении обзора процедур генной терапии смотри Anderson, Science 256:808-813 (1992); Nabel & Feigner, TIBTECH 11:211-217 (1993); Mitani & Caskey, TIBTECH 11:162-166 (1993); Dillon, TIBTECH 11:167-175 (1993); Miller, Nature 357:455-460 (1992); Van Brunt, Biotechnology 6(10):1149-1154 (1988); Vigne, Restorative Neurology and Neuroscience 8:35-36 (1995); Kremer & Perricaudet, British Medical Bulletin 51(1):31-44 (1995); Haddada et al., в Current Topics in Microbiology and Immunology, Doerfler and  (eds) (1995); и Yu et al., Gene Therapy 1:13-26 (1994).
(eds) (1995); и Yu et al., Gene Therapy 1:13-26 (1994).
Способы невирусной доставки нуклеиновых кислот включают липофекцию, микроинъекцию, баллистическую трансфекцию, виросомы, липосомы, иммунолипосомы, поликатион или конъюгаты липид:нуклеиновая кислота, "оголенную" ДНК, искусственные вирионы и повышенное при помощи определенного средства поглощение ДНК. Липофекция описана, например, в патентах США №№5049386, 4946787 и 4897355, и реагенты для липофекции реализуют в промышленных масштабах (к примеру, Transfectam™ и Lipofectin™). Катионные и нейтральные липиды, которые подходят для эффективной липофекции с узнаванием рецепторов полинуклеотидов, включают таковые из Feigner, WO 91/17424; WO 91/16024. Доставка может осуществляться в клетки (к примеру, введение in vitro или ex vivo) или целевые ткани (к примеру, введение in vivo).
Получение комплексов липид:нуклеиновая кислота, в том числе нацеливающих липосом, как, например, иммунолипидных комплексов, хорошо известно специалистам в данной области (смотри, к примеру, Crystal, Science 270:404-410 (1995); Blaese et al., Cancer Gene Ther. 2:291-297 (1995); Behr et al., Bioconjugate Chem. 5:382-389 (1994); Remy et al., Bioconjugate Chem. 5:647-654 (1994); Gao et al., Gene Therapy 2:710-722 (1995); Ahmad et al., Cancer Res. 52:4817-4820 (1992); патенты США №№4186183, 4217344, 4235871, 4261975, 4485054, 4501728, 4774085, 4837028 и 4946787).
При применении систем на основе РНК- и ДНК-содержащих вирусов для доставки нуклеиновых кислот используют тщательно разработанные способы обеспечения нацеливания вируса на конкретные клетки в организме и перемещения полезных последовательностей вируса в ядро. Вирусные векторы можно вводить непосредственно пациентам (in vivo), или их можно использовать для обработки клеток in vitro, и модифицированные клетки можно необязательно вводить пациентам (ex vivo). Традиционные системы на основе вирусов могут включать ретровирусные, лентивирусные, аденовирусные векторы, векторы на основе аденоассоциированного вируса и вируса простого герпеса для переноса генов. Интеграция в геном хозяина возможна со способами переноса генов на основе ретровируса, лентивируса и аденоассоциированного вируса, что часто приводит к длительной экспрессии встроенного трансгена. Кроме того, высокие показатели эффективности трансдукции наблюдали у многих различных типов клеток и целевых тканей.
Тропизм ретровирусов может быть изменен путем включения чужеродных белков оболочки с расширением возможной целевой популяции целевых клеток. Лентивирусные векторы являются ретровирусными векторами, которые способны трансдуцировать или инфицировать неделящиеся клетки и, как правило, дают высокие вирусные титры. Выбор системы переноса генов на основе ретровирусов, таким образом, будет зависеть от целевой ткани. Ретровирусные векторы состоят из действующих в цис-положении длинных концевых повторов с упаковывающей способностью до 6-10 т.о. чужеродной последовательности. Минимальных действующих в цис-положении LTR достаточно для репликации и упаковки векторов, которые затем используют для интеграции терапевтического гена в целевую клетку с получением постоянной экспрессии трансгена. Широко применяемые ретровирусные векторы включают такие, как основанные на вирусе лейкоза мышей (MuLV), вирусе лейкоза гиббонов (GaLV), вирусе иммунодефицита обезьян (SIV), вирусе иммунодефицита человека (HIV) и их комбинациях (смотри, к примеру, Buchscher et al., J. Virol. 66:2731-2739 (1992); Johann et al., J. Virol. 66:1635-1640 (1992); Sommnerfelt et al., Virol. 176:58-59 (1990); Wilson et al., J. Virol. 63:2374-2378 (1989); Miller et al., J. Virol. 65:2220-2224 (1991); PCT/US 94/05700).
В другом варианте осуществления предусматриваются псевдотипированные ретровирусные векторные частицы на основе оболочки везикуловируса Кокал (смотри, например, публикацию заявки на патент США №20120164118, закрепленной за Онкологическим исследовательским центром Фреда Хатчинсона). Вирус Кокал относится к роду Vesiculovirus и является возбудителем везикулярного стоматита у млекопитающих. Вирус Кокал изначально был выделен из клещей в Тринидаде (Jonkers et al., Am. J. Vet. Res. 25:236-242 (1964)), и инфекции были идентифицированы в Тринидаде, Бразилии и Аргентине у насекомых, крупного рогатого скота и лошадей. Многие везикуловирусы, которые инфицируют млекопитающих, были выделены у инфицированных в естественных условиях членистоногих, что позволяет предположить, что они являются переносчиками. Антитела к везикуловирусам распространены у людей, живущих в сельской местности, где вирусы являются эндемичными и лабораторными; причем инфекции у человека обычно приводят к гриппоподобным симптомам. Гликопротеин оболочки вируса Кокал обладает идентичностью 71,5% на аминокислотном уровне с VSV-G Индиана, и при этом филогенетическое сравнение генов оболочки везикуловирусов продемонстрировало, что вирус Кокал серологически отличается от штаммов VSV-G Индиана, но является - наиболее близкородственным с ними среди везикуловирусов. Jonkers et al., Am. J. Vet. Res. 25:236-242 (1964) и Travassos da Rosa et al., Am. J. Tropical Med. & Hygiene 33:999-1006 (1984). Псевдотипированные ретровирусные векторные частицы с оболочкой везикуловируса Кокал могут включать, например, лентивирусные, альфаретровирусные, бетаретровирусные, гаммаретровирусные, дельтаретровирусные и эпсилонретровирусные векторные частицы, которые могут содержать ретровирусные белки Gag, Pol и/или один или несколько акцессорных белков и белок оболочки везикуловируса Кокал. В некоторых аспектах этих вариантов осуществления белки Gag, Pol и акцессорные белки являются лентивирусными и/или гаммаретровирусными.
В применениях, в которых транзиентная экспрессия является предпочтительной, можно применять системы на основе аденовирусов. Аденовирусные векторы способны проявлять очень высокую эффективность трансдукции во многих типах клеток и не требуют деления клеток. С такими векторами были получены высокие титры и уровни экспрессии. Такой вектор можно получать в больших количествах в относительно простой системе.
Векторы на основе аденоассоциированного вируса ("AAV") также можно использовать для трансдукции клеток целевыми нуклеиновыми кислотами, к примеру, при получении in vitro нуклеиновых кислот и пептидов и для процедур генной терапии in vivo и ex vivo (смотри, к примеру, West et al., Virology 160:38-47 (1987); патент США №4797368; WO 93/24641; Kotin, Human Gene Therapy 5:793-801 (1994); Muzyczka, J. Clin. Invest. 94:1351 (1994). Создание рекомбинантных векторов на основе AAV описано в ряде публикаций, в том числе в патенте США №5173414; Tratschin et al., Mol. Cell. Biol. 5:3251-3260 (1985); Tratschin, et al., Mol. Cell. Biol. 4:2072-2081 (1984); Hermonat & Muzyczka, PNAS 81:6466-6470 (1984) и Samulski et al., J. Virol. 63:03822-3828 (1989).
Упаковывающие клетки, как правило, используют для получения вирусных частиц, которые способны инфицировать клетку-хозяина. Такие клетки включают клетки 293, которые упаковывают аденовирус, и клетки ψ2 или клетки РА317, которые упаковывают ретровирус. Вирусные векторы, используемые в генной терапии, как правило, создают путем получения линии клеток, которые упаковывают вектор на основе нуклеиновой кислоты в вирусную частицу. Векторы обычно содержат минимальные вирусные последовательности, необходимые для упаковки и последующей интеграции в хозяина, при этом другие вирусные последовательности замещены на кассету экспрессии для экспрессии полинуклеотида(полинуклеотидов). Отсутствующие вирусные функции, как правило, обеспечивают в транс-положении при помощи линии пакующих клеток. Например, векторы на основе AAV, применяемые в генной терапии, как правило, имеют только ITR-последовательности из генома AAV, которые необходимы для упаковки и интеграции в геном хозяина. Вирусная ДНК упаковывается в линии клеток, которая содержит плазмиду-помощника, кодирующую другие гены AAV, а именно rep и cap, но без ITR-последовательностей. Линия клеток также может быть инфицирована аденовирусом в качестве вируса-помощника. Вирус-помощник способствует репликации вектора на основе AAV и экспрессии генов AAV из плазмиды-помощника. Плазмида-помощник не упаковывается в значительном количестве в связи с отсутствием ITR-последовательностей. Контаминацию аденовирусом можно снизить, к примеру, при помощи тепловой обработки, к которой аденовирус более чувствителен, чем AAV.
Соответственно, AAV считается оптимальным кандидатом для применения в качестве трансдуцирующего вектора. Такие трансдуцирующие векторы на основе AAV могут содержать достаточные функции, действующие в цис-положении, для репликации в присутствии функций-помощников в виде аденовируса, или герпесвируса, или поксвируса (например, вируса осповакцины), предоставленных в транс-положении. Рекомбинантный AAV (rAAV) можно использовать для переноса экзогенных генов в клетки различных линий. В этих векторах гены cap и/или rep AAV удалены из вирусного генома и замещены выбранным сегментом ДНК. Современные векторы на основе AAV могут вмещать до 4300 оснований встроенной ДНК.
Существует ряд способов получения rAAV, и настоящее изобретение предусматривает rAAV и способы получения rAAV. Например, плазмидой(плазмидами), содержащими необходимую конструкцию или практически состоящими из нее, трансфицируют клетки, инфицированные AAV. Кроме того, эти клетки совместно трансфицируют второй или дополнительной плазмидой-помощником с обеспечением генов rep и/или cap AAV, которые являются обязательными для репликации и упаковки рекомбинантной вирусной конструкции. В этих условиях белки rep и/или cap AAV действуют в транс-положении для стимуляции репликации и упаковки конструкции rAAV. Через два-три дня после трансфекции собирают rAAV. Традиционно, rAAV собирают из клеток вместе с аденовирусом. Контаминирующий аденовирус затем инактивируют при помощи тепловой обработки. В настоящем изобретении rAAV преимущественно собирают не из самих клеток, а из надосадочной жидкости культуры клеток. Соответственно, в первом аспекте настоящего изобретения предусматривается получение rAAV, и в дополнение к вышеупомянутому, rAAV можно получить при помощи способа, который включает следующее или состоит по сути из: инфицирования восприимчивых клеток с использованием rAAV, содержащим экзогенную ДНК, в том числе ДНК для экспрессии, и вирусом-помощником (например, аденовирусом, герпесвирусом, поксвирусом, например, вирусом осповакцины), где rAAV не содержит функциональный cap и/или rep (и вирус-помощник (например, аденовирус, герпесвирус, поксвирус, например, вирус осповакцины) обеспечивает функцию cap и/или rep, которой лишен rAAV); или инфицирования восприимчивых клеток rAAV, содержащим экзогенную ДНК, в том числе ДНК для экспрессии, где рекомбинантная конструкция не содержит функциональный cap и/или rep, и трансфекции указанных клеток плазмидой, предоставляющей функцию cap и/или rep, которой лишен rAAV; или инфицирования восприимчивых клеток rAAV, содержащим экзогенную ДНК, в том числе ДНК для экспрессии, где рекомбинантная конструкция не содержит функциональный cap и/или rep, где указанные клетки предоставляют функцию cap и/или rep, которой лишена рекомбинантная конструкция; или трансфекции восприимчивых клеток AAV, не содержащим функциональный cap и/или rep, и плазмидами для встраивания экзогенной ДНК в рекомбинантную конструкцию, так что экзогенная ДНК экспрессируется рекомбинантной конструкцией, и для предоставления функций rep и/или cap, причем трансфекция приводит в результате к rAAV, содержащему экзогенную ДНК, в том числе ДНК для экспрессии, который не содержит функциональный cap и/или rep.
rAAV можно получить из AAV, как описано в данном документе, и преимущественно он может представлять собой rAAV1, rAAV2, AAV5 или rAAV, имеющий гибридный капсид, который может предусматривать AAV1, AAV2, AAV5 или любую их комбинацию. Можно выбрать AAV из rAAV с учетом клеток, подлежащих нацеливанию с применением rAAV, например, можно выбрать AAV серотипов 1, 2, 5, или гибридную структуру или капсид AAV1, AAV2, AAV5, или любую их комбинацию для нацеливания на головной мозг или нервные клетки; и при этом можно выбрать AAV4 для нацеливания на сердечную ткань.
Кроме клеток 293, при осуществлении на практике настоящего изобретения можно применять другие клетки, и при этом относительная инфекционность определенных серотипов AAV in vitro по отношению к этим клеткам (смотри Grimm, D. et al, J. Virol. 82: 5887-5911 (2008)) представлена ниже.
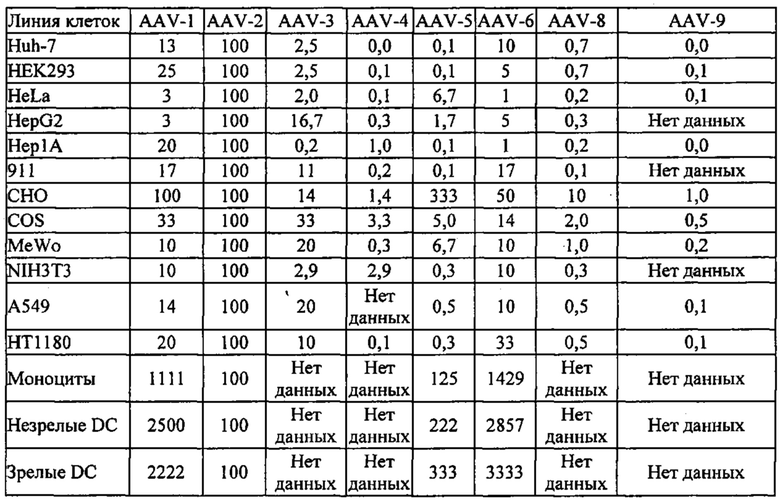
Настоящее изобретение предусматривает rAAV, который содержит или состоит по сути из экзогенной молекулы нуклеиновой кислоты, кодирующей систему CRISPR (короткие палиндромные повторы, регулярно расположенные группами), например, множество кассет, содержащих или состоящих из первой кассеты, содержащей или состоящей по сути из промотора, молекулы нуклеиновой кислоты, кодирующей CRISPR-ассоциированный (Cas) белок (предполагаемые нуклеазные или хеликазные белки), например, Cas9, и терминатора, и две или более, преимущественно до предела упаковки вектора, например, всего (включая первую кассету) пять кассет, содержащих или состоящих по сути из промотора, молекулы нуклеиновой кислоты, кодирующей направляющую РНК (gRNA), и терминатора (например, каждая кассета схематически представлена как промотор-gRNA1-терминатор, промотор-gRNA2-терминатор … промотор-gRNA(N)-терминатор (где N относится к тому количеству, которое можно встроить, находящемуся на верхней границе предела упаковки вектора), или два или более отдельных rAAV, причем каждый содержит одну или несколько кассет системы CRISPR, например, первый rAAV, содержащий первую кассету, содержащую или состоящую по сути из промотора, молекулы нуклеиновой кислоты, кодирующей Cas, например, Cas9, и терминатора, и второй rAAV, содержащий некоторое количество, а именно четыре кассеты, содержащие или состоящие по сути из промотора, молекулы нуклеиновой кислоты, кодирующей направляющую РНК (gRNA), и терминатора (например, каждая кассета схематически представлена как промотор-gRNA1-терминатор, npoMOTop-gRNA2-терминатор … промотор-gRNA(N)-терминатор (где N относится к количеству того, что можно встроить, находящемуся на верхней границе предела упаковки вектора). Поскольку rAAV представляет собой ДНК-содержащий вирус, молекулы нуклеиновой кислоты в изложенном в данном документе обсуждении в отношении AAV или rAAV преимущественно представляют собой ДНК. В некоторых вариантах осуществления промотор преимущественно представляет собой промотор гена синапсина I человека (hSyn).
Дополнительные способы доставки нуклеиновых кислот в клетки известны специалистам в данной области. Смотри, например, US 20030087817, включенный в данный документ при помощи ссылки. Смотри также литературный источник Kanasty, также включенный с помощью ссылки и обсуждаемый в данном документе.
В некоторых вариантах осуществления клетка-хозяин транзиентно или не транзиентно трансфицирована одним или несколькими векторами, описанными в данном документе. В некоторых вариантах осуществления клетка трансфицирована так, как это в естественных условиях происходит у субъекта. В некоторых вариантах осуществления клетка, которую трансфицируют получена от субъекта. В некоторых вариантах осуществления клетка отобрана из клеток, полученных от субъекта, как, например, линии клеток. Широкий спектр линий клеток для культуры тканей известен из уровня техники. Примеры линий клеток включают, без ограничения, С8161, CCRF-CEM, MOLT, mIMCD-3, NHDF, HeLa-S3, Huh1, Huh4, Huh7, HUVEC, HASMC, HEKn, HEKa, MiaPaCell, Pane1, PC-3, TF1, CTLL-2, C1R, Rat6, CV1, RPTE, A10, T24, J82, A375, ARH-77, Calul, SW480, SW620, SKOV3, SK-UT, CaCo2, P388D1, SEM-K2, WEHI-231, HB56, TIB55, Jurkat, J45.01, LRMB, Bcl-1, BC-3, IC21, DLD2, Raw264.7, NRK, NRK-52E, MRC5, MEF, Hep G2, HeLa B, HeLa T4, COS, COS-1, COS-6, COS-M6A, эпителиальные клетки почки обезьяны BS-C-1, эмбриональные фибробласты мыши BALB/ 3Т3, 3Т3 Swiss, 3T3-L1, фетальные фибробласты человека 132-d5; фибробласты мыши 10.1, 293-Т, 3Т3, 721, 9L, А2780, A2780ADR, A2780cis, А172, А20, А253, А431, А-549, ALC, В16, В35, клетки ВСР-1, BEAS-2B, bEnd.3, ВНК-21, BR 293, ВхРС3, С3Н-10Т1/2, С6/36, Cal-27, СНО, СНО-7, CHO-IR, СНО-K1, СНО-K2, СНО-Т, СНО Dhfr -/-, COR-L23, COR-L23/CPR, COR-L23/5010, COR-L23/R23, COS-7, COV-434, CML T1, СМТ, СТ26, D17, DH82, DU145, DuCaP, EL4, ЕМ2, ЕМ3, EMT6/AR1, EMT6/AR10.0, FM3, Н1299, Н69, НВ54, НВ55, НСА2, НЕK-293, HeLa, Hepa1c1c7, HL-60, НМЕС, НТ-29, Jurkat, клетки JY, клетки К562, Ku812, KCL22, KG1, KYO1, LNCap, Ma-Mel 1-48, МС-38, MCF-7, MCF-10A, MDA-MB-231, MDA-MB-468, MDA-MB-435, MDCK II, MDCK II, MOR/0.2R, MONO-MAC 6, MTD-1A, MyEnd, NCI-H69/CPR, NCI-H69/LX10, NCI-H69/LX20, NCI-H69/LX4, NIH-3T3, NALM-1, NW-145, линии клеток OPCN/OPCT, Peer, PNT-1A/PNT 2, RenCa, RIN-5F, RMA/RMAS, клетки Saos-2, Sf-9, SkBr3, T2, T-47D, T84, линия клеток THP1, U373, U87, U937, VCaP, клетки Vero, WM39, WT-49, X63, YAC-1, YAR и их трансгенные варианты. Линии клеток доступны из ряда источников, известных специалистам в данной области (смотри, к примеру, Американскую коллекцию типовых культур (АТСС) (Манассас, Вирджиния)). В некоторых вариантах осуществления клетку, трансфицированную одним или несколькими векторами, описанными в данном документе, используют для получения новой линии клеток, содержащей одну или несколько полученных из вектора последовательностей. В некоторых вариантах осуществления клетку, транзиентно трансфицированную компонентами системы CRISPR, как описано в данном документе (как, например, путем транзиентной трансфекции одним или несколькими векторами или трансфекции с использованием РНК), и модифицированную при помощи активности комплекса CRISPR, используют для получения новой линии клеток, содержащей клетки, которые содержат модификацию, но у которых отсутствует любая другая экзогенная последовательность. В некоторых вариантах осуществления клетки, транзиентно или не транзиентно трансфицированные одним или несколькими векторами, описанными в данном документе, или линии клеток, полученные из таких клеток, использовали при оценивании одного или нескольких тестовых соединений.
В некоторых вариантах осуществления один или несколько векторов, описанных в данном документе, используют для получения отличного от человека трансгенного животного или трансгенного растения. В некоторых вариантах осуществления трансгенным животным является млекопитающее, как, например, мышь, крыса или кролик. Способы получения трансгенных животных и растений известны из уровня техники и, как правило, начинаются со способа трансфекции клетки, такого как описанный в данном документе.
В другом варианте осуществления может предусматриваться устройство для доставки жидкости с помощью матрицы игл (смотри, например, публикацию заявки на патент США №20110230839, права на которую принадлежат Центру онкологических исследований имени Фреда Хатчинсона), для доставки CRISPR-Cas в плотную ткань. Устройство согласно публикации патентного документа США №20110230839 для доставки жидкости в плотную ткань может содержать множество игл, расположенных в виде матрицы; множество емкостей, каждая из которых находится в жидкостном связи с соответствующей одной иглой из множества игл; и множество приводов, функционально связанных с соответствующими емкостями из множества емкостей и выполненных с возможностью регулирования давления жидкости в емкости. В определенных вариантах осуществления каждый из множества приводов может содержать один из множества поршней, причем первая концевая часть каждого из множества поршней находится в соответствующей одной емкости из множества емкостей, и в определенных дополнительных вариантах осуществления поршни из множества поршней функционально связаны вместе по соответствующим вторым концевым частям с обеспечением возможности одновременного нажатия. В определенных других дополнительных вариантах осуществления может предусматриваться управляющий элемент для поршней, сконфигурированный с возможностью выборочного нажатия всех из множества поршней с различной скоростью. В других вариантах осуществления каждый из множества приводов может содержать одну из множества жидкостных поточных линий, имеющих первую и вторую концевые части, причем первая концевая часть каждой из множества жидкостных поточных линий соединена с соответствующей одной емкостью из множества емкостей. В других вариантах осуществления устройство может содержать источник давления жидкости, и при этом каждый из множества приводов предусматривает гидравлическую муфту между источником давления жидкости и соответствующей одной емкостью из множества емкостей. В дополнительных вариантах осуществления источник давления жидкости может предусматривать по меньшей мере одно из следующих: компрессор, вакуумный накопитель, перистальтический насос, основной цилиндр, микрожидкостный насос и клапан. В другом варианте осуществления каждая из множества игл может содержать множество отверстий, распределенных вдоль ее длины.
Модификация мишени
В одном аспекте настоящее изобретение предусматривает способы модификации целевого полинуклеотида в эукариотической клетке, что может происходить in vivo, ex vivo или in vitro. В некоторых вариантах осуществления способ включает отбор образца или биопсию клетки или популяции клеток у человека или отличного от человека животного и модификацию клетки или клеток. Культивирование можно осуществлять на любой стадии ex vivo. Клетку или клетки можно даже повторно вводить отличному от человека животному. Что касается повторно вводимых клеток, особенно предпочтительно, чтобы эти клетки являлись стволовыми клетками.
В некоторых вариантах осуществления способ включает обеспечение связывания комплекса CRISPR с целевым полинуклеотидом для осуществления расщепления указанного целевого полинуклеотида с модификацией, таким образом, целевого полинуклеотида, где комплекс CRISPR содержит фермент CRISPR, образующий комплекс с направляющей последовательностью, гибридизирующейся с целевой последовательностью в указанном целевом полинуклеотиде, где указанная направляющая последовательность связана с парной tracr-последовательностью, которая, в свою очередь, гибридизируется с tracr-последовательностью.
В одном аспекте настоящее изобретение предусматривает способ модификации экспрессии полинуклеотида в эукариотической клетке. В некоторых вариантах осуществления способ включает обеспечение связывания комплекса CRISPR с полинуклеотидом, вследствие чего указанное связывание приводит к повышенной или пониженной экспрессии указанного полинуклеотида; где комплекс CRISPR содержит фермент CRISPR, образующий комплекс с направляющей последовательностью, гибридизирующейся с целевой последовательностью в указанном целевом полинуклеотиде, где указанная направляющая последовательность связана с парной tracr-последовательностью, которая, в свою очередь, гибридизируется с tracr-последовательностью. Аналогичные соображения и условия распространяются на способы модификации целевого полинуклеотида, как изложено выше. Фактически эти варианты отбора образцов, культивирования и повторного введения охватывают аспекты настоящего изобретения.
Действительно в любом аспекте настоящего изобретения комплекс CRISPR может содержать фермент CRISPR, образующий комплекс с направляющей последовательностью, гибридизирующейся с целевой последовательностью, где указанная направляющая последовательность может быть связана с парной tracr-последовательностью, которая, в свою очередь, может гибридизоваться с tracr-последовательностью. Аналогичные соображения и условия распространяются на способы модификации целевого полинуклеотида, как изложено выше.
Наборы
В одном аспекте настоящее изобретение предусматривает наборы, содержащие любой один или несколько из элементов, раскрытых в приведенных выше способах и композициях. Элементы могут быть предоставлены отдельно или в комбинациях и могут быть предоставлены в любом подходящем контейнере, как, например, флаконе, бутыли или пробирке. В некоторых вариантах осуществления набор включает инструкции на одном или нескольких языках, например, на более чем одном языке.
В некоторых вариантах осуществления набор содержит один или несколько реагентов для применения в способе, в котором используется один или несколько элементов, описанных в данном документе. Реагенты могут быть предоставлены в любом подходящем контейнере. Например, набор может предусматривать один или несколько реакционных буферов или буферов для хранения. Реагенты могут быть предоставлены в форме, которая применима в конкретном анализе, или в форме, которая предусматривает добавление одного или нескольких других компонентов перед применением (к примеру, в форме концентрата или лиофилизированной форме). Буфер может быть любым буфером, в том числе, без ограничения, буфером с карбонатом натрия, буфером с бикарбонатом натрия, боратным буфером, Tris-буфером, буфером MOPS, буфером HEPES и их комбинациями. В некоторых вариантах осуществления буфер является щелочным. В некоторых вариантах осуществления буфер имеет значение рН от приблизительно 7 до приблизительно 10. В некоторых вариантах осуществления набор содержит один или несколько олигонуклеотидов, соответствующих направляющей последовательности, для встраивания в вектор, чтобы функционально связать направляющую последовательность и регуляторный элемент. В некоторых вариантах осуществления набор содержит матричный полинуклеотид для гомологичной рекомбинации. В некоторых вариантах осуществления набор содержит один или несколько векторов и/или один или несколько полинуклеотидов, описанных в данном документе. Преимущественно набор может предоставлять все элементы системы по настоящему изобретению.
Комплекс CRISPR
В одном аспекте настоящее изобретение предусматривает способы применения одного или нескольких элементов системы CRISPR. Комплекс CRISPR по настоящему изобретению обеспечивает эффективное средство модификации целевого полинуклеотида. Комплекс CRISPR по настоящему изобретению характеризуется большим разнообразием полезных свойств, включающих модификацию (например, делецию, вставку, транслокацию, инактивацию, активацию) целевого полинуклеотида во множестве типов клеток. Комплекс CRISPR по настоящему изобретению как таковой имеет широкий спектр применений, к примеру, в генной терапии, скрининге лекарственных средств, диагностике и прогнозировании заболеваний. Иллюстративный комплекс CRISPR содержит фермент CRISPR, образующий комплекс с направляющей последовательностью, гибридизирующейся с целевой последовательностью в целевом полинуклеотиде. Направляющая последовательность связана с парной tracr-последовательностью, которая, в свою очередь, гибридизируется с tracr-последовательностью.
В одном варианте осуществления настоящее изобретение предусматривает способ расщепления целевого полинуклеотида. Способ предусматривает модификацию целевого полинуклеотида с применением комплекса CRISPR, который связывается с целевым полинуклеотидом и осуществляет расщепление указанного целевого полинуклеотида. Как правило, комплекс CRISPR согласно настоящему изобретению при введении в клетку создает разрыв (например, однонитевой или двухнитевой разрыв) в геномной последовательности. Например, способ можно применять для расщепления гена, ответственного за развитие заболевания, в клетке.
Репарация разрыва, созданного комплексом CRISPR, может осуществляться посредством способа репарации, например, путем склонного к ошибкам негомологичного соединения концов (NHEJ) или высокоточной репарации с участием гомологичной рекомбинации (HDR) (фиг. 29). В ходе данного способа репарации в геномную последовательность может быть введен экзогенный матричный полинуклеотид. В некоторых способах способ HDR используют для модификации геномной последовательности. Например, в клетку вводят экзогенный матричный полинуклеотид, содержащий последовательность, подлежащую встраиванию, фланкированную последовательностью, расположенной выше, и последовательностью, расположенной ниже. Последовательности, расположенные выше и ниже, характеризуются сходством последовательности с каждой стороной сайта встраивания в хромосоме.
При необходимости донорный полинуклеотид может представлять собой ДНК, например, плазмидную ДНК, бактериальную искусственную хромосому (ВАС), искусственную хромосому дрожжей (YAC), вирусный вектор, линейный фрагмент ДНК, ПЦР-фрагмент, "оголенную" нуклеиновую кислоту или нуклеиновую кислоту в комплексе со средством доставки, например, липосомой или полоксамером.
Экзогенный матричный полинуклеотид содержит последовательность, подлежащую встраиванию (например, мутантный ген). Последовательность, предназначенная для встраивания, может представлять собой последовательность, эндогенную или экзогенную по отношению к клетке. Примеры последовательности, подлежащей встраиванию, включают полинуклеотиды, кодирующие белок или некодирующую РНК (например, микроРНК). Таким образом, последовательность, предназначенная для встраивания, может быть функционально связанной с соответствующей регуляторной последовательностью или последовательностями. В альтернативном случае последовательность, подлежащая встраиванию, может обеспечивать регуляторную функцию.
Последовательности, расположенные выше и ниже, в экзогенном матричном полинуклеотиде выбирають так, чтобы содействовать рекомбинации между хромосомной последовательностью, представляющей интерес, и донорным полинуклеотидом. Последовательность, расположенная выше, представляет собой последовательность нуклеиновой кислоты, которая обладает сходством последовательности с геномной последовательностью, расположенной выше целевого сайта интеграции. Аналогично, последовательность, расположенная ниже, представляет собой последовательность нуклеиновой кислоты, которая обладает сходством последовательности с хромосомной последовательностью, расположенной ниже целевого сайта интеграции. Последовательности, расположенные выше и ниже, в экзогенном матричном полинуклеотиде могут характеризоваться 75%, 80%, 85%, 90%, 95% или 100% идентичностью последовательности с целевой геномной последовательностью. Предпочтительно последовательности, расположенные выше и ниже, в экзогенном матричном полинуклеотиде могут иметь приблизительно 95%, 96%, 97%, 98%, 99,% или 100% идентичность последовательности с целевой геномной последовательностью. В некоторых способах последовательности, расположенные выше и ниже, в экзогенном матричном полинуклеотиде имеют приблизительно 99% или 100% идентичность последовательности с целевой геномной последовательностью.
Последовательность, расположенная выше или ниже, может содержать от приблизительно 20 п. о. до приблизительно 2500 п. о., например, приблизительно 50, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400 или 2500 п.о. В некоторых способах иллюстративная последовательность, расположенная выше или ниже, имеет от приблизительно 200 п. о. до приблизительно 2000 п. о., от приблизительно 600 п. о. до приблизительно 1000 п. о. или, в частности, от приблизительно 700 п. о. до приблизительно 1000 п. о.
В некоторых способах экзогенный матричный полинуклеотид может дополнительно содержать маркер. Такой маркер может облегчать скрининг на предмет целевых интеграции. Примеры подходящих маркеров включают сайты рестрикции, флуоресцентные белки или селектируемые маркеры. Экзогенный матричный полинуклеотид согласно настоящему изобретению можно сконструировать с применением методик рекомбинантной ДНК (смотри, например, Sambrook et al., 2001 и Ausubel et al., 1996).
В иллюстративном способе модификации целевого полинуклеотида посредством интеграции экзогенного матричного полинуклеотида в геномную последовательность вводят двухнитевой разрыв при помощи комплекса CRISPR, осуществляют репарацию разрыва посредством гомологичной рекомбинации с участием экзогенного матричного полинуклеотида, так что матрица интегрируется в геном. Наличие двухнитевого разрыва обеспечивает интеграцию матрицы.
В других вариантах осуществления настоящее изобретение предусматривает способ модификации экспрессии полинуклеотида в эукариотической клетке. Способ включает повышение или снижение экспрессии целевого полинуклеотида при помощи комплекса CRISPR, который связывается с полинуклеотидом.
В некоторых способах целевой полинуклеотид можно инактивировать для осуществления модификации экспрессии в клетке. Например, при связывании комплекса CRISPR с целевой последовательностью в клетке целевой полинуклеотид инактивируется таким образом, что последовательность не транскрибируется, кодируемый белок не продуцируется или последовательность не функционирует так, как последовательность дикого типа. Например, последовательность, кодирующую белок или микроРНК, можно инактивировать таким образом, что белок не будет продуцироваться.
В некоторых способах регуляторную последовательность можно инактивировать таким образом, что она более не функционирует в качестве регуляторной последовательности. Как используется в данном документе, "регуляторная последовательность" относится к любой последовательности нуклеиновой кислоты, которая оказывает влияние на транскрипцию, трансляцию или доступность последовательности нуклеиновой кислоты. Примеры регуляторной последовательности включают промотор, терминатор транскрипции и энхансер, которые являются регуляторными последовательностями.
Инактивированная целевая последовательность может содержать мутацию по типу делеции (т.е. делецию одного или нескольких нуклеотидов), мутацию по типу вставки (т.е. вставку одного или нескольких нуклеотидов) или нонсенс-мутацию (т.е. замену одного нуклеотида другим нуклеотидом, так что вводится стоп-кодон). В некоторых способах инактивация целевой последовательности приводит в результате к "нокауту" целевой последовательности.
Модели заболеваний
Способ по настоящему изобретению можно применять для создания животного или клетки, которые можно использовать в качестве модели заболевания. Как используется в данном документе, "заболеванием" называют заболевание, нарушение или симптом у субъекта. Например, способ по настоящему изобретению можно использовать для создания животного или клетки, которые содержат модификацию одной или нескольких последовательностей нуклеиновой кислоты, ассоциированных с заболеванием, или растения, животного или клетки, в которых изменены экспрессии одной или нескольких последовательностей нуклеиновой кислоты, ассоциированных с заболеванием. Такая последовательность нуклеиновой кислоты может кодировать последовательность белка, ассоциированного с заболеванием, или может представлять собой регуляторную последовательность, ассоциированную с заболеванием. Соответственно, подразумевается, что в вариантах осуществления настоящего изобретения растение, субъект, пациент, организм или клетка могут относиться к субъекту, отличному от человека, пациенту, организму или клетке. Таким образом, настоящее изобретение предусматривает растение, животное или клетку, полученных при помощи способов по настоящему изобретению, или их потомство. Потомство может представлять собой клон полученного животного, или его можно получить при помощи полового размножения посредством скрещивания с другими индивидами того же вида для придания дополнительных желательных признаков его потомкам. Клетка может находиться in vivo или ex vivo в случае многоклеточных организмов, в частности, животных. В случае, если клетка находится в культуре, можно получить линию клеток при выполнении соответствующих условий культивирования, и предпочтительно, если клетка соответствующим образом приспособлена для этой цели (например, стволовая клетка). Следовательно, также предусматриваются линии клеток.
В некоторых способах модель заболевания можно использовать для изучения влияния мутаций на животное или клетку и развитие и/или прогрессирование заболевания с применением показателей, обычно используемых при изучении заболевания. В альтернативном случае такая модель заболевания является применимой для изучения влияния фармацевтически активного соединения на заболевание.
В некоторых способах модель заболевания можно использовать для оценки эффективности потенциальной стратегии генной терапии. Таким образом, ген или полинуклеотид, ассоциированный с заболеванием, можно модифицировать, так что развитие и/или прогрессирование заболевания замедляется или уменьшается. В частности, способ предусматривает модификацию гена или полинуклеотида, ассоциированного с заболеванием, так что продуцируется измененный белок, и в результате у животного или клетки наблюдается измененный ответ. Соответственно, в некоторых способах генетически модифицированное животное можно сравнивать с животным, предрасположенным к развитию заболевания, так что можно оценить эффект осуществления генной терапии.
В другом варианте осуществления настоящее изобретение предусматривает способ получения биологически активного средства, которое модулирует процесс передачи сигнала в клетке, ассоциированный с геном, ответственным за развитие заболевания. Способ предусматривает приведение тестового соединения в контакт с клеткой, содержащей один или несколько векторов, которые управляют экспрессией одного или нескольких из фермента CRISPR, направляющей последовательности, связанной с парной tracr-последовательностью, и tracr-последовательности; и обнаружение изменения при считывании, которое свидетельствует об уменьшении или усилении процесса передачи сигнала в клетке, ассоциированного, например, с мутацией в гене, ответственном за развитие заболевания, который содержится в клетке.
Клеточную модель, в том числе органоид или скопление клеток, описанные в данном документе, или животную модель можно сконструировать в сочетании со способом по настоящему изобретению для скрининга изменения клеточной функции. Такую модель можно использовать для изучения влияния геномной последовательности, модифицированной при помощи комплекса CRISPR согласно настоящему изобретению, на представляющую интерес клеточную функцию. Например, модель клеточной функции можно использовать для изучения воздействия. модифицированной геномной последовательности на внутриклеточную передачу сигнала или внеклеточную передачу сигнала. В альтернативном случае модель клеточной функции можно использовать для исследования воздействий модифицированной геномной последовательности на сенсорную чувствительность. В некоторых таких моделях одна или несколько геномных последовательностей, ассоциированных с биохимическим путем передачи сигнала, в модели являются модифицированными.
Специально исследовали несколько моделей заболеваний. Они включают гены CHD8, KATNAL2 и SCN2A, связанные с риском развития аутизма de novo; и ген UBE3A, связанный с синдромным аутизмом (синдром Ангельмана). Эти гены и полученные в результате модели аутизма, разумеется, являются предпочтительными, но служат для того, чтобы продемонстрировать широкую применимость настоящего изобретения по отношению к генам и соответствующим моделям.
Измененную экспрессию одной или нескольких геномных последовательностей, ассоциированных с биохимическим путем передачи сигнала, можно определять при помощи анализа различия по уровням мРНК соответствующих генов между тестируемой модельной клеткой и контрольной клеткой, если их приводят в контакт с кандидатным средством. В альтернативном случае различную экспрессию последовательностей, ассоциированных с биохимическим путем передачи сигнала, определяют посредством выявления различия по уровню кодируемого полипептида или продукта гена.
Для анализа индуцированного определенным средством изменения уровня мРНК-транскриптов или соответствующих полинуклеотидов, нуклеиновую кислоту, которая содержится в образце, вначале экстрагируют в соответствии со стандартными способами из уровня техники. Например, мРНК можно выделять с использованием различных литических ферментов или химических растворов в соответствии с методиками, изложенными в Sambrook et al. (1989), или экстрагировать при помощи смол, связывающих нуклеиновые кислоты, в соответствии с прилагаемыми инструкциями, предоставленными производителями. мРНК, которая содержалась в экстрагированном образце нуклеиновой кислоты, затем выявляют при помощи методик амплификации или общепринятых гибридизационных анализов (например, нозерн-блот-анализа) в соответствии со способами, широко известными из уровня техники или основанными на способах, проиллюстрированных в данном документе.
Для целей настоящего изобретения амплификация означает любой способ с использованием праймера и полимеразы, способной обеспечивать репликацию целевой последовательности с достаточной точностью. Амплификацию можно осуществлять при помощи природных или рекомбинантных ДНК-полимераз, таких как TaqGold™, ДНК-полимераза Т7, фрагмент Кленова ДНК-полимеразы Е. coli и обратная транскриптаза. Предпочтительным способом амплификации является ПЦР. В частности, выделенную РНК можно подвергать анализу с обратной транскрипцией, который объединен с количественной полимеразной цепной реакцией (ОТ-ПЦР) для количественного определения уровня экспрессии последовательности, ассоциированной с биохимическим путем передачи сигнала.
Выявление уровня экспрессии генов можно осуществлять в анализе амплификации в режиме реального времени. В одном аспекте амплифицированные продукты можно непосредственно визуализировать при помощи флуоресцентных ДНК-связывающих средств, в том числе, без ограничения, ДНК-интеркаляторов и средств, связывающихся с бороздкой спирали ДНК. Поскольку количество интеркаляторов, включенных в двухнитевые молекулы ДНК, как правило, является пропорциональным количеству амплифицированных ДНК-продуктов, можно без труда определить количество амплифицированных продуктов путем количественного определения флуоресценции интеркалирующего красителя с применением общепринятых оптических систем из уровня техники. ДНК-связывающий краситель, подходящий для этой задачи, охватывает SYBR зеленый, SYBR синий, DAPI, йодид пропидия, Hoechst, SYBR золотой, бромид этидия, акридины, профлавин, акридиновый оранжевый, акрифлавин, фторкумарин, эллиптицин, дауномицин, хлорохин, дистамицин D, хромомицин, хомидий, митрамицин, комплексы рутений-полипиридил, антрамицин и т.п.
В другом аспекте можно использовать другие флуоресцентные метки, например, зонды, специфичные по отношению к последовательности, в реакции амплификации для обеспечения выявления и количественного определения амплифицированных продуктов. Количественная амплификация с использованием зонда основана на специфичном по отношению к последовательности выявлении требуемого амплифицированного продукта. Используются флуоресцентные зонды, специфичные по отношению к мишени (например, зонды TaqMan®), что приводит в результате к увеличению специфичности и чувствительности. Способы осуществления количественной амплификации с использованием зонда являются общепринятыми в данной области и описаны в патенте США №5210015.
В еще одном аспекте можно осуществлять общепринятые гибридизационные анализы с использованием гибридизационных зондов, которые характеризуются гомологией последовательности с последовательностями, ассоциированными с биохимическим путем передачи сигнала. Как правило, в реакции гибридизации зондам дают возможность образовать стабильные комплексы с последовательностями, ассоциированными с биохимическим путем передачи сигнала, которые содержатся в биологическом образце, полученном от тестируемого субъекта. Специалист в данной области поймет, что если антисмысловая нуклеиновая кислота используется в качестве зонда, то целевые полинуклеотиды, представленные в образце, выбирают так, чтобы они были комплементарными последовательностям антисмысловых нуклеиновых кислот. Напротив, если нуклеотидный зонд является смысловой нуклеиновой кислотой, то целевой полинуклеотид выбирают так, чтобы он был комплементарным последовательностям смысловой нуклеиновой кислоты.
Гибридизацию можно осуществлять в условиях различной жесткости. Подходящие условия гибридизации для осуществления на практике настоящего изобретения являются такими, что обеспечивающее распознавание взаимодействие зонда с последовательностями, ассоциированными с биохимическим путем передачи сигнала, является как достаточно специфичным, так и достаточно стабильным. Условия, которые приводят к увеличению жесткости реакции гибридизации, хорошо известны и опубликованы в уровне техники. Смотри, например (Sambrook, et al., (1989); Nonradioactive In Situ Hybridization Application Manual, Boehringer Mannheim, second edition). Гибридизационный анализ можно осуществлять с использованием зондов, иммобилизованных на любой твердой подложке, в том числе без ограничения нитроцеллюлозной, стеклянной, кремниевой, и ряда ДНК-чипов. Предпочтительный гибридизационный анализ проводят на генных чипах высокой плотности, описанных в патенте США №5445934.
Для удобного выявления комплексов зонд-мишень, образованных в ходе гибридизационного анализа, осуществляют конъюгирование нуклеотидного зонда с детектируемой меткой. Детектируемые метки, подходящие для применения в настоящем изобретении, включают любую композицию, выявляемую при помощи фотохимических, биохимических, спектроскопических, иммунохимических, электрических, оптических или химических средств. Широкий спектр соответствующих детектируемых меток известен из уровня техники, причем он включает флуоресцентные или хемилюминесцентные метки, метки на основе радиоактивных изотопов, ферментные или другие лиганды. В предпочтительных вариантах осуществления, вероятно, предпочтительной будет флуоресцентная метка или ферментная метка, например, дигоксигенин, β-галактозидаза, уреаза, щелочная фосфатаза или пероксидаза, комплекс авидин/биотин.
Способы выявления, применяемые для выявления или количественного определения интенсивности гибридизации, как правило, будут зависеть от метки, выбранной выше. Например, радиоактивные метки можно выявлять с использованием фотографической пленки или фосфовизуализатора. Можно выявлять флуоресцентные маркеры и проводить количественное определение с использованием фотодетектора для выявления излучаемого света. Ферментные метки, как правило, выявляют посредством снабжения фермента субстратом и измерения количества продукта реакции, образованного при воздействии фермента на субстрат; и, наконец, колориметрические метки выявляют посредством простой визуализации цветной метки.
Индуцированное определенным средством изменение экспрессии последовательностей, ассоциированных с биохимическим путем передачи сигнала, также можно определять посредством исследования соответствующих продуктов генов. Определение уровня белка, как правило, включает а) приведение белка, содержащегося в биологическом образце, в контакт со средством, которое специфично связывается с белком, ассоциированным с биохимическим путем передачи сигнала; и (b) идентификацию любого комплекса средство:белок, образованного таким образом. В одном аспекте данного варианта осуществления средство, которое специфически связывает белок, ассоциированный с биохимическим путем передачи сигнала, представляет собой антитело, предпочтительно моноклональное антитело.
Реакцию осуществляют посредством приведения средства в контакт с образцом белков, ассоциированных с биохимическим путем передачи сигнала, полученным из тестируемых образцов, при условиях, которые обеспечивают возможность образования комплекса между средством и белками, ассоциированными с биохимическим путем передачи сигнала. Образование комплекса можно выявлять непосредственно или опосредованно в соответствии со стандартными методиками из уровня техники. В способе непосредственного выявления средства снабжают детектируемой меткой и непрореагировавшие средства можно удалять от комплекса; количество оставшейся метки, таким образом, отражает количество образованного комплекса. Для такого способа предпочтительно выбирать метки, которые остаются прикрепленными к средствам даже при жестких условиях отмывки. Предпочтительно, чтобы метка не препятствовала реакции связывания. В альтернативном случае для методики опосредованного выявления можно использовать средство, которое содержит метку, введенную либо химическим, либо ферментативным путем. Желаемая метка, как правило, не препятствует связыванию или стабильности полученного в результате комплекса средство:полипептид. Однако, метка, как правило, разработана так, чтобы она была доступной для эффективного связывания антителом и, следовательно, выработки детектируемого сигнала.
Широкий спектр меток, подходящих для выявления уровней белка, известен из уровня техники. Неограничивающие примеры включают радиоактивные изотопы, ферменты, коллоидные металлы, флуоресцентные соединения, биолюминесцентные соединения и хемилюминесцентные соединения.
Количество комплексов средство:полипептид, образованных в ходе реакции связывания, можно количественно определять при помощи стандартных количественных анализов. Как проиллюстрировано выше, образование комплекса средство:полипептид можно измерить непосредственно по количеству метки, оставшейся в участке связывания. В альтернативном случае белок, ассоциированный с биохимическим путем передачи сигнала, тестируют в отношении его способности конкурировать с меченым аналогом за участки связывания на специфическом средстве. В этом конкурентном анализе количество захваченной метки является обратно пропорциональным количеству последовательностей белка, ассоциированного с биохимическим путем передачи сигнала, присутствующих в тестируемом образце.
Ряд методик анализа белка, основанных на общих принципах, изложенных выше, доступен из уровня техники. Они включают, без ограничения, радиоиммунные анализы, ELISA (твердофазные ферментные иммунорадиометрические анализы), "сэндвич"-иммуноанализы, иммунорадиометрические анализы, иммуноанализы in situ (с применением, например, коллоидного золота, фермента или радиоизотопных меток), вестерн-блот анализ, иммунопреципитационные анализы, иммунофлуоресцентные анализы и SDS-PAGE.
Антитела, обеспечивающие специфичное распознавание белков, ассоциированных с биохимическим путем передачи сигнала, или связывающие их, являются предпочтительными для осуществления вышеупомянутых анализов белка. При необходимости можно использовать антитела, которые обеспечивают распознавание конкретного типа посттрансляционных модификаций (например, модификации, индуцируемые биохимическим путем передачи сигнала). Посттрансляционные модификации включают, без ограничения, гликозилирование, липидизацию, ацетилирование и фосфорилирование. Эти антитела можно приобрести у коммерческих поставщиков. Например, антитела к фосфотирозину, которые обеспечивают специфичное распознавание фосфорилированных по тирозину белков, доступны от ряда поставщиков, включая Invitrogen и Perkin Elmer. Антитела к фосфотирозину являются особенно применимыми при выявлении белков, которые различным образом фосфорилируются по их тирозиновым остаткам в ответ на стресс, связанный с ER. Такие белки включают, без ограничения, эукариотический фактор инициации трансляции 2 альфа (eIF-2α). В альтернативном случае эти антитела можно получить при помощи общепринятых методик поликлональных или моноклональных антител посредством иммунизации животного-хозяина или клетки, продуцирующей антитела, целевым белком, который характеризуется необходимой посттрансляционной модификацией.
При осуществлении заявленного способа на практике может быть необходимо определить профиль экспрессии белка, ассоциированного с биохимическим путем передачи сигнала, в различных тканях организма, в различных типах клеток и/или в различных субклеточных структурах. Данные исследования можно проводить с применением тканеспецифичных, специфичных к определенным клеткам или специфичных к определенным субклеточным структурам антител, способных связываться с белковыми маркерами, которые преимущественно экспрессируются в определенных тканях, типах клеток или субклеточных структурах.
Измененную экспрессию гена, ассоциированного с биохимическим путем передачи сигнала, также можно определять при помощи исследования изменения активности продукта гена по сравнению с контрольной клеткой. Анализ индуцированного определенным средством изменения активности белка, ассоциированного с биохимическим путем передачи сигнала, будет зависеть от биологической активности и/или исследуемого пути передачи сигнала. Например, если белок представляет собой киназу, изменение его способности фосфорилировать субстрат(субстраты) на последующих стадиях можно определять посредством ряда анализов, известных из уровня техники. Типичные анализы включают, без ограничения, иммуноблоттинг и иммунопреципитацию с использованием антител, таких как антитела к фосфотирозину, которые обеспечивают распознавание фосфорилированных белков. Кроме того, активность киназы можно выявлять при помощи высокопроизводительных хемилюминесцентных анализов, например, анализов AlphaScreen™ (доступного от Perkin Elmer) и eTag™ (Chan-Hui, et al. (2003) Clinical Immunology 111: 162-174).
Если белок, ассоциированный с биохимическим путем передачи сигнала, является частью сигнального каскада, который приводит к колебанию внутриклеточных условий рН, молекулы, чувствительные к рН, например, флуоресцентные рН-чувствительные красители, можно использовать в качестве репортерных молекул. В другом примере, если белок, ассоциированный с биохимическим путем передачи сигнала, представляет собой ионный канал, можно отслеживать колебания мембранного потенциала и/или внутриклеточной концентрации ионов. Ряд коммерческих наборов и высокопроизводительных устройств являются особенно подходящими для быстрого и надежного скрининга модуляторов ионных каналов. Типичные инструменты включают FLIPRTM (Molecular Devices, Inc.) и VIPR (Aurora Biosciences). Эти инструменты способны обеспечивать одновременное выявление реакций в более чем 1000 лунках с образцом в микропланшете и обеспечивать измерение в реальном времени и функциональные данные в течение секунды или даже миллисекунды.
При осуществлении на практике любых способов, раскрытых в данном документе, подходящий вектор можно вводить в клетку или эмбрион посредством одного или нескольких способов, известных из уровня техники, в том числе, без ограничения, микроинъекции, электропорации, сонопорации, баллистической трансфекции, трансфекции, опосредованной фосфатом кальция, трансфекции с помощью катионных липидных частиц, липосомной трансфекции, трансфекции при помощи дендримеров, трансфекции посредством теплового шока, трансфекции посредством нуклеофекции, магнитофекции, липофекции, импалефекции, оптической трансфекции, поглощения нуклеиновых кислот, стимулируемого проприетарным средством, и доставки при помощи липосом, иммунолипосом, виросом или искусственных вирионов. В некоторых способах вектор вводят в эмбрион посредством микроинъекции. Можно осуществлять микроинъекцию вектора или векторов в ядро или цитоплазму эмбриона. В некоторых способах вектор или векторы можно вводить в клетку посредством нуклеофекции.
Целевым полинуклеотидом для комплекса CRISPR может быть любой полинуклеотид, эндогенный или экзогенный по отношению к эукариотической клетке. Например, целевым полинуклеотидом может быть полинуклеотид, находящийся в ядре эукариотической клетки. Целевой полинуклеотид может быть последовательностью, кодирующей продукт гена (к примеру, белок), или некодирующей последовательностью (к примеру, регуляторным полинуклеотидом или избыточной ДНК).
Примеры целевых полинуклеотидов включают последовательность, ассоциированную с биохимическим путем передачи сигнала, к примеру, ген или полинуклеотид, ассоциированный с биохимическим путем передачи сигнала. Примеры целевых полинуклеотидов включают ассоциированные с заболеваниями гены или полинуклеотиды. "Ассоциированный с заболеванием" ген или полинуклеотид означает любой ген или полинуклеотид, который обеспечивает продукты транскрипции или трансляции на аномальном уровне или в аномальной форме в клетках, полученных из пораженных заболеванием тканей, по сравнению с тканями или клетками контроля без заболевания. Это может быть ген, который начинает экспрессироваться на аномально высоком уровне; это может быть ген, который начинает экспрессироваться на аномально низком уровне, где измененная экспрессия коррелирует с появлением и/или прогрессированием заболевания. Ассоциированный с заболеванием ген также означает ген, несущий мутацию(мутации) или генетическое изменение, который непосредственно ответственен или находится в неравновесном сцеплении с геном(генами), ответственным(ответственными) за этиологию заболевания. Транскрибированные или транслированные продукты могут быть известными или неизвестными и могут быть на нормальном уровне или на аномальном уровне.
Целевым полинуклеотидом для комплекса CRISPR может быть любой полинуклеотид, эндогенный или экзогенный по отношению к эукариотической клетке. Например, целевым полинуклеотидом может быть полинуклеотид, находящийся в ядре эукариотической клетки. Целевой полинуклеотид может быть последовательностью, кодирующей продукт гена (к примеру, белок), или некодирующей последовательностью (к примеру, регуляторным полинуклеотидом или избыточной ДНК). Не желая ограничиваться какой-либо теорией, полагают, что целевая последовательность должна быть ассоциирована с РАМ (мотивом, прилегающим к протоспейсеру); то есть короткой последовательностью, распознаваемой комплексом CRISPR. Определенные требования в отношении последовательности и длины РАМ различаются в зависимости от применяемого фермента CRISPR, но РАМ, как правило, являются последовательностями в 2-5 пар оснований, прилегающими к протоспейсеру (то есть целевой последовательности). Примеры последовательностей РАМ приведены в разделе "Примеры" ниже, и специалист в данной области сможет выявить дополнительные последовательности РАМ для применения с данным ферментом CRISPR.
Целевой полинуклеотид для комплекса CRISPR может включать некоторое количество ассоциированных с заболеваниями генов и полинуклеотидов, а также генов и полинуклеотидов, ассоциированных с биохимическим путем передачи сигнала, которые перечислены в предварительных заявках на патенты США 61/736527 и 61/748427 с общей ссылкой BI-2011/008/WSGR, номер в реестре 44063-701.101, и BI-2011/008/WSGR, номер в реестре 44063-701.102, соответственно, обе из которых озаглавлены "СИСТЕМЫ, СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ МАНИПУЛЯЦИИ С ПОСЛЕДОВАТЕЛЬНОСТЯМИ", поданных 12 декабря 2012 г. и 2 января 2013 г., соответственно, содержания всех из которых включены в данный документ при помощи ссылки во всей их полноте.
Примеры целевых полинуклеотидов включают последовательность, ассоциированную с биохимическим путем передачи сигнала, к примеру, ген или полинуклеотид, ассоциированный с биохимическим путем передачи сигнала. Примеры целевых полинуклеотидов включают ассоциированные с заболеваниями гены или полинуклеотиды. "Ассоциированный с заболеванием" ген или полинуклеотид означает любой ген или полинуклеотид, который обеспечивает продукты транскрипции или трансляции на аномальном уровне или в аномальной форме в клетках, полученных из пораженных заболеванием тканей, по сравнению с тканями или клетками контроля без заболевания. Это может быть ген, который начинает экспрессироваться на аномально высоком уровне; это может быть ген, который начинает экспрессироваться на аномально низком уровне, где измененная экспрессия коррелирует с появлением и/или прогрессированием заболевания. Ассоциированный с заболеванием ген также означает ген, несущий мутацию(мутации) или генетическое изменение, который непосредственно ответственен или находится в неравновесном сцеплении с геном(генами), ответственным(ответственными) за этиологию заболевания. Транскрибированные или транслированные продукты могут быть известными или неизвестными и могут быть на нормальном уровне или на аномальном уровне.
Примеры ассоциированных с заболеваниями генов и полинуклеотидов перечислены в таблицах А и В. Конкретная информация в отношении заболеваний доступна от Института медицинской генетики Маккьюсика-Натанса при Университете Джонса Хопкинса (Балтимор, Мэриленд) и Национального центра биотехнологической информации Национальной библиотеки медицины (Бетесда, Мэриленд), доступных во всемирной сети Интернет. Примеры генов и полинуклеотидов, ассоциированных с биохимическими путями проведения сигнала, перечислены в таблице С.
Мутации в этих генах и путях могут приводить к продуцированию несоответствующих белков или белков в несоответствующих количествах, которые воздействуют на функцию. Дополнительные примеры генов, заболеваний и белков, таким образом, включены при помощи ссылки из предварительной заявки на патент США 61/736527, поданной 12 декабря 2012 г. Такие гены, белки и пути могут быть целевым полинуклеотидом для комплекса CRISPR.
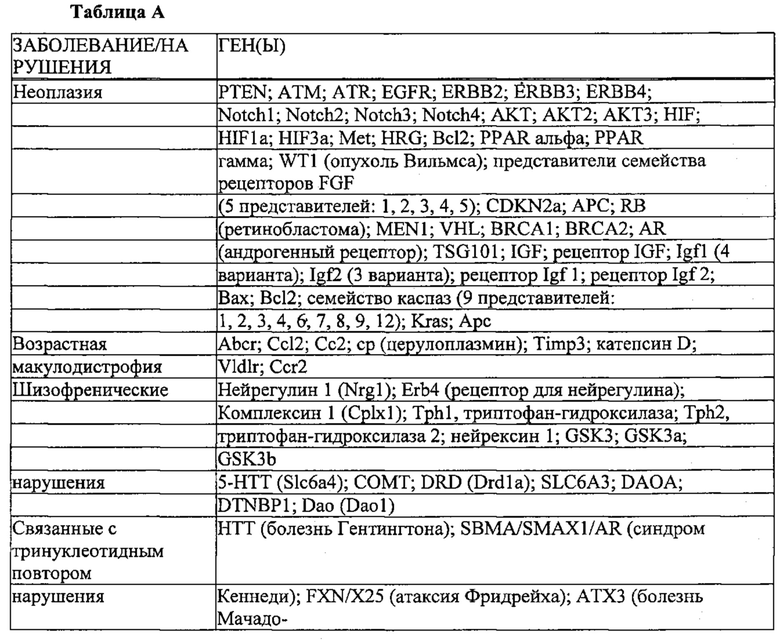
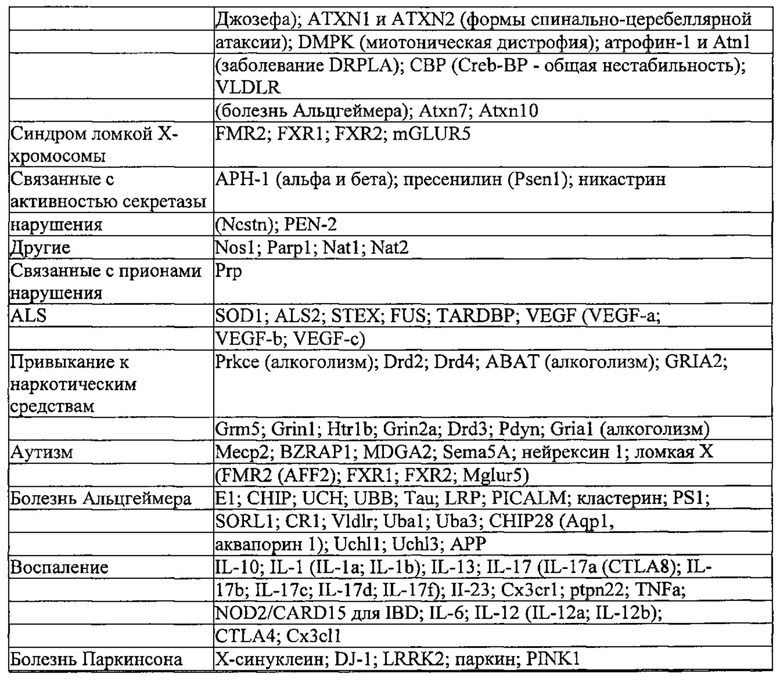

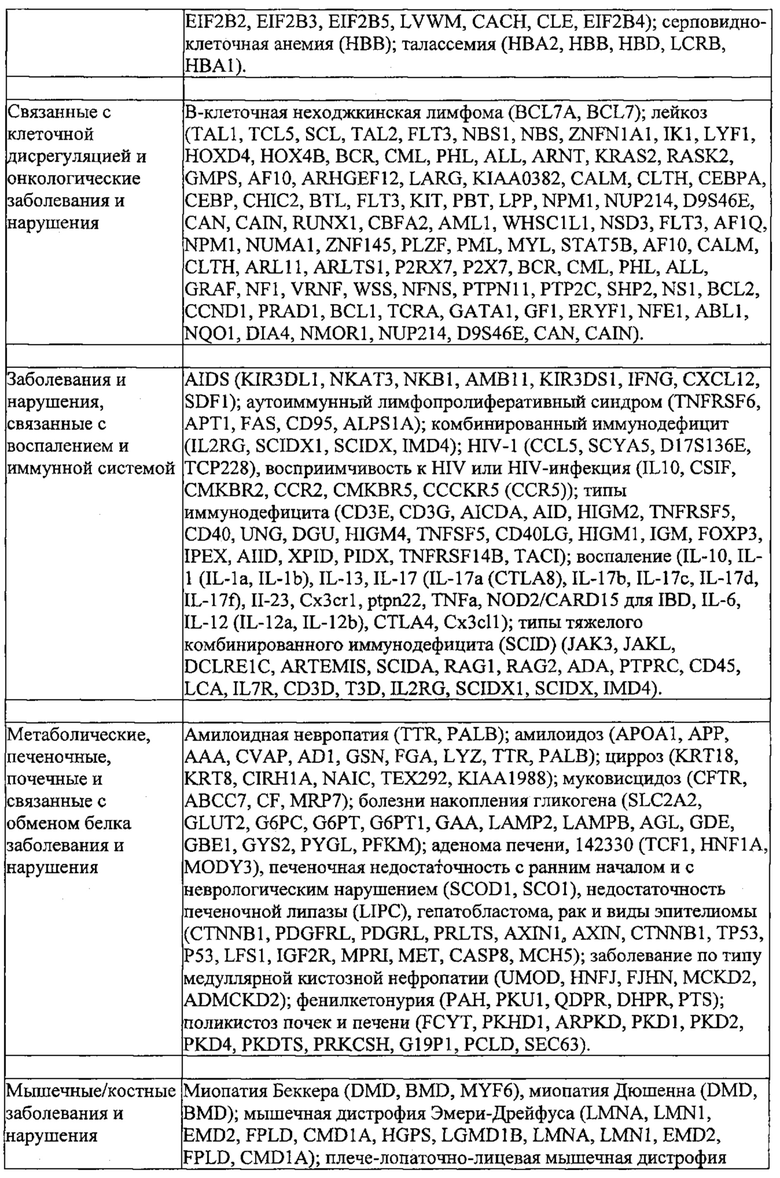


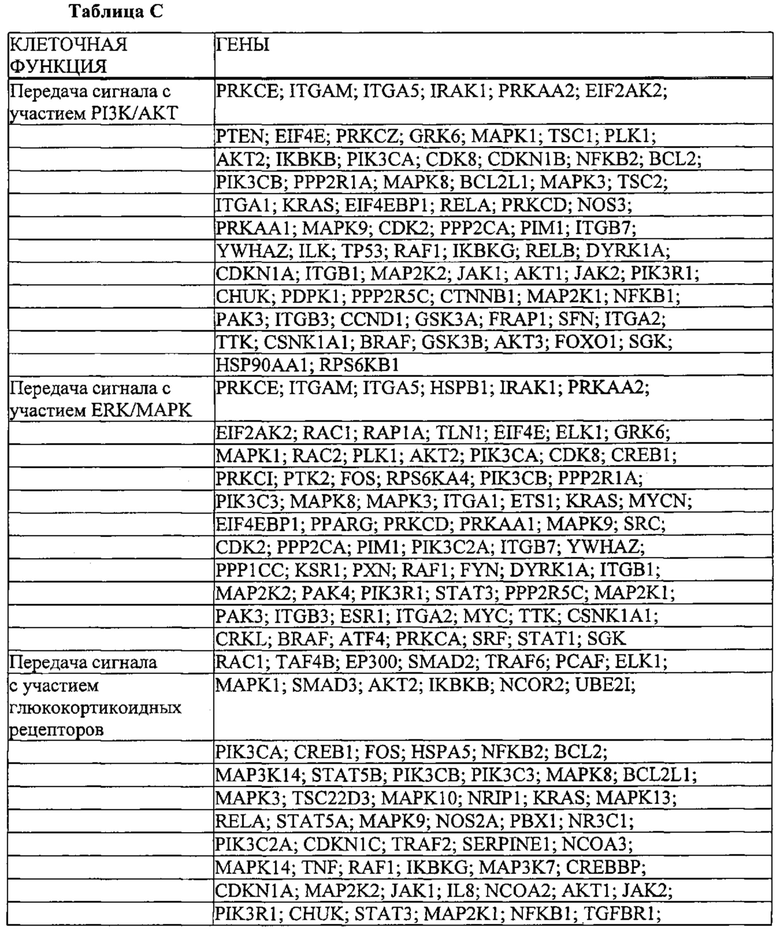

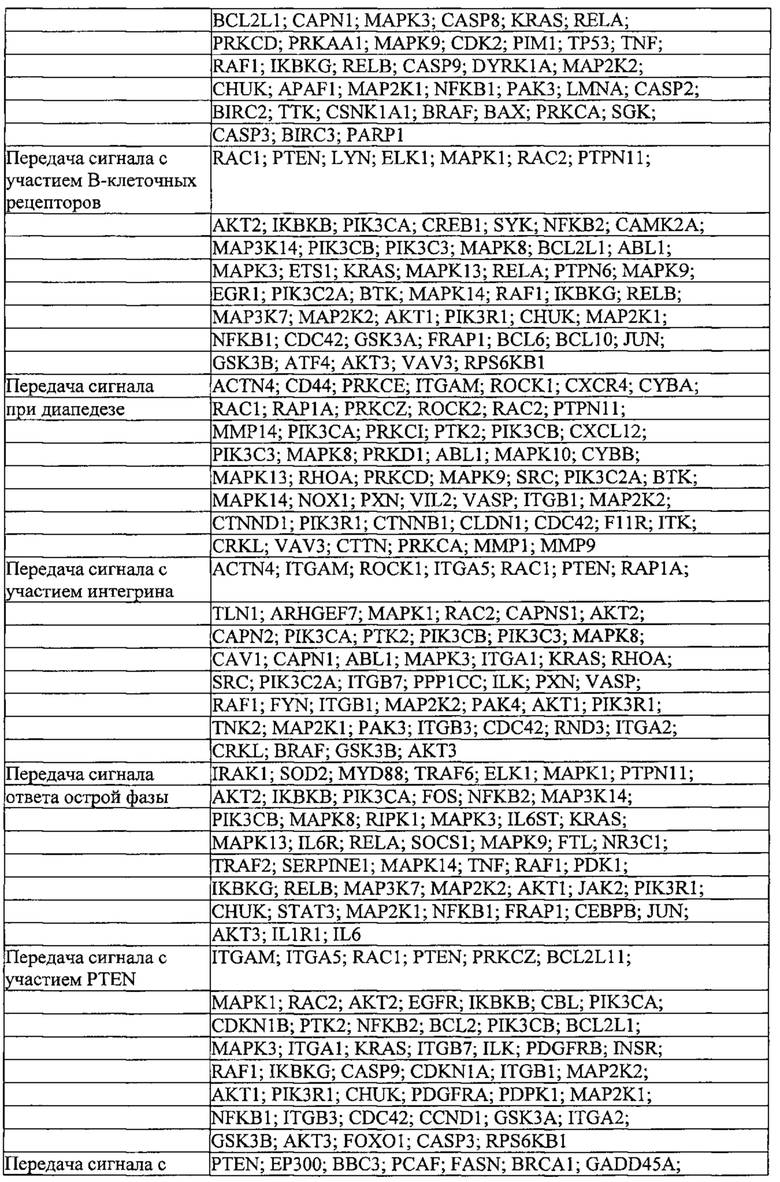


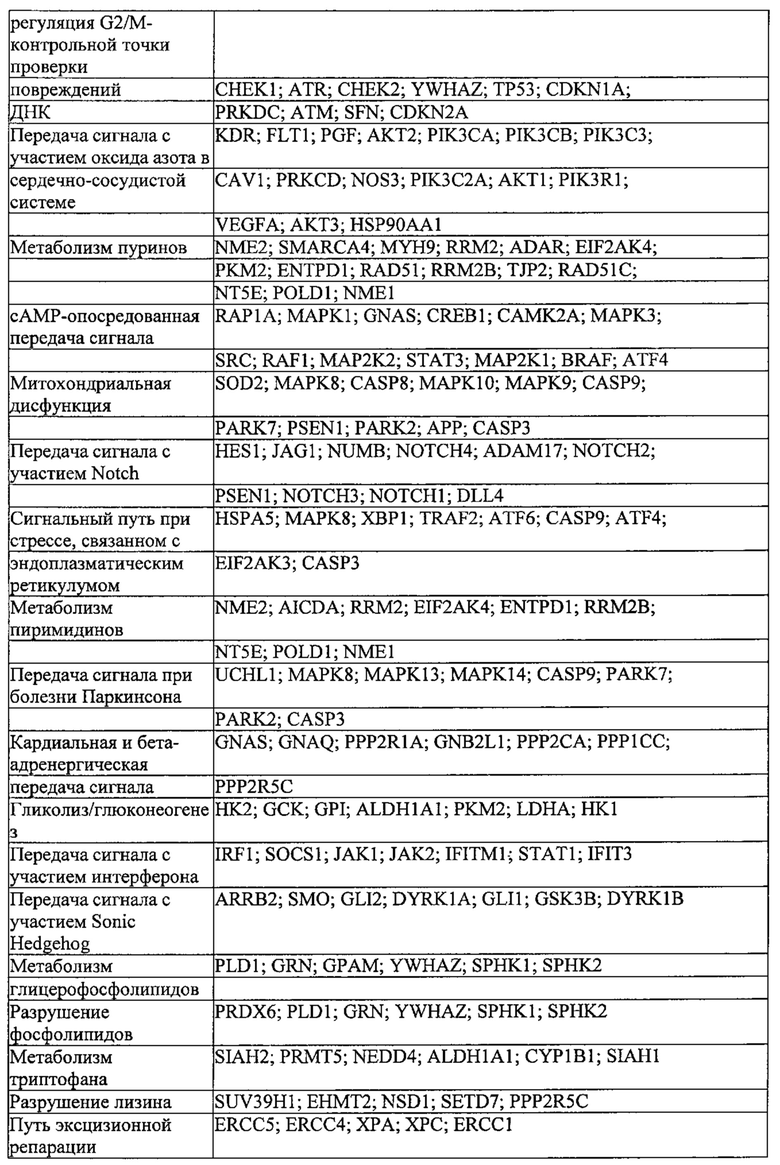
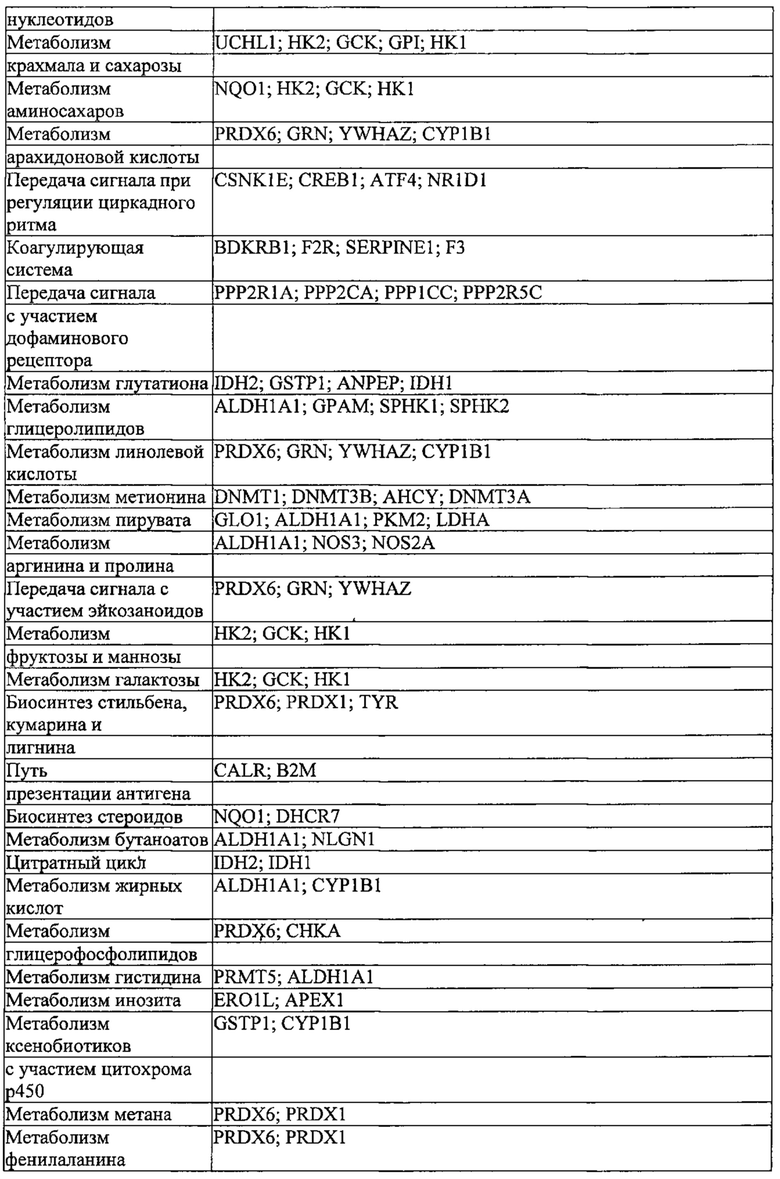

Варианты осуществления настоящего изобретения также относятся к способам и композициям, связанным с нокаутом генов, амплификацией генов и репарацией конкретных мутаций, ассоциированных с нестабильностью ДНК-повторов и неврологическими нарушениями (Robert D. Wells, Tetsuo Ashizawa, Genetic Instabilities and Neurological Diseases, Second Edition, Academic Press, Oct 13, 2011 - Medical). Как было обнаружено, определенные аспекты последовательностей тандемных повторов ответственны за более чем двадцать заболеваний человека (New insights into repeat instability: role of RNA⋅DNA hybrids. McIvor EI, Polak U, Napierala M. RNA Biol. 2010 Sep-Oct; 7(5):551-8). Система CRISPR-Cas может быть приспособлена для коррекции таких дефектов геномной нестабильности.
Дополнительный аспект настоящего изобретения относится к использованию системы CRISPR-Cas для коррекции дефектов в генах ЕМР2А и ЕМР2В, которые, как было обнаружено, ассоциированы с болезнью Лафора. Болезнь Лафора представляет собой аутосомно-рецессивное состояние, которое характеризуется прогрессирующей миоклонус-эпилепсией, которая может начинаться в виде эпилептических приступов в подростковом возрасте. Некоторые случаи заболевания могут вызываться мутациями в генах, которые уже были выявлены. Заболевание вызывает приступы, мышечные спазмы, затрудненную ходьбу, слабоумие и, в конечном итоге, смерть. В настоящее время не существует терапии, которая показала эффективность против прогрессирования заболевания. На другие генетические расстройства, ассоциированные с эпилепсией, также можно целенаправленно воздействовать при помощи системы CRISPR-Cas, и лежащие в основе генетические факторы дополнительно описаны в Genetics of Epilepsy and Genetic Epilepsies, edited by Giuliano Avanzini, Jeffrey L. Noebels, Mariani Foundation Paediatric Neurology:20; 2009).
Способы согласно публикации заявки на патент США №20110158957, закрепленной за Sangamo Biosciences, Inc., связанные с инактивацией генов Т-клеточных рецепторов (TCR), также можно модифицировать для применения с системой CRISPR-Cas согласно настоящему изобретению. В другом примере способы согласно публикации заявки на патент США №20100311124, права на которую принадлежат Sangamo Biosciences, Inc., и публикации заявки на патент США №20110225664, права на которую принадлежат Cellectis, оба из которых связаны с инактивацией экспрессии гена глутаминсинтетазы, также можно модифицировать для применения с системой CRISPR-Cas согласно настоящему изобретению.
Некоторые дополнительные аспекты настоящего изобретения касаются коррекции дефектов, ассоциированных с широким спектром наследственных заболеваний, которые дополнительно описаны на веб-сайте Национальных институтов здравоохранения в тематическом подразделе "Наследственные заболевания" ("Genetic Disorders") (веб-сайт по адресу health.nih.gov/topic/GeneticDisorders). Наследственные заболевания головного мозга могут включать, без ограничения, адренолейкодистрофию, агенезию мозолистого тела, синдром Айкарди, синдром Альперса, болезнь Альцгеймера, синдром Барта, болезнь Баттена, CADASIL, мозжечковую дегенерацию, болезнь Фабри, синдром Герстмана-Штраусслера-Шейнкера, болезнь Гентингтона и другие связанные с триплетными повторами нарушения, болезнь Лея, синдром Леша-Найхана, болезнь Менкеса, типы митохондриальной миопатии и кольпоцефалию по критериям NINDS. Такие заболевания дополнительно описаны на веб-сайте Национальных институтов здравоохранения в тематическом подразделе "Наследственные заболевания головного мозга" ("Genetic Brain Disorders").
В некоторых вариантах осуществления состоянием может быть неоплазия. В некоторых вариантах осуществления, где состоянием является неоплазия, гены, на которые целенаправленно воздействуют, являются любыми из перечисленных в таблице А (в данном случае PTEN и так далее). В некоторых вариантах осуществления состоянием может быть возрастная макулодистрофия. В некоторых вариантах осуществления состоянием может быть шизофреническое нарушение. В некоторых вариантах осуществления состоянием может быть связанное с экспансией тринуклеотидных повторов нарушение. В некоторых вариантах осуществления состоянием может быть синдром ломкой Х-хромосомы. В некоторых вариантах осуществления состоянием может быть связанное с активностью секретазы нарушение. В некоторых вариантах осуществления состоянием может быть связанное с прионами нарушение. В некоторых вариантах осуществления состоянием может быть ALS. В некоторых вариантах осуществления состоянием может быть наркомания. В некоторых вариантах осуществления состоянием может быть аутизм. В некоторых вариантах осуществления состоянием может быть болезнь Альцгеймера. В некоторых вариантах осуществления состоянием может быть воспаление. В некоторых вариантах осуществления состоянием может быть болезнь Паркинсона.
Например, в публикации заявки на патент США №20110023145 описывается применение нуклеаз с "цинковыми пальцами" для генетической модификации клеток, животных и белков, ассоциированных с расстройствами аутистического спектра (ASD). Расстройства аутистического спектра (ASD) представляют собой группу расстройств, характеризующихся качественным нарушением социального взаимодействия и коммуникации, а также ограниченными повторяющимися и стереотипными паттернами поведения, интересов и видов деятельности. Три расстройства, аутизм, синдром Аспергера (AS) и неспецифическое первазивное расстройство развития (PDD-NOS), составляют непрерывный спектр одного расстройства с различными степенями тяжести, ассоциированной умственной деятельности и медицинских состояний. ASD преимущественно являются расстройствами, которые предопределены наследственными факторами, с наследуемостью около 90%.
В публикации заявки на патент США №20110023145 предусматривается редактирование любых хромосомных последовательностей, которые кодируют белки, ассоциированные с ASD, что можно применять по отношению к системе CRISPR-Cas согласно настоящему изобретению. Белки, ассоциированные с ASD, как правило, выбирают на основании экспериментально установленной ассоциации белка, ассоциированного с ASD, с возникновением или симптомом ASD. Например, скорость образования или концентрация в кровотоке белка, связанного с ASD, может быть повышенной или пониженной в популяции с ASD по сравнению с популяцией без ASD. Различия в уровнях белка можно оценить при помощи протеомных методик, в том числе, без ограничения, вестерн-блот анализа, иммуногистохимического окрашивания, твердофазного иммуноферментного анализа (ELISA) и масс-спектрометрии. В альтернативном случае белки, ассоциированные с ASD, можно идентифицировать путем получения профилей экспрессии генов для генов, кодирующих белки, при помощи методик геномного анализа, в том числе, без ограничения, микроматричного анализа ДНК, серийного анализа экспрессии генов (SAGE) и количественной полимеразной цепной реакции в режиме реального времени (Q-PCR).
Неограничивающие примеры болезненных состояний или расстройств, которые могут быть ассоциированы с белками, ассоциированными с ASD, включают аутизм, синдром Аспергера (AS), неспецифическое первазивное расстройство развития (PDD-NOS), синдром Ретта, туберозный склероз, фенилкетонурию, синдром Смита-Лемли-Опитца и синдром ломкой Х-хромосомы. В качестве неограничивающего примера, белки, ассоциированные с ASD, включают, без ограничения, следующие белки: АТР10С - аминофосфолипид-транспортирующую АТФазу (АТР10С), МЕТ - МЕТ-рецепторную тирозинкиназу, BZRAP1, MGLUR5 (GRM5) - метаботропный глутаматный рецептор 5 (MGLUR5), CDH10 - кадгерин-10, MGLUR6 (GRM6) - метаботропный глутаматный рецептор 6 (MGLUR6), CDH9 - кадгерин-9, NLGN1 - нейролигин-1, CNTN4 - контактин-4, NLGN2 - нейролигин-2, CNTNAP2 - белок 2, подобный контактин-ассоциированному белку (CNTNAP2), SEMA5A - нейролигин-3, DHCR7 - 7-дегидрохолестеринредуктазу (DHCR7), NLGN4X - нейролигин-4 Х-связанный, NLGN4Y - нейролигин-4 Y-связанный, DOC2A - альфа-белок, содержащий двойной С2-подобный домен, DPP6 - белок 6, подобный дипептидиламинопептидазе, NLGN5 - нейролигин-5, EN2 - белок 2, кодируемый гомеобоксом (EN2), NRCAM - молекулу адгезии нейронов (NRCAM), MDGA2, ассоциированный с умственной отсталостью, сцепленной с ломкой X-хромосомой (MDGA2), NRXN1 - нейрексин-1, FMR2 (AFF2) - представитель 2 семейства AF4/FMR2, OR4M2 - рецептор обонятельных луковиц 4М2, FOXP2 - белок, кодируемый Forkhead-боксом Р2 (FOXP2), OR4N4 - рецептор обонятельных луковиц 4N4, FXR1 - аутосомный гомолог 1, связанный с умственной отсталостью, сцепленной с ломкой X-хромосомой (FXR1), OXTR - окситоциновый рецептор (OXTR), FXR2 - аутосомный гомолог 2, связанный с умственной отсталостью, сцепленной с ломкой Х-хромосомой (FXR2), РАН - фенилаланингидроксилазу (РАН), GABRA1 - субъединицу альфа-1 рецептора гамма-аминомасляной кислоты (GABRA1), PTEN - гомолог фосфатазы и тензина (PTEN), GABRA5 - субъединицу альфа-5 рецептора GABAA (гамма-аминомасляной кислоты) (GABRA5), PTPRZ1 - протеиновую тирозинфосфатазу-дзета рецепторного типа (PTPRZ1), GABRB1 - субъединицу бета-1 рецептора гамма-аминомасляной кислоты (GABRB1), RELN - рилин, GABRB3 - субъединицу бета-3 рецептора GABAA (гамма-аминомасляной кислоты) (GABRB3), RPL10 - рибосомальный белок 60S L10, GABRG1 - субъединицу гамма-1 рецептора гамма-аминомасляной кислоты (GABRG1), SEMA5A - семафорин-5А (SEMA5A), HIRIP3 - HIRA-взаимодействующий белок 3, SEZ6L2 - белок 2, подобный гомологу белка 6, связанного с приступами (мышь), НОХА1 - белок, кодируемый гомеобоксом Нох-А1 (НОХА1), SHANK3 - белок 3, содержащий SH3 и несколько повторяющихся доменов анкирина (SHANK3), IL6 - интерлейкин-6, SHBZRAP1 - белок 3, содержащий SH3 и несколько повторяющихся доменов анкирина (SHBZRAP1), LAMB1 - ламинин, субъединицу бета-1 (LAMB1), SLC6A4 - серотониновый транспортер (SERT), MAPK3 - митоген-активируемую протеинкиназу 3, TAS2R1 - вкусовой рецептор типа 2, представитель 1 (TAS2R1), MAZ - Мус-ассоциированный белок с "цинковыми пальцами", TSC1 - белок 1, ассоциированный с туберозным склерозом, MDGA2 - гликозилфосфатидилинозитол-связанный белок 2, якорная форма 2, содержащий домен МАМ (MDGA2), TSC2 - белок 2, ассоциированный с туберозным склерозом, МЕСР2 - метил-CpG-связывающий белок 2 (МЕСР2), UBE3A - убиквитинпротеинлигазу Е3А (UBE3A), МЕСР2 - метил-CpG-связывающий белок 2 (МЕСР2), WNT2 - сайт интеграции MMTV типа Wingless, представитель 2 семейства (WNT2).
Идентичность белка, ассоциированного с ASD, редактирование хромосомной последовательности которого осуществляют, может и будет варьировать. В предпочтительных вариантах осуществления белки, ассоциированные с ASD, редактирование хромосомной последовательности которых осуществляют, могут представлять собой белок 1, ассоциированный с (периферическим) бензодиазепиновым рецептором (BZRAP1), кодируемый геном BZRAP1, белок-представитель 2 семейства AF4/FMR2 (AFF2), кодируемый геном AFF2 (также называемый MFR2), белок аутосомный гомолог 1, ассоциированный с умственной отсталостью, сцепленной с ломкой Х-хромосомой (FXR1), кодируемый геном FXR1, или белок аутосомный гомолог 2, ассоциированный с умственной отсталостью, сцепленной с ломкой Х-хромосомой (FXR2), кодируемый геном FXR2, гликозилфосфатидилинозитол-связанный белок, содержащий домен МАМ, якорная форма 2 (MDGA2), кодируемый геном MDGA2, метил-CpG-связывающий белок 2 (МЕСР2), кодируемый геном МЕСР2, метаботропный глутаматный рецептор 5 (MGLUR5), кодируемый геном MGLUR5-1 (также называемый GRM5), белок нейрексин 1, кодируемый геном NRXN1, или белок семафорин-5А (SEMA5A), кодируемый геном SEMA5A. В иллюстративном варианте осуществления генетически модифицированное животное представляет собой крысу, и редактируемые хромосомные последовательности, кодирующие белок, ассоциированный с ASD, перечислены ниже: BZRAP1 - белок 1, ассоциированный с (периферическим) бензодиазепиновым рецептором (BZRAP1) - ХМ_002727789, ХМ_213427, ХМ_002724533, ХМ_001081125, AFF2 (FMR2) - представитель 2 семейства AF4/FMR2 (AFF2) - ХМ_219832, ХМ_001054673, FXR1 - аутосомный гомолог 1, ассоциированный с умственной отсталостью, сцепленной с ломкой Х-хромосомой (FXR1) - NM_001012179, FXR2 - аутосомный гомолог 2, ассоциированный с умственной отсталостью, сцепленной с ломкой Х-хромосомой (FXR2) - NM_001100647, MDGA2 - гликозилфосфатидилинозитол-связанный белок, содержащий домен МАМ, якорная форма 2 (MDGA2) - NM_199269, МЕСР2 - метил-CpG-связывающий белок 2 (МЕСР2) - NM_022673, MGLUR5 - метаботропный глутаматный рецептор 5 (GRM5) (MGLUR5) - NM_017012, NRXN1 - нейрексин-1 - NM_021767, (SEMA5A - семафорин-5А (SEMA5A) - NM_001107659.
Иллюстративные животные или клетки могут содержать одну, две, три, четыре, пять, шесть, семь, восемь, или девять, или более инактивированных хромосомных последовательностей, кодирующих белок, ассоциированный с ASD, и ноль, одну, две, три, четыре, пять, шесть, семь, восемь, или девять, или более интегрированных в хромосому последовательностей, кодирующих белки, ассоциированные с ASD. Отредактированную или интегрированную хромосомную последовательность можно модифицировать так, чтобы она кодировала измененный белок, ассоциированный с ASD. Неограничивающие примеры мутаций в белках, ассоциированных с ASD, включают мутацию L18Q в нейрексине 1, где лейцин в положении 18 замещен глутамином, мутацию R451C в нейролигине 3, где аргинин в положении 451 замещен цистеином, мутацию R87W в нейролигине 4, где аргинин в положении 87 замещен триптофаном, и мутацию I425V в серотониновом транспортере, где изолейцин в положении 425 замещен валином. Ряд других мутаций и хромосомных перестроек в связанных с ASD хромосомных последовательностях ассоциирован с ASD, и они известны из уровня техники. Смотри, например, Freitag et al. (2010) Eur. Child. Adolesc. Psychiatry 19:169-178 и Bucan et al. (2009) PLoS Genetics 5: e1000536, раскрытие которых включено в данный документ посредством ссылки во всей их полноте.
Примеры белков, ассоциированных с болезнью Паркинсона, включают, без ограничения, α-синуклеин, DJ-1, LRRK2, PINK1, паркин, UCHL1, синфилин-1 и NURR1.
Примеры связанных с привыканием белков могут включать, например, АВАТ.
Примеры связанных с воспалением белков могут включать, например, моноцитарный хемоаттрактантный белок-1 (МСР1), кодируемый геном Ccr2, С-С-рецептор хемокина 5 типа (CCR5), кодируемый геном Ccr5, рецептор IgG IIB (FCGR2b, также называемый CD32), кодируемый геном Fcgr2b, или белок Fc-эпсилон-R1g (FCER1g), кодируемый геном Fcer1g.
Примеры ассоциированных с заболеваниями сердечно-сосудистой системы белков могут включать, например, IL1B (интерлейкин 1, бета), XDH (ксантиндегидрогеназу), ТР53 (опухолевый белок р53), PTGIS (простагландин-I2(простациклин)-синтазу), MB (миоглобин), IL4 (интерлейкин 4), ANGPT1 (ангиопоэтин 1), ABCG8 (АТФ-связывающую кассету, подсемейство G (WHITE), представитель 8) или CTSK (катепсин K).
Например, в публикации заявки на патент США №20110023153 описывается применение нуклеаз с "цинковыми пальцами" для генетической модификации клеток, животных и белков, ассоциированных с болезнью Альцгеймера. В случае модификации клетки и животных можно дополнительно тестировать с применением известных способов для изучения воздействия целенаправленных мутаций на развитие и/или прогрессирование AD с использованием показателей, обычно применяемых в изучении AD - таких как, без ограничения, обучение и память, тревожность, депрессия, привыкание и сенсомоторные функции, а также анализов, при помощи которых измеряют поведенческие, функциональные, патологические, метаболические и биохимические характеристики.
Настоящее раскрытие предусматривает редактирование любых хромосомных последовательностей, которые кодируют белки, ассоциированные с AD. Белки, связанные с AD, обычно выбирают на основании экспериментально подтвержденной ассоциации белка, связанного с AD, с заболеванием AD. Например, скорость образования или концентрация в кровотоке белка, связанного с AD, может быть повышенной или пониженной в популяции с заболеванием AD по сравнению с популяцией без заболевания AD. Различия в уровнях белка можно оценить при помощи протеомных методик, в том числе, без ограничения, вестерн-блот анализа, иммуногистохимического окрашивания, твердофазного иммуноферментного анализа (ELISA) и масс-спектрометрии. В альтернативном случае белки, связанные с AD, можно идентифицировать путем получения профилей экспрессии генов для генов, кодирующих белки, при помощи методик геномного анализа, в том числе, без ограничения, микроматричного анализа ДНК, серийного анализа экспрессии генов (SAGE) и количественной полимеразной цепной реакции в режиме реального времени (Q-PCR).
Примеры ассоциированных с болезнью Альцгеймера белков могут включать, например, белок-рецептор липопротеинов очень низкой плотности (VLDLR), кодируемый геном VLDLR, фермент 1, активирующий убиквитин-подобный модификатор (UBA1), кодируемый геном UBA1, или белок, являющийся каталитической субъединицей NEDD8-активирующего фермента E1 (UBE1C), кодируемый геном UBA3.
В качестве неограничивающего примера, белки, ассоциированные с AD, включают, без ограничения, белки, перечисленные ниже: кодируемый хромосомной последовательностью белок ALAS2, дельта-аминолевулинатсинтазу 2 (ALAS2), АВСА1 - АТФ-связывающий кассетный транспортер (АВСА1), АСЕ - ангиотензин I-превращающий фермент (АСЕ), АРОЕ - предшественник аполипопротеина Е (АРОЕ), АРР - белок-предшественник амилоида (АРР), AQP1 - белок аквапорин 1 (AQP1), BIN1 - Мус-бокс-зависимый взаимодействующий белок 1 или адаптерный белок-интегратор 1 (BIN1), BDNF - нейротрофический фактор головного мозга (BDNF), BTNL8 - белок 8, подобный бутирофилину (BTNL8), C1ORF49 - белок, кодируемый открытой рамкой считывания 49 хромосомы 1, CDH4 - кадгерин-4, CHRNB2 - нейрональный ацетилхолиновый рецептор, субъединицу бета-2, CKLFSF2 - CKLF-подобный белок 2, содержащий трансмембранный домен MARVEL (CKLFSF2), CLEC4E - лектиновый домен С-типа, семейство 4, представитель е (CLEC4E), CLU - кластериновый белок (также известный как аполипопротеин J) CR1 - эритроцитарный рецептор комплемента 1 (CR1, также известный как CD35, рецептор C3b/C4b и рецептор иммунной адгезии), CR1L - эритроцитарный рецептор комплемента 1 (CR1L), CSF3R - рецептор гранулоцитарного колониестимулирующего фактора 3 (CSF3R), CST3 - цистатин С или цистатин 3, CYP2C - цитохром Р450 2С, DAPK1 - ассоциированную с клеточной гибелью протеинкиназу 1 (DAPK1), ESR1 - эстрогеновый рецептор 1, FCAR - Fc-фрагмент рецептора для IgA (FCAR, также известный как CD89), FCGR3B - Fc-фрагмент рецептора IIIb для IgG, с низким сродством (FCGR3B или CD16b), FFA2 - рецептор 2 свободных жирных кислот (FFA2), FGA - фибриноген (фактор I), GAB2 - GRB2-ассоциированный связывающий белок 2 (GAB2), GAB2 - GRB2-ассоциированный связывающий белок 2 (GAB2), GALP - галанин-подобный пептид, GAPDHS - глицеральдегид-3-фосфатдегидрогеназу сперматогенных клеток (GAPDHS), GMPB - GMBP, HP - гаптоглобин (HP), HTR7 - 5-гидрокситриптаминовый (серотониновый) рецептор 7 (сопряженный с аденилатциклазой), IDE - фермент, разрушающий инсулин IF127 IF127, IFI6 - интерферон альфа-индуцируемый белок 6 (IFI6), IFIT2 - интерферон-индуцируемый белок с тетратрикопептидными повторами 2 (IFIT2), IL1RN - антагонист рецептора интерлейкина-1 (IL-1RA), IL8RA - рецептор интерлейкина 8, альфа (IL8RA или CD181), IL8RB - рецептор интерлейкина 8, бета (IL8RB), JAG1 - белок Jagged 1 (JAG1), KCNJ15 - входящий калиевый канал, подсемейство J, представитель 15 (KCNJ15), LRP6 - белок 6, родственный рецептору липопротеинов низкой плотности (LRP6), МАРТ - белок tau, ассоциированный с микротрубочками (МАРТ), MARK4 - киназу 4 МАР/регулирующую сродство к микротрубочкам (MARK4), MPHOSPH1 - фосфобелок 1 М-фазы, MTHFR - 5,10-метилентетрагидрофолатредуктазу, МХ2 - интерферон-индуцируемый GTP-связывающий белок Мх2, NBN - нибрин, также известный как NBN, NCSTN - никастрин, NIACR2 - рецептор 2 ниацина (NIACR2, также известный как GPR109B), NMNAT3 - никотинамиднуклеотидаденилилтрансферазу 3, NTM - нейротримин (или HNT), ORM1 - орозомукоид 1 (ORM1) или альфа-1-кислый гликопротеин 1, P2RY13 - пуринергический рецептор P2Y 13 (P2RY13), PBEF1 - никотинамидфосфорибозилтрансферазу (NAmPRТазу или Nampt), также известную как колониестимулирующий фактор 1 пре-В-клеток (PBEF1) или висфатин, PCK1 - -фосфоенолпируваткарбоксикиназу, PICALM - фосфатидилинозитол-связывающий белок, вовлеченный в формирование клатриновых комплексов (PICALM), PLAU - активатор плазминогена урокиназного типа (PLAU), PLXNC1 - плексин C1 (PLXNC1), PRNP - прионный белок, PSEN1 - белок пресенилин 1 (PSEN1), PSEN2 - белок пресенилин 2 (PSEN2), PTPRA - белок, представляющий собой рецепторную протеинтирозинфосфатазу типа А (PTPRA), RALGPS2 - Ral GEF с доменом РН и SH3-связывающим мотивом 2 (RALGPS2), RGSL2 - белок 2, подобный регулятору передачи сигнала при помощи G-белка (RGSL2), SELENBP1 - селенсвязывающий белок 1 (SELNBP1), SLC25A37 - митоферрин-1, SORL1 - родственный сортилину рецептор L (класс DLR), белок, содержащий повторы A (SORL1), TF - трансферрин, TFAM - митохондриальный транскрипционный фактор A, TNF - фактор некроза опухоли, TNFRSF10C - суперсемейство рецепторов фактора некроза опухоли, представитель 10С (TNFRSF10C), TNFSF10 - суперсемейство рецепторов фактора некроза опухоли (TRAIL), представитель 10а (TNFSF10), UBA1 - фермент 1, активирующий убиквитин-подобный модификатор (UBA1), UBA3 - белок, являющийся каталитической субъединицей NEDD8-активирующего фермента E1 (UBE1C), UBB - белок убиквитин В (UBB), UBQLN1 - убиквилин-1, UCHL1 - белок эстеразу карбокси-конца убиквитина L1 (UCHL1), UCHL3 - белок-изофермент L3 гидролазы карбокси-конца убиквитина (UCHL3), VLDLR - белок-рецептор липопротеинов очень низкой плотности (VLDLR).
В иллюстративных вариантах осуществления белки, ассоциированные с AD, редактирование хромосомной последовательности которых осуществляют, могут представлять собой белок-рецептор липопротеинов очень низкой плотности (VLDLR), кодируемый геном VLDLR, фермент 1, активирующий убиквитин-подобный модификатор (UBA1), кодируемый геном UBA1, белок, являющийся каталитической субъединицей NEDD8-активирующего фермента E1 (UBE1C), кодируемый геном UBA3, белок аквапорин 1 (AQP1), кодируемый геном AQP1, белок эстеразу карбокси-конца убиквитина L1 (UCHL1), кодируемый геном UCHL1, белок-изофермент L3 гидролазы карбокси-конца убиквитина (UCHL3), кодируемый геном UCHL3, белок убиквитин В (UBB), кодируемый геном UBB, белок tau, ассоциированный с микротрубочками (МАРТ), кодируемый геном МАРТ, белок, представляющий собой рецепторную протеинтирозинфосфатазу типа А (PTPRA), кодируемый геном PTPRA, фосфатидилинозит-связывающий белок, вовлеченный в формирование клатриновых комплексов (PICALM), кодируемый геном PICALM, кластериновый белок (также известный как аполипопротеин J), кодируемый геном CLU, белок пресенилин 1, кодируемый геном PSEN1, белок пресенилин 2, кодируемый геном PSEN2, родственный сортилину рецептор L (класс DLR), белок, содержащий повторы A (SORL1), кодируемый геном SORL1, белок-предшественник амилоида (АРР), кодируемый геном АРР, предшественник аполипопротеина Е (АРОЕ), кодируемый геном АРОЕ, или нейротрофический фактор головного мозга (BDNF), кодируемый геном BDNF. В иллюстративном варианте осуществления генетически модифицированное животное представляет собой крысу, и редактируемые хромосомные последовательности, кодирующие белок, ассоциированный с AD, являются следующими: АРР - белок-предшественник амилоида (АРР) - NM_019288, AQP1 - белок аквапорин 1 (AQP1) - NM_012778, BDNF - нейротрофический фактор головного мозга - NM_012513, CLU - кластериновый белок (также известный как аполипопротеин J) - NM_053021, МАРТ - белок tau, ассоциированный с микротрубочками (МАРТ) - NM_017212, PICALM - фосфатидилинозитол-связывающий белок, вовлеченный в формирование клатриновых комплексов (PICALM) - NM_053554, PSEN1 - белок пресенилин 1 (PSEN1) - NM_019163, PSEN2 - белок пресенилин 2 (PSEN2) - NM_031087, PTPRA - белок, представляющий собой рецепторную протеинтирозинфосфатазу типа A (PTPRA) - NM_012763, SORL1 - родственный сортилину рецептор L (класс DLR), белок, содержащий повторы A (SORL1) - NM_053519, ХМ_001065506, ХМ_217115, UBA1 - фермент 1, активирующий убиквитин-подобный модификатор (UBA1) - NM_001014080, UBA3 - белок, являющийся каталитической субъединицей NEDD8-активирующего фермента E1 (UBE1C) - NM_057205, UBB - белок убиквитин В (UBB) - NM_138895, UCHL1 - белок эстераза карбокси-конца убиквитина L1 (UCHL1) - NM_017237, UCHL3 - белок-изофермент L3 гидролазы карбокси-конца убиквитина (UCHL3) - NM_001110165, VLDLR - белок-рецептор липопротеинов очень низкой плотности (VLDLR) - NM_013155.
Животное или клетка могут содержать 1, 2, 3, 4, 5, 6, 7, 8, 9,10, 11, 12, 13, 14, 15 или более хромосомных последовательностей с нарушенной структурой, кодирующих белок, ассоциированный с AD, и ноль, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или более интегрированных в хромосомы последовательностей, кодирующих белок, ассоциированный с AD.
Отредактированную или интегрированную хромосомную последовательность можно модифицировать так, чтобы она кодировала измененный белок, ассоциированный с AD. Ряд мутаций в хромосомных последовательностях, связанных с AD, были ассоциированы с AD. Например, миссенс-мутация V7171 (т.е. валин в положении 717 заменен изолейцином) в АРР приводит к семейной форме AD. Несколько мутаций в белке пресенилине-1, например, H163R (т.е. гистидин в положении 163 заменен аргинином), А246Е (т.е. аланин в положении 246 заменен глутаматом), L286V (т.е. лейцин в положении 286 заменен валином) и C410Y (т.е. цистеин в положении 410 заменен тирозином), приводят к семейной форме болезни Альцгеймера типа 3. Мутации в белке пресенилине-2, например, N141I (т.е. аспарагин в положении 141 заменен изолейцином), M239V (т.е. метионин в положении 239 заменен валином) и D439A (т.е. аспартат в положении 439 заменен аланином), приводят к семейной форме болезни Альцгеймера типа 4. Другие ассоциации генных вариантов генов, ассоциированных с AD, и заболевания известны из уровня техники. Смотри, например, Waring et al. (2008) Arch. Neurol. 65:329-334, раскрытие которого включено в данный документ посредством ссылки во всей своей полноте.
Примеры белков, ассоциированных с расстройствами аутистического спектра, могут включать, например, белок 1, ассоциированный с (периферическим) бензодиазепиновым рецептором (BZRAP1), кодируемый геном BZRAP1, белок-представитель 2 семейства AF4/FMR2 (AFF2), кодируемый геном AFF2 (также называемый MFR2), белок аутосомный гомолог 1, ассоциированный с умственной отсталостью, сцепленной с ломкой Х-хромосомой (FXR1), кодируемый геном FXR1, или белок аутосомный гомолог 2, ассоциированный с умственной отсталостью, сцепленной с ломкой Х-хромосомой (FXR2), кодируемый геном FXR2.
Примеры белков, ассоциированных с макулодистрофией, могут включать, например, АТФ-связывающую кассету, белок-представитель 4 подсемейства А (АВС1) (АВСА4), кодируемый геном ABCR, белок-аполипротеин Е (АРОЕ), кодируемый геном АРОЕ, или белок-лиганд 2 хемокина (С-С мотив) (CCL2), кодируемый геном CCL2.
Примеры белков, ассоциированных с шизофренией, могут включать NRG1, ErbB4, CPLX1, ТРН1, ТРН2, NRXN1, GSK3A, BDNF, DISC1, GSK3B и их комбинации.
Примеры белков, вовлеченных в подавление опухоли, могут включать, например, ATM (мутантный при атаксии-телеангиэктазии), ATR (родственный мутантному при атаксии-телеангиэктазии и Rad3), EGFR (рецептор эпидермального фактора роста), ERBB2 (гомолог 2 онкогена v-erb-b2 вируса эритробластического лейкоза), ERBB3 (гомолог 3 онкогена v-erb-b2 вируса эритробластического лейкоза), ERBB4 (гомолог 4 онкогена v-erb-b2 вируса эритробластического лейкоза), Notch 1, Notch2, Notch 3 или Notch 4.
Примеры белков, ассоциированных с нарушением, связанным с активностью секретазы, могут включать, например, PSENEN (гомолог усилителя 2 пресенилина (С. elegans)), CTSB (катепсин В), PSEN1 (пресенилин 1), АРР (белок-предшественник бета-амилоида (А4)), АРН1В (гомолог В дефектного белка 1 переднего отдела глотки (С. elegans)), PSEN2 (пресенилин 2 (болезнь Альцгеймера 4)) или ВАСЕ1 (фермент 1, расщепляющий АРР по бета-сайту).
Например, в публикации заявки на патент США №20110023146 описывается применение нуклеаз с "цинковыми пальцами" для генетической модификации клеток, животных и белков, ассоциированных с нарушением, связанным с активностью секретазы. Секретазы необходимы для процессинга белков-предшественников с образованием их биологически активных форм. Дефекты различных компонентов, секретазных путей обуславливают многие нарушения, особенно таковые с характерным амилоидогенезом или амилоидными бляшками, как, например, при болезни Альцгеймера (AD).
Что касается нарушения, связанного с активностью секретазы, белки, ассоциированные с этими нарушениями, представляют собой разнородную группу белков, которые оказывают влияние на восприимчивость ко многим нарушениям, наличие нарушения, тяжесть нарушения или любую их комбинацию. Настоящее раскрытие предусматривает редактирование любых хромосомных последовательностей, которые кодируют белки, ассоциированные с нарушением, связанным с активностью секретазы. Белки, ассоциированные с нарушением, связанным с активностью секретазы, как правило, выбирают на основании экспериментально установленной ассоциации белков, родственных секретазе, с развитием нарушения, связанного с активностью секретазы. Например, скорость образования или концентрация в кровотоке белка, ассоциированного с нарушением, связанным с активностью секретазы, может быть повышенной или пониженной в популяции с нарушением, связанным с активностью секретазы, по сравнению с популяцией без нарушения, связанного с активностью секретазы. Различия в уровнях белка можно оценить при помощи протеомных методик, в том числе, без ограничения, вестерн-блот анализа, иммуногистохимического окрашивания, твердофазного иммуноферментного анализа (ELISA) и масс-спектрометрии. В альтернативном случае белок, ассоциированный с нарушением, связанным с активностью секретазы, можно идентифицировать путем получения профилей экспрессии генов для генов, кодирующих белки, при помощи методик геномного анализа, в том числе, без ограничения, микроматричного анализа ДНК, серийного анализа экспрессии генов (SAGE) и количественной полимеразной цепной реакции в режиме реального времени (Q-PCR).
В качестве неограничивающего примера, белки, ассоциированные с нарушением, связанным с активностью секретазы, включают PSENEN (гомолог усилителя пресенилина 2 (С. elegans)), CTSB (катепсин В), PSEN1 (пресенилин 1), АРР (белок-предшественник бета-амилоида (А4)), АРН1В (гомолог В дефектного белка 1 переднего отдела глотки (С. elegans)), PSEN2 (пресенилин 2 (болезнь Альцгеймера 4 типа)), ВАСЕ1 (фермент 1, расщепляющий АРР по бета-сайту), ITM2B (интегральный мембранный белок 2В), CTSD (катепсин D), NOTCH1 (гомолог Notch 1, ассоциированный с транслокацией (Drosophila)), TNF (фактор некроза опухоли (суперсемейство TNF, представитель 2)), INS (инсулин), DYT10 (белок 10, связанный с дистонией), ADAM 17 (ADAM, металлопептидазный домен 17), АРОЕ (аполипопротеин Е), АСЕ (ангиотензин I-превращающий фермент (пептидилдипептидазу А) 1), STN (статин), ТР53 (опухолевый белок р53), IL6 (интерлейкин 6 (интерферон, бета 2)), NGFR (рецептор фактора роста нервов (суперсемейство TNFR, представитель 16)), IL1B (интерлейкин 1, бета), ACHE (ацетилхолинэстеразу (группа крови Yt)), CTNNB1 (катенин (кадгерин-ассоциированный белок), бета 1, 88 кДа), IGF1 (инсулиноподобный фактор роста 1 (соматомедин С)), IFNG (интерферон, гамма), NRG1 (нейрегулин 1), CASP3 (каспазу 3, связанную с апоптозом цистеиновую пептидазу), MAPK1 (митоген-активируемую протеинкиназу 1), CDH1 (кадгерин 1, тип 1, Е-кадгерин (эпителиальные клетки)), АРВВ1 (белок, связывающий предшественник бета-амилоида (А4), семейство В, представитель 1 (Fe65)), HMGCR (редуктазу 3-гидрокси-3-метилглутарилкофермента A), CREB1 (белок 1, связывающий сАМР-чувствительный элемент), PTGS2 (простагландинэндопероксидсинтазу 2 (простагландин-G/Н-синтазу и циклооксигеназу)), HES1 (белок 1 Hairy and enhancer of split (Drosophila)), CAT (каталазу), TGFB1 (трансформирующий фактор роста, бета 1), ENO2 (енолазу 2 (гамма, нейрональную), ERBB4 (гомолог 4 онкогена v-erb-a вируса эритробластического лейкоза (птичий)), TRAPPC10 (комплекс 10 транспортного белка частиц), МАОВ (моноаминоксидазу В), NGF (фактор роста нервов (бета-полипептид)), ММР12 (матриксную металлопептидазу 12 (эластазу макрофагов)), JAG1 (белок Jagged 1 (синдром Алажиля)), CD40LG (лиганд CD40), PPARG (гамма-рецептор, активируемый пролифератором пероксисом), FGF2 (фактор 2 роста фибробластов (основный)), IL3 (интерлейкин 3 (колониестимулирующий фактор, множественный)), LRP1 (белок 1, родственный рецептору липопротеинов низкой плотности), NOTCH4 (гомолог Notch 4 (Drosophila)), MAPK8 (митоген-активируемую протеинкиназу 8), PREP (пролилэндопептидазу), NOTCH3 (гомолог Notch 3 (Drosophila)), PRNP (прионный белок), CTSG (катепсин G), EGF (эпидермальный фактор роста (бета-урогастрон)), REN (ренин), CD44 (молекулу CD44 (система групп крови Indian)), SELP (селектин Р (гранулярный мембранный белок на 140 кДа, антиген CD62)), GHR (рецептор гормона роста), ADCYAP1 (полипептид 1, активирующий аденилатциклазу (гипофиз)), INSR (инсулиновый рецептор), GFAP (глиальный фибриллярный кислый белок), ММР3 (матриксную металлопептидазу 3 (стромелизин 1, прожелатиназу)), MAPK10 (митоген-активируемую протеинкиназу 10), SP1 (транскрипционный фактор Sp1), MYC (гомолог онкогена v-myc вируса миелоцитоматоза (птичий)), CTSE (катепсин Е), PPARA (альфа-рецептор, активируемый пролифератором пероксисом), JUN (онкоген jun), TIMP1 (ингибитор 1 металлопептидазы TIMP), IL5 (интерлейкин 5 (колониестимулирующий фактор, эозинофилы)), IL1A (интерлейкин 1, альфа), ММР9 (матриксную металлопептидазу 9 (желатиназу В, желатиназу на 92 кДа, коллагеназу IV типа на 92 кДа)), HTR4 (5-гидрокситриптаминовый (серотониновый) рецептор 4), HSPG2 (гепарансульфат-протеогликан 2), KRAS (гомолог онкогена v-Ki-ras2 вируса саркомы Кирстена крысы), CYCS (цитохром с, соматические клетки), SMG1 (гомолог SMG1, киназу, родственную фосфатидилинозитол-3-киназе (С. elegans)), IL1R1 (рецептор интерлейкина 1, I типа), PROK1 (прокинетицин 1), MAPK3 (митоген-активируемую протеинкиназу 3), NTRK1 (нейротрофическую тирозинкиназу, рецепторную, тип 1), IL13 (интерлейкин 13), ММЕ (мембранную металлоэндопептидазу), ТКТ (транскетолазу), CXCR2 (рецептор 2 хемокина (мотив С-Х-С)), IGF1R (рецептор 1 инсулиноподобного фактора роста), RARA (рецептор ретиноевой кислоты, альфа), CREBBP (CREB-связывающий белок), PTGS1 (простагландинэндопероксидсинтазу 1 (простагландин-G/H-синтазу и циклооксигеназу)), GALT (галактозо-1-фосфатуридилтрансферазу), CHRM1 (холинергический рецептор, мускариновый 1), ATXN1 (атаксин 1), PAWR (PRKC, связанный с апоптозом, WT1, регулятор), NOTCH2 (гомолог Notch 2 (Drosophila)), M6PR (рецептор маннозо-6-фосфата (катион-зависимый)), CYP46A1 (цитохром Р450, семейство 46, подсемейство А, полипептид 1), CSNK1 D (казеинкиназу 1, дельта), MAPK14 (митоген-активируемую протеинкиназу 14), PRG2 (протеогликан 2, костный мозг (активатор натуральных клеток-киллеров, главный основный белок гранул эозинофилов)), PRKCA (протеинкиназу С, альфа), L1 САМ (молекулу клеточной адгезии L1), CD40 (молекулу CD40, представителя 5 суперсемейства рецепторов TNF), NR1I2 (ядерный рецептор, подсемейство 1, I группа, представитель 2), JAG2 (белок Jagged 2), CTNND1 (катенин (кадгерин-ассоциированный белок), дельта 1), CDH2 (кадгерин 2, тип 1, N-кадгерин (нейрональный)), СМА1 (химазу 1, тучная клетка), SORT1 (сортилин 1), DLK1 (гомолог Delta-подобного белка 1 (Drosophila)), ТНЕМ4 (представителя 4 суперсемейства тиоэстераз), JUP (плакоглобин адгезионных контактов), CD46 (молекулу CD46, регуляторный белок комплемента), CCL11 (хемокиновый лиганд 11 (мотив С-С)), CAV3 (кавеолин 3), RNASE3 (рибонуклеазу 3, семейство РНКазы А (катионный белок эозинофилов)), HSPA8 (белок 8 теплового шока на 70 кДа), CASP9 (каспазу 9, связанную с апоптозом цистеиновую пептидазу), CYP3A4 (цитохром Р450, семейство 3, подсемейство А, полипептид 4), CCR3 (рецептор 3 хемокина (мотив С-С)), TFAP2A (транскрипционный фактор АР-2 альфа (активирующий энхансер-связывающий белок 2 альфа)), SCP2 (стерол-переносящий белок 2), CDK4 (циклин-зависимую киназу 4), HIF1A (фактор 1, индуцируемый гипоксией, альфа-субъединицу (транскрипционный фактор с основным доменом типа спираль-петля-спираль)), TCF7L2 (белок 2, подобный транскрипционному фактору 7 (специфический по отношению к Т-клеткам, HMG-бокс)), IL1R2 (рецептор интерлейкина 1, II типа), B3GALTL (белок, подобный бета-1,3-галактозилтрансферазе), MDM2 (гомолог Mdm2 белка, связывающего р53 (мышь)), RELA (гомолог А онкогена v-rel вируса ретикулоэндотелиоза (птичий)), CASP7 (каспазу 7, связанную с апоптозом цистеиновую пептидазу), IDE (фермент, разрушающий инсулин), FABP4 (белок 4, связывающий жирные кислоты, адипоцитарный), CASK (кальций/кальмодулин-зависимую сериновую протеинкиназу (семейство MAGUK)), ADCYAP1R1 (рецептор I типа полипептида 1, активирующего аденилатциклазу (гипофиз)), ATF4 (активирующий транскрипционный фактор 4 (tax-чувствительный энхансерный элемент В67)), PDGFA (полипептидный тромбоцитарный фактор роста альфа), С21 или f33 (белок, кодируемый открытой рамкой считывания 33 хромосомы 21), SCG5 (секретогранин V (белок 7В2)), RNF123 (белок 123 с доменом ring), NFKB1 (ядерный фактор 1 энхансера гена полипептидной легкой каппа-цепи иммуноглобулина в В-клетках), ERBB2 (гомолог 2 онкогена v-erb-b2 вируса эритробластического лейкоза, гомолог онкогена, полученный из нейро/глиобластомы (птичий)), CAV1 (кавеолин 1, кавеолярный белок, 22 кДа), ММР7 (матриксную металлопептидазу 7 (матрилизин, маточный)), TGFA (трансформирующий фактор роста, альфа), RXRA (рецептор ретиноида X, альфа), STX1A (синтаксин 1А (головной мозг)), PSMC4 (26S субъединицу протеасомы (просомы, макропаина), АТФазу 4), P2RY2 (пуринергический рецептор P2Y, связанный с G-белком, 2), TNFRSF21 (суперсемейство рецепторов фактора некроза опухоли, представитель 21), DLG1 (гомолог 1 discs large (Drosophila)), NUMBL (белок, подобный гомологу numb (Drosophila)), SPN (сиалофорин), PLSCR1 (фосфолипидскрамблазу 1), UBQLN2 (убиквилин 2), UBQLN1 (убиквилин 1), PCSK7 (пропротеинконвертазу субтилизин/кексин типа 7), SPON1 (спондин 1, белок внеклеточного матрикса), SILV (гомолог silver (мышь)), QPCT (глутаминилпептидциклотрансферазу), HESS (белок 5 hairy and enhancer of split (Drosophila)), GCC1 (белок 1, содержащий GRIP и суперспиральный домены) и любую их комбинацию.
Генетически модифицированные животное или клетка могут содержать 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более хромосомных последовательностей с нарушенной структурой, кодирующих белок, ассоциированный с нарушением, связанным с активностью секретазы, и ноль, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более интегрированных в хромосомы последовательностей, кодирующих белок с нарушенной структурой, ассоциированный с нарушением, связанным с активностью секретазы.
Примеры белков, ассоциированных с боковым амиотрофическим склерозом, могут включать, например, SOD1 (супероксиддисмутазу 1), ALS2 (белок 2, ассоциированный с боковым амиотрофическим склерозом), FUS (белок слияния при саркоме), TARDBP (ДНК-связывающий белок TAR), VAGFA (фактор роста эндотелия сосудов A), VAGFB (фактор роста эндотелия сосудов В) и VAGFC (фактор роста эндотелия сосудов С) и любую их комбинацию.
Например, в публикации заявки на патент США №20110023144 описывается применение нуклеаз с "цинковыми пальцами" для генетической модификации клеток, животных и белков, ассоциированных с заболеванием боковым амиотрофическим склерозом (ALS). ALS характеризуется постепенной прогрессирующей дегенерацией определенных нервных клеток в коре головного мозга, стволе головного мозга и спинном мозге, связанных с произвольными движениями.
Что касается нарушения, связанного с двигательными нейронами, белки, ассоциированные с этими нарушениями, представляют собой разнородную группу белков, которые оказывают влияние на восприимчивость к развитию нарушения, связанного с двигательными нейронами, наличие нарушения, связанного с двигательными нейронами, тяжесть нарушения, связанного с двигательными нейронами, или любую их комбинацию. Настоящее раскрытие предусматривает редактирование любых хромосомных последовательностей, которые кодируют белки, ассоциированные с заболеванием ALS, специфическим нарушением, связанным с двигательными нейронами. Белки, ассоциированные с ALS, как правило, выбирают на основании экспериментально установленной ассоциации белков, связанных с ALS, с ALS. Например, скорость образования или концентрация в кровотоке белка, ассоциированного с ALS, может быть повышенной или пониженной в популяции с ALS по сравнению с популяцией без ALS. Различия в уровнях белка можно оценить при помощи протеомных методик, в том числе, без ограничения, вестерн-блот анализа, иммуногистохимического окрашивания, твердофазного иммуноферментного анализа (ELISA) и масс-спектрометрии. В альтернативном случае белки, ассоциированные с ALS, можно идентифицировать путем получения профилей экспрессии генов для генов, кодирующих белки, при помощи методик геномного анализа, в том числе, без ограничения, микроматричного анализа ДНК, серийного анализа экспрессии генов (SAGE) и количественной полимеразной цепной реакции в режиме реального времени (Q-PCR).
В качестве неограничивающего примера, белки, ассоциированные с ALS, включают, без ограничения, следующие белки: SOD1 - растворимую супероксиддисмутазу 1, ALS3 - белок 3, ассоциированный с боковым амиотрофическим склерозом, SETX - сенатаксин, ALS5 - белок 5, ассоциированный с боковым амиотрофическим склерозом, FUS - белок слияния при саркоме, ALS7 - белок 7, ассоциированный с боковым амиотрофическим склерозом, ALS2 - белок 2, ассоциированный с боковым амиотрофическим склерозом, DPP6 - дипептидилпептидазу 6, NEFH - тяжелый полипептид нейрофиламента, PTGS1 - простагландинэндопероксидсинтазу 1, SLC1A2 - семейство 1 переносчиков растворенных веществ (глутаматный транспортер глиальных клеток с высоким сродством), представитель 2, TNFRSF10B - фактор некроза опухоли, суперсемейство рецепторов, представитель 10b, PRPH - периферин, HSP90AA1 - белок теплового шока альфа на 90 кДа (цитозольный), класс А, представитель 1, GRIA2 - рецептор глутамата, ионотропный, AMPA 2, IFNG - интерферон, гамма, S100B - S100, кальций-связывающий белок В, FGF2 фактор 2 роста фибробластов, AOXI - альдегидоксидазу 1, CS - цитратсинтазу, TARDBP - ДНК-связывающий белок TAR, TXN - тиоредоксин, RAPH1 - Ras-ассоциированный белок 1 (RaIGDS/AF-6), содержащий домены плекстриновой гомологии, MAP3K5 - митоген-активируемую протеинкиназу 5, NBEAL1 - белок 1, подобный нейробичину, GPX1 - глутатионпероксидазу 1, ICA1L - белок, подобный аутоантигену островковых клеток на 1,69 кДа, RAC1 - Ras-родственный белок 1, являющийся субстратом ботулинического токсина С3, МАРТ - белок tau, ассоциированный с микротрубочками, ITPR2 - рецептор инозитол-1,4,5-трифосфата, тип 2, ALS2CR4 - кандидатный участок 4 хромосомы для белка 2, ассоциированного с боковым амиотрофическим склерозом (ювенильным), GLS - глутаминазу, ALS2CR8 - кандидатный участок 8 хромосомы для белка 2, связанного с амиотрофическим латеральным склерозом (ювенильным), CNTFR - рецептор для цилиарного нейротрофического фактора, ALS2CR11 - кандидатный участок 11 хромосомы для белка 2, ассоциированного с боковым амиотрофическим склерозом (ювенильным), FOLH1 - фолатгидролазу 1, FAM117B - семейство белков со сходством последовательности с белком 117, представитель В, Р4НВ - пролил-4-гидроксилазу, полипептид бета, CNTF - цилиарный нейротрофический фактор, SQSTM1 - секвестосому 1, STRADB - STE20-родственную киназу, бета-адаптерную, NAIP - семейство NLR, связанный с апоптозом ингибиторный белок, YWHAQ - белок-активатор тирозин-3-монооксигеназы/триптофан-5-монооксигеназы, полипептид тета, SLC33A1 - семейство 33 переносчиков растворенных веществ (ацетил-СоА-транспортеры), представитель 1, TRAK2 - транспортный белок, кинезин-связывающий 2, FIG 4 - гомолог FIG4, содержащий домен фосфатазы липидов SAC1, NIF3L1 - белок 1, подобный NGG1 - взаимодействующему фактору 3 NIF3, INA - интернексин, нейрональный промежуточный филаментный белок, альфа, PARD3B - гомолог В par-3 (белка 3 при дефектном разделении), СОХ8А - цитохром с-оксидазу, субъединицу VIIIA, CDK15 - циклин-зависимую киназу, HECW1 - убиквитинпротеинлигазу Е3, содержащую домены НЕСТ, С2 и WW, NOS1 - синтазу 1 оксида азота, МЕТ - протоонкоген met, SOD2 - митохондриальную супероксиддисмутазу 2, HSPB1 - белок 1 теплового шока на 27 кДа, NEFL - легкий полипептид нейрофиламента, CTSB - катепсин В, ANG - ангиогенин, рибонуклеазу, семейство РНКазы A, HSPA8 - белок теплового шока 8 на 70 кДа, VAPB - белки В и С, ассоциированные с VAMP (ассоциированным с везикулами мембранным белком), ESR1 - эстрогеновый рецептор 1, SNCA - синуклеин, альфа, HGF - фактор роста гепатоцитов, CAT - каталазу, АСТВ - актин, бета, NEFM - средний полипептид нейрофиламента, ТН - тирозингидроксилазу, BCL2 - белок 2, ассоциированный с В-клеточными CLL/лимфомой, FAS - Fas (суперсемейство рецепторов TNF, представитель 6), CASP3 - каспазу 3, связанную с апоптозом цистеиновую пептидазу, CLU - кластерин, SMN1 - фактор выживания мотонейронов 1, теломерный, G6PD - глюкозо-6-фосфатдегидрогеназу, ВАХ BCL2 - ассоциированный белок X, HSF1 - транскрипционный фактор 1 белков теплового шока, RNF19A - белок 19А с доменом ring, JUN - онкоген jun, ALS2CR12 - кандидатный участок 12 хромосомы для белка 2, ассоциированного с боковым амиотрофическим склерозом (ювенильным), HSPA5 - белок 5 теплового шока на 70 кДа, MAPK14 - митоген-активируемую протеинкиназу 14, IL10 - интерлейкин 10, АРЕХ1 - АРЕХ-нуклеазу 1 (полифункциональный фермент репарации ДНК), TXNRD1 - тиоредоксинредуктазу 1, NOS2 - индуцируемую синтазу 2 оксида азота, TIMP1 - TIMP-ингибитор 1 металлопептидаз, CASP9 - каспазу 9, связанную с апоптозом цистеиновую пептидазу, XIAP - Х-сцепленный ингибитор апоптоза, GLG1 - гликопротеин 1 комплекса Гольджи, ЕРО - эритропоэтин, VEGFA - фактор роста эндотелия сосудов A, ELN - эластин, GDNF - нейротрофический фактор, полученный из глиальных клеток, NFE2L2 - белок 2, подобный (эритроидному) ядерному фактору 2, SLC6A3 - представитель 3 семейства 6 переносчиков растворенных веществ (транспортер нейротрансмиттеров, дофаминовый), HSPA4 - белок 4 теплового шока на 70 кДа, АРОЕ - аполипопротеин Е, PSMB8 - субъединицу 8 бета-типа протеасомы (просомы, макропаина), DCTN1 - динактин 1, TIMP3 - TIMP-ингибитор 3 металлопептидаз, KIFAP3 - кинезин-ассоциированный белок 3, SLC1A1 - представитель 1 семейства 1 переносчиков растворенных веществ (глутаматный транспортер нейронов/эпителиальных клеток с высоким сродством, система Xag), SMN2 - фактор выживания мотонейронов 2, центромерный, CCNC - циклин С, МРР4 - пальмитоилированный мембранный белок 4, STUB1 - белок 1, гомологичный STIP1 и содержащий U-бокс, ALS2 - белок-предшественник бета-амилоида (А4), PRDX6 - пероксиредоксин 6, SYP - синаптофизин, CABIN1 - кальциневрин-связывающий белок 1, CASP1 - каспазу 1, связанную с апоптозом цистеиновую пептидазу, GART - фосфорибозилглицинамидформилтрансферазу, фосфорибозилглицинамидсинтетазу, фосфорибозиламиноимидазолсинтетазу, CDK5 - циклин-зависимую киназу 5, ATXN3 - атаксин 3, RTN4 - ретикулон 4, C1QB - компонент комплемента 1, субкомпонент q, цепь В, VEGFC - рецептор фактора роста нервов, НТТ - гентингтин, PARK7 - белок 7, ассоциированный с болезнью Паркинсона, XDH - ксантиндегидрогеназу, GFAP - глиальный фибриллярный кислый белок, МАР2 - белок 2, ассоциированный с микротрубочками, CYCS - цитохром с, соматические клетки, FCGR3B - Fc-фрагмент рецепторов IIIb для IgG с низким сродством, CCS - медь-содержащий шаперон супероксиддисмутазы, UBL5 - белок 5, подобный убиквитину, ММР9 - матриксную металлопептидазу 9, SLC18A3 - представитель 3 семейства 18 переносчиков растворенных веществ (везикулярный, ацетилхолиновый), TRPM7 - катионный канал транзиентного рецепторного потенциала, подсемейство М, представитель 7, HSPB2 - белок 2 теплового шока на 27 кДа, AKT1 - гомолог 1 онкогена v-akt вируса тимомы мышей, DERL1 - представитель 1 семейства белков с Der1-подобным доменом, CCL2 - хемокиновый лиганд 2 (мотив С--С), NGRN - неугрин, ассоциированный с ростом аксонов, GSR - глутатионредуктазу, ТРРР3 - представитель 3 семейства белков, способствующих полимеризации тубулина, APAF1 - фактор 1, активирующий апоптическую пептидазу, BTBD10 - белок 10, содержащий домен ВТВ (POZ), GLUD1 - глутаматдегидрогеназу 1, CXCR4 - рецептор 4 хемокина (мотив С--Х--С), SLC1A3 - представитель 3 семейства 1 переносчиков растворенных веществ (глутаматный транспортер глиальных клеток с высоким сродством), FLT1 - тирозинкиназу 1, родственную fms, PON1 - параоксоназу 1, AR - андрогенный рецептор, LIF - фактор, ингибирующий лейкоз, ERBB3 - гомолог 3 онкогена v-erb-b2 вируса эритробластического лейкоза, LGALS1 - лектин, галактозид-связывающий растворимый белок 1, CD44 - молекулу CD44, ТР53 - опухолевый белок р53, TLR3 - Toll-подобный рецептор 3, GRIA1 - глутаматный рецептор, ионотропный, AMPA 1, GAPDH - глицеральдегид-3-фосфатдегидрогеназу, GRIK1 - глутаматный ионотропный каинатный рецептор 1, DES - десмин, CHAT - холинацетилтрансферазу, FLT4 - тирозинкиназу 4, родственную fms, СНМР2В - белок 2В, модифицирующий хроматин, BAG1 - BCL2-ассоциированный атаноген, МТ3 - металлотионеин 3, CHRNA4 - холинергический рецептор, никотиновый, альфа 4, GSS - глутатионсинтетазу, BAK1 - BCL2-гомологичный антагонист/киллер 1, KDR - рецептор с киназным вставочным доменом (рецепторную тирозинкиназу III типа), GSTP1 - глутатион-S-трансферазу пи 1, OGG1 - 8-оксогуанин-ДНК-гликозилазу, IL6 - интерлейкин 6 (интерферон, бета 2).
Животное или клетка могут содержать 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более хромосомных последовательностей с нарушенной структурой, кодирующих белок, ассоциированный с ALS, и ноль, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более интегрированных в хромосомы последовательностей, кодирующих белок, ассоциированный с ALS. Предпочтительные белки, ассоциированные с ALS, включают SOD1 (супероксиддисмутазу 1), ALS2 (белок 2, ассоциированный с боковым амиотрофическим склерозом), FUS (белок слияния при саркоме), TARDBP (ДНК-связывающий белок TAR), VAGFA (фактор роста эндотелия сосудов A), VAGFB (фактор роста эндотелия сосудов В) и VAGFC (фактор роста эндотелия сосудов С) и любую их комбинацию.
Примеры белков, ассоциированных с прионными болезнями, могут включать SOD1 (супероксиддисмутазу 1), ALS2 (белок 2, ассоциированный с боковым амиотрофическим склерозом), FUS (белок слияния при саркоме), TARDBP (ДНК-связывающий белок TAR), VAGFA (фактор роста эндотелия сосудов A), VAGFB (фактор роста эндотелия сосудов В) и VAGFC (фактор роста эндотелия сосудов С) и любую их комбинацию.
Примеры белков, связанных с нейродегенеративными состояниями при прионных болезнях, могут включать, например, А2М (альфа-2-макроглобулин), AATF (транскрипционный фактор, противодействующий апоптозу), АСРР (простатоспецифическую кислую фосфатазу), АСТА2 (альфа-актин 2 гладкой мускулатуры аорты), ADAM22 (ADAM с металлопептидазным доменом), ADORA3 (аденозиновый рецептор А3-типа) или ADRA1D (альфа-1D-адренергический рецептор или альфа-1D-адренорецептор).
Примеры белков, ассоциированных с иммунодефицитом, могут включать, например, А2М [альфа-2-макроглобулин]; AANAT [арилалкиламин-N-ацетилтрансферазу]; АВСА1 [АТФ-связывающую кассету, подсемейство А (АВС1), представитель 1]; АВСА2 [АТФ-связывающую кассету, подсемейство А (АВС1), представитель 2] или ABCA3 [АТФ-связывающую кассету, подсемейство А (АВС1), представитель 3].
Примеры белков, ассоциированных с нарушениями, связанными с экспансией тринуклеотидных повторов, включают, например, AR (андрогенный рецептор), FMR1 (белок 1, ассоциированный с умственной отсталостью, сцепленной с ломкой X-хромосомой), НТТ (гентингтин) или DMPK (миотонинпротеинкиназу), FXN (фратаксин), ATXN2 (атаксин 2).
Примеры белков, ассоциированных с нарушениями передачи нервных импульсов, включают, например, SST (соматостатин), NOS1 (синтазу оксида азота 1 (нейрональную)), ADRA2A (адренергический альфа-2А-рецептор), ADRA2C (адренергический альфа-2С-рецептор), TACR1 (тахикининовый рецептор 1) или HTR2c (5-гидрокситриптаминовый (серотониновый) рецептор 2С).
Примеры последовательностей, ассоциированных с неврологическим развитием, включают, например, А2ВР1 [атаксин-2-связывающий белок 1], AADAT [аминоадипатаминотрансферазу], AANAT [арилалкиламин-N-ацетилтрансферазу], АВАТ [4-аминобутиратаминотрансферазу], АВСА1 [АТФ-связывающую кассету, подсемейство А (АВС1), представитель 1] или АВСА13 [АТФ-связывающую кассету, подсемейство А (АВС1), представитель 13].
Дополнительные примеры предпочтительных состояний, которые подлежат лечению с помощью данной системы, включают те, которые могут быть выбраны из синдрома Айкарди-Гутьерес; болезни Александера; синдрома Аллана-Херндона-Дадли; связанных с геном POLG нарушений; альфа-маннозидоза (II и III типа); синдрома Альстрема; синдрома Ангельмана; атаксии-телеангиэктазии; восковидных липофусцинозов нейронов; бета-талассемии; двусторонней атрофии зрительного нерва и (инфантильной) атрофии зрительного нерва 1 типа; ретинобластомы (двусторонней); болезни Канавана; церебро-окуло-фацио-скелетного синдрома 1 [COFS1]; церебротендинального ксантоматоза; синдрома Корнелии де Ланге; связанных с геном МАРТ нарушений; наследственных прионных болезней; синдрома Драве; семейной болезни Альцгеймера с ранним началом; атаксии Фридрейха [FRDA]; синдрома Фринса; фукозидоза; врожденной мышечной дистрофии Фукуямы; галактосиалидоза; болезни Гоше; органической ацидемии; гемофагоцитарного лимфогистиоцитоза; синдрома прогерии Хатчинсона-Гилфорда; муколипидоза II; инфантильной болезни накопления свободной сиаловой кислоты; ассоциированной с геном PLA2G6 нейродегенерации; синдрома Джервелла-Ланге-Нильсена; узелкового врожденного буллезного эпидермолиза; болезни Хантингтона; болезни Краббе (инфантильной); ассоциированного с митохондриальной ДНК синдрома Ли и NARP; синдрома Леша-Найхана; ассоциированной с геном LIS1 лиссэнцефалии; синдрома Лоу; болезни "кленового сиропа"; синдрома дупликации МЕСР2; связанных с геном АТР7А нарушений обмена меди; связанной с геном LAMA2 мышечной дистрофии; недостаточности арилсульфатазы А; мукополисахаридоза I, II или III типов; нарушений биогенеза пероксисом, спектра синдрома Цельвегера; нарушений по типу нейродегенерации с накоплением железа в головном мозге; недостаточности кислой сфингомиелиназы; болезни Ниманна-Пика типа С; глициновой энцефалопатии; связанных с геном ARX нарушений; нарушений орнитинового цикла; связанного с геном COL1A1/2 несовершенного остеогенеза; синдромов делеции митохондриальной ДНК; связанных с геном PLP1 нарушений; синдрома Перри; синдрома Фелана-МакДермида; болезни накопления гликогена II типа (болезни Помпе) (инфантильной); связанных с геном МАРТ нарушений; связанных с геном МЕСР2 нарушений; эпифизарной точечной хондродисплазии 1 типа костей верхних конечностей или бедренной кости; синдрома Робертса; болезни Сандхоффа; болезни Шиндлера - 1 типа; недостаточности аденозиндезаминазы; синдрома Смита-Лемли-Опица; спинальной мышечной атрофии; спинально-церебеллярной атаксии с возникновением в младенческом возрасте; недостаточности гексозаминидазы; танатофорной дисплазии 1 типа; связанных с геном коллагена VI типа нарушений; синдрома Ашера I типа; врожденной мышечной дистрофии; синдрома Вольфа-Хиршхорна; недостаточности лизосомной кислой липазы и пигментной ксеродермы.
Как будет понятно, предусматривается, что настоящую систему можно использовать для целенаправленного воздействия на любую представляющую интерес полинуклеотидную последовательность. Некоторые состояния или заболевания, которые можно эффективно лечить с использованием настоящей системы, включены в таблицы выше, и примеры известных на данный момент генов, ассоциированных с такими состояниями, также предоставлены в них. Тем не менее, гены, приведенные в качестве примеров, не являются исчерпывающими.
Например, "StCas9 дикого типа" относится к Cas9 дикого типа из S. thermophilus, при этом последовательность его белка представлена в базе данных SwissProt под номером доступа G3ECR1. Аналогично, Cas9 S. pyogenes включен в SwissProt под номером доступа Q99ZW2.
ПРИМЕРЫ
Следующие примеры приведены с целью иллюстрации различных вариантов осуществления настоящего изобретения и не предназначены для ограничения настоящего изобретения каким-либо образом. Данные примеры совместно со способами, описанными в данном документе, в настоящее время отражают предпочтительные варианты осуществления, являются иллюстративными и не предназначены для ограничения объема настоящего изобретения. Изменения в данном документе и другие применения, которые охватываются сущностью настоящего изобретения, как определено объемом формулы изобретения, будут очевидны специалистам в данной области.
Пример 1. Активность комплекса CRISPR в ядре эукариотической клетки
Примером системы CRISPR типа II является локус CRISPR типа II из Streptococcus pyogenes SF370, который содержит кластер из 4 генов Cas9, Cas1, Cas2 и Csn1, а также два некодирующих элемента РНК, tracrRNA и характерный массив повторяющихся последовательностей (прямых повторов), чередующихся с короткими фрагментами неповторяющихся последовательностей (спейсерами, приблизительно 30 п.о. каждый). В данной системе целенаправленный двухнитевой разрыв (DSB) ДНК образуется в ходе четырех последовательных стадий (фиг. 2А). Во-первых, две некодирующих РНК, массив pre-crRNA и tracrRNA, транскрибируются с локуса CRISPR. Во-вторых, tracrRNA гибридизируется с прямыми повторами pre-crRNA, которая затем процессируется в зрелые crRNA, содержащие отдельные спейсерные последовательности. В-третьих, комплекс зрелая crRNA:tracrRNA направляет Cas9 к ДНК-мишени, состоящей из протоспейсера и соответствующего РАМ, посредством образования гетеродуплекса между спейсерным участком crRNA и протоспейсерной ДНК. И наконец, Cas9 опосредует расщепление целевой ДНК выше РАМ с образованием DSB внутри протоспейсера (фиг. 2А). В этом примере описывается иллюстративный способ адаптирования данной РНК-программируемой нуклеазной системы к управлению активностью комплекса CRISPR в ядрах эукариотических клеток. Культура клеток и трансфекции
Линию клеток почки человеческого эмбриона (НЕК), НЕК 293FT (Life Technologies), поддерживали в среде Игла в модификации Дульбекко (DMEM), дополненной 10% фетальной бычьей сыворотки (HyClone), 2 мМ GlutaMAX (Life Technologies), 100 ед./мл пенициллина и 100 мкг/мл стрептомицина, при 37°С с инкубированием при 5% СО2. Линию мышиных клеток neuro2A (N2A) (АТСС) поддерживали в DMEM, дополненной 5% фетальной бычьей сыворотки (HyClone), 2 мМ GlutaMAX (Life Technologies), 100 ед./мл пенициллина и 100 мкг/мл стрептомицина, при 37°С с 5% CO2.
Клетки НЕК 293FT или N2A высевали в 24-луночные планшеты (Corning) за один день до трансфекции с плотностью 200000 клеток на лунку. Клетки трансфицировали с применением Lipofectamine 2000 (Life Technologies), следуя рекомендованному производителем протоколу. Для каждой лунки 24-луночного планшета использовали в общей сложности 800 нг плазмид.
Анализ с помощью Surveyor и секвенирующий анализ на предмет наличия модификации генома
Клетки НЕК 293FT или N2A трансфицировали плазмидной ДНК, как описано выше. После трансфекции клетки инкубировали при 37°С в течение 72 часов перед экстракцией геномной ДНК. Геномную ДНК экстрагировали с помощью набора для экстракции ДНК QuickExtract (Epicentre), следуя протоколу производителя. Вкратце, клетки ресуспендировали в растворе QuickExtract и инкубировали при 65°С в течение 15 минут и при 98°С в течение 10 минут. Экстрагированную геномную ДНК подвергали немедленной обработке или хранили при -20°С.
Участок генома, ограничивающий целевой сайт CRISPR, для каждого гена подвергали ПЦР-амплификации и продукты очищали с использованием центрифужной колонки QiaQuick (Qiagen), следуя протоколу производителя. В общей сложности 400 нг очищенных продуктов ПЦР смешивали с 2 мкл 10Х ПЦР-буфера для Taq-полимеразы (Enzymatics) и водой сверхвысокой очистки до конечного объема 20 мкл и подвергали процессу повторного отжига для обеспечения образования гетеродуплекса: 95°С в течение 10 мин., линейное снижение температуры с 95°С до 85°С со скоростью 2°С/с, с 85°С до 25°С со скоростью 0,25°С/с и с выдерживанием при 25°С в течение 1 минуты. После повторного отжига продукты обрабатывали нуклеазой Surveyor и усилителем S Surveyor (Transgenomics), следуя рекомендованному производителем протоколу, и анализировали в 4-20% полиакриламидных гелях Novex ТВЕ (Life Technologies). Гели окрашивали красителем ДНК SYBR Gold (Life Technologies) в течение 30 минут и визуализировали с помощью системы для визуализации геля Gel Doc (Bio-rad). Количественная оценка основывалась на относительных значениях интенсивности полос в качестве меры доли расщепленной ДНК. На фиг. 7 представлена схематическая иллюстрация данного анализа с помощью Surveyor.
Анализ полиморфизма длин рестрикционных фрагментов для обнаружения гомологичной рекомбинации.
Клетки HEK 293FT и N2A трансфицировали плазмидной ДНК и инкубировали при 37°С в течение 72 часов перед экстракцией геномной ДНК, как описано выше. Целевой участок генома подвергали ПЦР-амплификации с использованием праймеров за пределами гомологичных плечей матрицы для гомологичной рекомбинации (HR). Продукты ПЦР разделяли в 1% агарозном геле и экстрагировали с помощью набора для экстракции из геля MinElute (Qiagen). Очищенные продукты расщепляли с помощью HindIII (Fermentas) и анализировали в 6% полиакриламидном геле Novex ТВЕ (Life Technologies).
Предсказание и анализ вторичной структуры РНК
Предсказание вторичной структуры РНК осуществляли с использованием доступного в режиме онлайн веб-сервера RNAfold, разработанного в Институте теоретической химии при Венском университете, с использованием алгоритма предсказания структуры на основе центроидного метода (смотри, например, A.R. Gruber et al., 2008, Cell 106(1): 23-24; и PA Carr and GM Church, 2009, Nature Biotechnology 27(12): 1151-62).
Очистка РНК
Поддерживали рост клеток HEK 293FT и трансфицировали, как указано выше. Клетки собирали путем трипсинизации с последующим промыванием в фосфатно-солевом буферном растворе (PBS). Общую клеточную РНК экстрагировали с помощью реагента TRI (Sigma), следуя протоколу производителя. Общую экстрагированную РНК анализировали количественно с использованием Nanodrop (Thermo Scientific) и приводили к одинаковой концентрации.
Анализ экспрессии crRNA и tracrRNA в клетках млекопитающих с помощью нозерн-блоттинга
РНК смешивали с равными объемами 2Х буфера для нанесения (Ambion), нагревали до 95°С в течение 5 мин., охлаждали на льду в течение 1 мин., а затем вносили в 8% денатурирующие полиакриламидные гели (SequaGel, National Diagnostics) после предварительного прогона геля в течение по меньшей мере 30 минут. Образцы подвергали электрофорезу в течение 1,5 часа при предельной мощности 40 Вт. После этого РНК переносили на мембрану Hybond N+ (GE Healthcare) при 300 мА в устройстве для полусухого переноса (Bio-rad) при комнатной температуре на 1,5 часа. РНК сшивали с мембраной с использованием кнопки "автоматического сшивания" на приборе для автоматического УФ-сшивания Stratagene Stratalinker (Stratagene). Мембрану подвергали предварительной гибридизации в буфере для гибридизации ULTRAhyb-Oligo (Ambion) в течение 30 мин. с вращением при 42°С, а затем добавляли зонды и проводили гибридизацию в течение ночи. Зонды заказывали у IDT и метили при помощи [гамма-32Р] ATP (Perkin Elmer) с использованием полинуклеотидкиназы Т4 (New England Biolabs). Мембрану промывали один раз предварительно подогретым (42°С) 2xSSC, 0,5% SDS в течение 1 мин. с последующими двумя промываниями по 30 минут при 42°С. Мембрану экспонировали на люминесцентном экране в течение одного часа или в течение ночи при комнатной температуре, а затем сканировали с использованием устройства для формирования изображения на люминесцентном фосфорном покрытии (Typhoon).
Конструирование и оценка бактериальной системы CRISPR
Элементы локуса CRISPR, в том числе tracrRNA, Cas9 и лидерную последовательность, подвергали ПЦР-амплификации из геномной ДНК Streptococcus pyogenes SF370 с фланкирующими гомологичными плечами для сборки по Методу Гибсона. Два сайта BsaI типа IIS вводили между двумя прямыми повторами для облегчения простой вставки спейсеров (фиг. 8). Продукты ПЦР клонировали в расщепленный с помощью EcoRV pACYC184 ниже промотора tet с использованием мастер-микса для сборки по методу Гибсона (NEB). Другие эндогенные элементы системы CRISPR пропускали, за исключением последних 50 п.о. Csn2. Олигонуклеотиды (Integrated DNA Technology), кодирующие спейсеры с комплементарными липкими концами, клонировали в расщепленный с помощью Bsal вектор pDC000 (NEB), а затем лигировали с использованием лигазы Т7 (Enzymatics) с получением плазмид pCRISPR. Контрольные плазмиды, содержащие спейсеры с экспрессией РАМ в клетках млекопитающих (экспрессионные конструкции, проиллюстрированные на фиг. 6А, с функциональностью, которая определена по результатам анализа с помощью Surveyor, показанным на фиг. 6В). Сайты инициации транскрипции обозначены как +1, а также указаны терминатор транскрипции и последовательность, анализированная с помощью нозерн-блоттинга. Экспрессию процессированной tracrRNA также подтверждали с помощью нозерн-блоттинга. На фиг. 6С показаны результаты анализа с помощью нозерн-блоттинга общей РНК, экстрагированной из клеток 293FT, трансфицированных экспрессионными конструкциями U6, несущими длинную или короткую tracrRNA, а также SpCas9 и DR-EMX1(1)-DR. Результаты на левой и правой панели получены с клетками 293FT, трансфицированными без SpRNase III или с таковой, соответственно. U6 являются показателем для контроля загрузки при блоттинге с snRNA-зондом, нацеленным на U6 человека. Трансфекция экспрессирующей конструкции с короткой tracrRNA приводила к высоким уровням процессированной формы tracrRNA (~75 п.о.). Очень низкие количества длинных tracrRNA выявляли при нозерн-блоттинге.
Для того, чтобы способствовать точной инициации транскрипции, промотор U6, зависимый от РНК-полимеразы III, выбирали для управления экспрессией tracrRNA (фиг. 2С). Подобным образом, конструкцию на основе промотора U6 разработали для экспрессии массива pre-crRNA, состоящего из одного спейсера, фланкированного двумя прямыми повторами (DR, также включены в термин "парные tracr-последовательности"; фиг. 2С). Исходный спейсер был сконструирован для нацеливания на целевой сайт размером 33 пары оснований (п.о.) (протоспейсер из 30 п.о., а также последовательность мотива CRISPR (РАМ) из 3 п.о., соответствующую мотиву узнавания NGG у Cas9) в локусе ЕМХ1 человека (фигура 2С), ключевом гене в развитии коры головного мозга.
Клетки HEK 293FT трансфицировали комбинациями компонентов CRISPR для тестирования того, возможно ли при гетерологичной экспрессии системы CRISPR (SpCas9, SpRNase III, tracrRNA и pre-crRNA) в клетках млекопитающих достичь целенаправленного расщепления хромосом млекопитающего. Поскольку DSB в ядрах млекопитающих подвергаются частичной репарации с помощью пути негомологичного соединения концов (NHEJ), который приводит к образованию вставок/делеций, анализ с помощью Surveyor использовали для выявления возможной активности в отношении расщепления в целевом локусе ЕМХ1 (фиг. 7) (смотри, например, Guschin et al., 2010, Methods Mol Biol 649: 247). Совместная трансфекция всех четырех компонентов CRISPR была способна, индуцировать расщепление в протоспейсере на уровне до 5,0% (смотри фиг. 2D). Совместная трансфекция всех компонентов CRISPR, за исключением SpRNase III, также индуцировала образование вставок/делеций в протоспейсере на уровне до 4,7%, что указывало на то, что могут существовать эндогенные РНКазы млекопитающих, которые способны помогать созреванию crRNA, такие как, например, родственные ферменты Dicer и Drosha. Удаление любого из трех остальных компонентов устраняло активность системы CRISPR в отношении расщепления генома (фиг. 2D). Секвенирование по Сэнгеру ампликонов, содержащих целевой локус, подтверждало активность в отношении расщепления: на 43 секвенированных клонах было обнаружено 5 мутантных аллелей (11,6%). В подобных экспериментах с использованием ряда направляющих последовательностей процентные значения частоты вставок/делеций составляют вплоть до 29% (смотри фиг. 3-6, 10 и 11). Эти результаты определяют трехкомпонентную систему для эффективной опосредованной CRISPR модификации генома в клетках млекопитающих. Для оптимизации эффективности расщепления заявители также тестировали, влияют ли различные изоформы tracrRNA на эффективность расщепления, и обнаружили, что в этой иллюстративной системе только короткая (89 п.о.) форма транскрипта была способна опосредовать расщепление локуса генома ЕМХ1 человека (фиг. 6В).
На фиг. 12 представлен дополнительный анализ процессинга crRNA в клетках млекопитающих с помощью нозерн-блоттинга. На фиг. 12А проиллюстрировано схематическое изображение вектора экспрессии для одного спейсера, фланкированного двумя прямыми повторами (DR-EMX1(1)-DR). Спейсер из 30 п.о., осуществляющий нацеливание на протоспейсер 1 локуса ЕМХ1 человека (смотри фиг. 6), и последовательности прямых повторов показаны в последовательности внизу фиг. 12А. Линия указывает на участок, обратно комплементарную последовательность для которого использовали для создания зондов для нозерн-блоттинга для выявления crRNA ЕМХ1(1). На фиг. 12В показаны результаты анализа с помощью нозерн-блоттинга общей РНК, экстрагированной из клеток 293FT, которые трансфицировали экспрессионными конструкциями U6, несущими DR-EMX1(1)-DR. Результаты на левой и правой панели получены с клетками 293FT, трансфицированными без SpRNase III или с таковой, соответственно. DR-EMX1(1)-DR подвергался процессингу в зрелые crRNA только в присутствии SpCas9 и короткой tracrRNA и не зависел от присутствия SpRNase III. Зрелая crRNA, обнаруженная в общей РНК трансфицированных 293FT, имела длину ~33 п.о. и была короче, чем зрелая crRNA из S. pyogenes длиной 39-42 п.о. Эти результаты демонстрируют, что систему CRISPR можно переместить в эукариотические клетки и перепрограммировать для облегчения расщепления эндогенных целевых полинуклеотидов млекопитающих.
На фиг. 2 показана бактериальная система CRISPR, описанная в этом примере. На фиг. 2А проиллюстрировано схематическое изображение локуса 1 CRISPR из Streptococcus pyogenes SF370 и предполагаемый механизм опосредованного CRISPR расщепления ДНК с помощью этой системы. Зрелая crRNA, подвергшаяся процессингу из массива прямых повторов-спейсеров, направляет Cas9 к мишеням в геноме, состоящим из комплементарных протоспейсеров и мотива, прилегающего к протоспейсеру (РАМ). При спаривании оснований мишень-спейсер Cas9 опосредует двухнитевой разрыв в целевой ДНК. На фиг. 2В проиллюстрировано конструирование Cas9 (SpCas9) S. pyogenes и РНКазы III (SpRNase III) с сигналами ядерной локализации (NLS) для обеспечения возможности импорта в ядро млекопитающих. На фиг. 2С проиллюстрирована экспрессия SpCas9 и SpRNase III у млекопитающих, управляемая конститутивным промотором EF1a, и массива tracrRNA и pre-crRNA (DR-спейсер-DR), управляемая промотором U6 для РНК-полимеразы 3 для стимуляции точной инициации и терминации транскрипции. Протоспейсер из локуса ЕМХ1 человека с удовлетворительной последовательностью РАМ использовали в качестве спейсера в массиве pre-crRNA. На фиг. 2D проиллюстрирован анализ с помощью нуклеазы Surveyor в отношении опосредованных SpCas9 минорных вставок и делеций. SpCas9 экспрессировался с SpRNase III, tracrRNA и массивом pre-crRNA, несущим целевой спейсер для ЕМХ1, и без таковых. На фиг. 2Е проиллюстрировано схематическое изображение спаривания оснований между целевым локусом и осуществляющей нацеливание на ЕМХ1 crRNA, а также иллюстративная хроматограмма, показывающая микроделецию, расположенную смежно с сайтом расщепления SpCas9. На фиг. 2F проиллюстрированы мутантные аллели, идентифицированные в результате секвенирующего анализа 43 клональных ампликонов, показывающие разнообразие микровставок и микроделеций. Черточками указаны удаленные основания, а невыровненные или несовпадающие основания указывают на вставки или мутации. Масштабная метка = 10 мкм.
Для дальнейшего упрощения трехкомпонентной системы приспосабливали гибридную конструкцию химерная crRNA-tracrRNA, в которой зрелая crRNA (содержащая направляющую последовательность) может быть слита с частичной tracrRNA через структуру по типу стебель-петля для имитации естественного дуплекса crRNA:tracrRNA. Для повышения эффективности совместной доставки создавали бицистронный вектор экспрессии для управления совместной экспрессией химерной РНК и SpCas9 в трансфицированных клетках. Параллельно, бицистронные векторы использовали для экспрессии pre-crRNA (DR-направляющая последовательность-DR) с SpCas9, чтобы индуцировать процессинг в crRNA с участием отдельно экспрессируемой tracrRNA (сравнение на фиг. 11В: верхняя часть и нижняя часть). На фиг. 8 представлены схематические иллюстрации бицистронных векторов экспрессии для массива pre-crRNA (фиг. 8А) или химерных crRNA (представлена короткой линией ниже сайта встраивания направляющей последовательности и выше промотора EF1α на фиг. 8В) с hSpCas9, показывающие положение различных элементов и точки встраивания направляющей последовательности. В расширенной последовательности возле положения сайта встраивания направляющей последовательности на фиг. 8В также показана частичная последовательность DR (GTTTTAGAGCTA) (SEQ ID NO: 11) и частичная последовательность tracrRNA 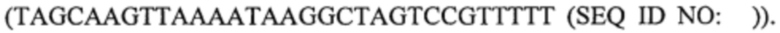 Направляющие последовательности можно встроить между сайтами BbsI с использованием отожженных олигонуклеотидов. Конструкции последовательностей для олигонуклеотидов показаны ниже схематических иллюстраций на фиг. 8 с указанными подходящими адаптерами лигирования. WPRE представляет собой посттранскрипционный регуляторный элемент вируса гепатита сурков. Эффективность опосредованного химерной РНК расщепления тестировали путем целенаправленного воздействия на тот же локус ЕМХ1, описанный выше. С использованием как анализа с помощью Surveyor, так и секвенирования ампликонов по Сэнгеру заявители подтвердили, что химерная конструкция РНК облегчает расщепление локуса ЕМХ1 человека со степенью модификации примерно 4,7% (фиг. 3).
Направляющие последовательности можно встроить между сайтами BbsI с использованием отожженных олигонуклеотидов. Конструкции последовательностей для олигонуклеотидов показаны ниже схематических иллюстраций на фиг. 8 с указанными подходящими адаптерами лигирования. WPRE представляет собой посттранскрипционный регуляторный элемент вируса гепатита сурков. Эффективность опосредованного химерной РНК расщепления тестировали путем целенаправленного воздействия на тот же локус ЕМХ1, описанный выше. С использованием как анализа с помощью Surveyor, так и секвенирования ампликонов по Сэнгеру заявители подтвердили, что химерная конструкция РНК облегчает расщепление локуса ЕМХ1 человека со степенью модификации примерно 4,7% (фиг. 3).
Генерализуемость опосредованного CPISPR расщепления в эукариотических клетках тестировали путем целенаправленного воздействия на дополнительные локусы генома как в клетках человека, так и мыши путем разработки химерных РНК, осуществляющих нацеливание на множество сайтов в ЕМХ1 и PVALB человека, а также на локусы Th мыши. На фиг. 13 проиллюстрирован выбор некоторых дополнительных целевых протоспейсеров в локусах PVALB человека (фиг. 13А) и Th мыши (фиг. 13В). Приведены схематические изображения локусов генов и положения трех протоспейсеров в последнем экзоне каждого из них. Подчеркнутые последовательности включают последовательность протоспейсера из 30 п. о. и 3 п. о. на 3'-конце, соответствующую последовательностям РАМ. Протоспейсеры на смысловой и антисмысловой нитях указаны выше и ниже последовательностей ДНК, соответственно. Степени модификации 6,3% и 0,75% достигали для локусов PVALB человека и Th мыши, соответственно, что демонстрировало широкую применимость системы CRISPR при модификации различных локусов у нескольких организмов (фигура 5). Хотя при использовании химерных конструкций расщепление выявлялось только с одним из трех спейсеров для каждого локуса, все целевые последовательности расщеплялись с эффективностью получения вставок/делеций, достигающей 27% при использовании схемы с совместно экспрессируемой pre-crRNA (фиг. 6 и 13).
На фиг. 11 представлена дополнительная иллюстрация того, что SpCas9 можно перепрограммировать для целенаправленного воздействия на несколько локусов генома в клетках млекопитающих. На фиг. 11А представлено схематическое изображение локуса ЕМХ1 человека, показывающее положение пяти протоспейсеров, указанных подчеркнутыми последовательностями. На фиг. 11В представлено схематическое изображение комплекса pre-crRNA/trcrRNA, показывающее гибридизацию между участком прямого повтора в pre-crRNA и tracrRNA (вверху), и схематическое изображение химерной конструкции РНК, содержащей направляющую последовательность из 20 п. о., и парную tracr-последовательность, и tracr-последовательность, состоящие из неполного прямого повтора и последовательностей tracrRNA, гибридизированных в шпилечную структуру (внизу). Результаты анализа с помощью a Surveyor со сравнением эффективности опосредованного Cas9 расщепления в пяти протоспейсерах в локусе ЕМХ1 человека проиллюстрированы на фиг. 11С. Целенаправленное воздействие на каждый протоспейсер осуществляли либо с использованием подвергнутого процессингу комплекса pre-crRNA/tracrRNA (crRNA), либо с использованием химерной РНК (chiRNA).
Поскольку вторичная структура РНК может быть важной для межмолекулярных взаимодействий, алгоритм предсказания структуры на основе минимальной свободной энергии и ансамбля взвешенных структур по Больцману использовали для сравнения предполагаемой вторичной структуры всех направляющих последовательностей, используемых в эксперименте с целенаправленным воздействием на геном (смотри, например, Gruber et al., 2008, Nucleic Acids Research, 36: W70). Анализ выявил, что в большинстве случаев эффективные направляющие последовательности в контексте химерной crRNA, по сути, не содержали мотивов вторичной структуры, тогда как неэффективные направляющие последовательности с большей вероятностью образовывали внутренние вторичные структуры, которые могут, препятствовать спариванию оснований с ДНК целевого протоспейсера. Следовательно, возможно, что вариабельность во вторичной структуре спейсера может оказывать воздействие на эффективность опосредованной CRISPR интерференции при использовании химерной crRNA.
Дополнительные конструкции векторов для SpCas9 показаны на фиг. 22, на которой показаны отдельные векторы экспрессии, включающие промотор U6, соединенный с сайтом встраивания для направляющего олигонуклеотида, и промотор Cbh, соединенный с кодирующей последовательностью SpCas9. Вектор, показанный на фиг. 22b, включает кодирующую последовательность tracrRNA, соединенную с промотором H1.
При анализе у бактерий все спейсеры способствовали эффективной CRISPR-интерференции (фиг. 3С). Эти результаты указывают на то, что могут существовать дополнительные факторы, влияющие на эффективность активности CRISPR в клетках млекопитающих.
Для исследования специфичности опосредованного CRISPR расщепления эффект однонуклеотидных мутаций в направляющей последовательности в отношении расщепления протоспейсера в геноме млекопитающих анализировали с использованием ряда осуществляющих нацеливание на ЕМХ1 химерных crRNA с одиночными точечными мутациями (фиг. 3А). На фиг. 3В проиллюстрированы результаты анализа с помощью нуклеазы Surveyor со сравнением эффективности расщепления Cas9 при спаривании с различными мутантными химерными РНК. Несовпадение одного основания в участке вплоть до 12 и.о. в 5'-направлении от РАМ, по сути, прекращало расщепление генома SpCas9, тогда как спейсеры с мутациями в более отдаленных положениях в 5'-направлении сохраняли активность в отношении исходного протоспейсера-мишени (фигура 3В). В дополнение к РАМ, SpCas9 характеризуется специфичностью в отношении одного основания в последних 12 п.о. спейсера. Кроме того, CRISPR способен опосредовать расщепление генома столь же эффективно, как и пара нуклеаз TALE (TALEN), целенаправленно воздействующих на тот же протоспейсер ЕМХ1. На фиг. 3С представлено схематическое изображение, показывающее конструкцию TALEN, целенаправленно воздействующих на ЕМХ1, и на фигуре 3D показано изображение геля, по которому сравнивают эффективность TALEN и Cas9 (n=3), после анализа с помощью Surveyor.
После разработки набора компонентов для достижения опосредованного CRISPR редактирования генов в клетках млекопитающих посредством склонного к ошибкам механизма NHEJ, исследовали способность CRISPR к стимуляции гомологичной рекомбинации (HR), высокоточный путь репарации генов для создания точных редакционных изменений в геноме. SpCas9 дикого типа способен опосредовать сайт-специфические DSB, которые могут репарироваться как с помощью NHEJ, так и HR. Кроме того, замену аспартата на аланин (D10A) в каталитическом домене RuvC I в SpCas9 производили посредством методик генной инженерии для превращения нуклеазы в никазу (SpCas9n; проиллюстрировано на фигуре 4А) (смотри, например, Sapranauskas et al., 2011, Nucleic Acids Resch, 39: 9275; Gasiunas et al., 2012, Proc. Natl. Acad. Sci. USA, 109:E2579) так, чтобы геномная ДНК с однонитевым разрывом подвергалась высокоточной репарации с участием гомологичной рекомбинации (HDR). Анализ с помощью Surveyor подтвердил, что SpCas9n не образует вставок/делеций в протоспейсере-мишени ЕМХ1. Как иллюстрируется на фиг. 4В, совместная экспрессия осуществляющей нацеливание на ЕМХ1 химерной crRNA с SpCas9 дает вставки/делеции в целевом сайте, тогда как совместная экспрессия с SpCas9n - нет (n=3). Более того, секвенирование 327 ампликонов не обнаружило каких-либо вставок/делеций, индуцированных SpCas9n. Тот же локус выбирали для тестирования опосредованной CRISPR HR при совместной трансфекции клеток HEK 293FT химерной РНК, целенаправленно воздействующей на ЕМХ1, hSpCas9 или hSpCas9n, а также матрицей для HR для введения пары сайтов рестрикции (для HindIII и NheI) возле протоспейсера. На фиг. 4С приведена схематическая иллюстрация стратегии HR с относительными положениями точек рекомбинации и последовательностей для отжига праймеров (стрелки). SpCas9 и SpCas9n действительно катализировали интеграцию матрицы для HR в локус ЕМХ1. ПЦР-амплификация целевого участка с последующим рестрикционным расщеплением HindIII выявила продукты расщепления, соответствующие ожидаемым размерам фрагментов (стрелки указывают на результаты анализа полиморфизма длин рестрикционных фрагментов с помощью гель-электрофореза, показанные на фиг. 4D), причем SpCas9 и SpCas9n опосредуют сходные уровни эффективности HR. Заявители дополнительно подтверждали HR с использованием секвенирования геномных ампликонов по Сэнгеру (фиг. 4Е). Эти результаты демонстрировали пригодность CRISPR для облегчения целенаправленной вставки генов в геном млекопитающего. С учетом специфичности целенаправленного воздействия в 14 п.о. (12 п.о. от спейсера и 2 п.о. от РАМ) SpCas9 дикого типа, доступность никазы может значительно снизить вероятность нецелевых модификаций, поскольку одноцепочечные разрывы не являются субстратами для склонного к ошибкам пути NHEJ.
Экспрессионные конструкции, имитирующие естественную архитектуру локусов CRISPR с собранными в массив спейсерами (фиг. 2А), создавали для исследования возможности мультиплексного целенаправленного воздействия на последовательности. При использовании одного массива CRISPR, кодирующего пару спейсеров, осуществляющих нацеливание на ЕМХ1 и PVALB, выявляли эффективное расщепление в обоих локусах (фиг. 4F, на которой показаны как схематическая конструкция массива crRNA, так и блот, полученный после анализа расщепления с помощью Surveyor, показывающий эффективное опосредование расщепления). Также тестировали целенаправленную делецию геномных участков большего размера посредством одновременных DSB с использованием спейсеров против двух мишеней в ЕМХ1, разделенных 119 п.о., и выявили эффективность делеции 1,6% (3 из 182 ампликонов; фиг. 4G). Это демонстрирует, что система CRISPR может опосредовать мультиплексное редактирование в пределах одного генома.
Пример 2. Модификации и альтернативы системы CRISPR
Возможность применения РНК для программирования специфичного к последовательности расщепления ДНК определяет новый класс инструментов для конструирования генома для разнообразных исследовательских и промышленных применений. Несколько аспектов системы CRISPR можно дополнительно улучшить для повышения эффективности и универсальности целенаправленного воздействия с помощью CRISPR. Оптимальная активность Cas9 может зависеть от доступности несвязанного Mg2+ на уровнях, которые превышают имеющиеся в ядре млекопитающего (смотри, например, Jinek et al., 2012, Science, 337:816), и предпочтение в отношении мотива NGG непосредственно ниже протоспейсера ограничивает способность к целенаправленному воздействию в среднем на каждые 12 п.о. в геноме человека (фиг. 9, оценка как плюс-, так и минус-нитей в хромосомных последовательностях человека). Некоторые из этих затруднений можно преодолеть путем изучения разнообразия локусов CRISPR в микробном метагеноме (смотри, например, Makarova et al., 2011, Nat Rev Microbiol, 9:467). Другие локусы CRISPR можно переместить в микроокружение клетки млекопитающего с помощью способа, подобного описанному в примере 1. Например, на фиг. 10 иллюстрируется адаптация системы CRISPR II типа из CRISPR 1 Streptococcus thermophilus LMD-9 для гетерологичной экспрессии в клетках млекопитающих, чтобы достичь опосредованного CRISPR редактирования генома. На фиг. 10А приведена схематическая иллюстрация CRISPR 1 из S. thermophilus LMD-9. На фиг. 10В показана структура системы экспрессии для системы CRISPR S. thermophilus. Кодон-оптимизированный hStCas9 человека экспрессируется с помощью конститутивного промотора EF1α. Зрелые варианты tracrRNA и crRNA экспрессируются с помощью промотора U6 для стимуляции точной инициации транскрипции. Показаны последовательности из зрелых crRNA и tracrRNA. Одно основание, обозначенное буквой "а" в нижнем регистре в последовательности crRNA, использовали для удаления последовательности поли-U, которая служит в качестве терминатора транскрипции для РНК-полимеразы III. На фиг. 10С приведено схематическое изображение направляющих последовательностей, осуществляющих нацеливание на локус ЕМХ1 человека. На фиг. 10D показаны результаты опосредованного hStCas9 расщепления в целевом локусе с использованием анализа с помощью Surveyor. РНК направляющих спейсеров 1 и 2 индуцировали 14% и 6,4%, соответственно. Статистический анализ активности в отношении расщепления по биологическим копиям в этих двух протоспейсерных сайтах также приведен на фиг. 5. На фиг. 14 приведено схематическое изображение последовательностей дополнительных протоспейсеров и соответствующих РАМ, являющихся мишенями для системы CRISPR S. thermophilus, в локусе ЕМХ1 человека. Последовательности двух протоспейсеров выделены, и их соответствующие последовательности РАМ, соответствующие мотиву NNAGAAW, обозначены путем подчеркивания в направлении 3' относительно соответствующей выделенной последовательности. Оба протоспейсера нацелены на антисмысловую нить.
Пример 3. Алгоритм выбора образцов целевой последовательности
Создали компьютерную программу для идентификации кандидатных целевых последовательностей CRISPR на обеих нитях вводимой последовательности ДНК на основе длины желаемой направляющей последовательности и мотива последовательности CRISPR (РАМ) для определенного фермента CRISPR. Например, целевые сайты для Cas9 из S. pyogenes с последовательностями РАМ NGG можно идентифицировать путем поиска в отношении 5'-Nx-NGG-3' как на вводимой последовательности, так и на последовательности, обратно-комплементарной вводимой. Подобным образом, целевые сайты для Cas9 CRISPR1 S. thermophilus с последовательностью РАМ NNAGAAW можно идентифицировать путем поиска в отношении 5'-Nx-NNAGAAW-3' как на вводимой последовательности, так и на последовательности, обратно-комплементарной вводимой. Подобным образом, целевые сайты для Cas9 CRISPR3 S. thermophilus с последовательностью РАМ NGGNG можно идентифицировать путем поиска в отношении 5'-Nx-NGGNG-3' как на вводимой последовательности, так и на последовательности, обратно-комплементарной вводимой. Значение "х" в Nx может фиксироваться программой или может быть определено пользователем, как, например, 20.
Поскольку несколько случаев появления целевого сайта ДНК в геноме могут приводить к неспецифичному редактированию генома, после идентификации всех возможных сайтов программа профильтровывает последовательности, исходя из количества раз, когда они встречаются в соответствующем эталонном геноме. Для тех ферментов CRISPR, для которых специфичность к последовательности определяется "затравочной" последовательностью, такой как находящаяся в 11-12 п.о. в направлении 5' от последовательности РАМ, в том числе сама последовательность РАМ, стадия фильтрования может основываться на затравочной последовательности. Следовательно, во избежание редактирования в дополнительных локусах генома результаты фильтруют, исходя из числа случаев появления последовательности затравка: РАМ в подходящем геноме. Пользователь может иметь возможность выбора длины затравочной последовательности. Пользователь также может иметь возможность определять число случаев появления последовательности затравка: РАМ в геноме применительно к прохождению фильтра. По умолчанию установлен скрининг в отношении уникальных последовательностей. Уровень фильтрования изменяют путем изменения как длины затравочной последовательности, так и числа случаев появления последовательности в геноме. В качестве дополнения или альтернативы, программа может обеспечивать последовательность направляющей последовательности, комплементарную сообщенной(сообщенным) целевой(целевым) последовательности(последовательностям), путем обеспечения последовательности, обратно комплементарной идентифицированной(идентифицированным) целевой(целевым) последовательности (последовательностям). Иллюстративная визуализация некоторых целевых сайтов в геноме человека представлена на фигуре 18.
Дополнительные подробности в отношении способов и алгоритмов для оптимизации выбора последовательности можно найти в заявке на патент США с порядковым номером 61/064798 (номер дела у патентного поверенного 44790.11.2022; общая ссылка BI-2012/084); включенной в данный документ при помощи ссылки.
Пример 4. Оценка гибридов нескольких химерных crRNA-tracrRNA
В данном примере описаны результаты, полученные для химерных РНК (chiRNA; содержащие направляющую последовательность, парную tracr-последовательность и tracr-последовательность в одном транскрипте), имеющих tracr-последовательности, которые включают фрагменты последовательности tracrRNA дикого типа с разной длиной. На фиг. 16а проиллюстрировано схематическое изображение бицистронного вектора экспрессии для химерной РНК и Cas9. Cas9 управляется промотором CBh, а химерная РНК управляется промотором U6. Химерная направляющая РНК состоит из направляющей последовательности (Ns) из 20 п.о., соединенной с tracr-последовательностью (проходящей от первого "U" в нижней нити к концу транскрипта), которая усечена в разных указанных положениях. Направляющие и tracr-последовательности разделены парной tracr-последовательностью GUUUUAGAGCUA (SEQ ID NO: ), за которой следует последовательность петли GAAA. Результаты анализов с помощью SURVEYOR в отношении опосредованных Cas9 вставок/делеций в локусах ЕМХ1 и PVALB человека проиллюстрированы на фиг. 16b и 16с, соответственно. Стрелки указывают на ожидаемые фрагменты, полученные в результате расщепления с помощью SURVEYOR. ChiRNA показаны путем обозначения их "+n", a crRNA относится к гибридной РНК, в которой направляющие и tracr-последовательности экспрессируются в виде отдельных транскриптов. Количественная оценка этих результатов, выполненная в трех повторностях, проиллюстрирована гистограммой на фигурах 17а и 17b, соответствующих фигурам 16b и 16с, соответственно ("N.D." указывает на отсутствие выявленных вставок/делеций). ID (идентификационные данные) протоспейсеров и их соответствующие геномная мишень, последовательность протоспейсера, последовательность РАМ и положение нити приведены в таблице D. Направляющие последовательности разработаны так, чтобы они были комплементарны полной последовательности протоспейсера в случае отдельных транскриптов в гибридной системе или только подчеркнутой части в случае химерных РНК.

Дополнительные детали для оптимизации направляющих последовательностей можно найти в заявке на патент США с порядковым номером 61/836127 (номер дела у патентного поверенного 44790.08.2022; общая ссылка BI-2013/004G); включенной в данный документ при помощи ссылки.
Первоначально целенаправленному воздействию подвергали три сайта в пределах локуса ЕМХ1 в клетках HEK 293FT человека. Эффективность модификации генома с помощью каждой chiRNA оценивали с использованием анализа с помощью нуклеазы SURVEYOR, который позволяет обнаруживать мутации, возникающие в результате двухнитевых разрывов (DSB) ДНК и их последующей репарации с помощью пути репарации повреждений ДНК за счет негомологичного соединения концов (NHEJ). В конструкциях, обозначенных chiRNA(+n), указывается, что нуклеотиды в количестве до +n нуклеотида в tracrRNA дикого типа включены в химерную РНК-конструкцию, при этом для n используются значения 48, 54, 67 и 85. Химерные РНК, содержащие более длинные фрагменты tracrRNA дикого типа (chiRNA(+67) и chiRNA(+85)), опосредовали расщепление ДНК во всех трех целевых сайтах ЕМХ1, причем chiRNA(+85), в частности, демонстрировал значительно более высокие уровни расщепления ДНК, чем соответствующие гибриды crRNA/tracrRNA, у которых направляющие и tracr-последовательности экспрессируются в отдельных транскриптах (фиг. 16b и 17а). Два сайта в локусе PVALB, которые не давали обнаруживаемого расщепления с использованием гибридной системы (направляющая последовательность и tracr-последовательность, экспрессируемые в виде отдельных транскриптов), также подвергались целенаправленному воздействию с использованием chiRNA. ChiRNA(+67) и chiRNA(+85) были способны опосредовать значительное расщепление в двух протоспейсерах в PVALB (фиг. 16с и 17b).
Для всех пяти мишеней в локусах ЕМХ1 и PVALB наблюдали соответствующее повышение эффективности модификации генома с увеличением длины tracr-последовательности. Не вдаваясь в какую-либо теорию, вторичная структура, формируемая 3'-концом tracrRNA, может играть роль в увеличении скорости образования комплекса CRISPR.
Пример 5. Разнообразие Cas9
Система CRISPR-Cas является адаптивным иммунным механизмом в отношении внедряющейся экзогенной ДНК, используемым разнообразными видами из числа бактерий и архей. Система CRISPR-Cas9 типа II состоит из набора генов, кодирующих белки, ответственные за "захват" чужеродной ДНК в локус CRISPR, а также из набора генов, кодирующих "выполнение" механизма расщепления ДНК; они включают ДНК-нуклеазу (Cas9), некодирующую транс-активирующую cr-RNA (tracrRNA) и массив полученных из чужеродной ДНК спейсеров, фланкированных прямыми повторами (crRNA). При созревании под действием Cas9 дуплекс tracRNA и crRNA направляет нуклеазу Cas9 к целевой последовательности ДНК, определенной спейсерными направляющими последовательностями, и опосредует двухнитевые разрывы в ДНК вблизи короткого мотива последовательности в целевой ДНК, необходимого для расщепления и являющегося специфичным для каждой системы CRISPR-Cas. Системы CRISPR-Cas типа II обнаруживаются повсеместно в царстве бактерий и являются очень разнообразными по последовательности и размеру белка Cas9, последовательности прямого повтора tracrRNA и crRNA, организации этих элементов в геноме и требованиям к мотиву для целенаправленного расщепления. Один вид может иметь несколько различных систем CRISPR-Cas.
Заявители оценивали 207 предполагаемых Cas9 из видов бактерий, идентифицированных на основании гомологии последовательности с известными Cas9 и структурами, ортологичными известным субдоменам, в том числе домену эндонуклеазы HNH и доменам эндонуклеазы RuvC [информация от Eugene Koonin и Kira Makarova]. Филогенетический анализ на основе консервативности белковой последовательности в этом наборе выявил пять семейств Cas9, включающие три группы больших Cas9 (~1400 аминокислот) и две группы небольших Cas9 (~1100 аминокислот) (смотри фиг. 19 и 20А-F).
Дополнительные подробности в отношении Cas9 и мутаций в ферменте Cas9 для превращения в никазу или ДНК-связывающий белок и их применение с измененной функциональностью можно найти в заявках на патенты США с серийными номерами 61/836101 и 61/835936 (номера дел у патентного поверенного 44790.09.2022 и 4790.07.2022 и общие ссылки BI-2013/004E и BI-2013/004F, соответственно), включенных в данный документ с помощью ссылки.
Пример 6. Ортологи Cas9
Заявители анализировали ортологи Cas9 для идентификации подходящих последовательностей РАМ и соответствующей химерной направляющей РНК. Наличие расширенного набора РАМ обеспечивает более расширенное целенаправленное воздействие по геному, а также значительно повышает число уникальных целевых сайтов и обеспечивает потенциал для идентификации новых Cas9 с повышенными уровнями специфичности в геноме.
Специфичность ортологов Cas9 можно оценить с помощью тестирования способности каждого Cas9 допускать несовпадения между направляющей РНК и ее ДНК-мишенью. Например, специфичность SpCas9 была охарактеризована с помощью исследования эффекта мутаций в направляющей РНК в отношении эффективности расщепления. Создавали библиотеки направляющих РНК с одним или несколькими несовпадениями между направляющей последовательностью и целевой ДНК. Исходя из этих данных, целевые сайты для SpCas9 можно выбрать на основе следующих рекомендаций.
Для максимального повышения специфичности SpCas9 в отношении редактирования конкретного гена специалисту следует выбирать целевой сайт в пределах представляющего интерес локуса таким образом, чтобы в возможных "нецелевых" геномных последовательностях соблюдались следующие четыре ограничения: первое и главное, за ними не должен следовать РАМ с любой из последовательностей 5'-NGG или NAG. Второе, глобальное сходство их последовательности с целевой последовательностью должно быть сведено к минимуму. Третье, максимальное число несовпадений должно находиться в пределах ближайшего к РАМ участка в нецелевом сайте. Наконец, максимальное число несовпадений должны быть последовательными или отделенными друг от друга менее чем четырьмя основаниями.
Подобные способы можно использовать для оценки специфичности других ортологов Cas9 и для установления критериев для выбора специфических целевых сайтов в геномах целевых видов. Как упоминалось ранее, филогенетический анализ на основе консервативности белковой последовательности в этом наборе выявил пять семейств Cas9, включающие три группы больших Cas9 (~1400 аминокислот) и две группы небольших Cas9 (~1100 аминокислот) (см. фигуры 19 и 20A-F). Дополнительные подробности в отношении ортологов Cas можно найти в заявках на патенты США с серийными номерами 61/836101 и 61/835936 (номера дел у патентного поверенного 44790.09.2022 и 4790.07.2022 и общие ссылки BI-2013/004E и BI-2013/004F, соответственно), включенных в данный документ с помощью ссылки.
Пример 7. Методические улучшения для упрощения клонирования и доставки
Вместо того, чтобы закодировать промотор U6 и направляющую РНК на плазмиде, заявители амплифицировали промотор U6 с олигонуклеотидом ДНК для достройки направляющей РНК. Полученный в результате ПЦР продукт можно трансфицировать в клетки для управления экспрессией направляющей РНК.
Иллюстративная пара праймеров, которая обеспечивает возможность образования продукта ПЦР, состоящего из промотора U6: направляющей РНК, осуществляющих нацеливание на локус Emx1 человека.
Прямой праймер: AAACTCTAGAgagggcctatttcccatgattc (SEQ ID NO: )
Обратный праймер (несущий направляющую РНК, которая подчеркнута):

Пример 8: методическое улучшение для улучшения активности
Вместо применения промоторов pol3, в частности, для РНК-полимеразы III (например, промоторов U6 или H1), для экспрессии направляющих РНК в эукариотических клетках заявители обеспечивали экспрессию полимеразы Т7 в эукариотических клетках для управления экспрессией направляющих РНК с использованием промотора Т7.
Один пример этой системы может включать введение трех фрагментов ДНК:
1. вектора экспрессии для Cas9;
2. вектора экспрессии для полимеразы Т7;
3. вектора экспрессии, содержащего направляющую РНК, слитую с промотором Т7.
Пример 9. Методическое улучшение для снижения токсичности Cas9: доставка Cas9 в форме мРНК
Доставка Cas9 в форме мРНК обеспечивает возможность транзиентной экспрессии Cas9 в клетках для снижения токсичности. Например, гуманизированный SpCas9 можно амплифицировать с использованием следующей пары праймеров:
Прямой праймер (для достройки промотора Т7 для транскрипции in' vitro): TAATACGACTCACTATAGGAAGTGCGCCACCATGGCCCCAAAGAAGAAGCGG (SEQ ID NO: ).
Обратный праймер (для достройки поли(А)-хвоста):
GGTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTttcttaCTTTTTCTTTTTTGCCTGGCCG (SEQ ID NO: ).
Заявители трансфицировали мРНК Cas9 в клетки с направляющей РНК в форме кассет РНК или ДНК для управления экспрессией направляющей РНК в эукариотических клетках.
Пример 10. Методическое улучшение для снижения токсичности Cas9: применение индуцируемого промотора
Заявители временно включали экспрессию Cas9, только когда она требовалась для осуществления модификации генома. Примеры индуцируемой системы включают индуцируемые тетрациклином промоторы (Tet-On или Tet-Off), двугибридные системы активации транскрипции с использованием малых молекул (FKBP, ABA и т.д.) или индуцируемые светом системы (фитохром, домены LOV или криптохром).
Пример 11. Улучшение системы Cas9 для применения in vivo
Авторы данной заявки проводили поиск с использованием метагеномного подхода в отношении Cas9 с малой молекулярной массой. Большинство гомологов Cas9 являются достаточно большими. Например, SpCas9 имеет длину около 1368 а.к., что слишком много для легкой упаковки в вирусные векторы для доставки. График, представляющий распределение длины гомологов Cas9, получали на основе последовательностей, депонированных в GenBank (фиг. 23). Некоторые из последовательностей могли быть неверно аннотированы, и, таким образом, точная частота каждой длины не обязательно может быть достоверной. Тем не менее, она дает некоторое представление о распределении белков Cas9 и указывает на то, что существуют более короткие гомологи Cas9.
С помощью анализа на основе расчетов авторы данной заявки обнаружили, что у штамма бактерии Campylobacter присутствуют два белка Cas9 с менее чем 1000 аминокислот. Последовательность для одного Cas9 из Campylobacter jejuni представлена ниже. При такой длине CjCas9 может быть легко упакован в AAV, лентивирусы, аденовирусы и другие вирусные векторы для надежной доставки в первичные клетки и in vivo в животных моделях. В предпочтительном варианте осуществления настоящего изобретения применяют белок Cas9 из S. aureus.
>Cas9 Campylobacter jejuni (CjCas9)


Предполагаемый элемент tracrRNA для данного CjCas9 представляет собой:
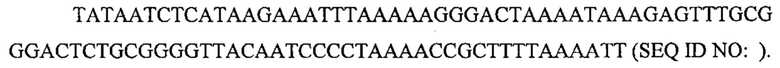
Последовательность прямого повтора представляет собой:
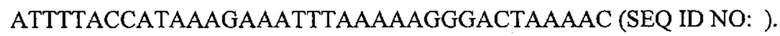
Пример химерной направляющей РНК для CjCas9 представляет собой:
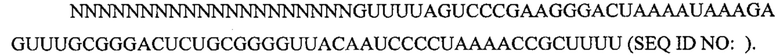
Пример 12. Оптимизация Cas9
Для усиленного функционирования или для развития новых функций заявители создали химерные белки Cas9 путем объединения фрагментов от различных гомологов Cas9. Например, два иллюстративных химерных белка Cas9:
Например, заявители слили N-конец St1Cas9 (фрагмент этого белка выделен жирным шрифтом) с С-концом SpCas9 (фрагмент этого белка подчеркнут).
>St1(N)Sp(C)Cas9


>Sp(N)St1(C)Cas9

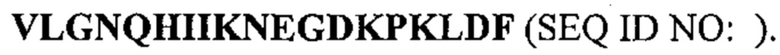
Выгода от создания химерного Cas9 включает:
снижение токсичности;
улучшение экспрессии в эукариотических клетках;
повышение специфичности;
снижение молекулярного веса белка, делающее белок меньшим за счет объединения наименьших доменов от различных гомологов Cas9.
Изменение требований к последовательности РАМ.
Пример 13. Использование Cas9 в качестве стандартного ДНК-связывающего белка
Заявители использовали Cas9 в качестве стандартного ДНК-связывающего белка путем внесения мутации в два каталитических домена (D10 и Н840), ответственных за расщепление обеих нитей ДНК-мишени. С целью повышающей регуляции транскрипции гена в целевом локусе заявители слили домен активации транскрипции (VP64) с Cas9. Заявители предположили, что будет важно увидеть четкую ядерную локализацию белка слияния Cas9-VP64, поскольку эффективность активации транскрипционным фактором зависит от времени, проведенного у мишени. Таким образом, заявители клонировали набор Cas9-VP64-GFP конструкций, переносили их в клетки 293 и оценивали их локализацию под флуоресцентным микроскопом через 12 часов после трансфекции.
Те же конструкции клонировали в виде 2A-GFP, а не в виде продукта прямого слияния, с целью функционального тестирования конструкций без помех от массового присутствия GFP. Заявители выбрали для целенаправленного воздействия локус Sox2 с трансактиватором Cas9, поскольку он может быть полезен для перепрограммирования клеток, и данный локус уже был валидирован как мишень для опосредованной TALE-TF активации транскрипции. Для локуса Sox2 заявители выбрали восемь целей рядом с сайтом инициации транскрипции (TSS). Каждая мишень имела длину 20 п.о. с расположенным рядом мотивом NGG, прилегающим к протоспейсеру (РАМ). Каждую конструкцию Cas9-VP64 совместно трансфицировали с. каждой полученной с помощью ПЦР химерной РНК CRISPR (chiRNA) в клетки 293. Через 72 часа после трансфекции активацию транскрипции оценивали с помощью RT-qPCR.
Для дополнительной оптимизации активатора транскрипции заявители подбирали соотношение chiRNA (Sox2.1 и Sox2.5) и Cas9 (NLS-VP64-NLS-hSpCas9-NLS-VP64-NLS), трансфицировали в клетки 293 и количественно определяли с помощью RT-qPCR. Эти результаты указывают на то, что Cas9 можно использовать в качестве стандартного ДНК-связывающего домена для повышающей регуляции транскрипции гена в целевом локусе.
Заявители разработали второе поколение конструкций. (Таблица ниже).

Заявители применяли эти конструкции для оценки активации (конструкции со слитым VP64) и репрессии (только Cas9) транскрипции с помощью RT-qPCR. Заявители оценивали клеточную локализацию каждой конструкции с использованием антитела к His, нуклеазную активность с использованием анализа с помощью нуклеазы Surveyor и аффинность связывания с ДНК с использованием анализа задержки электрофоретического сдвига в геле. В предпочтительном варианте осуществления настоящего изобретения анализ задержки электрофоретического сдвига в геле представляет собой анализ изменения электрофоретической подвижности EMSA.
Пример 14. Мыши, трансгенные no Cas9 и с нокином no Cas9
Для получения мыши, которая экспрессирует нуклеазу Cas9, заявители рассматривали две общих стратегии, трансгенез и нокин. Эти стратегии можно применять для получения любого другого модельного организма, представляющего интерес, например, крысы. Для каждой из общих стратегий заявители получили конститутивно активный Cas9 и Cas9, который экспрессируется при определенных условиях (зависимый от рекомбиназы Cre). Конститутивно активная нуклеаза Cas9 экспрессируется в следующем контексте: pCAG-NLS-Cas9-NLS-Р2А-EGFP-WPRE-bGH-поли(А). pCAG представляет собой промотор, NLS представляет собой сигнал ядерной локализации, Р2А представляет собой последовательность расщепления пептидом, EGFP представляет собой улучшенный зеленый флуоресцентный белок, WPRE представляет собой посттранскрипционный регуляторный элемент вируса гепатита сурков, а bGH-поли(А) представляет собой сигнальную последовательность поли(А) бычьего гормона роста (фиг. 25А-В). Экспрессируемый при определенных условиях вариант имел один дополнительный элемент в виде стоп-кассеты, loxP-SV40-поли(А)х3-loxP, после промотора и перед NLS-Cas9-NLS (т.е. pCAG-loxP-SV40-поли(А)х3-loxP-NLS-Cas9-NLS-P2A-EGFP-WPRE-bGH-поли(A)). Важные экспрессионные элементы наглядно представлены на фиг. 26. Конститутивная конструкция должна экспрессироваться во всех типах клеток в ходе развития, тогда как экспрессируемая при определенных условиях конструкция будет обеспечивать возможность экспрессии Cas9 только тогда, когда та же клетка будет экспрессировать рекомбиназу Cre. Этот последний вариант будет обеспечивать возможность тканеспецифичной экспрессии Cas9, когда экспрессия Cre находится под управлением тканеспецифичного промотора. Более того, экспрессию Cas9 можно индуцировать у взрослых мышей путем помещения экспрессии Cre под контроль индуцируемого промотора, такого как система ТЕТ-on или off.
Валидация конструкций Cas9. Каждую плазмиду подвергали функциональной валидации тремя способами: 1) транзиентная трансфекция в клетки 293 с последующим подтверждением экспрессии GFP; 2) транзиентная трансфекция в клетки 293 с последующей иммунофлуоресценцией с использованием антитела, узнающего последовательность Р2А; и 3) транзиентная трансфекция с последующим анализом с помощью нуклеазы Surveyor. Клетки 293 могут представлять собой клетки 293FT или 293 Т в зависимости от того, какие клетки представляют интерес. В предпочтительном варианте осуществления клетки представляют собой клетки 293FT. Результаты расщепления с помощью Surveyor разделяли по верхнему и нижнему рядам лунок геля для конструкции, экспрессируемой при определенных условиях, и для конститутивной конструкции, соответственно. Каждую из них исследовали в присутствии и в отсутствие химерной РНК, осуществляющей нацеливание на локус hEMX1 (химерная РНК hEMX1.1). Результаты указывают на то, что конструкция может успешно целенаправленно воздействовать на локус hEMX1 только в присутствии химерной РНК (и Сге в случае с экспрессией при определенных условиях). Гели использовали для количественного определения, и результаты представлены в виде средней эффективности разрезания и стандартного отклонения для трех образцов.
Трансгенные по Cas9 мыши. Для получения трансгенных мышей с конструкциями заявители инъецировали чистую линейную ДНК в пронуклеус зиготы от псевдобеременной самки СВ56. Особей-основателей идентифицировали, генотипировали и подвергали возвратному скрещиванию с мышами СВ57. Конструкции успешно клонировали и подтверждали путем секвенирования по Сэнгеру.
Мыши с нокином по Cas9. Для создания нокина по Cas9 у мышей заявители целенаправленно воздействовали теми же конститутивными конструкциями и конструкциями, экспрессируемыми при определенных условиях, на локус Rosa26. Заявители осуществили это путем клонирования каждого из них в целенаправленно воздействующий на Rosa26 вектор со следующими элементами: короткое гомологичное плечо Rosa26 - кассета для конститутивной/условной экспрессии Cas9 - длинное гомологичное плечо pPGK-Neo-Rosa26 - pPGK-DTA. pPGK представляет собой промотор для маркера положительного отбора Neo, который придает устойчивость к неомицину, короткое плечо длиной 1 т.п.о., длинное плечо длиной 4,3 т.п.о. и дифтерийный токсин (DTA), управляемый PGK, для отрицательного отбора.
Две конструкции вводили посредством электропорации в mESC R1, которым обеспечивали возможность роста в течение 2 дней до применения отбора с помощью неомицина. Отдельные колонии, которые выжили к 5-7 дню, отбирали и выращивали в отдельных лунках. 5-7 дней спустя колонии собирали, половину из них замораживали, а другую половину использовали для генотипирования. Генотипирование выполняли с помощью геномной ПЦР, когда один праймер отжигали в донорной плазмиде (AttpF), а второй за пределами короткого гомологичного плеча (Rosa26-R). Из 22 колоний, собранных для случаев условной экспрессии, 7 были положительными (слева). Из 27 колоний, собранных для случаев конститутивной экспрессии, ноль были положительных (справа). Вероятно, что Cas9 приводит к некоторому уровню токсичности в mESC, и по этой причине положительные клоны не присутствовали. Для тестирования этого факта заявители вводили плазмиду для экспрессии Сrе в клетках с точным целенаправленным воздействием экспрессируемой при определенных условиях Cas9 и выявили очень низкую токсичность после большого количества дней в культуре. Уменьшенного числа копий Cas9 в клетках с точным целенаправленным воздействием экспрессируемой при определенных условиях Cas9 (1-2 копии на клетку) достаточно для обеспечения возможности стабильной экспрессии и относительного отсутствия цитотоксичности. Более того, эти данные указывают на то, что число копий Cas9 определяет токсичность. После электропорации каждая клетка должна получить несколько копий Cas9, и, вероятно, вследствие этого не обнаруживалось положительных колоний в случае конститутивной конструкции Cas9. Это обеспечивает убедительное доказательство того, что использование стратегии условной экспрессии, Cre-зависимой стратегии, должно показать пониженную токсичность. Заявители вводили клетки, подвергнутые точному целенаправленному воздействию, в бластоцисту и имплантировали в самку мыши. Химерных особей идентифицировали и подвергали возвратному скрещиванию. Особей-основателей идентифицировали и генотипировали.
Полезность мышей с условной экспрессией Cas9. Заявители показали на клетках 293, что конструкция для условной экспрессии Cas9 может активироваться при совместной экспрессии с Cre. Заявители также показали, что надлежащим образом подвергшиеся целенаправленному воздействию mESC R1 могут иметь активный Cas9 при экспрессии Cre. Поскольку за Cas9 следует последовательность расщепления пептидом Р2А, а затем EGFP, заявители идентифицировали успешную экспрессию путем наблюдения EGFP. Эта же идея делает использование мышей с экспрессией Cas9 при определенных условиях столь полезным. Заявители могут скрещивать свою мышь с условной экспрессией Cas9 с мышью, у которой повсеместно экспрессируется Cre (линия АСТВ-Cre), и могут получать мышь, у которой Cas9 экспрессируется в каждой клетке. Для этого потребуется только доставка химерной РНК для индукции редактирования генома у мышиных эмбрионов или взрослых мышей. Что интересно, если мышь с условной экспрессией Cas9 скрестить с мышью, экспрессирующей Cre под контролем тканеспецифического промотора, Cas9 будет лишь в тканях, в которых также экспрессируется Cre. Этот подход можно применять для редактирования генома только в определенных тканях путем доставки химерной РНК в ту же ткань.
Пример 15. Разнообразие Cas9 и химерные РНК
Система CRISPR-Cas является адаптивным иммунным механизмом в отношении внедряющейся экзогенной ДНК, используемым разнообразными видами из числа бактерий и архей. Система CRISPR-Cas типа II состоит из набора генов, кодирующих белки, ответственные за "захват" чужеродной ДНК в локус CRISPR, а также из набора генов, кодирующих "выполнение" механизма расщепления ДНК; они включают ДНК-нуклеазу (Cas9), некодирующую транс-активирующую cr-RNA (tracrRNA) и массив полученных из чужеродной ДНК спейсеров, фланкированных прямыми повторами (crRNA). При созревании под действием Cas9 дуплекс tracRNA и crRNA направляет нуклеазу Cas9 к целевой последовательности ДНК, определенной спейсерными направляющими последовательностями, и опосредует двухнитевые разрывы в ДНК вблизи короткого мотива последовательности в целевой ДНК, необходимого для расщепления и являющегося специфичным для каждой системы CRISPR-Cas. Системы CRISPR-Cas типа II обнаруживаются повсеместно в царстве бактерий и являются очень разнообразными по последовательности и размеру белка Cas9, последовательности прямого повтора tracrRNA и crRNA, организации этих элементов в геноме и требованиям к мотиву для целенаправленного расщепления. Один вид может иметь несколько различных систем CRISPR-Cas.
Заявители оценивали 207 предполагаемых Cas9 из видов бактерий, идентифицированных на основании гомологии последовательности с известными Cas9 и структурами, ортологичными известным субдоменам, в том числе домену эндонуклеазы HNH и доменам эндонуклеазы RuvC [информация от Eugene Koonin и Kira Makarova]. Филогенетический анализ на основе консервативности белковой последовательности в этом наборе выявил пять семейств Cas9, включающих три группы больших Cas9 (~1400 аминокислот) и две группы небольших Cas9 (~1100 аминокислот) (фиг. 19A-D и 20A-F).
Заявители также оптимизировали направляющую РНК для Cas9 с применением способов in vitro.
Пример 16. Мутации Cas9
В этом примере заявители показали, что следующие мутации могут превратить SpCas9 в фермент, вносящий однонитевой разрыв: D10A, Е762А, Н840А, N854A, N863A, D986A.
Заявители представили последовательности, показывающие, где расположены точки мутаций в гене SpCas9 (фиг. 24А-М). Заявители также показали, что никазы при этом все еще способны опосредовать гомологичную рекомбинацию. Кроме того, заявители показали, что SpCas9 с этими мутациями (отдельно) не индуцировал двухнитевой разрыв.
Все ортологи Cas9, как правило, имеют общую структуру, включающую 3-4 домена RuvC и домен HNH. Наиболее близкий к 5'-концу домен RuvC расщепляет некомплементарную нить, а домен HNH расщепляет комплементарную нить. Все обозначения приведены в отношении направляющей последовательности.
Каталитический остаток в 5'-концевом домене RuvC идентифицируют посредством сравнения с целью поиска гомологии представляющего интерес Cas9 и других ортологов Cas9 (из локуса CRISPR типа II S. pyogenes, локуса 1 CRISPR S. thermophilus, локуса 3 CRISPR S. thermophilus и локуса CRISPR типа II Franciscilla novicida), и консервативный остаток Asp подвергают мутации по типу замены на аланин с превращением Cas9 в фермент, вносящий однонитевой разрыв в комплементарную нить. Аналогично, консервативные остатки His и Asn в доменах HNH подвергают мутации по типу замены на аланин с превращением Cas9 в фермент, вносящий однонитевой разрыв в некомплементарную нить.
Пример 17. Активация транскрипции Cas9 и репрессор Cas9
Активация транскрипции Cas9
Конструировали и тестировали второе поколение конструкций (таблица 1). Данные конструкции использовали для оценки активации транскрипции (конструкции со слитым VP64) и репрессии (только Cas9) с помощью RT-qPCR. Заявители оценивали клеточную локализацию каждой конструкции с использованием антитела к His, нуклеазную активность с использованием анализа с помощью нуклеазы Surveyor и аффинность связывания с ДНК с использованием анализа задержки электрофоретического сдвига в геле.
Репрессор Cas
Ранее было показано, что dCas9 можно использовать в качестве стандартного ДНК-связывающего домена для репрессии экспрессии гена. Заявители описывают улучшенную структуру dCas9, а также слияния dCas9 с репрессорными доменами KRAB и SID4x. Из плазмидной библиотеки, созданной для модуляции транскрипции с использованием Cas9, в таблице 1 с помощью qPCR были функционально охарактеризованы следующие репрессорные плазмиды: pXRP27, pXRP28, pXRP29, pXRP48, pXRP49, pXRP50, pXRP51, pXRP52, pXRP53, pXRP56, pXRP58, pXRP59, pXRP61 и pXRP62.
Каждую репрессорную плазмиду для dCas9 трансфицировали совместно с двумя направляющими РНК, осуществляющими нацеливание на кодирующую нить гена бета-катенина. РНК выделяли через 72 часа после трансфекции, и экспрессию гена количественно определяли с помощью RT-qPCR. Эндогенным контрольным геном был GAPDH. Две валидированные shRNA использовали в качестве положительных контролей. Отрицательными контролями были определенные плазмиды, трансфицированные без gRNA, они обозначены как "pXRP##-контроль". Плазмиды pXRP28, pXRP29, pXRP48 и pXRP49 могут репрессировать ген бета-катенина при использовании определенной стратегии целенаправленного воздействия. Эти плазмиды соответствуют dCas9 без функционального домена (pXRP28 и pXRP28) и dCas9, слитому с SID4x (pXRP48 и pXRP49).
В дальнейших работах проводятся следующие исследования: повторение вышеуказанного эксперимента, целенаправленное воздействие на различные гены, использование других gRNA для определения оптимального положения для целенаправленного воздействия и мультиплексная репрессия.

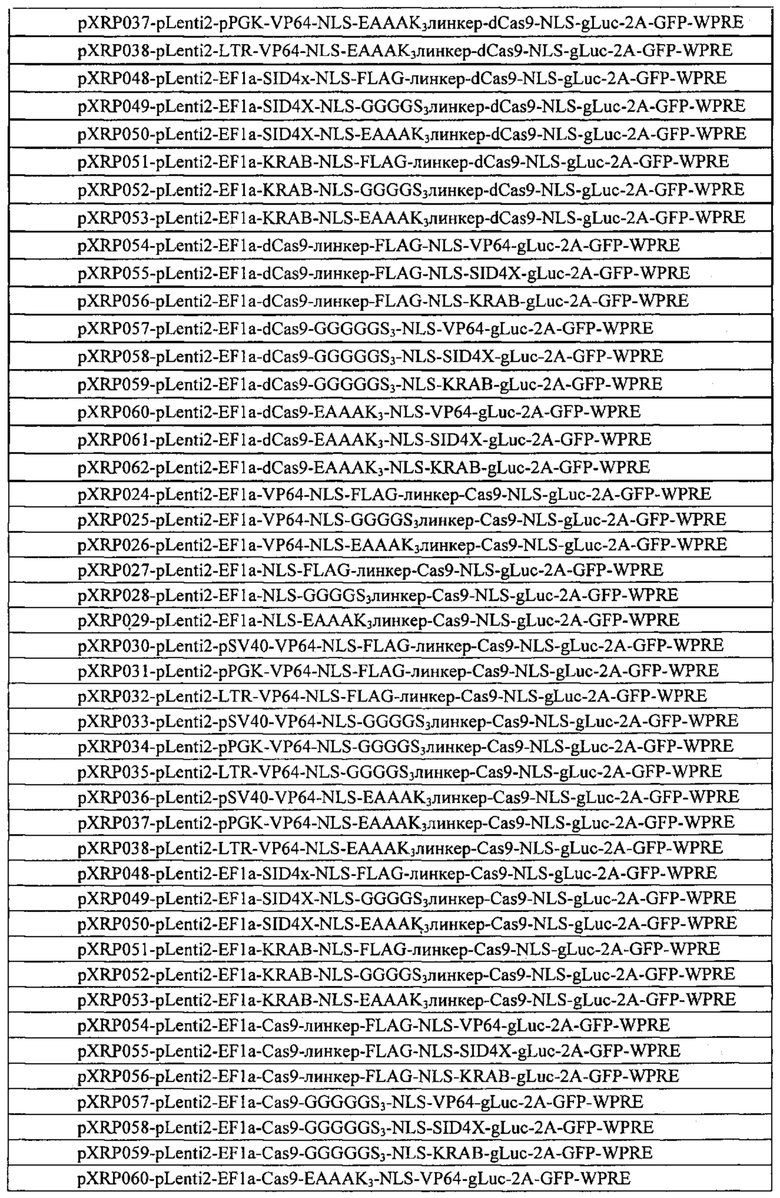
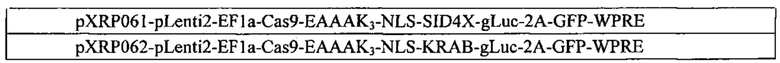
Пример 18. Целенаправленная делеция генов, вовлеченных в биосинтез холестерина, биосинтез жирных кислот и другие метаболические нарушения, генов, кодирующих неправильно свернутые белки, вовлеченных в амилоидоз и другие заболевания, онкогенов, приводящих к трансформации клеток, латентных генов вирусов и генов, приводящих к доминантно-негативным нарушениям среди прочих нарушений
Заявители продемонстрировали доставку гена системы CRISPR-Cas в ткань печени, головного мозга, глазную, эпителиальную, кроветворную или иную ткань субъекта или пациента, нуждающегося в этом, страдающего от метаболических нарушений, амилоидоза и заболеваний, связанных с агрегацией белков, трансформации клеток, возникающей в результате генных мутаций и транслокаций, доминантно-негативных эффектов генных мутаций, латентных вирусных инфекций и других связанных симптомов, с использованием либо вирусных систем доставки, либо систем доставки на основе наночастиц.
План исследования Нуждающиеся в лечении субъекты или пациенты, страдающие от метаболических нарушений, амилоидоза и заболевания, связанного с агрегацией белков, включают, без ограничения, человека, отличного от человека примата, собаку, кошку, корову, лошадь, других домашних животных и родственных млекопитающих. Система CRISPR-Cas направляется химерной направляющей РНК и оказывает целенаправленное воздействие на конкретный сайт в локусах генома человека, которые нужно расщепить. После расщепления и опосредованной негомологичным соединением концов репарации мутация сдвига рамки считывания приводит к нокауту генов.
Заявители выбирали направляющие РНК, осуществляющие нацеливание на гены, вовлеченные в вышеупомянутые нарушения, которые являются специфичными к эндогенным локусам при минимальной нецелевой активности. Две или более направляющих РНК могут быть закодированы в одном массиве CRISPR для индукции одновременных двухнитевых разрывов в ДНК, приводящих к микроделециям в подвергшихся воздействию генах или хромосомных участках.
Идентификация и конструирование генов-мишеней
Для каждого связанного с заболеванием кандидатного гена заявители выбирали представляющие интерес последовательности ДНК, включающие кодирующие белок экзоны, последовательности, включающие и фланкирующие известные сайты доминатно-негативных мутаций, последовательности, включающие и фланкирующие повторяющиеся последовательности, связанные с патологией. Для подходов, в которых используется нокаут генов, ранние кодирующие экзоны, наиболее близкие к старт-кодону, предлагают наилучшие варианты для достижения полного нокаута и сведения к минимуму возможности сохранения усеченными белковыми продуктами частичной функции.
Заявители анализировали представляющие интерес последовательности в отношении всех возможных поддающихся целенаправленному воздействию последовательностей из 20 п.о. в непосредственно близком 5' положении относительно мотива NGG (для системы SpCas9) или NNAGAAW (для системы St1Cas9). Заявители выбирали последовательности для уникального направляемого одной РНК распознавания Cas9 в геноме для сведения к минимуму нецелевых эффектов на основе расчетного алгоритма для определения специфичности.
Клонирование направляющих последовательностей в систему доставки
Направляющие последовательности синтезировали в виде двухнитевых олигонуклеотидов из 20-24 п.о. После обработки нуклеотидов 5'-фосфорилированием и отжига с образованием дуплексов, олигонуклеотиды лигируют в подходящий вектор в зависимости от способа доставки:
Способы доставки на основе вирусов
Векторы на основе AAV (РХ260, 330, 334, 335) были описаны в других местах.
В векторах на основе лентивирусов используется сходная стратегия клонирования путем прямого лигирования направляющих последовательностей в один вектор, несущий каркас из управляемой промотором U6 химерной РНК и управляемую промотором EF1a Cas9 или никазу Cas9.
Получение вируса описано в других местах.
Способы доставки РНК на основе наночастиц
1. Направляющие последовательности синтезировали в виде дуплекса олигонуклеотидов, кодирующих промотор Т7 - направляющую последовательность -химерную РНК. Промотор Т7 добавляли в положении 5' относительно Cas9 с помощью способа ПЦР.
2. РНК управляемой Т7 Cas9 и химерные направляющие РНК транскрибировали in vitro, и мРНК Cas9 подвергали дополнительному кэшированию и присоединению А-хвоста с использованием коммерческих наборов. РНК-продукты очищали согласно инструкциям к наборам.
Способы гидродинамической доставки через хвостовую вену (для мыши)
Направляющие последовательности клонировали в плазмиды на основе AAV, которые описаны выше и в других местах в данной заявке.
Валидация in vitro на линиях клеток
Трансфекция
1. Трансфекция плазмидными ДНК
Плазмиды, несущие направляющие последовательности, трансфицировали в клетки почки человеческого эмбриона (HEK293T) или человеческие эмбриональные стволовые (hES) клетки, другие подходящие типы клеток с использованием способов на основе липидов, химических средств или электропорации. Для трансфекции клеток HEK293T в 24-луночном формате (~260000 клеток) 500 нг общей ДНК трансфицировали в каждую отдельную лунку с использованием Lipofectamine 2000. Для трансфекции клеток hES в 12-луночном формате 1 мкг общей ДНК трансфицировали в отдельную лунку с использованием Fugene HD.
2. Трансфекция РНК
Описанную выше очищенную РНК использовали для трансфекции в клетки HEK293T. 1-2 мкг РНК можно трансфицировать в ~260000 с использованием Lipofectamine 2000 согласно инструкциям производителя. Доставка РНК Cas9 и химерной РНК показана на фиг. 28.
Анализ образования вставок/делеций in vitro
Клетки собирали через 72 часа после трансфекции и анализировали в отношении образования вставок/делеций в качестве признака двухнитевых разрывов.
Вкратце, участок генома вокруг, ограничивающий целевую последовательность, подвергали ПЦР-амплификации (размер ампликона ~400-600 п.о.) с использованием высокоточной полимеразы. Продукты очищали, приводили к равной концентрации и медленно отжигали при температуре от 95°С до 4°С для обеспечения возможности образования гетеродуплексов ДНК. После отжига фермент Cel-I использовали для расщепления гетеродуплексов, и полученные в результате продукты разделяли на полиакриламидном геле, и рассчитывали эффективность образования вставок/делеций.
Подтверждение принципа у животных in vivo
Механизмы доставки
Получение AAV или лентивируса описано в других местах.
Состав на основе наночастиц: РНК примешивали в состав на основе наночастиц.
Гидродинамические инъекции плазмидных ДНК в хвостовую вену мышей проводили с использованием коммерческого набора.
Cas9 и направляющие последовательности доставляли в виде вируса, смеси наночастиц, покрытых РНК, или плазмидных ДНК и инъецировали испытуемым животным. Параллельному набору контрольных животных инъецировали стерильный солевой раствор, Cas9 и GFP или только направляющую последовательность и GFP.
Через три недели после инъекции животных тестировали в отношении ослабления симптомов и умерщвляли. Подходящие системы органов анализировали в отношении образования вставок/делеций. Фенотипические анализы включают уровни HDL, LDL, липидов в крови.
Анализ образования вставок/делеций
ДНК экстрагировали из ткани с использованием коммерческих наборов; анализ вставок/делеций будут выполнять, как описано для демонстрации in vitro.
Терапевтические применения системы CPISPR-Cas являются пригодными для достижения тканеспецифичной и контролируемой по времени целенаправленной делеции в связанных с заболеванием кандидатных генах. Примеры включают гены, вовлеченные в метаболизм холестерина и жирных кислот, амилоидные заболевания, доминантно-негативные заболевания, латентные вирусные инфекции среди прочих нарушений.
Примеры одиночной направляющей РНК для введения целенаправленных вставок/делеций в локус гена
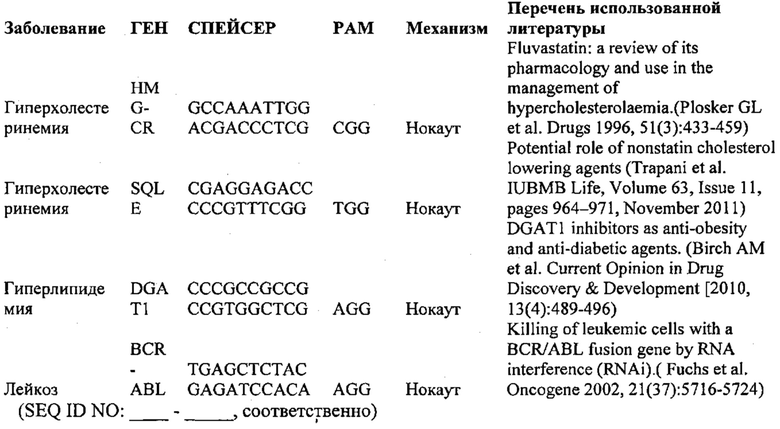
Примеры пар направляющих РНК для введения хромосомной микроделеции в локус гена


Пример 19. Целенаправленная интеграция или репарация генов, несущих вызывающие заболевания мутации; восстановление недостаточностей ферментов и других связанных заболеваний
План исследования
I. Идентификация и конструирование генов-мишеней
- Описывается в примере 22
II. Клонирование направляющих последовательностей и матриц для репарации в систему доставки.
- Описывается выше в примере 22
- Заявители клонировали матрицы для репарации ДНК с включением гомологичных плечей с аллелем, вызывающим заболевание, а также с матрицей для репарации дикого типа.
III. Валидация in vitro на линиях клеток
a. Трансфекция описана выше в примере 22; Cas9, направляющие РНК и матрицы для репарации совместно трансфицировали в подходящие типы клеток.
b. Анализ in vitro в отношении репарации
i. Заявители собирали клетки через 72 часа после трансфекции и анализировали в отношении репарации
ii. Вкратце, заявители амплифицировали участок генома около матрицы для репарации с помощью ПЦР с использованием высокоточной полимеразы. Заявители секвенировали продукты в отношении уменьшенной частоты мутантного аллеля.
IV. Подтверждение принципа у животных in vivo
a. Механизмы доставки описаны выше в примерах 22 и 34.
b. In vivo анализ в отношении репарации
i. Заявители осуществляли анализ репарации, как описано в демонстрации in vitro.
V. Терапевтические применения
Система CRISPR-Cas пригодна для достижения тканеспецифичной и контролируемой по времени целенаправленной делеции в связанных с заболеванием кандидатных генах. Примеры включают гены, вовлеченные в метаболизм холестерина и жирных кислот, амилоидные заболевания, доминантно-негативные заболевания, латентные вирусные инфекции среди прочих нарушений.
Пример одной отдельной миссенс-мутации с матрицей для репарации

Пример 20. Терапевтическое применение системы CRISPR-Cas при глаукоме, амилоидозе и болезни Гентингтона
Глаукома. Заявители сконструировали направляющие РНК для осуществления нацеливания на первый экзон гена миоцилина (MYOC). Заявители использовали аденовирусные векторы (Ad5) для упаковки как Cas9, так и направляющей РНК, целенаправленно воздействующих на ген MYOC. Заявители инъецировали аденовирусные векторы в трабекулярную сеть, где находились клетки, вовлеченные в патофизиологию глаукомы. Заявители первоначально тестировали их в мышиных моделях, несущих подвергшийся мутации ген MYOC, чтобы увидеть, будут ли они улучшать остроту зрения и снижать давление в глазах. При терапевтическом применении у людей используется подобная стратегия.
Амилоидоз. Заявители сконструировали направляющие РНК для осуществления нацеливания на первый экзон гена транстиретина (TTR) в печени. Заявители использовали AAV8 для упаковки Cas9, а также направляющей РНК, целенаправленно воздействующих на первый экзон гена TTR. Было показано, что AAV8 характеризуется эффективным целенаправленным воздействием в печени, и его будут вводить внутривенно. Экспрессией Cas9 можно управлять либо с использованием печеночноспецифических промоторов, таких как альбуминовый промотор, либо с использованием конститутивного промотора. Промотор pol3 управляет экспрессией направляющей РНК.
В альтернативном случае заявители использовали гидродинамическую доставку плазмидной ДНК для нокаута гена TTR. Заявители доставляли плазмиду, кодирующую Cas9, и направляющую РНК, осуществляющую нацеливание на экзон 1 в TTR.
В качестве еще одного альтернативного подхода заявители вводили комбинацию РНК (мРНК для Cas9 и направляющую РНК). РНК можно упаковывать при помощи липосом, таких как Invivofectamine от Life Technologies, и доставлять внутривенно. Для снижения индуцированной РНК иммуногенности, повышения уровня экспрессии Cas9 и стабильности направляющей РНК заявители модифицировали мРНК Cas9 с помощью 5'-кэпирования. Заявители также вводили модифицированные нуклеотиды РНК в мРНК Cas9 и направляющую РНК для повышения их стабильности и снижения иммуногенности (например, активации TLR). Для повышения эффективности заявители вводили несколько доз вируса, ДНК или РНК.
Болезнь Гентингтона. Заявители сконструировали направляющую РНК на основе аллель-специфичных мутаций в гене НТТ у пациентов. Например, у пациента, который является гетерозиготным по НТТ с экспансией повтора CAG, заявители идентифицировали нуклеотидные последовательности, уникальные для мутантного аллеля НТТ, и использовали их для конструирования направляющей РНК. Заявители убедились в том, что мутантное основание располагалось в пределах последних 9 п. о. направляющей РНК (которые, по убеждению заявителей, способны проводить различия по отдельным несовпадениям оснований ДНК между целевым сайтом и направляющей РНК).
Заявители упаковывали специфичную к мутантному аллелю НТТ направляющую РНК и Cas9 в AAV9 и доставляли в полосатое тело пациентов с болезнью Гентингтона. Вирус вводили в полосатое тело стереотаксически посредством краниотомии. Известно, что AAV9 эффективно преобразует нейроны. Заявители управляют экспрессией Cas9 с использованием нейрон-специфического промотора, такого как промотор гена синапсина I человека.
Пример 21. Терапевтическое применение системы CRISPR-Cas в HIV
Хроническая вирусная инфекция является источником значительной заболеваемости и смертности. Несмотря на то, что для многих из этих вирусов существуют традиционные средства противовирусной терапии, которые эффективно целенаправленно воздействуют на различные аспекты вирусной репликации, используемые в настоящее время терапевтические воздействия обычно являются не излечивающими по своей природе вследствие "латентности вируса". По своей природе латентность вируса характеризуется фазой покоя в жизненном цикле вируса без активного продуцирования вируса. Во время этого периода вирус в основном способен избегать как иммунного надзора, так и традиционных терапевтических средств, что обеспечивает создание долговременных резервуаров вируса в хозяине, из которых последующая повторная активация может давать возможность продолжения размножения и передачи вируса. Ключевой для скрытого воздействия вируса является возможность стабильного сохранения вирусного генома, осуществляемого за счет скрытности присутствия эписомной ДНК или провируса, которые хранят вирусный геном в цитоплазме или интегрируют его в геном хозяина, соответственно. В отсутствие эффективных вакцинаций, которые будут предотвращать первичную инфекцию, хронические вирусные инфекции, характеризующиеся скрытыми резервуарами и эпизодами литической активности, могут иметь существенные последствия: вирус папилломы человека (HPV) может приводить к раку шейки матки, вирус гепатита С (HCV) создает предрасположенность к гепатоцеллюлярной карциноме, и вирус иммунодефицита человека в конечном счете разрушает иммунную систему хозяина, приводя в результате к восприимчивости к оппортунистическим инфекциям. Вследствие этого эти инфекции требуют пожизненного применения доступных в настоящее время противовирусных терапевтических средств. Дополнительно осложняет ситуацию высокая частота мутирования многих из этих вирусных геномов, которая приводит к развитию устойчивых штаммов, в отношении которых не существует эффективной терапии.
Система CRISPR-Cas представляет собой бактериальную систему адаптивного иммунитета, способную индуцировать двухнитевые разрывы ДНК (DSB) мультиплексно, специфично к последовательности, и которая была недавно воссоздана в виде систем внутри клетки млекопитающего. Было показано, что нацеливание на ДНК одной или многочисленных направляющих РНК может приводить как к образованию вставок/делеций, так и к удалениям вставочных последовательностей, соответственно. Вследствие этого данная новая технология представляет средства, с помощью которых можно выполнять целенаправленный и мультиплексный мутагенез ДНК в пределах одной клетки с высокой эффективностью и специфичностью. Следовательно, доставка системы CRISPR-Cas, направленной против последовательности вирусной ДНК, может обеспечить возможность целенаправленного разрушения и удаления латентных вирусных геномов даже в отсутствие протекающего продуцирования вируса.
В качестве примера, хроническая инфекция, вызываемая HIV-1, представляет собой проблему для всемирного здравоохранения с инфицированными 33 миллионами людей и 2,6 миллиона случаев инфицирования ежегодно. Применение комбинированной высокоактивной антиретровирусной терапии (HAART), которая одновременно целенаправленно воздействует на различные аспекты репликации вируса, обеспечило возможность в большинстве случаев сдерживать развитие инфекции HIV до хронической, но не приводящей к смерти болезни. Без лечения прогрессирование HIV в AIDS обычно происходит в течение 9-10 лет, приводя к истощению иммунной системы хозяина и возникновению оппортунистических инфекций, обычно приводящих к смерти вскоре после этого. На фоне латентности вируса прерывание HAART неизменно приводит к вирусной отдаче. Более того, даже временные нарушения при терапии могут привести к отбору устойчивых штаммов HIV, не поддающихся контролю доступными средствами. Кроме того, затраты на HAART-терапию являются существенными: в пределах 10000-150000 долларов США на человека в год. Вследствие этого подходы к лечению, непосредственно целенаправленно воздействующие на геном HIV, а не на процесс вирусной репликации, представляют средства, с помощью которых ликвидация резервуаров латентного вируса может обеспечить возможный метод лечения, позволяющий излечение.
Разработка и доставка целенаправленно воздействующей на HIV-1 системы CRISPR-Cas представляет уникальный подход, отличный от существующих средств целенаправленного мутагенеза ДНК, т.е. ZFN и TALEN, с многочисленными терапевтическими значениями. Целенаправленное разрушение и удаление генома HIV-1 с помощью опосредованного CRISPR DSB и вставки/делеции в сочетании с HAART могут обеспечить возможность одновременного предотвращения активного продуцирования вируса, а также истощения скрытых вирусных резервуаров в хозяине.
После интеграции в иммунную систему хозяина система CRISPR-Cas обеспечивает возможность создания устойчивой к HIV-1 субпопуляции, которая даже в отсутствие полной ликвидации вируса может обеспечивать возможность поддержания и восстановления иммунной активности у хозяина. Она потенциально может предотвращать первичную инфекцию путем разрушения вирусного генома, предотвращая продуцирование и интеграцию вируса, представляя собой средство "вакцинации". Мультиплексная природа системы CRISPR-Cas обеспечивает возможность целенаправленного воздействия на многие аспекты генома одновременно в пределах отдельных клеток.
Как и при HAART, формирование устойчивости вируса за счет мутагенеза сводится к минимуму из-за необходимости одновременного приобретения нескольких адаптивных мутаций. Многие штаммы HIV-1 могут подвергаться целенаправленному воздействию одновременно, что сводит к минимуму вероятность развития суперинфекции и предотвращает последующее возникновение новых рекомбинантных штаммов. Опосредуемая нуклеотидами, а не белком специфичность к последовательности у системы CRISPR-Cas обеспечивает возможность быстрого создания терапевтических средств без необходимости существенного изменения механизма доставки.
Для выполнения этой задачи заявители создали направляющие РНК для CRISPR-Cas, которые осуществляли нацеливание на подавляющее большинство геномов HFV-1 с учетом вариантов штаммов HIV-1 для максимального охвата и эффективности. Анализы последовательности консервативности генома у подтипов и вариантов HIV-1 должен был обеспечивать возможность целенаправленного воздействия на фланкирующие консервативные участки в геноме с целью удаления лежащих между ними вирусных последовательностей или индукции мутаций со сдвигом рамки считывания, которые могут нарушать функции вирусных генов.
Заявители осуществляли доставку системы CRISPR-Cas с помощью общепринятой опосредованной аденовирусом или лентивирусом инфекции иммунной системы хозяина. В зависимости от подхода иммунные клетки хозяина могут быть а) выделены, трансдуцированы CRISPR-Cas, подвергнуты отбору и повторно введены хозяину, или b) трансдуцированы in vivo путем системной доставки системы CRISPR-Cas. Первый подход обеспечивает возможность получения популяции устойчивых иммунных клеток, тогда как второй, скорее, целенаправленно воздействует на резервуары латентного вируса в хозяине.

Пример 22. Целенаправленная коррекция дельта-F508 или других мутаций при муковисцидозе
Аспект настоящего изобретения предусматривает фармацевтическую композицию, которая может содержать частицу с CRISPR-Cas для генной терапии и биологически совместимый фармацевтический носитель. В соответствии с другим аспектом способ генной терапии для лечения субъекта, имеющего мутацию в гене CFTR, включает введение терапевтически эффективного количества частицы с CRISPR-Cas для генной терапии в клетки субъекта.
В данном примере демонстрируется перенос генов или доставка генов системы CRISPR-Cas в дыхательные пути нуждающегося в этом субъекта или пациента, страдающего от муковисцидоза или от связанных с муковисцидозом симптомов, с использованием частиц аденоассоциированного вируса (AAV).
План исследования Нуждающиеся во введении субъекты или пациенты: человек, не относящийся к человеку примат, собака, кошка, корова, лошадь, другие домашние животные, родственные животные. В данном исследовании изучали эффективность переноса генов системы CRISPR-Cas с помощью вектора на основе AAV. Заявители определяли уровни трансгена, достаточные для экспрессии гена, и использовали систему CRISPR-Cas, содержащую фермент Cas9, для целенаправленного воздействия на дельта-F508 или другие индуцирующие CFTR мутации.
Подвергающиеся лечению субъекты получали фармацевтически эффективное количество векторной системы на основе AAV в форме аэрозоля на легкое, доставляемое эндобронхиально при самостоятельном дыхании. Контрольные субъекты получали эквивалентное количество векторной системы на основе псевдотипированного AAV с внутренним контрольным геном. Векторную систему можно доставлять вместе с фармацевтически приемлемым или биологически совместимым фармацевтическим носителем. Через три недели или через подходящий временной интервал после введения вектора подвергающихся лечению субъектов тестировали в отношении ослабления связанных с муковисцидозом симптомов.
Заявители использовали аденовирусную частицу или частицу на основе AAV.
Заявители клонировали следующие конструкции с генами, каждый из которых был функционально связан с одной или несколькими регуляторными последовательностями (промотор Cbh или EF1a для Cas9, промотор U6 или H1 для химерной направляющей РНК), в один или несколько векторов на основе аденовируса или AAV или в любой другой совместимый вектор: осуществляющая нацеливание на CFTR с мутацией дельта-508 химерная направляющая РНК (фиг. 31В), матрица для репарации для мутации дельтаР508 (фиг. 31 С) и кодон-оптимизированный фермент Cas9 необязательно с одним или несколькими сигналами или последовательностями ядерной локализации (NLS), например, с двумя (2) NLS.
Идентификация целевого сайта для Cas9
Заявители анализировали локус генома CFTR человека и идентифицировали целевой сайт для Cas9 (фиг. 31А). (РАМ может содержать мотив NGG или NNAGAAW).
Стратегия репарации гена
Заявители вводили векторную систему на основе аденовируса/AAV, содержащую Cas9 (или никазу Cas9) и направляющую РНК, вместе с векторной системой на основе аденовируса/AAV, содержащей матрицу для репарации путем гомологичной рекомбинации, содержащую остаток F508, субъекту посредством одного из обсуждаемых ранее способов доставки. Система CRISPR-Cas направлялась химерной направляющей РНК к CFTR с мутацией дельта-508 и оказывала целенаправленное воздействие на конкретный сайт в локусе генома CFTR, подлежащий внесению однонитевого разрыва или расщеплению. После расщепления матрица для репарации вставляется в сайт расщепления посредством гомологичной рекомбинации, корректирующей делецию, которая приводит к муковисцидозу или вызывает связанные с муковисцидозом симптомы. Данную стратегию для управления доставкой и обеспечения системного встраивания систем CRISPR с помощью соответствующих направляющих РНК можно использовать для целенаправленного воздействия на генные мутации, чтобы редактировать гены, которые вызывают метаболические заболевания и нарушения, заболевания и нарушения печени, почек и заболевания и нарушения, связанные с белками, такие как приведенные в таблице В, или проводить иного рода манипуляции с ними.
Пример 23. Создание клеточной библиотеки с нокаутными генами
В данном примере продемонстрировано, как создать библиотеку клеток, в которой каждая клетка имеет один нокаутный ген.
Заявители получили библиотеку клеток ES, в которой каждая клетка имеет один нокаутный ген, и в полной библиотеке клеток ES все без исключения гены будут нокаутными. Эта библиотека применима для скрининга функции гена в клеточных процессах, а также в заболеваниях.
Для получения этой клеточной библиотеки заявители интегрировали Cas9, управляемый индуцируемым промотором (например, индуцируемым доксициклином промотором), в клетку ES. Кроме того, заявители интегрировали одиночную направляющую РНК, осуществляющую нацеливание на конкретный ген, в клетку ES. Для создания библиотеки клеток ES заявители просто смешивали ES с библиотекой генов, кодирующих направляющие РНК, которые осуществляют нацеливание на каждый ген в геноме человека. Сначала заявители вводили один сайт attB для ВхВ1 в локус AAVS1 в клетках ES человека. Затем заявители использовали интегразу ВхВ1 для облегчения интеграции отдельных генов направляющих РНК в сайт attB для ВхВ1 в локус AAVS1. Для облегчения интеграции каждый ген направляющей РНК размещался на плазмиде, которая несла один сайт attP. Таким образом, ВхВ1 будет рекомбинировать сайт attB в геноме с сайтом attP на плазмиде, содержащей направляющую РНК.
Для создания клеточной библиотеки заявители брали библиотеку клеток, которые имели одиночные интегрированные направляющие РНК, и индуцировали экспрессию Cas9. После индукции Cas9 опосредовала двухнитевой разрыв в сайтах, определенных направляющей РНК. Для подтверждения разнообразия этой клеточной библиотеки заявители выполняли секвенирование всего экзома для того, чтобы убедиться в том, что заявители способны наблюдать мутации в каждом отдельном подвергнутом целенаправленному воздействию гене. Данную клеточную библиотеку можно использовать для ряда применений, в том числе скрининг на основе целой библиотеки, или можно отсортировать в отдельные клоны клеток для облегчения быстрого создания клональных линий клеток с нокаутированными отдельными генами человека.
Пример 24. Конструирование микроводорослей с использованием Cas9
Способы доставки Cas9
Способ 1: заявители доставляли Cas9 и направляющую РНК с использованием вектора, который экспрессирует Cas9 под контролем конститутивного промотора, такого как промотор Hsp70A-Rbc S2 или бета-2-тубулиновый промотор.
Способ 2: заявители доставляли Cas9 и полимеразу Т7 с использованием векторов, которые экспрессируют Cas9 и полимеразу Т7 под контролем конститутивного промотора, такого как промотор Hsp70A-Rbc S2 или бета-2-тубулиновый промотор. Направляющая РНК будет доставляться с использованием вектора, содержащего промотор Т7, управляющий экспрессией направляющей РНК.
Способ 3: заявители доставляли мРНК Cas9 и in vitro транскрибировали направляющую РНК в клетках водорослей. РНК можно транскрибировать in vitro. мРНК Cas9 будет состоять из кодирующего участка для Cas9, а также 3'UTR из Cop1, чтобы обеспечивать стабилизацию мРНК Cas9.
Для гомологичной рекомбинации заявители обеспечивали дополнительную матрицу для репарации с участием гомологичной рекомбинации.
Последовательность для кассеты, управляющей экспрессией Cas9 под контролем бета-2-тубулинового промотора, за которой следует 3' UTR Cop1:
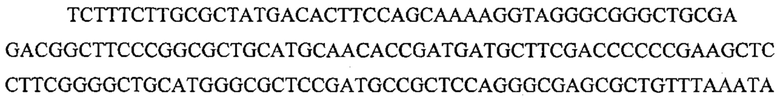



Последовательность для кассеты, управляющей экспрессией полимеразы Т7 под контролем бета-2-тубулинового промотора, за которой следует 3' UTR Cop1:


Последовательность направляющей РНК, управляемая промотором Т7 (промотор Т7, группа N представляет нацеливающую последовательность):

Доставка генов
Для электропорации будут 'использоваться штаммы СС-124 и СС-125 Chlamydomonas reinhardtii из Ресурсного центра штаммов хламидомонад. Протокол электропорации соответствует стандартному рекомендованному протоколу для набора для генной инженерии хламидомонад GeneArt.
Заявители также получали линию Chlamydomonas reinhardtii, которая экспрессирует Cas9 конститутивно. Это можно выполнить при помощи pChlamyl (линеаризованного с использованием PvuI) и отбора в отношении устойчивых к гигромицину колоний. Последовательность для pChlamyl, содержащая Cas9, приведена ниже. В данном пути для достижения нокаута гена необходимо просто доставить РНК в виде направляющей РНК. Для гомологичной рекомбинации заявители доставляли направляющую РНК, а также линеаризованную матрицу для гомологичной рекомбинации.
pChlamyl-Cas9:





Для всех модифицированных клеток Chlamydomonas reinhardtii заявители использовали ПЦР, анализ с помощью нуклеазы SURVEYOR и секвенирование ДНК для подтверждения успешной модификации.
Пример 25. Применение Cas9 для целенаправленного воздействия на разнообразные типы заболеваний
Заболевания, в которые вовлечены мутации в последовательности, кодирующей белок
Целенаправленное воздействие на доминантные нарушения можно оказывать путем инактивации доминантно-негативного аллеля. Заявители использовали Cas9 для целенаправленного воздействия на уникальную последовательность доминантно-негативного аллеля и введения мутации посредством NHEJ. Индуцированная NHEJ вставка/делеция может быть способна к введению мутации сдвига рамки считывания в доминантно-негативном аллеле и устранению доминантно-негативного белка. Это может функционировать, если ген является гаплодостаточным (например, в случае вызванной мутацией MYOC глаукомы и болезни Гентингтона).
Целенаправленное воздействие на рецессивные нарушения можно оказывать путем репарации связанной с заболеванием мутации в обоих аллелях. Для делящихся клеток заявители использовали Cas9 для введения двухнитевых разрывов около сайта с мутацией и повышения скорости гомологичной рекомбинации с использованием экзогенной матрицы для рекомбинации. Для делящихся клеток этого можно достичь с использованием фермента с мультиплексной никазной активностью для катализа замены мутантной последовательности в обоих аллелях с помощью опосредованного NHEJ лигирования фрагмента экзогенной ДНК, несущего комплементарные "липкие" концы.
Заявители также применяли Cas9 для введения защитных мутаций (например, инактивации CCR5 для предупреждения HIV-инфекции, инактивации PCSK9 для снижения уровня холестерина или введение А673Т в АРР для снижения вероятности возникновения болезни Альцгеймера).
Заболевания, в которые вовлечены некодирующие последовательности
Заявители применяли Cas9 для разрушения некодирующих последовательностей в промоторном участке, для изменения сайтов связывания транскрипционных факторов и для изменения энхансерных или репрессорных элементов. Например, Cas9 можно использовать для вырезания энхансера EHS1 K1f1 в гемопоэтических стволовых клетках для снижения уровней BCL11a и повторной активации экспрессии гена фетального глобина в дифференцированных эритроцитах.
Заявители также применяли Cas9 для разрушения функциональных мотивов в 5'- или 3'-нетранслируемых участках. Например, для лечения миотонической дистрофии Cas9 можно использовать для удаления экспансий повторов CTG в гене DMPK.
Пример 26. Мультиплексная никаза
Аспекты оптимизации и информация о Cas9, подробно описанные в данной заявке, также можно использовать для создания никаз Cas9. Заявители использовали никазы Cas9 в комбинации с парами направляющих РНК для создания двухнитевых разрывов ДНК с определенными "липкими" концами. Если используют две пары направляющих РНК, представляется возможным вырезание лежащего между ними фрагмента ДНК. Если экзогенный фрагмент ДНК расщепляется двумя парами направляющих РНК с созданием совместимых "липких" концов с геномной ДНК, то экзогенный фрагмент ДНК можно лигировать в геномную ДНК с заменой вырезаемого фрагмента. Например, это можно использовать для удаления экспансии тринуклеотидных повторов в гене гентингтина (НТТ) для лечения болезни Гентингтона.
Если обеспечивают экзогенную ДНК, которая несет меньшее число повторов CAG, то представляется возможным получение фрагмента ДНК, который несет такие же "липкие" концы и который можно лигировать в геномный локус НТТ, заменяя им вырезаемый фрагмент.

Лигирование экзогенного фрагмента ДНК в геном не требует механизмов гомологичной рекомбинации, и, таким образом, этот способ можно применять в постмитотических клетках, таких как нейроны.
Пример 27. Доставка системы CRISPR
Cas9 и ее химерную направляющую РНК или комбинацию tracrRNA и crRNA можно доставлять в виде либо ДНК, либо РНК. Доставку и Cas9, и направляющей РНК в виде молекул РНК (нормальной или содержащей модификации оснований или каркаса) можно использовать для уменьшения количества времени, в течение которого белок Cas9 продолжает находиться в клетке. Это может снижать уровень активности в отношении нецелевого расщепления в целевой клетке. Поскольку при доставке Cas9 в виде мРНК требуется время для трансляции в белок, преимущественной может быть доставка направляющей РНК через несколько часов после доставки мРНК Cas9 для обеспечения максимального уровня направляющей РНК, доступной для взаимодействия с белком Cas9.
В ситуациях, когда количество направляющей РНК ограничено, желательным может быть введение Cas9 в виде мРНК, а направляющей РНК в виде кассеты экспрессии ДНК с промотором, управляющим экспрессией направляющей РНК. Таким образом, количество доступной направляющей РНК будет увеличиваться в результате транскрипции.
Для введения Cas9 (ДНК или РНК) и направляющей РНК (ДНК или РНК) в клетку-хозяина можно использовать ряд систем доставки. Они включают применение липосом, вирусных векторов, электропорации, наночастиц, нанопроволок (Shalek et al., Nano Letters, 2012), экзосом. Липосомы по типу "молекулярного троянского коня" (Pardridge et al., Cold Spring Harb Protoc; 2010; doi:10.1101/pdb.prot5407) можно использовать для доставки Cas9 и направляющей РНК через гематоэнцефалический барьер.
Пример 28. Терапевтические стратегии для нарушений, связанных с экспансией тринуклеотидных повторов
Как ранее упоминалось в данной заявке, целевой полинуклеотид комплекса CRISPR может содержать ряд связанных с заболеванием генов и полинуклеотидов, и некоторые из этих связанных с заболеванием генов могут относиться к группе наследственных заболеваний, называемых нарушениями, связанными с тринуклеотидными повторами (также называемых нарушениями, связанными с экспансией тринуклеотидных повторов, нарушениями, связанными с экспансией триплетных повторов, или нарушениями, связанными с реитерацией кодонов).
Эти заболевания вызваны мутациями, при которых число тринуклеотидных повторов в некоторых генах превышает нормальное стабильное пороговое значение, которое обычно может различаться в гене. Обнаружение большего числа нарушений, связанных с экспансией повторов, обеспечило возможность подразделения этих нарушений на ряд категорий на основании лежащих в их основе сходных характеристик. Болезнь Гентингтона (HD) и спиноцеребеллярная атаксия, которые вызваны экспансией повтора CAG в кодирующих белок частях конкретных генов, включены в категорию I. В категорию II включены заболевания или нарушения, связанные с экспансиями, которые, как правило, делают их фенотипически разнообразными и включают экспансии, величина которых обычно является небольшой и которые часто обнаруживаются в экзонах генов. Категория III включает нарушения или заболевания, которые характеризуются намного большими экспансиями повторов, чем любые нарушения или заболевания из категории I или II, которые обычно имеют место за пределами кодирующих белок участков. Примеры заболеваний или нарушений из категории III включают, без ограничения, синдром ломкой Х-хромосомы, миотоническую дистрофию, две формы спиноцеребеллярной атаксии, ювенильную миоклоническую эпилепсию и атаксию Фридрейха.
Подобные терапевтические стратегии, такие как упоминаемые ниже для атаксии Фридрейха, можно также применять для воздействия на другие нарушения, связанные с тринуклеотидными повторами или с экспансией. Например, другим заболеванием, связанным с триплетными повторами, которое можно лечить с использованием практически идентичной стратегии, является миотоническая дистрофия 1 (DM1) с экспансией мотива CTG в 3' UTR. При атаксии Фридрейха заболевание обусловлено экспансией тринуклеотидов GAA в первом интроне гена фратаксина (FXN). Одной терапевтической стратегией применения CRISPR является вырезание повтора GAA из первого интрона. Как полагают, экспансия повтора GAA воздействует на структуру ДНК и приводит к усилению образования гетерохроматина, что выключает ген фратаксина (фиг. 32А).
Преимущества, обеспечивающие конкурентоспособность по сравнению с другими терапевтическими стратегиями, перечислены ниже.
Нокдаун с использованием siRNA в этом случае не доступен, поскольку заболевание обусловлено пониженной экспрессией фратаксина. В настоящее время исследуется генная терапия с использованием вирусов. Векторы на основе HSV-1 использовали для доставки гена фратаксина в животных моделях, и они продемонстрировали терапевтический эффект. Тем не менее, долговременная эффективность доставки фратаксина на основе вируса подвержена нескольким проблемам: во-первых, сложно регулировать экспрессию фратаксина, чтобы она соответствовала естественным уровням у здоровых индивидов, и во-вторых, долговременная сверхэкспрессия фратаксина приводит к гибели клеток.
Нуклеазы можно использовать для вырезания повтора GAA для восстановления здорового генотипа, но стратегии с использованием нуклеазы с "цинковыми пальцами" и TALEN требуют доставки двух пар высокоэффективных нуклеаз, что является сложным в отношении как доставки, так и конструирования нуклеаз (сложно достичь эффективного вырезания геномной ДНК с помощью ZFN или TALEN).
В отличие от приведенных выше стратегий, система CRISPR-Cas имеет явные преимущества. Фермент Cas9 является более эффективным и более мультиплексируемым, под чем подразумевается, что он одновременно может целенаправленно воздействовать на одну или несколько мишеней. На сегодняшний день вырезание геномной ДНК с помощью Cas9 в клетках человека обеспечивается с эффективностью >30%, и эффективность может составлять вплоть до 30%, а также она может быть улучшена в будущем. Кроме того, что касается определенных нарушений, связанных с тринуклеотидными повторами, таких как болезнь Гентингтона (HD), на тринуклеотидные повторы в кодирующем участке можно воздействовать, если существуют различия между двумя аллелями. В частности, если пациент с HD является гетерозиготным по мутантному НТТ, и существуют различия по нуклеотидам, такие как SNP между wt и мутантными аллелями НТТ, то Cas9 можно использовать для специфического целенаправленного воздействия на мутантный аллель НТТ. ZFN или TALEN не будут иметь возможности отличать два аллеля на основании различий по одному основанию.
При заимствовании стратегии применения фермента CRISPR-Cas 9 для воздействия на атаксию Фридрейха заявители сконструировали ряд направляющих РНК, которые осуществляют нацеливание на сайты, фланкирующие экспансию GAA, и выбирали наиболее эффективные и специфичные из них (фиг. 32В).
Заявители доставляли комбинацию направляющих РНК, осуществляющих нацеливание на интрон 1 в FXN, вместе с Cas9 для опосредования вырезания участка с экспансией GAA. AAV9 можно использовать для опосредования эффективной доставки Cas9 и в спинной мозг.
Если Alu-элемент, смежный с экспансией GAA, считается важным, могут существовать ограничения по числу сайтов, на которые можно целенаправленно воздействовать, но заявители могут применять стратегии во избежание его разрушения.
Альтернативные стратегии
Вместо того, чтобы модифицировать геном, используя Cas9, заявители могут также непосредственно активировать ген FXN с использованием ДНК-связывающего домена на основе Cas9 (лишенной нуклеазной активности) для целенаправленного воздействия на домен активации транскрипции гена FXN.
Пример 29. Стратегии сведения к минимуму нецелевого расщепления при использовании Cas9-никазы
Как упоминалось выше в данной заявке, Cas9 можно подвергнуть мутации для опосредования расщепления одной нити с помощью одной или нескольких из следующих мутаций: D10A, Е762А и Н840А.
Для опосредования нокаута гена с помощью NHEJ заявители использовали никазный вариант Cas9 вместе с двумя направляющими РНК. Нецелевое надрезание каждой отдельной направляющей РНК преимущественно может репарироваться без мутации, двухнитевые разрывы (которые могут привести к мутациям посредством NHEJ) возникают только тогда, когда целевые сайты являются смежными друг с другом. Поскольку двухнитевые разрывы, вводимые при двойном надрезании не являются "затупленными", совместная экспрессия ферментов, осуществляющих процессинг концевых участков, таких как TREX1, будет повышать уровень активности NHEJ.
Следующий перечень мишеней в форме таблицы представлен для генов, вовлеченных в следующие заболевания.
Болезнь Лафора - целенаправленное воздействие на GSY1 или PPP1R3C (PTG) для снижения уровня гликогена в нейронах.
Гиперхолестеринемия - целенаправленное воздействие на PCSK9.
Целевые последовательности приведены попарно (L и R) с различным числом нуклеотидов в спейсере (0-3 п.о.). Каждый спейсер можно использовать сам по себе с Cas9 дикого типа для введения двухнитевого разрыва в целевом локусе.

Альтернативные стратегии для улучшения стабильности направляющей РНК и повышения специфичности
1. Нуклеотиды в направлении 5' относительно направляющей РНК можно соединить посредством тиоэфирных связей, а не фосфоэфирных связей, как в натуральной РНК. Тиоэфирная связь может предотвращать расщепление направляющей РНК эндогенным аппаратом для разрушения РНК.
2. В качестве нуклеотидов в направляющей последовательности (20 п.о. на 5'-конце) направляющей РНК можно использовать мостиковые нуклеиновые кислоты (BNA) в качестве оснований для улучшения специфичности связывания.
Пример 30. CRISPR-Cas для быстрого мультиплексного редактирования генома
Аспекты настоящего изобретения относятся к протоколам и способам, с помощью которых можно тестировать эффективность и специфичность модификации генов в пределах 3-4 дней после конструирования мишени, а клональные линии модифицированных клеток можно получить в пределах 2-3 недель.
Программируемые нуклеазы представляют собой эффективные технологии для опосредования изменения генома с высокой точностью. Направляемую РНК нуклеазу Cas9 из микробной системы адаптивного иммунитета CRISPR можно использовать для облегчения эффективного редактирования генома в эукариотических клетках путем простого определения 20-нуклеотидной нацеливающей последовательности в ее направляющей РНК. Заявители описали набор протоколов для применения Cas9, чтобы облегчить эффективное редактирование генома в клетках млекопитающих и создавать линии клеток для последующих функциональных исследований. Начиная с конструирования мишени, эффективной и специфичной модификации гена можно достичь в пределах 3-4 дней, а клональные линии модифицированных клеток можно получить в пределах 2-3 недель.
Возможность конструирования биологических систем и организмов имеет огромный потенциал для применений в фундаментальной науке, медицине и биотехнологии. Программируемые специфичные к последовательности эндонуклеазы, которые облегчают точное редактирование эндогенных локусов генома, теперь дают возможность систематического исследования генетических элементов и каузальных генетических изменений у широкого спектра видов, в том числе у тех, которые ранее не поддавались обработке генетическими способами. В последние годы возник ряд технологий редактирования генома, в том числе нуклеазы с "цинковыми пальцами" (ZFN), подобные активаторам транскрипции эффекторные нуклеазы (TALEN) и направляемая РНК нуклеазная система CRISPR-Cas. В первых двух технологиях используется традиционная стратегия связывания эндонуклеазных каталитических доменов с модулярными ДНК-связывающими белками для индукции целенаправленных двухнитевых разрывов (DSB) ДНК в конкретных локусах генома. В отличие от этого, Cas9 представляет собой нуклеазу, направляемую небольшими РНК посредством спаривания оснований по Уотсону-Крику с целевой ДНК, представляя систему, которая является простой для конструирования, эффективной и хорошо подходящей для высокопроизводительного и мультиплексного редактирования генов для ряда типов клеток и организмов. В данном документе заявители описали набор протоколов для применения недавно разработанной нуклеазы Cas9, чтобы облегчить эффективное редактирование генома в клетках млекопитающих и создавать линии клеток для последующих функциональных исследований.
Подобно ZFN и TALEN, Cas9 способствует редактированию генома путем стимуляции DSB в целевых локусах генома. При расщеплении Cas9 целевой локус подвергается одному из двух основных путей репарации повреждений ДНК, пути склонного к ошибкам негомологичного соединения концов (NHEJ) или пути высокоточной репарации с участием гомологичной рекомбинации (HDR). Оба пути можно использовать для достижения требуемого результата редактирования.
NHEJ: в отсутствие матрицы для репарации в процессе NHEJ происходит повторное лигирование DSB, которое может оставлять "рубец" в виде мутаций по типу вставок/делеций. Данный способ можно использовать для достижения нокаутирования генов, поскольку вставки/делеции, возникающие в пределах кодирующего экзона, могут приводить к мутациям со сдвигом рамки считывания и преждевременному стоп-кодону. Множественные DSB также можно использовать для опосредования делеций большего размера в геноме.
HDR: репарация с участием гомологичной рекомбинации является альтернативным NHEJ основным путем репарации ДНК. Хотя HDR обычно происходит с более низкими частотами, чем NHEJ, его можно приспособить для создания точных определенных модификаций в целевом локусе в присутствии экзогенно введенной матрицы для репарации. Матрица для репарации может присутствовать либо в виде двухнитевой ДНК, сконструированной подобно общепринятым целенаправленно воздействующим на ДНК конструкциям с гомологичными плечами, фланкирующими последовательность вставки, либо в виде однонитевых олигонуклеотидов ДНК (ssODN). Последние обеспечивают эффективный и простой способ создания небольших редакционных изменений в геноме, таких как введение однонуклеотидных мутаций для зондирования каузальных генетических изменений. В отличие от NHEJ, HDR обычно активен только в делящихся клетках, и его эффективность варьирует в зависимости от типа и состояния клетки.
Обзор CRISPR: система CRISPR-Cas, напротив, является как минимум двухкомпонентной системой, состоящей из нуклеазы Cas9 и короткой направляющей РНК. Для повторного целенаправленного воздействия Cas9 на различные локусы или одновременного редактирования нескольких генов требуется просто клонировать другой олигонуклеотид размером 20 п.о. Хотя специфичность нуклеазы Cas9 подробно еще не освещалась, простое спаривание оснований по Уотсону-Крику в системе CRISPR-Cas, вероятно, является более предсказуемым, нежели у доменов ZFN или TALEN.
CRISPR-Cas типа II (короткие палиндромные повторы, регулярно расположенные группами) представляет собой бактериальную систему адаптивного иммунитета, в которой Cas9 используется для расщепления чужеродных генетических элементов. Cas9 направляется парой некодирующих РНК, переменной crRNA и необходимой вспомогательной tracrRNA. CrRNA содержит направляющую последовательность из 20 нуклеотидов, определяющую специфичность по расположению целевой ДНК посредством спаривания оснований по Уотсону-Крику. В нативной бактериальной системе несколько crRNA совместно транскрибируются для направления Cas9 на различные мишени. В системе CRISPR-Cas, полученной из Streptococcus pyogenes, целевая ДНК должна находиться непосредственно перед 5'-мотивом NGG/NRG, прилегающим к протоспейсеру (РАМ), который может отличаться в других системах CRISPR.
CRISPR-Cas воспроизводят в клетках млекопитающих посредством гетерологичной экспрессии кодон-оптимизированного для человека Cas9 и необходимых компонентов РНК. Кроме того, crRNA и tracrRNA можно слить для создания химерной синтетической направляющей РНК (sgRNA). Cas9 можно, таким образом, перенаправить на любую представляющую интерес мишень путем изменения направляющей последовательности размером 20 нуклеотидов в sgRNA.
С учетом простоты реализации и способности к мультиплексному действию Cas9 использовали для получения подвергнутых методам генной инженерии эукариотических клеток, несущих специфические мутации, посредством как NHEJ, так и HDR. Кроме того, прямая инъекция sgRNA и мРНК, кодирующей Cas9, в эмбрионы обеспечила возможность быстрого получения трансгенных мышей с несколькими модифицированными аллелями; эти результаты дают перспективу для редактирования в организмах, которые в ином случае не поддаются обработке генетическими способами.
Методами генной инженерии был разработан мутантный Cas9 с нарушением в одном из своих каталитических доменов для внесения однонитевых разрывов, а не для расщепления в ДНК, что обеспечивает возможность внесения однонитевых разрывов и преимущественной репарации посредством HDR, что потенциально позволяет избежать нежелательных мутации по типу вставок/делеций в результате нецелевых DSB. Кроме того, мутант Cas9 с подвергнутыми мутации обоими расщепляющими ДНК каталитическими остатками был приспособлен для обеспечения возможности регуляции транскрипции у Е. coli, что демонстрирует потенциал функционализации Cas9 для разнообразных применений. Определенные аспекты настоящего изобретения относятся к конструированию и применению Cas9 для мультиплексного редактирования в клетках человека.
Заявители обеспечили кодон-оптимизированный для человека, фланкированный последовательностями ядерной локализации Cas9 для облегчения редактирования генов эукариот. Заявители описали соображения, которые следует учитывать при конструировании направляющей последовательности из 20 нуклеотидов, протоколы для быстрого конструирования и функциональной валидации sgRNA и, наконец, применение нуклеазы Cas9 для опосредования модификаций генома как на основе NHEJ, так и HDR в линиях клеток почки человеческого эмбриона (HEK-293FT) и стволовых клеток человека (HUES9). Этот протокол можно аналогичным образом применить к другим типам клеток и организмам.
Выбор мишени для sgRNA Существуют два главных фактора, которые необходимо учитывать при выборе направляющей последовательности из 20 нуклеотидов для целенаправленного воздействия на ген: 1) целевая последовательность должна находиться перед 5'-NGG РАМ для Cas9 S. pyogenes и 2) направляющие последовательности следует выбирать со сведением к минимуму нецелевой активности. Заявители обеспечили инструмент конструирования для нацеливания Cas9 в режиме онлайн, в который вводят искомую представляющую интерес последовательность и он идентифицирует подходящие целевые сайты. Для экспериментальной оценки нецелевых модификаций для каждой sgRNA заявители также обеспечили предсказанные путем вычислений нецелевые сайты для каждой предполагаемой мишени, ранжированные согласно проведенному заявителями количественному анализу специфичности в отношении эффектов идентичности, положения и распределения несовпадений при спаривании оснований.
Подробная информация о предсказанных путем вычислений нецелевых сайтах выглядит следующим образом.
Соображения, которые следует учитывать для активностей в отношении нецелевого расщепления. Подобно другим нуклеазам Cas9 может расщеплять нецелевые ДНК-мишени в геноме с пониженной частотой. Степень, с которой данная направляющая последовательность проявляет нецелевую активность, зависит от комбинации факторов, включающих концентрацию фермента, термодинамические характеристики конкретной используемой направляющей последовательности и распространенность подобных последовательностей в целевом геноме. Для стандартного применения Cas9 важно учитывать пути для сведения к минимуму степени нецелевого расщепления, а также для возможности выявлять наличие нецелевого расщепления.
Сведение к минимуму нецелевой активности: для применения в линиях клеток заявители рекомендовали следующие две стадии для снижения степени нецелевой модификации генома. Во-первых, при использовании разработанного заявителями онлайн-инструмента для выбора мишени CRISPR возможно путем вычислений оценить вероятность того, что данная направляющая последовательность имеет нецелевые сайты. Эти анализы осуществляют посредством поиска методом полного перебора в геноме в отношении нецелевых последовательностей, которые представляют собой последовательности, подобные направляющей последовательности. Всестороннее экспериментальное исследование эффекта несовпадения оснований между sgRNA и ее целевой ДНК выявило, что допустимость несовпадения является 1) зависимой от положения - 8-14 п.о. на 3'-конце направляющей последовательности несовпадения являются менее допустимыми, чем у оснований на 5'-конце; 2) зависимой от количества - обычно не допускаются более 3 несовпадений; 3) зависимой от направляющей последовательности - в случае некоторых направляющих последовательностях несовпадения являются менее допустимыми, чем в случае других; и 4) зависимой от концентрации - нецелевое расщепление высокочувствительно к количеству трансфицированной ДНК. Разработанный заявителями веб-инструмент для анализа целевых сайтов (доступный на веб-сайте genome-engineering.org/tools) объединяет эти критерии для обеспечения предсказания вероятных нецелевых сайтов в целевом геноме. Во-вторых, заявители рекомендовали подбор количества Cas9 и плазмиды для экспрессии sgRNA для сведения к минимуму нецелевой активности.
Выявление нецелевых активностей: используя разработанный заявителями веб-инструмент для нацеливания CRISPR, можно создать перечень наиболее вероятных нецелевых сайтов, а также праймеров, осуществляя анализ данных сайтов с помощью SURVEYOR или анализа путем секвенирования. Для изогенных клонов, полученных с использованием Cas9, заявители настоятельно рекомендуют секвенирование этих кандидатных нецелевых сайтов для проверки в отношении любых нежелательных мутаций. Стоит отметить, что в сайтах, которые не включены в перечень прогнозируемых кандидатов, могут присутствовать нецелевые модификации, и полногеномное секвенирование следует проводить для полного подтверждения отсутствия нецелевых сайтов. Более того, в мультиплексных анализах, в которых несколько DSB индуцируют в одном и том же геноме, могут существовать низкие скорости событий транслокации, и их можно оценить с использованием ряда методик, таких как глубокое секвенирование.
Онлайн-инструмент обеспечивает последовательности для всех олигонуклеотидов и праймеров, необходимых для 1) получения конструкций sgRNA, 2) анализа эффективности целевой модификации и 3) оценки расщепления в возможных нецелевых сайтах. Стоит отметить, что вследствие того, что промотор U6 для РНК-полимеразы III, используемый для экспрессии sgRNA, предпочитает гуаниновый (G) нуклеотид в качестве первого основания в его транскрипте, дополнительный G прикрепляют на 5'-конце sgRNA, если направляющая последовательность из 20 нуклеотидов не начинается с G.
Подходы к конструированию и доставке sgRNA: в зависимости от требуемого применения sgRNA можно доставлять либо в виде 1) ПЦР-ампликонов, содержащих кассету экспрессии, либо в виде 2) экспрессирующих sgRNA плазмид. При доставке sgRNA с использованием ПЦР прикрепляют последовательность специальной sgRNA на обратный праймер для ПЦР, используемый для амплификации матрицы с промотором U6. Полученный в результате ампликон можно совместно трансфицировать с плазмидой, содержащей Cas9 (РХ165). Этот способ является оптимальным для быстрого скрининга нескольких кандидатных sgRNA, поскольку процедуры трансфекции клеток для функционального тестирования можно осуществлять всего лишь спустя часы после получения кодирующих sgRNA праймеров. Поскольку этот простой способ избегает потребности в клонировании с использованием плазмид и подтверждении последовательности, он хорошо подходит для тестирования или совместной трансфекции большого количества sgRNA для создания больших библиотек нокаутных генов или для других чувствительных к масштабу применений. Следует обратить внимание, что кодирующие sgRNA праймеры имеют длину более 100 п.о. по сравнению с олигонуклеотидами длиной ~20 п.о., требующимися для доставки sgRNA с использованием плазмид.
Конструирование плазмид для экспрессии sgRNA также является простым и быстрым, включающим одну стадию клонирования с парой частично комплементарных олигонуклеотидов. После отжига пар олигонуклеотидов полученные в результате направляющие последовательности можно встроить в плазмиду, несущую как Cas9, так и неизменяемый каркас, несущий остальную часть последовательности sgRNA (РХ330). Плазмиды для трансфекции также можно модифицировать для обеспечения возможности получения вируса для доставки in vivo.
Помимо ПЦР и способов доставки с использованием плазмид, как Cas9, так и sgRNA можно вводить в клетки в виде РНК.
Конструирование матрицы для репарации: традиционно, целенаправленные модификации ДНК требовали применения донорных матриц для репарации на основе плазмид, которые содержат гомологичные плечи, фланкирующие сайт изменения. Гомологичные плечи с каждой стороны могут варьировать по длине, но, как правило, имеют длину более 500 п.о. Этот способ можно применять для создания модификаций большого размера, в том числе вставок репортерных генов, таких как флуоресцентные белки или маркеры устойчивости к антибиотикам. Разработка и конструирование плазмид для целенаправленного воздействия были описаны в других местах в данном документе.
В последнее время однонитевые олигонуклеотиды ДНК (ssODN) использовали вместо плазмид для целенаправленного воздействия в случае коротких модификаций в пределах определенного локуса без клонирования. Для достижения высоких показателей эффективности HDR ssODN содержат фланкирующие последовательности по меньшей мере из 40 п.о. с каждой стороны, которые являются гомологичными целевому участку и которые могут быть ориентированы либо в смысловом, либо в антисмысловом направлении относительно целевого локуса.
Функциональное тестирование
Анализ с помощью нуклеазы SURVEYOR: заявители выявляли мутации по типу вставок/делеций либо посредством анализа с помощью нуклеазы SURVEYOR, либо посредством секвенирования ПЦР-ампликона. Разработанный заявителями онлайн-инструмент для нацеливания CRISPR обеспечивает рекомендованные праймеры для обоих подходов. Тем не менее, праймеры для анализа с помощью SURVEYOR или секвенирования, также можно сконструировать вручную для амплификации представляющего интерес участка из геномной ДНК и во избежание получения неспецифических ампликонов с использованием Primer-BLAST от NCBI. Праймеры для анализа с помощью SURVEYOR должны быть сконструированы для амплификации 300-400 п.о. (для общего ампликона 600-800 п.о.) с каждой стороны мишени Cas9, чтобы обеспечить возможность четкой визуализации полученных после расщепления полос с помощью гель-электрофореза. Чтобы предотвратить избыточное образование димеров праймеров, праймеры для анализа с помощью SURVEYOR должны быть сконструированы таким образом, чтобы они, как правило, имели длину до 25 нуклеотидов с температурами плавления ~60°С. Заявители рекомендуют тестирование каждой пары праймеров-кандидатов в отношении специфических ПЦР-ампликонов, а также в отношении отсутствия неспецифического расщепления во время процесса расщепления нуклеазой SURVEYOR.
HDR, опосредованная плазмидами или ssODN. HDR можно выявить с помощью ПЦР-амплификации и секвенирования модифицированного участка. Праймеры для ПЦР для этой цели следует отжигать за пределами участка, охватываемого гомологичными плечами, во избежание ложного выявления остаточной матрицы для репарации (прямой и обратный праймеры для HDR, фиг. 30). Для опосредованной ssODN HDR можно использовать ПЦР праймеры, полученные с помощью SURVEYOR.
Выявление вставок/делеций или HDR с помощью секвенирования: заявители выявляли целенаправленные модификации генома либо с помощью секвенирования по Сэнгеру, либо с помощью глубокого секвенирования нового поколения (NGS). Что касается первого из вышеупомянутых, геномную ДНК из модифицированного участка можно амплифицировать с использованием либо праймеров для анализа с помощью SURVEYOR, либо праймеров для HDR. Ампликоны следует субклонировать в плазмиду, такую как pUC19, для трансформации; отдельные колонии можно подвергнуть секвенированию для выявления клонального генотипа.
Заявители сконструировали используемые при секвенировании нового поколения (NGS) праймеры для более коротких ампликонов, как правило, с размером в диапазоне 100-200 п.о. Для выявления мутаций в результате NHEJ важным является конструирование праймеров по меньшей мере с 10-20 п.о. между премирующими участками и целевым сайтом Cas9 для обеспечения возможности выявления более длинных вставок/делеций. Заявители обеспечивают рекомендации для двухстадийного способа ПЦР, чтобы прикрепить адаптеры со штрих-кодами для мультиплексного глубокого секвенирования. Заявители рекомендуют платформу Illumina ввиду обычно характерных для нее низких уровней ложноположительных вставок/делеций. Затем можно провести анализ нецелевой активности (описанный ранее) с помощью программ выравнивания ридов, таких как ClustalW, Geneious, или простых скриптов для анализа последовательностей.
Материалы и реагенты
Получение sgRNA
Сверхвысокой очистки, не содержащая ДНКаз/РНКаз вода (Life Technologies, кат. №10977-023)
Слитая полимераза Herculase II (Agilent Technologies, кат. №600679)
ВАЖНО. Стандартная Taq-полимераза, которая лишена 3'-5' экзонуклеазной корректирующей активности, характеризуется более низкой точностью и может приводить к ошибкам при амплификации. Herculase II представляет собой высокоточную полимеразу (эквивалентную по точности Pfu), которая дает высокий выход продукта ПЦР при минимальной оптимизации. Можно заменить другими высокоточными полимеразами.
Реакционный буфер для Herculase II (5х; Agilent Technologies, включенный с полимеразой)
Смесь раствора dNTP (25 мМ каждого; Enzymatics, кат. №N205L)
MgCl2 (25 мМ; ThermoScientific, кат. №R0971)
Набор для экстракции из геля QIAquick gel extraction kit (Qiagen, кат. №28704)
Набор QIAprep spin miniprep kit (Qiagen, кат. №27106)
Сверхчистый ТВЕ буфер (10Х; Life Technologies, кат. №15581-028)
LE агароза SeaKem (Lonza, кат. №50004)
Краситель ДНК SYBR Safe (10000х; Life Technologies, кат. №S33102)
ДНК-маркер длиной более 1 т.п.н. (Life Technologies, кат. №10787-018)
Загрузочный буфер для синего и оранжевого красителей TrackIt CyanOrange (Life Technologies, кат. №10482-028)
Рестрикционный фермент FastDigest BbsI (BpiI) (Fermentas/ThermoScientific, кат. № FD1014)
Буфер Fermentas Tango Buffer (Fermentas/ThermoScientific, кат. №BY5)
DL-дитиотреитол (DTT; Fermentas/ThermoScientific, кат. №R0862)
ДНК-лигаза T7 (Enzymatics, кат. №L602L)
Важно: не заменять на используемую чаще лигазу Т4. Лигаза Т7 характеризуется в 1000 раз более высокой активностью на "липких" концах, чем на "тупых" концах, и более высокой общей активностью, чем коммерчески доступные концентрированные лигазы Т4.
2Х буфер для быстрого лигирования Т7 2Х Rapid Ligation Buffer (включен в ДНК-лигазу Т7, Enzymatics, кат. №L602L)
Полинуклеотид-киназа Т4 (New England Biolabs, кат. №M0201S)
Реакционный буфер для ДНК-лигазы Т4 (10Х; New England Biolabs, кат. №B0202S)
Аденозин-5'-трифосфат (10 мМ; New England Biolabs, кат. №P0756S)
АТФ-зависимая ДНКаза PlasmidSafe (Epicentre, кат. №E3101K)
Химически компетентная Escherichia coli (Е. coli) One Shot Stbl3 (Life Technologies, кат. №C7373-03)
Среда SOC (New England Biolabs, кат. №B9020S)
Среда LB (Sigma, кат. №L3022)
Агаровая среда LB (Sigma, кат. №L2897)
Ампициллин, стерилизованный фильтрованием (100 мг мл-1; Sigma, кат. №А5354)
Культура клеток млекопитающих
Клетки HEK293FT (Life Technologies, кат. №R700-07)
Минимальная среда Игла в модификации Дульбекко (DMEM, 1X, с высоким содержанием глюкозы; Life Technologies, кат. №10313-039)
Минимальная среда Игла в модификации Дульбекко (DMEM, 1X, с высоким содержанием глюкозы, без фенолового красного; Life Technologies, кат. №31053-028)
Фосфатно-солевой буферный раствор Дульбекко (DPBS, 1X; Life Technologies, кат. №14190-250)
Фетальная бычья сыворотка, разбавленная и инактивированная нагреванием (Life Technologies, кат. №10438-034)
Среда с пониженным содержанием сыворотки Opti-MEM I (FBS; Life Technologies, кат. №11058-021)
Пенициллин-стрептомицин (100х; Life Technologies, кат. №15140-163)
TrypLE™ экспрессировать (1X, без фенолового красного; Life Technologies, кат. №12604-013)
Реагент для трансфекции Lipofectamine 2000 (Life Technologies, кат. №11668027)
Набор Amaxa SF S для трансфекции линий клеток на 4D-Nucleofector® X (32 RCT; Lonza, кат. №V4XC-2032)
Линия клеток HUES 9 (HARVARD STEM CELL SCIENCE)
Матрикс базальной мембраны Geltrex с пониженным содержанием ростовых факторов и не содержащий LDEV (Life Technologies, кат. №А1413201)
Среда mTeSR1 (Stemcell Technologies, кат. №05850)
Раствор для отслоения клеток Accutase (Stemcell Technologies, кат. №07920)
Ингибитор ROCK (Y-27632; Millipore, кат. №SCM075)
Набор для трансфекции Amaxa Р3 Primary клетка 4D-Nucleofector® X Kit S (32 RCT; Lonza кат. №V4XP-3032)
Анализ генотипирования
Раствор для экстракции ДНК QuickExtract (Epicentre, кат. №QE09050)
Праймеры для ПЦР для анализа с помощью SURVEYOR, анализа RFLP или секвенирования (смотри таблицу праймеров)
Слитая полимераза Herculase II (Agilent Technologies, кат. №600679)
ВАЖНО. Поскольку анализ с помощью Surveyor является чувствительным к несовпадениям по одному основанию, особо важным является использование высокоточной полимеразы. Можно заменить другими высокоточными полимеразами.
Реакционный буфер для Herculase II (5х; Agilent Technologies, включенный с полимеразой)
Смесь раствора dNTP (25 мМ каждого; Enzymatics, кат. №N205L)
Набор для экстракции из геля QIAquick gel extraction kit (Qiagen, кат. №28704)
Буфер для Taq (10х; GenScript, кат. №B0005)
Набор для выявления мутаций с помощью SURVEYOR для стандартного гель-электрофореза (Transgenomic, кат. №706025)
Сверхчистый ТВЕ буфер (10х; Life Technologies, кат. №15581-028)
LE агароза SeaKem (Lonza, кат. №50004)
Гели с 4-20% ТВЕ. толщиной 1,0 мм, 15 лунок (Life Technologies, кат. №ЕС62255ВОХ)
Буфер для образца ТВЕ Novex®, с высокой плотностью (5Х; Life Technologies, кат. №LC6678)
Краситель SYBR Gold для окрашивания нуклеиновых кислот в геле (10000Х; Life Technologies, кат. №S-11494)
ДНК-маркер длиной более 1 т.п.н. (Life Technologies, кат. №10787-018)
Буфер для нанесения для красителей Tracklt Cyan/Orange (Life Technologies, кат. №10482-028)
Рестрикционный фермент FastDigest HindIII (Fermentas/ThermoScientific, кат. №FD0504)
Оборудование
Стерильные наконечники с фильтром для пипеток (Corning)
Стандартные микроцентрифужные пробирки на 1,5 мл (Eppendorf, кат. №0030125.150)
96-луночные планшеты для ПЦР Axygen (VWR, кат. №PCR-96M2-HSC)
Пробирки для ПЦР Axygen, 8 на стрип (Fischer Scientific, кат. №14-222-250)
Пробирки Falcon, полипропилен, 15 мл (BD Falcon, кат. №352097)
Пробирки Falcon, полипропилен, 50 мл (BD Falcon, кат. №352070)
Круглодонная пробирка с сетчатым фильтром для клеток, 5 мл (BD Falcon, кат. №352235)
Чашки Петри (60 мм × 15 мм; BD Biosciences, кат. №351007)
Планшет для тканевой культуры (24-лунки; BD Falcon, кат. №353047)
Планшет для тканевой культуры (96-лунок, плоскодонный; BD Falcon, кат. №353075)
Чашка для тканевой культуры (100 мм; BD Falcon, 353003)
Термоциклер на 96 лунок с программируемой функцией поэтапного изменения температуры Applied Biosystems Veriti, кат. №4375786).
Настольные микроцентрифуги 5424, 5804 (Eppendorf)
Система для гель-электрофореза (основной источник питания PowerPac, Bio-Rad, кат. №164-5050, и лоток для геля из системы Sub-Cell GT, Bio-Rad, кат. №170-4401)
Мини-ячейка для электрофореза Novex XCell SureLock (Life Technologies, кат. №EI0001)
Цифровая система для визуализации геля (GelDoc EZ, Bio-Rad, кат. №170-8270, и голубой лоток для образца, Bio-Rad, кат. №170-8273)
Прибор для просвечивания голубым светом и очки с оранжевым светофильтром (SafeImager 2.0; Invitrogen, кат. №G6600)
Программное обеспечение для количественной оценки геля (Bio-Rad, ImageLab, включена в GelDoc EZ, или ImageJ с открытым исходным кодом от Национальных институтов здравоохранения, доступная на веб-сайте rsbweb.nih.gov/ij/) с помощью УФ-спектрофотометра (NanoDrop 2000с, Thermo Scientific)
Приготовление реагентов
Раствор для электрофореза на основе Tris-бората EDTA (ТВЕ). Развести буфер ТВЕ в дистиллированной воде до 1X рабочего раствора для заливки агарозных гелей и для применения в качестве буфера для гель-электрофореза. Буфер можно хранить при комнатной температуре(18-22°С) в течение по меньшей мере 1 года.
• АТФ, 10 мМ. Разделить 10 мМ АТФ на аликвоты по 50 мкл и хранить при -20°С до 1 года; избегать повторных циклов замораживания-размораживания.
• DTT, 10 мМ. Приготовить 10 мМ раствор DTT в дистиллированной воде и хранить в аликвотах по 20 мкл при -70°С в течение периода до 2 лет; для каждой реакции использовать новую аликвоту, поскольку DTT легко окисляется.
•Культуральная среда D10. Для культивирования клеток HEK293FT приготовить культуральную среду D10 путем добавления к DMEM 1X GlutaMAX и 10% (об./об.) фетальной бычьей сыворотки. Как указано в протоколе, эту среду также дополняют 1X пенициллином-стрептомицином. Среду D10 можно приготовить заранее и хранить при 4°С в течение периода до 1 месяца.
• Культуральная среда mTeSR1. Для культивирования эмбриональных стволовых клеток человека приготовить среду mTeSR1 путем добавления 5Х добавки (включенной в базовую среду mTeSR1) и 100 мкг/мл нормоцина.
Процедура
Конструирование нацеливающих компонентов и применение онлайн-инструмента Временные рамки 1 день
1) Ввести последовательность целевой геномной ДНК. Заявители обеспечили онлайн-инструмент конструирования для нацеливания Cas9, который использует искомую представляющую интерес последовательность, идентифицирует и ранжирует подходящие целевые сайты и путем вычислений прогнозирует нецелевые сайты для каждой предполагаемой мишени. В альтернативном случае специалист может в ручном режиме выбирать направляющую последовательность путем идентификации последовательности из 20 п.о. непосредственно выше любого 5'-NGG.
2) Заказать необходимые олигонуклеотиды и праймеры, которые определены с помощью онлайн-инструмента. Если сайт выбирают вручную, олигонуклеотиды и праймеры должны быть сконструированы.
Получение экспрессионной конструкции sgRNA
3) Для создания экспрессионной конструкции sgRNA можно использовать протокол на основе ПЦР либо плазмид.
(А) Посредством ПЦР-амплификации • Временные рамки 2 часа
(i) Заявители готовили разведенную матрицу с U6 для ПЦР. Заявители рекомендуют использовать РХ330 в качестве матрицы для ПЦР, но любую содержащую U6 плазмиду можно подобным образом использовать в качестве матрицы для ПЦР. Заявители разбавляли матрицу с помощью ddH2O до концентрации 10 нг/мкл. Следует обратить внимание, что если в качестве матрицы используется плазмида или кассета, уже содержащая управляемую U6 sgRNA, следует провести экстракцию из геля, чтобы удостовериться в том, что продукт содержит только намеченную sgRNA и не содержит следовую sgRNA, перенесенную с матрицы.
(ii) Заявители готовили разбавленные олигонуклеотиды для ПЦР. Прямой праймер для U6 и обратный праймер для U6-sgRNA разбавляли до конечной концентрации 10 мкМ в ddH2O (добавляли 10 мкл 100 мкМ праймера к 90 мкл ddH2O).
(iii) Реакционная смесь для ПЦР с U6-sgRNA. Заявители готовили следующие реакционные смеси для каждого обратного праймера для U6-sgRNA и мастер-микса, если необходимо:


(iv) Заявители проводили ПЦР-реакцию с реакционными смесями из стадии (iii) с использованием следующих условий для циклов:

(v) По завершении реакции заявители прогоняли продукт в геле для подтверждения успешной амплификации, дающей одну полосу. Залить 2% (вес/об.) агарозный гель в 1X буфер ТВЕ с 1X красителем SYBR Safe. Разогнать 5 мкл PCR продукта в геле при 15 В см-1 в течение 20-30 мин. Успешно полученные ампликоны должны давать один единственный продукт из 370 п.о., а матрица должна быть невидимой. Экстракция из геля ПЦР-ампликона не обязательно является необходимой.
(vi) Заявители очищали продукт ПЦР с использованием набора для очистки продуктов ПЦР QIAquick согласно указаниям производителя. Элюировать ДНК в 35 мкл буфера ЕВ или воды. Очищенные продукты ПЦР можно хранить при 4°С или -20°С.
(В) Клонирование sgRNA в содержащий Cas9 бицистронный вектор экспрессии • Временные рамки 3 дня
(i) Приготовить вставки олигонуклеотидов sgRNA. Заявители ресуспендировали верхнюю и нижнюю нити олигонуклеотидов для каждой конструкции sgRNA в конечной концентрации 100 мкМ. Фосфорилировать и отжечь олигонуклеотиды следующим образом:

(ii) Отжечь в термоциклере с использованием следующих параметров:
37°С в течение 30 мин.
95°С в течение 5 мин.
Линейно понизить температуру до 25°С со скоростью 5°С в мин.
(iii) Заявители разбавляли фосфорилированные и отожженные олигонуклеотиды 1:200 путем добавления 1 мкл олигонуклеотидов к 199 мкл ddH2O комнатной температуры.
(iv) Клонировать олигонуклеотид sgRNA в РХ330. Заявители готовили реакционную смесь Golden Gate для каждой sgRNA. Заявители также рекомендуют приготовить не содержащий вставки отрицательный контроль только с РХ330.

(v) Инкубировать реакционную смесь Golden Gate в общей сложности в течение 1 часа:,
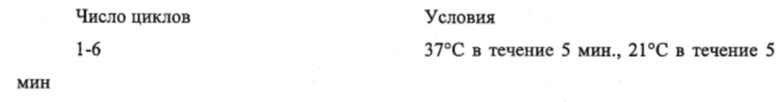
(vi) Заявители обрабатывали реакционную смесь Golden Gate экзонуклеазой PlasmidSafe для расщепления любой остаточной линеаризованной ДНК. Эта стадия является необязательной, но очень рекомендуется.
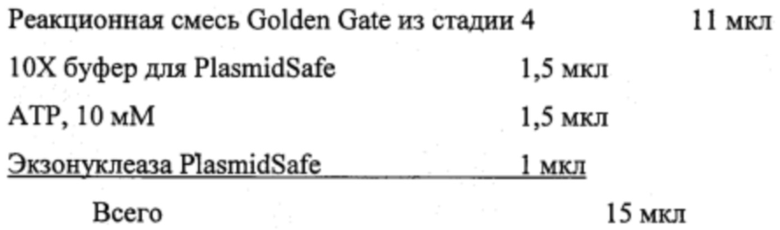
(vii) Заявители инкубировали реакционную смесь с PlasmidSafe при 37°С в течение 30 мин. с последующей инактивацией при 70°С в течение 30 мин. Точка паузы: после завершения реакционную смесь можно заморозить и продолжить позже. Кольцевая ДНК должна быть стабильна в течение по меньшей мере 1 недели.
(viii) Трансформация. Заявители трансформировали плазмиды, обработанные PlasmidSafe, в компетентный штамм Е. coli согласно протоколу, поставляемому с клетками. Заявители рекомендовали Stbl3 для быстрой трансформации. Вкратце, заявители добавляли 5 мкл продукта из стадии (vii) в 20 мкл охлажденных на льду химически компетентных клеток Stbl3. Затем их инкубировали на льду в течение 10 мин., подвергали тепловому шоку при 42°С в течение 30 с, немедленно возвращали на лед на 2 мин., добавляли 100 мкл среды SOC, и высевали их на чашку со средой LB, содержащей 100 мкг/мл ампициллина, с инкубированием в течение ночи при 37°С.
(ix) День 2. Заявители подвергали планшеты осмотру в отношении роста колоний. Как правило, колонии на планшетах с отрицательным контролем (лигирование только PX330, расщепленного BbsI, без отожженного олигонуклеотида sgRNA) отсутствуют, и колонии на планшетах для клонирования с PX330-sgRNA присутствуют в количестве от нескольких десятков до нескольких сотен.
(x) Из каждого планшета заявители отбирали 2-3 колонии для проверки правильности вставки sgRNA. Заявители использовали стерильные наконечники для пипеток, чтобы инокулировать одну колонию в 3 мл культуральной среды LB со 100 мкг/мл ампициллина. Инкубировали и встряхивали при 37°С в течение ночи.
(xi) День 3. Заявители выделяли плазмидную ДНК из суточных культур с использованием набора QIAprep Spin Miniprep согласно инструкциям производителя.
(xii) Валидация последовательности плазмиды с CRISPR. Заявители подтверждали последовательность в каждой колонии путем секвенирования от промотора U6 с использованием прямого праймера для U6. Необязательно: последовательность используемых праймеров для гена Cas9 приведена в следующей таблице праймеров.

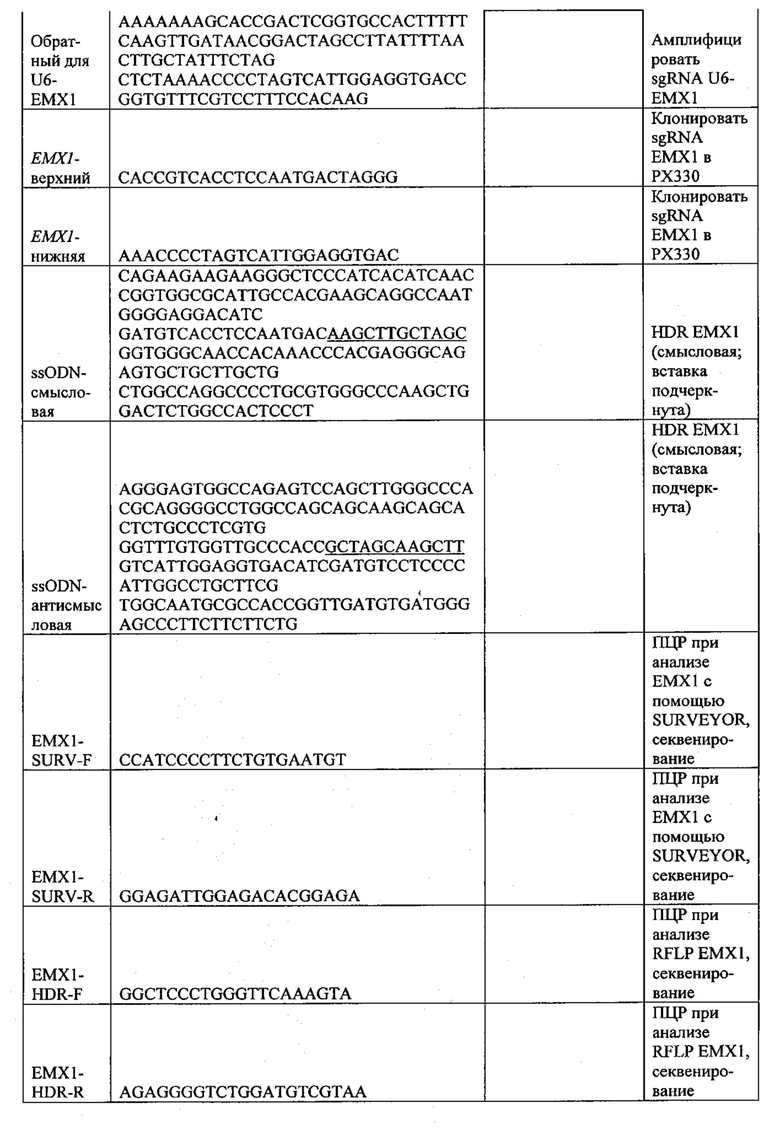
Заявители рассматривали результаты секвенирования в сравнении с последовательностью вектора клонирования PX330 для проверки того, что направляющая последовательность из 20 п.о. была встроена между промотором U6 и остальной частью каркаса sgRNA. Подробности и последовательность PX330 в виде карты в формате карты вектора, используемом в GenBank (файл *.gb), можно найти на веб-сайте crispr.genome-engineering.org.
(Необязательное) конструирование ssODN-матрицы • Временные рамки 3 дня с заблаговременным планированием
3) Конструирование и заказ ssODN. Либо смысловой, либо антисмысловой ssODN можно приобрести непосредственно у поставщика. Заявители рекомендовали конструирование гомологичных плеч по меньшей мере из 40 п.о. с каждой стороны и 90 п.о. для оптимальной эффективности HDR. По опыту заявителей антисмысловые олигонуклеотиды характеризуются чуть более высокими значениями эффективности модификации.
4) Заявители ресуспендировали и разводили ультрамеры ssODN до конечной концентрации 10 мкМ. Не объединять и не отжигать смысловые и антисмысловые ssODN. Хранить при -20°С.
5) Для применений с HDR следует учесть, что заявители рекомендуют клонировать sgRNA в плазмиду РХ330.
Функциональная валидация sgRNA: культура клеток и трансфекции • Временные рамки 3-4 дня
Система CRISPR-Cas была использована в ряде линий клеток млекопитающих. Условия могут варьировать для каждой линии клеток. В приведенных ниже протоколах подробно описываются условия трансфекции для клеток HEK239FT. Для трансфекции с опосредованной ssODN HDR следует учесть, что набор Amaxa SF Nucleofector для трансфекции линий клеток использовали для оптимальной доставки ssODN. Это описано в следующем разделе.
7) Поддержание HEK293FT. Клетки поддерживали согласно рекомендациям производителя. Вкратце, заявители культивировали клетки в среде D10 (DMEM GlutaMax, дополненная 10% фетальной бычьей сывороткой), при 37°С и 5% СО2.
8) Для пассирования заявители удаляли среду и однократно промывали путем осторожного добавления DPBS по боковой стенке сосуда для того, чтобы не сместить клетки. Заявители добавляли 2 мл TrypLE во флакон Т75 и инкубировали в течение 5 мин. при 37°С. Для инактивации добавляли 10 мл теплой среды D10 и переносили в пробирку Falcon на 50 мл. При необходимости заявители диссоциировали клетки путем осторожного ресуспендирования и пересевали в новые флаконы. Заявители, как правило, пассажировали клетки каждые 2-3 дня при индексе разведения 1:4 или 1:8, никогда не позволяя клеткам достигать больше 70% конфлюентности. Линии клеток возобновляли после достижения пассажа номер 15.
9) Получение клеток для трансфекции. Заявители высевали хорошо диссоциированные клетки на 24-луночные планшеты в среде D10 без антибиотиков за 16-24 часа до трансфекции при плотности посева 1,3×105 клеток на лунку и высеваемом объеме 500 мкл. При необходимости осуществляют пропорциональное увеличение или уменьшение согласно инструкциям производителя. Не стоит высаживать больше клеток, чем рекомендованная плотность, поскольку это может снизить эффективность трансфекции.
10) В денью трансфекции оптимальным является, чтобы клетки достигли 70-90% конфлюентности. Клетки можно трансфицировать с помощью реагента Lipofectamine 2000 или набора для трансфекции линий клеток Amaxa SF Nucleofector согласно протоколам производителя.
(A) Для sgRNA, клонированных в РХ330, заявители трансфицировали 500 нг подтвержденной по последовательности плазмиды с CRISPR; при трансфекции более чем одной плазмиды смешать в эквимолярном соотношении и не более чем 500 нг в сумме.
(B) Для sgRNA, амплифицированной с помощью ПЦР, заявители смешивали следующие компоненты:
Заявители рекомендовали осуществление трансфекции в трех повторностях согласно методике для надежной количественной оценки и включение контролей трансфекции (например, плазмиды с GFP) для отслеживания эффективности трансфекции. Кроме того, плазмиду для клонирования PX330 и/или ампликон sgRNA можно трансфицировать отдельно в качестве отрицательного контроля для последующих функциональных анализов.
11) Заявители осторожно добавляли комплекс Lipofectamine к клеткам, поскольку клетки HEK293FT могут легко отделяться от планшета, и это приводит к более низкой эффективности трансфекции.
12) Заявители проверяли клетки через 24 часа после трансфекции в отношении ее эффективности путем оценки доли флуоресцирующих клеток в контроле (например, GFP) трансфекции с использованием флуоресцентного микроскопа. Как правило, трансфицировались более 70% клеток.
13) Заявители дополняли культуральную среду дополнительными 500 мкл теплой среды D10. Добавлять D10 очень медленно по боковой стенке лунки и не использовать холодную среду, поскольку клетки легко могут отделиться.
14) Клетки инкубировали в общей сложности в течение 48-72 часов после трансфекции перед сбором для анализа вставок/делеций. Эффективность образования вставок/делеций заметно не повышалась после 48 часов.
(Необязательная) совместная трансфекция плазмид с CRISPR и ssODN или плазмид для целенаправленного воздействия для HR • Временные рамки 3-4 дня
15) Линеаризованная плазмида для целенаправленного воздействия. Вектор для целенаправленного воздействия линеаризуют, если это возможно, путем однократного разрезания в сайте рестрикции в каркасе вектора около одного из гомологичных плеч или на дальнем конце любого из гомологичных плеч.
16) Заявители прогоняли небольшое количество линеаризованной плазмиды наряду с неразрезанной плазмидой в 0,8-1% агарозном геле для проверки успешной линеаризации. Линеаризованная плазмида при разделении должна идти дальше сверхспирализованной плазмиды.
17) Заявители очищали линеаризованную плазмиду с использованием набора для очистки продуктов ПЦР QIAquick.
18) Получение клеток для трансфекции. Заявители культивировали HEK293FT в колбах Т75 или Т225. Предполагалось достаточное количество клеток перед днем трансфекции. Для Amaxa в формате стрипов с кюветами использовали 2×106 клеток на трансфекцию.
19) Подготовка планшетов для трансфекции. Заявители добавляли 1 мл теплой среды D10 в каждую лунку 12-луночного планшета. Планшеты помещали в инкубатор для сохранения среды теплой.
20) Нуклеофекция. Заявители трансфицировали клетки HEK293FT в соответствии с инструкциями производителя к набору Amaxa SF для трансфекции линий клеток на Nucleofector 4D, адаптированными в стадиях, приведенных ниже.
а. Для совместной трансфекции ssODN и CRISPR предварительно смешать следующие ДНК в пробирках для ПЦР:
Плазмида с pCRISPR (Cas9 + sgRNA) 500 нг
ssODN-матрица (10 мкМ) 1 мкл
Для совместной трансфекции плазмиды для целенаправленного воздействия посредством HDR и CRISPR предварительно смешать следующие ДНК в пробирках для ПЦР:
Плазмида с CRISPR (Cas9 + sgRNA) 500 нг
Линеаризованная плазмида для целенаправленного воздействия 500 нг
Что касается контролей для трансфекции, смотри предыдущий раздел. Кроме того, заявители рекомендуют трансфицировать ssODN или плазмиду для целенаправленного воздействия в отдельности в качестве отрицательного контроля.
21) Диссоциация на отдельные клетки. Заявители удаляли среду и однократно осторожно промывали при помощи DPBS, следя за тем, чтобы не сместить клетки. 2 мл TrypLE добавляли во флакон Т75 и инкубировали в течение 5 мин. при 37°С. Для инактивации добавляли 10 мл теплой среды D10 и осторожно взбалтывали в пробирке Falcon на 50 мл. Рекомендуется, чтобы клетки осторожно взбалтывали и диссоциировали на отдельные клетки. Большие скопления будут снижать эффективность трансфекции. Заявители брали 10 мкл аликвоту из суспензии и разводили в 90 мкл среды D10 для подсчета. Заявители производили подсчет клеток и рассчитывали количество клеток и объем суспензии, необходимый для трансфекции. Заявители, как правило, трансфицировали 2×105 клеток на процедуру с использованием стрипов Amaxa Nucleocuvette, и при расчетах рекомендуется учитывать на 20% больше клеток, чем требуется для того, чтобы ввести поправку на потерю объема на последующих стадиях отмеривания пипеткой. Необходимый объем переносили в новую пробирку Falcon.
23) Заявители производили осаждение центрифугированием в новой пробирке при 200 х g в течение 5 мин.
Заявители готовили раствор для трансфекции путем смешивания раствора SF и добавки S1, как рекомендовано Amaxa. Для стрипов с кюветами Amaxa требуется всего 20 мкл раствора SF с добавками на трансфекцию. Аналогично, при расчетах заявители рекомендовали учесть объем на 20% больше, чем требуется.
25) Заявители полностью удаляли среду с присутствующих в виде осадка клеток из стадии 23 и осторожно ресуспендировали в подходящем объеме (20 мкл на 2×105 клеток) раствора SF, дополненного S1. Не оставлять клетки в растворе SF в течение продолжительного периода времени.
26) 20 мкл ресуспендированных клеток добавляли пипеткой в каждую предварительно приготовленную на стадии 20 смесь ДНК. Осторожно перемешивали смесь с помощью пипетки и переносили в камеру для стрипов Nucleocuvette. Повторить для каждой процедуры трансфекции.
Клетки подвергали электропорации с использованием системы Nucleofector 4D, рекомендованной Amaxa, СМ-130.
28) Заявители осторожно и медленно добавляли пипеткой 100 мкл теплой среды D10 в каждую камеру для стрипов Nucleocuvette и переносили весь объем в предварительно подогретый планшет из стадии 19. ВАЖНО. Клетки являются очень хрупкими на этой стадии, и резкий отбор пипеткой может вызвать гибель клеток. Инкубировали в течение 24 часов. В этот момент эффективность трансфекции можно оценить, исходя из доли флюоресцирующих клеток в положительном контроле для трансфекции. Нуклеофекция, как правило, приводит к эффективности трансфекции более 70-80%. Заявители медленно добавляли 1 мл теплой среды D10 в каждую лунку без смещения клеток. Инкубировали клетки в течение в течение периода, составляющего в сумме 72 часа.
Культивирование и трансфекции эмбриональных стволовых клеток человека (HUES 9) • Временные рамки 3-4 дня
Поддержание линии hESC (HUES9). Заявители традиционным образом поддерживали линию клеток HUES9 в условиях отсутствия фидера со средой mTesR1. Заявители готовили среду mTeSR1 путем добавления 5Х добавки, включенной в базовую среду, и 100 мкг/мл нормоцина. Заявители готовили аликвоту на 10 мкл среды mTeSR1, дополненной, кроме того, 10 мкМ ингибитором Rock. Нанесение покрытия на планшет для культуры тканей. Разводили холодный GelTrex в пропорции 1:100 в холодной DMEM и покрывали всю поверхность 100 мм планшета для тканевой культуры.
Помещали планшет в инкубатор по меньшей мере на 30 мин. при 37°С. Размораживали флакон с клетками при 37°С в пробирке Falcon на 15 мл, добавляли 5 мл среды mTeSR1 и осаждали при 200 х g в течение 5 мин. Аспирировали покрытие GelTrex и высевали ~1×106 клеток в 10 мл среды mTeSR1, содержащей ингибитор Rock. Сменяли среду на нормальную среду mTeSR1 через 24 часа после трансфекции и "подпитывали" свежей средой ежедневно. Пассажирование клеток. Ежедневно "подпитывали" клетки свежей средой mTeSR1 и пассировали перед достижением 70% конфлюентности. Аспирировали среду mTeSR1 и однократно промывали клетки DPBS. Диссоциировали клетки путем добавления 2 мл Accutase и инкубировали при 37°С в течение 3-5 мин. Добавляли 10 мл среды mTeSR1 к отделившимся клеткам, переносили в пробирку Falcon на 15 мл и осторожно ресуспендировали. Повторно высевали на планшеты с покрытием GelTrex в среду mTeSR1 с 10 мкМ ингибитором Rock. Сменяли среду на нормальную среду mTeSR1 через 24 часа после посева.
Трансфекция. Заявители рекомендовали культивирование клеток по меньшей мере в течение 1 недели после размораживания перед трансфекцией с использованием набора Amaxa Р3 для трансфекции первичных клеток на 4-D Nucleofector (Lonza). "Подпитывали" клетки, находящиеся в log-фазе роста, свежей средой за 2 часа до трансфекции. Диссоциировали на отдельные клетки или небольшие кластеры не более чем из 10 клеток при помощи Accutase и осторожного ресуспендирования. Подсчитывали количество клеток, необходимое для нуклеофекции, и осаждали центрифугированием при 200 х g в течение 5 мин. Удаляли среду полностью и ресуспендировали в рекомендованном объеме дополненного S1 раствора Р3 для нуклеофекции. Осторожно высевали подвергнутые электропорации клетки в планшеты с покрытием в присутствии 1X ингибитора Rock.
Проверяли успешность трансфекции и "подпитывали" ежедневно стандартной средой mTeSR1, начиная с момента через 24 часа после нуклеофекции. Как правило, заявители наблюдали эффективность трансфекции более 70% при использовании нуклеофекции Amaxa. Сбор ДНК. Через 48-72 часа после трансфекции диссоциировали клетки с использованием Accutase, который инактивировали путем добавления 5-кратного объема mTeSR1. Осаждали клетки центрифугированием при 200 х g в течение 5 мин. Осажденные клетки можно подвергнуть непосредственной обработке для экстракции ДНК раствором QuickExtract. Рекомендуется не подвергать клетки механической диссоциации без Accutase. Рекомендуется не осаждать клетки центрифугированием без инактивации Accutase или со скоростью, превышающей рекомендованную; такие действия могут вызвать лизис клеток.
Выделение клональных линий клеток при помощи FACS. Временные рамки • практическое выполнение 2-3 часа; размножение 2-3 недели
Выделение клонов можно осуществлять через 24 часа после трансфекции с помощью FACS или с помощью серийного разведения.
54) Приготовление буфера для FACS. Клетки, для которых не требуется сортировка с использованием флуоресцирующих красителей, можно сортировать в стандартной среде D10, дополненной 1X пенициллином/стрептомицином. Если также требуется сортировка с использованием флуоресцирующих красителей, тогда не содержащую фенола DMEM или DPBS использовали вместо нормальной DMEM. Добавить 1X пенициллин/стрептиномицин и фильтровать через 22 мкм фильтр Steriflip.
55) Подготовка 96-луночных планшетов. Заявители добавляли 100 мкл среды D10, дополненной 1X пенициллином/стрептомицином, на лунку и получали такое количество планшетов, которое необходимо для требуемого числа клонов.
56) Получение клеток для FACS. Заявители диссоциировали клетки путем полной аспирации среды и добавления 100 мкл TrypLE на лунку в 24-луночном планшете. Инкубировали в течение 5 мин. и добавляли 400 мкл теплой среды D10.
57) Ресуспендированные клетки переносили в пробирку Falcon на 15 мл и осторожно взбалтывали 20 раз. Рекомендована проверка под микроскопом для того, чтобы удостовериться в диссоциации на отдельные клетки.
58) Осаждали клетки центрифугированием при 200 х g в течение 5 минут.
59) Заявители аспирировали среду и ресуспендировали клетки в 200 мкл среды для FACS.
60) Клетки фильтровали через сетчатый фильтр на 35 мкм в пробирки с метками для FACS. Заявители рекомендовали использовать пробирки BD Falcon 12×75 мм с сетчатым фильтром для клеток в крышке. Помещали клетки на лед до сортировки.
61) Заявители сортировали отдельные клетки в 96-луночные планшеты, подготовленные на стадии 55. Заявители рекомендовали, чтобы в одну отдельную предусмотренную лунку в каждом планшете отсортировывали 100 клеток в качестве положительного контроля.
ПРИМЕЧАНИЕ. Остальные клетки можно хранить и использовать для генотипирования на популяционном уровне для измерения общей эффективности модификации.
62) Заявители возвращали клетки в инкубатор и обеспечивали возможность их размножения в течение 2-3 недель. 100 мкл теплой среды D10 добавляли через 5 дней после сортировки. При необходимости заменяли 100 мкл среды каждые 3-5 дней.
63) Колонии подвергали осмотру в отношении "клонального" внешнего вида через 1 неделю после сортировки: округлые колонии, расходящиеся от центральной точки. Помечали лунки, которые были пустыми или могли быть засеяны с образованием двух колоний или нескольких колоний.
64) Когда клетки достигали конфлюентности более 60%, заявители готовили набор планшетов для реплик для пассирования. 100 мкл среды D10 добавляли в каждую лунку в планшетах для реплик. Заявители непосредственно диссоциировали клетки путем интенсивного втягивания в пипетку и выталкивания клеток из пипетки 20 раз. 20% ресуспендированного объема высевали в подготовленные планшеты для реплик для сохранения клональных линий. После этого заменяли среду каждые 2-3 дня и пассировали, соответственно.
65) Остальные 80% клеток использовали для выделения ДНК и генотипирования.
Необязательно: выделение клональных клеточных линий путем разведения. Временные рамки • практическое выполнение 2-3 часа; размножение 2-3 недели
66) Заявители диссоциировали клетки из 24-луночных планшетов, как описано выше. Удостоверялись в диссоциации до отдельных клеток. Сетчатый фильтр для клеток можно использовать для предотвращения образования скоплений клеток.
67) Количество клеток подсчитывали для каждой процедуры. Для каждой процедуры производили серийное разведение в среде D10 до конечной концентрации 0,5 клеток на 100 мкл. Для каждого 96-луночного планшета заявители рекомендовали разведение до конечного количества 60 клеток в 12 мл D10. Для надлежащего клонального разведения рекомендуется точный подсчет клеток. Клетки можно повторно подсчитать на промежуточной стадии серийного разведения для гарантии точности.
68) Многоканальную пипетку использовали для внесения пипеткой 100 мкл разбавленных клеток в каждую лунку 96-луночного планшета.
ПРИМЕЧАНИЕ. Остальные клетки можно хранить и использовать для генотипирования на популяционном уровне для измерения общей эффективности модификации.
69) Заявители подвергали осмотру колонии в отношении "клонального" внешнего вида через ~1 неделю после посева: округлые колонии, расходящиеся от центральной точки. Помечали лунки, которые могли быть засеяны с образованием двух колоний или нескольких колоний.
70) Заявители возвращали клетки в инкубатор и обеспечивали возможность их размножения в течение 2-3 недель. При необходимости "подпитывали" клетки, как подробно описано в предыдущем разделе.
Анализ с помощью SURVEYOR в отношении эффективности расщепления с помощью CRISPR. Временные рамки • 5-6 часов
Перед анализом эффективности расщепления на трансфицированных клетках заявители рекомендовали провести тестирование каждого нового праймера для анализа с помощью SURVEYOR на образцах отрицательного контроля (нетрансфицированных) посредством стадии расщепления нуклеазой SURVEYOR с использованием протокола, описанного ниже. Изредка даже присутствующие в виде одной полосы чистые продукты ПЦР для анализа с помощью SURVEYOR могут давать полосы в результате неспецифического расщепления нуклеазой SURVEYOR и потенциально создавать помехи для точного анализа вставок/делеций.
71) Сбор клеток для получения ДНК. Диссоциировали клетки и осаждали центрифугированием при 200 х g в течение 5 мин. ПРИМЕЧАНИЕ. Планшет для реплик на данной стадии необходим для сохранения трансфицированных линий клеток.
72) Полностью аспирировали надосадочную жидкость.
73) Заявители использовали раствор для экстракции ДНК QuickExtract согласно инструкциям производителя. Заявители, как правило, использовали 50 мкл раствора для каждой лунки в 24-луночном планшете и 10 мкл для 96-луночного планшета.
74) Заявители нормализовали экстрагированную ДНК до конечной концентрации 100-200 нг/мкл при помощи ddH2O. Точка паузы: экстрагированную ДНК можно хранить при -20°С в течение нескольких месяцев.
75) Схема ПЦР для анализа с помощью SURVEYOR. Мастер-микс из следующих компонентов с использованием праймеров для SURVEYOR, обеспеченный с использованием разработанного заявителями онлайн-инструмента/инструмента на основе компьютерного алгоритма.

76) Заявители добавляли 100-200 нг нормализованной геномной ДНК-матрицы из стадии 74 для каждой реакции.
77) ПЦР-реакцию проводили с использованием следующих условий для циклов при не более 30 циклах амплификации:

78) Заявители прогоняли 2-5 мкл продукта ПЦР в 1% геле для проверки на наличие продукта в виде одной полосы. Хотя данные условия ПЦР были разработаны для работы с большинством пар праймеров для SURVEYOR, для некоторых праймеров может требоваться дополнительная оптимизация путем корректировки концентрации матрицы, концентрации MgCl2 и/или температуры отжига.
79) Заявители очищали продукты ПЦР-реакций с использованием набора для очистки продуктов ПЦР QIAquick и нормализовали элюентом до 20 нг/мкл. Точка паузы: очищенный продукт ПЦР можно хранить при -20°С.
80) Образование гетеродуплекса ДНК. Реакционную смесь для отжига готовили следующим образом:
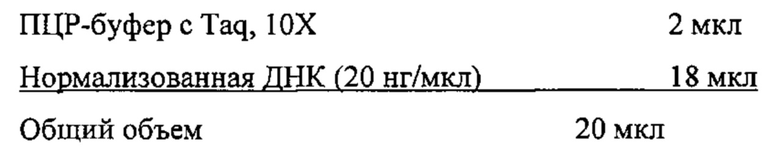
81) Проводили отжиг в реакционной смеси с использованием следующих условий:

82) Расщепление нуклеазой S SURVEYOR. Заявители готовили мастер-микс и добавляли следующие компоненты на льду к отожженным гетеродуплексам из стадии 81 до общего конечного объема 25 мкл.

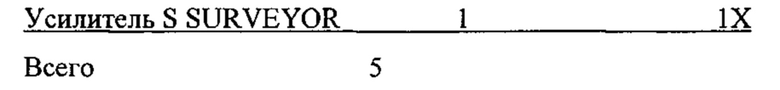
83) Хорошо перемешивали вихревой мешалкой и осаждали центрифугированием. Инкубировали реакционную смесь при 42°С в течение 1 часа.
84) Необязательно: можно добавить 2 мкл стоп-раствора из набора SURVEYOR.
Точка остановки. Расщепленный продукт можно хранить при -20°С для дальнейшего анализа.
85) Визуальная оценка продуктов реакции при анализе SURVEYOR. Продукты расщепления нуклеазой SURVEYOR можно визуально оценивать в 2% агарозном геле. Для лучшей разрешающей способности продукты можно прогнать в 4-20% градиентном полиакриламидном геле с ТВЕ. Заявители загружали 10 мкл продукта с рекомендованным загрузочным буфером и прогоняли в геле согласно инструкциям производителя. Как правило, заявители проводили прогон до тех пор, пока краситель бромфеноловый синий не мигрировал в нижнюю часть геля. В тот же гель включали маркер молекулярного веса ДНК и отрицательные контроли.
86) Заявители окрашивали гель 1X красителем SYBR золотым, разбавленным в ТВЕ. Гель осторожно покачивали в течение 15 мин.
87) Заявители визуализировали гель с использованием системы для количественной визуализации без чрезмерного экспонирования полос. Отрицательные контроли должны иметь только одну полосу, соответствующую размеру продукта ПЦР, но изредка могут характеризоваться полосами неспецифического расщепления продуктов других размеров. Они не будут препятствовать анализу, если они отличаются по размеру от полос целевого расщепления. Сумма размеров полос целевого расщепления, обеспеченная с помощью разработанного заявителями онлайн-инструмента/инструмента на основе компьютерного алгоритма, должна быть равна размеру продукта ПЦР.
88) Оценка интенсивности расщепления. Заявители, количественно определяли суммарную интенсивность каждой полосы с использованием ImageJ или другого программного обеспечения для количественного анализа геля.
89) Для каждой дорожки заявители рассчитывали долю расщепленного продукта ПЦР (ƒcut) с использованием следующей формулы: ƒcut=(b+с) / (а+b+с), где а представляет собой суммарную интенсивность для нерасщепленного продукта ПЦР, a b и с представляют собой значения суммарной интенсивности для каждого продукта расщепления.
90) Эффективность расщепления можно оценить с использованием следующей формулы, основанной на биномиальном распределении вероятности образования дуплексов:
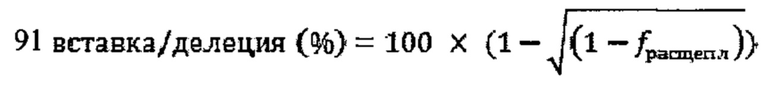
Секвенирование по Сэнгеру для оценки эффективности расщепления с помощью CRISPR. Временные рамки • 3 дня
Начальные стадии идентичны стадиям 71-79 в анализе с помощью SURVEYOR. Примечание: праймеры для SURVEYOR можно использовать для секвенирования по Сэнгеру, если подходящие сайты рестрикции прикреплены к прямому и обратному праймерам. Для клонирования в рекомендованный каркас pUC19 можно использовать EcoRI для прямого праймера, a HindIII для обратного праймера.
92) Amplicon digestion. Приготовить реакционную смесь для расщепления следующим образом:

93) Расщепление каркаса pUC19. Приготовить реакционную смесь для расщепления следующим образом:

94) Заявители очищали продукты реакций расщепления с использованием набора для очистки продуктов ПЦР QIAquick. Точка паузы: очищенный продукт ПЦР можно хранить при -20°С.
95) Заявители лигировали расщепленный каркас pUC19 и ампликоны для секвенирования по Сэнгеру в соотношении вектор: вставка, составляющем 1:3, следующим образом.
Компонент Количество (мкл)

96) Трансформация. Заявители трансформировали плазмиды, обработанные PlasmidSafe, в компетентный штамм Е. coli согласно протоколу, поставляемому с клетками. Заявители рекомендовали Stbl3 для быстрой трансформации. Вкратце, 5 мкл продукта со стадии 95 добавляли в 20 мкл охлажденных на льду химически компетентных клеток Stbl3, инкубировали на льду в течение 10 мин, подвергали тепловому шоку при 42°С в течение 30 с, немедленно возвращали на лед на 2 мин, добавляли 100 мкл среды SOC и высевали на чашку со средой LB, содержащую 100 мкг/мл ампициллина. Их инкубировали в течение ночи при 37°С.
97) День 2. Заявители подвергали планшеты осмотру в отношении роста колоний. Как правило, колонии на планшетах с отрицательным контролем (лигирование только pUC19, расщепленного EcoRI-HindIII, без вставки ампликона для секвенирования по Сэнгеру) отсутствуют, и колонии на чашках для клонирования с pUC19-ампликоном для секвенирования по Сэнгеру присутствуют в количестве от нескольких десятков до нескольких сотен.
98) День 3. Заявители выделяли плазмидную ДНК из суточных культур с использованием набора QIAprep Spin Miniprep согласно инструкциям производителя.
99) Секвенирование по Сэнгеру. Заявители подтверждали последовательность в каждой колонии путем секвенирования от каркаса pUC19 с использованием прямого праймера для pUC19. Заявители рассматривали результаты секвенирования в сравнении с ожидаемой последовательностью геномной ДНК для проверки присутствия индуцированных Cas9 мутаций в результате NHEJ. % эффективности редактирования = (число модифицированных клонов) / (общее число клонов). Важно отобрать приемлемое число клонов (>24) для получения правильных значений эффективности модификации.
Генотипирование в отношении микроделеций. Временные рамки • практическое выполнение 2-3 дня; размножение 2-3 недели
100) Клетки трансфицировали, как описано выше, парой sgRNA, осуществляющих нацеливание на участок, подлежащий делеции.
101) Через 24 часа после трансфекции клональные линии выделяли с помощью FACS или серийного разведения, как описано выше.
102) Клетки размножали в течение 2-3 недель.
103) Заявители отбирали ДНК из клональных линий, как описано выше, с использованием 10 мкл раствора QuickExtract и нормализовали геномную ДНК с помощью ddH2O до конечной концентрации 50-100 нг/мкл.
104) ПЦР-амплификация модифицированного участка. Реакционную смесь для ПЦР готовили следующим образом.

Примечание: если размер делеции составлял более 1 т.п.о., готовили параллельный набор реакционных смесей для ПЦР с внутренним прямым и внутренним обратным праймерами для скрининга в отношении присутствия аллеля wt.
105) Для скрининга в отношении инверсий реакционную смесь для ПЦР готовили следующим образом:

Примечание: праймеры расположены парами как внешний прямой + внутренний прямой или внешний обратный + внутренний обратный.
106) Заявители добавляли 100-200 нг нормализованной геномной ДНК-матрицы из стадии 103 для каждой реакции.
107) ПЦР-реакцию проводили с использованием следующих условий для циклов.

108) Заявители прогоняли 2-5 мкл продукта ПЦР в 1-2% геле для проверки на наличие продукта. Хотя эти условия ПЦР были разработаны для работы с большинством праймеров, для некоторых праймеров может требоваться дополнительная оптимизация путем корректировки концентрации матрицы, концентрации MgCl2 и/или температуры отжига.
Генотипирование в отношении целенаправленных модификаций посредством HDR. Временные рамки • 2-3 дня, практическое выполнение 2-3 часа
109) Заявители собирали ДНК, как описано выше, с использованием раствора QuickExtract и нормализовали геномную ДНК при помощи ТЕ до конечной концентрации 100-200 нг/мкл.
110) ПЦР-амплификация модифицированного участка. Реакционную смесь для ПЦР готовили следующим образом.

111) Заявители добавляли 100-200 нг геномной ДНК-матрицы из стадии 109 для каждой реакции и выполняли следующую программу.

112) Заявители прогоняли 5 мкл продукта ПЦР в 0,8-1% геле для проверки на наличие продукта в виде одной полосы. Может требоваться дополнительная оптимизация праймеров путем коррекции концентрации матрицы, концентрации MgCl2 и/или температуры отжига.
113) Заявители очищали продукты ПЦР-реакций с использованием набора для очистки продуктов ПЦР QIAquick.
114 В примере HDR сайт рестрикции для HindIII вводили в ген ЕМХ1. Это выявляют с помощью рестрикционного расщепления ПЦР-ампликона.

i. ДНК расщепляли в течение 10 мин. при 37°С.
ii. Заявители прогоняли 10 мкл расщепленного продукта с загрузочным красителем в градиенте полиакриламидного геля с ТВЕ 4-20% до тех пор, пока полоса ксилолцианола не мигрировала в нижнюю часть геля.
iii. Заявители окрашивали гель 1X красителем SYBR Gold при покачивании в течение 15 мин.
iv. Продукты расщепления визуально оценивали и количественно определяли, как описано выше, в разделе, посвященном анализу с помощью SURVEYOR. Эффективность HDR оценивали с помощью формулы: (b+с)/(а+b+с), где а представляет собой суммарную интенсивность для нерасщепленного ПЦР продукта с HDR, a b и с представляют собой суммарные интенсивности для разрезанных HindIII фрагментов.
115) В альтернативном случае очищенные ПЦР-ампликоны из стадии 113 можно клонировать и генотипировать с использованием секвенирования по Сэнгеру или NGS.
Глубокое секвенирование и анализ нецелевой активности • Временные рамки 1-2 дня
С помощью онлайн-инструмента конструирования для нацеливания CRISPR получали кандидатные нецелевые сайты генома для каждого идентифицированного целевого сайта. Анализ нецелевой активности в этих сайтах можно осуществлять путем анализа с помощью нуклеазы SURVEYOR, секвенирования по Сэнгеру или глубокого секвенирования нового поколения. С учетом вероятности низких или невыявляемых степеней модификации во многих из этих сайтов заявители рекомендуют глубокое секвенирование с использованием платформы Illumina Miseq для высокой чувствительности и точности. Протоколы будут изменяться с платформой для секвенирования; в данном документе заявители кратко описывали объединенный способ на основе ПЦР для прикрепления адаптеров секвенирования.
116) Конструирование праймеров для глубокого секвенирования. Праймеры для секвенирования нового поколения (NGS) конструировали для боле коротких ампликонов, как правило, с размером в диапазоне 100-200 п.о. Праймеры можно сконструировать вручную с использованием Primer-Blast от NCBI или создать с помощью онлайн-инструментов конструирования для нацеливания CRISPR (веб-сайт genome-engineering.org/tools).
117) Отбирали геномную ДНК из подвергшихся целенаправленному воздействию Cas9 клеток. Нормализовали полученную с помощью QuickExtract геномную ДНК до 100-200 нг/мкл при помощи ddH2O.
118) ПЦР для получения исходной библиотеки. С использованием праймеров для NGS со стадии 116 проводили ПЦР для получения исходной библиотеки

119) Добавляли 100-200 нг нормализованной геномной ДНК-матрицы для каждой реакции.
120) ПЦР-реакцию проводили с использованием следующих условий для циклов при не более 20 циклах амплификации:

121) Прогоняли 2-5 мкл продукта ПЦР в 1% геле для проверки на наличие продукта в виде одной полосы. Как и со всеми ПЦР геномной ДНК, может потребоваться дополнительная оптимизация праймеров для NGS путем коррекции концентрации матрицы, концентрации MgCl2 и/или температуры отжига.
122) Очищали продукты ПЦР-реакций с использованием набора для очистки продуктов ПЦР QIAquick и нормализовали элюентом до 20 нг/мкл. Точка остановки: очищенный ПЦР продукт можно хранить при -20°С.
123) Набор для приготовления образцов ДНК Nextera XT. Следуя протоколу производителя, создавали библиотеки, готовые для секвенирования в MiSeq, с уникальными штрих-кодами для каждого образца.
124) Анализ данных секвенирования. Анализ нецелевой активности можно проводить с помощью программ выравнивания ридов, таких как ClustalW, Geneious, или простых скриптов для анализа последовательностей.
Временные рамки
Стадии 1-2. Создание и синтез олигонуклеотидов sgRNA и ssODN: 1-5 дней, изменяются в зависимости от поставщика.
Стадии 3-5. Конструирование плазмиды с CRISPR или кассеты экспрессии для ПЦР: от 2 часов до 3 дней.
Стадии 6-53. Трансфекция в линии клеток: 3 дня (время практического выполнения 1 час).
Стадии 54-70. Необязательное получение клональных линий: 1-3 недели, изменяются в зависимости от типа клеток.
Стадии 71-91. Функциональная валидация NHEJ с помощью SURVEYOR: 5-6 часов.
Стадии 92-124. Генотипирование посредством секвенирования по Сэнгеру или глубокого секвенирования нового поколения: 2-3 дня (время практического выполнения 3-4 часа).
Проблемные ситуации, касающиеся приведенных в данном документе примеров
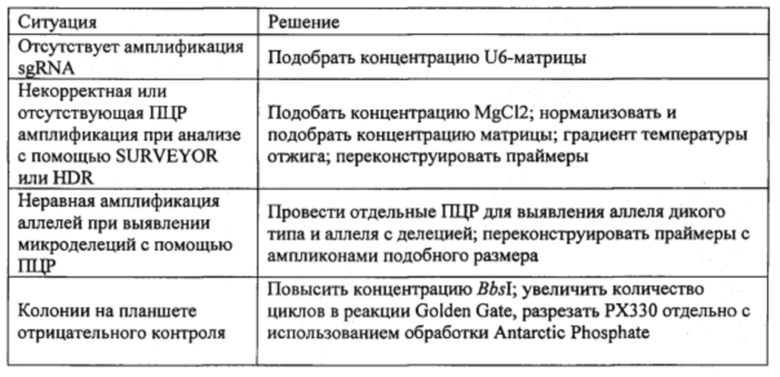

Обсуждение
Можно легко мультиплексировать CRISPR-Cas, чтобы облегчить одновременную модификацию нескольких генов и опосредовать хромосомные микроделеции с высокими значениями эффективности. Заявители использовали две sgRNA для демонстрации одновременного целенаправленного воздействия на локусы GRIN2B и DYRK1A человека с эффективностью до 68% в клетках HEK293FT. Подобным образом, пару sgRNA можно использовать для опосредования микроделеции, таких как вырезание экзона, которые можно генотипировать с помощью ПЦР на клональном уровне. Стоит учесть, что точное расположение мест соединений экзонов может изменяться. Заявители также продемонстрировали применение ssODN и вектора для целенаправленного воздействия для опосредования HDR как с использованием Cas9 дикого типа, так и никазы-мутанта Cas9 в клетках HEK 293FT и HUES9 (фиг. 30). Стоит учесть, что заявители не смогли выявить HDR в клетках HUES9 с использованием никазы Cas9, что могло быть обусловлено низкой эффективностью или возможным различием в активности репарации в клетках HUES9. Хотя эти значения являются типичными, существует некоторая изменчивость в эффективности расщепления для данной sgRNA, и в редких случаях определенные sgRNA могут не работать по неизвестным, пока что, причинам. Заявители рекомендуют сконструировать две sgRNA для каждого локуса и тестировать их эффективность у намеченного типа клеток.
Пример 31. NLS
Модулятор транскрипции на основе Cas9. заявители собирались превратить систему CRISPR Cas9/gRNA в универсальную ДНК-связывающую систему, при помощи которой могут выполняться функции помимо расщепления ДНК. Например, путем слияния функционального(функциональных) домена(доменов) в каталитически неактивном Cas9 заявители придали ему новые функции, такие как активация/репрессия транскрипции, метилирование/деметилирование или модификации хроматина. Для достижения этой цели заявители получили каталитически неактивный мутант Cas9 путем замены двух остатков, необходимых для нуклеазной активности, D10 и Н840, на аланин. При мутировании этих двух остатков нуклеазная активность Cas9 устраняется при сохранении способности связываться с целевой ДНК. Функциональные домены, на которых заявители решили сфокусироваться для тестирования своей гипотезы, представляли собой активатор транскрипции VP64 и репрессоры транскрипции SID и KRAB.
Ядерная локализация Cas9: заявители выдвинули гипотезу, что наиболее эффективный модулятор транскрипции на основе Cas9 обязательно должен быть локализован строго в ядре, где он будет оказывать наибольшее влияние на транскрипцию. Более того, любой остаточный Cas9 в цитоплазме может оказывать нежелательные воздействия. Заявители определили, что Cas9 дикого типа не локализуется в ядре без включения нескольких сигналов ядерной локализации (NLS) (хотя система CRISPR может не иметь один или несколько NLS, но преимущественно имеет по меньшей мере один или несколько NLS). Поскольку требовалось несколько последовательностей NLS, пришли к выводу о том, что сложно направить Cas9 в ядро, и любой дополнительный домен, который слит с Cas9, может нарушать ядерную локализацию. Таким образом, заявители создали четыре слитые конструкции Cas9-VP64-GFP с различными последовательностями NLS (pXRP02- pLenti2-EF1a-NLS-hSpCsn1(10A,840A)-NLS-VP64-EGFP, pXRP04- pLenti2-EF1a-NLS-hSpCsn1(10A,840A)-NLS-VP64-2A-EGFP-NLS, pXRP06- pLenti2-EF1a-NLS-EGFP-VP64-NLS-hSpCsn1(10A,840A)-NLS, pXRP08- pLenti2-EF1a-NLS-VP64-NLS-hSpCsn1(10A,840A)-NLS-VP64-EGFP-NLS). Эти конструкции клонировали в каркас на основе лентивируса с контролем экспрессии промотором EF1a человека. Элемент WPRE также добавляли для более устойчивой экспрессии белка. Каждую конструкцию трансфицировали в клетки HEK 293FT с использованием Lipofectamine 2000 и визуализировали через 24 часа после трансфекции. Наилучшую ядерную локализацию получали, когда белки слияния имели последовательности NLS как на N-, так и С-конце белка слияния. Наиболее выраженная наблюдаемая ядерная локализация наблюдалась у конструкции с четырьмя NLS-элементами.
Для более четкого понимания влияния NLS-элементов на Cas9 заявители создали 16 белков слияния Cas9-GFP путем добавления одной и той же последовательности NLS альфа-импортина либо на N-, либо С-конец в виде тандемных повторов в количестве от нуля до трех. Каждую конструкцию трансфицировали в клетки HEK 293FT с использованием Lipofectamine 2000 и визуализировали через 24 часа после трансфекции. Примечательно, что количество NLS-элементов не коррелирует прямо со степенью ядерной локализации. Добавление NLS на С-конце оказывало большее влияние на ядерную локализацию, чем добавление на N-конце.
Активатор транскрипции на основе Cas9: заявители проводили функциональное тестирование белка Cas9-VP64 путем целенаправленного воздействия на локус Sox2 и количественного определения активации транскрипции с помощью RT-qPCR. Восемь целевых сайтов ДНК выбирали для охвата промотора Sox2. Каждую конструкцию трансфицировали в клетки HEK 293FT с использованием Lipofectame 2000 и через 72 часа после трансфекции общую РНК экстрагировали из клеток. 1 мкг РНК подвергали обратной транскрипции в кДНК (qScript Supermix) в 40 мкл реакционной смеси. 2 мкл продукта реакции добавляли в отдельные 20 мкл реакционной смеси для реакции qPCR в анализе TaqMan. Каждый эксперимент осуществляли в трех повторностях из биологических и методических соображений. Ни контрольная RT, ни контрольная матрица не демонстрировали амплификацию. Конструкции, которые не демонстрировали строгую ядерную локализацию, pXRP02 и pXRP04, не приводили к активации. Для конструкции, которая не демонстрировала строгую ядерную локализацию, pXRP08, наблюдали умеренную активацию. Статистически значимую активацию наблюдали в случае направляющих РНК для Sox2.4 и Sox2.5.
Пример 32. Данные на мышах in vivo
Материалы и реагенты
Слитая полимераза Herculase II (Agilent Technologies, кат. №600679)
10x NEBuffer 4 (NEB, кат. №B7004S)
BsaI HF (NEB, кат. №R3535S)
ДНК-лигаза T7 (Enzymatics, кат. №L602L)
Буфер для FastDigest, 10Х (ThermoScientific, кат. №B64)
NotI FastDigest (ThermoScientific, кат. №FD0594)
Щелочная фосфатаза FastAP (ThermoScientific, кат. №EF0651)
Lipofectamine2000 (Life Technologies, кат. №11668-019)
Трипсин (Life Technologies, кат. №15400054)
Щипцы №4 (Sigma, кат. №Zl68777-1EA)
Щипцы №5 (Sigma, кат. №F6521-1EA)
10х сбалансированный солевой раствор Хэнкса (Sigma, кат. №H4641-500ML)
Раствор пенициллина/стрептомицина (Life Technologies, кат. №Р4333)
Neurobasal (Life Technologies, кат. №21103049)
Добавка В27 (Life Technologies, кат. №17504044)
L-глутамин (Life Technologies, кат. №25030081)
Глутамат (Sigma, кат. №RES5063G-A7)
β-меркаптоэтанол (Sigma, кат. №M6250-100ML)
Антитело кролика к НА (Cell Signaling, кат. №3724S)
Набор для визуализации клеток LIVE/DEAD® (Life Technologies, кат. №R37601)
Шприц 30 калибра World Precision Instrument (World Precision Instruments, кат. №NANOFIL)
Стереотаксический аппарат (Kopf Instruments)
UltraMicroPump3 (World Precision Instruments, кат. №UMP3-4)
Сахароза (Sigma, кат. №S7903)
Хлорид кальция (Sigma, кат. №C1016)
Ацетат магния (Sigma, кат. №М0631)
Tris-HCl (Sigma, кат. №Т5941)
EDTA (Sigma, кат. №E6758)
NP-40 (Sigma, кат. №NP40)
Фенилметансульфонилфторид (Sigma, кат. №78830)
Хлорид магния (Sigma, кат. №М8266)
Хлорид калия (Sigma, кат. №Р9333)
β-глицерофосфат (Sigma, кат. №G9422)
Глицерин (Sigma, кат. №G9012)
Рубиновый краситель Vybrant® DyeCycle™ (Life Technologies, кат. №S4942)
Клеточный сортер с активацией флуоресценции FACSAria (Koch Institute of MIT, Кембридж, США)
Набор DNAeasy для выделения ДНК из крови и тканей (Qiagen, кат. №69504)
Процедура
Конструирование мультиплексов gRNA для применения in vivo в головном мозге Заявители сконструировали и подвергали ПЦР-амплификации одиночные gRNA, нацеленные на представителей семейств ТЕТ и DNMT мыши (как описано в данном документе). Эффективность нацеливания оценивали на линии клеток N2a (фиг. 33). Для получения одновременной модификации нескольких генов in vivo эффективные gRNA мультиплексировали в упаковочном векторе на основе AAV (фиг. 34). Для облегчения дальнейшего анализа эффективности системы заявители добавляли к системе кассету экспрессии, состоящую из белка слияния из доменов GFP-KASH под контролем промотора гена синапсина I человека (фиг. 34). Данная модификация обеспечивала возможность дополнительного анализа эффективности системы в популяции нейронов (более подробная процедура описана в разделе Сортировка ядер и результаты in vivo).
Все 4 части системы подвергали ПЦР-амплификации, применяя слитую полимеразу Herculase II с использованием следующих праймеров:
1-й прямой праймер для U6:
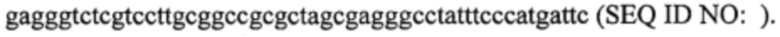
1-й обратный праймер для gRNA:
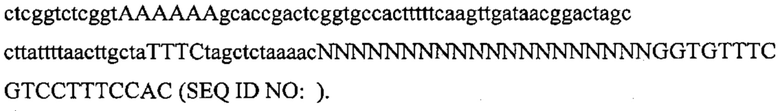
2-й прямой праймер для U6:
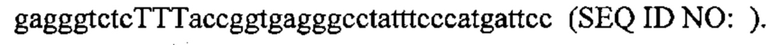
2-й обратный праймер для gRNA:
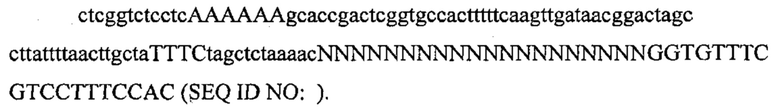
3-й прямой праймер для U6:
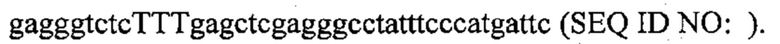
3-й обратный праймер для gRNA:
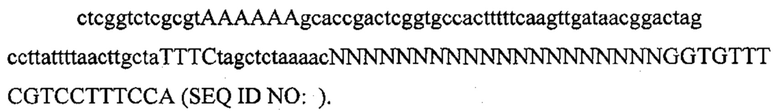
hSyn_GFP-kash Fw: 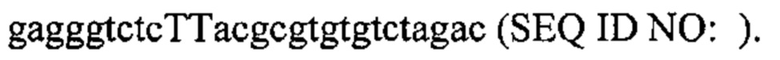
Обратный праймер для hSyn_GFP-kash:
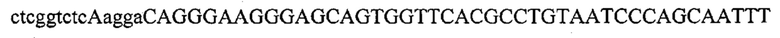
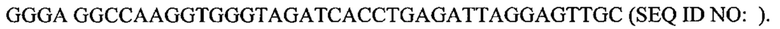
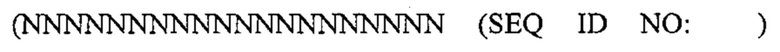 представляет собой последовательность, обратно-комплементарную целевой геномной последовательности)
представляет собой последовательность, обратно-комплементарную целевой геномной последовательности)
Заявители использовали стратегию Golden Gate для сборки всех частей (молекулярное соотношение 1:1) системы в одностадийной реакции:


Продукт реакции Golden Gate подвергали ПЦР-амплификации с использованием слитой полимеразы Herculase II и следующих праймеров:
Прямой 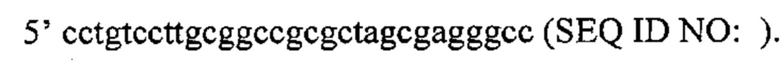
Обратный 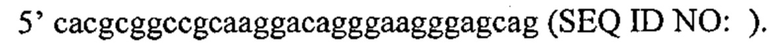
Продукт ПЦР клонировали в каркас на основе AAV между последовательностями ITR с использованием сайтов рестрикции для NotI.
Расщепление продукта ПЦР

Расщепление каркаса на основе AAV

Через 20 мин. инкубирования при 37°С образцы очищали с использованием набора для очистки продуктов ПЦР QIAquick. Стандартизированные образцы лидировали при соотношении вектор:вставка 1:3 следующим образом:

После трансформации бактерий продуктом реакции лигирования заявители подтверждали полученные клоны путем секвенирования по Сэнгеру.
Положительные клоны ДНК тестировали на клетках N2a после совместной трансфекции с конструкцией Cas9 (фиг. 35 и 36).
Создание новых конструкций Cas9 для доставки с помощью AAV
Система доставки на основе AAV, несмотря на ее характерные особенности, имеет ограничение по упаковке: для успешной доставки кассеты экспрессии in vivo она должна иметь размер менее 4,7 т.п.о. Для уменьшения размера кассеты экспрессии SpCas9 и облегчения доставки заявители тестировали несколько изменений: разные промоторы, более короткий сигнал полиА и, наконец, меньший вариант Cas9 из Staphylococcus aureus (SaCas9) (фиг. 37 и 38). Все тестируемые промоторы ранее тестировались и, как описано в публикациях, являлись активными в нейронах, включая мышиный Меср2 (Gray et al., 2011), крысиный Map1b и усеченный крысиный Map1b (Liu and Fischer, 1996). Ранее было показано, что альтернативная синтетическая последовательность поли(А) также является функциональной (Levitt et al., 1989; Gray et al., 2011). Все клонированные конструкции экспрессировались в клетках N2a после трансфекции с использованием Lipofectamine 2000, и их тестировали при помощи способа вестерн-блоттинга (фиг. 39).
Тестирование мультиплексной системы на основе AAV в первичных нейронах
Для подтверждения функциональности разработанной системы в нейронах заявители использовали культуры первичных нейронов in vitro. Нейроны коры головного мозга мыши получали согласно протоколу, опубликованному ранее Banker и Goslin (Banker and Goslin, 1988).
Нервные клетки получали из эмбрионов на 16 день беременности. Эмбрионы извлекали из подвергнутых эвтаназии беременных самок и декапитировали, а головы помещали в охлажденный на льду HBSS. Головной мозг затем извлекали из черепов пинцетом (№4 и №5) и переносили в другую порцию охлажденного на льду HBSS. Дальнейшие стадии осуществляли при помощи стереоскопического микроскопа в чашке Петри, наполненной охлажденным на льду HBSS, и щипцов №5. Полушария отделяли друг от друга и ствола головного мозга и очищали от оболочек головного мозга. Гиппокампы затем очень осторожно вырезали и помещали в коническую пробирку на 15 мл, заполненную охлажденным на льду HBSS. Кору, которая оставалась после вырезания гиппокампа, можно использовать для дальнейшего выделения клеток с помощью аналогичного протокола после удаления остатков ствола мозга и обонятельных луковиц. Выделенные гиппокампы промывали три раза 10 мл охлажденного на льду HBSS и диссоциировали путем 15-минутного инкубирования с трипсином в HBSS (4 мл HBSS с добавлением 10 мкл 2,5% трипсина на гиппокамп) при 37°С. После трипсинизации, чтобы удалить любые следы трипсина, гиппокампы очень осторожно промывали три раза HBSS, предварительно подогретым до 37°С, и диссоциировали в теплом HBSS. Заявители обычно диссоциировали клетки, полученные от 10-12 эмбрионов, в 1 мл HBSS с использованием наконечников для пипеток на 1 мл и разбавляли диссоциированные клетки до 4 мл. Клетки высевали с плотностью 250 клеток/мм2 и культивировали при 37°С и 5% СО2 в течение периода до 3 недель.
HBSS
435 мл H2O
50 мл 10х сбалансированного солевого раствора Хэнкса
16,5 мл 0,3 М HEPES, рН 7,3
5 мл раствора пенициллина-стрептомицина
Фильтровать (0,2 мкм) и хранить при 4°С.
Среда для посева нейронов (100 мл)
97 мл Neurobasal
2 мл добавки В27
1 мл раствора пенициллина-стрептомицина
250 мкл глутамина
125 мкл глутамата
Нейроны трансдуцировали концентрированным вирусом AAV1/2 или вирусом AAV1 из профильтрованной среды клеток HEK293FT в период между 4-7 днями в культуре и выдерживали в течение по меньшей мере одной недели в культуре после трансдукции для обеспечения возможности экспрессии доставленных генов.
Управляемая AAV экспрессия системы
Заявители подтверждали экспрессию SpCas9 и SaCas9 в культурах нейронов после доставки с помощью AAV с использованием вестерн-блот анализа (фиг. 42). Через одну неделю после трансдукции нейроны собирали в буфер для нанесения NuPage SDS с β-меркаптоэтанолом для денатурации белка при 95°С в течение 5 минут. Образцы разделяли в геле для SDS PAGE и переносили на мембрану из PVDF для выявления белков с помощью WB. Белки Cas9 выявляли с использованием антитела к НА.
Экспрессию Syn-GFP-Kash из мультиплексной gRNA в AAV подтверждали с использованием флуоресцентной микроскопии (фиг. 50).
Токсичность
Для оценки токсичности AAV с системой CRISPR заявители тестировали общие морфологические характеристики нейронов спустя неделю после трансдукции вируса (фиг. 45). Кроме того, заявители тестировали потенциальную токсичность сконструированной системы с использованием набора для визуализации клеток LIVE/DEAD®, который позволяет различать живые и мертвые клетки в культуре. Это основано на наличии внутриклеточной эстеразной активности (которая определяется по ферментативному превращению нефлуоресцентного кальцеина AM в интенсивно-зеленый флуоресцирующий кальцеин). С другой стороны, красный непроникающий в клетки компонент набора проникает только в клетки с поврежденными мембранами и связывается с ДНК, вызывая флуоресценцию у мертвых клеток. Оба флуорофора можно легко визуализировать в живых клетках с использованием флуоресцентной микроскопии. Управляемая AAV экспрессия белков Cas9 и мультиплексных конструкций gRNA в первичных нейронах коры головного мозга хорошо переносилась и не была токсичной (фиг. 43 и 44), это указывает на то, что сконструированная система на основе AAV является подходящей для исследований in vivo.
Получение вируса
Концентрированный вирус получали согласно способам, описанным в McClure et al., 2011. Получение вируса в надосадочной жидкости происходило в клетках HEK293FT.
Хирургические операции на головном мозге
Для инъекций вирусного вектора 10-15-недельных самцов мышей C57BL/6N анестезировали смесью кетамин/ксилазин (доза кетамина 100 мг/кг и доза ксилазина 10 мг/кг) путем внутрибрюшинной инъекции. Внутрибрюшинно вводимый бупренекс использовали в качестве упреждающего анальгетика (1 мг/кг). Животных обездвиживали в стереотаксическом аппарате Kopf с использованием внутриушных штифтов для позиционирования и зубной планки для сохранения черепа неподвижным. С использованием ручной дрели делали отверстие (1-2 мм) на -3,0 мм позади брегмы и на 3,5 мм латеральнее для инъекции в СА1-участок гиппокампа. При использовании шприца 30 калибра от World Precision Instrument раствор вирусных частиц AAV в общем объеме 1 мкл инъецировали на глубину 2,5 мм. Инъекцию контролировали с помощью насоса для инъекций 'World Precision Instruments UltraMicroPump3' со скоростью потока 0,5 мкл/мин. для предотвращения повреждения ткани. По завершении инъекции иглу для инъекции извлекали медленно со скоростью 0,5 мм/мин. После инъекции кожу закрывали с использованием шовного материала 6-0 Ethilon. Животных гидратировали после операции при помощи 1 мл раствора Рингера с лактатом (подкожно) и содержали в среде с контролируемой температурой (37°С) до достижения ими восстановления активности для передвижения. Через 3 недели после хирургической операции животных подвергали эвтаназии путем глубокой анестезии с последующим удалением ткани для сортировки ядер или перфузией 4% параформальдегидом для иммуногистохимического анализа.
Сортировка ядер и результаты in vivo
Заявители разработали способ специфического генетического мечения ядер нервных клеток, на которые осуществляет нацеливание gRNA, с использованием GFP для сортировки клеток с активированной флуоресценцией (FACS) в отношении меченых клеточных ядер и последующей обработки ДНК, РНК и ядерных белков. С этой целью разработанный заявителями вектор для мультиплексного целенаправленного воздействия конструировали для экспрессии как белка слияния из GFP и домена KASH белка ядерной мембраны (Starr DA, 2011, Current biology), так и 3 gRNA для нацеливания на конкретные локусы генов, представляющие интерес (фиг. 34). GFP-KASH экспрессировали под контролем промотора гена синапсина человека для специфического мечения нейронов. Белок слияния GFP-KASH имел следующие аминокислоты:

Через неделю после опосредованной AAV1/2 доставки в головной мозг наблюдали устойчивую экспрессию GFP-KASH. Для FACS и последующей обработки меченых ядер гиппокампы вырезали через 3 недели после хирургической операции и подвергали обработке для очистки клеточных ядер с использованием стадии центрифугирования в градиенте плотности. С этой целью ткань гомогенизировали в 320 мМ сахарозе, 5 мМ CaCl, 3мМ Mg(Ac)2, 10 мМ Tris рН 7,8, 0,1 мМ EDTA, 0,1% NP40, 0,1 мМ фенилметансульфонилфториде (PMSF), 1 мМ β-меркаптоэтаноле с использованием гомогенизатора Даунса емкостью 2 мл (Sigma). Гомогенат центрифугировали в градиенте от 25% к 29% Optiprep® согласно протоколу производителя в течение 30 мин при 3500 об./мин. и при 4°С. Осадок ядер ресуспендировали в 340 мМ сахарозе, 2 мМ MgCl2, 25 мМ KCl, 65 мМ глицерофосфате, 5% глицерине, 0,1 мМ PMSF, 1 мМ β-меркаптоэтаноле и добавляли красный краситель Vybrant® DyeCycle™ Ruby Stain (Life technologies) для мечения ядер клеток (обеспечивает испускание в ближней инфракрасной области спектра для ДНК). Меченые и очищенные ядра сортировали с помощью FACS с использованием клеточного сортера с активацией флуоресценции FACSAria и программного обеспечения BDFACS Diva. Отсортированные GFP+ и GFP- ядра в конечном итоге использовали для очистки геномной ДНК с использованием набора DNAeasy для выделения ДНК из крови и тканей (Qiagen) для анализа с помощью Surveyor подвергшихся целенаправленному воздействию участков генома. Этот же подход можно легко использовать для очистки ядерной РНК или белка из подвергшихся целенаправленному воздействию клеток для последующей обработки. Вследствие использования заявителями в данном подходе 2-векторной системы (фиг. 34) ожидалось, что эффективное опосредованное Cas9 расщепление ДНК будет происходить только у небольшой субпопуляции клеток в головном мозге (клетки, которые были совместно инфицированы как вектором для мультиплексного целенаправленного воздействия, так и вектором, кодирующим Cas9). Описанный в данном документе способ дает заявителям возможность специфической очистки ДНК, РНК и ядерных белков из популяции клеток, которые экспрессируют 3 gRNA, представляющие интерес, и, следовательно, как полагают, подвергаются опосредованному Cas9 расщеплению ДНК. Применяя этот способ заявители способны визуализировать эффективное расщепление ДНК in vivo, происходящее только в небольшой субпопуляции клеток.
В сущности, здесь заявители показали направленное расщепление in vivo. Кроме того, заявители применяли многосторонний подход с несколькими различными последовательностями, на которые осуществляется нацеливание одновременно, но независимо. Представленную систему можно применять для изучения патологических состояний головного мозга (нокаут гена, например, при болезни Паркинсона), и также она открывает область для дальнейшей разработки инструментов для редактирования генома в головном мозге. Путем замены нуклеазной активности на регуляторы транскрипции генов или эпигенетические регуляторы можно будет ответить на весь спектр научных вопросов о роли регуляции генов и эпигенетических изменений в головном мозге не только при патологических состояниях, но также при таких физиологических процессах, как обучение и формирование памяти. Наконец, представленную технологию можно применять в более сложных системах млекопитающих, таких как приматы, что позволяет преодолеть существующие на данный момент технологические ограничения.
Пример 33. Данные, полученные на модели
Специально было исследовано несколько моделей заболеваний. Они включают гены CHD8, KATNAL2 и SCN2A, связанные с риском развития аутизма de novo; и ген UBE3A, связанный с синдромным аутизмом (синдром Ангельмана). Эти гены и полученные на их основе модели аутизма, конечно, являются предпочтительными, но показывают, что настоящее изобретение можно применять в отношении любого гена, и, таким образом, любая модель является возможной.
Заявители получили эти линии клеток при использовании нуклеазы Cas9 в эмбриональных стволовых клетках человека (hESC). Линии создавали путем транзиентной трансфекции hESC с помощью Cbh-Cas9-2A-EGFP и pU6-sgRNA. Для каждого гена конструировали две sgRNA, наиболее часто осуществляющие нацеливание на одни те же экзоны, в которых у пациентов были недавно описаны нонсенс-мутации (нокаут) по результатам исследований с секвенированием всего экзома пациентов с аутизмом. Плазмиды Cas9-2A-EGFP и pU6 создавали специально для этого проекта.
Пример 34. Система или протокол для получения AAV
В данном документе представлены система или протокол для получения AAV, которые были разработаны для применений в скрининге с высокой пропускной способностью и которые особенно хорошо работают с ним, но они также имеют более широкую применимость в настоящем изобретении. Манипуляция с экспрессией эндогенных генов представляет разнообразные трудности, поскольку величина экспрессии зависит от многих факторов, включающих регуляторные элементы, процессинг мРНК и стабильность транскрипта. Для преодоления этой трудности заявители разработали вектор на основе аденоассоциированного вируса (AAV) для доставки. AAV имеет геном на основе ssDNA и, следовательно, является менее чувствительным к рекомбинации.
Протокол очистки концентрированного вируса AAV1/2 (серотип AAV1/2, т.е. гибридный или мозаичный капсид AAV из AAV1/AAV2) с использованием гепарина
Среда: D10 + HEPES
Бутыль на 500 мл с DMEM с высоким содержанием глюкозы + Glutamax (GIBCO)
50 мл FBS Hyclone (инактивированной нагреванием) (Thermo Fischer)
5,5 мл раствора HEPES (1 M, GIBCO)
Клетки: HEK293FT с малым числом пассажей (число пассажей <10 на момент получения вируса, произвести размораживание новых клеток 2-4 пассажа для получения вируса, выращивать в течение 3-5 пассажей)
Реагент для трансфекции: полиэтиленимин (PEI) "Мах"
Растворить 50 мг PEI "Max" в 50 мл стерильной сверхчистой Н2О
Довести рН до 7,1
Фильтровать с использованием фильтра в пластиковом съемном колпачке с размером отверстий 0,22 мкм
Запечатать пробирку и обернуть парафильмом
Заморозить аликвоты при -20°С (для хранения, также можно немедленно использовать)
Культура клеток
Культивировать клетки HEK293FT с малым числом пассажей в D10 + HEPES
Пассировать каждый день в соотношении от 1:2 до 1:2,5
Преимущественно не позволять клеткам достигать конфлюентности более 85%
Для Т75
- Подогреть 10 мл HBSS (-Mg2+, -Ca2+, GIBCO) + 1 мл TrypLE Express (GIBCO) на флакон до 37°С (водяная баня)
Полностью аспирировать среду
- Осторожно добавить 10 мл теплого HBSS (чтобы полностью вымыть среду)
- Добавить 1 мл TrypLE на флакон
- Поместить флакон в инкубатор (37°С) на 1 мин.
- Покачать флакон для отделения клеток
- Добавить 9 мл среды D10 + HEPES (37°С)
- Втягивать в пипетку и выталкивать из пипетки 5 раз для получения суспензии отдельных клеток
- Разделить в соотношении 1:2 - 1:2,5 (12 мл среды для Т75) (если клетки растут медленнее или они не проявляют оптимальный рост, тогда удалить их и разморозить новую партию)
- Перенести в Т225, как только будет присутствовать достаточное количество клеток (для простоты обращения с большими количествами клеток)
Получение AAV (в масштабе 5*чашек на 15 см на конструкцию)
Высеять 10 миллионов клеток в 21,5 мл среды в 15 см чашку
Инкубировать в течение 18-22 часов при 37°С
Трансфекция является идеальной при 80% конфлюентности
На планшет
Предварительно подогреть 22 мл среды (D10 + HEPES)
Подготовить пробирку со смесью ДНК (использовать не содержащую эндотоксина ДНК, полученную согласно протоколу для очистки больших количеств ДНК):
5,2 мкг вектора с представляющей интерес плазмидой
4,35 мкг плазмиды на основе AAV серотипа 1
4,35 мкг плазмиды на основе AAV серотипа 2
10,4 мкг плазмиды pDF6 (гены аденовируса-помощника)
Перемешать на вихревой мешалке для смешивания
Добавить 434 мкл DMEM (без сыворотки!)
Добавить 130 мкл раствора PEI
Перемешивать на вихревой мешалке 5-10 секунд
Добавить смесь ДНК/DMEM/PEI в предварительно подогретую среду
Быстро перемешать на вихревой мешалке для смешивания
Заменить среду в чашке на 15 см на смесь ДНК/DMEM/PEI
Поместить обратно в инкубатор с температурой 37°С
Инкубировать 48 часов перед сбором (убедиться, что среда не стала слишком кислой)
Сбор вируса
1. Осторожно аспирировать среду из 15 см чашек (преимущественно не смещая клетки)
2. Добавить 25 мл RT DPBS (Invitrogen) в каждый планшет и осторожно удалить клетки скребком для клеток. Собрать суспензию в пробирки на 50 мл.
3. Осаждать клетки при 800 х g в течение 10 минут.
4. Удалить надосадочную жидкость
Точка паузы: при необходимости заморозить осадок из клеток при -80°С.
5. Ресуспендировать осадок в 150 мМ NaCl, 20 мМ Tris с рН 8,0, использовать 10 мл на планшет для культуры тканей.
6. Приготовить свежий раствор 10% дезоксихолата натрия в dH2O. Добавить 1,25 мл этого раствора на планшет для культуры тканей для получения конечной концентрации 0,5%. Добавить нуклеазу Benzonase до конечной концентрации 50 единиц на мл. Тщательно перемешать содержимое пробирки.
7. Инкубировать при 37°С в течение 1 часа (водяная баня).
8. Удалить клеточный дебрис путем центрифугирования при 3000 х g в течение 15 мин. Перенести в новую 50 мл пробирку и удостовериться, что весь клеточный дебрис был удален для предотвращения блокирования колонок с гепарином.
Очистка AAV1/2 на колонке с гепарином
1. Настроить колонки HiTrap с гепарином с использованием перистальтического насоса таким образом, чтобы скорость потока растворов через колонку составлял 1 мл в минуту. Важно удостовериться, что пузырьки воздуха не попали в колонку с гепарином.
2. Уравновесить колонку 10 мл 150 мМ NaCl, 20 мМ Tris, pH 8,0 с использованием перистальтического насоса.
3. Связывание вируса: Внести 50 мл раствора вируса на колонку и обеспечить возможность его прохождения через нее.
4. Стадия промывки 1: колонка с 20 мл 100 мМ NaCl, 20 мМ Tris, pH 8,0 (использовать перистальтический насос).
5. Стадия промывки 2: с использованием шприца на 3 мл или 5 мл продолжать промывать колонку 1 мл 200 мМ NaCl, 20 мМ Tris, pH 8,0, затем промывать 1 мл 300 мМ NaCl, 20 мМ Tris, pH 8,0.
Прекратить промывание.
(приготовить шприцы с различными буферами во время 50 мин протекания раствора вируса сверху)
6. Элюирование. С использованием шприцев на 5 мл и небольшого давления (скорость потока <1 мл/мин) элюировать вирус из колонки путем применения:
1,5 мл 400 мМ NaCl, 20 мМ Tris, pH 8,0
3,0 мл 450 мМ NaCl, 20 мМ Tris, pH 8,0
1,5 мл 500 мМ NaCl, 20 мМ Tris, pH 8,0
Собрать его в центрифужную пробирку на 15 мл.
Концентрирование AAV1/2
1. Стадия концентрирования 1: концентрировать элюированный вирус с использованием центрифужных фильтрующих блоков Amicon Ultra на 15 мл с порогом отсечения по молекулярной массе 100000. Загрузить элюат из колонки в концентратор и центрифугировать при 2000 х g в течение 2 мин. (при комнатной температуре). Проверить объем сконцентрированного вируса - он должен составлять примерно 500 мкл. При необходимости центрифугировать с интервалами 1 мин. до достижения правильного объема.
2. Замена буфера: добавить 1 мл стерильного DPBS в фильтрующий блок, центрифугировать с интервалами 1 мин. до достижения правильного объема (500 мкл).
3. Стадия концентрирования 2: добавить 500 мкл концентрата в фильтрующий блок Amicon Ultra на 0,5 мл и 100K. Центрифугировать при 6000g в течение 2 мин. Проверить объем сконцентрированного вируса - он должен составлять примерно 100 мкл. При необходимости центрифугировать с интервалами 1 мин. до достижения правильного объема.
4. Извлечение: перевернуть фильтрующий элемент и вставить в новую пробирку для сбора. Центрифугировать при 1000 g в течение 2 мин.
Разделить на аликвоты и заморозить при -80°С.
Как правило, на один участок инъекции требуется 1 мкл, следовательно, рекомендуются небольшие аликвоты (например, 5 мкл) (во избежание замораживания-размораживания вируса).
Определить титр устойчивых к ДНКазе I частиц в GC с использованием qPCR (смотри отдельный протокол).
Материалы
Amicon Ultra, 0,5 мл, 100K; MILLIPORE; UFC510024
Amicon Ultra, 15 мл, 100K; MILLIPORE; UFC910024
Нуклеаза Benzonase; Sigma-Aldrich, E1014
Картридж с гепарином HiTrap; Sigma-Aldrich; 54836
Дезоксихолат натрия; Sigma-Aldrich; D5670
Протокол получения надосадочной жидкости с AAV1
Среда: D10 + HEPES
Бутыль на 500 мл с DMEM с высоким содержанием глюкозы + Glutamax (Invitrogen)
50 мл FBS Hyclone (инактивированная нагреванием) (Thermo Fischer)
5,5 мл раствора HEPES (1 М, GIBCO)
Клетки: HEK293FT с малым числом пассажей (число пассажей <10 на момент получения вируса)
Произвести размораживание новых клеток 2-4 пассажа для получения вируса, выращивать в течение 2-5 пассажей
Реагент для трансфекции: Полиэтиленимин (PEI) "Max"
Растворить 50 мг PEI "Мах" в 50 мл стерильной воды Ultrapure H20
Довести рН до 7,1
Фильтровать с использованием фильтра в пластиковом съемном колпачке с размером отверстий 0,22 мкм
Запечатать пробирку и обернуть пленкой parafilm
Заморозить аликвоты до -20°С (для хранения, также можно немедленно использовать)
Культура клеток
Культивировать HEK293FT с малым числом пассажей в D10 + HEPES. Пассажировать каждый день в соотношении от 1:2 до 1:2,5
Преимущественно позволять клеткам достигать более 85% конфлюентности
Для Т75
- Подогреть 10 мл HBSS (-Mg2+, -Са2+, GIBCO) + 1 мл TrypLE Express (GIBCO) на флакон до 37°С (водяная баня)
- Полностью аспирировать среду
- Осторожно добавить 10 мл теплого HBSS (чтобы полностью вымыть среду)
- Добавить 1 мл TrypLE на флакон
- Поместить флакон в термостат (37°С) на 1 мин.
- Покачать флакон для отделения клеток
- Добавить 9 мл среды D10 + HEPES (37°С)
- Втягивать в пипетку и выталкивать из пипетки 5 раз для получения суспензии отдельных клеток
- Разделить в соотношении 1:2 - 1:2,5 (12 мл среды для Т75) (если клетки растут медленнее или они не проявляют оптимальный рост, тогда удалить их и разморозить новую партию)
- Перенести в Т225, как только будет присутствовать достаточное количество клеток (для простоты обращения с большими количествами клеток)
Получение AAV (в масштабе одной чашки на 15 см)
Высеять 10 миллионов клеток в 21,5 мл среды в 15 см чашку
Инкубировать в течение 18-22 часов при 37°С
Трансфекция является идеальной при 80% конфлюентности на планшет
Предварительно подогреть 22 мл среды (D10 + HEPES)
Подготовить пробирку со смесью ДНК (использовать не содержащую эндотоксина ДНК, полученную согласно протоколу для очистки больших количеств ДНК):
5,2 мкг вектора с представляющей интерес плазмидой
8,7 мкг плазмиды на основе AAV серотипа 1
10,4 мкг плазмиды DF6 (гены аденовируса-помощника)
Перемешать на вихревой мешалке для смешивания
Добавить 434 мкл DMEM (без сыворотки!) Добавить 130 мкл раствора PEI
Перемешивать на вихревой мешалке 5-10 секунд
Добавить смесь ДНК/DMEM/PEI в предварительно подогретую среду
Быстро перемешать на вихревой мешалке для смешивания
Заменить среду в 15 см чашке на смесь ДНК/DMEM/PEI
Поместить обратно в инкубатор с температурой 37°С
Инкубировать 48 часов перед сбором (преимущественным является отслеживание, чтобы удостовериться в том, что среда не становится слишком кислой)
Сбор вируса
Удалить надосадочную жидкость из 15 см чашки
Фильтровать через фильтр с размером ячеек 0,45 мкм (низкая степень связывания белка). Разделить на аликвоты и заморозить при -80°С.
Трансдукция (культуры первичных нейронов в 24-луночном формате, 5DIV)
Заменить полную среду Neurobasal в каждой лунке с нейронами, которые подлежат трансдукции, свежей средой Neurobasal (обычно заменяют 400 мкл из 500 мкл в лунке)
Произвести размораживание надосадочной жидкости с AAV в водяной бане с температурой 37°С
Дать уравновеситься в инкубаторе в течение 30 мин.
Добавить 250 мкл надосадочной жидкости с AAV в каждую лунку
Инкубировать 24 часа при 37°С
Удалить среду/надосадочную жидкость и заменить свежей полной средой Neurobasal
Экспрессия становится видимой спустя 48 часов, насыщение в течение около 6-7 дней после инфицирования
Конструкции для плазмиды pAAV с GOI должны иметь размер, не превышающий 4,8 т.п.о., включая обе ITRS.
Пример кодон-оптимизированной для человека последовательности (т.е. являющейся оптимизированной для экспрессии у людей) SaCas9 приведен ниже:



Пример 35. Сведение к минимуму нецелевого расщепления с использованием никазы Cas9 и двух направляющих РНК
Cas9 представляет собой направляемую РНК ДНК-нуклеазу, которая можно нацелить на конкретные положения в геноме с помощью направляющей РНК из 20 п.о. Тем не менее, направляющая последовательность может допускать некоторые несовпадения между направляющей последовательностью и последовательностью ДНК-мишени. Данная гибкость является нежелательной вследствие потенциала в отношении нецелевого расщепления, когда направляющая РНК нацеливает Cas9 на нецелевую последовательность, которая отличается небольшим числом оснований от направляющей последовательности. Для всех экспериментальных применений (целенаправленное воздействие на гены, генная инженерия сельскохозяйственных культур, терапевтические применения и т.д.) важно иметь возможность улучшения специфичности опосредованного Cas9 целенаправленного воздействия на гены и снижения вероятности нецелевой модификации с использованием Cas9.
Заявители разработали способ применения мутантной никазы Cas9 в сочетании с двумя направляющими РНК для облегчения целенаправленных двухнитевых разрывов в геноме без нецелевых модификаций. Мутантную никазу Cas9 можно получить из нуклеазы Cas9 путем блокирования ее активности в отношении расщепления для того, чтобы вместо обеих нитей в дуплексе ДНК она расщепляла только одну нить. Никазу Cas9 можно получить путем индукции мутаций в одном или нескольких доменах нуклеазы Cas9, например, Ruvc1 или HNH. Данные мутации могут включать без ограничения мутации в каталитическом домене Cas9, например, в SpCas9 эти мутации могут находиться в положениях D10 или Н840. Данные мутации могут включать, без ограничения, D10A, Е762А, Н840А, N854A, N863A или D986A в SpCas9, но никазы можно получать путем индукции мутаций в соответствующих положениях у других ферментов CRISPR или ортологов Cas9. В наиболее предпочтительном варианте осуществления настоящего изобретения мутантная никаза Cas9 представляет собой никазу SpCas9 с мутацией D10A.
Это работает таким образом, что каждая направляющая РНК в комбинации с никазой Cas9 будет индуцировать целенаправленный однонитевой разрыв в присутствующей в виде дуплекса ДНК-мишени. Поскольку с помощью каждой направляющей РНК обеспечивается надрезание одной нити, окончательный результат представляет собой двухнитевой разрыв. Причина, по которой этот способ устраняет нецелевые мутации, заключается в том, что очень маловероятным является наличие нецелевого сайта, который характеризуется высокими степенями сходства в отношении обеих направляющих последовательностей (20 п.о. + 2 п.о.(РАМ) = 22 п.о. - специфичность в отношении каждой направляющей последовательности, а применение двух направляющих последовательностей означает, что любой нецелевой сайт должен будет иметь гомологичную последовательность около 44 п.о.). Хотя все еще существует вероятность, что отдельные направляющие последовательности могут иметь нецелевые мишени, но в эти нецелевые мишени будет вноситься только однонитевой разрыв, который с малой вероятностью будет репарироваться посредством процесса NHEJ с внесением мутаций. Таким образоем, мультиплексирование внесения однонитевых разрывов в две нити ДНК обеспечивает функциональный метод введения целенаправленных двухнитевых разрывов ДНК без нецелевых мутагенных эффектов.
Заявители проводили эксперименты, включающие совместную трансфекцию клеток HEK293FT плазмидой, кодирующей никазу Cas9(D10A), а также кассетами экспрессии ДНК для одной или нескольких направляющих последовательностей. Заявители трансфицировали клетки с использованием Lipofectamine 2000 и трансфицированные клетки собирали через 48 или 72 часа после трансфекций. Индуцированные внесением двойных однонитевых разрывов NHEJ выявляли с использованием анализа с помощью нуклеазы SURVEYOR, как описано в данном документе выше (фиг. 51, 52 и 53).
Заявители дополнительно идентифицировали параметры, связанные с эффективным расщеплением мутантной никазой Cas9 в сочетании с двумя направляющими РНК, и эти параметры включают, без ограничения, длину "липкого" 5'-конца. Об эффективном расщеплении сообщается в случае "липкого" 5'-конца, состоящего по меньшей мере из 26 пар оснований. В предпочтительном варианте осуществления настоящего изобретения "липкий" 5'-конец состоит по меньшей мере из 30 пар оснований и, более предпочтительно, по меньшей мере из 34 пар оснований. Для расщепления могут быть приемлемыми "липкие" концы, состоящие из вплоть до 200 пар оснований, хотя "липкие" 5'-концы, состоящие из менее чем 100 пар оснований, являются предпочтительными, и "липкие" 5'-концы, состоящие из менее чем 50 пар оснований, являются наиболее предпочтительными (фиг. 54 и 55).
Пример 36. Генотипические и фенотипические изменения АроВ, наблюдаемые in vivo в случае применения направляющих последовательностей и SaCas9, доставляемых внутривенно в печень с помощью вектора на основе AAV и печеночноспецифического промотора для Cas9
В этом примере, помимо прочего, представлены следующие положения.
AAV2/8 представляет собой аденовирусный вектор, нацеливающийся на печень.
TBG представляет собой печеночноспецифический промотор и используется здесь для управления экспрессией SaCas9.
U6 используется здесь для управления экспрессией sgRNA (направляющей).
АроВ представляет собой ген, участвующий в метаболизме липидов. Можно сказать, что он является "золотым стандартом" в доставке в печень и широко применяется в мышиных моделях ожирения.
"Мишень 1 - мишень 4" означает, что в АроВ были выбраны 4 мишени, из которых мишени 1 и три (Т1 и Т3) являлись наиболее полезными.
Доставка посредством экспрессии с вирусного вектора, рассматриваемая здесь, является улучшением по сравнению с предложенным Anderson/Yin (NBT 2884) применением гидродинамической доставки в качестве способа доставки, поскольку для гидродинамической доставки требуется инъекция нескольких мл жидкости, что является стрессовым для организма мыши и может быть смертельным. Гидродинамическая доставка хорошо подходит для доставки плазмидной ("оголенной") ДНК, тогда как заявители показали, что упаковка направляющей последовательности и последовательности Cas9 в вирусный вектор доставки является предпочтительной с точки зрения значительно возрастающей эффективности. Более того, необходимо вводить лишь относительно небольшие объемы, и это можно выполнить внутривенно (i.v.), что, вероятно, является намного более приемлемым с терапевтической точки зрения.
Особенно обнадеживающим является то, что для гена, являющегося "золотым стандартом" в печени, такого как АроВ, наблюдали не только генотипические изменения, но регистрировали также и фенотипические изменения. Предыдущая работа с PCSK9 показала генотипические, но не фенотипические изменения, так что фенотипические изменения, наблюдаемые для АроВ, подтверждают возможность доставки CRISPR в печень и ее способность к осуществлению фенотипического изменения в ней. Ее применяют в сочетании с более приемлемыми с терапевтической точки зрения способами доставки (i.v. по сравнению с гидродинамической доставкой). В связи с этим вирусная доставка CRISPR (направляющей последовательности и Cas9), особенно внутривенная, является предпочтительной.
Мишени включают: PCSK9, HMGCR, АРОВ, LDLR, ANGPTL3, F8, F9/FIX, ААТ, FAH, HPD, TAT, ATP7B, UGT1A1, ОТС, ARH
Материалы и способы
Вирусы и параметры инъекции
Применяемые конструкции: -AAV2/8 - TBG-SaCas9-U6-sgRNA (Apob-мишень 1 - мишень 4).
Тестирование in vitro: все индуцировали расщепление локуса Apob в клетках Нера при эффективности 10% - 15%.
Результаты in vivo: мыши - 8 недель, C57BL/6 (2 животных в каждый момент времени и с 1 животным в качестве контроля дикого типа, которому инъецировали солевой раствор).
Инъекция в хвостовую вену
Объем инъекции: 100 мкл 0,8Е12 vp/мл (vp = вирусная частица)
Доставка вирусных частиц: общее количество 0,8Е11 vp/животное
Обработка тканей и сбор данных
Обработка тканей и сбор данных происходили следующим образом:
первый момент времени ~ 1 неделя (8 дней). Второй момент времени ~ 4 недели.
После перфузии солевым раствором следовало получение тонких срезов ткани печени.
(A) Половину печени помещали в условия хранения при -80°С для анализа с помощью Surveyor, qPCR и вестерн-блоттинга белков (X12 пробирок/животное).
(B) Половину печени помещали в криопротектор и подвергали мгновенной заморозке для обработки в криостате. Криосрезы подвергали окрашиванию Н&Е и масляным красным.
Анализы с помощью QuickExtract и Surveyor применяли для выявления и количественной оценки вставок/делеций в 2 кусочках печени для каждого животного.
Результаты
Оценка вставок/делеций in vivo
На фигурах показана оценка вставок/делений in vivo применительно к направляющей последовательности для АроВ (мишеней) в течение определенного времени (до 4 недель после инъекции). На фиг. 56А показано, что направляющая последовательность для мишени 1 индуцировала более высокое процентное значение частоты вставок/делеций в АроВ. Для мишеней 2 и 4 был показан небольшой эффект или его отсутствие в том смысле, что в них было обусловлено лишь очень незначительное образование вставок/делеций или его отсутствие, тогда как для мишени 3 была показана некоторая активность. На фиг. 56В показаны результаты анализа в геле с помощью нуклеазы Surveyor в отношении эффективности образования вставок/делеций через 4 недели после инъекции.
Можно видеть, что мишень 1 характеризуется частотой образования вставок/делеций, составляющей почти 9%, что представляет значительные уровни в целевом локусе.
Фенотипические изменения, наблюдаемые с 2 из 4 направляющих последовательностей, сконструированных для нацеливания
Фенотипические изменения наблюдались с двумя из трех применяемых направляющих последовательностей (мишени 1 и 3), как видно на фиг. 57В, на которой показано окрашивание масляным красным для выявления фенотипа накопления липидов в печени in vivo после доставки AAV-Cas9-sgRNA. Накопление красных пятен, показанное на 2 фигурах слева для мишеней 1 и 3, указывает на нарушение функционирования АроВ и сравнивается с контролем справа внизу. Функционирование гена Apob было нарушено в результате индуцированного Cas9 целенаправленного расщепления генома, которое повлекло за собой данное физиологическое/фенотипическое изменение. Для мишени 2 не было показано заметного различия по сравнению с контролем, а мишень 4 не показана. Данное окрашивание масляным красным О представляет собой анализ, в котором жиры в печени визуализируют путем гистологического окрашивания. Данный краситель часто применяют в научно-исследовательской работе для оценки количества жиров в печени. В клинической практике краситель масляный красный О предназначен главным образом для замороженных срезов биоптатов печени для оценки количества жира в печени при трансплантации печени и других процедурах. Что касается протокола данного аспекта примеров и информации о нем, следует упомянуть: Mehlem et al, "Imaging of neutral lipids by oil red O for analyzing the metabolic status in health and disease". Nature Protocols 8, 1149-1154(2013); Maczuga et al., "Therapeutic expression of hairpins targeting apolipoprotein В 100 induces phenotypic and transcriptome changes in murine liver", Gene Therapy (2014) 21, 60-70; Koornneef et al, "Apolipoprotein В Knockdown by AAV-delivered shRNA Lowers Plasma Cholesterol in Mice", Molecular Therapy (2011) 19 4, 731-740; Tadin-Strapps et al., "siRNA-induced liver ApoB knockdown lowers serum LDL-cholesterol in a mouse model with human-like serum lipids", Journal of Lipid Research Volume 52, 1084-1097 (2011). Масштабная метка на фигуре представляет 20 микрон.
Пример 37. Эксперименты по оптимизации SaCas9
В исследования было включено следующее: оптимизация длины направляющей последовательности; тестирование интрона; промотор H1; тестирование двойной никазы D10A; дополнительное тестирование длины/DN.
Тестирование длины направляющей последовательности для SaCas9. Для определения длины направляющей sgRNA: 20 п.о. в сравнении с 21 и 22 п.о., а также эффект 'G' в начале (на 5'-конце) направляющей последовательности. Упоминается фигура 58. В данном эксперименте
целевые сайты
A1: AAVS1
El: ЕМХ1
Т1, Т2, ...: нумерация целевых сайтов
TGC, GTC, ...: состав оснований в положениях нуклеотидов 23, 22, 21 от 5'-конца РАМ
Эксперимент в данном примере проводят следующим образом. 1. Выбирают мишени с помощью NNGRR в качестве РАМ в двух генах, представляющих интерес, AAVS1 и ЕМХ1. 2. Синтезируют олигонуклеотиды, соответствующие мишеням, но варьируют длину части sgRNA, являющейся направляющей последовательностью, от 20 до 21 и до 22. 3. Применяют олигонуклеотиды для создания кассеты экспрессии sgRNA и вводят в линию клеток HEK. 293 FT путем совместной трансфекции с плазмидами, экспрессирующими белок SaCas9. 4. Через 72 часа после трансфекции клетки собирают и затем анализируют посредством анализа с помощью Surveyor для выявления вставок/делеций. 5. Частоту образования вставок/делеций, индуцированных Cas9, затем подсчитывают и настоящим обобщают на фигурах.
На фигуре 58 показано, что оптимальной длиной спейсера является 21 нуклеотид (нт)/пара оснований (п.о.), представленные серыми прямоугольниками, по сравнению по меньшей мере с 20 или 22 парами оснований (представленными черными и белыми прямоугольниками, соответственно) среди ряда мишеней в двух различных генах (AAVS1 и ЕМХ1). Мишени и гены не считаются важными, а лишь иллюстративными. В связи с этим 21 нуклеотид или пара оснований, по-видимому, являются оптимальными для приемлемой длины, особенно в случае или применительно к SaCas9. На фигуре 58 также показано, что нуклеотид G на 5'-конце направляющей/целевой последовательности может быть преимущественным, например, для промотора U6. Оптимальная длина направляющей последовательности может быть специфической для каждого белка Cas9. Например, для SpCas9 оптимальная длина направляющей последовательности может составлять 19-20 нт. Таким образом, данный пример демонстрирует, как можно определить и использовать оптимальную длину направляющей последовательности.
Тестирование интрона
Задачей данного эксперимента являлось тестирование того, можно ли направляющую последовательность встроить в интронную последовательность Cas9.
Применяли следующую конструкцию. Отмечено наличие направляющей РНК (sgRNA) в интроне (между N'- и С'-концевым экзонами Cas9).
CMV-SaCas9(N-конец)-интрон(sgRNA)-SaCas9(C-конец)
Конструкция экспрессировалась в клетках Нера.
Каждый интрон тестировали с 2 различными направляющими последовательностями: sgRNA для Pcsk9 и Hmgcr.
Показано в общей сложности 9 конструкций: три на основе EBV1, три на основе EBV2 и три на основе ADV:
- дорожки 1-3: показан EBV1-152 (на основе EBV, интрон 1 размером 152 п.о. из генома EBV)
- дорожки 4-6: показан EBV2 (на основе EBV, интрон из повтора W генома EBV)
- дорожки 7-9: показан ADV (аденовирусный интрон, происхождение аналогично описанному в Kiani et al., "CRISPR transcriptional repression devices and layered circuits in mammalian cells". Nature Methods doi:10.1038/nmeth.2969, опубликовано в режиме онлайн 5 мая 2014 г., и Nissim et al, "Multiplexed and Programmable Regulation of Gene Networks with an Integrated RNA and CRISPR/Cas Toolkit in Human Cells", Volume 54, Issue 4, p. 698-710, 22 мая 2014 г.; DOI: http://dx.doi.org/10.1016/j.molcel.2014.04.022).
В каждой группе конструирования три конструкции соответствуют трем различным сайтам встраивания sgRNA в интроне.
Конструкция 3 на основе ADV
Результаты показаны на фигуре 59. Данные результаты обеспечивают проверку и подтверждение принципа, заключающегося в том, что успешная упаковка направляющей последовательности в интрон SaCas9 определенно является возможной. sgRNA, несущую направляющую последовательность, встраивают в синтетический интрон, происходящий из аденовируса, и затем эту полную кассету интрон-sgRNA встраивают в ген SaCas9. Интроны можно встраивать в любом месте в гене SaCas9 без значительного нарушения нормальной экспрессии белка SaCas9. Несколько интронов с sgRNA можно встраивать в различные положения в гене SaCas9 Размещение является гибким, а данный широкий подход является преимущественным и включает следующие два пути:
Сведение размера к минимуму позволяет снизить общее количество п.о. или нт в конструкции.
Мультиплексирование позволяет достичь более высоких степеней мультиплексирования (совместная доставка нескольких направляющих последовательностей), поскольку вопрос 'пространства' здесь также всегда является проблемным. Поскольку для направляющих последовательностей не обязательно нужен конкретный промотор, одна или несколько направляющих последовательностей могут быть упакованы аналогичным образом в интрон Cas9.
В вышеприведенном тексте используется форма единственного числа, поскольку, как обсуждается выше, в Cas9 может быть введен ряд синтетических интронов. Может быть преимущественным встраивание sgRNA в положение, близкое к 5'-концу интрона, но находящееся на расстоянии по меньшей мере 5-15 п.о. от него, а также перед точкой ветвления интрона. Некоторую часть спейсерной последовательности в интроне между 5'-концевым донорным сайтом сплайсинга и точкой ветвления в середине интрона можно удалить, если специалист в данной области захочет это сделать. То, что это было достигнуто с Cas9, в частности, с SaCas9, может быть неожиданным, в том числе потому, что структура sgRNA различается между Sa и Sp.
На данный момент ADV является предпочтительным, но данный подход имеет широкую применимость среди ряда вирусов и Cas9 (Sa, Sp и т.д.).
Тестирования промотора H1
Задачей данного эксперимента являлось исследование промоторов, альтернативных промотору U6.
A) Н1 полной длины
Получали следующие конструкции:
CMV-SaCas9 с исходным промотором Н1, управляющим одной sgRNA (Pcsk9-мишень 201 либо Hmgcr-новая мишень 5)
Как можно видеть на фигуре 60, промотор Н1 полной длины (серый прямоугольник) все же является более слабым, чем промотор U6 (черный прямоугольник), поскольку U6 демонстрирует повышенное процентное значение количества образующихся вставок/делеций для каждой тестируемой мишени.
B) Тестирование двойного промотора Н1 (короткого Н1)
Получали следующие конструкции:
TBG-SaCas9 с двумя короткими промоторами H1, управляющими двумя sgRNA (Pcsk9-мишень 201 и Hmgcr-новая мишень 5), при этом двойной короткий промотор H1 применяется в одинаковой ориентации и в противоположных ориентациях.
Как можно видеть на фигуре 61, короткий промотор H1 является более слабым, чем промотор H1 полной длины.
Тестирование никазы SaCas9 (с использованием мутанта D10A)
В данном эксперименте рассматривали расстояние между 5'-концами двух направляющих последовательностей в конструкции и затем измеряли его применительно к эффективности расщепления двойной никазой SaCas9 D10A. Мишени относились к гену ААТ1 человека. Эти тестирования проводили с направляющими последовательностями размером 20 п.о. +G, клонированными в плазмиды.
Оптимальные результаты демонстрировались от -5 до +1 п.о. (от 5' до 5'), смотри фигуру 62.
Пример 38. Исследование функций генов in vivo в головном мозге млекопитающих с использованием CRISPR-Cas9
В данной работе представлены следующие основные положения. Первая демонстрация успешной опосредованной AAV доставки Cas9 in vivo, а также эффективной модификации генома в постмитотических нейронах. Разработка методики мечения ядер, позволяющей осуществлять простое выделение ядер нейронов из клеток, экспрессирующих Cas9 и sgRNA. Демонстрация применения анализа транскриптома нейрона путем секвенирования РНК. Объединение электрофизиологических исследований с опосредованным Cas9 внесением изменений в геном. А также демонстрация мультиплексного целенаправленного воздействия и возможности изучения функций генов по поведению грызунов с помощью опосредованного Cas9 редактирования генома.
Трансгенные животные модели, несущие ассоциированные с заболеваниями мутации, являются чрезвычайно полезными для изучения неврологических нарушений, содействуя выяснению генетического и патофизиологического механизма заболевания1. Однако создание животных моделей, несущих одиночные или множественные генные модификации, является особенно трудоемким и требует продолжительной селекции в течение многих поколений. Поэтому для облегчения быстрого анализа функций генов в нормальных и связанных с заболеваниями процессах в головном мозге необходима возможность осуществления точных и эффективных манипуляций с геномом нейронов in vivo. Было показано, что CRISPR-ассоциированная эндонуклеаза Cas9 из Streptococcus pyogenes (SpCas9) опосредует точное и эффективное расщепление генома в одном или нескольких генах в эукариотических клетках с реплицирующимся геномом, что приводит к мутациям сдвига рамки считывания по типу вставок или делеций (вставок/делений)2, 3. В данной работе авторы настоящего изобретения объединили опосредованное Cas9 внесение изменений в геном со снятием биохимических, относящихся к секвенированию, электрофизиологических и поведенческих показателей для изучения функций отдельных генов, а также их групп в нервных процессах и их роли в мозговых нарушениях in vivo.
Обсуждение
Векторы на основе аденоассоциированного вируса (AAV) широко применяются для доставки рекомбинантных генов в головной мозг мыши4. Основным ограничением системы AAV является ее небольшая емкость упаковки, не превосходящая примерно 4,5 т.п.о. без ITR5, что ограничивает количество генетического материала, которое можно упаковать в одиночный вектор. Поскольку размер SpCas96 уже составляет 4,2 т.п.о., что оставляет менее 0,3 т.п.о. для других генетических элементов в одиночном векторе на основе AAV, авторы настоящего изобретения разработали двухвекторную систему, в которой кассеты экспрессии SpCas9 (AAV-SpCas9) и sgRNA (AAV-Sp-направляющая последовательность) упакованы в двух отдельных вирусных векторах (фигура 67а). При конструировании вектора AAV-SpCas9 авторы настоящего изобретения сравнивали различные короткие нейрон-специфичные промоторы, а также сигналы полиаденилирования для оптимизации экспрессии SpCas9. Для конечной конструкции авторы настоящего изобретения выбрали промотор Меср2 мыши (235 п.о., рМеср2)7 и минимальный сигнал полиаденилирования (48 п.о., spA)8 на основании их способности к обеспечению достаточных уровней экспрессии SpCas9 в культивируемых первичных кортикальных нейронах мыши (фигура 67-с). Для облегчения иммунофлуоресцентной идентификации нейронов, экспрессирующих SpCas9, авторы настоящего изобретения метили SpCas9 эпитопной НА-меткой. Авторы настоящего изобретения упаковывали в вектор AAV-Sp-направляющая последовательность кассету экспрессии U6-sgRNA, a также зеленый флуоресцентный белок (GFP), слитый с ядерным трансмембранным доменом KASH9, под управлением промотора гена синапсина I человека (фигура 63а). Белок слияния GFP-KASH направляет GFP во внешнюю ядерную мембрану (фигура 67c,d) и обеспечивает флуоресцентную идентификацию и очистку интактных ядер нейронов, трансдуцированных AAV-Sp-направляющая последовательность.
Для тестирования эффективности доставки двухвекторной системой доставки авторы настоящего изобретения вначале трансдуцировали культивируемые первичные кортикальные нейроны мыши in vitro и наблюдали устойчивую экспрессию при помощи векторов AAV-SpCas9 и AAV-Sp-направляющая последовательность (фигура 67е) с более чем 80% эффективностью совместной трансдукции (фигура 67е). Важно, что, по сравнению с нетрансдуцированными нейронами, экспрессия SpCas9 не оказывала отрицательное влияние на морфологические характеристики и выживаемость трансдуцированных нейронов (фигура 67c,f).
Создав эффективную систему доставки, авторы настоящего изобретения затем стремились к тестированию опосредованного SpCas9 редактирования генома в первичных нейронах мыши. Хотя SpCas9 применялся для достижения эффективных модификаций генома в разнообразных типах делящихся клеток, оставалось неясно, можно ли применять SpCas9 для осуществления эффективного редактирования генома в постмитотических нейронах. Для первоначального тестирования авторы настоящего изобретения целенаправленно воздействовали на ген Меср2, играющий важнейшую роль при синдроме Ретта, типе расстройства аутистического спектра. Белок МеСР2 повсеместно экспрессируется в нейронах во всем головном мозге, но практически отсутствует в глиальных клетках11, 12, и было показано, что его недостаточность ассоциирована с тяжелыми морфологическим и электрофизиологическим фенотипами в нейронах, оба из которых, как полагают, вносят вклад в неврологические симптомы, наблюдаемые у пациентов с синдромом Ретта13-16. Для целенаправленного воздействия на Меср2 авторы настоящего изобретения вначале разработали несколько sgRNA, осуществляющих нацеливание на экзон 3 гена Меср2 мыши (фигура 68а), и оценивали их эффективность с применением клеток Neuro-2a. Наиболее эффективную sgRNA идентифицировали путем применения анализа с помощью нуклеазы SURVEYOR (фигура 68b). Авторы настоящего изобретения выбрали наиболее эффективную sgRNA (Меср2, мишень 5) для последующих экспериментов по нацеливанию на Меср2 in vitro и in vivo.
Для оценки эффективности редактирования двухвекторной системой в нейронах авторы настоящего изобретения трансдуцировали первичные кортикальные нейроны мыши на 7 день in vitro (7 DIV, фигура 69а) и измеряли частоту вставок/делеций путем применения анализа с помощью нуклеазы SURVEYOR через 7 дней после трансдукции (фигура 69b). Следует отметить, что культура нейронов, совместно трансдуцированных векторами AAV-SpCas9 и AAV-Sp-направляющая последовательность, нацеливающимися на Меср2, продемонстрировала снижение уровней белка МеСР2 по сравнению с контрольными нейронами, составляющее до 80% (фигура 69c,d). Одно возможное объяснение наблюдаемого несоответствия между относительно низкой частотой вставок/делеций (~14%) и сильным истощением запасов белка (~80%) может заключаться в том, что связывание SpCas9 с целевым сайтом попросту может препятствовать транскрипции, что было показано для Е. coli17, 18. Авторы настоящего изобретения исследовали данную вероятность с использованием мутантного SpCas9 с инактивированными каталитическими доменами как RuvC, так и HNH19, 20 (D10A и Н840А, dSpCas9). Совместная экспрессия dSpCas9 и sgRNA, осуществляющей нацеливание на Меср2, не снижала уровни белка МеСР2 (фигура 69a,d), что позволяет предположить, что наблюдаемое понижение уровня МеСР2 в присутствии активного SpCas9 обусловлено наличием модификации в локусе Меср2. Другое возможное объяснение несоответствия между низким уровнем выявляемых вставок/делений и высоким уровнем истощения запасов белка может быть обусловлено недооценкой истинной частоты вставок/делеций в анализе с помощью нуклеазы SURVEYOR - ранее было показано, что точность выявления с помощью SURVEYOR является чувствительной к составу последовательности вставки/делеции.21
Ранее было показано, что мутация потери функции МеСР2 ассоциирована с аномалиями дендритного дерева и дефектами морфогенеза шипиков в нейронах14, 16. Эти фенотипы утраты МеСР2 также воспроизводились в нейронах, отличных от iPS-клеток с МеСР-KO15. Поэтому авторы настоящего изобретения исследовали, может ли опосредованное SpCas9 истощение запасов МеСР2 в нейронах аналогичным образом воспроизводить морфологические фенотипы синдрома Ретта. В действительности нейроны, в которых совместно экспрессировались SpCas9 и sgRNA, осуществляющая нацеливание на Меср2, проявляли измененную морфологию дендритного дерева и плотность шипиков по сравнению с контрольными нейронами (фигура 70). Эти результаты демонстрируют, что SpCas9 также можно применять для облегчения изучения функций генов в клеточных анализах путем обеспечения целенаправленного нокаута в постмитотических нейронах.
С учетом сложности нервной системы, состоящей из разветвленных сетей разнородных типов клеток, способность к эффективному редактированию генома нейронов in vivo позволит осуществлять прямое тестирование функций генов в надлежащих типах клеток, погруженных в естественный контекст. В связи с этим авторы настоящего изобретения производили стереотаксическую инъекцию смеси (в соотношении 1:1) векторов AAV-SpCas9 и AAV-Sp-направляющая последовательность высокого титра в зубчатую извилину гиппокампа взрослых мышей. Авторы настоящего изобретения наблюдали высокую эффективность совместной трансдукции обоих векторов (более 80%) в гранулярных клетках гиппокампа через 4 недели после инъекции вируса (фигура 63b,с), приводившей к модификациям генома в локусе Меср2. (фигура 63d). Путем применения анализа с помощью нуклеазы SURVEYOR авторы настоящего изобретения выявили ~13% частоту вставок/делеций во фрагментах головного мозга, полученных из инъецированных участков головного мозга (фигура 63е). Аналогично результатам, полученным авторами настоящего изобретения для культивируемых первичных нейронов, опосредованное SpCas9 разрезание локуса Меср2 эффективно снижало уровни белка МеСР2 более чем на 60%. Дополнительно, количество МеСР2-положительных ядер в зубчатой извилине уменьшалось более чем на 75% в случае инъекции векторов AAV-SpCas9 и AAV-Sp-направляющая последовательность по сравнению с AAV-SpCas9 в отдельности (фигура 63g-h). Эти результаты позволяют предположить, что SpCas9 можно применять для непосредственного внесения изменений в конкретные гены в неизмененном биологическом контексте.
Целенаправленное внесение изменений в геном можно сочетать со снятием количественных показателей для обеспечения проникновения в сущность биологических функций конкретных элементов генома. Для облегчения анализа клеток, трансдуцированных векторами AAV-SpCas9 и AAV-Sp-направляющая последовательность, авторы настоящего изобретения разработали способ очистки ядер, меченных GFP-KASH, с помощью сортировки клеток с активированной флуоресценцией (FACS) (фигура 64а). Отсортированные ядра можно непосредственно применять для очистки ядерной ДНК и РНК для последующего биохимического или секвенирующего анализа. При помощи секвенирования по Сэнгеру авторы настоящего изобретения обнаружили, что 13 из 14 отдельных GFP-положительных ядер содержали мутацию по типу вставки/делеции в целевом сайте для sgRNA.
В дополнение к секвенированию геномной ДНК, очищенные GFP-положительные ядра также можно применять для анализа путем секвенирования РНК в целях изучения последствий истощения запасов МеСР2 для транскрипции (фигура 64b и фигура 71). Для тестирования эффекта нокаута Меср2 в отношении транскрипции в нейронах зубчатой извилины авторы настоящего изобретения получили библиотеки для секвенирования РНК с использованием очищенных с помощью FACS GFP+ ядер от животных, получавших AAV-SpCas9, а также либо контрольную sgRNA, сконструированную для нацеливания на бактериальный ген lacZ, а не на геном мыши, либо sgRNA, осуществляющую нацеливание на Меср2. Все sgRNA были оптимизированы для сведения к минимуму показателя их нецелевой активности (инструмент для конструирования CRISPR: http://tools.genome-engineering.org)2. Авторы настоящего изобретения смогли обнаружить дифференциально экспрессируемые гены (фигура 63b) среди контрольных и экспрессирующих sgRNA для Меср2 ядер (р<0,01). Авторы настоящего изобретения идентифицировали несколько интересных кандидатов среди генов, экспрессия которых была понижена в ядрах, экспрессирующих sgRNA для Меср2: Нрса, Olfm1 и Ncdn, о которых ранее сообщалось, что они играют важные роли в формах поведения при обучении22-24; и Cplx2, который, как было показано, вовлечен в высвобождение из синаптических пузырьков и связан с частотой спайковых разрядов нейронов25, 26. Данные результаты демонстрируют, что комбинация опосредованного SpCas9 внесения изменений в геном и анализа путем секвенирования РНК на популяционном уровне дает возможность охарактеризовать регуляцию транскрипции в нейронах и предположить, какие гены могут быть важными для конкретных функций или болезненных процессов в нейронах.
Опосредованное SpCas9 редактирование генома в головном мозге in vivo можно также сочетать с электрофизиологической регистрацией для изучения эффекта от внесения изменений в геном в отношении конкретных типов клеток или компонентов нервной цепи. Для изучения функционального эффекта истощения запасов МеСР2 в отношении физиологических характеристик нейронов авторы настоящего изобретения производили стереотаксическую совместную доставку векторов AAV-SpCas9 и AAV-Sp-направляющая последовательность, нацеливающихся на Меср2, в поверхностный слой первичной зрительной коры (VI) самцов мышей. V1 была выбрана по той причине, что кортикальные возбуждающие нейроны поверхностного слоя являются более доступными для двухфотонной визуализации и целевой регистрации потенциалов на основе использования двухфотонной визуализации. Через две недели после доставки SpCas9 мышей подвергали околоклеточной регистрации потенциалов на основе использования двухфотонной визуализации для сравнения электрофизиологической реакции KASH-GFP+ нейронов и соседних GFP- нейронов в 2/3 слоях V1 мыши (фигура 64а-с). Авторы настоящего изобретения измеряли реакции нейронов на 18 решеток, смещающихся с шагом в 20 градусов, и рассчитывали частоту вызванных спайковых разрядов (FR) и индекс ориентационной избирательности (OSI) клеток путем векторного усреднения реакции. Как FR, так и OSI были значительно снижены у возбуждающих GFP+ нейронов с нокаутом МеСР2 по сравнению с соседними возбуждающими GFP- нейронами (фигура 64d-e). Для сравнения, экспрессия контрольной sgRNA вместе с SpCas9 не оказывала какого-либо эффекта на FR и OSI по сравнению с соседними неинфицированными нейронами (фигура 64d-e). Эти результаты показывают, что опосредованное SpCas9 истощение запасов МеСР2 в зрелых кортикальных нейронах V1 изменяет свойства зрительных реакций возбуждающих нейронов in vivo в течение двух недель, и дополнительно демонстрируют универсальность SpCas9 в облегчении целенаправленного нокаута генов в головном мозге млекопитающих in vivo для изучения функций генов и разъединения нейронных цепей.
Одним из ключевых преимуществ системы SpCas9 является ее способность к содействию мультиплексному редактированию генома2. Введение стабильных нокаутов нескольких генов в головном мозге живых животных будет иметь потенциально многообещающие применения, такие как каузальное исследование полигенных механизмов, лежащих в основе физиологических и невропатологических состояний. Для тестирования возможности мультиплексного редактирования генома в головном мозге авторы настоящего изобретения разработали мультиплексный вектор экспрессии sgRNA, состоящий из трех последовательно расположенных sgRNA вместе с GFP-KASH для мечения ядер (фигура 65а). Авторы настоящего изобретения выбрали sgRNA, осуществляющие нацеливание на семейство генов ДНК-метилтрансфераз (DNMT), состоящее из Dnmt1, Dnmt3a и Dnmt3b. Dnmt1 и 3а характеризуются высоким уровнем экспрессии в зрелом головном мозге, и ранее было показано, что активность DNMT изменяет состояние метилирования ДНК и что как Dnmt3a, так и Dnmt1 необходимы для синаптической пластичности, а также обучения и формирования памяти27. Авторы настоящего изобретения сконструировали отдельные sgRNA, направленные на Dnmt3a и Dnmt1, с высокой эффективностью модификации. Во избежание любых возможных компенсаторных эффектов со стороны Dnmt3b авторы настоящего изобретения решили также дополнительно целенаправленно воздействовать на этот ген, даже несмотря на то, что он экспрессируется главным образом во время неврологического развития27. Наконец, авторы настоящего изобретения выбрали отдельные sgRNA для высокоэффективного одновременного расщепления ДНК во всех трех целевых генах (фигура 66b и фигура 72).
Для тестирования эффективности мультиплексного редактирования генома in vivo авторы настоящего изобретения производили стереотаксическую доставку смеси векторов AAV-SpCas9 и AAV-Sp-направляющая последовательность высокого титра в дорсальную и вентральную части зубчатой извилины самцов взрослых мышей. Через 4 недели гиппокампы вырезали, и подвергнутые целенаправленному воздействию клеточные ядра сортировали посредством FACS. Авторы настоящего изобретения выявили ~19% (Dnmt3a), 18% (Dnmt1) и 4% (Dnmt3b) частоту вставок/делеций в группе отсортированных ядер путем использования анализа с помощью нуклеазы SURVEYOR (фигура 66с) и секвенирования (фигура 73). Целенаправленное воздействие на несколько локусов ставит вопрос об эффективной частоте множественных нокаутов в отдельных клетках. Путем использования сортировки отдельных ядер в комбинации с целевым секвенированием авторы настоящего изобретения количественно определяли одновременное целенаправленное воздействие на несколько локусов DNMT в отдельных ядрах нейронов (фигура 66d). Среди ядер нейронов, несущих модификацию по меньшей мере в одном локусе Dnmt, более чем 70% ядер содержали вставки/делеции как в Dnmt3a, так и в Dnmt1 (~40% содержали вставки/делеции во всех 3 локусах и ~30% в локусе Dnmt3a, а также в локусе Dnmt1). Эти результаты согласуются с уровнями истощения запасов белков Dnmt3a и Dnmt1 в зубчатой извилине (фигура 66е). Ввиду низкой экспрессии Dnmt3b в зрелом головном мозге авторы настоящего изобретения не смогли выявить белок Dnmt3b.
Недавние исследования с SpCas9 показали, что, хотя каждое основание в последовательности sgRNA из 20 нт вносит вклад в общую специфичность, в локусах генома, частично совпадающих с sgRNA, может быть обусловлено образование нецелевых двухнитевых разрывов и вставок/делеций28, 29. Для оценки частоты нецелевых модификаций авторы настоящего изобретения путем вычислений определили перечень целевых сайтов генома с высокой степенью сходства2 и количественно определили частоту модификаций с помощью целевого глубокого секвенирования. Анализ вставок/делеций в главных предсказанных нецелевых локусах выявил частоту образования вставок/делеций, составляющую 0-1,6%, что демонстрировало специфичность модификации с помощью SpCas9. Для повышения специфичности опосредованного SpCas9 редактирования генома in vivo в будущих исследованиях можно применять стратегии сведения к минимуму нецелевых эффектов, такие как внесение двойных однонитевых разрывов30, 31 и применение усеченных sgRNA28.
Ранее было показано, что нокдаун Dnmt3a и Dnmt1 влияет на формирование гиппокамп-зависимой памяти27. В связи с этим авторы настоящего изобретения проводили тестирование поведения при выработке контекстного условного рефлекса в связи с переживанием чувства страха для исследования эффекта опосредованного SpCas9 тройного нокаута ((Dnmt3a, Dnmt1 и Dnmt3b)) на запоминание и консолидацию памяти. Хотя авторы настоящего изобретения не наблюдали каких-либо различий между контрольными мышами и мышами с тройным нокаутом в фазе запоминания, нокаутные мыши продемонстрировали ухудшенную консолидацию памяти при тестировании в условиях тренировочного контекста (фигура 66f). Данный эффект устранялся при тестировании мышей в измененном контексте. Результаты авторов настоящего изобретения демонстрируют, что опосредованный CRISPR-Cas9 нокаут представителей семейства DNMT в нейронах зубчатой извилины является достаточным для изучения функций генов в поведенческих задачах.
В совокупности результаты авторов настоящего изобретения демонстрируют, что опосредованная AAV доставка SpCas9 и sgRNA in vivo обеспечивает быструю и эффективную технологию осуществления внесения точных изменений в геном в интактных нервных цепях. При том, что SpCas9 широко применялся в генной инженерии делящихся клеток, авторы настоящего изобретения продемонстрировали, что SpCas9 также можно применять для геномной инженерии постмитотических нейронов с высокой эффективностью посредством опосредованного NHEJ образования вставок/делений. Опосредованное SpCas9 внесение изменений в геном можно объединять с биохимическим, секвенирующим, электрофизиологическим и поведенческим анализом для изучения функций целевого элемента генома. Авторы настоящего изобретения продемонстрировали, что при опосредованном SpCas9 целенаправленном воздействии на один или несколько генов, как правило, могут воспроизводиться морфологические, электрофизиологические и поведенческие фенотипы, наблюдаемые при применении классических, более трудоемких генетических мышиных моделей. В настоящем исследовании использовали Cas9 Streptococcus pyogenes, который не только требует применения векторов на основе AAV, но также и ограничивает размер промоторных элементов, которые можно применять для осуществления целенаправленного воздействия, специфичного к типу клеток. С учетом разнообразия ортологов Cas9, некоторые из которых являются значительно более короткими, чем SpCas92, 32, 33, может быть возможным конструирование одиночных векторов на основе AAV, экспрессирующих как Cas9, так и sgRNA, как описано в данном документе.
ЛИТЕРАТУРНЫЕ ИСТОЧНИКИ
1. Nestler, E.J. & Hyman, S.E, Animal models of neuropsychiatric disorders. Nat Neurosci 13, 1161-1169 (2010).
2. Cong, L. et al. Multiplex genome engineering using CRISPR/Cas systems. Science 339, 819-823 (2013).
3. Mali, P. et al. RNA-guided human genome engineering via Cas9. Science 339, 823-826 (2013).
4. Burger, С., Nash, K. & Mandel, R.J. Recombinant adeno-associated viral vectors in the nervous system. Hum Gene Ther 16, 781-791 (2005).
5. Wu, Z., Yang, H. & Colosi, P. Effect of genome size on AAV vector packaging. Mol Ther 18. 80-86 (2010).
6. Deltcheva, E. et al. CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III. Nature 471, 602-607 (2011).
7. Gray, S.J. et al. Optimizing promoters for recombinant adeno-associated virus-mediated gene expression in the peripheral and central nervous system using self-complementary vectors. Hum Gene Ther 22, 1143-1153 (2011).
8. Levitt, N., Briggs, D., Gil, A. & Proudfoot, N.J. Definition of an efficient synthetic poly(A) site. Genes Dev 3, 1019-1025 (1989).
9. Ostlund, С.et al. Dynamics and molecular interactions of linker of nucleoskeleton and cytoskeleton (LINC) complex proteins. J Cell Sci 122, 4099-4108 (2009).
10. Chahrour, M. & Zoghbi, H.Y. The story of Rett syndrome: from clinic to neurobiology. Neuron 56, 422-437 (2007).
11. Kishi, N. & Macklis, J.D. MECP2 is progressively expressed in post-migratory neurons and is involved in neuronal maturation rather than cell fate decisions. Molecular and cellular neurosciences 27, 306-321 (2004).
12. Skene, P.J. et al. Neuronal MeCP2 is expressed at near histone-octamer levels and globally alters the chromatin state. Molecular cell 37, 457-468 (2010).
13. Chen, R.Z., Akbarian, S., Tudor, M. & Jaenisch, R. Deficiency of methyl-CpG binding protein-2 in CNS neurons results in a Rett-like phenotype in mice. Nat Genet 27, 327-331 (2001).
14. Zhou, Z. et al. Brain-specific phosphorylation of MeCP2 regulates activity-dependent Bdnf transcription, dendritic growth, and spine maturation. Neuron 52, 255-269 (2006).
15. Li, Y. et al. Global transcriptional and translational repression in human-embryonic-stem-cell-derived Rett syndrome neurons. Cell Stem Cell 13, 446-458 (2013).
16. Nguyen, M.V. et al. MeCP2 is critical for maintaining mature neuronal networks and global brain anatomy during late stages of postnatal brain development and in the mature adult brain. J Neurosci 32, 10021-10034 (2012).
17. Jiang, W., Bikard, D., Cox, D., Zhang, F. & Marraffini, L.A. RNA-guided editing of bacterial genomes using CRISPR-Cas systems. Nature biotechnology 31, 233-239 (2013).
18. Qi, L.S. et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell 152, 1173-1183 (2013).
19. Sapranauskas, R. et al. The Streptococcus thermophilus CRISPR/Cas system provides immunity in Escherichia coli. Nucleic acids research 39, 9275-9282 (2011).
20. Jinek, M. et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science 337, 816-821 (2012).
21. Qiu, P. et al. Mutation detection using Surveyor nuclease. BioTechniques 36, 702-707 (2004).
22. Kobayashi, M. et al. Hippocalcin-deficient mice display a defect in cAMP response element-binding protein activation associated with impaired spatial and associative memory. Neuroscience 133, 471-484 (2005).
23. Dateki, M. et al. Neurochondrin negatively regulates CaMKII phosphorylation, and nervous system-specific gene disruption results in epileptic seizure. The Journal of biological chemistry 280, 20503-20508 (2005).
24. Nakaya, N. et al. Deletion in the N-terminal half of olfactomedin 1 modifies its interaction with synaptic proteins and causes brain dystrophy and abnormal behavior in mice. Experimental neurology 250, 205-218 (2013).
25. Reim, K. et al. Complexins regulate a late step in Ca2+-dependent neurotransmitter release. Cell 104, 71-81 (2001).
26. Edwardson, J.M. et al. Expression of mutant huntingtin blocks exocytosis in PC 12 cells by depletion of complexin II. The Journal of biological chemistry 278, 30849-30853 (2003).
27. Feng, J. et al. Dnmt1 and Dnmt3a maintain DNA methylation and regulate synaptic function in adult forebrain neurons. Nat Neurosci 13, 423-430 (2010).
28. Fu, Y. et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nature biotechnology 31, 822-826 (2013).
29. Hsu, P.D. et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nature biotechnology 31, 827-832 (2013).
30. Ran, F.A. et al. Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity. Cell 154, 1380-1389 (2013).
31. Mali, P. et al. CAS9 transcriptional activators for target specificity screening and paired nickases for cooperative genome engineering. Nature biotechnology 31, 833-838 (2013).
32. Esvelt, K.M. & Wang, H.H. Genome-scale engineering for systems and synthetic biology. Molecular systems biology 9, 641 (2013).
33. Li, W., Teng, F., Li, T. & Zhou, Q. Simultaneous generation and germline transmission of multiple gene mutations in rat using CRISPR-Cas systems. Nat Biotechnol 31, 684-686 (2013).
Способы
ДНК-конструкции
Для выбора мишеней для SpCas9 и создания одиночной направляющей РНК (sgRNA) выбирали целевые последовательности размером 20 нт, расположенные перед последовательностью РАМ 5'-NGG. Для сведения к минимуму нецелевых эффектов применяли инструмент для конструирования CRIPSR (http://tools.genome-engineering.org). sgRNA подвергали ПЦР-амплификации с применением промотора U6 в качестве матрицы с прямым праймером: 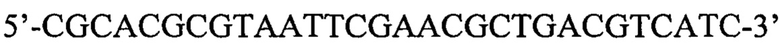 и обратным праймером, содержащим sgRNA с целевым сайтом ДНК размером 20 нт (жирным шрифтом):
и обратным праймером, содержащим sgRNA с целевым сайтом ДНК размером 20 нт (жирным шрифтом):
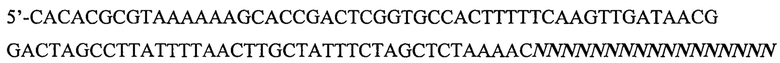

Контрольную последовательность sgRNA сконструировали для нацеливания на ген lacZ Е. coli: целевая последовательность: TGCGAATACGCCCACGCGATGGG (SEQ ID NO:). Конструкция EGFP-KASH1 была щедрым подарком от профессора Уормана (Колумбийский университет, Нью-Йорк) и использовалась в качестве матрицы для ПЦР для клонирования кодирующей кассеты в каркас на основе AAV под контроль промотора гена синапсина человека (hSyn). Затем вводили последовательность, кодирующую U6-Mecp2sgRNA, с применением сайта для MluI. Для стратегии мультиплексного целенаправленного воздействия на гены индивидуальные sgRNA подвергали ПЦР-амплификации, как описано выше. Все три sgRNA лигировали с подвергнутой ПЦР-амплификации кассетой hSyn-GFP-KASH-bGHpA путем применения стратегии клонирования Golden Gate. После ПЦР-амплификации продукт лидирования Golden Gate, содержащий 3 sgRNA и hSyn-GFP-KASH-bGHpA, клонировали в каркас на основе AAV. Все полученные конструкции подтверждали путем секвенирования. В целях нахождения оптимальной промоторной последовательности для управления экспрессией SpCas9 в нейронах авторы настоящего изобретения тестировали промоторные последовательности: hSyn1, усеченную Меср2 мыши (рМеср2) и усеченную Map1b крысы (pMap1b)2. Для амплификации промоторных участков использовали следующие праймеры:
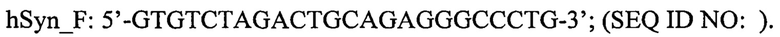
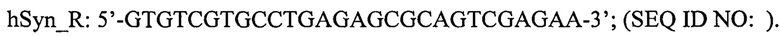
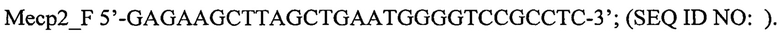
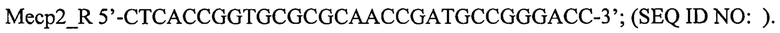
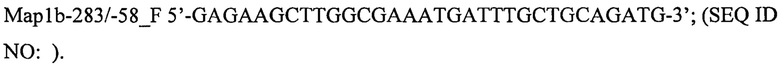
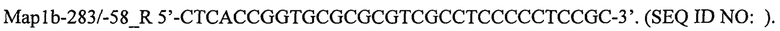
Сборку другого усеченного промотора map1b крысы производили с использованием следующих олигонуклеотидов:
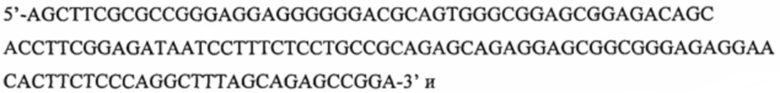

Сборку короткого синтетического сигнала полиаденилирования (spA)3 производили с использованием следующих олигонуклеотидов:
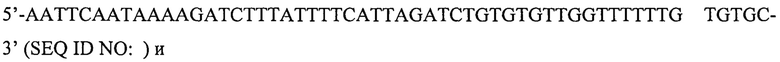
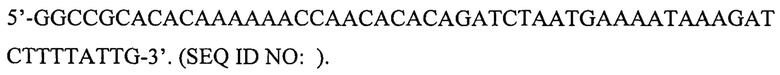
SpCas9 и его мутантный вариант D10A (dSpCas9) были описаны ранее4, 5. Для трансфекции нейронов с помощью Lipofectamine®2000 (Life Technologies) применяли плазмиду, кодирующую красный флуоресцентный белок (mCherry) под контролем промотора EF1α.
Культуры линий клеток и трансфекция
Клетки Neuro-2a (N2a) выращивали в DMEM, содержащей 5% фетальной бычьей сыворотки (BSA). Для клеток HEK293FT применяли DMEM, содержащую 10% фетальной бычьей сыворотки (FBS). Клетки поддерживали при 37°С в атмосфере с 5% CO2. Клетки трансфицировали с помощью Lipofectamine®2000 или реагента полиэтиленимина (PEI) "MAX" (Polysciences) согласно протоколам производителя.
Получение концентрированных векторов на основе AAV
Частицы AAV1/2 с высоким титром получали с использованием плазмид серотипов AAV1 и AAV2 в равном соотношении и плазмиды-помощника pDF6 и очищали на колонке для аффинной хроматографии с гепарином.6. Титрование вирусных частиц осуществляли с помощью qPCR. Частицы AAV1 в высоким титром получали в организации UNC Vector Core (Университет Северной Каролины в Чэпел-Хилле). Частицы AAV1 с низким титром в DMEM получали, как описано ранее7. Вкратце, клетки HEK293FT трансфицировали плазмидой с трансгеном, плазмидой серотипа pAAV1 и плазмидой-помощником pDF6 с помощью PEI "МАХ". Культуральную среду собирали через 48 ч. и фильтровали через фильтр из PVDF с диаметром пор 0,45 мкм (Millipore).
Культура первичных кортикальных нейронов
Животных, используемых для получения нейронов для культур тканей, умерщвляли согласно протоколу, одобренному Комитетом по содержанию и использованию животных MIT (CAC MIT). Первичные культуры получали из головного мозга эмбрионов мышей на 16 день беременности8. Использовали эмбрионов обоих полов. Клетки высевали в 24-луночные планшеты, покрытые поли-D-лизином (PDL) (BD Biosciences), или на покровные стекла, покрытые ламинином/PDL (VWR). Культуры выращивали при 37°С и 5% CO2 в среде Neurobasal, дополненной В27, Glutamax (Life Technologies) и смесью пенициллин/стрептомицин.
Для трансдукции AAV кортикальные нейроны в 500 мкл культуральной среды Newobasal инкубировали на 7 DIV с 300 мкл (совместное инфицирование в соотношении 1:1) кондиционированной среды клеток HEK293FT, содержащей AAV17. Через неделю после трансдукции нейроны собирали для последующей обработки или фиксировали в 4% параформальдегиде для иммунофлуоресцентного окрашивания или морфологического анализа.
Для визуализации морфологических характеристик нейронов клетки в DIV7 трансфицировали вектором экспрессии EF1α-mCherry с помощью Lipofectamine®2000 (Life Technologies) в течение недели, как описано ранее9. Для измерения общей длины дендритов все дендриты отдельных нейронов отслеживали с использованием программного обеспечения ImageJ. Количественная оценка числа первичных дендритов, кончиков дендритов и анализ10 Шолла проводили на изображениях, полученных с помощью флуоресцентного микроскопа при увеличении объектива 40х (микроскоп Zeiss AxioCam Ax10, камера AxioCam MRm). Для определения количества дендритов подсчитывали концы всех неаксональных выпячиваний длиннее 10 мкм. Для анализа Шолла вокруг тела клетки автоматически вычерчивали концентрические круги с шагом диаметра 5 мкм, и число дендритов, пересекающих каждый круг, подсчитывали с помощью программного обеспечения ImageJ с платаном Sholl.
Стереотаксическая инъекция AAV1/2 в головной мозг мыши
САС MIT одобрил все процедуры с животными, описанные в данном документе. Взрослых (в возрасте 12-16 недель) самцов мышей C57BL/6N анестезировали путем внутрибрюшинной (i.p.) инъекции 100 мг/кг кетамина и 10 мг/кг ксилазина. Проводили упреждающую анальгезию (бупренекс, 1 мг/кг, i.p.). Краниотомию проводили согласно одобренным процедурам, и 1 μмкл смеси AAV 1:1 (1×1013 vg/мл sMecp2-SpCas9; 6×1012 vg/мл 3 х sgRNA для DNMT; 3-5×1012 vg/мл hSyn-GFP-KASH) инъецировали в: дорсальную часть зубчатой извилины (переднезадняя ось: -1,7; медиолатеральная ось: 0,6; дорсовентральная ось: -2,15) и/или вентральную часть зубчатой извилины (переднезадняя ось: -3,52; медиолатеральная ось: 2,65; дорсовентральная ось: -3). Для электрофизиологических экспериментов по регистрации потенциалов in vivo координаты инъекции вируса были следующими: на 3 мм латеральнее (от брегмы) и на 1 мм кпереди от теменно-затылочного шва. Череп истончали с помощью дрели Dremel, периодически охлаждаемой солевым раствором, а остающуюся твердую мозговую оболочку прокалывали стеклянной микропипеткой, заполненной вирусом, суспендированным в минеральном масле. Производили несколько инъекций (3-4) в соседние участки на глубину 200-250 мкм. В каждый участок инъецировали смесь вирусов в объеме 150-200 нл при скорости 75 нл/мин. После каждой инъекции пипетку удерживали на месте в течение 3-5 минут до извлечения для предотвращения вытекания. Разрез зашивали и в течение трех дней после хирургической операции вводили надлежащие средства для послеоперационного обезболивания (мелоксикам, 1-2 мг/кг).
Целевая регистрация потенциалов по методу локальной фиксации при неплотном контакте на основе использования двухфотонной визуализации in vivo
Через две недели после инъекции вируса мышей использовали для электрофизиологических экспериментов. Мышей анестезировали 2% изофлураном и поддерживали в таком состоянии с помощью 0,8% изофлурана. Кожу срезали, производили очистку с помощью Sugi, и к черепу прикрепляли металлическую головную пластину с помощью клея и стоматологической акриловой смолы, и производили краниотомию на участке 2 мм × 2 мм над первичной зрительной корой (V1). Открытую область затем покрывали тонким слоем 1,5% агарозы в искусственной спинномозговой жидкости (aCSF; 140 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2, 1 мМ MgCl2, 0,01 мМ EDTA, 10 мМ HEPES, 10 мМ глюкозы; рН 7,4). Температуру тела животных поддерживали в ходе эксперимента на уровне 37,5°C с помощью греющей пластины.
Боросиликатные пипетки (WPI) вытягивали с использованием лазерного устройства для вытягивания пипеток Sutler P-2000 (Sutter Instruments). Диаметр наконечника составлял около 1 μмкм, при этом сопротивление составляло 3-5 МОм. Регистрацию потенциалов осуществляли с использованием специального программного обеспечения (Network Prism, Sur lab), написанного на Matlab (MathWorks), управляющего усилителем MultiClamp 700B (Axon). Стеклянный пипеточный электрод вводили в головной мозг под углом 20-35°, и шариковый заземляющий электрод из Ag/AgCl (Warner Instruments) помещали в тот же раствор, что и головной мозг и объектив. Для флуоресцентной визуализации пипетки заполняли Alexa Fluor 594 (Molecular Probes). Пипетку вначале направляли на участок инъекции с помощью линзы с увеличением 10х, а затем направляли на отдельные GFP+ клетки с помощью линзы с увеличением 25х посредством визуализации с одновременным поглощением двух фотонов при 770 нм. Близость к клетке выявляли по отклонениям сопротивления, наблюдаемым при фиксации напряжения во время быстро изменяющегося во времени управляющего импульса напряжения в 5 мВ. Как только сопротивление возрастало на 5-10 МОм, усилитель переключали в режим фиксации тока, и спайки регистрировали при нулевом подаваемом токе с фильтром Бесселя в 4 кГц и фильтром АС в 300 Гц. Головной мозг, в который инъецировали вирус, после этого перфузировали, и проводили иммуногистохимический анализ.
Зрительная стимуляция и анализ данных целевой регистрации потенциалов по методу локальной фиксации при неплотном контакте на основе использования двухфотонной визуализации in vivo
Для оценки ориентационной избирательности и настройки нейронов с отредактированным геномом авторы настоящего изобретения показывали ориентированные решетки с помощью специального программного обеспечения PsychToolbox-3, написанного на Matlab. Решетки оптимизировали для изучения ответных реакций клеток и показывали путем пошагового смещения ориентации от 0 до 360 градусов с шагом в 20 градусов, при этом каждому показу решетки предшествовали 4 секунды "выключенного состояния" с последующими 4 секундами "включенного состояния", ввиду чего общая продолжительность показа составляла 144 секунды. Данные получали непосредственно в Matlab и сохраняли в виде файлов.mat. Выявление спайков проводили посредством стандартного анализа, в котором использовали определенные вручную пороговые значения, за котором следовало сравнение формы спайка с эталоном для дополнительного подтверждения. Каждый спайк был отмечен и отображен на экране в графическом интерфейсе пользователя, после чего его вручную анализировал экспериментатор на наличие ложноположительных и ложноотрицательных результатов. Периоды формирования спайков в ответ на каждый раздражитель затем разделяли на группы периодов во "включенном состоянии" или в "выключенном состоянии", исходя из их временных рамок относительно зрительной стимуляции, и из количества спайков в "выключенном состоянии" для каждого раздражителя вычитали количество спайков во "включенном состоянии", наблюдаемых в течение такого же периода времени. Для ориентационных экспериментов количество спайков на раздражитель = (количество спайков во "включенном состоянии") - (количество спайков в "выключенном состоянии"), поскольку периоды "включенного состояния" и "выключенного состояния" имели одинаковую длительность.
Для каждой клетки, представляющей интерес, способы применяли для сбора данных о реакции на каждый ориентированный раздражитель (от 0 до 360 градусов с шагом в 20 градусов). Эти данные о реакции затем преобразовывали в "настроечную кривую" зависимости реакции от ориентации для каждого испытания. Индекс ориентационной избирательности (OSI) рассчитывали путем векторного усреднения для предпочтительной ориентации согласно следующей формуле:
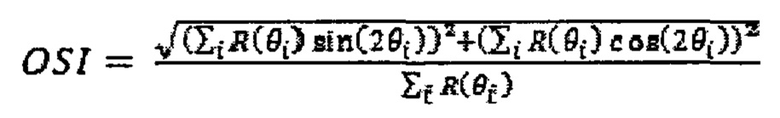
Получение ткани и очистка клеточных ядер
Весь гиппокамп или зубчатую извилину быстро вырезали в охлажденном на льду DPBS (Life Sciences) и подвергали шоковой заморозке на сухом льду. Для очистки клеточных ядер ткань осторожно гомогенизировали в 2 мл охлажденного на льду буфера для гомогенизации (НВ) (320 мМ сахарозы, 5 мМ CaCl, 3 мМ Mg(Ac)2, 10 мМ Tris с рН 7,8, 0,1 мМ EDTA, 0,1% NP40, 0,1 мМ PMSF, 1 мМ бета-меркаптоэтанола) с помощью гомогенизатора Даунса на 2 мл (Sigma); 25 раз пестиком А, а затем 25 раз пестиком В. Затем добавляли 3 мл НВ до общего объема 5 мл и выдерживали на льду в течение 5 мин. Для градиентного центрифугирования добавляли 5 мл 50% среды с градиентом плотности OptiPrep™ (Sigma), содержащей 5 мМ CaCl, 3 мМ Mg(Ac)2, 10 мМ Tris с рН 7,8, 0,1 мМ PMSF, 1 мМ бета-меркаптоэтанола, и перемешивали. Лизат осторожно загружали поверх 10 мл 29% изоосмолярного раствора OptiPrep™ в коническую центрифужную пробирку на 30 мл (Beckman Coulter, ротор SW28). Образцы центрифугировали при 10 100 х g (7500 об./мин.) в течение 30 мин. при 4°С. Надосадочную жидкость удаляли и осадок ядер осторожно ресуспендировали в 65 мМ бета-глицерофосфата (рН 7,0), 2 мМ MgCl2, 25 мМ KCl, 340 мМ сахарозы и 5% глицерине. Количество и качество очищенных ядер контролировали с использованием светлопольной микроскопии.
Сортировка клеточных ядер
Очищенные GFP-положительные (GFP+) и отрицательные (GFP-) интактные ядра совместно метили рубиновым красителем Vybrant® DyeCycle™ (1:500, Life Technologies) и сортировали при помощи BD FACSAria III (Koch Institute Flow Cytometry Core, MIT). GFP+ и GFP- ядра собирали в 1,5 мл пробирки эппендорф, покрытые 1% BSA и содержащие 400 мкл буфера для ресуспендирования (65 мМ бета-глицерофосфата с рН 7,0, 2 мМ MgCl2, 25 мМ KCl, 340 мМ сахарозы и 5% глицерин). После сортировки все образцы выдерживали на льду и центрифугировали при 10000 х g в течение 20 мин. при 4°С. Осажденные ядра хранили при -80°С или непосредственно применяли для последующей обработки.
Экстракция геномной ДНК и анализ с помощью SURVEYOR™
Для функционального тестирования sgRNA клетки N2апри 50-70% конфлюентности совместно трансфицировали одиночной sgRNA, подвергнутой ПЦР-амплификации, и вектором с SpCas9. Клетки, трансфицированные только SpCas9, служили в качестве отрицательного контроля. Клетки собирали через 48 ч. после трансфекции, и ДНК экстрагировали с использованием набора DNeasy для выделения ДНК из крови и тканей (Qiagen) согласно протоколу производителя. Для выделения геномной ДНК из трансдуцированных с помощью AAV1 первичных нейронов использовали набор DNeasy для выделения ДНК из крови и тканей через 7 дней после трансдукции с помощью AAV согласно инструкции производителя.
Отсортированные ядра или вырезанные ткани лизировали в лизирующем буфере (10 мМ Tris, рН 8,0, 10 мМ NaCl, 10 мМ EDTA, 0,5 мМ SDS, протеиназа K (PK, 1 мг/мл) и РНКаза А) при 55°С в течение 30 мин. Затем проводили экстракцию смесью фенол-хлороформ с последующим осаждением ДНК этанолом согласно стандартным процедурам. В заключение ДНК ресуспендировали в буфере ТЕ (10 мМ Tris с рН 8,0, 0,1 мМ EDTA) и применяли для последующего анализа. Функциональное тестирование отдельных sgRNA проводили путем применения анализа с помощью нуклеазы SURVEYOR™ (Transgenomics) с использованием праймеров для ПЦР, перечисленных в дополнительной таблице 2. Количественную оценку интенсивности полос проводили, как описано ранее11.
Получение и секвенирование библиотеки РНК
Через две недели после билатеральной вирусной доставки SpCas9 с направляющей последовательностью, целенаправленно воздействующих на Меср2 (4 животных), или SpCas9 с gRNA, целенаправленно воздействующих на lacZ (4 животных), зубчатую извилину быстро вырезали в охлажденном на льду DPBS (Life Sciences) и немедленно переносили в раствор RNAlater (Ambion). Через 24 часа при 4°С ткань переносили в условия -80°С. Группы из 100 целевых ядер нейронов сортировали путем FACS в 10 мкл буфера TCL, дополненного 1% 2-меркаптоэтанолом (Qiagen). После центрифугирования образцы сразу же замораживали при -80°С. РНК очищали с помощью гранул SPRI AMPure RNAclean XP (Beckman Coulter Genomics) согласно инструкциям производителя и трижды промывали 80% этанолом, пропуская заключительное элюирование. Гранулы с захваченной РНК высушивали на воздухе и сразу обрабатывали для синтеза кДНК. Образцы без ядер применяли в качестве отрицательных контролей. Для каждого животного использовали три отобранные группы, в общей сложности 24 отобранные группы, в получении библиотек кДНК согласно протоколу SMART-seq212, лишь заменяя фермент обратную транскриптазу 0,1 мкл фермента Maxima H Minus (200 ед./мкл, Thermo Scientific) и пропорционально уменьшая объем реакционной смеси для ПЦР до 25 мкл. Реакцию тагментации и заключительную ПЦР-амплификацию проводили с использованием набора для получения образцов ДНК Nextera XT (Illumina) со следующими модификациями. Объемы всех реакционных смесей пропорционально уменьшали в 4 раза, и библиотеки объединяли после стадии ПЦР-амплификации путем взятия 2,5 мкл каждого образца. Объединенные библиотеки очищали и отбирали по размеру с использованием двух циклов очистки в 0,7 объема гранул SPRI AMPure XP (Beckman Coulter Genomics). Образцы загружали на высокочувствительный ДНК-чип (Agilent) для проверки качества библиотеки, при этом количественную оценку производили с помощью набора для высокочувствительного анализа ДНК Qubit (Invitrogen). Объединенные библиотеки разбавляли до конечной концентрации 4 нМ и 12 пмоль и секвенировали с помощью Illumina MiSeq с использованием ридов со спаренными концами размером 75 п.о.
Анализ данных из библиотек РНК
Индекс Bowtie2 создавали на основе UCSC mm9 для генома мыши и известного генного транскриптома13, и риды со спаренными концами выравнивали непосредственно с этим индексом с помощью Bowtie2 с использованием параметров командной строки -q -- phred33-quals -n 2 -e 99999999 -1 25 -I 1 -X 1000 -a -m 200 -p 4 --chunkmbs 512. Затем выравнивания, созданные в Bowtie2, анализировали с помощью RSEM v1.27 с параметрами по умолчанию для оценки уровней экспрессии. Оценочные значения уровней экспрессии генов по RSEM (tau) умножали на 1000000 для получения оценочных значений количества транскриптов на миллион (ТРМ) для каждого гена, и оценочные значения ТРМ преобразовывали в логарифмическое пространство, путем взятия log2 (TPM+1). Гены считали выявленными, если их преобразованный уровень экспрессии был равен или превосходил 2 (в масштабе log2(TPM+1)). Библиотеку отсеивали, если в ней было выявлено менее 8000 генов. На основании этого критерия 4 библиотеки были отсеяны и исключены из последующего анализа. Для обнаружения дифференциально экспрессируемых генов среди контрольных животных и животных, экспрессирующих sgRNA для Меср2, применяли t-критерий Стьюдента (Matlab V2013b) и перекрестную проверку для 20 отрезков случайной перестановки, где в каждом отрезке от каждого животного случайным образом выбирали одну библиотеку для исключения (эти результаты в общей сложности для 12 библиотек всякий раз применяли для вычисления t-критерия). Определение t-критерия проводили для всех генов, которые имели средний уровень экспрессии выше квантиля 0,9 (обычно около 5 log2(TPM+1)) для каждого образца. Затем выбирали гены со значимыми результатами (р<0,01) в более чем одной трети отрезков перестановки. Уровни экспрессии этих генов в log2(TPM+1) для всех образцов кластеризовали с использованием иерархической кластеризации (Matlab V2013b).
Иммунофлуоресцентное окрашивание
Культура клеток. Для иммунофлуоресцентного окрашивания первичных нейронов клетки фиксировали через 7 дней после вирусной доставки в 4% параформальдегиде (PFA) в течение 20 мин. при RT. После 3-кратного промывания с помощью PBS клетки блокировали с помощью 5% нормальной сыворотки козы (NGS) (Life Technologies), 5% сыворотки осла (DS) (Sigma) и 0,1% Triton-X100 (Sigma) в PBS в течение 30 мин. при RT. Клетки инкубировали с первичными антителами в 2,5% NGS, 2,5% DS и 0,1% Triton-X100 в течение 1 часа при RT или в течение ночи при 4°С. После 3-кратного промывания с помощью PBST клетки инкубировали со вторичными антителами в течение 1 часа при RT. Наконец, монтировали покровные стекла с использованием среды для заключения VECTASHIELD HardSet с DAPI (Vector Laboratories) и производили визуализацию с помощью микроскопа Zeiss AxioCam AxlO и камеры AxioCam MRm. Фотографии обрабатывали с помощью программного обеспечения Zen 2012 (Zeiss). Количественную оценку проводили путем использования программного обеспечения ImageJ 1.48h и платина для выявления нейронов.
Мышей умерщвляли через 4 недели после вирусной доставки смертельной дозой смеси кетамин/ксилазин и подвергали транскардиальной перфузии с помощью PBS, a затем PFA. Из фиксированной ткани получали срезы с помощью вибротома (Leica, VT1000S). Затем срезы толщиной 30 мкм кипятили в течение 2 мин. в натрий-цитратном буфере (10 мМ дигидрата цитрата тринатрия, 0,05% Tween20, pH 6,0) и охлаждали при RT в течение 20 мин. Срезы блокировали с помощью 4% нормальной сыворотки козы (NGS) в TBST (137 мМ NaCl, 20 мМ Tris с pH 7,6, 0,2% Tween-20) в течение 1 часа. Парафиновые срезы нарезали с помощью микротома (Leica RM2125 RTS) до толщины 8 мкм и окрашивали, как описано ранее14.
Срезы инкубировали с первичными антителами, разбавленными в TBST с 4% NGS, в течение ночи при 4°С. После 3 промывок в TBST образцы инкубировали с вторичными антителами. После 3-кратного промывания с помощью TBST срезы заливали средой для заливки VECTASHIELD HardSet с DAPI и визуализировали при помощи конфокального микроскопа (Zeiss LSM 710, Ax10 Imager Z2, программное обеспечение Zen 2012).
Использовали следующие первичные антитела: антитело кролика к Dnmt3a (Santa Cruz, 1:100); антитело кролика к МеСР2 (Millipore, 1:200); антитело мыши к NeuN (Millipore, 1:50-1:400); антитело курицы к GFAP (Abcam, 1:400); антитело мыши к Мар2 (Sigma, 1:500); антитело курицы к GFP (Aves Labs, 1:200-1:400); антитело мыши к НА (Cell Signaling, 1:100). Вторичные антитела: AlexaFluor®488, 568 или 633 (Life Technologies, 1:500-1:1,000).
Количественная оценка в анализе с использованием LIVE/DEAD®
Контрольные и трансдуцированные первичные нейроны окрашивали путем применения анализа с использованием LIVE/DEAD® (Life Technologies) согласно инструкции производителя. Во избежание интерференции с сигналом GFP, обусловленным экспрессией GFP-KASH, клетки окрашивали только для выявления мертвых (гомодимером этидия) и с помощью DAPI (все клетки). Окрашенные клетки визуализировали с помощью флуоресцентной микроскопии, и мертвые, GFP- и DAPI-положительные клетки подсчитывали путем применения программного обеспечения ImageJ 1.48h и плагина для выявления нейронов.
Вестерн-блот анализ
Трансдуцированные первичные кортикальные нейроны (24 лунки, 7 дней после вирусной доставки) и трансдуцированные образцы ткани (4 недели после вирусной доставки) лизировали в 50 мкл охлажденного на льду буфера RIPA (Cell Signaling), содержащего 0,1% SDS и ингибиторы протеаз (Roche, Sigma). Клеточные лизаты подвергали ультразвуковой обработке в течение 5 мин. в ультразвуковом аппарате Bioruptor (Diagenode), и концентрацию белка определяли с помощью набора для анализа белков ВСА (Pierce Biotechnology, Inc.). Белковые лизаты растворяли в буфере для образца для SDS-PAGE, разделяли в восстановительных условиях в 4-15% гелях с Tris-HCl (Bio-Rad) и анализировали с помощью вестерн-блоттинга, используя первичные антитела: антитело кролика к Dnmt3a (Santa Cruz, 1:500), антитело мыши к Dnmt1 (Novus Biologicals, 1:800), антитело кролика к Меср2 (Millipore, 1:400), антитело кролика к тубулину (Cell Signaling, 1:10000), а затем вторичные антитела к иммуноглобулинам мыши и кролика, конъюгированные с HRP (Sigma-Aldrich, 1:10000). GAPDH непосредственно визуализировали с помощью антитела кролика к GAPDH, соединенного с HRP (Cell Signaling, 1:10000). Тубулин или GAPDH служил в качестве контроля для нанесения. Блоты визуализировали с помощью системы ChemiDoc™ MP с программным обеспечением ImageLab 4.1 (BioRad) и количественно определяли с применением программного обеспечения ImageJ 1.48h.
Выработка контекстного условного рефлекса в связи с переживанием чувства страха с задержкой (DCFC)
Через 8 недель после билатеральной доставки 3 х sgRNA для SpCas9/DNMT в дорсальную и вентральную части зубчатой извилины самцов мышей C57BL/6N в возрасте 12 недель обеспечивали привыкание животных к экспериментатору и комнате для изучения поведения в течение 7 дней. Однопометники, которым инъецировали SpCas9/GFP-KASH, служили в качестве контролей. В день 1 анализа DCFC клетки с мышами помещали в изолированный тамбур для предотвращения получения мышами звуковых сигналов до и после тестирования. Отдельных мышей помещали в камеру для изучения FC (Med Associates Inc.), и оставляли на период привыкания длительностью 12 мин. После привыкания мышей помещали обратно в их домашние клетки. На следующий день (тренировочный день) отдельных мышей помещали в камеру и оставляли для привыкания в течение 4 мин. По истечении еще одного интервала длительностью 20 с (до подачи звука) подавали звук (звуковой сигнал) на уровне 85 дБ, 2,8 кГц, в течение 20 c с последующим интервалом задержки длительностью 18 с перед подачей электроболевого раздражения на лапы (0,5 мА, 2 с). После подачи электроболевого раздражения на лапы интервал длительностью 40 с (после подачи звука/электроболевого раздражения) предшествовал следующему идентичному испытанию, начинавшемуся с периода до подачи звука длительностью 20 с. Тренировочное испытание повторяли 6 раз перед тем, как мышей помещали обратно в их домашние клетки. В день 3 (день тестирования) мышей вначале помещали в камеру для выработки контекстного условного рефлекса на 3 мин. Затем мышей подвергали 4х тестовым испытаниям длительностью 100 с, начинавшимся с интервала длительностью 20 с, за которым следовала подача звука длительностью 20 с и интервал после подачи звука длительностью 60 с. Наконец, мышей помещали в камеру выработки условного рефлекса в измененном контексте (сплошной пол в отличие от сетчатого, тетрамерная камера в отличие от гептамерной, аромат ванилина) и тестовое испытание повторяли. Регистрировали замирание, и анализ проводили вслепую и вручную в режиме оффлайн и подтверждали с помощью программного обеспечения Noldus Etho Vision XT (Noldus Information Technology).
Анализ по методу глубокого секвенирования и выявление вставок/делеций
Инструмент для конструирования CRISPR (http://crispr.mit.edu/) применяли для обнаружения потенциальных нецелевых мишеней для генов семейства DNMT, на которые в головном мозге целенаправленно воздействовали CRISPR-SpCas9. Подвергнутые целенаправленному воздействию клеточные ядра из зубчатой извилины сортировали путем FACS через 12 недель после вирусной доставки и геномную ДНК очищали, как описано выше. Для каждого гена, представляющего интерес, участок генома, фланкирующий целевой сайт для CRISPR, амплифицировали с помощью способа ПЦР с перекрывающимися праймерами для прикрепления адаптеров Illumina P5, а также уникальных специфичных для образца штрих-кодов к целевым ампликонам (что касается праймеров для целевых и нецелевых локусов, смотри дополнительную таблицу 3)15. Очищенные образцы ДНК со штрих-кодами количественно определяли с помощью флуорометра Qubit 2.0 (Life Technologies) и объединяли в эквимолярном соотношении. Библиотеки для секвенирования затем секвенировали с использованием персонального секвенатора Illumina MiSeq (Life Technologies) при длине ридов 300 п.о.
Риды MiSeq анализировали, как описано ранее в15. Вкратце, риды фильтровали по качеству Phred (баллу Q) и выравнивали с применением алгоритма Смита-Ватермана с участком генома, включающим в себя 50 нуклеотидов выше и ниже целевого сайта. Вставки/делеции оценивали в выровненном участке от 5 нуклеотидов выше до 5 нуклеотидов ниже целевого сайта (в общей сложности 30 п.о.). Отрицательные контроли для каждого образца применяли для оценки включения или исключения вставок/делеций как предполагаемых событий разрезания. Авторы настоящего изобретения рассчитали оценку максимального правдоподобия (MLE) для доли ридов, имеющих целевые участки с истинными вставками/делециями, с использованием частоты появления ошибок на целевой участок на рид из данных об отрицательном контрольном образце. Баллы MLE и показатели разрезания для каждой мишени перечислены в дополнительной таблице 1.
Статистический анализ
Все эксперименты проводили по меньшей мере в двух независимых биологических повторностях. Статистические вычисления производили с помощью Prism6 (GraphPad) с применением двустороннего t-критерия Стьюдента.
ДОПОЛНИТЕЛЬНЫЕ ТАБЛИЦЫ
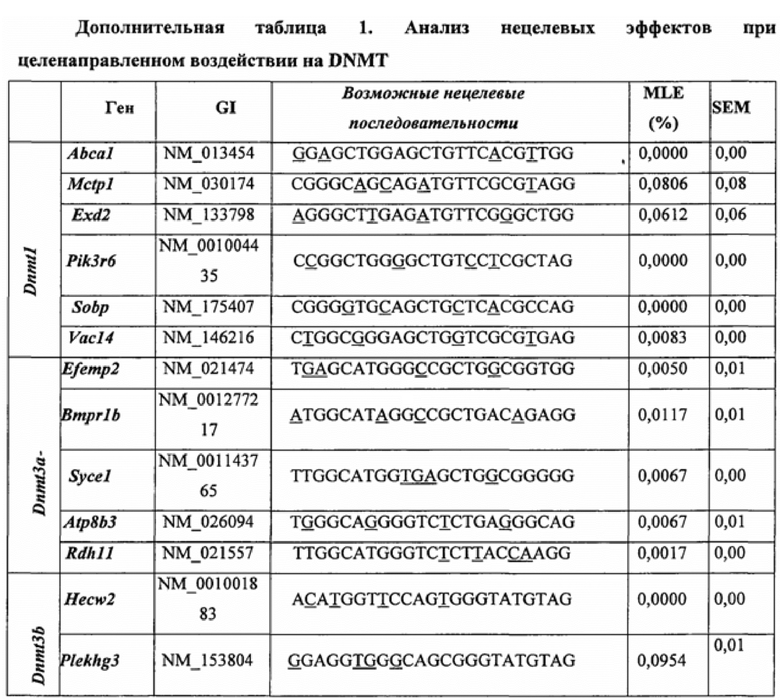
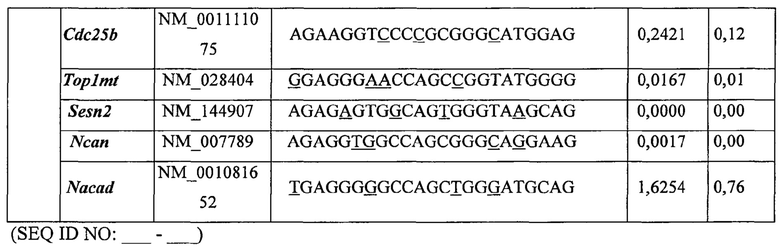

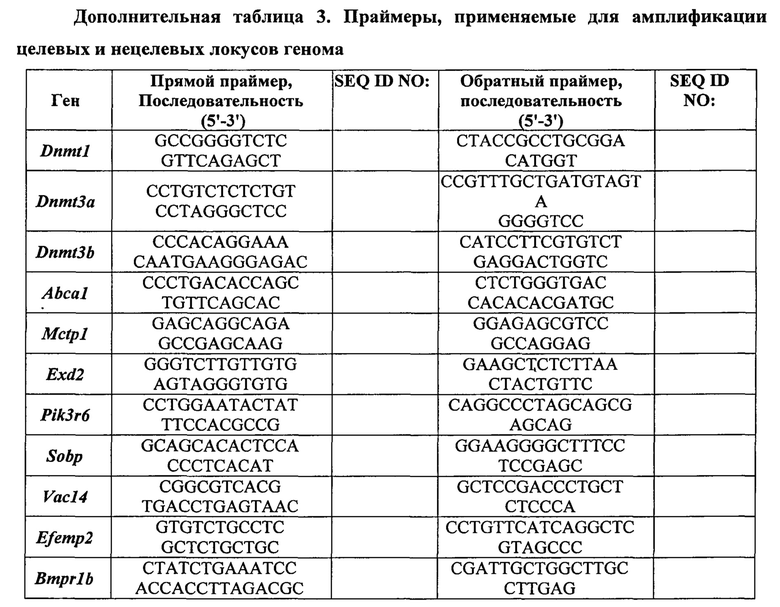

ЛИТЕРАТУРНЫЕ ИСТОЧНИКИ
1. Ostlund, С. et al. Dynamics and molecular interactions of linker ofnucleoskeleton and cytoskeleton (LINC) complex proteins. J Cell Sci 122, 4099-4108 (2009).
2. Gray, S.J. et al. Optimizing promoters for recombinant adeno-associated virus-mediated gene expression in the peripheral and central nervous system using self-complementary vectors. Hum Gene Ther 22, 1143-1153 (2011).
3. Levitt, N., Briggs, D., Gil, A. & Proudfoot, N.J. Definition of an efficient synthetic poly(A) site. Genes Dev 3, 1019-1025 (1989).
4. Jinek, M. et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science 337, 816-821 (2012).
5. Cong, L. et al. Multiplex genome engineering using CRISPR/Cas systems. Science 339, 819-823 (2013).
6. McClure, С., Cole, K.L., Wuiff, P., Klugmann, M. & Murray, A.J. Production and titering of recombinant adeno-associated viral vectors. J Vis Exp, e3348 (2011).
7. Konermann, S. et al. Optical control of mammalian endogenous transcription and epigenetic states. Nature 500, 472-476 (2013).
8. Banker, G. & Goslin, K. Developments in neuronal cell culture. Nature 336, 185-186 (1988).
9. Swiech, L. et al. CLIP-170 and IQGAP1 cooperatively regulate dendrite morphology. J Neurosci 31, 4555-4568 (2011).
10. Sholl, D.A. Dendritic organization in the neurons of the visual and motor cortices of the cat. J Anat 87, 387-406 (1953).
11. Ran, F.A. et al. Genome engineering using the CRISPR-Cas9 system. Nature protocols 8, 2281-2308 (2013).
12. Picelli, S. et al. Smart-seq2 for sensitive full-length transcriptome profiling in single cells. Nature methods 10, 1096-1098 (2013).
13. Fujita, P.A. et al. The UCSC Genome Browser database: update 2011. Nucleic acids research 39, D876-882 (2011).
14. Tzingounis, A.V. et al. The KCNQ5 potassium channel mediates a component of the afterhyperpolarization current in mouse hippocampus. Proceedings of the National Academy of Sciences of the United States of America 107, 10232-10237 (2010).
15. Hsu, P.D. et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nature biotechnology 31, 827-832 (2013).
16. Qiu, P. et al. Mutation detection using Surveyor nuclease. BioTechniques 36, 702-707 (2004).
Пример 39. Дополнительное исследование методики мечения ядер
Данный пример относится к эпитопному мечению Cas9. Вкратце, авторы настоящего изобретения обнаружили, что тройная эпитопная метка (в особенности 3хНА) усиливает детектирующий сигнал.
Материалы и способы
Клеточная культура и трансфекция
Линию клеток почки человеческого эмбриона (HEK) 293FT (Life Technologies) или линию клеток мыши Hepa1-6 (Sigma-Aldrich) поддерживали в среде Игла в модификации Дульбекко (DMEM), дополненной 10% фетальной бычьей сывороткой (HyClone), 2 мМ GlutaMAX (Life Technologies), 100 ед./мл пенициллина и 100 мкг/мл стрептомицина, при 37°C с инкубированием при 5% СО2.
Клетки высевали в 24-луночные планшеты (Corning) при плотности 120000 клеток/лунку за 24 часа до трансфекции. Клетки трансфицировали с применением Lipofectamine 2000 (Life Technologies) при конфлюентности 80-90%, следуя рекомендованному производителем протоколу. В общей сложности трансфицировали 500 нг плазмиды с Cas9 и 100 нг продукта ПЦР U6-sgRNA.
Анализ с помощью нуклеазы SURVEYOR на наличие модификации генома
Клетки 293FT и HUES62 трансфицировали ДНК, как описано выше. Клетки инкубировали при 37°С в течение 72 часов после трансфекции перед экстракцией геномной ДНК. Геномную ДНК экстрагировали с помощью раствора для экстракции ДНК QuickExtract (Epicentre), следуя протоколу производителя. Вкратце, присутствующие в виде осадка клетки ресуспендировали в растворе QuickExtract и инкубировали при 65°С в течение 15 минут, 68°С в течение 15 минут и 98°С в течение 10 минут.
Участок генома, фланкирующий целевой сайт для CRISPR, для каждого гена подвергали ПЦР-амплификации, и продукты очищали с использованием центрифужной колонки QiaQuick (Qiagen), следуя протоколу производителя. В общей сложности 400 нг очищенных продуктов ПЦР смешивали с 2 микролитрами 10Х ПЦР-буфера для ДНК-полимеразы Taq (Enzymatics) и водой сверхвысокой чистоты до конечного объема 20 микролитров и подвергали процессу повторного отжига для обеспечения образования гетеродуплекса: 95°С в течение 10 мин., линейное снижение температуры с 95°С до 85°С со скоростью 2°С/с, с 85°С до 25°С со скоростью 0,25°С/с и с выдерживанием при 25°С в течение 1 минуты. После повторного отжига продукты обрабатывали нуклеазой SURVEYOR и усилителем S SURVEYOR (Transgenomics), следуя рекомендованному производителем протоколу, и анализировали в 4-20% полиакриламидных гелях Novex ТВЕ (Life Technologies). Гели окрашивали красителем ДНК SYBR Gold (Life Technologies) в течение 30 минут и визуализировали с помощью системы для визуализации геля Gel Doc (Bio-rad). Количественная оценка основывалась на значениях относительной интенсивности полос. Процентное значение частоты вставок/делеций определяли по формуле 100 × (1 - (1 - (b + c)/(a + b + с))1/2), где а представляет собой суммарную интенсивность для нерасщепленного продукта ПЦР, а b и с представляют собой значения суммарной интенсивности для каждого продукта расщепления.
Вестерн-блоттинг
Клетки HEK 293FT трансфицировали и лизировали в 1X буфере RIPA (Sigma-Aldrich), дополненном ингибитором протеаз (Roche). Лизаты загружали в 4-12% гели Bolt Bis-Tris Plus (Invitrogen) и переносили на нитроцеллюлозные мембраны. Мембраны блокировали в забуференном с помощью Tris солевом растворе, содержащем 0,1% Tween-20 и 5% блокирующее средство (G-Biosciences). Мембраны зондировали антителом кролика к FLAG (1:5000, Abcam), антителом к GAPDH, конъюгированным с HRP (1:5000, Cell Signaling Technology), и антителом к иммуноглобулинам кролика, конъюгированным с HRP (1:1000), и визуализировали с помощью системы Gel Doc XR+ (Bio-Rad).
Перечень использованной литературы
Banker G, Goslin K. Developments in neuronal cell culture. Nature. 1988 Nov 10; 336(6195):185-6.
Bedell, V.M. et al. In vivo genome editing using a high-efficiency TALEN system. Nature 491, 114-U133 (2012).
Bhaya, D., Davison, M. & Barrangou, R. CRISPR-Cas systems in bacteria and archaea: versatile small RNAs for adaptive defense and regulation. Annu Rev Genet 45, 273-297 (2011).
Bobis-Wozowicz, S., Osiak, A., Rahman, S.H. & Cathomen, T. Targeted genome editing in pluripotent stem cells using zinc-finger nucleases. Methods 53, 339-346 (2011).
Boch, J. et al. Breaking the code of DNA binding specificity of TAL-type III effectors. Science 326, 1509-1512 (2009).
Bogenhagen, D.F. & Brown, D.D. Nucleotide sequences in Xenopus 5S DNA required for transcription termination. Cell 24, 261-270 (1981).
Bultmann, S. et al. Targeted transcriptional activation of silent oct4 pluripotency gene by combining designer TALEs and inhibition of epigenetic modifiers. Nucleic Acids Res 40, 5368-5377(2012).
Carlson, D.F. et al. Efficient TALEN-mediated gene knockout in livestock. Proc Nati Acad Sci USA 109, 17382-17387 (2012).
Chen, F.Q. et al. High-frequency genome editing using ssDNA oligonucleotides with zinc-finger nucleases. Nat Methods 8, 753-U796 (2011).
Cho, S.W., Kim, S., Kim, J.M. & Kim, J.S. Targeted genome engineering in human cells with the Cas9 RNA-guided endonuclease. Nat Biotechnol 31, 230-232 (2013).
Christian, M. et al. Targeting DNA double-strand breaks with TAL effector nucleases. Genetics 186, 757-761 (2010).
Cong, L. et al. Multiplex genome engineering using CRISPR-Cas systems. Science 339, 819-823 (2013).
Deltcheva, E. et al. CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III. Nature 471, 602-607 (2011).
Deveau, H., Garneau, J.E. & Moineau, S. CRISPR-Cas system and its role in phage-bacteria interactions. Annu Rev Microbiol 64, 475-493 (2010).
Ding, Q. et al. A TALEN genome-editing system for generating human stem cell-based disease models. Cell Stem Cell 12, 238-251 (2013).
Garneau, J.E. et al. The CRISPR-Cas bacterial immune system cleaves bacteriophage and plasmid DNA. Nature 468, 67-71 (2010).
Gasiunas, G., Barrangou, R., Horvath, P. &  , V. Cas9-crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria. Proc Natl Acad Sci USA 109, E2579-2586 (2012).
, V. Cas9-crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria. Proc Natl Acad Sci USA 109, E2579-2586 (2012).
Geurts, A.M. et al. Knockout Rats via Embryo Microinjection of Zinc-Finger Nucleases. Science 325, 433-433 (2009).
Gray SJ, Foti SB, Schwartz JW, Bachaboina L, Taylor-Blake B, Coleman J, Ehlers MD, Zylka MJ, McCown TJ, Samulski RJ. Optimizing promoters for recombinant adeno-associated virus-mediated gene expression in the peripheral and central nervous system using self-complementary vectors. Hum Gene Ther. 2011 Sep; 22(9):1143-53. doi: 10.1089/hum.2010.245.
Guschin, D.Y. et al. A rapid and general assay for monitoring endogenous gene modification. Methods Mol Biol 649, 247-256 (2010).
Hasty, P., Rivera-Perez, J. & Bradley, A. The length of homology required for gene targeting in embryonic stem cells. Mol Cell Biol 11, 5586-5591 (1991).
Horvath, P. & Barrangou, R. CRISPR-Cas, the immune system of bacteria and archaea. Science 327, 167-170 (2010).
Hsu, P.D. & Zhang, F. Dissecting neural function using targeted genome engineering technologies. ACS ChemNeurosci 3, 603-610 (2012).
Hwang, W.Y. et al. Efficient genome editing in zebrafish using a CRISPR-Cas system. Nat Biotechnol 31, 227-229 (2013).
Jiang, W., Bikard, D., Cox, D., Zhang, F. & Marraffini, L.A. RNA-guided editing of bacterial genomes using CRISPR-Cas systems. Nat Biotechnol 31, 233-239 (2013).
Jinek, M. et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science 337, 816-821 (2012).
Jinek, M. et al. RNA-programmed genome editing in human cells. eLife 2, e00471 (2013).
Kaplitt, M.G., et al.. Safety and tolerability of gene therapy with an adeno-associated virus (AAV) borne GAD gene for Parkinson's disease: an open label, phase I trial. Lancet. 2007 Jun 23; 369(9579):2097-105.
Levitt N. Briggs D. Gil A. Proudfoot N.J. Definition of an efficient synthetic poly(A) site. Genes Dev. 1989; 3:1019-1025.
Liu D, Fischer I. Two alternative promoters direct neuron-specific expression of the rat microtubule-associated protein 1B gene. J Neurosci. 1996 Aug 15; 16(16):5026-36.
Lopes, V.S., etc al., Retinal gene therapy with a large MYO7A cDNA using adeno-assocaited virus. Gene Ther, 2013 Jan 24. doi: 10.1038/gt 2013.3.[Epub ahead of print]
Mahfouz, M.M. et al. De novo-engineered transcription activator-like effector (TALE) hybrid nuclease with novel DNA binding specificity creates double-strand breaks. Proc Natl Acad Sci USA 108, 2623-2628 (2011).
Makarova, K.S. et al. Evolution and classification of the CRISPR-Cas systems. Nat Rev Microbiol 9, 467-477 (2011).
Mali, P. et al. RNA-guided human genome engineering via Cas9. Science 339, 823-826 (2013).
McClure С, Cole KL, Wuiff P, Klugmann M, Murray AJ. Production and titering of recombinant adeno-associated viral vectors. J Vis Exp. 2011 Nov 27; (57):e3348. doi: 10.3791/3348.
Michaelis, L.M., Maud "Die kinetik der invertinwirkung.". Biochem. z (1913).
Miller, J.C. et al. An improved zinc-finger nuclease architecture for highly specific genome editing. Nat Biotechnol 25, 778-785 (2007).
Miller, J.C. et al. A TALE nuclease architecture for efficient genome editing. Nat Biotechnol 29, 143-148 (2011).
Moscou, M.J. & Bogdanove, A.J. A simple cipher governs DNA recognition by TAL effectors. Science 326, 1501 (2009). Porteus, M.H. & Baltimore, D. Chimeric nucleases stimulate gene targeting in human cells. Science 300, 763 (2003).
Mussolino, С. et al. A novel TALE nuclease scaffold enables high genome editing activity in combination with low toxicity. Nucleic acids research 39, 9283-9293 (2011).
Nathwani, A.C., et al., Adenovirus-associated virus vector-mediated gene transfer in hemophilia B. N Engi J Med. 2011 Dec 22; 365(25):2357-65. dot: 10.1056/NEJMoa1108046. Epub 2011 Dec 10.
Oliveira, T.Y. et al. Translocation capture sequencing: a method for high throughput mapping of chromosomal rearrangements. J Immunol Methods 375, 176-181 (2012).
Perez, E.E. et al. Establishment of HIV-1 resistance in CD4(+) Т cells by genome editing using zinc-finger nucleases. Nat Biotechnol 26, 808-816 (2008).
Qi, L.S. et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell 152, 1173-1183 (2013).
REMINGTON'S PHARMACEUTICAL SCIENCES (Mack Pub. Co., N.J. 1991)
Reyon, D. et al. FLASH assembly of TALENs for high-throughput genome editing. Nat Biotechnol 30, 460-465 (2012).
Saleh-Gohari, N. & Helleday, Т. Conservative homologous recombination preferentially repairs DNA double-strand breaks in the S phase of the cell cycle in human cells. Nucleic Acids Res 32, 3683-3688 (2004).
Sander, J.D. et al. Selection-free zinc-finger-nuclease engineering by context-dependent assembly (CoDA). Nat Methods 8, 67-69 (2011).
Sanjana, N.E. et al. A transcription activator-like effector toolbox for genome engineering. Nat Protoc 7, 171-192 (2012).
Sapranauskas, R. et al. The Streptococcus thermophilus CRISPR-Cas system provides immunity in Escherichia coli. Nucleic Acids Res 39, 9275-9282 (2011).
Shen, В. et al. Generation of gene-modified mice via Cas9/RNA-mediated gene targeting. Cell Res 23, 720-723 (2013).
Smithies, O., Gregg, R.G., Boggs, S.S., Koralewski, M.A. & Kucherlapati, R.S. Insertion of DNA sequences into the human chromosomal beta-globin locus by homologous recombination. Nature 317, 230-234 (1985).
Soldner, F. et al. Generation of isogenic pluripotent stem cells differing exclusively at two early onset Parkinson point mutations. Cell 146, 318-331 (2011).
Takasu, Y. et al. Targeted mutagenesis in the silkworm Bombyx mori using zinc finger nuclease mRNA injection. Insect Biochem Molec 40, 759-765 (2010).
Tangri S, et al., Rationally engineered therapeutic proteins with reduced immunogenicity, J Immunol. 2005 Mar 15; 174(6):3187-96.
Thomas, K.R., Folger, K.R. & Capecchi, M.R. High frequency targeting of genes to specific sites in the mammalian genome. Cell 44, 419-428 (1986).
Tuschl, Т. Expanding small RNA interference. Nat Biotechnol 20, 446-448 (2002).
Urnov, F.D., Rebar, E.J., Holmes, M.C., Zhang, H.S. & Gregory, P.D. Genome editing with engineered zinc finger nucleases. Nat Rev Genet 11, 636-646 (2010).
Valton, J. et al. Overcoming transcription activator-like effector (TALE) DNA binding domain sensitivity to cytosine methylation. J Biol Chem 287, 38427-38432 (2012).
Wang, H. et al. One-Step Generation of Mice Carrying Mutations in Multiple Genes by CRISPR-Cas-Mediated Genome Engineering. Cell 153, 910-918 (2013).
Watanabe, Т. et al. Non-transgenic genome modifications in a hemimetabolous insect using zinc-finger and TAL effector nucleases. Nat Commun 3 (2012).
Wilson, E.B. Probable inference, the law of succession, and statistical inference. J Am Stat Assoc 22, 209-212 (1927).
Wood, A.J. et al. Targeted genome editing across species using ZFNs and TALENs. Science 333, 307 (2011).
Wu, S., Ying, G.X., Wu, Q. & Capecchi, M.R. A protocol for constructing gene targeting vectors: generating knockout mice for the cadherin family and beyond. Nat Protoc 3, 1056-1076 (2008).
Zhang, F. et al. Efficient construction of sequence-specific TAL effectors for modulating mammalian transcription. Nat Biotechnol 29, 149-153 (2011).

Несмотря на то, что предпочтительные варианты осуществления настоящего изобретения были показаны и описаны в данном документе, для специалиста в данной области будет очевидно, что такие варианты осуществления предоставлены только в качестве примера. Многочисленные вариации, изменения и замены теперь будут очевидны для специалиста в данной области без отступления от сути настоящего изобретения. Следует понимать, что различные альтернативные варианты вариантов осуществления настоящего изобретения, раскрытые в данном документе, можно применять при практическом осуществлении настоящего изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ИНСТИТУТ БРОДА ИНК.
МАССАЧУСЕТСКИЙ ТЕХНОЛОГИЧЕСКИЙ ИНСТИТУТ
<120> ДОСТАВКА, КОНСТРУИРОВАНИЕ И ОПТИМИЗАЦИЯ СИСТЕМ, СПОСOБЫ И
КОМПОЗИЦИИ ДЛЯ ЦЕЛЕНАПРАВЛЕННОГО ВОЗДЕЙСТВИЯ И МОДЕЛИРОВАНИЯ
ЗАБОЛЕВАНИЙ И НАРУШЕНИЙ ПОСТМИТОТИЧЕСКИХ КЛЕТОК
<130> 44790.99.2056
<140> PCT/US2014/041808
<141> 2014-06-11
<150> 61/979,573
<151> 2014-04-15
<150> 61/915,203
<151> 2013-12-12
<150> PCT/US2013/074667
<151> 2013-12-12
<150> 61/871,301
<151> 2013-08-28
<150> 61/862,355
<151> 2013-08-05
<150> 61/847,537
<151> 2013-07-17
<150> 61/836,123
<151> 2013-06-17
<160> 575
<170> PatentIn версия 3.5
<210> 1
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 1
gcactgaggg cctatttccc atgattc 27
<210> 2
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 2
cctccgtgtc agcgacccat gccaa 25
<210> 3
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 3
ccagcgtcga acagctccag cccg 24
<210> 4
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 4
agagggtgcc agcgggtata tgagg 25
<210> 5
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 5
gagtccgagc agaagaagaa 20
<210> 6
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 6
gagtcctagc aggagaagaa 20
<210> 7
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 7
gagtctaagc agaagaagaa 20
<210> 8
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(44)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (47)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 8
nnnnnnnnnn nnnnnnnnnn ccnnnnnnnn nnnnnnnnnn nnnnggnnnn nnnnnnnnnn 60
<210> 9
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(14)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (17)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 9
nnnnnnnnnn nnnnccnnnn nnnnnnnnnn nnnnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 10
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(43)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (46)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 10
nnnnnnnnnn nnnnnnnnnn ccnnnnnnnn nnnnnnnnnn nnnggnnnnn nnnnnnnnnn 60
<210> 11
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(15)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (18)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 11
nnnnnnnnnn nnnnnccnnn nnnnnnnnnn nnnnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 12
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(42)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (45)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 12
nnnnnnnnnn nnnnnnnnnn ccnnnnnnnn nnnnnnnnnn nnggnnnnnn nnnnnnnnnn 60
<210> 13
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(15)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (18)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 13
nnnnnnnnnn nnnnnccnnn nnnnnnnnnn nnnnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 14
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(41)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (44)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 14
nnnnnnnnnn nnnnnnnnnn ccnnnnnnnn nnnnnnnnnn nggnnnnnnn nnnnnnnnnn 60
<210> 15
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(17)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (20)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 15
nnnnnnnnnn nnnnnnnccn nnnnnnnnnn nnnnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 16
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(40)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (43)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 16
nnnnnnnnnn nnnnnnnnnn ccnnnnnnnn nnnnnnnnnn ggnnnnnnnn nnnnnnnnnn 60
<210> 17
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(18)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (21)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 17
nnnnnnnnnn nnnnnnnncc nnnnnnnnnn nnnnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 18
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(39)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (42)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 18
nnnnnnnnnn nnnnnnnnnn ccnnnnnnnn nnnnnnnnng gnnnnnnnnn nnnnnnnnnn 60
<210> 19
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(19)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (22)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 19
nnnnnnnnnn nnnnnnnnnc cnnnnnnnnn nnnnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 20
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 20
nnnnnnnnnn nnnnnnnnnn ccnnnnnnnn nnnnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 21
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 21
nnnnnnnnnn nnnnnnnnnn ccnnnnnnnn nnnnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 22
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(37)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (40)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 22
nnnnnnnnnn nnnnnnnnnn ccnnnnnnnn nnnnnnnggn nnnnnnnnnn nnnnnnnnnn 60
<210> 23
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(21)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (24)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 23
nnnnnnnnnn nnnnnnnnnn nccnnnnnnn nnnnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 24
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(36)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (39)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 24
nnnnnnnnnn nnnnnnnnnn ccnnnnnnnn nnnnnnggnn nnnnnnnnnn nnnnnnnnnn 60
<210> 25
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(22)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (25)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 25
nnnnnnnnnn nnnnnnnnnn nnccnnnnnn nnnnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 26
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(35)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (38)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 26
nnnnnnnnnn nnnnnnnnnn ccnnnnnnnn nnnnnggnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 27
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(23)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (26)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 27
nnnnnnnnnn nnnnnnnnnn nnnccnnnnn nnnnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 28
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(34)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (37)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 28
nnnnnnnnnn nnnnnnnnnn ccnnnnnnnn nnnnggnnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 29
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(24)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (27)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 29
nnnnnnnnnn nnnnnnnnnn nnnnccnnnn nnnnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 30
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(33)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (36)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 30
nnnnnnnnnn nnnnnnnnnn ccnnnnnnnn nnnggnnnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 31
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(25)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (28)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 31
nnnnnnnnnn nnnnnnnnnn nnnnnccnnn nnnnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 32
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(32)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (35)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 32
nnnnnnnnnn nnnnnnnnnn ccnnnnnnnn nnggnnnnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 33
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(26)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (29)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 33
nnnnnnnnnn nnnnnnnnnn nnnnnnccnn nnnnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 34
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(31)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (34)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 34
nnnnnnnnnn nnnnnnnnnn ccnnnnnnnn nggnnnnnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 35
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(27)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (30)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 35
nnnnnnnnnn nnnnnnnnnn nnnnnnnccn nnnnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 36
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(30)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (33)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 36
nnnnnnnnnn nnnnnnnnnn ccnnnnnnnn ggnnnnnnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 37
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(28)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (31)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 37
nnnnnnnnnn nnnnnnnnnn nnnnnnnncc nnnnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 38
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(29)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (32)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 38
nnnnnnnnnn nnnnnnnnnn ccnnnnnnng gnnnnnnnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 39
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(29)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (32)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 39
nnnnnnnnnn nnnnnnnnnn nnnnnnnnnc cnnnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 40
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(28)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (31)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 40
nnnnnnnnnn nnnnnnnnnn ccnnnnnngg nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 41
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(30)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (33)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 41
nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn ccnnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 42
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(27)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (30)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 42
nnnnnnnnnn nnnnnnnnnn ccnnnnnggn nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 43
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(31)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (34)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 43
nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn nccnnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 44
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(26)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (29)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 44
nnnnnnnnnn nnnnnnnnnn ccnnnnggnn nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 45
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(32)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (35)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 45
nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn nnccnnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 46
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(25)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (28)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 46
nnnnnnnnnn nnnnnnnnnn ccnnnggnnn nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 47
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(33)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (36)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 47
nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn nnnccnnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 48
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(24)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (27)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 48
nnnnnnnnnn nnnnnnnnnn ccnnggnnnn nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 49
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(34)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (37)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 49
nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn nnnnccnngg nnnnnnnnnn nnnnnnnnnn 60
<210> 50
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (23)..(23)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (26)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 50
nnnnnnnnnn nnnnnnnnnn ccnggnnnnn nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 51
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(35)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (38)..(38)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (41)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 51
nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn nnnnnccngg nnnnnnnnnn nnnnnnnnnn 60
<210> 52
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(21)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (26)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 52
nnnnnnnnnn nnnnnnnnnn nccggnnnnn nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 53
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(35)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (40)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 53
nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn nnnnnccggn nnnnnnnnnn nnnnnnnnnn 60
<210> 54
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(23)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (26)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 54
nnnnnnnnnn nnnnnnnnnn nnnggnnnnn nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 55
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(33)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (38)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 55
nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn nnnggccnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 56
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(22)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (26)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 56
nnnnnnnnnn nnnnnnnnnn nncggnnnnn nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 57
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(32)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (35)..(35)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (38)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 57
nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn nnggnccnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 58
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(31)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (34)..(35)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (38)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 58
nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn nggnnccnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 59
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(30)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (33)..(35)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (38)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 59
nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn ggnnnccnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 60
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(29)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (32)..(35)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (38)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 60
nnnnnnnnnn nnnnnnnnnn nnnnnnnnng gnnnnccnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 61
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(28)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (31)..(35)
<223> a, c, u, g, неизвестный или другой
<220>
<221> модифицированное_основание
<222> (38)..(60)
<223> a, c, u, g, неизвестный или другой
<400> 61
nnnnnnnnnn nnnnnnnnnn nnnnnnnngg nnnnnccnnn nnnnnnnnnn nnnnnnnnnn 60
<210> 62
<211> 9
<212> БЕЛОК
<213> Неизвестный
<220>
<221> источник
<223> /примечание=“Описание неизвестного:
пептида с мотивом семейства ‘LAGLIDADG’”
<400> 62
Leu Ala Gly Leu Ile Asp Ala Asp Gly
1 5
<210> 63
<211> 12
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 63
guuuuagagc ua 12
<210> 64
<211> 7
<212> БЕЛОК
<213> Вирус обезьян 40
<400> 64
Pro Lys Lys Lys Arg Lys Val
1 5
<210> 65
<211> 16
<212> БЕЛОК
<213> Неизвестный
<220>
<221> источник
<223> /примечание=“Описание неизвестной:
Последовательности двойного NLS из нуклеоплазмина”
<400> 65
Lys Arg Pro Ala Ala Thr Lys Lys Ala Gly Gln Ala Lys Lys Lys Lys
1 5 10 15
<210> 66
<211> 9
<212> БЕЛОК
<213> Неизвестный
<220>
<221> источник
<223> /примечание=“Описание неизвестной:
Последовательности NLS из c-myc”
<400> 66
Pro Ala Ala Lys Arg Val Lys Leu Asp
1 5
<210> 67
<211> 11
<212> БЕЛОК
<213> Неизвестный
<220>
<221> источник
<223> /примечание=“Описание неизвестной:
Последовательности NLS из c-myc”
<400> 67
Arg Gln Arg Arg Asn Glu Leu Lys Arg Ser Pro
1 5 10
<210> 68
<211> 38
<212> БЕЛОК
<213> Homo sapiens
<400> 68
Asn Gln Ser Ser Asn Phe Gly Pro Met Lys Gly Gly Asn Phe Gly Gly
1 5 10 15
Arg Ser Ser Gly Pro Tyr Gly Gly Gly Gly Gln Tyr Phe Ala Lys Pro
20 25 30
Arg Asn Gln Gly Gly Tyr
35
<210> 69
<211> 42
<212> БЕЛОК
<213> Неизвестный
<220>
<221> источник
<223> /примечание=“Описание неизвестной:
Последовательности домена IBB из импортина-альфа”
<400> 69
Arg Met Arg Ile Glx Phe Lys Asn Lys Gly Lys Asp Thr Ala Glu Leu
1 5 10 15
Arg Arg Arg Arg Val Glu Val Ser Val Glu Leu Arg Lys Ala Lys Lys
20 25 30
Asp Glu Gln Ile Leu Lys Arg Arg Asn Val
35 40
<210> 70
<211> 8
<212> БЕЛОК
<213> Неизвестный
<220>
<221> источник
<223> /примечание=“Описание неизвестной:
Последовательности Т-белка миомы”
<400> 70
Val Ser Arg Lys Arg Pro Arg Pro
1 5
<210> 71
<211> 8
<212> БЕЛОК
<213> Неизвестный
<220>
<221> источник
<223> /примечание=“Описание неизвестной:
Последовательности Т-белка миомы”
<400> 71
Pro Pro Lys Lys Ala Arg Glu Asp
1 5
<210> 72
<211> 8
<212> БЕЛОК
<213> Homo sapiens
<400> 72
Pro Gln Pro Lys Lys Lys Pro Leu
1 5
<210> 73
<211> 12
<212> БЕЛОК
<213> Mus musculus
<400> 73
Ser Ala Leu Ile Lys Lys Lys Lys Lys Met Ala Pro
1 5 10
<210> 74
<211> 5
<212> БЕЛОК
<213> Вирус гриппа
<400> 74
Asp Arg Leu Arg Arg
1 5
<210> 75
<211> 7
<212> БЕЛОК
<213> Вирус гриппа
<400> 75
Pro Lys Gln Lys Lys Arg Lys
1 5
<210> 76
<211> 10
<212> БЕЛОК
<213> Вирус гепатита дельта
<400> 76
Arg Lys Leu Lys Lys Lys Ile Lys Lys Leu
1 5 10
<210> 77
<211> 10
<212> БЕЛОК
<213> Mus musculus
<400> 77
Arg Glu Lys Lys Lys Phe Leu Lys Arg Arg
1 5 10
<210> 78
<211> 20
<212> БЕЛОК
<213> Homo sapiens
<400> 78
Lys Arg Lys Gly Asp Glu Val Asp Gly Val Asp Glu Val Ala Lys Lys
1 5 10 15
Lys Ser Lys Lys
20
<210> 79
<211> 17
<212> БЕЛОК
<213> Homo sapiens
<400> 79
Arg Lys Cys Leu Gln Ala Gly Met Asn Leu Glu Ala Arg Lys Thr Lys
1 5 10 15
Lys
<210> 80
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, t или g
<220>
<221> модифицированное_основание
<222> (21)..(22)
<223> a, c, t, g, неизвестный или другой
<400> 80
nnnnnnnnnn nnnnnnnnnn nnagaaw 27
<210> 81
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(12)
<223> a, c, t или g
<220>
<221> модифицированное_основание
<222> (13)..(14)
<223> a, c, t, g, неизвестный или другой
<400> 81
nnnnnnnnnn nnnnagaaw 19
<210> 82
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, t или g
<220>
<221> модифицированное_основание
<222> (21)..(22)
<223> a, c, t, g, неизвестный или другой
<400> 82
nnnnnnnnnn nnnnnnnnnn nnagaaw 27
<210> 83
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(11)
<223> a, c, t или g
<220>
<221> модифицированное_основание
<222> (12)..(13)
<223> a, c, t, g, неизвестный или другой
<400> 83
nnnnnnnnnn nnnagaaw 18
<210> 84
<211> 137
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий полинуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, t, g, неизвестный или другой
<400> 84
nnnnnnnnnn nnnnnnnnnn gtttttgtac tctcaagatt tagaaataaa tcttgcagaa 60
gctacaaaga taaggcttca tgccgaaatc aacaccctgt cattttatgg cagggtgttt 120
tcgttattta atttttt 137
<210> 85
<211> 123
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий полинуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, t, g, неизвестный или другой
<400> 85
nnnnnnnnnn nnnnnnnnnn gtttttgtac tctcagaaat gcagaagcta caaagataag 60
gcttcatgcc gaaatcaaca ccctgtcatt ttatggcagg gtgttttcgt tatttaattt 120
ttt 123
<210> 86
<211> 110
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий полинуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, t, g, неизвестный или другой
<400> 86
nnnnnnnnnn nnnnnnnnnn gtttttgtac tctcagaaat gcagaagcta caaagataag 60
gcttcatgcc gaaatcaaca ccctgtcatt ttatggcagg gtgttttttt 110
<210> 87
<211> 102
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий полинуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, t, g, неизвестный или другой
<400> 87
nnnnnnnnnn nnnnnnnnnn gttttagagc tagaaatagc aagttaaaat aaggctagtc 60
cgttatcaac ttgaaaaagt ggcaccgagt cggtgctttt tt 102
<210> 88
<211> 88
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, t, g, неизвестный или другой
<400> 88
nnnnnnnnnn nnnnnnnnnn gttttagagc tagaaatagc aagttaaaat aaggctagtc 60
cgttatcaac ttgaaaaagt gttttttt 88
<210> 89
<211> 76
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, t, g, неизвестный или другой
<400> 89
nnnnnnnnnn nnnnnnnnnn gttttagagc tagaaatagc aagttaaaat aaggctagtc 60
cgttatcatt tttttt 76
<210> 90
<211> 12
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 90
gttttagagc ta 12
<210> 91
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 91
tagcaagtta aaataaggct agtccgtttt t 31
<210> 92
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(22)
<223> a, c, t, g, неизвестный или другой
<400> 92
nnnnnnnnnn nnnnnnnnnn nnagaaw 27
<210> 93
<211> 33
<212> ДНК
<213> Homo sapiens
<400> 93
ggacatcgat gtcacctcca atgactaggg tgg 33
<210> 94
<211> 33
<212> ДНК
<213> Homo sapiens
<400> 94
cattggaggt gacatcgatg tcctccccat tgg 33
<210> 95
<211> 33
<212> ДНК
<213> Homo sapiens
<400> 95
ggaagggcct gagtccgagc agaagaagaa ggg 33
<210> 96
<211> 33
<212> ДНК
<213> Homo sapiens
<400> 96
ggtggcgaga ggggccgaga ttgggtgttc agg 33
<210> 97
<211> 33
<212> ДНК
<213> Homo sapiens
<400> 97
atgcaggagg gtggcgagag gggccgagat tgg 33
<210> 98
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 98
aaactctaga gagggcctat ttcccatgat tc 32
<210> 99
<211> 153
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 99
acctctagaa aaaaagcacc gactcggtgc cactttttca agttgataac ggactagcct 60
tattttaact tgctatgctg ttttgtttcc aaaacagcat agctctaaaa cccctagtca 120
ttggaggtga cggtgtttcg tcctttccac aag 153
<210> 100
<211> 52
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 100
taatacgact cactatagga agtgcgccac catggcccca aagaagaagc gg 52
<210> 101
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 101
ggtttttttt tttttttttt tttttttttt ttttcttact ttttcttttt tgcctggccg 60
<210> 102
<211> 984
<212> БЕЛОК
<213> Campylobacter jejuni
<400> 102
Met Ala Arg Ile Leu Ala Phe Asp Ile Gly Ile Ser Ser Ile Gly Trp
1 5 10 15
Ala Phe Ser Glu Asn Asp Glu Leu Lys Asp Cys Gly Val Arg Ile Phe
20 25 30
Thr Lys Val Glu Asn Pro Lys Thr Gly Glu Ser Leu Ala Leu Pro Arg
35 40 45
Arg Leu Ala Arg Ser Ala Arg Lys Arg Leu Ala Arg Arg Lys Ala Arg
50 55 60
Leu Asn His Leu Lys His Leu Ile Ala Asn Glu Phe Lys Leu Asn Tyr
65 70 75 80
Glu Asp Tyr Gln Ser Phe Asp Glu Ser Leu Ala Lys Ala Tyr Lys Gly
85 90 95
Ser Leu Ile Ser Pro Tyr Glu Leu Arg Phe Arg Ala Leu Asn Glu Leu
100 105 110
Leu Ser Lys Gln Asp Phe Ala Arg Val Ile Leu His Ile Ala Lys Arg
115 120 125
Arg Gly Tyr Asp Asp Ile Lys Asn Ser Asp Asp Lys Glu Lys Gly Ala
130 135 140
Ile Leu Lys Ala Ile Lys Gln Asn Glu Glu Lys Leu Ala Asn Tyr Gln
145 150 155 160
Ser Val Gly Glu Tyr Leu Tyr Lys Glu Tyr Phe Gln Lys Phe Lys Glu
165 170 175
Asn Ser Lys Glu Phe Thr Asn Val Arg Asn Lys Lys Glu Ser Tyr Glu
180 185 190
Arg Cys Ile Ala Gln Ser Phe Leu Lys Asp Glu Leu Lys Leu Ile Phe
195 200 205
Lys Lys Gln Arg Glu Phe Gly Phe Ser Phe Ser Lys Lys Phe Glu Glu
210 215 220
Glu Val Leu Ser Val Ala Phe Tyr Lys Arg Ala Leu Lys Asp Phe Ser
225 230 235 240
His Leu Val Gly Asn Cys Ser Phe Phe Thr Asp Glu Lys Arg Ala Pro
245 250 255
Lys Asn Ser Pro Leu Ala Phe Met Phe Val Ala Leu Thr Arg Ile Ile
260 265 270
Asn Leu Leu Asn Asn Leu Lys Asn Thr Glu Gly Ile Leu Tyr Thr Lys
275 280 285
Asp Asp Leu Asn Ala Leu Leu Asn Glu Val Leu Lys Asn Gly Thr Leu
290 295 300
Thr Tyr Lys Gln Thr Lys Lys Leu Leu Gly Leu Ser Asp Asp Tyr Glu
305 310 315 320
Phe Lys Gly Glu Lys Gly Thr Tyr Phe Ile Glu Phe Lys Lys Tyr Lys
325 330 335
Glu Phe Ile Lys Ala Leu Gly Glu His Asn Leu Ser Gln Asp Asp Leu
340 345 350
Asn Glu Ile Ala Lys Asp Ile Thr Leu Ile Lys Asp Glu Ile Lys Leu
355 360 365
Lys Lys Ala Leu Ala Lys Tyr Asp Leu Asn Gln Asn Gln Ile Asp Ser
370 375 380
Leu Ser Lys Leu Glu Phe Lys Asp His Leu Asn Ile Ser Phe Lys Ala
385 390 395 400
Leu Lys Leu Val Thr Pro Leu Met Leu Glu Gly Lys Lys Tyr Asp Glu
405 410 415
Ala Cys Asn Glu Leu Asn Leu Lys Val Ala Ile Asn Glu Asp Lys Lys
420 425 430
Asp Phe Leu Pro Ala Phe Asn Glu Thr Tyr Tyr Lys Asp Glu Val Thr
435 440 445
Asn Pro Val Val Leu Arg Ala Ile Lys Glu Tyr Arg Lys Val Leu Asn
450 455 460
Ala Leu Leu Lys Lys Tyr Gly Lys Val His Lys Ile Asn Ile Glu Leu
465 470 475 480
Ala Arg Glu Val Gly Lys Asn His Ser Gln Arg Ala Lys Ile Glu Lys
485 490 495
Glu Gln Asn Glu Asn Tyr Lys Ala Lys Lys Asp Ala Glu Leu Glu Cys
500 505 510
Glu Lys Leu Gly Leu Lys Ile Asn Ser Lys Asn Ile Leu Lys Leu Arg
515 520 525
Leu Phe Lys Glu Gln Lys Glu Phe Cys Ala Tyr Ser Gly Glu Lys Ile
530 535 540
Lys Ile Ser Asp Leu Gln Asp Glu Lys Met Leu Glu Ile Asp His Ile
545 550 555 560
Tyr Pro Tyr Ser Arg Ser Phe Asp Asp Ser Tyr Met Asn Lys Val Leu
565 570 575
Val Phe Thr Lys Gln Asn Gln Glu Lys Leu Asn Gln Thr Pro Phe Glu
580 585 590
Ala Phe Gly Asn Asp Ser Ala Lys Trp Gln Lys Ile Glu Val Leu Ala
595 600 605
Lys Asn Leu Pro Thr Lys Lys Gln Lys Arg Ile Leu Asp Lys Asn Tyr
610 615 620
Lys Asp Lys Glu Gln Lys Asn Phe Lys Asp Arg Asn Leu Asn Asp Thr
625 630 635 640
Arg Tyr Ile Ala Arg Leu Val Leu Asn Tyr Thr Lys Asp Tyr Leu Asp
645 650 655
Phe Leu Pro Leu Ser Asp Asp Glu Asn Thr Lys Leu Asn Asp Thr Gln
660 665 670
Lys Gly Ser Lys Val His Val Glu Ala Lys Ser Gly Met Leu Thr Ser
675 680 685
Ala Leu Arg His Thr Trp Gly Phe Ser Ala Lys Asp Arg Asn Asn His
690 695 700
Leu His His Ala Ile Asp Ala Val Ile Ile Ala Tyr Ala Asn Asn Ser
705 710 715 720
Ile Val Lys Ala Phe Ser Asp Phe Lys Lys Glu Gln Glu Ser Asn Ser
725 730 735
Ala Glu Leu Tyr Ala Lys Lys Ile Ser Glu Leu Asp Tyr Lys Asn Lys
740 745 750
Arg Lys Phe Phe Glu Pro Phe Ser Gly Phe Arg Gln Lys Val Leu Asp
755 760 765
Lys Ile Asp Glu Ile Phe Val Ser Lys Pro Glu Arg Lys Lys Pro Ser
770 775 780
Gly Ala Leu His Glu Glu Thr Phe Arg Lys Glu Glu Glu Phe Tyr Gln
785 790 795 800
Ser Tyr Gly Gly Lys Glu Gly Val Leu Lys Ala Leu Glu Leu Gly Lys
805 810 815
Ile Arg Lys Val Asn Gly Lys Ile Val Lys Asn Gly Asp Met Phe Arg
820 825 830
Val Asp Ile Phe Lys His Lys Lys Thr Asn Lys Phe Tyr Ala Val Pro
835 840 845
Ile Tyr Thr Met Asp Phe Ala Leu Lys Val Leu Pro Asn Lys Ala Val
850 855 860
Ala Arg Ser Lys Lys Gly Glu Ile Lys Asp Trp Ile Leu Met Asp Glu
865 870 875 880
Asn Tyr Glu Phe Cys Phe Ser Leu Tyr Lys Asp Ser Leu Ile Leu Ile
885 890 895
Gln Thr Lys Asp Met Gln Glu Pro Glu Phe Val Tyr Tyr Asn Ala Phe
900 905 910
Thr Ser Ser Thr Val Ser Leu Ile Val Ser Lys His Asp Asn Lys Phe
915 920 925
Glu Thr Leu Ser Lys Asn Gln Lys Ile Leu Phe Lys Asn Ala Asn Glu
930 935 940
Lys Glu Val Ile Ala Lys Ser Ile Gly Ile Gln Asn Leu Lys Val Phe
945 950 955 960
Glu Lys Tyr Ile Val Ser Ala Leu Gly Glu Val Thr Lys Ala Glu Phe
965 970 975
Arg Gln Arg Glu Asp Phe Lys Lys
980
<210> 103
<211> 91
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 103
tataatctca taagaaattt aaaaagggac taaaataaag agtttgcggg actctgcggg 60
gttacaatcc cctaaaaccg cttttaaaat t 91
<210> 104
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 104
attttaccat aaagaaattt aaaaagggac taaaac 36
<210> 105
<211> 95
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<400> 105
nnnnnnnnnn nnnnnnnnnn guuuuagucc cgaaagggac uaaaauaaag aguuugcggg 60
acucugcggg guuacaaucc ccuaaaaccg cuuuu 95
<210> 106
<211> 1115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий полипептид”
<400> 106
Met Ser Asp Leu Val Leu Gly Leu Asp Ile Gly Ile Gly Ser Val Gly
1 5 10 15
Val Gly Ile Leu Asn Lys Val Thr Gly Glu Ile Ile His Lys Asn Ser
20 25 30
Arg Ile Phe Pro Ala Ala Gln Ala Glu Asn Asn Leu Val Arg Arg Thr
35 40 45
Asn Arg Gln Gly Arg Arg Leu Ala Arg Arg Lys Lys His Arg Arg Val
50 55 60
Arg Leu Asn Arg Leu Phe Glu Glu Ser Gly Leu Ile Thr Asp Phe Thr
65 70 75 80
Lys Ile Ser Ile Asn Leu Asn Pro Tyr Gln Leu Arg Val Lys Gly Leu
85 90 95
Thr Asp Glu Leu Ser Asn Glu Glu Leu Phe Ile Ala Leu Lys Asn Met
100 105 110
Val Lys His Arg Gly Ile Ser Tyr Leu Asp Asp Ala Ser Asp Asp Gly
115 120 125
Asn Ser Ser Val Gly Asp Tyr Ala Gln Ile Val Lys Glu Asn Ser Lys
130 135 140
Gln Leu Glu Thr Lys Thr Pro Gly Gln Ile Gln Leu Glu Arg Tyr Gln
145 150 155 160
Thr Tyr Gly Gln Leu Arg Gly Asp Phe Thr Val Glu Lys Asp Gly Lys
165 170 175
Lys His Arg Leu Ile Asn Val Phe Pro Thr Ser Ala Tyr Arg Ser Glu
180 185 190
Ala Leu Arg Ile Leu Gln Thr Gln Gln Glu Phe Asn Pro Gln Ile Thr
195 200 205
Asp Glu Phe Ile Asn Arg Tyr Leu Glu Ile Leu Thr Gly Lys Arg Lys
210 215 220
Tyr Tyr His Gly Pro Gly Asn Glu Lys Ser Arg Thr Asp Tyr Gly Arg
225 230 235 240
Tyr Arg Thr Ser Gly Glu Thr Leu Asp Asn Ile Phe Gly Ile Leu Ile
245 250 255
Gly Lys Cys Thr Phe Tyr Pro Asp Glu Phe Arg Ala Ala Lys Ala Ser
260 265 270
Tyr Thr Ala Gln Glu Phe Asn Leu Leu Asn Asp Leu Asn Asn Leu Thr
275 280 285
Val Pro Thr Glu Thr Lys Lys Leu Ser Lys Glu Gln Lys Asn Gln Ile
290 295 300
Ile Asn Tyr Val Lys Asn Glu Lys Ala Met Gly Pro Ala Lys Leu Phe
305 310 315 320
Lys Tyr Ile Ala Lys Leu Leu Ser Cys Asp Val Ala Asp Ile Lys Gly
325 330 335
Tyr Arg Ile Asp Lys Ser Gly Lys Ala Glu Ile His Thr Phe Glu Ala
340 345 350
Tyr Arg Lys Met Lys Thr Leu Glu Thr Leu Asp Ile Glu Gln Met Asp
355 360 365
Arg Glu Thr Leu Asp Lys Leu Ala Tyr Val Leu Thr Leu Asn Thr Glu
370 375 380
Arg Glu Gly Ile Gln Glu Ala Leu Glu His Glu Phe Ala Asp Gly Ser
385 390 395 400
Phe Ser Gln Lys Gln Val Asp Glu Leu Val Gln Phe Arg Lys Ala Asn
405 410 415
Ser Ser Ile Phe Gly Lys Gly Trp His Asn Phe Ser Val Lys Leu Met
420 425 430
Met Glu Leu Ile Pro Glu Leu Tyr Glu Thr Ser Glu Glu Gln Met Thr
435 440 445
Ile Leu Thr Arg Leu Gly Lys Gln Lys Thr Thr Ser Ser Ser Asn Lys
450 455 460
Thr Lys Tyr Ile Asp Glu Lys Leu Leu Thr Glu Glu Ile Tyr Asn Pro
465 470 475 480
Val Val Ala Lys Ser Val Arg Gln Ala Ile Lys Ile Val Asn Ala Ala
485 490 495
Ile Lys Glu Tyr Gly Asp Phe Asp Asn Ile Val Ile Glu Met Ala Arg
500 505 510
Glu Asn Gln Thr Thr Gln Lys Gly Gln Lys Asn Ser Arg Glu Arg Met
515 520 525
Lys Arg Ile Glu Glu Gly Ile Lys Glu Leu Gly Ser Gln Ile Leu Lys
530 535 540
Glu His Pro Val Glu Asn Thr Gln Leu Gln Asn Glu Lys Leu Tyr Leu
545 550 555 560
Tyr Tyr Leu Gln Asn Gly Arg Asp Met Tyr Val Asp Gln Glu Leu Asp
565 570 575
Ile Asn Arg Leu Ser Asp Tyr Asp Val Asp His Ile Val Pro Gln Ser
580 585 590
Phe Leu Lys Asp Asp Ser Ile Asp Asn Lys Val Leu Thr Arg Ser Asp
595 600 605
Lys Asn Arg Gly Lys Ser Asp Asn Val Pro Ser Glu Glu Val Val Lys
610 615 620
Lys Met Lys Asn Tyr Trp Arg Gln Leu Leu Asn Ala Lys Leu Ile Thr
625 630 635 640
Gln Arg Lys Phe Asp Asn Leu Thr Lys Ala Glu Arg Gly Gly Leu Ser
645 650 655
Glu Leu Asp Lys Ala Gly Phe Ile Lys Arg Gln Leu Val Glu Thr Arg
660 665 670
Gln Ile Thr Lys His Val Ala Gln Ile Leu Asp Ser Arg Met Asn Thr
675 680 685
Lys Tyr Asp Glu Asn Asp Lys Leu Ile Arg Glu Val Lys Val Ile Thr
690 695 700
Leu Lys Ser Lys Leu Val Ser Asp Phe Arg Lys Asp Phe Gln Phe Tyr
705 710 715 720
Lys Val Arg Glu Ile Asn Asn Tyr His His Ala His Asp Ala Tyr Leu
725 730 735
Asn Ala Val Val Gly Thr Ala Leu Ile Lys Lys Tyr Pro Lys Leu Glu
740 745 750
Ser Glu Phe Val Tyr Gly Asp Tyr Lys Val Tyr Asp Val Arg Lys Met
755 760 765
Ile Ala Lys Ser Glu Gln Glu Ile Gly Lys Ala Thr Ala Lys Tyr Phe
770 775 780
Phe Tyr Ser Asn Ile Met Asn Phe Phe Lys Thr Glu Ile Thr Leu Ala
785 790 795 800
Asn Gly Glu Ile Arg Lys Arg Pro Leu Ile Glu Thr Asn Gly Glu Thr
805 810 815
Gly Glu Ile Val Trp Asp Lys Gly Arg Asp Phe Ala Thr Val Arg Lys
820 825 830
Val Leu Ser Met Pro Gln Val Asn Ile Val Lys Lys Thr Glu Val Gln
835 840 845
Thr Gly Gly Phe Ser Lys Glu Ser Ile Leu Pro Lys Arg Asn Ser Asp
850 855 860
Lys Leu Ile Ala Arg Lys Lys Asp Trp Asp Pro Lys Lys Tyr Gly Gly
865 870 875 880
Phe Asp Ser Pro Thr Val Ala Tyr Ser Val Leu Val Val Ala Lys Val
885 890 895
Glu Lys Gly Lys Ser Lys Lys Leu Lys Ser Val Lys Glu Leu Leu Gly
900 905 910
Ile Thr Ile Met Glu Arg Ser Ser Phe Glu Lys Asn Pro Ile Asp Phe
915 920 925
Leu Glu Ala Lys Gly Tyr Lys Glu Val Lys Lys Asp Leu Ile Ile Lys
930 935 940
Leu Pro Lys Tyr Ser Leu Phe Glu Leu Glu Asn Gly Arg Lys Arg Met
945 950 955 960
Leu Ala Ser Ala Gly Glu Leu Gln Lys Gly Asn Glu Leu Ala Leu Pro
965 970 975
Ser Lys Tyr Val Asn Phe Leu Tyr Leu Ala Ser His Tyr Glu Lys Leu
980 985 990
Lys Gly Ser Pro Glu Asp Asn Glu Gln Lys Gln Leu Phe Val Glu Gln
995 1000 1005
His Lys His Tyr Leu Asp Glu Ile Ile Glu Gln Ile Ser Glu Phe
1010 1015 1020
Ser Lys Arg Val Ile Leu Ala Asp Ala Asn Leu Asp Lys Val Leu
1025 1030 1035
Ser Ala Tyr Asn Lys His Arg Asp Lys Pro Ile Arg Glu Gln Ala
1040 1045 1050
Glu Asn Ile Ile His Leu Phe Thr Leu Thr Asn Leu Gly Ala Pro
1055 1060 1065
Ala Ala Phe Lys Tyr Phe Asp Thr Thr Ile Asp Arg Lys Arg Tyr
1070 1075 1080
Thr Ser Thr Lys Glu Val Leu Asp Ala Thr Leu Ile His Gln Ser
1085 1090 1095
Ile Thr Gly Leu Tyr Glu Thr Arg Ile Asp Leu Ser Gln Leu Gly
1100 1105 1110
Gly Asp
1115
<210> 107
<211> 1374
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий полипептид”
<400> 107
Met Asp Lys Lys Tyr Ser Ile Gly Leu Asp Ile Gly Thr Asn Ser Val
1 5 10 15
Gly Trp Ala Val Ile Thr Asp Glu Tyr Lys Val Pro Ser Lys Lys Phe
20 25 30
Lys Val Leu Gly Asn Thr Asp Arg His Ser Ile Lys Lys Asn Leu Ile
35 40 45
Gly Ala Leu Leu Phe Asp Ser Gly Glu Thr Ala Glu Ala Thr Arg Leu
50 55 60
Lys Arg Thr Ala Arg Arg Arg Tyr Thr Arg Arg Lys Asn Arg Ile Cys
65 70 75 80
Tyr Leu Gln Glu Ile Phe Ser Asn Glu Met Ala Lys Val Asp Asp Ser
85 90 95
Phe Phe His Arg Leu Glu Glu Ser Phe Leu Val Glu Glu Asp Lys Lys
100 105 110
His Glu Arg His Pro Ile Phe Gly Asn Ile Val Asp Glu Val Ala Tyr
115 120 125
His Glu Lys Tyr Pro Thr Ile Tyr His Leu Arg Lys Lys Leu Val Asp
130 135 140
Ser Thr Asp Lys Ala Asp Leu Arg Leu Ile Tyr Leu Ala Leu Ala His
145 150 155 160
Met Ile Lys Phe Arg Gly His Phe Leu Ile Glu Gly Asp Leu Asn Pro
165 170 175
Asp Asn Ser Asp Val Asp Lys Leu Phe Ile Gln Leu Val Gln Thr Tyr
180 185 190
Asn Gln Leu Phe Glu Glu Asn Pro Ile Asn Ala Ser Gly Val Asp Ala
195 200 205
Lys Ala Ile Leu Ser Ala Arg Leu Ser Lys Ser Arg Arg Leu Glu Asn
210 215 220
Leu Ile Ala Gln Leu Pro Gly Glu Lys Lys Asn Gly Leu Phe Gly Asn
225 230 235 240
Leu Ile Ala Leu Ser Leu Gly Leu Thr Pro Asn Phe Lys Ser Asn Phe
245 250 255
Asp Leu Ala Glu Asp Ala Lys Leu Gln Leu Ser Lys Asp Thr Tyr Asp
260 265 270
Asp Asp Leu Asp Asn Leu Leu Ala Gln Ile Gly Asp Gln Tyr Ala Asp
275 280 285
Leu Phe Leu Ala Ala Lys Asn Leu Ser Asp Ala Ile Leu Leu Ser Asp
290 295 300
Ile Leu Arg Val Asn Thr Glu Ile Thr Lys Ala Pro Leu Ser Ala Ser
305 310 315 320
Met Ile Lys Arg Tyr Asp Glu His His Gln Asp Leu Thr Leu Leu Lys
325 330 335
Ala Leu Val Arg Gln Gln Leu Pro Glu Lys Tyr Lys Glu Ile Phe Phe
340 345 350
Asp Gln Ser Lys Asn Gly Tyr Ala Gly Tyr Ile Asp Gly Gly Ala Ser
355 360 365
Gln Glu Glu Phe Tyr Lys Phe Ile Lys Pro Ile Leu Glu Lys Met Asp
370 375 380
Gly Thr Glu Glu Leu Leu Val Lys Leu Asn Arg Glu Asp Leu Leu Arg
385 390 395 400
Lys Gln Arg Thr Phe Asp Asn Gly Ser Ile Pro His Gln Ile His Leu
405 410 415
Gly Glu Leu His Ala Ile Leu Arg Arg Gln Glu Asp Phe Tyr Pro Phe
420 425 430
Leu Lys Asp Asn Arg Glu Lys Ile Glu Lys Ile Leu Thr Phe Arg Ile
435 440 445
Pro Tyr Tyr Val Gly Pro Leu Ala Arg Gly Asn Ser Arg Phe Ala Trp
450 455 460
Met Thr Arg Lys Ser Glu Glu Thr Ile Thr Pro Trp Asn Phe Glu Glu
465 470 475 480
Val Val Asp Lys Gly Ala Ser Ala Gln Ser Phe Ile Glu Arg Met Thr
485 490 495
Asn Phe Asp Lys Asn Leu Pro Asn Glu Lys Val Leu Pro Lys His Ser
500 505 510
Leu Leu Tyr Glu Tyr Phe Thr Val Tyr Asn Glu Leu Thr Lys Val Lys
515 520 525
Tyr Val Thr Glu Gly Met Arg Lys Pro Ala Phe Leu Ser Gly Glu Gln
530 535 540
Lys Lys Ala Ile Val Asp Leu Leu Phe Lys Thr Asn Arg Lys Val Thr
545 550 555 560
Val Lys Gln Leu Lys Glu Asp Tyr Phe Lys Lys Ile Glu Cys Phe Asp
565 570 575
Ser Val Glu Ile Ser Gly Val Glu Asp Arg Phe Asn Ala Ser Leu Gly
580 585 590
Thr Tyr His Asp Leu Leu Lys Ile Ile Lys Asp Lys Asp Phe Leu Asp
595 600 605
Asn Glu Glu Asn Glu Asp Ile Leu Glu Asp Ile Val Leu Thr Leu Thr
610 615 620
Leu Phe Glu Asp Arg Glu Met Ile Glu Glu Arg Leu Lys Thr Tyr Ala
625 630 635 640
His Leu Phe Asp Asp Lys Val Met Lys Gln Leu Lys Arg Arg Arg Tyr
645 650 655
Thr Gly Trp Gly Arg Leu Ser Arg Lys Leu Ile Asn Gly Ile Arg Asp
660 665 670
Lys Gln Ser Gly Lys Thr Ile Leu Asp Phe Leu Lys Ser Asp Gly Phe
675 680 685
Ala Asn Arg Asn Phe Met Gln Leu Ile His Asp Asp Ser Leu Thr Phe
690 695 700
Lys Glu Asp Ile Gln Lys Ala Gln Val Ser Gly Gln Gly Asp Ser Leu
705 710 715 720
His Glu His Ile Ala Asn Leu Ala Gly Ser Pro Ala Ile Lys Lys Gly
725 730 735
Ile Leu Gln Thr Val Lys Val Val Asp Glu Leu Val Lys Val Met Gly
740 745 750
Arg His Lys Pro Glu Asn Ile Val Ile Glu Met Ala Arg Glu Thr Asn
755 760 765
Glu Asp Asp Glu Lys Lys Ala Ile Gln Lys Ile Gln Lys Ala Asn Lys
770 775 780
Asp Glu Lys Asp Ala Ala Met Leu Lys Ala Ala Asn Gln Tyr Asn Gly
785 790 795 800
Lys Ala Glu Leu Pro His Ser Val Phe His Gly His Lys Gln Leu Ala
805 810 815
Thr Lys Ile Arg Leu Trp His Gln Gln Gly Glu Arg Cys Leu Tyr Thr
820 825 830
Gly Lys Thr Ile Ser Ile His Asp Leu Ile Asn Asn Ser Asn Gln Phe
835 840 845
Glu Val Asp His Ile Leu Pro Leu Ser Ile Thr Phe Asp Asp Ser Leu
850 855 860
Ala Asn Lys Val Leu Val Tyr Ala Thr Ala Asn Gln Glu Lys Gly Gln
865 870 875 880
Arg Thr Pro Tyr Gln Ala Leu Asp Ser Met Asp Asp Ala Trp Ser Phe
885 890 895
Arg Glu Leu Lys Ala Phe Val Arg Glu Ser Lys Thr Leu Ser Asn Lys
900 905 910
Lys Lys Glu Tyr Leu Leu Thr Glu Glu Asp Ile Ser Lys Phe Asp Val
915 920 925
Arg Lys Lys Phe Ile Glu Arg Asn Leu Val Asp Thr Arg Tyr Ala Ser
930 935 940
Arg Val Val Leu Asn Ala Leu Gln Glu His Phe Arg Ala His Lys Ile
945 950 955 960
Asp Thr Lys Val Ser Val Val Arg Gly Gln Phe Thr Ser Gln Leu Arg
965 970 975
Arg His Trp Gly Ile Glu Lys Thr Arg Asp Thr Tyr His His His Ala
980 985 990
Val Asp Ala Leu Ile Ile Ala Ala Ser Ser Gln Leu Asn Leu Trp Lys
995 1000 1005
Lys Gln Lys Asn Thr Leu Val Ser Tyr Ser Glu Asp Gln Leu Leu
1010 1015 1020
Asp Ile Glu Thr Gly Glu Leu Ile Ser Asp Asp Glu Tyr Lys Glu
1025 1030 1035
Ser Val Phe Lys Ala Pro Tyr Gln His Phe Val Asp Thr Leu Lys
1040 1045 1050
Ser Lys Glu Phe Glu Asp Ser Ile Leu Phe Ser Tyr Gln Val Asp
1055 1060 1065
Ser Lys Phe Asn Arg Lys Ile Ser Asp Ala Thr Ile Tyr Ala Thr
1070 1075 1080
Arg Gln Ala Lys Val Gly Lys Asp Lys Ala Asp Glu Thr Tyr Val
1085 1090 1095
Leu Gly Lys Ile Lys Asp Ile Tyr Thr Gln Asp Gly Tyr Asp Ala
1100 1105 1110
Phe Met Lys Ile Tyr Lys Lys Asp Lys Ser Lys Phe Leu Met Tyr
1115 1120 1125
Arg His Asp Pro Gln Thr Phe Glu Lys Val Ile Glu Pro Ile Leu
1130 1135 1140
Glu Asn Tyr Pro Asn Lys Gln Ile Asn Glu Lys Gly Lys Glu Val
1145 1150 1155
Pro Cys Asn Pro Phe Leu Lys Tyr Lys Glu Glu His Gly Tyr Ile
1160 1165 1170
Arg Lys Tyr Ser Lys Lys Gly Asn Gly Pro Glu Ile Lys Ser Leu
1175 1180 1185
Lys Tyr Tyr Asp Ser Lys Leu Gly Asn His Ile Asp Ile Thr Pro
1190 1195 1200
Lys Asp Ser Asn Asn Lys Val Val Leu Gln Ser Val Ser Pro Trp
1205 1210 1215
Arg Ala Asp Val Tyr Phe Asn Lys Thr Thr Gly Lys Tyr Glu Ile
1220 1225 1230
Leu Gly Leu Lys Tyr Ala Asp Leu Gln Phe Glu Lys Gly Thr Gly
1235 1240 1245
Thr Tyr Lys Ile Ser Gln Glu Lys Tyr Asn Asp Ile Lys Lys Lys
1250 1255 1260
Glu Gly Val Asp Ser Asp Ser Glu Phe Lys Phe Thr Leu Tyr Lys
1265 1270 1275
Asn Asp Leu Leu Leu Val Lys Asp Thr Glu Thr Lys Glu Gln Gln
1280 1285 1290
Leu Phe Arg Phe Leu Ser Arg Thr Met Pro Lys Gln Lys His Tyr
1295 1300 1305
Val Glu Leu Lys Pro Tyr Asp Lys Gln Lys Phe Glu Gly Gly Glu
1310 1315 1320
Ala Leu Ile Lys Val Leu Gly Asn Val Ala Asn Ser Gly Gln Cys
1325 1330 1335
Lys Lys Gly Leu Gly Lys Ser Asn Ile Ser Ile Tyr Lys Val Arg
1340 1345 1350
Thr Asp Val Leu Gly Asn Gln His Ile Ile Lys Asn Glu Gly Asp
1355 1360 1365
Lys Pro Lys Leu Asp Phe
1370
<210> 108
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий пептид”
<400> 108
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 109
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий пептид”
<400> 109
Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10 15
<210> 110
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий пептид”
<400> 110
Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly
1 5 10 15
Gly Ser
<210> 111
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 111
gccaaattgg acgaccctcg cgg 23
<210> 112
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 112
cgaggagacc cccgtttcgg tgg 23
<210> 113
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 113
cccgccgccg ccgtggctcg agg 23
<210> 114
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 114
tgagctctac gagatccaca agg 23
<210> 115
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 115
ctcaaaattc ataccggttg tgg 23
<210> 116
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 116
cgttaaacaa caaccggact tgg 23
<210> 117
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 117
ttcaccccgc ggcgctgaat ggg 23
<210> 118
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 118
accactacca gtccgtccac agg 23
<210> 119
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 119
agcctttctg aacacatgca cgg 23
<210> 120
<211> 39
<212> ДНК
<213> Homo sapiens
<400> 120
cctgccatca atgtggccat gcatgtgttc agaaaggct 39
<210> 121
<211> 39
<212> ДНК
<213> Homo sapiens
<400> 121
cctgccatca atgtggccgt gcatgtgttc agaaaggct 39
<210> 122
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 122
cactgcttaa gcctcgctcg agg 23
<210> 123
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 123
tcaccagcaa tattcgctcg agg 23
<210> 124
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 124
caccagcaat attccgctcg agg 23
<210> 125
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 125
tagcaacaga catacgctcg agg 23
<210> 126
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 126
gggcagtagt aatacgctcg agg 23
<210> 127
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 127
ccaattccca tacattattg tac 23
<210> 128
<211> 4677
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий полинуклеотид”
<400> 128
tctttcttgc gctatgacac ttccagcaaa aggtagggcg ggctgcgaga cggcttcccg 60
gcgctgcatg caacaccgat gatgcttcga ccccccgaag ctccttcggg gctgcatggg 120
cgctccgatg ccgctccagg gcgagcgctg tttaaatagc caggcccccg attgcaaaga 180
cattatagcg agctaccaaa gccatattca aacacctaga tcactaccac ttctacacag 240
gccactcgag cttgtgatcg cactccgcta agggggcgcc tcttcctctt cgtttcagtc 300
acaacccgca aacatgtacc catacgatgt tccagattac gcttcgccga agaaaaagcg 360
caaggtcgaa gcgtccgaca agaagtacag catcggcctg gacatcggca ccaactctgt 420
gggctgggcc gtgatcaccg acgagtacaa ggtgcccagc aagaaattca aggtgctggg 480
caacaccgac cggcacagca tcaagaagaa cctgatcgga gccctgctgt tcgacagcgg 540
cgaaacagcc gaggccaccc ggctgaagag aaccgccaga agaagataca ccagacggaa 600
gaaccggatc tgctatctgc aagagatctt cagcaacgag atggccaagg tggacgacag 660
cttcttccac agactggaag agtccttcct ggtggaagag gataagaagc acgagcggca 720
ccccatcttc ggcaacatcg tggacgaggt ggcctaccac gagaagtacc ccaccatcta 780
ccacctgaga aagaaactgg tggacagcac cgacaaggcc gacctgcggc tgatctatct 840
ggccctggcc cacatgatca agttccgggg ccacttcctg atcgagggcg acctgaaccc 900
cgacaacagc gacgtggaca agctgttcat ccagctggtg cagacctaca accagctgtt 960
cgaggaaaac cccatcaacg ccagcggcgt ggacgccaag gccatcctgt ctgccagact 1020
gagcaagagc agacggctgg aaaatctgat cgcccagctg cccggcgaga agaagaatgg 1080
cctgttcggc aacctgattg ccctgagcct gggcctgacc cccaacttca agagcaactt 1140
cgacctggcc gaggatgcca aactgcagct gagcaaggac acctacgacg acgacctgga 1200
caacctgctg gcccagatcg gcgaccagta cgccgacctg tttctggccg ccaagaacct 1260
gtccgacgcc atcctgctga gcgacatcct gagagtgaac accgagatca ccaaggcccc 1320
cctgagcgcc tctatgatca agagatacga cgagcaccac caggacctga ccctgctgaa 1380
agctctcgtg cggcagcagc tgcctgagaa gtacaaagag attttcttcg accagagcaa 1440
gaacggctac gccggctaca ttgacggcgg agccagccag gaagagttct acaagttcat 1500
caagcccatc ctggaaaaga tggacggcac cgaggaactg ctcgtgaagc tgaacagaga 1560
ggacctgctg cggaagcagc ggaccttcga caacggcagc atcccccacc agatccacct 1620
gggagagctg cacgccattc tgcggcggca ggaagatttt tacccattcc tgaaggacaa 1680
ccgggaaaag atcgagaaga tcctgacctt ccgcatcccc tactacgtgg gccctctggc 1740
caggggaaac agcagattcg cctggatgac cagaaagagc gaggaaacca tcaccccctg 1800
gaacttcgag gaagtggtgg acaagggcgc ttccgcccag agcttcatcg agcggatgac 1860
caacttcgat aagaacctgc ccaacgagaa ggtgctgccc aagcacagcc tgctgtacga 1920
gtacttcacc gtgtataacg agctgaccaa agtgaaatac gtgaccgagg gaatgagaaa 1980
gcccgccttc ctgagcggcg agcagaaaaa ggccatcgtg gacctgctgt tcaagaccaa 2040
ccggaaagtg accgtgaagc agctgaaaga ggactacttc aagaaaatcg agtgcttcga 2100
ctccgtggaa atctccggcg tggaagatcg gttcaacgcc tccctgggca cataccacga 2160
tctgctgaaa attatcaagg acaaggactt cctggacaat gaggaaaacg aggacattct 2220
ggaagatatc gtgctgaccc tgacactgtt tgaggacaga gagatgatcg aggaacggct 2280
gaaaacctat gcccacctgt tcgacgacaa agtgatgaag cagctgaagc ggcggagata 2340
caccggctgg ggcaggctga gccggaagct gatcaacggc atccgggaca agcagtccgg 2400
caagacaatc ctggatttcc tgaagtccga cggcttcgcc aacagaaact tcatgcagct 2460
gatccacgac gacagcctga cctttaaaga ggacatccag aaagcccagg tgtccggcca 2520
gggcgatagc ctgcacgagc acattgccaa tctggccggc agccccgcca ttaagaaggg 2580
catcctgcag acagtgaagg tggtggacga gctcgtgaaa gtgatgggcc ggcacaagcc 2640
cgagaacatc gtgatcgaaa tggccagaga gaaccagacc acccagaagg gacagaagaa 2700
cagccgcgag agaatgaagc ggatcgaaga gggcatcaaa gagctgggca gccagatcct 2760
gaaagaacac cccgtggaaa acacccagct gcagaacgag aagctgtacc tgtactacct 2820
gcagaatggg cgggatatgt acgtggacca ggaactggac atcaaccggc tgtccgacta 2880
cgatgtggac catatcgtgc ctcagagctt tctgaaggac gactccatcg acaacaaggt 2940
gctgaccaga agcgacaaga accggggcaa gagcgacaac gtgccctccg aagaggtcgt 3000
gaagaagatg aagaactact ggcggcagct gctgaacgcc aagctgatta cccagagaaa 3060
gttcgacaat ctgaccaagg ccgagagagg cggcctgagc gaactggata aggccggctt 3120
catcaagaga cagctggtgg aaacccggca gatcacaaag cacgtggcac agatcctgga 3180
ctcccggatg aacactaagt acgacgagaa tgacaagctg atccgggaag tgaaagtgat 3240
caccctgaag tccaagctgg tgtccgattt ccggaaggat ttccagtttt acaaagtgcg 3300
cgagatcaac aactaccacc acgcccacga cgcctacctg aacgccgtcg tgggaaccgc 3360
cctgatcaaa aagtacccta agctggaaag cgagttcgtg tacggcgact acaaggtgta 3420
cgacgtgcgg aagatgatcg ccaagagcga gcaggaaatc ggcaaggcta ccgccaagta 3480
cttcttctac agcaacatca tgaacttttt caagaccgag attaccctgg ccaacggcga 3540
gatccggaag cggcctctga tcgagacaaa cggcgaaacc ggggagatcg tgtgggataa 3600
gggccgggat tttgccaccg tgcggaaagt gctgagcatg ccccaagtga atatcgtgaa 3660
aaagaccgag gtgcagacag gcggcttcag caaagagtct atcctgccca agaggaacag 3720
cgataagctg atcgccagaa agaaggactg ggaccctaag aagtacggcg gcttcgacag 3780
ccccaccgtg gcctattctg tgctggtggt ggccaaagtg gaaaagggca agtccaagaa 3840
actgaagagt gtgaaagagc tgctggggat caccatcatg gaaagaagca gcttcgagaa 3900
gaatcccatc gactttctgg aagccaaggg ctacaaagaa gtgaaaaagg acctgatcat 3960
caagctgcct aagtactccc tgttcgagct ggaaaacggc cggaagagaa tgctggcctc 4020
tgccggcgaa ctgcagaagg gaaacgaact ggccctgccc tccaaatatg tgaacttcct 4080
gtacctggcc agccactatg agaagctgaa gggctccccc gaggataatg agcagaaaca 4140
gctgtttgtg gaacagcaca agcactacct ggacgagatc atcgagcaga tcagcgagtt 4200
ctccaagaga gtgatcctgg ccgacgctaa tctggacaaa gtgctgtccg cctacaacaa 4260
gcaccgggat aagcccatca gagagcaggc cgagaatatc atccacctgt ttaccctgac 4320
caatctggga gcccctgccg ccttcaagta ctttgacacc accatcgacc ggaagaggta 4380
caccagcacc aaagaggtgc tggacgccac cctgatccac cagagcatca ccggcctgta 4440
cgagacacgg atcgacctgt ctcagctggg aggcgacagc cccaagaaga agagaaaggt 4500
ggaggccagc taaggatccg gcaagactgg ccccgcttgg caacgcaaca gtgagcccct 4560
ccctagtgtg tttggggatg tgactatgta ttcgtgtgtt ggccaacggg tcaacccgaa 4620
cagattgata cccgccttgg catttcctgt cagaatgtaa cgtcagttga tggtact 4677
<210> 129
<211> 3150
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий полинуклеотид”
<400> 129
tctttcttgc gctatgacac ttccagcaaa aggtagggcg ggctgcgaga cggcttcccg 60
gcgctgcatg caacaccgat gatgcttcga ccccccgaag ctccttcggg gctgcatggg 120
cgctccgatg ccgctccagg gcgagcgctg tttaaatagc caggcccccg attgcaaaga 180
cattatagcg agctaccaaa gccatattca aacacctaga tcactaccac ttctacacag 240
gccactcgag cttgtgatcg cactccgcta agggggcgcc tcttcctctt cgtttcagtc 300
acaacccgca aacatgccta agaagaagag gaaggttaac acgattaaca tcgctaagaa 360
cgacttctct gacatcgaac tggctgctat cccgttcaac actctggctg accattacgg 420
tgagcgttta gctcgcgaac agttggccct tgagcatgag tcttacgaga tgggtgaagc 480
acgcttccgc aagatgtttg agcgtcaact taaagctggt gaggttgcgg ataacgctgc 540
cgccaagcct ctcatcacta ccctactccc taagatgatt gcacgcatca acgactggtt 600
tgaggaagtg aaagctaagc gcggcaagcg cccgacagcc ttccagttcc tgcaagaaat 660
caagccggaa gccgtagcgt acatcaccat taagaccact ctggcttgcc taaccagtgc 720
tgacaataca accgttcagg ctgtagcaag cgcaatcggt cgggccattg aggacgaggc 780
tcgcttcggt cgtatccgtg accttgaagc taagcacttc aagaaaaacg ttgaggaaca 840
actcaacaag cgcgtagggc acgtctacaa gaaagcattt atgcaagttg tcgaggctga 900
catgctctct aagggtctac tcggtggcga ggcgtggtct tcgtggcata aggaagactc 960
tattcatgta ggagtacgct gcatcgagat gctcattgag tcaaccggaa tggttagctt 1020
acaccgccaa aatgctggcg tagtaggtca agactctgag actatcgaac tcgcacctga 1080
atacgctgag gctatcgcaa cccgtgcagg tgcgctggct ggcatctctc cgatgttcca 1140
accttgcgta gttcctccta agccgtggac tggcattact ggtggtggct attgggctaa 1200
cggtcgtcgt cctctggcgc tggtgcgtac tcacagtaag aaagcactga tgcgctacga 1260
agacgtttac atgcctgagg tgtacaaagc gattaacatt gcgcaaaaca ccgcatggaa 1320
aatcaacaag aaagtcctag cggtcgccaa cgtaatcacc aagtggaagc attgtccggt 1380
cgaggacatc cctgcgattg agcgtgaaga actcccgatg aaaccggaag acatcgacat 1440
gaatcctgag gctctcaccg cgtggaaacg tgctgccgct gctgtgtacc gcaaggacaa 1500
ggctcgcaag tctcgccgta tcagccttga gttcatgctt gagcaagcca ataagtttgc 1560
taaccataag gccatctggt tcccttacaa catggactgg cgcggtcgtg tttacgctgt 1620
gtcaatgttc aacccgcaag gtaacgatat gaccaaagga ctgcttacgc tggcgaaagg 1680
taaaccaatc ggtaaggaag gttactactg gctgaaaatc cacggtgcaa actgtgcggg 1740
tgtcgacaag gttccgttcc ctgagcgcat caagttcatt gaggaaaacc acgagaacat 1800
catggcttgc gctaagtctc cactggagaa cacttggtgg gctgagcaag attctccgtt 1860
ctgcttcctt gcgttctgct ttgagtacgc tggggtacag caccacggcc tgagctataa 1920
ctgctccctt ccgctggcgt ttgacgggtc ttgctctggc atccagcact tctccgcgat 1980
gctccgagat gaggtaggtg gtcgcgcggt taacttgctt cctagtgaaa ccgttcagga 2040
catctacggg attgttgcta agaaagtcaa cgagattcta caagcagacg caatcaatgg 2100
gaccgataac gaagtagtta ccgtgaccga tgagaacact ggtgaaatct ctgagaaagt 2160
caagctgggc actaaggcac tggctggtca atggctggct tacggtgtta ctcgcagtgt 2220
gactaagcgt tcagtcatga cgctggctta cgggtccaaa gagttcggct tccgtcaaca 2280
agtgctggaa gataccattc agccagctat tgattccggc aagggtctga tgttcactca 2340
gccgaatcag gctgctggat acatggctaa gctgatttgg gaatctgtga gcgtgacggt 2400
ggtagctgcg gttgaagcaa tgaactggct taagtctgct gctaagctgc tggctgctga 2460
ggtcaaagat aagaagactg gagagattct tcgcaagcgt tgcgctgtgc attgggtaac 2520
tcctgatggt ttccctgtgt ggcaggaata caagaagcct attcagacgc gcttgaacct 2580
gatgttcctc ggtcagttcc gcttacagcc taccattaac accaacaaag atagcgagat 2640
tgatgcacac aaacaggagt ctggtatcgc tcctaacttt gtacacagcc aagacggtag 2700
ccaccttcgt aagactgtag tgtgggcaca cgagaagtac ggaatcgaat cttttgcact 2760
gattcacgac tccttcggta cgattccggc tgacgctgcg aacctgttca aagcagtgcg 2820
cgaaactatg gttgacacat atgagtcttg tgatgtactg gctgatttct acgaccagtt 2880
cgctgaccag ttgcacgagt ctcaattgga caaaatgcca gcacttccgg ctaaaggtaa 2940
cttgaacctc cgtgacatct tagagtcgga cttcgcgttc gcgtaaggat ccggcaagac 3000
tggccccgct tggcaacgca acagtgagcc cctccctagt gtgtttgggg atgtgactat 3060
gtattcgtgt gttggccaac gggtcaaccc gaacagattg atacccgcct tggcatttcc 3120
tgtcagaatg taacgtcagt tgatggtact 3150
<210> 130
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий полинуклеотид”
<220>
<221> модифицированное_основание
<222> (23)..(42)
<223> a, c, t, g, неизвестный или другой
<400> 130
gaaattaata cgactcacta tannnnnnnn nnnnnnnnnn nngttttaga gctagaaata 60
gcaagttaaa ataaggctag tccgttatca acttgaaaaa gtggcaccga gtcggtgctt 120
ttttt 125
<210> 131
<211> 8452
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий полинуклеотид”
<400> 131
tgcggtattt cacaccgcat caggtggcac ttttcgggga aatgtgcgcg gaacccctat 60
ttgtttattt ttctaaatac attcaaatat gtatccgctc atgagattat caaaaaggat 120
cttcacctag atccttttaa attaaaaatg aagttttaaa tcaatctaaa gtatatatga 180
gtaaacttgg tctgacagtt accaatgctt aatcagtgag gcacctatct cagcgatctg 240
tctatttcgt tcatccatag ttgcctgact ccccgtcgtg tagataacta cgatacggga 300
gggcttacca tctggcccca gtgctgcaat gataccgcga gacccacgct caccggctcc 360
agatttatca gcaataaacc agccagccgg aagggccgag cgcagaagtg gtcctgcaac 420
tttatccgcc tccatccagt ctattaattg ttgccgggaa gctagagtaa gtagttcgcc 480
agttaatagt ttgcgcaacg ttgttgccat tgctacaggc atcgtggtgt cacgctcgtc 540
gtttggtatg gcttcattca gctccggttc ccaacgatca aggcgagtta catgatcccc 600
catgttgtgc aaaaaagcgg ttagctcctt cggtcctccg atcgttgtca gaagtaagtt 660
ggccgcagtg ttatcactca tggttatggc agcactgcat aattctctta ctgtcatgcc 720
atccgtaaga tgcttttctg tgactggtga gtactcaacc aagtcattct gagaatagtg 780
tatgcggcga ccgagttgct cttgcccggc gtcaatacgg gataataccg cgccacatag 840
cagaacttta aaagtgctca tcattggaaa acgttcttcg gggcgaaaac tctcaaggat 900
cttaccgctg ttgagatcca gttcgatgta acccactcgt gcacccaact gatcttcagc 960
atcttttact ttcaccagcg tttctgggtg agcaaaaaca ggaaggcaaa atgccgcaaa 1020
aaagggaata agggcgacac ggaaatgttg aatactcata ctcttccttt ttcaatatta 1080
ttgaagcatt tatcagggtt attgtctcat gaccaaaatc ccttaacgtg agttttcgtt 1140
ccactgagcg tcagaccccg tagaaaagat caaaggatct tcttgagatc ctttttttct 1200
gcgcgtaatc tgctgcttgc aaacaaaaaa accaccgcta ccagcggtgg tttgtttgcc 1260
ggatcaagag ctaccaactc tttttccgaa ggtaactggc ttcagcagag cgcagatacc 1320
aaatactgtt cttctagtgt agccgtagtt aggccaccac ttcaagaact ctgtagcacc 1380
gcctacatac ctcgctctgc taatcctgtt accagtggct gttgccagtg gcgataagtc 1440
gtgtcttacc gggttggact caagacgata gttaccggat aaggcgcagc ggtcgggctg 1500
aacggggggt tcgtgcacac agcccagctt ggagcgaacg acctacaccg aactgagata 1560
cctacagcgt gagctatgag aaagcgccac gcttcccgaa gggagaaagg cggacaggta 1620
tccggtaagc ggcagggtcg gaacaggaga gcgcacgagg gagcttccag ggggaaacgc 1680
ctggtatctt tatagtcctg tcgggtttcg ccacctctga cttgagcgtc gatttttgtg 1740
atgctcgtca ggggggcgga gcctatggaa aaacgccagc aacgcggcct ttttacggtt 1800
cctggccttt tgctggcctt ttgctcacat gttctttcct gcgttatccc ctgattctgt 1860
ggataaccgt attaccgcct ttgagtgagc tgataccgct cgccgcagcc gaacgaccga 1920
gcgcagcgag tcagtgagcg aggaagcggt cgctgaggct tgacatgatt ggtgcgtatg 1980
tttgtatgaa gctacaggac tgatttggcg ggctatgagg gcgggggaag ctctggaagg 2040
gccgcgatgg ggcgcgcggc gtccagaagg cgccatacgg cccgctggcg gcacccatcc 2100
ggtataaaag cccgcgaccc cgaacggtga cctccacttt cagcgacaaa cgagcactta 2160
tacatacgcg actattctgc cgctatacat aaccactcag ctagcttaag atcccatcaa 2220
gcttgcatgc cgggcgcgcc agaaggagcg cagccaaacc aggatgatgt ttgatggggt 2280
atttgagcac ttgcaaccct tatccggaag ccccctggcc cacaaaggct aggcgccaat 2340
gcaagcagtt cgcatgcagc ccctggagcg gtgccctcct gataaaccgg ccagggggcc 2400
tatgttcttt acttttttac aagagaagtc actcaacatc ttaaaatggc caggtgagtc 2460
gacgagcaag cccggcggat caggcagcgt gcttgcagat ttgacttgca acgcccgcat 2520
tgtgtcgacg aaggcttttg gctcctctgt cgctgtctca agcagcatct aaccctgcgt 2580
cgccgtttcc atttgcagga gattcgaggt accatgtacc catacgatgt tccagattac 2640
gcttcgccga agaaaaagcg caaggtcgaa gcgtccgaca agaagtacag catcggcctg 2700
gacatcggca ccaactctgt gggctgggcc gtgatcaccg acgagtacaa ggtgcccagc 2760
aagaaattca aggtgctggg caacaccgac cggcacagca tcaagaagaa cctgatcgga 2820
gccctgctgt tcgacagcgg cgaaacagcc gaggccaccc ggctgaagag aaccgccaga 2880
agaagataca ccagacggaa gaaccggatc tgctatctgc aagagatctt cagcaacgag 2940
atggccaagg tggacgacag cttcttccac agactggaag agtccttcct ggtggaagag 3000
gataagaagc acgagcggca ccccatcttc ggcaacatcg tggacgaggt ggcctaccac 3060
gagaagtacc ccaccatcta ccacctgaga aagaaactgg tggacagcac cgacaaggcc 3120
gacctgcggc tgatctatct ggccctggcc cacatgatca agttccgggg ccacttcctg 3180
atcgagggcg acctgaaccc cgacaacagc gacgtggaca agctgttcat ccagctggtg 3240
cagacctaca accagctgtt cgaggaaaac cccatcaacg ccagcggcgt ggacgccaag 3300
gccatcctgt ctgccagact gagcaagagc agacggctgg aaaatctgat cgcccagctg 3360
cccggcgaga agaagaatgg cctgttcggc aacctgattg ccctgagcct gggcctgacc 3420
cccaacttca agagcaactt cgacctggcc gaggatgcca aactgcagct gagcaaggac 3480
acctacgacg acgacctgga caacctgctg gcccagatcg gcgaccagta cgccgacctg 3540
tttctggccg ccaagaacct gtccgacgcc atcctgctga gcgacatcct gagagtgaac 3600
accgagatca ccaaggcccc cctgagcgcc tctatgatca agagatacga cgagcaccac 3660
caggacctga ccctgctgaa agctctcgtg cggcagcagc tgcctgagaa gtacaaagag 3720
attttcttcg accagagcaa gaacggctac gccggctaca ttgacggcgg agccagccag 3780
gaagagttct acaagttcat caagcccatc ctggaaaaga tggacggcac cgaggaactg 3840
ctcgtgaagc tgaacagaga ggacctgctg cggaagcagc ggaccttcga caacggcagc 3900
atcccccacc agatccacct gggagagctg cacgccattc tgcggcggca ggaagatttt 3960
tacccattcc tgaaggacaa ccgggaaaag atcgagaaga tcctgacctt ccgcatcccc 4020
tactacgtgg gccctctggc caggggaaac agcagattcg cctggatgac cagaaagagc 4080
gaggaaacca tcaccccctg gaacttcgag gaagtggtgg acaagggcgc ttccgcccag 4140
agcttcatcg agcggatgac caacttcgat aagaacctgc ccaacgagaa ggtgctgccc 4200
aagcacagcc tgctgtacga gtacttcacc gtgtataacg agctgaccaa agtgaaatac 4260
gtgaccgagg gaatgagaaa gcccgccttc ctgagcggcg agcagaaaaa ggccatcgtg 4320
gacctgctgt tcaagaccaa ccggaaagtg accgtgaagc agctgaaaga ggactacttc 4380
aagaaaatcg agtgcttcga ctccgtggaa atctccggcg tggaagatcg gttcaacgcc 4440
tccctgggca cataccacga tctgctgaaa attatcaagg acaaggactt cctggacaat 4500
gaggaaaacg aggacattct ggaagatatc gtgctgaccc tgacactgtt tgaggacaga 4560
gagatgatcg aggaacggct gaaaacctat gcccacctgt tcgacgacaa agtgatgaag 4620
cagctgaagc ggcggagata caccggctgg ggcaggctga gccggaagct gatcaacggc 4680
atccgggaca agcagtccgg caagacaatc ctggatttcc tgaagtccga cggcttcgcc 4740
aacagaaact tcatgcagct gatccacgac gacagcctga cctttaaaga ggacatccag 4800
aaagcccagg tgtccggcca gggcgatagc ctgcacgagc acattgccaa tctggccggc 4860
agccccgcca ttaagaaggg catcctgcag acagtgaagg tggtggacga gctcgtgaaa 4920
gtgatgggcc ggcacaagcc cgagaacatc gtgatcgaaa tggccagaga gaaccagacc 4980
acccagaagg gacagaagaa cagccgcgag agaatgaagc ggatcgaaga gggcatcaaa 5040
gagctgggca gccagatcct gaaagaacac cccgtggaaa acacccagct gcagaacgag 5100
aagctgtacc tgtactacct gcagaatggg cgggatatgt acgtggacca ggaactggac 5160
atcaaccggc tgtccgacta cgatgtggac catatcgtgc ctcagagctt tctgaaggac 5220
gactccatcg acaacaaggt gctgaccaga agcgacaaga accggggcaa gagcgacaac 5280
gtgccctccg aagaggtcgt gaagaagatg aagaactact ggcggcagct gctgaacgcc 5340
aagctgatta cccagagaaa gttcgacaat ctgaccaagg ccgagagagg cggcctgagc 5400
gaactggata aggccggctt catcaagaga cagctggtgg aaacccggca gatcacaaag 5460
cacgtggcac agatcctgga ctcccggatg aacactaagt acgacgagaa tgacaagctg 5520
atccgggaag tgaaagtgat caccctgaag tccaagctgg tgtccgattt ccggaaggat 5580
ttccagtttt acaaagtgcg cgagatcaac aactaccacc acgcccacga cgcctacctg 5640
aacgccgtcg tgggaaccgc cctgatcaaa aagtacccta agctggaaag cgagttcgtg 5700
tacggcgact acaaggtgta cgacgtgcgg aagatgatcg ccaagagcga gcaggaaatc 5760
ggcaaggcta ccgccaagta cttcttctac agcaacatca tgaacttttt caagaccgag 5820
attaccctgg ccaacggcga gatccggaag cggcctctga tcgagacaaa cggcgaaacc 5880
ggggagatcg tgtgggataa gggccgggat tttgccaccg tgcggaaagt gctgagcatg 5940
ccccaagtga atatcgtgaa aaagaccgag gtgcagacag gcggcttcag caaagagtct 6000
atcctgccca agaggaacag cgataagctg atcgccagaa agaaggactg ggaccctaag 6060
aagtacggcg gcttcgacag ccccaccgtg gcctattctg tgctggtggt ggccaaagtg 6120
gaaaagggca agtccaagaa actgaagagt gtgaaagagc tgctggggat caccatcatg 6180
gaaagaagca gcttcgagaa gaatcccatc gactttctgg aagccaaggg ctacaaagaa 6240
gtgaaaaagg acctgatcat caagctgcct aagtactccc tgttcgagct ggaaaacggc 6300
cggaagagaa tgctggcctc tgccggcgaa ctgcagaagg gaaacgaact ggccctgccc 6360
tccaaatatg tgaacttcct gtacctggcc agccactatg agaagctgaa gggctccccc 6420
gaggataatg agcagaaaca gctgtttgtg gaacagcaca agcactacct ggacgagatc 6480
atcgagcaga tcagcgagtt ctccaagaga gtgatcctgg ccgacgctaa tctggacaaa 6540
gtgctgtccg cctacaacaa gcaccgggat aagcccatca gagagcaggc cgagaatatc 6600
atccacctgt ttaccctgac caatctggga gcccctgccg ccttcaagta ctttgacacc 6660
accatcgacc ggaagaggta caccagcacc aaagaggtgc tggacgccac cctgatccac 6720
cagagcatca ccggcctgta cgagacacgg atcgacctgt ctcagctggg aggcgacagc 6780
cccaagaaga agagaaaggt ggaggccagc taacatatga ttcgaatgtc tttcttgcgc 6840
tatgacactt ccagcaaaag gtagggcggg ctgcgagacg gcttcccggc gctgcatgca 6900
acaccgatga tgcttcgacc ccccgaagct ccttcggggc tgcatgggcg ctccgatgcc 6960
gctccagggc gagcgctgtt taaatagcca ggcccccgat tgcaaagaca ttatagcgag 7020
ctaccaaagc catattcaaa cacctagatc actaccactt ctacacaggc cactcgagct 7080
tgtgatcgca ctccgctaag ggggcgcctc ttcctcttcg tttcagtcac aacccgcaaa 7140
catgacacaa gaatccctgt tacttctcga ccgtattgat tcggatgatt cctacgcgag 7200
cctgcggaac gaccaggaat tctgggaggt gagtcgacga gcaagcccgg cggatcaggc 7260
agcgtgcttg cagatttgac ttgcaacgcc cgcattgtgt cgacgaaggc ttttggctcc 7320
tctgtcgctg tctcaagcag catctaaccc tgcgtcgccg tttccatttg cagccgctgg 7380
cccgccgagc cctggaggag ctcgggctgc cggtgccgcc ggtgctgcgg gtgcccggcg 7440
agagcaccaa ccccgtactg gtcggcgagc ccggcccggt gatcaagctg ttcggcgagc 7500
actggtgcgg tccggagagc ctcgcgtcgg agtcggaggc gtacgcggtc ctggcggacg 7560
ccccggtgcc ggtgccccgc ctcctcggcc gcggcgagct gcggcccggc accggagcct 7620
ggccgtggcc ctacctggtg atgagccgga tgaccggcac cacctggcgg tccgcgatgg 7680
acggcacgac cgaccggaac gcgctgctcg ccctggcccg cgaactcggc cgggtgctcg 7740
gccggctgca cagggtgccg ctgaccggga acaccgtgct caccccccat tccgaggtct 7800
tcccggaact gctgcgggaa cgccgcgcgg cgaccgtcga ggaccaccgc gggtggggct 7860
acctctcgcc ccggctgctg gaccgcctgg aggactggct gccggacgtg gacacgctgc 7920
tggccggccg cgaaccccgg ttcgtccacg gcgacctgca cgggaccaac atcttcgtgg 7980
acctggccgc gaccgaggtc accgggatcg tcgacttcac cgacgtctat gcgggagact 8040
cccgctacag cctggtgcaa ctgcatctca acgccttccg gggcgaccgc gagatcctgg 8100
ccgcgctgct cgacggggcg cagtggaagc ggaccgagga cttcgcccgc gaactgctcg 8160
ccttcacctt cctgcacgac ttcgaggtgt tcgaggagac cccgctggat ctctccggct 8220
tcaccgatcc ggaggaactg gcgcagttcc tctgggggcc gccggacacc gcccccggcg 8280
cctgataagg atccggcaag actggccccg cttggcaacg caacagtgag cccctcccta 8340
gtgtgtttgg ggatgtgact atgtattcgt gtgttggcca acgggtcaac ccgaacagat 8400
tgatacccgc cttggcattt cctgtcagaa tgtaacgtca gttgatggta ct 8452
<210> 132
<211> 27
<212> ДНК
<213> Homo sapiens
<400> 132
ccgtgccggg cggggagacc gccatgg 27
<210> 133
<211> 22
<212> ДНК
<213> Homo sapiens
<400> 133
ggcccggctg tggctgagga gc 22
<210> 134
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 134
cggtctcccg cccggcacgg 20
<210> 135
<211> 26
<212> ДНК
<213> Homo sapiens
<400> 135
gctcctcagc cacagccggg ccgggt 26
<210> 136
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 136
cgaccctgga aa 12
<210> 137
<211> 14
<212> ДНК
<213> Homo sapiens
<400> 137
ccccgccgcc accc 14
<210> 138
<211> 18
<212> ДНК
<213> Homo sapiens
<400> 138
tttccagggt cgccatgg 18
<210> 139
<211> 10
<212> ДНК
<213> Homo sapiens
<400> 139
ggcggcgggg 10
<210> 140
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 140
acccttgtta gccacctccc 20
<210> 141
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 141
gaacgcagtg ctcttcgaag 20
<210> 142
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 142
ctcacgccct gctccgtgta 20
<210> 143
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 143
ggcgacaact acttcctggt 20
<210> 144
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 144
ctcacgccct gctccgtgta 20
<210> 145
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 145
gggcgacaac tacttcctgg 20
<210> 146
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 146
cctcttcagg gccggggtgg 20
<210> 147
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 147
gaggacccag gtggaactgc 20
<210> 148
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 148
tcagctccag gcggtcctgg 20
<210> 149
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 149
agcagcagca gcagtggcag 20
<210> 150
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 150
tgggcaccgt cagctccagg 20
<210> 151
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 151
cagcagtggc agcggccacc 20
<210> 152
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 152
acctctcccc tggccctcat 20
<210> 153
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 153
ccaggaccgc ctggagctga 20
<210> 154
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 154
ccgtcagctc caggcggtcc 20
<210> 155
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 155
agcagcagca gcagtggcag 20
<210> 156
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 156
atgtgccaag caaagcctca 20
<210> 157
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 157
ttcggtcatg cccgtggatg 20
<210> 158
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 158
gtcgttgaaa ttcatcgtac 20
<210> 159
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 159
accacctgtg aagagtttcc 20
<210> 160
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 160
cgtcgttgaa attcatcgta 20
<210> 161
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 161
accacctgtg aagagtttcc 20
<210> 162
<211> 20
<212> ДНК
<213> Mus musculus
<400> 162
gaacgcagtg cttttcgagg 20
<210> 163
<211> 20
<212> ДНК
<213> Mus musculus
<400> 163
acccttgttg gccacctccc 20
<210> 164
<211> 20
<212> ДНК
<213> Mus musculus
<400> 164
ggtgacaact actatctggt 20
<210> 165
<211> 20
<212> ДНК
<213> Mus musculus
<400> 165
ctcacaccct gctccgtgta 20
<210> 166
<211> 20
<212> ДНК
<213> Mus musculus
<400> 166
gggtgacaac tactatctgg 20
<210> 167
<211> 20
<212> ДНК
<213> Mus musculus
<400> 167
ctcacaccct gctccgtgta 20
<210> 168
<211> 20
<212> ДНК
<213> Mus musculus
<400> 168
cgagaacgca gtgcttttcg 20
<210> 169
<211> 20
<212> ДНК
<213> Mus musculus
<400> 169
acccttgttg gccacctccc 20
<210> 170
<211> 20
<212> ДНК
<213> Mus musculus
<400> 170
atgagccaag caaatcctca 20
<210> 171
<211> 20
<212> ДНК
<213> Mus musculus
<400> 171
ttccgtcatg cccgtggaca 20
<210> 172
<211> 20
<212> ДНК
<213> Mus musculus
<400> 172
cttcgttgaa aaccattgta 20
<210> 173
<211> 20
<212> ДНК
<213> Mus musculus
<400> 173
ccacctctga agagtttcct 20
<210> 174
<211> 20
<212> ДНК
<213> Mus musculus
<400> 174
cttcgttgaa aaccattgta 20
<210> 175
<211> 20
<212> ДНК
<213> Mus musculus
<400> 175
accacctctg aagagtttcc 20
<210> 176
<211> 20
<212> ДНК
<213> Mus musculus
<400> 176
cttccactca ctctgcgatt 20
<210> 177
<211> 20
<212> ДНК
<213> Mus musculus
<400> 177
accatgtctc agtgtcaagc 20
<210> 178
<211> 20
<212> ДНК
<213> Mus musculus
<400> 178
ggcggcaaca gcggcaacag 20
<210> 179
<211> 20
<212> ДНК
<213> Mus musculus
<400> 179
actgctctgc gtggctgcgg 20
<210> 180
<211> 20
<212> ДНК
<213> Mus musculus
<400> 180
ccgcagccac gcagagcagt 20
<210> 181
<211> 20
<212> ДНК
<213> Mus musculus
<400> 181
gcacctctcc tcgccccgat 20
<210> 182
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 182
gagggcctat ttcccatgat tcc 23
<210> 183
<211> 126
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<220>
<221> модифицированное_основание
<222> (84)..(102)
<223> a, c, t, g, неизвестный или другой
<400> 183
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacnnnnnnn nnnnnnnnnn nnccggtgtt tcgtcctttc 120
cacaag 126
<210> 184
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<220>
<221> модифицированное_основание
<222> (6)..(24)
<223> a, c, t, g, неизвестный или другой
<400> 184
caccgnnnnn nnnnnnnnnn nnnn 24
<210> 185
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<220>
<221> модифицированное_основание
<222> (5)..(23)
<223> a, c, t, g, неизвестный или другой
<400> 185
aaacnnnnnn nnnnnnnnnn nnnc 24
<210> 186
<211> 126
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 186
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacccctagt cattggaggt gaccggtgtt tcgtcctttc 120
cacaag 126
<210> 187
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 187
caccgtcacc tccaatgact aggg 24
<210> 188
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 188
aaacccctag tcattggagg tgac 24
<210> 189
<211> 192
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 189
cagaagaaga agggctccca tcacatcaac cggtggcgca ttgccacgaa gcaggccaat 60
ggggaggaca tcgatgtcac ctccaatgac aagcttgcta gcggtgggca accacaaacc 120
cacgagggca gagtgctgct tgctgctggc caggcccctg cgtgggccca agctggactc 180
tggccactcc ct 192
<210> 190
<211> 192
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 190
agggagtggc cagagtccag cttgggccca cgcaggggcc tggccagcag caagcagcac 60
tctgccctcg tgggtttgtg gttgcccacc gctagcaagc ttgtcattgg aggtgacatc 120
gatgtcctcc ccattggcct gcttcgtggc aatgcgccac cggttgatgt gatgggagcc 180
cttcttcttc tg 192
<210> 191
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 191
ccatcccctt ctgtgaatgt 20
<210> 192
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 192
ggagattgga gacacggaga 20
<210> 193
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 193
ggctccctgg gttcaaagta 20
<210> 194
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 194
agaggggtct ggatgtcgta a 21
<210> 195
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 195
cgccagggtt ttcccagtca cgac 24
<210> 196
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 196
gagggtctcg tccttgcggc cgcgctagcg agggcctatt tcccatgatt c 51
<210> 197
<211> 133
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<220>
<221> модифицированное_основание
<222> (95)..(114)
<223> a, c, t, g, неизвестный или другой
<400> 197
ctcggtctcg gtaaaaaagc accgactcgg tgccactttt tcaagttgat aacggactag 60
ccttatttta acttgctatt tctagctcta aaacnnnnnn nnnnnnnnnn nnnnggtgtt 120
tcgtcctttc cac 133
<210> 198
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 198
gagggtctct ttaccggtga gggcctattt cccatgattc c 41
<210> 199
<211> 133
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<220>
<221> модифицированное_основание
<222> (95)..(114)
<223> a, c, t, g, неизвестный или другой
<400> 199
ctcggtctcc tcaaaaaagc accgactcgg tgccactttt tcaagttgat aacggactag 60
ccttatttta acttgctatt tctagctcta aaacnnnnnn nnnnnnnnnn nnnnggtgtt 120
tcgtcctttc cac 133
<210> 200
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 200
gagggtctct ttgagctcga gggcctattt cccatgattc 40
<210> 201
<211> 133
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<220>
<221> модифицированное_основание
<222> (96)..(115)
<223> a, c, t, g, неизвестный или другой
<400> 201
ctcggtctcg cgtaaaaaag caccgactcg gtgccacttt ttcaagttga taacggacta 60
gccttatttt aacttgctat ttctagctct aaaacnnnnn nnnnnnnnnn nnnnnggtgt 120
ttcgtccttt cca 133
<210> 202
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 202
gagggtctct tacgcgtgtg tctagac 27
<210> 203
<211> 98
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 203
ctcggtctca aggacaggga agggagcagt ggttcacgcc tgtaatccca gcaatttggg 60
aggccaaggt gggtagatca cctgagatta ggagttgc 98
<210> 204
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 204
cctgtccttg cggccgcgct agcgagggcc 30
<210> 205
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 205
cacgcggccg caaggacagg gaagggagca g 31
<210> 206
<211> 327
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий полипептид”
<400> 206
Met Val Ser Lys Gly Glu Glu Leu Phe Thr Gly Val Val Pro Ile Leu
1 5 10 15
Val Glu Leu Asp Gly Asp Val Asn Gly His Lys Phe Ser Val Ser Gly
20 25 30
Glu Gly Glu Gly Asp Ala Thr Tyr Gly Lys Leu Thr Leu Lys Phe Ile
35 40 45
Cys Thr Thr Gly Lys Leu Pro Val Pro Trp Pro Thr Leu Val Thr Thr
50 55 60
Leu Thr Tyr Gly Val Gln Cys Phe Ser Arg Tyr Pro Asp His Met Lys
65 70 75 80
Gln His Asp Phe Phe Lys Ser Ala Met Pro Glu Gly Tyr Val Gln Glu
85 90 95
Arg Thr Ile Phe Phe Lys Asp Asp Gly Asn Tyr Lys Thr Arg Ala Glu
100 105 110
Val Lys Phe Glu Gly Asp Thr Leu Val Asn Arg Ile Glu Leu Lys Gly
115 120 125
Ile Asp Phe Lys Glu Asp Gly Asn Ile Leu Gly His Lys Leu Glu Tyr
130 135 140
Asn Tyr Asn Ser His Asn Val Tyr Ile Met Ala Asp Lys Gln Lys Asn
145 150 155 160
Gly Ile Lys Val Asn Phe Lys Ile Arg His Asn Ile Glu Asp Gly Ser
165 170 175
Val Gln Leu Ala Asp His Tyr Gln Gln Asn Thr Pro Ile Gly Asp Gly
180 185 190
Pro Val Leu Leu Pro Asp Asn His Tyr Leu Ser Thr Gln Ser Ala Leu
195 200 205
Ser Lys Asp Pro Asn Glu Lys Arg Asp His Met Val Leu Leu Glu Phe
210 215 220
Val Thr Ala Ala Gly Ile Thr Leu Gly Met Asp Glu Leu Tyr Lys Ser
225 230 235 240
Gly Leu Arg Ser Arg Glu Glu Glu Glu Glu Thr Asp Ser Arg Met Pro
245 250 255
His Leu Asp Ser Pro Gly Ser Ser Gln Pro Arg Arg Ser Phe Leu Ser
260 265 270
Arg Val Ile Arg Ala Ala Leu Pro Leu Gln Leu Leu Leu Leu Leu Leu
275 280 285
Leu Leu Leu Ala Cys Leu Leu Pro Ala Ser Glu Asp Asp Tyr Ser Cys
290 295 300
Thr Gln Ala Asn Asn Phe Ala Arg Ser Phe Tyr Pro Met Leu Arg Tyr
305 310 315 320
Thr Asn Gly Pro Pro Pro Thr
325
<210> 207
<211> 3243
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий полинуклеотид”
<400> 207
accggtgcca ccatgtaccc atacgatgtt ccagattacg cttcgccgaa gaaaaagcgc 60
aaggtcgaag cgtccatgaa aaggaactac attctggggc tggacatcgg gattacaagc 120
gtggggtatg ggattattga ctatgaaaca agggacgtga tcgacgcagg cgtcagactg 180
ttcaaggagg ccaacgtgga aaacaatgag ggacggagaa gcaagagggg agccaggcgc 240
ctgaaacgac ggagaaggca cagaatccag agggtgaaga aactgctgtt cgattacaac 300
ctgctgaccg accattctga gctgagtgga attaatcctt atgaagccag ggtgaaaggc 360
ctgagtcaga agctgtcaga ggaagagttt tccgcagctc tgctgcacct ggctaagcgc 420
cgaggagtgc ataacgtcaa tgaggtggaa gaggacaccg gcaacgagct gtctacaaag 480
gaacagatct cacgcaatag caaagctctg gaagagaagt atgtcgcaga gctgcagctg 540
gaacggctga agaaagatgg cgaggtgaga gggtcaatta ataggttcaa gacaagcgac 600
tacgtcaaag aagccaagca gctgctgaaa gtgcagaagg cttaccacca gctggatcag 660
agcttcatcg atacttatat cgacctgctg gagactcgga gaacctacta tgagggacca 720
ggagaaggga gccccttcgg atggaaagac atcaaggaat ggtacgagat gctgatggga 780
cattgcacct attttccaga agagctgaga agcgtcaagt acgcttataa cgcagatctg 840
tacaacgccc tgaatgacct gaacaacctg gtcatcacca gggatgaaaa cgagaaactg 900
gaatactatg agaagttcca gatcatcgaa aacgtgttta agcagaagaa aaagcctaca 960
ctgaaacaga ttgctaagga gatcctggtc aacgaagagg acatcaaggg ctaccgggtg 1020
acaagcactg gaaaaccaga gttcaccaat ctgaaagtgt atcacgatat taaggacatc 1080
acagcacgga aagaaatcat tgagaacgcc gaactgctgg atcagattgc taagatcctg 1140
actatctacc agagctccga ggacatccag gaagagctga ctaacctgaa cagcgagctg 1200
acccaggaag agatcgaaca gattagtaat ctgaaggggt acaccggaac acacaacctg 1260
tccctgaaag ctatcaatct gattctggat gagctgtggc atacaaacga caatcagatt 1320
gcaatcttta accggctgaa gctggtccca aaaaaggtgg acctgagtca gcagaaagag 1380
atcccaacca cactggtgga cgatttcatt ctgtcacccg tggtcaagcg gagcttcatc 1440
cagagcatca aagtgatcaa cgccatcatc aagaagtacg gcctgcccaa tgatatcatt 1500
atcgagctgg ctagggagaa gaacagcaag gacgcacaga agatgatcaa tgagatgcag 1560
aaacgaaacc ggcagaccaa tgaacgcatt gaagagatta tccgaactac cgggaaagag 1620
aacgcaaagt acctgattga aaaaatcaag ctgcacgata tgcaggaggg aaagtgtctg 1680
tattctctgg aggccatccc cctggaggac ctgctgaaca atccattcaa ctacgaggtc 1740
gatcatatta tccccagaag cgtgtccttc gacaattcct ttaacaacaa ggtgctggtc 1800
aagcaggaag agaactctaa aaagggcaat aggactcctt tccagtacct gtctagttca 1860
gattccaaga tctcttacga aacctttaaa aagcacattc tgaatctggc caaaggaaag 1920
ggccgcatca gcaagaccaa aaaggagtac ctgctggaag agcgggacat caacagattc 1980
tccgtccaga aggattttat taaccggaat ctggtggaca caagatacgc tactcgcggc 2040
ctgatgaatc tgctgcgatc ctatttccgg gtgaacaatc tggatgtgaa agtcaagtcc 2100
atcaacggcg ggttcacatc ttttctgagg cgcaaatgga agtttaaaaa ggagcgcaac 2160
aaagggtaca agcaccatgc cgaagatgct ctgattatcg caaatgccga cttcatcttt 2220
aaggagtgga aaaagctgga caaagccaag aaagtgatgg agaaccagat gttcgaagag 2280
aagcaggccg aatctatgcc cgaaatcgag acagaacagg agtacaagga gattttcatc 2340
actcctcacc agatcaagca tatcaaggat ttcaaggact acaagtactc tcaccgggtg 2400
gataaaaagc ccaacagaga gctgatcaat gacaccctgt atagtacaag aaaagacgat 2460
aaggggaata ccctgattgt gaacaatctg aacggactgt acgacaaaga taatgacaag 2520
ctgaaaaagc tgatcaacaa aagtcccgag aagctgctga tgtaccacca tgatcctcag 2580
acatatcaga aactgaagct gattatggag cagtacggcg acgagaagaa cccactgtat 2640
aagtactatg aagagactgg gaactacctg accaagtata gcaaaaagga taatggcccc 2700
gtgatcaaga agatcaagta ctatgggaac aagctgaatg cccatctgga catcacagac 2760
gattacccta acagtcgcaa caaggtggtc aagctgtcac tgaagccata cagattcgat 2820
gtctatctgg acaacggcgt gtataaattt gtgactgtca agaatctgga tgtcatcaaa 2880
aaggagaact actatgaagt gaatagcaag tgctacgaag aggctaaaaa gctgaaaaag 2940
attagcaacc aggcagagtt catcgcctcc ttttacaaca acgacctgat taagatcaat 3000
ggcgaactgt atagggtcat cggggtgaac aatgatctgc tgaaccgcat tgaagtgaat 3060
atgattgaca tcacttaccg agagtatctg gaaaacatga atgataagcg cccccctcga 3120
attatcaaaa caattgcctc taagactcag agtatcaaaa agtactcaac cgacattctg 3180
ggaaacctgt atgaggtgaa gagcaaaaag caccctcaga ttatcaaaaa gggctaagaa 3240
ttc 3243
<210> 208
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 208
cgcacgcgta attcgaacgc tgacgtcatc 30
<210> 209
<211> 130
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<220>
<221> модифицированное_основание
<222> (92)..(110)
<223> a, c, t, g, неизвестный или другой
<400> 209
cacacgcgta aaaaagcacc gactcggtgc cactttttca agttgataac ggactagcct 60
tattttaact tgctatttct agctctaaaa cnnnnnnnnn nnnnnnnnnn cggtgtttcg 120
tcctttccac 130
<210> 210
<211> 23
<212> ДНК
<213> Escherichia coli
<400> 210
tgcgaatacg cccacgcgat ggg 23
<210> 211
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 211
gtgtctagac tgcagagggc cctg 24
<210> 212
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 212
gtgtcgtgcc tgagagcgca gtcgagaa 28
<210> 213
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 213
gagaagctta gctgaatggg gtccgcctc 29
<210> 214
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 214
ctcaccggtg cgcgcaaccg atgccgggac c 31
<210> 215
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 215
gagaagcttg gcgaaatgat ttgctgcaga tg 32
<210> 216
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 216
ctcaccggtg cgcgcgtcgc ctccccctcc gc 32
<210> 217
<211> 134
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий полинуклеотид”
<400> 217
agcttcgcgc cgggaggagg ggggacgcag tgggcggagc ggagacagca ccttcggaga 60
taatcctttc tcctgccgca gagcagagga gcggcgggag aggaacactt ctcccaggct 120
ttagcagagc cgga 134
<210> 218
<211> 134
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий полинуклеотид”
<400> 218
ccggtccggc tctgctaaag cctgggagaa gtgttcctct cccgccgctc ctctgctctg 60
cggcaggaga aaggattatc tccgaaggtg ctgtctccgc tccgcccact gcgtcccccc 120
tcctcccggc gcga 134
<210> 219
<211> 55
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 219
aattcaataa aagatcttta ttttcattag atctgtgtgt tggttttttg tgtgc 55
<210> 220
<211> 55
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 220
ggccgcacac aaaaaaccaa cacacagatc taatgaaaat aaagatcttt tattg 55
<210> 221
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 221
ggagctggag ctgttcacgt tgg 23
<210> 222
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 222
cgggcagcag atgttcgcgt agg 23
<210> 223
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 223
agggcttgag atgttcgggc tgg 23
<210> 224
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 224
ccggctgggg ctgtcctcgc tag 23
<210> 225
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 225
cggggtgcag ctgctcacgc cag 23
<210> 226
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 226
ctggcgggag ctggtcgcgt gag 23
<210> 227
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 227
tgagcatggg ccgctggcgg tgg 23
<210> 228
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 228
atggcatagg ccgctgacag agg 23
<210> 229
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 229
ttggcatggt gagctggcgg ggg 23
<210> 230
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 230
tgggcagggg tctctgaggg cag 23
<210> 231
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 231
ttggcatggg tctcttacca agg 23
<210> 232
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 232
acatggttcc agtgggtatg tag 23
<210> 233
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 233
ggaggtgggc agcgggtatg tag 23
<210> 234
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 234
agaaggtccc cgcgggcatg gag 23
<210> 235
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 235
ggagggaacc agccggtatg ggg 23
<210> 236
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 236
agagagtggc agtgggtaag cag 23
<210> 237
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 237
agaggtggcc agcgggcagg aag 23
<210> 238
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 238
tgagggggcc agctgggatg cag 23
<210> 239
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 239
ggtctcatgt gtggcactca 20
<210> 240
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 240
atccctcctc agagggtcag c 21
<210> 241
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 241
ttcgggcata gcatggtctt cc 22
<210> 242
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 242
gttctgagcc gcacagtttg g 21
<210> 243
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 243
tgtccaacct tcaggcaagg 20
<210> 244
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 244
tacctcatgc acagctagca cc 22
<210> 245
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 245
gttctatttc agagggctga tccc 24
<210> 246
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 246
ggataagaag ggacaataca gg 22
<210> 247
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 247
gccggggtct cgttcagagc t 21
<210> 248
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 248
cctgtctctc tgtcctaggg ctcc 24
<210> 249
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 249
cccacaggaa acaatgaagg gagac 25
<210> 250
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 250
ccctgacacc agctgttcag cac 23
<210> 251
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 251
gagcaggcag agccgagcaa g 21
<210> 252
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 252
gggtcttgtt gtgagtaggg tgtg 24
<210> 253
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 253
cctggaatac tatttccacg ccg 23
<210> 254
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 254
gcagcacact ccaccctcac at 22
<210> 255
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 255
cggcgtcacg tgacctgagt aac 23
<210> 256
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 256
gtgtctgcct cgctctgctg c 21
<210> 257
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 257
ctatctgaaa tccaccacct tagacgc 27
<210> 258
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 258
gcctgagggg gccagaggt 19
<210> 259
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 259
gggactcccc gggtggtg 18
<210> 260
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 260
gaccctgtgt ttcaagtctc tctg 24
<210> 261
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 261
ggccatccag tacattcaat acg 23
<210> 262
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 262
gcagaagccg tgactcacag ca 22
<210> 263
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 263
cttgtgcttg tgattctgtc cttactgc 28
<210> 264
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 264
cgagaagtcg atgcagacac ttcaa 25
<210> 265
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 265
gctgaagact ggcgagcaca gct 23
<210> 266
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 266
gacctgaatg ttgtggctga gagtcc 26
<210> 267
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 267
ccctcacgtt cctgtccagc aa 22
<210> 268
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 268
ctaccgcctg cggacatggt 20
<210> 269
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 269
ccgtttgctg atgtagtagg ggtcc 25
<210> 270
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 270
catccttcgt gtctgaggac tggtc 25
<210> 271
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 271
ctctgggtga ccacacacga tgc 23
<210> 272
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 272
ggagagcgtc cgccaggag 19
<210> 273
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 273
gaagctctct taactactgt tc 22
<210> 274
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 274
caggccctag cagcgagcag 20
<210> 275
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 275
ggaaggggct ttcctccgag c 21
<210> 276
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 276
gctccgaccc tgctctccca 20
<210> 277
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 277
cctgttcatc aggctcgtag ccc 23
<210> 278
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 278
cgattgctgg cttgccttga g 21
<210> 279
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 279
ggttcgcgtc cgcccgcgtg at 22
<210> 280
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 280
gagaggtggt cctgtcgcct atg 23
<210> 281
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 281
cccagcaggt cacagctgac atc 23
<210> 282
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 282
agcacagtat gtattctata aaataatacg ac 32
<210> 283
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 283
gtgggagggg acagagacca tg 22
<210> 284
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 284
ccttacctgt tcctcttcct tatccagc 28
<210> 285
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 285
atacccagtc cacatccctg cc 22
<210> 286
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 286
cctctgcatc tccctcagga agtatt 26
<210> 287
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 287
gcctcctgtc cccaggtccc 20
<210> 288
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 288
cactaggctt gggctgccct ct 22
<210> 289
<211> 102
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий полинуклеотид”
<400> 289
gttttagagc tatgctgttt tgaatggtcc caaaacggaa gggcctgagt ccgagcagaa 60
gaagaagttt tagagctatg ctgttttgaa tggtcccaaa ac 102
<210> 290
<211> 100
<212> ДНК
<213> Homo sapiens
<400> 290
cggaggacaa agtacaaacg gcagaagctg gaggaggaag ggcctgagtc cgagcagaag 60
aagaagggct cccatcacat caaccggtgg cgcattgcca 100
<210> 291
<211> 50
<212> ДНК
<213> Homo sapiens
<400> 291
agctggagga ggaagggcct gagtccgagc agaagaagaa gggctcccac 50
<210> 292
<211> 30
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 292
gaguccgagc agaagaagaa guuuuagagc 30
<210> 293
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 293
agctggagga ggaagggcct gagtccgagc agaagagaag ggctcccat 49
<210> 294
<211> 53
<212> ДНК
<213> Homo sapiens
<400> 294
ctggaggagg aagggcctga gtccgagcag aagaagaagg gctcccatca cat 53
<210> 295
<211> 52
<212> ДНК
<213> Homo sapiens
<400> 295
ctggaggagg aagggcctga gtccgagcag aagagaaggg ctcccatcac at 52
<210> 296
<211> 54
<212> ДНК
<213> Homo sapiens
<400> 296
ctggaggagg aagggcctga gtccgagcag aagaaagaag ggctcccatc acat 54
<210> 297
<211> 50
<212> ДНК
<213> Homo sapiens
<400> 297
ctggaggagg aagggcctga gtccgagcag aagaagggct cccatcacat 50
<210> 298
<211> 47
<212> ДНК
<213> Homo sapiens
<400> 298
ctggaggagg aagggcctga gcccgagcag aagggctccc atcacat 47
<210> 299
<211> 48
<212> ДНК
<213> Homo sapiens
<400> 299
ctggaggagg aagggcctga gtccgagcag aagaagaagg gctcccat 48
<210> 300
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 300
gaguccgagc agaagaagau 20
<210> 301
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 301
gaguccgagc agaagaagua 20
<210> 302
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 302
gaguccgagc agaagaacaa 20
<210> 303
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 303
gaguccgagc agaagaugaa 20
<210> 304
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 304
gaguccgagc agaaguagaa 20
<210> 305
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 305
gaguccgagc agaugaagaa 20
<210> 306
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 306
gaguccgagc acaagaagaa 20
<210> 307
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 307
gaguccgagg agaagaagaa 20
<210> 308
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 308
gaguccgugc agaagaagaa 20
<210> 309
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 309
gagucggagc agaagaagaa 20
<210> 310
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 310
gagaccgagc agaagaagaa 20
<210> 311
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 311
aatgacaagc ttgctagcgg tggg 24
<210> 312
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 312
aaaacggaag ggcctgagtc cgagcagaag aagaagttt 39
<210> 313
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 313
aaacaggggc cgagattggg tgttcagggc agaggtttt 39
<210> 314
<211> 38
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 314
aaaacggaag ggcctgagtc cgagcagaag aagaagtt 38
<210> 315
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 315
aacggaggga ggggcacaga tgagaaactc agggttttag 40
<210> 316
<211> 38
<212> ДНК
<213> Homo sapiens
<400> 316
agcccttctt cttctgctcg gactcaggcc cttcctcc 38
<210> 317
<211> 40
<212> ДНК
<213> Homo sapiens
<400> 317
cagggaggga ggggcacaga tgagaaactc aggaggcccc 40
<210> 318
<211> 80
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 318
ggcaatgcgc caccggttga tgtgatggga gcccttctag gaggccccca gagcagccac 60
tggggcctca acactcaggc 80
<210> 319
<211> 33
<212> ДНК
<213> Homo sapiens
<400> 319
catcgatgtc ctccccattg gcctgcttcg tgg 33
<210> 320
<211> 33
<212> ДНК
<213> Homo sapiens
<400> 320
ttcgtggcaa tgcgccaccg gttgatgtga tgg 33
<210> 321
<211> 33
<212> ДНК
<213> Homo sapiens
<400> 321
tcgtggcaat gcgccaccgg ttgatgtgat ggg 33
<210> 322
<211> 33
<212> ДНК
<213> Homo sapiens
<400> 322
tccagcttct gccgtttgta ctttgtcctc cgg 33
<210> 323
<211> 33
<212> ДНК
<213> Homo sapiens
<400> 323
ggagggaggg gcacagatga gaaactcagg agg 33
<210> 324
<211> 33
<212> ДНК
<213> Homo sapiens
<400> 324
aggggccgag attgggtgtt cagggcagag agg 33
<210> 325
<211> 33
<212> ДНК
<213> Mus musculus
<400> 325
caagcactga gtgccattag ctaaatgcat agg 33
<210> 326
<211> 33
<212> ДНК
<213> Mus musculus
<400> 326
aatgcatagg gtaccaccca caggtgccag ggg 33
<210> 327
<211> 33
<212> ДНК
<213> Mus musculus
<400> 327
acacacatgg gaaagcctct gggccaggaa agg 33
<210> 328
<211> 37
<212> ДНК
<213> Homo sapiens
<400> 328
ggaggaggta gtatacagaa acacagagaa gtagaat 37
<210> 329
<211> 37
<212> ДНК
<213> Homo sapiens
<400> 329
agaatgtaga ggagtcacag aaactcagca ctagaaa 37
<210> 330
<211> 98
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 330
ggacgaaaca ccggaaccat tcaaaacagc atagcaagtt aaaataaggc tagtccgtta 60
tcaacttgaa aaagtggcac cgagtcggtg cttttttt 98
<210> 331
<211> 186
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий полинуклеотид”
<400> 331
ggacgaaaca ccggtagtat taagtattgt tttatggctg ataaatttct ttgaatttct 60
ccttgattat ttgttataaa agttataaaa taatcttgtt ggaaccattc aaaacagcat 120
agcaagttaa aataaggcta gtccgttatc aacttgaaaa agtggcaccg agtcggtgct 180
tttttt 186
<210> 332
<211> 95
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 332
gggttttaga gctatgctgt tttgaatggt cccaaaacgg gtcttcgaga agacgtttta 60
gagctatgct gttttgaatg gtcccaaaac ttttt 95
<210> 333
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (5)..(34)
<223> a, c, t, g, неизвестный или другой
<400> 333
aaacnnnnnn nnnnnnnnnn nnnnnnnnnn nnnngt 36
<210> 334
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (7)..(36)
<223> a, c, t, g, неизвестный или другой
<400> 334
taaaacnnnn nnnnnnnnnn nnnnnnnnnn nnnnnn 36
<210> 335
<211> 84
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 335
gtggaaagga cgaaacaccg ggtcttcgag aagacctgtt ttagagctag aaatagcaag 60
ttaaaataag gctagtccgt tttt 84
<210> 336
<211> 46
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(19)
<223> a, c, u, g, неизвестный или другой
<400> 336
nnnnnnnnnn nnnnnnnnng uuauuguacu cucaagauuu auuuuu 46
<210> 337
<211> 91
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 337
guuacuuaaa ucuugcagaa gcuacaaaga uaaggcuuca ugccgaaauc aacacccugu 60
cauuuuaugg caggguguuu ucguuauuua a 91
<210> 338
<211> 70
<212> ДНК
<213> Homo sapiens
<400> 338
ttttctagtg ctgagtttct gtgactcctc tacattctac ttctctgtgt ttctgtatac 60
tacctcctcc 70
<210> 339
<211> 122
<212> ДНК
<213> Homo sapiens
<400> 339
ggaggaaggg cctgagtccg agcagaagaa gaagggctcc catcacatca accggtggcg 60
cattgccacg aagcaggcca atggggagga catcgatgtc acctccaatg actagggtgg 120
gc 122
<210> 340
<211> 48
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (3)..(32)
<223> a, c, u, g, неизвестный или другой
<400> 340
acnnnnnnnn nnnnnnnnnn nnnnnnnnnn nnguuuuaga gcuaugcu 48
<210> 341
<211> 67
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> источник
<223> /примечание=“Описание комбинированной молекулы ДНК/РНК:
Синтетитческий олигонуклеотид”
<400> 341
agcauagcaa guuaaaauaa ggctaguccg uuaucaacuu gaaaaagugg caccgagucg 60
gugcuuu 67
<210> 342
<211> 62
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<400> 342
nnnnnnnnnn nnnnnnnnnn guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cg 62
<210> 343
<211> 73
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 343
tgaatggtcc caaaacggaa gggcctgagt ccgagcagaa gaagaagttt tagagctatg 60
ctgttttgaa tgg 73
<210> 344
<211> 69
<212> ДНК
<213> Homo sapiens
<400> 344
ctggtcttcc acctctctgc cctgaacacc caatctcggc ccctctcgcc accctcctgc 60
atttctgtt 69
<210> 345
<211> 138
<212> ДНК
<213> Mus musculus
<400> 345
acccaagcac tgagtgccat tagctaaatg catagggtac cacccacagg tgccaggggc 60
ctttcccaaa gttcccagcc ccttctccaa cctttcctgg cccagaggct ttcccatgtg 120
tgtggctgga ccctttga 138
<210> 346
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 346
aaaaccaccc ttctctctgg c 21
<210> 347
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 347
ggagattgga gacacggaga g 21
<210> 348
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 348
ctggaaagcc aatgcctgac 20
<210> 349
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 349
ggcagcaaac tccttgtcct 20
<210> 350
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 350
gtgctttgca gaggcctacc 20
<210> 351
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 351
cctggagcgc atgcagtagt 20
<210> 352
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 352
accttctgtg tttccaccat tc 22
<210> 353
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 353
ttggggagtg cacagacttc 20
<210> 354
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетический зонд”
<400> 354
tagctctaaa acttcttctt ctgctcggac 30
<210> 355
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетический зонд”
<400> 355
ctagccttat tttaacttgc tatgctgttt 30
<210> 356
<211> 99
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестный или другой
<400> 356
nnnnnnnnnn nnnnnnnnnn guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuu 99
<210> 357
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 357
tagcgggtaa gc 12
<210> 358
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 358
tcggtgacat gt 12
<210> 359
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 359
actccccgta gg 12
<210> 360
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 360
actgcgtgtt aa 12
<210> 361
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 361
acgtcgcctg at 12
<210> 362
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 362
taggtcgacc ag 12
<210> 363
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 363
ggcgttaatg at 12
<210> 364
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 364
tgtcgcatgt ta 12
<210> 365
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 365
atggaaacgc at 12
<210> 366
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 366
gccgaattcc tc 12
<210> 367
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 367
gcatggtacg ga 12
<210> 368
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 368
cggtactctt ac 12
<210> 369
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 369
gcctgtgccg ta 12
<210> 370
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 370
tacggtaagt cg 12
<210> 371
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 371
cacgaaatta cc 12
<210> 372
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 372
aaccaagata cg 12
<210> 373
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 373
gagtcgatac gc 12
<210> 374
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 374
gtctcacgat cg 12
<210> 375
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 375
tcgtcgggtg ca 12
<210> 376
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 376
actccgtagt ga 12
<210> 377
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 377
caggacgtcc gt 12
<210> 378
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 378
tcgtatccct ac 12
<210> 379
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 379
tttcaaggcc gg 12
<210> 380
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 380
cgccggtgga at 12
<210> 381
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 381
gaacccgtcc ta 12
<210> 382
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 382
gattcatcag cg 12
<210> 383
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 383
acaccggtct tc 12
<210> 384
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 384
atcgtgccct aa 12
<210> 385
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 385
gcgtcaatgt tc 12
<210> 386
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 386
ctccgtatct cg 12
<210> 387
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 387
ccgattcctt cg 12
<210> 388
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 388
tgcgcctcca gt 12
<210> 389
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 389
taacgtcgga gc 12
<210> 390
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 390
aaggtcgccc at 12
<210> 391
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 391
gtcggggact at 12
<210> 392
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 392
ttcgagcgat tt 12
<210> 393
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 393
tgagtcgtcg ag 12
<210> 394
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 394
tttacgcaga gg 12
<210> 395
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 395
aggaagtatc gc 12
<210> 396
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 396
actcgatacc at 12
<210> 397
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 397
cgctacatag ca 12
<210> 398
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 398
ttcataaccg gc 12
<210> 399
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 399
ccaaacggtt aa 12
<210> 400
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 400
cgattccttc gt 12
<210> 401
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 401
cgtcatgaat aa 12
<210> 402
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 402
agtggcgatg ac 12
<210> 403
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 403
cccctacggc ac 12
<210> 404
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 404
gccaacccgc ac 12
<210> 405
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 405
tgggacaccg gt 12
<210> 406
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 406
ttgactgcgg cg 12
<210> 407
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 407
actatgcgta gg 12
<210> 408
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 408
tcacccaaag cg 12
<210> 409
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 409
gcaggacgtc cg 12
<210> 410
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 410
acaccgaaaa cg 12
<210> 411
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 411
cggtgtattg ag 12
<210> 412
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 412
cacgaggtat gc 12
<210> 413
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 413
taaagcgacc cg 12
<210> 414
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 414
cttagtcggc ca 12
<210> 415
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 415
cgaaaacgtg gc 12
<210> 416
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 416
cgtgccctga ac 12
<210> 417
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 417
tttaccatcg aa 12
<210> 418
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 418
cgtagccatg tt 12
<210> 419
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 419
cccaaacggt ta 12
<210> 420
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 420
gcgttatcag aa 12
<210> 421
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 421
tcgatggtaa ac 12
<210> 422
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 422
cgactttttg ca 12
<210> 423
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 423
tcgacgactc ac 12
<210> 424
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 424
acgcgtcaga ta 12
<210> 425
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 425
cgtacggcac ag 12
<210> 426
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 426
ctatgccgtg ca 12
<210> 427
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 427
cgcgtcagat at 12
<210> 428
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 428
aagatcggta gc 12
<210> 429
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 429
cttcgcaagg ag 12
<210> 430
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 430
gtcgtggact ac 12
<210> 431
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 431
ggtcgtcatc aa 12
<210> 432
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 432
gttaacagcg tg 12
<210> 433
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 433
tagctaaccg tt 12
<210> 434
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 434
agtaaaggcg ct 12
<210> 435
<211> 12
<212> ДНК
<213> Homo sapiens
<400> 435
ggtaatttcg tg 12
<210> 436
<211> 15
<212> ДНК
<213> Homo sapiens
<400> 436
cagaagaaga agggc 15
<210> 437
<211> 51
<212> ДНК
<213> Homo sapiens
<400> 437
ccaatgggga ggacatcgat gtcacctcca atgactaggg tggtgggcaa c 51
<210> 438
<211> 15
<212> ДНК
<213> Homo sapiens
<400> 438
ctctggccac tccct 15
<210> 439
<211> 52
<212> ДНК
<213> Homo sapiens
<400> 439
acatcgatgt cacctccaat gacaagcttg ctagcggtgg gcaaccacaa ac 52
<210> 440
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (6)..(25)
<223> a, c, t, g, неизвестный или другой
<400> 440
caccgnnnnn nnnnnnnnnn nnnnn 25
<210> 441
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (5)..(24)
<223> a, c, t, g, неизвестный или другой
<400> 441
aaacnnnnnn nnnnnnnnnn nnnnc 25
<210> 442
<211> 54
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 442
aacaccgggt cttcgagaag acctgtttta gagctagaaa tagcaagtta aaat 54
<210> 443
<211> 54
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 443
caaaacgggt cttcgagaag acgttttaga gctatgctgt tttgaatggt ccca 54
<210> 444
<211> 4104
<212> ДНК
<213> Homo sapiens
<220>
<221> КДп
<222> (1)..(4104)
<400> 444
atg gac aag aag tac agc atc ggc ctg gac atc ggc acc aac tct gtg 48
Met Asp Lys Lys Tyr Ser Ile Gly Leu Asp Ile Gly Thr Asn Ser Val
1 5 10 15
ggc tgg gcc gtg atc acc gac gag tac aag gtg ccc agc aag aaa ttc 96
Gly Trp Ala Val Ile Thr Asp Glu Tyr Lys Val Pro Ser Lys Lys Phe
20 25 30
aag gtg ctg ggc aac acc gac cgg cac agc atc aag aag aac ctg atc 144
Lys Val Leu Gly Asn Thr Asp Arg His Ser Ile Lys Lys Asn Leu Ile
35 40 45
gga gcc ctg ctg ttc gac agc ggc gaa aca gcc gag gcc acc cgg ctg 192
Gly Ala Leu Leu Phe Asp Ser Gly Glu Thr Ala Glu Ala Thr Arg Leu
50 55 60
aag aga acc gcc aga aga aga tac acc aga cgg aag aac cgg atc tgc 240
Lys Arg Thr Ala Arg Arg Arg Tyr Thr Arg Arg Lys Asn Arg Ile Cys
65 70 75 80
tat ctg caa gag atc ttc agc aac gag atg gcc aag gtg gac gac agc 288
Tyr Leu Gln Glu Ile Phe Ser Asn Glu Met Ala Lys Val Asp Asp Ser
85 90 95
ttc ttc cac aga ctg gaa gag tcc ttc ctg gtg gaa gag gat aag aag 336
Phe Phe His Arg Leu Glu Glu Ser Phe Leu Val Glu Glu Asp Lys Lys
100 105 110
cac gag cgg cac ccc atc ttc ggc aac atc gtg gac gag gtg gcc tac 384
His Glu Arg His Pro Ile Phe Gly Asn Ile Val Asp Glu Val Ala Tyr
115 120 125
cac gag aag tac ccc acc atc tac cac ctg aga aag aaa ctg gtg gac 432
His Glu Lys Tyr Pro Thr Ile Tyr His Leu Arg Lys Lys Leu Val Asp
130 135 140
agc acc gac aag gcc gac ctg cgg ctg atc tat ctg gcc ctg gcc cac 480
Ser Thr Asp Lys Ala Asp Leu Arg Leu Ile Tyr Leu Ala Leu Ala His
145 150 155 160
atg atc aag ttc cgg ggc cac ttc ctg atc gag ggc gac ctg aac ccc 528
Met Ile Lys Phe Arg Gly His Phe Leu Ile Glu Gly Asp Leu Asn Pro
165 170 175
gac aac agc gac gtg gac aag ctg ttc atc cag ctg gtg cag acc tac 576
Asp Asn Ser Asp Val Asp Lys Leu Phe Ile Gln Leu Val Gln Thr Tyr
180 185 190
aac cag ctg ttc gag gaa aac ccc atc aac gcc agc ggc gtg gac gcc 624
Asn Gln Leu Phe Glu Glu Asn Pro Ile Asn Ala Ser Gly Val Asp Ala
195 200 205
aag gcc atc ctg tct gcc aga ctg agc aag agc aga cgg ctg gaa aat 672
Lys Ala Ile Leu Ser Ala Arg Leu Ser Lys Ser Arg Arg Leu Glu Asn
210 215 220
ctg atc gcc cag ctg ccc ggc gag aag aag aat ggc ctg ttc ggc aac 720
Leu Ile Ala Gln Leu Pro Gly Glu Lys Lys Asn Gly Leu Phe Gly Asn
225 230 235 240
ctg att gcc ctg agc ctg ggc ctg acc ccc aac ttc aag agc aac ttc 768
Leu Ile Ala Leu Ser Leu Gly Leu Thr Pro Asn Phe Lys Ser Asn Phe
245 250 255
gac ctg gcc gag gat gcc aaa ctg cag ctg agc aag gac acc tac gac 816
Asp Leu Ala Glu Asp Ala Lys Leu Gln Leu Ser Lys Asp Thr Tyr Asp
260 265 270
gac gac ctg gac aac ctg ctg gcc cag atc ggc gac cag tac gcc gac 864
Asp Asp Leu Asp Asn Leu Leu Ala Gln Ile Gly Asp Gln Tyr Ala Asp
275 280 285
ctg ttt ctg gcc gcc aag aac ctg tcc gac gcc atc ctg ctg agc gac 912
Leu Phe Leu Ala Ala Lys Asn Leu Ser Asp Ala Ile Leu Leu Ser Asp
290 295 300
atc ctg aga gtg aac acc gag atc acc aag gcc ccc ctg agc gcc tct 960
Ile Leu Arg Val Asn Thr Glu Ile Thr Lys Ala Pro Leu Ser Ala Ser
305 310 315 320
atg atc aag aga tac gac gag cac cac cag gac ctg acc ctg ctg aaa 1008
Met Ile Lys Arg Tyr Asp Glu His His Gln Asp Leu Thr Leu Leu Lys
325 330 335
gct ctc gtg cgg cag cag ctg cct gag aag tac aaa gag att ttc ttc 1056
Ala Leu Val Arg Gln Gln Leu Pro Glu Lys Tyr Lys Glu Ile Phe Phe
340 345 350
gac cag agc aag aac ggc tac gcc ggc tac att gac ggc gga gcc agc 1104
Asp Gln Ser Lys Asn Gly Tyr Ala Gly Tyr Ile Asp Gly Gly Ala Ser
355 360 365
cag gaa gag ttc tac aag ttc atc aag ccc atc ctg gaa aag atg gac 1152
Gln Glu Glu Phe Tyr Lys Phe Ile Lys Pro Ile Leu Glu Lys Met Asp
370 375 380
ggc acc gag gaa ctg ctc gtg aag ctg aac aga gag gac ctg ctg cgg 1200
Gly Thr Glu Glu Leu Leu Val Lys Leu Asn Arg Glu Asp Leu Leu Arg
385 390 395 400
aag cag cgg acc ttc gac aac ggc agc atc ccc cac cag atc cac ctg 1248
Lys Gln Arg Thr Phe Asp Asn Gly Ser Ile Pro His Gln Ile His Leu
405 410 415
gga gag ctg cac gcc att ctg cgg cgg cag gaa gat ttt tac cca ttc 1296
Gly Glu Leu His Ala Ile Leu Arg Arg Gln Glu Asp Phe Tyr Pro Phe
420 425 430
ctg aag gac aac cgg gaa aag atc gag aag atc ctg acc ttc cgc atc 1344
Leu Lys Asp Asn Arg Glu Lys Ile Glu Lys Ile Leu Thr Phe Arg Ile
435 440 445
ccc tac tac gtg ggc cct ctg gcc agg gga aac agc aga ttc gcc tgg 1392
Pro Tyr Tyr Val Gly Pro Leu Ala Arg Gly Asn Ser Arg Phe Ala Trp
450 455 460
atg acc aga aag agc gag gaa acc atc acc ccc tgg aac ttc gag gaa 1440
Met Thr Arg Lys Ser Glu Glu Thr Ile Thr Pro Trp Asn Phe Glu Glu
465 470 475 480
gtg gtg gac aag ggc gct tcc gcc cag agc ttc atc gag cgg atg acc 1488
Val Val Asp Lys Gly Ala Ser Ala Gln Ser Phe Ile Glu Arg Met Thr
485 490 495
aac ttc gat aag aac ctg ccc aac gag aag gtg ctg ccc aag cac agc 1536
Asn Phe Asp Lys Asn Leu Pro Asn Glu Lys Val Leu Pro Lys His Ser
500 505 510
ctg ctg tac gag tac ttc acc gtg tat aac gag ctg acc aaa gtg aaa 1584
Leu Leu Tyr Glu Tyr Phe Thr Val Tyr Asn Glu Leu Thr Lys Val Lys
515 520 525
tac gtg acc gag gga atg aga aag ccc gcc ttc ctg agc ggc gag cag 1632
Tyr Val Thr Glu Gly Met Arg Lys Pro Ala Phe Leu Ser Gly Glu Gln
530 535 540
aaa aag gcc atc gtg gac ctg ctg ttc aag acc aac cgg aaa gtg acc 1680
Lys Lys Ala Ile Val Asp Leu Leu Phe Lys Thr Asn Arg Lys Val Thr
545 550 555 560
gtg aag cag ctg aaa gag gac tac ttc aag aaa atc gag tgc ttc gac 1728
Val Lys Gln Leu Lys Glu Asp Tyr Phe Lys Lys Ile Glu Cys Phe Asp
565 570 575
tcc gtg gaa atc tcc ggc gtg gaa gat cgg ttc aac gcc tcc ctg ggc 1776
Ser Val Glu Ile Ser Gly Val Glu Asp Arg Phe Asn Ala Ser Leu Gly
580 585 590
aca tac cac gat ctg ctg aaa att atc aag gac aag gac ttc ctg gac 1824
Thr Tyr His Asp Leu Leu Lys Ile Ile Lys Asp Lys Asp Phe Leu Asp
595 600 605
aat gag gaa aac gag gac att ctg gaa gat atc gtg ctg acc ctg aca 1872
Asn Glu Glu Asn Glu Asp Ile Leu Glu Asp Ile Val Leu Thr Leu Thr
610 615 620
ctg ttt gag gac aga gag atg atc gag gaa cgg ctg aaa acc tat gcc 1920
Leu Phe Glu Asp Arg Glu Met Ile Glu Glu Arg Leu Lys Thr Tyr Ala
625 630 635 640
cac ctg ttc gac gac aaa gtg atg aag cag ctg aag cgg cgg aga tac 1968
His Leu Phe Asp Asp Lys Val Met Lys Gln Leu Lys Arg Arg Arg Tyr
645 650 655
acc ggc tgg ggc agg ctg agc cgg aag ctg atc aac ggc atc cgg gac 2016
Thr Gly Trp Gly Arg Leu Ser Arg Lys Leu Ile Asn Gly Ile Arg Asp
660 665 670
aag cag tcc ggc aag aca atc ctg gat ttc ctg aag tcc gac ggc ttc 2064
Lys Gln Ser Gly Lys Thr Ile Leu Asp Phe Leu Lys Ser Asp Gly Phe
675 680 685
gcc aac aga aac ttc atg cag ctg atc cac gac gac agc ctg acc ttt 2112
Ala Asn Arg Asn Phe Met Gln Leu Ile His Asp Asp Ser Leu Thr Phe
690 695 700
aaa gag gac atc cag aaa gcc cag gtg tcc ggc cag ggc gat agc ctg 2160
Lys Glu Asp Ile Gln Lys Ala Gln Val Ser Gly Gln Gly Asp Ser Leu
705 710 715 720
cac gag cac att gcc aat ctg gcc ggc agc ccc gcc att aag aag ggc 2208
His Glu His Ile Ala Asn Leu Ala Gly Ser Pro Ala Ile Lys Lys Gly
725 730 735
atc ctg cag aca gtg aag gtg gtg gac gag ctc gtg aaa gtg atg ggc 2256
Ile Leu Gln Thr Val Lys Val Val Asp Glu Leu Val Lys Val Met Gly
740 745 750
cgg cac aag ccc gag aac atc gtg atc gcc atg gcc aga gag aac cag 2304
Arg His Lys Pro Glu Asn Ile Val Ile Ala Met Ala Arg Glu Asn Gln
755 760 765
acc acc cag aag gga cag aag aac agc cgc gag aga atg aag cgg atc 2352
Thr Thr Gln Lys Gly Gln Lys Asn Ser Arg Glu Arg Met Lys Arg Ile
770 775 780
gaa gag ggc atc aaa gag ctg ggc agc cag atc ctg aaa gaa cac ccc 2400
Glu Glu Gly Ile Lys Glu Leu Gly Ser Gln Ile Leu Lys Glu His Pro
785 790 795 800
gtg gaa aac acc cag ctg cag aac gag aag ctg tac ctg tac tac ctg 2448
Val Glu Asn Thr Gln Leu Gln Asn Glu Lys Leu Tyr Leu Tyr Tyr Leu
805 810 815
cag aat ggg cgg gat atg tac gtg gac cag gaa ctg gac atc aac cgg 2496
Gln Asn Gly Arg Asp Met Tyr Val Asp Gln Glu Leu Asp Ile Asn Arg
820 825 830
ctg tcc gac tac gat gtg gac gcc atc gtg cct cag agc ttt ctg aag 2544
Leu Ser Asp Tyr Asp Val Asp Ala Ile Val Pro Gln Ser Phe Leu Lys
835 840 845
gac gac tcc atc gac gcc aag gtg ctg acc aga agc gac aag gcc cgg 2592
Asp Asp Ser Ile Asp Ala Lys Val Leu Thr Arg Ser Asp Lys Ala Arg
850 855 860
ggc aag agc gac aac gtg ccc tcc gaa gag gtc gtg aag aag atg aag 2640
Gly Lys Ser Asp Asn Val Pro Ser Glu Glu Val Val Lys Lys Met Lys
865 870 875 880
aac tac tgg cgg cag ctg ctg aac gcc aag ctg att acc cag aga aag 2688
Asn Tyr Trp Arg Gln Leu Leu Asn Ala Lys Leu Ile Thr Gln Arg Lys
885 890 895
ttc gac aat ctg acc aag gcc gag aga ggc ggc ctg agc gaa ctg gat 2736
Phe Asp Asn Leu Thr Lys Ala Glu Arg Gly Gly Leu Ser Glu Leu Asp
900 905 910
aag gcc ggc ttc atc aag aga cag ctg gtg gaa acc cgg cag atc aca 2784
Lys Ala Gly Phe Ile Lys Arg Gln Leu Val Glu Thr Arg Gln Ile Thr
915 920 925
aag cac gtg gca cag atc ctg gac tcc cgg atg aac act aag tac gac 2832
Lys His Val Ala Gln Ile Leu Asp Ser Arg Met Asn Thr Lys Tyr Asp
930 935 940
gag aat gac aag ctg atc cgg gaa gtg aaa gtg atc acc ctg aag tcc 2880
Glu Asn Asp Lys Leu Ile Arg Glu Val Lys Val Ile Thr Leu Lys Ser
945 950 955 960
aag ctg gtg tcc gat ttc cgg aag gat ttc cag ttt tac aaa gtg cgc 2928
Lys Leu Val Ser Asp Phe Arg Lys Asp Phe Gln Phe Tyr Lys Val Arg
965 970 975
gag atc aac aac tac cac cac gcc cac gcc gcc tac ctg aac gcc gtc 2976
Glu Ile Asn Asn Tyr His His Ala His Ala Ala Tyr Leu Asn Ala Val
980 985 990
gtg gga acc gcc ctg atc aaa aag tac cct aag ctg gaa agc gag ttc 3024
Val Gly Thr Ala Leu Ile Lys Lys Tyr Pro Lys Leu Glu Ser Glu Phe
995 1000 1005
gtg tac ggc gac tac aag gtg tac gac gtg cgg aag atg atc gcc 3069
Val Tyr Gly Asp Tyr Lys Val Tyr Asp Val Arg Lys Met Ile Ala
1010 1015 1020
aag agc gag cag gaa atc ggc aag gct acc gcc aag tac ttc ttc 3114
Lys Ser Glu Gln Glu Ile Gly Lys Ala Thr Ala Lys Tyr Phe Phe
1025 1030 1035
tac agc aac atc atg aac ttt ttc aag acc gag att acc ctg gcc 3159
Tyr Ser Asn Ile Met Asn Phe Phe Lys Thr Glu Ile Thr Leu Ala
1040 1045 1050
aac ggc gag atc cgg aag cgg cct ctg atc gag aca aac ggc gaa 3204
Asn Gly Glu Ile Arg Lys Arg Pro Leu Ile Glu Thr Asn Gly Glu
1055 1060 1065
acc ggg gag atc gtg tgg gat aag ggc cgg gat ttt gcc acc gtg 3249
Thr Gly Glu Ile Val Trp Asp Lys Gly Arg Asp Phe Ala Thr Val
1070 1075 1080
cgg aaa gtg ctg agc atg ccc caa gtg aat atc gtg aaa aag acc 3294
Arg Lys Val Leu Ser Met Pro Gln Val Asn Ile Val Lys Lys Thr
1085 1090 1095
gag gtg cag aca ggc ggc ttc agc aaa gag tct atc ctg ccc aag 3339
Glu Val Gln Thr Gly Gly Phe Ser Lys Glu Ser Ile Leu Pro Lys
1100 1105 1110
agg aac agc gat aag ctg atc gcc aga aag aag gac tgg gac cct 3384
Arg Asn Ser Asp Lys Leu Ile Ala Arg Lys Lys Asp Trp Asp Pro
1115 1120 1125
aag aag tac ggc ggc ttc gac agc ccc acc gtg gcc tat tct gtg 3429
Lys Lys Tyr Gly Gly Phe Asp Ser Pro Thr Val Ala Tyr Ser Val
1130 1135 1140
ctg gtg gtg gcc aaa gtg gaa aag ggc aag tcc aag aaa ctg aag 3474
Leu Val Val Ala Lys Val Glu Lys Gly Lys Ser Lys Lys Leu Lys
1145 1150 1155
agt gtg aaa gag ctg ctg ggg atc acc atc atg gaa aga agc agc 3519
Ser Val Lys Glu Leu Leu Gly Ile Thr Ile Met Glu Arg Ser Ser
1160 1165 1170
ttc gag aag aat ccc atc gac ttt ctg gaa gcc aag ggc tac aaa 3564
Phe Glu Lys Asn Pro Ile Asp Phe Leu Glu Ala Lys Gly Tyr Lys
1175 1180 1185
gaa gtg aaa aag gac ctg atc atc aag ctg cct aag tac tcc ctg 3609
Glu Val Lys Lys Asp Leu Ile Ile Lys Leu Pro Lys Tyr Ser Leu
1190 1195 1200
ttc gag ctg gaa aac ggc cgg aag aga atg ctg gcc tct gcc ggc 3654
Phe Glu Leu Glu Asn Gly Arg Lys Arg Met Leu Ala Ser Ala Gly
1205 1210 1215
gaa ctg cag aag gga aac gaa ctg gcc ctg ccc tcc aaa tat gtg 3699
Glu Leu Gln Lys Gly Asn Glu Leu Ala Leu Pro Ser Lys Tyr Val
1220 1225 1230
aac ttc ctg tac ctg gcc agc cac tat gag aag ctg aag ggc tcc 3744
Asn Phe Leu Tyr Leu Ala Ser His Tyr Glu Lys Leu Lys Gly Ser
1235 1240 1245
ccc gag gat aat gag cag aaa cag ctg ttt gtg gaa cag cac aag 3789
Pro Glu Asp Asn Glu Gln Lys Gln Leu Phe Val Glu Gln His Lys
1250 1255 1260
cac tac ctg gac gag atc atc gag cag atc agc gag ttc tcc aag 3834
His Tyr Leu Asp Glu Ile Ile Glu Gln Ile Ser Glu Phe Ser Lys
1265 1270 1275
aga gtg atc ctg gcc gac gct aat ctg gac aaa gtg ctg tcc gcc 3879
Arg Val Ile Leu Ala Asp Ala Asn Leu Asp Lys Val Leu Ser Ala
1280 1285 1290
tac aac aag cac cgg gat aag ccc atc aga gag cag gcc gag aat 3924
Tyr Asn Lys His Arg Asp Lys Pro Ile Arg Glu Gln Ala Glu Asn
1295 1300 1305
atc atc cac ctg ttt acc ctg acc aat ctg gga gcc cct gcc gcc 3969
Ile Ile His Leu Phe Thr Leu Thr Asn Leu Gly Ala Pro Ala Ala
1310 1315 1320
ttc aag tac ttt gac acc acc atc gac cgg aag agg tac acc agc 4014
Phe Lys Tyr Phe Asp Thr Thr Ile Asp Arg Lys Arg Tyr Thr Ser
1325 1330 1335
acc aaa gag gtg ctg gac gcc acc ctg atc cac cag agc atc acc 4059
Thr Lys Glu Val Leu Asp Ala Thr Leu Ile His Gln Ser Ile Thr
1340 1345 1350
ggc ctg tac gag aca cgg atc gac ctg tct cag ctg gga ggc gac 4104
Gly Leu Tyr Glu Thr Arg Ile Asp Leu Ser Gln Leu Gly Gly Asp
1355 1360 1365
<210> 445
<211> 1368
<212> БЕЛОК
<213> Homo sapiens
<400> 445
Met Asp Lys Lys Tyr Ser Ile Gly Leu Asp Ile Gly Thr Asn Ser Val
1 5 10 15
Gly Trp Ala Val Ile Thr Asp Glu Tyr Lys Val Pro Ser Lys Lys Phe
20 25 30
Lys Val Leu Gly Asn Thr Asp Arg His Ser Ile Lys Lys Asn Leu Ile
35 40 45
Gly Ala Leu Leu Phe Asp Ser Gly Glu Thr Ala Glu Ala Thr Arg Leu
50 55 60
Lys Arg Thr Ala Arg Arg Arg Tyr Thr Arg Arg Lys Asn Arg Ile Cys
65 70 75 80
Tyr Leu Gln Glu Ile Phe Ser Asn Glu Met Ala Lys Val Asp Asp Ser
85 90 95
Phe Phe His Arg Leu Glu Glu Ser Phe Leu Val Glu Glu Asp Lys Lys
100 105 110
His Glu Arg His Pro Ile Phe Gly Asn Ile Val Asp Glu Val Ala Tyr
115 120 125
His Glu Lys Tyr Pro Thr Ile Tyr His Leu Arg Lys Lys Leu Val Asp
130 135 140
Ser Thr Asp Lys Ala Asp Leu Arg Leu Ile Tyr Leu Ala Leu Ala His
145 150 155 160
Met Ile Lys Phe Arg Gly His Phe Leu Ile Glu Gly Asp Leu Asn Pro
165 170 175
Asp Asn Ser Asp Val Asp Lys Leu Phe Ile Gln Leu Val Gln Thr Tyr
180 185 190
Asn Gln Leu Phe Glu Glu Asn Pro Ile Asn Ala Ser Gly Val Asp Ala
195 200 205
Lys Ala Ile Leu Ser Ala Arg Leu Ser Lys Ser Arg Arg Leu Glu Asn
210 215 220
Leu Ile Ala Gln Leu Pro Gly Glu Lys Lys Asn Gly Leu Phe Gly Asn
225 230 235 240
Leu Ile Ala Leu Ser Leu Gly Leu Thr Pro Asn Phe Lys Ser Asn Phe
245 250 255
Asp Leu Ala Glu Asp Ala Lys Leu Gln Leu Ser Lys Asp Thr Tyr Asp
260 265 270
Asp Asp Leu Asp Asn Leu Leu Ala Gln Ile Gly Asp Gln Tyr Ala Asp
275 280 285
Leu Phe Leu Ala Ala Lys Asn Leu Ser Asp Ala Ile Leu Leu Ser Asp
290 295 300
Ile Leu Arg Val Asn Thr Glu Ile Thr Lys Ala Pro Leu Ser Ala Ser
305 310 315 320
Met Ile Lys Arg Tyr Asp Glu His His Gln Asp Leu Thr Leu Leu Lys
325 330 335
Ala Leu Val Arg Gln Gln Leu Pro Glu Lys Tyr Lys Glu Ile Phe Phe
340 345 350
Asp Gln Ser Lys Asn Gly Tyr Ala Gly Tyr Ile Asp Gly Gly Ala Ser
355 360 365
Gln Glu Glu Phe Tyr Lys Phe Ile Lys Pro Ile Leu Glu Lys Met Asp
370 375 380
Gly Thr Glu Glu Leu Leu Val Lys Leu Asn Arg Glu Asp Leu Leu Arg
385 390 395 400
Lys Gln Arg Thr Phe Asp Asn Gly Ser Ile Pro His Gln Ile His Leu
405 410 415
Gly Glu Leu His Ala Ile Leu Arg Arg Gln Glu Asp Phe Tyr Pro Phe
420 425 430
Leu Lys Asp Asn Arg Glu Lys Ile Glu Lys Ile Leu Thr Phe Arg Ile
435 440 445
Pro Tyr Tyr Val Gly Pro Leu Ala Arg Gly Asn Ser Arg Phe Ala Trp
450 455 460
Met Thr Arg Lys Ser Glu Glu Thr Ile Thr Pro Trp Asn Phe Glu Glu
465 470 475 480
Val Val Asp Lys Gly Ala Ser Ala Gln Ser Phe Ile Glu Arg Met Thr
485 490 495
Asn Phe Asp Lys Asn Leu Pro Asn Glu Lys Val Leu Pro Lys His Ser
500 505 510
Leu Leu Tyr Glu Tyr Phe Thr Val Tyr Asn Glu Leu Thr Lys Val Lys
515 520 525
Tyr Val Thr Glu Gly Met Arg Lys Pro Ala Phe Leu Ser Gly Glu Gln
530 535 540
Lys Lys Ala Ile Val Asp Leu Leu Phe Lys Thr Asn Arg Lys Val Thr
545 550 555 560
Val Lys Gln Leu Lys Glu Asp Tyr Phe Lys Lys Ile Glu Cys Phe Asp
565 570 575
Ser Val Glu Ile Ser Gly Val Glu Asp Arg Phe Asn Ala Ser Leu Gly
580 585 590
Thr Tyr His Asp Leu Leu Lys Ile Ile Lys Asp Lys Asp Phe Leu Asp
595 600 605
Asn Glu Glu Asn Glu Asp Ile Leu Glu Asp Ile Val Leu Thr Leu Thr
610 615 620
Leu Phe Glu Asp Arg Glu Met Ile Glu Glu Arg Leu Lys Thr Tyr Ala
625 630 635 640
His Leu Phe Asp Asp Lys Val Met Lys Gln Leu Lys Arg Arg Arg Tyr
645 650 655
Thr Gly Trp Gly Arg Leu Ser Arg Lys Leu Ile Asn Gly Ile Arg Asp
660 665 670
Lys Gln Ser Gly Lys Thr Ile Leu Asp Phe Leu Lys Ser Asp Gly Phe
675 680 685
Ala Asn Arg Asn Phe Met Gln Leu Ile His Asp Asp Ser Leu Thr Phe
690 695 700
Lys Glu Asp Ile Gln Lys Ala Gln Val Ser Gly Gln Gly Asp Ser Leu
705 710 715 720
His Glu His Ile Ala Asn Leu Ala Gly Ser Pro Ala Ile Lys Lys Gly
725 730 735
Ile Leu Gln Thr Val Lys Val Val Asp Glu Leu Val Lys Val Met Gly
740 745 750
Arg His Lys Pro Glu Asn Ile Val Ile Ala Met Ala Arg Glu Asn Gln
755 760 765
Thr Thr Gln Lys Gly Gln Lys Asn Ser Arg Glu Arg Met Lys Arg Ile
770 775 780
Glu Glu Gly Ile Lys Glu Leu Gly Ser Gln Ile Leu Lys Glu His Pro
785 790 795 800
Val Glu Asn Thr Gln Leu Gln Asn Glu Lys Leu Tyr Leu Tyr Tyr Leu
805 810 815
Gln Asn Gly Arg Asp Met Tyr Val Asp Gln Glu Leu Asp Ile Asn Arg
820 825 830
Leu Ser Asp Tyr Asp Val Asp Ala Ile Val Pro Gln Ser Phe Leu Lys
835 840 845
Asp Asp Ser Ile Asp Ala Lys Val Leu Thr Arg Ser Asp Lys Ala Arg
850 855 860
Gly Lys Ser Asp Asn Val Pro Ser Glu Glu Val Val Lys Lys Met Lys
865 870 875 880
Asn Tyr Trp Arg Gln Leu Leu Asn Ala Lys Leu Ile Thr Gln Arg Lys
885 890 895
Phe Asp Asn Leu Thr Lys Ala Glu Arg Gly Gly Leu Ser Glu Leu Asp
900 905 910
Lys Ala Gly Phe Ile Lys Arg Gln Leu Val Glu Thr Arg Gln Ile Thr
915 920 925
Lys His Val Ala Gln Ile Leu Asp Ser Arg Met Asn Thr Lys Tyr Asp
930 935 940
Glu Asn Asp Lys Leu Ile Arg Glu Val Lys Val Ile Thr Leu Lys Ser
945 950 955 960
Lys Leu Val Ser Asp Phe Arg Lys Asp Phe Gln Phe Tyr Lys Val Arg
965 970 975
Glu Ile Asn Asn Tyr His His Ala His Ala Ala Tyr Leu Asn Ala Val
980 985 990
Val Gly Thr Ala Leu Ile Lys Lys Tyr Pro Lys Leu Glu Ser Glu Phe
995 1000 1005
Val Tyr Gly Asp Tyr Lys Val Tyr Asp Val Arg Lys Met Ile Ala
1010 1015 1020
Lys Ser Glu Gln Glu Ile Gly Lys Ala Thr Ala Lys Tyr Phe Phe
1025 1030 1035
Tyr Ser Asn Ile Met Asn Phe Phe Lys Thr Glu Ile Thr Leu Ala
1040 1045 1050
Asn Gly Glu Ile Arg Lys Arg Pro Leu Ile Glu Thr Asn Gly Glu
1055 1060 1065
Thr Gly Glu Ile Val Trp Asp Lys Gly Arg Asp Phe Ala Thr Val
1070 1075 1080
Arg Lys Val Leu Ser Met Pro Gln Val Asn Ile Val Lys Lys Thr
1085 1090 1095
Glu Val Gln Thr Gly Gly Phe Ser Lys Glu Ser Ile Leu Pro Lys
1100 1105 1110
Arg Asn Ser Asp Lys Leu Ile Ala Arg Lys Lys Asp Trp Asp Pro
1115 1120 1125
Lys Lys Tyr Gly Gly Phe Asp Ser Pro Thr Val Ala Tyr Ser Val
1130 1135 1140
Leu Val Val Ala Lys Val Glu Lys Gly Lys Ser Lys Lys Leu Lys
1145 1150 1155
Ser Val Lys Glu Leu Leu Gly Ile Thr Ile Met Glu Arg Ser Ser
1160 1165 1170
Phe Glu Lys Asn Pro Ile Asp Phe Leu Glu Ala Lys Gly Tyr Lys
1175 1180 1185
Glu Val Lys Lys Asp Leu Ile Ile Lys Leu Pro Lys Tyr Ser Leu
1190 1195 1200
Phe Glu Leu Glu Asn Gly Arg Lys Arg Met Leu Ala Ser Ala Gly
1205 1210 1215
Glu Leu Gln Lys Gly Asn Glu Leu Ala Leu Pro Ser Lys Tyr Val
1220 1225 1230
Asn Phe Leu Tyr Leu Ala Ser His Tyr Glu Lys Leu Lys Gly Ser
1235 1240 1245
Pro Glu Asp Asn Glu Gln Lys Gln Leu Phe Val Glu Gln His Lys
1250 1255 1260
His Tyr Leu Asp Glu Ile Ile Glu Gln Ile Ser Glu Phe Ser Lys
1265 1270 1275
Arg Val Ile Leu Ala Asp Ala Asn Leu Asp Lys Val Leu Ser Ala
1280 1285 1290
Tyr Asn Lys His Arg Asp Lys Pro Ile Arg Glu Gln Ala Glu Asn
1295 1300 1305
Ile Ile His Leu Phe Thr Leu Thr Asn Leu Gly Ala Pro Ala Ala
1310 1315 1320
Phe Lys Tyr Phe Asp Thr Thr Ile Asp Arg Lys Arg Tyr Thr Ser
1325 1330 1335
Thr Lys Glu Val Leu Asp Ala Thr Leu Ile His Gln Ser Ile Thr
1340 1345 1350
Gly Leu Tyr Glu Thr Arg Ile Asp Leu Ser Gln Leu Gly Gly Asp
1355 1360 1365
<210> 446
<211> 57
<212> ДНК
<213> Homo sapiens
<220>
<221> КДп
<222> (1)..(57)
<400> 446
ggc acc att aaa gaa aat atc att ggt gtt tcc tat gat gaa tat aga 48
Gly Thr Ile Lys Glu Asn Ile Ile Gly Val Ser Tyr Asp Glu Tyr Arg
1 5 10 15
tac aga agc 57
Tyr Arg Ser
<210> 447
<211> 19
<212> БЕЛОК
<213> Homo sapiens
<400> 447
Gly Thr Ile Lys Glu Asn Ile Ile Gly Val Ser Tyr Asp Glu Tyr Arg
1 5 10 15
Tyr Arg Ser
<210> 448
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> КДп
<222> (1)..(48)
<400> 448
att aaa gaa aat atc att ggc ttt gtt tcc tat gat gaa tat aga tac 48
Ile Lys Glu Asn Ile Ile Gly Phe Val Ser Tyr Asp Glu Tyr Arg Tyr
1 5 10 15
<210> 449
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий пептид”
<400> 449
Ile Lys Glu Asn Ile Ile Gly Phe Val Ser Tyr Asp Glu Tyr Arg Tyr
1 5 10 15
<210> 450
<211> 50
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (3)..(48)
<223> a, c, t, g, неизвестный или другой
<400> 450
ccnnnnnnnn nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn nnnnnnnngg 50
<210> 451
<211> 46
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (3)..(44)
<223> a, c, t, g, неизвестный или другой
<400> 451
ccnnnnnnnn nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn nnnngg 46
<210> 452
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (3)..(40)
<223> a, c, t, g, неизвестный или другой
<400> 452
ccnnnnnnnn nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn gg 42
<210> 453
<211> 38
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (3)..(36)
<223> a, c, t, g, неизвестный или другой
<400> 453
ccnnnnnnnn nnnnnnnnnn nnnnnnnnnn nnnnnngg 38
<210> 454
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (3)..(32)
<223> a, c, t, g, неизвестный или другой
<400> 454
ccnnnnnnnn nnnnnnnnnn nnnnnnnnnn nngg 34
<210> 455
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (3)..(28)
<223> a, c, t, g, неизвестный или другой
<400> 455
ccnnnnnnnn nnnnnnnnnn nnnnnnnngg 30
<210> 456
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (3)..(24)
<223> a, c, t, g, неизвестный или другой
<400> 456
ccnnnnnnnn nnnnnnnnnn nnnngg 26
<210> 457
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (3)..(20)
<223> a, c, t, g, неизвестный или другой
<400> 457
ccnnnnnnnn nnnnnnnnnn gg 22
<210> 458
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (3)..(16)
<223> a, c, t, g, неизвестный или другой
<400> 458
ccnnnnnnnn nnnnnngg 18
<210> 459
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (3)..(14)
<223> a, c, t, g, неизвестный или другой
<400> 459
ccnnnnnnnn nnnngg 16
<210> 460
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (3)..(13)
<223> a, c, t, g, неизвестный или другой
<400> 460
ccnnnnnnnn nnngg 15
<210> 461
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (3)..(12)
<223> a, c, t, g, неизвестный или другой
<400> 461
ccnnnnnnnn nngg 14
<210> 462
<211> 13
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (3)..(11)
<223> a, c, t, g, неизвестный или другой
<400> 462
ccnnnnnnnn ngg 13
<210> 463
<211> 12
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (3)..(10)
<223> a, c, t, g, неизвестный или другой
<400> 463
ccnnnnnnnn gg 12
<210> 464
<211> 11
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (3)..(9)
<223> a, c, t, g, неизвестный или другой
<400> 464
ccnnnnnnng g 11
<210> 465
<211> 10
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (3)..(8)
<223> a, c, t, g, неизвестный или другой
<400> 465
ccnnnnnngg 10
<210> 466
<211> 12
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (3)..(10)
<223> a, c, t, g, неизвестный или другой
<400> 466
ggnnnnnnnn cc 12
<210> 467
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 467
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aactcacatc aaccggtggc gcaggtgttt cgtcctttcc 120
acaag 125
<210> 468
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 468
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aactcacatc aaccggtggc gcaggtgttt cgtcctttcc 120
acaag 125
<210> 469
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 469
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgaggaca aagtacaaac ggcggtgttt cgtcctttcc 120
acaag 125
<210> 470
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 470
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgaggaca aagtacaaac ggcggtgttt cgtcctttcc 120
acaag 125
<210> 471
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 471
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgtggcgc attgccacga agcggtgttt cgtcctttcc 120
acaag 125
<210> 472
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 472
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aaccgagggc agagtgctgc ttgggtgttt cgtcctttcc 120
acaag 125
<210> 473
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 473
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgagtccg agcagaagaa gaaggtgttt cgtcctttcc 120
acaag 125
<210> 474
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 474
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgaggaca aagtacaaac ggcggtgttt cgtcctttcc 120
acaag 125
<210> 475
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 475
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacagcagaa gaagaagggc tccggtgttt cgtcctttcc 120
acaag 125
<210> 476
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 476
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aactcacatc aaccggtggc gcaggtgttt cgtcctttcc 120
acaag 125
<210> 477
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 477
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacccctggc ccaggtgaag gtgggtgttt cgtcctttcc 120
acaag 125
<210> 478
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 478
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aactccctcc ctggcccagg tgaggtgttt cgtcctttcc 120
acaag 125
<210> 479
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 479
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgaaccgg aggacaaagt acaggtgttt cgtcctttcc 120
acaag 125
<210> 480
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 480
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacaggtgaa ggtgtggttc cagggtgttt cgtcctttcc 120
acaag 125
<210> 481
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 481
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacggtgaag gtgtggttcc agaggtgttt cgtcctttcc 120
acaag 125
<210> 482
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 482
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgaaccgg aggacaaagt acaggtgttt cgtcctttcc 120
acaag 125
<210> 483
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 483
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacccctggc ccaggtgaag gtgggtgttt cgtcctttcc 120
acaag 125
<210> 484
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 484
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacaggtgaa ggtgtggttc cagggtgttt cgtcctttcc 120
acaag 125
<210> 485
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 485
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgaggaca aagtacaaac ggcggtgttt cgtcctttcc 120
acaag 125
<210> 486
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 486
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgggaggg aggggcacag atgggtgttt cgtcctttcc 120
acaag 125
<210> 487
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 487
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aaccaccttc acctgggcca gggggtgttt cgtcctttcc 120
acaag 125
<210> 488
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 488
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacaccctag tcattggagg tgaggtgttt cgtcctttcc 120
acaag 125
<210> 489
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 489
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aaccagagca gccactgggg cctggtgttt cgtcctttcc 120
acaag 125
<210> 490
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 490
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aaccaccttc acctgggcca gggggtgttt cgtcctttcc 120
acaag 125
<210> 491
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 491
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacccccatt ggcctgcttc gtgggtgttt cgtcctttcc 120
acaag 125
<210> 492
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 492
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacattggcc tgcttcgtgg caaggtgttt cgtcctttcc 120
acaag 125
<210> 493
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 493
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aactcctcct ccagcttctg ccgggtgttt cgtcctttcc 120
acaag 125
<210> 494
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 494
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aaccctccag cttctgccgt ttgggtgttt cgtcctttcc 120
acaag 125
<210> 495
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 495
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacattggcc tgcttcgtgg caaggtgttt cgtcctttcc 120
acaag 125
<210> 496
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 496
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgcagcaa gcagcactct gccggtgttt cgtcctttcc 120
acaag 125
<210> 497
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 497
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacttcttct tctgctcgga ctcggtgttt cgtcctttcc 120
acaag 125
<210> 498
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 498
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacaccggag gacaaagtac aaaggtgttt cgtcctttcc 120
acaag 125
<210> 499
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 499
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aactcttctt ctgctcggac tcaggtgttt cgtcctttcc 120
acaag 125
<210> 500
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 500
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgttgatg tgatgggagc cctggtgttt cgtcctttcc 120
acaag 125
<210> 501
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 501
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgggccag ggagggaggg gcaggtgttt cgtcctttcc 120
acaag 125
<210> 502
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 502
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgggaggg aggggcacag atgggtgttt cgtcctttcc 120
acaag 125
<210> 503
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 503
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacccggttc tggaaccaca cctggtgttt cgtcctttcc 120
acaag 125
<210> 504
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 504
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aactcacctg ggccagggag ggaggtgttt cgtcctttcc 120
acaag 125
<210> 505
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 505
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aactcacctg ggccagggag ggaggtgttt cgtcctttcc 120
acaag 125
<210> 506
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 506
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgttctgg aaccacacct tcaggtgttt cgtcctttcc 120
acaag 125
<210> 507
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 507
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgggaggg aggggcacag atgggtgttt cgtcctttcc 120
acaag 125
<210> 508
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 508
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgggccag ggagggaggg gcaggtgttt cgtcctttcc 120
acaag 125
<210> 509
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 509
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgttctgg aaccacacct tcaggtgttt cgtcctttcc 120
acaag 125
<210> 510
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 510
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacaggtgaa ggtgtggttc cagggtgttt cgtcctttcc 120
acaag 125
<210> 511
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 511
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgaaccgg aggacaaagt acaggtgttt cgtcctttcc 120
acaag 125
<210> 512
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 512
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aaccaaaccc acgagggcag agtggtgttt cgtcctttcc 120
acaag 125
<210> 513
<211> 125
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий праймер”
<400> 513
aaaaaaagca ccgactcggt gccacttttt caagttgata acggactagc cttattttaa 60
cttgctattt ctagctctaa aacgagtttc tcatctgtgc cccggtgttt cgtcctttcc 120
acaag 125
<210> 514
<211> 684
<212> ДНК
<213> Homo sapiens
<220>
<221> КДп
<222> (1)..(123)
<220>
<221> КДп
<222> (127)..(159)
<220>
<221> КДп
<222> (163)..(399)
<220>
<221> КДп
<222> (403)..(684)
<400> 514
aaa acc acc ctt ctc tct ggc cca ctg tgt cct ctt cct gcc ctg cca 48
Lys Thr Thr Leu Leu Ser Gly Pro Leu Cys Pro Leu Pro Ala Leu Pro
1 5 10 15
tcc cct tct gtg aat gtt aga ccc atg gga gca gct ggt cag agg gga 96
Ser Pro Ser Val Asn Val Arg Pro Met Gly Ala Ala Gly Gln Arg Gly
20 25 30
ccc cgg cct ggg gcc cct aac cct atg tag cct cag tct tcc cat cag 144
Pro Arg Pro Gly Ala Pro Asn Pro Met Pro Gln Ser Ser His Gln
35 40 45
gct ctc agc tca gcc tga gtg ttg agg ccc cag tgg ctg ctc tgg ggg 192
Ala Leu Ser Ser Ala Val Leu Arg Pro Gln Trp Leu Leu Trp Gly
50 55 60
cct cct gag ttt ctc atc tgt gcc cct ccc tcc ctg gcc cag gtg aag 240
Pro Pro Glu Phe Leu Ile Cys Ala Pro Pro Ser Leu Ala Gln Val Lys
65 70 75
gtg tgg ttc cag aac cgg agg aca aag tac aaa cgg cag aag ctg gag 288
Val Trp Phe Gln Asn Arg Arg Thr Lys Tyr Lys Arg Gln Lys Leu Glu
80 85 90
gag gaa ggg cct gag tcc gag cag aag aag aag ggc tcc cat cac atc 336
Glu Glu Gly Pro Glu Ser Glu Gln Lys Lys Lys Gly Ser His His Ile
95 100 105 110
aac cgg tgg cgc att gcc acg aag cag gcc aat ggg gag gac atc gat 384
Asn Arg Trp Arg Ile Ala Thr Lys Gln Ala Asn Gly Glu Asp Ile Asp
115 120 125
gtc acc tcc aat gac tag ggt ggg caa cca caa acc cac gag ggc aga 432
Val Thr Ser Asn Asp Gly Gly Gln Pro Gln Thr His Glu Gly Arg
130 135 140
gtg ctg ctt gct gct ggc cag gcc cct gcg tgg gcc caa gct gga ctc 480
Val Leu Leu Ala Ala Gly Gln Ala Pro Ala Trp Ala Gln Ala Gly Leu
145 150 155
tgg cca ctc cct ggc cag gct ttg ggg agg cct gga gtc atg gcc cca 528
Trp Pro Leu Pro Gly Gln Ala Leu Gly Arg Pro Gly Val Met Ala Pro
160 165 170
cag ggc ttg aag ccc ggg gcc gcc att gac aga ggg aca agc aat ggg 576
Gln Gly Leu Lys Pro Gly Ala Ala Ile Asp Arg Gly Thr Ser Asn Gly
175 180 185
ctg gct gag gcc tgg gac cac ttg gcc ttc tcc tcg gag agc ctg cct 624
Leu Ala Glu Ala Trp Asp His Leu Ala Phe Ser Ser Glu Ser Leu Pro
190 195 200 205
gcc tgg gcg ggc ccg ccc gcc acc gca gcc tcc cag ctg ctc tcc gtg 672
Ala Trp Ala Gly Pro Pro Ala Thr Ala Ala Ser Gln Leu Leu Ser Val
210 215 220
tct cca atc tcc 684
Ser Pro Ile Ser
225
<210> 515
<211> 41
<212> БЕЛОК
<213> Homo sapiens
<400> 515
Lys Thr Thr Leu Leu Ser Gly Pro Leu Cys Pro Leu Pro Ala Leu Pro
1 5 10 15
Ser Pro Ser Val Asn Val Arg Pro Met Gly Ala Ala Gly Gln Arg Gly
20 25 30
Pro Arg Pro Gly Ala Pro Asn Pro Met
35 40
<210> 516
<211> 11
<212> БЕЛОК
<213> Homo sapiens
<400> 516
Pro Gln Ser Ser His Gln Ala Leu Ser Ser Ala
1 5 10
<210> 517
<211> 79
<212> БЕЛОК
<213> Homo sapiens
<400> 517
Val Leu Arg Pro Gln Trp Leu Leu Trp Gly Pro Pro Glu Phe Leu Ile
1 5 10 15
Cys Ala Pro Pro Ser Leu Ala Gln Val Lys Val Trp Phe Gln Asn Arg
20 25 30
Arg Thr Lys Tyr Lys Arg Gln Lys Leu Glu Glu Glu Gly Pro Glu Ser
35 40 45
Glu Gln Lys Lys Lys Gly Ser His His Ile Asn Arg Trp Arg Ile Ala
50 55 60
Thr Lys Gln Ala Asn Gly Glu Asp Ile Asp Val Thr Ser Asn Asp
65 70 75
<210> 518
<211> 94
<212> БЕЛОК
<213> Homo sapiens
<400> 518
Gly Gly Gln Pro Gln Thr His Glu Gly Arg Val Leu Leu Ala Ala Gly
1 5 10 15
Gln Ala Pro Ala Trp Ala Gln Ala Gly Leu Trp Pro Leu Pro Gly Gln
20 25 30
Ala Leu Gly Arg Pro Gly Val Met Ala Pro Gln Gly Leu Lys Pro Gly
35 40 45
Ala Ala Ile Asp Arg Gly Thr Ser Asn Gly Leu Ala Glu Ala Trp Asp
50 55 60
His Leu Ala Phe Ser Ser Glu Ser Leu Pro Ala Trp Ala Gly Pro Pro
65 70 75 80
Ala Thr Ala Ala Ser Gln Leu Leu Ser Val Ser Pro Ile Ser
85 90
<210> 519
<211> 30
<212> ДНК
<213> Mus sp.
<400> 519
ccaccattct gcagagccag cagaggcagg 30
<210> 520
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 520
ccauucugca gagccagcag 20
<210> 521
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 521
ccattctgca gagccagcag agg 23
<210> 522
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 522
ccattctgca gagccagagg cagg 24
<210> 523
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 523
ccattctgca gagcccagag g 21
<210> 524
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 524
ccattctgca gagccagaga gg 22
<210> 525
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 525
ccattctgca gagcagagg 19
<210> 526
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 526
ccattctgca gagccccaga gg 22
<210> 527
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 527
ccattctgca gagccaggag gcagg 25
<210> 528
<211> 67
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (18)..(61)
<223> a, c, t, g, неизвестный или другой
<400> 528
ccattctgca gagccagnnn nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn 60
ncagagg 67
<210> 529
<211> 55
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (18)..(52)
<223> a, c, t, g, неизвестный или другой
<400> 529
ccattctgca gagccagnnn nnnnnnnnnn nnnnnnnnnn nnnnnnnnnn nnagg 55
<210> 530
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 530
ccattctgca gagccagaag agg 23
<210> 531
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 531
ccattctgca gagccagcac agagg 25
<210> 532
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 532
ccattctgca gagccacaga gg 22
<210> 533
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 533
ccattctgca gagccagtca gagg 24
<210> 534
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 534
uuggcauggg ucgcugacgg 20
<210> 535
<211> 30
<212> ДНК
<213> Mus sp.
<400> 535
ccagcctccg tcagcgaccc atgccaagac 30
<210> 536
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 536
cgggcuggag cuguucgcgc 20
<210> 537
<211> 30
<212> ДНК
<213> Mus sp.
<400> 537
gatgccagcg cgaacagctc cagcccgagt 30
<210> 538
<211> 30
<212> ДНК
<213> Mus sp.
<400> 538
agaagagggt gccagcgggt atgaggagtg 30
<210> 539
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 539
agagggugcc agcggguaug 20
<210> 540
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 540
ctgggagagg gagcccctcc agg 23
<210> 541
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 541
aaaggtggga gacacctcct tgg 23
<210> 542
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 542
tccaaccttc aggcaaggtg ggg 23
<210> 543
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 543
aggaagtctg gccgatctgc tgg 23
<210> 544
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 544
ctctgaggcc ctggagatcc tgg 23
<210> 545
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 545
ttggcatggg tcgctgacgg agg 23
<210> 546
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 546
cgggctggag ctgttcgcgc tgg 23
<210> 547
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 547
agagggtgcc agcgggtatg agg 23
<210> 548
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 548
cctccgtcag cgacccatgc caa 23
<210> 549
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 549
cctccgatca gcgacccatg ccaa 24
<210> 550
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 550
cctccgttca gcgacccatg ccaa 24
<210> 551
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 551
cctccgctca gcgacccatg ccaa 24
<210> 552
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 552
cctcctcagc gacccatgcc aa 22
<210> 553
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 553
cctccgcagc gacccatgcc aa 22
<210> 554
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 554
cctctcagcg acccatgcca a 21
<210> 555
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 555
cctccgcgac ccatgccaa 19
<210> 556
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 556
cctcagcgac ccatgccaa 19
<210> 557
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 557
ctcagcgacc catgccaa 18
<210> 558
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 558
ccagcgcgaa cagctccagc ccg 23
<210> 559
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 559
ccagcgccga acagctccag cccg 24
<210> 560
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 560
ccagcgaaca gctccagccc g 21
<210> 561
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 561
ccagcggaca gctccagccc g 21
<210> 562
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 562
ccagaacagc tccagcccg 19
<210> 563
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 563
ccagcgagct ccagcccg 18
<210> 564
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 564
ccagcgcaca gctccagccc g 21
<210> 565
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 565
ccagcgctcc agcccg 16
<210> 566
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 566
agagggtgcc agcgggttat gagg 24
<210> 567
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 567
agagggtgcc agcgggtaat gagg 24
<210> 568
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<220>
<221> модифицированное_основание
<222> (18)..(36)
<223> a, c, t, g, неизвестный или другой
<400> 568
agagggtgcc agcgggtnnn nnnnnnnnnn nnnnnn 36
<210> 569
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 569
agagggtgcc agtatgagg 19
<210> 570
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 570
agagggtgcc agcgggtgag g 21
<210> 571
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 571
agagggtgcc agcgagg 17
<210> 572
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий олигонуклеотид”
<400> 572
agagggtgcc agcggggagg 20
<210> 573
<211> 120
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий полинуклеотид”
<400> 573
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
<210> 574
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетитческий полипептид”
<220>
221> МОДИФИЦИРОВАННЫЙ_ОСТАТОК
<222> (2)..(2)
<223> Ahx
<400> 574
Arg Xaa Arg Arg Arg Arg
1 5
<210> 575
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=“Описание искусственной последовательности:
Синтетической метки 6xHis”
<400> 575
His His His His His His
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ДОСТАВКА, ПРИМЕНЕНИЕ И ПРИМЕНЕНИЯ В ТЕРАПИИ СИСТЕМ CRISPR-CAS И КОМПОЗИЦИЙ ДЛЯ ЦЕЛЕНАПРАВЛЕННОГО ВОЗДЕЙСТВИЯ НА НАРУШЕНИЯ И ЗАБОЛЕВАНИЯ С ИСПОЛЬЗОВАНИЕМ ВИРУСНЫХ КОМПОНЕНТОВ | 2014 |
|
RU2716421C2 |
| ДОСТАВКА, КОНСТРУИРОВАНИЕ И ОПТИМИЗАЦИЯ СИСТЕМ, СПОСОБОВ И КОМПОЗИЦИЙ ДЛЯ МАНИПУЛЯЦИИ С ПОСЛЕДОВАТЕЛЬНОСТЯМИ И ПРИМЕНЕНИЯ В ТЕРАПИИ | 2013 |
|
RU2721275C2 |
| КОНСТРУИРОВАНИЕ СИСТЕМ, СПОСОБЫ И ОПТИМИЗИРОВАННЫЕ НАПРАВЛЯЮЩИЕ КОМПОЗИЦИИ ДЛЯ МАНИПУЛЯЦИИ С ПОСЛЕДОВАТЕЛЬНОСТЯМИ | 2013 |
|
RU2796017C2 |
| КОМПОНЕНТЫ СИСТЕМЫ CRISPR-CAS, СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ МАНИПУЛЯЦИИ С ПОСЛЕДОВАТЕЛЬНОСТЯМИ | 2013 |
|
RU2796549C2 |
| НОВЫЕ ФЕРМЕНТЫ И СИСТЕМЫ CRISPR | 2016 |
|
RU2777988C2 |
| КОМПОЗИЦИИ И СПОСОБЫ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ЛЕЧЕНИЯ ГЕМОГЛОБИНОПАТИЙ | 2018 |
|
RU2834231C2 |
| НОВЫЕ ФЕРМЕНТЫ CRISPR И СИСТЕМЫ | 2016 |
|
RU2771826C2 |
| НОВЫЕ ФЕРМЕНТЫ И СИСТЕМЫ CRISPR | 2016 |
|
RU2737537C2 |
| НАПРАВЛЯЕМАЯ РНК РЕГУЛЯЦИЯ ТРАНСКРИПЦИИ | 2014 |
|
RU2756865C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ГЕМОГЛОБИНОПАТИЙ | 2016 |
|
RU2812491C2 |
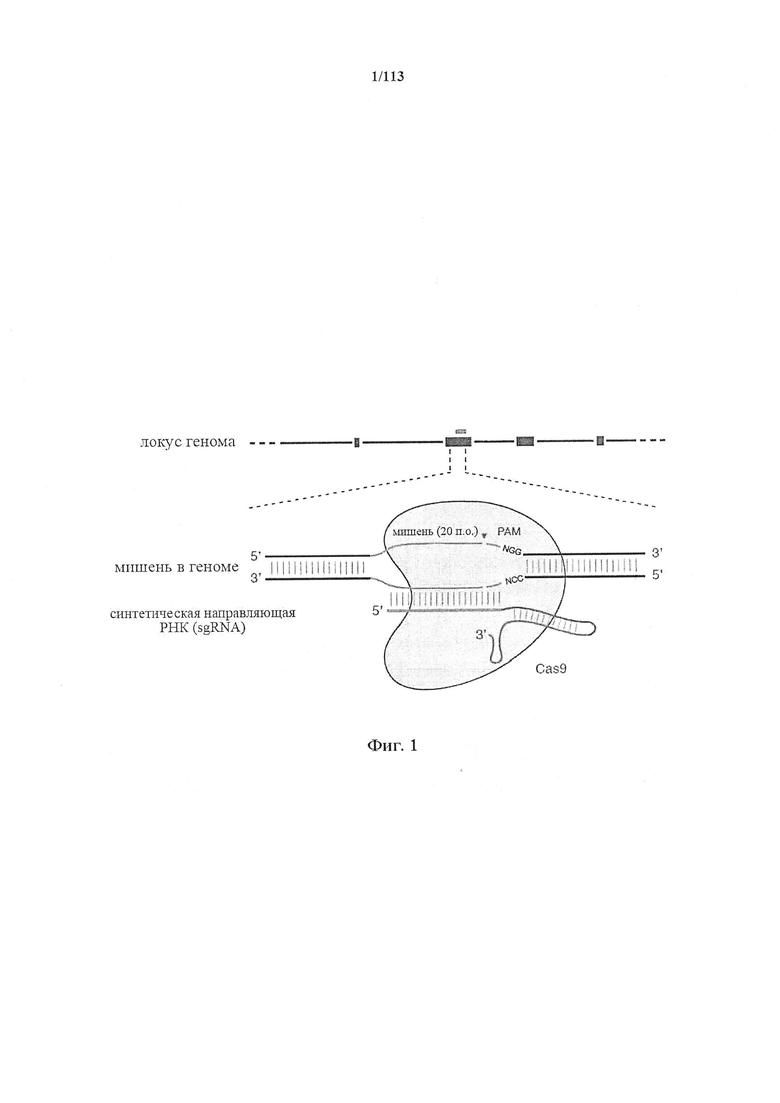
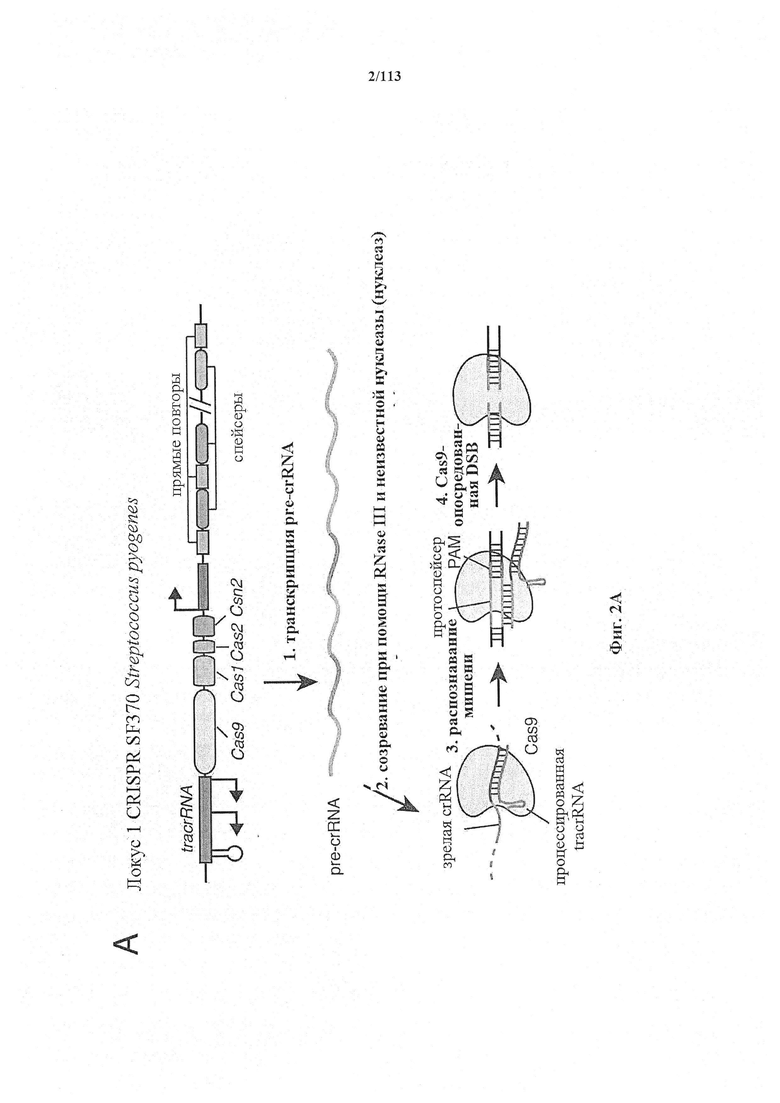
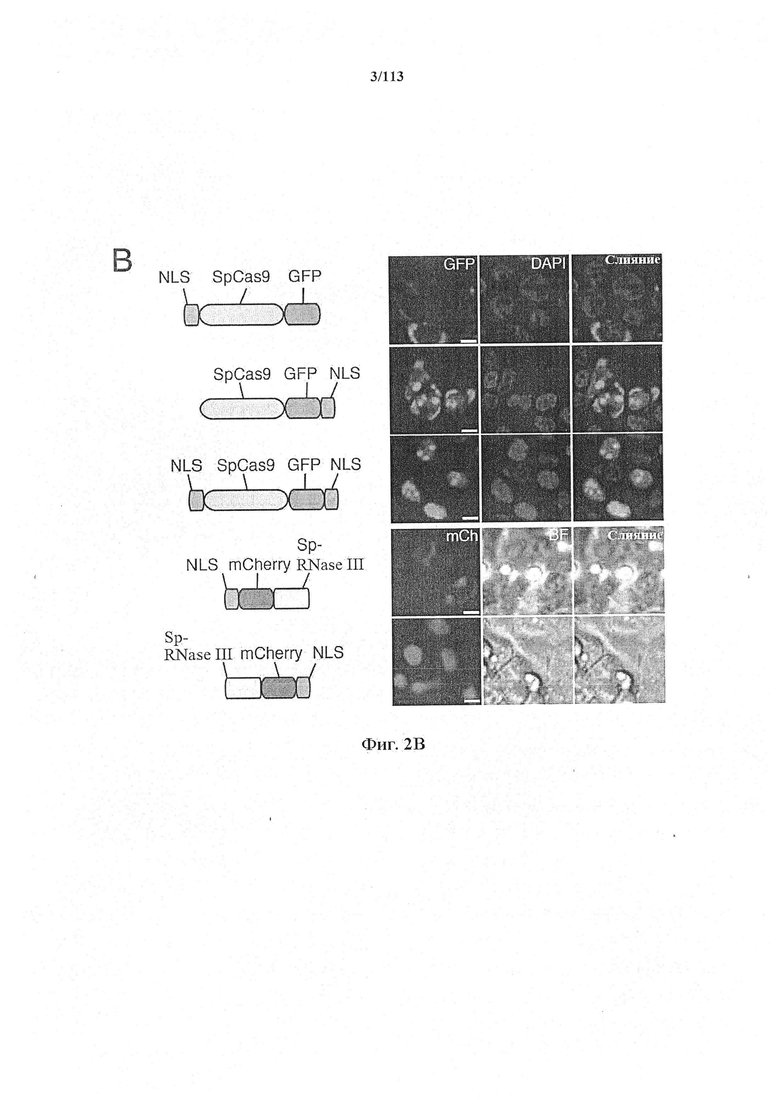

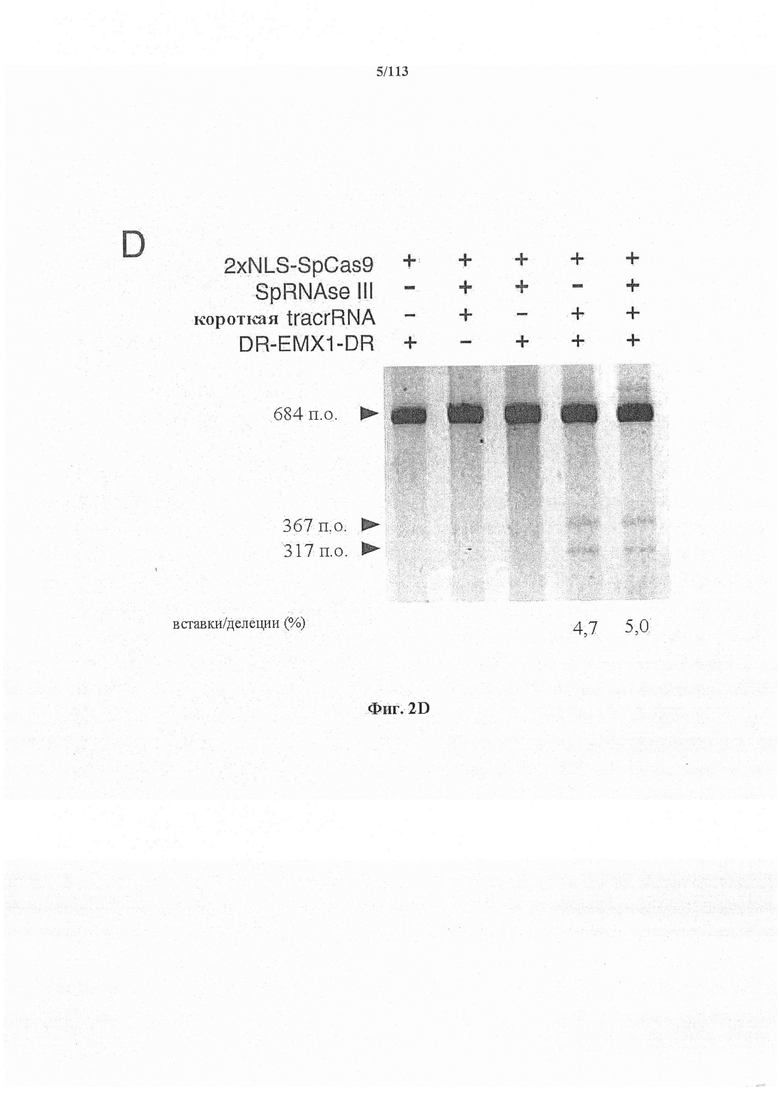

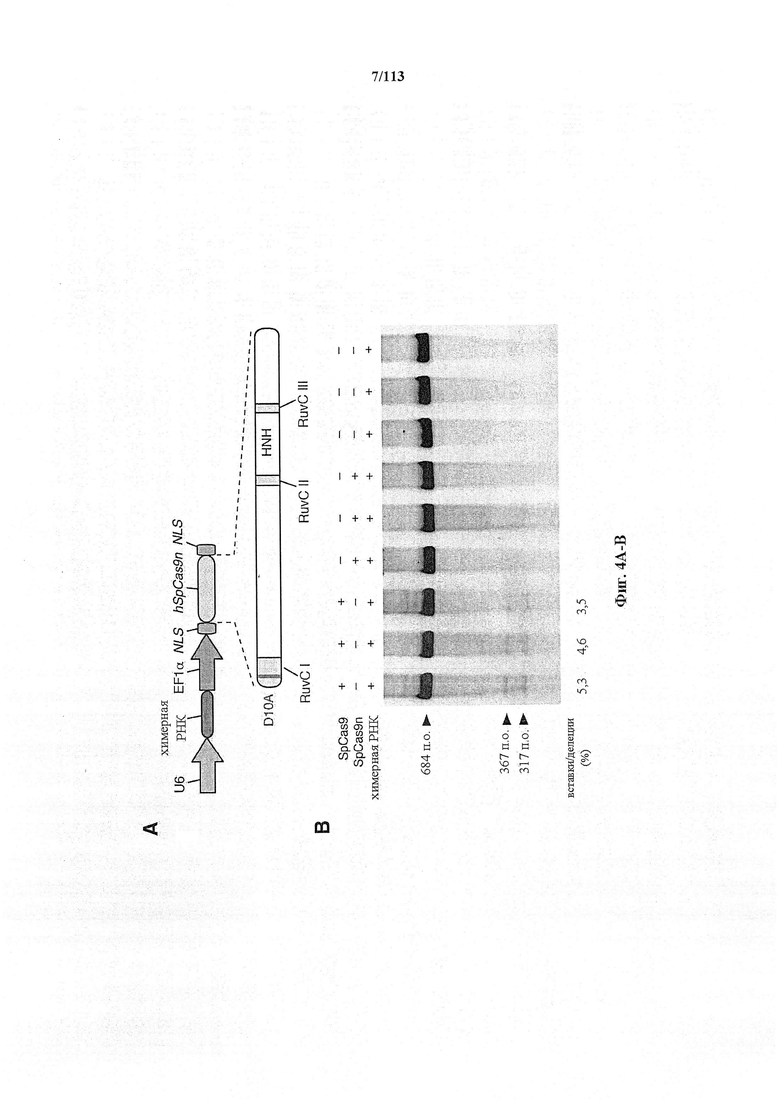
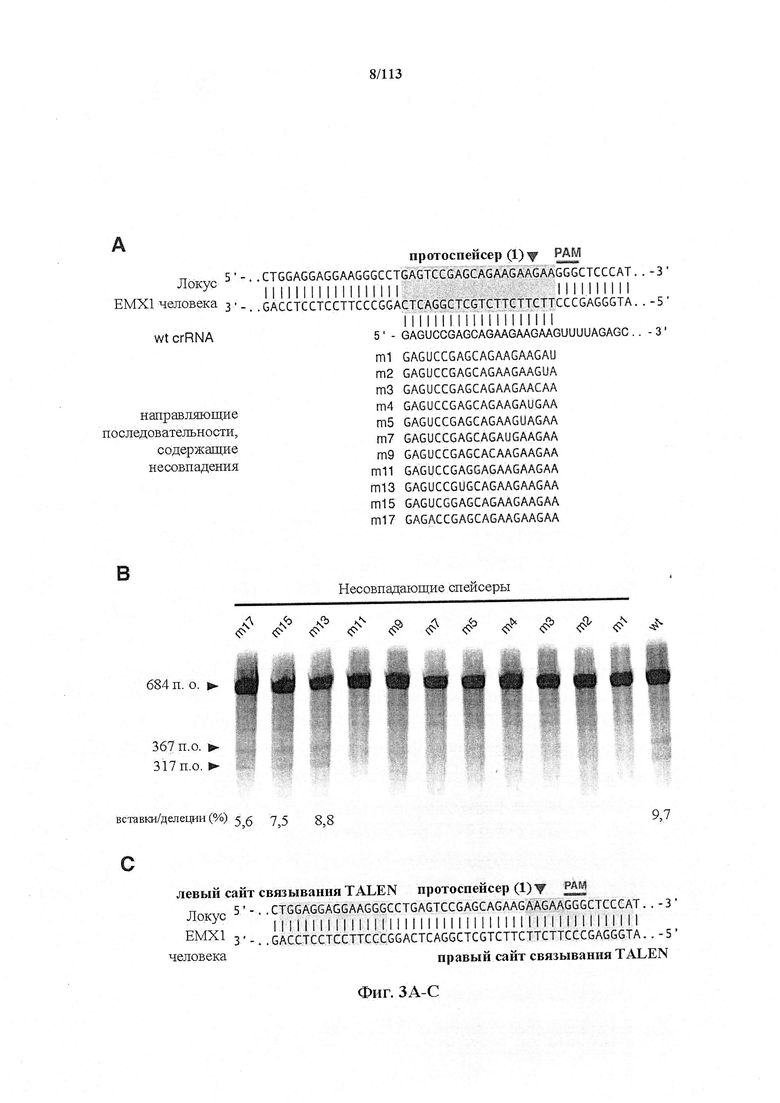
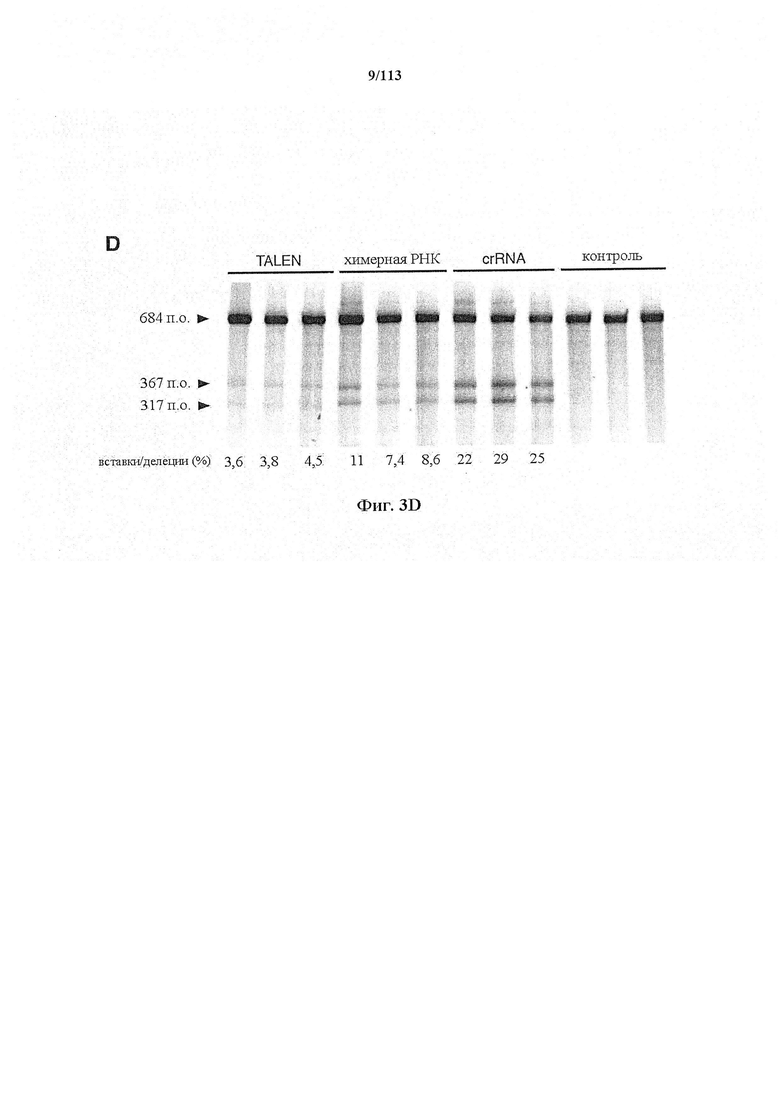
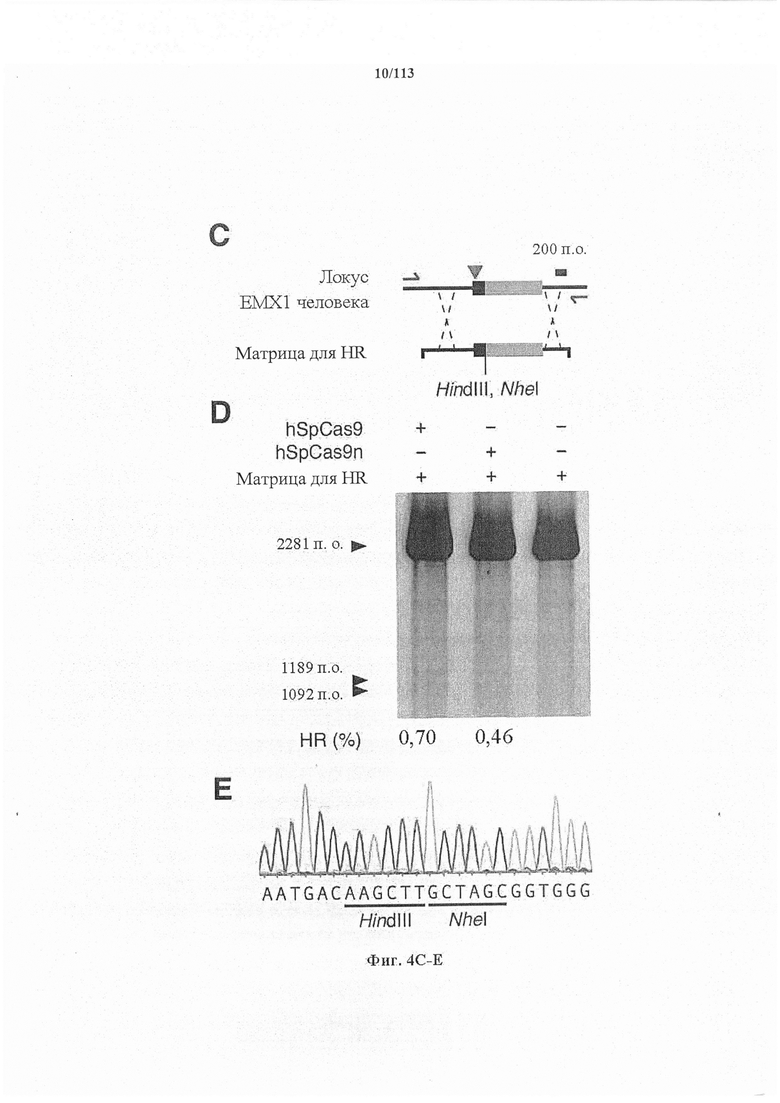

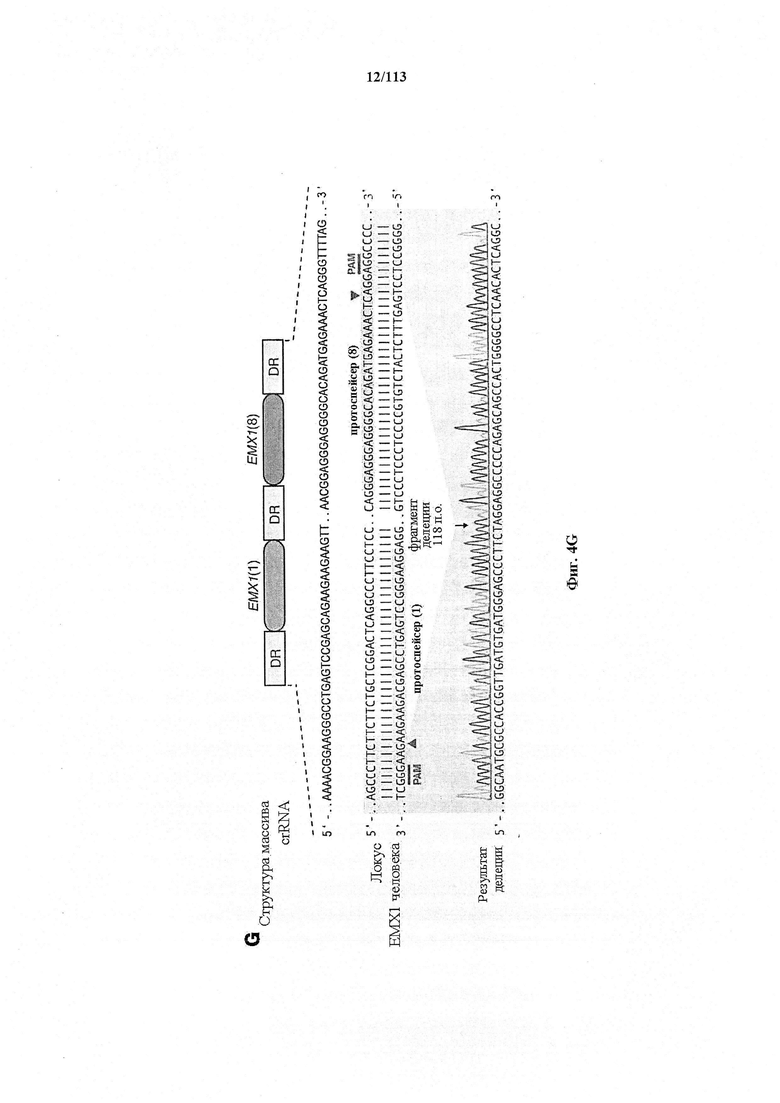
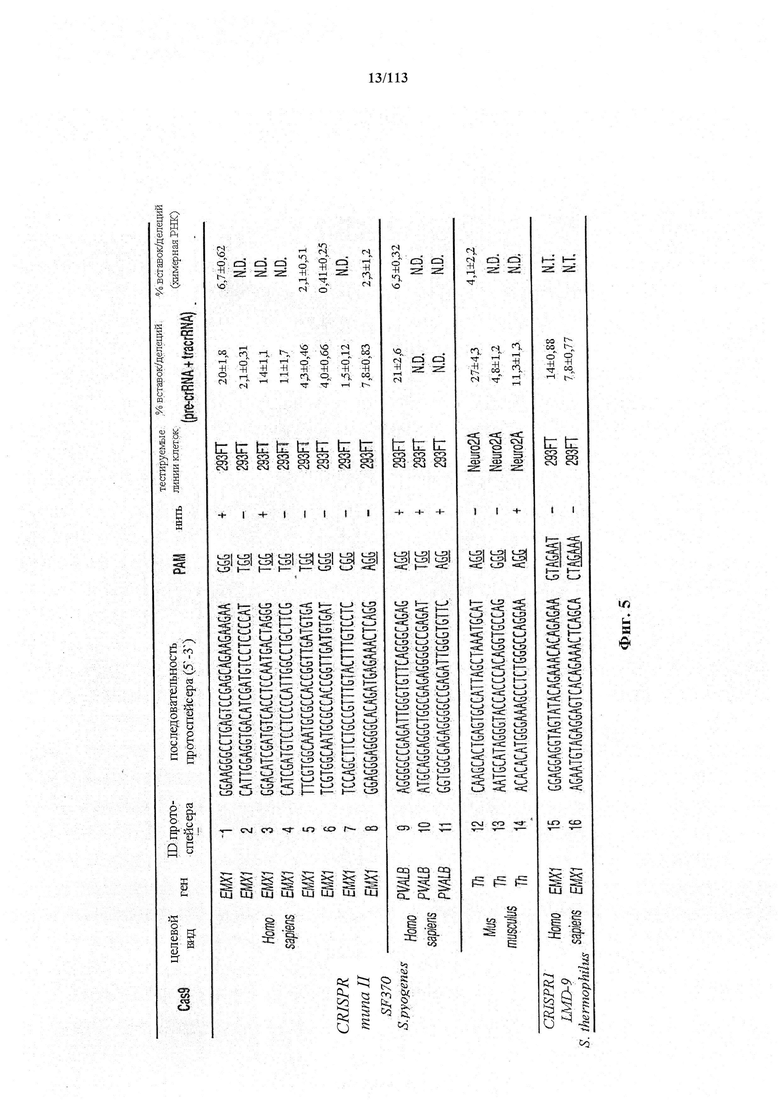
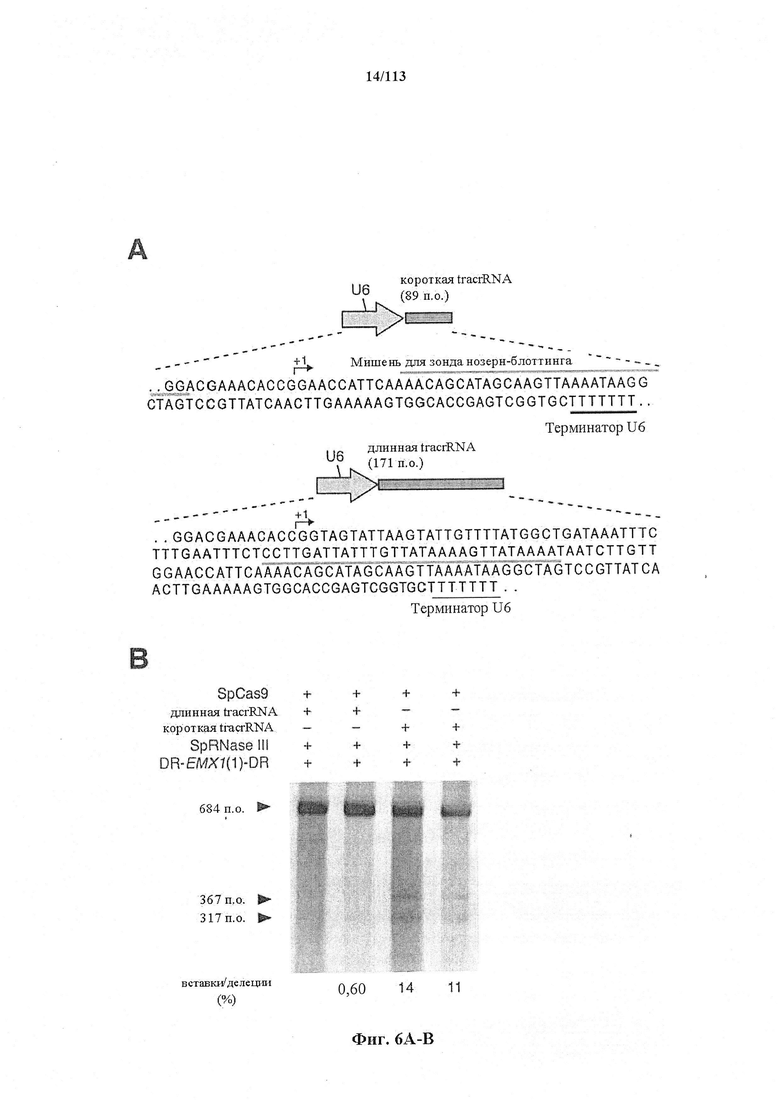
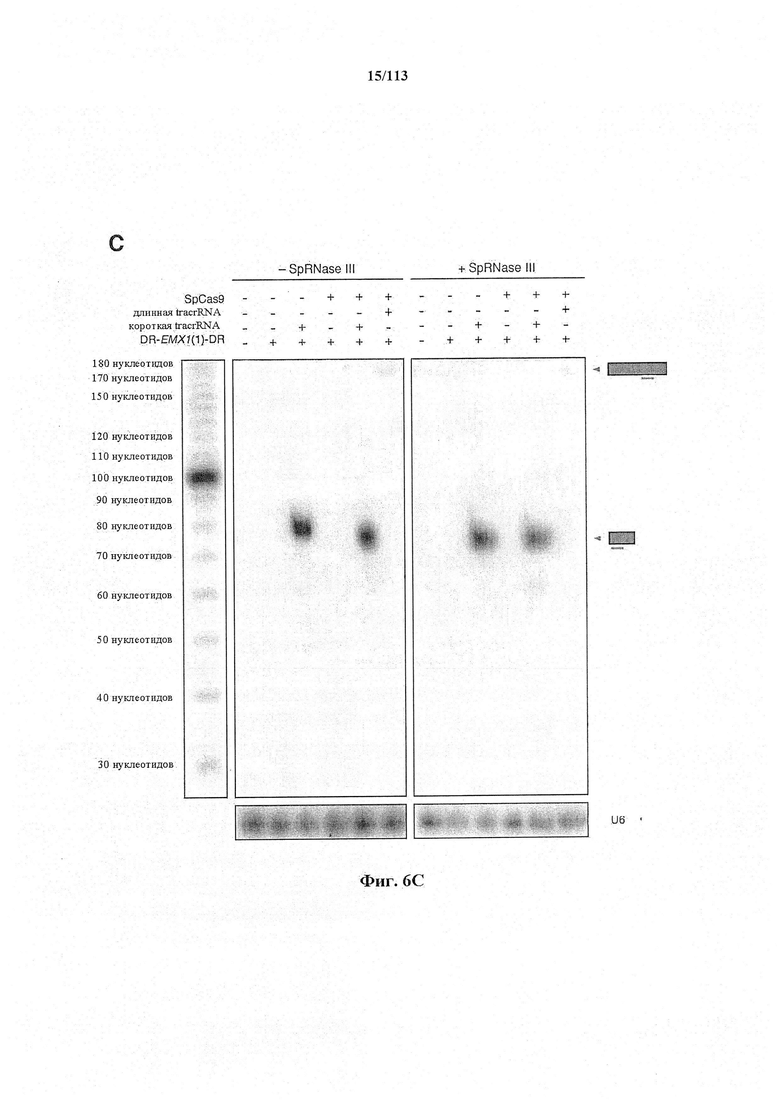
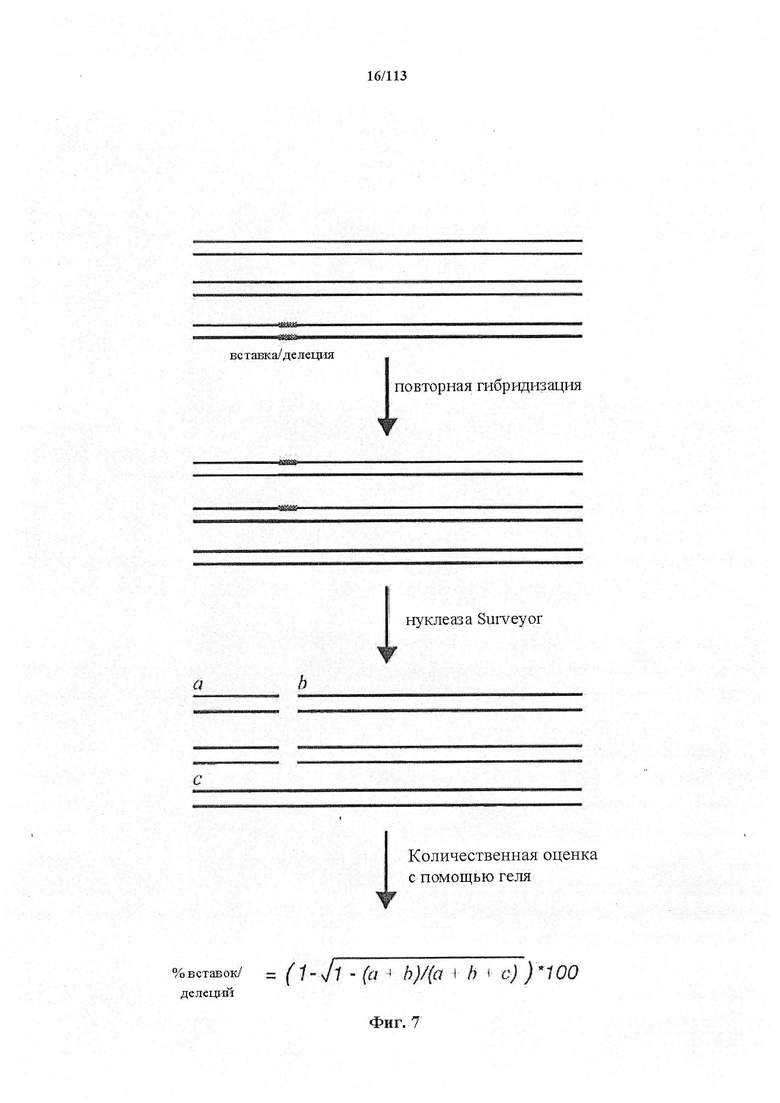
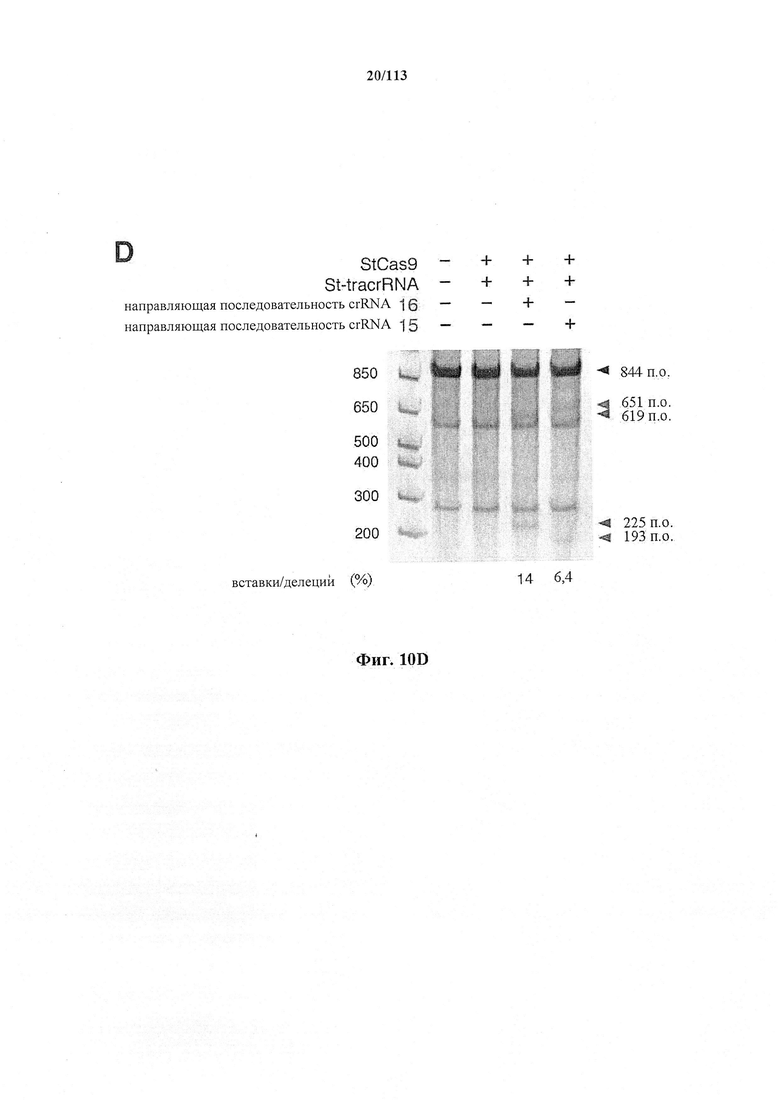
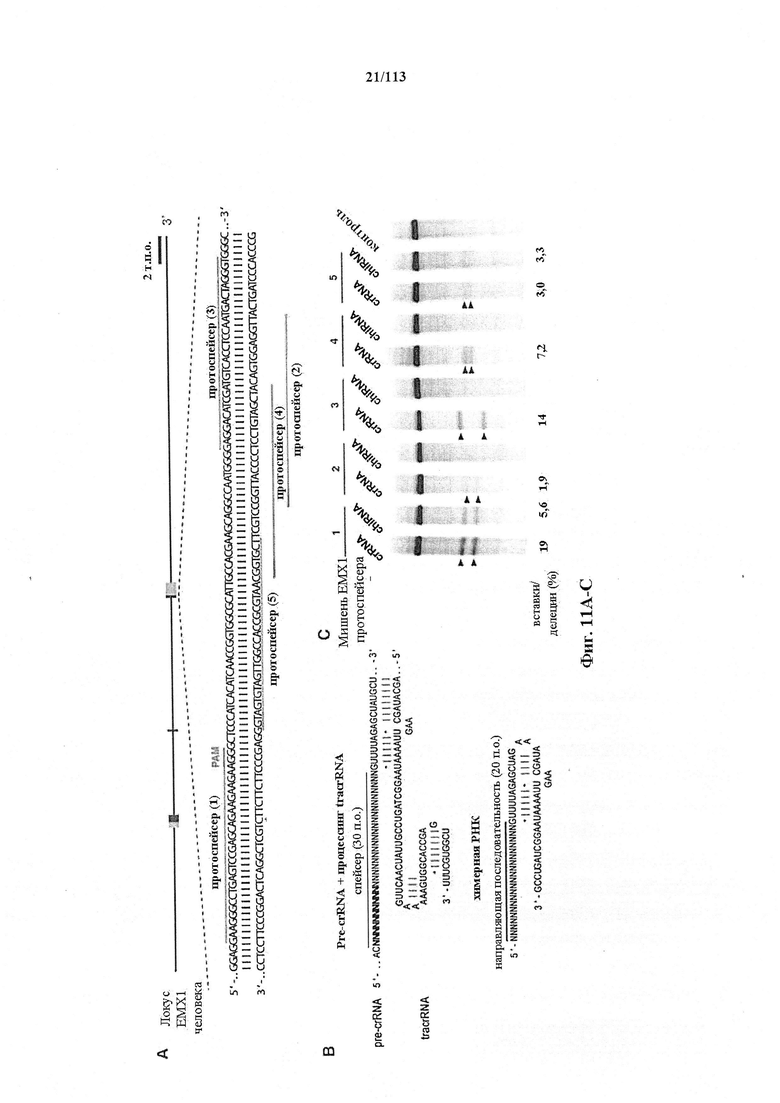
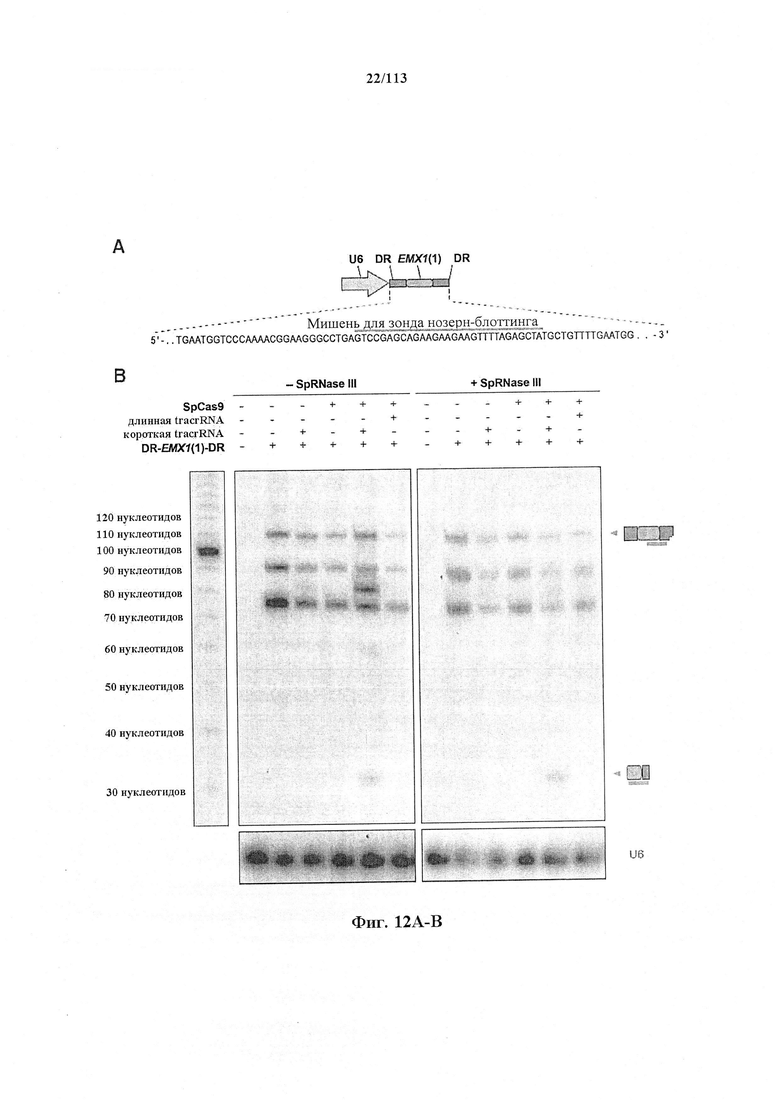
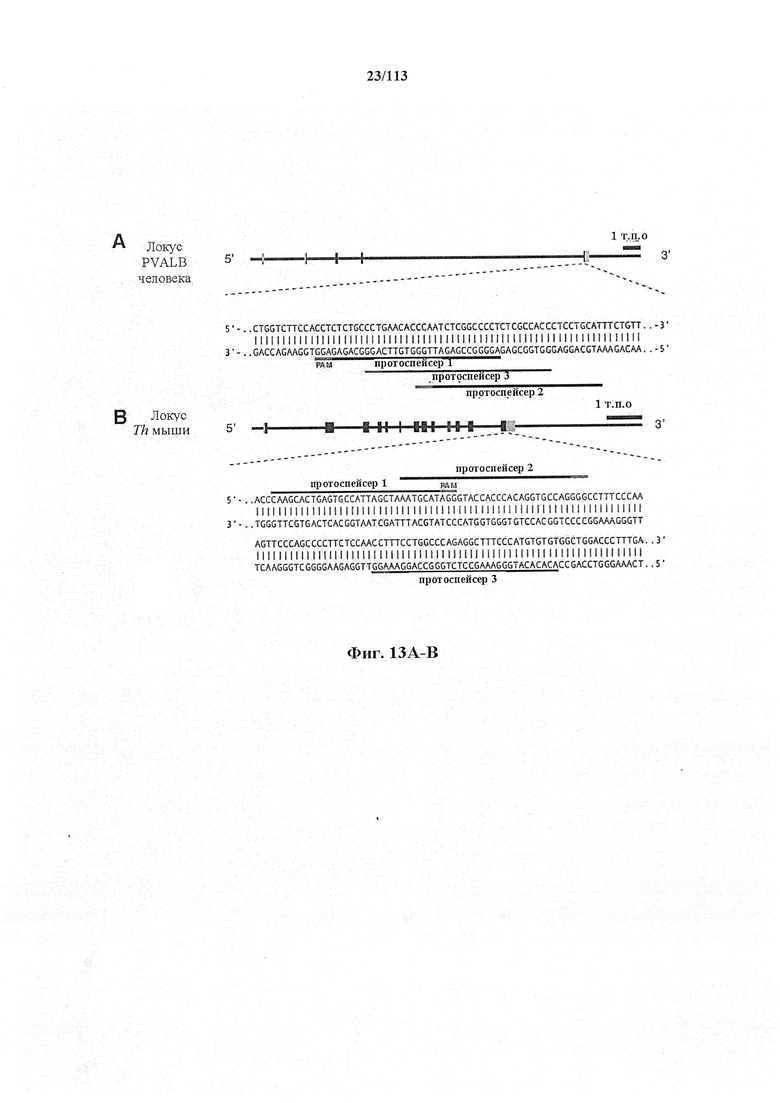
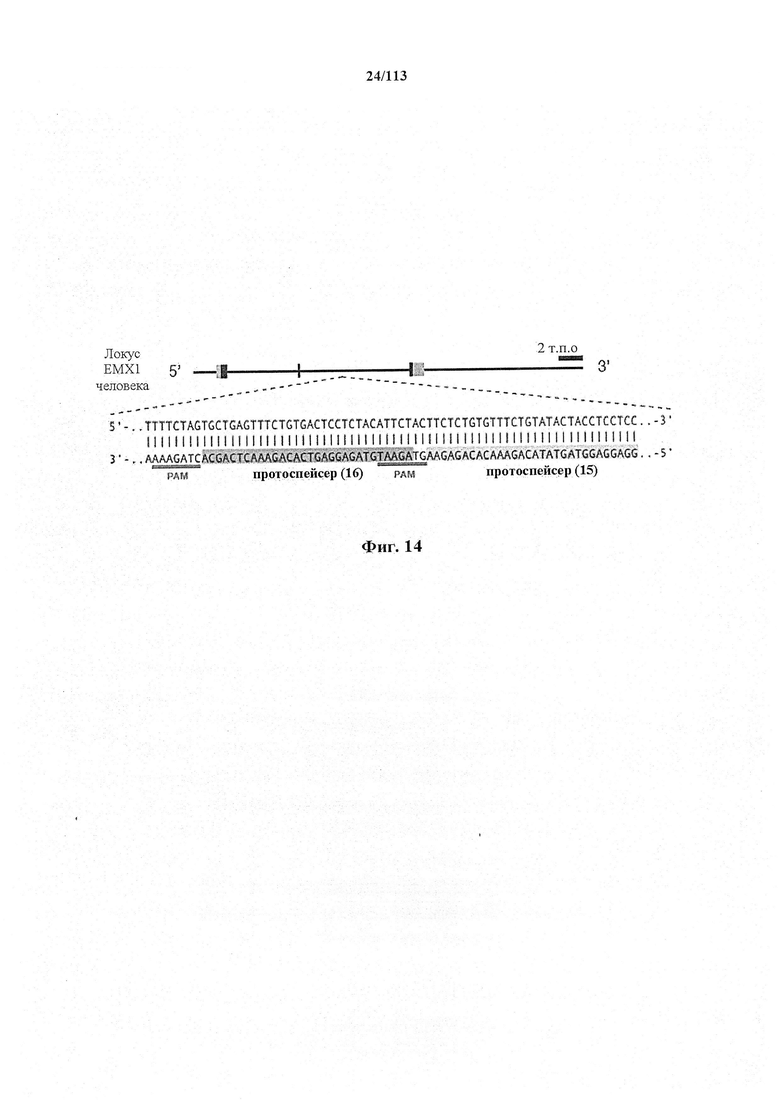

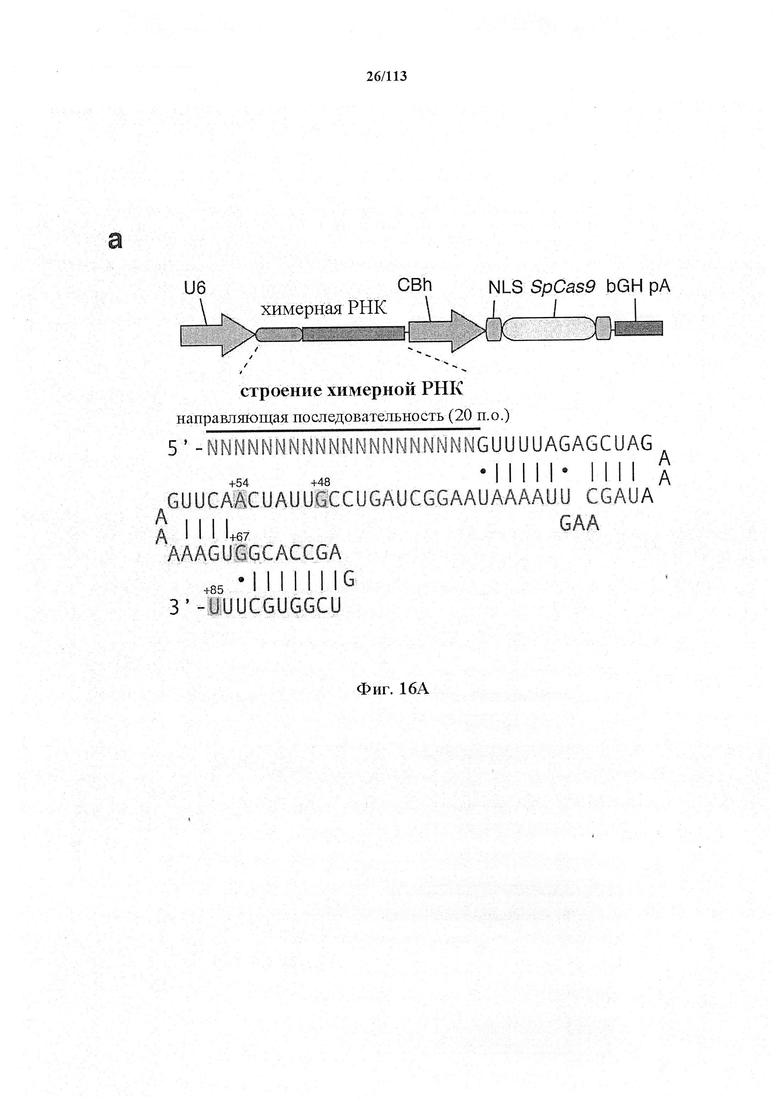
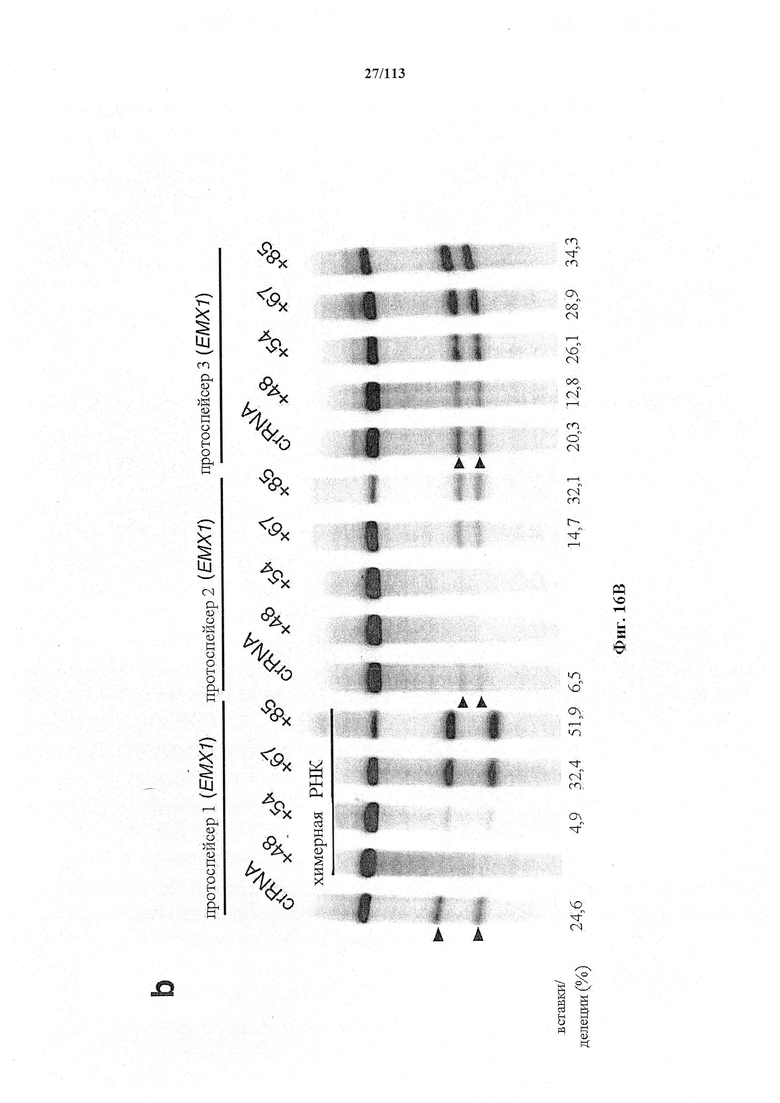
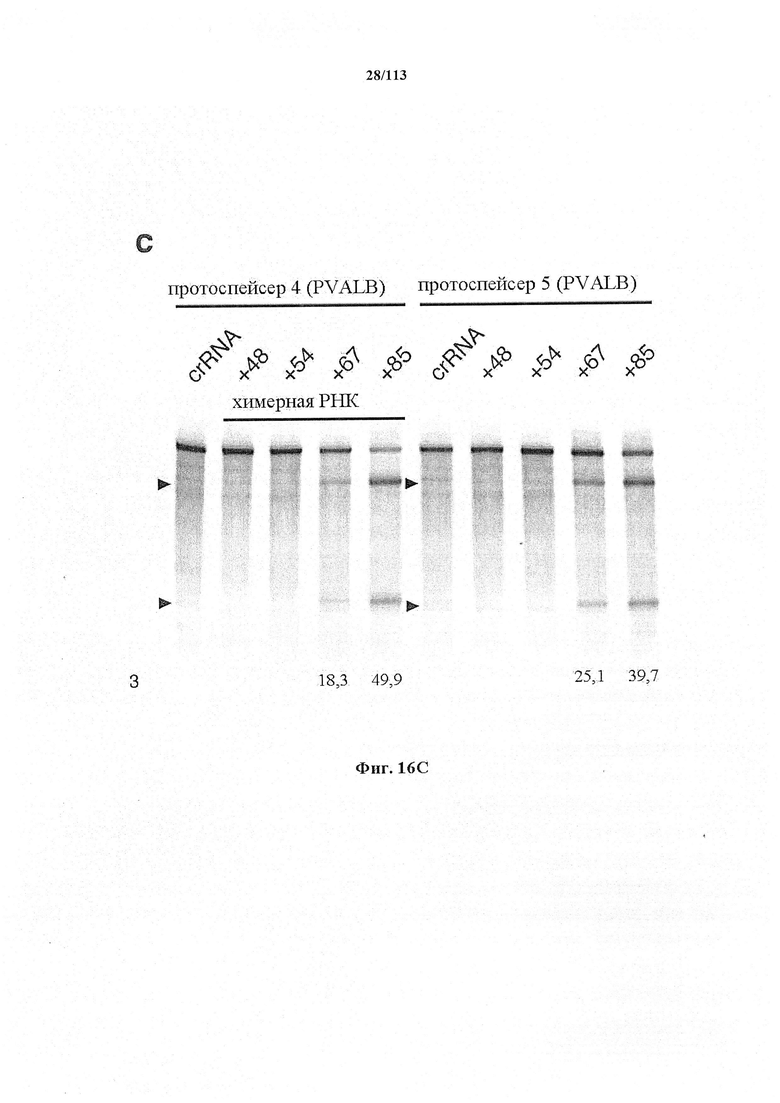
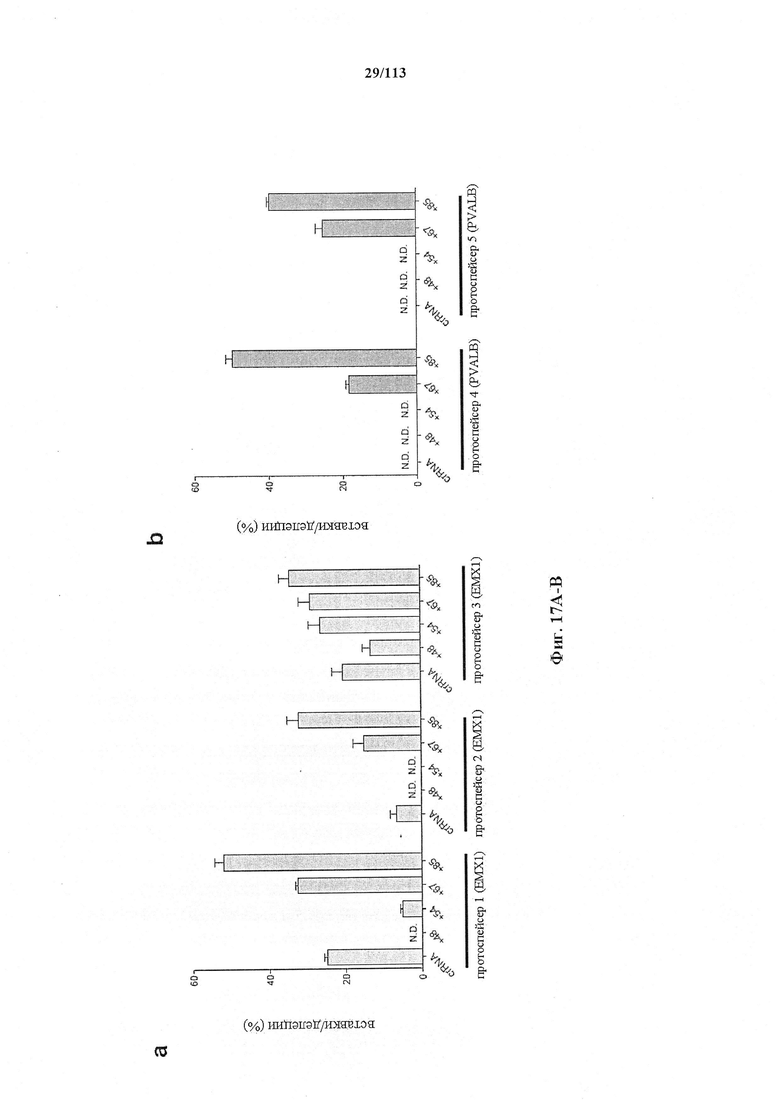







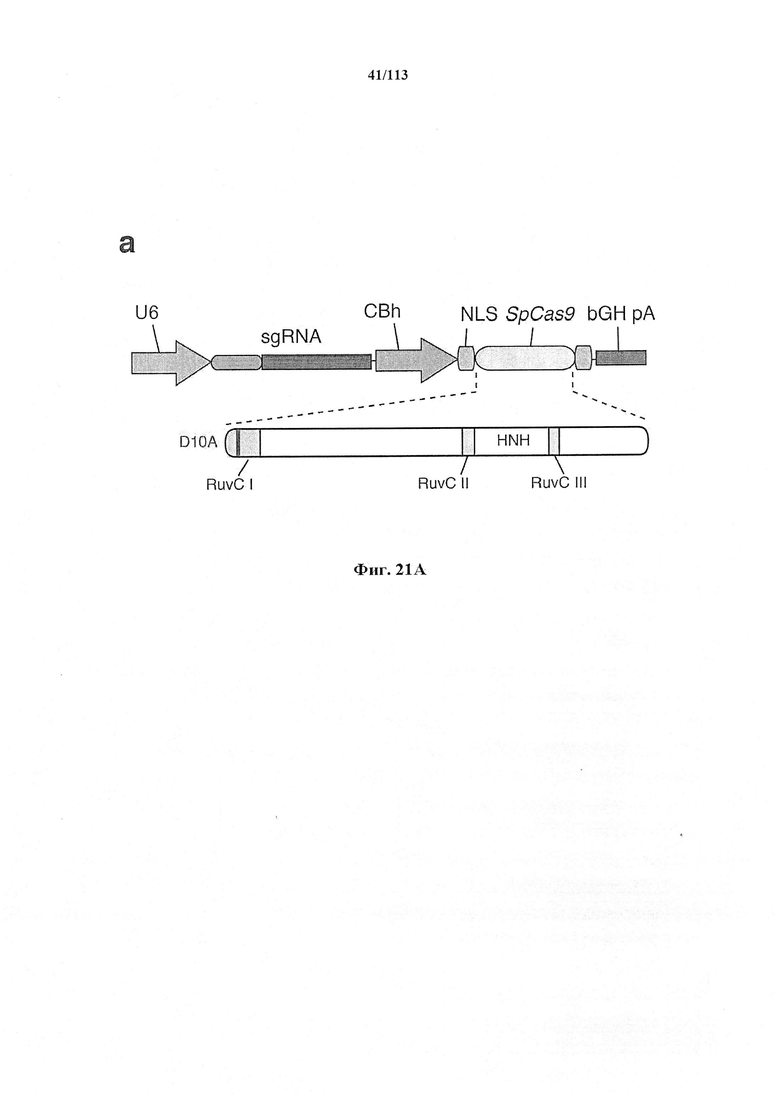
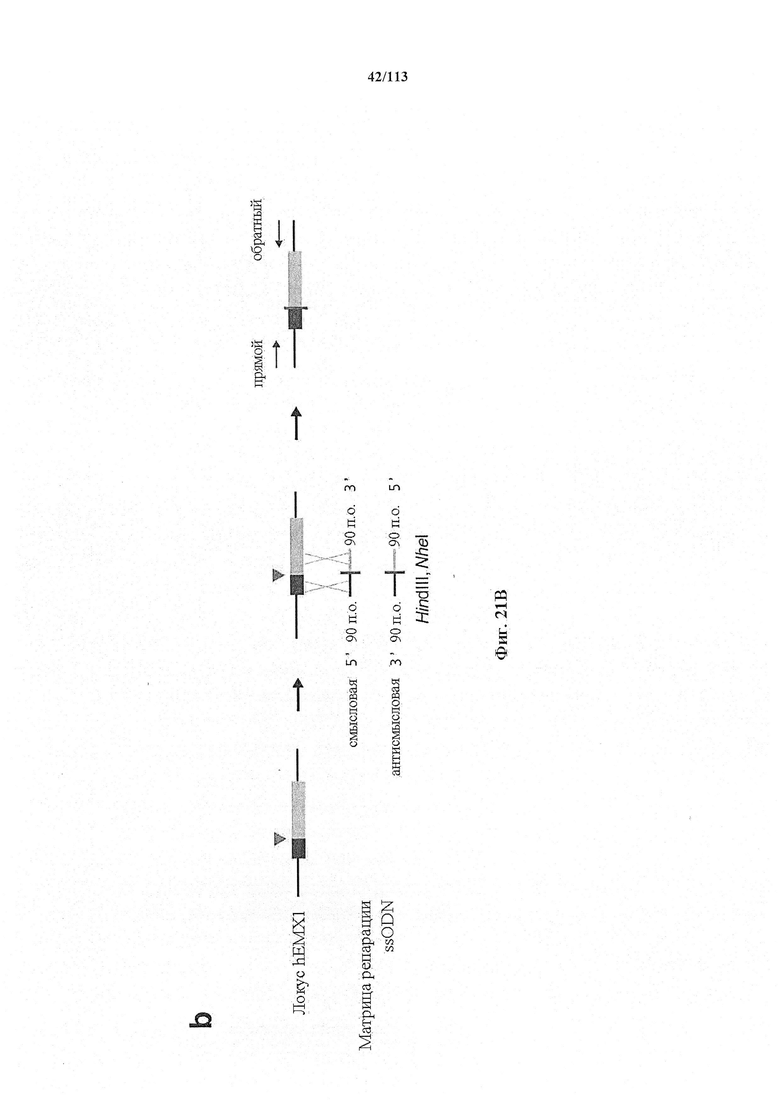
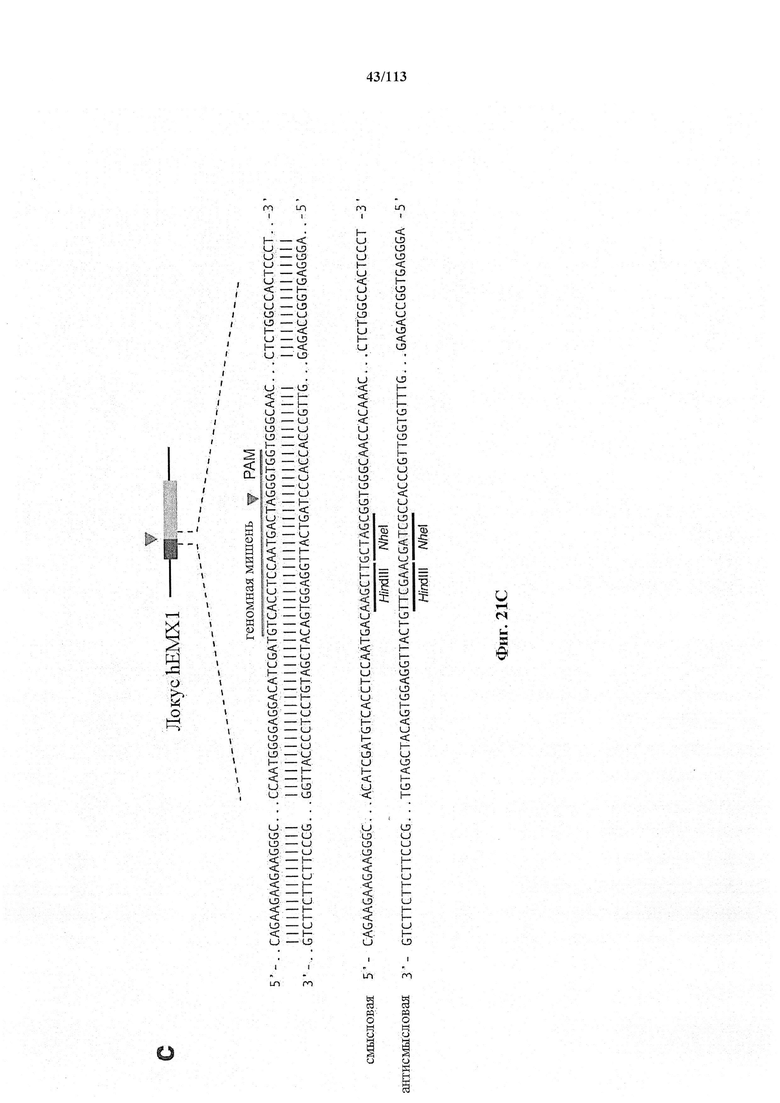
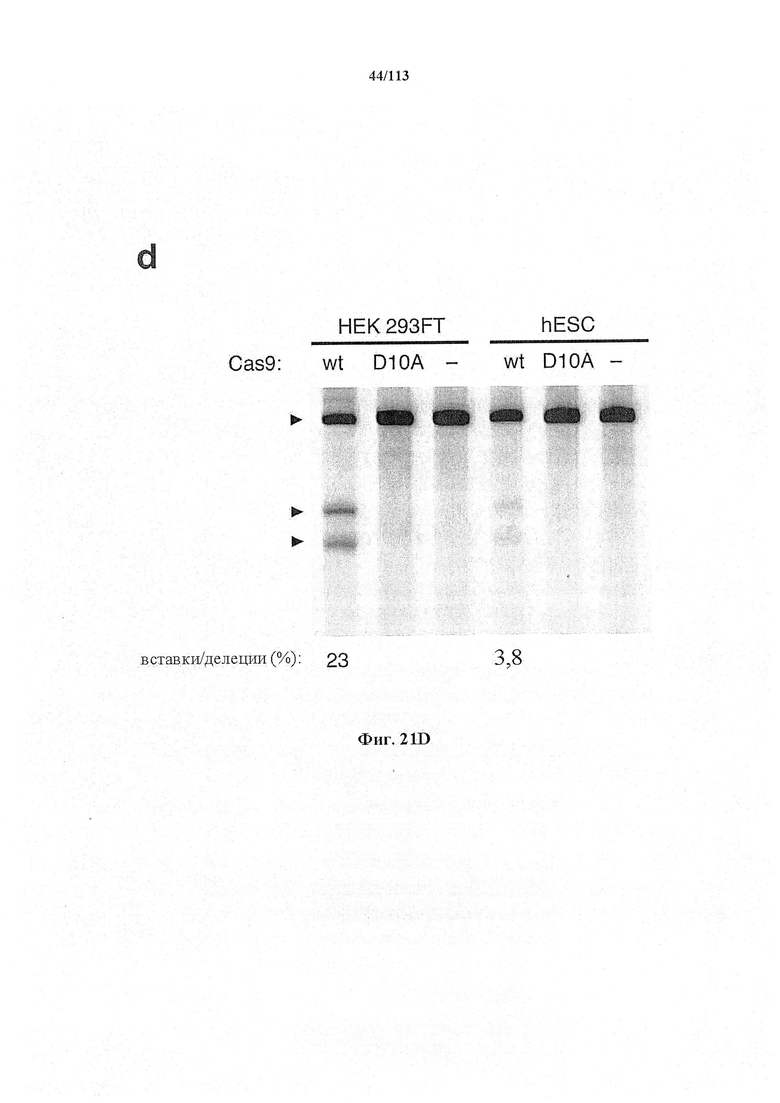

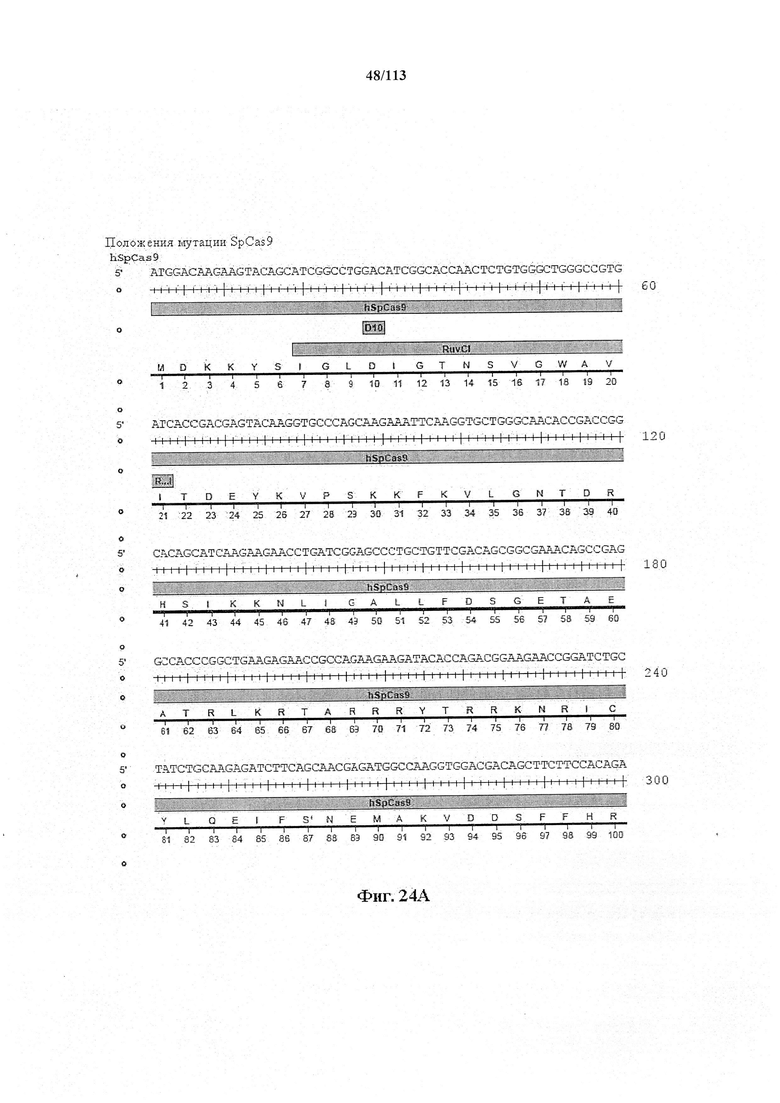






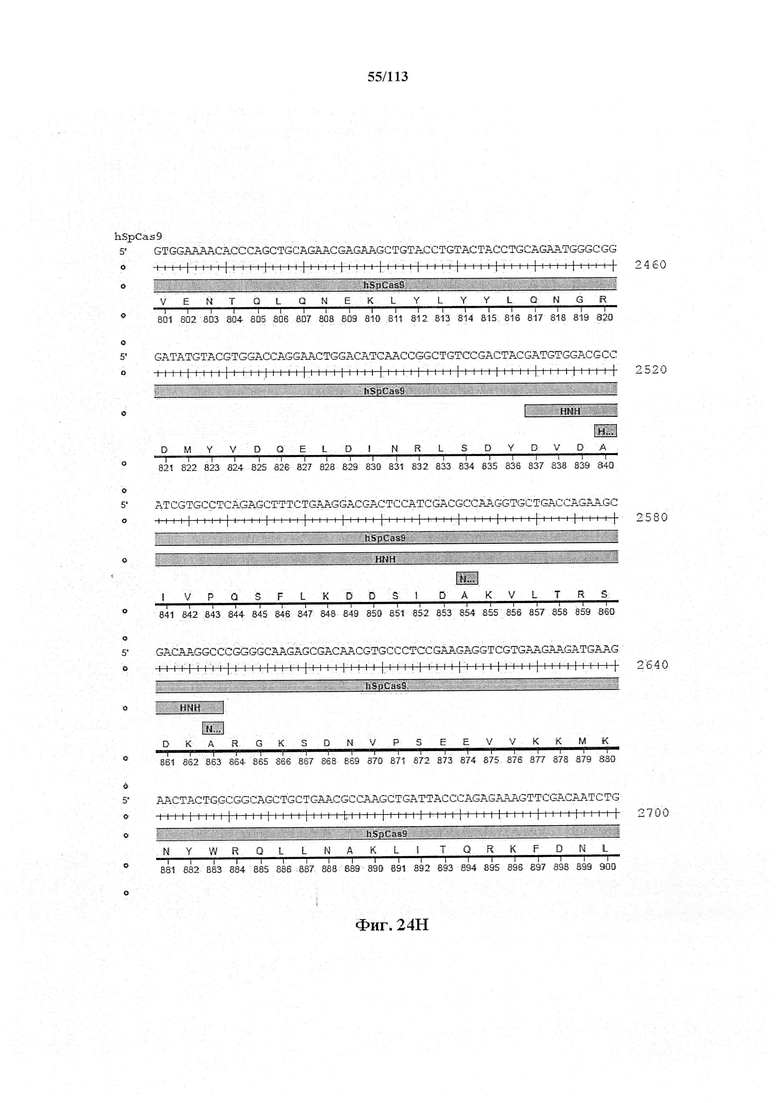







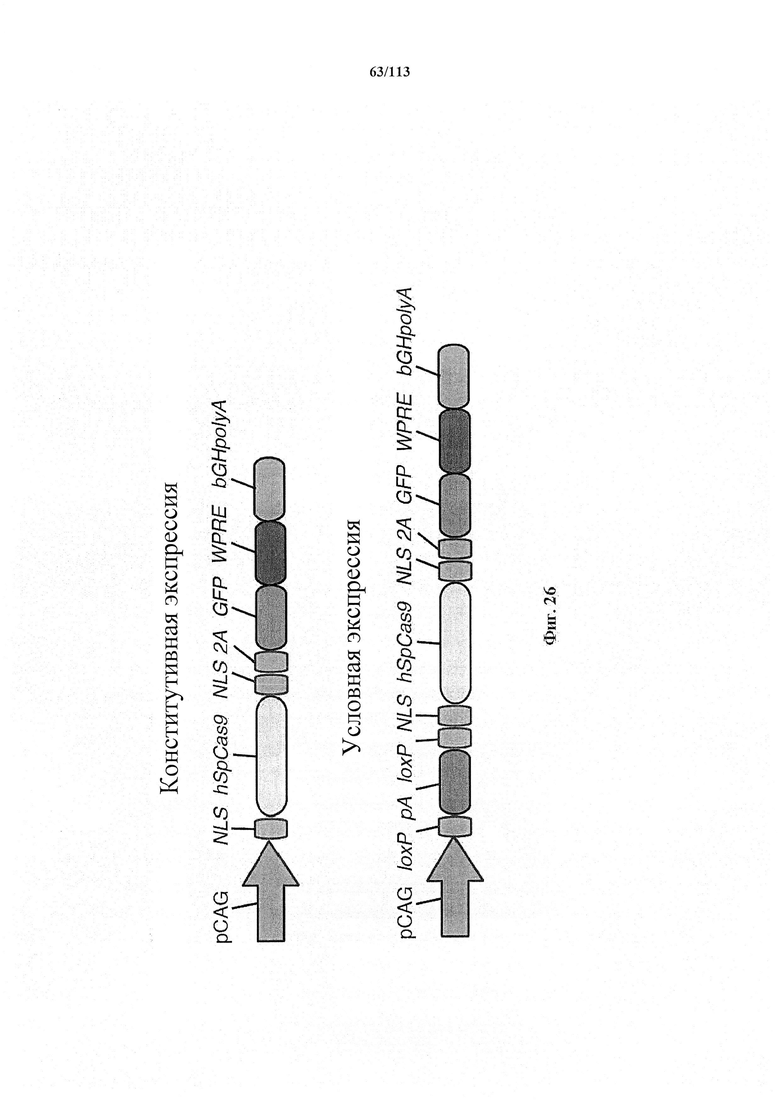
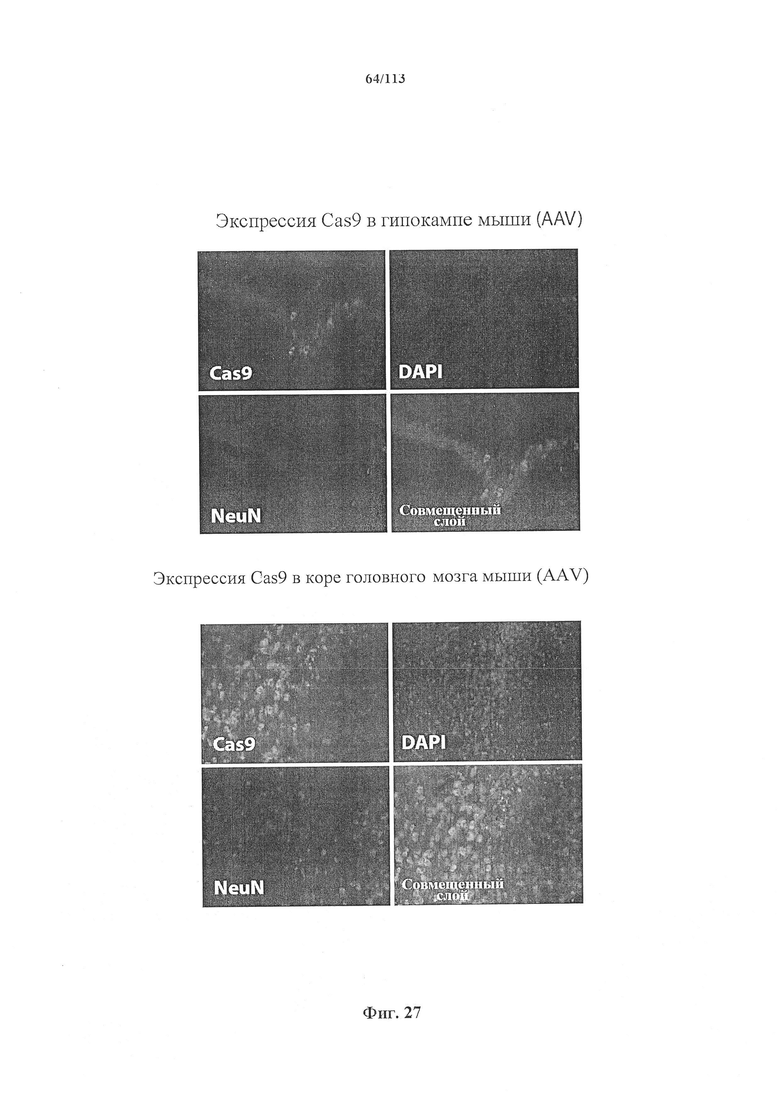
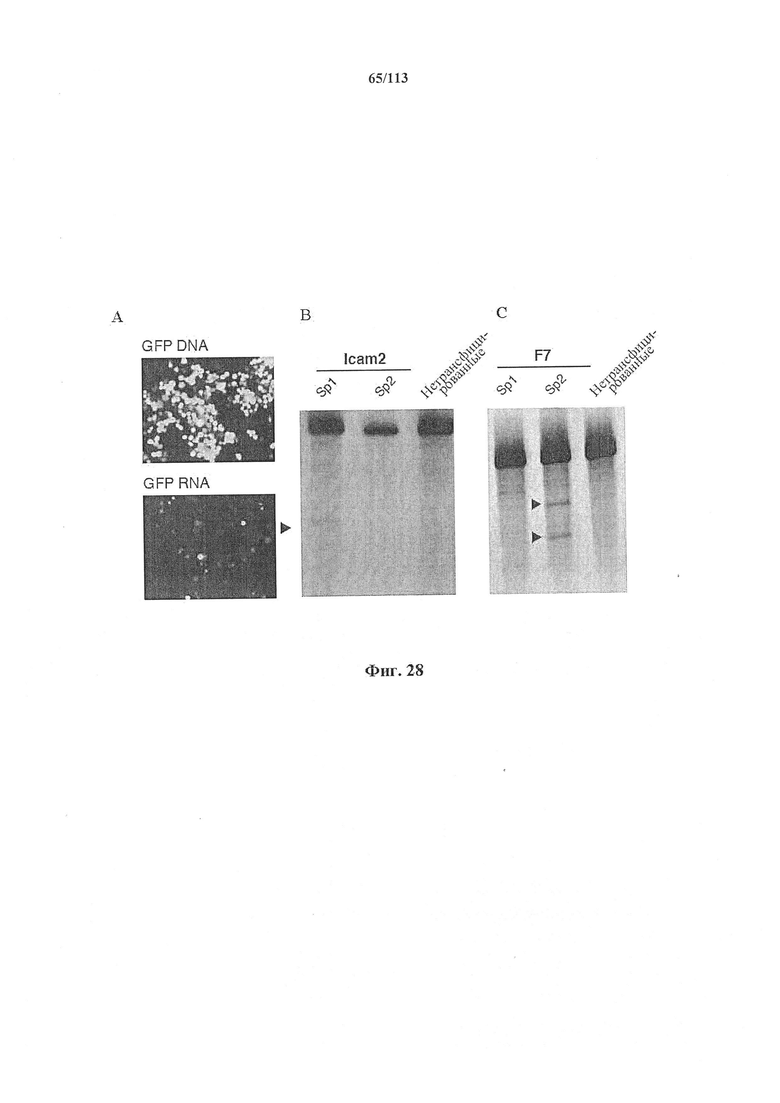
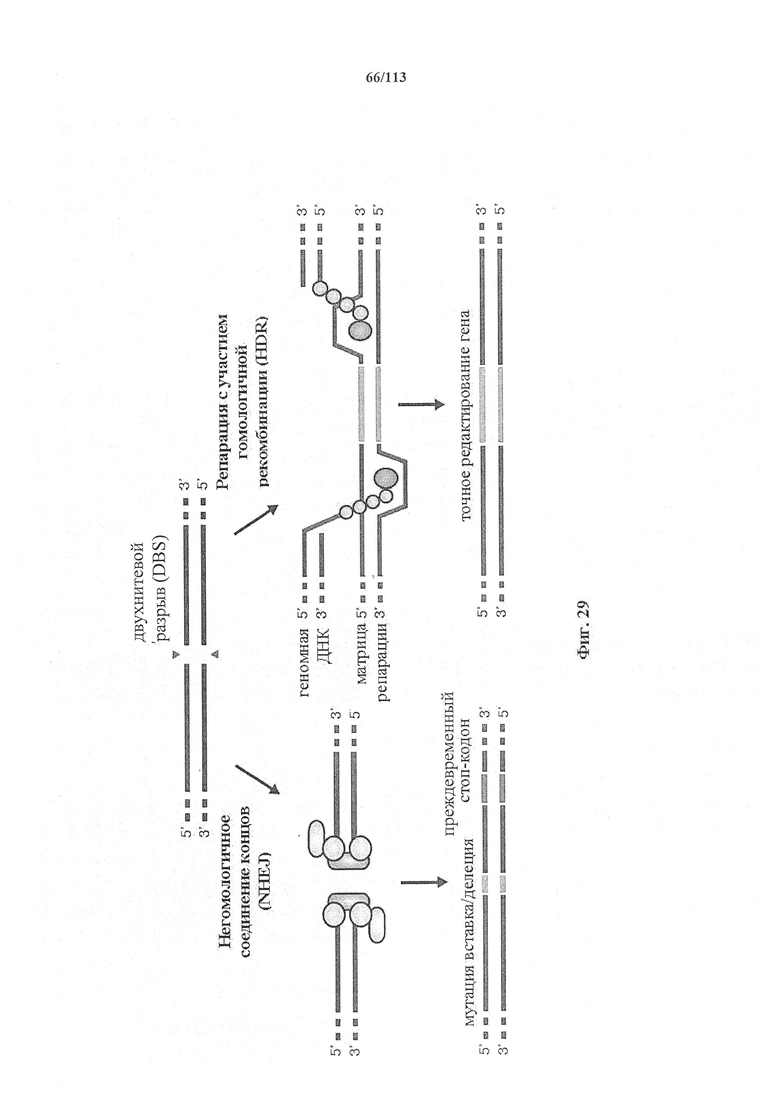
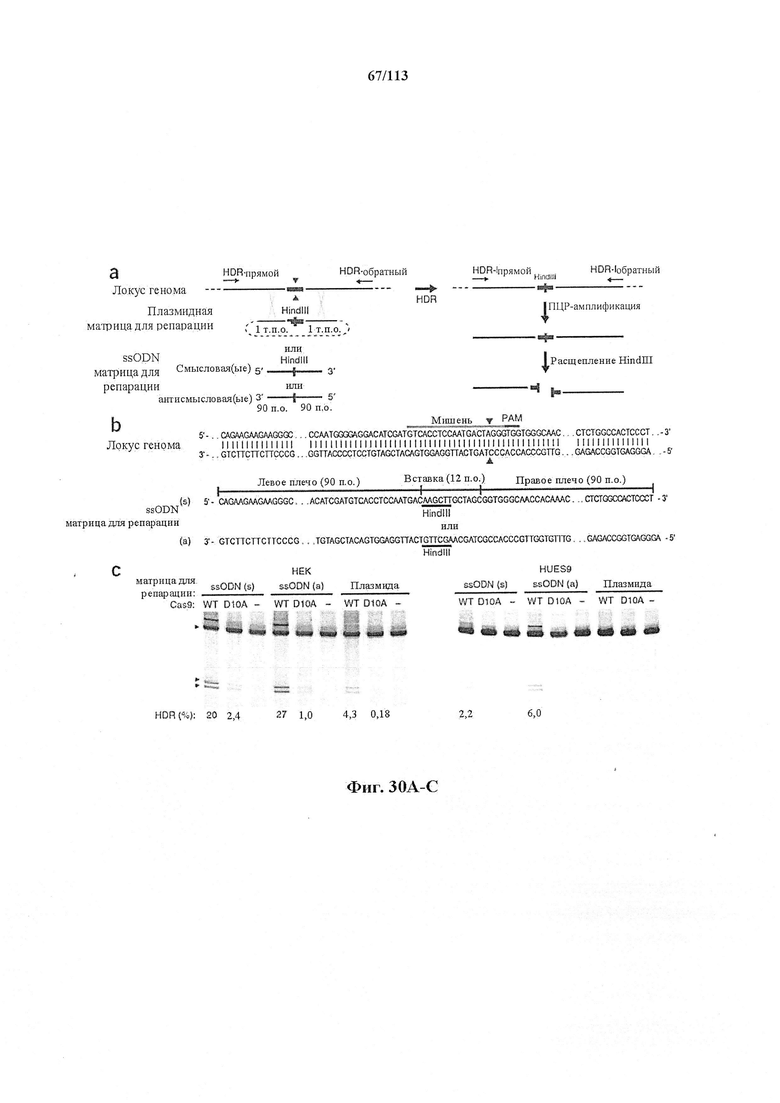
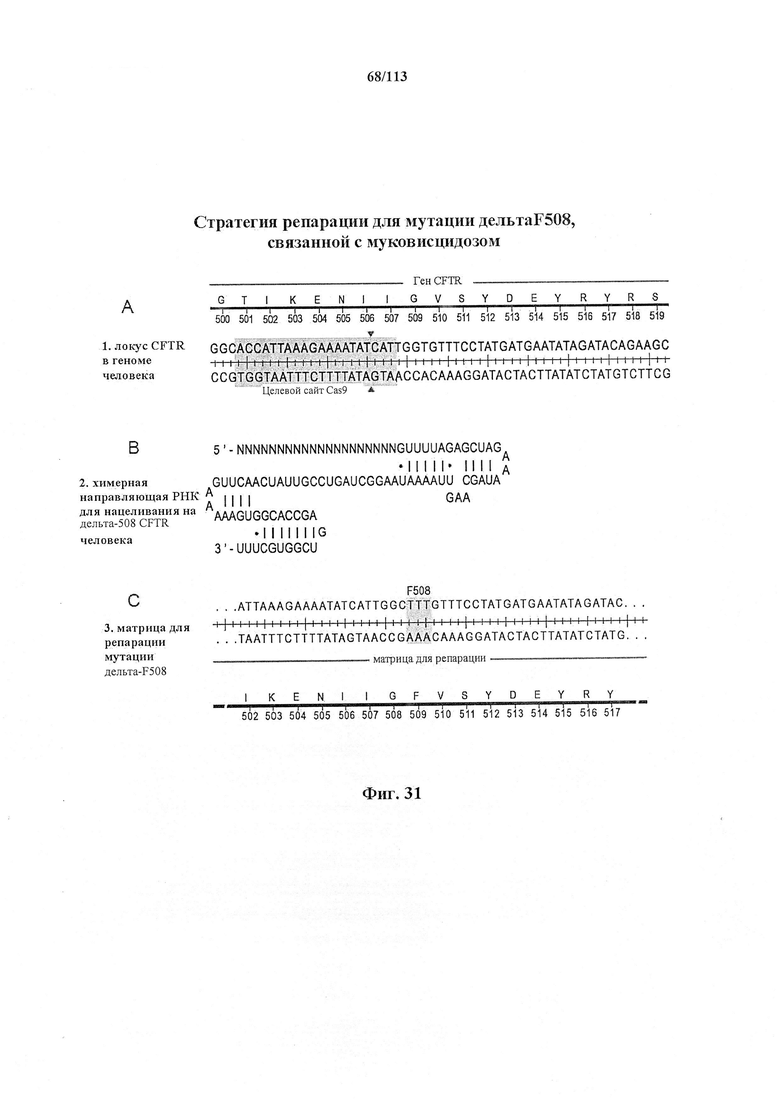

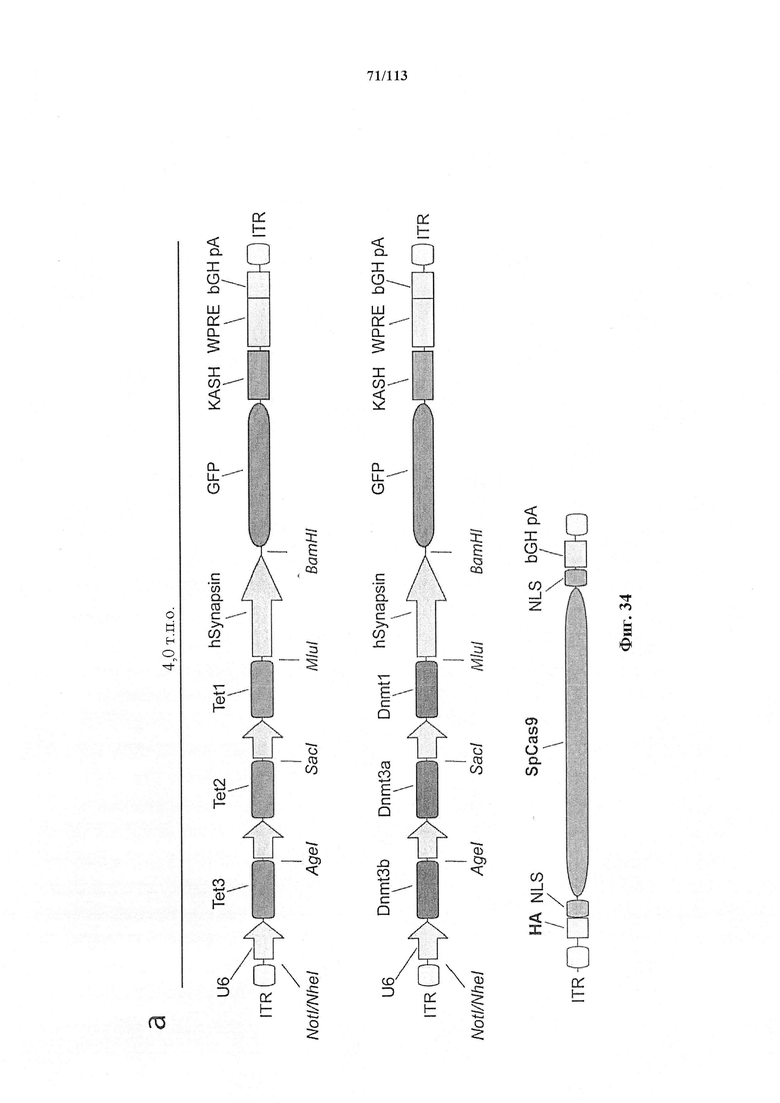
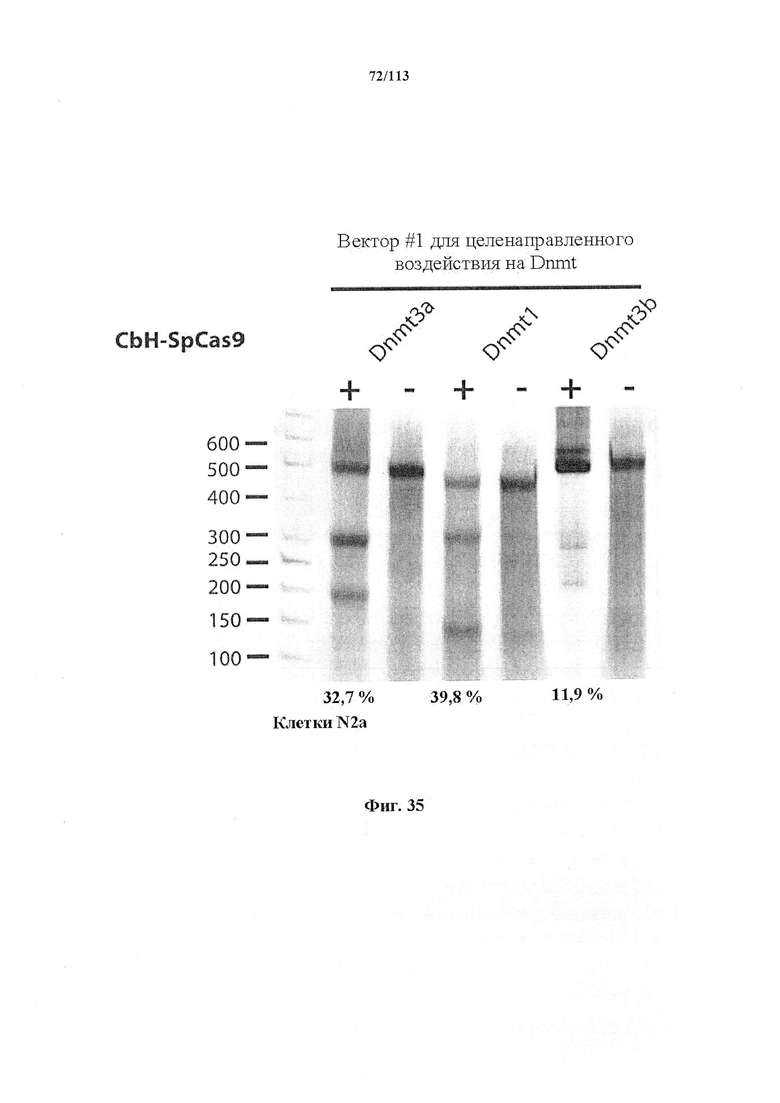
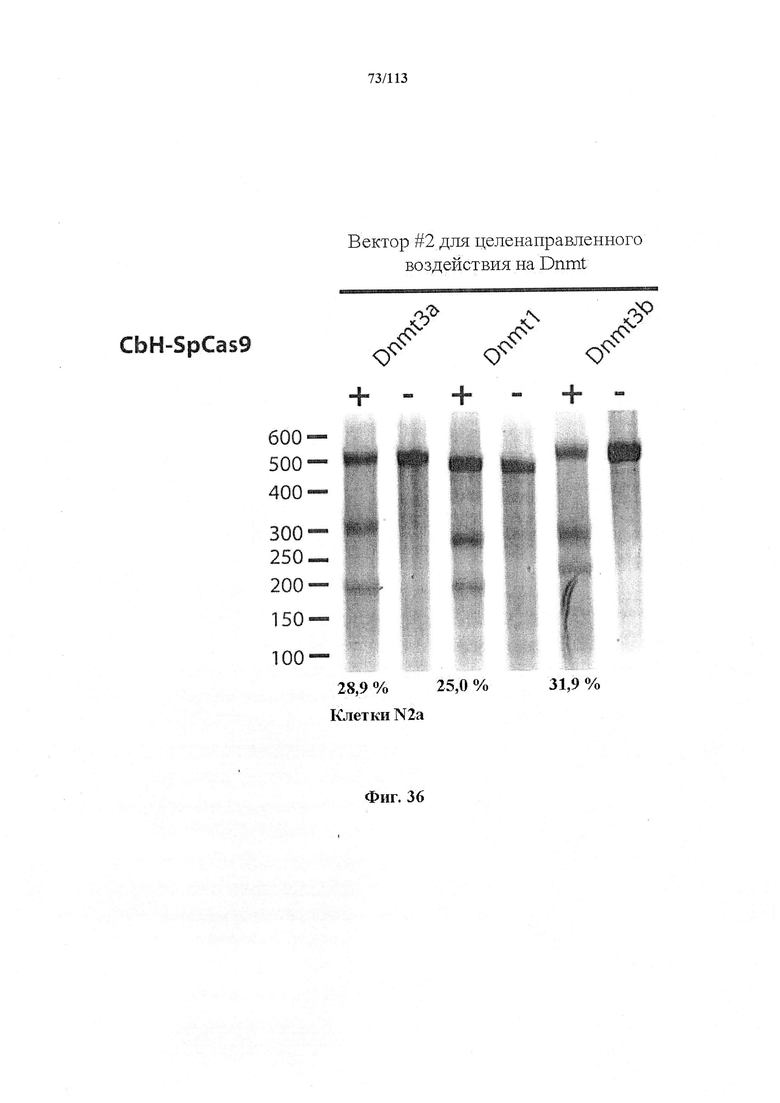
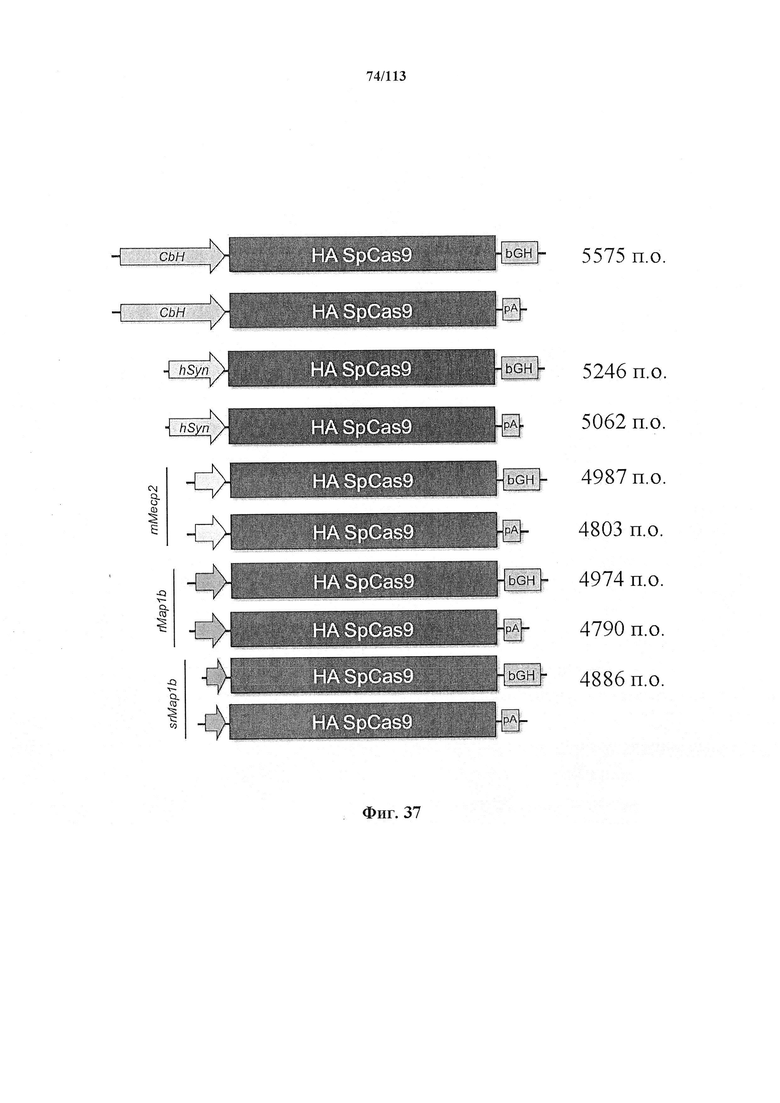
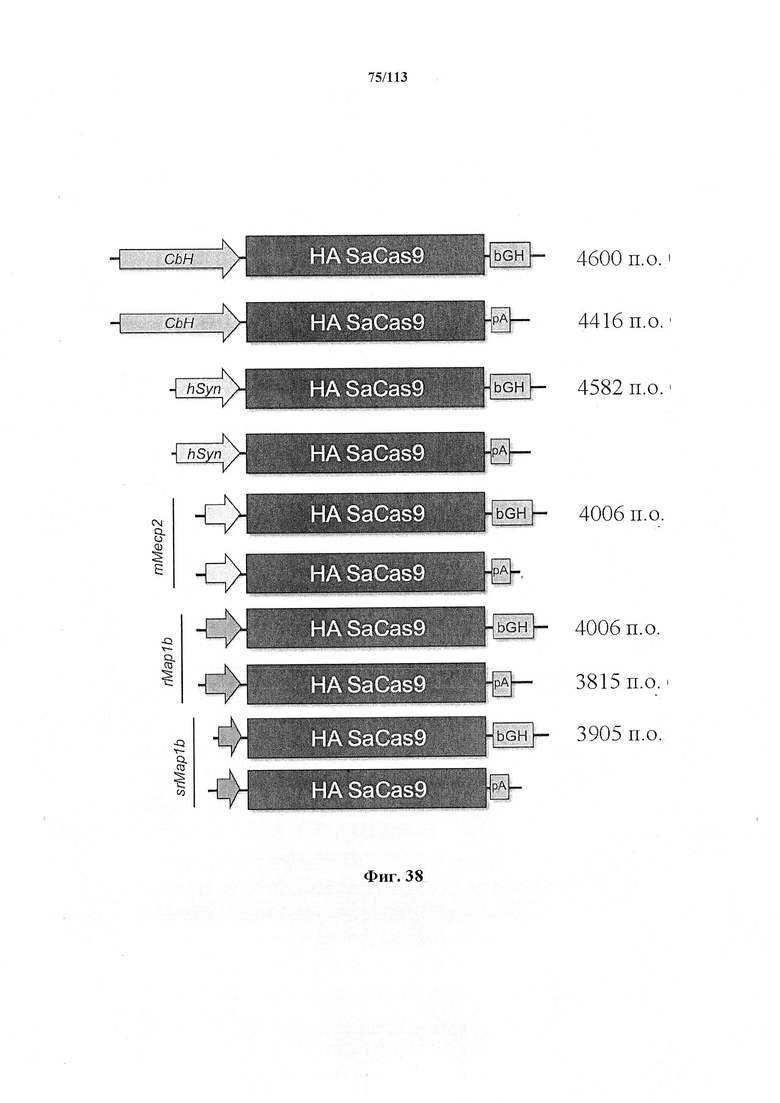

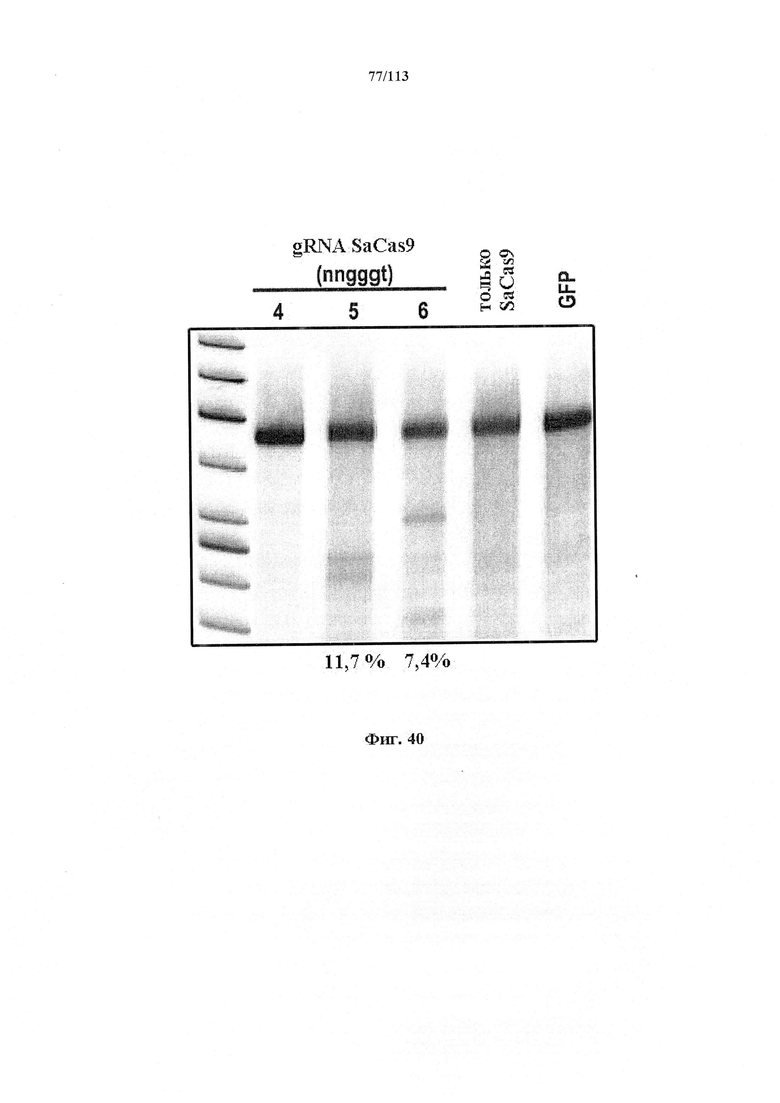
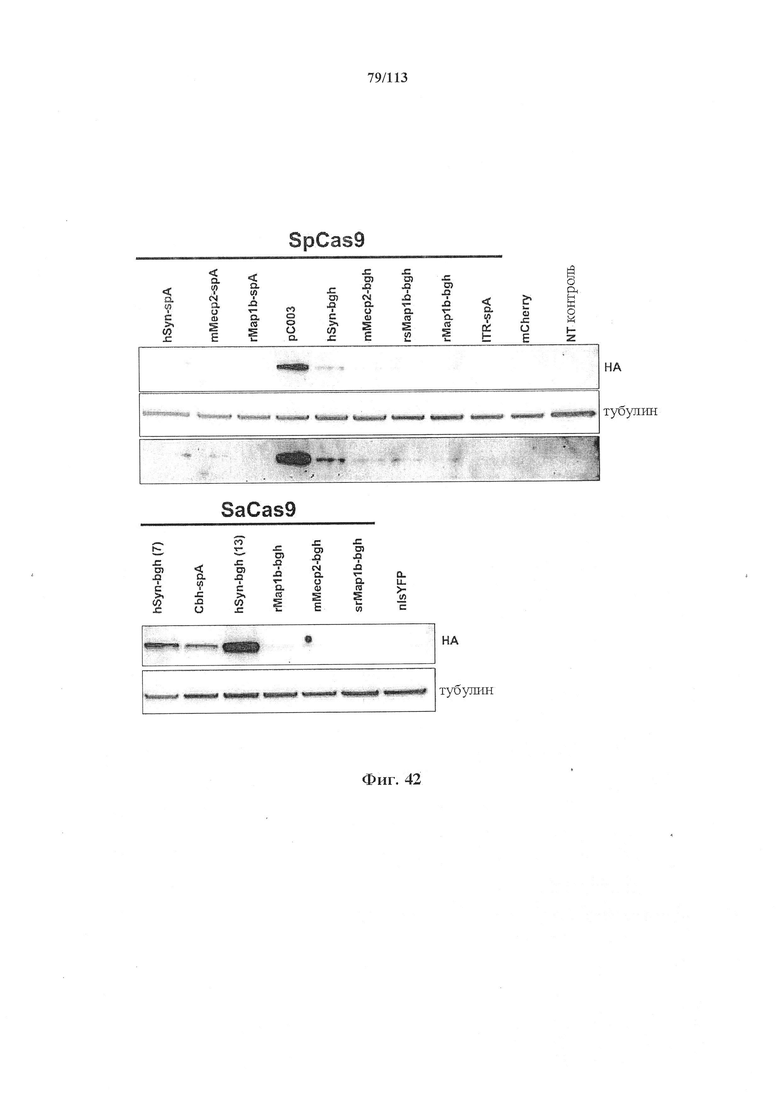

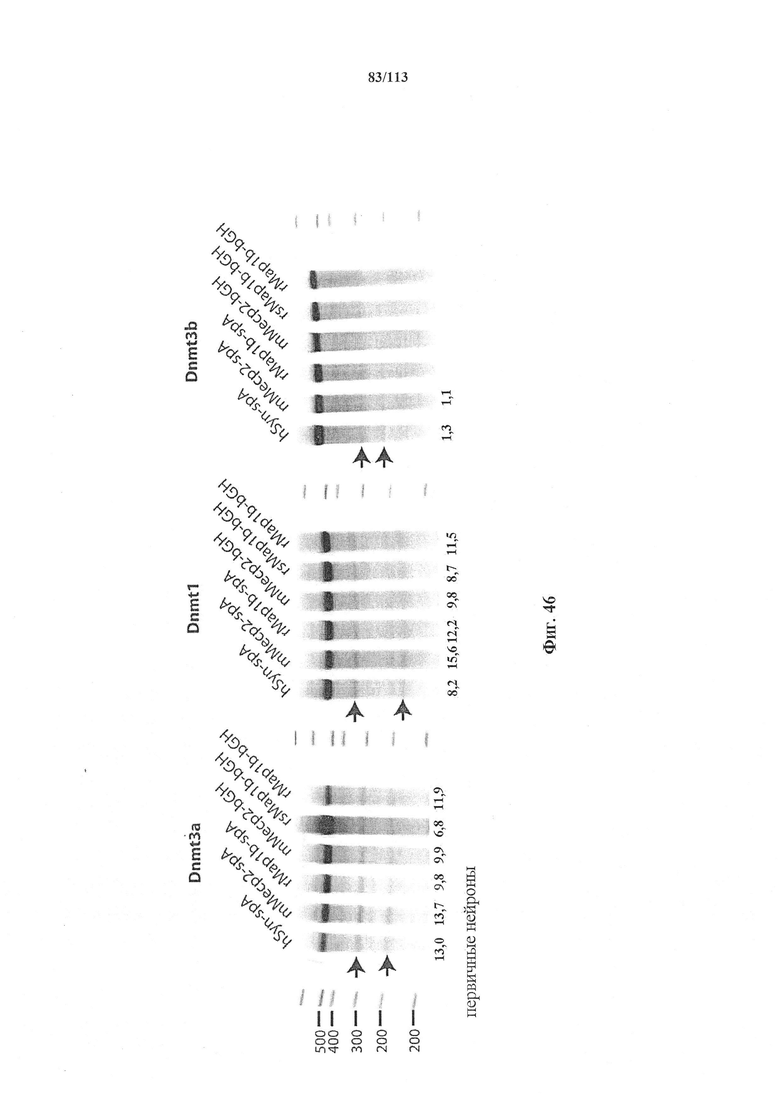
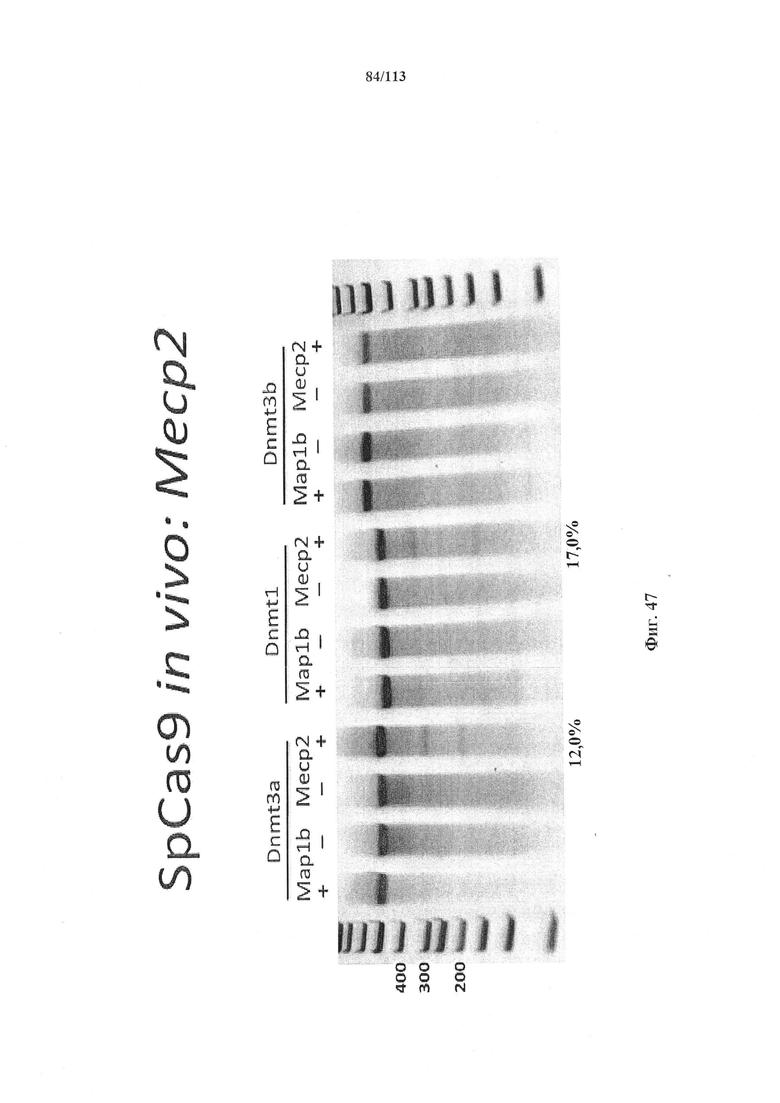
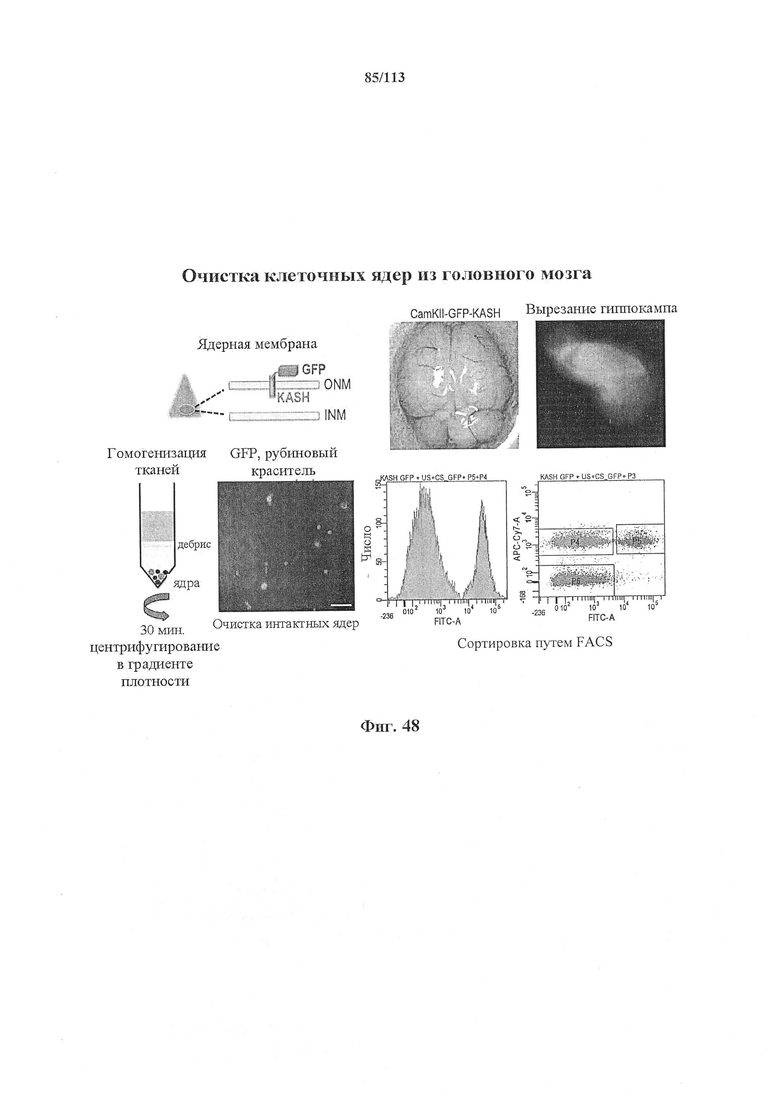
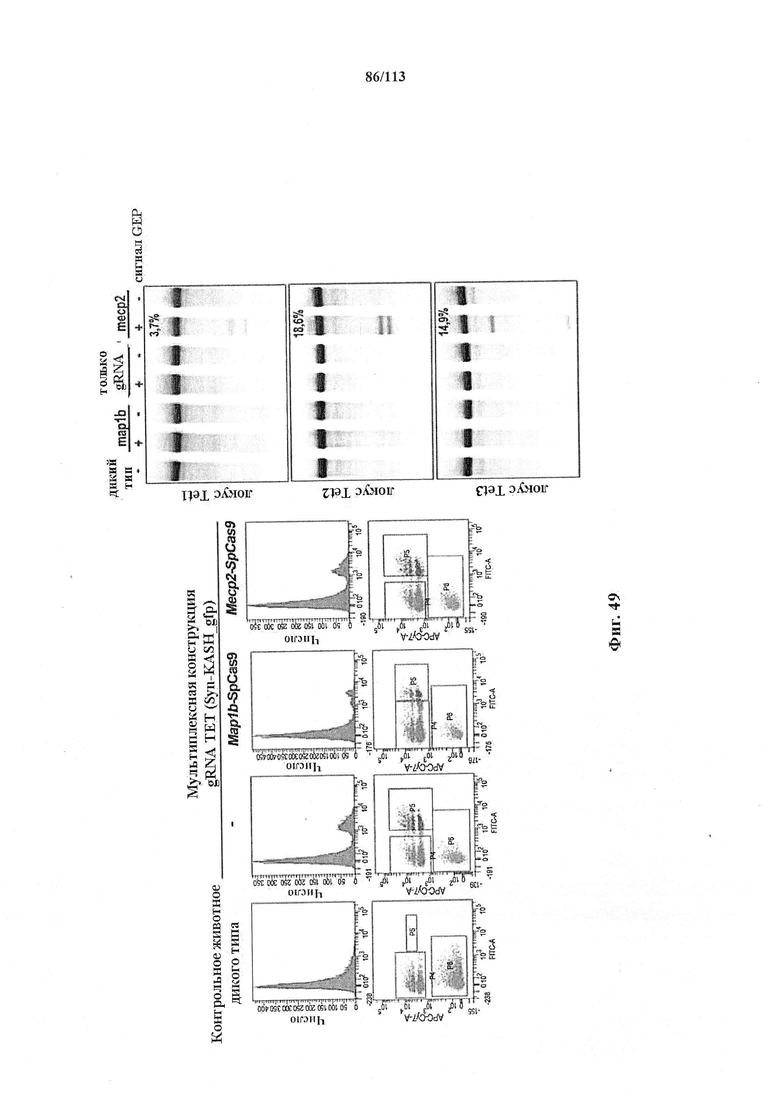
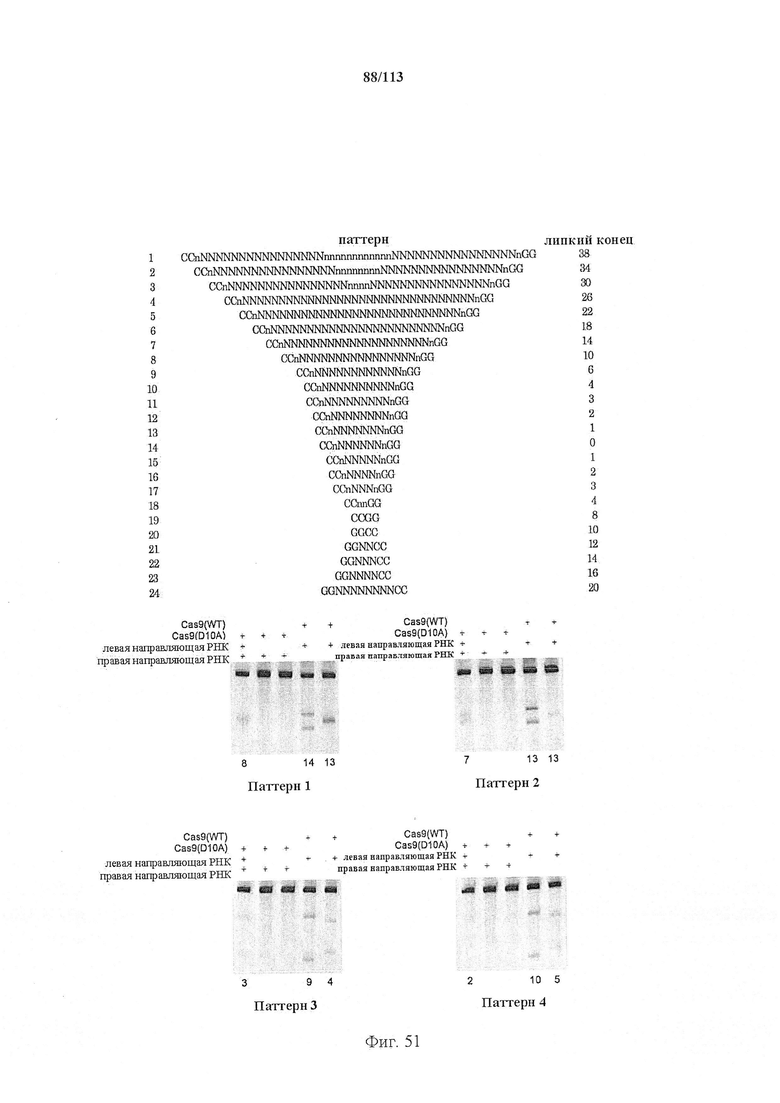


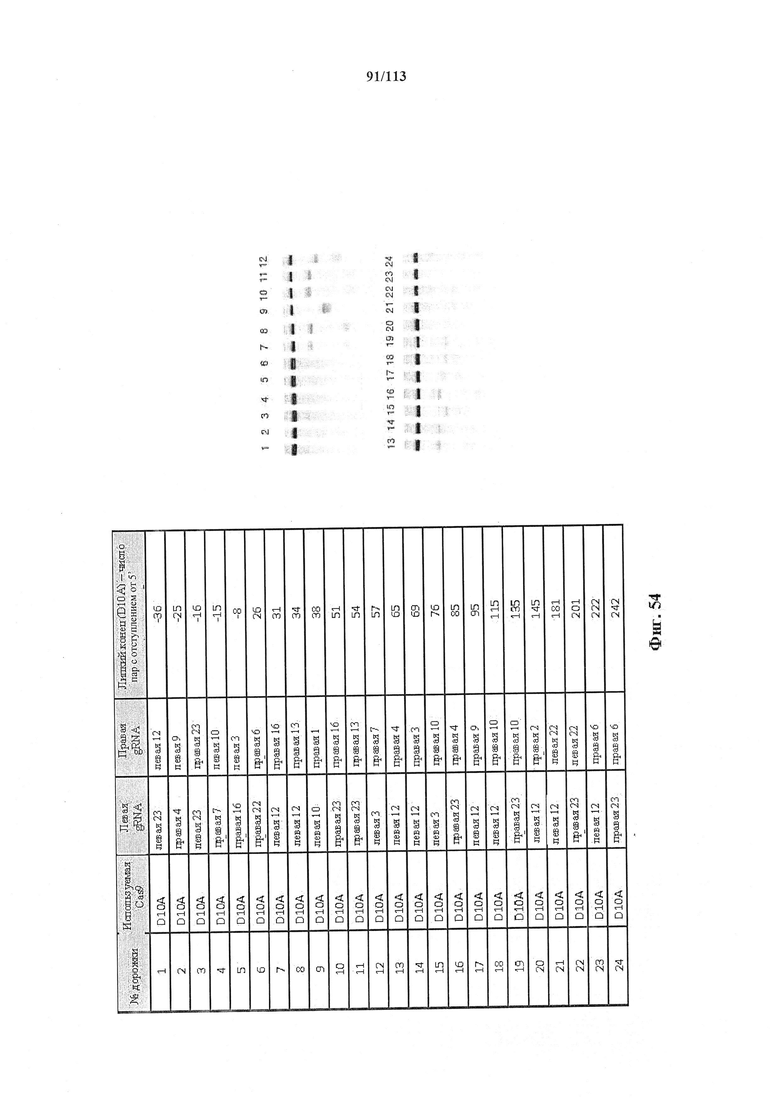
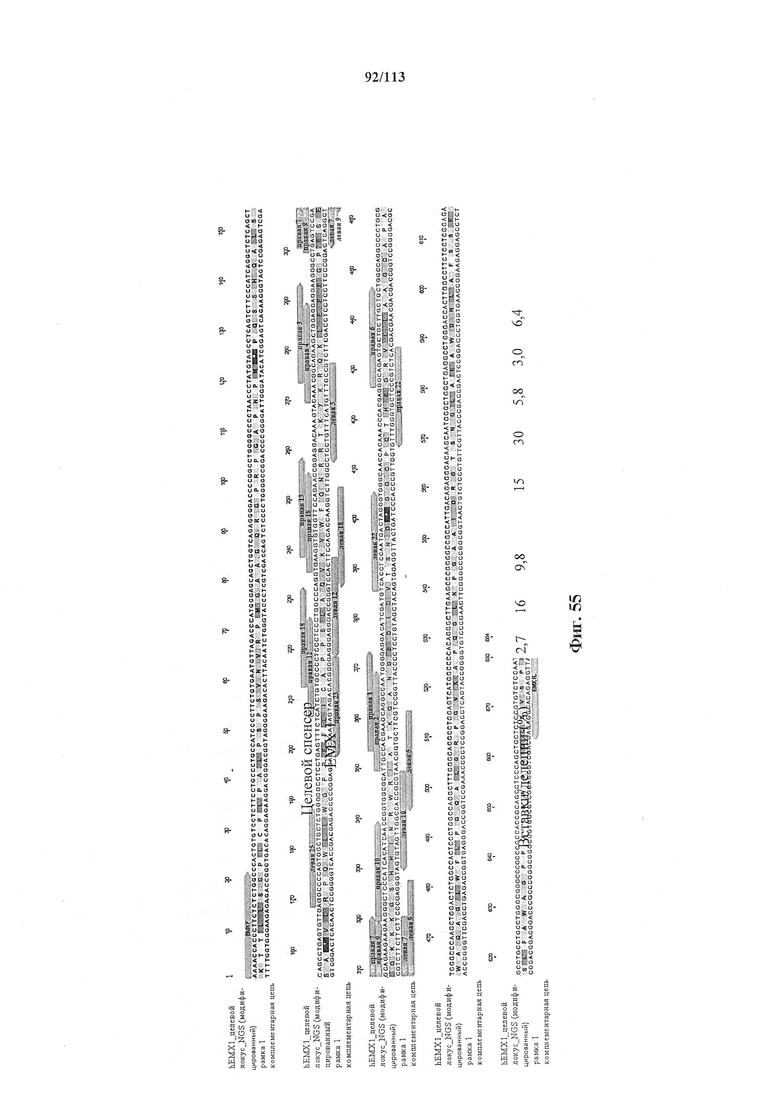
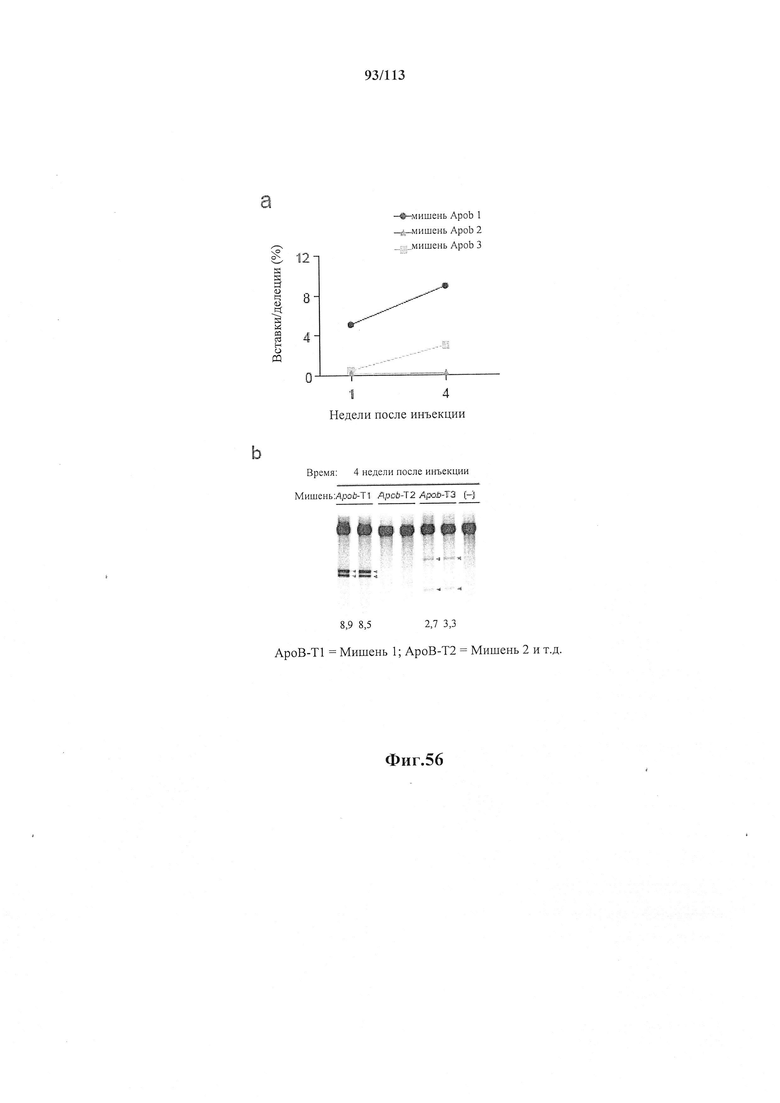
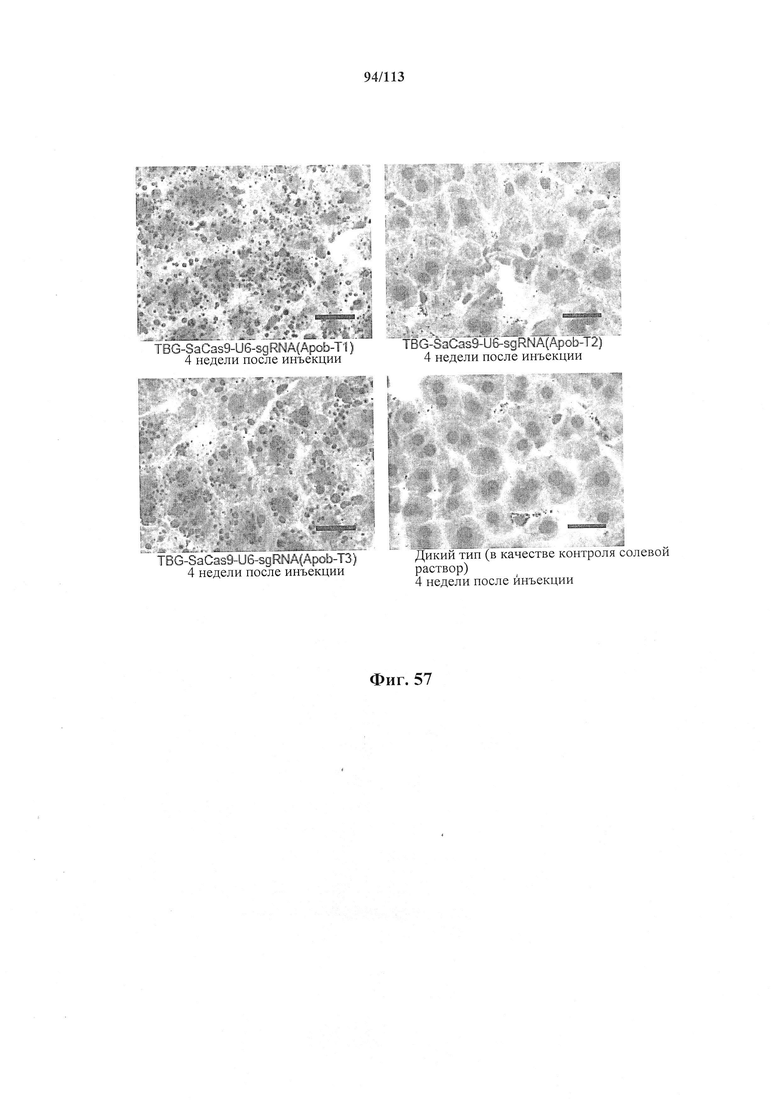
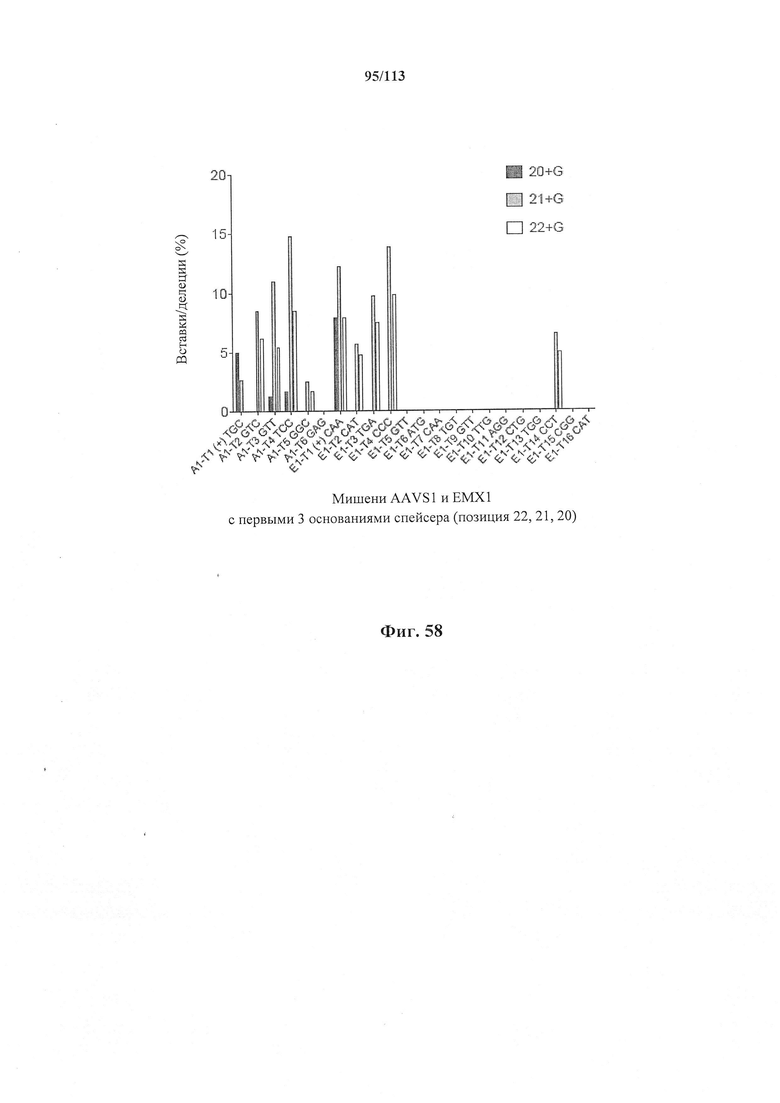
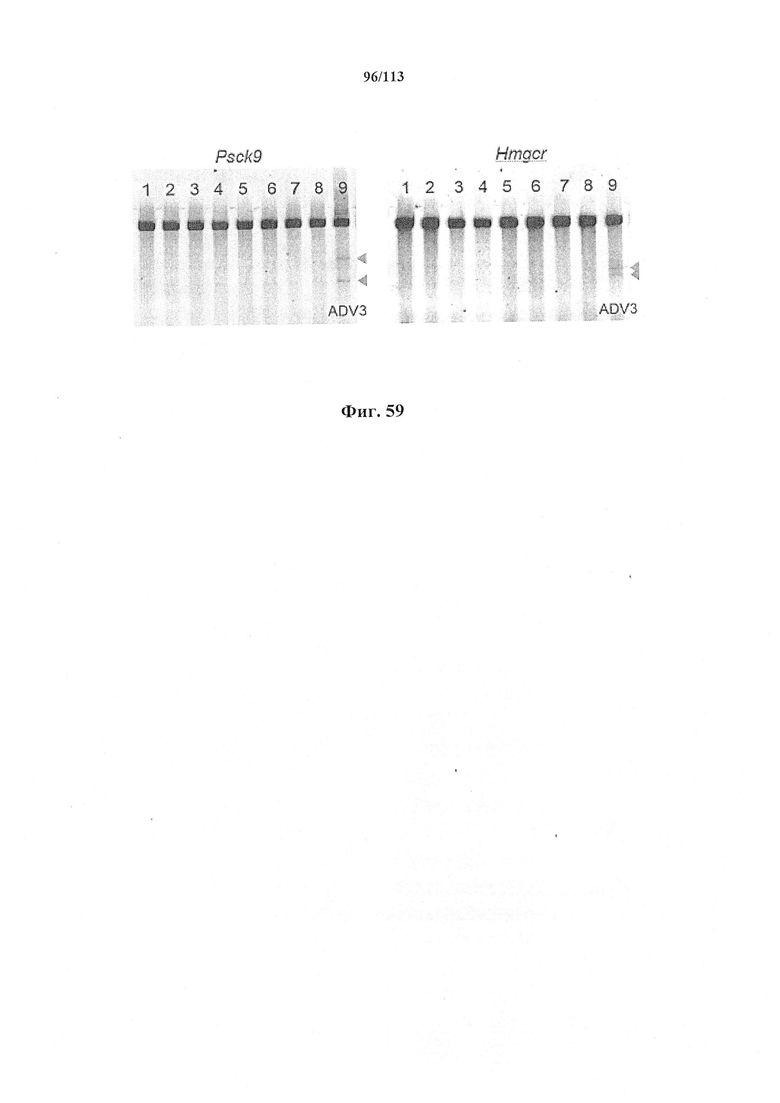
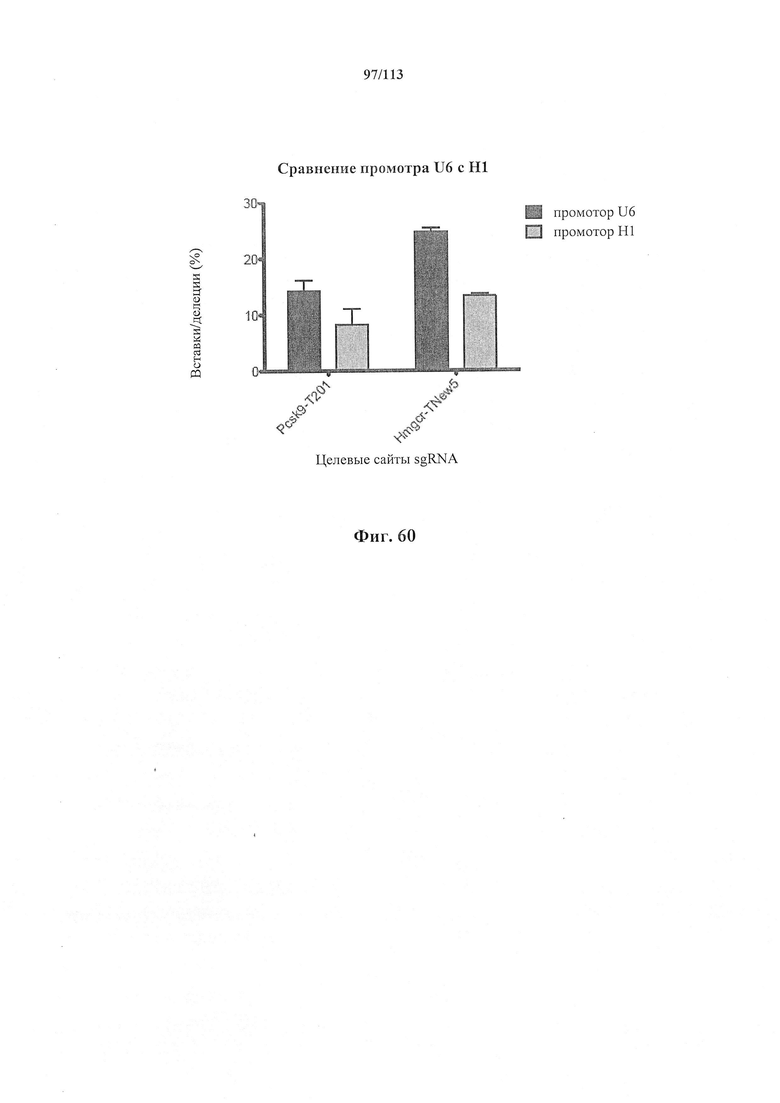
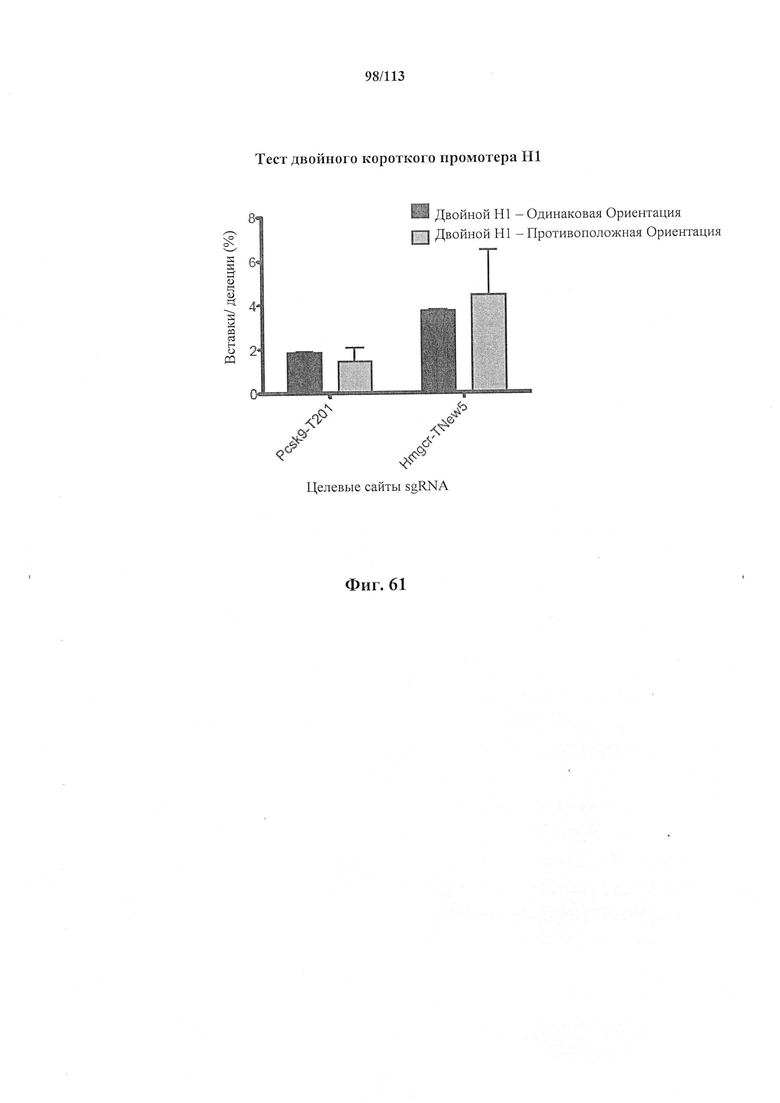
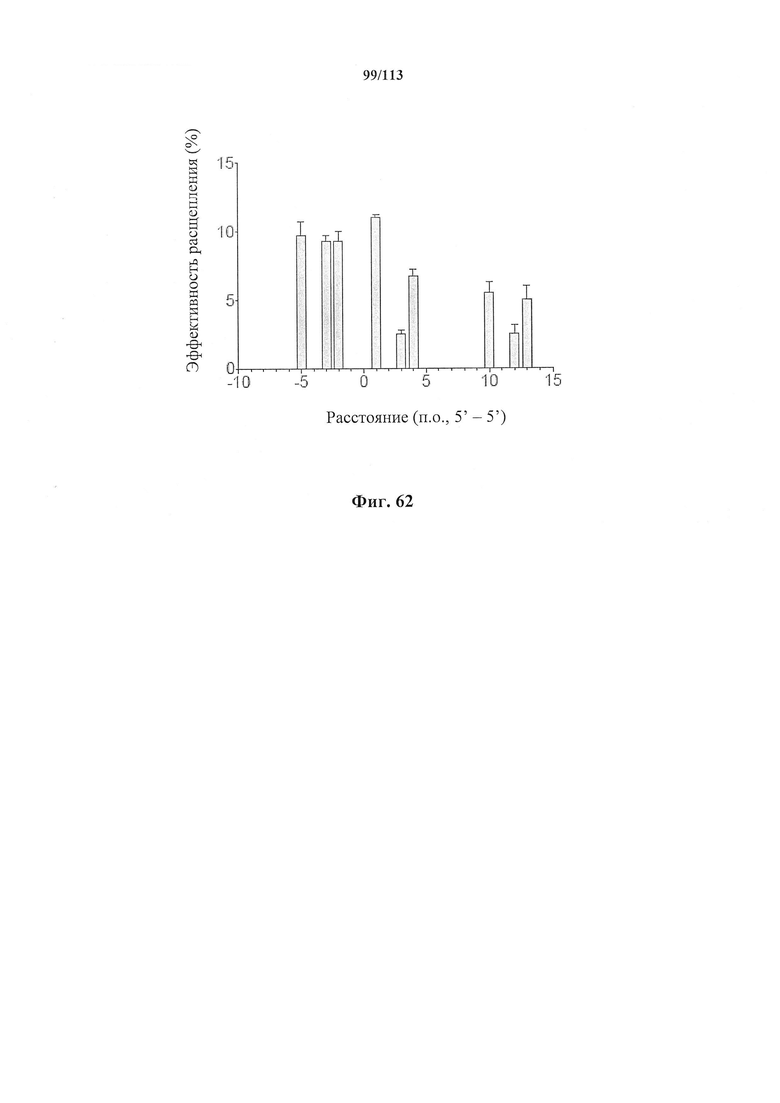
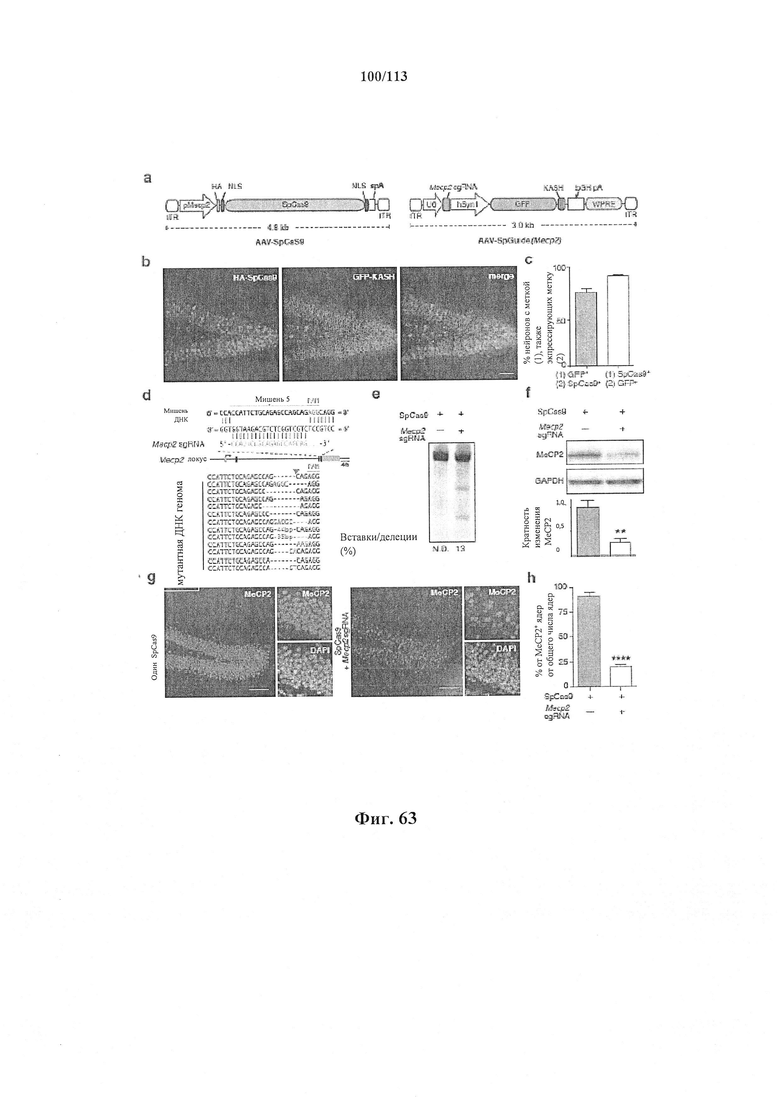
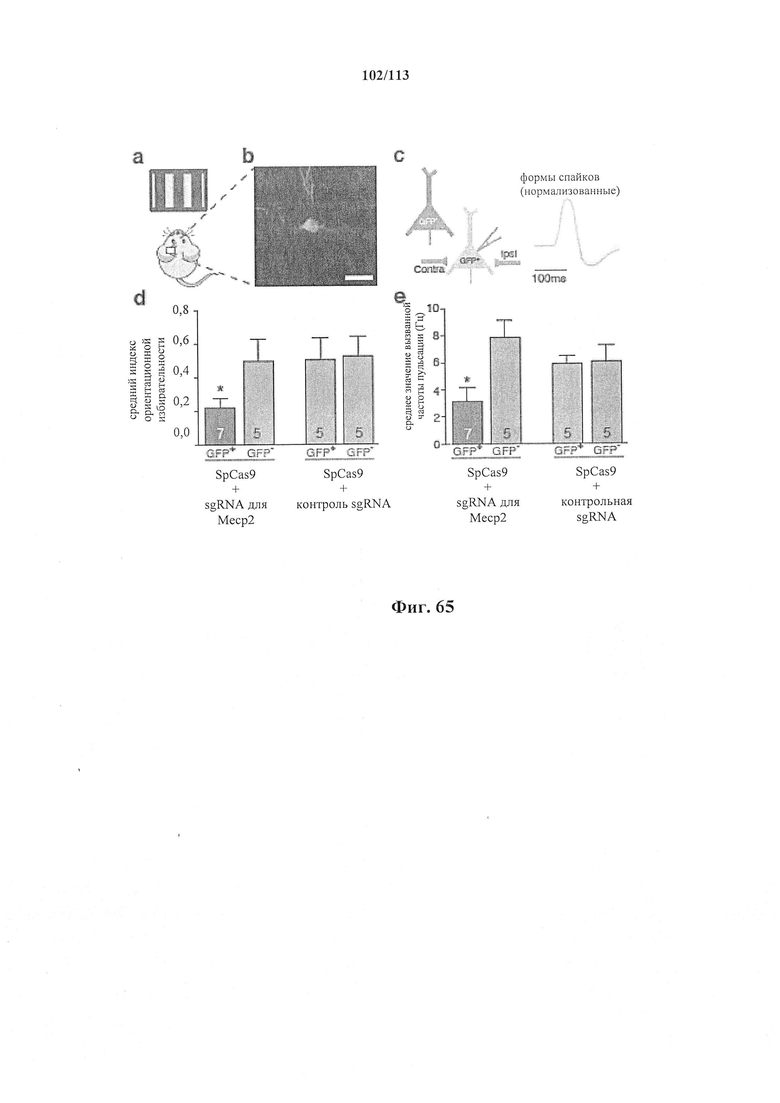

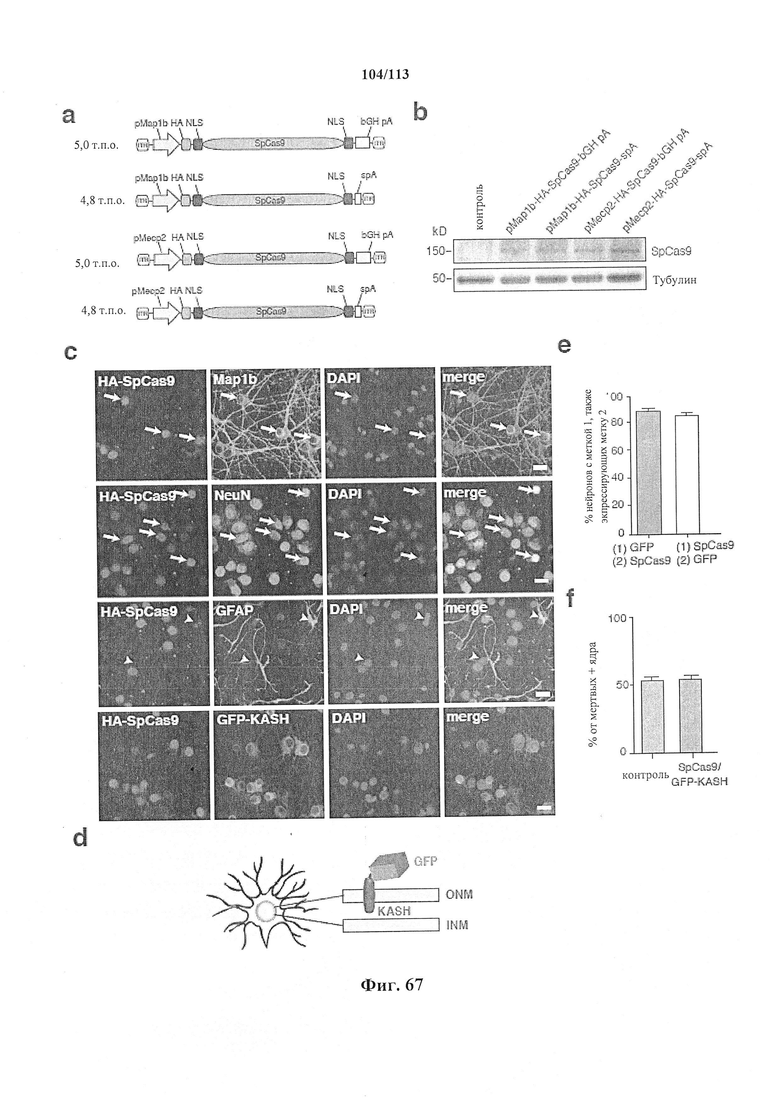
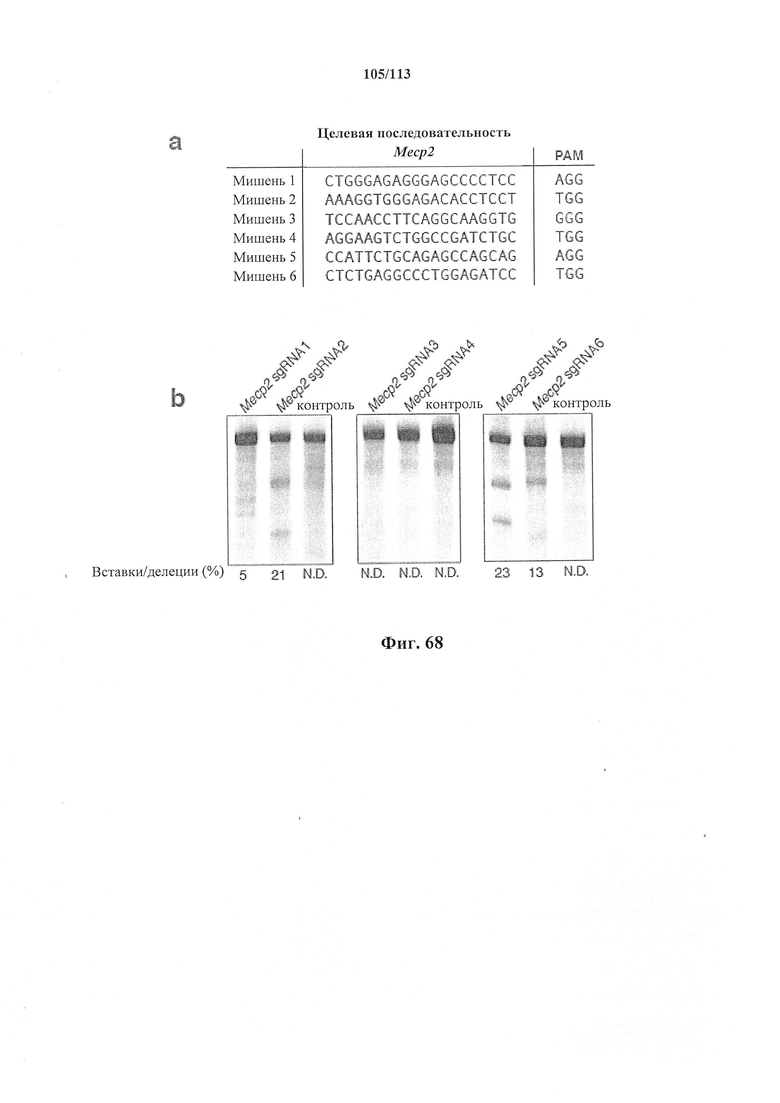

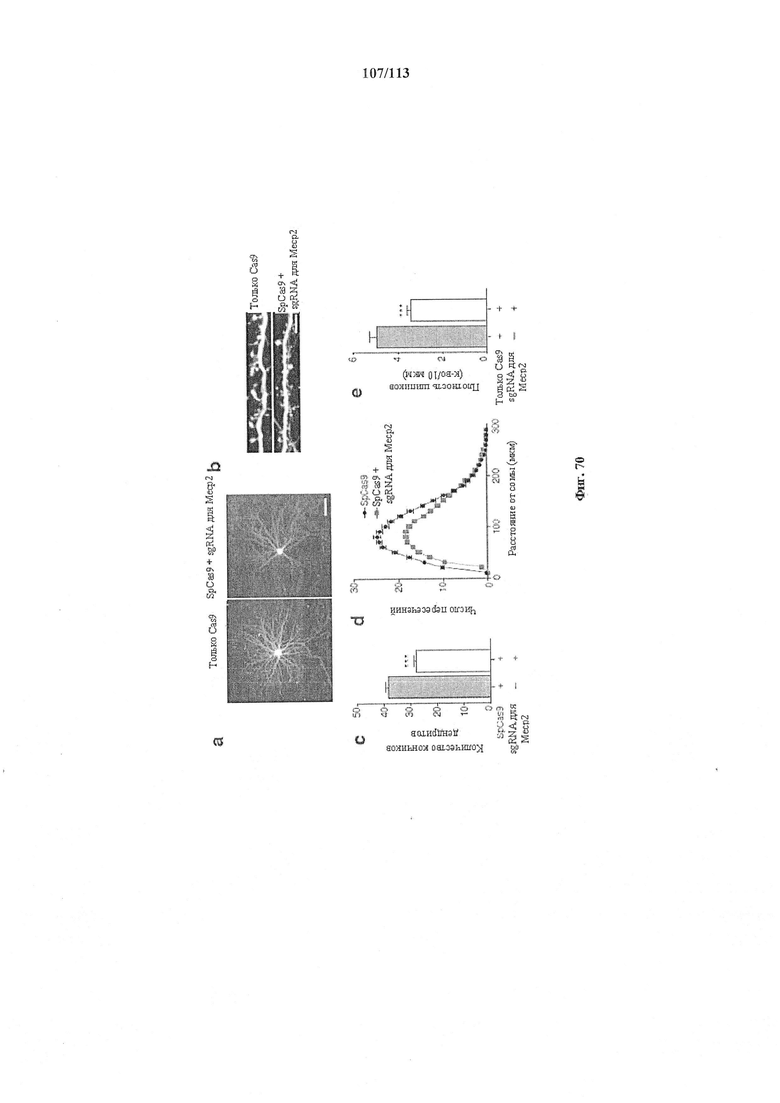
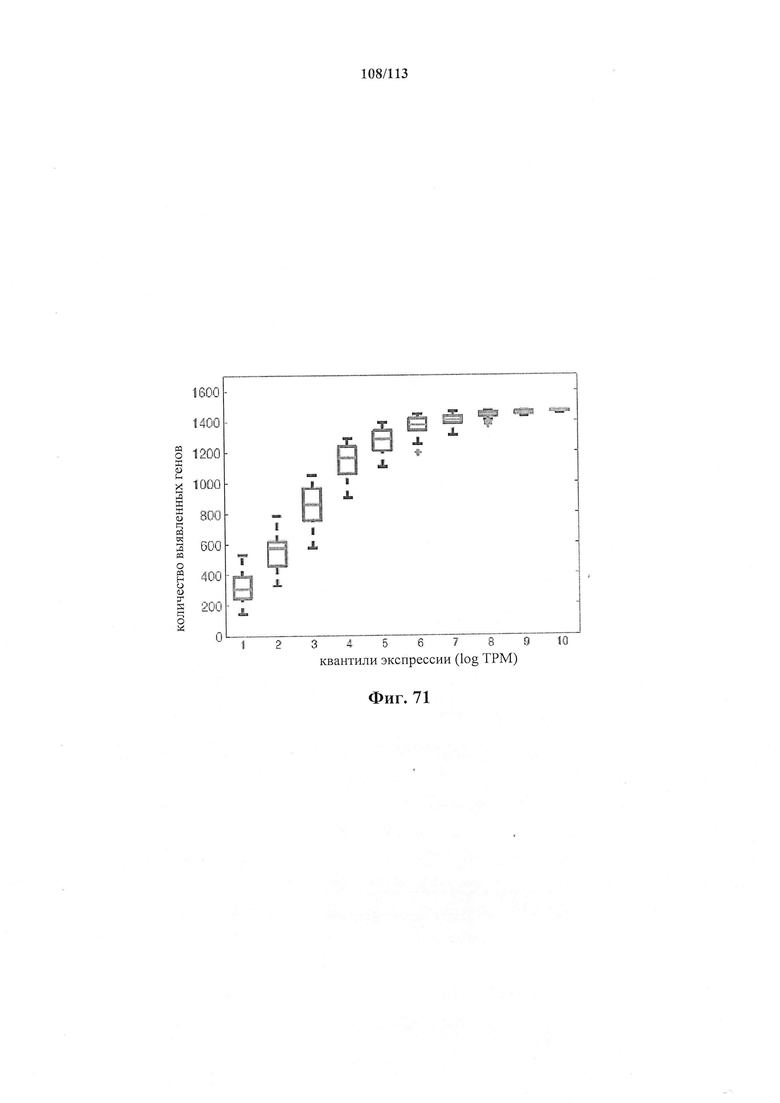
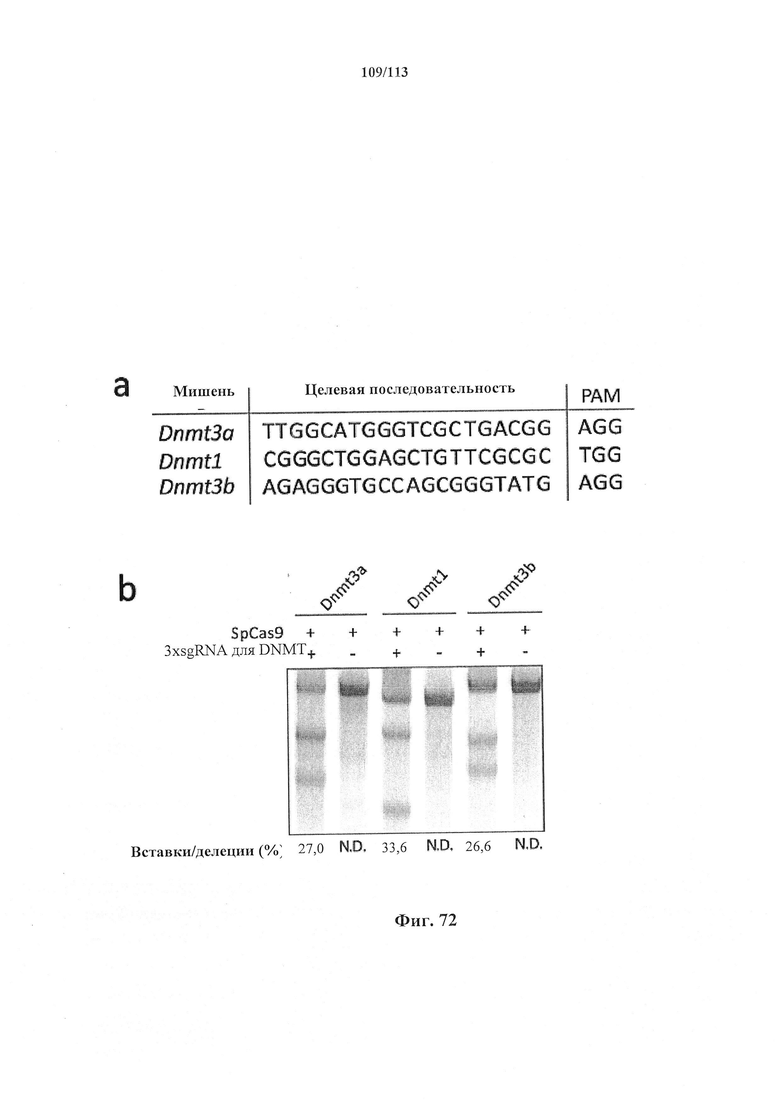


Настоящая группа изобретений относится к биотехнологии. Предложена композиция, содержащая систему CRISPR-Cas для применения при лечении нарушения постмитотической клетки, где Cas9 содержит по меньшей мере одну последовательность ядерной локализации. Кроме того, представлено применение композиции, содержащей полинуклеотиды, экспрессирующие Cas9, содержащий по меньшей мере одну последовательность ядерной локализации, направляющую последовательность, парную tracr-последовательность и tracr-последовательность, для получения композиции, содержащей систему CRISPR-Cas для применения при лечении нарушения постмитотической клетки. Данная группа изобретений обеспечивает целенаправленное редактирование гена, в связи с чем может найти применение в генной терапии. 2 н. и 28 з.п. ф-лы, 76 ил., 17 табл., 38 пр.
1. Композиция, содержащая систему CRISPR-Cas для применения при лечении нарушения постмитотической клетки при условии, что указанное применение не включает модификацию клетки зародышевой линии человека, где указанная система CRISPR-Cas содержит:
Cas9, содержащий по меньшей мере одну последовательность ядерной локализации,
направляющую последовательность, способную гибридизоваться с последовательностью-мишенью, экспрессируемой в постмитотической эукариотической клетке и ассоциированной с геном, вовлеченным в нарушение постмитотической клетки;
парную tracr-последовательность и
tracr-последовательность
или один или несколько полинуклеотидов, экспрессирующих указанный Cas9, направляющую последовательность, парную tracr-последовательность и tracr-последовательность,
где либо направляющая последовательность, парная tracr-последовательность и tracr-последовательность связаны вместе от 5' к 3' в одном полинуклеотиде, либо направляющая последовательность и парная tracr-последовательность связаны вместе от 5' к 3' в первом полинуклеотиде и tracr-последовательность содержится во втором полинуклеотиде.
2. Композиция по п.1, в которой экспрессия продукта гена изменяется с помощью системы CRISPR-Cas в постмитотической клетке, вызывая тем самым фенотипическое изменение.
3. Композиция по п.1 или 2, содержащая:
I. полинуклеотидную последовательность, включающую:
(а) направляющую последовательность, способную гибридизоваться с последовательностью-мишенью, экспрессируемой в постмитотической эукариотической клетке и ассоциированной с геном, вовлеченным в нарушение постмитотической клетки,
(б) парную tracr-последовательность и
(c) tracr-последовательность, и
II. полинуклеотидную последовательность, кодирующую Cas9, содержащий по меньшей мере одну последовательность ядерной локализации, где (a), (b) и (c) расположены в ориентации от 5' к 3',
где при транскрипции парная tracr-последовательность способна гибридизоваться с tracr-последовательностью, а направляющая последовательность способна направлять специфичное к последовательности связывание комплекса CRISPR с последовательностью-мишенью, и
где полинуклеотидная последовательность, кодирующая Cas9, представляет собой ДНК или РНК.
4. Композиция по п.1 или 2, включающая:
I. полинуклеотид, содержащий:
(а) направляющую последовательность, способную гибридизоваться с последовательностью-мишенью в эукариотической клетке, и
(б) парную tracr-последовательность,
II. полинуклеотидную последовательность, кодирующую Cas9, содержащую по меньшей мере одну последовательность ядерной локализации, и
III. полинуклеотидную последовательность, содержащую tracr-последовательность,
где при транскрипции парная tracr-последовательность способна гибридизоваться с tracr-последовательностью, а направляющая последовательность способна направлять специфичное для последовательности связывание комплекса CRISPR с последовательностью-мишенью, и
где комплекс CRISPR включает в себя комплекс Cas9 с (1) направляющей последовательностью, которая способна гибридизоваться с последовательностью-мишенью, и (2) парной tracr-последовательностью, которая гибридизуется с tracr-последовательностью, и полинуклеотидная последовательность, кодирующая Cas9, является ДНК или РНК.
5. Композиция по любому из предшествующих пунктов, содержащая: систему доставки, скомпонованную для доставки системы CRISPR-Cas к органу субъекта, содержащего постмитотические клетки, содержащая: (а) первый регуляторный элемент, действующий в клетке, функционально связанный с полинуклеотидной последовательностью, кодирующей направляющую последовательность, которая гибридизуется с последовательностью-мишенью l, и (b) второй регуляторный элемент, действующий в клетке, функционально связанный с полинуклеотидной последовательностью, кодирующей Cas9, содержащей по меньшей мере одну последовательность ядерной локализации, посредством чего направляющая последовательность направляется на последовательность-мишень в постмитотической клетке.
6. Композиция по любому из предыдущих пунктов, в которой система включает векторную систему и полинуклеотиды расположены на одном или разных векторах.
7. Композиция по п.6, в которой векторная система содержит один или несколько вирусных векторов.
8. Композиция по п.6 или 7, где векторная система содержит один или несколько лентивирусов, один или несколько аденовирусов, один или несколько аденоассоциированных вирусов или один или несколько вирусов герпеса.
9. Композиция по любому из пп.6-8, в которой каждый вирусный вектор упакован в вирусную частицу.
10. Композиция по любому из пп.6-9, в которой по меньшей мере один из векторов дополнительно содержит промотор для управления экспрессией молекулы нуклеиновой кислоты, кодирующей Cas9, и где указанный промотор предназначен для повсеместной или тканеспецифической экспрессии.
11. Композиция по п.10, в которой указанный промотор предназначен для повсеместной экспрессии и выбран из группы, состоящей CMV, CAG, CBh, PGK, SV40 и из тяжелых или легких цепей ферритина.
12. Композиция по п.10, в которой указанный промотор предназначен для тканеспецифической экспрессии и выбран из группы, состоящей из синапсина I для всех нейронов, CaMKIIalpha для возбуждающих нейронов, GAD67 или GAD65 или VGAT для GABAergic нейронов, промотора альбумина для экспрессии в печени и OG-2 для остеобластов.
13. Композиция по любому из пп.3-12, содержащая более одной направляющей последовательности, причем каждая направляющая последовательность направлена на другую последовательность-мишень.
14. Композиция по любому из пп.3-13, дополнительно включающая один или несколько репарирующих шаблонов.
15. Композиция по п.14, в которой одна или несколько репаративных матриц приводят к мутации, включающей вставку, делецию или замену одного или нескольких нуклеотидов указанной последовательности-мишени.
16. Композиция по п.14, в которой указанная мутация приводит к одному или нескольким аминокислотным заменам в белке, экспрессируемом из последовательности-мишени.
17. Композиция по любому из пп.1-16, в которой указанный Cas9 представляет собой S. aureus Cas9 (SaCas9).
18. Композиция по любому из пп.6-17, в которой указанная векторная система содержит один вирусный вектор, который представляет собой вектор AAV.
19. Композиция по любому из пп.1-18, в которой Cas9 содержит одну или несколько мутаций.
20. Композиция по п.19, в которой одну или несколько мутаций выбирают из группы, состоящей из D10A, H840A, N854A, N863A со ссылкой на нумерацию положений белка St99 Streptococcus pyogenes (SpCas9); или Cas9 содержит одну или несколько мутаций в домене RuvC1 Cas9.
21. Композиция по любому из пп.1-20, в которой Cas9 представляет собой никазу.
22. Композиция по любому из пп.1-21, в которой система CRISPR-Cas включает в себя функциональный домен.
23. Композиция по любому из пп.1-22, в которой система CRISPR-Cas включает домен-активатор.
24. Композиция по любому из пп.1-23, в которой клетки представляют собой клетки головного мозга, клетки почек, клетки сердца, клетки пищеварительной системы, клетки легкого, клетки глаза, клетки уха, клетки кожи, клетки мышц, клетки кости или клетки печени.
25. Композиция по любому из пп.1-23, в которой клетки являются иммунными клетками.
26. Композиция по любому из предшествующих пунктов, где композиция является терапевтической в отношении заболевания, нарушения или показания таблицы A или таблицы B или функции клетки или гена таблицы C.
27. Композиция по любому из предыдущих пунктов для применения при лечении генетических заболеваний или нарушений, вызванных или связанных с дефектным генотипом в постмитотических клетках.
28. Композиция по любому из предшествующих пунктов, где композиция является терапевтической в отношении: нарушения тринуклеотидного повтора; метаболического заболевания или нарушения печени, почек или белка; мышечного или скелетного заболевания или нарушения; неврологического или нейронального заболевания или нарушения; нарушения регуляции клеток или онкологического заболевания или нарушения; заболевания или нарушения крови или коагуляции; воспаления или связанного с иммунитетом заболевания или нарушения или глазного заболевания или нарушения.
29. Композиция по п.5, в которой система доставки включает липосому, частицу, экзосому или микровезикулу.
30. Применение композиции, содержащей один или более полинуклеотидов, экспрессирующих Cas9, содержащий по меньшей мере одну последовательность ядерной локализации, направляющую последовательность, способную гибридизоваться с целевой последовательностью, экспрессируемой в постмитотической эукариотической клетке и ассоциированной с геном, вовлеченным в нарушение постмитотической клетки, парную tracr-последовательность и tracr-последовательность, для получения композиции, содержащей систему CRISPR-Cas для применения при лечении нарушения постмитотической клетки при условии, что указанное применение не включает модификацию клетки зародышевой линии человека.
| MALI P | |||
| et al | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| CONG, LE, et al | |||
| "Multiplex genome engineering using CRISPR/Cas systems." Science, 15 FEBRUARY 2013, 339: 819-823 | |||
| WANG, HAOYI, et al | |||
| "One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering." | |||
Авторы
Даты
2020-07-02—Публикация
2014-06-11—Подача