Изобретение относится к медицине, а именно медицине катастроф, медицине критических состояний, к анестезиологии и реаниматологии, и может быть использовано для мониторинга эффективности реанимационных мероприятия на госпитальном этапе.
Традиционно реанимационные мероприятия начинаются уже при выявлении явных признаков отсутствия признаков жизни - сознания, дыхания, пульсации на магистральных сосудах. Отсутствием эффективности реанимационных мероприятий является визуальный мониторинг за состоянием пациента - экскурсия грудной клетки, изменение окраса кожных покровов, пульсация на магистральных сосудах. Однако применение метода визуальной оценки начала реанимационных мероприятий и оценка эффективности применяемых мер в качестве единственного метода является, на сегодняшний день, приемлемым исключительно на догоспитальном этапе.
Методы оценки начала реанимационных мероприятий и мониторинг их эффективности на госпитальном этапе строго регламентированы национальными и международными клиническими рекомендациями [Holcomb SJ. Analyzing the Effectiveness of Different Forms of Cardiopulmonary Resuscitation. J Emerg Med. 2019; 56(5):540-543. doi:10.1016/j.jemermed.2018.12.041; Highlights of the 2015 AHA Guidelines Update for CPR and ECC; 8. European Resuscitation Council Guidelines for Resuscitation 2010].
Известен метод мониторинга эффективности реанимационных мероприятий путем оценки с помощью капнографии. Содержание углекислого газа в конце выдоха (EtCO2) должно быть больше 20-25 мм рт.ст. Показатели EtCO2<20-25 мм рт.ст. свидетельствуют об отсутствии эффекта от проводимых реанимационных мероприятий. Однако данный метод возможно применять только у пациентов, которым проводится искусственная вентиляция легких, и даже у них имеются ограничения. Капнография в качестве метода оценки эффективности реанимационных мероприятий не применима при отсутствии перфузионного ритма (любой ритм сердца, обеспечивающий минимальную циркуляцию крови), при загрязнении детектора капнографа (водяными парами, бронхиальным секретом и т.д.), при наличии обструкции дыхательных путей (инородное тело дыхательных путей, астматический статус и др.), при внутривенном болюсном введении адреналина, так как это приводит к выраженному сокращению легочного кровотока, при не герметичности дыхательного контура.
Известен способ диагностики периферических сосудистых заболеваний путем мониторинга изменения насыщения кислородом тканей во время фазы гиперемии, при котором предварительно проводят соединение исследовательского зонда с компьютерной системой, предназначенной для вычисления содержания кислорода в тканях, затем прикладывают зонд на кожу ноги в проекции передней большеберцовой мышцы с минимальным давлением на кожу и проводят измерение насыщения кислородом тканей. Затем раздувают манжету, расположенную на конечности выше места исследования до значения, превышающего значение систолического регистрацию температуры выбранной подушечки дистальной фаланги пальца через каждые 30 секунд в течение 5 минут. При повышении температуры подушечки дистальной фаланги на 0,1-1,0°С от первоначального температурного показателя через 30-60 секунд делают заключение о нормальном состоянии микроциркуляторного русла и/или адекватном проведении противошоковой терапии. При превышении температуры подушечки дистальной фаланги на 0,1-1,0°С через 60-300 секунд делают заключение об обратимых микроциркуляторных повреждениях и необходимости проведения дополнительных противошоковых мероприятий. При отсутствии превышения температуры подушечки дистальной фаланги на 0,1-1,0°С через 60-300 секунд делают заключение о тяжелых микроциркуляторных повреждениях и неэффективности проведения реанимационных мероприятий [US 7582060, 2009]. Данный метод может быть применен и в качестве способа, определяющего начало реанимационных мероприятий и способа мониторинга эффективности проводимой сердечно-легочной реанимации. Однако существенными недостатками данного способа являются низкая точность и безопасность, а также сложность определения микроциркуляторных нарушений у пациентов в критическом состоянии.
Наиболее близким аналогом изобретения является регламентированный национальными и зарубежными руководствами способ мониторинга эффективности сердечно-легочной реанимации, заключающийся в том, что аппаратным методом пульсоксиметрии проводят непрерывный мониторинг насыщения гемоглобина кислородом пульсирующей крови (SatO2). К недостаткам прототипа относятся широкие ограничения транспекутарной оксиметрии: показатели SatO2 не могут использоваться для оценки оксигенации пациентов в критическом состоянии, у которых имеются выраженные нарушения перфузии и метаболический ацидоз, а также использоваться при отравлении угарным газом и метгемоглобинемии или при стойких нарушениях ритма [Holcomb SJ. Analyzing the Effectiveness of Different Forms of Cardiopulmonary Resuscitation. J Emerg Med. 2019; 56(5):540-543. doi:10.1016/j.jemermed.2018.12.041; Highlights of the 2015 AHA Guidelines Update for CPR and ECC; 8. European Resuscitation Council Guidelines for Resuscitation 2010].
Задачей изобретения является расширение арсенала методов, позволяющих своевременно начинать реанимационные мероприятия и проводить мониторинг их эффективности.
Технический результат при использовании изобретения - повышение точности и доступности способа.
Изобретение иллюстрируется следующими фигурами: на фигуре 1 представлен скриншот динамики церебральной оксиметрии и стандартной трансперкутарной пульсоксиметрии пациента по примеру №1 за 5 минут до и после окончания реанимационных мероприятий; на фигуре 2 - скриншот динамики церебральной оксиметрии и традиционной трансперкутарной пульсоксиметрии пациента по примеру №2 в моменты остановки сердечной деятельности и проводимых реанимационных мероприятий; на фигуре 3 - скриншот динамики церебральной оксиметрии пациента по примеру №3 в моменты остановки сердечной деятельности и проводимых реанимационных мероприятий; на фигуре 4 - скриншот динамики церебральной оксиметрии пациентки по примеру №4 в момент остановки сердечной деятельности.
Способ мониторинга эффективности сердечно-легочной реанимации (СЛР) осуществляется следующим образом. Контролируют локальную температуру кожи лба пациента с помощью тепловизора (например, ThermoTracer ТН9100ХХ (NEC, USA), достигают стабилизации температуры до 36,6-36,7°С (любым доступным способом - назначение антипиретиков, обкладывание холодом лба пациента и т.д.), фиксируют к коже лба датчик монитора церебральной оксиметрии, например, SenSmart Модель Х-100 (MPS, Medical Product Service GmbH, Германия), церебральную оксиметрию начинают при ясном сознании пациента и проводят непрерывно. При регистрации клинической смерти проводят СЛР. Эффективность искусственной вентиляции легких и непрямого массажа сердца оценивают по восстановлению показателя кривой церебральной оксигенации до исходного значения, которое поддерживают на всем периоде реанимационных мероприятий вплоть до восстановления сердечной деятельности.
Монитор церебральной оксиметрии SenSmart™ использует методику расчета, основанную на законе Бера-Ламберта, для определения регионарной оксигенации. Закон Бера-Ламберта определяет ослабление излучения при его распространении через поглощающую среду. В законе говорится о существовании логарифмической зависимости между концентрацией среды и ослаблением излучения при прохождении через нее. За счет использования длин волн, которые поглощаются исследуемой средой, может быть определена концентрация среды. Для регионарной оксиметрии, представляет интерес концентрация оксигемоглобина, дезоксигемоглобина и тканей под датчиком. Это устройство обеспечивает эффективное «глубокое» измерение поглощения света, сосредоточенное на головном мозге или соматических местах. Проведение измерения при ясном сознании пациента связанно с индивидуальными особенностями каждого пациента – толщина свода черепа, подкожной клетчатки, кожных покровов, размер черепной коробки, наличие гидроцефалии, возраст, исходное значение церебрального насыщения кислородом. Данные показатели будут отличатся у каждого человека индивидуально, поэтому начать регистрировать оксигенацию мозга в момент остановки сердечной деятельности или утраты сознания не корректно, так как для мониторинга нужны индивидуальные исходные показатели ЦО. Вторым важным моментом при регистрации насыщения мозга кислородом является необходимость стандартизации условий данного исследования по температурным показателям, а проще всего это реализовать достижением нормотермии (36,6-36,7°С) при мониторинге локальной температуры. Это связано с физикой метода, использующего датчик, улавливающий инфракрасное излучение. Отсутствие данного важного признака приведет к разным показателям насыщения кровью кислорода у одного и того же человека в одном и том же соматическом состоянии, но снятыми при разных температурных условиях места регистрации.
Сущность изобретения поясняется следующими примерами.
Пример 1.
Пациент К., 48 лет, поступил в экстренном порядке в хирургическую реанимацию в 9.15 с диагнозом «Деструктивный панкреатит. Гнойный панкреонекроз. Забрюшинная флегмона».
Объективно: Пациент в сознании, проводится ИВЛ в режиме SIMV аппаратом PNB 840 с СД=14 в мин, FiO2=0,4. Гемодинамика нестабильная, инотропная поддержка дофамином 120 мг/ч. Из данных анамнеза: болеет на протяжении 1 месяца, две санирующие операции по поводу основного заболевания 24 и 48 часов назад. Температура тела, измеренная в области лба, составляла 37,2°С.
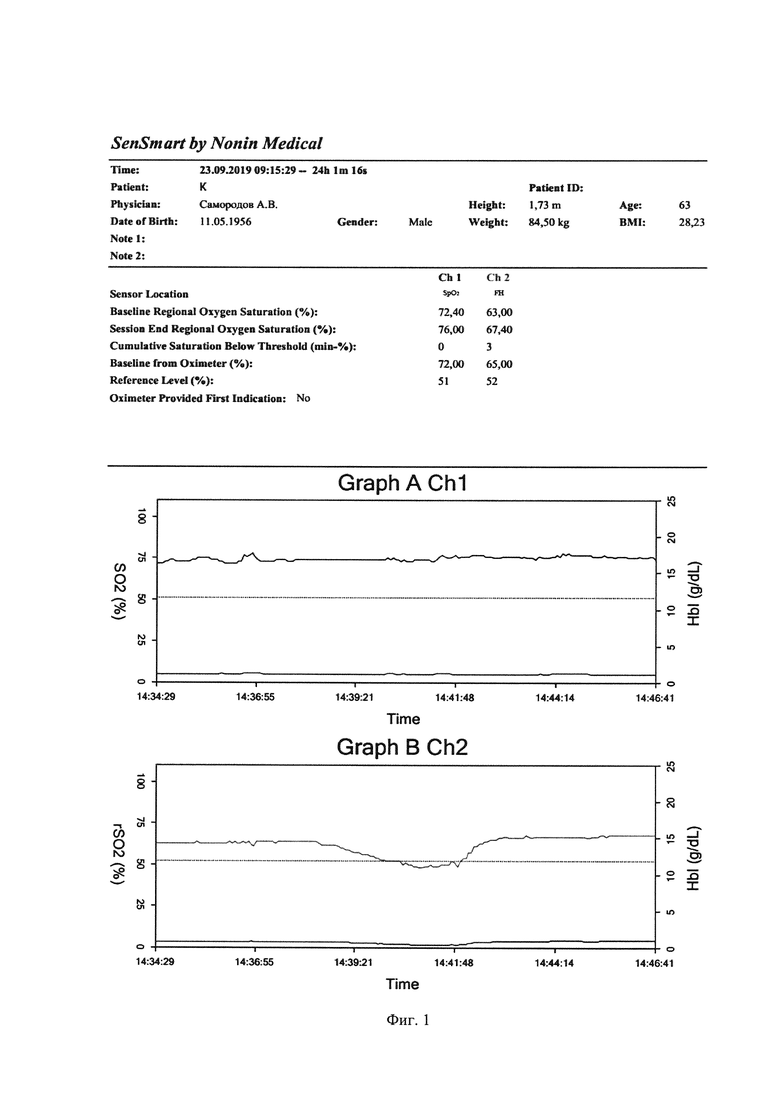
Пациенту проводился мониторинг: трансперкутарная пульсоксиметрия, неинвазивное измерение артериального давления, электрокардиография, церебральная оксиметрия. Базовый уровень оксигенации мозга определялся датчиком, установленным на лбу при ясном сознании и после локальной гипотермии до стабилизации температуры в области лба до 36.6°С. Через 5 часов после госпитализации в отделение реанимации у пациента на фоне нарастания явлений органных дисфункций произошла остановка сердечной деятельности. Реанимационные мероприятия начаты немедленно и проведены в полном объеме с эффектом через 5 минут. Из данных фиг. 1 видно, что снижение оксигенации мозга на фоне неизменных показателей АД, измеряемых неинвазивным методом, начинается с 14.37.17, а клиническая смерть зарегистрирована лишь в 14.40.32 (на 3,15 минуты позже и при снижении показателя церебральной оксигенации на 23,6% от исходного), когда и начаты реанимационные мероприятия. Непрямой массаж сердца и адекватная искусственная вентиляция легких приводит к постепенной нормализации и поддержанию нормальной оксигенации мозга к 14.42.47. Далее восстановление сердечного ритма по данным электрокардиографии зарегистрировано в 14.45.56.
Пример 2.
Пациент П., 40 лет, поступил в отделение хирургической реанимации из операционной с диагнозом «Опухоль сигмовидной кишки. Мезентериальный тромбоз. Разлитой каловый перитонит».
Объективно: Состояние крайне тяжелое. Уровень сознания - кома II. Проводится ИВЛ в режиме SIMV аппаратом PNB 840 с СД=16 в мин, FiO2=0,4. Гемодинамика нестабильная, инотропная поддержка дофамином 200 мг/ч. Температура тела в области лба составляла 38,9°С.
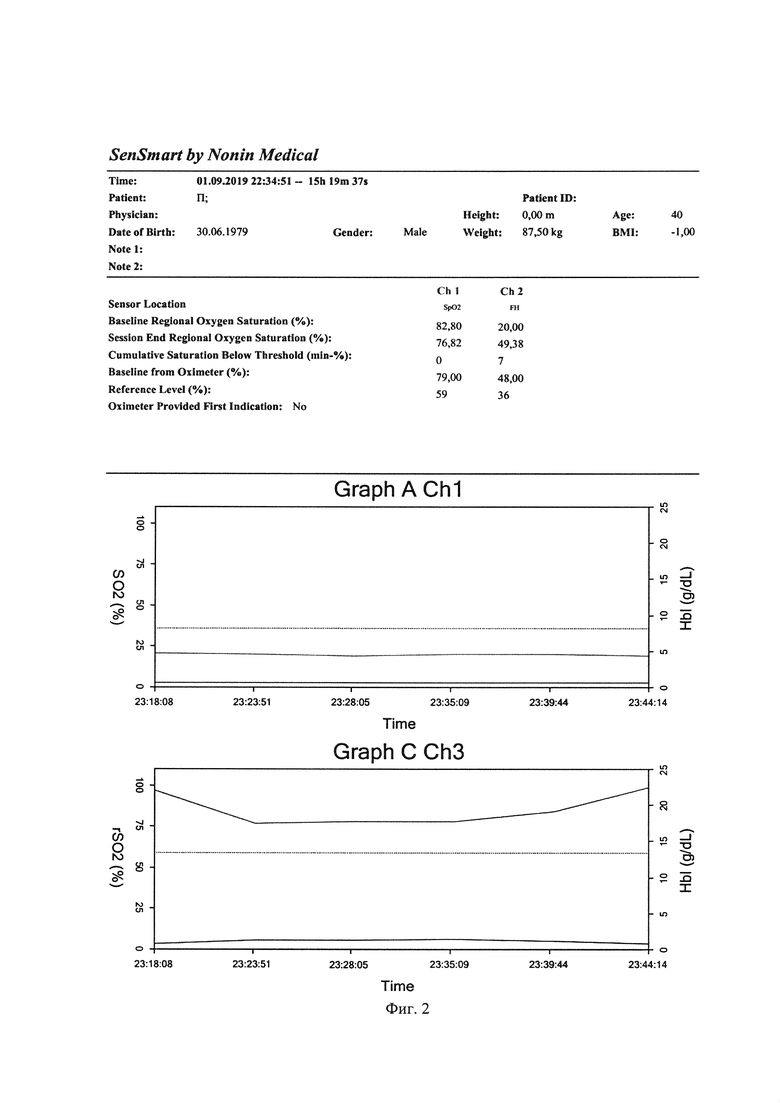
Пациенту исходно, начиная с операционной, проводился мониторинг - трансперкутарная пульсоксиметрия, неинвазивное измерение артериального давления, электрокардиография, церебральная оксиметрия. Базовый уровень оксигенации мозга определялся датчиком, установленным на лбу при ясном сознании и после локальной гипотермии до стабилизации температуры в области лба до 36.6°С. На фиг. 2 видно изначально некорректные данные пульсоксиметрии, которые логично объясняются нарушением периферической микроциркуляции у пациента в состоянии септического шока. Из данных фиг. 2 видно, что снижение оксигенации мозга на фоне неизменных показателей АД, измеряемых неинвазивным методом, начинается с 23.18.14 (на 4,10 минуты раньше и при снижении показателя церебральной оксигенации на 21,4% от исходного), а клиническая смерть зарегистрирована лишь в 23.22.24, когда и начаты реанимационные мероприятия. Непрямой массаж сердца и адекватная искусственная вентиляция легких приводит к последовательной нормализации и поддержанию исходной оксигенации мозга к 23.43.19, тогда и зафиксировано восстановление сердечного ритма по данным электрокардиографии.
Пример 3.
Пациент Л., 35 лет, поступил в экстренном порядке из операционной в хирургическую реанимацию с диагнозом «Деструктивный панкреатит. Гнойный панкреонекроз. Множественные несформированные кишечные свищи. Разлитой перитонит».
Объективно: Состояние крайне тяжелое. Уровень сознания - медикаментозной сон. Проводится ИВЛ в режиме SIMV аппаратом PNB 840 с СД=14 в мин, FiO2=0,4. Гемодинамика нестабильная, инотропная поддержка дофамином 160 мг/ч. Температура тела в области лба составляла 38,5°С.
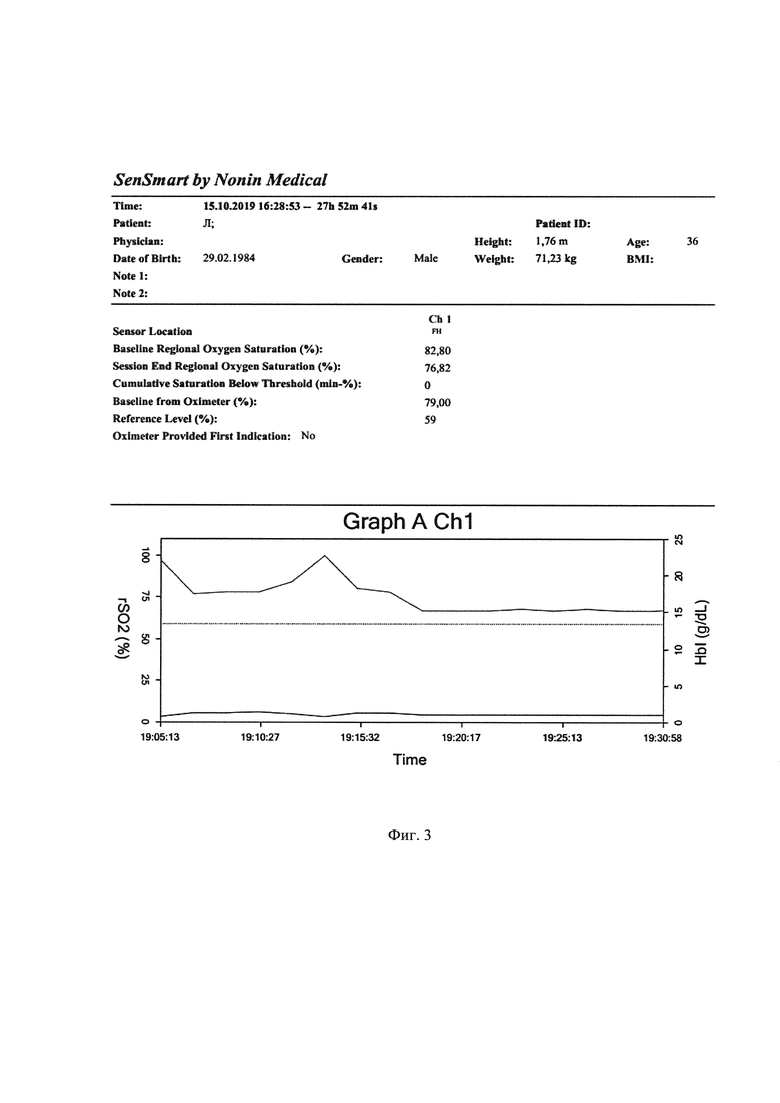
Пациенту исходно, начиная с операционной, проводился мониторинг - трансперкутарная пульсоксиметрия, неинвазивное измерение артериального давления, электрокардиография, церебральная оксиметрия. Базовый уровень оксигенации мозга определялся датчиком, установленным на лбу при ясном сознании и после локальной гипотермии до стабилизации температуры в области лба до 36.6°С. Из данных фиг. 3 видно, что снижение оксигенации мозга на фоне неизменных показателей АД, измеряемых неинвазивным методом, начинается с 19.05.10, а клиническая смерть зарегистрирована лишь в 19.07.36 (на 2,26 минуты позднее и при снижении показателя церебральной оксигенации на 24,1% от исходного), когда и начаты реанимационные мероприятия. Реанимационные мероприятия приводят к кратковременному восстановлению сердечного ритма, что видно на кривой оксиметрии в 19.13.15, однако далее следует повторная остановка сердечной деятельности, после чего реанимационные мероприятия оказываются неэффективными на протяжении 35 минут, затем констатирована смерть.
Пример 4.
Пациентка С., 62 лет, поступила в экстренном порядке в хирургическую реанимацию с диагнозом «Сахарный диабет II типа в стадии декомпенсации. Гнойно-некротическая рана правой стопы».
Объективно: Состояние тяжелое. Уровень сознания - ясное. Жалобы на сильные боли в области сердца. Дыхание самостоятельное, адекватное. Гипотензия, начата инотропная поддержка дофамином 40 мг/ч. По данным электрокардиографии - острый коронарный синдром с подъемом сегмента ST. Температура тела в области лба - 36,7°С.
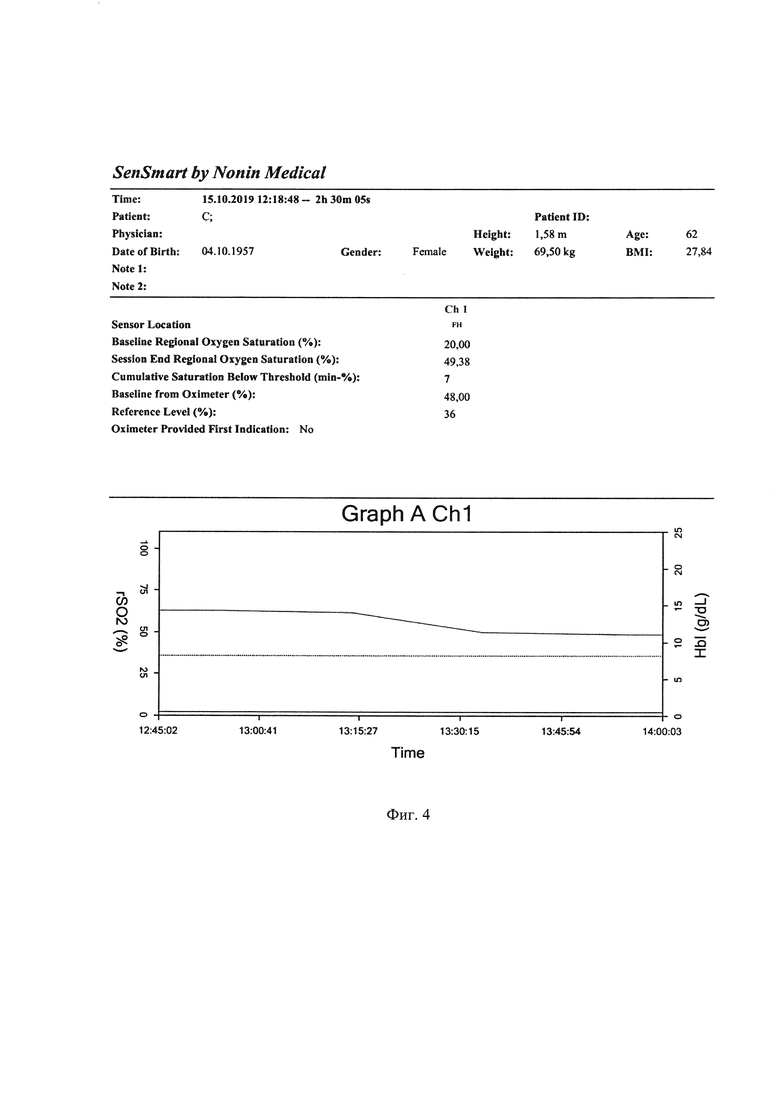
Пациентке начат мониторинг - трансперкутарная пульсоксиметрия, неинвазивное измерение артериального давления, электрокардиография, церебральная оксиметрия. Из данных фиг. 4 видно, что снижение оксигенации мозга на фоне неизменных показателей АД, измеряемых неинвазивным методом, начинается с 13.15.15, а внезапная утрата сознания и клиническая смерть зарегистрирована лишь в 13.18.32 (на 2,17 минуты позднее и при снижении показателя церебральной оксигенации на 21,9% от исходного), когда и начаты реанимационные мероприятия. Однако реанимационные мероприятия оказываются неэффективными на протяжении 35 минут, констатирована смерть.
Таким образом, метод транспекутарной пульсооксиметрии не позволяет адекватно оценивать эффективность реанимационных мероприятий, ЭКГ позволяет оценить момент остановки реанимационных мероприятий, но не позволяет определить нарушения трофики головного мозга, приближение клинической смерти и оценить эффективность перфузии головного мозга. В свою очередь, церебральная оксиметрия при регистрации исходного уровня оксигенации мозга в условиях локально скорректированной нормотермии в месте регистрации и ясного сознания позволяет провести раннюю диагностику надвигающейся катастрофы, а главное мониторировать эффективность проводимых мероприятий.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫБОРА ОПТИМАЛЬНОГО РЕЖИМА ИСКУССТВЕННОЙ ВЕНТИЛЯЦИИ ЛЕГКИХ У РЕАНИМАЦИОННЫХ БОЛЬНЫХ С ЧЕРЕПНО-МОЗГОВОЙ ТРАВМОЙ | 1998 |
|
RU2141350C1 |
| СПОСОБ ОЖИВЛЕНИЯ ЧЕЛОВЕКА | 2014 |
|
RU2559913C1 |
| СПОСОБ ВЫБОРА РЕЖИМА ПЕРЕВОДА БОЛЬНЫХ С ЧЕРЕПНО-МОЗГОВОЙ ТРАВМОЙ НА САМОСТОЯТЕЛЬНОЕ ДЫХАНИЕ | 2002 |
|
RU2223121C2 |
| СПОСОБ ОЦЕНКИ МЕТАБОЛИЗМА И СИСТЕМЫ ТРАНСПОРТА КИСЛОРОДА К ГОЛОВНОМУ МОЗГУ У БОЛЬНЫХ С ТЯЖЕЛОЙ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМОЙ | 2004 |
|
RU2264162C2 |
| РЕАНИМАЦИОННЫЙ НАБОР ДЛЯ ИСКУССТВЕННОЙ ВЕНТИЛЯЦИИ ЛЁГКИХ | 2024 |
|
RU2838415C1 |
| СПОСОБ ПОДБОРА ПРЕПАРАТА, РЕГУЛИРУЮЩЕГО ДАВЛЕНИЕ, ДЛЯ АДЕКВАТНОЙ ЦЕРЕБРАЛЬНОЙ ПЕРФУЗИИ ПРИ ОСТРОМ ПОВРЕЖДЕНИИ ГОЛОВНОГО МОЗГА | 2011 |
|
RU2469645C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СТАДИИ ГИПОКСИЧЕСКОГО ПОВРЕЖДЕНИЯ И ВЕРОЯТНОСТИ ОЖИВЛЕНИЯ ПО А.Л. УРАКОВУ | 2009 |
|
RU2422090C1 |
| СПОСОБ ПЕРЕМЕЩЕНИЯ ПОСТРАДАВШЕГО ДЛЯ ПРОВЕДЕНИЯ СЕРДЕЧНО-ЛЕГОЧНОЙ РЕАНИМАЦИИ | 2022 |
|
RU2803376C2 |
| СПОСОБ ЛЕЧЕНИЯ РЕСПИРАТОРНОГО ДИСТРЕСС-СИНДРОМА НОВОРОЖДЕННЫХ | 2009 |
|
RU2424001C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ТИПОВ ОТЕКА ГОЛОВНОГО МОЗГА У НЕЙРОХИРУРГИЧЕСКИХ ПАЦИЕНТОВ | 2003 |
|
RU2278611C2 |
Изобретение относится к медицине, а именно медицине катастроф, реаниматологии, и может быть использовано для мониторинга эффективности сердечно-легочной реанимации (СЛР). Проводят непрерывную церебральную оксиметрию. Оценивают эффективность СЛР по восстановлению показателя кривой церебральной окисгенации до исходного значения. При этом контролируют локальную температуру кожи лба пациента с помощью тепловизора, а церебральную оксиметрию начинают при ясном сознании пациента и стабилизации температуры до 36,6-36,7°С. Способ обеспечивает повысить точность мониторинга эффективности СЛР за счет стандартизации условий проведения церебральной оксиметрии. 4 пр., 4 ил.
Способ мониторинга эффективности сердечно-легочной реанимации (СЛР), включающий проведение непрерывной церебральной оксиметрии, оценку эффективности СЛР по восстановлению показателя кривой церебральной окисгенации до исходного значения, отличающийся тем, что контролируют локальную температуру кожи лба пациента с помощью тепловизора, а церебральную оксиметрию начинают при ясном сознании пациента и стабилизации температуры до 36,6-36,7°С.
| СПОСОБ ДИАГНОСТИКИ ГИПОКСИИ МОЗГА ПРИ ОПЕРАЦИЯХ НА ОТКРЫТОМ СЕРДЦЕ В УСЛОВИЯХ БЕСПЕРФУЗИОННОЙ УГЛУБЛЕННОЙ ГИПОТЕРМИЧЕСКОЙ ЗАЩИТЫ | 1998 |
|
RU2158925C2 |
| СПОСОБ КОНТРОЛЯ СЕРДЕЧНО-ЛЕГОЧНОЙ РЕАНИМАЦИИ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2549314C2 |
| US 7582060 B2, 01.09.2009 | |||
| АЛЕКСЕЕВА Е | |||
| А | |||
| Церебральная оксиметрия в составе мониторинга интраоперационного периода и интенсивной терапии у детей | |||
| Диссертация на соискание ученой степени кандидата медицинских наук | |||
| ФГБНУ "Научный центр здоровья детей" | |||
| Москва, 2015 | |||
| АКИМОВ Е | |||
| Б | |||
| и др | |||
| Кожная | |||
Авторы
Даты
2020-12-04—Публикация
2020-05-08—Подача