Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к водным липидным и/или липосомным составам с увеличенной химической стабильностью, способам получения таких водных составов, а также содержащим их наборам. Настоящее изобретение дополнительно относится к способам получения фармацевтических композиций на основе липидов, к полученным с помощью таких способов фармацевтическим композициям и к способам химической стабилизации водных липидных и/или липосомных составов.
Предшествующий уровень техники настоящего изобретения
В воде липиды могут существовать в различных формах ламеллярной или неламеллярной (например, кубической или гексагональной) фаз, которые часто носят название лиотропных липидных фаз. Например, липосомы состоят из одно- или многослойных самозамкнутых липидных бислоев, диспергированных в воде. В более общих терминах их можно рассматривать как коллоидные системы, в которых липиды организованы в ламеллярную форму. Многие из этих систем, которые содержат лиотропные липидные фазы, вызывают интерес в качестве фармацевтических составов для доставки лекарственных средств или других применений. Одно требование для введения таких фармацевтических продуктов на основе липидов в клиническую практику заключается в необходимости обеспечения достаточного срока хранения после производства. В этом случае, помимо других критериев, химическая стабильность липидов, которые образуют липосомы, может стать ограничивающим фактором. Липосомы, как правило, собраны из фосфолипидов или родственных соединений. Фосфолипиды состоят из жирных кислот, связанных с триглицеридным каркасом с помощью сложноэфирных связей. Указанные сложноэфирные связи подвержены химическому гидролизу, который ускоряется при кислотных или основных условиях (кислотный или основный сложноэфирный гидролиз). Если липосомы или другие системы, присутствующие в виде лиотропных липидных фаз, подлежат хранению в течение нескольких месяцев или лет в водной фазе, сложноэфирный гидролиз может стать ограничивающим фактором в отношении стабильности в течение срока хранения.
Ввиду ускорения сложноэфирного гидролиза при кислотных или основных условиях, предусмотрено, что лучшая стабильность или самая низкая скорость гидролиза для липидов, как правило, находится в диапазоне pH от 6 до 7. Другие возможности предупреждения гидролиза представляют собой замораживание и/или лиофилизацию липосом (Chen et al., 2010; van Winden and Crommelin, 1999; Stark et al., 2010). Протоколы для проведения замораживания и лиофилизации липосом представлены в литературе. Тем не менее, указанные дополнительные технические стадии также делают производство более сложным и дорогостоящим. Во многих случаях необходимо добавление криопротектора, что может являться невозможным или нежелательным для определенных продуктов. Например, присутствие криопротекторов и/или замораживание/лиофилизация сами по себе могут нежелательным образом повлиять на свойства продукта. Следовательно, длительная стабилизация жидких липосомных препаратов все еще представляет собой неудовлетворенную потребность. В связи с этим, существует значительный интерес к техникам минимизации гидролиза липосом или, в более общем плане, коллоидно-диспергированных липидов в жидкой (водной) фазе. Это особенно относится к тем случаям, когда липосомы предназначены для использования в качестве фармацевтических продуктов, поскольку в этом случае способ стабилизации должен удовлетворять нормативным и технологическим требованиям для таких продуктов. Наиболее сложными в этом контексте являются продукты для парентерального (например, внутривенного) введения, где необходимо удовлетворить, среди прочего, определенные критерии, относящиеся к стерильности, выбору вспомогательных веществ, ионных условий и условий pH или конкретного состава.
Настоящее изобретение направлено на обеспечение способов и средств для увеличения стабильности, в частности химической стабильности липидов и/или липосом, введенных в состав водных составов, таким образом увеличивая стабильность указанных составов в течение срока хранения.
Краткое раскрытие настоящего изобретения
Согласно первому аспекту настоящее изобретение относится к водному составу, содержащему
- по меньшей мере один липид, который характеризуется одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, и
- по меньшей мере один регулятор pH,
причем водный состав характеризуется значением pH между 2 и 5,5.
Согласно одному варианту осуществления по меньшей мере один из липидов, присутствующих в водном составе, представляет собой катионный липид. Согласно одному варианту осуществления катионный липид представляет собой катионный липид согласно представленному в настоящем документе определению.
Согласно одному варианту осуществления общий суммарный заряд липидов, присутствующих в водном составе, является положительным.
Согласно одному варианту осуществления водный состав характеризуется значением pH между 2 и 5, предпочтительно между 2,5 и 5, более предпочтительно между 3 и 4,5, более предпочтительно между 3 и 4 и даже более предпочтительно между 3,5 и 4.
Согласно одному варианту осуществления по меньшей мере один липид, характеризующийся одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, включает в себя глицеролипид и/или глицерофосфолипид.
Согласно одному варианту осуществления по меньшей мере один липид, характеризующийся одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, включает в себя катионный липид и/или некатионный липид.
Согласно одному варианту осуществления катионный липид выбран из группы, состоящей из 1,2-диолеоил-3-триметиламмонийпропана (DOTAP), 1,2-диолеоилокси-3-диметиламмонийпропана (DODAP) и аналогов указанных молекул, характеризующихся различной композицией фрагмента - ацильной цепи.
Согласно одному варианту осуществления некатионный липид представляет собой нейтральный липид, причем нейтральный липид предпочтительно выбран из группы, состоящей из 1,2-ди-(9Z-октадеценоил)-sn-глицеро-3-фосфоэтаноламина (DOPE), 1,2-диолеоил-sn-глицеро-3-фосфохолина (DOPC), фосфатидилхолина (PC) и димиристоилфосфатидилхолина (DMPC).
Согласно одному варианту осуществления некатионный липид представляет собой анионный липид, причем анионный липид предпочтительно выбран из группы, состоящей из фосфатидилсерина (PS), фосфатидилинозитола (PI), фосфатидной кислоты (PA), фосфатидилглицерола (PG) и димиристоилфосфатидилглицерола (DMPG).
Согласно одному варианту осуществления водный состав дополнительно содержит по меньшей мере один липид, не характеризующийся какими-либо сложноэфирными связями, тиоэфирными связями или амидными связями.
Согласно одному варианту осуществления по меньшей мере один липид, не характеризующийся какими-либо сложноэфирными связями, тиоэфирными связями или амидными связями, включает в себя катионный липид и/или некатионный липид.
Согласно одному варианту осуществления катионный липид выбран из группы, состоящей из 1,2-ди-O-октадеценил-3-триметиламмонийпропана (DOTMA), 1,2-диолеилокси-N,N-диметиламинопропана (DODMA), диоктадецилдиметиламмония (DODA(Br)/DDAB), диоктадецилдиметиламмонийхлорида (DODAC), 1,2-димиристоилоксипропил-1,3-диметилгидроксиэтиламмония (DMRIE), 2,3-диолеоилокси-N-[2(сперминкарбоксамид)этил]-N,N-диметил-1-пропанаминийтрифторацетата (DOSPA), аналогов указанных молекул, характеризующихся различной композицией фрагмента - ацильной цепи.
Согласно одному варианту осуществления некатионный липид представляет собой нейтральный липид, причем нейтральный липид предпочтительно выбран из группы, состоящей из холестерина (Chol) и сфингомиелина (SM).
Согласно одному варианту осуществления некатионный липид представляет собой анионный липид.
Согласно одному варианту осуществления водный состав содержит по меньшей мере один катионный липид и по меньшей мере один некатионный липид.
Согласно одному варианту осуществления молярное соотношение по меньшей мере одного катионного липида по меньшей мере к одному некатионному липиду составляет 1:4-4:1, предпочтительно 1:2-4:1.
Согласно одному варианту осуществления молярная доля по меньшей мере одного катионного липида по отношению к общему липиду составляет по меньшей мере 5%, предпочтительно по меньшей мере 10%, более предпочтительно по меньшей мере 20%.
Согласно одному варианту осуществления по меньшей мере один регулятор pH содержит кислоту и/или кислотный буфер.
Согласно одному варианту осуществления кислота представляет собой неразветвленную, разветвленную или циклическую C1-C28, предпочтительно C1-C22 карбоновую кислоту.
Согласно одному варианту осуществления кислота выбрана из группы, состоящей из уксусной кислоты, аскорбиновой кислоты, лимонной кислоты, соляной кислоты, ортофосфорной кислоты, разветвленных или неразветвленных, насыщенных, мононенасыщенных или полиненасыщенных C12-C28 жирных кислот, предпочтительно C12-C22 жирных кислот (например, олеиновой кислоты).
Согласно одному варианту осуществления кислотный буфер основан на кислоте согласно представленному выше определению.
Согласно одному варианту осуществления кислотный буфер выбран из группы, состоящей из ацетатного буфера, цитратного буфера, фосфатного буфера и карбонатного буфера.
Согласно одному варианту осуществления по меньшей мере один регулятор pH содержит уксусную кислоту и/или ацетатный буфер.
Согласно одному варианту осуществления по меньшей мере один регулятор pH присутствует в таком количестве, чтобы молярное соотношение общего липида по меньшей мере к одному регулятору pH не превышало 100:1.
Согласно одному варианту осуществления по меньшей мере один регулятор pH присутствует в таком количестве, чтобы молярное соотношение общего липида по меньшей мере к одному регулятору pH составляло 10:1-1:10, предпочтительно 5:1-1:5, более предпочтительно 2:1-1:2, более предпочтительно 1,5:1-1:1,5, даже более предпочтительно приблизительно 1:1.
Согласно одному варианту осуществления скорость гидролиза по меньшей мере одного липида, характеризующегося одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, уменьшена по сравнению со скоростью его гидролиза при значении pH между 6 и 7.
Согласно одному варианту осуществления липиды, присутствующие в водном составе, образуют липосомы.
Согласно одному варианту осуществления по меньшей мере один регулятор pH ассоциирован с липосомами.
Согласно дополнительному аспекту настоящее изобретение относится к способу получения водного состава согласно представленному выше определению, причем способ предусматривает
- образование липосом в водном растворе, содержащем по меньшей мере один регулятор pH и характеризующемся значением pH между 2 и 5,5 или
- добавление по меньшей мере одного регулятора pH к водному раствору, содержащему липосомы, для доведения pH водного раствора до значения pH между 2 и 5,5.
Согласно другому аспекту настоящее изобретение относится к набору, содержащему водный состав согласно представленному выше определению.
Согласно одному варианту осуществления набор дополнительно содержит, в отдельном контейнере, фармацевтически активное соединение, причем фармацевтически активное соединение предпочтительно содержит нуклеиновую кислоту, предпочтительно ДНК или РНК.
Согласно одному варианту осуществления нуклеиновая кислота предусмотрена в буферном растворе, характеризующемся значением pH между 6 и 8.
Согласно другому аспекту настоящее изобретение относится к способу получения фармацевтической композиции, причем способ предусматривает
- получения водного состава согласно представленному выше определению; и
- смешивание водного состава с фармацевтически активным соединением.
Согласно одному варианту осуществления фармацевтически активное соединение содержит нуклеиновую кислоту, предпочтительно ДНК или РНК, причем нуклеиновая кислота предпочтительно предусмотрена в буферном растворе, характеризующемся значением pH между 6 и 8.
Согласно дополнительному аспекту настоящее изобретение относится к фармацевтической композиции, полученной способом согласно представленному выше определению.
Согласно другому аспекту настоящее изобретение относится к способу химической стабилизации водного состава, содержащего по меньшей мере один липид, характеризующийся одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, причем способ предусматривает
- доведение pH водного состава до значения pH между 2 и 5,5.
Согласно одному варианту осуществления химическая стабилизация происходит путем ингибирования гидролиза сложноэфирной связи, тиоэфирной связи и/или амидной связи.
Согласно одному варианту осуществления по меньшей мере один из липидов, присутствующих в водном составе, представляет собой катионный липид. Согласно одному варианту осуществления катионный липид является таким, который соответствует приведенному выше определению.
Согласно одному варианту осуществления общий суммарный заряд липидов, присутствующих в водном составе, является положительным.
Согласно одному варианту осуществления значение pH доведено до значения pH между 2 и 5, предпочтительно между 2,5 и 5, более предпочтительно между 3 и 4,5, более предпочтительно между 3 и 4 и даже более предпочтительно между 3,5 и 4.
Согласно одному варианту осуществления значение pH водного липидного состава доведено с помощью добавления по меньшей мере одного регулятора pH, предпочтительно по меньшей мере одного регулятора pH согласно представленному выше определению.
Согласно одному варианту осуществления по меньшей мере один липид, характеризующийся одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, является таким, который соответствует приведенному выше определению.
Согласно одному варианту осуществления липиды, присутствующие в водном составе, образуют липосомы.
Краткое описание фигур
На фигуре 1 показано процентное отношение DOPE, извлеченного из липосомных дисперсий DOTMA/DOPE, полученных в дисперсионных растворах, характеризующихся различными значениями pH. Липосомную дисперсию хранили при 37°C и образцы собирали в различные моменты времени.
На фигуре 2 показано процентное отношение DOPE, извлеченного из липосомных дисперсий DOTMA/DOPE с различными значениями pH, полученными в присутствии уксусной кислоты (HAc) или различных концентраций буферов на основе уксусной кислоты (AcB). Дисперсии хранили в течение 5 недель при 40°C.
На фигуре 3 показано процентное отношение DOPE, извлеченного из липосомных дисперсий DOTMA/DOPE, подвергнутых стрессовому воздействию, через 5 или 6 недель в зависимости от значения pH. Показаны результаты от 3 независимых экспериментов.
На фигуре 4 показано процентное отношение извлечение липидов из липосом DOTAP/DOPE через 2 недели при 40°C в зависимости от значения pH.
На фигуре 5 показано процентное отношение извлечения DOPE из липосом DOTMA/DOPE в воде для инъекций в присутствии или при отсутствии 5 мМ уксусной кислоты (HAc) после хранения в течение 3 месяцев при 5°C, 25°C или 40°C.
На фигуре 6 показаны биолюминесцентные сигналы у мышей, которым вводили инъекции липоплексов РНК, кодирующей люциферазу, полученных с pH-стабилизированными липосомами или pH-нестабилизированными липосомами (стандарт).
На фигуре 7 показана стабильность DOPE в липосомах DOTMA/DOPE в воде для инъекций (L1) или в воде для инъекций с 5 мМ уксусной кислоты (L2) при 5°C (A), 25°C (B) или 40°C (C). Липосомы получали при GMP или GMP-подобных условиях.
Подробное раскрытие настоящего изобретения
Несмотря на то, что настоящее изобретение подробно описано ниже, следует понимать, что настоящее изобретение не ограничено конкретными методиками, протоколами и реагентами, описанными в данном документе, поскольку они могут варьировать. Кроме того, следует понимать, что терминология, используемая в настоящем документе, представлена исключительно с целью описания конкретных вариантов осуществления и не предусмотрена для ограничения объема настоящего изобретения, который будет ограничен исключительно прилагаемой формулой изобретения. Если не указано иное, все используемые в данном документе технические и научные термины, имеют такие же значения, которые обычно понятны специалисту в настоящей области техники.
В последующем описании будут описаны элементы настоящего изобретения. Указанные элементы перечислены с конкретными вариантами осуществления, тем не менее, следует понимать, что их можно комбинировать любым способом и в любом количестве для создания дополнительных вариантов осуществления. Различным образом описанные примеры и предпочтительные варианты осуществления не должны истолковываться как ограничивающие настоящее изобретение только явно описанными вариантами осуществления. Настоящее описание должно пониматься как поддерживающее и охватывающее варианты осуществления, которые объединяют явно описанные варианты осуществления с любым количеством раскрытых и/или предпочтительных элементов. Кроме того, любые перестановки и комбинации всех описанных элементов в настоящей заявке должны рассматриваться как раскрытые в описании настоящей заявки, если контекст не указывает иное.
Используемые в данном документе термины предпочтительно определяют так, как описано в "A multilingual glossary of biotechnological terms: (IUPAC Recommendations)", H.G.W. Leuenberger, B. Nagel, and  Eds., Helvetica Chimica Acta, CH-4010 Basel, Switzerland, (1995).
Eds., Helvetica Chimica Acta, CH-4010 Basel, Switzerland, (1995).
В осуществлении на практике настоящего изобретения, если не указано иное, будут использовать общепринятые способы химии, биохимии, клеточной биологии, иммунологии и техник рекомбинантных ДНК, объяснение которых можно найти в литературе в настоящей области техники (см., например, Molecular Cloning: A Laboratory Manual, 2nd Edition, J. Sambrook et al. eds., Cold Spring Harbor Laboratory Press, Cold Spring Harbor 1989).
В настоящем описании и прилагаемой формуле изобретения, если контекст не требует иного, слово "содержать" и такие его варианты, как "содержит" и "содержащий", будет подразумевать включение указанного представителя, целого числа или стадии или группы представителей, целых чисел или стадий, но не исключение какого-либо другого представителя, целого числа или стадии или группы представителей, целых чисел или стадий, хотя в некоторых вариантах осуществления такой другой представитель, целое число или стадия или группа представителей, целых чисел или стадий могут быть исключены, иными словами предмет состоит во включении указанного представителя, целого числа или стадии или группы представителей, целых чисел или стадий. Формы единственного числа, использованные в контексте описания настоящего изобретения (особенно в контексте формулы изобретения), следует рассматривать как охватывающие как формы единственного числа, так и формы множественного числа, если иное не указано в настоящем документе или это явно не противоречит контексту. Предусмотрено, что перечисление диапазонов значений в настоящем документе служит исключительно в качестве сокращенного способа ссылки индивидуально на каждое отдельное значение, попадающее в диапазон. Если в настоящем документе не указано иное, каждое индивидуальное значение включено в описание изобретения так, как если бы оно было индивидуально приведено в настоящем документе. Все способы, описанные в настоящем документе, можно провести в любом подходящем порядке, если иное не указано в настоящем документе или это явно не противоречит контексту. Применение какого-либо и всех примеров или иллюстративной формулировки (например, "такие как"), представленное в настоящем документе, предусмотрено исключительно для лучшей иллюстрации настоящего изобретения и не представляет собой ограничение объема настоящего изобретения, заявленного иным образом. Ни одну формулировку в настоящем описании изобретения не следует рассматривать как указывающую на какой-либо не заявленный элемент, необходимый для осуществления настоящего изобретения на практике.
Несколько документов цитируются в тексте настоящего описания изобретения. Каждый из документов, процитированных в настоящем документе (включая в себя патенты, патентные заявки, научные публикации, технические характеристики, инструкции производителей и т.д.), будь то выше или ниже, полностью включены в настоящий документ посредством ссылки. Ничто в настоящем документе не должно быть истолковано как признание того, что настоящее изобретение не наделено правом предшествовать такому раскрытию на основании предшествующего изобретения.
Согласно настоящему изобретению предусмотрен водный состав, содержащий:
- по меньшей мере один липид, характеризующийся одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, предпочтительно сложноэфирных связей, и
- по меньшей мере один регулятор pH,
причем водный состав характеризуется значением pH между 2 и 5,5.
Водный состав согласно настоящему изобретению (который также может носить название водной липидной дисперсии) характеризуется увеличенной химической стабильностью, более конкретно увеличенной химической стабильностью по меньшей мере одного липида, характеризующегося одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, предпочтительно сложноэфирных связей. Согласно одному варианту осуществления скорость гидролиза по меньшей мере одного липида, характеризующегося одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, предпочтительно сложноэфирных связей, уменьшена по сравнению со скоростью его гидролиза при значении pH между 6 и 7. Согласно одному варианту осуществления скорость гидролиза уменьшена по меньшей мере в 1,5 раза, предпочтительно по меньшей мере в 2 раза, более предпочтительно по меньшей мере в 3 раза, даже более предпочтительно по меньшей мере в 4 раза.
Согласно одному варианту осуществления водный состав характеризуется значением pH между 2 и 5, предпочтительно между 2,5 и 5, более предпочтительно между 3 и 4,5, более предпочтительно между 3 и 4 и даже более предпочтительно между 3,5 и 4. Согласно дополнительному предпочтительному варианту осуществления водный состав характеризуется значением pH между 3,1 и 3,9.
Предусмотрено, что используемый в настоящем документе термин "липид" относится к амфифильной молекуле, содержащей гидрофильный фрагмент (например, полярную головку) и липофильный или гидрофобный фрагмент. Липофильный или гидрофобный фрагмент может содержать по меньшей мере один разветвленный или неразветвленный, насыщенный или ненасыщенный жирнокислотный фрагмент или его производное или аналог (например, фторуглерод). Жирнокислотный фрагмент по существу состоит из углеводородного фрагмента/цепи, в частности ацильной цепи. Жирнокислотный фрагмент или его производное или аналог предпочтительно характеризуются длиной, составляющей 10-30, более предпочтительно 12-25, даже более предпочтительно 14-22 атомов углерода. В случае, когда липид содержит более одного, например, два или три жирнокислотных фрагмента или их производных или аналогов, указанные жирнокислотные фрагменты или их производные или аналоги могут быть одинаковыми или различными. Термин "липид" включает в себя катионные липиды и некатионные липиды, т.е. нейтральные или анионные липиды. Липиды могут включать в себя фосфолипиды или их производные, глицеролипиды или их производные, сфинголипиды (например, сфингомиелин) или их производные или стериновые липиды (например, холестерин) или их производные. Глицеролипиды состоят из глицеролов, являющихся моно-, ди- или тризамещенными с помощью жирнокислотных фрагментов. Фосфолипиды, чей гидрофильный фрагмент содержит фосфатную группу, могут представлять собой глицерофосфолипиды. Используемые согласно настоящему изобретению липиды предпочтительно представляют собой липиды, которые образуют бислой. Липиды также могут являться функционализированными/модифицированными, например, с помощью (олиго)пептидов, полимеров (например, ПЭГ) или других функциональных групп. В водной среде липиды дополнительно могут являться супрамолекулярно организованными, например, в форме частиц на основе липидов или лиотропных фаз, таких как липосомы, ламеллярные фазы, гексагональные и инвертированные гексагональные фазы, кубические фазы, мицеллы и обратные мицеллы, состоящие из монослоев. Эффект стабилизации согласно настоящему изобретению применим ко всем типам супрамолекулярной организации липидов. Используемые согласно настоящему изобретению липиды предпочтительно являются фармацевтически приемлемыми, например, используемыми в качестве вспомогательных веществ, в качестве компонентов составов для доставки лекарственных средств и/или для применения в трансфекции нуклеиновых кислот в клетки.
Если настоящее раскрытие относится к заряду, такому как положительный заряд, отрицательный заряд или нейтральный заряд, или к катионному соединению, отрицательному соединению или нейтральному соединению, как правило, это означает, что указанный заряд присутствует при выбранном значении pH, таком как физиологическое значение pH. Например, термин "катионный липид" относится к липиду, характеризующемуся положительным суммарным зарядом при выбранном значении pH, таком как физиологическое значение pH. Термин "нейтральный липид" относится к липиду, который не характеризуется положительным или отрицательным суммарным зарядом, который может существовать в форме незаряженной молекулы или нейтральной амфотерной (или цвиттерионной) молекулы при выбранном значении pH, таком как физиологическое значение pH. Под "физиологическим значением pH" в настоящем документе подразумевают значение pH между 6 и 8, предпочтительно между 6,5 и 8, более предпочтительно приблизительно 7,5.
Катионный липид предпочтительно содержит катионную головку. Полярная головка катионных липидов предпочтительно содержит такие аминопроизводные, как первичные, вторичные и/или третичные амины, четвертичный аммоний, различные комбинации аминов, соли амидиния или группы гуанидина и/или имидазола, а также пиридиний, пиперизин и такие аминокислотные головки, как лизин, аргинин, орнитин и/или триптофан. Полярная головка катионного липида более предпочтительно содержит аминопроизводные. Полярная головка катионного липида наиболее предпочтительно содержит четвертичный аммоний. Головка катионного липида может содержать один катионный заряд или многочисленные катионные заряды.
Анионный липид предпочтительно содержит такую анионную головку, как фосфатная группа. Головка анионного липида может содержать один анионный заряд или многочисленные анионные заряды.
Согласно одному варианту осуществления по меньшей мере один из липидов, присутствующих в водном составе, представляет собой катионный липид, предпочтительно катионный липид согласно представленному в настоящем документе определению.
Согласно одному варианту осуществления общий суммарный заряд липидов, присутствующих в водном составе, является положительным.
Используемый в настоящем документе термин "общий суммарный заряд" означает сумму результирующих зарядов всех липидов, присутствующих в водном составе.
Согласно одному варианту осуществления по меньшей мере один липид, характеризующийся одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, включает в себя глицеролипид и/или глицерофосфолипид.
Согласно одному варианту осуществления по меньшей мере один липид, характеризующийся одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, представляет собой глицеролипид. Согласно другому варианту осуществления по меньшей мере один липид, характеризующийся одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, представляет собой глицерофосфолипид. Согласно другому варианту осуществления водный состав содержит по меньшей мере два липида, характеризующихся одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, причем по меньшей мере два липида включают в себя глицеролипид и глицерофосфолипид.
Согласно одному варианту осуществления по меньшей мере один липид, характеризующийся одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, включает в себя катионный липид и/или некатионный липид.
Согласно одному варианту осуществления по меньшей мере один липид, характеризующийся одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, представляет собой катионный липид. Согласно другому варианту осуществления по меньшей мере один липид, характеризующийся одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, представляет собой некатионный липид. Согласно другому варианту осуществления водный состав содержит по меньшей мере два липида, характеризующихся одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, причем по меньшей мере два липида включают в себя катионный липид и некатионный липид.
Согласно одному варианту осуществления катионный липид выбран из группы, состоящей из 1,2-диолеоил-3-триметиламмонийпропана (DOTAP), 1,2-диолеоилокси-3-диметиламмонийпропана (DODAP) и аналогов указанных молекул, характеризующихся различной композицией фрагмента - ацильной цепи.
Согласно одному варианту осуществления некатионный липид представляет собой нейтральный липид, причем нейтральный липид предпочтительно выбран из группы, состоящей из 1,2-ди-(9Z-октадеценоил)-sn-глицеро-3-фосфоэтаноламина (DOPE), 1,2-диолеоил-sn-глицеро-3-фосфохолина (DOPC), фосфатидилхолина (PC) и димиристоилфосфатидилхолина (DMPC).
Согласно одному варианту осуществления некатионный липид представляет собой анионный липид, причем анионный липид предпочтительно выбран из группы, состоящей из фосфатидилсерина (PS), фосфатидилинозитола (PI), фосфатидной кислоты (PA), фосфатидилглицерола (PG) и димиристоилфосфатидилглицерола (DMPG).
Согласно одному варианту осуществления водный состав дополнительно содержит по меньшей мере один липид, не характеризующийся какими-либо сложноэфирными связями, тиоэфирными связями или амидными связями. Согласно одному варианту осуществления водный состав дополнительно содержит по меньшей мере один липид, не характеризующийся какими-либо сложноэфирными связями.
Согласно одному варианту осуществления по меньшей мере один липид, не характеризующийся какими-либо сложноэфирными связями, тиоэфирными связями или амидными связями, включает в себя глицеролипид и/или глицерофосфолипид.
Согласно одному варианту осуществления по меньшей мере один липид, не характеризующийся какими-либо сложноэфирными связями, тиоэфирными связями или амидными связями, представляет собой глицеролипид. Согласно другому варианту осуществления по меньшей мере один липид, не характеризующийся какими-либо сложноэфирными связями, тиоэфирными связями или амидными связями, представляет собой глицерофосфолипид. Согласно другому варианту осуществления водный состав содержит по меньшей мере два липида, не характеризующихся какими-либо сложноэфирными связями, тиоэфирными связями или амидными связями, причем по меньшей мере два липида включают в себя глицеролипид и глицерофосфолипид.
Согласно одному варианту осуществления по меньшей мере один липид, не характеризующийся какими-либо сложноэфирными связями, тиоэфирными связями или амидными связями, включает в себя катионный липид и/или некатионный липид.
Согласно одному варианту осуществления по меньшей мере один липид, не характеризующийся какими-либо сложноэфирными связями, тиоэфирными связями или амидными связями, представляет собой катионный липид. Согласно другому варианту осуществления по меньшей мере один липид, не характеризующийся какими-либо сложноэфирными связями, тиоэфирными связями или амидными связями, представляет собой некатионный липид. Согласно другому варианту осуществления водный состав содержит по меньшей мере два липида, не характеризующихся какими-либо сложноэфирными связями, тиоэфирными связями или амидными связями, причем по меньшей мере два липида включают в себя катионный липид и некатионный липид.
Согласно одному варианту осуществления катионный липид выбран из группы, состоящей из 1,2-ди-О-октадеценил-3-триметиламмонийпропана (DOTMA), 1,2-диолеилокси-N,N-диметиламинопропана (DODMA), диоктадецилдиметиламмоний (DODA(Br)/DDAB), диоктадецилдиметиламмонийхлорида (DODAC), 1,2-димиристоилоксипропил-1,3-диметилгидроксиэтиламмония (DMRIE), 2,3-диолеоилокси-N-[2(сперминкарбоксамид)этил]-N,N-диметил-1-пропанаминийтрифторацетата (DOSPA), аналогов указанных молекул, характеризующихся различной композицией фрагмента - ацильной цепи.
Согласно одному варианту осуществления некатионный липид представляет собой нейтральный липид, причем нейтральный липид предпочтительно выбран из группы, состоящей из холестерина (Chol) и сфингомиелина (SM).
Согласно одному варианту осуществления некатионный липид представляет собой анионный липид.
Согласно одному варианту осуществления водный состав содержит по меньшей мере один катионный липид и по меньшей мере один некатионный липид, предпочтительно по меньшей мере один катионный липид и по меньшей мере один нейтральный липид.
Согласно одному варианту осуществления водный состав содержит DOTMA и DOPE. Согласно другому варианту осуществления водный состав содержит DOTAP и DOPE.
Согласно одному варианту осуществления некатионный, т.е. нейтральный или анионный, предпочтительно нейтральный, липид функционирует в качестве "хелперного липида". Термин "хелперный липид" относится к липиду, способному увеличивать эффективность доставки частиц на основе липидов (например, липосом) к мишени, предпочтительно в клетке.
Согласно одному варианту осуществления молярное соотношение по меньшей мере одного катионного липида по меньшей мере к одному некатионному липиду составляет 4:1-1:4, предпочтительно 1:2-4:1.
Согласно одному варианту осуществления молярная доля по меньшей мере одного катионного липида по отношению к общему липиду составляет по меньшей мере 5%, предпочтительно по меньшей мере 10%, более предпочтительно по меньшей мере 20%.
Используемый в настоящем документе термин "регулятор pH" означает любое pH-активное средство, которое можно использовать для модификации значения pH (водного) раствора, и включает в себя подкисляющие и подщелачивающие средства. Подкисляющие средства используют для снижения pH, тогда как подщелачивающие средства используют для увеличения pH. Регулятор pH согласно настоящему изобретению предпочтительно представляет собой подкисляющее средство.
Согласно одному варианту осуществления по меньшей мере один регулятор pH содержит кислоту и/или кислотный буфер.
Согласно одному варианту осуществления кислота представляет собой неразветвленную, разветвленную или циклическую C1-C28, предпочтительно C1-C22 карбоновую кислоту.
Согласно одному варианту осуществления кислота выбрана из группы, состоящей из уксусной кислоты, аскорбиновой кислоты, лимонной кислоты, соляной кислоты, ортофосфорной кислоты, разветвленных или неразветвленных, насыщенных, мононенасыщенных или полиненасыщенных C12-C28 жирных кислот, предпочтительно C12-C22 жирных кислот (например, олеиновой кислоты).
Согласно одному варианту осуществления кислотный буфер основан на кислоте согласно представленному выше определению.
Согласно одному варианту осуществления кислотный буфер выбран из группы, состоящей из ацетатного буфера, цитратного буфера, фосфатного буфера и карбонатного буфера.
Согласно одному варианту осуществления по меньшей мере один регулятор pH содержит уксусную кислоту и/или ацетатный буфер.
Согласно одному варианту осуществления по меньшей мере один регулятор pH присутствует в таком количестве, чтобы молярное соотношение общего липида по меньшей мере к одному регулятору pH не превышало 100:1.
Согласно одному варианту осуществления по меньшей мере один регулятор pH присутствует в таком количестве, чтобы молярное соотношение общего липида по меньшей мере к одному регулятору pH составляло 10:1-1:10, предпочтительно 5:1-1:5, более предпочтительно 2:1-1:2, более предпочтительно 1,5:1-1:1,5, даже более предпочтительно приблизительно 1:1.
Согласно одному варианту осуществления по меньшей мере один регулятор pH присутствует в концентрации, составляющей 1 мМ-10 мМ.
Согласно одному варианту осуществления липиды, присутствующие в водном составе, образуют такие частицы на основе липидов, как липосомы. Таким образом, согласно одному варианту осуществления водный состав представляет собой водную липосомную дисперсию. Согласно одному варианту осуществления общий суммарный заряд липидов, образующих липосомы, является положительным. Согласно одному варианту осуществления липосомы представляют собой катионные липосомы.
Используемый в настоящем документе термин "липосома" означает микроскопическую липидную везикулу, которая зачастую характеризуется одним или несколькими бислоями образующего везикулу липида, такого как фосфолипид, и которая способна инкапсулировать лекарственное средство. В контексте настоящего изобретения можно использовать различные типы липосом, включая в себя без ограничения многослойные везикулы (MLV), небольшие однослойные везикулы (SUV), большие однослойные везикулы (LUV), стерически стабилизированные липосомы (SSL), мультивезикулярные везикулы (MV) и большие мультивезикулярные везикулы (LMV), а также другие бислойные формы, известные в настоящей области техники. Размер и ламеллярность липосомы будет зависеть от способа получения. Согласно одному варианту осуществления липосомы характеризуются средним диаметром в диапазоне от приблизительно 50 нм до приблизительно 1000 нм, предпочтительно от приблизительно 100 нм до приблизительно 800 нм, предпочтительно от приблизительно 200 нм до приблизительно 600 нм, например, приблизительно 300 нм - приблизительно 500 нм.
Липосомы можно образовать с использованием стандартных способов, таких как способ обратного испарения (REV), способ на основе инъекции этанола, способ дегидратации-регидратации (DRV), обработка ультразвуком или другие подходящие способы. Липосомы предпочтительно образуют с использованием способа на основе инъекции этанола.
Термин "способ на основе инъекции этанола" относится к способу, при котором раствор этанола, содержащего липиды, быстро вводят по каплям в водный раствор через иглу. Это действие диспергирует липиды в растворе и стимулирует образование липидных частиц, например, образование липосом.
Согласно одному варианту осуществления по меньшей мере один регулятор pH ассоциирован с частицами на основе липидов, предпочтительно липосомами. Согласно настоящему изобретению термин "ассоциирован с" означает, что регулятор pH связан или образует часть частиц на основе липидов, предпочтительно липосом, например, путем встраивания/включения в липидную бислойную мембрану. Согласно одному варианту осуществления регулятор pH, подлежащий ассоциации с липосомами, представляет собой карбоновую кислоту, предпочтительно карбоновую кислоту согласно представленному выше определению. Согласно одному варианту осуществления карбоновая кислота представляет собой разветвленную или неразветвленную C12-C28, предпочтительно C12-C22 карбоновую кислоту. Согласно одному варианту осуществления карбоновая кислота представляет собой разветвленную или неразветвленную, насыщенную, мононенасыщенную или полиненасыщенную C12-C28 жирную кислоту, предпочтительно C12-C22 жирную кислоту (например, олеиновую кислоту). Согласно одному варианту осуществления частицы на основе липидов, предпочтительно липосомы содержат 1-10% регулятора pH.
Согласно одному варианту осуществления частицы на основе липидов, предпочтительно липосомы, содержат (например, инкапсулируют) фармацевтически активное соединение, причем фармацевтически активное соединение предпочтительно содержит нуклеиновую кислоту, предпочтительно ДНК или РНК.
Согласно настоящему изобретению также предусмотрен способ получения водного состава согласно представленному выше определению, причем способ предусматривает:
- образование липосом в водном растворе, содержащем по меньшей мере один регулятор pH и характеризующемся значением pH между 2 и 5,5, или
- добавление по меньшей мере одного регулятора pH к водному раствору, содержащему липосомы для доведения pH водного раствора до значения pH между 2 и 5,5.
Согласно настоящему изобретению также предусмотрен набор, содержащий водный состав согласно представленному выше определению.
Согласно одному варианту осуществления набор дополнительно содержит, в отдельном контейнере, фармацевтически активное соединение, причем фармацевтически активное соединение предпочтительно содержит нуклеиновую кислоту, предпочтительно ДНК или РНК.
Согласно одному варианту осуществления нуклеиновая кислота предусмотрена в буферном растворе, характеризующемся значением pH между 6 и 8. Подходящие буферные вещества для применения в таких буферных растворах включают в себя Трис, HEPES, MOPS и MES.
Используемый в настоящем документе термин "набор" относится к готовому изделию, содержащему один или несколько контейнеров и необязательно носитель данных. Указанный один или несколько контейнеров могут быть заполнены одним или несколькими вышеупомянутыми средствами или реагентами. В набор можно включить дополнительные контейнеры, которые содержат, например, разбавители, буферы и дополнительные реагенты. Указанный носитель данных может представлять собой неэлектронный носитель данных, например, графический носитель данных, такой как информационный вкладыш, информационный листок, штрих-код или код доступа, или электронный носитель данных, такой как дискета, компакт-диск (CD), цифровой универсальный диск (DVD), микрочип или другой электронный носитель данных на основе полупроводников. Код доступа может обеспечивать доступ к базе данных, например, базе данных в сети Интернет, централизованной или децентрализованной базе данных. Указанный носитель данных может содержать инструкции по применению набора в способах согласно настоящему изобретению. Кроме того, носитель данных может содержать информацию или инструкции в отношении того, как осуществлять способы согласно настоящему изобретению.
Используемый в настоящем документе термин "фармацевтически активное соединение" (или "терапевтическое средство") относится к любому соединению, которое характеризуется положительным или благоприятным эффектом на состояние или болезненное состояние субъекта при введении субъекту в терапевтически эффективном количестве. Фармацевтически активное соединение предпочтительно характеризуется лечебными или паллиативными свойствами, и его можно вводить для уменьшения интенсивности, облегчения, ослабления, обратного развития заболевания, задержки начала развития или уменьшения тяжести одного или нескольких симптомов заболевания или нарушения. Фармацевтически активное соединение может характеризоваться профилактическими свойствами, и его можно использовать для задержки начала развития заболевания или уменьшения тяжести такого заболевания или патологического состояния.
Фармацевтически активные соединения включают в себя фармацевтически активные пептиды или белки, фармацевтически активные нуклеиновые кислоты, например, ДНК или РНК, и другие фармацевтически активные органические или неорганические молекулы, например, низкомолекулярные соединения (т.е. биоактивные органические соединения с молекулярной массой меньше чем 900 Да).
Используемый в настоящем документе термин "пептид" содержит олиго- и полипептиды, встречающиеся или не встречающиеся в природе, и относится к веществам, содержащим две или более, предпочтительно 3 или более, предпочтительно 4 или более, предпочтительно 6 или более, предпочтительно 8 или более, предпочтительно 10 или более, предпочтительно 13 или более, предпочтительно 16 или более, предпочтительно 21 или более и вплоть до предпочтительно 8, 10, 20, 30, 40 или 50, в частности 100 аминокислот (например, 10-100, 10-50, 10-40, 20-100, 20-50 или 20-40 аминокислот), ковалентно связанных с помощью пептидных связей. Термин "белок" предпочтительно относится к большим пептидам, предпочтительно к пептидам с более чем 100 аминокислотными остатками, но в общем термины "пептид" и "белок" являются синонимами, и в настоящем документе их используют взаимозаменяемо.
Термин "фармацевтически активный пептид или белок" включает в себя целые белки или полипептиды и, кроме того, он также относится к их фармацевтически активным фрагментам. Также он может включать в себя фармацевтически активные аналоги пептида или белка. Термин "фармацевтически активный пептид или белок" дополнительно включает в себя пептиды и белки, представляющие собой антигены, т.е. введение пептида или белка субъекту вызывает иммунный ответ у субъекта, который может являться терапевтическим или частично или полностью защитным.
Примеры фармацевтически активных белков включают в себя без ограничения цитокины и белки иммунной системы, такие как иммунологически активные соединения (например, интерлейкины, колониестимулирующий фактор (CSF), гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), эритропоэтин, фактор некроза опухоли (TNF), интерфероны, интегрины, адресины, селектины, хоминговые рецепторы, Т-клеточные рецепторы, иммуноглобулины, растворяющиеся антигены главного комплекса гистосовместимости, иммунологически активные антигены, такие как бактериальные, паразитарные или вирусные антигены, аллергены, аутоантигены, антитела), гормоны (инсулин, гормон щитовидной железы, катехоламины, гонадотропины, трофические гормоны, пролактин, окситоцин, дофамин, бычий соматотропин, лептины и подобное), гормоны роста (например, гормон роста человека), факторы роста (например, эпидермальный фактор роста, фактор роста нервов, исулиноподобный фактор роста и подобное), рецепторы факторов роста, ферменты (активатор тканевого плазминогена, стрептокиназа, биосинтетический или деструктивный фермент холестерина, стероидогенные ферменты, киназы, фосфодиэстеразы, метилазы, деметилазы, дегидрогеназы, целлюлазы, протеазы, липазы, фосфолипазы, ароматазы, цитохромы, аденилат- или гуанилатциклазы, нейраминидазы и подобное), рецепторы (рецепторы стероидных гормонов, пептидные рецепторы), связывающие белки (связывающие белки гормона роста или фактора роста и подобное), факторы транскрипции и трансляции, подавляющие рост опухолей белки (например, белки, ингибирующие ангиогенез), структурные белки (такие как коллаген, фиброин, фибриноген, эластин, тубулин, актин и миозин), белки крови (тромбин, сывороточный альбумин, фактор VII, фактор VIII, инсулин, фактор IX, фактор X, активатор тканевого плазминогена, белок C, фактор фон Виллебранда, антитромбин III, глюкоцереброзидаза, эритропоэтин, гранулоцитарный колониестимулирующий фактор (GCSF) или модифицированный фактор VIII, антикоагулянты и подобное.
Согласно одному варианту осуществления фармацевтически активный белок согласно настоящему изобретению представляет собой цитокин, который участвует в регуляции лимфоидного гомеостаза, предпочтительно цитокин, который участвует и предпочтительно индуцирует или усиливает развитие, примирование, экспансию, дифференцировку и/или выживаемость Т-клеток. Согласно одному варианту осуществления цитокин представляет собой интерлейкин. Согласно одному варианту осуществления фармацевтически активный белок согласно настоящему изобретению представляет собой интерлейкин, выбранный из группы, состоящей из IL-2, IL-7, IL-12, IL-15 и IL-21.
Термин "иммунологически активное соединение" относится к любому соединению, изменяющему иммунный ответ, предпочтительно путем индукции и/или угнетения созревания иммунных клеток, индукции и/или угнетения биосинтеза цитокинов, и/или изменяющему гуморальный иммунитет путем стимулирования продукции антител B-клетками. Иммунологически активные соединения обладают сильной иммуностимулирующей активностью, включая в себя без ограничения антивирусную и противоопухолевую активность, а также могут отрицательно регулировать другие аспекты иммунного ответа, например, сдвиг иммунного ответа в сторону от иммунного ответа TH2, что можно использовать для лечения широкого спектра опосредованных TH2 заболеваний. Иммунологически активные соединения можно применять в качестве адъювантов вакцин.
Нуклеиновая кислота согласно настоящему изобретению предпочтительно представляет собой дезоксирибонуклеиновую кислоту (ДНК) или рибонуклеиновую кислоту (РНК), более предпочтительно РНК, наиболее предпочтительно in vitro транскрибированную РНК (IVT РНК) или синтетическую РНК. Нуклеиновые кислоты включают в себя согласно настоящему изобретению геномную ДНК, кДНК, иРНК, полученные рекомбинантно и химически синтезированные молекулы. Нуклеиновая кислота согласно настоящему изобретению может находиться в форме молекулы, которая является одноцепочечной или двухцепочечной и неразветвленной или ковалентно замкнутой с образованием кольца.
Нуклеиновые кислоты также могут содержаться в векторе. Используемый в настоящем документе термин "вектор" включает в себя любые векторы, известные специалисту в настоящей области техники, включая в себя плазмидные векторы, космидные векторы, такие фаговые векторы, как лямбда-фаг, такие вирусные векторы, как аденовирусные или бакуловирусные векторы, или такие векторы на основе искусственных хромосом, как бактериальные искусственные хромосомы (BAC), дрожжевые искусственные хромосомы (YAC) или P1 искусственные хромосомы (PAC). Указанные векторы включают в себя как экспрессионные, так и клонирующие векторы. Экспрессионные векторы содержат плазмиды, а также вирусные векторы и, как правило, содержат требуемую кодирующую последовательность и соответствующие последовательности ДНК, необходимые для экспрессии функционально связанной кодирующей последовательности в конкретном организме-хозяине (например, организме бактерии, дрожжей, растения, насекомого или млекопитающего) или в in vitro экспрессионных системах. Клонирующие векторы, как правило, используют для конструирования и амплификации определенного требуемого фрагмента ДНК, и в них могут отсутствовать функциональные последовательности, необходимые для экспрессии требуемых фрагментов ДНК.
В контексте настоящего изобретения термин "ДНК" относится к молекуле, которая содержит дезоксирибонуклеотидные остатки и предпочтительно полностью или по существу состоит из дезоксирибонуклеотидных остатков. "Дезоксирибонуклеотид" относится к нуклеотиду, в котором отсутствует гидроксильная группа в 2'-положении β-D-рибофуранозильной группы. Термин "ДНК" предусматривает выделенную ДНК, такую как частично или полностью очищенная ДНК, по существу чистая ДНК, синтетическую ДНК и образованную рекомбинантно ДНК, и включает в себя модифицированную ДНК, которая отличается от встречающейся в природе ДНК, тем, что содержит вставку, делецию, замену и/или изменение одного или нескольких нуклеотидов. Указанные изменения могут включать в себя вставку ненуклеотидного материала, например, на конце(ах) ДНК или внутри, например, на одном или нескольких нуклеотидах ДНК. Нуклеотиды в молекулах ДНК также могут содержать нестандартные нуклеотиды, такие как не встречающиеся в природе нуклеотиды или химически синтезированные нуклеотиды. Указанные измененные ДНК можно назвать аналогами или аналогами встречающихся в природе ДНК.
В контексте настоящего изобретения термин "РНК" относится к молекуле, которая содержит рибонуклеотидные остатки и предпочтительно полностью или по существу состоит из рибонуклеотидных остатков. "Рибонуклеотид" относится к нуклеотиду с гидроксильной группой в 2'-положении β-D-рибофуранозильной группы. Термин "РНК" предусматривает выделенную РНК, такую как частично или полностью очищенная РНК, по существу чистая РНК, синтетическую РНК и образованную рекомбинантно РНК, и включает в себя модифицированную РНК, которая отличается от встречающейся в природе РНК тем, что содержит вставку, делецию, замену и/или изменение одного или нескольких нуклеотидов. Указанные изменения могут включать в себя вставку ненуклеотидного материала, например, на конце(ах) ДНК или внутри, например, на одном или нескольких нуклеотидах РНК. Нуклеотиды в молекулах РНК также могут содержать нестандартные нуклеотиды, такие как не встречающиеся в природе нуклеотиды или химически синтезированные нуклеотиды или дезоксинуклеотиды. Указанные измененные РНК можно назвать аналогами или аналогами встречающихся в природе РНК.
Термин "фармацевтически активная нуклеиновая кислота" означает нуклеиновые кислоты, характеризующиеся биологическими активностями, такими как экспрессия белка, интерференция экспрессии генов или иммуностимуляция. Таким образом, такие нуклеиновые кислоты являются применимыми для интерференции экспрессии генов (например, антисмысловая РНК или киРНК (короткая интерферирующая РНК, или siRNA)), модификации активностей белка (например, аптамеры ДНК или аптамеры РНК) или активации иммунитета (например, киРНК или вакцины на основе ДНК или вакцины на основе иРНК). "Фармацевтически активная нуклеиновая кислота" также может представлять собой нуклеиновую кислоту, которая кодирует фармацевтически активный пептид или белок, или является фармацевтически активной сама по себе, например, характеризуется одной или несколькими фармацевтическими активностями, такими как активности, описанные для фармацевтически активных белков.
Согласно настоящему изобретению термин "нуклеиновая кислота, кодирующая пептид или белок" означает, что нуклеиновая кислота, если она находится в соответствующем окружении, предпочтительно внутри клеток, может управлять сборкой аминокислот с получением пептида или белка во время процесса трансляции. Нуклеиновые кислоты согласно настоящему изобретению предпочтительно способны взаимодействовать с клеточным трансляционным комплексом, обеспечивая трансляцию пептида или белка.
Согласно одному варианту осуществления нуклеиновая кислота представляет собой РНК.
Согласно настоящему изобретению "РНК" относится к одноцепочечной РНК или двухцепочечной РНК и включает в себя информационную РНК (иРНК, или mRNA), транспортную РНК (тРНК, или tRNA), рибосомную РНК (рРНК, или rRNA), малую ядерную РНК (мяРНК, или snRNA), малую ингибирующую РНК (миРНК, или siRNA), малую шпилечную РНК (мшРНК, или shRNA), микроРНК (miRNA), антисмысловую РНК, имуностимулирующую РНК (исРНК, или isRNA) и аптамеры РНК. Согласно предпочтительному варианту осуществления РНК выбрана из группы, состоящей из иРНК, миРНК, мшРНК, микроРНК, антисмысловой РНК, исРНК и аптамеров РНК.
РНК может содержать самокомплементарные последовательности, что позволяет частям РНК сворачиваться и образовывать пары между собой с образованием двойных спиралей. Согласно настоящему изобретению предпочтительными в качестве РНК являются синтетические олигонуклеотиды длиной 6-100, предпочтительно 10-50, в частности 15-30 или 15-20 нуклеотидов или информационная РНК (иРНК) длиной больше чем 50 нуклеотидов, предпочтительно 50-10000, предпочтительно 100-5000, в частности 200-3000 нуклеотидов.
Согласно настоящему изобретению термин "информационная РНК (иРНК)" относится к "транскрипту", который можно создать с использованием матрицы ДНК и который может кодировать пептид или белок. Как правило, иРНК содержит 5'-нетранслируемую область, кодирующую белок область и 3'-нетранслируемую область. В контексте настоящего изобретения иРНК можно создать с помощью in vitro транскрипции из матрицы ДНК. Методика in vitro транскрипции известна специалисту в настоящей области техники. Например, существуют различные коммерчески доступные наборы для in vitro транскрипции.
Согласно настоящему изобретению термин "малая ингибирующая РНК (миРНК)" относится к двухцепочечным коротким (как правило, 19-23, предпочтительно 21 нуклеотид в длину) олигонуклеотидам, которые можно использовать для индукции разрушения целевой иРНК путем распознавания мишени одной цепью миРНК, этот механизм называется РНК-интерференция (RNAi).
Термин "малая шпилечная РНК (мшРНК)" относится к последовательности РНК, делающей крутой поворот шпильки, и ее можно использовать для сайленсинга экспрессии целевого гена с помощью РНК-интерференции.
Термин "микроРНК" относится к малой некодирующей молекуле РНК (как правило, 19-25 нуклеотидов в длину), которая функционирует в транскрипционной и посттранскрипционной регуляции генной экспрессии.
Согласно настоящему изобретению термин "антисмысловая РНК" относится к одноцепочечной РНК, как правило, к синтетическому олигонуклеотиду, разработанному для образования пар между нуклеотидами с целевой клеточной иРНК, таким образом, физически ингибируя процесс трансляции и в конце концов индуцируя разрушение целевой иРНК.
Согласно настоящему изобретению "иммуностимулирующая РНК (исРНК)" относится к РНК, которая может активировать врожденные иммунные рецепторы, такие как, например, эндоплазматический TLR-3, 7 и 8 или цитозольный белок RIG-1. Согласно одному варианту осуществления исРНК содержит один или несколько уридиновых (U) нуклеотидов.
Согласно настоящему изобретению термин "аптамер РНК" относится к РНК, которую благодаря ее точной трехмерной структуре можно использовать в качестве антитела, т.е. заставлять специфически связываться с заданными структурами и, таким образом, активировать или блокировать биологические механизмы.
Согласно настоящему изобретению РНК можно модифицировать. Например, РНК можно стабилизировать с помощью одной или нескольких модификаций, характеризующихся стабилизирующими эффектами на РНК.
Термин "модификация" в контексте РНК, используемой согласно настоящему изобретению, включает в себя любую модификацию РНК, которая не существует в природе в указанной РНК.
Согласно одному варианту осуществления настоящего изобретения РНК, используемая согласно настоящему изобретению, не содержит некэпированных 5'-трифосфатов. Удаление таких некэпированных 5'-трифосфатов можно осуществить путем обработки РНК фосфатазой.
РНК согласно настоящему изобретению может содержать модифицированные встречающиеся или не встречающиеся в природе (синтетические) рибонуклеотиды для увеличения ее стабильности и/или уменьшения цитотоксичности и/или модуляции ее иммуностимулирующего потенциала. Например, согласно одному варианту осуществления в РНК, используемой согласно настоящему изобретению, уридин замещен частично или полностью, предпочтительно полностью, псевдоуридином.
Согласно одному варианту осуществления термин "модификация" относится к обеспечению РНК 5'-кэпом или аналогом 5'-кэпа. Термин "5'-кэп" относится к кэповой структуре, находящейся на 5'-конце молекулы иРНК и, как правило, состоит из гуанозинового нуклеотида, соединенного с иРНК с помощью необычной 5'-5' трифосфатной связи. Согласно одному варианту осуществления указанный гуанозин метилирован в 7-положении. Термин "традиционный 5'-кэп" относится к 5'-кэпу встречающейся в природе РНК, предпочтительно 7-метилгуанозиновому кэпу (m7G). В контексте настоящего изобретения термин "5'-кэп" включает в себя аналог 5'-кэпа, который напоминает структуру кэпа РНК и модифицирован так, чтобы обладать способностью стабилизировать РНК, когда он прикреплен к ней, предпочтительно in vivo и/или в клетке. Обеспечение РНК 5'-кэпом или аналогом 5'-кэпа может быть достигнуто с помощью in vitro транскрипции матрицы ДНК в присутствии указанного 5'-кэпа или аналога 5'-кэпа, причем указанный 5'-кэп котранскрипционно встроен в образованную цепь РНК, или РНК можно образовать, например, с помощью in vitro транскрипции, и 5'-кэп можно образовать посттранскрипционно с использованием кэпирующих ферментов, например, кэпирующих ферментов вируса осповакцины.
РНК может содержать дополнительные модификации. Например, модификация иРНК, используемой согласно настоящему изобретению, может представлять собой удлинение или усечение встречающегося в природе поли(A) хвоста.
Термин "стабильность" РНК относится к "периоду полужизни" РНК. "Период полужизни" относится к периоду времени, необходимому для устранения половины активности, количества или числа молекул. В контексте настоящего изобретения период полужизни РНК является показателем стабильности указанной РНК.
Если согласно настоящему изобретению необходимо уменьшить стабильность РНК, также можно модифицировать РНК так, чтобы препятствовать функционированию элементов, которые, как описано выше, увеличивают стабильность РНК.
Согласно настоящему изобретению РНК можно получить с помощью химического синтеза или in vitro транскрипции соответствующей матрицы ДНК. В контексте настоящего изобретения термин "транскрипция" относится к процессу, в котором генетический код в последовательности ДНК транскрибируется в РНК. Впоследствии РНК может транслироваться в белок. Согласно настоящему изобретению термин "транскрипция" включает в себя "in vitro транскрипцию", причем термин "in vitro транскрипция" относится к процессу, в котором РНК, в частности иРНК, in vitro синтезируют в бесклеточной системе, предпочтительно с использованием клеточных экстрактов. Клонирующие векторы предпочтительно используют для образования транскриптов. Указанные клонирующие векторы, как правило, относят к транскрипционным векторам и согласно настоящему изобретению они включены в термин "вектор". Промотор для контроля транскрипции может представлять собой любой промотор для любой РНК-полимеразы. Конкретные примеры РНК-полимераз представляют собой РНК-полимеразы T7, T3, и SP6. Матрицу ДНК для in vitro транскрипции можно получить путем клонирования нуклеиновой кислоты, в частности кДНК, и введения ее в соответствующий вектор для in vitro транскрипции. кДНК можно получить с помощью обратной транскрипции РНК. Клонирующие векторы предпочтительно используют для получения транскриптов, которые, как правило, относят к транскрипционным векторам.
Термин "трансляция" согласно настоящему изобретению относится к процессу в рибосомах клеток, с помощью которого цепь информационной РНК управляет сборкой последовательности аминокислот с образованием пептида или белка.
Термин "ингибирование генной экспрессии" относится к процессу, при котором олигонуклеотиды РНК (например, одноцепочечную антисмысловую или двухцепочечную миРНК) можно использовать для связывания специфических последовательностей иРНК, индуцируя или деградацию целевой иРНК, и/или блокирование трансляции.
Согласно одному варианту осуществления фармацевтически активное соединение представляет собой антиген или кодирующую антиген нуклеиновую кислоту или их фрагмент, например, ассоциированный с заболеванием антиген.
Термин "заболевание" относится к аномальному состоянию, поражающему тело индивидуума. Заболевание зачастую рассматривают как медицинское состояние, ассоциированное с конкретными симптомами и признаками. Заболевание может быть вызвано факторами, происходящими из внешнего источника, например, инфекционное заболевание, или оно может быть вызвано внутренними дисфункциями, например, аутоиммунные заболевания.
Согласно настоящему изобретению термин "заболевание" также относится к злокачественному заболеванию. Термины "злокачественное заболевание" или "злокачественное опухоль" (медицинский термин: злокачественное новообразование) относятся к классу заболеваний, при которых группа клеток проявляет неконтролируемый рост (деление за пределами нормы), инвазию (вторжение и разрушение окружающих тканей), и иногда метастазирование (распространение на другие места локализации в организме через лимфу или кровь). Указанные три злокачественных свойства злокачественных опухолей отличают их от доброкачественных опухолей, которые являются самоограничивающимися и не характеризуются инвазией или метастазированием. Большинство злокачественных опухолей образуют опухоль, т.е. набухание или поражение, образованное аномальным ростом клеток (которые называются неопластические клетки или опухолевые клетки), но некоторые, такие как лейкоз, не делают этого. Примеры злокачественных опухолей включают в себя без ограничения карциному, лимфому, бластому, саркому, глиому и лейкоз. Более конкретно примеры таких злокачественных опухолей включают в себя следующее: злокачественная опухоль костей, злокачественная опухоль крови, злокачественная опухоль легкого, злокачественная опухоль печени, злокачественная опухоль поджелудочной железы, злокачественная опухоль кожи, злокачественная опухоль головы или шеи, кожная интраокулярная злокачественная меланома, злокачественная опухоль матки, злокачественная опухоль яичника, злокачественная опухоль прямой кишки, злокачественная опухоль анальной области, злокачественная опухоль желудка, злокачественная опухоль толстой кишки, злокачественная опухоль молочной железы, злокачественная опухоль предстательной железы, злокачественная опухоль матки, карцинома половых и репродуктивных органов, болезнь Ходжкина, злокачественная опухоль пищевода, злокачественная опухоль тонкого кишечника, злокачественная опухоль эндокринной системы, злокачественная опухоль щитовидной железы, злокачественная опухоль паращитовидной железы, злокачественная опухоль надпочечника, саркома мягкой ткани, злокачественная опухоль мочевого пузыря, злокачественная опухоль почки, почечно-клеточная карцинома, карцинома почечной лоханки, новообразование центральной нервной системы (ЦНС), нейроэктодермальная злокачественная опухоль, опухоли позвоночника, глиома, менингиома и аденома гипофиза. Термин "злокачественная опухоль" согласно настоящему изобретению также включает в себя метастазы злокачественной опухоли.
Злокачественная меланома представляет собой серьезный тип злокачественной опухоли кожи. Он обусловлен неконтролируемым ростом пигментных клеток, которые называются меланоциты.
Согласно настоящему изобретению "карцинома" представляет собой злокачественную опухоль, происходящую из эпителиальных клеток. Указанная группа представляет наиболее распространенные злокачественные опухоли, включая в себя распространенные формы злокачественной опухоли молочной железы, предстательной железы, легких и толстой кишки.
Лимфома и лейкоз представляют собой злокачественные опухоли, происходящие из гемопоэтических (кроветворных) клеток.
Саркома представляет собой злокачественную опухоль, возникающую из трансформированных клеток в одной из тех тканей, которые развиваются из эмбриональной мезодермы. Таким образом, саркомы включают в себя опухоли костной, хрящевой, жировой, мышечной, сосудистой и гемопоэтической тканей.
Властная опухоль, или бластома, представляет собой опухоль (как правило, злокачественную), которая напоминает незрелую или эмбриональную ткань. Многие из указанных опухолей наиболее часто встречаются у детей.
Глиома представляет собой тип опухоли, берущей начало в головном или спинном мозге. Он называется «глиома», поскольку возникает из глиальных клеток. Наиболее распространенным местом локализации глиом является головной мозг.
Под "метастазированием" подразумевают распространение злокачественных клеток из их исходного места расположения на другую часть организма. Образование метастазов представляет собой очень сложный процесс, и он зависит от открепления злокачественных клеток от первичной опухоли, инвазии внеклеточного матрикса, проникновения через эндотелиальные базальные мембраны для входа в полости тела и сосуды, и затем, после транспортировки с кровью, инфильтрации целевых органов. В конце концов, рост новой опухоли, т.е. вторичной опухоли или метастатической опухоли, в целевой локализации зависит от ангиогенеза. Метастазирование опухоли зачастую происходит даже после удаления первичной опухоли, поскольку клетки или компоненты опухоли могут оставаться и развивать метастатический потенциал. Согласно одному варианту осуществления термин "метастазирование" согласно настоящему изобретению относится к "отдаленному метастазированию", которое относится к метастазированию, которое является удаленным от первичной опухоли и системы региональных лимфатических узлов.
Термин "инфекционное заболевание" относится к любому заболеванию, которое может передаваться от индивидуума к индивидууму или от организма к организму, и вызвано агентом-микроорганизмом (например, простуда). Примеры инфекционных заболеваний включают в себя такие вирусные инфекционные заболевания, как СПИД (ВИЧ), гепатит A, B или C, герпес, опоясывающий герпес (ветряная оспа), краснуха (вирус краснухи), желтая лихорадка, лихорадка денге и т.д., флавивирусы, вирусы гриппа, геморрагические инфекционные заболевания (вирусы Марбург или Эбола), и тяжелый острый респираторный синдром (SARS), такие бактериальные инфекционные заболевания, как болезнь легионеров (Legionella), венерические заболевания (например, хламидиоз или гонорея), язва желудка (Helicobacter), холера (Vibrio), туберкулез, дифтерия, инфекции, вызванные Е. coli, Staphylococci, Salmonella или Streptococci (столбняк); инфекции, вызванные протозойными патогенами, такие как малярия, сонная болезнь, лейшманиоз; токсоплазмоз, т.е. инфекции, вызванные Plasmodium, Trypanosoma, Leishmania и Toxoplasma; или грибковые инфекции, вызванные, например, Cryptococcus neoformans, Histoplasma capsulatum, Coccidioides immitis, Blastomyces dermatitidis или Candida albicans.
Термин "аутоиммунное заболевание" относится к любому заболеванию, при котором организм производит иммуногенный ответ (т.е. ответ иммунной системы) на некоторые составляющие своей собственной ткани. Иными словами, иммунная система теряет свою способность распознавать определенную ткань или систему в организме как собственную и нацеленно воздействует на нее и атакует ее так, как если бы она была чужеродной. Аутоиммунные заболевания можно классифицировать на те, при которых поражен предпочтительно один орган (например, гемолитическая анемия и аутоиммунный тиреоидит), и те, при которых процесс аутоиммунного заболевания распространен на многие ткани (например, системная красная волчанка). Например, рассеянный склероз, как полагают, вызван Т-клетками, атакующими оболочки, окружающие нервные волокна головного и спинного мозга. Это приводит к потере координации, слабости и расфокусированному зрению. Аутоиммунные заболевания известны в настоящей области техники и включают в себя, например, тиреоидит Хашимото, болезнь Грейвса, волчанку, рассеянный склероз, ревматоидный артрит, гемолитическую анемию, аутоиммунный тиреоидит, системную красную волчанку, целиакию, болезнь Крона, колит, сахарный диабет, склеродермию, псориаз и подобное.
Термин "антиген" относится к агенту, содержащему эпитоп, против которого должен быть сформирован иммунный ответ. Термин "антиген" включает в себя, в частности, белки, пептиды, полисахариды, нуклеиновые кислоты, в частности РНК и ДНК, и нуклеотиды. Термин "антиген" также включает в себя агенты, которые становятся антигенными - и сенсибилизирующими - только путем трансформации (например, непосредственно в молекуле или за счет дополнения белком организма). Антиген предпочтительно презентируется клетками иммунной системы, такими как антигенпрезентирующие клетки, например, дендритные клетки или макрофаги. Кроме того, антиген или продукт его процессинга предпочтительно распознаются T- или B-клеточным рецептором или молекулой иммуноглобулина, такой как антитело. Согласно предпочтительному варианту осуществления антиген представляет собой ассоциированный с заболеванием антиген, такой как ассоциированный с опухолью антиген, вирусный антиген или бактериальный антиген.
Термин "ассоциированный с заболеванием антиген" используют в самом широком смысле, чтобы обозначить любой антиген, ассоциированный с заболеванием. Ассоциированный с заболеванием антиген представляет собой молекулу, содержащую эпитопы, которые будут стимулировать иммунную систему хозяина производить клеточную антиген-специфический иммунный ответ и/или гуморальный ответ антитела против заболевания. Таким образом, ассоциированный с заболеванием антиген можно использовать для терапевтических целей. Ассоциированные с заболеванием антигены предпочтительно ассоциированы с инфекцией, вызванной микроорганизмами, как правило, антигены микроорганизмов, или ассоциированы со злокачественной опухолью, как правило, опухолями.
Термин "заболевание с участием антигена" относится к любому заболеванию, в которое вовлечен антиген, например, заболеванию, которое характеризуется присутствием антигена. Заболевание с участием антигена может представлять собой инфекционное заболевание, аутоиммунное заболевание или злокачественное заболевание или просто злокачественную опухоль. Как указано выше, антиген может представлять собой ассоциированный с заболеванием антиген, такой как ассоциированный с опухолью антиген, вирусный антиген или бактериальный антиген.
Согласно одному варианту осуществления ассоциированный с заболеванием антиген представляет собой ассоциированный с опухолью антиген. Пораженный заболеванием орган или ткань предпочтительно характеризуются пораженными заболеванием клетками, такими как злокачественные клетки, экспрессирующие ассоциированный с заболеванием антиген и/или характеризуются ассоциацией ассоциированного с заболеванием антигена с их поверхностью. Иммунизация с помощью интактных или по существу интактных ассоциированных с опухолью антигенов или их фрагментов, таких как пептиды МНС I класса и II класса или нуклеиновыми кислотами, в частности иРНК, кодирующими такой антиген или фрагмент, обеспечивает возможность вызывать ответ МНС I класса и/или II класса и, таким образом, стимулировать такие Т-клетки, как CD8+ цитотоксические Т-лимфоциты, которые способны лизировать злокачественные клетки и/или CD4+ Т-клетки. Такая иммунизация также может вызывать гуморальный иммунный ответ (B-клеточный ответ), что приводит к продукции антител к ассоциированному с опухолью антигену. Кроме того, антигенпрезентирующие клетки (APC), такие как дентдритные клетки (DC), можно нагрузить пептидами, презентирующими МНС I класса, путем трансфекции нуклеиновыми кислотами, кодирующими опухолевые антигены in vitro, и введения пациенту. Согласно одному варианту осуществления термин "ассоциированный с опухолью антиген" относится к составляющей злокачественных клеток, которая может происходить из цитоплазмы, клеточной поверхности и ядра клетки. В частности, он относится к тем антигенам, которые производятся, предпочтительно в большом количестве, внутриклеточно или в качестве поверхностных антигенов на опухолевых клетках. Примеры опухолевых антигенов включают в себя без ограничения HER2, EGFR, VEGF, CAMPATH1-антиген, CD22, CA-125, HLA-DR, антиген лимфомы Ходжкина или муцин-1.
Согласно настоящему изобретению ассоциированный с опухолью антиген предпочтительно включает в себя любой антиген, который представляет собой характеристику опухолей или злокачественных опухолей, а также опухолевых или злокачественных клеток относительно типа и/или уровня экспрессии. Согласно одному варианту осуществления термин "ассоциированный с опухолью антиген" относится к белкам, которые при нормальных условиях, т.е. у здорового субъекта, специфически экспрессируются в ограниченном количестве органов и/или тканей или на конкретных стадиях развития, например, ассоциированный с опухолью антиген при нормальных условиях может специфически экспрессироваться в ткани желудка, предпочтительно в слизистой желудка, в репродуктивных органах, например, в яичке, в трофобластной ткани, например, в плаценте, или в клетках зародышевой линии, и экспрессируется или аномально экспрессируется в одной или нескольких тканях опухоли или злокачественной опухоли. В указанном контексте "ограниченное количество" предпочтительно означает не больше чем 3, более предпочтительно не больше чем 2 или 1. Ассоциированные с опухолью антигены в контексте настоящего изобретения включают в себя, например, антигены дифференцировки, предпочтительно антигены дифференцировки, специфической для типа клеток, т.е., белки, при нормальных условиях специфически экспрессирующиеся в определенном типе клеток на определенной стадии дифференцировки, антигены злокачественной опухоли/яичка, т.е., белки, при нормальных условиях специфически экспрессирующиеся в яичке и иногда в плаценте, и специфические для зародышевой линии антигены. В контексте настоящего изобретения ассоциированный с опухолью антиген предпочтительно не экспрессируется или редко экспрессируется в нормальных тканях или является мутированным в опухолевых клетках. Предпочтительно ассоциированный с опухолью антиген или аномальная экспрессия ассоциированного с опухолью антигена идентифицирует злокачественные клетки. В контексте настоящего изобретения ассоциированный с опухолью антиген, который экспрессируется злокачественной клеткой у субъекта, например, пациента, страдающего от злокачественного заболевания, предпочтительно представляет собой собственный белок указанного субъекта. Согласно предпочтительным вариантам осуществления ассоциированный с опухолью антиген в контексте настоящего изобретения экспрессируется при нормальных условиях специфически в ткани или органе, которые не являются жизненно необходимыми, т.е. ткани или органы, повреждение которых со стороны иммунной системы, не приведет к смерти субъекта, или в органах или структурах организма, которые являются недоступными или тяжело доступными для иммунной системы. Ассоциированный с опухолью антиген предпочтительно презентируется в контексте молекул МНС злокачественной клеткой, в которой он экспрессируется.
Примеры антигенов дифференцировки, которые идеально соответствуют критериям ассоциированных с опухолью антигенов, предусмотренных настоящим изобретением в качестве целевых структур в противоопухолевой иммунотерапии, в частности, в противоопухолевой вакцинации, представляют собой белки клеточной поверхности семейства Claudin, такие как CLDN6 и CLDN18.2. Указанные антигены дифференцировки экспрессируются в опухолях различного происхождения и особенно являются подходящими в качестве целевых структур в связи с опосредованной антителами противораковой иммунотерапией вследствие своей селективной экспрессии (отсутствие выраженной токсичности в отношении нормальной ткани и локализации относительно плазматической мембраны.
Дополнительные примеры антигенов, которые можно использовать согласно настоящему изобретению, представляют собой р53, ART-4, BAGE, бета-катенин/m, Bcr-abL CAMEL, САР-1, CASP-8, CDC27/m, CDK4/m, CEA, CLAUDIN-12, c-MYC, CT, Cyp-B, DAM, ELF2M, ETV6-AML1, G250, GAGE, GnT-V, Gap100, HAGE, HER-2/neu, HPV-E7, HPV-E6, HAST-2, hTERT (или hTRT), LAGE, LDLR/FUT, MAGE-A, предпочтительно MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A5, MAGE-A6, MAGE-A7, MAGE-A8, MAGE-A9, MAGE-A10, MAGE-A11, или MAGE-A12, MAGE-B, MAGE-C, MART-1 /Melan-A, MC1R, миозин/m, MUC1, MUM-1, -2, -3, NA88-A, NF1, NY-ESO-1, NY-BR-1, p190 минорный BCR-abL, Pm1/RARa, PRAME, протеиназу 3, PSA, PSM, RAGE, RU1 или RU2, SAGE, SART-1 или SART-3, SCGB3A2, SCP1, SCP2, SCP3, SSX, SURVIVIN, TEL/AML1, TPI/m, TRP-1, TRP-2, TRP-2/INT2, ТРТЕ и WT, предпочтительно WT-1.
Термин "вирусный антиген" относится к любому вирусному компоненту, характеризующемуся антигенными свойствами, т.е. способному вызывать иммунный ответ индивидуума. Вирусный антиген может представлять собой вирусный рибонуклеопротеин или белок оболочки.
Термин "бактериальный антиген" относится к любому бактериальному компоненту, характеризующемуся антигенными свойствами, т.е. способному вызывать иммунный ответ индивидуума. Бактериальный антиген может происходить из клеточной стенки или цитоплазматической мембраны бактерии.
Используемый в настоящем документе термин "иммунный ответ" относится к реакции иммунной системы на такие иммуногенные организмы, как бактерии или вирусы, клетки или вещества. Термин "иммунный ответ" включает в себя врожденный иммунный ответ и приобретенный иммунный ответ. Иммунный ответ предпочтительно связан с активацией иммунных клеток, индукций биосинтеза цитокинов и/или продукцией антител.
Согласно настоящему изобретению термин "лечение заболевания" включает в себя излечение, сокращение продолжительности, уменьшение интенсивности, замедление или ингибирование прогрессирования или ухудшения заболевания или его симптомов.
Термин "иммунотерапия" относится к лечению, которое предпочтительно предусматривает специфическую иммунную реакцию и/или иммунную эффекторную(ые) функцию(и).
Термин "иммунизация" или "вакцинация" описывает способ лечения субъекта для терапевтических или профилактических целей.
Используемый в настоящем документе термин "субъект" предпочтительно относится к млекопитающим. Например, млекопитающие в контексте настоящего изобретения представляют собой людей, не являющихся людьми приматов, таких одомашненных животных, как собаки, кошки, овцы, крупный рогатый скот, козы, свиньи, лошади и т.д., таких лабораторных животных, как мыши, крысы, кролики, морские свинки и т.д., а также таких животных в неволе, как животные зоопарков. Согласно предпочтительному варианту осуществления субъект представляет собой человека.
Согласно настоящему изобретению также предусмотрен способ получения фармацевтической композиции, причем способ предусматривает:
- получения водного состава согласно представленному выше определению; и
- смешивание водного состава с фармацевтически активным соединением.
Согласно одному варианту осуществления фармацевтически активное соединение включает в себя нуклеиновую кислоту, причем нуклеиновая кислота предпочтительно предусмотрена в буферном растворе, характеризующемся значением pH между 6 и 8.
Согласно настоящему изобретению также предусмотрена фармацевтическая композиция, полученная с помощью способа согласно представленному выше определению.
Согласно одному варианту осуществления фармацевтическая композиция содержит липосомы, наполненные фармацевтически активным соединением.
Согласно одному варианту осуществления фармацевтическая композиция содержит липоплексы нуклеиновых кислот.
Используемые в настоящем документе термины "липоплекс нуклеиновых кислот" или "липоплекс" относятся к комплексу липидов и нуклеиновых кислот, таких как ДНК или РНК, предпочтительно РНК. Липоплексы образуются спонтанно, когда катионные липиды (например, в форме катионных липосом, которые зачастую также включают в себя нейтральные хелперные липиды), катионные полимеры и другие вещества с положительными зарядами смешивают с нуклеиновыми кислотами, и, как было показано, таким образом можно доставлять нуклеиновые кислоты в клетки. Согласно одному варианту осуществления липоплексы характеризуются средним диаметром в диапазоне от приблизительно 50 нм до приблизительно 1000 нм, предпочтительно от приблизительно 100 нм до приблизительно 800 нм, предпочтительно от приблизительно 200 нм до приблизительно 600 нм, например, приблизительно 300 нм - приблизительно 500 нм.
Средний "диаметр" или "размер" частиц на основе липидов (например, липосом или липоплексов), описанных в настоящем документе, представляет собой, как правило, "номинальный размер" или заданный размер частиц на основе липидов, полученных согласно установленному способу. Размер может представлять собой определенную прямым измерением величину, такую как средний или максимальный диаметр, или его можно определить с помощью непрямого анализа, такого как скрининг-анализ фильтрации. Прямое измерение размера частиц, как правило, проводят с помощью динамического рассеяния света. Зачастую результаты измерений с помощью динамического рассеяния света выражают как Zсредний (величина среднего размера) и коэффициент полидисперсности, PI или PDI (величина по ли дисперсности). Поскольку во время процесса производства возникает небольшое отклонение в размере, отклонение до 40% заявленного измерения является приемлемым и считается находящимся в пределах заявленного размера. Альтернативно размер можно установить с помощью скрининг-анализа фильтрации. Например, препарат частиц меньше заявленного размера, если по меньшей мере 97% частиц проходят через "сетчатый" фильтр заявленного размера.
Согласно одному варианту осуществления по меньшей мере один регулятор pH ассоциирован с липосомами и/или липоплексами.
Фармацевтические композиции согласно настоящему изобретению предпочтительно являются стерильными и содержат эффективное количество липидов или частиц на основе липидов (например, липосом или липоплексов). Фармацевтические композиции также могут содержать дополнительные средства, обсуждаемые в настоящем документе, такие как дополнительное терапевтическое средство или антиген. Фармацевтические композиции согласно настоящему изобретению дополнительно могут содержать один или несколько фармацевтически приемлемых носителей, разбавителей и/или вспомогательных веществ. Фармацевтическая композиция согласно настоящему изобретению дополнительно может содержать по меньшей мере один адъювант.
"Эффективное количество" относится к количеству, которое достигает требуемой реакции или требуемого эффекта отдельно или вместе с дополнительными дозами. В случае лечения конкретного заболевания или конкретного состояния требуемая реакция предпочтительно относится к ингибированию течения заболевания. Это включает в себя замедление прогрессирования заболевания и, в частности, прерывание или смену на противоположное направление прогрессирования заболевания. Требуемая реакция в лечении заболевания или состояния также может представлять собой задержку возникновения или профилактику возникновения указанного заболевания или указанного состояния. Эффективное количество будет зависеть от подлежащего лечению состояния, тяжести заболевания, индивидуальных параметров пациента, включая в себя возраст, физиологическое состояние, размеры тела и массу, продолжительность лечения, тип сопутствующей терапии (если она имеет место), конкретный путь введения и аналогичные факторы. Соответственно, вводимые дозы могут зависеть от различных перечисленных параметров. В случае, когда реакция у пациента является недостаточной при использовании начальной дозы, можно использовать повышенную дозу (или эффективно повышенную дозу, достигнутую с помощью другого, более локализованного пути введения).
Описанные в настоящем документе фармацевтические композиции можно вводить любым общепринятым путем. Согласно одному варианту осуществления фармацевтическая композиция составлена для системного введения. Согласно настоящему изобретению системное введение предпочтительно осуществляют с помощью парентерального введения, включая в себя инъекцию или инфузию, например, внутривенно, интраартериально, подкожно, введение в лимфатический узел, интрадермально или внутримышечно.
Композиции, подходящие для парентерального введения, как правило, содержат стерильный водный или неводный препарат активного соединения, который предпочтительно является изотоническим крови реципиента. Примеры совместимых носителей и разбавителей/растворителей представляют собой стерильную воду (например, воду для инъекций), раствор Рингера и изотонический раствор хлорида натрия. Кроме того, как правило, стерильные, нелетучие масла используют в качестве раствора или суспензионной среды.
Используемый в настоящем документе термин "фармацевтически приемлемый" относится к отсутствию токсичности материала, который предпочтительно не взаимодействует с действием активного компонента фармацевтической композиции.
Используемый в настоящем документе термин "вспомогательное вещество" относится ко всем веществам, которые могут присутствовать в фармацевтической композиции согласно настоящему изобретению и которые не представляют собой активные ингредиенты, таким как, например, носители, связующие, смазывающие вещества, загустители, поверхностно-активные средства, консерванты, эмульгаторы, буферы, ароматизаторы или красители.
Термин "адъювант" относится к соединениям, которые пролонгируют, или повышают, или усиливают иммунный ответ. В этом отношении возможны различные механизмы в зависимости от разных типов адъювантов. Например, соединения, которые обеспечивают созревание DC, например, липополисахариды или лиганд CD40, образуют первый класс приемлемых адъювантов. Как правило, любое средство, которое воздействует на иммунную систему по типу "сигнала опасности" (LPS, GP96, дцРНК и т.д.) или цитокинов, таких как GM-CSF, можно использовать в качестве адъюванта, который обеспечивает возможность интенсифицировать и/или влиять на иммунную систему контролируемым способом. Олигодезоксинуклеотиды CpG необязательно также можно использовать в этом контексте, хотя следует принимать во внимание их побочные эффекты, которые возникают при определенных обстоятельствах, как объяснено выше. Наиболее предпочтительные адъюванты представляют собой такие цитокины, как монокины, лимфокины, интерлейкины или хемокины, например, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12, INFα, INF-γ, GM-CSF, LT-α, или факторы роста, например, hGH. Дополнительно известные адъюванты представляют собой гидроксид алюминия, адъювант Фрейнда или такое масло, как Montanide®, наиболее предпочтительно Montanide® ISA51. Такие липопептиды, как Pam3Cys, также являются приемлемыми для использования в качестве адъювантов в фармацевтических композициях согласно настоящему изобретению.
Фармацевтические композиции согласно настоящему изобретению также можно использовать совместно с другим терапевтическим средством, которое можно вводить до, одновременно или после введения фармацевтических композиций согласно настоящему изобретению. Такие терапевтические средства включают в себя иммуномодулирующие средства, которые могут являться иммуностимулирующими или иммунодепрессивными, химиотерапевтические лекарственные средства для пациентов со злокачественными опухолями, например, гемцитабин, этопофос, цисплатин, карбоплатин, противовирусные средства, противопаразитарные средства или антибактериальные средства, и при введении одновременно, они могут присутствовать в фармацевтической композиции согласно настоящему изобретению.
Фармацевтическую композицию согласно настоящему изобретению можно использовать для индукции иммунного ответа, в частности иммунного ответа против ассоциированного с заболеванием антигена или клеток, экспрессирующих ассоциированный с заболеванием антиген, такого как иммунный ответ против злокачественной опухоли. Соответственно, фармацевтическую композицию можно использовать для профилактического и/или терапевтического лечения заболевания с участием ассоциированного с заболеванием антигена или клеток, экспрессирующих ассоциированный с заболеванием антиген, такого как злокачественная опухоль. Указанный иммунный ответ предпочтительно представляет собой T-клеточный ответ. Согласно одному варианту осуществления ассоциированный с заболеванием антиген представляет собой опухолевый антиген.
Согласно настоящему изобретению также предусмотрена фармацевтическая композиция или набор согласно представленному в настоящем документе определению для применения в способе лечения или профилактики заболевания или для применения в способе иммуностимуляции.
Настоящее изобретение также относится к применению фармацевтической композиции или набору согласно представленному в настоящем документе определению в производстве лекарственного средства для лечения или профилактики заболевания или для применения в способе иммуностимуляции.
Согласно настоящему изобретению также предусмотрен способ лечения или профилактики заболевания или способ иммуностимуляции, причем способы предусматривают стадию введения фармацевтической композиции согласно представленному в настоящем документе определению нуждающемуся в этом субъекту.
В конце концов, согласно настоящему изобретению предусмотрен способ химической стабилизации водного состава, содержащего по меньшей мере один липид, характеризующийся одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, предпочтительно сложноэфирных связей, причем способ предусматривает:
- доведение pH водного состава до значения pH между 2 и 5,5.
Согласно одному варианту осуществления химическая стабилизация происходит путем ингибирования гидролиза сложноэфирной связи, тиоэфирной связи и/или амидной связи, предпочтительно гидролиза сложноэфирной связи.
Согласно одному варианту осуществления по меньшей мере один из липидов, присутствующих в водном составе, представляет собой катионный липид, предпочтительно катионный липид согласно представленному в настоящем документе определению.
Согласно одному варианту осуществления общий суммарный заряд липидов, присутствующих в водном составе, является положительным.
Согласно одному варианту осуществления pH доводят до значения pH между 2 и 5, предпочтительно между 2,5 и 5, более предпочтительно между 3 и 4,5, более предпочтительно между 3 и 4 и даже более предпочтительно между 3,5 и 4. Согласно дополнительному предпочтительному варианту осуществления водный состав характеризуется значением pH между 3,1 и 3,9.
Согласно одному варианту осуществления pH водного липидного состава доводят с помощью добавления по меньшей мере одного регулятора pH, предпочтительно по меньшей мере одного регулятора pH согласно представленному выше определению.
Согласно одному варианту осуществления по меньшей мере один липид, характеризующийся одной или несколькими связями, выбранными из группы, состоящей из сложноэфирных связей, тиоэфирных связей и амидных связей, соответствует приведенному выше определению.
Согласно одному варианту осуществления липиды, присутствующие в водном составе, образуют липосомы.
Согласно одному варианту осуществления по меньшей мере один регулятор pH ассоциирован с липосомами.
Настоящее изобретение дополнительно проиллюстрировано следующими примерами, которые не следует рассматривать как ограничивающие объем настоящего изобретения.
Примеры
Материалы
- (R)-N,N,N-триметил-2,3-диолеилокси-1-1-пропанаминийхлорид (R-DOTMA), Merck & Cie.
- 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин (DOPE), Corden Pharma
- Этанол 99,5%, Европейская фармакопея, Carl Roth
- Уксусная кислота, фармакопея США (USP), AppliChem
- Ацетат натрия USP, AppliChem
- Буфер HEPES, Life Technologies
- Вода для инъекций, Baxter
- 1 мл шприц inject-F, В. Braun
- 0,9×40 мм игла Microlance 3, BD
- Стеклянные флаконы R6 типу I, Wheaton
- 20 мм алюминиевые колпачки, Wheaton
- 20 мм бутилкаучуковые пробки, Wheaton
Пример 1: Получение липосом
Все материалы в контакте с растворами и препаратами липосом являлись стерильными и одноразовыми. Липосомы получали с помощью так называемой техники на основе инъекции этанола (Batzri and Korn, 1973), при которой липиды, растворенные в этаноле, вводили с помощью инъекции в водную фазу при перемешивании.
Соотношения липидов и концентрации липидов в этаноле варьировали в зависимости от требуемого состава и размера частиц. Для липосом DOTMA/DOPE раствор этанола содержал DOTMA и DOPE в молярном соотношении, составляющем 2:1 при концентрации общего липида, составляющей приблизительно 330 мМ. Для липосом DOTAP/DOPE раствор этанола содержал DOTAP и DOPE в молярном соотношении, составляющем 2:1 при концентрации общего липида, составляющей приблизительно 330 мМ. Раствор стерилизовали путем фильтрации через фильтр с размером пор, составляющим 0,2 мкм (Millipore Millex MP).
Стерильные липидные растворы в этаноле затем вводили с помощью инъекции в одноразовую роллерную колбу, содержащую водную фазу, и перемешивали со скоростью, составляющей 150 об/мин в течение по меньшей мере одного часа. Водная фаза представляла собой или воду для инъекций (wfi) или фильтрованную через Milli-Q воду с проводимостью, составляющей 1,3 мкСм/см при 25°C, или представляла собой буферный раствор, полученный из буферных солей и кислот согласно указанному. Все материалы характеризовались фармацевтической квалификацией. Инъекцию проводили до конечной концентрации липида, составляющей 5-10 мМ, в зависимости от эксперимента. Большинство экспериментов проводили при конечной концентрации общего липида в водной фазе, составляющей 6,6 мМ.
Полученные липосомные препараты фильтровали через целлюлозоацетатный фильтр с размером пор, составляющим 0,45 мкм. Препараты фильтратов затем разбавляли с помощью дисперсионного раствора до требуемой концентрации и хранили в пакетах для проведения биопроцессов. Для стандартных экспериментов 4 мМ выбирали в качестве конечной концентрации. Температура хранения перед проведением экспериментов в отношении стабильности pH составляла 2-5°C.
Пример 2: Стабильность липосом DOTMA/DOPE в зависимости от значения pH
Стабильность DOPE в липосомах DOTMA/DOPE исследовали после доведения pH до различных значений от pH 7 до pH 4. Для pH 7 использовали 10 мМ буфер HEPES. Для всех низких значений pH использовали буферы на основе уксусной кислоты (все 10 мМ) (см. таблицу 1). Стеклянные флаконы R6 I типа заполняли 2 мл дисперсией липосом и хранили в климатической камере при 37°C. Значение pH измеряли с помощью потенциометрии с использованием pH-метра WTW inoLab pH 7310, Вайльхайм, Германия
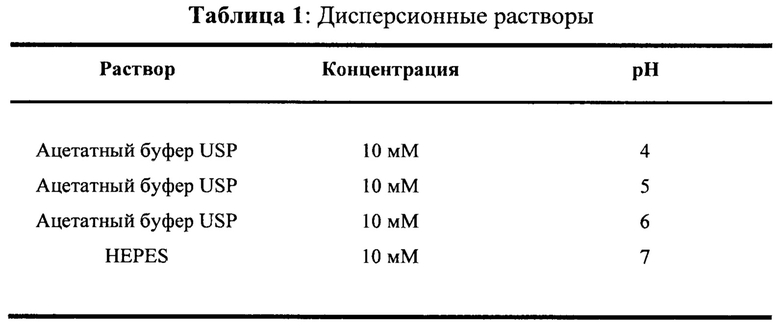
Стабильность липидов анализировали в различные моменты времени до 6 недель после получения липосом путем измерения концентрации липидов в липосомном препарате с использованием системы ВЭРХ (высокоэффективной жидкостной хроматографии) (Agilent Technologies 1200, оснащенная детекторами DAD и ELSD, Санта-Клара, Калифорния, США).
Результаты представлены на фигуре 1. На фигуре представлено нормированное извлечение DOPE (в процентах) из липосом DOTMA/DOPE. Показан только DOPE, поскольку для DOTMA, при всех условиях, не получили ни одного показателя деградации, что обусловлено тем фактом, что DOTMA содержит простые эфирные связи вместо сложноэфирных связей. Липосомы в водной фазе с самым низким значением pH, pH 4, показали самую лучшую стабильность без какой-либо значительной деградации через 6 недель. Напротив, при pH 5, наблюдали уже значительную деградацию с извлечением только 80% от начального значения. Стабильность уменьшалась с увеличением pH, и самую высокую деградацию наблюдали для pH 6 и pH 7 (диапазон, в котором прогнозировали самую лучшую стабильность).
Пример 3: Влияние концентрации буфера на стабильность липосом
Дополнительно исследовали стабильность DOPE в липосомах DOTMA/DOPE (DOTMA : DOPE при 2:1 молярном соотношении) в диапазоне низких значений pH. В настоящем эксперименте даже пониженное значение pH исследовали путем добавления чистой уксусной кислоты (10 мМ). Буферы на основе уксусной кислоты добавляли в трех различных концентрациях, а именно 1 мМ, 5 мМ и 10 мМ. Образцы подвергали стрессовому воздействию при 40°C в течение 5 недель.
На фигуре 2 извлечение DOPE представлено для различных условий. Для подтверждения результатов эксперимента, описанного в примере 2 (фигура 1), стабильность непрерывно улучшали путем понижения pH. Чистая уксусная кислота (10 мМ; pH 3,2) оказалась по меньшей мере такой ж эффективной или лучшей, чем ацетатный буфер pH 3,5 (AcB) при одинаковой концентрации. Стабилизирующий эффект кислотных буферов зависел от концентрации, что можно наиболее явно увидеть при pH 5 и 6. Можно заметить тенденцию того, что повышенные концентрации буфера давали в результате лучшую защиту от гидролиза. При очень низких значениях pH этот эффект был менее выраженным. Можно сделать вывод, что добавление чистой уксусной кислоты до соответствующей концентрации может представлять собой простой и прямой путь достижения стабилизации DOPE по отношению к сложноэфирному гидролизу.
Пример 4: Сравнение результатов исследований с использованием различных стрессовых воздействий
На фигуре 3 обобщенно представлен результат нескольких независимых исследований влияния стрессовых условий. В каждом случае липосомы DOTMA/DOPE подвергали стрессовому воздействию в уксусной кислоте и буферных растворах уксусной кислоты (все 10 мМ) при разных значениях pH при 40°C. Представлены результаты через 5 или 6 недель (квадраты разного цвета). Сплошную линию изображали для визуализации общей тенденции.
Можно легко увидеть корреляцию между стабильностью липидов и значением pH. Максимальную стабильность получали в диапазоне значений pH ниже 4, где защитный эффект, как можно увидеть, достигал плато. Пониженные значения pH или повышенные концентрации буфера/кислоты могут приводить даже к лучшей защите от гидролиза. Тем не менее в данном контексте очень высокие концентрации буфера или очень низкие значения pH не являются желательными, поскольку такие жесткие условия не должны использовать в составах для введения пациентам.
Пример 5: Стабильность липосом DOTAP/DOPE в зависимости от значения pH
В настоящем исследовании изучали стабильность липосом из DOTAP вместо DOTMA. DOTAP представляет собой катионный липид со структурой, аналогичной DOTMA, но он содержит сложноэфирные связи вместо простых эфирных связей. В связи с этим, DOTAP должен быть подвержен сложноэфирному гидролизу аналогично DOPE. Кроме замены DOTMA на DOTAP, все другие условия оставались неизменными.
На фигуре 4 результаты измерений извлечения липидов через две недели при 40°C показаны для разных условий pH в водной фазе. Показаны результаты как для DOTAP, так и DOPE. Происходил гидролиз обоих липидов, причем общее поведение было эквивалентным и аналогичным тому, которое наблюдали для DOPE в липосомах DOTMA/DOPE. Таким образом, гидролиз DOTAP можно было предупредить таким же образом, как и гидролиз DOPE путем добавления кислотных буферов или таких кислот, как уксусная кислота.
Пример 6: Сравнение деградации DOPE в липосомах DOTMA/DOPE в воде для инъекций с добавлением или без добавления 5 мМ уксусной кислоты
Добавление уксусной кислоты анализировали в отношении стабилизации липосом для фармацевтического применения, которые предварительно получали в чистой воде для инъекций (wfi). На фигуре 5 показаны результаты исследований влияния стрессовых условий с добавлением и без добавления уксусной кислоты. Для стабилизированных липосом 5 мМ уксусной кислоты добавляли к водной фазе перед образованием липосом. Показаны результаты измерений извлечения DOPE через 3 месяца хранения при трех различных температурах, 5°C, 25°C и 40°C. Во всех трех случаях извлечение было выше, когда уксусная кислота присутствовала в водной фазе. Эффект становился более выраженным при повышенных температурах (стрессовые условия) и наиболее явно выраженным при 40°C, где извлечение можно было повысить от приблизительно 60% до приблизительно 90%.
При сравнении стабильности при различных температурах добавление 5 мМ уксусной кислоты характеризовалось эффектом, аналогичным понижению температуры хранения на 15 до 35°C. Принимая во внимание эмпирическое правило, что понижение температуры на 10°C приводит к уменьшению скорости гидролиза в два раза, это будет соответствовать повышению стабильности (или уменьшению скорости гидролиза) при заданной температуре приблизительно в 4 раза (принимая за основу эффект, эквивалентный понижению температуры на 20°C).
Пример 7: Образование липоплексов
pH-стабилизированные липосомы DOTMA/DOPE использовали для образования составов липоплексов РНК для внутривенной инъекции с эквивалентным или лучшим качеством в отношении физико-химических характеристик по сравнению с липоплексами, полученными из липосом, которые не являлись pH-стабилизированными.
Липоплексы РНК получали согласно следующему протоколу:
1. Добавление 4 мл 0,9% раствора NaCl к 1,1 мл РНК;
2. Добавление 0,4 мл липосом к смеси РНК/NaCl; и
3. Уравновешивание в течение 3 минут при комнатной температуре.
В таблице 2 показаны результаты определения физико-химических характеристик липосом и липоплексов. Диаметр липосом измеряли с помощью динамического рассеяния света с использованием PSS-Nicomp 380 ZLS, Санта-Барбара, Калифорния, США. Наряду с тем, что размер и коэффициент полидисперсности (PDI) липосом с добавлением уксусной кислоты были несколько меньше, чем у липосом без добавления уксусной кислоты, размер частиц липоплексов был несколько больше, чем без добавления уксусной кислоты, тогда как коэффициент полидисперсности был меньше. Больший размер считается благоприятным с точки зрения биологической активности, тогда как меньший коэффициент полидисперсности является благоприятным с точки зрения требований к качеству. Количество суб-видимых частиц, которые не должны присутствовать в продуктах для инъекций выше определенных пороговых значений, было значительно ниже, если стабилизированные липосомы использовали для получения липоплексов. Значение pH конечного состава составляло выше 6 и, таким образом, хорошо подходило для инъекции. Осмолярность являлась эквивалентной физиологическим условиям.
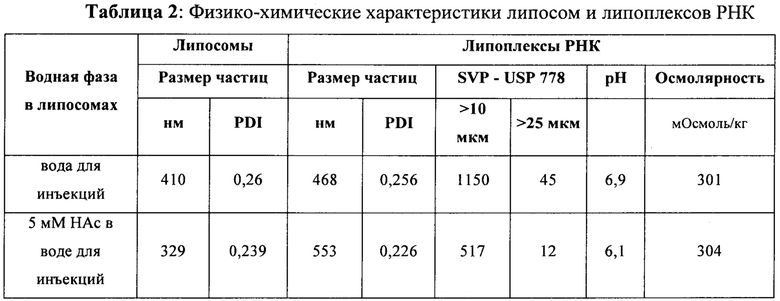
Пример 8: Биологическая оценка липоплексов
Биологическую активность липоплексов, образованных из pH-стабилизированных липосом (добавление уксусной кислоты), исследовали с помощью измерений биолюминесценции. Поглощение и трансляцию введенной в состав кодирующей люциферазу светлячка РНК (липоплексы luc РНК) оценивали с помощью in vivo биолюминесцентной визуализации с использованием системы визуализации Xenogen IVIS Spectrum (Caliper Life Sciences). Кратко, водный раствор D-люциферина (75 мг/кг массы тела) (Caliper Life Sciences) вводили с помощью инъекции мышам интраперитонеально через 6 часов после введения 20 мкг липоплексов luc РНК. Испускаемые фотоны живых животных или экстрагированных тканей определяли количественно через 10 мин со временем экспозиции, составляющим 1 мин. На полученных изображениях обозначали представляющие области (ROI), и биолюминесцентность количественно оценивали в виде средней яркости (фотоны/с/см2/ср, представлена цветными столбиками) с использованием программного обеспечения IVIS Living Image 4.0.
Как показано на фигуре 6, сигналы, полученные от липоплексов, образованных из pH-стабилизированных липосом (см. таблицу 3), были лишь немного ниже, чем сигналы липоплексов, образованных из pH-нестабилизированных липосом. Очень небольшое снижение абсолютного количества было ниже, чем погрешность измерения и, следовательно, не является значимым.

Пример 9: Стабильность DOPE в липосомах DOTMA/DOPE, полученных при GMP или GMP-подобных условиях в воде для инъекций или воде для инъекций, содержащей 5 мМ уксусной кислоты
Липосомы, состоящие из DOTMA/DOPE в молярном соотношении 2/1, получали с помощью техники с использованием инъекции этанола до концентрации, составляющей приблизительно 4 мМ (общий липид). В качестве водной фазы использовали или воду для инъекций (wfi), или wfi, содержащую 5 мМ уксусной кислоты. Липосомы в wfi обозначали как липосомы L1, липосомы в wfi, содержащие 5 мМ уксусной кислоты (что дает значение pH между 3 и 4), обозначали как липосомы L2. Кроме присутствия или отсутствия уксусной кислоты все другие условия получения являлись идентичными. Использовали липиды квалификации GMP и получение проводили при GMP или GMP-подобных условиях. Получили несколько партий липосом L1 и L2 и после заполнения ними стеклянных флаконов стабильность анализировали при следующих температурах:
1. 5°C (2-8°C);
2. 25°C (22-28°C) = ускоренные условия хранения;
3. 40°C (38-42°C) = стрессовые условия.
Данные в отношении стабильности липосом L1 и L2 собирали в течение периода до 25 месяцев (L1) и до 9 месяцев (L2), соответственно. Исследования стабильности все еще продолжаются. На фигуре 7A-C показаны данные в отношении стабильности для разных партий липосом L1 и L2 при различных температурах. При всех температурных условиях и для всех изготовленных партий стабильность DOPE в липосомах L2 была значительно лучше, чем в липосомах L1.
Это указывает на то, что доведение pH до кислотных условий путем добавления 5 мМ уксусной кислоты к водной фазе значительно улучшает стабильность DOPE в липосомах. Срок хранения липосом можно увеличить приблизительно в 4 раза.
Ссылки
Batzri, S. and E.D. Korn (1973). "Single bilayer liposomes prepared without sonication." Biochim Biophys Acta 298(4): 1015-1019.
Chen, C.J., D.D. Han, C.F. Cai and X. Tang (2010). "An overview of liposome lyophilization and its future potential." Journal of Controlled Release 142(3): 299-311.
Stark, В., G. Pabst and R. Prassl (2010). "Long-term stability of sterically stabilized liposomes by freezing and freeze-drying: Effects of cryoprotectants on structure." European Journal of Pharmaceutical Sciences 41(3-4): 546-555.
van Winden, E.C. and D.J. Crommelin (1999). "Short term stability of freeze-dried, lyoprotected liposomes." J Control Release 58(1): 69-86.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛУЧЕНИЕ И ХРАНЕНИЕ ЛИПОСОМНЫХ ПРЕПАРАТОВ РНК, ПРИГОДНЫХ ДЛЯ ТЕРАПИИ | 2020 |
|
RU2807543C2 |
| Изготовление и хранение липосомальных РНК-составов, подходящих для терапии | 2018 |
|
RU2784928C2 |
| ТЕРАПЕВТИЧЕСКАЯ РНК ДЛЯ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2020 |
|
RU2838161C2 |
| СТИМУЛЯЦИЯ ИММУННОГО ОТВЕТА ЭНАНТИОМЕРАМИ КАТИОННЫХ ЛИПИДОВ | 2009 |
|
RU2530555C2 |
| ТЕРАПЕВТИЧЕСКАЯ РНК ДЛЯ РАКА ЯИЧНИКА | 2020 |
|
RU2832172C2 |
| РНК-ЧАСТИЦЫ, ВКЛЮЧАЮЩИЕ ПОЛИСАРКОЗИН | 2019 |
|
RU2792644C2 |
| КОМБИНАЦИОННЫЕ ЛИПОСОМАЛЬНЫЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2012 |
|
RU2640934C2 |
| Композиция для ингибирования роста и стимуляции апоптоза клеток колоректального рака | 2016 |
|
RU2644675C1 |
| НОВЫЕ КОМПОЗИЦИИ ЛИПОСОМ | 2006 |
|
RU2454229C2 |
| АНТИГЕННЫЕ РЕЦЕПТОРЫ И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2792042C2 |
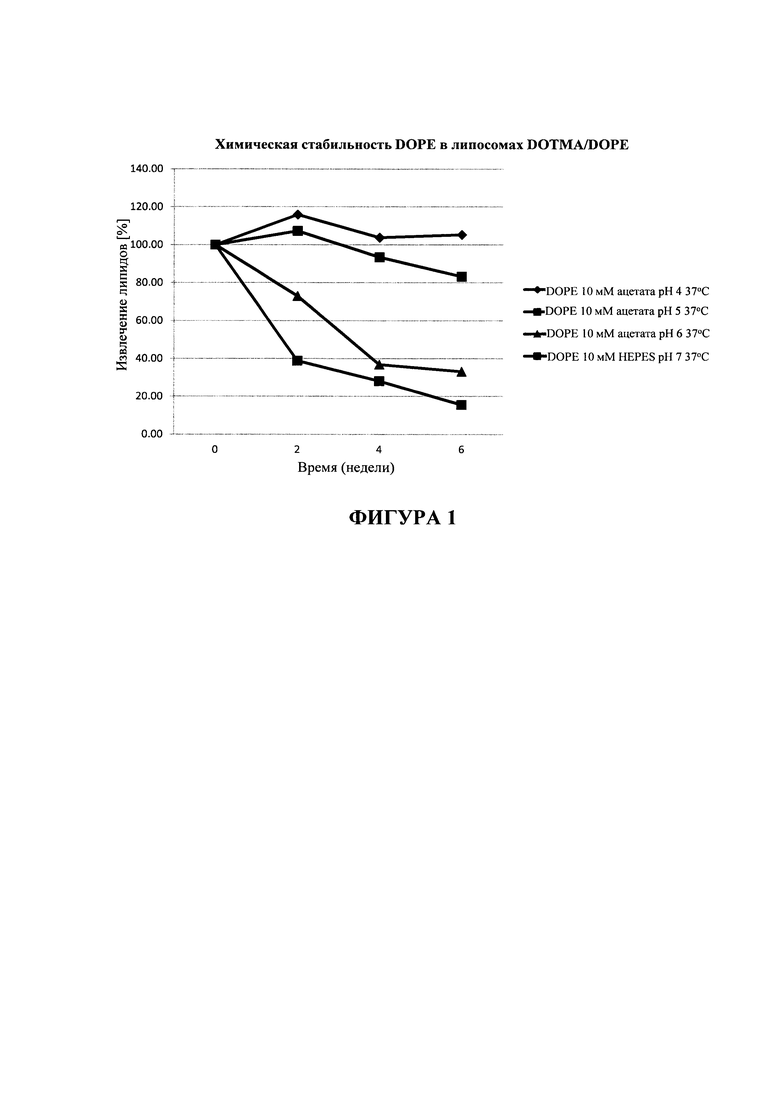
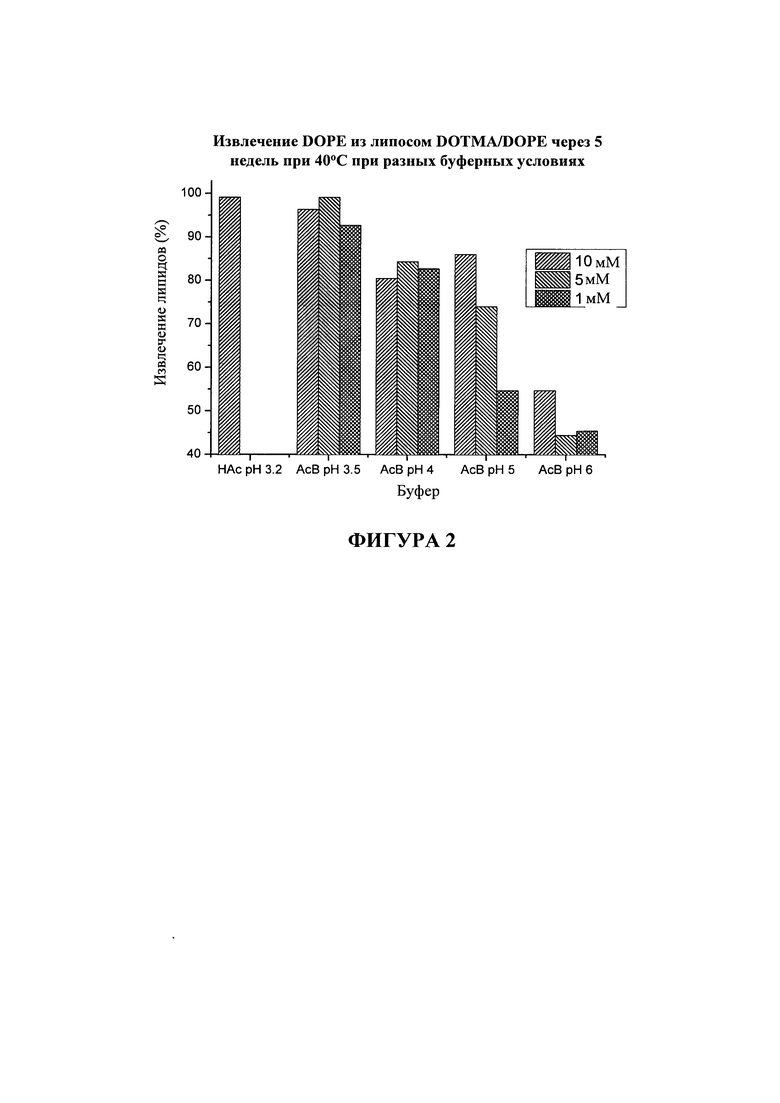
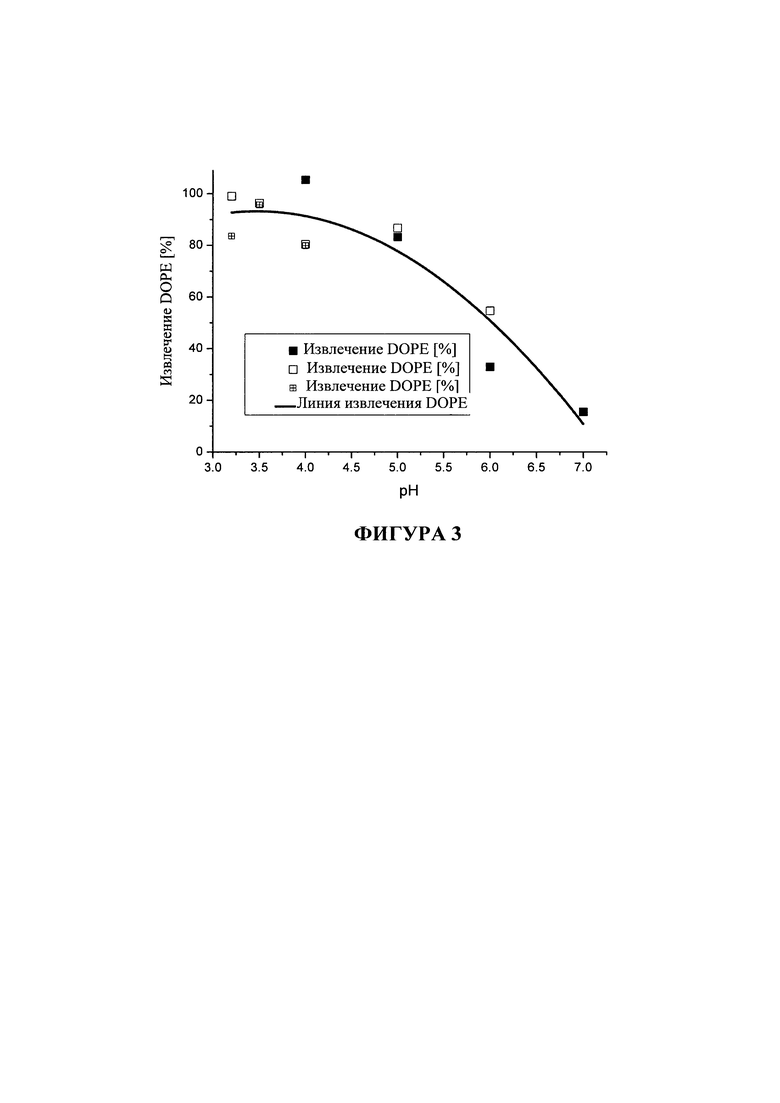
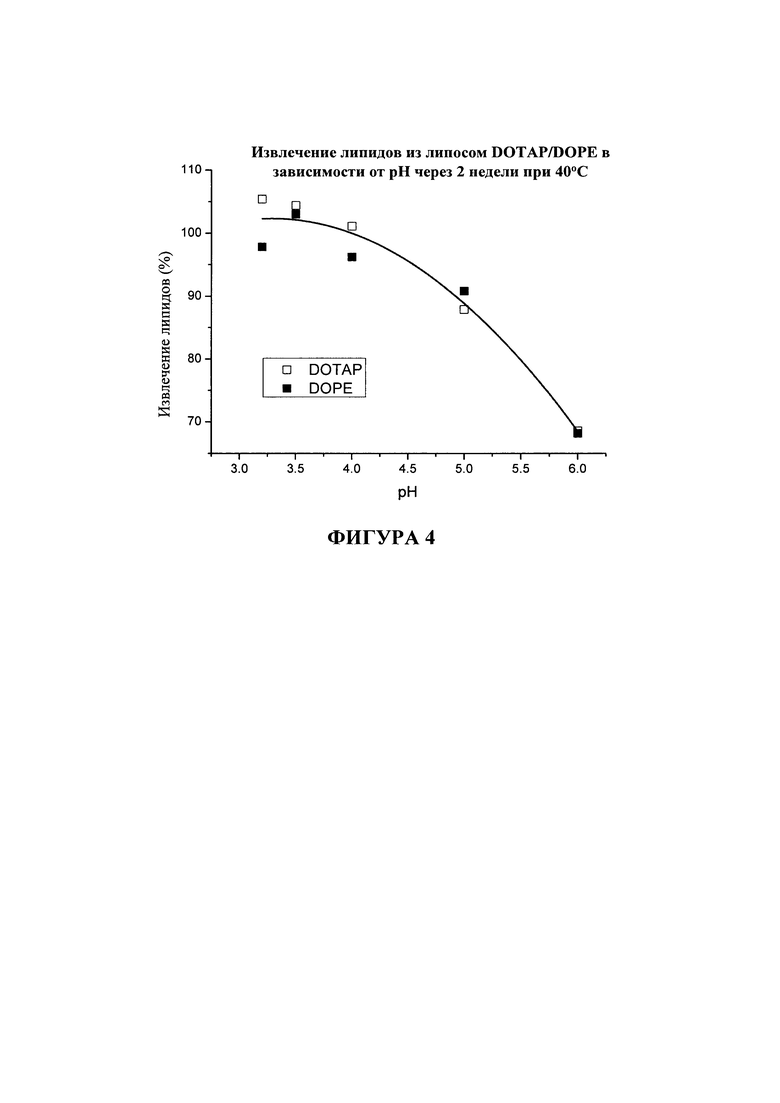
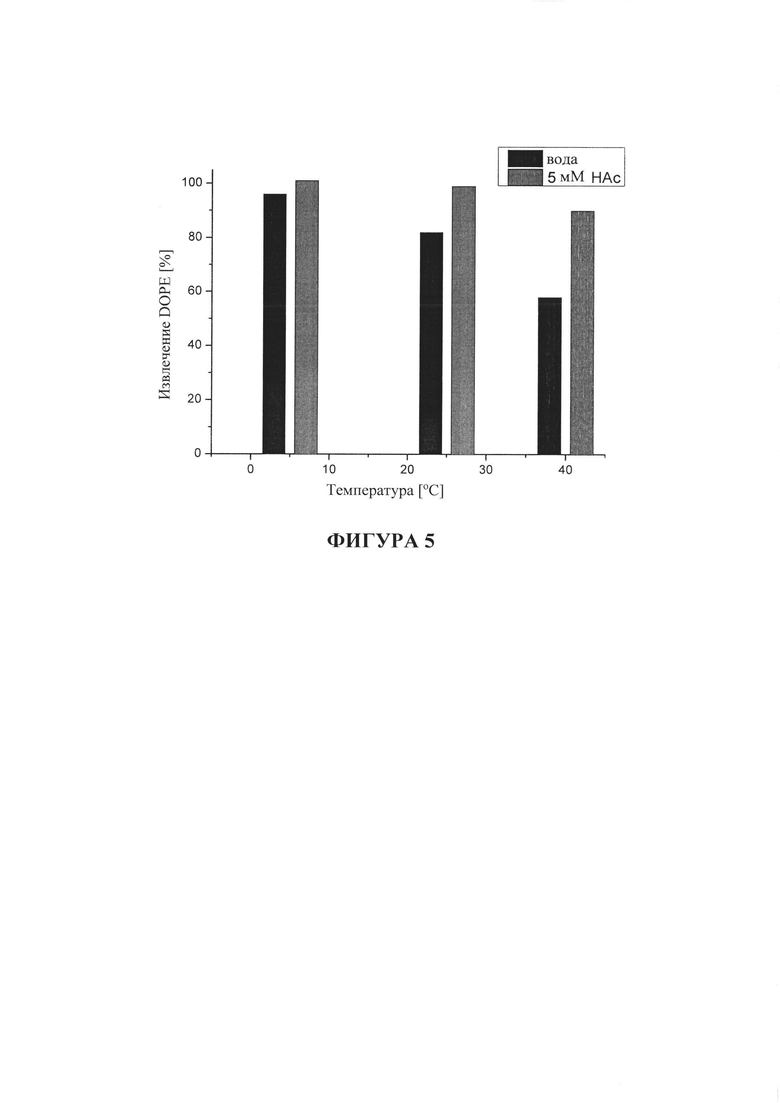
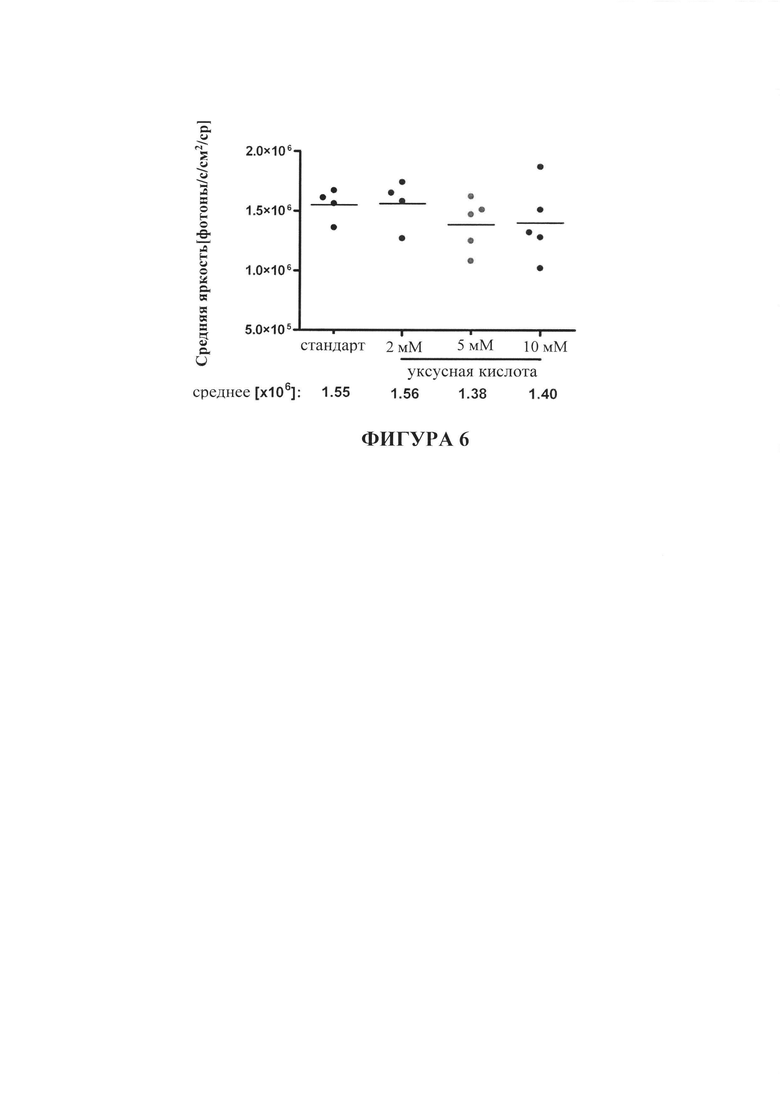
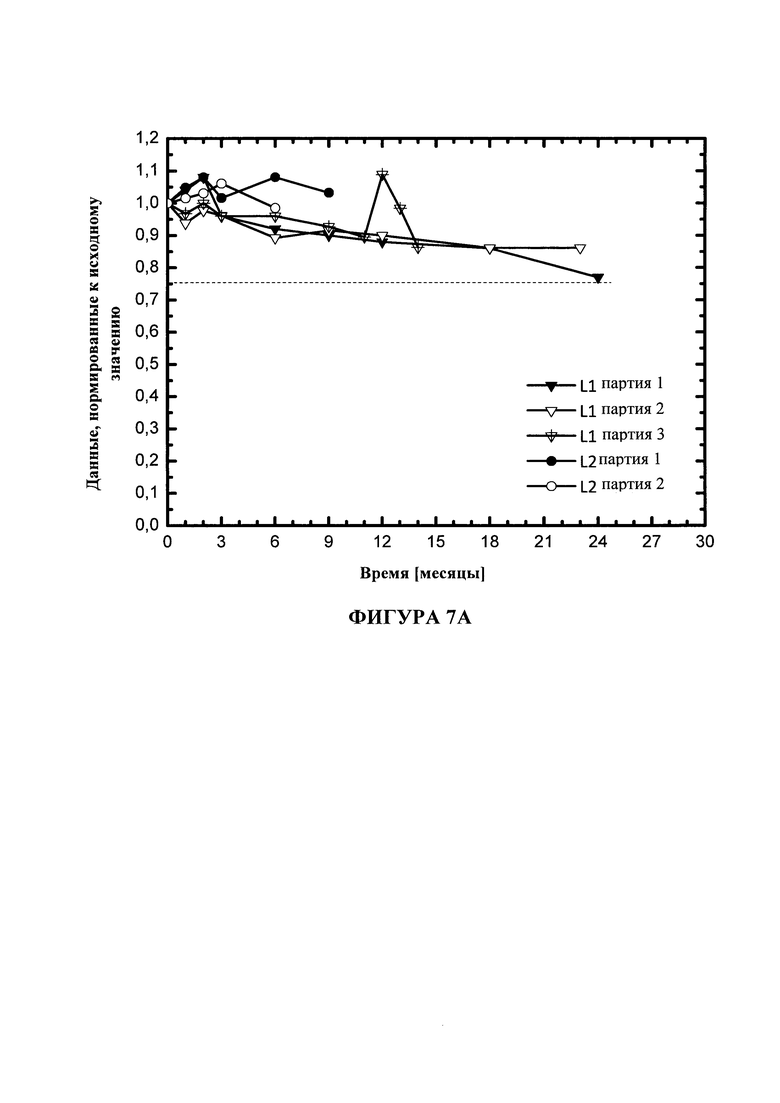
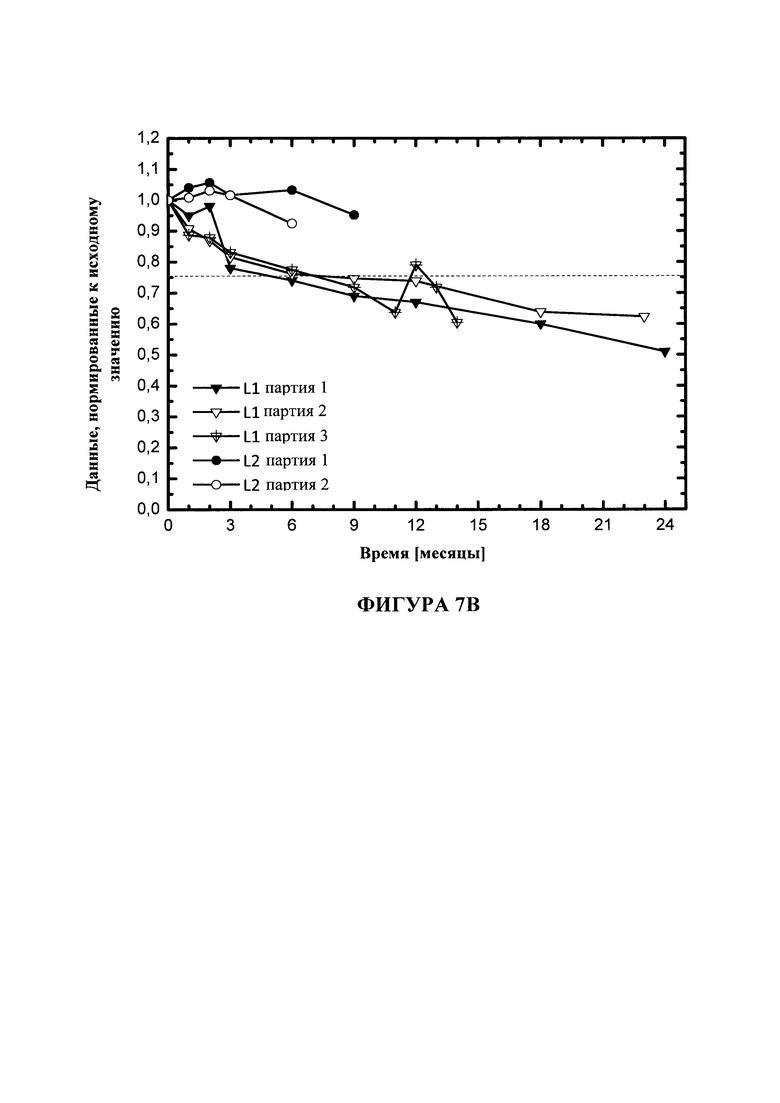
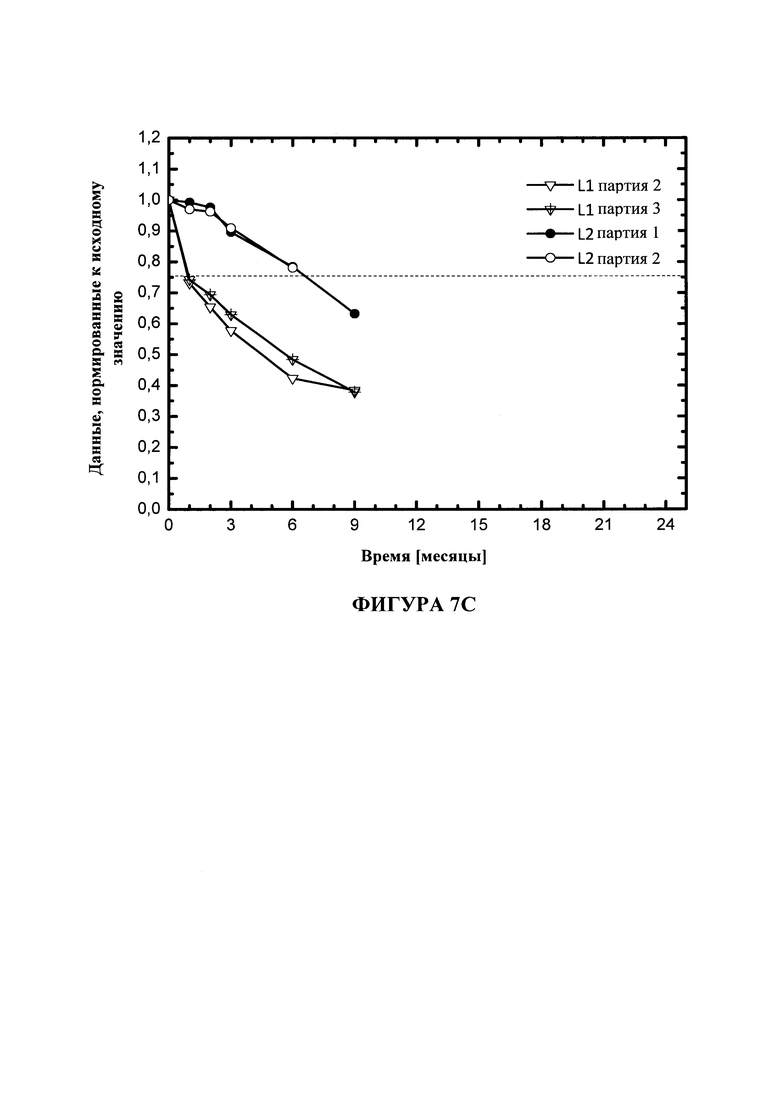
Группа изобретений относится к медицине и касается водной липосомной дисперсии, содержащей липосомы, содержащие DOPE и по меньшей мере один катионный липид, выбранный из группы, состоящей из DOTMA и DOTAP, и по меньшей мере один регулятор рН, причем водный состав характеризуется значением рН между 2 и 5,5, где указанные липосомы являются катионными при физиологическом рН. Группа изобретений также касается способа получения водной липосомной дисперсии; набора для получения фармацевтической композиции, где указанный набор содержит водную липосомную дисперсию и, в отдельном контейнере, фармацевтически активную нуклеиновую кислоту; фармацевтической композиции для доставки лекарственного средства. Группа изобретений обеспечивает увеличенную химическую стабильность водной липосомной дисперсии. 6 н. и 18 з.п. ф-лы, 3 табл., 9 пр., 7 ил.
1. Водная липосомная дисперсия с увеличенной стабильностью липидов, содержащая
- липосомы, содержащие 1,2-ди-(9Z-октадеценоил)-sn-глицеро-3-фосфоэтаноламин (DOPE) и по меньшей мере один катионный липид, выбранный из группы, состоящей из 1,2-ди-О-октадеценил-3-триметиламмонийпропана (DOTMA) и 1,2-диолеоил-3-триметиламмонийпропана (DOTAP), где указанные липосомы являются катионными при физиологическом рН, и
- по меньшей мере один регулятор рН,
причем водный состав характеризуется значением рН между 2 и 5,5.
2. Водная липосомная дисперсия по п. 1, которая характеризуется значением рН между 2 и 5, предпочтительно между 2,5 и 5, более предпочтительно между 3 и 4,5, более предпочтительно между 3 и 4 и даже более предпочтительно между 3,5 и 4.
3. Водная липосомная дисперсия по любому из пп. 1 или 2, у которой молярное соотношение по меньшей мере одного катионного липида к DOPE составляет от 1:4 до 4:1, предпочтительно от 1:2 до 4:1.
4. Водная липосомная дисперсия по любому из пп. 1 или 2, в которой по меньшей мере один регулятор рН содержит кислоту и/или кислотный буфер.
5. Водная липосомная дисперсия по п. 4, в которой кислота представляет собой неразветвленную, разветвленную или циклическую С1-С28, предпочтительно С1-С22 карбоновую кислоту.
6. Водная липосомная дисперсия по п. 4, в которой кислота выбрана из группы, состоящей из уксусной кислоты, аскорбиновой кислоты, лимонной кислоты, соляной кислоты, ортофосфорной кислоты, разветвленных или неразветвленных, насыщенных, мононенасыщенных или полиненасыщенных С12-С28 жирных кислот, предпочтительно С12-С22 жирных кислот (например, олеиновой кислоты).
7. Водная липосомная дисперсия по п. 4, в которой кислотный буфер основан на кислоте, как определено в п. 5.
8. Водная липосомная дисперсия по п. 4, в которой кислотный буфер выбран из группы, состоящей из ацетатного буфера, цитратного буфера, фосфатного буфера и карбонатного буфера.
9. Водная липосомная дисперсия по любому из пп. 1 или 2, в которой по меньшей мере один регулятор рН содержит уксусную кислоту и/или ацетатный буфер.
10. Водная липосомная дисперсия по любому из пп. 1 или 2, в которой по меньшей мере один регулятор рН присутствует в таком количестве, чтобы молярное соотношение общего липида по меньшей мере к одному регулятору рН не превышало 100:1.
11. Водная липосомная дисперсия по п. 10, в которой по меньшей мере один регулятор рН присутствует в таком количестве, чтобы молярное соотношение общего липида по меньшей мере к одному регулятору рН составляло от 10:1 до 1:10, предпочтительно от 5:1 до 1:5, более предпочтительно от 2:1 до 1:2, более предпочтительно от 1,5:1 до 1:1,5, даже более предпочтительно приблизительно 1:1.
12. Водная липосомная дисперсия по любому из пп. 1 или 2, в которой скорость гидролиза DOPE и/или DOTAP, уменьшена по сравнению со скоростью его гидролиза при значении рН между 6 и 7.
13. Водная липосомная дисперсия по п. 1 или 2, в которой по меньшей мере один регулятор рН ассоциирован с липосомами.
14. Способ получения водной липосомной дисперсии по п. 1 или 2, причем способ предусматривает:
- образование липосом в водном растворе, содержащем по меньшей мере один регулятор рН и характеризующемся значением рН между 2 и 5,5; или
- добавление по меньшей мере одного регулятора рН к водному раствору, содержащему липосомы, для доведения рН водного раствора до значения рН между 2 и 5,5.
15. Набор для получения фармацевтической композиции, где указанный набор содержит водную липосомную дисперсию по п. 1 или 2 и, в отдельном контейнере, фармацевтически активную нуклеиновую кислоту.
16. Набор по п. 15, в котором водный состав нуклеиновой кислоты представляет собой ДНК или РНК, предпочтительно РНК.
17. Набор по п. 15, в котором фармацевтически активная нуклеиновая кислота предусмотрена в буферном растворе, характеризующемся значением рН между 6 и 8.
18. Способ получения фармацевтической композиции, причем способ предусматривает:
- получение водной липосомной дисперсии по п. 1 или 2; и
- смешивание водной липосомной дисперсии с фармацевтически активной нуклеиновой кислотой.
19. Способ по п. 18, при котором фармацевтически активная нуклеиновая кислота представляет собой ДНК или РНК, причем фармацевтически активная нуклеиновая кислота предпочтительно предусмотрена в буферном растворе, характеризующемся значением рН между 6 и 8.
20. Фармацевтическая композиция для доставки лекарственного средства, полученная способом по п. 18.
21. Способ химической стабилизации водной липосомной дисперсии, содержащей липосомы, содержащие DOPE и по меньшей мере один катионный липид, выбранный из группы, состоящей из DOTMA и DOTAP, причем указанные липосомы являются катионными при физиологическом рН, где способ предусматривает
- доведение рН водной липосомной дисперсии до значения рН между 2 и 5,5.
22. Способ по п. 21, при котором химическая стабилизация происходит путем ингибирования гидролиза сложноэфирной связи.
23. Способ по п. 21, при котором рН доводят до значения рН между 2 и 5, предпочтительно между 2,5 и 5, более предпочтительно между 3 и 4,5, более предпочтительно между 3 и 4 и даже более предпочтительно между 3,5 и 4.
24. Способ по п. 21, при котором рН водного липидного состава доводят с помощью добавления по меньшей мере одного регулятора рН, предпочтительно по меньшей мере одного регулятора рН, как указано в п. 4.
| US 20060159737 A1, 20.07.2006 | |||
| WO 2007107304 A2, 27.09.2007 | |||
| СПОСОБ УСИЛЕНИЯ ИММУННОГО ОТВЕТА ПРИ ВАКЦИНАЦИИ НУКЛЕИНОВОЙ КИСЛОТОЙ | 2003 |
|
RU2311911C2 |
| EVEN-CHEN S., et al., Factors affecting DNA binding and stability of association to cationic liposomes.Chem Phys Lipids | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
Авторы
Даты
2020-12-07—Публикация
2015-09-17—Подача