ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной заявки США № 61/045837, поданной 17 апреля 2008 г. авторами Elizabeth Vasievich, Weihsu Chen, Kenya Toney, Gregory Conn, Frank Bedu-Addo и Leaf Huang, под названием «Стимуляция иммунного ответа энантиомерами катионных липидов», описание которой включено в настоящую заявку в качестве ссылки в полном объеме.
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение в основном относится к стимуляции иммунного ответа и более конкретно к применению R- и S-энантиомеров липидов в стимуляции иммунного ответа.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Этот раздел предназначен для введения в различные аспекты уровня техники, которые могут быть связаны с различными аспектами настоящего изобретения, которые описаны и/или заявлены ниже. Считается, что это обсуждение будет полезно для предоставления вводной информации для облегчения лучшего понимания различных аспектов настоящего изобретения. Соответственно, должно быть понятно, что эти положения следует толковать в этом аспекте, а не как признание существующего уровня техники.
Разработка безопасных и эффективных иммунотерапевтических средств для применения у людей остается крайне необходимой медицинской потребностью для пациентов во всем мире. Для индукции соответствующих иммунных реакций иммунологические модификаторы («иммуномодификаторы»), которые усиливают, направляют или стимулируют иммунный ответ, могут быть использованы в создании вакцин или для иммунотерапии [Gregoriadis, G., Immunological adjuvants: a role for liposomes. Immunol Today 11:89 (1990)]. Например, вакцины могут включать антигены для стимуляции иммунного ответа. Однако некоторые потенциальные вакцины, которые содержат антигены, являются слабыми стимуляторами иммунного ответа, поскольку эти вакцины эффективно не доставляют антиген к антиген-презентирующим клеткам («APC») иммунной системы и/или антиген является слабо иммуногенным. Таким образом, необходимы иммунотерапевтические средства, которые эффективно доставляют антигены к APC, а также стимулируют иммунную систему, для ответа на антиген. Иммуномодификаторы имеют возможность действовать в качестве иммунотерапевтических средств. Такие иммунотерапевтические средства могут обладать этими и другими полезными свойствами. Например, при включении в качестве части терапевтической вакцины иммуномодификатор по меньшей мере должен (1) улучшать доставку антигена и/или процессирование в APC [Wang, R. F., and Wang, H. Y., Enhancement of antitumor immunity by prolonging antigen presentation on dendritic cells. Nat Biotechnol 20:149 (2002)], (2) индуцировать продукцию иммуномодулирующих цитокинов, которые способствуют развитию иммунных реакций на антиген вакцины, таким образом стимулируя клеточно-опосредованный иммунитет, в том числе цитотоксические Т-лимфоциты («CTL»), (3) уменьшать количество иммунизаций или количество антигена, необходимого для эффективной вакцины [Vogel, F. R. Improving vaccine performance with adjuvants. Chin Infect Dis 30 Suppl 3:S266 (2000)], (4) увеличивать биологический или иммунологический период полужизни антигена вакцины и (5) преодолевать иммунологическую толерантность к антигену путем ингибирования иммуносупрессирующих факторов [Baecher-Allan, C., and Anderson, D. E. Immune regulation in tumor-bearing hosts. Curr Opin Immunol 18:214 (2006)].
В настоящее время основным классом веществ, используемых для усиления эффективности антигенов, таких как пептидные или белковые антигены, в индукции иммунного ответа, являются адъюванты, такие как эмульсии вода-в-масле, квасцы и другие химические вещества, которые усиливают антигенные реакции; однако эти адъюванты не являются иммуномодификаторами, как описано выше, поскольку сами они не обладают прямым иммуномодулирующим действием [Vogel, F. R., and Powell, M. F. A compendium of vaccine adjuvants and excipients, Pharm Biotechnol 6:141 (1995)]. Некоторые такие адъюванты доступны для применения у животных, а некоторые из них были протестированы в клинических испытаниях. Помимо традиционных адъювантов, таких как соли алюминия, продаются такие продукты, как виросомы гриппа [Gluck, R., and Walti, E. 2000. Biophysical validation of Epaxal Berna, a hepatitis A vaccine adjuvanted with immunopotentiating reconstituted influenza virosomes (IRIV). Dev Biol (Basel) 103:189 (2000)] и MF59 Широна (Chiron) [Kahn, J. O., et al. Clinical and immunologic responses to human immunodeficiency virus (HIV) type 1SF2 gpl20 subunit vaccine combined with MF59 adjuvant with or without muramyl tripeptide dipalmitoyl phosphatidylethanolamine in non-HIV-infected human volunteers. J. Infect Dis 170:1288 (1994)], которые обладают присущими им иммунными эффектами. Например, препарат MF59, который представляет собой адъювант на основе субмикронной эмульсии, интернализуется дендритными клетками [Dupuis, M., et al., Dendritic cells internalize vaccine adjuvant after intramuscular injection. Cell Immunol 186:18 (1998)]. Однако в соответствии с отчетами о клинических испытаниях по вакцинам против HSV и вируса гриппа [Jones, C. A., and Cunningham, A. L. Vaccination strategies to prevent genital herpes and neonatal herpes simplex virus (HSV) disease. Herpes 11:12 (2004); Minutello, M. et al., Safety and immunogenicity of an inactivated subunit influenza virus vaccine combined with MF59 adjuvant emulsion in elderly subjects, immunized for three consecutive influenza seasons. Vaccine 17:99 (1999)] данные, полученные от модели на животных, дают возможность предположить, что адъювант MF59 усиливает продукцию нейтрализующих антител, а не усиливает Т-клеточные ответы. Таким образом, необходимы новые способы стимуляции клеточно-опосредованных иммунных ответов.
Далее, как указано выше, некоторые антигены являются слабыми стимуляторами иммунного ответа. Таким образом, помимо совместного введения антигена с веществами, которые стимулируют иммунные ответы, как описано выше, слабоиммуногенный антиген может быть модифицирован для повышения его иммуногенности. Например, слабый иммуногенный антиген может быть соединен с иммуногенными пептидами, полисахаридами или липидами для повышения его иммуногенности. Однако простого соединения слабо иммуногенных антигенов с этими типами соединений может быть недостаточно для индукции иммунного ответа. Например, полученный в результате иммунный ответ может быть направлен на иммуногенные эпитопы на присоединенном соединении, а не на слабом антигене, или присоединенный антиген может не быть эффективно доставлен к APC иммунной системы. Таким образом, дополнительные способы необходимы для стимуляции иммунных ответов на антигены, которые являются слабо иммуногенными.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Некоторые аспекты настоящего изобретения, приводимые в качестве примера, изложены ниже. Должно быть понятно, что эти аспекты приведены просто для предоставления краткого изложения некоторых форм изобретения, которые оно может принимать, и что эти аспекты не предназначены для ограничения объема этого изобретения. В действительности, настоящее изобретение может охватывать целый ряд аспектов, которые могут не быть явным образом изложены ниже.
Настоящее изобретение относится к хиральности катионных липидов и применению R- и S-энантиомеров катионных липидов, которые в определенной дозе и условиях композиции действуют как новый класс иммуностимуляторов, для (1) эффективной презентации или доставки антигена к иммунной системе и (2) стимуляции иммунной системы в ответ на этот антиген.
Липосомы были широко использованы для доставки лекарственных средств с низкой молекулярной массой, плазмидной ДНК, олигонуклеотидов, белков и пептидов. Вакцины, используя липосомные везикулы в качестве невирусных антигенных носителей, предпочтительны по сравнению с традиционными иммунизациями с использованием живых аттенуированных вакцин или вирусных векторов, таких как вирус оспы или вирус гриппа. В патентной заявке США № 12/049957, переданной правопреемнику настоящей заявки, описывается простой набор эффективных иммунотерапевтических средств на основе липидов, включающих комплекс катионного липида и антигена, который имеет две молекулы, катионный липид и антиген, и воздействие дозы липида на полученный в результате иммунный ответ. Полученные результаты демонстрируют, что катионная липосома, образовавшая комплекс с антигеном, служит для стимуляции иммунных ответов и инициации взаимодействия дендритных клеток (APC) с T-клетками.
В настоящем изобретении дополнительные исследования, проведенные с двумя энантиомерами выбранного катионного липида, привели к открытию того, что существуют различия в способности R и S-энантиомеров катионных липидов действовать в качестве эффективных иммунных активаторов в различных условиях. В сочетании с антигеном комплекс катионного липида с антигеном, содержащий R-энантиомер, в различных условиях дозирования (включая условия низкой дозы) индуцирует сильные иммунные ответы, специфичные в отношении антигена, находящегося в этом комплексе, и в результате приводит к регрессии опухоли. Комплексы, состоящие из S-DOTAP и антигена, однако, были способны индуцировать только ограниченную регрессию опухоли, а вовсе не дозы, при которых R-DOTAP был эффективным. Оба энантиомера DOTAP, однако, являются равно эффективными в индукции созревания и активации дендритных клеток, которая является первым этапом в индукции клеточного иммунного ответа.
Таким образом, один аспект настоящего изобретения относится к композиции по меньшей мере одного энантиомера катионного липида в дозе, эффективной для индукции иммунного ответа у пациента.
Другой аспект настоящего изобретения относится к способу индукции иммунного ответа у пациента путем введения специфического энантиомера или смеси энантиомеров катионных липидов пациенту.
Другой аспект настоящего изобретения относится к композиции R- или S-энантиомера катионного липида в дозе, достаточной для индукции иммунного ответа у пациента.
Дополнительные аспекты настоящего изобретения включают добавление по меньшей мере одного антигена к R- или S-энантиомеру для образования комплекса катионного липида с антигеном, в случае которого иммунный ответ является антиген-специфичным.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Различные особенности, аспекты и преимущества настоящего изобретения будут лучше понятны при прочтении следующего подробного описания со ссылкой на сопровождающие фигуры, на которых:
На фиг. 1А и 1В представлена хиральность 1,2-диолеоил-3-триметиламмония пропана («DOTAP»).
На фиг. 2 представлен график, на котором изображена активация дендритных клеток человека, приводящая в результате к экспрессии костимулирующей молекулы CD80 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP.
На фиг. 3 представлен график, на котором изображена активация дендритных клеток человека, приводящая в результате к экспрессии костимулирующей молекулы CD83 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP.
На фиг. 4 представлен график, на котором изображена активация дендритных клеток человека, приводящая в результате к экспрессии костимулирующей молекулы CD86 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP.
На фиг. 5 представлен график, на котором изображена стимуляция дендритных клеток человека, приводящая в результате к продукции хемокина CCL-3 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP.
На фиг. 6 представлен график, на котором изображена стимуляция дендритных клеток человека, приводящая в результате к продукции хемокина CCL-4 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP.
На фиг. 7 представлен график, на котором изображена стимуляция дендритных клеток человека, приводящая в результате к продукции хемокина CCL-5 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP
На фиг. 8 представлен график, на котором изображена стимуляция дендритных клеток человека, приводящая в результате к продукции хемокина CCL-19 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP.
На фиг. 9 представлен график, на котором изображена стимуляция дендритных клеток человека, приводящая в результате к продукции цитокина IL-2 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP.
На фиг. 10 представлен график, на котором изображена стимуляция дендритных клеток человека, приводящая в результате к продукции цитокина IL-8 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP.
На фиг. 11 представлен график, на котором изображена стимуляция дендритных клеток человека, приводящая в результате к продукции цитокина IL-12 под действием R-DOTAP, S-DOTAP и рацемической смеси RS-DOTAP.
На фиг. 12 представлен график, демонстрирующий противоопухолевое действие in vivo различных доз комплекса катионного липида с антигеном на основе размера опухоли и времени после инъекции.
На фиг. 13 представлен график, демонстрирующий действие дозы S-DOTAP на противоопухолевую эффективность in vivo комплекса катионного липида и антигена.
На фиг. 14 представлен график, демонстрирующий действие дозы R-DOTAP на противоопухолевую активность in vivo комплекса катионного липида и антигена.
На фиг. 15 представлен график, на котором изображены ответные эффекты дозы липида рацемической смеси DOTAP, R-DOTAP и S-DOTAP на противоопухолевый иммунный ответ in vivo комплекса катионного липида и антигена с дозой антигена 20 мкг. Действие дозы антигена также продемонстрировано рацемической смесью DOTAP. R-DOTAP по сравнению с S-DOTAP: * p<0,05, **p<0,01, n=5-6.
ПОДРОБНОЕ ОПИСАНИЕ
Один или более специфических вариантов настоящего изобретения будет описано ниже. С целью обеспечения краткого описания этих вариантов осуществления все особенности фактического воплощения могут быть не описаны в этом описании. Должно быть понятно, что при разработке любого такого фактического воплощения многочисленные решения, специфичные для такого воплощения, должны быть сделаны для достижения особых целей разработчиков, которые могут варьировать от одного воплощения к другому. Более того, должно быть понятно, что такая опытная работа могла быть сложной и длительной, но тем не менее была бы обычной практикой, предпринимаемой специалистами, которым полезно это описание.
При введении элементов настоящего изобретения (например, его приводимых в качестве примера вариантов осуществления) формы единственного и множественного числа и «указанный» означают, что существует один или несколько элементов. Термины «содержащий», «включающий» и «имеющий» являются инклюзивными и означают, что могут быть дополнительные элементы, отличные от перечисленных элементов.
Один аспект настоящего изобретения относится к энантиомеру катионного липида для стимуляции иммунного ответа у млекопитающего для профилактики или лечения заболевания. Отдельные хиральные липиды могут функционировать независимо в качестве иммуномодуляторов дозозависимым образом, например, в отношении продукции хемокинов и/или цитокинов, путем активации различных компонентов сигнального пути MAP киназы. Определяют диапазон доз, который эффективно индуцирует иммунный ответ, для того чтобы провести различие между R- и S-энантиомерами, а также в пределах различных видов млекопитающих. Например, у грызунов R-энантиомер DOTAP эффективно ослабляет рост опухоли в диапазоне от примерно 30 нмоль до примерно 400 нмоль. Напротив, S-энантиомер DOTAP является эффективным в том же диапазоне доз у тех же видов грызунов, хотя менее, чем R-энантиомер. В другом аспекте хиральный катионный липид может быть ассоциирован с антигенами или лекарственными средствами для презентации клеткам иммунной системы, одновременно стимулируя сильный антиген-специфичный иммунный ответ. В некоторых аспектах настоящего изобретения антигеном является липопептид.
В патенте США № 7303881, включенном в качестве ссылки в полном объеме, описывается, что было показано, что многочисленные катионные липиды, образовавшие комплекс с антигенами, связанными с патологическими состояниями, стимулируют профилактический иммунный ответ, который предупреждал болезнь, вызываемую специфическим патогеном (например, HPV-позитивный рак), а также терапевтический иммунный ответ, который уничтожает клетки, экспрессирующие конкретный антиген, и приводит в результате к эффективному лечению этого заболевания. В настоящее время исследования проводились для дальнейшего понимания действия хиральности на иммуностимулирующую способность катионных липидов, путем использования R- и S-энантиомеров DOTAP. (R- и S-энантиомеры DOTAP показаны на фиг. 1A и 1B.) Эти исследования привели к открытию того, что отдельные энантиомеры катионных липидов могут действовать независимо в качестве иммуномодуляторов для стимуляции иммунного ответа с (или без) антигенов. Далее, когда энантиомеры катионных липидов образуют комплексы с антигеном, генерируется антиген-специфичный иммунный ответ, степень иммунного ответа, специфичного для заболевания, существенно различается между R- и S-энантиомерами катионного липида.
В другом аспекте хиральный катионный липид в дозе, достаточной для стимуляции иммунного ответа, вводят в сочетании с антигеном или антигенами. В этом случае сочетание катионного липида и антигена способно генерировать иммунный ответ, который специфичен в отношении этого антигена (антигенов), доставляемого(ых) в сочетании с катионным липидом. Вызываемый ответ может включать продукцию специфических цитотоксических Т-клеток, Т-клеток памяти или В-клеток, приводящую в результате к профилактическому или терапевтическому ответу на конкретное заболевание, связанное с этим антигеном (антигенами).
Хиральные катионные липиды по настоящему изобретению могут быть в форме катионных липидных комплексов. Катионный липидный комплекс может принимать вид различных везикул, таких как липосомы, мицеллы или эмульсии. Катионные липидные комплексы могут быть однослойными или многослойными. При включении антигена антиген может быть инкапсулирован в катионный липидный комплекс или может быть неинкапсулированным. Под инкапсулированным подразумевается, что антиген может содержаться во внутреннем пространстве комплекса и/или может быть включен в липидные стенки комплекса.
Другой аспект настоящего изобретения относится к способу получения этих комплексов, где указанный способ необязательно может включать стадию очистки этих составов от избытка отдельных компонентов.
В некоторых вариантах осуществления катионные липидные комплексы имеют общий положительный заряд и/или положительно заряженную поверхность при pH 6,0-8,0.
Производный «антиген», который может быть включен в катионные липидные комплексы по изобретению, может представлять собой нуклеиновые кислоты, пептиды, липопептиды, белки, липопротеины, полисахариды и другие макромолекулы, которые могут образовывать комплексы непосредственно с катионными липидами. Однако катионные лекарственные средства (например, крупный катионный белок) могут непосредственно образовывать комплекс с анионным липидом или последовательно образовывать комплекс сначала с анионным липидом или полимером, после чего с хиральным катионным липидом. Применение этого процесса позволяет осуществлять доставку положительно или нейтрально заряженных лекарственных средств к клеткам посредством комплексов по настоящему изобретению.
Один аспект настоящего изобретения включает применение хиральных катионных липидных комплексов для активации дендритных клеток, а также для стимуляции продукции хемокинов и цитокинов. Хемокины и цитокины являются важными регуляторами иммунных реакций. Хемокины первоначально идентифицированы как мощные хемоаттрактанты для воспалительных клеток, в том числе нейтрофилов, эозинофилов и моноцитов/макрофагов. Последующие исследования показали, что хемокины оказывают сильное действие на иммунные реакции путем регуляции направленной миграции дендритных клеток и других лимфоцитов в лимфоидные органы. Дендритные клетки представляют собой мигрирующие клетки, которые выбирают антигены в ткани, мигрируют к дренирующим лимфоузлам и созревают для стимуляции Т-клеточного ответа. CCL2, представитель CC хемокинов, первоначально был идентифицирован в качестве хемотактического и активирующего фактора для моноцитов/макрофагов. Последующие исследования показали, что он также может влиять на функцию Т-клеток, естественных клеток-киллеров и нейтрофилов. Дальнейшее исследование обнаружило, что CCL2 был наиболее мощным активатором активности CD8+ цитотоксических Т-лимфоцитов («CTL»), в присутствии Th1 цитокинов, интерлейкина-12 («IL-12») и интерферона-γ («IFN-γ»). Это можно объяснить позитивным двухсторонним взаимодействием между системами CCL2 и IFN-γ. Отсутствие любого из цитокина или хемокина может препятствовать поляризации Th1 и последующей выработке специфического опухолевого иммунитета. Также было показано, что другой CC хемокин, CCL-4, осуществляет рекрутинг и распространение дендритных клеток in vivo и потенцирование иммуногенности плазмидных ДНК вакцин. В последнее время было показано, что хемокины усиливают иммунитет путем направления наивных CD8+ T-клеток к местам взаимодействия CD4+ T-клеток-дендритных клеток и способствуют генерации CD8+ T-клеток памяти. Некоторыми примерами хемокинов, которые могут стимулироваться катионными липидными комплексами по настоящему изобретению, являются CCL-2, CCL-3 и CCL-4. Примерами цитокинов, которые могут стимулироваться катионными липидными комплексами по настоящему изобретению, являются IL-2, IL-8, IL-12 и IFN-γ. Авторы изобретения считают, что катионные липидные комплексы по настоящему изобретению могут стимулировать хемокины и цитокины в дополнение к тем, которые приведены в настоящем описании.
ЛИПИДЫ
Хиральные катионные липидные комплексы по настоящему изобретению могут образовывать липосомы, которые необязательно перемешивают с антигеном, и могут содержать хиральные катионные липиды отдельно или хиральные катионные липиды в сочетании с нейтральными липидами. Виды подходящих хиральных катионных липидов включают, но не только, R- и S-энантиомеры: 3-β[4N-(1N,8-дигуанидиноспермидин)карбамоил]холестерин (BGSC); 3-β[N,N-дигуанидиноэтил-аминоэтан)карбамоил]холестерин (BGTC); N,N1N2N3тетра-метилтетрапальмитилспермин (cellfectin); N-трет-бутил-N'-тетрадецил-3-тетрадецил-аминопропион-амидин (CLONfectin); диметилдиоктадецил аммония бромид (DDAB); 1,2-димиристилоксипропил-3-диметил-гидроксиэтил аммония бромид (DMRIE); 2,3-диолеоилокси-N-[2(сперминкарбоксамидо)этил]-N,N-диметил-1-п-ропанаминия трифторацетат) (DOSPA); 1,3-диолеоилокси-2-(6-карбоксиспермил)пропиламид (DOSPER); 4-(2,3-бис-пальмитоилокси-пропил)-1-метил-1H-имидазол (DPIM) N,N,N',N'-тетраметил-N,N'-бис(2-гидроксиэтил)-2,3-диолеоилокси-1,4-бутандиаммония йодид) (Tfx-50); N-1-(2,3-диолеоилокси)пропил-N,N,N-триметил аммония хлорид (DOTMA) или другие N-(N,N-1-диалкокси)-алкил-N,N,N-тризамещенные аммонийные поверхностно-активные вещества; 1,2 диолеоил-3-(4'-триметиламмонио)бутанол-sn-глицерин (DOBT) или холестерил (4'триметиламмоний)бутаноат (ChOTB), где триметиламмонийная группа соединена через бутанольное спейсерное плечо либо с двойной цепью (для DOTB), либо группой холестерила (для ChOTB); DORI (DL-1,2-диолеоил-3-диметиламинопропил-β-гидроксиэтиламмоний) или DORIE (DL-1,2-О-диолеоил-3-диметиламинопропил-β-гидроксиэтиламмоний) (DORIE) или их аналоги, как описано в WO 93/03709; 1,2-диолеоил-3-сукцитинил-sn-глицерин холин сложный эфир (DOSC); сложный эфир холестерил гемисукцината (ChOSC); липополимамины, такие как диоктадециламидоглицилспермин (DOGS) и дипальмитоил фосфатидилэтаноламилспермин (DPPES), или катионные липиды, описанные в патенте США № 5283185, холестерил-3β-карбоксил-амидо-этилентриметиламмония йодид, 1-диметиламино-3-триметиламмонио-DL-2-пропил-холестерил карбоксилат йодид, холестерил-3-O-карбоксиамидоэтиленамин, холестерил-3-β-оксисукцинамидо-этилентриметиламмония йодид, 1-диметиламино-3-триметиламмонио-DL-2-пропил-холестерил-3-β-оксисукцината йодид, 2-(2-триметиламмонио)этилметиламино этил-холестерил-3-β-оксисукцинат йодид, 3-β-N-(N',N'-диметиламиноэтан)карбамоилхолестерин (DC-chol) и 3-β-N-(полиэтиленимин)карбамоилхолестерин; О,О'-димиристил-N-лизил аспартат (DMKE); О,О'-димиристил-N-лизил-глутамат (DMKD); 1,2-димиристилоксипропил-3-диметил-гидроксиэтил аммония бромид (DMRIE); 1,2-дилауроил-sn-глицеро-3-этилфосфохолин (DLEPC); 1,2-димиристоил-sn-глицеро-3-этилфосфохолин (DMEPC); 1,2-диолеоил-sn-глицеро-3-этилфосфохолин (DOEPC); 1,2-дипальмитоил-sn-глицеро-3-этилфосфохолин (DPEPC); 1,2-дистеароил-sn-глицеро-3-этилфосфохолин (DSEPC); 1,2-диолеоил-3-триметиламмония пропан (DOTAP); диолеоил диметиламинопропан (DODAP); 1,2-пальмитоил-3-триметиламмония пропан (DPTAP); 1,2-дистеароил-3-триметиламмония пропан (DSTAP), 1,2-миристоил-3-триметиламмония пропан (DMTAF) и додецилсульфат натрия (SDS). В настоящем изобретении рассматривается применение структурных вариантов и производных катионных липидов, описанных в настоящей заявке.
Некоторые аспекты настоящего изобретения включают нестероидные хиральные катионные липиды, имеющие структуру, представленную следующей формулой:
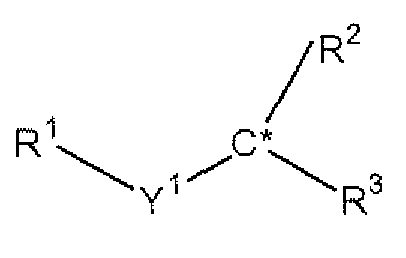 ,
,
где R1 представляет собой четвертичную аммонийную группу, Y1 выбран из углеводородной цепи, сложного эфира, кетона и пептида, C* представляет собой хиральный атом углерода, R2 и R3 независимо выбраны из насыщенной жирной кислоты, ненасыщенной жирной кислоты, углеводорода, связанного сложноэфирной связью, фосфор-диэфиров и их сочетаний. DOTAP, DMTAP, DSTAP, DPTAP, DPEPC, DSEPC, DMEPC, DLEPC, DOEPC, DMKE, DMKD, DOSPA, DOTMA являются примерами липидов, имеющих эту общую структуру.
В одном варианте осуществления хиральные катионные липиды по настоящему изобретению представляют собой липиды, в которых связи между липофильной группой и аминогруппой являются стабильными в водном растворе. Таким образом, отличительной чертой комплексов по настоящему изобретению является их стабильность при хранении (т.е. их способность сохранять небольшой диаметр и сохранение биологической активности на протяжении периода времени после их образования). Такие связи, используемые в катионных липидах, включают амидные связи, сложноэфирные связи, эфирные связи и карбамоильные связи. Специалистам в данной области будет понятно, что липосомы, содержащие более одного вида катионных липидов, могут быть использованы для получения комплексов по настоящему изобретению. Например, липосомы, содержащие два вида катионных липидов, лизил-фосфатидилэтаноламин и сложный эфир β-аланилхолестерина, были описаны для некоторых применений в доставке лекарственных средств [Brunette, E. et al., Nucl. Acids Res., 20:1151 (1992)].
Далее должно быть понятно, что в рассматриваемых хиральных катионных липосомах, подходящих для применения в настоящем изобретении и необязательного смешивания с антигеном, способы по настоящему изобретению не ограничиваются только применением катионных липидов, приведенных выше, а скорее любая липидная композиция может быть использована при условии получения катионной липосомы, и полученная в результате плотность катионного заряда является достаточной для активации и индукции иммунного ответа.
Таким образом, комплексы по изобретению могут содержать другие липиды помимо хиральных катионных липидов. Эти липиды включают, но не только, лизолипиды, примером которых является лизофосфатидилхолин(1-олеоиллизофосфатидилхолин), холестерин, или нейтральные фосфолипиды, в том числе диолеоилфосфатидилэтаноламин (DOPE) или диолеоилфосфатидилхолин (DOPC), а также различные липофильные поверхностно-активные вещества, содержащие группы полиэтиленгликоля, примерами которых являются Tween-80 и PEG-PE.
Комплексы хиральных катионных липидов по настоящему изобретению также могут содержать отрицательно заряженные липиды, а также катионные липиды, при условии, что конечный заряд образованных комплексов является положительным и/или поверхность комплекса является положительно заряженной. Отрицательно заряженные липиды по изобретению представляют собой липиды, содержащие по меньшей мере одну разновидность липидов, имеющих конечный отрицательный заряд в физиологичном рН или близкий к нему, или их сочетания. Подходящие отрицательно заряженные разновидности липидов включают, но не только, CHEMS (холестерилгемисукцинат), NGPE (N-глутарилфосфатидилэтаноламин), фосфатидилглицерин и фосфатидную кислоту или сходный фосфолипидный аналог.
Способы получения липосом, используемых в получении липидсодержащих комплексов для доставки лекарственных средств по настоящему изобретению, известны специалистам в данной области. Обзор методик получения липосом можно найти в Liposome Technology (CFC Press New York 1984); Liposomes by Ostro (Marcel Dekker, 1987); Methods Biochem Anal. 33:337-462 (1988) и патенте США № 5283185. Такие способы включают экструзию замораживания-оттаивания и обработку ультразвуком. Как однослойные липосомы (в среднем менее чем примерно 200 нм в диаметре), так и многослойные липосомы (в среднем примерно более чем 300 нм в диаметре) могут быть использованы в качестве исходных компонентов для получения комплексов по настоящему изобретению.
В катионных липосомах, используемых для получения катионных липидных комплексов по настоящему изобретению, хиральный катионный липид находится в липосоме в концентрации от примерно 10 мол.% до примерно 100 мол.% от общего липосомного липида, или от примерно 20 мол.% до примерно 80 мол.%. Нейтральный липид при включении в липосому может находиться в концентрации от примерно 0 мол.% до примерно 90 мол.% общего липосомного липида, или от примерно 20 мол.% до примерно 80 мол.%, или от 40 мол.% до 80 мол.%. Отрицательно заряженный липид при включении в липосому может находиться в концентрации в интервале от примерно 0 мол.% до примерно 49 мол.% от общего липосомного липида или от примерно 0 мол.% до примерно 40 мол.%. В одном варианте осуществления липосомы содержат хиральный катионный и нейтральный липид в соотношении примерно от 2:8 до примерно 6:4.
Далее понятно, что комплексы по настоящему изобретению могут содержать модифицированные липиды, белок, поликатионы или рецепторные лиганды, которые функционируют в качестве фактора направленной доставки, направляющего комплекс на конкретный тип ткани или клетки. Примеры факторов для направленной доставки включают, но не только, асиалогликопротеин, инсулин, липопротеин низкой плотности (LDL), фолат и моноклональные и поликлональные антитела, направленные против молекул клеточной поверхности. Более того, для модификации циркулирующего периода полужизни комплексов, положительный поверхностный заряд может быть стерически защищен путем включения липофильных поверхностно-активных веществ, которые содержат функциональные группы полиэтиленгликоля.
Катионные липидные комплексы могут храниться в изотоничном растворе сахарозы или декстрозы при получении из градиента сахарозы, или они могут быть лиофилизированы, а затем восстановлены в изотоничном растворе перед применением. В одном варианте осуществления катионные липидные комплексы хранят в растворе. Стабильность катионных липидных комплексов по настоящему изобретению измеряется специфическими анализами для определения физической стабильности и биологической активности катионных липидных комплексов на протяжении периода хранения. Физическая стабильность катионных липидных комплексов измеряют путем определения диаметра и заряда катионных липидных комплексов способами, известными специалистам в данной области, в том числе, например, электронной микроскопией, гельфильтрационной хроматографией или посредством квазиупругого рассеяния света, используя, например, анализатор размера частиц Coulter N4SD, как описано в Примере. Физическая стабильность катионного липидного комплекса является «по существу неизменной» при хранении, когда диаметр сохраняемых катионных липидных комплексов не увеличивается более чем на 100%, или не более чем на 50%, или не более чем на 30%, свыше диаметра катионных липидных комплексов, определенного во время очистки катионных липидных комплексов.
Хотя возможно применять хиральные катионные липиды в чистой или по существу чистой форме, предпочтительно представить их в виде фармацевтической композиции, состава или препарата. Фармацевтические составы с использованием хиральных катионных липидных комплексов по настоящему изобретению могут содержать катионные липидные комплексы в физиологически совместимом стерильном буфере, например, таком как фосфатно-солевой буферный раствор, физиологический раствор или буфер с низкой ионной силой, например ацетатный или Hepes (в качестве примера рН находится в диапазоне от примерно 3,0 до примерно 8,0). Хиральные катионные липидные комплексы могут применяться в виде аэрозолей или в виде липидных растворов для внутриопухолевого, внутриартериального, внутривенного, внутритрахеального, внутрибрюшинного, подкожного или внутримышечного введения.
Составы по настоящему изобретению могут включать любой стабилизатор, известный из уровня техники. Характерными стабилизаторами являются холестерин и другие стеролы, которые могут помочь сделать бислой липосомы более жестким и предотвратить дезинтеграцию или дестабилизацию этого бислоя. Также вещества, такие как полиэтиленгликоль, поли- и моносахариды, могут быть включены в липосому для модификации поверхности липосомы и предохранения ее от дестабилизации вследствие взаимодействия с компонентами крови. Другими иллюстрирующими стабилизаторами являются белки, сахариды, неорганические кислоты или органические кислоты, которые могут быть использованы либо как таковые, либо в смесях.
Ряд фармацевтических способов может быть использован для контроля, модификации или пролонгирования длительности иммунной стимуляции. Препараты с контролируемым высвобождением могут быть получены путем использования полимерных комплексов, таких как сложные полиэфиры, полиаминокислоты, метилцеллюлоза, поливинил, поли(молочная кислота) и гидрогели для инкапсулирования или задержки катионных липидов и медленного их высвобождения. Аналогичные полимеры также могут быть использованы для адсорбции липосом. Липосомы могут содержаться в эмульсионных составах для изменения профиля высвобождения стимулирующего вещества. Альтернативно длительность нахождения стимулирующего вещества в кровотоке может быть увеличена путем покрытия поверхности липосомы соединениями, такими как полиэтиленгликоль или другие полимеры и другие вещества, такие как сахариды, которые способны увеличить время циркуляции или период полужизни липосом и эмульсий.
В тех случаях, когда требуются пероральные препараты, хиральные катионные липиды могут быть объединены с обычными фармацевтическими носителями, известными из уровня техники, такими как, например, сахароза, лактоза, метилцеллюлоза, карбоксиметилцеллюлоза или аравийская камедь, среди прочих. Катионные липиды также могут быть инкапсулированы в капсулы или таблетки для системной доставки.
Введение хирального катионного липида по настоящему изобретению может осуществляться либо с профилактической, либо с терапевтической целью. При введении профилактически катионный липид вводят раньше каких-либо признаков или симптомов заболевания. При введении терапевтически катионный липид вводят во время или после начала болезни. Терапевтическое введение иммуностимулятора служит для ослабления или лечения заболевания. Для обеих целей катионный липид можно вводить с дополнительными терапевтическими средствами (средством) или антигенами (антигеном). При введении катионных липидов с дополнительным терапевтическим средством или антигеном профилактический или терапевтический эффект может быть вызван против конкретного заболевания.
Составы по настоящему изобретению, как для ветеринарного применения, так и для применения у людей, содержат хиральный катионный липид в чистом виде, как описано выше, или в виде смеси R- и S-энантиомеров, или также, необязательно, с одним или несколькими терапевтическими ингредиентами, такими как антиген(ы) или молекула(ы) лекарственного средства. Составы удобно предоставлять в единичной лекарственной форме, и они могут быть получены любым способом, известным в фармацевтической области.
АНТИГЕНЫ
В одном варианте осуществления хиральный катионный липид вводят без каких-либо дополнительных средств для усиления или ослабления различных иммунных реакций, включая продукцию других иммунных модуляторов, и для усиления иммунного ответа для борьбы с заболеванием. В другом варианте осуществления хиральный катионный липид вводят в сочетании с антигеном или антигенами. В этом случае целью является индукция иммунного ответа, который является специфичным в отношении антигена(ов), доставляемых в сочетании с катионным липидом. Индуцируемый ответ может включать продукцию специфических цитотоксических Т-клеток, Т-клеток памяти или В-клеток, приводя в результате к профилактике или терапевтическому ответу на конкретное заболевание, связанное с этим антигеном (антигенами). Антиген может представлять собой любой ассоциированный с опухолью антиген или любой другой антиген, известный специалисту в данной области.
«Ассоциированный с опухолью антиген» в контексте настоящего изобретения представляет собой молекулу или соединение (например, белок, пептид, полипептид, липопротеин, липопептид, гликопротеин, гликопептиды, липид, гликолипид, углевод, РНК и/или ДНК), связанную с опухолевой или злокачественной клеткой, и которая способна вызывать иммунный ответ (гуморальный и/или клеточный) при экспрессии на поверхности антиген-презентирующей клетки применительно к молекуле главного комплекса гистосовместимости («MHC»). Ассоциированные с опухолью антигены включают аутоантигены, а также другие антигены, которые специфически могут быть не связаны со злокачественной опухолью, но тем не менее усиливают иммунный ответ и/или уменьшают рост опухоли или злокачественной клетки при введении животному. Более конкретные варианты осуществления представлены в настоящей заявке.
«Микробный антиген» в контексте настоящего изобретения представляет собой антиген микроорганизма и включает, но не только, инфекционный вирус, инфекционные бактерии, инфекционных паразитов и инфекционные грибы. Микробные антигены могут представлять собой интактные микроорганизмы и природные изоляты, фрагменты или их производные, синтетические соединения, которые идентичны или аналогичны природным микробным антигенам, и предпочтительно индуцируют иммунный ответ, специфичный в отношении соответствующего микроорганизма (из которого происходит природный микробный антиген). В предпочтительном варианте осуществления соединение аналогично природному антигену микроорганизма, если оно индуцирует иммунный ответ (гуморальный и/или клеточный), аналогично природному антигену микроорганизма. Соединения или антигены, которые аналогичны природному антигену микроорганизма, хорошо известны специалистам в данной области, например, такие как белок, пептид, полипептид, липопротеин, липопептид, гликопротеин, гликопептиды, липид, гликолипид, углевод, РНК и/или ДНК. Другим неограничивающим примером соединения, которое является аналогичным природному антигену микроорганизма, является пептид, имитирующий полисахаридный антиген. Более конкретные варианты осуществления представлены в настоящей заявке.
Термин «антиген» дополнительно охватывает пептидные или белковые аналоги известных антигенов или антигенов дикого типа, такие как описано в настоящем описании. Аналоги могут быть более растворимыми или более стабильными, чем антиген дикого типа, а также могут содержать мутации или модификации, которые делают антиген более иммунологически активным. Антиген может быть модифицирован любым образом, таким как добавление липидных или сахарных групп, мутация пептидной или аминокислотной последовательностей, мутация последовательности ДНК или РНК, или любой другой модификацией, известной специалисту в данной области. Антигены могут быть модифицированы с использованием стандартных способов, известных специалисту в данной области.
В композициях и способах по настоящему изобретению также применимы пептиды или белки, аминокислотные последовательности которых гомологичны аминокислотной последовательности желаемого антигена, где гомологичный антиген индуцирует иммунный ответ на соответствующую клетку опухоли, микроорганизма или инфицированную клетку.
В одном варианте осуществления антиген в катионном липидном комплексе содержит антиген, ассоциированный с опухолью или злокачественным новообразованием, т.е. ассоциированный с опухолью антиген, для того чтобы вакцина осуществляла профилактику или лечение опухоли. В связи с этим в одном варианте осуществления вакцины против опухоли или злокачественного новообразования по настоящему изобретению дополнительно содержат по меньшей мере один эпитоп по меньшей мере одного ассоциированного с опухолью антигена. В другом предпочтительном варианте осуществления вакцины против опухоли или злокачественного новообразования по настоящему изобретению дополнительно содержат множество эпитопов из одного или нескольких ассоциированных с опухолью антигенов. Ассоциированные с опухолью антигены, находящие применение в катионных липидных комплексах и способах по настоящему изобретению, по своей природе могут быть иммуногенными, или неиммуногенными, или слабо иммуногенными. Как показано в настоящем описании, даже ассоциированные с опухолью аутоантигены могут быть преимущественно использованы в рассматриваемых вакцинах для терапевтического воздействия, поскольку рассматриваемые композиции способны ослабить иммунологическую толерантность в отношении таких антигенов. Приводимые в качестве примера антигены включают, но не ограничиваются, синтетические, рекомбинантные, чужеродные или гомологичные антигены, и антигенные вещества могут включать, но не только, белки, пептиды, полипептиды, липопротеины, липопептиды, липиды, гликолипиды, углеводы, РНК и ДНК. Примеры таких вакцин включают, но не только, вакцины для лечения или профилактики рака груди, рака тканей головы и шеи, меланомы, рака шейки матки, рака легких, рака предстательной железы, карциномы кишечника или любого другого злокачественного новообразования, известного в данной области, используя катионный липид в комплексе с антигеном(ами), ассоциированными с опухолью. Также возможно получить состав этого антигена с катионным липидом без инкапсулирования его в липосому. Таким образом, хиральные катионные липидные комплексы по настоящему изобретению могут быть использованы в способах для лечения или профилактики злокачественных новообразований. В таком случае иммунизируемому млекопитающему можно вводить инъекцию фармацевтического состава, содержащего липосому с инкапсулированным антигеном (антигенами).
Ассоциированные с опухолью антигены, подходящие для использования в настоящем изобретении, включают как природные, так и модифицированные молекулы, которые могут указывать на один тип опухоли, быть общими для нескольких типов опухолей и/или экспрессироваться или гиперэкспрессироваться только на опухолевых клетках, по сравнению с нормальными клетками. Помимо белков, гликопротеинов, липопротеинов, пептидов и липопептидов, специфичные для опухоли профили экспрессии углеводов, ганглиозидов, гликолипидов и муцинов также были подтверждены документально. Приводимые в качестве примера ассоциированные с опухолью антигены для использования в вакцинах против злокачественных новообразований включают белковые продукты онкогенов, генов-супрессоров опухолевого роста и других генов с мутациями или перестройками, присущими только опухолевым клеткам, продукты реактивированных эмбриональных генов, эмбриональных опухолевых антигенов, тканеспецифичных (но не опухолеспецифичных) антигенов дифференцировки, рецепторов факторов роста, углеводных остатков клеточной поверхности, чужеродных вирусных белков и ряда других собственных белков.
Конкретные варианты ассоциированных с опухолью антигенов включают, например, мутированные или модифицированные антигены, такие как белковые продукты протоонкогенов Ras p21, подавляющих рост опухоли p53 и HER-2/neu и онкогенов BCR-abl, а также CDK4, MUM1, каспазу 8 и бета катенин; гиперэкспрессирующиеся антигены, такие как галектин 4, галектин 9, карбоангидраза, альдолаза A, PRAME, Her2/neu, ErbB-2 и KSA, эмбриональные опухолевые антигены, такие как альфа-фетопротеин (AFP), гонадотропин хориона человека (hCG); аутоантигены, такие как карциноэмбриональный антиген (CEA) и антигены дифференцировки меланоцитов, такие как Mart 1/Melan A, gp100, gp75, тирозиназа, TRP1 и TRF2; антигены, ассоциированные с предстательной железой, такие как PSA, PAP, PSMA, FSM-P1 и PSM-P2; продукты реактивированных эмбриональных генов, такие как MAGE 1, MAGE 3, MAGE 4, GAGE 1, GAGE 2, BAGE, RAGE, и другие антигены рака яичка, такие как NY-ESO1, SSX2 и SCP1; муцины, такие как Muc-1 и Muc-2; ганглиозиды, такие как GM2, GD2 и GD3, нейтральные гликолипиды и гликопротеины, такие как Lewis (y) и globo-H; и гликопротеины, такие как Tn, антиген Томпсона-Фрейденрика (Thompson-Freidenreich) (TF) и sTn. В настоящее описание в качестве антигенов, ассоциированных с опухолью, включены лизаты целых клеток и опухолевых клеток, а также идиотипы иммуноглобулинов, экспрессированные на моноклональных пролиферациях B-лимфоцитов для использования против В-клеточных лимфом.
Ассоциированные с опухолью антигены и их мишени опухолевых клеток включают, например, цитокератины, в частности цитокератин 8, 18 и 19, в качестве антигенов для карциномы. Эпителиальный мембранный антиген (EMA), эмбриональный антиген человека (HEA-125), жировые глобулы женского молока, MBr1, MBr8, Ber-EP4,17-1A, C26 и T16 также являются известными антигенами карцином. Десмин и мышечный актин являются антигенами миогенных сарком. Плацентарная щелочная фосфатаза, бета-гонадотропин хориона человека и альфа-фетопротеин являются антигенами трофобластных опухолей и опухолей зародышевых клеток. Специфический антиген предстательной железы представляет собой антиген карциномы предстательной железы, карциноэмбриональный антиген аденокарцином толстой кишки. HMB-45 представляет собой антиген меланом. При раке шейки матки подходящие антигены могли бы кодироваться вирусом папилломы человека. Хромагранин-A и синаптофизин являются антигенами нейроэндокринных и нейроэктодермальных опухолей. Особый интерес представляют активные опухоли, которые образуют массу солидных опухолей, имеющих области некроза. Лизис таких некротических клеток является богатым источником антигенов для антиген-презентирующих клеток, и, следовательно, предлагаемая терапия может найти эффективное применение в сочетании с традиционной химиотерапией и/или лучевой терапией.
В одном варианте осуществления используют антигены вируса папилломы человека HPV. Специфичным антигеном HPV, который используется в качестве антигена, ассоциированного с опухолью, является HPV подтипа 16 E7. HPV E7 антиген-катионные липидные комплексы являются эффективными в профилактике и лечении рака шейки матки. Кроме того, генно-инженерный белок E7, т.е. белок E7m, обладающий антигенной активностью, но без онкогенной активности, является эффективным ассоциированным с опухолью антигеном. Комплексы E7m-катионный липид индуцируют клеточный иммунитет, чтобы вызвать полную регрессию сформировавшихся опухолей, и, следовательно, применимы в качестве эффективных вакцин против рака шейки матки.
Ассоциированные с опухолью антигены могут быть получены способами, хорошо известными из уровня техники. Например, такие антигены могут быть получены из злокачественных клеток либо путем получения неочищенных экстрактов злокачественных клеток (например, как описано у Cohen et al., Cancer Res., 54:1055 (1994)), путем частично очищенных антигенов, с помощью рекомбинантной технологии или путем синтеза de novo известных антигенов. Антиген также может быть в форме нуклеиновой кислоты, кодирующей антигенный пептид в форме, подходящей для экспрессии у пациента и презентации иммунной системе иммунизированного пациента. Дополнительно антиген может быть полным антигеном или может представлять собой фрагмент полного антигена, содержащий по меньшей мере один эпитоп.
Антигены патогенов, которые, как известно, предрасполагают к возникновению некоторых типов злокачественных опухолей, также могут быть преимущественно включены в вакцины против злокачественных опухолей в соответствии с настоящим изобретением. По оценкам, близко к 16% случаев злокачественных опухолей по всему миру может быть приписано инфекционным патогенам; и ряд распространенных злокачественных новообразований характеризуется экспрессией продуктов специфических вирусных генов. Таким образом, включение одного или нескольких антигенов из патогенов, вовлеченных в возникновение злокачественных опухолей, может помочь расширить иммунный ответ хозяина и усилить профилактическое или терапевтическое действие вакцины против злокачественных опухолей. Патогены, представляющие особый интерес для применения в вакцинах против злокачественных опухолей, представленные в настоящей заявке, включают вирус гепатита В (печеночно-клеточная карцинома), вирус гепатита С (гепатома), вирус Эпштейна-Барр (EBV) (лимфома Беркитта, рак носоглотки, PTLD у пациентов с иммуносупрессией), HTLVL (Т-клеточная лимфома взрослых), онкогенные вирусы папилломы человека типов 16, 18, 33, 45 (рак шейки матки взрослых) и бактерия Helicobacter pylori (B-клеточная лимфома желудка). Другие важные с медицинской точки зрения микроорганизмы, которые могут служить в качестве антигенов у млекопитающих, и более конкретно, у людей, широко описаны в литературе, например, C. G. A Thomas, Medical Microbiology, Bailliere Tindall, Great Britain 1983, полное содержание включено в настоящее описание в качестве ссылки.
В другом варианте осуществления антиген в катионном липидном комплексе содержит антиген, полученный из патогена или ассоциированный с патогеном, т.е. микробный антиген. В связи с этим в одном варианте осуществления патогенные вакцины по настоящему изобретению дополнительно содержат по меньшей мере один эпитоп по меньшей мере одного микробного антигена. Патогены, на которые могут быть направлены рассматриваемые вакцины, включают, но не только, вирусы, бактерии, паразитов и грибы. В другом варианте осуществления патогенные вакцины по настоящему изобретению дополнительно содержат эпитопы из одного или нескольких микробных антигенов.
Микробные антигены, находящие применение в катионных липидных комплексах и способах, по природе могут быть иммуногенными, или неиммуногенными, или слабо иммуногенными. Приводимые в качестве примера антигены включают, но не только, синтетические, рекомбинантные, чужеродные или гомологичные антигены, и антигенные вещества могут включать, но не только, белки, пептиды, полипептиды, липопротеины, липопептиды, липиды, гликолипиды, углеводы, РНК и ДНК.
Приводимые в качестве примера вирусные патогены включают, но не только, вирусы, которые инифируют млекопитающих и, более конкретно, людей. Примеры вирусов включают, но не только: Retroviridae (например, вирусы иммунодефицита человека), такие как HIV-1 (также называемый HTLV-III, LAV, или HTLV-III/LAV, или HIV-III; и другие изоляты, такие как HIV-LP; Picornaviridae (например, вирусы полиомиелита, вирус гепатита A; энтеровирусы, вирусы Коксаки человека, риновирусы, ЕСНО-вирусы); Calciviridae (например, штаммы, которые вызывают гастроэнтерит); Togaviridae (например, вирусы энцефалита лошадей, вирусы краснухи); Flaviridae (например, вирусы денге, вирусы энцефалита, вирусы желтой лихорадки); Coronoviridae (например, коронавирусы); Rhabdoviradae (например, вирусы везикулярного стоматита, вирусы бешенства); Coronaviridae (например, коронавирусы); Rhabdoviridae (например, вирусы везикулярного стоматита, вирусы бешенства); Filoviridae (например, вирусы эбола); Paramyxoviridae (например, вирусы парагриппа, вирус паротита, вирус кори, респираторно-синцитиальный вирус); Orthomyxoviridae (например, вирусы гриппа); Bungaviridae (например, хантавирусы, бунгавирусы, флебовирусы и найровирусы); Arena viridae (вирусы геморрагической лихорадки); Reoviridae (например, реовирусы, орбивирусы и ротавирусы); Birnaviridae; Hepadnaviridae (вирус гепатита B); Parvoviridae (парвовирусы); Papovaviridae (вирусы папилломы, вирусы полиомы); Adenoviridae (большинство аденовирусов); Herpesviridae вирус простого герпеса (HSV) 1 и 2, вирус варицелла зостер, цитомегаловирус (CMV), вирус герпеса; Poxyviridae (вирусы оспы, вирусы коровьей оспы, поксвирусы); и Iridoviridae (например, вирус африканской лихорадки свиней); и неклассифицированные вирусы (например, этиологические агенты губчатого энцефалита, возбудитель гепатита дельта (предположительно является неполным сателлитом вируса гепатита В), возбудители гепатита ни А, ни В (класс 1 = передаваемое внутренне; класс 2 = передаваемое парентерально (т.е. гепатит C); вирусы Norwalk и родственные вирусы и астровирусы).
Также грамотрицательные и грамположительные бактерии могут быть мишенями рассматриваемых композиций и способов у позвоночных животных. Такие грамположительные бактерии включают, но не только, виды Pasteurella, виды Staphylococci и виды Streptococcus. Грамотрицательные бактерии включают, но не только, Escherichia coli, виды Pseudomonas и виды Salmonella. Конкретные примеры инфекционных бактерий включают, но не только: Helicobacter pyloris, Borella burgdorferi, Legionella pneumophilia, Mycobacteria sps (например, M. tuberculosis, M. avium, M. intracellulare, M. kansaii, M. gordonae), Staphylococcus aureus, Neisseria gonorrhoeae, Neisseria meningitidis, Listeria monocytogenes, Streptococcus pyogenes (Streptococcus группы А), Streptococcus agalactiae (Streptococcus группы B), Streptococcus (группа вириданс), Streptococcus faecalis, Streptococcus bovis, Streptococcus (анаэробные виды), Streptococcus pneumoniae, патогенные Campylobacter sp., Enterococcus sp., Haemophilus infuenzae, Bacillus antracis, corynebacterium diphtheriae, coiynebacterium sp., Erysipelothrix rhusiopathiae, Clostridium perfringers, Clostridium tetani, Enterobacter aerogenes, Klebsiella pneumoniae, Pasturella multocida, Bacteroides sp., Fusobacterium nucleatum, Streptobacillus moniliformis, Treponema pallidium, Treponema pertenue, Leptospira, Rickettsia и Actinomyces israelii.
Полипептиды бактериальных патогенов, которые могут найти применение в качестве источников микробных антигенов в рассматриваемых композициях, включают, но не только, железозависимый наружный белок мембраны («IROMP2), наружный белок мембраны («OMP») и A-белок Aeromonis salmonicida, который вызывает фурункулез, белок p57 Renibacterium salmoninarum, который вызывает бактериальное заболевание почек («BKD»), основной антиген, связанный с поверхностью («msa»), поверхностно экспрессируемый цитотоксин («mpr»), поверхностно экспрессируемый гемолизин («ish») и флагеллярный антиген Yersiniosis; внеклеточный белок («ECP»), железозависимый наружный белок мембраны («IROMP»), структурный белок Pasteurellosis; OMP и флагеллярный белок Vibrosis anguillarum и V. ordalii; флагеллярный белок, OMP белок, aroA и purA Edwardsiellosis ictaluri и E. tarda; и поверхностный антиген Ichthyophthirius; и структурный и регуляторный белок Cytophaga columnari; и структурный и регуляторный белок Rickettsia. Такие антигены могут быть выделены или получены рекомбинантно или любым другим способом, известным из уровня техники.
Примеры патогенов дополнительно включают, но не только, грибы, которые инфицируют млекопитающих и, более конкретно, людей. Примеры грибов включают, но не только: Cryptococcus neoformans, Histoplasma capsulatum, Coccidioides immitis, Blastomyces dermatitidis, Chlamydia trachomatis и Candida albicans. Примеры инфекционных паразитов включают Plasmodium, такие как Plasmodium falciparum, Plasmodium malariae, Plasmodium ovale и Plasmodium vivax. Другие инфекционные организмы (т.е. одноклеточные организмы) включают Toxoplasma gondii. Полипептиды паразитарного патогена включают, но не только, поверхностные антигены Ichthyophthirius.
Другие важные с медицинской точки зрения микроорганизмы, которые служат в качестве антигенов у млекопитающих и, более конкретно, у людей, широко описаны в литературе (например, см. C. G. A Thomas, Medical Microbiology, Bailliere Tindall, Great Britain, 1983). Помимо лечения инфекционных заболеваний человека и патогенов человека композиции и способы по настоящему изобретению применимы для лечения инфекций у млекопитающих, не являющихся человеком. Многие вакцины для лечения млекопитающих, не являющихся человеком, описаны у Bennett, K. Compendium of Veterinary Products, 3rd ed. North American Compendiums, Inc., 1995; см. также WO 02/069369, описание которых специально включено в настоящую заявку в качестве ссылки в полном объеме.
Приводимые в качестве примера патогены, не относящиеся к людям, включают, но не только, вирус опухоли молочной железы мышей («MMTV»), вирус саркомы Рауса («RSV»), вирус лейкоза птиц («ALV»), вирус миелобластоза птиц («AMV»), вирус лейкоза мышей («MLV»), вирус лейкоза кошек («FeLV»), вирус саркомы мышей («MSV»), вирус лейкоза гиббонов («GALV»), вирус некроза селезенки («SNV»), вирус ретикулоэндотелиоза («RV»), вирус саркомы обезьян («SSV»), вирус обезьян Мейзена-Пфайзера (Mason-Pfizer) («MPMV»), ретровирус обезьян 1 типа («SRV-1»), лентивирусы, такие как HIV-1, HIV-2, SIV, вирус Visna, вирус иммунодефицита кошек («FIV») и вирус инфекционной анемии у лошадей («EIAV»), вирусы Т-клеточного лейкоза, такие как HTLV-I, HTLV-II, вирусы Т-клеточного лейкоза обезьян («STLV») и вирус лейкоза коров («BLV»), и пенистые вирусы, такие как пенистые вирусы человека («HFV»), пенистые вирусы обезьян («SFV») и пенистые вирусы крупного рогатого скота («BFV»).
В некоторых вариантах осуществления «лечебное воздействие», «терапия» и «лечение» в контексте настоящего изобретения в отношении инфекционных патогенов относится к профилактическому воздействию, которое повышает резистентность пациента к заражению патогеном или снижает вероятность того, что пациент будет инфицирован этим патогеном; и/или лечебному воздействию после инфицирования пациента для борьбы с инфекцией, например уменьшение или устранение инфекции или профилактика осложнений.
Микробные антигены могут быть получены способами, хорошо известными из уровня техники. Например, эти антигены могут быть получены непосредственно из вирусных и бактериальных клеток либо путем получения неочищенных экстрактов, путем частичной очистки антигенов, либо альтернативно с помощью рекомбинантной технологии или синтезом de novo известных антигенов. Антиген также может быть в форме нуклеиновой кислоты, кодирующей антигенный пептид в форме, подходящей для экспрессии у пациента и презентации иммунной системе иммунизированного пациента. Далее, антиген может быть полным антигеном или может представлять собой фрагмент полного антигена, содержащий по меньшей мере один эпитоп.
Для улучшения включения антигена в хиральные катионные липидные везикулы, а также для улучшения доставки к клеткам иммунной системы, антиген может быть конъюгирован с липидной цепью для улучшения его растворимости в гидрофобных ацильных цепях катионного липида, при сохранении антигенных свойств молекулы. Липидированный антиген может представлять собой липопротеин или липопептид и их сочетания. Липидированный антиген может иметь линкер, конъюгированный между липидом и антигеном, например, такой как N-концевой α- или ε-пальмитоил лизин может быть соединен с антигеном через дипептидный линкер Ser-Ser. В заявке США № 12/049957 описано, что комплекс DOTAP/E7-липопептид ингибировал повышенный функциональный антиген-специфичный ответ CD8+ Т-лимфоцитов in vivo по сравнению с композицией DOTAP/E7 и, следовательно, обеспечивал превосходную противоопухолевую эффективность.
Настоящее изобретение далее будет понятно в свете следующего примера.
ПРИМЕР
ЭФФЕКТИВНАЯ СТИМУЛЯЦИЯ ИММУННОЙ СИСТЕМЫ ЭНАНТИОМЕРАМИ КАТИОННЫХ ЛИПИДОВ
1. Клеточные линии и пептиды
Клетки TC-1 представляют собой эндотелиальные клетки легких мышей C57BL/6, которые трансформированы онкогенами HPV16 E6 и E7 и активированы H-ras. Клетки выращивают в среде RPMI (коммерчески доступна от Invitrogen of Carlsbad, CA), дополненной 10% эмбриональной сывороткой теленка и 100 Ед./мл пенициллина и 100 мг/мл стрептомицина. MHC класса I рестриктированный белок из белка HPV 16 E7 (аминокислоты с 11 по 20, YMLDLQPETT [SEQ ID NO:1]) синтезирован в университете University of Pittsburgh Peptide Synthesis Facility с помощью твердофазного синтеза с использованием пептидного синтезатора Advanced CliemTech model 200 и очищен с помощью ВЭЖХ.
2. Получение комплексов липид/антиген и определение физических свойств
Энантиомеры DOTAP поставляют Merck AG (EPROVA), Switzerland. Все остальные липиды приобретают у Avanti Polar Lipids (Alabaster, AL). Небольшие однослойные липосомы DOTAP получают путем тонкослойной гидратации с последующей экструзией. Этот липид, в хлороформе, сушат в виде тонкого слоя в потоке азота в стеклянной пробирке. Тонкую пленку высушивают вакуумом в течение 2-3 ч, а затем регидрируют в воде для клеточных культур (коммерчески доступна от Cambrex of Walkersville, MD) или буфере (такие буферы хорошо известны специалистам в данной области), содержащей пептид E7, до конечной концентрации 0,7 мг липидов и 0,1 мг E7 на мл (молярное соотношение - 11:1). Липидную дисперсию последовательно экструдируют через поликарбонатные мембраны с размером пор 0,4, 0,2 и 0,1 мкм. Незахваченный пептид не удаляют. Липосомы хранили при 4°C до применения. Соединение пептида E7 с липосомой определяют путем измерения процентного соотношения пептида, связанного с липосомой. Вкратце, несвязанный пептид E7 из комплексов R-DOTAP/E7, S-DOTAP/E7 или RS-DOTAP/E7 отделяют с использованием Microcon® центрифужного фильтровального устройства (Millipore, Bedford, MA) и концентрацию несвязанного пептида измеряют с помощью набора Micro BCA™ Protein Assay Kit (Pierce, Rockford, IL). Эффективность соединения пептида определяют как процент несвязанного пептида. Также могут быть использованы другие способы, в основном используемые в получении липосом, которые хорошо известны специалистам в данной области.
3. Статистический анализ
Данные представлены как среднее ± SD (стандартное отклонение) по меньшей мере 3 независимых экспериментов. Двусторонние критерии Стьюдента используют для оценки статистической значимости для разности между средними. Значимость была установлена при p<0,05.
4. Отдельные R- и S-энантиомеры комплексов катионного липида/E7 активируют дендритные клетки человека аналогично рацемической смеси DOATP
Катионные липосомы получают, как описано выше. Антиген E7, используемый в этой композиции, представляет собой идентифицированный пептид человека E7, рестриктированный HLA-A*0201 [HPV-16 E7, аминокислоты 11-20, YMLDLQPETT (SEQ ID NO:1)]. Этот пептид синтезирован в университете University of Pittsburgh, Molecular Medicine Institute, Pittsburgh, PA. Дендритные клетки человека HLA-A2 получают от Lonza (Walkersville, MD). Замороженные криопробирки размораживают и дендритные клетки культивируют в среде LGM-3 (коммерчески доступна от Lonza of Walkersville, M.D), дополненной 50 микрограммами на мл IL-4 и GM-CSF, при 37°С и 5% CO2 при начальной плотности высевания 125000 клеток/см2 в 2 мл среды в 12-луночные планшеты для тканевых культур. Клетки выращиваются в течение 3 дней в культуре и видны в виде смеси адгезивных и округлых клеток при микроскопическом исследовании.
Клетки обрабатывают на 3 день свежей дозой 50 микрограмм на мл IL-4 и GM-CSF (все лунки), и тестируемые лунки обрабатывают либо смесью интерлейкина 1-бета («IL-β»), интерлейкина 6 («IL-6») и TNF-α в концентрации 10 мкг/мл, либо простагландином Е2 (PGE-2) при 10 мг/мл (положительный контроль для активации), не обрабатывают (отрицательный контроль активации), и S-DOTAP/E7 в конечных концентрациях 2,5, 10 и 40 микромоль, и R-DOTAP/E7 в конечных концентрациях 2,5, 10 и 40 микромоль. Обработанные дендритные клетки поддерживают в культуре в течение 24 часов и собирают для окрашивания маркера клеточной поверхности и проточной цитометрии. Собранные клетки подсчитывают с помощью гемоцитометра и 10 мкл следующих конъюгатов антител добавляют последовательно к каждому образцу для мечения поверхностных маркеров: CD80-FITC, CD83-APC и CD86-PE (BD Biosciences). Клетки с меченой поверхностью впоследствии анализируют с помощью проточной цитометрии, используя проточный цитометр BD FACxcaliber, и подвергают мониторингу костимулирующие маркерные молекулы дендритных клеток CD80, CD83 и CD86, которые продуцируются при активации. Как видно на фигурах 2, 3 и 4, первичные дендритные клетки человека, обработанные обоими энантиомерами комплекса катионный липид/E7, активируют экспрессию всех трех костимулирующих маркеров активации дендритных клеток, оцениваемых и необходимых для успешной презентации антигена Т-клеткам, аналогично наблюдаемому с рацемической смесью (RS-DOTAP) катионного липида и изложенному в заявке США № 12/049957, переданной правоприемнику настоящей заявки.
5. Комплексы катионный липид/E7, состоящие из отдельных R- и S-энантиомеров, демонстрируют различные эффективности в активации дендритных клеток человека в отношении индукции продукции хемокинов и цитокинов
Дендритные клетки человека HLA-A2 (Lonza, Walkersville, MD) обрабатывают и выращивают в культуре, как описано выше. На 3 день клетки обрабатывают 40 микромолярным комплексом DOTAP/E7 или мощным иммуностимулирующим липополисахаридом (LPS) в 50 микромолярных концентрациях (положительный контроль). Среду из анализируемых лунок удаляют и центрифугируют при 1300 об./мин в микроцентрифуге в течение 5 минут для осаждения неприкрепившихся дендритных клеток. Супернатанты удаляют и обрабатывают 10 микролитрами на мл смесью ингибиторов протеаз набор I Calbiochem (La Jolla, CA) (кат. № 539131) и хранят замороженными до анализа. Образцы анализируют на экспрессию хемокинов и цитокинов с помощью анализа Searchlight Protein Array Multiplex ELISA [Pierce Biotechnology (Woburn, MA)].
Оценивают продукцию выбранных цитокинов, которые, как известно, являются необходимыми для клеточного иммунного ответа, CCL3, CCL4, CCL5 и CCL19, и оценивают продукцию IL-2, IL-8 и IL-12 (фиг. 5-11, которые иллюстрируют способность R-DOTAP/E7 и S-DOTAP/E7 индуцировать продукцию CCL3, CCL4, CCL5, CCL19, IL-2, IL-8 и lL-12). Эти фигуры иллюстрируют, что комплекс DOTAP/E7, содержащий отдельные энантиомеры DOTAP, индуцирует продукцию цитокинов и хемокинов дендритными клетками человека. Оба энантиомера, однако, активируют иммунную систему в различной степени, при этом R-энантиомер демонстрирует более высокую эффективность.
6. Кинетика роста TC-1 HPV-позитивной опухоли у мышей, обработанных композициями DOTAP/E7 в различных дозах рацемических смесей DOTAP
Как представлено на фиг. 12, мышам подкожно вводят клетки TC-1 в 0 день для индукции роста HPV-позитивных опухолей. Композиции DOTAP/E7 содержат рацемические смеси DOTAP. Мышам вводят композиции DOTAP/E7, содержащие 10 мкг пептида E7, подкожно с другой стороны живота на 6 день. Концентрация липида DOTAP в комплексе варьирует от 3 до 600 нмоль (3, 15, 30, 75, 150, 300 и 600 нмоль). Низкая доза DOTAP (15 нмоль) показывает частичное ингибирующее действие на опухоль (P<0,05) по сравнению с необработанным контролем на 23 день, тогда как DOTAP в концентрации 30, 150 или 300 нмоль демонстрирует повышенную эффективность (P<0,01). DOTAP в концентрации 75 нмоль продемонстрировал наиболее значительное воздействие на регрессию опухоли (P<0,001). Еще раз, мыши, которым вводят высокую дозу DOTAP (600 нмоль), не демонстрируют противоопухолевой активности, что подтверждает, что липосомы DOTAP в высокой дозе могут индуцировать отрицательную регуляцию иммунного ответа. Кроме того, липосомы DOTAP в дозе 100 нмоль, но без пептида E7, не демонстрируют значительного ингибирования опухолевого роста, указывая на то, что противоопухолевое действие было антигенспецифичным. Далее, липосомы 1,2-диолеоил-sn-глицеро-3-фосфоглицерола (DOPG), анионный липид, вводимый в дозе 150 нмоль с антигеном, значительно не ингибирует рост опухоли.
7. Кинетика роста TC-1 HPV-позитивной опухоли у мышей, обработанных композициями R-DOTAP/E7 и S-DOTAP в различных дозах R- и S-DOTAP
Как представлено на фиг. 13 и 14, мышам подкожно вводят клетки TC-1 в 0 день для индукции роста HPV-позитивных опухолей. Мышам вводят композиции R- и S-DOTAP/E7, содержащие 20 мкг пептида E7, подкожно с другой стороны живота на 6 день. Концентрации липида R- или S-DOTAP в комплексе варьируют от 3 до 600 нмоль (3, 15, 30, 75, 100, 125, 150, 300 и 600 нмоль). В отличие от рацемической смеси DOTAP (фиг. 12), комплексы S-DOTAP не демонстрируют способности ингибировать рост опухоли, и регрессии опухоли не наблюдают (фиг. 13). Однако наблюдают эффект доза-ответ, и дозы S-DOTAP 600 нмоль вызывают самый медленный рост опухоли (P<0,05) по сравнению с необработанным контролем на 23 день. Обращаясь к фиг. 14, противоопухолевое действие комплексов, содержащих R-DOTAP и антиген, сходно с эффектом, наблюдаемым в рацемических смесях (фиг. 12). Дозы 75-150 нмоль R-DOTAP демонстрируют частичный ингибирующий опухоль эффект (P<0,001) по сравнению с необработанным контролем на 23 день, тогда как R-DOTAP в концентрации 300 нмоль демонстрирует наиболее значительную эффективность в опухолевой регрессии (P<0,0001). Еще раз, мыши, которым вводят высокую дозу R-DOTAP (600 нмоль), не демонстрируют значительной противоопухолевой активности, подтверждая то, что липосомы R-DOTAP в высокой дозе могут индуцировать отрицательную регуляцию иммунного ответа. Отдельно пептид E7 не демонстрирует какого-либо ингибирования роста опухоли (не показано). На фиг. 15 представлены кривые «доза липида-ответ» в отношении эффективности опухолевой регрессии различных катионный липид/E7 антигенных комплексов DOTAP, S-DOTAP и R-DOTAP в концентрации 20 мкг антигена и DOTAP в концентрации 10 мкг антигена.
8. Индукция пролиферации Т-клеток под действием композиций S-DOTAP и R-DOTAP
Ранее было продемонстрировано в предварительной заявке США № 60/983799, переданной правоприемнику настоящего изобретения, что DOTAP/E7 взаимодействует непосредственно с Т-лимфоцитами человека, приводя к клональной экспансии и активации Т-клеток. В этих исследованиях изучают способность рацемических смесей DOTAP стимулировать клональную экспансию Т-клеток. В этих исследованиях обогащенные лимфоциты человека, полученные от HLA-A2+ здорового донора, стимулируют непосредственно средой, только DOTAP, только пептидом или DOTAP/hE7. Стимуляцию повторяют три раза с интервалом 7 дней. Через три дня после третьей стимуляции лимфоциты, обработанные DOTAP или D0TAP/E7, демонстрируют широкую экспансию Т-клеточных клонов в культуре в отличие от отсутствия клональной экспансии в контрольной среде. Распространившиеся Т-клетки также демонстрируют значительную CTL активность.
В этих исследованиях DOTAP-опосредованная активация Т-клеток дополнительно подтверждается ERK фосфорилированием в Т-клетках. Также наблюдают DOTAP-индуцированную экспрессию костимулирующей молекулы, CD86 на Т-лимфоцитах человека. Эти результаты дали возможность предположить, что DOTAP оказывает непосредственное воздействие на Т-клеточную активацию через опосредованную MAP киназой пролиферацию клеток.
В настоящих исследованиях изучали индукцию пролиферации Т-клеток человека под действием R- и S-энантиомеров DOTAP и подтверждали, используя очищенные Т-клетки, полученные от Lonza, MA. R-DOTAP индуцировал большую Т-клеточную пролиферацию, чем S-DOTAP, и был аналогичен по активности рацемической смеси DOTAP.
ОБСУЖДЕНИЕ
Как описано в патенте США № 7303881, широкий класс катионных липидов может действовать в качестве эффективных иммуностимуляторов вместе с антигеном для формирования антиген-специфичных иммунных ответов при лечении заболевания. Например, в патенте США № 7303881 описывается, что липосомы, содержащие катионные липиды, активируют дендритные клетки, как показано стимуляцией катионными липидами экспресии костимулирующих молекул CD80/CD86 на дендритных клетках DC2.4 (фиг. 14A и 14B). Как показано на фиг. 14А патента США № 7303881, способность стимулировать экспрессию CD80/CD86 на клетках DC2.4 под действием различных катионных липосом сильно варьирует. Липофектамин.RTM., 3:1 (масс./масс.) липосомная композиция поликатионного липида 2,3-диолеилокси-N-[2(сперминкарбоксамидо)этил]-N,N-диметил-1-пропанаминия трифторацетат (DOSPA) и нейтрального липида диолеоил фосфатидилэтаноламина (DOPE), и липосомы, полученные из О,О'-димиристил-N-лизил аспартата (DMKE) и О,О'-димиристил-N-лизил-глутамата (DMKD), сильно стимулировали экспрессию CD80/CD86 клетками CD2.4.
Как дополнительно описано в патенте США № 7303881, способность различных катионных липидов стимулировать экспрессию CD80 на клетках DC2.4 варьировала. Как гидрофильная голова, так и липофильный хвост липидов оказывают существенное воздействие на эту способность. Например, липиды DXEPC с концевыми группами этилфосфохолина (EPC) в основном, по-видимому, являются более эффективными, чем липиды DXTAP с концевой группой триметиламмония пропаном (TAP). Среди липидов, несущих одну конкретную структуру концевой группы, липиды с более короткими (1,2-дилауроил-sn-глицеро-3-этилфосфохолин (DLEPC-12:0), 1,2-димиристоил-sn-глицеро-3-этилфосфохолин (DMEPC-14:0)) или ненасыщенными (1,2-диолеоил-sn-глицеро-3-этилфосфохолин (DOEPC-18:1)) ацильными цепями, по-видимому, являются более эффективными, чем с более длинными (1,2-дипальмитоил-sn-глицеро-3-этилфосфохолин (DPEPC-16:0)), или насыщенными (1,2-дистеароил-sn-глицеро-3-этилфосфохолин (DSEPC-16:0)) ацильными цепями. Эти данные, однако, показали, что многочисленные катионные липиды были способны стимулировать активацию дендритных клеток. Исследования, о которых сообщается в заявке США № 12/049957, освещают механизм, посредством которого катионные липиды действуют в качестве иммуномодуляторов.
Данные из представленных выше исследований привели к наблюдению того, что катионные липиды не только являются эффективными средствами направления и доставки антигенов к APC иммунной системы, а также функционируют как эффективные адъюванты в композициях в диапазонах низких доз для непосредственного воздействия на функцию иммунной системы через активацию зависимых от MAP киназы путей передачи сигнала с продукцией в результате иммунной системой регуляторных молекул, в том числе цитокинов и хемокинов. Было продемонстрировано четкое дозозависимое воздействие катионного липида на иммуностимулирующие способности композиций. Было показано, что при введении комплекса липид/антиген частицы в основном поглощались дендритными клетками, главными профессиональными антиген-презентирующими клетками. Инициация активации и миграции дендритных клеток к дренирующему лимфоузлу, как показано, способствует иммунным ответам на антиген-специфичные TC-1 опухоли. Функциональные CD8+ T-лимфоциты продуцировались у мышей при введении DOTAP/E7, и уменьшались размеры опухоли, и демонстрировался усиленный апоптоз вследствие повышения числа инфильтрирующих Т-клеток в микроокружении опухоли. Полученная в результате колоколообразная (активность снижается выше и ниже оптимальной дозы) кривая «доза катионного липида-ответ» демонстрировала активность в очень низких дозах, указывая на то, что активность катионных липидов в качестве адъювантов или иммуностимуляторов является такой мощной, что EC50 настолько мала, что составляет примерно 15 нмоль на инъекцию. Высокие дозы катионных липидов устраняют иммуностимулирующую активность. Авторы изобретения также показали, что в тех случаях, когда антиген, например, такой как овальбумин, включен в катионные липосомы и введен в единой подкожной инъекции, продуцируются эффективные антитела против этого антигена. Катионные липосомы также могут индуцировать экспрессию костимулирующих молекул CD80 и CD83 и активировать дендритные клетки человека. Очевидно, что в оптимальной дозе композиции катионные липиды и комплексы катионный липид/антиген помимо эффективной доставки к дендритным клеткам являются мощными активаторами иммунной системы и обеспечивают простые, безопасные и очень эффективные иммунотерапевтические средства, применимые в профилактике и лечении заболеваний.
Основываясь на понимании механизма иммуностимуляции, дополнительные исследования проводились для оценки эффекта хиральности у катионных липидов и иммуностимулирующей способности катионных липидов. Для этого эффекта использовали чистые синтезированные R- и S-энантиомеры DOTAP и сравнивали с обычно используемой рацемической смесью. Было показано, что как R-, так и S-энантиомеры DOTAP обладают способностью, сходной с рацемическим DOTAP, в отношении активации и созревания дендритных клеток. Все три липида индуцировали экспрессию дендритными клетками костимулирующих молекул CD80, CD83 и CD86.
Важной характеристикой иммуностимулятора, способного индуцировать клеточные иммунные ответы на заболевание, является его способность индуцировать продукцию крайне важных хемокинов и цитокинов. Как представлено в примере, наблюдались существенные различия между R- и S-энантиомерами DOTAP в их способности индуцировать продукцию хемокинов и цитокинов. Наблюдалось, что R-DOTAP является более эффективным иммунным активатором, чем S-DOTAP. Во всех случаях эффективность R-DOTAP была эквивалентна или превышала эффективность рацемической смеси DOTAP.
Для того чтобы определить, переносится ли эффективность in vitro в индукции цитокинов на терапевтическую эффективность in vivo, три композиции, R-DOTAP/E7, S-DOTAP/E7 и DOTAP/E7 (рацемическую смесь), оценивали на их способность уничтожать HPV-E7 позитивные опухоли у мышей с опухолями. Каждую композицию оценивали в многократных дозах липидов. Как показано на фиг. 12-15, обе композиции, содержащие как R-DOTAP, так и DOTAP, демонстрировали колоколообразную зависимость ответа от дозы липида с сильной E7 специфичной активностью, приводящей к регрессии опухоли в особых диапазонах оптимальной дозы. Композиции, содержащие S-DOTAP, не индуцировали регрессию опухоли в каких-либо наблюдаемых условиях, хотя композиции с высоким содержанием липидов показали рост опухоли.
Таким образом, подтверждается, что R-энантиомер DOTAP отвечает за большинство наблюдаемых адъювантных эффектов DOTAP. Однако оба энантиомера являются мощными активаторами дендритных клеток, приводящими к созреванию.
Исследования, представленные выше, идентифицируют особые уникальные композиции и применения катионных липидов, состоящих из хиральных липидов или смесей хиральных липидов, которые могут быть использованы для разработки простых, экономически выгодных и столь необходимых иммунотерапевтических средств для лечения некоторых инвалидизирующих заболеваний.
Поскольку могли быть сделаны различные изменения в описанных выше аспектах и приводимых в качестве примера вариантах осуществления без отклонения от объема настоящего изобретения, это означает, что все сведения, содержащиеся в представленном выше описании, следует интерпретировать как иллюстрирующие, а не ограничивающие. С этой целью, хотя в примерах главным образом рассматриваются энантиомеры катионного липида DOTAP, специалистам в данной области будет понятно, что эти катионные липиды приведены просто в качестве примера и что способы и механизмы применимы к другим катионным липидам.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИННЫЕ КОМПОЗИЦИИ С КАТИОННЫМИ ЛИПИДАМИ И СПОСОБЫ ПРИМЕНЕНИЯ | 2013 |
|
RU2649365C2 |
| ПРИМЕНЕНИЕ МОНОМИКОЛИЛГЛИЦЕРИНА (MMG) В КАЧЕСТВЕ АДЪЮВАНТА | 2008 |
|
RU2479317C2 |
| СФИНГОИДНЫЕ ПОЛИАЛКИЛАМИНОВЫЕ КОНЪЮГАТЫ ДЛЯ ВАКЦИНАЦИИ | 2004 |
|
RU2361577C2 |
| СТАБИЛЬНЫЕ СОСТАВЫ ЛИПИДОВ И ЛИПОСОМ | 2015 |
|
RU2738060C2 |
| КОМПОЗИЦИИ ЛИПИДНЫХ ВЕЗИКУЛ И СПОСОБЫ ПРИМЕНЕНИЯ | 2011 |
|
RU2595872C2 |
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ И СПОСОБ РАЗРАБОТКИ ВАКЦИНЫ, ОСНОВАННОЙ НА СЛИТОМ БЕЛКЕ | 2004 |
|
RU2407749C2 |
| ИММУНОСТИМУЛИРУЮЩИЕ G, U-СОДЕРЖАЩИЕ ОЛИГОРИБОНУКЛЕОТИДЫ | 2003 |
|
RU2302865C2 |
| МОДУЛЬНЫЕ ЧАСТИЦЫ ДЛЯ ИММУНОТЕРАПИИ | 2014 |
|
RU2672055C2 |
| КОМБИНАЦИЯ ПРОТИВОРАКОВОЙ РНК-ВАКЦИНЫ И ИНГИБИТОРА ПУТИ PD-1 И ЕЕ ПРИМЕНЕНИЕ | 2014 |
|
RU2718988C2 |
| ЭМУЛЬСИИ ТИПА "МАСЛО В ВОДЕ", КОТОРЫЕ СОДЕРЖАТ НУКЛЕИНОВЫЕ КИСЛОТЫ | 2012 |
|
RU2606846C2 |

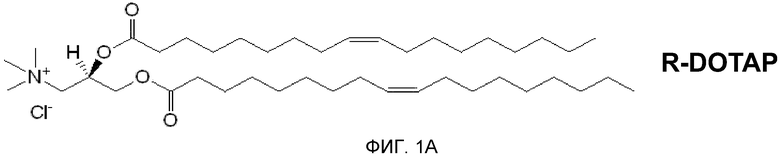
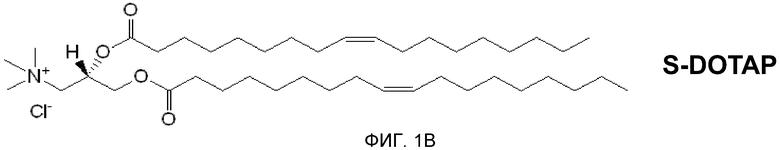
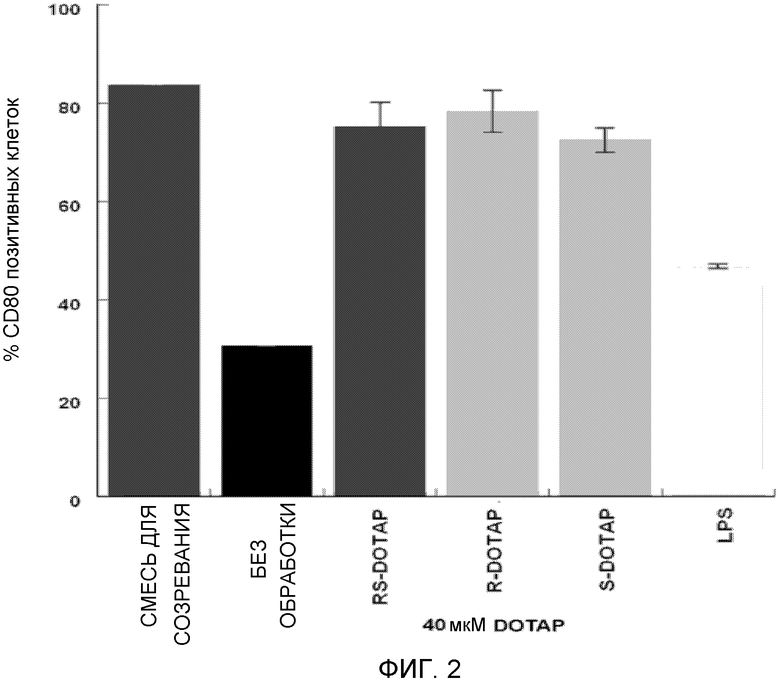
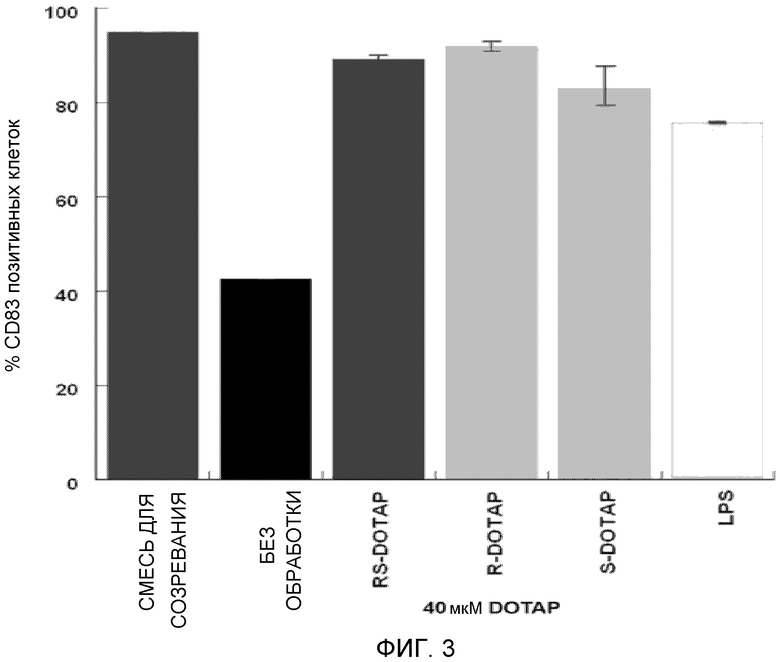
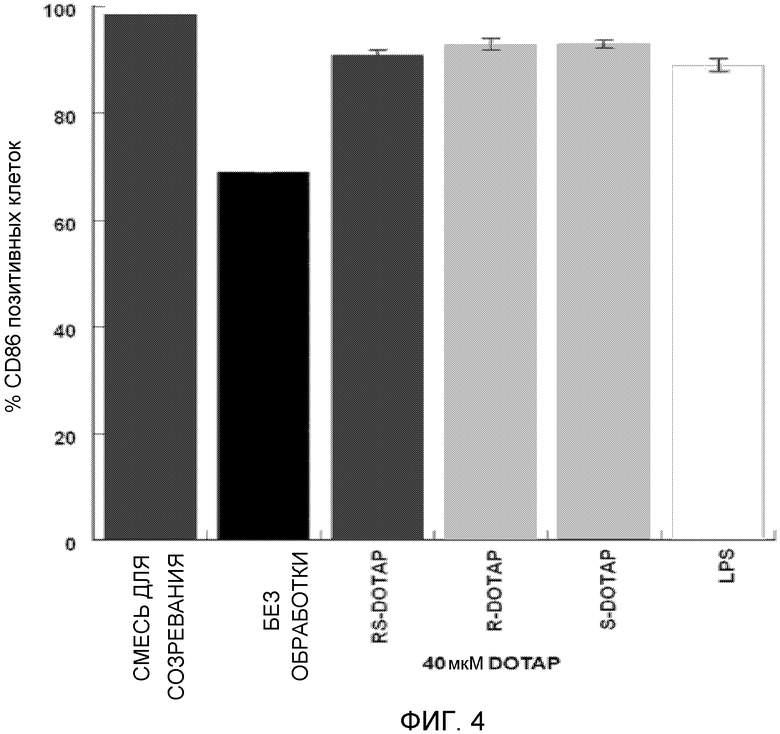
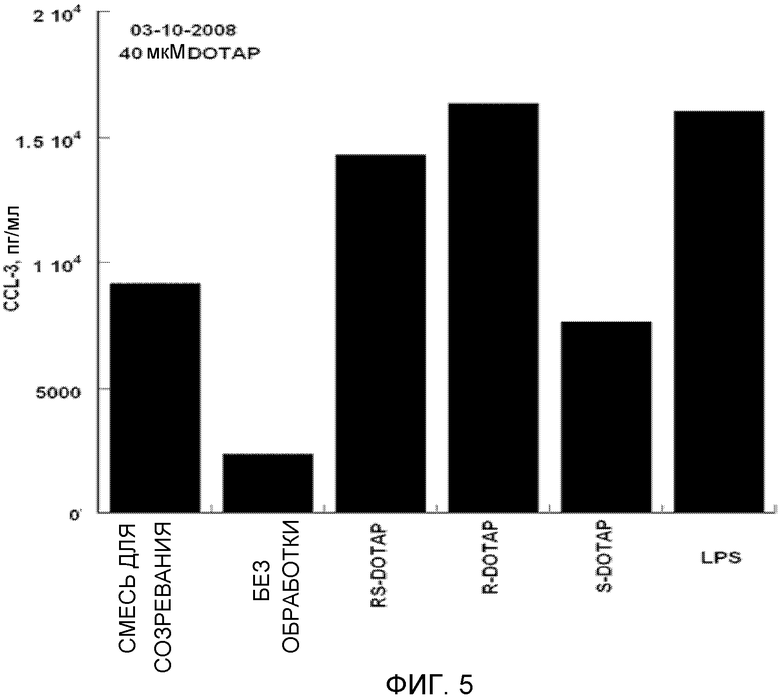
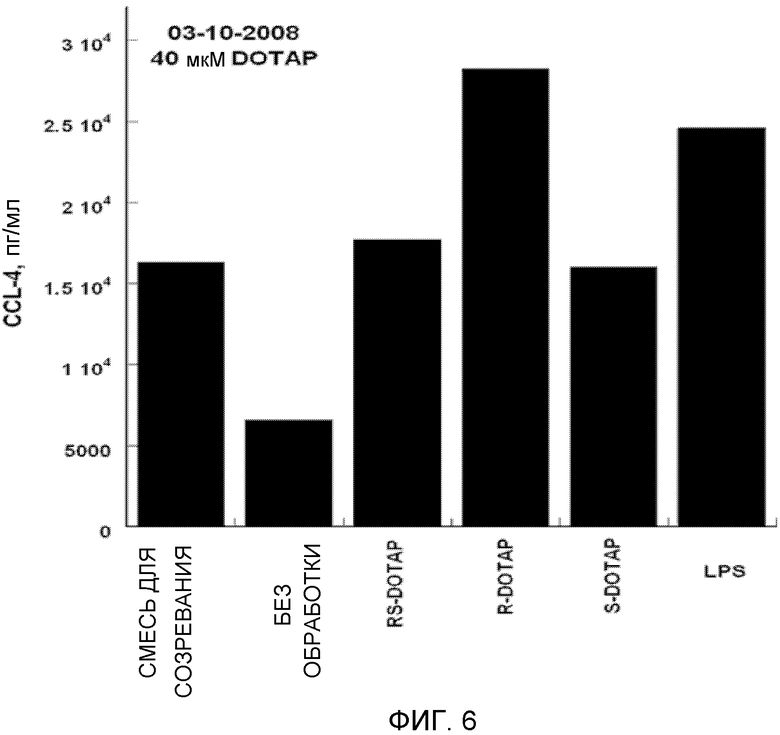
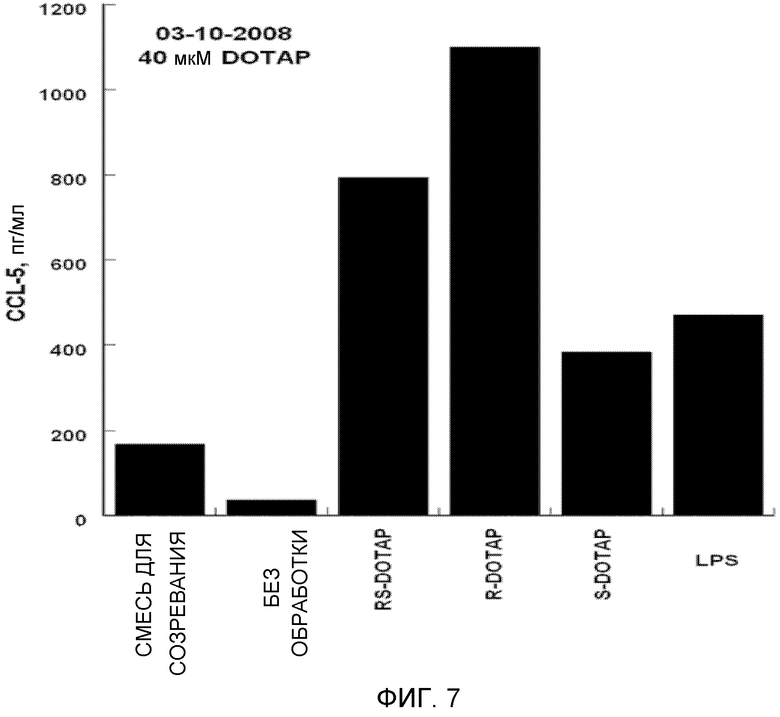
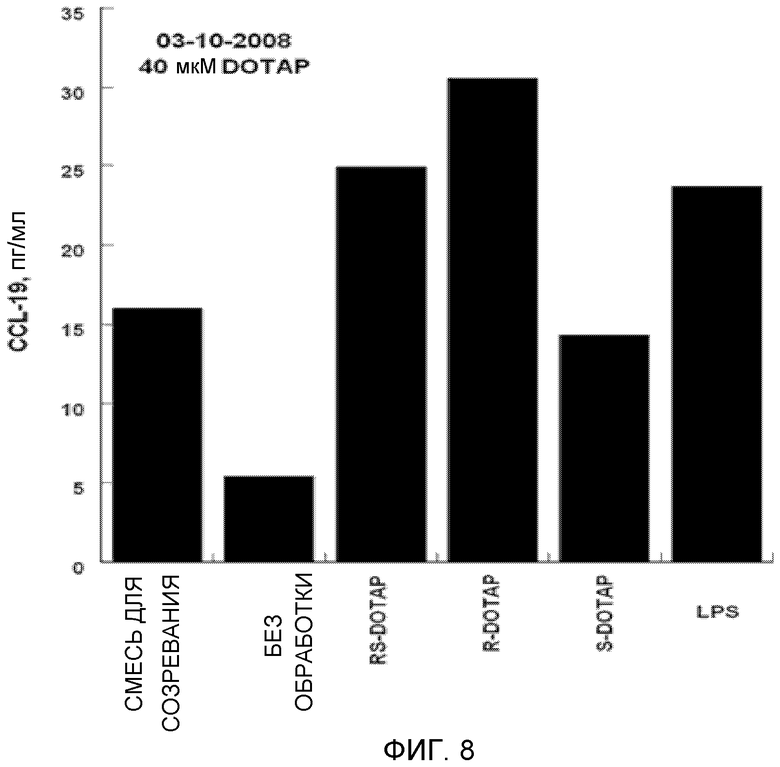
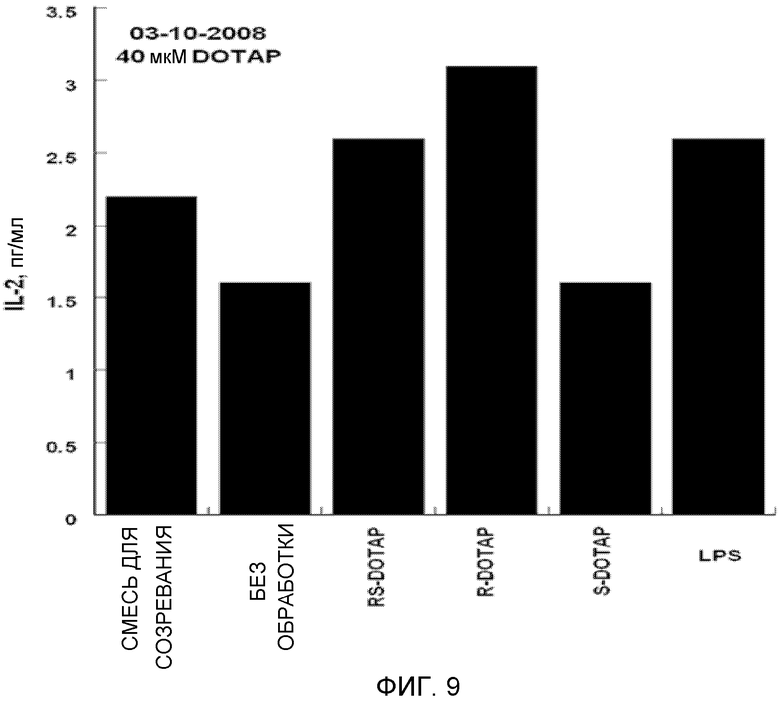
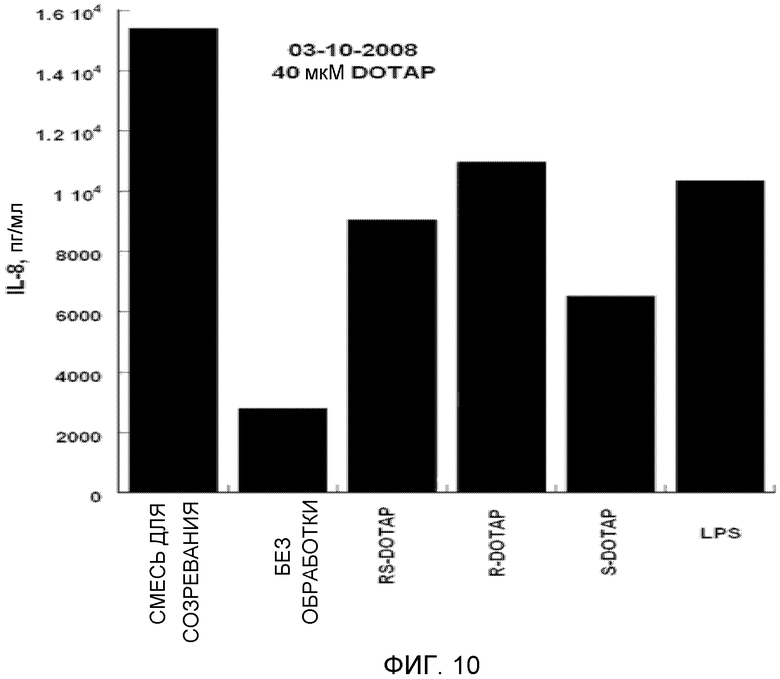
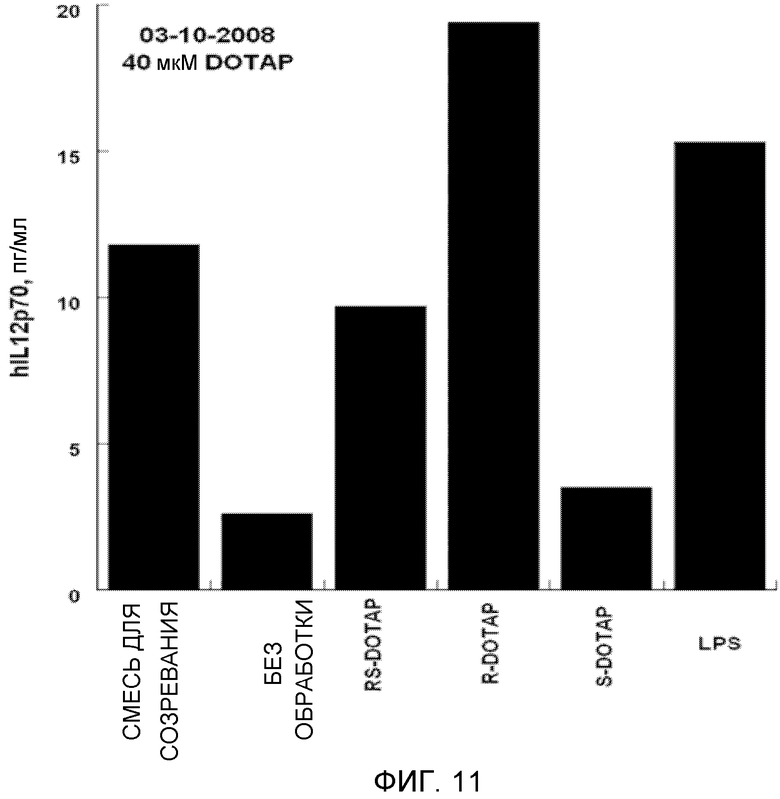
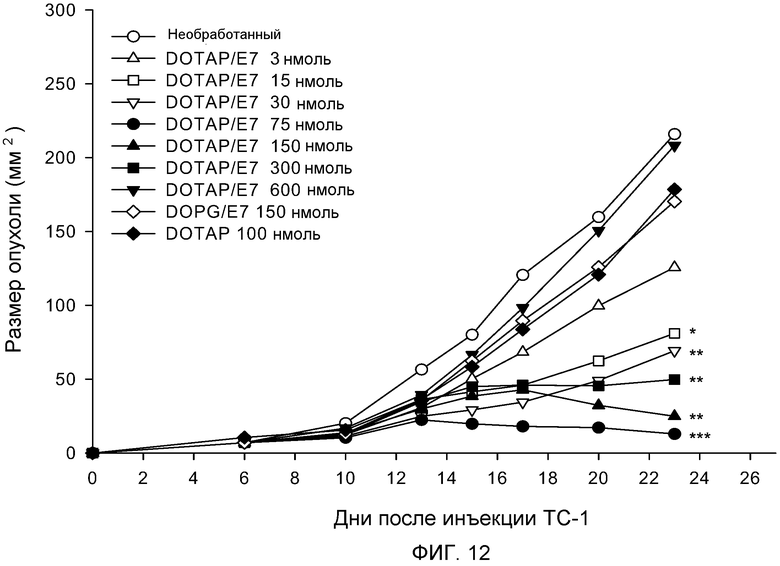
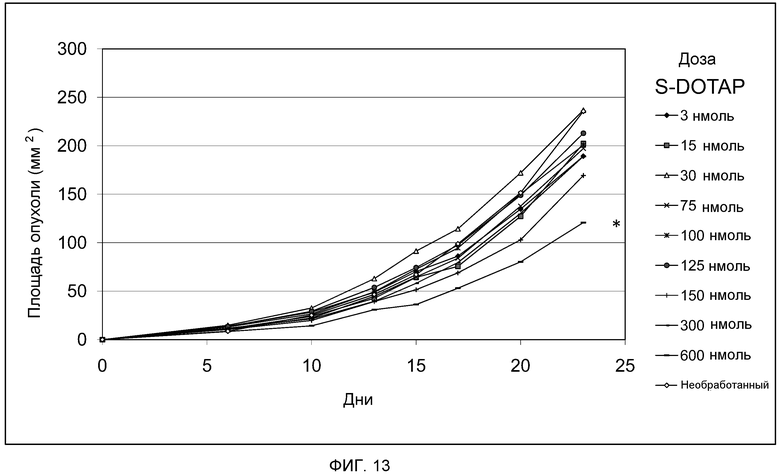
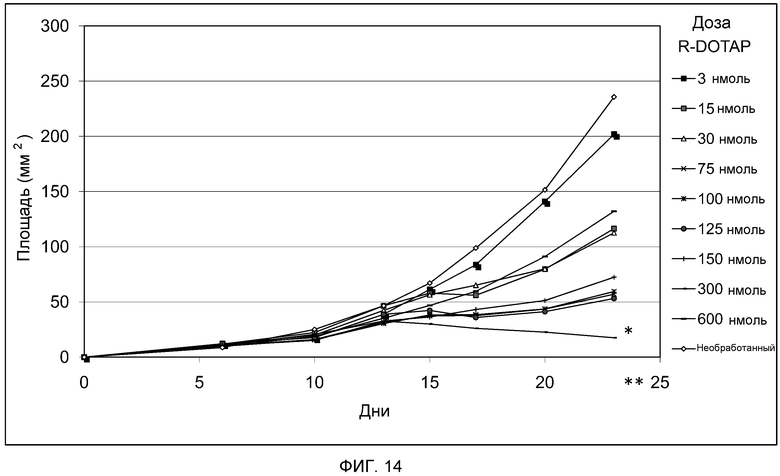
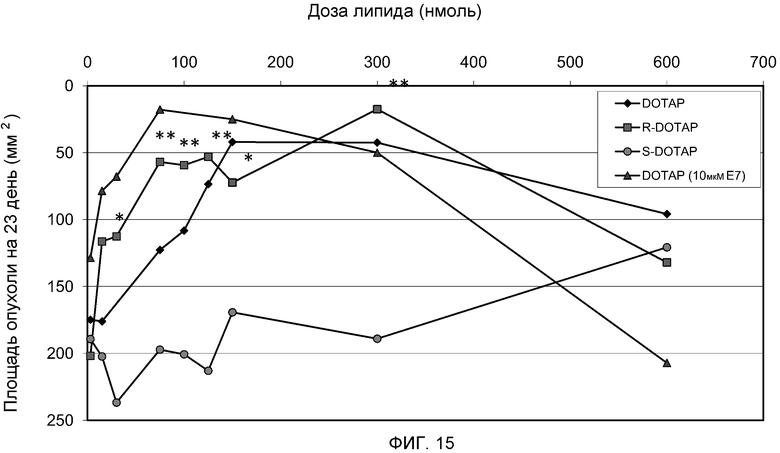
Предложена группа изобретений: фармацевтическая композиция, содержащая иммунологически активный энантиомер компонента катионного липида R-DOTAP или S-DOTAP, способ применения указанного энантиомера для вызова иммуностимулирующего адъювантного эффекта в иммунной системе, способ индукции иммунного ответа у пациента с его использованием и способ лечения или предотвращения заболевания у пациента путем индукции липидом иммуностимулирующего адъювантного эффекта. Технический результат: R-DOTAP и S-DOTAP индуцировали продукцию цитокинов IL-2, IL-8, IL-12, хемокинов CCL-5, CCL-19 и регрессию опухоли у мышей. 4 н. и 19 з.п. ф-лы, 15 ил., 8 пр.
1. Фармацевтическая композиция, содержащая иммунологически активный энантиомер компонента катионного липида,
где компонент катионного липида активирует иммунную систему пациента и
где энантиомер представляет собой R-DOTAP или S-DOTAP.
2. Фармацевтическая композиция по п.1, в которой энантиомер представляет собой S-DOTAP.
3. Фармацевтическая композиция по п.1, в которой энантиомер представляет собой R-DOTAP.
4. Фармацевтическая композиция по п.1, дополнительно содержащая один или несколько антигенов.
5. Способ применения энантиомера катионного липида для индукции иммуностимулирующего адъювантного эффекта в иммунной системе,
где энантиомер катионного липида активирует сигнальный путь MAP киназы для индукции иммуностимулирующего адъювантного эффекта,
где энантиомер представляет собой R-DOTAP или S-DOTAP.
6. Способ по п.5, где энантиомер представляет собой S-DOTAP.
7. Способ по п.5, где энантиомер представляет собой R-DOTAP.
8. Способ по п.5, где фармацевтическая композиция дополнительно содержит один или несколько антигенов.
9. Способ индукции иммунного ответа у пациента, где способ включает введение фармацевтической композиции, содержащей иммунологически активный энантиомер катионного липида пациенту, где энантиомер катионного липида индуцирует иммуностимулирующий адъювантный эффект у пациента и где энантиомер представляет собой R-DOTAP или S-DOTAP.
10. Способ по п.9, где энантиомер представляет собой S-DOTAP.
11. Способ по п.9, где энантиомер представляет собой R-DOTAP.
12. Способ по п.9, где фармацевтическая композиция дополнительно содержит один или несколько антигенов.
13. Способ лечения или профилактики заболевания, связанного со стимуляцией иммунного ответа, у пациента, нуждающегося в этом, где способ включает введение фармацевтической композиции, содержащей иммунологически активный энантиомер катионного липида пациенту,
где энантиомер катионного липида индуцирует иммуностимулирующий адъювантный эффект у пациента и
где энантиомер представляет собой R-DOTAP или S-DOTAP.
14. Способ по п.13, где энантиомер вводят в количестве, достаточном для активации сигнального пути MAP киназы для индукции иммуностимулирующего адъювантного эффекта.
15. Способ по п.13, где энантиомер представляет собой S-DOTAP.
16. Способ по п.13, где энантиомер представляет собой R-DOTAP.
17. Способ по п.13, где фармацевтическая композиция дополнительно содержит по меньшей мере один антиген.
18. Способ по п.17, где по меньшей мере один антиген модифицирован таким образом, что повышается его гидрофобность.
19. Способ по п.17, где по меньшей мере один антиген представляет собой липидированный антиген.
20. Способ по п.17, где по меньшей мере один антиген липидирован пальмитиновой кислотой.
21. Способ по п.13, где заболевание представляет собой злокачественное новообразование.
22. Способ по п.13, где заболевание представляет собой инфекционное заболевание.
23. Способ по п.22, где инфекционный агент инфекционного заболевания представляет собой вирус папилломы.
| US7303881 B2 04.12.2007 | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЛИПИДЫ, КОТОРЫЕ НЕСУТ ПОЛЯРНЫЙ И НЕПОЛЯРНЫЙ ФРАГМЕНТ | 2002 |
|
RU2294738C2 |
| СИСТЕМА ДОСТАВКИ НУКЛЕИНОВЫХ КИСЛОТ | 2002 |
|
RU2294192C2 |
| US6419931 B1 16.07.2002 | |||
| SHIMIZU T | |||
| et al | |||
| Antitumor activity, mitogenicity, and lethal toxicity of chemical synthesized monosaccharide analog of lipid A | |||
| J | |||
| Pharmacobiodyn | |||
| Механическая топочная решетка с наклонными частью подвижными, частью неподвижными колосниковыми элементами | 1917 |
|
SU1988A1 |
Авторы
Даты
2014-10-10—Публикация
2009-04-14—Подача