Изобретение относится к медицине, а именно к экспериментальной онкологии, и касается способа создания ортотопического ксенографта рака пищевода внутригрудной локализации на иммунодефицитных мышах, позволяющего получить наиболее адекватную модель онкогенеза рака пищевода в грудном отделе пищевода.
На сегодняшний день рак пищевода занимает 9 место по распространенности в мире (см. Bray F., Ferlay J., Soerjomataram I. et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries // CA: a cancer journal for clinicians, 2018, 68(6), P. 394-424). Индекс агрессивности данного заболевания (соотношение умерших к количеству вновь заболевших) крайне высок и составляет 0,87 (см. Torre L.A., Bray F., Siegel R.L. et al. Global cancer statistics, 2012 // CA: a cancer journal for clinicians, 2015, 65(2), P. 87-108). Несмотря на разработку новых методов диагностики, у 67% пациентов данная патология выявляется уже на III-IV стадиях опухолевого процесса (см. Состояние онкологической помощи населению в 2017 году // под ред. Каприна А.Д., Старинского В.В., Петровой Г.В. - М.: МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018 г. - 236 с.). По этим причинам рак пищевода находится на 6-м месте по уровню смертности среди онкологических заболеваний (см. Bray F., Ferlay J., Soerjomataram I. et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries // CA: a cancer journal for clinicians, 2018, 68(6), P. 394-424).
Лечение рака пищевода производится с помощью химиотерапевтического, лучевого, хирургического или сочетанных методов. Химиолучевая терапия является малоэффективной при лечении даже I-II стадий из-за высокой резистентности опухоли (см. Скворцов М.Б. Рак пищевода: хирургическое лечение // Сибирский медицинский журнал (Иркутск), 2011, 103(4), С. 21-30). Поэтому основным, а чаще всего и единственным, методом лечения данного заболевания остается хирургическое. Однако из-за технической сложности оперативного вмешательства и часто возникающих послеоперационных осложнений отмечается высокая летальность пациентов, а их пятилетняя выживаемость не превышает 10% (см. Арутюнян К.В., Шостка К.Г., Кузнецов И.М. и др. Хирургия рака пищевода: прошлое, настоящее, будущее (научный обзор) // Профилактическая и клиническая медицина, 2018, 1, С. 70-77). Наиболее проблематичным является хирургическое лечение у больных по поводу злокачественных новообразований в грудном отделе пищевода в виду технической сложности, а также локализацией опухоли в сложной анатомической зоне. Поэтому радикальные операции на грудном отделе пищевода сопровождаются высокой частотой послеоперационных осложнений (14,5-64%) и высоким уровнем летальности - 2,6-21% (см. Jiang K. Cheng L., Wang J.-J. et al Fast track clinical path-way implications in esophagogastrectomy // World J. Gastroenterol. - 2009. - Vol. 15 (4). - P. 496-501). Осложняет ситуацию высокий уровень встречаемости нерезектабельных случаев данного заболевания - 20-40% (см. Давыдов М.И., Стилиди И.С. Рак пищевода. 3-е изд. испр. и доп. М.: Изд. Гр. РОНЦ. 2007. 392 с.). Также в случае рака грудного отдела пищевода часто наблюдается развитие в послеоперационном периоде метастазов в медиастенальном, паратрахеальном и трахеобронхиальном лимфатических узлах (см. Дворецкий С.Ю. Современная стратегия лечения рака пищевода // Вестник хирургии. - 2016. - Т. 175. - №4. - С. 102-107).
На сегодняшний день представляется актуальным детальное изучение этиологии и патогенеза рака грудного отдела пищевода, а также разработка более эффективных методов лечения. Для этого необходимо создание объективной ксеногенной модели на иммунодефицитных мышах.
Известен способ ксенотрансплантации различных клеточных линий рака пищевода подкожно иммунодефицитным мышам методом инъекции (см. Grace G.-L.Y., Lin L., Julia K.-M.L. et al. Multiple modulatory activities of Andrographis paniculata on immune responses and xenograft growth in esophageal cancer preclinical models // Phytomedicine, 2019, 60, P. 152886). Этот метод является наиболее распространенным благодаря своей простоте и возможности непосредственного наблюдения за ростом опухоли. Его недостатком является развитие опухоли в нетипичном микроокружении, из-за чего она оказывается неспособной к инвазии и метастазированию.
Известен способ ксенотрансплантации клеточной линии аденокарциномы пищевода в абдоминальный отдел пищевода иммунодефицитных мышей методом инъекции. Авторами указывается, что доступ к пищеводу обеспечивается путем рассечения кожи и брюшной стенки в верхней части туловища вдоль средней линии тела длиной 10 мм. Для выделения и создания натяжения абдоминальной части пищевода приподнимали печень, выводили желудок в операционную рану, заводили под пищевод пинцет для микрохирургии, после чего вводили шприц на расстояние 3 мм в стенку дистальной части органа для имплантации суспензии культуры опухолевых клеток (см. Melsens Е., Vlieghere Е., Descamps В. et al. Improved xenograft efficiency of esophageal adenocarcinoma cell lines through in vivo selection // Oncology reports, 2017, 38(1), P. 71-81).
Известен способ инъекционной ксенотрансплантации клеточных линий рака пищевода в шейный отдел пищевода иммунодефицитных мышей. Для этого производили вертикальный и горизонтальный разрезы кожи шеи по типу «крест-накрест», тупое выделение пищевода и инъекцию опухолевого материала (см. Tung L.N., Song S., Chan K.T. et al. Preclinical Study of Novel Curcumin Analogue SSC-5 Using Orthotopic Tumor Xenograft Model for Esophageal Squamous Cell Carcinoma // Cancer Res Treat, 2018, 50(4), P. 1362-1377).
При ортотопической имплантации опухоль находится в адекватном клеточном микроокружении, что позволяет учитывать опухоле-стромальные взаимодействия. Еще одним преимуществом таких моделей является высокая вероятность развития метастазов, что оказывается крайне важным для изучения поздних стадий заболевания.
В настоящее время неизвестны способы трансплантации опухолевого материала в грудной отдел пищевода иммунодефицитных мышей.
Техническим результатом предлагаемого изобретения является разработка способа создания ксенографта рака пищевода внутригрудной локализации на иммунодефицитных мышах, обеспечивающего малотравматичный доступ к грудному отделу пищевода животного, позволяющий сохранить целостность грудной полости животного и избежать развития пневмоторакса.
Технический результат изобретения достигается тем, что осуществляют создание ксенографта рака пищевода внутригрудной локализации на иммунодефицитных мышах, включающий выполнение доступа в брюшную полость, выведение желудка и пищевода в операционную рану, инъекцию суспензии культуры клеток рака пищевода в мышечный слой пищевода, отличающийся тем, что укладывают животное на операционный стол в положение на живот, выполняют разрез кожи, мышечного слоя и брюшины перпендикулярно оси тела животного, на 2 мм ниже края реберной дуги, начиная разрез от точки пересечения края тринадцатой реберной дуги с задней подмышечной линией, заканчивая разрез на расстоянии 5 мм от позвоночного столба мыши, выводят в послеоперационную рану желудок животного, удерживая анатомическим пинцетом оттянутым желудок, вводят инъекционную иглу в мышечный слой пищевода на расстоянии 2 мм от диафрагмы под углом 15 градусов параллельно оси пищевода срезом вверх, далее проводят иглу в мышечном слое пищевода через диафрагмальное окно в грудную часть пищевода на 3 мм выше диафрагмального окна, производят инфильтрацию мышечного слоя пищевода опухолевыми клетками, удаляют иглу, послойно ушивают брюшную полость.
Способ осуществляют следующим образом.
Культура клеток рака пищевода отмывается и ресуспендируется в культуральной среде 199, не содержащей сыворотку и антибиотики.
Реципиентом опухолевого материала служат иммунодефицитные мыши Balb/c Nude.
Анестезию животных осуществляют с использованием ксилазина концентрацией 20 мг/мл в качестве премедикации и золетила концентрацией 22,57 мг/мл.
Для обеспечения доступа в брюшную полость мыши ее укладывают в положение на живот и разрезают кожу, мышечный слой, брюшину перпендикулярно оси тела животного, на 2 мм ниже края реберной дуги. Разрез начинается от точки пересечения края тринадцатой реберной дуги с задней подмышечной линией и заканчивается на расстоянии 5 мм от позвоночного столба мыши.
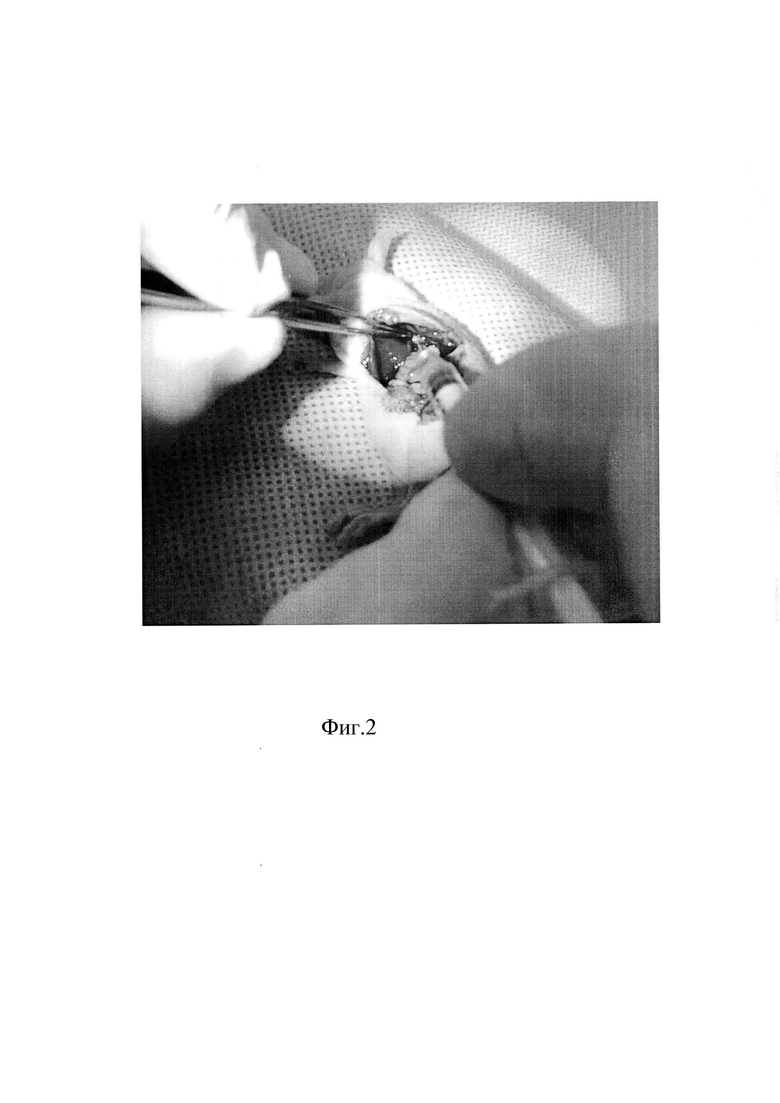
При помощи анатомического пинцета выводят в послеоперационную рану желудок и часть абдоминального отдела пищевода. Удерживая анатомическим пинцетом оттянутым желудок, вводят инъекционную иглу в мышечный слой пищевода на расстоянии 2 мм от диафрагмы под углом 15 градусов параллельно оси пищевода срезом вверх, далее проводят иглу в мышечном слое пищевода через диафрагмальное окно в грудную часть пищевода на 3 мм выше диафрагмального окна. Инъекцию суспензии культуры клеток производят в объеме 20 мкл с помощью инсулинового шприца (100 U) с иглой 27 G. Осуществляют инфильтрацию мышечного слоя грудного отдела пищевода опухолевыми клетками.
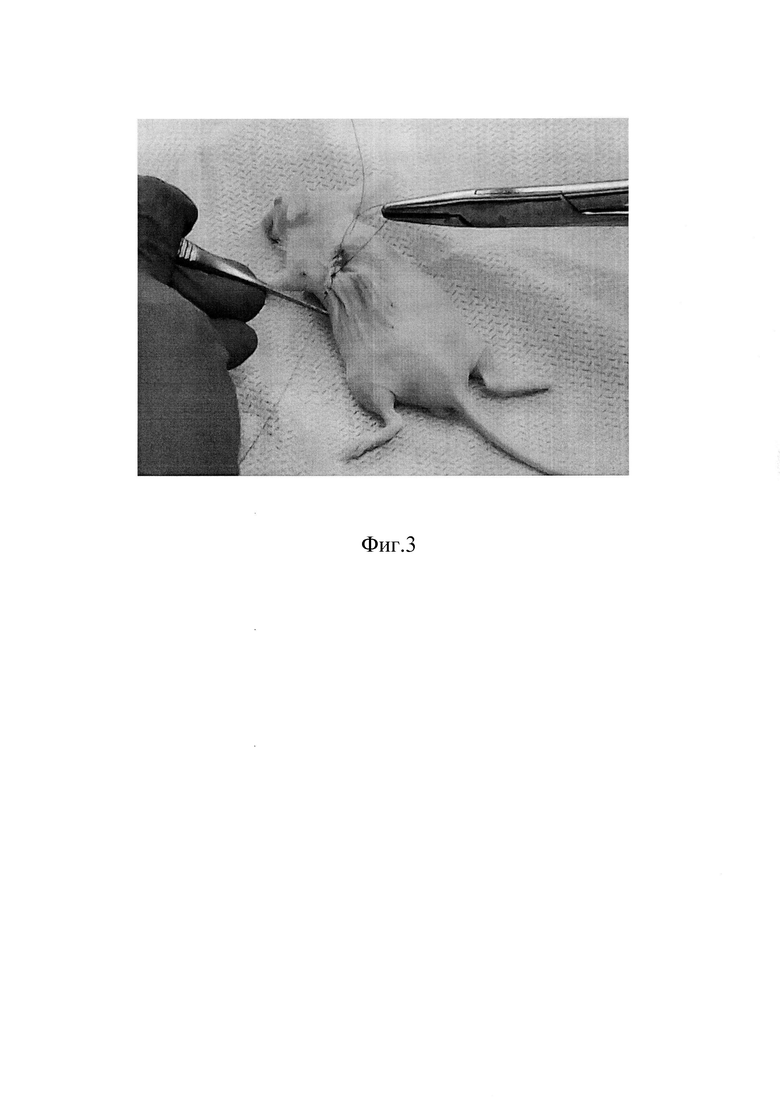
Удаляют иглу, послойно ушивают брюшную полость.
Изобретение иллюстрируется фигурами (1-3).
На Фиг 1 изображено выведение желудка и пищевода в операционную рану иммунодефицитной мыши Balb/c Nude.
На Фиг 2 изображена инъекция суспензии культуры опухолевых клеток в стенку пищевода иммунодефицитной мыши Balb/c Nude.
На Фиг 3 изображено ушитие операционной раны у иммунодефицитной мыши Balb/c Nude.
Данным способом произведена ортотопическая трансплантация культуры клеток рака пищевода человека в грудной отдел пищевода 15 иммунодефицитным мышам Balb/c Nude.
Технико-экономическая эффективность данного способа заключается в том, что он позволяет обеспечить малотравматичный доступ к грудному отделу пищевода животного при ортотопической трансплантации культуры опухолевых клеток пищевода человека в грудной отдел пищевода иммунодефицитных мышей с целью получения опухолевых моделей, использующихся в доклинических исследованиях различных вариантов терапии рака грудного отдела пищевода.
Пример.
Ксенотрансплантацию культуры клеток рака пищевода человека провели самке мыши линии Balb/c Nude весом 22 г. Премедикация была выполнена с использованием ксилазина концентрацией 20 мг/мл. Для наркоза применяли золетил концентрацией 22,57 мг/мл.
Мышь укладывали в положение лежа на живот. Разрез кожи, мышечного слоя и брюшной стенки производился перпендикулярно оси тела, на 2 мм ниже края реберной дуги, и начинался от точки пересечения края тринадцатой реберной дуги с задней подмышечной линией, заканчивался на расстоянии 5 мм от позвоночного столба мыши.
С помощью анатомического пинцета вывели в послеоперационную рану желудок с абдоминальной частью пищевода. Удерживая пинцетом желудок, ввели инъекционную иглу срезом вверх в мышечный слой на расстоянии 2 мм от диафрагмы под углом 15 градусов параллельно оси пищевода. Иглу проводили в мышечном слое пищевода через диафрагмальное окно в грудную его часть на 3 мм выше диафрагмального окна. Инъекцию суспензии культуры опухолевых клеток произвели в объеме 20 мкл при помощи инсулинового шприца с иглой 27G в мышечный слой грудного отдела пищевода. Удалили иглу и послойно ушили послеоперационную рану.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПТИМАЛЬНОГО ДОСТУПА К АБДОМИНАЛЬНОМУ ОТДЕЛУ ПИЩЕВОДА ИММУНОДЕФИЦИТНЫХ МЫШЕЙ ПРИ ОРТОТОПИЧЕСКОЙ ТРАНСПЛАНТАЦИИ ФРАГМЕНТА ОПУХОЛИ ПИЩЕВОДА ЧЕЛОВЕКА | 2018 |
|
RU2709835C1 |
| СПОСОБ ОРТОТОПИЧЕСКОЙ ТРАНСПЛАНТАЦИИ КУЛЬТУРЫ ОПУХОЛЕВЫХ КЛЕТОК ПИЩЕВОДА ЧЕЛОВЕКА В ШЕЙНЫЙ ОТДЕЛ ПИЩЕВОДА ИММУНОДЕФИЦИТНЫХ МЫШЕЙ | 2019 |
|
RU2713798C1 |
| Способ доступа к телу желудка иммунодефицитных мышей при ортотопической трансплантации фрагмента опухоли желудка человека | 2022 |
|
RU2790950C1 |
| Способ трансплантации фрагмента опухоли толстой кишки человека в нисходящий отдел толстой кишки иммунодефицитных мышей | 2020 |
|
RU2753144C1 |
| СПОСОБ СОЗДАНИЯ МОДЕЛИ РАКА ПЕЧЕНИ НА ИММУНОДЕФИЦИТНЫХ МЫШАХ | 2023 |
|
RU2799132C1 |
| Способ получения ортотопической PDX-модели плоскоклеточного рака пищевода человека для исследования лучевой терапии в эксперименте | 2021 |
|
RU2760084C1 |
| СПОСОБ ТРАНСПЛАНТАЦИИ ФРАГМЕНТА НЕЙРОЭНДОКРИННОЙ ОПУХОЛИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА В ПОДЖЕЛУДОЧНУЮ ЖЕЛЕЗУ ИММУНОДЕФИЦИТНЫХ МЫШЕЙ | 2019 |
|
RU2725273C1 |
| СПОСОБ ТРАНСПЛАНТАЦИИ ФРАГМЕНТА ОПУХОЛИ ТОЛСТОЙ КИШКИ ЧЕЛОВЕКА В СЛЕПУЮ КИШКУ ИММУНОДЕФИЦИТНЫХ МЫШЕЙ | 2020 |
|
RU2727868C1 |
| Способ выбора оптимального доступа для ортотопической трансплантации фрагмента опухоли рака яичника человека в яичник самки иммунодифицитной мыши | 2020 |
|
RU2740423C1 |
| Способ трансплантации фрагмента опухоли рака яичника человека в яичник самки иммунодефицитной мыши | 2020 |
|
RU2740443C1 |

Изобретение относится к медицине, а именно к онкологии, и может быть использовано для создания ортотопического ксенографта рака пищевода внутригрудной локализации на иммунодефицитных мышах. Способ включает выполнение доступа в брюшную полость, выведение желудка и пищевода в операционную рану, инъекцию суспензии культуры клеток рака пищевода в мышечный слой пищевода. Выполняют разрез кожи, мышечного слоя и брюшины перпендикулярно оси тела животного, на 2 мм ниже края реберной дуги, начиная разрез от точки пересечения края тринадцатой реберной дуги с задней подмышечной линией, заканчивая разрез на расстоянии 5 мм от позвоночного столба мыши, выводят в послеоперационную рану желудок животного, удерживая анатомическим пинцетом оттянутым желудок. Вводят инъекционную иглу в мышечный слой пищевода на расстоянии 2 мм от диафрагмы под углом 15 градусов параллельно оси пищевода срезом вверх, далее проводят иглу в мышечном слое пищевода через диафрагмальное окно в грудную часть пищевода на 3 мм выше диафрагмального окна, производят инфильтрацию мышечного слоя пищевода опухолевыми клетками, удаляют иглу, послойно ушивают брюшную полость. Использование изобретения позволяет обеспечить малотравматичный доступ к грудному отделу пищевода животного при ортотопической трансплантации культуры опухолевых клеток пищевода человека в грудной отдел пищевода иммунодефицитных мышей с целью получения опухолевых моделей, использующихся в доклинических исследованиях различных вариантов терапии рака грудного отдела пищевода. 1 пр., 3 ил.
Способ создания ксенографта рака пищевода внутригрудной локализации на иммунодефицитных мышах, включающий выполнение доступа в брюшную полость, выведение желудка и пищевода в операционную рану, инъекцию суспензии культуры клеток рака пищевода в мышечный слой пищевода, отличающийся тем, что укладывают животное на операционный стол в положение на живот, выполняют разрез кожи, мышечного слоя и брюшины перпендикулярно оси тела животного, на 2 мм ниже края реберной дуги, начиная разрез от точки пересечения края тринадцатой реберной дуги с задней подмышечной линией, заканчивая разрез на расстоянии 5 мм от позвоночного столба мыши, выводят в послеоперационную рану желудок животного, удерживая анатомическим пинцетом оттянутым желудок, вводят инъекционную иглу в мышечный слой пищевода на расстоянии 2 мм от диафрагмы под углом 15 градусов параллельно оси пищевода срезом вверх, далее проводят иглу в мышечном слое пищевода через диафрагмальное окно в грудную часть пищевода на 3 мм выше диафрагмального окна, производят инфильтрацию мышечного слоя пищевода опухолевыми клетками, удаляют иглу, послойно ушивают брюшную полость.
| СПОСОБ ОПТИМАЛЬНОГО ДОСТУПА К АБДОМИНАЛЬНОМУ ОТДЕЛУ ПИЩЕВОДА ИММУНОДЕФИЦИТНЫХ МЫШЕЙ ПРИ ОРТОТОПИЧЕСКОЙ ТРАНСПЛАНТАЦИИ ФРАГМЕНТА ОПУХОЛИ ПИЩЕВОДА ЧЕЛОВЕКА | 2018 |
|
RU2709835C1 |
| Способ оценки эффективности воздействия химиотерапевтических препаратов ксенотрансплантатной модели in vivo | 2016 |
|
RU2638285C1 |
| Способ лечения рака пищевода | 1949 |
|
SU85879A1 |
| КИТ О.И | |||
| и др | |||
| Методы создания ортотопических моделей рака пищевода и их применение в доклинических исследованиях // Современные проблемы науки и образования | |||
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2020-12-11—Публикация
2020-06-08—Подача