Изобретение относится к медицине, а именно к экспериментальной онкологии, и касается способа получения ортотопической PDX-модели (Patient derived xenografts) плоскоклеточного рака пищевода человека на иммунодефицитных мышах для исследования лучевой терапии в эксперименте. Изобретение позволяет проводить доклинические испытания ионизирующего излучения на модели, характеризующейся схожими морфологическими особенностями с опухолевым материалом, полученным от пациента-донора.
Рак пищевода отличается неблагоприятным течением, а также высокими показателями смертности среди больных (см. Napier K.J., Scheerer M., Misra S., Napier K.J. Esophageal cancer: A Review of epidemiology, pathogenesis, staging workup and treatment modalities // World J. Gastrointest. Oncol. - 2014. - 6. - P. 112-120; Siegel R., Naishadham D., Jemal A. Cancer statistics, 2013 // Cancer Journal for Clinicians. - 2013. - V. 63. - №. 1. - P. 11-30). Данное заболевание подразделяется на две формы, которые способны развиваться в различных частях пищевода: плоскоклеточный рак и аденокарцинома (см. Salem M.E., Puccini A., Xiu J., Raghavan D., Lenz H.J., Korn W.M., Shields A.F., Shi J.-j. Cancer Letters. - 2019. - 459. 145 - 151; Philip P.A., Marshall J.L., Goldberg R.M. Comparative molecular analyses of esophageal squamous cell carcinoma, esophageal adenocarcinoma, and gastric adenocarcinoma // Oncol. - 2018. - 23. - 1319-1327). В России наблюдается преобладание по встречаемости плоскоклеточного рака пищевода (89-92 %) (см. Кит О.И., Колесников Е.Н., Максимов А.Ю., Протасова Т.П., Гончарова А.С., Лукбанова Е.А. Методы создания ортотопических моделей рака пищевода и их применение в доклинических исследованиях // Современные проблемы науки и образования. 2019. № 2. 6 с.).
Плоскоклеточный рак пищевода является одним из самых распространенных и смертельных новообразований в мире (см. Bray F., Ferlay J., Soerjomataram I., Siegel R.L., Torre L.A., Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries, CA A // Cancer J. Clin. - 2018. - 68. - 394-424). Стандартом лечения данного заболевания является хирургическая, лучевая и химиолучевая терапия. При этом 5-летняя выживаемость пациентов составляет всего 15-25%, а рецидивы наблюдаются в 40-60% случаев (см. Pennathur A., Gibson M.K., Jobe B.A., Luketich J.D. Oesophageal carcinoma // Lancet. - 2013. - 381. - 400-412; Gwynne S., Hurt C., Evans M., Holden C., Vout L., Crosby T. Definitive chemoradiation for oesophageal cancer - a standard of care in patients with non-metastatic oesophageal cancer // Clin Oncol. - 2011. - 23. - 182-188). Поэтому первоочередной задачей экспериментальной онкологии является разработка или усовершенствование, а также внедрение более совершенных методов терапии, в том числе лучевой и мультимодальной (Miyata H., Yamasaki M., Takiguchi S., Nakajima K., Fujiwara Y., Nishida T. Salvage esophagectomy after definitive chemoradiotherapy for thoracic esophageal cancer // J Surg Oncol. - 2009. - 100. - Р. 442-446).
Известно исследование лучевой терапии в разовой дозе 15 Гр и ее сочетания с флавопиридолом на ксенографтах, полученных в результате трансплантации культуры клеток SEG-1 с использованием 137°Cs c-ray аппарата (Raju U., Ariga H., Koto M., Lu X., Pickett J., Valdecanas D., Mason K.A., Milas L. Improvement of esophageal adenocarcinoma celland xenograft responses to radiation by targeting cyclin-dependent kinases // Radiotherapy and Oncology 80. - 2006. Р. 185-191 doi:10.1016/j.radonc.2006.07.027).
В другом исследовании на подкожных ксенографтах, созданном путем трансплантации культур клеток аденокарциномы (ОЕ19) и плоскоклеточного рака пищевода (ОЕ21) показали противоопухолевый эффект сочетания фракционированной лучевой терапии (3 Â 2 Гр, использовали линейный ускоритель Varian, Palo Alto, CA) с препаратом TH-302 (50 мг / кг, внутрибрюшинно) (см. Spiegelberg L., van Hoof S.J., Biemans R., Lieuwes N.G., Marcus D., Niemans R., Theys J., Yaromina A., Lambin P., Verhaegen F., Dubois L.J. Evofosfamide sensitizes esophageal carcinomas to radiation without increasing normal tissue toxicity // Radiotherapy and Oncology. - 2019. - 141. - 247-255. preclinhttps://doi.org/10.1016/j.radonc.2019.06.034).
Недостатком обоих методик проведения исследований является использование ксенографтов, созданных путем подкожной трансплантации культур клеток. Подобные модели не способны точно отражать реальную картину онкогенеза и поэтому результаты подобных исследований могут подвергаться сомнению.
В настоящее время PDX-модели считаются ценным инструментом для трансляционных исследований, поскольку они, в отличие от моделей ксенотрансплантатов клеточных линий, способны сохранять характеристики опухоли пациента, а также гетерогенность состава. Это позволяет более точно прогнозировать чувствительность опухоли к лечению (Choi Y.Y., Lee J.E., Kim H. et all. Establishment and characterisation of patient-derived xenografts as paraclinical models for gastric cancer // Sci. Rep. - 2016. - 6: 22172. doi:10.1038/srep22172).
Известно исследование противоопухолевого эффекта препарата CYH33 (12,5 мг / кг, один раз в день), радиации (2 Гр на 0, 1, 7, 8, 9, 28 сутки) и их комбинации на подкожной PDX-модели плоскоклеточного рака пищевода на иммунодефицитных мышах Balb/c Nude (Shi J.-j., Xing H., Wang Y.-Х., Zhang X., Zhan Q.-М., Geng M.-Y., Ding J., Meng L.-H. PI3Kα inhibitors sensitize esophageal squamous cell carcinoma to radiation by abrogating survival signals in tumor cells and tumor microenvironment // Cancer Letters. - 2019. - 459. - Р. 145 - 155. https://doi.org/10.1016/j.canlet.2019.05.040). Ответ ксенотрансплантата на воздействия может считаться наиболее приближенным к ответу первичной опухоли пациента, однако данная модель не способна отражать процессы миграции клеток и метастазирования ввиду гетеротопического сайта трансплантации.
Технический результат изобретения заключается в получении ортотопической PDX-модели плоскоклеточного рака пищевода человека на иммунодефицитных мышах для исследования лучевой терапии в эксперименте, сохраняющей гистологические характеристики донорской опухоли, адаптированной к росту и имеющей стабильную кинетику роста в организме мышей линии Balb/c Nude.
Поставленная задача решается тем, что создана ортотопическая PDX-модель плоскоклеточного рака пищевода человека на иммунодефицитных мышах, гистологически схожая с опухолью пациента-донора и адаптированная к росту на иммунодефицитных мышах линии Balb/c Nude.
Способ иллюстрируется следующими фигурами:
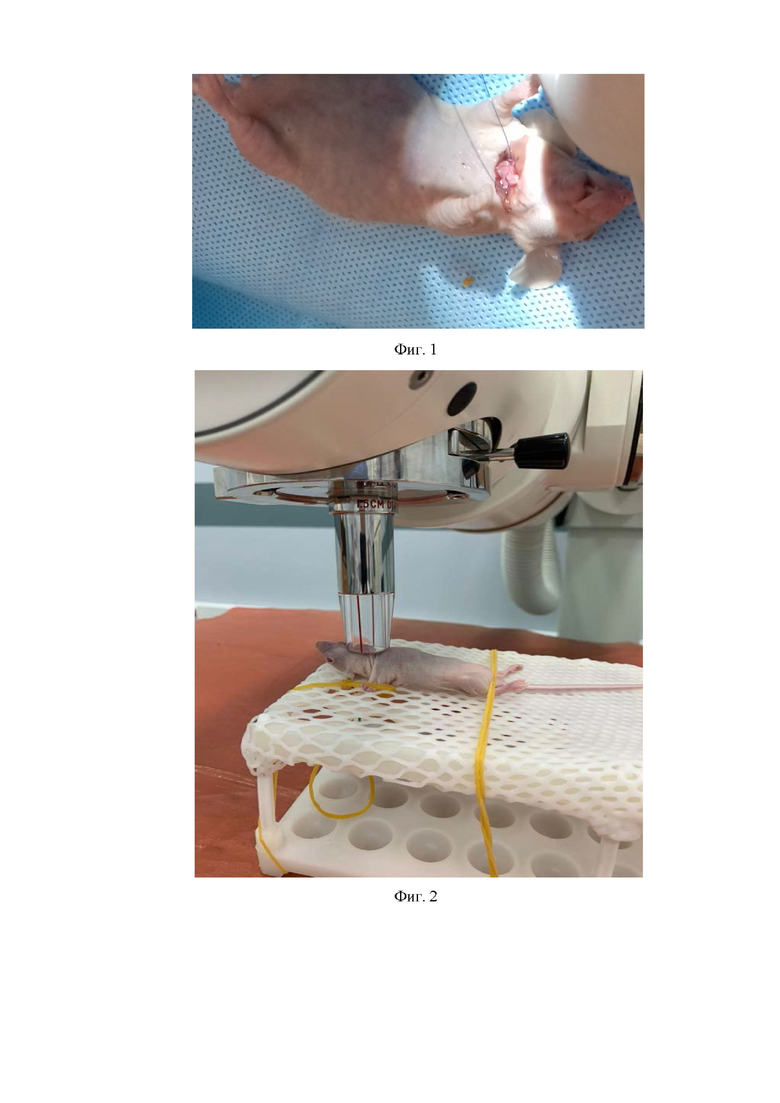
Фиг. 1. Создание PDX-модели плоскоклеточного рака пищевода человека путем трансплантации фрагмента опухоли в шейный отдел пищевода иммунодефицитной мыши Balb/c Nude;
Фиг. 2. Облучение иммунодефицитной мыши Balb/c Nude с установленным ксенографтом плоскоклеточного рака пищевода при помощи установки Xstrahl 150;
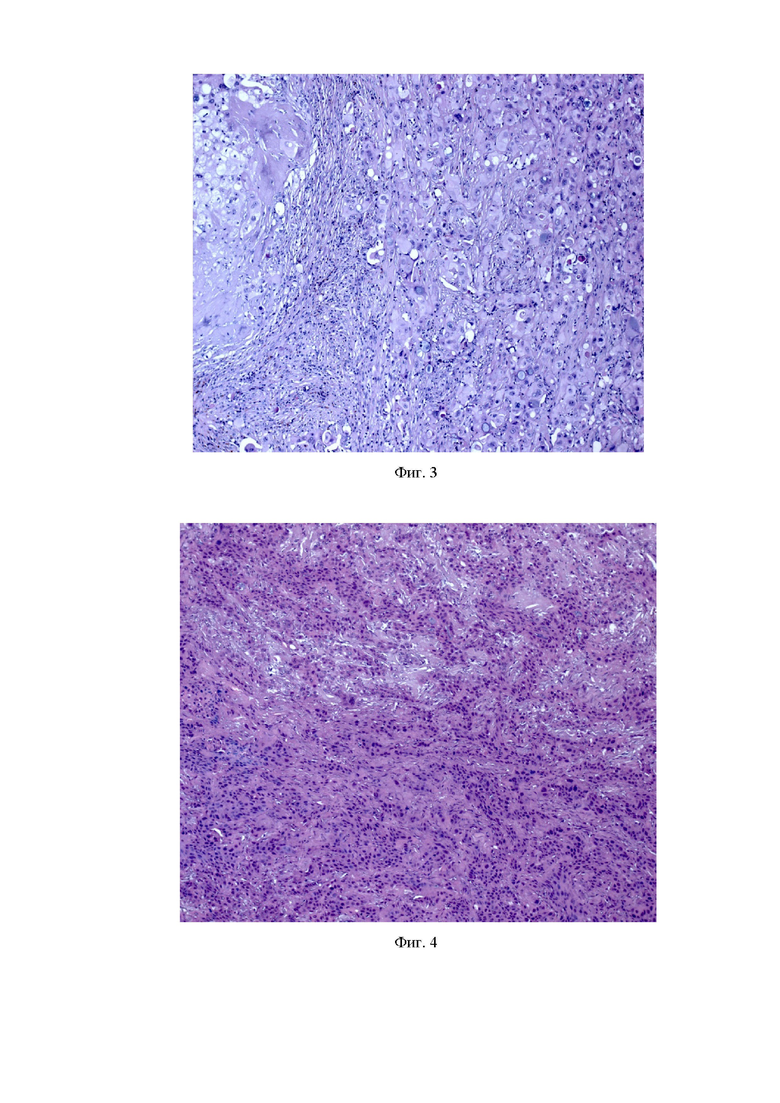
Фиг. 3. Плоскоклеточный рак пищевода пациента-донора. Окраска гематоксилином и эозином. Ув. 100х;
Фиг. 4. PDX-модель плоскоклеточного рака пищевода в 6 пассаже без воздействия. Окраска гематоксилином и эозином. Ув. 100х;
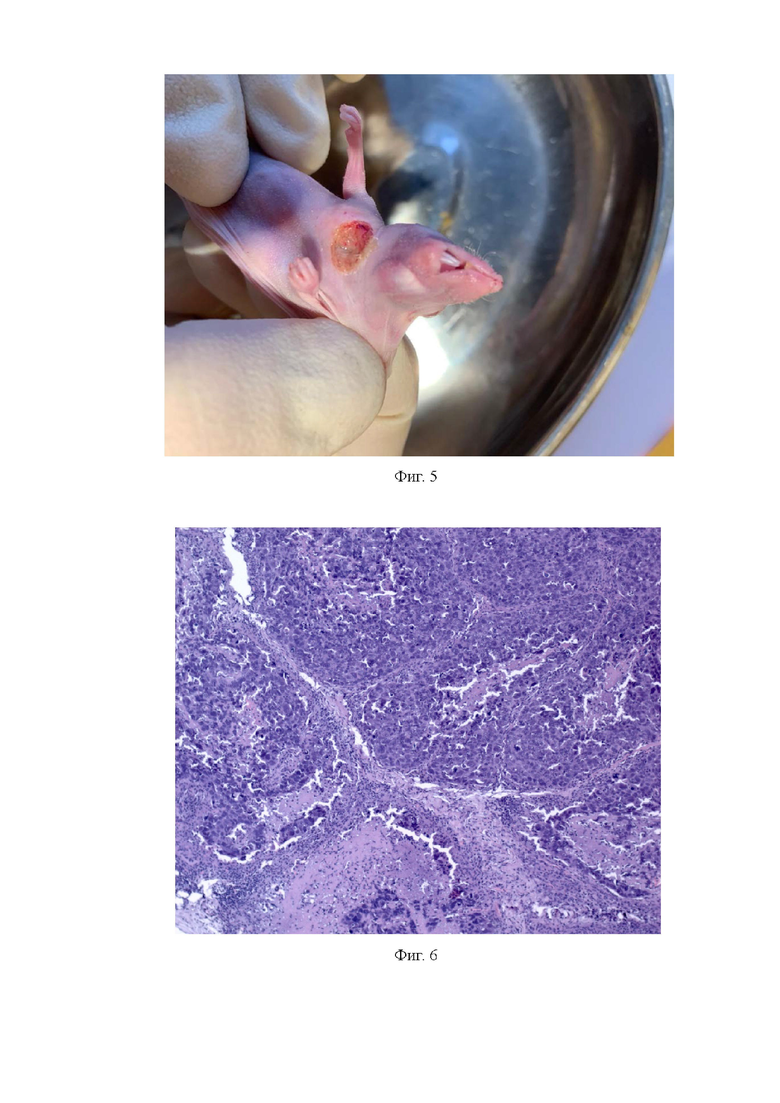
Фиг. 5. Мышь с ксенографтом плоскоклеточного рака пищевода в 6 пассаже после ионизирующего излучения в суммарной дозе 40 Гр.;
Фиг. 6. PDX-модель плоскоклеточного рака пищевода после ионизирующего излучения в суммарной дозе 40 Гр. Окраска гематоксилином и эозином. Ув. 100х.
Способ осуществляют следующим образом.
Для создания ортотопической PDX-модели плоскоклеточного рака пищевода использовали опухоль от пациента В., которая была представлена пластами плоских клеток без ороговения (фиг. 3).
После иссечения опухоли из организма донора, выделяют опухолевый фрагмент без некроза и васкуляризации, помещают в питательную среду 199 с 1% гентамицина. Наркоз мышей осуществляют при помощи препаратов Ксилазин и «Золетил 100» согласно протоколу (см. Патент RU № 2712916, опубл. 03.02.2020, Бюл. №4). Далее проводят трансплантацию фрагмента опухи объемом 27 мм3, рассекая кожу на шее. Разрез начинается у основания правого уха и заканчивают у основания левого уха. Далее выделяли тупым способом пищевод, рассекали его адвентициально-мышечный слой, после чего подшивали фрагмент опухоли объемом 27 мм3 над повреждением при помощи лигатуры из полипропилена размером 5-0 (фиг. 1). Операционную рану ушивали скорняжным швом при помощи лигатуры из полипропилена размером 4-0.
По достижении опухолевым материалом объема 150-250 мм3 ксенографты рака пищевода человека перевивали указанным способом до 6 пассажа (табл.1).
Доля приживления ксенотрансплантата увеличивалась с каждой генерацией и составляла в 1, 2 и 3, 4-м пассажах 40, 50, 70 и 90% соответственно. Начиная с 5-го пассажа, наблюдалась адаптация ксенографта к росту (100% приживления).
Данным способом было создано 100 ортотопических PDX-моделей плоскоклеточного рака пищевода на иммунодефицитных мышах.
Гистологическую верификацию PDX-модели плоскоклеточного рака пищевода для сравнения клеточного состава с исходной донорской опухолью проводили в каждом пассаже при помощи световой микроскопии срезов опухоли, окрашенных гематоксилином и эозином.
Таблица 1
Характеристика роста PDX-модели рака пищевода человека различных генераций на иммунодефицитных мышах
В результате морфологического исследования PDX-модели рака пищевода опухоль была представлена пластами плоских клеток без ороговений, что соответствовало гистологической структуре опухоли пациента-донора. В толще опухолевой ткани были видны очаги митотической активности опухолевых клеток, а также незначительные участки с некротическими изменениями, занимающие 10% площади в поле зрения при увеличении 100х (фиг. 4).
Для исследования лучевого воздействия использовали 6-ую генерацию PDX-модели плоскоклеточного рака пищевода на 25 самках мышей линии Balb/c Nude, разделенных на 5 групп, n=5 (табл. 2). Время наблюдения составило 15 суток.
Облучение животных проводили при помощи аппарата Xstrahl 150 с фильтром 1 (Al 0,2) и аппликаторами 1,5 и 2 см (фиг. 2).
Объем опухолевых узлов рассчитывали по формуле Шрека для эллипсоида - V=а×в×с×p/6, где V - объем опухоли (мм3), а, в, с - максимальные диаметры эллипсоида в трех плоскостях (мм).
Таблица 2.
Распределение мышей по группам в соответствии с режимами облучения
Наименьший противоопухолевый эффект отмечался в группе мышей, который получали разовую долю излучения 4 Гр, хотя после воздействия суммарной дозы 16 Гр объемы ксенографтов значимо отличались от объемов ксенографтов контрольной группы (р≤0,05). В остальных опытных группах, получавших разовую долю излучения 6, 8 и 10 Гр наблюдалась остановка роста опухоли, объем которой не превышал 250 мм3 и значимо отличался от объема ксенографтов в контроле. Следует отметить, что статистически значимых различий между средними объемами опухолевых узлов в группах 3, 4 и 5 не наблюдалось, что позволяет предложить в качестве эффективного излучение в разовой дозе 6 Гр. Остановка же роста ксенографта начиналась после 2-хкратного воздействия. Таким образом, наименьшей суммарной эффективной дозой ионизирующего излучения в отношении PDX-модели плоскоклеточного рака пищевода может считаться доза в 12 Гр.
У мышей, получивших суммарную дозу излучения 40 Гр, наблюдается в области опухолевого узла на шее изъязвление кожи и некроз опухоли с выделением гнойных масс молочного цвета (фиг. 5). При проведении морфологического анализа PDX-модели плоскоклеточного рака пищевода наблюдали пласты плоских раковых клеток без ороговений со значительными участками некроза (50% площади поля зрения), в которых отмечались клетки с карио- и цитолизисом, а также массы, образованные разрушенными клетками (фиг. 6).
Технико-экономическая эффективность заключается в том, что изобретение позволяет получить ортотопическую PDX-модель плоскоклеточного рака пищевода человека на иммунодефицитных мышах для исследования лучевой терапии в эксперименте, которая сохраняет гистологические характеристики опухолевого материала, полученного от пациента-донора, и может быть использована для получения адекватного характера роста, инвазии индуцированного новообразования, для доклинического изучения противоопухолевых эффектов лучевой терапии.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения ортотопической PDX-модели глиобластомы головного мозга человека на иммунодефицитных мышах для доклинического изучения противоопухолевых эффектов цитостатических препаратов | 2021 |
|
RU2761892C1 |
| Способ создания ксенографта рака пищевода внутригрудной локализации на иммунодефицитных мышах | 2020 |
|
RU2738308C1 |
| Способ исследования PDX-модели колоректального рака | 2024 |
|
RU2835140C1 |
| СПОСОБ ОПТИМАЛЬНОГО ДОСТУПА К АБДОМИНАЛЬНОМУ ОТДЕЛУ ПИЩЕВОДА ИММУНОДЕФИЦИТНЫХ МЫШЕЙ ПРИ ОРТОТОПИЧЕСКОЙ ТРАНСПЛАНТАЦИИ ФРАГМЕНТА ОПУХОЛИ ПИЩЕВОДА ЧЕЛОВЕКА | 2018 |
|
RU2709835C1 |
| Способ трансплантации фрагмента опухоли толстой кишки человека в нисходящий отдел толстой кишки иммунодефицитных мышей | 2020 |
|
RU2753144C1 |
| СПОСОБ ОРТОТОПИЧЕСКОЙ ТРАНСПЛАНТАЦИИ КУЛЬТУРЫ ОПУХОЛЕВЫХ КЛЕТОК ПИЩЕВОДА ЧЕЛОВЕКА В ШЕЙНЫЙ ОТДЕЛ ПИЩЕВОДА ИММУНОДЕФИЦИТНЫХ МЫШЕЙ | 2019 |
|
RU2713798C1 |
| Способ доступа к телу желудка иммунодефицитных мышей при ортотопической трансплантации фрагмента опухоли желудка человека | 2022 |
|
RU2790950C1 |
| СПОСОБ ТРАНСПЛАНТАЦИИ ФРАГМЕНТА ОПУХОЛИ ТОЛСТОЙ КИШКИ ЧЕЛОВЕКА В СЛЕПУЮ КИШКУ ИММУНОДЕФИЦИТНЫХ МЫШЕЙ | 2020 |
|
RU2727868C1 |
| СПОСОБ ТРАНСПЛАНТАЦИИ ФРАГМЕНТА НЕЙРОЭНДОКРИННОЙ ОПУХОЛИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА В ПОДЖЕЛУДОЧНУЮ ЖЕЛЕЗУ ИММУНОДЕФИЦИТНЫХ МЫШЕЙ | 2019 |
|
RU2725273C1 |
| СПОСОБ СОЗДАНИЯ МОДЕЛИ РАКА ПЕЧЕНИ НА ИММУНОДЕФИЦИТНЫХ МЫШАХ | 2023 |
|
RU2799132C1 |
Изобретение относится к медицине. Способ получения ортотопической PDX-модели плоскоклеточного рака пищевода человека для исследования лучевой терапии в эксперименте заключается в том, что иссекают опухоль из организма донора. Выделяют опухолевый фрагмент без некроза и васкуляризации. Далее помещают в питательную среду 199 с 1% гентамицин. Осуществляют наркоз мышей линии Balb/c Nude. Проводят трансплантацию фрагмента опухоли объемом 27 мм3, рассекая кожу на шее, разрез начинается у основания правого уха и заканчивается у основания левого уха. Далее выделяют тупым способом пищевод, рассекают его адвентициально-мышечный слой. Далее подшивают фрагмент опухоли объемом 27 мм3 над повреждением при помощи лигатуры из полипропилена, операционную рану ушивают скорняжным швом при помощи лигатуры из полипропилена. По достижении опухолевым материалом объема 150-250 мм3 ксенографты рака пищевода человека перевивают указанным способом до 6 пассажа. Изобретение позволяет проводить доклинические испытания ионизирующего излучения на модели, характеризующейся схожими морфологическими особенностями с опухолевым материалом, полученным от пациента-донора. 2 табл., 6 ил.
Способ получения ортотопической PDX-модели плоскоклеточного рака пищевода человека для исследования лучевой терапии в эксперименте, заключающийся в том, что иссекают опухоль из организма донора, выделяют опухолевый фрагмент без некроза и васкуляризации, помещают в питательную среду 199 с 1% гентамицина, осуществляют наркоз мышей линии Balb/c Nude, проводят трансплантацию фрагмента опухоли объемом 27 мм3, рассекая кожу на шее, разрез начинается у основания правого уха и заканчивается у основания левого уха, далее выделяют тупым способом пищевод, рассекают его адвентициально-мышечный слой, после чего подшивают фрагмент опухоли объемом 27 мм3 над повреждением при помощи лигатуры из полипропилена, операционную рану ушивают скорняжным швом при помощи лигатуры из полипропилена, по достижении опухолевым материалом объема 150-250 мм3 ксенографты рака пищевода человека перевивают указанным способом до 6 пассажа.
| RU 2009136053 A, 20.01.2010 | |||
| КИТ О.И | |||
| и др | |||
| МЕТОДЫ СОЗДАНИЯ ОРТОТОПИЧЕСКИХ МОДЕЛЕЙ РАКА ПИЩЕВОДА И ИХ ПРИМЕНЕНИЕ В ДОКЛИНИЧЕСКИХ ИССЛЕДОВАНИЯХ / Современные проблемы науки и образования, 2019, N 2 | |||
| LEE N.P | |||
| et al | |||
| Tumor xenograft animal models for esophageal squamous cell carcinoma / Journal of Biomedical Science, 2018, 25:66, 8 pages | |||
| VEERANKI |
Авторы
Даты
2021-11-22—Публикация
2021-03-26—Подача