Область техники, к которой относится изобретение
Настоящее изобретение относится к активной клеточной иммунотерапии, включающей способ получения популяции клинически значимых лимфоцитов с использованием композиции заранее определенных цитокинов. Также изобретение относится к композиции цитокинов и полученным клинически значимым лимфоцитам.
Уровень техники
Рак остается одной из наиболее распространенных причин смерти в развитых странах. Например, в США и Германии он является второй наиболее значимой причиной смерти с показателем смертности 560000 (2009) и 218000 (2010) соответственно. Уровни выживаемости остаются низкими при многих видах рака, несмотря на достижения в возможностях обнаруживать и лечить данную группу заболеваний.
Среди злокачественных заболеваний рак поджелудочной железы является четвертой по значимости причиной смерти от рака вообще в США и Швеции без признаков снижения смертности. У большинства больных ко времени диагностики рака поджелудочной железы он уже становится неизлечимым с прогрессированием в местно-распространенный рак или метастатическое заболевание, что позволяет проводить только паллиативное лечение. Средняя выживаемость составляет примерно шесть месяцев. Только примерно у 15-20% пациентов имеется операбельная опухоль и, следовательно, потенциальная возможность излечения болезни. Как и большинство видов рака, рак поджелудочной железы является системным заболеванием, которое требует раннего и системного вмешательства. По сравнению со многими другими видами рака рак поджелудочной железы является высоко резистентным к химиотерапии и резистентным к лучевой терапии. Для достижения существенного прорыва в улучшении плохого прогноза при раке поджелудочной железы необходим поиск новых альтернатив и более эффективные концепции лечения. Биология рака поджелудочной железы связана с местной и системной иммуносупрессией, позволяющей опухоли прогрессировать и метастазировать.
Эта ситуация аналогична ситуации с глиобластомой, которая представляет наиболее частую и прогрессирующую глиому с частотой случаев в США 2-3/100000. Глиобластома составляет до 12-15% от всех внутричерепных и до 50-60% от гистиоцитарных опухолей. С помощью новых схем лечения повысилась средняя общая выживаемость (14,6 месяцев при использовании лучевой терапии плюс темозоломида по сравнению с 12,1 месяцами с только лучевой терапией). До сих пор намерения разработать надежные и клинически эффективные иммунотерапевтические протоколы оказывались разочаровывающими для пациентов с глиобластомой или пациентов с раком поджелудочной железы. Одним из возможных подходов для лечения таких видов рака является преодоление индуцированной опухолями супрессии и/или индукция противоопухолевых направленных клеточных и гуморальных иммунных ответов.
Одним из наиболее перспективных достижений является новый способ лечения, называемый активной клеточной иммунотерапией (ACI). Иммунотерапия рака может быть пассивной или активной. Пассивная терапия основана на адоптивной передаче иммуномодуляторов, включая цитокины, специфические к опухолям антитела или иммунные клетки. Эти вещества или клетки затем вводят пациенту для инициации противоопухолевого действия. В общем, эти методы лечения не генерируют иммунологическую память, и следовательно, требуется постоянное лечение на основе инфузии. С другой стороны, активная иммунотерапия стимулирует иммунную систему пациента с целью стимуляции антигенспецифического противоопухолевого эффекта, используя собственные иммунные клетки организма. Кроме того, активная иммунотерапия стремится создать длительный противоопухолевый ответ, который может защитить от минимальной остаточной болезни и рецидивов опухоли.
Клинически значимые и длительные ремиссии с использованием Т-клеток, направленных против опухолей (опухолереактивных Т-клеток), были достигнуты у пациентов с меланомой (2, 3). Недавно в знаковой статье было показало, что наилучший и длительный ответ при лечении рака достигается, если собственные Т-клетки пациента направлены против собственных опухолевых клеток пациента, т.е. собственных «личных» мутаций пациента (4). Такие обнадеживающие результаты были также получены и для пациентов с эпителиальными опухолями, т.е. посредством адаптивного переноса Т-клеток, направленных на мутантные эпитопы в эпителиальной раковой опухоли (5). Обычно такие подходы основаны на получении лимфоцитов, инфильтрирующих опухоль (TIL), из опухолевых очагов или Т-клеток из периферической крови.
В недавнем докладе подкомитета CTEP по Адаптивной клеточной терапии были обобщены протоколы по экспансии опухолереактивных Т-клеток из периферической крови и TIL.
Это исследование составило дорожную карту для применения терапии TIL или терапии на основе Т-клеток с особым акцентом на соответствии продукта и эффективном выходе Т-клеточных продуктов. Оба фактора соответствие и выход для Т-клеток, нацеленных на меланому, вероятно, достигаются с использованием существующих методологий, которые позволяют стратегиям, основанным на Т-клетках, войти в основную схему лечения рака, наряду с биопрепаратами, т.е. анти-CD40L или анти-PD-1 направленным лекарственными средствами.
Оказалось, что минимально культивированные TIL обеспечивают наиболее эффективный фенотип и профиль для клинического применения (11). До настоящего времени самым успешным подходом было применение аутологичных активированных ex vivo Т-клеток, которые культивировали в 24-луночных планшетах, тестировали на иммунные эффекторные функции и затем подвергали экспансии с использованием IL-2, аллогенных фидерных клеток и OKT3 (9, 12, 13).
CD4+ или CD8+ Т-клетки, направленные на опухолевый антиген (ТАА), были получены в условиях, отвечающих требованиям GMP, из периферической крови и формулированы для последующего лечения пациентов. Это было достигнуто с аутологичными CD4+ T-клетками (14-16) или CD8+ Т-клетками (17), некоторые из которых были нацелены против антигена NY-ESO-1 (18), что также возможно сделать с МКПК от здоровых пациентов без рака, поскольку достаточное количество предшественников Т-клеток присутствует в периферическом кровотоке. Были описаны различные способы экспансии Т-клеточных клонов, генерирующих CD8+ Т-клетки, для целенаправленной терапии (19). Это представляет большой интерес, поскольку было показано, что клональное вторичное заселение иммунной системы пациента противоопухолевыми лимфоцитами вызывает не только регрессию рака, но и аутоиммунных процессов (20).
Состав культуральной среды также может иметь значение для успешной активной иммунотерапии. Результаты исследований показали, что выращивание клеток на минимальной среде оказывает влияние на иммунные ответы, опосредованные Т-клетками, и может вызывать иммуносупрессию, индуцированную выращиванием клеток на минимальной среде, и также экспансию определенных субпопуляций Т-клеток. Оказалось, что данный механизм опосредован лептином (21), который модулирует также развитие В-клеток и последующие ответы В-клеток (22). Это привело к открытию питательных сенсорных путей (т.е. GCN2 в дендритных клетках), которые улучшают презентацию антигена (23). Результаты более поздних исследований показали, что экспансия Т-клеток, регулируемая цитокинами (такая, как экспансия TIL или ACT ex vivo) зависит от экзогенных аминокислот и таких цитокинов, т.е. IL-7, которые положительно активируют гены, связанные с экспрессией транспортеров аминокислот. Следовательно, требования к выбору культуральной среды должны формироваться с учетом соответствующей смеси цитокинов, используемой для экспансии Т-клеток (24), а также аминокислот в среде; оба фактора будут оказывать влияние на созревание и дифференцировку Т-клеток, которые являются клинически значимыми.
Клиническая (противоопухолевая) эффективность, по-видимому, опосредуется CD8+ клетками и клетками центральной памяти, определяемыми CD45RA-CCR7+, полученными ex vivo от пациентов, реагирующих на терапию на основе Т-клеток. Фенотип таких Т-клеток определяется популяцией экспансированных ex vivo Т-клеток, а также факторами хозяина после адаптивной передачи. Разнообразная популяция Т-клеток, нацеленных на раковые клетки, может быть преимущественной для эффективных иммунных ответов, включая Т-клетки долговременной памяти, и так же Т-клеток, которые могут немедленно реагировать с (раковыми) клетками-мишенями, и генерируют противоопухолевые целенаправленные иммунные ответы, в том числе, терминально дифференцированные Т-клетки, которые экспрессируют цитолитические молекулы, такие как гранзим и перфорин (25, 26). Долговременная иммунная память частично определяется повышенным потенциалом пролиферации и периодом существования, которые могут быть измерены с помощью длины теломер (27, 28).
Относительно мало известно о том, какие стадии (меланома)-специфических TIL или Т-клеточных клонов лучше всего подходят для передачи in vivo, за счет различий экспрессии генов in vitro и in vivo, а также различной «цитокиновой среды» у отдельных пациентов. Не только индивидуальный фенотип, а также довольно разные фенотипы, связанные с быстрой доставкой Т-клеток (терминально дифференцированные CD45RA+CCR7-) с иммунными эффекторными функциями наряду с обеспечением долговременной иммунологической памяти Т-клеток центральной памяти, которые пополняют пул дифференцированных Т-клеток, могут представлять хороший выбор для экспансии Т-клеток.
Оказалось, что также актуальна экспрессия маркеров активации/истощения, т.е. LAG-3, PD-1 и или 4-1ВВ на Т-клетках, которые могут указывать на более выраженное изменение истощения и потерю функции Т-клеток, а также обогащение Т-клетками, специфичными для опухолевых антигенов (которые имеют тенденцию быть PD1+ и/или LAG-3, 4-1ВВ+ (29)).
Известно, что NY-ESO-1 является подходящей мишенью для Т-клеток, специфичных для опухолевых антигенов. NY-ESO-1 представляет собой антиген для тестирования на рак (36, 37) и экспрессируется в большом числе опухолей. Например, в исследователи в Каролинском институте 50 глиобластом подвергали скринингу на экспрессию белка NY-ESO-1, и было установлено, что 35% GB степени 3 и 4 были позитивными на NY-ESO-1. Скрининг раковой опухоли поджелудочной железы показал меньшее количество положительных очагов на белок NY-ESO-1 на уровне 20%, в частности, в метастатических очагах. Ориентация на NY-ESO-1 для экспансии опухолереактивных Т-клеток из периферической крови, как представляется, является «безопасным выбором» мишени, поскольку NY-ESO-1 экспрессируется только в злокачественных клетках и семенниках без явной реактивности «вне мишени» в Т-клетках, направленных на NY-ESO-1 (36). Это представляет большой интерес, поскольку было показано, что клональное вторичное заселение иммунной системы пациентов противоопухолевыми лимфоцитами вызывает регрессию рака и аутоиммунных процессов (20). NY-ESO-1 был опробован в ряде исследований в качестве потенциальной мишени при GB, а в также GB-стволовых клетках вместе с использованием ДНК-метилирующих агентов для повышения реактивности NY-ESO-1 (39, 40).
С учетом этого уровня техники целью настоящего изобретения является разработка усовершенствованных способов иммунотерапии.
Сущность изобретения
Настоящее изобретение inter alia основано на установлении того, что композиция, содержащая цитокины интерлейкин-2 (IL-2), интерлейкин-15 (IL-15) и/или интерлейкин-21 (IL-21), приводит к эффективной стимуляции и экспансии лимфоцитов, в частности, клинически значимых лимфоцитов. Процедура экспансии и стимуляции смесью цитокинов является высокочувствительной, и позволяет получать популяцию клинически значимых лимфоцитов, даже если исходный титр клеток в образце является очень низким.
Таким образом, согласно первому аспекту настоящее изобретение относится к композиции, предназначенной для экспансии лимфоцитов, содержащей по меньшей мере два типа цитокинов, выбранных из интерлейкина-2 (IL-2), интерлейкина-15 (IL-15) и интерлейкина-21 (IL-21).
С помощью этой композиции цитокинов авторы изобретения смогли предложить новый способ получения популяции «обученных» антигеном лимфоцитов. Следовательно, согласно второму аспекту настоящее изобретение относится к способу получения популяции клинически значимых лимфоцитов, включающему следующие стадии:
получение образца из организма млекопитающего, в частности, образца ткани или образца жидкости организма, содержащего по меньшей мере один лимфоцит и необязательно разделение клеток в образце из организма,
культивирование образца из организма in vitro для экспансии и/или стимуляции лимфоцитов в образце, где культивирование включает применение IL-2, IL-15 и/или IL-21,
и необязательно определение присутствия клинически значимого лимфоцита в культивированном образце.
Способ согласно второму аспекту настоящего изобретения приводит к образованию популяции лимфоцитов, которая включает популяцию клинически значимых лимфоцитов.
Согласно третьему аспекту настоящее изобретение относится к клинически значимому лимфоциту, полученному способом по второму аспекту, где клинически значимый лимфоцит выбран из В-клеток, NK-клеток и Т-клеток.
Согласно четвертому аспекту настоящее изобретение относится к популяции лимфоцитов, полученных по второму аспекту настоящего изобретения, содержащей популяцию клинически значимых лимфоцитов.
Популяция клинически значимых лимфоцитов, полученная способом согласно второму аспекту настоящего изобретения является, в частности, предпочтительной для клеточной иммунотерапии.
Согласно пятому аспекту настоящее изобретение относится к иммунотерапии для лечения или профилактики опухолевого заболевания, инфекционного заболевания или аутоиммунного заболевания у млекопитающего, включающей стадии получения популяции клинически значимых лимфоцитов по второму аспекту настоящего изобретения, где образец из организма получают от указанного млекопитающего, и введения популяции клинически значимых лимфоцитов указанному млекопитающему.
Согласно шестому аспекту настоящее изобретение относится к композиции по первому аспекту настоящего изобретения для применения медицине, в частности, для лечения и профилактики инфекционного заболевания, аутоиммунного заболевания или опухолевого заболевание.
Следовательно, согласно седьмому аспекту настоящее изобретение относится к набору для применения в медицине, в частности, для лечения или профилактики инфекционного заболевания, аутоиммунного заболевания или опухолевого заболевания, где набор содержит IL-2, IL-15 и IL-21, и, необязательно, по меньшей мере один компонент, который стимулирует TCR, в частности, OKT3, костимуляторные молекулы, фидерные клетки и пептид, содержащий аминокислотную последовательность по меньшей мере клинически значимого антигена.
Краткое описание фигур
На фиг. 1 представлено три графика, показывающие результаты анализа проточной цитометрией образцов экспансии МКПК с использованием смеси IL-2, IL-15 и IL-21 в комбинации с золедроновой кислотой. Образцы отбирали на различные временные точки, указанные выше на графиках. Измеренные сигналы представляют сигнал CD3 в направлении оси Y и сигнал гамма-дельта TCR в направлении к оси Х. Гамма-дельта Т-клетки находятся в прямоугольниках. Первоначально цветные изображения показывают интенсивности перекрывающихся сигналов по серой шкале. Процент клеток в прямоугольниках показан выше.
На фиг. 2 представлены результаты анализа проточной цитометрией образцов из МКПК, экспансированных с использованием смеси цитокинов в присутствии пептидов PRDM2. Большая левая панель показывает результаты по образцу в начале экспансии лимфоцитов, на правой панели представлены результаты анализа образца через 18 суток стимуляции. Клеточные сигналы разделяются на основе маркеров CD4/CD8. Небольшие панели справа показывают гейтинг лимфоцитов и клеток CD3+.
На фиг. 3 представлены результаты анализа проточной цитометрией тех же образцов, которые представлены на фиг. 2. Разделение клеточных сигналов проводили по маркеру IFN-γ и размеру (боковое светорассеяние/SSC).
На фиг. 4 показаны результаты анализа проточной цитометрией образцов экспансии МКПК с использованием смеси цитокинов и стимуляции INO80E и UCHL3. Клеточные сигналы гейтировали для лимфоцитов (4а), CD3+ (4b) и затем разделяли на основе сигнала CD8 и CD4 (4с).
На фиг. 5 показана продукция IFN-γ на популяции двойных негативных и CD8+ клеток после стимуляции INO80E или UCHL3.
На фиг. 6 представлены результаты анализа проточной цитометрией МКПК, экспансированных с использованием смеси цитокинов и пептидов INO80E и UCHL3. Клетки, стимулированные INO80E, анализировали на продукцию цитокинов CD107a (6d), CD127 (6e) и CD117 (6f).
На фиг. 7a-7f показаны результаты экспансии МКПК с использованием смеси цитокинов и стимуляции CMVpp65.
На фиг. 8 представлены результаты анализа IFN-γ после стимуляции экспансированных клеток с NY-ESO-1: фиг. 8а и 8b - нестимулированные на сутки 0 и сутки 18 соответственно. Фиг. 8b и 8d - стимулированные NY-ESO-1 на сутки 0 и сутки 18 соответственно.
На фиг. 9 показана продукция цитокинов клетками, эспансированными из МКПК, полученными от пациента с глиобластомой при стимуляции сурвивином снова на сутки 0 и сутки 18. Измеренными цитокинами являются IL-2, IFN-γ и TNF-α. На фиг. 9а представлены результаты для субпопуляции CD4+ Т-клеток, на фиг. 9b представлены результаты для субпопуляции двойных негативных Т-клеток, и на фиг. 9c - для субпопуляции CD8+ Т-клеток.
На фиг. 10 представлены результаты анализа фенотипов CD45RA и CCR7 лимфоцитов с использованием проточной цитометрии. Вновь лимфоциты измеряли на сутки 0 и через 18 суток после экспансии с использованием смеси цитокинов.
На фиг. 11 представлены результаты анализа влияния экспансии на фенотипы CD4+ клеток (TH1/TH2) и CD8+ Т-клеток.
На фиг. 12 представлены результаты анализа экспрессии цитокина CD107a клетками, экспансированными из периферической крови пациента с HPV. На фиг. 12a показана экспрессия CD107a при стимуляции пептидом HPV L1, на фиг. 12b представлен положительный контроль и на фиг. 12c представлены результаты без стимуляции (только среда). Процесс гейтинга CD8+ Т-клеток показан на фиг. 12d-12f.
На фиг. 13 представлены два графика, показывающие продукцию IFN-γ лимфоцитами, экспансированными без цитокинов, с IL-2, IL-15, IL-21 или с IL-7 и IL-2 и со стимуляцией NY-ESO-1 или сурвивином.
На фиг. 14 представлены три графика, показывающие продукцию IFN-γ лимфоцитами, экспансированными без цитокинов, с IL-2, IL-15, IL-21 или с IL-7 и IL-2 и со стимуляцией EBNA-1, EBNA-3a или CMVpp65.
На фиг. 15 представлены результаты определения проточной цитометрией Treg (регуляторных Т-клеток), которые были идентифицированы до и после экспансии Т-клеток с использованием смеси цитокинов. Слева направо: T-клетки гейтировали на CD4+ Т-клетки и затем на CD25high, означает высокую экспрессию рецептора IL-2 на активированных Т-клетках. Затем клетки гейтировали на IL-2R клетки (высокий CD125) и тестировали на экспрессию рецептора IL-7 (CD127) и Foxp3 (внутриклеточно).
На фиг. 16 представлены результаты определения проточной цитометрией процентного содержания PD-1+ Т-клеток в субпопуляции CD8+.
На фиг. 17 показан специфический лизис аутологичных В-клеток, стимулированных и стимулированных пептидами 1-12, экспансированными лимфоцитами.
На фиг. 18 представлены результаты анализа проточной цитометрией МКПК до экспансии, индуцированной IL-2/IL-15/IL-21, в присутствии ассоциированного с опухолями антигена NY-ESO-1. Вначале гейтировали CD3+ Т-клетки, затем CD3+ Т-клетки гейтировали на CD4+ и CD8+ Т-клетки.
На фиг. 19 представлены результаты анализа проточной цитометрией МКПК до экспансии, индуцированной IL-2/IL-15/IL-21, в присутствии ассоциированного с опухолями антигена NY-ESO-1. Вначале гейтировали CD3+ Т-клетки, затем CD3+ Т-клетки гейтировали на CD4+ и CD8+ Т-клетки.
На фиг. 20 показаны изображения культуры лимфоцитов, инфильтрирующих опухоль, культивированных in vitro с использованием цитокинов IL-2, IL-15 и IL-21 одной недели инкубации.
На фиг. 21 представлен обзор функциональной схемы анализа цитотоксичности экспансированных лимфоцитов против аутологичных опухолевых клеток с использованием включения радиоактивной метки (51Cr) и высвобождения радиоактивной метки.
На фиг. 22 представлены результаты анализа проточной цитометрией лимфоцитов, экспансированных из TIL, полученных от пациентов с глиобластомой. На фиг. 3(А) показано распределение фенотипов Т-клеток в экспансированных TIL из 16 TIL в специфические фенотипы: предшественники Т-клеток (CD45RA+CCR7+), Т-клетки центральной памяти (CD45RA-CCR7+), Т-клетки периферической памяти (CD45RA-CCR7-) и дифференциальные эффекторные Т-клетки (CD45RA+ CCR7-) по отдельности для основных фенотипов CD8+ (левая панель), CD4+ (правая панель) и двойные негативные Т-клетки (правая панель). Отдельные точки данных представляют процент конкретного фенотипа к базовому фенотипу. Данные показывают, что IL-2, LL-15 и IL-21 экспансируют TIL с фенотипом долговременной памяти, а также предшественники Т-клеток - которые могут обеспечить продолжительную иммунную защиту.
На фиг. 22 (В) показана экспрессия маркеров активации и истощения Т-клеток. Результаты сгруппированы в (А) согласно базовому фенотипу CD8+ (левая панель), CD4+ (правая панель) и двойные негативные Т-клетки (правая панель). Отдельные точки данных представляют процент клеток, экспрессирующих маркер, указанный на оси Х к базовому фенотипау. CD117 (с-kit) является маркером «стволовости», и обозначает Т-клетки с долговременной памятью, CD107a представляет маркер недавней дегрануляции Т-клеток. Данные показывают, что TIL, экспансированные с использованием IL-2, IL-15 и IL-21, экспрессируют маркеры (например, с-kit), которые обеспечивают долговременную память иммунных клеток и иммунный контроль.
На фиг. 23 представлены результаты анализа проточной цитометрией лимфоцитов (TIL), экспансированных из опухолевой ткани пациентов с раком поджелудочной железы. На левой панели показано распределение CD4+ Т-клеток в предшественниках Т-клеток (CD45RA+ CCR7+), Т-клетках центральной памяти (CD45RA-CCR7+), Т-клетках периферической памяти (CD45RA-CCR7-) и дифференцированных эффекторных Т-клетках (CD45RA+CCR7-). На правой панели показано распределение CD8+ клеток. Данные показывают, что IL-2, IL-15 и IL-21 экспансируют TIL с фенотипом долговременной памяти, а также предшественники Т-клеток - которые могут обеспечить долговременную иммунную защиту.
На фиг. 24 представлены результаты анализа проточной цитометрией лимфоцитов (TIL), экспансированных из опухолевой ткани пациентов с раком поджелудочной железы в отношении маркеров активации и истощения Т-клеток (4-1ВВ, LAG-3, TIM-3 и последующие). Результаты сгруппированы в соответствии с фенотипами CD4+/CD8+: CD4+ (верхняя панель), CD8+ (средняя панель), DN (нижняя панель). Отдельные точки данных представляют процент клеток, экспрессирующих маркер, указанный на оси Х, к базовому фенотипу. Данные показывают TIL, которые экспрессируют широкий ряд маркеров, указывающих на высокие противоопухолевые ответы и недавнее воздействие антигена. Молекула CD127 (IL-7R) опосредует факторы высокой выживаемости Т-клеток.
На фиг. 25 показано распределение длины TCR Т-клеток, экспансированных из опухолевой ткани пациентов с раком поджелудочной железы, определяемое подходом на основе ПЦР.
На фиг. 26 представлены результаты анализа внутриклеточной продукции цитокинов в CD4+, CD8 или DN Т-клетках в экспансированных лимфоцитах из глиобластомы. На графиках на фиг. 7B показан процент Т-клеток, продуцирующих цитокины IFN-γ и TNF-α, после стимуляции. На фиг. 12А показана максимальная стимуляция РМА/иономицином (положительный контроль) и фон только со средой. На фиг. 7В представлены результаты стимуляции синтетическими пептидами, полученными из антигенов, ассоциированных с опухолями, т.е. EGRvrIII, NY-ESO-1 или сурвивина. Данные показывают, что TIL, экспансированные с использованием IL-2, IL-15 и IL-21, от пациентов с глиобластомой содержат Т-клетки, которые реагируют на низкой частоте с известными ассоциированными с опухолями антигенами.
На фиг. 27 представлены результаты анализа внутриклеточной продукции цитокинов в CD4+, CD8 или DN Т-клетках в экспансированных лимфоцитах из раковой опухоли поджелудочной железы. На графиках на фиг. 8А показан процент Т-клеток, продуцирующих цитокины IFN-γ (верхняя панель) и TNF-α (нижняя панель), после стимуляции ассоциированными с опухолями антигенами, т.е. мезотелином, NY-ESO-1 или сурвивином: CD4+ (слева), CD8+ (в середине) и DN (справа). На фиг. 8B показаны примеры анализа проточной цитометрией со стимуляцией NY-ESO-1. Т-клетки, гейтированные на CD3+ и затем на CD8+, находятся в боковом светорассеянии (SSC) против продукции IFN-γ (верхний прямоугольник) или TNF-α (нижний прямоугольник). Показано, что TIL, экспансированные с использованием IL-2, IL-15 и IL-21, от пациентов с раком поджелудочной железы проявляют высокую реактивность с известными опухолевыми антигенами, т.е. NY-ESO-1.
На фиг. 28 представлены результаты анализа внутриклеточной продукции цитокинов в CD4+, CD8 или DN Т-клетках в экспансированных лимфоцитах из глиобластомы после стимуляции аутологичными опухолевыми клетками. На графиках на фиг. 9А показан процент Т-клеток, продуцирующих цитокины IFN-γ и TNF-α для CD4+ (левая панель), CD8+ (средняя панель) и DN (правая панель) Т-клеток. На фиг. 9B показаны примеры анализа проточной цитометрией клеток, стимулированных аутологичными опухолевыми клетками. Т-клетки, гейтированные на CD3+ и затем на CD4+ (верхний прямоугольник) или CD8+ (нижний прямоугольник), находятся в боковом светорассеянии (SSC) против продукции IFN-γ (верхний прямоугольник) и TNF-α (нижний прямоугольник). Показано, что TIL, экспансированные с использованием IL-2, IL-15 и IL-21, от пациентов с глиобластомой проявляют высокую реактивность с аутологичными опухолевыми клетками.
На фиг. 29 представлены результаты анализа внутриклеточной продукции цитокинов определения продукции TNF-α лимфоцитами, экспансированными с использованием смеси IL-2, IL-15 и IL-21. На верхней панели показан положительный контроль (максимальная стимуляция). На средней панели представлены результаты продукции цитокинов экспансированными Т-клетками, гейтированными по CD4+, в ответ на аутологичные опухолевые клетки (слева: все TIL, справа: TIL гейтированные на VB2+ Т-клетки). Нижняя панель: фоновая продукция во всей популяции TIL (слева) и в VB2+ TIL (справа). Данные показывают, что преимущественно экспансированные TCR VB семейства в IL-2, IL-15, IL-21 TIL (здесь: TCR VB2) направлены против аутологичных опухолевых клеток.
На фиг. 30 показан уровень INF-γ в лимфоцитах, экспансированных из опухолевой ткани поджелудочной железы, после стимуляции. TIL+опухоль обозначает стимуляцию экспансированных лимфоцитов аутологичными опухолевыми клетками. TIL+OKT3 обозначает стимуляцию лимфоцитов антителом против CD3. W6/32 представляет собой антитело, блокирующее CD8+ TIL. Антитело L243 блокирует CD4+ TIL. Данные показывают, что TIL, экспансированные с использованием смеси IL-2, IL-15 и IL-21, специфичны в отношении аутологичной опухоли пациентов.
На фиг. 31 представлены результаты анализа цитолитической реакции экспансированных TIL от пациентов с глиобластомой против аутологичных опухолевых клеток. Количество на оси абсцисс Х представляет отношение TIL к опухолевым клеткам. Процент по оси Y представляет количество погибших опухолевых клеток через 4 ч обработки экспансированными TIL, измеренный по высвобождению радиоактивной метки.
На фиг. 32 представлены результаты анализа цитолитической реакции экспансированных моноклональных Т-клеток и/или преимущественно экспансированных TIL от пациентов с глиобластомой против аутологичных опухолевых клеток. Количество на оси Х представляет отношение TIL к опухолевым клеткам. Процент на оси Y представляет число погибших опухолевых клеток через 4 ч обработки экспансированными TIL, измеренный по высвобождению радиоактивной метки.
На фиг. 32 представлены результаты анализа цитолитической реакции экспансированных TIL от пациентов с раком поджелудочной железы против аутологичных опухолевых клеток. Количество на оси абсцисс Х представляет отношение TIL к опухолевым клеткам. Процент по оси Y представляет количество погибших опухолевых клеток через 4 ч обработки экспансированными TIL, измеренный по высвобождению радиоактивной метки. Данные TIL, экспансированные с использованием смеси IL-2, IL-15 и IL-21, показали репертуар высокоспецифичных TCR и сильную цитотоксическую реакцию против аутологичных опухолевых клеток.
Подробное описание изобретения
Авторы настоящего изобретения обнаружили, что комбинация интерлейкинов IL-2, IL-15 и IL-21 обеспечивает значительное усовершенствование иммунотерапии лимфоцитами. Одним из основных преимуществ является то, что экспансия и стимуляция лимфоцитов, полученных от пациента под действием композиции комбинации по меньшей мере двух типов цитокинов, выбранных из IL-2, IL-15 и IL-21, специфически способствует генерации лимфоцитов, в частности, Т-клеток, которые являются клинически значимыми.
Согласно изобретению «клинически значимые лимфоциты» являются специфическими для и взаимодействуют с клинически значимыми антигенами. Существует три группы клинически значимых лимфоцитов, а именно опухолереактивные лимфоциты, реактивные лимфоциты при инфекционном заболевании и реактивные лимфоциты при аутоиммунном заболевании.
«Клинически значимые лимфоциты» также относятся к «обученным» антигеном лимфоцитам. Термин «клинически значимый» также используется для субпопуляций лимфоцитов. В частности, предпочтительные клинически значимые лимфоциты являются клинически значимыми Т-клетками или «обученными» антигеном Т-клетками.
«Клинически значимые антигены» по изобретению представляют антигены, участвующие в развитии болезни. Следовательно, клинически значимые антигены могут представлять ассоциированные с опухолями антигены (ТАА), ассоциированные с патогенами антигены (PAA) или аутоантигены. Опухолереактивные лимфоциты являются специфическими для и взаимодействуют с ТАА. Реактивные лимфоциты при инфекционном заболевании являются специфическими для и взаимодействуют с PAA, и реактивные лимфоциты при аутоиммунном заболевании являются специфическими для и взаимодействуют с аутоантигенами.
Согласно изобретению «антиген» (Ag) представляет любое структурное вещество, которое служит в качестве мишени для рецепторов адаптивного иммунного ответа, TCR или антитела соответственно. Антигены представляют, в частности, белки, полисахариды, липиды и их субструктуры, такие как пептиды. Липиды и нуклеиновые кислоты, в частности, являются антигенными в сочетании с белками или полисахаридами.
«Ассоциированные с патогенами антигены» (PAA) относятся к компонентам, таким как капсулы, клеточные стенки, жгутики и токсины патогенов, таких как бактерии, вирусы и другие микроорганизмы.
«Аутоантигены», как правило, представляют пептиды, олигопептиды, полипептиды или комплексы белков от индивидуума, которые распознаются иммунной системой того же индивидума. Этот эффект, как правило, приводит к развитию аутоиммунной болезни.
«Ассоциированные с опухолями антигены» или «ТАА» по изобретению представляют антигены, которые презентируются молекулами MHC класса I или МНС класса II или неклассическими молекулами MHC на поверхности опухолевых клеток. Как здесь используется, ТАА включает «специфичные для опухолей антигены», которые обнаруживаются только на поверхности опухолевых клеток, но не на поверхности нормальных клеток.
С помощью комбинации IL-2, IL-15 и IL-21 можно специфически индуцировать пролиферацию клинически значимых лимфоцитов в образце из организма, полученном от пациента, как показано в примерах. Способ по изобретению обеспечивает простой протокол экспансии клинически значимых лимфоцитов. Способ, в частности, преимущественен по сравнению с имеющимися протоколами в данной области техники, когда не требуются дендритные клетки. Кроме того, заявители настоящего изобретения смогли показать, что полученная популяции лимфоцитов после экспансии под действием смеси цитокинов комбинации по меньшей мере двух типов цитокинов, выбранных из IL-2, IL-15 и IL-21, содержит композицию лимфоцитов, которая является преимущественной для клинического применения. Например, композиция имеет высокий процент ТН1-хелперных Т-клеток, и практически отсутствуют ТН2-хелперные Т-клетки. Еще одно преимущество заключается в том, что практически отсутствует существенная экспансия регуляторных Т-клеток, которые могут привести к подавлению терапевтического действия популяции эспансированных лимфоцитов.
Таким образом, согласно первому аспекту настоящее изобретение относится к композиции, предназначенной для экспансии лимфоцитов, содержащей по меньшей мере два типа цитокинов, выбранных из интерлейкина-2 (IL-2), интерлейкина-15 (IL-15) и интерлейкина-21 (IL-21).
IL-2, IL-15 и IL-21 являются членами семейства цитокинов, каждый из которых имеет четыре альфа-спиральных цепи. IL-2 играет ключевую роль в основных функциях иммунной системы, толерантности и иммунитете, в основном посредством его прямого воздействия на Т-клетки. IL-2 индуцирует пролиферацию и дифференцировку Т-клеток в эффекторные Т-клетки и Т-клетки памяти.
IL-15 представляет собой цитокин, который в структурном отношении аналогичен IL-2. Как и IL-2, IL-15 связывается с и передает сигналы через комплекс, состоящий из бета-цепи рецептора IL-2/IL-15. IL-15 индуцирует активацию и пролиферацию Т-клеток, в частности, CD8+ Т-клеток (30), а также обеспечивает сигналы выживаемости для поддержания клеток памяти в отсутствии антигенов, поддерживает CD8+ Т-клетки и активирует моноциты. IL-15, по-видимому, регулирует пролиферацию иммунных эффекторных Т-клеток, а также их защиту от ингибирования ассоциированной с опухолью иммуносупрессии (31).
IL-21 представляет собой цитокин, который обладает высокими регуляторными эффектами на клетки иммунной системы, включая естественные клетки киллеры (NK) и цитотоксические Т-клетки. IL-21 обогащает Т-клетки центральной памяти фенотипом CD28+ CD127hi CD45RO+ и усиливает цитотоксичность цитотоксических Т-клеток. IL-21 может поддерживать Т-клетки в ранней фазе их дифференцировки и созревания (35).
Согласно изобретению композиция комбинации по меньшей мере двух типов цитокинов, выбранных из IL-2, IL-15 и IL-21, также относится к «смеси цитокинов».
В рамках изобретения, термин «интерлейкин-2» или «IL-2» относится к человеческому IL-2, который определяется последовательностью SEQ ID NO: 1 и ее функциональными эквивалентами. Функциональные эквиваленты IL-2 включают соответствующие субструктуры или слитые белки IL-2, которые сохраняют функции IL-2. Следовательно, определение IL-2 включает любой белок с идентичностью последовательности с SEQ ID NO: 1 по меньшей мере 80%, предпочтительно, по меньшей мере 90%, более предпочтительно, по меньшей мере 95%, наиболее предпочтительно, по меньшей мере 98%. Рекомбинантный человеческий IL-2, продуцированный E.coli в виде одной негликозилированной полипептидной цепи из 134 аминокислот и имеющий молекулярную массу 15 kDa, коммерчески доступен в лиофилизированной форме производства Prospec как CYT-209.
В рамках изобретения, термин «интерлейкин-15» или «IL-15» относится к человеческому IL-15 и его функциональным эквивалентам. Функциональные эквиваленты IL-15 включают соответствующие субструктуры или слитые белки IL-15, которые сохраняют функции IL-15. Следовательно, определение IL-15 включает любой белок с идентичностью последовательности с SEQ ID NO: 2 по меньшей мере 80%, предпочтительно, по меньшей мере 90%, более предпочтительно, по меньшей мере 95%, наиболее предпочтительно, по меньшей мере 98%. Рекомбинантный человеческий IL-2, продуцированный E.coli в виде одной негликозилированной полипептидной цепи из 114 аминокислот (и с N-концевым метионином) и имеющий молекулярную массу 12,8 kDa, коммерчески доступен в лиофилизированной форме производства Prospec как CYT-230.
В рамках изобретения, термин «интерлейкин-21» или «IL-21» относится к человеческому IL-21 и его функциональным эквивалентам. Функциональные эквиваленты IL-21 включают соответствующие субструктуры или слитые белки IL-21, которые сохраняют функции IL-21. Следовательно, определение IL-21 включает любой белок с идентичностью последовательности с SEQ ID NO: 3 по меньшей мере 80%, предпочтительно, по меньшей мере 90%, более предпочтительно, по меньшей мере 95%, наиболее предпочтительно, по меньшей мере 98%. Рекомбинантный человеческий IL-21, продуцированный E.coli в виде одной негликозилированной полипептидной цепи из 132 аминокислот и имеющий молекулярную массу 15 kDa, коммерчески доступен в лиофилизированной форме производства Prospec как CYT-408.
В рамках изобретения, «пептид может состоять из любого числа аминокислот любого типа, предпочтительно встречающихся в природе аминокислот, которые, предпочтительно, связаны пептидными связями. В частности, пептид содержит по меньшей мере 3 аминокислоты, предпочтительно, по меньшей мере 5, по меньшей мере 7, по меньшей мере 9, по меньшей мере 12 или по меньшей мере 15 аминокислот. Кроме того, не существует какого-либо верхнего предела для длины пептида. Тем не менее, предпочтительно, пептид по изобретению, не превышает в длине 500 аминокислот, более предпочтительно он не превышает в длине 300 аминокислот; еще более предпочтительно его длина составляет не более чем 250 аминокислот.
Таким образом, термин «пептид» включает «олигопептиды», которые, как правило, относятся к пептидам с длиной от 2 до 10 аминокислот, и «полипептиды», которые, как правило, относятся к пептидам с длиной более 10 аминокислот.
Термин «белок» относится к пептиду по меньшей мере из 60, по меньшей мере из 80, предпочтительно, по меньшей мере из 100 аминокислот.
Термин «слитый белок» по настоящему изобретению относится к белкам, созданных посредством соединения двух или более генов, кДНК или последовательностям, которые первоначально кодируют отдельные белки/пептиды. Эти гены могут встречаться в природе в одном и том же организме или различных организмах или могут представлять синтетические полинуклеотиды.
Связанность между двумя аминокислотными последовательностями или между двумя нуклеотидными последовательностями описывается параметром «идентичность последовательностей». Для целей настоящего изобретения степень идентичности последовательностей между двумя аминокислотными последовательностями определяется с использованием алгоритма Нидлмана-Вунша (Needleman и Wunsch, 1970, J. Mol Biol 48:443-453), реализованного в программе Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et a/., 2000, Trends Genet. 16: 276-277), предпочтительно версии 3.0.0 или более поздней версии. Используемыми необязательными параметрами являются штраф за открытие пробела, равный 10, штраф за продолжение пробела, равный 0,5, и матрица замещения EBLOSUM62 (версия BLOSUM62 для EMBOSS). Результат вычислений Needle, называемый «наиболее протяженная идентичность» (получаемый с использованием опции - nobrief), используется в качестве процента идентичности и рассчитывается следующим образом:
(идентичные остатки × 100)/(длина выравнивания - общее число пробелов в выравнивании).
Переходный термин «содержащий», который является синонимом терминов «включающий», «состоящий» или «характеризующийся», является включительным или открытым и не исключает дополнительных, неуказанных явно элементов или стадий способа. Переходное словосочетание «состоящий из» исключает любой элемент, стадию или ингредиент, не указанный в формуле изобретения, за исключением примесей, обычно связанных с этим. Когда фраза «состоящий из» появляется в части основы пункта формулы, а не сразу после преамбулы, то она ограничивает только элемент, изложенный в этой части; другие элементы не исключаются из пункта формулы в целом. Переходная фраза «состоящий по существу из» ограничивает объем формулы изобретения к указанным материалам или стадиям, «и которые действительно не влияют на основную и новую характеристику(и) заявленного изобретения. Выражение «состоящий по существу из» занимает промежуточное положение между формулой закрытого типа, написанной в закрытом формате, и формулой полностью открытого типа, написанной в открытом формате.
В рамках изобретения, «экспансия» или «клональная экспансия», означает продукцию дочерних клеток, которые все первоначально возникают из одной клетки. В клональной экспансии лимфоцитов все потомство имеет одну и ту же антигенную специфичность.
Согласно первому варианту осуществления изобретения композиция по первому аспекту включает два или три типа цитокинов. Дополнительные цитокины могут отрицательно повлиять на результаты экспансии, обеспеченной композицией по настоящему изобретению.
Альтернативно другие цитокины, используемые в дополнение к комбинации IL-2, IL-15 и IL-21, могут оказывать положительное влияние на популяцию лимфоцитов. Таким образом, композиция по первому аспекту настоящего изобретения может содержать больше цитокинов в дополнении к IL-2, IL-15 и IL-21. Примерами являются IL-1 бета, IL-4, GM-CSF, IL-12, IL-8, IL-17, TNF-α, IL-32. IL-1β участвует в праймировании, дифференцировке клеток в эффекторные В-клетки или Т-клетки после первого контакта с специфическим антигеном. IL-4 и GM-CSF принимают участие в стимуляции и/или праймировании дендритных клеток. IL-12 участвует в TH1 ответах. IL-18 стимулирует γδ-Т-клетки. IL-17 и TNF-α действуют провоспалительно. IL-32 также действует провоспалительно, опосредуя долговременные защитные иммунные ответы.
Согласно одному варианту осуществления первого аспекта настоящего изобретения композиция включает IL-2 и IL-15. Композиция также может включать IL-2 и IL-21. Альтернативно композиция может включать IL-15 и IL-21. Несмотря на то, уже два из цитокинов IL-2, IL-15 и IL-21, могут быть достаточными для получения популяции клинически значимых лимфоцитов, является предпочтительным использовать все три цитокина в композиции.
Согласно еще одному варианту осуществления композиция по первому аспекту находится в жидкой форме. В частности, композиция представляет собой клеточную культуральную среду. Согласно изобретению возможна любая известная клеточная культуральная среда. Не ограничивающие примеры клеточной культуральной среды представляют синтетическую среду, среду, полученную из сыворотки, плазмы или цельной крови или любую их комбинацию.
Согласно дополнительному варианту осуществления концентрация IL-2 в жидкой композиции находится в диапазоне от 10 до 6000 Е/мл. Международная единица (Е) является стандартной мерой для количества IL-2. Она определяется его способностью индуцировать пролиферацию клеток CTLL-2. Концентрации ниже 10 Е/мл является слишком низкой для достижения какого-либо значительного эффекта. Концентрация выше 6000 Е/мл может оказывать цитотоксический эффект. Концентрация IL-2 предпочтительно находится в диапазоне от 500 до 2000 Е/мл. Более предпочтительно концентрация IL-2 находится в диапазоне от 800 до 1100 Е/мл. Как показано в примерах, оптимальные результаты были получены при концентрации, равной примерно 1000 Е/мл.
Согласно дополнительному варианту осуществления первого аспекта концентрация IL-15 находится в диапазоне от 0,1 до 100 нг/мл. Диапазон концентраций следует тому же обоснованию, что для IL-2. Полагается, что концентрация ниже 0,1 нг/мл не оказывает существенного влияния на клетки. Концентрация выше 100 нг/мл может оказывать цитотоксический эффект. В предпочтительном варианте осуществления концентрация IL-15 находится в диапазоне от 2 до 50 нг/мл, более предпочтительно в диапазоне от 5 до 20 нг/мл. Наиболее предпочтительная концентрация составляет примерно 10 нг/мл.
В дополнительном варианте осуществления концентрация IL-21 находится в диапазоне от 0,1 нг/мл, предпочтительно в диапазоне от 2 до 50 нг/мл, более предпочтительно в диапазоне от 5 до 20 нг/мл.
Следует понимать, что согласно изобретению любой из указанных диапазонов концентраций одного из цитокинов может быть объединен с любым из диапазонов значений концентрации других цитокинов.
Согласно одному варианту осуществления комбинация включает смесь IL-15 и IL-21. Смесь предпочтительно включает каждый из IL-15 и IL-21 в диапазоне концентраций от 10 до 100 нг/мл. IL-15 и IL-21 могут обеспечить синергический эффект, особенно на субпопуляциях лимфоцитов в популяциях клеток предшественников, клеток памяти и эффекторов.
Согласно одному варианту осуществления первого аспекта комбинация содержит IL-2 в концентрации от 800 до 1000 Е/мл, и IL-15 и IL-21 в концентрации от 5 до 20 нг/мл. Согласно еще одному варианту осуществления настоящего изобретения композиция содержит IL-2 в концентрации примерно от 1000 Е/мл, и IL-15 и IL-21 в концентрации примерно 10 нг/мл.
Композиция IL-2, IL-15 и IL-21, в частности, полезна для стимуляции экспансии клинически значимых лимфоцитов в композиции лимфоцитов, в частности, в образце пациента. Как показано в примерах, заявители настоящего изобретения разработали способ получения специфически клинически значимых лимфоцитов из образца пациента.
Композиция IL-2, IL-15 и IL-21, в частности, полезна для стимуляции экспансии клинически значимых лимфоцитов в композиции лимфоцитов, в частности, в образце пациента. Как показано в примерах, заявители изобретения разработали способ снижения частоты PD1 и LAG3+ Т-клеток, где экспрессия PD1 и/или LAG3 служит в качестве маркера истощения Т-клеток, и не в качестве маркера «обученных» антигеном Т-клеток.
Композиция IL-2, IL-15 и IL-21, в частности, полезна для стимуляции экспансии клинически значимых лимфоцитов в композиции лимфоцитов, в частности, в образце пациента. Как показано в примерах, заявители изобретения разработали способ повышения частоты экспрессии 4-1ВВ в качестве маркера «обученных» антигеном Т-клеток.
Таким образом, согласно второму аспекту настоящее изобретение относится к способу получения популяции клинически значимых лимфоцитов, включающему стадии:
получение образца из организма млекопитающего, в частности, образца ткани или жидкости организма, содержащего по меньшей мере один лимфоцит и необязательно разделение клеток в образце из организма,
культивирование образца из организма in vitro для экспансии и/или стимуляции лимфоцитов в образце, где культивирование включает применение по меньшей мере двух типов цитокинов, выбранных из IL-2, IL-15 и IL-21,
и, необязательно, определение присутствия клинически значимого лимфоцита в культивированном образце.
По меньшей мере два типа цитокинов, выбранных из IL-2, IL-15 и IL-21, предпочтительно используют в концентрациях, указанных выше. Предпочтительно все три цитокины IL-2, IL-15 и IL-21 используются вместе.
Как показано в примерах, способ можно использовать для получения популяции опухолереактивных лимфоцитов, реактивных лимфоцитов при аутоиммунном заболевании или реактивных лимфоцитов при инфекционном заболевании. Предпочтительно, популяция лимфоцитов, полученная способом по второму аспекту, представляет популяцию опухолереактивных лимфоцитов.
Лимфоциты в целом включают множество различных лимфоцитов. Среди этих лимфоцитов могут быть присутствующие лимфоциты, которые имеют правильный рецептор для взаимодействия с клинически значимым антигеном, в частности, ассоциированным с опухолями антигеном, ассоциированным с инфекционным заболеванием или ассоциированным с аутоиммунным заболеванием антигеном. С помощью способа по изобретению данный клинически значимый лимфоцит, в частности, является сильно экспансированным. Однако другие лимфоциты, которые не обладают специфичностью к клинически значимому антигену, также подвергаются экспансии в способе по настоящему изобретению.
Таким образом, результат культивирования клеток из образца из организма с композицией, содержащей IL-2, IL-15 и/или IL-21, приводит к образованию популяции лимфоцитов, которая включает популяцию клинически значимых лимфоцитов. Определение присутствия клинически значимых лимфоцитов в культивированном образце является возможным, но не является необходимой стадией способа по второму аспекту настоящего изобретения. Можно использовать стадии, пригодные для подтверждения популяции экспансированных лимфоцитов, в качестве терапевтического средства.
Образец из организма можно отобрать из любой области организма, содержащей лимфоциты. Примерами образцов организма являются периферическая кровь, пуповинная кровь, костный мозг, лимфатические узлы, печень, плевральный экссудат, грудина, брюшная полость, синовиальная жидкость, брюшина, забрюшинное пространство, тимус и опухоль.
Образец лимфоцитов, полученный из опухоли, также называется лимфоцитами, инфильтрирующими опухоль (TIL). В рамках изобретения, термин «TIL» является аббревиатурой термина «лимфоциты, инфильтрирующие опухоль». TIL представляет любой тип лимфоцита, который находится в, на или около опухоли. TIL представляет любой тип лимфоцита, который находится в и около опухоли.
За счет их локализации в опухоли, TIL взаимодействуют с ассоцированными с опухолью антигенами. Следовательно, клинически значимые лимфоциты, в частности опухолереактивные лимфоциты могут быть экспансированы способом по изобретению без антигена для экспансии.
Образец из периферической крови также называется мононуклеарными клетками периферической крови (МКПК). В зависимости от типа заболевания предпочтительными могут быть другие образцы из организма.
В рамках изобретения, термин «млекопитающее» относится к любому млекопитающему, включая, не ограничиваясь этим, млекопитающих отряда Грызунов, таких как мыши и хомяки, и млекопитающих отряда Зайцеобразные, таких как кролики. Предпочтительно, чтобы млекопитающие происходили из отряда Хищные, включая подотряд Кошкообразные (кошки) и подотряд Псообразные (собаки). Более предпочтительно, чтобы млекопитающие происходили из отряда Парнокопытных, в том числе подсемейства Бычьи (коровы) и семейства Свиньи (свиньи) или отряда Непарнокопытных, в том числе семейства Лошадиные (лошади). Наиболее предпочтительно, что млекопитающие происходили из отряда Приматов, Ceboids или Simoids (обезьяны) или отряда Антропоиды (человек и обезьяны). Особенно предпочтительным млекопитающим является человек.
Согласно одному варианту осуществления второго аспекта изобретения млекопитающее, из организма которого получают образец, является человеком. Млекопитающее может иметь опухолевое заболевание или иметь риск развития опухолевого заболевания. Риск развития опухолевого заболевания включает высокий риск, средний риск и низкий риск. Млекопитающее, находящееся в таком предраковом состоянии, например, имеет предраковый очаг, который представляет морфологически атипичную ткань, которая является аномальной при микроскопическом исследовании, и в котором, вероятнее всего, будет развиваться рак, в отличие от нормального аналога.
Кроме того, млекопитающее может иметь инфекционное заболевание или иметь риск развития инфекционного заболевания. Риск развития инфекционного заболевания включает высокий риск, средний риск и низкий риск. Млекопитающее также может иметь аутоиммунное заболевание или риск развития аутоиммунного заболевания. Риск развития аутоиммунного заболевания включает высокий риск, средний риск и низкий риск. Например, высокий риск развития внутриклеточных инфекций (CMV, EBV, TB, HPV) имеет место при определенных генетических мутациях хозяина (дефекты рецепторов IFN-γ или приобретенные антитела, направленные против цитокинов, например, IL-12 или IFN-γ). Средний риск возникает при иммунной супрессии в результате применения кортикостероидов или лечения пациентов препаратами, направленными против TNF-α или TNF-α-рецепторов. Низкий риск может быть связан с сочетанной инфекцией, вызванной другими патогенами, или временным ослаблением состояния иммунной системы в результате большой операции. Подобные примеры представляют различные клинические проявления - в сочетании с генетическими маркерами - рассеянного склероза, редких неврологических заболеваний, например, нарколепсии, ревматоидного артрита, а также хронических аутоиммунных заболеваний, связанных с желудочно-кишечным трактом.
Если у млекопитающего имеется опухолевое заболевание или высокий риск развития опухолевого заболевания, то предпочтительным образцом из организма является периферическая кровь или сама опухоль. Как показано в примерах, лимфоциты периферической крови и опухоль можно обрабатывать способом по изобретению для обеспечения высоких противоопухолевых свойств. Если заболевание является аутоиммунным заболеванием, то предпочтительный образец из организма представляет периферическую кровь. Кроме того, когда заболевание является инфекционным заболеванием, то предпочтительным образцом из организма также является периферическая кровь. Как показано в примерах, в этих случаях клинически значимые лимфоциты могут быть экспансированы из периферической крови. Не связываясь с теорией, предполагается, что периферическая кровь содержит лимфоциты, которые были в контакте с клинически значимым антигеном, например, на опухоли или при инфекции.
Культивирование образца из организма in vitro для экспансии и/или стимуляции лимфоцитов может включать одну или более подстадий. Следовательно, в одном варианте осуществления культивирование in vitro включает первую стадию экспансии, включающую инкубацию в культуральной среде, содержащей IL-2, IL-15 и IL-21, пока лимфоциты не станут детектируемыми.
«Детектируемый» по изобретению означает, что лимфоциты, например, становятся видимыми, в частности, с помощью микроскопии. Лимфоциты, как правило, становятся детектируемыми с использованием обычной световой микроскопии при достижении титра 5×103 клеток/мл.
Детекция лимфоцитов может включать любой метод, известный в данной области, с помощью которого можно обнаружить присутствие лимфоцитов выше определенного порога. Первая стадия экспансии имеет цель мягко индуцировать пролиферацию клеток вместе со стимуляцией клеток смесью цитокинов.
Время инкубации на первой стадии экспансии находится в диапазоне от 6 ч до 180 суток. Широкий диапазон времени инкубации имеет место, в первую очередь, за счет того, что образцы от разных доноров могут вести себя очень по-разному. Также было показано, что лимфоциты, полученные из различных образцов организма, имеют различные скорости роста. Например, лимфоциты, полученные непосредственно из опухоли глиобластомы или злокачественной опухоли поджелудочной железы, растут очень по-разному. Лимфоциты, полученные из злокачественной опухоли поджелудочной железы, обнаруживаются уже в течение двух-пяти суток. Лимфоциты, полученные из глиобластомы, могут быть обнаружены только спустя одну-две недели. Следовательно, для лимфоцитов из других образцов организма может потребоваться еще больше времени, чтобы стать детектируемыми.
Предпочтительно время инкубации на первой стадии экспансии находится в диапазоне от 4 суток до 10 суток. Было показано, что для клеток периферической крови время инкубации примерно 7 суток является особенно пригодным для результата другой экспансии. Однако как упоминалось выше, в зависимости от образца экспансия всего за 4 суток может быть достаточной, или с другой стороны, может потребоваться примерно 10 суток или больше. За счет хороших результатов с МКПК, показанных в примерах, время инкубации в диапазоне от 6 до 8 суток, в частности, примерно семь суток является предпочтительным.
Согласно одному варианту осуществления настоящего изобретения культуральная среда на первой стадии экспансии включает по меньшей мере один антиген для экспансии. Антиген для экспансии представляет известный клинически значимый антиген или его фрагмент, мутант или вариант. В рамках изобретения, термин «мутант» определяется как аминокислотная последовательность, которая отличается от стандартной последовательности в результате вставки, делеции или замены по меньшей мере одной аминокислоты. Антиген для экспансии предпочтительно выбран из ТАА, PAA и аутоантигена.
Предпочтительно способ по изобретению включает многочисленные копии антигена для экспансии. Повышенное количество копий антигена для экспансии приводит к увеличению скорости экспансии клинически значимых лимфоцитов, в частности Т-клеток.
В одном варианте осуществления настоящего изобретения культуральная среда на первой стадии экспансии включает многочисленные антигены для экспансии. Предпочтительно, многочисленные антигены для экспансии включают известный клинически значимый антиген и один или более мутантов клинически значимого антигена. Вместо того, чтобы мутировать сам антиген, также можно мутировать молекулу MHC класса I/пептид, презентирующую антиген, в частности, пептид. Использование одного или более из дикого типа, варианта или мутантов клинически значимого антигена или молекул МНС класса I в качестве антигенов для экспансии приводит к получению разнообразной популяции лимфоцитов, в частности Т-клеток, реактивных по отношению к номинальному клинически значимому антигену.
Согласно предпочтительному варианту осуществления способа по второму аспекту образец из организма представляет опухоль и при культивировании не используется антиген для экспансии.
Опухолевую ткань, предпочтительно, дважды промывают перед разделением клеток в образце опухоли.
В еще одном предпочтительном варианте осуществления настоящего изобретения культуральная среда на первой стадии экспансии включает многочисленные антигены для экспансии. Имея многочисленные антигены, Т-клеточный продукт реагирует на более разнообразный репертуар Т-клеточного рецептора, как продемонстрировано Vβ-применением, ассоциированным с использованием стимулирующего антигена(ов).
В еще одном предпочтительном варианте осуществления настоящего изобретения культуральная среда на первой стадии экспансии включает многочисленные антигены для экспансии. Стимуляция Т-клеток из периферической крови приводит к получению Т-клетки, распознающей различные эпитопы, определяемые цитотоксичностью. Когда нативные Т-клетки отбирают из крови и стимулируют такими антигенами, то они приводят распознаванию различных эпитопов антигена.
Это отличается от заранее стимулированных Т-клеток или Т-клеток из опухоли, которые имеют тенденцию распознавать более ограниченное число или стандартное число эпитопов.
Выбор антигена для экспансии зависит от заболевания, подлежащего лечению. В частности, если популяция экспансированных клинически значимых лимфоцитов предназначена для использования для лечения опухолевых заболеваний, то антигеном для экспансии, добавляемым на первой стадии экспансии, предпочтительно является ТАА. Альтернативно, если заболевание, подлежащее лечению, является инфекционным заболеванием, то антиген для экспансии, добавляемый на первой стадии экспансии, предпочтительно представляет собой РАА. Кроме того, если популяция клинически значимых лимфоцитов предназначена для лечения аутоиммунного заболевания, то антиген для экспансии предпочтительно представляет собой аутоантиген.
Считается, что антиген для экспансии на первой стадии экспансии приводит к стимуляции клинически значимых лимфоцитов в смеси клеток уже на ранней стадии, и таким образом, вместе со смесью цитокинов усиливает экспансию клинически значимых лимфоцитов. Такую стимуляцию также называют антигенной активацией или антигенным «обучением».
За первой стадией экспансии может следовать вторая стадия экспансии, на которой клетки инкубируют с фидерными клетками и/или антителами против CD3 в дополнение к по меньшей мере двум типам цитокинов, выбранных из IL-2, IL-15 и IL-21. Экспансия с фидерными клетками и антителами против CD3 была описана в предшествующем уровне техники. Полагается, что фидерные клетки приводят к улучшению клеточного роста. Фидерные клетки представляют облученные клетки, которые не способны к пролиферации или пролиферируют только в незначительной степени. Фидерные клетки увеличивают число клеточных контактов в культуре и дополнительно питают культуры пролиферирующих и экспансирующихся клеток. Фидерные клетки предпочтительно представляют облученные МКПК. Аллогенные фидерные клетки происходят из другого организма, чем млекопитающее, подлежащее лечению экспансированными клинически значимыми лимфоцитами. Аутологичные фидерные клетки происходят от млекопитающего, подлежащего лечению.
Антитело против CD3 предпочтительно представляет антитело, определяемое как OKT3. OKT3 представляет собой мышиное моноклональное антитело, относящееся к иммуноглобулину изотипа IgG2a. Мишенью OKT3, CD3, является мультимолекулярный комплекс, обнаруживаемый только на зрелых Т-клетках. Взаимодействие между T-клетками, OKT3 и моноцитами вызывает активацию Т-клеток in vitro.
Предпочтительно фидерные клетки используются в комбинации с CD3 и цитокинами IL-2, IL-15 и IL-21. Согласно одному варианту осуществления способа по второму аспекту отношение фидерных клеток к лимфоцитам находится в диапазоне от 1:1 до 1:100. Предпочтительно отношение фидерных клеток к лимфоцитам находится в диапазоне от 1:2 до 1:50. Как показано в примерах, очень низкие уровни фидерных клеток достаточны для эффективной экспансии клинически значимых лимфоцитов, в частности, клинически значимых Т-клеток.
В примерах отношении 1:10 достаточно для поддержания роста и экспансии лимфоцитов. Следовательно, считается, что значение в диапазоне от 1:5 до 1:20 не приведет к другому результату. Низкое количество фидерных клеток имеет по меньшей мере два преимущества. Во-первых, имеется меньше рассеивающих клеточных сигналов, что позволяет получить более однородные и надежные результаты экспансии. Во-вторых, меньшее количество фидерных клеток приводит к меньшему содержанию экзогенного материала в продукте для иммунотерапии, полученным способом, т.е. в популяции клинически значимых лимфоцитов.
Вторая стадия экспансии, необязательно, также включает антиген для экспансии в культуральной среде. Предпочтительно клинически значимый антиген или его фрагмент добавляют в среду на второй стадии экспансии.
Согласно предпочтительному варианту осуществления второго аспекта настоящего изобретения, способ включает стадию рефокусирования. Стадия рефокусирования включает культивирование в культуральной среде, содержащей рефокусирующие клетки. Рефокусирующие клетки представляют собой клетки от млекопитающего, в частности, человека, из организма которого был получен образец. Следовательно, рефокусирующие клетки представляют аутологичные клетки, которые были обработаны по меньшей мере одним рефокусирующим антигеном. Любой антиген для экспансии, как здесь определено, также можеь быть использован в качестве рефокусирующего антигена. Предпочтительно в способе один или более рефокусирующих антигенов идентичны одному или более антигенов для экспансии.
Рефокусирующие клетки представляют собой клетки, которые были инкубированы с рефокусирующим антигеном в течение по меньшей мере 30 мин или более, например, по меньшей мере 1 ч, по меньшей мере 2 ч, по меньшей мере 5 ч или по меньшей мере 10 ч. После инкубации с рефокусирующим антигеном рефокусирующие клетки облучают по меньшей мере при 40 Гр. Предпочтительно клетки облучают при по меньшей мере 45 Гр или более, например, по меньшей мере 50 Гр, и особенно предпочтительно при 55 Гр. За счет этой обработки антиген-специфические Т-клетки более эффективно экспансируются, распознают опухоли, патогены или аутоиммунные клетки и могут обеспечивать защиту против раковых клеток или предраковых очагов.
Время рефокусирующей стадии находится в диапазоне от 1 до 6 суток, предпочтительно от 1 до 3 суток. Несмотря на то, рефокусирующая стадия может быть довольно короткой, это приводит к значительному улучшению выхода экспансированных клинически значимых лимфоцитов, в частности, клинически значимых лимфоцитов, экспансированных из периферической крови.
Также число рефокусирующих клеток по сравнению с числом лимфоцитов является довольно низким. В частности, отношение рефокусирующих клеток к лимфоцитам находится в диапазоне от 1:1 до 1:100. Установлено, что наилучшие результаты достигаются, если рефокусирующая стадия проводится сразу же после первой стадии экспансии и затем следует вторая стадия экспансия. Такая последовательность стадий культивирования является особенно пригодной для получения популяции клинически значимых лимфоцитов, в частности Т-клеток.
Согласно одному варианту осуществления способа первая стадия экспансии включает одновременное добавление IL-2, IL-15 и IL-21 к клеточной культуре. Для этого, можно приготовить смесь IL-2, IL-15 и IL-21 и добавить ее в среду для культивирования клеток или IL-2, IL-15 и IL-21 добавляют по отдельности, но одновременно в среду для культивирования клеток. Как показано в примерах, одновременное применение IL-2, IL-15 и IL-21 приводит к предпочтительной композиции лимфоцитов в популяции экспансированных лимфоцитов.
Для того, чтобы изменить состав популяции экспансированных лимфоцитов в способе по настоящему изобретению сначала можно добавить только IL-21 в среду для культивирования клеток на первой стадии экспансии. После добавления IL-21, можно добавить IL-15 и IL-2 одновременно или последовательно. Предпочтительно IL-15 добавляют вторым, и IL-2 добавляют в последнюю очередь. В альтернативном варианте осуществления IL-15 добавляется в качестве первого цитокина с последующим одновременным добавлением IL-2 и IL-21 или последовательным добавлением IL-2 и IL-21. Например, IL-21 добавляют вторым, и IL-2 добавляется последним.
Культуральная среда на первой и/или второй стадии экспансии может содержать меньшей мере один антиген для экспансии. Антиген для экспансии может представлять, например, фрагмент известного ТАА. Возможные ТАА в качестве антигена для экспансии представляют, например, NY-ESO-1, опухолевый антиген тирозиназу, связанный с тирозиназой белок (TRP)-1, TRP-2, VEGFR-2 и член семейства белков MAGE, теломеразу, p53, HER2/Neu, мезотелин, карциноэмбриональный антиген, сурвивин, EGFRvIII, VEGF, САМРАТН 1-антиген, CD22, CA-125, муцин-1, альфа-1-гетопротеин, PSMA.
Фрагмент ТАА, в частности, представляет пептид. Такой пептид может представлять, например, пептид, содержащий по меньшей мере восемь последовательных аминокислот аминокислотной последовательности, которая по меньшей мере на 80% идентична аминокислотной последовательности SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7.
SEQ ID NO: 4 представляет собой аминокислотную последовательность известного ассоциированного с опухолями антигена NY-ESO-1. SEQ ID NO: 5 представляет аминокислотную последовательность известного ассоциированного с опухолями антигена сурвивина. SEQ ID NO: 6 представляет аминокислотную последовательность известного ассоциированного с опухолями антигена мезотелина. SEQ ID NO: 7 представляет аминокислотную последовательность ассоциированного с опухолями антигена EGFRvIII.
Антиген для экспансии может представлять, например, фрагмент известного PAA. Возможные PAA в качестве антигенов для экспансии представляют, например, CMVpp65 или EBV (EBNA-3, EBNA-1), HPV-16/33 Е6, Е7 или L1. Фрагмент PAA является, в частности, пептидом. Такой пептид может представлять, например, пептид, содержащий по меньшей мере восемь последовательных аминокислот аминокислотной последовательности, которая по меньшей мере на 80% идентична аминокислотной последовательности SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10 или SEQ ID NO: 11, которая является аминокислотной последовательностью ассоциированных с известными патогенами антигенов CMVpp65, EBNA-3, EBNA-1 и HPV-L1 соответственно.
Антиген для экспансии может представлять, например, фрагмент известного PAA. Возможные аутоантигены в качестве антигенов для экспансии представляют, например, PRDM2, UCHL3, INO80E, SLC12A6 и рилин. Фрагмент PAA является, в частности, пептидом. Такой пептид может представлять, например, пептид, содержащий по меньшей мере восемь последовательных аминокислот аминокислотной последовательности, которая по меньшей мере на 80% идентична аминокислотной последовательности SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15, которая является аминокислотной последовательностью аутоантигенов PRDM2, INO80E, UCHL3 и DNaseB соответственно.
На стадии культивирования могут быть добавлены дополнительные компоненты, такие как дополнительные цитокины, в частности, во время первой или второй стадии экспансии или на стадии рефокусирования.
Кроме того, на стадии культивирования может быть добавлено промоторное соединение, в частности, на первой или второй стадии экспансии или на стадии рефокусирования. В предпочтительном варианте осуществления промоторное соединение добавляют на первой стадии экспансии. В рамках изобретения, промоторное соединение представляет собой соединение, которое в процессе экспансии приводит к увеличению определенной субпопуляции лимфоцитов. Предпочтительным промоторным соединением является золедроновая кислота. Золедроновая кислота способствует экспансии гамма-дельта Т-клеток. Еще одно предпочтительное промоторное соединение способствует экспансии В-клеток.
Согласно одному варианту осуществления на стадии культивирования, в частности, на первой или второй стадии экспансии или на стадии рефокусирования добавляют костимулирующее соединение. Костимулирующее соединение представляет, например, лиганд для сигналов Т-клеток, опосредованных CD28. Примерами лигандов для сигналов Т-клеток, опосредованных CD28, являются члены надсемейства В7, в частности, B7-1 (CD80) и В7-2 (CD86).
Согласно одному варианту осуществления способа по второму аспекту тестирование на присутствие клинически значимых лимфоцитов в образце экспансированных лимфоцитов включает применение антигенов для оценки.
Для тестирования популяцию лимфоцитов инкубируют с антигенами для оценки. Антиген для оценки может представлять антиген, входящий в объем определения антигена для экспансии. Например, известный клинически значимый антиген или его фрагмент добавляют в качестве антигена для оценки в культуральную среду популяции лимфоцитов для стимуляции лимфоцитов. После инкубационного периода измеряется параметр, указывающий на активацию клинически значимых лимфоцитов.
Предпочтительно антиген для оценки добавляется к лимфоцитам в форме, связанной с комплексом МНС класса I. Например, антигены для оценки могут быть презентированы лимфоцитам, связанными с декстрамерами MHC. Декстрамеры MHC представляют собой флуоресцентно меченные мультимеры MHC, связанные с декстрозным остовом.
Использование мультимерных структур MHC имеет то преимущество, что многочисленные копии антигена могут быть презентированы одному лимфоциту, тем самым усиливая стимуляцию антигеном для оценки. Альтернативно известные клинически значимые антигены могут быть презентированы культивированному образцу в качестве антигенов для оценки в виде клеток, экспрессирующих клинически значимый антиген в виде трансгена. Кроме того, можно добавить по меньшей мере частично генетически совпадающие аллогенные клетки, которые презентируют клинически значимые антигены на клеточной поверхности экспансированным лимфоцитам.
Параметр, указывающий на присутствие клинически значимых лимфоцитов, может представлять, например, продукцию одного или более цитокинов, в частности, продукцию IFN-γ или TNF-α. Дополнительные параметры, указывающие на присутствие клинически значимых лимфоцитов, представляют повышенную пролиферацию клеток, повышенную цитотоксичность, усиленную клеточную сигнализацию и/или повышенное внутриклеточное фосфорилирование. Определение этих параметров известно в данной области техники и показано в примерах.
Предпочтительно в дополнение к применению антигенов для оценки, полученных из известных клинически значимых антигенов, также возможно провести тестирование на клинически значимые лимфоциты, специфичные для млекопитающего, подлежащего лечению. Для этого, клетки, в частности опухолевые клетки, которые были получены от того же млекопитающего, что и экспансированные лимфоциты, используются для презентации антигенов для оценки. Используя эти аутологичные клетки в качестве презентирующих антигенов для оценки можно тестировать присутствие клинически значимых лимфоцитов, специфичных для клинически значимых антигенов, которые не обязательно являются известными клинически значимыми антигенами.
В одном варианте осуществления согласно второму аспекту настоящего изобретения антигены для оценки, презентированные культивированному образцу, находятся в форме, выбранной из клеток, в частности опухолевых клеток, полученных от того же млекопитающего, что и культивированный образец (аутологичные клетки) по меньшей мере частично генетически совпадающих аллогенных клеток, в частности опухолевых клеток или клеток, экспрессирующих клинически значимые антигены в виде трансгена.
Согласно дополнительному варианту осуществления способ тестирования на присутствие клинически значимых лимфоцитов включает контактирование лимфоцитов с по меньшей мере одним антигеном для оценки и определение изменения в одном из следующих событий: в продукции цитокинов, в частности, продукции IFN-γ или TNF-α, пролиферации клеток, цитотоксичности, передаче сигналов и/или внутриклеточном фосфорилировании.
Тестирование этих параметров можно комбинировать с проточной цитометрией и клеточным сортингом. Следовательно, можно также выделить популяцию клинически значимых лимфоцитов, в частности, популяцию опухолереактивных лимфоцитов из популяции экспансированных лимфоцитов. Выделенную популяцию клинически значимых лимфоцитов можно культивировать дополнительно или непосредственно использовать для иммунотерапии.
Способ по второму аспекту настоящего изобретения приводит к образованию популяции лимфоцитов, которая включает популяцию клинически значимых лимфоцитов. Клинически значимые лимфоциты, входящие в состав популяции экспансированных лимфоцитов, могут представлять любой тип лимфоцитов.
Лимфоциты включают B-клетки, NK-клетки и Т-клетки. Согласно одному варианту осуществления клинически значимый лимфоцит представляет собой В-клетку. Согласно одному варианту осуществления клинически значимый лимфоцит представляет NK-клетку.
Согласно третьему аспекту, изобретение относится к клинически значимому лимфоциту, полученному способом по второму аспекту, где клинически значимый лимфоцит представляет Т-клетку, NK-клетку или В-клетку.
Т-клетка предпочтительно выбрана из хелперной Т-клетки (TH-клетки или CD4+ Т-клетки), в частности, TH1-клетки, цитотоксической Т-клетки (ТС-клетки или CD8+ Т-клетки), в частности, CD8+CXCR3+ Т-клетки, Т-клетки памяти, в частности, Т-клетки центральной памяти (ТCM-клетка), стволовой Т-клетки памяти (TSCM-клетки) или Т-клетки периферической памяти (TPM-клетки), гамма-дельта Т-клетки (γδ-Т-клетки), NK-T-клетки, ассоциированной со слизистой инвариантной Т-клетки (MAIT), двойной негативной Т-клетки (CD3+CD4-CD8- T-клетки).
Согласно одному варианту осуществления клинически значимый лимфоцит представляет лимфоцит, который экспрессирует молекулы, способствующие поступлению в ткани, в частности, опухоль или инфицированную или воспаленную ткань (например CXCR3). Согласно еще одному варианту осуществления клинически значимый лимфоцит представляет лимфоцит, который обогащен в отношение маркеров любой долговременной памяти, в частности CD117 и с-kit, и цитолитических реакций клеток иммунной системы, в частности CD107a. Как было пояснено выше, популяция экспансированных лимфоцитов содержит не только клинически значимые лимфоциты, но и другие лимфоциты, которые не распознают клинически значимые антигены.
Считается, что клинически значимые и другие лимфоциты в культуре, полученной способом по второму аспекту, принимают участие в обеспечении терапевтического эффекта. Согласно одному варианту осуществления по третьему аспекту настоящее изобретение относится к лимфоциту, полученному способом по второму аспекту, который экспрессирует молекулы и цитокины, способствующие образованию комбинации лимфоцитов, пригодных для медицинского применения, в том числе и иммунотерапии. Комбинация лимфоцитов, пригодных для медицинского применения, предпочтительно содержит предшественники Т-клеток, клетки TCM, TSCM и/или TPM.
Согласно одному варианту осуществления лимфоцит, полученный способом по второму аспекту, экспрессирует молекулы и цитокины, которые способствуют экспансии клинически значимых лимфоцитов. Согласно еще одному варианту осуществления лимфоцит, полученный способом по второму аспекту, продуцирует цитокины, выбранные из IFN-γ, TNF-α, IL-2, IL-17 и любой их комбинации. Согласно одному варианту осуществления лимфоцит представляет CD3+CD4-CD8-Т-клетку.
Согласно четвертому аспекту настоящее изобретение относится к популяции лимфоцитов, полученной по второму аспекту настоящего изобретения, содержащую популяцию клинически значимых лимфоцитов.
Популяция лимфоцитов может состоять из популяции клинически значимых лимфоцитов. Популяция клинически значимых лимфоцитов может быть моноклональной олигоклональной или поликлональной.
В одном варианте осуществления популяция клинически значимых лимфоцитов является поликлональной и реагирует на многочисленные антигены или на различные эпитопы одного и того же антигена. Предпочтительно популяция клинически значимых лимфоцитов реагирует на различные антигены.
Лимфоциты, в частности, Т-клетки, отвечающие на многочисленные антигены, могут предотвратить риск рецидива развития предраковых клеток, опухолевых клеток и патогенов, тем самым снижая риск их «ускользания» от иммунного ответа.
Популяция лимфоцитов по четвертому аспекту имеет композицию различных фенотипов лимфоцитов, в частности фенотипов Т-клеток, которые являются полезными для иммунотерапии.
Популяция лимфоцитов имеет низкий процент регуляторных Т-клеток. Регуляторные Т-клетки, как известно, подавляют терапевтическую функцию популяции лимфоцитов. Согласно одному варианту осуществления четвертого аспекта в популяции лимфоцитов процент Treg в расчете к общему количеству Т-клеток составляет менее 5%, предпочтительно менее 3%.
Кроме того, большинство TH-клеток в популяции лимфоцитов представляют фенотип TH1. Согласно одному варианту осуществления настоящего изобретения процентное содержание Th1-клеток в расчете к общему числу ТН-клеток, составляет по меньшей мере 10%, предпочтительно, по меньшей мере 50%, более предпочтительно, по меньшей мере 70%.
В популяции лимфоцитов процент цитотоксических CD8+ Т-клеток увеличивается, о чем свидетельствует увеличение доли CXCR3+ клеток. Согласно одному варианту осуществления настоящего изобретения процентное содержание CXCR3+ клеток в расчете к общему количеству CD8+ Т-клеток составляет по меньшей мере 10%, по меньшей мере 50%, более предпочтительно, по меньшей мере 70%.
Кроме того, популяция лимфоцитов может содержать повышенное количество Т-клеток, которые недавно контактировали с их антигеном, как, например, идентифицированные фенотипом 4-1ВВ+. Согласно одному варианту осуществления четвертого аспекта процент 4-1ВВ+ Т-клеток в расчете к общему количеству Т-клеток составляет по меньшей мере 1%, предпочтительно, по меньшей мере 2%, более предпочтительно, по меньшей мере 2,5%. Согласно одному варианту осуществления процент CD107+ клеток в расчете к общему количеству Т-клеток составляет по меньшей мере 1%, предпочтительно, по меньшей мере 2%, более предпочтительно, по меньшей мере 2,5%. CD117+ Т-клетки ассоциированы с популяцией клеток долговременной памяти.
CXCR3+ фенотип CD8+ Т-клеток дополнительно ассоциирован с проникновением в ткани и, таким образом, может быть, в частности, полезен для иммунотерапии рака. Кроме того, популяция лимфоцитов может содержать достаточный процент CD3+CD4-CD8- клеток. Эти двойные негативные Т-клетки обладают высокой специфичностью к антигену-мишени, поскольку они зависят от корецептора CD4+ или CD8+ и продуцируют воспалительные цитокины. Таким образом, они являются цитотоксическими.
Согласно одному варианту осуществления популяция лимфоцитов содержит процент CD3+CD4-CD8- клеток, в расчете к общему количеству Т-клеток составляющий по меньшей мере 1%, предпочтительно, по меньшей мере 3%, более предпочтительно, по меньшей мере 5%. Согласно еще одному варианту осуществления процент гамма-дельта-Т-клеток в расчете к общему количеству Т-клеток в популяции лимфоцитов составляет по меньшей мере 1%, предпочтительно, по меньшей мере 3%, более предпочтительно, по меньшей мере 5%. Гамма-дельта Т-клетки обладают таким эффектом, что они распознают клетки, находящиеся в стрессовом состоянии, трансформированные клетки, инфицированные клетки, например, CMV+ клетки-мишени. Гамма-дельта Т-клетки также перекрестно распознают зараженные вирусами и трансформированные клетки.
Согласно одному варианту осуществления популяция лимфоцитов включает следующие признаки:
процент Treg в расчете к общему количеству Т-клеток составляет менее 5%, предпочтительно менее 3%;
процент TH1-клеток в расчете к общему количеству TH-клеток составляет по меньшей мере 50%, предпочтительно, по меньшей мере 70%, более предпочтительно, по меньшей мере 80%,
процент CXCR3+ Т-клеток в расчете к общему количеству CD8+ Т-клеток составляет по меньшей мере 50%, предпочтительно, по меньшей мере 70%, более предпочтительно, по меньшей мере 80%,
процент 4-1ВВ+ Т-клеток в расчете к общему количеству Т-клеток составляет по меньшей мере 1%, предпочтительно, по меньшей мере 2%, более предпочтительно, по меньшей мере 2,5%,
процент CD117+ Т-клеток в расчете к общему количеству Т-клеток составляет по меньшей мере 1%, предпочтительно, по меньшей мере 2%, более предпочтительно, по меньшей мере 2,5%,
процент CD3+CD4-CD8- клеток в расчете к общему количеству Т-клеток составляет по меньшей мере 1%, предпочтительно, по меньшей мере 3%, более предпочтительно, по меньшей мере 5%; и
процент γδT-клеток в расчете к общему количеству Т-клеток составляет по меньшей мере 1%, предпочтительно, по меньшей мере 3%, более предпочтительно, по меньшей мере 5%.
Согласно одному варианту в популяции лимфоцитов процент предшественников Т-клеток (CD45RA+ CCR7+) в расчете к общему количеству Т-клеток составляет по меньшей мере 1%, предпочтительно, по меньшей мере 2%, более предпочтительно, по меньшей мере 3%. Ранее было показано, что Т-клетки центральной памяти связаны с успехом Т-клеточной терапии.
Клетки центральной памяти продуцируют несколько цитокинов, полезных для терапии, обеспечивают хороший ответ памяти. Однако клетки центральной памяти не проникают хорошо в ткани. В одном варианте осуществления процент клеток периферической памяти (CD45RA- CCR7-) в расчете к общему количеству Т-клеток составляет по меньшей мере 2%, предпочтительно, по меньшей мере 5%, более предпочтительно, по меньшей мере 10%. Клетки периферической памяти показывают высокую продукцию цитокинов и хорошее проникновение в ткани. Таким образом, данные клетки, в частности, являются пригодными для иммунотерапии рака.
Также терминально дифференцированные Т-клетки (CD45RA+ CCR7-) способны проникать в ткани. Кроме того, эти клетки показывают продукцию терапевтически пригодных цитокинов. Согласно одному варианту осуществления процент эффекторных Т-клеток (CD45RA+ CCR7-) в расчете к общему количеству Т-клеток составляет по меньшей мере 1%, предпочтительно, по меньшей мере 3%, более предпочтительно, по меньшей мере 5%. Процент предшественников Т-клеток (CD45RA+ CCR7+) в расчете к общему количеству Т-клеток, может составлять по меньшей мере 1%. Предпочтительно процентное содержание составляет по меньшей мере 2%, более предпочтительно по меньшей мере 3%. Предшественники Т-клеток демонстрируют только продукцию цитокинов и слабо проникают в ткани. Однако эти клетки могут превращаться обратно в Т-клетки с эффектом памяти на протяжении всей жизни.
Популяцию лимфоцитов согласно пятому аспекту можно дополнительно охарактеризовать внутриклеточной продукцией цитокинов после стимуляции антигеном для оценки, имеющей значение, по меньшей мере в два раза превышающее стандартное отклонение без стимуляции антигеном для оценки. Кроме того, стимуляция антигеном для оценки приводит к значению индукции CD107a, которое по меньшей мере в два раза выше стандартного отклонения без стимуляции антигеном для оценки.
Согласно этим параметрам популяция лимфоцитов и/или популяция клинически значимых лимфоцитов представляют пригодные продукты для иммунотерапии для лечения рака, инфекционных заболеваний и аутоиммунных заболеваний.
Согласно пятому аспекту настоящее изобретение относится к иммунотерапии для лечения или профилактики опухолевого заболевания, инфекционного заболевания или аутоиммунного заболевания у млекопитающего, включающей стадии получения популяции клинически значимых лимфоцитов по второму аспекту настоящего изобретения, где образец из организма, полученный от указанного млекопитающего, и введения популяции клинически значимых лимфоцитов указанному млекопитающему. Инфекционное заболевание может быть любым известным инфекционным заболеванием, вызванным каким-либо известным патогеном.
Опухолевое заболевание по изобретению может представлять любой тип рака, включая следующие типы рака: острый лимфоцитарный лейкоз, острый миелоидный лейкоз, альвеолярную рабдомиосаркому, рак костей, рак головного мозга, рак молочной железы, рак заднего прохода, рак анального канала или прямой кишки, рак глаза, рак внутрипеченочных желчных протоков, рак суставов, рак шеи, желчного пузыря или плевры, рак носа, полости носа или среднего уха, рак вульвы, хронический лимфоцитарный лейкоз, хронический миелоидный лейкоз, рак шейки матки, глиому, лимфому Ходжкина, рак гортаноглотки, рак почки, рак гортани, рак печени, рак легких, злокачественную мезотелиому, меланому, множественную миелому, рак носоглотки, неходжкинскую лимфому, рак яичников, рак брюшины, сальника, рак брыжейки, рак поджелудочной железы, рак глотки, рак предстательной железы, рак прямой кишки, почечно-клеточный рак, рак кожи, рак мягких тканей, рак яичка, рак щитовидной железы, рак мочеточника, рак мочевого пузыря и рак органов желудочно-кишечного тракта, например, такой как рак пищевода, рак желудка, рак поджелудочной железы, рак желудка, рак тонкого кишечника, желудочно-кишечную карциноидную опухоль, рак ротовой полости, рак толстой кишки и гепатобилиарный рак. Предпочтительными видами рака является глиобластома и рак поджелудочной железы.
Для того, чтобы избежать иммунных эффектов на клинически значимые лимфоциты, пациенты с раком могут «кондиционироваться» перед введением Т-клеток. Кондиционирование имеет три цели. Во-первых, для того, чтобы обеспечить больше пространства для популяции экспансированных лимфоцитов, во-вторых, чтобы удалить отрицательные эффекторы, и третье увеличить продукцию факторов роста, которые могут способствовать быстрой экспансии и выживаемости Т-клеток, т.е. продукцию аутологичных IL-7 и IL-15.
Клинически значимые лимфоциты могут быть смешаны с фармацевтически приемлемым носителем с получением фармацевтической композиции, которая также находится в объеме настоящего изобретения. В одном варианте осуществления клинически значимые лимфоциты могут быть аутологичными для пациента, т.е. клинически значимые лимфоциты получают от пациента и затем вводят тому же пациенту.
Введение аутологичных клеток пациенту может привести к пониженному отторжению клеток хозяина по сравнению с введением неаутологичных клеток. Альтернативно клетки хозяина представляют аллогенные клетки, т.е. клетки получают от первого пациента и вводят второму пациенту, который отличается от первого пациента, но оба относятся к одному и тому же виду. Например, аллогенные клинически значимые лимфоциты можно получить от человека-донора и ввести человеку-реципиенту, который отличается от донора.
Для применения на практике способов, раскрытых здесь, эффективное количество клинически значимых лимфоцитов, описанных здесь, или их композиций, вводят пациенту (например, человеку, больному раком, пациенту с инфекционным заболеванием, пациенту с аутоиммунным заболеванием) подходящим путем, например, таким как внутривенное введение. Клетки могут быть введены инъекцией, катетером или тому подобное. При необходимости дополнительные лекарственные средства (например, цитокины) можно также ввести совместно или последовательно. Любые клетки или их композиции могут быть введены пациенту в эффективном количестве. В рамках изобретения, термин «эффективное количество» относится к количеству соответствующего агента (например, клеткам или их композиции), который при введении обеспечивают желаемый терапевтический эффект у пациента. Определение того, какое количество клеток или композиций, описанных здесь, обеспечивает желаемый терапевтический эффект будет очевидно специалисту в данной области техники. Например, смотри ссылки 2-5. Эффективные количества варьируют, как это было признается специалистами в данной области техники, в зависимости от конкретного состояния, подлежащего лечению, тяжести состояния, индивидуальных параметров пациента, включая возраст, физическое состояние, размер, пол и массу тела, продолжительности лечения, характера сопутствующей терапии (если таковая имеется), конкретного пути введения и подобных факторов, находящихся в пределах знаний и опыта практикующего врача. В некоторых вариантах осуществления настоящего изобретения эффективное количество ослабляет, смягчает, снимает, уменьшает симптомы или задерживает прогрессирование требуемого заболевания или расстройства у пациента.
«Введение» относится к физическому введению композиции, содержащей клетки или фармацевтической композиции, описанной здесь, пациенту, с использованием любого из различных способов и систем доставки, известных специалистам в данной области техники.
Введение популяции опухолереактивных лимфоцитов предпочтительно представляет введение в организм пациента локально в непосредственной близости от опухоли или в саму опухоль. Альтернативно популяцию опухолереактивных лимфоцитов вводят в кровоток. Другие клинически значимые лимфоциты предпочтительно вводят в кровоток.
Согласно одному варианту осуществления настоящего изобретения пациенту вводят дозу клинически значимых лимфоцитов, содержащую по меньшей мере примерно, 4×106, 4,5×106, 5×106, 5,5×106, 6×106, 6,5×106, 7×106, 7,5×106, 8×106, 8,5×106, 9×106, 9,5×106, 10×106, 12,5×106, 15×106, 20×106, 25×106, 30×106, 35×106, 40×106, 45×106, 50×106, 60×106, 70×106, 80×106, 90×106 клеток на килограмм массы тела {при необходимости можно использовать другие диапазоны}.
Иммунотерапия согласно пятому аспекту популяции клинически значимых лимфоцитов:
приводит к регрессии раковых клеток у млекопитающего;
препятствует перерождению предраковых очагов в злокачественные очаги;
приводит к быстрому старению опухолевых клеток или предраковых клеток;
приводит к удалению позитивных на аутоантиген клеток;
приводит к гибели, остановке роста или сдерживанию патогенов;
препятствует развитию раковых стволовых клеток; и/или
индуцирует остановку роста раковых клеток или клеток, экспрессирующих аутоантигены.
Согласно шестому аспекту настоящее изобретение относится к композиции по первому аспекту настоящего изобретения для применения в медицине, в частности, для лечения и профилактики инфекционного заболевания, аутоиммунного заболевания или опухолевого заболевания.
Согласно одному варианту осуществления шестого аспекта применение включает получение популяции клинически значимых лимфоцитов способом по второму аспекту настоящего изобретения.
Согласно одному варианту осуществления композиции по шестому аспекту применение включает иммунотерапию по пятому аспекту настоящего изобретения. Как обсуждалось выше, конкретные цитокины в смеси цитокинов не обязательно должны быть использованы одновременно, а могут быть добавлены на другой временной точке.
Согласно седьмому аспекту настоящее изобретение обеспечивает набор для применения в медицине, в частности, для лечения или профилактики инфекционного заболевания, аутоиммунного заболевания или опухолевого заболевания, где набор содержит IL-2, IL-15 и IL-21. Набор дополнительно необязательно содержит, по меньшей мере, один компонент, который стимулирует TCR, в частности, OKT3, костимуляторные молекулы, фидерные клетки и пептид, содержащий аминокислотную последовательность, клинически значимого антигена. Предпочтительно набор содержит все указанные компоненты.
Изобретение дополнительно описывается следующими примерами.
Примеры
Пример 1 - протокол экспансии лимфоцитов с использованием мононуклеарных клеток периферической крови
A) Материалы и оборудование
i) Оборудование
24-луночный планшет (Becton, Dickinson (BD), REF 353504)
Стерильный скальпель
Стерильные пинцеты
Medimachine (устройство для гомогенизации тканей), (BD, номер по каталогу: 340588)
Medicon, 50 мкм, (BD, номер по каталогу: 340591)
Filcons, 200 мкм (BD, номер по каталогу: 340613)
Ламинарный шкаф (ламинарный шкаф биологической безопасности 2 класса)
Низкотемпературная морозильная камера, -80°C
Холодильник
Центрифуга
ii) Расходные материалы
Перчатки (латекс)
Лабораторный халат
Стерильные центрифужные пробирки, 15 мл
Наконечники для пипеток
Пипетки
Контейнер для отходов
iii) Реагенты
RPMI 1640 (Gibco, REF 61870-044)
Cellgro, (CellGenix, номер по каталогу: 20801-0100)
Смешанная сыворотка крови человека группы АВ (Innoative Research, IPLA-SerAB-13458)
Эмбриональная телячья сыворотка (Gibco, REF: 26140-079)
Анти-CD3-антитела (ОКТ3), (BioLegend, номер по каталогу: 317304)
Человеческий IL-2 (Prospec, номер по каталогу: CYT-209-b)
Человеческий IL-15 (Prospec, номер по каталогу: CYT-230-b)
Человеческого IL-21 (Prospec, номер по каталогу: CYT-408-b)
Pest (антибиотики)
Амфотерицин
В) Процедура
Аферезис проводили у здорового донора, праймированного NY-ESO-1. После разделения компонентов крови продукт, содержащий лейкоциты, отделяют от остальной части образца. Клетки суспендируют в среде Cellgro, содержащей 5% смешанной сыворотки крови человека группы АВ, 1000 Е/мл IL-2, 10 нг/мл IL-15 и 10 нг/мл IL-21. Среда дополнительно содержала 10 мкмоль пептида NY-ESO-1 в качестве антигена для экспансии. Концентрация клеток из. Экспансия лимфоцитов из периферической крови включает стадию стимуляции облученными аутологичными МКПК, стимулированными представляющим интерес антигеном. Для этого аутологичные МКПК стимулировали в течение 2 ч с использованием 10 мМ пептида NY-ESO-1 при комнатной температуре и затем облучали при 55 Гр. Стимулированные облученные аутологичные МКПК добавляли в культуру лимфоцитов на 7 сутки и ресуспендировали в свежей культуральной среде, содержащей 5% человеческой смешанной сыворотки крови человека группы АВ, с цитокинами в концентрациях, указанных выше. На сутки 10 клетки подвергали экспансии с CellGro с добавлением 5% смешанной сыворотки крови человека группы AB и цитокинов. Антитела к OKT3 добавляли в концентрации 30 нг/мл в ту же самую культуральную среду, описанную выше, плюс облученные фидерные клетки (55Gy) в соотношении 1:10 (отношение фидерные клетки:Т-клетки), пептид и цитокины. На сутки 17-20 культивированные клетки собирали для анализа или переносили пациенту.
Пример 2 - протокол экспансии лимфоцитов с использованием мононуклеарных клеток периферической крови
Процедура примера 2 идентична процедуре, описанной в примере 1, за исключением того, что донором был пациент, которого вакцинировали NY-ESO-1.
Пример 3 - протокол экспансии лимфоцитов с использованием мононуклеарных клеток периферической крови
Пример 3 идентичен примеру 1, за исключением того, что донор был пациентом, опухоль которого уже экспрессировала TAA NY-ESO-1.
Пример 4 - гамма-дельта Т-клетки могут быть обогащены экспансированными лимфоцитами под действием цитокинов IL-2, IL-15 и IL-21
Экспансию осуществляют согласно протоколу, описанному в примере 1, с той разницей, что добавляли золедроновую кислоту к культуре клеток в концентрации 5 мкМ. Известно, что золедроновая кислота способствует экспансии TCR гамма-дельта Т-клеток. Как показано на фиг. 1, данные экспериментальные условия приводят к сильному повышению TCR гамма-дельта Т-клеток как по частоте, так и в абсолютных значениях. На фиг. 1 приведены изображения проточной цитометрии экспансированной культуры на различные временные точки. Следовательно, в первые сутки экспансии 3,68% клеток несут гамма-дельта TCR. На вторые сутки уже отмечается незначительное увеличение. Удивительно, что через 7 суток экспансии почти 50% Т-клеток представляют γδ-субпопуляцию.
Пример 5 - экспансия лимфоцитов с использованием смеси цитокинов индуцирует двойные негативные Т-клетки (CD3+CD4-CD8-)
Лимфоциты получали от пациента с нарколепсией. Экспансию проводили, как описано в примере 1, но с пептидом PRDM2 в качестве антигена для экспансии и стимуляции. Культивированные клетки тестировали на фенотип Т-клеток на сутки 1 и сутки 18. На фиг. 2 представлены результаты проточной цитометрии этих образцов. В результате вначале фильтруют лимфоциты и затем фильтруют CD3+ лимфоциты. Затем эти клетки дополнительно анализируют на присутствие CD4 и CD8. Из панелей можно видеть, что через 1 сутки только 13% клеток находятся в состоянии двойного негативного фенотипа. Большинство клеток представляют CD4+ клетки. Через 18 суток экспансии под действием смеси цитокинов 92% клеток представляют двойные негативные клетки (CD3+CD4-CD8-) Т-клетки.
Кроме того, тестировали индукцию продукции IFN-γ экспансированными лимфоцитами при стимуляции пептидом PRDM2. Как показано на фиг. 3, на сутки 1 только 0,89% клеток продуцируют IFN-γ при стимуляции PRDM2. В противоположность образец, отобранный на сутки 18, показывает достоверно более высокую популяцию PRDM2-специфических Т-клеток, продуцирующих цитокин. Поскольку большинство Т-клеток находятся в состоянии CD3+CD4-CD8-, то это показывает, что протокол экспансии приводит к образованию клинически значимых двойных негативных Т-клеток.
Пример 6 - сортированные на декстрамере клетки продуцируют IFN-γ в ответ на аутологичные EBV-LCLS, нагруженные пептидным и белковым антигенами
Протокол экспансии согласно примеру 1 проводили с кровью от двух разных пациентов с нарколепсией снова с PRDM2 в качестве пептида для экспансии. В двух разных экспериментальных условиях для каждого пациента добавляли один из пептидов DNAseB или PRDM2 к смеси цитокинов в культуральную среду. CD3+CD4-CD8- Т-клетки и обычные CD8+ Т-клетки, которые были ограничены MHC и направлены против PRDM2 или DNAseB, сортировали проточной цитометрией и тестировали, насколько они распознают естественно процессированные и представленные эпитопы. Т-клетки от одних и тех же пациентов стимулировали пептидами или рекомбинантными белками, и оценивали продукцию IFN-γ. Результаты эксперимента приведены в таблице 1:
Таблица 1
Измеренные значения представляют концентрацию IFN-γ в пг/мл. Результаты данного эксперимента показывают, что смесь цитокинов IL-2, IL-15 и IL-21 в комбинации со специфическим антигеном может экспансировать клинически значимые Т-клетки, в частности, Т-клетки, специфичные для антигена в периферической крови. Т-клетки могут преимущественно находиться в так называемой популяции DN CD3+CD4-CD8- Т-клеток, и эти Т-клетки обладают высокой функциональной активностью, они продуцируют IFN-γ и распознают с биологической и медицинской точки зрения соответствующие мишени.
Пример 7 - анализ лимфоцитов, экспансированных под действием смеси цитокинов и ассоциированных с опухолями антигенов
Процедуру экспансии проводили, как описано в примере 1, за исключением того, что вместо NY-ESO-1 использовали INO80E и UCHL3 в качестве антигена для экспансии. Через 18 суток экспансии клетки стимулировали INO80E или UCHL3 и анализировали проточной цитометрией. Результаты проточной цитометрии приведены на фиг. 4 и 5. На фиг. 4A показан сигнал клеток, разделенных боковым и передним светорассеянием. Лимфоциты гейтируют, как показано черным эллиптическим кругом. Затем отфильтрованные лимфоциты снова фильтруют на присутствие CD3. Затем CD3+ клетки дополнительно анализировали разделением по присутствию или отсутствию CD8 и CD4. В данном эксперименте 41% клеток представляют CD8+, 29,6% клеток являются CD4+, и 26,5% представляют двойные негативные клетки. Затем двойные негативные и CD8+ клетки тестировали на продукцию IFN-γ при стимуляции антигенами-мишенями INO80E и UCHL3. Следует отметить, что объективно Т-клетки определяют с использованием комплексов МНС класс 1/пептид. В соответствии с результатами, представленными на фиг. 5A, 1,4% CD8+ клеток продуцируют IFN-γ при стимуляции INO80E, но также 0,56% двойных негативных Т-клеток продуцируют IFN-γ при стимуляции (смотри фиг. 5B). Аналогичные результаты были получены для активации с использованием UCHL3, как показано на фиг. 5: 0,34% CD8+ клеток продуцирует IFN-γ. Кроме того, 0,45% двойных негативных клеток продуцирует IFN-γ (смотри фиг. 5D).
Клетки, стимулированные INO80E, дополнительно анализировали на продукцию цитокинов. На фиг. 6А-6С вновь показано гейтирование CD8+ Т-клеток, продуцирующих IFN-γ. Анализ клеток, продуцирующих CD107a, CD127 (IL-7R) и CD117, приведен на фиг. 6D-6F. Серые сигналы характерны для всей популяции CD3+CD8+ Т-клеток (независимо от антигенной специфичности), черные сигналы - для CD3+CD8+ Т-клеток, которые являются антигенспецифичными. Результаты анализа показывают, что реактивные с ТАА CD8+ Т-клетки экспрессируют CD107a, маркер, ассоциированный с цитотоксичностью, и CD127 (рецептор IL-7R, опосредующий сигналы выживаемости), но не CD117, маркер «стволовости» Т-клеток.
Пример 8 - экспансия МКПК с использованием смеси цитокинов и пептида CMVpp65
МКПК получали от пациента с глиобластомой и подвергали экспансии со смесью цитокинов IL-12, IL-15 и IL-21, как описано в примере 1, но в комбинации с пептидом CMVpp65. Результаты данного эксперимента показывают, что стимуляция пептидом CMVpp65 в комбинации со смесью цитокинов IL-2, IL-15 и IL-21 приводит к сильной экспансии специфических Т-клеток с высокой аффинностью к антигену (тетрамерный анализ). Результаты показаны на фиг. 7A-7D. APC-CMV bzw. PE-CMV и FITC-CMV обозначают i) идентичны молекулам МНС класса I-HLA-0201, ii) идентичные пептиды. Но молекула MHC мутирована. Единственным различием является мутация в молекуле MHC - которая детектирует Т-клетки с различной аффинностью. Тетрамеры CMV мутированы по-разному. APC-CMV (средняя аффинность, мутация в положении 245; между PE-CMV (высокая аффинность) и FITC-CMV (дикого типа, сравнительно низкая аффинность). Данные показывают, что мутантные тетрамеры, которые позволяют рецепторам Т-клеток только с высокой аффинностью связываться, детектируют Т-клетки с высокой аффинностью (также Т-клетки с низкой и средней аффинностью). Как полагается, Т-клетки с высокой аффинностью опосредуют более сильные иммунные эффекторные функции и являются более эффективными в удалении опухолевых клеток и/или патогенов.
Пример 9 - анализ частоты опухолереактивных Т-клеток после экспансии лимфоцитов из периферической крови с использованием смеси цитокинов и NY-ESO-1
МКПК получали от пациента с раком поджелудочной железы. Эксперимент проводили, как описано в примере 1. На фиг. 8 показаны результаты анализа проточной цитометрией образцов экспансии на сутки 0 и сутки 18. Несмотря на то, что на сутки 1 продукция IFN-γ при стимуляции NY-ESO-1 составляла только 1,85, данная концентрация резко возрастала до 9,25 на сутки 18 (смотри фиг. 8В и 8D). Таким образом, количество специфических Т-клеток к NY-ESO-1 резко возрастает в процессе экспансии.
Пример 10 - экспансия сурвивин-реактивных Т-клеток из периферической крови от пациентов с раком
МКПК получали от пациента с глиобластомой и экспансировали с использованием смеси цитокинов IL-2, IL-15 и IL-21, как описано в примере 1, но вместе с известным ТАА сурвивином. Вновь клетки анализировали на сутки 1 и через 18 суток культивирования с помощью проточной цитометрии. Перед анализом экспансированные клетки стимулировали сурвивином. Клетки были сгруппированы в субпопуляции CD4+, CD8+ и двойные негативные Т-клетки. В данных субпопялциях клеток определяли концентрацию IL-2, IFN-γ и TNF-α. На фиг. 9А представлены результаты для CD4+ клеток, на фиг. 9B - результаты для двойных негативных клеток и на фиг. 9С - результаты для CD8+ клеток. Результаты можно обобщить следующим образом: отсутствуют детектируемые Т-клеточные ответы, определяемые по продукции цитокинов, на временную точку 0 (T0). В противоположность через 18 суток экспансии обнаруживают интенсивную продукцию цитокинов в ответ на стимуляцию сурвивином, что подтверждает присутствие сурвивин-специфических Т-клеток. В этой связи следует отметить, что Т-клеточные ответы, как правило, очень трудно индуцировать против сурвивина.
Пример 11 - анализ фенотипа экспансированных лимфоцитов
МКПК были получены от пациента с глиобластомой. Экспансию проводили, как описано в примере 1. Образцы, отобранные на сутки 0 и сутки 18, анализировали на присутствие CD45RA и CCR7 с использованием проточной цитометрии. Результаты показаны на фиг. 10A и фиг. 10B. Для этого эксперимента клетки были сгруппированы в следующие субпопуляции. Положительные сигналы для CD45RA и CCR7 в верхней правой части графика обозначают предшественники клеток. CCR7+CD45RA- внизу справа соответствуют клеткам центральной памяти. CD45RA положительный сигнал с CCR7 - в вверху слева представляют эффекторные клетки и отрицательный сигнал в обеих нижних левых частях представляют клетки периферической памяти. При сравнении фиг. 10A и фиг. 10B, очевидно, что количество клеток центральной памяти за счет экспансии при использовании смеси цитокинов резко возрастает, т.е. динамика составляет от 3,72 до 21,1. Количество клеток периферической памяти немного увеличивается, в то время как количество эффекторных клеток резко снижается. Число предшественников клеток лишь незначительно уменьшается с 65,4 до 57,4. Следовательно, экспансия с комбинацией цитокинов согласно изобретению обогащает Т-клетками центральной памяти.
Пример 12 - анализ дифференцировки различных субпопуляций Т-клеток при экспансии с использованием смеси цитокинов IL-2, IL-15 и IL-21 вместе с различными ТАА
МКПК от пациентов с раком поджелудочной железы были обработаны, как описано в примере 1, с использованием различных антигенов: GPI, который представляет клеточный поверхностный, связанный фрагмент мезотелина, сурвивина и NY-ESO-1. Результаты приведены в следующей таблице 2:
Таблица 2
В первой колонке показана анализированная субпопуляция Т-клеток: CD4+, CD8+, CD4- и CD8-. Во второй колонке приводится антигенный стимул. В последующих колонках представлен процент клеток центральной памяти, предшественников, дифференцированных эффекторных клеток и клеток периферической памяти на сутки 0 и сутки 18 по результатам различных экспериментов. Соответственно, некоторые антигены, такие как мезотелин, особенно регулируют экспансию предшественников клеток и определяемые CD45RA+ CCR7+ клетки и клетки центральной памяти, определяемые CD45RA-CCR7+.
Пример 13 - обогащение предшественников Т-клеток и экспрессия с-kit
МКПК от пациентов с глиобластомой подвергали экспансии, следуя протоколу примера 1, с пептидами антигенов (EGRvIII, NY-ESO-1 или сурвивин). Клетки, стимулированные теми же пептидами, анализировали проточной цитометрией, и результаты приведены в таблице 3:
Таблица 3
Количественные данные представляют процентное содержание популяций Т-клеток в исходном CD4+, CD8+ или двойном негативном фенотипе для каждого из соответствующих антигенов на сутки 18 по сравнению с временной точкой 0 (начало экспансии). Обнаружено обогащение субпопуляциями предшественников Т-клеток, определяемые CD45RA+ CCR7+, ассоциированные с антигеном и сильной экспрессией с-kit (CD117). C-kit является маркером Т-клеток с признаками «своловости». CD117+ Т-клетки ассоциированы с обеспечением популяции клеток долговременной памяти. Также наблюдается сильная индукция маркера цитотоксичности/дегрануляции CD107a в стимулированных Т-клетках.
Пример 14 - протокол экспансии с использованием смеси цитокинов и пептида ТАА приводит к положительным на 4-1ВВ и TIM-3 Т-клеткам
МКПК получали от пациентов с раком поджелудочной железы и экспансировали, как описано в примере 1. Вновь пептиды ТАА получали из GPI, NY-ESO-1 и сурвивина. С использованием проточной цитометрии анализировали присутствие различных маркеров. Маркеры представляли: 4-1ВВ, CD25, CD127, CTLA-4, LAG3, PD1 и TIM3. Результаты приведены в таблице 4:
Таблица 4
В таблице 4 Т0 обозначает количество отдельных субпопуляций, указанных в колонке 2, до экспансии (T0). Ag представляет данные для 18-суточной антигенной стимуляции и экспансии под действием цитокинов. Значения 4-1ВВ и значения TIM3 указывают на количество «обученных» испытуемым антигеном Т-клеток. Установлено, в частности, что количество 4-1ВВ+ Т-клеток сильно увеличилось в некоторых экспериментах и клеточных субпопуляциях. Например, при стимуляции субпопуляций CD4+ антигеном NY-ESO-1 имеет место 200-кратное увеличение количества 4-1ВВ+ Т-клеток (от 0,03 до 5,96).
Пример 15 - подробный анализ клеточных маркеров в лимфоцитах, экспансированных из периферической крови пациентов с глиобластомой
Эксперимент проводили, следуя протоколу, описанному в примере 1, с EGVRVIII, NY-ESO-1 или сурвивином, соответственно. Результаты приведены в таблице 5.
Таблица 5
Аналогично лимфоциты разделяют по присутствию CD4+ или CD8+ клеток. Количественные данные в таблице относятся к процентному содержанию клеток, положительных в отношении отдельных маркеров, представленных во второй колонке таблицы, на T0 или через 18 суток экспансии (Ag). Вновь для большинства пациентов обнаружена сильная индукция 4-1ВВ+ Т-клеток.
Пример 16 - анализ лимфоцитов, экспансированных от пациента с раком поджелудочной железы и от пациента с глиобластомой
МКПК получали от пациента с раком поджелудочной железы и от пациента с глиобластомой. Лимфоциты подвергали экспансии, следуя протоколу, описанному в примере 1. Культуру лимфоцитов анализировали проточной цитометрией против различных маркеров. Результаты представлены в таблице 6:
Таблица 6
В первой колонке указано, какая субпопуляция лимфоцитов отфильтрована. Во второй колонке указаны соответствующие тестированные маркеры. Если не указан ни один маркер, то эта строка представляет процент от общего числа клеток с маркером для фильтрования CD3+ в расчете на общее количество клеток и CD4+, CD8+ или двойных негативных клеток. Вновь Т0 обозначает культуру до экспансии и TH - время сбора клеток на сутки 18. Количественные данные представляют процентное содержание клеток, несущих выбранные маркеры в колонке 2 или колонке 1 соответственно. Следует отметить, что большинство CD4+ клеток после экспансии является ТН1-положительным. При раке поджелудочной железы количество CD4+ клеток повышается с 22,2 до 92,1%. При глиобластоме результаты несколько менее выражены и повышение составляет от 9,64 до 68,1% CD4+ клеток. Аналогично имеется высокая экспрессия CXCR3+ в CD8+ Т-клетках после экспансии на уровне 96,8% при раке поджелудочной железе и на уровне 85,5% при глиобластоме. Следовательно, практически все CD8+ клетки представляют CXCR3+.
Кроме того, отмечается сдвиг от терминально дифференцированных Т-клеток в субпопуляции предшественников или Т-клеток центральной памяти.
На фиг. 11 представлены графики по результатам проточной цитометрии эксперимента по определению TH17, TH1, TH1* и TH2 в образце от пациента с раком поджелудочной железы. Вначале клетки гейтировали на CCR6, а затем на CCR3 и CCR4 соответственно.
Пример 17 - экспансия Т-клеток памяти, специфичных для определенных антигенов в отсутствии стимуляции данными антигенами
МКПК от пациентов с раком поджелудочной железы были экспансированы, как описано в примере 1, с ассоциированным с опухолями антигеном NY-ESO-1. Полученные клетки стимулировали в течение 4 ч со следующими ассоциированными с опухолями антигенами: CMV, EBNA-3a, INO80E, мезотелин, NY-ESO-1, сурвивин и UCHL3. С использованием проточной цитометрии определяли процент Т-клеток, продуцирующих цитокины. Количественные данные представлены в таблице 7 для различных субпопуляций Т-клеток: CD8+, CD4+ и двойных отрицательных клеток. Были тестированы следующие цитокины: IFN-γ, IL-2 и TNF. Интересно отметить, что не только стимуляция с NY-ESO-1 приводила к Т-клеткам, продуцирующим цитокины и, следовательно, опухолереактивным Т-клеткам, но также и стимуляция другими антигенами, которые не использовались в процессе экспансии. Также стимуляция антигенами вирусных мишеней (CMV и EBNA-3а) приводила к Т-клеткам, продуцирующим цитокины, показывающих присутствие Т-клеток, специфичных для этих мишеней.
Таблица 7
экспансии
Пример 18 - цитотоксичность после специфической экспансии под действием HPV L1
В этом примере периферическую кровь получали от пациента, который страдал тяжелой формой инфекции HPV (HPV33 и HPV56). Стимуляцию проводили пептидом HPV L1 и смесью цитокинов, содержащей IL-2, IL-15 и IL-21. Через 18 суток экспансии клетки стимулировали пептидом L1 и проводили анализ проточной цитометрией. Результаты этого анализа показаны на фиг. 12. На фиг. 12D-12F показано гейтирование CD3+ и CD8+ лимфоцитов соответственно. На фиг. 12A, 12B и 12C прямоугольник ограничивает область, показывающую клетки, которые экспрессируют цитокин CD107a, маркер дегрануляции/цитотоксичности, который является антигенспецифичным. На фиг. 12А представлены результаты, полученные с пептидом L1, на фиг. 12B - положительный контроль и фиг. 12C - только среда в качестве отрицательного контроля. Следовательно, имеет место увеличение в проценте клеток, продуцирующих CD107a, от 0,77 до 2,23.
Пример 19 - Т-клетки, экспансированные с использованием смеси цитокинов и опухолевых антигенов, распознают аутологичные опухолевые клетки
МКПК от пациента с глиобластомой стимулировали пептидами NY-ESO-1 и пептидами CMVpp65. Периферическую кровь от пациента с глиобластомой обрабатывали, следуя протоколу, описанному в примере 4, где в двух экспериментах стимулирующим пептидом был NY-ESO-1 или CMVpp65. Вновь через 18 суток проводили анализ продукции цитокинов с использованием различных антигенов для стимуляции или аутологичных опухолевых клеток. Было установлено, что антигенспецифическая экспансия Т-клеток при использовании пептидов и смеси цитокинов приводит к экспансии Т-клеток, направленных против стимулирующей мишени, а также и против собственных аутологичных опухолевых клеток пациента. Такая реакционная способность отсутствовала до экспансии Т-клеток с использованием NY-ESO-1 и цитокинов. Данные приведены в таблице 8. Количественные данные представляют процент Т-клеток, присутствующих в популяции родительских Т-клеток.
Таблица 8
8
5
17
9
1
17
2
2
17
Пример 20 - сравнение экспансии лимфоцитов при использовании комбинаций двух других цитокинов и стимуляции ТАА
Периферическую кровь получали от пациентов с раком поджелудочной железы и обрабатывали, следуя протоколу, описанному в примере 4. В различных экспериментальных условиях использовали NY-ESO-1 или сурвивин вместе со смесью цитокинов. Кроме того, аналогичные эксперименты проводили без добавления цитокинов или с комбинацией IL-7 и IL-2. Через 18 суток экспансии клетки тестировали на продукцию ими IFN-γ при стимуляции NY-ESO-1 или смесью пептидов сурвивина. Результаты представлены на фиг. 13. На фиг. 13 показана существенно повышенная продукция IFN-γ и таким образом повышенное количество антигенспецифических лимфоцитов после экспансии с использованием IL-2, IL15 и IL-21 по сравнению с композицией других цитокинов или без цитокинов.
Пример 21 - сравнение экспансии лимфоцитов с использованием комбинаций двух других цитокинов и стимуляции ТАА
Эксперимент по протоколу примера 20 повторяли с вирусными антигенами EBNA-1, EBNA-3a и CMVpp65. Результаты представлены на фиг. 14. На фиг. 14 показана существенно повышенная продукция IFN-γ и таким образом повышенное количество антигенспецифических лимфоцитов после экспансии с IL-2, IL15 и IL-21 по сравнению с композицией других цитокинов или без цитокинов.
Пример 22 - анализ экспансии Treg с использованием смеси цитокинов
Т-клетки, полученные из МКПК, культивировали в присутствии смеси цитокинов IL-2, IL-15 и IL-21 и Treg (регуляторные Т-клеток) идентифицировали до и после экспансии Т-клеток с использованием проточной цитометрии. Результаты показаны на фиг. 15. На фиг. 15 слева направо: показан гейтинг Т-клеток на CD4+ Т-клетки и затем на CD25high, означает высокую экспрессию рецептора IL-2 на активированных Т-клетках. Затем клетки гейтировали на IL-2R (высокий CD125) клетки и тестировали в отношение экспрессии рецептора IL-7 (CD127) и Foxp3 (внутриклеточно). Клетка Treg определяется как CD4+CD25high, Foxp3+ и CD127-отрицательная. Количество Treg было исходно низким (0,07% в CD4+ Т-клетках) и стало еще ниже после экспансии Т-клеток (0,01%). Эти данные свидетельствуют о том, что смесь цитокинов является очень эффективной в экспансии Т-клеток, поскольку известно, что IL-2 индуцирует сильную экспансию Treg, они также подчеркивают синергетические эффекты комбинации IL-2/IL-15/IL-21, которая блокирует экспансию Тreg, позволяя при этом протекать экспансии Т-клеток с противоопухолевым действием.
Пример 23 - анализ распределения семейства VB после экспансии
Т-клетки были подвергнуты экспансии с использованием смеси цитокинов IL-2/IL-15/IL-21 вместе с антигенами NY-ESO-1 в течение 21 суток. Был проведен анализ проточной цитометрией до (Т0=временная точка 0) и после экспансии (TH=время сбора клеток). Т-клетки, стимулированные одними цитокинами, служили в качестве контроля. Результаты приведены в таблице 9. Обращает на себя внимание сильная преимущественная экспансия семейства VB7.2 в CD8+ Т-клетках, экспансированных в биореакторе GRex, а также семейства VB13.2 в CD8+ Т-клетках (также экспансированных в в биореакторе GRex). Данные показывают, что присутствие антигена (NY-ESO-1) приводит к преимущественной экспансии отдельных семейств TCR VB и показывает также разнообразие реакций, регулируемых антигеном (не только цитокинами). Специализированные, кроме того, различные семейства TCR VB предполагают различный Т-клеточный ответ, направленный против мишеней.
Таблица 9. TH: временная точка сбора клеток, 21 сутки; G-Rex: биореактор G-Rex, стимуляция NY-ESO-1; Цито: только цитокины, без стимуляции; GE: система wave GE, стимуляция NY-ESO-1
Пример 24 - PD1 маркер в CD8+ клетках
Т-лимфоциты были подвергнуты экспансии с использованием смеси IL-2/IL-15/IL-21 и пептида NY-ESO-1. Верхняя панель: до, нижняя панель: после экспансии под действием цитокинов/TAA=Т-клетки культивировали в присутствии IL-2/IL-15/IL-21. Был проведен анализ проточной цитометрией до и после стимуляции Т-клеток. Слева направо: i) гейтинг на лимфоциты, ii) гейтинг на CD3+ Т-клетки, iii) гейтинг на CD4/CD8. Вверху справа: экспрессия PD1 на CD8+ активированных Т-клетках (37% Т-клеток). Т-клетки, экспансированные под действием цитокинов/ТАА, демонстрируют пониженную экспрессию PD1 на CD4CD8+ Т-клетках. Данные показывают, что Т-клетки, экспансированные под действием цитокинов/пептида, демонстрируют пониженную частоту PD1+ Т-клеток в CD8+ Т-клетках - означая, что эти экспансированные Т-клетки могут показывать более длительный период существования и, следовательно, более высокую эффективность против опухолевых клеток.
Пример 25 - многочисленные антигены
Смесь пептидов, состоящая из 12 отдельных пептидов из белка L1 из HPV 33, вместе со смесью цитокинов, использовали для стимуляции Т-клеток от пациентов с HPV+ очагами. На сутки 21 Т-клетки тестировали на цитотоксичность, направленную против каждого отдельного пептида. В данном случае были взяты аутологичные EBV-трансформированные B-клетки и стимулированы пептидами 1-12, с последующим проведением стандартного анализа с 51Cr. С использованием данных анализов измеряют способность Т-клеток индуцировать гибель специфических мишеней. Результаты показаны на фиг.16.
Т-клетки от донора А эффективно распознают пептиды 11 и 12. Т-клетки от донора B эффективно распознавали пептиды 7-12 с высокой реактивностью в отношение пептида 11. Эти данные показывают, что экспансия Т-клеток с использованием смеси цитокинов IL-2/IL-15/IL-21 и пептидов приводит i) к генерации цитотоксических Т-клеток и ii) и к тому, что Т-клеточный ответ разнообразен и специализирован на различный ряд отдельных пептидных молекул. Эти данные свидетельствуют о том, что Т-клетки, стимулированные смесью пептид/цитокины, могут быть преимущественно цитотоксическими, и они также могут быть направлены на несколько эпитопов-мишеней - что делает их более разнообразными в распознавании опухолевых клеток или инфицированных вирусом клеток, которые экспонируют на своей поверхности различные группы пептидных молекул.
Пример 26 - экспрессия CD117 до и после экспансии МКПК под действием цитокинов и NY-ESO-1
МКПК были экспансированы с использованием смеси IL-2/IL-15/IL-21 в присутствии ассоциированного с опухолями антигена NY-ESO-1. Клетки анализировали проточной цитометрией до (фиг. 18) и после экспансии (фиг. 19). Вначале, гейтировали CD3+ Т-клетки, затем CD3+ Т-клетки гейтировали на CD4+ и CD8+ Т-клетки. Затем CD117+ клетки гейтировали на CD8+ Т-клетки (вверху) и на CD4+ Т-клетки (нижняя панель, слева). Средняя панель: экспрессия CD45RA/CCR7 в CD8+ и CD4+ Т-клетках с высокой популяцией в CD45RA+ CCR7+ Т-клетках, представляющих предшественники Т-клеток (средняя панель). Справа: CD117+ Т-клетки (меченные синим цветом) находятся в эффекторных Т-клетках в CD8+ Т-клетках; CD117+ Т-клетки могут быть обнаружены в различных популяциях Т-клеток в субпопуляциях CD4+ Т-клеток. На основании этих данных следует, что экспрессия CD117, присутствующего маркера «стволовости», имеет место в различных субпопуляциях Т-клеток. CD117+ Т-клетки преимущественны для обеспечения источника Т-клеток долговременной памяти.
Вначале, гейтировали CD3+ Т-клетки, затем гейтировали CD3+ Т-клетки на CD4+ и CD8+ Т-клетки. Очень высокая экспрессия CD117 и высокая частота CD117+ клеток в CD8+ Т-клетках (вверху) и в CD4+ Т-клетках (нижняя панель, слева). Средняя панель: экпрессия CD45RA/CCR7 в CD8+ и CD4+ Т-клетках с высокой популяцией в CD45RA+ CCR7+ Т-клетках, представляющих предшественники Т-клетки (средняя панель). Справа: CD117+ Т-клетки (меченные синим цветом) располагаются в периферических эффекторных Т-клетках в CD45RA+ CCR7- Т-клетках (эффекторы). CD84 Т-клетки; CD117+ Т-клетки могут быть обнаружены в популяции CD45RA+CCR7+ предшественников Т-клеток. На основании этих данных следует, что экспрессия CD117, маркера «стволовости», имеет место в различных субпопуляциях Т-клеток. CD117+ Т-клетки преимущественны для обеспечения источника Т-клеток долговременной памяти. Также показано, что смесь цитокинов эффективно экспансирует CD117+ T-клетки, которые приводят к продукции клеток долговременной иммунной памяти, а также, что CD117+ Т-клетки находятся в предшественниках Т-клеток - для обеспечения долговременных противоопухолевых иммунных реакций.
Пример 27 - экспансия культуры TIL из глиобластомы
В этом примере описана процедура культивирования TIL из злокачественной опухоли поджелудочной железы для функционального теста и иммунотерапии.
Материалы, оборудование и расходные материалы смотри в примере 1.
Опухолевую ткань, полученную от пациента, помещали в стерильный контейнер. Ткань разрезали стерильным скальпелем на кусочки размером 1 до 2 мм3. Кусочки ткани переносили в лунки 24-луночного планшета из расчета 1 кусочек на лунку. Среду для культивирования клеток готовили с использованием Cellgro с добавлением 10% сыворотки крови человека группы АВ. В эту среду добавляли IL-2, IL-15 и IL-21 до конечной концентрации 1000 Е/мл для IL-2, 10 нг/мл для каждого из IL-15 и IL-21. Кроме того, в среду добавляли PEST и амфотерицин. 1 мл среды вносили в каждую лунку и культуру клеток инкубировали в течение 7 суток при 37°C. Параллельно МКПК от здорового донора культивировали в Cellgro, содержащей 10% сыворотки крови человека группы АВ. Определяли количество МКПК и доводили до титра 106/мл. Затем МКПК облучали в течение 18 мин при 55 Гр. После облучения добавляли OKT3 до конечной концентрации 10 нг/мл. Эта культура относится к фидерным клеткам с OKT3. На сутки 10 культивирования TIL 100 мкл культуры фидерных клеток с OKT3 добавляют в каждую лунку 24-луночного планшета. Соответственно, культура в каждой лунке содержит OKT3 в конечной концентрации 10 нг/мл, и общее количество фидерных клеток составляет 106. Соотношение TIL и фидерных клеток равняется примерно 1:10.
Пример 28 - экспансия культуры TIL из злокачественной опухоли поджелудочной железы
Опухолевую ткань, полученную от пациента, помещали в стерильный контейнер. Ткань разрезали стерильным скальпелем на кусочки размером 1 до 2 мм3. Кусочки ткани переносили в лунки 24-луночного планшета из расчета 1 кусочек на лунку. Среду для культивирования клеток готовили с использованием Cellgro с добавлением 10% сыворотки крови человека группы АВ. В эту среду добавляли IL-2, IL-15 и IL-21 до конечной концентрации 1000 Е/мл для IL-2, 10 нг/мл для каждого из IL-15 и IL-21. Кроме того, в среду добавляли PEST и амфотерицин. 1 мл среды вносили в каждую лунку и культуру клеток инкубировали в течение 4 суток при 37°C. Параллельно МКПК от здорового донора культивировали в Cellgro, содержащей 10% сыворотки крови человека группы АВ. Определяли количество МКПК и доводили до титра 106/мл. Затем МКПК облучали в течение 18 мин при 55 Гр. После облучения добавляли OKT3 до конечной концентрации 10 нг/мл. Эта культура относится к фидерным клеткам с OKT3. На сутки 10 культивирования TIL 100 мкл культуры фидерных клеток с OKT3 добавляют в каждую лунку 24-луночного планшета. Соответственно, культура в каждой лунке содержит OKT3 в конечной концентрации 10 нг/мл, и общее количество фидерных клеток равняется 106. Соотношение TIL и фидерных клеток составляет примерно 1:10.
Пример 29 - процедура получения линии опухолевых клеток из ткани
Ткань опухоли поджелудочной железы получали от пациента непосредственно после операции и помещали в стерильный контейнер. Опухолевую ткань разрезали стерильным скальпелем на кусочки размером 1 до 2 мм3. Кусочки ткани переносили в лунки 24-луночного планшета. 1 мл культуральной среды RPMI с 10% фетальной бычьей сыворотки добавляли в каждую лунку. Среду заменяли на сутки 7 и сутки 14, означая, что культуральную среду удаляли и заменяли свежей культуральной средой того же типа. Когда опухолевые клетки достигали очень высокой плотности, то культуру переносили в 6-луночные планшеты.
Пример 30 - определение правильной временной точки для добавления фидерных клеток
Было установлено, что добавление фидерных клеток не приводит к хорошей экспансии лимфоцитов, инфильтрирующих опухоль, если фидерные клетки добавляются, когда количество лимфоцитов очень низкое. На фиг. 20А показана культура лимфоцитов одной недели инкубации. Некоторые лимфоциты детектируются, однако количество лимфоцитов ниже базовой линии экспансии. На фиг. 20В и фиг. 2°C показана та же самая культура лимфоцитов через две недели инкубации. На данный момент времени число лимфоцитов, которое может быть детектируемым, увеличилось выше базовой линии экспансии. На этой стадии можно добавлять фидерные клетки. На фиг. 20D, 20Е и 20Е показана культура через 4 суток, одну неделю и две недели после добавления фидерных клеток. На фигурах можно видеть, что число лимфоцитов резко возрастает от фиг. 20D до фиг. 20F. Данные фиг. 20F свидетельствуют о том, что лимфоциты встречаются с и атакуют опухолевые клетки в культуре.
Пример 31 - анализ фенотипа и экспрессии маркеров активации/истощения лимфоцитов, экспансированных из TIL, полученных из глиобластомы
Опухолевая ткань была получена от 16 пациентов с глиобластомой. TIL экспансировали из ткани с использованием смеси цитокинов IL-2, IL-15 и IL-21, следуя протоколу, описанному в примере 1.
А)
Подвергшиеся экспансии клетки анализировали проточной цитометрией в отношение их фенотипа CD4/CD8 с использованием антител, направленных против CD3, CD4 и CD8.
Результаты приведены в таблице 10.
Таблица 10
опухо-левых клеток
CD8+
Данные показывают, что TIL, которые можно экспансировать из каждой отдельной опухоли, в основном содержат CD3+ Т-клетки. В зависимости от пациента одни из CD4+, CD8+ и DN Т-клеток находятся в большинстве. Однако было установлено, что CD4+ Т-клетки обнаруживаются чаще всего. В таблице также показано, что смесь цитокинов способна экспансировать Т-клетки из различных по гистологии опухолей ЦНС (смотри колонку 4 «Диагноз»).
В)
Экспансированные клетки анализировали проточной цитометрией в отношении их специфического фенотипа - предшественники Т-клеток (CD45RA+CCR7+), Т-клетки центральной памяти (CD45RA-CCR7+), Т-клетки периферической памяти (CD45RA-CCR7-) или дифференцированные эффекторные Т-клетки (CD45RA+CCR7-) и экспрессии маркеров активации/истощения в основных фенотипах CD8+, CD4+ и двойные негативные Т-клетки.
Антитела, использованные для анализа популяций TIL проточной цитометрией, приведены в таблице 11.
Таблица 11
Результаты представлены на фиг. 22А и 22В. Большинство CD8+, CD4+ или DN-Т-клеток находятся в субпопуляции Т-клеток центральной памяти, которая, как было показано, имеет решающее значение для эффективных противоопухолевых реакций и долговременной иммунной памяти. Результаты в среднем показывают сильную экспансию DN-Т-клеток. Эта субпопуляция является высоко активированной и имеет рецепторы аффинности Т-клеток. Кроме того, наблюдается сильная экспансия субпопуляций предшественников CD45RA+CCR7+ Т-клеток, которые обеспечивают ответы Т-клеток долговременной памяти, преимущественные для длительного иммунного надзора.
Отмеченная экспрессия 4-1ВВ, LAG-3 или TIM-3 в Т-клетках (смотри фиг. 3B) указывает на антиген/опухоль-специфические Т-клетки. Пример показывает, что смесь цитокинов экспансирует TIL, которые находятся в основном в субпопуляции Т-клеток памяти (центральной памяти), которая ассоциирована с полезными клиническими эффектами, также показано, что экспансированные TIL несут маркеры, связанные с антигенной специфичностью.
Пример 32 - анализ фенотипа и экспрессии маркеров активации/истощения лимфоцитов, экспансированных из TIL, полученных из злокачественной опухоли поджелудочной железы
Опухолевая ткань была получена от 17 пациентов с раком поджелудочной железы. В таблице 12 обобщены данные по возрасту, полу, типу образца и гистологии у пациента.
Таблица 12
Смесь цитокинов экспансирует TIL из злокачественных опухолей поджелудочной железы с различной гистологией
TIL экспансировали из ткани с использованием смеси цитокинов IL-2, IL-15 и IL-21, следуя протоколу, описанному в примере 28. Фенотип CD4/CD8 определяли с использованием антител, направленных против CD3, CD4 и CD8.
А)
Экспансированные клетки анализировали проточной цитометрией в отношении их фенотипа CD4/CD8 с использованием антител, направленных против CD3, CD4 и CD8. Результаты приведены в таблице 13.
Таблица 13
Анализ фенотипов Т-клеток в TIL из злокачественной опухоли поджелудочной железы. Доминирующие популяции CD+ TIL
Подвергшиеся экспансии клетки анализировали проточной цитометрией в отношении их специфического фенотипа - предшественники Т-клеток (CD45RA+CCR7+), Т-клетки центральной памяти (CD45RA-CCR7+), Т-клетки периферической памяти (CD45RA-CCR7-) или дифференцированные эффекторные Т-клетки (CD45RA+CCR7-) в основных фенотипах CD8+ и CD4+. Результаты представлены на фиг. 23 и 24.
Большинство CD8+, CD4+ или DN Т-клеток находится в субпопуляции Т-клеток центральной памяти, что, как было показано, имеет решающее значение для эффективных противоопухолевых реакций и долговременной иммунной памяти. Результаты в среднем показывают сильную экспансию DN Т-клеток. Эта субпопуляция является высоко активированной и имеет рецепторы аффинности Т-клеток. Кроме того, наблюдается сильная экспансия субпопуляций предшественников CD45RA+CCR7+ Т-клеток, которые обеспечивают ответы Т-клеток долговременной памяти, преимущественные для длительного иммунного надзора.
Отмеченная экспрессия 4-1ВВ, LAG-3 или TIM-3 в Т-клетках (смотри фиг. 24) указывает на антиген/опухоль-специфические Т-клетки. Пример показывает, что смесь цитокинов экспансирует TIL, которые находятся в основном в субпопуляции Т-клеток памяти (центральной памяти), которая ассоциирована с полезными клиническими эффектами, также показано, что экспансированные TIL несут маркеры, связанные с антигенной специфичностью.
Пример 33 - анализ длины TCR Т-клеток, экспансированных из опухолевой ткани пациентов с раком поджелудочной железы
Опухолевая ткань была получена от 17 пациентов с раком поджелудочной железы. TIL были экспансированы из ткани с использованием смеси цитокинов IL-2, IL-15 и IL-21, следуя протоколу, описанному в примере 28. Используя подход на основе ПЦР, измеряли длину TCR. «Нормальное» изображение семейства TCR представляет распределение Гаусса длины Т-клеточного рецептора. Одиночные пики свидетельствуют о моноклональности в отдельных семействах TCR. Данные, представленные на фиг. 25, свидетельствуют о том, что композиция TIL является моноклональной или поликлональной, на основании чего можно предположить, что она направлена против аутологичных опухолевых клеток-мишеней, смесь цитокинов способствует экспансии репертуара специализированных TCR.
Пример 34 - анализ продукции цитокинов в лимфоцитах, экспансированных из TIL, полученных от пациентов с глиобластомой
Опухолевая ткань была получена от пациентов с глиобластомой. TIL были экспансированы из опухолевой ткани с использованием смеси цитокинов IL-2, IL-15 и IL-21, следуя протоколу, описанному в примере 1. Экспансированные лимфоциты стимулировали пептидами, полученными из ассоциированных с опухолями антигенов, т.е. EGRvrIII, NY-ESO-1 или сурвивина, и определяли процент клеток, продуцирующих один из цитокинов IFN-γ и TNF-α.
Результаты представлены на фиг. 26В. Для сравнения тестировали максимальную стимуляцию РМА/инономицином в качестве положительного контроля, и определяли фоновый сигнал с использованием только среды (отрицательный контроль). Результаты показывают, что экспансированные Т-клетки распознают эти известные опухолевые антигены. Следовательно, смесь цитокинов экспансирует Т-клетки из глиобластомы, которые являются реактивными к опухолевым антигенам, которые были описаны как клинически значимые и связанные с клиническими эффектами.
Пример 35 - анализ продукции цитокинов в лимфоцитах, экспансированных из TIL, полученных от пациентов с раком поджелудочной железы
Опухолевая ткань была получена от пациентов с раком поджелудочной железы.
TIL экспансировали из опухолевой ткани с использованием смеси цитокинов IL-2, IL-15 и IL-21, следуя протоколу, описанному в примере 27. Экспансированные лимфоциты стимулировали пептидами, полученными из ассоциированных с опухолями антигенов, т.е. EGRvrIII, NY-ESO-1 или сурвивина, и определяли процент клеток, продуцирующих один из цитокинов IFN-γ и TNF-α. Результаты показаны на рис 27A. На фиг. 27B показаны изображения анализа проточной цитометрией для NY-ESO-1. Результаты подтверждают, что экспансированные Т-клетки распознают эти известные опухолевые антигены. Следовательно, смесь цитокинов экспансирует Т-клетки из злокачественной опухоли поджелудочной железы, которые являются реактивными к опухолевым антигенам, которые были описаны как клинически значимые и связанные с клиническими ответами.
Пример 36 - анализ продукции цитокинов в лимфоцитах, экспансированных из TIL, полученных от пациентов с глиобластомой, и с использованием аутологичной стимуляции
Опухолевая ткань была получена от пациентов с глиобластомой. TIL были экспансированы из ткани с использованием смеси цитокинов IL-2, IL-15 и IL-21, следуя протоколу, описанному в примере 27. Экспансированные лимфоциты стимулировали аутологичными опухолевыми клетками. Результаты показаны на фиг. 28A. На фиг. 28B показаны изображения анализа проточной цитометрией. Результаты подтверждают, что экспансированные Т-клетки распознают аутологичные опухолевые клетки. Следовательно, смесь цитокинов экспансирует Т-клетки из глиобластомы, которые являются реактивными на аутологичные опухолевые клетки, соответственно собственным мутациям пациента.
Пример 37 - связь применения TCR при раке поджелудочной железы с распознаванием аутологичных опухолевых клеток
Опухолевая ткань была получена от пациентов с глиобластомой. TIL экспансировали из опухолевой ткани с использованием смеси цитокинов IL-2, IL-15 и IL-21, следуя протоколу, описанному в примере 27. Экспансированные лимфоциты стимулировали аутологичными опухолевыми клетками. Вначале TIL гейтировали на CD3+ Т-клетки и затем на CD4+ и CD8+ Т-клетки. Частоту отдельных семейств Vβ тестировали с использованием панели антител против TCR VB. Эта панель TCR покрывает примерно 75% репертуара человеческих TCR, поэтому существует вероятность того, что не все семейства TCR Vβ захвачены в достаточной степени. Распределение семейств TCR Vβ составляет примерно от 2 до 6% в каждом семействе, за исключением TCR VB 2, где оно может достигать более 10%. В таблице 14 показана преимущественная экспансия семейства Vβ-2 в TIL от пациентов с глиобластомой.
Таблица 14
Данные таблицы 14 показывают, что отдельные TCR VB преимущественно экспансируются в TIL. Следует отметить, что клональность может быть определена только с помощью секвенирования. Следует отметить, что смесь цитокинов экспансирует разные семейства TCR Vβ у отдельных пациентов. Это верно для пациентов с глиобластомой, а также для пациентов с раком поджелудочной железы. Следует отметить также, что некоторые TIL составлены для одного или двух семейств VB, показывающих экспансию высокоспециализированных TCR VB, на основании чего можно предположить о процессе экспансии Т-клеток, регулируемом антигеном. Было показано, что некоторые TIL, которые преимущественно экспансируются, являются моноклональными. Таким образом, смесь цитокинов IL-2, IL-15 и IL-21 экспансирует специфический Т-клеточный ответ, который направлен против собственных опухолевых клеток пациента.
Пример 38 - связь применения TCR при раке поджелудочной железы с распознаванием аутологичных опухолевых клеток
Опухолевая ткань была получена от пациентов с раком поджелудочной железы. TIL экспансировали из опухолевой ткани с использованием смеси цитокинов IL-2, IL-15 и IL-21, следуя протоколу, описанному в примере 28.
Клетки окрашивали для проточной цитометрии с использованием CD3, CD4 и CD8 в комбинации с антителом против TCR Vβ. Панель покрывает до 75% всего репертуара TCR VB. Если некоторые семейства Т-клеток находятся в оставшихся 25%, которые не покрываются этой панелью, то они не захватываются ею. Результаты приведены в таблице 15.
Таблица 15
Продукцию IFN-γ измеряли через 3 суток после воздействия TIL на аутологичные опухолевые клетки (одноклеточную суспензию). Высокий уровень продукции IFN-γ отмечается только с аутологичными опухолевыми клетками (смотри фиг. 35). Продукция IFN-γ полностью блокируется антителом против W6/32 (блокирование CD8+ TIL). В качестве контроля, антитело L243, блокирующее CD4+ TIL, не способно блокировать данную реакционную способность, реактивные Т-клетки в экспансированных лимфоцитах все представляют CD8+ клетки. Данные показывают, что смесь цитокинов экспансирует TIL, которые высокоспециализированы и специфически распознают аутологичные опухолевые клетки у пациентов с раком поджелудочной железы. Моноклональные семейства TCR в TIL от пациентов с раком поджелудочной железы: IL-2, IL-15 и IL-21 экспансируют преимущественно отдельные семейства TCR VB, так что преимущественная экспансия Т-клеточных семейств связана с антигенспецифичностью и специализированной противоопухолевой реактивностью. Некоторые из этих преимущественно экспансированных семейств VB содержат моноклональные Т-клетки, определяемые одноцепочечным TCR VB. Такая моноклональная экспансия TCR является показателем целенаправленного, противоракового ответа. Анализ функционального ответа показал, что моноклонально экспансированные TIL распознают аутологичные опухолевые клетки.
Пример 39 - анализ цитолитической реакции экспансированных TIL у пациентов с глиобластомой, против аутологичных опухолевых клеток
Опухолевая ткань была получена от пациентов с глиобластомой. TIL подвергали экспансии из опухолевой ткани с использованием смеси цитокинов IL-2, IL-15 и IL-21, следуя протоколу, описанному в примере 28. Аутологичные опухолевые клетки получали, следуя протоколу, описанному в примере 29. Аутологичные опухолевые клетки метили радиоактивной меткой и культивировали с экспансированными TIL в течение 4 ч. Гибель опухолевых клеток приводит к высвобождению радиоактивной метки, которая затем измеряется. Принцип метода показан на фиг. 21. Результаты приведены на фиг. 31, подтверждая цитотоксический эффект, зависимый от соотношения TIL к опухолевым клеткам. Данные показывают, что смесь цитокинов экспансирует TIL, которые являются высоко цитотоксическими по отношению к аутологичным опухолевым клеткам.
Альтернативно экспансированные моноклональные Т-клетки и/или преимущественно экспансированные TIL тестировали на их цитотоксичность с использованием того же теста. Результаты показаны на фиг. 32. В таблице 16 показано, что эти иммунные ответы специфически направлены против аутологичных опухолевых клеток. Данные показывают, что смесь цитокинов экспансирует TIL со специфической реакционной способностью, включая цитотоксические реакции против аутологичной опухоли.
B)
В параллельном эксперименте аутологичные опухолевые клетки инкубировали в течение 3 суток с TIL, экспансированными из глиобластомы с использованием смеси цитокинов IL-15, IL-21 и IL-2. После инкубации измеряли продукцию IFN-γ (пг/мл) с помощью ELISA. Для того, чтобы выяснить насколько CD4+ или CD8+ клетки ответственны за противоопухолевые ответы, использовали антитела, блокирующие антигенные ответы MHC класса I (W6/32), отрицательно влияющие на CD8+ Т-клетки, или блокирующие HLA-DR (ответы MHC класса II), отрицательно влияющие на CD4+ Т-клетки. Результаты приведены в таблице 16.
Таблица 16
TIL, которые показали отсутствие продукции IFN-γ, обладали высокой цитотоксической активностью, как измерено в стандартном анализе высвобождения 51CR. Данные показывают, что TIL продуцируют IFN-γ против аутологичных опухолевых клеток специфическим образом.
Пример 40 - анализ цитолитической реакции экспансированных TIL от пациентов с раком поджелудочной железы против аутологичных опухолевых клеток
Опухолевая ткань была получена от пациентов с раком поджелудочной железы. TIL подвергали экспансии из опухолевой ткани с использованием смеси цитокинов IL-2, IL-15 и IL-21, следуя протоколу, описанному в примере 28. Аутологичные опухолевые клетки получали, следуя протоколу, описанному в примере 29. Аутологичные опухолевые клетки метили радиоактивной меткой и культивировали с экспансированными TIL в течение 4 ч. Гибель опухолевых клеток приводит к высвобождению радиоактивной метки, которая затем измеряется. Принцип метода показан на фиг. 7. Для сравнения и в качестве контроля использовали систему аутологичная опухоль(меланома)-TIL. Результаты представлены на фиг. 33, которые подтверждают цитотоксический эффект. Полученные данные показывают, что смесь цитокинов экспансирует TIL также от пациентов с раком поджелудочной железы. Эти TIL являются высокоспециализированными - на основе применения TCR - и показывают специфическую реактивность, включая цитотоксические реакции против аутологичной опухоли.
Пример 41 - анализ распределения экспрессии CXCR3 CD4+ клетками
Опухолевая ткань была получена от пациентов с глиобластомой. TIL подвергали экспансии с использованием смеси цитокинов IL-2, IL-15 и IL-21, следуя протоколу, описанному в примере 27. Клетки анализировали проточной цитометрией по экспрессии маркеров, которые определяют функции и хоминг Т-клеток.
Результаты анализа обобщены в таблице 17. Клетки Th1, а также CXCR3, составляли менее 10% до экспансии. Данные показывают, что смесь цитокинов приводит к получению Т-клеточного продукта, в котором CD8+ клетки по существу состоят из CXCR3+ CD8+ Т-клеток. Клетки данного фенотипа способны проникать в опухолевую ткань. CD4+ Т-клетки почти все имеют профиль TH1. Профиль ТН1 (продукция IFN-γ и TNF-α) приводит к усилению противоопухолевых реакций.
Также присутствуют CD3+CD4-CD8-(DN) Т-клетки, субпопуляция Т-клеток, связанная с сильными аутоиммунными и противоопухолевыми реакциями, которые также экспрессируют маркер CXCR3, позволяющий клеткам лучше проникать в опухолевую ткань.
Таблица 17
Пример 42 - распознавание известных опухолевых антигенов TIL от пациентов с раком поджелудочной железы
ТАА в виде 15 перекрывающихся пептидов инкубировали в течение трех суток с TIL и измеряли продукцию IFN-γ (пг/мл) с использованием ELISA. Кроме того, антигенные ответы блокировали антителом, блокирующим антигенные ответы MHC класса I (W6/32), отрицательно влияющие на CD8+ Т-клетки, или блокирующим HLA-DR (ответы МНС класса II, L243), отрицательно влияющим на CD4+ Т-клетки. Продукция IFN-γ (пг/ мл) в каждом из образцов показана в таблице 18. Продукция IFN-γ в TIL является антигенспецифической, что было показано блокированием антителами к MHC класса I (блокирование CD8+ Т-клеток) или антителами к МНС класса II (блокирование CD4+ Т-клеток). Результаты подтверждают, что TIL продуцируют IFN-γ против известных опухолевых антигенов, в частности, NY-ESO-1 или мезотелина, от пациентов с раком поджелудочной железы.
Таблица 18
+W6/32
+L243
Многие модификации и другие варианты осуществления настоящего изобретения, изложенного здесь, будут очевидны специалистам в данной области техники, к которой относится данное изобретение, имея преимущество идей изобретения, представленных в предшествующем описании и на сопутствующих чертежах. Таким образом, следует понимать, что изобретение не должно быть ограничено конкретными раскрытыми вариантами осуществления и что модификации и другие варианты осуществления предназначены для включения в объем прилагаемой формулы изобретения. Несмотря на то, что здесь используются специфические термины, они используются только в общем и описательном смысле, а не для целей ограничения.
Список источников литературы
1. Dunn GP, Old LJ, Schreiber RD. The immunobiology of cancer immunosurveillance and immunoediting. Immunity. 2004; 21(2):137-48.
2. Rosenberg SA, Restifo NP, Yang JC, Morgan RA, Dudley ME. Adoptive cell transfer: a clinical path to effective cancer immunotherapy. Nature reviews Cancer. 2008; 8(4):299-308.
3. Rosenberg SA, Packard BS, Aebersold PM, Solomon D, Topalian SL, Toy ST, et al. Use of tumor-infiltrating lymphocytes and interleukin-2 in the immunotherapy of patients with metastatic melanoma. A preliminary report. The New England journal of medicine. 1988; 319(25):1676-80.
4. Robbins PF, Lu YC, El-Gamil M, Li YF, Gross C, Gartner J, et al. Mining exomic sequencing data to identify mutated antigens recognized by adoptively transferred tumor-reactive T cells. Nat Med. 2013; 19(6):747-52.
5. Tran E, Turcotte S, Gros A, Robbins PF, Lu YC, Dudley ME, et al. Cancer immunotherapy based on mutation-specific CD4+ T cells in a patient with epithelial cancer. Science. 2014; 344(6184):641-5.
6. Li Y, Liu S, Hernandez J, Vence L, Hwu P, Radvanyi L. MART-1-specific melanoma tumor-infiltrating lymphocytes maintaining CD28 expression have improved survival and expansion capability following antigenic restimulation in vitro. Journal of immunology. 2010; 184(1):452-65.
7. June CH. Principles of adoptive T cell cancer therapy. The Journal of clinical investigation. 2007;117(5):1204-12.
8. Dudley ME, Wunderlich J, Nishimura MI, Yu D, Yang JC, Topalian SL, et al. Adoptive transfer of cloned melanoma-reactive T lymphocytes for the treatment of patients with metastatic melanoma. Journal of immunotherapy. 2001; 24(4):363-73.
9. Dudley ME, Wunderlich JR, Shelton TE, Even J, Rosenberg SA. Generation of tumor-infiltrating lymphocyte cultures for use in adoptive transfer therapy for melanoma patients. Journal of immunotherapy. 2003; 26(4):332-42.
10. Weber J, Atkins M, Hwu P, Radvanyi L, Sznol M, Yee C, et al. White paper on adoptive cell therapy for cancer with tumor-infiltrating lymphocytes: a report of the CTEP subcommittee on adoptive cell therapy. Clinical cancer research: an official journal of the American Association for Cancer Research. 2011; 17(7):1664-73.
11. Tran KQ, Zhou J, Durflinger KH, Langhan MM, Shelton TE, Wunderlich JR, et al. Minimally cultured tumor-infiltrating lymphocytes display optimal characteristics for adoptive cell therapy. Journal of immunotherapy. 2008; 31(8):742-51.
12. Nguyen LT, Yen PH, Nie J, Liadis N, Ghazarian D, Al- Habeeb A, et al. Expansion and characterization of human melanoma tumor-infiltrating lymphocytes (TILs). PloS one. 2010; 5(11):e13940.
13. Zhou J, Dudley ME, Rosenberg SA, Robbins PF. Selective growth, in vitro and in vivo, of individual T cell clones from tumor-infiltrating lymphocytes obtained from patients with melanoma. Journal of immunology. 2004; 173(12):7622-9.
14. Hunder NN, Wallen H, Cao J, Hendricks DW, Reilly JZ, Rodmyre R, et al.Treatment of metastatic melanoma with autologous CD4+ T cells against NY-ESO-1. The New England journal of medicine. 2008;358(25):2698-703.
15. Kagamu H, Shu S. Purification of L-selectin(low) cells promotes the generation of highly potent CD4 antitumor effector T lymphocytes. Journal of immunology. 1998; 160(7):3444-52.
16. Xie Y, Akpinarli A, Maris C, Hipkiss EL, Lane M, Kwon EK, et al. Naive tumorspecific CD4(+) T cells differentiated in vivo eradicate established melanoma. The Journal of experimental medicine. 2010; 207(3):651-67.
17. Mackensen A, Meidenbauer N, Vogl S, Laumer M, Berger J, Andreesen R. Phase I study of adoptive T-cell therapy using antigen-specific CD8+ T cells for the treatment of patients with metastatic melanoma. Journal of clinical oncology: official journal of the American Society of Clinical Oncology. 2006; 24(31):5060-9.
18. Jager E, Gnjatic S, Nagata Y, Stockert E, Jager D, Karbach J, et al. Induction of primary NY-ESO-1 immunity: CD8+ T lymphocyte and antibody responses in peptidevaccinated patients with NY-ESO-1+ cancers. Proc Natl Acad Sci U S A. 2000; 97(22):12198-203.
19. Ho WY, Nguyen HN, Wolfl M, Kuball J, Greenberg PD. In vitro methods for generating CD8+ T-cell clones for immunotherapy from the naive repertoire. Journal of immunological methods. 2006; 310(1-2):40-52.
20. Dudley ME, Wunderlich JR, Robbins PF, Yang JC, Hwu P, Schwartzentruber DJ, et al. Cancer regression and autoimmunity in patients after clonal repopulation with antitumor lymphocytes. Science. 2002; 298(5594):850-4.
21. Lord GM, Matarese G, Howard JK, Baker RJ, Bloom SR, Lechler RI. Leptin modulates the T-cell immune response and reverses starvation-induced immunosuppression. Nature. 1998; 394(6696):897-901.
22. Tanaka M, Suganami T, Kim-Saijo M, Toda C, Tsuiji M, Ochi K, et al. Role of central leptin signaling in the starvation-induced alteration of B-cell development. The Journal of neuroscience: the official journal of the Society for Neuroscience. 2011; 31(23):8373-80.
23. Ravindran R, Khan N, Nakaya HI, Li S, Loebbermann J, Maddur MS, et al. Vaccine activation of the nutrient sensor GCN2 in dendritic cells enhances antigen presentation. Science. 2014; 343(6168):313-7.
24. Pearson C, Silva A, Seddon B. Exogenous amino acids are essential for interleukin-7 induced CD8 T cell growth. [corrected]. PloS one. 2012; 7(4):e33998.
25. Schwartzentruber DJ, Hom SS, Dadmarz R, White DE, Yannelli JR, SteinbergSM, et al. In vitro predictors of therapeutic response in melanoma patients receiving tumor- infiltrating lymphocytes and interleukin-2. Journal of clinical oncology: official journal of the American Society of Clinical Oncology. 1994; 12(7):1475-83.
26. PittetMJ, Speiser DE, Valmori D, Cerottini JC, Romero P. Cutting edge: cytolytic effector function in human circulating CD8+ T cells closely correlates with CD56 surface expression. Journal of immunology. 2000; 164(3):1148-52.
27. ShenX, Zhou J, Hathcock KS, Robbins P, Powell DJ, Jr., Rosenberg SA, et al.Persistence of tumor infiltrating lymphocytes in adoptive immunotherapy correlates with telomere length. Journal of immunotherapy. 2007; 30(1):123-9.
28. Zhou J, Shen X, Huang J, Hodes RJ, Rosenberg SA, Robbins PF. Telomere length of transferred lymphocytes correlates with in vivo persistence and tumor regression in melanoma patients receiving cell transfer therapy. Journal of immunology. 2005; 175(10):7046-52.
29. Inozume T, Hanada K, Wang QJ, Ahmadzadeh M, Wunderlich JR, Rosenberg SA, et al. Selection of CD8+PD-1+ lymphocytes in fresh human melanomas enriches for tumor-reactive T cells. Journal of immunotherapy. 2010; 33(9):956-64.
30. Zeng R, Spolski R, Finkelstein SE, Oh S, Kovanen PE, Hinrichs CS, et al. Synergy of IL-21 and IL-15 in regulating CD8+ T cell expansion and function. The Journal of experimental medicine. 2005; 201(1):139-48.
31. Liu D, Song L, Wei J, Courtney AN, Gao X, Marinova E, et al. IL-15 protects NKT cells from inhibition by tumor-associated macrophages and enhances antimetastatic activity. The Journal of clinical investigation. 2012; 122(6):2221-33.
32. Li Y, Bleakley M, Yee C. IL-21 influences the frequency, phenotype, and affinity of the antigen-specific CD8 T cell response. Journal of immunology. 2005; 175(4):2261-9.
33. Gattinoni L, Ji Y, Restifo NP. Wnt/beta-catenin signaling in T- cell immunity and cancer immunotherapy. Clinical cancer research: an official journal of the American Association for Cancer Research. 2010; 16(19):4695-701.
34. Gattinoni L, Zhong XS, Palmer DC, Ji Y, Hinrichs CS, Yu Z, et al. Wnt signaling arrests effector T cell differentiation and generates CD8+ memory stem cells. Nat Med. 2009; 15(7):808-13.
35. Yi JS, Du M, Zajac AJ. A vital role for interleukin-21 in the control of a chronic viral infection. Science. 2009; 324(5934):1572-6.
36. Jager D, Karbach J, Pauligk C, Seil I, Frei C, Chen YT, et al. Humoral and cellular immune responses against the breast cancer antigen NY-BR-1: definition of two HLAA2 restricted peptide epitopes. Cancer immunity. 2005; 5:11.
37. Jager E, Karbach J, Gnjatic S, Jager D, Maeurer M, Atmaca A, et al. Identification of a naturally processed NY-ESO-1 peptide recognized by CD8+ T cells in the context of HLA-B51. Cancer immunity. 2002; 2:12.
38. Di Tomaso T, Mazzoleni S, Wang E, Sovena G, Clavenna D, Franzin A, et al.Immunobiological characterization of cancer stem cells isolated from glioblastoma patients. Clinical cancer research: an official journal of the American Association for Cancer Research. 2010; 16(3):800-13.
39. Natsume A, Wakabayashi T, Tsujimura K, Shimato S, Ito M, Kuzushima K, et al. The DNA demethylating agent 5-aza-2'-deoxycytidine activates NY-ESO-1 antigenicity in orthotopic human glioma. International journal of cancer Journal international du cancer. 2008; 122(11):2542-53.
40. Konkankit VV, Kim W, Koya RC, Eskin A, Dam MA, Nelson S, et al. Decitabine immunosensitizes human gliomas to NY-ESO-1 specific T lymphocyte targeting through the Fas/Fas ligand pathway. Journal of translational medicine. 2011; 9:192.
41. Maeurer M, Hohn H, Castelli C, Salter RD, Necker A, Reichert T, et al. Antigen recognition by T cells: a strong sense of structure. Trends in immunology. 2001; 22(11):599-601.
42. Maeurer MJ, Gollin SM, Martin D, Swaney W, Bryant J, Castelli C, et al. Tumor escape from immune recognition: lethal recurrent melanoma in a patient associated with downregulation of the peptide transporter protein TAP-1 and loss of expression of the immunodominant MART-1/Melan-A antigen. The Journal of clinical investigation. 1996; 98(7):1633-41.
43. Maeurer MJ, Necker A, Salter RD, Castelli C, Hohn H, Karbach J, et al. Improved detection of melanoma antigen-specific T cells expressing low or high levels of CD8 by HLA-A2 tetramers presenting a Melan-A/Mart-1 peptide analogue. International journal of cancer Journal international du cancer. 2002; 97(1):64-71.
44. Magalhaes I, Vudattu NK, Ahmed RK, Kuhlmann-Berenzon S, Ngo Y, Sizemore DR, et al. High content cellular immune profiling reveals differences between rhesus monkeys and men. Immunology. 2010; 131(1):128-40.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛУЧЕНИЕ АНТИГЕНСПЕЦИФИЧЕСКИХ T-КЛЕТОК | 2017 |
|
RU2745319C2 |
| СПОСОБ И КОМПОЗИЦИИ ДЛЯ КЛЕТОЧНОЙ ИММУНОТЕРАПИИ | 2012 |
|
RU2688185C2 |
| СПОСОБ ПОЛУЧЕНИЯ КУЛЬТУРЫ ЛИМФОЦИТОВ, ОБОГАЩЕННЫХ ОПУХОЛЬ-СПЕЦИФИЧНЫМИ КЛОНАМИ Т-ЛИМФОЦИТОВ, И КЛЕТОЧНЫЕ КУЛЬТУРЫ, ПОЛУЧЕННЫЕ С ИСПОЛЬЗОВАНИЕМ УКАЗАННОГО СПОСОБА | 2022 |
|
RU2808595C1 |
| ПРОДУКТЫ ОПРЕДЕЛЕННОГО СОСТАВА, СОДЕРЖАЩИЕ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ Т-КЛЕТКИ | 2015 |
|
RU2751921C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ КОМПОЗИЦИЙ ГЕННО-ИНЖЕНЕРНЫХ КЛЕТОК И РОДСТВЕННЫХ КОМПОЗИЦИЙ | 2018 |
|
RU2790444C2 |
| СПОСОБ ПРОИЗВОДСТВА T-КЛЕТОК | 2015 |
|
RU2813668C2 |
| Способ оценки чувствительности опухоли к иммуноонкологическим препаратам | 2021 |
|
RU2771760C1 |
| УЛУЧШЕННЫЙ СПОСОБ УВЕЛИЧЕНИЯ ЧИСЛА ОПУХОЛЕ-РЕАКТИВНЫХ Т-ЛИМФОЦИТОВ В ИММУНОТЕРАПИИ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ | 2006 |
|
RU2399382C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ T-КЛЕТОК ДЛЯ T-КЛЕТОЧНОЙ ТЕРАПИИ | 2020 |
|
RU2834232C1 |
| ВЕТО-КЛЕТКИ, ПОЛУЧЕННЫЕ ИЗ Т-КЛЕТОК ПАМЯТИ | 2017 |
|
RU2779844C2 |
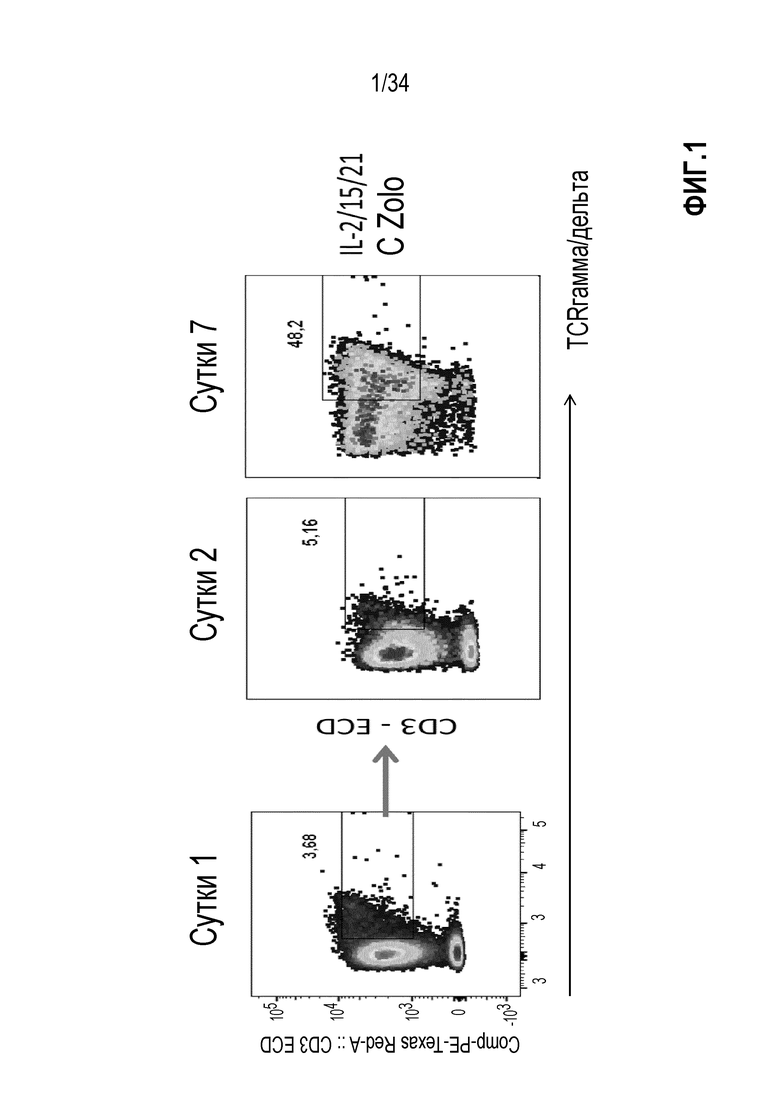
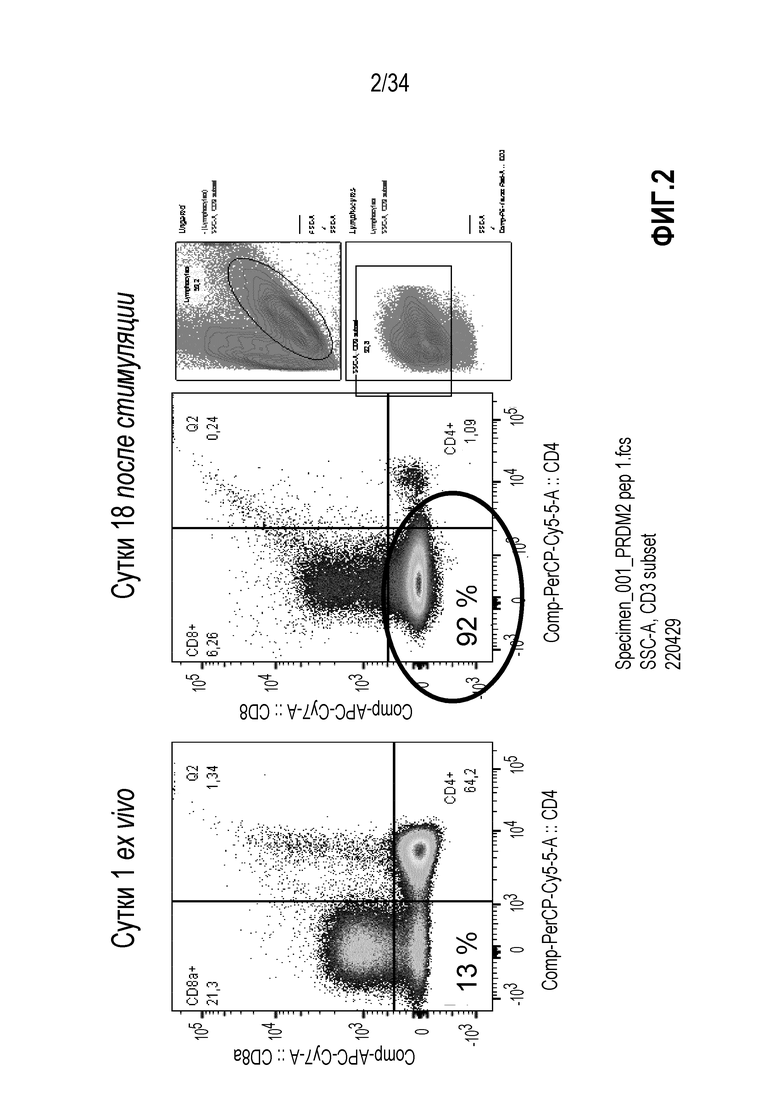

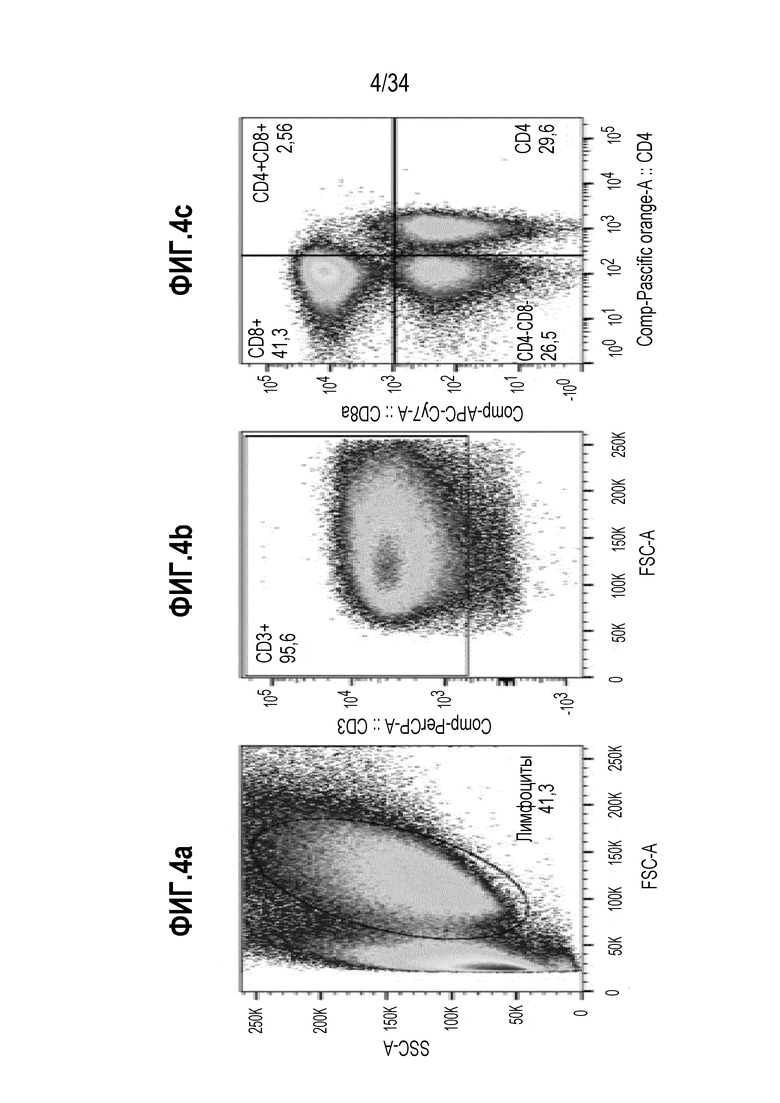

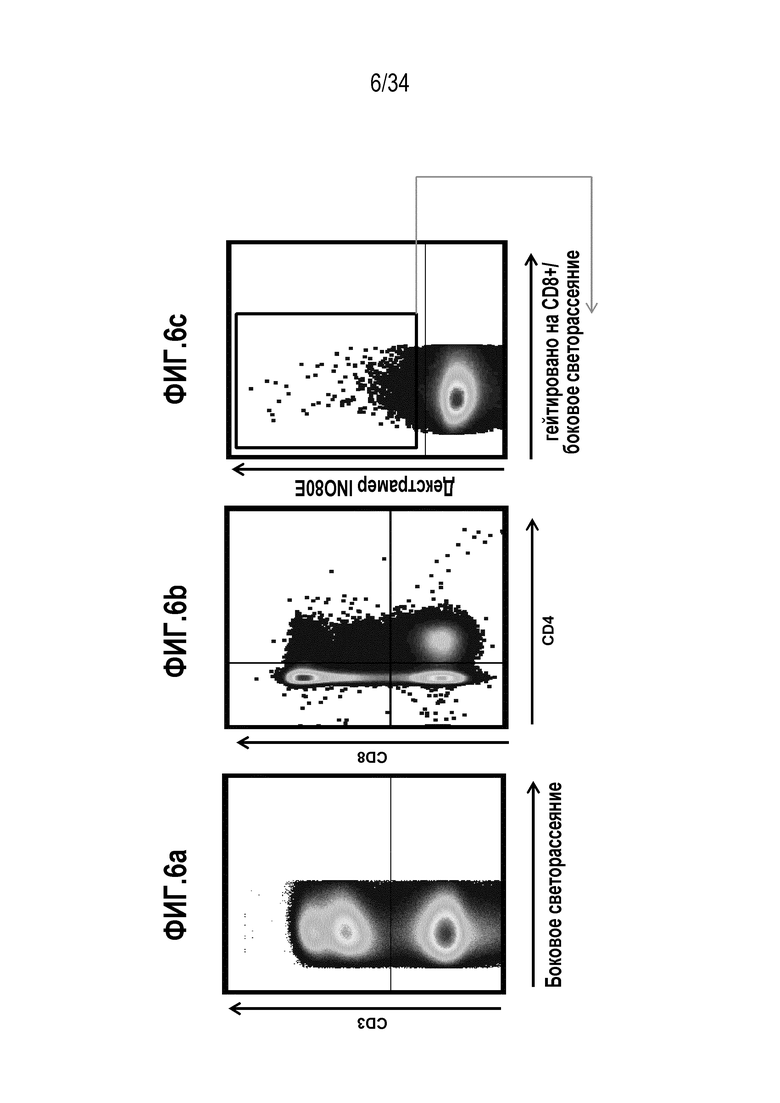
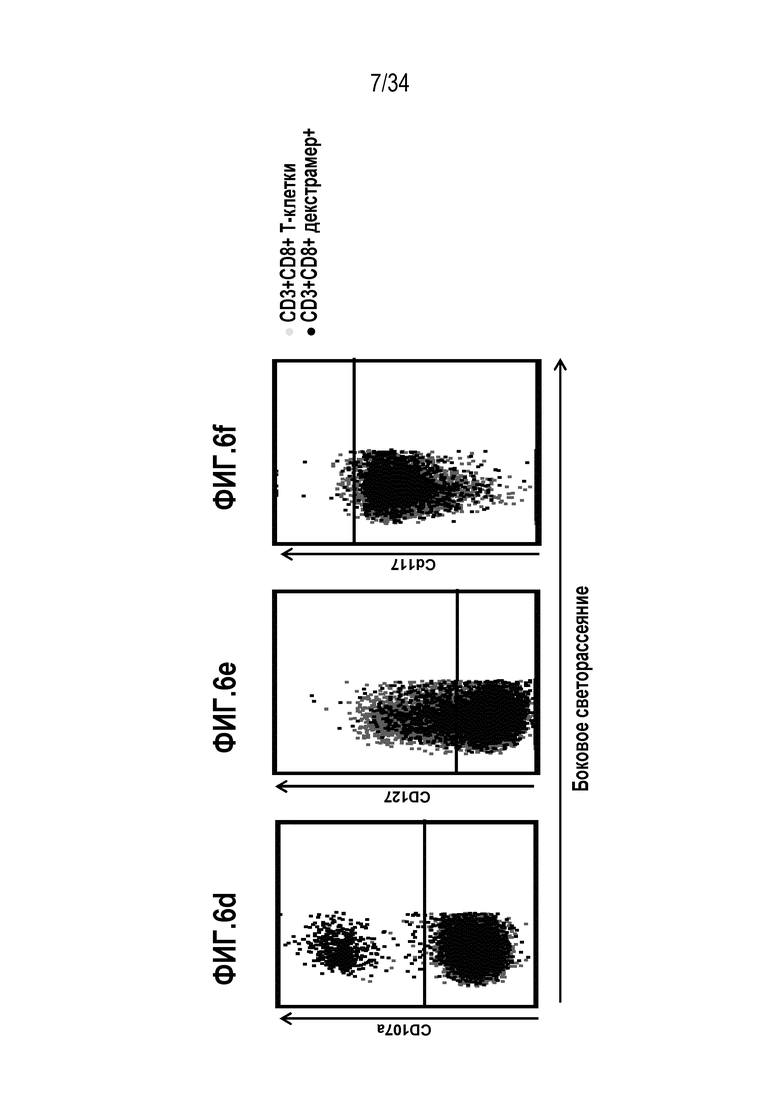
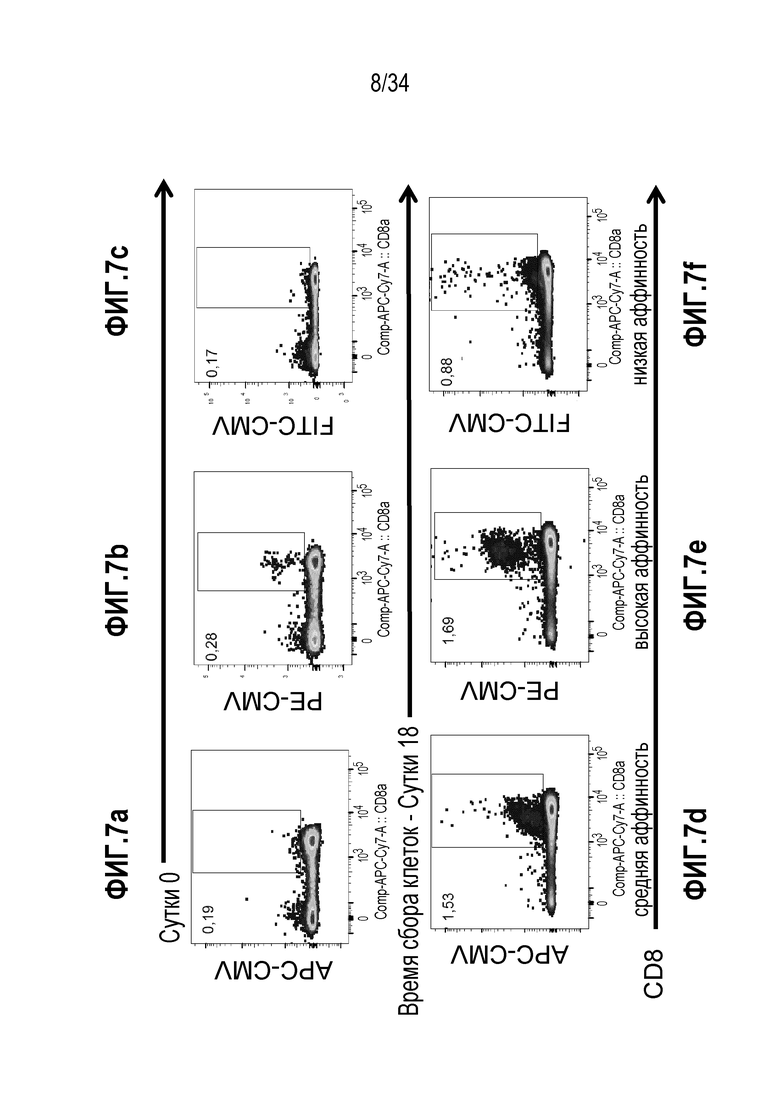
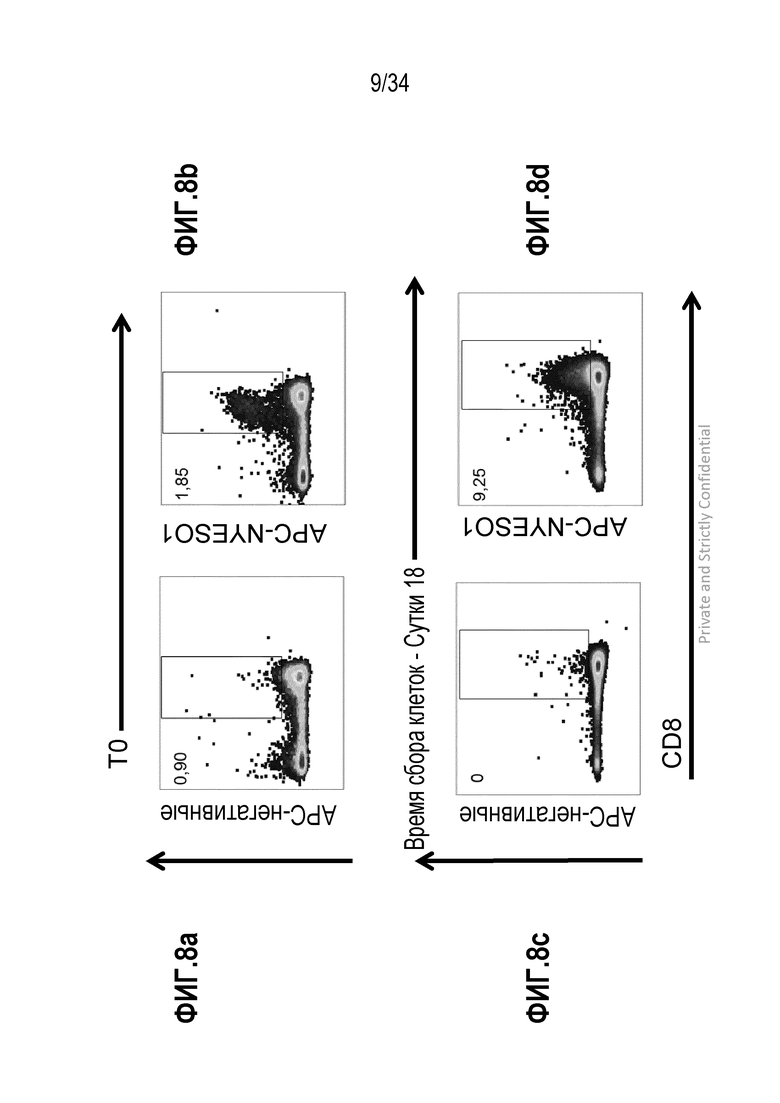
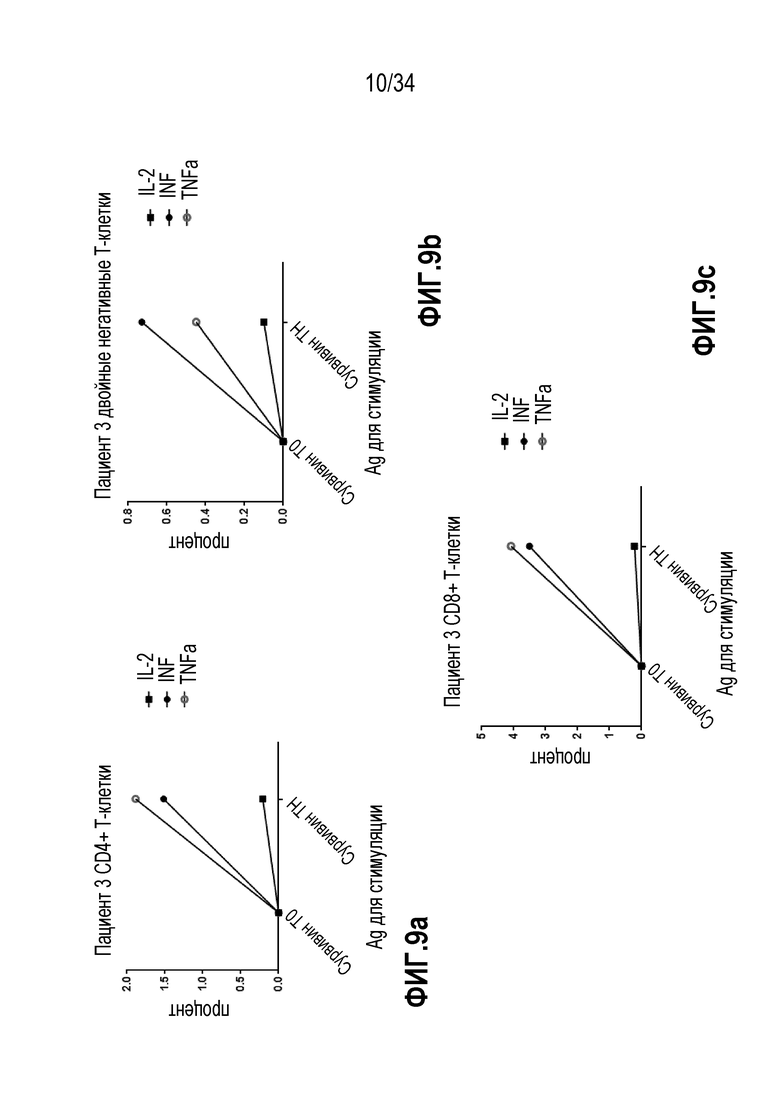

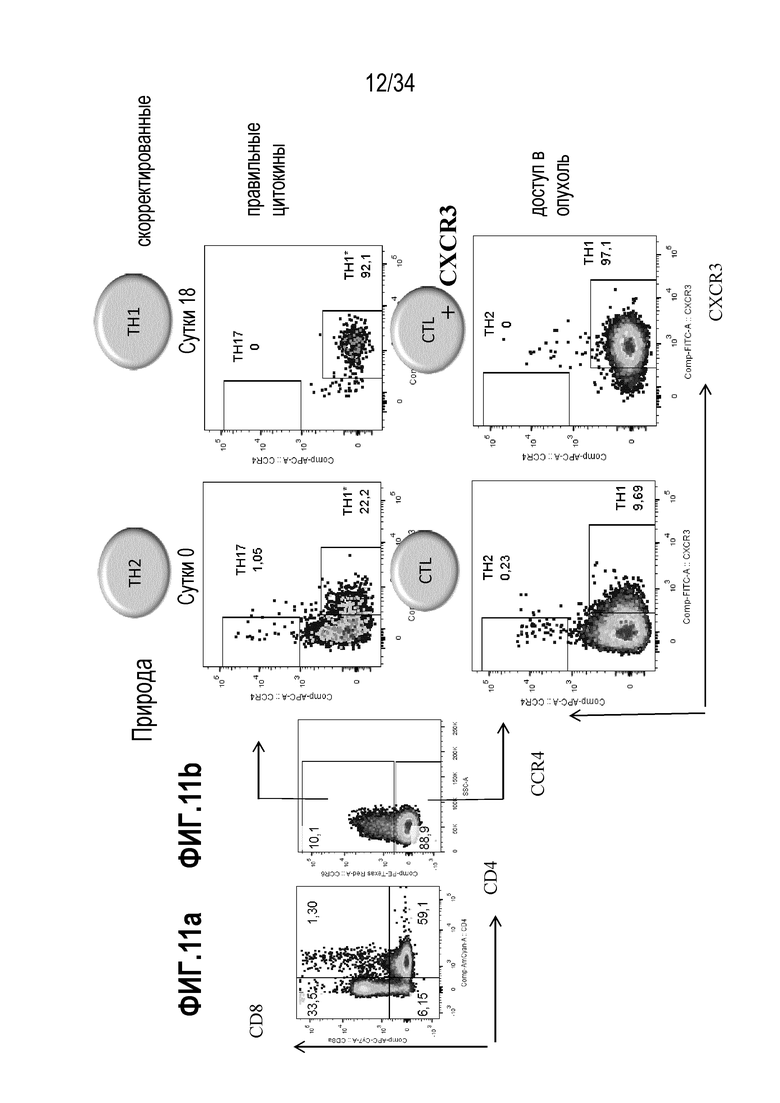
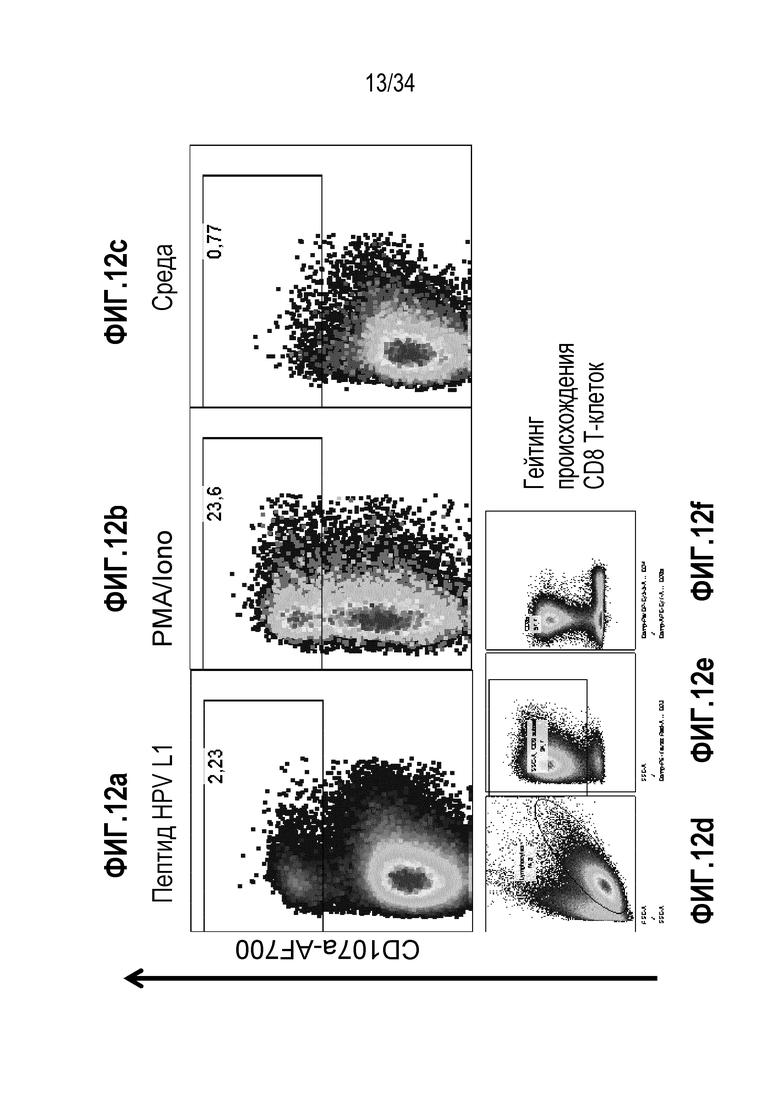
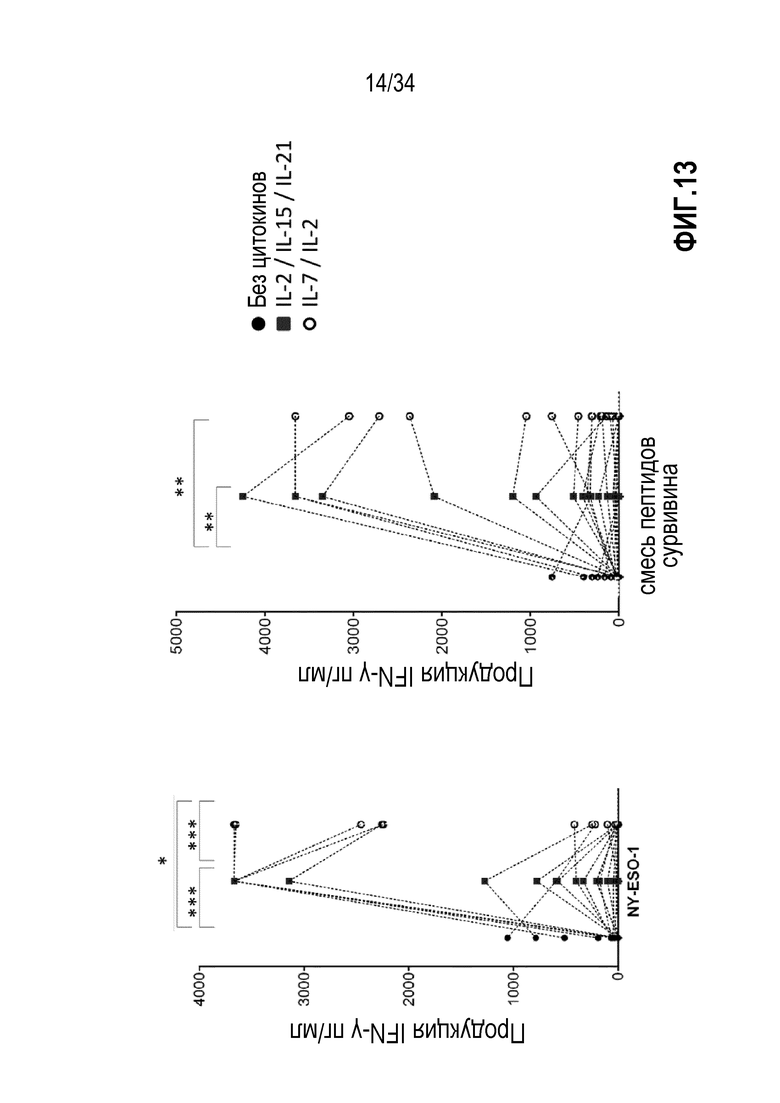
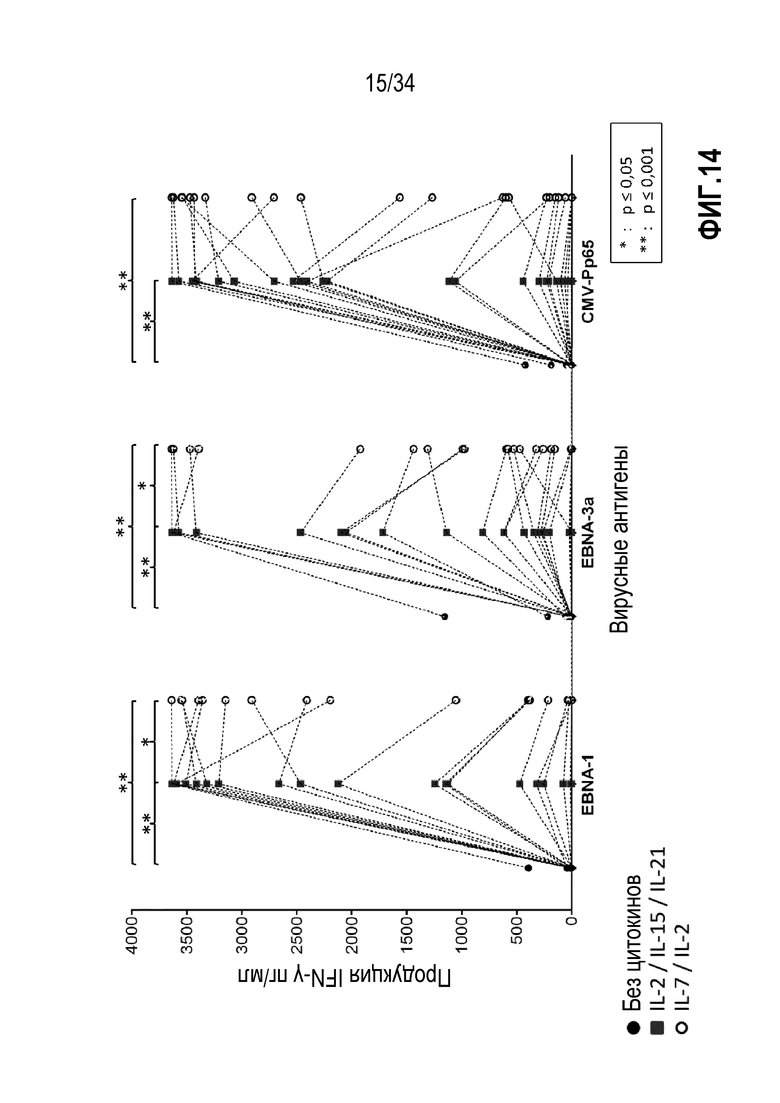

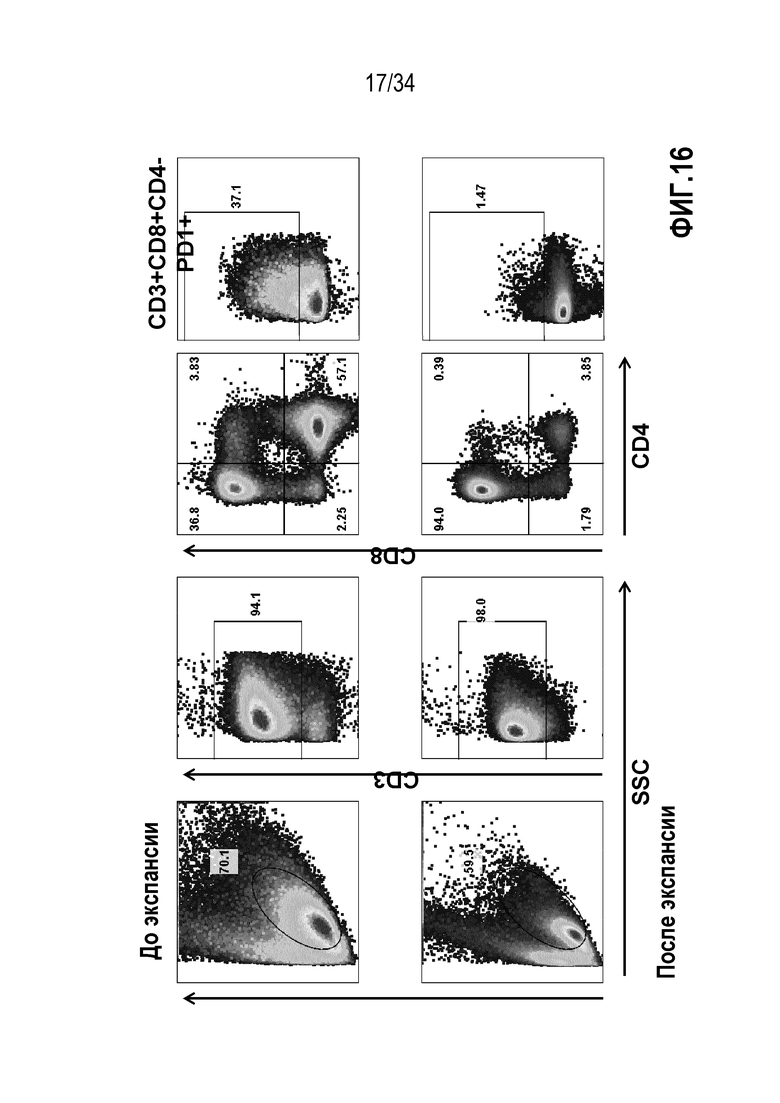
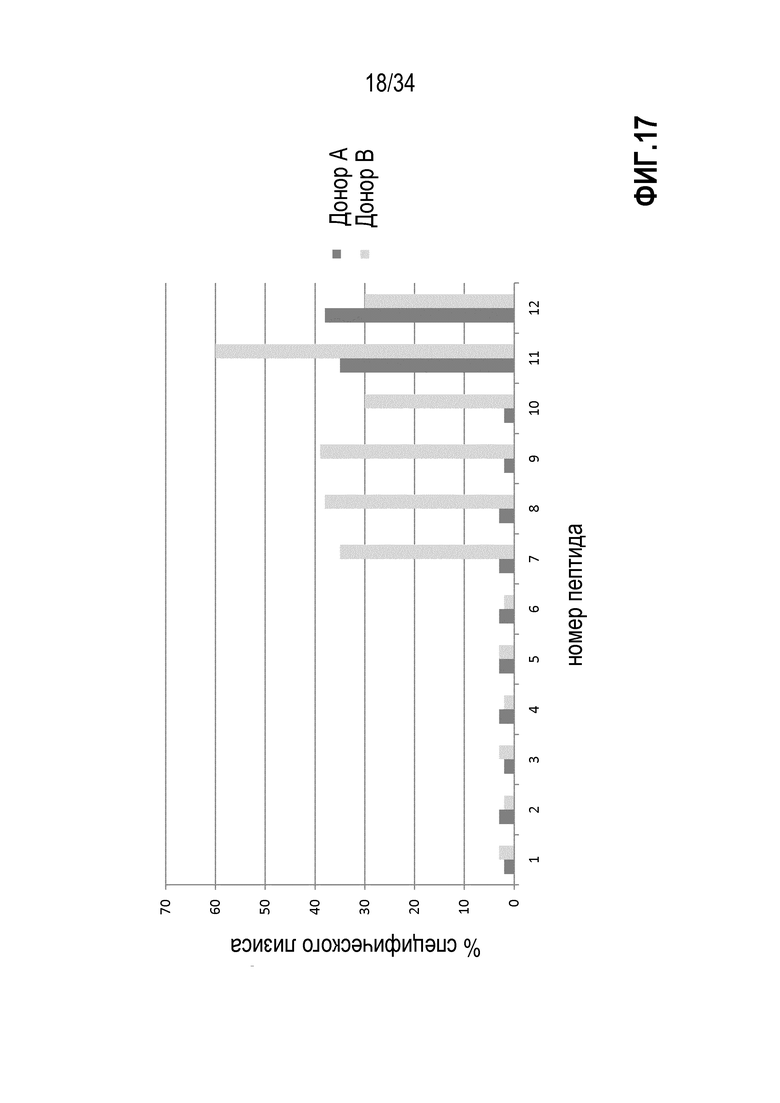
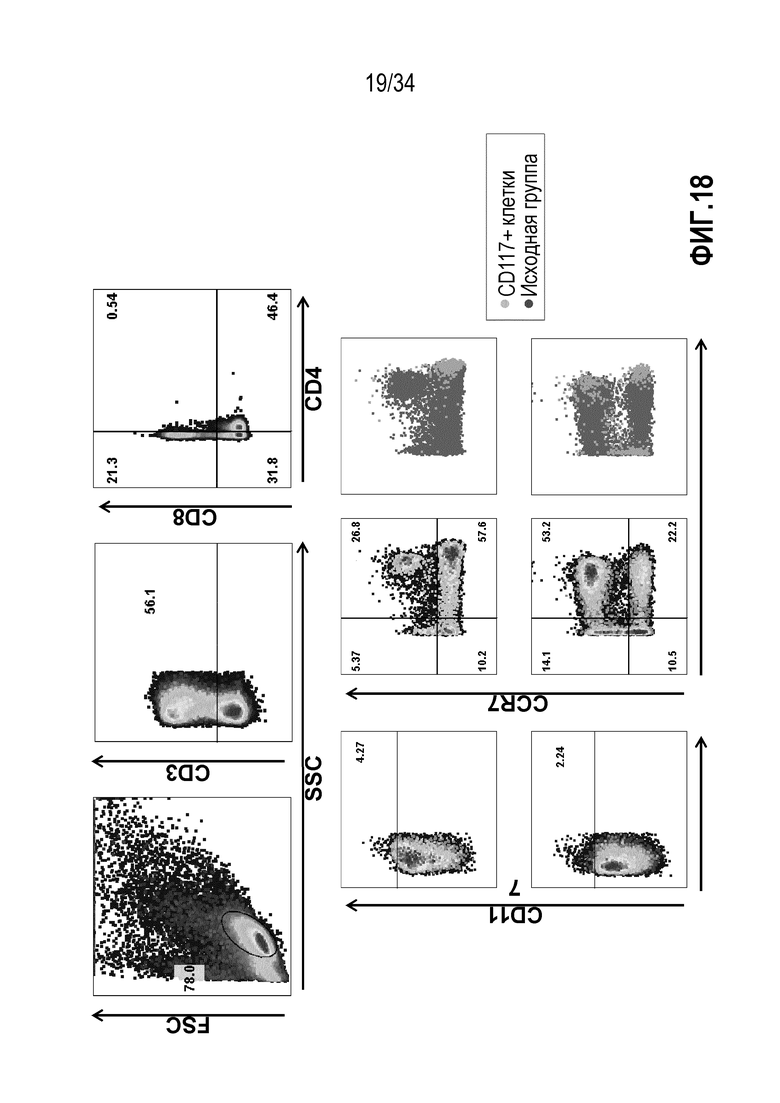
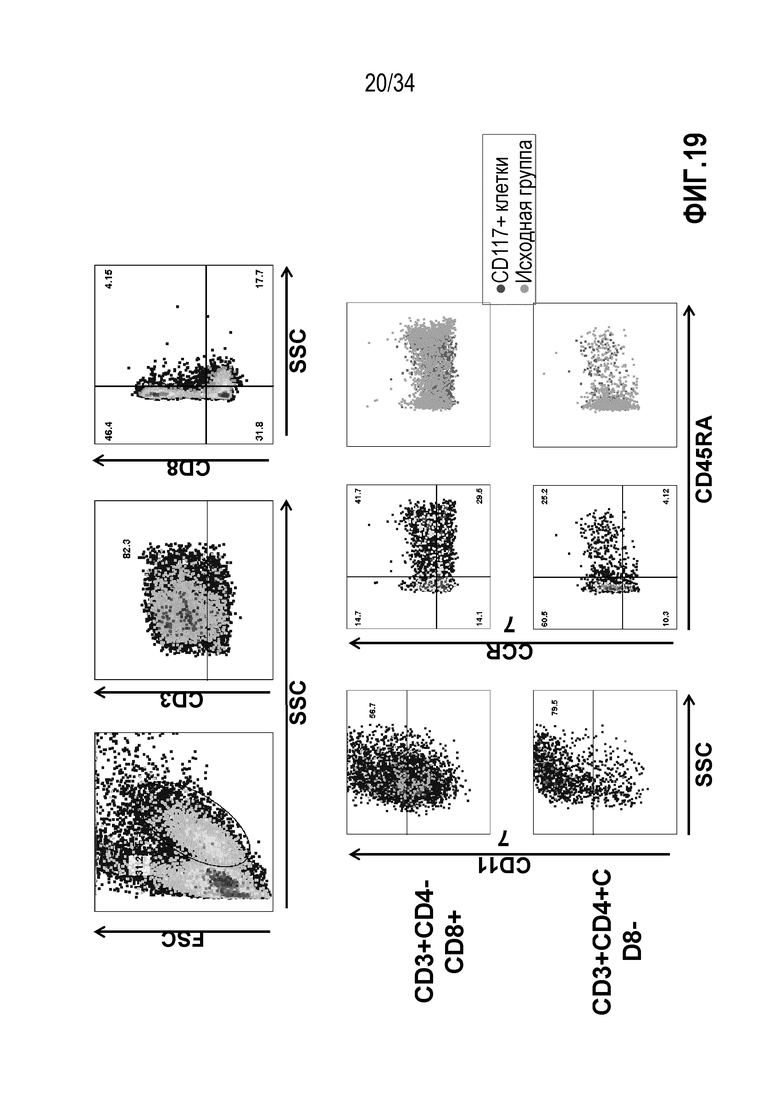
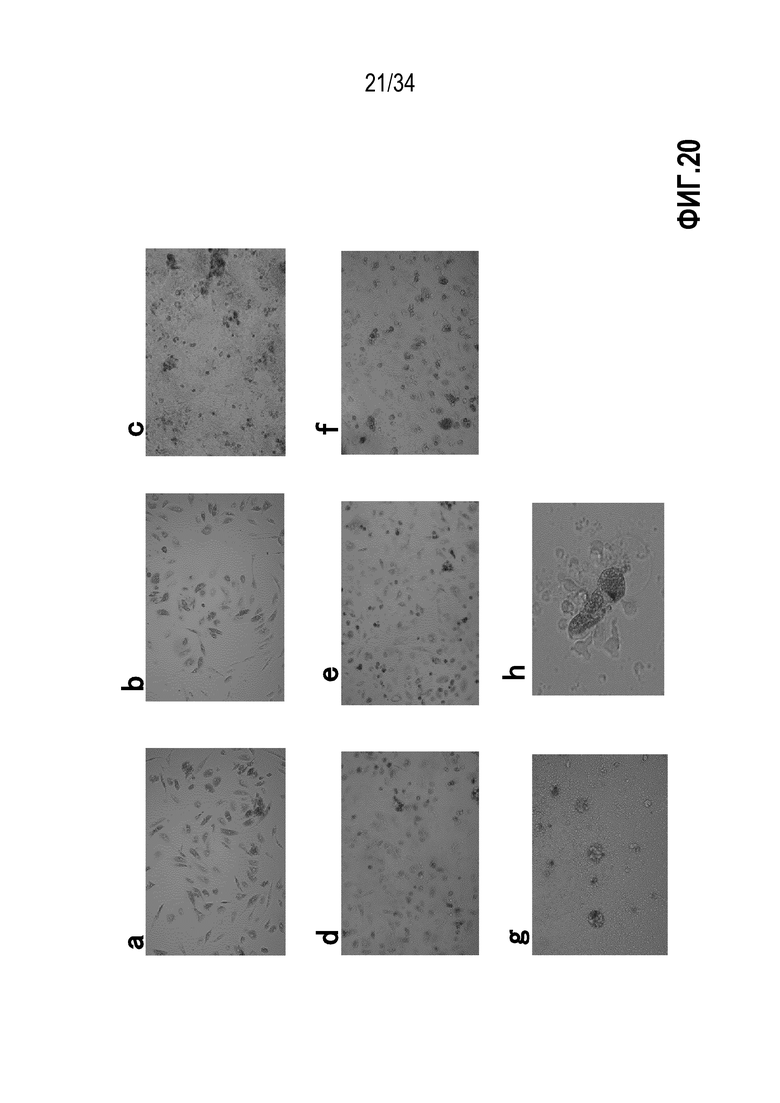
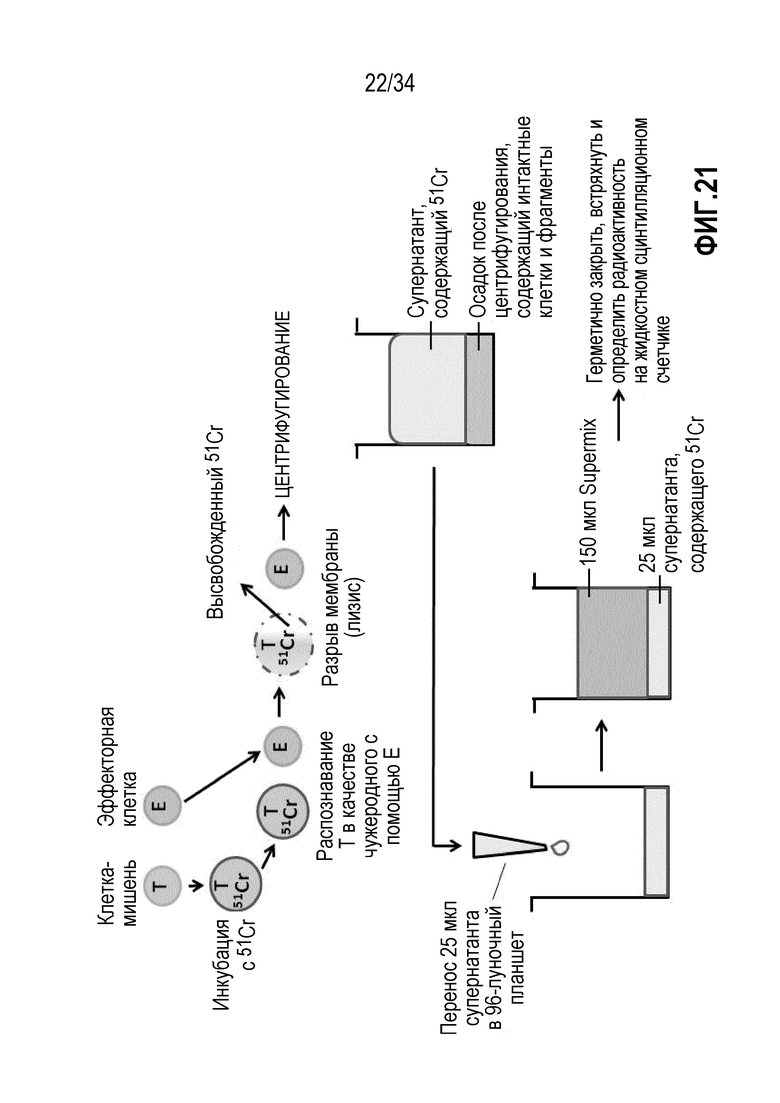
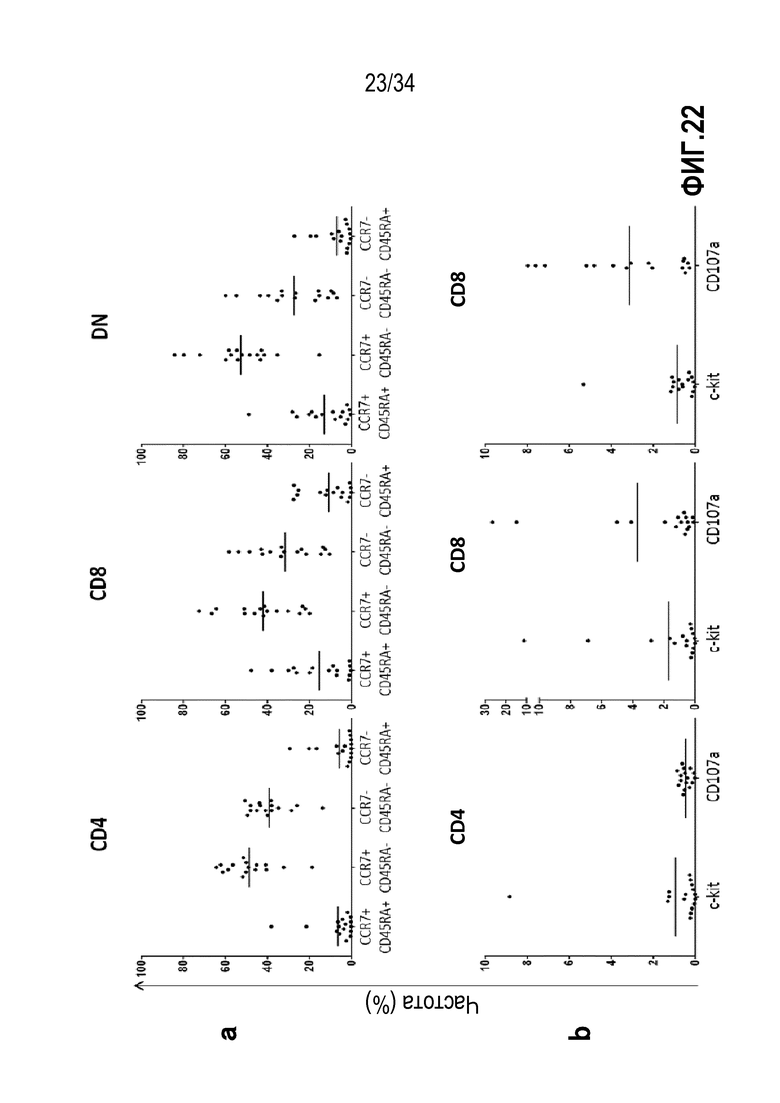
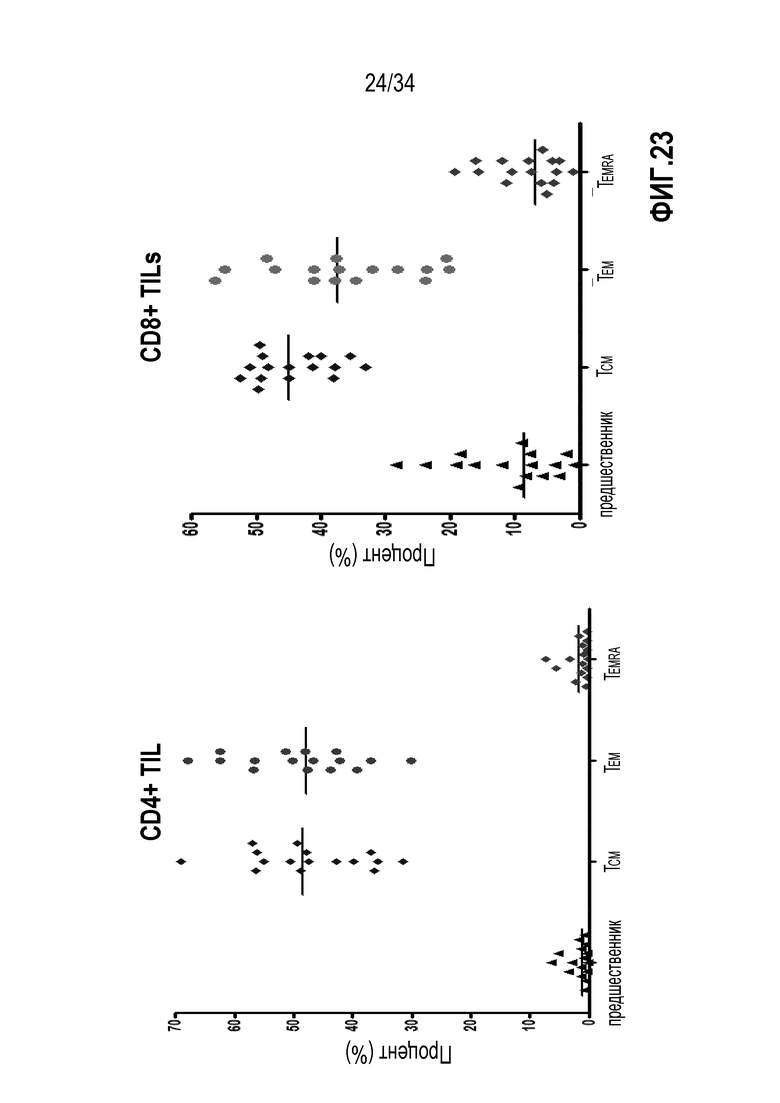
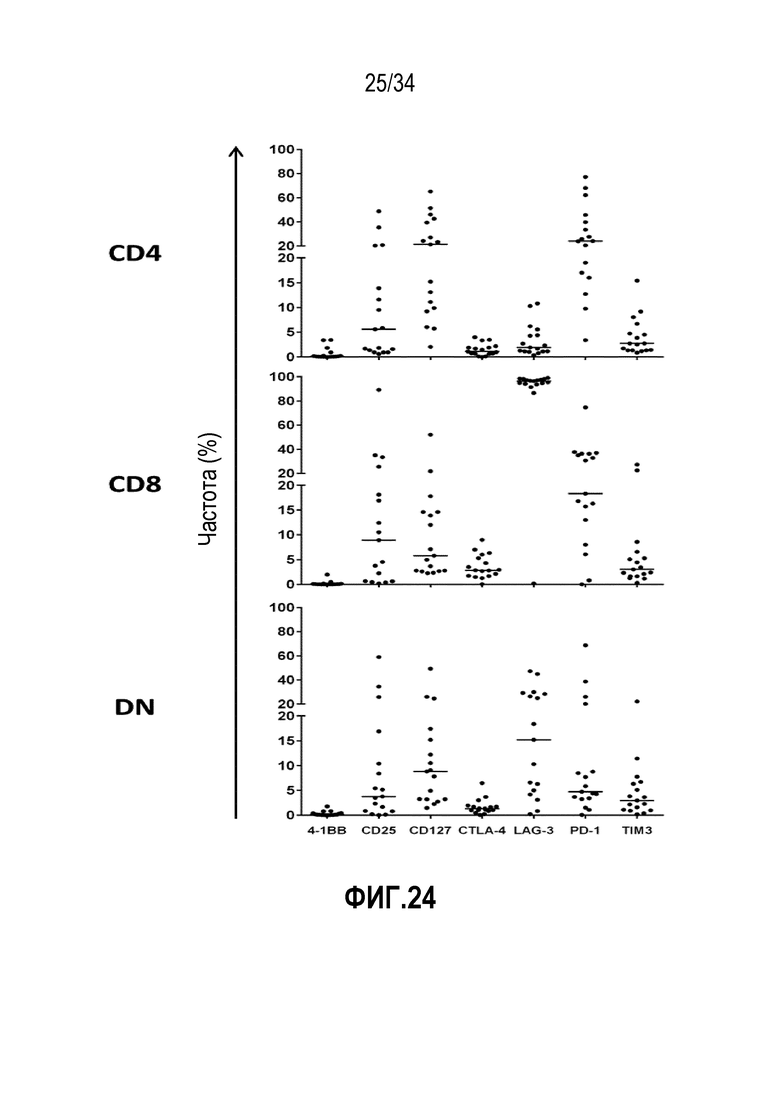
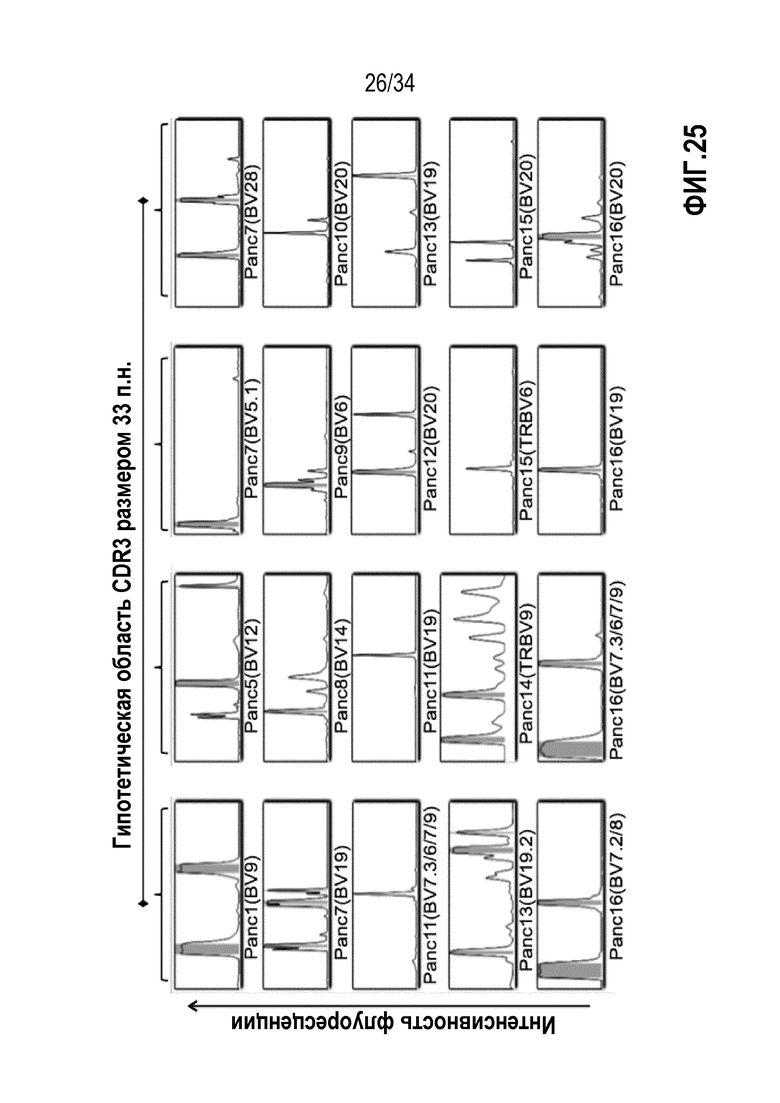
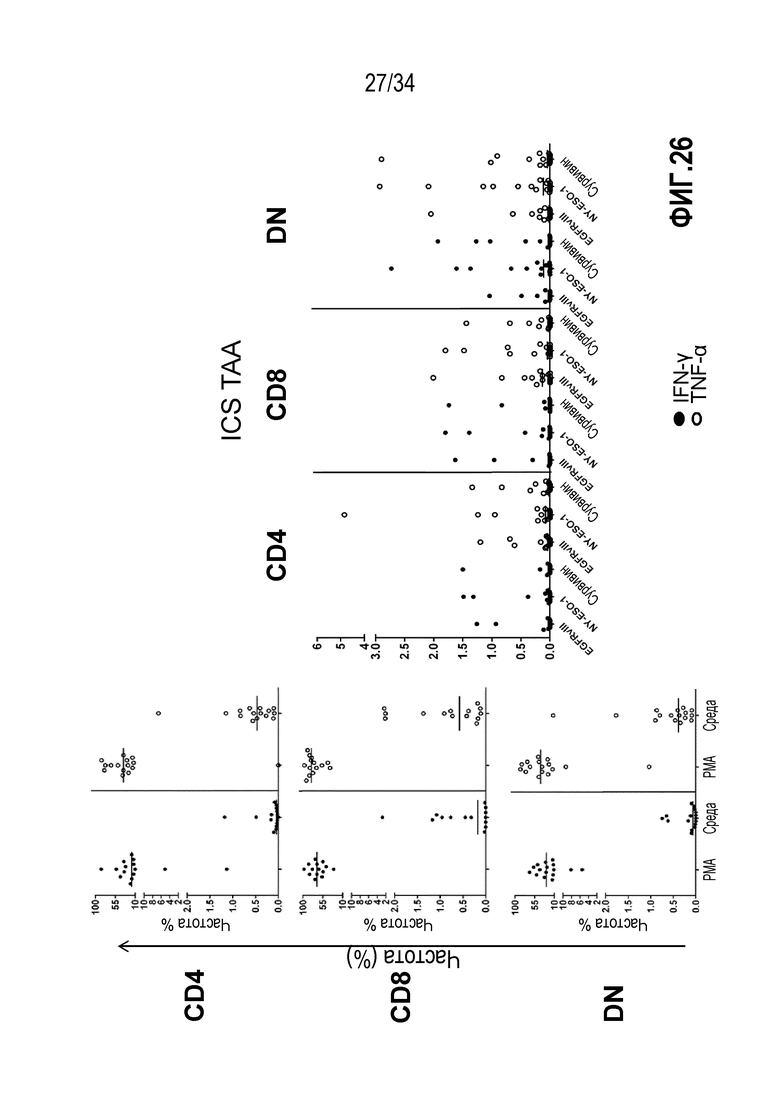

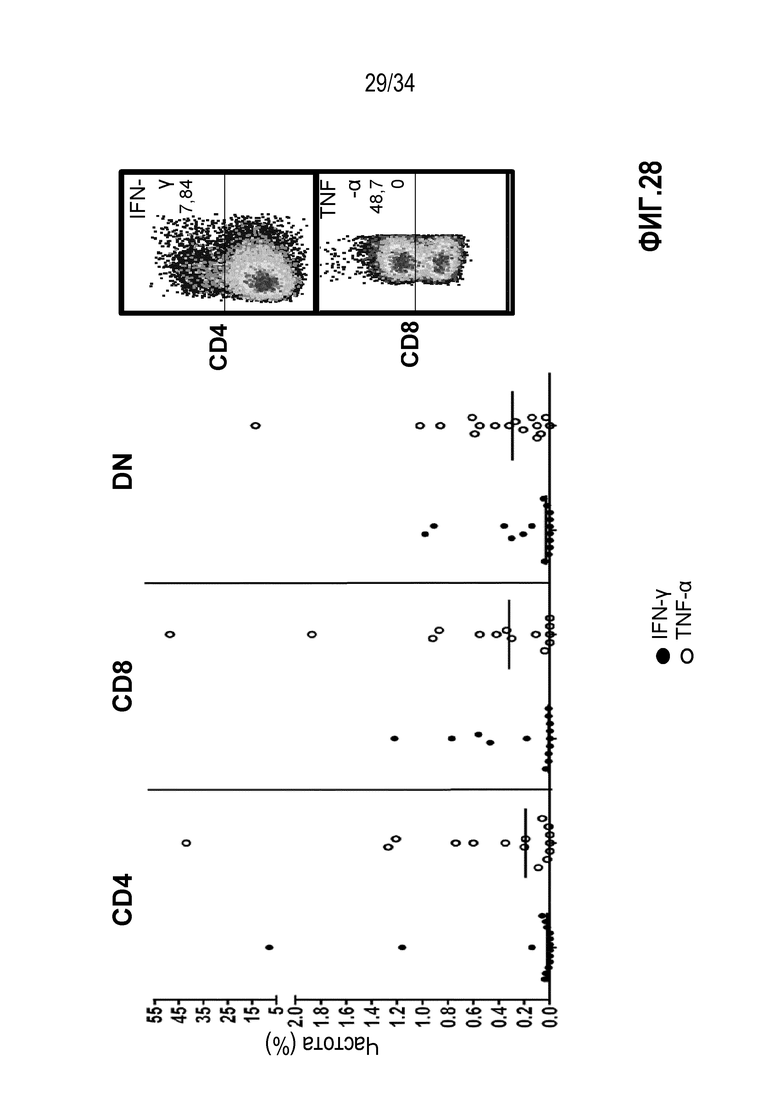
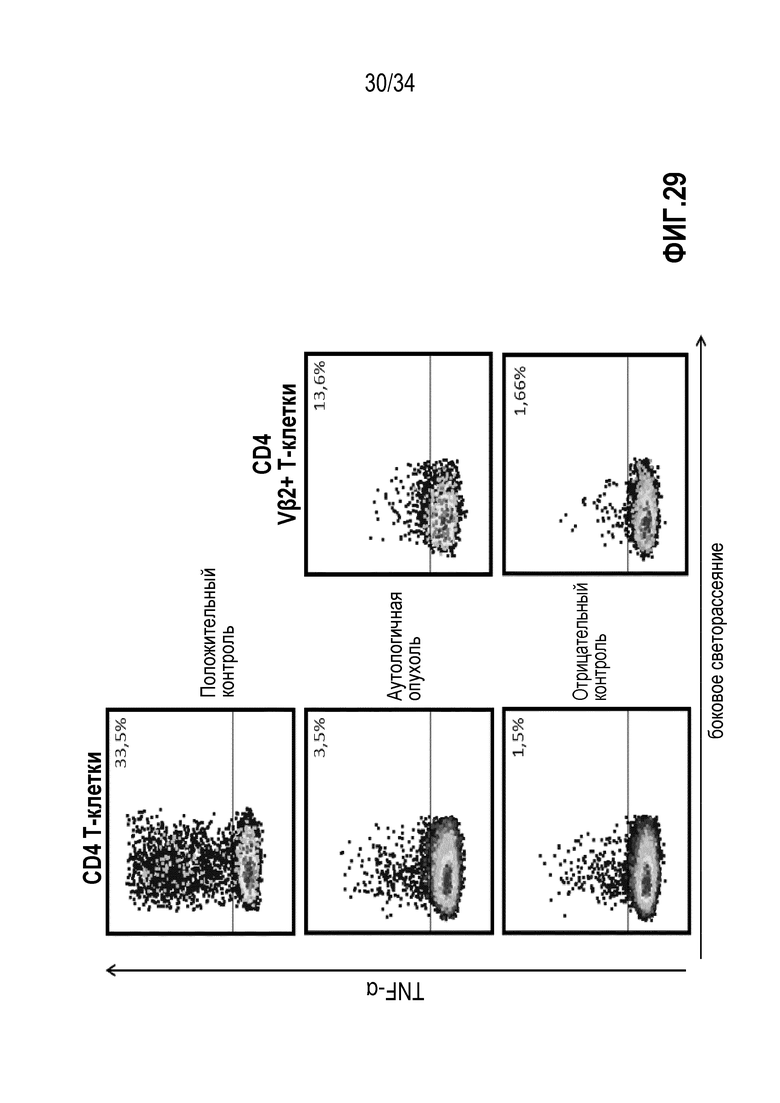
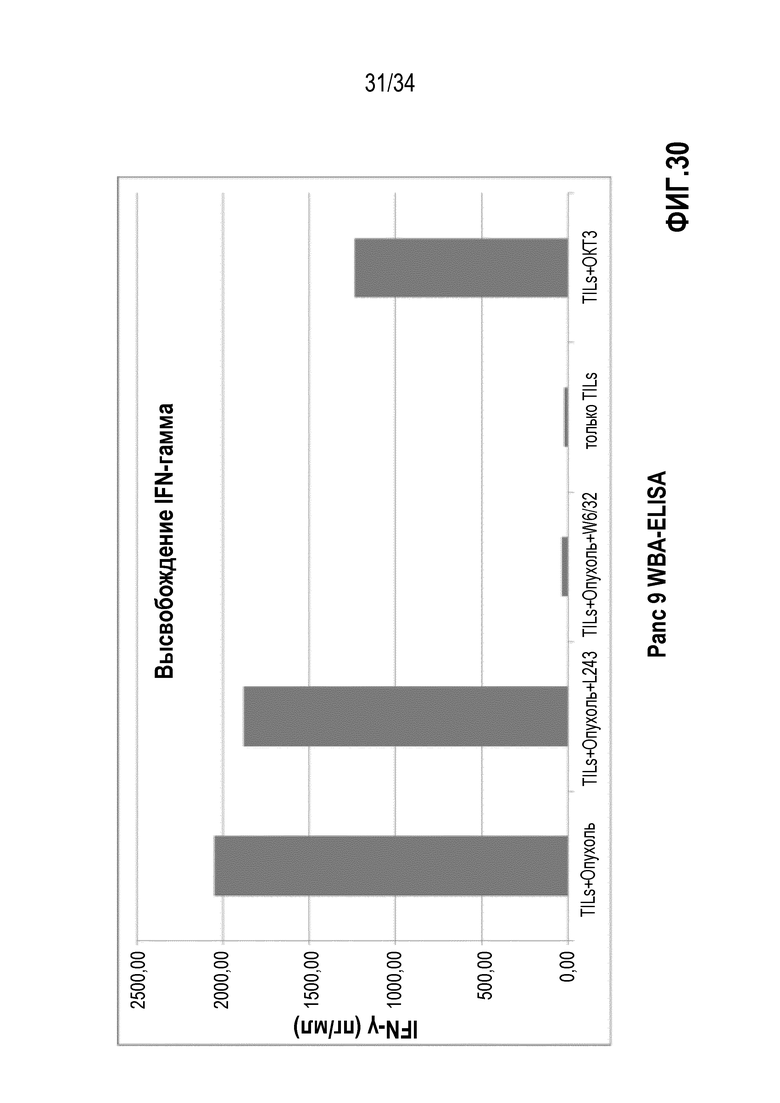

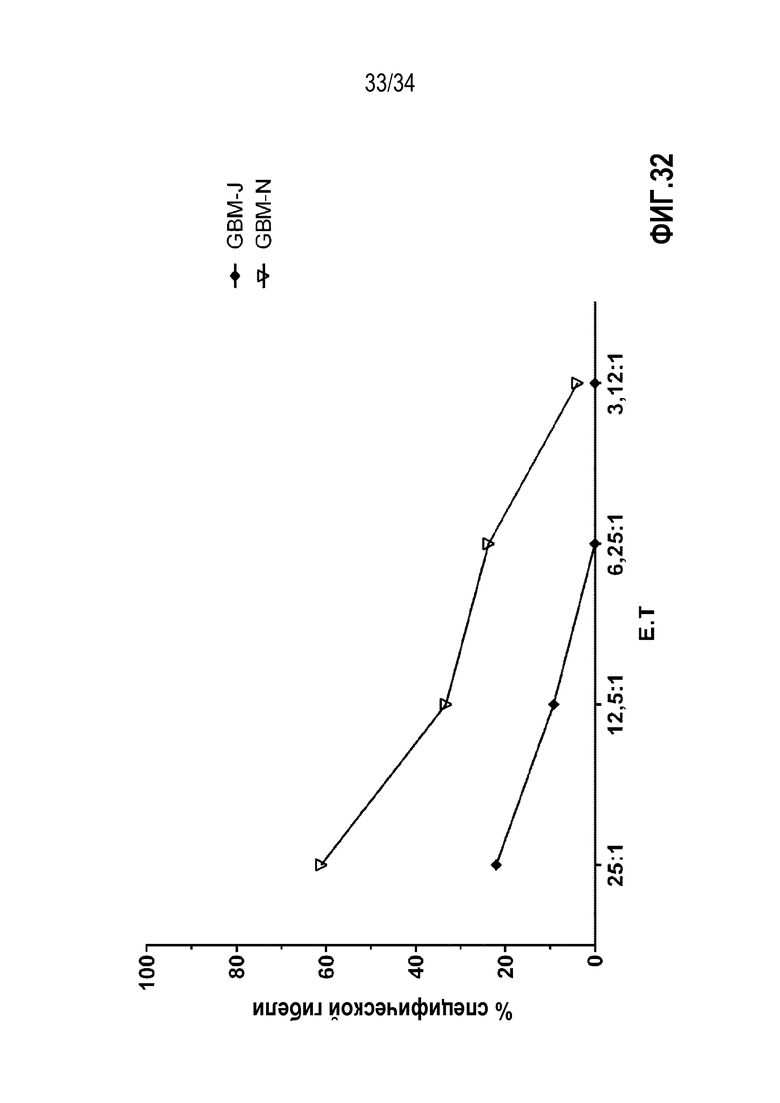
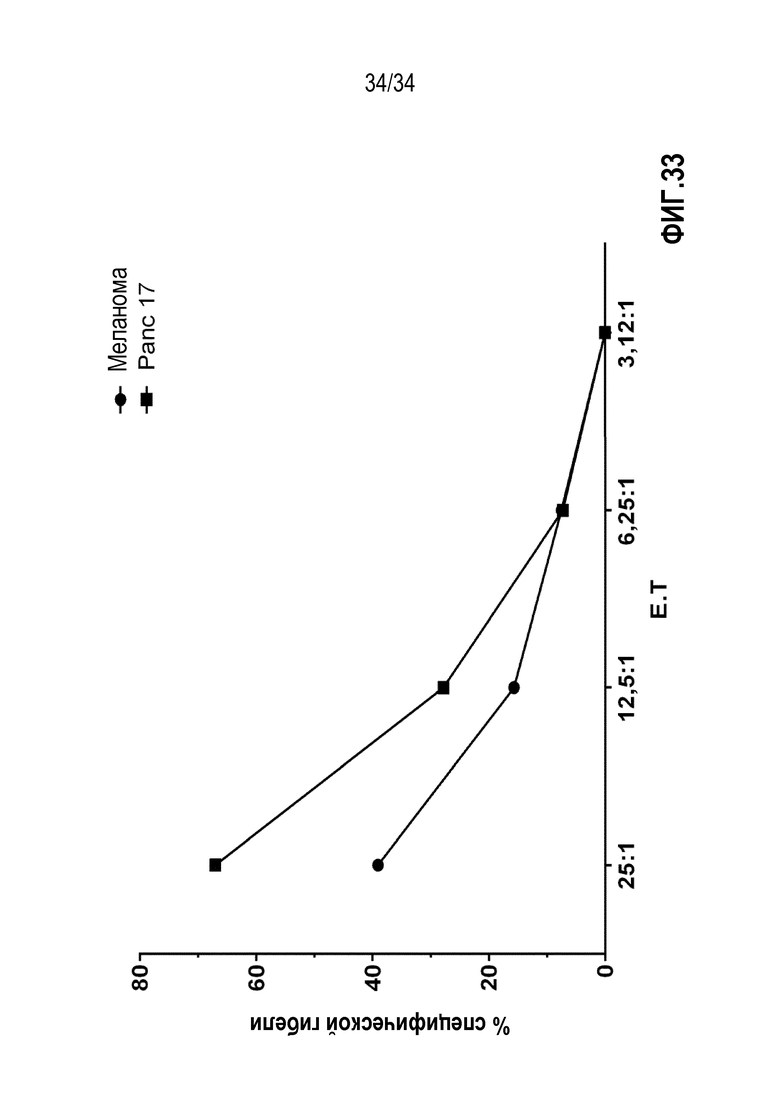
Изобретение относится к клеточной иммунотерапии, а именно к композиции, предназначенной для экспансии лимфоцитов, к способу получения популяции клинически значимых лимфоцитов, к способу лечения или профилактики заболеваний у млекопитающего (варианты), к применению набора в иммунотерапии, к клинически значимому лимфоциту (варианты), к популяции клинически значимых лимфоцитов (варианты). Композиция, предназначенная для экспансии лимфоцитов, содержит интерлейкин-2 (IL-2), интерлейкин-15 (IL-15) и интерлейкин-21 (IL-21) в определенных концентрациях, причем композиция находится в жидкой форме. Способ получения популяции клинически значимых лимфоцитов включает ряд стадий: получение образца ткани или образца жидкости организма, культивирование образца из организма in vitro для экспансии и/или стимуляции лимфоцитов в образце, где культивирование включает применение IL-2, IL-15 и IL-21 взятых в определённых концентрациях, определение присутствия клинически значимого лимфоцита в культивированном образце. Способ лечения или профилактики опухолевого заболевания у млекопитающего, включающий определенные стадии. Способ лечения или профилактики инфекционного заболевания у млекопитающего, включающий определенные стадии. Способ лечения или профилактики аутоиммунного заболевания у млекопитающего, включающий определенные стадии. Применение набора в иммунотерапии, где набор содержит IL-2, IL-15 и IL-21, взятых в определенных концентрациях, в жидкой композиции, компонент, который стимулирует TCR-костимуляторные молекулы, фидерные клетки и пептид, содержащий последовательность по меньшей мере одного клинически значимого антигена. Клинически значимый лимфоцит, полученный вышеуказанным способом (варианты). Популяция клинически значимых лимфоцитов, полученных вышеуказанным способом (варианты). Вышеописанное позволяет обеспечить успешную экспансию лимфоцитов против множества различных опухолей за счет разработанных средств и способов для получения продукта экспансированных лимфоцитов с улучшенным составом фенотипов Т-клеток для эффективной АСТ, применимых в отношении других видов опухолей. 10 н. и 28 з.п. ф-лы, 18 табл., 42 пр., 33 ил.
1. Композиция, предназначенная для экспансии лимфоцитов, содержащая интерлейкин-2 (IL-2), интерлейкин-15 (IL-15) и интерлейкин-21 (IL-21), причем композиция находится в жидкой форме, где концентрация IL-2 в жидкой композиции находится в диапазоне от 500 до 2000 Е/мл, концентрация IL-15 находится в диапазоне от 0,1 до 100 нг/мл, и где концентрация IL-21 находится в диапазоне от 0,1 до 100 нг/мл.
2. Композиция по п. 1, где концентрация IL-2 в жидкой композиции находится в диапазоне от 800 до 1200 Е/мл.
3. Композиция по п. 1, где концентрация IL-15 находится в диапазоне от 2 до 50 нг/мл, более предпочтительно в диапазоне от 5 до 20 нг/мл.
4. Композиция по п. 1, где концентрация IL-21 находится в диапазоне от 2 до 50 нг/мл, более предпочтительно в диапазоне от 5 до 20 нг/мл.
5. Способ получения популяции клинически значимых лимфоцитов, включающий следующие стадии:
получение образца ткани или образца жидкости организма, ранее полученного от млекопитающего, содержащего по меньшей мере один лимфоцит, и необязательно разделение клеток в образце из организма,
культивирование образца из организма in vitro для экспансии и/или стимуляции лимфоцитов в образце, где культивирование включает применение IL-2, IL-15 и IL-21, причем концентрация IL-2 в культуре составляет от 500 до 2000 Е/мл; концентрация IL-15 составляет от 0,1 до 100 нг/мл, и концентрация IL-21 составляет от 0,1 до 100 нг/мл;
и определение присутствия клинически значимого лимфоцита в культивированном образце;
причем культивирование in vitro включает первую стадию экспансии, включающую инкубацию в культуральной среде, содержащей IL-2, IL-15 и IL-21, до тех пор, пока лимфоциты не станут детектируемыми, и причем культивирование in vitro включает вторую стадию экспансии, включающую инкубацию в культуральной среде, содержащей фидерные клетки и/или антитела к CD3 в дополнение к IL-2, IL-15 и IL-21.
6. Способ по п. 5, где клинически значимые лимфоциты выбраны из опухолереактивных лимфоцитов, патогенреактивных лимфоцитов и аутоиммунных реактивных лимфоцитов, предпочтительно опухолереактивных лимфоцитов.
7. Способ по п. 5 или 6, где образец из организма выбран из группы, состоящей из периферической крови, пуповинной крови, костного мозга, лимфатических узлов, печени, плеврального экссудата, грудины, брюшной полости, синовиальной жидкости, брюшины, забрюшинного пространства, тимуса и опухоли.
8. Способ по п. 7, где образец из организма выбран из опухоли и периферической крови.
9. Способ по одному из пп. 5-8, где млекопитающее выбрано из млекопитающего с опухолевым заболеванием, млекопитающего, имеющего риск развития опухолевого заболевания, млекопитающего с инфекционным заболеванием, млекопитающего, имеющего риск развития инфекционного заболевания, млекопитающего с аутоиммунным заболеванием, млекопитающее, имеющего риск развития аутоиммунного заболевания.
10. Способ по п. 5, где время инкубации на первой стадии экспансии находится в диапазоне от 6 ч до 180 суток, предпочтительно в диапазоне от 4 до 10, более предпочтительно в диапазоне от 6 до 8 суток, наиболее предпочтительно составляет примерно 7 суток.
11. Способ по п. 5, где отношение фидерных клеток к лимфоцитам находится в диапазоне от 1:1 до 1:100, предпочтительно в диапазоне от 1:2 до 1:50, более предпочтительно в диапазоне от 1:5 до 1:20, наиболее предпочтительно оно составляет примерно 1:10.
12. Способ по одному из пп. 5-11, где популяция клинически значимых лимфоцитов является моноклональной, олигоклональной или поликлональной.
13. Способ по одному из пп. 5-12, где культуральная среда на первой и/или второй стадии экспансии содержит по меньшей мере один антиген для экспансии.
14. Способ по п. 13, где антиген для экспансии представляет собой фрагмент TAA.
15. Способ по п. 14, где фрагмент TAA представляет собой пептид, содержащий по меньшей мере восемь последовательных аминокислот аминокислотной последовательности, которая по меньшей мере на 80% идентична аминокислотной последовательности SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13 или SEQ ID NO: 14.
16. Способ по п. 5, где культивирование in vitro дополнительно включает стадию рефокусирования, включающую инкубирование в культуральной среде, содержащей рефокусирующие клетки.
17. Способ по п. 16, где время стадии рефокусирования находится в диапазоне от 1 до 6 суток, предпочтительно от 1 до 3 суток.
18. Способ по п. 16 или 17, где отношение рефокусирующих клеток к лимфоцитам находится в диапазоне от 1:1 до 1:100, предпочтительно в диапазоне от 1:5 до 1:10.
19. Способ по одному из пп. 5-18, где культивирование включает добавление промоторного соединения для стимуляции экспансии специфической субпопуляции лимфоцитов.
20. Способ по п. 19, где специфическая субпопуляция лимфоцитов представляет собой гамма-дельта Т-клетки (γδ-T-клетки).
21. Способ по одному из пп. 5-20, дополнительно включающий выделение популяции клинически значимых лимфоцитов из экспансированной клеточной культуры.
22. Способ по одному из пп. 5-21, где тестирование на присутствие клинически значимых лимфоцитов включает применение антигенов для оценки.
23. Способ по п. 22, где антигены для оценки презентируются культивированному образцу в форме, выбранной из клеток, полученных от того же млекопитающего что и культивированный образец (аутологичные клетки), по меньшей мере частично генетически совпадающих аллогенных клеток или клеток, экспрессирующих клинически значимые антигены в виде трансгена.
24. Способ по п. 22 или 23, где тестирование на присутствие клинически реактивных лимфоцитов включает контактирование лимфоцитов с по меньшей мере одним клинически значимым антигеном и определение изменения в продукции цитокинов, выбранной из продукции IFN-γ, пролиферации клеток, цитотоксичности, передачи сигналов и/или внутриклеточного фосфорилирования.
25. Способ лечения или профилактики опухолевого заболевания у млекопитающего, включающий следующие стадии:
получение или генерация популяции клинически значимых лимфоцитов способом по одному из пп. 5-24, где образец из организма получен от указанного млекопитающего; и
введение популяции клинически значимых лимфоцитов указанному млекопитающему.
26. Способ по п. 25, где опухолевое заболевание выбрано из глиобластомы и рака поджелудочной железы.
27. Способ лечения или профилактики инфекционного заболевания у млекопитающего, включающий стадии:
получение или генерация популяции клинически значимых лимфоцитов согласно способу по любому из пп. 5-24, где образец из организма получен от указанного млекопитающего; и
введение популяции клинически значимых лимфоцитов указанному млекопитающему.
28. Способ лечения или профилактики аутоиммунного заболевания у млекопитающего, включающий стадии:
получение или генерация популяции клинически значимых лимфоцитов согласно способу по любому из пп. 5-24, где образец из организма получен от указанного млекопитающего; и
введение популяции клинически значимых лимфоцитов указанному млекопитающему.
29. Способ по любому из пп. 25-28, где популяция клинически значимых лимфоцитов
приводит к регрессии раковых клеток у млекопитающего;
препятствует перерождению предраковых очагов в злокачественные очаги;
приводит к быстрому старению опухолевых клеток или предраковых клеток;
приводит к удалению позитивных на аутоантиген клеток;
приводит к гибели, остановке роста или сдерживанию патогенов;
препятствует развитию раковых стволовых клеток; и/или
индуцирует остановку роста раковых клеток или клеток, экспрессирующих аутоантигены.
30. Применение набора в иммунотерапии, где набор содержит IL-2, IL-15 и IL-21 в жидкой композиции, компонент, который стимулирует TCR-костимуляторные молекулы, фидерные клетки и пептид, содержащий последовательность по меньшей мере одного клинически значимого антигена, где концентрация IL-2 в жидкой композиции находится в диапазоне от 500 до 2000 Е/мл, концентрация IL-15 находится в диапазоне от 0,1 до 100 нг/мл, и где концентрация IL-21 находится в диапазоне от 0,1 до 100 нг/мл.
31. Клинически значимый лимфоцит, полученный способом по одному из пп. 5-24, где клинически значимый лимфоцит выбран из В-клетки, NK-клетки и Т-клетки, где Т-клетка предпочтительно выбрана из хелперной Т-клетки (TH-клетки или CD4+ Т-клетки), цитотоксической Т-клетки (ТС-клетки или CD8+ Т-клетки), Т-клетки памяти, в частности, Т-клетки центральной памяти (ТCM-клетка), стволовой Т-клетки памяти (TSCM-клетки) или Т-клетки периферической памяти (TPM-клетки), гамма-дельта Т-клетки (γδ-Т-клетки), NK-T-клетки, ассоциированной со слизистой инвариантной Т-клетки (MAIT), двойной негативной Т-клетки (CD3+CD4-CD8- T-клетки).
32. Клинически значимый лимфоцит по п. 30 или 31, где лимфоцит выбран из:
лимфоцита, который экспрессирует молекулы, способствующие поступлению в опухолевую или инфицированную, или воспаленную ткань (например, CXCR3); и
лимфоцита, который обогащен в отношение маркеров любого из долговременной памяти, активации антигенспецифических иммунных ответов и цитолитических иммунных клеточных реакций.
33. Лимфоцит, полученный способом по одному из пп. 5-24,
экспрессирующий молекулы и цитокины, способствующие образованию комбинации лимфоцитов, пригодных для медицинского применения, включая предшественники Т-клеток, клетки TCM, TSCM и/или TPM;
экспрессирующий молекулы и цитокины, которые способствуют экспансии клинически значимых лимфоцитов;
продуцирующий цитокины, выбранные из IFN-γ, TNF-α, IL-2, IL-17 и любой их комбинации;
представляющий CD3+CD4-CD8- Т-клетку.
34. Популяция клинически значимых лимфоцитов, полученных способом по одному из пп. 5-24.
35. Популяция лимфоцитов, полученных способом по одному из пп. 5-24, включающая популяцию клинически значимых лимфоцитов.
36. Популяция лимфоцитов по п. 35, отличающаяся одним или более из следующих признаков:
процент Treg в расчете к общему количеству Т-клеток составляет менее 5%, предпочтительно менее 3%;
процент TH1-клеток в расчете к общему количеству TH-клеток составляет по меньшей мере 50%, предпочтительно, по меньшей мере 70%, более предпочтительно, по меньшей мере 80%,
процент CXCR3+ Т-клеток в расчете к общему количеству CD8+ Т-клеток составляет по меньшей мере 50%, предпочтительно, по меньшей мере 70%, более предпочтительно, по меньшей мере 80%,
процент 4-1ВВ+ Т-клеток в расчете к общему количеству Т-клеток составляет по меньшей мере 1%, предпочтительно, по меньшей мере 2%, более предпочтительно, по меньшей мере 2,5%,
процент CD117+ Т-клеток в расчете к общему количеству Т-клеток составляет по меньшей мере 1%, предпочтительно, по меньшей мере 2%, более предпочтительно, по меньшей мере 2,5%,
процент CD3+CD4-CD8- клеток в расчете к общему количеству Т-клеток составляет по меньшей мере 1%, предпочтительно, по меньшей мере 3%, более предпочтительно, по меньшей мере 5%; и
процент γδT-клеток в расчете к общему количеству Т-клеток составляет по меньшей мере 1%, предпочтительно, по меньшей мере 3%, более предпочтительно, по меньшей мере 5%.
37. Популяция лимфоцитов по п. 35 или 36, отличающаяся одним или более из следующих признаков:
процент предшественников Т-клеток (CD45RA+ CCR7+) в расчете к общему количеству Т-клеток составляет по меньшей мере 1%, предпочтительно, по меньшей мере 2%, более предпочтительно, по меньшей мере 3%;
процент Т-клеток центральной памяти (CD45RA-CCR7+) в расчете к общему количеству Т-клеток составляет по меньшей мере 2%, предпочтительно, по меньшей мере 5%, более предпочтительно, по меньшей мере 10%;
процент Т-клеток периферической памяти (CD45RA-CCR7-) в расчете к общему количеству Т-клеток составляет по меньшей мере 2%, предпочтительно, по меньшей мере 5%, более предпочтительно, по меньшей мере 10%; и
процент эффекторных Т-клеток (CD45RA+CCR7-) в расчете к общему количеству Т-клеток составляет по меньшей мере 1%, предпочтительно, по меньшей мере 3%, более предпочтительно, по меньшей мере 5%.
38. Популяция лимфоцитов по одному из пп. 35-37, отличающаяся одним или более из следующих признаков:
процент клинически значимых Т-клеток составляет по меньшей мере 0,1% в расчете к общему количеству Т-клеток, определяемый мультимерными растворимыми комплексами МНС-пептида или внутриклеточной продукцией цитокинов;
внутриклеточная продукция цитокинов после стимуляции антигеном имеет значение, по меньшей мере в 2 раза превышающее стандартное отклонение без стимуляции антигеном; и
индукция CD107a после стимуляции антигеном имеет значение, по меньшей мере в 2 раза превышающее стандартное отклонение без стимуляции антигеном.
| HUARTE E et al | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| Капельная масленка с постоянным уровнем масла | 0 |
|
SU80A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| WO 2013074916 A1, 23.05.2013 | |||
| US 20080131396 A1, 5.06.2008 | |||
| US 5985656 A, 13.11.1999. | |||
Авторы
Даты
2020-12-28—Публикация
2015-06-11—Подача