Область техники, к которой относится изобретение
Настоящее изобретение относится к области медицины, в частности, к области иммунотерапии раковых заболеваний, конкретно - к адоптивной Т-клеточной терапии. Более конкретно, настоящее изобретение обеспечивает способ получения культуры лимфоцитов, обогащенных опухоль-специфичными клонами Т-лимфоцитов, которые затем могут быть использованы для масштабного выращивания с использованием известных протоколов экспансии ex vivo и введены пациенту, страдающему раком, при проведении адоптивной клеточной терапии (АКТ).
Уровень техники
Опухоли развивают различные механизмы уклонения от иммунного ответа, включая тканевую гипоксию, воспаление, создание иммуносупрессивного микроокружения, подавление презентации антигена, стимулирование инфильтрации регуляторными Т-лимфоцитами (Трег) и их пролиферации, а также индукцию дисфункции Т-лимфоцитов. Введение большого количества выращенных в условиях ex vivo аутологичных опухоль-реактивных Т-лимфоцитов - обычно после применения схем лечения, направленных на лимфодеплецию - представляет собой мощный терапевтический подход, который может преодолеть иммуносупрессивные механизмы, используемые опухолями. Клинические протоколы для таких терапевтических стратегий АКТ в настоящее время активно разрабатываются и используются для лечения пациентов (Dudley, М. Е. et al. Generation of tumor-infiltrating lymphocyte cultures for use in adoptive transfer therapy for melanoma patients. J. Immunother. 26, 332-342 (2003); Kelderman, S. et al. Antigen-specific TIL therapy for melanoma: A flexible platform for personalized cancer immunotherapy. Eur. J. Immunol. 46, 1351-1360 (2016); Rosenberg, S. A. & Restifo, N. P. Adoptive cell transfer as personalized immunotherapy for human cancer. Science 348, 62-68 (2015)).
АКТ является перспективным подходом к иммунотерапии рака, но ее эффективность принципиально зависит от степени обогащения трансплантата опухоль-специфичными Т-лимфоцитами. Современные способы обогащения популяции аутологичных культивированных лимфоцитов опухоль-реактивными Т-лимфоцитами основаны на идентификации специфических для пациента пептидных неоантигенов (антигенов, возникающих в результате мутаций, происходящих в опухолевых клетках), которые затем используются для функциональной характеристики и отбора культивируемых опухоль-инфильтрирующих лимфоцитов (ОИЛ) (Yossef, R. et al. Enhanced detection of neoantigen-reactive T cells targeting unique and shared oncogenes for personalized cancer immunotherapy. JCI Insight 3, (2018); Leko, V. et al. Identification of Neoantigen-Reactive Tumor-Infiltrating Lymphocytes in Primary Bladder Cancer. J. Immunol. 202, 3458-3467 (2019)). При этом известно, что клетки опухоли на ранних этапах канцерогенеза по своему молекулярному составу практически неотличимы от клеток окружающей ткани, они не могут быть узнаны и уничтожены иммунной системой, являясь неиммуногенными. По мере роста опухоли за счет накопления мутаций в ДНК происходит образование так называемых неоантигенов, которые могут быть презентированы дендритными клетками Т-хелперам, являющимся активаторами специфического иммунитета к опухолям. Появление неоантигенов происходит с задержкой, что позволяет клеткам опухоли реализовать механизмы защиты от иммунной системы, в частности, создать микроокружение, которое ингибирует специфический противоопухолевый иммунитет.
Для целей идентификации опухоль-специфичных лимфоцитов могут быть использованы известные опухоль-ассоциированные антигены (ОАА). ОАА являются доступной альтернативой неоантигенам, поскольку идентификация уникальных неоантигенов является дорогостоящей, трудоемкой и функционально ограниченной с точки зрения спектров идентифицируемых антигенов процедурой. Также культивируемая аутологичная опухолевая ткань может использоваться в качестве источника антиген-специфического стимула (Seliktar-Ofir, S. et al. Selection of Shared and Neoantigen-Reactive T Cells for Adoptive Cell Therapy Based on CD137 Separation. Front. Immunol. 8, 1211 (2017)), причем для этих целей могут быть использованы как живые, так и лизированные опухолевые клетки (Gonzalez FE et al. Tumor cell lysates as immunogenic sources for cancer vaccine design. Hum Vaccin Immunother. 2014;10(11):3261-9).
Некоторые поверхностные клеточные маркеры, такие как PD-1, CD39, CD69, CD103 или CD137, также могут быть полезными для выделения субпопуляции Т-лимфоцитов (обычно CD8+), которые обогащены клонально размноженными опухоль-реактивными Т-лимфоцитами (Gros, A. et al. PD-1 identifies the patient-specific CD8+ tumor-reactive repertoire infiltrating human tumors. J. Clin. Invest. 124, 2246-2259 (2014); Duhen, T. et al. Co-expression of CD39 and CD103 identifies tumor-reactive CD8 T cells in human solid tumors. Nat. Commun. 9,2724 (2018)), поэтому культивирование отобранных субпопуляций ОИЛ, таких как PD-1+ Т-лимфоциты, является одним из возможных вариантов.
Однако во всех указанных выше сценариях необходим надежный метод, позволяющий оценить обогащение трансплантируемых клеток опухоль-специфичными Т-лимфоцитами. Известно, что развивающийся адаптивный иммунный ответ на различные патогены часто бывает представлен группами клонов Т-лимфоцитов с высоко гомологичными аминокислотными последовательностями Т-клеточных рецепторов (ТКР) (и соответствующими им кодирующими нуклеотидными последовательностями), которые распознают одни и те же эпитопы (Dash, Р. et al. Quantifiable predictive features define epitope-speciflc T cell receptor repertoires. Nature 547, 89-93 (2017); Glanville, J. et al. Identifying specificity groups in the T cell receptor repertoire. Nature 547, 94-98 (2017)). Гипотетически идентификация таких конвергентных кластеров ТКР может оказаться высокоэффективным подходом к идентификации клонотипов, принимающих участие в формировании противоопухолевого иммунного ответа.
Соответственно, в онкологии и, в частности, в области АКТ существует большая потребность как в оптимизации существующих способов обогащения, так и в способах оценки степени обогащения культивируемых ОИЛ аутологичными Т-лимфоцитами, специфичными в отношении опухолевых антигенов, для использования в протоколах АКТ.
Такие протоколы, известные как «протокол быстрой экспансии» (Rapid Expansion Protocol (REP)), описаны в Dudley et al., Science 2002, 298, 850-854; Dudley et al., J. Clin. Oncol., 2005, 23, 2346-2357; J. Clin. Oncol., 2008, 26, 5233-5239 и т.д. В качестве параметров приемлемости выращенных и размноженных в условиях ex vivo ОИЛ для инфузии пациенту для целей АКТ в указанных протоколах рассматривали показатели состава популяции ОИЛ (положительные по CD28, CD8 или CD4), а также числовые значения, характеризующие степень размноженности популяции и ее жизнеспособности.
Указанные протоколы страдают рядом недостатков. Так, в частности, возможность их широкой коммерциализации серьезно ограничена продолжительностью процесса, высокой стоимостью, проблемами стерильности. В связи с этим были разработаны протоколы, пригодные для коммерциализации в промышленном масштабе и отвечающие требованиям регуляторных органов в отношении возможности использования на людях-пациентах. К указанным протоколам в первую очередь относятся способы, разработанные компанией Iovance Biotherapeutics и описанные в патентах US 10420799, US 10639330, US 10918666, US 11273180.
Раскрытие сущности изобретения
В основу настоящего изобретения положена неожиданно обнаруженная авторами изобретения возможность эффективно идентифицировать опухоль-специфичные Т-лимфоциты посредством анализа репертуара Т-клеточных рецепторов ОИЛ с использованием методов биоинформатики, таких как, в частности, кластерный анализ последовательностей указанных рецепторов. Указанный подход позволяет: 1) выявлять присутствие опухоль-специфичных Т-лимфоцитов в пуле ОИЛ, 2) оптимизировать условия культивирования ОИЛ, и 3) определять на основе поверхностных маркеров обогащение свежевыделенных или подвергнутых повторной стимуляции ОИЛ опухоль-специфичными Т-лимфоцитами.
Под ОИЛ лимфоцитами принято понимать популяцию лимфоцитов, которые мигрировали в опухолевую ткань. Клетки ОИЛ включают CD8+ цитотоксические Т-лимфоциты, Th1 и Th17 CD4+ лимфоциты, естественные киллеры, дендритные клетки и M1 макрофаги, но не ограничиваются указанными клетками. Т-лимфоциты, инфильтрирующие опухоль,
обогащены поликлональными Т-клетками, обладающими разнообразной антигенной специфичностью. Так, например, известно, что меланома характеризуется высокой мутационной нагрузкой и высоко индивидуализированным набором неоантигенов. Культивирование ОИЛ в условиях ex vivo после извлечения фрагмента опухоли выводит ОИЛ из агрессивного микроокружения, имеющего место в опухоли, и уменьшает иммуносупрессивные эффекты, оказываемые регуляторными Т-клетками (Трег) интратуморально. Таким образом, культивирование аутологичных ОИЛ в условиях ex vivo позволяет не только сохранить весь уникальный спектр изначальной опухоль-реактивности Т-лимфоцитов, но и наращивать их во многократно увеличенном количестве, что делает возможным проведение АКТ путем последующего введения пациенту.
ОИЛ могут быть охарактеризованы биохимически или функционально, по их способности инфильтрировать опухоль и тем самым оказывать терапевтическое действие. С точки зрения биохимических характеристик ОИЛ в общем могут быть разделены на категории на основании экспрессии одного или более из следующих биомаркеров: CD4, CD8, ТКР αβ, CD27, CD28, CD56, CCR7, CD45Ra, CD95, CD137, PD-1, CD39, CD69, CD103 (Duhen Т et al. Co-expression of CD39 and CD103 identifies tumor-reactive CD8 T cells in human solid tumors. Nat Commun. 2018; 9(1):2724) и CD25 (Abd Hamid M et al. Self-Maintaining CD103+ Cancer-Specific T Cells Are Highly Energetic with Rapid Cytotoxic and Effector Responses. Cancer Immunol Res. 2020; 8(2):203-216; Draghi A et al. Rapid Identification of the Tumor-Specific Reactive TIL Repertoire via Combined Detection of CD137, TNF, and IFNγ, Following Recognition of Autologous Tumor-Antigens. Front Immunol. 2021; 12:705422).
Для выявления групп клонотипов ТКР, участвующих в противоопухолевом иммунном ответе, в настоящем изобретении предложено использовать кластерный анализ. Предложенный подход позволяет успешно идентифицировать известные ОАА-специфичные клонотипы ТКР среди репертуаров ОИЛ у пациентов с меланомой и HLA-A*02. Было обнаружено, что количество клонотипов в кластерах и доля общего репертуара ОИЛ, которая на них приходится, значительно возрастают после иммунотерапии с использованием антител против PD-1. Исследование содержания ТКР в подвергнутых сортировке CD4+ и CD8+ CD39+ PD1+ ОИЛ показало, что эти субпопуляции заметно обогащены кластерами ТКР, значительная часть которых образована опухоль-специфичными ТКР. Эти результаты послужили основанием для того, чтобы сфокусироваться на использовании CD39+PD1+ ОИЛ в АКТ рака. Кластерный анализ репертуара ТКР облегчает оптимизацию условий культивирования ОИЛ и позволяет оценить степень обогащения культивируемых донорских клеток и подвергнутых сортировке ОАА-активированных Т-лимфоцитов опухоль-специфичными Т-лимфоцитами.
Использование кластерного анализа ТКР является мощным инструментом с возможностью практического применения в клинической АКТ.
Авторами настоящего изобретения обнаружено, что кластерный анализ гомологии Т-клеточных рецепторов (ТКР) эффективно идентифицирует опухоль-реактивные ТКР, позволяя: 1) обнаруживать их присутствие в пуле ОИЛ; 2) оптимизировать условия культивирования ОИЛ, при этом комбинация (низкий IL-2)/IL-21/анти-PD-1 демонстрирует повышенную эффективность; 3) исследовать обогащение на основе поверхностных маркеров Т-лимфоцитов, нацеленных на опухоль, в свежевыделенных ОИЛ (обогащение подтверждено для субпопуляций CD4+ и CD8+ PD-1+/CD39+) или повторно стимулированных ОИЛ (информирует об обогащении в 4-1ВВ-сортированных клетках (CD137+ клетках)).
Противоопухолевый иммунный ответ, как и иммунный ответ на любой «чужой» антиген/патоген, включает в себя адаптивный и врожденный компоненты. Для адаптивного иммунного ответа, развивающегося при вакцинации или при инфекционном заболевании, характерна экспансия множества вариантов ТКР, среди которых отсутствует четко выраженное доминирование отдельных вариантов над остальными. Для ОИЛ до настоящего времени подобного анализа не проводилось. Соответственно, обнаружение того, что при помощи настоящего изобретения, включающего кластерный анализ репертуара последовательностей ТКР из ОИЛ, можно выявлять противоопухолевый иммунный ответ на начальных этапах его развития; того, что кластеры гомологичных последовательностей можно обнаружить именно среди ОИЛ; а также того, что кластеры обогащены именно опухоль-реактивными ТКР, представляется неожиданным.
Технический результат, достигаемый при осуществлении изобретения, заключается в упрощении способа оценки степени обогащенности культуры ОИЛ опухоль-реактивными клонами Т-лимфоцитов. Также, технический результат заключается в получении культуры ОИЛ, обогащенной опухоль-реактивными клонами Т-лимфоцитов.
В своем первом аспекте настоящее изобретение относится к способу получения культуры ОИЛ, обогащенных опухоль-специфичными клонами, включающему стадии, на которых выделяют аутологичные ОИЛ пациента, страдающего солидным раком; аутологичные ОИЛ культивируют в среде, содержащей IL-2 и по меньшей мере один из агентов, выбранных из IL-21 и антитела, блокирующего передачу сигнала PD-1:PD-L1; проводят определение репертуаров нуклеотидных последовательностей Т-клеточных рецепторов с использованием высокопроизводительного секвенирования; оценивают степень обогащения культивированных ОИЛ опухоль-специфичными клонами с использованием биоинформатического анализа, определяющего присутствие в репертуаре кластеров конвергентных вариантов Т-клеточных рецепторов.
В одном из воплощений способа конвергентными вариантами Т-клеточных рецепторов являются варианты Т-клеточных рецепторов, характеризующиеся гомологичными аминокислотными
последовательностями, содержащими не более чем 3 отличия, представляющих собой аминокислотные замены, и/или инсерции, и/или делеции.
Еще в одном из воплощений способа степень обогащения опухоль-специфичными клонами Т-лимфоцитов характеризуется долей репертуара Т-клеточных рецепторов, занятой клонами Т-клеточных рецепторов, принадлежащих кластерам конвергентных вариантов Т-клеточных рецепторов.
В следующем воплощении способа степень обогащения опухоль-специфичными клонами Т-лимфоцитов характеризуется количеством клонотипов Т-клеточных рецепторов, принадлежащих кластерам конвергентных вариантов Т-клеточных рецепторов.
Еще в одном из воплощений способа на стадии культивирования аутологичные лимфоциты культивируют в среде, содержащей IL-2, IL-21 и антитело, блокирующее передачу сигнала PD-1:PD-L1. В предпочтительном воплощении способа антитело, блокирующее передачу сигнала PD-1:PD-L1, представляет собой ниволумаб.
В следующем воплощении способа аутологичные лимфоциты получают из опухолевого материала пациента, полученного в ходе операции.
В еще одном воплощении способа аутологичные лимфоциты получают из крови пациента.
В одном из воплощений способа солидный рак выбран из группы, включающей: меланому, рак легкого, рак головы и шеи, рак мочевого пузыря, рак яичника, рак молочной железы, рак поджелудочной железы.
В одном из воплощений способ дополнительно включает стадию, на которой из аутологичных лимфоцитов, выделенных из пациента, предварительно выделяют фракцию, обогащенную лимфоцитами, несущими по меньшей мере один поверхностный маркер, выбранный из группы, включающей PD-1, CD39, CD137. В предпочтительном воплощении указанная фракция обогащена лимфоцитами, несущими поверхностные маркеры PD1 и/или CD39.
В одном из воплощений способа среда, в которой проводят культивирование полученных лимфоцитов, дополнительно содержит опухолевые клетки и/или по меньшей мере один продукт их переработки.
В одном из воплощений способа среда, в которой проводят культивирование полученных лимфоцитов, дополнительно содержит по меньшей мере один опухоль-ассоциированный антиген.
В еще одном из воплощений способа среда, в которой проводят культивирование полученных лимфоцитов, дополнительно содержит по меньшей мере один опухолевый неоантиген. В предпочтительном воплощении указанный по меньшей мере один опухолевый неоантиген содержит по меньшей мере одну драйверную мутацию.
В еще одном из воплощений способа культивированные лимфоциты дополнительно обогащают опухоль-специфичными вариантами путем активации в присутствии по меньшей мере одного опухолевого антигена и последующего обогащения с использованием по меньшей мере одного маркера активации Т-лимфоцитов.
Наконец еще в одном из воплощений способа полученную культуру используют в протоколе ex-vivo экспансии. В предпочтительном воплощении культуру, оптимальную для последующего использования в протоколе ex vivo экспансии, выбирают по результатам оценки степени обогащения культивированных ОИЛ опухоль-специфичными клонами с использованием биоинформатического анализа.
В своем следующем аспекте настоящее изобретение относится к культуре ОИЛ, обогащенных опухоль-специфичными клонами, полученной способом настоящего изобретения.
Краткое описание чертежей
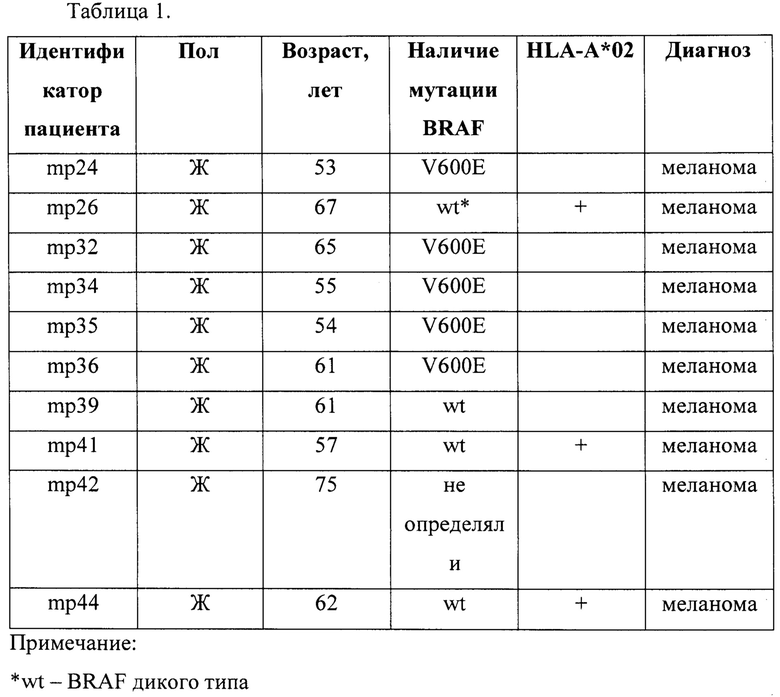
Фиг. 1. Кластеры ТКР из лимфоцитов, инфильтрирующих меланому, до и после иммунотерапии. А, Б. Нормализованное количество клонотипов в кластерах ТКРβ (нормализованные ALICE-хиты) из образцов метастатической меланомы до и после анти-PD-l терапии, описанных в ссылках Riaz, N. et al. Tumor and Microenvironment Evolution during Immunotherapy with Nivolumab. Cell 171, 934-949.e16 (2017) (А) и Tumeh, P. C. et al. PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature 515, 568-571 (2014). (Б). В. Доля ТКР, специфичных к ОАА, совпадающих с представленными в базе данных VDJdb, в пределах всего репертуара (всего) и в пределах клонотипов в кластерах (среди хитов) у пациентов по крайней мере с одним кластером, совпадающим с VDJdb (N=8 пациентов), из двух наборов данных, приведенных в указанных выше ссылках. N - число пациентов. Данные анализировали с использованием парного критерия Стьюдента (t-тест) (А) или критерия Вилкоксона (Б, В).
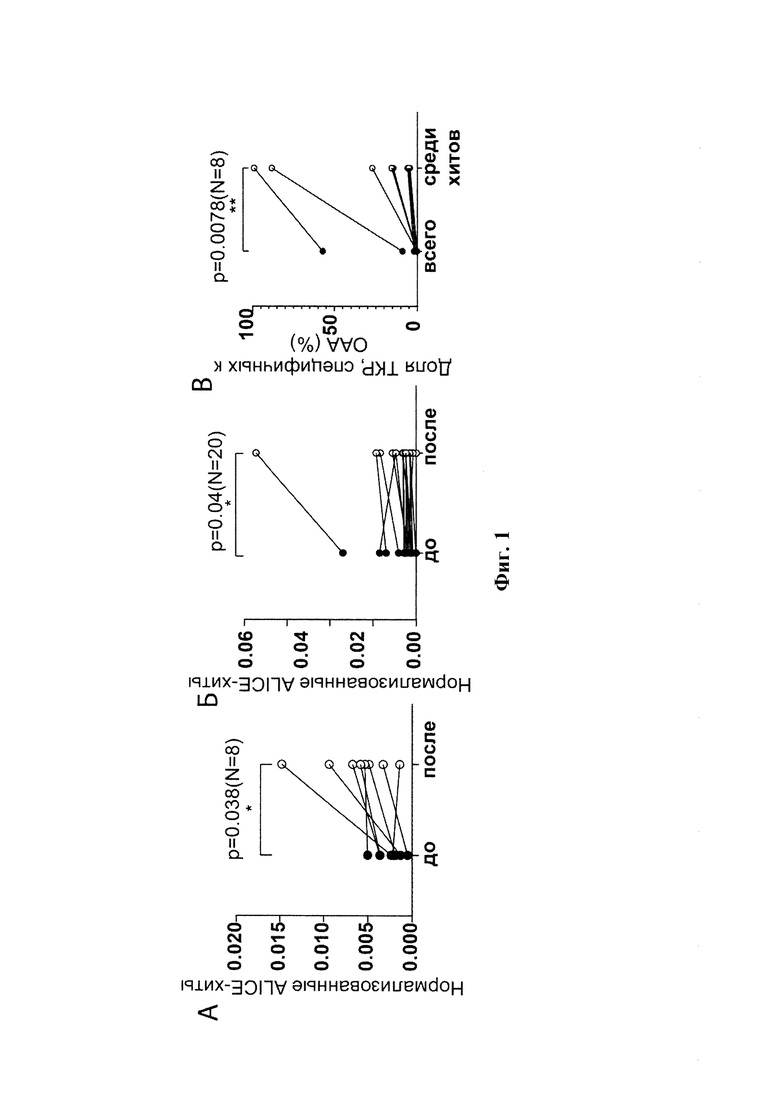
Фиг 2. Кластеры ТКРβ из образца от пациента pt44 (из группы полного/частичного ответа на проводимое лечение, ссылка Riaz, N. et al., 2014 (см. выше)]). А. Число и размер кластеров до и после терапии. Одна точка на графике соответствует одному кластеру. Б. Кластеры ТКРβ Кластеры ОАА-специфичных клонотипов, совпадающих с VDJdb, показаны серым цветом.
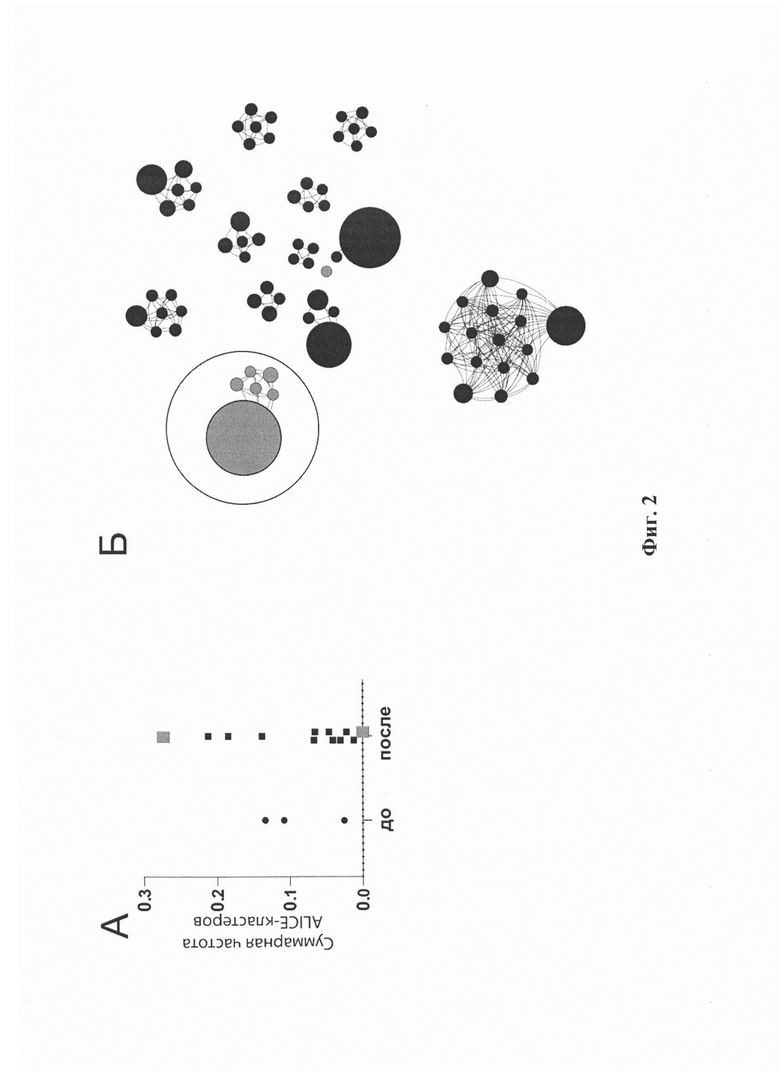
Фиг. 3. Анализ репертуара ТКРβ для CD8+ (А, В, Д)) и CD4+ (Б, Г, Е) субпопуляций DP и не-DP ОИЛ, полученных сортировкой из метастатических лимфатических узлов восьми больных меланомой. А, Б. Клональность репертуара, рассчитанная как [1-нормализованный индекс Шеннона-Винера]. В, Г. Нормализованное количество клонотипов в кластерах (нормализованные ALICE-хиты). Д, Е. Суммарная частота клонотипов в кластерах). Парный критерий Стьюдента (t-тест). * - р<0,05, ** - р<0,01, **** - р<0,0001.
Фиг. 4. Кластеры ТКРβ идентифицированные в репертуаре, полученном из свежезамороженной опухолевой ткани (СОТ), а также из отсортированных CD8+ DP и не-DP ОИЛ для пациента mp26 (HLA-A*02). А. Распределение ТКРβ по кластерам в зависимости от опухоль-реактивности. Серым цветом показаны ОАА-специфичные кластеры, совпадающие с VDJdb; черным - кластеры с неидентифицированной специфичностью. Б. Распределение ТКРβ по кластерам в зависимости от двойной позитивности по маркерам CD39 и PD1 (DP). Серым цветом показаны DP кластеры, черным -прочие.
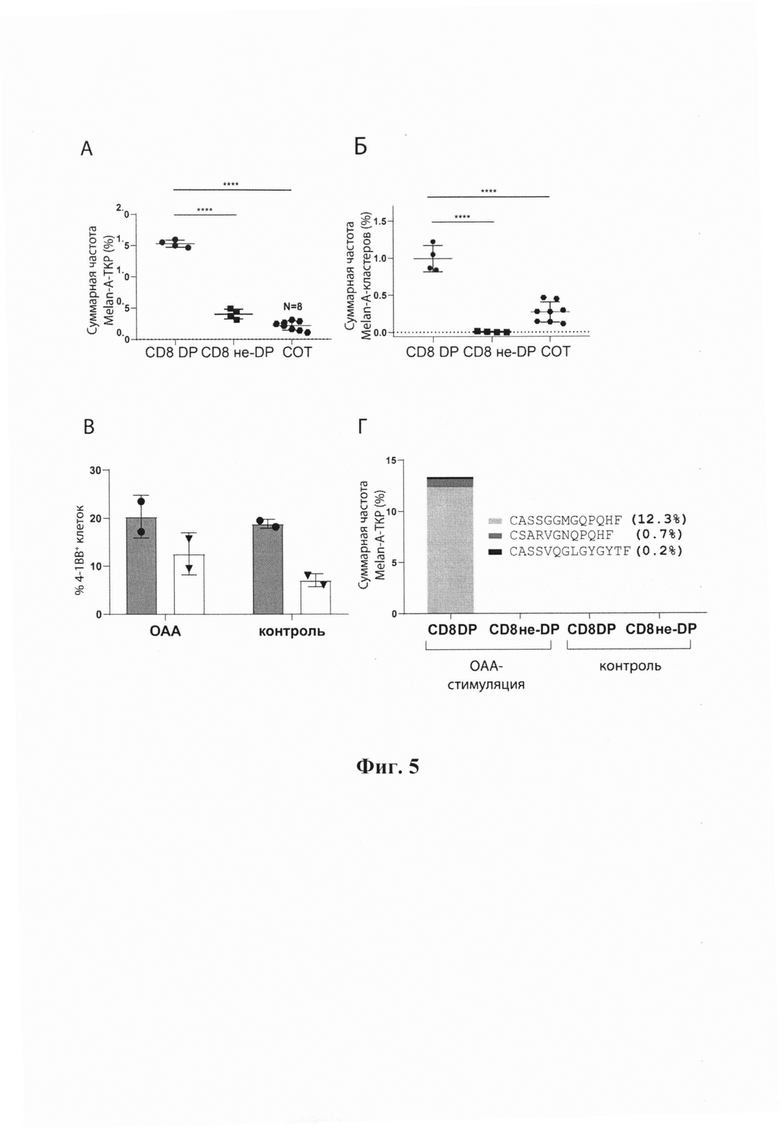
Фиг. 5. Кластеры ТКР в CD39+ PD1+ ОИЛ. А. Суммарная частота ОАА-специфичных клонотипов, совпадающих с VDJdb, в репертуарах CD8+ DP, CD8+ не-DP и СОТ ТКРβ пациента mp26. Б. Суммарная частота ОАА-специфичных клонотипов, совпадающих с VDJdb, в кластерах в репертуарах CD8+ DP, CD8+ не-DP и СОТ TKPJ3 пациента тр26. Однофакторный дисперсионный анализ с коррекцией множественных сравнений по Бонферрони. В. Доля клеток CD137+ (4-1ВВ+) среди CD8+ Т-лимфоцитов в DP и не-DP ОИЛ из пациента mp26, которые культивировали и повторно стимулировали с помощью нагруженных ОАА (ОАА) или контрольных (контроль) дендритных клеток. Столбики, закрашенные серым, относятся к CD8+ DP. Незакрашенные столбики относятся к CD8+ не-DP. Г. Доля ОАА-специфичных клонотипов, совпадающих с VDJdb, в отсортированных CD137+ CD8+ Т-клетках в DP и не-DP ОИЛ из пациента mp26, которые культивировали и повторно стимулировали с помощью нагруженных ОАА (ОАА-стимуляция) или контрольных (контроль) дендритных клеток. Парный критерий Стьюдента (t-тест). * - р<0,05, ** - р<0,01, **** - р<0,0001.
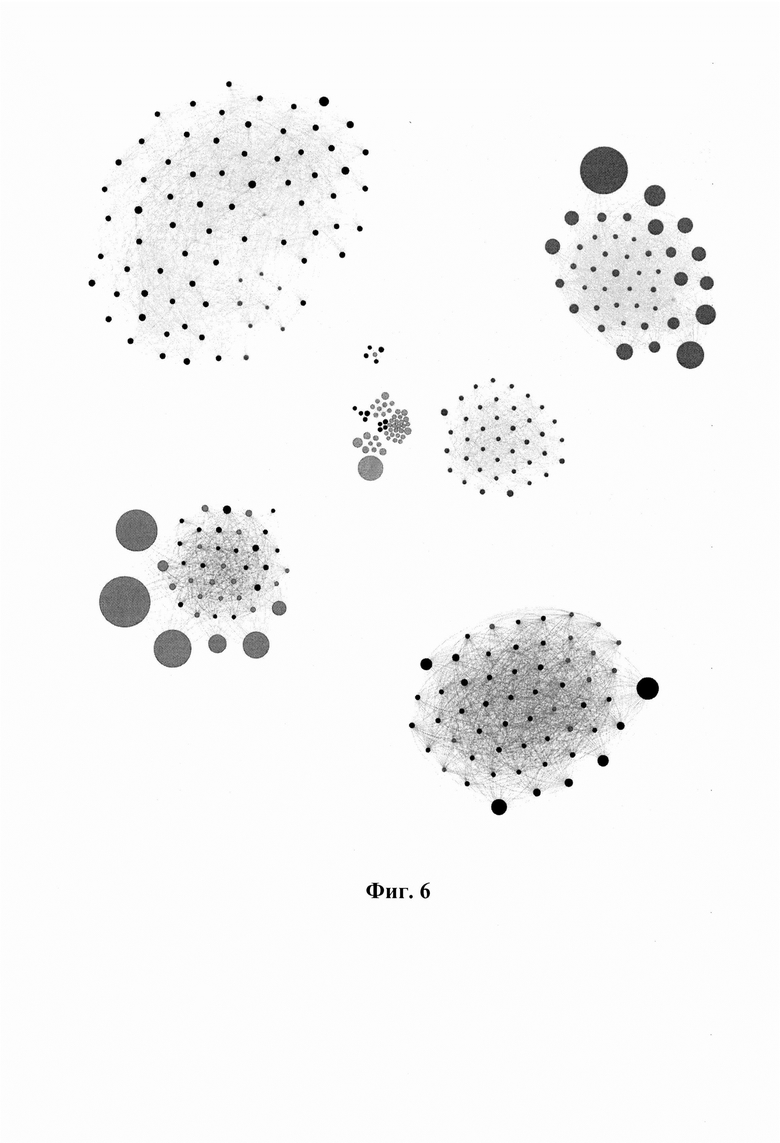
Фиг. 6. Влияние условий культивирования на ОИЛ и кластеры ТКР. Анализ репертуара ТКРβ для ОИЛ пациента mp26, культивируемых в четырех различных условиях. Черным цветом показаны кластеры клонотипов со специфичностью в отношении ОАА, определенной на основании VDJdb. Серым цветом - кластеры клонотипов с неидентифицированной или иной специфичностью.
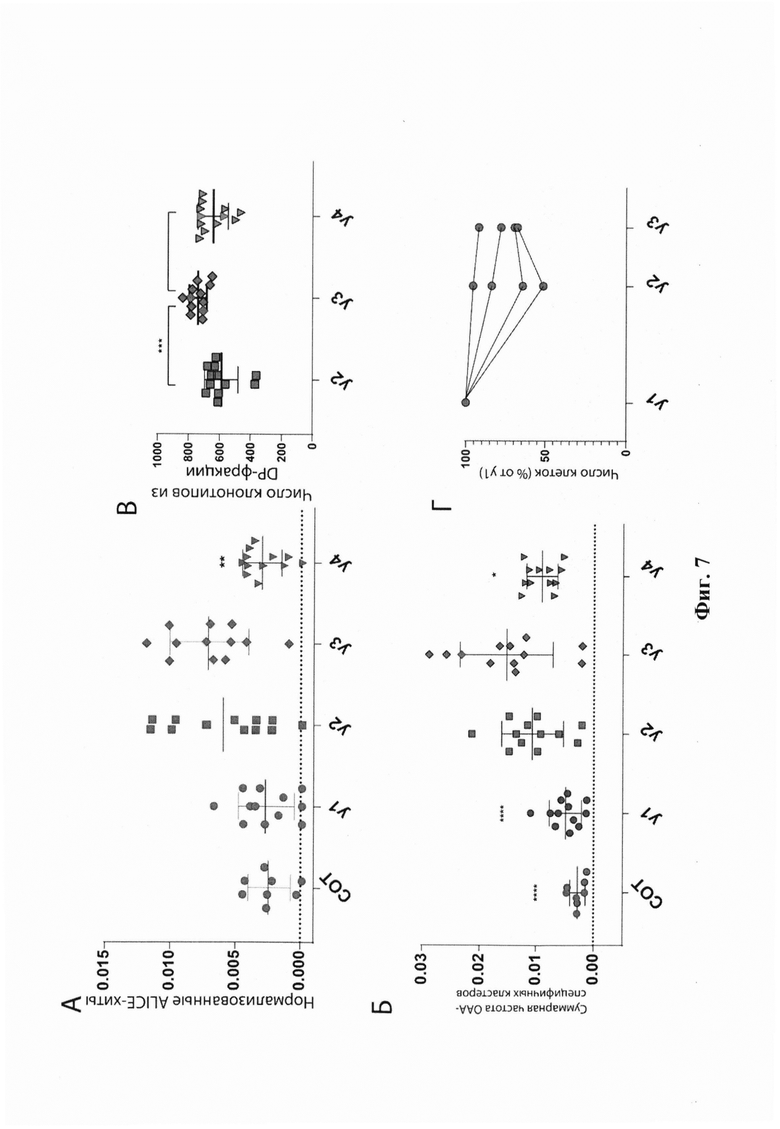
Фиг. 7. Анализ репертуара ТКРβ для ОИЛ пациента тр26, культивируемых в четырех различных условиях. А. Нормализованное количество клонотипов в кластерах ТКРβ (нормализованные ALICE-хиты). Б. Суммарная частота Melan-A-специфичных кластеров ТКРβ. В. Число клонотипов из DP-фракции. Г. Число клеток, в % от числа клеток, полученных в условиях культивирования y1 (высокий IL-2). Данные, представленные на панелях А, Б и Г, анализировали методом однофакторного дисперсионного анализа с поправкой множественных сравнений Бонферрони, причем для каждого из условий культивирования сравнение проводили с условиями культивирования IL-21/(низкий IL-2)/анти-PD-1. Данные на панели (В) анализировали с помощью критерия Краскела-Уоллиса, критерия множественного сравнения Дьюнна, причем каждую группу сравнивали с условиями культивирования IL-21/(низкий IL-2)/анти-PD-1. * - р=1,2⋅10-2, ** -р=1,7⋅10-3, **** - р<10-4. Сокращения: СОТ - свежезамороженная опухолевая ткань. Условия культивирования: y1 - (высокий IL-2); у2 - IL-21, (низкий IL-2); у3 - Ниволумаб, IL-21, (низкий IL-2); у4 - IFNγ, Ниволумаб, IL-21, (низкий IL-2).
Осуществление изобретения
Определения
Под «солидными опухолями» вообще понимаются аномальные тканевые массы, которые обычно не содержат цист или жидких областей. Солидные опухоли могут быть как доброкачественными, так и злокачественными. Термин «солидный рак» означает злокачественные (раковые) солидные опухоли. Солидные раки включают, но не ограничиваются перечисленным, саркомы, карциномы и лимфомы, включая рак легких, рак груди, рак простаты, рак толстого кишечника, рак прямой кишки, и рак мочевого пузыря, меланому. В некоторых воплощениях рак выбран из рака шейки матки, рака головы и шеи (включая, например, плоскоклеточную карциному головы и шеи (HNSCC)), глиобластомы, рака яичников, саркомы, рака поджелудочной железы, рака мочевого пузыря, рака груди, тройного негативного рака груди и немелкоклеточной карциномы легких, меланомы. Общим для структуры ткани всех солидных раков является то, что она содержит взаимозависимые тканевые компартменты, включая паренхиму (раковые клетки) и поддерживающие стромальные клетки, которые могут обеспечивать поддерживающее микроокружение, среди которых распределены раковые клетки.
Под "белком программируемой смерти 1 (PD-1)" понимается член костимуляторного семейства генов CD28, умеренно экспрессируется на наивных Т-, В- и NKT-клетках и повышающе регулируется передачей сигнала через Т/В-клеточные рецепторы на лимфоцитах, моноцитах и миелоидных клетках. PD-1 имеет два известных лиганда с различными профилями экспрессии, PD-L1 и PD-L2. Экспрессия PD-L2 относительно ограничена, тогда как PD-L1 экспрессируется более широко, включая экспрессию на наивных лимфоцитах, и его экспрессия индуцируется на активированных В- и Т-клетках, моноцитах и дендритных клетках. PD-1 рассматривают как важный элемент в иммунной регуляции и поддержании периферической толерантности. Показано, что у мыши для этого необходима экспрессия PD-L1 в периферических тканях и связывание с PD-1 на потенциально аутореактивных Т-клетках для негативной модуляции активации Т-клеток, включающей последовательность ITIM в цитоплазматическом домене PD-1.
Обнаружено, что в злокачественных новообразованиях человека, возникающих в различных тканях, гиперэкспрессируются PD-L1 или PD-L2. На больших наборах образцов, например, рака яичника, почек, колоректального рака, рака поджелудочной железы, печени и меланомы, показано, что экспрессия PD-L1 коррелирует с неблагоприятным прогнозом и сниженной общей выживаемостью независимо от последующего лечения. Аналогично, обнаруживали, что экспрессия PD-1 на инфильтрирующих опухоль лимфоцитах является признаком дисфункциональных Т-клеток при раке молочной железы и меланоме и коррелирует с неблагоприятным прогнозом при раке почки. С использованием первичных образцов пациентов показано, что блокада PD-1 или PD-L1 in vitro приводит к повышению опухолеспецифичной активации Т-клеток человека и продукции цитокинов. Так, в нескольких моделях опухолей сингенных мышей блокада PD-1 или PD-L1 значительно ингибировала рост опухоли или индуцировала полную регрессию. В общем, путь PD-1/PD-L1 является хорошо проверенной мишенью для разработки терапевтических средств на основе антител для лечения злокачественных опухолей.
Для целей настоящего изобретения в качестве агентов, блокирующих путь PD-1/PD-L1, могут быть использованы различные средства. В частности, предпочтительными являются моноклональные антитела, блокирующие PD-1, такие как ниволумаб (Bristol-Myers Squibb, США) или пембролизумаб (Merck Sharp and Dohme, США), выпускаемый в виде лекарственного препарата Keytruda. Также может быть использован препарат атезолизумаб, блокирующий PD-L1, выпускаемый в виде лекарственного препарата Tecentriq.
В данном изобретении выражение «конвергентные варианты Т-клеточных рецепторов» может быть использовано для обозначения вариантов Т-клеточных рецепторов, характеризующихся гомологичными аминокислотными последовательностями, содержащими не более трех отличий, заключающихся в аминокислотных заменах, инсерциях или делениях.
Термин «драйверная мутация» в настоящем изобретении означает такое изменение в последовательности ДНК (мутация), которое превращает нормальную клетку в раковую клетку и позволяет такой клетке расти и распространяться в организме.
Интерлейкин-2 (IL-2) представляет собой фактор роста Т-лимфоцитов и включает в себя все формы интерлейкина-2, в том числе человеческого и животного происхождения, варианты с консервативными аминокислотными заменами, гликоформы, а также биоаналоги доступных на коммерческой основе препаратов IL-2. В частности, полезными для целей настоящего изобретения могут быть рекомбинантные формы человеческого интерлейкина-2, такие как алдеслейкин, коммерчески доступный от ряда производителей под названием Пролейкин (Proleukin). Алдеслейкин (дез-аланил-1, серии-125 человеческий IL-2) представляет собой негликозилированную форму рекомбинантного человеческого IL-2 с молекулярной массой около 12 кДа. Также полезными для целей настоящего изобретения могут быть рекомбинантная форма IL-2, производимая компанией CellGenics, Inc. (Portsmouth, NH, USA) (CELLGRO GMP) или компанией ProSpec-tany TechnoGene Ltd. (East Brunswick, NJ, USA). Термин IL-2 также включает различные ПЭГ-илированные формы IL-2, например, коммерчески доступные от Nektar Therapeutics (South San Francisco, CA, USA) или описанные в US 2014/0328791 A1 или WO 2012/065086 A1. В частности, для целей настоящего изобретения может быть использован препарат Ронколейкин, выпускаемый ООО «НПК «Биотех», Россия.
Интерлейкин-21 (IL-21) представляет собой плейотропный белок-цитокин, и включает в себя все формы интерлейкина-21, в том числе человеческого и животного происхождения, варианты с консервативными аминокислотными заменами, гликоформы, а также биоаналоги доступных на коммерческой основе препаратов IL-21. IL-21 продуцируется главным образом Т-лимфоцитами - натуральными киллерами и активированными CD4+ Т-лимфоцитами. Рекомбинантный человеческий IL-21 состоит из одной негликозилированной полипептидной цепи, содержащей 132 аминокислотных остатка, с молекулярной массой около 15,4 кДа. Рекомбинантный человеческий IL-21 доступен от целого ряда производителей, в том числе от компании ProSpec-tany TechnoGene Ltd. (East Brunswick, NJ, USA) и Thermo Fisher Scientific Inc. (Waltham, MA, USA). В частности, для целей настоящего изобретения может быть использован препарат IL-21, выпускаемый компанией ООО «СайСторЛаб», Россия.
Для выделения геномной ДНК или РНК могут быть использованы любые методы, хорошо известные специалисту в данной области техники. В частности, могут быть использованы методы, описанные в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd edition. Cold Spring Harbor Laboratory Press, N.Y., (1989), а также коммерчески доступные наборы для выделения нуклеиновых кислот, такие как DNeasy или RNeasy (Qiagen, Германия) или их аналоги.
Образцы РНК могут быть использованы для получения кДНК и библиотек генов с использованием обратной транскрипции и полимеразной цепной реакции (ПЦР), как хорошо известно в данной области техники, к примеру, с использованием метода Гублера-Хоффмана (Gubler U., Hoffman B.J. Gene, 1983, v. 25, p.263-269). Также могут быть применены методы с использованием ДНК-лигазы фага Т4 (Akowitz, Manuelidis. Gene, 1989, vol. 81, p.295-306; Lukyanov et al. Biophys. Biochem. Res. Comm., 1997, vol. 230, p.285-288), методы с использованием других лигаз, методы синтеза кДНК с переключением матрицы (Chenchik et al., (1998) Gene Cloning and Analysis by RT-PCR, ed. by P. Siebert and J. Larrick, BioTechniques Books, Natick, Mass., p.315-319); Zhu et al., Biotechniques, 2001, vol. 30, p.892-897), а также иные методы.
Образцы ДНК или кДНК подвергают процедуре подготовки образцов, которая обычно включает амплификацию с использованием ПЦР и введение адаптеров для последующего секвенирования. В ходе подготовки образцы могут быть обогащены нуклеотидными последовательностями, кодирующими ТКР.
В данной области техники хорошо известны методы, применимые для анализа репертуаров ТКР путем секвенирования, в частности, высокопроизводительного секвенирования. Указанные методы позволяют идентифицировать геномные последовательности от десятков до миллионов вариантов ТКР в образцах крови, субпопуляциях клеток, или в образцах ткани, полученных от исследуемых доноров-людей или модельных животных. В данных методах при создании библиотек генов α- или β-цепей ТКР, или библиотек генов парных α- и β-цепей ТКР, в качестве исходного материала может использоваться геномная ДНК (см., к примеру, Robins H.S., et al. Blood, 2009, p.4099-4107) или РНК. Получение библиотек генов ТКР может быть осуществлено посредством ПЦР-амплификации с использованием набора ген-специфических праймеров, или с использованием подхода, известного как 5'RACE, или с использованием иных методов, либо в объеме всего образца, либо для клеток, разнесенных по индивидуальным микрообъемам с применением многолуночных планшетов или эмульсий типа «вода-в-масле».
Например, библиотека генов ТКР может быть получена с использованием 5'RACE, как описано в ряде публикаций (Britanova et al., J. Immunol., 2016, vol. 196(12), p.5005-5013). Тотальную РНК из моноцитов периферической крови или подвергнутых сортировке Т-клеток экстрагируют с использованием методов на основе колонок, таких как, например, набор RNeasy Micro Kit (Qiagen) или подобный ему, или с использованием протоколов на основе реагента Trizol. В качестве альтернативы мРНК может быть экстрагирована с использованием методов на основе колонок, таких как, например, набор Oligotex mRNA Mini Kit (Qiagen), или других методов. Синтез кДНК осуществляют с использованием праймеров, комплементарных константным участкам ТКР, или с использованием праймеров, содержащих олиго-дТ участки, с применение обратной транскприптазы, способной к переключению матрицы. В качестве примеров последнего подхода можно привести обратную транскриптазу SmartScribe (Clontech, США) или Mint (Евроген, Россия) с использованием олигонуклеотидов для переключения матрицы. Дальнейшую амплификацию библиотек генов ТКР проводят с использованием праймеров, специфичных к олигонуклеотиду для переключения матрицы и константным участкам или J-участкам генов ТКР.
В качестве альтернативы ПЦР-амплификацию с использованием кДНК в качестве матрицы можно проводить с использованием мультиплексного набора праймеров, специфичных к генам ТКР.
Еще одной альтернативой является экстракция геномной ДНК с использованием любого известного в данной области техники метода с последующим ее использованием в качестве матрицы для ПЦР в присутствии мультиплексного набора праймеров, специфичных в отношении генов ТКР. При этом можно осуществлять одну или несколько стадий ПЦР-амплификации с использованием вложенных (nested) и/или step-out праймеров. Адаптеры для секвенирования могут включаться как в ходе самой ПЦР, так и впоследствии посредством лигирования. Примеры получения экспериментальных данных с использованием описанного подхода представлены в ряде публикаций (Robins H.S., et al. Blood, 2009, p.4099-4107; Freeman J.D., et al. Genome Res. (2009), p.1817-1824; Mamedov I.Z., et al. Front. Immunol., 2013, 456).
В качестве еще одной альтернативы для целей настоящего изобретения для получения информации о репертуаре последовательностей ТКР могут быть использованы данные секвенирования, полученные при анализе транскриптома (RNA-seq) или анализе экзома (Exome-seq), либо иные данные секвенирования, которые содержат информацию по крайней мере о частичных последовательностях ТКР. Для извлечения информации о собственно последовательностях ТКР могут быть использовано соответствующее по своим функциональным возможностям программное обеспечение, такое как, например, MiXCR в режиме RNA-Seq (Bolotin D.A. et al. Nat. Biotechnol., 2017, vol. 35, No. 10, p.908-911).
Адаптеры для секвенирования и способы их введения в нуклеиновые кислоты хорошо известны специалистам в данной области техники; их практическая реализация осуществлена в форме коммерчески доступных наборов для высокопроизводительного секвенирования.
Для секвенирования в настоящее время на коммерческой основе доступен целый ряд решений в виде платформ. В частности, для целей настоящего изобретения могут быть использованы такие системы секвенирования, как HiSeg™, MiSec™, и/или Genome Anlyzer™, доступные от Illumina®; системы секвенирования Ion PGM™ или Ion Proton™, доступные от Ion Torrent™; система секвенирования PACBIO RS II от Pacific Biosciences; система секвенирования SOLID от Life Technologies™; системы секвенирования 454 GS FLX+или GS Junior от Roche или любые иные платформы для секвенирования.
Культура лимфоцитов, обогащенных опухоль-специфичными клонами Т-лимфоцитов, полученная способом настоящего изобретения, может быть затем использована для масштабного наращивания с использованием известных протоколов экспансии ex vivo.
Представленное в настоящем описании изобретение ниже будет проиллюстрировано со ссылкой на конкретные примеры. При этом должно быть понятно, что приведенные примеры служат исключительно для целей иллюстрации наиболее предпочтительных воплощений изобретения, но не предназначены для ограничения его объема. Объем притязаний определяется представленной ниже формулой изобретения.
Материалы и методы
Пациенты и образцы
Все клинические образцы были получены из Национального медицинского исследовательского центра (НМИЦ) онкологии им. Н.Н.
Блохина в соответствии с протоколом MoleMed-0921, одобренным этическим комитетом. Всем пациентам, участвовавшим в исследовании, был поставлен диагноз метастатической меланомы. Пациентами было подписано информированное согласие до сбора их биоматериала. Большинство экспериментов было проведено на резецированных метастатических лимфатических узлах, полученных во время операции. Образцы опухоли подвергали генотипированию на наличие мутации BRAFV600E. От каждого пациента, включенного в это исследование, также получали 20-30 мл периферической крови перед операцией. Информация о пациентах представлена ниже в Таблице 1.
Кратковременное культивирование ОИЛ
Свежерезецированные образцы опухоли разделяли на фрагменты размером 1-3 мм в каждом из измерений. Несколько фрагментов замораживали в жидком азоте для дальнейшего получения библиотек кДНК и HLA-типирования. Отдельные фрагменты высевали в лунки 24-луночного планшета для культуры ткани, содержавшие 2 мл полной среды для культивирования Т-лимфоцитов (СМ) с добавлением 5% инактивированной нагреванием сыворотки АВ человека (PanBiotech, Германия) и 1000 МЕ/мл IL-2 (Ронколейкин, ООО «Биотехнологии, Санкт-Петербург, Россия). Среда СМ содержала RPMI-1640 (ПанЭко, Россия), 25 мМ HEPES, рН 7,2 (ПанЭко, Россия), пенициллин 100 МЕ/мл, стрептомицин 100 мкг/мл, гентамицин 10 мкг/мл, 1х смесь заменимых аминокислот, lx GlutaMAX, β-меркаптоэтанол (0,55 мкМ) (все от Gibco, Thermo Fisher Scientific, США) и 110 мкг/мл пирувата натрия. На четвертые сутки культивирования ОИЛ собирали, фильтровали через сито с размером ячеек 70 мкм, окрашивали антителами, меченными флуорофором, и подвергали сортировке с помощью проточной цитометрии (FACS). Для создания библиотек репертуара ТКР Т-лимфоциты сортировали непосредственно в буфер для лизиса клеток RLT (QIAGEN, Нидерланды) и хранили при -80°С до использования для выделения РНК. Для
функциональных анализов ОИЛ сортировали по пробиркам Эппендорф на 1,5 мл, содержавшим 0,5 мл RPMI-1640. Живые отсортированные Т-лимфоциты высевали в лунки 96-луночного планшета для культуры клеток при концентрации 106 клеток/мл в среде СМ и культивировали не менее пяти дней. Затем к СМ добавляли 1000 МЕ/мл IL-2, 50 нг/мл IL-21 (SCI-STORE, Россия), 20 мкг/мл ниволумаба (Bristol-Myers Squibb, США) и 10% аутологичной сыворотки, полученной от пациентов. Половину среды заменяли три раза в неделю. За сутки до проведения функциональных анализов все среды были заменены свежей средой СМ, не содержавшей интерлейкинов или ниволумаба.
Культивирование ОИЛ
Фрагменты образцов опухоли от каждого из четырех пациентов с меланомой (mp26, mp32, mp34 и mp42) высевали в отдельные лунки 24-луночного планшета для культуры ткани (по 1 фрагменту на лунку, по 1 планшету на пациента) с базовой средой для культивирования на основе RPMI-1640 и 5% инактивированной нагреванием сыворотки АВ человека. Массу ОИЛ выращивали из фрагментов опухоли в следующих различных условиях (6 лунок/условие) в течение 9 дней: 1) высокий IL-2 (3000 МЕ/мл), 2) (низкий IL-2) (100 МЕ/мл), 3) IL-21 (25 нг/мл) + низкий IL-2, 4) ниволумаб (20 мкг/мл)+IL-21 + низкий IL-2, и 5) IFNγ (100 мкг/мл) + ниволумаб + IL-21 + низкий IL-2. ОИЛ от пациента тр26 культивировали в условиях 1, 3, 4 и 5; ОИЛ от пациентов mp32, mp34 и mp42 культивировали в условиях 1-4. Половину среды заменяли на 3-й и 5-й дни той же средой, что использовали изначально при посеве. На 9-й день культивирования ОИЛ из каждой лунки подсчитывали и лизировали при плотности 5×105 клеток/мл в буфере RLT для приготовления библиотек репертуара ТКР.
Культивирование сортированных популяций Т-лимфоцитов Подвергнутые FACS-сортировке Т-лимфоциты наращивали с помощью неспецифической ТКР-зависимой стимуляции с использованием бусин со связанными антителами против CD3/CD28 (anti-CD3/CD28 Dynabeads) (Thermofisher Scientific, США). Бусины добавляли в культуральную среду на следующий день после посева клеток из расчета 2 мкл раствора шариков на 105 клеток. Подвергнутые FACS-сортировке ОИЛ наращивали в течение 2 недель. Бусины удаляли с помощью магнита после достижения желаемой численности клеток. Перед экспериментами по совместному культивированию клеткам давали «отдохнуть» в течение суток в среде СМ, не содержавшей интерлейкинов, с добавлением 10% аутологичной сыворотки пациента (т.е. «среда покоя»).
Культивирование дендритных клеток, полученных из моноцитов Аутологичные дендритные клетки получали, как описано ниже. Клетки CD14+(моноциты) выделяли из РВМС пациентов с помощью процедуры магнитного обогащения с использованием анти-CD14 MicroBeads (Miltenyi Biotec, Германия). Затем моноциты высевали в лунки 24-луночного планшета для культуры ткани с концентрацией 5×105 клеток/лунку. Для дифференцировки моноцитов использовали среду X-Vivo-15 (Lonza, Швейцария) с 400 ЕД/мл IL-4 и 800 ЕД/мл ГМ-КСФ. На четвертый день культивирования среду обновляли, и дендритные клетки (ДК) нагружали смесью пептидов ОАА меланомы (PepTivator Melan-A/MART-1, gp100/Pmel и MAGE-А3 человека; Miltenyi Biotec) в концентрации 600 нМ каждого. На следующий день нагруженные дендритные клетки подвергали созреванию с использованием 1 мкг/мл PGE, 10 нг/мл IL-1β и 25 нг/мл TNF-α. После созревания в течение 24 часов ДК собирали и использовали для совместного культивирования с Т-лимфоцитами.
Анализ антиген-специфической активации CD-137
Полученные с помощью FACS-сортировки популяции PD1+CD39+(двойные положительные, DP) и не-DP после наращивания и двухдневного «отдыха» в отсутствие IL-2 совместно культивировали с нагруженными антигеном аутологичными ДК в соотношении 10:1 (Т-лимфоциты: ДК). Среда для совместного выращивания состояла из СМ и бессывороточной среды AIM-V (Gibco, США), взятых в соотношении 1:1, с добавлением 50 нг/мл IL-21. Для дальнейшего выделения РНК и получения библиотеки ТКР как Т-лимфоциты CD137высокий так и Т-лимфоциты CD137низкий лизировали с помощью буфера RLT. Долю клеток с повышенной экспрессией CD137 измеряли как для CD4+, так и для CD8+ОИЛ. Антиген-специфическую активацию измеряли как отношение доли Т-лимфоцитов CD137высокий в ОИЛ, которые совместно культивировали с нагруженными антигенами ДК, по сравнению с ненагруженными ДК.
Проточная цитометрия
Для FACS-сортировки субпопуляций PD1+CD39+ОИЛ клетки окрашивали следующими антителами: CD4-BV510 (RPA-T4), CD8-Alexa-647 (SK1), CD127-APC-Cy7 (IL-7Rα, A019D5), PD-1-BV421 (CD279, EH12.2H7) (BioLegend, Германия), CD25-PE (IL-2Rα, Beckman Coulter), CD39-FITC (eBioAl) (eBioscience, США). Клетки осаждали, ресуспендировали в окрашивающем растворе, содержавшем флуоресцентные антитела, и инкубировали 1 ч при 4°С в темноте. Далее клетки промывали и ресуспендировали в PBS при плотности приблизительно 5×106 клеток/мл. Т-лимфоциты подвергали сортировке с использованием проточного цитометра Aria III (BD Biosciences, США). Анализ данных проводили с помощью программного обеспечения FlowJo (FlowJo, LLC). С целью избежать антиген-специфической Трег-зависимой супрессии Т-лимфоцитов в дальнейших функциональных анализах клетки Трег идентифицировали как CD4+ CD25+ CD127- клетки и сортировали их отдельно. Для функциональных анализов Т-лимфоциты разделяли на субпопуляции CD39+ PD-1+ (двойные положительные, DP) и не-DP (положительные по одному из антигенов CD39 и PD-1 или двойные отрицательные), без разделения на CD4+ и CD8+ клетки. Для получения библиотеки ТКР клетки CD4+ DP и CD8+ DP, а также соответствующие популяции не-DP клеток подвергали сортировке по отдельности, чтобы оценить индивидуальные свойства репертуаров их ТКР. Для анализа активации CD137 Т-лимфоциты окрашивали флуоресцентно меченными антителами CD4-BV510 (RPA-T4), CD8-Alexa-647 (SK1), CD137-РЕ (4 В4-1) (BioLegend, Германия).
HLA-типирование
У пациентов mp39, mp41, mp42 и mp44 проверяли только наличие HLA-А*02. Аликвоты РВМС или ОИЛ от этих пациентов окрашивали анти-HLA-А*02-РЕ (BD7.2) (BD Biosciences, США) и анализировали с помощью проточного цитометра Navios. HLA-типирование остальных пациентов (Таблица 1) проводили с использованием секвенирования нового поколения (NGS).
Выделение РНК и получение библиотек ТКР РНК из свежезамороженных фрагментов опухолей выделяли с использованием реагента TRIzol (Invitrogen). РНК из лизированных с помощью RLT клеток экстрагировали с использованием набора RNeasy mini kit (Qiagen) в соответствии с инструкцией производителя. Концентрацию РНК измеряли с помощью набора Qubit RNA HS Assay Kit (Thermo Fisher Scientific, США). Для синтеза кДНК использовали не более 500 нг суммарной РНК.
Библиотеки кДНК были созданы с использованием набора Human RNA TCR Multiplex kit (MiLaboratories) согласно протоколу производителя. Достигаемая глубина секвенирования может составлять 20 парных ридов на клетку, или более, для отсортированных и культивированных популяций ОИЛ. Секвенирование проводили с использованием платформы Illumina NextSeq (длина ридов 2×150 п. н.).
Анализ данных секвенирования репертуаров ТКР
Данные секвенирования ТКР-репертуаров анализировали с помощью программного обеспечения MiXCR (MiLaboratories) для идентификации клонотипов CDR3 ТКРβ. Для обработки выходных данных по репертуару ТКР, полученных с помощью MiXCR, для расчета разнообразия репертуара ТКР и для предварительной обработки репертуаров ТКР (т.е. объединение репертуаров ТКР и снижения дискретности репертуаров ТКР) использовали программное обеспечение VDJtools (Shugay, М. et al. VDJtools: Unifying Post-analysis of T Cell Receptor Repertoires. PLoS Comput. Biol. 11, el004503 (2015)).
Кластерный анализ репертуаров TKPβ ОИЛ
Кластерный анализ проводили с использованием алгоритма ALICE (Pogorelyy, М. V. et al. Detecting T cell receptors involved in immune responses from single repertoire snapshots. PLoS Biol. 17, e3000314 (2019)). С целью исключить недостаточно скорректированные ошибочные варианты ТКР, которые потенциально могут быть источником появления ложных соседей для наиболее часто встречающихся клонотипов при кластерном анализе, тем самым искажая процесс идентификации конвергентных клонотипов (далее -ALICE-хиты), в анализ включали только те клонотипы, которые были прочитаны >1 раза. Pgen аминокислотных последовательностей рассчитывали с использованием моделирования методом Монте-Карло. Для каждой пары V-и J- сегментов моделировали 5 миллионов последовательностей ТКР и проводили 20 итераций алгоритма ALICE. Только клонотипы со значением р<0,001, рассчитанным с поправкой Бенджамини-Хохберга (ВН), принимали за значимые ALICE-хиты. Поскольку число ALICE-хитов сильно зависит от исходной изменчивости репертуара ТКР, количество ALICE-хитов от образца к образцу нормализовали на основе исходного количества клонотипов с количеством прочтений больше 1 в каждом образце.
Для визуализации кластеров, являющихся результатом конвергентной селекции ТКР, использовали функцию igraph (Csardi, G., Nepusz, Т. & Others. The igraph software package for complex network research. InterJournal, complex systems 1695, 1-9 (2006)). Эта функция основана на методе графов де Брейна для расчета расстояния между аминокислотными последовательностями гипервариабельных участков CDR3. На получаемом графе в формате GML каждый узел представляет индивидуальный клонотип ТКР, а расстояние между узлами пропорционально разнице между аминокислотными последовательностями CDR3. Ребра соединяют узлы, представляющие клонотипы ТКР, характеризующиеся расстоянием Хэмминга <2. Размер узла представляет частоту соответствующего клонотипа ТКР. После построения составных графов, включающих клонотипы из нескольких репертуаров ТКР, идентичные клонотипы из разных репертуаров ТКО отображаются отдельными узлами.
Хотя другие гипервариабельные участки (CDR1, CDR2) также принимают участие в связывании антигена, однако именно участок CDR3, как хорошо известно специалисту в данной области техники, вносит основной вклад во взаимодействие с антигеном. Таким образом, в силу большей информативности последовательностей CDR3, для проведения кластерного анализа были выбраны именно последовательности CDR3 ТКР.
Соотнесение клонотипов в кластерах ТКР с базой данных VDJdb Данные репертуара ТКР аннотировали, используя базу данных VDJdb по Т-клеточным рецепторам с известной специфичностью (Shugay, М. et al. VDJdb: a curated database of T-cell receptor sequences with known antigen specificity. Nucleic Acids Res. 46, D419-D427 (2018); Bagaev, D. V. et al. VDJdb in 2019: database extension, new analysis infrastructure and a T-cell receptor motif compendium. Nucleic Acids Res. 48, D1057-D1062 (2020)). При аннотировании исходили из предположения, что исследуемые ТКР обладают той же специфичностью, что и ТКР из базы данных, если: i) участки CDR3 сравниваемых ТКР отличаются не более чем на одну замену центральной аминокислоты, и) замещенные аминокислоты принадлежат к одной и той же группе на основании свойств их боковых цепей R (полярные, алифатические, ароматические, положительно/отрицательно заряженные), и iii) HLA-рестрикция клонотипов ТКР из базы данных VDJdb соответствует одному из аллелей HLA пациента, если таковой известен.
Кластеры ТКР, состоящие преимущественно из ОАА-специфичных клонотипов, но не из клонотипов с другими специфичностями, считались ОАА-специфичными в целом. Принимали, что члены ОАА-специфичных кластеров, для которых не было обнаружено соответствий в VDJdb, обладают той же специфичностью, что и весь кластер, на основе структурного сходства с клонотипами, имеющими соответствия в VDJdb, и их включали в последующий анализ.
Анализ дифференциально пролиферирующих клонотипов Для идентификации клонотипов ТКРβ, которые были представлены в значительных количествах в суммарных ОИЛ пациентов mp26 и mp34, использовали статистический подход, реализованный в пакете edgeR (Robinson, М. D., McCarthy, D. J. & Smyth, G. K. edgeR: a Bioconductor package for differential expression analysis of digital gene expression data. Bioinformatics vol. 26 139-140 (2010)). Сравнивали репертуары ТКР ОИЛ, культивируемых в экспериментальных условиях 2-4 (как описано выше), и ОИЛ, культивируемых в условиях «высокий IL-2». Биологические образцы, взятые в шести- и четырехкратной повторности, полученные при каждом из указанных экспериментальных условий культивирования, использовали для анализа репертуаров ТКР пациентов mp26 и mp24, соответственно. Клонотипы ТКР считали пролиферировавшими, если значение р, скорректированное по уровню ложноположительных результатов, составляло <0,01, a log2 кратности изменения был >1.
Статистический анализ
Статистический анализ проводили с помощью пакета программ Graph Pad Prism 8.0 (GraphPad Software Inc., США). Все данные представлены как среднее значение ± стандартное отклонение. Критерий Шапиро-Уилка использовался для оценки нормальности во всех случаях. Названия статистических тестов и количество повторов в каждой группе сравнения указаны в подписях к Фигурам.
Пример 1. Ретроспективный анализ данных.
Для первичного анализа использовали опубликованные репертуары последовательностей бета-цепи ТКР (ТКРР) ОИЛ, полученные до и после иммунотерапии с использованием антител против PD-1 для двух когорт, состоящих из 21 и 8 пациентов с меланомой кожи (Riaz, N. et al. Tumor and Microenvironment Evolution during Immunotherapy with Nivolumab. Cell 171, 934-949.e16 (2017); Tumeh, P. C. et al. PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature 515, 568-571 (2014)). С использованием алгоритма ALICE у всех пациентов были идентифицированы кластеры конвергентных клонотипов ТКРβ. Количество клонотипов в кластерах значительно увеличилось после проведенной терапии в обеих когортах (р=0.019 и 0.038, соответственно; Фиг. 1А, Б), что может отражать зависимую от лечения пролиферацию конвергентных опухоль-специфичных ОИЛ. Поиск в базе данных VDJdb выявил клонотипы в кластерах, которые были чрезвычайно сходными или идентичными с известными вариантами ТКРβ, специфичными в отношении ассоциированных с меланомой HLA А*02-рестриктированных антигенов, таких как Melan-A (Melan-Aaa26-35 -ELAGIGILTV) и NY-ESO-1 (NY-ESO-1aa157-165 - SLLMWITQC), у 20% и 50% пациентов из когорт, описанных в упомянутых выше ссылках, соответственно. Клонотипы в кластерах были обогащены ОАА-специфичными вариантами ТКРβ по сравнению с репертуаром ТКР в целом, что указывает на то, что кластерный анализ может выявлять клонотипы, принимающие участие в развивающемся противоопухолевом иммунном ответе (Фиг. 1В). На Фиг. 2 показаны выявленные кластеры ТКР для одного из пациентов (из группы полного/частичного ответа) после проведения иммунотерапии.
Пример 2. CD39+ PD-1+ субпопуляция свежевыделенных ОИЛ обогащена клональными, конвергентными и опухоль-специфичными ТКР
С целью проверить, связано ли обогащение конвергентными кластерами ТКР различных субпопуляций ОИЛ с CD39/PD-1 фенотипом, проводили активируемую флуоресценцией сортировку клеток (FACS) в отношении CD39+ PD-1+ (двойные позитивные, DP) и не-DP CD4+ и CD8+ Т-клеток из ОИЛ, свежевыделенных из метастазов в лимфатические узлы у восьми пациентов с меланомой. В целом состав ОИЛ был смещен в сторону большего преобладания CD4+ Т-лимфоцитов, хотя клетки с фенотипом DP были более распространены среди CD8+ ОИЛ по сравнению с CD4+ клетками. Анализ репертуара ТКРβ выявил увеличение клональности и обогащение кластерами как для CD4+, так и для CD8+ DP ОИЛ по сравнению с соответствующими не-DP субпопуляциями (Фиг. 3А-Е), с большей клональностью среди CD8+ОИЛ, чем CD4+ОИЛ независимо от статуса экспрессии иммунных контрольных точек.
Для ОИЛ, полученных от HLA-А*02-положительного пациента mp26 с меланомой BRAFwt, поиск в базе данных VDJdb позволил идентифицировать три кластера ТКР, которые включали А*02-Melan-Ааа26-35-специфичные клонотипы (Фиг. 4). Субпопуляция CD8+ DP по сравнению с общим репертуаром ТКР, полученным при использовании свежезамороженной опухолевой ткани (СОТ), и по сравнению с субпопуляцией CD8+ не-DP (Фиг. 5 А, Б) была значительно обогащена как Melan-А-специфичными клонотипами, так и кластерами ТКР, включающими такие клонотипы.
Сходные результаты были получены и для другого BRAFwt HLA-A*02-положительного пациента, pt41. Таким образом, субпопуляция CD39+PD1+обогащена крупными и конвергентными клонами Т-лимфоцитов, которые принимают участие в развивающемся опухоль-специфичном иммунном ответе, значительная часть которых может быть обнаружена с помощью кластерного анализа ТКР.
С целью подтверждения полученных результатов на функциональном уровне использовали анализ поверхностной экспрессии CD137 (4-1ВВ). Отсортированные DP и не-DP субпопуляции ОИЛ от пациента mp26 культивировали в течение двух недель и стимулировали с помощью полученных из моноцитов аутологичных дендритных клеток, которые были нагружены смесью пептидов ОАА. С помощью проточной цитометрии проводили количественное определение субпопуляций CD8+CD137высокий, и осуществляли сортировку для получения библиотеки ТКРβ. Как показано на Фиг. 5В, доля клеток CD137высокий была выше в культивированных клетках DP, однако различий между Т-лимфоцитами, стимулированными дендритными клетками, нагруженными ОАА, или контрольными дендритными клетками, обнаружено не было. Анализ репертуара ТКРβ показал, что фракция стимулированных ОАА CD8+ DP с высоким уровнем экспрессии CD137, но не (не-DP) и не контрольные клетки DP, была обогащена известными Melan-A-специфичными клонотипами (Фиг. 5Г). Эти клонотипы включали ОАА-реактивный вариант ТКРβ, CSARVGNQPQHF-TRBV20-TRBJ1-5, который был ранее обнаружен при кластерном анализе некультивированных клеток CD8+ DP, и вариант CASSGGMGQPQHF-TRBV19-TRBJ1-5, гомологичный другому кластеру. ОАА-специфичные клонотипы суммарно составляли приблизительно 13% фракции культивированных и активированных ОАА DP ОИЛ, характеризующейся высоким уровнем экспрессии CD137. Эти результаты подчеркивают важность анализа ТКР-репертуара антиген-реактивных клеток, и демонстрируют, что сам по себе анализ маркера CD137 является недостаточно информативным. Пример 3.
Проводили культивирование ОИЛ в четырех различных условиях: (высокий IL2), (низкий IL-2)/IL-21, (низкий IL-2)/IL-21/анти-PD-1 и (низкий IL-2)/IL-21/анти-PD-1/IFNγ, где в качестве анти-PD-1 агента использовали ниволумаб, а концентрация IL-2 составляла 100 МЕ/мл (низкий) и 3000 МЕ/мл (высокий). Для каждого из условий анализировали репертуары ТКРβ ОИЛ, независимо культивированных из 12 фрагментов опухоли, полученных от пациента mp26. Идентифицированные кластеры ТКР из всех образцов были объединены (Фиг. 6). В качестве измеряемых показателей использовали:
i) нормализованное количество клонотипов в кластерах (Фиг. 7А),
ii) совокупную долю репертуара, приходящуюся на Melan-A-специфичные кластеры ТКРβ (кластеры, преимущественно включающие Melan-A-специфичные клонотипы, определенные в VDJdb) (Фиг. 7Б).
Среди всех условий культивирования комбинация (низкий IL-2)/IL-21/анти-PD-1 дала наибольшее количество клонотипов в кластерах и самую высокую совокупную долю Melan-A-специфичных кластеров (Фиг. 7А, Б). Добавление IFNγ дополнительно не усиливало пролиферацию потенциально опухоль-специфичных клонов.
Для выявления клонотипов, которые в значительной степени пролиферировали в культурах фрагментов опухоли в присутствии IL-21 и (низкий IL-2) (как в присутствии ниволумаба и IFNγ, так и в их отсутствии) по сравнению с пан-активирующими условиями культивирования IL-2высокий, использовали программное обеспечение edgeR. Комбинация (низкий IL-2)/IL-21/анти-PD-l дала наибольшее количество воспроизводимо пролиферирующих клонотипов, 60% которых были обнаружены среди CD8+ DP ОИЛ, отсортированных после краткой пред-культивации. Общее количество клонотипов, совпадающих с репертуаром фракции CD8+ DP, также было самым высоким для этой комбинации (Фиг. 7В). Эти результаты показывают положительное влияние ингибирования PD-1 на пролиферативный потенциал CD8+ CD39+ PD-1+ Т-лимфоцитов. Также было отмечено небольшое увеличение числа клонотипов CD8+ из репертуара фракции не-DP, которые пролиферировали в тех же условиях - 10 клонотипов по сравнению с тремя клонотипами в условиях культивирования (низкий IL-2)/IL-21 без ниволумаба, что можно объяснить ниволумаб-зависимой пролиферацией PD-1+ CD39- Т-лимфоцитов.
Что касается суммарного пролиферативного потенциала, наибольшее число Т-лимфоцитов наблюдалось в условиях (высокий IL-2), хотя и в условиях (низкий IL-2) также наблюдалось примерно сопоставимое число клеток. В присутствии IL-21 наблюдалось подавление IL-2-зависимой пролиферации ОИЛ, как ранее сообщалось в отношении CD4+ Т-лимфоцитов человека.
Рациональное объединение ТКР в кластеры на основе структурной гомологии может использоваться для идентификации опухоль-специфичных клонов Т-лимфоцитов и оценки относительного обогащения ОИЛ ими. Начиная с опубликованных данных о репертуаре ТКР в случае меланомы, были выявлены кластеры конвергентных клонотипов ТКР, количество и общая частота которых после иммунотерапии с использованием антител против PD-1 возрастали. Также было обнаружено значительное обогащение конвергентными кластерами ТКР субпопуляций PD1+ CD39+, относящихся как к CD4+, так и CD8+ ОИЛ, которые, как было показано ранее, являлись обогащенными с точки зрения реактивности по отношению к опухоли. Эти выводы дополнительно подтверждаются данными, полученными для случаев, когда контекст HLA, а также некоторые представляющие интерес клонотипы ТКР и родственные им антигены были известны. Поиск по базе данных VDJdb позволил успешно идентифицировать варианты ТКР, специфичные к ОАА, у HLA-А*02-положительных пациентов, причем примерно половина кластеров может быть соотнесена с известными Melan-А-специфичными последовательностями. Суммарная частота таких Melan-А-специфичных кластеров в популяции CD8+ DP была лишь слегка ниже, чем общая частота всех идентифицированных Melan-A-специфичных ТКР. Данное наблюдение является свидетельством того, что предложенный подход позволяет идентифицировать подавляющее большинство опухоль-специфичных клонотипов, с высокой частотой представленных в субпопуляции CD8+ DP. Кластеры ТКР являются важным признаком конвергентного иммунного ответа, который включает несколько гомологичных клонотипов. Представленные данные демонстрируют эффективность этого подхода, применимого даже в тех в ситуациях, когда специфические антигены неизвестны.
В одном из воплощений предложенный подход использовали для оптимизации культуральных условий при выращивании ОИЛ в условиях ех vivo. В частности, ОИЛ культивированные в условиях IL-21+, демонстрировали самые высокие количества ТКР в кластерах, что свидетельствует о более заметном влиянии антигензависимой селекции ТКР. Без намерения быть ограниченными какой-либо научной теорией, изобретатели настоящего изобретения полагают, что IL-21 способен оказывать влияние на описанную систему культивирования клеток как на стадии презентации антигена (поскольку презентация MHC-I- и, в меньшей степени, презентация МНС-II-рестрицированного антигена опухолевыми клетками происходит при культивировании фрагментов опухоли ex vivo), так и на стадии пролиферации, на которой IL-21 избирательно способствует пролиферации популяций не-регуляторных (эффекторных) Т-лимфоцитов. Также, ранее было показано, что применение антитела к PD1 индуцирует секрецию IFNγ и TNFα клетками CD8+ ОИЛ, экспрессирующими PD-1 (Park, J. et al. Immune Checkpoint Inhibitor-induced Reinvigoration of Tumor-infiltrating CD8+ T Cells is Determined by Their Differentiation Status in Glioblastoma. Clin. Cancer Res. 25, 2549-2559 (2019). Авторами настоящего изобретения было обнаружено большее увеличение представленности входящих в кластеры и опухоль-специфичных ТКР для клеток, культивируемых в условиях IL-21+/анти-PD-1, по сравнению с IL-21+ самим по себе.
Ожидается, что предложенный подход к анализу степени обогащения ОИЛ опухоль-реактивными клонами, основанный на оценке репертуара ТКР ОИЛ, ускорит клиническую разработку адоптивной Т-клеточной терапии. Данный подход может значительно облегчить селекцию оптимальных субпопуляций ОИЛ и оптимизацию условий культивирования ОИЛ с последующей процедурой обогащения. В клинических условиях предложенный подход позволит оценивать представленность опухоль-реактивных ОИЛ для индивидуальных образцов опухоли как до, так и после культивирования и/или обогащения. По мере того, как Т-клеточная терапия будет развиваться в отношении способности определять клональные специфичности и фенотипы, которые могут эффективно бороться с опухолью каждого отдельного пациента, способы группировки конвергентных ТКР, которые реагируют с одними и теми же опухолевыми антигенами, станут важной частью набора инструментов для разработки рациональных Т-клеточных терапий.


Изобретение относится к области биотехнологии, а именно к способу получения культуры лимфоцитов, обогащенных опухоль-специфичными клонами Т-лимфоцитов. Способ предусматривает стадии, на которых выделяют аутологичные опухоль-инфильтрирующие лимфоциты (ОИЛ) пациента, страдающего солидным раком, аутологичные ОИЛ культивируют в среде, содержащей IL-2 и по меньшей мере один из агентов, выбранных из IL-21 и антитела, блокирующего передачу сигнала PD-1:PD-L1, проводят определение репертуаров нуклеотидных последовательностей Т-клеточных рецепторов с использованием высокопроизводительного секвенирования, оценивают степень обогащения культивированных ОИЛ опухоль-специфичными клонами с использованием биоинформатического анализа, определяющего присутствие в репертуаре кластеров конвергентных вариантов Т-клеточных рецепторов. Изобретение эффективно для масштабного наращивания с использованием известных протоколов экспансии ex vivo и введения пациенту, страдающему раком, при проведении адоптивной клеточной терапии. 17 з.п. ф-лы, 7 ил., 1 табл., 2 пр.
1. Способ получения культуры опухоль-инфильтрирующих лимфоцитов (ОИЛ), обогащенных опухоль-специфичными клонами, включающий стадии, на которых:
- выделяют аутологичные ОИЛ пациента, страдающего солидным раком;
- аутологичные ОИЛ культивируют в среде, содержащей IL-2 в концентрации 100 МЕ/мл и IL-21;
- проводят определение репертуаров нуклеотидных последовательностей Т-клеточных рецепторов культивированных ОИЛ с использованием высокопроизводительного секвенирования;
- оценивают степень обогащения культивированных ОИЛ опухоль-специфичными клонами с использованием биоинформатического анализа, определяющего присутствие в репертуаре нуклеотидных последовательностей Т-клеточных рецепторов не менее чем одного кластера конвергентных вариантов Т-клеточных рецепторов.
2. Способ по п. 1, в котором конвергентными вариантами Т-клеточных рецепторов являются варианты Т-клеточных рецепторов, характеризующиеся гомологичными аминокислотными последовательностями, содержащими не более трех отличий, представляющих собой аминокислотные замены, и/или инсерции, и/или делеции.
3. Способ по п. 1, в котором степень обогащения опухоль-специфичными клонами Т-лимфоцитов характеризуется долей репертуара Т-клеточных рецепторов, занятой клонами Т-клеточных рецепторов, принадлежащих кластерам конвергентных вариантов Т-клеточных рецепторов.
4. Способ по п. 1, в котором степень обогащения опухоль-специфичными клонами Т-лимфоцитов характеризуется количеством клонотипов Т-клеточных рецепторов, принадлежащих кластерам конвергентных вариантов Т-клеточных рецепторов.
5. Способ по п. 1, в котором на стадии культивирования аутологичные лимфоциты культивируют в среде, дополнительно содержащей антитело, блокирующее передачу сигнала PD-1:PD-L1.
6. Способ по п. 5, в котором антитело, блокирующее передачу сигнала PD-1:PD-L1, представляет собой ниволумаб.
7. Способ по п. 1, в котором аутологичные лимфоциты получают из опухолевого материала пациента, полученного в ходе операции.
8. Способ по п. 1, в котором аутологичные лимфоциты получают из крови пациента.
9. Способ по п. 1, в котором солидный рак выбран из группы, включающей: меланому, рак легкого, рак головы и шеи, рак мочевого пузыря, рак яичника, рак молочной железы, рак поджелудочной железы.
10. Способ по п. 1, дополнительно включающий стадию, на которой из аутологичных лимфоцитов, выделенных из пациента, предварительно выделяют фракцию, обогащенную лимфоцитами, несущими по меньшей мере один поверхностный маркер, выбранный из группы, включающей PD-1, CD39, CD137.
11. Способ по п. 10, в котором указанная фракция обогащена лимфоцитами, несущими поверхностные маркеры PD-1 и/или CD39.
12. Способ по любому из пп. 1-11, в котором среда, в которой проводят культивирование полученных лимфоцитов, дополнительно содержит опухолевые клетки и/или по меньшей мере один продукт их лизиса.
13. Способ по любому из пп. 1-11, в котором среда, в которой проводят культивирование полученных лимфоцитов, дополнительно содержит по меньшей мере один опухоль-ассоциированный антиген.
14. Способ по любому из пп. 1-11, в котором среда, в которой проводят культивирование полученных лимфоцитов, дополнительно содержит по меньшей мере один опухолевый неоантиген.
15. Способ по п. 14, в котором указанный опухолевый неоантиген содержит по меньшей мере одну драйверную мутацию.
16. Способ по любому из пп. 1-15, в котором культивированные лимфоциты дополнительно обогащают опухоль-специфичными вариантами путем активации в присутствии по меньшей мере одного опухолевого антигена и последующего обогащения с использованием по меньшей мере одного маркера активации Т-лимфоцитов.
17. Способ по любому из пп. 1-16, в котором полученную культуру используют в протоколе ex vivo экспансии.
18. Способ по п. 17, в котором культуру, оптимальную для последующего использования в протоколе ex vivo экспансии, выбирают по результатам оценки степени обогащения культивированных ОИЛ опухоль-специфичными клонами с использованием биоинформатического анализа.
| HALL M | |||
| et al | |||
| Expansion of tumor-infiltrating lymphocytes (TIL) from human pancreatic tumors, Journal for ImmunoTherapy of Cancer, 2016, 4, 61 | |||
| LI Y | |||
| et al | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Пропеллер-радиатор | 1924 |
|
SU951A1 |
| SANTEGOETS S.S.JAM et al | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
Авторы
Даты
2023-11-29—Публикация
2022-07-26—Подача