Перекрестная ссылка на родственные заявки
Эта заявка испрашивает приоритет по предварительной заявке США с № 62/543 363, поданной 9 августа 2017 года, под названием «СПОСОБЫ ПОЛУЧЕНИЯ КОМПОЗИЦИЙ ГЕННО-ИНЖЕНЕРНЫХ КЛЕТОК И РОДСТВЕНЫХ КОМПОЗИЦИЙ» и предварительной заявке США с № 62/596770, поданной 8 декабря 2017 г., под названием «СПОСОБЫ ПОЛУЧЕНИЯ КОМПОЗИЦИЙ ГЕННО-ИНЖЕНЕРНЫХ КЛЕТОК И РОДСТВЕНЫХ КОМПОЗИЦИЙ», содержание которых включено посредством ссылки во всей их полноте.
Включение посредством ссылки списка последовательностей
Настоящая заявка подается вместе со списком последовательностей в электронной форме. Список последовательностей предоставлен в виде файла под названием 735042013140SEQLIST.txt, созданного 9 августа 2018 года, размер которого составляет 35001 килобайт. Информация в электронной форме о списке последовательностей включена посредством ссылки во всей своей полноте.
Область техники, к которой относится изобретение.
Настоящее изобретение относится к способам и композициям для получения сконструированных клеток, таких как клетки, экспрессирующие рекомбинантный рецептор, в том числе способам, включающим стимуляцию и/или инженерию входной композиции (исходной композиции), характеризующейся определенным отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ Т-клеткам. В частности, способы могут использоваться для конструирования Т-клеток с генно-инженерными рецепторами, такими как генно-инженерные рецепторы антигенов, например сконструированные (рекомбинантные) TCR и химерные рецепторы антигенов (CAR), или другими рекомбинантными химерными рецепторами. Особенности способов включают получение более единообразного и/или предсказуемого Т-клеточного продукта и/или продукта с более низкой токсичностью по сравнению с другими способами.
Предпосылки создания изобретения
В распоряжении имеются различные способы приготовления клеток для терапевтического применения и введения клеток. Например, для инженерии и клеточной терапии в распоряжении имеются способы приготовления клеток, включая Т-клетки, в том числе способы, включающие истощение или обогащение в отношение определенных субпопуляций. Усовершенствованные способы необходимы, например, для уменьшения токсичности, связанной с назначения некоторых адоптивных клеточных терапий, для улучшения производственного процесса, для обеспечения улучшенного введения и/или для снижения стоимости или других средств. Предоставляются способы, клетки, композиции, наборы и системы, которые удовлетворяют таким потребностям.
Краткое изложение сущности настоящего изобретения
Здесь предоставляется способ получения композиции клеток, включающий объединение первой композиции клеток, содержащей подобные наивным CD4+ T-клетки, со второй композицией клеток, содержащей подобные наивным CD8+ T-клетки, для получения входной композиции клеток, в которой отношение подобных наивным CD4+ Т-клеток к подобным наивным CD8+ Т-клеткам находится между или приблизительно между 0,8:1 и 2,2:1, включительно. В некоторых вариантах осуществления первую композицию клеток получают путем выделения CD4+ T-клеток из биологического образца, полученного от субъекта, и/или вторую композицию клеток получают путем выделения CD8+ T-клеток из биологического образца, полученного от субъекта.
В некоторых вариантах осуществления до объединения способ включает определение количества, количества на объем, количества на вес и/или процентного содержания подобных наивным CD4+ T-клеток в первой композиции клеток и/или количества, количества на объем, количества на вес и/или процентного содержания подобных наивным CD8+ Т-клеток во второй композиции. В некоторых случаях до объединения способ включает определение количества, количества на объем, количества на вес и/или процентного содержания подобных наивным CD4+ Т-клеток и/или количества, количества на объем, количества на вес и/или процентного содержания подобных наивным CD8+ Т-клеток в биологическом образце от субъекта. В некоторых из любых таких вариантов осуществления отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам во входной композиции регулируется или изменяется по сравнению с отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ T клеткам в биологическом образце от субъекта.
Здесь предоставляется способ получения композиции клеток, включающий определение количества, количества на объем, количества на вес и/или процентного содержания подобных наивным CD4+ T-клеток и подобных наивным CD8+ T-клеток в биологическом образец, полученном от субъекта, или в одном или более полученных от него образцов; и получение входной композиции, содержащей CD4+ T-клетки и CD8+ T-клетки, в которой отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам находится между или приблизительно между 2,2:1 и 0,8:1, включительно, причем указанное отношение во входной композиции регулируется или изменяется по сравнению с отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам в биологическом образце от субъекта.
В некоторых вариантах осуществления способ включает, кроме того, приведение входной композиции в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки во входной композиции.
Здесь предоставляется способ получения композиции клеток, включающий приведение входной композиции, содержащей подобные наивным CD4+ T-клетки и подобные наивным CD8+ T-клетки из биологического образца от субъекта, в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции, причем отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам, которое присутствуют во входной композиции, находится между или приблизительно между 0,8:1 и 2,2:1, включительно.
В некоторых вариантах осуществления способ включает, кроме того, стимуляцию клеток до, во время и/или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации и/или пролиферации клеток.
Здесь предоставляется способ получения композиции клеток, включающий объединение первой композиции клеток, содержащей подобные наивным CD4+ T-клетки, со второй композицией клеток, содержащей подобных наивным CD8+ T-клетки, для получения входной композиции клеток, в которой отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам находится между или приблизительно между 0,8:1 и 2,2:1, включительно; приведение входной композиции в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции; и стимуляцию клеток до, во время и/или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации и/или пролиферации клеток.
В некоторых из любых таких вариантов осуществления подобные наивным CD4+ клетки и/или подобные наивным CD8+ клетки являются поверхностно-позитивными по маркеру, выбранному из группы, состоящей из CD45RA, CD27, CD28, CD62L и CCR7; и/или являются поверхностно-негативными по маркеру, выбранному из группы, состоящей из CD25, CD45RO, CD56, KLRG1; и/или характеризуются низкой экспрессией CD95; и/или являются негативными по внутриклеточной экспрессии цитокина, выбранного из группы, состоящей из IL-2, IFN-γ, IL-4, IL-10. В некоторых вариантах осуществления подобные наивным CD4+ клетки и/или подобные наивным CD8+ клетки являются поверхностно-позитивными по маркеру активации Т-клеток, выбранному из группы, состоящей из CD45RA, CD27, CD28 и CCR7; и/или являются поверхностно-негативными по маркеру, выбранному из группы, состоящей из CD45RO, CD56, KLRG1; и/или характеризуются низкой экспрессией CD95. В некоторых аспектах подобные наивным CD4+ клетки и/или подобные наивным CD8+ клетки являются поверхностно-позитивными по CD45RA и CCR7. В некоторых вариантах осуществления подобные наивным CD4+ клетки и/или подобные наивным CD8+ клетки являются поверхностно-позитивными по CD45RA, CD27 и CCR7 и поверхностно-негативными по CD45RO.
В некоторых из любых таких вариантов осуществления количество, количество на объем, количество на вес и/или процентное содержание подобных наивным CD4+ Т-клеток и/или количество, количество на объем, количество на вес и/или процентное содержание подобных наивным CD8+ Т-клеток определяется с помощью проточной цитометрии. В некоторых аспектах отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам было отрегулировано по сравнению с отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ Т-клетки в биологическом образце от субъекта.
В некоторых вариантах осуществления биологический образец представляет собой или получают из образца крови, плазмы или сыворотки. В некоторых аспектах биологический образец представляет собой или включает образец цельной крови, образец лейкоцитарной пленки, образец мононуклеарных клеток периферической крови (PBMC), образец нефракционированных Т-клеток, образец лимфоцитов, образец лейкоцитов, продукт афереза, или продукт лейкафереза. В некоторых случаях биологический образец представляет собой или получают из образца для афереза или лейкафереза. В некоторых вариантах осуществления субъектом является человек.
В некоторых из любых таких вариантов осуществления входная композиция характеризуется отношением подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам, находящимся между или приблизительно между 0,8:1 и 2,0:1, 0,8:1 и 1,6:1, 0,8:1 и 1,4:1, 0,8:1 и 1,2:1 или 1,0:1 и 1,2:1, включительно каждое отношение. В некоторых вариантах осуществления входная композиция характеризуется отношением подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам, составляющим или приблизительно составляющим 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1 или 1,0:1. В некоторых вариантах осуществления входная композиция характеризуется отношением подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам, составляющим или приблизительно составляющим 1,1:1.
В некоторых из любых таких вариантов осуществления входная композиция содержит от или приблизительно от 1x107 до 5x109 всех клеток или всех T-клеток, от или приблизительно от 5x107 до 1x109 всех клеток или всех T-клеток, от или приблизительно от 1x108 до 5x108 всех клеток или всех T-клеток, или от или приблизительно от 2x108 до 5x108 всех клеток или всех T-клеток, или жизнеспособных популяций любых из вышеперечисленных. В некоторых случаях входная композиция содержит по крайней мере или по крайней мере приблизительно 1x108, 2x108, 3x108, 4x108 или 5x108 всех клеток или всех T-клеток или жизнеспособных популяций любых из вышеперечисленных.
В некоторых вариантах осуществления один или более стимулирующих агентов способен активировать Т-клетки, CD4+ Т-клетки и/или CD8+ Т-клетки; способен к индукции сигнала через TCR комплекс; и/или способен к вызову пролиферации Т-клеток, CD4+ Т-клеток и/или CD8+ Т-клеток. В некоторых аспектах один или более стимулирующих агентов включает первичный агент, который связывается с членом TCR комплекса, который необязательно специфически связывается с CD3. В некоторых случаях один или более стимулирующих агентов включает, кроме того, вторичный агент, который специфически связывается с костимулирующей молекулой Т-клеток. В некоторых примерах костимулирующая молекула выбрана из группы, состоящей из CD28, CD137 (4-1-BB), OX40 или ICOS.
В некоторых вариантах осуществления первичные и вторичные агенты включают антитела, причем необязательно один или более стимулирующих агентов включают инкубацию с антителом против CD3 и антителом против CD28. В некоторых вариантах осуществления один или более стимулирующих агентов присутствуют на поверхности твердой подложки, необязательно шарика. В некоторых вариантах осуществления один или более стимулирующих агентов присутствуют на поверхности шарика, и шарик представляет собой парамагнитный шарик. В некоторых аспектах один или более одного стимулирующего агента выбран из группы, состоящей из CD3-связывающих молекул; CD28-связывающих молекул; рекомбинантного IL-2; рекомбинантного IL-15; и рекомбинантного IL-7, вакцины, содержащей антиген, специфически распознаваемый рецептором антигена, и антиидиотипического антитела, которое специфически связывается с рецептором антигена, или их комбинаций.
В некоторых из любых таких вариантов осуществления инкубацию проводят в течение от 2 до 15 дней, от 2 до 12 дней, от 2 до 12 дней, от 2 до 8 дней, от 2 до 6 дней, от 2 до 4 дней, от 4 до 12 дней, от 4 до 10 дней, от 4 до 8 дней, от 4 до 6 дней, от 6 до 12 дней, от 6 до 10 дней, от 6 до 8 дней, от 8 до 12 дней, от 8 до 10 дней или от 10 до 12 дней. В некоторых случаях инкубацию проводят в течение по крайней мере, или приблизительно по крайней мере, или 4 дней, 6 дней, 8 дней, 10 дней или 12 дней.
В некоторых из любых таких вариантов осуществления агент, включающий молекулу нуклеиновой кислоты, представляет собой вирусный вектор или представляет собой транспозон. В некоторых случаях агент, включающий молекулу нуклеиновой кислоты, представляет собой вирусный вектор, а вирусный вектор представляет собой ретровирусный вектор. В некоторых примерах вирусный вектор представляет собой лентивирусный вектор или гаммаретровирусный вектор.
В некоторых вариантах осуществления рекомбинантный рецептор способен связываться с антигеном-мишенью, который связан с клеткой или тканью заболевания, нарушения или состояния, является специфическим для них и/или экспрессируется в них. В некоторых случаях заболевание, нарушение или состояние представляет собой инфекционное заболевание или расстройство, аутоиммунное заболевание, воспалительное заболевание или опухоль или рак. В некоторых случаях антиген-мишень представляет собой опухолевый антиген. В некоторых примерах антиген-мишень выбран из ROR1, антигена созревания В-клеток (BCMA), карбоангидразы 9 (CAIX), tEGFR, Her2/neu (рецепторной тирозинкиназы erbB2), CD19, CD20, CD22, мезотелина, CEA и поверхностного антигена вируса гепатита В, антитела против фолатного рецептора, CD23, CD24, CD30, CD33, CD38, CD44, EGFR, эпителиального гликопротеина 2 (EPG-2), эпителиального гликопротеина 40 (EPG-40), EPHa2, erb-B2, erb-B3, erb-B4, димеров erbB, EGFR vIII, фолат-связывающего белка (FBP), FCRL5, FCRH5, фетального ацетилхолинового рецептора, GD2, GD3, сопряженного с G-белком рецептора 5D (GPCR5D, HMW-MAA, IL-22R-альфа, рецептора, содержащего домен вставки киназы, (kdr), легкой цепи каппа, Lewis Y, молекулы адгезии клеток L1 (L1-CAM), связанного с меланомой антигена А1 (MAGE)-А1, MAGE-A3, MAGE-A6, преимущественно экспрессируемого антигена меланомы (PRAME), сурвивина, TAG72, B7-H6, рецептор-альфа 2 IL-13 (IL-13Rα2), CA9, GD3, HMW-MAA, CD171, G250/CAIX, PSCA, фолатного рецептора-a, CD44v6, CD44v7/8, интегрина avb6, 8H9, NCAM, рецепторов VEGF, 5T4, фетального AchR, лигандов NKG2D, CD44v6, двойного антигена, антигена рака яичек, мезотелина, CMV мышей, муцина 1 (MUC1), MUC16, PSCA, NKG2D, NY-ESO-1, MART-1, gp100, онкофетального антигена, ROR1, TAG72, VEGF-R2, раково-эмбрионального антигена (CEA), Her2/neu, рецептора эстрогена, рецептора прогестерона, эфрина B2, CD123, c-Met, GD-2, O-ацетилированного GD2 (OGD2), CE7, белка 1 опухоли Вильмса (WT-1), циклина, циклина А2, CCL-1, CD138, специфического для патогена антигена и антигена, связанного с универсальной меткой.
В некоторых примерах антиген-мишень выбран из числа рецептора-сироты 1 типа рецепторных тирозинкиназ (ROR1), антигена созревания В-клеток (BCMA), карбоангидразы 9 (CA9, также известной как CAIX или G250), Her2/neu (рецепторной тирозинкиназы erbB2), CD19, CD20, CD22, мезотелина (MSLN), раково-эмбрионального антигена (CEA) и поверхностного антигена вируса гепатита B, антитела против фолатного рецептора, CD23, CD24, CD30, CD33, CD38, CD44, хондроитинсульфат-протеогликана 4 (CSPG4), EGFR, эпителиального гликопротеина 2 (EPG-2), эпителиального гликопротеина 40 (EPG-40), рецептора-А2 эфрина (EPHa2), Her3 (erb-B3), Her4 (erb-B4), димеров erbB, мутации рецептора эпидермального фактора роста типа III (EGFR vIII), фолат-связывающего белка (FBP), подобного Fc-рецептору рецептора 5 (FCRL5, также известного как гомолог 5 Fc-рецептора или FCRH5), фетального ацетилхолинового рецептора (фетального AchR), ганглиозида GD2, ганглиозида GD3, лейкоцитарного антигена A1 человека (HLA-A1), лейкоцитарного антигена A2 человека (HLA-A2), рецептора-альфа IL-22 (IL-22Ra), рецептора, содержащего домен вставки киназы (kdr), легкой цепи каппа, члена А семейства белков, богатых повторами лейцина 8, (LRRC8A), Lewis Y, молекулы адгезии клеток L1 (L1-CAM), связанного с меланомой антигена А1 (MAGE)-A1, MAGE-A3, MAGE-A6, MAGE-A10, преимущественно экспрессируемого антигена меланомы (PRAME), сурвивина, опухолевого гликопротеина 72 (TAG72), B7-H3, B7-H6, рецептора-альфа 2 IL-13 (IL-13Rα2), высокомолекулярного связанного с меланомой антигена человека (HMW-MAA), CD171, фолатного рецептора-альфа, CD44v7/8, интегрина αvβ6 (интегрина avb6), 8H9, молекулы адгезии нервных клеток (NCAM), рецептора фактора роста эндотелия сосудов (рецепторов VEGF или VEGFR), гликопротеина трофобластов (TPBG, также известного как 5T4), лигандов NKG2D, CD44v6, двойного антигена, антигена рака яичек, цитомегаловируса (CMV) мышей, муцина 1 (MUC1), MUC16, антигена стволовых клеток предстательной железы (PSCA), специфического для предстательной железы мембранного антигена (PSMA), лигандов члена D группы 2 природных киллеров (NKG2D), антигена 1B рака/яичка (CTAG, также известного как NY-ESO-1 и LAGE-2), мелана A (MART-1), гликопротеина 100 (gp100), глипикана-3 (GPC3), сопряженного с G-белком рецептора 5D (GPRC5D), онкофетального антигена, TAG72, родственного тирозиназе белка 1 (TRP1, также известного как TYRP1 или gp75), родственного тирозиназе белка 2 (TRP2, также известного как допахром-таутомераза, допахром-дельта-изомераза или DCT), рецептора 2 фактора роста эндотелия сосудов (VEGF-R2), раково-эмбрионального антигена (CEA), рецептора эстрогена, рецептора прогестерона, специфического для предстательной железы антигена, эфрина B2, CD123, CD133, c-Met, O-ацетилированного GD2 (OGD2), эпитопа CE7 L1-CAM, белка опухоли Вильмса 1 (WT-1), циклина, циклина A2, лиганда 1 хемокина, содержащего мотив C-C (CCL-1), CD138, специфического для патогена антигена или экспрессируемого патогеном антигена и антигена, связанного с универсальной меткой, и/или биотинилированных молекул, и/или молекул, экспрессируемых ВИЧ, HCV, HBV или другими патогенами.
В некоторых вариантах осуществления антигены, на которые нацелены рецепторы, включают связанные со злокачественной В-клеточной опухолью антигены, такие как любой из ряда известных В-клеточных маркеров. В некоторых вариантах осуществления антиген представляет собой или включает CD20, CD19, CD22, ROR1, CD45, CD21, CD5, CD33, Ig каппа, Ig лямбда, CD79a, CD79b или CD30.
В некоторых вариантах осуществления антиген представляет собой или включает специфический для патогена или экспрессируемый патогеном антиген. В некоторых вариантах осуществления антиген представляет собой вирусный антиген (такой как вирусный антиген из ВИЧ, HCV, HBV и т.д.), бактериальные антигены и/или паразитные антигены.
В некоторых вариантах осуществления рекомбинантный рецептор представляет собой или включает функциональный рецептор антигена, не являющийся TCR, или TCR или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления рекомбинантный рецептор представляет собой химерный рецептор антигена (CAR). В некоторых случаях химерный рецептор антигена содержит экстраклеточный домен, включающий антигенсвязывающий домен. В некоторых случаях антигенсвязывающий домен представляет собой или включает антитело или фрагмент антитела, который необязательно является одноцепочечным фрагментом. В некоторых вариантах осуществления фрагмент включает вариабельные области антитела, соединенные гибким линкером. В некоторых аспектах фрагмент включает scFv.
В некоторых вариантах осуществления химерный рецептор антигена содержит, кроме того, спейсер и/или шарнирную область. В некоторых вариантах осуществления химерный рецептор антигена содержит внутриклеточную сигнальную область. В некоторых случаях внутриклеточная сигнальная область включает внутриклеточный сигнальный домен. В некоторых вариантах осуществления внутриклеточный сигнальный домен представляет собой или включает первичный сигнальный домен, сигнальный домен, который способен индуцировать первичный сигнал активации в Т-клетке, сигнальный домен компонента Т-клеточного рецептора (TCR), и/или сигнальный домен, содержащий мотив активации иммунорецепторов на основе тирозина (ITAM). В некоторых вариантах осуществления внутриклеточный сигнальный домен представляет собой или включает внутриклеточный сигнальный домен цепи CD3, необязательно цепи CD3-дзета (CD3ζ), или ее сигнальную часть.
В некоторых вариантах осуществления CAR включает специфический для антигена scFv, трансмембранный домен, цитоплазматический сигнальный домен, происходящий из костимулирующей молекулы, который необязательно представляет собой или включает сигнальный домен 4-1BB, или цитоплазматический сигнальный домен, происходящий из первичной сигнальной ITAM-содержащей молекулы, который необязательно представляет собой или включает сигнальный домен CD3 дзета, и необязательно включает, кроме того, спейсер между трансмембранным доменом и scFv; CAR включает, по порядку, специфический для антигена scFv, трансмембранный домен, цитоплазматический сигнальный домен, происходящий из костимулирующей молекулы, который необязательно представляет собой или включает сигнальный домен 4-IBB, и цитоплазматический сигнальный домен, происходящий из первичной сигнальной ITAM-содержащей молекулы, который необязательно является сигнальным доменом CD3 дзета; или CAR включает, по порядку, специфический для антигена scFv, спейсер, трансмембранный домен, цитоплазматический сигнальный домен, происходящий из костимулирующей молекулы, который необязательно является сигнальным доменом 4-1BB, и цитоплазматический сигнальный домен, происходящий из первичной сигнальной ITAM-содержащей молекулы, который необязательно представляет собой или включает сигнальный домен CD3 дзета.
В некоторых вариантах осуществления химерный рецептор антигена содержит, кроме того, трансмембранный домен, расположенный между экстраклеточным доменом и внутриклеточной сигнальной областью. В некоторых вариантах осуществления внутриклеточная сигнальная область включает, кроме того, костимулирующую сигнальную область. В некоторых аспектах костимулирующая сигнальная область включает внутриклеточный сигнальный домен костимулирующей молекулы Т-клеток или ее сигнальную часть. В некоторых примерах костимулирующая сигнальная область включает внутриклеточный сигнальный домен CD28, 4-IBB или ICOS или их сигнальную часть. В некоторых вариантах осуществления костимулирующая сигнальная область находится между трансмембранным доменом и внутриклеточной сигнальной областью.
В некоторых из любых таких вариантов осуществления у субъекта имеется заболевание или состояние, причем необязательно рекомбинантный рецептор специфически распознает или специфически связывается с антигеном, связанным с заболеванием или состоянием или экспрессируемым или присутствующим на клетках заболевания или состояния.
В некоторых вариантах осуществления способ дает выходную композицию, в которой отношение экспрессирующих рекомбинантный рецептор CD4+ Т-клеток к экспрессирующим рекомбинантный рецептор CD8+ Т-клеткам, необязательно отношение их жизнеспособных клеток, отличается не более чем на 20%, или не более чем на 10%, или не более чем на 5% от среднего значения указанного отношения во множестве композиций Т-клеток, полученных этим способом, и/или отличается от такого среднего значения не более чем на одно среднеквадратичное отклонение. В некоторых вариантах осуществления способ дает выходную композицию, в которой отношение экспрессирующих рекомбинантный рецептор CD4+ Т-клеток к экспрессирующим рекомбинантный рецептор CD8+ Т-клеткам, необязательно отношение их жизнеспособных клеток, находится между или приблизительно между 0,5:1 и 2:1, или 0,8:1 и 1,6:1, или 1:1 и 1,5:1, включительно каждое отношение. В некоторых примерах отношение экспрессирующих рекомбинантный рецептор CD4+ T-клеток к экспрессирующим рекомбинантный рецептор CD8+ T-клеткам, необязательно, отношение их жизнеспособных клеток, в выходной композиции составляет или приблизительно составляет 1,2:1, 1,1:1, 1:1, 0,9:1 или 0,8:1. В некоторых случаях отношение экспрессирующих рекомбинантный рецептор CD4+ Т-клеток к экспрессирующим рекомбинантный рецептор CD8+ Т-клеткам, необязательно, отношение их жизнеспособных клеток в выходной композиции составляет или приблизительно составляет 1:1.
В некоторых вариантах осуществления жизнеспособные клетки содержат клетки, которые являются негативными (-) по маркеру апоптоза, причем необязательно маркером апоптоза является аннексин V или активная каспаза 3.
В некоторых из любых таких вариантов осуществления способ выполняется in vitro или ex vivo.
Здесь предоставляется выходная композиция, полученная любым из описанных здесь способов. Также предоставляется фармацевтическая композиция, содержащая описанную выходную композицию. В некоторых вариантах осуществления фармацевтическая композиция содержит, кроме того, фармацевтический носитель.
Здесь предоставляется способ лечения, включающий введение являющемуся млекопитающим субъекту выходной композиции, полученной любым из описанных способов, или любой из описанных фармацевтических композиций. В некоторых вариантах осуществления клетки получены от субъекта, которому эти клетки вводят.
В некоторых вариантах осуществления предоставленных способов подобные наивным CD4+ клетки и/или подобные наивным CD8+ клетки являются поверхностно-позитивными по CD45RA и CCR7. В некоторых вариантах осуществления предоставленных способов подобные наивным CD4+ клетки и/или подобные наивным CD8+ клетки являются поверхностно-позитивными по CD27 и CCR7. В конкретных вариантах осуществления предоставленных способов подобные наивным CD4+ клетки и/или подобные наивным CD8+ клетки являются поверхностно-позитивными по CD45RA, CD27 и CCR7 и поверхностно-негативными по CD45RO.
В некоторых вариантах осуществления предоставленных способов подобные наивным CD4+ клетки и/или подобные наивным CD8+ клетки являются поверхностно-позитивными по CCR7 и поверхностно-негативными по CD62L. В некоторых вариантах осуществления предоставленных способов входная композиция характеризуется отношением подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам, которые являются поверхностно-позитивными по CD45RA и CCR7, составляющим или приблизительно составляющим 1,1:1. В конкретных вариантах осуществления предоставленных способов входная композиция характеризуется отношением подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам, которые являются поверхностно-позитивными по CD45RA и CD27, составляющим или приблизительно составляющим 1,69:1. В некоторых вариантах осуществления входная композиция клеток характеризуется отношением подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам, которые являются поверхностно-позитивными по CD27 и CCR7, составляющим или приблизительно составляющим 1,69:1.
В некоторых вариантах осуществления здесь предоставляется способ получения композиции клеток, включающий объединение первой композиции клеток, содержащей CCR7+ CD45RA+ CD4+ T-клетки, со второй композицией клеток, содержащей CCR7+ CD45RA+ CD8+ T-клетки, для получения входной композиции клеток, в которой отношение CCR7+ CD45RA+ CD4+ T-клеток к CCR7+ CD45RA+ CD8+ T-клетках находится между или приблизительно между 0,8:1 и 2,2:1, включительно. В некоторых вариантах осуществления предоставленных способов первую композицию клеток получают путем выделения CD4+ T-клеток из биологического образца, полученного от субъекта, и/или вторую композицию клеток получают путем выделения CD8+ T-клеток из биологического образца, полученного от субъекта.
В конкретных вариантах осуществления предоставленных способов до объединения способ включает определение количества, количества на объем, количества на вес и/или процентного содержания CCR7+ CD45RA+ CD4+ Т-клеток в первой композиции клеток и/или количества, количества на объем, количества на вес и/или процентного содержания CCR7+ CD45RA+ CD8+ Т-клеток во второй композиции. В некоторых вариантах осуществления предоставленных способов до объединения способ включает определение количества, количества на объем, количества на вес и/или процентного содержания CCR7+ CD45RA+ CD4+ Т-клеток и/или количества, количества на объем, количества на вес и/или процентного содержания CCR7+ CD45RA+ CD8+ Т-клеток в биологическом образце от субъекта. В некоторых вариантах осуществления предоставленных способов отношение CCR7+ CD45RA+ CD4+ Т-клеток к CCR7+ CD45RA+ CD8+ Т-клеткам во входной композиции регулируется или изменяется по сравнению с отношением CCR7+ CD45RA+ CD4+ Т-клеток к CCR7+ CD45RA+ CD8+ Т-клеткам в биологическом образце от субъекта.
В конкретных вариантах осуществления здесь предоставляется способ получения композиции клеток, включающий: определение количества, количества на объем, количества на вес и/или процентного содержания CCR7+ CD45RA+ CD4+ T-клеток и CCR7+ CD45RA+ CD8+ Т-клеток в биологическом образце, полученном от субъекта, или в одном или более полученных от него образцов; и получение входной композиции, содержащей CD4+ T-клетки и CD8+ T-клетки, в которой отношение CCR7+ CD45RA+ CD4+ T-клеток к CD8+ T-клеткам, подобным наивным, находится между или приблизительно между 2,2:1 и 0,8:1, включительно, причем указанное отношение во входной композиции регулируется или изменяется по сравнению с отношением CCR7+ CD45RA+ CD4+ T-клеток к CD8+ T-клеткам, подобным наивным, в биологическом образце от субъекта.
Некоторые варианты осуществления предоставленных способов включают, кроме того, приведение входной композиции в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки во входной композиции.
Здесь предоставляется способ получения композиции клеток, включающий: приведение входной композиции, содержащей CCR7+ CD45RA+ CD4+ T-клетки и CCR7+ CD45RA+ CD8+ Т-клетки из биологического образца от субъекта, в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции, причем отношение CCR7+ CD45RA+ CD4+ T-клеток к CCR7+ CD45RA+ CD8+ T-клеткам, присутствующее во входной композиции, находится между или приблизительно между 0,8:1 и 2,2:1, включительно. Некоторых вариантах осуществления предоставленных способов включают, кроме того, стимуляцию клеток до, во время и/или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации и/или пролиферации клеток.
В конкретных вариантах осуществления здесь предоставляется способ получения композиции клеток, включающий объединение первой композиции клеток, содержащей CCR7+ CD45RA+ CD4+ T-клетки, со второй композицией клеток, содержащей CCR7+ CD45RA+ CD8+ T-клетки, для получения входной композиция клеток, в которой отношение CCR7+ CD45RA+ CD4+ T-клеток к CCR7+ CD45RA+ CD8+ T-клеткам находится между или приблизительно между 0,8:1 и 2,2:1, включительно; приведение входной композиции в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции; и стимуляцию клеток до, во время и/или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации и/или пролиферации клеток.
В некоторых вариантах осуществления предоставленных способов количество, количество на объем, количество на вес и/или процентное содержание CCR7+ CD45RA+ CD4+ T-клеток и/или количество, количество на объем, количество на вес и/или процентное содержание CCR7+ CD45RA+ CD8+ T-клеток определяется с помощью проточной цитометрии. В некоторых вариантах осуществления предоставленных способов отношение CCR7+ CD45RA+ CD4+ T-клеток к CCR7+ CD45RA+ CD8+ T-клеткам было отрегулировано по сравнению с отношением CCR7+ CD45RA+ CD4+ T-клеток к CCR7+ CD45RA+ CD8+ T-клеткам в биологическом образце от субъекта. В конкретных вариантах осуществления предоставленных способов входная композиция характеризуется отношением CCR7+ CD45RA+ CD4+ клеток к CCR7+ CD45RA+ CD8+ клеткам, находящимся между или приблизительно между 0,8:1 и 2,0:1, 0,8:1 и 1,6:1, 0,8:1 и 1,4:1, 0,8:1 и 1,2:1 или 1,0:1 и 1,2:1, включительно каждое отношение. В некоторых вариантах осуществления предоставленных способов входная композиция характеризуется отношением CCR7+ CD45RA+ CD4+ клеток к CCR7+ CD45RA+ CD8+ клеткам, составляющим или приблизительно составляющим 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1 или 1,0:1.
В некоторых вариантах осуществления предоставленных способов входная композиция характеризуется отношением CCR7+ CD45RA+ CD4+ клеток к CCR7+ CD45RA+ CD8+ клеткам, составляющим или приблизительно составляющим 1,1:1. В конкретных вариантах осуществления здесь предоставляется способ получения композиции клеток, включающий объединение первой композиции клеток, содержащей CD27+ CCR7+ CD4+ T-клетки, со второй композицией клеток, содержащей CD27+ CCR7+ CD8+ T-клетки, для получения входной композиции клеток, в которой отношение CD27+ CCR7+ CD4+ Т-клеток к CD27+ CCR7+ CD8+ Т-клеткам находятся между или приблизительно между 1,2:1 и 2,4:1, включительно.
В некоторых вариантах осуществления предоставленных способов первую композицию клеток получают путем выделения CD4+ T-клеток из биологического образца, полученного от субъекта, и/или вторую композицию клеток получают путем выделения CD8+ T-клеток из биологического образца, полученного от субъекта. В некоторых вариантах осуществления предоставленных способов до объединения способ включает определение количества, количества на объем, количества на вес и/или процентного содержания CD27+ CCR7+ CD4+ Т-клеток в первой композиции клеток и/или количества, количества на объем, количества на вес и/или процентного содержания CD27+ CCR7+ CD8+ T-клеток во второй композиции. В конкретных вариантах осуществления предоставленных способов до объединения способ включает определение количества, количества на объем, количества на вес и/или процентного содержания CD27+ CCR7+ CD4+ T-клеток и/или количества, количества на объем, количества на вес и/или процентного содержания CD27+ CCR7+ CD8+ Т-клеток в биологическом образце от субъекта.
В некоторых вариантах осуществления предоставленных способов отношение CD27+ CCR7+ CD4+ T-клеток к CD27+ CCR7+ CD8+ T-клеткам во входной композиции регулируется или изменяется по сравнению с отношением CD27+ CCR7+ CD4+ T-клеток к CD27+ CCR7+ CD8+ T-клеткам в биологическом образце от субъекта. В некоторых вариантах осуществления здесь предоставляется способ получения композиции клеток, включающий: определение количества, количества на объем, количества на вес и/или процентного содержания CD27+ CCR7+ CD4+ T-клеток и CD27+ CCR7+ CD8+ T-клеток в биологическом образце, полученном от субъекта, или в одном или более полученных от него образцов; и получение входной композиции, содержащей CD4+ T-клетки и CD8+ T-клетки, в которой отношение CD27+ CCR7+ CD4+ T-клеток к CD8+ T-клеткам, подобным наивным, находится между или приблизительно между 2,2:1 и 0,8:1, включительно, причем указанное отношение во входной композиции регулируется или изменяется по сравнению с отношением CD27+ CCR7+ CD4+ T-клеток к CD8+ T-клеткам, подобным наивным, в биологическом образце от субъекта.
Некоторые варианты осуществления предоставленных способов включают, кроме того, приведение входной композиции в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки во входной композиции.
В конкретных вариантах осуществления здесь предоставляется способ получения композиции клеток, включающий: приведение входной композиции, содержащей CD27+ CCR7+ CD4+ T-клетки и CD27+ CCR7+ CD8+ T-клетки из биологического образца от субъекта, в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции, причем отношение CD27+ CCR7+ CD4+ T-клеток к CD27+ CCR7+ CD8+ T-клеткам, присутствующее во входной композиции, находится между и приблизительно между 0,8:1 и 2,2:1, включительно. Некоторые варианты осуществления предоставленных способов включают, кроме того, стимуляцию клеток до, во время и/или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации и/или пролиферации клеток.
В некоторых вариантах осуществления здесь предоставляется способ получения композиции клеток, включающий: объединение первой композиции клеток, содержащей CD27+ CCR7+ CD4+ T-клетки, со второй композицией клеток, содержащей CD27+ CCR7+ CD8+ T-клетки, для получения входной композиции клеток, в которой отношение CD27+ CCR7+ CD4+ T-клеток к CD27+ CCR7+ CD8+ Т-клеткам находится между или приблизительно между 0,8:1 и 2,2:1, включительно; приведение входной композиции в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции; и стимуляцию клеток до, во время и/или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации и/или пролиферации клеток.
В конкретных вариантах осуществления предоставленных способов количество, количество на объем, количество на вес и/или процентное содержание CD27+ CCR7+ CD4+ T-клеток и/или количество, количество на объем, количество на вес и/или процентное содержание CD27+ CCR7+ CD8+ Т-клеток определяется с помощью проточной цитометрии. В некоторых вариантах осуществления предоставленных способов отношение CD27+ CCR7+ CD4+ T-клеток к CD27+ CCR7+ CD8+ T-клеткам было отрегулировано по сравнению с отношением CD27+ CCR7+ CD4+ T-клеток к CD27+ CCR7+ CD8+ T-клеткам в биологическом образце от субъекта.
В некоторых вариантах осуществления предоставленных способов входная композиция характеризуется отношением CD27+ CCR7+ CD4+ клеток к CD27+ CCR7+ CD8+ клеткам, находящимся между или приблизительно между 0,8:1 и 2,0:1, 0,8:1 и 1,6:1, 0,8:1 и 1,4:1, 0,8:1 и 1,2:1 или 1,0:1 и 1,2:1, включительно каждое отношение. В конкретных вариантах осуществления предоставленных способов входная композиция характеризуется отношением CD27+ CCR7+ CD4+ клеток к CD27+ CCR7+ CD8+ клетках, составляющим или приблизительно составляющим 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1. или 1,0:1. В некоторых вариантах осуществления предоставленных способов входная композиция характеризуется отношением CD27+ CCR7+ CD4+ клеток к CD27+ CCR7+ CD8+ клетках, составляющим или приблизительно составляющим 1,1:1. В некоторых вариантах осуществления входная композиция клеток характеризуется отношением CD27+ CCR7+ CD4+ клеток к CD27+ CCR7+ CD8+ клетках, составляющим или приблизительно составляющим 1,69:1.
В некоторых вариантах осуществления здесь предоставляется способ получения композиции клеток, включающий: объединение первой композиции клеток, содержащей CD62L- CCR7+ CD4+ T-клетки, со второй композицией клеток, содержащей CD62L- CCR7+ CD8+ T-клетки, для получения входной композиции клеток, в которой отношение CD62L-CCR7+ CD4+ T-клеток к CD62L-CCR7+ CD8+ T-клеткам находится между или приблизительно между 0,5:1 и 2:1, включительно.
В конкретных вариантах осуществления здесь предоставляется способ получения композиции клеток, включающий: определение количества, количества на объем, количества на вес и/или процентного содержания CD62L- CCR7+ CD4+ T-клеток и CD62L- CCR7+ CD8+ Т-клеток в биологическом образце, полученном от субъекта, или в одном или более полученных от него образцов; и получение входной композиции, содержащей CD4+ T-клетки и CD8+ T-клетки, в которой отношение CD62L-CCR7+ CD4+ T-клеток к CD8+ T-клеткам, подобным наивным, находится между или приблизительно между 0,5:1 и 2:1, включительно, причем указанное отношение во входной композиции регулируется или изменяется по сравнению с отношением CD62L- CCR7+ CD4+ T-клеток к CD8+ T-клеткам, подобным наивным, в биологическом образце от субъекта.
Некоторые варианты осуществления предоставленных способов включают, кроме того, приведение входной композиции в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки во входной композиции. В некоторых вариантах осуществления здесь предоставляется способ получения композиции клеток, включающий объединение первой композиции клеток, содержащей CD62L- CCR7+ CD4+ T-клетки, со второй композицией клеток, содержащей CD62L-CCR7+ CD8+ T-клетки, для получения входной композиция клеток, в которой отношение CD62L- CCR7+ CD4+ T-клеток к CD62L-CCR7+ CD8+ T-клеткам находится между или приблизительно между 0,5:1 и 2:1, включительно; приведение входной композиции в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции; и стимуляцию клеток до, во время и/или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации и/или пролиферации клеток.
В конкретных вариантах осуществления предоставленных способов количество, количество на объем, количество на вес и/или процентное содержание CD62L-CCR7+ CD4+ Т-клеток и/или количество, количество на объем, количество на вес и/или процентное содержание CD62L-CCR7+ CD8+ Т-клеток определяется с помощью проточной цитометрии. В некоторых вариантах осуществления предоставленных способов отношение CD62L-CCR7+ CD4+ T-клеток к CD62L-CCR7+ CD8+ T-клеткам было отрегулировано по сравнению с отношением CD62L-CCR7+ CD4+ T-клеток к CD62L-CCR7+ CD8+ T-клеткам в биологическом образце от субъекта. В некоторых вариантах осуществления предоставленных способов входная композиция характеризуется отношением CD62L-CCR7+ CD4+ клеток к CD62L-CCR7+ CD8+ клеткам, находящимся между или приблизительно между 0,5:1 и 1,5:1, 1:1 и 2:1, 0,75:1 и 1,5:1 или 0,8:1 и 1,2:1, включительно каждое отношение. В конкретных вариантах осуществления предоставленных способов входная композиция характеризуется отношением CD62L-CCR7+ CD4+ клеток к CD62L-CCR7+ CD8+ клеткам, составляющим или приблизительно составляющим 1,2:1, 1,1:1, 1,0:1, 0,9:1 или 0,8:1.
В некоторых вариантах осуществления предоставленных способов биологический образец представляет собой или получают из образца крови, плазмы или сыворотки. В некоторых вариантах осуществления предоставленных способов биологический образец представляет собой или включает образец цельной крови, образец лейкоцитарной пленки, образец мононуклеарных клеток периферической крови (PBMC), образец нефракционированных Т-клеток, образец лимфоцитов, образец лейкоцитов, продукт афереза или продукт лейкафереза. В конкретных вариантах осуществления предоставленных способов биологический образец представляет собой или получают из образца для афереза или лейкафереза.
Краткое описание чертежей
На фиг. 1А представлен график двумерного анализа соответствия отношения жизнеспособных CD4+ клеток к жизнеспособным CD8+ клеткам (отношение жизнеспособных CD4+/CD8+) в образце для афереза отношению CAR+ CD4+ T-клеток к CAR+ CD8+ T-клеткам (отношению CAR+ CD4+/CD8+) в Т-клеточной композиции после активации Т-клеток, их трансдукции с помощью конструкции для химерного рецептора антигена (CAR) и размножения. Кривые линии представляют границы двумерного нормального эллипса распределения при p=0,990. Точки на графике представляют средние отношения для четырех образцов от каждого субъекта, включая здоровых субъектов (кружки) и субъекта с миеломой (знак плюс).
На фиг. 1B представлен график двумерного анализа соответствия отношения CD45RA+/CCR7+ CD4/CD8 в исходной смеси отобранных CD4 и CD8 клеток отношению CAR+ CD4+/CD8+ в Т-клеточной композиции после активации Т-клеток, их трансдукции с помощью конструкции для химерного рецептора антигена (CAR) и размножения. Кривые линии представляют границы двумерного нормального эллипса распределения при p=0,990. Точки на графике представляют средние отношения для четырех образцов от каждого субъекта, включая здоровых субъектов (кружки) и субъекта с миеломой (знак плюс).
На фиг. 2А-2С представлены графики двумерного анализа соответствия отношения клеток с различными фенотипами в исходной смеси отобранных CD4 и CD8 клеток отношению CAR+ CD4+/CD8+ в композиции сконструированных CAR+ T-клеток. На фиг. 2А представлен график двумерного анализа соответствия отношения CD45RA+/CCR7+/CD4+ клеток к CD45RA+/CCR7+/CD8+ клеткам в исходной смеси отобранных CD4 и CD8 клеток отношению CAR+ CD4+/CD8+ в композиции сконструированных CAR+ T-клеток. На фиг. 2В представлен график двумерного анализа соответствия отношения CD62L-/CCR7+/CD4+ Т-клеток к CD62L-/CCR7+/CD8+ Т-клеткам в исходной смеси отобранных CD4 и CD8 клеток отношению CAR+ CD4+/CD8+ в композиции сконструированных CAR+ T-клеток. На фиг. 2C представлен график двумерного анализа соответствия отношения CD27+/CCR7+/CD4+ T-клеток к CD27+/CCR7+/CD8+ Т-клеткам в исходной смеси отобранных CD4 и CD8 клеток отношению CAR+ CD4+/CD8+ в композиции сконструированных CAR+ T-клеток. Кривые линии представляют границы двумерного нормального эллипса распределения при p=0,950. Точки на графике представляют средние отношения для множества композиций от каждого субъекта, включая здоровых доноров (кружки) и пациента с множественной миеломой (знаки плюс).
На фиг. 3А-3С представлены графики двумерного анализа соответствия отношения клеток с различными фенотипами в исходной смеси отобранных CD4 и CD8 клеток от семи доноров с множественной миеломой отношению CAR+ CD4+/CD8+ в композиции сконструированных CAR+ T-клеток. На фиг. 3А представлен график двумерного анализа соответствия отношения CD27+/CCR7+/CD4+ клеток к CD27+/CCR7+/CD8+ клеткам в исходной смеси отобранных CD4 и CD8 клеток отношению CAR+ CD4+/CD8+ в композиции сконструированных CAR+ T-клеток. На фиг. 3B представлен график двумерного анализа соответствия отношения CD27+/CCR7+/CD4+ T-клеток к CD27+/CCR7+/CD8+ Т-клеткам в исходной смеси отобранных CD4 и CD8 клеток отношению CAR+ CD4+/CD8+ в композиции сконструированных CAR+ T-клеток. На фиг. 3C представлен график двумерного анализа соответствия отношения CD62L-/CCR7+/CD4+ T-клеток к CD62L-/CCR7+/CD8+ Т-клеткам в исходной смеси отобранных CD4 и CD8 клеток отношению CAR+ CD4+/CD8+ в композиции сконструированных CAR+ T-клеток. Кривые линии представляют границы двумерного нормального эллипса распределения при p=0,950.
Подробное описание настоящего изобретения
Здесь предоставляются способы приготовления композиции клеток, например входной композиции клеток, для использования в генной инженерии клеток, которые экспрессируют рекомбинантный рецептор. В некоторых вариантах осуществления способы включают одну или более стадий для получения входной композиции клеток, характеризующейся определенным, контролируемым или желательным отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам. В некоторых случаях предоставленная входная композиция может быть получена путем смешивания или объединения композиции клеток, содержащей CD4+ T-клетки с известным или определенным количеством или процентным содержанием подобных наивным CD4+ T-клеток, с композицией клеток, содержащей CD8+ T-клетки с известным или определенным количеством или процентным содержанием подобных наивным CD8+ Т-клеток, например, для достижения выбранного или желательного отношения. Также предоставляются способы стимуляции, размножения и/или индукции пролиферации клеток во входной композиции. Предоставленные способы также могут включать способы, связанные с генной инженерией клеток, такие как способы трансдукции, включая способы введения рекомбинантного рецептора, например химерного рецептора антигена, в такие клетки для использования в связи с адоптивной клеточной терапией.
В одном варианте осуществления обработка полученной входной композиции включает инкубацию клеток в условиях стимуляции, например, в некоторых аспектах, для активации клеток для инженерии или трансдукции или для размножения клеток. В некоторых вариантах осуществления способы включают стадии инженерии множества типов клеток, таких как CD4+ клетки и CD8+ клетки, например клетки, выделенные и присутствующие во входной композиции. В некоторых аспектах инженерия осуществляется для введения в клетки генно-инженерного рецептора антигена, такого как TCR, например TCR с высоким сродством, или функционального не являющегося TCR рецептора антигена, такого как химерный рецептор антигена (CAR). В некоторых аспектах способы включают дальнейшую обработку, такую как дальнейшая инкубация, например, при или приблизительно при 37°С±2°С, и/или составление клеток и содержащих их композиций. В некоторых вариантах осуществления обработка приводит к полученной в результате выходной композиции, содержащей генно-инженерные клетки, такие как генно-инженерные CD4+ клетки и CD8+ клетки, включая клетки, в которой сконструированные CD4+ и CD8+ клетки присутствуют в желательном соотношении. В некоторых вариантах осуществления полученная в результате обработанная выходная композиция может использоваться в способах введения пациенту клеток и композиций, приготовленных этими способами, например, в связи с адоптивной клеточной терапией.
В некоторых аспектах предпочтительной является выходная композиция, содержащая сконструированные клетки, например CAR+ T-клетки, в которой сконструированные CD4+ клетки и CD8+ клетки присутствуют в желательном соотношении или в пределах определенной степени допустимой погрешности желательного соотношения. Например, инженерные клетки, обогащенные в отношении множества различных популяций клеток или типов клеток, таких как выделенные популяции и субпопуляции CD4+ и CD8+ Т-клеток, могут увеличить эффективность, уменьшить или избежать нежелательных эффектов. В некоторых случаях такие соотношения включают соотношения, которые считаются оптимальными для терапевтического применения, например соотношения на выходе, которые считаются подходящими или оптимальными для введения пациенту в связи с адоптивной клеточной терапией. В некоторых вариантах осуществления желательное отношение CD4+ к CD8+ T-клеткам в выходной композиции для введения субъекту, например, в связи с адоптивной клеточной терапией, составляет от или приблизительно от 2:1 до 0,5:1, например 1:1 или приблизительно 1:1. В некоторых аспектах композиция, содержащая выделенные CD8+ и CD4+ T-клетки, например содержащая определенное желательное соотношение таких клеток, увеличивает способность клеток, в конечном счете, вводимых субъекту, сохраняться, размножаться, становиться активированными и/или прививаться in vivo или при введении субъекту. В некоторых аспектах она улучшает или увеличивает одну или более эффекторных функций или фенотипов активированных клеток. Например, такие преимущества могут быть достигнуты в некоторых аспектах путем введения популяции CD4+ и CD8+ клеток по сравнению только с популяцией CD8+ клеток.
В некоторых вариантах осуществления способы дают одно или более преимуществ по сравнению с другими способами приготовления, выделения, инкубации и инженерии, такими как экономия затрат, времени и/или средств. Такие преимущества могут включать способность выделять, обрабатывать, например, инкубировать и/или конструировать множество популяций клеток, присутствующих в или приблизительно в желательном соотношении, с увеличенной эффективностью и/или уменьшенной сложностью, временем, стоимостью и/или использованием ресурсов, по сравнению с другими способами.
В некоторых вариантах осуществления предоставленные способы основаны на наблюдениях, что в случае некоторых процессов получения инженерных клеток, отношение CD4+ клеток к CD8+ клеткам на входе, или отношение их жизнеспособных клеток, может не соотноситься с отношением сконструированных CD4+ и CD8+ клеток на выходе, или отношением их жизнеспособных клеток. Как здесь показано, установлено, что желательное отношение сконструированных CD4+ клеток к CD8+ T-клеткам (например, CAR+ CD4+ клеток к CAR+ CD8+ T-клеткам или отношение их жизнеспособных клеток) в выходной композиции соотнесено или связано с отношением подобных наивным CD4+ Т-клеток к подобным наивным CD8+ Т-клеткам, или отношением их жизнеспособных клеток, присутствующим во входной композиции перед выполнением процесса получения на клетках для получения выходной композиции, например, включающего одну или более стадий стимуляции, активации, размножения, пролиферации и/или трансдукции клеток. Примерами отношений таких подобных наивным клеток являются отношения CD4+ клеток к CD8+ клеткам, которые являются CD45RA+ и CCR7+, CD62L-/CCR7+ или CD27+/CCR7+. В некоторых аспектах, как наблюдается, такая корреляция между отношением CD4/CD8 клеток, подобных наивным, во входной композиции и отношением сконструированных CD4+ клеток к CD8+ клеткам, например CAR+ CD4 к CAR+ CD8+ T-клеткам, или отношением их жизнеспособных клеток) в выходной композиции существует, даже несмотря на различия в процессе, используемом для создания или получения выходной композиций. Источники этого различия могут включать ряд различных факторов, в том числе конкретные стадии или условия процесса, которые могут вводить колебания от одной композиции клеток к другой, или могут исходить от различий в индивидуумах или образцах, из которых создаваемые клетки выделяются, отбираются, происходят или получают.
В некоторых вариантах осуществления предоставленные способы основаны на наблюдениях, что желательное отношение сконструированных CD4+ T-клеток к CD8+ Т-клеткам (например, CAR+ CD4 к CAR+ CD8+ T-клеткам, или отношение их жизнеспособных клеток) в выходной композиции соотнесено или связано с отношением CD45RA+/CCR7+ CD4+ T-клеток к CD45RA+/CCR7+ CD8+ T-клеткам или отношением их жизнеспособных клеток, присутствующим во входной композиции перед проведением процесса получения на клетках для получения выходной композиции, например, включающего одну или более стадий стимуляции, активации, размножения, пролиферации и/или трансдукции клеток. В некоторых аспектах, как наблюдается, такая корреляция между отношением CD45RA+/CCR7+ CD4+ клеток к CD45RA+/CCR7+/CD8+ клеткам во входной композиции и отношением сконструированным CD4+ клеток к CD8+ клеткам (например, CAR+ CD4+ к CAR+ CD8+ T-клеткам, или соотношением их жизнеспособных клеток) в выходной композиции существует, даже несмотря на различия в доноре и/или процессе, используемом для создания или получения выходных композиций.
В конкретных вариантах осуществления предоставленные способы основаны на наблюдениях, что желательное отношение сконструированных CD4+ T-клеток к CD8+ Т-клеткам (например, CAR+ CD4 к CAR+ CD8+ T-клеткам, или отношение их жизнеспособных клеток) в выходной композиции соотнесено или связано с отношением CD62L-/CCR7+ CD4+ T-клеток к CD62L-/CCR7+ CD8+ T-клеткам или с отношением их жизнеспособных клеток, присутствующим во входной композиции перед проведением процесса получения на клетках для получения выходной композиции, например, включающего одну или более стадий стимуляции, активации, размножения, пролиферации и/или трансдукции клеток. В некоторых аспектах, как наблюдается, такая корреляция между отношением CD62L-/CCR7+ CD4+ клеток к CD62L-/CCR7+/CD8+ клеткам во входной композиции и отношением сконструированных CD4+ к CD8+ клеткам (например, CAR+ CD4 к CAR+ CD8+ T-клеткам, или отношением их жизнеспособных клеток) в выходной композиции существует, даже несмотря на различия в доноре и/или процессе, используемом для создания или получения выходной композиций.
В некоторых вариантах осуществления предоставленные способы основаны на наблюдениях, что желательное отношение сконструированных CD4+ T-клеток к CD8+ Т-клеткам (например, CAR+ CD4+ к CAR+ CD8+ T-клеткам, или отношение их жизнеспособных клеток) в выходной композиции соотнесено или связано с отношением CD27+/CCR7+ CD4+ T-клеток к CD27+/CCR7+ CD8+ T-клеткам или с отношением их жизнеспособных клеток, присутствующим во входной композиции перед проведением процесса получения на клетках для получения выходной композиции, например, включающего одну или более стадий стимуляции, активации, размножения, пролиферации и/или трансдукции клеток. В некоторых аспектах, как наблюдается, такая корреляция между отношением CD27+/CCR7+ CD4+ к CD27+/CCR7+/CD8+ клеткам во входной композиции и отношением сконструированных CD4+ к CD8+ клеткам (например, CAR+ CD4 к CAR+ CD8+ T-клеткам, или отношением их жизнеспособных клеток) в выходной композиции существует, даже несмотря на различия в доноре и/или процессе, используемом для создания или получения выходной композиций.
В некоторых аспектах предоставленные способы гарантируют, что в выходной композиции генно-инженерных клеток, например CAR+ T-клеток, сконструированных в процессе получения клеток, достигается относительно постоянное и/или контролируемое желательное отношение сконструированных CD4+ T-клеток к CD8+ клеткам, или отношение их жизнеспособных клеток, в этой композиции демонстрируется колебание такого отношения, которое является малым или меньше приемлемого или порогового колебания, среди полученных этим способом композиций, включая те, которые получены из образцов от ряда различных субъектов, например тех которые имеют различные характеристики, таких как субъекты разного возраста, с разным числом и/или типами предшествующего лечения, а также заболеванием и его подтипом или серьезностью или степенью тяжести. В некоторых аспектах такие процессы создают отношение таких сконструированных CD4+ к CD8+ (например, CAR+ CD4 к CAR+ CD8+ T-клеткам, или отношение их жизнеспособных клеток), которое отличается не более чем на 20%, или не более чем на 10%, или не более чем на 5% от среднего значения указанного отношения во множестве композиций Т-клеток, полученных этим способом, и/или отличается от такого среднего значения не более чем на одно среднеквадратичное отклонение или отличается не более чем на 20% или не более чем на 10% или не более чем на 5% среди множества композиций Т-клеток, полученных этим способом среди таких различных образцов и пациентов.
В некоторых вариантах осуществления использование процесса, который обеспечивает большее постоянство выходной композиции, создаваемой в процессе получения клеток, например, что касается отношения сконструированных CD4 к CD8 Т-клеткам, может быть выгодным для обеспечения постоянства при введении доз субъекту, что в некоторых аспектах может оптимизировать эффективность, активность и/или безопасность вводимой композиции среди подвергнутых лечению субъектов. В некоторых аспектах сконструированные клетки, обогащенные в отношении популяций CD4+ и CD8+ Т-клеток в желательном отношении на выходе в созданной выходной композиции, могут увеличить эффективность, уменьшить или избежать нежелательных эффектов. В некоторых аспектах выделение или обогащение увеличивают способность клеток, в конечном итоге вводимых субъекту, сохраняться, размножаться, становиться активированными и/или приживаться in vivo или при введении субъекту. В некоторых аспектах оно улучшает или увеличивает одну или более эффекторных функций или фенотипов активированных клеток. Такие результаты могут быть достигнуты даже там, где среди исходных образцов клеток для клеточной инженерии существует разница в доноре.
В некоторых вариантах осуществления предоставленные здесь способы позволяют получать терапевтические клеточные композиции сконструированных клеток, характеризующиеся желательным отношением на выходе в выходной композиции, не требуя отдельной обработки и/или введения сконструированных CD4+ и CD8+ T-клеток. Таким образом, предоставленные способы обеспечивают более хорошо налаженные и/или контролируемые способы приготовления композиции с или с близким к желательному отношением на выходе популяции сконструированных CD4+ Т-клеток к популяции CD8+ Т-клеток. В конкретных аспектах, после получения входной композиции, характеризующейся желательным отношением подобных наивным CD4 клеток к CD8 клеткам, как описано, предоставленные способы могут использоваться в процессе получения клеток, в котором CD4+ и CD8+ T-клетки обрабатываются, например, активируются, стимулируются, размножаются и/или трансдуцируются, вместе в одном поточном процессе. Таким образом, в некоторых аспектах способы позволяют вводить генно-инженерный рецептор антигена для использования в адоптивной клеточной терапии, причем популяции клеток выделяют, инкубируют и/или конструируют вместе, и способ сопровождается увеличением эффективности и/или уменьшением сложности, времени, стоимости и/или использования средств по сравнению со способом, в котором популяции изолируются, инкубируются и/или конструируются по-отдельности.
Также предоставляются клетки и композиции, полученные этими способами, включая фармацевтические композиции и препараты, а также наборы, системы и устройства для осуществления способов. Также предоставляются способы применения клеток и композиций, полученных этими способами, включая терапевтические способы, такие как способы адоптивной клеточной терапии, и фармацевтические композиции для введения субъектам.
Все публикации, в том числе патентные документы, научные статьи и базы данных, упомянутые в этой заявке, включены посредством ссылки во всей их полноте для всех целей в той же степени, как если бы каждая отдельная публикация была отдельно включена посредством ссылки. Если приведенное здесь определение противоречит или иным образом не согласуется с определением, приведенным в патентах, заявках, опубликованных заявках и других публикациях, которые включены сюда посредством ссылки, приведенное здесь определение имеет преимущественную силу над определением, которое включено сюда посредством ссылки.
Используемые здесь заголовки разделов предназначены только для организационных целей и не должны рассматриваться как ограничивающие описываемый объект изобретения.
I. Способы получение сконструированных клеток с контролируемым отношением CD4+ к CD8+ Т-клеткам или их конкретных подтипов
Здесь предоставляются способы получения композиции клеток, например входной композиции клеток, для использования в генной инженерии клеток, которые экспрессируют рекомбинантный рецептор. В некоторых вариантах осуществления входная композиция клеток содержит CD4+ T-клетки и CD8+ T-клетки. В некоторых вариантах осуществления входная композиция клеток содержит один или более подтипов или популяций CD4+ и/или CD8+ Т-клеток. В некоторых вариантах осуществления один или более подтипов или популяций представляют собой наивные и/или подобные наивным клетки. В конкретных вариантах осуществления входная композиция клеток содержит CD4+ T-клетки, и, по крайней мере, часть CD4+ T-клеток представляет собой подобные наивным CD4 клетки. В некоторых вариантах осуществления входная композиция клеток содержит CD8+ T-клетки, и, по крайней мере, часть CD8+ T-клеток представляет собой наивные клетки. В конкретных вариантах осуществления входная композиция клеток характеризуется и/или имеет фиксированное, предпочтительное, целевое, определенное и/или контролируемое отношение подобных наивным CD4+ Т-клеток к подобным наивным CD8+ Т-клеткам.
В некоторых вариантах осуществления способы включают одну или более стадий смешивания или объединения клеток или композиций клеток для создания или получения входной композиции клеток. В некоторых вариантах осуществления клетки или композиции клеток были отобраны и/или выделены из образца. В некоторых вариантах осуществления клетки входной композиции клеток были отобраны и/или выделены из образца. В некоторых вариантах осуществления CD4+ T-клетки и/или композиция CD4+ T-клеток отбираются или выделяются из образца. В некоторых вариантах осуществления образец представляет собой биологический образец, такой как образец крови, образец для афереза и/или образец для лейкафереза. В некоторых вариантах осуществления образец взят от субъекта, например человека. В конкретных вариантах осуществления композиция CD4+ T-клеток и композиция CD8+ T-клеток выделяются и/или отбираются из одного и того же образца. В некоторых вариантах осуществления композиция CD4+ T-клеток и композиция CD8+ T-клеток выделяются и/или отбираются из образцов, взятых или полученных от одного и того же субъекта.
В некоторых вариантах осуществления создание или получение входной композиции клеток включает одну или более стадий оценки, характеристики и/или идентификации клеток. В конкретных вариантах осуществления клетки оценивают, характеризуют и/или идентифицируют в композиции CD4+ T-клеток. В некоторых вариантах осуществления клетки оценивают, характеризуют и/или идентифицируют в композиции CD8+ T-клеток. В некоторых вариантах осуществления клетки оценивают на наличие клеток, которые являются позитивными по маркеру, который указывает и/или связан с наивным состоянием Т-клеток. В некоторых вариантах осуществления клетки оценивают на наличие клеток, которые являются негативными по маркеру, который указывает и/или связан с наивным состоянием Т-клеток. В конкретных вариантах осуществления клетки из композиций CD4+ и CD8+ T-клеток, таких как композиции клеток, выделенных из биологического образца от субъекта, оценивают, характеризуют и/или идентифицируют для определения количества, уровня, доли и/или процента клеток, которые являются позитивными по одному или более маркеров, связанных с наивным состоянием, и/или являются негативными по одному или более маркеров, связанных с состоянием, которое не является наивным состоянием. В некоторых вариантах осуществления клетки из композиций CD4+ и CD8+ Т-клеток, таких как композиции клеток, выделенных из биологического образца от субъекта, оценивают, характеризуют и/или идентифицируют для определения количества, уровня, доли и/или процента клеток, которые являются клетками, подобными наивным.
В некоторых вариантах осуществления способы включают одну или более стадий смешивания или объединения композиции клеток, содержащей CD4+ T-клетки, с композицией клеток, содержащей CD8+ T-клетки, для создания или получения композиции клеток, например входной композиции клеток, с определенным отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам. В некоторых вариантах осуществления создание или получение входной композиции клеток включает одну или более стадий: (i) выделения или отбора композиции CD4+ T-клеток и/или композиции CD8+ T-клеток из образца, например биологического образца; (ii) оценки, характеристики и/или определении количества, уровня, доли и/или процента клеток, которые являются позитивными по одному или более маркеров, связанных с наивным состоянием, и/или являются негативными по одному или более маркеров, связанных с состоянием, которое не является наивным состоянием, в композиции CD4+ и/или CD8+ T-клеток; и/или (iii) смешивания или объединения клеток композиции CD4+ T-клеток с клетками композиции CD8+ T-клеток при определенном, фиксированном и/или предпочтительном отношении подобных наивным CD4+ T-клеток к подобным наивным CD8+ Т-клеткам. В конкретных вариантах осуществления отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам во входной композиции клеток отличается от отношения, которое присутствует в образце.
В конкретных вариантах осуществления содержание, состав и/или структура входной композиции клеток коррелирует, контролирует, соответствует и/или связано с содержанием, составом и/или структурой выходной композиции клеток. В некоторых вариантах осуществления количество, доля, процент, количество, количество на объем, количество на вес и/или соотношение наивных и/или подобных наивным клеток, например подобных наивным T-клеток, во входной композиции клеток коррелирует, контролирует, соответствует и/или связано с содержанием, составом и/или структурой выходной композиции клеток. В конкретных вариантах осуществления количество, доля, количество, количество на объем, количество на вес и/или соотношение подобных наивным CD4+ T-клеток и/или подобных наивным CD8+ T-клеток во входной композиции клеток коррелирует, контролирует, соответствует и/или связано с содержанием, составом и/или структурой выходной композиции клеток.
В некоторых вариантах осуществления способы включают одну или более стадий генной инженерии клеток входной композиции. В некоторых вариантах осуществления генная инженерия включает одну или более стадий инкубации клеток входной композиции клеток в условиях, которые активируют и/или стимулируют клетки, доставки гена, например рекомбинантного и/или гетерологичного гена, в клетки, размножения клеток путем инкубации клеток в активирующих или стимулирующих условиях, сбора клеток и/или хранения клеток при замораживании, например криоконсервации. В некоторых вариантах осуществления одна или более стадий генной инженерии создает выходную композицию клеток, содержащую сконструированные клетки. В некоторых вариантах осуществления сконструированные клетки выходной композиции характеризуются фиксированным, определенным и/или целевым отношением CD4+ к CD8+ клеткам.
В некоторых вариантах осуществления предоставленные здесь способы включают одну или более стадий для создания сконструированных клеток, таких как клетки, экспрессирующие рекомбинантный рецептор, которые характеризуются определенным отношением CD4+ к CD8+ T-клеткам. В некоторых вариантах осуществления предоставленные здесь способы включают одну или более стадий для генной инженерии клеток из исходной и/или входной композиции клеток для получения результирующей и/или выходной композиции клеток, характеризующейся определенным отношением генно-инженерных CD4+ к CD8+ T-клеткам. В конкретных вариантах осуществления генная инженерия представляет собой или включает трансфекцию или трансдукцию клеток из входной композиции клеток для введения агента, включающего нуклеиновую кислоту, в клетки входной композиции клеток. В некоторых вариантах осуществления нуклеиновая кислота кодирует рекомбинантный рецептор, например химерный рецептор антигена (CAR). В некоторых вариантах осуществления создание выходной композиции клеток включает одну или более стадий активации или стимуляции клеток входной композиции клеток; генной инженерии, трансдукции или трансфекции клеток из входной композиции клеток; и/или размножения трансфицированных клеток; тем самым получая в результате выходную композицию клеток, характеризующуюся определенным отношением генно-инженерных CD4+ к CD8+ Т-клеткам, таким как отношение 1:1.
А. Клетки и получение входной композиций клеток
В некоторых вариантах осуществления предоставленные здесь способы включают одну или более стадий приготовления клеток для генной инженерии. В некоторых вариантах осуществления одна или более стадий включают выделение клеток из биологического образца для приготовления композиции клеток, которая должна быть генетически модифицирована, например, входной композиции клеток. В некоторых вариантах осуществления приготовления входной композиции клеток включает одну или более стадий выделения двух или более типов клеток и/или композиций определенного типа клеток или подтипа клеток и смешивания или объединения типов клеток и/или композиций клеток определенных типов в одну входную композицию клеток. В конкретных вариантах осуществления композиции клеток определенных типов оценивают для определения наличия, количества и/или соотношений других подтипов в композициях. В некоторых вариантах осуществления композиции клеток определенных типов смешивают или объединяют для получения входных композиций клеток с фиксированными или определенными соотношениями типов или подтипов клеток. В некоторых вариантах осуществления типы клеток и/или подтипы клеток коррелируют, контролируют, соответствуют и/или связаны с содержанием, составом и/или структурой выходной композиции клеток.
В некоторых вариантах осуществления приготовление входной композиции клеток включает одну или более стадий выделения композиций, состоящих из или включающих CD4+ Т-клетки, выделения композиций, состоящих из или включающих CD8+ T-клетки, и смешивания или объединения композиций, CD4+ и CD8+ T-клеток определенных типов в одну входную композицию клеток. В некоторых вариантах осуществления приготовление входной композиции клеток включает одну или более стадий оценки, определения и/или количественного определения доли или количества подтипа CD4+ и/или CD8+ T-клеток клеточных композиций. В конкретных вариантах осуществления подтип CD4+ и/или CD8+ T-клеток представляет собой или включает наивные и/или подобные наивным CD4+ и/или CD8+ T-клетки. В некоторых вариантах осуществления доли или количества подобных наивным клеток во входной композиции клеток коррелируют, контролируют, соответствуют и/или связаны с содержанием, составом и/или структурой выходной композиции клеток.
В некоторых вариантах осуществления клетки, например CD4+ и/или CD8+ Т-клетки, которые выделены из образца, представляют собой эукариотические клетки, такие как клетки млекопитающих, а в некоторых вариантах осуществления представляют собой клетки человека. В некоторых вариантах осуществления клетки происходят из крови, костного мозга, лимфы или лимфоидных органов субъекта и/или являются клетками иммунной системы, такими как клетки врожденного или приобретенного иммунитета. В некоторых вариантах осуществления клетки представляют собой лимфоциты. В некоторых вариантах осуществления лимфоциты представляют собой Т-лимфоциты или Т-клетки. В некоторых вариантах осуществления клетки включают CD4+ T-клетки и CD8+ T-клетки.
В некоторых вариантах осуществления композиции Т-клеток, например композиции CD4+ Т-клеток и/или композиции CD8+ Т-клеток, содержат подтипы клеток, которые дополнительно классифицируют по функции, состоянию активации, зрелости, потенциалу для дифференцировки, размножению, маркеру или профилю секреции цитокинов и/или степени дифференцировки. Например, в некоторых вариантах осуществления клетки представляют собой или включают наивные и/или подобные наивным CD4+ и/или CD8+ T-клетки. Применительно к подвергаемому лечению субъекту клетки могут быть аллогенными и/или аутологичными. Среди способов включены имеющиеся в наличии способы. В некоторых вариантах осуществления способы включают выделение клеток от субъекта, подготовку, обработку, культивирование и/или конструирование клеток и введение клеток снова тому же субъекту, до или после криоконсервации.
В некоторых вариантах осуществления получение сконструированных клеток включает одну или несколько стадий культивирования и/или приготовления. Клетки для использования во входной композиции клеток, например композиции клеток, которые должны быть генетически модифицированы, например, для экспрессии рекомбинантного рецептора, такого как CAR, могут содержать клетки, которые были выделены из образца, такого как биологический образец, например образец, полученный от субъекта или происходящий от него. В некоторых вариантах осуществления субъект, от которого выделена клетка, является субъектом, имеющим заболевание или состояние или нуждающимся в клеточной терапии, или которому будет назначаться клеточная терапия. Субъектом в некоторых вариантах осуществления является человек, нуждающийся в конкретном терапевтическом вмешательстве, таком как адоптивная клеточная терапия, для которой клетки выделяют, обрабатывают и/или конструируют.
В некоторых аспектах образец, например биологический образец, из которого происходят или выделены клетки, представляет собой кровь или образец, полученный из крови, или полученный из продукта афереза или лейкафереза. Приводимые в качестве примера образцы включают цельную кровь, мононуклеарные клетки периферической крови (РВМС), лейкоциты, костный мозг, тимус и/или полученные из них клетки. В некоторых вариантах осуществления клетки получают, выделяют и/или отбирают из образцов или биологических образцов, которые могут включать образец цельной крови, образец лейкоцитарной пленки, образец мононуклеарных клеток периферической крови (РВМС), образец нефракционированных Т-клеток, образец лимфоцитов, образец лейкоцитов, продукт афереза или продукт лейкафереза. В связи с клеточной терапией, например адоптивной клеточной терапией, образцы включают образцы из аутологичных и аллогенных источников.
В некоторых вариантах осуществления клетки происходят из клеточных линий, например Т-клеточных линий. В некоторых вариантах осуществления клетки получают из ксеногенного источника, например, от мыши, крысы, не являющегося человеком примата и свиньи.
В некоторых вариантах осуществления выделение клеток или композиций клеток, например композиций T-лимфоцитов или CD4+ T-клеток и/или композиций CD8+ T-клеток, включает одну или более стадий приготовления и/или разделения клеток не на основе сродства. В некоторых примерах клетки промывают, центрифугируют и/или инкубируют в присутствии одного или более реагентов, например, для удаления нежелательных компонентов, обогащения в отношении компонентов, лизирования или удаления клеток, чувствительных к конкретным реагентам. В некоторых примерах клетки разделяют на основе одного или более свойств, таких как плотность, адгезивные свойства, размер, чувствительность и/или устойчивость к конкретным компонентам.
В некоторых примерах клетки из циркулирующей крови субъекта получают, например, с помощью афереза или лейкафереза. Образцы, в некоторых аспектах, содержат лимфоциты, включая Т-клетки, моноциты, гранулоциты, В-клетки, другие ядросодержащие лейкоциты, эритроциты и/или тромбоциты, и в некоторых аспектах содержат клетки, отличные от эритроцитов и тромбоцитов.
В некоторых вариантах осуществления клетки крови, собранные у субъекта, промывают, например, для удаления фракции плазмы и помещения клеток в соответствующий буфер или среду для последующих стадий обработки. В некоторых вариантах осуществления клетки промывают фосфатно-солевым буфером (PBS). В некоторых вариантах осуществления в растворе для промывки отсутствует кальций, и/или магний, и/или многие или все двухвалентные катионы. В некоторых аспектах стадия промывки выполняется с помощью полуавтоматической проточной центрифуги (например, клеточного процессора Cobe 2991, Baxter) в соответствии с инструкциями производителя. В некоторых аспектах стадия промывки выполняется посредством тангенциальной фильтрации (TFF) в соответствии с инструкциями производителя. В некоторых вариантах осуществления клетки ресуспендируют после промывки в ряде биосовместимых буферов, таких как, например, PBS, не содержащий Ca++/Mg++. В некоторых вариантах осуществления компоненты образца клеток крови удаляют, и клетки непосредственно ресуспендируют в культуральной среде.
В некоторых вариантах осуществления способы включают способы разделения клеток на основе плотности, такие как получение лейкоцитов из периферической крови путем лизиса эритроцитов и центрифугирования в градиенте плотности перколла или фиколла.
В некоторых вариантах осуществления способы выделения включают разделение различных типов клеток на основе экспрессии или присутствия в клетке одной или более специфических молекул, таких как маркеры поверхности, например поверхностные белки, внутриклеточные маркеры или нуклеиновая кислота. В некоторых вариантах осуществления может использоваться любой известный способ разделения на основе таких маркеров. В некоторых вариантах осуществления разделение представляет собой разделение на основе аффинности или иммуноаффинности. Например, выделение в некоторых аспектах включает разделение клеток и популяций клеток на основе экспрессии или уровня экспрессии в клетках одного или более маркеров, обычно маркеров клеточной поверхности, например, путем инкубации с антителом или партнером по связыванию, который специфически связывается с такими маркерами, за которым обычно следуют стадии промывки и отделения клеток, связавших антитело или партнер по связыванию, от тех клеток, не связавших антител или партнер по связыванию.
Такие стадии разделения могут быть основаны на положительной селекции, в случае которой клетки, связавшие реагенты, сохраняются для дальнейшего использования, и/или отрицательной селекции, в случае которой сохраняются клетки, не связавшие антитело или партнер по связыванию. В некоторых примерах обе фракции сохраняются для дальнейшего использования. В некоторых аспектах отрицательная селекция может быть особенно полезной, когда нет доступных антител, которые бы конкретно идентифицировали тип клеток в гетерогенной популяции, так что разделение лучше всего проводить на основе маркеров, экспрессируемых клетками, отличными от желательной популяции.
Разделение не должно приводить к 100% обогащению или удалению определенной популяции клеток или клеток, экспрессирующих конкретный маркер. Например, положительная селекция клеток или обогащение клетками определенного типа, таких как клетки, экспрессирующие маркер, относится к увеличению количества или процентного содержания таких клеток, но необязательно приводит к полному отсутствию клеток, не экспрессирующих маркер. Аналогично, отрицательная селекция, удаление или истощение клеток определенного типа, таких как клетки, экспрессирующие маркер, относится к уменьшению количества или процентного содержания таких клеток, но не должно приводить к полному удалению всех таких клеток.
В некоторых примерах выполняется множество раундов стадий разделения, причем полученная на одной стадии медом положительной или отрицательной селекции фракция подвергается другой стадии разделения, такой как последующая положительная или отрицательная селекция. В некоторых примерах одна стадия разделения может истощать клетки, экспрессирующие множество маркеров одновременно, например, при инкубации клеток с множеством антител или партнеров по связыванию, каждое из которых специфично для маркера, на который нацеливаются для отрицательной селекции. Аналогичным образом, множество типов клеток может быть одновременно получено методом положительной селекции путем инкубации клеток с множеством антител или партнеров по связыванию с ними, экспрессируемых на различных типах клеток.
Например, в некоторых аспектах конкретные субпопуляции или подтипы Т-клеток, такие как CD4+ Т-клетки и/или CD8+ Т-клетки, выделяют методами положительной или отрицательно селекции. В некоторых вариантах осуществления CD4+ T-клетки и/или клеточная композиция, состоящая или включающая CD4+ T-клетки, выделяются методами положительной или отрицательной селекции. В конкретных вариантах осуществления CD8+ T-клетки и/или клеточная композиция, состоящая или включающая CD8+ T-клетки, выделяются методами положительной или отрицательной селекции. В конкретных вариантах осуществления композицию CD4+ T-клеток и/или композицию CD8+ T-клеток выделяются методами положительной или отрицательной селекции.
В некоторых вариантах осуществления выделение осуществляют путем обогащения в отношении определенной популяции клеток путем положительной селекции или истощения определенной популяции клеток путем отрицательной селекции. В некоторых вариантах осуществления положительная или отрицательная селекция осуществляется путем инкубации клеток с одним или более антител или других связывающих агентов, которые специфически связываются с одним или более поверхностных маркеров, экспрессируемых (маркер+ или маркер+) или экспрессируемых на относительно более высоком уровне (маркервысокий уровень) на полученных методом положительной или отрицательной селекции клетках, соответственно.
В некоторых вариантах осуществления Т-клетки выделяют из образца РВМС путем отрицательной селекции с помощью маркеров, экспрессируемых на не-Т-клетках, таких как В-клетки, моноциты или другие лейкоциты, такие как CD14. В некоторых аспектах стадия селекции CD4+ или CD8+ используется для разделения CD4+ хелперов и CD8+ цитотоксических Т-клеток. Такие композиции CD4+ и CD8+ клеток могут содержать клетки, которые могут быть дополнительно разделены или отсортированы на субпопуляции на основе положительной или отрицательной экспрессии маркеров и/или относительного уровня экспрессии маркеров. Такие подтипы могут включать наивные, подобные наивным и/или не являющиеся наивными подтипы или субпопуляции.
В некоторых вариантах осуществления CD4+ T-клетки, например CD4+ T-хелперные клетки, подразделяют на наивные и/или подобные наивным, и не являющиеся наивными и/или подобными наивным клетки путем идентификации популяций клеток, которые имеют антигены клеточной поверхности. В конкретных вариантах осуществления CD8+ T-клетки, например CD8+ T-хелперные клетки, подразделяют на наивные и/или подобные наивным, и не являющиеся наивными и/или подобными наивным клетки путем идентификации популяций клеток, которые имеют антигены клеточной поверхности.
В некоторых вариантах осуществления Т-лимфоциты отделяют или выделяют с использованием иммуномагнитных (или аффинно-магнитных) методов разделения. В конкретных вариантах осуществления CD4+ T-клетки и/или композиции CD4+ T-клеток отделяют или выделяют с использованием иммуномагнитных метолов разделения. В некоторых вариантах осуществления CD8+ T-клетки и/или композиции CD8+ T-клеток отделяют или выделяют, используя иммуномагнитные методы разделения. Разделение и выделение с использованием иммуномагнитных (или аффинно-магнитных) методов разделения рассматриваются в Methods in Molecular Medicine, vol. 58: Metastasis Research Protocols, Vol. 2: Cell Behavior In Vitro and In Vivo, p 17-25 Edited by: S. A. Brooks and U. Schumacher © Humana Press Inc., Totowa, NJ.
В некоторых аспектах образец или композицию клеток, подлежащую разделению, инкубируют с маленьким, намагничиваемым или магнитно-управляемым материалом, таким как магнитно-управляемые частицы или микрочастицы, такие как парамагнитные шарики (например, такие как шарики Dynalbeads или MACS). Магнитно-управляемый материал, например частица, обычно прямо или косвенно связан с партнером по связыванию, например антителом, которое специфически связывается с молекулой, например маркером поверхности, присутствующим на клетке, клетках или популяции клеток, которые он желательно отделит, например, желательно отберет в результате отрицательной или положительной селекции.
В некоторых вариантах осуществления магнитная частица или шарик включает магнитно-управляемый материал, связанный с конкретным связывающим элементом, таким как антитело или другой партнер по связыванию. Существует много известных магнитно-управляемых материалов, используемых в магнитных методах разделения. Подходящие магнитные частицы включают те, которые описаны Molday, в патенте США с № 4452773 и в Европейском патенте EP 452342 B, которые включены сюда посредством ссылки. Коллоидные частицы, выдержанные по размеру, такие как описанные Owen в патенте США с № 4795698 и Liberti и др., в патенте США с № 5200084, являются другими примерами.
Как правило, инкубацию проводят в условиях, при которых антитела или партнеры по связыванию, или молекулы, такие как вторые антитела или другие реагенты, которые специфически связываются с такими антителами или партнерами по связыванию, которые присоединены к магнитной частице или шарику, специфически связываются с молекулами клеточной поверхности, если присутствуют на клетках в образце.
В некоторых аспектах образец помещают в магнитное поле, и те клетки, к которым прикреплены магнитоуправляемые или намагничиваемые частицы, будут притягиваться к магниту и отделяться от немеченых клеток. В случае положительной селекции сохраняются клетки, которые притягиваются к магниту; в случае отрицательной селекции сохраняются клетки, которые не притягиваются (клетки без метки). В некоторых аспектах сочетание положительной и отрицательной селекции выполняется во время одной и той же стадии селекции, когда положительные и отрицательные фракции сохраняются и дополнительно обрабатываются или подвергаются дополнительным стадиям разделения.
В некоторых вариантах осуществления магнитно-управляемые частицы покрыты первыми антителами или другими партнерами по связыванию, вторыми антителами, лектинами, ферментами или стрептавидином. В некоторых вариантах осуществления магнитные частицы прикрепляются к клеткам посредством покрытия первыми антителами, специфическими для одного или более маркеров. В некоторых вариантах осуществления клетки, а не шарики, метят первым антителом или партнером по связыванию, а затем добавляют магнитные частицы, покрытые специфическим для типа клеток вторым антителом или другим партнером по связыванию (например, стрептавидином). В некоторых вариантах осуществления магнитные частицы, покрытые стрептавидином, используются в сочетании с биотинилированными первыми или вторыми антителами.
В некоторых вариантах осуществления частицы, управляемые магнитным полем, оставляют прикрепленными к клеткам, которые должны быть впоследствии проинкубированы, прокультивированы и/или сконструированы; в некоторых аспектах частицы остаются прикрепленными к клеткам для введения пациенту. В некоторых вариантах осуществления намагничиваемые или магнитоуправляемые частицы удаляются из клеток. Способы удаления намагничиваемых частиц из клеток известны и включают, например, использование конкурирующих немеченых антител, и намагничиваемых частиц или антител, конъюгированных с расщепляемыми линкерами. В некоторых вариантах осуществления намагничиваемые частицы являются биоразлагаемыми.
В некоторых вариантах осуществления отбор на основе сродства осуществляется посредством магнитно-активируемой сортировки клеток (MACS) (Miltenyi Biotec, Auburn, CA). Системы магнитно-активируемой сортировки клеток (MACS) способны отбирать с высокой чистотой клетки с намагниченными частицами, прикрепленными к ним. В некоторых вариантах осуществления MACS работает в режиме, в котором нецелевые и целевые виды последовательно элюируются после приложения внешнего магнитного поля. Т.е. клетки, прикрепленные к намагниченным частицам, удерживаются на месте, в то время как неприкрепленные частицы элюируются. Затем, после завершения этой первой стадии элюирования, виды, которые были захвачены магнитным полем и не были элюированы, освобождаются каким-либо образом, так что их можно элюировать и выделить. В некоторых вариантах осуществления нецелевые клетки помечаются и истощаются из гетерогенной популяции клеток.
В некоторых вариантах осуществления выделение или разделение проводят с использованием системы, устройства или инструмента, которая выполняют одну или более стадий выделения, подготовки клеток, разделения, обработки, инкубации, культивирования и/или составления композиций, включенных в эти способы. В некоторых аспектах система используется для выполнения каждой из этих стадий в закрытой или стерильной среде, например, чтобы минимизировать ошибки, оперирование пользователем и/или загрязнение. В одном примере система представляет собой систему, описанную в международной заявке на патент, номер публикации WO2009/072003 или US 20110003380 A1.
В некоторых вариантах осуществления система или устройство выполняет одну или более, например, все стадии выделения, обработки, конструирования и составления композиции в интегрированной или автономной системе и/или автоматизированным или программируемым образом. В некоторых аспектах система или устройство включает компьютер и/или компьютерную программу, взаимодействующую с системой или устройством, которая позволяет пользователю программировать, контролировать, оценивать результат и/или регулировать различные аспекты стадий обработки, выделения, конструирования и составления композиции.
В некоторых аспектах разделение и/или другие стадии осуществляют с использованием системы CliniMACS (Miltenyi Biotec), например, для автоматического разделения клеток на уровне масштаба клинической деятельности в закрытой и стерильной системе. Составные части могут включать встроенный микрокомпьютер, блок магнитного разделения, перистальтический насос и различные запорные клапаны. В некоторых аспектах встроенный компьютер контролирует все составные части прибора и дает указание системе выполнять повторяющиеся процедуры в стандартизированной последовательности. В некоторых аспектах блок магнитного разделения включает передвижной постоянный магнит и держатель для разделительной колонки. Перистальтический насос контролирует скорость потока по всему комплекту трубок и вместе с запорными клапанами обеспечивает контролируемый поток буфера через систему и непрерывную суспензию клеток.
В некоторых аспектах система CliniMACS использует связанные с антителами намагничиваемые частицы, которые подают в стерильном непирогенном растворе. В некоторых вариантах осуществления после мечения клеток магнитными частицами клетки промывают для удаления избытка частиц. Затем мягкий резервуар для приготовления клеток соединяют с комплектом трубок, который, в свою очередь, соединяют с мягким резервуаром, содержащим буфер, и мягким резервуаром для сбора клеток. Комплект труб состоит из предварительно собранных стерильных трубок, включая предколонку и разделительную колонку, и предназначен только для одноразового использования. После запуска программы разделения система автоматически наносит образец клеток на разделительную колонку. Меченые клетки сохраняются в колонке, в то время как немеченые клетки удаляются с помощью ряда стадий промывки. В некоторых вариантах осуществления популяции клеток для использования с описанными здесь способами являются немечеными и не удерживаются в колонке. В некоторых вариантах осуществления популяции клеток для использования с описанными здесь способами являются мечеными и удерживаются в колонке. В некоторых вариантах осуществления популяции клеток для использования с описанными здесь способами элюируются из колонки после удаления магнитного поля и собираются в мягкий резервуар для сбора клеток.
В некоторых вариантах осуществления разделение и/или другие стадии проводят с использованием системы CliniMACS Prodigy (Miltenyi Biotec). В некоторых аспектах система CliniMACS Prodigy оснащена блоком обработки клеток, который позволяет автоматически промывать и фракционировать клетки с помощью центрифугирования. Система CliniMACS Prodigy может также включать встроенную камеру и программное обеспечение для распознавания изображений, которое определяет оптимальную конечную точку фракционирования клеток путем определения макроскопических слоев исходного клеточного продукта. Например, периферическая кровь автоматически разделяется на эритроциты, лейкоциты и слои плазмы. Система CliniMACS Prodigy также может включать встроенную камеру для культивирования клеток, которая выполняет протоколы культивирования клеток, такие как, например, дифференцировка и размножение клеток, загрузка антигенов и длительное культивирование клеток. Входные порты могут обеспечить стерильное удаление и пополнение среды, а клетки можно контролировать с помощью встроенного микроскопа. Смотрите, например, Klebanoff et al. (2012) J Immunother. 35(9):651–660, Terakura et al. (2012) Blood.1:72–82, и Wang et al. (2012) J Immunother. 35(9):689-701.
В некоторых вариантах описанная здесь осуществления популяция клеток собирается и обогащается (или истощается) с помощью проточной цитометрии, в случае которой клетки, окрашенные для выявления множества маркеров клеточной поверхности, переносятся в жидком потоке. В некоторых вариантах осуществления описанная здесь популяция клеток собирается и обогащается (или истощается) посредством сортировки в препаративном масштабе (FACS). В некоторых вариантах осуществления описанная здесь популяция клеток собирается и обогащается (или истощается) путем использования микросхем микроэлектромеханических систем (MEMS) в сочетании с системой обнаружения на основе FACS (смотрите, например, WO 2010/033140, Cho et al. (2010) Lab Chip 10, 1567-1573; и Godin et al. (2008) J Biophoton. 1(5):355–376). В обоих случаях клетки могут быть помечены множеством маркеров, что позволяет выделить четко определенные подмножества Т-клеток с высокой чистотой.
В некоторых вариантах осуществления антитела или партнеры по связыванию помечены одним или более обнаруживаемых маркеров для облегчения разделения в случае положительной и/или отрицательной селекции. Например, разделение может основываться на связывании с флуоресцентно меченными антителами. В некоторых примерах разделение клеток на основе связывания с антителами или другими партнерами по связывания, специфическими для одного или более маркеров клеточной поверхности, осуществляется в жидком потоке, например, с помощью сортировки клеток с возбуждением флуоресценции (FACS), в том числе в препаративном масштабе (FACS), и/или микросхем микроэлектромеханических систем (MEMS), например, в сочетании с проточной цитометрической системой обнаружения. Такие способы допускают положительную и отрицательную селекцию на основе множества маркеров одновременно.
Входные композиции клеток
В некоторых вариантах осуществления здесь предоставляются способы получения и/или приготовления входной композиции клеток. В некоторых вариантах осуществления входная композиция клеток представляет собой композицию клеток для использования в генной инженерии, например, клеток, которые будут генетически модифицированы с помощью нуклеиновой кислоты, кодирующей рекомбинантный белок, такой как рекомбинантный рецептор, например CAR, и/или которые будут подвергаться процессу для получения генно-инженерных клеток, экспрессирующих рекомбинантный белок, такой как рекомбинантный рецептор, например CAR. В некоторых вариантах осуществления клетки входной композиции будут обрабатываться, приводиться в контакт и/или инкубироваться с нуклеиновой кислотой, которая кодирует рекомбинантный рецептор. В некоторых вариантах осуществления входная композиция клеток содержит CD4+ T-клетки и CD8+ T-клетки. В конкретных вариантах осуществления входная композиция клеток содержит CD4+ T-клетки и CD8+ T-клетки, которые характеризуются определенным желательным, фиксированным и/или контролируемым отношением CD4+ к CD8+ T-клеткам, которые являются наивными и/или подобными наивным T-клетками.
В некоторых вариантах осуществления желательное, фиксированное и/или контролируемое отношение CD4+ к CD8+ T-клеткам, которые являются наивными и/или подобными наивным T-клетками, представляет собой отношение или количество клеток, в котором два типа клеток или выделенных популяций клеток включены во входную композицию клеток, предназначенную для получения выходной композиции клеток с желательным, определенным и/или контролируемым отношением сконструированных CD4+ к CD8+ T-клеткам, или в пределах допустимого уровня погрешностей или их разницы, по завершении стадии инкубации и/или конструирования или других стадий обработки и/или после оттаивания и/или непосредственно перед введением субъекту.
В некоторых вариантах осуществления входная композиция клеток характеризуется отношением, например определенным, контролируемым и/или фиксированным отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам. В конкретных вариантах осуществления отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам находится между 10:1 и 0,05:1, 8:1 и 0,1:1, 5:1 и 0,2:1, 2,5:1 и 0,25:1, 2,2:1 и 0,8:1, 2:1 и 0,5:1 или 1,5:1 и 1:1, включительно. В конкретных вариантах осуществления отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам находится между 2:1 и 0,8:1, 1,6:1 и 0,8:1, 1,4:1 и 0,8:1, 1,2:1 и 0,8:1 или 1,2:1 и 0,8:1, включительно. В некоторых вариантах осуществления отношение находится между 2,2:1 и 0,8:1, включительно. В некоторых вариантах осуществления отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам составляет или приблизительно составляет 2,2:1, 2,1:1, 2,0:1, 1,9:1, 1,8:1, 1,7:1, 1,6:1, 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1, 1,0:1, 0,9:1 или 0,8:1. В некоторых вариантах осуществления отношение составляет или приблизительно составляет 1,1:1.
В конкретных вариантах осуществления входная композиция клеток содержит количество, составляющее или приблизительно составляющее 1x106, 5x106, 1x107, 5x107, 1,0x108, 1,1x108, 1,2x108, 1,3x108, 1,4x108, 1,5x108, 1,6x108, 1,7x108, 1,8x108, 1,9x108, 2,0x108, 2,1x108, 2,2x108, 2,3x108, 2,4x108, 2,5x108, 2,6x108, 2,7x108, 2,8x108, 2,9x108, 3,0x108, 3,5x108, 4,0x108, 4,5x108, 5x108, 5x108 или 1x109 всех клеток или всех жизнеспособных клеток. В некоторых вариантах осуществления входная композиция клеток содержит количество, составляющее или приблизительно составляющее 1x106, 5x106, 1x107, 5x107, 1,0x108, 1,1x108, 1,2x108, 1,3x108, 1,4x108, 1,5x108, 1,6x108, 1,7x108, 1,8x108, 1,9x108, 2,0x108, 2,1x108, 2,2x108, 2,3x108, 2,4x108, 2,5x108, 2,6x108, 2,7x108, 2,8x108, 2,9x108, 3,0x108, 3,5x108, 4,0x108, 4,5x108, 5x108, 5x108 или 1x109 клеток, которые экспрессируют CD4 или CD8. В некоторых вариантах осуществления входная композиция клеток содержит количество, составляющее или приблизительно составляющее 1x106, 5x106, 1x107, 5x107, 1,0x108, 1,1x108, 1,2x108, 1,3x108, 1,4x108, 1,5x108, 1,6x108, 1,7x108, 1,8x108, 1,9x108, 2,0x108, 2,1x108, 2,2x108, 2,3x108, 2,4x108, 2,5x108, 2,6x108, 2,7x108, 2,8x108, 2,9x108, 3,0x108, 3,5x108, 4,0x108, 4,5x108, 5x108, 5x108 или 1x109 CD4+ Т-клеток, подобных наивным, и CD8+ Т-клеток, подобных наивным.
В конкретных вариантах осуществления входная композиция клеток содержит от 1х106 до 1х1010, от 1х107 до 1х109, от 5х107 и 5х108 или от 1х108 до 3х108 всех клеток или всех жизнеспособных клеток. В некоторых вариантах осуществления входная композиция клеток содержит количество, составляющее или приблизительно составляющее от 1х106 до 1х1010, от 1х107 до 1х109, от 5х107 до 5х108 или от 1х108 до 3х108 клеток, которые экспрессируют CD4 или CD8. В некоторых вариантах осуществления входная композиция клеток содержит количество, составляющее или приблизительно составляющее от 1х106 до 1х1010, от 1х107 до 1х109, от 5х107 до 5х108 или от 1х108 до 3х108 CD4+ Т-клеток, подобных наивным, и CD8+ Т-клеток, подобных наивным.
В некоторых вариантах осуществления входная композиция клеток имеет или содержит по крайней мере 1%, по крайней мере 5%, по крайней мере 10%, по крайней мере 20%, по крайней мере 30%, по крайней мере 40%, по крайней мере 50%, по крайней мере 60%, по крайней мере 70%, по крайней мере 75%, по крайней мере 80%, по крайней мере 85%, по крайней мере 90%, по крайней мере 95%, по крайней мере 96%, по крайней мере 97%, по крайней мере 98%, по крайней мере 99%, по крайней мере 99,5%, по крайней мере 99,9% или 100% или приблизительно 100% клеток, подобных наивным. В конкретных вариантах осуществления входная композиция клеток содержит или включает не более 100%, не более 99%, не более 98%, не более 97%, не более 96%, не более 95%, не более 90% или не более 85% клеток, подобных наивным.
В конкретных вариантах осуществления предоставленные здесь способы включают одну или более стадий получения, создания и/или приготовления входной композиции клеток. В некоторых вариантах осуществления получение, создание и/или приготовление входной композиции клеток включает одну или более стадий смешивания или объединения клеток композиции CD4+ T-клеток с клетками композиции CD8+ T-клеток.
В некоторых вариантах осуществления клетки, например CD4+ T-клетки и CD8+ T-клетки, входной композиции были выделены и/или отобраны из образца, например биологического образца. В некоторых вариантах осуществления источником клеток входной композиции являются композиции клеток, например композиции CD4+ Т-клеток и композиции CD8+ Т-клеток, которые были выделены и/или отобраны, например, по отдельности выделены или отобраны, из образца. В конкретных вариантах осуществления композицию CD4+ T-клеток и композицию CD8+ T-клеток выделяют и/или отбирают, например, по отдельности выделяют и/или отбирают, из образца, например биологического образца. В некоторых вариантах осуществления композицию CD4+ T-клеток и композиция CD8+ T-клеток выделяют и/или отбирают из одного и того же образца. В некоторых вариантах осуществления композицию CD4+ T-клеток и композицию CD8+ T-клеток выделяют и/или отбирают из образцов, взятых или полученных от одного и того же субъекта.
В конкретных вариантах осуществления композиция CD4+ Т-клеток содержит или включает по крайней мере 60%, по крайней мере 75%, по крайней мере 80%, по крайней мере 85%, по крайней мере 90%, по крайней мере 95%, по крайней мере 96% , по крайней мере 97%, по крайней мере 98%, по крайней мере 99%, по крайней мере 99,5%, по крайней мере 99,9%, или 100%, или приблизительно 100% CD4+ Т-клеток. В некоторых вариантах осуществления композиция CD4+ Т-клеток содержит или включает не более 100%, не более 99%, не более 98%, не более 97%, не более 96%, не более 95%, не более 90% или не более 85% CD4+ Т-клеток.
В некоторых вариантах осуществления композиция CD8+ Т-клеток содержит или включает по крайней мере 60%, по крайней мере 75%, по крайней мере 80%, по крайней мере 85%, по крайней мере 90%, по крайней мере 95%, по крайней мере 96%, по крайней мере 97%, по крайней мере 98%, по крайней мере 99%, по крайней мере 99,5%, по крайней мере 99,9% или 100%, или приблизительно 100% CD8+ Т-клеток. В конкретных вариантах композиция CD8+ Т-клеток содержит или включает не более 100%, не более 99%, не более 98%, не более 97%, не более 96%, не более 95%, не более 90% или не более 85% CD8+ Т-клеток.
В некоторых вариантах осуществления получение, создание и/или приготовление входной композиции клеток включает одну или более стадий измерения, определения и/или количественного определения числа, доли, количества, количества на объем, количества на вес и/или процентного содержания жизнеспособных CD4+ T-клеток и/или жизнеспособных CD8+ T-клеток, которые присутствуют в композиции CD4+ T-клеток и/или в композиции CD8+ T-клеток, например, до объединения или смешивания клеток клеточных композиций. В конкретных вариантах осуществления получение, создание и/или приготовление входной композиции клеток включает одну или более стадий измерения, определения и/или количественного определения числа, доли, количества, количества на объем, количества на вес и/или процентного содержания CD4+ T-клеток, подобных наивным, и/или CD8+ T-клеток, подобных наивным, которые присутствуют в композиции CD4+ T-клеток и/или в композиции CD8+ T-клеток. В некоторых вариантах осуществления подобные наивным CD4+ T-клетки и/или подобные наивным CD8+ T-клетки являются жизнеспособными подобными наивным клетками.
В некоторых вариантах осуществления получение, создание и/или приготовление входной композиции клеток включает одну или более стадий измерения, определения и/или количественного определения числа, доли, количества, количества на объем, количества на вес и/или процентного содержания жизнеспособных CD4+ Т-клеток и/или жизнеспособных CD8+ Т-клеток, которые присутствуют в образце, например биологическом образце. В конкретных вариантах осуществления получение, создание и/или приготовление входной композиции клеток включает одну или более стадий измерения, определения и/или количественного определения числа, доли, количества, количества на объем, количества на вес и/или процентного содержания подобных наивным CD4+ T-клеток и/или подобных наивным CD8+ T-клеток, которые присутствуют в образце. В некоторых вариантах осуществления подобные наивным CD4+ Т-клетки и/или подобные наивным CD8+ T-клетки являются жизнеспособными клетками, подобными наивным.
В некоторых вариантах осуществления клетки входной композиции выделяют и/или отбирают из образца, например биологического образца. В конкретных вариантах осуществления доли клеток, подобных наивным, в образце, например доля CD4+ и CD8+ T-клеток, подобных наивным, известны или были определены, измерены или оценены. В некоторых вариантах осуществления клетки из образца выделяют и/или отбирают для непосредственного получения композиции клеток, например входной композиции клеток, с определенным, фиксированным или контролируемым отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ Т-клеткам. В некоторых вариантах осуществления клетки выделяют и/или отбирают с помощью иммуноаффинного отбора шариков. В некоторых вариантах осуществления клетки выделяют и/или отбирают с помощью аффинных колонок. В конкретных вариантах осуществления клетки из образца выделяют или отбирают в соответствии с любым из способов, описанных в WO 2015/164675, для получения композиции клеток с определенным, контролируемым и/или фиксированным отношением подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам.
В некоторых вариантах осуществления входная композиция клеток содержит клетки, которые были непосредственно выделены и/или отобраны из образца путем первого и второго выделения или отбора. В некоторых вариантах осуществления входную композицию получают путем выполнения первого и второго отбора для выделения количества, числа или концентрации CD4+ T-клеток и CD8+ T-клеток, достаточных для получения определенного, фиксированного и/или контролируемого отношения подобных наивным CD4+ Т-клеток к подобным наивным CD8+ T-клеткам.
В некоторых вариантах осуществления клетки из образца непосредственно выделяют, отбирают и/или обогащают для получения входной композиции клеток, обогащенной CD4+ клетками и CD8+ клетками. В некоторых вариантах осуществления количество, число, процент, количество на объем и/или количество на вес CD4+ клеток, подобных наивным, и CD8+ клеток, подобных наивным, были измерены, оценены и/или определены в образце, и CD4+ и CD8+ клетки выделяются, отбираются и/или обогащаются в достаточных количествах для успешного получения входной композиции клеток с определенным, фиксированным или контролируемым отношением подобных наивным CD4+ Т-клеток к подобным наивным CD8+ Т-клеткам. В некоторых вариантах осуществления клетки, которые непосредственно выделены, отобраны и/или обогащены из образца, являются входной композицией клеток и используются на последующих стадиях обработки, таких как последующие стадии обработки, включающие инкубацию, стимуляцию, активацию, конструирование и/или составление композиций из обогащенных клеток.
В некоторых вариантах осуществления выделенные, отобранные и/или обогащенные клетки из образца, такие как входная композиция клеток, содержат CD4+ клетки к CD8+ клетки в определенном, фиксированном или контролируемом отношении подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам. В некоторых вариантах осуществления предоставленных здесь способов первый и/или второй отборы, или отборы их субпопуляций, из образца могут быть выполнены таким образом, чтобы получить входную композицию клеток с желательным отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ клеткам.
В некоторых вариантах осуществления перед выполнением первого и/или второго отбора из образца определяют отношение CD4+ к CD8+ T-клеткам в образце, например в биологическом образце. В некоторых вариантах осуществления перед выполнением первого и/или второго выбора определяют отношение подобных наивным CD4+ Т-клеток к подобным наивным CD8+ T-клеткам в образце. Основываясь на конкретном отношении CD4+ к CD8+ T-клеткам и/или подобных наивным CD4+ к подобным наивным CD8+ T-клеткам, в образце, которое может отличаться для образцов, конкретный способ отбора может быть индивидуализирован для образца, например, путем задания размеров хроматографических колонок или выбора количества или концентрации иммуноаффинных реагентов, для достижения желательного, фиксированного или контролируемого соотношения. Относительный уровень или частоту различных популяций клеток у субъекта можно определить на основе оценки экспрессии на поверхности маркера или маркеров, присутствующих в таких популяциях или субпопуляциях. Можно использовать ряд хорошо известных методов для оценки уровня экспрессии маркеров или белков на поверхности, таких как детектирование с помощью методов на основе аффинности, например, методов на основе иммуноаффинности, например, в связи с белками клеточной поверхности, таких как проточная цитометрия.
В некоторых случаях подходящее соотношение CD4+ и CD8+ T-клеток, подобных наивным, может изменяться в зависимости от случая, например, конкретного заболевания, состояния или предшествующего лечения субъекта, от которого клетки получены, и/или специфичности клеток к конкретному антигену, относительного представления среди клеток конкретного типа (например, CD4+ клеток) различных субпопуляций, например, эффекторных клеток в сравнении с клетками памяти в сравнении с наивными клетками, и/или одного или более условий, при которых клетки будут инкубироваться, например, среды, стимулирующих агентов, времени культивирования, буферов, содержания кислорода, содержания углекислого газа, антигена, цитокина, антител и других компонентов. Таким образом, может случиться так, что тип клетки, который, как обычно или в общем известно, пролиферирует или размножается быстрее, чем другой, не всегда будет обладать таким свойством в каждом случае. Таким образом, в некоторых аспектах соотношение подобных наивным CD4+ T-клеток и подобных наивным CD8+ T-клеток определяется на основе известных функциональных возможностей типов клеток в нормальном или типичном случае, в сочетании с оценкой фенотипов или состояния клеток или субъекта, от которого получены клетки, и/или эмпирических данных.
В некоторых вариантах осуществления разделение и/или стадии разделения выполняют с использованием иммуномагнитных шариков. В некоторых вариантах осуществления образец клеток, содержащий CD4+ и CD8+ клетки, приводят в контакт с магнитными шариками, содержащими первый иммуноаффинный реагент, который связывается с CD4 или CD8, и магнитными шариками, содержащими второй иммуноаффинный реагент, который связывается с другим из CD4 или CD8. Разделение и/или стадии разделения могут происходить одновременно и/или последовательно.
В некоторых вариантах осуществления первый и/или второй иммуноаффинный реагент присутствуют в инкубационной композиции в субоптимальной для выхода концентрацией, в силу чего обогащенная композиция содержит меньше, чем все, например, 70% от общего числа CD4+ клеток в инкубационной композиции и/или меньше, чем все, например, 70%, CD8+ клеток в инкубационной композиции, таким образом получая композицию, обогащенную CD4+ и CD8+ Т-клетками.
В некоторых вариантах осуществления субоптимальная для выхода концентрация аффинного реагента представляет собой концентрацию, которая ниже концентрации, используемой или требуемой для достижения оптимального или максимального выхода связавшихся клеток при данном отборе или обогащении, включающем инкубацию клеток с реагентом и выделение или отделение клеток, связавшихся с реагентом (при этом «выход», например, представляют собой количество клеток, выделенных или отобранных таким образом, по сравнению с общим количеством клеток в инкубационной композиции, на которые нацелен реагент, или к которым данный реагент обладает специфичностью, или которые имеют маркер, к(с) которому(ым) реагент обладает специфичностью и способен к связыванию). Субоптимальная для выхода концентрация, как правило, представляет собой концентрацию или количество реагента, при которой в таком процессе или стадии достигается менее чем, весь, например, не более чем 70%-ный выход связавшихся клеток, например CD4+ и/или CD8+ Т-клеток, после извлечения клеток, связавшихся с реагентом. В некоторых вариантах осуществления при субоптимальной концентрации аффинного реагента достигается не более чем или приблизительно 50%, 45%, 40%, 30% или 25% выход. Концентрация может быть выражена в виде количества или массы частиц или поверхностей на клетку и/или количества массы или молекул агента (например, антитела, такого как фрагмент антитела) на клетку. В конкретных вариантах осуществления субоптимальные для выхода концентрации являются достаточными для получения или достижения фиксированного, контролируемого и/или определенного отношения подобных наивным CD4+ Т-клеток к подобным наивным CD8+ Т-клеткам.
В некоторых вариантах осуществления, например, при работе с субоптимальной для выхода концентрацией для каждого или одного или более из двух или более селективных реагентов со сродством к CD4+ и/или CD8+ Т-клеткам, один или более таких реагентов используют в концентрации, которая выше таковой одного или более других таких реагентов, чтобы сместить соотношение типов клеток, распознаваемых этим реагентом, по сравнению с типом(ами) клеток, распознаваемым другим(и). Например, реагент, специфически связывающийся с маркером, для которого желательно сместить отношение, может быть включен в концентрации (например, агент или масса на клетки), которая увеличена наполовину, в 1, 2, 3, 4, 5, 10 раз или более, по сравнению с другими, в зависимости от того, насколько желательно увеличить отношение.
В некоторых вариантах осуществления при работе в субоптимальном диапазоне и/или с достаточным количеством клеток для достижения насыщения реагентов количество иммуноаффинного реагента пропорционально приблизительному выходу обогащенных клеток. В некоторых вариантах осуществления подходящее количество или концентрация иммуноаффинных реагентов, которое зависит от желательного отношения в получаемой композиции, содержащей обогащенные или отобранные CD4+ и CD8+ Т-клетки, может быть определено в обычном порядке.
В некоторых вариантах осуществления стадии разделения и/или выделения выполняют с использованием магнитных шариков, в которых иммуноаффинные реагенты связываются обратимо, например, посредством взаимодействия пептидного лиганда с мутеином стрептавидина, как описано в WO 2015/164675. Примерами таких магнитных шариков являются Streptamers®. В некоторых вариантах осуществления разделение и/или стадии выполняют с использованием магнитных шариков, таких как те, которые коммерчески доступны от Miltenyi Biotec.
В некоторых вариантах осуществления первый отбор CD4+ и CD8+ клеток из образца или обогащение ими выполняют с использованием иммуноаффинных реагентов, которые включают по крайней мере первую и вторую матрицу для аффинной хроматографии, соответственно, с иммобилизованным на ней антителом. В некоторых вариантах осуществления в одном или обоих из первого и/или второго отбора может использоваться множество матриц для аффинной хроматографии и/или антител, в силу чего множество матриц и/или антител, используемых для одного и того же отбора, т.е. первого отбора или второго отбора, соединены последовательно. В некоторых вариантах осуществления матрица или матрицы для аффинной хроматографии, используемые в первом и/или втором отборе, адсорбирует или способна отбирать или обогащать, по крайней мере, приблизительно 50х106 клеток/мл, 100х106 клеток/мл, 200х106 клеток/мл или 400х106 клеток/мл. В некоторых вариантах осуществления адсорбционная емкость может регулироваться на основе диаметра и/или длины колонки. В некоторых вариантах осуществления соотношение в выбранной или обогащенной композиции для инициации культуры достигается путем выбора количества матрицы и/или относительного количества, достаточного для достижения соотношения для инициации культуры, исходя, например, из адсорбционной способности колонки или колонок для отбора клеток.
В одном приводимом в качестве примера варианте осуществления CD4+ T-клетки и CD8+ T-клетки содержат равную или схожую долю клеток, подобных наивным, и адсорбционная емкость матрицы или матриц является одинаковой между первым и вторым отбором, например, составляет или приблизительно составляет 1х108 клеток/мл для обоих, в результате чего обогащение или отбор клеток при первом отборе и втором отборе приводит к получению композиции, содержащей CD4+ клетки и CD8+ клетки с отношением подобных наивным CD4+ к CD8+ T-клеткам, составляющим или приблизительно составляющим 1:1. В конкретных вариантах осуществления соответствующий объем, диаметр или количество колонок для аффинной матричной хроматографии для первого и/или второго отбора в зависимости от долей клеток, подобных наивным, и от желательного соотношения в созданной входной композиции клеток могут быть выбраны или определены в обычном порядке.
В некоторых вариантах осуществления адсорбционная емкость матрицы или матриц колонок регулируется для учета различий в частоте клеток, подобных наивным, например CD4+ или CD8+ клеток, подобных наивным», по сравнению с частотой клеток соответствующей родительской популяции CD4+ или CD8+ клеток в исходном образце от субъекта. Относительный уровень или частоту различных популяций клеток у субъекта можно определить на основе оценки экспрессии на поверхности маркера или маркеров, присутствующих в таких популяциях или субпопуляциях. Можно использовать ряд хорошо известных способов оценки уровня экспрессии маркеров или белков на поверхности, таких как обнаружение с помощью методов на основе аффинности, например, методов на основе иммуноаффинности, например, в связи с белками клеточной поверхности, например, с помощью проточной цитометрии.
В некоторых вариантах осуществления клетки, подобные наивным, например CD4+ и/или CD8+ T-клетки, подобные наивным, оцениваются, измеряются и/или обнаруживаются в композициях клеток, например композициях CD4+ и/или CD8+ Т-клеток, или в образце, например в биологическом образце. В некоторых вариантах осуществления T-клетка, подобная наивной, представляет собой T-клетку, которая является позитивной по экспрессии одного или более маркеров, которые указывают, что клетка является наивной и/или подобной наивной клеткой. В некоторых вариантах осуществления T-клетка, подобная наивной, представляет собой клетку, которая является позитивной по экспрессии маркера, который связан с наивным или подобным наивному состоянием в T-клетках. В конкретных вариантах осуществления T-клетка, подобная наивной, представляет собой T-клетку, которая является негативной по экспрессии одного или более маркеров, которые указывают, что клетка не является наивной и/или подобной наивной клеткой. В некоторых вариантах осуществления T-клетка, подобная наивной, представляет собой клетку, которая является негативной по экспрессии маркера, который связан с не являющимся наивным или подобным наивному состоянием в T-клетках. В некоторых вариантах осуществления не являющееся наивным или подобным наивному состояние в Т-клетках включает, например, но без ограничения ими, эффекторные T-клетки (TEFF), T-клетки памяти, центральные T-клетки памяти (TCM), эффекторные Т-клетки памяти (TEM) и их комбинации.
В некоторых вариантах осуществления Т-клетка, подобная наивной, является позитивной по экспрессии по крайней мере одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти или более чем десяти маркеров которые указывают, что клетка является наивной и/или подобной наивной клеткой, и/или связаны с наивным или подобным наивному состоянием в Т-клетках. В некоторых вариантах осуществления маркеры экспрессируются на поверхности клетки. В некоторых вариантах осуществления Т-клетка, подобная наивной, является негативной по экспрессии по крайней мере одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти или более чем десяти маркеров которые указывают, что клетка не является наивной и/или подобной наивной клеткой, и/или связаны с не являющимся наивным или подобным наивному состоянием в Т-клетках.
Маркеры, которые указывают, что T-клетка является наивной и/или подобной наивной T-клеткой, и/или связаны с наивным и/или подобным наивному состоянием в T-клетках, включают, но без ограничения, CD27, CD28, CD45RA, CD62L и/или CCR7. В некоторых вариантах осуществления T-клетка, подобная наивной, например CD4+ и/или CD8+ T-клетка, подобная наивной, является позитивной по экспрессии CD27, CD28, CD45RA и/или CCR7. В некоторых вариантах осуществления Т-клетка, подобная наивной, является позитивной по экспрессии на поверхности одного или более из CD27, CD28, CD45RA и/или CCR7. В некоторых вариантах осуществления T-клетка, подобная наивной, например CD4+ и/или CD8+ T-клетка, подобная наивной, является негативной по экспрессии CD62L.
Маркеры, которые указывают, что T-клетка не является наивной и/или подобной наивной T-клеткой, и/или связаны с не являющимся наивным и/или подобным наивному состоянием в T-клетках, включают, но без ограничения, CD25, CD45RO, CD56, KLRG1 и/или CD95. В некоторых вариантах осуществления T-клетка, подобная наивной, например CD4+ и/или CD8+ T-клетка, подобная наивной, является негативной по экспрессии CD25, CD45RO, CD56 и/или KLRG1. В конкретных вариантах осуществления T-клетка, подобная наивной, например CD4+ и/или CD8+ T-клетка, подобная наивной, характеризуется низкой экспрессией маркера, связанного с не являющими наивными или подобными наивным клетками. В конкретных вариантах осуществления T-клетка, подобная наивной характеризуется низкой экспрессией CD95. В некоторых вариантах осуществления T-клетка, подобная наивной, является негативной по экспрессии на поверхности одного или более из CD25, CD45RO, CD56 и/или KLRG1.
В некоторых вариантах осуществления низкая экспрессия маркера, связанного с клетками, не являющимися наивными или подобными наивным, представляет собой или включает экспрессию, которая меньше на по крайней мере 10%, по крайней мере 20%, по крайней мере 30%, по крайней мере 40%, по крайней мере 50%, по крайней мере 60%, по крайней мере 70%, по крайней мере 80%, по крайней мере 90%, по крайней мере 95% или по крайней мере 99% экспрессии маркера в клетке, которая не является клеткой, подобной наивной, и/или клетке, которая является позитивной по одному или более маркеров, которые указывают, что клетка не является наивной и подобной наивной T-клеткой, и/или связаны с не являющимся наивным или подобным наивному состоянием в Т-клетках. В некоторых вариантах осуществления низкая экспрессия маркера, связанного с клетками, не являющимися наивными или подобными наивным, представляет собой или включает экспрессию, которая меньше на по крайней мере 10%, по крайней мере 20%, по крайней мере 30%, по крайней мере 40%, по крайней мере 50%, по крайней мере 60%, по крайней мере 70%, по крайней мере 80%, по крайней мере, 90%, по крайней мере 95% или по крайней мере 99% экспрессия маркера в эффекторной T-клетке (TEFF), Т-клетке памяти, центральной T-клетке памяти (TCM) и/или эффекторной T-клетке памяти (TEM).
В некоторых вариантах осуществления маркеры, которые указывают, что клетка не является наивной и/или подобной наивной T-клеткой, и/или связаны с не являющимся наивным и/или подобным наивному состоянием в T-клетках, включают один или более цитокинов. Например, в некоторых вариантах осуществления не являющаяся наивной и/или подобной наивной T-клетка является негативной по экспрессии и/или продукции одного или более из IL-2, IFN-γ, IL-4, и IL-10. В некоторых вариантах осуществления один или более цитокинов секретируются. В конкретных вариантах осуществления один или более цитокинов экспрессируются внутри не являющихся подобными наивным Т-клеток, например, во время или после обработки агентом, который предотвращает, ингибирует или уменьшает секрецию.
В некоторых вариантах осуществления Т-клетка, подобная наивной, является позитивной по экспрессии, например экспрессии на поверхности, CD45RA и CCR7. В конкретных вариантах осуществления CD4+ T-клетка, подобная наивной, является позитивной по экспрессии, например экспрессии на поверхности, CD45RA и CCR7. В некоторых вариантах осуществления CD8+ T-клетка, подобная наивной, является позитивной по экспрессии, например экспрессии на поверхности, CD45RA и CCR7. В конкретных вариантах осуществления Т-клетка, подобная наивной, является позитивной по экспрессии, например экспрессии на поверхности, CD45RA, CD27 и CCR7 и негативной по экспрессии, например экспрессии на поверхности, CD45RO. В конкретных вариантах осуществления CD4+ T-клетка, подобная наивной, является позитивной по экспрессии, например экспрессии на поверхности, CD45RA, CD27 и CCR7 и негативной по экспрессии, например экспрессии на поверхности, CD45RO. В некоторых вариантах осуществления CD8+ T-клетка, подобная наивной, является позитивной по экспрессии, например экспрессии на поверхности, CD45RA, CD27 и CCR7 и негативной по экспрессии, например экспрессии на поверхности, CD45RO.
В некоторых вариантах осуществления CD4+ и/или CD8+ T-клетки являются жизнеспособными клетками. В некоторых вариантах осуществления CD4+ и/или CD8+ T-клетки являются жизнеспособными клетками, подобными наивным. Жизнеспособная клетка является позитивной по экспрессии маркера, который указывает на то, что клетка подвергается нормальным функциональным клеточным процессам и/или не претерпела или не подвергается процессу некроза или запрограммированной гибели клеток. В некоторых вариантах осуществления жизнеспособность может оцениваться по окислительно-восстановительному потенциалу клетки, целостности клеточной мембраны или активности или функции митохондрий. В некоторых вариантах осуществления жизнеспособность представляет собой отсутствие конкретной молекулы, связанной с гибелью клеток, или отсутствие указания на гибель клеток в анализе.
В некоторых вариантах осуществления жизнеспособность клеток оценивают с помощью анализа, который может включать, но без ограничения, анализы поглощения красителя (например, анализы с использованием кальцеина-AM), анализы жизнеспособности клеток XTT и анализы методом исключения красителя (например, трипанового синего, эозина или анализы методом исключения пропидиевого красителя). В конкретных вариантах осуществления жизнеспособная клетка характеризуется негативной экспрессией одного или более маркеров апоптоза, например, аннексина V или активной каспазы 3. В некоторых вариантах осуществления жизнеспособная клетка является негативной по экспрессии или активации одного или более маркеров апоптоза, которые могут включать, но без ограничения ими, каспазу, например каспазу 2, каспазу 3, каспазу 6, каспазу 7, каспазу 8, каспазу 9 и каспазу 10, члены семейства Bcl-2, например, Bax, Bad и Bid, аннексин V и/или окрашивание в TUNEL-тесте.
В некоторых вариантах осуществления экспрессия представляет собой или включает количество, уровень, концентрацию и/или присутствие маркера. В конкретных вариантах осуществления маркер представляет собой полипептид. В некоторых вариантах осуществления маркер представляет собой мРНК. В некоторых вариантах осуществления экспрессия представляет собой или включает количество, уровень, концентрацию и/или присутствие полипептида, например маркерного полипептида. В некоторых вариантах осуществления экспрессия представляет собой или включает количество, уровень, концентрацию и/или присутствие полинуклеотида, например мРНК или кДНК, полученной из мРНК, которая кодирует маркер. В некоторых вариантах осуществления экспрессия представляет собой или включает количество, уровень, концентрацию и/или присутствие маркера, находящегося или представленного на поверхности клетки или внутри клеточной мембраны. В некоторых вариантах осуществления экспрессия представляет собой или включает количество, уровень, концентрацию и/или присутствие маркера, находящегося или представленного на поверхности клетки или внутри клеточной мембраны. В конкретных вариантах осуществления экспрессия представляет собой или включает внутреннюю экспрессию, например, количество, уровень, концентрацию и/или присутствие маркера внутри клетки, например, внутри цитозоля, ядра, эндоплазматического ретикулума и/или аппарата Гольджи.
В некоторых вариантах осуществления маркеры измеряются, оцениваются и/или количественно определяются путем проведения анализа in vitro. В некоторых примерах анализ in vitro представляет собой иммуноанализ, анализ на основе аптамеров, гистологический или цитологический анализ или анализ уровня экспрессии мРНК. В некоторых случаях используемый анализ in vitro может быть иммуноферментным твердофазным анализом (ELISA), иммуноблоттингом, иммунопреципитацией, радиоиммуноанализом (RIA), иммуноокрашиванием, анализом с помощью проточной цитометрии, поверхностным плазмонным резонансом (SPR), анализом хемилюминесценции, иммуноанализом бокового потока, анализом ингибирования или анализом авидности. В некоторых вариантах осуществления экспрессия маркеров измеряется, оценивается и/или количественно определяется с помощью RNA-Seq. В конкретных вариантах осуществления экспрессия маркеров измеряется, оценивается и/или количественно определяется методами иммуноокрашивания. В конкретных вариантах осуществления экспрессия маркеров измеряется, оценивается и/или количественно определяется с помощью анализа с использованием проточной цитометрии. В некоторых вариантах осуществления экспрессия маркеров измеряется, оценивается и/или количественно определяется с помощью окрашивания внутриклеточных цитокинов.
В некоторых вариантах осуществления маркеры измеряют, оценивают и/или количественно определяют в композиции CD4+ Т-клеток. В конкретных вариантах осуществления по крайней мере 1%, по крайней мере 5%, по крайней мере 10%, по крайней мере 15%, по крайней мере 20%, по крайней мере 25%, по крайней мере 30%, по крайней мере 35%, по крайней мере 40%, по крайней мере 45%, по крайней мере 50%, по крайней мере 55%, по крайней мере 60%, по крайней мере 65%, по крайней мере 70%, по крайней мере 75%, по крайней мере 80%, по крайней мере 85%, по крайней мере 90%, по крайней мере 95%, по крайней мере 95%, по крайней мере 97% или по крайней мере 99% CD4+ T-клеток представляют собой CD4+ T-клетки, подобные наивным. В некоторых вариантах осуществления от 10% до 50%, от 20% до 60%, от 25% до 75%, от 30% до 80%, от 40% до 90%, от 50% до 100%, от 30% до 50%, от 40% до 60%, от 50% до 70%, от 60% до 80%, от 70% до 90%, от 80% до 100%, от 5% до 25%, от 25% до 50%, от 50% до 75% или от 75% до 99% CD4+ T-клеток являются CD4+ T-клетками, подобными наивным. В некоторых вариантах осуществления CD4+ T-клетки, подобные наивным, являются жизнеспособными CD4+ T-клетками, подобными наивным.
В некоторых вариантах осуществления маркеры измеряют, оценивают и/или количественно определяют в композиции CD8+ Т-клеток. В конкретных вариантах осуществления по крайней мере 1%, по крайней мере 5%, по крайней мере 10%, по крайней мере 15%, по крайней мере 20%, по крайней мере 25%, по крайней мере 30%, по крайней мере 35%, по крайней мере 40%, по крайней мере 45%, по крайней мере 50%, по крайней мере 55%, по крайней мере 60%, по крайней мере 65%, по крайней мере 70%, по крайней мере 75%, по крайней мере 80%, по крайней мере 85%, по крайней мере 90%, по крайней мере 95%, по крайней мере 95%, по крайней мере 97% или по крайней мере 99% CD8+ T-клеток представляют собой CD8+ T-клетки, подобные наивным. В некоторых вариантах осуществления от 10% до 50%, от 20% до 60%, от 25% до 75%, от 30% до 80%, от 40% до 90%, от 50% до 100%, от 30% до 50%, от 40% до 60%, от 50% до 70%, от 60% до 80%, от 70% до 90%, от 80% до 100%, от 5% до 25%, от 25% до 50%, от 50% до 75% или от 75% до 99% CD8+ T-клеток являются CD8+ T-клетками, подобными наивным. В некоторых вариантах осуществления CD8+ T-клетки, подобные наивным, являются жизнеспособными CD8+ T-клетками, подобными наивным.
В некоторых вариантах осуществления клетки из композиции CD4+ T-клеток смешивают или объединяют с клетками из композиции CD8+ T-клеток в количествах и/или пропорциях, достаточных для получения входной композиции с отношением подобных наивным CD4+ T клеток к подобным наивным CD8+ Т-клеткам, находящимся между 10:1 и 0,05:1, 8:1 и 0,1:1, 5:1 и 0,2:1, 2,5:1 и 0,25:1, 2,2:1 и 0,8:1, 2:1 и 0,5:1 или 1,5:1 и 1:1, включительно. В некоторых вариантах осуществления клетки смешивают в количествах и/или пропорциях, достаточных для получения отношения подобных наивным CD4+ Т-клеток к подобным наивным CD8+ Т-клеткам, находящегося между 2,2:1 и 0,8:1, включительно. В некоторых вариантах осуществления клетки смешивают или объединяют до отношения подобных наивным CD4+ Т-клеток к подобным наивным CD8+ Т-клеткам, составляющего или приблизительно составляющего 2,2:1, 2,1:1, 2,0:1, 1,9:1, 1,8:1, 1,7:1, 1,6:1, 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1, 1,0:1, 0,9:1 или 0,8:1. В некоторых вариантах осуществления клетки смешивают или объединяют до отношения, составляющего или приблизительно составляющего 1,1:1.
В некоторых вариантах осуществления количество, составляющее или приблизительно составляющее 5x105, 1x106, 5x106, 1x107, 5x107, 1,0x108, 1,1x108, 1,2x108, 1,3x108, 1,4x108, 1,5x108, 1,6x108, 1,7x108, 1,8x108, 1,9x108, 2,0x108, 2,1x108, 2,2x108, 2,3x108, 2,4x108, 2,5x108, 2,6x108, 2,7x108, 2,8x108, 2,9x108, 3,0x108, 3,5x108, 4,0x108, 4,5x108, 5x108, 5x108 или 1x109 всех или всех жизнеспособных CD4+ Т-клеток, смешивают или объединяют с количеством, составляющим или приблизительно составляющим 5x105, 1x106, 5x106, 1x107, 5x107, 1,0x108, 1,1x108, 1,2x108, 1,3x108, 1,4x108, 1,5x108, 1,6x108, 1,7x108, 1,8x108, 1,9x108, 2,0x108, 2,1x108, 2,2x108, 2,3x108, 2,4x108, 2,5x108, 2,6x108, 2,7x108, 2,8x108, 2,9x108, 3,0x108, 3,5x108, 4,0x108, 4,5x108, 5x108, 5,5x108 или 1x109 всех или всех жизнеспособных CD8+ T-клеток, для получения входной композиции клеток с определенным отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ T клеткам. В некоторых вариантах осуществления от 1х106 до 1х1010, от 1х107 до 1х109, от 5х107 до 5х108 или от 1х108 до 3х108 всех или всех жизнеспособных CD4+ Т-клеток смешивают или объединяют с количеством, составляющим или приблизительно составляющим от 1х106 до 1х1010, от 1х107 до 1х109, от 5х107 до 5х108 или от 1х108 до 3х108 всех или всех жизнеспособных CD8+ Т-клеток, для получения входной композиции клеток с определенным отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ T клеткам.
В некоторых вариантах осуществления количество, составляющее или приблизительно составляющее 5x105, 1x106, 5x106, 1x107, 5x107, 1,0x108, 1,1x108, 1,2x108, 1,3x108, 1,4x108, 1,5x108, 1,6x108, 1,7x108, 1,8x108, 1,9x108, 2,0x108, 2,1x108, 2,2x108, 2,3x108, 2,4x108, 2,5x108, 2,6x108, 2,7x108, 2,8x108, 2,9x108, 3,0x108, 3,5x108, 4,0x108, 4,5x108, 5x108, 5x108 или 1x109 CD4+ Т-клеток, подобных наивным, смешивают или объединяют с количеством, составляющим или приблизительно составляющим 5x105, 1x106, 5x106, 1x107, 5x107, 1,0x108, 1,1x108, 1,2x108, 1,3x108, 1,4x108, 1,5x108, 1,6x108, 1,7x108, 1,8x108, 1,9x108, 2,0x108, 2,1x108, 2,2x108, 2,3x108, 2,4x108, 2,5x108, 2,6x108, 2,7x108, 2,8x108, 2,9x108, 3,0x108, 3,5x108, 4,0x108, 4,5x108, 5x108, 5,5x108 или 1x109 CD8+ Т-клеток, подобных наивным, для получения входной композиции клеток с определенным отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам. В некоторых вариантах осуществления от 5х105 до 1х1010, от 1х106 до 1х1010, от 1х107 до 1х109, от 5х107 до 5х108 или от 1х108 до 3х108 CD4+ Т-клеток, подобных наивным смешивают или объединяют с количеством, составляющим или приблизительно составляющим от 5х105 до 1х1010, от 1х106 до 1х1010, от 1х107 до 1х109, от 5х107 до 5х108 или от 1х108 до 3х108 CD8+ Т-клеток, подобных наивным, для получения входной композиции клеток с определенным отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ T клеткам.
В конкретных вариантах осуществления отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам во входной композиции клеток было отрегулировано, изменено и/или изменено по сравнению с отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам в образце, например биологическом образце. В конкретных вариантах осуществления отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам отрегулировано, изменено и/или изменено, по сравнению с отношением в биологическом образце, на или приблизительно на или по крайней на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 100%, в 1, 1,5, 2, 2,5, 3, 4, 5, 10, 20, 50, 100 раз. В некоторых вариантах осуществления образец представляет собой образец, из которого клетки входной композиции клеток происходят, были выделены, отобраны и/или получены.
В некоторых вариантах осуществления входная композиция клеток характеризуется отношением, например определенным, контролируемым и/или фиксированным отношением CD45RA+/CCR7+/CD4+ T-клеток к CD45RA+/CCR7+/CD8+ T-клеткам. В конкретных вариантах осуществления отношение CD45RA+/CCR7+/CD4+ T-клеток к CD45RA+/CCR7+/CD8+ T-клеткам находится между 10:1 и 0,05:1, 8:1 и 0,1:1, 5:1 и 0,2:1, 2,5:1 и 0,25:1, 2,2:1 и 0,8:1, 2:1 и 0,5:1 или 1,5:1 и 1:1, включительно. В конкретных вариантах осуществления отношение CD45RA+/CCR7+/CD4+ T-клеток к CD45RA+/CCR7+/CD8+ T-клеткам находится между 2:1 и 0,8:1, 1,6:1 и 0,8:1, 1,4:1 и 0,8:1, 1,2:1 и 0,8:1 или 1,2:1 и 0,8:1, включительно. В некоторых вариантах осуществления отношение находится между 2,2:1 и 0,8:1, включительно. В некоторых вариантах осуществления отношение CD45RA+/CCR7+/CD4+ T-клеток к CD45RA+/CCR7+/CD8+ T-клеткам составляет или приблизительно составляет 2,2:1, 2,1:1, 2,0:1, 1,9:1, 1,8:1, 1,7:1, 1,6:1, 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1, 1,0:1, 0,9:1 или 0,8:1. В некоторых вариантах осуществления отношение составляет или приблизительно составляет 1,1:1.
В конкретных вариантах осуществления входная композиция клеток содержит количество, составляющее или приблизительно составляющее 1x106, 5x106, 1x107, 5x107, 1,0x108, 1,1x108, 1,2x108, 1,3x108, 1,4x108, 1,5x108, 1,6x108, 1,7x108, 1,8x108, 1,9x108, 2,0x108, 2,1x108, 2,2x108, 2,3x108, 2,4x108, 2,5x108, 2,6x108, 2,7x108, 2,8x108, 2,9x108, 3,0x108, 3,5x108, 4,0x108, 4,5x108, 5x108, 5x108 или 1x109 всех клеток или всех жизнеспособных клеток. В некоторых вариантах осуществления входная композиция клеток содержит количество, составляющее или приблизительно составляющее 5x105, 1x106, 5x106, 1x107, 5x107, 1,0x108, 1,1x108, 1,2x108, 1,3x108, 1,4x108, 1,5x108, 1,6x108, 1,7x108, 1,8x108, 1,9x108, 2,0x108, 2,1x108, 2,2x108, 2,3x108, 2,4x108, 2,5x108, 2,6x108, 2,7x108, 2,8x108, 2,9x108, 3,0x108, 3,5x108, 4,0x108, 4,5x108, 5x108, 5x108 или 1x109 клеток, которые экспрессируют CD4 или CD8. В некоторых вариантах осуществления входная композиция клеток содержит количество, составляющее или приблизительно составляющее 5x105, 1x106, 5x106, 1x107, 5x107, 1,0x 108, 1,1x108, 1,2x108, 1,3x108, 1,4x108, 1,5x108, 1,6x108, 1,7x108, 1,8x108, 1,9x108, 2,0x108, 2,1x108, 2,2x108, 2,3x108, 2,4x108, 2,5x108, 2,6x108, 2,7x108, 2,8x108, 2,9x108, 3,0x108, 3,5x108, 4,0x108, 4,5x108, 5x108, 5x108 или 1x109 CD45RA+/CCR7+/CD4+ и CD45RA+/CCR7+/CD8+ Τ клеток.
D конкретных вариантах осуществления входная композиция клеток содержит от 1х106 до 1х1010, от 1х107 до 1х109, от 5х107 до 5х108 или от 1х108 до 3х108 всех клеток или всех жизнеспособных клеток. В некоторых вариантах осуществления входная композиция клеток содержит количество, составляющее или приблизительно составляющее от 5х105 до 1х1010, от 1х106 до 1х1010, от 1х107 до 1x109, от 5x107 до 5x108 или от 1x108 до 3x108 клеток, которые экспрессируют CD4 или CD8. В некоторых вариантах осуществления входная композиция клеток содержит количество, составляющее или приблизительно составляющее от 5х105 до 1х1010, от 1х106 до 1х1010, от 1х107 до 1x109, от 5х107 до 5х108 или от 1х108 до 3х108 CD45RA+/CCR7+/CD4+ и CD45RA+/CCR7+/CD8+ Т-клеток.
В некоторых вариантах входная композиция клеток имеет или содержит по крайней мере 1%, по крайней мере 5%, по крайней мере 10%, по крайней мере 20%, по крайней мере 30%, по крайней мере 40%, по крайней мере 50%, по крайней мере 60%, по крайней мере 70%, по крайней мере 75%, по крайней мере 80%, по крайней мере 85%, по крайней мере 90%, по крайней мере 95%, по крайней мере 96%, по крайней мере 97%, по крайней мере 98%, по крайней мере 99%, по крайней мере 99,5%, по крайней мере 99,9% или 100% или приблизительно 100% CD45RA+/CCR7+ клеток. В конкретных вариантах входная композиция клеток содержит или включает не более 100%, не более 99%, не более 98%, не более 97%, не более 96%, не более 95%, не более 90% или не более 85% CD45RA+/CCR7+ клеток.
В некоторых вариантах осуществления количество, составляющее или приблизительно составляющее 5x105, 1x106, 5x106, 1x107, 5x107, 1,0x108, 1,1x108, 1,2x108, 1,3x108, 1,4x108, 1,5x108, 1,6x108, 1,7x108, 1,8x108, 1,9x108, 2,0x108, 2,1x108, 2,2x108, 2,3x108, 2,4x108, 2,5x108, 2,6x108, 2,7x108, 2,8x108, 2,9x108, 3,0x108, 3,5x108, 4,0x108, 4,5x108, 5x108, 5x108 или 1x109 всех или всех жизнеспособных CD4+ Т-клеток, смешивают или объединяют с количеством, составляющим или приблизительно составляющим 5x105, 1x106, 5x106, 1x107, 5x107, 1,0x108, 1,1x108, 1,2x108, 1,3x108, 1,4x108, 1,5x108, 1,6x108, 1,7x108, 1,8x108, 1,9x108, 2,0x108, 2,1x108, 2,2x108, 2,3x108, 2,4x108, 2,5x108, 2,6x108, 2,7x108, 2,8x108, 2,9x108, 3,0x108, 3,5x108, 4,0x108, 4,5x108, 5x108, 5,5x108 или 1x109 всех или всех жизнеспособных CD8+ T-клеток, для получения входной композиции клеток с определенным соотношением CD45RA+/CCR7+/CD4+ T-клеток к CD45RA+/CCR7+/CD8+ T-клеткам. В некоторых вариантах осуществления от 5x105 до 1x1010, от 1x106 до 1x1010, от 1x107 до 1x109, от 5x107 до 5х108 или от 1x108 до 3x108 всех или всех жизнеспособных CD4+ Т-клеток, смешивают или объединяют с количеством, составляющим или приблизительно составляющим от 5x105 до 1x1010, от 1x106 до 1x1010, от 1x107 до 1x109, от 5x107 до 5x108 или от 1x108 до 3x108 всех или всех жизнеспособных CD8+ T-клеток, для получения входной композиции клеток с определенным отношением CD45RA+/CCR7+/CD4+ T-клеток к CD45RA+/CCR7+/CD8+ T-клеткам.
В конкретных вариантах осуществления отношение CD45RA+/CCR7+/CD4+ T-клеток к CD45RA+/CCR7+/CD8+ T-клеткам во входной композиции клеток было отрегулировано, изменено и/или изменено по сравнению с отношением CD45RA+/CCR7+/CD4+ Т-клеток к CD45RA+/CCR7+/CD8+ Т-клеткам в образце, например биологическом образце. В конкретных вариантах осуществления отношение CD45RA+/CCR7+/CD4+ T-клеток к CD45RA+/CCR7+/CD8+ T-клеткам отрегулировано, изменено и/или изменено, по сравнению с отношением в биологическом образце, на или приблизительно на или по крайней на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 100%, в 1, 1,5, 2, 2,5, 3, 4, 5, 10, 20, 50, 100 раз. В некоторых вариантах осуществления образец представляет собой образец, из которого клетки входной композиции клеток происходят, были выделены, отобраны и/или получены.
В некоторых вариантах осуществления входная композиция клеток характеризуется отношением, например определенным, контролируемым и/или фиксированным отношением CD27+/CCR7+/CD4+ T-клеток к CD27+/CCR7+/CD8+ T-клеткам. В конкретных вариантах осуществления отношение CD27+/CCR7+/CD4+ T-клеток к CD27+/CCR7+/CD8+ T-клеткам находится между 10:1 и 0,05:1, 8:1 и 0,1:1, 5:1 и 0,2:1, 2,5:1 и 0,25:1, 2,2:1 и 0,8:1, 2:1 и 0,5:1 или 2:1 и 1:1, включительно. В конкретных вариантах осуществления отношение CD27+/CCR7+/CD4+ T-клеток к CD27+/CCR7+/CD8+ T-клеткам находится между 2:1 и 0,8:1, 1,8:1 и 1:1, 1,8:1 и 1,2:1, 1,2:1 и 1,4:1 или 1,8:1 и 1,6:1, включительно. В некоторых вариантах осуществления отношение находится между 1,8:1 и 1,6:1, включительно. В некоторых вариантах осуществления отношение CD27+/CCR7+/CD4+ T-клеток к CD27+/CCR7+/CD8+ T-клеткам составляет или приблизительно составляет 2,2:1, 2,1:1, 2,0:1, 1,9:1, 1,8:1, 1,7:1, 1,69:1, 1,6:1, 1,5:1, 1,4:1 или 1,3:1. В некоторых вариантах осуществления отношение составляет или приблизительно составляет 1,69:1.
В конкретных вариантах осуществления входная композиция клеток содержит количество, составляющее или приблизительно составляющее 1x106, 5x106, 1x107, 5x107, 1,0x108, 1,1x108, 1,2x108, 1,3x108, 1,4x108, 1,5x108, 1,6x108, 1,7x108, 1,8x108, 1,9x108, 2,0x108, 2,1x108, 2,2x108, 2,3x108, 2,4x108, 2,5x108, 2,6x108, 2,7x108, 2,8x108, 2,9x108, 3,0x108, 3,5x108, 4,0x108, 4,5x108, 5x108, 5x108 или 1x109 всех клеток или всех жизнеспособных клеток. В некоторых вариантах осуществления входная композиция клеток содержит количество, составляющее или приблизительно составляющее 5x105, 1x106, 5x106, 1x107, 5x107, 1,0x108, 1,1x108, 1,2x108, 1,3x108, 1,4x108, 1,5x108, 1,6x108, 1,7x108, 1,8x108, 1,9x108, 2,0x108, 2,1x108, 2,2x108, 2,3x108, 2,4x108, 2,5x108, 2,6x108, 2,7x108, 2,8x108, 2,9x108, 3,0x108, 3,5x108, 4,0x108, 4,5x 108, 5x108, 5x108, или 1x109 клеток, которые экспрессируют CD4 или CD8. В некоторых вариантах осуществления входная композиция клеток содержит количество, составляющее или приблизительно составляющее 5x105, 1x106, 5x106, 1x107, 5x107, 1,0x108, 1,1x108, 1,2x108, 1,3x108, 1,4x108, 1,5x108, 1,6x108, 1,7x108, 1,8x108, 1,9x108, 2,0x108, 2,1x108, 2,2x108, 2,3x108, 2,4x108, 2,5x108, 2,6x108, 2,7x108, 2,8x108, 2,9x108, 3,0x108, 3,5x108, 4,0x108, 4,5x108, 5x108, 5x108 или 1x109 CD27+/CCR7+/CD4+ и CD27+/CCR7+/CD8+ Т-клеток.
В конкретных вариантах осуществления входная композиция клеток содержит от 1x106 до 1х1010, от 1х107 до 1х109, от 5х107 до 5х108 или от 1х108 до 3х108 всех клеток или всех жизнеспособных клеток. В некоторых вариантах осуществления входная композиция клеток содержит количество, составляющее или приблизительно составляющее от 5х105 до 1х1010, от 1x106 до 1х1010, от 1х107 до 1x109, от 5x107 до 5x108 или от 1x108 до 3x108 клеток, которые экспрессируют CD4 или CD8. В некоторых вариантах осуществления входная композиция клеток содержит количество, составляющее или приблизительно составляющее от 5х105 до 1х1010, от 1x106 до 1х1010, от 1х107 до 1x109, от 5x107 до 5x108 или от 1x108 до 3x108 CD27+/CCR7+/CD4+ и CD27+/CCR7+/CD8+ Т-клеток.
В некоторых вариантах осуществления входная композиция клеток имеет или содержит по крайней мере 1%, по крайней мере 5%, по крайней мере 10%, по крайней мере 20%, по крайней мере 30%, по крайней мере 40%, по крайней мере 50%, по крайней мере 60%, по крайней мере 70%, по крайней мере 75%, по крайней мере 80%, по крайней мере 85%, по крайней мере 90%, по крайней мере 95%, по крайней мере 96%, по крайней мере 97%, по крайней мере 98%, по крайней мере 99%, по крайней мере 99,5%, по крайней мере 99,9% или 100% или приблизительно 100% CD27+/CCR7+ клеток. В конкретных вариантах осуществления входная композиция клеток содержит или включает не более 100%, не более 99%, не более 98%, не более 97%, не более 96%, не более 95%, не более 90% или не более 85% CD27+/CCR7+ клеток.
В некоторых вариантах осуществления количество, составляющее или приблизительно составляющее 5x105, 1x106, 5x106, 1x107, 5x107, 1,0x108, 1,1x108, 1,2x108, 1,3x108, 1,4x108, 1,5x108, 1,6x108, 1,7x108, 1,8x108, 1,9x108, 2,0x108, 2,1x108, 2,2x108, 2,3x108, 2,4x108, 2,5x108, 2,6x108, 2,7x108, 2,8x108, 2,9x108, 3,0x108, 3,5x108, 4,0x108, 4,5x108, 5x108, 5x108 или 1x109 всех или всех жизнеспособных CD4+ Т-клеток, смешивают или объединяют с количеством, составляющим или приблизительно составляющим 5x105, 1x106, 5x106, 1x107, 5x107, 1,0x108, 1,1x108, 1,2x108, 1,3x108, 1,4x108, 1,5x108, 1,6x108, 1,7x108, 1,8x108, 1,9x108, 2,0x108, 2,1x108, 2,2x108, 2,3x108, 2,4x108, 2,5x108, 2,6x108, 2,7x108, 2,8x108, 2,9x108, 3,0x108, 3,5x108, 4,0x108, 4,5x108, 5x108, 5,5x108 или 1x109 всех или всех жизнеспособных CD8+ T-клеток, для получения входной композиции клеток с определенным отношением CD27+/CCR7+/CD4+ T-клеток к CD27+/CCR7+/CD8+ T-клеткам. В некоторых вариантах осуществления от 5x105 до 1x1010, от 1x106 до 1x1010, от 1x107 до 1x109, от 5х107 до 5х 108 или от 1х108 до 3х108 всех или всех жизнеспособных CD4+ Т-клеток смешивают или объединяют с количеством, составляющим или приблизительно составляющим от 5х105 до 1x1010, от 1x106 до 1x1010, от 1x107 до 1x109, от 5x107 до 5x108 или от 1x108 до 3x108 всех или всех жизнеспособных CD8+ T-клеток, для получения входной композиции клеток с определенным отношением CD27+/CCR7+/CD4+ T-клеток к CD27+/CCR7+/CD8+ T-клеткам.
В конкретных вариантах осуществления отношение CD27+/CCR7+/CD4+ T-клеток к CD27+/CCR7+/CD8+ T-клеткам во входной композиции клеток было отрегулировано, изменено и/или изменено по сравнению с отношением CD27+/CCR7+/CD4+ Т-клеток к CD27+/CCR7+/CD8+ Т-клеткам в образце, например биологическом образце. В конкретных вариантах осуществления отношение CD27+/CCR7+/CD4+ T-клеток к CD27+/CCR7+/CD8+ T-клеткам отрегулировано, изменено и/или изменено, по сравнению с отношением в биологическом образце, на или приблизительно на или по крайней на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 100%, в 1, 1,5, 2, 2,5, 3, 4, 5, 10, 20, 50, 100 раз. В некоторых вариантах осуществления образец представляет собой образец, из которого клетки входной композиции клеток происходят, были выделены, отобраны и/или получены.
В некоторых вариантах осуществления входная композиция клеток характеризуется отношением, например определенным, контролируемым и/или фиксированным отношением CD62L-/CCR7+/CD4+ T-клеток к CD62L-/CCR7+/CD8+ T-клеткам. В конкретных вариантах осуществления отношение CD62L-/CCR7+/CD4+ T-клеток к CD62L-/CCR7+/CD8+ T-клеткам находится между 10:1 и 0,05:1, 8:1 и 0,1:1, 5:1 и 0,2:1, 2,5:1 и 0,25:1, 2,2:1 и 0,8:1, 2:1 и 0,5:1 или 1,5:1 и 1:1, включительно. В конкретных вариантах осуществления отношение CD62L-/CCR7+/CD4+ T-клеток к CD62L-/CCR7+/CD8+ T-клеткам находится между 2:1 и 0,8:1, 1,6:1 и 0,8:1, 1,4:1 и 0,8:1, 1,2:1 и 0,8:1 или 1,2:1 и 0,8:1, включительно. В некоторых вариантах осуществления отношение находится между 2,2:1 и 0,8:1, включительно. В некоторых вариантах осуществления отношение CD62L-/CCR7+/CD4+ T-клеток к CD62L-/CCR7+/CD8+ T-клеткам составляет или приблизительно составляет 2,2:1, 2,1:1, 2,0:1, 1,9:1, 1,8:1, 1,7:1, 1,6:1, 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1, 1,0:1, 0,9:1 или 0,8:1. В некоторых вариантах осуществления отношение составляет или приблизительно составляет 1,1:1.
В конкретных вариантах осуществления входная композиция клеток содержит от 1х106 до 1х1010, от 1х107 до 1х109, от 5х107 до 5х108 или от 1х108 до 3х108 всех клеток или всех жизнеспособных клеток. В некоторых вариантах осуществления входная композиция клеток содержит количество, составляющее или приблизительно составляющее от 1х106 до 1х1010, от 1х107 до 1х109, от 5х107 до 5х108 или от 1х108 до 3х108 клеток, которые экспрессируют CD4 или CD8. В некоторых вариантах осуществления входная композиция клеток содержит количество, составляющее или приблизительно составляющее от 1х106 до 1х1010, от 1х107 до 1х109, от 5х107 до 5х108 или от 1х108 до 3х108 CD62L-/CCR7+/CD4+ и CD62L-/CCR7+/CD8+ T-клеток.
В некоторых вариантах осуществления входная композиция клеток имеет или содержит по крайней мере 1%, по крайней мере 5%, по крайней мере 10%, по крайней мере 20%, по крайней мере 30%, по крайней мере 40%, по крайней мере 50%, по крайней мере 60%, по крайней мере 70%, по крайней мере 75%, по крайней мере 80%, по крайней мере 85%, по крайней мере 90%, по крайней мере 95%, по крайней мере 96%, по крайней мере 97%, по крайней мере 98%, по крайней мере 99%, по крайней мере 99,5%, по крайней мере 99,9% или 100% или приблизительно 100% CD62L-/CCR7+ клеток. В конкретных вариантах осуществления входная композиция клеток содержит или включает не более 100%, не более 99%, не более 98%, не более 97%, не более 96%, не более 95%, не более 90% или не более 85% CD62L-/CCR7+ клеток.
В некоторых вариантах осуществления количество, составляющее или приблизительно составляющее 1x106, 5x106, 1x107, 5x107, 1,0x108, 1,1x108, 1,2x108, 1,3x108, 1,4x108, 1,5x108, 1,6x108, 1,7x108, 1,8x108, 1,9x108, 2,0x108, 2,1x108, 2,2x108, 2,3x108, 2,4x108, 2,5x108, 2,6x108, 2,7x108, 2,8x108, 2,9x108, 3,0×10808, 3,5×108, 4,0×108, 4,5×108, 5×108, 5×108 или 1×109 всех или всех жизнеспособных CD4+ Т-клеток, смешивают или объединяют с количеством, составляющим или приблизительно составляющим 1×106, 5×106, 1×107, 5×107, 1,0×108, 1,1×108, 1,2×108, 1,3×108, 1,4×108, 1,5×108, 1,6×108, 1,7×108, 1,8×108, 1,9×108, 2,0×108, 2,1×108, 2,2×108, 2,3×108, 2,4×108, 2,5×108, 2,6×108, 2,7×108, 2,8×108, 2,9×108, 3,0×108, 3,5×108, 4,0×108, 4,5×108, 5×108, 5,5×108 или 1×109 всех или всех жизнеспособных CD8+ Т-клеток, для получения входной композиции клеток с определенное отношение CD62L-/CCR7+/CD4+ T-клеток к CD62L-/CCR7+/CD8+ T-клеткам. В некоторых вариантах осуществления от 1х106 до 1х1010, от 1х107 до 1х109, от 5х107 до 5х108 или от 1х108 до 3х108 всех или всех жизнеспособных CD4+ Т-клеток смешивают или объединяют с количеством, составляющим или приблизительно составляющим от 1х106 до 1х1010, от 1х107 до 1×109, от 5×107 до 5×108 или от 1×108 до 3×108 всех или всех жизнеспособных CD8+ T-клеток, для получения входной композиции клеток с определенным отношением CD62L-/CCR7+/CD4+ T-клеток к CD62L-/CCR7+/CD8+ T-клеткам.
В конкретных вариантах осуществления отношение CD62L-/CCR7+/CD4+ T-клеток к CD62L-/CCR7+/CD8+ T-клеткам во входной композиции клеток было отрегулировано, изменено и/или изменено по сравнению с отношением CD62L-/CCR7+/CD4+ T-клеток к CD62L-/CCR7+/CD8+ T-клеткам в образце, например биологическом образце. В конкретных вариантах осуществления отношение CD62L-/CCR7+/CD4+ T-клеток к CD62L-/CCR7+/CD8+ T-клеткам отрегулировано, изменено и/или изменено, по сравнению с отношением в биологическом образце, на или приблизительно на или по крайней на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 100%, в 1, 1,5, 2, 2,5, 3, 4, 5, 10, 20, 50, 100 раз. В некоторых вариантах осуществления образец представляет собой образец, из которого клетки входной композиции клеток происходят, были выделены, отобраны и/или получены.
В некоторых вариантах осуществления получение, создание и/или приготовление входной композиции клеток включает одну или более стадий смешивания или объединения клеток композиции CD4+ T-клеток с клетками композиций CD8+ T-клеток для получения входной композиции клеток с отношением от 2,2:1 до 0,8:1 CD45RA+/CCR7+/CD4+ T-клеток к CD45RA+/CCR7+/CD8+ T-клеткам. В конкретных вариантах осуществления количество, количество на объем, количество на вес и/или количество, уровень или процентное содержание CD45RA+/CCR7+ клеток измеряются, оцениваются и/или количественно определяются в композиции CD4+ Т-клеток и композиции CD8+ Т-клеток перед смешиванием или объединением. В некоторых вариантах осуществления количество, уровень, количество, количество на объем, количество на вес и/или процентное содержание CD45RA+/CCR7+ клеток измеряются, оцениваются и/или количественно определяются путем обнаружения CD45RA+; CCR7+ Т-клеток. В конкретных вариантах осуществления входная композиция клеток характеризуется составляющим от 2,2:1 до 0,8:1 отношением CD45RA+/CCR7+/CD4+ T-клеток к CD45RA+/CCR7+/CD8+ T-клеткам. В некоторых вариантах осуществления входная композиция клеток характеризуется составляющим или приблизительно составляющим 1,1:1 отношением CD45RA+/CCR7+/CD4+ T-клеток к CD45RA+/CCR7+/CD8+ T-клеткам.
В некоторых вариантах осуществления получение, создание и/или приготовление входной композиции клеток включает одну или более стадий смешивания или объединения клеток композиции CD4+ T-клеток с клетками композиций CD8+ T-клеток для получения входной композиции клеток с составляющим от 2,4:1 до 1:1 отношением CD27+/CCR7+/CD4+ T-клеток к CD27+/CCR7+/CD8+ T-клеткам. В конкретных вариантах осуществления количество, количество на объем, количество на вес и/или количество, уровень или процентное содержание CD27+/CCR7+ клеток измеряются, оцениваются и/или количественно определяются в композиции CD4+ Т-клеток и композиции CD8+ Т-клеток перед смешиванием или объединением. В некоторых вариантах осуществления количество, уровень, количество, количество на объем, количество на вес и/или процентное содержание CD27+/CCR7+ клеток измеряются, оцениваются и/или количественно определяются путем обнаружения CD45RA+; CCR7+ Т-клеток. В конкретных вариантах осуществления входная композиция клеток характеризуется составляющим от 2,4:1 до 1:1 отношением CD27+/CCR7+/CD4+ T-клеток к CD27+/CCR7+/CD8+ T-клеткам. В некоторых вариантах осуществления входная композиция клеток характеризуется составляющим или приблизительно составляющим 1,69:1 отношением CD27+/CCR7+/CD4+ T-клеток к CD27+/CCR7+/CD8+ T-клеткам.
В некоторых вариантах осуществления получение, создание и/или приготовление входной композиции клеток включает одну или более стадий смешивания или объединения клеток композиции CD4+ T-клеток с клетками композиций CD8+ T-клеток для получения входной композиции клеток с составляющим от 2,2:1 до 0,8:1 отношением CD62L-/CCR7+/CD4+ T-клеток к CD62L-/CCR7+/CD8+ T-клеткам. В конкретных вариантах осуществления количество, количество на объем, количество на вес и/или количество, уровень или процентное содержание CD62L-/CCR7+ клеток измеряются, оцениваются и/или количественно определяются в композиции CD4+ T-клеток и CD8+ T-клеток перед смешиванием или объединением. В некоторых вариантах осуществления количество, уровень, количество, количество на объем, количество на вес и/или процентное содержание CD62L-/CCR7+ клеток измеряются, оцениваются и/или количественно определяются путем обнаружения CD62L-/CCR7+ Т-клеток. В конкретных вариантах осуществления входная композиция клеток характеризуется составляющим от 2,2:1 до 0,8:1 отношением CD62L-/CCR7+/CD4+ T-клеток к CD62L-/CCR7+/CD8+ T-клеткам. В некоторых вариантах осуществления входная композиция клеток характеризуется составляющим или приблизительно составляющим 1,1:1 отношением CD62L-/CCR7/CD4+ T-клеток к CD62L-/CCR7/CD8+ T-клеткам.
В некоторых вариантах осуществления получение, создание и/или приготовление входной композиции клеток включает одну или более стадий смешивания или объединения клеток композиции CD4+ T-клеток с клетками композиций CD8+ T-клеток для получения входной композиции клеток с составляющим от 2,2:1 до 0,8:1 отношением подобных наивным CD4+ Т-клеток к подобным наивным CD8+ Т-клеткам. В конкретных вариантах осуществления количество, количество на объем, количество на вес и/или количество, уровень или процентное содержание клеток, подобных наивным, измеряются, оцениваются и/или количественно определяются в композиции CD4+ T-клеток и композиции CD8+ T-клеток перед смешиванием или объединением. В некоторых вариантах осуществления количество, уровень, количество, количество на объем, количество на вес и/или процентное содержание клеток, подобных наивным, измеряются, оцениваются и/или количественно определяются путем обнаружения CD45RA+; CCR7+ Т-клеток. В конкретных вариантах осуществления входная композиция клеток характеризуется составляющим от 2,2:1 до 0,8:1 отношением CD45RA+/CCR7+/CD4+ T-клеток к CD45RA+/CCR7+/CD8+ T-клеткам. В некоторых вариантах осуществления входная композиция клеток характеризуется составляющим или приблизительно составляющим 1,1:1 отношением CD45RA+/CCR7+/CD4+ T-клеток к CD45RA+/CCR7+/CD8+ T-клеткам.
В. Активация или стимуляция клеток
В некоторых вариантах осуществления клетки инкубируют и/или культивируют до, в связи и/или после процесса генной инженерии. В некоторых вариантах осуществления клетки инкубируют и/или культивируют до, во время или сразу после одной или более стадий, связанных с протоколом или процессом генной инженерии. Стадии инкубации могут включать культивирование, культивирование, стимуляцию, активацию и/или размножение. Инкубацию и/или конструирование можно проводить в сосуде для культивирования, таком как устройство, камера, лунка, колонка, пробирка, набор трубок, клапан, флакон, чашка для культивирования, мешок или другой контейнер для культуры или культивирования клеток. В некоторых вариантах осуществления композиции или клетки инкубируют в условиях стимуляции или в присутствии стимулирующего агента. Такие условия включают условия, предназначенные для индукции пролиферации, размножения, активации и/или выживания клеток в популяции, для имитации воздействия антигена и/или для примирования клеток для генной инженерии, например, для введения рекомбинантного рецептора антигена.
В некоторых вариантах осуществления предоставленные здесь способы включают одну или более стадий инкубации клеток в условиях стимуляции или активации. В некоторых вариантах осуществления клетки инкубируют в течение или приблизительно в течение 15 минут, 30 минут, 45 минут, 60 минут, 90 минут, 120 минут, 2 часов, 3 часов, 4 часов, 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часов, 36 часов, 1 дня, 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 7 дней или более 7 дней. В некоторых вариантах осуществления клетки инкубируют в течение от 5 минут до 90 минут, от 1 часа до 4 часов, от 2 часов до 8 часов, от 6 часов до 24 часов, от 12 часов до 48 часов, от 16 часов до 32 часов, от 18 часов до 30 часов, от 1 дня до 4 дней или от 2 дней до 7 дней. В некоторых вариантах осуществления клетки инкубируют в течение от 2 до 15 дней, от 2 до 12 дней, от 2 до 10 дней, от 2 до 8 дней, от 2 до 6 дней, от 2 до 4 дней, от 4 до 12 дней, от 4 до 10 дней, от 4 до 8 дней, от 4 до 6 дней, от 6 до 12 дней, от 6 до 10 дней, от 6 до 8 дней, от 8 до 12 дней, от 8 до 10 дней или от 10 до 12 дней. В некоторых вариантах осуществления клетки инкубируют в течение по крайней мере 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 7 дней, 8 дней, 9 дней, 10 дней, 11 дней, 12 дней, 13 дней, 14 дней или более 14 дней.
В некоторых вариантах осуществления клетки создают с помощью генной инженерии способом или процессом, который включает одну или более стадий переноса гена. В некоторых вариантах осуществления перенос гена осуществляется путем первой стимуляции клеток, например, путем инкубации клеток в условиях стимуляции, например, инкубации клеток со стимулом, который вызывает ответную реакцию, такую как пролиферация, выживание и/или активация, с последующим переносом гена. В некоторых вариантах осуществления клетки инкубируют в условиях стимуляции с целью активации клеток перед переносом гена. В некоторых вариантах осуществления перенос гена представляет собой или включает трансдукцию активированных клеток. В конкретных вариантах осуществления стимулирующие агенты или условия стимуляции индуцируют и/или способны индуцировать первичный сигнал, передачу сигналов, стимуляцию, активацию и/или размножение клеток.
В некоторых вариантах осуществления клетки, например клетки входной композиции клеток, инкубируют в условиях стимуляции или активации до переноса гена. В некоторых вариантах осуществления клетки инкубируют в условиях стимуляции или активации в течение или приблизительно в течение 15 минут, 30 минут, 45 минут, 60 минут, 90 минут, 120 минут, 2 часов, 3 часов, 4 часов, 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часов, 36 часов, 1 дня, 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 7 дней или более 7 дней. В некоторых вариантах осуществления клетки входной композиции клеток инкубируют в условиях стимуляции или активации в течение от 5 минут до 90 минут, от 1 часа до 4 часов, от 2 часов до 8 часов, от 6 часов до 24 часов, от 12 часов до 48 часов, от 16 часов до 32 часов, от 18 часов до 30 часов, от 1 дня до 4 дней или от 2 дней до 7 дней до переноса гена. В конкретных вариантах осуществления клетки входной композиции клеток инкубируют в условиях стимуляции или активации в течение от 2 до 15 дней, от 2 до 12 дней, от 2 до 12 дней, от 2 до 8 дней, от 2 до 6 дней, от 2 до 4 дней, от 4 до 12 дней, от 4 до 10 дней, от 4 до 8 дней, от 4 до 6 дней, от 6 до 12 дней, от 6 до 10 дней, от 6 до 8 дней, от 8 до 12 дней, от 8 до 10 дней или от 10 до 12 дней. В некоторых вариантах осуществления клетки инкубируют в течение по крайней мере 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 7 дней, 8 дней, 9 дней, 10 дней, 11 дней, 12 дней, 13 дней, 14 дней или более 14 дней.
В некоторых вариантах осуществления клетки инкубируют в условиях стимуляции или активации во время части или всего времени переноса гена. Например, в некоторых вариантах осуществления клетки инкубируют в условиях стимуляции в течение всего или части времени трансдукции или трансфекции клеток для введения гетерологичной нуклеиновой кислоты. В некоторых вариантах осуществления клетки инкубируют в условиях стимуляции или активации в присутствии вирусного вектора, например ретровирусного вектора, такого как гаммаретровирусный вектор или лентивирусный вектор.
В конкретных вариантах осуществления клетки инкубируют в условиях стимуляции или активации после, например, сразу после переноса гена. В некоторых вариантах осуществления клетки инкубируют в условиях стимуляции или активации после переноса гена, чтобы размножить клетки, например, чтобы размножить клетки до количеств, достаточных для клинических применений. В некоторых вариантах осуществления клетки инкубируют после переноса гена в условиях стимуляции или активации в течение или приблизительно в течение 15 минут, 30 минут, 45 минут, 60 минут, 90 минут, 120 минут, 2 часов, 3 часов, 4 часов, 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часов, 36 часов, 1 дня, 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 7 дней или более 7 дней. В некоторых вариантах осуществления композицию клеток инкубируют после переноса гена в условиях стимуляции или активации в течение от 5 минут до 90 минут, от 1 часа до 4 часов, от 2 часов до 8 часов, от 6 часов до 24 часов, от 12 часов до 48 часов, от 16 часов до 32 часов, от 18 часов до 30 часов, от 1 дня до 4 дней или от 2 дней до 7 дней до переноса гена. В некоторых вариантах осуществления клетки композиции инкубируют после переноса гена в условиях стимуляции или активации в течение от 2 до 15 дней, от 2 до 12 дней, от 2 до 12 дней, от 2 до 8 дней, от 2 до 6 дней, от 2 до 4 дней, от 4 до 12 дней, от 4 до 10 дней, от 4 до 8 дней, от 4 до 6 дней, от 6 до 12 дней, от 6 до 10 дней, от 6 до 8 дней, от 8 до 12 дней, от 8 до 10 дней или от 10 до 12 дней. В некоторых вариантах осуществления клетки инкубируют в течение по крайней мере 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 7 дней, 8 дней, 9 дней, 10 дней, 11 дней, 12 дней, 13 дней, 14 дней или более 14 дней. В некоторых вариантах осуществления клетки размножают в течение времени, достаточного для образования подходящего количества клеток для клинического применения.
Условия могут включать одно или более из следующего: конкретных сред, температуры, содержания кислорода, содержания углекислого газа, времени, агентов, например питательных веществ, аминокислот, антибиотиков, ионов и/или стимулирующих факторов, таких как цитокины, хемокины, антигены, партнеры по связыванию, слитые белки, рекомбинантные растворимые рецепторы и любые другие агенты, предназначенные для активации клеток.
В некоторых вариантах осуществления условия стимуляции или стимулирующие агенты индуцируют и/или способны индуцировать первичный сигнал, передачу сигналов, стимуляцию, активацию и/или размножение клеток.
В некоторых вариантах осуществления условия стимуляции или стимулирующие агенты включают один или более агентов, например лиганд, который способен активировать внутриклеточный сигнальный домен TCR комплекса. В некоторых аспектах агент включает или инициирует внутриклеточный сигнальный каскад от TCR/CD3 в Т-клетке. Такие агенты могут включать антитела, такие как антитела, специфические для TCR, например, против CD3. В некоторых вариантах осуществления условия стимуляции включают один или более агентов, например лиганд, который способен стимулировать костимулирующий рецептор, например антитело против CD28. В некоторых вариантах осуществления такие агенты и/или лиганды могут быть связаны с твердой подложкой, такой как шарик, и/или быть одним или более цитокинов. Необязательно, способ размножения может включать, кроме того, стадию добавления антитела против CD3 и/или против CD28 к культуральной среде (например, в концентрации, составляющей по крайней мере приблизительно 0,5 нг/мл). В некоторых вариантах осуществления стимулирующие агенты включают IL-2, IL-15 и/или IL-7. В конкретных вариантах осуществления агент представляет собой антитело, которое специфически связывается с рекомбинантным рецептором. В конкретных вариантах осуществления рекомбинантный рецептор представляет собой антигенсвязывающий рецептор, например CAR, а агент представляет собой антиидиотипическое антитело, которое специфически связывается с антигенсвязывающим рецептором.
В некоторых вариантах осуществления агенты и/или лиганды прикреплены к магнитным шарикам, таким как парамагнитные шарики (например, такие как шарики Dynalbeads или MACS). В некоторых вариантах осуществления шарики могут быть удалены из клеток путем помещения клеток в магнитное поле, таким образом удаляя и/или отделяя шарики от клеток, например, отгибая клетки. В некоторых вариантах осуществления шарики удаляют сразу после инкубации для активации клеток. В некоторых вариантах осуществления шарики удаляют до доставки гена, например, путем трансдукции или трансфекции. В некоторых вариантах осуществления шарики удаляют во время или сразу после доставки гена. В конкретных вариантах осуществления шарики удаляют до или во время инкубации для размножения клеток. В некоторых вариантах осуществления шарики удаляют до сбора и/или криозащиты клеток.
В некоторых аспектах инкубацию проводят в соответствии с такими методами, которые описаны в патенте США № 6040177, выданном Riddell et al., Klebanoff et al. (2012) J Immunother. 35 (9):651-660, Terakura et al. (2012) Blood.1:72-82 и/или Wang et al. (2012) J Immunother. 35 (9):689-701.
В некоторых вариантах осуществления Т-клетки размножают путем добавления к композиции для инициации культуры питающих клеток, таких как неделящиеся мононуклеарные клетки периферической крови (РВМС) (например, так, чтобы получающаяся популяция клеток содержала по крайней мере приблизительно 5, 10, 20 или 40 или более питающих клеток РВМС для каждого Т-лимфоцита в исходной популяции, которая будет размножена); и инкубации культуры (например, в течение времени, достаточного для увеличения числа Т-клеток). В некоторых аспектах неделящиеся питающие клетки могут включать подвергнутые гамма-облучению РВМС в качестве питающих клеток. В некоторых вариантах осуществления РВМС облучают гамма-лучами в диапазоне от приблизительно 3000 до 3600 рад для предотвращения деления клеток. В некоторых аспектах питающие клетки добавляют в культуральную среду до добавления популяций Т-клеток.
В некоторых вариантах осуществления условия стимуляции включают температуру, подходящую для роста Т-лимфоцитов человека, например, по крайней мере приблизительно 25 градусов Цельсия, как правило, по крайней мере приблизительно 30 градусов и, как правило, 37 градусов Цельсия или приблизительно 37 градусов Цельсия. Необязательно, инкубация может, кроме того, включать добавление неделящихся EBV-трансформированных лимфобластоидных клеток (LCL) в качестве питающих клеток. LCL можно облучать гамма-лучами в диапазоне от приблизительно 6000 до 10000 рад. В некоторых аспектах питающие клетки LCL предоставляются в любом подходящем количестве, таком как отношение питающих клеток LCL к исходным Т-лимфоцитам, составляющее по крайней мере приблизительно 10:1.
В некоторых вариантах осуществления антигенспецифические Т-клетки, такие как антигенспецифические CD4+ и/или CD8+ Т-клетки получают путем стимуляции антигеном наивных или антигенспецифических Т-лимфоцитов. Например, линии или клоны антигенспецифических Т-клеток могут быть созданы для антигенов цитомегаловируса путем выделения Т-клеток от инфицированных субъектов и стимуляции клеток in vitro тем же антигеном.
C. Генная инженерия
В некоторых вариантах осуществления предоставленные способы включают создание или получение композиции сконструированных клеток, например композиции клеток, содержащей клетки, которые экспрессируют рекомбинантный рецептор антигена. Различные способы введения генно-инженерных компонентов, например рекомбинантных рецепторов, например CAR или TCR, хорошо известны и могут использоваться с предоставленными способами и композициями. Приводимые в качестве примера способы включают способы переноса нуклеиновых кислот, кодирующих рецепторы, в том числе с помощью вирусной, например ретровирусной или лентивирусной трансдукции, транспозонов и электропорации.
В некоторых вариантах осуществления клетки входной композиции клеток приводят в контакт с одним или более агентов, содержащих нуклеиновую кислоту, например, которые кодируют рекомбинантный рецептор, такой как CAR, и/или такие агенты вводятся в указанные клетки. В некоторых вариантах осуществления агент представляет собой вектор, например вирусный вектор, плазмиду или транспозон. В некоторых вариантах осуществления клетки представляют собой CD4+ T-клетки. В некоторых вариантах осуществления клетки представляют собой CD8+ T-клетки. В конкретных вариантах осуществления введение и/или приведение клеток в контакт с нуклеиновой кислотой приводит к получению сконструированных клеток с определенным, желательным или фиксированным отношением сконструированных CD4+ T-клеток к сконструированным CD8+ T-клеткам. В некоторых вариантах осуществления нуклеиновые кислоты являются гетерологичными, т.е. обычно не присутствуют в клетке или образце, полученном из клетки, например, вводится полученная из другого организма или клетки нуклеиновая кислота, которая, например, обычно не обнаруживается в конструируемой клетке и/или организме, от которого происходит такая клетка. В некоторых вариантах осуществления нуклеиновые кислоты не встречаются в природе, например, вводится не встречающаяся в природе нуклеиновая кислота, включающая такую, которая содержит химерные комбинации нуклеиновых кислот, кодирующих различные домены из множества различных типов клеток.
В некоторых вариантах осуществления способы приготовления включают стадии замораживания, например, криоконсервации клеток, либо до, например, непосредственно до, во время или после, например, сразу после любой из стадий или стадий генной инженерии, и/или получение выходной композиции клеток, которая содержит генно-инженерные клетки. В некоторых вариантах осуществления клетки подвергают криоконсервации до, во время или после стадий выделения или отбора клеток, смешивания или объединения клеток во входную композицию клеток, инкубации, активации, переноса гена, трансдукции, трансфекции, размножения и/или сбора. В некоторых вариантах осуществления все или часть клеток собирают для замораживания. В некоторых вариантах осуществления часть клеток собирают до, во время или после стадии или этапа в процессе генной инженерии клеток для более позднего или последующего анализа, например, такого как анализ после того, как композиция сконструированных клеток была введена субъекту.
В некоторых вариантах осуществления стадия замораживания и последующего оттаивания удаляет гранулоциты и, в некоторой степени, моноциты в популяции клеток. В некоторых вариантах осуществления клетки суспендируют в растворе для замораживания, например, после стадии промывки для удаления плазмы и тромбоцитов. В некоторых аспектах может использоваться любой из ряда известных растворов и параметров замораживания. Один пример включает использование PBS, содержащего 20% DMSO и 8% сывороточного альбумина человека (HSA), или других подходящих сред для замораживания клеток. Затем осуществляют разведение 1: 1 средой, так что конечная концентрация DMSO и HSA составляет 10% и 4%, соответственно. Затем клетки, как правило, замораживают до -80°С со скоростью 1°С в минуту и хранят в газообразной фазе резервуара для хранения жидкого азота.
1. Векторы и методы генной инженерии
В некоторых вариантах осуществления рекомбинантные нуклеиновые кислоты переносятся в клетки с использованием инфекционных частиц рекомбинантных вирусов, таких как, например, векторы, происходящие из вакуолизирующего обезьяньего вируса (SV40), аденовирусов, аденоассоциированного вируса (AAV). В некоторых вариантах осуществления рекомбинантные нуклеиновые кислоты переносятся в Т-клетки с использованием рекомбинантных лентивирусных векторов или ретровирусных векторов, таких как гамма-ретровирусные векторы (смотрите, например, Koste et al. (2014) Gene Therapy 2014 Apr 3. doi: 10.1038/gt.2014.25; Carlens et al. (2000) Exp Hematol 28(10): 1137-46; Alonso-Camino et al. (2013) Mol Ther Nucl Acids 2, e93; Park et al., Trends Biotechnol. 2011 November 29(11):550–557). В некоторых вариантах осуществления вирус представляет собой аденоассоциированный вирус (AAV).
В некоторых вариантах осуществления ретровирусный вектор, например ретровирусный вектор, происходящий от вируса лейкоза мышей Молони (MoMLV), миелопролиферативного вируса саркомы (MPSV), вируса эмбриональных стволовых клеток мышей (MESV), вируса стволовых клеток мышей (MSCV), вируса некроза селезенки (SFFV), имеет последовательность длинного концевого повтора (LTR). Большинство ретровирусных векторов происходят от ретровирусов мышей. В некоторых вариантах осуществления ретровирусы включают те, которые происходят из любого источника клеток птиц или млекопитающих. Ретровирусы, как правило, являются амфотропными, что означает, что они способны инфицировать клетки-хозяева нескольких видов, включая людей. В одном варианте осуществления экспрессируемый ген заменяет ретровирусные последовательности gag, pol и/или env. Был описан ряд иллюстративных ретровирусных систем (например, патенты США с № 5219740; 6207453; 5219740; Miller and Rosman (1989) BioTechniques 7:980-990; Miller, A. D. (1990) Human Gene Therapy 1:5-14; Scarpa et al. (1991) Virology 180:849-852; Burns et al. (1993) Proc. Natl. Acad. Sci. USA 90:8033-8037; и Boris-Lawrie and Temin (1993) Cur. Opin. Genet. Develop. 3:102-109.
Способы лентивирусной трансдукции известны. Приводимые в качестве примера способы описаны, например, в Wang et al. (2012) J. Immunother. 35(9): 689-701; Cooper et al. (2003) Blood. 101:1637–1644; Verhoeyen et al. (2009) Methods Mol Biol. 506: 97-114; and Cavalieri et al. (2003) Blood. 102(2): 497-505.
В некоторых вариантах осуществления частицы вирусного вектора содержат геном, происходящий из вектора на основе ретровирусного генома, такой как происходящий из лентивирусного генома или вектора на основе гаммаретровируса. В некоторых аспектах предоставленных вирусных векторов гетерологичная нуклеиновая кислота, кодирующая рекомбинантный рецептор, такой как рецептор антигена, такой как CAR, содержится и/или расположена между последовательностями 5'-LTR и 3'-LTR векторного генома.
В некоторых вариантах осуществления геном вирусного вектора представляет собой геном лентивируса, такой как геном ВИЧ-1 или геном SIV. Например, лентивирусные векторы были сконструированы путем многократного ослабления генов вирулентности, например, гены env, vif, vpu и nef могут быть делетированы, что делает вектор более безопасным для терапевтических целей. Лентивирусные векторы известны. Смотрите Naldini et al., (1996 and 1998); Zufferey et al., (1997); Dull et al., 1998, патенты США с № 6013516 и 5994136). В некоторых вариантах осуществления эти вирусные векторы основаны на плазмидах или вирусах и сконфигурированы для переноса необходимых последовательностей для включения чужеродной нуклеиновой кислоты, для отбора и для переноса нуклеиновой кислоты в клетку-хозяина. Известные лентивирусы могут быть легко получены из депозитариев или коллекций, таких как Американская коллекция типовых культур («ATCC»; 10801 University Blvd., Manassas, VA. 20110-2209), или выделены из известных источников с использованием общедоступных методов.
Неограничивающие примеры лентивирусных векторов включают векторы, происходящие из лентивируса, такие как вирус иммунодефицита человека 1 (ВИЧ-1), ВИЧ-2, вирус иммунодефицита обезьян (SIV), T-лимфотропный вирус 1 человека (HTLV-1), HTLV-2 или вирус инфекционной анемии лошадей (ElAV). Например, лентивирусные векторы были сконструированы путем многократного ослабления генов вирулентности ВИЧ, например, гены env, vif, vpr, vpu и nef делетируются, что делает вектор более безопасным для терапевтических целей. Лентивирусные векторы известны в данной области, смотрите Naldini et al., (1996 and 1998); Zufferey et al., (1997); Dull et al., 1998, патенты США с № 6013516 и 5994136). В некоторых вариантах осуществления эти вирусные векторы основаны на плазмидах или вирусах и сконфигурированы для переноса необходимых последовательностей для включения чужеродной нуклеиновой кислоты, для отбора и для переноса нуклеиновой кислоты в клетку-хозяина. Известные лентивирусы могут быть легко получены из депозитариев или коллекций, таких как Американская коллекция типовых культур («ATCC»; 10801 University Blvd., Manassas, VA. 20110-2209), или выделены из известных источников с использованием общедоступных методов.
В некоторых вариантах осуществления вектор на основе вирусного генома может содержать последовательности 5'- и 3'-LTR ретровируса, такого как лентивирус. В некоторых аспектах конструкция на основе вирусного генома может содержать последовательности из 5'- и 3'-LTR лентивируса и, в частности, может содержать последовательности R и U5 из 5'-LTR лентивируса и инактивированную или самоинактивирующуюся последовательность 3'-LTR из лентивируса. Последовательности LTR могут быть последовательностями LTR из любого лентивируса из любого вида. Например, они могут быть последовательностями LTR из ВИЧ, SIV, FIV или BIV. Как правило, последовательности LTR представляют собой последовательности LTR ВИЧ.
В некоторых вариантах осуществления в нуклеиновой кислоте вирусного вектора, такого как ВИЧ вирусный вектор, нет дополнительных транскрипционных единиц. Векторный геном может содержать инактивированную или самоактивирующуюся последовательность 3'-LTR (Zufferey et al. J Virol 72: 9873, 1998; Miyoshi et al., J Virol 72:8150, 1998). Например, делеция в области U3 3'-LTR нуклеиновой кислоты, используемой для продуцирования вирусной векторной РНК, может использоваться для получения самоинактивирующихся (SIN) векторов. Затем эта делеция может быть перенесена в 5'-LTR провирусной ДНК во время обратной транскрипции. Самоинактивирующийся вектор, как правило, имеет делецию энхансерной и промоторной последовательностей из 3'-длинного концевого повтора (LTR), которая копируется в 5'-LTR во время интеграции вектора. В некоторых вариантах осуществления может быть элиминировано достаточно последовательности, включая удаление блока TATA, чтобы отменить транскрипционную активность LTR. Это может предотвратить продукцию полноразмерной векторной РНК в трансдуцированных клетках. В некоторых аспектах элемент U3 3'-LTR содержит делецию своей энхансерной последовательности, бокса TATA, сайтов для Spl и NF-каппа B. В результате самоинактивирующегося 3'-LTR провирус, который образуется после проникновения и обратной транскрипции, содержит инактивированный 5'-LTR. Это может повысить безопасность за счет снижения риска мобилизации векторного генома и влияния LTR на соседние клеточные промоторы. Самоактивирующийся 3'-LTR может быть сконструирован любым способом, известным в данной области техники. В некоторых вариантах осуществления это не влияет на титры вектора или свойства вектора in vitro или in vivo.
Необязательно, последовательность U3 из лентивирусного 5'-LTR может быть заменена на промоторную последовательность в вирусной конструкции, такую как гетерологичная промоторная последовательность. Это может увеличить титр вируса, выделяемого из линии пакующих клеток. Также может быть включена энхансерная последовательность. Может быть использована любая комбинация энхансер/промотор, которая увеличивает экспрессию вирусного РНК-генома в линии пакующих клеток. В одном примере используется последовательность энхансер/промотор CMV (патент США с № 5385839 и патент США с № 5168062).
В некоторых вариантах осуществления риск инсерционного мутагенеза может быть минимизирован при конструировании генома ретровирусного вектора, такого как геном лентивирусного вектора, с дефектом интеграции. Можно использовать ряд подходов для получения не интегрирующегося векторного генома. В некоторых вариантах осуществления мутация(и) может быть встроена в ферментный компонент интегразы гена pol, так что она кодирует белок с неактивной интегразой. В некоторых вариантах осуществления сам геном вектора можно модифицировать, чтобы предотвратить интеграцию, например, путем мутации или делеции одного или обоих сайтов присоединения, или делая 3'-LTR-проксимальный полипуриновый участок (PPT) нефункциональным посредством делеции или модификации. В некоторых вариантах осуществления доступны негенетические подходы; к ним относятся фармакологические агенты, которые ингибируют одну или более функций интегразы. Подходы не являются взаимоисключающими; т.е. более одного из них могут быть использованы одновременно. Например, как сайты для интегразы, так и сайты присоединения могут быть нефункциональными, или сайт для интегразы и PPT могут быть нефункциональными, или сайты присоединения и сайт PPT могут быть нефункциональными, или все они могут быть нефункциональными. Такие способы и геномы вирусных векторов известны и доступны (смотрите Philpott and Thrasher, Human Gene Therapy 18:483, 2007; Engelman et al. J Virol 69:2729, 1995; Brown et al J Virol 73:9011 (1999); WO 2009/076524; McWilliams et al., J Virol 77:11150, 2003; Powell and Levin J Virol 70:5288, 1996).
В некоторых вариантах осуществления предоставленные способы включают способы трансдукции клеток путем контактирования, например, инкубации, композиции клеток, содержащей множество клеток, с вирусной частицей. В некоторых вариантах осуществления клетки, подвергаемые трансфекции или трансдукции, представляют собой или включают первичные клетки, полученные от субъекта, такие как клетки, обогащенные и/или отобранные от субъекта.
В некоторых вариантах осуществления концентрация подвергаемых трансдукции клеток композиции составляет от или приблизительно от 1,0×105 клеток/мл до 1,0×108 клеток/мл, например по крайней мере или приблизительно по крайней мере или приблизительно 1,0х105 клеток/мл, 5х105 клеток/мл, 1х106 клеток/мл, 5х106 клеток/мл, 1х107 клеток/мл, 5х107 клеток/мл или 1х108 клеток/мл.
В некоторых вариантах осуществления вирусные частицы предоставляются в определенном соотношении копий частиц вирусного вектора или их инфекционных единиц (IU) на общее число клеток, которые должны быть трансдуцированы (IU/клетка). Например, в некоторых вариантах осуществления вирусные частицы присутствуют во время контакта в или приблизительно в или по крайней мере в соотношении, составляющем или приблизительно составляющем или по крайней мере или приблизительно 0,5, 1, 2, 3, 4, 5, 10, 15, 20, 30, 40, 50 или 60 IU частиц вирусного вектора на одну клетку.
В некоторых вариантах осуществления титр частиц вирусного вектора находится между или приблизительно между 1×106 IU/мл и 1×108 IU/мл, например между или приблизительно между 5×106 IU/мл и 5×107 IU/мл, например составляет по крайней мере 6×106 IU/мл, 7×106 IU/мл, 8×106 IU/мл, 9×106 IU/мл, 1×107 IU/мл, 2×107 IU/мл, 3×107 IU/мл, 4×107 IU/мл или 5×107 IU/мл.
В некоторых вариантах осуществления трансдукция может быть достигнута при множественности инфицирования (MOI), составляющей менее 100, например, как правило, менее 60, 50, 40, 30, 20, 10, 5 или меньше.
В некоторых вариантах осуществления способ включает контактирование или инкубацию клеток с вирусными частицами. В некоторых вариантах осуществления контактирование осуществляют в течение от 30 минут до 72 часов, например от 30 минут до 48 часов, от 30 минут до 24 часов или от 1 часа до 24 часов, например по крайней мере или приблизительно по крайней мере 30 минут, 1 час, 2 часа, 6 часов, 12 часов, 24 часа, 36 часов и более.
В некоторых вариантах осуществления контактирование может быть осуществлено с помощью центрифугирования, такого как спиннокуляция (например, центрифужная инокуляция). В некоторых вариантах осуществления композицию, содержащую клетки, вирусные частицы и реагент, можно вращать, как правило, с относительно низкой силой или скоростью, такой как скорость, меньшая скорости, используемой для осаждения клеток, например от или приблизительно от 600 об/мин до 1700 об/мин (например, составляющей или составляющей приблизительно или по крайней мере 600 об/мин, 1000 об/мин или 1500 об/мин или 1700 об/мин). В некоторых вариантах осуществления вращение осуществляется с силой, например, относительной центробежной силой, от или приблизительно от 100хg до 3200хg (например, составляющей или составляющей приблизительно или по крайней мере или приблизительно 100хg, 200хg 300хg, 400хg, 500хg, 1000хg, 1500хg, 2000хg, 2500хg, 3000хg или 3200хg), как измерено, например, на внутренней или внешней стенке камеры или полости. Термин «относительная центробежная сила» или RCF, как правило, понимается как эффективное усилие, накладываемое на объект или вещество (например, клетку, образец или осадок и/или точку в камере или другом вращающемся контейнере), относительно гравитационной силы Земли, в определенной точке пространства по сравнению с осью вращения. Значение может быть определено с использованием известных формул с учетом силы тяжести, скорости вращения и радиуса вращения (расстояния от оси вращения и объекта, вещества или частицы, на которых измеряется RCF).
В некоторых вариантах осуществления исходные клетки обрабатывают, инкубируют или контактируют с частицами, которые включают связывающие молекулы, которые связываются или распознают рекомбинантный рецептор, который кодируется вирусной ДНК.
В некоторых вариантах осуществления рекомбинантные нуклеиновые кислоты переносятся в Т-клетки посредством электропорации (смотрите, например, Chicaybam et al, (2013) PLoS ONE 8(3): e60298 и Van Tedeloo et al. (2000) Gene Therapy 7(16):1431-1437). В некоторых вариантах осуществления рекомбинантные нуклеиновые кислоты переносятся в Т-клетки посредством транспозиции (смотрите, например, Manuri et al. (2010) Hum Gene Ther 21(4): 427-437; Sharma et al. (2013) Molec Ther Nucl Acids 2, e74; и Huang et al. (2009) Methods Mol Biol 506:115-126). Другие способы введения и экспрессии генетического материала в иммунных клетках включают трансфекцию с использованием фосфата кальция (например, как описано в Current Protocols in Molecular Biology, John Wiley & Sons, New York. NY), слияние протопластов, трансфекцию с использованием катионных липосом; бомбардировку микрочастицами с помощью частиц вольфрама (Johnston, Nature, 346: 776-777 (1990)); и копреципитацию ДНК с использованием фосфата стронция (Brash et al., Mol. Cell Biol., 7:2031-2034 (1987)).
Другими подходами и векторами для переноса нуклеиновых кислот, кодирующих рекомбинантные продукты, являются те, которые описаны, например, в международной заявке на патент, публикации №: WO2014055668 и патенте США с № 7446190.
В некоторых вариантах осуществления рекомбинантные нуклеиновые кислоты переносятся в Т-клетки с помощью транспозонов. Примеры транспозонов, подходящих для использования с клетками млекопитающих, например, первичными лейкоцитами человека, включают, но без ограничения ими, Sleeping Beauty и Piggybac. Трансфекция на основе транспозонов представляет собой двухкомпонентную систему, состоящую из транспозазы и транспозона. В некоторых вариантах осуществления система включает транспозон, сконструированный так, чтобы включать чужеродную ДНК (также называемую здесь ДНК-грузом), например, ген, кодирующий рекомбинантный рецептор, который фланкирован последовательностями инвертированных повторов/прямых повторов (IR/DR), которые распознаются сопровождающей транспозазой. В некоторых вариантах осуществления невирусная плазмида кодирует транспозазу под контролем промотора. В некоторых вариантах осуществления трансфекция плазмиды в клетку-хозяина приводит к транзиторной экспрессии транспозазы на уровнях, достаточных для интеграции транспозона в геномную ДНК.
Sleeping Beauty (SB) является синтетическим членом суперсемейства транспозонов Tc1/mariner, реконструированных из неактивных элементов, содержащихся в геноме лососевых рыб. Трансфекция на основе SB-транспозона представляет собой двухкомпонентную систему, состоящую из транспозазы и транспозона, содержащего последовательности инвертированных повторов/прямых повторов (IR/DR), которые приводят к точной интеграции в динуклеотид ТА. Транспозон разрабатывается вместе с представляющей интерес экспрессионной кассетой, фланкированной IR/DR. Транспозаза SB связывается со специфическими сайтами связывания, которые расположены в IR транспозона Sleeping Beauty. Транспозаза SB опосредует интеграцию транспозона, мобильного элемента, кодирующего последовательность-груз, фланкированную с обеих сторон инвертированными концевыми повторами, которые содержат сайты связывания для каталитического фермента (SB). Стабильная экспрессия возникает, когда SB вставляет последовательности генов в хромосомы позвоночных в динуклеотид-мишень ТА посредством механизма вырезания и вставки. Эта система использовалась для конструирования ряда типов клеток позвоночных, включая первичные лейкоциты периферической крови человека. В некоторых вариантах осуществления клетки контактируют, инкубируют и/или обрабатывают транспозоном SB, содержащим ген-груз, например ген, кодирующий рекомбинантный рецептор или CAR, фланкированный последовательностями IR SB. В конкретных вариантах осуществления клетки, подвергаемые трансфекции, приводят в контакт, инкубируют и/или обрабатывают плазмидой, включающей транспозон SB, содержащий ген-груз, например ген, кодирующий CAR, фланкированный последовательностями IR SB. В некоторых вариантах осуществления плазмида содержит, кроме того, кодирующий транспозазу SB ген, который не фланкирован последовательностями IR SB.
PiggyBac (PB) представляет собой другую систему транспозонов, которая может использоваться для интеграции ДНК-груза в геномную ДНК хозяина, например человека. Транспозаза PB распознает специфические для транспозона PB последовательности инвертированных концевых повторов (ITR), расположенные на обоих концах транспозона, и эффективно перемещает содержимое из исходных сайтов и эффективно интегрирует их в хромосомные сайты TTAA. Система транспозонов PB позволяет представляющим интерес геном, расположенным между двумя ITR в векторе PB, быть подвижными в геномах-мишенях. Система PB использовалась для конструирования ряда типов клеток позвоночных, включая первичные клетки человека. В некоторых вариантах осуществления клетки, подвергаемые трансфекции, приводят в контакт, инкубируют и/или обрабатывают транспозоном PB, содержащим ген-груз, например ген, кодирующий CAR, фланкированный последовательностями IR PB. В конкретных вариантах осуществления клетки, подвергаемые трансфекции, приводят в контакт, инкубируют и/или обрабатывают плазмидой, включающей транспозон PB, содержащий ген-груз, например кодирующий CAR ген, фланкированный последовательностями IR PB. В некоторых вариантах осуществления плазмида содержит, кроме того, кодирующий транспозазу PB ген, который не фланкирован последовательностями IR PB.
В некоторых вариантах осуществления трансдукцию с помощью транспозонов выполняют с использованием плазмиды, которая включает ген транспозазы, и плазмиды, которая включает транспозон, который содержит последовательность ДНК-груза, которая фланкирована последовательностями инвертированных повторов/прямых повторов (IR/DR), которые распознаются транспозазой. В некоторых вариантах осуществления последовательность ДНК-груза кодирует гетерологичный белок, например рекомбинантный Т-клеточный рецептор или CAR. В некоторых вариантах осуществления плазмида включает транспозазу и транспозон. В некоторых вариантах осуществления транспозаза находится под контролем убиквитарного промотора или любого промотора, подходящего для управления экспрессией транспозазы в клетке-мишени. Убиквитарные (повсеместно распространенные) промоторы включают, но без ограничения ими, EFla, CMB, SV40, PGK1, Ubc, β-актин человека, CAG, TRE, UAS, Ac5, CaMKIIa и U6. В некоторых вариантах осуществления ДНК-груз содержит селективную кассету, позволяющую отбирать клетки со стабильной интеграцией ДНК-груза в геномную ДНК. Подходящие селективные кассеты включают, но без ограничения ими, селективные кассеты, кодирующие ген устойчивости к канамицину, ген устойчивости к спектиномицину, ген устойчивости к стрептомицину, ген устойчивости к ампициллину, ген устойчивости к карбенициллину, ген устойчивости к гигромицину, ген устойчивости к блеомицину, ген устойчивости к эритромицину и ген устойчивости к полимиксину B.
В некоторых вариантах осуществления компоненты для трансдукции с помощью транспозона, например, плазмиды, содержащие транспозазу SB и транспозон SB, вводят в клетку-мишень. Может использоваться любой удобный протокол, в котором может предусматриваться введение компонентов системы in vitro или in vivo в клетку-мишень, в зависимости от местонахождения клетки-мишени. Например, если клетка-мишень представляет собой выделенную клетку, система может вводиться непосредственно в клетку в условиях культивирования клеток, допускающих жизнеспособность клетки-мишени, например, с использованием стандартных методов трансформации. Такие методы включают, но без ограничения ими: инфицирование вирусами, трансформацию, конъюгацию, слияние протопластов, электропорацию, технологию генной пушки, преципитацию с использованием фосфата кальция, прямую микроинъекцию, доставку вирусного вектора и т.п. Выбор метода, как правило, зависит от типа трансформируемой клетки и обстоятельств, при которых происходит трансформация (т.е. in vitro, ex vivo или in vivo). Общее обсуждение этих методов можно найти в Ausubel, et al., Short Protocols in Molecular Biology, 3-е изд., Wiley & Sons, 1995.
В некоторых вариантах осуществления транспозон SB и источник транспозазы SB вводятся в клетку-мишень многоклеточного организма, например млекопитающего или человека, в условиях, достаточных для вырезания фланкированной инвертированными повторами нуклеиновой кислоты из вектора, несущего транспозон, и последующей интеграции вырезанной нуклеиновой кислоты в геном клетки-мишени. Некоторые варианты осуществления включают, кроме того, стадию обеспечения того, что требуемая транспозазная активность присутствует в клетке-мишени вместе с введенным транспозоном. В зависимости от структуры самого вектора с транспозоном, т.е. того, включает ли вектор область, кодирующую продукт, обладающий транспозазной активностью, способ может включать, кроме того, введение в клетку-мишень второго вектора, который кодирует требуемую транспозазную активность.
В некоторых вариантах осуществления количество векторной нуклеиновой кислоты, включающей транспозон, и количество векторной нуклеиновой кислоты, кодирующей транспозазу, которая вводится в клетку, является достаточным для обеспечения желательного вырезания и вставки нуклеиновой кислоты транспозона в геном клетки-мишени. По сути, количество введенной векторной нуклеиновой кислоты должно обеспечивать достаточную степень транспозазной активности и достаточное число копий нуклеиновой кислоты, которое желательно вставить в клетку-мишень. Количество векторной нуклеиновой кислоты, которая вводится в клетку-мишень, изменяется в зависимости от эффективности конкретного применяемого протокола введения, например, конкретного применяемого протокола введения ex vivo.
После того, как векторная ДНК проникла в клетку-мишень в комбинации с требуемой транспозазой, область нуклеиновой кислоты вектора, которая фланкирована инвертированными повторами, т.е. векторная нуклеиновая кислота, расположенная между распознаваемыми транспозазой Sleeping Beauty инвертированными повторами, вырезается из вектора с помощью предоставленной транспозазы и вставляется в геном клетки-мишени. По сути, введение векторной ДНК в клетку-мишень сопровождается последующим опосредованным транспозазой вырезанием и вставкой экзогенной нуклеиновой кислоты, переносимой вектором, в геном клетки-мишени. В конкретных вариантах осуществления вектор интегрируется в геномы по крайней мере 1%, по крайней мере 2%, по крайней мере 3%, по крайней мере 4%, по крайней мере 5%, по крайней мере 6%, по крайней мере 7%, по крайней мере 8%, по крайней мере 9%, по крайней мере 10%, по крайней мере 15% или по крайней мере 20% клеток, которые трансфицируются транспозоном SB и/или транспозазой SB. В некоторых вариантах осуществления интеграция нуклеиновой кислоты в геном клетки-мишени является стабильной, т.е. векторная нуклеиновая кислота остается в геноме клетки-мишени в течение более чем переходного периода времени и передается на части хромосомного генетического материала потомству клетки-мишени.
В некоторых вариантах осуществления транспозоны используются для интеграции нуклеиновых кислот, т.е. полинуклеотидов, различных размеров в геном клетки-мишени. В некоторых вариантах осуществления размер ДНК, которая вставляется в геном клетки-мишени с использованием рассматриваемых способов, находится в диапазоне приблизительно от 0,1 т.п.н. до 200 т.п.н., от приблизительно 0,5 т.п.н. до 100 т.п.н., от приблизительно 1,0 т.п.н. до приблизительно 8,0 т.п.н., от приблизительно 1,0 до приблизительно 200 т.п.н., от приблизительно 1,0 до приблизительно 10 т.п.н., от приблизительно 10 т.п.н. до приблизительно 50 т.п.н., от приблизительно 50 т.п.н. до приблизительно 100 т.п.н. или от приблизительно 100 т.п.н. до приблизительно 200 т.п.н. В некоторых вариантах осуществления размер ДНК, которая вставляется в геном клетки-мишени с использованием рассматриваемых способов, находится в диапазоне от приблизительно 1,0 т.п.н. до приблизительно 8,0 т.п.н. В некоторых вариантах осуществления размер ДНК, которая вставляется в геном клетки-мишени с использованием рассматриваемых способов, находится в диапазоне приблизительно от 1,0 до приблизительно 200 т.п.н. В конкретных вариантах осуществления размер ДНК, которая вставляется в геном клетки-мишени с использованием рассматриваемых способов, находится в диапазоне от приблизительно 1,0 т.п.н. до приблизительно 8,0 т.п.н.
В некоторых вариантах осуществления клетки, например Т-клетки, могут быть либо во время, либо после размножения, трансфицированы, например, Т-клеточным рецептором (TCR) или химерным рецептором антигена (CAR). Эта трансфекция для введения гена желательного рецептора может быть осуществлена с использованием, например, любого подходящего ретровирусного вектора. Затем популяция генетически модифицированных клеток может быть освобождена от исходного стимула (например, стимула в форме антитела против CD3/против CD28) и впоследствии подвергнута стимулированию с использованием второго типа стимула, например, через de novo введенный рецептор). Этот второй тип стимула может включать антигенный стимул в форме молекулы пептид/МНС, узнаваемого (сшивающего) лиганда генетически введенного рецептора (например, природного лиганда CAR) или любого лиганда (такого как антитело), который непосредственно связывается в пределах нового рецептора (например, путем распознавания константных областей внутри рецептора). Смотрите, например, Cheadle et al, “Chimeric antigen receptors for T-cell based therapy” Methods Mol Biol. 2012; 907:645-66 или Barrett et al., Chimeric Antigen Receptor Therapy for Cancer Annual Review of Medicine Vol. 65:333-347 (2014).
В некоторых случаях может использоваться вектор, который не требует активации клеток, например T-клеток. В некоторых таких случаях клетки могут быть отобраны и/или трансдуцированы до активации. Таким образом, клетки могут быть сконструированы до или после культивирования клеток, а в некоторых случаях одновременно или во время, по крайней мере, части культивирования.
Среди дополнительных нуклеиновых кислот, например, гены для введения представляют собой гены, которые увеличивают эффективность терапии, например, путем повышения жизнеспособности и/или функции трансфицированных клеток; гены для обеспечения генетического маркера для отбора и/или оценки клеток, например, для оценки выживаемости или локализации in vivo; гены для повышения безопасности, например, делая клетку восприимчивой к отрицательной селекции in vivo, как описано Lupton S. D. et al., Mol. and Cell Biol., 11:6 (1991); и Riddell et al., Human Gene Therapy 3:319-338 (1992); смотрите также публикации PCT/US91/08442 и PCT/US94/05601, на имя Lupton и др., в которых описывается использования бифункциональных селектируемых слитых генов, полученных в результате слияния доминантного позитивно селектируемого маркера с негативно селектируемым маркером. Смотрите, например, Riddell et al., патент США с № 6040177, столбцы 14-17.
2. Рекомбинантные рецепторы
В некоторых вариантах осуществления клетки для применения или введения в связи с предоставленными способами содержат или сконструированы так, чтобы содержать сконструированный рецептор, например сконструированный рецептор антигена, такой как химерный рецептор антигена (CAR) или Т-клеточный рецептор (TCR). Также предоставляются популяции таких клеток, композиции, содержащие такие клетки и/или обогащенные такими клетками, например, в которых клетки определенного типа, такие как Т-клетки или CD8+ или CD4+ Т-клетки, обогащены или отобраны. Среди композиций имеются фармацевтические композиции и препараты для введения, например, для адоптивной клеточной терапии. Также предоставляются способы введения клеток и композиций субъектам, например, пациентам, в соответствии с предоставленными способами и/или с предоставленными изделиями или композициями.
В некоторых вариантах осуществления клетки включают одну или более нуклеиновых кислот, введенных с помощью генной инженерии, и тем самым экспрессируют рекомбинантные или генно-инженерные продукты таких нуклеиновых кислот. В некоторых вариантах осуществления перенос гена осуществляется путем первой стимуляции клеток, например, путем сочетания его со стимулом, который индуцирует ответную реакцию, такую как пролиферация, выживание и/или активация, например, определяемую по экспрессии цитокина или маркера активации, с последующей трансдукцией активированных клеток и размножением в культуре до количеств, достаточных для клинических применений.
Клетки, как правило, экспрессируют рекомбинантные рецепторы, такие как рецепторы антигенов, включая функциональные не являющиеся TCR рецепторы антигенов, например химерные рецепторы антигенов (CAR), и другие антигенсвязывающие рецепторы, такие как трансгенные T-клеточные рецепторы (TCR). Также среди рецепторов есть и другие химерные рецепторы.
а. Химерные рецепторы антигенов (CAR)
В некоторых вариантах осуществления предоставленных способов и применений химерные рецепторы, такие как химерные рецепторы антигенов, содержат один или более доменов, которые объединяют лиганд-связывающий домен (например, антитело или фрагмент антитела), который обеспечивает специфичность к желательному антигену (например, опухолевому антигену), с внутриклеточными сигнальными доменами. В некоторых вариантах осуществления внутриклеточный сигнальный домен представляет собой часть активирующего внутриклеточного домена, такую как Т-клеточный активирующий домен, обеспечивающий первичный сигнал активации. В некоторых вариантах осуществления внутриклеточный сигнальный домен содержит или дополнительно содержит костимулирующий сигнальный домен для облегчения эффекторных функций. В некоторых вариантах осуществления химерные рецепторы при генной инженерии в иммунных клетках могут модулировать активность Т-клеток и, в некоторых случаях, могут модулировать дифференцировку или гомеостаз Т-клеток, тем самым приводя к получению генно-инженерных клеток с увеличенным сроком жизни, выживанием и/или устойчивостью in vivo, например, для использования в способах адоптивной клеточной терапии.
В некоторых вариантах осуществления предоставляются сконструированные клетки, такие как Т-клетки, которые экспрессируют CAR со специфичностью к конкретному антигену (или маркеру или лиганду), такому как антиген, экспрессируемый на поверхности определенного типа клеток. В некоторых вариантах антиген представляет собой полипептид. В некоторых вариантах осуществления антиген представляет собой углевод или другую молекулу. В некоторых вариантах осуществления антиген селективно экспрессируется или сверхэкспрессируется в клетках заболевания или состояния, например, опухоли или патогенных клетках, по сравнению с нормальными или не являющимися мишенями клетками или тканями. В других вариантах осуществления антиген экспрессируется в нормальных клетках и/или экспрессируется в сконструированных клетках.
В конкретных вариантах осуществления рекомбинантный рецептор, такой как химерный рецептор, содержит внутриклеточную сигнальную область, которая включает цитоплазматический сигнальный домен (также взаимозаменяемо называемый внутриклеточным сигнальным доменом), такой как цитоплазматическая (внутриклеточная) область, способная индуцировать первичный сигнал активации в Т-клетке, например цитоплазматический сигнальный домен компонента Т-клеточного рецептора (TCR) (например, цитоплазматический сигнальный домен дзета-цепи CD3-дзета (CD3ζ) или его функциональный вариант или сигнальная часть), и/или которая включает мотив активации иммунорецепторов на основе тирозина (ITAM).
В некоторых вариантах осуществления химерный рецептор содержит, кроме того, экстраклеточный лиганд-связывающий домен, который специфически связывается с лигандом (например, антигеном). В некоторых вариантах осуществления химерный рецептор представляет собой CAR, который содержит экстраклеточный распознающий антиген домен, который специфически связывается с антигеном. В некоторых вариантах осуществления лиганд, такой как антиген, представляет собой белок, экспрессируемый на поверхности клеток. В некоторых вариантах осуществления CAR представляет собой CAR типа TCR, а антиген представляет собой процессированный пептидный антиген, такой как пептидный антиген внутриклеточного белка, который, подобно TCR, распознается на поверхности клетки в связи с молекулой главного комплекса гистосовместимости (MHC).
Приводимые в качестве примера рецепторы антигенов, включая CAR, и способы конструирования и введения таких рецепторов в клетки включают те, которые описаны, например, в публикациях международных заявок на патенты с №: WO200014257, WO2013126726, WO2012/129514, WO2014031687, WO2013/166321, WO2013/071154, WO2013/123061, публикациях заявок на патенты США с №: US2002131960, US2013287748, US20130149337, патентах США с №: 6451995, 7446190, 8252592, 8339645, 8398282, 7446179, 6410319, 7070995, 7265209, 7354762, 7446191, 8324353 и 8479118, и Европейской патентной заявке № EP2537416, и/или те, которые описаны в Sadelain et al., Cancer Discov. 2013 April; 3(4): 388–398; Davila et al. (2013) PLoS ONE 8(4):e61338; Turtle et al., Curr. Opin. Immunol., 2012 October; 24(5):633-39; Wu et al., Cancer, 2012 March 18(2):160-75. В некоторых аспектах рецепторы антигенов включают CAR, описанный в патенте США с № 7446190, и рецепторы, описанные в публикации международной заявки на патент: WO/2014055668 A1. Примеры CAR включают CAR, раскрытые в любой из вышеупомянутых публикаций, таких как WO2014031687, US 8339645, US 7446179, US 2013/0149337, патент США с № 7446190, патент США с № 8389,282, Kochenderfer et al., 2013, Nature Reviews Clinical Oncology, 10, 267-276 (2013); Wang et al. (2012) J. Immunother. 35(9):689-701; и Brentjens et al., Sci Transl Med. 2013 5(177). Смотрите также WO2014031687, US 8339645, US 7446179, US 2013/0149337, патент США с № 7446190 и патент США с № 8389282.
В некоторых вариантах осуществления, CAR конструируется со специфичностью к конкретному антигену (или маркеру или лиганду), такому как антиген, экспрессируемый в конкретном типе клеток, на который будет направлена адоптивная терапия, например, раковый маркер, и/или антиген, предназначенный для индукции сдерживающей реакции, такой как антиген, экспрессируемый на нормальных или не пораженных болезнью клетках. Таким образом, CAR, как правило, включает в своей экстраклеточной части одну или более антигенсвязывающих молекул, таких как один или более антигенсвязывающих фрагментов, доменов или частей, или один или более вариабельных доменов антител, и/или молекул антител. В некоторых вариантах осуществления CAR включает антигенсвязывающую часть или части молекулы антитела, такие как одноцепочечный фрагмент антитела (scFv), происходящий из вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL) моноклонального антитела (мАт).
В некоторых вариантах осуществления антитело или его антигенсвязывающая часть экспрессируется на клетках в виде части рекомбинантного рецептора, такого как рецептор антигена. Среди рецепторов антигенов находятся функциональные не являющиеся TCR рецепторы антигенов, такие как химерные рецепторы антигенов (CAR). Как правило, CAR, содержащий антитело или антигенсвязывающий фрагмент, который проявляет TCR-подобную специфичность к комплексам пептид-MHC, также может называться CAR типа TCR. В некоторых вариантах осуществления экстраклеточный антигенсвязывающий домен, специфический для комплекса MHC-пептид, CAR типа TCR связан с одним или более внутриклеточных сигнальных компонентов, в некоторых аспектах через линкеры и/или трансмембранный домен(ы). В некоторых вариантах осуществления такие молекулы обычно могут имитировать или аппроксимировать сигнал через природный рецептор антигена, такой как TCR, и, необязательно, сигнал через такой рецептор в сочетании с костимулирующим рецептором.
В некоторых вариантах осуществления рекомбинантный рецептор, такой как химерный рецептор (например CAR), включает лиганд-связывающий домен, который связывается, например специфически связывается, с антигеном (или лигандом). Среди антигенов, на которые нацелены химерные рецепторы, есть антигены, экспрессируемые в связи с заболеванием, состоянием или типом клеток, который является мишенью при адоптивной клеточной терапии. К числу заболеваний и состояний относятся пролиферативные, неопластические и злокачественные заболевания и нарушения, включая раки и опухоли, в том числе гематологические раковые заболевания, раки иммунной системы, такие как лимфомы, лейкозы и/или миеломы, такие как B-клеточные, T-клеточные и миелоидные лейкозы, лимфомы и множественные миеломы.
В некоторых вариантах осуществления антиген (или лиганд) представляет собой полипептид. В некоторых вариантах осуществления он представляет собой углевод или другую молекулу. В некоторых вариантах осуществления антиген (или лиганд) селективно экспрессируется или сверхэкспрессируется на клетках заболевания или состояния, например, опухоли или патогенных клетках, по сравнению с нормальными или не являющимися мишенями клетками или тканями. В других вариантах осуществления антиген экспрессируется в нормальных клетках и/или экспрессируется в сконструированных клетках.
В некоторых вариантах осуществления CAR содержит антитело или антигенсвязывающий фрагмент (например, scFv), который специфически распознает антиген, такой как интактный антиген, экспрессируемый на поверхности клетки.
В некоторых вариантах осуществления антиген (или лиганд) представляет собой опухолевый антиген или раковый маркер. В некоторых вариантах осуществления антиген (или лиганд) представляет собой или включает рецептор-сироту 1 типа рецепторных тирозинкиназ (ROR1), антиген созревания В-клеток (BCMA), карбоангидразу 9 (CA9, также известную как CAIX или G250), Her2/neu (рецепторную тирозинкиназу erbB2), CD19, CD20, CD22, мезотелин (MSLN), раково-эмбриональный антиген (CEA) и поверхностный антиген вируса гепатита B, антитело против фолатного рецептора, CD23, CD24, CD30, CD33, CD38, CD44, хондроитинсульфат-протеогликан 4 (CSPG4), EGFR, эпителиальный гликопротеин 2 (EPG-2), эпителиальный гликопротеин 40 (EPG-40), рецептор-А2 эфрина (EPHa2), Her3 (erb-B3), Her4 (erb-B4), димеры erbB, мутацию рецептора эпидермального фактора роста типа III (EGFR vIII), фолат-связывающий белок (FBP), подобный Fc-рецептору рецептор 5 (FCRL5, также известный как гомолог 5 Fc-рецептора или FCRH5), фетальный ацетилхолиновый рецептор (фетальный AchR), ганглиозид GD2, ганглиозид GD3, лейкоцитарный антиген A1 человека (HLA-A1), лейкоцитарный антиген A2 человека (HLA-A2), рецептор-альфа IL-22 (IL-22Ra), рецептор, содержащий домен вставки киназы (kdr), легкую цепь каппа, член А семейства белков, богатых повторами лейцина 8, (LRRC8A), Lewis Y, молекулу адгезии клеток L1 (L1-CAM), связанный с меланомой антиген А1 (MAGE)-A1, MAGE-A3, MAGE-A6, MAGE-A10, преимущественно экспрессируемый антиген меланомы (PRAME), сурвивин, опухолевый гликопротеин 72 (TAG72), B7-H3, B7-H6, рецептор-альфа 2 IL-13 (IL-13RΑ2), высокомолекулярный связанный с меланомой антиген человека (HMW-MAA), CD171, фолатный рецептор-альфа, CD44v7/8, интегрин αvβ6 (интегрин avb6), 8H9, молекулу адгезии нервных клеток (NCAM), рецептор фактора роста эндотелия сосудов (рецепторы VEGF или VEGFR), гликопротеин трофобластов (TPBG, также известный как 5T4), лиганды NKG2D, CD44v6, двойной антиген, антиген рака яичек, цитомегаловирус (CMV) мышей, муцин 1 (MUC1), MUC16, антиген стволовых клеток предстательной железы (PSCA), специфический для предстательной железы мембранный антиген (PSMA), лиганды члена D группы 2 природных киллеров (NKG2D), антиген 1B рака/яичка (CTAG, также известный как NY-ESO-1 и LAGE-2), мелан A (MART-1), гликопротеин 100 (gp100), глипикан-3 (GPC3), сопряженный с G-белком рецептор 5D (GPRC5D), онкофетальный антиген, TAG72, родственный тирозиназе белок 1 (TRP1, также известный как TYRP1 или gp75), родственный тирозиназе белок 2 (TRP2, также известный как допахром-таутомераза, допахром-дельта-изомераза или DCT), рецептор 2 фактора роста эндотелия сосудов (VEGF-R2), раково-эмбриональный антиген (CEA), рецептор эстрогена, рецептор прогестерона, специфический для предстательной железы антиген, эфрин B2, CD123, CD133, c-Met, O-ацетилированный GD2 (OGD2), эпитоп CE7 L1-CAM, белок опухоли Вильмса 1 (WT-1), циклин, циклин A2, лиганд 1 хемокина, содержащий мотив C-C (CCL-1), CD138, специфический для патогена антиген или экспрессируемый патогеном антиген и антиген, связанный с универсальной меткой, и/или биотинилированные молекулы, и/или молекулы, экспрессируемые ВИЧ, HCV, HBV или другими патогенами. В некоторых вариантах осуществления антигены, на которые направлены рецепторы, включают антигены, связанные со злокачественной В-клеточной опухолью, такие как любой из ряда известных В-клеточных маркеров. В некоторых вариантах осуществления антиген, на который направлен рецептор, представляет собой CD20, CD19, CD22, ROR1, CD45, CD21, CD5, CD33, Ig каппа, Ig лямбда, CD79a, CD79b или CD30.
В некоторых вариантах осуществления антиген представляет собой специфический для патогена антиген. В некоторых вариантах осуществления антиген представляет собой вирусный антиген (такой как вирусный антиген из ВИЧ, HCV, HBV и т.д.), бактериальные антигены и/или паразитные антигены.
В некоторых вариантах осуществления антиген или антигенсвязывающий домен представляет собой CD19. В некоторых вариантах осуществления scFv содержит VH и VL, происходящие из антитела или фрагмента антитела, специфического для CD19. В некоторых вариантах осуществления антитело или фрагмент антитела, который связывает CD19, представляет собой антитело мышиного происхождения, такое как FMC63 и SJ25C1. В некоторых вариантах осуществления антитело или фрагмент антитела представляет собой антитело человека, например, описанное в публикации заявки на патент США с № US 2016/0152723.
В некоторых вариантах осуществления scFv происходит из FMC63. FMC63, как правило, относится к мышиному моноклональному антителу подкласса IgG1, полученному против клеток Nalm-1 и -16, экспрессирующих CD19 человеческого происхождения (Ling, N. R., et al. (1987). Leucocyte typing III. 302). Антитело FMC63 включает CDRH1 и H2, определенные в SEQ ID NO:38 и 39, соответственно, и CDRH3, определенный в SEQ ID NOS:40 или 54, и CDRL1, определенный в SEQ ID NO:35, и CDRL2, определенный в последовательностях 36 или 55, и CDRL3, определенный в последовательностях 37 или 34. Антитело FMC63 включает вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность SEQ ID NO:41, и вариабельную область легкой цепи (VL), включающую аминокислотную последовательность SEQ ID NO:42. В некоторых вариантах осуществления svFv включает вариабельную область легкой цепи, содержащую последовательность CDRL1 SEQ ID NO:35, последовательность CDRL2 SEQ ID NO:36 и последовательность CDRL3 SEQ ID NO:37, и/или вариабельную область тяжелой цепи, содержащую последовательность CDRH1 SEQ ID NO:38, последовательность CDRH2 SEQ ID NO:39 и последовательность CDRH3 SEQ ID NO:40. В некоторых вариантах осуществления scFv включает вариабельную область тяжелой цепи FMC63, определенную в SEQ ID NO:41, и вариабельную область легкой цепи FMC63, определенную в SEQ ID NO:42. В некоторых вариантах осуществления вариабельная область тяжелой цепи и вариабельная область легкой цепи связаны линкером. В некоторых вариантах осуществления линкер определен в SEQ ID NO:56. В некоторых вариантах осуществления scFv включает, по порядку, VH, линкер и VL. В некоторых вариантах осуществления scFv включает, по порядку, VL, линкер и VH. В некоторых вариантах осуществления svFc кодируется последовательностью нуклеотидов, определенной в SEQ ID NO:57, или последовательностью, которая идентична SEQ ID NO:57 на по крайней мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%. В некоторых вариантах осуществления scFv включает последовательность аминокислот, определенную в SEQ ID NO: 43, или последовательность, которая идентична SEQ ID NO:43 на крайней мере, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92% 93%, 94%, 95%, 96%, 97%, 98% или 99%.
В некоторых вариантах осуществления scFv происходит из SJ25C1. SJ25C1 представляет собой мышиное моноклональное антитело подкласса IgG1, полученное против клеток Nalm-1 и -16, экспрессирующих CD19 человеческого происхождения (Ling, N. R., et al. (1987). Leucocyte typing III. 302). Антитело SJ25C1 включает CDRH1, H2 и H3, определенные в SEQ ID NO:47-49, соответственно, и последовательности CDRL1, L2 и L3, определенные в SEQ ID NO:44-46, соответственно. Антитело SJ25C1 включает вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность SEQ ID NO:50, и вариабельную область легкой цепи (VL), включающую аминокислотную последовательность SEQ ID NO:51. В некоторых вариантах осуществления svFv включает вариабельную область легкой цепи, содержащую последовательность CDRL1 SEQ ID NO:44, последовательность CDRL2 SEQ ID NO:45 и последовательность CDRL3 SEQ ID NO:46, и/или вариабельную область тяжелой цепи, содержащую последовательность CDRH1 SEQ ID NO:47, последовательность CDRH2 SEQ ID NO:48 и последовательность CDRH3 SEQ ID NO:49. В некоторых вариантах осуществления scFv включает вариабельную область тяжелой цепи SJ25C1, определенную в SEQ ID NO:50, и вариабельную область легкой цепи SJ25C1, определенную в SEQ ID NO:51. В некоторых вариантах осуществления вариабельная область тяжелой цепи и вариабельная область легкой цепи связаны линкером. В некоторых вариантах осуществления линкер определен в SEQ ID NO:52. В некоторых вариантах осуществления scFv включает, по порядку, VH, линкер и VL. В некоторых вариантах осуществления scFv включает, по порядку, VL, линкер и VH. В некоторых вариантах осуществления scFv включает последовательность аминокислот, определенную в SEQ ID NO:53, или последовательность, которая идентична SEQ ID NO:53 на по крайней мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%.
В некоторых вариантах осуществления антиген или антигенсвязывающий домен представляет собой ВСМА. В некоторых вариантах осуществления scFv содержит VH и VL, происходящие из антитела или фрагмента антитела, специфического для BCMA. В некоторых вариантах осуществления антитело или фрагмент антитела, который связывает ВСМА, представляет собой или включает VH и VL из антитела или фрагмента антитела, указанных в международных заявках на патенты, публикациях № WO 2016/090327 и WO 2016/090320.
В некоторых вариантах осуществления антиген или антигенсвязывающий домен представляет собой GPRC5D. В некоторых вариантах осуществления scFv содержит VH и VL, происходящие из антитела или фрагмента антитела, специфического для GPRC5D. В некоторых вариантах осуществления антитело или фрагмент антитела, который связывает GPRC5D, представляет собой или содержит VH и VL из антитела или фрагмента антитела, указанных в международных заявках на патенты, публикациях № WO 2016/090329 и WO 2016/090312.
В некоторых вариантах осуществления CAR содержит TCR-подобное антитело, такое как антитело или антигенсвязывающий фрагмент (например, scFv), который специфически распознает внутриклеточный антиген, такой как связанный с опухолью антиген, представленный на поверхности клетки в виде комплекса МНС-пептид. В некоторых вариантах осуществления антитело или его антигенсвязывающая часть, которая распознает комплекс MHC-пептид, может быть экспрессировано в клетках в виде части рекомбинантного рецептора, такого как рецептор антигена. Среди рецепторов антигенов находятся функциональные не являющиеся TCR рецепторы антигенов, такие как химерные рецепторы антигенов (CAR). Как правило, CAR, содержащий антитело или антигенсвязывающий фрагмент, который проявляет TCR-подобную специфичность к комплексам пептид-MHC, также может называться CAR типа TCR.
Ссылка на «главный комплекс гистосовместимости» (МНС) относится к белку, обычно гликопротеину, который содержит полиморфный пептид-связывающий сайт или связывающую бороздку, который может, в некоторых случаях, образовывать комплекс с пептидными антигенами полипептидов, включая процессированные клеточным аппаратом пептидные антигены. В некоторых случаях молекулы MHC могут быть представлены или экспрессированы на поверхности клетки, в том числе в виде комплекса с пептидом, т.е. комплекса MHC-пептид, для презентации антигена в конформации, распознаваемой рецептором антигена на Т-клетках, таким как TCR или TCR-подобное антитело. Как правило, молекулы МНС класса I представляют собой гетеродимеры, имеющие простирающуюся через мембрану α-цепь, в некоторых случаях с тремя α-доменами, и нековалентно связанный β2-микроглобулин. Как правило, молекулы MHC класса II состоят из двух трансмембранных гликопротеинов, α и β, оба из которых обычно простираются через мембрану. Молекула МНС может включать эффективную часть МНС, которая содержит антигенсвязывающий сайт или сайты для связывания пептида и последовательности, необходимые для распознавания соответствующим рецептором антигена. В некоторых вариантах осуществления молекулы MHC класса I доставляют пептиды, происходящие из цитозоля, на поверхность клетки, где комплекс MHC-пептид распознается T-клетками, такими как обычно CD8+ T-клетки, но в некоторых случаях CD4+ T-клетки. В некоторых вариантах осуществления молекулы MHC класса II доставляют пептиды, происходящие из везикулярной системы, на поверхность клетки, где они обычно распознаются CD4+ Т-клетками. Как правило, молекулы MHC кодируются группой связанных локусов, которые в совокупности называются H-2 в мышином и человеческом лейкоцитарном антигене (HLA). Следовательно, обычно MHC человека может также упоминаться как лейкоцитарный антиген человека (HLA).
Термин «комплекс MHC-пептид» или «комплекс пептид-MHC» или его варианты относится к комплексу или ассоциации пептидного антигена и молекулы MHC, например, обычно с помощью нековалентных взаимодействий пептида в связывающей бороздке или углублении молекулы МНС. В некоторых вариантах осуществления комплекс MHC-пептид присутствует или представлен на поверхности клеток. В некоторых вариантах осуществления комплекс MHC-пептид может специфически распознаваться рецептором антигена, таким как TCR, CAR типа TCR или его антигенсвязывающие части.
В некоторых вариантах осуществления пептид, такой как пептидный антиген или эпитоп, полипептида может ассоциироваться с молекулой МНС, например, для распознавания рецептором антигена. Как правило, пептид получается из фрагмента более длинной биологической молекулы, такой как полипептид или белок, или на его основе. В некоторых вариантах осуществления длина пептида, как правило, составляет от приблизительно 8 до приблизительно 24 аминокислот. В некоторых вариантах осуществления длина пептида составляет или составляет приблизительно от 9 до 22 аминокислот для распознавания в комплексе MHC класса II. В некоторых вариантах осуществления длина пептида составляет или составляет приблизительно от 8 до 13 аминокислот для распознавания в комплексе МНС класса I. В некоторых вариантах осуществления после распознавания пептида в связи с молекулой МНС, например, комплекса МНС-пептид, рецептор антигена, такой как TCR или CAR типа TCR, генерирует или запускает сигнал активации Т-клетки, который индуцирует Т-клеточную реакцию, такую как пролиферация Т-клеток, продукция цитокинов, цитотоксическая Т-клеточная реакция или другая ответная реакция.
В некоторых вариантах осуществления TCR-подобное антитело или его антигенсвязывающая часть известны или могут быть получены известными способами (смотрите, например, опубликованные заявки США №№ US 2002/0150914; US 2003/0223994; US 2004/0191260; US 2006/0034850; US 2007/00992530; US20090226474; US20090304679; и публикацию международной PCT-заявки с № WO 03/068201).
В некоторых вариантах осуществления антитело или его антигенсвязывающую часть, которая специфически связывается с комплексом МНС-пептид, можно получить путем иммунизации хозяина эффективным количеством иммуногена, содержащего специфический комплекс МНС-пептид. В некоторых случаях пептид комплекса MHC-пептид представляет собой антигенную детерминанту, способную связываться с MHC, такую как опухолевый антиген, например универсальный опухолевый антиген, миеломный антиген или другой антиген, описанный ниже. В некоторых вариантах осуществления эффективное количество иммуногена затем вводят хозяину для вызова иммунного ответа, причем иммуноген сохраняет свою трехмерную форму в течение периода времени, достаточного для вызова иммунного ответа против трехмерной презентации пептида в связывающей бороздке молекулы МНС. Сыворотку, собранную у хозяина, затем анализируют для определения, продуцируются ли желательные антитела, которые распознают трехмерную презентацию пептида в связывающей бороздке молекулы МНС. В некоторых вариантах осуществления продуцированные антитела могут быть оценены для подтверждения того, что антитело может отличить комплекс МНС-пептид от только молекулы МНС, только представляющего интерес пептида и комплекса МНС и нерелевантного пептида. Желательные антитела затем могут быть выделены.
В некоторых вариантах осуществления антитело или его антигенсвязывающую часть, которая специфически связывается с комплексом MHC-пептид, можно получить с использованием методов дисплея библиотеки антител, такой как библиотеки антител в фагах. В некоторых вариантах осуществления могут быть сконструированы библиотеки фагового дисплея мутантных форм Fab, scFv или других форм антител, например, в которых члены библиотеки мутированы в одном или более остатков одного или более CDR. Смотрите, например, опубликованную заявку США с № US20020150914, US2014/0294841; и Cohen CJ. et al. (2003) J Mol. Recogn. 16:324-332.
Здесь термин «антитело» используется в самом широком смысле и включает поликлональные и моноклональные антитела, в том числе интактные антитела и функциональные (антигенсвязывающие) фрагменты антител, включая антигенсвязывающие (Fab)-фрагмент, F(ab')2-фрагменты, Fab'-фрагменты, Fv-фрагменты, фрагменты рекомбинантного IgG (rIgG), вариабельные области тяжелой цепи (VH), способные специфически связывать антиген, одноцепочечные фрагменты антител, включая одноцепочечные вариабельные фрагменты (scFv) и фрагменты в виде однодоменных антител (например, sdAb, sdFv, нанотело). Термин охватывает генно-инженерные и/или иным образом модифицированные формы иммуноглобулинов, такие как интратела, пептитела, химерные антитела, полностью человеческие антитела, гуманизированные антитела и гетероконъюгатные антитела, полиспецифические, например биспецифические, антитела, диатела, триатела и тетратела, тандем ди-scFv, тандем три-scFv. Кроме особо оговоренных случаев, следует понимать, что термин «антитело» охватывает его функциональные фрагменты. Термин также охватывает интактные или полноразмерные антитела, включая антитела любого класса или подкласса, включая IgG и его подклассы, IgM, IgE, IgA и IgD.
В некоторых вариантах осуществления антигенсвязывающие белки, антитела и их антигенсвязывающие фрагменты специфически распознают антиген полноразмерного антитела. В некоторых вариантах осуществления тяжелая и легкая цепи антитела могут быть полноразмерными или могут представлять собой антигенсвязывающую часть (Fab, F(ab')2, Fv или одноцепочечный Fv-фрагмент (scFv)). В других вариантах осуществления константная область тяжелой цепи антитела выбрана, например, из IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgD и IgE, в частности, выбрана, например, из IgG1, IgG2, IgG3 и IgG4, конкретнее, IgG1 (например, IgG1 человека). В другом варианте осуществления константная область легкой цепи антитела выбрана, например, из каппа или лямбда, в частности из каппа.
Среди предоставленных антител имеются фрагменты антител. «Фрагмент антитела» относится к молекуле, отличной от интактного антитела, которая включает часть интактного антитела, которая связывает антиген, с которым связывается встречающееся в природе антитело. Примеры фрагментов антител включают, но без ограничения ими, Fv, Fab, Fab', Fab'-SH, F (ab')2; диатела; линейные антитела; вариабельные области тяжелой цепи (VH), одноцепочечные молекулы антител, такие как scFv и антитела с одним доменом VH; и полиспецифические антитела, образованные из фрагментов антител. В конкретных вариантах осуществления антитела представляют собой одноцепочечные фрагменты антител, включающие вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, такие как scFv.
Термин «вариабельная область» или «вариабельный домен» относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) встречающегося в природе антитела, как правило, имеют сходные структуры, причем каждый домен включает четыре консервативных каркасных области (FR) и три CDR. (Смотрите, например, Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007). Один VH- или VL-домен может быть достаточным для придания антигенсвязывающей специфичности. Кроме того, антитела, которые связывают определенный антиген, могут быть выделены с использованием VH- или VL-домена антитела, которое связывает антиген, для скрининга библиотеки комплементарных VH- или VL-доменов, соответственно. Смотрите, например, Portolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991).
Однодоменные антитела представляют собой фрагменты антител, включающие весь или часть вариабельного домена тяжелой цепи или весь или часть вариабельного домена легкой цепи антитела. В некоторых вариантах осуществления однодоменным антителом является однодоменное антитело человека. В некоторых вариантах осуществления CAR включает домен тяжелой цепи антитела, который специфически связывает антиген, такой как раковый маркер или антиген клеточной поверхности клетки или заболевания, на которое нужно воздействовать, такой как опухолевая клетка или раковая клетка, например любой из описанных здесь или известных в данной области техники антигенов-мишеней.
Фрагменты антител могут быть получены различными способами, включая, но без ограничения ими, протеолитическое расщепление интактного антитела, а также продуцирование рекомбинантными клетками-хозяевами. В некоторых вариантах осуществления антитела представляют собой полученные рекомбинантным путем фрагменты, такие как фрагменты с компоновками, которые не встречаются в природе, такие как фрагменты с двумя или более областями или цепями антител, соединенными синтетическими линкерами, например пептидными линкерами, и/или которые могут не создаваться путем ферментативного расщепления встречающегося в природе интактного антитела. В некоторых вариантах осуществления фрагменты антител представляют собой scFv.
«Гуманизированное» антитело представляет собой антитело, в котором все или по существу все аминокислотные остатки CDR происходят из нечеловеческих CDR, а все или по существу все аминокислотные остатки FR происходят из человеческих FR. Гуманизированное антитело необязательно может включать по крайней мере часть константной области антитела, происходящей из антитела человека. «Гуманизированная форма» нечеловеческого антитела относится к варианту нечеловеческого антитела, которое было подвергнуто гуманизации, обычно для снижения иммуногенности для людей, сохраняя при этом специфичность и аффинность родительского нечеловеческого антитела. В некоторых вариантах осуществления некоторые остатки FR в гуманизированном антителе замещены соответствующими остатками нечеловеческого антитела (например, антитела, из которого происходят остатки CDR), например, для восстановления или увеличения специфичности или аффинности антитела.
Таким образом, в некоторых вариантах осуществления химерный рецептор антигена, включая CAR типа TCR, включает экстраклеточную часть, содержащую антитело или фрагмент антитела. В некоторых вариантах осуществления антитело или фрагмент включает scFv. В некоторых аспектах химерный рецептор антигена включает экстраклеточную часть, содержащую антитело или фрагмент, и внутриклеточную сигнальную область. В некоторых вариантах осуществления внутриклеточная сигнальная область включает внутриклеточный сигнальный домен. В некоторых вариантах осуществления внутриклеточный сигнальный домен представляет собой или включает первичный сигнальный домен, сигнальный домен, который способен индуцировать первичный сигнал активации в Т-клетке, сигнальный домен компонента Т-клеточного рецептора (TCR), и/или сигнальный домен, включающий мотив активации иммунорецепторов на основе тирозина (ITAM).
В некоторых вариантах осуществления рекомбинантный рецептор, такой как CAR, например, его антительная часть, включает, кроме того, спейсер, который может представлять собой или включать, по крайней мере, часть константной области иммуноглобулина или ее вариант или модифицированный вариант, такую как шарнирная область, например шарнирная область IgG4, и/или CH1/CL- и/или Fc-область. В некоторых вариантах осуществления рекомбинантный рецептор включает, кроме того, спейсер и/или шарнирную область. В некоторых вариантах осуществления константная область или часть представляет собой таковую IgG человека, например IgG4 или IgG1. В некоторых аспектах часть константной области служит в качестве спейсерной области между антиген-распознающим компонентом, например, scFv, и трансмембранным доменом. Спейсер может иметь длину, которая обеспечивает повышенную реактивность клетки после связывания антигена по сравнению с отсутствием спейсера. В некоторых примерах длина спейсера составляет или приблизительно составляет 12 аминокислот или не более 12 аминокислот. Приводимые в качестве примера спейсеры включают те, которые содержат по крайней мере приблизительно 10-229 аминокислот, приблизительно 10-200 аминокислот, приблизительно 10-175 аминокислот, приблизительно 10-150 аминокислот, приблизительно 10-125 аминокислот, приблизительно 10-100 аминокислот, приблизительно 10-75 аминокислот, приблизительно 10-50 аминокислот, приблизительно 10-40 аминокислот, приблизительно 10-30 аминокислот, приблизительно 10-20 аминокислот или приблизительно 10-15 аминокислот, включая любое целое число между конечными точками любого из перечисленных диапазонов. В некоторых вариантах осуществления спейсерная область содержит приблизительно 12 аминокислот или менее, приблизительно 119 аминокислот или менее или приблизительно 229 аминокислот или менее. Приводимые в качестве примера спейсеры включают только шарнирную область IgG4, шарнирную область IgG4, связанную с СН2- и СН3-доменами, или шарнирную область IgG4, связанную с доменом СН3-доменом. Приводимые в качестве примера спейсеры включают, но без ограничения ими, те, которые описаны в Hudecek et al. (2013) Clin. Cancer Res., 19: 3153 или публикации международной заявки на патент с № WO2014031687. В некоторых вариантах осуществления спейсер имеет последовательность, определенную в SEQ ID NO:1, и кодируется последовательностью, определенной в SEQ ID NO:2. В некоторых вариантах осуществления спейсер имеет последовательность, определенную в SEQ ID NO:3. В некоторых вариантах осуществления спейсер имеет последовательность, определенную в SEQ ID NO:4.
В некоторых вариантах осуществления константная область или часть является таковой IgD. В некоторых вариантах осуществления спейсер имеет последовательность, определенную в SEQ ID NO:5. В некоторых вариантах осуществления спейсер имеет последовательность аминокислот, которая идентична любой из SEQ ID NO:1, 3, 4 и 5 на по крайней мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более. В некоторых вариантах осуществления спейсер имеет последовательность, определенную в SEQ ID NO:23-31. В некоторых вариантах осуществления спейсер имеет последовательность аминокислот, которая идентична любой из SEQ ID NO:23-31 на по крайней мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более.
В некоторых вариантах осуществления рецептор антигена включает внутриклеточный домен, связанный прямо или косвенно с экстраклеточным доменом. В некоторых вариантах осуществления химерный рецептор антигена включает трансмембранный домен, связывающий экстраклеточный домен и внутриклеточный сигнальный домен. В некоторых вариантах осуществления внутриклеточный сигнальный домен включает ITAM. Например, в некоторых аспектах антиген-распознающий домен (например, экстраклеточный домен) связан с одним или более внутриклеточных сигнальных компонентов, таких как сигнальные компоненты, которые имитируют активацию через комплекс, включающий рецептор антигена, такой как TCR комплекс, в случае CAR, и/или сигнал через другие домены рецептора клеточной поверхности. В некоторых вариантах осуществления химерный рецептор включает трансмембранный домен, связанный или слитый между экстраклеточным доменом (например, scFv) и внутриклеточным сигнальным доменом. Таким образом, в некоторых вариантах осуществления антигенсвязывающий компонент (например, антитело) связан с одной или более трансмембранных и внутриклеточных сигнальных областей. В некоторых вариантах осуществления трансмембранный домен слит с экстраклеточным доменом. В одном варианте осуществления используется трансмембранный домен, который в природе связан с одним из доменов в рецепторе, например CAR. В некоторых случаях трансмембранный домен выбирают или модифицируют путем аминокислотной замены во избежание связывания таких доменов с трансмембранными доменами одного и того же или разных поверхностных мембранных белков, чтобы минимизировать взаимодействия с другими членами рецепторного комплекса.
В некоторых вариантах осуществления трансмембранный домен происходит из природного или синтетического источника. Если источник является природным, домен в некоторых аспектах происходит из любого мембраносвязанного или трансмембранного белка. Трансмембранные области включают области, происходящие из (т.е. включают по крайней мере трансмембранную область(и)) альфа-, бета- или дзета-цепи Т-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154. Альтернативно, трансмембранный домен в некоторых вариантах осуществления является синтетическим. В некоторых аспектах синтетический трансмембранный домен включает преимущественно гидрофобные остатки, такие как лейцин и валин. В некоторых аспектах триплет для фенилаланина, триптофана и валина будет обнаруживаться на каждом конце синтетического трансмембранного домена. В некоторых вариантах осуществления связь осуществляется с помощью линкеров, спейсеров и/или трансмембранного домена(ов). В некоторых аспектах трансмембранный домен содержит трансмембранную часть CD28.
В некоторых вариантах осуществления экстраклеточный домен и трансмембранный домен могут быть связаны прямо или косвенно. В некоторых вариантах осуществления экстраклеточный домен и трансмембранный домен связаны спейсером, таким как любой описанный здесь спейсер. В некоторых вариантах осуществления рецептор содержит экстраклеточную часть молекулы, из которой происходит трансмембранный домен, такую как экстраклеточная часть CD28.
Среди внутриклеточных сигнальных доменов есть те, которые имитируют или аппроксимируют сигнал через природный рецептор антигена, сигнал через такой рецептор в комбинации с костимулирующим рецептором и/или сигнал через один только костимулирующий рецептор. В некоторых вариантах осуществления короткий олиго- или полипептидный линкер, например линкер длиной от 2 до 10 аминокислот, такой как линкер, содержащий глицины и серины, например дублет глицин-серин, присутствует и образует связь между трансмембранным доменом и цитоплазматическим сигнальным доменом CAR.
Рецептор, например CAR, обычно включает по крайней мере один внутриклеточный сигнальный компонент или компоненты. В некоторых вариантах осуществления рецептор включает внутриклеточный компонент TCR комплекса, такой как цепь CD3 TCR, которая опосредует активацию Т-клеток и цитотоксичность, например, дзета-цепь CD3. Таким образом, в некоторых аспектах ROR1-связывающее антитело связано с одним или более клеточных сигнальных модулей. В некоторых вариантах осуществления клеточные сигнальные модули включают трансмембранный домен CD3, внутриклеточные сигнальные домены CD3 и/или трансмембранные домены других CD. В некоторых вариантах осуществления рецептор, например CAR, включает, кроме того, часть одной или более дополнительных молекул, таких как Fc-рецептор γ, CD8, CD4, CD25 или CD16. Например, в некоторых аспектах CAR включает химерную молекулу между CD3-дзета (CD3-ζ) или Fc-рецептором γ и CD8, CD4, CD25 или CD16.
В некоторых вариантах осуществления после лигирования CAR цитоплазматический домен или внутриклеточный сигнальный домен рецептора активирует по крайней мере одну из нормальных эффекторных функций или ответных реакций иммунной клетки, например T-клетки, сконструированной для экспрессии CAR. Например, в некоторых случаях CAR индуцирует функцию T-клетки, такую как цитолитическая активность или T-хелперная активность, например, секрецию цитокинов или других факторов. В некоторых вариантах осуществления вместо интактной иммуностимулирующей цепи используется, например, усеченная часть внутриклеточной сигнальной области компонента рецептора антигена или костимулирующей молекулы, если она передает сигнал эффекторной функции. В некоторых вариантах осуществления внутриклеточный сигнальный домен или домены включают цитоплазматические последовательности Т-клеточного рецептора (TCR), а в некоторых аспектах также последовательности корецепторов, которые в природном окружении действуют совместно с таким рецептором, чтобы инициировать преобразование сигнала после вхождения в контакт с рецептором антигена, и/или любое производное или вариант таких молекул, и/или любую синтетическую последовательность, которая обладает такой же функциональной способностью.
В случае природного TCR, для полной активации обычно требуется не только передача сигналов через TCR, но также и костимулирующий сигнал. Таким образом, в некоторых вариантах осуществления для способствования полной активации в CAR также включен компонент для выдачи вторичного или костимулирующего сигнала. В других вариантах осуществления CAR не включает компонент для выдачи костимулирующего сигнала. В некоторых аспектах дополнительный CAR экспрессируется в той же клетке и обеспечивает компонент для выдачи вторичного или костимулирующего сигнала.
В некоторых аспектах активация Т-клеток описывается как опосредуемая двумя классами цитоплазматических сигнальных последовательностей: теми, которые инициируют антиген-зависимую первичную активацию через TCR (первичными цитоплазматическими сигнальными последовательностями), и теми, которые действуют антиген-независимым образом для обеспечения вторичного или костимулирующего сигнала (вторичными цитоплазматическими сигнальными последовательностями). В некоторых аспектах CAR включает один или оба из таких сигнальных компонентов.
В некоторых аспектах CAR включает первичную цитоплазматическую сигнальную последовательность, которая регулирует первичную активацию TCR комплекса. Первичные цитоплазматические сигнальные последовательности, которые действуют стимулирующим образом, могут содержать сигнальные мотивы, известные как мотивы активации иммунорецепторов на основе тирозина или ITAM. Примеры ITAM-содержащих первичных цитоплазматических сигнальных последовательностей включают последовательности, происходящие из TCR или CD3 дзета, FcR гамма или FcR бета. В некоторых вариантах осуществления цитоплазматическая сигнальная молекула(ы) в CAR содержит цитоплазматический сигнальный домен, его часть или последовательность, происходящую из CD3 дзета.
В некоторых вариантах осуществления CAR включает сигнальную область и/или трансмембранную часть костимулирующего рецептора, такой как CD28, 4-IBB, OX40, DAP10 и ICOS. В некоторых аспектах один и тот же CAR включает как сигнальную область, так и костимулирующие компоненты. В некоторых вариантах осуществления химерный рецептор антигена содержит внутриклеточный домен, происходящий из костимулирующей молекулы Т-клеток или ее функционального варианта, например, между трансмембранным доменом и внутриклеточным сигнальным доменом. В некоторых аспектах костимулирующей молекулой Т-клеток является CD28 или 41BB.
В некоторых вариантах осуществления сигнальная область и/или активирующий домен включены в один CAR, тогда как костимулирующий компонент обеспечивается другим CAR, распознающим другой антиген. В некоторых вариантах осуществления CAR включают активирующие или стимулирующие CAR и костимулирующие CAR, оба экспрессируемые в одной и той же клетке (смотрите WO2014/055668). В некоторых аспектах клетки включают один или более стимулирующих или активирующих CAR и/или костимулирующий CAR. В некоторых вариантах осуществления клетки включают, кроме того, ингибирующие CAR (iCAR, смотрите Fedorov et al., Sci. Transl. Medicine, 5 (215) (декабрь 2013 г.)), такие как CAR, распознающий антиген, отличный от антигена, связанного с и/или специфического для заболевания или состояния, в силу чего активирующий сигнал, доставляемый через нацеленный на заболевание CAR, уменьшается или ингибируется при связывании ингибирующего CAR с его лигандом, например, для уменьшения эффектов вне мишени.
В некоторых вариантах осуществления внутриклеточный сигнальный домен включает трансмембранный и сигнальный домен CD28, связанный с внутриклеточным доменом CD3 (например, CD3-дзета). В некоторых вариантах осуществления внутриклеточный сигнальный домен включает химерные CD28/CD137 (4-1BB, TNFRSF9) костимулирующие домены, связанные с внутриклеточным доменом CD3 дзета.
В некоторых вариантах осуществления CAR включает один или более, например два или более костимулирующих доменов и домен активации, например домен первичной активации, в цитоплазматической части. Приводимые в качестве примера CAR включают внутриклеточные компоненты CD3-дзета, CD28 и 4-IBB.
В некоторых вариантах осуществления рецептор антигена включает, кроме того, маркер, и/или клетки, экспрессирующие CAR или другой рецептор антигена, включает, кроме того, суррогатный маркер, такой как маркер клеточной поверхности, который может использоваться для подтверждения трансдукции или конструирования клетки для экспрессии рецептора. В некоторых аспектах маркер включает весь или часть (например, усеченную форму) CD34, NGFR или рецептора эпидермального фактора роста, такую как усеченный вариант такого рецептора на клеточной поверхности (например, tEGFR). Приводимые в качестве примера суррогатные маркеры могут включать усеченные формы полипептидов клеточной поверхности, такие как усеченные формы, которые не функционируют и не передают или не способны передавать сигнал или сигнал, обычно передаваемый полноразмерной формой полипептида клеточной поверхности, и/или не интернализуются или не способны к интернализации. Приводимые в качестве примера усеченные полипептиды клеточной поверхности включают усеченные формы факторов роста или других рецепторов, такие как усеченный рецептор 2 эпидермального фактора роста человека (tHER2), усеченный рецептор эпидермального фактора роста (tEGFR, приводимая в качестве примера последовательность tEGFR определена в SEQ ID NO:7 или 16) или специфический для предстательной железы мембранный антиген (PSMA) или его модифицированная форма. tEGFR может содержать эпитоп, распознаваемый антителом цетуксимабом (Erbitux®) или другим терапевтическим антителом против EGFR или связывающей молекулой, которая может использовать для идентификации или отбора клеток, которые были сконструированы с использованием конструкции для tEGFR и кодируемого экзогенного белка, и/или для устранения или отделения клеток, экспрессирующих кодируемый экзогенный белок. Смотрите патент США с № 8802374 и Liu et al., Nature Biotech. 2016 April; 34(4):430–434). В некоторых аспектах маркер, например суррогатный маркер, включает весь или часть (например, усеченную форму) CD34, NGFR, CD19 или усеченный CD19, например усеченный нечеловеческий CD19, или рецептор эпидермального фактора роста (например, tEGFR). В некоторых вариантах осуществления маркер представляет собой или включает флуоресцентный белок, такой как зеленый флуоресцентный белок (GFP), усиленный зеленый флуоресцентный белок (EGFP), такой как сверхсвернутый GFP (sfGFP), красный флуоресцентный белок (RFP), такой как tdTomato, mCherry, mStrawberry, AsRed2, DsRed или DsRed2, голубой флуоресцентный белок (CFP), сине-зеленый флуоресцентный белок (BFP), усиленный синий флуоресцентный белок (EBFP) и желтый флуоресцентный белок (YFP), и их варианты, включая видовые варианты, мономерные варианты и оптимизированные в отношении частоты использования кодонов и/или улучшенные варианты флуоресцентных белков. В некоторых вариантах осуществления маркер представляет собой или включает фермент, такой как люцифераза, ген lacZ из E.coli, щелочная фосфатаза, секретируемая эмбриональная щелочная фосфатаза (SEAP), хлорамфеникол-ацетилтрансфераза (CAT). Приводимые в качестве примера светоизлучающие гены-репортеры включают люциферазу (luc), β-галактозидазу, хлорамфеникол-ацетилтрансферазу (CAT), β-глюкуронидазу (GUS) или их варианты.
В некоторых вариантах осуществления маркер представляет собой селективный маркер. В некоторых вариантах осуществления селективный маркер представляет собой или включает полипептид, который придает устойчивость к экзогенным агентам или лекарственным средствам. В некоторых вариантах осуществления селективный маркер представляет собой ген устойчивости к антибиотику. В некоторых вариантах осуществления селективный маркер представляет собой ген устойчивости к антибиотику, придающий устойчивость к антибиотику клетке млекопитающего. В некоторых вариантах осуществления селективный маркер представляет собой или включает ген устойчивости к пуромицину, ген устойчивости к гигромицину, ген устойчивости к бластицидину, ген устойчивости к неомицину, ген устойчивости к генетицину или ген устойчивости к зеоцину или их модифицированную форму.
В некоторых вариантах осуществления нуклеиновая кислота, кодирующая маркер, функционально связана с полинуклеотидом, кодирующим линкерную последовательность, такую как расщепляемая линкерная последовательность, например, T2A. Например, маркер и, необязательно, линкерная последовательность могут быть любыми, как описано в публикации РСТ с № WO2014031687. Например, маркер может быть усеченным EGFR (tEGFR), который, необязательно, связан с последовательностью линкера, такой как расщепляемая последовательность линкера T2A. Приводимый в качестве примера полипептид усеченного EGFR (например, tEGFR) включает последовательность аминокислот, определенную в SEQ ID NO:7 или 16, или последовательность аминокислот, которая идентична на по крайней мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более последовательности с SEQ ID NO:7 или 16.
В некоторых вариантах осуществления нуклеиновая кислота, кодирующая маркер, функционально связана с полинуклеотидом, кодирующим линкерную последовательность, такую как расщепляемая линкерная последовательность, например расщепляемая линкерная последовательность ММР. Например, маркер и, необязательно, линкерная последовательность могут быть любыми, как описано в опубликованной заявке на патент с № WO2014031687. Например, маркер может быть усеченным EGFR (tEGFR), который, необязательно, связан с последовательностью линкера, такой как расщепляемая последовательность линкера T2A.
В некоторых вариантах осуществления маркер представляет собой молекулу, например белок клеточной поверхности, который не обнаруживается в природе на Т-клетках или не обнаруживается в природе на поверхности Т-клеток, или его часть. В некоторых вариантах осуществления молекула представляет собой несобственную молекулу, например несобственный белок, т.е. тот, который не распознается как «собственный» иммунной системой хозяина, которому будут адоптивно переноситься клетки.
В некоторых вариантах осуществления маркер не выполняет терапевтической функции и/или не производит никакого эффекта, кроме как для использования в качестве маркера для генной инженерии, например, для отбора успешно сконструированных клеток. В других вариантах осуществления маркер может представлять собой терапевтическую молекулу или молекулу, оказывающую в других обстоятельствах некоторый желательный эффект, такую как лиганд для клетки, встречающейся in vivo, например, костимулирующую молекулу или молекулу иммунной контрольной точки, для усиления и/или ослабления ответов клеток при адоптивном переносе и встрече с лигандом.
В некоторых случаях CAR называются CAR первого, второго и/или третьего поколения. В некоторых аспектах CAR первого поколения представляет собой тот, который обеспечивает только сигнал, индуцированный цепью CD3 при связывании антигена; в некоторых аспектах CAR второго поколения представляют собой тот, который обеспечивает такой сигнал и костимулирующий сигнал, например тот, который включает внутриклеточный сигнальный домен от костимулирующего рецептора, такого как CD28 или CD137; в некоторых аспектах CAR третьего поколения представляет собой тот, который включает множество костимулирующих доменов различных костимулирующих рецепторов.
В некоторых вариантах осуществления химерный рецептор антигена включает экстраклеточную часть, содержащую антитело или фрагмент, описанный здесь. В некоторых аспектах химерный рецептор антигена включает экстраклеточную часть, содержащую антитело или фрагмент, описанный здесь, и внутриклеточный сигнальный домен. В некоторых вариантах осуществления антитело или его фрагмент включает scFv или антитело с одним доменом VH, а внутриклеточный домен содержит ITAM. В некоторых аспектах внутриклеточный сигнальный домен включает сигнальный домен дзета-цепи CD3-дзета (CD3ζ). В некоторых вариантах осуществления химерный рецептор антигена включает трансмембранный домен, расположенный между экстраклеточным доменом и внутриклеточной сигнальной областью.
В некоторых аспектах трансмембранный домен содержит трансмембранную часть CD28. Экстраклеточный домен и трансмембранный домен могут быть связаны прямо или косвенно. В некоторых вариантах осуществления экстраклеточный домен и трансмембранный домен связаны спейсером, таким как любой, описанный здесь. В некоторых вариантах осуществления химерный рецептор антигена содержит внутриклеточный домен костимулирующей молекулы Т-клеток, например, между трансмембранным доменом и внутриклеточным сигнальным доменом. В некоторых аспектах костимулирующая молекула Т-клеток представляет собой CD28 или 4-1BB.
В некоторых вариантах осуществления CAR содержит антитело, например, фрагмент антитела, трансмембранный домен, который является или содержит трансмембранную часть CD28 или его функционального варианта, и внутриклеточный сигнальный домен, содержащий сигнальную часть CD28 или его функционального варианта и сигнальную часть CD3-дзета или его функционального варианта. В некоторых вариантах осуществления CAR содержит антитело, например, фрагмент антитела, трансмембранный домен, который является или содержит трансмембранную часть CD28 или его функционального варианта, и внутриклеточный сигнальный домен, содержащий сигнальную часть 4-IBB или его функционального варианта и сигнальную часть CD3-дзета или его функционального варианта. В некоторых таких вариантах осуществления рецептор включает, кроме того, спейсер, содержащий часть молекулы Ig, такой как молекула Ig человека, такую как шарнирная область Ig, например шарнирная область IgG4, например спейсер в виде только шарнирной области.
В некоторых вариантах осуществления трансмембранный домен рецептора, например CAR, представляет собой трансмембранный домен CD28 человека или его варианта, например 27-аминокислотный трансмембранный домен CD28 человека (№ доступа: P10747.1), или представляет собой трансмембранный домен, который включает последовательность аминокислот, определенную в SEQ ID NO: 8, или последовательность аминокислот, которая идентична на по крайней мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более последовательности с SEQ ID NO:8; в некоторых вариантах осуществления часть рекомбинантного рецептора, содержащая трансмембранный домен, включает последовательность аминокислот, определенную в SEQ ID NO: 9, или последовательность аминокислот, идентичную ей на по крайней мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более.
В некоторых вариантах осуществления химерный рецептор антигена содержит внутриклеточный домен костимулирующей молекулы Т-клеток. В некоторых аспектах костимулирующая молекула Т-клеток представляет собой CD28 или 4-1BB.
В некоторых вариантах осуществления внутриклеточная сигнальная область включает внутриклеточный костимулирующий сигнальный домен CD28 человека или его функциональный вариант или часть, например его 41-аминокислотный домен и/или такой домен с заменой LL на GG в положениях 186-187 встречающегося в природе белка CD28. В некоторых вариантах осуществления внутриклеточный сигнальный домен может включать последовательность аминокислот, определенную в SEQ ID NO:10 или 11, или последовательность аминокислот, которая идентична на по крайней мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более последовательности с SEQ ID NO:10 или 11. В некоторых вариантах осуществления внутриклеточная область включает внутриклеточный костимулирующий сигнальный домен 4-IBB или его функциональный вариант или часть, например 42-аминокислотный цитоплазматический домен 4-IBB человека (№ доступа Q07011.1) или его функциональный вариант или часть, например последовательность аминокислот, определенную в SEQ ID NO:12, или последовательность аминокислот, которая идентична на по крайней мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более последовательности с SEQ ID NO:12.
В некоторых вариантах осуществления внутриклеточная сигнальная область включает цепь CD3 человека, необязательно стимулирующий сигнальный домен CD3 дзета или его функциональный вариант, такой как 112-аминокислотный цитоплазматический домен изоформы 3 CD3ζ человека (номер доступа: P20963.2) или сигнальный домен CD3 дзета, описанный в патенте США с № 7446190 или патенте США с № 8911993. В некоторых вариантах осуществления внутриклеточная сигнальная область включает последовательность аминокислот, определенную в SEQ ID NO:13, 14 или 15, или последовательность аминокислот, которая идентична на по крайней мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более последовательности с SEQ ID NO:13, 14 или 15.
В некоторых аспектах спейсер содержит только шарнирную область IgG, например только шарнирную область IgG4 или IgG1, например спейсер в виде шарнирной области, определенной в SEQ ID NO:1. В других вариантах осуществления спейсер представляет собой шарнирную область Ig, например шарнирную область IgG4, связанную с СН2- и/или СН3-доменами. В некоторых вариантах осуществления спейсер представляет собой шарнирную область Ig, например шарнирную область IgG4, связанную с СН2- и СН3-доменами, например, как определено в SEQ ID NO:3. В некоторых вариантах осуществления спейсер представляет собой шарнирную область Ig, например шарнирную область IgG4, связанную только с СН3-доменом, например, как определено в SEQ ID NO:4. В некоторых вариантах осуществления спейсер представляет собой или включает последовательность, богатую глицином и серином, или другой гибкий линкер, такой как известные гибкие линкеры.
Например, в некоторых вариантах осуществления CAR включает антитело, например, фрагмент антитела, включая scFv, спейсер, такой как спейсер, содержащий часть молекулы иммуноглобулина, такую как шарнирная область, и/или одну или более константных областей молекулы тяжелой цепи, например спейсер, содержащий шарнирную область Ig, трансмембранный домен, содержащий весь или часть трансмембранного домена, происходящего из CD28, внутриклеточный сигнальный домен, происходящий из CD28, и сигнальный домен CD3 дзета. В некоторых вариантах осуществления CAR включает антитело или его фрагмент, такой как scFv, спейсер, такой как любой из спейсеров, содержащих шарнирную область Ig, трансмембранный домен, происходящий из CD28, внутриклеточный сигнальный домен, происходящий из 4-1BB, и сигнальный домен, происходящий из CD23 дзета.
В некоторых вариантах осуществления молекулы нуклеиновых кислот, кодирующие такие конструкции CAR, включают, кроме того, последовательность, кодирующую элемент пропуска рибосомой T2A, и/или последовательность tEGFR, например, ниже (3’) последовательности, кодирующей CAR. В некоторых вариантах осуществления эта последовательность кодирует элемент пропуска рибосомой T2A, определенный в SEQ ID NO:6 или 17, или последовательность аминокислот, которая идентична на по крайней мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более последовательности с SEQ ID NO:6 или 17. В некоторых вариантах осуществления также могут быть сконструированы экспрессирующие рецептор антигена (например, CAR) Т-клетки, которые экспрессируют также усеченный EGFR (EGFRt) в качестве неиммуногенного селективного эпитопа (например, путем введения конструкции, кодирующей CAR и EGFRt, разделенные переключателем рибосом T2A для экспрессии двух белков с одной и той же конструкции), который затем может использоваться в качестве маркера для обнаружения таких клеток (смотрите, например, патент США с №8802374). В некоторых вариантах осуществления последовательность кодирует последовательность tEGFR, определенную в SEQ ID NO:7 или 16, или последовательность аминокислот, которая идентична на по крайней мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более последовательности с SEQ ID NO:7 или 16. В некоторых случаях пептид, такой как T2A, может заставить рибосому пропустить (вызвать пропуск рибосомой) синтез пептидной связи на С-конце элемента 2А, что приводит к разделению между концом последовательности 2А и последующим пептидом (смотрите, например, de Felipe. Genetic Vaccines and Ther. 2:13 (2004) и de Felipe et al. Traffic 5:616-626 (2004)). Многие элементы 2А известны. Примеры последовательностей 2А, которые могут использоваться в способах и нуклеиновых кислотах, раскрытых здесь, включают, без ограничения, последовательности 2А из вируса ящура (F2A, например, SEQ ID NO:22), вируса ринита A у лошадей (E2A, например, SEQ ID NO:21), вируса Thosea asigna (T2A, например, SEQ ID NO:6 или 17) и тешовируса 1 свиней (P2A, например, SEQ ID NO:19 или 20), как описано в публикации заявки на патент США с № 20070116690.
Рекомбинантные рецепторы, такие как CAR, экспрессируемые клетками, вводимыми субъекту, обычно распознают или специфически связываются с молекулой, которая экспрессируется, связана и/или специфична для заболевания или состояния, подвергаемого лечению, или его клеток. При специфическом связывании с молекулой, например антигеном, рецептор, как правило, доставляет иммуностимулирующий сигнал, такой как ITAM-преобразуемый сигнал, в клетку, тем самым стимулируя иммунный ответ, направленный на заболевание или состояние. Например, в некоторых вариантах осуществления клетки экспрессируют CAR, который специфически связывается с антигеном, экспрессируемым клеткой или тканью заболевания или состояния или связанным с заболеванием или состоянием.
b. Химерные рецепторы аутоантител (CAAR)
В некоторых вариантах осуществления среди рекомбинантных рецепторов, экспрессируемых сконструированными клетками, используемыми в связи с предоставленными способами, применениями, изделиями и композициями, находится химерный рецептор аутоантитела (CAAR). В некоторых вариантах осуществления CAAR является специфическим для аутоантитела. В некоторых вариантах осуществления клетка, экспрессирующая CAAR, такая как Т-клетка, сконструированная для экспрессии CAAR, может использоваться для специфического связывания и уничтожения клеток, экспрессирующих аутоантитело, но не клеток, экспрессирующих нормальное антитело. В некоторых вариантах осуществления CAAR-экспрессирующие клетки могут использоваться для лечения аутоиммунного заболевания, связанного с экспрессией аутоантигенов, такого как аутоиммунные заболевания. В некоторых вариантах осуществления мишенью CAAR-экспрессирующих клеток могут являться B-клетки, которые в конечном итоге продуцируют аутоантитела и представляют аутоантитела на своих клеточных поверхностях, помечая эти B-клетки как специфические для заболевания мишени для терапевтического вмешательства. В некоторых вариантах осуществления CAAR-экспрессирующие клетки могут использоваться для эффективного нацеливания и уничтожения патогенных B-клеток при аутоиммунных заболеваниях путем нацеливания на вызывающие заболевание B-клетки с использованием антигенспецифического химерного рецептора аутоантитела. В некоторых вариантах осуществления рекомбинантный рецептор представляет собой CAAR, такой как любой, описанный в публикации заявки на патент США с № US 2017/0051035.
В некоторых вариантах осуществления CAAR включает связывающий аутоантитело домен, трансмембранный домен и внутриклеточную сигнальную область. В некоторых вариантах осуществления внутриклеточная сигнальная область включает внутриклеточный сигнальный домен. В некоторых вариантах осуществления внутриклеточный сигнальный домен представляет собой или включает первичный сигнальный домен, сигнальный домен, который способен индуцировать первичный сигнал активации в Т-клетке, сигнальный домен компонента Т-клеточного рецептора (TCR) и/или сигнальный домен, включающий мотив активации иммунорецепторов на основе тирозина (ITAM). В некоторых вариантах осуществления внутриклеточная сигнальная область включает вторичную или костимулирующую сигнальную область (вторичные внутриклеточные сигнальные области).
В некоторых вариантах осуществления домен, связывающий аутоантитело, включает аутоантиген или его фрагмент. Выбор аутоантигена может зависеть от типа аутоантитела, на которое нацеливаются. Например, аутоантиген может быть выбран, потому что он распознает аутоантитело в клетке-мишени, такой как В-клетка, связанная с конкретным болезненным состоянием, например аутоиммунным заболеванием, таким как аутоиммунное заболевание, опосредованное аутоантителами. В некоторых вариантах осуществления аутоиммунное заболевание включает пузырчатку обыкновенную (PV). Приводимые в качестве примера аутоантигены включают десмоглеин 1 (Dsgl) и Dsg3.
с. Множественное нацеливание
В некоторых вариантах осуществления клетки, используемые в связи с предоставленными способами, применениями, изделиями и композициями, включают клетки, использующие стратегии множественного нацеливания. В некоторых вариантах осуществления клетки экспрессируют многоцепочечные химерные рецепторы антигенов (CAR) или экспрессируют два или более генно-инженерных рецепторов в клетке, каждый из которых распознает один отличный антиген и, как правило, каждый из них включает отличный компонент внутриклеточной сигнализации. Такие стратегии множественного нацеливания описаны, например, в международной заявке на патент, публикации с № WO 2014055668 A1 (в которой описываются комбинации активирующих и костимулирующих CAR, например, нацеливание на два разных антигена, присутствующих по отдельности вне мишени, например, на нормальных клетках, но присутствующих вместе только на клетках заболевания или состояния, подвергаемого лечению) и в Fedorov et al., Sci. Transl. Medicine, 5(215) (2013) (где описываются клетки, экспрессирующие активирующий и ингибирующий CAR, такие как клетки, в которых активирующий CAR связывается с одним антигеном, экспрессируемым как в нормальных или не пораженных болезнью клетках, так и в клетках заболевания или состояния, подвергаемого лечению, а ингибирующий CAR связывается с другим антигеном, экспрессируемым только на нормальных клетках или клетках, которые нежелательно подвергать воздействию).
Например, в некоторых вариантах осуществления клетки включают рецептор, представляющий первый генно-инженерный рецептор антигена (например, CAR или TCR), который способен индуцировать активирующий или стимулирующий сигнал в клетке, как правило, при специфическом связывании с антигеном, распознаваемым первым рецептором, например первым антигеном. В некоторых вариантах осуществления клетка включает, кроме того, второй генно-инженерный рецептор антигена (например, CAR или TCR), например химерный костимулирующий рецептор, который способен индуцировать костимулирующий сигнал в иммунной клетке, как правило, при специфическом связывании со вторым антигеном, распознаваемым вторым рецептором. В некоторых вариантах осуществления первый антиген и второй антиген являются одинаковыми. В некоторых вариантах осуществления первый антиген и второй антиген являются отличными.
В некоторых вариантах осуществления первый и/или второй генно-инженерный рецептор антигена (например, CAR или TCR) способен индуцировать активирующий сигнал в клетке. В некоторых вариантах осуществления рецептор включает внутриклеточный сигнальный компонент, содержащий ITAM или ITAM-подобные мотивы. В некоторых вариантах осуществления активация, индуцированная первым рецептором, включает преобразование сигнала или изменение экспрессии белка в клетке, что приводит к инициации иммунного ответа, например, фосфорилированию ITAM и/или инициации каскада преобразования сигнала, опосредуемого ITAM, образованию иммунологического синапса и/или кластеризации молекул вблизи связанного рецептора (например, CD4 или CD8 и т.д.), активации одного или более факторов транскрипции, таких как NF-KB и/или AP-1, и/или индукции экспрессии генов таких факторов, как цитокины, пролиферации и/или выживанию.
В некоторых вариантах осуществления первый и/или второй рецептор включает внутриклеточные сигнальные домены или области костимулирующих рецепторов, таких как CD28, CD137 (4-1BB), OX40 и/или ICOS. В некоторых вариантах осуществления первый и второй рецепторы включают внутриклеточный сигнальный домен костимулирующего рецептора, которые различны. В одном варианте осуществления первый рецептор содержит костимулирующую сигнальную область CD28, а второй рецептор содержит костимулирующую сигнальную область 4-1BB, или наоборот.
В некоторых вариантах осуществления первый и/или второй рецептор включает как внутриклеточный сигнальный домен, содержащий IT-AM или ITAM-подобные мотивы, так и внутриклеточный сигнальный домен костимулирующего рецептора.
В некоторых вариантах осуществления первый рецептор содержит внутриклеточный сигнальный домен, содержащий ITAM или ITAM-подобные мотивы, а второй рецептор содержит внутриклеточный сигнальный домен костимулирующего рецептора. Костимулирующий сигнал в сочетании с активирующим сигналом, индуцированным в одной и той же клетке, является сигналом, который приводит к иммунному ответу, такому как устойчивый и длительный иммунный ответ, например, увеличенной экспрессии генов, секреции цитокинов и других факторов, и опосредованным Т-клетками эффекторным функциям, таким как уничтожение клеток.
В некоторых вариантах осуществления ни лигирование только первого рецептора, ни лигирование только второго рецептора не индуцирует стойкий иммунный ответ. В некоторых аспектах, при лигировании только одного рецептора, клетка становится толерантной или не реагирующей на антиген, или ингибируется и/или не индуцируется ее пролиферация или секреция ею факторов или выполнение ею эффекторных функций. Однако в некоторых таких вариантах осуществления, при лигировании множества рецепторов, например, при встрече с клеткой, экспрессирующей первый и второй антигены, достигается желательный ответ, такой как полная иммунная активация или стимуляция, на что, например, указывает секреция одного или более цитокинов, пролиферация, персистенция и/или выполнение иммунной эффекторной функции, такой как цитотоксическое уничтожение клетки-мишени.
В некоторых вариантах осуществления два рецептора индуцируют, соответственно, активирующий и ингибирующий сигнал в клетке, так что связывание одним из рецепторов его антигена активирует клетку или индуцирует ответ, но связывание вторым ингибирующим рецептором его антигена индуцирует сигнал, который подавляет или ослабляет этот ответ. Примерами являются комбинации активирующих CAR и ингибирующих CAR или iCAR. Например, может использоваться такая стратегия, в которой активирующий CAR связывает антиген, экспрессируемый при заболевании или состоянии, но который также экспрессируется на нормальных клетках, а ингибирующий рецептор связывается с отдельным антигеном, который экспрессируется в нормальных клетках, но не в клетках заболевания или состояния.
В некоторых вариантах осуществления стратегия множественного нацеливания применяется в случае, когда антиген, связанный с конкретным заболеванием или состоянием, экспрессируется в пораженной заболеванием клетке и/или экспрессируется в самой сконструированной клетке, либо транзиторно (например, после стимуляции в связи с генной инженерией) или постоянно. В таких случаях, при необходимости лигирования двух отдельных и индивидуально антигенспецифических рецепторов можно увеличить специфичность, селективность и/или эффективность.
В некоторых вариантах осуществления множество антигенов, например первый и второй антигены, экспрессируются в клетке, ткани или заболевании или состоянии, являющейся мишенью, например, в раковой клетке. В некоторых аспектах клетка, ткань, заболевание или состояние представляет собой множественную миелому или клетку множественной миеломы. В некоторых вариантах осуществления один или более из множества антигенов, как правило, также экспрессируются в клетке, на которую нежелательно воздействовать с помощью клеточной терапии, такой как нормальная или не пораженная болезнью клетка или ткань, и/или самих сконструированных клетках. В таких вариантах осуществления, при необходисти лигирования множества рецепторов для достижения ответа клетки достигается специфичность и/или эффективность.
d. Т-клеточные рецепторы (TCR)
В некоторых вариантах осуществления предоставляются сконструированные клетки, такие как T-клетки, которые экспрессируют T-клеточный рецептор (TCR) или его антигенсвязывающую часть, которая распознает пептидный эпитоп или T-клеточный эпитоп полипептида-мишени, такого как опухолевый антиген, вирусный или аутоиммунный белок.
В некоторых вариантах осуществления «Т-клеточный рецептор» или «TCR» представляет собой молекулу, которая содержит вариабельные цепи α и β (также известные как TCRα и TCRβ, соответственно) или вариабельные цепи γ и δ (также известные как TCRα и TCRβ, соответственно) или их антигенсвязывающие части, и которая способна к специфическому связыванию с пептидом, связанным с молекулой МНС. В некоторых вариантах осуществления TCR находится в форме αβ. Как правило, TCR, которые существуют в формах αβ и γδ, обычно структурно сходны, но экспрессирующие их T-клетки могут иметь различные анатомические положения или функции. TCR можно найти на поверхности клетки или в растворимой форме. Как правило, TCR обнаруживается на поверхности Т-клеток (или Т-лимфоцитов), где он обычно отвечает за распознавание антигенов, связанных с молекулами главного комплекса гистосовместимости (МНС).
Кроме особо оговоренных случаев, следует понимать, что термин «TCR» охватывает полноразмерные TCR, а также их антигенсвязывающие части или антигенсвязывающие фрагменты. В некоторых вариантах осуществления TCR представляет собой интактный или полноразмерный TCR, включая TCR в форме αβ или γδ. В некоторых вариантах осуществления TCR представляет собой антигенсвязывающую часть, которая меньше полноразмерного TCR, но которая связывается со специфическим пептидом, связанным с молекулой MHC, например, связывается с комплексом MHC-пептид. В некоторых случаях антигенсвязывающая часть или фрагмент TCR может содержать только часть структурных доменов полноразмерного или интактного TCR, но все же способна связывать пептидный эпитоп, такой как комплекс MHC-пептид, с который связывается полноразмерный TCR. В некоторых случаях антигенсвязывающая часть содержит вариабельные домены TCR, такие как вариабельная цепь α и вариабельная цепь β TCR, достаточные для образования сайта связывания для связывания со специфическим комплексом MHC-пептид. Как правило, вариабельные цепи TCR содержат определяющие комплементарность участки, участвующие в распознавании пептида, MHC и/или комплекса MHC-пептид.
В некоторых вариантах осуществления вариабельные домены TCR содержат гипервариабельные петлевые участки или определяющие комплементарность участки (CDR), которые, как правило, являются основными вкладчиками в способность к распознаванию и связыванию антигена и специфичность. В некоторых вариантах осуществления CDR TCR или их комбинации образуют весь или по существу весь антигенсвязывающий сайт данной молекулы TCR. Различные CDR в вариабельной области цепи TCR обычно разделяются каркасными областями (FR), которые обычно демонстрируют меньшую вариабельность среди молекул TCR по сравнению с CDR (смотрите, например, Jores et al., Proc. Nat’l Acad. Sci. U.S.A. 87:9138, 1990; Chothia et al., EMBO J. 7:3745, 1988; смотрите также Lefranc et al., Dev. Comp. Immunol. 27:55, 2003). В некоторых вариантах осуществления CDR3 является основным CDR, ответственным за связывание или специфичность к антигену, или является самым важным среди трех CDR в данной вариабельной области TCR для распознавания антигена и/или для взаимодействия с процессированной пептидной частью комплекса пептид-MHC. В некоторых случаях CDR1 альфа-цепи может взаимодействовать с N-концевой частью определенных антигенных пептидов. В некоторых случаях CDR1 бета-цепи может взаимодействовать с С-концевой частью пептида. В некоторых случаях CDR2 вносит самый большой вклад или является основным CDR, ответственным за взаимодействие или распознавание MHC-части комплекса MHC-пептид. В некоторых вариантах осуществления вариабельная область β-цепи может содержать дополнительный гипервариабельный участок (CDR4 или HVR4), который обычно участвует в связывании с суперантигеном, а не в распознавании антигена (Kotb (1995) Clinical Microbiology Reviews, 8:411-426).
В некоторых вариантах осуществления TCR также может содержать константный домен, трансмембранный домен и/или короткий цитоплазматический хвост (смотрите, например, Janeway et al., Immunobiology: The Immune System in Health and Disease, 3rd Ed., Current Biology Publications, p. 4:33, 1997). В некоторых аспектах каждая цепь TCR может иметь один N-концевой вариабельный домен иммуноглобулина, один константный домен иммуноглобулина, трансмембранную область и короткий цитоплазматический хвост на С-конце. В некоторых вариантах осуществления TCR связан с инвариантными белками комплекса CD3, участвующими в передаче сигнала.
В некоторых вариантах осуществления цепь TCR содержит один или более константных доменов. Например, экстраклеточная часть конкретной цепи TCR (например, α-цепи или β-цепи) может содержать два иммуноглобулиноподобных домена, таких как вариабельный домен (например, Vα или Vβ; обычно аминокислоты с 1 по 116 на основе нумерации по Kabat (Kabat et al., “Sequences of Proteins of Immunological Interest, US Dept. Health and Human Services, Public Health Service National Institutes of Health, 1991, 5th ed.) и константный домен (например, константный домен α-цепи или Cα, как правило, в положениях 117-259 цепи на основе нумерации по Kabat) или константный домен β-цепи или Cβ, как правило, в положениях 117-295 цепи на основе нумерации по Kabat) рядом с клеточной мембраной. Например, в некоторых случаях экстраклеточная часть TCR, образованного двумя цепями, содержит два мембранно-проксимальных константных домена и два мембранно-дистальных вариабельных домена, при этом каждый вариабельный домен содержит CDR. Константный домен TCR может содержать короткие соединительные последовательности, в которых остаток цистеина образует дисульфидную связь, тем самым связывая две цепи TCR. В некоторых вариантах осуществления TCR может иметь дополнительный остаток цистеина в каждой из цепей α и β; так что TCR содержит две дисульфидные связи в константных доменах.
В некоторых вариантах осуществления цепи TCR содержат трансмембранный домен. В некоторых вариантах осуществления трансмембранный домен является положительно заряженным. В некоторых случаях цепь TCR содержит цитоплазматический хвост. В некоторых случаях структура позволяет TCR связываться с другими молекулами типа CD3 и его субъединицами. Например, TCR, содержащий константные домены с трансмембранной областью, может закреплять белок в клеточной мембране и связываться с инвариантными субъединицами сигнального аппарата или комплекса CD3. Внутриклеточные хвосты сигнальных субъединиц CD3 (например, цепи CD3у, CD35, CD3s и CD3ζ) содержат один или более мотивов активации иммунорецепторов на основе тирозина или ITAM, которые участвуют в способности TCR комплекса к передаче сигналов.
В некоторых вариантах осуществления TCR может представлять собой гетеродимер с двумя цепями α и β (или необязательно γ и δ), или он может представлять собой одноцепочечную конструкцию TCR. В некоторых вариантах осуществления TCR представляет собой гетеродимер, содержащий две отдельные цепи (цепи α и β или цепи γ и δ), которые связаны, например, дисульфидной связью или дисульфидными связями.
В некоторых вариантах осуществления TCR может быть получен исходя из известной последовательности(ей) TCR, такой как последовательности цепей Vαβ, для которых легкодоступна по существу полноразмерная кодирующая последовательность. Способы получения полноразмерных последовательностей TCR, включая последовательности V-цепей, из клеточных источников хорошо известны. В некоторых вариантах осуществления нуклеиновые кислоты, кодирующие TCR, могут быть получены из ряда источников, например, путем амплификации с помощью полимеразной цепной реакции (ПЦР) кодирующих TCR нуклеиновых кислот внутри данной клетки или клеток или выделенных из них, или синтеза общедоступных ДНК-последовательностей TCR.
В некоторых вариантах осуществления TCR получают из биологического источника, такого как клетки, такие как T-клетки (например, цитотоксические T-клетки), T-клеточные гибридомы или другие общедоступные источники. В некоторых вариантах осуществления Т-клетки могут быть получены из выделенных клеток in vivo. В некоторых вариантах осуществления TCR представляет собой тимически отобранный TCR. В некоторых вариантах осуществления TCR представляет собой TCR с рестрикцией по неоэпитопу. В некоторых вариантах осуществления Т-клетки могут представлять собой культивируемую Т-клеточную гибридому или клон. В некоторых вариантах осуществления TCR или его антигенсвязывающая часть или его антигенсвязывающий фрагмент могут быть синтезированы, исходя из знания последовательности TCR.
В некоторых вариантах осуществления TCR конструируют исходя из TCR, идентифицированного или отобранного при скрининге библиотеки TCR-кандидатов против полипептидного антигена-мишени или его Т-клеточного эпитопа-мишени. Библиотеки TCR могут быть сконструированы путем амплификации репертуара Vα или Vβ из Т-клеток, выделенных от субъекта, включая клетки, присутствующие в РВМС, селезенке или другом лимфоидном органе. В некоторых случаях Т-клетки могут быть амплифицированы из инфильтрирующих опухоль лимфоцитов (TIL). В некоторых вариантах осуществления библиотеки TCR могут быть получены из CD4+ или CD8+ T-клеток. В некоторых вариантах осуществления TCR можно амплифицировать из источника T-клеток нормального здорового субъекта, т.е. библиотек нормальных TCR. В некоторых вариантах осуществления TCR можно амплифицировать из источника T-клеток пораженного болезнью субъекта, т.е. библиотек пораженных болезнью TCR. В некоторых вариантах осуществления вырожденные праймеры используются для амплификации репертуара генов Vα или Vβ, например, с помощью ОТ-ПЦР в образцах, таких как Т-клетки, полученных от людей. В некоторых вариантах осуществления библиотеки scTv могут быть собраны из библиотек наивных Vα или Vβ, в которых амплифицированные продукты клонируются или собираются с разделением линкером. В зависимости от источника субъекта и клеток, библиотеки могут быть специфическими для аллели HLA. Альтернативно, в некоторых вариантах осуществления библиотеки TCR могут быть получены путем мутагенеза или диверсификации родительской или каркасной молекулы TCR. В некоторых аспектах TCR подвергаются направленной эволюции, например, путем мутагенеза, например, цепи α или β. В некоторых аспектах изменяют конкретные остатки в CDR TCR. В некоторых вариантах осуществления отобранные TCR могут быть модифицированы путем созревания аффинности. В некоторых вариантах осуществления антигенспецифические Т-клетки могут быть отобраны, например, путем скрининга для оценки активности CTL против пептида. В некоторых аспектах TCR, например, присутствующие в антигенспецифических Т-клетках, могут быть отобраны, например, по активности связывания, например, определенной аффинности или авидности к антигену.
В некоторых вариантах осуществления TCR или его антигенсвязывающая часть является таковой, которая была модифицирована или сконструирована. В некоторых вариантах осуществления способы направленной эволюции используются для создания TCR с измененными свойствами, такими как более высокое сродство к конкретному комплексу MHC-пептид. В некоторых вариантах осуществления направленная эволюция достигается с использованием способов дисплея, в том числе, но без ограничения ими, дрожжевого дисплея (Holler et al. (2003) Nat Immunol, 4, 55-62; Holler et al. (2000) Proc Natl Acad Sci USA, 97, 5387-92), фагового дисплея (Li et al. (2005) Nat Biotechnol, 23, 349-54) или Т-клеточного дисплея (Chervin et al. (2008) J Immunol Methods, 339, 175-84). В некоторых вариантах осуществления подходы к дисплею включают конструирование или модификацию известного, родительского или ссылочного TCR. Например, в некоторых случаях TCR дикого типа может использоваться в качестве матрицы для получения подвергнутых мутагенезу TCR, в которых один или более остатков CDR мутированы, и отбираются мутанты с желательным измененным свойством, таким как более высокое сродство к желательному антигену-мишени.
В некоторых вариантах осуществления пептиды полипептида-мишени для использования при получении или конструировании представляющего интерес TCR известны или могут быть без труда идентифицированы. В некоторых вариантах осуществления пептиды, подходящие для использования в конструировании TCR или антигенсвязывающих частей, могут быть определены на основе присутствия мотива с рестрикцией по HLA в представляющем интерес полипептиде-мишени, таком как полипептид-мишень, описанный ниже. В некоторых вариантах осуществления пептиды идентифицируют с использованием доступных компьютерных моделей прогнозирования. В некоторых вариантах осуществления для прогнозирования сайтов связывания МНС класса I такие модели включают, но без ограничения ими, ProPredl (Singh and Raghava (2001) Bioinformatics 17 (12):1236-1237 и SYFPEITHI (смотрите Schuler et al. (2007) Immunoinformatics Methods in Molecular Biology, 409(1):75-93 2007). В некоторых вариантах осуществления MHC-рестриктированный эпитоп представляет собой HLA-A0201, который экспрессируется приблизительно у 39-46% всех представителей белой европеоидной расы и, следовательно, представляет собой подходящий выбор антигена MHC для использования при получении TCR или другой молекулы, связывающей MHC-пептид.
HLA-A0201-связывающие мотивы и сайты расщепления для протеасом и иммунных протеасом известны с использованием компьютерных моделей прогнозирования. Для прогнозирования сайтов связывания MHC класса I, такие модели включают, но без ограничения ими, ProPredl (более подробно описанная в Singh and Raghava, ProPred: prediction of HLA-DR binding sites. BIOINFORMATICS 17(12):1236-1237 2001), и SYFPEITHI (смотрите Schuler et al. SYFPEITHI, Database for Searching and T-Cell Epitope Prediction. in Immunoinformatics Methods in Molecular Biology, vol 409(1):75-93 2007)
В некоторых вариантах осуществления TCR или его антигенсвязывающая часть могут представлять собой рекомбинантно продуцируемый природный белок или его мутированную форму, в которой было изменено одно или более свойств, например характеристика связывания. В некоторых вариантах осуществления TCR может происходить от одного из различных видов животных, таких как человек, мышь, крыса или другое млекопитающее. TCR может быть связанным с клеткой или в растворимой форме. В некоторых вариантах осуществления для целей предоставленных способов TCR находится в связанной с клеткой форме, экспрессируемой на поверхности клетки.
В некоторых вариантах осуществления TCR является полноразмерным TCR. В некоторых вариантах осуществления TCR представляет собой антигенсвязывающую часть. В некоторых вариантах осуществления TCR представляет собой димерный TCR (dTCR). В некоторых вариантах осуществления TCR представляет собой одноцепочечный TCR (sc-TCR). В некоторых вариантах осуществления dTCR или scTCR имеют структуры, описанные в WO 03/020763, WO 04/033685, WO 2011/044186.
В некоторых вариантах осуществления TCR содержит последовательность, соответствующую трансмембранной последовательности. В некоторых вариантах осуществления TCR содержит последовательность, соответствующую цитоплазматическим последовательностям. В некоторых вариантах осуществления TCR способен образовывать комплекс TCR с CD3. В некоторых вариантах осуществления любой из TCR, включая dTCR или scTCR, может быть связан с сигнальными доменами, которые дают активный TCR на поверхности Т-клетки. В некоторых вариантах осуществления TCR экспрессируется на поверхности клеток.
В некоторых вариантах осуществления dTCR содержит первый полипептид, в котором последовательность, соответствующая последовательности вариабельной области α-цепи TCR, слита с N-концом последовательности, соответствующей экстраклеточной последовательности константной области α-цепи TCR, и второй полипептид, в котором последовательность, соответствующая последовательности вариабельной области β-цепи TCR, слита с N-концом последовательности, соответствующей экстраклеточной последовательности константной области β-цепи TCR, при этом первый и второй полипептиды связаны дисульфидной связью. В некоторых вариантах осуществления связь может соответствовать встречающейся в природе межцепочечной дисульфидной связи, присутствующей во встречающихся в природе димерных αβ TCR. В некоторых вариантах осуществления межцепочечные дисульфидные связи не присутствуют во встречающемся в природе TCR. Например, в некоторых вариантах осуществления один или более цистеинов могут быть включены в экстраклеточные последовательности константной области пары полипептидов dTCR. В некоторых случаях может быть желательной как встречающаяся в природе, так и не встречающаяся в природе дисульфидная связь. В некоторых вариантах осуществления TCR содержит трансмембранную последовательность для закрепления в мембране.
В некоторых вариантах осуществления dTCR содержит α-цепь TCR, содержащую вариабельный α-домен, константный α-домен и первый мотив димеризации, присоединенный к C-концу константного α-домена, и β-цепь TCR, содержащую вариабельный β-домен, константный β-домен и второй мотив димеризации, присоединенный к C-концу константного β-домена, причем первый и второй мотивы димеризации легко взаимодействуют с образованием ковалентной связи между аминокислотой в первом мотиве димеризации и аминокислотой во втором мотиве димеризации, связывая вместе α-цепь TCR и β-цепь TCR.
В некоторых вариантах осуществления TCR представляет собой scTCR. Как правило, scTCR может быть сконструирован с использованием известных методов, смотрите, например, Soo Hoo, W. F. et al. PNAS (USA) 89, 4759 (1992); Wülfing, C. and Plückthun, A., J. Mol. Biol. 242, 655 (1994); Kurucz, I. et al. PNAS (USA) 90 3830 (1993); международные опубликованные РСТ-заявки с № WO 96/13593, WO 96/18105, WO99/60120, WO99/18129, WO 03/020763, WO2011/044186; и Schlueter, C. J. et al. J. Mol. Biol. 256, 859 (1996). В некоторых вариантах осуществления scTCR содержит введенную не встречающуюся в природе дисульфидную межцепочечную связь для облегчения ассоциации цепей TCR (смотрите, например, международную опубликованную РСТ-заявку с № WO 03/020763). В некоторых вариантах осуществления scTCR представляет собой усеченный TCR с недисульфидной связью, в котором гетерологичные лейциновые молнии, слитые с их С-концами, облегчают ассоциацию цепей (смотрите, например, международную опубликованную РСТ-заявку с № WO99/60120). В некоторых вариантах осуществления scTCR содержит вариабельный домен TCRα, ковалентно связанный с вариабельным доменом TCRβ через пептидный линкер (смотрите, например, международную опубликованную РСТ-заявку с № W099/18129).
В некоторых вариантах осуществления scTCR содержит первый сегмент, состоящий из аминокислотной последовательности, соответствующей вариабельной области α-цепи TCR, второй сегмент, состоящий из аминокислотной последовательности, соответствующей последовательности вариабельной области β-цепи TCR, слитый с N-концом аминокислотной последовательности, соответствующей экстраклеточной последовательности константного домена β-цепи TCR, и линкерную последовательность, связывающую C-конец первого сегмента с N-концом второго сегмента.
В некоторых вариантах осуществления scTCR содержит первый сегмент, состоящий из последовательности вариабельной области α-цепи, слитый с N-концом экстраклеточной последовательности константного домена α-цепи, и второй сегмент, состоящий из последовательности вариабельной области β-цепи, слитый с N-концом экстраклеточной константной и трансмембранной последовательности β-цепи, и, необязательно, линкерную последовательность, связывающую C-конец первого сегмента с N-концом второго сегмента.
В некоторых вариантах осуществления scTCR содержит первый сегмент, состоящий из последовательности вариабельной области β-цепи TCR, слитой с N-концом экстраклеточной последовательности константной области β-цепи, и второй сегмент, состоящий из последовательности вариабельной области α-цепи, слитый с N-концом экстраклеточной константной и трансмембранной последовательности α-цепи, и, необязательно, линкерную последовательность, связывающую C-конец первого сегмента с N-концом второго сегмента.
В некоторых вариантах осуществления линкер scTCR, который связывает первый и второй сегменты TCR, может представлять собой любой линкер, способный образовывать одну полипептидную цепь, сохраняя при этом специфичность связывания TCR. В некоторых вариантах осуществления линкерная последовательность может, например, иметь формулу -P-AA-P-, где P представляет собой пролин, а AA представляет собой аминокислотную последовательность, в которой аминокислоты представляют собой глицин и серин. В некоторых вариантах осуществления первый и второй сегменты спарены так, что последовательности их вариабельных областей ориентированы для такого связывания. Следовательно, в некоторых случаях линкер имеет достаточную длину, чтобы охватить расстояние между C-концом первого сегмента и N-концом второго сегмента, или наоборот, но он не является слишком длинным, чтобы блокировать или уменьшать связывание scTCR с лигандом-мишенью. В некоторых вариантах осуществления линкер может содержать от или приблизительно от 10 до 45 аминокислот, например от 10 до 30 аминокислот или от 26 до 41 аминокислотных остатков, например 29, 30, 31 или 32 аминокислоты. В некоторых вариантах осуществления линкер имеет формулу -PGGG-(SGGGG)5-P-, где P представляет собой пролин, G представляет собой глицин, и S представляет собой серин (SEQ ID NO:32). В некоторых вариантах осуществления линкер имеет последовательность GSADDAKKDAAKKDGKS (SEQ ID NO:33).
В некоторых вариантах осуществления scTCR содержит ковалентную дисульфидную связь, связывающую остаток иммуноглобулиной области константного домена α-цепи с остатком иммуноглобулиной области константного домена β-цепи. В некоторых вариантах осуществления межцепочечная дисульфидная связь во встречающемся в природе TCR отсутствует. Например, в некоторых вариантах осуществления один или более цистеинов могут быть включены в экстраклеточные последовательности константных областей первого и второго сегментов полипептида scTCR. В некоторых случаях может быть желательной как встречающаяся в природе, так и не встречающаяся в природе дисульфидная связь.
В некоторых вариантах осуществления dTCR или scTCR, содержащих введенные межцепочечные дисульфидные связи, встречающиеся в природе дисульфидные связи отсутствуют. В некоторых вариантах осуществления один или более природных цистеинов, образующих встречающиеся в природе межцепочечные дисульфидные связи, замещены другим остатком, таким как серин или аланин. В некоторых вариантах осуществления введенная дисульфидная связь может быть образована путем мутации нецистеиновых остатков в первом и втором сегментах с заменой на цистеин. Приводимые в качестве примера не встречающиеся в природе дисульфидные связи TCR описаны в опубликованной международной РСТ-заявке с № WO2006/000830.
В некоторых вариантах осуществления TCR или его антигенсвязывающий фрагмент проявляют сродство с константой равновесного связывания для антигена-мишени между или приблизительно между 10-5 и 10-12 М и всеми отдельными значениями и диапазонами в них. В некоторых вариантах осуществления антиген-мишень представляет собой комплекс MHC-пептид или лиганд.
В некоторых вариантах осуществления нуклеиновую кислоту или нуклеиновые кислоты, кодирующие TCR, например, α- и β-цепи, можно амплифицировать с помощью ПЦР, клонирования или других подходящих способов и клонировать в подходящий экспрессионный вектор или векторы. Экспрессионный вектор может быть любым подходящим рекомбинантным экспрессионным вектором и может использоваться для трансформации или трансфекции любого подходящего хозяина. Подходящие векторы включают векторы, предназначенные для размножения и увеличения количества или для экспрессии или того и другого, такие как плазмиды и вирусы.
В некоторых вариантах осуществления вектор может представлять собой вектор из серии pUC (Fermentas Life Sciences), серии pBluescript (Stratagene, LaJolla, CA), серии pET (Novagen, Madison, WI), серии pGEX (Pharmacia Biotech, Uppsala, Швеция) или серия pEX (Clontech, Palo Alto, CA). В некоторых случаях также могут использоваться векторы на основе бактериофагов, такие как G10, GT11, ZapII (Stratagene), EMBL4 и γ MI149. В некоторых вариантах осуществления могут использоваться векторы для экспрессии в клетках растений, и они включают pBIO1, pBI101.2, pBI101.3, pBI121 и pBIN19 (Clontech). В некоторых вариантах осуществления векторы для экспрессии в клетках животных включают pEUK-Cl, pMAM и pMAMneo (Clontech). В некоторых вариантах осуществления используется вирусный вектор, такой как ретровирусный вектор.
В некоторых вариантах осуществления рекомбинантные экспрессионные векторы могут быть получены с использованием стандартных методов рекомбинантных ДНК. В некоторых вариантах осуществления векторы могут содержать регуляторные последовательности, такие как кодоны инициации и терминации транскрипции и трансляции, которые специфичны для типа хозяина (например, бактерии, гриба, растения или животного), в который должен быть введен вектор, как уместно и принимая во внимание, является ли вектор вектором на основе ДНК или РНК. В некоторых вариантах осуществления вектор может содержать не встречающийся в природе промотор, функционально связанный с нуклеотидной последовательностью, кодирующей TCR или его антигенсвязывающую часть (или другую связывающую MHC-пептид молекулу). В некоторых вариантах осуществления промотор может быть невирусным промотором или вирусным промотором, таким как промотор цитомегаловируса (CMV), промотор SV40, промотор RSV и промотор, обнаруживаемый в длинном концевом повторе вируса мышиных стволовых клеток. Другие известные промоторы также рассматриваются.
В некоторых вариантах осуществления для создания вектора, кодирующего TCR, α- и β-цепи амплифицируют с помощью ПЦР исходя из тотальной кДНК, выделенной из клона Т-клеток, экспрессирующего представляющий интерес TCR, и клонируют в экспрессионный вектор. В некоторых вариантах осуществления α- и β-цепи клонируют в один и тот же вектор. В некоторых вариантах осуществления α- и β-цепи клонируют в разные векторы. В некоторых вариантах осуществления сконструированные α- и β-цепи вставляют в ретровирусный, например лентивирусный вектор.
D. Особенности выходной композиции клеток
В конкретных вариантах осуществления предоставленные здесь способы создают или образуют композицию клеток, которые содержат генно-инженерные клетки, например выходную композицию клеток. В некоторых вариантах осуществления выходная композиция клеток представляет собой композицию клеток, которая является результатом некоторых или всех стадий генной инженерии клеток. В некоторых вариантах осуществления выходная композиция клеток является результатом процесса генной инженерии клеток входной композиции клеток. В некоторых вариантах осуществления процесс включает одну или более стадий активации, трансдукции или трансфекции, размножения и/или сбора клеток, таких как клетки, которые были получены из входной композиции клеток. В некоторых вариантах осуществления выходная композиция клеток содержит клетки, которые были сконструированы с помощью генной инженерии. В конкретных вариантах осуществления клетки выходной композиции клеток прошли все стадии процесса генной инженерии.
В некоторых вариантах осуществления выходная композиция клеток содержит клетки, которые включают одну или более нуклеиновых кислот, введенных с помощью генной инженерии, и тем самым экспрессируют рекомбинантные или генно-инженерные продукты таких нуклеиновых кислот. В некоторых вариантах осуществления нуклеиновые кислоты являются гетерологичными, т.е. обычно не присутствуют в клетке или образце, полученном из клетки, например, полученной из другого организма или клетки, которая(ый), например, обычно не обнаруживается в клетке, подвергаемой стадиям конструирования, и/или организме, из которого получена такая клетка. В некоторых вариантах осуществления нуклеиновые кислоты не встречаются в природе, такие как нуклеиновая кислота, не встречающаяся в природе, включая такую, которая включает химерные комбинации нуклеиновых кислот, кодирующих различные домены из множества различных типов клеток.
В некоторых вариантах осуществления выходная композиция клеток содержит клетки, которые были сконструированы с помощью генной инженерии. В конкретных вариантах осуществления выходная композиция клеток содержит сконструированные Т-клетки. В некоторых вариантах осуществления сконструированные T-клетки включают сконструированные CD4+ T-клетки и сконструированные CD8+ T-клетки. В конкретных вариантах осуществления выходная композиция клеток содержит или включает по крайней мере 25%, по крайней мере 30%, по крайней мере 40%, по крайней мере 50%, по крайней мере 60%, по крайней мере 70%, по крайней мере 75%, по крайней мере 80%, по крайней мере 85%, по крайней мере 90%, по крайней мере 95%, по крайней мере 96%, по крайней мере 97%, по крайней мере 98%, по крайней мере 99%, по крайней мере 99,5%, по крайней мере 99,9% или 100% или приблизительно 100% сконструированных Т-клеток. В некоторых вариантах осуществления сконструированные клетки экспрессируют рекомбинантный рецептор. В конкретных вариантах осуществления выходная композиция клеток содержит или включает по крайней мере 25%, по крайней мере 30%, по крайней мере 40%, по крайней мере 50%, по крайней мере 60%, по крайней мере 70%, по крайней мере 75%, по крайней мере 80%, по крайней мере 85%, по крайней мере 90%, по крайней мере 95%, по крайней мере 96%, по крайней мере 97%, по крайней мере 98%, по крайней мере 99%, по крайней мере 99,5%, по крайней мере 99,9% или 100% или приблизительно 100% Т-клеток, которые экспрессируют рекомбинантный рецептор. В некоторых вариантах осуществления рекомбинантный рецептор представляет собой TCR или CAR. В конкретных вариантах осуществления рекомбинантный рецептор представляет собой CAR.
В некоторых вариантах осуществления выходная композиция клеток характеризуется отношением сконструированных CD4+ T-клеток к CD8+ T-клеткам, находящимся между 5:1 и 0,2:1, 4:1 и 0,25:1, 3:1 и 0,33:1, 2:1 и 0,5:1, 1,5:1 и 0,66:1 или 1,25:1 и 0,8:1. В конкретных вариантах осуществления выходная композиция клеток характеризуется отношением сконструированных CD4+ T-клеток к CD8+ T-клеткам, находящимся между 2:1 и 0,5:1. В некоторых вариантах осуществления выходная композиция клеток характеризуется отношением сконструированных CD4+ T-клеток к CD8+ T-клеткам, составляющим или приблизительно составляющим 2,0:1, 1,9:1, 1,8:1, 1,7:1, 1,6:1, 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1, 1,0:1, 0,9:1, 0,8:1, 0,7:1, 0,6:1 или 0,5:1. В конкретных вариантах осуществления выходная композиция клеток характеризуется отношением сконструированных CD4+ T-клеток к CD8+ T-клеткам, составляющим или приблизительно составляющим 1:1. В конкретных вариантах осуществления сконструированные Т-клетки экспрессируют рекомбинантный рецептор. В конкретных вариантах осуществления выходная композиция клеток характеризуется отношением экспрессирующих рекомбинантный рецептор CD4+ Т-клеток к экспресирующим рекомбинантный рецептор CD8+ Т-клеткам, составляющим или приблизительно составляющим 2,0:1, 1,9:1, 1,8:1, 1,7:1, 1,6:1, 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1, 1,0:1, 0,9:1, 0,8:1, 0,7:1, 0,6:1 или 0,5:1. В конкретных вариантах осуществления выходная композиция клеток характеризуется отношением экспрессирующих рекомбинантный рецептор CD4+ T-клеток к экспрессирующим рекомбинантный рецептор CD8+ T-клеткам, составляющим или приблизительно составляющим 1:1. В некоторых вариантах осуществления рекомбинантный рецептор представляет собой TCR или CAR. В конкретных вариантах осуществления рекомбинантный рецептор представляет собой CAR.
В некоторых вариантах осуществления способы дают в результате выходную композицию клеток, характеризующуюся отношением сконструированных CD4+ T-клеток к сконструированным CD8+ T-клеткам, отношением экспрессирующих рекомбинантный рецептор CD4+ T-клеток к экспрессирующим рекомбинантный рецептор CD8+ T-клеткам и/или отношением эксопрессирующих CAR CD4+ T-клеток к эксопрессирующим CAR CAR CD8+ T-клеткам, которое находится в пределах определенной допустимой разности или диапазона погрешности такого определенного, желательного или фиксированного отношения, и/или дают такое отношение через определенный процент времени, в течение которого выполняется способ, например, через по крайней мере или по крайней мере приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или более 95% времени. В некоторых вариантах осуществления допустимая разность находится в пределах приблизительно 1%, приблизительно 2%, приблизительно 3%, приблизительно 4%, приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 60%, приблизительно 70% или приблизительно 75% от отношения. В некоторых аспектах отношение находится в пределах 10%, 20% или 30% от желательного отношения и/или находится в пределах этого отношения через по крайней мере 70%, 80% или 90% времени выполнения способов. В некоторых вариантах осуществления отношение находится в пределах 50% от отношения 1:1 через по крайней мере 90% времени выполнения способов.
В некоторых вариантах осуществления допустимая разность и/или определенное отношение сконструированных, экспрессирующих рекомбинантный рецептор и/или экспрессирующих CAR CD4+ к CD8+ Т-клеткам определяется или определялось путем введения различных типов клеток, например введения CD4+ и CD8+ Т-клеток, одному или более субъектов во множестве исследуемых отношений или количеств и оценке одного или более параметров. В некоторых аспектах определение определенного или фиксированного отношения или допустимой разности включает оценку одного или более результатов после введения субъекту. В некоторых аспектах результаты включают результаты, выбранные среди уменьшения интенсивности симптомов заболевания и результатов, указывающих на безопасность и/или низкую токсичность или ее отсутствие.
В некоторых вариантах осуществления выходная композиция клеток, полученная предоставленными здесь способами, характеризуется отношением сконструированных CD4+ T-клеток к сконструированным CD8+ T-клеткам, находящимся между 2:1 и 0,5:1. В некоторых вариантах осуществления выходная композиция характеризуется отношением сконструированных CD4+ T-клеток к сконструированным CD8+ T-клеткам, составляющим или приблизительно составляющим 1:1. В некоторых вариантах осуществления выходная композиция клеток была получена из входной композиции клеток, описанной здесь, например входной композиции клеток, описанной в разделе IA, и характеризуется отношением сконструированных CD4+ T-клеток к сконструированным CD8+ T-клеткам, находящимся между 2:1 и 0,5:1. В конкретных вариантах осуществления выходная композиция клеток, полученная из входной композиции клеток, характеризуется отношением сконструированных CD4+ T-клеток к сконструированным CD8+ T-клеткам, составляющим 1:1 с допустимой разностью, составляющей 50%, 25%, 10% или менее. В некоторых вариантах осуществления сконструированные Т-клетки экспрессируют рекомбинантный рецептор. В некоторых вариантах осуществления сконструированные T-клетки экспрессируют CAR.
II. КОМПОЗИЦИИ И ПРЕПАРАТЫ
Здесь предоставляются композиции или препараты, содержащие клетки, полученные в соответствии с описанными здесь способами инкубации (например, стимуляции). В некоторых вариантах осуществления композиции и способы, описанные здесь, могут использоваться для получения выходной композиции клеток с определенным отношением экспрессирующих рекомбинантный рецептор CD4+ T-клеток к CD8+ Т-клеткам, например, для использования в качестве терапевтической клеточной композиции. Здесь также предоставляется выходная композиция клеток, полученная любым из описанных здесь способов.
В некоторых вариантах осуществления клетки, полученные с использованием любого из описанных здесь способов, например клетки выходной композиции клеток, предоставляются в виде композиций, в том числе фармацевтических композиций и препаратов, таких как композиции в форме стандартной дозы, включающие количество клеток для введения в конкретной дозе или ее части. В конкретных вариантах осуществления клетки выходной композиции клеток сконструированы с помощью генной инженерии с использованием рекомбинантного рецептора (например, CAR-T-клетки). В некоторых вариантах осуществления фармацевтические композиции и препараты, как правило, включают один или более необязательных фармацевтически приемлемых носителей или наполнителей. В некоторых вариантах композиция включает по крайней мере одно дополнительное терапевтическое средство.
В некоторых вариантах осуществления композицию клеток, например выходную композицию клеток, создают или изготавливают для целей клеточной терапии. В некоторых вариантах осуществления композиция клеток представляет собой фармацевтическую композицию или препарат. Такие композиции могут использоваться в соответствии с предоставленными способами, например, для оценки их выпуска для применения для профилактики или лечения заболеваний, состояний и расстройств или в способах обнаружения, диагностики и прогнозирования.
Термин «фармацевтический препарат» относится к препарату, который находится в такой форме, чтобы обеспечить биологическую активность активного ингредиента, содержащегося в нем, и который не содержит дополнительных компонентов, которые являются неприемлемо токсичными для субъекта, которому препарат будет вводиться. В некоторых вариантах осуществления предоставленные здесь способы могут использоваться для сравнения экспрессии гликанов на поверхности в случае композиций клеток, состоящих из одних и тех же сконструированных клеток, но с разными фармацевтическими составами.
«Фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтической композиции, отличному от активного ингредиента, который нетоксичен для субъекта. Фармацевтически приемлемый носитель включает, но без ограничения ими, буфер, наполнитель, стабилизатор или консервант. В конкретных вариантах осуществления предоставленные здесь способы могут использоваться для сравнения экспрессии гликанов на поверхности в случае композиций клеток, состоящих из одних и тех же сконструированных клеток, но с разными фармацевтически приемлемыми носителями.
В некоторых вариантах осуществления Т-клеточная терапия, такая как сконструированные Т-клетки (например, CAR-Т-клетки), составляется с фармацевтически приемлемым носителем. В некоторых аспектах выбор носителя частично определяется конкретной клеткой и/или способом введения. Соответственно, существует ряд подходящих препаратов. Например, фармацевтическая композиция может содержать консерванты. Подходящие консерванты могут включать, например, метилпарабен, пропилпарабен, бензоат натрия и хлорид бензалкония. В некоторых аспектах используется смесь двух или более консервантов. Консервант или их смеси, как правило, присутствуют в количестве от приблизительно 0,0001% до приблизительно 2% от общего веса композиции. Носители описаны, например, в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980). Фармацевтически приемлемые носители, как правило, нетоксичны для реципиентов в используемых дозах и концентрациях и включают, но без ограничения ими, буферы, такие как фосфатный, цитратный и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее чем приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глютамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ).
В некоторых аспектах буферные агенты включены в композиции. Подходящие буферные агенты включают, например, лимонную кислоту, цитрат натрия, фосфорную кислоту, фосфат калия и различные другие кислоты и соли. В некоторых аспектах используется смесь двух или более буферных агентов. Буферный агент или их смеси обычно присутствуют в количестве от приблизительно 0,001% до приблизительно 4% от общего веса композиции. Способы приготовления вводимых фармацевтических композиций известны. Приводимые в качестве примера способы описаны более подробно, например, в Remington: The Science and Practice of Pharmacy, Lippincott Williams & Wilkins; 21-е изд. (1 мая 2005 г.)
Препараты могут включать водные растворы. Препарат или композиция также может содержать более одного активного ингредиента, применимого для профилактики или лечения конкретного показания, заболевания или состояния с помощью клеток, включая один или более активных ингредиентов, активности которых дополняют клетки, и/или соответствующие активности которых не оказывают вредного влияния друг на друга. Такие активные ингредиенты соответственно присутствуют в комбинации в количествах, которые эффективны для предполагаемой цели. Таким образом, в некоторых вариантах осуществления фармацевтическая композиция включает, кроме того, другие фармацевтически активные агенты или лекарственные средства, такие как химиотерапевтические средства, например аспарагиназу, бусульфан, карбоплатин, цисплатин, даунорубицин, доксорубицин, фторурацил, гемцитабин, гидроксимочевину, метотрексат, паклитаксел, ритуксимаб, винбластин, винкристин и т.д.
В некоторых вариантах осуществления фармацевтическая композиция содержит клетки, например клетки выходной композиции клеток, в количествах, эффективных для лечения или предотвращения заболевания или состояния, таких как терапевтически эффективное или профилактически эффективное количество. Терапевтическая или профилактическая эффективность в некоторых вариантах контролируется путем периодической оценки подвергаемых лечению субъектов. В случае повторных введений в течение нескольких дней или дольше, в зависимости от состояния, лечение повторяют до тех пор, пока не произойдет желательное подавление симптомов заболевания. Однако другие схемы введения доз могут применяться и могут быть определены. Желательная доза может быть доставлена путем однократного болюсного введения композиции, путем многократных болюсных введений композиции или путем непрерывного инфузионного введения композиции.
Клетки, например клетки выходной композиции клеток, могут быть составлены для введения с использованием стандартных способов введения, препаратов и/или устройств. Предоставляются препараты и устройства, такие как шприцы и флаконы, для хранения и введения композиций. Что касается клеток, введение может быть аутологичным или гетерологичным. Например, иммунореактивные клетки или предшественники могут быть получены от одного субъекта и введены тому же субъекту или другому совместимому субъекту. Иммунореактивные клетки периферической крови или их потомство (например, полученные in vivo, ex vivo или in vitro) могут вводиться с помощью местной инъекции, включая введение через катетер, системную инъекцию, местную инъекцию, внутривенную инъекцию или парентеральное введение. При введении терапевтической композиции (например, фармацевтической композиции, содержащей генетически модифицированную иммунореактивную клетку) ее, как правило, составляют в форме для инъекций стандартной дозы (раствора, суспензии, эмульсии).
Препараты включают препараты для перорального, внутривенного, внутрибрюшинного, подкожного, легочного, трансдермального, внутримышечного, интраназального, трансбуккального, сублингвального или суппозиторного введения. В некоторых вариантах осуществления агент или популяции клеток вводят парентерально. Используемый здесь термин «парентеральный» включает внутривенное, внутримышечное, подкожное, ректальное, вагинальное и внутрибрюшинное введение. В некоторых вариантах осуществления агент или популяции клеток вводят субъекту с использованием периферической системной доставки путем внутривенной, внутрибрюшинной или подкожной инъекции.
В некоторых вариантах осуществления композиции предоставляются в виде стерильных жидких препаратов, например изотонических водных растворов, суспензий, эмульсий, дисперсий или вязких композиций, которые в некоторых аспектах могут быть забуферены до выбранного рН. Жидкие препараты обычно легче приготовить, чем гели, другие вязкие композиции и твердые композиции. Кроме того, жидкие композиции несколько удобнее вводить, особенно путем инъекции. Вязкие композиции, с другой стороны, могут быть составлены в пределах соответствующего диапазона вязкости, чтобы обеспечить более длительные периоды контакта с конкретными тканями. Жидкие или вязкие композиции могут содержать носители, которые могут быть растворителем или дисперсионной средой, содержащей, например, воду, физиологический раствор, забуференный фосфатом физиологический раствор, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль) и их подходящие смеси.
Стерильные инъецируемые растворы могут быть приготовлены путем включения клеток в растворитель, такой как смесь с подходящим носителем, разбавителем или наполнителем, таким как стерильная вода, физиологический раствор, глюкоза, декстроза или т.п. Композиции также могут быть лиофилизированы. Композиции могут содержать вспомогательные вещества, такие как смачивающие агенты, диспергаторы или эмульгаторы (например, метилцеллюлозу), рН-буферные агенты, гелеобразующие или повышающие вязкость добавки, консерванты, ароматизаторы, красители и т.п., в зависимости от способа введения и желательного препарата. К стандартным текстам можно в некоторых аспектах обращаться за справкой, чтобы приготовить подходящие препараты.
Могут быть добавлены различные добавки, которые улучшают стабильность и стерильность композиций, включая противомикробные консерванты, антиоксиданты, хелатообразующие агенты и буферы. Предотвращение действия микроорганизмов может быть обеспечено с помощью различных антибактериальных и противогрибковых средств, например парабенов, хлорбутанола, фенола, сорбиновой кислоты и т.п. Пролонгированная абсорбция инъецируемой фармацевтической формы может быть достигнута при использовании агентов, замедляющих абсорбцию, например, моностеарата алюминия и желатина.
Препараты, используемые для введения in vivo, обычно являются стерильными. Стерильность может быть легко достигнута, например, путем фильтрации через стерильные мембраны для фильтрации.
Для профилактики или лечения заболевания подходящая доза может зависеть от типа заболевания, подвергаемого лечению, типа агента или агентов, типа клеток или рекомбинантных рецепторов, тяжести и течения заболевания, от того, вводится ли агент или клетки с профилактической или терапевтической целью, предшествующей терапии, истории болезни субъекта и ответной реакции на агент или клетки, и быть на усмотрение лечащего врача. В некоторых вариантах осуществления композиции соответственно вводят субъекту за один раз или на протяжении ряда процедур лечения.
III. СПОСОБЫ ВВЕДЕНИЯ
Также предоставляются способы использования и применений клеток и композиций, таких как те, которые присутствуют в описанной здесь выходной композиции, для лечения заболеваний, состояний и нарушений, при которых экспрессируется антиген, распознаваемый рекомбинантным рецептором. (например, CAR). Здесь также предоставляются способы лечения, включающие введение субъекту выходной композиции клеток, полученной любым из описанных способов конструирования. В некоторых вариантах осуществления способ включает конструирование генно-инженерных Т-клеток, таких как генно-инженерные Т-клетки выходной композиции клеток, используя любой из описанных здесь способов, и введение генно-инженерных Т-клеток, полученных описанными здесь способами.
Предоставляются способы введения сконструированных клеток и композиций и применения таких сконструированных клеток и композиций для лечения или профилактики заболеваний, состояний и нарушений, включая рак. Предоставленные способы и применения включают способы и применения для адоптивной клеточной терапии. В некоторых вариантах осуществления способы включают введение сконструированных клеток или композиции, содержащей клетки, такие как клетки из описанной выходной композиции, субъекту, в ткань или клетку, такому как субъект, подверженный риску развития или с подозрением на наличие заболевания, состояния или нарушения. В некоторых вариантах осуществления клетки, популяции и композиции вводят субъекту, имеющему конкретное заболевание или состояние, которое лечат, например, с помощью адоптивной клеточной терапии, такой как адоптивная Т-клеточная терапия. В некоторых вариантах осуществления клетки или композиции вводят субъекту, такому как субъект, имеющий или подверженный риску развития заболевания или состояния, для уменьшения интенсивности одного или более симптомов заболевания или состояния, например, путем уменьшения опухолевой масса при раке, экспрессирующем антиген, распознаваемый сконструированной Т-клеткой.
В некоторых аспектах заболевание или состояние, которое лечат, может быть любым, при котором экспрессия антигена связана с, специфична для и/или представлена на клетке(ой, и) или ткани(ью, и) заболевания, нарушения или состояния и/или вовлечена в этиологию заболевания, состояния или нарушения, например, вызывает, обостряет или иным образом связана с таким заболеванием, состоянием или нарушением. Приводимые в качестве примера заболевания и состояния могут включать заболевания или состояния, связанные со злокачественным развитием или трансформацией клеток (например, раком), аутоиммунным или воспалительным заболеванием или инфекционным заболеванием, например, вызванным бактериальным, вирусным или другим патогеном. Приводимые в качестве примера антигены, которые включают антигены, связанные с различными заболеваниями и состояниями, которые можно лечить, описаны выше. В конкретных вариантах осуществления иммуномодулирующий полипептид и/или рекомбинантный рецептор, например химерный рецептор антигена или TCR, специфически связывается с антигеном, связанным с заболеванием или состоянием. В некоторых вариантах осуществления субъект имеет заболевание, нарушение или состояние, необязательно рак, опухоль, аутоиммунное заболевание, расстройство или состояние или инфекционное заболевание.
В некоторых вариантах осуществления заболевание, нарушение или состояние включает опухоли, связанные с различными типами рака. Рак в некоторых вариантах осуществления может представлять собой любой рак, обнаруживаемый в теле субъекта, такой как, но без ограничения ими, рак, обнаруживаемый в области головы и шеи, молочной железы, печени, ободочной кишки, яичника, предстательной железы, поджелудочной железы, головного мозга, шейки матки, кости, кожи, глаз, мочевого пузыря, желудка, пищевода, брюшины или легкого. Например, противораковое средство может использоваться для лечения рака ободочной кишки, рака шейки матки, рака центральной нервной системы, рака молочной железы, рака мочевого пузыря, рака анального отверстия, рака головы и шеи, рака яичников, рака эндометрия, мелкоклетоточного рака легких, немелкоклеточного рака легкого, нейроэндокринного рака, рака мягких тканей, рака полового члена, рака предстательной железы, рака поджелудочной железы, рака желудка, рака желчного пузыря или рака пищевода. В некоторых случаях рак может быть раком крови. В некоторых вариантах осуществления заболевание, нарушение или состояние представляет собой опухоль, такую как солидная опухоль, лимфома, лейкоз, опухоль крови, метастатическая опухоль или другой тип рака или опухоли. В некоторых вариантах осуществления заболевание, нарушение или состояние выбрано из числа раковых заболеваний ободочной кишки, легкого, печени, молочной железы, предстательной железы, яичника, кожи, меланомы, кости, рака головного мозга, рака яичника, эпителиального рака, почечно-клеточного рака, аденокарциномы поджелудочной железы, рака шейки матки, колоректального рака, глиобластомы, нейробластомы, саркомы Юинга, медуллобластомы, остеосаркомы, синовиальной саркомы и/или мезотелиомы.
К числу заболеваний, состояний и нарушений относятся опухоли, в том числе солидные опухоли, злокачественные гематологические опухоли и меланомы, и в том числе локализованные и метастатические опухоли, инфекционные заболевания, такие как вирусная инфекция или инфекция, вызванная другим патогеном, например ВИЧ, HCV, HBV, CMV, HPV, и паразитарные заболевания, и аутоиммунные и воспалительные заболевания. В некоторых вариантах осуществления заболевание, нарушение или состояние представляет собой опухоль, рак, злокачественную опухоль, новообразование или другое пролиферативное заболевание или нарушение. Такие заболевания включают, но без ограничения ими, лейкоз, лимфому, например острый миелоидный (или миелогенный) лейкоз (AML), хронический миелоидный (или миелогенный) лейкоз (CML), острый лимфоцитарный (или лимфобластный) лейкоз (ALL), хронический лимфоцитарный лейкоз (CLL), волосатоклеточный лейкоз (HCL), лимфому из малых лимфоцитов (SLL), мантийноклеточную лимфому (MCL), лимфому маргинальной зоны, лимфому Беркитта, лимфому Ходжкина (HL), неходжкинскую лимфому (NHL), анапластическую крупноклеточную лимфому (ALCL), фолликулярную лимфому, рефрактерную фолликулярную лимфому, диффузную крупно-B-клеточную лимфому (DLBCL) и множественную миелому (MM). Злокачественную B-клеточную опухоль выбирают из числа острых лимфобластных лейкозов (ALL), ALL у взрослых, хронических лимфобластных лейкозов (CLL), неходжкинской лимфомы (NHL) и диффузной крупно-B-клеточной лимфомы (DLBCL).
В некоторых вариантах осуществления заболевание или состояние представляет собой инфекционное заболевание или состояние, такое как, но без ограничения ими, вирусные, ретровирусные, бактериальные и протозойные инфекции, иммунодефицит, цитомегаловирус (CMV), вирус Эпштейна-Барр (EBV), аденовирус, полиомавирус ВК. В некоторых вариантах осуществления заболевание или состояние представляет собой аутоиммунное или воспалительное заболевание или состояние, такое как артрит, например ревматоидный артрит (RA), диабет I типа, системная красная волчанка (SLE), воспалительное заболевание кишечника, псориаз, склеродермия, аутоиммунное заболевание щитовидной железы, болезнь Грейвса, болезнь Крона, рассеянный склероз, астма и/или заболевание или состояние, связанное с трансплантацией.
В некоторых вариантах осуществления антиген, связанный с заболеванием или нарушением, выбран из группы, состоящей из рецептора-сироты типа рецепторных тирозинкиназ (ROR1), антигена созревания В-клеток (BCMA), карбоангидразы 9 (CAIX), tEGFR, Her2/neu (рецепторной тирозинкиназы erbB2), L1-CAM, CD19, CD20, CD22, мезотелина, CEA, поверхностного антигена вируса гепатита B, антитела против фолатного рецептора, CD23, CD24, CD30, CD33, CD38, CD44, EGFR, эпителиального гликопротеина 2 (EPG-2), эпителиального гликопротеина 40 (EPG-40), рецептора-А2 эфрина (EPHa2), Her2/neu (рецепторной тирозинкиназы erbB2), Her3 (erb-B3), Her4 (erb-B4), димеров erbB, мутации рецептора эпидермального фактора роста типа III (EGFR vIII), фолат-связывающего белка (FBP), подобного Fc-рецептору рецептора 5 (FCRL5, также известного как гомолог 5 Fc-рецептора или FCRH5), фетального ацетилхолинового рецептора, ганглиозида GD2, ганглиозида GD3, сопряженного с G-белком рецептора 5D (GPRC5D), HMW-MAA, IL-22R-альфа, IL-13R-альфа2, рецептора, содержащего домен вставки киназы (kdr), легкой цепи каппа, члена А семейства белков, богатых повторами лейцина 8 (LRRC8A), Lewis Y, молекулы адгезии клеток L1 (L1-CAM), связанного с меланомой антигена А1 (MAGE)-A1, MAGE-A3, MAGE-A6, MAGE-A10, преимущественно экспрессируемого антигена меланомы (PRAME), сурвивина, TAG72, B7-H6, рецептора-альфа 2 IL-13 (IL-13Rα2), CA9, GD3, HMW-MAA, CD171, G250/CAIX, лейкоцитарного антигена А1 человека (HLA-A1), MAGE A1, HLA-A2, NY-ESO-1, PSCA, фолатного рецептора-a, CD44v6, CD44v7/8, интегрина αvβ6 (интегрина avb6), 8H9, NCAM, рецепторов VEGF, 5T4, фетального AchR, лигандов члена D группы 2 природных киллеров D (NKG2D), CD44v6, двойного антигена, антиген рака яичек, мезотелина, CMV мышей, муцина 1 (MUC1), MUC16, антигена стволовых клеток предстательной железы (PSCA), NKG2D, антигена рака яичка, антигена яичка 1B (CTAG, также известного как NY-ESO-1 и LAGE-2), MART-1, гликопротеина 100 (gp100), онкофетального антигена, ROR1, гликопротеина трофобластов (TPBG, также известного как 5T4), TAG72, VEGF-R2, раково-эмбрионального антигена (CEA), Her2/neu, рецептора эстрогена, рецептора прогестерона, эфрина B2, CD123, c-Met, GD-2, O-ацетилированного GD2 (OGD2), CE7, белка опухоли Вильмса 1 (WT-1), циклина, циклина A2, лиганда 1 хемокина, содержащего мотив C-C (CCL-1), CD138, специфического для патогена антигена и антигена, связанного с универсальной меткой, и/или биотинилированных молекул, и/или молекул, экспрессируемых ВИЧ, HCV, HBV или другими патогенами.
В некоторых вариантах осуществления антиген или лиганд представляет собой опухолевый антиген или раковый маркер. В некоторых вариантах осуществления антиген или лиганд представляет собой или включает рецептор-сироту типа рецепторных тирозинкиназ (ROR1), антиген созревания В-клеток (BCMA), карбоангидразу 9 (CA9, также известную как CAIX или G250), Her2/neu (рецепторную тирозинкиназу erbB2), CD19, CD20, CD22, мезотелин (MSLN), раково-эмбриональный антиген (CEA) и поверхностный антиген вируса гепатита B, антитело против фолатного рецептора, CD23, CD24, CD30, CD33, CD38, CD44, хондроитинсульфат-протеогликан 4 (CSPG4), EGFR, эпителиальный гликопротеин 2 (EPG-2), эпителиальный гликопротеин 40 (EPG-40), рецептор-А2 эфрина (EPHa2), Her3 (erb-B3), Her4 (erb-B4), димеры erbB, мутацию рецептора эпидермального фактора роста типа III (EGFR vIII), фолат-связывающий белок (FBP), подобный Fc-рецептору рецептор 5 (FCRL5, также известный как гомолог 5 Fc-рецептора или FCRH5), фетальный ацетилхолиновый рецептор (фетальный AchR), ганглиозид GD2, ганглиозид GD3, лейкоцитарный антиген A1 человека (HLA-A1), лейкоцитарный антиген A2 человека (HLA-A2), рецептор-альфа IL-22 (IL-22Rα), рецептор, содержащий домен вставки киназы (kdr), легкую цепь каппа, член А семейства белков, богатых повторами лейцина 8, (LRRC8A), Lewis Y, молекулу адгезии клеток L1 (L1-CAM), связанный с меланомой антигена А1 (MAGE)-A1, MAGE-A3, MAGE-A6, MAGE-A10, преимущественно экспрессируемый антиген меланомы (PRAME), сурвивин, опухолевый гликопротеин 72 (TAG72), B7-H3, B7-H6, рецептор-альфа 2 IL-13 (IL-13RΑ2), высокомолекулярный связанный с меланомой антиген человека (HMW-MAA), CD171, фолатный рецептор-альфа, CD44v7/8, интегрин αvβ6 (интегрин avb6), 8H9, молекулу адгезии нервных клеток (NCAM), рецептор фактора роста эндотелия сосудов (рецепторы VEGF или VEGFR), гликопротеин трофобластов (TPBG, также известный как 5T4), лиганды NKG2D, CD44v6, двойной антиген, антиген рака яичек, цитомегаловирус (CMV) мышей, муцин 1 (MUC1), MUC16, антиген стволовых клеток предстательной железы (PSCA), специфический для предстательной железы мембранный антиген (PSMA), лиганды члена D группы 2 природных киллеров (NKG2D), антиген 1B рака/яичка (CTAG, также известный как NY-ESO-1 и LAGE-2), мелан A (MART-1), гликопротеин 100 (gp100), глипикан-3 (GPC3), сопряженный с G-белком рецептор 5D (GPRC5D), онкофетальный антиген, TAG72, родственный тирозиназе белок 1 (TRP1, также известный как TYRP1 или gp75), родственный тирозиназе белок 2 (TRP2, также известный как допахром-таутомераза, допахром-дельта-изомераза или DCT), рецептор 2 фактора роста эндотелия сосудов (VEGF-R2), раково-эмбриональный антиген (CEA), рецептор эстрогена, рецептор прогестерона, специфический для предстательной железы антиген, эфрин B2, CD123, CD133, c-Met, O-ацетилированный GD2 (OGD2), эпитоп CE7 L1-CAM, белок опухоли Вильмса 1 (WT-1), циклин, циклин A2, лиганд 1 хемокина, содержащий мотив C-C (CCL-1), CD138, специфический для патогена антиген или экспрессируемый патогеном антиген и антиген, связанный с универсальной меткой, и/или биотинилированные молекулы, и/или молекулы, экспрессируемые ВИЧ, HCV, HBV или другими патогенами.
В некоторых вариантах осуществления заболевание или состояние представляет собой злокачественную В-клеточную опухоль. В некоторых вариантах осуществления злокачественная В-клеточная опухоль представляет собой лейкоз или лимфому. В некоторых аспектах заболевание или состояние представляет собой острый лимфобластный лейкоз (ALL), ALL у взрослых, хронический лимфобластный лейкоз (CLL), неходжкинскую лимфому (NHL) или диффузную крупно-B-клеточную лимфому (DLBCL). В некоторых случаях заболевание или состояние представляет собой NHL, например, или в том числе NHL, которая представляет собой агрессивную NHL, диффузную В-клеточную лимфому (DLBCL), NOS (de novo и трансформированную из индолентной), первичную средостенную крупно-В-клеточную лимфому (PMBCL), Т-клеточную/богатую гистиоцитами крупно-В-клеточную лимфому (TCHRBCL), лимфому Беркитта, мантийноклеточную лимфому (MCL) и/или фолликулярную лимфому (FL), необязательно, фолликулярную лимфому степени 3B (FL3B). В некоторых аспектах рекомбинантный рецептор, такой как CAR, специфически связывается с антигеном, связанным с заболеванием или состоянием или экспрессируемым в клетках окружения очага поражения, связанного со злокачественной В-клеточной опухолью. В некоторых вариантах осуществления антигены, на которые нацелены рецепторы, включают антигены, связанные со злокачественной В-клеточной опухолью, такие как любой из ряда известных В-клеточных маркеров. В некоторых вариантах осуществления антиген, на который нацелен рецептор, представляет собой CD20, CD19, CD22, ROR1, CD45, CD21, CD5, CD33, Ig каппа, Ig лямбда, CD79a, CD79b или CD30.
В некоторых вариантах осуществления заболевание или состояние представляет собой миелому, такую как множественная миелома. В некоторых аспектах рекомбинантный рецептор, такой как CAR, специфически связывается с антигеном, связанным с заболеванием или состоянием или экспрессируемым в клетках окружения очага поражения, связанного с множественной миеломой. В некоторых вариантах осуществления антигены, на которые нацелены рецепторы, включают антигены, связанные с множественной миеломой, такие как GPRC5D или BCMA.
В некоторых вариантах осуществления антиген представляет собой специфический для патогена или экспрессируемый патогеном антиген. В некоторых вариантах осуществления антиген представляет собой вирусный антиген (такой как вирусный антиген из ВИЧ, HCV, HBV и т.д.), бактериальные антигены и/или паразитные антигены.
В некоторых вариантах осуществления клеточная терапия представляет собой или включает введение клеток, таких как Т-клетки, которые нацелены на молекулу, экспрессируемую на поверхности очага поражения, такого как опухоль или рак. В некоторых вариантах осуществления иммунные клетки экспрессируют T-клеточный рецептор (TCR) или другой антигенсвязывающий рецептор. В некоторых вариантах осуществления иммунные клетки экспрессируют рекомбинантный рецептор, такой как трансгенный TCR или химерный рецептор антигена (CAR). В некоторых вариантах осуществления клетки являются аутологичными для субъекта. В некоторых вариантах осуществления клетки являются аллогенными для субъекта.
Способы введения сконструированных клеток для адоптивной клеточной терапии известны и могут использоваться в связи с предоставленными способами и композициями. Например, способы адоптивной Т-клеточной терапии описаны, например, в публикации заявки на патент США с № 2003/0170238 на имя Gruenberg et al; патенте США с № 4690915, выданном Rosenberg; Rosenberg (2011) Nat Rev Clin Oncol. 8(10):577-85). Смотрите, например, Themeli et al., (2013) Nat Biotechnol. 31(10): 928-933; Tsukahara et al., (2013) Biochem Biophys Res Commun 438(1): 84-9; Davila et al., (2013) PLoS ONE 8(4): e61338.
В некоторых вариантах осуществления клеточная терапия, например адоптивная Т-клеточная терапия, осуществляется путем аутологичного переноса, при котором клетки выделяют и/или иным образом получают от субъекта, который должен получить клеточную терапию, или из образца, полученного от такого субъекта. Таким образом, в некоторых аспектах клетки получают от субъекта, например пациента, нуждающегося в лечении, и клетки после выделения и обработки вводят тому же субъекту.
В некоторых вариантах осуществления клеточная терапия, например адоптивная Т-клеточная терапия, осуществляется путем аллогенного переноса, при котором клетки выделяют и/или иным образом получают от субъекта, отличного от субъекта, который должен получить или который в конечном счете получает клеточную терапию, например от первого субъекта. В таких вариантах осуществления клетки затем вводят другому субъекту, например второму субъекту того же вида. В некоторых вариантах осуществления первый и второй субъекты являются генетически идентичными. В некоторых вариантах осуществления первый и второй субъекты генетически схожи. В некоторых вариантах осуществления второй субъект экспрессирует тот же класс или супертип HLA, что и первый субъект. Клетки могут вводиться любым подходящим способом. Дозирование и введение могут отчасти зависеть от того, является ли введение кратким или постоянным. Различные схемы дозирования включают, но без ограничения, однократное или многократное введение в различные моменты времени, болюсное введение и импульсную инфузию.
В некоторых вариантах осуществления предоставленные способы включают одну или более стадий введения в клетки субъекта выходной композиции клеток, такой как композиция клеток, описанная в разделе I. В некоторых вариантах осуществления клетки выходной композиции клеток включают сконструированные CD4+ Т-клетки и сконструированные CD8+ Т-клетки. В некоторых вариантах осуществления сконструированные CD4+ и CD8+ T-клетки экспрессируют T-клеточный рецептор (TCR) или другой антигенсвязывающий рецептор. В некоторых вариантах осуществления иммунные клетки экспрессируют рекомбинантный рецептор, такой как трансгенный TCR или химерный рецептор антигена (CAR). В некоторых вариантах осуществления клетки выходной композиции клеток являются аутологичными для субъекта. В некоторых вариантах осуществления клетки являются аллогенными для субъекта.
В некоторых вариантах осуществления CD4+ T-клетки и CD8+ T-клетки выходной композиции клеток вводят субъекту в одной и той же композиции, дозе или смеси. Таким образом, в некоторых вариантах осуществления экспрессирующие рекомбинантный рецептор CD4+ T-клетки и экспрессирующие рекомбинантный рецептор CD8+ T-клетки, например CAR+ CD4+ и CAR+ CD8+, вводятся субъекту в одной и той же композиции, дозе или смеси.
В некоторых вариантах осуществления клетки, например клетки выходной композиции клеток или отдельные популяции подтипов клеток, вводят субъекту в диапазоне от приблизительно одного миллиона до приблизительно 100 миллиардов клеток и/или это количество клеток на килограмм веса тела, например, от 1 миллиона до приблизительно 50 миллиардов клеток (например, приблизительно 5 миллионов клеток, приблизительно 25 миллионов клеток, приблизительно 500 миллионов клеток, приблизительно 1 миллиард клеток, приблизительно 5 миллиардов клеток, приблизительно 20 миллиардов клеток, приблизительно 30 миллиардов клеток, приблизительно 40 миллиардов клеток или в диапазоне, определяемом любыми двумя из вышеупомянутых значений), например, от приблизительно 10 миллионов до приблизительно 100 миллиардов клеток (например, приблизительно 20 миллионов клеток, приблизительно 30 миллионов клеток, приблизительно 40 миллионов клеток, приблизительно 60 миллионов клеток, приблизительно 70 миллионов клеток, приблизительно 80 миллионов клеток, приблизительно 90 миллионов клеток, приблизительно 10 миллиардов клеток, приблизительно 25 миллиардов клеток, приблизительно 50 миллиардов клеток, приблизительно 75 миллиардов клеток, приблизительно 90 миллиардов клеток, или в диапазоне, определяемом любыми двумя из вышеуказанных значений), и в некоторых случаях от приблизительно 100 миллионов клеток до приблизительно 50 миллиардов клеток (например, приблизительно 120 миллионов клеток, приблизительно 250 миллионов клеток, приблизительно 350 миллионов клеток, приблизительно 450 миллионов клеток, приблизительно 650 миллионов клеток, приблизительно 800 миллионов клеток, приблизительно 900 миллионов клеток, приблизительно 3 миллиарда клеток, приблизительно 30 миллиардов клеток, приблизительно 45 миллиардов клеток) или любое значение между этими диапазонами и/или на килограмм веса тела. Дозы могут изменяться в зависимости от особенностей, специфических для заболевания или нарушения, и/или пациента и/или других способов лечения.
В некоторых вариантах осуществления, например, когда субъектом является человек, доза включает менее чем приблизительно 1х108 всех экспрессирующих рекомбинантный рецептор (например, CAR) клеток, Т-клеток или мононуклеарных клеток периферической крови (PBMC), например в диапазоне приблизительно от 1×106 до 1×108 таких клеток, например 2×106, 5×106, 1×107, 5х107 или 1х108, или всех таких клеток, или в диапазоне между любыми двумя из вышеупомянутых значений.
В некоторых вариантах осуществления доза генно-инженерных клеток составляет от или приблизительно от 1х105 до 5х108 всех CAR-экспрессирующих T-клеток, от 1х105 до 2,5х108 всех CAR-экспрессирующих T-клеток, от 1х105 до 1х108 всех CAR-экспрессирующих T-клеток, от 1х105 до 5х107 всех CAR-экспрессирующих T-клеток, от 1х105 до 2,5х107 всех CAR-экспрессирующих T-клеток, от 1х105 до 1х107 всех CAR-экспрессирующих T-клеток, от 1х105 до 5х106 всех CAR-экспрессирующих T-клеток, от 1×105 до 2,5×106 всех CAR-экспрессирующих T-клеток, от 1×105 до 1×106 всех CAR-экспрессирующих T-клеток, от 1×106 до 5×108 всех CAR-экспрессирующих T-клеток, от 1×106 до 2,5×108 всех CAR-экспрессирующих T-клеток, от 1×106 до 1×108 всех CAR-экспрессирующих T-клеток, от 1×106 до 5×107 всех CAR-экспрессирующих T-клеток, от 1×106 до 2,5×107 всех CAR-экспрессирующих T-клеток, от 1х106 до 1х107 всех CAR-экспрессирующих T-клеток, от 1х106 до 5х106 всех CAR-экспрессирующих T-клеток, от 1х106 до 2,5х106 всех CAR-экспрессирующих T-клеток, от 2,5х106 до 5х108 всех CAR-экспрессирующих T-клеток, от 2,5х106 до 2,5х108 всех CAR-экспрессирующих T-клеток, от 2,5х106 до 1х108 всех CAR-экспрессирующих T-клеток, от 2,5х106 до 5×107 всех CAR-экспрессирующих T-клеток, от 2,5×106 до 2,5×107 всех CAR-экспрессирующих T-клеток, от 2,5×106 до 1×107 всех CAR-экспрессирующих T-клеток, от 2,5×106 до 5×106 всех CAR-экспрессирующих T-клеток, от 5×106 до 5×108 всех CAR-экспрессирующих T-клеток, от 5х106 до 2,5×108 всех CAR-экспрессирующих T-клеток, от 5×106 до 1×108 всех CAR-экспрессирующих T-клеток, от 5×106 до 5×107 всех CAR-экспрессирующих T-клеток, от 5х106 до 2,5х107 всех CAR-экспрессирующих T-клеток, от 5х106 до 1х107 всех CAR-экспрессирующих T-клеток, от 1х107 до 5×108 всех CAR-экспрессирующих T-клеток, от 1×107 до 2,5×108 всех CAR-экспрессирующих T-клеток, от 1×107 до 1×108 всех CAR-экспрессирующих T-клеток, от 1×107 до 5×107 всех CAR-экспрессирующих T-клеток, от 1×107 до 2,5×107 всех CAR-экспрессирующих T-клеток, от 2,5х107 до 5×108 всех CAR-экспрессирующих T-клеток, от 2,5×107 до 2,5×108 всех CAR-экспрессирующих T-клеток, от 2,5×107 до 1×108 всех CAR-экспрессирующих T-клеток, от 2,5×107 до 5×107 всех CAR-экспрессирующих T-клеток, от 5×107 до 5×108 всех CAR-экспрессирующих T-клеток, от 5×107 до 2,5×108 всех CAR-экспрессирующих T-клеток, от 5×107 до 1×108 всех CAR-экспрессирующих Т-клеток, от 1х108 до 5х108 всех CAR-экспрессирующих Т-клеток, от 1х108 до 2,5х108 всех CAR-экспрессирующих Т-клеток или от 2,5х108 до 5х108 всех CAR-экспрессирующих T-клеток.
В некоторых вариантах осуществления доза генно-инженерных клеток включает по крайней мере или по крайней мере приблизительно 1х105 CAR-экспрессирующих клеток, по крайней мере или по крайней мере приблизительно 2,5х105 CAR-экспрессирующих клеток, по крайней мере или по крайней мере приблизительно 5х105 CAR-экспрессирующих клеток, по крайней мере или по крайней мере приблизительно 1х106 CAR-экспрессирующих клеток, по крайней мере или по крайней мере приблизительно 2,5х106 CAR-экспрессирующих клеток, по крайней мере или по крайней мере приблизительно 5х106 CAR-экспрессирующих клеток, по крайней мере или по крайней мере приблизительно 1х107 CAR-экспрессирующих клеток, по крайней мере или по крайней мере приблизительно 2,5х107 CAR-экспрессирующих клеток, по крайней мере или по крайней мере приблизительно 5х107 CAR-экспрессирующих клеток, по крайней мере или по крайней мере приблизительно 1х108 CAR-экспрессирующих клеток, по крайней мере или по крайней мере приблизительно 2,5х108 CAR-экспрессирующих клеток или по крайней мере или по крайней мере приблизительно 5х108 CAR-экспрессирующих клеток.
В некоторых вариантах осуществления клеточная терапия включает введение дозы, включающей количество клеток от или приблизительно от 1х105 до 5х108 всех экспрессирующих рекомбинантный рецептор клеток, всех Т-клеток или всех мононуклеарных клеток периферической крови (РВМС), от или приблизительно от 5х105 до 1х107 всех экспрессирующих рекомбинантный рецептор клеток, всех Т-клеток или всех мононуклеарных клеток периферической крови (РВМС) или от или приблизительно от 1х106 до 1х107 всех экспрессирующих рекомбинантный рецептор клеток, всех Т-клеток или всех мононуклеарных клеток периферической крови (РВМС), включительно каждое значение. В некоторых вариантах осуществления клеточная терапия включает введение дозы клеток, включающей количество клеток, составляющее по крайней мере или по крайней мере приблизительно 1х105 всех экспрессирующих рекомбинантный рецептор клеток, всех Т-клеток или всех мононуклеарных клеток периферической крови (РВМС), например по крайней мере или по крайней мере приблизительно 1х106, по крайней мере или по крайней мере приблизительно 1х107, по крайней мере или по крайней мере приблизительно 1х108 таких клеток. В некоторых вариантах осуществления количество относится к общему количеству CD3+или CD8+ клеток, в некоторых случаях также экспрессирующих рекомбинантный рецептор (например, CAR+) клеток. В некоторых вариантах осуществления клеточная терапия включает введение дозы, включающей количество клеток от или приблизительно от 1х105 до 5х108 всех CD3+ или CD8+ Т-клеток или экспрессирующих рекомбинантный рецептор CD3+ или CD8+ клеток, от или приблизительно от 5х105 до 1х107 всех CD3+ или CD8+ Т-клеток или экспрессирующих рекомбинантный рецептор CD3+ или CD8+ клеток, или от или приблизительно от 1х106 до 1х107 всех CD3+ или CD8+ Т-клеток или экспрессирующих рекомбинантный рецептор CD3+ или CD8+ клеток, включительно каждое значение. В некоторых вариантах осуществления клеточная терапия включает введение дозы, включающей количество клеток от или приблизительно от 1х105 до 5х108 всех CD3+/CAR+ или CD8+/CAR+ клеток, от или приблизительно от 5×105 до 1х107 всех CD3+/CAR+ или CD8+/CAR+ клеток, или от или приблизительно от 1х106 до 1×107 CD3+/CAR+ или CD8+/CAR+ клеток, включительно каждое значение.
В некоторых вариантах осуществления, например, когда субъектом является человек, CD8+ T-клетки в дозе, в том числе в дозе, включающей CD4+ и CD8+ T-клетки, включают приблизительно от 1х106 до 5х108 всех экспрессирующих рекомбинантный рецептор (например, CAR) CD8+ клеток, например в диапазоне приблизительно от 5х106 до 1х108 таких клеток, например 1х107, 2,5х107, 5х107, 7,5х107, 1х108 или 5х108 всех таких клеток, или в диапазоне между любыми двумя из вышеуказанных значений. В некоторых вариантах осуществления пациенту вводят множество доз, и каждая из доз или суммарная доза может находиться в пределах любого из вышеуказанных значений. В некоторых вариантах осуществления доза клеток включает введение от или приблизительно от 1х107 до 0,75х108 всех экспрессирующих рекомбинантный рецептор CD8+ Т-клеток, от или приблизительно от 1х107 до 2,5х107 всех экспрессирующих рекомбинантный рецептор CD8+ Т-клеток, от или приблизительно от 1х107 до 0,75х108 всех экспрессирующих рекомбинантный рецептор CD8+ Т-клеток, включительно каждое значение. В некоторых вариантах осуществления доза клеток включает введение количества, составляющего или составляющего приблизительно 1х107, 2,5х107, 5х107, 7,5х107, 1х108 или 5х1078 всех экспрессирующих рекомбинантный рецептор CD8+ Т-клеток.
В некоторых вариантах осуществления доза клеток, например экспрессирующих рекомбинантный рецептор Т-клеток, вводится субъекту в виде однократной дозы или вводится только один раз в течение периода двух недель, одного месяца, трех месяцев, шести месяцев, 1 года или больше.
В некоторых аспектах фармацевтические композиции и препараты предоставляются в виде композиций в стандартной дозе, включающей количество клеток для введения в данной дозе или ее части. В некоторых вариантах осуществления предоставленные способы позволяют получить клетки в предсказуемые сроки до введения доз по сравнению с другими способами инкубации (например, стимуляции) клеток. В некоторых случаях дозу клеток для введения определяют на основе количества клеток, подобных наивным, во входной композиции клеток.
В некоторых аспектах размер дозы определяется тяжестью заболевания или состояния у субъекта. Например, в некоторых аспектах количество клеток, вводимых в дозе, определяется на основе опухолевой массы, которая присутствует у субъекта непосредственно перед началом введения дозы клеток. В некоторых вариантах осуществления размер первой и/или последующей дозы находится в обратной корреляции с тяжестью заболевания. В некоторых аспектах, как в случае значительной тяжести заболевания, субъекту вводят низкое количество клеток. В других вариантах осуществления, как в случае меньшей тяжести заболевания, субъекту вводят большее количество клеток.
В некоторых вариантах осуществления после введения клеток измеряют биологическую активность популяций сконструированных клеток, например, любым из ряда известных способов. Параметры для оценки включают специфическое связывание сконструированной или природной Т-клетки или другой иммунной клетки с антигеном in vivo, например, с помощью визуализации или ex vivo, например, с помощью ELISA или проточной цитометрии. В некоторых вариантах осуществления способность сконструированных клеток к уничтожению клеток-мишеней можно определить, используя любой подходящий способ, такой как анализы цитотоксичности, описанные, например, в Kochenderfer et al., J. Immunotherapy, 32(7):689-702 (2009) и Herman et al. J. Immunological Methods, 285(1):25-40 (2004). В некоторых вариантах осуществления биологическую активность клеток измеряют путем анализа экспрессии и/или секреции одного или более цитокинов, таких как CD107a, IFNγ, IL-2 и TNF. В некоторых аспектах биологическая активность измеряется путем оценки клинического результата, такого как уменьшение опухолевой массы или нагрузки.
Клетки могут вводиться любым подходящим способом. Клетки вводят по схеме введения доз для достижения терапевтического эффекта, такого как уменьшение опухолевой нагрузки. Дозирование и введение могут отчасти зависеть от схемы введения иммуномодулирующего соединения, которое может вводиться до, после и/или одновременно с началом осуществления Т-клеточной терапии. Различные схемы дозирования Т-клеточной терапии включают, но без ограничения, однократное или многократное введение в различные моменты времени, болюсное введение и импульсную инфузию. В некоторых вариантах осуществления сконструированные Т-клетки экспрессируют рекомбинантный рецептор. В некоторых вариантах осуществления сконструированные T-клетки экспрессируют CAR.
В конкретных вариантах осуществления отношение CD4+ T-клеток к CD8+ T-клеткам, которые вводят субъекту в одной и той же композиции, дозе или смеси, находится между 5:1 и 0,2:1, 4:1 и 0,25:1, 3:1 и 0,33:1, 2:1 и 0,5:1, 1,5:1 и 0,66:1 или 1,25:1 и 0,8:1. В некоторых вариантах осуществления отношение CD4+ T-клеток к CD8+ T-клеткам, вводимым субъекту в одной и той же композиции, дозе или смеси, составляет или составляет приблизительно 2,0:1, 1,9:1, 1,8:1, 1,7:1, 1,6:1, 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1, 1,0: 1, 0,9: 1, 0,8: 1, 0,7:1, 0,6:1 или 0,5:1.
В конкретных вариантах осуществления отношение экспрессирующих рекомбинантный рецептор CD4+ T-клеток к экспрессирующим рекомбинантный рецептор CD8+ T-клеткам, которые вводят субъекту в одной и той же композиции, дозе или смеси, находится между 5:1 и 0,2:1, 4:1 и 0,25:1, 3:1 и 0,33:1, 2:1 и 0,5:1, 1,5:1 и 0,66:1 или 1,25:1 и 0,8:1. В некоторых вариантах осуществления отношение экспрессирующих рекомбинантный рецептор CD4+ Т-клеток к экспрессирующим рекомбинантный рецептор CD8+, Т-клеткам, которые вводят субъекту в одной и той же композиции, дозе или смеси, составляет или составляет приблизительно 2,0:1, 1,9:1, 1,8:1. 1,7:1, 1,6:1, 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1, 1,0:1, 0,9:1, 0,8:1, 0,7:1, 0,6:1 или 0,5:1. В конкретных вариантах осуществления отношение вводимые экспрессирующих рекомбинантный рецептор CD4+ T-клеток к экспрессирующим рекомбинантный рецептор CD8+ T-клеткам составляет или составляет приблизительно 1:1. В некоторых вариантах осуществления рекомбинантный рецептор представляет собой TCR или CAR. В конкретных вариантах осуществления рекомбинантный рецептор представляет собой CAR.
В некоторых вариантах осуществления отношение сконструированных CD4+ T-клеток к сконструированным CD8+ T-клеткам в дозе, композиции или смеси, которую вводят субъекту, находится в пределах определенной допустимой разности или диапазона погрешности такого определенного, желательного, или фиксированного отношения. В некоторых вариантах осуществления допустимая разность находится в пределах или составляет приблизительно 1%, 2%, 3%, 4%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или 50% от целевого, определенного, предпочтительного и/или фиксированного отношения.
В некоторых вариантах осуществления композицию клеток, полученную предоставленными здесь способами, например выходную композицию, характеризующуюся отношением сконструированных CD4+ T-клеток к сконструированным CD8+ T-клеткам, находящимся между 2:1 и 0,5:1, вводят субъекту в одной композиции, дозе или смеси. В некоторых вариантах осуществления композиция характеризуется отношением сконструированных CD4+ T-клеток к сконструированным CD8+ T-клеткам, составляющим или приблизительно составляющим 1:1. В некоторых вариантах осуществления композиция клеток, полученная из входной композиции клеток, например входной композиции клеток, описанной в разделе I-Al, характеризуется отношением сконструированных CD4+ T-клеток к сконструированным CD8+ T-клеткам, находящимся между 2:1 и 0,5:1, и вводится субъекту в одной композиции, дозе или смеси. В конкретных вариантах осуществления композиция клеток, полученная из входной композиции клеток, характеризуется отношением сконструированных CD4+ T-клеток к сконструированным CD8+ T-клеткам, составляющим 1:1 с допустимой разностью, составляющей 50%, 25%, 10% или менее.
В некоторых вариантах осуществления клетки вводят как часть дополнительного комбинированного лечения, например, одновременно или последовательно, в любом порядке, с другим терапевтическим вмешательством, таким как антитело или сконструированная клетка или рецептор или агент, такой как цитотоксический агент или терапевтическое средство. Например, в некоторых вариантах осуществления противораковое средство или иммуномодулятор может использоваться в комбинированной терапии с адоптивной клеточной терапией с использованием сконструированной клетки, экспрессирующей рекомбинантный рецептор, например CAR. В некоторых случаях клетки вводят совместно с другой терапией, достаточно близко по времени, так что популяции клеток усиливают действие одного или более дополнительных терапевтических средств, или наоборот. В некоторых вариантах осуществления клетки вводят до введения одного или более дополнительных терапевтических средств. В некоторых вариантах клетки вводят после введения одного или более дополнительных терапевтических средств.
В некоторых вариантах осуществления одно или более дополнительных терапевтических средств включают цитокин, такой как IL-2, например, для усиления персистенции. В некоторых вариантах осуществления способы включают введение химиотерапевтического средства. В некоторых вариантах осуществления одно или более дополнительных терапевтических средств включают одну или более противолимфоцитарных терапий, например до или одновременно с началом введения сконструированных клеток. В некоторых вариантах осуществления противолимфоцитарная терапия включает введение фосфамида, такого как циклофосфамид. В некоторых вариантах осуществления противолимфоцитарная терапия может включать введение флударабина. В некоторых вариантах осуществления флударабин исключается при противолимфоцитарной терапии. В некоторых вариантах осуществления противолимфоцитарная терапия не назначается.
В некоторых вариантах осуществления способы включают введение агента для предварительного кондиционирования, такого как противолимфоцитарное или химиотерапевтическое средство, такое как циклофосфамид, флударабин или их комбинации, субъекту до начала клеточной терапии. Например, субъекту может вводиться агент для предварительного кондиционирования за по крайней мере 2 дня до начала, например за по крайней мере 3, 4, 5, 6 или 7 дней до начала клеточной терапии. В некоторых вариантах осуществления субъекту вводят агент для предварительного кондиционирования не более чем за 7 дней до начала, например не более чем за 6, 5, 4, 3 или 2 дня до начала клеточной терапии.
В некоторых вариантах осуществления субъекта подвергают предварительному кондиционированию с использованием циклофосфамида в дозе между и приблизительно между 20 мг/кг и 100 мг/кг, например между или приблизительно между 40 мг/кг и 80 мг/кг. В некоторых аспектах субъекта подвергают предварительному кондиционированию с использованием или с использованием приблизительно 60 мг/кг циклофосфамида. В некоторых вариантах осуществления циклофосфамид может вводиться в однократной дозе или может вводиться во множестве доз, например, назначаемых ежедневно, через день или каждые три дня. В некоторых вариантах осуществления циклофосфамид вводят один раз в день в течение одного или двух дней. В некоторых вариантах осуществления, когда противолимфоцитарное средство включает циклофосфамид, субъекту вводят циклофосфамид в дозе между или приблизительно между 100 мг/м2 и 500 мг/м2, например между или приблизительно между 200 мг/м2 и 400 мг/м2 или 250 мг/м2 и 350 мг/м2, включительно. В некоторых случаях субъекту вводят приблизительно 300 мг/м2 циклофосфамида. В некоторых вариантах осуществления циклофосфамид может вводиться в однократной дозе или может вводиться во множестве доз, например, назначаемых ежедневно, через день или каждые три дня. В некоторых вариантах осуществления циклофосфамид вводят ежедневно, например, в течение 1-5 дней, например в течение 3-5 дней. В некоторых случаях субъекту вводят приблизительно 300 мг/м2 циклофосфамида ежедневно в течение 3 дней до начала клеточной терапии.
В некоторых вариантах осуществления, когда противолимфоцитарное средство включает флударабин, субъекту вводят флударабин в дозе между или приблизительно между 1 мг/м2 и 100 мг/м2, например между или приблизительно между 10 мг/м2 и 75 мг/м2, 15 мг/м2 и 50 мг/м2, 20 мг/м2 и 40 мг/м2 или 24 мг/м2 и 35 мг/м2, включительно. В некоторых случаях субъекту вводят приблизительно 30 мг/м2 флударабина. В некоторых вариантах осуществления флударабин может вводиться в однократной дозе или может вводиться во множестве доз, например, назначаемых ежедневно, через день или каждые три дня. В некоторых вариантах осуществления флударабин вводят ежедневно, например, в течение 1-5 дней, например в течение 3-5 дней. В некоторых случаях субъекту вводят приблизительно 30 мг/м2 флударабина ежедневно в течение 3 дней до начала клеточной терапии.
В некоторых вариантах осуществления противолимфоцитарное средство включает комбинацию средств, такую как комбинация циклофосфамида и флударабина. Таким образом, комбинация средств может включать циклофосфамид в любой дозе или схеме введения, такой как описанные выше, и флударабин в любой дозе или схеме введения, такой как описанные выше. Например, в некоторых аспектах субъекту вводят 60 мг/кг (~2 г/м2) циклофосфамида и от 3 до 5 доз 25 мг/м2 флударабина перед первой или последующей дозой.
IV. ИЗДЕЛИЯ И НАБОРЫ
Также предоставляются изделия, такие как наборы и устройства, для введения клеток субъектам в соответствии с предоставленными способами для адоптивной клеточной терапии, а также для хранения и введения клеток и композиций, таких как описанные входные композиции или выходные композиции.
Изделия включают один или более контейнеров, обычно множество контейнеров, упаковочный материал и этикетку или вкладыш в упаковку на контейнере или контейнерах и/или упаковке или связанную с ними, как правило, включающую(ий) инструкции по введению клеток субъекту.
В некоторых вариантах осуществления контейнеры содержат клетки для введения, например, одну или более их стандартных доз. Изделие обычно включает множество контейнеров, каждый из которых содержит одну стандартную дозу клеток. Стандартная доза может представлять собой количество или число клеток, вводимых субъекту в первой дозе, или удвоенное количество (или более) клеток, вводимых в первой или любой одной или более следующих друг за другом доз. Это может быть самая низкая доза или минимально возможная доза клеток, которые будут вводиться субъекту в связи со способом введения. В некоторых вариантах осуществления стандартная доза представляет собой минимальное количество клеток или число клеток или минимальное количество ссылочных единиц или целевых ссылочных единиц или ссылочных единиц в пределах целевого диапазона, которое можно вводить в одной дозе любому субъекту, имеющему конкретное заболевание или состояние, или любому субъекту, в соответствии с предоставляемыми здесь способами.
Подходящие контейнеры включают, например, бутыли, флаконы, шприцы и гибкие мягкие контейнеры, такие как мешки для инфузии. В конкретных вариантах осуществления контейнеры представляют собой мягкие контейнеры, например гибкие мягкие контейнеры, такие как те, которые подходят для инфузии клеток субъектам, например, гибкие пластиковые или ПВХ мешки, и/или мешки для внутривенного введения. В некоторых вариантах осуществления мягкие контейнеры являются герметичными и/или могут стерилизоваться, чтобы обеспечить стерильный раствор и доставку клеток и композиций. В некоторых вариантах осуществления контейнеры, например мешки, имеют вместимость, составляющую или составляющую приблизительно или по крайней мере или по крайней мере приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500 или 1000 мл, например между или приблизительно 10 и приблизительно 100 или между или приблизительно 10 и приблизительно 500 мл, включительно каждое значение. В некоторых вариантах осуществления контейнеры, например мешки, представляют собой и/или изготовлены из материала, который является стабильным и/или обеспечивает стабильное хранение и/или поддержание клеток при одной или более различных температур, таких как низкие температуры, например ниже или ниже приблизительно или при или приблизительно при -20°С, -80°С, -120°С, -135°С и/или температур, подходящих для криоконсервации, и/или другие температуры, такие как температуры, подходящие для оттаивания клеток, и температура тела, например при или при приблизительно 37°С, например, чтобы обеспечить оттаивание, например, в месте расположения субъекта или в месте лечения, например у кровати, непосредственно перед лечением.
Контейнеры могут быть изготовлены из ряда материалов, таких как стекло или пластик. В некоторых вариантах осуществления контейнер имеет одно или более отверстий, например стерильных входных отверстий, например, для соединения трубки или катетера с одной или более трубок, например, для внутривенной или другой инфузии и/или для соединения с целью переноса в и из других контейнеров, таких как мешки для культивирования клеток и/или хранения или другие контейнеры. Приводимые в качестве примера контейнеры включают мешки для инфузии, мешки для внутривенных растворов, флаконы, в том числе с пробками, прокалываемыми иглой для инъекции.
Изделие может включать, кроме того, вкладыш в упаковку или этикетку с одним или более фрагментов идентифицирующей информации и/или инструкций по применению. В некоторых вариантах осуществления информация или инструкции указывают, что содержимое может или должно использоваться для лечения конкретного состояния или заболевания и/или обеспечения инструкций для него. Этикетка или вкладыш в упаковку могут указывать, что содержимое изделия должно использоваться для лечения заболевания или состояния. В некоторых вариантах осуществления этикетка или вкладыш в упаковку предоставляют инструкции для лечения субъекта, например субъекта, от которого были получены клетки, с помощью способа, включающего введение первой и одной или более следующих друг за другом доз клеток, например, в соответствии с любым из вариантов осуществления предоставленных способов. В некоторых вариантах осуществления инструкции описывают введение в первой дозе одной стандартной дозы, например, содержимого одного отдельного контейнера в изделии, а затем одной или более следующих друг за другом доз в определенный момент времени или в пределах определенного временного окна и/или после обнаружения присутствия или отсутствия, или количества, или степени одного или более факторов или результатов у субъекта.
В некоторых вариантах осуществления инструкции описывают введение одной или более стандартных доз субъекту.
В некоторых вариантах осуществления этикетка или вкладыш в упаковку или упаковка содержат идентификатор, указывающий на конкретную личность субъекта, от которого получены клетки, и/или которому клетки должны вводиться. В случае аутологичного переноса личность субъекта, от которого получены клетки, идентична личности субъекта, которому клетки должны вводиться. Таким образом, идентифицирующая информация может указывать, что клетки должны вводиться конкретному пациенту, такому как тот, от которого клетки были первоначально получены. Такая информация может присутствовать в упаковочном материале и/или этикетке в виде штрих-кода или другого закодированного идентификатора или может указывать имя и/или другие идентифицирующие характеристики субъекта.
В некоторых вариантах осуществления изделие включает один или более, обычно множество, контейнеров, содержащих композиции, содержащие клетки, например, их отдельные формы в виде стандартной дозы, и включает, кроме того, один или более дополнительных контейнеров с содержащейся в нем композицией, которая включает дополнительный агент, такой как цитотоксическое или иное терапевтическое средство, например, которое должно вводиться в комбинации, например, одновременно или последовательно в любом порядке с клетками. Альтернативно или дополнительно, изделие может включать, кроме того, другой или такой же контейнер, содержащий фармацевтически приемлемый буфер. Кроме того, оно может включать другие материалы, такие как другие буферы, разбавители, фильтры, трубки, иглы и/или шприцы.
Термин «вкладыш в упаковку» используется для обозначения инструкций, обычно включаемых в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, комбинированной терапии, противопоказаниях и/или предупреждениях относительно применения таких терапевтических продуктов.
V. ОПРЕДЕЛЕНИЯ
Кроме особо оговоренных случаев, все термины, обозначения и другие технические и научные термины или терминология, используемые здесь, как предполагается, имеют то же значения, в котором они обычно понимаются специалистом со средним уровнем компетентности в области техники, к которой относится заявленный объект изобретения. В некоторых случаях термины с общепринятыми значениями определены здесь для внесения ясности и/или для удобства ссылки, и включение сюда таких определений необязательно должно истолковываться как то, что они представляют существенную разницу по сравнению с тем, что обычно подразумевается в данной области техники.
Используемый здесь термин «субъект» представляет собой млекопитающее, такое как человек или другое животное, и, как правило, представляет собой человека. В некоторых вариантах осуществления субъектом, например пациентом, которому вводят иммуномодулирующие полипептиды, сконструированные клетки или композиции, является млекопитающее, обычно примат, такой как человек. В некоторых вариантах осуществления примат представляет собой обезьяну или человекообразную обезьяну. Субъект может быть мужчиной или женщиной и может быть любого подходящего возраста, включая младенцев, юношей, подростков, взрослых и пожилых людей. В некоторых вариантах осуществления субъект является млекопитающим, не являющимся приматом, таким как грызун.
Используемый здесь термин «лечение» (и его грамматические варианты, такие как «лечить» или «лечение») относится к полному или частичному улучшению или уменьшению заболевания или состояния или нарушения, или симптома, неблагоприятного эффекта или результата, или связанного с ним фенотипа. Желательные эффекты лечения включают, но без ограничения ими, предотвращение возникновения или рецидива заболевания, ослабление симптомов, уменьшение любых прямых или косвенных патологических последствий заболевания, предотвращение метастазирования, уменьшение скорости прогрессирования заболевания, улучшение или смягчение болезненного состояния и ремиссию или улучшение прогноза. Термины не подразумевают полное излечение заболевания или полное устранение какого-либо симптома или эффект(ы) на все симптомы или результаты.
Используемый здесь термин «отсрочка развития заболевания» означает отсрочку, задержку, замедление, замедление, стабилизацию, подавление и/или откладывание развития заболевания (такого как рак). Эта отсрочка может быть различной продолжительности, в зависимости от истории болезни и/или индивидуума, подвергаемого лечению. Как очевидно, достаточная или значительная отсрочка может, по сути, включать предотвращение, поскольку у индивидуума заболевание не развивается. Например, может быть отсрочена поздняя стадия рака, такая как развитие метастазирования.
«Предотвращение», как здесь используется, включает обеспечение профилактики в отношении возникновения или рецидива заболевания у субъекта, который может быть предрасположен к заболеванию, но у которого еще не было диагностировано заболевание. В некоторых вариантах осуществления предоставленные клетки и композиции используются для отсрочки развития заболевания или для замедления прогрессирования заболевания.
Как здесь используется, «подавлять» функцию или активность означает уменьшать функцию или активность по сравнению с другими такими же в других отношениях состояниями, за исключением состояния или параметра, представляющего интерес, или, альтернативно, по сравнению с другим состоянием. Например, клетки, которые подавляют рост опухоли, снижают скорость роста опухоли по сравнению со скоростью роста опухоли в отсутствие клеток.
«Эффективное количество» агента, например фармацевтической композиции, клеток или композиции, в связи с введением, относится к количеству, эффективному в дозах/количествах и в течение периодов времени, которые необходимы, для достижения желательного результата, такого как терапевтический или профилактический результат.
«Терапевтически эффективное количество» агента, например фармацевтического препарата или сконструированных клеток, относится к количеству, эффективному в дозах и в течение периодов времени, которые необходимы, для достижения желательного терапевтического результата, например, для лечения заболевание, состояние или нарушения, и/или фармакокинетического или фармакодинамического эффекта лечения. Терапевтически эффективное количество может изменяться в зависимости от таких факторов, как болезненное состояние, возраст, пол и вес субъекта, а также от вводимых иммуномодулирующих полипептидов или сконструированных клеток. В некоторых вариантах осуществления предоставленные способы включают введение иммуномодулирующих полипептидов, сконструированных клеток или композиций в эффективных количествах, например терапевтически эффективных количествах.
«Профилактически эффективное количество» относится к количеству, эффективному в дозах и в течение периодов времени, которые необходимы, для достижения желательного профилактического результата. Как правило, но необязательно, поскольку профилактическая доза используется для субъектов до или на более ранней стадии заболевания, профилактически эффективное количество будет меньше терапевтически эффективного количества.
Термин «фармацевтический препарат» относится к препарату, который находится в такой форме, которая позволяет биологической активности активного ингредиента, содержащегося в нем, быть эффективной, и который не содержит дополнительных компонентов, которые являются неприемлемо токсичными для субъекта, которому будет вводиться препарат.
«Фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтической композиции, отличному от активного ингредиента, который нетоксичен для субъекта. Фармацевтически приемлемый носитель включает, но без ограничения ими, буфер, наполнитель, стабилизатор или консервант.
Как здесь используется, выражение, что положения нуклеотидов или аминокислот «соответствуют» положениям нуклеотидов или аминокислот в раскрытой последовательности, например, определенной в Списке последовательностей, относится к положениям нуклеотидов или аминокислот, определенным при совмещении с раскрытой последовательностью для максимизации процента идентичности, используя стандартный алгоритм совмещения, такой как алгоритм GAP. Совмещая последовательности, можно идентифицировать соответствующие остатки, например, используя консервативные и идентичные аминокислотные остатки в качестве направляющих. В общем, для определения соответствующих положений последовательности аминокислот совмещают так, чтобы получить соответствие наивысшего порядка (смотрите, например, Computational Molecular Biology, Lesk, A.M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D.W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part I, Griffin, A.M., and Griffin, H.G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; и Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M Stockton Press, New York, 1991; Carrillo et al. (1988) SIAM J Applied Math 48: 1073).
Замена аминокислоты может включать замену одной аминокислоты в полипептиде другой аминокислотой. Замена может представлять собой консервативную аминокислотную замену или неконсервативную аминокислотную замену. Замены аминокислот могут быть введены в связывающую молекулу, например антитело, представляющую интерес, и продукты, подвергаемые скринингу на желательную активность, например сохраненное/улучшенное связывание антигена, пониженную иммуногенность или улучшенную ADCC или CDC.
Как правило, аминокислоты могут быть сгруппированы в соответствии со следующими общими свойствами боковой цепи:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
В некоторых вариантах осуществления консервативные замены могут включать замену члена одного из этих классов на другого члена того же класса. В некоторых вариантах осуществления неконсервативные аминокислотные замены могут включать замену члена одного из этих классов на другой класс.
Как здесь используются, формы единственного числа «а», «an» и «the» включают множественные ссылки, если контекст явно не предписывает иное. Например, «a» или «an» означает «по крайней мере один» или «один или несколько». Понятно, что аспекты и варианты, описанные здесь, включают «состоящие» и/или «по существу состоящие» из аспектов и вариантов».
На протяжении всего этого раскрытии различные аспекты заявленного объекта изобретения представлены в форме диапазона. Следует понимать, что описание в форе диапазона дано просто для удобства и краткости и не должно рассматриваться как жесткое ограничение объема заявленного объекта изобретения. Соответственно, следует считать, что описание диапазона конкретно раскрывает все возможные поддиапазоны, а также отдельные числовые значения в этом диапазоне. Например, когда предоставляется диапазон значений, подразумевается, что каждое промежуточное значение между верхним и нижним пределом этого диапазона и любое другое указанное или промежуточное значение в указанном диапазоне включено в заявленный объект изобретения. Верхние и нижние пределы этих меньших диапазонов могут быть независимо включены в меньшие диапазоны и также включены в заявленный объект изобретения, с учетом любого специально исключенного предела в указанном диапазоне. Если указанный диапазон включает один или оба из этих пределов, диапазоны, исключающие один или оба из этих включенных пределов, также включены в заявленный объект изобретения. Это применимо независимо от широты диапазона.
Используемый здесь термин «приблизительно» относится к обычному диапазону ошибок для соответствующего значения, вероятно известного специалисту в этой области техники. Здесь ссылка на «приблизительно» значение или параметр включает (и описывает) варианты, которые направлены на это значение или параметр как таковое. Например, описание, относящееся к «приблизительно X», включает описание «X». В некоторых вариантах осуществления «приблизительно» указанное значение относится к значению в пределах ±25%, ±20%, ±10%, ±5%, ±1%, ±0,1% или ±0,01% от указанного значения.
Используемый здесь термин «композиция» относится к любой смеси двух или более продуктов, веществ или соединений, включая клетки. Это может быть раствор, суспензия, жидкость, порошок, паста, водная, неводная или любая их комбинация.
Как здесь используется, утверждение, что клетка или популяция клеток является «позитивной» по конкретному маркеру, относится к обнаруживаемому присутствию на клетке или в ней конкретного маркера, обычно маркера поверхности. При ссылке на маркер поверхности термин относится к наличию экспрессии (представления) на поверхности, обнаруживаемой с помощью проточной цитометрии, например, путем окрашивания антителом, которое специфически связывается с маркером, и обнаружения указанного антитела, причем окрашивание обнаруживается с помощью проточной цитометрии на уровне, существенно превышающем окрашивание, обнаруживаемое при выполнении этой же процедуры с подобранным по изотипу контролем в идентичных в других отношениях условиях, и/или на уровне, по существу схожем с уровнем для клетки, которая, как известно, является позитивной по маркеру, и/или на уровне, существенно более высоком, чем уровень для клетки, о которой известно, что она является негативной по маркеру.
Как здесь используется, утверждение, что клетка или популяция клеток является «негативной» по конкретному маркеру, относится к отсутствию существенного обнаруживаемого присутствия на клетке или в ней конкретного маркера, обычно маркера поверхности. При ссылке на маркер поверхности термин относится к отсутствию экспрессии на поверхности, обнаруживаемой с помощью проточной цитометрии, например, путем окрашивания антителом, которое специфически связывается с маркером, и обнаружения указанного антитела, причем окрашивание не обнаруживается с помощью проточной цитометрии на уровне, существенно превышающем окрашивание, обнаруживаемое при выполнении этой же процедуры с подобранным по изотипу контролем в идентичных в других отношениях условиях, и/или обнаруживается на уровне, существенно более низком, чем уровень для клетки, о которой известно, что она является позитивной по маркеру, и/или на уровне, по существу схожем с уровнем для клетки, которая, как известно, является негативной по маркеру.
Используемый здесь термин «вектор» относится к молекуле нуклеиновой кислоты, способной к размножению другой нуклеиновой кислоты, с которой она связана. Термин включает вектор в виде самореплицирующейся структуры нуклеиновой кислоты, а также вектор, встраиваемый в геном клетки-хозяина, в которую он был введен. Некоторые векторы способны управлять экспрессией нуклеиновых кислот, с которыми они функционально связаны. Такие векторы упоминаются здесь как «экспрессионные векторы».
Термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используются взаимозаменяемо и относятся к клеткам, в которые была введена экзогенная нуклеиновая кислота, в том числе потомству таких клеток. Клетки-хозяева включают «трансформанты» и «трансформированные клетки», которые включают первичную трансформированную клетку и ее потомство, независимо от числа пассажей. Потомство может не быть полностью идентичным по содержанию нуклеиновых кислот с родительской клеткой, но может содержать мутации. Сюда включено мутантное потомство, которое имеет ту же функцию или биологическую активность, что и функция или биологическая активность, в отношении которой проводится скрининг или отбор, у первоначально трансформированной клетки.
VI. ПРИВОДИМЫЕ В КАЧЕСТВЕ ПРИМЕРА ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
В число представленных вариантов осуществления входят:
1. Способ получения композиции клеток, включающий:
объединение первой композиции клеток, содержащей подобные наивным CD4+ Т-клетки, со второй композицией клеток, содержащей подобные наивным CD8+ T-клетки, для получения входной композиции клеток, в которой отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам находится между или приблизительно между 0,8:1 и 2,2:1, включительно.
2. Способ по варианту осуществления 1, в котором первую композицию клеток получают путем выделения CD4+ T-клеток из биологического образца, полученного от субъекта, и/или вторую композицию клеток получают путем выделения CD8+ T-клеток из биологического образца, полученного от субъекта.
3. Способ по варианту осуществления 1 или варианту осуществления 2, в котором до объединения способ включает определение количества, количества на объем, количества на вес и/или процентного содержания подобных наивным CD4+ Т-клеток в первой композиции и/или количества, количества на объем, количества на вес и/или процентного содержания подобных наивным CD8+ Т-клеток во второй композиции.
4. Способ по варианту осуществления 2, в котором до объединения способ включает определение количества, количества на объем, количества на вес и/или процентного содержания подобных наивным CD4+ Т-клеток и/или количества, количества на объем, количество на вес и/или процентного содержания подобных наивным CD8+ Т-клеток в биологическом образце от субъекта.
5. Способ по любому из вариантов осуществления 1-4, в котором отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам во входной композиции регулируется или изменяется по сравнению с отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ Т-клеткам в биологическом образце от субъекта.
6. Способ получения композиции клеток, включающий:
определение количества, количества на объем, количества на вес и/или процентного содержания подобных наивным CD4+ Т-клеток и подобных наивным CD8+ Т-клеток в биологическом образце, полученном от субъекта, или в одном или более полученных от него образцов; и
получение входной композиции, содержащей CD4+ T-клетки и CD8+ T-клетки, в которой отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам находится между или приблизительно между 2,2:1 и 0,8:1, включительно, причем указанное отношение во входной композиции регулируется или изменяется по сравнению с отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам в биологическом образце от субъекта.
7. Способ по любому из вариантов осуществления 1-6, включающий, кроме того, приведение входной композиции в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки во входной композиции клеток.
8. Способ получения композиции клеток, включающий:
приведение входной композиции, содержащей подобные наивным CD4+ T-клетки и подобные наивным CD8+ T-клетки из биологического образца от субъекта, в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции,
причем отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам, присутствующее во входной композиции, находится между или приблизительно между 0,8:1 и 2,2:1, включительно.
9. Способ по варианту осуществления 7 или варианту осуществления 8, включающий, кроме того, стимуляцию клеток до, во время и/или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации и/или пролиферация клеток.
10. Способ получения композиции клеток, включающий
объединение первой композиции клеток, содержащей подобные наивным CD4+ T-клетки, со второй композицией клеток, содержащей подобные наивным CD8+ T-клетки, для получения входной композиции клеток, в которой отношение подобных наивным CD4+ Т-клеток к подобным наивным CD8+ Т-клеткам находится между или приблизительно между 0,8:1 и 2,2:1, включительно;
приведение входной композиции в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции; и
стимуляцию клеток до, во время и/или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации и/или пролиферации клеток.
11. Способ по любому из вариантов осуществления 1-10, в котором подобные наивным CD4+ и/или подобные наивным CD8+ клетки:
являются поверхностно-позитивными по маркеру, выбранному из группы, состоящей из CD45RA, CD27, CD28 и CCR7; и/или
являются поверхностно-негативными по маркеру, выбранному из группы, состоящей из CD25, CD45RO, CD56, CD62L и KLRG1; и/или
характеризуются низкой экспрессией CD95; и/или
являются негативными по внутриклеточной экспрессии цитокина, выбранного из группы, состоящей из IL-2, IFN-γ, IL-4, IL-10.
12. Способ по любому из вариантов осуществления 1-11, в котором подобные наивным CD4+ и/или подобные наивным CD8+ клетки:
являются поверхностно-позитивными по маркеру активации Т-клеток, выбранному из группы, состоящей из CD45RA, CD27, CD28 и CCR7; и/или
являются поверхностно-негативными по маркеру, выбранному из группы, состоящей из CD45RO, CD56, CD62L и KLRG1; и/или
характеризуются низкой экспрессией CD95.
13. Способ по любому из вариантов осуществления 1-12, в котором подобные наивным CD4+ и/или подобные наивным CD8+ клетки являются поверхностно-позитивными по CD45RA и CCR7.
14. Способ по любому из вариантов осуществления 1-12, в котором подобные наивным CD4+ и/или подобные наивным CD8+ клетки являются поверхностно-позитивными по CD27 и CCR7.
15. Способ по любому из вариантов осуществления 1-14, в котором подобные наивным CD4+ и подобные наивным клетки CD8+ являются поверхностно-позитивными по CD45RA, CD27 и CCR7 и поверхностно-негативными по CD45RO.
16. Способ по любому из вариантов осуществления 1-12, в котором подобные наивным CD4+ и/или подобные наивным CD8+ клетки являются поверхностно-позитивными по CCR7 и поверхностно-негативными по CD62L.
17. Способ по любому из вариантов осуществления 3-16, в котором количество, количество на объем, количество на вес и/или процентное содержание подобных наивным CD4+ Т-клеток и/или количество, количество на объем, количество на вес и/или процентное содержание подобных наивным CD8+ Т-клеток определяется с помощью проточной цитометрии.
18. Способ по любому из вариантов осуществления 8-17, в котором отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам было отрегулировано по сравнению с отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам в биологическом образце от субъекта.
19. Способ по любому из вариантов осуществления 1-18, в котором входная композиция клеток характеризуется отношением подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам, находящимся между или приблизительно между 0,8:1 и 2,0:1, 0,8:1 и 1,6:1, 0,8:1 и 1,4:1, 0,8:1 и 1,2:1, 1,5:1 и 2:1, 1,6:1 и 1,8:1 или 1,0:1 и 1,2:1, включительно каждое отношение.
20. Способ по любому из вариантов осуществления 1-19, в котором входная композиция характеризуется отношением подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам, составляющим или приблизительно составляющим 2:1, 1,9:1, 1,8:1, 1,7:1, 1,69:1, 1,6:1, 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1 или 1,0:1.
21. Способ по любому из вариантов осуществления 1-20, в котором входная композиция характеризуется отношением подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам, составляющим или приблизительно составляющим 1,1:1.
22. Способ по любому из вариантов осуществления 1-20, в котором входная композиция характеризуется отношением подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам, которые являются поверхностно-позитивными по CD45RA и CCR7, составляющим или приблизительно составляющим 1,1:1.
23. Способ по любому из вариантов осуществления 1-20, в котором входная композиция характеризуется отношением подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам, которые являются поверхностно-позитивными по CD45RA и CD27, составляющим или приблизительно составляющим 1,69:1.
24. Способ получения композиции клеток, включающий:
объединение первой композиции клеток, содержащей CCR7+ CD45RA+ CD4+ T-клетки, со второй композицией клеток, содержащей CCR7+ CD45RA+ CD8+ T-клетки, для получения входной композиции клеток, в которой отношение CCR7+ CD45RA+ CD4+ T-клеток к CCR7+ CD45RA+ CD8+ Т-клеткам находится между или приблизительно между 0,8:1 и 2,2:1, включительно.
25. Способ по варианту осуществления 24, в котором первую композицию клеток получают путем выделения CD4+ T-клеток из биологического образца, полученного от субъекта, и/или вторую композицию клеток получают путем выделения CD8+ T-клеток из биологического образца, полученного от субъекта.
26. Способ по варианту осуществления 24 или по варианту осуществления 25, в котором до объединения способ включает определение количества, количества на объем, количества на вес и/или процентного содержания CCR7+ CD45RA+ CD4+ T-клеток в первой композиции и/или количества, количества на объем, количества на вес и/или процентного содержания CCR7+ CD45RA+ CD8+ T-клеток во второй композиции.
27. Способ по любому из вариантов осуществления 24-26, в котором до объединения способ включает определение количества, количества на объем, количества на вес и/или процентного содержания CCR7+ CD45RA+ CD4+ T-клеток и/или количества, количества на объем, количества на вес и/или процентного содержания CCR7+ CD45RA+ CD8+ T-клеток в биологическом образце от субъекта.
28. Способ по любому из вариантов осуществления 24-27, в котором отношение CCR7+ CD45RA+ CD4+ T-клеток к CCR7+ CD45RA+ CD8+ Т-клеткам во входной композиции регулируется или изменяется по сравнению с отношением CCR7+ CD45RA+ CD4+ Т-клеток к CCR7+ CD45RA+ CD8+ Т-клеткам в биологическом образце от субъекта.
29. Способ получения композиции клеток, включающий:
определение количества, количества на объем, количества на вес и/или процентного содержания CCR7+ CD45RA+ CD4+ Т-клеток и CCR7+ CD45RA+ CD8+ T-клеток в биологическом образце, полученном от субъекта, или в одном или более полученных от него образцов; и
получение входной композиции, содержащей CD4+ T-клетки и CD8+ T-клетки, в которой отношение CCR7+ CD45RA+ CD4+ T-клеток к подобным наивным CD8+ T-клеткам находится между или приблизительно между 2,2:1 и 0,8:1, включительно, причем указанное отношение во входной композиции регулируется или изменяется по сравнению с отношением CCR7+ CD45RA+ CD4+ T-клеток к подобным наивным CD8+ T-клеткам в биологическом образце от субъекта.
30. Способ по варианту осуществления 29, включающий, кроме того, приведение входной композиции клеток в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки во входной композиции.
31. Способ получения композиции клеток, включающий:
приведение входной композиции, содержащей CCR7+ CD45RA+ CD4+ T-клетки и CCR7+ CD45RA+ CD8+ T-клетки из биологического образца от субъекта, в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции,
причем отношение CCR7+ CD45RA+ CD4+ T-клеток к CCR7+ CD45RA+ CD8+ T-клеткам, присутствующее во входной композиции, находится между или приблизительно между 0,8:1 и 2,2:1, включительно.
32. Способ по варианту осуществления 31, включающий, кроме того, стимуляцию клеток до, во время и/или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации и/или пролиферация клеток.
33. Способ получения композиции клеток, включающий:
объединение первой композиции клеток, содержащей CCR7+ CD45RA+ CD4+ T-клетки, со второй композицией клеток, содержащей CCR7+ CD45RA+ CD8+ T-клетки, для получения входной композиции клеток, в которой отношение CCR7+ CD45RA+ CD4+ T-клеток к CCR7+ CD45RA+ CD8+ T-клеткам находится между или приблизительно между 0,8:1 и 2,2:1, включительно;
приведение входной композиции в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции; и
стимуляцию клеток до, во время и/или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации и/или пролиферации клеток.
34. Способ по любому из вариантов осуществления 24-33, в котором количество, количество на объем, количество на вес и/или процентное содержание CCR7+ CD45RA+ CD4+ T-клеток и/или количество, количество на объем, количество на вес и/или процентное содержание CCR7+ CD45RA+ CD8+ T-клеток определяется с помощью проточной цитометрии.
35. Способ по любому из вариантов осуществления 31-34, в котором отношение CCR7+ CD45RA+ CD4+ T-клеток к CCR7+ CD45RA+ CD8+ Т-клеткам было отрегулировано по сравнению с отношением CCR7+ CD45RA+ CD4+ T-клеток к CCR7+ CD45RA+ CD8+ T-клеткам в биологическом образце от субъекта.
36. Способ по любому из вариантов осуществления 24-35, в котором входная композиция характеризуется отношением CCR7+ CD45RA+ CD4+ клеток к CCR7+ CD45RA+ CD8+ клеткам, находящимся между или приблизительно между 0,8:1 и 2,0:1, 0,8:1 и 1,6:1, 0,8:1 и 1,4:1, 0,8:1 и 1,2:1 или 1,0:1 и 1,2:1, включительно каждое отношение.
37. Способ по любому из вариантов осуществления 24-36, в котором входная композиция характеризуется отношением CCR7+ CD45RA+ CD4+ клеток к CCR7+ CD45RA+ CD8+ клеткам, составляющим или приблизительно составляющим 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1 или 1,0:1.
38. Способ по любому из вариантов осуществления 24-37, в котором входная композиция характеризуется отношением CCR7+ CD45RA+ CD4+ клеток к CCR7+ CD45RA+ CD8+ клеткам, составляющим или приблизительно составляющим 1,1:1.
39. Способ получения композиции клеток, включающий:
объединение первой композиции клеток, содержащей CD27+ CCR7+ CD4+ Т-клетки, со второй композицией клеток, содержащей CD27+ CCR7+ CD8+ Т-клетки, для получения входной композиции клеток, в которой отношение CD27+ CCR7+ CD4+ T-клеток к CD27+ CCR7+ CD8+ T-клеткам находится между или приблизительно между 1,2:1 и 2,4:1, включительно.
40. Способ по варианту осуществления 39, в котором первую композицию клеток получают путем выделения CD4+ T-клеток из биологического образца, полученного от субъекта, и/или вторую композицию клеток получают путем выделения CD8+ T-клеток из биологического образца, полученного от субъекта.
41. Способ по варианту осуществления 39 или варианту осуществления 40, в котором до объединения способ включает определение количества, количества на объем, количества на вес и/или процентного содержания CD27+ CCR7+ CD4+ T-клеток в первой композиции и/или количества, количества на объем, количества на вес и/или процентного содержания CD27+ CCR7+ CD8+ Т-клеток во второй композиции.
42. Способ по любому из вариантов осуществления 39-41, в котором до объединения способ включает определение количества, количества на объем, количества на вес и/или процентного содержания CD27+ CCR7+ CD4+ T-клеток и/или количества, количества на объем, количества на вес и/или процентного содержания CD27+ CCR7+ CD8+ T-клеток в биологическом образце от субъекта.
43. Способ по любому из вариантов осуществления 39-42, в котором отношение CD27+ CCR7+ CD4+ T-клеток к CD27+ CCR7+ CD8+ T-клеткам во входной композиции регулируется или изменяется по сравнению с отношением CD27+ CCR7+ CD4+ Т-клеток к CD27+ CCR7+ CD8+ Т-клеткам в биологическом образце от субъекта.
44. Способ получения композиции клеток, включающий:
определение количества, количества на объем, количества на вес и/или процентного содержания CD27+ CCR7+ CD4+ T-клеток и CD27+ CCR7+ CD8+ T-клеток в биологическом образце, полученном от субъекта, или в одном или более полученных от него образцов; и
получение входной композиции, содержащей CD4+ T-клетки и CD8+ T-клетки, в которой отношение CD27+ CCR7+ CD4+ T-клеток к подобным наивным CD8+ T-клеткам находится между или приблизительно между 2,2:1 и 0,8:1, включительно, причем указанное отношение во входной композиции регулируется или изменяется по сравнению с отношением CD27+ CCR7+ CD4+ T-клеток к подобным наивным CD8+ T-клеткам в биологическом образце от субъекта.
45. Способ по любому из вариантов осуществления 39-44, включающий, кроме того, приведение входной композиции в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки во входной композиции.
46. Способ получения композиции клеток, включающий:
приведение входной композиции, содержащей CD27+ CCR7+ CD4+ T-клетки и CD27+ CCR7+ CD8+ T-клетки из биологического образца от субъекта, в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции,
причем отношение CD27+ CCR7+ CD4+ T-клеток к CD27+ CCR7+ CD8+ T-клеткам, присутствующее во входной композиции, находится между или приблизительно между 0,8:1 и 2,2:1, включительно.
47. Способ по варианту осуществления 46 или варианту осуществления 47, включающий, кроме того, стимуляцию клеток до, во время и/или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации и/или пролиферация клеток.
48. Способ получения композиции клеток, включающий:
объединение первой композиции клеток, содержащей CD27+ CCR7+ CD4+ T-клетки, со второй композицией клеток, содержащей CD27+ CCR7+ CD8+ T-клетки, для получения входной композиции клеток, в которой отношение CD27+ CCR7+ CD4+ T-клеток к CD27+ CCR7+ CD8+ T-клеткам находится между или приблизительно между 0,8:1 и 2,2:1, включительно;
приведение входной композиции в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции; и
стимуляцию клеток до, во время и/или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации и/или пролиферации клеток.
49. Способ по любому из вариантов осуществления 39-48, в котором количество, количество на объем, количество на вес и/или процентное содержание CD27+ CCR7+ CD4+ T-клеток и/или количество, количество на объем, количество на вес и/или процентное содержание CD27+ CCR7+ CD8+ T-клеток определяется с помощью проточной цитометрии.
50. Способ по любому из вариантов осуществления 39-49, в котором отношение CD27+ CCR7+ CD4+ T-клеток к CD27+ CCR7+ CD8+ T-клеткам было отрегулировано по сравнению с отношением CD27+ CCR7+ CD4+ T-клеток к CD27+ CCR7+ CD8+ T-клеткам в биологическом образце от субъекта.
51. Способ по любому из вариантов осуществления 39-50, в котором входная композиция характеризуется отношением CD27+ CCR7+ CD4+ клеток к CD27+ CCR7+ CD8+ клеткам, находящимся между или приблизительно между 0,8:1 и 2,0:1, 0,8:1 или 1,6:1, 0,8:1 и 1,4:1, 0,8:1 и 1,2:1 или 1,0:1 и 1,2:1, включительно.
52. Способ по любому из вариантов осуществления 39-51, в котором входная композиция характеризуется отношением CD27+ CCR7+ CD4+ клеток к CD27+ CCR7+ CD8+ клеткам, составляющим или приблизительно составляющим 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1 или 1,0:1.
53. Способ по любому из вариантов осуществления 39-52, в котором входная композиция характеризуется отношением CD27+ CCR7+ CD4+ клеток к CD27+ CCR7+ CD8+ клеткам, составляющим или приблизительно составляющим 1,1:1.
54. Способ получения композиции клеток, включающий:
объединение первой композиции клеток, содержащей CD62L-CCR7+ CD4+ Т-клетки, со второй композицией клеток, содержащей CD62L-CCR7+ CD8+ Т-клетки, для получения входной композиции клеток, в которой отношение CD62L-CCR7+ CD4+ T-клеток к CD62L-CCR7+ CD8+ T-клеткам находится между или приблизительно между 0,5:1 и 2:1, включительно.
55. Способ получения композиции клеток, включающий:
определение количества, количества на объем, количества на вес и/или процентного содержания CD62L-CCR7+ CD4+ T-клеток и CD62L-CCR7+ CD8+ T-клеток в биологическом образце, полученном от субъекта, или в одном или более полученных от него образцов; и
получение входной композиции, содержащей CD4+ T-клетки и CD8+ T-клетки, в которой отношение CD62L-CCR7+ CD4+ T-клеток к подобным наивным CD8+ T-клеткам находится между или приблизительно между 0,5:1 и 2:1, включительно, причем указанное отношение во входной композиции регулируется или изменяется по сравнению с отношением CD62L-CCR7+ CD4+ T-клеток к подобным наивным CD8+ T-клеткам в биологическом образце от субъекта.
56. Способ по варианту осуществления 54 или 55, включающий, кроме того, приведение входной композиции в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки во входной композиции.
57. Способ получения композиции клеток, включающий:
объединение первой композиции, содержащей CD62L-CCR7+ CD4+ T-клетки, со второй композицией клеток, содержащей CD62L-CCR7+ CD8+ T-клетки, для получения входной композиции клеток, в которой отношение CD62L-CCR7+ CD4+ T-клеток к CD62L-CCR7+ CD8+ T-клеткам находится между или приблизительно между 0,5:1 и 2:1, включительно;
приведение входной композиции клеток в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции; и
стимуляцию клеток до, во время и/или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации и/или пролиферации клеток.
58. Способ по варианту осуществления 56 или 57, в котором количество, количество на объем, количество на вес и/или процентное содержание CD62L- CCR7+ CD4+ Т-клеток и/или количество, количество на объем, количество на вес и/или процентное содержание CD62L-CCR7+ CD8+ Т-клеток определяется с помощью проточной цитометрии.
59. Способ по любому из вариантов осуществления 55-58, в котором отношение CD62L-CCR7+ CD4+ T-клеток к CD62L-CCR7+ CD8+ T-клеткам было отрегулировано по сравнению с отношением CD62L-CCR7+ CD4+ T-клеток к CD62L- CCR7+ CD8+ T-клеткам в биологическом образце от субъекта.
60. Способ по любому из вариантов осуществления 55-59, в котором входная композиция клеток характеризуется отношением CD62L-CCR7+ CD4+ клеток к CD62L-CCR7+ CD8+ клеткам, находящимся между или приблизительно между 0,5:1 и 1,5:1, 1:1 и 2:1, 0,75:1 и 1,5:1 или 0,8:1 и 1,2:1, включительно каждое отношение.
61. Способ по любому из вариантов осуществления 55-60, в котором входная композиция характеризуется отношением CD62L-CCR7+ CD4+ клеток к CD62L-CCR7+ CD8+ клеткам, составляющим или приблизительно составляющим 1,2:1, 1,1:1, 1,0:1, 0,9:1 или 0,8:1.
62. Способ по любому из вариантов осуществления 2-9, 18-23, 25-32, 34-38, 40-47, 50-53, 55-56 или 59-61, в котором биологический образец представляет собой или получают из образца крови, плазмы или сыворотки.
63. Способ по любому из вариантов осуществления 2-9, 18-23, 25-32, 34-38, 40-47, 50-53, 55-56 или 59-62, в котором биологический образец представляет собой или включает образец цельной крови, образец лейкоцитарной пленки, образец мононуклеарных клеток периферической крови (PBMC), образец нефракционированных Т-клеток, образец лимфоцитов, образец лейкоцитов, продукт афереза, или продукт лейкафереза.
64. Способ по любому из вариантов осуществления 2-9, 18-23, 25-32, 34-38, 40-47, 50-53, 55-56 или 59-63, в котором биологический образец представляет собой или получают из образца для афереза или лейкафереза.
65. Способ по любому из вариантов осуществления 2-9, 18-23, 25-32, 34-38, 40-47, 50-53, 55-56 или 59-64, в котором субъектом является человек.
66. Способ по любому из вариантов осуществления 1-65, в котором входная композиция содержит от или приблизительно от 1×107 до 5×109 всех клеток или всех T-клеток, от или приблизительно от 5×107 до 1×109 всех клеток или всех T-клеток, от или приблизительно от 1×108 до 5×108 всех клеток или всех T-клеток, или от или приблизительно от 2×108 до 5×108 всех клеток или всех T-клеток, или жизнеспособных популяций любых из вышеперечисленных.
67. Способ по любому из вариантов осуществления 1-66, в котором входная композиция содержит по крайней мере или по крайней мере приблизительно 1×108, 2×108, 3×108, 4×108 или 5×108 всех клеток или всех T-клеток, или жизнеспособных популяций любых из вышеперечисленных.
68. Способ по любому из вариантов осуществления 9-23, 32-38, 47-53, 57-67, в котором один или более стимулирующих агентов способен к активации Т-клеток, CD4+ Т-клеток и/или CD8+ Т-клеток; способен к индукции сигнала через TCR комплекс; и/или способен к вызову пролиферации Т-клеток, CD4+ Т-клеток и/или CD8+ Т-клеток.
69. Способ по любому из вариантов осуществления 9-23, 32-38, 47-53, 57-68, в котором один или более стимулирующих агентов включает первичный агент, который связывается с членом TCR комплекса, который необязательно специфически связывается с CD3.
70. Способ по варианту осуществления 69, в котором один или более стимулирующих агентов включает, кроме того, вторичный агент, который специфически связывается с костимулирующей молекулой Т-клеток.
71. Способ по варианту осуществления 70, в котором костимулирующая молекула выбрана из группы, состоящей из CD28, CD137 (4-1-BB), OX40 или ICOS.
72. Способ по варианту осуществления 70 или варианту осуществления 71, в котором первичные и вторичные агенты включают антитела, причем, необязательно, один или более стимулирующих агентов подразумевает инкубацию с антителом против CD3 и антителом против CD28.
73. Способ по любому из вариантов осуществления 9-23, 32-38, 47-53, 57-72, в котором один или более стимулирующих агентов присутствуют на поверхности твердой подложки, необязательно шарика.
74. Способ по любому из вариантов осуществления 9-23, 32-38, 47-53, 57-73, в котором один или более одного стимулирующего агента выбран из группы, состоящей из CD3-связывающих молекул; CD28-связывающих молекул; рекомбинантного IL-2; рекомбинантного IL-15 и рекомбинантного IL-7, вакцины, содержащей антиген, специфически распознаваемый рецептором антигена, и антиидиотипического антитела, которое специфически связывается с рецептором антигена, или их комбинаций.
75. Способ по любому из вариантов осуществления 9-23, 32-38, 47-53, 57-74, в котором инкубацию проводят в течение от 2 до 15 дней, от 2 до 12 дней, от 2 до 12 дней, от 2 до 8 дней, от 2 до 6 дней, от 2 до 4 дней, от 4 до 12 дней, от 4 до 10 дней, от 4 до 8 дней, от 4 до 6 дней, от 6 до 12 дней, от 6 до 10 дней, от 6 до 8 дней, от 8 до 12 дней, от 8 до 10 дней или от 10 до 12 дней.
76. Способ по любому из вариантов осуществления 9-23, 32-38, 47-53, 57-75, в котором инкубацию проводят в течение по крайней мере, или приблизительно по крайней мере, или 4 дней, 6 дней, 8 дней, 10 дней или 12 дней.
77. Способ по любому из вариантов осуществления 7-23, 30-39, 45-53 или 57-76, в котором агент, включающий молекулу нуклеиновой кислоты, представляет собой вирусный вектор или представляет собой транспозон.
78. Способ по варианту осуществления 77, в котором агент, включающий молекулу нуклеиновой кислоты, представляет собой вирусный вектор, а вирусный вектор представляет собой ретровирусный вектор.
79. Способ по варианту осуществления 78, в котором вирусный вектор представляет собой лентивирусный вектор или гаммаретровирусный вектор.
80. Способ по любому из вариантов осуществления 7-23, 30-38, 45-53 или 56-79, в котором рекомбинантный рецептор способен связываться с антигеном-мишенью, который связан с клеткой или тканью заболевания, нарушения или состояния, является специфическим для них и/или экспрессируется в них.
81. Способ по варианту осуществления 80, в котором заболевание, нарушение или состояние представляет собой инфекционное заболевание или расстройство, аутоиммунное заболевание, воспалительное заболевание или опухоль или рак.
82. Способ по варианту осуществления 80 или варианту осуществления 81, в котором антиген-мишень представляет собой опухолевый антиген.
83. Способ по любому из вариантов осуществления 80-82, в котором антиген-мишень выбран из числа рецептора-сироты 1 типа рецепторных тирозинкиназ (ROR1), антигена созревания В-клеток (BCMA), карбоангидразы 9 (CA9, также известной как CAIX или G250), Her2/neu (рецепторной тирозинкиназы erbB2), CD19, CD20, CD22, мезотелина (MSLN), раково-эмбрионального антигена (CEA) и поверхностного антигена вируса гепатита B, антитела против фолатного рецептора, CD23, CD24, CD30, CD33, CD38, CD44, хондроитинсульфат-протеогликана 4 (CSPG4), EGFR, эпителиального гликопротеина 2 (EPG-2), эпителиального гликопротеина 40 (EPG-40), рецептора-А2 эфрина (EPHa2), Her3 (erb-B3), Her4 (erb-B4), димеров erbB, мутации рецептора эпидермального фактора роста типа III (EGFR vIII), фолат-связывающего белка (FBP), подобного Fc-рецептору рецептора 5 (FCRL5, также известного как гомолог 5 Fc-рецептора или FCRH5), фетального ацетилхолинового рецептора (фетального AchR), ганглиозида GD2, ганглиозида GD3, лейкоцитарного антигена A1 человека (HLA-A1), лейкоцитарного антигена A2 человека (HLA-A2), рецептора-альфа IL-22 (IL-22Ra), рецептора, содержащего домен вставки киназы (kdr), легкой цепи каппа, члена А семейства белков, богатых повторами лейцина 8, (LRRC8A), Lewis Y, молекулы адгезии клеток L1 (L1-CAM), связанного с меланомой антигена А1 (MAGE)-A1, MAGE-A3, MAGE-A6, MAGE-A10, преимущественно экспрессируемого антигена меланомы (PRAME), сурвивина, опухолевого гликопротеина 72 (TAG72), B7-H3, B7-H6, рецептора-альфа 2 IL-13 (IL-13RΑ2), высокомолекулярного связанного с меланомой антигена человека (HMW-MAA), CD171, фолатного рецептора-альфа, CD44v7/8, интегрина αvβ6 (интегрина avb6), 8H9, молекулы адгезии нервных клеток (NCAM), рецептора фактора роста эндотелия сосудов (рецепторов VEGF или VEGFR), гликопротеина трофобластов (TPBG, также известного как 5T4), лигандов NKG2D, CD44v6, двойного антигена, антигена рака яичек, цитомегаловируса (CMV) мышей, муцина 1 (MUC1), MUC16, антигена стволовых клеток предстательной железы (PSCA), специфического для предстательной железы мембранного антигена (PSMA), лигандов члена D группы 2 природных киллеров (NKG2D), антигена 1B рака/яичка (CTAG, также известного как NY-ESO-1 и LAGE-2), мелана A (MART-1), гликопротеина 100 (gp100), глипикана-3 (GPC3), сопряженного с G-белком рецептора 5D (GPRC5D), онкофетального антигена, TAG72, родственного тирозиназе белка 1 (TRP1, также известного как TYRP1 или gp75), родственного тирозиназе белка 2 (TRP2, также известного как допахром-таутомераза, допахром-дельта-изомераза или DCT), рецептора 2 фактора роста эндотелия сосудов (VEGF-R2), раково-эмбрионального антигена (CEA), рецептора эстрогена, рецептора прогестерона, специфического для предстательной железы антигена, эфрина B2, CD123, CD133, c-Met, O-ацетилированного GD2 (OGD2), эпитопа CE7 L1-CAM, белка опухоли Вильмса 1 (WT-1), циклина, циклина A2, лиганда 1 хемокина, содержащего мотив C-C (CCL-1), CD138, специфического для патогена антигена или экспрессируемого патогеном антигена и антигена, связанного с универсальной меткой.
84. Способ по любому из вариантов осуществления 7-23, 30-38, 45-53 или 56-83, в котором рекомбинантный рецептор представляет собой или включает функциональный рецептор антигена, не являющийся TCR, или TCR или его антигенсвязывающий фрагмент.
85. Способ по любому из вариантов осуществления 7-23, 30-38, 45-53 или 56-83, в котором рекомбинантный рецептор представляет собой химерный рецептор антигена (CAR).
86. Способ по варианту осуществления 85, в котором химерный рецептор антигена содержит экстраклеточный домен, включающий антигенсвязывающий домен.
87. Способ по варианту осуществления 86, в котором антигенсвязывающий домен представляет собой или включает антитело или фрагмент антитела, который необязательно является одноцепочечным фрагментом.
88. Способ по варианту осуществления 87, в котором фрагмент включает вариабельные области антитела, соединенные гибким линкером.
89. Способ по варианту осуществления 87 или варианту осуществления 88, в котором фрагмент включает scFv.
90. Способ по любому из вариантов осуществления 86-89, в котором химерный рецептор антигена, кроме того, содержит спейсер и/или шарнирную область.
91. Способ по любому из вариантов осуществления 86-90, в котором химерный рецептор антигена содержит внутриклеточную сигнальную область.
92. Способ по варианту осуществления 91, в котором внутриклеточная сигнальная область включает внутриклеточный сигнальный домен.
93. Способ по варианту осуществления 92, в котором внутриклеточный сигнальный домен представляет собой или включает первичный сигнальный домен, сигнальный домен, который способен индуцировать первичный сигнал активации в Т-клетке, сигнальный домен компонента Т-клеточного рецептора (TCR) и/или сигнальный домен, содержащий мотив активации иммунорецепторов на основе тирозина (ITAM).
94. Способ по варианту осуществления 93, в котором внутриклеточный сигнальный домен представляет собой или включает внутриклеточный сигнальный домен цепи CD3, необязательно цепи CD3-дзета (CD3ζ) или ее сигнальную часть.
95. Способ по любому из вариантов осуществления 91-94, в котором химерный рецептор антигена, кроме того, содержит трансмембранный домен, расположенный между экстраклеточным доменом и внутриклеточной сигнальной областью.
96. Способ по любому из вариантов осуществления 91-95, в котором внутриклеточная сигнальная область включает, кроме того, костимулирующую сигнальную область.
97. Способ по варианту осуществления 96, в котором костимулирующая сигнальная область включает внутриклеточный сигнальный домен костимулирующей молекулы Т-клеток или ее сигнальную часть.
98. Способ по варианту осуществления 96 или по варианту осуществления 97, в котором костимулирующая сигнальная область включает внутриклеточный сигнальный домен CD28, 4-IBB или ICOS или их сигнальную часть.
99. Способ по любому из вариантов осуществления 96-98, в котором костимулирующая сигнальная область находится между трансмембранным доменом и внутриклеточной сигнальной областью.
100. Способ по любому из вариантов осуществления 2-9, 11-23, 25-32, 34-38, 40-47, 50-53, 55-56 или 59-99, в котором у субъекта имеется заболевание или состояние, причем необязательно рекомбинантный рецептор специфически распознает или специфически связывается с антигеном, связанным с заболеванием или состоянием или экспрессируемым или присутствующим на клетках заболевания или состояния.
101. Способ по любому из вариантов осуществления 1-100, который дает выходную композицию, в которой отношение экспрессирующих рекомбинантный рецептор CD4+ Т-клеток к экспрессирующим рекомбинантный рецептор CD8+ Т-клеткам, необязательно отношение их жизнеспособных клеток, отличается не более чем на 20%, или не более чем на 10%, или не более чем на 5% от среднего значения указанного отношения во множестве композиций Т-клеток, полученных этим способом, и/или отличается от такого среднего значения не более чем на одно среднеквадратичное отклонение.
102. Способ по любому из вариантов осуществления 1-101, который дает выходную композицию, в которой отношение экспрессирующих рекомбинантный рецептор CD4+ Т-клеток к экспрессирующим рекомбинантный рецептор CD8+ Т-клеткам, необязательно отношение их жизнеспособных клеток, находится между или приблизительно между 0,5:1 и 2:1, или 0,8:1 и 1,6:1, или 1:1 и 1,5:1, включительно каждое отношение.
103. Способ по варианту осуществления 101 или варианту осуществления 102, в котором отношение экспрессирующих рекомбинантный рецептор CD4+ Т-клеток к экспрессирующим рекомбинантный рецептор CD8+ Т-клеткам, необязательно отношение их жизнеспособных клеток, в выходной композиции составляет или приблизительно составляет 1,2:1, 1,1:1, 1:1, 0,9:1 или 0,8:1.
104. Способ по любому из вариантов осуществления 101-103, в котором отношение экспрессирующих рекомбинантный рецептор CD4+ T-клеток к экспрессирующим рекомбинантный рецептор CD8+ T-клеткам, необязательно отношение их жизнеспособных клеток, в выходной композиции составляет или приблизительно составляет 1:1.
105. Способ по любому из вариантов осуществления 66-104, в котором жизнеспособные клетки включают клетки, которые являются негативными (-) по маркеру апоптоза, причем необязательно маркер апоптоза представляет собой аннексин V или активную каспазу 3.
106. Способ по любому из вариантов осуществления 1-105, который выполняется in vitro или ex vivo.
107. Выходная композиция, полученная способом по варианту осуществлений 104.
108. Фармацевтическая композиция, содержащая выходную композицию по варианту осуществлений 107.
109. Фармацевтическая композиция по варианту осуществления 108, содержащая, кроме того, фармацевтический носитель.
110. Способ лечения, включающий введение являющемуся млекопитающим субъекту выходной композиции, полученной способом по варианту осуществлений 105, или фармацевтической композиции по варианту осуществлений 108 или варианту осуществлений 109.
111. Способ по варианту осуществления 110, в котором клетки получены от субъекта, которому эти клетки вводят.
VII. ПРИМЕРЫ
Следующие примеры включены лишь с иллюстративной целью и не предназначены для ограничения объема изобретения.
Пример 1. Корреляция между фенотипом исходной композиции и отношением CD4+ к CD8+ экспрессирующим CAR клеткам в композиции CAR+ T-клеток
Композиции CAR+ T-клеток, содержащие аутологичные T-клетки, экспрессирующие химерный рецептор антигена (CAR), были получены в результате афереза материала, собранного от 11 отдельных доноров, с раздельно обработанными четырьмя образцами для исследования из образца от каждого донора. Один донор был пациентом с миеломой, а остальные доноры были здоровыми субъектами. После промывки каждого образца для афереза каждый образец оценивали с помощью проточной цитометрии на жизнеспособность клеток с использованием маркера апоптоза и на экспрессию CD4 и CD8 на поверхности для определения отношения жизнеспособных CD4+ к CD8+ Т-клеткам (отношения CD4/CD8) в каждом исследуемом образце для афереза.
CD4+ и CD8+ Т-клетки отбирали из образцов для афереза иммуноаффинным методом селекции. CD4+ T-клетки и CD8+ T-клетки объединяли в составляющем 1:1 отношении жизнеспособных CD4+ к CD8+ клеткам. Образец объединенных клеток оценивали с помощью проточной цитометрии на жизнеспособность клеток с использованием специфического маркера апоптоза и на экспрессию на поверхности маркеров, которые включали CD4, CD8, CD45RA и CCR7. Было определено отношение жизнеспособных CD45RA+/CCR7+CD4+ к жизнеспособным CD45RA+/CCR7+CD8+ (отношение CD45RA+ CCR7+ CD4/CD8) в смеси отобранных CD4 и CD8 клеток.
Для получения композиции CAR+ T-клеток объединенные CD4+ и CD8+ T-клетки активировали путем инкубации с шариками, покрытыми антителом против CD3 и против CD28, в присутствии цитокинов, а затем трансдуцировали с использованием лентивирусного вектора, кодирующего специфический для ВСМА CAR. CAR содержал антигенсвязывающий домен scFv, специфический для ВСМА, спейсер, трансмембранную область CD28, костимулирующую сигнальную область 4-1BB и внутриклеточный сигнальный домен, происходящий из CD3-дзета. После трансдукции клетки размножали, а затем замораживали путем криоконсервации. Клетки в замороженной композиции оттаивали и оценивали с помощью проточной цитометрии на жизнеспособность, экспрессию CD4 и CD8 на поверхности и экспрессию CAR с использованием реагента BCMA-Fc. Определяли отношение жизнеспособных CAR+ клеток, которые были CD4+, к жизнеспособным CAR+ клеткам, которые были CD8+ (отношение CAR+ CD4/CD8).
Отношение CD4/CD8 в образцах для афереза или отношение CD45RA+ CCR7+ CD4/CD8 в смеси отобранных CD4 и CD8 клеток сравнивали, задним числом, с отношением CAR+ CD4/CD8 в композиции сконструированных CAR+ Т-клеток. Степень корреляции средних значений отношений для каждого субъекта оценивали с помощью двумерного анализа, и двумерный нормальный эллипс распределения, представляющий область вероятности=0,990, для представленных данных продемонстрирован на фиг. 1А и 1В, соответственно. В таблице 1A и таблице 1В показаны результаты корреляционного анализа Пирсона, проведенного по отношению к данным, представленным на фиг. 1А и фиг. 1В, соответственно.
Как показано на фиг. 1А и таблице 1А, в этом эксперименте не было корреляции между отношением жизнеспособных CD4+/CD8+ Т-клеток из образца для афереза и отношением CAR+ CD4/CD8 в конечной композиции. Этот результат согласуется с наблюдениями, что смешивание очищенных CD4 и CD8 Т-клеток в соотношении 1:1 до активации на основе общего количества жизнеспособных клеток необязательно коррелирует с составляющим 1:1 соотношением CD4+ и CD8+ Т-клеток в выходной композиции Т-клеток.
Как показано на фиг. 1B и таблица 1B, в этом эксперименте наблюдалась положительная корреляция между отношением CAR+ CD4/CD8 в конечной композиции Т-клеток и отношением подобных наивным CD4/CD8 Т-клеток в исходном образце, определенным по отношению CD45RA+ CCR7+ CD4/CD8 в смеси CD4 и CD8 клеток. В частности, результаты на фиг. 1B показывает, что корреляция между отношением CD45RA+/CCR7+/CD4+ клеток к CD45RA+/CCR7+/CD8+ клеткам в исходном образце и отношением CAR+ CD4/CD8 в композиции Т-клеток является высокой, как следует из коэффициента корреляции Пирсона и значения p<0,0001. Эта корреляция сохранялась, несмотря на колебания во входной композиции клеток и между проводимыми процессами исследований. Основываясь на этой модели, установленной из этого приводимого в качестве примера набора образцов, было определено, что составляющее приблизительно 1,1:1 отношение CD45RA+/CCR7+/CD4+ к CD45RA+/CCR7+/CD8+ привит к составляющему приблизительно 1:1 отношению CAR+ CD4/CD8 в выходной композиции Т-клеток.
Эти данные подтверждают гипотезу, что можно контролировать и/или регулировать соотношение и/или смесь CD4+ клеток и CD8+ клеток в выходной композиции Т-клеток путем контролирования соотношения подмножества подобных наивным CD4+ клеток и подобных наивным CD8+ T-клеток у субъекта, например, определенного по экспрессии CD45RA+ и CCR7+ на поверхности.
Пример 2. Корреляция между фенотипами исходной популяции Т-клеток и отношением CAR+ CD4+ к CAR+ CD8+ T-клеткам в композициях сконструированных CAR+ T-клеток
В общей сложности 50 композиций сконструированных CAR+ T-клеток было получено из образцов для афереза, собранных от 15 здоровых доноров и одного пациента с множественной миеломой. Для получения композиций CAR+ T-клеток, жизнеспособные отобранные CD4+ и CD8+ T-клетки объединяли в исходную композицию клеток в соотношении 1:1, а затем активировали, трансдуцировали и размножали, как описано в примере 1. Образцы из исходных композиций объединенных жизнеспособных CD4+ и CD8+ Т-клеток оценивали с помощью проточной цитометрии на жизнеспособность и экспрессию на поверхности маркеров, которые включали CD4, CD8, CD27, CD45RA, CCR7 и CD62L.
Образцы из композиций сконструированных CAR+ T-клеток оценивали на экспрессию CAR и на экспрессию на поверхности маркеров, которые включали CD4 и CD8. Средние значения рассчитывали для отношений CD4+ CAR+ T-клеток к CD8+ CAR+ T-клеткам (отношения CAR+ CD4/CD8) в отдельных композициях CAR+ T-клеток одного и того же донора, которые были получены с использованием того же приводимого в качестве примера процесса, который описан в примере 1, за исключением того, что некоторые параметры процесса были изменены. Средние значения отношений CAR+ CD4/CD8 анализировали на корреляции с различными фенотипами исходных композиций объединенных жизнеспособных CD4+ и CD8+ клеток. Объединение отобранных CD4+ и CD8+ T-клеток в соотношении 1:1 до активации необязательно коррелировало с составляющим 1:1 соотношением CAR+ CD4 и CAR+ CD8 в полученных выходных композициях клеток.
Степень корреляции между средними отношениями CAR+ CD4/CD8 и фенотипами от каждого донора оценивали с помощью двумерного анализа. Двумерные нормальные эллипсы распределения, представляющие вероятность=0,950, показаны для отношений CD45RA+/CCR7+/CD4+ T-клеток к CD45RA+/CCR7+/CD8+ T-клеткам (отношения CD45RA+ CCR7+ CD4/CD8; фиг. 2A); CD62L-/CCR7+/CD4+ к CD62L-/CCR7+/CD8+ (отношение CD62L- CCR7+ CD4/CD8; фиг. 2B); и отношения CD27+/CCR7+/CD4+ к CD27+/CCR7+/CD8+ (отношение CD27+ CCR7+ CD4/CD8; фиг. 2C). В таблице 2 показаны результаты корреляционного анализа Пирсона, проведенного в отношении данных, представленных на фиг. 2A-2C.
Анализ показал, что при использовании приводимого в качестве примера протокола, описанного в примере 1, наблюдалась положительная корреляция между отношением CAR+ CD4/CD8 и отношением CD45RA+ CCR7+ CD4/CD8 T-клеток для здоровых доноров, но в этом эксперименте, не для одного образца от пациента. Было показано, что наблюдается положительная корреляция между отношением CAR+ CD4/CD8 и отношениями CD62L- CCR7+ CD4/CD8 и CD27+ CCR7+ CD4 CD8 в исходных композициях клеток, как от здоровых доноров, так и в образце пациента. Основываясь на установленной модели, было рассчитано, что составляющее 1,69:1 отношение CD27+ CCR7+ CD4/CD8 отношение в исходной композиции в соответствии с прогнозами создаст выходную композицию клеток с отношением CAR+ CD4/CD8, приблизительно составляющим 1:1. Эти результаты согласуются с обнаружением, что отношение CD27+ CCR7+ CD4/CD8 можно отрегулировать в исходной композиции клеток для контроля и/или прогнозирования результирующего отношения CAR+ CD4/CD8 в композиции сконструированных клеток.
Пример 3. Процесс получения композиции CAR+ T-клеток на основе фенотипа исходной композиции.
Десять композиций CAR+ T-клеток, содержащих аутологичные T-клетки, экспрессирующие CAR, было получено в результате афереза материала, собранного от 3 отдельных доноров, включая двух здоровых доноров и одного пациента с множественной миеломой. CD4+ и CD8+ Т-клетки были отобраны из образцов для афереза, как описано в примере 1. Образцы для афереза и отобранные CD4+ и CD8+ Т-клетки оценивали с помощью проточной цитометрии на жизнеспособность и маркеры поверхности, включающие CD27, CCR7, CD4 и CD8. Определяли частоту CD27+ CCR7+ клеток среди отобранных CD4+ и CD8+ Т-клеток, причем каждый донор демонстрировал различное отношение CD27+ CCR7+ CD4+ клеток к CD27+ CCR7+ CD8+ клеткам в образцах для афереза. Например, в образце от пациента отношение CD27+ CCR7+ CD4+ клеток к CD27+ CCR7+ CD8+ клеткам составляло приблизительно 12,2:1, тогда как в двух образцах от здоровых доноров отношения CD27+ CCR7+ CD4+ клеток к CD27+ CCR7+ CD8+ клеткам составляли 3,56:1 и 2.15:1. Входные композиции клеток были получены либо путем (1) объединения отобранных CD4+ и CD8+ клеток в составляющем 1:1 соотношении жизнеспособных CD4+ и CD8+ клеток (жизнеспособных CD4/CD8), либо путем (2) объединения CD4+ и CD8+ клеток в составляющем 1,69:1 соотношении CD27+ CCR7+ CD4+ клеток и CD27+ CCR7+ CD8+ клеток (CD27+ CCR7+ CD4/CD8) до активации. В общей сложности либо 300х106 клеток, либо 100х106 клеток из входных композиций были активированы, трансдуцированы и размножены для получения выходных композиций клеток, по существу, как описано в примере 1.
Не наблюдалось, что общее количество клеток на стадии активации оказывает влияние на отношение CAR+ CD4/CD8. Выходные композиции клеток, полученные из исходных композиций, содержащих CD27+ CCR7+ CD4/CD8 клетки, смешанные в соотношении приблизительно 1,69:1, в том числе из образца от пациента, продемонстрировали отношения CAR+ CD4/CD8, которые были близки к желательному целевому отношению 1:1 (например, приблизительно от 1,86:1 до 1:1,86). Выходные композиции клеток, полученные из исходных композиций, содержащих жизнеспособные CD4/CD8 клетки, смешанные в соотношении 1:1, продемонстрировали более значительное колебание отношений CAR+ CD4/CAR+ CD8 по сравнению с композициями, полученными из входных композиций, содержащих CD4+ и CD8+ клетки в составляющем 1,69:1 соотношении CD27+ CCR7+ CD4+ клеток и CD27+ CCR7+ CD8+ клеток. В этом эксперименте выходные композиции, полученные с использованием материала от пациента в приводимом в качестве примера процессе, продемонстрировали отношения CAR+ CD4/CAR+ CD8, составляющие приблизительно 7,6 и 8,6 в случае активации 100х106 клеток или 300х106 клеток, соответственно. При смешивании на основе фенотипа в аналогичном процессе, например, в составляющем 1,627:1 соотношении CD27+ CCR7+ CD4+ Т-клеток и CD27+ CCR7+ CD8+ T-клеток, конечное отношение CAR+ CD4/CAR+ CD8 составляло 1,6 и 1,3 в случае активации 100х106 клеток или 300х106 клеток, соответственно. Эти результаты согласуются с обнаружением, что определенные фенотипы, например CD27+/CCR7+ клетки, могут коррелировать с результирующими отношениями CAR+ CD4/CAR+ CD8 в выходных композициях, полученных как из образцов здоровых доноров, так и от пациента.
Пример 4: Оценка образцов от больных субъектов с корреляцией между фенотипом исходной композиции и отношением CD4+ к CD8+ CAR-экспрессирующим клеткам в композиции CAR+ T-клеток
Композиции CAR+ T-клеток, содержащие аутологичные T-клетки, экспрессирующие химерный рецептор антигена (CAR), были получены в результате афереза материала, собранного от 7 отдельных доноров с множественной миеломой.
CD4+ и CD8+ Т-клетки отбирали из образцов для афереза иммуноаффинным методом селекции. CD4+ T-клетки и CD8+ T-клетки объединяли в соотношении 1:1 жизнеспособных CD4+ к CD8+ клеткам. Образец объединенных клеток оценивали на экспрессию на поверхности маркеров, которые включали CD4, CD8, CD27, CD45RA, CCR7 и CD62L. В смеси отобранных CD4 и CD8 клеток определяли отношение следующих клеточных фенотипов: (1) CD27+ CCR7+ CD4+ клеток к CD27+ CCR7+ CD8+ клеткам (отношение CD27+ CCR7+ CD4/CD8), (2) CD45RA+ CCR7+ CD4+ клеток к CD45RA+ CCR7+ CD8+ клеткам (отношение CD45RA+ CCR7+ CD4/CD8) и (3) CD62L- CCR7+ CD4+ клеток к CD62L- CCR7+ CD8+ клеткам (отношение CD62L- CCR7+ CD4/CD8).
Композиция CAR+ T-клеток, экспрессирующих специфический для BCMA CAR, была получена с использованием процесса, по существу, как описано в примере 1, включая активацию, трансдукцию, размножение и криоконсервацию сконструированных клеток. Клетки в замороженной композиции оттаивали и оценивали с помощью проточной цитометрии на жизнеспособность, экспрессию CD4 и CD8 на поверхности и экспрессию CAR с использованием реагента BCMA-Fc. Определяли отношение жизнеспособных CAR+ клеток, которые были CD4+, к жизнеспособным CAR+ клеткам, которые были CD8+ (отношение CAR+ CD4/CD8).
Отношение CD27+ CCR7+ CD4/CD8, отношение CD45RA+ CCR7+ CD4/CD8 или отношение CD62L- CCR7+ CD4/CD8 в смеси отобранных CD4 и CD8 клеток сравнивали, задним числом, с отношением CAR+ CD4/CD8 в композиции сконструированных CAR+ T-клеток. Степень корреляции средних значений отношений для каждого субъекта оценивали с помощью двумерного анализа, и двумерный нормальный эллипс распределения, представляющий область вероятности=0,990, для представленных данных продемонстрирован на фиг. 3A-3C. Как продемонстрировано, корреляция между отношением CD27+ CCR7+ CD4/CD8, отношением CD45RA+ CCR7+ CD4/CD8 или отношением CD62L-CCR7+ CD4/CD8 в исходном образце и отношением CAR+ CD4/CD8 в композиции Т-клеток была значимой, основываясь на корреляционном анализе Пирсона. Таблицы 3A-3C отображают результаты корреляционного анализа, проведенного по отношению к данным, представленным на фиг. 3A-3C. Значимость <0,05 отмечена *.
отношение (%) CD45RA+ CCR7+ CD4/CD8
Настоящее изобретение не предназначено для ограничения объема конкретными раскрытыми вариантами осуществления, которые предоставлены, например, для иллюстрации различных аспектов настоящего изобретения. Различные модификации описанных композиций и способов станут очевидными из описания и представленных здесь идей. Такие вариации могут быть осуществлены без отклонения от истинного объема и сущности настоящего изобретения и, как предполагается, попадают в объем настоящего изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> JUNO THERAPEUTICS, INC.
MUJACIC, Mirna
RAHARDJO, Ayu
<120> СПОСОБЫ ПОЛУЧЕНИЯ КОМПОЗИЦИЙ ГЕННО-ИНЖЕНЕРНЫХ КЛЕТОК И РОДСТВЕННЫХ
КОМПОЗИЦИЙ
<130> 735042013140
<140> Пока не переуступлено
<141> Одновременно с этим
<150> US 62/543,363
<151> 2017-08-09
<150> US 62/596,770
<151> 2017-12-08
<160> 57
<170> FastSEQ для версии Windows 4.0
<210> 1
<211> 12
<212> Белок
<213> Homo sapiens
<220>
<223> спейсер (шарнирная область IgG4)
<400> 1
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 2
<211> 36
<212> ДНК
<213> Homo sapiens
<220>
<223> спейсер (шарнирная область IgG4)
<400> 2
gaatctaagt acggaccgcc ctgcccccct tgccct 36
<210> 3
<211> 119
<212> Белок
<213> Homo sapiens
<220>
<223> Спейсер шарнирная область-CH3
<400> 3
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Gly Gln Pro Arg
1 5 10 15
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
20 25 30
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
35 40 45
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
50 55 60
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
65 70 75 80
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
85 90 95
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
100 105 110
Leu Ser Leu Ser Leu Gly Lys
115
<210> 4
<211> 229
<212> Белок
<213> Homo sapiens
<220>
<223> Спейсер шарнирная область-CH2-CH3
<400> 4
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 5
<211> 282
<212> Белок
<213> Homo sapiens
<220>
<223> Fc-шарнирная область IgD
<400> 5
Arg Trp Pro Glu Ser Pro Lys Ala Gln Ala Ser Ser Val Pro Thr Ala
1 5 10 15
Gln Pro Gln Ala Glu Gly Ser Leu Ala Lys Ala Thr Thr Ala Pro Ala
20 25 30
Thr Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys
35 40 45
Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro
50 55 60
Ser His Thr Gln Pro Leu Gly Val Tyr Leu Leu Thr Pro Ala Val Gln
65 70 75 80
Asp Leu Trp Leu Arg Asp Lys Ala Thr Phe Thr Cys Phe Val Val Gly
85 90 95
Ser Asp Leu Lys Asp Ala His Leu Thr Trp Glu Val Ala Gly Lys Val
100 105 110
Pro Thr Gly Gly Val Glu Glu Gly Leu Leu Glu Arg His Ser Asn Gly
115 120 125
Ser Gln Ser Gln His Ser Arg Leu Thr Leu Pro Arg Ser Leu Trp Asn
130 135 140
Ala Gly Thr Ser Val Thr Cys Thr Leu Asn His Pro Ser Leu Pro Pro
145 150 155 160
Gln Arg Leu Met Ala Leu Arg Glu Pro Ala Ala Gln Ala Pro Val Lys
165 170 175
Leu Ser Leu Asn Leu Leu Ala Ser Ser Asp Pro Pro Glu Ala Ala Ser
180 185 190
Trp Leu Leu Cys Glu Val Ser Gly Phe Ser Pro Pro Asn Ile Leu Leu
195 200 205
Met Trp Leu Glu Asp Gln Arg Glu Val Asn Thr Ser Gly Phe Ala Pro
210 215 220
Ala Arg Pro Pro Pro Gln Pro Gly Ser Thr Thr Phe Trp Ala Trp Ser
225 230 235 240
Val Leu Arg Val Pro Ala Pro Pro Ser Pro Gln Pro Ala Thr Tyr Thr
245 250 255
Cys Val Val Ser His Glu Asp Ser Arg Thr Leu Leu Asn Ala Ser Arg
260 265 270
Ser Leu Glu Val Ser Tyr Val Thr Asp His
275 280
<210> 6
<211> 24
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> T2A
<400> 6
Leu Glu Gly Gly Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp
1 5 10 15
Val Glu Glu Asn Pro Gly Pro Arg
20
<210> 7
<211> 357
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> tEGFR
<400> 7
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu
195 200 205
Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys
210 215 220
Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu
225 230 235 240
Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met
245 250 255
Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala
260 265 270
His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val
275 280 285
Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His
290 295 300
Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro
305 310 315 320
Gly Leu Glu Gly Cys Pro Thr Asn Gly Pro Lys Ile Pro Ser Ile Ala
325 330 335
Thr Gly Met Val Gly Ala Leu Leu Leu Leu Leu Val Val Ala Leu Gly
340 345 350
Ile Gly Leu Phe Met
355
<210> 8
<211> 27
<212> Белок
<213> Homo sapiens
<220>
<223> CD28 (аминокислоты 153-179 № доступа P10747)
<300>
<308> UniProt P10747
<309> 1989-07-01
<400> 8
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val
20 25
<210> 9
<211> 66
<212> Белок
<213> Homo sapiens
<220>
<223> CD28 (аминокислоты 114-179 № доступа P10747)
<300>
<308> UniProt P10747
<309> 1989-07-01
<400> 9
Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser Asn
1 5 10 15
Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro Leu
20 25 30
Phe Pro Gly Pro Ser Lys Pro Phe Trp Val Leu Val Val Val Gly Gly
35 40 45
Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe
50 55 60
Trp Val
65
<210> 10
<211> 41
<212> Белок
<213> Homo sapiens
<220>
<223> CD28 (аминокислоты 180-220 P10747)
<300>
<308> UniProt P10747
<309> 1989-07-01
<400> 10
Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 11
<211> 41
<212> Белок
<213> Homo sapiens
<220>
<223> CD28 (с заменой LL на GG)
<400> 11
Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 12
<211> 42
<212> Белок
<213> Homo sapiens
<220>
<223> 4-1BB (аминокислоты 214-255 Q07011.1)
<300>
<308> UniProt Q07011.1
<309> 1995-02-01
<400> 12
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 13
<211> 112
<212> Белок
<213> Homo sapiens
<220>
<223> CD3 дзета
<400> 13
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 14
<211> 112
<212> Белок
<213> Homo sapiens
<220>
<223> CD3 дзета
<400> 14
Arg Val Lys Phe Ser Arg Ser Ala Glu Pro Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 15
<211> 112
<212> Белок
<213> Homo sapiens
<220>
<223> CD3 дзета
<400> 15
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 16
<211> 335
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> tEGFR
<400> 16
Arg Lys Val Cys Asn Gly Ile Gly Ile Gly Glu Phe Lys Asp Ser Leu
1 5 10 15
Ser Ile Asn Ala Thr Asn Ile Lys His Phe Lys Asn Cys Thr Ser Ile
20 25 30
Ser Gly Asp Leu His Ile Leu Pro Val Ala Phe Arg Gly Asp Ser Phe
35 40 45
Thr His Thr Pro Pro Leu Asp Pro Gln Glu Leu Asp Ile Leu Lys Thr
50 55 60
Val Lys Glu Ile Thr Gly Phe Leu Leu Ile Gln Ala Trp Pro Glu Asn
65 70 75 80
Arg Thr Asp Leu His Ala Phe Glu Asn Leu Glu Ile Ile Arg Gly Arg
85 90 95
Thr Lys Gln His Gly Gln Phe Ser Leu Ala Val Val Ser Leu Asn Ile
100 105 110
Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu Ile Ser Asp Gly Asp Val
115 120 125
Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr Ala Asn Thr Ile Asn Trp
130 135 140
Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys Thr Lys Ile Ile Ser Asn
145 150 155 160
Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly Gln Val Cys His Ala Leu
165 170 175
Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu Pro Arg Asp Cys Val Ser
180 185 190
Cys Arg Asn Val Ser Arg Gly Arg Glu Cys Val Asp Lys Cys Asn Leu
195 200 205
Leu Glu Gly Glu Pro Arg Glu Phe Val Glu Asn Ser Glu Cys Ile Gln
210 215 220
Cys His Pro Glu Cys Leu Pro Gln Ala Met Asn Ile Thr Cys Thr Gly
225 230 235 240
Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala His Tyr Ile Asp Gly Pro
245 250 255
His Cys Val Lys Thr Cys Pro Ala Gly Val Met Gly Glu Asn Asn Thr
260 265 270
Leu Val Trp Lys Tyr Ala Asp Ala Gly His Val Cys His Leu Cys His
275 280 285
Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro Gly Leu Glu Gly Cys Pro
290 295 300
Thr Asn Gly Pro Lys Ile Pro Ser Ile Ala Thr Gly Met Val Gly Ala
305 310 315 320
Leu Leu Leu Leu Leu Val Val Ala Leu Gly Ile Gly Leu Phe Met
325 330 335
<210> 17
<211> 18
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> T2A
<400> 17
Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu Glu Asn Pro
1 5 10 15
Gly Pro
<210> 18
<211> 6
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> Расщепляемый линкер MMP
<400> 18
Pro Leu Gly Leu Trp Ala
1 5
<210> 19
<211> 22
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> P2A
<400> 19
Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val
1 5 10 15
Glu Glu Asn Pro Gly Pro
20
<210> 20
<211> 19
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> P2A
<400> 20
Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val Glu Glu Asn
1 5 10 15
Pro Gly Pro
<210> 21
<211> 20
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> E2A
<400> 21
Gln Cys Thr Asn Tyr Ala Leu Leu Lys Leu Ala Gly Asp Val Glu Ser
1 5 10 15
Asn Pro Gly Pro
20
<210> 22
<211> 22
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> F2A
<400> 22
Val Lys Gln Thr Leu Asn Phe Asp Leu Leu Lys Leu Ala Gly Asp Val
1 5 10 15
Glu Ser Asn Pro Gly Pro
20
<210> 23
<211> 5
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> Шарнирная область
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa= Gly,Cys или Arg
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa=Cys или Thr
<400> 23
Xaa Pro Pro Xaa Pro
1 5
<210> 24
<211> 15
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> Шарнирная область
<400> 24
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
<210> 25
<211> 12
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> Шарнирная область
<400> 25
Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro
1 5 10
<210> 26
<211> 61
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> Шарнирная область
<400> 26
Glu Leu Lys Thr Pro Leu Gly Asp Thr His Thr Cys Pro Arg Cys Pro
1 5 10 15
Glu Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys Pro Glu
20 25 30
Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys Pro Glu Pro
35 40 45
Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys Pro
50 55 60
<210> 27
<211> 12
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> Шарнирная область
<400> 27
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro
1 5 10
<210> 28
<211> 12
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> Шарнирная область
<400> 28
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 29
<211> 9
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> Шарнирная область
<400> 29
Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5
<210> 30
<211> 10
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> Шарнирная область
<400> 30
Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 31
<211> 14
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> Шарнирная область
<400> 31
Glu Val Val Val Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 32
<211> 10
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> Приводимая в качестве примера последовательность линкера
<220>
<221> ПОВТОР
<222> (5)...(9)
<223> SGGGG повторена 5 раз
<400> 32
Pro Gly Gly Gly Ser Gly Gly Gly Gly Pro
1 5 10
<210> 33
<211> 17
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> Приводимая в качестве примера последовательность линкера
<400> 33
Gly Ser Ala Asp Asp Ala Lys Lys Asp Ala Ala Lys Lys Asp Gly Lys
1 5 10 15
Ser
<210> 34
<211> 9
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> CDR3 легкой цепи FMC63
<400> 34
Gln Gln Gly Asn Thr Leu Pro Tyr Thr
1 5
<210> 35
<211> 11
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> CDR L1 FMC63
<400> 35
Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn
1 5 10
<210> 36
<211> 7
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> CDR L2 FMC63
<400> 36
Ser Arg Leu His Ser Gly Val
1 5
<210> 37
<211> 9
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> CDR L3 FMC63
<400> 37
Gly Asn Thr Leu Pro Tyr Thr Phe Gly
1 5
<210> 38
<211> 5
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> CDR H1 FMC63
<400> 38
Asp Tyr Gly Val Ser
1 5
<210> 39
<211> 16
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> CDR H2 FMC63
<400> 39
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser
1 5 10 15
<210> 40
<211> 7
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> CDR H3 FMC63
<400> 40
Tyr Ala Met Asp Tyr Trp Gly
1 5
<210> 41
<211> 120
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> VH FMC63
<400> 41
Glu Val Lys Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Val Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Leu Thr Ile Ile Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 42
<211> 107
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> VL FMC63
<400> 42
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr
100 105
<210> 43
<211> 245
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> scFv FMC63
<400> 43
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr Gly Ser Thr Ser Gly
100 105 110
Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val Lys
115 120 125
Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser Leu Ser
130 135 140
Val Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser
145 150 155 160
Trp Ile Arg Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly Val Ile
165 170 175
Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser Arg Leu
180 185 190
Thr Ile Ile Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys Met Asn
195 200 205
Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys His Tyr
210 215 220
Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
225 230 235 240
Val Thr Val Ser Ser
245
<210> 44
<211> 11
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> CDR L1 SJ25C1
<400> 44
Lys Ala Ser Gln Asn Val Gly Thr Asn Val Ala
1 5 10
<210> 45
<211> 7
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> CDR L2 SJ25C1
<400> 45
Ser Ala Thr Tyr Arg Asn Ser
1 5
<210> 46
<211> 9
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> CDR L3 SJ25C1
<400> 46
Gln Gln Tyr Asn Arg Tyr Pro Tyr Thr
1 5
<210> 47
<211> 5
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> CDR H1 SJ25C1
<400> 47
Ser Tyr Trp Met Asn
1 5
<210> 48
<211> 17
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> CDR H2 SJ25C1
<400> 48
Gln Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe Lys
1 5 10 15
Gly
<210> 49
<211> 13
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> CDR H3 SJ25C1
<400> 49
Lys Thr Ile Ser Ser Val Val Asp Phe Tyr Phe Asp Tyr
1 5 10
<210> 50
<211> 122
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> VH SJ25C1
<400> 50
Glu Val Lys Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gln Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Gln Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Gly Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Lys Thr Ile Ser Ser Val Val Asp Phe Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 51
<211> 108
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> VL SJ25C1
<400> 51
Asp Ile Glu Leu Thr Gln Ser Pro Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Pro Leu Ile
35 40 45
Tyr Ser Ala Thr Tyr Arg Asn Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr Asn Val Gln Ser
65 70 75 80
Lys Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn Arg Tyr Pro Tyr
85 90 95
Thr Ser Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 52
<211> 15
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> Линкер
<400> 52
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 53
<211> 245
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> scFv SJ25C1
<400> 53
Glu Val Lys Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gln Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Gln Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Gly Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Lys Thr Ile Ser Ser Val Val Asp Phe Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Glu Leu Thr Gln Ser
130 135 140
Pro Lys Phe Met Ser Thr Ser Val Gly Asp Arg Val Ser Val Thr Cys
145 150 155 160
Lys Ala Ser Gln Asn Val Gly Thr Asn Val Ala Trp Tyr Gln Gln Lys
165 170 175
Pro Gly Gln Ser Pro Lys Pro Leu Ile Tyr Ser Ala Thr Tyr Arg Asn
180 185 190
Ser Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe
195 200 205
Thr Leu Thr Ile Thr Asn Val Gln Ser Lys Asp Leu Ala Asp Tyr Phe
210 215 220
Cys Gln Gln Tyr Asn Arg Tyr Pro Tyr Thr Ser Gly Gly Gly Thr Lys
225 230 235 240
Leu Glu Ile Lys Arg
245
<210> 54
<211> 12
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> CDR3 тяжелой цепи FMC63
<400> 54
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr
1 5 10
<210> 55
<211> 7
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> CDR2 легкой цепи FMC63
<400> 55
His Thr Ser Arg Leu His Ser
1 5
<210> 56
<211> 18
<212> Белок
<213> Искуссвенная последовательность
<220>
<223> Линкер
<400> 56
Gly Ser Thr Ser Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr
1 5 10 15
Lys Gly
<210> 57
<211> 735
<212> ДНК
<213> Искуссвенная последовательность
<220>
<223> Последовательность, кодирующая scFv.
<400> 57
gacatccaga tgacccagac cacctccagc ctgagcgcca gcctgggcga ccgggtgacc 60
atcagctgcc gggccagcca ggacatcagc aagtacctga actggtatca gcagaagccc 120
gacggcaccg tcaagctgct gatctaccac accagccggc tgcacagcgg cgtgcccagc 180
cggtttagcg gcagcggctc cggcaccgac tacagcctga ccatctccaa cctggaacag 240
gaagatatcg ccacctactt ttgccagcag ggcaacacac tgccctacac ctttggcggc 300
ggaacaaagc tggaaatcac cggcagcacc tccggcagcg gcaagcctgg cagcggcgag 360
ggcagcacca agggcgaggt gaagctgcag gaaagcggcc ctggcctggt ggcccccagc 420
cagagcctga gcgtgacctg caccgtgagc ggcgtgagcc tgcccgacta cggcgtgagc 480
tggatccggc agccccccag gaagggcctg gaatggctgg gcgtgatctg gggcagcgag 540
accacctact acaacagcgc cctgaagagc cggctgacca tcatcaagga caacagcaag 600
agccaggtgt tcctgaagat gaacagcctg cagaccgacg acaccgccat ctactactgc 660
gccaagcact actactacgg cggcagctac gccatggact actggggcca gggcaccagc 720
gtgaccgtga gcagc 735
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ПОЛУЧЕНИЯ ГЕННО-ИНЖЕНЕРНЫХ КЛЕТОК | 2018 |
|
RU2795454C2 |
| КОМПОЗИЦИИ, ИЗДЕЛИЯ И СПОСОБЫ, СВЯЗАННЫЕ С ДОЗИРОВАНИЕМ В КЛЕТОЧНОЙ ТЕРАПИИ | 2018 |
|
RU2776823C2 |
| СПОСОБ И КОМПОЗИЦИИ ДЛЯ КЛЕТОЧНОЙ ИММУНОТЕРАПИИ | 2015 |
|
RU2752275C2 |
| ХИМЕРНЫЕ РЕЦЕПТОРЫ, СОДЕРЖАЩИЕ TRAF-6-ИНДУЦИРУЮЩИЕ ДОМЕНЫ, И СВЯЗАННЫЕ С НИМИ КОМПОЗИЦИИ И СПОСОБЫ | 2016 |
|
RU2773159C2 |
| СПОСОБЫ ВЫДЕЛЕНИЯ, КУЛЬТИВИРОВАНИЯ И ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ ПОПУЛЯЦИЙ КЛЕТОК ИММУННОЙ СИСТЕМЫ ДЛЯ АДОПТИВНОЙ ТЕРАПИИ | 2015 |
|
RU2763795C2 |
| СПОСОБЫ КУЛЬТИВИРОВАНИЯ КЛЕТОК И НАБОРЫ И УСТРОЙСТВО ДЛЯ НИХ | 2016 |
|
RU2761557C2 |
| СПОСОБЫ КУЛЬТИВИРОВАНИЯ КЛЕТОК И НАБОРЫ И УСТРОЙСТВО ДЛЯ НИХ | 2016 |
|
RU2778411C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР | 2019 |
|
RU2822196C2 |
| СПОСОБЫ ПРОВЕДЕНИЯ ИММУНОТЕРАПИИ ХИМЕРНЫМ РЕЦЕПТОРОМ АНТИГЕНА В КОМБИНАЦИИ С АГОНИСТОМ 4-1BB | 2019 |
|
RU2788524C2 |
| ОЛИГОМЕРНЫЕ РЕАГЕНТЫ В ВИДЕ ЧАСТИЦ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2777989C2 |
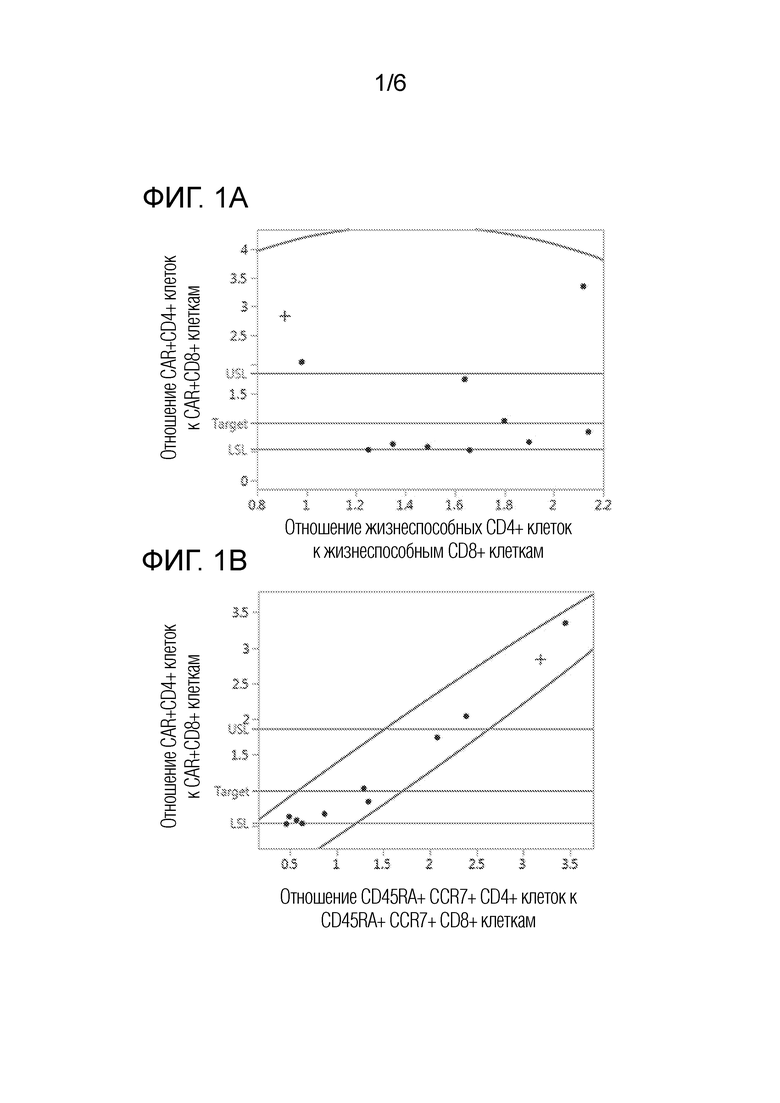
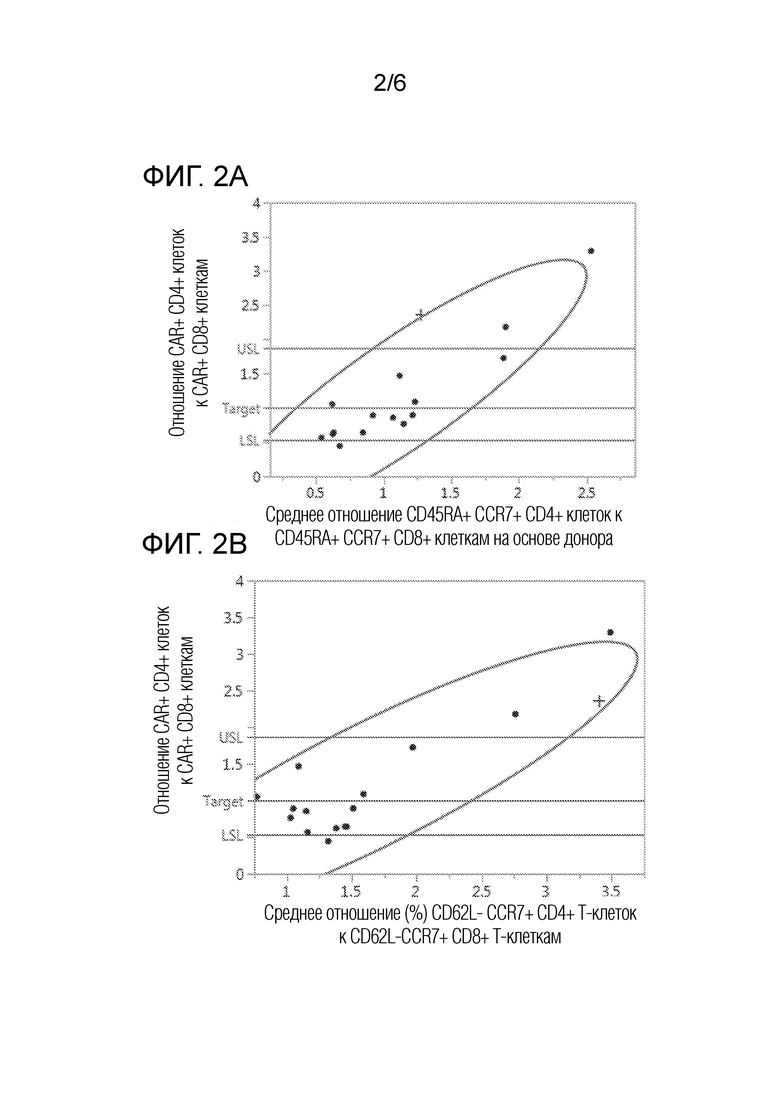
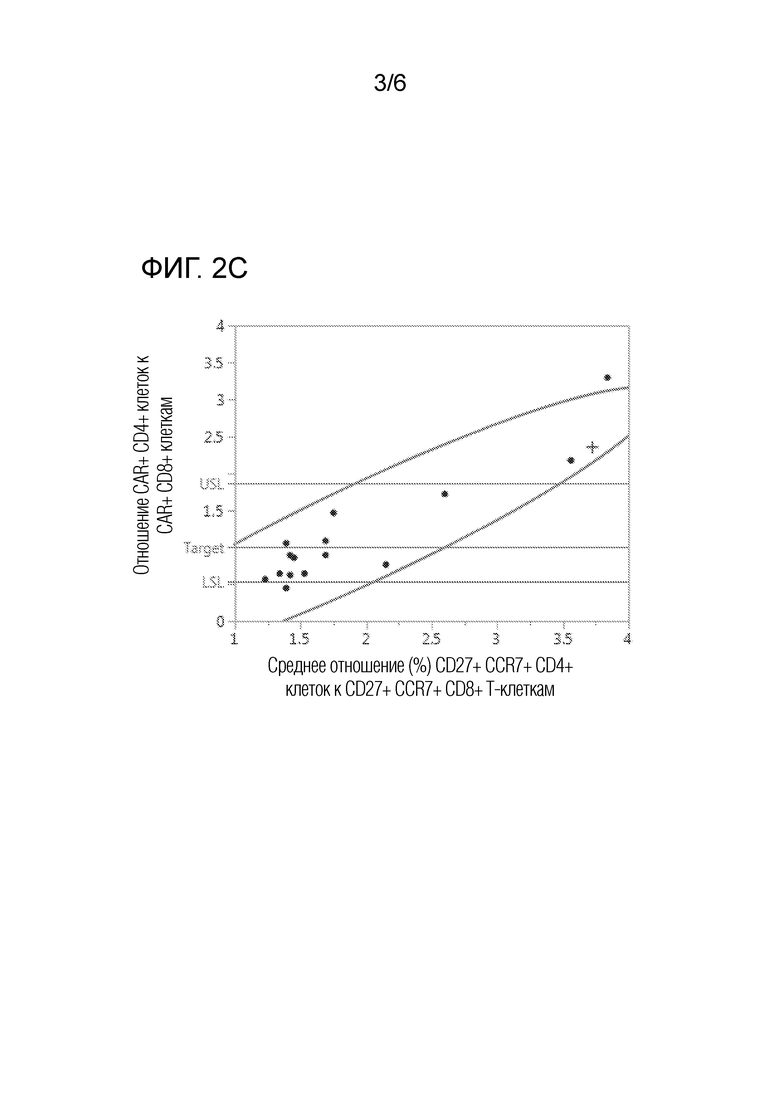
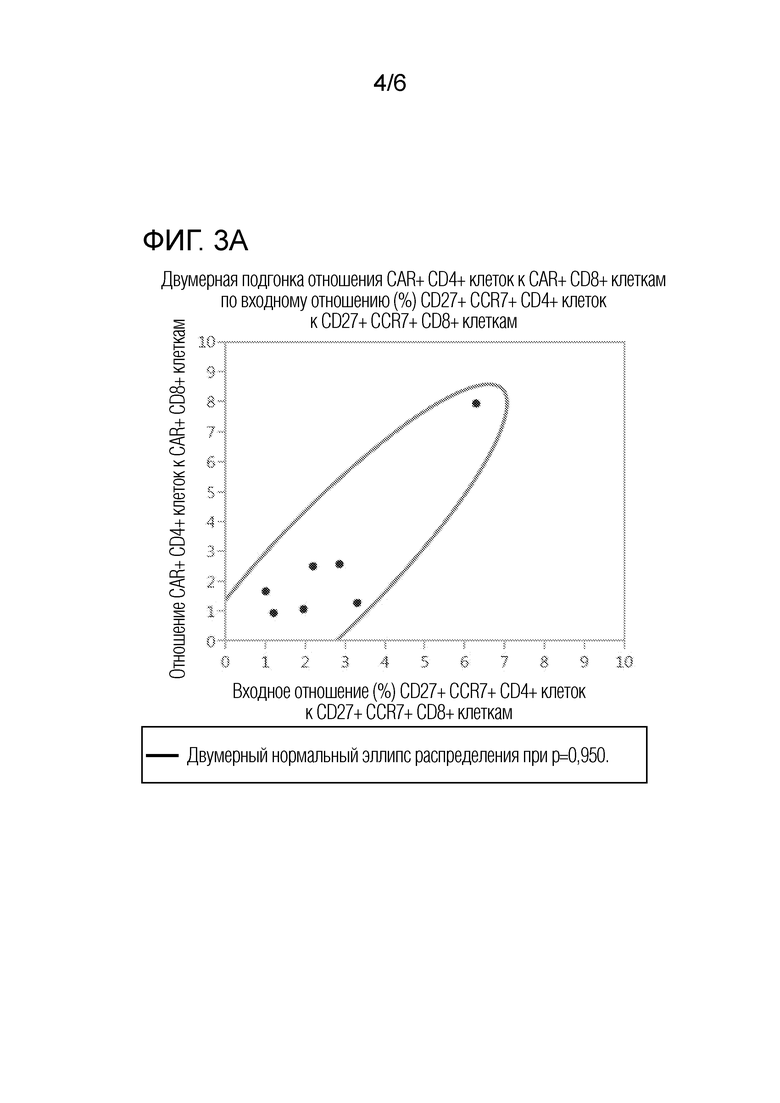
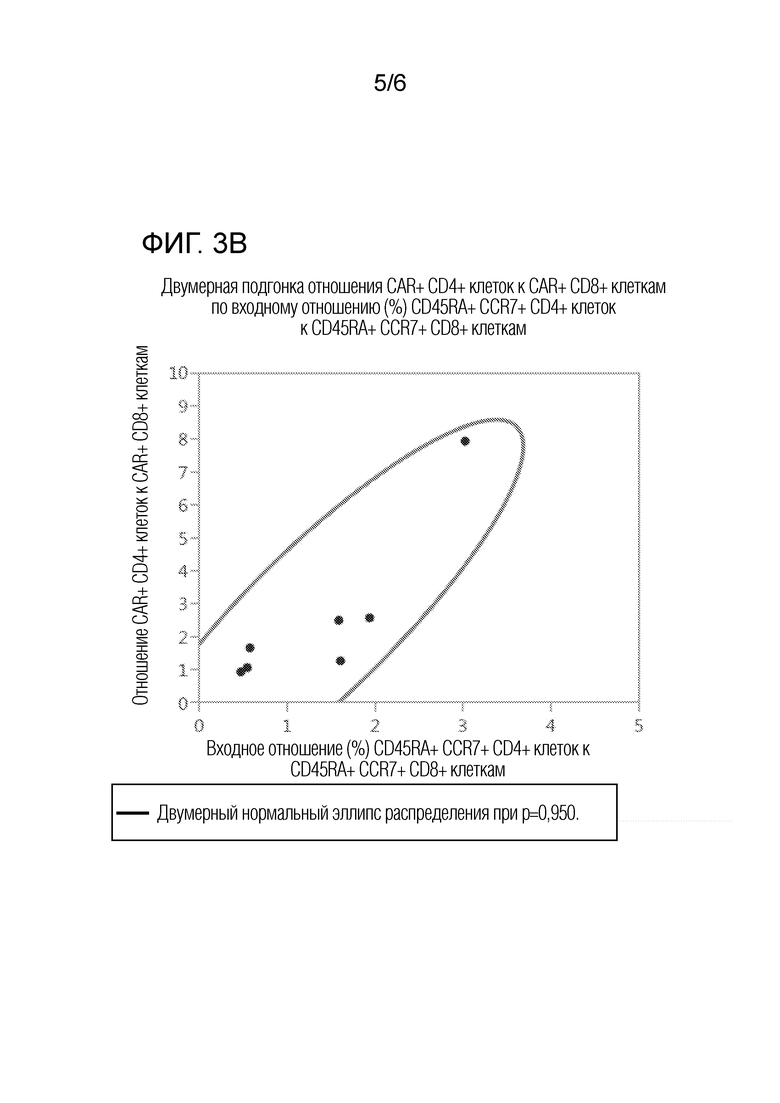
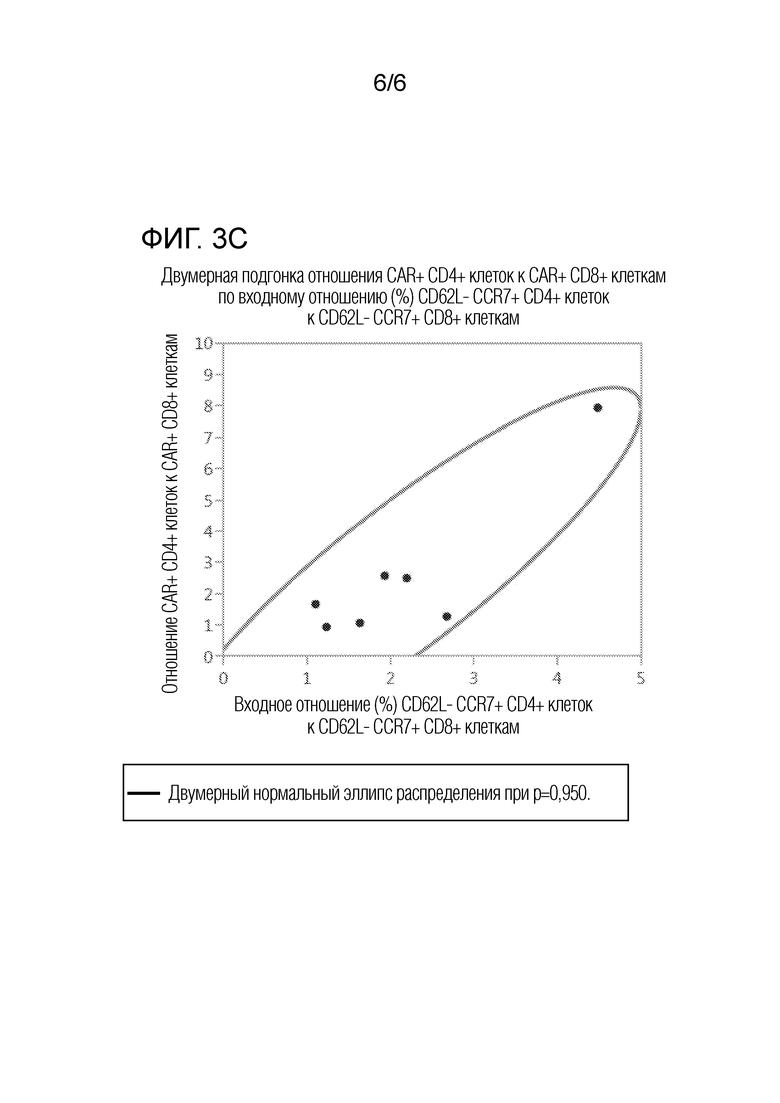
Изобретение относится к области биотехнологии, в частности к способам получения композиции клеток. Способы включают получение входной композиции клеток, приведение входной композиции клеток в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, а также стимуляцию входной композиции клеток до, во время или после указанного контакта. Изобретение эффективно для получения единообразного и/или предсказуемого Т-клеточного продукта и/или продукта с более низкой токсичностью по сравнению с другими способами. 15 н. и 74 з.п. ф-лы, 3 ил., 3 табл., 4 пр.
1. Способ получения композиции клеток, включающий:
(а) объединение первой композиции клеток, содержащей подобные наивным CD4+ Т-клетки, со второй композицией клеток, содержащей подобные наивным CD8+ T-клетки, для получения входной композиции клеток, в которой отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам находится приблизительно между 0,8:1 и 2,2:1, включительно,
при этом подобные наивным CD4+ T-клетки:
(i) являются поверхностно-позитивными по CD45RA и CCR7;
(ii) являются поверхностно-позитивными по CD27 и CCR7; или
(iii) являются поверхностно-позитивными по CCR7 и поверхностно-негативными по CD62L; и
при этом подобные наивным CD8+ T-клетки:
(i) являются поверхностно-позитивными по CD45RA и CCR7;
(ii) являются поверхностно-позитивными по CD27 и CCR7; или
(iii) являются поверхностно-позитивными по CCR7 и поверхностно-негативными по CD62L;
(b) приведение входной композиции клеток в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки во входной композиции; и
(c) стимуляцию входной композиции клеток до, во время или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации или пролиферации клеток.
2. Способ по п. 1, в котором первую композицию клеток получают путем выделения CD4+ T-клеток из биологического образца, полученного от субъекта, или вторую композицию клеток получают путем выделения CD8+ T-клеток из биологического образца, полученного от субъекта.
3. Способ по п. 1 или 2, в котором до объединения способ включает определение количества, количества на объем, количества на вес и/или процентного содержания подобных наивным CD4+ Т-клеток в первой композиции или количества, количества на объем, количества на вес или процентного содержания подобных наивным CD8+ Т-клеток во второй композиции.
4. Способ по п. 2, в котором до объединения способ включает определение количества, количества на объем, количества на вес или процентного содержания подобных наивным CD4+ Т-клеток или количества, количества на объем, количество на вес и/или процентного содержания подобных наивным CD8+ Т-клеток в биологическом образце от субъекта.
5. Способ по любому из пп. 1-4, в котором отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам во входной композиции клеток регулируется или изменяется по сравнению с отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ Т-клеткам в биологическом образце от субъекта.
6. Способ получения композиции клеток, включающий:
(a)определение количества, количества на объем, количества на вес или процентного содержания подобных наивным CD4+ Т-клеток и подобных наивным CD8+ Т-клеток в биологическом образце, полученном от субъекта, или в одном или более полученных от него образцов; и
при этом подобные наивным CD4+ T-клетки:
(i) являются поверхностно-позитивными по CD45RA и CCR7;
(ii) являются поверхностно-позитивными по CD27 и CCR7; или
(iii) являются поверхностно-позитивными по CCR7 и поверхностно-негативными по CD62L; и
при этом подобные наивным CD8+ T-клетки:
(i) являются поверхностно-позитивными по CD45RA и CCR7;
(ii) являются поверхностно-позитивными по CD27 и CCR7; или
(iii) являются поверхностно-позитивными по CCR7 и поверхностно-негативными по CD62L;
(b) получение входной композиции клеток, содержащей CD4+ T-клетки и CD8+ T-клетки, в которой отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам находится между или приблизительно между 0,8:1 и 2,2:1, включительно, причем указанное отношение во входной композиции клеток регулируется или изменяется по сравнению с отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам в биологическом образце от субъекта, и
(c) приведение входной композиции клеток в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки во входной композиции; и
(d) стимуляцию входной композиции клеток до, во время или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации или пролиферации клеток.
7. Способ получения композиции клеток, включающий:
(а) приведение входной композиции клеток, содержащей подобные наивным CD4+ T-клетки и подобные наивным CD8+ T-клетки из биологического образца от субъекта, в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции,
причем отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам, присутствующее во входной композиции клеток, находится приблизительно между 0,8:1 и 2,2:1, включительно,
при этом подобные наивным CD4+ T-клетки:
(i) являются поверхностно-позитивными по CD45RA и CCR7;
(ii) являются поверхностно-позитивными по CD27 и CCR7; или
(iii) являются поверхностно-позитивными по CCR7 и поверхностно-негативными по CD62L; и
при этом подобные наивным CD8+ T-клетки:
(i) являются поверхностно-позитивными по CD45RA и CCR7;
(ii) являются поверхностно-позитивными по CD27 и CCR7; или
(iii) являются поверхностно-позитивными по CCR7 и поверхностно-негативными по CD62L; и
(b) стимуляцию входной композиции клеток до, во время или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации или пролиферации клеток.
8. Способ получения композиции клеток, включающий:
(a) объединение первой композиции клеток, содержащей подобные наивным CD4+ T-клетки, со второй композицией клеток, содержащей подобные наивным CD8+ T-клетки, для получения входной композиции клеток, в которой отношение подобных наивным CD4+ Т-клеток к подобным наивным CD8+ Т-клеткам находится приблизительно между 0,8:1 и 2,2:1, включительно,
при этом подобные наивным CD4+ T-клетки:
(i) являются поверхностно-позитивными по CD45RA и CCR7;
(ii) являются поверхностно-позитивными по CD27 и CCR7; или
(iii) являются поверхностно-позитивными по CCR7 и поверхностно-негативными по CD62L; и
при этом подобные наивным CD8+ T-клетки:
(i) являются поверхностно-позитивными по CD45RA и CCR7;
(ii) являются поверхностно-позитивными по CD27 и CCR7; или
(iii) являются поверхностно-позитивными по CCR7 и поверхностно-негативными по CD62L; и
(b) приведение входной композиции клеток в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции; и
(c) стимуляцию входной композиции клеток до, во время или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации или пролиферации клеток.
9. Способ по любому из пп. 1-8, в котором подобные наивным CD4+ или подобные наивным CD8+ клетки:
характеризуются низкой экспрессией CD95; или
являются негативными по внутриклеточной экспрессии цитокина, выбранного из группы, состоящей из IL-2, IFN-γ, IL-4, IL-10.
10. Способ по любому из по пп. 1-9, в котором подобные наивным CD4+ или подобные наивным CD8+ клетки
характеризуются низкой экспрессией CD95.
11. Способ по любому из пп. 3-10, в котором количество, количество на объем, количество на вес или процентное содержание подобных наивным CD4+ Т-клеток или количество, количество на объем, количество на вес или процентное содержание подобных наивным CD8+ Т-клеток определяется с помощью проточной цитометрии.
12. Способ по любому из пп. 8-11, в котором отношение подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам было отрегулировано по сравнению с отношением подобных наивным CD4+ T-клеток к подобным наивным CD8+ T-клеткам в биологическом образце от субъекта.
13. Способ по любому из пп. 1-12, в котором входная композиция клеток характеризуется отношением подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам, находящимся приблизительно между 0,8:1 и 2,0:1, 0,8:1 и 1,6:1, 0,8:1 и 1,4:1, 0,8:1 и 1,2:1, 1,5:1 и 2:1, 1,6:1 и 1,8:1 или 1,0:1 и 1,2:1, включительно каждое отношение.
14. Способ по любому из пп. 1-13, в котором входная композиция клеток характеризуется отношением подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам, приблизительно составляющим 2:1, 1,9:1, 1,8:1, 1,7:1, 1,69:1, 1,6:1, 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1 или 1,0:1.
15. Способ по любому из пп. 1-14, в котором входная композиция клеток характеризуется отношением подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам, приблизительно составляющим 1,1:1.
16. Способ по любому из пп. 1-15, в котором входная композиция клеток характеризуется отношением подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам, которые являются поверхностно-позитивными по CD45RA и CCR7, приблизительно составляющим 1,1:1.
17. Способ по любому из пп. 1-16, в котором входная композиция клеток характеризуется отношением подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам, которые являются поверхностно-позитивными по CD45RA и CD27, приблизительно составляющим 1,69:1.
18. Способ по любому из пп. 1-17, в котором входная композиция клеток характеризуется отношением подобных наивным CD4+ клеток к подобным наивным CD8+ клеткам, которые являются поверхностно-позитивными по CD27 и CDR7, приблизительно составляющим 1,69:1.
19. Способ получения композиции клеток, включающий:
(a) объединение первой композиции клеток, содержащей CCR7+ CD45RA+ CD4+ T-клетки, со второй композицией клеток, содержащей CCR7+ CD45RA+ CD8+ T-клетки, для получения входной композиции клеток, в которой отношение CCR7+ CD45RA+ CD4+ T-клеток к CCR7+ CD45RA+ CD8+ Т-клеткам находится приблизительно между 0,8:1 и 2,2:1, включительно;
(b) приведение входной композиции клеток в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки во входной композиции; и
(c) стимуляцию входной композиции клеток до, во время или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации или пролиферации клеток.
20. Способ по п. 19, в котором первую композицию клеток получают путем выделения CD4+ T-клеток из биологического образца, полученного от субъекта, или вторую композицию клеток получают путем выделения CD8+ T-клеток из биологического образца, полученного от субъекта.
21. Способ по п. 19 или 20, в котором до объединения способ включает определение количества, количества на объем, количества на вес или процентного содержания CCR7+ CD45RA+ CD4+ T-клеток в первой композиции или количества, количества на объем, количества на вес или процентного содержания CCR7+ CD45RA+ CD8+ T-клеток во второй композиции клеток.
22. Способ по любому из пп. 19-21, в котором до объединения способ включает определение количества, количества на объем, количества на вес или процентного содержания CCR7+ CD45RA+ CD4+ T-клеток или количества, количества на объем, количества на вес или процентного содержания CCR7+ CD45RA+ CD8+ T-клеток в биологическом образце от субъекта.
23. Способ по любому из пп. 19-22, в котором отношение CCR7+ CD45RA+ CD4+ T-клеток к CCR7+ CD45RA+ CD8+ Т-клеткам во входной композиции клеток регулируется или изменяется по сравнению с отношением CCR7+ CD45RA+ CD4+ Т-клеток к CCR7+ CD45RA+ CD8+ Т-клеткам в биологическом образце от субъекта.
24. Способ получения композиции клеток, включающий:
(a) определение количества, количества на объем, количества на вес или процентного содержания CCR7+ CD45RA+ CD4+ Т-клеток и CCR7+ CD45RA+ CD8+ T-клеток в биологическом образце, полученном от субъекта, или в одном или более полученных от него образцов; и
(b) получение входной композиции клеток, содержащей CD4+ T-клетки и CD8+ T-клетки, в которой отношение CCR7+ CD45RA+ CD4+ T-клеток к наивным CCR7+CD45RA+CD8+ T-клеткам находится приблизительно между 0,8:1 и 2,2:1, включительно, причем указанное отношение во входной композиции клеток регулируется или изменяется по сравнению с отношением CCR7+ CD45RA+ CD4+ T-клеток к подобным наивным CD8+ T-клеткам в биологическом образце от субъекта, и
(c) приведение входной композиции клеток в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки во входной композиции.
25. Способ получения композиции клеток, включающий:
(a) приведение входной композиции клеток, содержащей CCR7+ CD45RA+ CD4+ T-клетки и CCR7+ CD45RA+ CD8+ T-клетки из биологического образца от субъекта, в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции,
причем отношение CCR7+ CD45RA+ CD4+ T-клеток к CCR7+ CD45RA+ CD8+ T-клеткам, присутствующее во входной композиции клеток, находится приблизительно между 0,8:1 и 2,2:1, включительно, и
(b) стимуляцию входной композиции клеток до, во время или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации или пролиферации клеток.
26. Способ получения композиции клеток, включающий:
(a) объединение первой композиции клеток, содержащей CCR7+ CD45RA+ CD4+ T-клетки, со второй композицией клеток, содержащей CCR7+ CD45RA+ CD8+ T-клетки, для получения входной композиции клеток, в которой отношение CCR7+ CD45RA+ CD4+ T-клеток к CCR7+ CD45RA+ CD8+ T-клеткам находится приблизительно между 0,8:1 и 2,2:1, включительно;
(b) приведение входной композиции клеток в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции; и
(c) стимуляцию входной композиции клеток до, во время или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации или пролиферации клеток.
27. Способ по любому из пп. 19-26, в котором количество, количество на объем, количество на вес или процентное содержание CCR7+ CD45RA+ CD4+ T-клеток или количество, количество на объем, количество на вес или процентное содержание CCR7+ CD45RA+ CD8+ T-клеток определяется с помощью проточной цитометрии.
28. Способ по любому из пп. 25-27, в котором отношение CCR7+ CD45RA+ CD4+ T-клеток к CCR7+ CD45RA+ CD8+ Т-клеткам было отрегулировано по сравнению с отношением CCR7+ CD45RA+ CD4+ T-клеток к CCR7+ CD45RA+ CD8+ T-клеткам в биологическом образце от субъекта.
29. Способ по любому из пп. 19-28, в котором входная композиция клеток характеризуется отношением CCR7+ CD45RA+ CD4+ клеток к CCR7+ CD45RA+ CD8+ клеткам, находящимся приблизительно между 0,8:1 и 2,0:1, 0,8:1 и 1,6:1, 0,8:1 и 1,4:1, 0,8:1 и 1,2:1 или 1,0:1 и 1,2:1, включительно каждое отношение.
30. Способ по любому из пп. 19-29, в котором входная композиция клеток характеризуется отношением CCR7+ CD45RA+ CD4+ клеток к CCR7+ CD45RA+ CD8+ клеткам, приблизительно составляющим 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1 или 1,0:1.
31. Способ по любому из пп. 19-30, в котором входная композиция клеток характеризуется отношением CCR7+ CD45RA+ CD4+ клеток к CCR7+ CD45RA+ CD8+ клеткам, приблизительно составляющим 1,1:1.
32. Способ получения композиции клеток, включающий:
(a) объединение первой композиции клеток, содержащей CD27+ CCR7+ CD4+ Т-клетки, со второй композицией клеток, содержащей CD27+ CCR7+ CD8+ Т-клетки, для получения входной композиции клеток, в которой отношение CD27+ CCR7+ CD4+ T-клеток к CD27+ CCR7+ CD8+ T-клеткам находится приблизительно между 1,2:1 и 2,4:1, включительно,
(b) приведение входной композиции клеток в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции; и
(c) стимуляцию входной композиции клеток до, во время или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации или пролиферации клеток.
33. Способ по п. 32, в котором первую композицию клеток получают путем выделения CD4+ T-клеток из биологического образца, полученного от субъекта, или вторую композицию клеток получают путем выделения CD8+ T-клеток из биологического образца, полученного от субъекта.
34. Способ по п. 32 или 33, в котором до объединения способ включает определение количества, количества на объем, количества на вес или процентного содержания CD27+ CCR7+ CD4+ T-клеток в первой композиции или количества, количества на объем, количества на вес или процентного содержания CD27+ CCR7+ CD8+ Т-клеток во второй композиции клеток.
35. Способ по любому из пп. 32-34, в котором до объединения способ включает определение количества, количества на объем, количества на вес или процентного содержания CD27+ CCR7+ CD4+ T-клеток или количества, количества на объем, количества на вес или процентного содержания CD27+ CCR7+ CD8+ T-клеток в биологическом образце от субъекта.
36. Способ по любому из пп. 32-35, в котором отношение CD27+ CCR7+ CD4+ T-клеток к CD27+ CCR7+ CD8+ T-клеткам во входной композиции клеток регулируется или изменяется по сравнению с отношением CD27+ CCR7+ CD4+ Т-клеток к CD27+ CCR7+ CD8+ Т-клеткам в биологическом образце от субъекта.
37. Способ получения композиции клеток, включающий:
(a) определение количества, количества на объем, количества на вес или процентного содержания CD27+ CCR7+ CD4+ T-клеток и CD27+ CCR7+ CD8+ T-клеток в биологическом образце, полученном от субъекта, или в одном или более полученных от него образцов;
(b) получение входной композиции клеток, содержащей CD4+ T-клетки и CD8+ T-клетки, в которой отношение CD27+ CCR7+ CD4+ T-клеток к CD27+CCR7+наивным CD8+ T-клеткам находится приблизительно между 0,8:1 и 2,2:1, включительно, причем указанное отношение во входной композиции клеток регулируется или изменяется по сравнению с отношением CD27+ CCR7+ CD4+ T-клеток к CD27+CCR7+наивным CD8+ T-клеткам в биологическом образце от субъекта,
(c) приведение входной композиции клеток в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции; и
(d) стимуляцию входной композиции клеток до, во время или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации или пролиферации клеток.
38. Способ получения композиции клеток, включающий:
(a) приведение входной композиции клеток, содержащей CD27+ CCR7+ CD4+ T-клетки и CD27+ CCR7+ CD8+ T-клетки из биологического образца от субъекта, в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции,
причем отношение CD27+ CCR7+ CD4+ T-клеток к CD27+ CCR7+ CD8+ T-клеткам, присутствующее во входной композиции клеток, находится приблизительно между 0,8:1 и 2,2:1, включительно, и
(b) стимуляцию входной композиции клеток до, во время или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации или пролиферации клеток.
39. Способ получения композиции клеток, включающий:
(a) объединение первой композиции клеток, содержащей CD27+ CCR7+ CD4+ T-клетки, со второй композицией клеток, содержащей CD27+ CCR7+ CD8+ T-клетки, для получения входной композиции клеток, в которой отношение CD27+ CCR7+ CD4+ T-клеток к CD27+ CCR7+ CD8+ T-клеткам находится приблизительно между 0,8:1 и 2,2:1, включительно;
(b) приведение входной композиции клеток в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции; и
(c) стимуляцию входной композиции клеток до, во время или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации или пролиферации клеток.
40. Способ по любому из пп. 32-39, в котором количество, количество на объем, количество на вес или процентное содержание CD27+ CCR7+ CD4+ T-клеток или количество, количество на объем, количество на вес или процентное содержание CD27+ CCR7+ CD8+ T-клеток определяется с помощью проточной цитометрии.
41. Способ по любому из пп. 32-40, в котором отношение CD27+ CCR7+ CD4+ T-клеток к CD27+ CCR7+ CD8+ T-клеткам было отрегулировано по сравнению с отношением CD27+ CCR7+ CD4+ T-клеток к CD27+ CCR7+ CD8+ T-клеткам в биологическом образце от субъекта.
42. Способ по любому из пп. 32-41, в котором входная композиция клеток характеризуется отношением CD27+ CCR7+ CD4+ клеток к CD27+ CCR7+ CD8+ клеткам, находящимся приблизительно между 0,8:1 и 2,0:1, 0,8:1 и 1,6:1, 0,8:1 и 1,4:1, 0,8:1 и 1,2:1 или 1,0:1 и 1,2:1, включительно каждое отношение.
43. Способ по любому из пп. 32-42, в котором входная композиция клеток характеризуется отношением CD27+ CCR7+ CD4+ клеток к CD27+ CCR7+ CD8+ клеткам, приблизительно составляющим 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1 или 1,0:1.
44. Способ по любому из пп. 32-43, в котором входная композиция клеток характеризуется отношением CD27+ CCR7+ CD4+ клеток к CD27+ CCR7+ CD8+ клеткам, приблизительно составляющим 1,1:1.
45. Способ по любому из пп. 32-44, в котором входная композиция клеток характеризуется отношением CD27+ CCR7+ CD4+ клеток к CD27+ CCR7+ CD8+ клеткам, приблизительно составляющим 1,69:1.
46. Способ получения композиции клеток, включающий:
(a) объединение первой композиции клеток, содержащей CD62L-CCR7+ CD4+ Т-клетки, со второй композицией клеток, содержащей CD62L-CCR7+ CD8+ Т-клетки, для получения входной композиции клеток, в которой отношение CD62L-CCR7+ CD4+ T-клеток к CD62L-CCR7+ CD8+ T-клеткам находится приблизительно между 0,5:1 и 2:1, включительно,
(b) приведение входной композиции клеток в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции; и
(c) стимуляцию входной композиции клеток до, во время или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации или пролиферации клеток.
47. Способ получения композиции клеток, включающий:
(a) определение количества, количества на объем, количества на вес или процентного содержания CD62L-CCR7+ CD4+ T-клеток и CD62L-CCR7+ CD8+ T-клеток в биологическом образце, полученном от субъекта, или в одном или более полученных от него образцов;
(b) получение входной композиции клеток, содержащей CD4+ T-клетки и CD8+ T-клетки, в которой отношение CD62L-CCR7+ CD4+ T-клеток к наивным CD62L-CCR7+ CD8+ T-клеткам находится приблизительно между 0,5:1 и 2:1, включительно, причем указанное отношение во входной композиции клеток регулируется или изменяется по сравнению с отношением CD62L-CCR7+ CD4+ T-клеток к наивным CD62L-CCR7+ CD8+ T-клеткам в биологическом образце от субъекта;
(c) приведение входной композиции клеток в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции; и
(d) стимуляцию входной композиции клеток до, во время или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации или пролиферации клеток.
48. Способ получения композиции клеток, включающий:
(a) объединение первой композиции клеток, содержащей CD62L-CCR7+ CD4+ T-клетки, со второй композицией клеток, содержащей CD62L-CCR7+ CD8+ T-клетки, для получения входной композиции клеток, в которой отношение CD62L-CCR7+ CD4+ T-клеток к CD62L-CCR7+ CD8+ T-клеткам находится приблизительно между 0,5:1 и 2:1, включительно;
(b) приведение входной композиции клеток в контакт с агентом, включающим молекулу нуклеиновой кислоты, кодирующую рекомбинантный рецептор, в условиях для введения нуклеиновой кислоты, кодирующей рекомбинантный рецептор, в клетки в композиции; и
(c) стимуляцию входной композиции клеток до, во время или после указанного контакта, при этом стимуляция включает инкубацию клеток в присутствии одного или более стимулирующих агентов, причем стимуляция приводит к активации или пролиферации клеток.
49. Способ по п. 47 или 48, в котором количество, количество на объем, количество на вес или процентное содержание CD62L-CCR7+ CD4+ Т-клеток или количество, количество на объем, количество на вес или процентное содержание CD62L-CCR7+ CD8+ Т-клеток определяется с помощью проточной цитометрии.
50. Способ по любому из пп. 47-49, в котором отношение CD62L-CCR7+ CD4+ T-клеток к CD62L-CCR7+CD8+ T-клеткам было отрегулировано по сравнению с отношением CD62L-CCR7+CD4+ T-клеток к CD62L-CCR7+ CD8+ T-клеткам в биологическом образце от субъекта.
51. Способ по любому из пп. 47-50, в котором входная композиция клеток характеризуется отношением CD62L-CCR7+ CD4+ клеток к CD62L-CCR7+ CD8+ клеткам, находящимся приблизительно между 0,5:1 и 1,5:1, 1:1 и 2:1, 0,75:1 и 1,5:1 или 0,8:1 и 1,2:1, включительно каждое отношение.
52. Способ по любому из пп. 47-51, в котором входная композиция клеток характеризуется отношением CD62L-CCR7+ CD4+ клеток к CD62L-CCR7+ CD8+ клеткам, приблизительно составляющим 1,2:1, 1,1:1, 1,0:1, 0,9:1 или 0,8:1.
53. Способ по любому из пп. 2-7, 12-18, 20-25, 27-31, 33-38, 41-44, 47 или 50-52, в котором биологический образец представляет собой или получают из образца крови, плазмы или сыворотки.
54. Способ по любому из пп. 2-7, 12-18, 20-25, 27-31, 33-38, 41-44, 47 или 50-53, в котором биологический образец представляет собой или включает образец цельной крови, образец лейкоцитарной пленки, образец мононуклеарных клеток периферической крови (PBMC), образец нефракционированных Т-клеток, образец лимфоцитов, образец лейкоцитов, продукт афереза, или продукт лейкафереза.
55. Способ по любому из пп. 2-7, 12-18, 20-25, 27-31, 33-38, 41-44, 47 или 50-54, в котором биологический образец представляет собой или получают из образца для афереза или лейкафереза.
56. Способ по любому из пп. 2-7, 12-18, 20-25, 27-31, 33-38, 41-44, 47 или 50-55, в котором субъектом является человек.
57. Способ по любому из пп. 1-56, в котором входная композиция клеток содержит приблизительно от 1×107 до 5×109 всех клеток или всех T-клеток, приблизительно от 5×107 до 1×109 всех клеток или всех T-клеток, приблизительно от 1×108 до 5×108 всех клеток или всех T-клеток или приблизительно от 2×108 до 5×108 всех клеток или всех T-клеток или жизнеспособных популяций любых из вышеперечисленных.
58. Способ по любому из пп. 1-57, в котором входная композиция клеток содержит по крайней мере приблизительно 1×108, 2×108, 3×08, 4×108 или 5×108 всех клеток или всех T-клеток или жизнеспособных популяций любых из вышеперечисленных.
59. Способ по любому из пп. 8-18, 26-31, 39-44 или 48-58, в котором один или более стимулирующих агентов способен к активации Т-клеток, CD4+ Т-клеток или CD8+ Т-клеток; способен к индукции сигнала через TCR комплекс; или способен к вызову пролиферации Т-клеток, CD4+ Т-клеток или CD8+ Т-клеток.
60. Способ по любому из пп. 8-18, 26-31, 39-44 или 48-59, в котором один или более стимулирующих агентов включает первичный агент, который связывается с членом TCR комплекса, который необязательно специфически связывается с CD3.
61. Способ по п. 60, в котором один или более стимулирующих агентов дополнительно включает вторичный агент, который специфически связывается с костимулирующей молекулой Т-клеток.
62. Способ по п. 61, в котором костимулирующая молекула выбрана из группы, состоящей из CD28, CD137 (4-1-BB), OX40 или ICOS.
63. Способ по п. 61 или 62, в котором первичные и вторичные агенты включают антитела, причем, необязательно, один или более стимулирующих агентов предусматривают инкубацию с антителом против CD3 и антителом против CD28.
64. Способ по любому из вариантов осуществления по пп. 8-18, 26-31, 39-44 или 48-63, в котором один или более стимулирующих агентов присутствуют на поверхности твердой подложки, необязательно шарика.
65. Способ по п. 64, в котором один или более стимулирующих агентов присутствуют на поверхности шарика и шарик представляет собой парамагнитный шарик.
66. Способ по любому из пп. 8-18, 26-31, 39-44 или 48-65, в котором один или более одного стимулирующего агента выбран из группы, состоящей из CD3-связывающих молекул; CD28-связывающих молекул; рекомбинантного IL-2; рекомбинантного IL-15 и рекомбинантного IL-7, вакцины, содержащей антиген, специфически распознаваемый рецептором антигена, и антиидиотипического антитела, которое специфически связывается с рецептором антигена, или их комбинаций.
67. Способ по любому из пп. 8-18, 26-31, 39-44 или 48-66, в котором инкубацию проводят в течение от 2 до 15 дней, от 2 до 12 дней, от 2 до 12 дней, от 2 до 8 дней, от 2 до 6 дней, от 2 до 4 дней, от 4 до 12 дней, от 4 до 10 дней, от 4 до 8 дней, от 4 до 6 дней, от 6 до 12 дней, от 6 до 10 дней, от 6 до 8 дней, от 8 до 12 дней, от 8 до 10 дней или от 10 до 12 дней.
68. Способ по любому из пп. 8-18, 26-31, 39-44 или 48-67, в котором инкубацию проводят в течение по крайней мере, или приблизительно по крайней мере, 4 дней, 6 дней, 8 дней, 10 дней или 12 дней.
69. Способ по любому из пп. 7-18, 25-32, 38-45 или 49-68, в котором агент, включающий молекулу нуклеиновой кислоты, представляет собой вирусный вектор или представляет собой транспозон.
70. Способ по п. 69, в котором агент, включающий молекулу нуклеиновой кислоты, представляет собой вирусный вектор, а вирусный вектор представляет собой ретровирусный вектор.
71. Способ по п. 70, в котором вирусный вектор представляет собой лентивирусный вектор или гаммаретровирусный вектор.
72. Способ по любому из вариантов осуществления по пп. 7-18, 25-32, 38-45 или 49-71, в котором рекомбинантный рецептор способен связываться с антигеном-мишенью, который связан с клеткой или тканью заболевания, нарушения или состояния, является специфическим для них или экспрессируется в них.
73. Способ по п. 72, в котором заболевание, нарушение или состояние представляет собой инфекционное заболевание или расстройство, аутоиммунное заболевание, воспалительное заболевание или опухоль или рак.
74. Способ по п. 72 или 73, в котором антиген-мишень представляет собой опухолевый антиген.
75. Способ по любому из пп. 72-74, в котором антиген-мишень выбран из числа рецептора-сироты 1 типа рецепторных тирозинкиназ (ROR1), антигена созревания В-клеток (BCMA), карбоангидразы 9 (CA9, также известной как CAIX или G250), Her2/neu (рецепторной тирозинкиназы erbB2), CD19, CD20, CD22, мезотелина (MSLN), раково-эмбрионального антигена (CEA) и поверхностного антигена вируса гепатита B, антитела против фолатного рецептора, CD23, CD24, CD30, CD33, CD38, CD44, хондроитинсульфат-протеогликана 4 (CSPG4), EGFR, эпителиального гликопротеина 2 (EPG-2), эпителиального гликопротеина 40 (EPG-40), рецептора-А2 эфрина (EPHa2), Her3 (erb-B3), Her4 (erb-B4), димеров erbB, мутации рецептора эпидермального фактора роста типа III (EGFR vIII), фолат-связывающего белка (FBP), подобного Fc-рецептору рецептора 5 (FCRL5, также известного как гомолог 5 Fc-рецептора или FCRH5), фетального ацетилхолинового рецептора (фетального AchR), ганглиозида GD2, ганглиозида GD3, лейкоцитарного антигена A1 человека (HLA-A1), лейкоцитарного антигена A2 человека (HLA-A2), рецептора-альфа IL-22 (IL-22Ra), рецептора, содержащего домен вставки киназы (kdr), легкой цепи каппа, члена А семейства белков, богатых повторами лейцина 8, (LRRC8A), Lewis Y, молекулы адгезии клеток L1 (L1-CAM), связанного с меланомой антигена А1 (MAGE)-A1, MAGE-A3, MAGE-A6, MAGE-A10, преимущественно экспрессируемого антигена меланомы (PRAME), сурвивина, опухолевого гликопротеина 72 (TAG72), B7-H3, B7-H6, рецептора-альфа 2 IL-13 (IL-13Rα2), высокомолекулярного связанного с меланомой антигена человека (HMW-MAA), CD171, фолатного рецептора-альфа, CD44v7/8, интегрина αvβ6 (интегрина avb6), 8H9, молекулы адгезии нервных клеток (NCAM), рецептора фактора роста эндотелия сосудов (рецепторов VEGF или VEGFR), гликопротеина трофобластов (TPBG, также известного как 5T4), лигандов NKG2D, CD44v6, двойного антигена, антигена рака яичек, цитомегаловируса (CMV) мышей, муцина 1 (MUC1), MUC16, антигена стволовых клеток предстательной железы (PSCA), специфического для предстательной железы мембранного антигена (PSMA), лигандов члена D группы 2 природных киллеров (NKG2D), антигена 1B рака/яичка (CTAG, также известного как NY-ESO-1 и LAGE-2), мелана A (MART-1), гликопротеина 100 (gp100), глипикана-3 (GPC3), сопряженного с G-белком рецептора 5D (GPRC5D), онкофетального антигена, TAG72, родственного тирозиназе белка 1 (TRP1, также известного как TYRP1 или gp75), родственного тирозиназе белка 2 (TRP2, также известного как допахром-таутомераза, допахром-дельта-изомераза или DCT), рецептора 2 фактора роста эндотелия сосудов (VEGF-R2), раково-эмбрионального антигена (CEA), рецептора эстрогена, рецептора прогестерона, специфического для предстательной железы антигена, эфрина B2, CD123, CD133, c-Met, O-ацетилированного GD2 (OGD2), эпитопа CE7 L1-CAM, белка опухоли Вильмса 1 (WT-1), циклина, циклина A2, лиганда 1 хемокина, содержащего мотив C-C (CCL-1), CD138, специфического для патогена антигена или экспрессируемого патогеном антигена и антигена, связанного с универсальной меткой.
76. Способ по любому из пп. 7-18, 25-32, 38-45 или 49-75, в котором рекомбинантный рецептор представляет собой или включает функциональный рецептор антигена, не являющийся TCR, или TCR или его антигенсвязывающий фрагмент.
77. Способ по любому из пп. 7-18, 25-32, 38-45 или 49-76, в котором рекомбинантный рецептор представляет собой химерный рецептор антигена (CAR).
78. Способ по п. 77, в котором химерный рецептор антигена содержит экстраклеточный домен, включающий антигенсвязывающий домен, который специфически связывается с антигеном, и внутриклеточный сигнальный домен, содержащий ITAM.
79. Способ по п. 78, в котором антигенсвязывающий домен представляет собой или включает антитело или фрагмент антитела, который необязательно является одноцепочечным фрагментом.
80. Способ по п. 78 или 79, в котором внутриклеточный сигнальный домен представляет собой или включает внутриклеточный сигнальный домен цепи CD3, необязательно цепи CD3-дзета (CD3ζ), или ее сигнальную часть.
81. Способ по любому из пп. 78, 79 и 80, в котором внутриклеточная сигнальная область дополнительно включает костимулирующую сигнальную область.
82. Способ по п. 81, в котором костимулирующая сигнальная область включает внутриклеточный сигнальный домен костимулирующей молекулы Т-клеток или ее сигнальную часть.
83. Способ по п. 81 или 82, в котором костимулирующая сигнальная область включает внутриклеточный сигнальный домен CD28, 4-IBB или ICOS или их сигнальную часть.
84. Способ по любому из пп. 77-82, в котором
CAR включает специфический для антигена scFv, трансмембранный домен, цитоплазматический сигнальный домен, происходящий из костимулирующей молекулы, который необязательно представляет собой или включает сигнальный домен 4-1BB, или цитоплазматический сигнальный домен, происходящий из первичной сигнальной ITAM-содержащей молекулы, который необязательно представляет собой или включает сигнальный домен CD3 дзета, и необязательно дополнительно включает спейсер между трансмембранным доменом и scFv;
CAR включает, по порядку, специфический для антигена scFv, трансмембранный домен, цитоплазматический сигнальный домен, происходящий из костимулирующей молекулы, который необязательно представляет собой или включает сигнальный домен 4-IBB, и цитоплазматический сигнальный домен, происходящий из первичной сигнальной ITAM-содержащей молекулы, который необязательно является сигнальным доменом CD3 дзета; или
CAR включает, по порядку, специфический для антигена scFv, спейсер, трансмембранный домен, цитоплазматический сигнальный домен, происходящий из костимулирующей молекулы, который необязательно является сигнальным доменом 4-1BB, и цитоплазматический сигнальный домен, происходящий из первичной сигнальной ITAM-содержащей молекулы, который необязательно представляет собой или включает сигнальный домен CD3 дзета.
85. Способ по любому из пп. 2-7, 9-18, 20-25, 27-31, 33-38, 41-45, 47 или 50-84, в котором у субъекта имеется заболевание или состояние, причем необязательно рекомбинантный рецептор специфически распознает или специфически связывается с антигеном, связанным с заболеванием или состоянием или экспрессируемым или присутствующим на клетках заболевания или состояния.
86. Способ по любому из пп. 1-85, который дает выходную композицию, в которой отношение экспрессирующих рекомбинантный рецептор CD4+ Т-клеток к экспрессирующим рекомбинантный рецептор CD8+ Т-клеткам, необязательно отношение их жизнеспособных клеток, отличается не более чем на 20%, или не более чем на 10%, или не более чем на 5% от среднего значения указанного отношения во множестве композиций Т-клеток, полученных этим способом, или отличается от такого среднего значения не более чем на одно среднеквадратичное отклонение.
87. Способ по любому из пп. 1-86, который дает выходную композицию, в которой отношение экспрессирующих рекомбинантный рецептор CD4+ Т-клеток к экспрессирующим рекомбинантный рецептор CD8+ Т-клеткам, необязательно отношение их жизнеспособных клеток, находится между или приблизительно между 0,5:1 и 2:1, или 0,8:1 и 1,6:1, или 1:1 и 1,5:1, включительно каждое отношение.
88. Способ по п. 86 или 87, в котором отношение экспрессирующих рекомбинантный рецептор CD4+ Т-клеток к экспрессирующим рекомбинантный рецептор CD8+ Т-клеткам, необязательно отношение их жизнеспособных клеток, в выходной композиции приблизительно составляет 1,2:1, 1,1:1, 1:1, 0,9:1 или 0,8:1.
89. Способ по любому из пп. 86-88, в котором отношение экспрессирующих рекомбинантный рецептор CD4+ T-клеток к экспрессирующим рекомбинантный рецептор CD8+ T-клеткам, необязательно отношение их жизнеспособных клеток, в выходной композиции приблизительно составляет 1:1.
| WO 2012129514 A1, 27.09.2012 | |||
| REBECCA A | |||
| GARDNER et al., Intent-to-treat leukemia remission by CD19 CAR T cells of defined formulation and dose in children and young adults, BLOOD, 22 June 2017, ol.129, N.25 | |||
| SYED ABBAS ALI et al., T cells expressing an anti-B-cell maturation antigen chimeric antigen receptor cause remissions of multiple myeloma, |
Авторы
Даты
2023-02-21—Публикация
2018-08-09—Подача