Изобретение относится к области биотехнологии, а именно к способу получения антибиотика широкого действия амикумацина А из природного штамма-продуцента, относящегося к Bacillus pumilus. Изобретение может быть использовано для высокоэффективного производства амикумацин А.
Рост числа случаев инфицирования резистентными штаммами микроорганизмов носит в настоящее время лавинообразный характер, бросающий вызов устойчивому развитию человечества и создающий опасность возвращения тех времен, когда основной причиной смертности являлись инфекционные заболевания. Для решения проблемы антибиотикорезистентности принципиально важен поиск новых антибиотиков, штаммов-продуцентов антибиотиков и поиск новых мишеней для ранее открытых антибиотиков. В 1982 году из Bacillus pumilus AI-77 было выделено вещество AI-77-B, которое показывает хорошую гастропротекторную активность и не обладает антихолинергическими (холинолитическими) или антигистаминными свойствами. Антибиотик амикумацин А относится к гетероциклическим соединениям класса оксикумаринов (Фиг. 1). Ранее было показано, что взаимосвязь терапии язвы желудка с антибиотическим действием амикумацина А в отношении Helicobacter pilory - агента, вызывающего язву желудка (Pinchuk I.V. и др., 2001). Позднее было показано, что амикумацин А эффективен в отношении штаммов MRSA (Lama А., 2012). Установлено, что амикумацин А обладает противоопухолевой активностью (US 5925671, WO 1996027594), противовирусной активностью (US 20080161324, US 200100009970). Механизм действия амикумацина А основан на специфическом ингибировании рибосомы (Y.S. Polikanov и др., 2014), позднее было показано, что антибиотик действует как на прокариотическую, так и на эукариотическую рибосому. Применение этого вещества в качестве терапевтического средства ограничено его плохой оральной абсорбцией (Maddimsetti, Venkateswara, Rao и др. 2014). Этот факт требует получение стабильных аналогов амикумацина А. Химический синтез чрезвычайно затруднен вследствие наличия пяти стерео-центров (Фиг. 1). В то же врем модификация природного амикумацина представляется более реализуемой задачей. Это делает перспективным поиск штаммов-продуцентов амикумацина для последующей его эффективной наработке и очистке. Амикумацин А и его близкие аналоги образуются бациллами, выделенными из различных источников, в основном Bacillus pumilus (Itoh J. и др., 1981, 1982; Berrue F. и др., 2009, Terekhov и др. 2018) и Bacillus subtilis (Li Y. и др, 2012; Azumi М., 2008), а также неидентифицированными до вида представителями рода Bacillus (СА2214776). В результате скрининга микробиоты ротовой полости сибирского бурого медведя Ursus arctos collaris нами был идентифицирован штамм, отнесенный к Bacillus pumilus и продуцирующий амикумацин, который был депонирован 25 ноября 2019 года во Всероссийскую коллекцию микроорганизмов (ВКМ) Института биохимии и физиологии микроорганизмов им. Г. К. Скрябина РАН, находящийся по адресу: 142290, Россия, г. Пущино Московской обл., проспект Науки, д.3 (ИБФМ РАН - обособленное подразделение Федерального исследовательского центра «Пущинский научный центр биологических исследований РАН (ФИЦ ПНЦБИ РАН)), с присвоенным при депонировании обозначением AmiA_125 и номером ВКМ: В-3464D. Наиболее подробное описание получения амикумацина А дано в работе Itoh J. и др., 1981 и патенте RU 2627187, которые выбраны нами в качестве прототипа. В указанной статье штамм В. pumilus продуцирует смесь антибиотиков, из которых основным компонентом является амикумацин А. В патенте RU 2627187 наработка происходит в колбах Эрленмейера и среде следующего состава (содержание компонентов в %): сахароза - 3-4, глюкоза - 0.1-0.2, дрожжевой экстракт - 0.3-0.5, K2НРО4 - 0.1-0.15, NaCl - 0.1-0.15, MgSO4 - 0.1-0.15, (NH4)2SO4 - 0.1-0.2, FeSO4×7H2O - 0.001, MnCl2×4H2O - 0.001, CaCO3 - 0.2-0.5, вода водопроводная - 94.7, pH 7.4, содержание в культуральной жидкости амикумацина А, образованного в результате биосинтеза, составляет 80-110 мкг/мл.
Таким образом, техническая проблема, решаемая настоящим изобретением, заключается в создании высокоэффективного способа получения амикумацина А с использованием штамма-продуцента B. pumilus AmiA_125, ВКМ: В-3464D для наработки вещества.
Для решения поставленной технической проблемы предлагается культивация штамма ВКМ: В-3464D с увеличенным количеством катионов аммония в питательной среде и высокой аэрацией в условиях биореактора (ферментера) в среде следующего состава: 50 г/л глюкозы, 10 г/л бакто-триптона, 10 г/л дрожжевого экстракта, 2 г/л хлорида натрия, 3 г/л YNB, 1 г/л аммония гидроксида, 1 г/л карбоната кальция и 8.2 г/л фосфата натрия, рН 7.5 и последующая двухстадийная хроматографическая очистка амикумацина А, образованного в результате биосинтеза, из культуральной жидкости.
Технический результат, достигаемый настоящим изобретением, заключается высоком содержании в культуральной жидкости амикумацина А, который составляет 220-245 мг/л и превышает уровень биосинтеза штамма-прототипа, что, в свою очередь, увеличивает количество вещества, получаемого при хроматографической очистке.
Описание настоящего изобретения
Для обеспечения высокого уровня биосинтеза антибиотика амикумацина А (Фиг. 1) штаммом Bacillus pumilus AmiA_125, ВКМ: В-3464D, была разработана следующая композиция питательной среды: 50 г/л глюкозы, 10 г/л бакто-триптона, 10 г/л дрожжевого экстракта, 2 г/л хлорида натрия, 3 г/л дрожжевой азотистой основы (YNB), 1 г/л аммония гидроксида, 1 г/л карбоната кальция и 8.2 г/л фосфата натрия, pH 7.5. Культивацию проводили в ферментере в указанной выше среде при температуре 30°C; при контролируемом поддержании pH в значении 7.5, кислорода (рО2) в значении 65-75% от насыщения питательной среды и подпитке глюкозой и раствором аммония гидроксида.
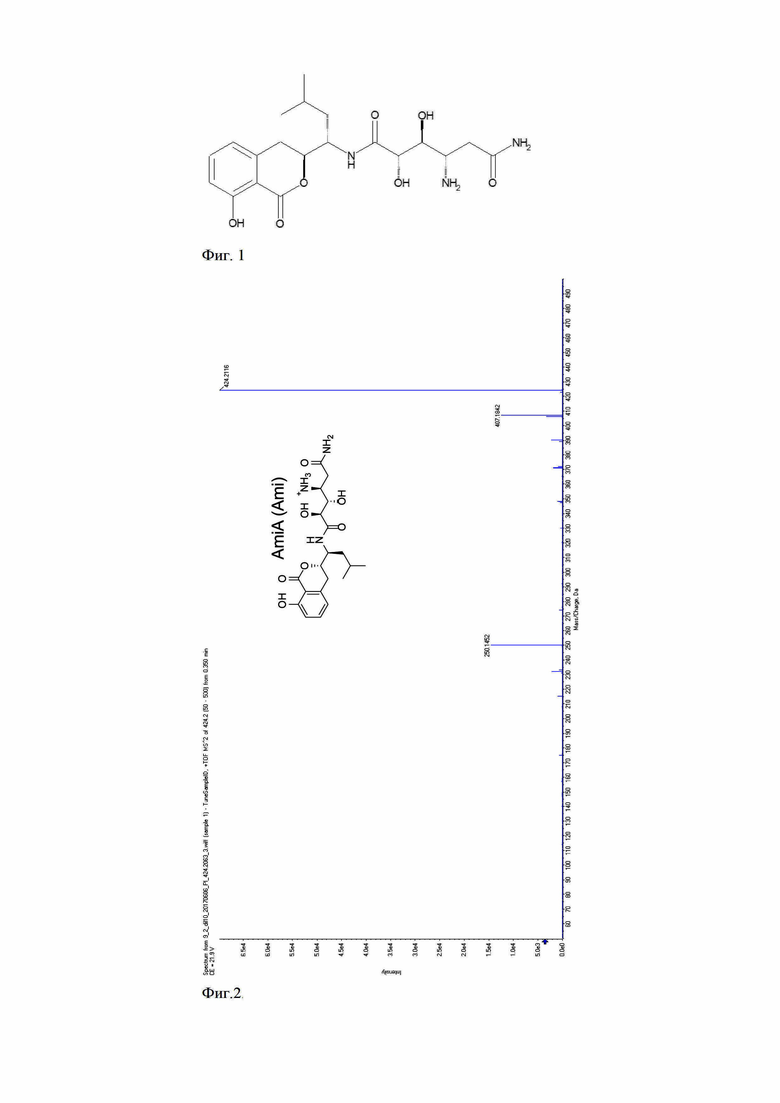
По завершении ферментации фильтрат культуральной жидкости, содержащей антибиотик амикумацин А, экстрагировали этилацетатом, экстракт упаривали и растворяли в ДМСО. Полученный препарат наносили на ВЭЖХ Zorbax C8 (Agilent) и фракционировали с использованием смеси буфера 1 (20 мМ NH4OAc pH 5.0, 5% AсCN), буфер 2 (20 мМ NH4OAc pH 5.0, 80% AсCN) при скорости потока 5 мл/мин. Окончательную очистку проводили с использованием ВЭЖХ колонки Symmetry C18 (Waters) смесью буферов 1 и 2 при скорости 1 мл/мин, и использовании линейного градиента 0 - 3 мин (100% буфер 1, 0% буфер 2), 3 - 4 мин (0 - 30% буфер 2), 4 - 11 мин (30 - 37% буфер 2), 11 - 12 мин (37 - 100% буфер 2). Детекцию амикумацина А проводили при длине волны 315 нм. Количественное определение очищенного вещества проводили спектрофотометрически с использованием коэффициента экстинкции, ε 315nm, MeOH = 4380 М-1см-1. Идентичность препарата подтверждали масс-спектрометрически (Фиг. 2).
Продуктивность штамма Bacillus pumilus AmiA_125, ВКМ: В-3464D означает содержание амикумацина А в единице объема культуральной жидкости, образовавшегося в результате биосинтеза, при культивировании в среде 50 г/л глюкозы, 10 г/л бакто-триптон, 10 г/л дрожжевой экстракт, 2 г/л хлорид натрия, 3 г/л YNB, 1 г/л аммония гидроксид, 1 г/л карбоната кальция и 8.2 г/л фосфата натрия, pH 7.5, при 30°C в условиях ферментера при контролируемом поддержании значения pH, рО2 в значении 65-75% от насыщения питательной среды и подпитке глюкозой и раствором аммония гидроксида. Продуктивность штамма В. pumilus AmiA_125, ВКМ: В-3464D составила от 220 до 245 мг/л, что на 222-275% превышает уровень биосинтеза штамма-прототипа.
Изобретение иллюстрируют следующими графическими материалами:
Фиг. 1. Химическая структура амикумацина А.
Фиг. 2. Спектр фрагментации MS/MS антибиотика амикумацина А. Доказательство идентичности.
Далее настоящее изобретение поясняется примерами, которые служат его иллюстрацией и не ограничивают области охвата настоящего изобретения, изложенной в формуле изобретения.
ПРИМЕР 1
Выращивание инокулята в колбах. Колбу объемом 750 мл со 100 мл среды засевают суспензией клеток Bacillus pumilus AmiA_125, ВКМ: В-3464D в количестве 106 клеток/колбу. Культивацию проводят в условиях аэрирования на роторной качалке со скоростью вращения 220 об./мин при 30°C. Длительность культивации составляет 16 часов.
Биосинтез амикумацина А в ферментере. В ферментере объемом 10 л, содержащем 6 л основной стерильной питательной среды, устанавливают скорость вращения мешалки 1000 об./мин., подачу стерильного воздуха в количестве 6 л в минуту, показания датчика растворенного кислорода (рО2) - 100% и производят засев ферментера 100 мл инокулята. Для этого к ферментеру с соблюдением правил асептики подсоединяют емкость с инокулятом и перистальтическим насосом и переносят содержимое колбы в ферментер. В процессе выращивания культуры каждый час из аппарата отбирают пробы культуральной жидкости для измерения ее оптической плотности. Через 5 часов после засева ферментера при достижении оптической плотности культуральной жидкости, равной 6.5-0.5 оптических единиц, начинают подпитку культуры раствором глюкозы с концентрацией 500 г/л и раствора гидроксида аммония - 3.5 г/л. Подачу подпитки в ферментер осуществляют непрерывно (с помощью перистальтического насоса) до окончания процесса. Скорость подачи подпитки:
с 5 до 6 часов роста 20 мл /час
с 6 до 7 часов роста 30 мл /час
с 7 до 8 часов роста 40 мл /час
с 9 до 10 часов роста 60 мл /час
с 10 часа роста до окончания процесса 80 мл /час.
Процесс биосинтеза проводят при соблюдении следующих параметров:
- температура 30 ± 0.2°С
- рН 7.5± 0.2
- концентрация растворенного кислорода (рО2) 70±5% от насыщения питательной среды
- давление в аппарате 0.25±0.05 атм
Общее время культивирования продуцента составляет 20-24 часа.
Полученную после ферментации культуральную жидкость центрифугируют. Общий объем культуральной жидкости составляет 7.5 л. Клетки из культуральной жидкости осаждают центрифугированием на центрифуге Beckman Avanti JСE (фирма Beckman Coulter, США). Надосадочную жидкость фильтруют и добавляют этилацетат в соотношении 1:1 = об.:об. Экстракт упаривают досуха и растворяют в диметилсульфоксиде (ДМСО). Полученный препарат наносят на ВЭЖХ Zorbax C8 (Agilent) и фракционируют с использованием смеси буфера 1 (20 мМ NH4OAc pH 5.0, 5% AсCN) и буфер 2 (20 мМ NH4OAc pH 5.0, 80% AсCN) при скорости потока 5 мл/мин. Окончательную очистку проводят с использованием ВЭЖХ колонки Symmetry C18 (Waters) смесью буферов 1 и 2 при скорости 1 мл/мин, и использовании линейного градиента 0-3 мин (100% буфер 1, 0% буфер 2), 3 - 4 мин (0 - 30% буфер 2), 4 - 11 мин (30 - 37% буфер 2), 11 - 12 мин (37 - 100% буфер 2). Детекцию ведут при длине волны 315 нм. Элюат упаривают, лиофилизируют и растворяют в ДМСО. Количественное определение очищенного амикумацина А проводят спектрофотометрически с использованием коэффициента экстинкции, ε 315nm, MeOH = 4380 М-1см-1. Продуктивность штамма рассчитывают по формуле:
П (мг/л) = AAmiA×VAmiA×423.47×1000/(4380×7.5), где
AAmiA× - значение оптической плотности при спектрофотометрическом определении концентрации при длине волны 315 нм,
VAmiA× - объем пробы после очистки,
423.47 - молекулярный вес амикумацина А, г/моль,
7.5 - объем культуральной жидкости после продукции, л,
4380 - коэффициент экстинкции при длине волны 315 нм, М-1см-1.
В результате трех последовательных наработок установлено, что средняя продуктивность штамма Bacillus pumilus AmiA_125, ВКМ: В-3464D в условиях культивирования в ферментере составляет 232 мг/л.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ BACILLUS PUMILUS, ПРОДУЦИРУЮЩИЙ АНТИБИОТИК ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ АМИКУМАЦИН | 2019 |
|
RU2737856C1 |
| Штамм Bacillus pumilus и способ получения антибиотика амикумацина А с его применением | 2016 |
|
RU2627187C1 |
| ШТАММ STREPTOMYCES TSUKUBENSIS - ПРОДУЦЕНТ ТАКРОЛИМУСА И СПОСОБ ПОЛУЧЕНИЯ ТАКРОЛИМУСА | 2018 |
|
RU2686779C1 |
| ШТАММ STREPTOMYCES HYGROSCOPICUS BKM AC-2737D - ПРОДУЦЕНТ АНТИБИОТИКА РАПАМИЦИНА И СПОСОБ УВЕЛИЧЕНИЯ ЕГО ПРОДУКТИВНОСТИ | 2018 |
|
RU2679051C1 |
| КОМБИНИРОВАННЫЙ ПРОБИОТИК ДЛЯ АКВАКУЛЬТУРЫ НА ОСНОВЕ СПОРООБРАЗУЮЩИХ БАКТЕРИЙ РОДА BACILLUS И СПОСОБ ЕГО ПРОИЗВОДСТВА | 2021 |
|
RU2768281C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА SAV-RGD, СПЕЦИФИЧЕСКИ УЗНАЮЩЕГО КЛЕТКИ МЕЛАНОМЫ | 2013 |
|
RU2563540C2 |
| Штамм Streptomyces virginiae - продуцент вирджиниамицина и способ получения вирджиниамицина | 2016 |
|
RU2637857C1 |
| ШТАММ ДРОЖЖЕЙ SACCHAROMYCES CEREVISIAE-BKM CR-349D-ПРОДУЦЕНТ ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА ЧЕЛОВЕКА | 1999 |
|
RU2150501C1 |
| Штамм дрожжей Yarrowia lipolytica - продуцент янтарной кислоты (варианты) | 2016 |
|
RU2631922C1 |
| Способ получения рестриктазы В @ AI | 1990 |
|
SU1712415A1 |
Изобретение относится к биотехнологии. Способ получения антибиотика амикумацин А предусматривает культивирование штамма-продуцента Bacillus pumilus ВКМ В-3464D в ферментере в питательной среде, содержащей глюкозу, бакто-триптон, дрожжевой экстракт, хлорид натрия, YNB, аммония гидроксид, карбоната кальция, натрия фосфат и дистиллированную воду в заданном соотношении компонентов в режиме высокой аэрации, и подачу непрерывной подпитки культуры при достижении ею оптической плотности 6.5±0.5 оптических единиц раствором глюкозы с концентрацией 500 г/л и раствором гидроксида аммония - 3.5 г/л в течение 15-19 часов. По окончании ферментации культуральную жидкость центрифугируют, надосадочную жидкость фильтруют и добавляют этилацетат в соотношении 1:1 по объему. Экстракт упаривают, растворяют в ДМСО и подвергают двухстадийной очистке, последовательно, на сорбенте Zorbax C8, а затем на сорбенте Symmetry C18 в буфере, содержащем 20 мМ ацетата аммония, pH 5.0, 5% ацетонитрила с элюированием амикумацина А градиентом ацетонитрила и детекцией при длине волны 315 нм. Изобретение позволяет повысить выход антибиотика амикумацин А. 1 пр., 2 ил.
Способ получения антибиотика амикумацин А, включающий посев штамма Bacillus pumilus ВКМ В-3464D в колбу Эрленмейера и его последующую культивацию в ферментере в среде, содержащей 50 г/л глюкозы, 10 г/л бакто-триптона, 10 г/л дрожжевого экстракта, 2 г/л хлорида натрия, 3 г/л дрожжевой азотистой основы (YNB), 1 г/л аммония гидроксида, 1 г/л карбоната кальция и 8.2 г/л фосфата натрия, рН 7.5, в режиме высокой аэрации, обеспечивающей 70±5% насыщение питательной среды растворенным кислородом, при рН-статировании на уровне 7.5±0.2, и подачу непрерывной подпитки культуры при достижении ею оптической плотности 6.5±0.5 оптических единиц раствором глюкозы с концентрацией 500 г/л и раствором гидроксида аммония - 3.5 г/л в течение 15-19 часов, после чего культуральную жидкость центрифугируют, надосадочную жидкость фильтруют, добавляют этилацетат в соотношении 1:1 по объему, экстракт упаривают, растворяют в диметилсульфоксиде и подвергают двухстадийному хроматографическому фракционированию на сорбенте Zorbax C8 и затем на сорбенте Symmetry C18 в буфере, содержащем 20 мМ ацетата аммония, pH 5.0, 5% ацетонитрила, с элюированием амикумацина А градиентом ацетонитрила до 80% и его детекцией при длине волны 315 нм.
| Штамм Bacillus pumilus и способ получения антибиотика амикумацина А с его применением | 2016 |
|
RU2627187C1 |
| ЕФРЕМЕНКОВА О.В., ГАБРИЭЛЯН Н.И | |||
| и др | |||
| Антимикробные свойства амикумацина А, Антибиотики химиотерпия, 2017, N1-2, с | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| ЕФИМЕНКО Е.А | |||
| Бактериальные продуценты антибиотиков, активных ы отношении микроорганизмов с лекарственной устойчивостью, Автореф | |||
| дис | |||
| на соискание уч | |||
| степени кандидата биологических наук, М, | |||
Авторы
Даты
2020-12-28—Публикация
2019-12-27—Подача